Тест по биологии 10 класс на тему Органические вещества (углеводы, белки) с ответами
1.Органические вещества это….
А)соединение белка с другими элементами которые образовались в живых существах
Б)соединение белка с другими элементами которые образовались в мёртвых существах
В) соединение углерода с другими элементами которые образовались в живых существах +
2.Что не относится к органическим веществам?
А)Минеральные соли +
Б)Нуклеиновые кислоты
В)Жиры
Г) Вода+
3.Дайте значения понятию « Макромолекула»
А)Молекула высокой молекулярной массой +
Б) Молекула с низкой молекулярной массой
В) Молекула с средней молекулярной массой
4.Липиды это…
А)Преимущественно гидрофобные неорганические соединения ,которые растворяются в
неполярных веществах (эфире ацетоне и др.)
Б) Преимущественно гидрофобные органические соединения ,которые растворяются в
неполярных веществах (эфире ацетоне и др.) +
В)Преимущественно гидрофобные органические соединения ,которые растворяются в полярных
веществах (эфире ацетоне и др.
5) Одна из важнейших функций липидов —
А)Защитная
Б)Терморегуляция
В)Гуморальная
Г)Энергетическая +
6.Дайте значения понятию « Жиры»
А)Сложные эфиры, образованные трёхатомным спиртом глицерином ,и тремя остатками
жирных кислот.+Б) Сложные эфиры, образованные трёхатомным спиртом жирных кислот и тремя остатками
глицерина.
В)Сложные эфиры, образованные двухатомным спиртом глицерином ,и тремя остатками жирных
кислот.
7.Воски выполняют в основном…
А)Энергетическую функцию
Б)Терморегуляцию
В)Защитную функцию+
Г)Строительную функцию
8.Из перечисленного выберите что не относится к группам липидов
А) Гликолипиды
Б)Жиры
В)Воски
Г) Белки +
9. Углеводы это…
А) Органические вещества, содержащие карбонильную группу и несколько
гидроксильных групп +
Б)Неорганические вещества ,содержащие карбонильную группу и несколько
гидроксильных групп
В)Полисахариды, содержащие карбонильную группу и несколько гидроксильных групп
10.
 Углеводы вступающие в связь с другими соединениям называются…
Углеводы вступающие в связь с другими соединениям называются…А) Простые
Б)Полисахариды
В)Сложные +
11.Какая функция не относится к функции углеводов:
А)Защитная
Б)Строительная
В)Энергетическая
Г) Терморегуляция +
12. Углеводы, содержащие от 2 до 10 моносахаридных остатков (от греч. ὀλίγος —
немногий)- это…А)Полисахариды
Б)Олигосахариды +
В)Дисахариды
Г)Моносахариды
13. Какие соединения называют углеводами ?
А)Органические вещества , содержащие карбонильную группу и
несколько гидроксильных групп +
Б)Неорганические вещества, содержащие карбонильную группу и
несколько гидроксильных групп
В) Содержащие от 2 до 10 моносахаридных остатков
14. Высокомолекулярные органические вещества, состоящие из альфа-аминокислот,
А)Углеводы
Б)Жиры
В)Белки +
Г)Нуклеотиды
15 Полипептиды с высокой молекулярно массой называют …
А) Белками +
Б)Нуклеотидом
В)Жирами
Г) Водой
16.
 Дипептид это…
Дипептид это…А)Соединение стоящие из двух кислот
Б) Соединение состоящие из молекулярной массы
В)Соединение состоящие из двух аминокислот +
17.Первичную структуру белков определяет та или иная последовательность….
А) борной кислоты
Б) нуклеотида
В) субстрата
Г)Аминокислотных остатков +
18. Как можно назвать другими словами «простые белки»?
А)Протеины +Б)Кератины
В)Протеиды
19. Как можно назвать другими словами «сложные белки» ?
А)Протеины
Б)Кератины
В)Протеиды +
20.Что содержат сложные белки?
А) небелковые компоненты ,остатки фосфорной и нуклеиновой кислот ,углеводов
,липидов, цинка и др.+
Б)Аминокислотные остатки
В) Липиды
21.Из чего состоят простые белки ?
А)Небелковые компоненты
Б)Остатки нуклеиновой кислоты
В)Аминокислотные остатки +
22. Каких белков не существует ?
А)Фибриллярные
Б)Глобулярные
В) Нитевидные
Г) Факторные +
23.Денатурация белка это…
А) образование новых гибридных орбиталей атомов, имеющих одинаковые энергию и
форму, в результате смешения электронных облаков разной энергии и формы.

Б) термин биологической химии, означающий потерю белками их естественных
свойств (растворимости, гидрофильности и др. ) вследствие нарушения
пространственной структуры их молекул. +
В) образование новых гибридных орбиталей атомов, имеющих одинаковые энергию и
форму, в результате смешения электронных облаков разной энергии и формы.
24.Ренатурация белка это…
А) образование новых гибридных орбиталей атомов, имеющих одинаковые
формы. +
Б) образование новых гибридных орбиталей атомов, имеющих одинаковые энергию и
форму, в результате смешения электронных облаков разной энергии и формы.В) термин биологической химии, означающий потерю белками их естественных свойств
(растворимости, гидрофильности и др. ) вследствие нарушения пространственной
структуры их молекул.
25.Что является главным компонентом хрящей и сухожилий ?
А)Эластин
Б)Белок коллаген +
В) Микронити
26.
 Основой шелковых нитей и паутины служит…
Основой шелковых нитей и паутины служит…А) Белок коллаген
Б)Белок фиброин+
В)Эластин
27.Как по другому можно назвать « Иммуноглобулины»
А)Антитела +
Б) Вирусы
В) Белки
28.Дайте значения слову «Катализ»
А) это вещество, увеличивающее количество активных частиц в системе.
Б) избирательное ускорение одного из возможных термодинамически разрешенных
направлений химической реакции под действием катализатора (ов) .+
В) процесс развития индивидуального организма, в отличие от филогенеза как
процесса формирования систематической группы.
29. малые молекулы небелковой природы, специфически соединяющиеся с
соответствующими белками, называемыми апоферментами, и играющие роль активного
центра или простетической группы молекулы фермента это –
А)Ферменты
Б)Биокатализ
В)Кофактор+
30. особый вид протеинов, которым природой отведена роль катализаторов разных
химических процессов это…
А)Ферменты+
Б)Биокатализ
В)Кофактор
Тема №11950 Тест по биологии на тему «Современные методы биохимических исслед
Тема №11950
1. По химической природе белки являются:
По химической природе белки являются:
А) полисахаридами
Б) полипептидами
В) триглицеридами
Г) стероидами
2. Функциями белков в организме являются:
А) пластическая
Б) энергетическая
В) защитная
Г) все перечисленные
3. Защитную функцию в организме выполняют:
А) антитела
Б) гликопротеины
В) нуклеопротеины
Г) все перечисленные
4. Структурной единицей белков являются:
А) нуклеиновые кислоты
Б) аминокислоты
В) моносахариды
Г) олигосахариды
5. В состав белков обязательно входит:
А) фосфор
Б) кальций
В) азот
Г) натрий
6. Транспортную функцию в организме выполняют:
А) гемоглобин
Б) альбумин
В) трансферрин
Г) все перечисленные
7. Веществом, содержащим дисульфидную связь, является:
А) цистеин
Б) цистин
В) метионин
Г) все перечисленные
8. Свойства белков:
Свойства белков:
А) коллоидность
Б) амфотерность
В) высокомолекулярность
Г) все перечисленное верно
Выберите один правильный ответ:
9. Нингидриновая реакция применяется для открытия:
А) холестерина
Б) глюкозы
В) -аминокислоты
Г) крахмала
10. Гемоглобин выполняет функцию:
А) пластическую
Б) энергетическую
В) транспорт кислорода и углекислого газа
Г) каталитическую
11. Белки образуют с водой растворы:
А) истинные
Б) коллоидные
В) эмульсии
Г) суспензии
12. Первичная структура белка определяется наличием связи:
А) пептидной
Б) дисульфидной
В) водородной
Г) всеми перечисленными
13. Вторичная структура белка определяется наличием связи:
А) пептидной
Б) водородной
В) сульфидной
Г) всеми перечисленными
14. Третичная структура белка определяется наличием связи:
А) водородной
Б) пептидной
В) дисульфидной
Г) всеми перечисленными
15. К простым белкам относятся:
К простым белкам относятся:
А) гемоглобин
Б) фетопротеин
В) альбумин
Г) нуклеопротеин
16. К сложным белкам относятся:
А) гемоглобин
Б) глобулин
В) альбумин
Г) протамин
17. В изоэлектрической точке белок является:
А) катионом
Б) анионом
В) электронейтральным
Г) все перечисленное верно
Выберите один правильный ответ:
18. Альбумины – это:
А) наибольшая и самая однородная фракция белков плазмы крови
Б) имеют высокий отрицательный заряд
В) наиболее быстро передвигаются от катода к аноду при электрофорезе
Г) все перечисленное верно
19. Альбумины способны адсорбировать на своей поверхности и обезвреживать
А) билирубин
Б) аммиак
В) изолейцин
Г) мочевину
20. В желудке белки активно расщепляются под действием фермента:
А) амилазы
Б) пепсина
В) трипсина
Г) химотрипсина
21. Сыворотка от плазмы отличается отсутствием:
Сыворотка от плазмы отличается отсутствием:
А) глюкозы
Б) фибриногена
В) креатина
Г) креатинина
22. Процесс отщепления от аминокислоты СО2 называется:
А) дезаминирование
Б) переаминирование
В) аминирование
Г) декарбоксилирование
23. Конечными продуктами гниения белков являются:
А) индол
Б) скатол
В) фенол
Г) все перечисленное верно
24. С помощью биуретовой реакции можно открыть наличие связи:
А) дисульфидной
Б) ионной
В) пептидной
Г) водородной
25. При денатурации белков изменяется структура:
А) первичная
Б) вторичная, третичная
В) изменяются все структуры
26. Процесс переноса аминогруппы с аминокислоты на кетокислоту называется:
А) дезаминирование
Б) переаминирование
В) аминирование
Г) декарбоксилирование
Выберите один правильный ответ:
27. Процесс отщепления от аминокислоты группы Nh3 — это:
Процесс отщепления от аминокислоты группы Nh3 — это:
А) переаминирование
Б) декарбоксилирование
В) дезаминирование
Г) гидрогенизация
28. Продуктом гидролиза белков является:
А) глюкоза
Б) аминокислота
В) глицерин
Г) жирные кислоты
29. Назвать аминокислоту, получающуюся из -кетоглютаровой кислоты путем прямого аминирования:
А) лизин
Б) аргинин
В) глутаминовая
Г) глутамин
30. Основным компонентом остаточного азота является:
А) глюкоза
Б) ацетон
В) глицерин
Г) мочевина
31. Процессам обезвреживания в печени подвергаются:
А) продукты гниения в кишечнике
Б) продукты катаболизма гема
В) лекарственные вещества
Г) все перечисленное верно
32. К незаменимым аминокислотам относятся:
А) аланин
Б) фенилаланин
В) глицин
Г) орнитин
33. Синтез мочевины происходит в:
А) печени
Б) легких
В) почках
Г) желудке
34. Гипопротеинемия возникает при:
Гипопротеинемия возникает при:
А) недостатке поступления белка с пищей
Б) понижении процессов биосинтеза белка
В) потере белка организмом при острых и хронических кровотечениях
Г) все перечисленное верно
Выберите один правильный ответ:
35. Диспротеинемия — это
А) увеличение общего белка
Б) уменьшение общего белка
В) снижение фибриногена
Г) нарушение соотношения белковых фракций
36. Назвать метаболит, по которому определяют эффективность клубочковой фильтрации:
А) мочевина
Б) мочевая кислота
В) креатин
Г) креатинин
37. Виды азотемий:
А) продукционная
Б) ретенционная
В) почечная
Г) все перечисленное верно
38. Защитная функция белков состоит в:
А) обеспечении энергией
Б) переносе кислорода
В) выработке антител
Г) построении клеточной мембраны
39. Важное значение в обезвреживании аммиака принадлежит кислоте:
А) глюкуроновой
Б) глутаминовой
В) серной
Г) арахидоновой
40. В печени обезвреживание токсических веществ происходит при участии кислот:
В печени обезвреживание токсических веществ происходит при участии кислот:
А) серной и глюкуроновой
Б) азотной
В) желчных
Г) бензойной
41. Изменение концентрации остаточного азота в крови – это:
А) уремия
Б) азотемия
В) глюкозурия
Г) липемия
42. Основное место синтеза альбуминов:
А) почки
Б) печень
В) мозг
Г) селезенка
43. γ-глобулины – это:
А) ферменты
Б) гормоны
В) антитела
Г) рецепторы
Выберите один правильный ответ:
44. К сложным белкам относятся:
А) полипептиды
Б) нуклеопротены
В) ТАГ
Г) аминокислоты
45. Простетической группой нуклеопротеинов являются:
А) углеводы
Б) липиды
В) нуклеиновые кислоты
Г) белки
46. Конечными продуктами обмена пуриновых азотистых оснований являются:
А) мочевина
Б) креатинин
В) мочевая кислота
Г) все перечисленное верно
47. К нарушениям белкового обмена можно отнести:
К нарушениям белкового обмена можно отнести:
А) гиперурикемию
Б) гипергликемию
В) парапротеинемию
Г) глюкозурию
48. Увеличение содержания мочевой кислоты в крови называется:
А) гиперпротеинемия
Б) гиперурикемия
В) уремия
Г) все перечисленное верно
49. Гиперурикемия сопровождается развитием:
А) холестаза
Б) гепатита
В) подагры
Г) все перечисленное верно
50. Увеличение концентрации мочевины характерно для патологических состояний:
А) почечная недостаточность
Б) заболевание печени
В) мышечная дистрофия
Г) все перечисленное
51. При закупорке желчного протока возникает патология:
А) печёночно-клеточная недостаточность
Б) внепечёночный холестаз
В) внутрипечёночный холестаз
Г) гемолитический сирдром
52. К сложным белкам относятся:
А) гемоглобин
Б) миоглобин
В) нуклеопротеины
Г) все перечисленное верно
Выберите один правильный ответ:
53. Функциями гемоглобина являются:
Функциями гемоглобина являются:
А) транспортная
Б) буферная
В) все перечисленное верно
Г) все перечисленное неверно
54. Назовите микроэлемент в составе гема:
А) магний
Б) марганец
В) цинк
Г) железо
55. Назвать продукты распада гемоглобина:
А) вердоглобин
Б) биливердин
В) билирубин
Г) все перечисленное верно
56. Железо в организме человека запасается в виде:
А) трансферрина
Б) гемоглобина
В) ферритина
Г) миоглобина
57. Источники погрешности при определении общего белка биуретовым методом:
А) использование гемолизированной сыворотки
Б) хранение биуретового реактива на свету
В) неточное приготовление стандартного раствора
Г) все перечисленное верно
58. Какие виды патологических состояний, связанных с развитием желтушного синдрома, знаете:
А) гемолитический синдром
Б) холестаз
В) печеночно-клеточная недстаточность
Г) все перечисленное верно
59. В организме человека железо входит в состав:
В организме человека железо входит в состав:
А) гемоглобина
Б) трансферрина
В) ферритина
Г) все перечисленное верно
60. Креатинин в крови и моче определяют для:
А) оценки углеводного обмена
Б) оценки азотистого баланса
В) характеристики почечной фильтрации
Г) расчета осмотической концентрации
61. Наличие печёночно-клеточной недостаточности в дожелтушный период можно установить по появлению в моче:
А) коньюгированного билирубина
Б) неконьюгированного билирубина
В) уробилина
Г) мезобилиногена
Выберите один правильный ответ:
62. Аммиак в организме обезвреживается путем связывания с образованием:
А) глутаминовой кислоты
Б) глутамина
В) мочевины
Г) все перечисленное верно
63. В основе иммунохимических методов лежит взаимодействие:
А) антитела с антигеном
Б) фермента с субстратом
В) фермента с коферментом
Г) все перечисленное верно
64. Биологическое значение переваривания белков заключается в том, что благодаря этому процессу происходит:
Биологическое значение переваривания белков заключается в том, что благодаря этому процессу происходит:
А) образование набора аминокислот, необходимых для синтеза собственных белков организма и биологически активных соединений
Б) образование продуктов, лишенных антигенной специфичности
В) образование продуктов, которые могут легко проникать в клетки слизистой оболочки кишечника
Г) все перечисленное верно
65. В составе желчи в желчном пузыре находится:
А) коньюгированный билирубин
Б) неконьюгированный билирубин
В) биливердин
Г) вердоглобин
66. Свободный билирубин в печени подвергается:
А) декарбоксилированию
Б) соединению с глюкуроновой кислотой
В) соединению с белками
Г) гидролизу
67. Увеличение неконьюгированного билирубина характерно для:
А) холестаза
Б) гемолитического синдрома
В) печёночно-клеточной недостаточности
Г) дожелтушного периода
68. Неконьюгированный билирубин в крови соединяется с:
Неконьюгированный билирубин в крови соединяется с:
А) миоглобином
Б) глобулином
В) альбумином
Г) аминокислотой
69. Физиологическое значение переаминирования заключается в образовании:
А) незаменимых аминокислот
Б) заменимых аминокислот
В) заменимых и незаменимых аминокислот
Г) кетокислот
70. Билирубин – это:
А) белок
Б) пигмент
В) углевод
Г) фермент
Выберите один правильный ответ:
71. Часть мезобилиногена поступает в:
А) селезенку
Б) печень
В) кишечник
Г) желудок
72. В норме неконьюгированный билирубин в крови составляет:
А) 25% от общего
Б) 40% от общего
В) 75% от общего
Г) 50% от общего
73. Назвать методы, с помощью которых можно разделить аминокислоты:
А) высаливание
Б) тонкослойная хроматография (ТСХ)
В) гель-фильтрация
Г) все перечисленное неверно
74. Аффинная хроматография основана на:
Аффинная хроматография основана на:
А) разделении веществ по размеру молекул
Б) разделении веществ по заряду
В) на различной способности веществ адсорбироваться на сорбентах
Г) сродстве разделяемых веществ к специфическим химическим группам, закрепленных на носителях
75. Указать методы, которые могут быть использованы для разделения белков:
А) электрофорез
Б) хроматография
В) высаливание
Г) все перечисленные
76. Увеличение содержания мочевины в крови называется:
А) гиперпротеинемия
Б) гиперуремия
В) урикемия
Г) все перечисленное верно
77. Аминокислоты на ТСХ выявляют с помощью реактива:
А) нингидринового
Б) биуретового
В) молибденового
Г) всех указанных
78. Адсорбционная хроматография основана на:
А) разделении веществ по размеру молекул
Б) различии в общем заряде
В) различной способности адсорбироваться на сорбентах
Г) сродстве веществ к специфическим химическим группам, закрепленных на носителях
79. Методом электрофореза определяют:
Методом электрофореза определяют:
А) мочевину
Б) холестерин
В) белковые фракции
Г) креатинин
Выберите один правильный ответ:
80. Физиологическая роль церулоплазмина:
А) участие в реакции острой фазы
Б) создании оксидазной активности
В) активация гемопоэза
Г) все перечисленное верно
81. С-реактивный белок:
А) присутствует в норме, но при воспалении снижается
Б) появляется при воспалении, некрозах ткани
В) исчезает при обострениях заболеваний
Г) все перечисленное верно
82. При подозрении на воспалительный процесс рекомендуется провести исследование:
А) лейкоцитарной формулы
Б) СОЭ
В) С-реактивный белок
Г) всего перечисленного
83. Белок транспортирующий железо — это:
А) церулоплазмин
Б) трансферрин
В) альбумин
Г) протамин
84. Заряд белка зависит от:
А) температуры
Б) величины рН раствора
В) изоэлектрической точки
Г) количества пептидных связей
85. В составе иммуноглобулинов сыворотки крови человека больше всего представлено:
В составе иммуноглобулинов сыворотки крови человека больше всего представлено:
А) Ig М
Б) Ig G
В) Ig А
Г) Ig Д
86. Физиологическая роль гаптоглобина:
А) связывание гемоглобина
Б) участие в свертывании крови
В) участие в реакции иммунитета
Г) все перечисленное верно
87. Положительные белки острой фазы:
А) церулоплазмин
Б) гаптоглобин
В) С-реактивный белок
Г) все указанные
88. Молекула иммуноглобулина состоит из:
А) 2-х тяжелых и 2-х легких цепей
Б) 2-х тяжелых цепей
В) 2-х легких цепей
Г) 4-х тяжелых цепей
Выберите один правильный ответ:
89. Определение парапротеинов имеет клиническое значение как маркеров:
А) неопластических процессов
Б) воспалительных процессов
В) хронических процессов
Г) все перечисленное верно
90. Альбумины способны адсорбировать на своей поверхности вещества и обезвреживать их:
А) билирубин
Б) глицерин
В) глюкозу
Г) аминокислоты
91. Электрофорез белков проводят:
Электрофорез белков проводят:
А) полиакриламидном геле
Б) агаровом геле
В) целлюлозоацетатных пленках
Г) всех перечисленных носителях
92. Определение -фетопротеина имеет диагностическое значение при:
А) первичном раке печени
Б) инфекционном гепатите
В) раке желудка
Г) осложненном инфаркте миокарда
93. Белок Бенс-Джонса составляют:
А) тяжелые цепи иммуноглобулина
Б) легкие цепи иммуноглобулина
В) молекула иммуноглобулина
Г) все перечисленное верно
94. С помощью электрофореза можно выявить:
А) нарушения в гуморальном звене иммунитета
Б) острый или хронический воспалительный процесс
В) снижение синтеза белка в печени
Г) все перечисленное
95. Основной функцией углеводов является:
А) структурная
Б) энергетическая
В) защитная
Г) транспортная
96. При полном распаде углеводов образуется энергии:
А) 3, 1 ккал
Б) 4, 2 ккал
В) 5, 1 ккал
Г) 6, 1 ккал
97. К моносахаридам относится:
К моносахаридам относится:
А) глюкоза
Б) фруктоза
В) рибоза
Г) все перечисленные
Выберите один правильный ответ:
98. К полисахаридам относится:
А) крахмал
Б) клетчатка
В) гликоген
Г) все перечисленные
99. Конечным продуктам гидролиза крахмала является:
А) фруктоза
Б) мальтоза
В) лактоза
Г) глюкоза
100. Сахароза относится к классу:
А) моносахаридов
Б) гомополисахаридов
В) олигосахаридов
Г) гетерополисахаридов
101. Депонированной формой глюкозы в организме человека является:
А) глюкозо-6-фосфат
Б) гликоген
В) пируват
Г) олигосахариды
102. Перестальтику кишечника обусловливает:
А) клетчатка
Б) мукополисахариды
В) крахмал
Г) гликоген
103. Основным источником энергии в организме человека является
А) глюкоза
Б) галактоза
В) фруктоза
Г) крахмал
104. Рибоза и дезоксирбоза относятся к:
Рибоза и дезоксирбоза относятся к:
А) триозам
Б) тетрозам
В) пентозам
Г) гексозам
105. Кетоизомером глюкозы является:
А) галактоза
Б) манноза
В) фруктоза
Г) сахароза
106. Гликоген – это:
А) моносахарид
Б) олигосахарид
В) гомополисахарид
Г) гетерополисахарид
Выберите один правильный ответ:
107. Указать ферменты, расщепляющие углеводы:
А) пепсин
Б) липаза
В) амилаза
Г) химотрипсин
108. Фермент участвующий в переваривании крахмала:
А) амилаза
Б) лактаза
В) мальтаза
Г) сахараза
109. В состав крахмала входит:
А) амилоза
Б) амилопектин
В) все перечисленные
Г) ни один из перечисленных
110. Углеводы всасываются в виде:
А) фруктозы
Б) глюкозы
В) сахарозы
Г) полисахаридов
111. Основное количество глюкозы утилизируется в процессе:
А) синтеза гликогена
Б) гликолиза
В) липолиза
Г) протеолиза
112. Переваривание углеводов происходит главным образом в:
Переваривание углеводов происходит главным образом в:
А) ротовой полости
Б) желудке
В) тонком кишечнике
Г) толстом кишечнике
113. Гликозилированный гемоглобин увеличивается в крови при:
А) лейкозе
Б) гиперурикемии
В) сахарном диабете
Г) костных заболеваниях
114. На углеводный обмен влияет:
А) инсулин
Б) адреналин
В) глюкагон
Г) все перечисленное
115. Глюкозурия является следствием:
А) гипогликемии
Б) гипергликемии
В) всех перечисленных состояний
Г) ни одного из названных состояний
Выберите один правильный ответ:
116. К кетоновым телам относятся:
А) ацетоуксусная кислота
Б) -оксимасляная кислота
В) ацетон
Г) все перечисленное
117. Глюконеогенез — это синтез глюкозы из:
А) лактата
Б) глицерина
В) пирувата
Г) все перечисленное верно
118. Депонирование гликогена происходит в:
А) мозге
Б) печени
В) крови
Г) костях
119. Ферменты, участвующие в переваривании сахарозы:
Ферменты, участвующие в переваривании сахарозы:
А) мальтаза
Б) лактаза
В) сахараза
Г) амилаза
120. Конечные продукты распада глюкозы в аэробных условиях:
А) ПВК
Б) СО2 и Н2 О
В) лактат
Г) этанол
121. Тест на гликозилированный гемоглобин может быть использован для:
А) диагностики сахарного диабета
Б) контроля за состоянием и лечением больных
В) дополнения к тесту толерантности к глюкозе
Г) все перечисленное верно
122. Ацетоновые тела синтезируются из:
А) глюкозы
Б) гликогена
В) ацетил-КоА
Г) билирубина
123. Кетоновые тела в крови вызывают:
А) алкалоз
Б) ацидоз
В) глюкозурию
Г) полиурию
124. Гормон, повышающий проницаемость клеточной мембраны для глюкозы:
А) адреналин
Б) инсулин
В) глюкагон
Г) глюкокортикоиды
Выберите один правильный ответ:
125. При образовании мочи в почках в норме глюкоза:
При образовании мочи в почках в норме глюкоза:
А) выводится с мочой
Б) реабсорбируется полностью
В) реабсорбируется частично
Г) не реабсорбируется
126. О состоянии углеводного обмена в организме судят по уровню в крови:
А) гликогена
Б) дезоксирибозы
В) глюкозы
Г) сахарозы
127. Глюкозурия – это:
А) повышение уровня глюкозы в крови
Б) появление глюкозы в моче
В) снижение уровня глюкозы в крови
Г) кетоновые тела в моче
128. Кетонурия – это:
А) появление глюкозы в моче
Б) появление кетоновых тел в моче
В) появление глюкозы в крови
Г) алкалоз
129. Увеличение в крови кетоновых тел способствует развитию:
А) алкалоза
Б) ацидоза
В) кетонурии
Г) глюкозурии
130. Основной функцией липидов является:
А) энергетическая
Б) защитная
В) транспортная
Г) пластическая
131. При полном распаде 1 г жира выделяется энергии:
При полном распаде 1 г жира выделяется энергии:
А) 8,3 ккал
Б) 9,3 ккал
В) 10,3 ккал
Г) 12,3 ккал
132. Мутность сыворотки обусловлена избытком:
А) холестерина
Б) фосфолипидов
В) ТАГ
Г) жирных кислот
133. К липидам относятся:
А) холестерин
Б) ТАГ
В) фосфолипиды
Г) все перечисленные
Выберите один правильный ответ:
134. К ненасыщенным жирным кислотам относятся:
А) олеиновая
Б) линолевая
В) леноленовая
Г) все перечисленные
135. Основной транспортной формой ТАГ являются:
А) хиломикроны
Б) ЛПНП
В) ЛПВП
Г) все перечисленное
136. Эмульгаторами жиров в организме являются:
А) холин
Б) креатинин
В) желчные кислоты
Г) глицерин
137. Общие свойства липидов:
А) гидрофобность
Б) гидрофильность
В) амфотерность
Г) все перечисленное верно
138. Холестерин является предшественником:
Холестерин является предшественником:
А) стероидных гормонов
Б) витамина Д
В) желчных кислот
Г) всех перечисленных веществ
139. На уровень холестерина крови влияет
А) возраст
Б) гормональный статус
В) характер питания
Г) все перечисленное верно
140. Всасывание липидов происходит преимущественно в:
А) полости рта
Б) желудке
В) 12-ти перстной кишке
Г) тонкой кишке
141. Липопротеины состоят из:
А) белков и углеводов
Б) белков и липидов
В) глицерина и жирных кислот
Г) углеводов и липидов
142. Высокую активность липолитических ферментов в слизистой оболочке тонкого кишечника обеспечивает среда:
А) кислая
Б) слабощелочная
В) нейтральная
Г) все перечисленные
Выберите один правильный ответ:
143. Для оценки состояния липидного обмена следует провести определение
А) холестерина
Б) ТАГ
В) ЛПВП
Г) все перечисленное верно
144. Антиатерогенным эффектом обладают:
Антиатерогенным эффектом обладают:
А) холестерин
Б) ЛПНП
В) ЛПВП
Г) ЛПОНП
145. Снижение ЛПВП характерно для:
А) больших регулярных физических нагрузок
Б) цирроза печени
В) ожирения
Г) алкоголизма
146. Желчные кислоты способствуют:
А) эмульгированию пищевых жиров
Б) активированию липазы
В) все перечисленное верно
Г) все перечисленное неверно
147. Для переваривания фосфолипидов в желудочно-кишечном тракте необходим фермент:
А) фосфолипаза
Б) декарбоксилаза
В) амилаза
Г) трансаминаза
148. К патологии липидного обмена относится:
А) гипербилирубинемия
Б) глюкозурия
В) гиперпротеинемия
Г) гиперлипемия
149. Подобрать соответствующий состав для липопротеинов высокой плотности:
А) 90 % ТАГ и 2% белков
Б) 50 % эфиры холестерина и холестерин
В) 50 % белка, 20 % эфиры холестерина и холестерин
Г) 10% белка и 50-55% ТАГ
150. Хиломикроны необходимы для транспорта липидов:
Хиломикроны необходимы для транспорта липидов:
А) из стенки кишечника в лимфу и кровь
Б) из печени в кровь
В) из просвета кишечника в стенку кишечника
Г) от клеток тканей к клеткам печени
Белки — тест с ответами
Проверить усвоенные знания студентов можно различными способами, но быстрее всего это получится с помощью теста. На этой странице представлен тест по биологии на тему Белки. В тесте правильные варианты ответов выделены символом [+].
Какое количество известных аминокислот участвуют в синтезе белка:
[+] а) 20
[-] б) 30
[-] в) 100
[-] г) 200.
Какая часть молекул аминокислот отвечает за функцию различения их друг от друга:
[+] а) радикал
[-] б) карбоксильная группа
[-] в) жирная кислота
[-] г) аминная группа.
Какой белок был первым из синтезирован искусственно.
[+] а) инсулин
[-] б) каталаза
[-] в) гемоглобин
[-] г) интерферон
С помощью какой химической связи происходит соединение аминокислот между собой в молекуле белка первичной структуры?
[-] а) дисульфидная
[+] б) пептидная
[-] в) водородная.
Какой белок выполняет ферментативную функцию.
[-] а) гормон роста
[-] б) фибрин
[-] в) инсулин
[-] г) актин
[+] д) трипсин
Где происходит синтез белка?
[-] а) в хлоропластах
[-] б) в митохондриях
[+] в) в рибосомах
[-] г) в эндоплазматической сети.
Что из ниже перечисленного относится к аминокислотам?
[-] а) тубулин, коллаген, лизоцим
[+] б) лизин, триптофан, аланин
[-] в) холестерин, прогестерон, стеариновая кислота
[-] г) валин, мальтаза, кератин
[-] д) сахароза, лактоза, глицин
[-] е) аденин, тимин, гуанин
Где находятся рибосомы:
[-] а) в хлоропластах
[-] б) в митохондриях
[+] в) в мембране эндоплазматической сети.
Какие органические соединения содержатся в клетке в наибольшем
[-] количестве (в % на сырую массу).
[-] а) углеводы
[-] б) липиды
[+] в) белки
[-] г) нуклеиновые кислоты
[-] д) низкомолекулярные органические вещества
Сколько энергии освобождается при расщеплении 1 г белка:
[+] а) 17,6 кДж
[-] б) 35,2 кДж.
Какой белок выполняет рецепторную функцию.
[-] а) лизоцим
[-] б) протромбин
[-] в) пепсин
[+] г) родопсин
В чем отличие ферментов от других белков?
[-] а) являются катализаторами химических реакций
[+] б) включают в свой состав витамины, металлы
[-] в) синтезируются на рибосомах.
Как называется структура белков, которая разрушается под действием солей тяжелых металлов.
[-] а) первичная
[-] б) вторичная
[+] в) третичная
Каковы главнейшие функции белков?
[+] а) транспортная
[+] б) защитная
[+] в) каталитическая
[+] г) строительная.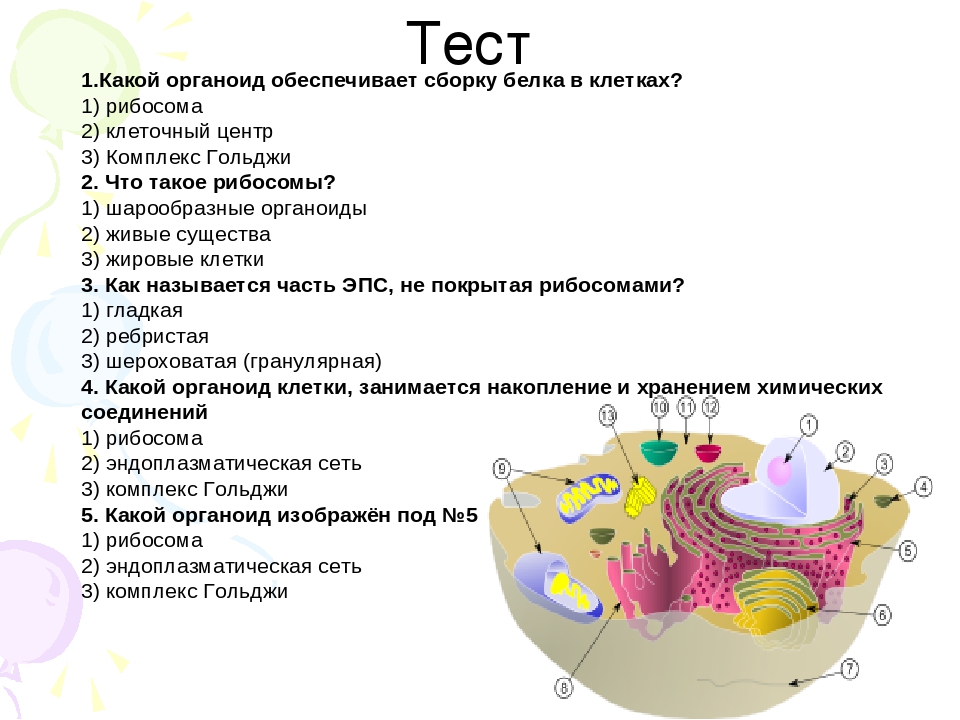
Благодаря чему разные белки похожи друг на друга?
[-] а) количество аминокислот
[-] б) количественное соотношение аминокислот разных видов
[-] в) последовательность соединения аминокислот друг с другом
[+] г) структура химических связей, участвующих в формировании
[-] д) последовательности аминокислот
Какой белок выполняет в основном строительную функцию?
[+] а) кератин
[-] б) липаза
[-] в) каталаза
[-] г) гормон роста
[-] д) нуклеаза
Между какими функциональными группами соседних аминокислот в белке образуется пептидная связь?
[-] а) радикалы
[-] б) карбоксильные группы
[+] в) карбоксильная группа и аминогруппа
[-] г) карбоксильная группа и радикал
[-] д) радикал и ион водорода
[-] е) аминогруппа и радикал
Какой белок выполняет по большей степени транспортную функцию?
[-] а) коллаген
[+] б) гемоглобин
[-] в) кератин
[-] г) миоглобин
[-] д) фибрин
Какой из данных белков выполняет ферментативную функцию?
[+] а) каталаза
[-] б) глюкагон
[-] в) протромбин
[-] г) кератин
[-] д) тубулин
Какую основную функцию выполняют такие белки – кератин, коллаген, тубулин?
[-] а) двигательная
[-] б) транспортная
[-] в) защитная
[+] г) строительная
[-] д) ферментативная
В каком из данных вариантов все химические соединения являются белками?
[+] а) сахароза, инсулин, урацил
[-] б) фенилаланин, глюкагон, пепсин
[-] в) глюкоза, фруктоза, гликоген
[-] г) каталаза, глюкагон, кератин
[-] д) рибоза, тимин, актин
Что из ниже перечисленного является белком волос?
[+] а) кератин
[-] б) миозин
[-] в) актин
[-] г) тубулин
[-] д) коллаген
[-] е) фибрин
Какое количество видов аминокислот входит в состав природных белков?
[-] а) 10
[+] б) 20
[-] в) 46
[-] г) 15
[-] д) 25
[-] е) 64
Название процесса образования первичной структуры белка?
[-] а) транскрипция
[-] б) диссимиляция
[+] в) трансляция
[-] г) полимеризация
[-] д) редупликация
Какой белок выполняет в основном двигательную функцию?
[+] а) актин
[-] б) каталаза
[-] в) фибрин
[-] г) липаза
[-] д) тромбин
[-] е) миоглобин
Функция, которую выполняет основная масса белков семян растений и яйцеклеток животных:
[-] а) защитная
[-] б) двигательная
[-] в) строительная
[-] г) ферментативная
[+] д) запасающая
Выберите ряд, в котором все названные химические соединения являются белками:
[-] а) сахароза, инсулин, урацил
[-] б) фенилаланин, глюкагон, пепсин
[-] в) глюкоза, фруктоза, гликоген
[+] г) каталаза, глюкагон, кератин
[-] д) рибоза, тимин, актин
Отметьте признак, по которому все данные химические соединения, кроме одного, объединены в одну группу. Отметьте это «лишнее» среди них химическое соединение.
Отметьте это «лишнее» среди них химическое соединение.
[-] а) аланин
[+] б) актин
[-] в) валин
[-] г) лейцин
[-] д) глицин
[-] е) цистеин
[-] ж) триптофан
Какой белок выполняет ферментативную функцию?
[+] а) каталаза
[-] б) глюкагон
[-] в) протромбин
[-] г) кератин
[-] д) тубулин
Какой белок входит в состав микротрубочек жгутиков и ресничек, центриолей и веретена движения?
[-] а) кератин
[-] б) миозин
[+] в) тубулин
[-] г) коллаген
Отметьте белок волос.
[+] а) кератин
[-] б) миозин
[-] в) актин
[-] г) тубулин
[-] д) коллаген
[-] е) фибрин
Мономером белков является:
[-] а) глюкоза
[-] б) нуклеиновая кислота
[-] в) нуклеотид
[-] г) азотистое основание
[+] д) аминокислота
___ видов аминокислот входит в состав природных белков?
[-] а) 10
[+] б) 20
[-] в) 46
[-] г) 15
[-] д) 25
[-] е) 64
Выберите, что происходит с третичной структурой транспортных и ферментативных белков в момент выполнения ими своих функций?
[-] а) не изменяется
[-] б) разрушаются
[+] в) слегка видоизменяется
[-] г) усложняется
[-] д) приобретает четвертичную структуру
[-] е) переходит во вторичную структуру
ИЗ какого белка состоят рога, копыта, когти, перья и волоса животных?
[-] а) коллаген
[-] б) тубулин
[+] в) кератин
[-] г) миозин
Отметьте белок, который был первым из синтезирован искусственно.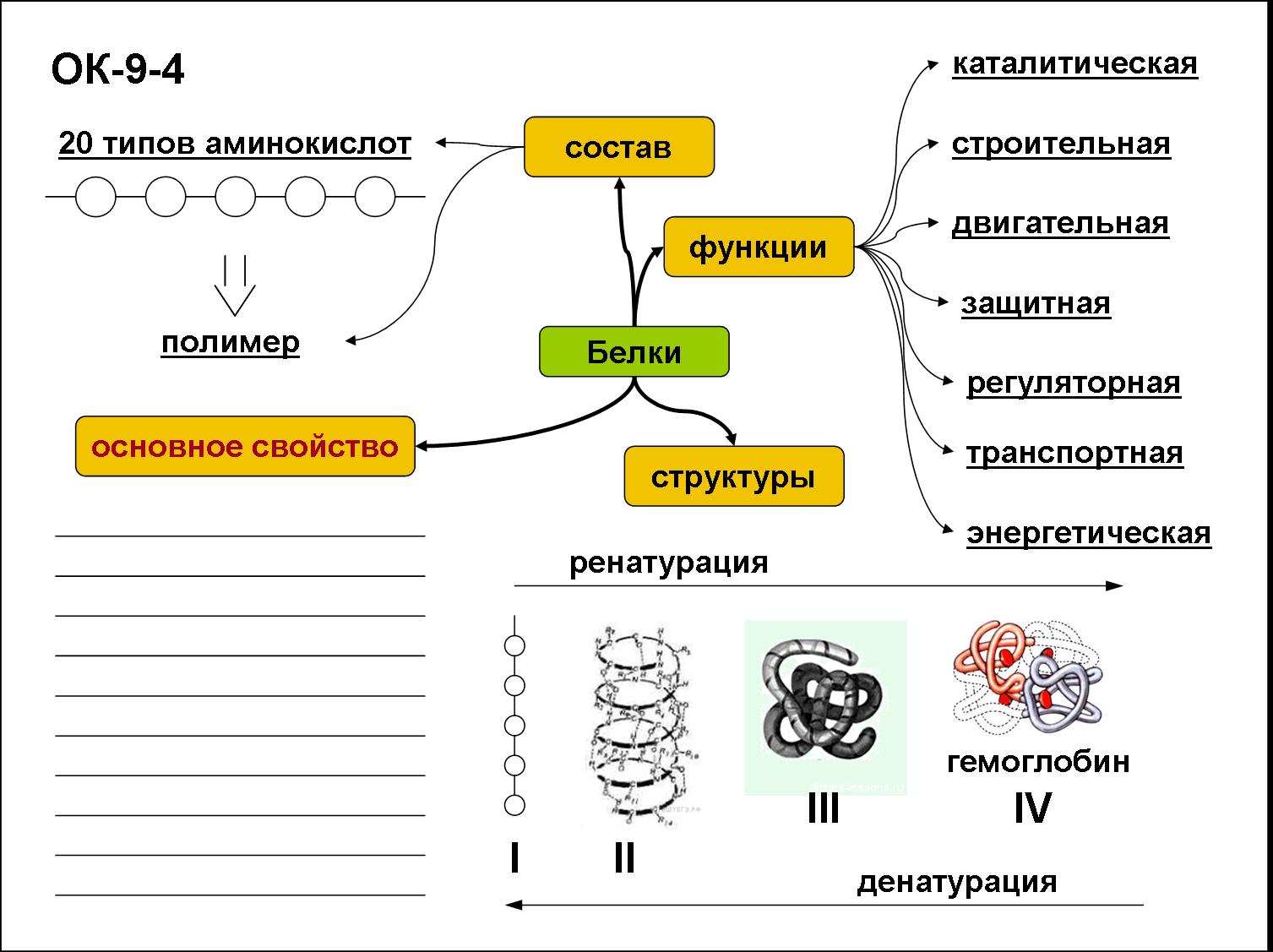
[+] а) инсулин
[-] б) каталаза
[-] в) гемоглобин
[-] г) интерферон
Выберите белок, состоящий из нескольких полипептидных цепей.
[-] а) трипсин
[-] б) миоглобин
[-] в) пепсин
[+] г) коллаген
Выберите все химические группировки, одинаковые у всех аминокислот, входящих в состав природных белков.
[-] а) только аминогруппа и карбоксильная группа
[-] б) водород и радикал
[+] в) водород, аминогруппа и карбоксильная группа
[-] г) радикал, аминогруппа и карбоксильная группа
Потеря белком своей естественной пространственной структуры:
[-] а) спирализация
[-] б) дисперсия
[-] в) конденсация
[-] г) репарация
[+] д) денатурация
[-] е) дегенерация
Этот белок составляет основу сухожилий, связок и межклеточного вещества костной ткани.
[-] а) кератин
[+] б) коллаген
[-] в) тубулин
[-] г) актин
[-] д) миозин
[-] е) фибрин
| 1. |
Установи соответствие триплетов иРНК и ДНК
Сложность: лёгкое |
1 |
| 2. |
Установи соответствие антикодона тРНК триплету ДНК
Сложность: лёгкое |
1 |
3.
|
Определи триплет ДНК
Сложность: лёгкое |
1 |
| 4. |
Определи аминокислоту по антикодону
Сложность: лёгкое |
1,5 |
5.
|
Что необходимо для сборки молекул белка в клетке?
Сложность: лёгкое |
1,5 |
| 6. |
Заполни пропуск в таблице
Сложность: среднее |
1,5 |
7.
|
Определи число нуклеотидов, кодирующих белок
Сложность: среднее |
2 |
| 8. |
Дополни текст «Биосинтез белка»
Сложность: среднее |
2 |
9.
|
Установи последовательность нуклеотидов ДНК по иРНК
Сложность: сложное |
3 |
| 10. |
Комплементарность триплетов тРНК и иРНК
Сложность: сложное |
3 |
11.
|
Запиши кодон, комплементарный антикодону
Сложность: сложное |
3 |
30 вопросов по биологии за 10 класс. | Биология
30 вопросов по биологии за 10 класс.
1..Живое отличается от неживого:А) составом неорганических веществ
С) обменом веществ
В) наличием катализаторов
Д) взаимодействием молекул друг с другом
2. Основными веществами в живых организмах являются:
A) Углеводы.
B) Витамины.
C) Жиры.
D) Белки.
3. Биологической системой называют:
Биологической системой называют:
А) объединение однородных клеток
С) несколько рядом расположенных органов
В) органы живого организма
Д) любые биологические объекты
4. Межвидовые отношения начинают проявляться:
A) На биогеоценотическом уровне.
B) На популяционно-видовом уровне.
C) На организменном уровне.
D) На биосферном уровне.
5. Предметом изучения биологии является:
A) Строение и функции организма.
B) Природные явления.
C) Закономерности развития и функционирования живых систем.
D) Строение и функции растений и животных.
6. В 1988 году вышел 4-томный труд А.А.Слудского и А.Бекенова:
A) «Флора Казахстана».
B) «Заповедники Казахстана».
C) «Биологические открытия Казахстана».
D) «Млекопитающие Казахстана»
7. К прокариотам относятся:
А) растения
В) животные
С) грибы
Д) бактерии и цианобактерии
8. Только у прокариот встречаются органоиды:
А) пластиды
С) клеточный центр
В) митохондрии
Д) рибосомы
9. Рибосомы участвуют в синтезе:
Рибосомы участвуют в синтезе:
А) АТФ
В) белков
С) липидов
Д) углеводов
10. Размножение — это процесс: А) увеличения числа клеток;
В) воспроизведения себе подобных;
С) развития организмов в процессе эволюции;
Д) усложнения строения и функций органов
11. Набор половых хромосом у мужчин:
А) XX;
В) XY;
С) ХО;
Д) YY.
12. Клетка — структурная и функциональная единица живого, так как:
А) в состав клетки входит около 70 химических элементов;
В) все белки клеток построены из 20 аминокислот;
С) в клетках непрерывно идут процессы биологического синтеза и распада;
Д) все живые организмы, кроме вирусов, построены из клеток.
13. Тип деления клеток, в результате которого образуются половые клетки:
А) Амитоз;
В) мейоз;
С) амитоз;
Д) биоценоз.
14. При каком клеточном делении количество хромосом не уменьшается?
А) митоз;
В) митоз и мейоз;
С) мейоз и амитоз;
Д) мейоз.
15. Белки — биологические полимеры, мономерами которых являются:
А) нуклеотиды;
В) аминокислоты;
С) пептиды;
Д) моносахариды.
16. Какое число хромосом у человека?
А) 46;
В) 25;
С) 47;
Д) 48
17. Уровень, являющийся высшим уровнем организации жизни:
А) биосферный;
В) биогеоценотический;
С) популяционно-видовой;
Д) организменный.
18. Ядро – это :
А) двумембранная структура;
В) одномембранная структура;
С) немембранная структура;
Д) трехмембранная структура.
19. Ассимиляция – это процесс:
А) катализа;
В) распада;
С) биосинтеза;
Д) гидролиза.
20. В реакциях распада веществ:
А) энергия накапливается;
В) энергия не изменяется;
С) энергия выделяется;
Д) энергия сохраняется.
21. Один триплет ДНК содержит информацию:
А) о последовательности аминокислот в белке;
В) об одном признаке организма;
С) об одной аминокислоте, включаемой в белковую цепь;
Д) о начале синтеза и-РНК,
22. Количество этапов в энергетическом обмене:
Количество этапов в энергетическом обмене:
А) один;
В) два;
С) три;
Д) четыре.
23. Автотрофные организмы получают энергию:
А) за счет органических веществ, синтезированных из неорганических;
В) из готовых органических веществ;
С) за счет распада неорганических веществ;
Д) за счет распада воды.
24. К гормонам не относится:
А) инсулин;
В) окситоцин;
С) меланин;
Д) прогестерон.
25. Индивидуальное развитие организма называется:
А) филогенез;
В) овогенез;
С) метаморфоз;
Д) онтогенез.
26. У всех цветковых растений происходит:
А) двойное оплодотворение;
В) двойное опыление;
С) простое оплодотворение;
Д) тройное оплодотворение.
27. Оплодотворенная яйцеклетка называется:
А) гамета;
В) гаструла;
С) бластула;
Д) зигота.
28. Нервная система, органы чувств, эпителий кожи, зубная эмаль образуются во время органогенеза:
А) из эктодермы;
В) из мезодермы;
С) из энтодермы;
Д) из гаструлы.
29. Способность организма на должном уровне поддерживать постоянство своего строения и функциональных возможностей называется:
А) гомеостаз;
В) раздражимость;
С) онтогенез;
Д) обмен веществ.
30. Заключительной фазой в митозе является:
А) анафаза;
В) профаза;
С) телофаза;
Д) метафаза.
1С 16А
2С 17А
3А 18В
4С 19В
5В 20В
6Д 21А
7Д 22В
8Д 23В
9С 24А
10А 25В
11Д 26А
12С 27А
13С 28А
14В 29Д
15Д 30Д
Порядок вывода комментариев: По умолчаниюСначала новыеСначала старые
Тест по биологии Химический состав клетки 9 класс
Тест по биологии Химический состав клетки 9 класс с ответами. Тест включает в себя 40 тестовых заданий.
1. Содержание воды в клетке в среднем составляет (в процентах от массы)
1) 1-2
2) 5-10
3) 30-40
4) 70-80
2. Содержание минеральных солей в клетке в среднем составляет (в процентах от массы)
1) 1-2
2) 5-10
3) 30-40
4) 70-80
3. К группе макроэлементов относится
К группе макроэлементов относится
1) кальций
2) цинк
3) медь
4) марганец
4. К группе микроэлементов относится
1) калий
2) фосфор
3) железо
4) иод
5. Скелет молекулы органического вещества состоит
1) из кислорода
2) из водорода
3) из углерода
4) из азота
6. В молекулах органических веществ углерод проявляет валентность
1) I
2) II
3) III
4) IV
7. Среди углеводов много полимеров. Их мономерами являются
1) простые сахара
2) аминокислоты
3) липиды
4) микроэлементы
8. Мономерами белков являются
1) простые сахара
2) аминокислоты
3) липиды
4) микроэлементы
9. Аминокислоты входят в состав
1) глюкозы
2) целлюлозы
3) белков
4) жиров
10. Глицерин входит в состав
1) глюкозы
2) целлюлозы
3) белков
4) жиров
11. Мономерами белка являются
Мономерами белка являются
1) углеводы
2) нуклеотиды
3) нуклеиновые кислоты
4) аминокислоты
12. Мономерами нуклеиновых кислот являются
1) углеводы
2) нуклеотиды
3) белки
4) аминокислоты
13. Число аминокислот, встречающихся в живых организмах, составляет около
1) 20
2) 50
3) 150
4) 250
14. Число аминокислот, участвующих в построении молекул белка, составляет
1) 20
2) 50
3) 150
4) 250
15. Первичная структура белка представляет собой
1) длинную цель аминокислот
2) спирально закрученную нить
3) шарообразную структуру — глобулу
4) агрегат из нескольких глобул
16. Вторичная структура белка представляет собой
1) длинную цепь аминокислот
2) спирально закрученную нить
3) шарообразную структуру — глобулу
4) агрегат из нескольких глобул
17. Третичная структура белка представляет собой
1) длинную цепь аминокислот
2) спирально закрученную нить
3) шарообразную структуру — глобулу
4) агрегат из нескольких глобул
18. Четвертичная структура белка представляет собой
Четвертичная структура белка представляет собой
1) длинную цепь аминокислот
2) спирально закрученную нить
3) шарообразную структуру — глобулу
4) агрегат из нескольких глобул
19. Нарушение естественной структуры белка в результате сильного внешнего воздействия носит название
1) конформация
2) денатурация
3) ренатурация
4) полимеризация
20. Восстановление естественной структуры белка и его функций носит название
1) конформация
2) денатурация
3) ренатурация
4) полимеризация
21. Вид туго скрученной спирали характерен
1) для первичной структуры белка
2) для вторичной структуры белка
3) для третичной структуры белка
4) для четвертичной структуры белка
22. Длинная неразветвленная цепочка аминокислот формирует
1) первичную структуру белка
2) вторичную структуру белка
3) третичную структуру белка
4) четвертичную структуру белка
23. В результате объединения друг с другом нескольких глобул формируется
В результате объединения друг с другом нескольких глобул формируется
1) первичная структура белка
2) вторичная структура белка
3) третичная структура белка
4) четвертичная структура белка
24. В результате упаковки спирали в компактный клубок формируется
1) первичная структура белка
2) вторичная структура белка
3) третичная структура белка
4) четвертичная структура белка
25. В составе ДНК отсутствует азотистое основание
1) аденин
2) тимин
3) урацил
4) цитозин
26. В составе РНК отсутствует азотистое основание
1) аденин
2) тимин
3) урацил
4) цитозин
27. В молекуле ДНК аденин комплементарен
1) аденину
2) тимину
3) гуанину
4) цитозину
28. В молекуле ДНК цитозин комплементарен
1) аденину
2) тимину
3) гуанину
4) цитозину
29. О химическом составе клетки в целом можно сказать следующее:
1) клетки различных организмов характеризуются сходством химического состава
2) клетки различных организмов принципиально различны по химическому составу
3) содержание минеральных солей в клетке невелико
4) количество минеральных солей в клетке составляет десятки процентов
5) содержание макроэлементов в клетке велико
6) содержание макроэлементов в клетке незначительно
30. О химическом составе клетки в целом можно сказать следующее:
О химическом составе клетки в целом можно сказать следующее:
1) в клетке содержится много воды
2) содержание воды в клетке невелико
3) в клетке содержится большое количество сложных органических веществ
4) содержание органических веществ в клетке исчисляется единицами процентов
5) микроэлементы присутствуют в клетке в незначительном количестве
6) содержание микроэлементов в клетке велико
31. Для углеводов характерны следующие особенности строения и функции:
1) многие являются полимерами
2) являются полимерами аминокислот
3) все представители нерастворимы в воде
4) в клетке выполняют защитную функцию
5) в клетке выполняют резервную функцию
6) содержат остатки молекул глицерина
32. Для углеводов характерны следующие особенности строения и функции:
1) многие не являются полимерами
2) содержат остатки молекул жирных кислот
3) обязательный компонент всех клеточных мембран
4) могут быть растворимы в воде
5) могут иметь сладкий вкус
6) в клетке выполняют энергетическую функцию
33. Для липидов характерны следующие особенности строения и функций:
Для липидов характерны следующие особенности строения и функций:
1) не растворяются в воде
2) молекулы являются полимерами
3) наиболее распространёнными представителями являются пентозы и гексозы
4) входят в состав клеточных мембран
5) в клетке выполняют резервную функцию
6) могут содержать остатки молекул жирных кислот
34. Для липидов характерны следующие особенности строения и функций:
1) растворяются в органических растворителях
2) в клетке выполняют энергетическую функцию
3) хорошо растворимы в воде
4) могут выполнять защитную функцию
5) могут содержать остатки молекул глицерина
6) состоят из молекул моносахаридов
35. Укажите, какие химические элементы относятся к названным группам. Установите соответствие.
1) макроэлементы
2) микроэлементы
а) водород
б) медь
в) фосфор
г) кислород
д) иод
е) железо
36. Укажите, какие химические элементы относятся к названным группам. Установите соответствие.
Установите соответствие.
1) макроэлементы
2) микроэлементы
а) углерод
б) азот
в) кобальт
г) марганец
д) сера
е) калий
37. Установите соответствие между веществами и строением их молекул.
1) полимеры
2) неполимеры
а) пентозы
б) целлюлоза
в) глюкоза
г) фосфолипиды
д) гликоген
е) белки
38. Установите соответствие между веществами и строением их молекул.
1) полимеры
2) не полимеры
а) нуклеиновые кислоты
б) гексозы
в) липиды
г) крахмал
д) простые сахара
е) жиры
39. Установите соответствие между нуклеиновой кислотой и её биологическими особенностями.
1) ДНК
2) РНК
а) является посредником между хранителем наследственной информации и белком
б) хранит наследственную информацию
в) входит в состав рибосом
г) осуществляет транспорт аминокислот
д) молекула имеет форму спирали
е) состоит из двух цепочек
40. Установите соответствие между нуклеиновой кислотой и её биологическими особенностями.
Установите соответствие между нуклеиновой кислотой и её биологическими особенностями.
1) ДНК
2) РНК
а) молекула представлена одной цепочкой
б) входит в состав хромосом
в) способна к удвоению
г) содержит информацию о структуре одного белка
д) осуществляет репликацию
е) встречается в виде молекул трёх типов
Ответы на тест по биологии Химический состав клетки
1-4
2-1
3-1
4-4
5-3
6-4
7-1
8-2
9-3
10-4
11-4
12-2
13-3
14-1
15-1
16-2
17-3
18-4
19-2
20-3
21-2
22-1
23-4
24-3
25-3
26-2
27-2
28-3
29-135
30-135
31-145
32-1456
33-1456
34-1245
35. 1) авге, 2) бд
36. 1) абде, 2) вг
37. 1) бде, 2) авг
38. 1) аг, 2) бвде
39. 1) бде, 2) авг
40. 1) бвд, 2) аге
Состав и строение белков | Параграф 1.4
«Введение в общую биологию и экологию. 9 класс». А. А. Каменский (гдз)
А. Каменский (гдз)
Вопрос 1. Какие вещества называются белками или протеинами?
Белки (протеины) — это гетерополимеры, состоящие из 20 различных мономеров — природных альфа-аминокислот. Белки — нерегулярные полимеры.
Общее строение аминокислоты может быть представлено следующим образом:
R—С(NH2)—СООН. Все аминокислоты имеют аминогруппу (—МН2) и карбоксильную группу (—СООН) и различаются строением и свойствами радикалов. Аминокислоты в белке связаны пептидной
связью —N(Н)—С(=О), поэтому белки ещё называют пептидами.
Вопрос 2. Что такое первичная структура белка?
В молекуле белка аминокислоты связаны друг с другом пептидной связью между атомами углерода и азота. В строении молекулы белка различают первичную структуру — последовательность аминокислотных остатков.
Вопрос 3. Как образуются вторичная, третичная и четвертичная структуры белка?
Вторичная структура белка — как правило, это спиральная структура (альфа-спираль), которая удерживается множеством водородных связей, возникающих между находящимся близко друг от друга С=О и NН-группами. Другой тип вторичной структуры — это бета-слой, или складчатый слой; это две параллельные полипептидные цепи, связанные водородными связями, перпендикулярными цепям.
Другой тип вторичной структуры — это бета-слой, или складчатый слой; это две параллельные полипептидные цепи, связанные водородными связями, перпендикулярными цепям.
Третичная структура белковой молекулы — это пространственная конфигурация, напоминающая компактную глобулу. Она поддерживается ионными, водородными и дисульфидными (S=S) связями, а также гидрофобными взаимодействиями.
Четвертичная структура белка образуется при взаимодействии нескольких глобул, которые объединяются в комплекс (например, молекула гемоглобина состоит из четырех таких субъединиц).
Вопрос 4. Что такое денатурация белка?
Утрата белковой молекулой своей структуры называется денатурацией; она может быть вызвана повышением температуры, обезвоживанием, облучением и т.д. Если при денатурации первичная структура не нарушается, то при восстановлении нормальных условий полностью воссоздается структура белка. Если же действие фактора нарастает, разрушается и первичная структура белка — полипептидная цепь. Это уже необратимый процесс — восстановить структуру белок не может. Например, при высокой температуре (выше 42oС) в организме человека многие белки денатурируют необратимо.
Это уже необратимый процесс — восстановить структуру белок не может. Например, при высокой температуре (выше 42oС) в организме человека многие белки денатурируют необратимо.
Вопрос 5. По какому признаку белки делятся на простые и сложные?
Простые белки (протеины) состоят исключительно из аминокислот (альбумины, глобулины, кератин, коллаген, гистон и другие). В состав сложных белков могут входить другие органические вещества: углеводы (тогда они называются гликопротеидами), жиры (липопротеиды), нуклеиновые кислоты (нуклеопротеиды), фосфорная кислота (фосфопротеиды), при сочетании белка с каким-либо окрашенным веществом образуются так называемые хромопротеиды. Из хромопротеидов наиболее изучен гемоглобин – красящее вещество красных кровяных шариков (эритроцитов).
Биуретовый тест на белок – определение, принцип, процедура, результаты, применение
Что такое биуретовый тест?
Белки представляют собой сложные соединения, образованные тысячами аминокислот. Аминокислоты представляют собой амфотерные электролиты, имеющие карбоксильные и аминогруппы, которые действуют как кислота и основание. Он имеет один положительный заряд и один отрицательный заряд, поэтому эти ионы электрически нейтральны и не мигрируют в электрическом поле. Две аминокислоты связаны вместе с помощью связи, называемой пептидной связью, и это дает дипептид.Связь образуется между α-аминогруппой одной аминокислоты и α-карбоксильной группой другой аминокислоты с отщеплением молекулы воды. Образование пептидной связи называют реакцией конденсации. Точно так же три аминокислоты, соединенные вместе двумя пептидными связями, называются трипептидами, а когда цепь удлиняется, ее называют полипептидом. Биурет представляет собой соединение, образующееся при нагревании мочевины при 1800°С, что приводит к конденсации 2 молекул мочевины. Пептидные связи в биурете дают положительный результат теста, отсюда и название реагента.Он считается общим тестом для соединений (белков и пептидов), имеющих две или более пептидных (CO-NH) связей.
Аминокислоты представляют собой амфотерные электролиты, имеющие карбоксильные и аминогруппы, которые действуют как кислота и основание. Он имеет один положительный заряд и один отрицательный заряд, поэтому эти ионы электрически нейтральны и не мигрируют в электрическом поле. Две аминокислоты связаны вместе с помощью связи, называемой пептидной связью, и это дает дипептид.Связь образуется между α-аминогруппой одной аминокислоты и α-карбоксильной группой другой аминокислоты с отщеплением молекулы воды. Образование пептидной связи называют реакцией конденсации. Точно так же три аминокислоты, соединенные вместе двумя пептидными связями, называются трипептидами, а когда цепь удлиняется, ее называют полипептидом. Биурет представляет собой соединение, образующееся при нагревании мочевины при 1800°С, что приводит к конденсации 2 молекул мочевины. Пептидные связи в биурете дают положительный результат теста, отсюда и название реагента.Он считается общим тестом для соединений (белков и пептидов), имеющих две или более пептидных (CO-NH) связей.
Цели
- Для обнаружения белка в данном растворе.
- Для демонстрации наличия пептидной связи.
Принцип биуретового теста (Как работает биуретовый тест?)
Биуретовый тест — это химический тест, используемый для определения наличия пептидной связи в веществе. Он основан на биуретовой реакции, в которой пептидная структура, содержащая не менее двух пептидных звеньев, окрашивается в фиолетовый цвет при обработке щелочным сульфатом меди.В присутствии щелочного раствора окрашенный в синий цвет ион меди II может образовывать комплекс с пептидными связями, поскольку пептид имеет неподеленные электронные пары в азоте и кислороде воды. Окрашенный координационный комплекс образуется между ионом Cu2+ и карбонильным кислородом (>C=O) и амидным азотом (=NH) пептидной связи. Как только этот комплекс образовался, раствор меняет цвет с синего на фиолетовый. Чем глубже фиолетовый цвет, тем выше количество комплексов пептид-медь. Реакция протекает в любом соединении, содержащем не менее двух h3N-C, h3N-Ch3-, h3N-CS- или подобных групп, соединенных вместе непосредственно или через атом углерода или азота. Один ион меди, вероятно, связан координационными связями с 6 соседними пептидными связями. Интенсивность окраски прямо пропорциональна количеству пептидных связей, присутствующих в реагирующей белковой молекуле, а также количеству белковых молекул, присутствующих в реакционной системе.
Один ион меди, вероятно, связан координационными связями с 6 соседними пептидными связями. Интенсивность окраски прямо пропорциональна количеству пептидных связей, присутствующих в реагирующей белковой молекуле, а также количеству белковых молекул, присутствующих в реакционной системе.
Рисунок: Принцип биуретового теста. Источник изображения: Изучающий химию.
Биуретовый реагент представляет собой раствор, состоящий из гидроксида натрия (NaOH) или гидроксида калия (KOH), гидратированного сульфата меди (II) и тартрата калия-натрия.Гидроксид натрия и гидроксид калия обеспечивают щелочную среду, а тартрат калия-натрия добавляется к хелату и, таким образом, стабилизирует ионы двухвалентной меди в растворе или поддерживает их растворимость в щелочном растворе.
Процедура испытания биурета
- Возьмите 3 чистые и сухие пробирки.
- Добавьте по 1-2 мл тестового раствора, яичного альбумина и деионизированной воды в соответствующие пробирки.

- Внести во все пробирки по 1-2 мл реагента Биурет.
- Хорошо встряхните и дайте смеси постоять 5 минут.
- Следите за любым изменением цвета.
Результаты теста на биурет
Наблюдение | Интерпретация |
| Цвет не меняется, т. е. раствор остается синим | Белки отсутствуют (отрицательный биуретовый тест) |
| Раствор меняет цвет с синего на темно-фиолетовый | Белки присутствуют (положительный биуретовый тест) |
Биуретовый тест использует
- Может использоваться для определения количества белка в моче.
- Биуретовая реакция с белком применима для количественного определения общего белка с помощью спектрофотометрического анализа.
Ссылки
- Шреста Б. (2002 г.). Практическая биохимия и биотехнология. Первое издание. 99933-665-1-Х.

- Сатьянараяна У и Чакрапани У (2006). Биохимия. Uppala Автор-издатель Interlink. Третье издание. № страницы 43-67.
- https://study.com/academy/lesson/what-does-biuret-test-for-method-equation.HTML.
- 2% – https://www.slideshare.net/jammalavamsikrishna/amino-acids-71579203
- 2% – https://www.sciencedirect.com/topics/medicine-and-dentistry/biuret
- 2% – https://www.sciencedirect.com/science/article/pii/0009898175
4
- 2% – https://peptidesciences.com/information/peptide-bonds/
- 10% – https://onlinesciencenotes.com/biuret-test-principle-requirements-procedure-and-result-interpretation/
- 1% – https://quizlet.com/18722031/biology-chapter-5-flash-cards/
- 1% – https://microbiologyinfo.com/benedicts-test-principle-composition-preparation-procedure-and-result-interpretation/
- 1% – https://brainly.in/question/716138
- 1% – http://amrita.olabs.edu.in/?sub=79&brch=17&sim=205&cnt=1
- <1% — https://education.
 jlab.org/qa/charges_01.html
jlab.org/qa/charges_01.html
Что означает биуретовый тест в биологии? | Education
Эрик Бэнк, MBA, MS Finance
Биуретовый тест представляет собой химический анализ, определяющий присутствие белков в образце.Тест основан на изменении цвета, чтобы подтвердить наличие белков. Если белки обнаружены, образец станет фиолетовым. Забавно, но биуретовый тест не включает химический биурет, который получают из мочевины. Биурет не является белком, но дает положительный результат биуретовой пробы.
Биуретовый реагент
Биуретовый тест использует щелочную смесь или реагент, состоящий из гидроксида калия и сульфата меди. Нормальный цвет биуретового реагента — синий. Реагент становится фиолетовым в присутствии пептидных связей — химических связей, которые удерживают вместе аминокислоты.Обнаруженные белки должны иметь не менее трех аминокислот, что означает, что белок должен иметь не менее двух пептидных связей. Ионы меди реагента с зарядом +2 восстанавливаются до заряда +1 в присутствии пептидных связей, вызывая изменение цвета. Методы абсорбционной спектроскопии, определяющие электромагнитные частоты, которые будет поглощать образец, позволяют тестировщикам количественно определять концентрацию белка в образце.
Методы абсорбционной спектроскопии, определяющие электромагнитные частоты, которые будет поглощать образец, позволяют тестировщикам количественно определять концентрацию белка в образце.
Проведение теста
На практике тестировщики смешивают равные количества гидроксида калия и материала образца в пробирке.Если исследуемый материал твердый, как пища, его сначала разжижают или растворяют. Затем тестер добавляет несколько капель 1-процентного водного раствора сульфата меди, стараясь не встряхивать смесь. Фиолетовый цвет указывает на белок в образце. Ученые измеряют количество белка путем спектроскопии при длине волны 540 нанометров (нм).
Повышенная чувствительность
Ученые нашли способ модифицировать биуретовый тест и повысить его чувствительность.Анализ Смита увеличивает чувствительность в сотни раз. Он использует бицинхониновую кислоту в качестве источника меди и становится фиолетовым, когда присутствует белок. Спектроскопия при 562 нм показывает количество белка в образце.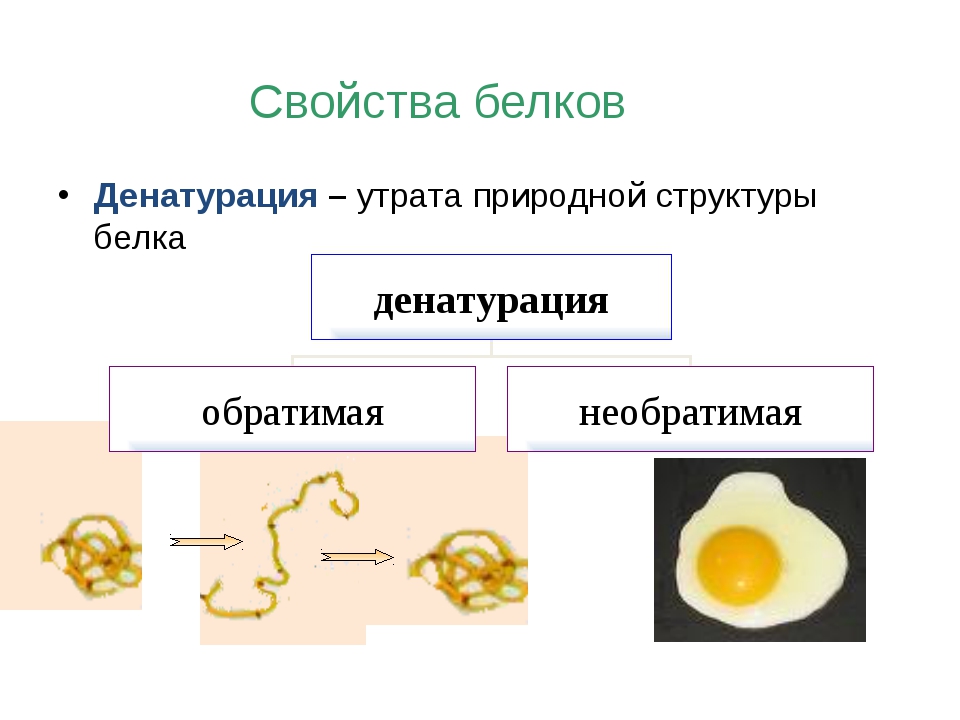 В анализе белка Лоури используются фосфатные соли элементов молибдена и вольфрама. Поглощение света с длиной волны 750 нм в спектроскопе указывает на концентрацию присутствующего белка.
В анализе белка Лоури используются фосфатные соли элементов молибдена и вольфрама. Поглощение света с длиной волны 750 нм в спектроскопе указывает на концентрацию присутствующего белка.
Заболевания, связанные с белками
Исследователи ожидают найти некоторое количество белка в моче человека.Однако если уровень многократно превышает норму, это может свидетельствовать о проблемах с почками. Другие возможные причины включают диабет, болезни сердца, высокое кровяное давление, лейкемию, волчанку и беременность. Чрезмерный уровень белка в крови может указывать на обезвоживание, хроническое воспаление или инфекцию. К более серьезным состояниям относятся ВИЧ/СПИД, множественная миелома, аномальные состояния костного мозга и амилоидоз. Высокобелковая диета не является причиной высокого уровня белка в крови или моче.
Ссылки
Ресурсы
Авторская биография
Эрик Бэнк, проживающий в Гринвилле, Южная Каролина, пишет статьи о бизнесе с 1985 года. в области финансов Университета ДеПола. Вы можете увидеть образцы его работ на ericbank.com.
Вы можете увидеть образцы его работ на ericbank.com.
Основной практический курс 3 — Тесты пищевых продуктов — Ферменты — Edexcel — GCSE Biology (Single Science) Revision — Edexcel
Существуют различные тесты, которые можно использовать для определения углеводов, белков и липидов в пищевых продуктах.
Цели
Исследовать использование химических реагентов для идентификации крахмала, восстанавливающих сахаров, белков и жиров.
Йодный тест на крахмал
Метод:
- Поместите один шпатель образца пищевого продукта на блюдо или 1 см 0.$0.$2.$2.$0.$1″> 3 , если образец жидкий.
- С помощью пипетки нанесите на пищу несколько капель раствора йода.
- Запишите любое изменение цвета раствора.
Крахмал определяют раствором йода.Это превращает в сине-черный в присутствии крахмала.
Проверка риса на наличие крахмала.Тест Бенедикта на редуцирующие сахара
- Поместите два шпателя образца пищевого продукта в пробирку или 1 см 3 , если образец жидкий. Добавьте в пробирку примерно 1 см 0.$0.$3.$1.$0.$3″> 3 глубины воды и перемешайте.
- Добавьте равный объем раствора Бенедикта и перемешайте.
- Поместите пробирку на несколько минут в водяную баню при температуре около 95°C.
- Запишите цвет раствора.
Редуцирующие сахара обнаруживаются с помощью раствора Бенедикта.
Редуцирующие сахара включают:
- моносахариды, такие как глюкоза и фруктоза
- дисахариды, такие как мальтоза.
Раствор Бенедикта постепенно меняет цвет с синего на 14jkjtrrbi4.0.0.0.1:0.1.0.$0.$3.$5.$1″> мутно-оранжевый или кирпично-красный при нагревании с восстанавливающим сахаром. Сахароза является невосстанавливающим сахаром и не реагирует с раствором Бенедикта.
Биуретовый тест на белки
- Поместите один-два шпателя пробы пищевого продукта в пробирку или на 1 см 3 , если проба жидкая.Добавьте в пробирку примерно 1 см 3 глубины воды и перемешайте.
- Добавьте в пробирку равный объем раствора гидроксида калия и перемешайте.
- Добавьте две капли раствора сульфата меди и перемешивайте в течение двух минут.

- Запишите цвет раствора.
Белки выявляются с помощью биуретового реагента. При смешивании с белком он приобретает лиловый цвет или фиолетовый цвет .
Эмульсионный тест на липиды
- Поместите два шпателя образца пищевого продукта в пробирку или 1 см 3 , если образец жидкий.
- Добавьте в пробирку 2 см 3 этанола. Закройте конец пробирки и энергично встряхните пробирку.
- $2″> Дайте содержимому отстояться.
- Перелейте жидкость из верхней части смеси в пробирку, наполовину заполненную водой.
- Запишите уровень пищи и прозрачную или мутную воду.
Липиды определяются с помощью эмульсионного теста. Вот что получается:
- Тестируемое вещество смешивают с 2 см 3 этанола.
- Добавляется равное количество дистиллированной воды.
- молочно-белая эмульсия образуется, если испытуемое вещество содержит липиды.

Опасности
- Гидроксид калия может нанести вред коже и глазам.
- Горячая вода может ошпарить.
Меры контроля
- Использовать защитные очки.
- Не пробуйте продукты.
- Будьте осторожны с горячей водой.
- Немедленно смывайте любые брызги.
РЕЗУЛЬТАТЫ
Цвет наблюдается в конце теста:
| еда | тест на йод | тест на Бенедикт | тест на Бенедикт | тест на бидикт | тест-эмульсионные липид | говядина | оранжевый коричневый | 14jkjtrrbi4.0.0.0.1:0.1.0.$0.$5.$10.$2.$0.$2″> Blue | фиолетовый | 1 Brown | 37 Blue97 Blue9Blue-Black |
|---|---|---|---|---|---|
| Сухие завтраки | Сине-черный | Оранжевый | 14jkjtrrbi4.0.0.0.1:0.1.0.$0.$5.$10.$2.$3.$3″> Синий | Молочно-белый |
Выводы
Изменения цвета показывают, что говядина является единственным продуктом питания.Говядина, растительное масло и сухие завтраки содержат липиды. И рис, и сухие завтраки содержат крахмал. Хлопья для завтрака — единственный проверенный продукт, который содержит редуцирующие сахара.
Эксперименты по пищевой химии
Индекс экспериментов по пищевой химии
1. Сахар с раствором Бенедикта. 2. Белок с раствором биурета. 3. Жир с окраской Суданом III. 4. Витамин С с реагентом витамина С. 5. Сколько сахара в моей газировке?
Использование простых химических индикаторов
Мы можем проверить наличие этих важных соединений в пище, используя химические реагенты, которые реагируют предсказуемым образом в присутствии этих питательных веществ.
Работайте в местах, пригодных для работы с химическими веществами, которые могут испачкать мебель или пол в случае их проливания. Носите надлежащее защитное оборудование, включая защитные очки, резиновые перчатки и лабораторный фартук.
Ниже описаны только основные процедуры тестирования, необходимые для использования этих тестовых растворов. Вы можете расширить их и разработать свой собственный проект тестирования пищевых продуктов.
Необходимые материалы:
Пищевой тест 1: сахарный тест-раствор Бенедикта
Раствор Бенедикта используется для определения простых сахаров, таких как глюкоза.Это прозрачный раствор солей натрия и меди голубого цвета. В присутствии простых сахаров синий раствор меняет цвет на зеленый, желтый и кирпично-красный в зависимости от количества сахара.Что делать.
- Смешайте небольшое количество каждого образца пищевого продукта с дистиллированной водой, чтобы получить тестовую жидкость.
- В пробирку добавьте 40 капель тестируемой жидкости.

- При тестировании более одной жидкости пометьте каждую пробирку маркером.
- Добавьте в каждую пробирку по 10 капель раствора Бенедикта.Осторожно нагрейте пробирки, поместив их в ванну с горячей водой при температуре около 40-50 градусов Цельсия на пять минут.
- Обратите внимание на любое изменение цвета. Если присутствует сахар, раствор станет зеленым, желтым или кирпично-красным, в зависимости от концентрации сахара.
Пищевой тест 2: белок – раствор биурета
Раствор биурета используют для выявления наличия белка. Биуретовый реактив представляет собой раствор синего цвета, который при взаимодействии с белком меняет цвет на розово-фиолетовый.Что делать.
- В пробирку добавьте 40 капель тестируемой жидкости.
- При тестировании более одной жидкости пометьте каждую пробирку маркером.
- Добавьте в каждую пробирку по 3 капли раствора реагента биурета. Аккуратно встряхните, чтобы перемешать.

- Обратите внимание на любое изменение цвета. Белки окрасят раствор в розовый или фиолетовый цвет.
Пищевой тест 3: жир – пятно Судана III
Судан III используется для определения наличия липидов в жидкостях.Он окрашивает жировые клетки в красный цвет.Что делать.
- В пробирку налейте равные части тестовой жидкости и воды, чтобы заполнить ее примерно наполовину.
- При тестировании более одной жидкости пометьте каждую пробирку маркером.
- Добавьте по 3 капли красителя Судана III в каждую пробирку. Аккуратно встряхните, чтобы перемешать.
- При наличии жира слой масла с красными пятнами будет отделяться и плавать на поверхности воды.
Пищевой тест 4: витамин С
Индикаторный раствор реагента витамина С (дихлорфенолиндофенол) окрашен в синий цвет.Бесцветная конечная точка достигается при добавлении к этому индикатору раствора, содержащего витамин С (например, апельсинового сока).
Что делать.
Сначала приготовьте тестовый раствор, измельчив таблетку реагента витамина С в порошок с помощью ступки и пестика или тыльной стороны ложки. Насыпьте порошок в бутылку-капельницу и добавьте 30 мл (1 унцию) дистиллированной воды.
При тестировании более одной жидкости пометьте каждую пробирку маркером. Наполните каждую 50 каплями синего индикаторного раствора витамина С.
Теперь добавляйте сок по одной капле к индикаторному раствору в пробирке.
Считайте капли, пока темно-синий цвет не станет прозрачным. Это ваша конечная точка.
Сравните разные соки. Те, которым требуется больше капель для достижения конечной точки очистки, содержат МЕНЬШЕ витамина С.
Пищевой тест 5: сколько сахара в моей газировке?
Чтобы измерить количество сахара в растворе, будь то сок, кока-кола и т. д., вы используете ареометр Брикса, называемый Бриксом, так как в пищевой промышленности этот термин используется для обозначения процентного содержания сахара, содержащегося в жидкости.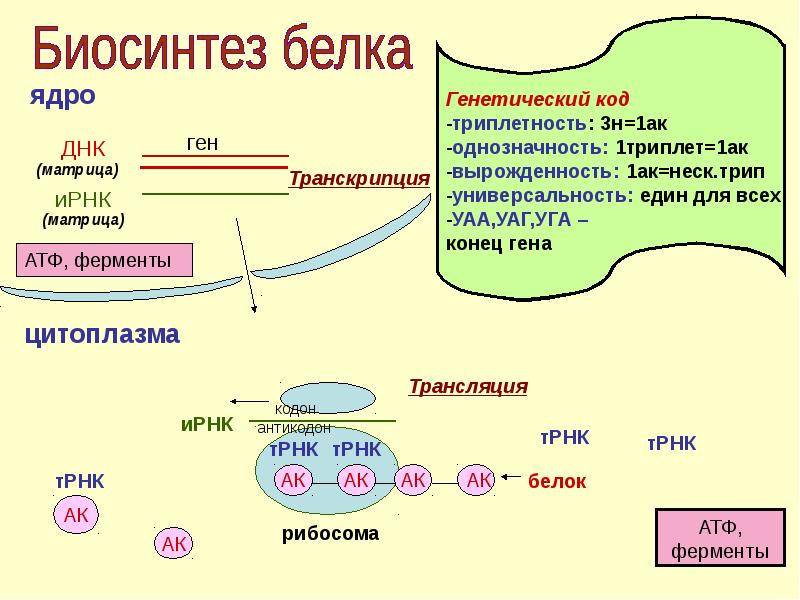 Ареометр плавает в растворе, и точка, в которой поверхность жидкости касается стержня вставленного ареометра, показывает процентное содержание сахара в жидкости.
Ареометр плавает в растворе, и точка, в которой поверхность жидкости касается стержня вставленного ареометра, показывает процентное содержание сахара в жидкости.
То, что вам нужно.
Чтение шкалы Брикса.
Шкала Брикса показывает количество граммов сахара на 100 граммов чистой воды. Так, например, скажем, бутылка корневого пива на 20 унций (591 мл) дает измерение 12 Брикс. Сколько сахара во всей бутылке? Вот уравнение: 12 г/100 мл = X г/591 мл.Решение для X дает X = 70,92 г сахара.
Советы по использованию ареометра.
Сода должна быть дегазирована перед измерением. Крошечные пузырьки в газированных напитках, как правило, прилипают к ареометру и добавляют нежелательную плавучесть. Вы можете дегазировать образец соды легким нагреванием или просто оставить газировку до тех пор, пока она не станет «плоской». Перед измерением убедитесь, что сода имеет комнатную температуру. Ареометры наиболее точны при использовании при калиброванной температуре, отмеченной на шкале.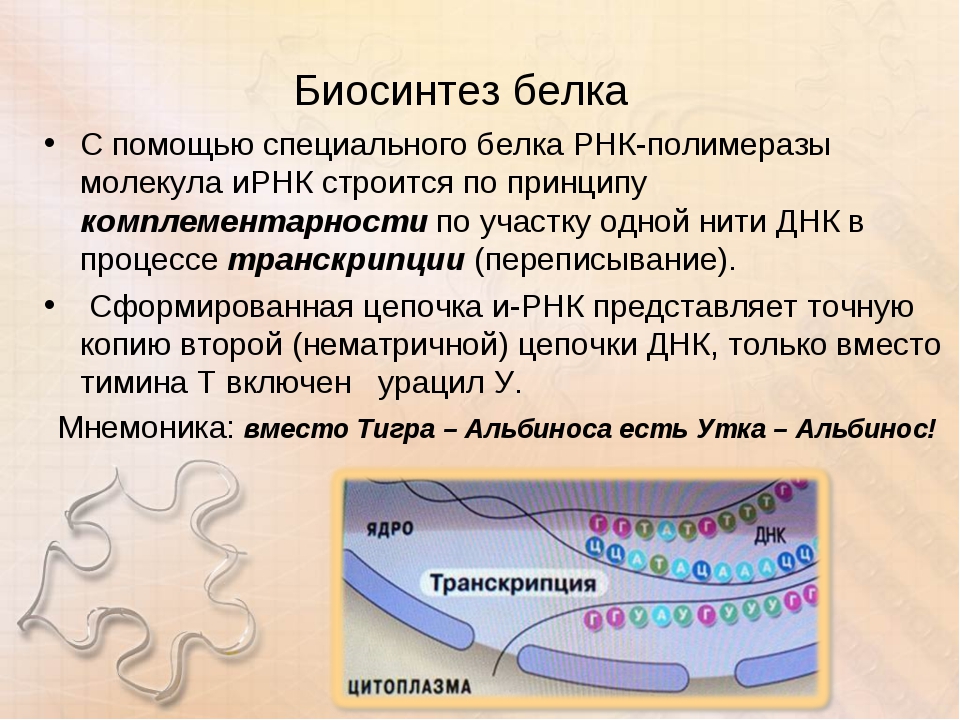 Большинство ареометров, продаваемых Science Company, предназначены для использования при температуре 20°C (68°F).
Большинство ареометров, продаваемых Science Company, предназначены для использования при температуре 20°C (68°F).
Посмотрите наше обучающее видео.
Обратная связь
Существует много вариантов основных шагов, описанных выше. Дайте нам знать, что вы тестировали и чем закончился ваш эксперимент. Мы будем рады услышать от вас! Нажмите здесь и воспользуйтесь формой обратной связи.
Химия белковых анализов | Thermo Fisher Scientific
Большинство методов колориметрического анализа белков можно разделить на две группы в зависимости от типа используемого химического состава: методы, включающие комплексообразование белок-медь с вторичным обнаружением восстановленной меди, и методы, основанные на связывании белка с красителем с прямым обнаружением изменение цвета, связанное со связанным красителем.
Большинство коммерческих реагентов для анализа белков представляют собой хорошо охарактеризованные надежные продукты, дающие стабильные и надежные результаты. Тем не менее, каждый реагент для анализа имеет свои ограничения; базовое понимание химических процессов, связанных с каждым типом анализа, необходимо для выбора подходящего метода для данного образца и для правильной оценки результатов.
Тем не менее, каждый реагент для анализа имеет свои ограничения; базовое понимание химических процессов, связанных с каждым типом анализа, необходимо для выбора подходящего метода для данного образца и для правильной оценки результатов.
Химические анализы на основе меди
Пептиды и биуретовая реакция
Анализы белков на основе меди, включая BCA и методы Лоури, основаны на хорошо известной «биуретовой реакции», при которой пептиды, содержащие три или более аминокислотных остатка, образуют окрашенный хелатный комплекс с медью. ионов (Cu2+) в щелочной среде, содержащей виннокислый натрий-калий.Это стало известно как биуретовая реакция, потому что она химически подобна комплексу, который образуется с органическим соединением биурета (Nh3-CO-NH-CO-Nh3) и ионом меди. Биурет, продукт избытка мочевины и тепла, реагирует с медью с образованием светло-голубого тетрадентатного комплекса.
Рис. 1. Схема биуретовой реакции. При восстановлении иона меди из формы меди в форму меди реакция дает слабый сине-фиолетовый цвет.
Рисунок 2. Структуры мочевины, биурета и пептида. Поскольку полипептиды имеют структуру, подобную биурету, они способны образовывать комплексы с медью в результате биуретовой реакции.
Отдельные аминокислоты и дипептиды не дают биуретовой реакции, но трипептиды и более крупные полипептиды или белки будут реагировать с образованием комплекса от светло-голубого до фиолетового, который поглощает свет при 540 нм. Один ион меди образует окрашенный координационный комплекс с четырьмя-шестью соседними пептидными связями. Интенсивность окрашивания пропорциональна количеству пептидных связей, участвующих в реакции.Таким образом, биуретовая реакция лежит в основе одноименного простого и быстрого колориметрического реагента для количественного определения концентрации общего белка. Рабочий диапазон для анализа биурета составляет 5–160 мг/мл, что достаточно для некоторых видов промышленного применения, но недостаточно чувствительно для большинства потребностей в исследованиях белков.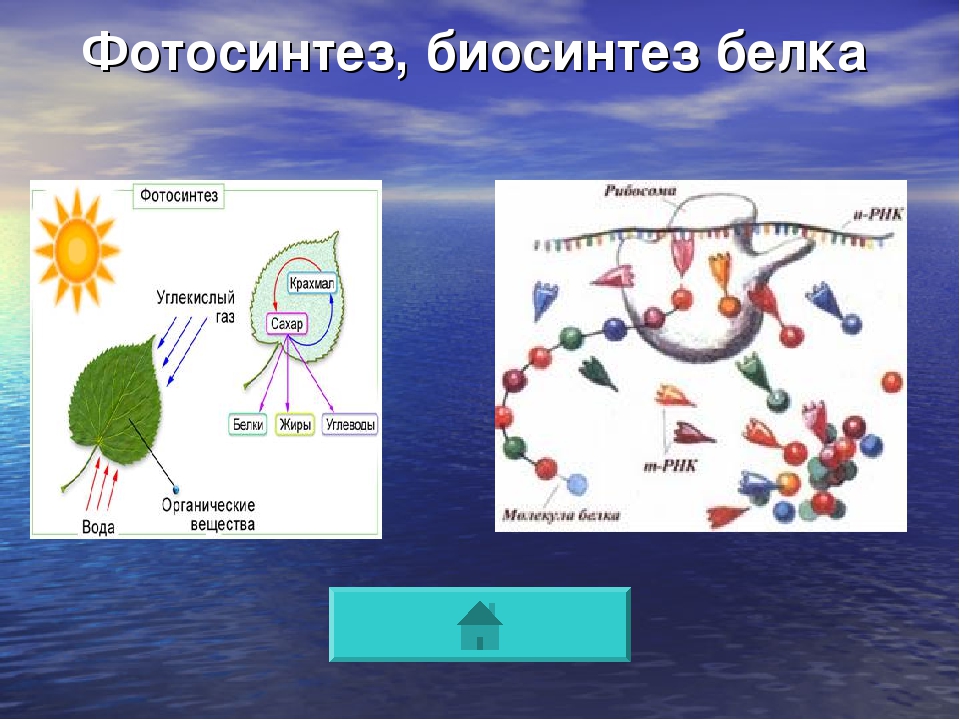
Анализы белка на бицинхониновую кислоту (BCA)
Анализ белка BCA был представлен Smith, et al., в 1985 году.С тех пор он стал самым популярным методом колориметрического определения и количественного определения общего белка. Одним из особых преимуществ является то, что, в отличие от других методов, доступных в то время (например, анализы Брэдфорда и Лоури), анализ белка BCA совместим с образцами, которые содержат до 5% поверхностно-активных веществ (детергентов). Кроме того, анализ BCA более равномерно реагирует на различные белки, чем метод Брэдфорда.
BCA Protein Assay сочетает индуцированную белком биуретовую реакцию (см. выше) с высокочувствительным и селективным колориметрическим определением образовавшегося катиона меди (Cu1+) с помощью бицинхониновой кислоты (BCA).Таким образом, задействованы два шага. Во-первых, это биуретовая реакция, слабый синий цвет которой возникает в результате восстановления иона меди до иона меди. Во-вторых, это хелатирование BCA ионами меди, что приводит к интенсивному фиолетовому цвету. Продукт реакции фиолетового цвета образуется в результате хелатирования двух молекул BCA с одним ионом меди. Комплекс BCA/медь растворим в воде и демонстрирует сильное линейное поглощение при 562 нм при увеличении концентрации белка. Фиолетовый цвет можно измерить на любой длине волны от 550 до 570 нм с минимальной (менее 10%) потерей сигнала.Реактив BCA примерно в 100 раз более чувствителен (нижний предел обнаружения), чем биуретовый реагент.
Продукт реакции фиолетового цвета образуется в результате хелатирования двух молекул BCA с одним ионом меди. Комплекс BCA/медь растворим в воде и демонстрирует сильное линейное поглощение при 562 нм при увеличении концентрации белка. Фиолетовый цвет можно измерить на любой длине волны от 550 до 570 нм с минимальной (менее 10%) потерей сигнала.Реактив BCA примерно в 100 раз более чувствителен (нижний предел обнаружения), чем биуретовый реагент.
Рис. 3. Реакция БЦА с ионом меди. Две молекулы BCA связываются с каждой молекулой меди, которая была восстановлена в результате биуретовой реакции, опосредованной пептидами.
Реакция, которая приводит к образованию цвета BCA в результате восстановления Cu2+, особенно зависит от присутствия в белках трех определенных аминокислотных остатков: цистеина/цистина, тирозина и триптофана.По-видимому, эти аминокислоты независимо усиливают восстановление меди в биуретовой реакции, вызывая тем самым образование окрашенного хелата BCA-Cu1+. Однако исследования, проведенные с ди- и трипептидами, показывают, что они производят больше цвета, чем можно объяснить четырьмя отдельными BCA-реактивными аминокислотами. Другими словами, пептидный скелет (и, следовательно, общее количество белка) вносит основной вклад в снижение содержания меди в биуретовой реакции и развитие окраски в анализе BCA.Незначительные межбелковые различия в анализе белков BCA являются результатом различий между белками в составе этих трех аминокислот.
Однако исследования, проведенные с ди- и трипептидами, показывают, что они производят больше цвета, чем можно объяснить четырьмя отдельными BCA-реактивными аминокислотами. Другими словами, пептидный скелет (и, следовательно, общее количество белка) вносит основной вклад в снижение содержания меди в биуретовой реакции и развитие окраски в анализе BCA.Незначительные межбелковые различия в анализе белков BCA являются результатом различий между белками в составе этих трех аминокислот.
Связывание BCA с ионом меди эффективно удаляет слабохелатированные пептиды биуретовой реакции. Затем эти пептидные группы могут связываться с другой молекулой иона двухвалентной меди. Следовательно, если бицинхониновая кислота и медь присутствуют в большом избытке (как они всегда присутствуют в реагентах для анализа белка BCA), анализ белка не достигает конечной точки.Кроме того, скорость образования цвета BCA зависит от температуры инкубации. Следовательно, ключ к получению точных результатов с помощью метода анализа BCA заключается в одновременном анализе стандартов и неизвестных образцов, чтобы они оба получали одинаковое время инкубации и температуру. Предполагая, что анализ проводится таким образом, характеристика анализа позволяет ускорить проявление или дольше ждать проявления желаемого цвета по мере необходимости.
Предполагая, что анализ проводится таким образом, характеристика анализа позволяет ускорить проявление или дольше ждать проявления желаемого цвета по мере необходимости.
Вещества, восстанавливающие содержание меди, также вызывают окрашивание в анализе АЦК, что влияет на точность количественного определения белка.Реагенты, которые хелатируют медь, также мешают, уменьшая количество цвета BCA, производимого белком. Определенные отдельные аминокислоты (цистеин или цистин, тирозин и триптофан) также вызывают окрашивание и мешают анализу АЦК. Технические советы и специализированные версии продуктов для анализа белка BCA решают ту или иную из этих проблем несовместимости образцов.
Последним достижением в колориметрическом анализе белка является анализ белка Pierce Rapid Gold BCA, который сохраняет высокую чувствительность и линейность традиционного анализа BCA, но дает готовые к считыванию результаты в течение 5 минут при инкубации при комнатной температуре (КТ).Напротив, при традиционных анализах BCA — в зависимости от протокола — время инкубации варьируется от 30 минут до 2 часов при температуре от 37 ₀ C до 60 ₀ C.
Анализ белков BCA включает восстановление меди белками в щелочной среде (биуретовая реакция) для получения чувствительного и селективного колориметрического обнаружения с помощью нового хелатора меди. Количество восстановленной меди пропорционально количеству белка, присутствующего в растворе.Селективный хелатор меди образует комплекс оранжево-золотистого цвета, который сильно поглощает свет при 480 нм. Эти репрезентативные данные сравнивают эффективность традиционных и недавно адаптированных анализов белка BCA.
Рис. 4. Определение концентрации белка в лизатах с использованием стандартного анализа белка Pierce BCA и анализа белка Pierce Rapid Gold BCA. Оба анализа были проведены в соответствии с протоколами производителя в формате микропланшета. Для стандартного анализа BCA 25 мкл образца добавляли к 200 мкл рабочего реагента BCA и инкубировали в течение 30 минут при 37°C.Для анализа белков Pierce Rapid Gold BCA 20 мкл образца добавляли к 200 мкл рабочего реагента Pierce Rapid Gold BCA и инкубировали при комнатной температуре в течение 5 минут.
Анализы белка Лоури
Анализ белка Лоури назван в честь Оливера Х. Лоури, который разработал и представил его (Lowry, et al., 1951). Он предложил значительное улучшение по сравнению с предыдущими анализами белка, и его статья стала одной из самых цитируемых ссылок в литературе по наукам о жизни на многие годы.В модифицированном анализе белка Лоури используется стабильный реагент, который заменяет два нестабильных реагента, описанных Лоури. По сути, анализ представляет собой расширенный анализ биурета, включающий химию хелатирования меди.
Хотя механизм формирования окраски для анализа Лоури аналогичен механизму анализа белка ВСА, между ними есть несколько существенных различий. Точный механизм образования окраски в анализе Лоури остается малоизученным. Анализ проводится в два отдельных этапа.Сначала белок подвергают реакции со щелочным сульфатом меди в присутствии тартрата в течение 10 минут при комнатной температуре. Во время этой инкубации образуется тетрадентатный комплекс меди из четырех пептидных связей и одного атома меди (это «биуретовая реакция»). Во-вторых, добавляют раствор фосфорно-молибденовой и фосфорно-вольфрамовой кислоты. Это соединение (называемое реагентом Фолин-фенол) восстанавливается, придавая ему интенсивный синий цвет. Считается, что усиление цвета происходит, когда тетрадентатный комплекс меди передает электроны комплексу фосфорно-молибденовой и фосфорно-вольфрамовой кислот.Синий цвет продолжает усиливаться в течение 30 минут инкубации при комнатной температуре. Было высказано предположение, что в течение 30 минут инкубации перегруппировка исходного нестабильного синего комплекса приводит к стабильному конечному комплексу синего цвета, который имеет более высокую абсорбцию (Lowry, et al., 1951; Legler, et al., 1985).
Во-вторых, добавляют раствор фосфорно-молибденовой и фосфорно-вольфрамовой кислоты. Это соединение (называемое реагентом Фолин-фенол) восстанавливается, придавая ему интенсивный синий цвет. Считается, что усиление цвета происходит, когда тетрадентатный комплекс меди передает электроны комплексу фосфорно-молибденовой и фосфорно-вольфрамовой кислот.Синий цвет продолжает усиливаться в течение 30 минут инкубации при комнатной температуре. Было высказано предположение, что в течение 30 минут инкубации перегруппировка исходного нестабильного синего комплекса приводит к стабильному конечному комплексу синего цвета, который имеет более высокую абсорбцию (Lowry, et al., 1951; Legler, et al., 1985).
Окончательный синий цвет оптимально измеряется при 750 нм, но его можно измерить при любой длине волны от 650 до 750 нм с небольшой потерей интенсивности цвета. Лучше всего измерять цвет при длине волны 750 нм, так как немногие другие вещества поглощают свет с такой длиной волны.
Рис.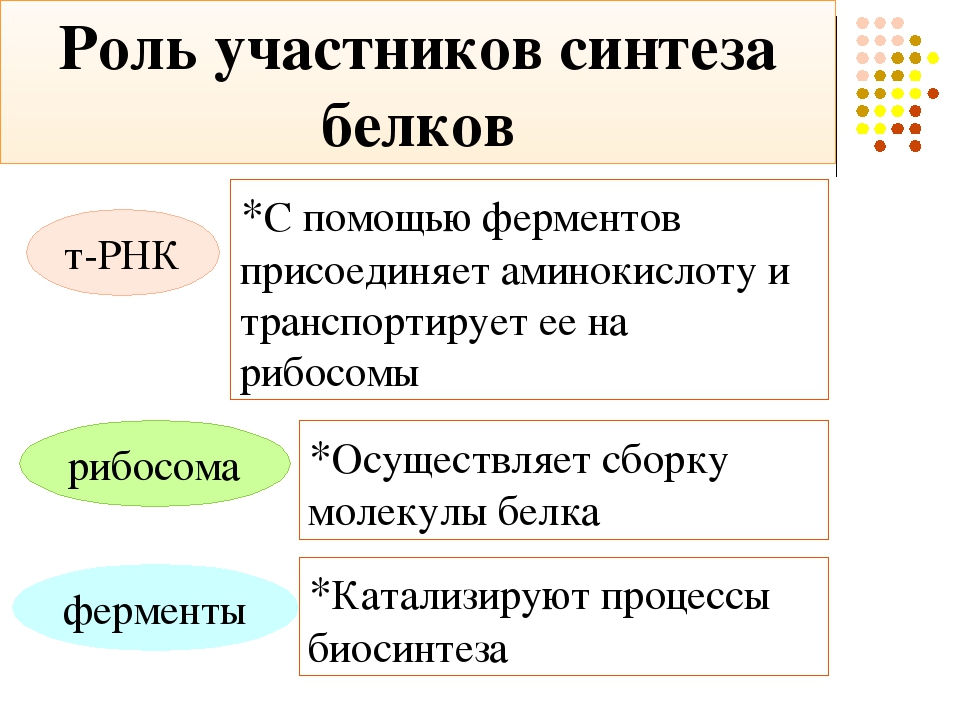 5. Сводка протокола модифицированного анализа белка Лоури.
5. Сводка протокола модифицированного анализа белка Лоури.
Для небольших пептидов интенсивность окраски увеличивается с увеличением размера пептида. Присутствие любого из пяти аминокислотных остатков (тирозин, триптофан, цистеин, гистидин и аспарагин) в пептидной или белковой цепи дополнительно усиливает количество производимого цвета, поскольку они вносят дополнительные восстанавливающие эквиваленты для дальнейшего восстановления комплекса фосфомолибденовой/фосфовольфрамовой кислоты.За исключением тирозина и триптофана, свободные аминокислоты не дают окрашенного продукта с реактивом Лоури; однако большинство дипептидов можно обнаружить. В отсутствие какой-либо из пяти аминокислот, перечисленных выше, в пептидном остове белки, содержащие остатки пролина, имеют более низкую цветовую реакцию с реактивом Лоури из-за того, что аминокислота препятствует образованию комплекса.
В отличие от анализа BCA, этап вторичного связывания в методе Лоури не включает отсоединение пептидно-медного хелата. Таким образом, метод Лоури фактически является анализом конечной точки. Хотя всегда лучше включать внутренние стандарты в любой анализ белка, можно получить разумные оценки белка с помощью этого метода анализа путем сравнения с предварительно построенной стандартной кривой.
Таким образом, метод Лоури фактически является анализом конечной точки. Хотя всегда лучше включать внутренние стандарты в любой анализ белка, можно получить разумные оценки белка с помощью этого метода анализа путем сравнения с предварительно построенной стандартной кривой.
Протокол требует, чтобы фенольный реагент Folin добавлялся в каждую пробирку точно в конце десятиминутной инкубации. При щелочном рН реактива Лоури фенольный реактив Фолина практически сразу инактивируется.Поэтому лучше всего добавлять фенольный реагент Folin в точное время, одновременно перемешивая каждую пробирку. Поскольку это несколько громоздко, для получения стабильных результатов требуется некоторая практика. Это также ограничивает общее количество образцов, которые можно проанализировать за один цикл. Если используется десятисекундный интервал между пробирками, максимальное количество пробирок, которое можно проанализировать в течение десяти минут, равно шестидесяти (10 секунд/пробирка x 60 пробирок = 600 секунд или 10 минут).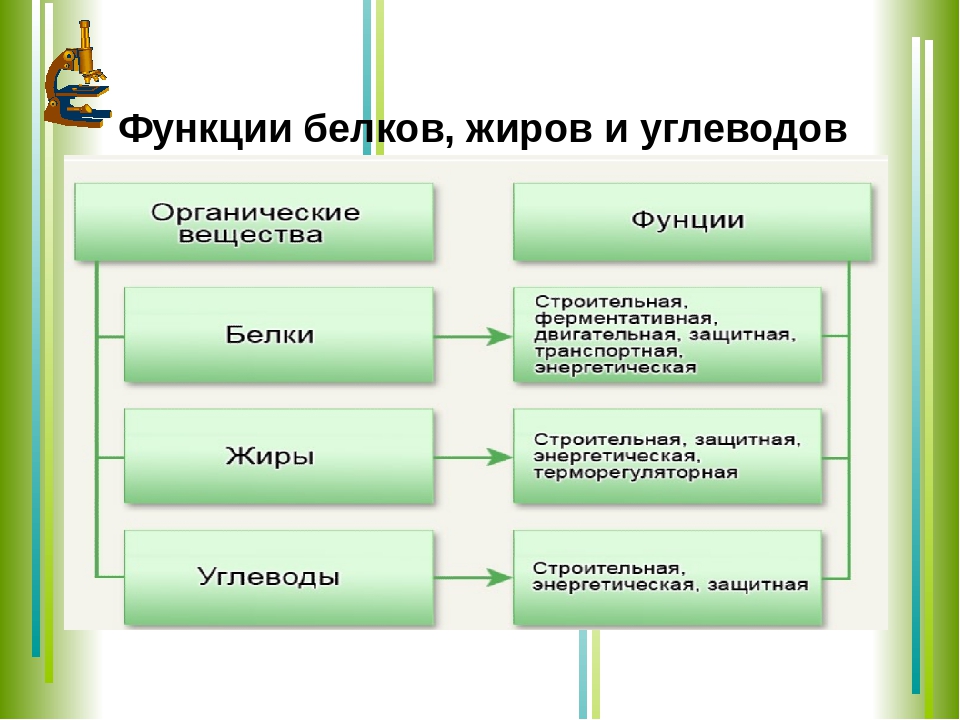
Реактив Лоури образует осадок в присутствии детергентов или ионов калия.Когда причиной являются ионы калия, проблему иногда можно решить путем центрифугирования пробирки и измерения цвета надосадочной жидкости. Большинство поверхностно-активных веществ вызывают осаждение реагента даже при очень низких концентрациях. Единственным исключением является додецилсульфат натрия (SDS), который совместим с реагентом при концентрациях до 1% в образце. Хелатирующие агенты мешают связыванию меди и предотвращению образования комплекса медных пептидных связей. Восстанавливающие агенты и свободные тиолы также мешают восстановлению фосфовольфрамат-фосфомолибдатного комплекса, немедленно образуя при их добавлении продукт интенсивного синего цвета.
Модифицированный реагент Лоури для анализа белка должен храниться в холодильнике для длительного хранения, но перед использованием его необходимо нагреть до комнатной температуры. Использование холодного модифицированного реагента для анализа белка Лоури приведет к низким значениям абсорбции.
Химические анализы на основе красителей
Анализ белка на красителе Кумасси (Брэдфорд)
Использование красителя Coomassie G-250 в качестве колориметрического реагента для обнаружения и количественного определения общего белка было впервые описано Dr.Мэрион Брэдфорд в 1976 году (Bradford, 1976). Анализы Thermo Scientific Pierce Coomassie (Bradford) представляют собой варианты реагента, о котором впервые сообщил Брэдфорд.
Рисунок 6. Химическая структура красителя Кумасси. Эта коллоидная форма красителя Кумасси, приготовленная в буфере с фосфорной кислотой с низким pH, является основой реагентов для анализа белков Брэдфорда.
В кислой среде реагента белок связывается с красителем Кумасси. Это приводит к спектральному сдвигу от красновато-коричневой формы красителя (максимум поглощения при 465 нм) к синей форме красителя (максимум поглощения при 610 нм).Разница между двумя формами красителя наибольшая при 595 нм, так что это оптимальная длина волны для измерения синего цвета комплекса кумасси-краситель-белок. При желании синий цвет можно измерить при любой длине волны от 575 нм до 615 нм. На двух крайних значениях (575 нм и 615 нм) происходит потеря около 10% измеренного количества цвета (поглощения) по сравнению с полученным при 595 нм.
При желании синий цвет можно измерить при любой длине волны от 575 нм до 615 нм. На двух крайних значениях (575 нм и 615 нм) происходит потеря около 10% измеренного количества цвета (поглощения) по сравнению с полученным при 595 нм.
Развитие окраски в анализе белков по Бредфорду связано с присутствием в белке определенных основных аминокислот (в первую очередь аргинина, лизина и гистидина).Силы Ван-дер-Ваальса и гидрофобные взаимодействия также участвуют в связывании красителя белком. Количество лигандов красителя кумасси, связанных с каждой молекулой белка, приблизительно пропорционально количеству положительных зарядов, обнаруженных на белке. Свободные аминокислоты, пептиды и белки с низкой молекулярной массой не дают окрашивания реагентами красителя Кумасси. Как правило, масса пептида или белка должна быть не менее 3000 дальтон, чтобы его можно было обнаружить с помощью этого реагента. В некоторых приложениях это может быть преимуществом.Например, анализ белка кумасси использовался для измерения «белков с высокой молекулярной массой» во время ферментации в пивоваренной промышленности.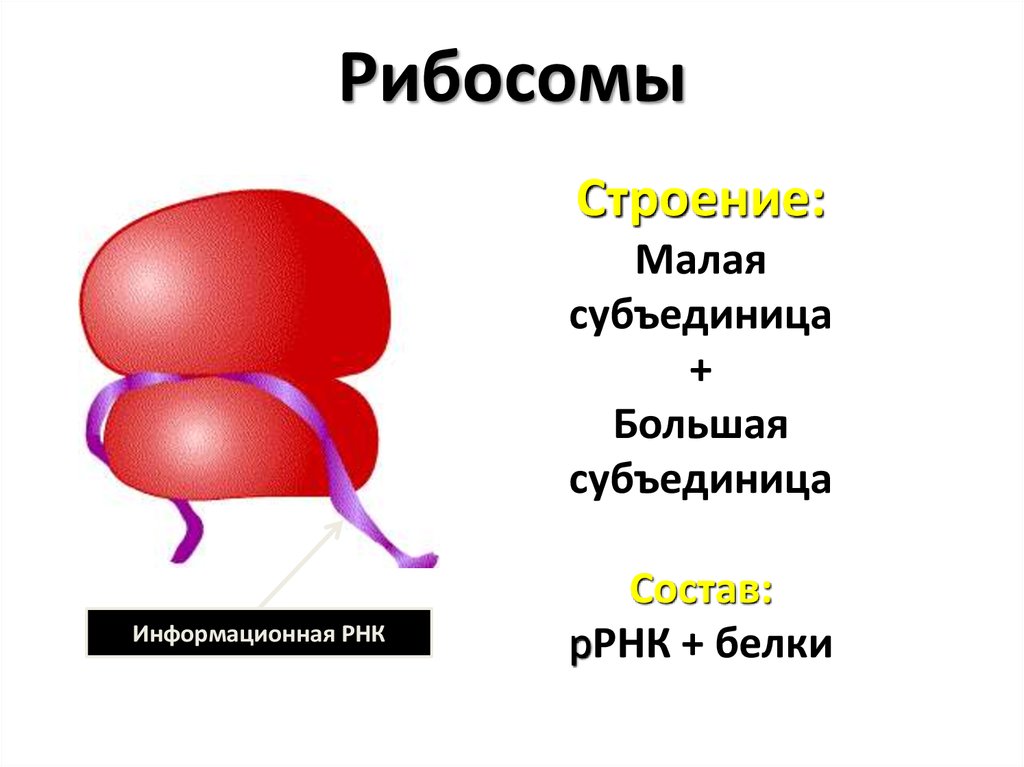
Анализы связывания красителя кумасси являются самыми быстрыми и простыми в выполнении из всех белковых анализов. Анализ проводится при комнатной температуре и не требует специального оборудования. Стандартные и неизвестные образцы добавляют в пробирки, содержащие предварительно приготовленный реагент для анализа кумасси, и измеряют полученную синюю окраску при 595 нм после непродолжительной инкубации при комнатной температуре.Белковые анализы, содержащие краситель кумасси, совместимы с большинством солей, растворителей, буферов, тиолов, восстанавливающих веществ и агентов, хелатирующих металлы, встречающихся в образцах белка.
Основным недостатком белковых анализов на основе кумасси является их несовместимость с поверхностно-активными веществами в концентрациях, обычно используемых для солюбилизации мембранных белков. Как правило, присутствие поверхностно-активного вещества в образце даже при низких концентрациях вызывает осаждение реагента. Кроме того, реагент-краситель кумасси очень кислый, поэтому белки с плохой растворимостью в кислоте не могут быть проанализированы с помощью этого реагента. Наконец, реагенты Кумасси приводят к примерно вдвое большей вариации между белками, чем реагенты для анализа на основе хелатирования меди.
Наконец, реагенты Кумасси приводят к примерно вдвое большей вариации между белками, чем реагенты для анализа на основе хелатирования меди.
Рисунок 7. Спектры поглощения белковых стандартов в анализе белков Thermo Scientific Pierce Coomassie Plus (Bradford) . Стандарты белка: 0, 125, 250, 500, 750, 1000, 1500 и 2000 мкг/мл бычьего сывороточного альбумина соответственно. Линия 2000 мкг/мл нарисована толще остальных, чтобы ориентировать последовательность.Обратите внимание, что обратная зависимость между концентрацией белка и поглощением возникает ниже 525 нм (максимум при 465 нм).
Готовые к использованию жидкие реагенты для окрашивания кумасси следует осторожно перемешать переворачиванием непосредственно перед использованием. Краситель в этих жидких реагентах образует рыхлые агрегаты в течение 60 минут в ненарушенных растворах. Аккуратное перемешивание реагента путем переворачивания бутыли обеспечивает равномерное распределение красителя и гомогенность аликвот. После связывания с белком краситель также образует агрегаты белок-краситель.К счастью, эти агрегаты белок-краситель можно легко диспергировать, перемешивая реакционную пробирку. Это характерно для всех жидких реагентов на основе красителя кумасси. Поскольку эти агрегаты образуются относительно быстро, также лучше регулярно перемешивать (встряхивать в течение 2-3 секунд) каждую пробирку или планшет непосредственно перед измерением цвета.
После связывания с белком краситель также образует агрегаты белок-краситель.К счастью, эти агрегаты белок-краситель можно легко диспергировать, перемешивая реакционную пробирку. Это характерно для всех жидких реагентов на основе красителя кумасси. Поскольку эти агрегаты образуются относительно быстро, также лучше регулярно перемешивать (встряхивать в течение 2-3 секунд) каждую пробирку или планшет непосредственно перед измерением цвета.
Анализ белка Пирса 660 нм
Представленный в 2008 году анализатор белка Thermo Scientific Pierce 660 нм представляет собой реагент на основе красителя, который обеспечивает такое же удобство, как анализы на основе кумасси, но устраняет некоторые из их недостатков.В частности, анализ Пирса 660 нм совместим с большинством моющих средств и дает более линейную кривую отклика.
Подробная химия анализа является собственностью компании, но основной механизм можно резюмировать следующим образом. Реагент содержит запатентованный комплекс краситель-металл в кислом буфере. Комплекс краситель-металл связывается с белком в кислой среде, вызывая сдвиг максимума поглощения красителя, который измеряется при 660 нм. Реактив имеет красновато-коричневый цвет и становится зеленым при связывании с белком.
Комплекс краситель-металл связывается с белком в кислой среде, вызывая сдвиг максимума поглощения красителя, который измеряется при 660 нм. Реактив имеет красновато-коричневый цвет и становится зеленым при связывании с белком.
Рис. 8. Максимум поглощения комплекса реагент-металл при 660 нм смещается пропорционально при связывании с БСА. Спектры поглощения были записаны для реагента для анализа белка Pierce 660 нм в диапазоне от 340 до 800 нм с использованием спектрофотометра. Белок в присутствии комплекса реагент-металл вызывает значительный сдвиг поглощения при длине волны 660 нм.
Цвет, полученный в результате анализа, стабилен и увеличивается пропорционально широкому диапазону возрастающих концентраций белка.Изменение цвета вызывается депротонированием красителя при низком pH, которому способствуют взаимодействия с белком через положительно заряженные аминокислотные группы и отрицательно заряженный депротонированный комплекс краситель-металл.
Анализ связывается с белками аналогично красителю Кумасси. Таким образом, он имеет сходную межбелковую изменчивость с методами анализа Кумасси (Брэдфорд). Однако, в отличие от анализов на основе кумасси, анализ белка Пирса 660 нм полностью совместим с неионогенными детергентами, обычно используемыми в образцах белка.Фактически, при использовании с реагентом совместимости с ионным детергентом (IDCR) анализ Пирса 660 нм также совместим с образцом, содержащим буфер образца Laemmli SDS с бромфеноловым синим и другими буферами, содержащими обычные ионные детергенты.
Анализы флуоресцентных белков
Методы количественного определения белка на основе флуоресценции обеспечивают превосходную чувствительность, а это означает, что для количественного определения используется меньше образца белка, что оставляет больше образцов для экспериментов.Для анализов, описанных ниже, требуется несколько шагов, и время не имеет решающего значения, поскольку продолжительность сигнала обычно составляет несколько часов, поэтому анализы можно адаптировать для автоматизированной обработки в приложениях с высокой пропускной способностью. Сигнал флуоресценции можно обнаружить с помощью флуорометра или считывателя микропланшетов.
Сигнал флуоресценции можно обнаружить с помощью флуорометра или считывателя микропланшетов.
Флуоресцентные анализы белков обычно обеспечивают исследователям большую чувствительность, чем та, которую можно измерить с помощью колориметрических анализов белков. Анализы белков Thermo Scientific Quanti-iT, Qubit и NanoOrange основаны на связывании молекулы красителя с детергентным покрытием на белках и гидрофобных участках белков, что приводит к флуоресценции, в то время как несвязанный краситель не флуоресцирует.Длина волны обнаружения для всех трех анализов составляет 470/570 нм. Первые два дают квазилинейную стандартную кривую от 0,5 до 4 мкг в образце 200 мкл при объеме образца 1-20 мкл, в то время как NanoOrange имеет более низкий диапазон чувствительности 10 нг/мл, в пределах до 10 мкг/мл. мл. Для обнаружения липопротеинов или белков в сложной липидной среде можно использовать набор для количественного определения белков CBQCA. Эти репрезентативные данные показывают типичную стандартную кривую, полученную с использованием набора для анализа флуоресцентного белка.
Рис. 9. Низкая межбелковая вариация в тесте Qubit Protein Assay.
Набор NanoOrange Protein Quantitation Kit содержит очень чувствительный и простой анализ для количественного определения белка с обнаружением всего 10 нг/мл белка в растворе. Этот флуоресцентный краситель подходит для использования со спектрофлуориметрами и ридерами микропланшетов. Для обнаружения липопротеинов или белков в сложной липидной среде воспользуйтесь нашим набором для количественного анализа белков CBQCA.
Набор для количественного определения белков CBQCA — это очень чувствительный анализ для количественного определения белков в растворе, способный обнаруживать до 10 нг белка на мл.Сходный по чувствительности с нашим реагентом для количественного определения белка NanoOrange (N-6666), CBQCA лучше подходит для точного количественного определения белков в присутствии липидов, мембранных фракций или детергентов, а также для липопротеинов и малых пептидов. Этот анализ основан на реакции красителя с первичными аминогруппами в присутствии цианида или тиолов, в результате чего он становится флуоресцентным. Непрореагировавший краситель остается нефлуоресцентным. Этот анализ белка может обнаруживать белки в диапазоне от 10 нг/мл до 150 мкг/мл.
Непрореагировавший краситель остается нефлуоресцентным. Этот анализ белка может обнаруживать белки в диапазоне от 10 нг/мл до 150 мкг/мл.
Наконец, набор EZQ Protein Quantitation Kit обеспечивает анализ белка на основе флуоресценции, который облегчает быстрый количественный анализ образцов белка, подготовленных для гель-электрофореза. Анализ основан на электростатическом связывании красителя с основными аминокислотами, дополненном дополнительными гидрофобными взаимодействиями, что приводит к флуоресценции, которую можно считывать при 280 нм и 450/618 нм.
Обнаружение методом флуоресцентного анализа белка
Флуорометры — это приборы, которые измеряют интенсивность флуоресцентного сигнала от красителей, прикрепленных к биологическим молекулам, а также от естественных флуоресцентных молекул на основе сигнатурных длин волн возбуждения (Ex) и излучения (Em).Флуорометры были разработаны для количественного определения, обнаружения и мониторинга аналитов и их реакций с высокой степенью чувствительности и специфичности.
Флуорометр Invitrogen Qubit представляет собой настольный прибор, который точно измеряет ДНК, РНК и белок с помощью высокочувствительных количественных анализов Qubit. В сочетании с оптимизированными алгоритмами флуорометр Qubit 3 использует флуоресцентные красители, которые производят сигнал только при связывании с интересующей мишенью, тем самым сводя к минимуму влияние загрязняющих веществ, включая деградировавшую ДНК или РНК, на экспериментальные результаты.
Рекомендуемое чтение
- Брэдфорд, штат Массачусетс. (1976) Быстрый и чувствительный метод количественного определения количества белка в микрограммах, использующий принцип связывания белка с красителем. Аналитическая биохимия. 72, 248-254.
- Smith, P.K., Krohn R.I., Hermanson G.T., et al. (1987) Измерение белка с использованием бицинхониновой кислоты. Аналитическая биохимия. 150, 76-85.
- Крон, Р.И. (2002). Колориметрическое обнаружение и количественный анализ общего белка, Текущие протоколы в клеточной биологии, А.
 3H.1-A.3H.28, John Wiley & Sons, Inc.
3H.1-A.3H.28, John Wiley & Sons, Inc. - Krohn, RI (2001). Колориметрическое определение общего белка, текущие протоколы пищевой аналитической химии, B1.1.1-B1.1.27, John Wiley & Sons, Inc.
- Lowry, OH, Rosebrough, NJ, Farr, AL, et al. (1951) Измерение белка с помощью фолинофенольного реагента. Журнал биологической химии. 193, 265-75.
- Леглер Г., Мюллер-Платц К.М., Ментгес-Хетткамп М. и др. (1985) На химической основе определения белка Лоури.Аналитическая биохимия. 150, 278-87.
Статьи по Теме
Для чего нужен биурет? — Метод и уравнение — Видео и стенограмма урока
Метод
Во-первых, необходимо создать стандарт. Как правило, это делается с использованием деионизированной воды для отрицательного теста на белок и яичного белка с альбумином для полного положительного теста на белок. Как только мы узнаем, как выглядит синий цвет в отрицательном тесте и фиолетовый цвет в положительном тесте, мы можем начать тестирование неизвестных. Здесь перечислены различные тесты, на которые вы можете посмотреть:
Здесь перечислены различные тесты, на которые вы можете посмотреть:
- Добавьте к образцу гидроксид натрия; это делает образец щелочным
- Добавить раствор сульфата меди (II) к пробе
- Изменение цвета часов
- Измерение цвета с помощью спектрофотометра
Последний тест предназначен для того, чтобы мы могли точно измерить, сколько белка присутствует. Мы не можем точно сказать, какой оттенок фиолетового или синего присутствует, поэтому мы используем машину, называемую спектрофотометром, которая может определить точный оттенок.
Закон Бера и уравнение
В соответствии с законом Бера , показания спектрофотометра по поглощению прямо пропорциональны количеству белка в образце. Чтобы рассчитать уравнение для закона Бера, нам нужно сначала запустить несколько известных образцов. Это дает нам линию, на которой мы будем основывать наши образцы.
Допустим, мы собрали пять образцов с содержанием белка 0, 0,1, 0,4, 4 и 10 мг/мл соответственно. Пробирки выглядели так:
Пробирки выглядели так:
Сначала мы устанавливаем спектрофотометр на 550 нанометров (нм).Мы используем 550, потому что это длина волны цвета, наблюдаемая для полного белка. Другими словами, мы измеряем, какая часть этой длины волны содержится в каждом образце. Когда мы измерили их на спектрофотометре, мы получили следующие результаты:
0 мг/мл = 0,04 абс.
0,1 мг/мл = 0,08 абс. 10 мг/мл = 0,6 абс. у = 0.0533 х + 0,0735. Есть несколько программ, которые вычислят линию графика.
Итак, y относится к абсорбции, а x относится к концентрации белка. Теперь, следуя шагам, которые мы только что рассмотрели, мы можем использовать поглощение, найденное в каждом образце, и перевести его в концентрацию белка. Допустим, мы получили оптическую плотность 0,22 для нашего образца. Подключаем его и можем определить концентрацию белка:
0,22 = 0.0533 x + 0. 0499 90009 9000 900099
0499 90009 9000 900099
9999
x 99990499 = 0.0.22 — 0,0735 = 0,22 — 0.0735 = 0.0.22 — 0.0735 = 0.0.22 — 0.0735 = 0.0.22 — 0.0735 = 0.0.22 — 0.0735 = 0.0.22 — 0.0735 = 0.0.22 — 0.0735 = 0.0.22 — 0.0735 = 0.0.22 — 0.0735 = 0.0.22 — 0,07351 x == x
2.7486 = x
.
Итак, в следующий раз, когда вы будете в супермаркете и будете смотреть на питательную ценность коробки хлопьев или пакета чипсов и задаетесь вопросом, откуда они узнали, сколько граммов белка на порцию содержится в еде, вы буду знать, как процесс работает!
Краткий обзор урока
Биуретовый тест проверяет пептидные связи в белках.Медь II в реагенте образует комплекс с пептидными связями в щелочной среде. Когда образуется этот комплекс, цвет образца меняется со светло-голубого на фиолетовый, при этом низкая концентрация белка становится светло-голубой, а высокая концентрация белка становится фиолетовой. В соответствии с законом Бера можно измерить поглощение, которое прямо пропорционально содержанию белка в образце.
В соответствии с законом Бера можно измерить поглощение, которое прямо пропорционально содержанию белка в образце.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie.
 Попробуйте другой браузер, если вы подозреваете это.
Попробуйте другой браузер, если вы подозреваете это. - Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.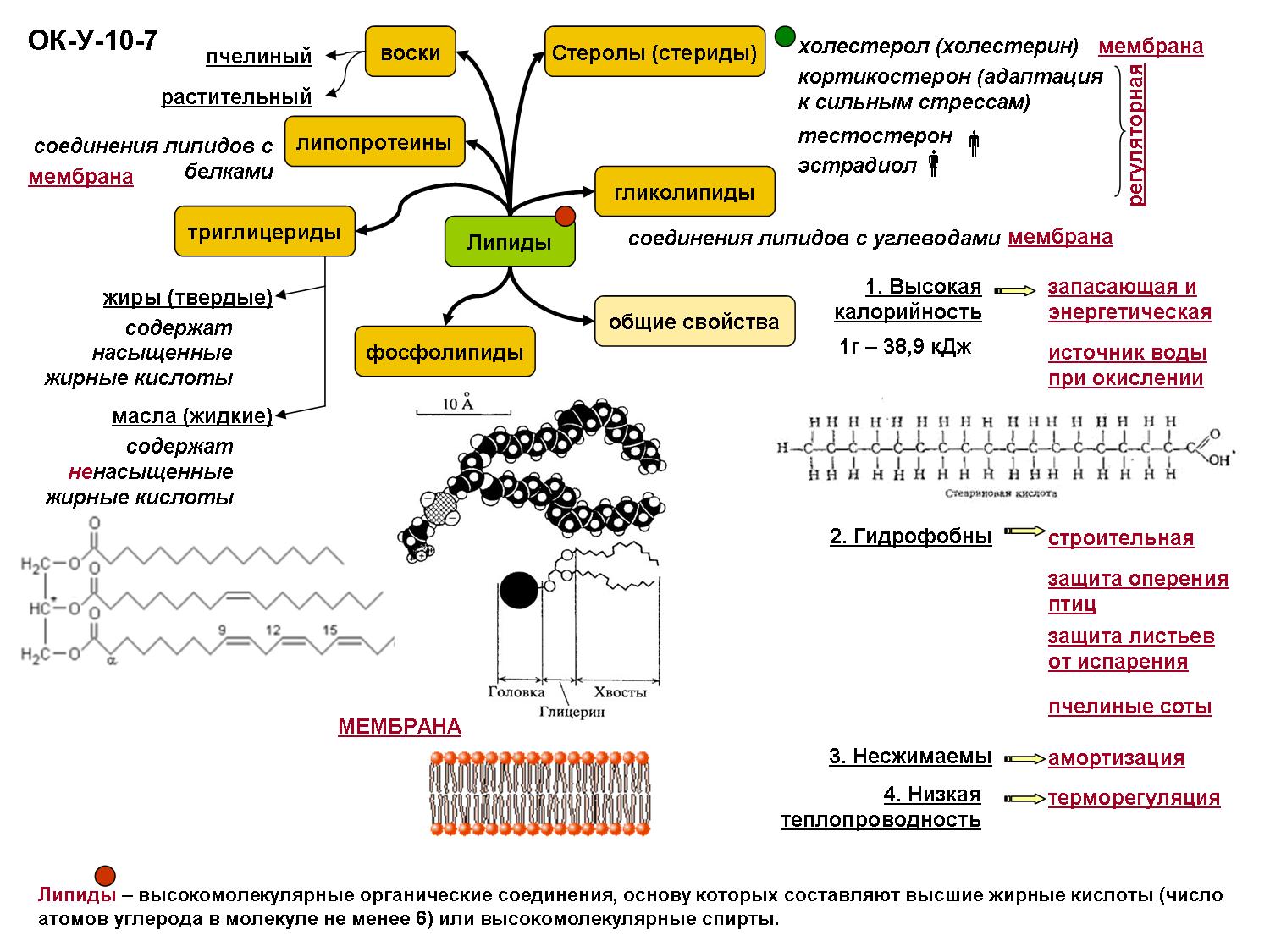

 Биология, Общие биологические закономерности (9–11 класс): уроки, тесты, задания.
Биология, Общие биологические закономерности (9–11 класс): уроки, тесты, задания.