Зоны корня – онлайн-тренажер для подготовки к ЕНТ, итоговой аттестации и ВОУД
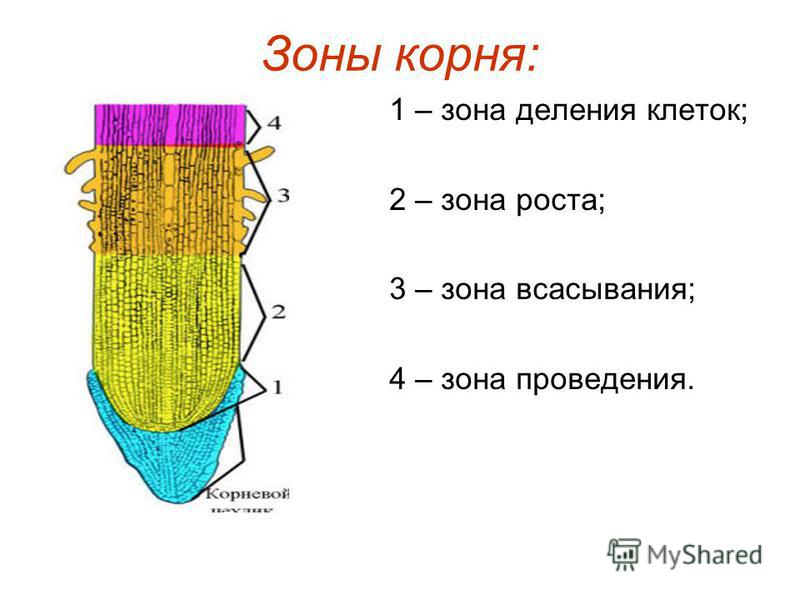
На продольном разрезе кончика корня можно выделить несколько зон: деления, роста, всасывания и проведения.
Корневой чехлик не относится к зонам корня. Он покрывает снаружи и защищает верхушку корня, его точку роста, состоящую из образовательной ткани. Клетки корневого чехлика живые. Наружные клетки корневого чехлика при слущивании выделяют слизь, защищающую нежные молодые клетки кончика корня от повреждений и облегчающую продвижение корня в почве.
1. Зона деления, или конус нарастания, находится под корневым чехликом и представлена клетками верхушечной образовательной ткани. Здесь клетки постоянно делятся и тем самым способствуют росту корня в длину и развитию других зон. Длина зоны деления около 1 мм.
2. Зона растяжения, или зона роста, состоит из образовательной ткани. Ее клетки имеют крупные ядра, тонкие стенки и густую зернистую цитоплазму без вакуолей.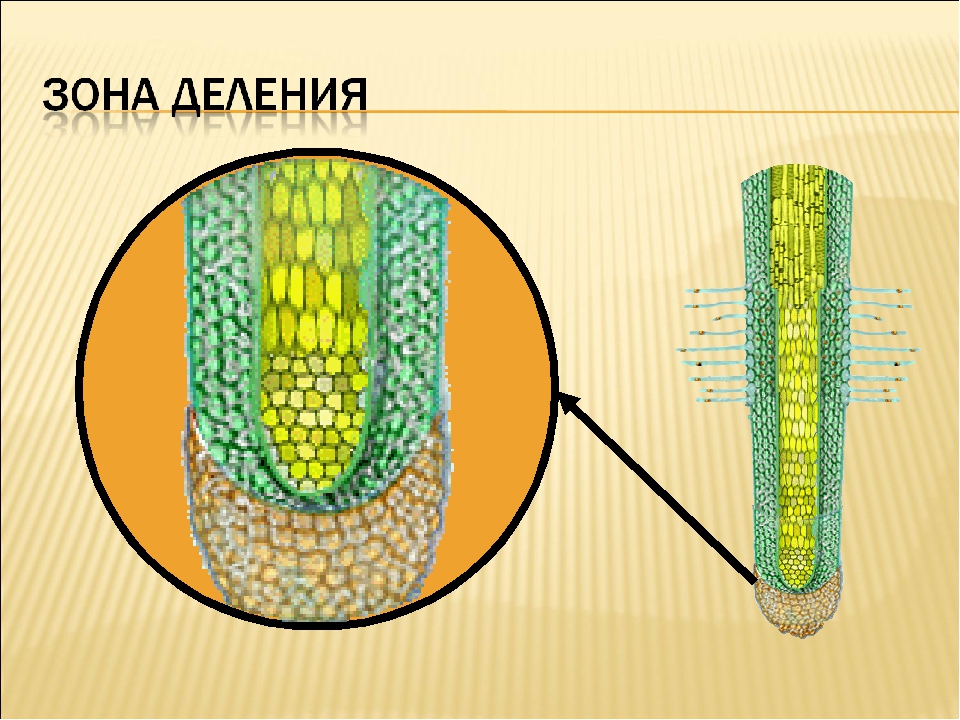
3. Зона всасывания или поглощения, или зона корневых волосков, длинной до несколько сантиметров, начинается над зоной растяжения. Здесь отдельные клетки кожицы корня вытягиваются, образуя наружные выросты длинной от 1–2 до 20 мм – корневые волоски, которые по мере роста вытягиваются, покрываются слизью. Тонкие наружные оболочки корневых волосков тесно соприкасаются с частицами почвы, что способствует всасывающей функции, т. е. поглощению растворов минеральных веществ.
4. Проводящая зона покрыта пробковой тканью находится над всасывающей зоной и расположена в центре корня. Она включает первичную флоэму (луб) и первичную ксилему (древесину).
Проводящая система обеспечивает восходящий по древесине ток воды и минеральных веществ из корня в стебель, и нисходящий ток – передвижение органических веществ по лубу из стебля в корень.
У однодольных растений такое строение сохраняется в течение всей жизни, у двудольных – только на первых этапах развития. Но уже в течение первого года жизни у некоторых двудольных наблюдаются вторичные изменения в корне, связанные с появлением образовательной ткани – камбия.
Камбий закладывается между ксилемой и флоэмой, замыкая первичную ксилему в центре и отодвигая первичную флоэму к периферии. За счет деления клеток камбия корень двудольных растений растет в толщину.
Зоны корня
|
Зоны корня |
Преобладающая ткань |
Особенности строения клеток |
Функции |
|---|---|---|---|
|
Корневой чехлик (не является зоной корня) |
Покровная (перидерма) |
Клетки мелкие с толстой оболочкой |
Защита от повреждения |
|
Зона деления |
Образовательная (меристема) |
Клетки мелкие с тонкой оболочкой |
Рост корня |
|
Зона растяжения |
Образовательная (меристема) |
Вытянутые клетки с тонкой оболочкой |
Рост корня |
|
Зона всасывания |
Всасывающая (ризодерма) |
Корневой волосок |
Всасывание растворенных веществ |
|
Зона проведения |
Проводящая (флоэма и ксилема) |
Клетки вытянутые (сосуды, ситовидные трубки) |
Перемещение веществ |
Все зоны |
Механическая (колленхима, склеренхима) |
Вытянутые вдоль корня клетки с толстой оболочкой. Они рано теряют содержимое и заполнены воздухом. |
Опора органа |
Урок биологии по теме «Зоны корня». 6-й класс
Тип – урок с применением групповой технологии.
Форма – изучение нового материала.
Цели урока для учителя.
- Закрепить знания о строение корневой системы, изучить клеточное строение и функции корня.
- Установить взаимосвязь внутреннего строения корня с выполняемыми функциями.
- Развить логическое мышление, закрепить навыки работы с книгой, повысить мотивацию к изучаемой теме.
- Развить коммуникативное общение, умение оценивать свои успехи и успехи других учащихся.
- Познакомиться с агротехническим приемом
выращивания растений с пикировкой, с последующим
применением на практике.

Цели урока для учащихся.
- Знать клеточное строение корня и его функции.
- Уметь определять ткани корня растения.
Оборудование:
- таблицы “Зоны корня”, таблицы с разными видами тканей,
- микроскопы с готовыми препаратами тканей растений,
- оценочные листы на каждой парте,
- инструктивные карточки с заданиями,
- тесты для проверки полученных знаний.
Термины: корневой чехлик, корневой волосок и зоны корня (деления, растяжения, всасывания, проведения).
Ход урока
I. Организационный момент.
1. Приветствие
2. Сообщение цели урока
Учитель. Любой урок – это познание нового
и интересного. Мы с вами уже знаем немного о
корне. Каждому из нас приходится заниматься
растениями, и каждый должен знать, что сила
растения кроется в корне. Корень всасывает воду.
Из 100% воды, которую всасывает корень, 99% испаряют
листья. Каким же образом он выполняет эту работу,
какое он должен иметь строение, чтобы выполнить
работу по доставке воды к листьям и закреплению
растения в почве. Имея ещё более глубокие знания
о корне, мы сможем более эффективно ухаживать за
растениями.
Корень всасывает воду.
Из 100% воды, которую всасывает корень, 99% испаряют
листья. Каким же образом он выполняет эту работу,
какое он должен иметь строение, чтобы выполнить
работу по доставке воды к листьям и закреплению
растения в почве. Имея ещё более глубокие знания
о корне, мы сможем более эффективно ухаживать за
растениями.
Что мы ещё недостаточно хорошо знаем о корне? Какие новые сведения о корне мы можем получить на уроке?
Эту часть можно провести в форме беседы. Учитель должен подвести детей к цели урока, чтобы цель назвали сами учащиеся.
Для того чтобы ответить на эти вопросы, каждый из вас получит инструктивную карточку с заданиями.
Но, в начале, провожу инструктаж, как работать в группах.
Затем каждая группа получает инструктивную карточку.
II. Работа с инструктивными карточками
1. Прочитать 1 и 2 абзацы §20 и ответить на вопросы:
А) Что такое корневой чехлик и какое он имеет значение?
Б) Клетками какой ткани образован корневой чехлик?
В) Найти под микроскопом клетки корневого
чехлика и зоны деления.
2. Прочитайте 3 и 4 абзац и ответьте на вопросы:
А) Почему верхушка корня с течением времени устремляется вниз в почву?
Б) Какие зоны за это отвечают?
В) Какой тканью они образованы?
Г) Каким опытом можно доказать наличие зон роста?
В рабочей тетради зарисовать рисунок “верхушечный рост корня”.
В рабочей тетради на стр. 35 задание 65 найдите на рисунке корневой чехлик, зону деления, зону роста и подпишите под соответствующими цифрами.
По ходу изучения зон корня, заполняйте таблицу в рабочей тетради на стр. 37 задание № 67 “связь строения корня с выполняемыми функциями”.
3. Прочитать абзац корневые волоски, зона всасывания и сформулировать ответы на вопросы:
А) Что такое корневой волосок?
Б) Какую функцию он выполняет?
В) См. рабочую тетрадь стр. 36 задание №66. Сравните клетку кожицы лука и корневого волоска.
4. Прочитайте абзац “Зоны проведения” и ответьте на вопросы:
А) Почему она получила такое название?
Б) Какой тканью она образована?
5. Рассмотрите рис. 66 и ответьте на вопросы:
Рассмотрите рис. 66 и ответьте на вопросы:
А) Почему на одном из растений мало боковых корней, а на другом много? С чем это связано.
Б) Какое это имеет значение для растения?
Затем старшие групп отвечают на вопросы, поставленные в инструктивных карточках, остальные внимательно слушают, корректируют ответы, задают дополнительные вопросы.
III. Рефлексия
Для закрепления основных понятий предлагаются два варианта тестов.
Вариант 1
1. Самая длинная часть корня:
А) зона роста,
Б) зона деления,
В) зона проведения,
Г) зона всасывания .
2. Образовательная ткань в корне расположена в зоне:
А) коневого чехлика,
В) проведения,
С) роста,
D) деления,
Е) всасывания.
3. В поглощении воды и минеральных
солей участвует одна из зон корня:
В поглощении воды и минеральных
солей участвует одна из зон корня:
А) зона деления,
Б) зона роста,
В) зона всасывания,
Г) зона проведения.
4. Корневые волоски расположены в зоне:
А) роста,
В) проведения,
С) всасывания,
D) корневого чехлика,
Е) деления.
5. Мертвые клетки, по которым вода и растворённые вещества поднимаются вверх по стеблю к листьям, называются:
А) межклетники,
Б) сосуды,
В) механическая ткань,
Г) корневой волосок.
6. Вода необходима клеткам корня:
А) для дыхания,
Б) для растворения питательных веществ,
В) для увеличения плодородия почвы,
Г) является питательным веществом.
7. Роль корневого чехлика в том, что он:
А) обеспечивает передвижение веществ по растению,
Б) выполняет защитную роль,
В) придают корню прочность и упругость,
Г) участвует в делении клеток.
Вариант 2
1. Через корни растение получает:
А) воду,
Б) минеральные вещества,
В) воду и минеральные вещества,
Г) органические вещества.
2. Самая короткая часть корня:
А) зона деления,
Б) зона роста,
В) зона всасывания,
Г) зона проведения.
3. Образованию придаточных корней способствует:
А) пикировка,
Б) обрезка части стебля,
В) окучивание.
4. Какая ткань обеспечивает корню прочность и упругость?
А) образовательная ткань,
Б) механическая ткань,
В) проводящая ткань,
Г) покровная ткань.
5. Корневой чехлик образуется из:
А) зоны всасывания,
Б) из зоны деления,
В) из зоны проведения,
Г) из зоны роста.
6. Не относится к зонам корня:
А) зона деления,
В) корневой волосок,
С) корневой чехлик,
D) зона роста,
Е) зона всасывания.
7. Выше зоны роста в корне расположена зона:
А) всасывания,
В) деления,
С) проведения,
D) размножения,
Е) корневой волосок.
IV. Подведение итогов
Вот и закончился урок. Что мы узнали?
- Корень имеет несколько зон, выполняющих
несколько функций.

- Функции корня зависят от клеток корня.
Выставление оценок по работе на уроке.
V. Домашнее задание
Учитель. Вам просто необходимо поделиться своими впечатлениями о работе на уроке. Свои впечатления вы можете отобразить в кроссворде, синквейне, рисунках, можно подобрать пословицы, загадки о корне.
Ответить на вопросы стр. 102.
Литература
1. Пасечник В.В. Биология. 6 кл. Бактерии, грибы, растения. – М.: Дрофа, 2010.
2. Пасечник В. В., Снисаренко Т. А.. Биология. Бактерии, грибы, растения. 6 кл.: рабочая тетрадь к учебнику В. В. Пасечника. – М.: Дрофа, 2014.
Зоны (участки) корня | Параграф 20
«Биология. Бактерии, грибы, растения. 6 класс». В.В. Пасечник
Вопрос 1. Какие участки (зоны) можно различить, рассматривая молодой корень?
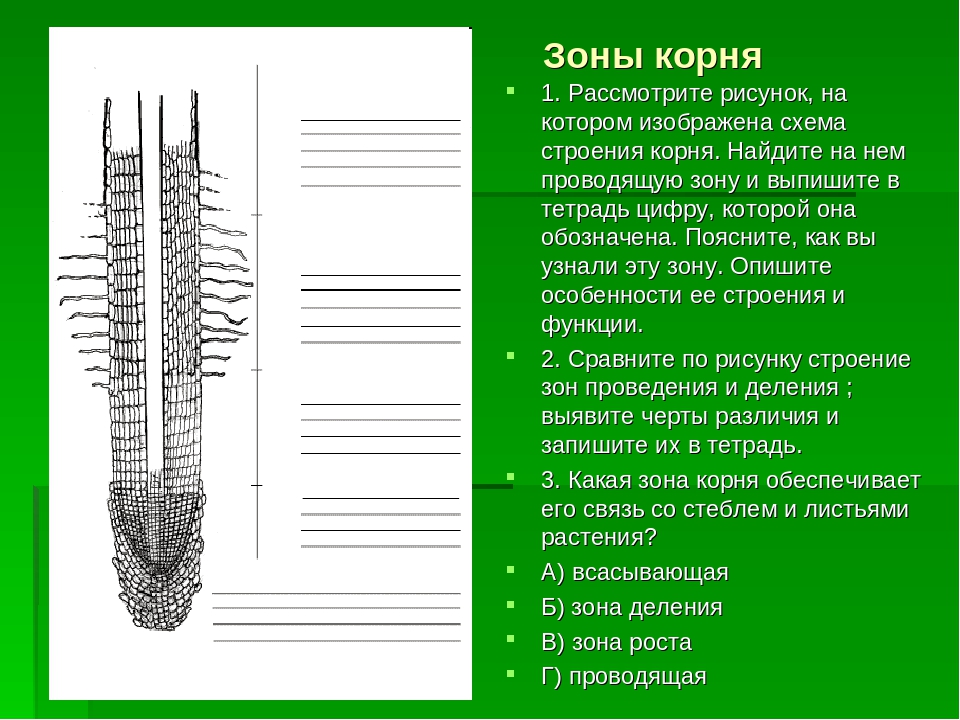
На продольном разрезе растущего корня можно видеть несколько зон: зону деления клеток, зону роста, зону всасывания и зону проведения (рис. 1).
1).
Рис. 1. Схема строения кончика корня (продольный разрез):
1 — корневой чехлик; 2 — зона деления;
3 — зона растяжения клеток;
4 — зона корневых волосков.
В зоне деления клетки интенсивно размножаются, тем самым обусловливая рост корня в длину. Клетки, переставшие делиться, вытягиваются вдоль оси корня и увеличиваются в размерах (зона роста или растяжения). На расстоянии 1—3 мм от кончика корня начинается зона всасывания длиной от нескольких миллиметров до нескольких сантиметров. В этой зоне покровные клетки корня образуют выросты — корневые волоски, поглощающие воду и минеральные соли. Поверхность корневого волоска покрыта слизью, которая контактирует с коллоидными растворами почвы. Этим объясняется эффективное всасывание. Корневые волоски быстро отмирают, продолжительность их жизни составляет обычно 10—20 дней. Выше зоны всасывания начинается зона проведения, которая обеспечивает транспорт всасываемых веществ к другим органам растения.
Вопрос 2. Каково значение корневого чехлика?
Точка роста одета корневым чехликом. Корневой чехлик образован живыми клетками, которые слущиваются и замещаются за счет клеток точки роста. Корневой чехлик защищает точку роста от механических повреждений (например, твёрдых частичек почвы).
Вопрос 3. Где располагается зона деления клеток? Чем ее клетки отличаются от клеток других зон?
Корень нарастает в длину за счет верхушечной точки роста (меристемы). Она состоит из образовательной ткани, клетки которой способны к постоянному делению. Эта зона корня называется зоной деления. В зоне деления клетки интенсивно размножаются, тем самым обусловливая рост корня в длину.
Вопрос 4. Что такое корневой волосок? Какое строение он имеет?
За зоной растяжения находится зона зсасывания. В ней наблюдается дифференциация клеток на ткани. Зона всасывания снаружи несет эпиблему (ризодерму) — покровную ткань, каждая клетка которой образует корневой волосок. За эпиблемой располагается первичная кора, перицикл и центральный осевой цилиндр. При помощи корневых волосков происходит всасывание из почвенных растворов воды и минеральных веществ. Оболочка клеток корневых волосков тонкая — это облегчает всасывание. Почти всю клетку корневого волоска занимает крупная вакуоль, а ядро располагается у верхушки волоска. С ростом корня корневые волоски погибают, и зона всасывания образуется заново. Корневые волоски быстро отмирают, продолжительность их жизни составляет обычно 10—20 дней.
За эпиблемой располагается первичная кора, перицикл и центральный осевой цилиндр. При помощи корневых волосков происходит всасывание из почвенных растворов воды и минеральных веществ. Оболочка клеток корневых волосков тонкая — это облегчает всасывание. Почти всю клетку корневого волоска занимает крупная вакуоль, а ядро располагается у верхушки волоска. С ростом корня корневые волоски погибают, и зона всасывания образуется заново. Корневые волоски быстро отмирают, продолжительность их жизни составляет обычно 10—20 дней.
Вопрос 5. Почему одну из зон корня называют зоной всасывания?
Корневые волоски всасывают из почвы воду с растворенными в ней минеральными веществами. Поэтому участок корня, на котором находятся корневые волоски, принято называть зоной всасывания.
Вопрос 6. Где расположена зона проведения корня? Почему ее так называют?
Выше зоны всасывания начинается зона проведения, которая обеспечивает транспорт всасываемых веществ к другим органам растения. Ее функция — транспорт воды и минеральных веществ в надземные органы растения и транспорт органических веществ из стебля в корень. По клеткам этого участка корня вода с растворенными минеральными веществами перемещается к стеблю вверх, а органические вещества из листьев и стебля поступают для питания корня. В этой зоне закладываются боковые корни.
Ее функция — транспорт воды и минеральных веществ в надземные органы растения и транспорт органических веществ из стебля в корень. По клеткам этого участка корня вода с растворенными минеральными веществами перемещается к стеблю вверх, а органические вещества из листьев и стебля поступают для питания корня. В этой зоне закладываются боковые корни.
Вопрос 7. Что такое ткань?
Ткань — это совокупность клеток, сходных по морфологическим и физиологическим признакам и выполняющих определенные функции. Орган состоит обычно из нескольких тканей. Различают образовательные, покровные, проводящие, механические, основные и выделительные (секреторные) ткани.
Вопрос 8. Какие ткани различают в корнях растений?
Все виды тканей характерны для корня. Образовательная ткань входит в состав кончика корня, что делает возможным нарастание корня в длину. В толщину корень растёт за счет деления клеток камбия, который тоже представляет собой образовательную ткань. Покровная ткань составляет эпидерму корня. Проводящая ткань в корне находится в зоне проведения (сосуды и ситовидные трубки). Элементы проводящей системы вместе с волокнами механической ткани образуют пучки. Сосудисто-волокнистые пучки хорошо видны в листьях в виде жилок, они распространены в корнях. В корнях механическая ткань сосредоточена в центре органа.
Покровная ткань составляет эпидерму корня. Проводящая ткань в корне находится в зоне проведения (сосуды и ситовидные трубки). Элементы проводящей системы вместе с волокнами механической ткани образуют пучки. Сосудисто-волокнистые пучки хорошо видны в листьях в виде жилок, они распространены в корнях. В корнях механическая ткань сосредоточена в центре органа.
Сайт учителей биологии МБОУ Лицей № 2 города Воронежа
Повторите: Растительные ткани.
Если разрезать молодой корень поперёк, то можно увидеть, что он, как и все другие органы цветкового растения, состоит из многочисленных клеток. Но внутреннее строение корня в разных участках различно в зависимости от того, где сделан поперечный срез.
Лучше всего внутреннее строение можно рассмотреть, если разрезать молодой корень вдоль.
На кончике корня находятся клетки образовательной ткани. Они активно делятся. Образовавшиеся молодые клетки мелкие, в них еще почти нет вакуолей. Этот участок корня длиной около 1 мм называют зоной деления. Зона деления корня снаружи защищена от повреждений корневым чехликом.
Зона деления корня снаружи защищена от повреждений корневым чехликом.
Выше зоны деления находится гладкий участок корня. В этой очень небольшой части корня (длиной около 3-9 мм) клетки уже не делятся, но они сильно вытягиваются (растут), удлиняются в продольном направлении (вдоль корня) и тем увеличивают длину корня – это зона растяжения, или зона роста корня. Клетки этой зоны уже имеют большие вакуоли, заполненные клеточным соком. Благодаря этому корень становится упругим, способным с большой силой протискиваться в глубь почвы.
Рост корня. (Анимация)
Выше зоны роста находится участок корня с корневыми волосками. Корневые волоски – это длинные выросты клеток наружного покрова корня. Длина корневых волосков обычно составляет 1-2 мм. Они густо расположены на корне. С их помощью корень поглащает (всасывает) из почвы воду с растворенными минеральными солями. Корневые волоски при этом работают как маленькие насосы. Вот почему зону корня с корневыми волосками называют зоной всасывания, или зоной поглощения.
Вот почему зону корня с корневыми волосками называют зоной всасывания, или зоной поглощения.
Зона всасывания занимает на корне 2-3 см. Но находящееся здесь огромное количество корневых волосков в 15-18 раз увеличивает общую всасывающую поверхность корня.
Строение и функции корневого волоска. (Анимация)
Выделяемая корневыми волосками слизь растворяет минеральные соли почвы. При этом корневые волоски приклеиваются к частичкам почвы, как бы «срастаются» с ней и отсасывают из нее нужные растению питательные вещества. Поэтому у растения, только что вынутого из почвы, всегда можно видеть прилипшие к корневым волоскам комочки почвы.
Клетки зоны всасывания не растягиваются в длину и, следовательно, не смещаются относительно частиц почвы, но корень активно взаимодействует с ней посредством большого количества корневых волосков.
По мере старения корневые волоски отмирают. Живут они недолго, обычно 5-9 дней. На смену отросшим волоскам появляются новые. Они вырастают вблизи кончика корня. В результате такого постоянного включения новых молодых клеток в образование новых корневых волосков и отмирания старых зона всасывания медленно продвигается в глубь почвы. При этом корень использует для питания всё новые почвенные слои.
На смену отросшим волоскам появляются новые. Они вырастают вблизи кончика корня. В результате такого постоянного включения новых молодых клеток в образование новых корневых волосков и отмирания старых зона всасывания медленно продвигается в глубь почвы. При этом корень использует для питания всё новые почвенные слои.
Выше зоны всасывания находится зона проведения корня, по клеткам которой вода и минеральные соли, поглощенные корневыми волосками, передвигаются к стеблю.
Механизм функционирования проводящих сосудов корня. (Анимация)
Зона проведения – самая длинная и прочная часть корня. Здесь уже имеется хорошо сформированная проводящая ткань. По клеткам проводящей ткани к стеблю поднимается вода с растворенными солями – это восходящий ток, а от стебля и листьев к корню передвигаются органические вещества, нужные для жизнедеятельности клеток корня, – это нисходящий ток.
Зоны деления, растяжения и всасывания всегда имеют определенные размеры в длину, а зона проведения по мере роста корня постоянно удлиняется.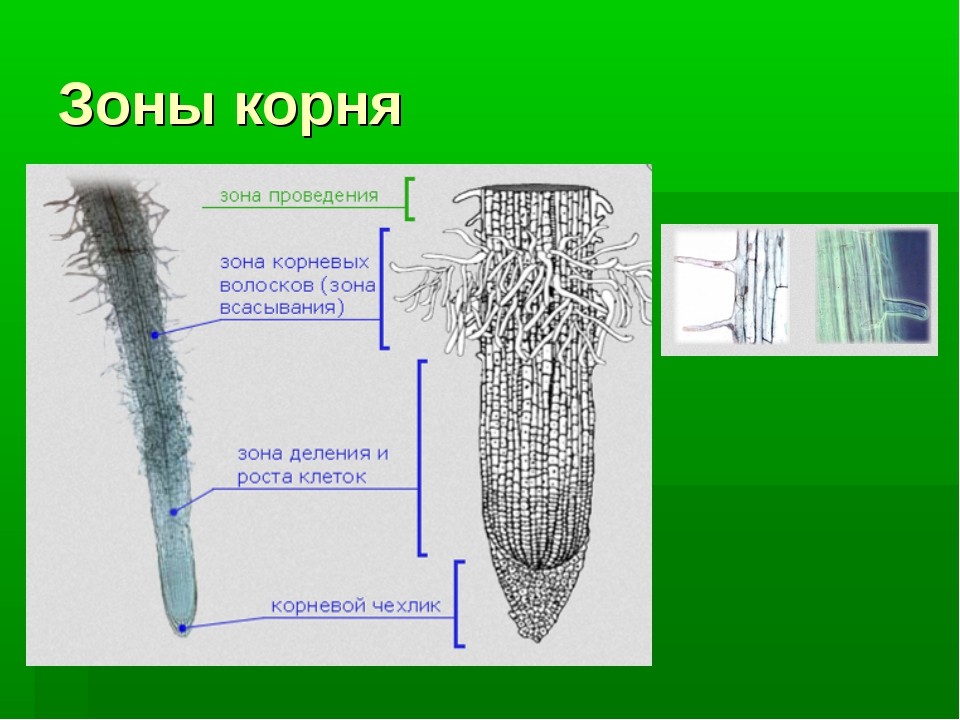
Внутреннее строение корня. (Анимация)
Интерактивный урок-тренажёр. (Пройдите все страницы урока и выполните все задания)
Корень – это специализированный, т.е. приспособленный для почвенного питания, орган растения. Его внешнее и внутреннее строение обусловлено этим назначением. По строению и выполняемым функциям в корне различают четыре зоны: деления, растяжения (роста), всасывания и проведения. Каждая зона корня имеет своё особое клеточное строение, которое и обеспечивает выполнение её функций. Так, в зоне всасывания вода и растворённые вещества, поглощаемые живыми клетками кожицы корневыми волосками, проходят через клетки коры в древесину центрального цилиндра и поднимаются наверх. Хорошо развита кора, состоящая из живых клеток, которая может выполнять функции запасающей ткани. В зоне проведения наружный слой корня – сначала кора, а потом и пробка – это водо- и воздухонепроницаемые ткани. В этой зоне хорошо развиты проводящие ткани – луб и древесина.
Хорошо развита кора, состоящая из живых клеток, которая может выполнять функции запасающей ткани. В зоне проведения наружный слой корня – сначала кора, а потом и пробка – это водо- и воздухонепроницаемые ткани. В этой зоне хорошо развиты проводящие ткани – луб и древесина.
Тесное взаимодействие всех зон корня обеспечивает его бесперебойную, нормальную работу, важную для жизнедеятельности всего организма растения.
|
ЭТАПЫ УРОКА |
СОДЕРЖАНИЕ ЭТАПОВ |
ДЕЯТЕЛЬНОСТЬ |
ФАЗЫ РАБОТЫ ПАМЯТИ |
||||||||||||||
|
ОРГМОМЕНТ |
|
Внимательно слушают, отвечают на вопросы, задают вопросы. |
|
||||||||||||||
|
МОТИВАЦИЯ УЧАЩИХСЯ (ИНДУКЦИЯ). |
|
Отвечают на вопросы учителя. |
|
||||||||||||||
|
ПРОВЕРКА ДОМАШНЕГО ЗАДАНИЯ. |
1. ГРАФИЧЕСКИЙ ДИКТАНТ ПО ТЕМЕ «СЕМЯ»
КЛЮЧ К ДИКТАНТУ: |
Работают в тетради. Затем обмениваются тетрадями и по ключу, выданному учителем, осуществляют взаимопроверку, выставляют отметку в тетради. |
Формирование долговременной памяти по теме «Семя». |
||||||||||||||
|
2. Учащимся предлагается в конвертах 2 разрезанные схемы: «Строение семени фасоли» и «Строение зерновки пшеницы». За три минуты они должны правильно их собрать. |
Работают в парах. По мере выполнения задания осуществляют взаимопроверку, исправляют ошибки. |
|
|||||||||||||||
|
ИЗУЧЕНИЕ НОВОЙ ТЕМЫ. |
План изучения темы: 1) функции корня; 2) виды корней; 3) типы корневых систем; 4) клеточное строение молодого корня: зоны корня; ткани |
|
|
||||||||||||||
|
1.
|
Слушают объяснение учителя и фиксируют схему в тетрадь |
Аудиально-визуально-кинестетическое восприятие. Концентрация внимания. Запечатление |
|||||||||||||||
|
2. ВИДЫ КОРНЕЙ. Учитель рассказывает детям о том, что корни различаются по внешнему строению и расположению относительно друг друга и других органов растения. Выделяют три вида корней: главные, боковые и придаточные. Главный корень бывает у растения один, значительно длиннее и толще других. Отходит от стебля (схема 1.) Придаточные корни отходят от стебля и других органов, их много. Они имеют приблизительно одинаковые размеры (схема 1).
Боковые корни возникают как ответвления от главных, придаточных и других боковых корней. |
Внимательно слушают объяснение учителя. |
Аудиальное |
|||||||||||||||
|
СХЕМА 1 «ВИДЫ КОРНЕЙ И ТИПЫ КОРНЕВЫХ СИСТЕМ».
|
Копируют схему в рабочие тетради. Задают уточняющие вопросы учителю |
Визуально-кинестетическое восприятие. Концентрация внимания. Запечатление |
|||||||||||||||
|
3. ТИПЫ КОРНЕВЫХ СИСТЕМ. Используя схему 1, учитель объясняет, что совокупность корней растения называют корневой системой.
СКС характерна для двудольных растений (морковь, петрушка, дуб, сосна). МКС характерна для однодольных растений (рожь, пшеница, овес).
|
Слушают учителя, рассматривают схемы, за- |
Аудиально-визуально-эмоциональное
Концентрация Запечатление. |
|||||||||||||||
|
4. КЛЕТОЧНОЕ СТРОЕНИЕ МОЛОДОГО КОРНЯ: ЗОНЫ КОРНЯ. Что общего между сердцем и корнем в специфике их работы? Это ее непрерывность (безостановочность). Корни растут непрерывно, если условия благоприятны. Это врожденное свойство, но оно возникло и развилось от необходимости следовать в почве за водой и питательными веществами. В постоянном росте корней состоит стратегия выживания неподвижного растения. Поэтому растущий корень делится на зоны: деления, роста, всасывания, проведения. Учитель характеризует каждую зону, используя таблицу «Строение корня». В заключение подтемы учитель демонстрирует учащимся таблицу «Зоны корня» (на ватмане) и предлагает учащимся зафиксировать ее в своих тетрадях. |
Внимательно слушают учителя. |
Аудиальное восприятие. Концентрация. |
|||||||||||||||
|
Таблица 2. ЗОНЫ КОРНЯ.
СТРОЕНИЕ КОРНЕВОГО ВОЛОСКА.
Такая форма клетки позволяет увеличить площадь всасывающей поверхности, улучшая тем самым минеральное питание растения. |
Слушают учителя, рассматривают таблицу. Фиксируют таблицу в тетрадях. |
Аудиально-визуальное восприятие. Концентрация внимания. Кинестетическое восприятие. Запечатление. Забывание подтемы «Виды корней и типы корневых систем».
|
|||||||||||||||
|
ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА. |
ЗАДАНИЕ 1. Работа в парах. Каждая пара получает в конвертах разрезанную схему (мозаику) «Виды корней и типы корневых систем». Учащимся предлагается собрать ее в течение 5 минут. Провести взаимопроверку. |
Собирают схемы. Корректируют ошибки друг друга. Проводят анализ и делают вывод о видах корней и типах корневых систем. |
Первичное повторение. Припоминание. Концентрация внимания. Запечатление. Забывание подтемы «Зоны корня». |
||||||||||||||
|
ЗАДАНИЕ 2. Работа с тестом (лучше устно). Тест выдается каждому учащемуся. Задание теста: из предложенных утверждений выбрать только правильные.
|
Отвечают устно. Корректируют и анализируют ответы друг друга. Могут задавать уточняющие вопросы. |
Припоминание. Концентрация. Запечатление. |
|||||||||||||||
|
ЗАДАНИЕ 3. Каждому ученику выдается карточка- немая схема с изображением зон корня, на которой они должны правильно подписать каждую и указать кратко функцию данной зоны. Задание выполняется в течение 4-5 минут. После выполнения задания учитель выборочно просит одного (или нескольких) ученика прокомментировать свои ответы. В это время все остальные проверяют правильность выполнения своих заданий. |
Работают индивидуально. Внимательно слушают ответ одноклассника. Анализируют его и свой ответ. Исправляют ошибки. Устанавливают истину. |
Припоминание. Концентрация. Запечатление. |
|||||||||||||||
|
ДОМАШНЕЕ ЗАДАНИЕ. |
|
Записывают задания в дневник и тетради. |
|
||||||||||||||
|
РЕФЛЕКСИВНЫЙ ЭТАП. |
|
Беседуют с учителем. Отвечают на вопросы учителя и друг друга. Обмениваются мнениями, дают советы и пожелания друг другу и учителю по оптимизации форм, средств и методов при изучении этой темы. |
|
Зоны (участки) корня. Ответы на вопросы — Биология
Зоны (участки) корня
Вопрос 1. Какие участки (зоны) можно различить, рассматривая молодой корень?
Выделяют несколько зон растущего корня: зона деления, зона растяжения, зона всасывания и зона проведения. Верхушка корня покрыта корневым чехликом.
Вопрос 2. Каково значение корневого чехлика?
Клетки корневого чехлика защищают верхушку (зону деления) корня от повреждений твердыми частицами почвы.
Вопрос 3. Где располагается зона деления клеток?
Чем ее клетки отличаются от клеток других зон? Зона деления находится под корневым чехликом на верхушке корня и представлена образовательной тканью, состоящей из мелких, живых, плотно прилегающих одна к другой клеток с крупными ядрами. Клетки зоны деления постоянно делятся.
Вопрос 4. Где располагается зона растяжения корня?
Каково ее значение? Выше зоны деления расположена зона растяжения. Здесь клетки подрастают, вытягиваются, в результате чего корень растет в длину.
Вопрос 5. Что такое корневой волосок? Какое строение он имеет?
Корневой волосок — длинный вырост наружной клетки корня. Под клеточной оболочкой в корневом волоске находятся цитоплазма, ядро, бесцветные пластиды и вакуоль с клеточным соком.
Вопрос 6. Почему одну из зон корня называют зоной всасывания?
Корневые волоски всасывают из почвы воду с растворенными в ней минеральными веществами. Поэтому участок корня, на котором находятся корневые волоски, принято называть зоной всасывания.
Вопрос 7. Где расположена зона проведения корня? Почему ее так называют?
Выше зоны всасывания находится зона проведения. По клеткам этого участка корня вода с растворенными минеральными веществами перемещается к стеблю вверх, а органические вещества из листьев и стебля поступают для питания корня. В этой зоне закладываются боковые корни.
Вопрос 8. Какие ткани различают в корнях растений?
На поверхности корня находится покровная ткань . Зона деления корня представлена образовательной тканью. В состав зоны проведения входят проводящие ткани (сосуды и ситовидные трубки). Прочность и упругость корню
§ 3. Зоны (участки) корня
Вопросы в начале параграфа1. Что такое ткань?
Ткань — это совокупность клеток, которые имеют общее строение и выполняют одинаковые функции.
2. Какие виды растительных тканей вы знаете?
Покровная, механическая, основная, проводящая, образовательная ткань.
Лабораторные работы
Лабораторная работа: Корневой чехлик и корневые волоски
1. Рассмотрите корешок редиса или проростка пшеницы невооружённым глазом, а затем в лупу. Найдите на конце корешка корневой чехлик.
Рассмотрим корень проростка пшеницы.
2. Обратите внимание на часть корня выше корневого чехлика. Найдите выросты в виде пушка — корневые волоски. Прочтите в учебнике. какое они имеют строение и значение.
Корневые волоски — недлинные тонкие выросты наружной клетки корня. Они необходимы растению для того, чтобы значительно увеличить всасывающую поверхность корня. Корень, обладающий большей всасывающей поверхностью, способен получать из почвы большее количество воды с растворёнными в ней питательными веществами, а значит и обеспечить растению лучшее питание и рост.
Корневые волоски имеют следующее строение: под клеточной оболочкой в нём находится цитоплазма, ядро, вакуоль с клеточным соком и бесцветные пластины. Длина корневых волосков редко превышает 10 мм.
3. Положите корешок на предметное стекло в каплю воды, подкрашенную чернилами, и рассмотрите под микроскопом. Сопоставьте увиденное под микроскопом с рисунком учебника, зарисуйте и сделайте надписи.
4. Что общего в строении корневого волоска и клеток кожицы лука? Чем объясняется различие в их форме?
Рассмотрим в микроскоп корневой волосок и клетки кожицы лука:
И у корневого волоска, и у клетки кожицы лука есть оболочка, вакуоль, ядро и цитоплазма. Но у корневого волоска ещё есть пластиды, а у клеток кожицы лука — поры оболочки.
Корневой волосок имеет более вытянутую форму по сравнению с клеткой кожицы лука, так как назначение корневого волоска — это всасывание воды и растворённых в ней минеральных веществ из почвы. Для большего объема всасывания необходима как можно большая поверхность оболочки корневого волоска. Вытянутая форма позволяет создать большую поверхность всасывания.
Вывод:
Клетки растений имеют сходное строение, а их различие объясняется функциями, которые выполняют те или иные клетки.
Вопросы в конце параграфа
1. Какие участки (зоны) можно различить, рассматривая молодой корень?
Рассматривая молодой корень можно различить 5 зон корня: корневой чехлик, зону деления, зону роста, зону всасывания (с корневыми волосками) и зону проведения.
2. Каково значение корневого чехлика?
Корневой чехлик защищает верхушку корня от повреждения твёрдыми частицами почвы.
3. Где располагается зона деления клеток? Чем её клетки отличаются от клеток других зон?
Зона деления клеток корня находится прямо над корневым чехликом. Клетки этой зоны очень мелкие и плотно прилегают одна к другой. Они постоянно делятся и, благодаря этому, число этих клеток постоянно увеличивается.
4. Где располагается зона растяжения корня? Каково её значение?
Зона растяжения находится между зоной деления и зоной всасывания. Клетки этой зоны постоянно вытягиваются, что приводит к росту корня в длину.
5. Что такое корневой волосок? Какое строение он имеет?
Корневой волосок — это длинный вырост наружной клетки корня. Каждый такой волосок — это одна клетка, которая состоит из клеточной оболочки и находящихся внутри неё цитоплазмы, вакуоли, ядра и бесцветных пластид.
6. Почему одну из зон корня называют зоной всасывания?
Участок корня, на котором расположены корневые волоски, называют зоной всасывания. Именно в этой зоне, благодаря корневым волоскам, проникающим между частицами почвы, происходит активное всасывание растением воды, насыщенной питательными минеральными веществами.
7. Где расположена зона проведения корня? Почему её так называют?
Зона проведения находится над зоной всасывания. Она соединяет стебель растения с остальными частями корня. Именно через зону проведения все впитанные из почвы питательные вещества поступают в стебель и далее к другим частям растения.
8. Что такое ткань?
Ткань — это совокупность клеток, обладающих одинаковым строением и общими свойствами.
9. Какие ткани различают в корнях растений?
В корне растений различают покровную ткань, образовательную ткань, проводящую ткань, механическую ткань и основную ткань.
Подумайте
Зная строение корня, может ли человек влиять на формирование корневой системы? Если да, то каким образом?
Да, при помощи различных методов человек может стимулировать рост тех или иных частей корня.
Например, метод пикировки позволяет увеличить количество придаточных корней, а метод окучивания — расширить зону всасывания.
ЗаданияПикировка — это отщипывание кончика корня при рассаживании молодых растений с помощью заострённого колышка-пики. Какое влияние она оказывает на развитие корневой системы растений (рис. 10)?
Пикировка — отщипывание кончика корня, приводит к тому, что корень перестаёт активно расти в длину (вниз) и начинает расширяться в ширь. В результате придаточные корни становятся более сильными и многочисленными, способными извлечь из почвы максимальное количество воды с минеральными питательными веществами.
Используя рекомендации памятки на с. 11 —12, проведите анализ строения корня.
Анализ строения корня
- Корень растения состоит из главного корня (вырастающего из зачаточного корешка), а также придаточных и боковых корней. В зависимости от развитости главного и придаточных корней различают стержневые и мочковатые корневые системы.
- У каждого растения корень состоит из пяти зон: корневого чехлика, зоны деления, зоны роста, зоны всасывания и зоны проведения.
- У каждой из зон корня имеются особенности, отличающие её от других зон. Так, корневой чехлик состоит из клеток покрывной ткани — довольно плотной и грубой. Зона деления состоит из клеток соединительной ткани, которые умеют быстро делиться, чтобы клеток становилось все больше. Зона роста также состоит из соединительной ткани, но её клетки уже не делятся, а вытягиваются, растут. Зона всасывания обладает клетками специальной формы — корневыми волосками. Зона проведения состоит из клеток 4 видов: покровной ткани, проводящей ткани, механической ткани и основной ткани.
- Каждая часть корня связана с другими частями:
- корневой чехлик защищает нежные, только что созданные клетки зоны деления;
- зона деления обеспечивает новыми клетками зону роста;
- зона роста поставляет новые поверхности для образования корневых волосков зоны всасывания;
- зона всасывания обеспечивает все зоны корня питанием и водой;
- зона передачи поставляет все добытые корнем вещества в другие части растения.
- Каждая из зон корня обладает собственными функциями. Корневой чехлик предназначен для защиты верхушки корня от повреждений. Зона деления корня отвечает за деление клеток корня и увеличение их количества. Зона роста обладает функцией вытягивания клеток корня и обеспечивает рост корня в длину. Зона всасывания необходима корню для всасывания воды и питательных минеральных веществ из почвы.Зона проведения служит для проведения впитанных минеральных веществ в стебель и другие части растения.
Задания для любознательных
Задания для любознательных
1. Осторожно выньте из почвы проросток пшеницы и рассмотрите его. Какая зона корня покрыта приставшей почвой? Объясните почему.
Наибольшее количество почвы пристало к зоне всасывания корня, поскольку в этой зоне на корне вырастают корневые волоски, которые буквально присасываются к почве для получения из неё воды с минеральными веществами.
2. Отщипните кончики корня у молодых растений капусты, астры, фасоли и др. Наблюдайте за развитием корневых систем контрольных и опытных растений. Результаты опыта обсудите с другими учащимися.
Растения с отщипнутыми кончиками корня развиваются быстрее и выглядят более сильными: с толстыми стеблями и большими листьями.
Словарик
Корневой чехлик — это часть корня, защищающая верхушку корня от повреждений.
Корневой волосок — это наружные клетки зоны всасывания корня. Эти клетки имеют особую форму, позволяющую им эффективно впитывать влагу из почвы.
Зона деления — это часть корня, клетки которой постоянно делятся.
Зона растяжения — это зона корня, клетки которой все время растут, растягиваются в длину.
Зона всасывания — это зона корня, на поверхности которой имеется много корневых волосков, всасывающих влагу из почвы.
Зона проведения— это зона корня, которая обеспечивает передачу впитанных корнем из почвы питательных веществ стеблю и остальным частям растения.
Развитие растений II: Первичный и вторичный рост
Цели обучения
- Различие между первичным и вторичным ростом
- Идентифицировать и описать роль апикальной и латеральной меристем в росте растений
- Сравните и сопоставьте процессы и результаты первичного и вторичного роста стеблей и корней
- Опишите функцию и организацию древесных стеблей, полученных в результате вторичного роста
Индетерминантный рост растений: Meristems
Приведенная ниже информация была адаптирована из OpenStax Biology 30.1
В отличие от большинства животных, которые вырастают до определенного размера и формы, а затем перестают расти ( определяют рост ), растения демонстрируют неопределенный рост , при котором растение будет продолжать добавлять новые органы (листья, стебли, корни), пока оно имеет доступ к необходимым ресурсам. Растения могут продолжать расти так бесконечно благодаря специализированным тканям, называемым меристемами , которые являются областями непрерывного деления и роста клеток. Клетки меристематической ткани либо недифференцированы, либо не полностью дифференцированы, и они продолжают производить клетки, которые быстро дифференцируются или специализируются и становятся постоянными тканями (кожными, наземными и сосудистыми).
Меристематические ткани бывают трех типов в зависимости от их расположения в растении. Апикальные меристемы содержат меристематическую ткань, расположенную на концах стеблей и корней, которые позволяют растению увеличиваться в длину. Боковые меристемы способствуют увеличению толщины или обхвата созревающего растения. Меристемы Intercalary (также называемые базальными ) встречаются только у некоторых однодольных, в основаниях листовых пластинок и в узлах (областях, где листья прикрепляются к стеблю).Эта ткань позволяет листовой пластине однодольных увеличиваться в длину от основания листа; например, он позволяет листьям газонной травы удлиняться даже после многократного выпаса скота или кошения.
Меристемыспособствуют росту как первичных, (выше / длиннее), так и вторичных (более широких). Первичный рост контролируется апикальными меристемами корня или апикальными меристемами побегов , в то время как вторичный рост контролируется двумя боковыми меристемами, называемыми сосудистым камбием и корковым камбием .Не все растения демонстрируют вторичный рост.
Видео ниже дает хорошее обсуждение первичного и вторичного роста растений (начало в 2:20):
Первичный рост корней
Информация ниже была адаптирована из OpenStax Biology 30.3
Рост корней начинается с прорастания семян. Когда зародыш растения выходит из семени, корешок зародыша образует корневую систему. Кончик корня защищен крышкой корня , структурой, характерной только для корней и не похожей на любую другую структуру растения.Корневой покров постоянно заменяется, потому что он легко повреждается, когда корень проталкивается через почву. За корневой крышкой, в пределах первого сантиметра или около того, кончик корня можно разделить на три зоны:
- Зона клеточного деления , которая содержит апикальную меристему, является местом сразу за корневой крышкой, где клетки активно делятся посредством митоза.
- Зона растяжения клеток — это место, где вновь образованные клетки растут или увеличиваются в длине, чтобы увеличить длину корня.Этот процесс требует поглощения воды, которая буквально растягивает клетки и увеличивает их размер.
- Зона созревания клеток — это место, где вновь удлиненные клетки завершают свою дифференцировку в кожные, сосудистые или наземные ткани. Созревание обусловлено изменениями в экспрессии генов.
Верхушка корня разделена на три области: верхняя область созревания, средняя область удлинения и нижняя область деления клеток на верхушке корня.В зоне созревания корневые волоски отходят от основного корня, а клетки имеют большие размеры и прямоугольную форму. Область удлинения не имеет корневых волосков, а клетки все еще прямоугольные, но несколько меньшего размера. Сосудистый цилиндр проходит через центр корня в области созревания и области удлинения. В области клеточного деления клетки намного меньше. Клетки в этой области называются апикальной меристемой. Слой клеток, называемый корневой крышкой, окружает апикальную меристему. Изображение предоставлено: OpenStax Biology
Растения также могут иметь боковых корней , ответвляющихся от главного главного корня.Боковые корни происходят из меристематической ткани в перицикле , который является самым внешним клеточным слоем в сосудистом цилиндре в центре корня (показано ниже). После того, как они появились, боковые корни демонстрируют свой собственный первичный рост, постоянно увеличивая длину бокового корня.
Окрашиваниепоказывает различные типы клеток на этой световой микрофотографии поперечного сечения корня пшеницы ( Triticum ). Клетки склеренхимы экзодермы и клетки ксилемы окрашиваются в красный цвет, а клетки флоэмы окрашиваются в синий цвет.Другие типы клеток окрашиваются в черный цвет. Стела или сосудистая ткань — это область внутри энтодермы (обозначена зеленым кольцом). За пределами эпидермиса видны корневые волоски. (Источник: OpenStax Biology, данные шкалы от Мэтта Рассела)
Изображение представляет собой поперечный разрез части корня однодольной кукурузы ( Zea mays ), на котором видны стела и боковой корень. Боковые корни развиваются из слоя клеток под энтодермой, называемого перициклом. Они возникают в результате деления клеток перицикла напротив группы протоксилемы.Корень начинает набухать по мере того, как новый боковой корень проникает наружу к поверхности, проталкивается через клетки корковой паренхимы и, наконец, вырывается через эпидермис в почву. По мере роста он развивает ксилему и флоэму, которые соединяются с сосудистыми тканями главного корня. Этот процесс сильно отличается от того, что происходит в побегах, где боковые ветви, образующие стебли или листья, берут начало только из апикальной меристематической ткани побега. Боковые корни могут развиваться на большом расстоянии от кончика корня.Изображение Джона Беббингтона FRPS, https://www.flickr.com/photos/71183136@N08/6947183226
Первичный рост побегов
Приведенная ниже информация была адаптирована из OpenStax Biology 30.2
Как и в корнях, первичный рост стеблей является результатом быстрого деления клеток в апикальных меристемах на кончике побега. Последующее удлинение клеток приводит к первичному росту.
У многих растений основной рост происходит главным образом на верхушечной (верхней) почке, а не на пазушных почках (почках в местах бокового ветвления).Влияние апикальной почки на общий рост растения известно как апикальное доминирование , которое предотвращает рост пазушных почек, образующихся по бокам ветвей и стеблей. Большинство хвойных деревьев демонстрируют сильное верхушечное доминирование, что дает типичную коническую форму рождественской елки. Если удалить верхушечную почку, тогда пазушные почки начнут формировать боковые ветви. Садоводы используют этот факт, когда подрезают растения, срезая верхушки веток, тем самым стимулируя рост пазушных почек, придавая растению густую форму.
Вторичный рост побегов (и корней)
Процесс вторичного роста контролируется боковыми меристемами и одинаков как для стеблей, так и для корней. Боковые меристемы включают сосудистый камбий, а у древесных растений — пробковый камбий (камбий — еще один термин для обозначения меристемы). Травянистые (недревесные) растения в основном развиваются первично, без вторичного роста или увеличения толщины. У древесных растений заметен вторичный рост, или древесина; встречается у некоторых двудольных, но очень редко у однодольных.
Приведенные ниже сведения относятся к вторичному росту стеблей. Хотя принципы вторичного роста корней аналогичны, детали несколько отличаются. Мы обсудим только детали, относящиеся к стеблям.
Сосудистый камбий расположен между первичной ксилемой и первичной флоэмой в сосудистом пучке. (Напомним, что ксилема расположена по направлению к внутренней части, а флоэма по направлению к внешней стороне пучка.) Клетки сосудистого камбия делятся и образуют вторичную ксилему (трахеиды и сосудистые элементы) внутрь и вторичную флоэму (сетчатые элементы и сопутствующие клетки). наружу.Клетки вторичной ксилемы содержат лигнин , основной компонент древесины, который обеспечивает выносливость и прочность. Ксилема вместе с сердцевиной образуют древесину и древесного стебля.
У древесных растений пробковый камбий является самой внешней боковой меристемой. Он производит пробковых ячеек , которые содержат воскообразное вещество, способное отталкивать воду. Флоэма вместе с пробковыми клетками образуют кору , которая защищает растение от физических повреждений и помогает уменьшить потерю воды.Пробковый камбий также производит слой клеток, известный как phelloderm , который растет внутрь от камбия. Пробковый камбий, пробковые клетки и феллодерма вместе называются перидермой . Перидерма заменяет эпидермис зрелых растений.
Совместное действие сосудистой и пробковой камбии приводит к вторичному росту или расширению стебля растения. Эти структуры проиллюстрированы ниже:
У древесных растений за первичным ростом следует вторичный рост, который позволяет стеблю растения увеличиваться в толщине или в обхвате.Вторичная сосудистая ткань добавляется по мере роста растения, а также пробковый слой. Кора дерева простирается от сосудистого камбия до эпидермиса. Изображение предоставлено: OpenStax Biology
Каждый год в течение вегетационного периода добавляется новый слой ксилемы и флоэмы. Внутренние слои ксилемы в конечном итоге умирают и заполняются смолой, функционируя только в качестве структурной опоры. Внутренняя нефункциональная ксилема называется сердцевиной . Более новая функциональная ксилема называется заболонь .Внешние слои флоэмы в конечном итоге раздавливаются о пробковый камбий и разрушаются. Таким образом, зрелое дерево содержит много внутренних слоев старой нефункциональной ксилемы глубоко внутри ствола, но лишь небольшое количество более старой флоэмы.
Слои тканей внутри ствола зрелого дерева. Изображение основано на работе брата Лаппена — общественное достояние, https://commons.wikimedia.org/w/index.php?curid=8979988
В этом видео описывается процесс и результат вторичного роста стеблей:
Вторичный прирост и годовые кольца
Активность сосудистого камбия приводит к образованию годовых колец.В весенний вегетационный период клетки вторичной ксилемы имеют большой внутренний диаметр, а их первичные клеточные стенки не сильно утолщены. Это известно как ранняя древесина или весенняя древесина. Во время осеннего сезона вторичная ксилема развивает утолщенные клеточные стенки, образуя позднюю древесину или осеннюю древесину, которая плотнее, чем ранняя древесина. Такое чередование ранней и поздней древесины во многом связано с сезонным уменьшением количества сосудистых элементов и сезонным увеличением количества трахеид.Это приводит к образованию годичного кольца, которое можно увидеть как круговое кольцо в поперечном сечении стержня (показано ниже). Изучение количества годовых колец и их природы (например, их размера и толщины клеточной стенки) может выявить возраст дерева и преобладающие климатические условия в течение каждого сезона.
Скорость роста древесины увеличивается летом и уменьшается зимой, образуя характерное кольцо для каждого года роста. Сезонные изменения погодных условий также могут повлиять на скорость роста, в результате чего кольца различаются по толщине.CC BY 2.5, https://en.wikipedia.org/w/index.php?curid=11591972
апикальная меристема | Определение, развитие и факты
Апикальная меристема , область клеток, способных делиться и расти в корне и на концах побегов растений. Апикальные меристемы дают начало первичному телу растения и отвечают за распространение корней и побегов. В отличие от большинства животных, растения продолжают расти на протяжении всей своей жизни из-за неограниченного деления этих и других меристем.
меристемаПродольный разрез апикальной меристемы.
J.M. LanghamКак и в других меристематических областях, клетки апикальных меристем обычно маленькие и почти сферические. У них плотная цитоплазма и относительно немного мелких вакуолей (водянистые мешковидные оболочки). Некоторые из этих клеток, известные как инициалы, поддерживают меристему как постоянный источник новых клеток и могут многократно подвергаться митозу (делению клеток), прежде чем дифференцироваться в конкретные клетки, необходимые для роста корня или побега.Клетки, исходящие из апикальной меристемы, расположены в клонах частично дифференцированных тканей, известных как первичные меристемы. Есть три основных меристемы: протодерма, которая станет эпидермисом; наземная меристема, которая будет формировать основные ткани, включающие клетки паренхимы, колленхимы и склеренхимы; и прокамбий, который станет тканями сосудов (ксилема и флоэма).
апикальные меристемы корня и побегаАпикальная меристема побега Hypericum uralum (слева) появляется на самой верхней стороне стебля.Сразу за апикальной меристемой находятся три области первичных меристематических тканей. Апикальная меристема корня (справа) появляется сразу за защитной крышкой корня. Сразу за апикальной меристемой отчетливо видны три первичные меристемы.
Encyclopædia Britannica, Inc.Апикальная меристема корня
Апикальная меристема корня, или верхушка корня, представляет собой небольшую область на кончике корня, в которой все клетки способны к повторному делению и из которой происходят все первичные ткани корня. полученный.Апикальная меристема корня защищена при прохождении через почву внешней областью живых клеток паренхимы, называемой корневым покровом. По мере того, как клетки корневого чехлика разрушаются и отслаиваются, к ним добавляются новые клетки с помощью специального внутреннего слоя меристематических клеток, называемого калиптрогеном. Корневые волоски также начинают развиваться как простые продолжения клеток около апикальной меристемы корня. Они значительно увеличивают площадь поверхности корня и способствуют усвоению воды и минералов из почвы.
анатомия корняАпикальная меристема — это область активно делящихся клеток, которая формирует все клетки корня. Корневой покров обеспечивает защитное покрытие, облегчающее прохождение корня через почву. Клетки становятся специализированными для выполнения определенных функций в зоне дифференцировки или созревания. Эпидермальный слой позволяет воде и растворенным материалам проникать внутрь. Клетки коры хранят пищу и транспортируют воду и вещества к энтодерме, которая регулирует их поступление в сосудистый цилиндр, содержащий ксилему (для транспортировки воды и растворенных минералов к остальной части растения) и флоэму (для транспортировки питательных веществ, образующихся в листья).
© Merriam-Webster Inc.Начиная с корня и отходя от кончика корня, существуют три отдельные зоны, в которых доминируют определенные специфические модели роста: деление клеток, удлинение клеток, дифференциация и созревание тканей. Между этими регионами происходит постепенный переход. Область деления клеток включает апикальную меристему и первичные меристемы — протодерму, наземную меристему и прокамбий — происходящие из апикальной меристемы. Как в целом верно для немеристематических областей в других частях тела растения, длина корня во второй области увеличивается в результате удлинения клеток, а не деления клеток.Область дифференцировки и созревания ткани, которая следует за этим, — это место, где клетки дифференцируются (то есть изменение структуры и физиологии в клетки определенного типа) и где четко видны первая первичная флоэма и ксилема, а также зрелые корневые волоски. У растений с древесными корнями (то есть у многолетних двудольных) развивается вторичный рост, включая вторичную ксилему и флоэму, а также перидерму, которые добавляют растению обхват.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчасАпикальная меристема побега
Все ветви и стебли высших сосудистых растений оканчиваются апикальной меристемой побега. Это центры потенциально неопределенного роста и развития, производящие листья, а также почку на оси большинства листьев, которая может расти как ветвь. Эти апикальные центры роста побегов образуют первичное тело растения.
Меристемы побегов у некоторых видов могут взаимопревращаться и изменять тип производимых побегов. Например, у длиннолистной сосны ( Pinus palustris ) сеянцы переходят в стадию травы, которая может сохраняться до 15 лет.Здесь конечная почка на главной оси существует в виде короткого побега и дает многочисленные игольчатые карликовые побеги, в которых отсутствует или незначительное удлинение междоузлий. Следовательно, саженец напоминает пучок травы. Вероятно, это адаптация к огню, водному стрессу и, возможно, пастбищу. Объем корня, однако, продолжает расти, увеличивая шанс выживания проростков после того, как побеги начинают расти (то есть междоузлия начинают расширяться). Этот процесс называется промывкой.
The Editors of Encyclopaedia Britannica Эта статья была недавно отредактирована и обновлена Мелиссой Петруццелло, помощником редактора.Узнайте больше в этих связанных статьях Britannica:
Определение недифференцированного в биологии.
Примеры недифференцированных в следующих темах:
Типы клеток в костях
- Эти остеогенные клетки являются недифференцированными с высокой митотической активностью; они единственные костные клетки, которые делятся.
- Остеогенные клетки — это недифференцированных , которые развиваются в остеобласты.
Meristems
- Меристемы растений являются центрами деления митотических клеток и состоят из группы из недифференцированных самообновляющихся стволовых клеток, из которых возникает большинство структур растений.
- Апикальная меристема, также известная как «кончик роста», представляет собой недифференцированную меристематическую ткань, обнаруженную в почках и на кончиках корней растений.
Экспрессия гена в стволовых клетках
- Стволовые клетки — это недифференцированных биологических клеток, обнаруженных в многоклеточных организмах, которые могут дифференцироваться в специализированные клетки (асимметричное деление) или могут делиться с образованием большего количества стволовых клеток (симметричное деление).
- Альтернативная теория состоит в том, что стволовые клетки остаются на недифференцированными и на из-за сигналов окружающей среды в их конкретной нише.
Типы корневых систем и зоны роста
- Зона деления клеток находится ближе всего к кончику корня и состоит из активно делящихся клеток корневой меристемы, которая содержит недифференцированных клеток прорастающего растения.
Структурные приспособления для земли под бессемянными растениями
- Апикальная меристема состоит из недифференцированных клеток, которые продолжают размножаться на протяжении всей жизни растения.
Характеристика животных по признакам эмбриологического развития
- В отличие от протостомов дейтеростомы подвергаются неопределенному расщеплению: клетки остаются недифференцированными до более поздней стадии развития.
Растительные ткани и системы органов
- Клетки меристематической ткани либо недифференцированные, , либо неполностью дифференцированные; они продолжают делиться и способствуют росту растения.
Природные и искусственные методы бесполого размножения растений
- Часть растения часто дает начало недифференцированной массе , известной как каллус, из которой через некоторое время начинают расти отдельные ростки.
Продолжительность жизни растений
- Даже когда некоторые части растения, такие как области, содержащие меристематическую ткань (область активного роста растения, состоящая из недифференцированных клеток , способных к делению клеток), продолжают расти, некоторые части подвергаются запрограммированной гибели клеток (апоптозу).
Эволюция репродукции
- Эти организмы производят сперму и яйцеклетки из недифференцированных клеток в целом, сохраняя их в этой полости.
морских зон ~ Общество охраны природы MarineBio
ниток
Пляжи или берега. — это геологические образования, состоящие из рыхлой породы, такой как песок, галька или булыжник, и расположенные вдоль берега водоема.В 1980 году Уильям Баском оспорил идею о том, что пляж — это просто набор песка, приводимый в движение волнами на глубине 10 м и более вдоль побережья. Судя по его измененному описанию, пляжи также включают затопленные прибрежные бары. В описании Баскома пляж может быть либо небольшой системой, где скальный материал перемещается на берег под действием волн и течений, либо геологической единицей значительных размеров.
Берма пляжа — это часть пляжа над водой (в зависимости от прилива), на которую в какой-то момент во время прилива активно влияют волны.У насыпи есть гребень наверху и поверхность, которая представляет собой склон, ведущий к воде. Береговая насыпь также считается отложением материала (рыхлой породы, песка, гальки или булыжника), образованного силами океанской воды. В нижней части лица обычно есть желоб. Дальше в море, у одной из прибрежных полос, есть подводные набережные, где разбиваются волны. Отложения песка с гребня бермы часто простираются далеко вглубь суши в результате сильных штормовых волн. В точке выше на пляже, куда вода не может попасть при нормальных погодных условиях, ветер начинает превращать песок в дюны и другие песчаные образования.
Нет четкой границы между пляжем и дюной, потому что между этими двумя объектами всегда происходит обмен песка. Линия дрейфа — это высшая точка материала, наносимого волнами, и ее потенциально можно назвать разделительной линией между пляжем и дюнами. На линии уноса ветром может происходить значительное движение песка из-за штормовых волн, когда они достигают далеко вглубь суши. Однако в штормовых условиях линия дрейфа также может перемещаться вглубь суши под бушующими волнами.
Приливная зона расположена между отливом и приливом и подвержена влиянию приливных движений.Приливная зона расположена ниже линии отлива. Приливная или литоральная зона (также известная как береговая линия) расположена между средним приливом и средним отливом. Там, где вода задерживается в каменистых впадинах во время отлива, часто встречаются приливные бассейны.
Формирование пляжей
Пляжи — это рельефы, образованные волновой нагрузкой — процессом, при котором волны или течения перемещают отложения (песок или другой рыхлый материал), взвешенные в воде, на сушу. Отложения также могут возникать в результате подпрыгивающего движения крупных частиц или сальтации, когда материалы, присутствующие на пляже, возникают в результате процесса эрозии горных пород на шельфе, в результате эрозии мыса (узкий участок земли, выступающий от берега) и в результате оползания, образующего отложения осыпей. (скопление камней и обломков у подножия холма).Коралловые рифы также являются значительными источниками песчаных частиц для пляжей.
Природа волн и доступные материалы формируют пляж. Конструктивные волны добавляют материал и перемещают его вверх по пляжу, в то время как разрушительные волны смывают материал с пляжа. Песчаные пляжи имеют пологий уклон из-за выноса песка обратным потоком волн. Пляжи с галькой более крутые, потому что обратная волна просачивается между крупными частицами и становится слабее по силе, поэтому материал не такой скульптурный. Неровный край песчаного пляжа образуется, когда набегающие волны разделяются, осаждая песок в виде рогов и вымывая песок, образуя выступы.
Морские зоны жизни
Организмы, обитающие на береговой линии пляжа, должны быть адаптированы как к влажным, так и к сухим условиям, так как эта территория находится под водой во время прилива. Такие животные, как морские анемоны, ракушки, хитоны, крабы, равноногие моллюски, блюдца, мидии, морские звезды, улитки и детеныши, приспособились к тому, чтобы выжить, будучи разбитыми волнами или унесенными в море.
«Прибрежная зона» может относиться к береговой линии пресноводного или соленого водоема, а также означает любую территорию, близкую к воде или находящуюся под воздействием воды.Для пресноводного биома прибрежная зона — это область с обильным освещением вблизи берега. Прибрежная зона пруда или озера обеспечивает активную фотосинтетическую деятельность и, следовательно, является местом обитания почти всей водной флоры и фауны. Поскольку вода находится так близко к прибрежным зонам, как пресной, так и соленой, организмы, существующие здесь, часто встречаются в дюнах или эстуариях. Большое количество доступной воды помогает создать прекрасную среду обитания для множества растений и животных и добавляет влажность, что позволяет выжить более уникальным организмам.Люди также часто полагаются на прибрежную зону, что можно наблюдать в больших популяциях, живущих у моря.
I. Пелагические — (1) эпипелагические (2) мезопелагические (3) батипелагические (4) абиссопелагические
II. Бентосный — (5) Прибрежный, Сублиторальный (6) Батиальный (7) Абиссальный (8) Ультраабиссальный | Примечание: глубины указаны в метрах
Прибрежная область состоит из трех подзон, называемых супралиторальной зоной , литоральной зоной и сублиторальной зоной .Супралиторальная зона или «зона распыления» находится под водой только во время штормов и расположена между линией прилива и сушей. Приливная зона расположена между приливами и отливами. Сублитораль всегда находится под водой и находится ниже линии отлива. Эта зона простирается до того места, где континентальный шельф опускается в абиссальную плоскость.
Все, кроме участков у побережья и морского дна, называется пелагической зоной. Противоположный термин — это демерсальная зона, которая представляет собой воду, находящуюся рядом с берегом или морским дном и находящуюся под ее влиянием.Пелагиали делятся на эпипелагические, мезопелагические, батипелагические, абиссопелагические и гадопелагические.
Эпипелагическая зона простирается от поверхности до 200 м и является домом для самого большого биоразнообразия в море, в основном из-за наличия солнечного света, который позволяет фотосинтезирующим организмам процветать. Здесь водятся как морские растения, так и животные. На высоте 200–1000 м находится мезопелагическая зона, сумеречная зона, где часть света проходит сквозь нее, но не достигает уровня яркости, необходимого для фотосинтеза.
Батипелагическая зона находится на высоте 1000-4000 м и полностью темна. Здесь обитают биолюминесцентные организмы, одни из самых странных морских глубин.
Physonect siphonophores, колония специализированных полипов, обнаруженная на глубине 2000 метров в батипелагической зоне. Северная часть Атлантического океана, каньон океанографа. Фотограф: М. Янгблут, OAR / Национальная программа подводных исследований (NURP); Океанографическое учреждение Харбор-Бранч (фото-библиотека NOAA)
Растения в батипелагической зоне отсутствуют.Животные, которые могут здесь жить, выживают за счет мертвого материала или детрита, который падает с поверхности на других животных, живущих в глубоком море. Гигантский кальмар является обитателем батипелагической зоны и служит источником пищи для глубоководных кашалотов. Большинство животных в абиссопелагической зоне, расположенной на глубине 4000 м, слепые и бесцветные из-за полного отсутствия света. Название «абиссопелагический» происходит от греческого, означающего «бездонная бездна», во времена, когда считалось, что глубокий океан никогда не кончается.Гадопелагическая зона — это область глубокой воды в самых глубоких океанских желобах. Hadopelagic от греческого означает «Аид» или греческий подземный мир.
Фотическая зона ( с освещением ) открытого океана состоит из эпипелагиали и мезопелагиали. Афотическая зона ( без света ) открытого океана состоит из всех нижних зон океана. Нижние зоны часто просто группируются морскими биологами в афотическую зону из-за их сходства.
Другие морские зоны
Абиссальная равнина — это плоская или пологая часть дна океана, достигающая глубины от 2200 до 5500 м.На абиссальной равнине камни погружены в дно океана из-за отсутствия поддерживающей тепловой энергии внизу. В результате получаются самые плоские и гладкие регионы мира. Абиссальные равнины обычно находятся между основанием континентального возвышения (или шельфа) и срединно-океаническим хребтом. Поверхность не всегда была гладкой, но была покрыта мелкозернистыми отложениями, такими как глина и ил, отложившимися из-за мутных течений и направившимися вниз по подводным каньонам в более глубокие области. Другие отложения, усиливающие эффект, — это частицы глиняной пыли, уносимые в море с суши, и крошечные кусочки мертвых растений и животных, падающие с поверхностных слоев.В Тихом океане меньше всего абиссальных равнин, что является прямым результатом захвата отложений в подводных желобах, окружающих Тихий океан.
Океанские траншеи
Желоба в океане — это узкие и длинные впадины на дне океана. Это самые глубокие участки дна океана, их длина обычно составляет несколько сотен километров. Траншеи возникают в результате движения тектонических плит, иногда ныряющих (погружающихся) под другую плиту глубоко в дно океана.Обычно они простираются на 3-4 км ниже дна окружающего океана. Марианская впадина — самая глубокая часть океана, она была обнаружена во время путешествия к Бездне Челленджера.
Основными океанскими желобами являются Каймановы желоба на максимальной глубине 7686 м, Японские желобы на максимальной глубине 9000 м, желоб Кермадек, Алеутский желоб, Курильский желоб, Марианский желоб, Среднеамериканский желоб, Перу-Чилийский желоб. на максимальной глубине 8065 м, желоб Пуэрто-Рико, желоб Рюкю (или желоб Нансей-Шото), желоб Сундра и желоб Тонга на максимальной глубине 10882 м.
| Срок | Определение
| ||
| Срок | Определение
| ||
Срок
| Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
TANGLED1 опосредует взаимодействия микротрубочек, которые могут способствовать позиционированию плоскости деления у кукурузы | Журнал клеточной биологии
Цитоскелет микротрубочек служит динамической структурной основой митоза в эукариотических клетках.TANGLED1 (TAN1) — это связывающий микротрубочки белок, который локализуется в месте деления и митотических микротрубочках и играет критическую роль в ориентации плоскости деления у растений. Здесь, эксперименты in vitro демонстрируют, что TAN1 напрямую связывает микротрубочки, опосредуя взаимодействие микротрубочек или концевых микротрубочек, в зависимости от их контактного угла. Мутантные клетки кукурузы tan1 неправильно позиционируют препрофазную полосу (PPB), которая предсказывает сайт будущего деления. Однако моделирование на основе формы клеток показывает, что дефекты позиционирования PPB скорее всего являются следствием аномальных форм клеток, а не из-за отсутствия TAN1.В телофазе совместная локализация растущих микротрубочек заканчивается от фрагмопласта с TAN1 в месте деления, это указывает на то, что TAN1 взаимодействует с кончиками микротрубочек на конце. Вместе наши результаты подтверждают, что TAN1 вносит вклад в организацию микротрубочек, чтобы гарантировать правильную ориентацию плоскости деления.
Правильная организация сетей микротрубочек во время интерфазы и митоза важна для стимулирования роста и развития как на клеточном, так и на уровне организма (Wasteneys and Ambrose, 2009; Elliott and Shaw, 2018; Ehrhardt and Shaw, 2006; Baskin et al., 2004). Механизмы достижения и модуляции организации микротрубочек управляются взаимодействиями микротрубочка-микротрубочка или микротрубочка-белок, включая застегивание молнии при низких углах смачивания (Ho et al., 2012; Tulin et al., 2012; Smertenko et al., 2004; Shaw et al. ., 2003), контактно-опосредованная катастрофа (Dixit, Cyr, 2004), разрушение (Lindeboom et al., 2013; Zhang et al., 2013; Panteris et al., 2018; Komis et al., 2017) и стабилизация на краях клеток (Ambrose et al., 2011). Эти процессы изменяют динамику и организацию микротрубочек.Эти активности формируют и модифицируют структуры митотических микротрубочек, чтобы выполнять особую роль в сегрегации ДНК и разделении дочерних клеток. У растений ключевыми митотическими структурами являются препрофазная полоса (PPB), метафазное веретено и фрагмопласт. Белки, которые регулируют образование и функцию этих структур, расположены вдоль этих различных структур, а также в месте деления коры растения.
Во время фазы G2 клеточного цикла PPB формируется как кольцевая структура из микротрубочек, актина и связанных белков, которые локализуются непосредственно под плазматической мембраной, образуя зону кортикального деления (Smertenko et al., 2017; Ван Дамм и др., 2007). PPB — это ранний маркер будущего подразделения наземных заводов; он указывает место, где развивающаяся новая клеточная стенка будет сливаться с материнской клеткой (Rasmussen and Bellinger, 2018; Facette et al., 2019; Pickett-Heaps and Northcote, 1966). Некоторые белки, ассоциированные с микротрубочками, играют важную роль в ориентации плоскости деления, способствуя образованию PPB. Большое семейство белков с мотивами, связывающими микротрубочки, привлекает комплекс протеинфосфатазы типа 2А для образования PPB (Spinner et al., 2010, 2013; Райт и др., 2009; Traas et al., 1995; Древенсек и др., 2012; Schaefer et al., 2017). Правильное формирование и расположение PPB может ориентировать веретено метафазы, чтобы способствовать быстрой митотической прогрессии (Chan et al., 2005; Ambrose and Cyr, 2008; Schaefer et al., 2017). Когда клетки входят в метафазу, PPB полностью разбирается; однако несколько белков, которые совместно локализуются с PPB, продолжают метить сайт деления до конца цитокинеза (Walker et al., 2007; Xu et al., 2008; Липка и др., 2014; Мартинес и др., 2017; Ли и др., 2017; Buschmann et al., 2015).
Во время телофазы фрагмопласт собирается из микротрубочек, актина и ассоциированных белков, чтобы способствовать формированию клеточной пластинки посредством доставки пузырьков (Смертенко и др., 2017; Смертенко, 2018; Lee and Liu, 2013; Jürgens, 2005b). . Фрагмопласт расширяется в направлении коры клетки за счет полимеризации новых микротрубочек из существующих передних микротрубочек и деполимеризации на отстающем крае по мере сборки клеточной пластинки (Murata et al., 2013). Считается, что направление экспансии фрагмопластов определяется белками, которые непрерывно маркируют сайт деления (Rasmussen and Bellinger, 2018; Livanos and Müller, 2019). Как только фрагмопласт достигает коры, он разбирается, и клеточная пластинка сливается с плазматической мембраной, завершая цитокинез (Jürgens, 2005a; Worden et al., 2012). Мутанты с дефектами в поддержании ориентации плоскости деления размещают новые клеточные стенки вне места, первоначально указанного PPB. У кукурузы мутанты tangled1 ( tan1 ) имеют дефекты плоскости деления как в симметричных, так и в асимметричных делениях (Smith et al., 1996), вызванные неспособностью фрагмопласта вернуться к месту деления, первоначально указанному PPB (Martinez et al., 2017). TAN1-YFP локализуется в участке коркового деления на протяжении митоза у Arabidopsis thaliana и кукурузы (Martinez et al., 2017; Walker et al., 2007). TAN1 также колокализуется с массивами митотических микротрубочек in vivo при слиянии с YFP (Martinez et al., 2017) и с использованием неспецифических антител к TAN1 (Smith et al., 2001). TAN1 — это высокоосновной белок без каких-либо очевидных известных доменов (Smith et al., 2001). Структурно-функциональный анализ идентифицировал две высококонсервативные области TAN1, которые по отдельности способствовали его локализации в сайте деления либо во время поздней G2, либо во время телофазы (Rasmussen et al., 2011). Впоследствии было показано, что участок белка, способствующий локализации TAN1 во время телофазы, является критическим для его функции in vivo (Mir et al., 2018).
Двойные мутанты по двум паралогам кинезина 12 в A . thaliana , ориентирующий фрагмопласт кинезин 1 ( pok1 ) и pok2 обнаруживают серьезный дефект плоскости деления (Müller et al., 2006). POK1 взаимодействует непосредственно с TAN1 и локализуется в сайте деления (Walker et al., 2007; Lipka et al., 2014; Rasmussen et al., 2011). И POK1, и POK2 необходимы для локализации TAN1 в сайте деления после метафазы (Walker et al., 2007; Lipka et al., 2014). POK2 действует как слабый двигатель, направленный на плюс-конец микротрубочек in vitro (Chugh et al., 2018). Интересно, что в дополнение к локализации сайта деления, POK2 также накапливается в средней линии фрагмопласта, где он может взаимодействовать с ассоциированным с микротрубочками белком 65-3 (MAP65-3) или другими белками MAP65 (Herrmann et al., 2018; Ho et al. ., 2011). Другой близкородственный MAP65, MAP65-4, локализуется в PPB, веретене, фрагмопласте и сайте деления (Li et al., 2017). Двойной мутант map65-3 map65-4 в A. thaliana имеет дефект цитокинеза, но пока не ясно, есть ли у него дефект плоскости деления (Li et al., 2017). MAP65-4 регулирует стабильность микротрубочек за счет увеличения фаз удлинения микротрубочек во время связывания (Fache et al., 2010), в то время как другой родственный MAP65, MAP65-1, увеличивает стабильность микротрубочек, защищая от разделения и способствуя гибкости микротрубочек во время связывания (Portran et al., 2013; Стоппин-Меллет и др., 2013; Буркарт, Диксит, 2019). Таким образом, связывающие микротрубочки и связывающие белки могут вносить вклад в сборку митотических структур микротрубочек, но они также служат важными эффекторами для установления, своевременного развития и выполнения правильно ориентированных делений растительных клеток.
Помимо дефектов плоскости деления, мутант tan1 имеет задержку митотической прогрессии и пониженный рост растений (Martinez et al., 2017; Smith et al., 1996). Задержки митотической прогрессии и дефекты наведения фрагмопластов в основном были разделены с использованием частично спасенного мутанта tan1 , экспрессирующего TAN1-YFP, слитого с мотивом CYCLIN B — деструктивный бокс (Martinez et al., 2017). В этой частично спасенной линии наблюдаются митотические задержки, но дефекты плоскости деления встречаются редко, они совпадают с сигналом TAN1-YFP в месте деления, но отсутствуют детектируемый сигнал TAN1-YFP в веретене и фрагмопласте.Мы предполагаем, что TAN1 является многофункциональным белком, который способствует своевременной митотической прогрессии, когда он локализуется в структурах митотических микротрубочек, и поддерживает ориентацию плоскости деления посредством руководства фрагмопластами, когда он локализуется в месте деления. Здесь мы сообщаем о функции TAN1 in vitro в обеспечении взаимодействий микротрубочек и о функции in vivo в организации веретена и взаимодействиях фрагмопластов с микротрубочками в месте деления.
Было показано, что белокTAN1 связывается с микротрубочками, стабилизированными таксолом, в анализе с наложением блоттинга (Smith et al., 2001). Чтобы количественно оценить связывание TAN1 с микротрубочками, мы рекомбинантно экспрессировали 6xHIS-меченный белок ZmTAN1 (HIS-TAN1) и протестировали его способность связываться с микротрубочками. Белок HIS-TAN1 связался с микротрубочками, стабилизированными таксолом, в экспериментах по совместной седиментации (рис. 1 A). Титрование микротрубочек против фиксированной концентрации HIS-TAN1 приводило к насыщаемому связыванию TAN1 с микротрубочками. Гиперболическая подгонка данных о связывании, как и в аналогичных исследованиях (Tulin et al., 2012; Wong and Hashimoto, 2017), дала K 0.5 1,08 мкМ (95% доверительный интервал [CI], 0,722–1,43 мкМ) и предполагал, что по крайней мере 70% HIS-TAN1 были активны в связывании микротрубочек. Это рассчитанное сродство аналогично таковому у других белков, связывающих микротрубочки (Tulin et al., 2012; Portran et al., 2013; Wong and Hashimoto, 2017). Значительно меньше, чем 100% насыщение TAN1 наблюдалось при максимальной доступной концентрации микротрубочек. Это можно объяснить с точки зрения неактивной белковой фракции, но, альтернативно, с помощью модели, такой как многосайтовое связывание с отрицательной кооперативностью (Таблица S1).Чтобы непосредственно визуализировать связывание TAN1 с микротрубочками in vitro, мы очистили рекомбинантный HIS-TAN1-GFP. К сожалению, этот гибридный белок не был флуоресцентным, возможно потому, что GFP не укладывался правильно во время ренатурации рекомбинантного белка из бактериальных телец включения. Поскольку HIS-TAN1-GFP все еще связывается с микротрубочками со сродством, аналогичным HIS-TAN1 (рис. S1 A), мы пометили его органическим флуорофором Atto488, чтобы визуализировать его с помощью флуоресцентной микроскопии. При совмещении со стабилизированными таксолом и меченными родамином микротрубочками, HIS-TAN1-GFP, меченный Atto488 (100 нМ), локализуется вдоль решетки микротрубочек (рис.1, Г и Д). Кимограммы HIS-TAN1-GFP, меченного Atto488, показали, что он не перемещался по микротрубочкам, меченным биотинилированным гуанозин-5 ‘- (α, β-метилен) трифосфатом (GMPCPP) родамином, в течение ∼2 минут визуализации (рис. 1, F. и G). HIS-TAN1-GFP, меченный Atto488, к сожалению, агрегировался в ходе анализов коседиментации микротрубочек (рис. S1 B), и поэтому мы не использовали его в дальнейших экспериментах.
Предыдущие результаты показали, что TAN1-YFP колокализуется с микротрубочками PPB, веретена и фрагмопласта (Martinez et al., 2017). Однако прямые данные о связывании TAN1 с микротрубочками подтверждают, что TAN1 будет взаимодействовать с микротрубочками независимо от стадии клеточного цикла. Чтобы изучить взаимодействие TAN1 и микротрубочек в интерфазе, мы временно экспрессировали как TAN1-GFP, так и RFP-TUBULIN в неделящихся эпидермальных клетках Nicotiana benthamiana , используя конститутивный промотор 35S . Через 3 дня инкубации мы визуализировали TAN1-GFP и RFP-TUBULIN с помощью конфокальной микроскопии. TAN1-GFP колокализован с RFP-TUBULIN (рис. S2, A и B), что указывает на то, что митоз-специфические белки не необходимы для взаимодействия TAN1 с микротрубочками, что согласуется с нашими анализами совместной седиментации in vitro.Никаких очевидных различий в массивах микротрубочек в интерфазных эпидермальных клетках не наблюдалось между теми, которые инфильтрированы RFP-TUBULIN и TAN1-GFP (рис. S2, A и B) или только RFP-TUBULIN (рис. S2 C). Это отсутствие очевидных изменений в организации микротрубочек контрастирует с избыточной экспрессией др. MAPs, таких как MAP65-1 (Ho et al., 2012) и CLASP (Kirik et al., 2007). Однако флуоресцентный сигнал TAN1-GFP также был низким, что согласуется с гипотезой о том, что уровни TAN1 могут посттрансляционно регулироваться деградацией (Rasmussen et al., 2011).
Чтобы определить, регулирует ли TAN1 динамику полимеризации микротрубочек, мы провели эксперименты по полимеризации микротрубочек in vitro. Микротрубочки зародились из семян микротрубочек, стабилизированных GMPCPP, и их полимеризация и деполимеризация стимулировались добавлением 17,5 мкМ тубулина. Динамику микротрубочек визуализировали с помощью тубулина, меченного родамином, и флуоресцентной микроскопии полного внутреннего отражения (TIRF) (Материалы и методы).При более низких концентрациях HIS-TAN1 (<1 мкМ) не наблюдалось значительного влияния на динамику микротрубочек (таблица 1). При концентрации 2 мкМ HIS-TAN1, которая близка к кажущемуся значению K 0,5 TAN1 для микротрубочек, стабилизированных таксолом, мы наблюдали небольшое снижение как скорости роста плюс-конца микротрубочек, так и скорости усадки плюсового конца (по сравнению с 0 мкМ HIS-TAN1 с использованием критерия Манна – Уитни; таблица 1). Добавление HIS-TAN1 не изменило количество времени, в течение которого микротрубочки росли, или частоту катастроф.Однако наблюдались небольшие, но существенные различия во времени, затрачиваемом на усадку (по сравнению с 0 мкМ HIS-TAN1; Таблица 1). В используемых экспериментальных условиях события спасения были редкими, а отрицательные концы не были динамическими; следовательно, эти параметры не были определены количественно. Вместе эти результаты указывают на то, что регуляция динамики полимеризации микротрубочек вряд ли является основной функцией TAN1.
В ходе наших экспериментов по динамике микротрубочек in vitro мы наблюдали, что при высоких концентрациях HIS-TAN1 (2 мкМ) микротрубочки, которые контактировали друг с другом, временно взаимодействовали.Чтобы способствовать взаимодействию микротрубочек, мы провели эксперименты с более высокой концентрацией семян, стабилизированных GMPCPP, и свободных димеров тубулина (концентрация 22,5 мкМ) для создания большего количества микротрубочек, которые становились длиннее и, следовательно, чаще встречались друг с другом. Мы использовали 2 мкМ HIS-TAN1, потому что это привело к взаимодействиям микротрубочек (139 событий взаимодействия в результате 506 пересечений) в динамических анализах микротрубочек, тогда как при более низких концентрациях HIS-TAN1 взаимодействия не наблюдались (таблица 1).Мы наблюдали два типа взаимодействий связывания микротрубочек в зависимости от краевого угла микротрубочек. При малых или неглубоких углах смачивания (угол = 19,6 ° ± 7,6 ° [среднее ± стандартное отклонение]) микротрубочки постепенно соединяются вместе, образуя пучки ( n = 47 событий объединения из 139 наблюдаемых взаимодействий [34% случаев объединения в пучки]. события]; рис. 2, А и Б). Застегивание микротрубочек в параллельной и антипараллельной конфигурациях происходило с аналогичными частотами ( n = 13/27 и 14/27, где ориентация была однозначной, соответственно).Следовательно, TAN1 предпочтительно не связывает микротрубочки в определенных ориентациях. Напротив, белки связывания микротрубочек MAP65 преимущественно связывают антипараллельные микротрубочки (Gaillard et al., 2008; Tulin et al., 2012). При высоких углах смачивания (угол = 60 ° ± 20 ° [среднее ± стандартное отклонение]) во время деполимеризации микротрубочек наблюдались временные взаимодействия «конец-на» микротрубочек (рис. 2, C и D; видео 1). Когда одна микротрубочка деполимеризуется мимо предыдущего сайта кроссовера, TAN1 опосредует взаимодействие в точке кроссовера.Деполимеризующийся конец оставался связанным с боковой стенкой второй микротрубочки, что приводило к растягивающей силе на стабильной микротрубочке ( n = 92 концевых взаимодействия из 139 наблюдаемых взаимодействий [66% событий взаимодействия]). Интересно, что высокоосновные пептиды, связанные вместе с образованием искусственного полипептида, способного к мультивалентному электростатическому взаимодействию с микротрубочками, проявляют сходную с TAN1 активность по вытягиванию и связыванию микротрубочек (Drechsler et al., 2019).Внутренне неупорядоченный белок тау, связанный с микротрубочками, также приводит к аналогичным взаимодействиям с микротрубочками, которые, как полагают, зависят от связывания мультивалентных микротрубочек тау (Kellogg et al., 2018). Основываясь на сходстве типов взаимодействий микротрубочек, опосредованных искусственным полипептидом тау и TAN1, и их общих биохимических характеристиках чистого положительного заряда и внутренне неупорядоченных областей, мы предполагаем, что TAN1, вероятно, содержит несколько сайтов связывания микротрубочек, которые обеспечивают взаимодействие между микротрубочками.Это свойство д. Также позволить TAN1 связывать микротрубочки без необходимости димеризации или мультимеризации в отличие от связывающего белка MAP65-1 (Ho et al., 2011). Основываясь на этих данных, мы заключаем, что результаты взаимодействий TAN1 с микротрубочками зависят от начального угла контакта или перекрестного угла между микротрубочками и что при высоких углах смачивания взаимодействия TAN1 с микротрубочками приводят к временному притягиванию или захвату.
Застегивание микротрубочек — это хорошо охарактеризованная форма связывания микротрубочек у растений, животных и грибов (Dixit and Cyr, 2004; Tulin et al., 2012; Янсон и др., 2007; Субраманиан и др., 2010; Gaillard et al., 2008). Взаимодействия между концом микротрубочек широко изучены на животных и грибах и обычно включают силы, генерируемые моторными белками (Laan et al., 2012a, b). Напр., Захват микротрубочек на концах моторными белками важен для позиционирования веретена у животных (Kiyomitsu, 2019) и дрожжей (Gupta et al., 2006). Немоторно-зависимые механизмы, такие как использование энергии деполимеризующейся микротрубочки, также генерируют тянущие силы (Dogterom et al., 2005; Грищук и др., 2005). TAN1, поскольку он лишен канонических моторных доменов, вряд ли может быть моторным белком. Однако, подобно связывающему микротрубочки белку tau, он является одновременно высокоосновным и, как предполагается, содержит внутренне неупорядоченные области при анализе с помощью программного обеспечения для прогнозирования DisEMBL (Linding et al., 2003).
Мы были удивлены тем, что значительное количество взаимодействий микротрубочек было обнаружено in vitro только с относительно высокими концентрациями TAN1 (2 мкМ), когда взаимодействия TAN1-MT были обнаружены с использованием стабилизированных GMPCPP семян микротрубочек при низких концентрациях TAN1 (100 нМ).Одна потенциальная причина этого очевидного несоответствия в связывании или взаимодействии может быть связана с TAN1 связывающими димерами тубулина в дополнение к микротрубочкам. Связывание димера тубулина в дополнение к связыванию микротрубочек происходит с такими белками, как тау (Fauquant et al., 2011) или Clasp (Al-Bassam et al., 2010). Поэтому мы проверили, связывает ли TAN1 растворимый тубулин, с помощью аффинной хроматографии in vitro. Тубулин инкубировали с HIS-TAN1-GFP и гранулами агарозы против GFP. HIS-TAN1-GFP снижает тубулин, в то время как HIS-GFP — нет, что указывает на то, что TAN1 взаимодействует с тубулином в дополнение к полимерам микротрубочек (рис.S3 A). Путем денситометрического анализа мы оценили, что одна молекула HIS-TAN1-GFP связывается приблизительно с двумя димерами тубулина ( n = 3 повтора), что указывает на то, что TAN1 содержит по крайней мере две отдельные тубулин-связывающие области. Мы использовали эксклюзионную хроматографию, чтобы оценить, был ли тубулин димерным в буфере для аффинной хроматографии (BRB80) и в температурных условиях (~ 4 ° C). Тубулин элюируется с кажущимся размером ~ 110 кДа, что согласуется с димеризацией тубулина с использованием одинаковой концентрации тубулина, используемой для аффинной хроматографии (5 мкМ, 91.45 ± 12,32 кД [среднее ± стандартное отклонение]) и вдвое больше (10 мкМ, 111,13 ± 14,18 кД [среднее ± стандартное отклонение]; рис. S3, B и C). В целом это указывает на то, что TAN1 связывает тубулин в двух разных регионах. Связывание TAN1 с тубулином может потенциально изолировать TAN1 как в динамических анализах микротрубочек, так и in vivo. Альтернативно, связывание TAN1 с тубулином может способствовать спасению микротрубочек, подобно Clasp (Al-Bassam et al., 2010). Дальнейшие эксперименты должны быть выполнены, чтобы определить, димеризуется или мультимеризуется TAN1, происходит ли связывание тубулина in vivo и перекрываются ли сайты связывания тубулина и микротрубочек, а также их относительное сродство.
Дефекты ориентации плоскости деления могут возникать на ранних этапах клеточного цикла, до образования PPB или позже, после того, как PPB уже сформирован. Мы показали с помощью визуализации живых клеток, что tan1 мутантные фрагмопласты не вернулись в сайт деления, ранее отмеченный PPB, что указывает на более поздний дефект в ориентации плоскости деления (Martinez et al., 2017). Напротив, предыдущая работа показала, что ориентация PPB более вариабельна у мутанта tan1 по сравнению с клетками WT, что указывает на потенциальный дефект размещения PPB (Cleary and Smith, 1998; Mir et al., 2018). Однако неясно, вносит ли TAN1 вклад в правильное размещение PPB, потому что белок TAN1 не накапливается в месте деления до конца G2, после того, как PPB уже сформировался (Martinez et al., 2017).
Предыдущие измерения размещения PPB были получены из двухмерных микрофотографий, которые могут неточно отражать положение PPB в 3D, особенно в ячейках неправильной формы. Чтобы преодолеть этот недостаток, мы использовали наш недавно разработанный подход к математическому моделированию для точного прогнозирования трехмерных плоскостей разделения (Martinez et al., 2018). Эта модель генерирует минимумы мыльной пленки из реальных трехмерных форм клеток и позволяет нам сравнивать чисто геометрические предсказания с сайтами деления клеток in vivo (Martinez et al., 2018). Большинство предсказанных делений близко совпадают с делениями клеток животных и растений in vivo (Martinez et al., 2018). Мы собрали конфокальные Z-стеки и использовали программу обработки изображений MorphoGraphX (Barbier de Reuille et al., 2015) для извлечения WT (рис. 3 A) и tan1 мутантных трехмерных форм клеток (рис. 3 B). Затем мы использовали Surface Evolver для создания трехмерных реконструкций ячеек.Затем функция градиентного спуска в Surface Evolver использовалась для создания минимумов мыльной пленки, которые делили объем на две равные половины. Эти минимумы мыльной пленки являются предсказаниями s плоскости деления (Martinez et al., 2018; Brakke, 1992). Затем предсказанные плоскости деления сравнивали с положением PPB in vivo (рис. 3, A и B). Чтобы измерить смещение между предсказанным делением и положением PPB, мы сравнили положение средней плоскости PPB с внешним краем предсказанного деления.Когда значение смещения PPB низкое, прогноз соответствует плоскости деления in vivo. Для клеток WT среднее смещение PPB от предсказанных делений составило 0,40 мкм 2 ± 0,96 (среднее ± SD, n = 16), в то время как смещение PPB было выше у мутантов tan1 (смещение PPB = 1,85 мкм 2 ± 3,93, среднее ± стандартное отклонение, n = 45; P = 0,0012, Манн – Уитни; рис. 3 C).
Чтобы определить, вызвано ли повышенное смещение PPB у мутантов tan1 неправильным размещением PPB или косвенным следствием аномальной формы клеток у мутанта tan1 , мы разработали количественный метод сравнения форм клеток, названный «индексом аномальности». измерение расстояния между центром площади поверхности и центром объема (см. Материалы и методы).Клетки WT имели примерно в три раза более низкий и более устойчивый индекс аномалии по сравнению с мутантными клетками tan1 (рис. 3 D; клетки WT: n = 16, индекс аномальности [средний ± SD] = 0,14 ± 0,1; tan1 : n = 45, индекс аномальности = 0,39 ± 0,35; P <0,0008, Манна – Уитни). Эти данные подтверждают, что растения WT имеют тенденцию иметь клетки нормальной формы, в то время как мутанты tan1 имеют клетки как нормальной, так и аномальной формы, что согласуется с данными визуализации.
Если TAN1 играет непосредственную роль в размещении PPB, мы могли бы ожидать аномального размещения PPB у мутантов tan1 независимо от вариаций индекса аномальности формы клеток. Напротив, мы обнаружили значительную положительную корреляцию между индексом аномалии и смещением PPB в мутантных клетках tan1 (коэффициент корреляции Спирмена = 0,59, P <0,0001, n = 45 клеток), предполагая, что размещение PPB отклонялось от предсказанных делений больше в клетки очень аномальной формы.Чтобы выяснить, была ли эта тенденция аналогичной в клетках WT, мы специально искали и моделировали дополнительные клетки WT, которые отображали аберрантную форму клеток с высокими индексами аномальности (коэффициент корреляции Спирмена = 0,57, значение P = 0,003 n = 25 клеток). Как WT, так и tan1 мутантные клетки с более высокими индексами аномальности обычно имели более высокие смещения PPB для всего набора данных (рис. 3 E, левая панель), а также набор данных, удаляющий выбросы (рис. 3 E, правая панель), с примерами клетки с высокими показателями аномальности, представленные на (рис.3, F – J). Из-за корреляции между дефектами размещения PPB и аберрантной формой клеток у мутантов tan1 мы предполагаем, что дефекты размещения PPB являются следствием аномалий формы клеток и не связаны напрямую с функцией TAN1 во время G2.
Подходы к моделированию, основанные на организации микротрубочек, предполагают, что межфазное расположение кортикальных микротрубочек может быть важным модулятором позиционирования PPB (Chakrabortty et al., 2018; Mirabet et al., 2018). Ориентация PPB обычно следует ориентации предшествующего межфазного массива микротрубочек (Flanders et al., 1989; Gunning and Sammut, 1990). Наш результат предполагает, что клетки с изначально аномальной формой могут привести в следующем раунде клеточного деления к менее геометрически точно размещенным PPBs. Этот эффект может объяснить, почему др. Мутанты в плоскости деления имеют смещенные или наклонные PPBs (Müller et al., 2006; Pietra et al., 2013). Кроме того, мутанты с дефектами роста клеток, которые вызывают аберрантную форму клеток, могут также приводить сначала к дезориентированным PPBs, а затем к явным дефектам плоскости деления.
Ранее мы показали, что мутантные клетки tan1 имеют задержку митотической прогрессии во время метафазы и телофазы, но мы не предложили конкретной гипотезы, чтобы объяснить, почему возникают задержки (Martinez et al., 2017). Если TAN1 играет важную роль в перекрестном связывании микротрубочек веретена, то задержки метафаз могут отражать дефектную организацию веретена. Используя покадровую визуализацию, мы оценили общую морфологию веретена в клетках листьев кукурузы, экспрессирующих YFP-TUBULIN.В клетках WT мы всегда наблюдали биполярные веретена ( n = 38; Рис. 4 A). В мутантных клетках tan1 веретена иногда демонстрировали отсроченную биполярную организацию (13,5%; n = 5/35), но восстанавливались через ~ 20 ± 8 мин (среднее ± стандартное отклонение) после разрушения ядерной оболочки на типичные биполярные веретена (рис. 4 B и видео 2). Задержки метафаз, ранее описанные у мутантов tan1 , встречались часто, что приводило к средней задержке в 1,5 раза по сравнению с WT (Martinez et al., 2017), тогда как задержанные дефекты организации биполярного веретена встречались реже. Это указывает на то, что дефекты в организации микротрубочек только иногда приводят к обнаруживаемым дефектам в организации веретена у мутантов tan1 , что согласуется с избыточными механизмами сборки веретена. Метафазная микротрубочка веретена s Сшивание или связывание важно для правильной и своевременной сборки веретена (Masoud et al., 2013; Mullen and Wignall, 2017; Ambrose and Cyr, 2007; Winters et al., 2019). Основываясь на слипании микротрубочек in vitro с помощью TAN1, возможно, что TAN1 обеспечивает связывание микротрубочек веретена, когда они встречаются друг с другом под небольшими углами. Т.о., локализация TAN1 в веретене может быть важна для правильной сборки веретена и митотической прогрессии через метафазу.
Чтобы понять, как TAN1 может опосредовать наведение фрагмопластов во время телофазы (Martinez et al., 2017; Mir et al., 2018) мы визуализировали TAN1 и микротрубочки в месте деления. CFP-TUBULIN-меченные микротрубочки и TAN1-YFP были визуализированы вместе в клетках, претерпевающих продольные деления, где наведение фрагмопластов визуализируется более легко. Совместную локализацию CFP-TUBULIN и TAN1-YFP на участке деления оценивали в коре клеток после первоначального контакта фрагмопласта. Небольшое количество микротрубочек фрагмопласта совместно локализуется с точками TAN1 (коэффициент корреляции Пирсона = 0,23 ± 0,078 [среднее ± стандартное отклонение], n = 21), но примерно половина точек TAN1 связана с микротрубочками (коэффициент перекрытия Мандерса [C] = 0.41 ± 0,1 [среднее ± стандартное отклонение]; Рис. 4 C). Вместе эти результаты подтверждают, что небольшая субпопуляция микротрубочек от переднего края фрагмопласта взаимодействует с кортикальными точками TAN1, поскольку фрагмопласт расширяется через сайт деления (Fig. 4, D and E; and Video 3). Эти точки TAN1 в месте деления, по-видимому, не подвижны при визуализации в течение ~ 5 мин ( n = 8 клеток; Рис. 4, F и G).
Модели для руководства фрагмопластом ранее предполагали, что передние края микротрубочек фрагмопласта взаимодействуют с белками в месте кортикального деления либо посредством специфических межбелковых взаимодействий, либо микротрубочек-белковых взаимодействий (Herrmann et al., 2018; Липка и др., 2014; Ли и др., 2017). POK2, который локализован в сайте деления, как было показано, является кинезином, направленным на плюс-конец (Chugh et al., 2018). POK2 может эффективно давить на положительные концы микротрубочек, которые встречаются с сайтом деления (Chugh et al., 2018). POK2 также напрямую взаимодействует с MAP65-3, который локализован в связанных микротрубочках как в средней зоне фрагмопласта, так и на переднем крае, служа еще одним потенциальным типом взаимодействия между фрагмопластом и местом деления.Локализация TAN1 в месте деления важна для его функции в ведении фрагмопластов (Mir et al., 2018; Martinez et al., 2017). Основываясь на результатах этого исследования, мы предполагаем, что концевые взаимодействия между плюс-концами микротрубочек переднего края фрагмопласта и TAN1-YFP puncta в месте деления могут оказывать тянущие силы на эти микротрубочки, чтобы направлять траекторию фрагмопластов.
В то время как TAN1 долгое время был охарактеризован как белок, связывающий микротрубочки, функциональное значение этого открытия оставалось неуловимым.Наш in vitro анализ активности TAN1-микротрубочек в сочетании с наблюдениями в реальном времени локализации TAN1 на микротрубочках веретена и на концах передних краев микротрубочек фрагмопласта предполагает, что взаимодействия TAN1-микротрубочки могут зависеть от геометрии встреч микротрубочек. Это обеспечивает правдоподобное объяснение того, как TAN1 способствует организации веретена и ведению фрагмопластов.
Оптимизированная по кодонам кДНК, кодирующая HIS-TAN1 и HIS-TAN1-GFP кукурузы, была синтезирована in vitro с последующей экспрессией и очисткой белка, все выполнялось Genscript. Escherichia coli штамм SHuffle трансформировали рекомбинантной плазмидой, кодирующей HIS-TAN1. После обработки осадка клеток ультразвуком и центрифугирования осадок растворяли с использованием мочевины с последующей аффинной очисткой. E.coli штамм BL21 Star (DE3) трансформировали рекомбинантной плазмидой, кодирующей HIS-TAN1-GFP. После обработки осадка клеток ультразвуком и центрифугирования осадок растворяли с использованием мочевины с последующей аффинной очисткой (Genscript). Белки подвергали повторной укладке и стерилизовали фильтрованием.Концентрации HIS-TAN1 и HIS-TAN1-GFP проверяли с помощью анализа белка BCA (Genscript). После повторной укладки HIS-TAN1-GFP больше не был флуоресцентным. Следовательно, HIS-TAN1-GFP был помечен красителем Atto488. HIS-TAN1-GFP конъюгировали с Atto488-малеимидом (Sigma; 28562). 4 мкМ HIS-TAN1-GFP в 80 мМ трубках, 1 мМ MgCl 2 и 1 кмМ EGTA-буфер восстанавливали с помощью 12,5 мкМ трис (2-карбоксиэтил) фосфин гидрохлорида в течение 10 минут с последующей 4-часовой инкубацией с 250 мкМ. Atto488 растворяли в ДМСО (10 мМ) при комнатной температуре.Избыток непрореагировавшего красителя удаляли, пропуская образец через обессоливающую колонку 10DG (Bio-Rad; 732–2010) и концентрируя с помощью концентратора с мембраной из полиэфирсульфона с отсечкой молекулярной массы 30 кДа (30K MWCO PES) (Thermo; 88521). Активность HIS-TAN1-GFP и HIS-TAN1-GFP-Atto488 (~ 80% степень мечения) подтверждали с помощью анализа совместимости микротрубочек. Конъюгацию красителя Atto488 определяли путем визуализации результатов анализа совместимости микротрубочек в эксперименте SDS-PAGE с использованием источника УФ-света, показывающего флуоресцентные полосы, соответствующие HIS-TAN1-GFP, меченному Atto488.
5-недельный возраст N. benthamiana растения, выращенные в условиях стандартного 16-часового освещения и 8-часовой темноты, использовали для временных экспериментов по совместной локализации. Плазмиды для конститутивной экспрессии вирусного белка p19, RFP-TUBULIN6 (Ambrose et al., 2011) и TAN1-GFP (Walker et al., 2007) трансформировали в штамм Agrobacterium tumefaciens GV3101. Агробактерии выращивали до стационарной фазы, центрифугировали со скоростью 1000 об / мин, а затем ресуспендировали в течение 1 часа при комнатной температуре в буфере для инфильтрации, содержащем 10 мМ MES (pH 5.7), 10 мМ MgCl 2 , 0,5% D-глюкозы (вес / объем) и 200 мкМ ацетосирингона. Равные количества агробактерий (с TAN1-GFP и без него) смешивали вместе и использовали шприц объемом 1 мл без иглы для инфильтрации абаксиальной стороны листьев N. benthamiana . После 3 дней инкубации листья удаляли и абаксиальные эпидермальные клетки получали с помощью вращающегося конфокального дискового микроскопа с описанным выше объективом 60 ×. Проекции максимальной интенсивности и автоматическое вычитание фона в FIJI использовались на рис.S2.
Динамику микротрубочек in vitro проводили в соответствии с предыдущими протоколами (Dixit and Ross, 2010). Проточные камеры были собраны с использованием силанизированных покровных стекол и двусторонней липкой ленты с объемом камеры ∼20 мкл. Для покрытия поверхности использовали 20% моноклональное антитело против биотина (Sigma; клон BN-34) с последующим блокированием 5% плюроником F-127 (Sigma; # P2443) в течение 5 минут на каждом этапе. Затем в клетку пропускали семена микротрубочек родамина и GMPCPP.Рост микротрубочек был инициирован с использованием 17,5 мкМ 1:25 меченного родамином тубулина крупного рогатого скота в 80 мМ Pipes, 1 мМ MgCl 2 , 1 мМ EGTA с 0,15% метилцеллюлозы (вес / объем), 100 мМ DTT, поглотители кислорода (250 мкг / мл глюкозооксидазы, 25 мкг / мл каталазы), 5 мг / мл глюкозы и 2 мМ GTP вместе с указанным количеством белка HIS-TAN1. Для оценки связывания микротрубочек в реакции использовали более высокую концентрацию тубулина (22,5 мкМ, 1:25 родамин-тубулин / немеченый тубулин), чтобы способствовать росту микротрубочек и пересечениям.Для каждой концентрации и условий эксперимента готовили по крайней мере два предметных стекла. Образцы возбуждали твердотельным лазером с диодной накачкой 561 нм (при выходной мощности 4 мВт) (Melles Griot) и визуализировали через 100-кратный объектив (NA 1,45) и камеру электронного умножителя с зарядовой связью с задней подсветкой и набор эмиссионных фильтров 582–636 нм с использованием TIRF (Hammamatsu; ImageEM). Изображения собирались каждые 2 с. Кимографы использовались для анализа данных в FIJI (Schindelin et al., 2012).
Образцы из WT и tan1 мутантных растений кукурузы , экспрессирующих YFP-TUBULIN (α-тубулин, слитый с цитриновым вариантом YFP; Mohanty et al., 2009) были рассечены до симметрично делящихся листовых зон для определения местоположения PPB. Чтобы идентифицировать контуры клеток для трехмерной реконструкции, образцы либо окрашивали 0,1 мМ пропидиум йодидом, либо экспрессировали собственный белок 2-1 плазматической мембраны, слитый с CFP, чтобы очертить плазматические мембраны (Mohanty et al., 2009). 3D-реконструкции формы клеток были созданы с использованием MorphoGraphX, а 3D-реконструкции PPB были созданы с использованием обучаемой сегментации Weka (Barbier de Reuille et al., 2015; Arganda-Carreras et al., 2017). Клетки были собраны более чем с трех отдельных растений для каждого генотипа. Предыдущий протокол использовался для моделирования симметричных делений путем минимизации мыльной пленки с использованием Surface Evolver (Brakke, 1992; Martinez et al., 2018). Эта модель генерирует минимумы мыльной пленки из реальных трехмерных форм клеток, чтобы явно проверить гипотезу о том, что деления растительных клеток имитируют математически предсказанные минимумы мыльной пленки (Errera, 1888). Как мы ранее продемонстрировали как для растительных, так и для животных клеток, большинство предсказанных делений близко совпадают с делениями in vivo (Martinez et al., 2018). Эта модель не принимает во внимание межклеточные взаимодействия, механические сигналы или сигналы развития. Вкратце, контуры ячеек были сглажены с использованием сферических гармоник 30-й степени с последующей минимизацией площади поверхности из 241 исходной плоскости с нормалями, равномерно распределенными по сфере. Для измерений смещения PPB расстояние между средней плоскостью PPB и поверхностью прогнозируемого разделения измерялось в квадрате микрон. Индекс аномальности определялся расстоянием между центром поверхности области и центром объема клетки.Конвейер Surface Evolver можно загрузить с GitHub (https://github.com/jdhayes/predictive_division/).
Стабилизированные таксолом, меченные родамином микротрубочки и HIS-TAN1-GFP-Atto488 были визуализированы на перевернутом стенде Nikon Ti с вращающимся диском W1 (Yokogawa) и моторизованным столиком (ASI Piezo), запущенным с помощью программного обеспечения Micromanager (micromanager.org) и построен Solamere Technology. Промежуток времени для меченных родамином стабилизированных GMPCPP микротрубочек и HIS-TAN1-Atto488 также отображали на этом микроскопе.Используемые твердотельные лазеры (Obis) и эмиссионные фильтры (Chroma Technology) имели возбуждение 561 нм, эмиссию 620/60 нм для родамин-тубулин и возбуждение 488 нм, эмиссию 520/50 нм для HIS-TAN1-GFP-Atto488. Использовали 100-кратную масляную линзу (1,45 NA) и иммерсионное масло типа FF (Cargille; иммерсионное масло, 16212). Эпидермальные клетки кукурузы, использованные для моделирования, визуализировали с помощью объективов с погружением в воду 60 × с числовой апертурой 1,2. Для йодида пропидия использовали возбуждение 561 нм и эмиссию 620/60 нм, а для YFP-TUBULIN использовали возбуждение 514 нм и эмиссию 540/30 нм.Иммерсионная жидкость на основе перфторуглерода (Cargille; RIAAA-678) была использована на объективе.
Динамические микротрубочки, меченные родамином, возбуждали твердотельным лазером с диодной накачкой 561 нм (при выходной мощности 4 мВт) (Melles Griot) с использованием объектива 100 × (NA 1,45) и микроскопии TIRF, как описано выше. Изображения получали с помощью камеры электронного умножителя с зарядовой связью с задней подсветкой (Hamamatsu ImageEM) и наборов родаминовых фильтров (эмиссия 582–636 нм).
Данные совместной локализации TAN1-YFP и CFP-TUBULIN на фиг. 4 были собраны с использованием Zeiss LSM 880 Elyra, Axio Observer и масляной линзы 100 × / 1,46 NA (Cargille; иммерсионное масло, 16212). TAN1-YFP возбуждали с использованием 514 нм, в то время как CFP-TUBULIN возбуждали с использованием 458 нм и отображали с использованием режима Airyscan сверхвысокого разрешения с разделителем основного луча 458/514 и набором полос пропускания 420–480 + длиннопроходных фильтров 605. Изображения Airyscan обрабатывались с использованием настроек по умолчанию с использованием программного обеспечения Zen Black (Zeiss).
Благодарю г-жу Джоселин Аранда, г-на Кристофера Хойта и г-жу Сухмани Сидху за сбор некоторых изображений, используемых для представленной работы по моделированию. Спасибо доктору Хун Лян за помощь с временными анализами табака. Мы благодарим доктора Дэвида Картера (Калифорнийский университет, Риверсайд, штат Калифорния) за обучение Zeiss LSM 880. Мы благодарим профессора Лори Смит (Калифорнийский университет, Сан-Диего, Ла-Хойя, Калифорния) за плазмиду TAN1-GFP и проф.Крис Амброуз (Университет Саскачевана, Саскатун, Канада) для плазмиды RFP-TUBULIN. Мы также благодарим Калифорнийский университет, Риверсайдские сельскохозяйственные предприятия за теплицы и поля, а также Дэвида Ветовика (Калифорнийский университет, Риверсайд, Риверсайд, Калифорния) за полезное управление полями.
Эта работа финансировалась Национальным научным фондом (грант MCB1716972 К.Г. Расмуссену и грант MCB1453726 Р.Диксит) и Национального института продовольствия и сельского хозяйства Министерства сельского хозяйства США (К.Г. Расмуссен). Благодарим П. Мартинеса за финансирование диссертационной работы Фонда Форда.
Авторы заявляют об отсутствии конкурирующих финансовых интересов.
Вклад авторов: C.G. Расмуссен, Р. Диксит, А. Чжан, С.Е. О’Лири, К.А. Бракке предоставил оборудование, реактивы и руководство экспериментом. П. Мартинес и Р.С. Балкунде проводил эксперименты in vitro с Р.С. Балкунде предлагает помощь в рассадке микротрубочек. П. Мартинес сделал снимки, использованные для моделирования, и выполнил покадровую съемку живых клеток. П. Мартинес и А. Чжан выполнили эксклюзионную хроматографию. К.Г. Расмуссен, С. О’Лири и Р. Диксит руководили экспериментами. П. Мартинес и К.Г. Расмуссен проанализировал данные и сделал цифры, П. Мартинес и К.Г. Расмуссен написал рукопись с комментариями и правками соавторов.К.Г. Расмуссен, П. Мартинес и Р. Диксит получили финансирование.
Прибрежная зона — определение, организация и проверка
Определение прибрежной зоны
Прибрежную зону в водной экосистеме (река, озеро, море) можно определить по наличию солнечного света на уровне донных отложений и соответствующему росту частично погруженных или полностью погруженных водных растений. Он также обычно характеризуется обилием растворенного кислорода, питательных веществ, движения воды и чередования интервалов погружения и воздействия.
Как подробно показано на рисунке выше, литоральная зона обычно простирается от начального края побережья, где субстрат и населяющие его организмы часто подвергаются воздействию воздуха и риску высыхания, до начального края лимнетической зоны, где субстрат никогда не обнажается. Однако не существует единого общепринятого определения прибрежной зоны. В зависимости от того, кого вы спрашиваете и какую область изучаете, определение литоральной зоны немного варьируется, чтобы соответствовать конкретному контексту.
В прибрежной среде, например на пляже или на берегу, прибрежная зона включает сушу до отметки половодья, которая часто подвергается воздействию воздуха, и часто является взаимозаменяемой с термином «приливная зона». В морской биологии прибрежная зона включает области океана, простирающиеся до концов континентального шельфа, и может быть подразделена на три меньшие зоны в зависимости от областей приливного воздействия. От мелководья до глубоких эти зоны представляют собой супралиторальную зону, эулиторальную зону и сублиторальную зону.
В пресноводных средах, таких как озера или реки, прибрежная зона включает водно-болотные угодья или участки суши, сезонно или постоянно затопляемые водоемом. Здесь приливы несущественны и не используются для классификации области, охватываемой литоральной зоной. Вместо этого, различные типы обнаруженных прибрежных зон можно определить по глубине и чистоте воды, а также по профилю береговой линии. Типы зон, обнаруженных на более высоких и более низких высотах, соответственно, включают лесистые заболоченные земли, влажные луга, болота и субстрат, поддерживающий жизнь водных растений.
Организм прибрежной зоны
Прибрежная зона и ее подзоны представляют собой особую среду с одинаково отличительными организмами. Типы организмов, встречающихся на каждом уровне прибрежной зоны, адаптированы к конкретным проблемам, возникающим в каждом месте и его близости к воде и суше. В районах со значительным воздействием волн, таких как морское побережье и его приливные зоны, организмы адаптированы к ежедневным изменениям солености, влажности, турбулентности воды, температуры и хищничества со стороны наземных и морских существ.Кроме того, в зависимости от того, подвижны ли организмы или нет, механизмы выживания для питания и дыхания становятся более неотъемлемой частью их адаптации к выживанию.
Животные
Подвижные организмы, такие как крабы, улитки и блюдца, могут искать убежища от хищников и иссушающего солнца, прячась в тени, создаваемой камнями, водорослями, грязью или песком, а также небольшими трещинами, обнаруженными в их окружающей среде. . Другие подвижные животные, которых можно найти в зарослях донных отложений, включают грязевых креветок и червей.Неподвижные организмы, такие как ракушки или мидии, прикреплены органическим цементом к твердым субстратам, чтобы предотвратить их вынос в море приливом. Из-за того, что они неподвижны, эти организмы становятся уязвимыми для хищников морских звезд, особенно если они закреплены ближе к отложениям; однако, когда они бросают якорь в районах высоких приливов, эти существа могут сидеть вне досягаемости своих хищников и использовать свои панцири для захвата воды для использования во время отливов.
Растения
Многие виды растений приспособились к жизни, находясь под водой лишь частично, а другие приспособились к жизни, находясь под водой полностью.Eelgrass — это тип цветущей затопленной водной растительности (SAV) с корневищами, которые помогают накапливать излишки питательных веществ для последующего развития. Ленточный водоросль — это еще один тип SAV, который увеличивает количество получаемого солнечного света за счет использования наполненного воздухом пузыря, который помещает большую часть своего тела ближе к поверхности, где доступно больше света. У ламинарии развита очень прочная корневая система, которая удерживает организм на якоре к субстрату, несмотря на сильные волны, которые угрожают вытащить некорневые организмы в море.
Грибки
У таких видов, как лишайник, которые встречаются в скалистых приливных районах, есть симбионт грибов, который может накапливать воду и защищать их от высыхания, а также симбионт водорослей или цианобактерий, который фотосинтетически производит пищу для организма. Способность терять большое количество воды, высыхать, а затем возвращаться к жизни, когда вода становится доступной, делает лишайник впечатляюще устойчивым к засухе.
Викторина
1. Что является ограничивающим фактором для растений литорали?
А. Растворенный кислород
B. Вода
C. Воздух
D. Солнечный свет
Ответ на вопрос № 1
D правильный. Растения в прибрежной зоне ограничены в росте, численности и распространении количеством солнечного света, проникающего через воду. Чем больше света доступно, тем лучше для роста растений
2. Какое утверждение о литорали неверно?
A. Он богат растворенными питательными веществами и кислородом.
B. Выживание в прибрежной зоне во многом зависит от способности человека убегать от хищников.
C. Определение различается для морских и пресноводных экосистем.
D. Его можно разделить на более мелкие зоны.
Ответ на вопрос № 2
B правильный. Выживание в прибрежной зоне может зависеть от способности организма убегать от хищников; однако это не единственное средство выживания. Многие неподвижные организмы избегают нападения хищников, используя твердую оболочку или зарываясь в субстрат, где они могут остаться незамеченными.
3. Что не встречается в прибрежной зоне?
A. Водно-болотные угодья
B. Приливная зона
C. Супралитораль
D. Лимнетическая зона
Ответ на вопрос № 3
D правильный. Хотя водно-болотные угодья могут показаться заманчивым ответом, на самом деле они представляют собой тип экосистемы, обнаруженной в прибрежных зонах рядом с более крупными водоемами. Приливная зона — это меньшая зона в прибрежной зоне, включающая пляжи и берега.Супралитораль — еще одна меньшая зона литорали. Лимнетическая зона не является частью литорали; это следующая зона за литоральной зоной.
Список литературы
.
- Адаптации. (нет данных). Получено 8 июня 2017 г. с сайта http://intertidalproject.weebly.com/adaptations.html
.- Интересные факты о грибах. (нет данных). Получено 8 июня 2017 г. с http://herbarium.usu.edu/fungi/FunFacts/lichens.htm
.- Приливная зона. (2013, 14 ноября).Получено 8 июня 2017 г. с сайта https://www.crd.bc.ca/education/our-environment/ecosystems/coastal-marine/intertidal-zone
.- Прибрежная зона. (2017, 4 июня). Получено 8 июня 2017 г. с сайта https://en.wikipedia.org/wiki/Littoral_zone
.



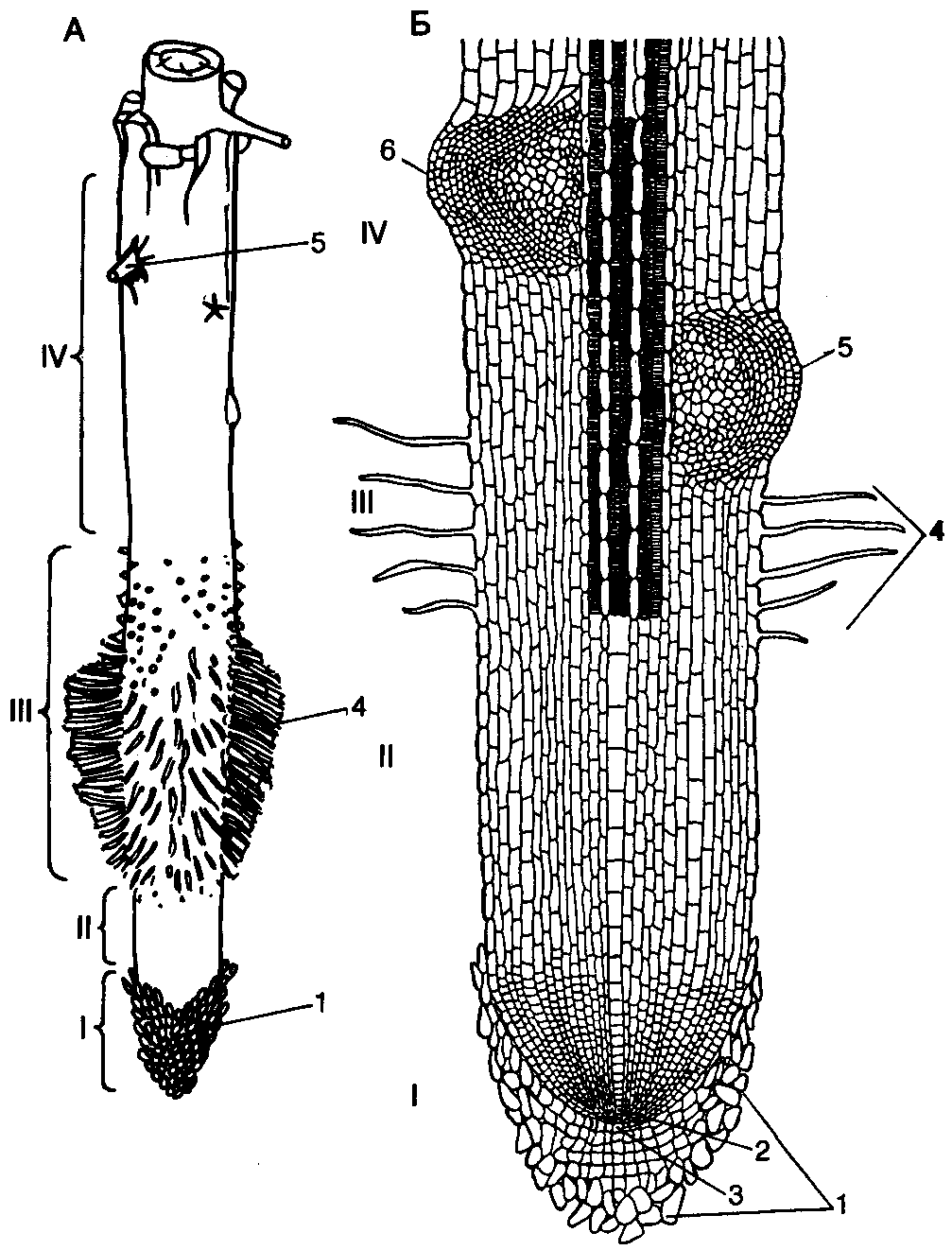

 ФУНКЦИИ КОРНЯ.
ФУНКЦИИ КОРНЯ.

