(PDF) АБСОЛЮТНАЯ ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ В ГАЗЕ ENSEMBLE N-REPRESENTABILITY AND ELECTRONEGATIVITY
В. К. Кочнев
отношение 𝐸=𝜇𝑁 является очевидным свойством экстенсивности
энергии такой системы с константой 𝜇. Жёсткость 𝜂=1
2
𝜕𝜇
𝜕𝑁 = 0 ,
как следствие независимости электронного хим. потенциала от числа
частиц. Формула (19) тогда указывает, что среднее значение энергии
одного электрона 𝐸=𝐸
𝑁в точности совпадает с 𝜇, что опять же при-
водит к очевидному в такой ситуации равенству 𝐸=𝜇𝑁.
Электроны в металле. В отличии от свободного электронного га-
за, электроны в металле нельзя считать невзаимодействующими, од-
нако, для них получаются те же соотношения. При неограниченном
увеличении числа электронов 𝑁→ ∞ правая часть (19) очевидно в
пределе не зависит от 𝑁, и тогда и левая часть обязана не зависеть
от 𝑁, что возможно только при стремлении жёсткости электронной
системы металла к нулю. В левой части (19) оказывается неопреде-
В левой части (19) оказывается неопреде-
лённость вида 0× ∞, для разрешения которой требуется какая-то до-
полнительная информация. Если положить при этом левую часть (19)
равной нулю, то из него в точности следует равенство 𝐸=𝜇𝑁, которое
часто используется в физике твёрдого тела. Более того, переобозначив
для этой ситуации среднюю энергию одного электрона, как 𝐸=𝜖, и
переписав затем правую часть (19) в виде −(𝜖−𝜇), получим таким
образом ни что иное, как числитель показателя экспоненты Ферми-
Дирака 𝑒−𝜖−𝜇
𝑘𝑇 для распределения энергии одного электрона в металле.
Электроны в молекулах. Для системы взаимодействующих элек-
тронов в соответствии с (19) получается, что среднее значение энергии
одного электрона 𝐸=𝐸
𝑁отличается от величины электронного хим.
потенциала тем больше, чем выше жёсткость 𝜂электронной системы,
т.е. чем в большей степени электроны взаимодействуют между собой.
Сравнивая соотношение (16), записанное как 𝜇=𝐸
𝑁и среднюю энер-
гию одного электрона 𝐸=𝜖=𝐸
𝑁заключаем, что различаться они мо-
9
Электроотрицательность — Справочник химика 21
В большинстве соединений хлор как сильно электроотрицательный элемент (ЭО =3,0) выступает в отрицательной степени окисления —1. В соединениях же с более электроотрицательными фтором, кислородом и азотом он проявляет положительные степени окисления. Особо разнообразны соединения хлора с кислородом, в которых степени окисления хлора +1, -f3, +5 и +7, а также +4 и Ч-6. [c.286]
В соединениях же с более электроотрицательными фтором, кислородом и азотом он проявляет положительные степени окисления. Особо разнообразны соединения хлора с кислородом, в которых степени окисления хлора +1, -f3, +5 и +7, а также +4 и Ч-6. [c.286]
Соединения брома (I), иода (I) и астата (I). Степень окисления + 1 у брома и его аналогов проявляется в соединениях с более электроотрицательными галогенами и кислородом, например [c.303]
Подобно фтору, кислород образует соединения почти со всеми элементами (кроме гелия, неона и аргона). Поскольку по электроотрицательности кислород уступает только фтору, степень окисления кислорода в подавляющем большинстве соединений равна —2. Кроме того, кислород проявляет степени окисления +2 и +4, а также +1 и —1 в соединениях со связью О—О.
Ранее было показано, что при определенном значении налагаемого напряжения на электроды можно практически занершить выделение металла в процессе электролиза. Различные значения потенциалов разложения у разных ионов металлов позволяют при соответствующем выборе налагаемого напряжения определять их в смеси. Однако в процессе электролиза, как было показано ранее, э. д. с. образуемой системы постепенно возрастает, и по мере уменьшения потенциала катода может наступить момент, когда потенциал катода станет настолько низким, что начнется выделение второго компонента смеси. Для того чтобы избежать этого явления, необходимо строго контролировать потенциал катода и поддерживать его значение, отвечающим количественному выделеннк более электроположительного катиона. При этом в конце процесса электролиза ток падает практически до нуля, что и является критерием завершения электролиза данного катиона. Далее, изменяя потенциал электрода до значения, необ.ко-димого для количественного выделения второго, более электроотрицательного компонента, можно осуществить и это определение и т. д. Для проведения электролиза с контролируемым потенциалом служат так называемые потенцио-статы — приборы, поддерживающие строго заданные потенциалы катода или анода.
Различные значения потенциалов разложения у разных ионов металлов позволяют при соответствующем выборе налагаемого напряжения определять их в смеси. Однако в процессе электролиза, как было показано ранее, э. д. с. образуемой системы постепенно возрастает, и по мере уменьшения потенциала катода может наступить момент, когда потенциал катода станет настолько низким, что начнется выделение второго компонента смеси. Для того чтобы избежать этого явления, необходимо строго контролировать потенциал катода и поддерживать его значение, отвечающим количественному выделеннк более электроположительного катиона. При этом в конце процесса электролиза ток падает практически до нуля, что и является критерием завершения электролиза данного катиона. Далее, изменяя потенциал электрода до значения, необ.ко-димого для количественного выделения второго, более электроотрицательного компонента, можно осуществить и это определение и т. д. Для проведения электролиза с контролируемым потенциалом служат так называемые потенцио-статы — приборы, поддерживающие строго заданные потенциалы катода или анода.
Образование гипервалентной связи отвечает перетеканию электронной плотности от центрального атома (донор) на лиганды (акцептор) (см. рис. 139, б). Поэтому в роли лигандов эффективнее всего выступают наиболее электроотрицательные атомы (фтор, кислород), этим же объясняется стабилизация высших степеней окисления элементов в их фторо- и оксо-соединениях.
S- и р-элементов противоположен. Из рис. 15 следует, что электроотрицательность элементов при переходе в периоде от I к VII группе увеличивается, а в подгруппах сверху вниз уменьшается. Таковы общие тенденции изменения рассматриваемых констант. Как уже указывалось, в характере изменения свойств элементов по периоду проявляется внутренняя периодичность, а по подгруппе — вторичная периодичность (см. рис. 18). [c.264]
рис. 18). [c.264]
Атом серы 5, как и атом кислорода, имеет шесть валентных электронов (35 3/) ). Сера — типичный неметаллический элемент. По электроотрицательности (ЭО = 2,5) она уступает только галогенам, кислороду, азоту. Наиболее устойчивы четные степени окисления серы (—2, +2, -j-4 и +6), что объясняется участием в образовании химических связей двух непарных электронов, а также одной или двух электронных пар [c.322]
Соединения с отрицательной степенью окисления углерода. С менее электроотрицательными, чем он сам, элементами углерод дает карбиды. Поскольку для углерода характерно образовывать гомоцепи, состав большинства карбидов не отвечает степени окисления углерода —4. По типу химической связи можно выделить ковалентные, ионно-ковалентные и металлические карбиды. [c.396]
Соединения со степенью окисления брома, иода и астата—1. Бром, иод и астат с менее электроотрицательными, чем они сами, элементами образуют бромиды, иодиды и астатиды.
Энергетическая диаграмма уровней молекулы ВеНз приведена на рис. 38. В соответствии с большей электроотрицательностью водорода его орбитали в схеме расположены ниже бериллия. Четыре валентных электрона невозбужденной молекулы ВеНз (два электрона от атома бериллия и два от двух атомов водорода) располагаются на а — и оГ-орбиталях, что описывается электронной конфигурацией [c.60]
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Она зависит от многих факторов, в частности от валентного состояния элемента, типа соединения, в которое он входит, н пр. Тем не менее эго понятие полезно для качественного объяснения свойств химической связи и соединений.
В связывающую орбиталь больш[ й вклад вносит орбиталь более электроотрицательного атома, а в разрыхляющую орбиталь менее электроотрицательного атома. [c.57]
Введение металлов, обладающ,их меньшей электроотрицательностью по сравнению с СиО и поэтому действующих как доноры электронов (щелочные или щелочноземельные металлы), повышает активность и снижает селективность. Электронные акцепторы (С1 , SO , S, Р), напротив, увеличивают селективность и уменьшают активность [74, 75]. [c.97]
Соединения со степенью окисления селена, теллура и полония —2. У селена, теллура и полония степень окисления —2 проявляется соответственно в селенидах, теллуридах и полонидах — соединениях с менее электроотрицательными, чем они сами, элементами. В этих типах соединений проявляется аналогия элементов селена и теллура с кислородом и серой. Например
Как видно из приведенных данных, в периодах наблюдается общая тенденция роста величины электроотрицательности, а в под- [c. 37]
37]
Электрические методы защиты основаны на изменении электрохимических свойств металла иод действием поляризующего тока. Наибольшее распространение получила защита металлов при наложении на них катодной поляризации. При смещении потенциала металла в сторону более электроотрицательных значений (по сравнению с величиной стационарного потенциала коррозии) скорость катодной реакции увеличивается, а скорость анодной падает (см. рис. 24.8). Если при стационарном потенциале Гкор соблюдалось равенство /а = /к, то при более отрицательном значении это [c.503]
Роль хлора, обладающего высокой электроотрицательностью, заключается в повышении эффективного заряда иона Pt +, что благоприятствует донорно-акцепторному взаимодействию электронов углеводорода — лиганда с -орбиталями центрального иона. [c.256]
В ljOy эффективный заряд на атоме кислорода ничтожно мал и связь С1—О близка к неполярной, тогда как в Na O эффективный заряд на атоме кислорода составляет —0,81, т. е. в этом соединении химическая связь сильно полярна. Понижение полярности связи в этом ряду соответствует уменьшению различия в электроотрицательностях элементов, образующих соединения. [c.81]
е. в этом соединении химическая связь сильно полярна. Понижение полярности связи в этом ряду соответствует уменьшению различия в электроотрицательностях элементов, образующих соединения. [c.81]
N1 Электроотрицательность. Понятие злектроотрицательности (ЭО) позволяет оценить способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения. Очевидно, что эта способность зависит от энергии ионизации атома и его сродства к электрону. Согласно одному из определений (Малликен) электроотрицателыюсть атома / может быть выражена как полусумма его энергии ионизации и сродства к электрону X 2 (/ + Р)- Имеется около 20 шкал электроотрнцатель-нс сти, в основу расчета значений которых положены разные свойства в(ществ. Значения электроотрицательностей разных шкал отли-
Роль комплексообразователя может играть любой элемент периодической системы. В соответствии со своей химической природой неметаллические элементы обычно дают анионные комплексы, в которых роль лигандов играют атомы наиболее электроотрицательных элементов, например ИРРеК Кз(Р04 , KslPS I Что же касается типичных металлических элементов (щелочных и щелочноземельных ме-тал.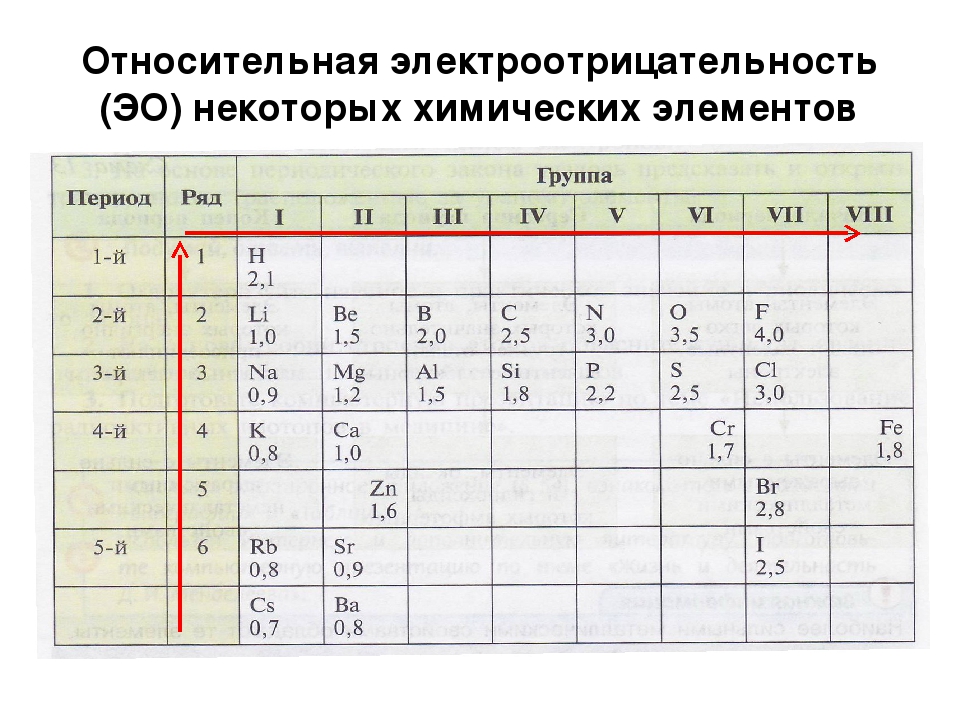 лов), то способность к образованию комплексных соединеиий с не рганическими лигандами у них выражена слабо. Имеющиеся [c.95]
лов), то способность к образованию комплексных соединеиий с не рганическими лигандами у них выражена слабо. Имеющиеся [c.95]
К ковалентным относятся гидриды менее электроотрицательных, чем сам водород, неметаллических элементов. К ковалентным относятся, например, гидриды состава SIh5 и ВНд. По химической природе гидриды неметаллов являются кислотными соединениями. [c.276]
Сочетание занятой а -орбитали Н и свободной a -орбитали 2 приводит к нулевому перекрыванию. Следовательно, такая комбинация орбиталей к акту химического взаимодействия не приводит. Сочетание свободной а5 » -орбитали Нд и занятой ir -орби-тали 2 энергетически невыгодно (иод электроотрицательнее водорода). Таким образом, в молекулах Hj и I2 нет орбиталей, которые могли бы привести к реакции непосредственно между молекулами. [c.199]
В простейших ковалентных соединениях значение положительной степени окисления элемента — соответствует числу оттянутых от атома связывающих электронных пар, а величина отрицательной степени окисления — числом притянутых электронных пар.
I (Ър ). Поскольку иод электроотрицательнее водорода, в активированном комплексе I. .. Иг. ..1 происходит смещение электронной плотности от молекулы Н 2 к атомам I и разрыву связи Н—Н. [c.200]
Водородная связь по прочности превосходит ван-дер-ваальсово взаимодействие, и ее энергия составляет 8—40 кДж/моль. Однако она на порядок слабее ковалентной связи. Водородная связь характерна для соединений наиболее электроотрицательных элементов фтора (25—40 кДж/моль), кислорода (13—29 кДж/моль), азота (8—21 кДж/моль) — ив меньшей степени хлора и серы. [c.92]
[c.92]
По указанному механизму взаимодействуют с водой простые вещества наиболее электроотрицательных элементов (С1, Вг, Г). [c.239]
Примерно такой же характер изменения ДО (в расчете на 1 моль атомов электроотрицательного элемента) имеет место и в случае остальных галидов, оксидов, сульфидов, нитридов. [c.247]
Уравнение (22.5), таким образом, удовлетворительно описывает ряд основных особенностей дофазового осаждения металлов, но не раскрывает его механизм. В этом отношении более перспективными представляются работы, в которых Д п сопоставляется с электроотрицательностями металлов, работами выхода электронов из них и т. д. По Кольбу, Прзасиицкому и Геришеру, между ДЛ п и разностью работ выхода электрона из металла подложки [c.458]
Вследствие больших размеров и низкой электроотрицательности [c.339]
Для групповой орбитали Ф2 подходящей по условиям симметрии орбитали центрального атома нет, поэтому в ионе НР орбиталь фз играет роль несвязывающей (рис. 143). Четыре электрона (один от атома Н, два от двух атомов Р и один за счет заряда иона) распределяются на связывающей и несвязывающей а молекулярных орбиталях. Нахождение электронов на молекулярной а-несвязывающей орбитали соответствует концентрации избыточного отрицательного заряда иа концевых атомах. Следовательно, гидрогенат-ионы типа НХг должны быть наиболее стабильными в том случае, когда X — наиболее электроотрицательные атомы или их группировки. Так, в ионе НР связь почти в три раза прочнее межмолекулярной водородной связи (с. 92). [c.278]
143). Четыре электрона (один от атома Н, два от двух атомов Р и один за счет заряда иона) распределяются на связывающей и несвязывающей а молекулярных орбиталях. Нахождение электронов на молекулярной а-несвязывающей орбитали соответствует концентрации избыточного отрицательного заряда иа концевых атомах. Следовательно, гидрогенат-ионы типа НХг должны быть наиболее стабильными в том случае, когда X — наиболее электроотрицательные атомы или их группировки. Так, в ионе НР связь почти в три раза прочнее межмолекулярной водородной связи (с. 92). [c.278]
Скорости гидрогенолиза неопентана в присутствии нанесенных КН-, Ки-, Рс1-, Оз-, 1г-, Р1-, Си- и Аи-катализаторов при 250 °С, отнесенные к единице поверхности металла, сильно отличаются друг от Друга, в ряде случаев в 100 раз наиболее активным является Ки-катализатор, наименее активным — Аи. При этом порядок активности коррелируется со степенью заполнения -уровня металла. Среди исследованных металлов У1П группы, а также Си и Аи, лишь 1г, Pt и Аи активны в реакции изомеризации неопентана в изопентан, что, по мнению авторов [34], обусловлено высокой электроотрицательностью этих металлов. [c.94]
[c.94]
Соединения бора (III). Степень окисления +3 у бора проявляется в соединениях с более электроотрицательными, чем он сам, элементами, т. е. Е галидах, оксиде, сульфиде, нитриде, гидридах и в соответствующих. шионных борат-комплексах, простейшие из которых приведены ниже [c.437]
Взаимным отталкиванием связывающих и несвязывающих электронных пар центрального атома можно объяснить влияние на величину валентных углов природы периферических атомов (или их группировок). Например, в рядах И )Ы (107,3°) и МРз(102°), Н2О (104,5°) и 0р2(103°) валентные углы уменьша-птся. Связывающее электронное облако занимает тем меньший объем (локализовано в большей степени), чем выше электроотрицательность периферического [c.76]
Bei эти ионы имеют тетраэдричеекое или искаженно тетраэдрическое строение. Учитывая различие в электроотрицательностях атомов, можно считать, что степень окисления фосфора в указанном ряду изменяется от —3 до +5. [c.369]
[c.369]
Таким же образом можно объяснить уменьшение термической устойчивости по мере увеличения электроотрицательности атома внешней сферы в ряду KNO3—HNO3—FNO3 [c.257]
В зависимости от типа менее электроотрицательного, чем кремний, элемента тип связи в силицидах изменяется от ионно-ковалентного до металлического. Силициды X- и -элементов I и II групп, например Са231, СаЗ и Са312,— полупроводники. В химическом ошошении силициды этого типа неустойчивы. Они более или менее легко разлагаются водой и особенно кислотами. [c.412]
Основы неорганической химии для студентов нехимических специальностей (1989) — [ c.24 , c.25 ]
Общая химия (1984) — [ c.99 ]
Химия (1986) — [ c.60 ]
Химия для поступающих в вузы 1985 (1985) — [
c. 56
]
56
]
Химия для поступающих в вузы 1993 (1993) — [ c.65 ]
Аналитическая химия (1973) — [ c.22 ]
Физическая химия (1987) — [ c.592 ]
Учебник общей химии (1981) — [ c.79 , c.190 ]
Неорганическая химия (1981) — [ c.103 ]
Общая и неорганическая химия 1997 (1997) — [ c.75 ]
Пособие по химии для поступающих в вузы 1972 (1972) — [ c.78 ]
Общая химия (1987) — [ c.48 , c.454 ]
Общая химия в формулах, определениях, схемах (1996) — [
c. 51
]
51
]
Химические приложения топологии и теории графов (1987) — [ c.173 ]
Общая и неорганическая химия Изд.3 (1998) — [ c.42 ]
Химия (1978) — [ c.156 , c.215 , c.321 , c.323 ]
Симметрия глазами химика (1989) — [ c.116 , c.150 , c.155 ]
Биохимия Том 3 (1980) — [ c.10 , c.11 ]
Методы получения и некоторые простые реакции присоединения альдегидов и кетонов Ч.1 (0) — [ c.25 , c.356 ]
Общая химия (1979) — [
c. 102
,
c.106
,
c.323
]
102
,
c.106
,
c.323
]
Физическая химия (1978) — [ c.443 , c.444 ]
Прикладная ИК-спектроскопия (1982) — [ c.153 , c.160 ]
Общая химия в формулах, определениях, схемах (0) — [ c.51 ]
Введение в химию окружающей среды (1999) — [ c.77 , c.78 , c.83 ]
Кристаллохимия (1971) — [ c.212 ]
Органическая химия (1979) — [ c.75 , c.76 ]
Химия (2001) — [
c. 40
]
40
]
Химия и периодическая таблица (1982) — [ c.70 ]
Биоорганическая химия (1991) — [ c.35 , c.36 ]
Общая химия в формулах, определениях, схемах (1985) — [ c.51 ]
Химия Краткий словарь (2002) — [ c.362 ]
Общая химия в формулах, определениях, схемах (0) — [ c.51 ]
Органическая химия Том1 (2004) — [ c.57 , c.122 ]
Органическая химия (2001) — [ c.29 ]
Органическая химия (2002) — [ c.79 , c.80 ]
Органическая химия (1998) — [
c. 42
,
c.140
]
42
,
c.140
]
Общая и неорганическая химия (2004) — [ c.75 ]
Большой энциклопедический словарь Химия изд.2 (1998) — [ c.702 ]
Физическая химия поверхностей (1979) — [ c.523 ]
Химия справочное руководство (1975) — [ c.416 ]
Методы сравнительного расчета физико — химических свойств (1965) — [ c.93 , c.99 , c.100 , c.105 , c.323 , c.325 ]
Современная химия координационных соединений (1963) — [ c.0 ]
Равновесия в растворах (1983) — [
c. 250
,
c.261
,
c.265
]
250
,
c.261
,
c.265
]
Современная общая химия Том 3 (1975) — [ c.2 , c.304 , c.429 , c.430 ]
Основы органической химии (1968) — [ c.174 , c.175 ]
Курс химии Часть 1 (1972) — [ c.92 ]
Общая химия ( издание 3 ) (1979) — [ c.46 ]
Курс теоретических основ органической химии (1975) — [ c.2 , c.4 , c.5 ]
Введение в теоретическую органическую химию (1974) — [
c. 0
]
0
]
Курс общей химии (1964) — [ c.49 ]
Основы органической химии (1983) — [ c.21 ]
Основы неорганической химии (1979) — [ c.63 , c.66 ]
Современная неорганическая химия Часть 3 (1969) — [ c.122 ]
Неорганическая химия (1979) — [ c.167 ]
Неорганическая химия (1974) — [ c.73 , c.75 ]
Неорганическая химия Издание 2 (1976) — [ c.95 , c.96 ]
Основы органической химии 1 Издание 2 (1978) — [ c.212 ]
Основы органической химии Часть 1 (1968) — [
c.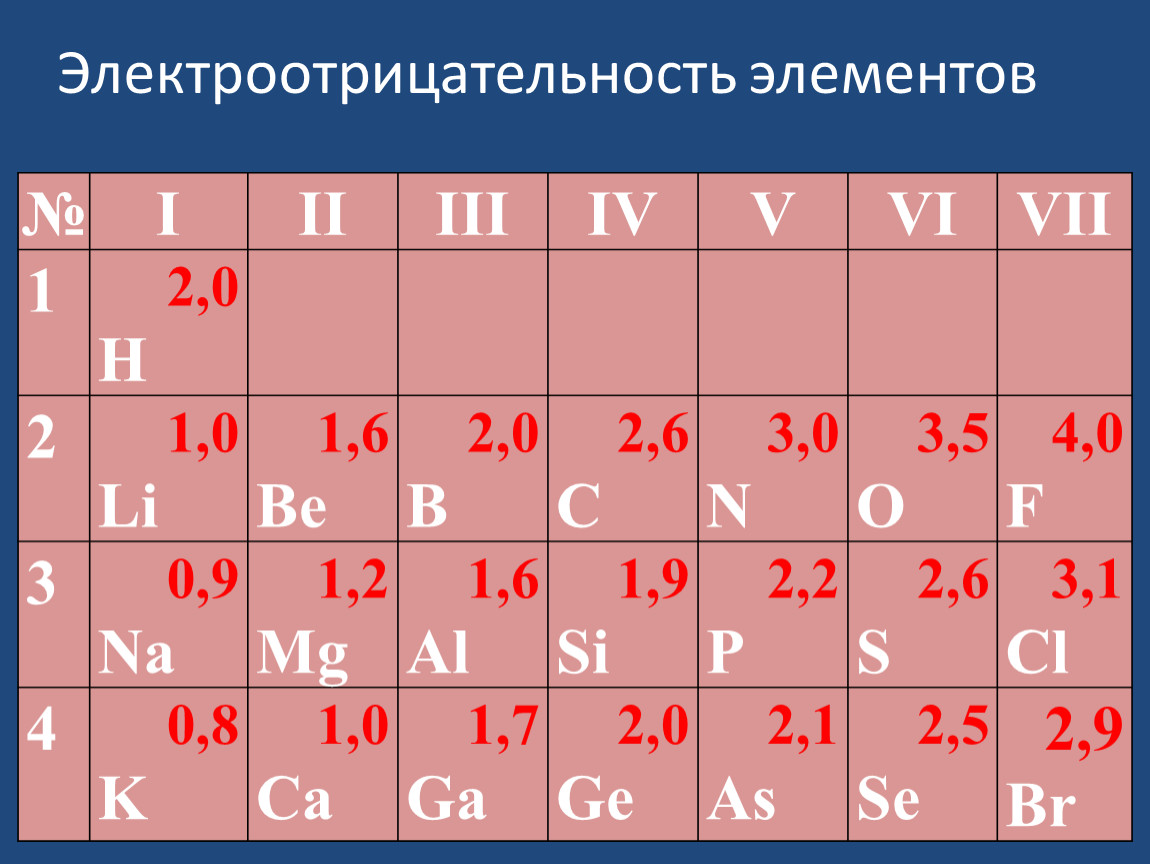 174
,
c.175
]
174
,
c.175
]
Курс теоретических основ органической химии (1959) — [ c.0 ]
Аналитическая химия (1965) — [ c.62 ]
Общая химия 1982 (1982) — [ c.124 , c.125 ]
Общая химия 1986 (1986) — [ c.118 , c.119 ]
Органическая химия Издание 2 (1980) — [ c.24 ]
Справочник полимеров Издание 3 (1966) — [ c.302 , c.403 ]
Физические методы в неорганической химии (1967) — [ c.51 ]
Аккумулятор знаний по химии (1977) — [
c. 56
]
56
]
Общая и неорганическая химия (1981) — [ c.66 , c.115 ]
Очерки кристаллохимии (1974) — [ c.158 , c.160 , c.462 ]
Неорганическая химия (1981) — [ c.101 ]
Химия (1985) — [ c.48 , c.50 ]
Теория резонанса (1948) — [
c.3
,
c.34
,
c.51
,
c.62
,
c.73
,
c.74
,
c.126
,
c.190
,
c. 255
,
c.258
,
c.258
,
c.344
]
255
,
c.258
,
c.258
,
c.344
]
Неорганическая химия (1978) — [ c.61 ]
Неорганическая химия (1987) — [ c.0 ]
Введение в электронную теорию органических реакций (1977) — [ c.57 , c.58 ]
Химия (1975) — [ c.82 , c.84 ]
История стереохимии органических соединений (1966) — [
c.125
,
c.183
,
c.196
,
c.202
,
c.229
,
c.252
,
c. 255
,
c.258
]
255
,
c.258
]
Общая химия (1974) — [ c.168 , c.170 , c.218 , c.224 , c.468 , c.469 , c.470 , c.478 , c.547 ]
Кристаллография (1976) — [ c.146 ]
Аккумулятор знаний по химии (1985) — [ c.56 ]
Химия (1982) — [ c.35 ]
Теоретические основы органической химии (1979) — [
c.14
,
c.15
,
c. 56
,
c.57
,
c.76
]
56
,
c.57
,
c.76
]
Современная общая химия (1975) — [ c.2 , c.304 , c.429 , c.430 ]
Химия и радиоматериалы (1970) — [ c.47 ]
Теоретическая неорганическая химия (1969) — [ c.122 ]
Теоретическая неорганическая химия (1971) — [ c.117 ]
Общая химия Издание 18 (1976) — [ c.120 , c.121 ]
Общая химия Издание 22 (1982) — [ c.124 , c.125 ]
Общая и неорганическая химия (1994) — [
c. 71
,
c.123
]
71
,
c.123
]
Неорганическая химия (1969) — [ c.33 ]
Общая и неорганическая химия (1981) — [ c.36 ]
Краткий справочник физико-химических величин Издание 8 (1983) — [ c.97 , c.161 ]
Теория молекулярных орбиталей в органической химии (1972) — [ c.162 , c.464 , c.468 ]
Теоретическая неорганическая химия (1969) — [ c.122 ]
Курс химического качественного анализа (1960) — [ c.29 ]
Химия несовершенных ионных кристаллов (1975) — [ c.12 ]
Стереохимия (1949) — [
c. 203
]
203
]
Теоретические основы общей химии (1978) — [ c.69 ]
Органические аналитические реагенты (1967) — [ c.34 ]
Как квантовая механика объясняет химическую связь (1973) — [ c.204 ]
Органическая химия Издание 3 (1980) — [ c.35 ]
Неорганическая химия (1994) — [ c.60 ]
Строение материи и химическая связь (1974) — [ c.121 ]
Химия Издание 2 (1988) — [ c.47 ]
Неорганическая химия Изд2 (2004) — [ c.136 ]
Общая химия Изд2 (2000) — [ c.32 ]
Катализ в химии и энзимологии (1972) — [
c.![]() 77
]
77
]
Теоретические основы органической химии (1973) — [ c.18 ]
Курс химического и качественного анализа (1960) — [ c.29 ]
Теплоты реакций и прочность связей (1964) — [ c.145 , c.190 , c.204 , c.205 , c.208 , c.209 ]
Основы общей химии Т 1 (1965) — [ c.95 , c.122 ]
Основы общей химии Том 2 Издание 3 (1973) — [ c.94 , c.120 ]
Основы общей химии Том 3 (1970) — [ c.267 ]
Курс физической органический химии (1972) — [
c.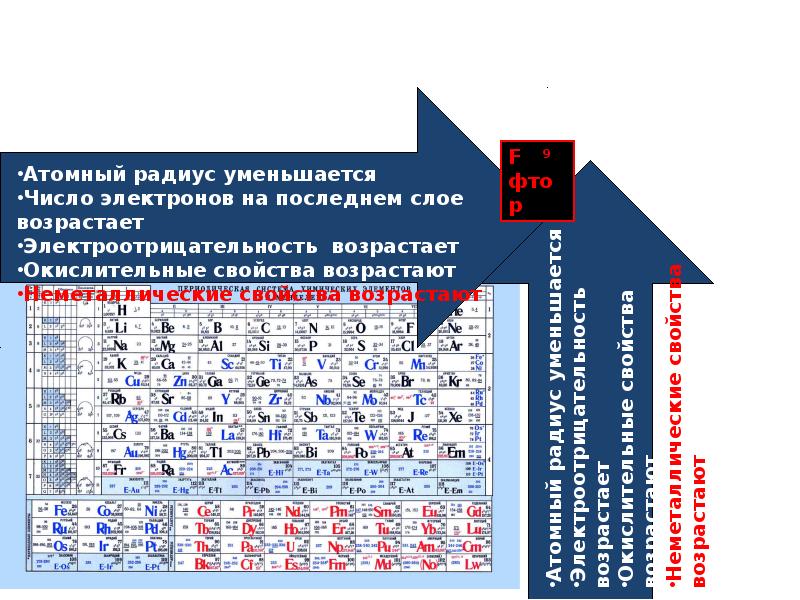 43
]
43
]
Электронное строение и химическая связь в неорганической химии (1949) — [ c.107 ]
Комплексные соединения в аналитической химии (1975) — [ c.64 , c.153 ]
Современные теоретические основы органической химии (1978) — [ c.31 ]
Современные теоретические основы органической химии (1978) — [ c.31 ]
Физическая химия Издание 2 1979 (1979) — [ c.177 ]
Курс общей химии (0) — [ c.87 ]
Курс общей химии (0) — [ c.87 ]
Физическая химия (1967) — [ c.523 ]
Предмет химии (0) — [
c.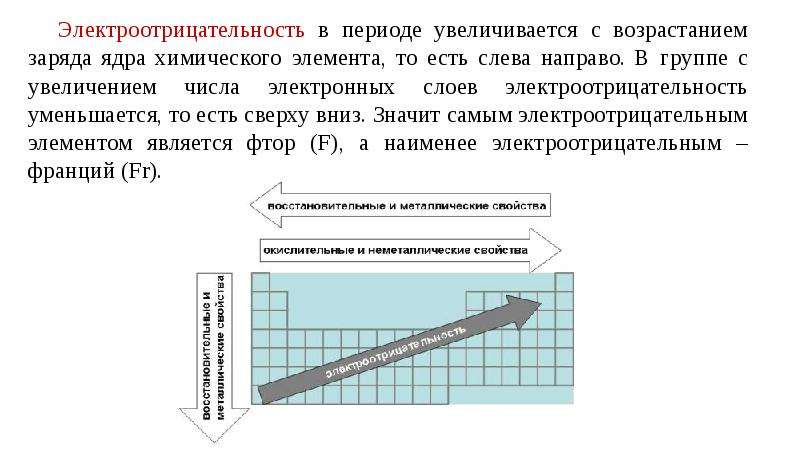 87
]
87
]
Неорганическая геохимия (1985) — [ c.157 , c.158 ]
Теоретическая неорганическая химия (1971) — [ c.117 ]
Химия Справочник (2000) — [ c.25 ]
Эмиссионные и адсорбционные свойства веществ и материалов (1975) — [ c.11 ]
Российские химики создали новую шкалу электроотрицательности атомов — Наука
ТАСС, 7 апреля. Российские ученые разработали новую шкалу электроотрицательности атомов, то есть их способности притягивать электроны других элементов. В отличие старой, которую разработал нобелевский лауреат Лайнус Полинг, новая шкала корректно отражает то, как ведут себя разные атомы при высоких давлениях или большой энергии связей между ними, отмечают авторы работы. Статью с ее описанием опубликовал научный журнал Nature Communications.
На эту тему
“К огромному удивлению, мы увидели, что увидели, что шкала Полинга не согласуется ни с теоретическими, ни с экспериментальными энергиями связей. Более того, это было известно в химической
литературе, но удовлетворительного решения предложено не было”, – рассказал один из авторов работы, профессор Сколковского института науки и технологий Артем Оганов.
Электроотрицательность – это одна из фундаментальных химических характеристик атома. Она показывает способность атома вступать в реакции и притягивать к себе электроны других атомов. Зная электроотрицательность вступающих в реакцию атомов, можно достаточно точно предсказать конечный результат реакции.
Это свойство открыл в начале XIX века шведский химик Йёнс Якоб Берцелиус, а первую теорию электроотрицательности сформулировал в 1932 году Лайнус Полинг. Ученый связал ее с энергией связей между атомами. Последующие исследования показали, что электроотрицательность подчиняется тем же периодическим законам, что и другие свойства химических элементов.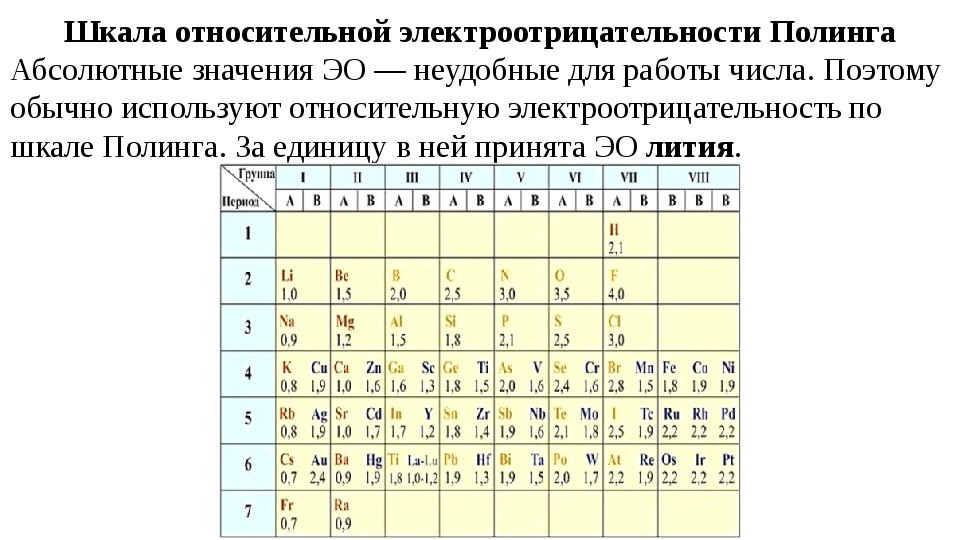
На эту тему
По словам Оганова, идеи, которые сформулировал Полинг, при нормальных температурах и давлениях работают относительно неплохо. Однако в экспериментах при высоких давлениях и при опытах с веществами, электроотрицательность атомов которых очень сильно различается, предсказание теории Полинга существенно расходятся с данными наблюдений.
“Я понял, в чем корень проблем – ионная стабилизация молекулы представлялась Полингом как аддитивная добавка. Я изменил формулу, заменив эту аддитивную добавку на мупликативную. Поллинг прибавлял, а мы умножаем. У нас получилась очень красивая шкала, которая работает как при маленьких разностях в электроорицательности, так и при больших», – объясняет ученый.
Используя новые формулировки, российские ученые подготовили новую шкалу электроотрицательности элементов. По словам разработчиков, она одинаково хорошо работает при низких и высоких давлениях и правильно предсказывает характер взаимодействий как похожих друг на друга атомов, так и элементов с противоположных концов этой шкалы.
Ученые надеются, что их шкала найдет свое применение в самых разных областях химии и позволит химикам ускорить многие исследования.
Российские химики нашли несоответствие в формуле нобелевского лауреата
https://ria.ru/20210407/elektrootritsatelnost-1727163698.html
Российские химики нашли несоответствие в формуле нобелевского лауреата
Российские химики нашли несоответствие в формуле нобелевского лауреата — РИА Новости, 21.04.2021
Российские химики нашли несоответствие в формуле нобелевского лауреата
Ученые из Сколтеха по-новому определили одно из фундаментальных химических понятий — электроотрицательность, и предложили свою шкалу для его оценки, которая… РИА Новости, 21.04.2021
2021-04-07T12:44
2021-04-07T12:44
2021-04-21T10:29
наука
сколковский институт науки и технологий
химия
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21. img.ria.ru/images/155879/51/1558795189_0:25:3555:2025_1920x0_80_0_0_d01961a41c153d1a8e26628dc2946d68.jpg
img.ria.ru/images/155879/51/1558795189_0:25:3555:2025_1920x0_80_0_0_d01961a41c153d1a8e26628dc2946d68.jpg
МОСКВА, 7 апр — РИА Новости. Ученые из Сколтеха по-новому определили одно из фундаментальных химических понятий — электроотрицательность, и предложили свою шкалу для его оценки, которая отличается от классической шкалы Полинга. Статья опубликована в журнале Nature Communications.Электроотрицательность — количественная характеристика способности атома оттягивать к себе электроны других атомов. Это одно из важнейших понятий в химии, необходимое для объяснения многих свойств — от энергии химических связей и стабильности соединений до цвета и твердости кристаллов.Современное понятие об электроотрицательности атомов было введено американским химиком, нобелевским лауреатом Линусом Полингом в 1930-х годах. Он же предложил первую шкалу относительных атомных электроотрицательностей, основанную на способности атома притягивать электронную плотность. В химической связи более электроотрицательный атом получает дополнительные электроны, становясь отрицательно заряженными, в то время как менее электроотрицательный атом теряет электроны и становится положительно заряженным. Шкала Полинга охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора. Фтор — наиболее электроотрицательный элемент, за ним следует кислород со значением 3,5, потом азот, хлор и так далее. Полинг вывел свои значения электроотрицательности из термохимии, используя энергии некоторых химических связей. Он предложил простейшую формулу для расчета стабилизации связи из-за разницы в электроотрицательности между атомами. Однако со временем стало ясно, что формула Полинга дает довольно низкую точность.Поэтому различные ученые в разное время предлагали свои определения электроотрицательности, которые грубо можно разделить на спектроскопические — для изолированных атомов — и термохимические — характеризующие энергии связи и теплоты образования соединений.Российские химики из Сколтеха профессор Артем Оганов и исследователь Кристиан Тантардини внесли изменения в формулу Полинга и на ее основе создали новую термохимическую шкалу электроотрицательности. «Все началось с того, что мы решили вычислить электроотрицательность Полинга под давлением, — приводятся в пресс-релизе Сколтеха слова Артема Оганова.
Шкала Полинга охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора. Фтор — наиболее электроотрицательный элемент, за ним следует кислород со значением 3,5, потом азот, хлор и так далее. Полинг вывел свои значения электроотрицательности из термохимии, используя энергии некоторых химических связей. Он предложил простейшую формулу для расчета стабилизации связи из-за разницы в электроотрицательности между атомами. Однако со временем стало ясно, что формула Полинга дает довольно низкую точность.Поэтому различные ученые в разное время предлагали свои определения электроотрицательности, которые грубо можно разделить на спектроскопические — для изолированных атомов — и термохимические — характеризующие энергии связи и теплоты образования соединений.Российские химики из Сколтеха профессор Артем Оганов и исследователь Кристиан Тантардини внесли изменения в формулу Полинга и на ее основе создали новую термохимическую шкалу электроотрицательности. «Все началось с того, что мы решили вычислить электроотрицательность Полинга под давлением, — приводятся в пресс-релизе Сколтеха слова Артема Оганова. — Химия высоких давлений довольно экзотична. Тем не менее, вы, вероятно, сможете понять многое, как только узнаете, как электроотрицательность элементов изменяется под давлением. Мы использовали определение Полинга для расчета электроотрицательности в нормальных условиях и были поражены, обнаружив, что ее масштаб не соответствует ни теоретическим, ни экспериментальным энергиям связи. Более того, многие публикации в химической литературе упоминают об этом несоответствии, но ни одна не предлагает последовательного решения». «Я понял, что основная причина заключалась в том, что Полинг рассматривал ионную стабилизацию молекулы как аддитивный эффект. Если рассматривать ее как мультипликативный эффект, то многие недостатки будут устранены. С помощью новой формулы и экспериментально полученных энергий химических связей мы определили электроотрицательность всех элементов и получили красивую шкалу, которая работает как для малых, так и для больших разностях в электроотрицательности», — отмечает ученый.
— Химия высоких давлений довольно экзотична. Тем не менее, вы, вероятно, сможете понять многое, как только узнаете, как электроотрицательность элементов изменяется под давлением. Мы использовали определение Полинга для расчета электроотрицательности в нормальных условиях и были поражены, обнаружив, что ее масштаб не соответствует ни теоретическим, ни экспериментальным энергиям связи. Более того, многие публикации в химической литературе упоминают об этом несоответствии, но ни одна не предлагает последовательного решения». «Я понял, что основная причина заключалась в том, что Полинг рассматривал ионную стабилизацию молекулы как аддитивный эффект. Если рассматривать ее как мультипликативный эффект, то многие недостатки будут устранены. С помощью новой формулы и экспериментально полученных энергий химических связей мы определили электроотрицательность всех элементов и получили красивую шкалу, которая работает как для малых, так и для больших разностях в электроотрицательности», — отмечает ученый.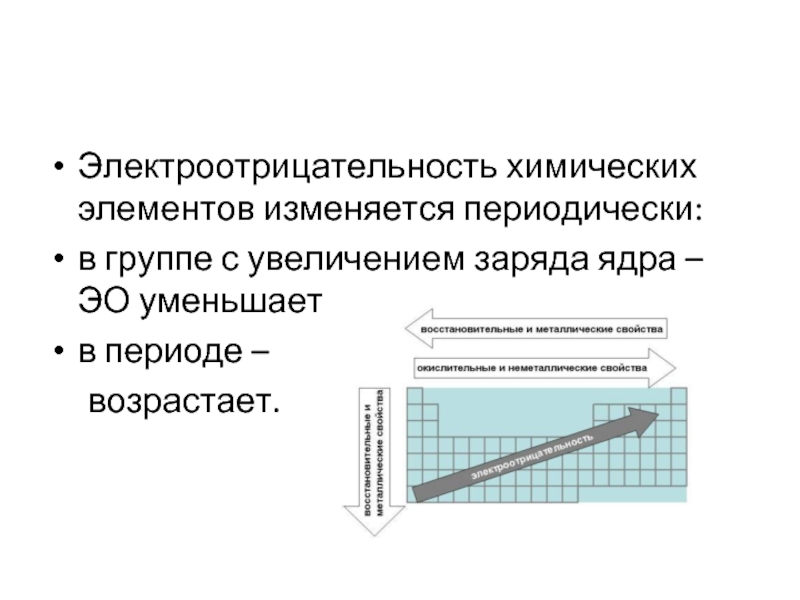 В новой формуле, в отличие от шкалы Полинга, электроотрицательность является безразмерной величиной и, по словам авторов, лучше описывает химические связи, энергии молекул и реакции.
В новой формуле, в отличие от шкалы Полинга, электроотрицательность является безразмерной величиной и, по словам авторов, лучше описывает химические связи, энергии молекул и реакции.
https://ria.ru/20210204/magnony-1596017192.html
https://ria.ru/20201105/khimiya-1583166856.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/155879/51/1558795189_413:0:3144:2048_1920x0_80_0_0_147b5c917658c5d742890be50f3af8a3. jpg
jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
сколковский институт науки и технологий, химия
МОСКВА, 7 апр — РИА Новости. Ученые из Сколтеха по-новому определили одно из фундаментальных химических понятий — электроотрицательность, и предложили свою шкалу для его оценки, которая отличается от классической шкалы Полинга. Статья опубликована в журнале Nature Communications.Электроотрицательность — количественная характеристика способности атома оттягивать к себе электроны других атомов. Это одно из важнейших понятий в химии, необходимое для объяснения многих свойств — от энергии химических связей и стабильности соединений до цвета и твердости кристаллов.
Современное понятие об электроотрицательности атомов было введено американским химиком, нобелевским лауреатом Линусом Полингом в 1930-х годах. Он же предложил первую шкалу относительных атомных электроотрицательностей, основанную на способности атома притягивать электронную плотность. В химической связи более электроотрицательный атом получает дополнительные электроны, становясь отрицательно заряженными, в то время как менее электроотрицательный атом теряет электроны и становится положительно заряженным.
Он же предложил первую шкалу относительных атомных электроотрицательностей, основанную на способности атома притягивать электронную плотность. В химической связи более электроотрицательный атом получает дополнительные электроны, становясь отрицательно заряженными, в то время как менее электроотрицательный атом теряет электроны и становится положительно заряженным.
Шкала Полинга охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора. Фтор — наиболее электроотрицательный элемент, за ним следует кислород со значением 3,5, потом азот, хлор и так далее.
4 февраля, 14:39НаукаФизики получили новое состояние материиПолинг вывел свои значения электроотрицательности из термохимии, используя энергии некоторых химических связей. Он предложил простейшую формулу для расчета стабилизации связи из-за разницы в электроотрицательности между атомами. Однако со временем стало ясно, что формула Полинга дает довольно низкую точность.
Поэтому различные ученые в разное время предлагали свои определения электроотрицательности, которые грубо можно разделить на спектроскопические — для изолированных атомов — и термохимические — характеризующие энергии связи и теплоты образования соединений.
Российские химики из Сколтеха профессор Артем Оганов и исследователь Кристиан Тантардини внесли изменения в формулу Полинга и на ее основе создали новую термохимическую шкалу электроотрицательности.
«Все началось с того, что мы решили вычислить электроотрицательность Полинга под давлением, — приводятся в пресс-релизе Сколтеха слова Артема Оганова. — Химия высоких давлений довольно экзотична. Тем не менее, вы, вероятно, сможете понять многое, как только узнаете, как электроотрицательность элементов изменяется под давлением. Мы использовали определение Полинга для расчета электроотрицательности в нормальных условиях и были поражены, обнаружив, что ее масштаб не соответствует ни теоретическим, ни экспериментальным энергиям связи. Более того, многие публикации в химической литературе упоминают об этом несоответствии, но ни одна не предлагает последовательного решения».
«Я понял, что основная причина заключалась в том, что Полинг рассматривал ионную стабилизацию молекулы как аддитивный эффект. Если рассматривать ее как мультипликативный эффект, то многие недостатки будут устранены. С помощью новой формулы и экспериментально полученных энергий химических связей мы определили электроотрицательность всех элементов и получили красивую шкалу, которая работает как для малых, так и для больших разностях в электроотрицательности», — отмечает ученый.
Если рассматривать ее как мультипликативный эффект, то многие недостатки будут устранены. С помощью новой формулы и экспериментально полученных энергий химических связей мы определили электроотрицательность всех элементов и получили красивую шкалу, которая работает как для малых, так и для больших разностях в электроотрицательности», — отмечает ученый.
В новой формуле, в отличие от шкалы Полинга, электроотрицательность является безразмерной величиной и, по словам авторов, лучше описывает химические связи, энергии молекул и реакции.
5 ноября 2020, 13:44НаукаРоссийские химики раскрыли смысл загадочных менделеевских чиселЭлектроотрицательность химических элементов. Химическая связь
I. Электроотрицательность
Электроотрицательность — химическое свойство атома, количественная характеристика способности атома в молекуле притягивать к себе электроны от атомов других элементов.
Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом.
Полингом.
Значения относительной электроотрицательности элементов представлены в таблице:
С точки зрения теории строения атомов принадлежность элементов к металлам и неметаллам определяется способностью их атомов отдавать или присоединять электроны при химических реакциях.
Наиболее сильными металлическими свойствами обладают те элементы, атомы которых легко отдают электроны. Значения их электроотрицательностей малы (χ ≤ 1).
Неметаллические свойства особенно выражены у тех элементов, атомы которых энергично присоединяют электроны.
В каждом периоде Периодической системы электроотрицательность элементов увеличивается при возрастании порядкового номера (слева направо), в каждой группе Периодической системы электроотрицательность уменьшается при возрастании порядкового номера (сверху вниз).
Элемент фтор F обладает наивысшей, а элемент цезий Cs — наименьшей электроотрицательностью среди элементов 1-6 периодов.
II. Химическая связь
В природе не существуют одиночные атомы. Все они находятся в составе простых и сложных соединений, где их объединение в молекулы обеспечивается образованием химических связей друг с другом.
Образование химических связей между атомами – естественный, самопроизвольный процесс, так как при этом происходит понижение энергии молекулярной системы, т.е. энергия молекулярной системы меньше суммарной энергии изолированных атомов. Это движущая сила образования химической связи.
Природа химических связей – электростатическая, т.к. атомы есть совокупность заряженных частиц, между которыми действуют силы притяжения и отталкивания, которые приходят в равновесие.
В образовании связей участвуют неспаренные электроны, находящиеся на внешних атомных орбиталях (или готовые электронные пары) – валентные электроны. Говорят, что при образовании связей происходит перекрывание электронных облаков, в результате чего между ядрами атомов возникает область, где вероятность нахождения электронов обоих атомов максимальна.
|
s, p — элементы |
d – элементы |
|
Валентыми являются электроны внешнего уровня Например, Н +1)1e 1s1 — внешний уровень не завершён — 1 валентный электрон O +8 )2e)6e 1s22s22p4 — внешний уровень не завершён — 6 валентных электронов |
Валентыми являются электроны внешнего уровня и d – электроны предвнешнего уровня Например, Cr +24)2e)8e)8e+5e)1e — 6 валентных электронов (5е+1е) |
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами.
При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную – Н, Не) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа, т.е. завершить свой внешний уровень.
III. Классификация химических связей
1. По механизму образования химической связи
а) обменный, когда оба атома, образующие связь, предоставляют для неё неспаренные электроны.
Например, образование молекул водорода Н2 и хлора Cl2:
б) донорно – акцепторный, когда один из атомов предоставляет для образования связи готовую пару электронов (донор), а второй атом – пустую свободную орбиталь.
Например, образование иона аммония (Nh5)+ (заряженная частица):
2. По способу перекрывания электронных орбиталей
а) σ — связь (сигма), когда максимум перекрывания лежит на линии, соединяющей центры атомов.
Например,
h3 σ(s-s)
Cl2 σ(p-p)
HCl σ(s-p)
б) π — связи (пи), если максимум перекрывания не лежит на линии, соединяющей центры атомов.
3. По способу достижения завершенной электронной оболочки
Каждый атом стремится завершить свою внешнюю электронную оболочку, при этом способов достижения такого состояния может быть несколько.
|
Признак сравнения |
Ковалентная |
Ионная |
Металлическая |
|
|
неполярная |
полярная |
|||
|
Как достигается завершенная электронная оболочка ? |
Обобществление электронов |
Обобществление электронов |
Полная передача электронов, образование ионов (заряженных частиц). |
Обобществление электронов всеми атомами в крист. решетке |
|
Какие атомы участвуют? |
немет – немет ЭО = ЭО |
1) Немет-Немет1
2)Мет–немет ЭО < ЭО |
мет +[немет]- ЭО << ЭО |
В узлах находятся катионы и атомы металла. Связь осуществляют свободно перемещающиеся в межузловом пространстве электроны. |
|
∆c= ЭО1 – ЭО2 |
0 |
< 1,7 |
> 1,7 |
0 |
|
Примеры |
простые вещества – неметаллы. |
кислоты, оксиды |
соли, щелочи, оксиды щелочных металлов. |
простые вещества – металлы. Связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке. |
IV. Задания для закрепления
Задание №1. Определите виды химических связей в молекулах следующих веществ:
h3S, KCl, O2, Na2S, Na2O, N2, Nh4, Ch5, BaF2, LiCl, O3, CO2, SO3, CCl4, F2.
Задание №2. Напишите механизм образования молекул h3S, KCl, O2, Na2S, Na2O, N2, Nh4, Ch5, BaF2, LiCl, CCl4, F2. В случае ковалентной связи определите тип перекрывания электронных облаков (π или σ), а так же механизм образования (обменный или донорно-акцепторный)
Задание №3.
Тренажер
Тренажер «Электроотрицательность»
Понятие об электроотрицательности.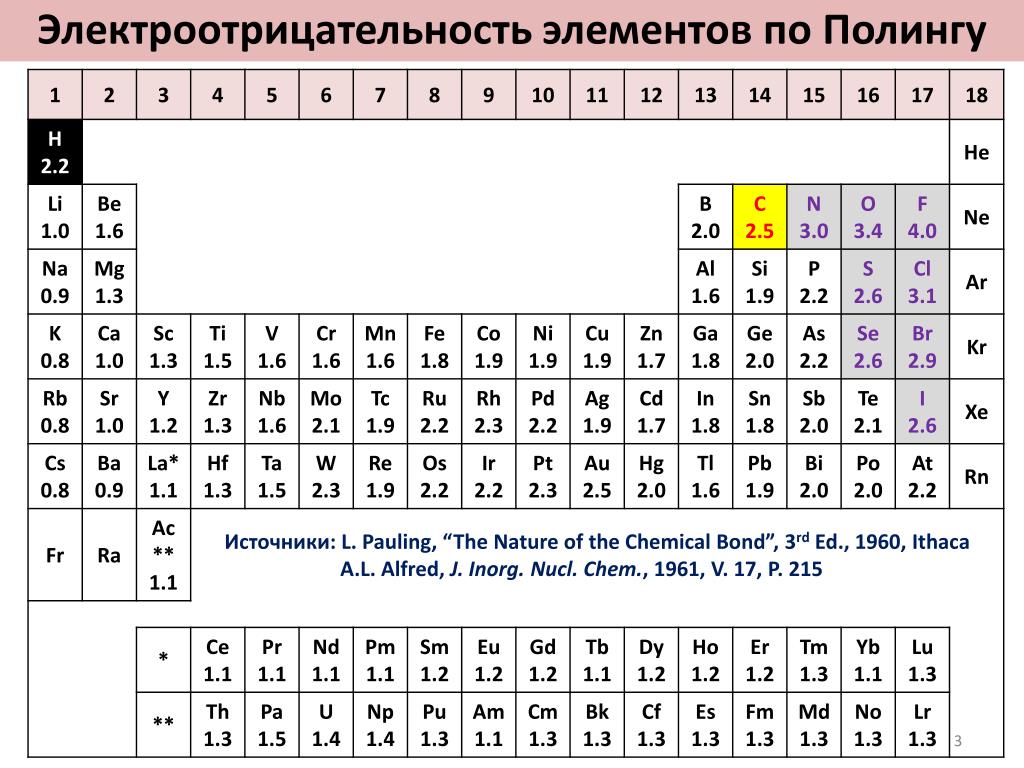 изменение величины электроотрицательности в пределах периода и в пределах главной и побочной подгрупп. изменение величины электроотрицательности в пределах периода и в пределах главной и побочной подгрупп.
|
|||||||||||||||||||||||||||||
|
Электpоoтрицательность (c) — способность атома удерживать внешние (, типа атомных орбиталей и характера их гибридизации. валентные) электроны. Она определяется степенью притяжения этих электронов к положительно заряженному ядру.
Электроотрицательность элементов возрастает по периоду и несколько убывает в группах с возрастанием номера периода у элементов I, II, V, VI и VII главных подгрупп, III, IV и V – побочных подгрупп, имеет сложную зависимость у элементов III главной подгруппы (минимум ЭО у Al), возрастает с увеличением номера периода у элементов VII-VIII побочных подгрупп. |
|||||||||||||||||||||||||||||
В Сколтехе создали новую шкалу электроотрицательности
Химики из Сколтеха предложили новую шкалу электроотрицательности. Результаты исследования опубликованы в журнале Nature Communications.
Понятие электроотрицательности появилось в химии в первой половине 20 века, его ввел великий американский химик Лайнус Полинг. Электроотрицательность – это способность атома смещать на себя электронную плотность. Более отрицательный атом перетягивает на себя электроны и становится отрицательно заряженным, а менее электроитрицательный приобретает положительный заряд. Это очень важная концепция, хорошо объясняющая многие вещи: от энергии химических связей до стабильности или нестабильности химических соединений, а также цвета и твердости кристаллов.
Химиками было создано множество определений и шкал электроотрицательности. Шкала Полинга оказалась самой первой и наиболее часто используемой, ее можно встретить в каждом учебнике химии. Значения электроотрицательности Полинг вывел из термохимии, используя энергии химических связей: что большая разница в электроорицательности между вступающими в связь атомами существенно стабилизирует связь, и Полинг предложил простейшую формулу, с помощью которой можно это рассчитать. Но позже выяснилось, что предсказания, сделанные на основе шкалы Полинга, обладают довольно низкой точностью.
Профессор Сколтеха Артем Оганов и научный сотрудник Кристиан Тантардини поняли, что необходимо поменять формулу Полинга и переопределить электроотрицательности элементов – и создать новую шкалу электроотрицательностей.
«Началось все с того, что мы решили рассчитать электроотрицательности под давлением – химия высоких давлений сильно отличается от привычной нам, и многое наверняка можно понять, если узнать, как меняются электроотрицательности элементов под давлением. За основу мы взяли определение Полинга, и начали с расчета электроотрицательностей при нормальных условиях. К огромному удивлению, мы увидели, что увидели, что эта шкала не согласуется ни с теоретическими, ни с экспериментальными энергиями связей. Более того, это было известно в химической литературе, но удовлетворительного решения предложено не было. Я понял, в чем корень проблем – ионная стабилизация молекулы представлялась Полингом как аддитивная добавка. Я изменил формулу, заменив эту аддитивную добавку на мупликативную. Полинг прибавлял, а мы умножаем. С помощью новой формулы и экспериментальных энергий химических связей мы определили электроотрицательности всех элементов. У нас получилась очень красивая шкала, которая работает как при маленьких разностях в электроорицательности, так и при больших», – рассказывает профессор Артем Оганов.
За основу мы взяли определение Полинга, и начали с расчета электроотрицательностей при нормальных условиях. К огромному удивлению, мы увидели, что увидели, что эта шкала не согласуется ни с теоретическими, ни с экспериментальными энергиями связей. Более того, это было известно в химической литературе, но удовлетворительного решения предложено не было. Я понял, в чем корень проблем – ионная стабилизация молекулы представлялась Полингом как аддитивная добавка. Я изменил формулу, заменив эту аддитивную добавку на мупликативную. Полинг прибавлял, а мы умножаем. С помощью новой формулы и экспериментальных энергий химических связей мы определили электроотрицательности всех элементов. У нас получилась очень красивая шкала, которая работает как при маленьких разностях в электроорицательности, так и при больших», – рассказывает профессор Артем Оганов.
В новой шкале электроотрицательность это безразмерная величина (что очень удобно), и хорошо воспроизводятся энергии как молекул, так и химических реакций.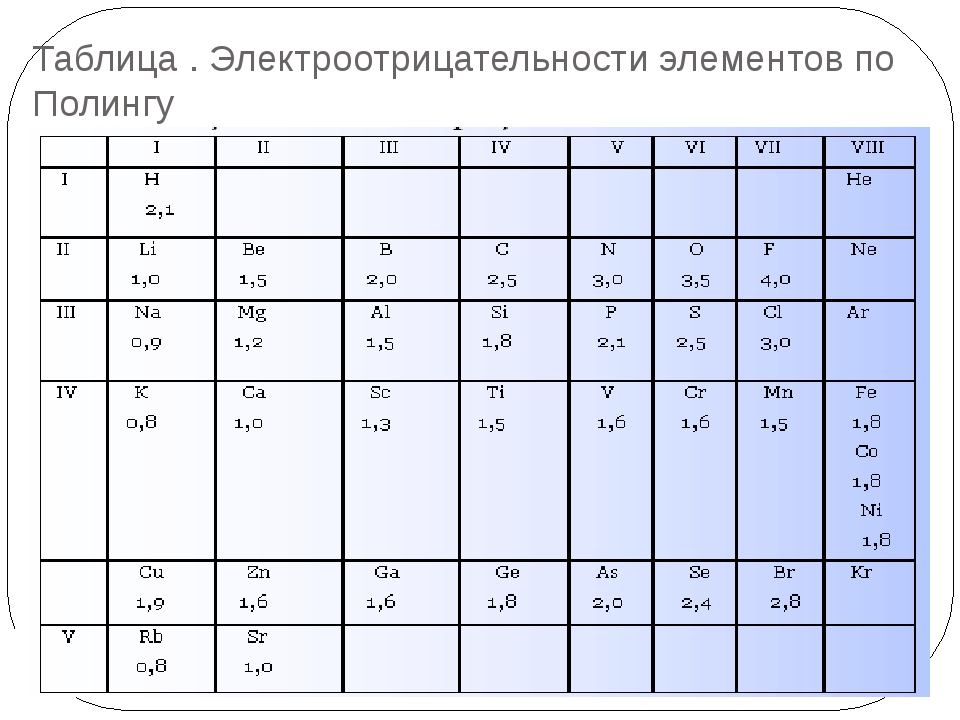
Контакты:
Skoltech Communications
+7 (495) 280 14 81
11.2: Электроотрицательность — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
- Электроотрицательность Полинга
- Тенденции электроотрицательности за период
- Тенденции электроотрицательности вниз по группе
- Объяснение закономерностей электроотрицательности
- Почему электроотрицательность увеличивается за период?
- Почему электроотрицательность падает при уменьшении группы?
- Ссылки
- Проблемы
- Авторы и авторство
Линус Полинг d описал электроотрицательность как «способность атома в молекуле притягивать к себе электроны.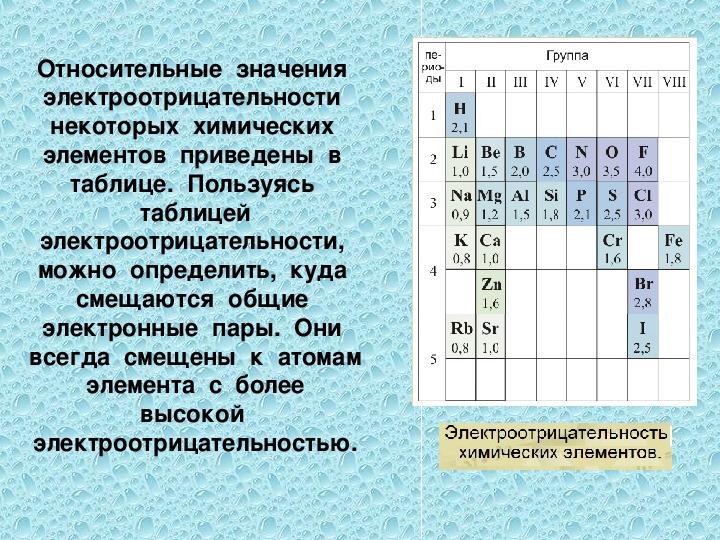 1 По сути, электроотрицательность атома — это относительная величина способности этого атома притягивать к себе избирательную плотность, когда он связывается с другим атомом. Чем выше электроотрицательность элемента, тем сильнее этот атом будет пытаться притягивать электроны к себе и от любого атома, с которым он связан. Основные свойства атома, определяющие его электроотрицательность, — это его атомный номер, а также его атомный радиус. Тенденция электроотрицательности возрастает по мере того, как вы перемещаетесь слева направо и снизу вверх по периодической таблице.Это означает, что наиболее электроотрицательным атомом является фтор, а наименее электроотрицательным — франций.
1 По сути, электроотрицательность атома — это относительная величина способности этого атома притягивать к себе избирательную плотность, когда он связывается с другим атомом. Чем выше электроотрицательность элемента, тем сильнее этот атом будет пытаться притягивать электроны к себе и от любого атома, с которым он связан. Основные свойства атома, определяющие его электроотрицательность, — это его атомный номер, а также его атомный радиус. Тенденция электроотрицательности возрастает по мере того, как вы перемещаетесь слева направо и снизу вверх по периодической таблице.Это означает, что наиболее электроотрицательным атомом является фтор, а наименее электроотрицательным — франций.
Существует несколько различных «типов» электроотрицательности, которые различаются только своими определениями и системой, с помощью которой они присваивают значения электроотрицательности. Например, есть электроотрицательность по Малликену, которая определяется как «среднее значение энергии ионизации и сродства к электрону атома» 3 , что, как мы увидим, немного отличается от определения электроотрицательности Полинга.
Pauling Электроотрицательность
Линус Полинг был первым ученым, описавшим явление электроотрицательности. Присвоив фтору (наиболее электроотрицательному элементу) значение 4,0, Полинг смог установить относительные значения для всех элементов. Именно тогда он впервые заметил тенденцию, согласно которой электроотрицательность атома определяется его положением в периодической таблице, и что электроотрицательность имеет тенденцию увеличиваться при перемещении слева направо и снизу вверх по таблице.Диапазон значений шкалы электроотрицательности Полинга варьируется от фтора (наиболее электроотрицательный = 4,0) до франций (наименее электроотрицательный = 0,7). Кроме того, если разница в электроотрицательности между двумя атомами очень велика, тогда тип связи имеет тенденцию быть более ионным, однако, если разница в электроотрицательности мала, то это неполярная ковалентная связь.
Линус Полинг (1901–1994)
Когда ему было девять лет, умер отец Полинга, и его мать пыталась убедить его бросить школу, чтобы поддержать семью. Он не бросил школу, но позже ему отказали в средней школе, и ему пришлось работать на нескольких работах, чтобы закончить колледж. Полинг стал одним из самых влиятельных химиков века, если не всех времен. Он получил две Нобелевские премии, одну по химии в 1954 году и одну за мир в 1962 году.
Он не бросил школу, но позже ему отказали в средней школе, и ему пришлось работать на нескольких работах, чтобы закончить колледж. Полинг стал одним из самых влиятельных химиков века, если не всех времен. Он получил две Нобелевские премии, одну по химии в 1954 году и одну за мир в 1962 году.
Тенденции электроотрицательности за период
Положительно заряженные протоны в ядре притягивают отрицательно заряженные электроны. По мере увеличения числа протонов в ядре электроотрицательность или притяжение будет увеличиваться.Следовательно, электроотрицательность увеличивается на с слева направо на подряд в периодической таблице. Этот эффект справедлив только для строки в периодической таблице, потому что притяжение между зарядами быстро спадает с расстоянием. На диаграмме показаны значения электроотрицательности от натрия к хлору (без учета аргона, поскольку он не образует связей).
Тенденции снижения электроотрицательности группы
По мере того, как вы спускаетесь по группе, электроотрицательность уменьшается. (Если он увеличивается до фтора, он должен уменьшаться по мере снижения.) На диаграмме показаны модели электроотрицательности в группах 1 и 7.
(Если он увеличивается до фтора, он должен уменьшаться по мере снижения.) На диаграмме показаны модели электроотрицательности в группах 1 и 7.
Объяснение закономерностей в электроотрицательности
Притяжение, которое связывающая пара электронов испытывает к определенному ядру, зависит от:
- количество протонов в ядре;
- расстояние от ядра;
- степень экранирования внутренними электронами.
Почему электроотрицательность увеличивается с течением времени?
Рассмотрим натрий в начале периода 3 и хлор в конце (игнорируя благородный газ, аргон).Представьте, что хлорид натрия связан с ковалентной связью.
И натрий, и хлор имеют свои связывающие электроны на трехуровневом уровне. Электронная пара экранирована от обоих ядер 1s, 2s и 2p-электронами, но в ядре хлора есть еще 6 протонов. Неудивительно, что электронная пара увлекается настолько далеко к хлору, что образуются ионы. Электроотрицательность увеличивается с течением времени, потому что количество зарядов на ядре увеличивается. Это сильнее притягивает связывающую пару электронов.
Электроотрицательность увеличивается с течением времени, потому что количество зарядов на ядре увеличивается. Это сильнее притягивает связывающую пару электронов.
Почему электроотрицательность падает по мере того, как вы спускаетесь по группе?
По мере того, как вы спускаетесь вниз по группе, электроотрицательность уменьшается на , потому что связывающая пара электронов все больше отдаляется от притяжения ядра. Рассмотрим молекулы фтороводорода и хлористого водорода:
Связующая пара защищена от ядра фтора только 1s 2 электронами. В случае хлора он экранирован всеми 1s 2 2s 2 2p 6 электронами.В каждом случае чистое притяжение от центра фтора или хлора +7. Но фтор имеет пару связей на 2-м уровне, а не на 3-м уровне, как в хлоре. Чем ближе к ядру, тем больше притяжение.
Список литературы
- Зумдаль, Стивен С. «Химические принципы», 5-е издание.
 Компания Houghton Mifflin 2005. Глава 13.2 «Электроотрицательность» стр. 587-590.
Компания Houghton Mifflin 2005. Глава 13.2 «Электроотрицательность» стр. 587-590. - Housecroft, Catherine E. et. al. «Неорганическая химия» 3-е издание.Pearson Education Limited, 2008 г. Глава 2.5 «Значения электроотрицательности» стр. 42-44
- Международный союз теоретической и прикладной химии. «Электроотрицательность». http://goldbook.iupac.org/E01990.html.
Проблемы
- Предскажите порядок или возрастание электроотрицательности следующих элементов:
a) F, Li, C, O
b) Te, Cl, S, Se
c) Cs, At, Tl, I
Авторы и авторство
Электроотрицательность — обзор | Темы ScienceDirect
4.22.2.2 Электроотрицательность валентного состояния
Электроотрицательность валентного состояния (VSE) определяется как способность атома в его валентном состоянии притягивать к себе электронную плотность от соседних атомов через сеть сигма-связей молекулы. Экспериментальная мера VSE была разработана Хансом Джаффе и его сотрудниками, 18 , на основе определения электроотрицательности Малликена. 19 В определении Малликена электроотрицательность основана на среднем значении потенциала ионизации ( I p ) и сродства к электрону ( E A ) для атома.Хинце и Джаффе распространили определение Малликена на валентные состояния, используя данные I p и E A , взятые из данных электронной спектроскопии для атомных орбиталей; они разработали численные значения для валентных состояний. Этот подход позволяет оценивать значения X MJ для различных гибридных валентных состояний.
19 В определении Малликена электроотрицательность основана на среднем значении потенциала ионизации ( I p ) и сродства к электрону ( E A ) для атома.Хинце и Джаффе распространили определение Малликена на валентные состояния, используя данные I p и E A , взятые из данных электронной спектроскопии для атомных орбиталей; они разработали численные значения для валентных состояний. Этот подход позволяет оценивать значения X MJ для различных гибридных валентных состояний.
Значения электроотрицательности валентного состояния Малликена – Джаффе ( X MJ ) характеризуют атом в его нескольких валентных состояниях в отличие от менее чувствительных значений Полинга, которые одинаковы для всех валентных состояний.Например, значение Полинга для углерода одинаково для атомов углерода в этане, этилене и ацетилене. 20 Однако значения X MJ для этих трех углеводородов различаются, что соответствует возрастающей кислотности атомов водорода в этих трех молекулах. Большая электроотрицательность валентного состояния для ацетиленового углерода коррелирует с большей кислотностью атома водорода в ацетилене и большей полярностью связи C – H. Аналогичная информация содержится в значениях X MJ для всех атомов в их валентном состоянии (см. Таблицу 3).
Большая электроотрицательность валентного состояния для ацетиленового углерода коррелирует с большей кислотностью атома водорода в ацетилене и большей полярностью связи C – H. Аналогичная информация содержится в значениях X MJ для всех атомов в их валентном состоянии (см. Таблицу 3).
Таблица 3. Значения дельты и экспериментальные значения электроотрицательности валентного состояния
| Группа | N | δ | δ v | X MJ (эВ) a | |||||
|---|---|---|---|---|---|---|---|---|---|
| C (sp 3 ) | 2 | 1 | 1 | 0 | 7.98 | ||||
| C (sp 2 ) | 2 | 2 | 3 | 1 | 8,79 | ||||
| C (sp) | 2 | 2 | 1024 902 421 4|||||||
| N (SP 3 ) | 2 | 3 | 5 | 2 | 11,54 | ||||
| N (SP 2 ) | 2 | 2 902 902 902 | 12,87 | ||||||
N (уд.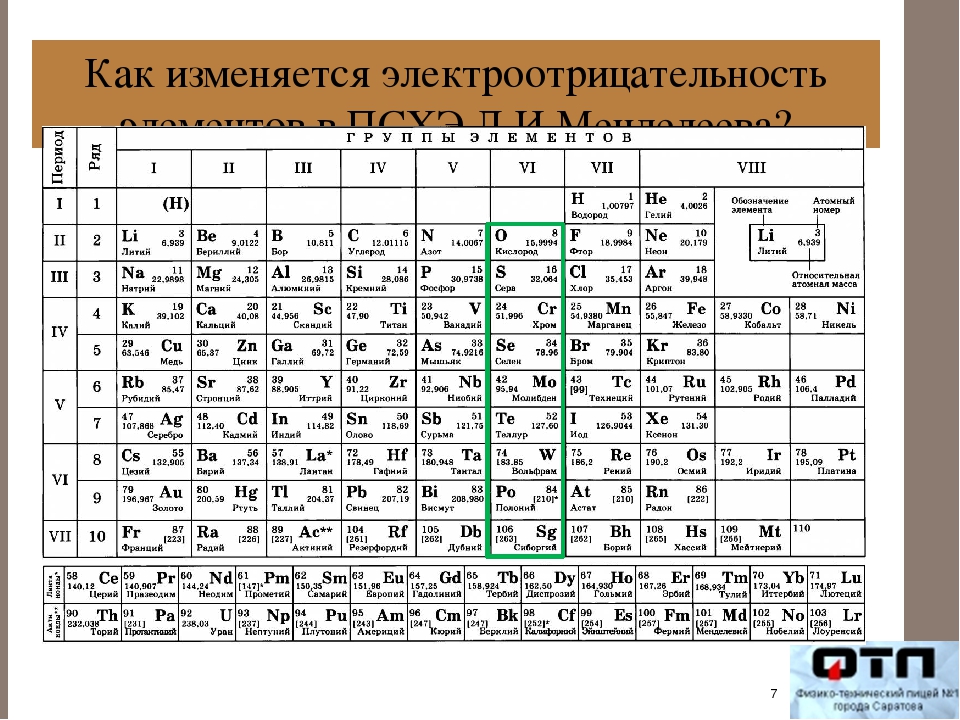 ) ) | 2 | 1 | 5 | 4 | 15.68 | ||||
| O (sp 3 ) | 2 | 2 | 6 | 4 | 15,25 | ||||
| O (sp 2 ) | 2 | 1 902 | 17,07 | ||||||
| F (sp 3 ) | 2 | 1 | 7 | 6 | 17,63 | ||||
| Si (sp 2 ) 902 902 | 1 902 902 902 902 902 902 902 902 | 0 | 7.30 | ||||||
| Si (sp 2 ) | 3 | 2 | 3 | 1 | 7,90 | ||||
| P (sp 3 ) | 3 | 3 902 | 8,90 | ||||||
| S (sp 3 ) | 3 | 2 | 6 | 4 | 10,14 | ||||
| S (sp 2 ) | 1 902 902 902 902 902 | 5 | 10.88 | ||||||
| Cl (sp 3 ) | 3 | 1 | 7 | 6 | 11,84 | ||||
| & gt; As– | 4 | 3 | 902|||||||
| –Se– | 4 | 2 | 6 | 4 | 9,08 | ||||
| –Br | 4 | 1 | 7 902.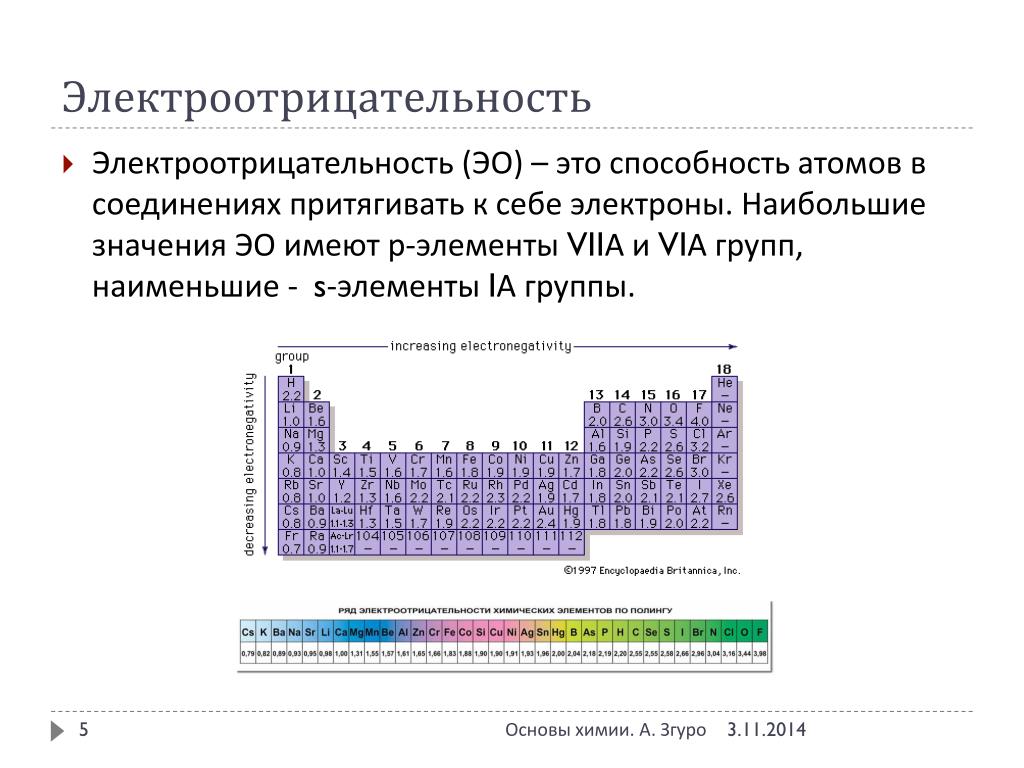 9024 9024 | 902 902 902 902 902 902 902 902 902 902 902 902 902 902 902 | 5 | 1 | 7 | 6 | 9.02 |
При разработке формализма электронного состояния мы включили электронную информацию валентного состояния, поскольку она эффективно характеризует органическую молекулу. По этой причине мы приняли значения электроотрицательности валентного состояния Малликена – Джаффе в качестве эталона для свойств атомов, которые важны для электронной плотности. Первым шагом в этом развитии является обнаружение связи между X MJ и информацией о молекулярной структуре.Связь можно понять с точки зрения источника электроотрицательности в молекуле. Этот эффект возникает из-за эффективного заряда ядра на атоме, то есть притяжения электронов, возникающего из-за незащищенных протонов в ядре атома. 5,17
В качестве ориентира мы можем считать, что атом углерода в валентном состоянии sp 3 имеет четыре валентных электрона на четырех сигма-орбиталях.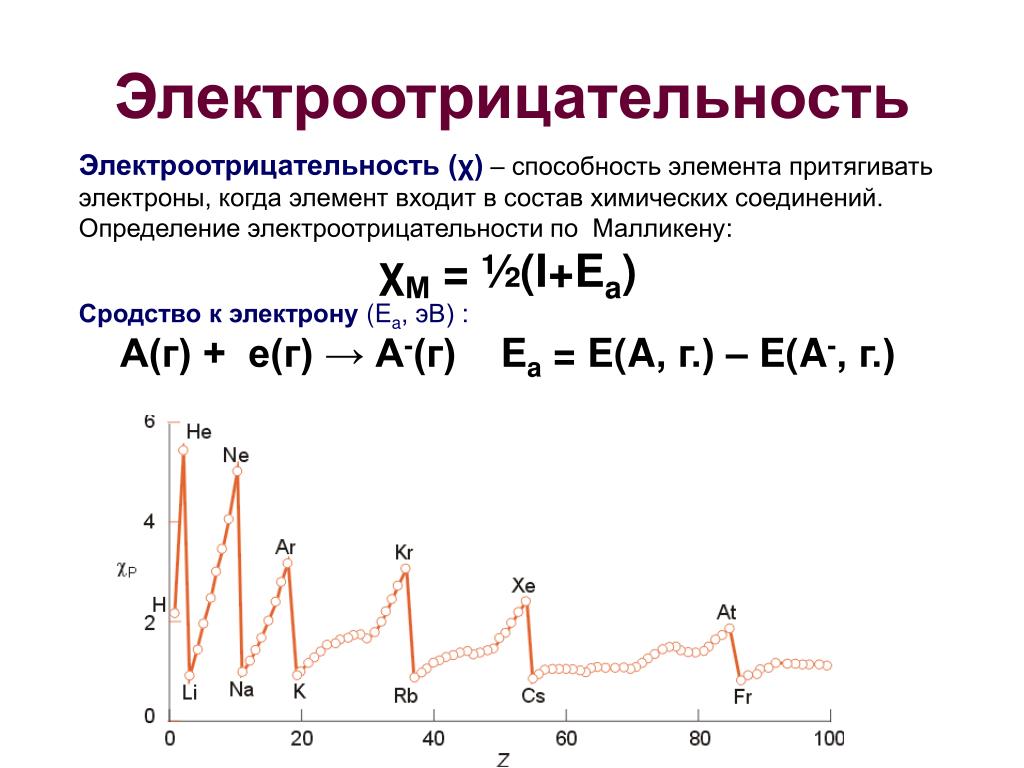 Каждый валентный электрон на своей сигма-орбитали как часть сигма-связи эффективно экранирует один ядерный протон.Эффективный ядерный заряд для этого углерода sp 3 принимается равным нулю, и соответствующий VSE также принимается равным нулю.
Каждый валентный электрон на своей сигма-орбитали как часть сигма-связи эффективно экранирует один ядерный протон.Эффективный ядерный заряд для этого углерода sp 3 принимается равным нулю, и соответствующий VSE также принимается равным нулю.
Для атома углерода sp 2 один валентный электрон находится на пи-орбитали, а три — на сигма-орбиталях. В этом случае пи-электрон, электронная плотность которого находится в основном за пределами сигма-связывающей орбитали, не эффективно экранирует заряд ядра. Эффективный ядерный заряд можно принять за единицу. Результирующая электроотрицательность углерода sp 2 выше, чем у углерода sp 3 .Следуя той же аргументации, эффективный заряд ядра для ацетиленового углерода (sp) намного выше, чем у углерода sp 2 , исходя из двух неэкранированных протонов. В более общем плане, для электроотрицательности валентного состояния углерода наблюдается следующий ранжирование свойств и описывается электроотрицательностью валентного состояния: C – H> CH 2 > –CH 3 .
Этот подход к электроотрицательности валентного состояния можно обобщить. Неэффективное экранирование возникает из-за того, что плотность пи и неподеленной пары электронов имеет низкую или нулевую вероятность вдоль линии оси связи.В результате электроны пи и неподеленной пары не экранируют ядерные протоны так же эффективно, как электроны на сигма-орбиталях, направленных вдоль оси связи. 5,17
Подсчет пи-электронов и неподеленных пар электронов на связанном атоме может быть оправдан как модель электроотрицательности его связанного атома как с экспериментальной, так и с теоретической точки зрения. Работа Слэтера показала, что пи-электроны и неподеленные пары электронов, находясь дальше от ядра, чем сигма-электроны, приводят к меньшей экранировке, следовательно, большему влиянию сердечника на сигма-связывающие электроны. 23 В этом суть электроотрицательности.
Подсчет пи-электронов и электронов неподеленной пары можно легко связать с эффективным зарядом ядра и, как следствие, с электроотрицательностью валентного состояния:
XMJ → δv − δ = σ + π + n − h− (σ− h) = π + n
Это выражение для элементов второй строки содержит количество дополнительных электронов на сигма-связанном атоме, то есть количество пи (π) и неподеленных пар ( n ) электронов. . Для элементов, помимо фтора, необходимо учитывать дополнительное экранирование дополнительных электронов остова.Чтобы включить валентные состояния для элементов помимо фтора, включается главное квантовое число валентных электронов ( N ) следующим образом:
[1] XMJ = 7,44 (δv − δ) /N2+6.57r2=0.965,s = 0,55, n = 19
Это выражение использовалось в модели VSE для 19 валентных состояний, что привело к высокой корреляции с X MJ со стандартной ошибкой регрессии, которая приближается к известным экспериментальным ошибкам, в первую очередь в определение значений сродства к электрону. 5,17 В таблице 3 показаны значения VSE для валентных состояний 19 атомов с соответствующими значениями дельта-значений.
ЭЛЕКТРОНЕГАТИВНОСТЬ На этой странице объясняется, что такое электроотрицательность, и как и почему она меняется в зависимости от Периодической таблицы. Если вас интересует электроотрицательность в контексте органической химии, вы найдете ссылку внизу этой страницы. Что такое электроотрицательность Определение Электроотрицательность — это мера тенденции атома притягивать связывающую пару электронов. Чаще всего используется шкала Полинга. Фтору (наиболее электроотрицательному элементу) присваивается значение 4,0, а значения варьируются до цезия и франция, которые являются наименее электроотрицательными при 0,7. Что произойдет, если два атома с одинаковой электроотрицательностью связаны вместе? Рассмотрим связь между двумя атомами, A и B.Каждый атом может образовывать другие связи, кроме показанной, но они не имеют отношения к аргументу. Если атомы одинаково электроотрицательны, оба имеют одинаковую тенденцию притягивать связывающую пару электронов, и поэтому будет найдено в среднем на полпути между двумя атомами. | ||
Примечание: Важно понимать, что это среднее изображение . Электроны на самом деле находятся на молекулярной орбитали и все время перемещаются по этой орбитали. | ||
Связь такого типа можно рассматривать как «чистую» ковалентную связь, в которой электроны равномерно распределяются между двумя атомами. Что произойдет, если B будет немного более электроотрицательным, чем A? B будет притягивать электронную пару больше, чем A. Это означает, что конец B связи имеет более чем справедливую долю электронной плотности и поэтому становится немного отрицательным. В то же время конец A (довольно короткий от электронов) становится слегка положительным. Определение полярных связей Это описывается как полярная связь . Полярная связь — это ковалентная связь, в которой существует разделение зарядов между одним концом и другим — другими словами, в которой один конец является слегка положительным, а другой — слегка отрицательным.Примеры включают большинство ковалентных связей. Связь водород-хлор в HCl или связи водород-кислород в воде являются типичными. Что произойдет, если B будет намного более электроотрицательным, чем A? В этом случае электронная пара перетаскивается прямо на конец связи B. Фактически, A потерял контроль над своим электроном, а B имеет полный контроль над обоими электронами. Ионы образовались. «Спектр» связей Смысл всего этого в том, что нет четкого разделения между ковалентными и ионными связями. Как далеко должно пройти это перетаскивание, прежде чем связь будет считаться ионной? На это нет настоящего ответа. Обычно вы думаете о хлориде натрия как о типично ионном твердом веществе, но даже здесь натрий не полностью потерял контроль над своим электроном. Однако из-за свойств хлорида натрия мы склонны считать его чисто ионным. | ||
Примечание: Не беспокойтесь слишком о точной точке отсечения между полярными ковалентными связями и ионными связями. На A’level примеры будут стремиться избегать серых областей — они будут явно ковалентными или явно ионными. Однако ожидается, что вы поймете, что эти серые зоны существуют. | ||
Иодид лития, с другой стороны, можно описать как «ионный с некоторым ковалентным характером». Резюме
Полярные связи и полярные молекулы В простой молекуле, такой как HCl, если связь полярна, то же самое происходит и со всей молекулой. А как насчет более сложных молекул? В CCl 4 каждая связь полярна. | ||
Примечание: Обычные линии обозначают связи в плоскости экрана или бумаги. Пунктирные линии представляют собой связи, уходящие от вас в экран или бумагу. 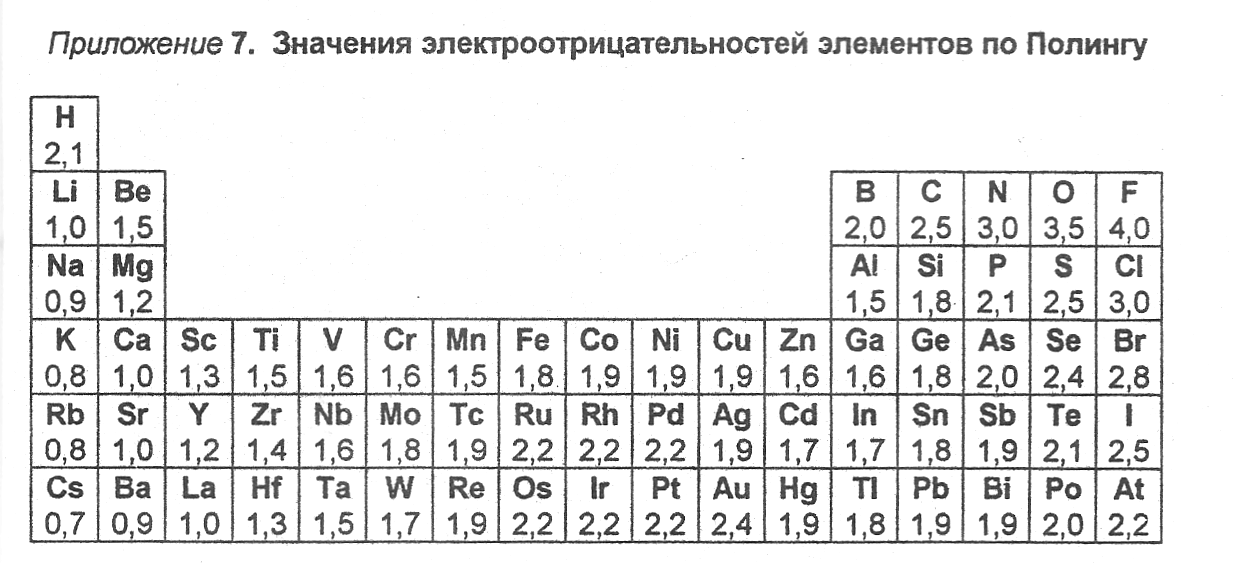 Клиновидные линии представляют собой облигации, выходящие из экрана или бумаги по направлению к вам. Клиновидные линии представляют собой облигации, выходящие из экрана или бумаги по направлению к вам. | ||
Молекула в целом, однако, не полярна — в том смысле, что у нее нет конца (или стороны), который был бы слегка отрицательным, и одним, который был бы слегка положительным. Вся внешняя часть молекулы несколько отрицательна, но нет общего разделения заряда сверху вниз или слева направо. Напротив, CHCl 3 является полярным. Водород в верхней части молекулы менее электроотрицателен, чем углерод, и поэтому немного положителен. Это означает, что молекула теперь имеет слегка положительный «верх» и слегка отрицательный «низ», и поэтому в целом молекула является полярной. Полярная молекула должна быть каким-то образом «односторонней». Паттерны электроотрицательности в Периодической таблице Самый электроотрицательный элемент — фтор. | ||
Примечание: Это упрощение игнорирует благородные газы. Исторически это связано с тем, что считалось, что они не образуют связей — и если они не образуют связи, у них не может быть значения электроотрицательности. Даже сейчас, когда мы знаем, что некоторые из них действительно образуют связи, источники данных по-прежнему не указывают для них значения электроотрицательности. | ||
Тенденции электроотрицательности за период По мере прохождения периода электроотрицательность возрастает. График показывает электроотрицательность от натрия до хлора — аргон не учитывается. У него нет электроотрицательности, потому что он не образует связей. Тенденции изменения электроотрицательности в группе По мере того, как вы спускаетесь по группе, электроотрицательность уменьшается. Объяснение закономерностей в электроотрицательности Притяжение, которое связывающая пара электронов испытывает к определенному ядру, зависит от:
| ||
Примечание: Если вас не устраивает концепция экранирования или экранирования , вам стоит прочитать страницу об энергиях ионизации перед тем, как продолжить. Факторы, влияющие на энергии ионизации, такие же, как и факторы, влияющие на электроотрицательность. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Почему электроотрицательность увеличивается за период? Рассмотрим натрий в начале периода 3 и хлор в конце (игнорируя благородный газ, аргон). И натрий, и хлор имеют свои связывающие электроны на трехуровневом уровне. Электронная пара экранирована от обоих ядер 1s, 2s и 2p-электронами, но в ядре хлора есть еще 6 протонов. Неудивительно, что электронная пара увлекается настолько далеко к хлору, что образуются ионы. Электроотрицательность увеличивается с течением времени, потому что количество зарядов на ядре увеличивается.Это сильнее притягивает связывающую пару электронов. Почему электроотрицательность падает при уменьшении группы? Подумайте о фтороводороде и хлористом водороде. Связующая пара защищена от ядра фтора только 1s 2 электронами. В случае хлора он экранирован всеми 1s 2 2s 2 2p 6 электронами. В каждом случае чистое притяжение от центра фтора или хлора +7.Но фтор имеет пару связей на 2-м уровне, а не на 3-м уровне, как в хлоре. По мере того, как вы спускаетесь по группе, электроотрицательность уменьшается, потому что связывающая пара электронов все больше отдаляется от притяжения ядра. Диагональные отношения в Периодической таблице Что такое диагональное соотношение? В начале периодов 2 и 3 Периодической таблицы есть несколько случаев, когда элемент в верхней части одной группы имеет некоторое сходство с элементом в следующей группе. На схеме ниже показаны три примера. Обратите внимание, что сходство проявляется в элементах, которые расположены по диагонали друг к другу, а не бок о бок. Например, бор — неметалл с некоторыми свойствами, похожими на кремний. В отличие от остальной части группы 2, бериллий имеет некоторые свойства, напоминающие алюминий. А литий имеет некоторые свойства, которые отличаются от других элементов в группе 1, и в некоторых отношениях напоминает магний. Говорят, что между этими элементами существует диагональное соотношение . Для этого есть несколько причин, но каждая зависит от того, как атомные свойства, такие как электроотрицательность, изменяются в Периодической таблице. Итак, мы быстро рассмотрим это в отношении электроотрицательности — что, вероятно, проще всего объяснить. Объяснение диагонального отношения относительно электроотрицательности Электроотрицательность увеличивается по Периодической таблице. Так, например, электроотрицательности бериллия и бора составляют: Электроотрицательность падает по мере того, как вы спускаетесь по Периодической таблице.Так, например, электроотрицательности бора и алюминия: Итак, сравнивая Be и Al, вы обнаруживаете, что значения (случайно) точно совпадают. Повышение из группы 2 в группу 3 компенсируется падением по мере перехода от бора к алюминию в группе 3. Нечто подобное происходит с литием (1,0) с магнием (1,2) и с бором (2,0) с кремнием (1,8). В этих случаях электроотрицательность отличается от , но очень близка. Сходная электроотрицательность между членами этих диагональных пар означает, что они могут образовывать схожие типы связей, и это повлияет на их химию. Вы можете встретить такие примеры позже в своем курсе.
| ||
Внимание! Насколько мне известно, ни одна из британских программ уровня A (или эквивалентных) больше не требует следующего бита.  Раньше он входил в программу AQA, но был удален из их новой программы. Однако на момент написания он все еще присутствует по крайней мере в одной зарубежной программе уровня A (Мальта, но могут быть и другие, о которых я не знаю).Если сомневаетесь, проверьте свой учебный план. Раньше он входил в программу AQA, но был удален из их новой программы. Однако на момент написания он все еще присутствует по крайней мере в одной зарубежной программе уровня A (Мальта, но могут быть и другие, о которых я не знаю).Если сомневаетесь, проверьте свой учебный план. В противном случае игнорируйте остальную часть этой страницы. Это альтернативный (и, на мой взгляд, более неудобный) способ взглянуть на формирование полярной связи. Чтение этого без надобности может сбить вас с толку. | ||
Поляризующая способность положительных ионов Что мы подразумеваем под «поляризационной способностью»? В ходе обсуждения мы рассмотрели образование полярных связей с точки зрения искажений, которые происходят в ковалентной связи, если один атом более электроотрицателен, чем другой.Но вы также можете посмотреть на образование полярных ковалентных связей, представив, что вы начинаете с ионов. Твердый хлорид алюминия ковалентен. Вместо этого представьте, что он был ионным. Он будет содержать ионы Al 3+ и Cl — . Ион алюминия очень мал и имеет три положительных заряда, поэтому «плотность заряда» очень высока. Это окажет значительное влияние на ближайшие электроны. Мы говорим, что ионы алюминия поляризуют ионы хлора. В случае хлорида алюминия электронные пары притягиваются к алюминию до такой степени, что связи становятся ковалентными. Но поскольку хлор более электроотрицателен, чем алюминий, электронные пары не будут протягиваться на полпути между двумя атомами, и поэтому образующаяся связь будет полярной. Факторы, влияющие на поляризационную способность Положительные ионы могут иметь эффект поляризации (электрически искажения) соседних отрицательных ионов.Поляризационная способность зависит от плотности заряда положительного иона. Поляризационная способность увеличивается по мере уменьшения размера положительного иона и увеличения количества зарядов. Чем больше отрицательный ион, тем легче его поляризовать. Например, в иодид-ионе I — внешние электроны находятся на 5-м уровне — относительно далеко от ядра. Положительный ион будет более эффективным в привлечении пары электронов от иодид-иона, чем соответствующие электроны, скажем, во фторид-ионе, где они намного ближе к ядру. Иодид алюминия ковалентен, потому что электронная пара легко уносится от иона иодида. С другой стороны, фторид алюминия является ионным, потому что ион алюминия не может поляризовать небольшой ион фтора в достаточной степени для образования ковалентной связи.
© Джим Кларк 2000 (последнее изменение в марте 2013 г. | ||
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.

- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.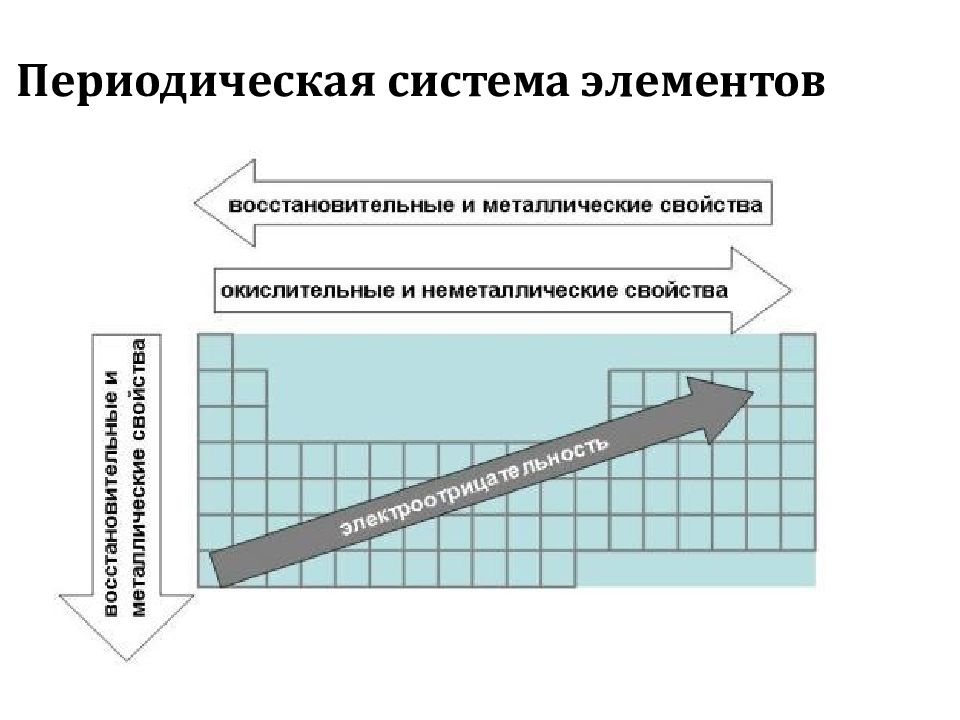
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Новое определение электроотрицательности исправляет недостатки, оставленные Линусом Полингом | Исследование
Российские исследователи изменили формулу фундаментальной концепции электроотрицательности, сделав ее более полезной для предсказания других аспектов химии. Артем Оганов и Кристиан Тантардини из Сколковского института науки и технологий, Москва, внесли простые на вид изменения в уравнение, первоначально разработанное Линусом Полингом в 1932 году. Новая формула лучше согласуется с тем, выделяют ли реакции или поглощают энергию, и позволяет избежать странных предсказаний, которые оригинал для металлосодержащих модулей.
Артем Оганов и Кристиан Тантардини из Сколковского института науки и технологий, Москва, внесли простые на вид изменения в уравнение, первоначально разработанное Линусом Полингом в 1932 году. Новая формула лучше согласуется с тем, выделяют ли реакции или поглощают энергию, и позволяет избежать странных предсказаний, которые оригинал для металлосодержащих модулей.
«Электроотрицательность, вероятно, является наиболее важным химическим свойством элементов», — говорит Оганов. Он обозначает, насколько равномерно или неравномерно электроны распределяются между атомами в химической связи.Как таковая идея часто объясняет, какие химические реакции позволят работать законам термодинамики. Но определение Полинга иногда не соответствует действительности. «Глядя на электроотрицательность Полинга, вы увидите, что в боридах молибдена или гидридах вольфрама атомы металлов должны быть заряжены отрицательно, а неметаллы — положительно, что возмутительно для химической интуиции», — говорит Оганов. «Наша шкала решает эту проблему».
«Наша шкала решает эту проблему».
Оганов определял электроотрицательность элементов при высоком давлении, чтобы помочь объяснить экзотические химические явления, происходящие в этих условиях.Он попросил своего аспиранта Тантардини проверить, может ли их вычислительный подход производить электроотрицательность атомов при нулевом давлении. «К нашему удивлению, вы не можете согласовать энергии связи, как расчетные, так и экспериментальные, и значения электроотрицательностей Полинга», — говорит Оганов. «Когда разница электроотрицательностей велика, формула Полинга больше не работает. Другими словами, он не работает именно там, где описываемые им эффекты являются наибольшими, где это больше всего необходимо ».
В уравнении Полинга энергия химической связи представляет собой сумму ковалентного и ионного членов.Ионный член — это квадрат разности электроотрицательностей связанных атомов. Это простейшая из возможных формул, но в ней есть очевидные проблемы. Например, при сравнении фторида лития и фторида цезия связь между литием и фтором более короткая и прочная. Это означает, что ковалентные и ионные члены больше для фторида лития, чем для фторида цезия. «Согласно формуле Полинга следует сделать вывод, что цезий более электроотрицателен, чем литий, что противоречит химической интуиции», — говорит Оганов.
Это означает, что ковалентные и ионные члены больше для фторида лития, чем для фторида цезия. «Согласно формуле Полинга следует сделать вывод, что цезий более электроотрицателен, чем литий, что противоречит химической интуиции», — говорит Оганов.
Полинг арматурный
Другие исследователи с разумным успехом пытались исправить это, используя более сложные формулы. Однако Оганов говорит, что формулы для получения электроотрицательностей из энергий связи все еще несовместимы с формулами для получения энергий связи из электроотрицательностей. Поэтому он и Тантардини «предложили простейшую из возможных формул, устраняющую эти проблемы», — говорит он. Они изменили уравнение так, что квадрат разности электроотрицательностей больше не равен ионной части энергии связи.Теперь он представляет собой соотношение ионной и ковалентной частей.
«На самом деле это больше соответствует первоначальному взгляду Полинга на стабилизацию связи за счет резонанса ионных и ковалентных волновых функций», — говорит Оганов. Это также имеет дополнительное преимущество, заключающееся в том, что результирующие электроотрицательности не выражаются количественно никакими единицами измерения, тогда как формула Полинга имеет странные единицы: эВ −1/2 .
Это также имеет дополнительное преимущество, заключающееся в том, что результирующие электроотрицательности не выражаются количественно никакими единицами измерения, тогда как формула Полинга имеет странные единицы: эВ −1/2 .
Педро Сальвадор из Университета Жироны, Испания, отмечает, что Полинг вывел свое уравнение на основе экспериментальных данных, а не на основе физической модели.Он говорит, что новое уравнение является «законным», а также более эффективным. Однако он добавляет, что вычислительная химия сегодня предсказывает энергии реакций с высокой точностью без электроотрицательности. «Во времена Полинга это оказало бы более значительное влияние», — говорит Сальвадор.
В целом ученые положительно отреагировали на новую формулу, говорит Оганов. Он добавляет, что интуитивное представление Полинга об электроотрицательности все еще «чрезвычайно полезно». «Он действительно был гением, и его идея не разрушена, а видоизменена и усилена нашей работой», — говорит Оганов.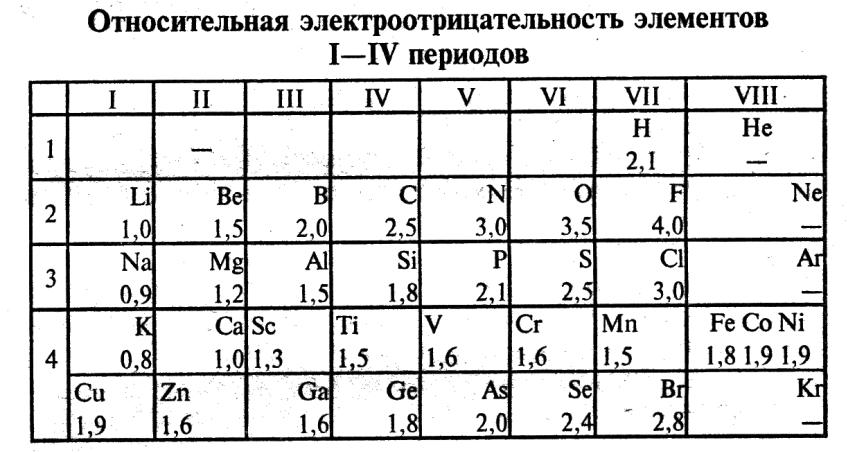 2 \), поэтому начнем с фторидов щелочных и щелочноземельных металлов. Из экспериментальных энергий диссоциации связи 20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41, 42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59 мы находим, что энергия ионной стабилизации больше в LiF, чем в CsF. или в любом фториде щелочного металла. Согласно (1) это должно указывать на то, что Li является наиболее электроположительным щелочным металлом, и общая электроотрицательность увеличивается вниз по группе периодической таблицы, что полностью противоречит химической интуиции и значениям, которые можно найти по шкале Полинга.Как ни странно, электроотрицательность Полинга для щелочных металлов (и, что не менее важно, для щелочноземельных металлов) не может быть получена из их высокоионных молекул, используя формулу Полинга (1). Значения, полученные из (1) и экспериментальных энергий диссоциации связи, равны X (Li) = 1,85, X (Na) = 1,96, X (K) = 1,99, X (Rb) = 2,00, X (Cs) = 1,93; они сильно отличаются от стандартных значений электроотрицательности Полинга: 0,98, 0,93, 0,82, 0,82 и 0.
2 \), поэтому начнем с фторидов щелочных и щелочноземельных металлов. Из экспериментальных энергий диссоциации связи 20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41, 42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59 мы находим, что энергия ионной стабилизации больше в LiF, чем в CsF. или в любом фториде щелочного металла. Согласно (1) это должно указывать на то, что Li является наиболее электроположительным щелочным металлом, и общая электроотрицательность увеличивается вниз по группе периодической таблицы, что полностью противоречит химической интуиции и значениям, которые можно найти по шкале Полинга.Как ни странно, электроотрицательность Полинга для щелочных металлов (и, что не менее важно, для щелочноземельных металлов) не может быть получена из их высокоионных молекул, используя формулу Полинга (1). Значения, полученные из (1) и экспериментальных энергий диссоциации связи, равны X (Li) = 1,85, X (Na) = 1,96, X (K) = 1,99, X (Rb) = 2,00, X (Cs) = 1,93; они сильно отличаются от стандартных значений электроотрицательности Полинга: 0,98, 0,93, 0,82, 0,82 и 0. 79 соответственно (см. Дополнительный рис. 1).
79 соответственно (см. Дополнительный рис. 1).
Проблема заключается в форме формулы (1): длина связи Li – F намного короче, чем у Cs – F, и ионный член, конечно, должен быть сильнее в более короткой связи в Li + F –, чем в Cs. + Ф. — . То же верно и для ковалентной части энергии связи, которая также больше в LiF, чем в CsF. Ионные эффекты больше в CsF, чем в LiF, только в относительном (по сравнению с ковалентными эффектами), но не в абсолютном смысле (см. Таблицу 1).2) $$
(2)
Таблица 1 Энергетика связи для фторидов щелочных металлов. Теперь электроотрицательности, определяемые формулой (2), безразмерны (см. Рис. 1). С помощью формулы (2) мы восстанавливаем правильные тенденции для всей таблицы Менделеева и не сталкиваемся с такими патологиями, как упомянутые выше для щелочных и щелочноземельных металлов. Все металлы имеют более низкую электроотрицательность, чем бор и водород, что лучше согласуется с химической интуицией, чем значения Полинга. Применяя формулу (2) к молекулам ClF, BrF, IF, мы получили электроотрицательности Cl (3.56), Br (3.45), I (3.22). Затем мы пересчитали электроотрицательность щелочных металлов, используя молекулы хлорида, бромида и йодида щелочных металлов, и нашли те же значения в пределах ~ 0,2 (что можно рассматривать как погрешность наших значений): например, электроотрицательность Na, извлеченного из NaF, составляет 2,15, из NaCl 2,28, из NaBr 2,13, из NaI 1,94. Электроотрицательность всех 118 известных элементов была рассчитана с использованием экспериментальных энергий диссоциации 20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38 , 39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59 (мы взяли средние значения при наличии двух или более измерений см. в дополнительной таблице 2) и показаны на рис.1. Электроотрицательность некоторых элементов, для которых недостаточно надежных данных об энергиях связи (благородные газы, Pm, Ra, Po, At и некоторые из самых тяжелых элементов), были получены косвенно, через линейную корреляцию с их экспериментальными электроотрицательностями по Малликену, поскольку Шкала Малликена показывает лучшую корреляцию с нашей шкалой.
Применяя формулу (2) к молекулам ClF, BrF, IF, мы получили электроотрицательности Cl (3.56), Br (3.45), I (3.22). Затем мы пересчитали электроотрицательность щелочных металлов, используя молекулы хлорида, бромида и йодида щелочных металлов, и нашли те же значения в пределах ~ 0,2 (что можно рассматривать как погрешность наших значений): например, электроотрицательность Na, извлеченного из NaF, составляет 2,15, из NaCl 2,28, из NaBr 2,13, из NaI 1,94. Электроотрицательность всех 118 известных элементов была рассчитана с использованием экспериментальных энергий диссоциации 20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38 , 39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59 (мы взяли средние значения при наличии двух или более измерений см. в дополнительной таблице 2) и показаны на рис.1. Электроотрицательность некоторых элементов, для которых недостаточно надежных данных об энергиях связи (благородные газы, Pm, Ra, Po, At и некоторые из самых тяжелых элементов), были получены косвенно, через линейную корреляцию с их экспериментальными электроотрицательностями по Малликену, поскольку Шкала Малликена показывает лучшую корреляцию с нашей шкалой.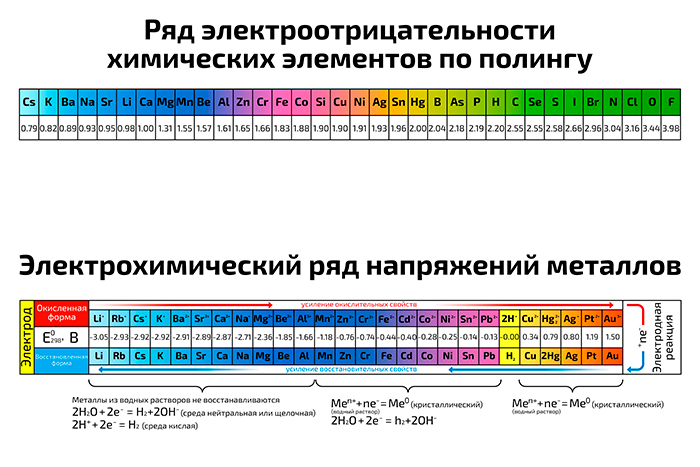 Фактически, наша термохимическая шкала имеет разумную линейную корреляцию со всеми другими шкалами (рис. 2 и дополнительная таблица 3), коэффициент корреляции Пирсона R составляет 98% для шкал Малликена и Аллена, 87% для шкал Полинга и 85% для шкал Мартынова – Бацанова. ).Для короткоживущих 6d- и 7p-элементов Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn, Nh, Fl, Mc, Lv, Ts, Og мы получили термохимические электроотрицательности из теоретических электроотрицательностей Малликена 60, 61 . Когда для этих элементов станет доступно больше данных, термохимическая электроотрицательность будет определяться напрямую. Интересно, что наклон линии корреляции составляет 1/2 для шкал Полинга и Мартынова – Бацанова, 2/3 для шкалы Аллена и 1/4 для шкалы Малликена. В периодической таблице можно увидеть ожидаемые тенденции: периодичность электроотрицательностей и их общее уменьшение сверху вниз таблицы.Наибольшие электроотрицательности имеют галогены и благородные газы; самый низкий — из щелочных металлов (Li: 2,17, Cs: 1,97) и, что удивительно, некоторых других металлов (Zr: 2,05, Hf: 2,01, а два аномальных лантаноида даже немного ниже, чем Cs – Eu: 1,81, Yb: 1,78).
Фактически, наша термохимическая шкала имеет разумную линейную корреляцию со всеми другими шкалами (рис. 2 и дополнительная таблица 3), коэффициент корреляции Пирсона R составляет 98% для шкал Малликена и Аллена, 87% для шкал Полинга и 85% для шкал Мартынова – Бацанова. ).Для короткоживущих 6d- и 7p-элементов Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn, Nh, Fl, Mc, Lv, Ts, Og мы получили термохимические электроотрицательности из теоретических электроотрицательностей Малликена 60, 61 . Когда для этих элементов станет доступно больше данных, термохимическая электроотрицательность будет определяться напрямую. Интересно, что наклон линии корреляции составляет 1/2 для шкал Полинга и Мартынова – Бацанова, 2/3 для шкалы Аллена и 1/4 для шкалы Малликена. В периодической таблице можно увидеть ожидаемые тенденции: периодичность электроотрицательностей и их общее уменьшение сверху вниз таблицы.Наибольшие электроотрицательности имеют галогены и благородные газы; самый низкий — из щелочных металлов (Li: 2,17, Cs: 1,97) и, что удивительно, некоторых других металлов (Zr: 2,05, Hf: 2,01, а два аномальных лантаноида даже немного ниже, чем Cs – Eu: 1,81, Yb: 1,78). 2) \) (см. уравнение.2 \) представляет собой квадрат термохимической электроотрицательности между атомами A и B. Значения электроотрицательности элементов также представлены в качестве дополнительных данных 1.
2) \) (см. уравнение.2 \) представляет собой квадрат термохимической электроотрицательности между атомами A и B. Значения электроотрицательности элементов также представлены в качестве дополнительных данных 1.
(a) X наш против Pauling (в эВ 1/2 ), ( b ) X наш против Mulliken (в эВ), ( c ) X наш против Аллена (в эВ) и ( d ) X наш против Мартынова-Бацанова (в эВ 1/2 ).Линии указывают на линейную корреляцию. Легенда: металлы, пустые кружки; неметаллы, полная пл.
Электроотрицательность можно использовать в качестве критерия для различения металлов и неметаллов, но разные шкалы делают это с разной степенью успеха. Наилучшее разделение на металлы и неметаллы достигается с помощью наших весов и весов Аллена. Например, все элементы с электроотрицательностью выше 3 (по нашей шкале) — неметаллы. Почти все элементы с электроотрицательностью ниже 3 — металлы; за исключением Si (2.82), Ge (2,79), Sn (2,68, но Sn известен при нормальных условиях в аллотропах белого металлического олова и полупроводникового серого олова). Весы Полинга, Малликена и Мартынова – Бацанова тоже работают хорошо, но имеют трудности с отнесением благородных металлов и некоторых других элементов. Из нашей таблицы электроотрицательностей (рис.1) можно ожидать, что оганессон (Og, элемент # 118, принадлежащий к группе благородных газов) будет намного более реактивным, чем благородные газы: при электроотрицательности всего 2,59 ожидается быть металлом, подобным Pb (электроотрицательность 2.62). Такая низкая электроотрицательность возникает из-за релятивистских эффектов, которые особенно сильны в сверхтяжелых элементах, а неинертность Og согласуется с предположениями из литературы 63,64,65 .
Наилучшее разделение на металлы и неметаллы достигается с помощью наших весов и весов Аллена. Например, все элементы с электроотрицательностью выше 3 (по нашей шкале) — неметаллы. Почти все элементы с электроотрицательностью ниже 3 — металлы; за исключением Si (2.82), Ge (2,79), Sn (2,68, но Sn известен при нормальных условиях в аллотропах белого металлического олова и полупроводникового серого олова). Весы Полинга, Малликена и Мартынова – Бацанова тоже работают хорошо, но имеют трудности с отнесением благородных металлов и некоторых других элементов. Из нашей таблицы электроотрицательностей (рис.1) можно ожидать, что оганессон (Og, элемент # 118, принадлежащий к группе благородных газов) будет намного более реактивным, чем благородные газы: при электроотрицательности всего 2,59 ожидается быть металлом, подобным Pb (электроотрицательность 2.62). Такая низкая электроотрицательность возникает из-за релятивистских эффектов, которые особенно сильны в сверхтяжелых элементах, а неинертность Og согласуется с предположениями из литературы 63,64,65 .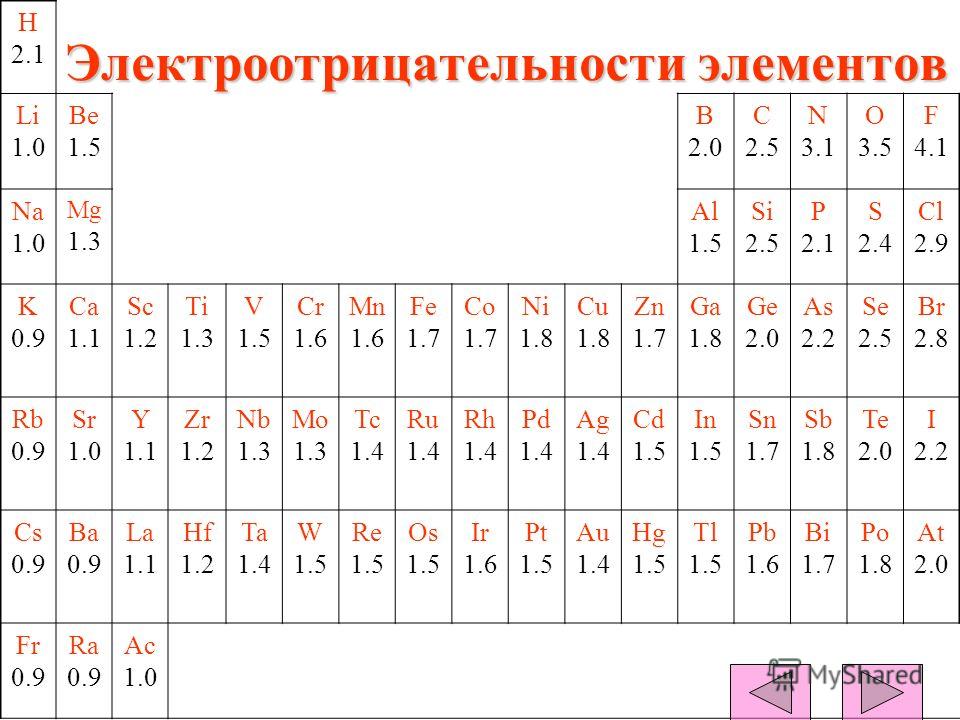 2} $$
2} $$
(3)
где k = 0.25. Эта функция была откалибрована для описания экспериментальных дипольных моментов ряда двухатомных молекул. Используя наши электроотрицательности, мы можем описать те же данные с k = 0,67 (см. Рис. 3) и достичь по крайней мере такой же точности (RMSD составляет 9,5% против 9,8%). То же самое верно и для степеней ионности, полученных из зарядов Бадера 68 (см. Дополнительную таблицу 4–6), хотя с этими зарядами разброс намного больше (среднеквадратичное отклонение составляет 25,0% для наших прогнозов против 30,1% для прогнозов, основанных на формуле Полинга) .
Рис. 3: Ионный характер двухатомных молекул. Ионный характер связи (IC) для различных соединений, рассчитанный по дипольному моменту (т. Е. Красные кружки) и зарядам Бадера для молекул (т. Е. Закрашенных ромбов) и кристаллов (т. Е. Открытых ромбов) в зависимости от разницы электроотрицательностей (наша шкала).
Мы видим, что наша шкала электроотрицательности приводит к правильной полярности связи даже там, где шкала Полинга не работает. Например, электроотрицательность по Полингу для Ru, Rh, Pd, Os, Ir, Pt, Au, W и Mo выше, чем для H и B, и можно получить отрицательные заряды на атомах металлов в их боридах и гидридах.В нашей шкале все наоборот, что согласуется с рассчитанными зарядами Бейдера: например, W +0,69 B −0,69 , Mo +0,61 B −0,61 , Au +0,14 B 2 -0,07 , Pt +0,24 H 4 -0,06 .
Существует некоторая физическая разница между нашим использованием функции (4) и функцией Полинга. В нашем случае квадрат разности электроотрицательностей в показателе степени в (4) представляет собой отношение ионного и ковалентного вкладов в энергию связи.Это должно быть более непосредственно связано со степенью ионности, чем просто вклад ионов, взятый без учета ковалентной энергии (как в версии Полинга). 2 / {{K}}} \ right)} \ right] $$
2 / {{K}}} \ right)} \ right] $$
(4)
с регулируемым параметром K = 4.56 эВ. Давайте проиллюстрируем, как наши результаты сравниваются с результатами Полинга и Матча. Используя наши электроотрицательности из рис. 1 и энергии одинарных гомоядерных связей X – X из дополнительной таблицы 2, мы оценили энергию атомизации этанола, C 2 H 5 OH, как сумму 5 связей C – H, 1 Связь C – C, 1 связь C – O и 1 связь O – H. Пренебрегая ионным членом в (2), мы получаем 31,37 эВ — при его включении получаем 34,67 эВ, что всего на 2% меньше экспериментального результата (33,94 эВ 59 ).Результаты формулы Полинга (1) и формулы Матча (4) составляют 34,32 и 33,64 эВ соответственно. Для более ионной молекулы, такой как NaCl, наша оценка энергии атомизации составляет 4,81 эВ, а прогнозы, основанные на подходах Полинга и Матча, составляют 6,58 эВ и 4,71 эВ, соответственно, для сравнения с экспериментом (4,29 эВ 59 ).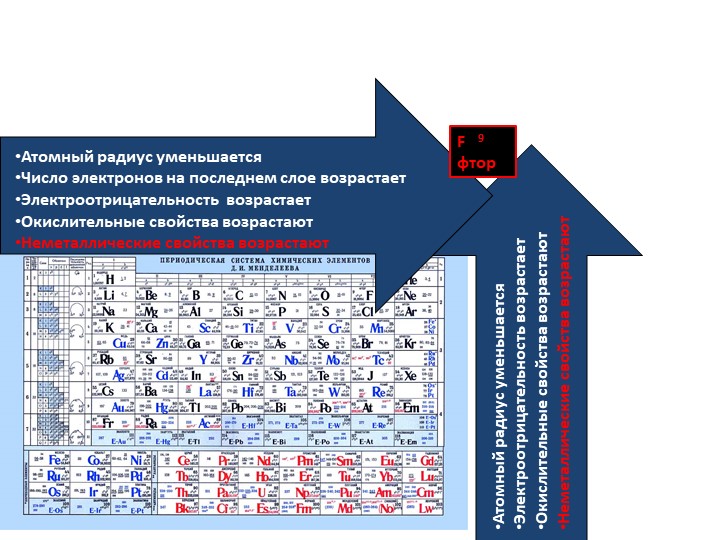 Ясно, что и Матча, и наш подход значительно улучшают подход Полинга. Мы распространили такое сравнение на набор молекул (фториды, оксиды, гидроксиды, хлориды, нитриды, гидриды, карбиды) с различной степенью ионности и сравнили их предсказанные энергии атомизации с экспериментом (см.рис.4). В целом наша шкала дает гораздо более точные прогнозы, чем шкала Полинга, а также более точна, чем подход Матча. Эти преимущества становятся больше, если посмотреть на энергии реакций, т. Е. На разницу энергий.
Ясно, что и Матча, и наш подход значительно улучшают подход Полинга. Мы распространили такое сравнение на набор молекул (фториды, оксиды, гидроксиды, хлориды, нитриды, гидриды, карбиды) с различной степенью ионности и сравнили их предсказанные энергии атомизации с экспериментом (см.рис.4). В целом наша шкала дает гораздо более точные прогнозы, чем шкала Полинга, а также более точна, чем подход Матча. Эти преимущества становятся больше, если посмотреть на энергии реакций, т. Е. На разницу энергий.
( a ) Экспериментальное против нашего, ( b ) экспериментальное против Полинга ( c ) и экспериментальное против Полинга, исправленное Матча 8 .Линии показывают идеальные результаты, среднеквадратичные отклонения от которых составляют 0,17 эВ / атом для нашего подхода, 1,21 эВ / атом для метода Полинга и 0,25 эВ / атом для теста Матча (относительные ошибки по энергиям атомизации составляют 5%, 40 , и 7% соответственно).
Тот же подход можно использовать для оценки энтальпий образования соединений. Снова взяв в качестве примера молекулу NaCl, мы прогнозируем энергию реакции ее образования в газовой фазе (Na 2 + Cl 2 = 2NaCl) как −6.31 эВ с использованием нашей шкалы электроотрицательности и -9,85 эВ по подходу Полинга и -9,42 эВ по методу Матча; ясно, что оценка, основанная на наших электроотрицательностях, намного ближе к эксперименту (-5,27 эВ из экспериментальных энергий молекул 59 ). Большое отрицательное значение указывает на то, что образование NaCl из элементов очень благоприятно.
Термохимические электроотрицательности должны позволять предсказывать направление хотя бы простых химических реакций.Известно, что электроотрицательность Полинга часто приводит к неверным предсказаниям 12 . Возьмем реакцию:
$$ 2 {\ mathrm {NaF}} + {\ mathrm {CaCl}} _ 2 = 2 {\ mathrm {NaCl}} + {\ mathrm {CaF}} _ 2 $$
(5)
Игнорируя ионный член, можно было бы обнаружить, что энтальпия этой реакции равна нулю. Электроотрицательности Полинга и формула (1) дают положительное значение +0,23 эВ, ошибочно предсказывая, что эта реакция неблагоприятна.Подход Матча дает +0,11 эВ. Наша шкала электроотрицательности и формула (2) показывают, что эта молекулярная реакция является благоприятной с энтальпией -0,45 эВ. Экспериментальное значение -0,92 эВ 59 . На рис. 5 показаны энергии очень разных обменных реакций (от реакции (3) до гидролиза Li 3 N и фторирования метана), рассчитанные с использованием электроотрицательностей и экспериментальных значений энергии молекул. Видно, что практически во всех случаях наша модель предсказывает правильный знак и разумную величину энергии реакции, в отличие от предсказаний, основанных на подходе Полинга.Наш подход также явно намного точнее, чем у Матча.
Электроотрицательности Полинга и формула (1) дают положительное значение +0,23 эВ, ошибочно предсказывая, что эта реакция неблагоприятна.Подход Матча дает +0,11 эВ. Наша шкала электроотрицательности и формула (2) показывают, что эта молекулярная реакция является благоприятной с энтальпией -0,45 эВ. Экспериментальное значение -0,92 эВ 59 . На рис. 5 показаны энергии очень разных обменных реакций (от реакции (3) до гидролиза Li 3 N и фторирования метана), рассчитанные с использованием электроотрицательностей и экспериментальных значений энергии молекул. Видно, что практически во всех случаях наша модель предсказывает правильный знак и разумную величину энергии реакции, в отличие от предсказаний, основанных на подходе Полинга.Наш подход также явно намного точнее, чем у Матча.

( a ) Экспериментальное против нашего, ( b ) экспериментальное против Полинга ( c ) и экспериментальное против Полинга, исправленное Матча 8 . Линии указывают на идеальный результат (среднеквадратичные отклонения равны 0.9 эВ для нашего подхода, 5,1 эВ для Полинга и 1,9 эВ для Матча).
Ожидается, что электроотрицательность коррелирует со многими физическими свойствами материалов — от механических (таких как твердость, см. — Ref. 69,70 ) до электронных, оптических и т. Д. Выше мы показали, насколько хорошо он различает металлы и неметаллы. . Можно ожидать, что он будет коррелировать с работой выхода, которая (как и электроотрицательность Малликена для изолированного атома) равна химическому потенциалу электрона на поверхности.Эта связь была известна до 71,72 , хотя корреляция не идеальна (см. Дополнительный рис.7): лучший коэффициент корреляции (91%) у шкалы Полинга, за ней следует шкала Малликена (83%), Мартынова-Бацанова.



 Она зависит от эффективного заряда ядра атома, который может изменяться под влиянием соседних атомов или групп атомов
Она зависит от эффективного заряда ядра атома, который может изменяться под влиянием соседних атомов или групп атомов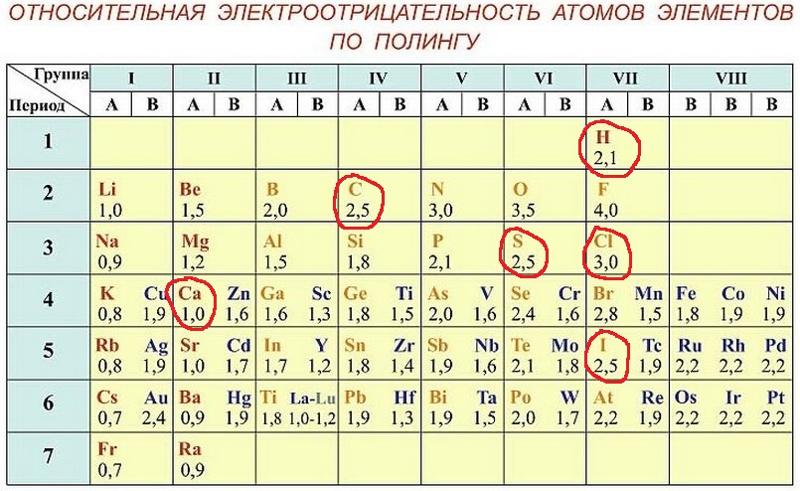 8
8 Наименьшие значения ЭО имеют s-элементы I подгруппы, наибольшие – p-элементы VII и VI групп.
Наименьшие значения ЭО имеют s-элементы I подгруппы, наибольшие – p-элементы VII и VI групп. Он рассматривает то, как различия электроотрицательности влияют на тип связи, и объясняет, что подразумевается под полярными связями и полярными молекулами.
Он рассматривает то, как различия электроотрицательности влияют на тип связи, и объясняет, что подразумевается под полярными связями и полярными молекулами. Чтобы получить такую связь, обычно А и В должны быть одним и тем же атомом. Вы найдете такую связь, например, в молекулах H 2 или Cl 2 .
Чтобы получить такую связь, обычно А и В должны быть одним и тем же атомом. Вы найдете такую связь, например, в молекулах H 2 или Cl 2 .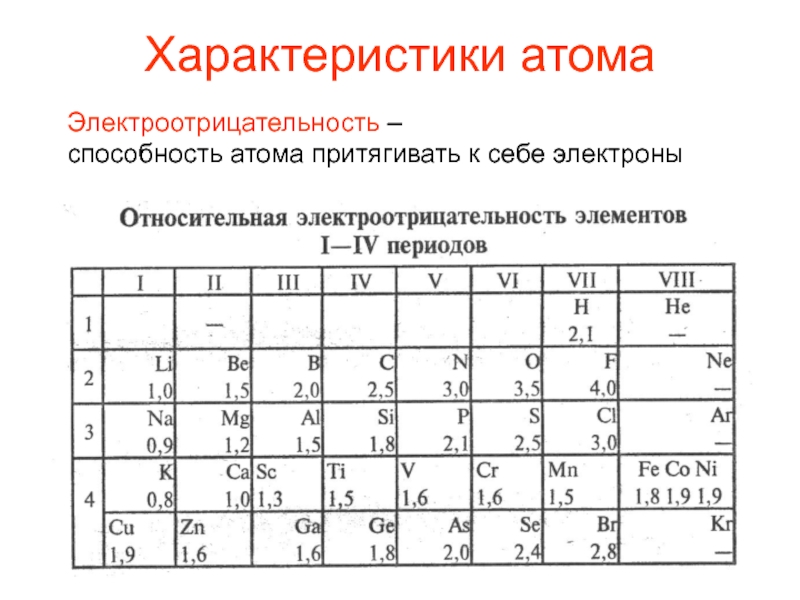 На диаграмме «» (читается как «дельта») означает «слегка», поэтому + означает «слегка положительный».
На диаграмме «» (читается как «дельта») означает «слегка», поэтому + означает «слегка положительный».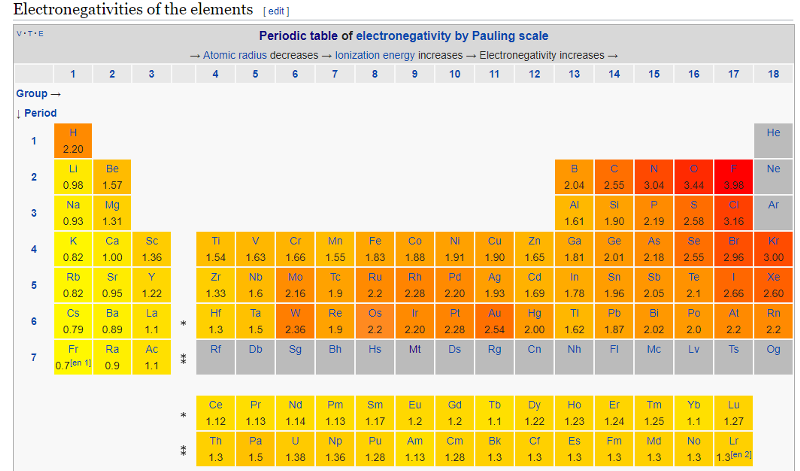 В чистой ковалентной связи электроны удерживаются в среднем ровно на полпути между атомами. В полярной связи электроны слегка притягиваются к одному концу.
В чистой ковалентной связи электроны удерживаются в среднем ровно на полпути между атомами. В полярной связи электроны слегка притягиваются к одному концу. В этом случае пара электронов не переместилась полностью на йодный конец связи. Например, йодид лития растворяется в органических растворителях, таких как этанол, а ионные вещества не растворяются.
В этом случае пара электронов не переместилась полностью на йодный конец связи. Например, йодид лития растворяется в органических растворителях, таких как этанол, а ионные вещества не растворяются.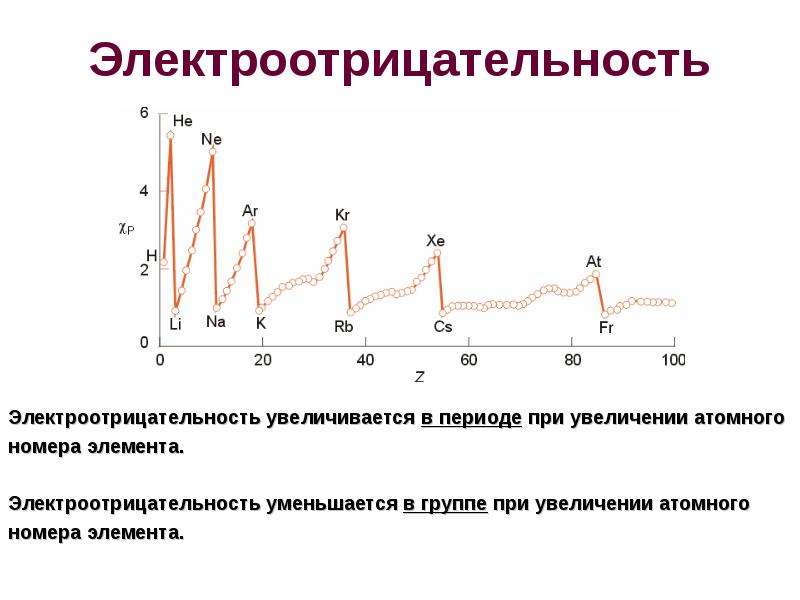 Если вы помните этот факт, все становится легко, потому что электроотрицательность всегда должна возрастать по отношению к фтору в Периодической таблице.
Если вы помните этот факт, все становится легко, потому что электроотрицательность всегда должна возрастать по отношению к фтору в Периодической таблице. (Если оно увеличивается до фтора, оно должно уменьшаться по мере снижения.) На диаграмме показаны закономерности электроотрицательности в группах 1 и 7.
(Если оно увеличивается до фтора, оно должно уменьшаться по мере снижения.) На диаграмме показаны закономерности электроотрицательности в группах 1 и 7. Представьте, что хлорид натрия связан с ковалентной связью.
Представьте, что хлорид натрия связан с ковалентной связью.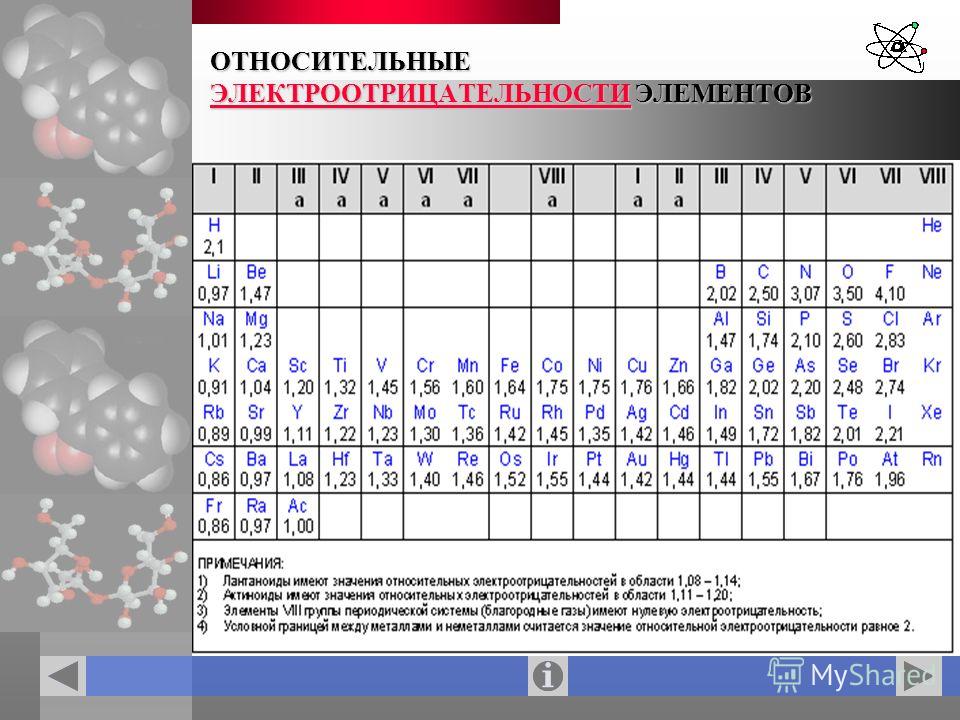 Чем ближе к ядру, тем больше притяжение.
Чем ближе к ядру, тем больше притяжение.


 )
)