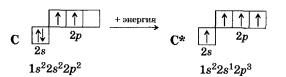
Фосфор валентность — Справочник химика 21
Фосфор Р (Is 2s 2/f 3s Зр ) по числу валентных электронов является аналогом азота. Однако как элемент 3-го периода он существенно отличается от азота — элемента 2-го периода. Это отличие состоит в том, что у фосфора больше размер атома, меньше энергия ионизации, большее сродство к электрону и большая поляризуемость атома, чем у азота. Максимальное координационное число фосфора шесть. Как и для других элементов 3-го периода, рл — рл-связывание для атома фосфора не характерно и поэтому в отличие от азота sp- и sp -гибридные состоянья орбиталей фосфора неустойчивы. Фосфор в соединениях проявляет степени окисления от —3 до +5. Наиболее характерна степень окисления +5. [c.365]Составим формулу соединения, которое состоит и. фосфора (валентность V) и кислорода (валентность II). [c.19]
В каких соединениях фосфор имеет максимальную валентность  553]
553]
Каковы валентные возможности фосфора Чем он в этом отношении отличается от своего аналога — азота [c.133]
Электронная структура атома фосфора соответствует формуле 1бР 5 25 2р Зз Зр . У фосфора валентные электроны находятся на третьем (внешнем) энергетическом уровне, на котором помимо 5- и трех р-орбиталей имеются пять свободных -орбиталей. [c.79]
Согласно другой точке зрения различие свойств фосфора и азота объясняется наличием в атоме фосфора валентных З -орбиталей, [c.365]
Объясните различие между первой энергией ионизации фосфора, Р (1063 кДж моль ) и серы, 8 (1000 кДж моль ), основываясь на сопоставлении валентных орбитальных электронных конфигураций атомов Р и 8. [c.401]
Но у фосфора, как элемента 3-го периода, роль валентных играют также З -орбитали. Поэтому наряду с общностью свойств в химии этих типических элементов V группы проявляются существенные различия.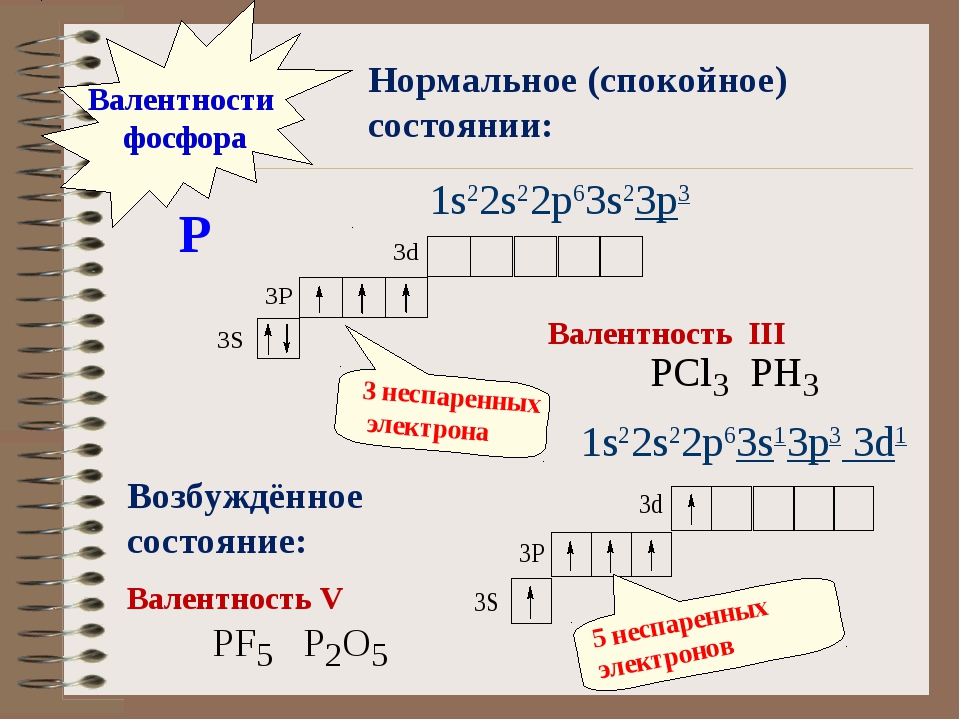
Устойчивое координационное число фосфора (V) 4, что отвечает sp -гибридизации его валентных орбиталей. Реже проявляются координационные числа 5 и 6, в этих случаях атому фосфора приписывают соответственно sp4- и вр й -гибридные состояния (стр. 415). [c.414]
Аналогичное поведение обнаруживается и у элементов группы VA, но граница между металлами и неметаллами в этой группе проходит ниже. Азот и фосфор являются неметаллами, химия их ковалентных соединений и возможные состояния окисления определяются наличием пяти валентных электронов в конфигурации Азот и фосфор чаще всего имеют степени окисления — 3, -Ь 3 и +5. Мыщьяк As и сурьма Sb-семи-металлы, образующие амфотерные оксиды, и только висмут обладает металлическими свойствами.
Менделеев выполнял свою диссертационную работу в Германии, в Гейдельберге, как раз во время Международного химического конгресса в Карлсруэ. Он присутствовал на конгрессе и слышал речь Канниццаро, в которой тот четко изложил свою точку зрения на проблему атомного веса. Вернувшись в Россию, Менделеев приступил к изучению списка элементов и обратил внимание на периодичность изменения валентности у элементов, расположенных в порядке возрастания атомных весов валентность водорода 1, лития I, бериллия 2, бора 3, углерода 4, магния 2, азота 3, серы 2, фтора 1, натрия 1, алюминия 3, кремния 4, фосфора 3, к1 слорода 2, хлора I и т.
Фосфор по числу валентных электронов (35 3р ) является аналогом азота [c.407]
Атомы кислорода соединяются не менее чем с двумя различными атомами. Так же ведут себя кальций, сера, магний и барий. У этих элементов валентность два, У азота, фосфора, алюминия и золота валентность три. Железо может иметь валентность два или три. В принципе вопрос о валентности оказался не столь простым, каким представлялось вначале, но даже такой простейший вариант этой теории позволил сделать важные выводы.
При переходе от лития к фтору Г происходит закономерное ослабление металлических свойств и усиление неметаллических с одновременным увеличением валентности. Переход от фтора Г к следующему по значению атомной массы элементу натрию Ыа сопровождается скачкообразным изменением свойств и валентности, причем натрий во многом повторяет свойства лития, будучи типичным одновалентным металлом, хотя и более активным.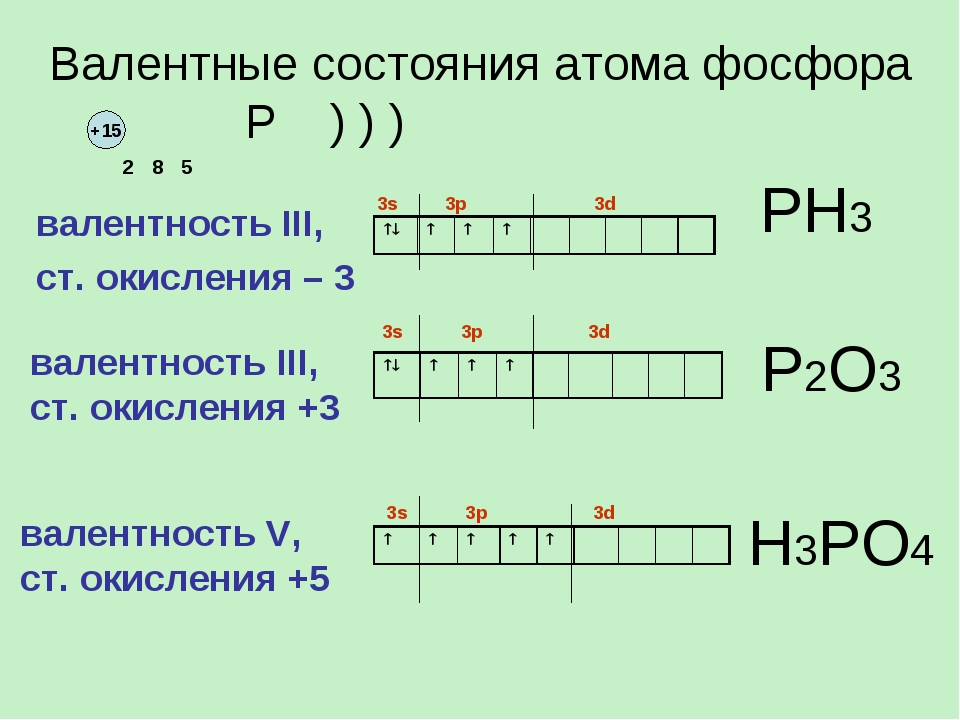 Следующий за натрием магний во многом сходен с бериллием Ве (оба двухвалентны, проявляют металлические свойства, но химическая активность обоих выражена слабее, чем у пары Ы — Ыа). Алюминий А1, следующий за магнием, напоминает бор В (валентность равна 3). Как близкие родственники похожи друг на друга кремний 81 и углерод С, фосфор Р и азот Ы, сера 8 и кислород О, хлор С1 и фтор Г. При переходе к следующему за хлором в последовательности увеличения атомной массы элементу калию К опять происходит скачок в изменении валентности и химических свойств. Калий, подобно литию и натрию, открывает ряд элементов (третий по счету), представители которого показывают глубокую аналогию с элементами первых двух рядов. [c.20]
Следующий за натрием магний во многом сходен с бериллием Ве (оба двухвалентны, проявляют металлические свойства, но химическая активность обоих выражена слабее, чем у пары Ы — Ыа). Алюминий А1, следующий за магнием, напоминает бор В (валентность равна 3). Как близкие родственники похожи друг на друга кремний 81 и углерод С, фосфор Р и азот Ы, сера 8 и кислород О, хлор С1 и фтор Г. При переходе к следующему за хлором в последовательности увеличения атомной массы элементу калию К опять происходит скачок в изменении валентности и химических свойств. Калий, подобно литию и натрию, открывает ряд элементов (третий по счету), представители которого показывают глубокую аналогию с элементами первых двух рядов. [c.20]
Эффективность присадки зависит от валентного состояния и положения элементов в молекуле присадки, наличия функциональных групп, их синергизма и других факторов. Применение фосфор-, серу-, кислород- и азотсодержащих соединений в качестве присадок к смазочным маслам тесно связано с особенностью электронной структуры этих элементов.
 Взаимодействие их с металлической поверхностью деталей двигателя приводит к модифицированию последней (изменению структуры) и за счет образования защитных пленок обеспечиваются противокоррозионные, противоизносные и противозадирные свойства указанных соединений в растворе масел. Кроме того, присадки, содержащие эти элементы, стабилизируют масло, обрывая цепь окисления по реакции с пер-оксидными радикалами и разрушая гидропероксиды.
Взаимодействие их с металлической поверхностью деталей двигателя приводит к модифицированию последней (изменению структуры) и за счет образования защитных пленок обеспечиваются противокоррозионные, противоизносные и противозадирные свойства указанных соединений в растворе масел. Кроме того, присадки, содержащие эти элементы, стабилизируют масло, обрывая цепь окисления по реакции с пер-оксидными радикалами и разрушая гидропероксиды. Галоидирование. Катализаторы, наиболее часто применяющиеся для хлорирования металлическое железо, окись меди, бром, сера, иод, галоиды железа, сурьмы, олова, мышьяка, фосфора, алюминия и меди растительный и животный уголь, активированный боксит и другие глины. Большинство этих катализаторов является носителями галоидов. Так, Fe, Sb и Р в галоидных соединениях способны существовать в двух валентных состояниях в присутствии свободного хлора они поочередно присоединяют и отдают хлор в активной форме. Аналогично иод, бром и сера образуют с хлором неустойчивые соединения. Катализаторы броми-рования подобны катализаторам хлорирования. Для иодирования наилучшим ускорителем служит фосфор. Для проведения процесса фторирования катализатор не требуется. В присутствии кислорода галоидирование замедляется. [c.329]
Катализаторы броми-рования подобны катализаторам хлорирования. Для иодирования наилучшим ускорителем служит фосфор. Для проведения процесса фторирования катализатор не требуется. В присутствии кислорода галоидирование замедляется. [c.329]
Каталитическое хлорирование основано на применении переносчика хлора, такого как йод [2], сера [3], фосфор, сурьма и другие, в виде соответствующих хлоридов, которые растворяются в хлорируемом углеводороде или прн хлорировании газообразных парафиновых углеводородов — в растворителе. Применяются исключительно элементы, имеющие по крайней мере два значения валентности. В качестве гомогенных катализаторов могут также применяться вещества, образующие радикалы, как, например, диазо-метап, тетраэтилсвинец и гексафенилэтан [4]. Они обладают способностью разделять молекулу хлора на атомы, которые тотчас ке вызывают возникновение цепной реакции. [c.113]
Когда элемент образует несколько рядов соединений, соответствующих различным степеням окисления, после названия соединения в скобках дается указание либо на валентность катиона (римской цифрой), либо на число атомов галогена, кислорода, серы или кислотного остатка в молекуле соединения (прописью).
Проводимость таких веществ, как кремний и германий, можно повысить, вводя в них небольшое количество определенных примесей. Например, введение в кристаллы кремния примесей бора или фосфора приводит к эффективному сужению межзонной щели. Небольшие количества бора или фосфора (несколько миллионных долей) удается включить в структуру кремния при выращивании кристалла. Атом фосфора имеет пять валентных электронов, и поэтому, после того как четыре из них используют- [c.631]
Фосфор, мышьяк, сурьма и висмут образуют стехиометрические соединения, отвечающие формальной валентности, только с s-элементами и d-элементами подгруппы цинка.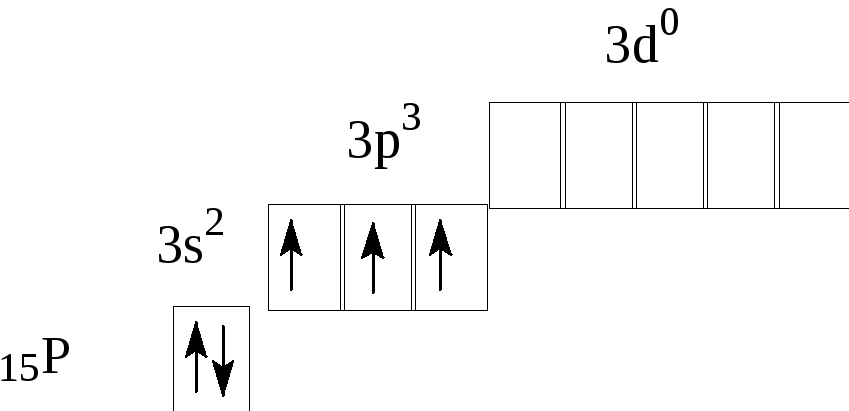 [c.342]
[c.342]
То, что краситель и адсорбент составляют единую квантовую систему, видно из многих фактов. Самый наглядный из них состоит в том, что поглощение радиации любой, например самой малой, частоты в пределах полосы поглощения данного фосфора вызывает испускание всего его спектра излучения, в том числе и значительно больших частот, чем частот поглощенного света. Значит, кванты излучения поступают в общее пользование, причем энергия, недостаточная для излучения частот, которые превышают малую частоту поглощенного света, также поступает за счет общих ресурсов твердого тела. Не допускает иных толкований также тот факт, что хотя краситель, несомненно, находится только на поверхности, поглощение света характерных для него длинных волн (для которых кристалл, адсорбирующий данный краситель, практически прозрачен) сопровождается образованием металлического серебра в объеме кристалла бромида серебра. При этом чувствительность бромида серебра тем дальше сдвигается в сторону длинных волн, чем длиннее цепь сопряженных связей в структуре молекулы красителя (рис.
Фосфор, Р, имеет валентную конфигурацию Зх Зр , а сера, 8, обладает валентной конфигурацией Зх Зр . У атома Р, таким образом, имеется полузаполненная Зр-оболочка, тогда как у атома 8 дополнительный электрон вынужден спариваться с одним из уже имеющихся на Зр-орбиталях электроном [c.401]
СЯ для образования ковалентных связей в кристаллической структуре кремния, у фосфора остается еще один электрон. При наложении на кристалл электрического поля этот электрон может смещаться в сторону от атома фосфора поэтому говорят, что фосфор является донором электронов в кристалле кремния. Для высвобождения донируемых электронов требуется лищь 1,05 кДж моль эта энергия превращает кристалл кремния с небольшой примесью фосфора в проводник. При введении в кристалл кремния примеси бора возникает противоположное явление. Атому бора недостает одного электрона для построения необходимого числа ковалентных связей в кристалле кремния. Поэтому на каждый атом бора в кристалле кремния приходится одна вакансия на связывающей орбитали. На эти вакантные орбитали, связанные с атомами бора, могут быть возбуждены валентные электроны кремния, что дает возможность электронам свободно перемещаться по кристаллу. Подобная проводимость осуществляется в результате того, что на вакантную орбиталь атома бора перескакивает электрон соседнего атома кремния. Вновь образовавшаяся вакансия на орбитали атома кремния тут же заполняется электроном со следующего за ним другого атома кремния. Возникает каскадный эффект, при котором электроны перескакивают от одного атома к следующему. Физики предпочитают описывать это явление как движение положительно заряженной дырки в противоположном направлении. Но независимо от того, как описывается это явление, твердо установлено, что для активации проводимости такого вещества, как кремний, требуется меньше энергии, если в кристалле содержится небольшое количество донора электронов типа фосфора либо акцептора электронов типа бора.
При введении в кристалл кремния примеси бора возникает противоположное явление. Атому бора недостает одного электрона для построения необходимого числа ковалентных связей в кристалле кремния. Поэтому на каждый атом бора в кристалле кремния приходится одна вакансия на связывающей орбитали. На эти вакантные орбитали, связанные с атомами бора, могут быть возбуждены валентные электроны кремния, что дает возможность электронам свободно перемещаться по кристаллу. Подобная проводимость осуществляется в результате того, что на вакантную орбиталь атома бора перескакивает электрон соседнего атома кремния. Вновь образовавшаяся вакансия на орбитали атома кремния тут же заполняется электроном со следующего за ним другого атома кремния. Возникает каскадный эффект, при котором электроны перескакивают от одного атома к следующему. Физики предпочитают описывать это явление как движение положительно заряженной дырки в противоположном направлении. Но независимо от того, как описывается это явление, твердо установлено, что для активации проводимости такого вещества, как кремний, требуется меньше энергии, если в кристалле содержится небольшое количество донора электронов типа фосфора либо акцептора электронов типа бора. [c.632]
[c.632]
Белый фосфор состоит из тетраэдрических молекул Р4, схематически изображенных на рис. 21.25. Как было отмечено в разд. 8.7, ч. 1, валентные углы по 60″, как в молекуле Р4, довольно редко встречаются в других молекулах. Они свидетельствуют о наличии очень напряженных связей, что согласуется с высокой реакционной способ- [c.321]
Хотя фосфор является электронным аналогом азота, но наличие в валентном мектронном слое атома свободных /-орбиталей делает соединения фосфора не похожими на соединения азота. [c.414]
Электронная структура фосфорорганических соединений и природа химических связей энергии и длины связей фосфора валентные углы образование связей с участием Зй-орб италей . [c.63]
В еще большей мере ароматические свойства присущи фосфо-риновому кольцу. 2,4,6-Трифенилфосфорнн не аутоокисляется и не кватернизуется при действии иодистого метила или борофторида триэтилоксония . В то же время взаимодействие его с нуклеофильными реагентами — алкил- или ариллитиевыми соединениями, легко протекает в бензоле уже при комнатной температуре» . При этом атака происходит по фосфору, валентная оболочка которого расширяется до децета, и возникает стабилизованный резонансом фосфо-рин-анион (1). Образование аниона (I) доказано при помощи ПМР и УФ-спектров. Гидролиз реакционной смеси, имеющей глубокую сине-фиолетовую окраску, приводит к 1-алкил(арил)-2,4,6-три- [c.628]
В то же время взаимодействие его с нуклеофильными реагентами — алкил- или ариллитиевыми соединениями, легко протекает в бензоле уже при комнатной температуре» . При этом атака происходит по фосфору, валентная оболочка которого расширяется до децета, и возникает стабилизованный резонансом фосфо-рин-анион (1). Образование аниона (I) доказано при помощи ПМР и УФ-спектров. Гидролиз реакционной смеси, имеющей глубокую сине-фиолетовую окраску, приводит к 1-алкил(арил)-2,4,6-три- [c.628]
Приготовление силикатных фосфоров. Химический состав фосфоров, структура фосфоров, валентность Мп. Существует значительное число различных методик приготовления кристаллофосфоров на силикатной основе. В качестве примера мы приведём одну из них [270]. Хорошо очищенный аммиачный раствор окиси цинка, водный раствор азотнокислого марганца н спиртовой раствор кремниевой кислоты (этилсиликат) сливают вместе при этом образуется гель. Гель высушивается, растирается и прокаливается до 1200° С в кварцевых сосудах и после прокаливания быстро охлаждается. При малом содержании Мп прокаливание монгно вести в воздухе при больпюм содержании Мп, во избежание его окисления, прокаливание ведётся в атмосфере углекислоты. [c.411]
При малом содержании Мп прокаливание монгно вести в воздухе при больпюм содержании Мп, во избежание его окисления, прокаливание ведётся в атмосфере углекислоты. [c.411]
Каталитическое окисление нефтяных остатков. Имеется множество попыток ускорить процесс окисления сырья, повысить качество или придать определенные свойства окисленному битуму с помощью различных катализаторов и инициаторов. В качестве катализаторов окислительногвосстановительных реакций предложено применять соли соляной кислоты и металлов переменной валентности (железа, меди, олова, титана и др.). В качестве катализаторов дегидратации, алкилирования и крекинга (перенос протонов) предложены хлориды алюминия, железа, олова, пятиокись фосфора в качестве инициаторов окисления — перекиси. Большинство из этих катализаторов инициирует реакции уплотнения молекул сырья (масел и смол) в асфальтены, не обогащая битумы кислородом. Возможности ускорения процесса окисления сырья и улучшения свойств битума (в основном в направлении повышения пенетрации при данной температуре размягчения), приводимые в многочисленной патентной литературе, обобщены в [63], но, поскольку авторы патентов делают свои предложения, не раскрывая химизма процесса, их выводы в настоящей монографии не рассматриваются. Исследования А. Хойберга [64, 65] [c.141]
Исследования А. Хойберга [64, 65] [c.141]
В большинстве случаев галоидирование ускоряется под действием светового облучения (длина волны 3000—5000 А) или высокой температуры (в присутствии катализатора или без него). В качестве катализаторов обычно применяют галоидные соединения металлов, имеющих два валентных состояния, способные отдавать атомы галоидов при переходе из одного валентного состояния в другое, — P I5, P I3, Fe lg. Используют также хлористую сурьму или хлористый марганец, а также неметаллические катализаторы — иод, бром или фосфор. [c.259]
Литий и натрий имеют умеренное сродство к электрону сродство к электрону бериллия отрицательно, а у магния оно близко к нулю. В атомах Ве и М валентная х-орбиталь полностью заполнена и присоединяемый электрон должен заселять расположенную выше по энергии р-орбиталь. Азот и фосфор имеют небольшое сродство к электрону, потому что присоединяемый электрон должен спариваться в этих атомах с одним из электронов на полузаполненнь х р-орбиталях. [c.400]
[c.400]
Атомы элементов третьего и следующих периодов часто не подчиняются правилу октета. Некоторые из них обнаруживают поразительную способность связываться с большим числом атомов (т. е. окружаться больщим числом электронных пар), чем предсказывает правило октета. Например, фосфор и сера образуют соединения PF5 и SF соответственно. В льюисовых структурах этих соединений все валентные электроны тяжелого элемента используются им для образования связей с другими атомами [c.475]
В этих схемах полной стрелкой показано положение координационной связи. Фигурирующие здесь донорные элементы (сера, -мышьяк и азот), а также селен, фосфор и другие не образуют соединений, обладающих свойства.ми каталитических ядов, если они находятся в состоянии наивысшей валентности, поскольку в этом случае молекулы не обладают парами свободных электронов. То же справедливо для ионов этих элементов. Например, сульфит-ион является ядом, в то время как сульфат-ион им не является [c.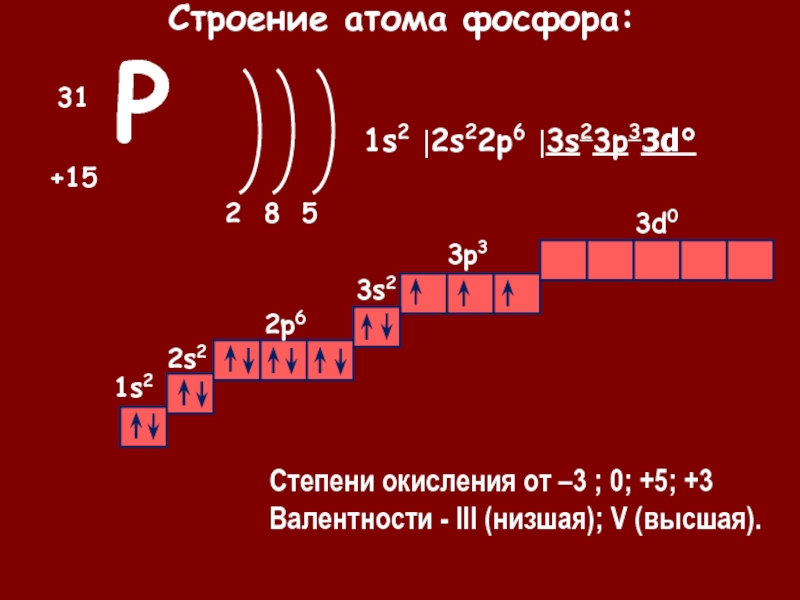 50]
50]
Числом электронов наружной оболочки определяются валентные состояния, свойственные данному элементу, а следовательно, типы его соединений — гидридов, окислов, гидроокисей, солей и т. д. Так, в наружных оболочках атомов фосфора, мышьяка, сурьмы и висмута находится одинаковое число (пять) электронов. Этим определяется одинаковость их основных валентных состояний (—3, -fЗ, -Ь5), однотипность гидридов ЭНз, окислов Э2О3 и ЭаОб, гидроокисей и т. д. Данное обстоятельство в конечном счете и является причиной того, что указанные элементы располагаются в одной подгруппе периодической системы. [c.42]
Таким образом, число непарных электронов в атомах бериллия, бора и углерода, находящихся в возбужденном состоянии, соответствует фактической валентности этих элементов. Что же касается атомов азота, кислорода и фтора, то возбуждение их не может привести к увеличению чис.г а неиарных электронов во втором уровне их электронных оболочек. Однако у аналогов этих элементов — фосфора, серы и хлора,— поскольку на третьем уровне их [c. 45]
45]
Число непарных электронов в атоме фосфора прн возбуждении достигает пяти, что соответствует его фактической максимальной палентности. При возбуждении атома серы число непарных электронов увеличивается до четырех и даже до [иести, а у атома хлора— до трех, пяти и, максимально, до семи, что также соответствует фактическим значениям проявляемой ими валентности. Подобным же образом ведут себя при возбул[c.46]
Пентахлорид фосфора в твердом состоянии имеет одну модификацию с ионной решеткой, состоящей из ионов РС и РС1 . Напишите льюисовы (валентные) структуры этих ионов и предскажите их геометрическое строение. Какая гибридизация орбиталей используется атомом фосфора в каждом из этих ионов для образования связей с атомами хлора Почему РС15 в твердом состоянии существует в виде ионного соединения, тогда как в газовой фазе его устойчивой формой являются нейтральные мо.пекулы [c.334]
Кристалл — Проводимость металлов
Металлы обладают высокой плотностью электронов проводимости. В Атом алюминия имеет три валентных электрона в частично заполненной внешней оболочке. В металлическом алюминии три валентных электрона на атом становятся электронами проводимости. Число электронов проводимости постоянно, не зависит ни от температуры, ни от примесей. Металлы проводят электричество при всех температурах, но для большинства металлов проводимость лучше всего при низких температурах.Двухвалентные атомы, такие как магний или кальций, отдают оба валентных электрона, чтобы стать электронами проводимости, в то время как одновалентные атомы, такие как литий или золото, отдают один. Как мы помним, количество электронов проводимости само по себе не определяет проводимость; это также зависит от подвижности электронов. Серебро, имеющее только один электрон проводимости на атом, является лучшим проводником, чем алюминий с тремя, поскольку более высокая подвижность серебра компенсирует его меньшее количество электронов.
В Атом алюминия имеет три валентных электрона в частично заполненной внешней оболочке. В металлическом алюминии три валентных электрона на атом становятся электронами проводимости. Число электронов проводимости постоянно, не зависит ни от температуры, ни от примесей. Металлы проводят электричество при всех температурах, но для большинства металлов проводимость лучше всего при низких температурах.Двухвалентные атомы, такие как магний или кальций, отдают оба валентных электрона, чтобы стать электронами проводимости, в то время как одновалентные атомы, такие как литий или золото, отдают один. Как мы помним, количество электронов проводимости само по себе не определяет проводимость; это также зависит от подвижности электронов. Серебро, имеющее только один электрон проводимости на атом, является лучшим проводником, чем алюминий с тремя, поскольку более высокая подвижность серебра компенсирует его меньшее количество электронов.
В таких металлах, как натрий и алюминий, атомы отдают все свои валентные электроны зоне проводимости. Образующиеся ионы имеют небольшие размеры, занимая всего 10–15% от объема кристалла. Электроны проводимостисвободно перемещаться по оставшемуся пространству. Простая модель, которая часто хорошо описывает свойства электронов проводимости, рассматривает их как взаимодействующие ни с ионами, ни друг с другом. Электроны аппроксимируются как свободные частицы, легко блуждающие по кристаллу. Эту концепцию впервые предложил немецкий ученый.Арнольд Иоганнес Вильгельм Зоммерфельд . Он хорошо работает с металлами, известными какпростые металлы , электроны проводимости которых поступают от s p -оболочек, например алюминий, магний, кальций, цинк и свинец. Их называют простыми, потому что они точно описываются простой теорией Зоммерфельда.
Образующиеся ионы имеют небольшие размеры, занимая всего 10–15% от объема кристалла. Электроны проводимостисвободно перемещаться по оставшемуся пространству. Простая модель, которая часто хорошо описывает свойства электронов проводимости, рассматривает их как взаимодействующие ни с ионами, ни друг с другом. Электроны аппроксимируются как свободные частицы, легко блуждающие по кристаллу. Эту концепцию впервые предложил немецкий ученый.Арнольд Иоганнес Вильгельм Зоммерфельд . Он хорошо работает с металлами, известными какпростые металлы , электроны проводимости которых поступают от s p -оболочек, например алюминий, магний, кальций, цинк и свинец. Их называют простыми, потому что они точно описываются простой теорией Зоммерфельда.
В переходные металлы находятся в трех строках периодической таблицы: первая строка состоит из скандия через никель, вторая строка — от иттрия до палладия, а третья строка — от лантана и гафния до платины. Внутри этих строк по мере увеличения атомного номера электроны заполняют d- состояния внешней оболочки атома.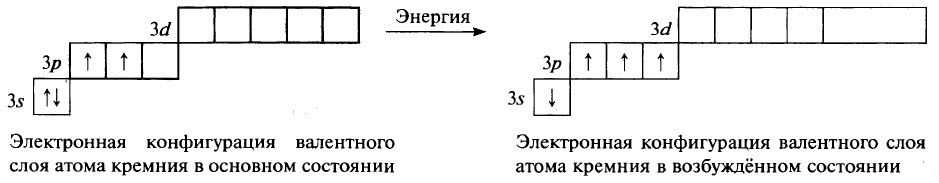 В кристаллической форме атомы переходных металлов представляют собой металлы с интересными свойствами. В д -электронов более тесно связаны с ионным центром , чем сек р -электронов. В то время как s p -валентные электроны становятся электронами проводимости, которые свободно перемещаются через кристалл, d-электроны стремятся оставаться локализованными рядом с ионом. Соседние ионы могут ковалентно связывать d -электроны. В большинстве случаев эти d -состояния заполнены лишь частично. Электроны в этих d- состояниях могут проводить так же, как и в s p -состояниях, но движение электронов в d- состояниях плохо аппроксимируется моделью свободных частиц Зоммерфельда. Вместо этого электроны перемещаются от иона к иону через общие ковалентные связи d-электронов . У этих металлов одни электроны проводимости передаются из s p -состояний, а другие — из d.-состояния; следовательно, одни электроны свободно движутся согласно модели Зоммерфельда, а другие движутся через связи.
В кристаллической форме атомы переходных металлов представляют собой металлы с интересными свойствами. В д -электронов более тесно связаны с ионным центром , чем сек р -электронов. В то время как s p -валентные электроны становятся электронами проводимости, которые свободно перемещаются через кристалл, d-электроны стремятся оставаться локализованными рядом с ионом. Соседние ионы могут ковалентно связывать d -электроны. В большинстве случаев эти d -состояния заполнены лишь частично. Электроны в этих d- состояниях могут проводить так же, как и в s p -состояниях, но движение электронов в d- состояниях плохо аппроксимируется моделью свободных частиц Зоммерфельда. Вместо этого электроны перемещаются от иона к иону через общие ковалентные связи d-электронов . У этих металлов одни электроны проводимости передаются из s p -состояний, а другие — из d.-состояния; следовательно, одни электроны свободно движутся согласно модели Зоммерфельда, а другие движутся через связи.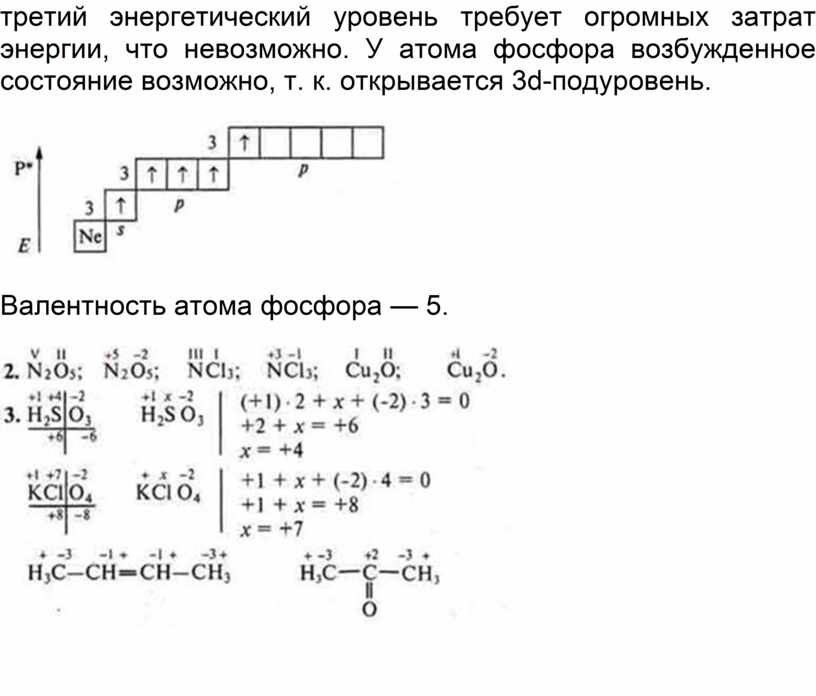 Каждый электрон переключается между этими двумя режимами проводимости, что приводит к довольно сложному движению электронов.
Каждый электрон переключается между этими двумя режимами проводимости, что приводит к довольно сложному движению электронов.
Приложенное напряжение заставляет электроны металлов ускоряться и вносить вклад в электрический ток. Электроны иногда рассеиваются на дефектах кристалла, и скорость рассеяния определяет подвижность. Электроны не рассеиваются на ионах в кристалле, которые расположены в ожидаемом месте кристаллической решетки. Электроны движутся, чтобы приспособиться к ионам хозяина, а не рассеиваться от них. Однако, если ион отсутствует, неправильно размещен или принадлежит к другому виду, электрон будет рассеиваться от этого дефекта.. Ионы колеблются вокруг узла своей решетки, причем амплитуда колебаний увеличивается с температурой. Вибрация может вызвать смещение иона из своего кристаллического узла, создавая дефект, от которого будет рассеиваться электрон. Сопротивление металлов увеличивается при высокой температуре из-за увеличения колебаний ионов в кристалле и, как следствие, увеличения рассеяния.
Полупроводники обладают промежуточными проводящими свойствами по сравнению с изоляторами и металлами. В некоторых случаях полупроводники являются изоляторами, а в других — металлами. Полупроводники разделяют с изоляторами то свойство, что у них нет электронов проводимости в идеальном кристалле без тепловых флуктуаций. Электроны проводимости создаются электронами от примесей или тепловыми колебаниями электронов от атомных оболочек. Важное различие между изоляторами и полупроводниками заключается в природеловушки . Ловушка — это локальное энергетическое состояние электрона на дефекте. Хотя ловушки в изоляторах прочно связывают электроны проводимости, ловушки в полупроводниках только слабо связывают электроны. Захваченный электрон проводимости в полупроводникеможет быть отброшен обратно в зону проводимости из-за тепловых флуктуаций. При комнатной температуре большинство лишних электронов находится в зоне проводимости, а не в ловушках. Неспособность ловушек удерживать электроны — главное отличие полупроводников от изоляторов. Полупроводник при комнатной температуре имеет достаточное количество электронов проводимости для обеспечения хорошей электропроводности. Поскольку подвижность электронов во многих полупроводниках исключительно высока, даже небольшого количества электронов проводимости обычно достаточно для обеспечения высокой проводимости.
Полупроводник при комнатной температуре имеет достаточное количество электронов проводимости для обеспечения хорошей электропроводности. Поскольку подвижность электронов во многих полупроводниках исключительно высока, даже небольшого количества электронов проводимости обычно достаточно для обеспечения высокой проводимости.
Фосфор имеет пять валентных электронов, ау кремния их четыре. Когда атом фосфора заменяет атом в кристаллической решетке кремния, четыре из пяти его валентных электронов входят в ковалентные связи. Пятый лишний, сидит в мелкой ловушке вокруг участка фосфора. Однако он легко возбуждается в зону проводимости за счет тепловых флуктуаций. При комнатной температуре на каждую примесь фосфора приходится почти один электрон проводимости в кремнии. Контролируя количество примесей, можно контролировать проводимость кремния. Другие замещающие атомы, такие как мышьяк и сурьма, также служат донорами электронов в зоне проводимости кремния.
Если достаточное количество электронов проводимости добавляется к полупроводнику посредством введения примесей, электрические свойства становятся металлическими.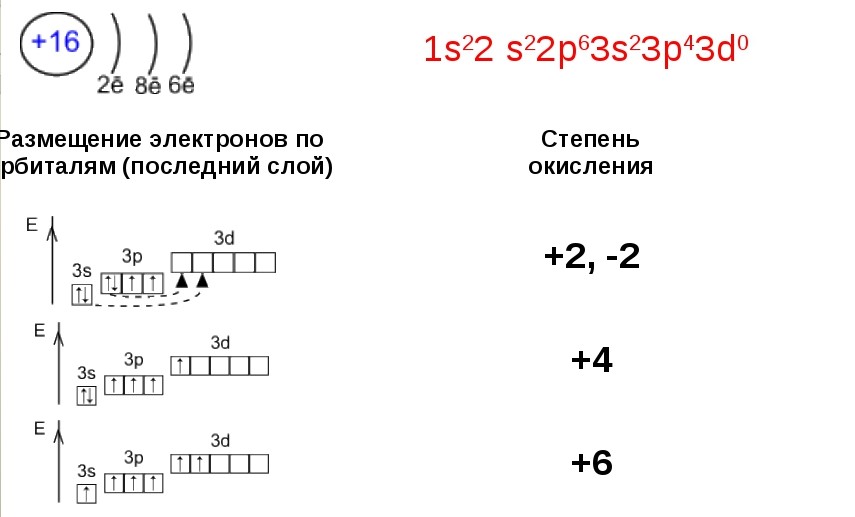 Eстькритическая концентрация примеси N c , которая зависит от типа примеси. При концентрациях примесей меньше критического количества N c электроны проводимости становятся связанными в ловушках при чрезвычайно низких температурах, и полупроводник становится изолятором. При концентрации примесей выше N c электроны проводимости не связываются в ловушках при низких температурах, и полупроводник проявляет металлическую проводимость. Для примесей фосфора в кремнии N c = 2 · 10 18примесей на кубический сантиметр. Хотя это число кажется большим, оно составляет примерно один атом фосфора на каждые 100 000 атомов кремния. В процентном отношении небольшое количество атомов фосфора превратит кремний из изолятора в металлический проводник. Другие полупроводники обладают аналогичными свойствами. ВВ арсениде галлия критическая концентрация примесей для металлической проводимости в 100 раз меньше, чем в кремнии.
Eстькритическая концентрация примеси N c , которая зависит от типа примеси. При концентрациях примесей меньше критического количества N c электроны проводимости становятся связанными в ловушках при чрезвычайно низких температурах, и полупроводник становится изолятором. При концентрации примесей выше N c электроны проводимости не связываются в ловушках при низких температурах, и полупроводник проявляет металлическую проводимость. Для примесей фосфора в кремнии N c = 2 · 10 18примесей на кубический сантиметр. Хотя это число кажется большим, оно составляет примерно один атом фосфора на каждые 100 000 атомов кремния. В процентном отношении небольшое количество атомов фосфора превратит кремний из изолятора в металлический проводник. Другие полупроводники обладают аналогичными свойствами. ВВ арсениде галлия критическая концентрация примесей для металлической проводимости в 100 раз меньше, чем в кремнии.
Атомы галлия , как и атомы фосфора, могут использоваться в качестве примесей замещения в кремнии. Каждый атом вносит три электрона в ковалентные связи. Поскольку четыре электрона необходимы для завершения тетраэдрической структуры, один электрон отсутствует на каждый атом галлия в полном наборе ковалентных связей. Отсутствующий электрон называетсядыра . Дырки могут перемещаться по кристаллу аналогично движению ионных вакансий, за исключением того, что в этом случае есть электронная вакансия . Электрон из соседней ковалентной связи может перепрыгнуть и заполнить пустое электронное состояние, тем самым перемещая дырку в соседнюю связь. Дырка дает положительный заряд, так как это отсутствие электрона. Подвижность дырок под действием внешнего напряжения почти равна подвижности электронов проводимости. Полупроводник может иметь высокую плотность примесей, которые вызывают дырки, и их движение создает высокую электропроводность. АПолупроводник p- типа — полупроводник с преобладанием дырок; анВ полупроводнике n- типа преобладают электроны проводимости. Символы р и п приходит от знака заряда частиц: р ositive для дырок и п egative для электронов.
Символы р и п приходит от знака заряда частиц: р ositive для дырок и п egative для электронов.
Тепловые колебания могут вывести электрон из ковалентной связи, что сделает его электроном проводимости. Связь остается с отсутствующим электроном, который представляет собой дырку. Таким образом, тепловые колебания вызываютэлектронно-дырочные пары . Обычно электрон и дырка разделяются в пространстве, и каждая удаляется. Швейцарско-американский ученый Грегори Хью Ванье впервые предположил, что электрон и дырка могут слабо связываться друг с другом. Это связанное состояние, называемоеЭкситон Ванье существует; дырка имеет положительный заряд, электрон имеет отрицательный заряд, а противоположности притягиваются. Экситон легко наблюдается в экспериментах с электромагнитным излучением . Он живет очень короткое время — от наносекунды до микросекунды — в зависимости от полупроводника. Короткое время жизни связано с тем, что электрон предпочитает повторно входить в состояние ковалентной связи, тем самым устраняя как дырку, так и электрон проводимости. Этотрекомбинация электрона и дырки легко осуществляется из экситонного состояния, поскольку две частицы пространственно близки. Если электрон и дырка покидают экситонное состояние в результате тепловых колебаний, они удаляются друг от друга. В этом случае рекомбинация менее вероятна, поскольку она происходит только тогда, когда блуждающие частицы снова проходят близко друг к другу. Рекомбинация также может происходить на дефектных участках. Сначала одна частица связывается с дефектом, а затем вторая частица. Вэлектрон и дырка снова близки друг к другу, и электрон может повторно занять ковалентную связь.
Этотрекомбинация электрона и дырки легко осуществляется из экситонного состояния, поскольку две частицы пространственно близки. Если электрон и дырка покидают экситонное состояние в результате тепловых колебаний, они удаляются друг от друга. В этом случае рекомбинация менее вероятна, поскольку она происходит только тогда, когда блуждающие частицы снова проходят близко друг к другу. Рекомбинация также может происходить на дефектных участках. Сначала одна частица связывается с дефектом, а затем вторая частица. Вэлектрон и дырка снова близки друг к другу, и электрон может повторно занять ковалентную связь.
Как и в случае с металлами, подвижность электронов в полупроводниках ограниченарассеяние электронов . Для кристаллов с небольшим количеством дефектов подвижность ограничивается рассеянием на дефектах при самых низких температурах и колебаниями ионов при умеренных и высоких температурах. Поскольку полупроводники с небольшим количеством дефектов имеют небольшое количество дефектов. электронов проводимости , сопротивление высокое. Количество электронов проводимости в полупроводниках увеличивается за счет добавления примесей. К сожалению, это также увеличивает рассеяние на примесях, что снижает подвижность. На рисунке 8 показанудельное сопротивление кремния при комнатной температуре ( T = 300 K) как функция концентрации примесей. Две кривые представляют проводимость по электронам и дыркам. Каждая отметка сетки на графике имеет коэффициент 10. Удельное сопротивление изменяется в миллион раз от самой низкой до самой высокой концентрации примесей.
электронов проводимости , сопротивление высокое. Количество электронов проводимости в полупроводниках увеличивается за счет добавления примесей. К сожалению, это также увеличивает рассеяние на примесях, что снижает подвижность. На рисунке 8 показанудельное сопротивление кремния при комнатной температуре ( T = 300 K) как функция концентрации примесей. Две кривые представляют проводимость по электронам и дыркам. Каждая отметка сетки на графике имеет коэффициент 10. Удельное сопротивление изменяется в миллион раз от самой низкой до самой высокой концентрации примесей.
Полупроводники с небольшим количеством примесей — хорошие фотопроводники. Фотопроводимость — это явление, при котором электрическая проводимость твердого тела увеличивается, подвергая его воздействиюсвет . Свет — это электромагнитное излучение в определенной узкой полосе частот. Кванты света поглощается полупроводником, создавая электронно-дырочные пары , которые обеспечивают электрическую проводимость. Более интенсивный свет производит больше электронно-дырочных пар и способствует лучшей проводимости. Каждый полупроводник поглощает свет в определенном диапазоне частот, поэтому разные полупроводники используются в качестве фотопроводников для разных диапазонов частот.
Каждый полупроводник поглощает свет в определенном диапазоне частот, поэтому разные полупроводники используются в качестве фотопроводников для разных диапазонов частот.
Оксид цинка (ZnO) представляет собой интересный материал с точки зрения проводимости. Он кристаллизуется в структуре вюрцита, и его связи представляют собой смесь ионных и ковалентных связей. Монокристаллы высокой чистоты являются изоляторами. Оксид цинка — самыйпьезоэлектрик из всех материалов и широко используется в качестве преобразователя в электронных устройствах. (Пьезоэлектричество — это свойство кристалла поляризоваться под воздействием давления.) Оксид цинка является хорошим полупроводником, когда в кристалл входят примеси алюминия. Поликристаллическая керамика из полупроводникового оксида цинка хорошо проводит и подчиняется закону Ома . Добавление небольших количеств других оксидов, таких как оксиды бария и хрома, приводит к тому, что керамика из оксида цинка имеет очень неомические электрические свойства; электрическиеток в такой керамике является наиболее нелинейным из всех известных материалов.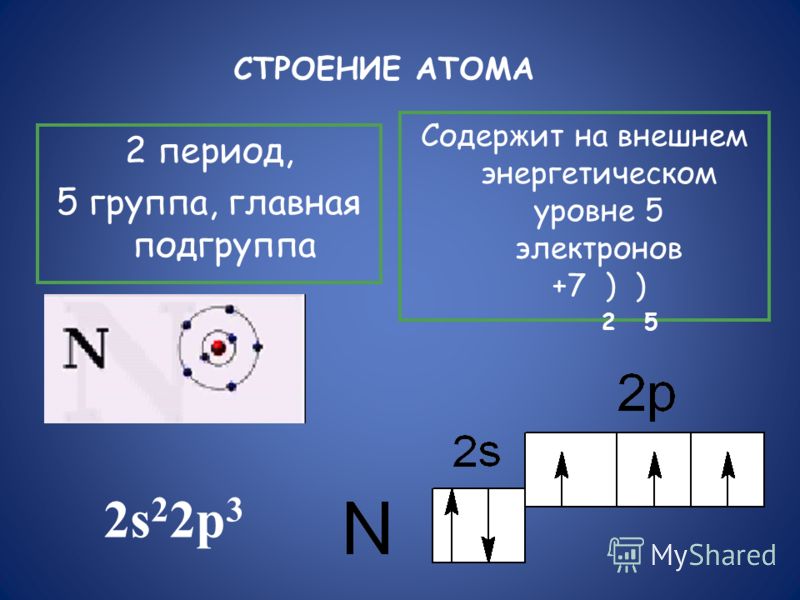 Ток I становится пропорциональным мощности напряжения V n , где показатель степени n имеет значения более 100 в определенных диапазонах напряжения. Этот материал называетсяваристор, который представляет собой сокращение слов переменный и резистор. Варисторы из оксида цинка широко используются в качестве элементов схем для защиты от скачков напряжения. На рисунке 9 показан график зависимости тока от напряжения для варистора из оксида цинка, используемого в бытовой электронике. Ток будет небольшим, пока не будет достигнуто критическое напряжение около 330 вольт, после чего ток резко возрастет нелинейным образом. Еще одним интересным применением оксида цинка было его прежнее использование в качествебелый пигмент в краске. Однако он был заменен диоксидом титана (TiO 2 ), который имеет более белый цвет.
Ток I становится пропорциональным мощности напряжения V n , где показатель степени n имеет значения более 100 в определенных диапазонах напряжения. Этот материал называетсяваристор, который представляет собой сокращение слов переменный и резистор. Варисторы из оксида цинка широко используются в качестве элементов схем для защиты от скачков напряжения. На рисунке 9 показан график зависимости тока от напряжения для варистора из оксида цинка, используемого в бытовой электронике. Ток будет небольшим, пока не будет достигнуто критическое напряжение около 330 вольт, после чего ток резко возрастет нелинейным образом. Еще одним интересным применением оксида цинка было его прежнее использование в качествебелый пигмент в краске. Однако он был заменен диоксидом титана (TiO 2 ), который имеет более белый цвет.
Видеоурок по химии «Валентные возможности атомов. Степень окисления»
Цель урока: повторить и углубить знания учащихся о валентности и степени окисления атомов, познакомить с понятием валентные возможности атомов.
Задачи урока:
- дать понятия «валентность», «валентные электроны»;
- научить определять валентность атома в основном состоянии;
- закрепить знания о возбужденном состоянии атома и научить определять его валентные возможности;
- закрепить знание понятия «степень окисления», научить определять С.О. в бинарных соединениях и более сложного состава;
- убедиться в существенном различии понятий «степень окисления» и «валентность атома»;
- дать представление об атомах-донорах и атомах-акцепторах.
Скачать видеоурок «Валентные возможности атомов. Степень окисления»
Данный материал будет полезен учащимся 11 классов при подготовке к ЕГЭ, при закреплении и повторении изученного материала в предыдущих классах.
Как вы знаете, атомы большинства химических элементов взаимодействуют с другими атомами и образуют множество соединений. Но почему так происходит? Ответ на этот вопрос долгое время оставался неизвестен.
Первой попыткой объяснить химическое взаимодействие была теория Бертолле. Атомы должны притягиваться друг к другу тем сильнее, чем больше их массы. А по электрохимической теории Берцелиуса, каждый атом имеет два противоположно заряженных полюса. Теория делила все элементы на два класса — металлы с преобладанием положительного заряженного полюса и металлоиды с отрицательным заряженным полюсом. Причём считалось, что соединяться друг с другом могли лишь атомы противоположной электрической природы.
Эта теория была отвергнута, когда выяснилось, что элементы одного и того же класса также могут соединяться друг с другом. И только лишь в 20 столетии возникли два направления теории химического взаимодействия на основе электронных представлений, основные положения которых были сформулированы Косселем и Льюисом. С точки зрения Косселя, движущей причиной химического взаимодействия является «стремление» атомов к достижению наиболее устойчивых электронных конфигураций. Основной недостаток теории Косселя в том, что не все соединения могут рассматриваться с ионной точки зрения. Между тем идея Льюиса об образовании электронной пары позволяет охватить самые разнообразные случаи валентной связи и сохраняет свое значение до сих пор.
С точки зрения Косселя, движущей причиной химического взаимодействия является «стремление» атомов к достижению наиболее устойчивых электронных конфигураций. Основной недостаток теории Косселя в том, что не все соединения могут рассматриваться с ионной точки зрения. Между тем идея Льюиса об образовании электронной пары позволяет охватить самые разнообразные случаи валентной связи и сохраняет свое значение до сих пор.
Впервые понятие «валентности» как соединительной силы ввел Э. Франкланд. Он считал, что взаимодействие разнообразных атомов происходит благодаря валентным силам.
Из всего вышесказанного приходим к выводу, валентность — это мера способности атомов притягиваться друг к другу посредством общих электронных пар. Валентность, как правило, обозначается римской цифрой. Рассмотрим электронные конфигурации атомов, чтобы разобраться, как возникают валентные взаимодействия между атомами.
В основном состоянии на внешних энергетических уровнях, а иногда и на предвнешних уровнях атомов, могут находиться спаренные и неспаренные электроны.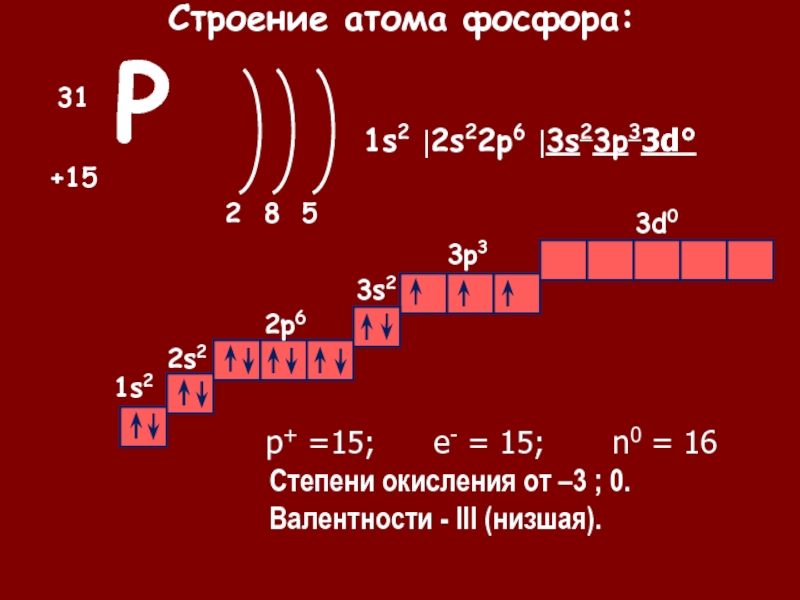 Валентность атома определяется числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентность атома определяется числом неспаренных электронов, принимающих участие в образовании химической связи.
У s- и p-элементов валентные электроны расположены на s- и p-подуровнях внешнего энергетического уровня.
Например, литий, у которого заряд ядра +3, 3 электрона, это s-элемент, атом имеет один неспаренный s-электрон, значит валентность лития I.
Рассмотрим другой пример, азот. Заряд его атома +7, у него 7 электронов. Это p-элемент. Соответственно, азот имеет 5 валентных электронов — два спаренных s- электрона и 3 неспаренных p-электрона.
У d-элементов валентные электроны находятся на s-подуровне последнего энергетического уровня и d-подуровне предвнешнего энергического уровня.
Например, у атома титана заряд ядра +22, соответственно столько же электронов — 22. Титан имеет 4 валентных электрона, 2 спаренных s-электронов и два неспаренных d-электронов.
У f-элементов валентные электроны располагаются на s-подуровне последнего энергетического уровня и d-подуровне предпоследнего энергетического уровня и f- подуровня, третьего с края энергетического уровня.
Например, у атома эйнштейния заряд ядра +99, столько же у него и электронов. Эйнштейний имеет 13 валентных электронов, 12 спаренных и 1 неспаренный на 5f-подуровне. Этому элементу было присвоено название эйнштейний в честь выдающегося ученого двадцатого столетия Альберта Эйнштейна, внесшего большой вклад в науку об атоме и атомном ядре.
Следует усвоить, что основные свойства элементов определяются валентными электронами, а уровни, подуровни, на которых располагаются валентные электроны, называются валентными. Самыми первыми вступают в реакцию неспаренные электроны, расположенные на внешнем энергетическом уровне. Количеством этих неспаренных электронов и определяет валентность. Если на спаренные электроны, при имеющейся свободной орбитали в атоме, подействует энергия извне, эти электроны распариваются и атом переходит из основного состояния в возбужденное. Энергия, затраченная на переход электронов, компенсируется при образовании новых связей.
Валентные возможности атомов также определяются числом пустых орбиталей и числом неподеленных электронных пар.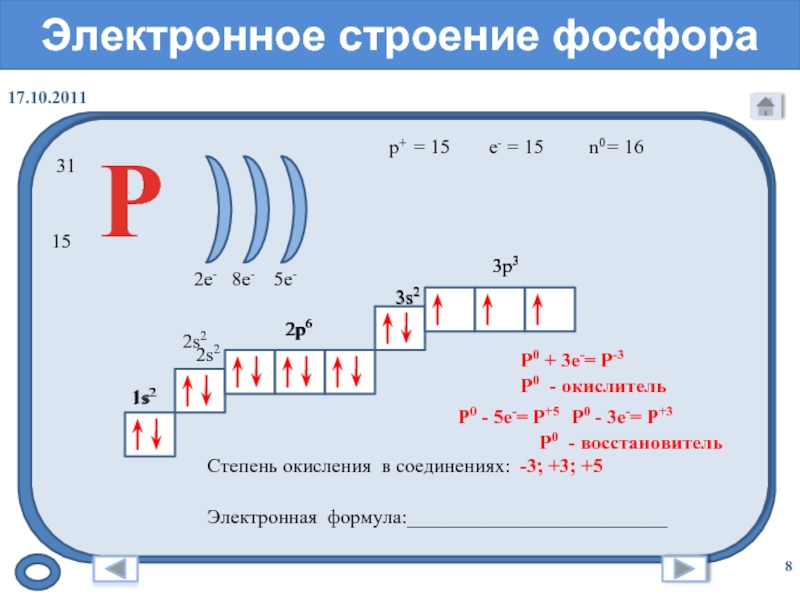 Атом-донор предоставляет неподеленную электронную пару атому-акцептору, который имеет свободные орбитали.
Атом-донор предоставляет неподеленную электронную пару атому-акцептору, который имеет свободные орбитали.
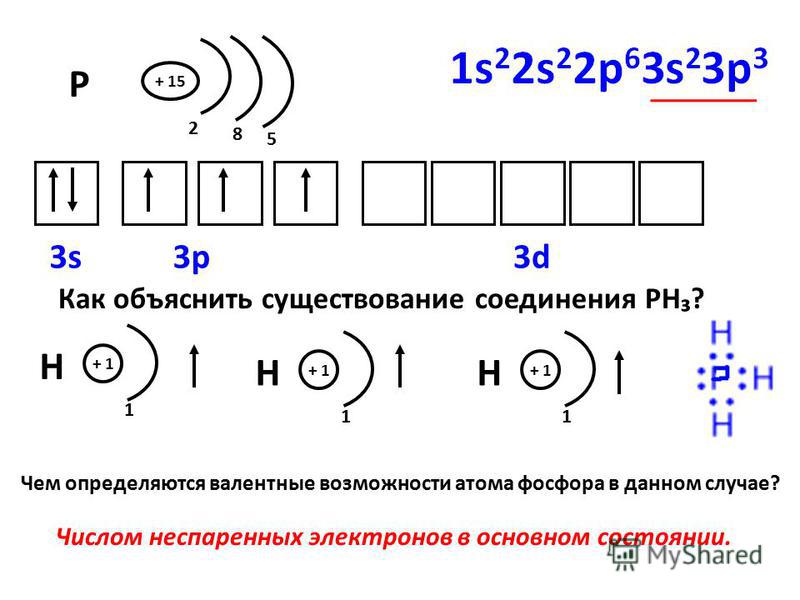
Например, заряд ядра атома фосфора +15, число электронов 15. В основном состоянии атом фосфора, который относится к p-элементам, на внешнем уровне содержит 1 пару спаренных электронов и 3 неспаренных электрона. Поэтому, он проявляет валентность III, так как у него 3 неспаренных p-электрона. Валентность азота IV, так как атом фосфора это атом-донор, который может предоставить пару электронов для образования химической связи.
При имеющихся вакантных орбиталях на 3d-подуровне и паре спаренных электронов на 3s-подуровне атом фосфора может переходить в возбужденное состояние. Это происходит за счёт распаривания и перехода электрона на свободную орбиталь другого подуровня. В атоме появляется 5 неспаренных электронов, что и обеспечивает возможность существования валентности атома фосфора — V.
Поэтому, если у элементов на внешнем энергетическом уровне есть неспаренные электроны, то они являются активными элементами или реакционноспособными.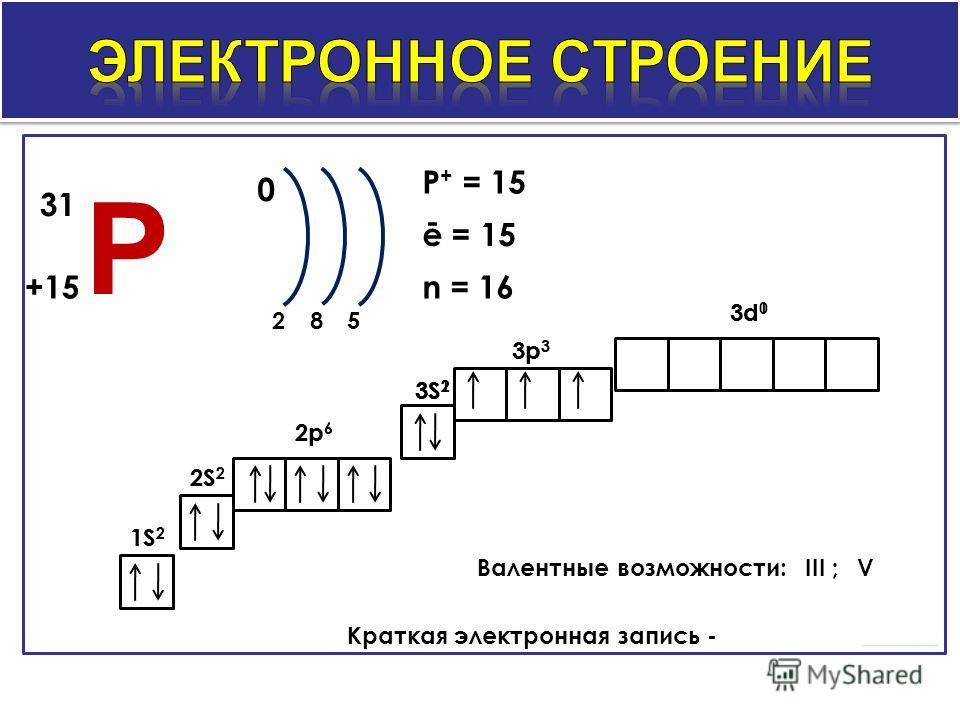 А если на внешнем уровне электроны находятся только в спаренном состоянии, тогда эти элементы относят к малоактивным.
А если на внешнем уровне электроны находятся только в спаренном состоянии, тогда эти элементы относят к малоактивным.
Например, к малоактивным химическим элементам относят VIIIA группу химических элементов Периодической системы. Их так и называют — благородные или инертные (малоактивные) химические элементы — так как на внешнем слое этих элементов все электроны находятся в спаренном состоянии. Нет свободных или неспаренных электронов, которые образовывали связи с электронами других химических элементов.
Следует запомнить, что s-, d-, f-элементы — это металлические элементы, кроме некоторых исключений. Так как на последнем уровне у них электронов меньше, чем 3; у неметаллических элементов, наоборот, на последнем уровне электронов больше, чем 4.
P-элементы могут быть металлические и неметаллические. Рассмотрим Периодическую систему химических элементов. По диагонали от бора к астату все p-элементы выше диагонали — неметаллические, ниже — металлические. По строению элементы, у которых на внешнем энергетическом уровне 3 или 4 электрона, считаются переходными элементами; многие d-элементы — металлические с переходными свойствами.
По строению элементы, у которых на внешнем энергетическом уровне 3 или 4 электрона, считаются переходными элементами; многие d-элементы — металлические с переходными свойствами.
У элементов в соединении можно определить не только валентность, но и степень окисления. Степень окисления — это условный заряд атома — положительный или отрицательный, в зависимости от смещения электронов от атома или к нему, если считать все связи в веществе ионными. Степень окисления и валентность это не одно и тоже понятие. Например, атом углерода в органических соединениях четырёхвалентен, однако степени окисления имеет различные.
Запомним, если в соединении атом не проявляет валентность как донор, то степень окисления численно совпадает с валентностью. Например, в молекуле аммиака валентность азота равна III и степень окисления равна тоже -3. И наоборот, если в соединении атом проявляет валентность как донор, то степень окисления численно не совпадает с валентностью. У катиона аммония атом азота проявляет валентность IV, а степень окисления -3.
Степень окисления может быть минимальной, промежуточной и максимальной.
Минимальная степень окисления для неметаллических элементов определяется числом валентных мест в незавершенном энергетическом уровне. У атома углерода она равна -4, так как до устойчивости внешнего энергетического уровня атома углерода (до 8 электронов) число валентных мест — 4. Соответственно, у атома азота минимальная степень окисления -3, у кислорода — -2.
Максимальная степень окисления определяется суммой s- и p-электронов на внешних энергетических уровнях, а для d-элементов — суммой s- и d-электронов.
Например, атом титана — это d-элемент, металлический. На внешнем электронном слое у него находится 4 электрона. Значит, максимальная степень окисления титана +4.
Промежуточными степенями окисления считаются значения между минимальной и максимальной степенями окисления в атомах химических элементов.
Определим степень окисления в бинарных соединениях на примере оксидов азота.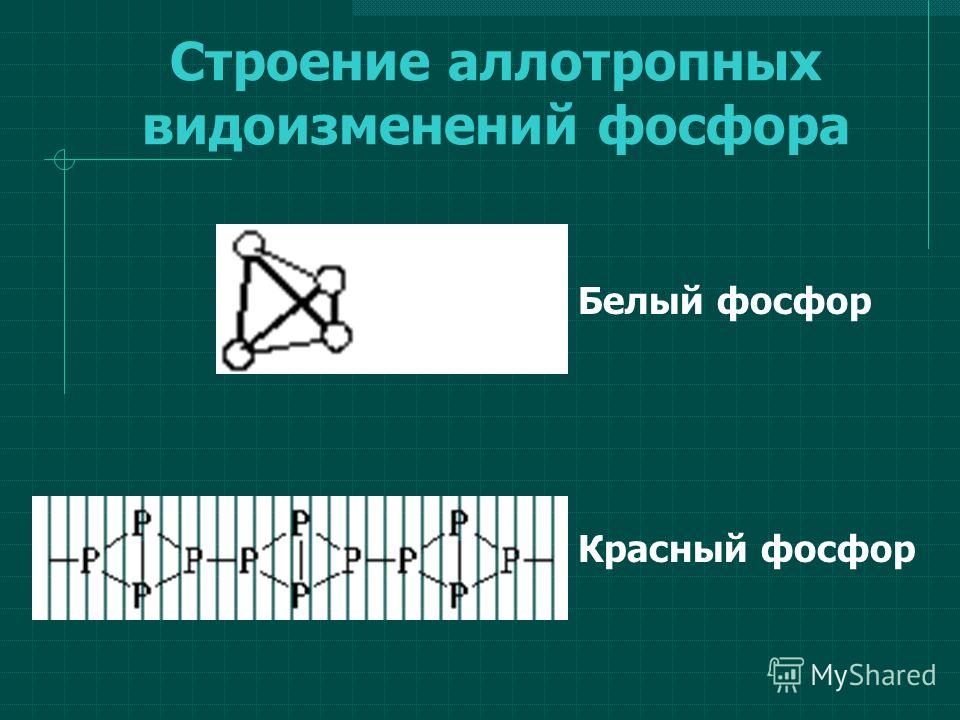 Более электроотрицательным элементом, к которому смещаются электроны во всех оксидах, является кислород. Как мы помним, минимальная степень окисления кислорода равнa -2, а молекула всегда электронейтральна. Следовательно, произведение степени окисления электроотрицательного элемента на количество атомов по абсолютной величине равно произведению его электроположительного элемента на количество атомов. Таким образом, определяется валентность в соединениях, состоящих из двух элементов, то есть бинарных.
Более электроотрицательным элементом, к которому смещаются электроны во всех оксидах, является кислород. Как мы помним, минимальная степень окисления кислорода равнa -2, а молекула всегда электронейтральна. Следовательно, произведение степени окисления электроотрицательного элемента на количество атомов по абсолютной величине равно произведению его электроположительного элемента на количество атомов. Таким образом, определяется валентность в соединениях, состоящих из двух элементов, то есть бинарных.
В соединениях более сложного состава необходимо расставить известные степени окисления химических элементов, а неизвестную степень окисления обозначить, например, за «x». Далее так же, как и в бинарных соединениях решаем уравнение с одной неизвестной и получаем ответ по абсолютной величине.
В простых веществах с неполярной ковалентной связью степень окисления равна 0. Степень окисления углерода в органических соединениях определяется у каждого в отдельности, учитывая степень окисления элементов, связанных с ним. 1 $, что дает нам всего 3. Самая внешняя орбита — 2-я орбита, а общее число электронов в ней — всего одно. Поэтому валентность лития одна.
1 $, что дает нам всего 3. Самая внешняя орбита — 2-я орбита, а общее число электронов в ней — всего одно. Поэтому валентность лития одна.
Однако гораздо проще сделать это так, как я показал выше, как с натрием. Не нужно вводить все орбитали
Для спина просто помните, что перед тем, как вы начнете наносить отрицательные спиновые электроны, вы должны заполнить весь орбитальный с помощью спиновых электронов. Не просто чередуйте вверх и вниз.
Давайте поговорим о орбите «р». Каждый «тип» p-орбитали должен иметь электроны с восходящим спином перед добавлением вниз-спина. Таким образом, перед тем, как вы начнете добавлять спин-спины, будет 3 спиновых электрона. Кроме того, вы не можете перейти на следующую орбиталь без полного заполнения предыдущего с EQUAL числом спинов вверх и вниз.
Для фосфора; допустим, мы заполнили орбиты 1s, 2s и 2p. Теперь мы добавляем один зажим в 3s, а затем вниз. Что оставляет нас с еще тремя электронами, которые будут добавлены к валентной орбите (3-е). Это «p’-орбиталь», которая должна иметь 3 спиновых электрона до того, как можно будет разместить любые вниз. Но у нас осталось всего 3! Таким образом, все будут закрученными электронами на валентной орбите. Таким образом, у нас будет полный оборот +3/2.
Это «p’-орбиталь», которая должна иметь 3 спиновых электрона до того, как можно будет разместить любые вниз. Но у нас осталось всего 3! Таким образом, все будут закрученными электронами на валентной орбите. Таким образом, у нас будет полный оборот +3/2.
Надеюсь, я не усложнил слишком много, но я на самом деле пытался сделать это как можно короче. Я по-прежнему совсем забыл.
Характеристика химических элементов малых периодов по их месту в периодической системе и строению атома — Химия — Мастер-класс
Характеристика химических элементов малых периодов по их месту в периодической системе и строению атома
Зная формулировка периодического закона и используя периодическую систему элементов Д. И. Менделеева, можно дать характеристику любому химическому элементу и его соединениям. Такую характеристику химического элемента удобно составлять по плану.
I. Символ химического элемента и его название.
Символ химического элемента и его название.
II. Положение химического элемента в периодической системе элементов Д. И. Менделеева:
1) порядковый номер;
2) номер периода;
3) номер группы;
4) подгруппа (главная или побочная).
III. Строение атома химического элемента:
1) заряд ядра атома;
2) относительная атомная масса химического элемента;
3) число протонов;
4) число электронов;
5) число нейтронов;
6) число электронных уровней в атоме.
IV. Электронная и электронно-графическая формулы атома, его валентные электроны.
Тип V. химического элемента (металл или неметал, s-, p-, d- или f-элемент).
химического элемента (металл или неметал, s-, p-, d- или f-элемент).
VI. Формулы высшего оксида и гидроксида химического элемента, характеристика их свойств (основные, кислотные или амфотерные).
VII. Сравнение металлических или неметаллических свойств химического элемента по свойствам элементов-соседей по периоду и подгруппе.
Например, дадим характеристику химического элемента с порядковым номером 15 и его соединениям по положению в периодической системе элементов Д. И. Менделеева и строением атома.
I. Находим в таблице Д. И. Менделеева клетку с номером химического элемента, записываем его символ и название.
Химический элемент номер 15 — Фосфор. Его символ Г.
II. Охарактеризуем
положение элемента в таблице Д. И. Менделеева (номер периода, группы, тип
подгруппы).
Фосфор находится в главной подгруппе V группы, в 3-м периоде.
III. Предоставим общую характеристику состава атома химического элемента (заряд ядра, атомная масса, число протонов, нейтронов, электронов и электронных уровней).
Заряд ядра атома Фосфора равна +15. Относительная атомная масса Фосфора равна 31. Ядро атома содержит 15 протонов и 16 нейтронов (31 — 15 = 16. Атом Фосфора имеет три энергетических уровня, на которых находятся 15 электронов.
IV. Составляем электронную и электронно-графическую формулы атома, отмечаем его валентные электроны.
Электронная
формула атома Фосфора: Электронно-графическая
формула внешнего уровня атома Фосфора: на третьем энергетическом уровне на 3s-подуровне
находятся два электрона (в одной клетке записываются две стрелки, имеющие
противоположное направление), на три р-подуровне находятся три электроны (в
каждой из трех клеток записываются по одной стрелке, имеют одинаковое направление).
Валентными электронами являются электроны внешнего уровня, то есть электроны.
V. Определяем тип химического элемента (металл или неметал, s-, p-, d- или f-элемент).
Фосфор — неметал. Поскольку в последнее підрівнем в атоме Фосфора, который заполняется электронами, есть -подуровень, Фосфор относится к семейству -элементов.
VI. Составляем формулы высшего оксида и гидроксида Фосфора и характеризуем их свойства (основные, кислотные или амфотерные).
Высший оксид Фосфора проявляет свойства кислотного оксида. Гидроксид, который соответствует высшему оксида, , проявляет свойства кислоты. Подтвердим указанные свойства уравнениями соответствующих химических реакций:
VII. Сравним
неметаллические свойства Фосфора со свойствами элементов-соседей по периоду
и подгруппой.
Сравним
неметаллические свойства Фосфора со свойствами элементов-соседей по периоду
и подгруппой.
Соседом Фосфора по подгруппе является Азот. Соседями Фосфора за периодом является Кремний и Сульфур. Неметаллические свойства атомов химических элементов главных подгрупп с ростом порядкового номера возрастают в периодах и снижаются в группах. Поэтому неметаллические свойства Фосфора более выражены, чем у Кремния и менее выражены, чем у Азота и Серы.
Что такое полупроводники?. Статьи компании «ООО «М-ФОКУС» / Прямые поставки с завода по России»
Полупроводники, такие как кремний (Si), с энергетическими зазорами только среднего размера, могут быть легко превращены в довольно хорошие проводники. Как читатель, возможно, помнит из курсов химии, кремний имеет валентность четыре, как углерод, германий и олово. Если элемент, такой как фосфор (P) или мышьяк (As), с валентностью 5, каким-то образом помещается в кристалл кремния, квантовая механика предсказывает, что он примет валентность остальной части кристалла, поэтому он только сделает 4 связывается с окружающими атомами Si. Это оставляет один лишний электрон во внешней оболочке, который не используется ни в каких связях и поэтому легко уносится.
Это оставляет один лишний электрон во внешней оболочке, который не используется ни в каких связях и поэтому легко уносится.
Эти атомы P или As имеют энергетические уровни внутри запрещенной зоны Si. Небольшого количества случайной энергии, доступной при комнатной температуре, достаточно, чтобы отбросить некоторые из их дополнительных электронов в зону проводимости, где горизонтальное электрическое поле может заставить его перемещаться в любом месте. кристалл. Пока зона проводимости не заполнена на 100%, материал становится проводником.
Требуется всего около 0,0001% («одна часть на миллион») фосфора или мышьяка в Si, чтобы превратить достаточно хороший изолятор в достаточно хороший проводник. P или As являются «донорами» в «полупроводниках». Акт помещения небольшого количества донора в собственный полупроводник называется «легированием». Часто это делается путем нагревания чистого Si, контактирующего с некоторым материалом донора, примерно до 1000 ° C, и в этом случае донор диффундирует в основной кристалл.
Полупроводник, который был легирован так, чтобы электроны (отрицательные «носители заряда») могли проводить, называется материалом «N-типа». Первоначальный чистый материал был «I-типа» до того, как был легирован.
Бор (B) или алюминий (Al), имеющие основные валентности только 3, также могут диффундировать в Si, заставляя их «принимать» электрон из кристалла Si вместо того, чтобы отдавать его. Это также показано на рисунке. То , что осталось позади является отсутствие одного электрона в Si, и это называется «дыра» . Электрон в валентной зоне теперь может перемещаться в это отверстие в ответ на электрическое поле (от батареи и т. д.), Оставляя новое отверстие рядом со старым. Затем другой электрон может переместиться в новую дырку, снова создавая еще более новую дыру поблизости. Таким образом, не все валентные электроны должны двигаться одновременно, поэтому они могут свободно проводить там, где до легирования их не было. (Обратите внимание, однако, что электрон, который был принят B или Al, не может двигаться,поскольку поблизости нет повторяющейся кристаллической структуры B или Al). Для каждого электрона в ядре атома есть положительно заряженный протон, который не показан на рисунке. Таким образом, если электрон движется вправо, возникает положительный заряд, который действует так, как будто он движется влево. Протоны на самом деле не движутся, но для простоты предполагается, что движется положительно заряженная дырка, хотя на самом деле движутся только электроны (в противоположном направлении). Кремний, легированный таким образом, называется материалом P-типа.
Для каждого электрона в ядре атома есть положительно заряженный протон, который не показан на рисунке. Таким образом, если электрон движется вправо, возникает положительный заряд, который действует так, как будто он движется влево. Протоны на самом деле не движутся, но для простоты предполагается, что движется положительно заряженная дырка, хотя на самом деле движутся только электроны (в противоположном направлении). Кремний, легированный таким образом, называется материалом P-типа.
Оглядываясь на мгновение на материал N-типа, донор оставляет на своем месте новое отверстие, которое не может двигаться. Движущийся электрон может упасть обратно в эту дыру, а затем временно «пойман», пока не получит достаточно случайной тепловой энергии, чтобы снова выпрыгнуть. Точно так же движущаяся дыра может упасть обратно в место приема и оказаться в ловушке, и для того, чтобы выбраться снова, не требуется большого изменения энергии. Эти факты важны для понимания различных взаимодействий со светом.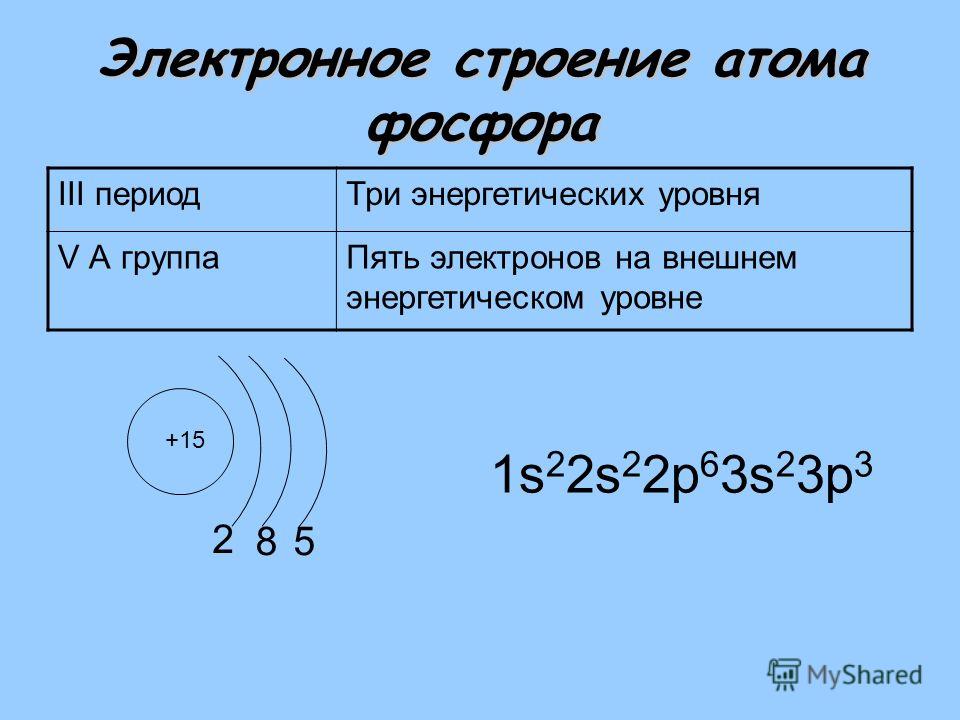
Нагрев полупроводника вызывает большую проводимость, потому что больше электронов может подниматься вверх и быть передано или принято. Однако есть обратный эффект, менее мощный. Тепло заставляет атомы перемещаться случайным образом, поэтому они больше не находятся в своих точных «периодических» положениях. Таким образом, правила квантовой механики не соблюдаются так хорошо, и носители заряда (электроны или дырки) не могут двигаться так легко (их «подвижность» меньше). Это называется «рассеянием» носителей.
В металлах достаточно носителей без нагрева, поэтому рассеяние вызывает уменьшение проводимости при повышении температуры. Вот почему сопротивление изменяется при включении лампочки. Оба явления — повышенное сопротивление металлов при нагревании и пониженное сопротивление полупроводников — используются в «датчиках», которые могут измерять температуру.
Валентные возможности атомов элементов в химических соединениях. Валентные возможности атомов химических элементов.
 Валентные возможности атома водорода
Валентные возможности атома водородаСвойства атома во многом определяется строением его внешнего электронного слоя. Электроны, находящиеся на внешнем, а иногда и на предпоследнем, электронном слое атома могут принимать участие в образовании химических связей. Такие электроны называют валентными. Например, в атоме фосфора 5 валентных электронов: (рис. 1).
Рис. 1. Электронная формула атома фосфора
Валентные электроны атомов элементов главных подгрупп расположены на s- и р-орбиталях внешнего электронного слоя. У элементов побочных подгрупп, кроме лантаноидов и актиноидов, валентные электроны расположены на s-орбитали внешнего и d-орбиталях предпоследнего слоев.
Валентность — это способность атома образовывать химические связи. Данное определение и само понятие валентность корректны только по отношению к веществам с ковалентным типом связи. Для ионных соединений это понятие неприменимо, вместо него используют формальное понятие «степень окисления».
Валентность характеризуется числом электронных пар, образующихся при взаимодействии атома с другими атомами. Например, валентность азота в аммиаке NH 3 равна трем (Рис. 2).
Рис. 2. Электронная и графическая формулы молекулы аммиака
Количество электронных пар, которое может образовать атом с другими атомами, зависит, в первую очередь, от числа его неспаренных электронов. Например, в атоме углерода два неспаренных электрона — на 2р-орбиталях (Рис. 3). По числу неспаренных электронов мы можем сказать, что такой атом углерода может проявлять валентность, равную II.
Рис. 3. Электронное строение атома углерода в основном состоянии
Во всех органических веществах и некоторых неорганических соединениях углерод четырехвалентен. Такая валентность возможна только в возбужденном состоянии атома углерода, в которое он переходит при получении дополнительной энергии.
В возбужденном состоянии в атоме углерода распариваются 2s-электроны, один из которых переходит на свободную 2р-орбиталь. Четыре неспаренных электрона могут участвовать в образовании четырех ковалентных связей. Возбужденное состояние атома принято обозначать «звездочкой» (Рис. 4).
Четыре неспаренных электрона могут участвовать в образовании четырех ковалентных связей. Возбужденное состояние атома принято обозначать «звездочкой» (Рис. 4).
Рис. 4. Электронное строение атома углерода в возбужденном состоянии
Может ли азот иметь валентность, равную пяти — по числу его валентных электронов? Рассмотрим валентные возможности атома азота.
В атоме азота два электронных слоя, на которых расположено всего 7 электронов (Рис. 5).
Рис. 5. Электронная схема строения внешнего слоя атома азота
Азот может образовать три общие электронные пары с тремя другими электронами. Пара электронов на 2s-орбитали тоже может участвовать в образовании связи, но по другому механизму — донорно-акцепторному, образуя четвертую связь.
Распаривание 2s-электронов в атоме азота невозможно, т. к. на втором электронном слое нет d-подуровня. Поэтому высшая валентность азота равна IV.
Подведение итога урока
На уроке вы научились определять валентные возможности атомов химических элементов. В ходе изучения материала вы узнали, сколько атомов других химических элементов может присоединить к себе конкретный атом, а также почему элементы проявляют разные значения валентности.
В ходе изучения материала вы узнали, сколько атомов других химических элементов может присоединить к себе конкретный атом, а также почему элементы проявляют разные значения валентности.
Список литературы
- Новошинский И.И., Новошинская Н.С. Химия. Учебник для 10 класса общеобр. учрежд. Профильный уровень. — М.: ООО «ТИД «Русское слово — РС», 2008. (§ 9)
- Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учеб. для общеобраз. учрежд.: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. — М.: Просвещение, ОАО «Московские учебники», 2010. (§ 5)
- Радецкий А.М. Химия. Дидактический материал. 10-11 классы. — М.: Просвещение, 2011.
- Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. — М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 8)
- Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) ().
- Электронная версия журнала «Химия и жизнь» ().
Домашнее задание
- с.
 30 №№ 2.41, 2.43 из Сборника задач и упражнений по химии для средней школы (Хомченко И.Д.), 2008.
30 №№ 2.41, 2.43 из Сборника задач и упражнений по химии для средней школы (Хомченко И.Д.), 2008. - Запишите электронные схемы строения атома хлора в основном и возбужденном состояниях.
- Сколько валентных электронов в атоме: а) бериллия; б) кислорода; в) серы?
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
Элемент | Степень окисления практически во всех соединениях | Исключения |
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = № группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF 2). Расставим известные степени окисления:
Обозначим степень окисления серы как x :
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т. к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Решим его:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение. Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы NH 4 + (заряд данного катиона можно посмотреть в таблице растворимости). Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH 4 + , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH 4 + и анионами Cr 2 O 7 2- .
Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH 4 + , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH 4 + и анионами Cr 2 O 7 2- .
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x и y :
Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
Как определять степени окисления элементов в органических веществах можно почитать .
Валентность
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов
2) неподеленных электронных пар на орбиталях валентных уровней
3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных () орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III.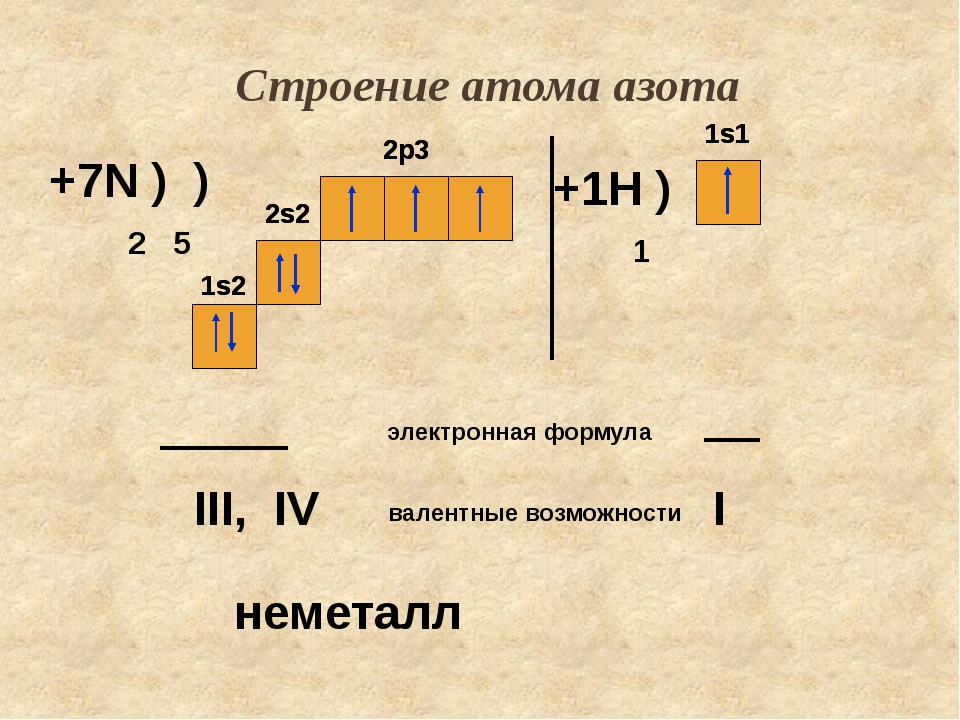 Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH 3), азотистой кислоты (HNO 2), треххлористого азота (NCl 3) и т.д.
Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH 3), азотистой кислоты (HNO 2), треххлористого азота (NCl 3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор() предоставляет ее другому атому с вакантной () орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d -подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO 3 или оксида азота N 2 O 5 ? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная π -связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O 3 , бензола C 6 H 6 и т.д.
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d -подуровень с 5-ю вакантными орбиталями.
В связи с этим он способен переходить в возбужденное состояние, распаривая электроны 3s -орбитали:
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d -подуровня, распаривание электронов s и p- орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H 2 S.
Как мы видим, у атома серы на внешнем уровне появляется d -подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p -подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV.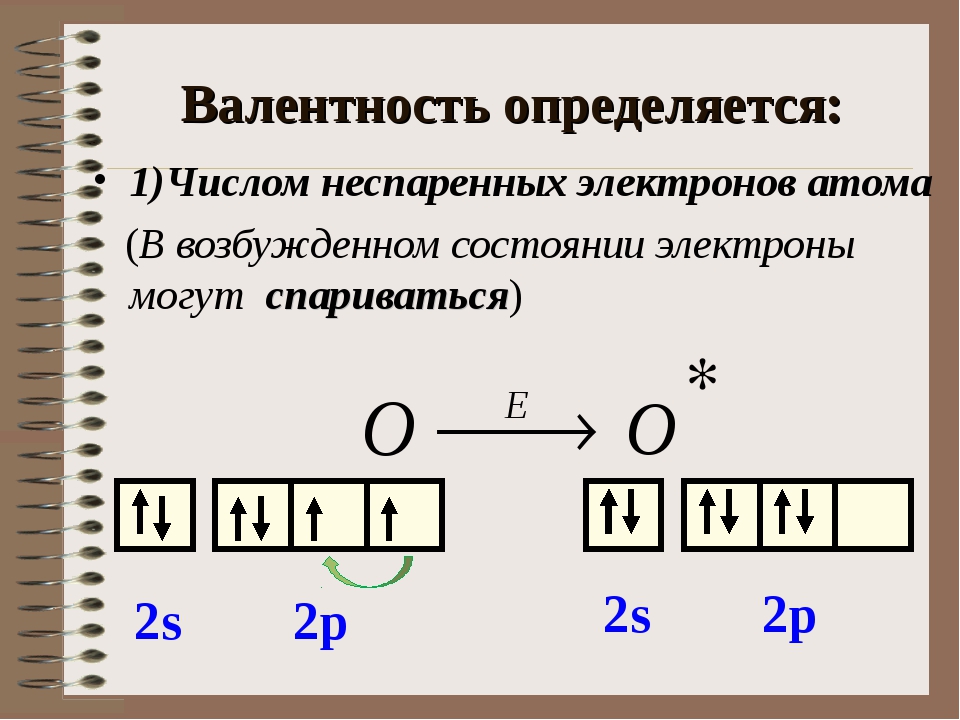 Действительно, валентность IV сера имеет в молекулах SO 2 , SF 4 , SOCl 2 и т.д.
Действительно, валентность IV сера имеет в молекулах SO 2 , SF 4 , SOCl 2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s -подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO 3 , H 2 SO 4 , SO 2 Cl 2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.
Лекция 3. Кто на что способен или Валентные возможности атомов.
1. Строение Периодической Системы
Каждый из присутствующих в аудитории обладает яркой индивидуальностью, особенным талантом. Точно также элементы, собравшиеся вместе в Периодической системе, хоть и похожи порой один на другой, но все-таки имеют свои особенности: сильные и слабые стороны.
Начнем с того, что элементов очень много – и хорошо бы нам их как-нибудь называть, чтобы не запутаться. Давайте соберем в группы близкие по свойствам элементы –
электронные аналоги.
Чтобы не запутаться, сперва в два ряда «сложим» f -элементы: лантаноиды и актиноиды.
Затем расположим группы так, чтобы в элементах первой группы был 1 валентный электрон,
у элементов второй группы – 2 валентных электрона и т.д.
У нас получится 8 групп, в каждой из которых образуется подгруппы: в одной окажутся s — или p -элементы, а в другой – d -элементы.
Например, 1А группа: H, Li, Na, K, Rb, Cs, Fr и 1Б группа: Cu, Ag, Au, Rg
Соберем из групп Периодическую систему. Поскольку периодом называется время между двумя повторяющими событиями, расстояние между двумя соседними электронными аналогами (горизонтальный ряд Периодической системы) будет также называться периодом.
Наконец, дадим названия группам
Обозначение | Конфигурация | Название |
щелочные металлы и водород | ||
щёлочноземельные металлы | ||
ns2 np1 | ||
ns2 np2 | ||
ns2 np3 | пниктогены | |
ns2 np4 | халькогены | |
ns2 np5 | галогены | |
ns2 np6 | инертные газы | |
6s2 5d1 4f x | лантаноиды | |
7s2 6d1 5f x | актиноиды |
Лекция 3. Валентные возможности атомов. Ковалентная химическая связь
Валентные возможности атомов. Ковалентная химическая связь
Побочные подгруппы будем назвать по первому их элементу: «подгруппа меди», «подгруппа цинка».
ns2 (n-1)d10 | подгруппа Zn | |
ns1 (n-1)d5 | подгруппа Cr |
Попробуем найти в нашей системе металлы.
Оказывается, если от бора B к астату At провести диагональ, то металлы главных подгрупп занимают левый нижний угол, а неметаллы – правый верхний. Такие металлы назовем непереходными , т.е. непереходные элементы – это металлы главных подгрупп.
Все элементы побочных подгрупп и f -элементы – переходные элементы , или переходные металлы.
Учитывая, что в природе ничтожные количества (или совсем нет) элементов с Z > 92,
назовем такие элементы трансурановыми .
Теперь собственно, можно начинать.
2. Валентные возможности атомов.
Итак, наш вопрос на сегодня: как атомы образуют молекулы и почему эти молекулы
не рассыпаются?
Логично предполагать, что если атомы держатся вместе, значит, их что-то связывает.
Такое состояние назовем химической связью . Поскольку строение атома для нас
секрета не представляет, то остановимся на самом простом возможном объяснении:
Химическая связь – особый тип взаимодействия между атомами в химических
соединениях, основанный на взаимодействии положительно заряженных ядер атомов
одного элемента с отрицательно заряженными электронами другого элемента.
Лекция 3. Валентные возможности атомов. Ковалентная химическая связь
Проводя аналогию с законом всемирного тяготения, ядро атома, как черная дыра, пытается
притянуть любой электрон, попавший в его сферу притяжения.
Типы химической связи. Ковалентная связь.
Как Вы знаете, любое животное ищет себе пару. И электрон не исключение: для того,
чтобы образовать прочную химическую связь, нужна пара электронов с противоположно направленными спинами.
Пусть есть 2 атома – A и B, которые взаимодействуют между собой.
В зависимости от способа взаимодействия электроны могут оказаться либо «в фазе»
(одинаковый знак волновой функции e 1 и e 2 ), так что образуется химическая связь,
либо «в противофазе» (разные знаки волновых функций), приводящая к отталкиванию атомов друг от друга.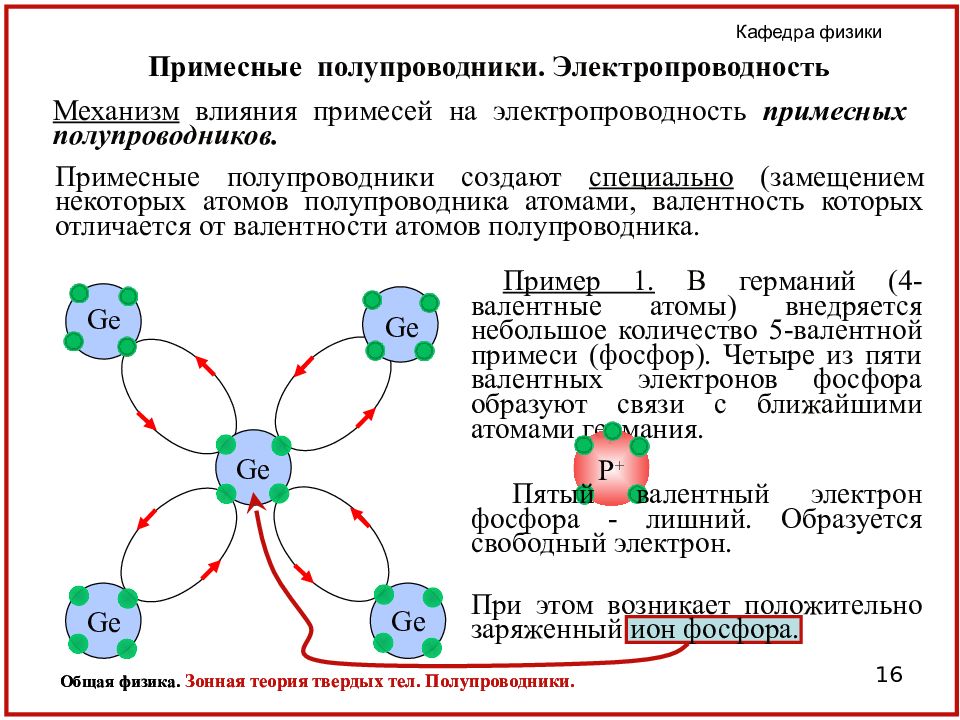 В первом случае возникает выигрыш в энергии (зеленый уровень энергии V
располагает ниже, а величина этого выигрыша точно равна энергии образующейся связи). Во втором случае возникает проигрыш в энергии (красный уровень X
).
В первом случае возникает выигрыш в энергии (зеленый уровень энергии V
располагает ниже, а величина этого выигрыша точно равна энергии образующейся связи). Во втором случае возникает проигрыш в энергии (красный уровень X
).
Представьте себе, что Вы катите шарик. Если он катится под горку – Вы не прикладываете никаких усилий – и шарик закатывается в ямку. Напротив, Вы в поте лица толкаете шарик в горку, но, стоит Вам его отпустить
– и шарик скатывается к её подножию.
Лекция 3. Валентные возможности атомов. Ковалентная химическая связь
Что происходит при образовании связи с электронным облаком?
Для простоты картинки возьмем сферически симметричные s -АО (l = 0).
1. Если облака (серые шарики) складываются, возникает картинка внизу – есть область перекрывания, в которой электронная плотность «удвоилась», а на остальной области она совпадает либо с плотностью электронного облака атома А, либо с плотностью электронного облака атома B.
В этом случае увеличенная электронная плотность подобно котлете в гамбургере связывает
между собой положительно заряженные ядра атомов А и Б.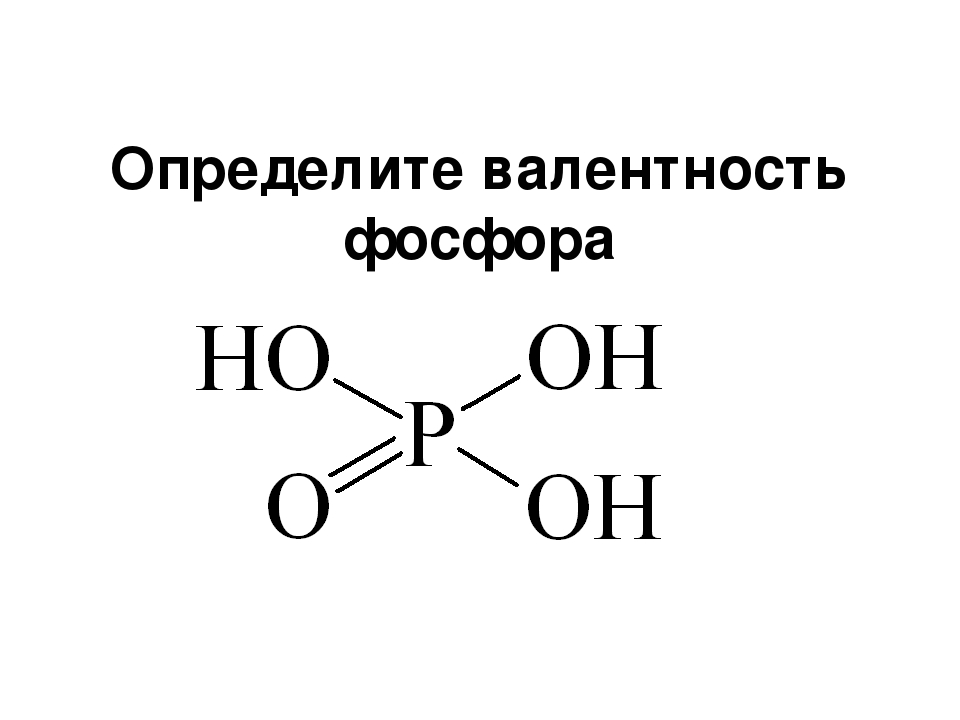
2. Если же облака (серые шарики) вычитаются, то возникает картинка сверху – посередине полное взаимоуничтожение, а на краях – плотность электронного облака атома до взаимодействия.
В этом случае электронной плотности между ядрами нет – и беспощадный закон Кулона предписывает атомам разлететься в разные стороны.
Итак, ковалентная химическая связь возникает при обобществлении неспаренных электронов с противоположными спинами, изначально принадлежавшим разным атомам.
При этом вступающие в ковалентную химическую связь элементы как бы обмениваются электронами, поэтому такой механизм (способ) образования
ковалентной связи получил название – обменный .
А· + ·B = A: B
(обобществление электронов, образование общей электронной пары)
А· + ·B = A – B
(образование химической связи,
черточка между А и B обозначает химическую связь и называется валентным штрихом)
Лекция 3. Валентные возможности атомов. Ковалентная химическая связь
Таким образом, для образования ковалентной химической связи по обменному
механизму атомы должны иметь неспаренные электроны | ||||
Примеры
: водород 1
H 1s1
; кислород 8
O … 2s 2
2p4
. | ||||
образование молекулы h3 | ||||
из двух атомов водорода | ||||
образование молекулы h3 O | ||||
из двух атомов водорода | ||||
и атома кислорода | ||||
Например, при образовании молекулы водорода каждый атом предоставляет по 1e
– получается общая (связывающая
) пара электронов.
При образовании молекулы воды, на 1 атом кислорода, у которого
2 неспаренных электрона, требуется 2 атома водорода, у каждого из которых по 1e –
образуются 2 связи O – H. При этом атом кислорода располагает также двумя парами электронов (на 2s и на 2p-подуровне), которые в реакции не участвуют. Такие пары называются неподеленными электронными парами .
Изображение у атомов электронов валентного уровня называется структурами Льюиса . При этом рекомендуется электроны разных атомов изображать разными символами, например, · , *, и т.п.
Изображение порядка связывания атомов между собой получило название
структурных формул . При этом каждая пара электронов на письме заменяется валентным штрихом.
Структурные формулы веществ: H – H, H – O – H, O = O .
Лекция 3. Валентные возможности атомов. Ковалентная химическая связь
Количество ковалентных связей, которое образует данный элемент, называется
ковалентностью, или
валентностью данного элемента.
Валентность обозначается римскими цифрами .
Таким образом, на данном этапе валентность элемента определяется количеством неспаренных электронов, которые могут принять участие в образовании ковалентных связей.
Валентные возможности элементов.
1. Углерод.
В основном состоянии электронная конфигурация атома углерода 1s2 2s2 2p2 , из которых валентными являются 2s и 2p-электроны.
В таком состоянии атом углерода способен образовать 2 ковалентные связи по обменному
механизму.
Однако на практике стабильных соединений двухвалентного углерода не существует.
Вследствие небольшой разницы между 2s и 2p-
подуровнем атом углерода при небольших затратах энергии способен переходить в первое
возбужденное состояние (обозначается C*).
В таком состоянии атом углерода способен
образовать 4 ковалентные связи по обменному механизму.
Примерами стабильных молекул, в которых валентность углерода равна IV,
могут служить соединения с водородом, кислородом, …
Лекция 3. Валентные возможности атомов. Ковалентная химическая связь
Валентные возможности атомов. Ковалентная химическая связь
Оксид углерода (IV), | Циановодород, | Муравьиная | |||||||||||||||||||
Углекислый газ | Синильная кислота | ||||||||||||||||||||
Валентность углерода во всех соединениях равна IV, водорода – I, кислорода – II.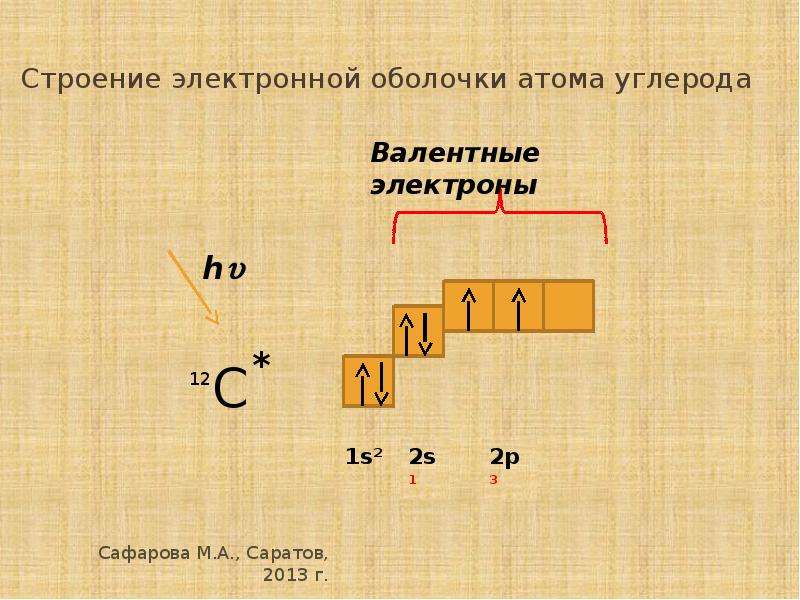
Ацетилен H–C ≡C–H – горючий газ, который используется для получения высокотемпературного пламени, например, при сварке.
Вывод : при наличии такой возможности (вакантных орбиталей) атомы способны распаривать свои валентные электроны с тем, чтобы увеличить свою ковалентность.
Донорно-акцепторный механизм образования ковалентной связи.
Математика – великая сила. Как следует из вышеизложенного, для образования химической связи требуется 2 электрона (общая электронная пара).
Очевидно, два электрона можно получить:
Однако существует и другое решение!
Донорно-акцепторный механизм образования ковалентной связи – способ образования ковалентной связи, при которой один атом (донор) предоставляет для образования связи пару электронов, а другой атом (акцептор) – вакантную (незанятую)
орбиталь.
Лекция 3. Валентные возможности атомов. Ковалентная химическая связь
Пример . Строение молекулы монооксида углерода (оксид углерода(II), угарный газ)
В молекуле монооксида углерода атомы углерода и кислорода связаны двумя ковалентными связями, образованными по обменному механизму
.
Однако, поскольку у атома углерода есть незаполненная орбиталь на 2p-подуровне, а у атома кислорода – неподеленная пара электронов, то образуется третья ковалентная связь по донорно-акцепторному механизму .
На письме донорно-акцепторный механизм изображают стрелкой, направленной от
атома-донора к атому-акцептору пары электронов.
Правильная структурная формула молекулы монооксида углерода.
Валентность кислорода III, валентность углерода III.
Тройная связь между атомами кислорода и углерода подтверждается значением
энергии связи углерод-кислород (значение ближе к энергии тройной связи, чем к
энергии двойной связи), данными спектральных методов анализа.
2. Валентные возможности атомов. Азот.
Атомы азота, кислорода и фтора существенно отличаются от своих электронных
аналогов вследствие отсутствия энергетического d -подуровня.
Электронная конфигурация атома азота 7 N 1s2 2s2 2p3 .
Валентные электроны 2s2
2p3
– 3 неспаренных электрона и 1 электронная пара.
очевидным, что кроме трёх связывающих пар, у атома азота располагается
1 неподелённая пара электронов (2s2 ).
Лекция 3. Валентные возможности атомов. Ковалентная химическая связь
Следовательно, атом азота способен выступать в качестве донора пары электронов.
В простейшем случае в роли акцептора выступает ПРОТОН: нам данный пример знаком по реакции аммиака с кислотами с образованием солей аммония .
Обратите внимание:
1. Акцептор должен иметь вакантную орбиталь (в данном случае атом водорода потерял электрон и располагает вакантной 1s-АО)
2. В ходе химической реакции заряд сохраняется (закон сохранения заряда!).
Грубейшей ошибкой является отсутствие заряда, так как атом азота не способен образовать по обменному механизму 4 связи.
3. Строение катиона аммония изображается в виде трех ковалентных связей N – H,
образованных по обменному механизму, обозначенных валентными штрихами, и
одной ковалентной связи, образованной по донорно-акцепторному механизму,
обозначенной стрелкой от атома азота к атому водорода. Положительный заряд должен быть изображен или на атоме азота (обычно над атомом), или частица Nh5
Положительный заряд должен быть изображен или на атоме азота (обычно над атомом), или частица Nh5
заключается в квадратные скобки и за скобками рисуют знак «+».
4. Максимальная валентность азота равна ЧЕТЫРЕМ – у атома всего 4 АО, три из которых содержат неспаренные электроны, а одна – электронную пару. Следующий энергетический уровень (3s) располагается слишком далеко, чтобы использовать его для образования связи, по поэтому атом азота не в состоянии образовать валентность V.
О более сложных случаях образования ковалентных связей атомом азота Вы узнаете немного позже.
Лекция 3. Валентные возможности атомов. Ковалентная химическая связь
3. Валентные возможности атомов. Сера.
Электроны валентного уровня атома серы в основном состоянии имеют конфигурацию
16 S … 3s 2 3p 4 – 2 электронных пары и 2 неспаренных электрона.
Вывод (правило октета ) 1 : при образовании химических соединений атомы элементов стремятся дополнить свою электронную конфигурацию до наиболее стабильной,
Например, в молекуле сероводорода атом серы образует октет электронов за счет двух связывающих пар с атомами водорода и двух неподелённых электронных пар
Правило октета НЕ является ОБЯЗАТЕЛЬНЫМ, непреложным – существует бесчисленное множество соединений, в молекулах которых правило октета не соблюдается для того или иного элемента, однако оно правильно предсказывает общую тенденцию к образованию соединений подобной стехиометрии.
Для соединений d -элементов существует соответствующее правило восемнадцати электронов , так как именно такое количество электронов соответствует полностью завершенной ns2 (n-1)d10 np6 – электронной оболочке.
1 Дублет – 2, триплет – 3, квартет – 4, квинтет – 5, секстет – 6, септет – 7, октет – 8. Таким образом, правило октета – это правило восьми электронов .
Количество ковалентных связей, которые может образовывать атом, называется валентностью элемента. Валентные возможности атомов обусловлены наличием валентных электронов на внешнем энергетическом уровне.
Все элементы планеты образованы атомами. Это мельчайшие частицы, состоящие из положительно заряженного ядра и отрицательно заряженных электронов. Ядро включает протоны и нейтроны. Электроны, притягиваемые ядром, располагаются и движутся по орбиталям на разном расстоянии от центра. Неравномерное положение электронов относительно ядра называется энергетическими уровнями.
Рис. 1. Строение атома.
В таблице Менделеева высшая валентность соответствует номеру группы, в которой находится элемент. Количество энергетических уровней совпадает с номером периода, электронов — с порядковым номером.
Рис. 2. Таблица Менделеева.
Валентные возможности
Чтобы оценить валентные возможности атомов химических элементов, необходимо подробно рассмотреть распределение электронов на энергетических уровнях.
Валентность соответствует числу неспаренных электронов, располагающихся на s- и р-орбиталях внешнего энергетического уровня. Валентные электроны атомов элементов, входящих в побочные группы периодической таблицы, располагаются на s-орбитали внешнего уровня и d-орбиталях, образующих внешний подуровень.
В обычном (стационарном) состоянии электроны занимают определённое положение в атоме. Стационарная электронная конфигурация зафиксирована в таблице Менделеева. При возбуждённом состоянии (реакции с другими элементами) энергия атома перераспределяется, и электроны меняют своё положение.
Рассмотрим пример. Атом фосфора в стационарном положении имеет электронную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 3 .
Это значит, что 15 электронов распределены по трём уровням. На внешнем уровне, включающем s- и p-орбитали, находятся пять валентных электронов. При этом три электрона на p-орбитали неспаренные, а два электрона на s-орбитали образуют пару. Соответственно, три неспаренных электрона могут образовывать ковалентные связи, и валентность фосфора равна трём.
Фосфор находится в V группе, главной подгруппе. Это значит, что в атоме находится пустой d-подуровень. В возбуждённом состоянии спаренные электроны s-уровня распариваются, и один электрон переходит на d-подуровень. Образуется пять свободных, неспаренных электронов. Соответственно, атом фосфора приобретает пятую валентность.
Рис. 3. Графическая электронная формула фосфора в обычном и возбуждённом состоянии.
Распаривание происходит с затратой энергии. Расход энергии компенсируется образованием ковалентных связей с высвобождением энергии.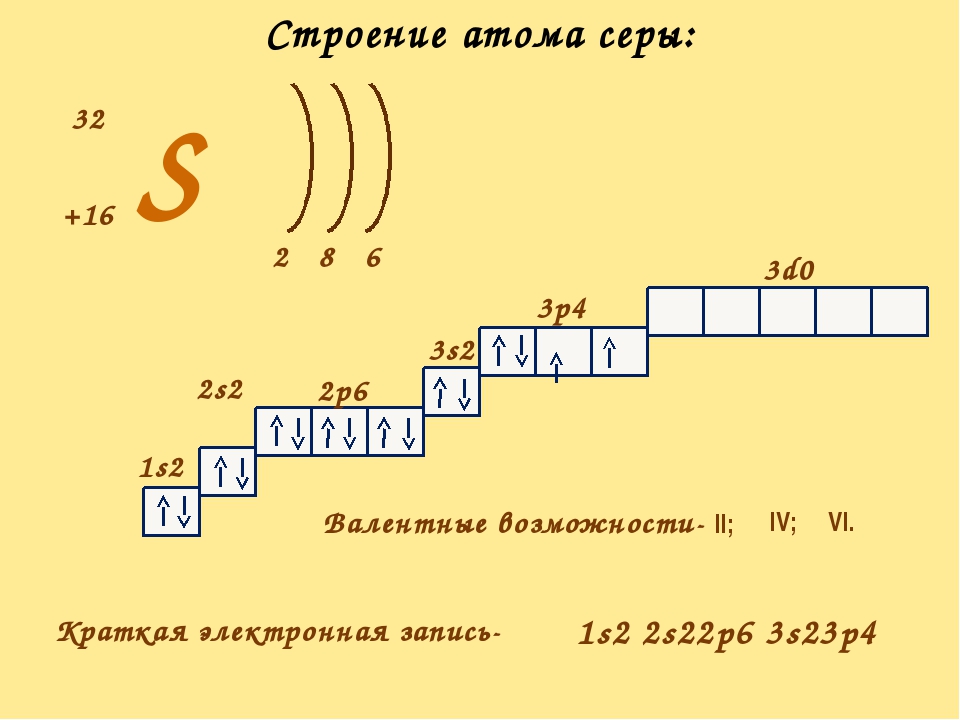
В зависимости от возможности переходить в возбуждённое состояние элементы делятся на две группы: с переменной и постоянной валентностью. Постоянную валентность (соответствует номеру группы) имеют щелочные, щелочноземельные металлы, фтор и алюминий. Переменная валентность присуща всем остальным элементам. Инертные газы не вступают в реакции, поэтому считается, что валентность у них отсутствует.
Что мы узнали?
Валентность показывает, сколько атомов может присоединить элемент посредством ковалентных связей. Значение валентности совпадает с количеством электронов на внешнем энергетическом уровне и соответствует номеру группы периодической таблицы, в которой находится элемент. Из-за возможности переходить в возбуждённое состояние большинство элементов имеют непостоянную валентность. Одинаковую валентность в любом состоянии сохраняют активные металлы и фтор.
Строение наружных энергетических уровней атомов химических элементов и определяет в основном свойства их атомов. Поэтому эти уровни называют валентными. Электроны этих уровней, а иногда и предвнешних уровней могут принимать участие в образовании химических связей. Такие электроны также называют валентными.
Поэтому эти уровни называют валентными. Электроны этих уровней, а иногда и предвнешних уровней могут принимать участие в образовании химических связей. Такие электроны также называют валентными.
Валентность атома химического элемента определяется в первую очередь числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентные электроны атомов элементов главных подгрупп расположены на s- и р-орбиталях внешнего электронного слоя. У элементов побочных подгрупп, кроме лантаноидов и актиноидов, валентные электроны расположены на s-орбитали внешнего и d-орбиталях предвнешнего слоев.
Для того чтобы верно оценить валентные возможности атомов химических элементов, нужно рассмотреть распределение электронов в них по энергетическим уровням и подуровням и определить число неспаренных электронов в соответствии с принципом Паули и правилом Хунда для невозбужденного (основного, или стационарного) состояния атома и для возбужденного (то есть получившего дополнительную энергию, в результате чего происходит распаривание электронов внешнего слоя и переход их на свободные орбитали).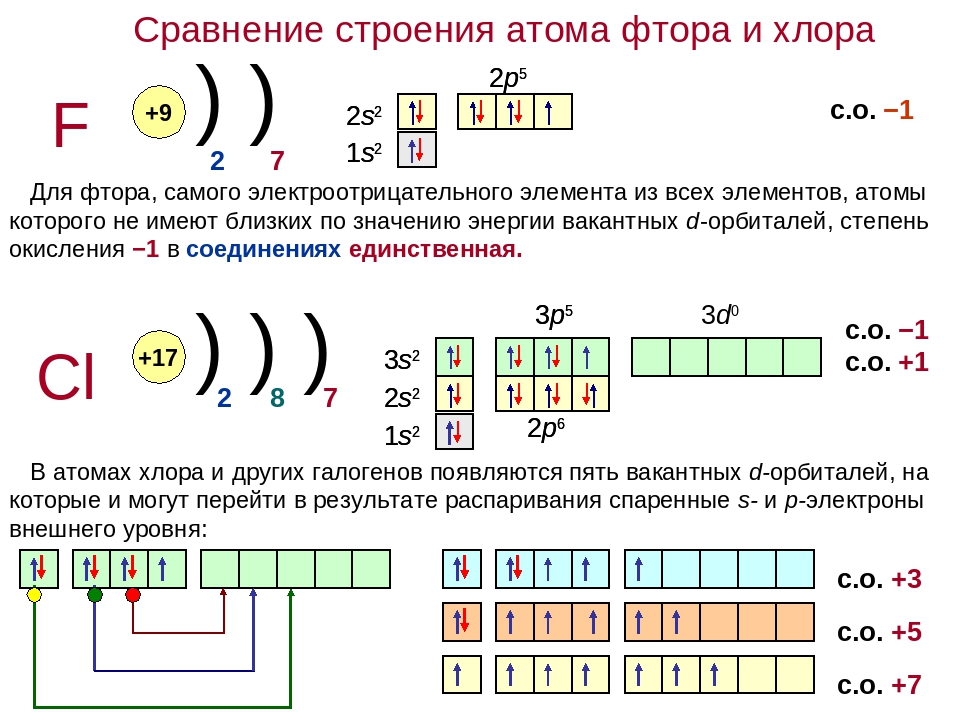 Атом в возбужденном состоянии обозначают соответствующим символом элемента со звездочкой. Например, рассмотрим валентные возможности атомов фосфора в стационарном и возбужденном состояниях:
Атом в возбужденном состоянии обозначают соответствующим символом элемента со звездочкой. Например, рассмотрим валентные возможности атомов фосфора в стационарном и возбужденном состояниях:
В невозбужденном состоянии атом фосфора имеет три не-спаренных электрона на р-подуровне. При переходе атома в возбужденное состояние один из пары электронов d-подуровня может переходить на свободную орбиталь d-подуровня. Валентность фосфора при этом изменяется с трех (в основном состоянии) до пяти (в возбужденном состоянии).
Разъединение спаренных электронов требует затрат энергии, так как спаривание электронов сопровождается понижением потенциальной энергии атомов. Вместе с тем расход энергии на перевод атома в возбужденное состояние компенсируется энергией, выделяющейся при образовании химических связей неспаренными электронами.
Так, атом углерода в стационарном состоянии имеет два неспаренных электрона. Следовательно, с их участием могут образоваться две общие электронные пары, осуществляющие две ковалентные связи. Однако вам хорошо известно, что во многих неорганических и во всех органических соединениях присутствуют атомы четырехвалентного углерода. Очевидно, что его атомы образовали четыре ковалентные связи в этих соединениях, находясь в возбужденном состоянии.
Однако вам хорошо известно, что во многих неорганических и во всех органических соединениях присутствуют атомы четырехвалентного углерода. Очевидно, что его атомы образовали четыре ковалентные связи в этих соединениях, находясь в возбужденном состоянии.
Затраты энергии на возбуждение атомов углерода с избытком компенсируются энергией, выделяющейся при образовании двух дополнительных ковалентных связей. Так, для перевода атомов углерода из стационарного состояния 2s 2 2р 2 в возбужденное — 2s 1 2р 3 требуется затратить около 400 кДж/моль энергии. Но при образовании С-Н-связи в предельных углеводородах выделяется 360 кДж/моль. Следовательно, при образовании двух молей С-Н-связей выделится 720 кДж, что превышает энергию перевода атомов углерода в возбужденное состояние на 320 кДж/моль.
В заключение следует отметить, что валентные возможности атомов химических элементов далеко не исчерпываются числом неспаренных электронов в стационарном и возбужденном состояниях атомов. Если вы вспомните донорно-ак-цепторный механизм образования ковалентных связей, то вам станут понятны и две другие валентные возможности атомов химических элементов, которые определяются наличием свободных орбиталей и наличием неподеленных электронных пар, способных дать ковалентную химическую связь по донор-но-акцепторному механизму. Вспомните образование иона аммония Nh5+. (Более подробно мы рассмотрим реализацию этих валентных возможностей атомами химических элементов при изучении химической связи.) Сделаем общий вывод.
Вспомните образование иона аммония Nh5+. (Более подробно мы рассмотрим реализацию этих валентных возможностей атомами химических элементов при изучении химической связи.) Сделаем общий вывод.
Сколько валентных электронов в атоме фосфора
Ответ: нейтральный атом фосфора имеет пять валентных электронов. Они содержатся на третьем энергетическом уровне атома.| Элемент фосфор, как он представлен в современной периодической таблице. Источник |
Боровская модель атома фосфора. |
| Электронная конфигурация фосфора с диаграммой Льюиса сбоку. Источник |
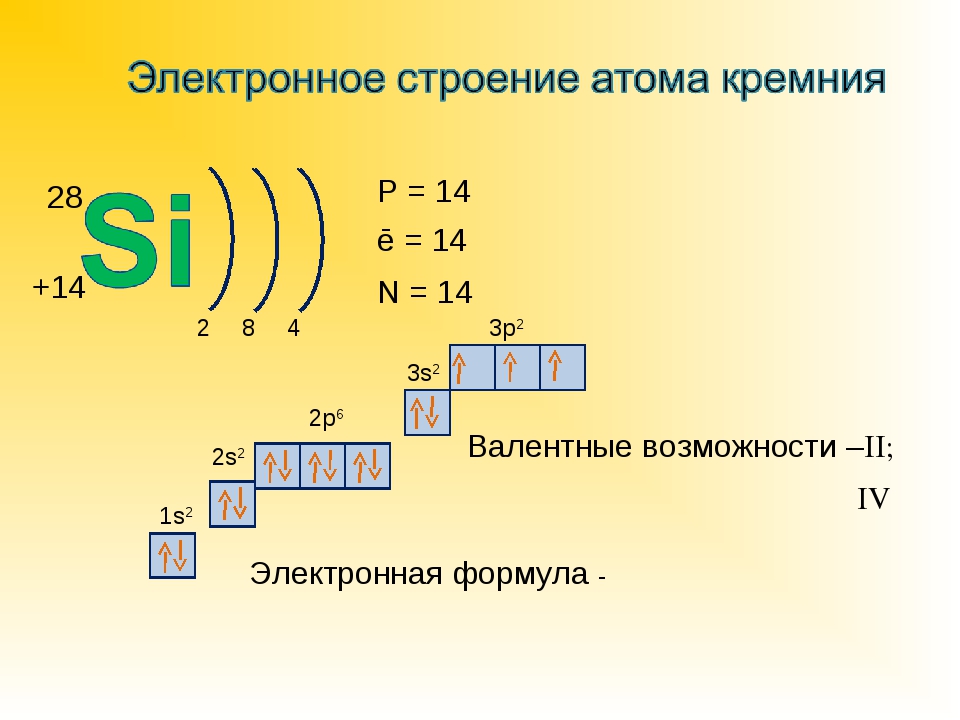 Следовательно, фосфор имеет более высокую ионизацию, чем его соседи по группе 16 (халькоген), сера.
Следовательно, фосфор имеет более высокую ионизацию, чем его соседи по группе 16 (халькоген), сера.| Фосфор в процессе биохимического процесса. Источник |
Источники:
http://thechemistryguru.com/phosphorus/
Периодическая таблица в KnowledgeDoor
Ссылки (Щелкните рядом со значением выше, чтобы увидеть полную информацию о цитировании этой записи)
Олбрайт, Томас А. и Джереми К. Бёрдетт. Проблемы теории молекулярных орбиталей. Нью-Йорк: Oxford University Press, 1992.
Аллен, Леланд К. «Электроотрицательность — это средняя энергия одного электрона
Электроны валентной оболочки в основных свободных атомах.»Журнал Американского химического общества, том 111, номер 25, 1989 г., стр. 9003–9014. Doi: 10.1021 /
«Электроотрицательность — это средняя энергия одного электрона
Электроны валентной оболочки в основных свободных атомах.»Журнал Американского химического общества, том 111, номер 25, 1989 г., стр. 9003–9014. Doi: 10.1021 /
Аллен, Леланд К.» Электроотрицательность — это средняя энергия одного электрона
электроны валентной оболочки в основных свободных атомах ». Журнал Американского химического общества, том 111, номер 25, 1989 г., стр. 9003–9014. doi: 10.1021 /
Allred, AL« Значения электроотрицательности из термохимических Данные. «Журнал неорганической и ядерной химии, том 17, номер 3-4, 1961 г., стр.215–221. DOI: 10.1016 /
Allred, A. L. и E. G. Rochow. «Шкала электроотрицательности, основанная на
Электростатическая сила ». Журнал неорганической и ядерной химии, том 5, номер 4, 1958, стр. 264–268. DOI: 10.1016 /
Андерс, Эдвард и Николас Гревесс.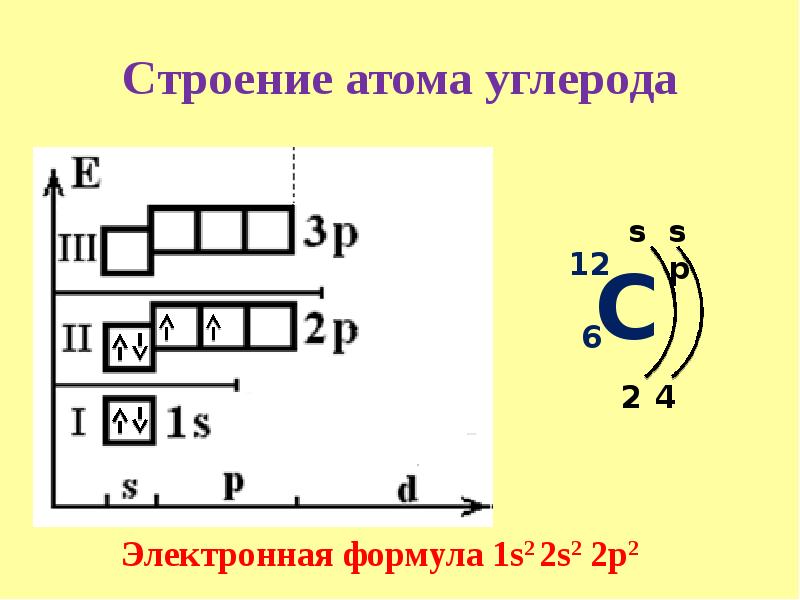 «Изобилие стихий:
Метеоритные и солнечные ». Geochimica et Cosmochimica Acta, volume 53, number 1, 1989, pp. 197–214. Doi: 10.1016 /
«Изобилие стихий:
Метеоритные и солнечные ». Geochimica et Cosmochimica Acta, volume 53, number 1, 1989, pp. 197–214. Doi: 10.1016 /
Andersen, T., Х. К. Хауген и Х. Хотоп. «Энергии связи в атомных отрицательных ионах: III». Справочный журнал физических и химических данных, том 28, номер 6, 1999 г., стр. 1511–1533.
Барсан, Майкл Э., редактор. Карманный справочник NIOSH по химической опасности. Цинциннати, Огайо: NIOSH Publications, 2007.
Бацанов С.С. «Ван-дер-Ваальсовые радиусы элементов». Неорганические материалы, том 37, номер 9, 2001 г., стр. 871–885. См. Реферат
Bearden, J. A., and A. F. Burr. «Переоценка рентгеновских уровней атомной энергии.»Обзоры современной физики, том 39, номер 1, 1967, стр. 125–142. Doi: 10.1103 /
Бонди, А.» Ван-дер-Ваальсовые объемы и радиусы. «Журнал физической химии, том 68, номер 3, 1964, стр. 441–451. doi: 10.1021 /
Bowen, HJM Environment Chemistry of the Elements.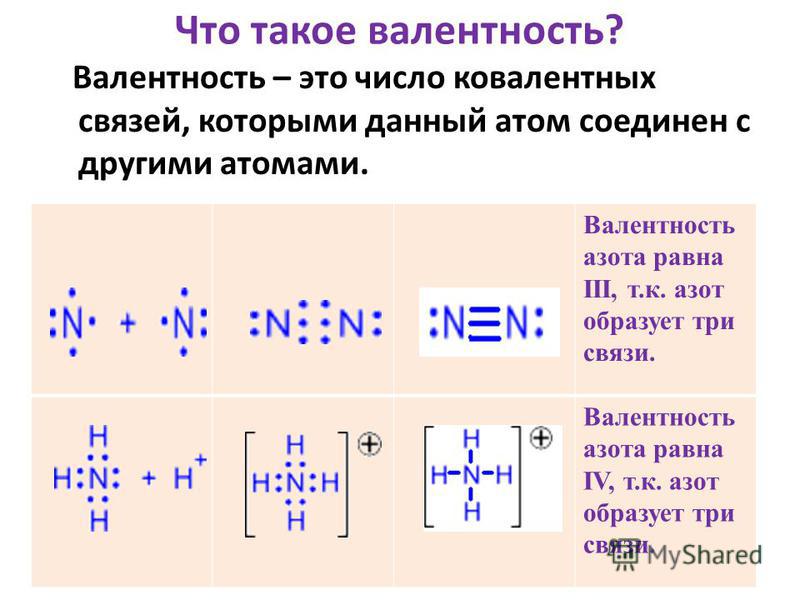 Лондон: Academic Press, Inc., 1979.
Лондон: Academic Press, Inc., 1979.
Boyd, Russell J., и Кеннет Э. Эджкомб. «Атомные и групповые электроотрицательности из распределения электронной плотности молекул.»Журнал Американского химического общества, том 110,
№ 13, 1988 г., стр. 4182–4186. doi: 10.1021 /
Братч, Стивен Г. «Пересмотренные значения электроотрицательности Малликена: I. Расчет и преобразование в единицы Полинга». Журнал химии
Образование, том 65, номер 1, 1988 г., стр. 34–41. DOI: 10.1021 /
Cardarelli, François. Справочник по материалам: Краткий настольный справочник, 2-е издание. Лондон: Springer – Verlag, 2008.
.Кардона, М., и Л. Лей, редакторы. Фотоэмиссия в твердых телах I: общие принципы. Берлин: Springer-Verlag, 1978.
Шовен, Реми. «Явный периодический тренд радиусов Ван-дер-Ваальса». Журнал физической химии, том 96, номер 23, 1992 г., стр. 9194–9197. DOI: 10.1021 /
Clementi, E., and D. L. Raimondi. «Константы атомарного экранирования из функций SCF». Журнал химической физики, том 38, номер 11, 1963 г., стр. 2686–2689. DOI: 10,1063 /
L. Raimondi. «Константы атомарного экранирования из функций SCF». Журнал химической физики, том 38, номер 11, 1963 г., стр. 2686–2689. DOI: 10,1063 /
Коэн, Э.Ричард, Дэвид Р. Лид и Джордж Л. Тригг, редакторы. Настольный справочник по физике AlP, 3-е издание. Нью-Йорк: Springer-Verlag New York, Inc., 2003.
Коннелли, Нил Г., Туре Дамхус, Ричард М. Хартсхорн и Алан Т. Хаттон. Номенклатура неорганической химии: Рекомендации ИЮПАК 2005. Кембридж: RSC Publishing, 2005.
Кордеро, Беатрис, Вероника Гомес, Ана Э. Платеро-Пратс, Марк Ревес, Хорхе Эчеверриа, Эдуард Кремадес, Флавиа Барраган и Сантьяго Альварес. «Новый взгляд на ковалентные радиусы.»Dalton Transactions, номер 21, 2008 г., стр. 2832–2838. Doi: 10.1039 /
Cox, PA The Elements: их происхождение, изобилие и распространение. Oxford: Oxford University Press, 1989.
de Podesta, Michael» . Понимание свойств материи, 2-е издание. Лондон: Тейлор и Фрэнсис, 2002.
Донохью, Джерри. Структуры элементов, 2-е издание. Малабар, Флорида: издательство Robert E. Krieger Publishing Company, 1974.
Dronskowski, Richard.Вычислительная химия твердотельных материалов. Вайнхайм, Германия: WILEY-VCH Verlag GmbH & Co. KGaA, 2005.
Эббинг, Даррелл Д. и Стивен Д. Гаммон. Общая химия, 8-е издание. Бостон, Массачусетс: Компания Houghton Mifflin, 2005.
.Эмсли, Джон. Строительные блоки природы: руководство по элементам от А до Я. Оксфорд: Издательство Оксфордского университета, 2003.
Эмсли, Джон. Элементы, 3-е издание. Oxford: Oxford University Press, 1998.
Файерстоун, Ричард Б. Таблица изотопов, 8-е издание, том 2.Под редакцией Вирджинии С. Ширли с помощниками редакторов Корал М. Бэглин, С. Ю. Фрэнк Чу и Джин Зипкин. Нью-Йорк: John Wiley & Sons, Inc., 1996.
Галассо, Фрэнсис С. Структура и свойства неорганических твердых тел. Oxford: Pergamon Press, 1970.
Ghosh, Dulal C., and Kartick Gupta. «Новая шкала электроотрицательности 54 элементов периодической таблицы, основанная на поляризуемости атомов». Журнал теоретической и вычислительной химии, том 5, номер 4, 2006 г., стр. 895–911.DOI: 10.1142 /
Журнал теоретической и вычислительной химии, том 5, номер 4, 2006 г., стр. 895–911.DOI: 10.1142 /
Грин, Дон В., редактор. Справочник инженеров-химиков Перри, 8-е издание. Нью-Йорк: McGraw-Hill Companies, Inc., 2008.
Гринвуд, Н. Н. и А. Эрншоу. Химия элементов, 2-е издание. Берлингтон, Массачусетс: Баттерворт-Хайнеманн, 1997.
.Гринвуд, Н. Н. и А. Эрншоу. Химия элементов, 2-е издание. Оксфорд: Баттерворт-Хайнеманн, 1997.
Гвин Уильямс. Энергии связи электронов. http: //
Хо, К. Ю., Р. У. Пауэлл и П. Э. Лили. «Теплопроводность элементов: всесторонний обзор». Справочный журнал физических и химических данных, том 3, приложение 1, 1974 г., стр. С I – 1 по I – 796.
Хорват, А. Л. «Критическая температура элементов и периодическая система». Журнал химического образования, том 50, номер 5, 1973 г., стр. 335–336. DOI: 10. 1021 /
1021 /
Хухи, Джеймс Э., Эллен А. Кейтер и Ричард Л. Кейтер. Неорганическая химия: принципы структуры и реакционной способности, 4-е издание. Нью-Йорк: издательство HarperCollins College, 1993.
Ihde, Аарон Дж. Развитие современной химии. Нью-Йорк: Dover Publications, Inc., 1984.
Международная организация труда (МОТ). Международная карта химической безопасности белого фосфора. http: //
Международная организация труда (МОТ). Международная карта химической безопасности белого фосфора. http: //  htm
htm
Карудзава, М., М. Исидзука и С. Эндо. «Влияние давления на температуру сверхпроводящего перехода черного фосфора.»Journal of Physics: Condensed Matter, volume 14, number 44, 2002, 10759. doi: 10.1088 /
Киттель, Чарльз. Введение в физику твердого тела. , 8-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc, 2005.
Краузе, Миссури «Атомное излучение и Безызлучательные выходы для оболочек K и L «. Справочный журнал физических и химических данных, том 8, номер 2, 1979, стр. 307–327.
Ли, Вай-Ки, Гонг-Ду Чжоу и Томас Мак.Расширенная структурная неорганическая химия. Oxford: Oxford University Press, 2008.
Li, Y.-H., and J. E. Schoonmaker. «Химический состав и минералогия Морские отложения. «Стр. 1–36 в Отложениях, диагенезе и осадочных породах. Под редакцией Фреда Т. Маккензи. Оксфорд: Elsevier Ltd., 2005.
Либофф, Ричард Л. Введение в квантовую механику, 3-е издание. Чтение, Массачусетс. : Addison Wesley Longman, Inc., 1998.
Введение в квантовую механику, 3-е издание. Чтение, Массачусетс. : Addison Wesley Longman, Inc., 1998.
Лиде, Дэвид Р., редактор, Справочник CRC по химии и физике, 88-е издание.Бока-Ратон, Флорида: Taylor & Francis Group, 2008.
Маделунг, О., У. Рёсслер и М. Шульц, редакторы. Нететраэдрически связанные элементы и бинарные соединения I. Берлин: Springer-Verlag, 1998. doi: 10.1007 /
Маделунг, Отфрид, редактор. Полупроводники — основные Данные, 2-е издание. Берлин: Springer – Verlag, 1996.
Манн, Джозеф Б., Терри Л. Мик и Леланд К. Аллен. «Энергии конфигурации основных элементов группы». Журнал Американского химического общества, том 122, номер 12, 2000 г., стр.2780–2783. DOI: 10.1021 /
Мануэль О., редактор. Происхождение элементов в Солнечной системе: последствия наблюдений после 1957 года. Нью-Йорк: Kluwer Academic Publishers, 2000.
Маршалл, Джеймс Л. Открытие элементов: поиск фундаментальных принципов Вселенной, 2-е издание. Бостон, Массачусетс: Pearson Custom Publishing, 2002.
Бостон, Массачусетс: Pearson Custom Publishing, 2002.
Мартин, У. К. «Электронная структура элементов». Европейский физический журнал C — Частицы и поля, том 15, номер 1–4, 2000 г., стр.78–79. DOI: 10.1007 /
Мартин В. К., Ромуальд Залубас и Арлин Масгроув. «Уровни энергии фосфора, P I — P XV». Справочный журнал физических и химических данных, том 14, номер 3, 1985 г., стр. 751–802.
Макдонаф, У. Ф. «Композиционная модель ядра Земли». стр. 547–568 в The Mantle and Core. Под редакцией Ричарда В. Карлсона. Oxford: Elsevier Ltd., 2005.
Mechtly, Eugene A. «Свойства материалов». С. 4–1–4–33 в Справочных данных для инженеров: радио, электроника, компьютер и связь.Мак Э. Ван Валкенбург, отредактированный Венди М. Миддлтон. Уоберн, Массачусетс: Баттерворт-Хайнеманн, 2002. DOI: 10.1016 /
Мисслер, Гэри Л. и Дональд А. Тарр. Неорганическая химия, 3-е издание. Река Аппер Сэдл, Нью-Джерси: Пирсон Прентис Холл, 2004.
Нэгл, Джеффри К. «Атомная поляризуемость и электроотрицательность». Журнал Американского химического общества, том 112,
№ 12, 1990, с. 4741–4747. DOI: 10.1021 /
Национальный институт профессиональной безопасности и здоровья (NIOSH).Международная карта химической безопасности белого фосфора. http: //
Национальный институт безопасности и гигиены труда (NIOSH). Международная карта химической безопасности белого фосфора. http: //
Национальный институт безопасности и гигиены труда (NIOSH).Реестр токсических эффектов химических веществ для белых
Фосфор. http: //
Орем, У. Х. и Р. Б. Финкельман. «Угледобыча и геохимия».
С. 191–222 в Отложениях, диагенезе и осадочных породах. Под редакцией Фреда Т. Маккензи. Oxford: Elsevier Ltd., 2005.
Х. и Р. Б. Финкельман. «Угледобыча и геохимия».
С. 191–222 в Отложениях, диагенезе и осадочных породах. Под редакцией Фреда Т. Маккензи. Oxford: Elsevier Ltd., 2005.
Oxtoby, Дэвид У., Х. П. Гиллис и Алан Кэмпион. Принципы современной химии, 6-е издание.Бельмонт, Калифорния: Томсон Брукс / Коул, 2008.
Палм, Х. и Хью Сент-К. О’Нил. «Космохимические оценки состава мантии». стр. 1–38 в The Mantle и Core. Под редакцией Ричарда В. Карлсона. Оксфорд: Elsevier Ltd., 2005.
Полинг, Линус. Природа химической связи, 3-е издание. Итака, Нью-Йорк: издательство Корнельского университета, 1960.
Пирсон, Ральф Г. «Абсолютная электроотрицательность и твердость: применение к неорганической химии». Неорганическая химия, том 27, номер 4, 1988 г., стр. 734–740.DOI: 10.1021 /
Pekka Pyykkö. Самосогласованные ковалентные радиусы 2009 г. http: // 
Pyykkö, Pekka, and Michiko Atsumi. «Ковалентные радиусы молекул с двойной связью для элементов Li-E112». Химия — Европейский журнал, том 15, номер 46, 2009 г., стр. 12770–12779. DOI: 10.1002 /
Pyykkö, Pekka и Michiko Atsumi.«Молекулярные ковалентные радиусы одинарных связей для элементов 1-118». Химия — Европейский журнал, том 15, номер 1, 2009 г., стр. 186–197. doi: 10.1002 /
Pyykkö, Pekka, Sebastian Riedel и Michael Patzschke. «Ковалентные радиусы с тройной связью». Химия — Европейский журнал, том 11, номер 12, 2005 г., стр. 3511–3520. DOI: 10.1002 /
Рингнес, Виви. «Происхождение названий химических элементов». Журнал химического образования, том 66, номер 9, 1989 г., стр.731–738. DOI: 10.1021 /
Рорер, Грегори С. Структура и связь в кристаллических материалах. Кембридж: Издательство Кембриджского университета, 2001.
Сандерсон Р. Т. Простые неорганические вещества. Малабар, Флорида: Роберт Э. Кригер Publishing Co., Inc., 1989.
Т. Простые неорганические вещества. Малабар, Флорида: Роберт Э. Кригер Publishing Co., Inc., 1989.
Сандерсон, Р. Т. «Принципы электроотрицательности: Часть I. Общая природа». Журнал химического образования, том 65,
№ 2, 1988, с. 112–118. DOI: 10.1021 /
Сандерсон, Р.Т. Полярная ковалентность. Нью-Йорк: Academic Press, Inc., 1983.
Sansonetti, J. E., and W. C. Martin. «Справочник основных данных атомной спектроскопии». Справочный журнал физических и химических данных, том 34, номер 4, 2005 г., стр. 1559–2259. doi: 10.1063 /
Шеннон Р. Д. «Пересмотренные эффективные ионные радиусы и систематические исследования межатомных расстояний в галогенидах и халькогенидах». Acta Crystallographica Раздел A, том 32, номер 5, 1976 г., стр. 751–767. DOI: 10.1107/
Силби, Роберт Дж., Роберт А. Олберти и Мунги Г. Бавенди. Физическая химия, 4-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc. , 2005.
, 2005.
Сингман, Чарльз Н. «Атомный объем и аллотропия элементов». Журнал химического образования, том 61, номер 2, 1984 г.,
С. 137–142. DOI: 10.1021 /
Слейтер, Дж. К. «Атомные радиусы в кристаллах». Журнал химической физики, том 41, номер 10, 1964 г., стр.3199–3204. doi: 10.1063 /
Смит, Дерек В. «Электроотрицательность в двух измерениях: переоценка и разрешение парадокса Пирсона-Полинга». Журнал химического образования, том 67, номер 11, 1990 г., стр. 911–914. DOI: 10.1021 /
Смит, Дерек В. Неорганические вещества: прелюдия к изучению описательной неорганической химии. Кембридж: Издательство Кембриджского университета, 1990.
Спейт, Стандартные таблицы и формулы Джеймса Г. Перри. для инженеров-химиков.Нью-Йорк: McGraw-Hill Companies, Inc., 2003.
Министерство транспорта США (DOT), Транспорт Канады (TC), Секретариат транспорта и коммуникаций Мексики (SCT) и Centro de Información Química para Emergencias (CIQUIME ). Руководство по реагированию на чрезвычайные ситуации 2008 г.
Руководство по реагированию на чрезвычайные ситуации 2008 г.
Вайнштейн, Борис К., Владимир М. Фридкин, Владимир Л. Инденбом. Структура кристаллов, 2-е издание. Современная кристаллография 2. Под ред. Б. К. Вайнштейна, А. А. Чернова, Л. А. Шувалова. Берлин: Springer-Verlag, 1995.
Фойгт, Х. Х., редактор. Ландольт – Бёрнштейн — Астрономия и астрофизика VI группы. Берлин: Springer – Verlag, 1993.
Waber, J. T., and Don T. Cromer. «Радиусы орбиты атомов и ионов». Журнал химической физики, том 42, номер 12, 1965, стр. 4116–4123. DOI: 10.1063 /
Уолдрон, Кимберли А., Эрин М. Ферингер, Эми Э. Стриб, Дженнифер Э. Троски и Джошуа Дж. Пирсон. «Процент скрининга, основанный на эффективном
Ядерный заряд как универсальный инструмент обучения периодическим тенденциям.»Журнал химического образования, том 78, номер 5, 2001 г., стр. 635–639. DOI: 10.1021 /
Weeks, Мэри Эльвира и Генри М. Лестер. Открытие
Элементы, 7-е издание. Истон, Пенсильвания: Журнал химического образования, 1968.
Истон, Пенсильвания: Журнал химического образования, 1968.
Визер, Майкл Э. и Тайлер Б. Коплен. «Атомный вес элементов 2009 (Технический отчет IUPAC)». Чистый и прикладной
Химия, том 83, номер 2, 2011 г., стр. 359–396. DOI: 10.1351 /
Yaws, Carl L.«Плотность жидкости в элементах». Химическая инженерия, том 114, номер 12, 2007 г., стр. 44–46.
Yaws, Карл Л. Справочник по физическим свойствам углеводородов и химикатов Yaws. Хьюстон, Техас: Gulf Publishing Company, 2005.
Янг, К. Ф. и Х. П. Р. Фредерикс. «Составление статической диэлектрической проницаемости неорганических Твердые вещества ». Журнал физических и химических справочных данных, том 2, номер 2, 1973, стр. 313–409.
Химия азота и фосфора
Химия Азот и фосфор
The Химия азота
В химии азота преобладает легкость, с которой
атомы азота образуют двойные и тройные связи. Нейтральный азот
Атом содержит пять валентных электронов: 2 с 2 2 p 3 .
Следовательно, атом азота может достигать октета валентности.
электронов, разделив три пары электронов с другим
атом азота.
Нейтральный азот
Атом содержит пять валентных электронов: 2 с 2 2 p 3 .
Следовательно, атом азота может достигать октета валентности.
электронов, разделив три пары электронов с другим
атом азота.
Поскольку ковалентный радиус атома азота относительно маленькие (всего 0,070 нм), атомы азота подходят достаточно близко друг к другу образовывать очень прочные связи. Энтальпия диссоциации связи для тройная связь азот-азот составляет 946 кДж / моль, что почти вдвое больше большой, как для двойной связи O = O.
Прочность тройной связи азот-азот делает N 2 молекула очень инертная. N 2 настолько инертен, что литий один из немногих элементов, с которыми он реагирует в комнате температура.
| 6 Li ( с ) | + | N 2 ( г ) | 2 Li 3 Н ( с ) |
Несмотря на то, что молекула N 2 является
инертные, соединения, содержащие азот, существуют практически
все элементы периодической таблицы, кроме элементов группы VIIIA
(Он, Не, Ар и т. Д.).Это можно объяснить двумя способами.
Во-первых, N 2 становится значительно более реактивным, чем
температура повышается. При высоких температурах азот реагирует с
водород с образованием аммиака и с кислородом с образованием оксида азота.
Д.).Это можно объяснить двумя способами.
Во-первых, N 2 становится значительно более реактивным, чем
температура повышается. При высоких температурах азот реагирует с
водород с образованием аммиака и с кислородом с образованием оксида азота.
| N 2 ( г ) | + | 3 H 2 ( г ) | 2 NH 3 ( г ) | |
| N 2 ( г ) | + | О 2 ( г ) | 2 НО ( г ) |
Во-вторых, ряд катализаторов, встречающихся в природе, преодолевают инертность N 2 при низких температурах.
Синтез Аммиак
Трудно представить себе живую систему, которая не
содержат азот, который является важным компонентом
белки, нуклеиновые кислоты, витамины и гормоны, которые делают жизнь
возможный. Животные получают необходимый им азот из растений
или других животных в их рационе. Растения должны собирать свои
азота из почвы или абсорбировать его как N 2 из
Атмосфера.Концентрация азота в почве довольно высокая.
маленький, поэтому процесс, с помощью которого растения восстанавливают N 2 до NH 3 или
«исправить» N 2 чрезвычайно важно.
Животные получают необходимый им азот из растений
или других животных в их рационе. Растения должны собирать свои
азота из почвы или абсорбировать его как N 2 из
Атмосфера.Концентрация азота в почве довольно высокая.
маленький, поэтому процесс, с помощью которого растения восстанавливают N 2 до NH 3 или
«исправить» N 2 чрезвычайно важно.
Хотя 200 миллионов тонн NH 3 производит азотфиксации каждый год, растения сами по себе не могут уменьшить N 2 к NH 3 . Эта реакция осуществляется сине-зеленые водоросли и бактерии, связанные с определенными растения.Наиболее понятный пример азотфиксации включает: бактерии ризобий, обнаруженные в корневых клубеньках бобовых, таких как клевер, горох и фасоль. Эти бактерии содержат нитрогеназу. фермент, который способен замечательно восстанавливать N 2 из атмосферы в NH 3 при комнатной температуре.
Аммиак сначала производится в промышленных масштабах с помощью технологического процесса. разработан между 1909 и 1913 годами Фрицем Габером. В Haber
процесс , смесь N 2 и H 2 газ при 200-300 атм и 400-600 o C пропускается
катализатор из мелкодисперсного металлического железа.
разработан между 1909 и 1913 годами Фрицем Габером. В Haber
процесс , смесь N 2 и H 2 газ при 200-300 атм и 400-600 o C пропускается
катализатор из мелкодисперсного металлического железа.
| Fe | |||||
| N 2 ( г ) | + | 3 H 2 ( г ) | 2 NH 3 ( г ) |
Почти 20 миллионов тонн NH 3 производится в
Соединенные Штаты каждый год этим процессом.Около 80% этого стоит
более 2 миллиардов долларов используется для производства удобрений для растений, которые
не может исправить азот из атмосферы. Исходя из веса,
аммиак — второй по важности промышленный химикат в
Соединенные Штаты. (Только серная кислота производится в больших
количества.)
Исходя из веса,
аммиак — второй по важности промышленный химикат в
Соединенные Штаты. (Только серная кислота производится в больших
количества.)
Две трети аммиака, используемого для производства удобрений, перерабатывается. в твердые вещества, такие как нитрат аммония, NH 4 NO 3 ; фосфат аммония, (NH 4 ) 3 PO 4 ; сульфат аммония, (NH 4 ) 2 SO 4 ; и мочевина, H 2 NCONH 2 .Другая треть применяется прямо в почву как безводный (буквально, «без воды») аммиак. Аммиак — это газ в комнате температура. С ним можно обращаться как с жидкостью при растворении в вода с образованием водного раствора. В качестве альтернативы это может быть охлаждается до температуры ниже -33 o ° C, в этом случае газ конденсируется с образованием безводной жидкости NH 3 ( л ).
Синтез Азотная кислота
NH 3 , произведенный по технологии Габера, не
используется как удобрение, сжигается в кислороде для производства азота
окись.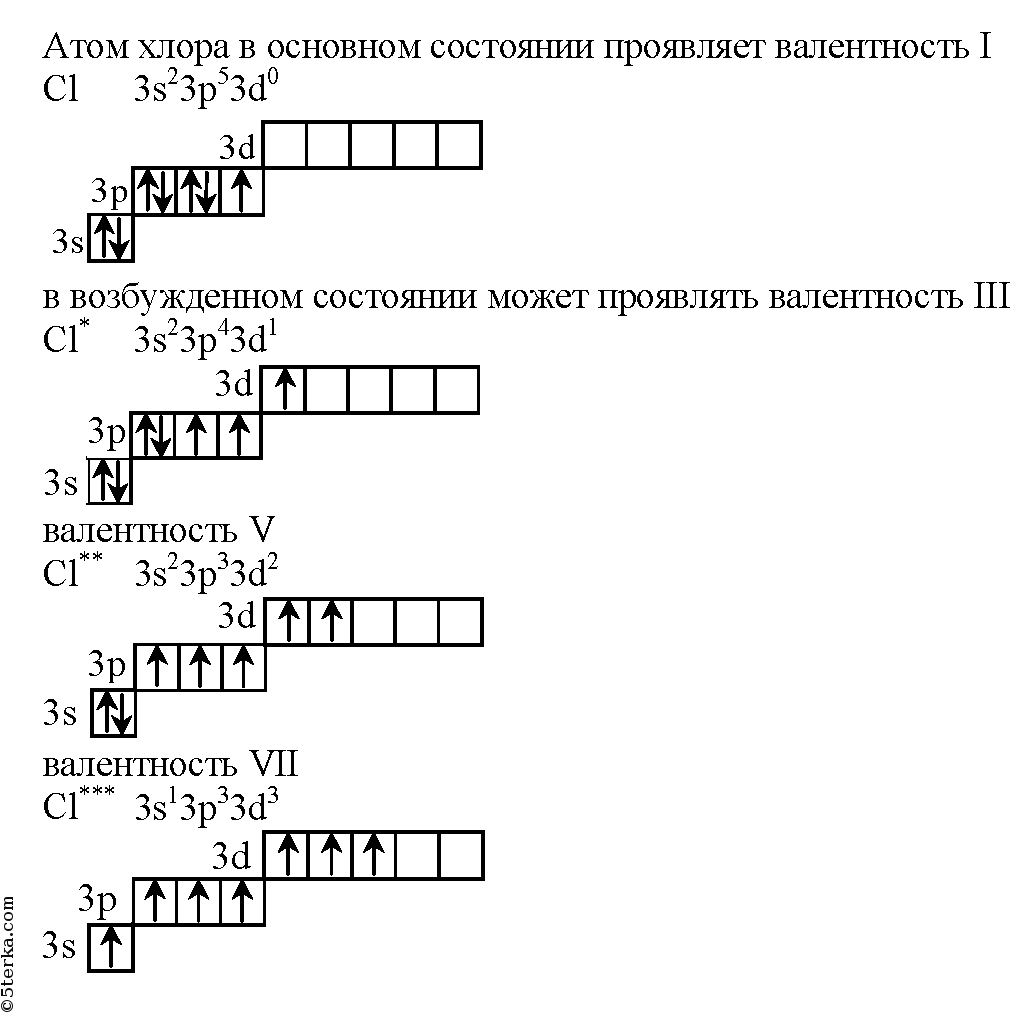
| 4 NH 3 ( г ) | + | 5 O 2 ( г ) | 4 НО ( г ) | + | 6 H 2 O ( г ) |
Оксид азота или оксид азота, как раньше было известно, является бесцветный газ, который быстро реагирует с кислородом с образованием азота диоксид, темно-коричневый газ.
| 2 НЕТ ( г ) | + | О 2 ( г ) | 2 НО 2 ( г ) |
Двуокись азота растворяется в воде с образованием азотной кислоты и НЕТ, который может быть уловлен и переработан.
| 3 НО 2 ( г ) | + | H 2 O ( л ) | 2 HNO 3 ( водн. ) ) | + | НЕТ ( г ) |
Таким образом, с помощью трехэтапного процесса, разработанного Фридрихом Оствальдом в 1908 г. аммиак можно превратить в азотную кислоту.
| 4 NH 3 ( г ) | + | 5 O 2 ( г ) | 4 НЕТ ( г ) | + | 6 H 2 O ( г ) | |
| 2 НЕТ ( г ) | + | O 2 ( г ) | 2 НЕТ 2 ( г ) | |||
| 3 НЕТ 2 ( г ) | + | H 2 O ( л ) | 2 HNO 3 ( водн. ) ) | + | НЕТ ( г ) |
Процесс Габера для синтеза аммиака в сочетании с процесс Оствальда для преобразования превращение аммиака в азотную кислоту произвело революцию в индустрии взрывчатых веществ.Нитраты были важным взрывчатым веществом со времен брата Роджера. Бэкон смешал серу, селитру и порошкообразный уголь, чтобы получить порох 1245.
| 16 KNO 3 ( s ) | + | S 8 ( S ) | + | 24 ° C ( с ) | 8 К 2 S ( с ) | + | 24 CO 2 ( г ) | + | 8 N 2 ( г ) | H o = -571. 9 кДж / моль N 2 9 кДж / моль N 2 |
До того, как был разработан процесс Оствальда, единственный источник нитраты для использования во взрывчатых веществах — это природные минералы например селитра, которая представляет собой смесь NaNO 3 и KNO 3 . Как только надежный запас азотной кислоты стал доступен из Процесс Оствальда, ряд нитратов может быть использован в качестве взрывчатые вещества. Объединение NH 3 из процесса Габера с HNO 3 из процесса Оствальда, например, дает аммиачная селитра, которая одновременно является отличным удобрением и дешевое и надежное взрывчатое вещество, обычно используемое в порохе.
| 2 NH 4 NO 3 ( с ) | 2 N 2 ( г ) | + | О 2 ( г ) | + | 4 H 2 O ( г ) |
Разрушающая сила аммиачной селитры составляет
видно на фотографиях федерального здания им. Альфреда П. Мурры.
в Оклахома-Сити, который был разрушен бомбой, сделанной из
аммиачная селитра 19 апреля 1995 г.
Альфреда П. Мурры.
в Оклахома-Сити, который был разрушен бомбой, сделанной из
аммиачная селитра 19 апреля 1995 г.
Средний Номера окисления
Азотная кислота (HNO 3 ) и аммиак (NH 3 ) представляют собой максимальное (+5) и минимальное (-3) степени окисления для азот. Азот также образует соединения при каждом окислении. число между этими крайними значениями (см. таблицу ниже).
Общие числа окисления азота
| Окисление Число | Примеры | |
| -3 | NH 3 , NH 4 + , NH 2 — , Мг 3 N 2 | |
| -2 | N 2 H 4 | |
| -1 | NH 2 OH | |
| -1/3 | NaN 3 , HN 3 | |
| 0 | N 2 | |
| +1 | N 2 O | |
| +2 | НЕТ, N 2 O 2 | |
| +3 | HNO 2 , NO 2 —, N 2 O 3 , НЕТ + | |
| +4 | НЕТ 2 , N 2 O 4 | |
| +5 | HNO 3 , NO 3 —, N 2 O 5 |
отрицательный Число окисления азота помимо -3
Примерно в то время, когда Хабер разработал процесс изготовления
аммиак и Оствальд разработали процесс преобразования аммиака
в азотную кислоту, Рашиг разработал процесс, в котором
ион гипохлорита (OCl —) для окисления аммиака с образованием
гидразин, N 2 H 4 .
| 2 NH 3 ( водн. ) | + | OCl — ( водн. ) | N 2 H 4 ( водн. ) | + | Класс — ( водн. ) | + | H 2 O ( л ) |
Эту реакцию можно понять, отметив, что OCl — ion — двухэлектронный окислитель.Потеря пары электронов и пары ионов H + соседними NH 3 молекулы образуют пару высокореакционных NH 2 молекулы, которые будут объединяться, чтобы сформировать молекулу гидразина как показано на рисунке ниже.
Гидразин — бесцветная жидкость со слабым запахом аммиака.
которые могут быть собраны при нагревании этого раствора до N 2 H 4 отгоняется из реакционной колбы. Многие физические
Свойства гидразина аналогичны свойствам воды.
Многие физические
Свойства гидразина аналогичны свойствам воды.
| H 2 O | N 2 H 4 | |||
| Плотность | 1.000 г / см 3 | 1.008 г / см 3 | ||
| Точка плавления | 0,00 o С | 1,54 o С | ||
| Температура кипения | 100 o С | 113,8 o С |
Существует значительная разница между химическим
свойства этих соединений, однако.Гидразин горит при
воспламеняется на воздухе с образованием газообразного азота, водяного пара и большого количества
количество энергии.
| N 2 H 4 ( л ) | + | О 2 ( г ) | N 2 ( г ) | + | 2 H 2 O ( г ) | H o = -534.3 кДж / моль N 2 H 4 |
В основном гидразин используется в качестве ракетного топлива. это уступает только жидкому водороду по количеству килограмм тяги на килограмм сожженного топлива. Гидразин имеет ряд преимуществ перед жидким H 2 , тем не мение. Его можно хранить при комнатной температуре, тогда как жидкий водород необходимо хранить при температуре ниже -253 o С. Гидразин также более плотный, чем жидкий H 2 и поэтому требуется меньше места для хранения.
Чистый гидразин редко используется в качестве ракетного топлива, поскольку он
замерзает при температурах, встречающихся в верхних слоях атмосферы. Гидразин смешан с N, N -диметилгидразином, (CH 3 ) 2 NNH 2 ,
образовывать раствор, который при низких температурах остается жидким.
Смеси гидразина и N, N -диметилгидразина были
использовались для заправки ракет Titan II, которые несли Project Gemini
космический аппарат, и реакция производных гидразина с N 2 O 4 до сих пор используется в качестве топлива для небольших ракетных двигателей, которые позволяют
космический шаттл для маневра в космосе.
Гидразин смешан с N, N -диметилгидразином, (CH 3 ) 2 NNH 2 ,
образовывать раствор, который при низких температурах остается жидким.
Смеси гидразина и N, N -диметилгидразина были
использовались для заправки ракет Titan II, которые несли Project Gemini
космический аппарат, и реакция производных гидразина с N 2 O 4 до сих пор используется в качестве топлива для небольших ракетных двигателей, которые позволяют
космический шаттл для маневра в космосе.
Продукт сгорания гидразина необычный. Когда соединения углерода горят, углерод окисляется до СО или СО 2 . При горении соединений серы образуется SO 2 . Когда гидразин сжигается, продукт реакции N 2 из-за необычайно прочной тройной связи азот-азот в молекула N 2 .
| N 2 H 4 ( л ) | + | О 2 ( г ) | N 2 ( г ) | + | 2 H 2 O ( г ) |
Гидразин реагирует с азотистой кислотой (HNO 2 ) с образованием
азид водорода, HN 3 , в котором атом азота
формально имеет степень окисления — 1 / 3 .
| N 2 H 4 ( водн. ) | + | HNO 2 ( водн. ) | HN 3 ( водн. ) | + | 2 H 2 O ( л ) |
Чистый азид водорода — чрезвычайно опасное вещество. Четное с разбавленными растворами следует обращаться осторожно из-за риска взрывов.Азид водорода лучше всего описать как резонансный гибрид структур Льюиса, показанный на рисунке ниже. В соответствующий азид-ион, N 3 — , является линейным молекула, которая представляет собой резонансный гибрид трех структур Льюиса.
| HN 3 | |
| N 3 — |
Положительно Числа окисления азота: галогениды азота
Фтор, кислород и хлор — единственные элементы. электроотрицательный, чем азот.В результате положительное окисление
количества азота находятся в соединениях, которые содержат один или
больше этих элементов.
электроотрицательный, чем азот.В результате положительное окисление
количества азота находятся в соединениях, которые содержат один или
больше этих элементов.
Теоретически N 2 может реагировать с F 2 на образуют соединение с формулой NF 3 . На практике N 2 слишком инертен, чтобы проходить эту реакцию при комнатной температуре. NF 3 получается реакцией аммиака с F 2 в присутствии катализатор на основе металлической меди.
| Cu | ||||||
| NH 3 ( г ) | + | 3 ф. 2 ( г ) | NF 3 ( г ) | + | 3 HF ( г ) |
HF, образующийся в этой реакции, соединяется с аммиаком с образованием
фторид аммония. Общая стехиометрия реакции составляет
поэтому написано так.
Общая стехиометрия реакции составляет
поэтому написано так.
| Cu | ||||||
| 4 NH 3 ( г ) | + | 3 ф. 2 ( г ) | NF 3 ( г ) | + | 3 NH 4 F ( с ) |
Структура Льюиса в NF 3 аналогична структуре Льюиса. Структура Льюиса NH 3 , и две молекулы имеют похожие формы.
Аммиак реагирует с хлором с образованием NCl 3 , который на первый взгляд кажется тесно связанным с NF 3 . Но между этими составами есть существенная разница. NF 3 практически инертен при комнатной температуре, тогда как NCl 3 это чувствительная к ударам, взрывоопасная жидкость, разлагающаяся до форма N 2 и Cl 2 .
| 2 NCl 3 ( л ) | N 2 ( г ) | + | 3-й класс 2 ( г ) |
Аммиак реагирует с йодом с образованием твердого вещества, представляющего собой комплекс. между NI 3 и NH 3 .Этот материал является предмет популярной, но опасной демонстрации, в которой заливают свежеприготовленные образцы НИ 3 в аммиаке. на фильтровальную бумагу, которой дают высохнуть на подставке для колец. После аммиак испаряется, NH 3 / NI 3 кристаллы касаются пером, прикрепленным к метровой палочке, в результате взрыва этого чувствительного к удару твердого тела, которое разлагается с образованием смеси N 2 и I 2 .
| 2 NI 3 ( с ) | N 2 ( г ) | + | 3 I 2 ( г ) |
Положительно Числа окисления азота: оксиды азота
Структуры Льюиса для семи оксидов азота с окислением числа от +1 до +5 приведены в Таблица ниже.
Все эти соединения имеют две общие черты: они содержат N = O двойные связи, и они менее стабильны, чем их элементы в газовой фазы, как показано данными об энтальпии образования в Таблица ниже.
Энтальпия образования оксидов азота
| Соединение | H o F (кДж / моль) | |
| N 2 O ( г ) | 82.05 | |
| НЕТ ( г ) | 90,25 | |
| НЕТ 2 ( г ) | 33,18 | |
| N 2 O 3 ( г ) | 83,72 | |
| N 2 O 4 ( г ) | 9.16 | |
| N 2 O 5 ( г ) | 11,35 |
Оксид диазота, N 2 O, также известный как закись азота, может быть получена осторожным разложением аммония нитрат.
| от 170 до 200 o C | ||||
| NH 4 NO 3 ( с ) | N 2 O ( г ) | + | 2 H 2 O ( г ) |
Закись азота — бесцветный газ со сладким запахом, наиболее известный нехимики как «веселящий газ».«Еще в 1800 году Хамфри Дэви отметил, что N 2 O, вдыхаемый в относительно в небольших количествах, часто вызывает состояние явного опьянения сопровождается судорожным смехом или плачем. Когда принято в больших дозах закись азота обеспечивает быстрое и эффективное облегчение от боли. N 2 O использовался в качестве первого анестетик. Поскольку для анестезии необходимы большие дозы, и продолжительное воздействие газа может быть фатальным, N 2 O is сегодня используется только для относительно коротких операций.
Закись азота имеет несколько других интересных свойств. Первый, хорошо растворяется в сливках; по этой причине он используется как пропеллент в дозаторах для взбитых сливок. Во-вторых, хотя это так не гореть сам по себе, это лучше, чем воздух при поддержке возгорание других предметов. Это можно объяснить, отметив, что N 2 O может разлагаться с образованием атмосферы, которая одна треть O 2 по объему, тогда как нормальный воздух составляет только 21% кислород по объему.
| 2 N 2 O ( г ) | 2 N 2 ( г ) | + | О 2 ( г ) |
Уже много лет окончания — ous и — ic использовались для различения самого низкого и самого высокого в паре степени окисления. N 2 O — закись азота, поскольку степень окисления азота +1.NO оксид азота потому что степень окисления азота +2.
Огромные количества оксида азота или оксида азота генерируется каждый год реакцией между N 2 и O 2 в атмосфере, катализируемая ударом молния, проходящая через атмосферу или горячие стены двигатель внутреннего сгорания.
| N 2 ( г ) | + | О 2 ( г ) | 2 НЕТ ( г ) |
Одна из причин понижения степени сжатия автомобильных двигателей в последние годы является снижение температуры реакции горения, тем самым уменьшая количество NO выбрасывается в атмосферу.
NO может быть получен в лаборатории путем реакции металлической меди с разбавленной азотной кислотой .
| 3 Cu ( с ) | + | 8 HNO 3 ( водн. ) | 3 Cu (NO 3 ) 2 ( водн. ) | + | 2 НЕТ ( г ) | + | 4 H 2 O ( л ) |
Молекула NO содержит нечетное количество валентных электронов.В результате невозможно написать структуру Льюиса для этого молекула, в которой все электроны спарены (см. таблицу оксидов азота). Когда НЕТ газа При охлаждении пары молекул NO соединяются в обратимой реакции образуют димер (от греч. «два частей «), по формуле N 2 O 2 , в в котором все валентные электроны спарены, как показано в таблице оксидов азота.
NO быстро реагирует с O 2 с образованием диоксида азота (когда-то известный как перекись азота), который представляет собой темно-коричневый газ при температуре комнатная температура.
| 2 НЕТ ( г ) | + | О 2 ( г ) | 2 НЕТ 2 ( г ) |
NO 2 можно приготовить в лаборатории путем нагревания определенные нитраты металлов до их разложения.
| 2 Pb (NO 3 ) 2 ( с ) | 2 PbO ( с ) | + | 4 НЕТ 2 ( г ) | + | О 2 ( г ) |
Его также можно получить реакцией металлической меди с концентратом азотная кислота,
| Cu ( с ) | + | 4 HNO 3 ( водн. ) | Cu (NO 3 ) 2 ( водн. ) | + | 2 НЕТ 2 ( г ) | + | 2 H 2 O ( л ) |
NO 2 также имеет нечетное количество электронов и следовательно, содержит по крайней мере один неспаренный электрон в своей льюисовской конструкции.NO 2 димеризуется при низких температурах с образованием N 2 O 4 молекулы, в которых все электроны являются парными, как показано в таблице оксидов азот.
Смеси NO и NO 2 при охлаждении объединяются с образованием триоксид диазота, N 2 O 3 , который является синим жидкость. Образование голубой жидкости при НЕТ или НЕТ 2 охлаждается поэтому подразумевает наличие хотя бы небольшого часть другого оксида, потому что N 2 O 2 и N 2 O 4 оба бесцветны.
Путем осторожного удаления воды из концентрированной азотной кислоты при низкие температуры с дегидратирующим агентом мы можем образовывать диазот пятиокись.
| 4 HNO 3 ( водн. ) | + | P 4 O 10 ( с ) | 2 N 2 O 5 ( s ) | + | 4 HPO 3 ( с ) |
N 2 O 5 — бесцветное твердое вещество, которое разлагается на свету или при нагревании до комнатной температуры.Как мог и следовало ожидать, N 2 O 5 растворяется в воде до образуют азотную кислоту.
| N 2 O 5 ( с ) | + | H 2 O ( л ) | 2 HNO 3 ( водн. ) |
Химия Фосфор
Фосфор — первый элемент, открытие которого можно проследить одному человеку.В 1669 году в поисках пути к конвертировать серебро в золото, Hennig Brand получил белый восковой твердое вещество, которое светилось в темноте и самопроизвольно вспыхнуло пламенем при контакте с воздухом. Бренд создал это вещество путем испарения вода из мочи и позволяя черному остатку разлагаться на несколько месяцев. Затем он смешал этот остаток с песком, нагрел это смесь в присутствии минимального количества воздуха и собрана под вода летучие продукты, которые вышли из реакции колба.
Фосфор образует ряд соединений, являющихся прямыми аналогами азотсодержащих соединений. Однако тот факт, что элементарный азот практически инертен при комнатной температуре, тогда как элементарный фосфор может самопроизвольно загореться при контакте с воздухом показывает, что есть различия между эти элементы тоже. Фосфор часто образует соединения с те же степени окисления, что и аналогичные соединения азота, но с разными формулами, как показано в таблице ниже.
Соединения азота и фосфора с Те же числа окисления, но разные формулы
| Окислительное число | Соединение азота | Соединение фосфора | ||
| 0 | N 2 | П 4 | ||
| +3 | HNO 2 (азотистая кислота) | H 3 PO 3 (фосфористая кислота) | ||
| +3 | N 2 O 3 | П 4 О 6 | ||
| +5 | HNO 3 (азотная кислота) | H 3 PO 4 (фосфорная кислота) | ||
| +5 | NaNO 3 (нитрат натрия) | Na 3 PO 4 (фосфат натрия) | ||
| +5 | N 2 O 5 | П 4 О 10 |
Те же факторы, которые объясняют разницу между серой и кислород можно использовать для объяснения различий между фосфор и азот.
1. Тройные связи азот-азот намного прочнее, чем тройные связи фосфор-фосфор.
2. Одинарные связи P-P прочнее одинарных связей N-N.
3. Фосфор ( EN = 2,19) намного меньше электроотрицательна, чем азот ( EN = 3,04).
4. Фосфор может расширять свою валентную оболочку, удерживая более восемь электронов, но не азот.
Эффект Различия в прочности одиночной и тройной связи
Отношение радиусов атомов фосфора и азота равно такое же, как отношение радиусов атомов серы и кислорода, в пределах экспериментальная ошибка.
В результате тройные связи фосфор-фосфор сильно слабее, чем тройные связи азот-азот, по той же причине что двойные связи S = S слабее, чем двойные связи O = O фосфора атомы слишком велики, чтобы подходить достаточно близко друг к другу, чтобы образовать прочные облигации.
Каждый атом в молекуле N 2 завершает свой октет валентных электронов, разделяя три пары электронов с единственный соседний атом. Поскольку фосфор не образует прочных кратные связи с собой, элементарный фосфор состоит из тетраэдрические P 4 молекулы, в которых каждый атом образует одинарные связи с тремя соседними атомами, как показано на рисунке ниже.
Фосфор — белое твердое вещество с восковым оттенком, которое плавится при 44,1 ° ° C и кипит при 287 ° ° C. производится путем восстановления фосфата кальция углеродом в присутствии кремнезем (песок) при очень высоких температурах.
| 2 Ca 3 (PO 4 ) 2 ( с ) | + | 6 SiO 2 ( с ) | + | 10 ° C ( с ) | 6 CaSiO 3 ( с ) | + | П 4 ( с ) | + | 10 CO ( г ) |
Белый фосфор хранится под водой, потому что элемент самопроизвольно воспламеняется в присутствии кислорода при температура лишь немного выше комнатной.Несмотря на то что фосфор нерастворим в воде, хорошо растворяется в углероде дисульфид. Решения P 4 в CS 2 являются достаточно стабильный. Как только CS 2 испарится, однако фосфор воспламеняется.
Валентный угол P-P-P в тетраэдрической молекуле P 4 составляет всего 60 o . Этот очень маленький угол дает значительное количество штамма в молекуле P 4 , что можно облегчить, разорвав одну из связей P-P.Таким образом, фосфор образует другие аллотропы, открывая P 4 тетраэдр. Когда белый фосфор нагревается до 300 o ° C, одна связь внутри каждого тетраэдра P 4 разорвана, и P 4 молекулы соединяются вместе, образуя полимер (от греческого pol — «многие» и meros , «части») со структурой, показанной на рисунке ниже. Этот аллотроп фосфора темно-красный, и его присутствие в небольшие следы часто придают белому фосфору светло-желтый цвет.Красный фосфор более плотный (2,16 г / см 3 ), чем белый фосфор (1,82 г / см 3 ) и гораздо менее реакционноспособен при нормальные температуры.
Эффект Различия в сильных сторонах двойных облигаций P = X и N = X
Размер атома фосфора также влияет на его способность образовывать двойные связи с другими элементами, такими как кислород, азот, и сера.В результате фосфор имеет тенденцию образовывать соединения, которые содержат две одинарные связи P-O, где азот образует N = O двойная связь. Азот образует нитрат, NO 3 — , ион, например, у которого степень окисления +5. Когда фосфор образует ион с такой же степенью окисления, это фосфат, PO 4 3- , ион, как показано на рисунок ниже.
Аналогичным образом азот образует азотную кислоту HNO 3 , которая содержит двойную связь N = O, тогда как фосфор образует фосфорную кислота, H 3 PO 4 , которая содержит одиночный P-O облигации, как показано на рисунке ниже.
Эффект Различия в электроотрицательности фосфора и азота.
Разница между электроотрицательностями фосфора и азот ( EN = 0,85) то же самое, что и разница между электроотрицательностями серы и кислорода ( EN = 0,86), в пределах ошибки эксперимента. Потому что меньше электроотрицательный, фосфор с большей вероятностью, чем азот показывают положительную степень окисления.Наиболее важное окисление числа для фосфора -3, +3 и +5 (см. таблицу ниже).
Общее число окисления фосфора
| Окисление Число | Примеры | |
| -3 | Ca 3 P 2 , PH 3 | |
| +3 | PF 3 , P 4 O 10 , H 3 PO 3 | |
| +5 | PF 5 , P 4 O 10 , H 3 PO 4 , PO 4 3- |
Поскольку он более электроотрицателен, чем большинство металлов, фосфор реагирует с металлами при повышенных температурах с образованием фосфиды, у которых степень окисления -3.
| 6 Ca ( с ) | П 4 ( с ) | 2 Ca 3 P 2 ( с ) |
Эти фосфиды металлов реагируют с водой с образованием ядовитый, высокореактивный, бесцветный газ, известный как фосфин (PH 3 ), который имеет самый отвратительный запах, с которым столкнулись авторы.
| Ca 3 P 2 ( с ) | + | 6 H 2 O ( л ) | 2 PH 3 ( г ) | + | 3 Ca 2+ ( водн. ) | + | 6 OH — ( водн. ) |
Образцы фосфорного аналога аммиака РН 3 , часто содержат следы P 2 H 4 , фосфорный аналог гидразина.Как будто токсичность и запах PH 3 было недостаточно, смеси PH 3 и P 2 H 4 самопроизвольно загорелся в наличие кислорода.
Соединения (например, Ca 3 P 2 и PH 3 ) в которых фосфор имеет отрицательную степень окисления, далеко превосходит количество соединений, в которых степень окисления фосфор положительный. Фосфор горит в О 2 до производят P 4 O 10 в реакции, которая выделяет необычайное количество энергии в виде тепла и света.
| П 4 ( с ) | + | 5 O 2 ( г ) | P 4 O 10 ( с ) | H o = -2985 кДж / моль P 4 |
Когда фосфор горит в присутствии ограниченного количества O 2 , П 4 О 6 выпускается.
| П 4 ( с ) | + | 3 O 2 ( г ) | П 4 О 6 ( с ) | H o = -1640 кДж / моль P 4 |
P 4 O 6 состоит из тетраэдра, в котором атом кислорода вставлен в каждую связь P-P в P 4 молекула (см. рисунок ниже).P 4 O 10 имеет аналогичная структура, с дополнительным атомом кислорода, связанным с каждым четырех атомов фосфора.
P 4 O 6 и P 4 O 10 реагировать с водой с образованием фосфористой кислоты, H 3 PO 3 , и фосфорная кислота, H 3 PO 4 соответственно.
| P 4 O 6 ( с ) | + | 6 H 2 O ( л ) | 4 ч 3 PO 3 ( водн. ) | |
| P 4 O 10 ( с ) | + | 6 H 2 O ( л ) | 4 ч 3 PO 4 ( водн. ) |
P 4 O 10 обладает таким высоким сродством к воде что он обычно используется как обезвоживающий агент.Фосфор кислота, H 3 PO 3 , и фосфорная кислота, H 3 PO 4 , являются примерами большого класса оксикислот фосфора. Льюис структуры для некоторых из этих оксикислот и родственных им оксианионов приведены в таблице ниже.
Эффект Различия в способности фосфора и азота расширяться Их валентная оболочка
Реакция между аммиаком и фтором останавливается на NF 3 поскольку азот использует 2 s , 2 p x , 2 p y и 2 p z орбитали для удержания валентных электронов.Следовательно, атомы азота могут иметь максимум восемь валентностей. электроны. Фосфор, однако, имеет пустое 3 d атомных атомов. орбитали, которые можно использовать для расширения валентной оболочки до 10 или больше электронов. Таким образом, фосфор может реагировать с фтором с образованием образуют как PF 3 , так и PF 5 . Фосфор может даже образуют ион ПФ 6 — , в котором 12 валентные электроны на центральном атоме, как показано на рисунке ниже.
Ковалентных связей
Каждая из трех линий представляет собой общую пару электронов в ковалентной связи. Когда линии используются для представления связывающих пар электронов, структуру часто называют структурной формулой . Некоторые учебники для простоты опускают несвязывающие электроны.
Поскольку атом водорода имеет свою единственную 1 s орбиталь, завершенную только двумя электронами, молекула хлористого водорода нарисована, как показано на рисунке 7.
Рис. 7. Молекула хлористого водорода.
г.Атомы водорода и хлора отдают по одному электрону ковалентной связи каждый. В молекуле водород завершил свою валентную оболочку двумя электронами, а хлор имеет полную оболочку с восемью валентными электронами.
В некоторых молекулах связанные атомы имеют более двух общих электронов, как в этилене (C 2 H 4 ), где два атома углерода имеют четыре общих электрона. (См. Рисунок 8.)
Рисунок 8.Двойная связь между двумя атомами углерода.
Обратите внимание, что каждый углерод получает восемь электронов за счет этого распределения. Поскольку каждая общая пара представляет собой простую ковалентную связь, две общие пары называются двойной связью . Структура в правой части рисунка 8 показывает эту двойную связь четырех общих электронов двумя линиями, а левая часть рисунка
показывает двойную связь в виде двух пар точек.Есть даже тройные связи шести общих электронов, как в молекуле азота.В N 2 каждый атом азота вносит пять валентных электронов. Из 10 электронов, показанных на рисунке 9, четыре не связывают, а шесть составляют тройную связь, удерживающую атомы азота вместе.
Рис. 9. Тройная связь между двумя атомами азота.
- Посмотрите на периодическую таблицу и определите количество валентных электронов алюминия и кислорода по положению столбцов этих двух элементов.
- Нарисуйте диаграмму Льюиса, представляющую электронную конфигурацию молекулы сероводорода, H 2 S.
Сколько валентных электронов в атоме фосфора? — Restaurantnorman.com
Сколько валентных электронов в атоме фосфора?
5 валентных электронов
Есть ли у фосфора 15 валентных электронов?
Есть ли у фосфора 2 валентных электрона?
Согласно приведенной выше таблице Менделеева, фосфор относится к Группе 5A. Следовательно, его валентных электронов должно быть 5. Внешние орбитали, 3s2 3p3, содержат 5 электронов. Таким образом, валентных электронов для P равно 5.
Каким образом Phosphorus может показать максимальную ковалентность 6?
Фосфор имеет 5 ковалентных связей и одну координационную связь. Следовательно, максимальная ковалентность фосфора равна 6. Элементы, которые имеют вакантную d-орбиталь, могут расширять свой октет, передавая электроны, которые возникают после разрыва пары, на эти вакантные d-орбитали, например. в сере.
Какова максимальная ковалентность фосфора?
Его максимальная ковалентность будет 15-10, то есть 5.
Какой заряд будет у натрия, если он подчинится правилу октетов?
Правило октетов гласит, что атом наиболее стабилен, когда в его валентной оболочке восемь электронов.Например, если атом натрия теряет один электрон, он будет иметь на один протон больше, чем электрон, что дает ему общий заряд +1. Химический символ иона натрия — Na + 1 или просто Na +.
Сколько кислорода нужно больше для соответствия правилу октетов?
Кислород имеет 6 валентных электронов, чтобы подчиняться правилу октета, он должен иметь восемь валентных электронов. Кислоду нужны еще два электрона, чтобы сформировать правило октета.
Сколько еще электронов нужно кислороду для выполнения правила октетов?
Карточки по химии 51-100 (промежуточный обзор)
| А | B |
|---|---|
| октет = | 8 |
| электронная конфигурация кислорода 1s2 2s2 2p4.Сколько еще электронов нужно кислороду, чтобы удовлетворять правилу октетов? | 2 |
| множественные ковалентные связи могут встречаться в атомах, содержащих углерод, азот или | кислород |
Что такое простое правило октетов?
Правило октета гласит, что атомы имеют тенденцию образовывать соединения способами, которые дают им восемь валентных электронов и, таким образом, электронную конфигурацию благородного газа. Один из способов — поделиться своими валентными электронами с другими атомами.Второй способ — перенос валентных электронов от одного атома к другому.
Может ли фосфор иметь более 8 валентных электронов?
В отличие от атомов первого и второго периодов, которые имеют только s- и p-орбитали (всего 8 валентных электронов), такие атомы, как фосфор, сера и хлор, могут иметь более 8 электронов, потому что они не ограничены s- и p-орбиталями и имеют ад-орбиталь для дополнительных электронов, необходимых для связи.
Какова конфигурация валентных электронов у атома фосфора?
Какова валентная электронная конфигурация атома фосфора?
[Ne] 3s² 3p³ Конфигурация фосфор / электрон
Что такое валентные электроны фосфора?
Фосфор находится в группе VA, поэтому он имеет 5 валентных электронов, и кислород находится в группе VIA, поэтому каждый кислород имеет 6 валентных электронов.Всего валентных электронов = 5 + 4 (6) = 29.
Что из следующего является правильной электронной конфигурацией фосфора?
Фосфор — это химический элемент с атомным номером 15. Его электронная конфигурация в отношении электронов, присутствующих в каждой оболочке, составляет 2,8,5, а в отношении молекулярных орбиталей его конфигурация составляет 1s2, 2s2 2p6, 3s2 3p3 .
Как определить валентные электроны фосфора?
0: 091: 23Как найти валентные электроны для фосфора (P) — YouTubeYouTubeНачало предложенного роликаКонец предложенного роликаУ них 5 валентных электронов, поэтому у фосфора 5 валентных электронов согласно периодическому. к периодическому.
Какова электронная конфигурация фосфора 15?
Информационная панель
| Группа | 15 | 44.15 ° C, 111,47 ° F, 317,3 K |
|---|---|---|
| Блок | p | 1,823 (белый) |
| Атомный номер | 15 | 30,974 |
| Состояние при 20 ° C | Твердый | 31P |
| Электронная конфигурация | [Ne] 3s23p3 | 7723-14-0 |
Сколько электронов присутствует в ядре фосфора?
15 электронов Так… Что касается элемента PHOSPHORUS, вы уже знаете, что атомный номер говорит вам количество электронов. Это означает, что в атоме фосфора 15 электронов. Глядя на картинку, вы можете увидеть, что есть два электрона в первой оболочке, восемь — в второй и пять — в третьей.
Сколько электронов находится на внешнем энергетическом уровне фосфора?
Это означает, что в атоме фосфора 15 электронов . Глядя на картинку, вы можете увидеть, что есть два электрона в первой оболочке, восемь — в второй и пять — в третьей.3 # с пятью валентными электронами.
Где в атоме находятся валентные электроны?
Валентные электроны всегда находятся на ‘s’ и ‘p’ орбиталях наивысшего энергетического уровня электронной конфигурации, образуя валентные орбитали 3s и 3p и составляя валентную конфигурацию 3s23p3 с пятью валентными электронами. Я надеюсь, что это было полезно.
Где в периодической таблице содержится фосфор?
Фосфор входит в группу 15, другие неметаллы периодической таблицы.3 #.
⇐ Как начать выступление на прослушивании? Что произойдет, если вы будете бегать по 10 минут в день? ⇒Похожие сообщения:
Видео с вопросами: Определение объяснения различий в электронном сродстве азота и фосфора
стенограмма видео
В таблице ниже показаны первые и второе электронное сродство к атомам азота и фосфора.Почему происходит изменение энергии для оба сродства к электрону для атомов фосфора ниже, чем для атомов азот? (A) В атоме фосфора меньше электронов во внешней валентной оболочке, чем атом азота, и поэтому отталкивание от присоединения электронов. (B) Больший размер атома фосфор приводит к меньшему отталкиванию электронов, когда первый и второй электроны добавляются по сравнению с меньшим атомом азота.(C) Добавленные электроны помещаются ближе к ядру в атоме фосфора, и поэтому они испытывают сильные притяжение от ядра. Или (D) атом фосфора получает наполовину заполненную p подоболочку из трех электронов за счет добавления электрон, которого нет у атома азота.
В этом вопросе мы должны обозначить почему первое и второе сродство к электрону фосфора и азота различаются.Давайте освободим место на экране, чтобы обсудите эти различия.
В этом вопросе обсуждается электрон сродство, то есть количество энергии, высвобождаемой при добавлении электрона к нейтральный атом в газовом состоянии с образованием отрицательного иона. Обычно измеряется в килоджоулей на моль. Сокращенно его можно обозначить как ea. Когда сродство к электрону равно положительный, энергия высвобождается. Это означает, что изменение энтальпии равно отрицательный, и процесс добавления электрона экзотермичен.
И наоборот, когда сродство к электрону отрицательный, энергия должна поглощаться, и процесс эндотермический с положительным изменение энтальпии. Для азота как первый, так и второе электронное сродство отрицательно и, следовательно, является эндотермическим процессом, требуется, чтобы энергия поглощалась из окружающей среды, чтобы электроны добавлен к атому, в то время как для фосфора первое сродство к электрону является экзотермическим а второй менее эндотермичен, чем азот.
Если мы обнаружим азот и фосфор в периодической таблице, мы обнаружим, что они оба находятся в группе 15, с азотом во втором периоде и фосфором в третьем периоде. Это означает, что в фосфоре больше занятые электронные оболочки, чем азот. Так что у азота будет меньше радиус атома. Это означает, что электроны ближе вместе. Таким образом, есть больше отвращения к добавленный электрон и больше энергии требуется для этого процесса.
Обратное верно для фосфор, где электроны и отрицательный заряд более рассредоточены в большей радиус атома. Меньше отталкивания добавлен электрон, и процесс требует меньше энергии. Это верно как для первого, так и для добавлены вторые электроны.
Используя эту информацию, давайте еще один взгляд на варианты ответов.
Мы видим, что ответ только один выбор упоминает большой размер фосфора, что приводит к меньшему отталкиванию добавлены электроны.Вариант ответа (B) правильный. Итак, причина того, что изменение энергия для обоих сродств к электрону для атомов фосфора ниже, чем для атомов азота — вариант ответа (B). Больший размер атома фосфор приводит к меньшему отталкиванию электронов, когда первый и второй электроны добавляются по сравнению с меньшим атомом азота.