Свойства оксидов, кислот, оснований и солей в свете ТЭД и процессов окисления-восстановления
Свойства оксидов, кислот, оснований и солей в свете теории электролитической диссоциации и процессов окисления-восстановления.
Сегодня мы с вами повторим химические свойства оксидов, кислот, оснований и солей.
Оксиды.
Оксиды всегда состоят из двух элементов, один из которых – обязательно кислород. В состав оксида может входить как металл, так и неметалл. Если в состав оксида входит неметалл, то тогда он чаще всего является кислотным, если в составе оксида металл с валентностью меньше четырёх, то тогда оксид считается основным. А вот если валентность металла высокая, то тогда этот оксид будет не основным, а кислотным.
А
амфотерные оксиды могут быть и кислотным и основным, в
зависимости от того, с чем они вступает в реакцию.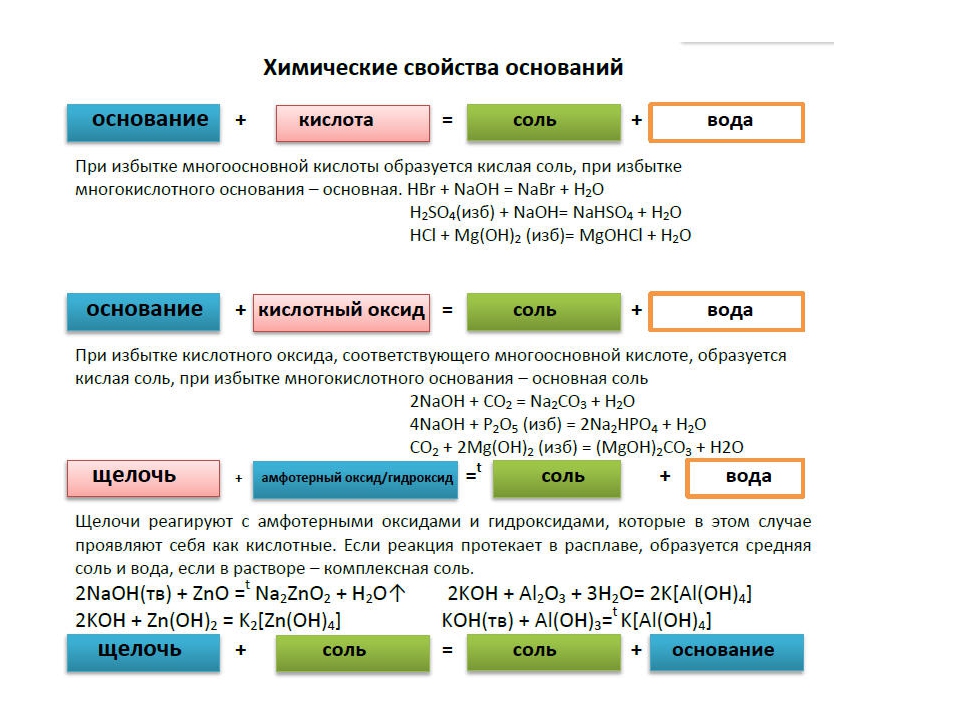
У амфотерных, кислотных и основных оксидов много общего, ведь они являются солеобразующими оксидами. А вот такие оксиды, как оксид углерода (II) – CO, оксид азота (I) – N2O, оксид азота (II) – NO и оксид кремния (II) – SiO являются несолеобразующими, они не взаимодействуют ни с кислотами, ни с основаниями и не образуют солей.
Основным оксидам соответствуют основания. Они вступают в реакции обмена
с кислотами. При этом образуется соль и вода.Например,
если поместить в пробирку немного порошка оксида меди (II),
он чёрного цвета, и в эту пробирку налить раствора серной кислоты и слегка
нагреть, то постепенно проходит реакция, т.![]() к. порошок начинает растворяться.
Чтобы убедиться в том, что в результате реакции образуется соль, несколько
капель содержимого пробирки поместим на предметное стекло и выпарим, после чего
на стекле появляются кристаллы соли.
к. порошок начинает растворяться.
Чтобы убедиться в том, что в результате реакции образуется соль, несколько
капель содержимого пробирки поместим на предметное стекло и выпарим, после чего
на стекле появляются кристаллы соли.
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu2+ + H2O
Кроме этого, они вступают в реакции соединения с кислотными оксидами, при этом образуются соли.
Например, при взаимодействии оксида натрия (Na2

3Na2O + P2O5 = 2Na3PO4
MgO + SO3 = MgSO4
CaO + CO2 = CaCO3
Они вступают в реакции соединения с водой с образованием щелочей. Если образуется нерастворимое основание, то такая реакция не идёт.
Например, если мы нальём в две пробирки воды и капнем туда несколько капель лакмуса, а затем поместим в первую пробирку оксид кальция (CaO), а в другую оксид меди (II) (CuO), то реакция у нас идёт только в первой пробирке. Так как образовалась щёлочь и лакмус изменил свою окраску на синюю, во второй пробирке изменений нет, т.к. оксид меди (II) не реагирует с водой, ведь Cu(OH)2 – нерастворимое в воде основание.
CaO + H2O = Ca(OH)2
CaO + H2O = Ca2+ + 2OH—
CuO + H2O ≠
Кислотным
оксидам соответствуют кислоты.
Они вступают в реакции обмена с основаниями, при этом образуется соль и вода.
Если
через пробирку с известковой водой (Ca(OH)2)
пропустить углекислый газ (CO
А также они реагируют с
основными оксидами, при этом образуются соли. Например, в
результате взаимодействия оксида серы (IV)
(SO2)
и оксида калия (K2O)
образуется соль – сульфит калия (K2SO3),
в результате взаимодействия оксида кремния (IV)
(SiO2
) с оксидом натрия (Na2O)
при нагревании, образуется соль – силикат натрия (Na2SiO3),
при взаимодействии оксида азота (V)
(N2O5)
с оксидом бария (BaO), образуется
соль – нитрат бария (Ba(NO3)2).
SO2 + K2O = K2SO 3
SiO2 + Na2O = Na2SiO3
N2O5 + BaO = Ba(NO3)2
Кроме
этого, они вступают в реакции соединения с водой, при этом образуются
кислоты, однако эти реакции возможные, если оксиды растворимы в
воде. Для этого подтверждения, нальём в одну пробирку дистиллированной
воды, а в другую – раствор углекислого газа (СО2) (газированной
воды). В первую пробирку добавим оксида кремния (IV)
(SiO2).
А затем в каждую из пробирок добавим несколько капель лакмуса. В первой
пробирке изменений нет, а во второй лакмус окрасился в красный цвет,
значит во второй пробирке кислота. В первой пробирке кислоты не
образовалось, потому что оксид кремния (IV)
(SiO2)
не растворим в воде.
А
вот оксид цинка (ZnO) реагирует и с
кислотами и с основаниями. Например, в реакции с соляной кислотой (HCl)
он образует соль – хлорид цинка (ZnCl2),
а в реакции с раствором гидроксида натрия (NaOH)
образую комплексную соль – тетрагидроксоцинкат натрия (Na2[Zn(OH)4]), а при сплавлении с
гидроксидом натрия он образует цинкат натрия (Na2ZnO2). Но с водой он не реагирует. Зато, он
реагирую и с основными оксидами и с кислотными оксидами и
образует при этом соли. Например, в реакции с оксидом калия (K2O),
он проявляет кислотные свойства т.е. свойства кислотного оксида, в
результате реакции образуется соль – цинкат калия (K2ZnO2),
а в реакции с оксидом серы (VI)
(SO3),
он проявляет свойства основного оксида, в результате образуется соль –
сульфат цинка (ZnSO4).
ZnO + 2HCl = ZnCl2 + H2O;
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
ZnO + 2NaOH = Na2ZnO2 + H2O
ZnO + K2O = K2ZnO2
ZnO + SO3 = ZnSO4
Кислоты.
Кислоты всегда начинается с водорода, окрашивают лакмус и метиловый оранжевый в красный цвет, ведь в их составе есть ион водорода (H+), который всегда образуется при диссоциации.
Так, при диссоциации соляной кислоты (HCl), образуется ион водорода и хлорид-ион (Cl—
HCl = H+ + Cl—
HNO3 = H+ + NO3—
HNO2 ⇆ H+ + NO2—
Именно
поэтому, кислоты окрашивают лакмус и метиловый оранжевый в красный
цвет.
Они реагируют с основаниями: как с растворимыми, так и с нерастворимыми. При этом образуется соль и вода. Этот тип реакций относится к реакциям обмена.
Кислота + основание = соль + вода
Например, если мы в пробирку с гидроксидом натрия (NaOH) добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты (HCl), то малиновая окраска исчезает. Окраска исчезает, т.к. в результате этой реакции образуется соль и вода. Образование соли можно легко подтвердить: если мы на предметное стекло капнем несколько капель раствора и выпарим, то на стекле появятся кристаллы соли.
Аналогично они
реагируют с нерастворимыми основаниями. Но для этого, сначала необходимо
его получить, например, получим нерастворимое основание – гидроксид железа (III)
(Fe(OH)3). Для этого, в раствор сульфата железа (III)
(Fe2(SO4)3)
добавим несколько капель гидроксида калия (КOH),
при этом образуется осадок бурого цвета – это гидроксид железа (III).
К этому нерастворимому основанию добавим соляной кислоты (HCl),
Для этого, в раствор сульфата железа (III)
(Fe2(SO4)3)
добавим несколько капель гидроксида калия (КOH),
при этом образуется осадок бурого цвета – это гидроксид железа (III).
К этому нерастворимому основанию добавим соляной кислоты (HCl),
Кислоты также вступают в реакции обмена с оксидами металлов. В результате реакции образуется соль и вода. Эта реакция вам уже знакома, наверняка оксиды, вам уже всё рассказали об этом.
Кислота + оксид металла = соль + вода
Кислоты
реагируют с металлами, эти реакции относятся к реакциям замещения,
при этом образуется соль и выделяется водород.
Кислота + металл = соль + водород
Для протекания данных реакций необходимо выполнение ряда условий:
· металл находиться в ряду напряжений до водорода
· должна получиться растворимая соль
· если кислота нерастворимая, то она не может вступить в реакцию с металлами.
Давайте,
попробуем проверить. Поместим в четыре пробирки металлы: в первую пробирку – цинк,
во вторую – алюминий, в третью – свинец, четвёртую – медь.
В первую и третью пробирку нальём раствора серной кислоты (H2SO4),
во вторую и четвёртую – раствора соляной кислоты (HCl).
Понаблюдаем за изменениями. В первой и второй пробирке наблюдается выделение
водорода, в третьей и четвёртой – нет. В пробирке со свинцом
и серной кислотой реакция не пошла, т.к. в результате образуется
нерастворимая соль, которая покрывает всю поверхность металла защитной плёнкой. В четвёртой пробирке также изменений нет, т.к. медь стоит в ряду напряжений
металлов после водорода.
В четвёртой пробирке также изменений нет, т.к. медь стоит в ряду напряжений
металлов после водорода.
Zn + H2SO4 = ZnSO4 + H2↑
Zn0 + 2H+ = Zn2+ + H20↑
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al0 + 6H+ = 2Al3+ + 3H20↑
Pb + H2SO4 ≠
Cu + HCl ≠
Кислоты вступаем в реакции обмена с солями, при этом образуется новая кислота и новая соль. Эти реакции протекают в том случае, если образуется осадок или газ.
Кислота + соль = новая кислота + новая соль
Соляна
(HCl) и серная кислоты (H2SO4),
вам покажут это: в первой пробирке будет соляная кислота и силикат натрия
(Na2SiO3),
во второй – серная кислота и карбоната калия (K2CO3),
в третьей – опять соляной кислоты и хлорида бария (BaCl2).
Посмотрим за изменениями. В первой пробирке мы наблюдаем образование студенистого
осадка (H2SiO3),
во второй – выделение газа (CO2),
а в третьей – изменений нет. В двух пробирках реакции прошли, т.к.
выполнялись следующие условия: в первой – образование осадка, во второй –
выделение газа.
Основания.
В составе оснований всегда есть гидроксигруппа (ОН—), лакмус окрашивают они в синий цвет, метиловый оранжевый – в жёлтый, а фенолфталеин – в малиновый. При диссоциации оснований образуется катион металла (Меn+) и анион гидроксогруппы (ОН—).
Ме(ОН)n = Меn+ + nОН—
Щёлочи — растворимые в
воде основания, реагируют с кислотами, об этой реакции
нейтрализации вы уже знаете.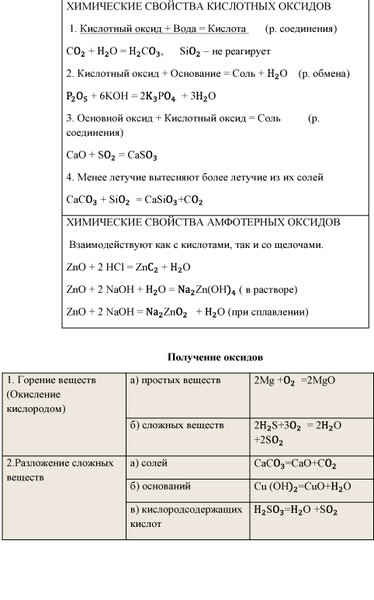 А также реагируют с кислотными и
амфотерными оксидами. При этом образуются соли. Отличительной их
особенностью является то, что они реагируем и с амфотерными основаниями,
но тогда они ведут себя, как кислоты. Например, реакция гидроксида
натрия (NaOH) и гидроксида цинка
(Zn(OH)2).
А также реагируют с кислотными и
амфотерными оксидами. При этом образуются соли. Отличительной их
особенностью является то, что они реагируем и с амфотерными основаниями,
но тогда они ведут себя, как кислоты. Например, реакция гидроксида
натрия (NaOH) и гидроксида цинка
(Zn(OH)2).
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
В этой реакции образуется комплексная соль – тетрагидроксоцинкат натрия (Na2[Zn(OH)4]), а если эта реакция идёт при нагревании, то тогда образуется цинкат натрия (Na2ZnO2).
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Щёлочи
вступаем в реакцию обмена с солями, при этом образуется новая
соль и новое основание, но для этого нужно, чтобы образовался
осадок или слабый электролит. Если в одну пробирку с гидроксида
натрия добавить хлорида аммония (NH4Cl),
во вторую – с гидроксидом калия (КОН) добавить сульфат железа (III)
(Fe2(SO4)3),
а в третью – с гидроксидом натрия добавить хлорид бария (BaCl2)
и содержимое первой пробирки нагреем, то в результате появляется резкий запах
аммиака (NH3).
Во второй пробирке образуется осадок бурого цвета, а в третьей
пробирке изменений не произошло.
Если в одну пробирку с гидроксида
натрия добавить хлорида аммония (NH4Cl),
во вторую – с гидроксидом калия (КОН) добавить сульфат железа (III)
(Fe2(SO4)3),
а в третью – с гидроксидом натрия добавить хлорид бария (BaCl2)
и содержимое первой пробирки нагреем, то в результате появляется резкий запах
аммиака (NH3).
Во второй пробирке образуется осадок бурого цвета, а в третьей
пробирке изменений не произошло.
Все нерастворимые основания при нагревании разлагаются на оксид металла и воду. Щёлочи этой способностью не обладают. Нальём в пробирку раствора сульфата меди (II) (CuSO4), затем сюда же добавим несколько капель гидроксида натрия. Образуется осадок голубого цвета. Это гидроксид меди (II) (Cu(OH)2).
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Cu2+ + 2OH— = Cu(OH)2↓
Нагреем пробирку с гидроксидом
меди (II). В результате образуется вещество черного цвета – это оксид меди (II)
(CuO).
В результате образуется вещество черного цвета – это оксид меди (II)
(CuO).
Cu(OH)2 = CuO + H2O
Соли.
А вот соли – особый класс. Они тоже диссоциируют, но при этом образуют катион металла (Меn+) и анион кислотного остатка (Кисл.ост.n—).
МеКисл.ост. = Меn+ + Кисл.ост.n—
В реакциях солей с солями образуются новые соли, в реакциях с кислотой – образуется новая кислота, в реакциях с основаниями образуется новая соль и новое основание.
Они
вступают в реакции замещения с металлами. Но нужно быть
внимательным и обязательно пользоваться рядом активности металлов.
Каждый металл вытесняет из раствора соли металлы, расположенные
правее его в этом ряду.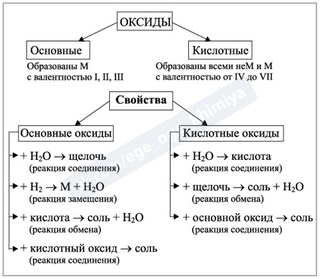
При этом должны соблюдаться условия:
· обе соли (и реагирующая, и образующаяся) должны быть растворимыми
· металлы не должны реагировать с водой (т.е. щелочные и щелочноземельные металлы, которые реагируют с водой с образованием щелочей).
Посмотрим,
как это происходит: в первую пробирку поместим железный гвоздь, во
вторую – свинцовую пластину, а в третью – медную пластину. В
первые две пробирки нальём раствора сульфата меди (II)
(CuSO4),
а в третью – раствор сульфата железа (II)
(FeSO4).
Через некоторое время мы можем наблюдать, что на железном гвозде осела
медь, а во второй и третьей пробирке нет никаких изменений.
Следовательно, в первой пробирке находился более активный металл,
который вытеснил медь из раствора, во второй пробирке реакция не пошла, т. к.
образующая соль (сульфат свинца (II))
является нерастворимой, в третьей пробирке реакция не
прошла, т.к. медь стоит правее железа в ряду напряжений и не может вытеснить
его из раствора соли.
к.
образующая соль (сульфат свинца (II))
является нерастворимой, в третьей пробирке реакция не
прошла, т.к. медь стоит правее железа в ряду напряжений и не может вытеснить
его из раствора соли.
Fe + CuSO4 = FeSO4 + Cu↓
Fe0 + Cu2+ = Fe2+ + Cu0↓
Pb + CuSO4 ≠
Cu + FeSO4 ≠
А теперь, вам несложно будет отгадать,
о каком классе соединений идёт речь.
Известны ли вам дети
Какие есть оксиды на планете?
У оксидов пристрастия разные
То кислоты им нравятся праздные
То к воде их душа склоняется –
скажите, как они называются? (Основные оксиды)
А эти спешат к основаниям,
Растворимые, очень желанные,
Но с водой дружбу водят не все
Уж поверь…
Назовите оксиды теперь. (Кислотные оксиды.)
(Кислотные оксиды.)
Мы состоим из двух частей:
Во-первых, водород, о’кей!
Во-вторых, остаток наш.
Ну, вот и весь наш экипаж!
Окрасим лакмус в красный цвет,
Без нас и удобрений нет. (Кислоты)
Мы – жители непростые,
Нас очень много на Земле!
Особым даром обладая,
Мы растворяемся в воде.
А как на кожу попадём,
Мы тут же сильно обожжем.
Окрасим лакмус в синий цвет,
Без нас нейтрализации нет.
Без нас не обойдётесь тут!
Скажите, как же нас зовут? (Щёлочи)
Хоть мы разные на цвет,
Но важней нас в мире нет!
И нитраты, и сульфаты,
Карбонаты и фосфаты!
Все важны и все нужны!
Догадались, кто же мы? (Соли)
11. Химические свойства оснований. Химические свойства кислот.
Кислоты — это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка.
Общая формула кислот НnА, где А — кислотный остаток.
1. Диссоциация
HCl = H+ + Cl–
Многоосновные кислоты диссоциируют по ступеням (в основном по первой):
H2SO4 = H+ + НSO4– (1 ступень)
HSO4– = H+ + SO42– (2 ступень)
2. Взаимодействие с основаниями и амфотерными гидроксидами
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
H2SO4 + Zn(OH)2 = ZnSO4 + 2H2O
3. Взаимодействие с основными и амфотерными оксидами
H2SO4 + CaO = CaSO4 + H2O
H2SO4 + ZnO = ZnSO4 + H2O
4. Взаимодействие с металлами
а) кислоты-окислители по Н+ (HCl, HBr, HI, HClO4, h3SO4, h4PO4 и др.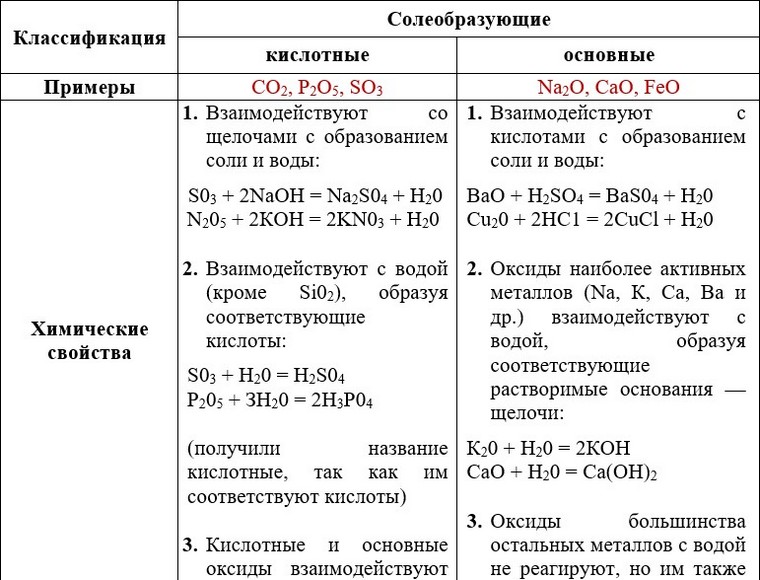 ).
).
В реакцию вступают металлы, расположенные в ряду активности до водорода:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
2HCl + Fe = FeCl2 + H2
б) кислоты-окислители по аниону (концентрированная серная, азотная любой концентрации):
2Fe + 6H2SO4 (конц.) = Fe2(SO4)3 + 3SO2 + 6H2O
5. Взаимодействие с солями
Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок:
2HCl + Na2CO3 = 2NaCl + CO2 + H2O
СaCl2 + H2SO4 = CaSO4 + 2HCl
6. Разложение.
При разложении кислородсодержащих кислот получаются кислотный оксид и вода.
H2SiO3 = SiO2 + H2O
Кислоты-окислители разлагаются сложнее:
4НNO3 = 4NO2 + 2H2O + O2
Интернет-источники
Химические свойства кислот, оснований, солей
МИНОБРНАУКИ РОССИИ
САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ ЭЛЕКТРОТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
«ЛЭТИ» ИМ.
 В.И. УЛЬЯНОВА (ЛЕНИНА)
В.И. УЛЬЯНОВА (ЛЕНИНА)Кафедра физической химии
ОТЧЕТ
по лабораторной работе №1 по дисциплине «Химия»
Тема: Химические свойства кислот, оснований, солей
Студентка гр. 1501 |
| Мажен Ж. |
Преподаватель |
| Ломакин М.С. |
Санкт-Петербург 2021
Цель работы: ознакомление с методами получения оксидов и оснований и изучение их химических свойств.
Основные теоретические положения
Оксиды –химические соединения, состоящие из двух элементов, один из которых кислород в степени окисления «−2».
Оксиды делятся на солеобразующие и несолеобразующие. Солеобразующие оксиды делятся на основные (CuO, Nа2O и др.), кислотные ( 2CO2 SO , и др.) и амфотерные (ZnO, PbO и др.).
Основными называются оксиды , которым соответствуют гидроксиды, относящиеся к классу оснований. Реагируя с кислотами, они образуют соль и воду. Основные оксиды – это оксиды металлов. Для них характерен ионный тип химической связи. У металлов, входящих в состав основных оксидов, степень окисления, как правило, бывает не выше +3.
Основные оксиды – это оксиды металлов. Для них характерен ионный тип химической связи. У металлов, входящих в состав основных оксидов, степень окисления, как правило, бывает не выше +3.
Основные оксиды образуют металлы, проявляющие в соединениях валентность I, II, III.
Получение основных оксидов:
Взаимодействие металла с кислородом: 2Mg + О2 = 2МgО Обжиг сульфидов: 2CuS + ЗО2 = 2СuО + 2SО2
Разложение солей кислородсодержащих кислот(при t):
BaCO3 = BaO + CO2
[pic 1] [pic 2]
Кислотными называют оксиды (SO2, CO2 и др.), которым соответствуют гидроксиды, относящиеся к классу кислот. Реагируя с основаниями, эти оксиды образуют соль и воду. Кислотные оксиды – это, главным образом, оксиды неметаллов с ковалентной связью. Степень окисления металлов в кислотных оксидах, как правило, больше +4 (V2O5, CrO3, Mn2O7) .
Получение кислотных оксидов:
- Окисление кислородом: 4Р + 5О2 = 2Р2О5,
- Горение сложных веществ: СН4 + 2О2 → СО2 + 2 Н2О
Амфотерными называются оксиды (BeO, ZnO, PbO, SnO, а также оксиды металлов со степенью окисления III и IV, например Al2O3, Cr2O3 и др. ), которые обладают двойственными свойствами и ведут себя в одних условиях как основные, а в других – как кислотные, т. е. образуют соли при взаимодействии как с кислотами, так и с основаниями.
), которые обладают двойственными свойствами и ведут себя в одних условиях как основные, а в других – как кислотные, т. е. образуют соли при взаимодействии как с кислотами, так и с основаниями.
Основания − это гидроксиды металлов, при диссоциации которых образуются гидроксид-ионы (ОН− ) и основные остатки: + − Cu(OH)2 (CuOH) + OH .
По растворимости в воде различают: основания, растворимые в воде – щелочи (гидроксиды щелочных и щелочно-земельных металлов) и основания, нерастворимые в воде, например Cu(OH)2 , Fe(OH)3, Cr(OH)3 и др.
Получение оснований:
1.Взаимодействие активных металлов с водой 2Na + 2h3O = 2NaOH + h3
2. Взаимодействие основных оксидов с водой (только щелочи) Na2O + h3O = 2NaOH
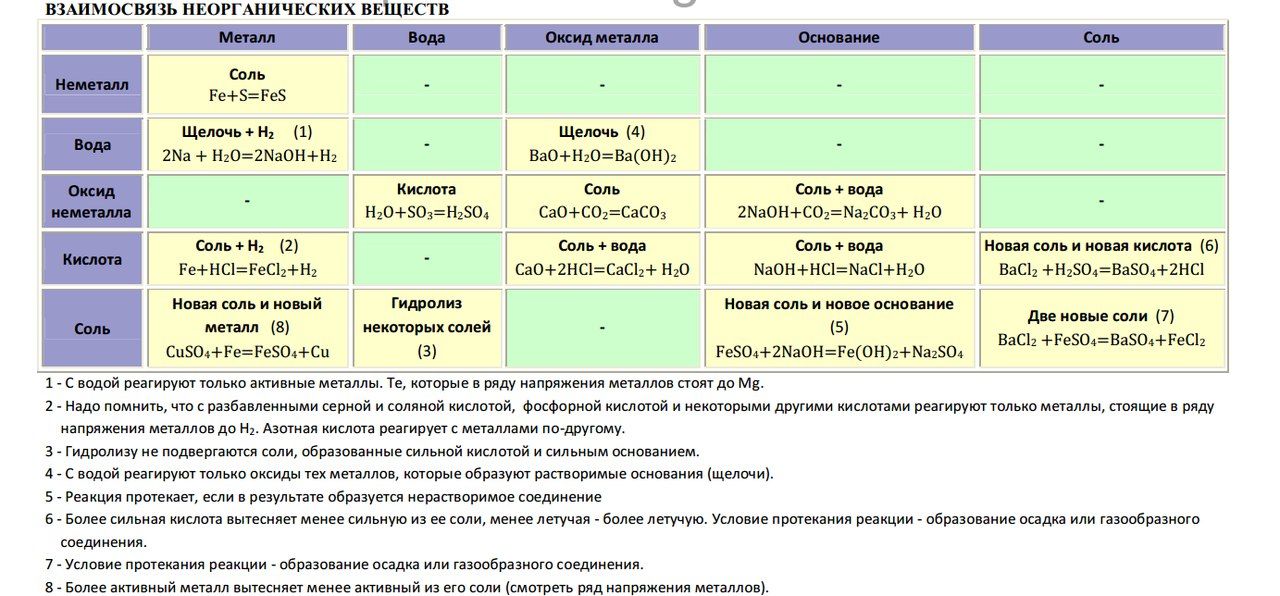
Свойства:
- В водном растворе растворимые основания диссоциируют, образуя катион металла и гидроксогруппу: NaOH = Na+ + OH—.
- Взаимодействие с кислотами (реакция нейтрализации) NaOH + HCl = NaCl + h3O,
OH— + H+ = h3O.
Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются ионы водорода (H+) и анионы кислотных остатков.
По наличию кислорода в своем составе кислоты делятся на бескислородные (например, HCl, HBr, h3S) и кислородосодержащие (например, HNO3, h3SO4, h4PO4).
В растворах кислот индикаторы меняют свою окраску: лакмус и метилоранж становятся красными.
Кислоты взаимодействуют с металлами, стоящими левее водорода в электрохимическом ряду напряжений (ряд активностей металлов), образуют
Ответы: Химические свойства оснований,оксидов,кислот,солей. СРОЧНО!!!…
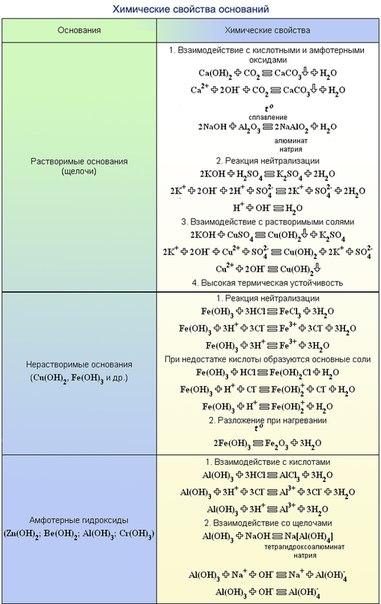
Химические свойства оснований.Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид –
ионов ОН—.
1. Изменение цвета индикаторов:
фенолфталеин – малиновый
лакмус – синий
метиловый оранжевый – желтый
2. Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
2NaOH + h3SO4 → Na2SO4 + 2h3O,
растворимое
Cu(OH)2 + 2HCI → CuCI2 + 2h3O.
нерастворимое
3. Взаимодействие с кислотными оксидами:
2NaOH + SO3 → Na2SO4 + h3O
4. Взаимодействие с амфотерными оксидами и гидроксидами:
а) при плавлении:
2NaOH + AI2O3 2NaAIO2 + h3O,
NaOH + AI(OH)3 NaAIO2 + 2h3O.
б) в растворе:
2NaOH + AI2O3 +3h3O → 2Na[AI(OH)4],
NaOH + AI(OH)3 → Na[AI(OH)4].
5. Взаимодействие с некоторыми простыми веществами (амфотерными металлами, кремнием и другими):
2NaOH + Zn + 2h3O → Na2[Zn(OH)4] + h3
2NaOH + Si + h3O → Na 2SiO3 + 2h3
6. Взаимодействие с растворимыми солями с образованием осадков:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4,
Ba(OH)2 + K2SO4 → BaSO4 + 2KOH.
7. Малорастворимые и нерастворимые основания разлагаются при нагревании:
Ca(OH)2=CaO + h3O,
Cu(OH)2=CuO + h3O.
голубой цвет черный цвет
Химические свойства оксидов.
1. Взаимодействие с водой:
— взаимодействие с водой с образованием основания (или щёлочи)
CaO+h3O→ Ca(OH)2 (известная реакция гашения извести, при этом выделяется большое количества тепла!)
2. Взаимодействие с кислотами:
Взаимодействие с кислотами:
— взаимодействие с кислотой с образованием соли и воды (раствор соли в воде)
CaO+h3SO4→ CaSO4+ h3O (Кристаллы этого вещества CaSO4 известны всем под названием «гипс»).
3. Взаимодействие с кислотными оксидами: образование соли
CaO+CO2→ CaCO3 (Это вещество известно всем — обычный мел!)
Химическое соединение. Типы соединений. Кислоты, атомы, свойства и семейства
Большинство из примерно десяти миллионов известных сегодня химических соединений можно разделить на относительно небольшое число подгрупп или семейств. Более 90% этих соединений в первую очередь относятся к органическим соединениям, потому что они содержат элемент углерод. В свою очередь, органические соединения можно подразделить на несколько десятков основных семейств, таких как алканы, алкены, алкины, спирты, альдегиды , кетоны карбоновые кислоты и амины.Каждое из этих семейств можно узнать по наличию характерной функциональной группы, которая сильно определяет физические и химические свойства соединений, составляющих это семейство. Например, функциональной группой спиртов является гидроксильная группа (-ОН), а у карбоновых кислот — карбоксильная группа (-СООН).
Например, функциональной группой спиртов является гидроксильная группа (-ОН), а у карбоновых кислот — карбоксильная группа (-СООН).
Важным подмножеством органических соединений являются те, которые встречаются в живых организмах, биохимические соединения. Биохимические соединения можно разделить на четыре основных семейства: углеводы, белки, , нуклеиновые кислоты и липиды.Члены первых трех семейств сгруппированы вместе из-за общих структурных особенностей и схожих физических и химических свойств. Члены семейства липидов классифицируются таким образом на основе их растворимости . Они, как правило, не растворяются в воде, но растворяются в органических жидкостях.
Неорганические соединения обычно подразделяются на одну из пяти основных групп: кислоты, основания, соли, оксиды и другие. Кислоты определяются как соединения, которые ионизируются или диссоциируют в водном растворе с образованием ионов водорода.Основания – это соединения, которые ионизируются или диссоциируют в водном растворе с образованием гидроксид-ионов. Оксиды — это соединения, у которых единственная отрицательная часть — это кислород. Соли — это соединения, катионами которых являются любые ионы, кроме водорода, а анионы — любыми ионами, кроме гидроксид-иона. Соли часто описываются как соединения, образующиеся (кроме воды) при взаимодействии кислоты и основания.
Оксиды — это соединения, у которых единственная отрицательная часть — это кислород. Соли — это соединения, катионами которых являются любые ионы, кроме водорода, а анионы — любыми ионами, кроме гидроксид-иона. Соли часто описываются как соединения, образующиеся (кроме воды) при взаимодействии кислоты и основания.
Эта система классификации полезна для группировки соединений, обладающих многими сходными свойствами. Например, все кислоты имеют кислый вкус , придают розовый цвет лакмусовой бумаге и реагируют с основаниями с образованием солей.Однако одним недостатком этой системы является то, что она может не дать представления об огромном разнообразии соединений, существующих в пределах определенного семейства. Например, элемент хлор образует по крайней мере пять распространенных кислот, известных как соляная, хлорноватистая, хлорноватистая, хлорная и хлорная кислоты. При всем сходстве эти пять кислот также обладают важными отличительными свойствами.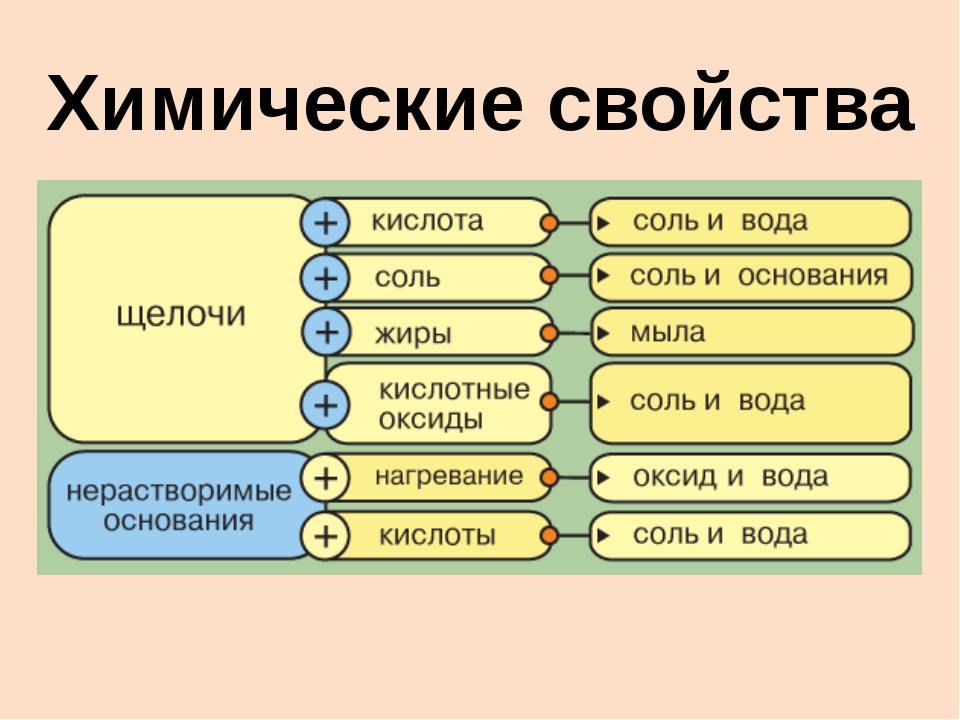
Категория «другие» классификации соединений включает все те соединения, которые не вписываются ни в одну из четырех других категорий.Возможно, наиболее важной группой соединений, содержащихся в этой категории «других», являются координационные соединения. Координационные соединения отличаются от кислот, оснований, солей и оксидов в первую очередь способом связывания. Члены последних четырех групп образуются, когда атомы отдают или принимают электроны для образования ионных связей, разделяют пары электронов для образования ковалентных связей или обмениваются электронами каким-либо промежуточным образом между этими случаями для образования полярных ковалентных связей. С другой стороны, координационные соединения образуются, когда один или несколько ионов или молекул отдают оба электрона в связывающей паре металлическому атому или иону.Содействующие вещества в таком соединении известны (или известны) как лиганды, а соединение в целом часто называют комплексом металла .
Книги Мастерсон, Уильям Л. , Эмиль Дж. Словински и Конрад Л. Станицкий. Химические принципы. Филадельфия: Сондерс, 1983, глава 3.
, Эмиль Дж. Словински и Конрад Л. Станицкий. Химические принципы. Филадельфия: Сондерс, 1983, глава 3.
Мур, Джон и Николас Д. Спенсер. Энциклопедия химической физики и физической химии. Вашингтон, округ Колумбия: Институт физики, 2001.
Уильямс, Артур Л., Харланд Д. Эмбри и Гарольд Дж. ДеБей. Введение в химию. 3-е издание. Рединг, Массачусетс: Addison-Wesley Publishing Company, 1986.
Периодические тенденции в оксидах
CuO + h3SO4 ————- CuSO4 + h3O
Эти оксиды металлов, как правило, имеют ионный характер связи с высокими температурами плавления.
При перемещении слева направо оксиды становятся менее основными и более кислыми.
Слайд 21
ТИПЫ ОКСИДОВ
КИСЛЫЕ ОКСИДЫ: В правой части периодической таблицы присутствуют кислотные оксиды неметаллов, например CO2, P2O5, SO2, SO3 и т. д.
д.
Имеют тенденцию к ковалентному характеру связи с низкими температурами плавления/кипения.
Сера и фосфор хорошо растворяются в воде, образуя кислые растворы, которые могут быть нейтрализованы щелочами с образованием солей.
SO2 + h3O ———— h3SO3
SO3 + h3O ———— h3SO4
Слайд 22
ТИПЫ ОКСИДОВ
АМФОТЕРНЫЕ ОКСИДЫ:
Это оксиды металлов.
Реагируют как с кислотами, так и со щелочами.
Обычно они относительно нерастворимы и мало влияют на показатели.
Например, оксид алюминия растворяется в кислотах с образованием «нормальных» солей алюминия, таких как хлорид, сульфат и нитрат. Однако он также растворяется в сильных щелочах, таких как раствор гидроксида натрия, с образованием «алюминатных» солей.
Слайд 23
ТИПЫ ОКСИДОВ
НЕЙТРАЛЬНЫЕ ОКСИДЫ:
Это оксиды неметаллов.
Они имеют низкую растворимость в воде и не влияют на лакмус.
не реагируют с кислотами и щелочами. например, монооксид углерода CO и монооксид азота NO, h3O.
Невозможно просто предсказать такое поведение по шаблонам периодической таблицы!
Слайд 24
Периодические тренды оксидов
Слайд 25
Соли
Когда ион H+ кислоты заменяется ионом металла, образуется соль e.г.
h3SO4(вод) + 2NaOH(вод) ====== Na2SO4(вод) + 2h3O(ж)
Здесь сульфат натрия (Na2SO4) представляет собой образовавшуюся соль. Соли являются ионными соединениями.
Примечание: аммиак (Nh4) — необычная основа — он не содержит металла. Образует соли аммония, содержащие ион аммония Nh5+.
напр. Nh4(водн.) + HNO3(водн.) Nh5NO3(водн.) (нитрат аммония)
Слайд 26
Способы получения растворимых солей
КИСЛОТА + МЕТАЛЛ → СОЛЬ + ВОДОРОД
2) КИСЛОТА + ОСНОВАНИЕ → СОЛЬ + ВОДА
3) КИСЛОТА + УГЛЕРОД СОЛЬ + ВОДА + ДВУОКИСЬ УГЛЕРОДА
КИСЛОТА + ЩЕЛОЧЬ СОЛЬ + ВОДА
ПРЯМАЯ КОМБИНАЦИЯ
Слайд 27
Метод 1 (кислота + металл)
Не подходит для получения солей металлов выше магния или ниже железа/олова по реакционной способности.
напр.
Перейти на страницу:1 2 3 4 5 6 7
Нейтрализация
Влияние кислот и щелочей на здоровье:
Кислоты и основания являются примерами коррозионно-активных ядов, которые реагируют локально на тканевых клетках. Химические вещества, которые являются очень основными или очень кислые реакционноспособны. Эти химические вещества могут вызвать серьезные ожоги. Кислота автомобильного аккумулятора представляет собой кислотное химическое вещество, обладающее реакционной способностью. Автомобильные аккумуляторы содержат более сильную форму некоторых из тех же кислота, которая находится в кислотных дождях.Бытовые чистящие средства часто содержат щелочь, очень щелочной химический реактив.
Кислоты и основания способны вызывать сильные «ожоги».
похоже на ожоги от тепла. Эти материалы действуют в первую очередь
обезвоживание клеточных структур. Тогда структуры белков
разрушается под действием кислоты или основания, катализирующего расщепление
пептидных связей. Образуются все меньшие и меньшие фрагменты, приводящие к
к окончательному распаду ткани.
Тогда структуры белков
разрушается под действием кислоты или основания, катализирующего расщепление
пептидных связей. Образуются все меньшие и меньшие фрагменты, приводящие к
к окончательному распаду ткани.
Глаза и легкие особенно чувствительны к коррозионным
яды. Роговица глаза повреждается ожогами кислотой или щелочью.
Отек легких (наполнение водой) возникает при сильно концентрированных
едкие загрязнители (острые отравления) попадают в легкие. Подкладка
нос, пазухи и легкие раздражаются и застаиваются
(при обезвоживании клеток). Это происходит при попытке разбавить
ядовитый агент.Это заболоченное состояние препятствует нормальному
обмен кислорода и углекислого газа. Жертва может умереть от
немедленное удушье, вторичная атака бактерий, приводящая
к пневмонии, или страдать от необратимого повреждения легких. Длительный субхронический
эффекты кислотно-щелочной дозы менее понятны.
Загрязнители воздуха, такие как оксиды серы, оксиды азота, хлор, и аммиак оказывают разъедающее воздействие на дыхательные пути.Растворимость газов в воде определяет их судьбу. То большинство растворимых газов, таких как аммиак и оксиды серы, быстро адсорбируется на влажных поверхностях верхних дыхательных путей, вызывая назальный и раздражение горла. Менее растворимые газы, такие как оксиды азота и хлор, производят свое действие в глубине легких вызывая отек легких, пневмонию и эмфизему (потеря эластичности и площадь поверхности).
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Амфотерные оксиды – синтез, свойства, идентификация
Термин «амфотерный» происходит от греческого слова amphoteroi (ἀμφότεροι) , что означает «оба». Амфотерные оксиды — это оксиды элементов (обычно металлов), проявляющие амфотерное поведение.
Амфотерность или амфотерность – это свойство соединения действовать как как кислота, так и как основание . В зависимости от реагентов и других условий реакции соединение ведет себя либо как кислота, либо как основание.
Пример амфотерных оксидов: Оксид алюминия Al 2 O 3 является амфотерным оксидом, поскольку он может нейтрализовать как HCl, так и NaOH.
Другими элементами, образующими амфотерные оксиды, являются галлий, индий, скандий, титан, цирконий, ванадий, хром, олово, железо, кобальт, медь, цинк, свинец, серебро, золото, германий, сурьма, висмут, бериллий и теллур.
Синтез Так как амфотерные оксиды являются оксидами определенных элементов, то они являются прямым результатом сжигания этих элементов на воздухе. Например, оксид цинка(II) получается в результате прямого сжигания Zn в большом количестве приточного воздуха:
Например, оксид цинка(II) получается в результате прямого сжигания Zn в большом количестве приточного воздуха:
2Zn(т) + O 2 (г) -> 2ZnO(т)
Аналогично,
4Al(т) + 3O 2 (ж) -> 2Al 2 O 3 (т)
Оксид свинца (II) получают путем нагревания Нитрат свинца (II):
2Pb(NO 3 ) 2 -> \(\Delta\) 2PbO(s) + 4NO 2 + O 2 (г)
Оксид олова (II), также известный как Оксид олова , может быть получен путем нагревания оксида олова (II) в инертной среде.Оксид олова (II) образуется, когда соли олова реагируют со щелочью, такой как гидроксид натрия.
SnCl 2 + 2NaOH -> Sn(OH) 2 + 2NaCl
Sn(OH) 2 -> \(\Delta\) SnO + H 2 O
Амфотерные оксиды в периодической таблице- В определенный период таблицы Менделеева оксиды переходят от основных к амфотерным и, наконец, к кислым.
 Например, рассмотрим 3 rd элементов периода: Na 2 O и MgO — основные, Al 2 O 3 — амфотерные, SiO 2 — слабокислые, P 2 O 2 O 3 , SO 2 , SO 3 , Cl 2 O и Cl 2 O 7 являются кислыми.
Например, рассмотрим 3 rd элементов периода: Na 2 O и MgO — основные, Al 2 O 3 — амфотерные, SiO 2 — слабокислые, P 2 O 2 O 3 , SO 2 , SO 3 , Cl 2 O и Cl 2 O 7 являются кислыми. - Вниз по группам основность увеличивается с увеличением атомного номера.
рассмотреть Группу 15 Оксиды:
NO 2 o 2 o 3 o 3 o 3 o 3 o 3 o 3 2 O 3 являются амфотерными, Bi 2 o 3 является основным. - Кислотность также увеличивается с увеличением степени окисления одного и того же оксида элемента. Пример. O 3
и
Sb 2 O 5 > Sb 2 O 3
Амфотерные оксиды обычно имеют очень высокие температуры плавления и кипения. Они имеют гигантские ковалентные структуры, для разрыва которых требуется много энергии.
Они имеют гигантские ковалентные структуры, для разрыва которых требуется много энергии.
Амфотерные оксиды нерастворимы в воде.
Химические свойства амфотерных оксидовАмфотерные оксиды реагируют как с кислотами, так и с основаниями.
Базовый натуральныйОсновная природа амфотерных оксидов выясняется их взаимодействием с кислотами. Амфотерные оксиды реагируют с обычными неорганическими кислотами с образованием соли металла и воды.
ZnO(т) + 2HNO 3 (водн.) -> Zn(NO 3 ) 2 (водн.) + H 2 O(л)
Al 2 O 3 (т) + 6HCl(водн.) -> 2AlCl 3 (водн.) + 3H 2 O(ж)
SnO(т) + 2HCl(водн.) -> SnCl 2 (водн.) + H 2 O(л)
PbO(т) + 2HNO 3 (водн.) -> Pb(NO 3 ) 2 (водн.) + H 2 O(л)
As 2 O 3 (т) + 6HCl(водн. ) -> 2AsCl(водн.) + 3H 2 O(л)
) -> 2AsCl(водн.) + 3H 2 O(л)
Кислая природа амфотерных оксидов выясняется по их реакции с основаниями.Амфотерные оксиды реагируют с обычными неорганическими основаниями с образованием сложных солей металлов и воды.
ZnO(s) + 2NaOH(aq) -> Na 2 ZnO 2 (aq) + H 2 O(l)
Обратите внимание, что Na 2 ZnO 2 в действительности состоит из воды.
Таким образом, более точное уравнение:
ZnO(т) + 2NaOH(водн.) + H 2 O(ж) -> Na 2 [Zn(OH) 4 ](водн.)
, где Na 2 [Zn(OH) 4 ] представляет собой гидратированный цинкат натрия, а анион представляет собой [Zn(OH) 4 ] +2 .
Al 2 O 3 (т) + 2NaOH(водн.) -> 2NaAlO 2 (водн.) + H 2 O(л)
или
Al 2 O 3 (т) + 2NaOH(водн. ) + 3H 2 O(л) -> 2Na[Al(OH) 4 ](водн.)
) + 3H 2 O(л) -> 2Na[Al(OH) 4 ](водн.)
, где Na[Al(OH) 4 ] представляет собой гидратированный алюминат натрия, а [Al(OH) 4 ] +1 представляет собой анион.
PbO(т) + 2NaOH(водн.) + H 2 O(ж) -> Na 2 [Pb(OH) 4 ](водн.)
SnO(s) + 4NaOH(aq) + H 2 O(l) <=> Na 4 [Sn(OH) 6 ](aq)
Идентификация амфотерных оксидовАмфотерный оксид может нейтрализовать как кислоту, так и основание .Таким образом, чтобы определить, является ли соединение амфотерным, необходимо наблюдать за его реакцией с кислотой, такой как HCl, и реакцией с основанием, таким как NaOH.
Убедившись, что данное вещество является амфотерным, нам необходимо выяснить, является ли данное вещество оксидом или нет. Проводятся тесты на другие анионы, такие как сульфат, нитрат, нитрит, хлорид и т. д. Если все тесты показывают отрицательный результат, данное соединение является оксидом.
д. Если все тесты показывают отрицательный результат, данное соединение является оксидом.
Обычное использование некоторых амфотерных оксидов:
- Оксид свинца(II): Добавление PbO в стекло увеличивает его электрическое сопротивление, показатель преломления и способность поглощать рентгеновские лучи.В то же время он снижает вязкость стекла. Следовательно, PbO необходим для стекольной промышленности.
PbO также используется в керамической промышленности для изготовления керамических изделий, которые являются магнитно- и электрически инертными. - Оксид цинка: Оксид цинка широко используется в цементной и косметической промышленности. Он также используется для изготовления сухих элементов и других типов постоянных элементов.
- Оксид алюминия: Руды оксида алюминия, такие как бокситы, присутствуют в земной коре.Сначала эти руды концентрируются с образованием чистого оксида алюминия.
 Этот оксид алюминия затем используется в процессе Холла-Эру для получения чистого металлического алюминия.
Этот оксид алюминия затем используется в процессе Холла-Эру для получения чистого металлического алюминия.
Амфотерные оксиды представляют собой оксиды элементов (обычно металлов), проявляющие амфотерные свойства. Амфотеризм или амфотерное поведение — это свойство соединения действовать как кислота и как основание. В зависимости от реагентов и других условий реакции соединение ведет себя либо как кислота, либо как основание.
Как идентифицировать амфотерные оксиды? Амфотерный оксид может нейтрализовать как кислоту, так и основание. Таким образом, чтобы определить, является ли соединение амфотерным, необходимо наблюдать за его реакцией с кислотой, такой как HCl, и реакцией с основанием, таким как NaOH.
После подтверждения того, что данное вещество является амфотерным, нам необходимо выяснить, является ли данное вещество оксидом или нет. Проводятся тесты на другие анионы, такие как сульфат, нитрат, нитрит, хлорид и т. д. Если все тесты показывают отрицательный результат, данное соединение является оксидом.
Проводятся тесты на другие анионы, такие как сульфат, нитрат, нитрит, хлорид и т. д. Если все тесты показывают отрицательный результат, данное соединение является оксидом.
Да, вода является амфотерным соединением.
H 2 o <=> H
Кислотное поведение:
H 2 o (кислота) + NH 3 (База) -> NH 4 + + OH –
Основное поведение:
H 2 O(основание) + HCl(кислота) -> Cl – + H 3 O +
ФИЗИЧЕСКИЙ СВОЙСТВА КИСЛОТ | |||
 | |||
ХИМИЧЕСКАЯ ПРОДУКЦИЯ СВОЙСТВА КИСЛОТ | |||
НЕЙТРАЛИЗАЦИЯ | |||
| Ан кислота при взаимодействии с основанием образует соль и воду.Эта реакция называется нейтрализацией | |||
| HCl + NaOH NaCl
+ H 2 O HNO 3 + NaOH NaNO 3 + H 2 OHCl + KOH KCl + H 2 O | |||
РЕАКЦИЯ С КАРБОНАТАМИ | |||
| Кислота и карбонаты объединяются для получения соли, воды и двуокиси углерода | |||
МгСО 3 + 2HCl MgCl 2 + CO 2 + H 2 O СаСО 3 + 2HCl CaCl 2 + CO 2 + H 2 O Na 2 CO 3 + H 2 SO 4 Na 2 SO 4 + CO 2 + H 2 O СаСО 3 + H 2 SO 4 CaSO 4 + CO 2 + H 2 O | |||
РЕАКЦИЯ С БИКАРБОНАТАМИ | |||
| Кислота и бикарбонаты объединяются для получения соли, воды и двуокиси углерода | |||
NaHCO 3 + HCl NaCl + CO 2 + H 2 O | |||
РЕАКЦИЯ С МЕТАЛЛОМ | |||
| С Цинк: | |||
Цинк + 2HCl ZnCl 2 + Н 2 | |||
| С Алюминий: | |||
2Ал + 6HCl 2AlCl 3 + 3H 2 | |||
| Реакция с оксидом железа: | |||
6HCl + Fe 2 O 3 2FeCl 3 + 3Н 2 О | |||
Для
последнюю информацию , бесплатные компьютерные курсы и важные заметки посетите :
www.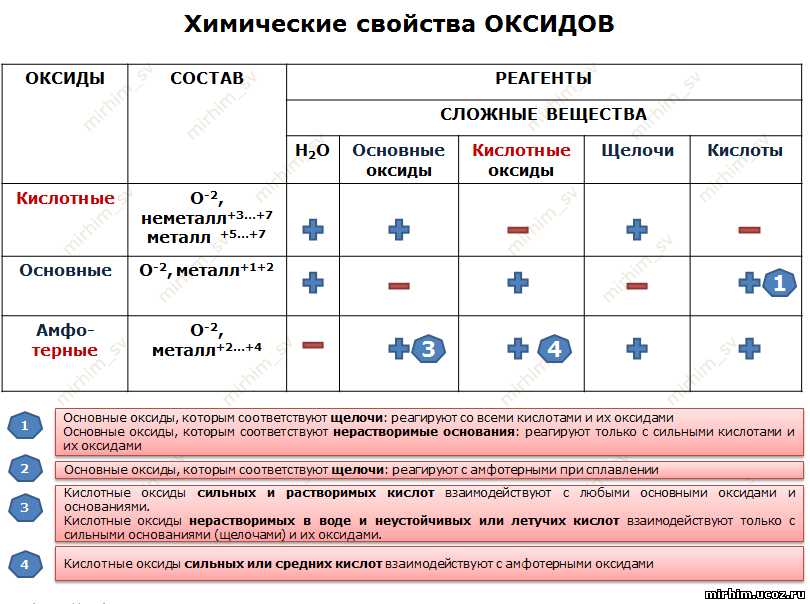 citycollegiate.com citycollegiate.com | |||
Ангидриды кислот и оснований: определение и примеры – видео и стенограмма урока
Ангидриды кислот
Ангидриды кислот представляют собой молекулы, образующие кислые растворы в воде. А ангидриды кислот — это оксиды неметаллов, способные реагировать с водой. В растворе они образуют молекулярные кислоты. Важно понимать, что не все оксиды неметаллов являются ангидридами кислот, а только те, которые могут реагировать с водой.Например, монооксид углерода представляет собой оксид углерода, но не реагирует с водой. Следовательно, это не ангидрид кислоты.
Здесь мы имеем две общие и важные реакции.
Первый – образование серной кислоты:
SO3(g) + h3O —> h3SO4(aq)
Здесь газообразный триоксид серы реагирует с водой с образованием серной кислоты. Вы можете распознать серную кислоту, потому что она отдает два атома водорода.
Эта реакция важна, потому что она вызывает кислотные дожди.Кислотные дожди образуются из-за загрязнения. В частности, кислотные дожди обычно образуются из-за загрязнения угольными электростанциями, производящими диоксид серы SO2.
На воздухе диоксид серы вступает в реакцию с кислородом с образованием триоксида серы. Это ангидрид кислоты в нашей реакции. После образования он быстро вступает в реакцию с водяным паром в атмосфере и выпадает в виде кислотных дождей. Кислотные дожди оказывают разрушительное воздействие на окружающую среду.
По этой причине были введены правила по снижению количества диоксида серы в атмосфере от промышленности.Эти правила успешно уменьшили количество кислотных дождей.
Другой важной реакцией ангидрида кислоты является образование угольной кислоты:
CO2(g) + h3O —> h3CO3(aq)
На этот раз диоксид углерода реагирует с водой с образованием угольной кислоты. Опять же, вы можете узнать, что это кислота, потому что она отдает водород.
Углекислота также участвует в образовании кислотных дождей. Но еще важнее его роль в изменении уровня pH наших океанов, рек и ручьев.
Из нашей реакции, я уверен, вы можете видеть, что чем больше углекислого газа в атмосфере, тем больше угольной кислоты будет произведено. Это вызывает серьезную озабоченность у ученых, поскольку океаны становятся более кислыми из-за повышения уровня углекислого газа в атмосфере.
Ангидриды кислот также широко используются в органической химии. Они используются в производстве всевозможных вещей, включая промышленные химикаты, фармацевтические препараты, парфюмерию и взрывчатые вещества.Если у вас сильная головная боль, вы можете принять аспирин. Так, важной реакцией для многих людей является использование ангидрида кислоты в синтезе аспирина.
Основные ангидриды
Теперь перейдем к основным ангидридам . Это молекулы, которые образуют основные растворы в воде. Основные ангидриды – это оксиды металлов I и II групп. Они реагируют с водой с образованием гидроксид-иона в качестве одного из продуктов.
Они реагируют с водой с образованием гидроксид-иона в качестве одного из продуктов.
Типичной реакцией ангидрида основания является реакция оксида кальция:
CaO(s) + h3O —> Ca(OH)2(aq)
Здесь оксид кальция реагирует с водой с образованием гидроксида кальция.Вы можете распознать гидроксид кальция как основание из-за ионов гидроксида, которые он может отдавать.
Именно такая реакция происходит при добавлении воды в сухой цемент. Оксид кальция, или негашеная известь, входит в состав цемента. По этой причине очень важно защитить кожу, когда вы работаете с цементом или затиркой для укладки плитки.
Продолжительный контакт ваших рук с этими продуктами может вызвать раздражение. Это связано с тем, что гидроксид кальция вступает в реакцию с водой в вашей коже, распадаясь на ионы кальция и гидроксида.Ионы гидроксида очень едкие.
Резюме урока
В этом уроке вы узнали, что термин ангидрид означает «без воды». Кислотные ангидриды представляют собой оксиды неметаллов, которые могут реагировать с водой с образованием кислых растворов.
