Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
Что такое расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
Что такое расчеты массы (объема, количества вещества) продукта реакции? Какой алгоритм поиска массы растворенного вещества, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества.
Для расчета массы (объема, количества вещества) продукта реакции, если данные по одному из веществ представлены в виде раствора с определенной массовой долей этого растворенного вещества, следует воспользоваться нижеследующим алгоритмом:
1) Прежде всего следует найти массу растворенного вещества. Возможны две ситуации:
* В условии даны масса раствора и массовая доля растворенного вещества (концентрация). В этом случае масса растворенного вещества рассчитывается по формуле:
формула расчета массы растворенного вещества, зная массу раствора и его концентрацию
* В условии даны объем раствора вещества, плотность этого раствора и массовая доля растворенного вещества в этом растворе.
m(р-ра) = ρ(р-ра) ∙V(р-ра)
После чего следует рассчитать массу растворенного вещества по формуле 1.
2) Рассчитать количество вещества (моль) участника реакции, масса которого стала известна из расчетов выше. Для этого воспользоваться формулой:
n(в-ва) = m(в-ва)/M(в-ва), где М — молярная масса вещества
3) Записать уравнение реакции и убедиться в правильности расставленных коэффициентов.
4) Рассчитать количество моль интересующего участника реакции исходя из известного количества другого участника реакции, зная, что количества веществ любых двух участников реакции A и B относятся друг к другу как коэффициенты перед этими же веществами в уравнении реакции, то есть:
n(A)/n(B) = k(A)/k(B)
Если в условии требовалось рассчитать количество вещества, то действия на этом заканчиваются. Если же требуется найти его массу или объем, следует переходить к следующему пункту.
5) Зная количество вещества, определенное в п.4, мы можем рассчитать его массу по формуле:
Расчет количества продукта по данным раствора другого вещества
Также, если вещество является газообразным и речь идет о нормальных условиях (н.у.), его объем может быть рассчитан по формуле:
V(газа) = Vm ∙ n(газа) = n(газа) ∙ 22,4 л/моль
Рассмотрим пару примеров расчетных задач по этой теме.
Пример 1
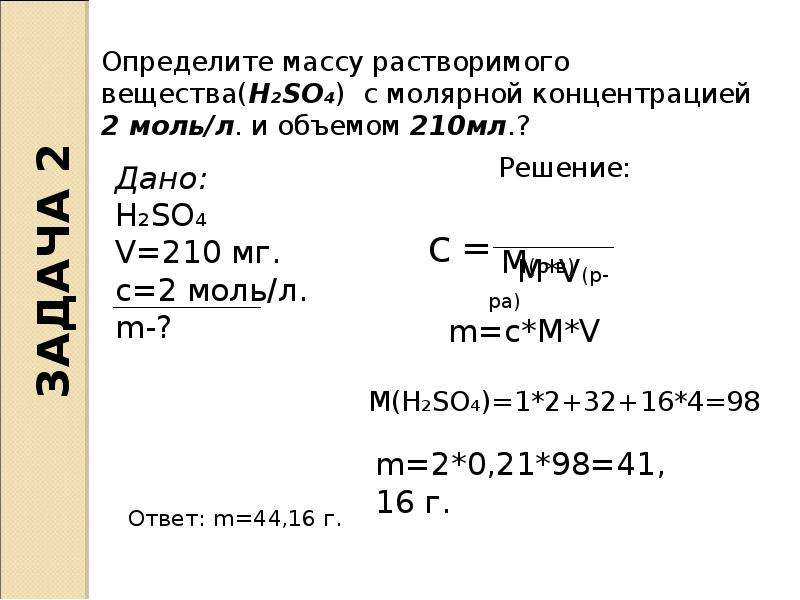
Рассчитайте массу осадка, который образуется при добавлении к 147 г 20%-ного раствора серной кислоты избытка раствора нитрата бария.
Решение:
1) Рассчитаем массу чистой серной кислоты:
m(h3SO4) = w(h3SO4) ∙ m(р-ра h3SO4)/100% = 147 г ∙ 20% /100% = 29,4 г
2) Рассчитаем количество вещества (моль) серной кислоты:
n(h3SO4) = m(h3SO4) / M(h3SO4) = 29,4 г/98 г/моль = 0,3 моль.
3) Запишем уравнение взаимодействия серной кислоты с нитратом бария:
h3SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
n(BaSO4)/n(h3SO4) = k(BaSO4)/k(h3SO4), где n — количество вещества, а k — коэффициент в уравнении реакции,
можем записать:
n(BaSO4) = n(h3SO4) ∙ k(h3SO4)/k(BaSO4) = 0,3 моль ∙ 1/1 = 0,3 моль
5) Тогда масса осадка, т.е. сульфата бария, может быть рассчитана следующим образом:
m(BaSO4) = M(BaSO4) ∙ n(BaSO4) = 233 г/моль ∙ 0,3 моль = 69,9 г
Пример 2
Какой объем газа (н.у.) выделится при растворении необходимого количества сульфида железа (II) в 20%-ном растворе соляной кислоты с плотностью 1,1 г/мл и объемом 83 мл.
Решение:
1) Рассчитаем массу раствора соляной кислоты:
m(р-ра HCl) = V(р-ра HCl) ∙ ρ(р-ра HCl) = 83 мл ∙ 1,1 г/мл = 91,3 г
Далее рассчитаем массу чистого хлороводорода, входящего в состав кислоты:
m(HCl) = m(р-ра HCl) ∙ w(HCl)/100% = 91,3 г ∙ 20%/100% = 18,26 г
2) Рассчитаем количество вещества хлороводорода:
n(HCl) = m(HCl)/M(HCl) = 18,26 г/36,5 г/моль = 0,5 моль;
3) Запишем уравнение реакции сульфида железа (II) с соляной кислотой:
FeS + 2HCl = FeCl2 + h3S↑
4) Исходя из уравнения реакции следует, что количество прореагировавшей соляной кислоты с количеством выделившегося сероводорода связано соотношением:
n(HCl)/n(h3S) = 2/1, где 2 и 1 — коэффициенты перед HCl и и h3S соответственно
Следовательно:
n(h3S) = n(HCl)/2 = 0,5/2 = 0,25 моль
5) Объем любого газа, находящегося при нормальных условиях, можно рассчитать по формуле V(газа) = Vm ∙ n(газа), тогда:
V(h3S) = Vm ∙ n(h3S) = 22,4 л/моль ∙ 0,25 моль = 5,6 л
КАК РЕШАТЬ ПРОСТЕЙШИЕ ЗАДАЧИ ПО ХИМИИ
КАК РЕШАТЬ ПРОСТЕЙШИЕ ЗАДАЧИ ПО ХИМИИКАК РЕШАТЬ ПРОСТЕЙШИЕ ЗАДАЧИ ПО ХИМИИВ реакцию с соляной кислотой вступило 13 г цинкаНовая страница 1
Как вычислить молекулярную и молярную массы вещества?
Для
этого нужно сложить массы всех атомов в
этой молекуле.
Пример 1. В молекуле воды Н2О 2 атома водорода и 1 атом кислорода. Атомная масса водорода = 1, а кислорода – 16. Поэтому молекулярная масса воды равна 1 + 1 + 16 = 18 атомных единиц массы, а молярная масса воды = 18 г/моль.
Пример 2. В молекуле серной кислоты Н2SO4 2 атома водорода, 1 атом серы и 4 атома кислорода. Поэтому молекулярная масса этого вещества составит 1 2 + 32 + 4 16 = 98 а.е.м, а молярная масса – 98 г/моль.
Пример 3. В молекуле сульфата алюминия А12(SO4)3 2 атома алюминия, 3 атома серы и 12 атомов кислорода. Молекулярная масса этого вещества равна 27 · 2 + 32 · 3 + 16 · 12 = 342 а.е.м., а молярная масса – 342 г/моль.
Как решить простейшую расчетную задачу
по химическому уравнению?
Сначала
записываем числовые данные из условия
задачи – массу вещества, или объем газа. Затем выясняем, что нужно определить в той
задаче, и записываем вопрос под условием
задачи. Далее действуем так:
Затем выясняем, что нужно определить в той
задаче, и записываем вопрос под условием
задачи. Далее действуем так:
Определяем количества веществ, массы или объемы которых даны в условии задачи.
Записываем уравнение реакции, о которой сказано в условии задачи и расставляем в нем коэффициенты.
Вычисленное количество вещества записываем над формулой этого вещества в уравнении реакции.
Учитывая коэффициенты, определяем количества тех веществ, массы или объемы которых нужно определить в данной задаче.
По найденным количествам веществ рассчитываем массы или объемы этих веществ.
Проверяем, на все ли поставленные вопросы условия задачи найдены ответы.
Записываем ответы задачи.
Как решать задачи с участием растворов веществ?
Если
в условии задачи указаны объем и плотность
раствора, то по этим данным можно найти
массу раствора (объем раствора в мл
умножается на плотность раствора).
По массе раствора находится масса растворенного вещества (масса раствора умножается на массовую долю растворенного вещества и переводится в проценты).
По найденной массе растворенного вещества определяется его количество (масса растворенного вещества делится на его молярную массу)
Записывается уравнение реакции, о которой сказано в условии задачи, и в нем расставляются все коэффициенты.
Найденное в п.3 количество вещества записывается над формулой этого вещества в уравнении реакции.
Учитывая коэффициенты, определяется количество вещества, массу или объем которого нужно найти.
По найденному количеству вещества определяются его масса или объем.
4.Как решать задачи, где одно из реагирующих веществ дано в избытке?
Если
в условии задачи есть числовые данные (массы
или объемы) по обоим веществам, участвующим
в реакции, то, возможно, одно из них
находится в избытке. Поэтому решение задачи
начните с расчета
количеств этих веществ в моль.
Поэтому решение задачи
начните с расчета
количеств этих веществ в моль.
Далее запишите уравнение нужной реакции со всеми коэффициентами.
По коэффициентам в уравнении и найденным количествам веществ определите, какое из веществ находится в избытке, а какое – в недостатке.
В уравнении реакции над формулой вещества, находящегося в недостатке, записываем его количество в моль и с учетом коэффициентов находим количества остальных веществ, участвующих в реакции.
Далее рассчитываются массы или объемы остальных веществ.
В реакцию с соляной кислотой вступило 13 г цинка. Определите массы израсходованной кислоты и полученной соли, а также объем выделившегося газа.
Решение.
1. Находим количество вещества цинка, разделив его массу на молярную массу:
n(Zn) = m : M = 13 г : 65 г/моль = 0,2 моль
2. Вносим эту величину в уравнение
реакции и с ее помощью определяем
количества всех указанных в задаче веществ
(с учетом коэффициентов):
Вносим эту величину в уравнение
реакции и с ее помощью определяем
количества всех указанных в задаче веществ
(с учетом коэффициентов):
0,2 моль 0,4 моль 0,2 моль 0,2 моль
Zn + 2HCl => ZnCl2 + h3
m(HCl) = M · n = 36,5 г/моль · 0,4 моль = 14,6 г
m(ZnCl2) = M · n = 136 г/моль · 0,2 моль = 27,2 г
Объем водорода находим аналогично:
V(h3) = Vm · n = 22,4 л/моль · 0,2 моль = 4,48 л
ЗАДАЧИ НА ИЗБЫТОК РЕАГЕНТА
Главный
отличительный признак таких расчетов – это
наличие числовых данных (массы, объема,
количества вещества или необходимых
компонентов для их вычисления) по обоим
веществам, реагирующим между собой. Чаще
всего это говорит о том, что одно из этих
веществ находится в избытке и вступит в
реакцию не полностью. Определить же, что
именно в избытке, удобнее всего, когда
известны количества вещества реагентов.
Если они не указаны в условии, их следует
вычислить по исходным данным.
Чаще
всего это говорит о том, что одно из этих
веществ находится в избытке и вступит в
реакцию не полностью. Определить же, что
именно в избытке, удобнее всего, когда
известны количества вещества реагентов.
Если они не указаны в условии, их следует
вычислить по исходным данным.
Задача 1.
8 г серы нагрели с 28 г железа. Определите массу продукта реакции.
Решение.
1. Так как в условии указаны массы железа и серы одновременно, то одно из этих веществ вполне может оказаться в избытке. Для выяснения этого находим количества вещества реагентов:
n(
Fe) = m : M = 28 г : 56 г/моль = 0,5 мольn(S) = m : M = 8 г : 32 г/моль = 0,25 моль
2. Записываем уравнение реакции и по коэффициентам определяем мольные отношения реагентов:
Fe + S ® FeS
3. Так как железа и серы должно
реагировать равное количество молей, то
ясно, что в этой реакции будет
израсходовано по 0,25 моль их, избыток железа
при этом составит 0,5 – 0,25 + 0,25 моль, и в
реакцию не вступит.
Так как железа и серы должно
реагировать равное количество молей, то
ясно, что в этой реакции будет
израсходовано по 0,25 моль их, избыток железа
при этом составит 0,5 – 0,25 + 0,25 моль, и в
реакцию не вступит.
4. Так как сера взята в недостатке, то по ее количеству определяем количество продукта реакции, а затем его массу:
0,25 моль 0,25 моль 0,25 моль
Fe + S ® FeS
m (FeS) = M · n = 88 г/моль · 0,25 моль = 22 г
Задача 2.
Для реакции взято 56 л хлора и 56 г железа. Определите массу полученного продукта.
Решение.
2Fe + 3Cl2 ® 2 FeCl3
В этом случае расчет избытка более сложен, поэтому можно использовать такую хитрость:
|
Fe |
Cl2 |
|
2 |
3 |
|
1 |
|
|
|
2,5 |
В
первой строке пишем формулы реагирующих
веществ, во второй – их мольные отношения
по уравнению реакции (по коэффициентам), а в
двух следующих – количества
этих веществ,
имеющихся в наличии, причем на разных
строках. Далее по
этим данным находим количества вещества
реагента, необходимого для взаимодействия
с этими количествами вещества железа
и хлора:
Далее по
этим данным находим количества вещества
реагента, необходимого для взаимодействия
с этими количествами вещества железа
и хлора:
| Fe | Cl2 |
|
2 |
3 |
|
1 |
1,5 |
|
1,67 |
2,5 |
Далее анализируем полученные данные.
Железа есть 1 моль, а
для реакции с 2,5 моль хлора его нужно в
полтора раза меньше, это составляет 1,67 моль,
чего у нас нет. Следовательно, железо в
недостатке, а число 1,67 можно зачеркнуть.
Хлора имеется 2,5 моль, а на реакцию с
железом нужно лишь 1,5 моль, поэтому хлор
взят в избытке. Избыток хлора составляет
2,5 – 1,5 = 1 моль.
Следовательно, железо в
недостатке, а число 1,67 можно зачеркнуть.
Хлора имеется 2,5 моль, а на реакцию с
железом нужно лишь 1,5 моль, поэтому хлор
взят в избытке. Избыток хлора составляет
2,5 – 1,5 = 1 моль.
Таким образом, в недостатке железо, и дальнейшие расчеты ведем по его количеству:
1 моль 1,5 моль 1 моль
2Fe + 3Cl2 ® 2 FeCl3
m (FeСl3) = M · n = 162,5 г/моль · 1 моль = 162,5 г
Задача 3.
К раствору, содержащему 26,1 г нитрата бария, добавлен раствор, содержащий 35,5 г сульфата натрия, осадок отфильтрован. Что находится в фильтрате и в каком количестве?
Решение.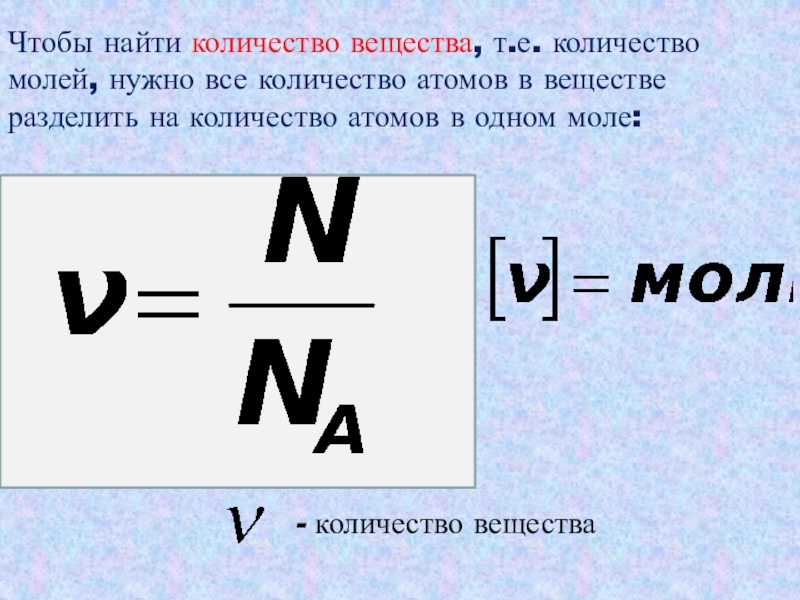
n [
Ba(NO3)2] = 26,1 г : 261 г/моль = 0,1 мольn (Na2SO4) = 35,5 г : 142 г/моль = 0,25 моль (избыток 0,15 моль)
0,1 моль 0,1 моль 0,1 моль 0,2 моль
Ba(NO3)2 + Na2SO4 ® BaSO4 + 2HCl
В растворе после реакции окажется 0,2 моль нитрата натрия и остаток сульфата натрия 0,15 моль. При необходимости можно найти массы этих веществ.
Иногда от количеств вещества реагентов может зависеть не только количество продуктов реакции, но и их состав.
Задача 4.
К
раствору, содержащему 49 г серной кислоты,
добавлено 20 г гидроксида натрия. Определите
состав и массу полученной соли.
Решение.
n (h3SO4) = 49 г : 98 г/моль = 0,5 моль
n (NaOH) = 20 г : 40 г/моль = 0,5 моль
Так как серная кислота двухосновна, то она может образовать два ряда солей:
2 NaOH + h3SO4 ® Na2SO4 + 2h3O средняя соль
NaOH + h3SO4 ® NaHSO4 + h3O кислая соль
В нашей задаче оказалось равное мольное количество кислоты и щелочи, поэтому расчет следует вести по второму уравнению реакции:
0,5 моль 0,5 моль 0,5 моль
NaOH + h3SO4 ® NaHSO4 + h3O
m (NaHSO4) = M
· n = 120 г/моль · 0,5 моль = 60 г.
Задача 5.
Через раствор, содержащий 60 г гидроксида натрия, пропущен углекислый газ, полученный при действии избытка соляной кислоты на 200 г карбоната кальция. Определите состав и массу полученной соли.
Решение.
1. Определяем количества вещества веществ, указанных в условии задачи:
n (NaOH) = m : M =
60 г : 40 г/моль = 1,5 мольn (CaCO3) = m : M = 200 г : 100 г/моль = 2 моль
2. Записываем уравнение реакции, в которой был получен углекислый газ, и по количеству вещества СаСО3 определяем, сколько моль газа выделилось:
2 моль 2 моль
CaCO3 + 2HCl ® CaCl2 + h3O + CO2
3. Таким
образом, для второй реакции у нас имеется 2
моль углекислого газа и 1,5 моль гидроксида
натрия. Так как СО2
– ангидрид двухосновной угольной кислоты Н2СО3,
то при его взаимодействии с щелочами могут
образоваться как средние, так и кислые соли:
Таким
образом, для второй реакции у нас имеется 2
моль углекислого газа и 1,5 моль гидроксида
натрия. Так как СО2
– ангидрид двухосновной угольной кислоты Н2СО3,
то при его взаимодействии с щелочами могут
образоваться как средние, так и кислые соли:
NaOH + CO2 ® NaHCO3
2NaOH + CO2 ® Na2CO3 + h3O
Теперь нужно определиться, по какому из двух уравнений реакций нам вести расчет. Для образования средней соли щелочи должно быть вдвое больше, чем газа. У нас же наоборот, газа больше, чем щелочи. Следовательно, реакция пойдет по первому уравнению, с образованием кислой соли, причем СО2 окажется в избытке (0,5 моль):
1,5 моль 1,5 моль 1,5 моль
NaOH + CO2 ® NaHCO3
m
(NaHCO3)
= M ·
n = 84 г/моль
· 1,5 моль
= 126 г.
Решите самостоятельно.
1. 14 г оксида кальция обработали раствором, содержащим 36 г азотной кислоты. Какова масса полученной соли? (41 г).
2. К раствору, содержащему 40 г сульфата меди (II), добавили 12 г железных опилок. Останется ли в растворе сульфат меди после реакции?
3. Хватит ли 15 л кислорода для сжигания 4 г серы?
(да)
4. В раствор, содержащий 16 г сульфата меди (II), пропустили сероводород объемом 5,6 л. Какова масса выпавшего осадка? (9,6 г).
5. К раствору, содержащему 10,4 г хлорида бария, добавили 9,8 г серной кислоты. Определите массу осадка и состав полученного раствора. (11,65 г)
Задачи к разделу Основные понятия и законы химии
Здесь собраны примеры задач с решениями на нахождение молекулярной формулы вещества, эквивалента, парциального давления и другие задачи. Теоретическую часть вы найдете в разделе Основные понятия и законы химии.
Теоретическую часть вы найдете в разделе Основные понятия и законы химии.
Задача 1. Какой объем (н.у.) занимает 5∙10-3 кг углекислого газа?
Показать решение »
Решение.
Найдем молекулярную массу СО2:
Mr(CO2)= 12+2∙16=44 г.
Tакже нам известен молярный объем газа, который равен 22,4 м3.
Составим следующую пропорцию:
44 кг СО2 занимает объем 22,4 м3
5∙10-3 кг СО2 занимает объем – х
откуда х=(5∙10-3∙22,4)/44=2,5∙10-3 м3
Таким образом, 5∙10-3 кг углекислого газа занимает объем равный 2,5∙10-3 м3.
Задача 2. Определить массу 0,9∙10-3 м3 кислорода при 21 °С и давлении 96000 Па, если масса 10-3 м3 кислорода равна 1,5∙10-3 кг при нормальных условиях.
Показать решение »
Решение:
Найдем температуру в Кельвинах Т=273+21=294 К;
Найдем объем газа, приведенный к н. у. по формуле
у. по формуле
P1V1 / T1 = P2V2 / T2;
V1= T1P2V2/ T2P1=(273∙96000∙0.9∙10-3)/(294∙101325)=0.8∙10-3 м3
Теперь рассчитаем массу вычисленного объема:
10-3 м3 кислорода имеют массу равную 1,5∙10-3 кг
0,8∙10-3 м3 кислорода имеют массу равную х
х = 0,8∙10-3∙1,5∙10-3/10-3=1,2∙10-3 кг
Таким образом, 0,8∙10-3 м3 кислорода имеют массу равную 1,2∙10-3 кг.
Задача 3. Рассчитайте объем атома железа, если его плотность равна 7900 кг/ м3
Показать решение »
Решение:
Найдем молярный объем железа (M(Fe)=56 г.)
V=n/ρ=56/7900=7,1∙10-3 м3
Условно примем, что атомы имеют форму шара и в кристалле касаются друг друга, то истинный объем будет составлять только 74% от общего объема:
V=0,071∙0,74=5,25∙10-3 м3
Тогда объем одно атома железа будет равен:
VА=5,25∙10-3/6,02∙1026=8,7∙10-30 м3
Задача 4. Определить массу молекулы газа, если масса 10-3 м3 газа, при н.у., равна 0,3810-3 кг.
Определить массу молекулы газа, если масса 10-3 м3 газа, при н.у., равна 0,3810-3 кг.
Показать решение »
Решение:
Число молекул 1 кмоль любого вещества равна числу Авогадро (6,02*1026 ), поэтому для начала определим 1 кмоль газа:
10-3 м3 газа имеют массу равную 0,3810-3 кг
22,4 м3 газа имеют массу равную — х
х=22,4∙0,3810-3/10-3=7,6 кг,
Далее определяем массу молекулы газа:
m=7,6/6,02∙1026=1,26∙10-26 кг.
Задача 5. Рассчитайте молярную массу эквивалента металла, если при соединении 7,2 г. металла с хлором было получено 28,2 г. соли. Молярная масса эквивалента хлора равна 35,45 г/моль
Показать решение »
Решение:
Согласно закону эквивалента отношение массы металла и соли должно быть равно отношению их молярных масс эквивалентов. Обозначим молярную массу эквивалента металла через х, тогда:
7,2/28,2=х/(х+35,45)
Решая уравнение, находим, что х=12,15 г/моль.
Таким образом, молярная масса эквивалента металла Мэкв=12,15 г/моль.
Задача 6. Определение молярной массы эквивалента сложных веществ в реакциях обмена
Определите молярные массы эквивалентов H2SO4 в следующих реакциях:
А) H2SO4+2KOH = K2SO4+2H2O
Б) H2SO4+KOH = KHSO4+H2O
Показать решение »
Решение: Значение эквивалента вещества зависит от того, в какой именно реакции оно участвует.
В реакции А) 1 моль H2SO4 взаимодействует с 2 моль KOH, а эквивалент H2SO4 с 2 эквивалентами KOH. Молярная масса эквивалента KOH равна его молекулярной массе, следовательно, молярная масса эквивалента H2SO4 равна половине ее молекулярной массы:
Мэкв=98/2=49 г/моль
В реакции Б) 1 моль H2SO4 взаимодействует с 1 моль KOH, а эквивалент H2SO4 с 1 эквивалентами KOH. Молярная масса эквивалента KOH равна его молекулярной массе, следовательно, молярная масса эквивалента H2SO4 равна ее молекулярной массе: 98 г/моль.
Молярная масса эквивалента KOH равна его молекулярной массе, следовательно, молярная масса эквивалента H2SO4 равна ее молекулярной массе: 98 г/моль.
Задача 7. Рассчитайте молярную массу эквивалента кислоты, если на нейтрализацию 9 г. ее израсходовано 8 г. гидроксида натрия.
Показать решение »
Молярная масса эквивалента гидроксида натрия равна его молекулярной массе Мэкв=40 г/моль.
Вещества взаимодействуют между собой в массах, пропорциональных из молярным массам эквивалента, т.е.:
Обозначим молярную массу эквивалента кислоты – х, тогда
9/8=х/40
х=45 г/моль
Таким образом , молярная масса эквивалента кислоты Мэкв=45 г/моль.
Задача 8. Найдите молекулярную формулу вещества, если относительная плотность паров этого вещества по водороду равна 67,5, а массовые доли элементов (%) в веществе следующие: серы – 23,7, кислорода – 23,7, хлора – 52.
Показать решение »
Решение:
Формулу искомого соединения можно представить как SxOyClz. Найдем соотношение между числом атомов S, O, Cl делением его содержания на его атомную массу:
Найдем соотношение между числом атомов S, O, Cl делением его содержания на его атомную массу:
x:y:z = 23,7/32 : 23,7/16 : 52/35,5 = 0,74 : 1,48 : 1,46
Делим все полученные соотношения на наименьшее, получаем:
x:y:z =1:2:2
Простейшая формула вещества SO2Cl2
Его молекулярная масса равна
Mr = 32+16∙2+35,5∙2 = 135 г.
Теперь найдем молекулярную массу вещества по плотности паров этого вещества по водороду:
Mr = 2Dh3= 2∙67,5 = 135 г.
Следовательно, истинная формула вещества совпадает с простейшей: SO2Cl2
Задача 9. Рассчитайте молекулярную массу газа, если 7∙10-3 кг. его при 20°С и 0,253∙105 Па занимают объем 22,18∙10-3 м3
Показать решение »
Решение:
В данном случае, вычислить молярную массу газа можно, используя уравнение Клапейрона – Менделеева:
pV = nRT = (m/M)RT;
R=8,3144∙103 Дж/моль∙К
Т=273+20=293 К
М=mRT/pV=7∙10-3∙8,3144∙103293/(0,253∙105∙22,18∙10-3)=30,35 г/моль
Молярная масса газа равна 30,35 г/моль
Задача 10. При 0°С в сосуде объемом 14∙10-3 м3 содержится 0,8∙10-3 кг водорода и 6,3∙10-3 кг азота. Определите парциальное давление азота и общее давление смеси.
При 0°С в сосуде объемом 14∙10-3 м3 содержится 0,8∙10-3 кг водорода и 6,3∙10-3 кг азота. Определите парциальное давление азота и общее давление смеси.
Показать решение »
Решение:
Найдем количества вещества водорода и азота:
n=m/Mn(H2)=0,8∙10-3/2=0,4∙10-3моль
n(N2)= 6,3∙10-3/28=0,225∙10-3моль
Далее, с помощью уравнения Клапейрона – Менделеева, найдем парциальное давление каждого газа в смеси:
pV = nRT = (m/M)RT;
p = nRT/V;
p(H2)=n(H2)
RT/V=0,4∙10-3∙8,3144*103∙273/14∙10-3=64,85∙103 Па
p(N2)= n(N2)
RT/V=0,225∙10-3∙8,3144∙103∙273/14∙10-3=36,479∙103 Па
pобщ=p(H2)+p(N2)= 64,85∙103+36,479∙103=101329 Па
Задача 11. Газовая смесь составлена из 5∙10-3 м3 метана под давлением 96000 Па, 2∙10-3 м3 водорода под давлением 84000 Па и 3∙10-3 м3 диоксида углерода под давлением 109000 Па. Объем смеси 8∙10-3 м3. Определите парциальные давления газов в смеси и общее давление смеси.
Газовая смесь составлена из 5∙10-3 м3 метана под давлением 96000 Па, 2∙10-3 м3 водорода под давлением 84000 Па и 3∙10-3 м3 диоксида углерода под давлением 109000 Па. Объем смеси 8∙10-3 м3. Определите парциальные давления газов в смеси и общее давление смеси.
Показать решение »
Решение:
Сначала найдем парциальное давление каждого из газов:
p(CH4)=P(CH4)∙V(CH4)/Vобщ=96000∙5∙10-3/8∙10-3=60000 Па
p(H2)=P(H2)∙V(H2)/Vобщ=84000∙2∙10-3/8∙10-3=21000 Па
p(CО2)=P(CО2)∙V(CО2)/Vобщ=109000∙3∙10-3/8∙10-3=40875 Па
Общее давление:
pобщ= p(CH4)+ p(H2)+ p(CО2)= 60000+21000+40875=121875 Па
Задача 12.Газовая смесь состоит из оксида и диоксида азота. Вычислите парциальные давления газов в смеси, если объемные доли газов соответственно равны (%) 37,5 и 62,5. Общее давление газовой смеси 106640 Па.
Вычислите парциальные давления газов в смеси, если объемные доли газов соответственно равны (%) 37,5 и 62,5. Общее давление газовой смеси 106640 Па.
Показать решение »
Решение:
Парциальное давление газа в смеси равно произведению общего давления на его объемную долю в смеси:
p(NO)= pобщ∙φNO=106640∙0,375=39990 Па
p(NO2)= pобщ∙φNO2=106640∙0,625=66650 Па
Как рассчитать массу вещества в смеси | Химия
Расчет массы вещества в смеси
Этап 1 : Определите компоненты смеси.
Шаг 2 : Найдите процентное содержание желаемого компонента в смеси.
Шаг 3 : Найдите общую массу смеси.
Этап 4 : Умножьте процент желаемого компонента на общую массу смеси.
Расчет массы вещества в смеси: словарь и формулы
Смесь : Смесь получают путем объединения двух или более чистых компонентов. Смесь может быть гетерогенной или гомогенной. Гетерогенные смеси содержат компоненты, которые можно (как правило) разделить обычными физическими методами (декантация, грубая фильтрация с помощью сита, гравитационная и магнитная сепарация и т. д.). Гомогенные смеси (как правило) требуют лабораторных методов (перегонка, хроматография, химическая обработка и т. д.).) для разделения.
Гетерогенные смеси содержат компоненты, которые можно (как правило) разделить обычными физическими методами (декантация, грубая фильтрация с помощью сита, гравитационная и магнитная сепарация и т. д.). Гомогенные смеси (как правило) требуют лабораторных методов (перегонка, хроматография, химическая обработка и т. д.).) для разделения.
Процентный состав : Количество компонентов, присутствующих на единицу общей смеси, представляет собой процентный состав смеси. Процентный состав может быть записан в единицах, таких как масса, объем, количество молей и т. д., и зависит от использования. Здесь мы используем процентный состав по массе, так как навык требует расчета массы компонента в смеси.
Масса компонента : Масса компонента определяется по формуле:
{экв}\rm m_A = \%A\times M_{\text{смесь}}\\ \текст{где}\\ m = \text{масса компонента A} \\ \%A = \text{Процентный состав компонента A}\\ M_{\text{смесь}} = \text{Общая масса смеси} {/экв}
Общая масса смеси : Поскольку смесь представляет собой сумму ее компонентов (например, A, B, C и т. д.)…), общая масса смеси определяется по формуле:
д.)…), общая масса смеси определяется по формуле:
{экв}\rm M _ {\ text {смесь}} = m_A + m_B + m_C + \ точки {/экв}
Давайте теперь используем два примера, чтобы понять шаги и то, как их использовать.
Расчет массы вещества в смеси Пример 1. Процентное содержание компонента указывается напрямую.
В смеси песка и соли 30% смеси составляет соль по массе. Какова масса соли в 1,2 кг смеси?
Этап 1 : Определите компоненты смеси.
Смесь состоит из двух компонентов: песка и соли.
Шаг 2 : Найдите процентное содержание желаемого компонента в смеси.
30% всей смеси составляет соль.
Шаг 3 : Найдите общую массу смеси.
Общая масса смеси составляет 1,2 кг.
Этап 4 : Умножьте процент желаемого компонента на общую массу смеси.
{экв}\начало{выравнивание} \rm m_{\text{соль}} &=\rm \%\text{соль} \times M_{смесь}\\ &\rm = \dfrac{30}{100}\times 1.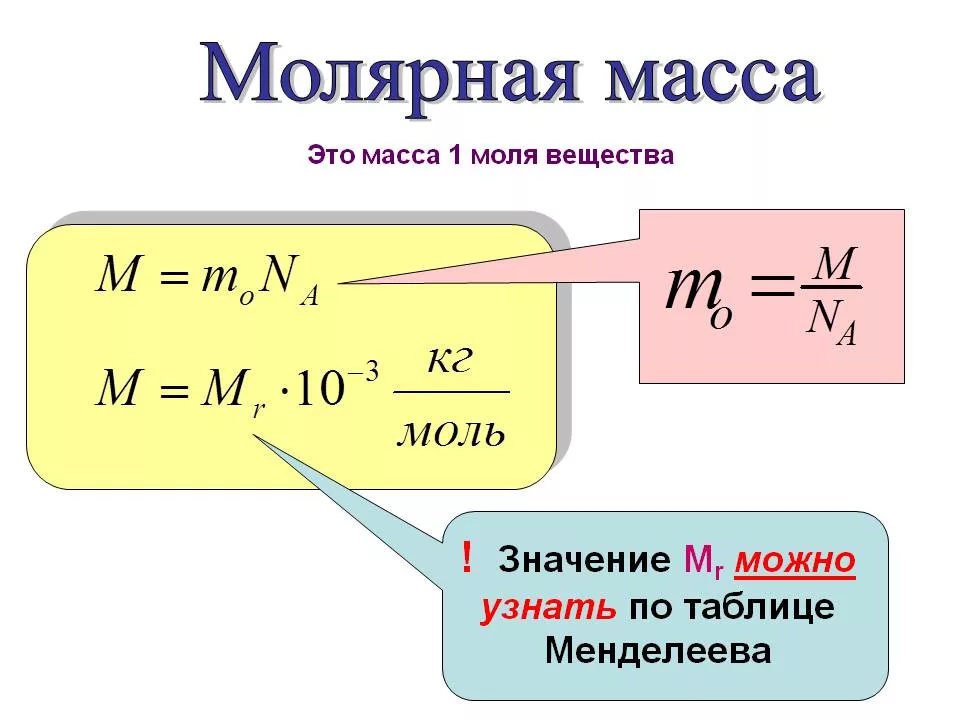 2\\ &\rm = 0,36\text{ кг} \end{выравнивание} {/экв}
2\\ &\rm = 0,36\text{ кг} \end{выравнивание} {/экв}
Отсюда масса вещества в смеси 0,36 кг.
Расчет массы вещества в смеси Пример 2: процентное содержание компонента
, а не , указанное напрямую.В газовой смеси двуокиси углерода и азота Углерод присутствует в количестве 20% по весу. Какова масса азота в 50-граммовой пробе такой смеси?
Этап 1 : Определите компоненты смеси.
Двумя компонентами смеси являются двуокись углерода и азот.
Шаг 2 : Найдите процентное содержание желаемого компонента в смеси.
20% всей смеси составляет углерод. Это не значит, что у нас 80% азота.
{экв}\rm \%\text{Азот} = 100-\%\text{Двуокись углерода} {/экв}
Но мы не знаем процент содержания углекислого газа в смеси. Мы выполним следующие шаги для этого расчета:
- Рассчитайте массу углерода в смеси.
- Рассчитайте процентное содержание двуокиси углерода в смеси, используя молярные массы углерода и двуокиси углерода.

- Рассчитайте массу азота в смеси, рассчитав процент присутствующего азота.
{экв}\rm \text{масса углерода} = \%C\times M_{смесь}=\dfrac{20}{100}\times 50 = 10\text{g}\\ \dfrac{\text{масса углекислого газа}}{\text{масса углерода}} = \dfrac{\text{молярная масса углекислого газа}}{\text{молярная масса углерода}} = \dfrac{44 {12}\\ \подразумевается \text{масса углекислого газа} = \text{масса углерода}\times \dfrac{44}{12}\\ \подразумевается \text{масса углекислого газа} = \text{10} \times \dfrac{44}{12} =\dfrac{110}{3} \text{ грамм} {/экв}
Теперь мы можем рассчитать процент углекислого газа в смеси.
{экв}\rm \%CO_2 = \dfrac{\dfrac{110}{3}}{50}\умножить на 100\\ \подразумевается \%N_2 = 100-\%CO_2 = 100 — \dfrac{\dfrac{110}{3}}{50}\times 100 = \dfrac{\dfrac{40}{3}}{50}\times 100 = \dfrac{80}{3}\% {/экв}
Шаг 3 : Найдите общую массу смеси.
Общая масса смеси указана как 50 г.
Этап 4 : Умножьте процент желаемого компонента на общую массу смеси.
{экв}\rm m_{N_2} = \%N_2\times M_{смесь} = \dfrac{80}{3}\% \times 50= \dfrac{80}{3}\times \dfrac{1}{100}\times 50 \ около 13.33\г {/экв}
Следовательно, масса вещества в смеси оценивается в 13,33 г
Примечание: Мы могли бы получить массу азота, вычитая массу двуокиси углерода непосредственно из массы всей смеси. Сначала мы рассчитали процент присутствующего азота, чтобы проиллюстрировать, как упомянутые шаги могут быть обобщены в любой ситуации. С практикой вы должны быть в состоянии решать вопросы самым коротким способом, но вы всегда можете использовать длинный метод в периоды замешательства.
| Шаг | Причина | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1…… | 1…. | ||||||||||||||
| 2……. | 2…… 1
Получите доступ к тысячам практических вопросов и пояснений!Как рассчитать молярную массу вещества [Видео] Масса моля вещества называется молярной массой . Нахождение молярной массы элементаЕсли вы пытаетесь найти молярную массу элемента, то вы берете среднюю атомную массу, указанную в периодической таблице. Если вы посмотрите на элемент меди, вы посмотрите в периодическую таблицу и обнаружите, что его средняя атомная масса составляет 63,55 а.е.м., так что это молярная масса. Теперь мы напишем это в другой единице измерения, потому что это также наша молярная масса, и это будут граммы, а не моли: \(\frac{63.55 \text{г}}{\текст{моль}}\). Это молярная масса меди. Вот как можно найти молярную массу элемента. Определение молярной массы соединения Теперь можно рассчитать молярную массу соединения путем суммирования молярных масс каждого атома и химической формулы. Вы как бы следуете тому же протоколу для нахождения молярной массы элемента, но затем вы объединяете все эти молярные массы вместе, чтобы найти молярную массу соединения. Я покажу вам трехэтапный процесс определения молекулярной массы соединения. Сначала найдите атомную массу атома. Вы начнете с одного атома за раз. После того, как вы нашли атомную массу, умножьте атомную массу на нижний индекс. Таким образом, вы находите общую молярную массу для всего этого атома, потому что вы находите атомную массу, а затем умножаете ее на то, сколько раз она встречается в соединении. Умножая атомную массу на индекс, вы получаете произведение, вы получаете произведение молярной массы этого атома. Затем , чтобы найти молярную массу соединения, вы должны сложить все эти продукты вместе. Если бы вы пытались найти молярную массу составного диоксида углерода, который выглядит вот так — СО2 — и молярная масса равна 44. Тогда вы бы нашли первый способ: найти атомную массу углерода, которая равна 12. , а затем вы умножаете его на нижний индекс, который прямо здесь представляет собой понятную 1, поэтому произведение будет 12. Затем , наконец, , вы складываете все продукты, так что 12 плюс 32 равно 44. Это общая молярная масса атома. соединение СО2. Опять же, масса моля вещества называется молярной массой, и чтобы найти молярную массу вещества, вам достаточно таблицы Менделеева и химической формулы. Произошла ошибка при настройке пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт. Настройка браузера на прием файлов cookieСуществует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
Почему этому сайту требуются файлы cookie? Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Что сохраняется в файле cookie?Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется. Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать. Глава 6 – Величины в химических реакциях – ХимияГлава 6 – Величины в химических реакциях Этот текст опубликован в соответствии с лицензией Creative Commons, для ссылки и адаптации, пожалуйста, нажмите здесь. 6.1: Введение в главу До сих пор мы говорили о химических реакциях с точки зрения отдельных атомов и молекул.Хотя это работает, в большинстве реакций, происходящих вокруг нас, участвует гораздо большее количество химических веществ. Даже крошечный образец вещества будет содержать миллионы, миллиарды или сто миллиардов миллиардов атомов и молекул. Как мы можем сравнивать количества веществ друг с другом в химическом отношении, когда так трудно сосчитать до ста миллиардов миллиардов? На самом деле есть способы сделать это, и мы рассмотрим их в этой главе. 6.2: Крот Рисунок 6.1 «Молекулы воды» показывает, что нам нужно 2 атома водорода и 1 атом кислорода, чтобы сделать 1 молекулу воды. Если мы хотим сделать 2 молекулы воды, нам понадобится 4 атома водорода и 2 атома кислорода. Если мы хотим сделать 5 молекул воды, нам нужно 10 атомов водорода и 5 атомов кислорода. Соотношение атомов, которое нам понадобится для создания любого количества молекул воды, одинаково: 2 атома водорода на 1 атом кислорода. Рисунок 6.1 Молекулы воды: Отношение атомов водорода к атомам кислорода, используемых для образования молекул воды, всегда составляет 2:1, независимо от того, сколько молекул воды образуется. Однако у нас есть одна проблема: чрезвычайно трудно, если вообще возможно, организовать атомы по одному. Атом водорода имеет массу примерно 1 ед. Атом кислорода имеет массу примерно 16 ед. Таким образом, отношение массы атома кислорода к массе атома водорода составляет приблизительно 16:1. Если у нас есть 2 атома каждого элемента, отношение их масс составляет примерно 32:2, что сводится к 16:1 — такое же отношение. Если у нас есть 12 атомов каждого элемента, отношение их полных масс примерно (12 × 16): (12 × 1), или 192:12, что также сокращается до 16:1. Если у нас есть 100 атомов каждого элемента, отношение масс составляет примерно 1600:100, что снова сокращается до 16:1.Пока у нас одинаковое количество атомов водорода и кислорода, соотношение масс всегда будет 16:1. Такая же закономерность наблюдается и при сравнении соотношений масс других элементов. Итак, мы установили, что массы атомов постоянны по отношению друг к другу, пока мы имеем одинаковое количество атомов каждого типа.Рассмотрим более макроскопический пример. Если в образце содержится 40 г Са, то в этом образце столько же атомов, сколько в образце из 7 г лития. Что нам нужно, так это число, которое представляет подходящее количество атомов, чтобы мы могли связать макроскопические количества веществ. Ясно, что даже 12 атомов слишком мало, потому что сами атомы очень малы. Нам нужно число, которое представляет миллиарды и миллиарды атомов. моль определяется как 6,02 × 10 23 единиц, поэтому химики используют его для представления большого количества атомов или молекул.Точно так же, как дюжина подразумевает 12 вещей, моль (сокращенно моль ) представляет 6,02 × 10 23 вещей. Обратите внимание, что мы применяем моль к различным типам химических объектов. В этих примерах мы привели молей атомов и молей молекул. Слово моль представляет несколько вещей — 6.02 × 10 23 из них, но сам по себе не указывает, что это за «они». Поскольку 1 молекула H 2 содержит 2 атома H, 1 моль молекул H 2 (6,02 × 10 23 молекул) содержит 2 моля атомов H. Используя формулы, чтобы указать, сколько атомов каждого элемента содержится в веществе, мы можем связать количество молей молекул с количеством молей атомов.Например, в 1 моль этанола (C 2 H 6 O) можно построить следующие соотношения (табл. 6.1 «Молекулярные соотношения»): Таблица 6.1: Молекулярные связи В следующем примере показано, как мы можем использовать эти отношения в качестве коэффициентов пересчета. (наверх)6.3: Атомная и молярная масса Теперь, когда мы ввели крот и попрактиковались в использовании его в качестве коэффициента пересчета, мы задаем очевидный вопрос: почему крот представляет собой конкретное количество вещей? Почему это 6,022 × 10 23 , а не 1 × 10 23 или даже 1 × 10 20 ? Число в моле, число Авогадро, связано с относительными размерами атомной единицы массы и единицы массы грамма. Один моль вещества имеет ту же массу в граммах, что и один атом или молекула в атомных единицах массы. Числа в периодической таблице, которые мы идентифицировали как атомные массы атомов, говорят нам не только о массе одного атома в единицах атомной массы, но и о массе 1 моля атомов в граммах! Это связано с тем, что все атомы состоят из одних и тех же частей (протонов, нейтронов и электронов), причем протоны и нейтроны имеют почти одинаковые массы.Электроны, поскольку они такие легкие, пренебрежимо малы в своем вкладе в атомную массу даже в самых больших атомах. Таким образом, атомная или молекулярная масса указывает на то, сколько атомов или молекул присутствует. Таким образом, формируется важное трехстороннее соотношение: 1 моль = атомная или молекулярная масса в граммах = 6,02 X 10 23 атомов или молекул. Напомним, что масса ионного соединения (обозначается формулой масса ) или ковалентной молекулы (обозначается молекулярной массой ) — это просто сумма масс его атомов. Чтобы рассчитать формулу или молекулярную массу, важно отслеживать количество атомов каждого элемента в молекулярной формуле, чтобы получить правильную молекулярную массу. Например: Молекула NaCl содержит 1 Na + и 1 Cl – .Таким образом, мы можем определить формулу массы этого соединения, сложив вместе атомные массы натрия и хлора, указанные в периодической таблице (рис. 6.1). Рисунок 6.1 Периодическая таблица элементов
Для более крупной молекулы, такой как глюкоза (C 6 H 12 O 6 ), которая имеет несколько атомов одного типа, просто умножьте атомную массу каждого атома на количество присутствующих атомов, а затем добавьте все атомные массы, чтобы получить окончательную молекулярную массу. Понятие «моль» можно распространить и на массы формульных единиц и молекул. Масса 1 моль молекул (или формульных единиц) в граммах численно эквивалентна массе одной молекулы (или формульных единиц) в атомных единицах массы. Например, одна молекула О 2 имеет массу 32,00 ед (сумма 2 атомов кислорода), а 1 моль молекул О 2 имеет массу 32,00 г. Как и в случае масс, основанных на единицах атомной массы, чтобы получить массу 1 моля вещества, мы просто суммируем массы отдельных атомов в формуле этого вещества.Масса 1 моля вещества называется его молярной массой , независимо от того, является ли вещество элементом, ионным соединением или ковалентным соединением. Рис. 6.2. Удивительный крот. Показаны основные коэффициенты преобразования молей. Соотношение количеств в молях и коэффициентов пересчета в граммы, перечисленные выше на рис. 6.2, – это, в частности, одни из наиболее полезных уравнений во всей химии. Так почему же связь между молью и массой соединения так важна? В микроскопическом мире химические уравнения строятся в масштабе молекул. На рис. 6.3 изображена типичная химическая реакция. Как мы узнали из главы 5, коэффициенты перед каждым соединением представляют количество молекул, необходимых для протекания реакции.В этой реакции горения 2 молекулы бутана (C 4 H 10 ) реагируют с 13 молекулами кислорода с образованием 8 молекул углекислого газа и 10 молекул воды. Однако в лаборатории химики не могут сосчитать молекулы и поместить их в реакционную колбу. Рис. 6.3 Реакция горения бутана. В примере показаны молекулярные соотношения субстратов и продуктов реакции. 6.  4 Преобразование моль-масса 4 Преобразование моль-масса Простейшим типом манипуляций с использованием молярной массы в качестве коэффициента пересчета является преобразование моль-масса (или обратное преобразование масс-молей), как показано на рис. 6.2. При таком преобразовании мы используем молярную массу вещества в качестве коэффициента пересчета для перевода единиц моля в единицы массы (или, наоборот, единицы массы в единицы моля). Нами установлено, что 1 моль Al имеет массу 26,98 г (пример 3 в разделе 6.3). Выражаясь математически, 1 моль Al = 26,98 г Al Мы можем разделить обе части этого выражения на любую часть, чтобы получить один из двух возможных коэффициентов преобразования: Первый коэффициент преобразования можно использовать для преобразования массы в моли, а второй — из молей в массу. Оба могут быть использованы для решения проблем. Подобные преобразования возможны для любого вещества, если известна (или может быть определена) надлежащая атомная масса, формульная масса или молярная масса, выраженная в граммах на моль.
Рисунок 6.4. Простая блок-схема преобразования массы в моли вещества. Рис. 6.5 Блок-схема, иллюстрирующая этапы выполнения преобразования единиц измерения. Для вашего здоровья: минералыЧтобы наше тело функционировало должным образом, нам необходимо получать определенные вещества из нашего рациона.Среди наших диетических потребностей есть минералы , неуглеродные элементы, которые наш организм использует для различных функций, таких как развитие костей или обеспечение правильной передачи нервных импульсов. Министерство сельского хозяйства США установило некоторые рекомендации по суточному потреблению (RDI) различных минералов. Таблица 6.2: Рекомендуемая суточная доза (RDI) минеральных добавок Таблица 6.2 иллюстрирует несколько вещей. Во-первых, потребности мужчин и женщин в некоторых минералах различны. Крайний случай для железа; женщинам нужно в два раза больше, чем мужчинам. Во всех остальных случаях, когда имеется другая RDI, мужчинам нужно больше, чем женщинам. Во-вторых, количество различных минералов, необходимых ежедневно, сильно различается — как в массовом, так и в молярном масштабе. В среднем человеку требуется 0,1 моль Na в день, что составляет около 2,5 г. С другой стороны, человеку требуется всего около 25–35 мкг Cr в день, что составляет менее одной миллионной моля.Каким бы маленьким ни было это количество, дефицит хрома в рационе может привести к диабетическим симптомам или неврологическим проблемам, особенно в конечностях (руки и ноги). Хотя правильно сбалансированная диета обеспечивает организм всеми необходимыми минералами, некоторые люди принимают пищевые добавки. Однако слишком много хорошего, даже минералов, нехорошо. Воздействие слишком большого количества хрома, например, вызывает раздражение кожи, а некоторые формы хрома, как известно, вызывают рак (как показано в фильме Эрин Брокович ). (наверх)6.5 Взаимосвязи моль-моль в химических реакциях В этом разделе вы узнаете, как использовать сбалансированную химическую реакцию для определения молярных соотношений между веществами. В главе 5 вы научились балансировать химические уравнения, сравнивая количество атомов каждого типа в реагентах и продуктах. Коэффициенты перед химическими формулами представляют количество молекул или формульных единиц (в зависимости от типа вещества). Рассмотрим простое химическое уравнение 2H2 + O 2 → 2H 2 OПри написании сбалансированных химических уравнений принято использовать наименьшее отношение целых чисел для коэффициентов. Однако уравнение сбалансировано, пока коэффициенты находятся в соотношении 2:1:2. Например, это уравнение также уравновешивается, если мы запишем его как .4H2 + 2O 2 → 4H 2 OСоотношение коэффициентов 4:2:4, что сводится к 2:1:2.Уравнение также сбалансировано, если мы запишем его как .22H2 + 11O 2 → 22H 2 O, потому что 22:11:22 также сокращается до 2:1:2. Предположим, мы хотим использовать большие числа. Рассмотрим следующие коэффициенты: 12,044 × 1023 H 2 + 6,022 × 10 23 O 2 → 12,044 × 10 23 H 3 O 2 2 → 12,044 × 10 2 Эти коэффициенты также имеют соотношение 2:1:2 (проверьте и посмотрите), поэтому это уравнение уравновешено. 2 моль H2 + 1 моль O 2 → 2 моль H 2 OМы можем опустить слово моль и не писать коэффициент 1 (по нашей привычке), поэтому окончательная форма уравнения, все еще сбалансированная, будет 2H2 + O 2 → 2H 2 OТеперь мы интерпретируем коэффициенты как относящиеся к молярным количествам, а не к отдельным молекулам.Урок? Сбалансированные химические уравнения сбалансированы не только на молекулярном уровне, но и с точки зрения молярных количеств реагентов и продуктов. Таким образом, мы можем прочитать эту реакцию как «два моля водорода реагируют с одним молем кислорода с образованием двух молей воды». Точно так же отношения, которые мы построили в главе 5, также могут быть построены в терминах молей, а не молекул.
Мы можем использовать эти отношения, чтобы определить, какое количество вещества в молях будет реагировать или производить данное количество молей другого вещества.Изучение численных соотношений между реагентами и продуктами в сбалансированных химических реакциях называется стехиометрией . 6.6 Задачи моль-масса и масса-массаВ этом разделе вы научитесь переводить массу или моли одного вещества в массу или моли другого вещества в химической реакции. Мы установили, что сбалансированное химическое уравнение сбалансировано с точки зрения молей, а также атомов или молекул.Мы использовали уравновешенные уравнения, чтобы установить отношения, теперь в терминах молей материалов, которые мы можем использовать в качестве коэффициентов преобразования для ответа на стехиометрические вопросы, такие как, сколько молей вещества A реагирует с таким количеством молей реагента B. Рис. 6.6: Блок-схема расчета преобразования молей в массу с использованием химических уравнений. В совокупности эти преобразования называются расчетами молярной массы. В качестве примера рассмотрим сбалансированное химическое уравнение .Fe2 O 3 + 3SO 3 → Fe 2 (SO 4 ) 3 Если у нас есть 3,59 моля Fe 2 O 3 , сколько граммов SO 3 может с ним прореагировать? Используя последовательность расчета молярной массы, мы можем определить требуемую массу SO 3 в два этапа.Во-первых, мы строим соответствующее молярное соотношение, определенное из сбалансированного химического уравнения, для расчета необходимого количества молей SO 3 . Первый шаг напоминает упражнения, которые мы выполняли в разделе 6.4 «Моль-мольные отношения в химических реакциях». Как обычно, начинаем с количества, которое нам дали: Моль Fe 2 O 3 ед. отменить, оставив моль SO 3 ед.Теперь мы берем этот ответ и конвертируем его в граммы SO 3 , используя молярную массу SO 3 в качестве коэффициента преобразования: Наш окончательный ответ выражается тремя значащими цифрами. Таким образом, в двухстадийном процессе получаем, что 862 г SO 3 прореагируют с 3,59 моль Fe 2 O 3 . Таким образом можно решить многие задачи этого типа. Та же двухшаговая задача может быть решена в одну строку, а не в два отдельных шага, как показано ниже: При объединении всех математических шагов мы получаем точно такой же ответ, как и при расчете по одному шагу за раз. Это небольшой шаг от расчета моль-массы до расчета массы-массы. Если мы начнем с известной массы одного вещества в химической реакции (вместо известного числа молей), мы сможем вычислить соответствующие массы других веществ в реакции. Первым шагом в этом случае является преобразование известной массы в моли с использованием молярной массы вещества в качестве коэффициента преобразования. Затем — и только тогда — мы используем сбалансированное химическое уравнение для построения коэффициента преобразования для преобразования этого количества в моли другого вещества, которое, в свою очередь, может быть преобразовано в соответствующую массу.Последовательно процесс выглядит следующим образом: Рисунок 6.7 Блок-схема проведения преобразований с использованием химических уравнений. Этот процесс, состоящий из трех частей, может быть выполнен в три отдельных шага или объединен в один расчет, содержащий три коэффициента преобразования. На здоровье: синтез таксолаТаксол — мощный противораковый препарат, который первоначально был извлечен из тихоокеанского тиса ( Taxus brevifolia ).Как видно из прилагаемого рисунка, таксол представляет собой очень сложную молекулу с молекулярной формулой C 47 H 51 NO 14 . Выделение таксола из его природного источника сопряжено с определенными проблемами, главным образом из-за того, что тихоокеанский тис является медленнорастущим деревом, и необходимо собрать эквивалент шести деревьев, чтобы обеспечить достаточное количество таксола для лечения одного пациента. Хотя родственные виды тиса также производят таксол в небольших количествах, существует значительный интерес к синтезу этой сложной молекулы в лаборатории. После 20-летних усилий две исследовательские группы объявили о полном лабораторном синтезе таксола в 1994 году. Однако для каждого синтеза требовалось более 30 отдельных химических реакций с общей эффективностью менее 0,05%. Очевидно, существует повышенный интерес к повышению общей эффективности синтеза таксола. Улучшенный синтез будет не только проще, но и будет производить меньше отходов, что позволит большему количеству людей воспользоваться преимуществами этого потенциально спасающего жизнь лекарства. Рис. 6.8 Структура противоракового препарата таксола. Из-за сложности молекулы атомы водорода не показаны, но они присутствуют на каждом атоме, чтобы дать атому правильное количество ковалентных связей (четыре связи на каждый атом углерода).
6.7 Краткое содержание главы Чтобы убедиться, что вы понимаете материал этой главы, вам следует просмотреть значения следующих выделенных жирным шрифтом терминов в следующем резюме и спросить себя, как они относятся к темам этой главы. Химические реакции относятся к количествам реагентов и продуктов. Химики используют единицу моль для представления 6,022 × 10 23 вещей, независимо от того, являются ли эти вещи атомами элементов или молекулами соединений. Это число, называемое числом Авогадро , важно, потому что это количество атомов или молекул имеет ту же массу в граммах, что и один атом или молекула в атомных единицах массы. Молярные массы веществ можно определить путем суммирования соответствующих масс из таблицы Менделеева; конечная молярная масса будет иметь единицы граммы. Поскольку один моль вещества будет иметь определенную массу, мы можем использовать это соотношение для построения коэффициентов преобразования, которые преобразуют количество молей в количество массы или наоборот. Такие преобразования моль-массы обычно требуют одного алгебраического шага. Химические реакции перечисляют реагенты и продукты в молярных количествах, а не только в молекулярных количествах. Мы можем использовать коэффициенты сбалансированного химического уравнения, чтобы связать моли одного вещества в реакции с молями других веществ (стехиометрия).При расчете молярной массы мы связываем количество молей одного вещества с массой другого вещества. В расчете масса-масса мы соотносим массу одного вещества с массой другого вещества. Дополнительные упражнения
6.8 Каталожные номера: Материалы главы 6 были адаптированы и изменены из следующих ресурсов Creative Commons, если не указано иное: Расчет массы продукта — Мониторинг химических реакций — OCR Gateway — GCSE Chemistry (Single Science) Revision — OCR GatewayТеоретический выход — это максимально возможная масса продукта, которая может быть получена в результате химической реакции. Его можно рассчитать, используя: Рабочий пример 1
$1.$5″> Глядя на сбалансированное уравнение:
\ [теоретические \ выход \ = \ \ \фракция{масса\ предельного\ реагента}{сумма\ \\mathit{A}_{r}\ или\ \mathit{M}_{r}\ предельного\ реагента}\ \times\ сумма\ of\ \mathit{A}_{r}\ или \mathit{M}_{r}\ of\ product\] \[теоретический\ выход\ =\ \frac{6.0} {12. = 22,0 г Работал пример 2 8
\ реактив {сумма\ из\ \mathit{A}_{r}\ или\ \mathit{M}_{r}\ из\ предельного\ реагента}\ \times\ сумма\ из\ \mathit{A}_ {r}\ или \mathit{M}_{r}\ of\ product\] \[теоретический\ выход\ =\ \frac{12.0}{6,0}\ \times\ 34,0\] = 68,0 г
Глядя на сбалансированное уравнение:
5 \ из\ предельного\ реагента}{сумма\ из\\mathit{A}_{r}\ or\ \mathit{M}_{r}\ из\предельного\ реагента}\ \times\ сумма\ из\ \mathit {A}_{r}\ или \mathit{M}_{r}\ продукта\] \[теоретический\ выход\ =\ \frac{95.6}{47,8}\ \times\ 18,0\] = 36,0 г Моль-масса и расчет массы-массы5.4 Расчеты моль-массы и массы-массыЦели обученияРасчеты моль-моль — не единственный тип расчетов, которые можно выполнять с использованием сбалансированных химических уравнений. Напомним, что молярную массу можно определить по химической формуле и использовать в качестве коэффициента пересчета. Мы можем добавить этот коэффициент преобразования в качестве еще одного шага в расчете, чтобы произвести расчет молярной массы. Расчет, в котором вы начинаете с заданного количества молей вещества и вычисляете массу другого вещества, участвующего в химическом уравнении, или наоборот., где мы начинаем с заданного количества молей вещества и вычисляем массу другого вещества, участвующего в химическом уравнении, или наоборот. Например, предположим, что у нас есть сбалансированное химическое уравнение 2Al + 3Cl 2 → 2AlCl 3 Предположим, мы знаем, что у нас есть 123,2 г Cl 2 . Теперь, когда у нас есть количество в молях, мы можем использовать сбалансированное химическое уравнение для построения коэффициента преобразования, который связывает количество молей Cl 2 с количеством молей AlCl 3 . Используя этот коэффициент преобразования с молярным количеством, которое мы рассчитали выше, мы получаем 1,738 моль Cl2 × 2 моль AlCl33 моль Cl2=1.159 моль AlCl3Итак, мы получим 1,159 моль AlCl 3 , если прореагируем 123,2 г Cl 2 . В этом последнем примере мы выполнили расчет в два этапа. Однако математически эквивалентно последовательному выполнению двух вычислений в одной строке: 123,2 г Cl2 × 1 моль Cl270,90 г Cl2 × 2 моль AlCl33 моль Cl2=1,159 моль AlCl3Единицы по-прежнему корректно сокращаются, и в конце мы получаем тот же числовой ответ. Иногда ответ может немного отличаться от пошагового выполнения из-за округления промежуточных ответов, но окончательные ответы должны быть практически одинаковыми. Пример 10Сколько молей HCl образуется при реакции 249 г AlCl 3 в соответствии с этим химическим уравнением? 2AlCl 3 + 3H 2 O(л) → Al 2 O 3 + 6HCl(г)Решение Мы сделаем это в два этапа: переведем массу AlCl 3 в моли, а затем воспользуемся сбалансированным химическим уравнением, чтобы найти количество молей образовавшейся HCl. Теперь мы можем использовать это количество, чтобы определить количество молей HCl, которое образуется. Из сбалансированного химического уравнения мы строим коэффициент преобразования между количеством молей AlCl 3 и количеством молей HCl: 6 моль HCl2 моль AlCl3Применяя этот коэффициент пересчета к количеству AlCl 3 , мы получаем 1.87 моль AlCl3 × 6 моль HCl2 моль AlCl3=5,61 моль HClВ качестве альтернативы мы могли бы сделать это в одной строке: 249 г AlCl3 × 1 моль AlCl3133,33 г AlCl3 × 6 моль HCl2 моль AlCl3=5,60 моль HClПоследняя цифра в нашем окончательном ответе немного отличается из-за различий в округлении, но ответ по существу тот же. Проверь себя Сколько молей Al 2 O 3 будет произведено при 23. Ответить 0,442 моль Вариант расчета молярной массы состоит в том, чтобы начать с количества в молях, а затем определить количество другого вещества в граммах. Действия такие же, но выполняются в обратном порядке. Пример 11Сколько граммов NH 3 будет произведено, когда 33.9 моль H 2 вступают в реакцию по этому химическому уравнению? N 2 (г) + 3H 2 (г) → 2NH 3 (г)Решение Преобразования одинаковы, но они применяются в другом порядке. Начните с использования сбалансированного химического уравнения для преобразования в моли другого вещества, а затем используйте его молярную массу для определения массы конечного вещества. Теперь, используя молярную массу NH 3 , которая равна 17,03 г/моль, мы получаем 22,6 моль Nh4 × 17,03 г Nh41 моль Nh4=385 г Nh4Проверь себя Сколько граммов N 2 необходимо для получения 2,17 моль NH 3 при реакции согласно этому химическому уравнению? N 2 (г) + 3H 2 (г) → 2NH 3 (г)Ответить 30.4 г (Примечание: здесь мы переходим от продукта к реагенту, показывая, что проблемы с молекулярной массой могут начинаться и заканчиваться для любого вещества в химическом уравнении.) Теперь должно быть тривиальной задачей расширить расчеты до расчетов массы-массыРасчет, в котором вы начинаете с заданной массы вещества и вычисляете массу другого вещества, участвующего в химическом уравнении., в котором мы начинаем с массы некоторого вещества и заканчиваются массой другого вещества в химической реакции. Например, определим количество граммов SO 3 , которое может быть получено по реакции 45.3 г SO 2 и O 2 : 2SO 2 (г) + O 2 (г) → 2SO 3 (г)Сначала мы переводим данное количество, 45,3 г SO 2 , в моли SO 2 , используя его молярную массу (64,06 г/моль): 45,3 г SO2 × 1 моль SO264,06 г SO2=0,707 моль SO2Во-вторых, мы используем сбалансированную химическую реакцию для преобразования молей SO 2 в моли SO 3 : . 0,707 моль SO2 × 2 моль SO32 моль SO2=0.707 моль SO3 0,707 моль SO2 × 2 моль SO32 моль SO2=0.707 моль SO3Наконец, мы используем молярную массу SO 3 (80,06 г/моль) для преобразования в массу SO 3 : . 0,707 моль SO3 × 80,06 г SO31 моль SO3 = 56,6 г SO3Мы также можем выполнить все три шага последовательно, записав их в одну строку как 45,3 г SO2 × 1 моль SO264,06 г SO2 ×2 моль SO32 моль SO2 × 80,06 г SO31 моль SO3=56,6 г SO3Получаем тот же ответ. Обратите внимание, как начальные и все промежуточные единицы сокращаются, оставляя граммы SO 3 , что мы ищем, в качестве нашего окончательного ответа. Пример 12Какая масса магния образуется при реакции 86,4 г калия? MgCl 2 (т) + 2K(т) → Mg(т) + 2KCl(т)Решение Мы просто будем следовать шагам масса K → моль K → моль Mg → масса Mg В дополнение к сбалансированному химическому уравнению нам нужны молярные массы K (39,09 г/моль) и Mg (24,31 г/моль). Проверь себя Какая масса H 2 образуется при реакции 122 г Zn? Zn(т) + 2HCl(водн.) → ZnCl 2 (водн.) + H 2 (г)Ответить 3,77 г Ключевые выводыУпражненияКакая масса PbSO 4 образуется при 29.6 г H 2 SO 4 вступают в реакцию? Pb(т) + PbO 2 (т) + 2H 2 SO 4 (водн.) → 2PbSO 4 (т) + 2H 2 O(ℓ)Если образуется 83,9 г ZnO, какая масса Mn 2 O 3 образуется с ним? Zn(т) + 2MnO 2 (т) → ZnO(т) + Mn 2 O 3 (т)Если 14.Вступает в реакцию 7 г NO 2 , какая масса H 2 O вступает с ним в реакцию? 3NO 2 (г) + H 2 O(л) → 2HNO 3 (водн. ) + NO(г) ) + NO(г)Какая масса HF образуется при реакции 88,4 г CH 2 S? CH 2 S + 6F 2 → CF 4 + 2HF + SF 6Если 100.0 г Cl 2 , какая масса NaOCl должна вступить в реакцию? NaOCl + HCl → NaOH + Cl 2Измерительная массаИзмерение массы Измерение массы в лаборатории осуществляется с помощью весов. Хотя существует большое разнообразие типов балансов, все они являются дорогими и хрупкими инструментами, к которым нужно относиться с уважением. Большинство весов, используемых в настоящее время, являются электронными весами.Если в вашей школе это не так, вам нужно будет проконсультироваться со своим инструктором, чтобы получить указания о том, как использовать ваши весы. Правила баланса Для защиты весов и обеспечения точных результатов следует соблюдать ряд правил:
Прямое взвешивание Прямое взвешивание означает, что предмет помещается непосредственно на весы и считывается масса. Взвешивание по разнице Взвешивание по разнице требует проведения двух измерений. Эти измерения могут быть выполнены одним из двух способов:
При взвешивании по разнице точная установка весов на нуль не требуется, поскольку любая ошибка в начальных показаниях устраняется при вычитании показаний. |

 Для расчета молярной массы вещества вам понадобится таблица Менделеева и химическая формула.
Для расчета молярной массы вещества вам понадобится таблица Менделеева и химическая формула.
 Затем вы проделаете то же самое с кислородом.Вы обнаружите, что его атомная масса равна 16. Вы должны умножить его на его нижний индекс 2, который равен 32.
Затем вы проделаете то же самое с кислородом.Вы обнаружите, что его атомная масса равна 16. Вы должны умножить его на его нижний индекс 2, который равен 32.
 Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
 При этом мы расширим наше понимание стехиометрии, которая представляет собой изучение числовых отношений между реагентами и продуктами в сбалансированной химической реакции.
При этом мы расширим наше понимание стехиометрии, которая представляет собой изучение числовых отношений между реагентами и продуктами в сбалансированной химической реакции.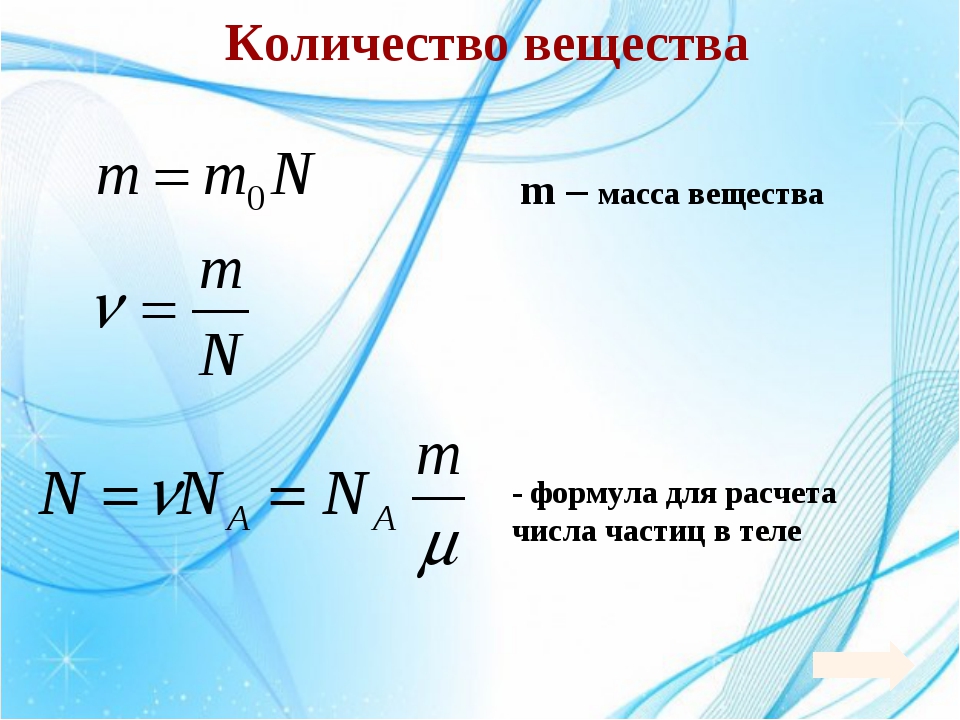 Как сказано во введении, мы имеем дело с миллиардами атомов одновременно. Как мы можем отслеживать такое количество атомов (и молекул) одновременно? Мы делаем это, используя массу, а не подсчитывая отдельные атомы.
Как сказано во введении, мы имеем дело с миллиардами атомов одновременно. Как мы можем отслеживать такое количество атомов (и молекул) одновременно? Мы делаем это, используя массу, а не подсчитывая отдельные атомы. Например, отношение масс атомов кремния к равному числу атомов водорода всегда составляет примерно 28:1, а отношение масс атомов кальция к равному числу атомов лития составляет примерно 40:7.
Например, отношение масс атомов кремния к равному числу атомов водорода всегда составляет примерно 28:1, а отношение масс атомов кальция к равному числу атомов лития составляет примерно 40:7. Число 6,02 × 10 23 , называемое числом Авогадро в честь химика XIX века Амедео Авогадро, — это число, которое мы используем в химии для представления макроскопических количеств атомов и молекул. Таким образом, если у нас есть 6,02 × 10 23 атомов кислорода, мы говорим, что у нас есть 1 моль атомов кислорода. Если у нас есть 2 моля атомов Na, у нас есть 2 × (6,02 × 10 23 ) атомов Na, или 1.2044 × 10 24 атомов Na. Точно так же, если у нас есть 0,5 моль бензола (C 6 H 6 ) молекул, мы имеем 0,5 × (6,02 × 10 23 ) C 6 H 2 2 1093 103 103 10325 молекул, или C 6 H 6 молекул.
Число 6,02 × 10 23 , называемое числом Авогадро в честь химика XIX века Амедео Авогадро, — это число, которое мы используем в химии для представления макроскопических количеств атомов и молекул. Таким образом, если у нас есть 6,02 × 10 23 атомов кислорода, мы говорим, что у нас есть 1 моль атомов кислорода. Если у нас есть 2 моля атомов Na, у нас есть 2 × (6,02 × 10 23 ) атомов Na, или 1.2044 × 10 24 атомов Na. Точно так же, если у нас есть 0,5 моль бензола (C 6 H 6 ) молекул, мы имеем 0,5 × (6,02 × 10 23 ) C 6 H 2 2 1093 103 103 10325 молекул, или C 6 H 6 молекул. Это могут быть атомы, формульные единицы (ионных соединений) или молекулы. Эту информацию еще нужно уточнить.
Это могут быть атомы, формульные единицы (ионных соединений) или молекулы. Эту информацию еще нужно уточнить. В то время как один атом водорода имеет массу примерно 1 а.е.м., 1 моль атомов Н имеет массу примерно 1 грамм .И в то время как один атом натрия имеет приблизительную массу 23 а.е.м., 1 моль атомов Na имеет приблизительную массу 23 граммов .
В то время как один атом водорода имеет массу примерно 1 а.е.м., 1 моль атомов Н имеет массу примерно 1 грамм .И в то время как один атом натрия имеет приблизительную массу 23 а.е.м., 1 моль атомов Na имеет приблизительную массу 23 граммов . Это эффективно дает нам возможность подсчитывать молекулы в лаборатории, используя обычные весы! Обратите внимание, что в химических уравнениях и расчетах молярные концентрации обозначаются аббревиатурой мол.
Это эффективно дает нам возможность подсчитывать молекулы в лаборатории, используя обычные весы! Обратите внимание, что в химических уравнениях и расчетах молярные концентрации обозначаются аббревиатурой мол.
 Они позволяют проводить химические реакции безопасным и эффективным образом и оказывают огромное влияние на экономику многих промышленных и производственных процессов и производства лекарств.Если вы серьезно изучаете химию, я бы рекомендовал распечатать таблицу 6.2 и сохранить копию в своей тетради. Это будет чрезвычайно полезно при постановке множества текстовых задач и функционально полезно в лаборатории.
Они позволяют проводить химические реакции безопасным и эффективным образом и оказывают огромное влияние на экономику многих промышленных и производственных процессов и производства лекарств.Если вы серьезно изучаете химию, я бы рекомендовал распечатать таблицу 6.2 и сохранить копию в своей тетради. Это будет чрезвычайно полезно при постановке множества текстовых задач и функционально полезно в лаборатории. Молекулы слишком малы, чтобы их можно было увидеть невооруженным глазом, и нет доступного оборудования, способного сортировать и подсчитывать молекулы таким образом. С другой стороны, массу можно легко измерить с помощью весов.Таким образом, отношение массы к числу присутствующих молекул становится очень важным преобразованием. Поскольку моль представляет собой фиксированное число молекул (6,02 X 10 23 ), коэффициенты, используемые в химических реакциях, также можно рассматривать как молярные соотношения. Вместо того, чтобы читать наше уравнение в терминах молекул, мы можем читать его в терминах молей. На макроскопическом уровне приведенная ниже реакция выглядит следующим образом: 2 моля бутана (C 4 H 10 ) реагируют с 13 молями кислорода с образованием 8 молей диоксида углерода и 10 молей воды.
Молекулы слишком малы, чтобы их можно было увидеть невооруженным глазом, и нет доступного оборудования, способного сортировать и подсчитывать молекулы таким образом. С другой стороны, массу можно легко измерить с помощью весов.Таким образом, отношение массы к числу присутствующих молекул становится очень важным преобразованием. Поскольку моль представляет собой фиксированное число молекул (6,02 X 10 23 ), коэффициенты, используемые в химических реакциях, также можно рассматривать как молярные соотношения. Вместо того, чтобы читать наше уравнение в терминах молекул, мы можем читать его в терминах молей. На макроскопическом уровне приведенная ниже реакция выглядит следующим образом: 2 моля бутана (C 4 H 10 ) реагируют с 13 молями кислорода с образованием 8 молей диоксида углерода и 10 молей воды. На рис. 6.4 представлена диаграмма для определения необходимого коэффициента преобразования, а на рис. 6.5 — блок-схема шагов, необходимых для выполнения преобразования. Обратите внимание, что для преобразования молей в массу или массы в моли требуется один математический шаг.
На рис. 6.4 представлена диаграмма для определения необходимого коэффициента преобразования, а на рис. 6.5 — блок-схема шагов, необходимых для выполнения преобразования. Обратите внимание, что для преобразования молей в массу или массы в моли требуется один математический шаг. В прилагаемой таблице перечислены РСНП для минералов, как в массе, так и в молях, при ежедневном рационе в 2000 калорий.
В прилагаемой таблице перечислены РСНП для минералов, как в массе, так и в молях, при ежедневном рационе в 2000 калорий.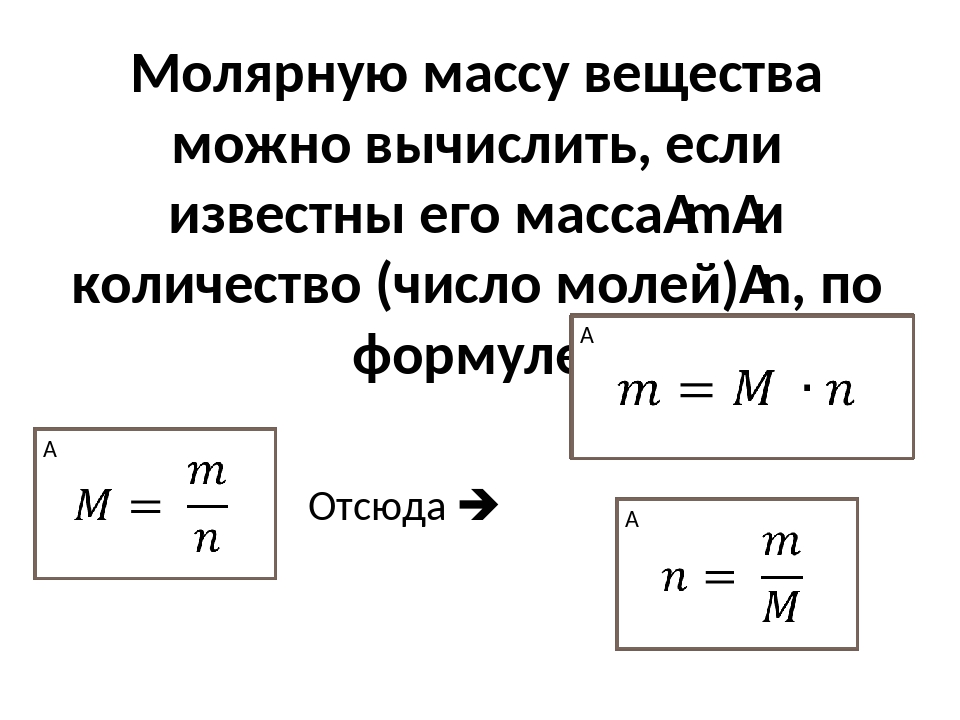 Для некоторых минералов организму не требуется много, чтобы нормально функционировать.
Для некоторых минералов организму не требуется много, чтобы нормально функционировать. Здесь мы расширим значение коэффициентов в химическом уравнении.
Здесь мы расширим значение коэффициентов в химическом уравнении. Но 6,022 × 10 23 — это 1 моль, а 12,044 × 10 23 — это 2 моль (и число написано таким образом, чтобы сделать это более очевидным), поэтому мы можем упростить эту версию уравнения, записав ее как
Но 6,022 × 10 23 — это 1 моль, а 12,044 × 10 23 — это 2 моль (и число написано таким образом, чтобы сделать это более очевидным), поэтому мы можем упростить эту версию уравнения, записав ее как Например, для реакции, в которой водород и кислород образуют воду, мы можем составить следующие соотношения:
Например, для реакции, в которой водород и кислород образуют воду, мы можем составить следующие соотношения: Мы можем расширить эта техника еще больше. Напомним, что мы можем связать молярное количество с массовым количеством, используя молярную массу. Мы можем использовать эту способность, чтобы отвечать на вопросы стехиометрии с точки зрения масс конкретного вещества, помимо молей. Делаем это, используя следующую последовательность:
Мы можем расширить эта техника еще больше. Напомним, что мы можем связать молярное количество с массовым количеством, используя молярную массу. Мы можем использовать эту способность, чтобы отвечать на вопросы стехиометрии с точки зрения масс конкретного вещества, помимо молей. Делаем это, используя следующую последовательность: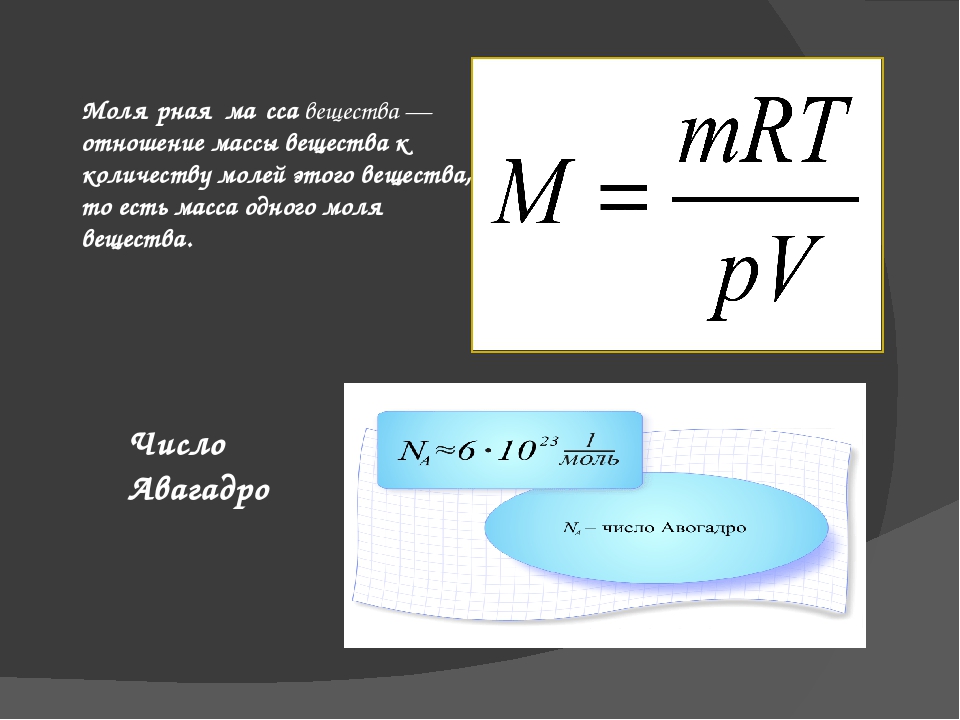 Затем, используя молярную массу SO 3 в качестве коэффициента пересчета, мы определяем массу, которую имеет это количество молей SO 3 . Графически это представлено двумя шагами:
Затем, используя молярную массу SO 3 в качестве коэффициента пересчета, мы определяем массу, которую имеет это количество молей SO 3 . Графически это представлено двумя шагами: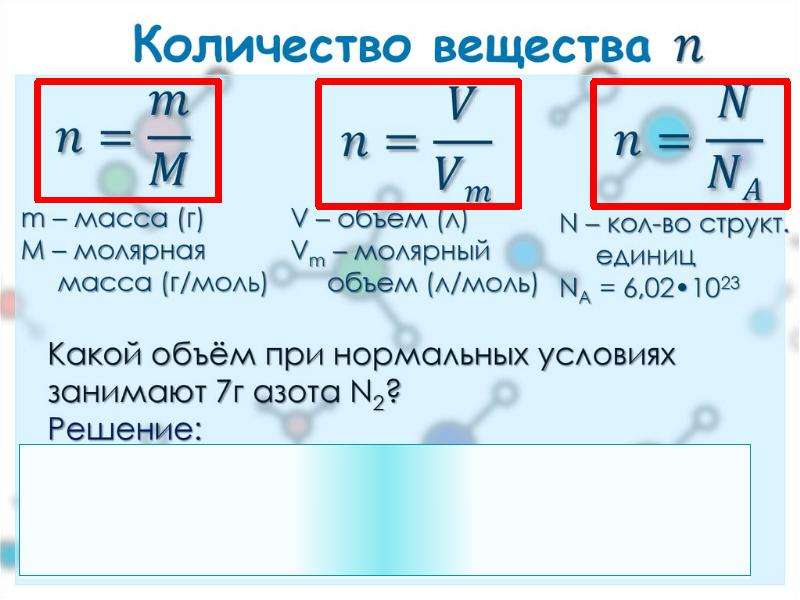
 Следующий пример иллюстрирует оба метода.
Следующий пример иллюстрирует оба метода. Чтобы представить это в перспективе, чтобы получить разовую дозу таксола 300 мг, вам придется начать с 600 г исходного материала. Для лечения 26 000 женщин, у которых ежегодно диагностируют рак яичников, одной дозой, почти 16 000 кг (более 17 тонн) исходного материала необходимо преобразовать в таксол.Таксол также используется для лечения рака молочной железы, который ежегодно диагностируется у 200 000 женщин в США. Это только увеличивает количество необходимого исходного материала.
Чтобы представить это в перспективе, чтобы получить разовую дозу таксола 300 мг, вам придется начать с 600 г исходного материала. Для лечения 26 000 женщин, у которых ежегодно диагностируют рак яичников, одной дозой, почти 16 000 кг (более 17 тонн) исходного материала необходимо преобразовать в таксол.Таксол также используется для лечения рака молочной железы, который ежегодно диагностируется у 200 000 женщин в США. Это только увеличивает количество необходимого исходного материала.
 Один пример выглядит следующим образом:
Один пример выглядит следующим образом: Реагирует с соляной кислотой в желудке по следующей реакции:
Реагирует с соляной кислотой в желудке по следующей реакции: Химическая реакция выглядит следующим образом:
Химическая реакция выглядит следующим образом:
 0 кг и содержит 0,00174% железа, сколько молей железа содержится в средней женщине?
0 кг и содержит 0,00174% железа, сколько молей железа содержится в средней женщине? Сколько молей в 0,034 г гемоглобина?
Сколько молей в 0,034 г гемоглобина? html
html  0} \ \ times \ 44.0 \]
0} \ \ times \ 44.0 \] (Относительные атомные массы: H = 1,0, N = 14,0)
(Относительные атомные массы: H = 1,0, N = 14,0)
 Как определить, сколько молей AlCl 3 мы получим, когда реакция завершится? Прежде всего, химических уравнений не сбалансированы в граммах; они сбалансированы по количеству молей .Таким образом, чтобы использовать сбалансированное химическое уравнение, чтобы связать количество Cl 2 с количеством AlCl 3 , нам нужно преобразовать данное количество Cl 2 в моли. Мы знаем, как это сделать, просто используя молярную массу Cl 2 в качестве коэффициента пересчета. Молярная масса Cl 2 (которую мы получаем из атомной массы Cl из таблицы Менделеева) составляет 70,90 г/моль. Мы должны инвертировать эту дробь, чтобы единицы правильно сокращались:
Как определить, сколько молей AlCl 3 мы получим, когда реакция завершится? Прежде всего, химических уравнений не сбалансированы в граммах; они сбалансированы по количеству молей .Таким образом, чтобы использовать сбалансированное химическое уравнение, чтобы связать количество Cl 2 с количеством AlCl 3 , нам нужно преобразовать данное количество Cl 2 в моли. Мы знаем, как это сделать, просто используя молярную массу Cl 2 в качестве коэффициента пересчета. Молярная масса Cl 2 (которую мы получаем из атомной массы Cl из таблицы Менделеева) составляет 70,90 г/моль. Мы должны инвертировать эту дробь, чтобы единицы правильно сокращались: Числа в коэффициенте пересчета получены из коэффициентов в сбалансированном химическом уравнении:
Числа в коэффициенте пересчета получены из коэффициентов в сбалансированном химическом уравнении: Молярная масса AlCl 3 равна 133.33 г/моль, которую мы должны инвертировать, чтобы получить соответствующий коэффициент преобразования:
Молярная масса AlCl 3 равна 133.33 г/моль, которую мы должны инвертировать, чтобы получить соответствующий коэффициент преобразования: 9 г H 2 O вступают в реакцию по этому химическому уравнению?
9 г H 2 O вступают в реакцию по этому химическому уравнению? В два шага у нас есть
В два шага у нас есть Для этого типа расчетов должны использоваться молярные массы двух разных веществ — обязательно следите за тем, какое из них есть какое. Тем не менее, важно еще раз подчеркнуть, что прежде чем использовать сбалансированную химическую реакцию, массовое количество должно быть сначала преобразовано в моли. Затем коэффициенты уравновешенной химической реакции можно использовать для преобразования в моли другого вещества, которые затем можно преобразовать в массу.
Для этого типа расчетов должны использоваться молярные массы двух разных веществ — обязательно следите за тем, какое из них есть какое. Тем не менее, важно еще раз подчеркнуть, что прежде чем использовать сбалансированную химическую реакцию, массовое количество должно быть сначала преобразовано в моли. Затем коэффициенты уравновешенной химической реакции можно использовать для преобразования в моли другого вещества, которые затем можно преобразовать в массу. В одну строку
В одну строку 00 моль CH 4 ?
00 моль CH 4 ? ) + CO 2 (г) → Li 2 CO 3 (водн.)
) + CO 2 (г) → Li 2 CO 3 (водн.) ) → BrO 3 — (водн.) + 903 +
) → BrO 3 — (водн.) + 903 + 
 Взвешивание напрямую требует, чтобы весы были тщательно обнулены (показывают ноль, когда на чаше весов ничего нет), чтобы получить точные результаты.
Взвешивание напрямую требует, чтобы весы были тщательно обнулены (показывают ноль, когда на чаше весов ничего нет), чтобы получить точные результаты.