Вакуоли. Комплекс Гольджи. Лизосомы
Вопрос 1. Какое значение имеют клеточные мембраны в клетке?
Наружная клеточная мембрана ограничивает клетку и клеточные органеллы от окружающей среды и осуществляет транспорт веществ. Мембраны обладают свойством полупроницаемости. При этом молекулы воды могут беспрепятственно проходить через клеточную мембрану, а молекулы других веществ проникают избирательно. Через клеточную мембрану клетка получает воду, питательные вещества, кислород, через нее удаляются продукты клеточного обмена.
Вопрос 2. Клетки каких организмов содержат вакуоли?
Вакуоли характерны для клеток растений, грибов и многих протистов.
Вопрос 3. Как образуются вакуоли в клетке? Можно ли рассматривать данные клеточные структуры в качестве органоидов клетки?
Вакуоли образуются из пузыревидных расширений ЭПС или из пузырьков комплекса Гольджи.
Да, можно рассматривать данные клеточные структуры в качестве органоидов клетки. Хоть вакуоли являются не постоянными, а временными органоидами, они как ЭПС, аппарат Гольджи и лизосомы построены из фосфолипидных мембран и тесно связаны с выполняемыми в клетке функциями. Можно считать, что эти органоиды входят в единую систему, элементы которой могут в случае необходимости перестраиваться и переходить друг в друга, используя универсальные свойства мембран.
Вопрос 4. Какие функции выполняет аппарат Гольджи? Каково его строение?
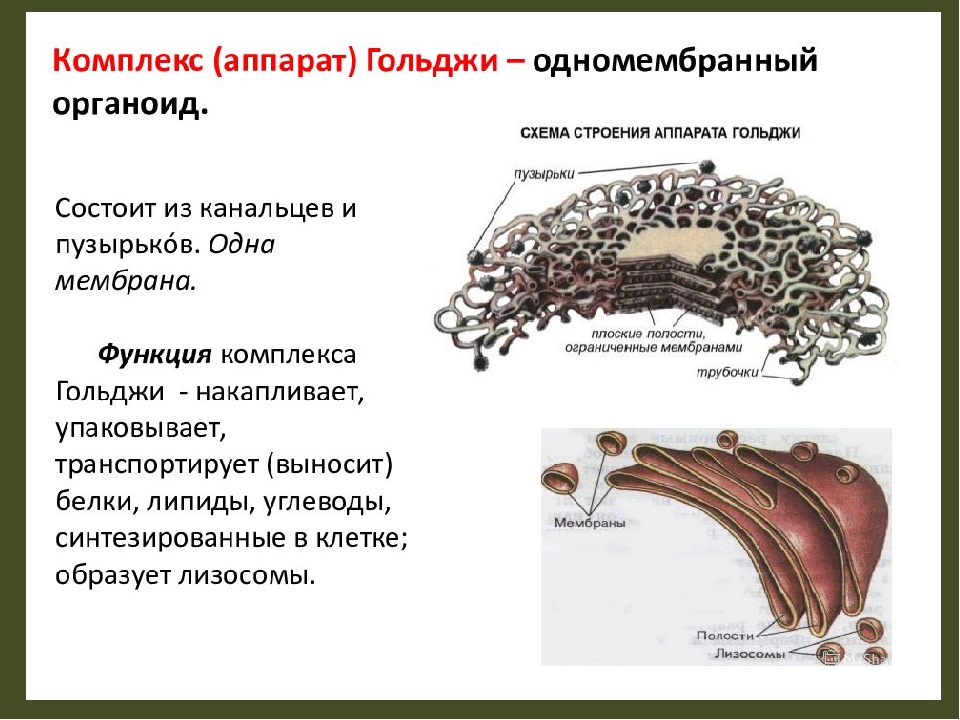
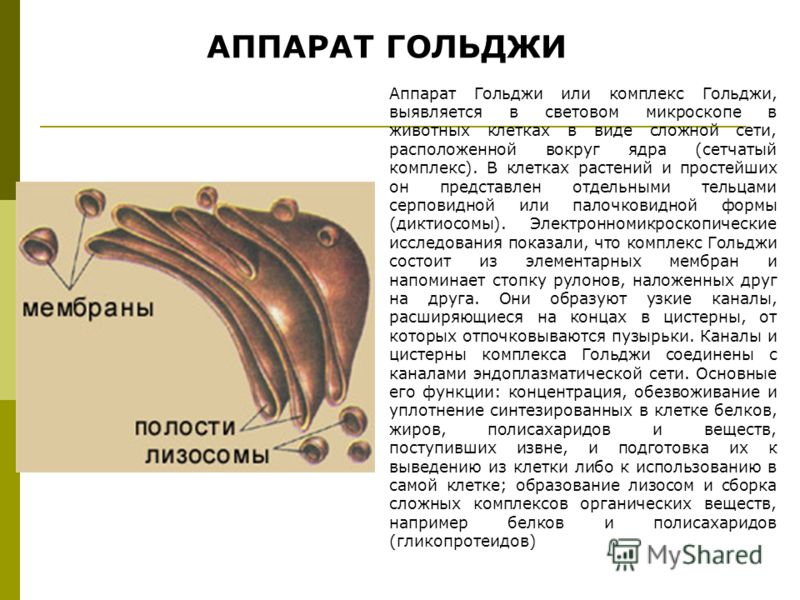
Аппарат Гольджи — это мембранный органоид, построенный из плоских полых мембранных структур, называемых цистернами. Они собраны в стопки по 4—6 штук. Внешне аппарат Гольджи (АГ) напоминает стопку тарелок, поставленных одна на другую.
Аппарат Гольджи выполняет синтетическую, запасающую, строительную и секреторную функции. Кроме того, в нём происходит формирование лизосом.
Вопрос 5. Во всех ли клетках имеется аппарат Гольджи и почему? Приведите примеры.
Во всех ли клетках имеется аппарат Гольджи и почему? Приведите примеры.
Аппарат Гольджи является компонентом всех эукариотических клеток (практически единственное исключение — эритроциты млекопитающих). Нет АГ и у бактерий.
Отсутствие АГ, как и ядра, в клетках эритроцитов позволяет вмещать больше молекул гемоглобина и использовать для транспортировки кислорода и углекислого газа весь объем клетки.
Вопрос 6. В каких клеточных структурах перевариваются частицы пищи?
В лизосомах, т.к. они содержат набор ферментов для внутриклеточного переваривания пищи.
Вопрос 7. Как вы думаете, что произойдёт с клеткой, в которой по какой — то причине разрушатся мембраны лизосом?
Ферменты лизосом нередко высвобождаются при разрушении мембраны лизосомы. Обычно при этом они инактивируются в нейтральной среде цитоплазмы. Однако при одновременном разрушении всех лизосом клетки может произойти ее саморазрушение — автолиз.
Вопрос 8. Продолжайте заполнение сравнительной таблицы о строении клеток эукариотов (см. задание 1 на с. 152).
Вопрос 9. Проанализируйте содержание статей параграфа, раскрывающих особенности таких клеточных структур, как лизосомы и вакуоли. Что у них общего и чем они отличаются друг от друга?
Общее:
1. Одномембранные органеллы клетки.
2. Происхождение. Вакуоли развиваются из мембранных пузырьков — провакуолей, — которые являются производными ЭПС и комплекса Гольджи. Лизосомы синтезируются в ЭПС, подвергаются там некоторым превращениям, а затем упаковываются в мембранные пузырьки и отсоединяются от аппарата Гольджи.
3. Заполняются продуктами жизнедеятельности протопласта.
4. Некоторые вакуоли, как и лизосомы, содержат набор пищеварительных ферментов (пищеварительные вакуоли).
Отличия:
1. Лизосомы есть во всех клетках млекопитающих, за исключением эритроцитов. У растений к лизосомам по способу образования, а отчасти и по функциям близки вакуоли. Лизосомы есть также у большинства протистов и у грибов. Таким образом, наличие лизосом характерно для клеток всех эукариот. У прокариот лизосомы отсутствуют, так как у них отсутствует фагоцитоз и нет внутриклеточного пищеварения. Вакуоли содержатся почти во всех растительных клетках.
Лизосомы есть во всех клетках млекопитающих, за исключением эритроцитов. У растений к лизосомам по способу образования, а отчасти и по функциям близки вакуоли. Лизосомы есть также у большинства протистов и у грибов. Таким образом, наличие лизосом характерно для клеток всех эукариот. У прокариот лизосомы отсутствуют, так как у них отсутствует фагоцитоз и нет внутриклеточного пищеварения. Вакуоли содержатся почти во всех растительных клетках.
2. В лизосомах поддерживается кислая среда, а в вакуолях реакция клеточного сока обычно слабокислая или нейтральная, реже щелочная (рН 4 — 6).
3. Лизосомы содержат множество растворимых гидролитических ферментов. Вакуоли заполнены клеточным соком. Это водный раствор различных веществ: неорганические вещества (нитраты, фосфаты, хлориды и др.), углеводы (сахара и полисахариды), белки, органические кислоты и их соли, алкалоиды, гликозиды, пигменты, танины, фитонциды и другие органические соединения, растворимые в воде.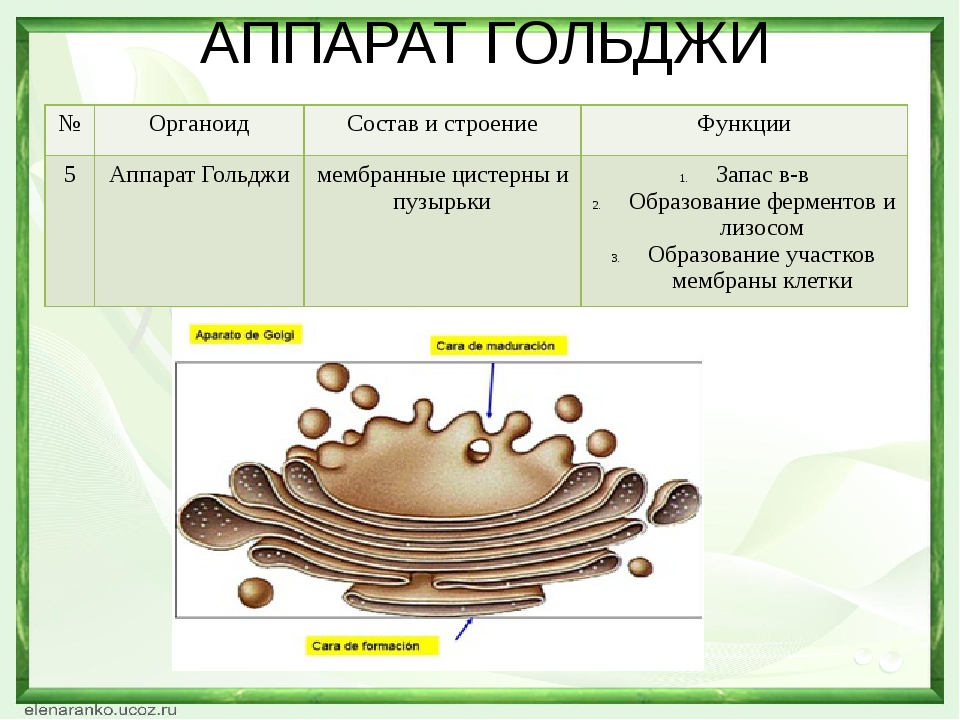
4. Функции. Для лизосом характерна активация пищеварительных вакуолей, переваривание (лизис) веществ, частиц, старых органелл и т. п. Вакуоли нужны для поддержания тургора в клетке (постоянная форма клетки), частичное переваривание, накопление запасных питательных веществ, токсичных продуктов метаболизма.
Вопрос 10. Когда головастик превращается во взрослую лягушку, многие его органы изменяются. А вот хвост головастика постепенно разрушается в результате процесса, который называют аутолизом. Какие клеточные структуры и вещества обеспечивают этот важный физиологический процесс и как он может осуществляться?
Этот процесс обеспечивают лизосомы. При превращении головастика в лягушку, лизосомы, находящиеся в клетках хвоста, переваривают его: хвост исчезает, а образовавшиеся во время этого процесса вещества всасываются и используются другими клетками тела. Т.е. аутолиз в этом случае сопровождает развитие организма.
Вопрос 11. Обсудите с одноклассниками, от чего зависит наличие в клетке каких — либо клеточных структур. Может ли эта зависимость быть перенесена на любой другой уровень организации биологических систем?
Обсудите с одноклассниками, от чего зависит наличие в клетке каких — либо клеточных структур. Может ли эта зависимость быть перенесена на любой другой уровень организации биологических систем?
Наличие в клетке каких — либо клеточных структур зависит от функций, которые выполняет клетка. Например, у эритроцитов млекопитающих отсутствует клеточное ядро и большинство органелл, что повышает содержание гемоглобина. В прокариотических клетках отсутствуют лизосомы, так как у них отсутствует фагоцитоз и нет внутриклеточного пищеварения. Пластид нет у животных клетках. И др.
Это приспособление к жизни клетки. Зачем иметь в своем составе, что «мешает» или вовсе не нужно?
Мне кажется, что эта зависимость не может быть перенесена на любой другой уровень организации биологических систем.
Вопрос 12. ЛАБОРАТОРНАЯ РАБОТА № 9 «Приготовление, рассматривание и описание микропрепаратов клеток растений».
В растительных клетках пигменты, окрашивающие в яркие цвета цветки и плоды покрытосеменных растений, содержатся не только в пластидах, но и в растворе, заполняющем крупные клеточные вакуоли.
Цель: развить умение работы с лабораторным оборудованием, освоить технику приготовления временных микропрепаратов, изучить строение клеток, сделать описание.
Оборудование: микроскоп, предметные и покровные стёкла, пипетки, пинцеты, биологический материал (кусочки яблока, томата, мякоть арбуза).
Реактивы: вода.
Ход работы:
1. Приготовьте препараты клеток плодов яблони, томата, арбуза. Для этого в каплю воды на предметном стекле перенесите частицу мякоти плода, разделите мякоть на клетки и накройте покровным стеклом.
2.Рассмотрите препарат под микроскопом. Найдите в клетках вакуоли, отметьте их окраску.
3. Зарисуйте строение клеток.
клетки яблока под микроскопом (вакуоли прозрачные).
клетки томата (вакуоли светло — красные, также видно наличие красных пластид).
клетки арбуза (сок в вакуолях окрашен в красный цвет).
4. Сделайте вывод. В растительных клетках пигменты, окрашивающие в яркие цвета цветки и плоды покрытосеменных растений, содержатся не только в пластидах, но и в растворе, заполняющем крупные клеточные вакуоли.
Вакуоль является местом локализации водорастворимых пигментов, придающих окраску корнеплодам (свекла), плодам (вишня, жимолость, слива, брусника, смородина, арбуз, яблоко), лепесткам цветков (василек, примула, гортензия, мальва и др.).
Пигменты клеточного сока (антоцианы, флавоноиды) являются веществами фенольной природы, хорошо растворимы в воде и окрашивают органы растений в красный, розовый, синий, голубой, желтый и бурый цвета.
§15. Эндоплазматическая сеть. Комплекс Гольджи. Лизосомы
1. К какой группе органоидов относятся лизосомы, эндоплазматическая сеть и аппарат Гольджи?
Одномембранные, двумембранные, немембранные.
Лизосомы, эндоплазматическая сеть и аппарат Гольджи являются одномембранными органоидами.
2. Каково строение и функции эндоплазматической сети? Чем шероховатая ЭПС отличается от гладкой?
Эндоплазматическая сеть (ЭПС) представляет собой систему каналов и полостей, окружённых мембраной и пронизывающих гиалоплазму клетки. Мембрана эндоплазматической сети по строению сходна с плазмалеммой. ЭПС может занимать до 50% объёма клетки, её каналы и полости нигде не обрываются и не открываются в гиалоплазму.
Различают шероховатую и гладкую ЭПС. На мембране шероховатой ЭПС расположено множество рибосом, мембрана гладкой ЭПС не содержит рибосом. На рибосомах шероховатой ЭПС синтезируются белки, выводимые за пределы клетки, а также мембранные белки. На поверхности гладкой ЭПС происходит синтез липидов, олиго- и полисахаридов. Кроме того, в гладкой ЭПС, накапливаются ионы Са
Шероховатая ЭПС лучше развита в клетках, которые синтезируют большое количество белков (например, в клетках слюнных желез и поджелудочной железы, осуществляющих синтез пищеварительных ферментов; в клетках поджелудочной железы и гипофиза, вырабатывающих гормоны белковой природы). Гладкая ЭПС хорошо развита в клетках, которые синтезируют, например, полисахариды и липиды (клетки надпочечников и половых желез, вырабатывающие стероидные гормоны; клетки печени, осуществляющие синтез гликогена и др.).
Вещества, которые образуются на мембранах ЭПС, накапливаются внутри полостей сети и преобразуются. Например, белки приобретают свойственную им вторичную, третичную или четвертичную структуру. Затем вещества заключаются в мембранные пузырьки и транспортируются в комплекс Гольджи.
3. Как устроен комплекс Гольджи? Какие функции он выполняет?
Комплекс Гольджи – это система внутриклеточных мембранных структур: цистерн и пузырьков, в которых накапливаются и модифицируются вещества, синтезированные на мембранах ЭПС.
Вещества доставляются в комплекс Гольджи в мембранных пузырьках, которые отшнуровываются от ЭПС и присоединяются к цистернам комплекса Гольджи. Здесь эти вещества претерпевают различные биохимические превращения, а затем снова упаковываются в мембранные пузырьки и большая их часть транспортируется к плазмалемме. Мембрана пузырьков сливается с цитоплазматической мембраной, а содержимое выводится за пределы клетки. В комплексе Гольджи растительных клеток синтезируются полисахариды клеточной стенки. Ещё одна важная функция комплекса Гольджи – образование лизосом.
4. Самые крупные комплексы Гольджи (до 10 мкм) обнаружены в клетках эндокринных желез. Как вы думаете, с чем это связано?
Главная функция клеток эндокринных желез – секреция гормонов. Синтез гормонов происходит на мембранах ЭПС, а накопление, преобразование и выведение этих веществ осуществляет комплекс Гольджи. Поэтому в клетках эндокринных желез сильно развит комплекс Гольджи.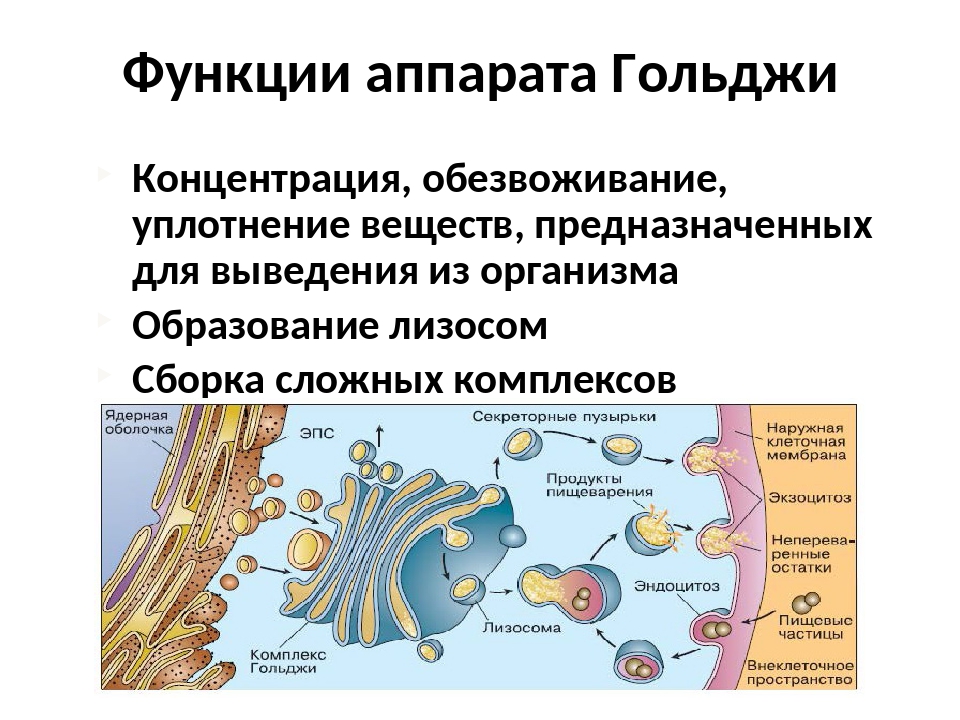
5. Что общего в строении и функциях эндоплазматической сети и комплекса Гольджи? Чем они отличаются?
Сходство:
● Представляют собой комплексы внутриклеточных мембранных структур, ограниченных одинарной мембраной от гиалоплазмы (т.е. являются одномембранными органоидами).
● Способны отделять мембранные пузырьки, содержащие различные органические вещества. Вместе составляют единую систему, обеспечивающую синтез веществ, их модификацию и выведение из клетки (обеспечивают «экспорт»).
● Лучше всего развиты в тех клетках, которые специализируются на секреции биологически активных веществ.
Различия:
● Основные мембранные компоненты эндоплазматической сети – каналы и полости, а комплекса Гольджи – уплощённые цистерны и мелкие пузырьки.
● ЭПС специализируется на синтезе веществ, а комплекс Гольджи – на накоплении, модификации и выведении из клетки.
…и (или) другие существенные признаки.
6. Что представляют собой лизосомы? Как они образуются? Какие функции выполняют?
Лизосомы – небольшие мембранные пузырьки, которые отшнуровываются от цистерн аппарата Гольджи и содержат набор пищеварительных ферментов, способных расщеплять различные вещества (белки, углеводы, липиды, нуклеиновые кислоты и др.) до более простых соединений.
Пищевые частицы, поступающие в клетку извне, упаковываются в фагоцитарные пузырьки. Лизосомы сливаются с этими пузырьками – так образуются вторичные лизосомы, в которых под действием ферментов питательные вещества расщепляются до мономеров. Последние путём диффузии поступают в гиалоплазму, а непереваренные остатки выводятся за пределы клетки путём экзоцитоза.
Помимо переваривания веществ, поступивших в клетку извне, лизосомы принимают участие в расщеплении внутренних компонентов клетки (молекул и целых органоидов), повреждённых или отслуживших свой срок. Этот процесс получил название аутофагии. Кроме того, под действием ферментов лизосом может происходить самопереваривание старых, утративших функциональную активность или повреждённых клеток и тканей.
Кроме того, под действием ферментов лизосом может происходить самопереваривание старых, утративших функциональную активность или повреждённых клеток и тканей.
7*. Предположите, почему ферменты, находящиеся в лизосоме, не расщепляют её собственную мембрану. К каким последствиям для клетки может привести разрыв мембран лизосом?
Структурные компоненты мембран лизосом ковалентно связаны с большим количеством олигосахаридов (необычайно сильно гликозилированы). Это не позволяет ферментам лизосом взаимодействовать с мембранными белками и липидами, т.е. «переваривать» мембрану.
Вследствие разрыва мембран лизосом пищеварительные ферменты попадают в гиалоплазму, что может привести к расщеплению структурных компонентов клетки и даже к автолизу – самоперевариванию клетки. Однако ферменты лизосом работают в кислой среде (рН внутри лизосом составляет 4,5 — 5,0), если же среда близка к нейтральной, что характерно для гиалоплазмы (рН = 7,0 — 7,3), их активность резко снижается. Это один из механизмов защиты клеток от самопереваривания в случае спонтанного разрыва мембран лизосом.
Это один из механизмов защиты клеток от самопереваривания в случае спонтанного разрыва мембран лизосом.
8*. Установлено, что к молекулам многих веществ, подлежащих выведению из клетки, в комплексе Гольджи «пришиваются» определённые олиго- или полисахариды, причём к разным веществам — различные углеводные компоненты. В таком модифицированном виде вещества и выводятся во внеклеточную среду. Как вы думаете, для чего это нужно?
Углеводные компоненты являются своеобразными метками или «удостоверениями», в соответствии с которыми вещества поступают к местам их функционирования, не будучи по пути расщеплёнными под действием ферментов. Таким образом, по углеводным меткам организм отличает служебные вещества от чужеродных и подлежащих переработке.
* Задания, отмеченные звёздочкой, предполагают выдвижение учащимися различных гипотез. Поэтому при выставлении отметки учителю следует ориентироваться не только на ответ, приведённый здесь, а принимать во внимание каждую гипотезу, оценивая биологическое мышление учащихся, логику их рассуждений, оригинальность идей и т.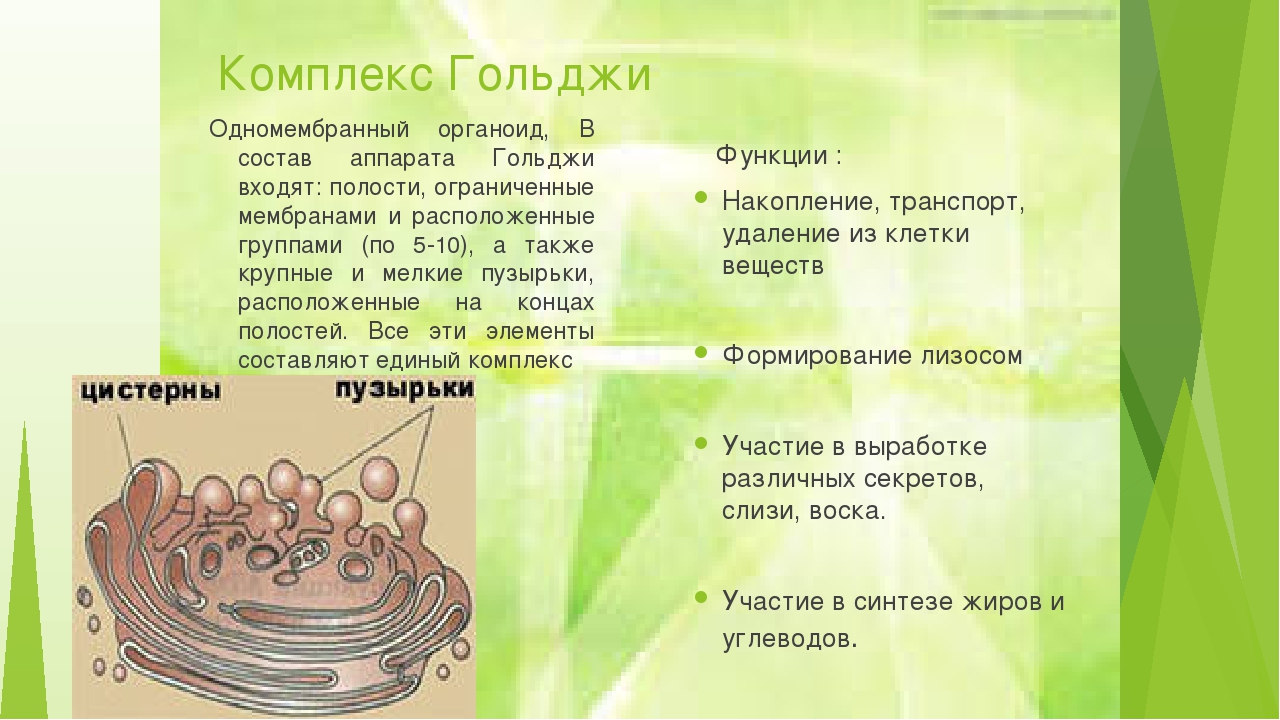 д. После этого целесообразно ознакомить учащихся с приведённым ответом.
д. После этого целесообразно ознакомить учащихся с приведённым ответом.
Дашков М.Л.
Сайт: dashkov.by
Вернуться к оглавлению
| < Предыдущая | Следующая > |
|---|
Комплекс Гольджи
Комплекс Гольджи представляет собой стопку мембранных мешочков (цистерн) и связанную с ней систему пузырьков.
На наружной, вогнутой стороне стопки из пузырьков, отпочковывающихся от глад. ЭПС, постоянно формируются новые цистерны, а на внутренней стороне цистерны превращаются обратно в пузырьки.
Основная функция комплекса Гольджи — транспорт веществ в цитоплазму и внеклеточную среду, а также синтез жиров и углеводов. Комплекс Гольджи участвует в росте и обновлении плазматической мембраны и в формировании лизосом.
Комплекс Гольджи был открыт в 1898 г. К. Гольджи. Располагая крайне примитивным оборудованием и ограниченным набором реактивов, он сделал открытие, благодаря которому совместно с Рамон-и-Кахалом получил Нобелевскую премию. Он обработал нервные клетки раствором бихромата, после чего добавил нитраты серебра и осмия. С помощью осаждения солей осмия или серебра с клеточными структурами Гольджи обнаружил в нейронах темноокрашенную сеть, которую назвал внутренним сетчатым аппаратом. При окраске общими методами пластинчатый комплекс не накапливает красителей, поэтому зона его концентрации видна как светлый участок. Например, вблизи ядра плазмоцита видна светлая зона, соответствующая области расположения органеллы.
Он обработал нервные клетки раствором бихромата, после чего добавил нитраты серебра и осмия. С помощью осаждения солей осмия или серебра с клеточными структурами Гольджи обнаружил в нейронах темноокрашенную сеть, которую назвал внутренним сетчатым аппаратом. При окраске общими методами пластинчатый комплекс не накапливает красителей, поэтому зона его концентрации видна как светлый участок. Например, вблизи ядра плазмоцита видна светлая зона, соответствующая области расположения органеллы.
Чаще всего комплекс Гольджи прилежит к ядру. При световой микроскопии он может распределяться в виде сложных сетей или отдельных диффузно расположенных участков (диктиосом). Форма и положение органеллы не имеют принципиального значения и могут изменяться в зависимости от функционального состояния клетки.
Комплекс Гольджи — это место конденсации и накопления продуктов секреции, вырабатываемых в других участках клетки, в основном в ЭПС. Во время синтеза белков меченные радиоизотопом аминокислоты накапливаются в гр. ЭПС, а затем их находят в комплексе Гольджи, секреторных включениях или лизосомах. Такое явление позволяет определить значение комплекса Гольджи в синтетических процессах в клетке.
ЭПС, а затем их находят в комплексе Гольджи, секреторных включениях или лизосомах. Такое явление позволяет определить значение комплекса Гольджи в синтетических процессах в клетке.
При электронной микроскопии видно, что комплекс Гольджи состоит из скоплений плоских цистерн, которые называются диктиосомами. Цистерны плотно прилежат друг к другу на расстоянии 20…25 нм. Просвет цистерн в центральной части около 25 нм, а на периферии образуются расширения — ампулы, ширина которых непостоянна. В каждой стопке около 5…10 цистерн. Кроме плотно расположенных плоских цистерн в зоне комплекса Гольджи находится большое количество мелких пузырьков (везикул), особенно по краям органеллы. Иногда они отшнуровываются от ампул.
Со стороны, прилежащей к ЭПС и к ядру, в комплексе Гольджи имеется зона, содержащая значительное количество мелких пузырьков и небольших цистерн.
Комплекс Гольджи поляризован, то есть качественно неоднороден с разных сторон. Он имеет незрелую цис-поверхность, лежащую ближе к ядру, и зрелую — транс-поверхность, обращенную к поверхности клетки.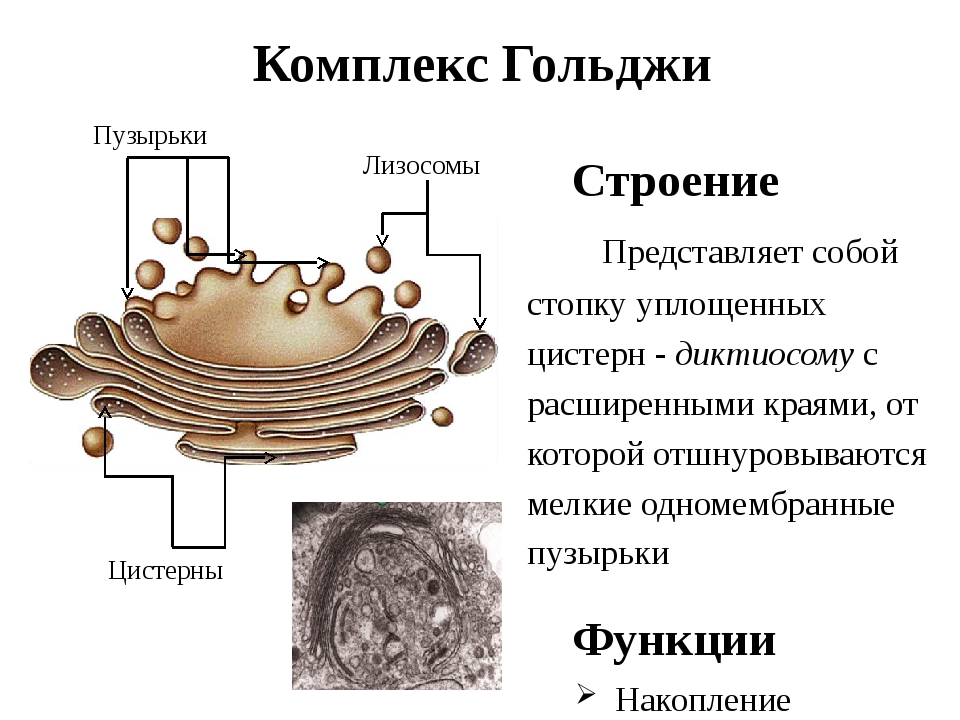 Соответственно органелла состоит из нескольких взаимосвязанных компартментов, выполняющих специфические функции.
Соответственно органелла состоит из нескольких взаимосвязанных компартментов, выполняющих специфические функции.
Цис-компартмент обычно обращен к клеточному центру. Его внешняя поверхность имеет выпуклую форму. С цистернами сливаются микровезикулы (транспортные пиноцитозные пузырьки), направляющиеся из ЭПС. Мембраны постоянно обновляются за счет пузырьков и, в свою очередь, восполняют содержимое мембранных образований других компартментов. В компартменте начинается посттрансляционная обработка белков, которая продолжается в следующих частях комплекса.
Промежуточный компаргмент осуществляет гликозилирование, фосфорилирование, карбоксилирование, сульфатирование биополимерных белковых комплексов. Происходит так называемая посттрансляционная модификация полипептидных цепочек. Идет синтез гликолипидов и липопротеидов. В промежуточном компартмснте, как и в цис-компартменте, формируются третичные и четвертичные белковые комплексы. Часть белков подвергается частичному протеолизу (разрушению), что сопровождается их трансформацией, необходимой для созревания. Таким образом, цис — и промежуточный компартменты необходимы для созревания белков и других сложных биополимерных соединений.
Таким образом, цис — и промежуточный компартменты необходимы для созревания белков и других сложных биополимерных соединений.
Транс-компартмент располагается ближе к периферии клетки. Внешняя поверхность его обычно вогнутая. Частично транс-компартмент переходит в транс-сеть — систему везикул, вакуолей и канальцев.
В клетках отдельные диктиосомы могут быть связаны друг с другом системой везикул и цистерн, примыкающих к дистальному концу скопления плоских мешков, так что образуется рыхлая трехмерная сеть — транс-сеть.
В структурах транс-компартмента и транс-сети происходят сортировка белков и других веществ, образование секреторных гранул, предшественников первичных лизосом и пузырьков спонтанной секреции. Секреторные пузырьки и прелизосомы окружают белки — клатрины.
Клатрины осаждаются на мембране формирующегося пузырька, постепенно отщепляя его от дистальной цистерны комплекса. Окаймленные пузырьки отходят от транс-сети, их перемещение гормонозависимое и контролируется функциональным состоянием клетки. Процесс транспортировки окаймленных пузырьков находится под влиянием микротрубочек. Белковые (клатриновые) комплексы вокруг пузырьков распадаются после отщепления пузырька от транс-сети и вновь формируются в момент секреции. В момент секреции белковые комплексы пузырьков взаимодействуют с белками микротрубочек, и пузырек транспортируется к наружной мембране. Пузырьки спонтанной секреции не окружены клатринами, их формирование происходит непрерывно и они, направляясь к клеточной мембране, сливаются с ней, обеспечивая восстановление цитолеммы.
Процесс транспортировки окаймленных пузырьков находится под влиянием микротрубочек. Белковые (клатриновые) комплексы вокруг пузырьков распадаются после отщепления пузырька от транс-сети и вновь формируются в момент секреции. В момент секреции белковые комплексы пузырьков взаимодействуют с белками микротрубочек, и пузырек транспортируется к наружной мембране. Пузырьки спонтанной секреции не окружены клатринами, их формирование происходит непрерывно и они, направляясь к клеточной мембране, сливаются с ней, обеспечивая восстановление цитолеммы.
В целом комплекс Гольджи участвует в сегрегации — это разделение, отделение определенных частей от основной массы, и накоплении продуктов, синтезированных в ЭПС, в их химических перестройках, созревании. В цистернах происходит синтез полисахаридов, их соединение с белками, что приводит к образованию сложных комплексов пептидогликанов (гликопротеинов). С помощью элементов комплекса Гольджи выводятся готовые секреты за пределы секреторной клетки.
Мелкие транспортные пузырьки отщепляются от гр. ЭПС в зонах, свободных от рибосом. Пузырьки восстанавливают мембраны комплекса Гольджи и доставляют в него полимерные комплексы, синтезируемые в ЭПС. Пузырьки транспортируются в цис-компартмент, где сливаются с его мембранами. Следовательно, в комплекс Гольджи поступают новые порции мембран и продуктов, синтезированных в гр. ЭПС.
В цистернах комплекса Гольджи происходят вторичные изменения в белках, синтезированных в гр. ЭПС. Эти изменения связаны с перестройкой олигосахаридных цепочек гликопротеинов. Внутри полостей комплекса Гольджи с помощью трансглюкозидаз модифицируются лизосомальные белки и белки секретов: происходит последовательная замена и наращивание олигосахаридных цепочек. Модифицирующиеся белки переходят от цистерны цис-компартмента в цистерны транс-компартмента за счет транспорта в пузырьках, содержащих белок.
В транс-компартменте белки сортируются: на внутренних поверхностях мембран цистерн располагаются белковые рецепторы, которые узнают секреторные белки, белки мембран и лизосом (гидролазы). В результате от дистальных транс-участков диктиосом отщепляются три типа мелких вакуолей: содержащие гидролазы — прелизосомы; с секреторными включениями, вакуоли, восполняющие клеточную мембрану.
В результате от дистальных транс-участков диктиосом отщепляются три типа мелких вакуолей: содержащие гидролазы — прелизосомы; с секреторными включениями, вакуоли, восполняющие клеточную мембрану.
Секреторная функция комплекса Гольджи заключается в том, что синтезированный на рибосомах экспортируемый белок, отделяющийся и накапливающийся внутри цистерн ЭПС, транспортируется в вакуоли пластинчатого аппарата. Затем накопленный белок может конденсироваться, образуя секреторные белковые гранулы (в поджелудочной, молочной и других железах), или оставаться в растворенном виде (иммуноглобулины в плазматических клетках). От ампулярных расширений цистерн комплекса Гольджи отщепляются пузырьки, содержащие эти белки. Такие пузырьки могут сливаться между собой, увеличиваться в размерах, образуя секреторные гранулы.
После этого секреторные гранулы начинают двигаться к поверхности клетки, соприкасаются с плазмолеммой, с которой сливаются их собственные мембраны, и содержимое гранул оказывается за пределами клетки. Морфологически этот процесс называется экструзией, или экскрецией (выбрасывание, экзоцитоз) и напоминает эндоцитоз, только с обратной последовательностью стадий.
Морфологически этот процесс называется экструзией, или экскрецией (выбрасывание, экзоцитоз) и напоминает эндоцитоз, только с обратной последовательностью стадий.
Комплекс Гольджи может резко увеличиваться в размерах в клетках, активно осуществляющих секреторную функцию, что обычно сопровождается развитием ЭПС, а в случае синтеза белков — ядрышка.
Во время деления клетки комплекс Гольджи распадается до отдельных цистерн (диктиосом) и/или пузырьков, которые распределяются между двумя делящимися клетками и в конце телофазы восстанавливают структурную целостность органеллы. Вне деления происходит непрерывное обновление мембранного аппарата за счет пузырьков, мигрирующих из ЭПС и дистальных цистерн диктиосомы за счет проксимальных компартментов.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
пластинчатый комплекс — это… Что такое пластинчатый комплекс?
- пластинчатое тельце
- пластическое обеспечение функций
Смотреть что такое «пластинчатый комплекс» в других словарях:
Пластинчатый комплекс — Аппарат Гольджи и другие мембранные органеллы эукариотической клетки Аппарат Гольджи (комплекс Гольджи) мембранная структура эукариотической клетки, органелла, в основном предназначенная для выведения веществ, синтезированных в эндоплазматическом … Википедия
КОМПЛЕКС ГОЛЬДЖИ — аппарат Гольджи, пластинчатый комплекс (complexus lamellosus), клеточный органоид, выполняющий ряд важных функций.
 Открыт К. Гольджи (1898) в нервных клетках. С помощью электронной микроскопии было показано, что К. Г. присутствует во всех… … Биологический энциклопедический словарь
Открыт К. Гольджи (1898) в нервных клетках. С помощью электронной микроскопии было показано, что К. Г. присутствует во всех… … Биологический энциклопедический словарьГольджи комплекс — (С. Golgi) см. Пластинчатый комплекс … Большой медицинский словарь
Кольчато-пластинчатый доспех — Русский бехтерец (первая половина XVII века) … Википедия
Кровь — I (sanguis) жидкая ткань, осуществляющая в организме транспорт химических веществ (в т.ч. кислорода), благодаря которому происходит интеграция биохимических процессов, протекающих в различных клетках и межклеточных пространствах, в единую систему … Медицинская энциклопедия
Нейросекреция — (от Нейро… и лат. secretio отделение) свойство некоторых нервных клеток (так называемых нейросекреторных) вырабатывать и выделять особые активные продукты нейросекреты, или Нейрогормоны. Способность к синтезу и секреции физиологически… … Большая советская энциклопедия
НЕЙРОСЕКРЕЦИЯ — (от нейро.
 .. и секреция), образование и выделение специализированными нервными клетками (т. н. нейросекреторными) нейрогормонов. В отличие от классич. нервных клеток, секретирующих химич. передатчики нервного импульса медиаторы, нейросекреторные… … Биологический энциклопедический словарь
.. и секреция), образование и выделение специализированными нервными клетками (т. н. нейросекреторными) нейрогормонов. В отличие от классич. нервных клеток, секретирующих химич. передатчики нервного импульса медиаторы, нейросекреторные… … Биологический энциклопедический словарьЩИТОВИДНАЯ ЖЕЛЕЗА — Рис. 1. Гистологическая картина щитовидной железы коровы. Рис. 1. Гистологическая картина щитовидной железы коровы. щитовидная железа (Glandula thyroidea), железа внутренней секреции, расположенная на шее по обеим сторонам трахеи, позади… … Ветеринарный энциклопедический словарь
КЛЕТКА — Рис. 1. Светоскопическая картина клетки и электронно микроскопическое строение её структурных элементов. Рис. 1. Светоскопическая картина клетки (в середине) и электронно микроскопическое строение её структурных элементов (вокруг клетки):… … Ветеринарный энциклопедический словарь
система вакуолярная — совокупность вакуолей и канальцев в цитоплазме, включающая эндоплазматическую сеть и пластинчатый комплекс (комплекс Гольджи) … Большой медицинский словарь
1.
 1.2. Строение дрожжевой клетки — Технология производства дрожжей
1.2. Строение дрожжевой клетки — Технология производства дрожжейДрожжевая клетка состоит из оболочки, цитоплазматической мембраны и цитоплазмы. Размер клетки составляет в среднем 8-10 мкм (рисунок 1).
Рисунок 1 — Строение дрожжевой клетки: 1 — цитоплазматическая мембрана: 2 — оболочка; 3 — рибосомы; 4 — протоплазма; 5 — ядре; 6 — митохондрия; 7 — капля жира; 8 — вакуоль; 9 — гранулы метахроматина; 10 — рубец (место, где отпочковалась дочерняя клетка).
Оболочка представляет собой плотную, прочную и эластичную структуру, способную обеспечивать постоянство формы клетки и выдерживать значительное осмотическое давление (до 2 МПа). Оболочка, обладающая избирательной проницаемостью, обеспечивает транспорт питательных веществ в клетку и удаление из неё продуктов обмена.
Цитоплазматическая
мембрана
расположена непосредственно под клеточной стенкой. Основная её функция —
регулирование проникновения в клетку питательных веществ и выведения наружу
продуктов обмена. Здесь локализуются некоторые ферменты
и происходит биосинтез ряда веществ и компонентов клеточной
стенки.
Основная её функция —
регулирование проникновения в клетку питательных веществ и выведения наружу
продуктов обмена. Здесь локализуются некоторые ферменты
и происходит биосинтез ряда веществ и компонентов клеточной
стенки.
Цитоплазма — сложная по составу коллоидная система. В цитоплазме протекают важнейшие процессы биосинтеза и хранится генетическая информация. В ней расположены органоиды (митохондрии, рибосомы, ядро, эндоплазматический ретикулум и аппарат Гольджи) и вакуоли.
Митохондрии представляют собой сферические или удлиненные внутриклеточные органеллы, содержащие ферментные системы, главным образом переноса электронов. В функции митохондрий входят окислительные реакции, являющиеся источником энергии, перенос электронов по цепи реакций синтеза АТФ, синтез части митохондриальных белков.
Рибосомы
—
ультрамикроскопические гранулы в виде неправильных шариков, состоящих из белка и
РНК. В рибосомах осуществляется синтез белков
и ферментов.
В рибосомах осуществляется синтез белков
и ферментов.
Ядро имеет форму круглого и овального пузырька, окруженного оболочкой. Функция ядра — хранение и передача генетической информации при делении клетки.
Эндоплазматический ретикулум представляет сложную мембранную сеть, образующую множество каналов, по которым различные вещества перемещаются от внешней оболочки к центру.
Аппарат Гольджи — скопление мельчайших сплющенных телец, связанных с мембранной системой эндоплазматического ретикулума. Роль аппарата Гольджи, предположительно, заключается в создании новых мембран. Кроме того он выполняет и защитную функцию — консервирование и удаление продуктов секреции клетки.
Вакуоли
занимают центральную часть клетки. Они заполнены клеточным соком, который
заключен в липопротеидную оболочку. Вакуоли участвуют в осмотическом
регулировании и являются местом протекания различных окислительно —
восстановительных процессов.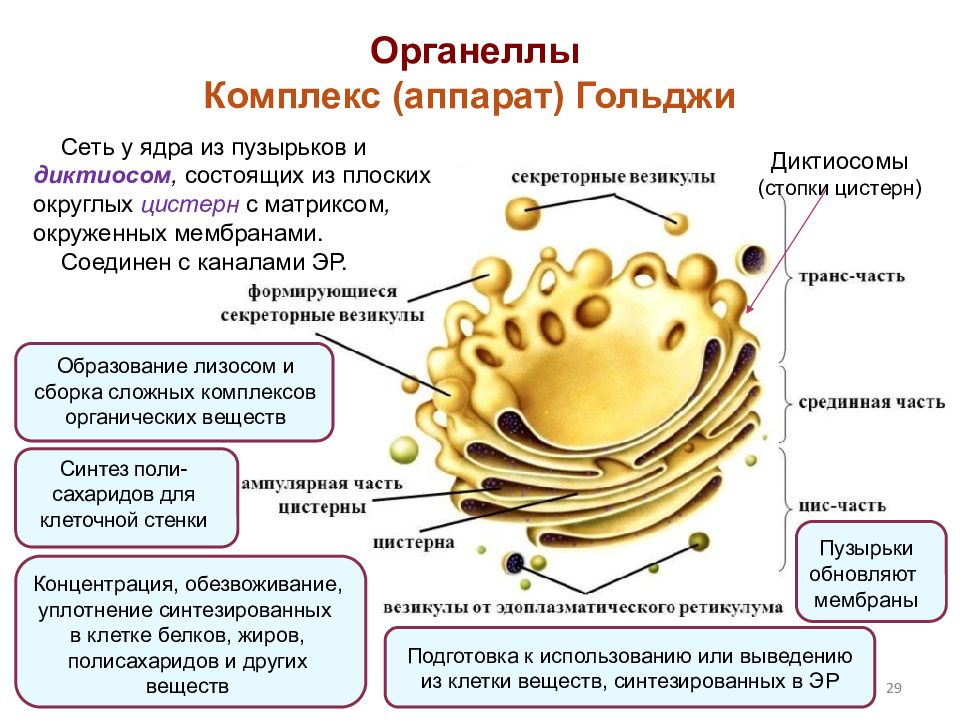 Вакуоли образуются при старении дрожжевой клетки в
них содержатся питательные вещества, продукты жизнедеятельности и гранулы
запасных веществ: валютина, гликогена, трегалозы, жира
Вакуоли образуются при старении дрожжевой клетки в
них содержатся питательные вещества, продукты жизнедеятельности и гранулы
запасных веществ: валютина, гликогена, трегалозы, жира
Аппарат Гольджи — Устройство — Функция
Гольджи Аппарат — это мембраносвязанная органелла, обнаруженная в большинстве клеток. Он отвечает за упаковку белков в пузырьки до их секреции и, следовательно, играет ключевую роль в секреторном пути.
В этой статье мы рассмотрим структуру и функцию аппарата Гольджи и его роль в болезни Вильсона .
Строение
Гольджи состоит из 5-8 складок, называемых цистерн .Цистерны содержат специфические ферменты, образующие пять функциональных областей, которые стереотипно модифицируют протеины, проходящие через них, а именно:
- Сеть Цис-Гольджи : обращена к ядру, образует соединение с эндоплазматическим ретикулумом и является точкой входа в аппарат Гольджи.
- Цис-Гольджи : основная область обработки, допускающая биохимические модификации.
- Medial-Golgi : основная область обработки, допускающая биохимические модификации.
- Trans-Golgi : основная область обработки, допускающая биохимические модификации.
- Сеть Транс-Гольджи : точка выхода пузырьков, отрастающих от поверхности Гольджи, упаковывает и сортирует биохимические вещества в пузырьки в соответствии с их назначением.
Функция
Аппарат Гольджи модифицирует белки и липиды, которые он получает из эндоплазматической сети.Эти биохимические вещества покидают гольджи посредством экзоцитоза прежде, чем доставляются к различным внутриклеточным или внеклеточным мишеням.
- Процессинг белка — углеводные области гликопротеинов изменяются путем добавления, удаления или модификации углеводов.
- Обработка липидов — добавляет фосфатные группы и гликопротеины к липидам из эндоплазматического ретикулума (например, холестерину) для создания фосфолипидов, составляющих клеточную мембрану.
Сортировка, почкование и экзоцитоз
Биохимические продукты — это , химически , помеченные как в гольджи, чтобы гарантировать надлежащую доставку в нужное место назначения. Как только они отпочковываются от транс-Гольджи, они вступают в определенный путь в соответствии с этой сигнальной последовательностью.
Лизосомальные белки — такие как ферменты, упакованы в определенные везикулы.Эти белки обычно помечены маннозо-6-фосфатом в Golgi
. Секреторные белки — такие как гормоны, упакованы в секреторные пузырьки, готовые к экзоцитозу. Для этого требуется АТФ, поскольку две отрицательно заряженные мембраны должны слиться, чтобы позволить их высвобождению. Мембрана везикулы будет составлять часть клеточной мембраны. Это возможно только в секреторных клетках Гольджи.
Мембрана везикулы будет составлять часть клеточной мембраны. Это возможно только в секреторных клетках Гольджи.
Клетка поверхностные белки — такие как фосфолипиды, входят в конститутивный секреторный путь, присутствующий во всех клетках.
[старт-клиническая]
Клиническая значимость — болезнь Вильсона
Болезнь Вильсона — аутосомно-рецессивное заболевание, характеризующееся аномальным накоплением меди в организме. Печень особенно восприимчива к этому накоплению.
Мутация гена ATP7B участвует в развитии болезни Вильсона. Ген ATP7B кодирует переносящую медь АТФазу 2 (также известную как белок болезни Вильсона или WDP), фермент, расположенный в аппарате Гольджи многих клеток, таких как гепатоцитов и нейронов .
WDP обычно позволяет меди связываться с церулоплазмином, белком, который транспортирует медь к различным частям тела. Если уровень меди слишком высок, WDP покидает Гольджи, позволяя меди выводиться с желчью, а не переноситься по телу.
Если уровень меди слишком высок, WDP покидает Гольджи, позволяя меди выводиться с желчью, а не переноситься по телу.
Пациенты испытывают симптомы и признаки печени отказ , такие как зуд, вздутие живота, усталость, желтуха, асцит и кольца Кайзера-Флейшера (отложение меди в роговице).
У них также может быть психоневрологических симптомов, таких как спутанность сознания, психоз, изменения личности и тремор. Медь также может накапливаться в суставах, вызывая боль в суставах и отек.
Рис. 3.0 — Кольцо Кайзера-Флейшера снаружи роговицы [/ caption]Диагноз ставится на основании аномальных функциональных тестов печени, уровней меди в сыворотке, уровней меди в моче и низких уровней церулоплазмина в сыворотке. Если диагноз неясен, может быть показана биопсия печени.
Управление направлено на снижение уровня меди с использованием хелатирующих агентов меди, таких как пеницилламин .
[окончание клинической]
Biology4Kids.com: Структура клетки: Аппарат Гольджи
Аппарат Гольджи или комплекс Гольджи встречается в большинстве клеток. Это еще одна упаковывающая органелла , подобная эндоплазматическому ретикулуму (ЭР). Он был назван в честь итальянского биолога Камилло Гольджи. Он произносится как GOL-JI так же, как вы бы сказали squee-gie, как мягкий звук «G».Хотя слои мембран могут выглядеть как грубый ER, они выполняют совсем другую функцию. Аппарат Гольджи собирает простые молекулы и объединяет их, чтобы сделать молекулы более сложными. Затем он берет эти большие молекулы, упаковывает их в пузырьков и либо сохраняет их для дальнейшего использования, либо отправляет их из клетки. Это также органелла, из которой строятся лизосомы (машины для переваривания клеток). Комплексы Гольджи в растении также могут создавать сложные сахара и отправлять их в секреторные пузырьки.
 Пузырьки создаются так же, как и ER. Везикулы отрываются от мембран и плавают через клетку.
Пузырьки создаются так же, как и ER. Везикулы отрываются от мембран и плавают через клетку.Аппарат Гольджи представляет собой серию мембран в форме блинов. Одиночная мембрана похожа на клеточную мембрану тем, что имеет два слоя. Мембрана окружает область жидкости, в которой хранятся и изменяются сложные молекулы (белки, сахара, ферменты). Поскольку комплекс Гольджи поглощает пузырьки из грубого ER, вы также найдете рибосомы в этих стопках блинов.
Комплекс Гольджи тесно связан с грубой неотложной помощью. Когда белок образуется в ER, образуется нечто, называемое переходным пузырьком . Этот пузырек или мешок перемещается по цитоплазме к аппарату Гольджи и абсорбируется. После того, как Гольджи выполняет свою работу с молекулами внутри мешочка, создается секреторный пузырь , который выделяется в цитоплазму. Оттуда везикула перемещается к клеточной мембране, и молекулы высвобождаются из клетки.
Что такое диабет? (Видео Калифорнийского университета в Сан-Франциско)
Полезные справочные ссылки
Encyclopedia.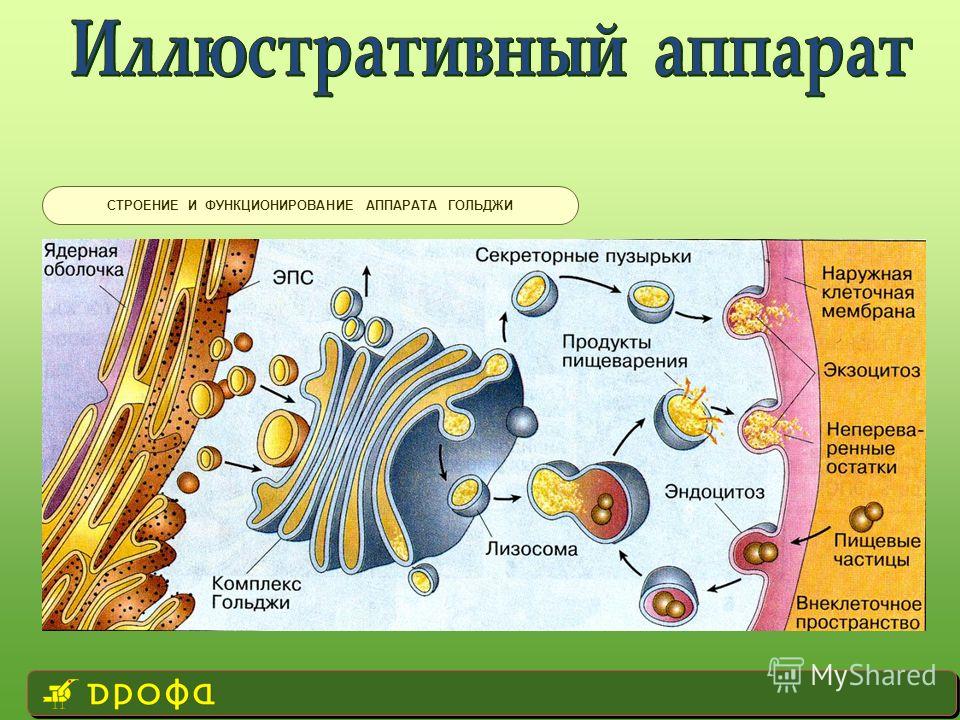 com:
com: http://www.encyclopedia.com/topic/Golgi_apparatus.aspx
Википедия:
http://en.wikipedia.org/wiki/Golgi_apparatus
Британская энциклопедия
http://www.britannica.com/EBchecked/topic/238044/Golgi-apparatus
Аппарат Гольджи — обзор
Морфология и динамика Гольджи
Аппарат Гольджи во многих клетках животных выглядит как ленточная структура, прилегающая к ядру и близко к центросоме, главному центру организации микротрубочек клетки (рис.21.18А). Электронные микрофотографии тонких срезов показывают, что аппарат Гольджи состоит из уложенных друг на друга уплощенных, окруженных мембранами цистерн, которые напоминают стопку блинов (рис. 21.18B). Поперечное сшивание цистерн с помощью связанных с Гольджи факторов привязки приводит к их тесному параллельному выравниванию внутри стека. Трубочки и пузырьки на краях стопок соединяют множество стопок в единую ленточную структуру посредством процесса, зависящего от микротрубочек. Если микротрубочки деполимеризованы экспериментально, ленточная структура Гольджи реорганизуется в отдельные стопки, обнаруживаемые в местах выхода ЭР (рис.21.19). Это распределение напоминает распределение стопок Гольджи в растительных клетках, где сотни отдельных стопок расположены рядом с сайтами выхода ER, а не соединяются вместе в одну ленту.
Если микротрубочки деполимеризованы экспериментально, ленточная структура Гольджи реорганизуется в отдельные стопки, обнаруживаемые в местах выхода ЭР (рис.21.19). Это распределение напоминает распределение стопок Гольджи в растительных клетках, где сотни отдельных стопок расположены рядом с сайтами выхода ER, а не соединяются вместе в одну ленту.
Стеки цистерн Гольджи в клетках животных и растений все обладают полярностью цис -to- транс , отражая прохождение груза через органеллы. Белки и липиды из ER попадают на лицевую сторону цис (входную грань) стека. Пройдя через стопку цистерн, груз уходит из trans лицом на противоположную сторону стопки.Мембранные сортировочные и транспортные активности Гольджи, как полагают, особенно высоки на гранях цис и транс и внутри трубчато-везикулярных элементов (некомпактная зона), которые соединяют стопки между собой (Рис. 21.18B).
Три предложенных механизма объясняют транспорт секреторных грузовых белков через аппарат Гольджи (Рис. 21.20). В одной модели цистерны, составляющие стек Гольджи, являются относительно стабильными структурами, и секреторный груз переходит от цистерны к цистерне через стек в канальцах или пузырьках, которые зарождаются из одной цистерны и сливаются с другой.Направленный поток достигается за счет того, что белки-грузчики обладают преимущественным сродством к мембранам, содержащим трубчатые / везикулярные транспортные промежуточные звенья, отходящие от Гольджи к плазматической мембране. Во втором механизме, называемом цистернальной прогрессией, секреторный груз транспортируется через стек в непрерывно прогрессирующих цистернах. Новые цистерны образуются на стороне cis стопки за счет слияния VTC и затем продвигаются по стопке к стороне trans .Молекулы секреторного груза удерживаются внутри данной цистерны до тех пор, пока он не перейдет от грани цис к грани транс и не выйдет из аппарата Гольджи в транспортных носителях. Подтверждение цистернальной прогрессии происходит из исследований на дрожжах, показывающих маркеры в отдельных цистернах Гольджи, созревающих от ранних до поздних форм с течением времени.
21.20). В одной модели цистерны, составляющие стек Гольджи, являются относительно стабильными структурами, и секреторный груз переходит от цистерны к цистерне через стек в канальцах или пузырьках, которые зарождаются из одной цистерны и сливаются с другой.Направленный поток достигается за счет того, что белки-грузчики обладают преимущественным сродством к мембранам, содержащим трубчатые / везикулярные транспортные промежуточные звенья, отходящие от Гольджи к плазматической мембране. Во втором механизме, называемом цистернальной прогрессией, секреторный груз транспортируется через стек в непрерывно прогрессирующих цистернах. Новые цистерны образуются на стороне cis стопки за счет слияния VTC и затем продвигаются по стопке к стороне trans .Молекулы секреторного груза удерживаются внутри данной цистерны до тех пор, пока он не перейдет от грани цис к грани транс и не выйдет из аппарата Гольджи в транспортных носителях. Подтверждение цистернальной прогрессии происходит из исследований на дрожжах, показывающих маркеры в отдельных цистернах Гольджи, созревающих от ранних до поздних форм с течением времени.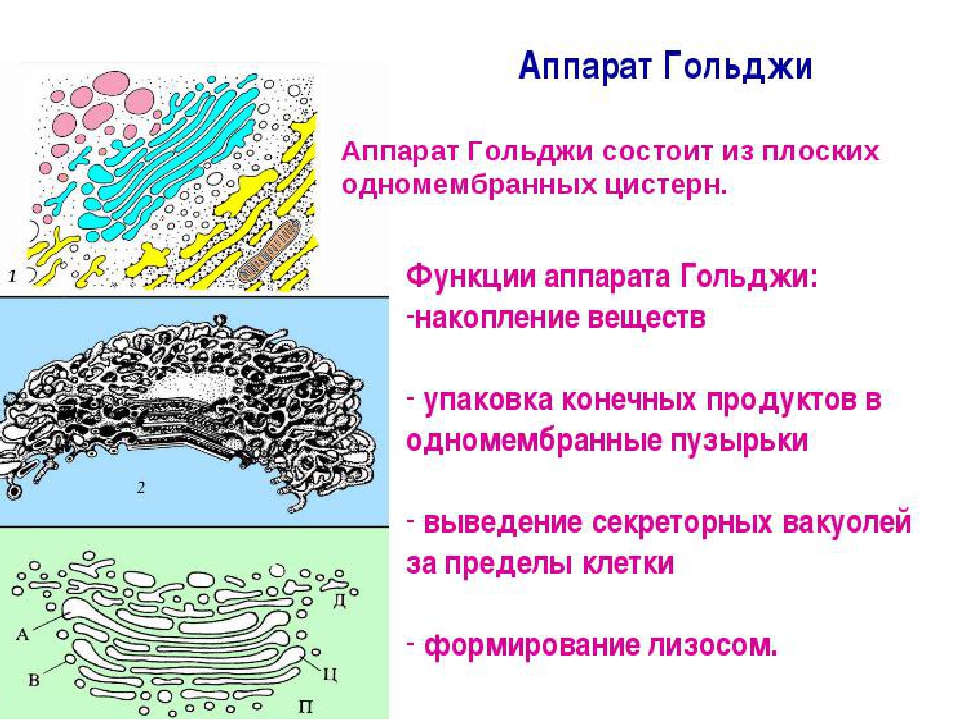 Измерения кинетики живых клеток в клетках млекопитающих показывают, что груз покидает Гольджи в геометрической прогрессии без задержки. Это открытие, вместе с наблюдением, что резидентные ферменты и груз разделяются на отдельные домены в аппарате Гольджи, в дополнение к наличию перекрывающихся распределений, привели к третьей модели трафика Гольджи.В этой модели разделение грузовых белков на липидные домены, лишенные ферментов Гольджи, обеспечивает механизм их экспорта из Гольджи (Рис. 21.20).
Измерения кинетики живых клеток в клетках млекопитающих показывают, что груз покидает Гольджи в геометрической прогрессии без задержки. Это открытие, вместе с наблюдением, что резидентные ферменты и груз разделяются на отдельные домены в аппарате Гольджи, в дополнение к наличию перекрывающихся распределений, привели к третьей модели трафика Гольджи.В этой модели разделение грузовых белков на липидные домены, лишенные ферментов Гольджи, обеспечивает механизм их экспорта из Гольджи (Рис. 21.20).
Размер, внешний вид и даже наличие аппарата Гольджи зависят от количества и скорости движения груза по секреторному пути. Дрожжи Saccharomyces cerevisiae, , например, имеют плохо развитый аппарат Гольджи, потому что секреторный транспорт обычно слишком быстр для накопления сложных структур Гольджи.Однако условия, которые замедляют транспорт грузов из аппарата Гольджи в дрожжевых клетках, приводят к увеличению и перегруппировке аппарата Гольджи в компактные стопки, подобные тем, которые наблюдаются в большинстве клеток животных и растений.
Аппарат Гольджи представляет собой скорее динамическую, чем постоянную клеточную структуру, потому что и его белки, и липиды непрерывно перемещаются по различным путям. Никакой класс белка Гольджи не связан стабильно с этой органеллой. Интегральные мембранные белки, включая процессирующие ферменты и SNAREs, постоянно выходят из аппарата Гольджи и повторно входят в него по путям переноса через мембрану, ведущим в и из ER.Белки периферических мембран, связанные с аппаратом Гольджи (включая Arf1, коатомер, Rab белки, матричные белки, факторы привязки и GEF), постоянно обмениваются между мембранами Гольджи и цитоплазматическими пулами.
Временная и динамическая ассоциация молекул с аппаратом Гольджи делает эту органеллу чувствительной к функциям многих клеточных систем. Например, в отсутствие микротрубочек аппарат Гольджи в клетках млекопитающих перемещается рядом с сайтами экспорта ER (рис.21.19). Это происходит из-за того, что ферменты Гольджи, которые непрерывно рециркулируют обратно в ER, не могут вернуться в центросомное место без микротрубочек.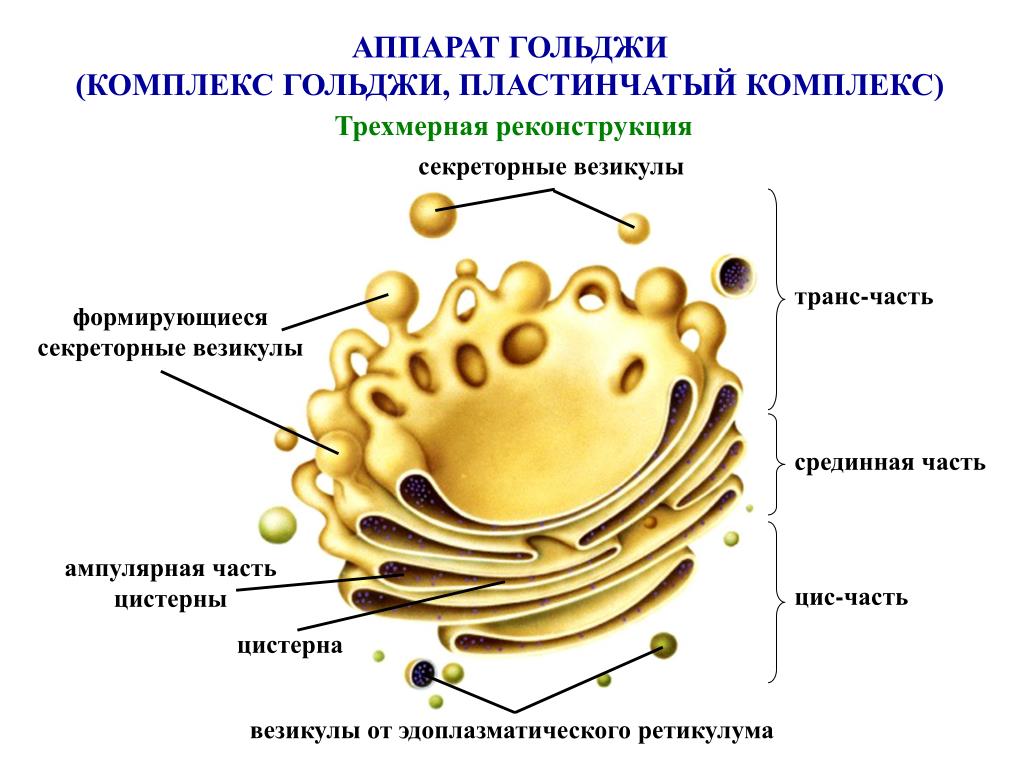 Вместо этого они накапливаются вместе с каркасами Гольджи, связующими и структурными белками оболочки в сайтах выхода ER, распределенных по ER, образуя министаки Гольджи.
Вместо этого они накапливаются вместе с каркасами Гольджи, связующими и структурными белками оболочки в сайтах выхода ER, распределенных по ER, образуя министаки Гольджи.
BFA разгоняет аппарат Гольджи с помощью другого механизма. Препарат предотвращает обмен Arf1 GDP на GTP (рис. 21.5), тем самым предотвращая рекрутирование эффекторов Arf1 из цитоплазмы мембраной.В течение нескольких минут резидентные трансмембранные белки Гольджи возвращаются в ER, где они сохраняются, а аппарат Гольджи исчезает. Если BFA удаляется, аппарат Гольджи восстанавливается за счет разрастания мембраны из ER.
Аппарат Гольджи разбирается во время митоза во многих эукариотических клетках, а затем снова собирается в интерфазе (рис. 21.21). Этот процесс внешне напоминает эффекты применения и вымывания BFA, поскольку многие ферменты Гольджи возвращаются в ER или в места выхода ER во время митоза и повторно выходят из ER в конце митоза.Это вызывается как инактивацией Arf1, так и тем, что связывающие факторы / матричные белки аппарата Гольджи фосфорилируются митотическими киназами (см. Главу 40) во время митоза.
Главу 40) во время митоза.
Хотя аппарат Гольджи очень динамичен и постоянно обменивается своими белковыми и липидными компонентами с другими клеточными компартментами, он сохраняет уникальную биохимическую и морфологическую идентичность. Это позволяет аппарату Гольджи участвовать в нескольких основных биосинтетических и процессинговых путях в клетке, как обсуждается далее.
Аппарат Гольджи — обзор
Морфология и динамика Гольджи
Аппарат Гольджи во многих клетках животных выглядит как ленточная структура, прилегающая к ядру и близко к центросоме, главному центру организации микротрубочек клетки (рис. . 21.18A). Электронные микрофотографии тонких срезов показывают, что аппарат Гольджи состоит из уложенных друг на друга уплощенных, окруженных мембранами цистерн, которые напоминают стопку блинов (рис. 21.18B). Поперечное сшивание цистерн с помощью связанных с Гольджи факторов привязки приводит к их тесному параллельному выравниванию внутри стека.Трубочки и пузырьки на краях стопок соединяют множество стопок в единую ленточную структуру посредством процесса, зависящего от микротрубочек.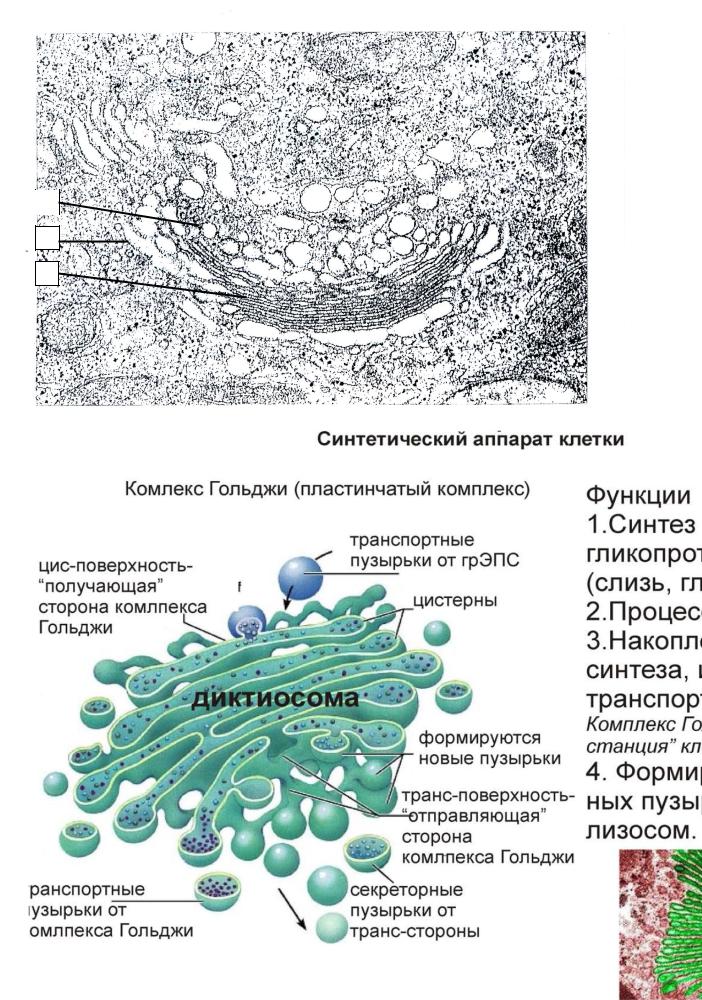 Если микротрубочки экспериментально деполимеризованы, ленточная структура Гольджи реорганизуется в отдельные стопки, обнаруживаемые в сайтах выхода ER (Fig. 21.19). Это распределение напоминает распределение стопок Гольджи в растительных клетках, где сотни отдельных стопок расположены рядом с сайтами выхода ER, а не соединяются вместе в одну ленту.
Если микротрубочки экспериментально деполимеризованы, ленточная структура Гольджи реорганизуется в отдельные стопки, обнаруживаемые в сайтах выхода ER (Fig. 21.19). Это распределение напоминает распределение стопок Гольджи в растительных клетках, где сотни отдельных стопок расположены рядом с сайтами выхода ER, а не соединяются вместе в одну ленту.
Стеки цистерн Гольджи в клетках животных и растений все обладают полярностью цис -to- транс , отражая прохождение груза через органеллы.Белки и липиды из ER попадают на лицевую сторону цис (входную грань) стека. Пройдя через стопку цистерн, груз уходит из trans лицом на противоположную сторону стопки. Мембранные сортировочные и транспортные активности Гольджи, как полагают, особенно высоки на гранях цис и транс и внутри трубчато-везикулярных элементов (некомпактная зона), которые соединяют стопки между собой (Рис. 21.18B).
Три предложенных механизма объясняют транспорт секреторных грузовых белков через аппарат Гольджи (рис.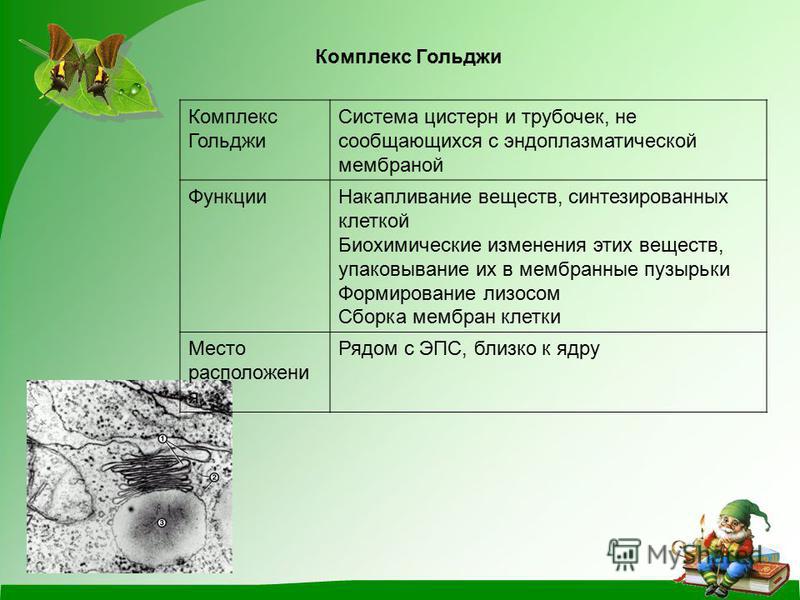 21.20). В одной модели цистерны, составляющие стек Гольджи, являются относительно стабильными структурами, и секреторный груз переходит от цистерны к цистерне через стек в канальцах или пузырьках, которые зарождаются из одной цистерны и сливаются с другой. Направленный поток достигается за счет того, что белки-грузчики обладают преимущественным сродством к мембранам, содержащим трубчатые / везикулярные транспортные промежуточные звенья, отходящие от Гольджи к плазматической мембране. Во втором механизме, называемом цистернальной прогрессией, секреторный груз транспортируется через стек в непрерывно прогрессирующих цистернах.Новые цистерны образуются на стороне cis стопки за счет слияния VTC и затем продвигаются по стопке к стороне trans . Молекулы секреторного груза удерживаются внутри данной цистерны до тех пор, пока он не перейдет от грани цис к грани транс и не выйдет из аппарата Гольджи в транспортных носителях. Подтверждение цистернальной прогрессии происходит из исследований на дрожжах, показывающих маркеры в отдельных цистернах Гольджи, созревающих от ранних до поздних форм с течением времени.
21.20). В одной модели цистерны, составляющие стек Гольджи, являются относительно стабильными структурами, и секреторный груз переходит от цистерны к цистерне через стек в канальцах или пузырьках, которые зарождаются из одной цистерны и сливаются с другой. Направленный поток достигается за счет того, что белки-грузчики обладают преимущественным сродством к мембранам, содержащим трубчатые / везикулярные транспортные промежуточные звенья, отходящие от Гольджи к плазматической мембране. Во втором механизме, называемом цистернальной прогрессией, секреторный груз транспортируется через стек в непрерывно прогрессирующих цистернах.Новые цистерны образуются на стороне cis стопки за счет слияния VTC и затем продвигаются по стопке к стороне trans . Молекулы секреторного груза удерживаются внутри данной цистерны до тех пор, пока он не перейдет от грани цис к грани транс и не выйдет из аппарата Гольджи в транспортных носителях. Подтверждение цистернальной прогрессии происходит из исследований на дрожжах, показывающих маркеры в отдельных цистернах Гольджи, созревающих от ранних до поздних форм с течением времени.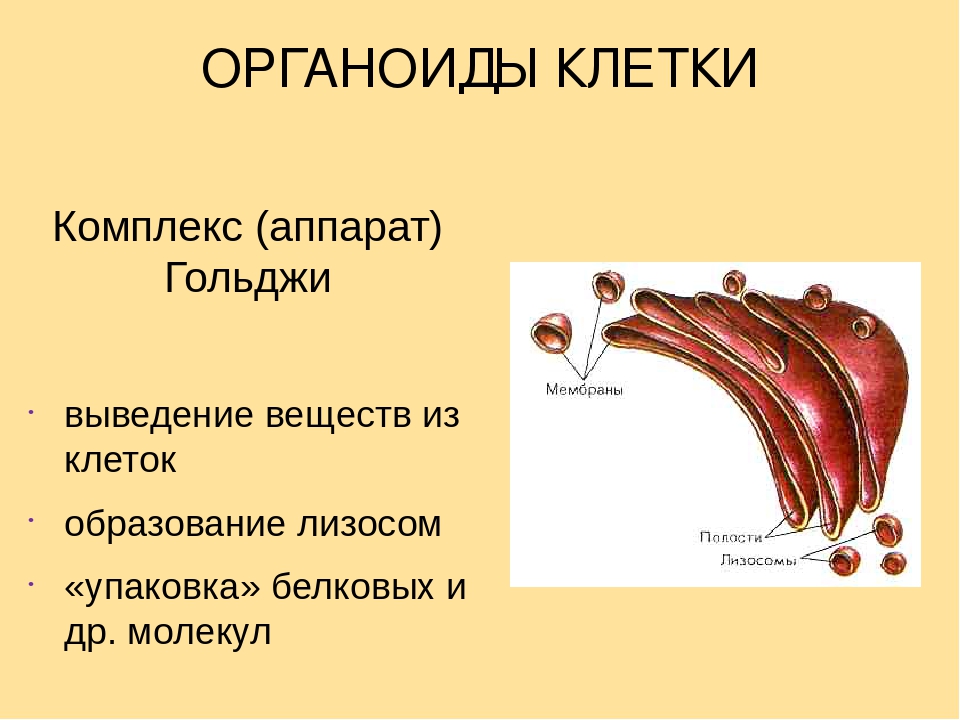 Измерения кинетики живых клеток в клетках млекопитающих показывают, что груз покидает Гольджи в геометрической прогрессии без задержки. Это открытие, вместе с наблюдением, что резидентные ферменты и груз разделяются на отдельные домены в аппарате Гольджи, в дополнение к наличию перекрывающихся распределений, привели к третьей модели трафика Гольджи. В этой модели разделение грузовых белков на липидные домены, лишенные ферментов Гольджи, обеспечивает механизм их экспорта из Гольджи (рис.21.20).
Измерения кинетики живых клеток в клетках млекопитающих показывают, что груз покидает Гольджи в геометрической прогрессии без задержки. Это открытие, вместе с наблюдением, что резидентные ферменты и груз разделяются на отдельные домены в аппарате Гольджи, в дополнение к наличию перекрывающихся распределений, привели к третьей модели трафика Гольджи. В этой модели разделение грузовых белков на липидные домены, лишенные ферментов Гольджи, обеспечивает механизм их экспорта из Гольджи (рис.21.20).
Размер, внешний вид и даже наличие аппарата Гольджи зависят от количества и скорости движения груза по секреторному пути. Дрожжи Saccharomyces cerevisiae, , например, имеют плохо развитый аппарат Гольджи, потому что секреторный транспорт обычно слишком быстр для накопления сложных структур Гольджи. Однако условия, которые замедляют транспорт грузов из аппарата Гольджи в дрожжевых клетках, приводят к увеличению и перегруппировке аппарата Гольджи в компактные стопки, подобные тем, которые наблюдаются в большинстве клеток животных и растений.
Аппарат Гольджи представляет собой скорее динамическую, чем постоянную клеточную структуру, потому что и его белки, и липиды непрерывно перемещаются по различным путям. Никакой класс белка Гольджи не связан стабильно с этой органеллой. Интегральные мембранные белки, включая процессирующие ферменты и SNAREs, постоянно выходят из аппарата Гольджи и повторно входят в него по путям переноса через мембрану, ведущим в и из ER. Белки периферических мембран, связанные с аппаратом Гольджи (включая Arf1, коатомер, Rab белки, матричные белки, факторы привязки и GEF), постоянно обмениваются между мембранами Гольджи и цитоплазматическими пулами.
Временная и динамическая ассоциация молекул с аппаратом Гольджи делает эту органеллу чувствительной к функциям многих клеточных систем. Напр., В отсутствие микротрубочек аппарат Гольджи в клетках млекопитающих перемещается рядом с сайтами экспорта ER (Fig. 21.19). Это происходит из-за того, что ферменты Гольджи, которые непрерывно рециркулируют обратно в ER, не могут вернуться в центросомное место без микротрубочек.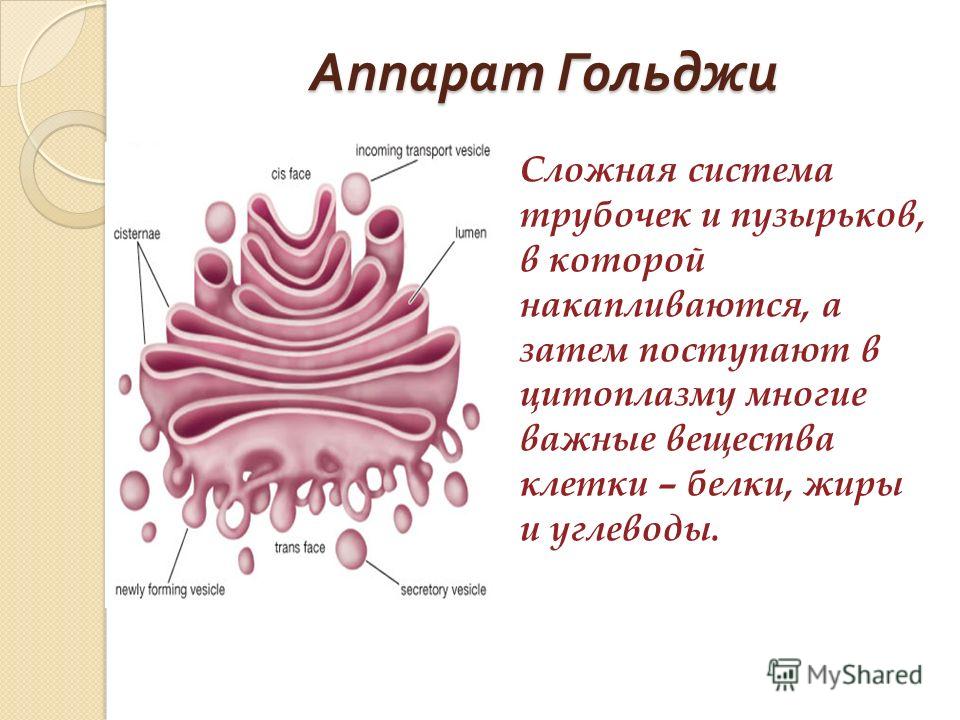 Вместо этого они накапливаются вместе с каркасами Гольджи, связующими и структурными белками оболочки в сайтах выхода ER, распределенных по ER, образуя министаки Гольджи.
Вместо этого они накапливаются вместе с каркасами Гольджи, связующими и структурными белками оболочки в сайтах выхода ER, распределенных по ER, образуя министаки Гольджи.
BFA разгоняет аппарат Гольджи с помощью другого механизма. Препарат предотвращает обмен Arf1 GDP на GTP (рис. 21.5), тем самым предотвращая рекрутирование эффекторов Arf1 из цитоплазмы мембраной. В течение нескольких минут резидентные трансмембранные белки Гольджи возвращаются в ER, где они сохраняются, а аппарат Гольджи исчезает. Если BFA удаляется, аппарат Гольджи восстанавливается за счет разрастания мембраны из ER.
Аппарат Гольджи разбирается во время митоза во многих эукариотических клетках, а затем снова собирается в интерфазе (рис.21.21). Этот процесс внешне напоминает эффекты применения и вымывания BFA, поскольку многие ферменты Гольджи возвращаются в ER или в места выхода ER во время митоза и повторно выходят из ER в конце митоза. Это вызывается как инактивацией Arf1, так и тем, что связывающие факторы / матричные белки аппарата Гольджи фосфорилируются митотическими киназами (см. Главу 40) во время митоза.
Главу 40) во время митоза.
Хотя аппарат Гольджи очень динамичен и постоянно обменивается своими белковыми и липидными компонентами с другими клеточными компартментами, он сохраняет уникальную биохимическую и морфологическую идентичность.Это позволяет аппарату Гольджи участвовать в нескольких основных биосинтетических и процессинговых путях в клетке, как обсуждается далее.
Аппарат Гольджи: определение и функции — видео и стенограмма урока
Структура аппарата Гольджи
Аппарат Гольджи можно найти в цитоплазме как растительных, так и животных клеток. Цитоплазма — это внутриклеточная жидкость, заполняющая клетки. Гольджи состоит из цистерн , которые представляют собой мембраносвязанные структуры, сложенные вместе.Эти стопки могут иметь размер от двух цистерн до 60. В клетках млекопитающих обычно бывает от 40 до 100 таких стопок. Сложение цистерн обеспечивает большую площадь поверхности мембран для протекания реакций и процессов.
Функция аппарата Гольджи
Клетки производят большое количество различных больших молекул, включая белки.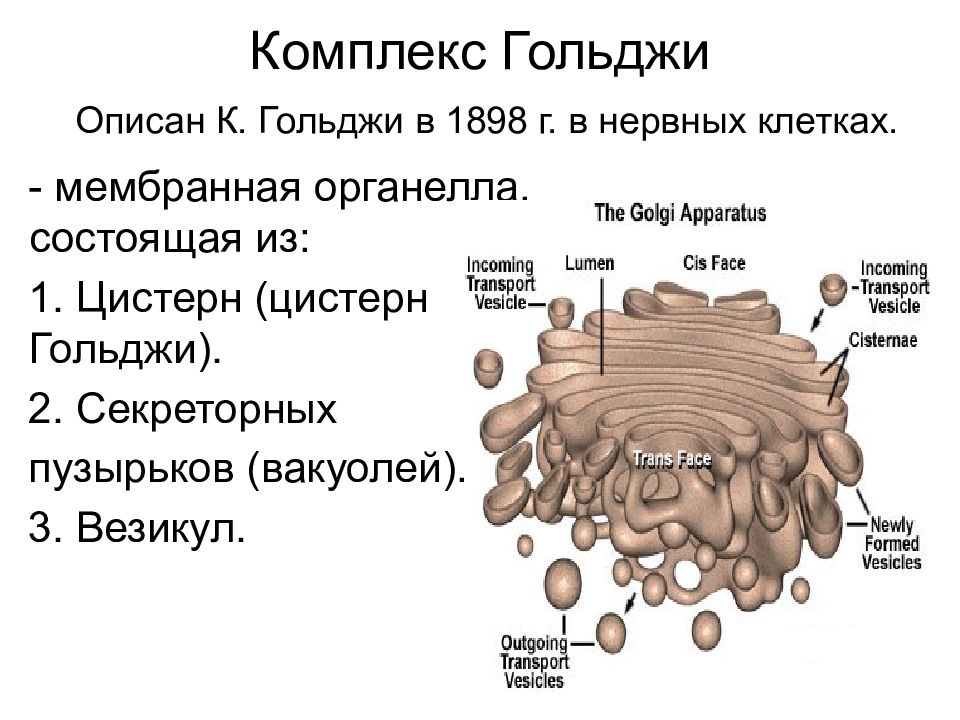 Когда многие из этих молекул построены, они упакованы в пузырьки. Вы можете представить везикулу как транспортный конверт для клетки.После упаковки везикулы перемещаются к аппарату Гольджи. Гольджи открывает эти пакеты и изменяет их содержимое до их окончательной формы.
Когда многие из этих молекул построены, они упакованы в пузырьки. Вы можете представить везикулу как транспортный конверт для клетки.После упаковки везикулы перемещаются к аппарату Гольджи. Гольджи открывает эти пакеты и изменяет их содержимое до их окончательной формы.
Ферменты, обнаруженные в цистернах, завершают процесс модификации. После того, как молекулы обработаны и модифицированы, они переупаковываются в пузырьки и выходят из Гольджи, используя процесс экзоцитоза, и доставляются в соответствующую часть клетки, где они будут функционировать. Как и в случае с оригами, вся функция белка определяется его структурой, поэтому для аппарата Гольджи очень важно правильно складывать их.
Краткое содержание урока
Все живые существа состоят из клеток. Этим клеткам для функционирования необходимы белки и другие молекулы. Аппарат Гольджи — это критическая органелла внутри клетки, которая принимает молекулы, которые были произведены, затем модифицирует их в их правильную форму и отправляет их в нужное место внутри клетки.
| Термины / Функция | Определения / Пояснения |
|---|---|
| Аппарат Гольджи | клеточная органелла, которая упаковывает и сортирует белки и другие молекулы перед их отправкой по назначению |
| Цитоплазма | внутриклеточная жидкость, заполняющая клетки |
| Цистерны | представляют собой мембранные структуры, уложенные вместе |
| Функция аппарата Гольджи | Гольджи открывает эти пакеты с пузырьками и изменяет их содержимое до их окончательной формы. |
Результаты обучения
Убедитесь, что вы способны достичь этих целей по окончании урока по аппарату Гольджи:
- Обсудите функцию аппарата Гольджи
- Запомните определения цитоплазмы и цистерн
- Изобразите структуру аппарата Гольджи в ячейках
- Укажите функцию аппарата Гольджи
Клетка человека в аппарате Гольджи
Аппарат Гольджи назван в честь итальянского врача и ученого Камилло Гольджи, открывшего тонкую мембранную структуру органелл в 1898 году. В клетках млекопитающих аппарат Гольджи имеет морфологически отличную архитектуру. Он состоит из стопок связанных между собой мембранных цистерн и располагается рядом с ядром, вблизи центров организации микротрубочек. Он играет центральную роль во внутриклеточном транспорте белков и мембранных липидов к другим органеллам, а также в транспорте секретируемых веществ во внеклеточное пространство. Белки, присутствующие в аппарате Гольджи, принимают участие в различных этапах этого процесса транспортировки, участвуя в посттрансляционной модификации, упаковке и сортировке белков.
В клетках млекопитающих аппарат Гольджи имеет морфологически отличную архитектуру. Он состоит из стопок связанных между собой мембранных цистерн и располагается рядом с ядром, вблизи центров организации микротрубочек. Он играет центральную роль во внутриклеточном транспорте белков и мембранных липидов к другим органеллам, а также в транспорте секретируемых веществ во внеклеточное пространство. Белки, присутствующие в аппарате Гольджи, принимают участие в различных этапах этого процесса транспортировки, участвуя в посттрансляционной модификации, упаковке и сортировке белков.
Было показано, что в субклеточном отделе 1127 генов (6% всех генов человека, кодирующих белок) кодируют белки, которые локализуются в аппарате Гольджи (рис. 2). Анализ функционального обогащения генов, кодирующих белок, локализованных в аппарате Гольджи, на основе онтологии генов (GO), в основном показывает обогащение терминов, связанных с трансмембранным транспортом и транспортировкой везикул, а также метаболизмом и процессингом белка. Около 76% (n = 853 белка) белков аппарата Гольджи локализуются в одном или нескольких дополнительных клеточных компартментах, наиболее распространенными из которых являются ядро и везикулы.Примеры белков, ассоциированных с Гольджи, можно найти на Рисунке 1.
Около 76% (n = 853 белка) белков аппарата Гольджи локализуются в одном или нескольких дополнительных клеточных компартментах, наиболее распространенными из которых являются ядро и везикулы.Примеры белков, ассоциированных с Гольджи, можно найти на Рисунке 1.
GORASP1 — HeLa
ГОРАСП2 — А-431
SLC30A6 — А-431
Рис. 1. Примеры белков, локализованных в аппарате Гольджи. GORASP1 является ключевым белком для поддержания структуры аппарата Гольджи, особенно для повторной сборки фрагментированного аппарата Гольджи после его разрушения во время митоза (обнаруженного в клетках HeLa).GORASP2 выполняет функцию, аналогичную GORASP1, а также участвует в сборке и укладке цистерн Гольджи (обнаруженных в клетках A-431). SLC30A6 — это мембранный белок Гольджи, который регулирует транспорт ионов цинка между просветом Гольджи и цитозолем (обнаруживается в клетках A-431).
- 6% (1127 белков) всех белков человека были экспериментально обнаружены в аппарате Гольджи с помощью Атласа белков человека.

- 271 белок в аппарате Гольджи подтверждены экспериментальными данными, и из этих 72 белков усилены Атласом белков человека.
- 853 белков в аппарате Гольджи имеют несколько мест.
- 156 белков в аппарате Гольджи демонстрируют межклеточные изменения. Из них 151 демонстрируют изменение интенсивности, а 5 — пространственное изменение.
- Белки, расположенные в аппарате Гольджи, в основном участвуют в транспорте и модификации белков.
Рис. 2. 6% всех генов, кодирующих человеческие белки, кодируют белки, локализованные в аппарате Гольджи. Каждая панель кликабельна и дает результат поиска белков, принадлежащих выбранной категории.
Устройство аппарата Гольджи
В клетках человека аппарат Гольджи состоит из серии уплощенных мембраносвязанных дисков, известных как цистерны, возникающих в результате слияния везикулярных кластеров, отростковывающихся от эндоплазматического ретикулума (ER) (Kulkarni-Gosavi P et al. (2019) ); Шорт Б. и др. (2000)). Мембранные диски расположены в последовательных отсеках, названных в честь направления, в котором белки движутся через них. Белки, поступающие из ER или из промежуточного компартмента ER-Гольджи (ERGIC), входят в цис-сеть Гольджи (CGN), за которой следует медиальный компартмент-Гольджи, и в конечном итоге выходят через прилегающую транс-сеть Гольджи (TGN) по пути к своей конечные пункты назначения.Мембраны Гольджи характеризуются постоянным возникновением и слиянием мелких транспортных пузырьков, перемещающихся между компартментами. В большинстве клеток человека отдельные стеки аппарата Гольджи взаимосвязаны друг с другом и образуют скрученную ленточную сеть (рис. 3). Однако в некоторых клеточных линиях, таких как MCF7, аппарат Гольджи более фрагментирован и разбросан по цитозолю, что облегчает его распределение между дочерними клетками в митозе. Форма ленты Гольджи не обязательна для ее функции в посттрансляционных модификациях или секреции.Однако было высказано предположение, что ленточная структура и ее расположение близко к ядру играют роль в поляризации клеток, включая поляризованную секрецию и миграцию (Wei JH et al.
(2019) ); Шорт Б. и др. (2000)). Мембранные диски расположены в последовательных отсеках, названных в честь направления, в котором белки движутся через них. Белки, поступающие из ER или из промежуточного компартмента ER-Гольджи (ERGIC), входят в цис-сеть Гольджи (CGN), за которой следует медиальный компартмент-Гольджи, и в конечном итоге выходят через прилегающую транс-сеть Гольджи (TGN) по пути к своей конечные пункты назначения.Мембраны Гольджи характеризуются постоянным возникновением и слиянием мелких транспортных пузырьков, перемещающихся между компартментами. В большинстве клеток человека отдельные стеки аппарата Гольджи взаимосвязаны друг с другом и образуют скрученную ленточную сеть (рис. 3). Однако в некоторых клеточных линиях, таких как MCF7, аппарат Гольджи более фрагментирован и разбросан по цитозолю, что облегчает его распределение между дочерними клетками в митозе. Форма ленты Гольджи не обязательна для ее функции в посттрансляционных модификациях или секреции.Однако было высказано предположение, что ленточная структура и ее расположение близко к ядру играют роль в поляризации клеток, включая поляризованную секрецию и миграцию (Wei JH et al. (2010)).
(2010)).
ИИПФ3 — ОС У-2
YIPF3 — SH-SY5Y
YIPF3 — MCF7
Рис. 3. Примеры морфологии аппарата Гольджи в различных клеточных линиях, представленные иммунофлуоресцентным окрашиванием белка, кодируемого YIPF3, в клетках U-2 OS, SH-SY5Y и MCF7.
Рисунок 4. 3D-вид аппарата Гольджи в U-2 OS, визуализированный иммунофлуоресцентным окрашиванием GORASP2. Морфологию аппарата Гольджи в индуцированных человеком стволовых клетках можно увидеть в Allen Cell Explorer.
Функция аппарата Гольджи
Аппарат Гольджи является ключевой органеллой секреторного пути и необходим для внутриклеточного транспорта белков и мембран (Short B et al. (2000); Kulkarni-Gosavi P et al. (2019); Wilson C et al.(2011); Farquhar MG et al. (1998). Большинство вновь синтезированных белков, которые входят в секреторный путь, перемещаются из ER через аппарат Гольджи к своему конечному месту назначения (Brandizzi F et al. (2013)). Во время прохождения через аппарат Гольджи они сильно модифицируются посттрансляционными модификациями, опосредованными резидентными белками Гольджи. Эти модификации включают, но не ограничиваются ими, гликозилирование, сульфатирование, фосфорилирование и протеолитическое расщепление. Такие модификации часто важны для функциональных характеристик модифицированного белка, а также для правильной сортировки и транспортировки белка.Поэтому неудивительно, что сбои в работе белков, ассоциированных с Гольджи, которые влияют на морфологию аппарата Гольджи, или перенос или посттрансляционные модификации (особенно гликозилирование), которые происходят в компартменте, могут приводить к заболеваниям человека, таким как врожденное заболевание Гликозилирование (CDG) (Potelle S et al. (2015)).
Эти модификации включают, но не ограничиваются ими, гликозилирование, сульфатирование, фосфорилирование и протеолитическое расщепление. Такие модификации часто важны для функциональных характеристик модифицированного белка, а также для правильной сортировки и транспортировки белка.Поэтому неудивительно, что сбои в работе белков, ассоциированных с Гольджи, которые влияют на морфологию аппарата Гольджи, или перенос или посттрансляционные модификации (особенно гликозилирование), которые происходят в компартменте, могут приводить к заболеваниям человека, таким как врожденное заболевание Гликозилирование (CDG) (Potelle S et al. (2015)).
Gene Ontology (GO) обогащающий анализ генов, кодирующих белки, которые локализуются в аппарате Гольджи, выявляет несколько функций, связанных с этой органеллой.Наиболее богатые термины для определения биологического процесса в домене GO связаны с локализацией и организацией по Гольджи, везикулярным и трансмембранным транспортом, а также с посттрансляционными модификациями белков (рис.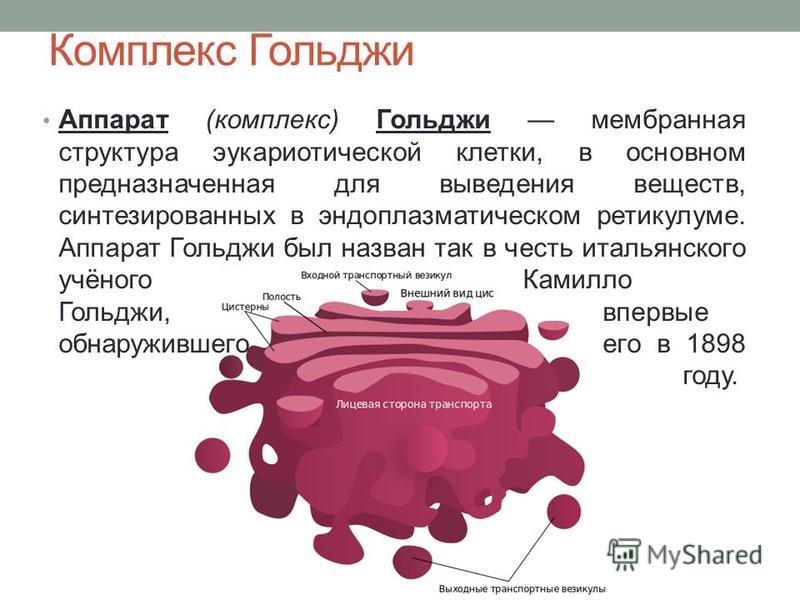 5а). Обогащающий анализ молекулярной функции домена GO указывает на обогащение генов с различной ферментативной активностью и белков, которые образуются или связываются с рецепторами SNAP (SNARES) (рис. 5b). Последние играют важную роль в слиянии пузырьков (Yoon TY et al. (2018)).
5а). Обогащающий анализ молекулярной функции домена GO указывает на обогащение генов с различной ферментативной активностью и белков, которые образуются или связываются с рецепторами SNAP (SNARES) (рис. 5b). Последние играют важную роль в слиянии пузырьков (Yoon TY et al. (2018)).
Рисунок 5а.Обогащенный анализ на основе онтологии генов для протеома аппарата Гольджи, показывающий значительно расширенные термины для биологического процесса домена GO. Каждая панель кликабельна и дает результат поиска белков, принадлежащих выбранной категории.
Рисунок 5б. Обогащенный анализ на основе онтологии генов для протеома аппарата Гольджи, показывающий значительно расширенные термины для молекулярной функции домена GO. Каждая панель кликабельна и дает результат поиска белков, принадлежащих выбранной категории.
Белки, которые участвуют в поддержании аппарата Гольджи, являются подходящими маркерами аппарата Гольджи, например члены семейства белков Golgin (таблица 1). Однако они не принадлежат к группе белков с наивысшей экспрессией, которая содержит несколько белков, связанных с транспортом везикул, таких как CAV1 и COPE (Таблица 2).
Однако они не принадлежат к группе белков с наивысшей экспрессией, которая содержит несколько белков, связанных с транспортом везикул, таких как CAV1 и COPE (Таблица 2).
Таблица 1. Выбор белков, подходящих в качестве маркеров для аппарата Гольджи.
| Ген | Описание | Каркас |
|---|---|---|
| GOLGB1 | Голгин Б1 | Аппарат Гольджи |
| ГОЛГА5 | Голгин А5 | Аппарат Гольджи |
| ГАЛНТ2 | Полипептид N-ацетилгалактозаминилтрансфераза 2 | Аппарат Гольджи |
| ZFPL1 | Белок цинковых пальцев типа 1 | Аппарат Гольджи |
| GORASP2 | Повторная сборка стекирующего белка Гольджи 2 | Аппарат Гольджи |
| ГОЛМ1 | Мембранный белок Гольджи 1 | Аппарат Гольджи |
| ГОЛИМ4 | Интегральный мембранный белок Гольджи 4 | Аппарат Гольджи |
Таблица 2. Высоко экспрессируемые единственные локализующиеся белки, связанные с аппаратом Гольджи, в разных клеточных линиях.
Высоко экспрессируемые единственные локализующиеся белки, связанные с аппаратом Гольджи, в разных клеточных линиях.
| Ген | Описание | Среднее значение nTPM |
|---|---|---|
| CAV1 | Кавеолин 1 | 447 |
| SRGN | Серглицин | 419 |
| CD74 | Молекула CD74 | 346 |
| SPP1 | Фосфопротеин секретированный 1 | 313 |
| RER1 | Удержание в рецепторе сортировки эндоплазматического ретикулума 1 | 201 |
| NUCB2 | Нуклеобиндин 2 | 188 |
| СПРАВЛЯТЬСЯ | Субъединица эпсилон покрытия комплекса COPI | 187 |
| SDF4 | Фактор 4, полученный из стромальных клеток | 152 |
| TMED10 | Трансмембранный транспортный белок p24 10 | 108 |
| TMED3 | Трансмембранный транспортный белок p24 3 | 107 |
Белки, связанные с аппаратом Гольджи, с множеством местоположений
Примерно 76% (n = 853) белков, связанных с аппаратом Гольджи, обнаруженных в субклеточном отделе, также локализуются в других компартментах клетки. Сетевой график (рис. 5) показывает, что двойные местоположения между аппаратом Гольджи и пузырьками, а также ER представлены чрезмерно. Это согласуется с взаимодействием между ER, Golgi и пузырьками в секреторном пути. Однако также наблюдается чрезмерное представительство генов, которые локализуются в аппарате Гольджи и ядре. На рисунке 6 показаны примеры наиболее распространенных и / или чрезмерно представленных комбинаций мультилокализованных белков в протеоме аппарата Гольджи.
Сетевой график (рис. 5) показывает, что двойные местоположения между аппаратом Гольджи и пузырьками, а также ER представлены чрезмерно. Это согласуется с взаимодействием между ER, Golgi и пузырьками в секреторном пути. Однако также наблюдается чрезмерное представительство генов, которые локализуются в аппарате Гольджи и ядре. На рисунке 6 показаны примеры наиболее распространенных и / или чрезмерно представленных комбинаций мультилокализованных белков в протеоме аппарата Гольджи.
Рисунок 5.Интерактивный сетевой график белков, связанных с Гольджи, с множеством локализаций. Цифры в соединительных узлах показывают белки, которые локализованы в аппарате Гольджи и в одном или нескольких дополнительных местах. Показаны только соединительные узлы, содержащие более одного белка и не менее 0,5% белков в протеоме аппарата Гольджи. Размеры кружков связаны с количеством белков. Узлы голубого цвета показывают комбинации, которые значительно перепредставлены, в то время как узлы пурпурного цвета показывают комбинации, которые значительно недопредставлены по сравнению с вероятностью наблюдения этой комбинации на основе частоты каждой аннотации и гипергеометрического теста (p≤0.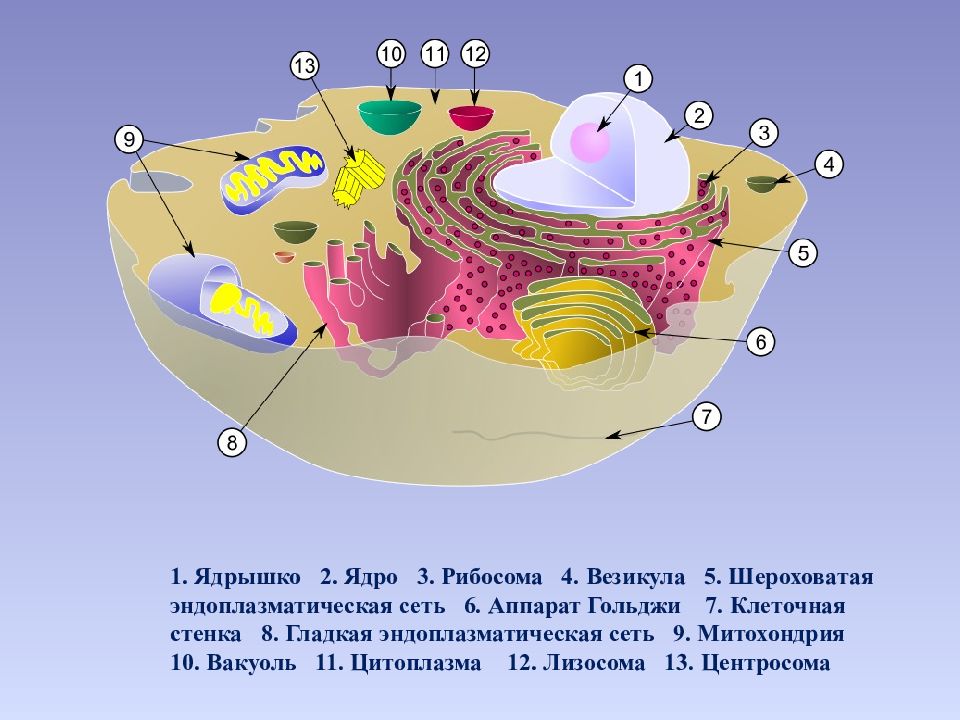 05). Обратите внимание, что этот расчет выполняется только для белков с двойной локализацией. Каждый узел доступен для нажатия и приводит к списку всех белков, обнаруженных в связанных органеллах.
05). Обратите внимание, что этот расчет выполняется только для белков с двойной локализацией. Каждый узел доступен для нажатия и приводит к списку всех белков, обнаруженных в связанных органеллах.
SLC39A14 — А-431
РАБ20 — ОС У-2
TMEM87A — А-431
Рис. 6. Примеры мультилокализующих белков в протеоме аппарата Гольджи. SLC39A14 представляет собой переносчик цинка, который был идентифицирован в аппарате Гольджи, ER и плазматической мембране.Он может участвовать в регуляции гомеостаза ионов цинка (обнаружен в клетках A-431). RAB20 — это белок, который был идентифицирован в аппарате Гольджи, а также в цитоплазматических везикулах и участвует в эндоцитозе (обнаруживается в клетках U-2 OS). TMEM87A представляет собой трансмембранный белок, субклеточное расположение и функция которого не были описаны ранее, но были обнаружены в аппарате Гольджи и нуклеоплазме (обнаружены в клетках A-431).
Уровни экспрессии белков, связанных с аппаратом Гольджи, в тканях
Анализ транскриптома и классификация генов по категориям распределения в тканях (рисунок 7) показывает, что гены, кодирующие белки, связанные с аппаратом Гольджи, имеют такое же распределение по этим категориям, как и все гены, представленные в субклеточной секции, за исключением того, что немного меньшая доля эти гены принадлежат к генам, не обнаруженным ни в одной из проанализированных тканей.
Рис. 8. Столбчатая диаграмма, показывающая процентное соотношение генов в различных категориях тканевого распределения для генов, кодирующих белок, связанных с аппаратом Гольджи, по сравнению со всеми генами в субклеточной секции. Звездочкой отмечено статистически значимое отклонение (p≤0,05) количества генов в категории на основе биномиального статистического теста. Каждая панель кликабельна и дает результат поиска белков, принадлежащих выбранной категории.
Соответствующие ссылки и публикации
Uhlen M et al., Предложение по валидации антител. Нат. Методы. (2016)
PubMed: 27595404 DOI: 10.1038 / nmeth.3995
Stadler C et al., Систематическая проверка связывания антител и субклеточной локализации белков с использованием миРНК и конфокальной микроскопии. J Протеомика. (2012)
PubMed: 22361696 DOI: 10.1016 / j.jprot.2012.01.030
Poser I et al., BAC TransgeneOmics & Colon; высокопроизводительный метод исследования функции белков у млекопитающих и периода; Nat Методы и период; (2008)
PubMed: 183
 1038 / nmeth.1199
1038 / nmeth.1199 Skogs M et al., Валидация антител в приложениях биоимиджинга на основе эндогенной экспрессии меченых белков. J Proteome Res. (2017)
PubMed: 27723985 DOI: 10.1021 / acs.jproteome.6b00821
Parikh K et al., Разнообразие эпителиальных клеток толстой кишки в состоянии здоровья и воспалительных заболеваниях кишечника и периоде; Природа и период; (2019)
PubMed: 30814735 DOI: 10.1038 / s41586-019-0992-y
Menon M et al., Одноклеточный транскриптомный атлас сетчатки глаза человека идентифицирует типы клеток, связанные с возрастной дегенерацией желтого пятна и периодом; Нац Коммуна & период; (2019)
PubMed: 31653841 DOI: 10.1038 / s41467-019-12780-8
Wang L et al., Одноклеточная реконструкция сердца взрослого человека во время сердечной недостаточности и восстановления показывает клеточный ландшафт, лежащий в основе сердечной функции и периода; Nat Cell Biol & period; (2020)
PubMed: 31
 1038 / s41556-019-0446-7
1038 / s41556-019-0446-7 Wang Y et al., Анализ одноклеточного транскриптома выявляет дифференциальные функции всасывания питательных веществ в кишечнике человека и периоде; J Exp Med & period; (2020)
PubMed: 31753849 DOI: 10.1084 / jem.201
Liao J et al., Секвенирование одноклеточной РНК почки человека & период; Научные данные и период; (2020)
PubMed: 31896769 DOI: 10.1038 / s41597-019-0351-8
MacParland SA et al., Секвенирование одноклеточной РНК печени человека выявляет различные популяции внутрипеченочных макрофагов & период; Нац Коммуна & период; (2018)
PubMed: 30348985 DOI: 10.1038 / s41467-018-06318-7
Vieira Braga FA et al., Перепись клеток легких человека выявляет новые состояния клеток при здоровье и астме и периоде; Nat Med & period; (2019)
PubMed: 31209336 DOI: 10.1038 / s41591-019-0468-5
Vento-Tormo R et al., Одноклеточная реконструкция ранней границы раздела матери и плода у людей & период; Природа и период; (2018)
PubMed: 30429548 DOI: 10. 1038 / s41586-018-0698-6
1038 / s41586-018-0698-6
Henry GH et al., Клеточная анатомия простаты и уретры простаты взрослого человека & period; Cell Rep & period; (2018)
PubMed: 30566875 DOI: 10.1016 / j.celrep.2018.11.086
Chen J et al., Фиксация и обработка PBMC для секвенирования одноклеточной РНК хрома & период; J Transl Med & period; (2018)
PubMed: 30016977 DOI: 10.1186 / s12967-018-1578-4
Guo J et al., Атлас транскрипционных клеток семенников взрослого человека. Cell Res. (2018)
PubMed: 30315278 DOI: 10.1038 / s41422-018-0099-2
Qadir MMF et al., Анализ одноклеточного разрешения ниши клеток-предшественников протоков поджелудочной железы человека & период; Proc Natl Acad Sci U S A & period; (2020)
PubMed: 32354994 DOI: 10.1073 / pnas.1
Solé-Boldo L et al., Одноклеточные транскриптомы кожи человека показывают возрастную потерю прайминга фибробластов & period; Commun Biol & period; (2020)
PubMed: 32327715 DOI: 10. 1038 / s42003-020-0922-4
1038 / s42003-020-0922-4
Lukassen S et al., Рецептор SARS-CoV-2 ACE2 и TMPRSS2 в основном экспрессируются в транзиторных секреторных клетках бронхов & period; EMBO J & период; (2020)
PubMed: 32246845 DOI: 10.15252 / embj.20105114
Wang W et al., Транскриптомный атлас одноклеточного эндометрия человека во время менструального цикла и периода; Nat Med & period; (2020)
PubMed: 32929266 DOI: 10.1038 / s41591-020-1040-z
De Micheli AJ et al., Эталонный одноклеточный транскриптомный атлас ткани скелетных мышц человека выявляет популяции раздвоенных мышечных стволовых клеток & period; Скелетная мышца и точка; (2020)
PubMed: 32624006 DOI: 10.1186 / s13395-020-00236-3
Man L et al., Сравнение антральных фолликулов ксенотрансплантата человека и яичникового происхождения выявляет разные молекулярные сигнатуры и период; Cell Rep & period; (2020)
PubMed: 32783948 DOI: 10.1016 / j. celrep.2020.108027
celrep.2020.108027
Hildreth AD et al., Одноклеточное секвенирование белой жировой ткани человека позволяет идентифицировать новые состояния клеток при здоровье и ожирении & период; Nat Immunol & period; (2021)
PubMed: 330 DOI: 10.1038 / s41590-021-00922-4
He S et al., Профилирование одноклеточного транскриптома атласа клеток взрослого человека из 15 основных органов и периода; Биология генома & период; (2020)
PubMed: 33287869 DOI: 10.1186 / s13059-020-02210-0
Bhat-Nakshatri P et al., Одноклеточный атлас здоровых тканей груди выявляет клинически значимые кластеры эпителиальных клеток груди & period; Cell Rep Med & period; (2021)
PubMed: 33763657 DOI: 10.1016 / j.xcrm.2021.100219
Takahashi H et al., Профилирование 5′-концевой экспрессии с использованием кэп-анализа экспрессии генов и секвенирования следующего поколения & period; Nat Protoc & period; (2012)
PubMed: 22362160 DOI: 10. 1038 / nprot.2012.005
1038 / nprot.2012.005
Lein ES et al., Полногеномный атлас экспрессии генов в мозге взрослой мыши & period; Природа и период; (2007)
PubMed: 17151600 DOI: 10.1038 / nature05453
Kircher M et al., Двойное индексирование устраняет неточности в мультиплексном секвенировании на платформе Illumina и период; Nucleic Acids Res & period; (2012)
PubMed: 22021376 DOI: 10.1093 / nar / gkr771
Uhlén M. et al., Секретом человека. Sci Signal. (2019)
PubMed: 31772123 DOI: 10.1126 / scisignal.aaz0274
Uhlen M et al., Полногеномный транскриптомный анализ генов, кодирующих белок в клетках крови человека. Наука. (2019)
PubMed: 31857451 DOI: 10.1126 / science.aax9198
Sjöstedt E et al., Атлас генов, кодирующих белок, в мозге человека, свиньи и мыши. Наука. (2020)
PubMed: 32139519 DOI: 10.1126 / science.aay5947
Robinson JL et al., Атлас обмена веществ человека. Sci Signal. (2020)
Sci Signal. (2020)
PubMed: 32209698 DOI: 10.1126 / scisignal.aaz1482
Uhlen M. et al., Атлас патологии транскриптома рака человека. Наука. (2017)
PubMed: 28818916 DOI: 10.1126 / science.aan2507
Hikmet F et al., Профиль экспрессии белка ACE2 в тканях человека. Mol Syst Biol. (2020)
PubMed: 32715618 DOI: 10.15252 / msb.20209610
Gordon DE et al., Карта взаимодействия белков SARS-CoV-2 выявляет цели для перепрофилирования лекарств & period; Природа и период; (2020)
PubMed: 32353859 DOI: 10.1038 / s41586-020-2286-9
Karlsson M. et al., Карта транскриптомики одноклеточного типа тканей человека. Sci Adv. (2021)
PubMed: 34321199 DOI: 10.1126 / sciadv.abh3169
Pollard TD et al., Actin & comma; центральный игрок в форме клетки, движении и периоде; Наука и период; (2009)
PubMed: 19965462 DOI: 10.1126 / science.1175862
Mitchison TJ et al. , Подвижность клеток на основе актина и перемещение клеток и период; Ячейка и период; (1996)
, Подвижность клеток на основе актина и перемещение клеток и период; Ячейка и период; (1996)
PubMed: 8608590
Pollard TD et al., Molecular Mechanism of Cytokinesis & period; Annu Rev Biochem & period; (2019)
PubMed: 30649923 DOI: 10.1146 / annurev-biochem-062917-012530
dos Remedios CG et al., Актин-связывающие белки и толстая кишка; регуляция микрофиламентов цитоскелета и периода; Physiol Rev & period; (2003)
PubMed: 12663865 DOI: 10.1152 / Physrev.00026.2002
Campellone KG et al., Гонка вооружений нуклеаторов и двоеточие; клеточный контроль сборки актина и период; Nat Rev Mol Cell Biol & period; (2010)
PubMed: 20237478 DOI: 10.1038 / nrm2867
Rottner K et al., Краткий обзор механизмов сборки актина и период; J Cell Sci & period; (2017)
PubMed: 257 DOI: 10.1242 / jcs.206433
Bird RP & period ;, Наблюдение и количественная оценка аберрантных крипт в толстой кишке мыши, обработанной канцерогеном толстой кишки & col; предварительные выводы и период; Рак Lett & period; (1987)
PubMed: 3677050 DOI: 10.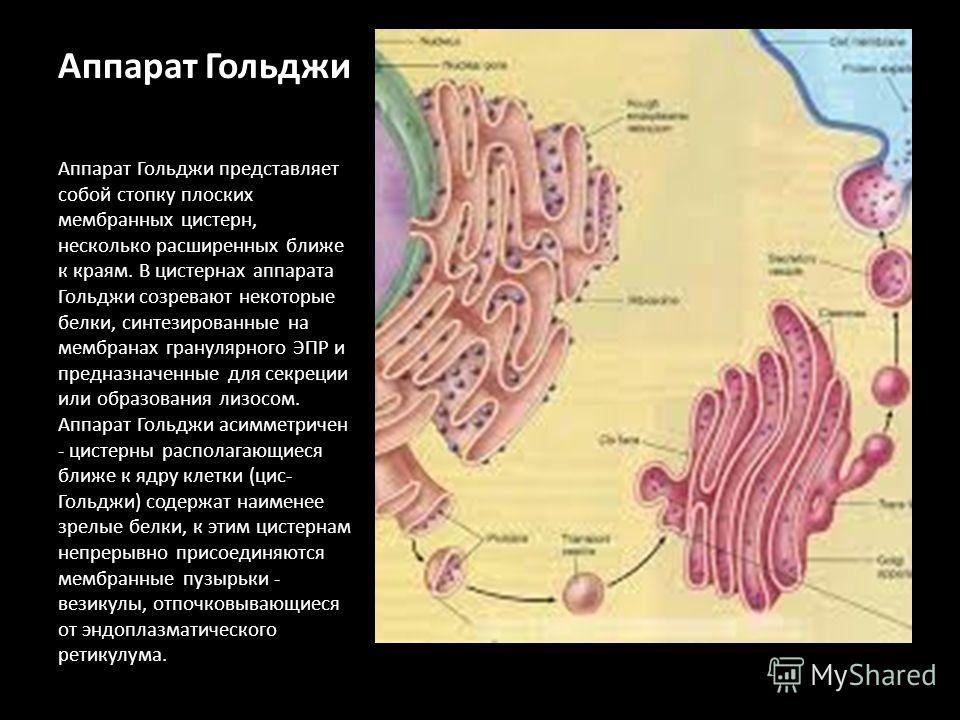 1016 / 0304-3835 (87) -1
1016 / 0304-3835 (87) -1
HUXLEY AF et al., Структурные изменения в мышцах во время сокращения & semi; интерференционная микроскопия живых мышечных волокон и периода; Природа и период; (1954)
PubMed: 13165697
HUXLEY H et al., Изменения поперечных полос в мышцах во время сокращения и растяжения и их структурная интерпретация и период; Природа и период; (1954)
PubMed: 13165698
Svitkina T & period ;, Актиновый цитоскелет и подвижность на основе актина & период; Cold Spring Harb Perspect Biol & period; (2018)
PubMed: 29295889 DOI: 10.1101 / cshperspect.a018267
Kelpsch DJ et al., Nuclear Actin & Colon; От открытия до функции и периода; Анат Рек & lpar; Хобокен & rpar; & period; (2018)
PubMed: 30312531 DOI: 10.1002 / ar.23959
Malumbres M et al., Клеточный цикл и запятая; CDK и рак и толстая кишка; меняющаяся парадигма и период; Nat Rev Рак и период; (2009)
PubMed: 148 DOI: 10.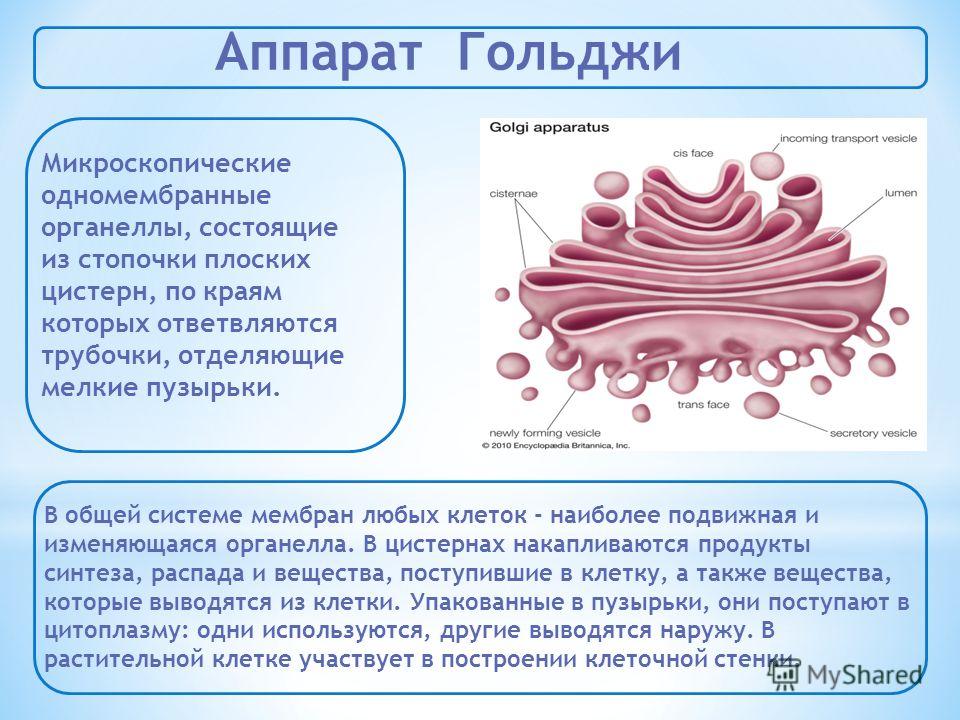 1038 / nrc2602
1038 / nrc2602
Massagué J & period ;, G1 контроль клеточного цикла и рак & период; Природа и период; (2004)
PubMed: 15549091 DOI: 10.1038 / nature03094
Hartwell LH et al., Контроль клеточного цикла и рак & период; Наука и период; (1994)
PubMed: 7997877 DOI: 10.1126 / science.7997877
Barnum KJ et al., Регулирование клеточного цикла с помощью контрольных точек и периода; Методы Mol Biol & period; (2014)
PubMed: 24
Weinberg RA & period ;, Белок ретинобластомы и контроль клеточного цикла & период; Ячейка и период; (1995)
PubMed: 7736585 DOI: 10.1016 / 0092-8674 (95) -2
Morgan DO & period ;, Принципы регулирования CDK и период; Природа и период; (1995)
PubMed: 7877684 DOI: 10.1038 / 374131a0
Teixeira LK et al., Убиквитин-лигазы и контроль клеточного цикла & период; Annu Rev Biochem & period; (2013)
PubMed: 23495935 DOI: 10. 1146 / annurev-biochem-060410-105307
1146 / annurev-biochem-060410-105307
King RW et al., Как протеолиз управляет клеточным циклом и периодом; Наука и период; (1996)
PubMed: 8939846 DOI: 10.1126 / science.274.5293.1652
Cho RJ et al., Регуляция транскрипции и функция во время клеточного цикла человека & период; Nat Genet & period; (2001)
PubMed: 11137997 DOI: 10.1038 / 83751
Whitfield ML et al., Идентификация генов, периодически экспрессируемых в клеточном цикле человека, и их экспрессия в опухолях & период; Клетка Mol Biol & период; (2002)
PubMed: 12058064 DOI: 10.1091 / mbc.02-02-0030.
Boström J et al., Сравнительная транскриптомика клеточного цикла показывает синхронизацию сетей онтогенетических факторов транскрипции в раковых клетках. PLoS One. (2017)
PubMed: 202 DOI: 10.1371 / journal.pone.0188772
Lane KR et al., Изменения содержания белка, регулируемого клеточным циклом, в синхронно пролиферирующих клетках HeLa включают регуляцию белков сплайсинга пре-мРНК & period; PLoS One & period; (2013)
PubMed: 23520512 DOI: 10. 1371 / journal.pone.0058456
1371 / journal.pone.0058456
Ohta S et al., Белковый состав митотических хромосом, определенный с использованием мультиклассификатора комбинаторной протеомики и периода; Ячейка и период; (2010)
PubMed: 20813266 DOI: 10.1016 / j.cell.2010.07.047
Ly T et al., Протеомная хронология экспрессии генов через клеточный цикл в клетках миелоидного лейкоза человека & период; Элиф и период; (2014)
PubMed: 24596151 DOI: 10.7554 / eLife.01630
Pagliuca FW et al., Количественная протеомика раскрывает основу биохимической специфичности механизма клеточного цикла & период; Mol Cell & period; (2011)
PubMed: 21816347 DOI: 10.1016 / j.molcel.2011.05.031
Ly T et al., Протеомный анализ ответа на остановку клеточного цикла в клетках миелоидного лейкоза человека & период; Элиф и период; (2015)
PubMed: 25555159 DOI: 10.7554 / eLife.04534
Mahdessian D et al., Пространственно-временное рассечение клеточного цикла с одноклеточной протеогеномикой. Природа. (2021)
Природа. (2021)
PubMed: 33627808 DOI: 10.1038 / s41586-021-03232-9
Dueck H et al., Вариация — функция & двоеточие; Функционально ли важны различия отдельных клеток & quest; & col; Проверка гипотезы о том, что для агрегированной функции & period; Биологические исследования и период; (2016)
PubMed: 26625861 DOI: 10.1002 / bies.201500124
Snijder B et al., Происхождение регулируемой межклеточной изменчивости и период; Nat Rev Mol Cell Biol & period; (2011)
PubMed: 21224886 DOI: 10.1038 / nrm3044
Thul PJ et al., Субклеточная карта протеома человека. Наука. (2017)
PubMed: 28495876 DOI: 10.1126 / science.aal3321
Cooper S et al., Анализ содержания циклинов A & comma с мембранной элюцией; B1 & запятая; и E во время невозмущенного клеточного цикла & period; Ячейка Div & период; (2007)
PubMed: 17892542 DOI: 10.1186 / 1747-1028-2-28
Davis PK et al. , Биологические методы синхронизации клеточного цикла клеток млекопитающих & период; Биотехнологии и период; (2001)
, Биологические методы синхронизации клеточного цикла клеток млекопитающих & период; Биотехнологии и период; (2001)
PubMed: 11414226 DOI: 10.2144 / 01306rv01
Domenighetti G et al., Влияние информационной кампании в СМИ на частоту и период гистерэктомии; Ланцет и точка; (1988)
PubMed: 21 DOI: 10.1016 / s0140-6736 (88) -9
Scialdone A et al., Вычислительное назначение стадии клеточного цикла на основе данных транскриптома одной клетки и периода; Методы и период; (2015)
PubMed: 26142758 DOI: 10.1016 / j.ymeth.2015.06.021
Sakaue-Sawano A et al., Визуализация пространственно-временной динамики развития многоклеточного клеточного цикла и периода; Ячейка и период; (2008)
PubMed: 18267078 DOI: 10.1016 / j.cell.2007.12.033
Grant GD et al., Идентификация генов, регулируемых клеточным циклом, периодически экспрессируемых в клетках U2OS, и их регуляция факторами транскрипции FOXM1 и E2F & period; Клетка Mol Biol & период; (2013)
PubMed: 24109597 DOI: 10. 1091 / mbc.E13-05-0264
1091 / mbc.E13-05-0264
Semple JW et al., Существенная роль Orc6 в репликации ДНК через поддержание пререпликативных комплексов & период; EMBO J & период; (2006)
PubMed: 17053779 DOI: 10.1038 / sj.emboj.7601391
Kilfoil ML et al., Стохастическая вариация и двоеточие; от одиночных клеток до суперорганизмов & период; HFSP J & период; (2009)
PubMed: 20514130 DOI: 10.2976 / 1.3223356
Ansel J et al., Стохастическая изменчивость экспрессии генов от клетки к клетке является сложным генетическим признаком & период; PLoS Genet & период; (2008)
PubMed: 18404214 DOI: 10.1371 / journal.pgen.1000049
Colman-Lerner A et al., Регулируемая межклеточная изменчивость в системе принятия решений о клеточной судьбе & период; Природа и период; (2005)
PubMed: 16170311 DOI: 10.1038 / nature03998
Liberali P et al., Одноклеточные и многомерные подходы к скринингу генетических возмущений & период; Nat Rev Genet & period; (2015)
PubMed: 25446316 DOI: 10. 1038 / nrg3768
1038 / nrg3768
Elowitz MB et al., Стохастическая экспрессия гена в одной клетке & период; Наука и период; (2002)
PubMed: 12183631 DOI: 10.1126 / science.1070919
Kaern M et al., Стохастичность экспрессии генов & двоеточие; от теорий к фенотипам и периоду; Nat Rev Genet & period; (2005)
PubMed: 15883588 DOI: 10.1038 / nrg1615
Bianconi E et al., Оценка количества клеток в организме человека & период; Ann Hum Biol & period; (2013)
PubMed: 23829164 DOI: 10.3109 / 03014460.2013.807878
Malumbres M & period ;, Cyclin-зависимые киназы & период; Биология генома & период; (2014)
PubMed: 25180339
Collins K et al., Клеточный цикл и рак & период; Proc Natl Acad Sci U S A & period; (1997)
PubMed: 91
Животовский Б. и др., Клеточный цикл и гибель клеток при заболевании и толстой кишке; прошедшее & запятая; настоящее и будущее и период; J Intern Med & period; (2010)
PubMed: 20964732 DOI: 10. 1111 / j.1365-2796.2010.02282.x
1111 / j.1365-2796.2010.02282.x
Cho RJ et al., Полногеномный транскрипционный анализ митотического клеточного цикла и периода; Mol Cell & period; (1998)
PubMed: 9702192
Spellman PT et al., Комплексная идентификация регулируемых клеточным циклом генов дрожжей Saccharomyces cerevisiae с помощью гибридизации на микроматрицах и период; Клетка Mol Biol & период; (1998)
PubMed: 9843569
Orlando DA et al., Глобальный контроль транскрипции клеточного цикла с помощью связанных CDK и сетевых осцилляторов & period; Природа и период; (2008)
PubMed: 18463633 DOI: 10.1038 / nature06955
Rustici G et al., Программа периодической экспрессии генов клеточного цикла делящихся дрожжей & период; Nat Genet & period; (2004)
PubMed: 15195092 DOI: 10.1038 / ng1377
Uhlén M et al., Тканевая карта протеома человека. Science (2015)
PubMed: 25613900 DOI: 10. 1126 / science.1260419
1126 / science.1260419
Nigg EA et al., Цикл центросомы и толстая кишка; Биогенез центриолей & запятая; дублирование и врожденная асимметрия и период; Nat Cell Biol & period; (2011)
PubMed: 21968988 DOI: 10.1038 / ncb2345
Doxsey S & period ;, Повторная оценка функции и периода центросомы; Nat Rev Mol Cell Biol & period; (2001)
PubMed: 11533726 DOI: 10.1038/35089575
Bornens M & period;, Состав центросом и механизмы закрепления микротрубочек и период; Curr Opin Cell Biol & period; (2002)
PubMed: 11792541
Conduit PT et al., Функция и сборка центросом в клетках животных & период; Nat Rev Mol Cell Biol & period; (2015)
PubMed: 26373263 DOI: 10.1038 / nrm4062
Tollenaere MA et al., Центриолярные спутники и толстая кишка; ключевые медиаторы функций и периода центросомы; Cell Mol Life Sci & period; (2015)
PubMed: 25173771 DOI: 10.1007 / s00018-014-1711-3
Prosser SL et al.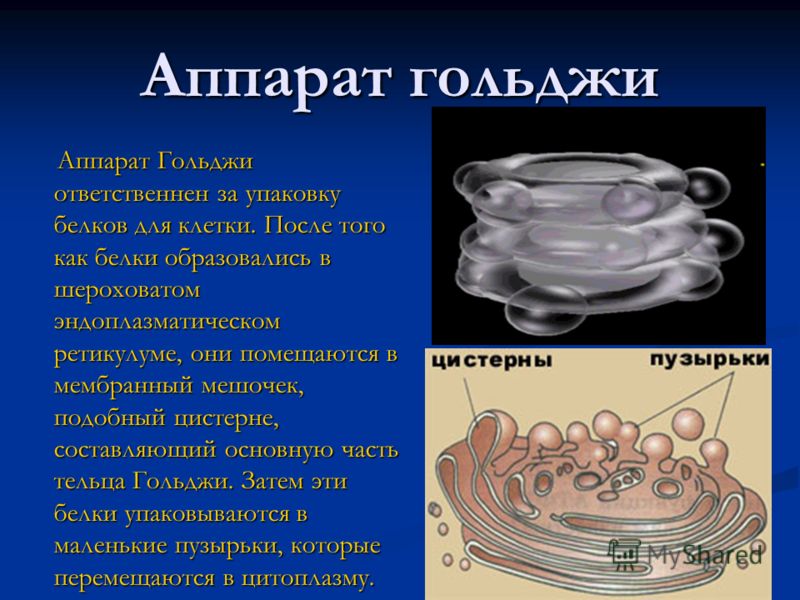 , Центриолярный сателлитный биогенез и функция в клетках позвоночных и период; J Cell Sci & period; (2020)
, Центриолярный сателлитный биогенез и функция в клетках позвоночных и период; J Cell Sci & period; (2020)
PubMed: 31896603 DOI: 10.1242 / jcs.239566
Rieder CL et al., Центросома позвоночных и толстой кишки; больше, чем центр организации микротрубочек & период; Trends Cell Biol & period; (2001)
PubMed: 11567874
Badano JL et al., Центросома в генетических заболеваниях человека & период; Nat Rev Genet & period; (2005)
PubMed: 15738963 DOI: 10.1038 / nrg1557
Clegg JS & period ;, Свойства и метаболизм водной цитоплазмы и ее границ & period; Am J Physiol & period; (1984)
PubMed: 6364846
Luby-Phelps K & period ;, Физическая химия цитоплазмы и ее влияние на функцию клеток & толстой кишки; обновление & период; Клетка Mol Biol & период; (2013)
PubMed: 23989722 DOI: 10.1091 / mbc.E12-08-0617
Luby-Phelps K & period ;, Цитоархитектура и физические свойства цитоплазмы и толстой кишки; объем и запятая; вязкость и запятая; диффузия и запятая; площадь и период внутриклеточной поверхности; Int Rev Cytol & period; (2000)
PubMed: 10553280
Ellis RJ & period;, Макромолекулярная скученность и толстая кишка; очевидный, но недооцененный & период; Trends Biochem Sci & period; (2001)
PubMed: 115
Bright GR et al. , Визуализирующая микроскопия с соотношением флуоресценции и толстой кишки; временные и пространственные измерения цитоплазматического pH и периода; J Cell Biol & period; (1987)
, Визуализирующая микроскопия с соотношением флуоресценции и толстой кишки; временные и пространственные измерения цитоплазматического pH и периода; J Cell Biol & period; (1987)
PubMed: 3558476
Kopito RR & period;, Aggresomes & comma; тельца включения и агрегация белков и период; Trends Cell Biol & period; (2000)
PubMed: 11121744
Aizer A et al., Внутриклеточное перемещение и динамика P-тел и период; Прион и период; (2008)
PubMed: 19242093
Carcamo WC et al., Молекулярная клеточная биология и иммунобиология стержневых и кольцевых структур и периода млекопитающих; Int Rev Cell Mol Biol & period; (2014)
PubMed: 24411169 DOI: 10.1016 / B978-0-12-800097-7.00002-6
Lang F & period ;, Механизмы и значение регулирования объема клеток & период; J Am Coll Nutr & period; (2007)
PubMed: 174
Becht E et al., Снижение размерности для визуализации данных отдельных ячеек с использованием UMAP & period; Nat Biotechnol & period; (2018)
PubMed: 30531897 DOI: 10. 1038 / nbt.4314
1038 / nbt.4314
Schwarz DS et al., Эндоплазматический ретикулум и толстая кишка; структура и запятая; функция и ответ на сотовую сигнализацию & период; Cell Mol Life Sci & period; (2016)
PubMed: 26433683 DOI: 10.1007 / s00018-015-2052-6
Friedman JR et al., ER в 3D и двоеточии; многофункциональная динамическая мембранная сеть & период; Trends Cell Biol & period; (2011)
PubMed: 21
9 DOI: 10.1016 / j.tcb.2011.07.004
Travers KJ et al., Функциональный и геномный анализ выявляет существенную координацию между развернутым белковым ответом и ER-ассоциированной деградацией & период; Ячейка и период; (2000)
PubMed: 10847680
Roussel BD et al., Дисфункция эндоплазматического ретикулума при неврологических заболеваниях и периоде; Ланцет Neurol & период; (2013)
PubMed: 23237905 DOI: 10.1016 / S1474-4422 (12) 70238-7
Neve EP et al., белки цитохрома P450 и толстой кишки; удержание и распространение из эндоплазматической сети и периода; Curr Opin Drug Discov Devel & period; (2010)
PubMed: 20047148
Kulkarni-Gosavi P et al. , Форма и функция аппарата Гольджи и толстой кишки; строительные леса и запятая; цитоскелет и передача сигналов и период; FEBS Lett & period; (2019)
, Форма и функция аппарата Гольджи и толстой кишки; строительные леса и запятая; цитоскелет и передача сигналов и период; FEBS Lett & period; (2019)
PubMed: 31378930 DOI: 10.1002 / 1873-3468.13567
Short B et al., Аппарат Гольджи и период; Curr Biol & period; (2000)
PubMed: 10985372 DOI: 10.1016 / s0960-9822 (00) 00644-8
Wei JH et al., Распутывая ленту Гольджи и период; Трафик и период; (2010)
PubMed: 21040294 DOI: 10.1111 / j.1600-0854.2010.01114.x
Wilson C et al., Аппарат Гольджи и толстая кишка; органелла с множеством сложных функций & период; Biochem J & period; (2011)
PubMed: 21158737 DOI: 10.1042 / BJ20101058
Farquhar MG et al., Аппарат Гольджи и толстая кишка; 100 лет прогресса, противоречий и периода; Trends Cell Biol & period; (1998)
PubMed: 9695800
Brandizzi F et al., Организация интерфейса ER-Golgi для мембранного управления трафиком & период; Nat Rev Mol Cell Biol & period; (2013)
PubMed: 23698585 DOI: 10. 1038 / nrm3588
1038 / nrm3588
Potelle S et al., Посттрансляционные модификации Гольджи и связанные с ними заболевания и период; J Наследовать Metab Dis & period; (2015)
PubMed: 25967285 DOI: 10.1007 / s10545-015-9851-7
Yoon TY et al., Сборка и разборка комплекса SNARE и период; Curr Biol & period; (2018)
PubMed: 29689222 DOI: 10.1016 / j.cub.2018.01.005
Границы | Две недооцененные функции аппарата Гольджи: удаление избытка Ca2 + и биосинтез фарнезол-подобных сесквитерпеноидов, возможно, в виде агонистов Ca2 + -помпа и мембранных «разжижителей-пластификаторов»
Введение
В физиологии клеток и организмов животных Ca 2+ наиболее известен своими полезными эффектами, например, при построении известковых скелетов у различных животных, в качестве вторичного посредника в сигнальных путях, в активности нейронов, в сокращении мышц, и Т. Д.Менее известно, что Ca 2+ является наиболее распространенным токсином на Земле, и что именно эта токсичность — при увеличении цитоплазматических концентраций до более 100 нМ — формирует основу для указанных положительных эффектов.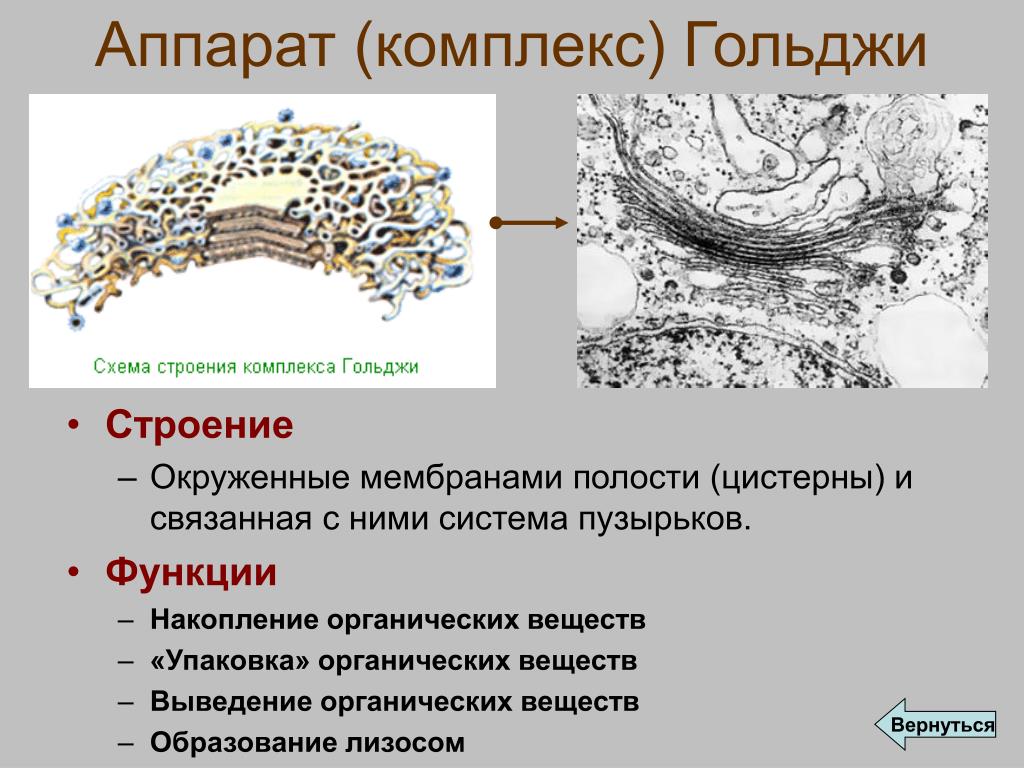 Огромные градиенты концентрации Ca 2+ над плазматической мембраной, в среднем от около 1-2 мМ внеклеточно по сравнению с 100 нМ в цитоплазме нестимулированных клеток, в сочетании с тем фактом, что плазматическая мембрана не полностью непроницаема для Ca 2+ (в основном из-за каналов и насосов Ca 2+ ) приводит к постоянному движению Ca 2+ в клетку.Рисунок 1 дает визуальное представление о том, как Ca 2+ градиентно распределяется не только по плазматической мембране, но и внутриклеточно. Он иллюстрирует проблемы, с которыми сталкивается эукариотическая клетка из-за того, что она должна поддерживать низкую концентрацию свободного внутриклеточного Ca 2+ в среде, в которой концентрация внеклеточного Ca 2+ как минимум в 20 000 раз выше.
Огромные градиенты концентрации Ca 2+ над плазматической мембраной, в среднем от около 1-2 мМ внеклеточно по сравнению с 100 нМ в цитоплазме нестимулированных клеток, в сочетании с тем фактом, что плазматическая мембрана не полностью непроницаема для Ca 2+ (в основном из-за каналов и насосов Ca 2+ ) приводит к постоянному движению Ca 2+ в клетку.Рисунок 1 дает визуальное представление о том, как Ca 2+ градиентно распределяется не только по плазматической мембране, но и внутриклеточно. Он иллюстрирует проблемы, с которыми сталкивается эукариотическая клетка из-за того, что она должна поддерживать низкую концентрацию свободного внутриклеточного Ca 2+ в среде, в которой концентрация внеклеточного Ca 2+ как минимум в 20 000 раз выше.
Рис. 1. Схематическое изображение градиентов Ca 2+ (адаптировано из De Loof, 2017a).Различные оттенки зеленого не предназначены для точного представления различий в концентрации Ca 2+ .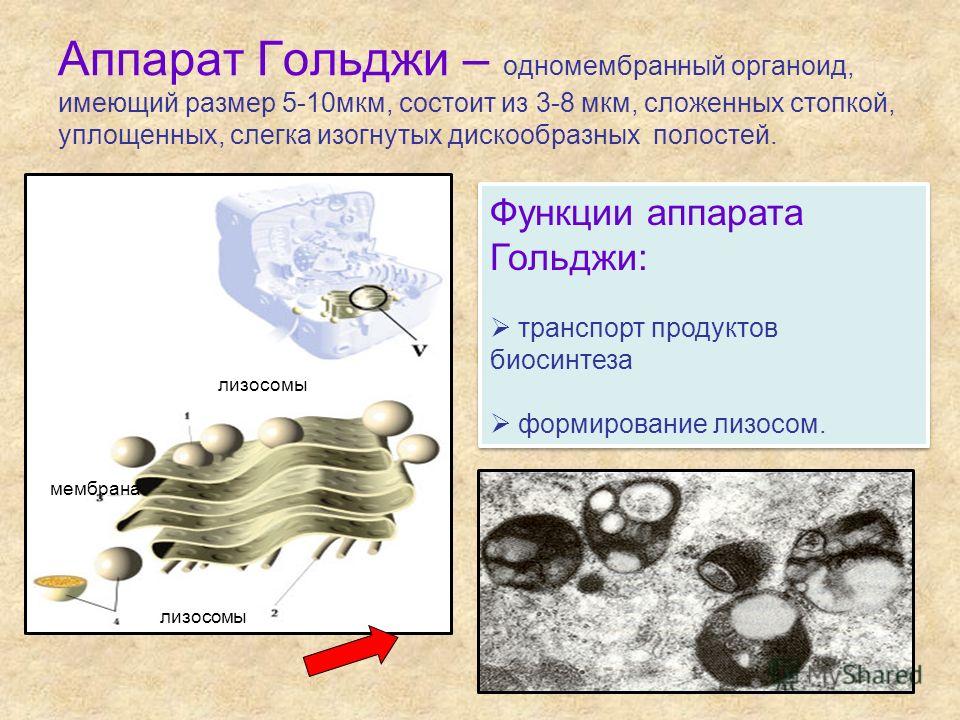 L, лизосома; N — ядро; М — митохондрия; RER, грубая эндоплазматическая сеть; SER, гладкая эндоплазматическая сеть. Просто взглянув на ультраструктуру клеток и оценив, насколько многочисленны SER и RER, можно сделать правдоподобные предположения о общих чертах их системы гомеостаза Ca 2+ , а также о некоторых из его негеномных эффектов на те ферментные системы, которые участвуют в синтезе липидов, стероидов и белков.Это связано с тем, что многочисленные ферменты, активность которых (частично) контролируется градиентом Ca 2+ над их мембраной, закреплены в этих мембранных системах SER и RER. Красные точки с цифрами 1, 2 и 3 соответствуют механизмам 1-3 для поддержания низкого уровня [Ca 2+ ] i (см. Текст). Разрешение на авторские права: собственная работа (De Loof, 2017a) под лицензией Creative Commons.
L, лизосома; N — ядро; М — митохондрия; RER, грубая эндоплазматическая сеть; SER, гладкая эндоплазматическая сеть. Просто взглянув на ультраструктуру клеток и оценив, насколько многочисленны SER и RER, можно сделать правдоподобные предположения о общих чертах их системы гомеостаза Ca 2+ , а также о некоторых из его негеномных эффектов на те ферментные системы, которые участвуют в синтезе липидов, стероидов и белков.Это связано с тем, что многочисленные ферменты, активность которых (частично) контролируется градиентом Ca 2+ над их мембраной, закреплены в этих мембранных системах SER и RER. Красные точки с цифрами 1, 2 и 3 соответствуют механизмам 1-3 для поддержания низкого уровня [Ca 2+ ] i (см. Текст). Разрешение на авторские права: собственная работа (De Loof, 2017a) под лицензией Creative Commons.
Когда по какой-либо причине избыток Ca 2+ попадает в ячейку, этот избыток необходимо удалить как можно быстрее.Небольшие количества Ca 2+ могут быть удалены АТФазами плазматической мембраны и функционально родственными ферментами (механизм 1 на рисунке 1) и путем временного накопления избытка Ca 2+ в просвете внутриклеточных мембранных систем, в частности ER и митохондрии (механизм 2 на рисунке 1; Orrenius et al.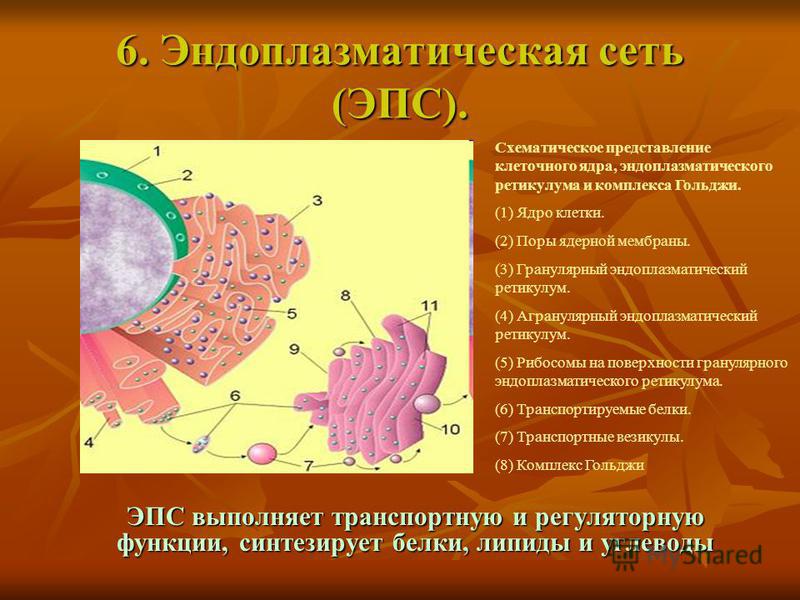 , 2003; Groenendyk et al., 2004). Когда этих механизмов недостаточно, задействуется третья система, а именно удаление Ca 2+ через грубый эндоплазматический ретикулум (RER) — систему Гольджи (механизм 3 на рисунке 1).Секреция Ca 2+ вместе с белками молока из клеток молочной железы является крайним примером (см. Раздел «Из физиологической необходимости»: какая роль в гомеостазе Ca 2+ ? »). Если даже этот механизм не работает, перегрузка Ca 2+ вызовет гибель / апоптоз клеток (Nicotera and Orrenius, 1998; Orrenius et al., 2003). Селективная массовая (запрограммированная) гибель клеток, которая контролируется физиологически и с точки зрения развития, происходит, например, в эпителии кишечника во время полного метаморфоза насекомых и у людей на более поздних стадиях болезни Альцгеймера (De Loof and Schoofs, 2019a).
, 2003; Groenendyk et al., 2004). Когда этих механизмов недостаточно, задействуется третья система, а именно удаление Ca 2+ через грубый эндоплазматический ретикулум (RER) — систему Гольджи (механизм 3 на рисунке 1).Секреция Ca 2+ вместе с белками молока из клеток молочной железы является крайним примером (см. Раздел «Из физиологической необходимости»: какая роль в гомеостазе Ca 2+ ? »). Если даже этот механизм не работает, перегрузка Ca 2+ вызовет гибель / апоптоз клеток (Nicotera and Orrenius, 1998; Orrenius et al., 2003). Селективная массовая (запрограммированная) гибель клеток, которая контролируется физиологически и с точки зрения развития, происходит, например, в эпителии кишечника во время полного метаморфоза насекомых и у людей на более поздних стадиях болезни Альцгеймера (De Loof and Schoofs, 2019a).
Всегда помните, что в эволюции нет «цели», только «физиологическая необходимость»
Наше нелогичное предположение о том, что секреция белка с помощью RER-Golgi подчиняется его роли в удалении избытка Ca 2+ , вероятно, встретит первоначальный скептицизм. На первый взгляд причина скептицизма кажется очень логичной и понятной, но, тем не менее, ошибочной. «Пример с молоком» показывает, почему. Если людей спросить, почему самки млекопитающих после родов начинают вырабатывать молоко, почти единодушный ответ: «Чтобы накормить и обеспечить иммунную защиту своим детенышам!» Но если в следующий раз спросить, планирует ли самка намеренно заниматься производством молока, возникают сомнения.Это колебание превращается в отрицание после вопроса: «Знают ли клетки молочной железы», что они должны производить молоко, потому что детеныш / ребенок ждет, чтобы его накормили? » Конечно, нет. Но почему вообще инициируется галактопоэз, если для этого нет никакой «цели»? Правильный ответ: самки начинают выделять молоко из-за гормонально контролируемой физиологической необходимости . «Молочный кейс» показывает, что в эволюции не существует «цели» (De Loof, 2015, 2017b), возможно, некоторые исключения не принимаются во внимание (Pookottil, 2013), и что способы, которыми следует придерживаться для улучшения физической формы, могут быть очень гениальными.
На первый взгляд причина скептицизма кажется очень логичной и понятной, но, тем не менее, ошибочной. «Пример с молоком» показывает, почему. Если людей спросить, почему самки млекопитающих после родов начинают вырабатывать молоко, почти единодушный ответ: «Чтобы накормить и обеспечить иммунную защиту своим детенышам!» Но если в следующий раз спросить, планирует ли самка намеренно заниматься производством молока, возникают сомнения.Это колебание превращается в отрицание после вопроса: «Знают ли клетки молочной железы», что они должны производить молоко, потому что детеныш / ребенок ждет, чтобы его накормили? » Конечно, нет. Но почему вообще инициируется галактопоэз, если для этого нет никакой «цели»? Правильный ответ: самки начинают выделять молоко из-за гормонально контролируемой физиологической необходимости . «Молочный кейс» показывает, что в эволюции не существует «цели» (De Loof, 2015, 2017b), возможно, некоторые исключения не принимаются во внимание (Pookottil, 2013), и что способы, которыми следует придерживаться для улучшения физической формы, могут быть очень гениальными.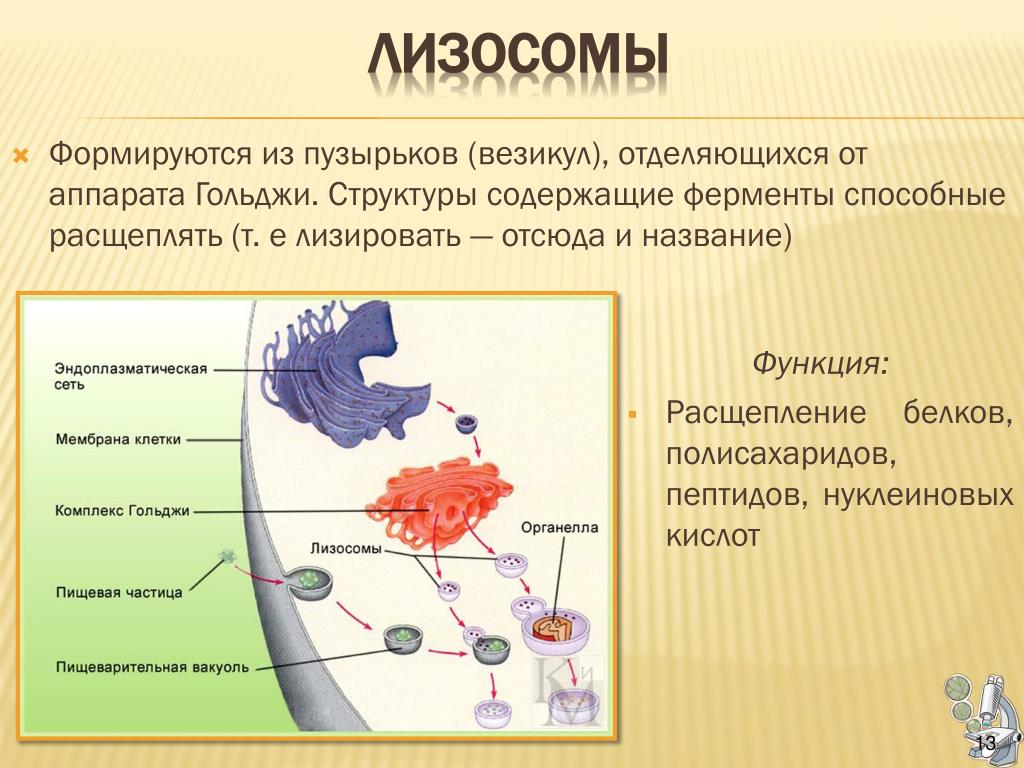
«Из физиологической необходимости»: какая роль в гомеостазе Ca
2+ ?Падение титров прогестерона и эстрогена перед родами в сочетании с повышенным высвобождением некоторых гормонов головного мозга, таких как пролактин, который способствует проникновению Ca 2+ в клетки молочной железы, и окситоцина, который способствует выделению молока , является причиной этой «необходимости». Во-вторых, благотворное влияние молока с его высокими концентрациями белков, Ca 2+ , липидов и т. Д., увеличивает физическую форму кормящей самки и популяции, к которой она принадлежит. Лактация была сохранена в эволюции, потому что она увеличивает физическую форму.
«Молочный ящик» поднимает несколько физиологических проблем клетки. Один касается высокой концентрации Ca 2+ в молоке, до 60–100 мМ (Wuytack et al., 2003). Эта концентрация примерно в 600 000–1 миллион раз выше, чем концентрация свободного Ca 2+ в цитоплазме нестимулированных клеток. Опять же, обычный ответ на вопрос, почему молоко настолько богато Ca 2+ : «Потому что развивающийся ребенок / молодой человек нуждается в большом количестве Ca 2+ , среди прочего, для построения своего известкового эндоскелета.И далее: «Неужели клетки молочной железы добавляют столько Ca 2+ в молочную жидкость с этим« намерением »?» Конечно, нет. Они делают это, чтобы избавиться от огромных количеств, которые попадают в клетки железы в результате увеличения проницаемости для Ca 2+ , которое вызвано «гормонами, способствующими лактации», вырабатываемыми мозгом кормящих женщин. Конечная причина секретирования Ca 2+ заключается в том, что избыток Ca 2+ очень токсичен (раздел «Основные механизмы гомеостаза Ca 2+ ») и должен быть устранен как можно быстрее.Молодняк выживает, получая потенциально токсичное питательное вещество, потому что он или она нейтрализует избыточный поступающий Ca 2+ , загружая его в отложения Ca 2+ , которые больше не являются токсичными, в частности, в развивающемся скелете и во внутриклеточном пространстве.
Опять же, обычный ответ на вопрос, почему молоко настолько богато Ca 2+ : «Потому что развивающийся ребенок / молодой человек нуждается в большом количестве Ca 2+ , среди прочего, для построения своего известкового эндоскелета.И далее: «Неужели клетки молочной железы добавляют столько Ca 2+ в молочную жидкость с этим« намерением »?» Конечно, нет. Они делают это, чтобы избавиться от огромных количеств, которые попадают в клетки железы в результате увеличения проницаемости для Ca 2+ , которое вызвано «гормонами, способствующими лактации», вырабатываемыми мозгом кормящих женщин. Конечная причина секретирования Ca 2+ заключается в том, что избыток Ca 2+ очень токсичен (раздел «Основные механизмы гомеостаза Ca 2+ ») и должен быть устранен как можно быстрее.Молодняк выживает, получая потенциально токсичное питательное вещество, потому что он или она нейтрализует избыточный поступающий Ca 2+ , загружая его в отложения Ca 2+ , которые больше не являются токсичными, в частности, в развивающемся скелете и во внутриклеточном пространстве. Ca 2+ депо, таких как просветы / цистерны эндоплазматической сети, митохондрии и Гольджи. Клетки молочной железы не гибнут при высоких концентрациях Ca 2+ , потому что они используют конвейерную ленту транспортных белков, продуцируемых в RER и затем секретируемых Гольджи, упакованных в пузырьки.
Ca 2+ депо, таких как просветы / цистерны эндоплазматической сети, митохондрии и Гольджи. Клетки молочной железы не гибнут при высоких концентрациях Ca 2+ , потому что они используют конвейерную ленту транспортных белков, продуцируемых в RER и затем секретируемых Гольджи, упакованных в пузырьки.
Основные механизмы в Ca
2+ Гомеостаз Если кто-то не знаком с принципами гомеостаза Ca 2+ , утверждение о том, что Ca 2+ является наиболее распространенным токсичным загрязнителем в водной среде клеток, но, тем не менее, он стал лучшим коммуникатором, может сначала показаться странным. сталкиваться. Кальций — амбивалентный мессенджер (Krebs et al., 2015; Carafoli and Krebs, 2016). С одной стороны, он важен для правильного функционирования клеточных процессов, но, если его не контролировать пространственно и временно внутри клеток, он вызывает различные тяжелые клеточные дисфункции и даже гибель клеток (Nicotera and Orrenius, 1998; Orrenius et al. , 2003; Карафоли и Кребс, 2016). Само происхождение системы гомеостаза Ca 2+ восходит к предкам прокариот как система выживания, предотвращающая опосредованное Ca 2+ повреждение клеток (Case et al., 2007). Дальнейшее развитие он получил на одноклеточной стадии эволюции эукариот (Plattner, Verkhratsky, 2015, 2016). Позже механизмы передачи сигналов стали разнообразными, отражая умножение и специализацию регулируемых Ca 2+ клеточных активностей (Рисунок 2). Они очень хорошо сохранились в эволюции (Plattner, Verkhratsky, 2015).Токсичность Ca 2+ и уравновешивание эндогенными фарнезол-подобными сесквитерпеноидами (FLS) (De Loof et al., 2015; De Loof and Schoofs, 2019e) напоминают историю эволюции токсичности O 2 , то есть лежащие в основе механизмов свободных радикалов [активных форм кислорода (АФК)] и роль антиоксидантов (Zhu et al., 2016).
, 2003; Карафоли и Кребс, 2016). Само происхождение системы гомеостаза Ca 2+ восходит к предкам прокариот как система выживания, предотвращающая опосредованное Ca 2+ повреждение клеток (Case et al., 2007). Дальнейшее развитие он получил на одноклеточной стадии эволюции эукариот (Plattner, Verkhratsky, 2015, 2016). Позже механизмы передачи сигналов стали разнообразными, отражая умножение и специализацию регулируемых Ca 2+ клеточных активностей (Рисунок 2). Они очень хорошо сохранились в эволюции (Plattner, Verkhratsky, 2015).Токсичность Ca 2+ и уравновешивание эндогенными фарнезол-подобными сесквитерпеноидами (FLS) (De Loof et al., 2015; De Loof and Schoofs, 2019e) напоминают историю эволюции токсичности O 2 , то есть лежащие в основе механизмов свободных радикалов [активных форм кислорода (АФК)] и роль антиоксидантов (Zhu et al., 2016).
Рисунок 2. Классический вид основных игроков в системе, которая регулирует внутриклеточную компартментализацию Ca 2+ . Клеточный импорт Ca 2+ через плазматическую мембрану происходит в основном по каналам, управляемым рецепторами (например, рецепторами глутамата), чувствительным к напряжению и хранилищем. Попав внутрь клетки, Ca 2+ может либо взаимодействовать с белками, связывающими Ca 2+ , либо секвестрироваться в эндоплазматическом ретикулуме (ER) или митохондриях. Самый большой запас Ca 2+ в клетках находится в ER или саркоплазматическом ретикулуме, при этом локальные концентрации Ca 2+ достигают миллимолярных уровней.Уровни Ca 2+ в ER зависят от относительного распределения насосов сарко (эндо) плазматического ретикулума Ca 2+ -АТФазы (SERCA) и инозитол-1,4,5-трифосфата [Ins (1, 4 , 5) P 3 ] рецепторов [Ins (1, 4, 5) P 3 Rs] и рианодиновых рецепторов (RYR), а также по относительному количеству Ca 2+ -связывающих белков (кальретикулин, кальсеквестрин) в ER или саркоплазматическом ретикулуме.
Клеточный импорт Ca 2+ через плазматическую мембрану происходит в основном по каналам, управляемым рецепторами (например, рецепторами глутамата), чувствительным к напряжению и хранилищем. Попав внутрь клетки, Ca 2+ может либо взаимодействовать с белками, связывающими Ca 2+ , либо секвестрироваться в эндоплазматическом ретикулуме (ER) или митохондриях. Самый большой запас Ca 2+ в клетках находится в ER или саркоплазматическом ретикулуме, при этом локальные концентрации Ca 2+ достигают миллимолярных уровней.Уровни Ca 2+ в ER зависят от относительного распределения насосов сарко (эндо) плазматического ретикулума Ca 2+ -АТФазы (SERCA) и инозитол-1,4,5-трифосфата [Ins (1, 4 , 5) P 3 ] рецепторов [Ins (1, 4, 5) P 3 Rs] и рианодиновых рецепторов (RYR), а также по относительному количеству Ca 2+ -связывающих белков (кальретикулин, кальсеквестрин) в ER или саркоплазматическом ретикулуме. Концентрация цитозольного Ca 2+ в нестимулированных клетках поддерживается на уровне приблизительно 100 нМ за счет как поглощения ER, так и экструзии Ca 2+ во внеклеточное пространство плазматической мембраной Ca 2+ -ATPase (PMCA).Высвобождение ER Ca 2+ запускается стимуляцией агонистом посредством образования Ins (1, 4, 5) P 3 посредством гидролиза фосфатидилинозитол-4,5-бифосфата [PtdIns (4,5) P 2 ] управляется фосфолипазой C (PLCγ). Митохондрии поглощают Ca 2+ электрофоретически через унипортный транспортер и могут снова высвобождать его тремя разными путями: обращение унипортера, Na + / H + -зависимый обмен Ca 2+ или как следствие открытия поры перехода проницаемости (PTP).PTP также может мигать, высвобождая небольшие количества Ca 2+ . Отток Ca 2+ из клеток регулируется главным образом PMCA, который связывает кальмодулин и имеет высокое сродство к Ca 2+ .
Концентрация цитозольного Ca 2+ в нестимулированных клетках поддерживается на уровне приблизительно 100 нМ за счет как поглощения ER, так и экструзии Ca 2+ во внеклеточное пространство плазматической мембраной Ca 2+ -ATPase (PMCA).Высвобождение ER Ca 2+ запускается стимуляцией агонистом посредством образования Ins (1, 4, 5) P 3 посредством гидролиза фосфатидилинозитол-4,5-бифосфата [PtdIns (4,5) P 2 ] управляется фосфолипазой C (PLCγ). Митохондрии поглощают Ca 2+ электрофоретически через унипортный транспортер и могут снова высвобождать его тремя разными путями: обращение унипортера, Na + / H + -зависимый обмен Ca 2+ или как следствие открытия поры перехода проницаемости (PTP).PTP также может мигать, высвобождая небольшие количества Ca 2+ . Отток Ca 2+ из клеток регулируется главным образом PMCA, который связывает кальмодулин и имеет высокое сродство к Ca 2+ . Отток Ca 2+ также может быть опосредован обменником Na + / Ca 2+ (NCX). [Ca 2+ ], концентрация кальция; ДАГ, диацилглицерид. Эта цифра была любезно предоставлена профессором С. Оррениусом. Он послужил шаблоном для рисунка в Orrenius et al.(2003). Регулирование гибели клеток: связь кальций-апоптоз. Nature Rev. Cell Biol. 2003; 4: 552–565; https://doi.org/10.1038/nrm1150. Рисунок был немного изменен путем добавления красных точек с фарнезол-подобным сесквитерпеноидом (FLS), что указывает на роль эндогенных сесквитерпеноидов (FLS) в качестве агонистов Ca 2+ -АТФаз. Такая роль более вероятна для сарко (эндо) плазматического ретикулума Ca 2+ -АТФаз (SERCA), чем для PMCA (отсюда вопросительный знак). В 2003 г. роль системы Гольджи в гомеостазе Ca 2+ еще не была хорошо документирована и поэтому не представлена на этом рисунке.С разрешения автора на рисунок и легенду от издателя и профессора С. Оррениуса.
Отток Ca 2+ также может быть опосредован обменником Na + / Ca 2+ (NCX). [Ca 2+ ], концентрация кальция; ДАГ, диацилглицерид. Эта цифра была любезно предоставлена профессором С. Оррениусом. Он послужил шаблоном для рисунка в Orrenius et al.(2003). Регулирование гибели клеток: связь кальций-апоптоз. Nature Rev. Cell Biol. 2003; 4: 552–565; https://doi.org/10.1038/nrm1150. Рисунок был немного изменен путем добавления красных точек с фарнезол-подобным сесквитерпеноидом (FLS), что указывает на роль эндогенных сесквитерпеноидов (FLS) в качестве агонистов Ca 2+ -АТФаз. Такая роль более вероятна для сарко (эндо) плазматического ретикулума Ca 2+ -АТФаз (SERCA), чем для PMCA (отсюда вопросительный знак). В 2003 г. роль системы Гольджи в гомеостазе Ca 2+ еще не была хорошо документирована и поэтому не представлена на этом рисунке.С разрешения автора на рисунок и легенду от издателя и профессора С. Оррениуса. Этот измененный рисунок был опубликован ранее в De Loof (2017a) с разрешения авторского права (открытый доступ).
Этот измененный рисунок был опубликован ранее в De Loof (2017a) с разрешения авторского права (открытый доступ).
Система гомеостаза Ca 2+ с ее многочисленными молекулярными игроками (насосы Ca 2+ , каналы Ca 2+ , кальмодулин и т. Д., Рис. 2) производила крутой (см. Раздел «Из физиологической необходимости»: Какая роль в гомеостазе Ca 2+ ? ») Градиент концентрации между внеклеточными и внутриклеточными компартментами, которые имеют как сигнальную функцию, так и важность выживания.Последнее иллюстрируется тем фактом, что даже относительно (продолжительное) умеренное повышение концентрации цитозольного Ca 2+ выше 100 нМ несовместимо с жизнью. Таким образом, основная активность системы гомеостаза Ca 2+ заключается в поддержании цитозольного Ca 2+ на очень низком уровне , не выше 100 нМ. Примечательно, что механизмы, контролирующие это «поддержание низкого уровня Ca 2+ », изучены лишь частично, в частности, роль фарнезолоподобных эндогенных сесквитерпеноидов до настоящего времени остается недооцененной (De Loof and Schoofs, 2019e; эта статья).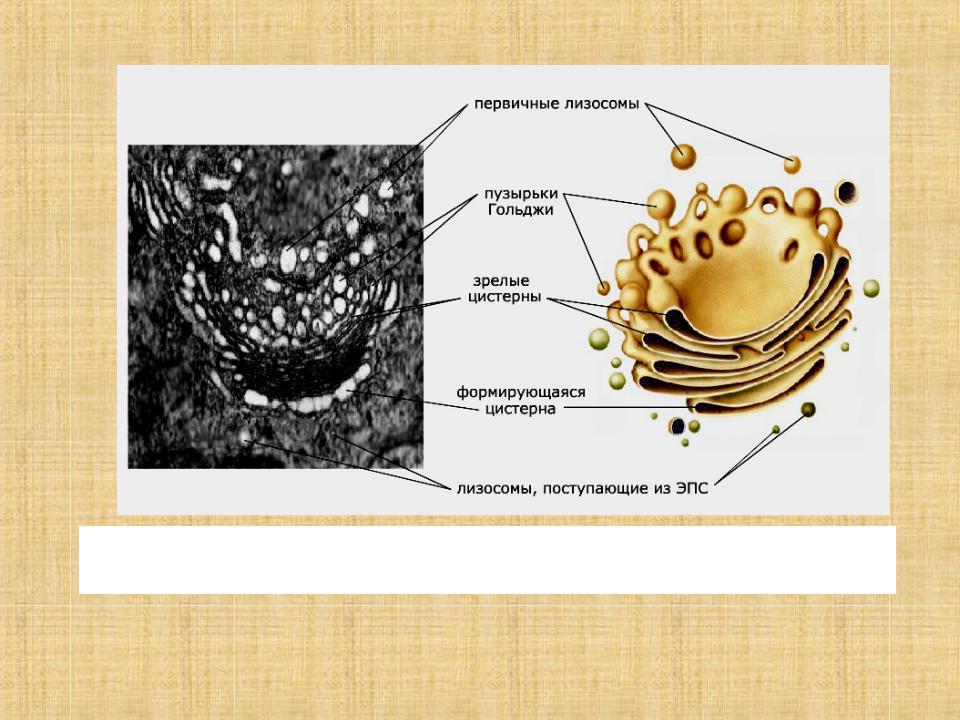
Растущие концентрации Ca 2+ могут изменять трехмерную конформацию некоторых типов макромолекул, в частности белков, а также хроматина / ДНК. Это составляет основу потенциальной токсичности Ca 2+ , а также того факта, что Ca 2+ может действовать как вторичный мессенджер в различных сигнальных системах (De Loof, 2017a; De Loof and Schoofs, 2019b). . Сокращение мышц является примером эффекта внезапного увеличения Ca 2+ в результате его высвобождения из просвета гладкой эндоплазматической сети.Поддержание «жизнеспособных градиентов» Ca 2+ — важнейшая задача для всех эукариотических клеток. Далее мы сосредоточимся на некоторых новых взглядах на роль системы Гольджи и эндогенных FLS в достижении этой цели.
Аппарат Гольджи: сложная система
По данным Barlow et al. (2018), характерная морфология Гольджи, состоящая из множества дифференцированных компартментов, организованных в штабелированные уплощенные цистерны (рис. 3), слитых вместе в непрерывную ленточную структуру (Gosavi and Gleeson, 2017), является одной из наиболее узнаваемых особенностей современных эукариотических клеток.Как он возник и как поддерживается, не совсем понятно. Можно разумно предположить, что состав и латеральная организация мембран Гольджи не менее сложны, чем у плазматической мембраны (Jacobson et al., 2019). По данным Barlow et al. (2018), голгины, которые вездесущи у эукариот, являются важными белками, участвующими в структуре Гольджи, и это со времен общего эукариотического предка. Аппарат Гольджи выполняет множество функций (Makhoul et al., 2018). Его роль в секреции белка, процессе, который обычно включает модификацию белка, наиболее известна.Мембраны Гольджи несут в себе набор гликозилирующих ферментов (рис. 3С), которые присоединяют различные мономеры сахара к белкам, движущимся через устройство. Другие функции включают митоз, репарацию ДНК, стрессовые реакции, гомеостаз Ca 2+ (Zhang et al., 2020), производство лизосом (Nakano and Luini, 2010), аутофагию, апоптоз, воспаление и синтез простагландинов (Smith and Malkowski, 2019).
3), слитых вместе в непрерывную ленточную структуру (Gosavi and Gleeson, 2017), является одной из наиболее узнаваемых особенностей современных эукариотических клеток.Как он возник и как поддерживается, не совсем понятно. Можно разумно предположить, что состав и латеральная организация мембран Гольджи не менее сложны, чем у плазматической мембраны (Jacobson et al., 2019). По данным Barlow et al. (2018), голгины, которые вездесущи у эукариот, являются важными белками, участвующими в структуре Гольджи, и это со времен общего эукариотического предка. Аппарат Гольджи выполняет множество функций (Makhoul et al., 2018). Его роль в секреции белка, процессе, который обычно включает модификацию белка, наиболее известна.Мембраны Гольджи несут в себе набор гликозилирующих ферментов (рис. 3С), которые присоединяют различные мономеры сахара к белкам, движущимся через устройство. Другие функции включают митоз, репарацию ДНК, стрессовые реакции, гомеостаз Ca 2+ (Zhang et al., 2020), производство лизосом (Nakano and Luini, 2010), аутофагию, апоптоз, воспаление и синтез простагландинов (Smith and Malkowski, 2019).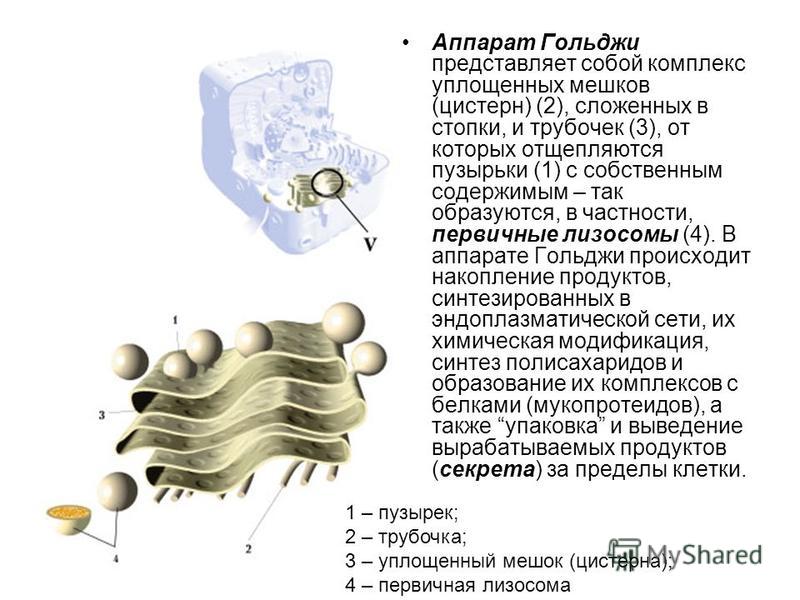 Аппарат Гольджи также взаимодействует с сетями микротрубочек и актина (Kulkarni-Gosavi et al., 2019).Это центральное место встречи эндоцитотической и экзоцитотической систем в эукариотических клетках (Barlow et al., 2018). И наконец, что не менее важно, с помощью логической дедукции Де Луф и Скуфс (2019b, d) пришли к выводу, что система Гольджи является наиболее вероятным местом синтеза эндогенных ФЛС) (раздел «Аппарат Гольджи как вероятный субклеточный сайт синтеза Фарнезол / Фарнезолоподобный сесквитерпеноид: происхождение этой идеи »).
Аппарат Гольджи также взаимодействует с сетями микротрубочек и актина (Kulkarni-Gosavi et al., 2019).Это центральное место встречи эндоцитотической и экзоцитотической систем в эукариотических клетках (Barlow et al., 2018). И наконец, что не менее важно, с помощью логической дедукции Де Луф и Скуфс (2019b, d) пришли к выводу, что система Гольджи является наиболее вероятным местом синтеза эндогенных ФЛС) (раздел «Аппарат Гольджи как вероятный субклеточный сайт синтеза Фарнезол / Фарнезолоподобный сесквитерпеноид: происхождение этой идеи »).
Рисунок 3. Аппарат Гольджи в контексте секреторного пути: (A) Схематическое изображение (Гольджи в розовом цвете лосося). (B) Электронная микрофотография. (C) Схематическое изображение насосов Ca 2 + — и Ca 2+ / Mn 2+ , а также гликозилирующих ферментов в мембранах. (D) Мембраны Гольджи также содержат ферменты для синтеза фарнезола / фарнезол-подобного сесквитерпеноида (FLS). Основная функция грубого эндоплазматического ретикулума (RER) — аппарата Гольджи — удаление избытка Ca 2+ из цитоплазмы, активность, которая требует синтеза специфичных для клеточного типа транспортных белков в RER.Отсюда белки отправляются в аппарат Гольджи, который организует, модифицирует (например, путем гликозилирования), упаковывает и маркирует их. Некоторые из этих продуктов транспортируются в другие области клетки, а некоторые выводятся из клетки посредством экзоцитоза. Ферментные белки упакованы в виде новых лизосом (или упакованы и отправлены для слияния с существующими лизосомами) (Nakano and Luini, 2010). Повторный анализ классических данных из эндокринологии насекомых (см. Текст) показал, что аппарат Гольджи является вероятным местом синтеза фарнезола и фарнезол-подобных сесквитерпеноидов (FLS), из которых наиболее известны ювенильные гормоны насекомых.Разрешение на авторские права: (A – D) Все под лицензией Creative Commons CC BY 4.0. (A, B) Исходные файлы из Википедии без изменений.
Основная функция грубого эндоплазматического ретикулума (RER) — аппарата Гольджи — удаление избытка Ca 2+ из цитоплазмы, активность, которая требует синтеза специфичных для клеточного типа транспортных белков в RER.Отсюда белки отправляются в аппарат Гольджи, который организует, модифицирует (например, путем гликозилирования), упаковывает и маркирует их. Некоторые из этих продуктов транспортируются в другие области клетки, а некоторые выводятся из клетки посредством экзоцитоза. Ферментные белки упакованы в виде новых лизосом (или упакованы и отправлены для слияния с существующими лизосомами) (Nakano and Luini, 2010). Повторный анализ классических данных из эндокринологии насекомых (см. Текст) показал, что аппарат Гольджи является вероятным местом синтеза фарнезола и фарнезол-подобных сесквитерпеноидов (FLS), из которых наиболее известны ювенильные гормоны насекомых.Разрешение на авторские права: (A – D) Все под лицензией Creative Commons CC BY 4.0. (A, B) Исходные файлы из Википедии без изменений. Файл 0314 Golgi Apparatus.jpg (создан 18 мая 2016 г.). (C, D) Немного изменены из этого файла.
Файл 0314 Golgi Apparatus.jpg (создан 18 мая 2016 г.). (C, D) Немного изменены из этого файла.
Выкачивание избытка Ca
2+ из клетки: система Гольджи как часть системы гомеостаза Ca 2+ Самыми известными насосными системами Ca 2+ (активными переносчиками) являются плазматическая мембрана Ca 2+ -АТФазы (PMCA) и сарко / эндоплазматический ретикулум Ca 2+ -транспортирующие АТФазы (SERCA с различными вариантами сплайсинга). ).Рисунок 2 иллюстрирует сложность системы. Кроме того, животные клетки также содержат менее охарактеризованную Са 2+ -транспортную АТФазу P-типа, PMR1 / SPCA Ca 2+ / Mn 2+ -транспортную АТФазу (Van Baelen et al., 2002), которая кодируется двумя генами, имеющими различные варианты сплайсинга. Эта Са 2+ -транспортная АТФаза P-типа в основном нацелена на аппарат Гольджи (Wuytack et al., 2003). Он обеспечивает Гольджи Ca 2+ и Mn 2+ , необходимыми для производства и обработки секреторных белков. N-концевой Ca 2+ -связывающий мотив в Ca 2+ / Mn 2+ -транспортной АТФазы SPCA1 регулирует секреторный путь, в частности, в клетках с высокой нагрузкой Ca 2+ (например, в молочных железах). клетки железы во время лактации) или в клетках с низким содержанием АТФ, таких как кератиноциты (Chen et al., 2019). Филогенетический анализ показал, что SPCA1 может быть старше, чем насос SERCA и связан с предполагаемым предковым насосом Ca 2+ (Wuytack et al., 2003). Система Гольджи может функционировать как хранилище Ca 2+ , которое может участвовать в настройке цитозольных колебаний Ca 2+ (Wuytack et al., 2003).
N-концевой Ca 2+ -связывающий мотив в Ca 2+ / Mn 2+ -транспортной АТФазы SPCA1 регулирует секреторный путь, в частности, в клетках с высокой нагрузкой Ca 2+ (например, в молочных железах). клетки железы во время лактации) или в клетках с низким содержанием АТФ, таких как кератиноциты (Chen et al., 2019). Филогенетический анализ показал, что SPCA1 может быть старше, чем насос SERCA и связан с предполагаемым предковым насосом Ca 2+ (Wuytack et al., 2003). Система Гольджи может функционировать как хранилище Ca 2+ , которое может участвовать в настройке цитозольных колебаний Ca 2+ (Wuytack et al., 2003).
Связь между Ca
2+ Накачка Sarco (Endo) Plasmatic Reticulum Ca 2+ -Atpases и эндогенными сесквитерпеноидамиПятьдесят лет назад: прекращение выработки фарнезола / ювенильного гормона ухудшает секреторную активность голгикрина у насекомых. Временное спасение возможно
С помощью электронной микроскопии Де Луф и Лагассе (1970) обнаружили, что ультраструктура клеток жирового тела колорадского жука ( Leptinotarsa decemlineata ) изменяется, когда железы, синтезирующие фарнезол / ювенильный гормон (JH), corpora allata ( CA), инактивируются микрохирургическим удалением.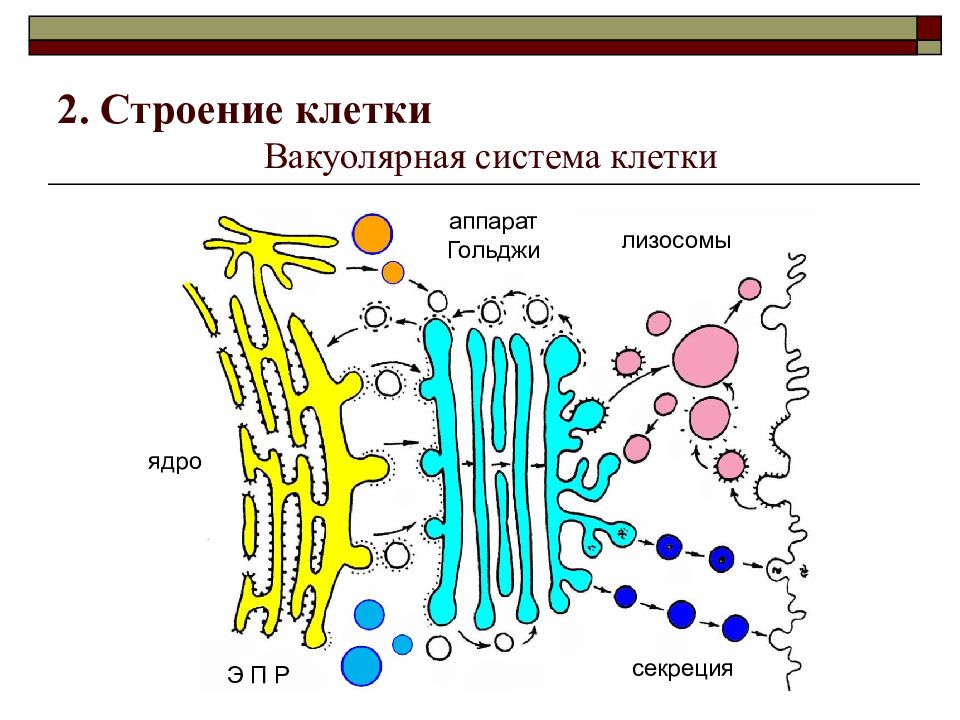 Кроме того, они также наблюдали этот фенотип, когда жуков выращивали в условиях с коротким световым периодом (= менее 12 часов света в день). Другие ткани не исследовались, и сайты синтеза JH, отличные от CA, в то время не были известны (см. Ниже).
Кроме того, они также наблюдали этот фенотип, когда жуков выращивали в условиях с коротким световым периодом (= менее 12 часов света в день). Другие ткани не исследовались, и сайты синтеза JH, отличные от CA, в то время не были известны (см. Ниже).
Наиболее сильное воздействие на клетки жирового тела оказало на функционирование системы Гольджи: секреция пузырьков была полностью нарушена. Исходящие транспортные везикулы больше не сливаются с плазматической мембраной, а вместо этого сливаются друг с другом, образуя тем самым большие белковые тела (см. Рисунок De Loof and Schoofs, 2019b или De Loof and Schoofs, 2019a).В то время этот эффект (ошибочно: см. Разделы «Из физиологической необходимости»: какая роль в гомеостазе Ca 2+ ? »И« Из физиологической необходимости »: какая роль в гомеостазе Ca 2+ ?) Интерпретировался как физиологически актуален и полезен для накопления резервов при подготовке к гибернации / диапаузе.
Теперь мы считаем, что этот эффект на самом деле является шагом к запрограммированной гибели клеток.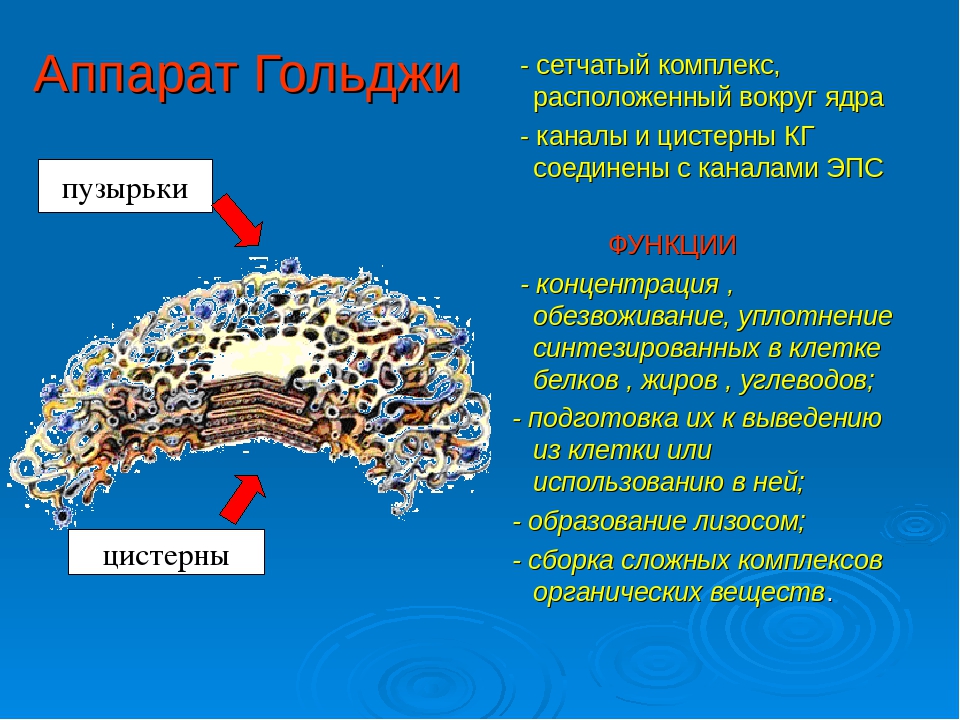 Однако в то время роль Ca 2+ в индукции апоптоза еще не была известна.Оррениус и др. (2003) около 30 лет спустя выдвинули это как причинную связь. Удаление КА влияет не только на системы Гольджи, но и почти на все аспекты физиологии клетки, включая биосинтез липидов, белков и экдистероидов, размножение митохондрий и т.д. ) в физиологии и развитии насекомых (De Loof and Schoofs, 2019b, d). И реимплантация активной СА, и введение синтетического JH (растворенного в масле, чтобы действовать как формула с медленным высвобождением) временно (= в течение нескольких дней) спасли наблюдаемый фенотип и, таким образом, продемонстрировали, что отсутствие фарнезола / JH является реальным причина физиологических эффектов клеток, вызванных аллатэктомией (De Loof and Lagasse, 1970).
Однако в то время роль Ca 2+ в индукции апоптоза еще не была известна.Оррениус и др. (2003) около 30 лет спустя выдвинули это как причинную связь. Удаление КА влияет не только на системы Гольджи, но и почти на все аспекты физиологии клетки, включая биосинтез липидов, белков и экдистероидов, размножение митохондрий и т.д. ) в физиологии и развитии насекомых (De Loof and Schoofs, 2019b, d). И реимплантация активной СА, и введение синтетического JH (растворенного в масле, чтобы действовать как формула с медленным высвобождением) временно (= в течение нескольких дней) спасли наблюдаемый фенотип и, таким образом, продемонстрировали, что отсутствие фарнезола / JH является реальным причина физиологических эффектов клеток, вызванных аллатэктомией (De Loof and Lagasse, 1970).
Еще одна «искра» понимания: Sarco (эндо) плазматический ретикулум Ca
2+ -АТФаза, блокатор помпы Тапсигаргин, как и фарнезол / ювенильные гормоны, сесквитерпеноид Sarco (эндо) плазматический ретикулум Ca 2+ -АТФазы могут взаимодействовать с множеством молекул. Количество взаимодействующих белков продолжает расти (Vandecaetsbeek et al., 2011). Одним из хорошо известных агентов является тапсигаргин, мощный блокатор как насоса SERCA (Rogers et al., 1995), так и транспортной АТФазы SPCA1a Ca 2+ / Mn 2+ , присутствующей в аппарате Гольджи (Chen et al. al., 2017, 2019; Smaardijk et al., 2017). Тапсигаргин получают из растения Thapsia garganica , отсюда и его название. По структуре он относится к сесквитерпеновым лактонам. Блокируя способность клетки перекачивать кальций в саркоплазматический и эндоплазматический ретикулы, тапсигаргин повышает цитозольную (внутриклеточную) концентрацию Ca 2+ . Истощение запасов может вторично активировать кальциевые каналы плазматической мембраны, обеспечивая приток кальция в цитозоль. Истощение запасов кальция в ЭР приводит к стрессу в ЭР и, в конечном итоге, к гибели клеток (Zhang et al., 2020).
Количество взаимодействующих белков продолжает расти (Vandecaetsbeek et al., 2011). Одним из хорошо известных агентов является тапсигаргин, мощный блокатор как насоса SERCA (Rogers et al., 1995), так и транспортной АТФазы SPCA1a Ca 2+ / Mn 2+ , присутствующей в аппарате Гольджи (Chen et al. al., 2017, 2019; Smaardijk et al., 2017). Тапсигаргин получают из растения Thapsia garganica , отсюда и его название. По структуре он относится к сесквитерпеновым лактонам. Блокируя способность клетки перекачивать кальций в саркоплазматический и эндоплазматический ретикулы, тапсигаргин повышает цитозольную (внутриклеточную) концентрацию Ca 2+ . Истощение запасов может вторично активировать кальциевые каналы плазматической мембраны, обеспечивая приток кальция в цитозоль. Истощение запасов кальция в ЭР приводит к стрессу в ЭР и, в конечном итоге, к гибели клеток (Zhang et al., 2020).
Сходство индукции клеточной смерти у большого числа эукариот при введении тапсигаргина, а также путем подавления продукции JH СА насекомых с полным метаморфозом (= Holometabola) инициировало поиск причины этого сходства.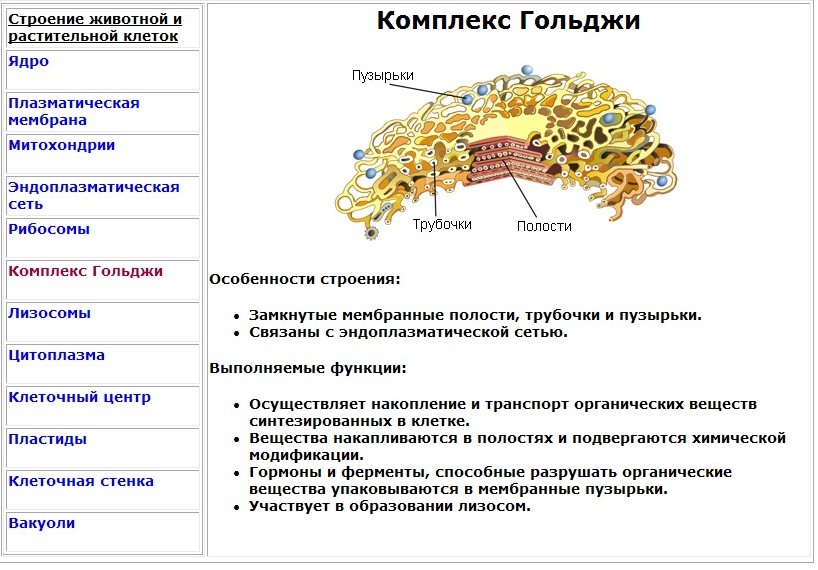 Возможно ли, что тапсигаргин токсичен, потому что он вытесняет природный сесквитерпеноидный лиганд из своего сайта связывания на Ca 2+ -насосе (ах), тем самым блокируя их (De Loof et al., 2014)? Давно известно, что фарнезол и его JH-эфиры (Röller et al., 1967; Röller and Dahm, 1968) являются сесквитерпеноидами, но для тапсигаргина это свойство упоминается редко. Несмотря на интенсивные исследования, природный лиганд для этого связывания все еще остается неизвестным. Мы думаем, не имея экспериментальных доказательств, что для участия в перекачивании Ca 2+ , SERCA и других насосов Ca 2+ необходимо присутствие эндогенного FLS в качестве агониста насосов (De Loof et al., 2014; Де Луф, 2017а).
Возможно ли, что тапсигаргин токсичен, потому что он вытесняет природный сесквитерпеноидный лиганд из своего сайта связывания на Ca 2+ -насосе (ах), тем самым блокируя их (De Loof et al., 2014)? Давно известно, что фарнезол и его JH-эфиры (Röller et al., 1967; Röller and Dahm, 1968) являются сесквитерпеноидами, но для тапсигаргина это свойство упоминается редко. Несмотря на интенсивные исследования, природный лиганд для этого связывания все еще остается неизвестным. Мы думаем, не имея экспериментальных доказательств, что для участия в перекачивании Ca 2+ , SERCA и других насосов Ca 2+ необходимо присутствие эндогенного FLS в качестве агониста насосов (De Loof et al., 2014; Де Луф, 2017а).
Некоторые типы каналов Ca
2+ являются рецепторами для фарнезола В дополнение к предполагаемой, но еще не доказанной экспериментально роли FLS как агонистов SERCA и возможных других насосов Ca 2+ (De Loof, 2017a), прямое экспериментальное доказательство рецепторной роли фарнезола для потенциал-зависимого Ca 2+ был описан электрофизиологами Roullet et al. (1999) и Люфт и др. (1999). Для получения дополнительной информации см. De Loof and Schoofs (2019a, b).
(1999) и Люфт и др. (1999). Для получения дополнительной информации см. De Loof and Schoofs (2019a, b).
В комбинации возникает картина, что фарнезол / ДУТ действуют на поддержание низкого уровня внутриклеточного Ca 2+ , одновременно подавляя приток Ca 2+ через (некоторые типы) каналов Ca 2+ и действуя как агонисты Ca 2+ насосы для удаления излишков Ca 2+ . Это заставило Де Луфа и Шуфа (2019b) заявить, что мембранный рецептор (рецепторы) фарнезола / JH представляет собой интегрированную систему гомеостаза Ca 2+ в целом.Подобным образом могут действовать даже экдистероиды и гидрофобные стероидные гормоны позвоночных.
Ядерный рецептор (ы) для ювенильных гормонов: толерантность к метопрену (Met), предполагаемый рецептор ядерного ювенильного гормона насекомых, остается спорным
Ямамото (1988) предположил, основываясь на убедительных экспериментальных результатах, что мембранный белок опосредует эффект JH, который включает кальций и киназу C.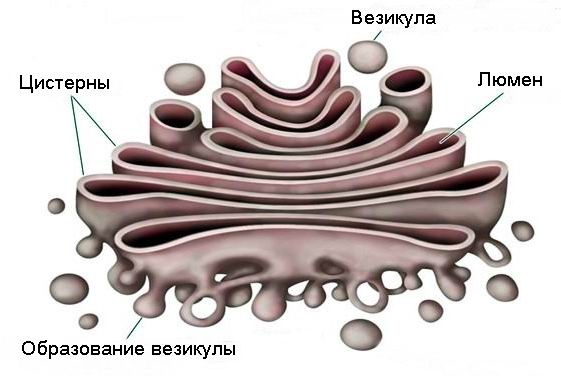 Много позже Jindra et al. (2015a, b) высказали мнение, что толерантный к метопрену фактор транскрипции является, по их мнению, ключевым / главным рецептором для JH: нет необходимости в мембранном рецепторе, Ca 2+ и киназе C.Эта точка зрения получила довольно широкое признание среди молекулярных биологов, но не среди клеточных биологов. Основное возражение состоит в том, что до настоящего времени не было экспериментально продемонстрировано, что фарнезол / JH, которые являются высокогидрофобными молекулами, когда-либо проникают в ядро с его внутренней гидрофильной водянистой средой. Поскольку связывание in situ между JH и его Met-транскрипционным фактором внутри ядра не было экспериментально доказано, Met не удовлетворяет необходимым условиям, чтобы быть классифицированным как «настоящий рецептор».По словам Де Луфа и Шуфса (2019a, d, e), нет никаких проблем с тем, чтобы классифицировать НДПИ как цель JH . Более того, вполне вероятно, что Met является чувствительной к Ca 2+ мишенью (De Loof and Schoofs, 2019e, и эта статья).
Много позже Jindra et al. (2015a, b) высказали мнение, что толерантный к метопрену фактор транскрипции является, по их мнению, ключевым / главным рецептором для JH: нет необходимости в мембранном рецепторе, Ca 2+ и киназе C.Эта точка зрения получила довольно широкое признание среди молекулярных биологов, но не среди клеточных биологов. Основное возражение состоит в том, что до настоящего времени не было экспериментально продемонстрировано, что фарнезол / JH, которые являются высокогидрофобными молекулами, когда-либо проникают в ядро с его внутренней гидрофильной водянистой средой. Поскольку связывание in situ между JH и его Met-транскрипционным фактором внутри ядра не было экспериментально доказано, Met не удовлетворяет необходимым условиям, чтобы быть классифицированным как «настоящий рецептор».По словам Де Луфа и Шуфса (2019a, d, e), нет никаких проблем с тем, чтобы классифицировать НДПИ как цель JH . Более того, вполне вероятно, что Met является чувствительной к Ca 2+ мишенью (De Loof and Schoofs, 2019e, и эта статья).
Фарнезол / JH влияет на многие другие мишени, большинство из которых находится в мембранах, как указывалось ранее (раздел «Связь между Ca 2+ , накачка Sarco (Endo) Plasmatic Reticulum Ca 2+ -атпазами и эндогенными сесквитерпеноидами»). Насколько нам известно, данные о ядерных рецепторах фарнезола у хордовых отсутствуют.Вигглсворт (1969) предположил, что разница в биологической активности примерно 40 соединений, которые он тестировал в типичном биоанализе JH, была скорее количественной, чем качественной, и что такие соединения сначала действуют на плазматическую мембрану, а в результате — на ядро. Wigglesworth (1969) также сообщил, что аналоги JH не активны в водной среде или в присутствии смачивающих агентов. Это ставит в центр внимания проблему гидрофобности, которая очень актуальна для сесквитерпеноидов и некоторых стероидных гормонов (раздел «Проблема гидрофобности фарнезола / фарнезол-подобного сесквитерпеноидного транспорта и способ действия».«Режим водного пути» в сравнении с липидным мембранным путем или «инбромным путем»).
Поиск все еще продолжается: сколько участков синтеза фарнезола / фарнезол-подобного сесквитерпеноида находится в организме?
Положение с насекомыми лучше всего задокументировано
Есть несколько причин, по которым больше экспериментальных данных о месте синтеза и функциях фарнезола было продвинуто на насекомых, а не на каких-либо хордовых / позвоночных. Во-первых, до недавнего времени (De Loof et al., 2015; De Loof and Schoofs, 2019e) фарнезол не был известен ни как гормон, ни как «инбром» (De Loof et al., 2015) у позвоночных. Считалось, что его единственная роль в хордовых — это один из промежуточных звеньев в пути биосинтеза мевалоната, который приводит к синтезу сквалена, а также холестерина и стероидов, не выполняя при этом никакой самостоятельной функции. По логике, это должно было измениться, когда электрофизиологи Roullet et al. (1999) и Люфт и др. (1999) продемонстрировали, что фарнезол является мощным блокатором потенциалзависимых каналов Ca 2+ N-типа в головном мозге некоторых грызунов и людей. Это не так. Следовательно, вопрос о том, где синтезируются эндогенные ДУТ, никогда не становился предметом изучения хордовых. В отличие от насекомых, он начался с новаторской работы Копека (1922) около века назад, когда он обнаружил, что мозг насекомого является эндокринной железой. Позже ключевыми пионерами были сэр Винсент Вигглсворт с его открытием JH, синтезированного CA, и Кэрролл М. Уильямс с случайным открытием, что брюшко самцов бабочек Hyalophora cecropia является хранилищем большого количества JH (ссылки в Riddiford, 1994; Watt and Davey, 1996; Nijhout, 1998).Прошло много лет, прежде чем стало ясно, что СА — не единственное место синтеза фарнезола / JH. Косвенное указание в пользу множественных сайтов синтеза фарнезола / JH было выдвинуто Castillo-Gracia и Couillaud (1999). Они обнаружили, что каталитический сайт фермента фарнезил-дифосфатсинтазы, который играет роль в биосинтезе изопреноидов, присутствует в образцах головного мозга, яичников, жирового тела и КА (= все ткани с активными системами Гольджи), но не в мышцах.
Это не так. Следовательно, вопрос о том, где синтезируются эндогенные ДУТ, никогда не становился предметом изучения хордовых. В отличие от насекомых, он начался с новаторской работы Копека (1922) около века назад, когда он обнаружил, что мозг насекомого является эндокринной железой. Позже ключевыми пионерами были сэр Винсент Вигглсворт с его открытием JH, синтезированного CA, и Кэрролл М. Уильямс с случайным открытием, что брюшко самцов бабочек Hyalophora cecropia является хранилищем большого количества JH (ссылки в Riddiford, 1994; Watt and Davey, 1996; Nijhout, 1998).Прошло много лет, прежде чем стало ясно, что СА — не единственное место синтеза фарнезола / JH. Косвенное указание в пользу множественных сайтов синтеза фарнезола / JH было выдвинуто Castillo-Gracia и Couillaud (1999). Они обнаружили, что каталитический сайт фермента фарнезил-дифосфатсинтазы, который играет роль в биосинтезе изопреноидов, присутствует в образцах головного мозга, яичников, жирового тела и КА (= все ткани с активными системами Гольджи), но не в мышцах. , ткань, которая не участвует в значительной секреции белка.В CA сверхэкспрессируется ген, кодирующий фарнезилдифосфатсинтазу.
, ткань, которая не участвует в значительной секреции белка.В CA сверхэкспрессируется ген, кодирующий фарнезилдифосфатсинтазу.
Эндокринный, экзокринный и голгикринный фарнезол / синтез ювенильного гормона
Последовательные шаги в этом развитии недавно были рассмотрены Де Луфом и Шуфсом (2019d, e). Короче говоря, до 1995 г. предполагалось, что КА является единственным местом синтеза JH. Ситуация изменилась, когда Боровский и др. (1994a, b) сообщили, что, помимо КА, и мужские и женские половые железы комаров также синтезировали JH de novo .Еще два десятилетия спустя Paroulek и Sláma (2014) уточнили это дополнение, показав, что у моли H. cecropia , модельного насекомого, из которого был первоначально извлечен и химически идентифицирован JH I, JH синтезируется de novo в мужские дополнительные железы (= до некоторой степени аналог предстательной железы млекопитающих), и это на стадии развития, на которой CA неактивны. Они назвали это «экзокринным синтезом JH». Они также сообщили, что эта мужская добавочная железа (MAG) JH не секретируется в гемолимфу, а вместо этого покидает мужское тело вместе с секреторными белками, которые во время совокупления переносятся в женскую половую систему.Эта избирательность или, лучше сказать, однонаправленность секреции JH побудила Де Луфа и Шуфа (2019d) искать объяснение этому необычному на первый взгляд транспорту гидрофобного / липофильного гормона. При анализе экспериментальных данных Schmialek (1961) возникла идея, что наиболее правдоподобный и логичный ответ на вопрос, как фарнезол может попасть в просвет пищеварительного тракта личинок мучных червей, заключался в том, что для этого требуется ключевой вклад систем Гольджи. эпителиальные клетки кишечника.Действительно, система Гольджи с ее мембранами, содержащими различные ферменты, включая некоторые ферменты P450, семейство ферментов, играющих важную роль как в биосинтезе, так и в инактивации 20-гидроксиэкдизона и JH (Iga and Kataoka, 2012), является единственной клеточной органеллой.
Они также сообщили, что эта мужская добавочная железа (MAG) JH не секретируется в гемолимфу, а вместо этого покидает мужское тело вместе с секреторными белками, которые во время совокупления переносятся в женскую половую систему.Эта избирательность или, лучше сказать, однонаправленность секреции JH побудила Де Луфа и Шуфа (2019d) искать объяснение этому необычному на первый взгляд транспорту гидрофобного / липофильного гормона. При анализе экспериментальных данных Schmialek (1961) возникла идея, что наиболее правдоподобный и логичный ответ на вопрос, как фарнезол может попасть в просвет пищеварительного тракта личинок мучных червей, заключался в том, что для этого требуется ключевой вклад систем Гольджи. эпителиальные клетки кишечника.Действительно, система Гольджи с ее мембранами, содержащими различные ферменты, включая некоторые ферменты P450, семейство ферментов, играющих важную роль как в биосинтезе, так и в инактивации 20-гидроксиэкдизона и JH (Iga and Kataoka, 2012), является единственной клеточной органеллой. это может объяснить однонаправленный транспорт JH вместе с секреторными белками в Hyalophora . Так родилась идея «синтеза и секреции голгикрина фарнезола / FLS». Сразу же возник вопрос, совместима ли такая «активность голгикрина» с синтезом ЮГ СА.
это может объяснить однонаправленный транспорт JH вместе с секреторными белками в Hyalophora . Так родилась идея «синтеза и секреции голгикрина фарнезола / FLS». Сразу же возник вопрос, совместима ли такая «активность голгикрина» с синтезом ЮГ СА.
Железистые клетки тела Аллата имеют системы Гольджи: возникает проблема
Первое упоминание о наличии активных систем Гольджи в КА было опубликовано Шаррером (1964) у таракана Leucophaea maderae . Подобные результаты были позже опубликованы Брэдли и Эдвардсом (1979) в CA по домашнему крикету Acheta domesticus . Хотя с давних пор было известно, что системы Гольджи играют роль в секреции белков, возможность того, что «фактор ювенилизации», секретируемый КА, может быть белком, в то время не рассматривалась.В то время на сцене доминировал образ мышления, основанный на фарнезоле (Schmialek, 1961). Фактически, это продолжается до сегодняшнего дня. Отсюда вопрос: «Какой тип белка / пептида секретирует Гольджи СА?» до сих пор остается без ответа. Нельзя исключить, что ключевой функцией CA является , а не секреция JH, а еще неизвестный вид белкового / пептидного фактора роста. В частности, в последнее десятилетие было предпринято несколько анализов пептидома КА.Лю и др. (2012) смогли отнести в общей сложности 41 ионную массу, присутствующую в комплексе CC-CA пятой возрастной стадии , Bombyx mori , но не было обнаружено четкого кандидата на пептид, который секретируется только Гольджи СА, в этом или другом (например, Nouzova et al., 2018b) масс-спектрометрические исследования.
Нельзя исключить, что ключевой функцией CA является , а не секреция JH, а еще неизвестный вид белкового / пептидного фактора роста. В частности, в последнее десятилетие было предпринято несколько анализов пептидома КА.Лю и др. (2012) смогли отнести в общей сложности 41 ионную массу, присутствующую в комплексе CC-CA пятой возрастной стадии , Bombyx mori , но не было обнаружено четкого кандидата на пептид, который секретируется только Гольджи СА, в этом или другом (например, Nouzova et al., 2018b) масс-спектрометрические исследования.
Следует помнить, что Sláma (2013, 2015) давно постулировал возможность того, что «настоящий JH» может быть белком / пептидом, секретируемым Гольджи из СА. Почти никто не слушал. На наш взгляд, ответ на этот вопрос имеет первостепенное значение для того, чтобы избежать продолжения работы некоторых исследователей, исходя из неверных предпосылок и гипотез.
Возможно, предполагаемый «пептид, стимулирующий рост Гольджи» еще не найден, потому что он мог полностью отсутствовать на ранних этапах метаморфоза и вплоть до появления взрослых особей.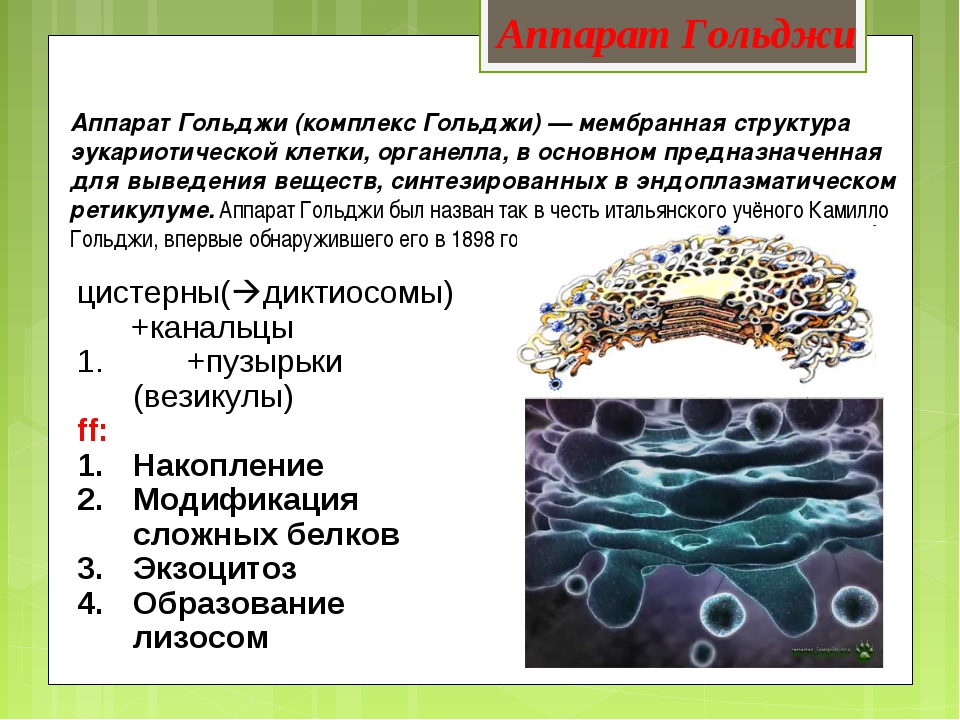 В такой ситуации можно выдвигать только косвенные аргументы. Короткий нейропептид F может быть хорошим кандидатом (аргументы и ссылки в De Loof and Schoofs, 2019b; Fadda et al., 2019). Когда пептид sNPF вводили взрослым самкам саранчи, стимуляция развития яичников была настолько выраженной, что Cerstiaens et al. (1999) думали, что они открыли мощный гормон роста насекомых или, альтернативно, гормон высвобождения для такого гормона роста.Более поздние исследования показали, что это гораздо более сложная проблема и что sNPF, помимо других функций, играет важную роль в контроле за кормлением (Carlson et al., 2013; Fadda et al., 2019). Кроме того, изменения в микроРНК также могут играть роль (Nouzova et al., 2018a).
В такой ситуации можно выдвигать только косвенные аргументы. Короткий нейропептид F может быть хорошим кандидатом (аргументы и ссылки в De Loof and Schoofs, 2019b; Fadda et al., 2019). Когда пептид sNPF вводили взрослым самкам саранчи, стимуляция развития яичников была настолько выраженной, что Cerstiaens et al. (1999) думали, что они открыли мощный гормон роста насекомых или, альтернативно, гормон высвобождения для такого гормона роста.Более поздние исследования показали, что это гораздо более сложная проблема и что sNPF, помимо других функций, играет важную роль в контроле за кормлением (Carlson et al., 2013; Fadda et al., 2019). Кроме того, изменения в микроРНК также могут играть роль (Nouzova et al., 2018a).
Аппарат Гольджи как вероятный субклеточный сайт синтеза фарнезола / фарнезол-подобного сесквитерпеноида: происхождение этой идеи
Не только вопрос, какой белок / пептид секретируется Гольджи из CA, но и вопросы, где именно фарнезол / FLS синтезируется в клетках железы и как он покидает клетки CA, остаются без ответа и заслуживают инновационного мышления.
Идентификация Фарнезола и Фарнезала в экскрементах мучного червя Питера Шмиалека
Schmialek (1961) был первым, кто химически охарактеризовал два соединения, которые были активны в тесте Tenebrio для определения активности JH, а именно, сесквитерпеноиды фарнезол и фарнезал. Они были извлечены не из тканей или экстрактов всего тела, а из экскрементов мучного червя Tenebrio molitor . Был задан вопрос, как эти соединения могут попасть в просвет пищеварительного тракта, но не получил ответа.Гипотеза заключалась в том, что их транспорт достигался через систему мальпигиевых канальцев как продукты деградации истинного — но в то время еще не идентифицированного — JH. Но система мальпигиевых канальцев не переносит такие гидрофобные соединения. Пересмотрев данные Schmialek, De Loof и Schoofs (2019d) логически пришли к выводу, что более вероятное объяснение состоит в том, что система Гольджи эпителиальных клеток кишечника играет роль в однонаправленном транспорте эндогенных сесквитерпеноидов в просвет кишечника.
Paroulek и Sláma: в мужских добавочных железах
H. cecropia экзокринный ювенильный гормон I транспортируется однонаправленноКак уже упоминалось ранее, Paroulek и Sláma (2014) решили проблему сайта синтеза высоких количеств JH-активного материала в MAG H. cecropia. В течение многих лет считалось, что MAG функционируют только как репозиторий для JH, которые уже были синтезированы в CA (Shirk et al., 1976). Однако авторы доказали, что не СА, а сами МАГ синтезируют JH, который они накапливают, и что они не выделяют его в гемолимфу. Следствием этого является то, что MAG JH I не следовало называть «гормоном». Позже, когда было показано, что СА также продуцируют JH I, который они действительно выделяют в гемолимфу, он по праву приобрел статус «гормона», по крайней мере, для JH, которые попадают в гемолимфу. Без ответа остался интригующий вопрос: как объяснить, что MAG-JH не диффундирует в гемолимфу, а вместо этого однонаправленно транспортируется вместе с секреторными белками, продуцируемыми MAG, в женскую генитальную систему во время совокупления.
Проблема гидрофобности в транспорте и способе действия фарнезола / фарнезол-подобного сесквитерпеноида. «Режим водного пути» в сравнении с липидным мембранным способом или «инбромным путем»
На сегодняшний день почти все согласны с тем, что после своего синтеза где-то в клетках железы СА, JH свободно диффундирует через цитоплазму к плазматической мембране клеток железы, затем внедряется в ее липидный бислой и затем «прыгает». »Липопротеинам, циркулирующим в гемолимфе. Эта точка зрения не учитывает последствия наиболее важного химического свойства фарнезола / JH, а именно того, что он очень умеренно растворим в воде.Таким образом, без гидрофобного носителя он не может свободно диффундировать через водянистую / гидрофильную среду. В последних учебниках (например, Raven et al., 2019) уделяется внимание проблеме гидрофобности. Обозначение MAG-JH «экзокринным JH» Парулеком и Сламой (2014) предполагает другой способ транспортировки JH. После своего синтеза в самой системе Гольджи, JH присоединяется к гидрофобным частям (транспортных) белков, которые находятся на своем пути от RER к внешней стороне клетки, чтобы в конечном итоге оказаться в гемолимфе. По-видимому, это гидрофобное взаимодействие достаточно сильно, чтобы предотвратить диффузию JH через мембраны системы Гольджи.В таком сценарии экзокринный JH также будет выполнять эндокринную функцию, в отличие от MAG Hyalophora , потому что MAG-JH не попадает в гемолимфу и не переносится ею. Таким образом, путем логического вывода можно сделать вывод, что фарнезол / FLS после их синтеза в мембранах Гольджи (еще не доказано экспериментально!) Распределяется между мембранами Гольджи и гидрофобными участками аминокислот, присутствующими в Гольджи. просвет, где они могут быть дополнительно изменены.Поскольку и мембрана, и содержимое просвета Гольджи перемещаются к стороне trans , где происходит отщипывание, фарнезол / FLS также перемещаются. Мы предлагаем термин «липидный мембранный способ транспорта» или «внутрибромный способ транспорта» (De Loof et al., 2015) малых гидрофобных молекул для такого транспорта (рис. 4). Фактически, мембранная система клеток действует как жидкая гидрофобная система растворителей, через которую могут свободно диффундировать гидрофобные гормоны и другие растворенные вещества. Эта система масляных каналов дополняет «режим водных путей» для транспортировки, например, нефтепродуктов.г. водорастворимые гормоны: через кровь или через гидрофильную цитоплазму.
Рисунок 4. Две модели проникновения и внутриклеточного транспорта небольших небелковых / пептидных гормонов в клетках. (Левая панель) Согласно Карлсону и Секерису (1966) экдистероидный гормон линьки насекомых (20-гидроксиэкдизон или 20E), умеренно растворимый в воде, может проходить через плазматическую мембрану путем простой диффузии, не вызывая каких-либо сигналов (e .g., через Ca 2+ ) на уровне этой мембраны. Затем он диффундирует через цитоплазму и попадет в ядро. Здесь он (не) активирует определенные гены. В 1960–1970-х годах эта концепция была расширена и теперь применима и к липофильным / гидрофобным молекулам, таким как некоторые половые стероиды позвоночных, и к ювенильным гормонам насекомых. Позже эта модель была дополнена переносчиками цитоплазматических белков для транспорта липофильных / гидрофобных молекул через цитоплазму в ядро.Эта модель, несмотря на обоснованную критику, до сих пор широко используется. (правая панель) «Модель внутримембранного транспорта» или «модель инброма». В частности, для гидрофобных малых гормонов, например сложных эфиров ювенильного гормона фарнезола, модель инбромного механизма действия была первоначально предложена Де Луфом (2015). В нем говорится, что такие гидрофобные гормоны транспортируются в крови / гемолимфе с помощью липопротеина, который доставляет гормон на плазматическую мембрану, в которую гормон будет проникать посредством гидрофобного взаимодействия.Затем гормон начнет диффундировать через всю систему всех связанных мембранных систем: плазматическую мембрану, гладкую эндоплазматическую сеть (ГЭР) через эндоплазматический ретикулум (РЭР), ядерную оболочку, аппарат Гольджи, митохондрии и т. Д. Эти двухслойные липидные мембраны жидкие. и действуют как растворитель и транспортная система для гидрофобных молекул. Во время диффузии гидрофобные молекулы будут сталкиваться со многими белками, закрепленными в мембранах. Все они имеют гидрофобные трансмембранные участки аминокислотных цепей.Некоторые мембранные белки могут действовать как настоящие рецепторы. Важно взаимодействие с акторами системы гомеостаза Ca 2+ . Светло-зеленый цвет в верхней части этого рисунка не означает, что здесь концентрация Ca 2+ ниже, а для того, чтобы детали были читаемыми. Внутриклеточные градиенты Ca 2+ (рис. 1) не представлены. Собственная работа, измененная после De Loof (2017a, открытый доступ): разрешение на авторское право в соответствии с лицензией Creative Commons.
Функция (и) фарнезола / фарнезол-подобных сесквитерпеноидов в мембранах Гольджи
Sarco (эндо) плазматический ретикулум Ca
2+ -АТФаза и SPCA1a Ca 2+ / Mn 2+ Транспортная АТФаза имеет сайт связывания для некоторых сесквитерпеноидовМы рассматриваем только растительный токсин тапсигаргин, потому что это сесквитерпеноид, который, по нашему мнению, вероятно, действует путем вытеснения естественного эндогенного сесквитерпеноидного лиганда (ов) с его сайта связывания на насосе SERCA.Этим лигандом может быть сам фарнезол или фарнезол-подобный сесквитерпеноид (FLS) (De Loof, 2017a). Как уже упоминалось в разделе «Еще одна« искра »понимания: Sarco (эндо) плазматический ретикулум Ca 2+ -АТФаза, блокатор помпы, тапсигаргин, как и фарнезол / ювенильные гормоны, сесквитерпеноид», как SERCAs, так и Ca 2 + / Mn 2+ Ca 2+ -транспортные АТФазы имеют сайт связывания для растительного токсина тапсигаргин, который блокирует эти насосы. Этот токсин представляет собой сесквитерпеновый лактон.Он связывается с SERCA в гидрофобной воронкообразной полости, открытой для цитозоля, образованного трансмембранными петлями TM3, TM5 и TM7 насоса SERCA, и предотвращает перемещение спиралей относительно друг друга. Девять из 10 трансмембранных петель SERCA претерпевают перестройки во время цикла откачки, что позволяет высвобождать Ca 2+ в просвет ER и Гольджи и, на цитоплазматической стороне, создавать путь для входа нового Ca 2+ иона (ссылки см. В De Loof, 2017a).На сегодняшний день (2020 г.) экспериментальное подтверждение этой гипотезы или идентификация других предполагаемых эндогенных лигандов все еще отсутствуют. Тот факт, что аппарат Гольджи, по-видимому, является основным местом синтеза фарнезола / FLS, подтверждает гипотезу о том, что такие соединения могут быть, так или иначе, агонистами насосов Ca 2+ , которые играют важную роль в RER-Golgi. секреторный путь. Поскольку тапсигаргин действует как блокатор SERCA у различных эукариот и поскольку SERCA очень хорошо консервативны в эволюции, можно предположить, что связывание также хорошо сохраняется.Однако это требует экспериментальной проверки.
Способствуя самозакрыванию мембраны? Фарнезол как мембранный «ликвидатор-пластификатор»?
Отличительной особенностью мембран Гольджи является их высокая гибкость и способность к самозакрыванию. В активных системах Гольджи везикулы, которые отщепляются от RER, будут сливаться с мембранами Гольджи на его стороне cis . На стороне trans происходит обратное. Везикулы trans , в свою очередь, сливаются с плазматической мембраной и выводят свое содержимое наружу клетки.Все эти слияния и защемления требуют мгновенного закрытия вовлеченных мембран; в противном случае электрические свойства секретирующих клеток будут серьезно нарушены из-за потери неорганических ионов, которые градиентно распределяются по мембранам. По своей природе сесквитерпеноиды являются очень гибкими молекулами, на что указывает их большое количество вращающихся связей (7 согласно PubChem) и форма подковы. Кроме того, они могут быть закреплены в части липидного бислоя мембран, как показано для прикрепления Ras к мембране Schafer et al.(1989). Уже в Barber et al. (1981) сообщили, что JH и два аналога JH могут модулировать физические свойства фосфолипидных бислоев. Это открыло перспективу того, что некоторые из их физиологических эффектов могут быть отредактированы посредством их влияния, в частности, на молекулярную организацию мембранных липидов. Такой эффект, например, на вязкость, для природных полиизопреноидных спиртов (включая фарнезол / FLS) был дополнительно документирован Murgolo et al. (1989), которые определили подковообразную форму таких соединений, а также их большое количество вращающихся связей, два свойства фарнезола / JH, которые только недавно были упомянуты как функционально важные в литературе по эндокринологии насекомых (De Loof and Schoofs, 2019c , д).Murgolo et al. (1989) (также) предположили роль в гликозилировании белков, другой важной активности в системах Гольджи. Таким образом, на наш взгляд, фарнезол / ДУТ в аппарате Гольджи может выполнять роль мембранного «ликвидатора-пластификатора». Возможно, их можно рассматривать как биологические аналоги фталатов, которые используются в качестве пластификаторов в производстве поливинилхлоридных (ПВХ) пластмасс. Фарнезол / FLS также может играть роль в гликозилировании белков в Гольджи.
В предыдущей статье De Loof and Schoofs (2019c) предложили модель для другой, независимой от транскрипции, роли фарнезола через механизм пренилирования, «вставленного между некоторыми спиралями рецепторов, связанных с G-белком».Это связано с высокой гибкостью фарнезола / ДУТ. Самозакрывание мембран, конечно, также важно во время митоза, процесса, который требует активности Гольджи (Smith and Malkowski, 2019).
Почему необходимы множественные участки синтеза фарнезола / фарнезол-подобных сесквитерпеноидов в организме?
Чем крупнее животное, тем выше его мембранный оборот. У насекомых КА у личинок может продуцировать достаточно JH, чтобы смазывать плазматические мембраны всех клеток. Этому может способствовать тот факт, что сложные эфиры фарнезола с активностью JH (которая на несколько порядков превышает биологическую активность самого фарнезола) гарантируют, что для размещения всего тела необходимы лишь очень низкие количества JH.
Проблема возникает, когда CA перестают секретировать JH, в то время как внутри некоторые ткани продолжают выполнять функцию, которая требует высокого оборота мембраны. Так обстоит дело с MAG H. cecropia . Но даже на взрослой стадии, когда КА активны, может потребоваться дополнительное поступление фарнезола, например, в гонады с их многочисленными микроворсинками и секреторными пузырьками в некоторых типах клеток как у мужчин, так и у женщин (Roth and Porter, 1964; Боровский и др., 1994а, б).
Наша гипотеза состоит в том, что у насекомых секреции CA фарнезола достаточно для удовлетворения потребностей в гибкости плазматической мембраны для эндоцитоза и экзоцитоза, т.е.г., при иммунных реакциях. Для интенсивного синтеза и высвобождения белка через систему RER – Golgi, по-видимому, необходимы дополнительные сайты синтеза фарнезола / FLS.
Фарнезол / фарнезолоподобные сесквитерпеноиды: наиболее распространенные гормоны животных?
Да, это неизбежный вывод из данной обзорной статьи. Почему этого раньше не предлагали? Во-первых, по историческим причинам. Впервые фарнезол был идентифицирован не у животных, а в экстрактах цветов, которые использовались в парфюмерии.Его физиологическая роль в растениях до сих пор до конца не изучена. Вероятны те же функции, что и в клетках животных (эта статья). Цветы — это структуры, в которых происходит массовое деление клеток, активность, для которой гибкость и обновление плазматической мембраны, по определению, является серьезной проблемой. Во-вторых, функция «ликвидатора мембран» или «смазки для мембран» — последнее, о чем могло бы подумать большинство исследователей. Тем не менее, как мы знаем из работы машины, движущиеся части необходимо смазывать.Но эта проблема гибкости / смазки не ограничивается только клетками животных, а всеми клетками эукариот. Это может быть объяснением вездесущности синтеза фарнезола / FLS повсеместным путем биосинтеза мевалоната. В-третьих, только недавно ключевая роль пути биосинтеза мевалоната в гомеостазе Ca 2+ стала очевидной (De Loof and Schoofs, 2019e).
Фарнезол: также входит в состав феромонной системы животных, например, в растениях?
В течение долгого времени фарнезол был наиболее известен как компонент цветочных экстрактов, используемых в парфюмерной промышленности.Его основная физиологическая роль в растениях до сих пор плохо изучена. В физиологии животных возможная роль как компонента «запаха» (наземных) животных еще не рассматривалась. На наш взгляд, нет оснований полагать, что в отношении «(физиологически вторичного) парфюмерного аспекта» ситуация у животных должна сильно отличаться от ситуации у растений.
Перспективы будущих исследований
Перечислено лишь несколько возможных тем:
У позвоночных
Ключевой вопрос: является ли фарнезол / FLS гормоном у позвоночных? Какие стереоизомеры встречаются? Нужны ли помпы SERCA и SPCA агонист, подобный фарнезолу / ФЛС? Как такие агонисты будут присоединены: гидрофобным взаимодействием, пренилированием или еще каким-либо способом? Все ли ткани с активным Гольджи синтезируют фарнезол / FLS? Применима ли «модель инброма» к гидрофобным половым стероидам?
У насекомых и других протостомов
Определите белок или пептид, секретируемый Гольджи, присутствующим в СА.Закреплены ли ферменты, участвующие в синтезе ЮГ, в мембранах Гольджи? Почему «экзокринный JH» не диффундирует в компартмент гемолимфы? Оказывается ли фарнезол / ФЛС из-за своей гидрофобной природы в ядре? Как экзокринный JH комплементарен эндокринному JH?
Обсуждение
Фарнезол был впервые обнаружен в экстрактах цветов, которые используются в парфюмерной промышленности. Название «фарнезол» происходит от названия Vachellia farnesiana , посаженного в саду Одоардо Фарнезе в Риме.Насколько нам известно, точная физиологическая роль фарнезола в растениях до сих пор неизвестна. Но такое незнание функций фарнезола / ДУТ также распространяется на подавляющее большинство всех эукариот. Все они синтезируют фарнезол. Даже у позвоночных фарнезол в начале 2019 года был назван «благородным неизвестным» (De Loof and Schoofs, 2019e). Считалось, что его единственная функция заключается в том, чтобы действовать как одно из промежуточных звеньев хорошо задокументированного пути биосинтеза мевалоната и холестерина, не имея самостоятельной функции в физиологии клетки.Одна из причин такого мышления заключалась в том, что фарнезол не известен как гормон, инбром или какой-либо другой тип сигнальной молекулы у позвоночных. Также не известно, что у позвоночных есть стадия развития, на которой организм полностью лишен фарнезола / ФЛС. Наконец, еще не исследовано, вытесняет ли сесквитерпеноидный лактон тапсигаргин при связывании с SERCA или белками транспорта кальция Ca 2+ / Mn 2+ предполагаемый эндогенный лиганд, возможно, FLS.
Это резко контрастирует с ситуацией с насекомыми. У них есть такой этап в своем развитии. В начале последней личиночной стадии голометаболических насекомых единственная железа, которая синтезирует фарнезол / FLS (CA), полностью инактивируется, в результате чего титры фарнезола / FLS падают до нуля. Гормон, секретируемый КА, который в отсутствие вызвал метаморфоз, был назван «ювенильным гормоном». Röller et al. (1967) и Рёллер и Дам (1968) идентифицировали его как сложный эфир фарнезола.Сам фарнезол обладает биологической активностью в типичных биоанализах для определения активности JH (картину положительной реакции см. De Loof et al., 2014, открытый доступ). Его активность слабая по сравнению с гораздо более высокой активностью его сложных эфиров.
У грызунов и человека фарнезол, который биосинтезируется в головном мозге и других тканях, действует как мощный блокатор потенциалзависимых каналов Ca 2+ N-типа (Roullet et al., 1999) и Luft et al. (1999). Это открытие причинно связало фарнезол с контролем гомеостаза Ca 2+ .Однако по той или иной причине эти данные не привлекли внимание эндокринного сообщества позвоночных, но с некоторой задержкой они привлекли внимание эндокринологов насекомых, которые исследовали природу мембранного рецептора (ов) JH у насекомых (De Loof and Schoofs, 2019b). Вот почему в этой обзорной статье большинство данных и моделей взяты из эндокринологии насекомых: данные по позвоночным почти отсутствуют.
Тот факт, что все эукариоты, как одноклеточные, так и многоклеточные, продуцируют фарнезол, совместим с ключевой ролью в гомеостазе Ca 2+ .Действительно, Ca 2+ — самый распространенный токсин на Земле для всех эукариот; все они должны противодействовать притоку избыточного Ca 2+ из внеклеточной среды клеток.
Идея функциональной связи между Гольджи и фарнезолом / FLS возникла в результате случайного пересмотра (De Loof and Schoofs, 2019d) статьи Schmialek (1961). Это породило идею о том, что наиболее логичным объяснением того факта, что фарнезол обнаруживается в значительных концентрациях в экскрементах мучного червя Tenebrio , было то, что фарнезол должен однонаправленно переноситься из эпителиальных клеток кишечника в просвет кишечника.Единственная клеточная органелла, которая может сделать это возможным, — это система RER – Golgi. Paroulek и Sláma (2014) впервые показали, что JH I, который, как оказалось, был синтезирован самими MAG шелковой моли H. cecropia , а не в их СА, как предполагалось ранее, транспортируется однонаправленно не в гемолимфу, а в половую систему самки во время совокупления. Это странный способ транспортировки гидрофобного гормона, который, как предполагалось, свободно, а не однонаправленно, диффундирует в клетках.Возникает вопрос: возможно, система Гольджи участвует в производстве и транспортировке всех клеток с активным Гольджи?
При повторном изучении более старой литературы стало очевидно, что присутствие активного Гольджи в СА уже было хорошо задокументировано с 1964 года (Scharrer, 1964; Bradley and Edwards, 1979), но эти данные были похоронены под огромным количеством новых разработок в эндокринное поле. Тем не менее, присутствие активных, секретирующих белок Golgi в CA заслуживает повторного анализа.Возможно, это может дать очень мощный фактор роста, важность которого может превышать важность JH, который может быть скорее вспомогательным, чем сам по себе фактором роста, идея, уже сформулированная Sláma (2013). Наши знания о гомеостазе Ca 2+ в CA ограничены (Allen et al., 1992a, b; Granger et al., 1995) и требуют дальнейшего изучения.
Фарнезол и его сложные эфиры — не единственные гидрофобные гормоны, присутствующие у животных. Некоторые половые стероиды, например, тестостерон и эстрадиол, также плохо растворяются в воде (см. PubChem).Кажется правдоподобным предположить, что основные механизмы их транспорта и способ действия на уровне плазматической мембраны могут быть аналогичны таковым у фарнезола / JH.
Выводы этой статьи основаны на сочетании экспериментальных данных и логических выводов. Мы полностью согласны с возражением о том, что на данный момент доступно слишком мало экспериментальных данных, чтобы полностью обобщить «данные о насекомых» на повсеместные механизмы, которые, как мы полагаем, действуют у всех эукариот. Тем не менее, мы поддерживаем наши обобщения, потому что мы предполагаем, что система Гольджи хорошо сохранилась в эволюции в течение миллиардов лет, как и путь биосинтеза мевалоната, который также вездесущ у эукариот, потому что оба они выполняют важную функцию, а именно, в Ca 2+ гомеостаз.В противном случае они бы исчезли в некоторых подразделениях эукариот, но этого не произошло.
В эндокринологии насекомых идея о том, что КА является уникальным местом синтеза JH (ов), энергично «защищалась» более двух десятилетий от несогласных исследователей: невозможно опубликовать «отклоняющиеся от нормы» экспериментальные данные. Сегодняшняя ситуация совсем иная. Если принять две основные функции Гольджи, а именно роль в гомеостазе Ca 2+ и в производстве фарнезола / FLS, новая парадигма утверждает, что это нормально и почти самоочевидно, что все белок-секретирующие клетки и ткани могут производить свои собственные ДУТ.Остается выяснить, существуют ли количественные и качественные различия (типы изомеров). Данные о том, что фарнезилдифосфатсинтаза в изобилии присутствует только в СА, а не в какой-либо другой ткани, которая, как известно, синтезирует фарнезол / FLS (Castillo-Gracia and Couillaud, 1999), предполагают, что СА действительно является главной железой, которая влияет на все клетки тела. По-видимому, некоторые (внутри) клеточные функции, в частности, в случае секреции активного белка с помощью RER-Golgi, массивное удаление Ca 2+ и оборот мембраны в Golgi требуют дополнительного локального сайта синтеза.
Этим обзором мы намерены стимулировать исследования как в фундаментальных, так и в медицинских науках, чтобы полностью изучить роль Гольджи. Неисправность системы Гольджи связана с несколькими заболеваниями, например, раком груди и болезнью Хейли-Хейли (Chen et al., 2019). Де Луф и Скуфс (2019a) также предположили, что дисфункциональный путь мевалоната может нарушать активность голгикрина (как это происходит у насекомых) и быть основным индуктором болезни Альцгеймера.
Мы также намерены внести свой вклад в устранение целенаправленного мышления об эволюции, которое до сих пор неосознанно пропагандируется в учебниках: см. «Случай производства молока» в этой статье, в которой многие люди все еще принимают результат за физиологическую необходимость.
Авторские взносы
Оба автора разработали и написали рукопись совместно.
Финансирование
Благодарим Исследовательский фонд Левенского университета (KU Leuven, Бельгия) за финансовую поддержку.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Благодарим Marijke Christiaens за помощь с цифрами.
Список литературы
Аллен, К. У., Герман, Б., и Грейнджер, Н. А. (1992a). Измерение концентрации свободного в цитозоле Ca2 + с помощью Fura-2 в клетках тела личинок Manduca sexta. J. Exp. Биол. 166, 253–266.
Google Scholar
Аллен, К. У., Янцен, В. П., и Грейнджер, Н. А. (1992b). Манипуляции с внутриклеточным кальцием влияют на синтез ювенильного гормона in vitro личиночными телами allata Manduca sexta. Мол. Клетка. Эндокринол. 84, 227–241.DOI: 10.1016 / 0303-7207 (92)
CrossRef Полный текст | Google Scholar
Барбер, Р. Ф., МакКерси, Б. Д., Даунер, Р. Г., и Томпсон, Дж. Э. (1981). Нарушение фосфолипидных мембран ювенильным гормоном. Biochem. Биофиз. Acta 643, 593–600. DOI: 10.1016 / 0005-2736 (81)
CrossRef Полный текст | Google Scholar
Барлоу, Л. Д., Нивлтова, Э., Агуиллар, М., Дакс Дж. Б. (2018). Сложный, дифференцированный Гольджи в предке эукариот. БМС Биол . 16:27. DOI: 10.1186 / s12915-018-0492499
CrossRef Полный текст | Google Scholar
Боровский Д., Карлсон Д. А., Хэнкок Р. Г., Рембольд Х. и ван Гендель Э. (1994a). Биосинтез ювенильного гормона III и I de novo добавочными железами самца комара. Насекомое. Биохим. Мол. Биол. 24, 437–444. DOI: 10.1016 / 0965-1748 (94)
CrossRef Полный текст | Google Scholar
Боровский Д., Карлсон Д. А., Уйвари И.и Прествич Г. Д. (1994b). Биосинтез ювенильного гормона III (10R) из фарнезоевой кислоты яичником Aedes aegypti. Arch. Насекомое. Биохим. Physiol . 27, 11–25. DOI: 10.1002 / arch.940270104
CrossRef Полный текст | Google Scholar
Брэдли, Дж. Т., и Эдвардс, Дж. С. (1979). Ультраструктура сердечного и allatum тела домашнего сверчка Acheta domesticus. Cell Tissue Res. 198, 201–208. DOI: 10.1007 / bf00232004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карлсон, М.А., Энелл, Л. Э., Нэссель, Д. Р. (2013). Распределение короткого нейропептида F и его рецептора в нейронных цепях, связанных с питанием у личинок дрозофилы. Клеточная ткань Res . 353, 511–523. DOI: 10.1007 / с 00441-013-16601664
CrossRef Полный текст | Google Scholar
Кейс, Р. М., Эйснер, Д., Герни, А., Джонс, О., Муаллем, С., и Верхратский, А. (2007). Эволюция кальциевого гомеостаза: от рождения первой клетки до вездесущей сигнальной системы. Cell Calcium 42, 345–350.DOI: 10.1016 / j.ceca.2007.05.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кастильо-Грасиа, М., и Куийо, Ф. (1999). Молекулярное клонирование и тканевая экспрессия фарнезилдифосфатсинтазы насекомых. Eur. J. Biochem. 262, 365–370. DOI: 10.1046 / j.1432-1327.1999.00385x
CrossRef Полный текст | Google Scholar
Cerstiaens, A., Benfekih, L., Zouiten, H., Verhaert, P., De Loof, A., and Schoofs, L. (1999). Led-NPF 1 стимулирует развитие яичников у саранчи. Пептиды 20, 39–44. DOI: 10.1016 / S0196-9781 (98) 00152151
CrossRef Полный текст | Google Scholar
Chen, J., De Raeymaecker, J., Brøndsted Hovgaard, J., Smaardijk, S., Vandecaetsbeek, I., Wuytack, F., et al. (2017). Взаимосвязь структура / активность ингибирования тапсигаргина очищенной Гольджи / секреторный путь Са2 + / Mn2 + транспортная АТФаза (SPCA1a). J. Biol. Chem. 292, 6938–6951. DOI: 10.1074 / jbc.M117.778431
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, Дж., Smaardijk, S., Mattelaer, C.A., Pamula, F., Vandecaetsbeek, I., Vanoevelen, J., et al. (2019). N-концевой Са2 + -связывающий мотив регулирует секреторный путь Са2 + / Mn2 + транспорта АТФазы SPCA1. J. Biol. Chem. 294, 7878–7891. DOI: 10.1074 / jbc.RA118.006250
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Де Луф, А. (2015). Из книги Дарвина «О происхождении видов путем естественного отбора». к «Эволюция жизни с коммуникативной деятельностью как самой сущностью и движущей силой» (= Мега-эволюция) . Life Exc. Биол. 3 (3), 153–187. DOI: 10.9784 / LEB3 (3) DeLoof.01
CrossRef Полный текст | Google Scholar
Де Луф, А. (2017a). Старение, вызванное кальцитоксом, уравновешивается эндогенными фарнезолоподобными сесквитерпеноидами: недооцененный эволюционно древний ключевой сигнальный путь. Commun. Интегр. Биол. 10 (4): e1341024. DOI: 10.1080 / 19420889.2017.1341024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Де Луф А. и Лагасс А.(1970). Ювенильный гормон и ультраструктурные свойства жирового тела взрослого колорадского жука Leptinotarsa decemlineata Say. Z. Zellforsch. Микроск. Анат. 106, 439–450. DOI: 10.1007 / bf00335785
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Де Луф, А., Де Хаес, В., Янссен, Т., и Скуфс, Л. (2014). Суть метаморфоза и старения насекомых: электрическая перестройка клеток, основанная на принципах Са2 + -гомеостаза, зависимого от ювенильного гормона. Gen. Comp. Эндокринол. 199, 70–85. DOI: 10.1016 / j.ygcen.2014.01.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Де Луф, А., Маршал, Э., Ривера-Перес, К., Норьега, Ф. Г., и Скуфс, Л. (2015). Фарнезол-подобные эндогенные сесквитерпеноиды у позвоночных: вероятный, но упускаемый из виду функциональный «инбром» антивозрастной аналог ювенильного гормона насекомых? Фронт. Эндокринол. (Лозанна). 5: 222 DOI: 10.3389 / fendo.2014.00222
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Де Луф, А., и Schoofs, L. (2019a). Болезнь Альцгеймера: является ли дисфункциональный путь биосинтеза мевалоната главным индуктором пагубных изменений в физиологии клетки? OBM Neurobiol . 3 (4): 46. DOI: 10.21926 / obm.neurobiol.1
6
CrossRef Полный текст | Google Scholar
Де Луф, А., Скуфс, Л. (2019b). Кальцитокс-метаморфоз у насекомых: система гомеостаза кальция (Ca2 +) как интегрированная первичная рецепторная система как для ювенильного гормона, так и для экдистероидов. Life Exc.Биол. 2019, 2325–081X. DOI: 10.9784 / LEB7 (2) DeLoof.01
CrossRef Полный текст | Google Scholar
Де Луф, А., Скуфс Л. (2019c). Флип-флоп сетчатка в микробных родопсинах в качестве шаблона для модели флип-флоп фарнезил / пренил в GPCR эукариот. Перед. Neurosci. 13: 465. DOI: 10.3389 / fnins.2019.00456
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Де Луф, А., Скуфс, Л. (2019d). Внутрипросветный фарнезол и фарнезал в пищеварительном канале мучного червя: необычное хранилище, раскрывающее скрытые эукариотические зависящие от Ca2 + -гомеостаза активность «голгикрина». Перед. Эндокринол. 10: 885. DOI: 10.3389 / fendo.2019.00885
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Де Луф, А., Скуфс, Л. (2019e). Механизм действия фарнезола, «благородного неизвестного», в частности, при Ca2 + -гомеостазе, и его эфиры ювенильных гормонов в эволюционной ретроспективе. Перед. Neurosci. 13: 141 DOI: 10.3389 / fnins.2019.00141
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фадда, М., Хасакиогуллари, И., Теммерман, Л., Свекла, И., Скуфс, Л. (2019). Регуляция питания и метаболизма нейропептидом F и коротким нейропептидом F у беспозвоночных. Перед. Эндокринол. (Лозанна) 10:64. DOI: 10.3389 / fendo.2019.00064
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Госави П., Глисон П. (2017). Функция структуры ленты Гольджи — раскрывается непреходящая тайна. BioEssays 39 (11): 6063. DOI: 10.1002 / bies.2017006063
CrossRef Полный текст | Google Scholar
Грейнджер, Н.А., Аллен, Л. Г., Стерджис, С. Л., Комбест, В., и Эберсоль, Р. (1995). Корпуса аллатных личинок табачного рогатого червя содержат аденилатциклазу, чувствительную к кальцию / кальмодулину. Arch. Насекомое Biochem. Physiol. 30, 149–164. DOI: 10.1002 / arch.940300206
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гроенендик Дж., Линч Дж. И Михалак М. (2004). Кальретикулин, Са2 + и кальциневрин — передача сигналов из эндоплазматического ретикулума. Мол. Ячейки. 17, 383–389.
Google Scholar
Джиндра, М., Ухлирова, М., Чарльз, Дж. П., Смыкал, В., и Хилл, Р. Дж. (2015b). Генетические доказательства функции белка Gce / Met bHLP-PAS в качестве рецептора ювенильного гормона. PLoS Genet . 11: E1005394. DOI: 10.1371 / journal.pgen.1005394
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Копец, С. (1922). Исследования о необходимости мозга в начале метаморфоза насекомых. Biol. Бык. 42, 322–342.DOI: 10.2307 / 1536759
CrossRef Полный текст | Google Scholar
Кребс, Дж., Агеллон, Л. Б., и Михалак, М. (2015). Ca2 + гомеостаз и стресс эндоплазматического ретикулума (ER): комплексный взгляд на передачу сигналов кальция. Biochem. Биофиз. Res. Comm. 460, 114–121. DOI: 10.1016 / j.bbrc.2015.02.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кулькарни-Госави П., Махуд К. и Глисон П. А. (2019). Форма и функция аппарата Гольджи: каркасы, цитоскелет и передача сигналов. FEBS Lett. 593, 2289–2305. DOI: 10.1002 / 1873-3468.13567
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю X., Нин X., Чжан Ю., Чен В., Чжао З. и Чжан К. (2012). Пептидомный анализ головного мозга и комплекса сердечных тел — всех тел Bombyx mori. Внутр. Дж. Пепт . 2012: 640359. DOI: 10.1156 / 2012/640359
CrossRef Полный текст | Google Scholar
Люфт, У. К., Бычков, Р., Голлаш, М., Гросс, В., Roullet, J. B., McCarron, D. A., et al. (1999). Фарнезол блокирует канал Ca2 + L-типа, нацеливаясь на альфа-субъединицу 1С. Артериосклер. Тромб. Васк. Биол. 19, 959–966. DOI: 10.1161 / 01.atv.19.4.959
CrossRef Полный текст | Google Scholar
Никотера П., Оррениус С. (1998). Роль кальция в апоптозе. Cell Calcium 23, 173–80. DOI: 10.1016 / s0143-4160 (98)
CrossRef Полный текст | Google Scholar
Nijhout, H.Ф. (1998). Гормоны насекомых. Princeton: Princeton University Press, 280.
Google Scholar
Ноузова, М., Этебари, К., Норьега, Ф. Г., и Асгари, С. (2018a). Сравнительный анализ репертуара микроРНК corpora allata-corpora cardiaca выявил существенные изменения при метаморфозе комаров. Insect Biochem. Мол. Биол. 96, 10–18. DOI: 10.1016 / j.ibmb.2018.03.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ноузова, М., Ривера-Перес, К., и Норьега, Ф. Г. (2018b). Omics Подходы к изучению синтеза ювенильных гормонов. Curr. Opin. Insect Sci. 29, 49–55. DOI: 10.1016 / j.cois.2018.05.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Paroulek, M., and Sláma, K. (2014). Продукция сесквитерпеноида, ювенильного гормона-1 (JH-I) и витамина E в дополнительных половых (коллекционных) железах взрослых самцов моли, Hyalophora cecropia (Linnaeus, 1758), (Lepidoptera: Saturniidae). Life Exc. Биол. 2 (2), 102–124. DOI: 10.9784 / LEB2 (2) Paroulek.01
CrossRef Полный текст | Google Scholar
Платтнер Х., Верхратский А. (2016). Неразделимый тандем: эволюция выбирает АТФ и Са2 + для управления жизнью, смертью и передачей клеточных сигналов. Philos. Пер. R. Soc. Лондон. B Biol. Sci. 371: 20150419. DOI: 10.1098 / rstb.2015.0419
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Pookottil, R. (2013). BEEM: Эволюционные механизмы, основанные на биологической эмерджентности: как виды направляют свою собственную эволюцию. Соединенное Королевство: Fossil Fish Publishing, 290.
Google Scholar
Рэйвен, П., Джонсон, Г., Лосос, Дж., Дункан, Т., Сингер, С., и Мейсон, К. (2019). Биология. New York: Mcgraw-Hill Education, 12-е издание, 1472 стр.
Google Scholar
Риддифорд, Л. М. (1994). Клеточные и молекулярные действия ювенильного гормона I. Общие соображения и преметаморфические действия . Adv. Insect Physiol. 24, 213–274. DOI: 10.1016 / S0065-2806 (08) 6008460083
CrossRef Полный текст | Google Scholar
Рёллер Х. и Дам К. Х. (1968). Химия и биология ювенильного гормона. Недавние прог. Horm. Res. 24, 651–680. DOI: 10.1016 / b978-1-4831-9827-9.5001850016
CrossRef Полный текст | Google Scholar
Рёллер, Х., Дам, К. Х., Суили, К. К., и Трост, Б. М. (1967). Структура ювенильного гормона. Angew. Chem. Int. Редактировать. 6, 179–180. DOI: 10.1002 / anie.196701792
CrossRef Полный текст | Google Scholar
Рулле, Дж. Б., Шпетгенс, Р. Л., Бурлингейм, Т., Фен, З. П., и Зампони, Г. В. (1999). Модуляция нейронных потенциалзависимых кальциевых каналов фарнезолом. J. Biol. Chem. 274, 25439–25446. DOI: 10.1074 / jbc.274.36.25439
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шафер, В. Р., Ким, Р., Стерн, Р., Хорнер, Дж., Ким, С. Х., и Райн, Дж. (1989). Генетическое и фармакологическое подавление онкогенных мутаций в генах РАС дрожжей и человека. Наука 245, 379–385. DOI: 10.1126 / science.2569235
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шаррер Б. (1964). H — изофизиологические исследования allatum тела Leucophaea maderae. IV. Ультраструктура во время нормального цикла активности . Z. Zellforsch. Мик. Ана. 62, 125–148.
Google Scholar
Schmialek, P. (1961). Die Identifizierung zweier in Tenebriokot und in Hefe vorkommender Substanzen mit Juvenilhormonwirkung. Z. Naturforsch. B 16, 461–464. DOI: 10.1515 / znb-1961-0710
CrossRef Полный текст | Google Scholar
Ширк П. Д., Дам К. Х. и Рёллер Х. (1976). Дополнительные половые железы как хранилище ювенильных гормонов у самцов моли цекропиевых. Z. Naturforsch . 31c, 199–200. DOI: 10.1515 / znc-1976-3-421
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Слама, К. (2013). Гормоны насекомых: более чем через 50 лет после открытия аналогов ювенильных гормонов насекомых (JHA, ювеноиды). Terrestr. Артроп. Ред. 6, 1–77.
Google Scholar
Слама, К. (2015). Новый взгляд на природу ювенильного гормона насекомых с особым упором на исследования, проведенные в Чешской Республике. евро . J. Entomol. 112, 567–590. DOI: 10.14411 / eje.2015.073
CrossRef Полный текст | Google Scholar
Smaardijk, S., Chen, J., Wuytack, F., and Vangheluwe, P. (2017). SPCA2 связывает приток Ca2 + через Orai1 с захватом Cad по Гольджи-секреторному пути. Тканевая клетка 49 (2 PtA), 141–149. DOI: 10.1016 // jtice.2016.09.004
CrossRef Полный текст | Google Scholar
Смит, В. Л., Малковски, М. Г. (2019). Взаимодействие жирных кислот, нестероидных противовоспалительных препаратов и коксибов с каталитическими и аллостерическими субъединицами циклооксигеназ-1 и -2. J. Biol. Chem. 294, 1697–1705. DOI: 10.1074 / jbc.TM118.006295
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Бэлен, К., Dode, L., Vanoevelen, J., Callewaert, G., De Smedt, H., et al. (2002). Ca2 + / Mn2 + насосы в аппарате Гольджи. Biochem Biophys Acta 742, 103–112. DOI: 10.1016 / j.bbamcr.2004.08.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Vandecaetsbeek, I., Vangheluwe, P., Raeymaekers, L., Wuytack, F., and Vanoevelen, J. (2011). Са2 + насосы эндоплазматического ретикулума и аппарата Гольджи. Колд Спринг Харб . Перспектива. Биол .3 (5): а004184. DOI: 10.1101 / cshperspect.a004184
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ватт, Г. Р., и Дэйви, К. Г. (1996). Клеточные и молекулярные действия ювенильного гормона. II. Роль ювенильного гормона у взрослых насекомых . Adv. Insect Physiol. 26, 1–55. DOI: 10.1016 / S0065-2806 (08) 600300032
CrossRef Полный текст | Google Scholar
Вигглсворт, В. Б. (1969). Химическая структура и активность ювенильного гормона: сравнительные тесты на Rhodnius prolixus. J. Insect Physiol. 15, 73–94. DOI: 10.1016 / 0022-1910 (69)
CrossRef Полный текст | Google Scholar
Wuytack, F., Raeymaekers, L., и Missiaen, L. (2003). PMR1 / SPCA насосы Ca2 + и роль аппарата Гольджи как хранилища Ca2 +. Pflugers Arch. 446, 148–153. DOI: 10.1007 / s00424-003-10111015
CrossRef Полный текст | Google Scholar
Zhang, Y., Wang, Y., Read, E., Fu, M. Pei, Y., et al. (2020). G olgi Стресс-реакция, сероводородный метаболизм и внутриклеточный гомеостаз кальция . Антиоксид. Редокс-сигнал . 32, 583–601. DOI: 10.1089 / ars.2019.7824
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжу, Х., Траоре, К., Санто, А., Труш, М. А., Ли, Ю. Р. и др. (2016). Кислород и кислородное отравление: рождение концепций. React. Oxyg. Вид (Apex) 1, 1-8. DOI: 10.20455 / ros.2016.801
PubMed Аннотация | CrossRef Полный текст | Google Scholar
.