общая характеристика, строение; свойства и получение простых веществ — урок. Химия, 8–9 класс.
Щелочными металлами называются химические элементы-металлы \(IA\) группы Периодической системы Д. И. Менделеева: литий \(Li\), натрий \(Na\), калий \(K\), рубидий \(Rb\), цезий \(Cs\) и франций \(Fr\).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. Поэтому для всех металлов группы \(IA\) характерна степень окисления \(+1\).
Этим объясняется сходство свойств всех щелочных металлов.
Для них (сверху вниз по группе) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
- каменная соль (хлорид натрия \(NaCl\)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na2SO4 \(·\) 10h3O,
- сильвин — хлорид калия \(KCl\),
- сильвинит — двойной хлорид калия-натрия \(KCL\) \(·\)\(NaCl\) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами \(IA\) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.

Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ=1,01 г/см3, у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Все щелочные металлы активно реагируют с водой, выделяя из неё водород.
Пример:
2Na+2h3O=2NaOH+h3↑.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
В расплаве хлорида натрия присутствуют ионы:
NaCl⇄Na++Cl−.
При электролизе
на катоде восстанавливаются катионы Na+, а на аноде окисляются анионы Cl−:
катод (\(–\)): 2Na++2e=2Na,
анод (\(+\)): 2Cl−−2e=Cl2↑.
Суммарное уравнение реакции при электролизе расплава хлорида натрия:
2NaCl→2Na+Cl2↑.
Источники:
Иллюстрация: https://arhivurokov.ru/multiurok/html/2017/02/26/s_58b332582fb94/img1.jpg
www.yaklass.ru
Химические свойства щелочных металлов.
Щелочными металлами (ЩМ) называют все элементы IA группы таблицы Менделеева, т.е. литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
У атомов ЩМ на внешнем электронном уровне находится только один электрон на s-подуровне, легко отрывающийся при протекании химических реакций. При этом из нейтрального атома ЩМ образуется положительно заряженная частица – катион с зарядом +1:
М0 – 1 e → М+1
Семейство ЩМ является наиболее активным среди прочих групп металлов в связи с чем в природе обнаружить их в свободной форме, т.е. в виде простых веществ невозможно.
Простые вещества щелочные металлы являются крайне сильными восстановителями.
Взаимодействие щелочных металлов с неметаллами
с кислородом
Щелочные металлы реагируют с кислородом уже при комнатной температуре, в связи с чем их требуется хранить под слоем какого-либо углеводородного растворителя, такого как, например, керосина.
Взаимодействие ЩМ с кислородом приводит к разным продуктам. С образованием оксида, с киcлородом реагирует только литий:
4Li + O2 = 2Li2O
Натрий в аналогичной ситуации образует с кислородом пероксид натрия Na2O2:
2Na + O2 = Na2O2,
а калий, рубидий и цезий – преимущественно надпероксиды (супероксиды), общей формулы MeO2:
K + O2 = KO2
Rb + O2 = RbO2
с галогенами
Щелочные металлы активно реагируют с галогенами, образуя галогениды щелочных металлов, имеющих ионное строение:
2Li + Br2 = 2LiBr бромид лития
2Na + I2 = 2NaI иодид натрия
2K + Cl2 = 2KCl хлорид калия
с азотом
Литий реагирует с азотом уже при обычной температуре, с остальными же ЩМ азот реагирует при нагревании. Во всех случаях образуются нитриды щелочных металлов:
6Li + N2 = 2Li3N нитрид лития
6K + N2 = 2K3N нитрид калия
с фосфором
Щелочные металлы реагируют с фосфором при нагревании, образуя фосфиды:
3Na + P = Na3Р фосфид натрия
3K + P = K3Р фосфид калия
с водородом
Нагревание щелочных металлов в атмосфере водорода приводит к образованию гидридов щелочных металлов, содержащих водород в редкой степени окисления – минус 1:
Н2 + 2K = 2KН-1гидрид калия
Н2 + 2Rb = 2RbН гидрид рубидия
с серой
Взаимодействие ЩМ с серой протекает при нагревании с образованием сульфидов:
S + 2K = K2S сульфид калия
S + 2Na = Na2S сульфид натрия
Взаимодействие щелочных металлов со сложными веществами
с водой
Все ЩМ активно реагируют с водой с образованием газообразного водорода и щелочи, из-за чего данные металлы и получили соответствующее название:
2HOH + 2Na = 2NaOH + H2↑
2K + 2HOH = 2KOH + H2↑
Литий реагирует с водой довольно спокойно, натрий и калий самовоспламеняются в процессе реакции, а рубидий, цезий и франций реагируют с водой с мощным взрывом.
с галогенпроизводными углеводородов (реакция Вюрца):
2Na + 2C2H5Cl → 2NaCl + C4H10
2Na + 2C6H5Br → 2NaBr + C6H5–C6H5
со спиртами и фенолами
ЩМ реагируют со спиртами и фенолами, замещая водород в гидроксильной группе органического вещества:
2CH3OH + 2К = 2CH3OК + H2↑
метилат калия
2C6H5OH + 2Na = 2C6H5ONa + H2
фенолят натрия
scienceforyou.ru
Щелочные металлы | CHEM-MIND.com
- НОВОСТИ
- КУРС ХИМИИ
- Дополнительные уроки
- Курс химии
- Разбор заданий ЕГЭ
- ТЕСТЫ
- Вариаты ЕГЭ
- Тесты по заданиям
- Тесты по темам
- СТАТЬИ
- ОПЫТЫ
- ТАБЛИЦА МЕНДЕЛЕЕВА
Поиск
CHEM-MIND.com- НОВОСТИ
- Новости
Алгоритм обучения для подготовки к ЕГЭ по химии
НовостиОтветы в тестах вновь правильно отображаются!
НовостиТехнические проблемы
НовостиНовый раздел на сайте
НовостиС 8 марта
- Новости
- КУРС ХИМИИ
- ВсеДополнительные урокиКурс химииРазбор заданий ЕГЭ
Разбор заданий ЕГЭ
Разбор задания №11 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №10 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №9 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №8 ЕГЭ по химии
- ВсеДополнительные урокиКурс химииРазбор заданий ЕГЭ
Разбор заданий ЕГЭ
- ТЕСТЫ
www.chem-mind.com
Щелочные металлы список и свойства
Химия изучает свойства металлов и неметаллов. А вы знали, что металлы бывают щелочные и не щелочные? А мы не только знаем, а и список вам дадим для успешной подготовки по предмету химии. Итак, щелочные металлы список уже приведен в периодической таблице Менделеева. Там все металлы главной подгруппы в первой группе являются щелочными.
Это литий, калий, натрий, цезий, рубидий и франций. Только эти металлы называются щелочными. А называются они так потому, что если они будут взаимодействовать с водой, то в результате образуются щелочи.
Есть еще один вид металлов — это щелочно-земельные. Если вам нужен список только щелочных металлов, то в нем всего 6 металлов. Если всех металлов, гидроксиды которых обладают щелочными свойствами, то тут войдут еще четыре элемента — кальций, стронций, барий и радий.
Все щелочные металлы в чистом виде в природе встретить сложно — ведь они легко вступают в соединения. В частности, в виде этих соединений эти металлы и находят.
Свойства щелочных металлов
Щелочные металлы отличные проводники тепла, а также они хорошо проводят электрический ток.
Щелочные металлы имеют низкую температуру плавления
Плотность металлов с увеличением номера увеличивается, а вот плавить их становится все проще, если металлы находятся внизу группы.
Получение щелочных металлов
Обычно щелочные металлы получают с помощью электролиза, однако два металла щелочно-земельных — стронций и барий, получают, используя алюмотермический метод.
Химические свойства
Как мы уже сказали, эти металлы являются очень активными, они также отличные восстановители. Встречаются в виде соединений, в которых главной будет ионная связь.
Как правило, всегда они образуют устойчивые соединения. Основные реакции и дополнительные свойства щелочных металлов приведены в таблице:
Итак, вы теперь, пользуясь списком и таблицей, а также периодической системой Менделеева, сможете многое рассказать про щелочные металлы.
Посмотреть как выглядят щелочные металлы можно здесь. Там также есть список и приведены реакции связи с водой, серой, с кислотами, солями и галогенами.
novstudent.ru
Щелочные металлы
Структура внешних электронных слоев в атомах элементов I группы позволяет прежде всего предполагать отсутствие у них тенденции к присоединению электронов. С другой стороны, отдача единственного внешнего электрона, казалось бы, должна происходить весьма легко и вести к образованию устойчивых одновалентных катионов рассматриваемых элементов.
Как показывает опыт, предположения эти в полной мере оправдываются только применительно к элементам левого столбца (Li, Na, К и аналогам). Для меди и ее аналогов они верны лишь, наполовину: в смысле отсутствия у них тенденции к присоединению электронов. Вместе с тем их наиболее удаленный от ядра 18-электронный слой оказывается еще не вполне закрепленным и при определённых условиях способен к частичной потере электронов. Последнее обусловливает возможность существования на ряду с одновалентными С
u, Agи Аu также и соединений рассматриваемых элементов, отвечающих их более высокой валентности.Подобное расхождение выведенных из атомных моделей предположений н результатов опыта показывает, что рассмотрение свойств элементов на основе только электронных структур атомов и без учета остальных особенностей не всегда достаточно для химической характеристики этих элементов даже в самых грубых чертах.
Щелочные металлы.
Применяемое к элементам ряда Li—Cs название щелочные металлы связано с тем, что их гидроокиси являются сильными щелочами. Натрий и калий относятся к наиболее распространенным элементам, составляя соответственно 2,0 и 1,1% от общего числа атомов земной коры. Содержание в ней лития(0,02%), рубидия
40К (0,01%) и 41К (6,77%), рубидий— из изотопов 85Rb (72,2%) и 87Rb (27,8%). Из изотопов франция основное значение имеет встречающийся в природе 223Fr (средняя продолжительность жизни атома 32 мин).
Распространённость:
В природе встречаются только соединения щелочных металлов. Натрий и калий являются постоянными составными частями многих силикатов. Из отдельных минералов натрия важнейший — поваренная соль (NaCl) входит в состав морской воды и на отдельных участках земной поверхности образует под слоем наносных пород громадные залежи каменной соли. Верхние слои подобных залежей иногда содержат скопления солей калия в виде пластов сильвинита (mKCl∙nNaCl), карналлита (КСl • MgCl2 • 6Н2О) и др., служащие основным источником получения соединений этого элемента. Имеющих промышленное значение природных скоплений калийных солей известно лишь немного. Для лития известен ряд минералов, но скопления их редки. Рубидий и цезий встречаются почти исключительно в виде примесей к калию. Следы франция всегда содержатся в урановых рудах. Минералами лития являются, например, сподумен [LiAl(SiO3)2] и лепидолит {Li2KAl [Si4O10(F, OH)2]}. Часть калия в последнем из них иногда бывает замещена на рубидий. То же относится к карналлиту, который может служить хорошим источником получения рубидия. Для технологии цезия наиболее важен сравнительно редкий минерал поллуцит — CsAI(SiO3)2.
Получение:
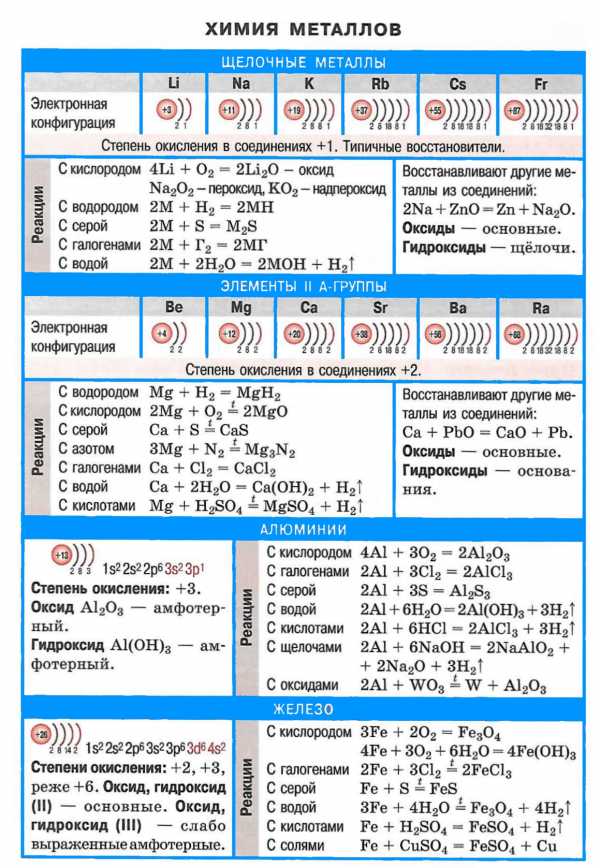
В свободном состоянии щелочные металлы могут быть выделены электролизом их расплавленных хлористых солей. Основное практическое значение имеет натрий, ежегодная мировая выработка которого составляет более 200 тыс. т.Схема установки для его получения электролизом расплавленного NaCl показана ниже. Ванна состоит из стального кожуха с шамотной футеровкой, графитовым анодом (А) и кольцевым железным катодом (К), между которыми расположена сетчатая диафрагма. Электролитом обычно служит не чистый NaCl (т. пл. 800 ℃), а более легкоплавкая смесь из приблизительно 40% NaCl и 60% СаСl2, что дает возможность работать при температурах около 580 °С. Собирающийся в верхней части кольцевого катодного пространства и переходящий в сборник металлический натрий содержит небольшую (до 5%) примесь кальция, который затем почти полностью выделяется (растворимость Са в жидком натрии при температуре его плавления равна лишь 0,01%). По мере хода электролиза в ванну добавляют NaCl. Расход электроэнергии составляет около 15 кВт • ч на 1 кг Na.
2NaCl→ 2Na+Cl2
Это интересно:
До введения в практику электролитического метода металлический натрий получали накаливанием соды с углем по реакции:
Na2CO3+2C+244ккал→2Na+3CO
Выработка металлических К и Li несравненно меньше, чем натрия. Литий получают электролизом расплава LiCl + КСl, а калий—действием паров натрия на расплав КСl, поступающий противотоком к ним в специальных дистилляционных колоннах (из верхней части которых выходят пары калия). Рубидий и цезий в больших масштабах почти не добываются. Дли получении небольших количеств этих металлов удобно пользоваться нагреванием в вакууме их хлоридов с металлическим кальцием.
KCl+Na→NaCl+K
2LiCl→2Li+Cl2
Физический свойства:
При отсутствии воздуха литий и его аналоги представляют собой серебристо-белые (за исключением желтоватого цезия) вещества с более или менее сильным металлическим блеском. Все щелочные металлы характеризуются небольшими плотностями, малой твердостью, низкими температурами плавления и кипения и хорошей электропроводностью. Их важнейшие константы сопоставлены ниже:
|
|
Li |
Na |
К |
Rb |
Cs |
|
Плотность, г/см3. |
0,53 |
0,97 |
0,86 |
1.53 |
1,87 |
|
Температура плавления, °С |
180 |
98 |
63 |
39 |
29 |
|
Температура кипения, °С |
1350 |
900 |
776 |
686 |
670 |
Благодаря малой плотности Li, Na и К всплывают на воде (Li — даже на керосине). Щелочные металлы легко режутся ножом, а твердость наиболее мягкого из них — цезия — не превышает твердость воска. Несветящееся пламя газовой горелки щелочные металлы и их летучие соединения окрашивают в характерные цвета, из которых наиболее интенсивен присущий натрию ярко-желтый.
Это интересно:
Внешне проявляющееся в виде окрашивания пламени испускания нагретыми атомами щелочных металлов световых лучей обусловлено перескоком электронов с более высоких на более низкие энергетические уровни. Например, характерная желтая линия спектра натрия возникает при перескоке электрона с уровня 3р на уровень 3s. Очевидно, что для возможности такого перескока необходимо предварительное возбуждение атома, т. е. перевод одного или нескольких его электронов на более высокий энергетический уровень. В рассматриваемом случае возбуждение достигается за счет теплоты пламени (и требует затраты 48 ккал/г-атом), вообще же оно может последовать в результате сообщения атому энергии различных видов. Другие щелочные металлы вызывают появление следующих окрасок пламени: Li — карминово-красной, К—фиолетовый, Rb — синевато-красной, Cs — синей.
Спектр люминесценции ночного неба показывает постоянное наличие в ней желтого излучения натрия. Высота места его возникновения оценивается в 200—300 км.Т. е. атмосфера на этих высотах содержит атомы натрия (конечно, в ничтожных количествах). Возникновение излучения описывается рядом элементарных процессов (звездочкой показано возбужденное состояние; М —любая третья частица — О2, О0, N2 и др.): Na + О0 + М = NaO + М*, затем NaO + О=О2+ Na* и, наконец, Na*= Na +λν.
Хранить натрий и калий следует в плотно закрытых сосудах под слоем сухого и нейтрального керосина. Недопустим их контакт с кислотами, водой, хлорированными органическими соединениями и твердой двуокисью углерода. Нельзя накапливать мелкие обрезки калия, которые окисляются особенно легко (из-за своей относительно большой поверхности). Неиспользованные остатки калия и натрия при малых количествах уничтожают взаимодействием с избытком спирта, при больших — сжиганием на углях костра. Загоревшиеся в помещении щелочные металлы лучше всего тушить, засыпая сухим порошком кальцинированной соды.
Химические свойства:
С химической стороны литий и его аналоги являются исключительно реакционноспособными металлами (причем активность их по направлению от Li к Cs обычно возрастает). Во всех соединениях щелочные металлы одновалентны. Располагаясь в крайней левой части ряда напряжений, они энергично взаимодействуют с водой по схеме:
2Э + 2H2O = 2ЭОН +H2↑
При реакции с Li и Na выделение водорода не сопровождается его воспламенением, у К оно уже происходит, а у Rb и Cs взаимодействие протекает со взрывом.
· В соприкосновении с воздухом свежие разрезы Na и К (в меньшей степени и Li) тотчас покрываются рыхлой пленкой продуктов окисления. Ввиду этого Na и К хранят обычно под керосином. Нагретые на воздухе Na и К легко загораются, а рубидий и цезий самовоспламеняются уже при обычной температуре.
4Э+O2→2Э2O (для лития)
2Э+O2 →Э2O2(для натрия)
Э+O2→ЭO2(для калия, рубидия и цезия)
|
Li20 |
Na202 |
К02 |
Rb02 |
Cs02 |
|
белый |
белый
|
желтый
|
желтый
|
желтый
|
Практическое применение находит главным образом перекись натрия (Na202). Технически ее получают окислением при 350°С распыленного металлического натрия:
2Na+O2→Na2O2+122ккал
· Расплавы простых веществ способны соединяться с аммиаком, с образованием амидов и имидов, сольватов:
2Naрасплав+2NH3→2NaNH2+H2↑ (амид натрия)
2Naрасплав+NH3→Na2 NH+H2↑ (имид натрия)
Naрасплав+6NH3 →[Na(NH3)6 ] (сольват натрия)
При взаимодействии пероксидов с водой происходит реакция:
2Э2O2+2H2O=4ЭOH+O2↑
Взаимодействие Na2O2 с водой сопровождается гидролизом:
Na2O2+2H2O→2NaOH + H2O2+34 ккал
Это интересно:
Взаимодействие Na2O2с двуокисью углерода по схеме
2Na2O2+ 2CO2=2Na2CO3+O2↑+111 ккал
служит основой применения перекиси натрия как источника кислорода в изолирующих противогазах и на подводных лодках. Чистая или содержащая различные добавки (например, хлорной извести с примесью солей Ni или Сu) перекись натрия носит техническое название «оксилит». Смешанные препараты оксилита особенно удобны для получения кислорода, который выделяется ими под действием воды. Спрессованный в кубики оксилит может быть использован для получения равномерного тока кислорода в обычном аппарате для получения газов.
Na2O2+H2O=2NaOH+O0(выделяется атомарный кислород, вследствие распада перекиси водорода).
Надперекись калия (КО2) нередко вводится в состав оксилита. Его взаимодействие с двуокисью углерода идет в этом случае по суммарномууравнению:
Na2O2 + 2KO2 + 2СO2 = Na2 CO3 +K2CO3+ 2O2+ 100 ккал, т. е. двуокись углерода заменяется равным объемом кислорода.
· Способны образовывать озониды. Образование озонида калия-KO3 идёт по уравнению:
4КОН+3O3= 4КO3+ O2+2H2O
Он представляет собой красное кристаллическое вещество и является сильнейшим окислителем. При хранении KO3 медленно распадается по уравнению 2NaO3→2NaO2+O2+11 ккал уже в обычных условиях. Водой он мгновенно разлагается по суммарной схеме 4KO3+2H2O=4KOH+5O2
· Способны реагировать с водородом, с образованием ионных гидридов, по общей схеме:
2Na+H2→2NaH
Взаимодействие водорода с нагретыми щелочными металлами идет медленнее, чем с щелочноземельными. В случае Li требуется нагревание до 700—800 °С, тогда как его аналоги взаимодействуют уже при 350—400 °С. Гидриды щелочных металлов являются очень сильными восстановителями. Окисление их кислородом воздуха в сухом состоянии идет сравнительно медленно, но в присутствии влаги процесс настолько ускоряется, что может привести к самовоспламенению гидрида. Особенно это относится к гидридам К, Rb и Cs. С водой происходит бурная реакция по схеме:
ЭН+ H2O= H2+ЭОН
ЭH+O2→2ЭOH
При взаимодействии NaH или КН с двуокисью углерода образуется соответствующая соль муравьиной кислоты:
NaH+CO2→HCOONa
Способны образовывать комплексы:
NaH+AlCl3→NaAlH4+3NaCl (алланат натрия)
NaAlH4 → NaH+AlH3
NaH+CuO=NaOH+Cu
Нормальные оксиды щелочных металлов (за исключением Li20) могут быть получены только косвенным путем. Они представляют собой твердые вещества следующих цветов:
|
Li20 |
Na20 |
К20 |
Rb20 |
Cs20 |
|
белый |
белый |
белый |
желтый |
оранжевый |
Na2O+2HCl=2NaCl+H2O
Гидроокиси (ЭОН) щелочных металлов представляют собой бесцветные, очень гигроскопичные вещества, разъедающие большинство соприкасающихся с ними материалов. Отсюда их иногда употребляемое в практике название — едкие щелочи. При действии щелочей кожа человеческого тела сильно разбухает и становится скользкой; при более продолжительном действии образуется очень болезненный глубокий ожог. Особенно опасны едкие щелочи для глаз (работать рекомендуется в защитных очках). Попавшую на руки или платье щелочь следует тотчас же смыть водой, затем смочить пораженное место очень разбавленным раствором какой- либо кислоты и вновь промыть водой.
Все они сравнительно легкоплавки и летучи без разложения (кроме отщепляющей воду LiOH).Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизомконцентрированного водного раствора поваренной соли:
2NaCl+2H2O→2NaOH+Cl2↑ +H2↑
Ø Являются типичными основаниями:
NaOH+HCl=NaCl+H2O
2NaOH+CO2=Na2 CO3+H2O
2NaOH+2NO2=NaNO3+NaNO2+H2O
Ø Способны образовывать комплексы:
NaOH+ZnCl2= (ZnOH)Cl+NaCl
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2
Al2O3+ 6NaOH= 2Na3 AlO3+3H2O
Al(OH)3+NaOH=Na[Al(OH)4]
Ø Способны реагировать с неметаллами:
Cl2+2KOH=KCl+KClO+H2O(реакция идёт без нагреванием)
Cl2+6KOH=5KCl+KClO3+3H2O (реакция идёт с нагреванием)
3S+6NaOH=2Na2 S+Na2SO3+3H2O
Ø Применяются в органическом синтезе (в частности гидроксид калия и натрия, в примерах указан гидроксид натрия):
NaOH+C2H5Cl=NaCl+C2H4 (метод получения алкенов, этилена (этена) в данном случае), использовался спиртовой раствор гидроксида натрия.
NaOH+C2H5Cl=NaCl+C2H5OH (метод получения спиртов, этанола в данном случае), использовался водный раствор гидроксида натрия.
2NaOH+C2H5Cl=2NaCl+C2H2+H2O (метод получения алкинов, ацетилена (этина) в данном случае), использовался спиртовой раствор гидроксида натрия.
C6H5OH (фенол) +NaOH= C6 H5ONa+H2O
NaOH(+CaO)+CH3COONa→Na2CO3CH4(один из способов получения метана)
Ø Надо знать разложение нескольких солей:
2KNO3→2KNO2+O2
4KClO3→KCl+3KClO4
2KClO3→KCl+3O2
4Na2SO3→Na2S+3Na2SO4
Примечательно то, что разложение нитратов идет примерно в диапазоне 450-600 ℃, далее они плавятся без разложения, но при достижении примерно 1000- 1500 ℃ идет разложение по схеме:
4LiNO2→2Li2O+4NO+O2↑
Это интересно:
K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]+3KCl(качественная реакция на Fe3+)
3K4[Fe(CN)6]+4FeCl3=Fe4[Fe(CN)6]3+12KCl
Na2O2+2H2O=2NaOH+H2O2
4NaO2+2H2O=4NaOH+ 3O2
4NaO3+2H2O=4NaOH+5O2 (реакцияозониданатриясводой)
2NaO3→2NaO2+O2(Распад происходит при различных температурах, например: распад озонида натрия при -10°C, озонида цезия при +100°C)
NaNH2+H2O→ NaOH+NH3↑
Na2NH+2H2O→ 2NaOH+NH3↑
Na3N+3H2O→3NaOH+NH3
KNO2+2Al+KOH+5H2O→2K[Al(OH)4 ]+NH3↑
2NaI + Na2O2 + 2H2SO4→I2↓+ 2Na2SO4 + 2H2O
Fe3O4+4NaH=4NaOH+3Fe
5NaN3+NaNO3→8N2↑+3Na2O
Применение:
Натрием широко пользуются при синтезах органических соединений и отчасти для получения некоторых его производных. В ядерной технике он используется как теплоноситель.
Литий имеет совершенно исключительное значение для термоядерной техники. В резиновой промышленности он используется при выработке искусственного каучука (как катализатор полимеризации), в металлургии — как ценная присадка к некоторым другим металлам и сплавам. Например, присадка лишь сотых долей процента лития сильно повышает твердость алюминия и его сплавов, а присадка 0,4% лития к свинцу почти в три раза повышает его твердость, не ухудшая сопротивления на изгиб. Имеются указания на то, что подобная же присадка цезия сильно улучшает механические свойства магния и предохраняет его от коррозии, однако такое его использование. Гидрид натрия используется иногда в металлургии для выделения редких металлов из их соединений. Его 2%-ный раствор в расплавленном NaOH находит применение для снятия окалины со стальных изделий (после минутного выдерживания в нем горячее изделие погружают в воду, причем восстановившаяся по уравнению
Fe3O4+4NaH = 4NaOH + 3Fe (окалина отпадает).
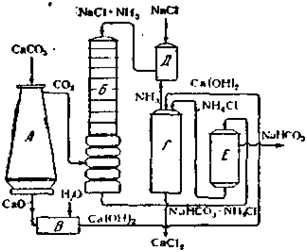
Принципиальная схема заводской установки для получения соды по аммиачному методу (Сольвэ, 1863 г.).
В печи (Л) идет обжиг известняка, причем образующаяся СO2 поступает в карбонизационную башню (Б), а СаО гасится водой (В), после чего Ca(OH)2 перекачивают в смеситель (Г), где она встречается с NH4Cl, при этом выделяется аммиак. Последний поступает в абсорбер (Д)и насыщает там крепкий раствор NaCl, который затем перекачивают в карбонизационную башню, где при взаимодействии с СО2 образуются NaHCO3 и NH4Cl. Первая соль почти полностью осаждается и задерживается на вакуум-фильтре (Е), а вторую вновь перекачивают в смеситель (Г). Таким образом все время расходуются NaCl и известняк, а получаются NaHCO3 и CaCl2(последний — в виде отброса производства). Бикарбонат натрия переводят затем нагреванием в соду.
Автор статьи: Каштанов Артём Денисович
Редактор: Харламова Галина Николаевна
www.teslalab.ru
Щелочные металлы — Знаешь как
Содержание статьи
В группу щелочных металлов входит следующий ряд металлов; литий Li, натрий Na, калий К, рубидий Rb, цезий Cs, франций Fr. Они находятся в главной подгруппе I группы периодической системы.
Все эти металлы сходны в том отношении, что на внешнем электронном слое их имеется один электрон (табл. 18)/.
Щелочные металлы относятся к числу s-элементов. Электрон внешнего электронного слоя атома щелочного металла по сравнению с другими элементами того же периода наиболее удален от ядра, т. е. радиус атома щелочного металла наибольший по сравнению с радиусами атомов других элементов того же периода. В связи
Число электронов на энергетических уровнях | |||||||||
+ 3 + 11 + 19 + 37 + 55 + 87 | |||||||||
с этим валентный электрон внешнего слоя атомов щелочных металлов легко отрывается, превращая их в положительные однозарядные ионы. Этим обусловлено то, что соединения щелочных металлов с другими элементами построены по типу ионной связи.
В окислительно-восстановительных реакциях щелочные металлы ведут себя как сильные восстановители, и эта способность возрастает от металла к металлу с увеличением заряда ядра атома.
Среди металлов щелочные металлы проявляют наиболее высокую химическую активность. В ряду напряжений все щелочные металлы располагаются в начале ряда. Электрон внешнего электронного слоя является единственным валентным электроном, поэтому щелочные металлы в любых соединениях одновалентны. Степень окисления щелочных металлов обычно +1.
Физические свойства щелочных металлов приведены в табл. 19.
Порядковый номер | Температура плавления, °С | Температура кипения, °С | Плотность, г/смЗ | Твердость по шкале | ||
6,94 22,997 39,1 85,48 132,91 |
Типичными представителями щелочных металлов являются натрий и калий.
■ 26. Составьте общую характеристику щелочных металлов по следующему плану:
а) сходство и различие в строении атомов щелочных металлов;
б) особенности поведения щелочных металлов в окислительно-восстановительных реакциях;
в) тип кристаллической решетки в соединениях щелочных металлов;
г) особенности изменения физических свойств металлов в зависимости от радиуса атома. (См. Ответ)
Натрий
Электронная конфигурация атома натрия ls22s22p63s1. Структура его внешнего слоя:
Натрий встречается в природе только в виде солей. Наиболее распространенной солью натрия является поваренная соль NaCl, а также минерал сильвинит КCl · NaCl и некоторые сернокислые соли, например глауберова соль Na2SO4 · 10h3O, встречающаяся в больших количествах в заливе Каспийского моря Кара-Богаз-Гол.
Из поваренной соли NaCl металлический натрий получают путем электролиза расплава этой соли. Установка для электролиза изображена на рис. 76. В расплавленную соль опускают электроды. Анодное и катодное пространство разделено диафрагмой, которая изолирует образующийся хлор от натрия, чтобы не произошло обратной реакции. Положительный ион натрия принимает с катода электрон и превращается в нейтральный атом натрия. Нейтральные атомы натрия собираются на катоде в виде расплавленного металла. Происходящий на катоде процесс можно изобразить следующей схемой:
Na+ + Na0.
Поскольку на катоде происходит принятие электронов, а всякое принятие электронов атомом или ионом является восстановлением, то ионы натрия на катоде восстанавливаются. На аноде ионы хлора отдают электроны, т. е. происходит процесс окисления и выделение свободного
газообразного хлора, что можно изобразить следующей схемой:
Cl— — е— → Cl0
Полученный металлический натрий имеет серебристо-белый цвет, легко режется ножом. Срез у натрия, если его рассмотреть сразу после разреза, имеет яркий металлический блеск, но быстро тускнеет вследствие крайне быстрого окисления металла.
Рис. 76. Схема установки для электролиза расплава поваренной соли. 1 — кольцевой катод; 2 — колокол для выведения газообразного хлора из анодного пространства
Если натрий окислять в небольшом количестве кислорода при температуре около 180°, то получается окись натрия:
4Na + О2 = 2Na2O.
При горении в кислороде получается перекись натрия:
2Na + O2 = Na2O2.
При этом натрий сгорает ослепительно желтым пламенем.
В связи с легкой и быстрой окисляемостью натрия его хранят под слоем керосина или парафина, причем парафин предпочтительнее, так как в керосине все же растворяется некоторое количество воздуха и окисление натрия хотя и медленно, но все же происходит.
Натрий может давать соединение с водородом — гидрид NaH, в котором водород проявляет степень окисления — 1. Это солеподобное соединение, которое по характеру химической связи и величине степени окисления отличается от летучих гидридов элементов главных подгрупп IV—VII группы.
Металлический натрий может реагировать не только с кислородом и водородом, но и с многими простыми и сложными веществами. Например, при растирании в ступке с серой натрий бурно реагирует с ней, образуя сульфид натрия:
2Na + S = Na2S
Реакция сопровождается вспышками, поэтому ступку нужно держать подальше от глаз и обернуть руку полотенцем. Для реакции следует брать небольшие кусочки натрия.
Натрий энергично сгорает в хлоре с образованием хлорида натрия, что особенно хорошо наблюдать в хлор-кальциевой трубке, в которой через расплавленный и сильно разогретый натрий пропускают ток хлора:
2Na + Сl2 = 2NaCl
Натрий реагирует не только с простыми, но и со сложными веществами, например с водой, вытесняя из нее водород, так как является весьма активным металлом, в ряду напряжений стоит намного левее водорода и легко вытесняет последний из воды:
2Na + 2Н2O = 2NaOH + h3
Загоревшийся щелочной металл нельзя тушить водой. Лучше всего засыпать его порошком кальцинированной соды. В присутствии натрия бесцветное пламя газовой горелки окрашивается в желтый цвет.
Металлический натрий можно использовать как катализатор в органическом синтезе, например при производстве синтетического каучука из бутадиена. Он служит исходным веществом для получения других соединений натрия, например перекиси натрия.
■ 27. Докажите с помощью приведенных в тексте уравнений реакций с участием металлического натрия, что он ведет себя как восстановитель. (См. Ответ)
28. Почему натрий нельзя хранить на воздухе?
29. Ученик опустил в раствор сульфата меди кусочек натрия, надеясь вытеснить из соли металлическую медь. Вместо металла красного цвета получился студенистый голубой осадок. Опишите происшедшие реакции и напишите их уравнения в молекулярной и ионной формах. Как следовало изменить условия реакции, чтобы реакция привела к желаемому результату? Уравнения напишите в молекулярной, полной и сокращенной ионной формах.
30. В сосуд с 45 мл воды поместили 2,3 г металлического натрия. Какова концентрация раствора едкого натра, образовавшегося по окончании реакции.
31. Какие средства можно применять при тушении загоревшегося натрия? Дайте обоснованный ответ. (См. Ответ)
Кислородные соединения натрия. Едкий натр
Кислородными соединениями натрия, как уже было сказано, являются окись натрия Na2O и перекись натрия Na2O2.
Окись натрия Na2O особого значения не имеет. Она энергично реагирует с водой, образуя едкий натр:
Na2O + Н2O = 2NaOH
Перекись натрия Na202 — желтоватый порошок. Ее можно рассматривать как своеобразную соль перекиси водорода, ибо структура ее такая же, как у Н2O2. Как и перекись водорода, перекись натрия является сильнейшим окислителем. При действии воды она образует щелочь и перекись водорода:
Na2O2 + Н2O = Н2O2 + 2NaOH
Перекись водорода образуется и при действии разбавленных кислот на перекись натрия:
Na2O2 + h3SO4 = Н2O2 + Na2SO4
Все указанные выше свойства перекиси натрия позволяют использовать ее для отбелки все возможных материалов.
Рис. 77. Схема установки для электролиза раствора поваренной соли. 1 — анод; 2 — диафрагма, разделяющее анодное и катодное пространство; 3 —катод
Очень важным соединением натрия является гидроокись натрия, или едкий натр, NaOH. Его называют также каустической содой, или просто каустиком.
Для получения едкого натра используют поваренную соль — наиболее дешевое природное соединение натрия, подвергая ее электролизу, но в этом случае применяют не расплав, а раствор соли (рис. 77). Описание процесса электролиза раствора поваренной соли см. § 33. На рис. 77 показано, что анодное и катодное пространство разделено диафрагмой. Это сделано с той целью, чтобы образующиеся продукты не вступали между собой во взаимодействие, например Сl2 + 2NaOH = NaClO + NaCl + Н2O.
Едкий натр — твердое кристаллическое вещество белого цвета, прекрасно растворимое в воде. При растворении едкого натра в воде выделяется большое количество тепла и раствор сильно разогревается. Едкий натр необходимо хранить в хорошо закупоренных сосудах, чтобы предохранить его от проникновения водяных паров, под действием которых он может сильно увлажниться, а также двуокиси углерода, под действием которой едкий натр может постепенно превратиться в карбонат натрия:
2NaOH + СO2 = Na2CO3+ Н2O.
Едкий натр—типичная щелочь, поэтому меры предосторожности при работе с ним такие же, как и при работе с любыми другими щелочами.
Едкий натр применяется во многих отраслях промышленности, например для очистки нефтепродуктов, производства мыла из жиров, в бумажной промышленности, в производстве искусственного волокна и красителей, производстве медикаментов и др. (рис. 78).
• Запишите в тетрадь области применения едкого натра.
Из солей натрия следует отметить в первую очередь поваренную соль NaCl, которая служит основным сырьем для получения едкого натра и металлического натрия (подробно об этой соли см. стр. 164), соду Na2CO3 (см. стр. 278), сульфат натрия Na2SO4 (см. стр. 224), нитрат натрия NaNO3 (см. стр. 250) и др.
Рис. 78. Применение едкого натра
■ 32. Опишите способ получения едкого натра электролизом поваренной соли. (См. Ответ)
33. Едкий натр можно получить действием на карбонат натрия гашеной известью. Составьте молекулярную и ионные формы уравнения этой реакции, а также рассчитайте, сколько соды, содержащей 95% карбоната, потребуется для получения 40 кг едкого натра.
34. Почему при хранении раствора едкого натра в склянках с притертыми пробками пробки «заедают» и их нельзя вынуть? Если же в течение некоторого срока подержать склянку опрокинутой в воду, то пробка свободно вынимается. Объясните, приведя уравнения реакций, что за процессы имеют место в данном случае.
35. Напишите уравнения реакций в молекулярной и ионных формах, характеризующих свойства едкого натра как типичной щелочи.
36. Какие меры предосторожности следует соблюдать при работе с едким натром? Какие меры первой помощи следует оказать при ожогах едким натром? (См. Ответ)
Калий
Калий К — также довольно распространенный щелочной металл, отличающийся от натрия величиной атомного радиуса (четвертый период) и потому обладающий большей химической активностью, чем натрий. Электронная конфигурация атома калия 1s22s22p63s23p64s1.
Структура его внешнего электронного слоя
Калий — мягкий металл, который хорошо режется ножом. Во избежание окисления его, как и натрий, хранят под слоем керосина.
С водой калий реагирует еще более бурно, чем натрий, с образованием щелочи и с выделением водорода, который загорается:
2К + 2Н2O = 2КОН + Н2.
При сжигании в кислороде (при этом для сжигания рекомендуется брать еще более мелкие кусочки металла, чем для сжигания натрия) он, подобно натрию, сгорает очень энергично с образованием перекиси калия.
Следует отметить, что в обращении калий гораздо опаснее натрия. Сильный взрыв может произойти даже при разрезании калия, поэтому обращаться с ним нужно еще осторожнее.
Гидроокись калия, или едкое кали КОН — белое кристаллическое вещество. Едкое кали во всех отношениях сходно с едким натром. Они широко применяются в мыловаренной промышленности, но его получение обходится несколько дороже, поэтому такого применения, как NaOH, оно не находит.
Соли калия следует отметить особо, так как некоторые из них широко используются в качестве удобрения. Таковы хлорид калия КСl, нитрат калия KNO3, который является также азотным удобрением.
■ 37. Чем объяснить то, что едкое кали химически активнее едкого натра? (См. Ответ)
38. В кристаллизатор с водой опустили кусочек калия. После того как реакция закончилась, туда же поместили немного гидроокиси цинка в виде белого студенистого осадка. Осадок исчез, а при испытании раствора фенолфталеином последний окрасился в малиновый цвет. Какие химические процессы здесь произошли?
Какие вещества находятся в растворе? Дайте обоснованный ответ.
39. Почему калий, как и все щелочные металлы, относят к семейству s-элементов? (См. Ответ)
33
32 34
znaesh-kak.com
Щелочные металлы — Госстандарт
Элементы первой группы периодической системы характеризуются прежде всего одинаковым строением внешнего электронного слоя атомов, в котором у всех членов группы содержится только один электрон. Но второй снаружи электронный слой у отдельных элементов группы построен различно. Это обстоятельство оказывает большое влияние на свойства соответствующих элементов и вызывает деление группы на две подгруппы — главную и побочную. Главную подгруппу образуют типические элементы — литий и натрий исходные с ними по строению атомов элементы четных рядов больших периодов — калий, рубидий и цезий, содержащие в предпоследнем слое восемь электронов. К побочной подгруппе относятся элементы нечетных рядов больших периодов — медь, серебро и золото, с восемнадцатью электронами в предпоследнем слое.
Название «щелочные «металлы» присвоено элементам главной подгруппы первой группы ввиду того, что гидроокиси двух главных представителей этой группы — лития, натрия и калия — издавна были известны под названием «щелочей». Из этих щелочей, подвергая их в расплавленном состоянии электролизу, Дэви в 1807 г. впервые получил свободные калий и натрий. Имея в наружном слое только один электрон, удаленный от ядра на значительное расстояние, атомы щелочных металлов чрезвычайно легко отдают его, превращаясь в положительные однозарядные ионы с устойчивой оболочкой соответствующего инертного газа.
Поэтому щелочные металлы являются наиболее типичными представителями металлов. Все металлические свойства выражены у них особенно резко.
Щелочные металлы совершенно не способны присоединять электроны.
Одинаковое строение не только наружного, но и предпоследнего электронного слоя обусловливает большое сходство щелочных металлов друг с другом. Но в то же время увеличение заряда ядра и общего числа электронов в атоме при переходе от лития к цезию создает некоторые качественные различия между отдельными членами группы. Как и в других группах, эти различия проявляются главным образом в более легкой отдаче валентных электронов и усилении металлических свойств с возрастанием порядкового номера.
В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1. Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО).
Таблица 1. Некоторые свойства щелочных металлов
Атомный номер | Название, символ | Металлический радиус, нм | Ионный радиус, нм | Потенциал ионизации, эВ | ЭО | p, г/смі | tпл, °C | tкип, °C | |
3 | Литий Li | 0,152 | 0,078 | 5,32 | 0,98 | 0,53 | 181 | 1347 | |
11 | Натрий Na | 0, 190 | 0,098 | 5,14 | 0,93 | 0,97 | 98 | 883 | |
19 | Калий K | 0,227 | 0,133 | 4,34 | 0,82 | 0,86 | 64 | 774 | |
37 | Рубидий Rb | 0,248 | 0,149 | 4,18 | 0,82 | 1,53 | 39 | 688 | |
55 | Цезий Cs | 0,265 | 0,165 | 3,89 | 0,79 | 1,87 | 28 | 678 | |
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Щелочные металлы встречаются в природе в форме соединений, содержащих однозарядные катионы. Многие минералы содержат в своём составе металлы главной подгруппы I группы. Например, ортоклаз, или полевой шпат, состоит из алюмюсиликата калия K2 [Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2 [Al2Si6O16]. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl KCl, карналлит KCl MgCl26H2O, полигалит K2SO4 MgSO4 CaSO4 2H2O.
Щелочные металлы в природе и их применение
Вследствие очень легкой окисляемости щелочные металлы встречаются в природе исключительно в виде соединений. Натрий и калий принадлежат к наиболее распространенным на земле элементам: содержание натрия в земной коре составляет 2,40, а калия 2,35 вес. %. Оба металла входят в состав различных минералов и горных пород силикатного типа. Хлористый натрий находится в морской воде, а также образует мощные отложения каменной соли во многих местах земного шара. В верхних слоях этих отложений иногда содержатся довольно значительные количества калия, преимущественно в виде хлористого калия и в виде двойных солей с натрием и магнием. Однако большие скопления калиевых солей, имеющие промышленное значение, встречаются редко.
Залежи натриевой селитры находятся в Чили. Сода содержится в воде многих озер. Наконец, огромные количества сульфата натрия находятся в заливе Кара-Богаз-Гол Каспийского моря, где эта соль в зимние месяцы толстым слоем осаждается на дно залива.
Значительно меньше, чем натрий и калий, распространены остальные три щелочных металла: литий, рубидий и цезий.
Чаще других встречается литий, но содержащие его минералы редко образуют большие скопления. Следы лития можно обнаружить в воде многих минеральных источников, в почве, а также в золе некоторых растений, как, например, свеклы, табака, хмеля. Рубидий и цезий содержатся в малых количествах в некоторых литиевых минералах.
Щелочные металлы всегда находятся в соединениях в виде положительно заряженных ионов. Так как атомы щелочных металлов очень легко окисляются, отдавая свои электроны, то ионы их, наоборот, трудно восстанавливаются.
Химические и физические свойства
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже и азоту (Li, Cs) их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О22?и надпероксид-ион O2?.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs:
Цвет формул кислородного соединения
Формула кислородного соединения | Цвет | |
Li2O | Белый | |
Na2O | Белый | |
K2O | Желтоватый | |
Rb2O | Жёлтый | |
Cs2O | Оранжевый | |
Na2O2 | Светло- жёлтый | |
KO2 | Оранжевый | |
RbO2 | Тёмно- коричневый | |
CsO2 | Жёлтый | |
3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов.
При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами. Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах. При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака. Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей).
4. Качественное определение щелочных металлов. Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
Окраска пламени щелочными металлами и их соединениями
Щелочной металл | Цвет пламени | |
Li | Карминно-красный | |
Na | Жёлтый | |
K | Фиолетовый | |
Rb | Бурокрасный | |
Cs | Фиолетово-красный | |
Литий, натрий, калий, рубидий в свободном состоянии серебристо-белые металлы, цезий имеет золотисто-желтый цвет. Все металлы очень мягкие и пластичные. Наибольшей твердостью обладает литий, остальные металлы легко режутся ножом и могут быть раскатаны в фольгу.
В кристаллическом состоянии все они имеют объемоцентрированную кристаллическую решетку с металлическим типом химической связи, что обуславливает их высокую тепло — и электропроводность.
Все щелочные металлы имеют небольшую плотность, самый легкий металл — литий, его плотность составляет всего 0,53 г/см3.
Некоторые физические свойства щелочных металлов приведены в таблице.
Некоторые физические свойства щелочных металлов
Свойство | Li | Na | K | Rb | Cs | |
Плотность, кг/м3 | 530 | 970 | 860 | 1530 | 1880 | |
Температура плавления,°С | 180 | 98 | 64 | 40 | 29 | |
Температура кипения,°С | 1342 | 883 | 759 | 688 | 671 | |
Металлы имеют достаточно низкие температуры плавления и кипения, причем с увеличением порядкового номера элемента температура плавления металла понижается.
Все металлы очень активны, поэтому их хранят в запаянных ампулах, под слоем вазелинового масла или керосина.
himiya.gosstandart.info
