Кислород
Кислород (O2) — газ без цвета, запаха и вкуса, с высокой химической активностью. Реакции соединения с кислородом протекают с выделением большого количества тепла. В основном применяется в медицине и в различных производствах (особенно металлургии) для поддержания процесса горения и получения повышенных температур пламени.
Использование
- Кислород используют при резке и сварке металлов. При этом применяют баллонный O2. Жидкий кислород — мощный окислитель, его используют как компонент ракетного топлива.
- Кислород используется в больших количествах как окислитель керосина и других горючих в ракетах и космических аппаратах.
- Сталелитейная промышленность потребляет газообразный кислород для продувки через расплав чугуна для быстрого и эффективного удаления примесей.
-
Применяют O2 и в медицине для обогащения дыхательной среды пациентов с затрудненным дыханием.

Безопасность
При соприкосновении сжатого газообразного кислорода с маслами, жирами или твердыми горючими веществами, находящимися в распыленном состоянии, происходит их самовоспламенение, что служит причиной взрыва или пожара. Поэтому для предупреждения несчастных случаев кислородную аппаратуру и сосуды с газом необходимо тщательно обезжиривать.
Производство и поставка
Благодаря наличию свободного кислорода в атмосфере наиболее эффективным методом его извлечения является сжижение воздуха, из которого химическими и физическими методами удаляют примеси. Для получения кислорода особой чистоты процесс дистилляции необходимо повторять неоднократно.
К месту потребления кислород доставляется в баллонах, а в жидком виде — в специальных сосудах с хорошей теплоизоляцией. Для превращения жидкого кислорода в газ используются газификаторы или насосы с испарителями.
В баллоне кислород может находиться под давлением до 15 МПа. Баллоны с кислородом окрашены в голубой цвет.
Баллоны с кислородом окрашены в голубой цвет.
Молярная масса кислорода (O), формула и примеры
Молярная масса кислорода
Единицей измерения молярной массы является г/моль или кг/кмоль. Молярная масса вещества в граммах численно равна его молекулярной (атомной) массе, выраженной в атомных единицах массы:
M = Ar.
Относительная атомная масса атомарного кислорода равна 15,99903 а.е.м. Его относительная молекулярная масса будет равна 15,99903, а молярная масса:
M(O) = Mr (O) × 1 моль = 15,99903 г/моль.
Известно, что молекула кислорода двухатомна – O2, тогда, относительная атомная масса молекулы кислорода будет равна:
Ar
Относительная молекулярная масса молекулы кислорода будет равна 31,99806, а молярная масса:
M(O2) = Mr (O2) × 1 моль = 31,99806 г/моль или просто 32 г/моль.
Кислород представляет собой газ без цвета и запаха (схема строения атома представлена на рис. 1), плохо растворимый в воде с очень низкими значениями температур плавления(-218,9oC) и кипения (-183oC).
Рис. 1. Строение атома кислорода.
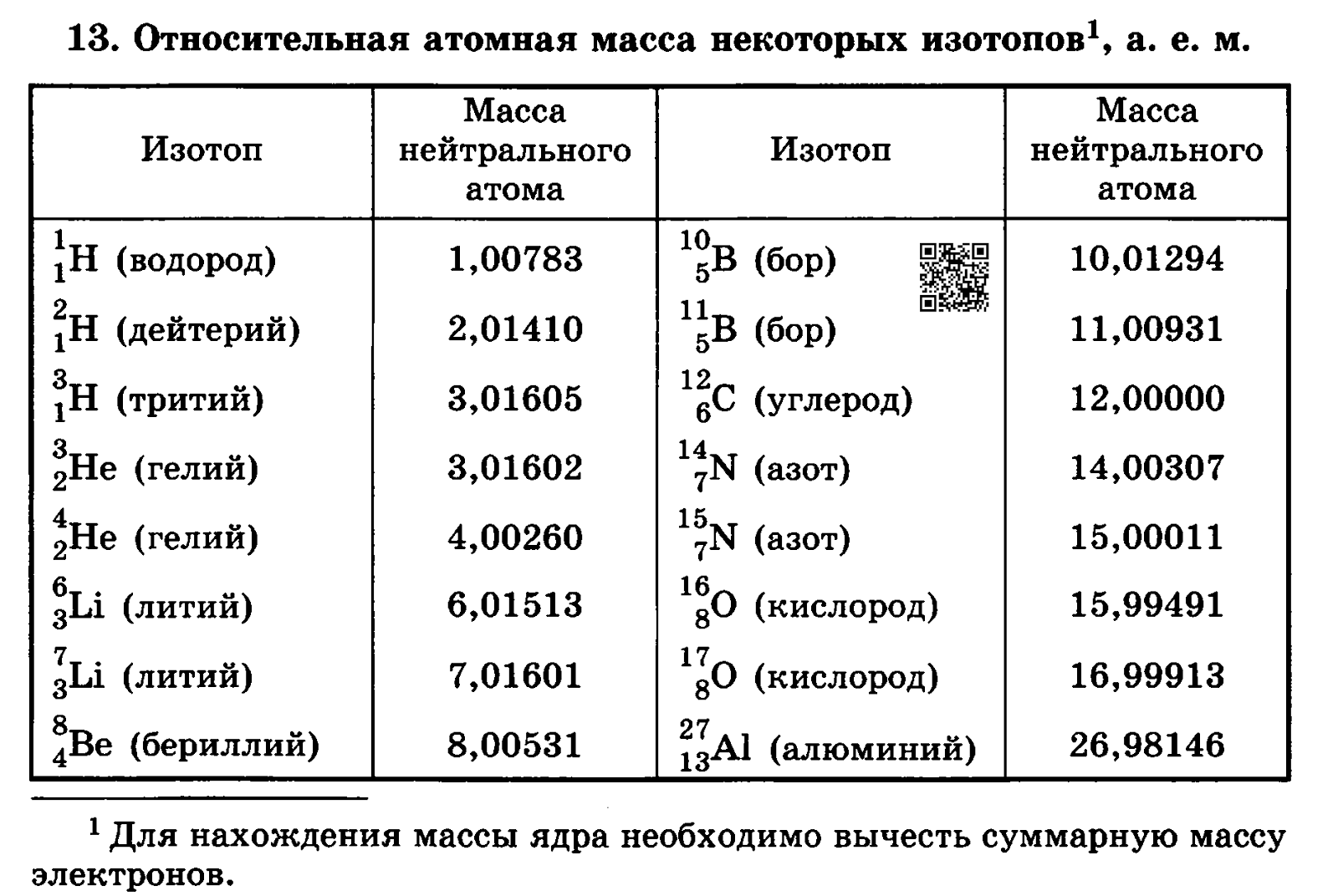
Известно, что в природе кислород может находиться в виде трех изотопов 16O (99,76%), 17O (0,04%) и 18O (0,2%). Эти изотопы характеризуются различным содержанием нейтронов в ядре атома, а значит и молярной массой. В первом случае она будет равна 16 г/моль, во втором – 17 г/моль, а в третьем – 18 г/моль.
Молярную массу газа можно рассчитать, как произведение его плотности по отношению к любому другому газу на молекулярную массу последнего. Под плотностью понимают отношение массу определенного объема данного газа к массе такого же объема другого газа (при одинаковых температуре и давлении), молекулярная масса которого известна.
Молекулярную массу вещества в газообразном состоянии также можно рассчитать, зная его молярный объем: найти объем (н. у.), занимаемый определенной массой данного вещества, а затем вычислить массу 22,4 л этого вещества при этих же условиях.
у.), занимаемый определенной массой данного вещества, а затем вычислить массу 22,4 л этого вещества при этих же условиях.
Кроме этих способов, чтобы определить молярную массу газа, возможно использование уравнения состояния идеального газа (уравнение Менделеева-Клапейрона), однако это метод является наименее точным из всех перечисленных.
Примеры решения задач
Молярная масса кислорода. Чему равна молярная масса кислорода?
Атомы элементов и молекулы веществ обладают ничтожно малой массой. Для изучения количественных отношений, характерных для химических реакций, используется несколько физических величин. Одна из них — молярная масса, которую можно рассчитать для атомов, ионов и молекул. Один из важнейших элементов на Земле — кислород, с его участием протекают многие реакции и процессы. Для выполнения расчетов по формулам соединений, уравнениям реакций используется молярная масса кислорода, которая численно равна относительной массе его атома или молекулы.
Кислород
Общие сведения о кислороде (химическом элементе):
- латинское название — Oxygenium;
- химический символ — O;
- находится в верхней части 16-й группы (ранее — группы VI A) периодической таблицы;
- расположен во втором периоде сразу после азота, перед фтором;
- относится к семейству халькогенов;
- номер элемента в периодической таблице и заряд ядер его атомов — 8.
Кислород как один из компонентов атмосферы долгое время не могли выделить в чистом виде. Газ называли «животворящим», «эликсиром жизни». Честь открытия кислорода делят между собой ученые с мировым именем: К. Шееле, Дж. Пристли, А. Лавуазье. Термин «оксиген» предложил А. Лавуазье, исходя из важной роли вещества, его атомов в процессах образования оксидов и кислот.
При выполнении химических расчетов нужно знать массы участвующих в реакциях атомов и молекул веществ. Но они слишком малы, что затрудняет использование таких единиц измерения, как граммы и килограммы. Выход был найден: предложены другие величины, облегчающие расчеты. Например, в химии используются относительные значения атомных и молекулярных масс. Относительная масса атома (Ar) как физическая величина была введена в 1961 году. Ее значение равно 1/12 массы атома углерода (изотопа 12C).
Выход был найден: предложены другие величины, облегчающие расчеты. Например, в химии используются относительные значения атомных и молекулярных масс. Относительная масса атома (Ar) как физическая величина была введена в 1961 году. Ее значение равно 1/12 массы атома углерода (изотопа 12C).
Для выполнения расчетов по формулам и уравнениям с применением этой и других величин нужно помнить несколько правил:
- Масса атома указана в периодической системе рядом с химическим знаком. Молярная масса имеет такое же численное значение, но с единицами измерения г/моль.
- Массу одного моля вещества определяют по формуле соединения, для чего находят сумму молярных масс всех частиц в молекуле.
- Если в химической формуле есть индекс, указывающий на количество структурных единиц, то необходимо умножить молярную массу на этот коэффициент.
Атомная и молекулярная масса кислорода
Масса атома кислорода получена с учетом количества и распространения трех его природных изотопов: Ar (О) = 15,999 (в а. е. м.). В расчетах это значение обычно округляют, получается 16. Для каждого элемента его атомная масса — постоянная величина. По известной массе атомов элемента с порядковым номером 8 может быть найдена молярная масса элемента кислорода. М(О) = 16. Еще одна безразмерная физическая величина — молекулярная масса кислорода — относится к простому веществу. Вычисляют массу молекулы кислорода, умножив массу атома на стехиометрический коэффициент в формуле: Mr(O2) = Ar (О) . 2 = 16 . 2 = 32. На практике нет необходимости выяснять, какая молярная масса кислорода, ведь ее значение численно равно массе молекулы вещества, но с единицей измерения г/моль. Для конкретного соединения его молекулярная масса является постоянной величиной, широко используется при расчетах количества и массы вещества.
е. м.). В расчетах это значение обычно округляют, получается 16. Для каждого элемента его атомная масса — постоянная величина. По известной массе атомов элемента с порядковым номером 8 может быть найдена молярная масса элемента кислорода. М(О) = 16. Еще одна безразмерная физическая величина — молекулярная масса кислорода — относится к простому веществу. Вычисляют массу молекулы кислорода, умножив массу атома на стехиометрический коэффициент в формуле: Mr(O2) = Ar (О) . 2 = 16 . 2 = 32. На практике нет необходимости выяснять, какая молярная масса кислорода, ведь ее значение численно равно массе молекулы вещества, но с единицей измерения г/моль. Для конкретного соединения его молекулярная масса является постоянной величиной, широко используется при расчетах количества и массы вещества.
Количество вещества
В химии для удобства расчетов используется одна из важнейших физических величин — количество вещества. Относится она не к массе, а к числу структурных единиц. За единицу измерения количества вещества в Международной системе (СИ) принят 1 моль. Зная, что 1 моль включает столько же частиц, сколько их содержится в 12 г углеродного изотопа 12С, можно рассчитать число атомов, молекул, ионов, электронов, содержащихся в навеске любого вещества. Еще одна постоянная величина получила название в честь великого итальянского ученого Авогадро (обозначается NА), Она характеризует число структурных частиц, которые содержит вещество, если его количество — 1 моль. Численное значение постоянной Авогадро — 6,02 . 1023 1/моль. Именно такое количество атомов (молекул, ионов) обладает молярной массой. Обозначение этой физической величины — М, единица измерения — 1 г/моль, формула для расчета — М = m/n (m — масса (г), n — количество вещества (моль)).
За единицу измерения количества вещества в Международной системе (СИ) принят 1 моль. Зная, что 1 моль включает столько же частиц, сколько их содержится в 12 г углеродного изотопа 12С, можно рассчитать число атомов, молекул, ионов, электронов, содержащихся в навеске любого вещества. Еще одна постоянная величина получила название в честь великого итальянского ученого Авогадро (обозначается NА), Она характеризует число структурных частиц, которые содержит вещество, если его количество — 1 моль. Численное значение постоянной Авогадро — 6,02 . 1023 1/моль. Именно такое количество атомов (молекул, ионов) обладает молярной массой. Обозначение этой физической величины — М, единица измерения — 1 г/моль, формула для расчета — М = m/n (m — масса (г), n — количество вещества (моль)).
Чему равна молярная масса кислорода
На практике нет необходимости пользоваться формулой М = m/n для вычисления молярной массы кислорода. При решении задач чаще требуется определить, чему равна масса, или найти количество вещества. В первом случае используют для расчетов формулу m = n . M, во втором — n = m/M. Численное значение молярной массы элемента совпадает с массой атома, а для вещества — молекулы. Например, массу 16 г имеет 1 моль элемента кислорода. М (О2) — молярная масса молекулы кислорода, которая равна 32 г/моль.
В первом случае используют для расчетов формулу m = n . M, во втором — n = m/M. Численное значение молярной массы элемента совпадает с массой атома, а для вещества — молекулы. Например, массу 16 г имеет 1 моль элемента кислорода. М (О2) — молярная масса молекулы кислорода, которая равна 32 г/моль.
Молярная масса эквивалента кислорода
Эквивалентной называют величину, равную массе 1 моля атомов любого одновалентного элемента. В общем случае можно определить эквивалентную массу, поделив молярную массу атомов химического элемента на его валентность, найденную по формуле конкретного соединения. В большинстве своих соединений кислород, как химический элемент-халькоген, двухвалентен. Молярная масса кислорода может быть найдена по таблице Менделеева, ее округленное значение — 16. Эквивалентная масса в 2 раза меньше — 8. В химии применяется закон эквивалентов, который гласит, что вещества вступают в реакцию между собой в количествах, равных их эквивалентам.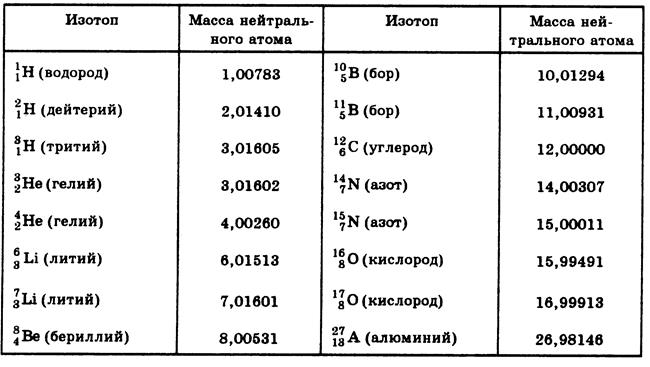 При выполнении расчетов можно использовать молярную массу эквивалента кислорода, чтобы определить массу эквивалента вещества, для которого она неизвестна.
При выполнении расчетов можно использовать молярную массу эквивалента кислорода, чтобы определить массу эквивалента вещества, для которого она неизвестна.
Кислород — один из важнейших элементов в земной коре, на него приходится 46,6 % массы. Простое соединение с тем же названием — второе по распространенности в атмосфере Земли. Содержание молекулярного кислорода в воздухе — 20,947 % по объему. При участии атомов элемента и молекул вещества протекают многие реакции и процессы в технике, промышленности, живой и неживой природе. Важно учесть количественные отношения в этих процессах, что значительно облегчает использование физических величин, в том числе молярной массы кислорода.
Водород атома масса — Справочник химика 21
Земная кора и гидросфера содержат = 49% кислорода и = 0,8% водорода по массе. Сколько атомов кислорода приходится на один атом водорода Н) и массой атома 1 (Н ), 1Н — атом водорода с массой атома [c. 29]
29]
Атом дейтерия, который является тяжелым изотопом водорода, состоит из ядра с массой 2 (ядро атома водорода имеет массу, равную 1) и зарядом + е и из одного электрона, связанного с ядром. Для дейтерия теоретическое значение константы Ридберга [c.109]
Масса молекулы любого. всщества равна сумме масс атомов, образующих эту молекулу. Поэтому молекулярная масса равна сумме соответствующих атомных масс. Например, молекулярная масса молекулы водорода, состоящей из двух атомов, равна 2,0158 а. е. м. молекулярная. масса воды, молекула которой сО держит дна атома водорода и один атом кислорода, равна. 15,9994 + 2-1,0079 = 18,0152 а. е. м. — и т. д. Следовательно, or-носительной молекулярной массой (или просто молекулярной массой) простого или сложного вещества называют массу его молекулы, выраженную в атомных единицах массы. [c.27]
Среди свойств, положенных в основу построения первой периодической системы, основными были масса атома и его способность взаимодействовать с атомами других элементов. Предшествующее этому развитие науки показало, что атомы различных элементов имеют различную массу. Например, атом водорода — самый легкий из всех, атом кислорода примерно в 16 раз тяжелее атома водорода, атом серы примерно в 2 раза тяжелее атома кислорода (или в 32 раза тяжелее атома водорода). Сравнивая таким образом элементы между собой, каждому атому можно приписать атомную массу. [c.124]
Предшествующее этому развитие науки показало, что атомы различных элементов имеют различную массу. Например, атом водорода — самый легкий из всех, атом кислорода примерно в 16 раз тяжелее атома водорода, атом серы примерно в 2 раза тяжелее атома кислорода (или в 32 раза тяжелее атома водорода). Сравнивая таким образом элементы между собой, каждому атому можно приписать атомную массу. [c.124]
Самая легкая из этих частиц была получена, когда остаточным газом был водород. Ее масса приблизительно та же, что и масса атома водорода. Поэтому решили, что этой частицей является атом водорода, потерявший свой электрон ее назвали протоном. Положительный заряд протона равен отрицательному заряду электрона, т. е. элементарному заряду е. Масса протона Л/= 1,67 10″ г. Протон в 1836 раз тяжелее электрона.
Известно, что молекула воды состоит из одного атома кислорода и двух атомов водорода, причем атом кислорода значительно больше атома водорода (атомные массы соответственно равны 16 и 1). Атом кислорода притягивает к себе электроны обоих атомов водорода (причем последние вовсе не находятся по обе стороны кислорода, а располагаются с одной его стороны). В результате кислород получает отрицательный заряд, а атомы водорода заряжены положительно. Поскольку одна сторона молекулы воды положительна, а другая — отрицательна, молекула воды асимметрична и представляет собой диполь. Этим объясняются многие уникальные свойства воды, в том числе и ее способность растворять в себе многие вещества. [c.26]
Атом кислорода притягивает к себе электроны обоих атомов водорода (причем последние вовсе не находятся по обе стороны кислорода, а располагаются с одной его стороны). В результате кислород получает отрицательный заряд, а атомы водорода заряжены положительно. Поскольку одна сторона молекулы воды положительна, а другая — отрицательна, молекула воды асимметрична и представляет собой диполь. Этим объясняются многие уникальные свойства воды, в том числе и ее способность растворять в себе многие вещества. [c.26]
Эти методики резко увеличили предельные молекулярные массы соединений, исследуемых методом масс-спектрометрии. Плазменная десорбция с применением бомбардировки продуктами деления радиоактивного калифорния-252 позволила получить молекулярные ионы с массой 23 ООО из полипептида трипсина. Метод бомбардировки быстрыми атомами (РАВ) обеспечил получение подробных сведений о строении гликопротеина с молекулярной массой около 15 ООО.
 С помощью полевой и лазерной десорбции удалось получить масс-спектры молекулярных ионов, что дает возможность определять распределение олигомеров во фрагментах ДНК. Выпускаемые в настоящее время промышленностью приборы позволяют измерять молекулярные массы до 20 ООО при разрешении 150 ООО. Еще более высокого (в 5—10 раз) разрешения можно достичь, используя метод фурье-преобразования, но он пригоден для ионов относительно малых масс. Предельно высокое разрешение может быть особенно полезным в тех случаях, когда необходимо отличить в масс-спектре массы одного дейтерия от массы двух атомов водорода (разность масс всего 0,007) или массу одного атома от массы фрагмента —Н (разность масс 0,003). При изучении масс-спектров больших молекул эти задачи становятся чрезвычайно важными, поскольку и дейтерий и присутствуют в природе. Достаточно, например, вспомнить, что в молекулу с массой 900 может входить 60 и более атомов углерода, и если содержание соответствует природному (1,1%), то примерно в половине таких молекул имеется по крайней мере один атом углерода-13.
С помощью полевой и лазерной десорбции удалось получить масс-спектры молекулярных ионов, что дает возможность определять распределение олигомеров во фрагментах ДНК. Выпускаемые в настоящее время промышленностью приборы позволяют измерять молекулярные массы до 20 ООО при разрешении 150 ООО. Еще более высокого (в 5—10 раз) разрешения можно достичь, используя метод фурье-преобразования, но он пригоден для ионов относительно малых масс. Предельно высокое разрешение может быть особенно полезным в тех случаях, когда необходимо отличить в масс-спектре массы одного дейтерия от массы двух атомов водорода (разность масс всего 0,007) или массу одного атома от массы фрагмента —Н (разность масс 0,003). При изучении масс-спектров больших молекул эти задачи становятся чрезвычайно важными, поскольку и дейтерий и присутствуют в природе. Достаточно, например, вспомнить, что в молекулу с массой 900 может входить 60 и более атомов углерода, и если содержание соответствует природному (1,1%), то примерно в половине таких молекул имеется по крайней мере один атом углерода-13.
Коэффициенты пересчета различных единиц содержания водорода в железе (относительная плотность 7,88 ат. масса 55,84) [159] [c.4]
При схеме с суспендированным катализатором гидрирование проводят с помощью металлического кобальта, осаждающегося на кизельгуре в результате снижения давления и обработки водородом реакционной массы после карбонилирования. В этом случае осуществляется обычная схема жидкофазного гидрирования с суспендированным катализатором в двух последовательных колоннах непрерывного действия (рис. 127, стр. 715). Гидрирование проводят при 180—200 °С и 200 ат. Однако металлический кобальт является сравнительно малоактивным катализатором гидрирования— в его присутствии восстанавливаются только сами альдегиды, но не ацетали и другие побочные продукты. Поэтому первая стадия гидрирования обычно дополняется второй, проводимой на более активном стационарном катализаторе. [c.756]
Небольшой атом водорода Н, масса которого почти равна массе нейтрона, весьма эффективно замедляет и рассеивает нейтроны.
В свете этого закона представлялось вполне допустимым, что молекула воды состоит из двух атомов водорода и одного атома кислорода. Используя этот закон, можно было также решить, наконец, сколько атомов азота и водорода в аммиаке. А после того как было установлено, что в молекуле аммиака содержится один атом азота и три (а не один) атом водорода, выяснилось, что атомная масса азота равна не примерно 5, а 14. [c.59]
А после того как было установлено, что в молекуле аммиака содержится один атом азота и три (а не один) атом водорода, выяснилось, что атомная масса азота равна не примерно 5, а 14. [c.59]
Приведенные цифры являются атомными массами, взятыми из табл. 98 (стр. 782). На самом деле, в таких расчетах нужно было бы пользоваться массами ядер, но не атомов. Масса электрона в углеродных единицах = 12,000000) составляют 0,000548, и, следовательно, ею нельзя пренебрегать. Но так как суммы атомных чисел Z, а следовательно, и число электронов в правом и левом членах уравнения равны, то массы электронов компенсируются. Отнесенная к 1 г-атому лития и к 1 г-атому водорода, убыль массы в приведенной реакции составляет 18,62 мг. [c.779]
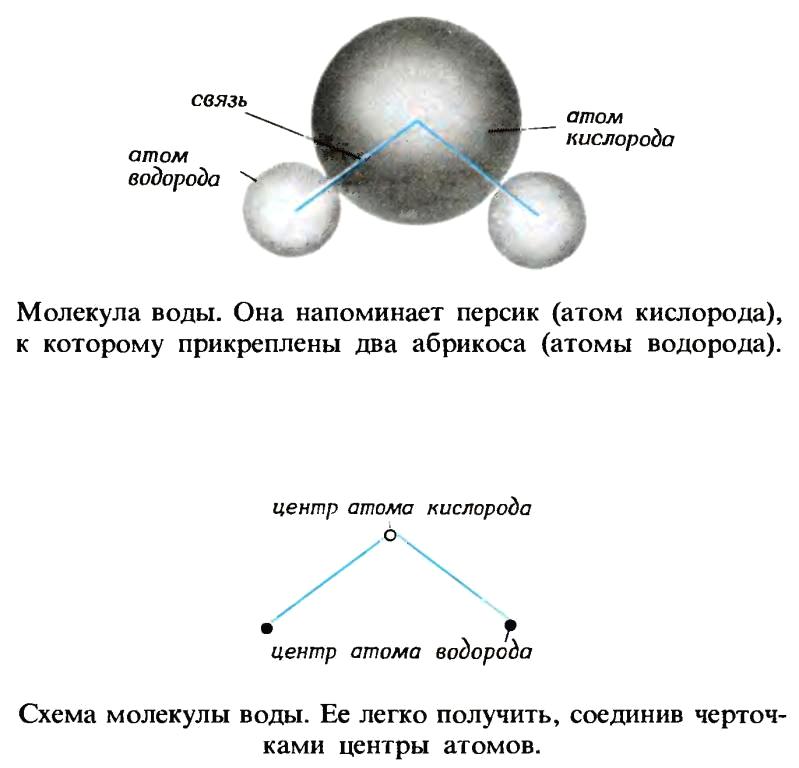
Вода — однородное химическое соединение, молекулы которого состоят из трех атомов, принадлежащих двум химическим элементам — водороду и кислороду. ДвЭ атома водорода и один атом кислорода располагаются ио углам равнобедренного треугольника. По современным воззрениям в воде имеются одновременно и ассоциированные молекулы, образующие рыхлый каркас (льдоподобные рои), и отдельные молекулы, свободно заполняющие промежутки в этом каркасе. Вода является ире-красным растворителем, и поэтому все природные воды представляют собой растворы, содержащие массу раз-нообразных веществ — солей, газов и др. [c.6]
По современным воззрениям в воде имеются одновременно и ассоциированные молекулы, образующие рыхлый каркас (льдоподобные рои), и отдельные молекулы, свободно заполняющие промежутки в этом каркасе. Вода является ире-красным растворителем, и поэтому все природные воды представляют собой растворы, содержащие массу раз-нообразных веществ — солей, газов и др. [c.6]
Во вращающийся автоклав емкостью 2 л загружено 60 г активного алюминия, 500 мл н-гептана и 160 г триэтилалюминия.Туда же введен сухой очищенный водород (150—160 ат). Автоклав нагрет 2 часа при 110—115° С до прекращения падения давления. По окончании поглощения водорода реакционная масса содержала 70% диэтилалюминийгидрида и 30% триэтилалюминия. При правильном ходе реакции не наблюдалось образования этана . Избыточный водород удален при комнатной температуре введен сухой очищенный этилен. Необходимое количество этилена поглотилось за 20—30 мин. при 70—75° С. Избыток этилена удален из нагретого автоклава, затем снова введен водород, и реакция велась, как описано выше. После четырех циклов реакция была закончена. Отделенный от шлама раствор перегнан в вакууме. Всего получено 327 г триэтилалюминия с т. кип. 87—88° С/3 мм (.33], 55-65°С/0,7жж [15], 75-80°С/2,5жж[15] т. пл. — 52,5° С [36] т. замерз.—50,5° С [35, 37]. [c.320]
После четырех циклов реакция была закончена. Отделенный от шлама раствор перегнан в вакууме. Всего получено 327 г триэтилалюминия с т. кип. 87—88° С/3 мм (.33], 55-65°С/0,7жж [15], 75-80°С/2,5жж[15] т. пл. — 52,5° С [36] т. замерз.—50,5° С [35, 37]. [c.320]
Солнце это, в сущности, водородная бомба. Оно представляет собой как бы термоядерный реактор , в котором из атомов водорода синтезируются атомы гелия в результате сложной последовательности реакций четыре атома водорода с массой, близкой к 1, сливаются в атом гелия с массой, близкой к 4 (рис. 1,.2,) 4Н -> Не. [c.13]
Следовательно, в молекуле глюкозы на одни гтом углерода приходится два атома водорода н один атом кнслсрода. Зтому условию удовлетворяют формулы СН2О С2Н4О3 СзНбОз н т. д. Первая из этих формул — СН О — называется простейшей или эмпирической форм у л о и сГ 01 нечаст молекулярная масса [c.38]
Как известно, наименьшей массой обладает атом водорода, н если предположить, что частица катодных лучей имеет такую же массу, то электрический заряд ее должен быть в сотни раз больше, чем наименьший известный заряд (заряд иона водорода). В то же время если предположить, что заряд частицы катодных лучей равен минимальному заряду, наблюдаемому у ионов, то в этом случае масса частицы должна быть во много раз меньше массы атома [c.148]
В то же время если предположить, что заряд частицы катодных лучей равен минимальному заряду, наблюдаемому у ионов, то в этом случае масса частицы должна быть во много раз меньше массы атома [c.148]
Но, согласно новым представлениям о строении атома, атом имеет ядро, состоящее из протонов (и нейтронов). Протоны и нейтроны примерно равны по массе, и, следовательно, массы всех атомов должны быть кратными массе атома водорода (состоящего из одного протона). Гипотеза Праута возродилась, зато вновь возникли сомнения относительно того, какими должны быть атомные массы. [c.167]
Найдем, например, плотность водорода (относительная молекулярная масса М = 2) при температуре t = 27° и давлении р = = 5 ат. Прямая линия, соединяющая точки М = 2 и / = 27°С, пересечет вспомогательную ось О в точке 0. Проведя теперь прямую линию от точки Oi до точки р = 5 ат, получим на оси р точку, соответствующую р = 0,41 г/л. [c.119]
Кислоты из сырьевой емкости 6 насосом 8 и свежий водород компрессором 3 сжимаются до 300 ат и подаются в систему высокого давления. Смесь кислот и водорода проходит подогреватель 9, где нагревается за счет тепла отходящих продуктов гидрирования. Для окончательного подогрева до требуемой температуры смесь проходит трубчатую печь 10 и далее поступает в колонну гидрирования 11. Схемой предусматривается возможность раздельного нагрева кислот и водорода. В этом случае кислоты непосредственно направляются в колонну гидрирования, а циркуляционный водород нагревается в печи до более высокой температуры, обеспечивающей нагрев реакционной массы в колонне гидрирования до 230—240° С. При таком варианте подачи сырья снижается коррозия трубопроводов и нагревательных труб печи, что позволяет изготавливать их из менее качественных сталей. [c.181]
Смесь кислот и водорода проходит подогреватель 9, где нагревается за счет тепла отходящих продуктов гидрирования. Для окончательного подогрева до требуемой температуры смесь проходит трубчатую печь 10 и далее поступает в колонну гидрирования 11. Схемой предусматривается возможность раздельного нагрева кислот и водорода. В этом случае кислоты непосредственно направляются в колонну гидрирования, а циркуляционный водород нагревается в печи до более высокой температуры, обеспечивающей нагрев реакционной массы в колонне гидрирования до 230—240° С. При таком варианте подачи сырья снижается коррозия трубопроводов и нагревательных труб печи, что позволяет изготавливать их из менее качественных сталей. [c.181]
Молекула воды, Н2О, содержит два атома водорода и один атом кислорода, поэтому ее молекулярная масса равна [c.23]
Атом (наш, а не Кэрролла ) состоит из положительно заряженного ядра, окруженного одной или несколькими отрицательно заряженными частицами, называемыми электронами. Сумма всех положительных зарядов равна сумме всех отрицательных зарядов, поэтому атом не имеет результирующего заряда он электрически нейтрален. Большая часть массы атома сосредоточена в его ядре масса электрона составляет лишь 1/1836 часть массы ядра легчайшего из атомов — водорода. Хотя ядро такое тяжелое, оно очень невелико по сравнению с общим размером атома. Радиус типичного атома составляет приблизительно 1-2,5 ангстрема (А), тогда как радиус ядра имеет величину порядка 10 А. Если бы атом оказался увеличенным до размеров Земли, его ядро имело бы всего 60 м в диаметре и смогло свободно уместиться на небольшом футбольном поле. [c.14]
Сумма всех положительных зарядов равна сумме всех отрицательных зарядов, поэтому атом не имеет результирующего заряда он электрически нейтрален. Большая часть массы атома сосредоточена в его ядре масса электрона составляет лишь 1/1836 часть массы ядра легчайшего из атомов — водорода. Хотя ядро такое тяжелое, оно очень невелико по сравнению с общим размером атома. Радиус типичного атома составляет приблизительно 1-2,5 ангстрема (А), тогда как радиус ядра имеет величину порядка 10 А. Если бы атом оказался увеличенным до размеров Земли, его ядро имело бы всего 60 м в диаметре и смогло свободно уместиться на небольшом футбольном поле. [c.14]
Для наиболее распространенной системы н елезо—водород соотношение различных единиц таково I ppm = 0,0001% (масс.) = 0,000553% (ат.) = = 0.0873% (об.) =1.11 см /100 г. [c.236]
Газ, выходящий из абсорбера под давлением 18 ат, состоит из водорода, (основная масса), метана, этилена и других газов, таких, как азот и (в небольшом количество) окись углерода. Пз этой смеси иа двух установках Лииде отделяют чистые водород и этилен. Иа первой установке отбирают этан-этиленовую фракцию, па 1 торой отделяют эта]1 от этилена. Этап (соответственно метан) возвращают на установку электрокрекипга. [c.127]
Пз этой смеси иа двух установках Лииде отделяют чистые водород и этилен. Иа первой установке отбирают этан-этиленовую фракцию, па 1 торой отделяют эта]1 от этилена. Этап (соответственно метан) возвращают на установку электрокрекипга. [c.127]
К электрону определяют их высокую реакц. способность. Г.-сильные окислители Наиб, активен фтор, образующий соед. со всеми хим. элементами, кроме Не, Ne и Аг Реакц. способность Г. убывает с увеличением ат. массы и обычно возрастает в присут. влаги и других Г. Водород с Г. образует галогеноводороды НХ. Энтальпии их образования очень мало зависят от т-ры и уменьшаются от HF к HI. Термич устойчивость в этом ряду также уменьшается Р-ры НС1, НВг и HI в воде-сильные к-ты, р-р HF-к-та средней силы. См. также Бромистый водород. Йодистый водород, Соляная кислота. Фтористый водород. [c.497]
Следует отметить, что этиленацетали ароматических альдегидов и кетали арилалкилкетонов не способны элиминировать из М+ арильные заместители, а лишь алкильные или атом водорода. В масс-спектрах таких соединений обычно присутствуют очень интенсивные пики ароильных катионов. [c.191]
В масс-спектрах таких соединений обычно присутствуют очень интенсивные пики ароильных катионов. [c.191]
Масса атома водорода равна 1,008 к. е. масса электрона равна 5,5-10″ = = 0,00055 к. е. Таким образом, масса электрона составляет лишь небольшую часть массы атома водорода. Следовательно, масса атома водорода практически вся сосредоточена в его ядре (в протоне). Приблизительно такое же соотношетше существует и у атомов других элементов, например урана, атом которого содержит сравнительно с атомами других элементов очень [c.90]
В этой главе мы рассмотрим при помощи методов квантовой механики простейшую атомную систему, именно — атом водорода. Атом водорода состоит из протона с зарядом — -е и массой М и электрона с зарядом — е и массой т. Эти две частицы притягиваются между собой согласно ку лоновскому закону электростатического взаимодействия. Если мы обозначим координаты протона через х , и и координаты электрона — через х , у и z , то потенциальная энергия будет иметь вид [c. 109]
109]
Возможность протекания первой реакции (наиболее обычной) обеспечивается кинетической энергией поглощаемого нейтрона сравнительно легко. Напротив, две последние реакции требуют большой затраты энергии и поэтому могут протекать только под воздействием достаточно быстрых нейтронов. Одним из продуктов третьей реакции является изотоп водорода с массой 3. — т. н. тритий (Т), распространенность которого в природе ничтожно мала (один атом трития приходится примерно на 10 атомов протия). В результате четвертой реакции происходит как бы размножение нейтронов. [c.563]
Водородная связь. Еще в XIX веке было замечено, что соединения, в которых атом водорода непосредственно связан с атомами фтора, кислорода и азота, обладают рядом аномальных свойств. Это проявляется, например, в значениях температур плавления и кипения подобных соединений. Обычно в ряду однотипных соединений элементов данной подгруппы температуры плавления и кипения с увеличением атомной массы элемента возрастают, Это объясняется усилением взанмиога притяжения молекул, чтб связано с увеличением размеров атомов и с ростом дисперсионного взаимодействия между ними (см. 48). Так, в ряду H I—НВг—HI температуры плавления равны, соответственно, [c.154]
48). Так, в ряду H I—НВг—HI температуры плавления равны, соответственно, [c.154]
Дальтон придавал столь же большое значение весовым измерениям, как и Лавуазье, но, кроме того, Дальтон предложил удобное символическое обозначение атомов, показанное на рис. 6-5. Предложенный Дальтоном символ водорода означает нечто большее, чем просто произвольное количество водорода. Он означает один атом водорода либо некоторое стандартное весовое количество водорода, содержащее стандартное число атомов (подобно тому как атомная масса элемента содержит авогадрово число его атомов). Это придавало химическим формулам и уравнениям не только символический, но и количественный смысл. [c.280]
Природные ресурсы. Содержание водорода в земной коре составляет 1,0% (масс.) или 16% (ат.). Водород, в основном, находится в виде НгО. В Свободном состоянии, в виде атомов, он имеется е. ничтожном количестве в верхних слоях атмосферы. Кроме того, немного водорода содержат вулканические и природные газы. Водород — самый распространенный элемент во Вселенной, в атмосфере Солнца его содержание составляет 84%. Он входит в состав всех живых существ. Значительные количества связанного врдорода содержат нефть и природный газ. [c.462]
Водород — самый распространенный элемент во Вселенной, в атмосфере Солнца его содержание составляет 84%. Он входит в состав всех живых существ. Значительные количества связанного врдорода содержат нефть и природный газ. [c.462]
Химия — 7
4. Относительная атомная масса химических элементов
Согласно атомно-молекулярному учению, один вид атома отличается от других видов атома своей массой. Как известно, масса атомов определяется суммой масс находящихся в их ядре протонов и нейтронов (нейтрон отсутствует лишь у атома легкого изотопа водорода). Сумму протонов и нейтронов в каждом атоме называют массовым числом. А можно ли выразить массу атомов известными нам единицами (мг, г, кг)? Атомы настолько мелкие частицы, что определить их массу непосредственно даже точнейшими весами не представляется возможным. Определить массу атомов возможно лишь при помощи физических экспериментов и математических вычислений. Так, например, было вычислено, что масса самого легкого изотопа водорода (protium) ≈ 1,67•10-24 г. На основе массы атома водорода можно вычислить массы и других атомов. При помощи экспериментов можно определить, что масса атома кислорода больше массы атома водорода в 16 раз, а азота — в 14 раз. Тогда получим:
На основе массы атома водорода можно вычислить массы и других атомов. При помощи экспериментов можно определить, что масса атома кислорода больше массы атома водорода в 16 раз, а азота — в 14 раз. Тогда получим:
ma(O) = 1,67•10-24 г • 16 =26,7•10-24 г
ma(N) = 1,67•10-24 г • 14 =23,38•10-24 г
Аналогичным путем вычисляется масса атома углерода:
ma(C) = 1,67•10-24 г • 12 =20,00-24 г.
Так как производить расчеты с такими минимальными числами крайне неудобно, было введено понятие относительной атомной массы. С этой целью впервые Д.Дальтон выдвинул идею сопоставления масс атомов с массой атома водорода. Позже было обнаружено, что при определении относительной атомной массы металлов на основе массы атома водорода возникают некоторые трудности. После этого относительную атомную массу элементов стали вычислять по 1/16 атомной массы кислорода. Открытие изотопов вновь создало определенные трудности. В настоящее время для определения относительной атомной массы элементов в качестве самого удобного эталона берется 1/12 атомной массы изотопа углерода -12 (12С). Данный эталон называют атомной единицей массы (а.е.м.).
Открытие изотопов вновь создало определенные трудности. В настоящее время для определения относительной атомной массы элементов в качестве самого удобного эталона берется 1/12 атомной массы изотопа углерода -12 (12С). Данный эталон называют атомной единицей массы (а.е.м.).
Следует учесть, что при вычислении относительной атомной массы элементов берется масса не одного их атома, а средняя атомная масса их изотопов, которая делится на 1/12 массы изотопа углерода 12С. Относительная атомная масса элементов обозначается знаком Аг. А — начальная буква слова «атом»; г — от латинского слова «relative»— т.е. относительный.
Богданов К.Ю. — учебник по физике для 10 класса
§ 19. МАССЫ АТОМОВ И МОЛЕКУЛ. КОЛИЧЕСТВО ВЕЩЕСТВА. ЧИСЛО АВОГАДРО.
Один моль вещества содержит количество молекул или
атомов, равное постоянной Авогадро.
Закон кратных отношений, открытый Дальтоном, утверждал, что, если два элемента образуют между собой несколько молекулярных соединений, то масса одного элемента, приходящаяся на одну и ту же массу другого, относятся между собой как небольшие целые числа. Например, при взаимодействии азота с кислородом образуются пять оксидов. На 1 грамм азота в образующихся молекулах приходится 0,57, 1,14, 1,71, 2,28, 2,85 грамм кислорода, что соответствует отношением 2:1, 1:1, 2:3, 1:2, 2:5 в этих оксидах, и поэтому состав молекул этих оксидов можно записать в виде N2O, NO, N2O3, NO2, N2O5.
Возьмём другой пример.
Для образования молекулы углекислого газа требуется соединить один атом
углерода с двумя атомами кислорода (CO2) или по весу,
например, 12 г углерода и 32 г кислорода. Из 12 г углерода можно создать также
газ метан (CH4),
если они вступят в реакцию с 4 г водорода. Из этого следует, что в 1 г
водорода, 12 г углерода и 16 г кислорода содержится одно и то же число атомов.
Оказалось, что самыми лёгкими являются атомы водорода, поэтому массу остальных
атомов сначала измеряли в единицах равных массе атома водорода. Однако сейчас
за единицу массы взята 1/12 массы атома углерода, его изотопа
12С. Таким образом, относительной молекулярной или атомной
массой вещества называют отношение массы его молекулы и атома к 1/12 массе
атома углерода.
Из этого следует, что в 1 г
водорода, 12 г углерода и 16 г кислорода содержится одно и то же число атомов.
Оказалось, что самыми лёгкими являются атомы водорода, поэтому массу остальных
атомов сначала измеряли в единицах равных массе атома водорода. Однако сейчас
за единицу массы взята 1/12 массы атома углерода, его изотопа
12С. Таким образом, относительной молекулярной или атомной
массой вещества называют отношение массы его молекулы и атома к 1/12 массе
атома углерода.
Чем больше молекул в кусочке или объёме данного вещества, тем больше вещества там содержится. Чтобы оценить, сколько находится вещества в данном его образце, число молекул в нём сравнивают с числом NА молекул в 12 г углерода. Таким образом, количество вещества, n, содержащееся в некотором его кусочке или объёме, равно:
где N— число молекул в данном его образце.
 Единицей измерения количества вещества в системе СИ служит моль – количество
вещества, содержащееся в 12 г углерода. Другими словами, один моль вещества
содержится в его массе, выраженной в граммах и равной относительной
молекулярной (или атомной) массе этого вещества. Так, моль углерода содержится
в 12 его граммах, моль кислорода (O2) – в 32 его граммах, и т.д.
Единицей измерения количества вещества в системе СИ служит моль – количество
вещества, содержащееся в 12 г углерода. Другими словами, один моль вещества
содержится в его массе, выраженной в граммах и равной относительной
молекулярной (или атомной) массе этого вещества. Так, моль углерода содержится
в 12 его граммах, моль кислорода (O2) – в 32 его граммах, и т.д.Число атомов (или молекул) в одном моле называют числом или постоянной Авогадро, NА, измерить которую удалось только в начале XX века французскому физику Жану Перрену, и за эту работу, демонстрирующую «дискретную природу материи» в 1926 г. он был удостоен Нобелевской премии по физике. Согласно современным измерениям:
Молярной массой, M называют отношение массы m данного образца вещества к количеству n вещества, содержащегося в нём:
которая численно равна массе вещества, взятого в количестве одного моля.
 Молярная масса в системе СИ выражается в
кг/моль. Найдём молярную массу воды (H2O). 1 моль воды содержится в её 0,018
кг, и значит, MH2O= 0,018 кг/моль.
Молярная масса в системе СИ выражается в
кг/моль. Найдём молярную массу воды (H2O). 1 моль воды содержится в её 0,018
кг, и значит, MH2O= 0,018 кг/моль.Абсолютное значение массы mВ атомов или молекул любого вещества можно легко вычислить, если знать молярную массу M этого вещества и постоянную Авогадро, NА. Так как NА равна числу атомов или молекул в одном моле вещества, то очевидно следующее равенство:
дающее
возможность определить mВ по известному значению молярной массы. Например,
масса одной молекулы воды равна 3.10-26 кг. Аналогично
можно вычислить массу атома углерода, 1/12 которой приняли за атомную
единицу массы (а. е.м):
е.м):
Знание числа Авогадро даёт также возможность оценить размер молекул или объём V0, приходящийся на одну молекулу. Пусть данное вещество имеет молярную массу M, а его образец, содержащий n молей этого вещества, имеет массу m, объём V и плотность, т.е. отношение массы к объёму, r. Найдём V0, разделив V на число молекул N в образце и используя (19.1) и (19.2):
Например, объём, приходящийся на одну молекулу воды (r = 103 кг/м3, М=0,018 кг/моль), согласно (19.3), составит 3.10-29 м3 . Если считать, что молекула имеет форму кубика этого объёма, то длина ребра этого кубика, или размер молекулы воды равен 3,1.
 10-10
м.
10-10
м. Вопросы для повторения:
· Что такое относительная молекулярная (или атомная) масса?
· Что такое и в чём измеряется количество вещества?
· Чему равна постоянная Авогадро?
· Сформулируйте определение молярной массы
· Как с помощью числа Авогадро вычислить массу атома и его приблизительные размеры?
2.4: Атомная масса — Химия LibreTexts
Атомный и молекулярный вес
Нижние индексы в химических формулах и коэффициенты в химических уравнениях представляют точных величин. \(H_2O\), например, указывает, что молекула воды содержит ровно двух атомов водорода и одного атома кислорода. Следующее уравнение:
\[ C_3H_{8(г)} + 5O_{2(г)} \rightarrow 3CO_{2(г)} + 4H_2O_{(л)} \label{Eq1}\]
говорит нам не только о том, что пропан реагирует с кислородом с образованием двуокиси углерода и воды, но и о том, что 1 молекул пропана реагирует с 5 молекулами кислорода с образованием 3 молекул двуокиси углерода и молекул углекислого газа и молекул 4 молекул воды. Поскольку сосчитать отдельные атомы или молекулы немного сложно, количественные аспекты химии полагаются на знание масс участвующих соединений.
Поскольку сосчитать отдельные атомы или молекулы немного сложно, количественные аспекты химии полагаются на знание масс участвующих соединений.
Атомы разных элементов имеют разную массу. Ранние работы по разделению воды на составные элементы (водород и кислород) показали, что в 100 граммах воды содержится 11,1 грамма водорода и 88,9 грамма кислорода:
\[\text{100 граммов воды} \rightarrow \text{11,1 граммов водорода} + \text{88.9 грамм кислорода} \label{Eq2}\]
Позже ученые обнаружили, что вода состоит из двух атомов водорода на каждый атом кислорода. Следовательно, в приведенном выше анализе в 11,1 граммах водорода было в два раза больше атомов, чем в 88,9 граммах кислорода. Следовательно, атом кислорода должен весить примерно в 16 раз больше, чем атом водорода:
\[ \dfrac{\dfrac{88,9\;г\;Кислород}{1\; атом}}{\dfrac{111\;g\;водород}{2\;атомы}} = 16 \label{Eq3}\]
Водороду, самому легкому элементу, была присвоена относительная масса «1», а другим элементам были присвоены «атомные массы» относительно этого значения для водорода. Таким образом, кислороду была присвоена атомная масса 16. Теперь мы знаем, что атомов водорода имеют массу 1,6735 x 10 -24 граммов, а атомов кислорода имеют массу 2,6561 X 10 -23 грамм. Как мы видели ранее, при работе с такими малыми числами удобно использовать единицу отсчета: единиц атомной массы . Атомная единица массы ( а.е.м. ) была стандартизирована не по водороду, а, скорее, по 12 изотопа углерода ( а.е.м. = 12 ).
Таким образом, кислороду была присвоена атомная масса 16. Теперь мы знаем, что атомов водорода имеют массу 1,6735 x 10 -24 граммов, а атомов кислорода имеют массу 2,6561 X 10 -23 грамм. Как мы видели ранее, при работе с такими малыми числами удобно использовать единицу отсчета: единиц атомной массы . Атомная единица массы ( а.е.м. ) была стандартизирована не по водороду, а, скорее, по 12 изотопа углерода ( а.е.м. = 12 ).
Таким образом, масса атома водорода ( 1 Н) равна 1,0080 а.е.м. , а масса атома кислорода ( 16 О) равна 15,995 а.е.м.6. Как только массы атомов были определены,
а.е.м. можно было присвоить фактическое значение:
 е.м.
е.м. Средняя атомная масса
Хотя массы электрона, протона и нейтрона известны с высокой степенью точности (таблица 2.3.1), масса любого данного атома — это не просто сумма масс его электронов, протонов и нейтронов. Например, отношение масс 1 H (водород) и 2 H (дейтерий) на самом деле составляет 0,500384, а не 0,49979, как предсказывалось исходя из числа присутствующих нейтронов и протонов. Хотя разница в массе невелика, она чрезвычайно важна, поскольку является источником огромного количества энергии, выделяемой в ядерных реакциях.
Поскольку атомы слишком малы, чтобы их можно было измерить по отдельности, и не имеют зарядов, не существует удобного способа точного измерения абсолютных атомных масс.Однако ученые могут очень точно измерять относительные атомные массы, используя прибор, называемый масс-спектрометром. Этот метод концептуально похож на тот, который Томсон использовал для определения отношения массы электрона к заряду. Во-первых, электроны удаляются или присоединяются к атомам или молекулам, создавая таким образом заряженные частицы, называемые ионами. Когда приложено электрическое поле, ионы ускоряются в отдельной камере, где они отклоняются от своей первоначальной траектории магнитным полем, как электроны в эксперименте Томсона.Степень отклонения зависит от отношения массы иона к заряду. Измеряя относительное отклонение ионов с одинаковым зарядом, ученые могут определить их относительную массу (рис. \(\PageIndex{1}\)). Таким образом, невозможно точно вычислить абсолютные массы атомов, просто сложив вместе массы электронов, протонов и нейтронов, и нельзя измерить абсолютные массы атомов, но можно очень точно измерить относительные массы. На самом деле в химии довольно часто встречаются величины, величина которых может быть измерена только относительно какой-либо другой величины, а не абсолютно.{37}Cl\) примерно в соотношении 3:1. (а) Когда образец элементарного хлора вводится в масс-спектрометр, электрическая энергия используется для диссоциации молекул Cl 2 на атомы хлора и превращения атомов хлора в ионы Cl + .
Во-первых, электроны удаляются или присоединяются к атомам или молекулам, создавая таким образом заряженные частицы, называемые ионами. Когда приложено электрическое поле, ионы ускоряются в отдельной камере, где они отклоняются от своей первоначальной траектории магнитным полем, как электроны в эксперименте Томсона.Степень отклонения зависит от отношения массы иона к заряду. Измеряя относительное отклонение ионов с одинаковым зарядом, ученые могут определить их относительную массу (рис. \(\PageIndex{1}\)). Таким образом, невозможно точно вычислить абсолютные массы атомов, просто сложив вместе массы электронов, протонов и нейтронов, и нельзя измерить абсолютные массы атомов, но можно очень точно измерить относительные массы. На самом деле в химии довольно часто встречаются величины, величина которых может быть измерена только относительно какой-либо другой величины, а не абсолютно.{37}Cl\) примерно в соотношении 3:1. (а) Когда образец элементарного хлора вводится в масс-спектрометр, электрическая энергия используется для диссоциации молекул Cl 2 на атомы хлора и превращения атомов хлора в ионы Cl + . Затем ионы ускоряются в магнитном поле. Степень, в которой ионы отклоняются магнитным полем, зависит от их относительного отношения массы к заряду. Обратите внимание, что более легкие ионы 35 Cl + отклоняются больше, чем более тяжелые ионы 37 Cl + .Измеряя относительные отклонения ионов, химики могут определить их отношение массы к заряду и, следовательно, их массы. (b) Каждый пик в масс-спектре соответствует иону с определенным отношением массы к заряду. Содержание двух изотопов можно определить по высоте пиков.
Затем ионы ускоряются в магнитном поле. Степень, в которой ионы отклоняются магнитным полем, зависит от их относительного отношения массы к заряду. Обратите внимание, что более легкие ионы 35 Cl + отклоняются больше, чем более тяжелые ионы 37 Cl + .Измеряя относительные отклонения ионов, химики могут определить их отношение массы к заряду и, следовательно, их массы. (b) Каждый пик в масс-спектре соответствует иону с определенным отношением массы к заряду. Содержание двух изотопов можно определить по высоте пиков.
Произвольным стандартом, который был установлен для описания атомной массы, является атомная единица массы (аму или u), определяемая как одна двенадцатая массы одного атома 12 C. Поскольку массы всех других атомов рассчитываются относительно по стандарту 12 C, 12 C — единственный атом, указанный в таблице 2.{12} C = 0,167842 \× 12 \; а.е.м. = 2,104104 \; аму \label{Eq4}\]
Аналогично определяются массы остальных элементов.
В периодической таблице перечислены атомные массы всех элементов. Сравнение этих значений с данными, указанными для некоторых изотопов в таблице 2.3.2, показывает, что атомные массы, указанные в периодической таблице, никогда точно не соответствуют массам любого из изотопов. Поскольку большинство элементов существуют в виде смесей нескольких стабильных изотопов, атомная масса элемента определяется как средневзвешенное значение масс изотопов.Например, встречающийся в природе углерод в основном представляет собой смесь двух изотопов: 98,89% 12 C (масса = 12 а.е.м. по определению) и 1,11% 13 C (масса = 13,003355 а.е.м.). Процентное содержание 14 C настолько мало, что его можно не учитывать в этом расчете. Затем средняя атомная масса углерода рассчитывается следующим образом:
\[ \rm(0,9889 х 12 а.е.м.) + (0,0111 х 13,003355 а.е.м.) = 12,01 а.е.м. \label{Eq5} \]
Углерод состоит преимущественно из 12 С, поэтому его средняя атомная масса должна быть близка к 12 а. е.м., что согласуется с этим расчетом.
е.м., что согласуется с этим расчетом.
Значение 12,01 показано под символом C в периодической таблице, хотя и без сокращения аму, которое обычно опускается. Таким образом, приведенная в таблице атомная масса углерода или любого другого элемента представляет собой средневзвешенное значение масс встречающихся в природе изотопов.
Пример \(\PageIndex{1}\)
Встречающийся в природе бром состоит из двух изотопов, перечисленных в следующей таблице:
| Изотоп | Точная масса (а.е.м.) | Численность в процентах (%) |
|---|---|---|
| 79 Бр | 78.9183 | 50,69 |
| 81 Бр | 80.9163 | 49.31 |
Рассчитайте атомную массу брома.
Дано : точная масса и процент содержания
Запрашиваемый : атомная масса
Стратегия :
- Преобразуйте содержание в процентах в десятичную форму, чтобы получить массовую долю каждого изотопа.
- Умножьте точную массу каждого изотопа на его соответствующую массовую долю (процент содержания ÷ 100), чтобы получить его взвешенную массу.
- Сложите взвешенные массы, чтобы получить атомную массу элемента.
- Убедитесь, что ваш ответ имеет смысл.
Решение :
A Атомная масса представляет собой средневзвешенное значение масс изотопов. В общем можно написать
атомная масса элемента = [(масса изотопа 1 в а.е.м.) (массовая доля изотопа 1)] + [(масса изотопа 2) (массовая доля изотопа 2)] + …
Бром имеет только два изотопа.{81}Br: 80,9163 \;а.е.м. \×0,4931 = 39,90 \;а.е.м.\)
C Сумма взвешенных масс атомная масса брома равна
40,00 а. е.м. + 39,90 а.е.м. = 79,90 а.е.м.
е.м. + 39,90 а.е.м. = 79,90 а.е.м.
D Это значение находится примерно посередине между массами двух изотопов, что ожидается, поскольку процентное содержание каждого из них составляет примерно 50%.
Упражнение \(\PageIndex{1}\)
Магний имеет три изотопа, перечисленных в следующей таблице:
| Изотоп | Точная масса (а.е.м.) | Численность в процентах (%) |
|---|---|---|
| 24 мг | 23.98504 | 78,70 |
| 25 мг | 24.98584 | 10.13 |
| 26 мг | 25.98259 | 11.17 |
Используйте эти данные для расчета атомной массы магния.
Ответ : 24.31 а.е.м.
Резюме
Масса атома представляет собой средневзвешенное значение, которое в значительной степени определяется количеством его протонов и нейтронов, тогда как количество протонов и электронов определяет его заряд.Каждый атом элемента содержит одинаковое количество протонов, известное как атомный номер (Z). Нейтральные атомы имеют одинаковое количество электронов и протонов. Атомы элемента, содержащие разное количество нейтронов, называются изотопами. Каждый изотоп данного элемента имеет одинаковый атомный номер, но разное массовое число (А), которое представляет собой сумму количества протонов и нейтронов. Относительные массы атомов сообщаются с использованием атомной единицы массы (а.е.м.), которая определяется как одна двенадцатая массы одного атома углерода-12 с 6 протонами, 6 нейтронами и 6 электронами.Атомная масса элемента представляет собой средневзвешенное значение масс встречающихся в природе изотопов. Когда один или несколько электронов присоединяются к атому или молекуле или удаляются от них, образуется заряженная частица, называемая ионом, заряд которой указывается верхним индексом после символа.
Почему относительная атомная масса кислорода меньше 16?
Почему относительная атомная масса кислорода меньше 16? Почему относительная атомная масса кислорода меньше 16?Кислород имеет три встречающихся в природе изотопа (см. таблицу ниже).Относительная атомная масса кислорода равна 15,9994. Почему родственник атомная масса кислорода менее 16?
| Изотоп | % Естественное изобилие |
| кислород-16 | 99,762% |
| кислород-17 | 0,038% |
| кислород-18 | 0,200% |
Атомная масса элемента определяется как среднее значение масс изотопов, взвешенных в соответствии с встречающимися в природе содержания изотопов элемента.
 Хотя кислород имеет девять изотопов с массовыми числами от 13 до 21, кислород-13, кислород-14 и
кислород-15 не являются естественными изотопами. Таким образом, нам не нужно включать их, когда мы вычисляем относительную атомную массу кислорода. Почему
относительная атомная масса кислорода менее 16?
Хотя кислород имеет девять изотопов с массовыми числами от 13 до 21, кислород-13, кислород-14 и
кислород-15 не являются естественными изотопами. Таким образом, нам не нужно включать их, когда мы вычисляем относительную атомную массу кислорода. Почему
относительная атомная масса кислорода менее 16?На самом деле мы не можем определить массу атома, просто сложив массы его протонов и нейтронов. Таким образом, следующее расчет неверен:
Относительная атомная масса = 16 x 99.762% + 17 х 0,038% + 18 х 0,200% = 16,008
Фактические массы отдельных атомов кислорода не являются целыми числами, даже если их массовые числа являются целыми числами. Когда протоны и нейтроны объединяются, чтобы сформировать ядро кислорода, очень небольшое количество общей массы преобразуется в энергии связи ядра . Однако мы не может предсказать количество энергии связи ядра, просто подсчитав количество протонов и нейтронов. Это должно быть экспериментально определено с помощью масс-спектрометра.
 Например, поскольку масса одного атома кислорода-16 в 1,33291 раза больше массы одного атома углерода-12, масса одного
атом кислорода-16 должен быть равен 1,33291 х 12 = 15,99492 атомных единиц массы.
Например, поскольку масса одного атома кислорода-16 в 1,33291 раза больше массы одного атома углерода-12, масса одного
атом кислорода-16 должен быть равен 1,33291 х 12 = 15,99492 атомных единиц массы.Важно отметить, что только масса одного атома углерода-12 является целым числом, поскольку по международному соглашению один атом углерода изотопу углерода-12 была присвоена масса 12 атомных единиц массы.
Понятие массы изотопов четко не описано во многих учебниках.Писатели обычно подчеркивают, что относительная масса электрон близок к нулю, поэтому относительная масса изотопа примерно равна его массовому числу. Такое объяснение может привести к студенческие заблуждения об атомной массе.
Дэвид Дайс разработал интересный эксперимент с атомной массой (http://www.carlton.paschools.pa.sk.ca/chemical/Molemass/moles3a.htm). Вы можете адаптировать его для удовлетворения потребностей ваших студентов-химиков.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера для приема файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Атомный вес кислорода | Комиссия по изотопному содержанию и атомному весу
| Изотоп | Атомная масса (Да) | Содержание изотопов (доля количества) | |||||
|---|---|---|---|---|---|---|---|
16 50057 O| [0,997 38, 0,997 76] | 17 O | 16.999 131 757 (5) | [0.000 367, 0,000 400] | 18 O | 17,999 159 613(5) | [0,001 87, 0,002 22] | |
Двумя основными источниками кислорода являются воздух и вода. Измерения относительного изотопного соотношения кислорода в воде и многих других веществах обычно выражаются
относительно эталонного материала VSMOW, и в этом случае значение VSMOW δ ( 18 O) равно 0 ‰ по определению. Тем не мение,
обычно использовались две другие шкалы: (1) в исследованиях атмосферных газов и смежных тем атмосферный
O 2 может быть присвоено δ ( 18 O) значение 0 ‰, (2) при изучении морских карбонатных отложений и
смежные темы, образцу морского карбоната (PDB, белемнит Пиди) может быть присвоено значение δ ( 18 O) 0 ‰.
Тем не мение,
обычно использовались две другие шкалы: (1) в исследованиях атмосферных газов и смежных тем атмосферный
O 2 может быть присвоено δ ( 18 O) значение 0 ‰, (2) при изучении морских карбонатных отложений и
смежные темы, образцу морского карбоната (PDB, белемнит Пиди) может быть присвоено значение δ ( 18 O) 0 ‰.
Связь атомных весов с относительными измерениями соотношения изотопов кислорода может быть сложной в принципе.
наблюдением, что показатель степени в уравнении фракционирования в зависимости от массы может значительно отклоняться
от половины, и тем фактом, что относительные измерения соотношения изотопов обычно не включают 17 О.Тем не менее, хотя значение показателя степени 17 O может достигать 0,52 или 0,53 в общем
веществ, ошибки атомного веса, вызванные этими различиями, малы по сравнению с неопределенностью
«абсолютного» измерения атомного веса. Большие отклонения от массового фракционирования 18 O, 17 O и 16 O наблюдались в второстепенных атмосферных газах, таких как O 3 , CO 2 , N 2 O,
и CO, по-видимому, в результате фотохимических реакций, не зависящих от массы. Похожие функции
наблюдались в сульфатах и нитратах в атмосферных выпадениях и некоторых типах почв,
и вполне вероятно, что количество и разнообразие образцов, о которых сообщается, демонстрируют не зависящий от массы изотоп кислорода.
фракционирование будет быстро увеличиваться в будущем.
Похожие функции
наблюдались в сульфатах и нитратах в атмосферных выпадениях и некоторых типах почв,
и вполне вероятно, что количество и разнообразие образцов, о которых сообщается, демонстрируют не зависящий от массы изотоп кислорода.
фракционирование будет быстро увеличиваться в будущем.
Изменения атомного веса кислорода в поверхностных водах на Земле обычно коррелируют с те из водорода, поскольку изотопы обоих элементов фракционируются путем испарения и конденсации. В то время как океанская вода имеет почти постоянные значения атомного веса H и O во всем мире (около VSMOW) осадки сильно различаются, при этом самые низкие значения приходятся на высокие широты.Естественные вариации в изотопном составе кислорода использовались с 1950-х годов в исследованиях гидрологических круговорот, биогеохимия и палеоклиматы.
Самое высокое естественное наземное значение δ ( 18 O) получено из морской N 2 O.
с δ ( 18 O) = +109 ‰, x ( 18 O) = 0,002 218 и A r (O) = 15,999 7,999 7
Самое низкое естественное значение δ ( 18 O) получено из антарктических осадков с δ ( 18 O) = −63 ‰, х ( 18 О) = 0. 001 875 и A r (O) = 15,999 04. Учитывая относительно небольшие погрешности
в лучших «абсолютных» измерениях (0,25 ‰) и в типичных относительных измерениях (0,1 ‰ и менее) очевидно, что неопределенность стандартного атомного веса кислорода
преобладают реальные природные вариации.
001 875 и A r (O) = 15,999 04. Учитывая относительно небольшие погрешности
в лучших «абсолютных» измерениях (0,25 ‰) и в типичных относительных измерениях (0,1 ‰ и менее) очевидно, что неопределенность стандартного атомного веса кислорода
преобладают реальные природные вариации.
Атомные массы элементов 2009 М.Е.Визер и Т.Б. Коплен. Чистое приложение. хим. 2011 (83) 359-396
CIAAW
Oxygen
A R (O) = [15.999 03, 15.999 77] С 2009 года
Наименование происходит от греческого OXYS для «кислоты» и генов для «формирования», потому что французы химик
Антуан-Лоран Лавуазье когда-то считал, что кислород является неотъемлемой частью всех кислот.
Кислород был открыт независимо друг от друга шведским фармацевтом и химиком Карлом-Вильгельмом Шееле в 1771 году и английским священником и
химик Джозеф Пристли в 1774 году. Химический трактат Шееле о воздухе и огне был отложен в публикации.
до 1777 года, поэтому Пристли приписывают открытие, потому что он опубликовал его первым.
Химический трактат Шееле о воздухе и огне был отложен в публикации.
до 1777 года, поэтому Пристли приписывают открытие, потому что он опубликовал его первым.
Естественные вариации изотопного состава кислорода
Стандарты изотопные кислорода.
Химическая лаборатория первокурсников Университета Массачусетса Лоуэлла
Эксперимент
7
Формула соединения I: магний и кислород
Обзор
В этом эксперименте вы
точно взвесьте образец металлического магния, а затем нагрейте
образец в воздухе. Металлический магний реагирует с кислородом (O 2 )
воздуха с образованием оксида магния. Mg+O 2 оксид магния
Металлический магний реагирует с кислородом (O 2 )
воздуха с образованием оксида магния. Mg+O 2 оксид магния
После реакции образца магния полностью, вы определяете массу продукта оксида магния. От этих двух масс, вы вычисляете процентный состав оксид магния.
Расчеты
Предположим, что данные ниже были записаны для этого эксперимента (см. стр. 33, раздел I).
Масса магний | 0,3397 г |
Тигельная масса, крышка, стакан | 45. |
Тигельная масса, крышка, стакан, продукт | ———- |
после первого отопление | 46.3105 г |
после секунды отопление | 46,2995 г |
после третьего обогрев (если выполняется) | 46. |
Обратите внимание, что эксперимент требует от вас
определить в мензурке начальную массу магния
взят металл.Масса магния, записанная на странице 33 раздела I,
часть (а) должна быть только масса металлического магния
сам (без учета массы стакана, в котором масса
было принято решение). Ваш ответ должен быть между 0,3 и 0,4 г.
(если у вас есть большее число, чем это, вы включаете массу
стакана). Массы, записанные на странице 33 в разделе I, часть
(c) включают массу контейнеров (массу пустого
контейнеров записывается в Разделе I, часть (b)). Обратите внимание, что все массы
должен быть определен до четырех знаков после запятой на электронном
баланс: это обычно приводит к 6 значащим цифрам, когда
включены массы контейнеров, что предусматривает массы
магний и оксид магния должны быть определены до четырех значащих
цифры.
Обратите внимание, что все массы
должен быть определен до четырех знаков после запятой на электронном
баланс: это обычно приводит к 6 значащим цифрам, когда
включены массы контейнеров, что предусматривает массы
магний и оксид магния должны быть определены до четырех значащих
цифры.
Страница 33 Часть II
а. Масса продукта
Масса продукта, используемого во всех последующие расчеты основаны на окончательной массе тигель/химический стакан и содержимое (после всех нагреваний) завершено) минус масса пустого контейнера (до в него был добавлен магний).По указанным выше данным рассчитайте масса продукта, затем нажмите здесь, чтобы проверить ваш ответ.
б. Масса прореагировавшего кислорода
Поскольку продукт вашей реакции
должен быть чистый оксид магния (содержащий магний и
кислород), а в качестве исходного материала был взят чистый элемент магний , масса прореагировавшего кислорода должна быть как раз разница в этих двух массах. Используя приведенные выше данные, рассчитайте
масса кислорода, прореагировавшего с взятой пробой магния, и
затем нажмите здесь, чтобы проверить свой ответ.
Используя приведенные выше данные, рассчитайте
масса кислорода, прореагировавшего с взятой пробой магния, и
затем нажмите здесь, чтобы проверить свой ответ.
с. Молей магния прореагировало
Количество молей магния прореагировавшего основано на массе взятого магния и молярная масса магния (24.31 г на моль Mg). Для данных выше рассчитайте количество молей магния, прореагировавшего, затем нажмите здесь, чтобы проверить свой ответ.
д. Молей кислорода прореагировало
Число молей атомов кислорода
содержится в 0,2270 г кислорода (вычислено выше) рассчитывается
используя атомную массу кислорода (16.00 г на моль). Обратите внимание, что
атомы кислорода находятся в MgO индивидуально…. вместо как O 2 молекулы. Вычислите количество молей атомов кислорода, содержащихся
в 0,2270 г кислорода, затем нажмите здесь, чтобы проверить
ваш ответ.
вместо как O 2 молекулы. Вычислите количество молей атомов кислорода, содержащихся
в 0,2270 г кислорода, затем нажмите здесь, чтобы проверить
ваш ответ.
эл. Отношение молей атомов Mg к молям O атомы
Эмпирическая формула представляет собой наименьшее целочисленное отношение 90 387 типов атомов в соединении.Экспериментально установлено, что 0,01397 моль магний соединился с 0,01419 моль кислорода. Это означает, что количество атомов кислорода, которые объединились на атом магния дается соотношением
ф.
 Эмпирическая формула (малое целое
номера)
Эмпирическая формула (малое целое
номера)Поскольку у нас не может быть кислорода «1,016» атомов, а поскольку в любом начинании есть экспериментальная ошибка, мы округлить это отношение до целого числа один . Это соединение содержит один атомов кислорода на каждый атомов магния, и так что эмпирическая формула просто MgO.
г. Экспериментальный % Mg (по массе) в продукт
Процент магния (по массе) составляет в расчете на массу взятого магния и массу продукта, который в результате.По приведенным выше данным рассчитайте процентное содержание магния (по масса), определенная в эксперименте, то нажмите здесь чтобы проверить свой ответ.
час. Фактическая формула оксида магния (на основе степеней окисления)
В «Номенклатурной мастерской» вы
практиковались в написании формул соединений, и во многих случаях вы
могли использовать расположение данного репрезентативного элемента в
Периодической таблице, чтобы определить заряд иона, который
элемент будет образовывать соединения. Поскольку магний относится к группе 2А.
элемент, образует ионы +2: Mg 2+ . Поскольку кислород представляет собой группу
Элемент 6А образует ионы -2: O 2- . Итак, исходя из этих
заряды, мы могли бы предсказать, что формула оксида магния должна
быть MgO (один ион +2 в сочетании с одним ионом -2).
Поскольку магний относится к группе 2А.
элемент, образует ионы +2: Mg 2+ . Поскольку кислород представляет собой группу
Элемент 6А образует ионы -2: O 2- . Итак, исходя из этих
заряды, мы могли бы предсказать, что формула оксида магния должна
быть MgO (один ион +2 в сочетании с одним ионом -2).
я. Теоретический % Mg по массе
На основе предсказанной формулы оксида магния (часть h выше), мы можем рассчитать «теоретическое» процентов по массе магния в оксиде магния.
Молярная масса MgO = 24,31 г + 16,00 г = 40,31 г |
л.
 % ошибка в процентах магния
% ошибка в процентах магнияЭто сравнивает ваше экспериментальное значение для %Mg [часть (г) выше] с теоретическим % Mg на основе истинная формула [часть (i) выше]. Если вы провели свой эксперимент очень осторожно, это число должно быть меньше 1%. Для данных выше
вопросов
Мы не можем дать вам ответы,
но вот несколько «полезных советов».
- Когда в вопросе сказано «элементарно» кислород, это относится к форме, в которой кислород находится в атмосфера.
- Когда в вопросе написано «элементарно» азот, это относится к форме, в которой азот находится в атмосфера.
- Это уравнение написано на основе того, что вы сделали на шагах 7 и 8 процедуры (что вы добавили к тиглю в этот момент??) и информация, приведенная в сам вопрос.
- С таким вопросом, подумайте
самая экстремальная ситуация. Предположим, у вас есть три образца по 1000 г
магний. Предположим, вы нагреваете один образец магния в чистоте .
кислород , чтобы он полностью превратился в оксид магния
(не беспокоясь о присутствии нитрида магния. Что такое
% Mg в этом продукте?? Предположим, вы нагреваете другой образец магния.
в чистый азот , чтобы полностью преобразовать его в магний
нитрид.
 Каким будет % Mg в этом продукте?? Предположим, вы нагреваете
третий образец воздух который представляет собой смесь магния и
кислорода, и обнаруживаем, что продукт в основном представляет собой оксид магния, но
загрязнены небольшим количеством нитрида магния?? Как бы
% Mg этой смеси оксида магния и нитрида магния
сравните с % Mg в чистом MgO и % Mg в чистом Mg 3 N 2 ??
Каким будет % Mg в этом продукте?? Предположим, вы нагреваете
третий образец воздух который представляет собой смесь магния и
кислорода, и обнаруживаем, что продукт в основном представляет собой оксид магния, но
загрязнены небольшим количеством нитрида магния?? Как бы
% Mg этой смеси оксида магния и нитрида магния
сравните с % Mg в чистом MgO и % Mg в чистом Mg 3 N 2 ??
Молекулярный кислород — Энергетическое образование
Рисунок 1.Модель молекулярного или двухатомного кислорода, состоящего из двух атомов кислорода, связанных вместе. [1] Молекулярный кислород (O 2 ) представляет собой двухатомную молекулу, состоящую из двух атомов кислорода, соединенных ковалентной связью. Молекулярный кислород необходим для жизни, так как он используется для дыхания многими организмами. Это также важно для сжигания ископаемого топлива.
Молекулярный кислород необходим для жизни, так как он используется для дыхания многими организмами. Это также важно для сжигания ископаемого топлива.
Молекулярный кислород очень химически активен и довольно легко образует оксиды в результате реакции с другими элементами и соединениями.Мы полагаемся на фотосинтез растений для пополнения молекулярного кислорода в атмосфере — если фотосинтез прекратится, в конечном итоге содержание кислорода в атмосфере упадет почти до нуля.
Поскольку животные (включая людей) дышат молекулярным кислородом и нуждаются в нем для обмена веществ, это важно с медицинской точки зрения. Молекулярный кислород используется в терапевтических целях при оксигенотерапии и гипербарических камерах, а также входит в состав дыхательного газа для исследования космоса и подводного плавания с аквалангом.
В промышленности кислород используется для удаления примесей серы и углерода во время плавки.Кислород (в виде сжатого газа) также широко используется при сварке и резке металлов, как окислитель в ракетных двигателях. Кислород также важен для создания многих видов химического сырья, например оксида этилена. [2]
Кислород также важен для создания многих видов химического сырья, например оксида этилена. [2]
Свойства
Некоторые физические свойства молекулярного кислорода:
Горение
Молекулярный кислород важен для горения, особенно при сжигании топлива для получения энергии. Горение — это реакция соединения (топлива) с окислителем (обычно это молекулярный кислород) с образованием оксидов.Третий компонент горения — это «подъем» энергии, необходимой для начала реакции, — энергия активации . Все три компонента (топливо, окислитель, энергия) должны присутствовать, чтобы произошла реакция горения.
Сжигание ископаемого топлива, такого как метан, показанное на рис. 2 ниже, приводит к образованию двуокиси углерода, водяного пара и энергии. Сжигание ископаемого топлива обеспечивает около 95% первичной энергии в мире. Сжигание углеводородов также способствует изменению климата, производя такие выбросы, как двуокись углерода.
Рисунок 2. Метан соединяется с кислородом с образованием углекислого газа, воды и тепла. [5]
Метан соединяется с кислородом с образованием углекислого газа, воды и тепла. [5] В то время как другие вещества (например, фтор) могут выступать в качестве окислителей при горении [6] , наиболее распространенным является кислород. Окислители поддерживают горение, принимая электроны от молекулы топлива, что облегчает разрыв химических связей в реакции. Хотя фтор на самом деле является лучшим акцептором электронов, чем кислород, окисление фтором слишком сильное, чтобы его можно было использовать в большинстве приложений.Кислород также более распространен, и его легче найти, что делает его наиболее распространенным окислителем для этих реакций.
Ссылки
Молекулярная масса кислорода
Молярная масса O = 15,9994 г/моль
Преобразование граммов кислорода в моли или молей кислорода в граммы
| Элемент | Символ | Атомная масса | Количество атомов | Процент по массе |
| Кислород | О | 15. 9994 9994 | 1 | 100.000% |
В химии формульный вес представляет собой величину, вычисляемую путем умножения атомного веса (в атомных единицах массы) каждого элемента в химической формуле на число атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов.
Веса формулособенно полезны при определении относительных весов реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные из химического уравнения, иногда называют весами уравнения.
Обычный запрос на этом сайте — конвертировать граммы в моли. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
Атомные веса, используемые на этом сайте, получены из NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Вот как можно рассчитать молярную массу (среднюю молекулярную массу), основанную на изотропно взвешенных средних.Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Вот как можно рассчитать молярную массу (среднюю молекулярную массу), основанную на изотропно взвешенных средних.Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные массы и рассчитать молекулярную массу вещества.
Нахождение молярной массы начинается с граммов на моль (г/моль).При расчете молекулярной массы химического соединения она сообщает нам, сколько граммов содержится в одном моле этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Если формула, используемая для расчета молекулярной массы, является молекулярной формулой, вычисляемая формула веса является молекулярной массой. Весовой процент любого атома или группы атомов в соединении можно рассчитать, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.

 7324 г
7324 г 2991 г
2991 г