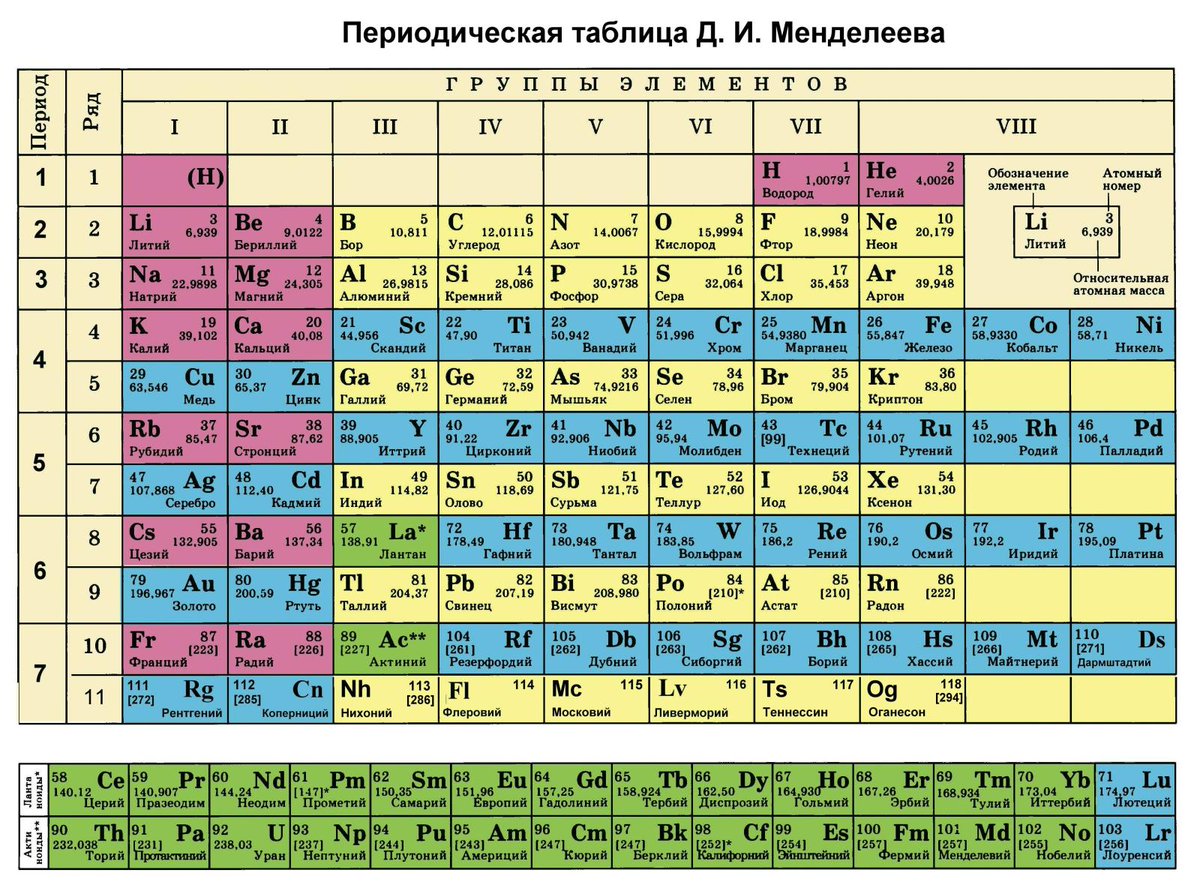
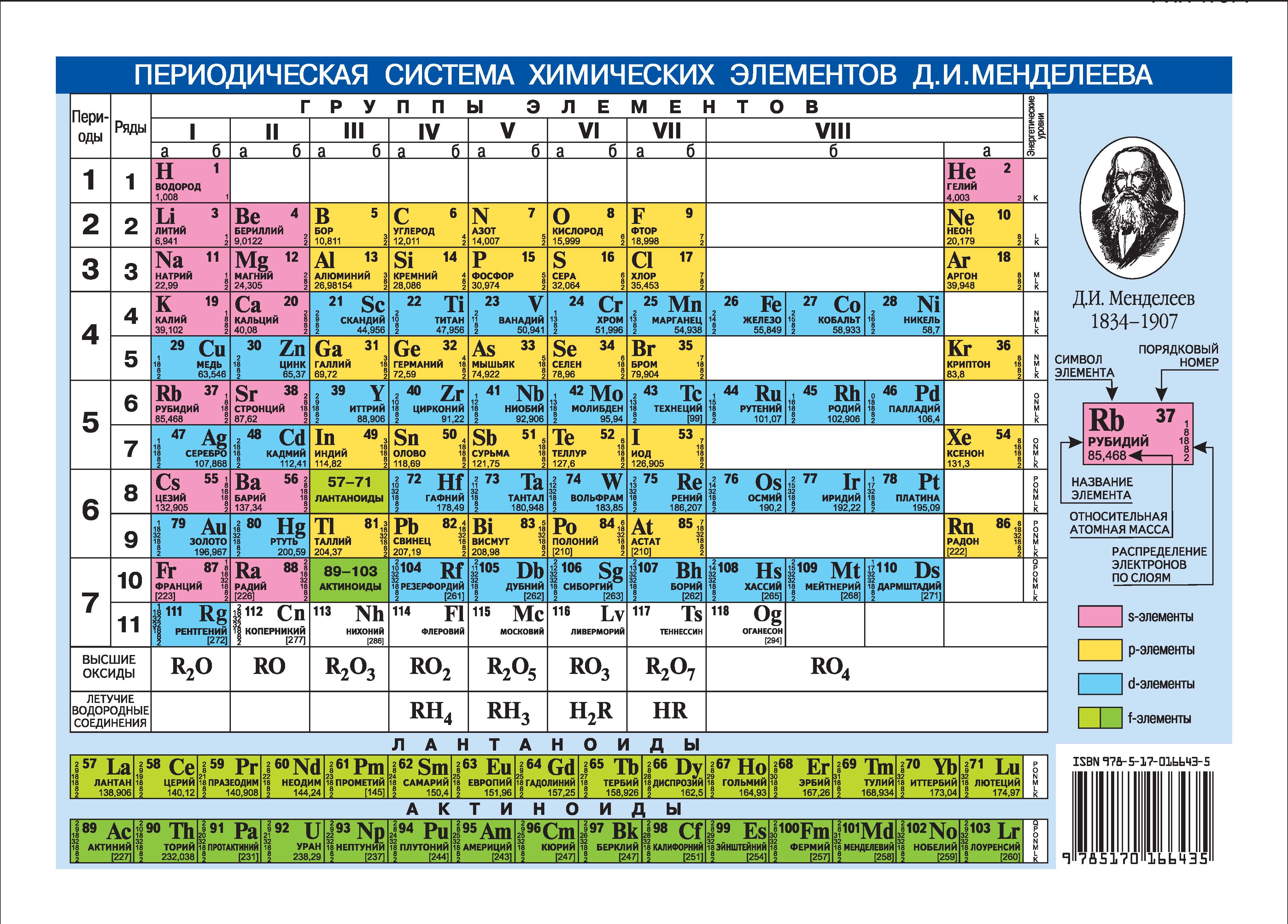
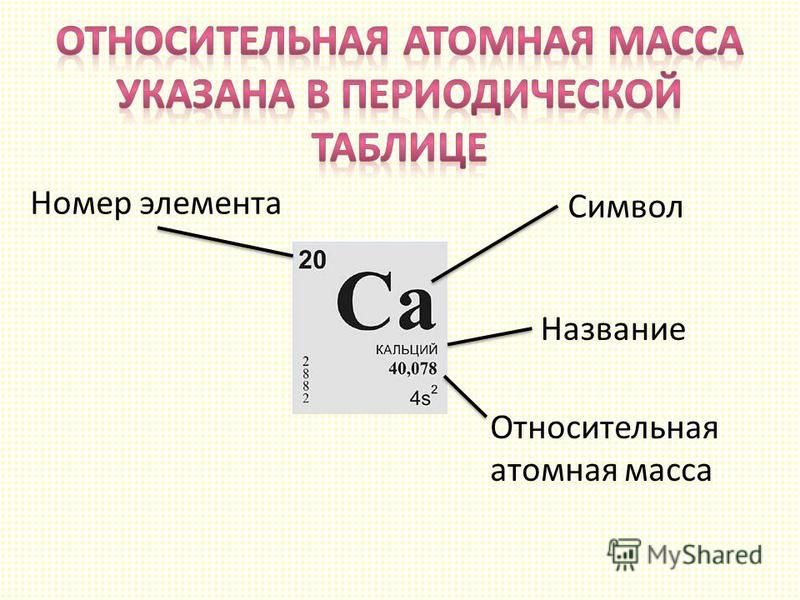
Относительная атомная масса. Относительная молекулярная масса
Молярную массу вещества легко вычислить, зная массу молекулы. Так, если масса молекулы воды равна 2,99-10 кг, то молярная масса Л4,(Н20)=2,99> кг-6,02-10 3 1/моль=0,018 кг/моль, или 18 г/моль. В общем случае молярная масса вещества, выраженная в г/моль, численно равна относительной атомной или относительной молекулярной массе этого вещества. Например, относительные атомные и молекулярные массы С, Ре, Оа, НаО соответственно равны 12, 56, 32, 18, а их молярные массы составляют соответственно 12 г/моль, 56 г/моль, 32 г/моль, 18 г/моль. [c.14]При решении задач, связанных с расчетами по химическим формулам и уравнениям, используется понятие о количестве вещества, а не метод составления пропорций, который подробно рассматривается во многих других задачниках. В задачнике дано четкое представление о таких понятиях, как моль , относительная атомная масса , относительная молекулярная масса , мо-
 3]
3]Термины атомный вес , молекулярный вес не вполне точны, правильнее было бы говорить относительная атомная масса , относительная молекулярная масса . Однако употребление выражений атомный вес , молекулярный вес утвердилось в химической литературе и мы будем пользоваться ими. [c.9]
Условие задачи (пункт 2) дополняется теми данными, которые в задачах обычно не даются (но требуются для расчета в соответствии с выведенной формулой), поскольку эти данные можно получить из уравнения реакции (стехиометрические коэффициенты), из Периодической системы (относительные атомные массы, относительные молекулярные массы, молярные массы) или из справочных таблиц (число Авогадро и молярный объем газа при н.у. должны быть известны по памяти). [c.232]
При решении задач, связанных с расчетами по химическим формулам и уравнениям, используется понятие о количестве вещества, а не метод составления пропорций, который подробно рассматривается во многих других задачниках.
Относительная атомная масса. Относительная молекулярная масса [c.10]
В этой теме закладываются и количественные понятия относительная атомная масса, относительная молекулярная масса, количество вещества, моль. Уже известный из физики закон сохранения и превращения энергии позволяет обозначить энергетическую сторону некоторых процессов и образования веществ с точки зрения энергетической выгодности. Впоследствии все это должно развиваться.
Относительная молекулярная масса — частное от деления массы молекулы соединения на /12 абсолютной атомной массы изотопа углерода 1С.
 Относительная молекулярная масса химического соединения равна сумме относительных атомных масс всех атомов, составляющих молекулу соединения. [c.4]
Относительная молекулярная масса химического соединения равна сумме относительных атомных масс всех атомов, составляющих молекулу соединения. [c.4]Безразмерную величину, определяемую отношением плотности рассматриваемого вещества к плотности условного стандартного вещества (воды для твердых и жидких тел и воздуха для газов в определенных физич. условиях), следует называть относительной плотностью (а не удельным весом или относительным удельным весом). Аналогично неправильно применять термины атомный вес , молекулярный вес , эквивалентный вес , закон сохранения веса веществ , молекулярно-весовое распределение , весовая концентрация , весовое содержание в % вместо терминов относительная атомная масса , относительная молекулярная масса , эквивалентная масса , закон сохранения массы вещества , молекулярно-массовое распределе- [c.79]
Атомы и молекулы. Химический элемент, простое вещество, сложное вещество, смесь веществ. Понятие об аллотропных модификациях. Относительная атомная масса, относительная молекулярная масса. Постоянство состава вещества. Закон сохранения массы. Моль [c.756]
Относительная атомная масса, относительная молекулярная масса. Постоянство состава вещества. Закон сохранения массы. Моль [c.756]
Относительная атомная и относительная молекулярная масса являются величинами безразмерными. [c.19]
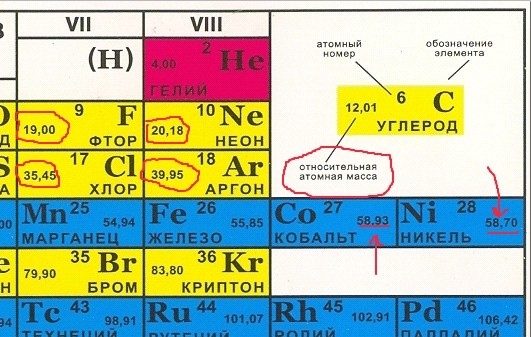
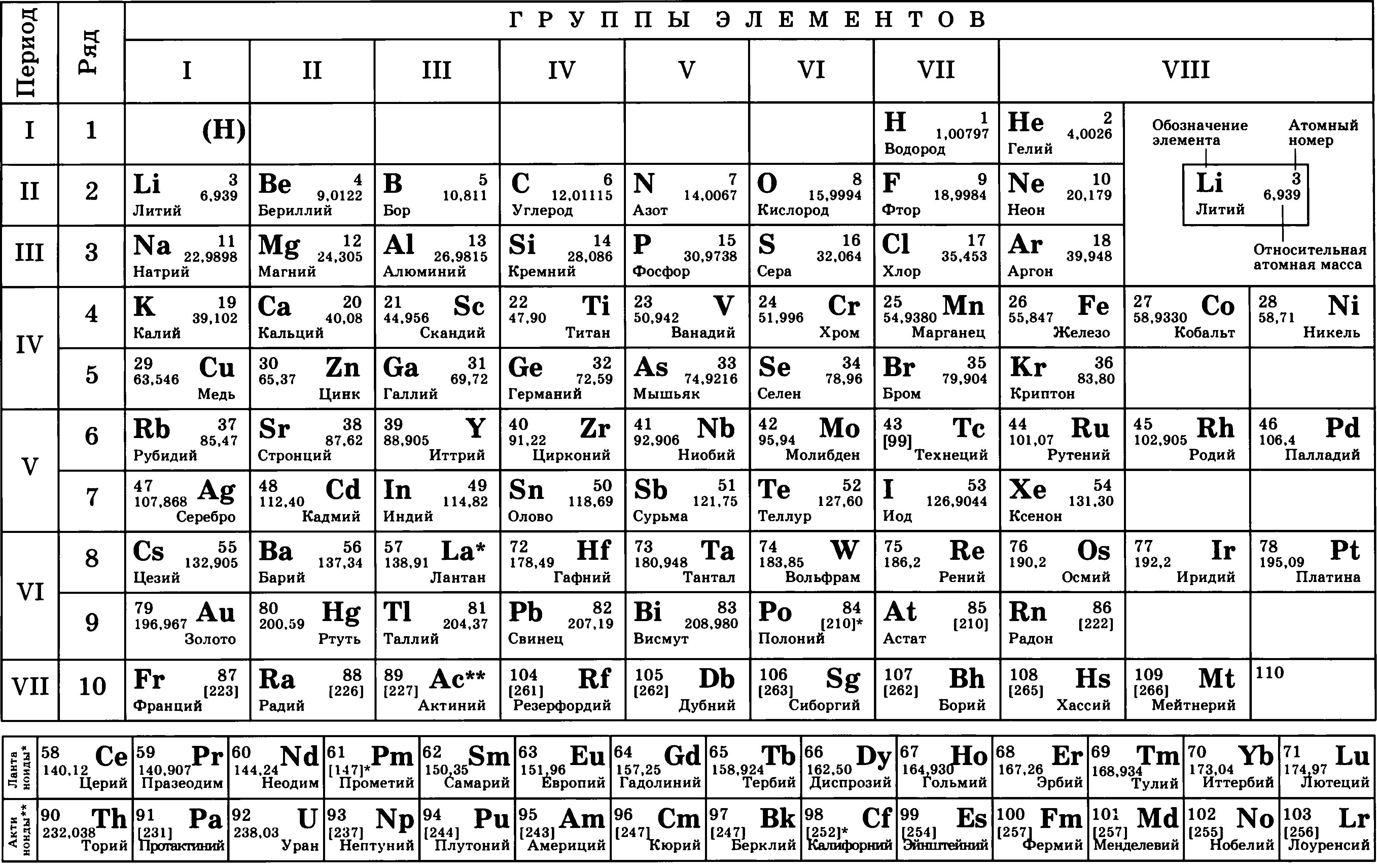
Относительная атомная и относительная молекулярная массы. Массы атомов и молекул выражают в относи-тс.льных единицах. За атомную единицу массы (а. е. м.) принимают /12 массы атома изотопа углерод-12 ( С), т, е. 1,66-10 кг. Относительная масса атома Аг будет равна
Затем изучается состав веществ, образуемых атомами разных видов. На основе положения о постоянстве состава веществ дается всесторонний разбор их состава, при этом оперируют понятиями валентность , относительная атомная и относительная молекулярная масса , содержание (массовая доля) элемента в веществе . Все это позволяет закрепить и углубить изученные понятия и затем провести обобщение, раскрыв положения атомно-молекулярного учения. [c.58]
[c.58]
Что характеризуют относительная атомная и относительная молекулярная массы Что является атомной единицей массы Какое значение она принимает и как обозначается [c.22]
Основы атомно-молекулярной теории. Понятие атома, элемента, вещества. Относительная атомная и относительная молекулярная массы. Моль — единица количества вещества. Молярная масса. Законы стехиометрии закон сохранения массы вещества, закон постоянства состава. Относительная плотность газа. [c.500]
Молярная масса численно равна относительной атомной или относительной молекулярной массе вещества. [c.107]
Молярную массу вещества легко вычислить, зная массу молекулы. Так, если масса молекулы воды равна 2,99 кг, то молярная масса М (Н20)=2,99-10 кг-6,021/моль=0,018 кг/моль, или 18 г/моль. В общем случае молярная масса вещества, выраженная в г/моль, численно равна относительной атомной или относительной молекулярной массе этого вещества.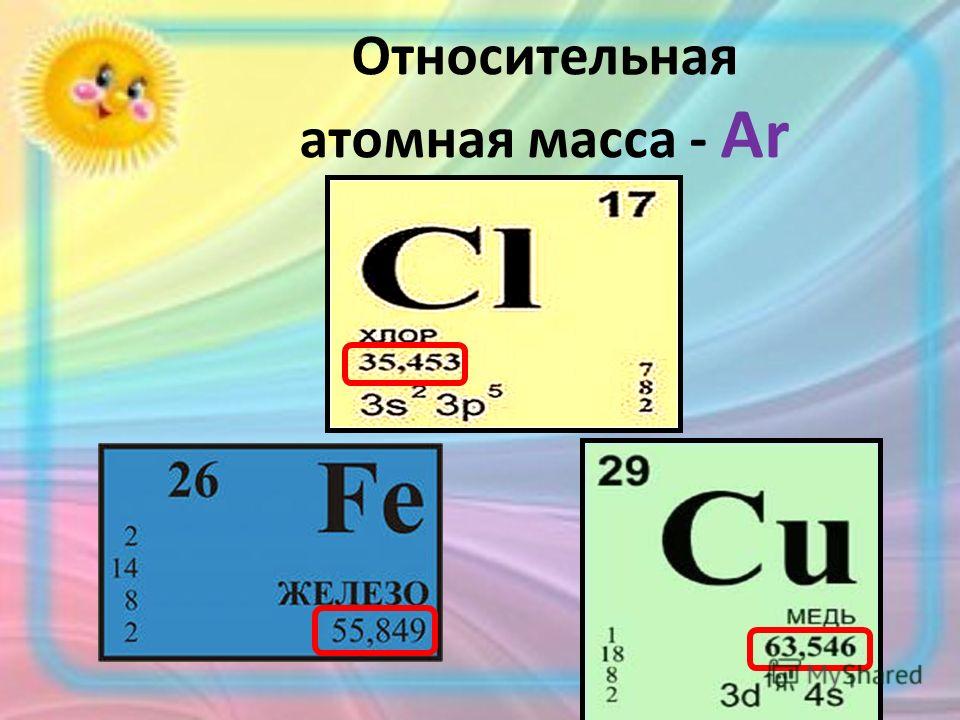 Например, относитель- [c.13]
Например, относитель- [c.13]
Относительные атомные массы (сокращенно — атомные массы) . Определения молекулярных масс открыли возможность надежного установления и атомных масс. Иногда последние можно было определить совсем просто. Зная, например, что молекулярная масса хлора равна 70,9 и молекула его состоит из двух атомов, сразу находят атомную массу хлора— 35,45.
Понятия атомная масса и молекулярная масса были введены в химию задолго до того, как научились точно определять их значения. Принято представлять массу атомов и молекул в виде относительных величин, определенных по отношению к массе атома какого-либо одного химического элемента. Это так называемые относительные атомные и молекулярные массы, или просто атомные и молекулярные массы. [c.16]
Обозначения мол. масса — относительная молекулярная масса неорганических соединений, вычисленная по относительным атомным массам углеродной шкалы (по С ) d — относительная плотность для твердых и жидких веществ при 20° С (плотность газов дана в кг/м при нормальных условиях — температуре 0°С и давлении 101 325 н/м (1,01325 6ap—l i мм рт.
Решение. Пользуясь таблицей относительных атомных масс, находим относительную молекулярную массу сульфата кальция [c.208]
Относительной молекулярной массой, или просто молекулярной массой, вещества называется масса его молекулы, выраженная в атомных единицах массы, и обозначается М . Зная формулу химического вещества, его относительную молекулярную массу можно определить как сумму относительных атомных масс элементов, входящих в состав молекулы данного вещества. Например A1ai,(soj, = = 2, 27 + 3 32 + 12 16 = 342. [c.16]
Что такое относительная атомная масса и относительная молекулярная масса Что выбрано в качестве единицы относительной атомной и относительной молекулярной массы
Масса атомов измеряется в атомных единицах массы (а. е. м.), которая представляет собой 1/12 массы атэма изотопа углерода С, принятого за эталон сравнения. Таким образом, масса атомов и соответственно молекул онред( ляется не абсолютно, а но отношению к массе углерода, являясь относительной атомной и относительной молекулярной массой и, по сунтеству, величиной безразмерной. Она показывает, во сколько раз масса атома (молекулы) данного веитества больше массы углерода С, Применение а. е. м. указывает только на выбор условной шкалы атомных масс. [c.23]
е. м.), которая представляет собой 1/12 массы атэма изотопа углерода С, принятого за эталон сравнения. Таким образом, масса атомов и соответственно молекул онред( ляется не абсолютно, а но отношению к массе углерода, являясь относительной атомной и относительной молекулярной массой и, по сунтеству, величиной безразмерной. Она показывает, во сколько раз масса атома (молекулы) данного веитества больше массы углерода С, Применение а. е. м. указывает только на выбор условной шкалы атомных масс. [c.23]
Как известно, относительная молекулярная масса вещества и относительная атомная масса элемента — это масса молекулы или, соответственно, атома, выраженная в условных атомных единицах. В качестве единицы измерения молекулярных и атомных масс вначале щ уце ЛОЖешШ Да избрать массу атома водорода — са- [c.17]
Разумеется, вы можете спросить А что нам это дает Ведь все равно мы не можем считать или отсчитывать молекулы или атомы Вопрос закономерный и справедливый. Действительно, отсчитать определенное число молекул невозможно. Но это и не нужно Достаточно знать массу 1 моля данного вещества и просто воспользоваться весами. А массу 1 моля любого вещества (т.е. молярную массу) мы легко можем определить, поскольку молярная масса вещества М в граммах численно равна относительной атомной массе, если вещество состоит из атомов, или относительной молекулярной массе, если вещество состоит из молекул. (Объясняется это численное совпадение очень просто дело в том, что в одном грамме содержится 6,02 X 1Q23 атомных единиц массы, в которых выражаются относительные атомные и молекулярные массы.) [c.11]
Действительно, отсчитать определенное число молекул невозможно. Но это и не нужно Достаточно знать массу 1 моля данного вещества и просто воспользоваться весами. А массу 1 моля любого вещества (т.е. молярную массу) мы легко можем определить, поскольку молярная масса вещества М в граммах численно равна относительной атомной массе, если вещество состоит из атомов, или относительной молекулярной массе, если вещество состоит из молекул. (Объясняется это численное совпадение очень просто дело в том, что в одном грамме содержится 6,02 X 1Q23 атомных единиц массы, в которых выражаются относительные атомные и молекулярные массы.) [c.11]
Долгое время в качестве единицы атомной массы была принята /16 средней массы атомов природного кислорода, состоящего из изотопов 0, 0 и 0. Эта единица составляла основу химической гикалы атомных масс. В основе же физической шкалы лежала массы изотопа > 0. Переходный множитель от одной шкалы к другой 1,000275. Существование двух шкал атомных масс создавало определенные трудности.
Относительной молекулярной массой простого или сложного вещества называют массу его молекулы, выралсенную в атомных единицах массы. Молекулярная масса равна сум.ме атомных масс всех атомов, которые входят в данную молекулу. Например, чтобы получить молекулярную массу воды, нужно суммировать удвоенную атомную массу водорода с атомной массой кислорода 2-1,0079+ 15,9994 = 18,0152. [c.22]
[c.22]
Относительная молекулярная масса воды МДН2О) = 18. Следовательно, масса молекулы воды в атомных единицах массы равна 18 а. е. м. Так как 1 а. е. м. = 1,66 10 г (см. 1.3), то абсолютная масса молекулы воды (НгО) = = 18 1,66 г. Масса одного моля воды в г равна произведению абсолютной молекулярной массы в г на число молекул в 1 моле [c.29]
Молекулы высокомолекулярных i единений (ВМС) состоят из атомов, соединенных между собой химическими связями, относительная молекулярная масса которых оиредсляетси суммой относительных атомных масс элементов, входящих в состав молекул, и изменяется от несколь.чпх тысяч до нескольких миллионов, а число атомов, содержащихся в молекуле, выражается цифрой порядка 1000—100 000. Например, длина молекулы этилена составляет 0,133 нм, а высокомолекулярного соединения полиэтилена — 1000—10 ООО нм. [c.270]
Химическое вендество, или, более точно, индивидуальное вещество, состоит из одного определенного типа молекул. Молекулой назы-иается мельчайшая частица индивидуального вещества, способная существовать самостоятельно и сохраняющая химические свойства нещества. Химическое превращение, т. е. образование новых веществ, обладаюндих по сравнению с исходными вещества.ми нными свойствами, связано с изменением состава молекул вентества. Молекулы одних венгеств сложнее, чем других, т, е. различные вещества отличаются друг от друга сложностью и составом молекул.. Молекула характеризуется массой, которая определяется числом и массой входящих в ее состав атомов. Относительная молекулярная масса вептества и относительная атомная масса элемента — это масса молекулы или, соответственно, атома, выражается в условных атомных единицах. [c.12]
Молекулой назы-иается мельчайшая частица индивидуального вещества, способная существовать самостоятельно и сохраняющая химические свойства нещества. Химическое превращение, т. е. образование новых веществ, обладаюндих по сравнению с исходными вещества.ми нными свойствами, связано с изменением состава молекул вентества. Молекулы одних венгеств сложнее, чем других, т, е. различные вещества отличаются друг от друга сложностью и составом молекул.. Молекула характеризуется массой, которая определяется числом и массой входящих в ее состав атомов. Относительная молекулярная масса вептества и относительная атомная масса элемента — это масса молекулы или, соответственно, атома, выражается в условных атомных единицах. [c.12]
Значения относительных атомных масс 8, Н и О берем из Периодической таблицы. Относительную молекулярную массу серной кислоты находим по формуле(3). МДН280 )=2х1+1х32+4х16=98 Итак, подставим полученные значения. [c.241]
Страница не найдена |
Страница не найдена | 404. Страница не найдена
Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Метки
Настройки
для слабовидящих
Основные Химические формулы для решения задач.

| № | Количественные характеристики вещества | Обозначение | Единицы измерения | Формула для расчета |
|---|---|---|---|---|
| 1 | Плотность вещества | ρ | кг/м³ | ρ = m / V(Массу делим на объем вещества) |
| 2 | Относительная атомная масса элемента | Аr | — | Ar = ma / u см. в периодической система химических элементов |
| 3 | Атомная единица массы | u а.е.м. | кг | u = 1/12 * ma (12C) const = 1.66*10-27 |
| 4 | Масса атома (абсолютная) | ma | кг | ma = Ar * u |
| 5 | Относительная молекулярная (формульная) масса вещества | Mr | — | Mr (AxBy)=m(AB) / u Mr(AxBy)=x*Ar(A) + y*Ar(B) |
| 6 | Масса молекулы (формульной единицы) | m M | кг | mM = Mr*u |
| 7 | Количество вещества | n | моль | n=m/M n=N/NA n=V/VM |
| 8 | Молярная масса (масса 1 моль вещества) | M | г/моль | M=m/n M=Mr M=Ar (для простых веществ) |
| 9 | Масса вещества | m | г (кг) | m=M*n m=ρ*V |
| 10 | Число структурных единиц | N | атомов, молекул, ионов, частиц, формульных единиц (Ф. Е.) Е.) | N=NA*n |
| 11 | Молярный объем — число 1 моль ГАЗООБРАЗНОГО вещества в нормальных условиях (н.у.) | VM | л/моль | const=22,4 |
| 12 | Объем газа при н.у. | V | л | V=VM*n V=m/ρ |
| 13 | Постоянная Авогадро | NA | частиц/моль | const=6,02*1023 |
| 14 | Массовая доля вещества (омега) | ωЭ/В | % | ωЭ/В = (Ar(э) * k) / Mr(В) |
| Формула | Название кислоты | Формула кислотного остатка | Название кислотного остатка |
|---|---|---|---|
| HF | Фтороводород, плавиковая | F— | Фторид |
| HCl | Хлороводород, соляная | Cl— | Хлорид |
| HBr | Бромоводород | Br— | Бромид |
| HI | Йодоводород | I— | Йодид |
| h3S | Сероводород | S2- | Сульфид |
| HCN | Циановодородная | CN— | Цианид |
| HNO2 | Азотистая | NO2— | Нитрит |
| HNO3 | Азотная | NO3— | Нитрат |
| h4PO4 | Ортофосфорная | PO43- | Фосфат |
| h4AsO4 | Мышьяковая | AsO43- | Арсенат |
| h3SO3 | Сернистая | SO32- | Сульфит |
| h3SO4 | Серная | SO42- | Сульфат |
| h3CO3 | Угольная | CO32- | Карбонат |
| h3SiO3 | Кремниевая | SiO32- | Силикат |
| h3CrO4 | Хромовая | CrO42- | Хромат |
| h3Cr2O7 | Дихромовая | Cr2O72- | Дихромат |
| HMnO4 | Марганцовая | MnO4— | Перманганат |
| HClO | Хлорноватистая | ClO— | Гипохлорит |
| HClO2 | Хлористая | ClO2— | Хлорит |
| HClO3 | Хлорноватая | ClO3— | Хлорат |
| HClO4 | Хлорная | ClO4— | Перхлорат |
| HCOOH | Метановая, муравьиная | HCOO— | Формиат |
| Ch4COOH | Этановая, уксусная | Ch4COO— | Ацетат |
| h4C2O4 | Этандиовая, щавелевая | C2O42- | Оксалат |
Нажмите на картинку для увеличения
Относительная атомная масса — это.
 .. Что такое Относительная атомная масса?
.. Что такое Относительная атомная масса?А́томная ма́сса, относительная атомная масса (устаревшее название — атомный вес) — значение массы атома, выраженное в атомных единицах массы. В настоящее время атомная единица массы принята равной 1/12 массы нейтрального атома наиболее распространённого изотопа углерода 12C, поэтому атомная масса этого изотопа по определению равна точно 12. только для свинца изотопа атомная масса не является целым числом, хотя и близка к массовому числу данного изотопа (т. е. суммарному количеству нуклонов — протонов и нейтронов — в его ядре). Разность между атомной массой изотопа и его массовым числом называется избытком массы (обычно его выражают в МэВ). Он может быть как положительным, так и отрицательным; причина его возникновения — нелинейная зависимость энергии связи ядер от числа протонов и нейтронов, а также различие в массах протона и нейтрона.
Зависимость атомной массы от массового числа такова: избыток массы положителен у водорода-1, с ростом массового числа он уменьшается и становится отрицательным, пока не достигается минимум у железа-56, потом начинает расти и возрастает до положительных значений у тяжёлых нуклидов. Это соответствует тому, что деление ядер, более тяжёлых, чем железо, высвобождает энергию, тогда как деление лёгких ядер требует энергии. Напротив, слияние ядер легче железа высвобождает энергию, слияние же элементов тяжелее железа требует дополнительной энергии.
Это соответствует тому, что деление ядер, более тяжёлых, чем железо, высвобождает энергию, тогда как деление лёгких ядер требует энергии. Напротив, слияние ядер легче железа высвобождает энергию, слияние же элементов тяжелее железа требует дополнительной энергии.
Атомная масса химического элемента (также «средняя атомная масса», «стандартная атомная масса») является средневзвешенной атомной массой всех стабильных изотопов данного химического элемента с учётом их природной распространённости в земной коре и атмосфере. Именно эта атомная масса представлена в периодической таблице, её используют в стехиометрических расчётах. Атомная масса элемента с нарушенным изотопным соотношением (например, обогащённого каким-либо изотопом) отличается от стандартной.
Молекулярной массой химического соединения называется сумма атомных масс элементов, составляющих её, умноженных на стехиометрические коэффициенты элементов по химической формуле соединения. Строго говоря, масса молекулы меньше массы составляющих её атомов на величину, равную энергии связи молекулы. Однако этот дефект массы на 9-10 порядков меньше массы молекулы, и им можно пренебречь.
Однако этот дефект массы на 9-10 порядков меньше массы молекулы, и им можно пренебречь.
Определение моля (и числа Авогадро) выбирается таким образом, чтобы масса одного моля вещества (молярная масса), выраженная в граммах, была численно равна атомной (или молекулярной) массе этого вещества. Например, атомная масса железа равна 55,847. Поэтому один моль атомов железа (т. е. их количество, равное числу Авогадро, 6,022·1023) содержит 55,847 граммов.
Прямое сравнение и измерение масс атомов и молекул выполняется с помощью масс-спектрометрических методов.
История
До 1960-х годов атомную массу определяли таким образом, чтобы изотоп кислород-16 имел атомную массу 16 (кислородная шкала). Однако соотношение кислорода-17 и кислорода-18 в природном кислороде, который также использовался в расчётах атомной массы, приводило к наличию двух разных таблиц атомных масс. Химики использовали шкалу, основанную на том, что естественная смесь изотопов кислорода должна была иметь атомную массу 16, тогда как физики присваивали то же число 16 атомной массе наиболее распространённого изотопа кислорода (имеющего восемь протонов и восемь нейтронов).
Ссылки
Wikimedia Foundation. 2010.
2.3: Расчет атомных масс — Chemistry LibreTexts
The Mole
Идентичность вещества определяется не только типами атомов или ионов, которые оно содержит, но и количеством каждого типа атома или иона. Например, вода H 2 O и пероксид водорода H 2 O 2 схожи в том, что их соответствующие молекулы состоят из атомов водорода и кислорода. Однако, поскольку молекула перекиси водорода содержит два атома кислорода, в отличие от молекулы воды, которая имеет только один, эти два вещества обладают очень разными свойствами.Сегодня у нас есть сложные инструменты, которые позволяют напрямую измерять эти определяющие микроскопические признаки; однако те же характеристики были первоначально получены при измерении макроскопических свойств (масс и объемов объемных количеств вещества) с использованием относительно простых инструментов (весов и мерной посуды). Этот экспериментальный подход потребовал введения новой единицы количества веществ, моль , которая остается незаменимой в современной химической науке.
Этот экспериментальный подход потребовал введения новой единицы количества веществ, моль , которая остается незаменимой в современной химической науке.
Моль — это единица измерения, аналогичная знакомым единицам, таким как пара, дюжина, брутто и т. Д. Она обеспечивает конкретную меру , число атомов или молекул в массивном образце вещества. Моль определяется как количество вещества, содержащего такое же количество дискретных элементов (таких как атомы, молекулы и ионы), что и количество атомов в образце чистого 12 C весом ровно 12 г. Слово «моль» на латинском языке означает «большая масса» или «большой объем», что согласуется с его использованием в качестве названия этой единицы.{23} / \ ce {mol} \).
Видео \ (\ PageIndex {3} \) : Что такое число Авогадро?
В соответствии с определением единицы количества, 1 моль любого элемента содержит такое же количество атомов, как 1 моль любого другого элемента. Однако массы 1 моля разных элементов различаются, поскольку массы отдельных атомов сильно различаются. Молярная масса элемента (или соединения) — это масса в граммах 1 моля этого вещества, свойство, выраженное в граммах на моль (г / моль) (рисунок \ (\ PageIndex {3} \)).{23} \) атомы —1,00 моль атомов. Слева направо (верхний ряд): 65,4 г цинка, 12,0 г углерода, 24,3 г магния и 63,5 г меди. Слева направо (нижний ряд): 32,1 г серы, 28,1 г кремния, 207 г свинца и 118,7 г олова. (кредит: модификация работы Марка Отта).
Однако массы 1 моля разных элементов различаются, поскольку массы отдельных атомов сильно различаются. Молярная масса элемента (или соединения) — это масса в граммах 1 моля этого вещества, свойство, выраженное в граммах на моль (г / моль) (рисунок \ (\ PageIndex {3} \)).{23} \) атомы —1,00 моль атомов. Слева направо (верхний ряд): 65,4 г цинка, 12,0 г углерода, 24,3 г магния и 63,5 г меди. Слева направо (нижний ряд): 32,1 г серы, 28,1 г кремния, 207 г свинца и 118,7 г олова. (кредит: модификация работы Марка Отта).
Поскольку определения как моля, так и атомной единицы массы основаны на одном и том же эталонном веществе, 12 C, молярная масса любого вещества численно эквивалентна его атомному или формульному весу в а.е.м.Согласно определению а.е.м., один атом углерода 12 весит 12 а.е.м. (его атомная масса составляет 12 а.е.м.). Предыдущее определение моля заключалось в том, что моль был 12 г 12 C, содержащего 1 моль 12 атомов C (его молярная масса составляет 12 г / моль). Это соотношение сохраняется для всех элементов, поскольку их атомные массы измеряются относительно атомных масс эталонного вещества, 12 C. Расширяя этот принцип, молярная масса соединения в граммах также численно эквивалентна его формульной массе в а.е.м. (Рисунок \ (\ PageIndex {4} \)).{23} \) молекулы или формульные единицы — 1,00 моль соединения или элемента. По часовой стрелке сверху слева: 130,2 г C 8 H 17 OH (1-октанол, формульная масса 130,2 а.е.м.), 454,4 г HgI 2 (иодид ртути (II), формульная масса 454,4 а.е.м.) , 32,0 г CH 3 OH (метанол, формульная масса 32,0 а.е.м.) и 256,5 г S 8 (сера, формульная масса 256,5 а.е.м.). (Источник: Сахар Атва).
Это соотношение сохраняется для всех элементов, поскольку их атомные массы измеряются относительно атомных масс эталонного вещества, 12 C. Расширяя этот принцип, молярная масса соединения в граммах также численно эквивалентна его формульной массе в а.е.м. (Рисунок \ (\ PageIndex {4} \)).{23} \) молекулы или формульные единицы — 1,00 моль соединения или элемента. По часовой стрелке сверху слева: 130,2 г C 8 H 17 OH (1-октанол, формульная масса 130,2 а.е.м.), 454,4 г HgI 2 (иодид ртути (II), формульная масса 454,4 а.е.м.) , 32,0 г CH 3 OH (метанол, формульная масса 32,0 а.е.м.) и 256,5 г S 8 (сера, формульная масса 256,5 а.е.м.). (Источник: Сахар Атва).
| Элемент | Средняя атомная масса (а.е.м.) | Молярная масса (г / моль) | Атомов / моль |
|---|---|---|---|
| С | 12. {23} \) {23} \) |
Хотя атомная масса и молярная масса численно эквивалентны, имейте в виду, что они сильно различаются по масштабу, о чем свидетельствует огромная разница в величинах соответствующих единиц (а.е.м. по сравнению с г). Чтобы оценить размеры крота, представьте себе небольшую каплю воды весом около 0,03 г (см. Рисунок \ (\ PageIndex {5} \)). Хотя это составляет лишь крошечную долю 1 моля воды (~ 18 г), он содержит больше молекул воды, чем можно ясно представить.Если бы молекулы были равномерно распределены среди примерно семи миллиардов людей на Земле, каждый человек получил бы более 100 миллиардов молекул.
Рисунок \ (\ PageIndex {5} \) : Количество молекул в одной капле воды примерно в 100 миллиардов раз больше, чем количество людей на Земле. (кредит: «tanakawho» / Wikimedia commons)
Видео \ (\ PageIndex {4} \) : моль используется в химии для обозначения \ (6. {23} \) чего-то, но может быть трудно представить себе такое большое количество. Посмотрите это видео и затем ответьте на следующие вопросы «Подумайте». Узнайте больше о кроте, просмотрев информацию в разделе «Копай глубже».
{23} \) чего-то, но может быть трудно представить себе такое большое количество. Посмотрите это видео и затем ответьте на следующие вопросы «Подумайте». Узнайте больше о кроте, просмотрев информацию в разделе «Копай глубже».
атомный вес азота | Комиссия по изотопному содержанию и атомному весу
| Изотоп | Атомная масса (Да) | Изотопное содержание (количественная доля) |
|---|---|---|
| 14 N | 14.003074004 (2) | [0,995 78, 0,996 63] |
| 15 N | 15,000 108 899 (4) | [0,003 37, 0,004 22] |
Основным эталонным материалом для измерения относительного содержания изотопов азота является атмосферный
N 2 , который является однородным в отношении аналитических неопределенностей и которому присвоена δ воздух ( 15 Н) значение 0 ‰. Измерения относительного изотопного отношения азота обычно имеют погрешности порядка 0. 1 ‰,
что значительно меньше, чем заявленная погрешность откалиброванного «лучшего измерения»
(1.1 ‰). Вариации изотопного состава азота в химических реактивах и природных земных
системы, как известно, превышают 200 ‰, что намного больше, чем неопределенность из-за относительной или
«абсолютные» измерения изотопного отношения. Следовательно, точность и прецизионность стандартных атомных
Вес азота почти полностью ограничен реальными вариациями, отсюда и обозначение «r».
1 ‰,
что значительно меньше, чем заявленная погрешность откалиброванного «лучшего измерения»
(1.1 ‰). Вариации изотопного состава азота в химических реактивах и природных земных
системы, как известно, превышают 200 ‰, что намного больше, чем неопределенность из-за относительной или
«абсолютные» измерения изотопного отношения. Следовательно, точность и прецизионность стандартных атомных
Вес азота почти полностью ограничен реальными вариациями, отсюда и обозначение «r».
Измеримые вариации содержания изотопов (и атомной массы) азота обнаруживаются в большинстве азотных
соединения. Подавляющее большинство химических реагентов, промышленных удобрений и экологических
образцы имеют δ ( 15 N) значений между примерно -15 и +20 ‰, что соответствует x ( 15 N) = от 0,003 61 до 0,003 74 и A r (N) = 14,006 67–14,006 80. Изотопное фракционирование вызвано физическими, химическими и биологическими
процессы.Некоторые из наиболее распространенных эффектов в естественной среде вызваны микробиологически опосредованными
реакции окисления и восстановления и испарением аммиака или азотной кислоты.
Наиболее 15 N-обогащенных проявлений, зарегистрированных в природе, включают растворенный нитрат, который частично подвергся микробной биохимии. уменьшение (денитрификация) в подземных водах (например, δ ( 15 N) = +103 ‰, x ( 15 N) = 0,004 039, и A r (Н) = 14.007 10), и нитраты в антарктическом льду, которые могли быть фракционированы испарением HNO 3 с δ ( 15 N) = +150 ‰, x ( 15 N) = 0,004 210 и A r (N) = 14,007 27.
Наиболее 15 N-обедненных веществ из природных земных сред включают закись азота из подземных вод, подвергающихся микробной денитрификации ( δ 15 N = -55 ‰). Еще более низкие значения были зарегистрированы для
NOx, выходящий из установки по производству азотной кислоты ( δ ( 15 N) = -150 ‰, x ( 15 N) = 0.003 115, и A r (N) = 14,006 18), и для имеющегося в продаже реагента нитрита калия ( δ ( 15 N) = -80 ‰, x ( 15 N) = 0,003 371, и A r (N) = 14,006 43).
Аннотация «g» отражает тот факт, что a известно, что количество образцов имеет атомный вес за пределами погрешностей стандартных атомных вес азота. Многие тысячи изотопных анализов азота были выполнены с 1950-х годов; тем не менее, можно ожидать появления большего числа экстремальных значений по мере расширения работы в области гидрологии загрязнителей, биология и химия атмосферы.
ИСТОЧНИКИ Атомный вес элементов: Обзор, 2000 г., John R de Laeter et al. Pure Appl. Chem. 2003 (75) 683-800Атомные веса элементов 2009 М.Э.Визер и Т.Б. Коплен. Pure Appl. Chem. 2011 (83) 359-396
CIAAW
Азот
A r (N) = [14,006 43, 14,007 28] с 2009 г.
Название происходит от латинского nitrum и греческого nitron для «природной соды» и генов для «формирование».Азот был открыт шотландским врачом и химиком Дэниелом Резерфордом в 1772 году.
Природные вариации изотопного состава азота
Изотопные стандартные образцы азота.
19,1 Атомная масса и моль | Количественные аспекты химического изменения
19.1 Атомная масса и моль (ESAFW)
Уравнение химической реакции может дать нам много полезной информации. Это говорит нам, что реагенты и продукты находятся в реакции, и это также говорит нам о соотношении, в котором реагенты объединяются, чтобы формировать изделия.Посмотрите на уравнение ниже:
\ [\ text {Fe} + \ text {S} \ rightarrow \ text {FeS} \] В этой реакции каждый атом железа (\ (\ text {Fe} \)) будет реагировать с одним атомом серы (\ (\ text {S} \)), чтобы
образуют сульфид железа (\ (\ text {FeS} \)). Однако то, что уравнение нам не говорит, — это количество или количество каждого вещества, которое задействовано. Вы можете, например,
дать небольшой образец железа для реакции. Как узнать, сколько атомов железа в этом образце? И
сколько атомов серы вам понадобится для реакции, чтобы израсходовать все железо, которое у вас есть? Есть ли способ
зная, какая масса сульфида железа будет произведена в конце реакции? Все это очень важно
вопросы, особенно когда реакция является промышленной, когда важно знать количество
необходимые реагенты и количество продукта, которое будет образовано. В этой главе мы рассмотрим, как
количественно оценить изменения, происходящие в
химические реакции.
В этой главе мы рассмотрим, как
количественно оценить изменения, происходящие в
химические реакции.
Крот (ESAFX)
Иногда важно точно знать, сколько частиц (например, атомов или молекул) содержится в образце вещество, или какое количество вещества необходимо для протекания химической реакции.
Количество вещества настолько важно в химии, что ему дано собственное имя — моль.
- Моль (\ (n \))
Моль (сокращение «моль») — это единица СИ (международный стандарт) для «количества субстанция ».{-1} \).
Если бы у нас было такое количество банок с холодными напитками, то мы могли бы покрыть поверхность земли на глубину более \ (\ text {300} \) \ (\ text {km} \)! Если бы вы могли считать атомы со скоростью 10 миллионов в секунду, то это заняло бы вам 2 миллиарда лет, чтобы сосчитать атомы в одном моле!
Первоначальная гипотеза, предложенная Амадео Авогадро, заключалась в том, что «равные объемы газов в
одинаковые температура и давление, содержат одинаковое количество молекул ». Его идеи не были приняты
научное сообщество, и только через четыре года после его смерти его первоначальная гипотеза была принята и
что он стал известен как «Закон Авогадро». В честь его вклада в науку номер
частиц в одном моле назвали числом Авогадро .
Его идеи не были приняты
научное сообщество, и только через четыре года после его смерти его первоначальная гипотеза была принята и
что он стал известен как «Закон Авогадро». В честь его вклада в науку номер
частиц в одном моле назвали числом Авогадро .
Мы используем число Авогадро и моль в химии, чтобы помочь нам количественно определить, что происходит в химической реакции. В родинка — очень особенное число.{\ text {23}} \) атомы меди. Фактически, если мы измерим относительную атомная масса любого элемента в периодической таблице, у нас есть один моль этого элемента.
временный текстМоль и масса
Учебное упражнение 19.1Сколько атомов в:
1 моль вещества
2 моля кальция
5 моль фосфора
\ (\ text {24,3} \) \ (\ text {g} \) магния
\ (\ text {24,0} \) \ (\ text {g} \) углерода
Решение пока недоступно
Заполните следующую таблицу:
Элемент | Относительная атомная масса (ед. | Масса образца (г) | Количество молей в образце |
Водород | \ (\ text {1,01} \) | \ (\ text {1,01} \) | |
Магний | \ (\ text {24,3} \) | \ (\ text {24,3} \) | |
Углерод | \ (\ text {12,0} \) | \ (\ text {24,0} \) | |
Хлор | \ (\ text {35,45} \) | \ (\ text {70,9} \) | |
Азот | \ (\ text {14,0} \) | \ (\ text {42,0} \) |
Решение пока недоступно
Молярная масса (ESAFY)
- Молярная масса
Молярная масса (\ (M \)) — это масса 1 моля химического вещества.
 {-1} $} \).
{-1} $} \).
Вы помните, что когда масса элемента в граммах равна его относительной атомной массе, образец содержит один моль этого элемента. Эта масса называется молярной массой этого элемента.
Иногда вы можете увидеть молярную массу, записанную как \ (M_ {m} \). В этой книге мы будем использовать \ (M \), но вы должны известно об альтернативных обозначениях.
Следует помнить следующее: В периодической таблице указанная относительная атомная масса может быть равна интерпретируется двояко.
Масса (в граммах) одного среднего атома этого элемента относительно массы атома углерод.
Средняя атомная масса всех изотопов этого элемента. Это использование относительной атомной массы .
Масса моль элемента .
 Это третье использование — молярная масса элемента.{-1} $} \))
Это третье использование — молярная масса элемента.{-1} $} \)) Масса одного моля элемента (г)
Магний
\ (\ text {24,3} \)
\ (\ text {24,3} \)
\ (\ text {24,3} \)
Литий
\ (\ text {6,94} \)
\ (\ text {6,94} \)
\ (\ text {6,94} \)
Кислород
\ (\ text {16,0} \)
\ (\ text {16,0} \)
\ (\ text {16,0} \)
Азот
\ (\ text {14,0} \)
\ (\ text {14,0} \)
\ (\ text {14,0} \)
Утюг
\ (\ text {55,8} \)
\ (\ text {55,8} \)
\ (\ text {55,8} \)
Таблица 19.
 {- 1} $} \), что означает, что 1 моль цинка имеет массу
из \ (\ text {65,4} \) \ (\ text {g} \).{\ text {24}} \ text {atom} \) (ответ на b)
{- 1} $} \), что означает, что 1 моль цинка имеет массу
из \ (\ text {65,4} \) \ (\ text {g} \).{\ text {24}} \ text {atom} \) (ответ на b)Моль и молярная масса
Учебное упражнение 19.2Укажите молярную массу каждого из следующих элементов:
газообразный водород
азот газ
газообразный бром
Решение пока недоступно
Рассчитайте количество молей в каждом из следующих образцов:
\ (\ text {21,6} \) \ (\ text {g} \) бора (\ (\ text {B} \))
\ (\ text {54,9} \) \ (\ text {g} \) марганца (\ (\ text {Mn} \))
\ (\ text {100,3} \) \ (\ text {g} \) ртути (\ (\ text {Hg} \))
\ (\ text {50} \) \ (\ text {g} \) бария (\ (\ text {Ba} \))
\ (\ text {40} \) \ (\ text {g} \) свинца (\ (\ text {Pb} \))
Решение пока недоступно
Уравнение для расчета молей и массы (ESAFZ)
Мы можем вычислить молярную массу следующим образом: \ (\ text {молярная масса} (M) = \ frac {\ text {mass (g)}} {\ text {моль (моль)}} \)
Это можно переставить, чтобы получить количество родинок:
\ [n = \ frac {m} {M} \]Следующая диаграмма может помочь запомнить взаимосвязь между этими тремя переменными.
 {- 1} $}} \\
& = \ текст {2} \ текст {моль}
\ end {выровнять *}
{- 1} $}} \\
& = \ текст {2} \ текст {моль}
\ end {выровнять *}В пробе 2 моля меди.{\ text {24}} \) атомы алюминия в образце \ (\ text {81} \) \ (\ текст {g} \).
Некоторые простые вычисления
Учебное упражнение 19.3Рассчитайте количество молей в каждом из следующих образцов:
\ (\ text {5,6} \) \ (\ text {g} \) кальция
\ (\ text {0,02} \) \ (\ text {g} \) марганца
\ (\ text {40} \) \ (\ text {g} \) из алюминия
Решение пока недоступно
Свинцовый грузило имеет массу \ (\ text {5} \) \ (\ text {g} \).
Подсчитайте количество молей свинца в грузиле.
 {\ text {23}} \) молекулы азотной кислоты.{\ text {23}} \) молекулы хлорида натрия в одной формульной единице.
{\ text {23}} \) молекулы азотной кислоты.{\ text {23}} \) молекулы хлорида натрия в одной формульной единице.В сбалансированном химическом уравнении число, стоящее перед элементом или соединением, показывает мольное соотношение , при котором реагенты объединяются с образованием продукта. Если впереди нет цифр символа элемента, это означает, что число равно «1».
например \ (\ text {N} _ {2} + 3 \ text {H} _ {2} \ rightarrow 2 \ text {NH} _ {3} \)
В этой реакции 1 моль молекул азота реагирует с 3 молями молекул водорода с образованием 2 моль молекул азота. молекулы аммиака.{-1} $} \ end {выровнять *}
Рабочий пример 6: Расчет молей по массе
Вычислите количество родинок в \ (\ text {1} \) \ (\ text {kg} \) из \ (\ text {MgCl} _ {2} \).
Перевести массу в граммы
\ [m = \ text {1} \ text {kg} \ times \ frac {\ text {1 000} \ text {g}} {\ text {1} \ text {kg}} = \ текст {1 000} \ текст {g} \]Рассчитать молярную массу
\ [M _ {\ text {MgCl} _ {2}} = \ text {24,3} \ text {g · mol $ ^ {- 1} $} + 2 (\ text {35,45} \ text {g · Моль $ ^ {- 1} $}) = \ text {95,2} \ text {g · mol $ ^ {- 1} $} \]Найдите количество родинок
\ begin {align *} n & = \ frac {\ text {1 000} \ text {g}} {\ text {95,2} \ text {g · mol $ ^ {- 1} $}} \\ & = \ текст {10,5042. ..} \ text {mol} \\
& \ ок \ текст {10,5} \ текст {мол}
\ end {выровнять *}
..} \ text {mol} \\
& \ ок \ текст {10,5} \ текст {мол}
\ end {выровнять *}В пробе \ (\ text {1} \) \ (\ text {kg} \) содержится \ (\ text {10,5} \) \ (\ text {moles} \) хлорида магния.
Что такое родинки, молекулы и число Авогадро
Разделитесь на группы по три человека и потратьте около 20 минут, отвечая вместе на следующие вопросы:
Какие единицы измерения моль? Подсказка: проверьте определение родинки.
У вас есть \ (\ text {46} \) \ (\ text {g} \) образец диоксида азота (\ (\ text {NO} _ {2} \))
Сколько молей \ (\ text {NO} _ {2} \) содержится в образце?
Сколько молей атомов азота содержится в образце?
Сколько молей атомов кислорода содержится в образце?
Сколько молекул \ (\ text {NO} _ {2} \) содержится в образце?
В чем разница между кротом и молекулой?
Точный размер Число Авогадро иногда сложно представить.
Запишите число Авогадро без экспонирования.
Сколько времени нужно, чтобы сосчитать до числа Авогадро? Вы можете считать, что можете сосчитать два числа каждую секунду.
Более сложные вычисления
Учебное упражнение 19.4Рассчитайте молярную массу следующих химических соединений:
\ (\ text {KOH} \)
\ (\ text {FeCl} _ {3} \)
\ (\ text {Mg} (\ text {OH}) _ {2} \)
Решение пока недоступно
Сколько родинок присутствует в:
\ (\ text {10} \) \ (\ text {g} \) из \ (\ text {Na} _ {2} \ text {SO} _ {4} \)
\ (\ text {34} \) \ (\ text {g} \) из \ (\ text {Ca} (\ text {OH}) _ {2} \)
\ (\ text {2,45} \ times \ text {10} ^ {\ text {23}} \) молекул \ (\ text {CH} _ {4} \)?
Решение пока недоступно
Для образца \ (\ text {0,2} \) \ (\ text {moles} \) бромида магния (\ (\ text {MgBr} _ {2} \)) рассчитайте:
число молей ионов \ (\ text {Mg} ^ {2 +} \)
число молей ионов \ (\ text {Br} ^ {-} \)
Решение пока недоступно
У вас есть образец, содержащий \ (\ text {3} \) \ (\ text {mol} \) хлорида кальция.

Какова химическая формула хлорида кальция?
Сколько атомов кальция в образце?
Решение пока недоступно
Вычислим массу:
\ (\ text {3} \) \ (\ text {moles} \) из \ (\ text {NH} _ {4} \ text {OH} \)
\ (\ text {4,2} \) \ (\ text {moles} \) из \ (\ text {Ca} (\ text {NO} _ {3}) _ {2} \)
Решение пока недоступно
Атомная и молярная масса
6.2 Атомные и молярные массы
Цель обучения
- Узнайте, как выражаются массы молей атомов и молекул.
Теперь, когда мы представили крот и попрактиковались в его использовании в качестве коэффициента преобразования, мы задаем очевидный вопрос: почему крот соответствует именно этому числу ? Почему это 6.
 022 × 10 23 , а не 1 × 10 23 или даже 1 × 10 20 ?
022 × 10 23 , а не 1 × 10 23 или даже 1 × 10 20 ?Число в моле, число Авогадро, связано с относительными размерами атомной единицы массы и грамма единиц массы.Принимая во внимание, что один атом водорода имеет массу приблизительно 1 u, 1 моль атомов H имеет массу приблизительно 1 грамм . И хотя один атом натрия имеет приблизительную массу 23 u, 1 моль атомов Na имеет приблизительную массу 23 граммов .
Масса одного моля вещества в граммах равна массе одного атома или молекулы в единицах атомной массы. Числа в периодической таблице, которые мы определили как атомные массы атомов, не только говорят нам массу одного атома в u, но также говорят нам массу 1 моля атомов в граммах.
Примечание
Масса одного моля вещества в граммах равна массе одного атома или молекулы в единицах атомной массы.
Пример 3
Какова масса каждого количества?
- 1 моль атомов Al
- 2 моль атомов U
Решение
- Масса одного моля атомов Al в граммах численно эквивалентна атомной массе алюминия.
 Периодическая таблица показывает, что атомная масса (с округлением до двух десятичных знаков) Al составляет 26,98, таким образом, 1 моль атомов Al имеет массу 26,98 г.
Периодическая таблица показывает, что атомная масса (с округлением до двух десятичных знаков) Al составляет 26,98, таким образом, 1 моль атомов Al имеет массу 26,98 г. - Согласно периодической таблице, 1 моль U имеет массу 238,03 г, поэтому масса 2 моль вдвое больше, или 476,06 г.
Упражнение по развитию навыков
Какова масса каждого количества?
Концепция молей может быть распространена также на массы формульных единиц и молекул.Масса 1 моля молекул (или формульных единиц) в граммах численно эквивалентна массе одной молекулы (или формульной единицы) в атомных единицах массы. Например, одна молекула O 2 имеет массу 32,00 ед., А 1 моль молекул O 2 имеет массу 32,00 г. Как и в случае с массами, основанными на единицах атомной массы, чтобы получить массу 1 моля вещества, мы просто суммируем массы отдельных атомов в формуле этого вещества.
 Масса 1 моля вещества называется его молярной массой — массой 1 моля атомов или молекул.независимо от того, является ли вещество элементом, ионным соединением или ковалентным соединением.
Масса 1 моля вещества называется его молярной массой — массой 1 моля атомов или молекул.независимо от того, является ли вещество элементом, ионным соединением или ковалентным соединением.Пример 4
Какова масса 1 моль каждого вещества?
- NaCl
- билирубин (C 33 H 36 N 4 O 6 ), основной пигмент, присутствующий в желчи (секреция печени)
Решение
Суммирование молярных масс атомов в формульной единице NaCl дает
1 молярная масса Na: 23.00 г 1 Cl молярная масса: 35,45 г Всего: 58,45 г Масса 1 моля NaCl 58,45 г.

Умножая молярную массу каждого атома на количество атомов этого типа в формуле билирубина и складывая результаты, получаем
33 C молярная масса: 33 × 12.01 г 396,33 г 36 H молярная масса: 36 × 1,01 = 36,36 г 4 N молярная масса: 4 × 14,00 = 56,00 г 6 O молярная масса: 6 × 16. 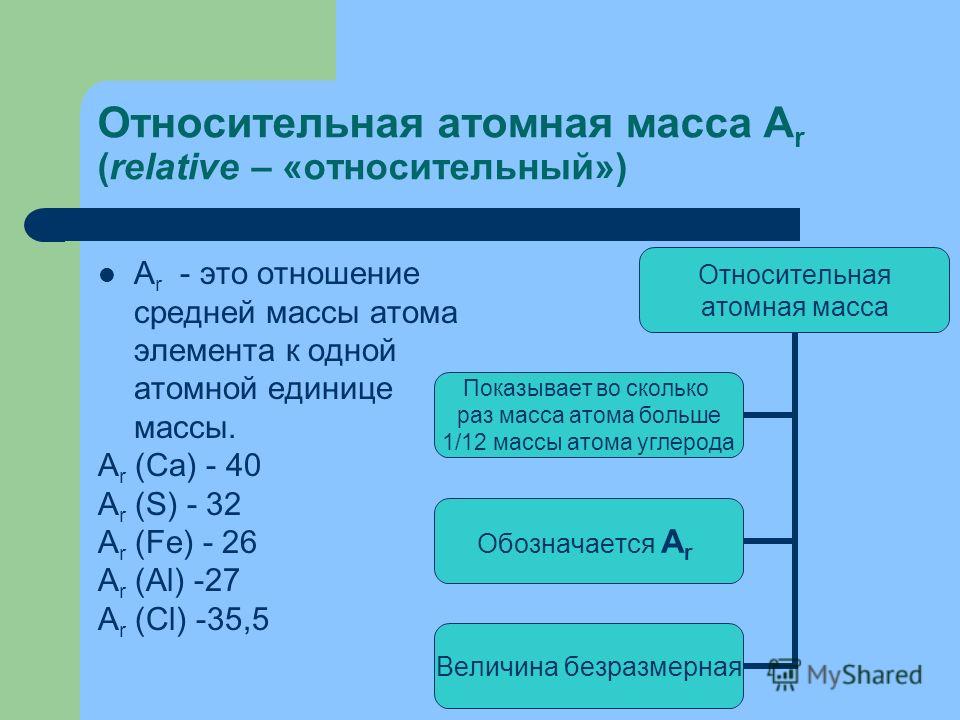 00 =
00 =96,00 г Всего: 584,69 г Масса 1 моля билирубина 584,69 г.
Упражнение по развитию навыков
сульфат бария (BaSO 4 ), используемый для рентгеновских снимков желудочно-кишечного тракта
аденозин (C 10 H 13 N 5 O 4 ), компонент ядер клеток, важный для деления клеток
Какова масса 1 моль каждого вещества?
Будьте осторожны при подсчете атомов.
 В формулах с многоатомными ионами в скобках нижний индекс вне скобок применяется к каждому атому внутри скобок. Например, молярная масса Ba (OH) 2 требует суммы 1 массы Ba, 2 масс O и 2 масс H:
В формулах с многоатомными ионами в скобках нижний индекс вне скобок применяется к каждому атому внутри скобок. Например, молярная масса Ba (OH) 2 требует суммы 1 массы Ba, 2 масс O и 2 масс H:1 Ba молярная масса: 1 × 137,33 г = 137,33 г 2 O молярная масса: 2 × 16.00 г = 32,00 г 2 H молярная масса: 2 × 1,01 г = 2,02 г Всего: 171,35 г Поскольку молярная масса определяется как масса на 1 моль вещества, мы можем обозначать молярную массу как граммы на моль (г / моль).
 Знак деления (/) означает «per», а «1» подразумевается в знаменателе.Таким образом, молярная масса билирубина может быть выражена как 584,05 г / моль, что читается как «пятьсот восемьдесят четыре целых ноль пять граммов на моль».
Знак деления (/) означает «per», а «1» подразумевается в знаменателе.Таким образом, молярная масса билирубина может быть выражена как 584,05 г / моль, что читается как «пятьсот восемьдесят четыре целых ноль пять граммов на моль».Упражнения по обзору концепции
Как определяются молярные массы элементов?
Как определяются молярные массы соединений?
ответы
Молярные массы элементов — это то же числовое значение, что и массы отдельного атома в атомных единицах массы, но вместо этого в граммах.
Молярные массы соединений вычисляются путем сложения молярных масс их атомов.

Ключевые вынос
- Масса молей атомов и молекул выражается в граммах.
Упражнения
Какова молярная масса Si? Какова молярная масса U?
Какова молярная масса Mn? Какова молярная масса Mg?
Какова молярная масса FeCl 2 ? Какова молярная масса FeCl 3 ?
Какова молярная масса C 6 H 6 ? Какова молярная масса C 6 H 5 CH 3 ?
Какова молярная масса (NH 4 ) 2 S? Какова молярная масса Ca (OH) 2 ?
Какова молярная масса (NH 4 ) 3 PO 4 ? Какова молярная масса Sr (HCO 3 ) 2 ?
Аспирин (C 9 H 8 O 4 ) — болеутоляющее (болеутоляющее) и жаропонижающее (жаропонижающее).
 Какова молярная масса аспирина?
Какова молярная масса аспирина?Ибупрофен (C 13 H 18 O 2 ) является анальгетиком (болеутоляющим). Какова молярная масса ибупрофена?
Морфин (C 17 H 19 NO 3 ) — наркотическое обезболивающее. Какая масса 1 моль морфина?
Героин (C 21 H 23 NO 5 ) — наркотическое средство, являющееся производным морфина.Какая масса 1 моль героина?
ответы
28,09 г / моль; 238,00 г / моль
126,75 г / моль; 162,20 г / моль
масс
массТочные массы и соотношения изотопов Элемент Обозначение Номинальная масса Точная масса Изобилие X + 1
Фактор *X + 2
Фактор *Водород H
D или 2 H1
21.  00783
00783
2,0141099,99
0,01Углерод 12 С
13 С12
1312.0000
13.003498,91
1,09
1.1н С
0,006n С 2Азот 14 N
15 N14
1514.0031
15,000199,6
0,37
0,37n NКислород 16 О
17 О
18 О16
17
1815,9949
16,9991
17,999299,76
0,037
0,20
0,04н О
0. 2н О
2н О фтор F 19 18.9984 100 Кремний 28 Si
29 Si
30 Si28
29
3027,9769
28,9765
29,973892.28
4,70
3,02
5.1n Si
3.3n Siфосфор -П, 31 30,9738 100 сера 32 S
33 S
34 S32
33
3431.  9721
9721
32,9715
33,967995,02
0,74
4,22
0,78n S
4.4n SХлор 35 Класс
37 Класс35
3734,9689
36,965975,77
24,2332.5н Класс
Бром 79 руб.
81 руб.79
8178.9183
80.916350,5
49,598.0н Br
Йод я 127 126.  9045
9045100 * X представляет относительную интенсивность иона с наименьшей массой. в кластере изотопных ионов.Для этого расчета установлено значение 100%. Коэффициент умножается на количество атомов (n) указанного элемента, чтобы вычислить вклад интенсивности от изотопов большей массы.
Органическая химия
Университет штата Мичиган
Эта таблица адаптирована из Introduction to Mass Spectrometry J.T. ВатсонКалькулятор массы справа можно использовать для расчета точной массы молекулы на основе ее элементного состава.Просто введите соответствующий номер нижнего индекса справа от каждого символа, оставив эти элементы пустыми, и нажмите кнопку « Рассчитать ». Для этих расчетов используется только масса наиболее распространенного изотопа относительно C (12,0000).
 Для соединений хлора и брома необходимо прибавить 1,997 и 1,998 соответственно для каждого галогена, чтобы получить более высокие значения массовых изотопов.
Для соединений хлора и брома необходимо прибавить 1,997 и 1,998 соответственно для каждого галогена, чтобы получить более высокие значения массовых изотопов.Калькулятор слева можно использовать для расчета изотопных вкладов в содержание ионов на 1 и 2 а.е.м. больше, чем молекулярный ион (M).Просто введите соответствующий номер нижнего индекса справа от каждого символа, оставив эти элементы пустыми, и нажмите кнопку « Рассчитать ». Числа, отображаемые в полях M + 1 и M + 2, относятся к M, установленному на 100%. Конечно, соединения хлора и брома имеют очень большое количество изотопов.
Более элегантный и полный калькулятор структуры изотопов был создан Джунхау Яном. Чтобы использовать этот ресурс, щелкните здесь.
Полезный ресурс, написанный Джефом Розенски, вычисляет все возможные комбинации H, C, N и O, которые дают определенную номинальную массу.Чтобы использовать этот калькулятор, щелкните здесь.Обогащение урана | Обогащение урана
(Обновлено сентябрь 2020 г.
 )
)- Для большинства из 500 действующих или строящихся в мире коммерческих ядерных энергетических реакторов сегодня в качестве топлива требуется уран, «обогащенный» изотопом U-235.
- Коммерческий процесс, используемый для этого обогащения, включает газообразный уран в центрифугах. Австралийский процесс, основанный на лазерном возбуждении, находится в стадии разработки.
- Перед обогащением оксид урана необходимо превратить во фторид, чтобы его можно было обрабатывать как газ при низкой температуре.
- С точки зрения нераспространения обогащение урана является чувствительной технологией, требующей жесткого международного контроля.
- Имеется значительный избыток обогатительных мощностей в мире.
Уран, встречающийся в природе, состоит в основном из двух изотопов: U-235 и U-238.Производство энергии в ядерных реакторах происходит за счет «деления» или расщепления атомов U-235, процесса, при котором энергия выделяется в виде тепла.
 U-235 — основной делящийся изотоп урана.
U-235 — основной делящийся изотоп урана.Природный уран содержит 0,7% изотопа U-235. Остальные 99,3% составляют в основном изотоп U-238, который не вносит прямого вклада в процесс деления (хотя он делает это косвенно, путем образования делящихся изотопов плутония). Разделение изотопов — это физический процесс концентрирования («обогащения») одного изотопа относительно других.Большинство реакторов являются легководными реакторами (двух типов — PWR и BWR) и требуют обогащения урана от 0,7% до 3-5% по U-235 в их топливе. Это нормальный низкообогащенный уран (НОУ). Существует некоторый интерес к повышению уровня обогащения примерно до 7% и даже почти до 20% для некоторых видов топлива для специальных энергетических реакторов, таких как высокопробный НОУ (HALEU).
Уран-235 и U-238 химически идентичны, но различаются своими физическими свойствами, особенно массой. Ядро атома U-235 содержит 92 протона и 143 нейтрона, что дает атомную массу 235 единиц.Ядро U-238 также имеет 92 протона, но 146 нейтронов — на три больше, чем U-235 — и, следовательно, имеет массу 238 единиц.

Разница в массе между U-235 и U-238 позволяет разделить изотопы и дает возможность увеличить или «обогатить» процентное содержание U-235. Все нынешние и исторические процессы обогащения прямо или косвенно используют эту небольшую разницу масс.
В некоторых реакторах, например, в реакторах Candu канадской конструкции и British Magnox, в качестве топлива используется природный уран.(Для сравнения, уран, используемый для ядерного оружия, должен быть обогащен на заводах, специально разработанных для производства не менее 90% U-235.)
Процессы обогащения требуют, чтобы уран находился в газообразной форме при относительно низкой температуре, поэтому оксид урана из шахты превращается в гексафторид урана в предварительном процессе на отдельной установке по конверсии.
Во всем мире наблюдается значительный избыток обогатительных мощностей, большая часть которых была использована для уменьшения спроса на уран или пополнения предложения урана.Способность обогащения заменять уран (см.
 Описание недостаточной подпитки ниже) стала более значимой по мере того, как технология центрифуг пришла на смену, поскольку это означает как более низкие затраты на ЕРР, так и необходимость поддерживать центрифуги в рабочем состоянии, поэтому мощность остается в рабочем состоянии, даже если спрос отпадает.
Описание недостаточной подпитки ниже) стала более значимой по мере того, как технология центрифуг пришла на смену, поскольку это означает как более низкие затраты на ЕРР, так и необходимость поддерживать центрифуги в рабочем состоянии, поэтому мощность остается в рабочем состоянии, даже если спрос отпадает.Хотя 13 стран имеют производственные мощности или близкие к возможностям обогатительные фабрики, около 90% мировых мощностей по обогащению урана находится в пяти государствах, обладающих ядерным оружием. Они, а также Германия, Нидерланды и Япония предоставляют услуги по увеличению дорожных пошлин на коммерческом рынке.
Международные центры по обогащению, многосторонние подходы
По предложениям Международного агентства по атомной энергии (МАГАТЭ) и России, а также в связи с возглавляемым США Глобальным партнерством по ядерной энергии (GNEP), предпринимаются шаги по созданию международных центров по обогащению урана. Это один из видов многосторонних ядерных подходов (МПЯО), к которым призывает МАГАТЭ.
 Отчасти мотивация для международных центров состоит в том, чтобы поставить все новые обогатительные мощности, и, возможно, в конечном итоге все обогащение, под международный контроль в качестве меры нераспространения.Что именно означает «контроль», еще предстоит определить, и оно не будет единообразным во всех ситуациях. Но совместное владение и эксплуатация между несколькими странами, по крайней мере, означает, что существует такой уровень международного контроля, который маловероятен для национального объекта, находящегося в строго государственной собственности и эксплуатации.
Отчасти мотивация для международных центров состоит в том, чтобы поставить все новые обогатительные мощности, и, возможно, в конечном итоге все обогащение, под международный контроль в качестве меры нераспространения.Что именно означает «контроль», еще предстоит определить, и оно не будет единообразным во всех ситуациях. Но совместное владение и эксплуатация между несколькими странами, по крайней мере, означает, что существует такой уровень международного контроля, который маловероятен для национального объекта, находящегося в строго государственной собственности и эксплуатации.Первым из этих международных центров является Международный центр по обогащению урана (МЦОУ) в Ангарске в Сибири, пока с акциями Казахстана, Армении и Украины. Центр должен обеспечивать гарантированные поставки низкообогащенного урана для энергетических реакторов новым ядерным державам и странам с небольшими ядерными программами, предоставляя им долю в проекте, но не давая им доступа к технологии обогащения.
 Россия сохранит контрольный пакет акций, и в феврале 2007 года МЦОУ был включен в список российских ядерных объектов, подпадающих под действие гарантий МАГАТЭ. США выразили поддержку МЦОУ в Ангарске. МЦОУ будет продавать как услуги по обогащению (ЕРР), так и обогащенный урановый продукт.
Россия сохранит контрольный пакет акций, и в феврале 2007 года МЦОУ был включен в список российских ядерных объектов, подпадающих под действие гарантий МАГАТЭ. США выразили поддержку МЦОУ в Ангарске. МЦОУ будет продавать как услуги по обогащению (ЕРР), так и обогащенный урановый продукт.В некоторых отношениях это очень похоже на то, что имело место при установке Eurodif, где единственный крупный завод по обогащению во Франции с пятью владельцами (Франция — 60%, Италия, Испания, Бельгия и Иран) эксплуатировался под гарантиями МАГАТЭ со стороны принимающей страной, не предоставляя участникам никакого доступа к технологии — просто некоторое право на долю продукта, и даже это было ограничено в случае Ирана.Комиссия по атомной энергии Франции предложила, чтобы новый завод Georges Besse II, пришедший на смену Eurodif, был открыт для международного партнерства на аналогичной основе, а второстепенные акции дочерней операционной компании Areva (ныне Orano) Societe d’Enrichissement du Tricastin (SET) имели до сих пор было продано GDF Suez (теперь Engie), японскому партнерству, и Korea Hydro and Nuclear Power (KHNP) — всего 12%.

Организация Urenco с тремя странами также похожа, хотя с большим количеством заводов в разных странах — Великобритании, Нидерландах и Германии — и здесь технология недоступна для принимающих стран или недоступна для других держателей акций.Как и Россия с IUEC, Urenco (принадлежит правительствам принимающих стран Великобритании и Нидерландов, а также E.On и RWE в Германии) заявила, что, если ее технология будет использоваться в международных центрах, она будет недоступна. Его новый завод находится в США, где правительство принимающей страны имеет регулирующий, но не управленческий контроль.
Планируемый новый завод Areva в США не имеет другого разнообразия собственности, кроме самого Areva, поэтому по сути это был бы французский завод на территории США.
В проекте Global Laser Enrichment, который может быть продолжен до строительства коммерческого завода в США, принадлежат доли компаний, расположенных в трех странах: США (51%), Канаде (24%) и Японии (25%).

Процессы обогащения
Ряд процессов обогащения был продемонстрирован исторически или в лабораторных условиях, но только два, процесс газовой диффузии и процесс центрифугирования, работали в промышленных масштабах. В обоих случаях в качестве исходного материала используется газ UF 6 . Молекулы UF 6 с атомами U-235 примерно на один процент легче остальных, и эта разница в массе лежит в основе обоих процессов. Разделение изотопов — это физический процесс.*
* Один химический процесс был продемонстрирован на стадии пилотной установки, но не использовался. Во французском процессе Chemex использовалась очень небольшая разница в склонности двух изотопов к изменению валентности при окислении / восстановлении с использованием водной (валентность III) и органической (IV) фаз.
Крупные коммерческие обогатительные фабрики работают во Франции, Германии, Нидерландах, Великобритании, США и России, а более мелкие заводы находятся в других местах.
 Новые центрифужные заводы строятся во Франции и США.Несколько заводов добавляют мощности. Производственные мощности Китая значительно расширяются в соответствии с внутренними потребностями. Имея избыточные мощности, российские заводы работают с низкообогащенным ураном (недокорм) для производства низкообогащенного урана для продажи.
Новые центрифужные заводы строятся во Франции и США.Несколько заводов добавляют мощности. Производственные мощности Китая значительно расширяются в соответствии с внутренними потребностями. Имея избыточные мощности, российские заводы работают с низкообогащенным ураном (недокорм) для производства низкообогащенного урана для продажи.Мировые мощности по обогащению — эксплуатационные и планируемые (тыс. ЕРР / год)
Страна Компания и завод 2013 2015 2020 Франция Areva, Georges Besse I & II 5500 7000 7500 Германия-Нидерланды-Великобритания Urenco: Гронау, Германия; Алмело, Нидерланды; Кепенхерст, Великобритания. 14 200 14 400 14 900 Япония JNFL, Роккаашо 75 75 75 США USEC, Пикетон 0 * 0 0 США Уренко, Нью-Мексико 3500 4700 4700 США Global Laser Enrichment, Падука 0 0 0 Россия Тенекс: Ангарск, Новоуральск, Зеленогорск, Северск 26 000 26 578 28,663 Китай CNNC, Ханьчжун и Ланьчжоу 2200 5760 10,700+ Другое Различные: Аргентина, Бразилия, Индия, Пакистан, Иран 75 100 170 Всего ЕРР / год приблизительно 51,550 58600 66,700 Требования ( Эталонный сценарий WNA ) 49,154 47,285 57 456 Мировые мощности по обогащению — действующие в 2018 г.
 и планируемые (тыс. ЕРР / год)
и планируемые (тыс. ЕРР / год) Оператор 2018 2020 2030 CNNC 6750 6750 19 644 Орано 7500 7500 7500 Росатом 28 215 27 654 25 000 Urenco 18 600 18 320 16 487 Другое 46 66 450 Итого 61,111 60,199 69,081 Источник: Отчет WNA по ядерному топливу 2019
Сырье для обогащения состоит из гексафторида урана (UF 6 ) с конверсионной установки.После обогащения образуются два потока UF 6 : обогащенный «продукт», содержащий более высокую концентрацию U-235, который будет использоваться для производства ядерного топлива, и «хвосты», содержащие более низкую концентрацию U-235 и известные как обедненный уран (DU).
 Анализ хвостов (концентрация U-235) является важной величиной, поскольку он косвенно определяет объем работы, который необходимо проделать с определенным количеством урана, чтобы произвести данный анализ продукта. Исходное сырье может иметь различную концентрацию U-235 в зависимости от источника.В природном уране концентрация U-235 будет около 0,7%, в то время как у рециркулируемого урана будет около 1%, а хвосты для повторного обогащения часто будут составлять около 0,25-0,30%.
Анализ хвостов (концентрация U-235) является важной величиной, поскольку он косвенно определяет объем работы, который необходимо проделать с определенным количеством урана, чтобы произвести данный анализ продукта. Исходное сырье может иметь различную концентрацию U-235 в зависимости от источника.В природном уране концентрация U-235 будет около 0,7%, в то время как у рециркулируемого урана будет около 1%, а хвосты для повторного обогащения часто будут составлять около 0,25-0,30%.Мощность обогатительных фабрик измеряется в «единицах работы разделения» или ЕРР. ЕРР — это сложная единица измерения, которая указывает количество потребляемой энергии относительно количества переработанного урана, степени его обогащения (, т. Е. степень увеличения концентрации изотопа U-235 по отношению к остатку) и уровень истощения остатка — так называемые «хвосты».Единица строго: килограмм разделительная рабочая единица, и она измеряет количество разделительной работы, выполненной для обогащения заданного количества урана определенным количеством, когда количества сырья и продукта выражаются в килограммах.
.jpg) Также используется единица измерения «тонны ЕРР».
Также используется единица измерения «тонны ЕРР».
Например, для производства одного килограмма урана, обогащенного до 5% по U-235, требуется 7,9 ЕРР, если установка работает при анализе хвостов 0,25%, или 8,9 ЕРР, если анализ хвостов составляет 0,20% (таким образом, требуется только 9.4 кг вместо 10,4 кг натурального корма U). Всегда существует компромисс между стоимостью ЕРР обогащения и стоимостью урана.Сегодня 5% U-235 является максимальным уровнем обогащения топлива, используемого в обычных энергетических реакторах. Однако, особенно в отношении новых конструкций реакторов малой мощности, растет интерес к более высоким уровням обогащения. Комиссия по ядерному регулированию США одобрила поправку к лицензии для Urenco USA на обогащение до 5,5% по U-235, а Global Nuclear Fuel-Americas, производитель топлива GE Hitachi, подала заявку на использование урана с обогащением до 8%.Запланированный завод Global Laser Enrichment в Уилмингтоне в Северной Каролине (см.
 Ниже) имеет лицензию на обогащение до 8%.
Ниже) имеет лицензию на обогащение до 8%.НОУ высокой концентрации (HALEU) составляет от 5% до 20% U-235, и более высокие уровни в этом диапазоне необходимы для некоторых видов топлива усовершенствованных энергетических реакторов. Некоторый небольшой спрос на исследовательские реакторы уже существует. Однако такое топливо HALEU лучше всего производить на месте, где оно превращается из фторида и превращается в топливо, чтобы избежать необходимости в специальных транспортных упаковках для HALEU UF 6 .Для уровней обогащения до 10%, называемых НОУ +, существующие транспортные контейнеры могут быть модифицированы. Свыше 10% HALEU требует усиленной физической безопасности и другого лицензирования.
Первый график показывает усилие по обогащению (ЕРР) на единицу продукта . Второй показывает, как одна тонна природного урана , исходный материал , может оказаться в конечном итоге: как 120-130 кг урана для топлива энергетического реактора, как 26 кг обычного топлива исследовательского реактора или, возможно, как 5. 6 кг оружейного материала. Кривая сглаживается настолько, что масса обогащаемого материала постепенно уменьшается до этих количеств, по сравнению с исходной одной тонной, поэтому требуется меньше усилий по сравнению с тем, что уже было применено, для дальнейшего прогресса в процентном обогащении. Относительно небольшое увеличение усилий, необходимых для достижения увеличения по сравнению с нормальным уровнем, является причиной того, почему обогатительные фабрики считаются чувствительной технологией с точки зрения предотвращения распространения оружия и очень строго контролируются в соответствии с международными соглашениями.Когда этот надзор за гарантиями нарушается или затрудняется, как в Иране, возникают опасения.
6 кг оружейного материала. Кривая сглаживается настолько, что масса обогащаемого материала постепенно уменьшается до этих количеств, по сравнению с исходной одной тонной, поэтому требуется меньше усилий по сравнению с тем, что уже было применено, для дальнейшего прогресса в процентном обогащении. Относительно небольшое увеличение усилий, необходимых для достижения увеличения по сравнению с нормальным уровнем, является причиной того, почему обогатительные фабрики считаются чувствительной технологией с точки зрения предотвращения распространения оружия и очень строго контролируются в соответствии с международными соглашениями.Когда этот надзор за гарантиями нарушается или затрудняется, как в Иране, возникают опасения.Приблизительно 140 000 ЕРР требуется для обогащения годовой загрузки топлива для типичного легководного реактора мощностью 1000 МВт при сегодняшних более высоких уровнях обогащения. Затраты на обогащение в значительной степени связаны с используемой электрической энергией.
 Процесс газовой диффузии потребляет около 2500 кВтч (9000 МДж) на ЕРР, в то время как современные газоцентрифужные установки требуют всего около 50 кВтч (180 МДж) на ЕРР.
Процесс газовой диффузии потребляет около 2500 кВтч (9000 МДж) на ЕРР, в то время как современные газоцентрифужные установки требуют всего около 50 кВтч (180 МДж) на ЕРР.На обогащение приходится почти половина стоимости ядерного топлива и около 5% от общей стоимости вырабатываемой электроэнергии.В прошлом он также учитывал основное воздействие парниковых газов от ядерного топливного цикла, когда электроэнергия, используемая для обогащения, вырабатывается из угля. Однако при использовании современных газоцентрифужных установок он по-прежнему составляет всего 0,1% углекислого газа от эквивалентной выработки электроэнергии на угле.
Коммунальные предприятия, покупающие уран на рудниках, нуждаются в фиксированном количестве обогащенного урана для производства топлива для загрузки в их реакторы. Количество урана, которое они должны поставить на предприятие по обогащению, определяется требуемым уровнем обогащения (% U-235) и анализом хвостов (также% U-235).Это контрактный или транзакционный анализ хвостов, который определяет, сколько природного урана должно быть поставлено для создания определенного количества продукта обогащенного урана (EUP) — анализ с более низкими хвостами означает, что необходимо применить больше услуг по обогащению (особенно энергии).
 Однако обогатитель имеет некоторую гибкость в отношении анализа рабочих хвостов на заводе. Если оперативный анализ хвостов ниже, чем контрактный / транзакционный анализ, предприятие по обогащению может отложить некоторый излишек природного урана, который он может свободно продать (либо как природный уран, либо как EUP) за свой собственный счет.
Однако обогатитель имеет некоторую гибкость в отношении анализа рабочих хвостов на заводе. Если оперативный анализ хвостов ниже, чем контрактный / транзакционный анализ, предприятие по обогащению может отложить некоторый излишек природного урана, который он может свободно продать (либо как природный уран, либо как EUP) за свой собственный счет.Это известно как недокорм. * Коммунальные предприятия все чаще стремятся контролировать эту гибкость операций в контрактах и сами получают некоторую выгоду от недокармливания.
* Противоположная ситуация, когда оперативный анализ хвостов выше, требует, чтобы обогатитель дополнял природный уран, поставляемый коммунальным предприятием, частью собственного — это называется избыточной подачей.
Что касается недокормки (или перекармливания), то предприятие по обогащению будет основывать свое решение на экономических показателях завода вместе с ценами на уран и энергоносители.В отчете Всемирной ядерной ассоциации за 2015 год о ядерном топливе оценивается, что недостаточное снабжение обогатителей потенциально может принести от 5700 до 8000 т уранов в год на мировые рынки к 2025 году на основе типичного западного анализа хвостов 0,22%, большая часть этого потенциала приходится на Россию.
 где в анализах хвостов обычно содержится 0,10% U-235.
где в анализах хвостов обычно содержится 0,10% U-235.В связи со снижением спроса на обогащенный уран после аварии на Фукусиме, обогатительные фабрики продолжили работу, поскольку отключение и повторный запуск центрифуг обходятся дорого.Избыточный выпуск ЕРР может быть продан, или заводы могут быть недокормлены, чтобы обогатитель остался с избыточным ураном для продажи или с обогащенным продуктом для собственных запасов и последующей продажи. Таким образом, инерция процесса обогащения усугубляет избыточное предложение на рынке урана и снижает цены на ЕРР (со 160 долларов за ЕРР в 2010 году, спотовая цена в марте 2016 года составляла 60 долларов). При прогнозируемой избыточной мощности вполне вероятно, что некоторые старые каскады будут выведены из эксплуатации.
Устаревшие диффузионные установки были выведены из эксплуатации, последняя из которых связана с запоздалой активностью в Падуке в 2013 году.
Природный уран обычно отправляется на обогатительные фабрики в баллонах типа 48Y, каждый из которых содержит около 12,5 т гексафторида урана (8,4 тU).
 Эти цилиндры затем используются для длительного хранения DU, обычно на участке обогащения. Обогащенный уран отгружается в баллонах типа 30В, каждый по 2,27 т UF6 (1,54 тU).
Эти цилиндры затем используются для длительного хранения DU, обычно на участке обогащения. Обогащенный уран отгружается в баллонах типа 30В, каждый по 2,27 т UF6 (1,54 тU).Источник поставки: 2000 2010 2015 прогноз 2020 Распространение 50% 25% 0 0 Центрифуга 40% 65% 100% 93% Лазер 0 0 0 3% ВОУ бывшее оружие 10% 10% 0 4% Три процесса обогащения, описанные ниже, имеют разные характеристики.Распространение является гибким в зависимости от изменений спроса и затрат на электроэнергию, но при этом очень энергоемко.
 Технология центрифуг позволяет легко увеличить емкость за счет модульного расширения, но она негибкая и лучше всего работает на полную мощность при низких эксплуатационных расходах. Лазерная технология позволяет анализировать хвосты до очень низкого уровня, а также позволяет модульное расширение предприятия.
Технология центрифуг позволяет легко увеличить емкость за счет модульного расширения, но она негибкая и лучше всего работает на полную мощность при низких эксплуатационных расходах. Лазерная технология позволяет анализировать хвосты до очень низкого уровня, а также позволяет модульное расширение предприятия.Процесс центрифуги
Процесс газовой центрифуги был впервые продемонстрирован в 1940-х годах, но был отложен в пользу более простого процесса диффузии.Затем она была разработана и введена в эксплуатацию в 1960-х годах как технология обогащения второго поколения. Это экономично в меньшем масштабе, например. менее 2 миллионов ЕРР в год, что позволяет поэтапно развивать более крупные предприятия. Это намного более энергоэффективно, чем диффузия, требуя всего около 40-50 кВтч на ЕРР.
Процесс центрифугирования был внедрен на коммерческом уровне в России и в Европе Urenco, промышленной группой, созданной правительствами Великобритании, Германии и Нидерландов, а недавно и Areva / Orano.
 На четыре российских завода в Северске, Зеленогорске, Ангарске и Новоуральске приходится около 40% мировой мощности. Urenco управляет обогатительными заводами в Великобритании, Нидерландах и Германии, а также одним в США. Orano управляет новым большим заводом во Франции и владеет 50% компании Urenco Enrichment Technology Company, которая производит центрифуги для обеих компаний.
На четыре российских завода в Северске, Зеленогорске, Ангарске и Новоуральске приходится около 40% мировой мощности. Urenco управляет обогатительными заводами в Великобритании, Нидерландах и Германии, а также одним в США. Orano управляет новым большим заводом во Франции и владеет 50% компании Urenco Enrichment Technology Company, которая производит центрифуги для обеих компаний.В Японии JNC и JNFL управляют небольшими центрифужными заводами, мощность JNFL в Роккашо планировалась на уровне 1,5 миллиона ЕРР в год. В Китае есть две небольшие центрифужные установки, импортированные из России.В Китае есть несколько центрифужных заводов, первый в Ханьчжуне с центрифугами 6-го поколения, импортированными из России. Производительность завода в Ланьчжоу составляет 3,5 миллиона ЕРР в год, но к 2020 году объем производства вырастет до 6,5 миллиона ЕРР в год, а в Ханьчжуне — 2,2 миллиона ЕРР в год. Остальные находятся в стадии строительства. В Бразилии есть небольшой завод, который будет доводиться до 0,2 миллиона ЕРР в год.
 Пакистан разработал технологию центрифужного обогащения, которая, похоже, была продана Северной Корее. Иран имеет сложную технологию центрифуг, которая находится в эксплуатации, с расчетной производительностью 9000 ЕРР / год.
Пакистан разработал технологию центрифужного обогащения, которая, похоже, была продана Северной Корее. Иран имеет сложную технологию центрифуг, которая находится в эксплуатации, с расчетной производительностью 9000 ЕРР / год.И во Франции, и в США заводы с технологией центрифуг Urenco последнего поколения были построены для замены стареющих диффузионных установок, не в последнюю очередь потому, что они более экономичны в эксплуатации. Как уже отмечалось, центрифужная установка требует всего 40 кВтч / ЕРР энергии (Urenco в Кепенхерсте, Великобритания, вводила 62,3 кВтч / ЕРР для всего завода в 2001–2002 годах, включая инфраструктуру и капитальные работы).
Французский завод Orano стоимостью 3 миллиарда евро — Georges Besse II — начал коммерческую эксплуатацию в апреле 2011 года и достиг полной мощности в 7 единиц.5 миллионов ЕРР / год в 2016 году. Как отмечалось выше, клиенты владеют 12% акций операционной дочерней компании Orano SET.
Национальный обогатительный комплекс Urenco стоимостью 1,5 миллиарда долларов США в Нью-Мексико, США, начал производство в июне 2010 года.
 Полная начальная мощность в 3,7 миллиона ЕРР в год была достигнута в 2014 году, а мощность достигла 4,7 миллиона ЕРР в год в 2015 году — этого достаточно для 10% электроэнергии в США. потребности.
Полная начальная мощность в 3,7 миллиона ЕРР в год была достигнута в 2014 году, а мощность достигла 4,7 миллиона ЕРР в год в 2015 году — этого достаточно для 10% электроэнергии в США. потребности.После этого Areva планировала построить завод Eagle Rock стоимостью 2 миллиарда долларов США и 3,3 миллиона ЕРР в год в Айдахо-Фолс, США.В 2009 году он подал заявку на удвоение мощности до 6,6 млн ЕРР в год. Сейчас она отменена, и в 2018 году Орано обратилось в NRC с просьбой о прекращении действия лицензии.
USEC, ныне Centrus, строила свой завод американских центрифуг в Пикетоне, штат Огайо, на том же участке в Портсмуте, где в 1980-х годах действовал экспериментальный завод Министерства энергетики США, ставший кульминацией очень крупной программы НИОКР. Предполагалась эксплуатация с 2012 года, стоимость которой тогда оценивалась в 3,5 миллиарда долларов. Он был спроектирован так, чтобы иметь начальную мощность 3 штуки в год.8 миллионов ЕРР. Запрошено разрешение на обогащение до 10% — на большинстве заводов по обогащению используется продукт U-235, содержащий до 5%, что становится серьезным препятствием по мере увеличения выгорания реакторного топлива.
 Демонстрационный каскад был запущен в сентябре 2007 года с примерно 20 прототипами машин, а ведущий каскад коммерческих центрифуг начал работу в марте 2010 года. Это очень большие машины, 13 м высотой, каждая производительностью около 350 ЕРР в год и требующие регулярного обслуживания. Однако весь проект был в основном остановлен в июле 2009 года в ожидании дальнейшего финансирования, хотя демонстрационный каскад начал работать в октябре 2013 года как «центральный элемент программы НИОКР с Министерством энергетики».«У него была лицензия на обогащение 7 миллионов ЕРР в год до 10% по U-235, но деятельность была прекращена в феврале 2016 года.
Демонстрационный каскад был запущен в сентябре 2007 года с примерно 20 прототипами машин, а ведущий каскад коммерческих центрифуг начал работу в марте 2010 года. Это очень большие машины, 13 м высотой, каждая производительностью около 350 ЕРР в год и требующие регулярного обслуживания. Однако весь проект был в основном остановлен в июле 2009 года в ожидании дальнейшего финансирования, хотя демонстрационный каскад начал работать в октябре 2013 года как «центральный элемент программы НИОКР с Министерством энергетики».«У него была лицензия на обогащение 7 миллионов ЕРР в год до 10% по U-235, но деятельность была прекращена в феврале 2016 года.Группа центрифуг на заводе Urenco
Подобно процессу диффузии, процесс центрифугирования использует газ UF 6 в качестве сырья и использует небольшую разницу в массе между U-235 и U-238. Газ подается в серию вакуумных трубок, каждая из которых содержит ротор высотой от 3 до 5 метров и диаметром 20 см.
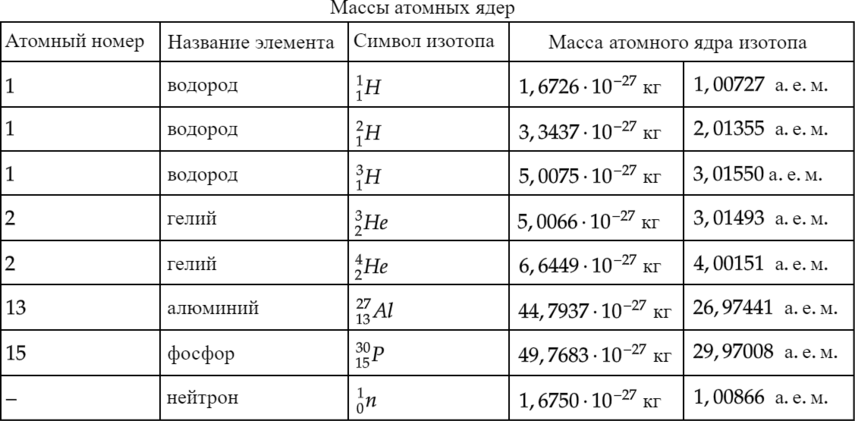 * Европейские центрифуги производят 40-100 ЕРР в год.Когда роторы вращаются быстро, со скоростью от 50 000 до 70 000 об / мин, более тяжелые молекулы с U-238 увеличиваются в концентрации по направлению к внешнему краю цилиндра. Соответствующее увеличение концентрации молекул U-235 вблизи центра. Противоточный поток, создаваемый тепловым градиентом, позволяет отводить обогащенный продукт в осевом направлении: более тяжелые молекулы с одного конца и более легкие — с другого.
* Европейские центрифуги производят 40-100 ЕРР в год.Когда роторы вращаются быстро, со скоростью от 50 000 до 70 000 об / мин, более тяжелые молекулы с U-238 увеличиваются в концентрации по направлению к внешнему краю цилиндра. Соответствующее увеличение концентрации молекул U-235 вблизи центра. Противоточный поток, создаваемый тепловым градиентом, позволяет отводить обогащенный продукт в осевом направлении: более тяжелые молекулы с одного конца и более легкие — с другого.* Американские центрифуги USEC имеют высоту более 12 м и диаметр 40-50 см.Высота российских центрифуг меньше одного метра. Китайские крупнее, но короче, чем у Urenco.
Обогащенный газ является частью сырья для следующих стадий, тогда как обедненный газ UF6 возвращается на предыдущую стадию. В конечном итоге обогащенный и обедненный уран извлекается из каскада при желаемых анализах.
Для эффективного разделения двух изотопов центрифуги вращаются с очень высокой скоростью, при этом внешняя стенка вращающегося цилиндра движется со скоростью от 400 до 500 метров в секунду, что дает ускорение свободного падения в миллион раз.
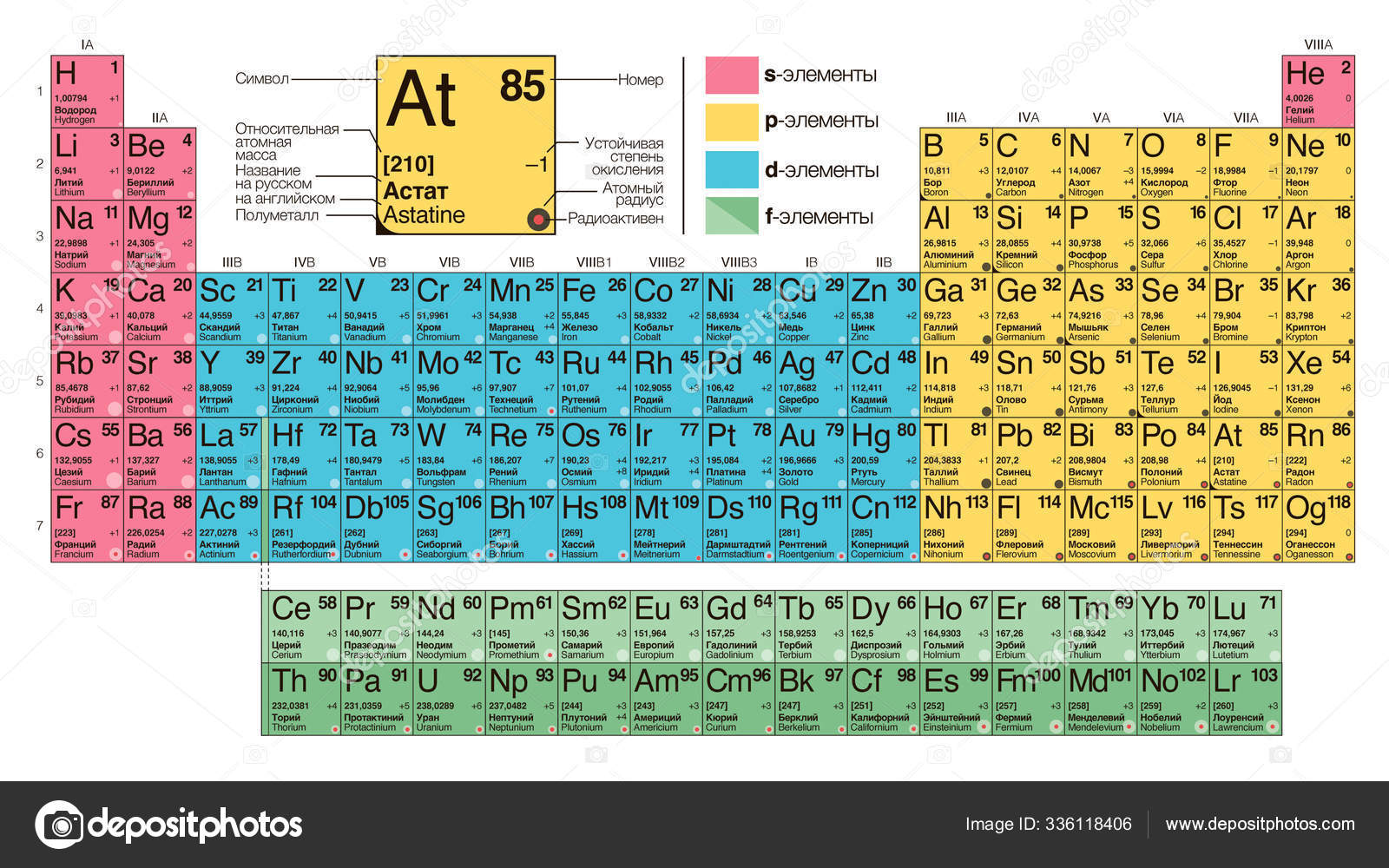
Хотя объем одной центрифуги намного меньше, чем у одной ступени диффузии, ее способность разделять изотопы намного больше. Ступени центрифуги обычно состоят из большого количества параллельно включенных центрифуг. Такие ступени затем располагаются каскадом, как и ступени для распространения. Однако в процессе центрифуги количество стадий может составлять от 10 до 20 вместо тысячи или более для диффузии. Центрифуги рассчитаны на непрерывную работу около 25 лет, и их нельзя просто замедлить, выключить и перезапустить по мере необходимости.Западные каскады рассчитаны на определение хвостов от 0,18 до 0,22%, российские — на 0,10%.
Лазерные процессы
Процессы лазерного обогащения в течение некоторого времени были в центре внимания. Они представляют собой возможную технологию третьего поколения, обещающую более низкие энергозатраты, более низкие капитальные затраты и более низкие анализы хвостов, следовательно, значительные экономические преимущества. Один из этих процессов почти готов к коммерческому использованию.
 Лазерные процессы делятся на две категории: атомные и молекулярные.
Лазерные процессы делятся на две категории: атомные и молекулярные.Разработка аппарата для лазерного разделения изотопов на атомных парах (AVLIS и французская SILVA) началась в 1970-х годах.В 1985 году правительство США поддержало эту технологию как новую технологию для замены своих газодиффузионных заводов, поскольку они подошли к концу своей экономической жизни в начале 21 века. Однако после того, как исследования и разработки составили около 2 миллиардов долларов США, от него отказались в пользу SILEX, молекулярного процесса. Французские работы над SILVA прекратились после четырехлетней программы до 2003 года, чтобы доказать научную и техническую осуществимость процесса. Здесь было произведено около 200 кг урана с обогащением 2,5%.
Процессы с атомным паром работают по принципу фотоионизации, при котором мощный лазер используется для ионизации определенных атомов, присутствующих в парах металлического урана.(Электрон может быть выброшен из атома светом определенной частоты.
 В лазерных технологиях для урана используются частоты, настроенные на ионизацию атома U-235, но не атома U-238.) Положительно заряженные ионы U-235 затем притягиваются к отрицательно заряженной пластине и собираются. Атомные лазерные методы также могут разделять изотопы плутония.
В лазерных технологиях для урана используются частоты, настроенные на ионизацию атома U-235, но не атома U-238.) Положительно заряженные ионы U-235 затем притягиваются к отрицательно заряженной пластине и собираются. Атомные лазерные методы также могут разделять изотопы плутония.Большинство молекулярных процессов, которые были исследованы, работают по принципу фотодиссоциации UF 6 в твердый UF 5 + с использованием настроенного лазерного излучения, как указано выше, для разрыва молекулярной связи, удерживающей один из шести атомов фтора. атом U-235.Затем это позволяет отделить ионизированный UF 5 от не подвергшихся воздействию молекул UF 6 , содержащих атомы U-238, тем самым достигая разделения изотопов. * Любой процесс с использованием UF 6 лучше подходит для обычного топливного цикла, чем атомный процесс.
* Аналогичный принцип может быть использован при обогащении атомарного лития с магнитным разделением ионизированных атомов с получением чистого Li-7.

Основной молекулярный лазерный процесс для обогащения урана — SILEX , в котором используется UF 6 , и теперь он известен как глобальное лазерное обогащение (GLE).В 2006 году GE Energy вступила в партнерство с австралийской Silex Systems для разработки процесса SILEX третьего поколения. Он предусматривал, что GE (ныне GE Hitachi) построит в США испытательный контур инженерного масштаба, затем пилотную установку или ведущий каскад, который может быть введен в эксплуатацию в 2012 году, и расширен до полноценного коммерческого завода. Помимо авансовых платежей в размере 20 миллионов долларов и последующих платежей, лицензионное соглашение будет приносить отчисления в размере 7–12%, точная сумма зависит от стоимости развертывания коммерческой технологии.В середине 2008 г. Cameco приняла участие в проекте GLE, заплатив 124 миллиона долларов за 24% акций, наряду с GE (51%) и Hitachi (25%). (Ранее, в 1996 году USEC получила права на оценку и разработку SILEX для урана, но вышла из проекта в 2003 году.
 )
)В апреле 2016 года GE и Hitachi уведомили о своем намерении выйти из GLE, и в ходе последующих переговоров Silex профинансировала 76% НИОКР GLE в Уилмингтоне, Северная Каролина. GLE хорошо продвинулась в коммерциализации процесса SILEX и имеет соглашение с Министерством энергетики США об обогащении около 300 000 тонн хвостов обедненного урана в Падуке, штат Кентукки, до урана природного качества.
В феврале 2019 года Silex Systems и Cameco договорились о выкупе 76% доли GEH в GLE за 20 млн долларов США на основе отсрочки платежа, в результате чего Cameco будет принадлежать 49% GLE и 51% Silex. Cameco имеет возможность приобрести дополнительно 26% GLE. Соглашение требует, чтобы Silex и Cameco платили 300 000 долларов в месяц для завершения строительства опытного образца обогатительной фабрики, известного как Wilmington Test Loop, который был частично построен компанией GEH. Соглашение зависит от одобрения правительства США.Silex сказал: «Коммерческая возможность Paducah представляет собой идеальный путь к рынку для нашей революционной технологии лазерного обогащения SILEX».
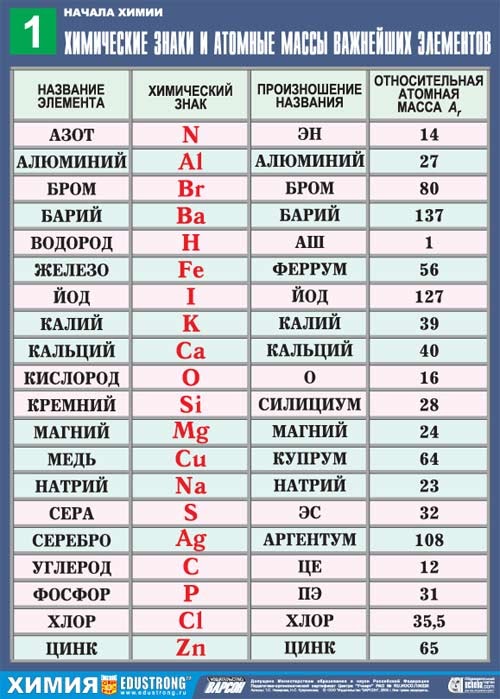
GE ранее называл SILEX, который он переименовал в GLE, как «технологию, меняющую правила игры» с «очень высокой вероятностью» успеха. GLE завершает программу цикла испытаний, начальная фаза которой уже успешно соответствует критериям производительности, и началось инженерное проектирование коммерческого объекта. GLE эксплуатирует испытательный цикл на заводе по изготовлению топлива Global Nuclear Fuel в Уилмингтоне, штат Северная Каролина. GNF является партнерством GE, Toshiba и Hitachi.
В октябре 2007 года две крупнейшие ядерные компании США, Exelon и Entergy, подписали письма о намерениях заключить контракт на оказание услуг по обогащению урана с GE Hitachi Global Laser Enrichment LLC (GLE). В августе 2010 года TVA согласилась купить у GLE услуги по обогащению на 400 миллионов долларов, если проект будет продолжен.
В середине 2009 года GEH подала последнюю часть своей заявки на лицензию на этот завод GLE в Уилмингтоне и после рассмотрения положений о физической защите специальных ядерных материалов и секретных материалов, контроля и учета материалов, а также дальнейшего рассмотрения NRC Atomic Совет по безопасности и лицензированию, полная лицензия на строительство и эксплуатацию завода производительностью до 6 миллионов ЕРР в год была выдана в сентябре 2012 года.
 Теперь GLE примет решение с учетом коммерческих соображений, следует ли продолжать строительство полномасштабной установки по обогащению в Уилмингтоне. Проект, имеющий лицензию на обогащение до 8% по U-235, может быть введен в эксплуатацию через несколько лет и довольно быстро вырастет до мощности.
Теперь GLE примет решение с учетом коммерческих соображений, следует ли продолжать строительство полномасштабной установки по обогащению в Уилмингтоне. Проект, имеющий лицензию на обогащение до 8% по U-235, может быть введен в эксплуатацию через несколько лет и довольно быстро вырастет до мощности.В августе 2013 года компания GLE представила Министерству энергетики предложение о создании завода по лазерному обогащению стоимостью 1 миллиард долларов в Падуке, штат Кентукки, для обогащения высокопробных хвостов (более 0,34% U-235), принадлежащих Министерству энергетики, до уровня природного урана (0,7% U -235). Их около 115 000 тонн в Падуке и Портсмуте (из общего количества хвостовиков 550 000).В ноябре 2013 года Министерство энергетики объявило, что продолжит переговоры по контракту с этой целью. В январе 2014 года GLE сообщила NRC, что, хотя переговоры с Министерством энергетики продолжаются, в том же году ожидается подача заявки на лицензию на строительство и эксплуатацию установки лазерного обогащения в Падуке (PLEF), которая позволит обогащать хвосты в течение примерно 40 лет до естественного содержания.
 продается. GLE ожидает, что лицензирование займет 2–3 года. Переговоры с Министерством энергетики продолжались в 2016 году, и в ноябре с Министерством энергетики было подписано соглашение о поставке около 300000 тонн высокопробных хвостов, что оправдывает строительство GLE завода в начале 2020-х годов.PLEF станет коммерческим предприятием по обогащению урана по лицензии NRC США, производя около 100 000 тонн урана природного качества в течение 40 или более лет. Министерство энергетики избавилось бы от остатков для анализа с уменьшенным объемом. Предполагаемый размер завода составляет от 0,5 до 1,0 млн ЕРР / год, поскольку закупки ОУ не могут превышать 2000 т / год эквивалента природного урана.
продается. GLE ожидает, что лицензирование займет 2–3 года. Переговоры с Министерством энергетики продолжались в 2016 году, и в ноябре с Министерством энергетики было подписано соглашение о поставке около 300000 тонн высокопробных хвостов, что оправдывает строительство GLE завода в начале 2020-х годов.PLEF станет коммерческим предприятием по обогащению урана по лицензии NRC США, производя около 100 000 тонн урана природного качества в течение 40 или более лет. Министерство энергетики избавилось бы от остатков для анализа с уменьшенным объемом. Предполагаемый размер завода составляет от 0,5 до 1,0 млн ЕРР / год, поскольку закупки ОУ не могут превышать 2000 т / год эквивалента природного урана.Приложения для стабильных изотопов кремния и циркония также разрабатываются компанией Silex Systems недалеко от Сиднея.
CRISLA — это еще один процесс молекулярного лазерного разделения изотопов, который находится на ранней стадии развития.При этом газ облучается лазером с определенной длиной волны, который возбуждает только изотоп U-235.
 Весь газ подвергается воздействию низких температур, достаточных для того, чтобы вызвать конденсацию на холодной поверхности или коагуляцию неионизированного газа. Возбужденные молекулы в газе не так вероятно конденсируются, как невозбужденные молекулы. Следовательно, при конденсации холодных стенок газ, выводимый из системы, обогащается изотопом U-235, который был возбужден лазером. Компания-разработчик NeuTrek планирует построить пилотный завод в США.
Весь газ подвергается воздействию низких температур, достаточных для того, чтобы вызвать конденсацию на холодной поверхности или коагуляцию неионизированного газа. Возбужденные молекулы в газе не так вероятно конденсируются, как невозбужденные молекулы. Следовательно, при конденсации холодных стенок газ, выводимый из системы, обогащается изотопом U-235, который был возбужден лазером. Компания-разработчик NeuTrek планирует построить пилотный завод в США.Процесс газовой диффузии
Энергоемкий газодиффузионный процесс обогащения урана больше не используется в атомной промышленности. Он включает нагнетание газообразного гексафторида урана под давлением через серию пористых мембран или диафрагм. Поскольку молекулы U-235 легче, чем молекулы U-238, они движутся быстрее и имеют немного больше шансов пройти через поры в мембране. UF 6 , который диффундирует через мембрану, таким образом, слегка обогащается, в то время как газ, который не прошел, обедняется U-235.

Этот процесс повторяется много раз в серии стадий распространения, называемых каскадом. Каждая ступень состоит из компрессора, диффузора и теплообменника для отвода тепла сжатия. Обогащенный продукт UF 6 выводится с одного конца каскада, а обедненный UF 6 удаляется с другого конца. Чтобы получить продукт с концентрацией 3–4% U-235, необходимо пройти около 1400 этапов переработки газа. Диффузионные установки обычно имеют небольшое разделение на одну ступень (отсюда большое количество ступеней), но способны обрабатывать большие объемы газа.
Коммерческое обогащение урана было впервые осуществлено методом диффузии в США в Ок-Ридже, штат Теннесси. Этот процесс также использовался в России, Великобритании, Франции, Китае и Аргентине, но в последние годы только в значительных масштабах в США и Франции. Россия прекратила этот процесс в 1992 году, и последним диффузионным заводом был завод USEC в Падуке, который остановился в середине 2013 года. Это очень энергоемкий процесс, требующий около 2400 кВтч на ЕРР *.
 В USEC заявили, что на электричество приходилось 70% производственных затрат на Падуке, который был последним из трех крупных заводов в США, первоначально построенных для программ вооружений, и имел мощность около 8 миллионов ЕРР в год.Он использовался для обогащения некоторых высокопробных хвостов, прежде чем был окончательно закрыт после 60 лет эксплуатации. В Трикастине, на юге Франции, с 1979 года работает более современная диффузионная установка мощностью 10,8 млн. Кг ЕРР в год (см. Фото ниже). Этот завод им. Жоржа Бесса I может производить достаточно урана с обогащением 3,7% в год, чтобы заправить около девяноста ядерных реакторов мощностью 1000 МВт. Он был остановлен в середине 2012 года после 33 лет непрерывной работы. Его замена (GB II, центрифужная установка — см. Выше) приступила к работе.
В USEC заявили, что на электричество приходилось 70% производственных затрат на Падуке, который был последним из трех крупных заводов в США, первоначально построенных для программ вооружений, и имел мощность около 8 миллионов ЕРР в год.Он использовался для обогащения некоторых высокопробных хвостов, прежде чем был окончательно закрыт после 60 лет эксплуатации. В Трикастине, на юге Франции, с 1979 года работает более современная диффузионная установка мощностью 10,8 млн. Кг ЕРР в год (см. Фото ниже). Этот завод им. Жоржа Бесса I может производить достаточно урана с обогащением 3,7% в год, чтобы заправить около девяноста ядерных реакторов мощностью 1000 МВт. Он был остановлен в середине 2012 года после 33 лет непрерывной работы. Его замена (GB II, центрифужная установка — см. Выше) приступила к работе.В последние годы на процесс газовой диффузии приходилось около 25% мировых мощностей по обогащению. Однако, несмотря на то, что они оказались прочными и надежными, газодиффузионные установки подошли к концу своего расчетного срока службы, и их заменила гораздо более энергоэффективная технология центрифужного обогащения.

Большая обогатительная фабрика Georges Besse I в Трикастене во Франции (помимо градирен) была остановлена в 2012 году.
Большая часть мощности атомной электростанции (4×915 МВт нетто) использовалась для питания установки по обогащению.Электромагнитный процесс
Очень ранней попыткой был процесс электромагнитного разделения изотопов (ЭМИС) с использованием калютронов. Он был разработан в начале 1940-х годов в рамках Манхэттенского проекта по производству высокообогащенного урана, использованного в бомбе Хиросимы, но вскоре от него отказались. Однако он снова стал основным направлением тайной программы Ирака по обогащению урана для оружия, обнаруженного в 1992 году. EMIS использует те же принципы, что и масс-спектрометр (хотя и в гораздо большем масштабе).Ионы урана-238 и урана-235 разделены, потому что они описывают дуги разного радиуса при движении в магнитном поле. Процесс очень энергоемкий — примерно в десять раз больше, чем диффузия.

Аэродинамические процессы
Два аэродинамических процесса были доведены до демонстрационной стадии примерно в 1970-х годах. Один из них — это процесс с использованием струйного сопла, демонстрационная установка которого построена в Бразилии, а другой — процесс с использованием вихревых труб Helikon, разработанный в Южной Африке. Ни один из них сейчас не используется, хотя последний является предвестником новых исследований и разработок.Они зависят от высокоскоростного газового потока, несущего UF6, который вращается на очень малом радиусе, вызывая градиент давления, аналогичный тому, который имеет место в центрифуге. Легкую фракцию можно извлечь к центру, а тяжелую — снаружи. Для производства обогащенного продукта для реактора требуются тысячи ступеней. Оба процесса энергоемки — более 3000 кВтч / ЕРР. Завод Helikon Z в начале 1980-х не был коммерчески ориентирован и имел мощность менее 500 000 ЕРР в год.Потребовалось около 10 000 кВтч / ЕРР.
В процессе аэродинамического разделения (ASP), разрабатываемом компанией Klydon в Южной Африке, используются аналогичные центрифуги с неподвижными стенками, в которых UF6 вводится по касательной.
 Он основан на Helikon, но ожидает разрешения регулирующих органов, он еще не тестировался на UF6 — только на легких изотопах, таких как кремний. Однако при экстраполяции результатов ожидается, что коэффициент обогащения в каждой единице составит 1,10 (ср. 1,03 в Helikon) с примерно 500 кВтч / ЕРР, и его разработка нацелена на 1.15 и менее 500 кВтч / ЕРР. Согласно прогнозам, стоимость обогащения составляет менее 100 долларов США за ЕРР, причем эта сумма равномерно распределяется между капиталом, эксплуатацией и затратами энергии.
Он основан на Helikon, но ожидает разрешения регулирующих органов, он еще не тестировался на UF6 — только на легких изотопах, таких как кремний. Однако при экстраполяции результатов ожидается, что коэффициент обогащения в каждой единице составит 1,10 (ср. 1,03 в Helikon) с примерно 500 кВтч / ЕРР, и его разработка нацелена на 1.15 и менее 500 кВтч / ЕРР. Согласно прогнозам, стоимость обогащения составляет менее 100 долларов США за ЕРР, причем эта сумма равномерно распределяется между капиталом, эксплуатацией и затратами энергии.Один химический процесс был продемонстрирован на стадии пилотной установки, но не использовался. Во французском процессе Chemex использовалась очень небольшая разница в склонности двух изотопов к изменению валентности при окислении / восстановлении с использованием водной (валентность III) и органической (IV) фаз.
Обогащение регенерированного урана
В некоторых странах использованное топливо перерабатывается для извлечения из него урана и плутония, а также для уменьшения конечного объема высокоактивных отходов.
 Плутоний обычно незамедлительно рециркулируют в смешанное оксидное (МОКС) топливо, смешивая его с обедненным ураном.
Плутоний обычно незамедлительно рециркулируют в смешанное оксидное (МОКС) топливо, смешивая его с обедненным ураном.Если уран, полученный при переработке отработанного ядерного топлива (RepU), подлежит повторному использованию, его необходимо преобразовать и повторно обогатить. Это осложняется наличием примесей и, в частности, двух новых изотопов: U-232 и U-236, которые образуются в результате захвата нейтронов в реакторе или после него и увеличиваются с увеличением уровня выгорания. U-232 в значительной степени является продуктом распада Pu-236 и увеличивается со временем хранения в отработанном топливе, достигая пика примерно через десять лет.Оба распадаются намного быстрее, чем U-235 и U-238, а один из дочерних продуктов U-232 испускает очень сильное гамма-излучение, а это означает, что экранирование необходимо для любого растительного материала, работающего с материалами с более чем очень небольшими его следами. U-236 является поглотителем нейтронов, который препятствует цепной реакции, и означает, что для компенсации в продукте требуется более высокий уровень обогащения U-235.
 Для голландского реактора Борсселе, который обычно использует топливо с обогащением 4,4%, уран с компенсированным обогащением и переработкой (c-ERU) равен 4.Обогащен на 6% для компенсации по U-236. Поскольку оба изотопа легче, оба изотопа имеют тенденцию концентрироваться в обогащенном (а не обедненном) продукте, поэтому переработанный уран, который повторно обогащается для получения топлива, должен быть отделен от обогащенного свежего урана. Присутствие U-236, в частности, означает, что большая часть переработанного урана может быть переработана только один раз, за исключением Великобритании, где производится переработка топлива AGR, сделанного из переработанного урана Magnox. U-234 также присутствует в RepU, но как альфа-излучатель не создает дополнительных проблем.Следы некоторых продуктов деления, таких как Tc-99, также могут уноситься.
Для голландского реактора Борсселе, который обычно использует топливо с обогащением 4,4%, уран с компенсированным обогащением и переработкой (c-ERU) равен 4.Обогащен на 6% для компенсации по U-236. Поскольку оба изотопа легче, оба изотопа имеют тенденцию концентрироваться в обогащенном (а не обедненном) продукте, поэтому переработанный уран, который повторно обогащается для получения топлива, должен быть отделен от обогащенного свежего урана. Присутствие U-236, в частности, означает, что большая часть переработанного урана может быть переработана только один раз, за исключением Великобритании, где производится переработка топлива AGR, сделанного из переработанного урана Magnox. U-234 также присутствует в RepU, но как альфа-излучатель не создает дополнительных проблем.Следы некоторых продуктов деления, таких как Tc-99, также могут уноситься.Все эти соображения означают, что только RepU из низкообогащенного отработанного топлива с низким выгоранием обычно рециркулируется непосредственно через установку по обогащению.
 Например, около 16 000 тонн RepU из реакторов Magnox * в Великобритании было использовано для производства около 1650 тонн обогащенного топлива AGR с помощью двух заводов по обогащению. В других странах, во Франции и Японии, использовались гораздо меньшие количества. Некоторое дообогащение, например для швейцарского, немецкого и российского топлива фактически делается путем смешивания RepU с ВОУ.
Например, около 16 000 тонн RepU из реакторов Magnox * в Великобритании было использовано для производства около 1650 тонн обогащенного топлива AGR с помощью двух заводов по обогащению. В других странах, во Франции и Японии, использовались гораздо меньшие количества. Некоторое дообогащение, например для швейцарского, немецкого и российского топлива фактически делается путем смешивания RepU с ВОУ.Теоретически лазерный процесс был бы идеальным для обогащения RepU, поскольку он игнорировал бы все, кроме желаемого U-235, но это еще предстоит продемонстрировать на переработанном сырье.
Хвосты обогащения регенерированного урана остаются собственностью обогащающего. Некоторое количество рециклированного урана было обогащено компанией Tenex в Северске для компании Areva в соответствии с десятилетним контрактом 1991 года, охватывающим около 500 тонн UF 6 . Сообщения французских СМИ в 2009 году о том, что отходы французских атомных электростанций хранились в Северске, очевидно, относятся к «хвостам» оттуда.

Обогащение хвостов обедненного урана
В ходе работ по раннему обогащению в хвостах обедненного урана часто оставалось около 0,30% U-235, и десятки тысяч тонн этого остатка оставались собственностью компаний по обогащению. После сворачивания военного обогащения, особенно в России, многие резервные мощности остались неиспользованными. Следовательно, с середины 1990-х годов Areva и Urenco отправили в Россию некоторые из хвостов с самым высоким уровнем анализа для повторного обогащения компанией Tenex.Однако эти договоренности прекращаются в 2010 году, хотя Tenex может продолжить обогащение российских хвостов. Сейчас Tenex владеет всеми хвостами от этого вторичного дообогащения, и, как говорят, они содержат только около 0,10% U-235.
После обогащения
Обогащенный UF 6 преобразуется в UO 2 и превращается в топливные таблетки — в конечном итоге из спеченной керамики, которые заключены в металлические трубки для образования топливных стержней, обычно длиной до четырех метров.
 Ряд тепловыделяющих элементов составляют тепловыделяющую сборку, готовую к загрузке в ядерный реактор.См. Документ по изготовлению топлива.
Ряд тепловыделяющих элементов составляют тепловыделяющую сборку, готовую к загрузке в ядерный реактор.См. Документ по изготовлению топлива.Проблемы окружающей среды
За незначительным исключением регенерированного урана, обогащение включает только природные долгоживущие радиоактивные материалы; нет образования продуктов деления или облучения материалов, как в реакторе. Сырье, продукт и обедненный материал находятся в форме UF 6 , хотя обедненный уран может храниться долгое время как более стабильный U 3 O 8 .
Уран слабо радиоактивен, и его химическая токсичность — особенно UF 6 — более значительна, чем его радиологическая токсичность.Поэтому защитные меры, необходимые для обогатительной фабрики, аналогичны мерам, принимаемым в других химических отраслях, связанных с производством фторированных химикатов.
Гексафторид урана при воздействии влаги образует очень коррозионный материал (HF — плавиковая кислота), поэтому любая утечка нежелательна.
 Следовательно:
Следовательно:- почти на всех участках центрифужной установки давление газа UF 6 поддерживается ниже атмосферного, и, таким образом, любая утечка может привести только к внутреннему потоку; Двойная изоляция
- предусмотрена для тех немногих зон, где требуется более высокое давление;
- отходящих и отходящих газов собираются и надлежащим образом обрабатываются.
Примечания и ссылки
Общие источники
Heriot, I.D. (1988). Обогащение урана с помощью центрифуги, отчет 11486 евро, Комиссия Европейских сообществ, Брюссель.
.
Кехо, Р. Б. (2002). Обогащающая тройка, история Urenco до 2000 года. Urenco, Marlow UK.
Уилсон, П. (ред) (1996). Ядерный топливный цикл — от руды к отходам. Издательство Оксфордского университета, Оксфорд, Великобритания.
МАГАТЭ 2007, Управление переработанным ураном — текущее состояние и перспективы на будущее , Tecdoc 1529.

 )
)