Физические свойства оксидов — Справочник химика 21
Эти ионы имеют такую же электронную конфигурацию, как атом азота (см. рис. 1.33). При соединении ионов С и О образуется тройная связь, аналогичная связи в молекуле N2. Очевидно, что тройная связь более прочна, чем двойная система с тройной связью обладает более низкой энергией. Выделение энергии при образовании третьей связи с избытком компенсирует ее затраты на перенос электрона от более электроотрицательного кислорода к углероду, и можно считать, что в молекуле СО, как и в N2, имеется тройная связь. Поэтому физические свойства оксида углерода и азота весьма близки [c.102]НЕМЕТАЛЛЫ (металлоиды) — простые вещества, не имеющие характерных для металлов свойств. Многие из Н. газообразны, отличаются от металлов по химическим и физическим свойствам. Оксиды Н. преимущественно носят кислотный характер. [c.172] Чем объяснить близкое совпадение физических свойств оксида углерода СО и азота N2
 83]
83]Химическая связь в молекуле СО очень прочная (1071 кДж/моль), п физические свойства оксида углерода (II) близки к свойствам азога. Это объясняется образованием тройной связи в молекуле СО [c.132]
Физические свойства оксидов также различны. Наличие субоксидов регистрируется металлофизическими методами, остальные оксиды выделены в свободном виде и их свойства приведены в табл. 12.26. [c.346]
Рассмотрим еще один пример определения валентности атомов. Химическая связь в молекуле СО очень прочна (1071 кДж/моль), а физические свойства оксида углерода (II) близки к свойствам азота. Это объясняется образованием тройной связи в молекуле СО [c.87]
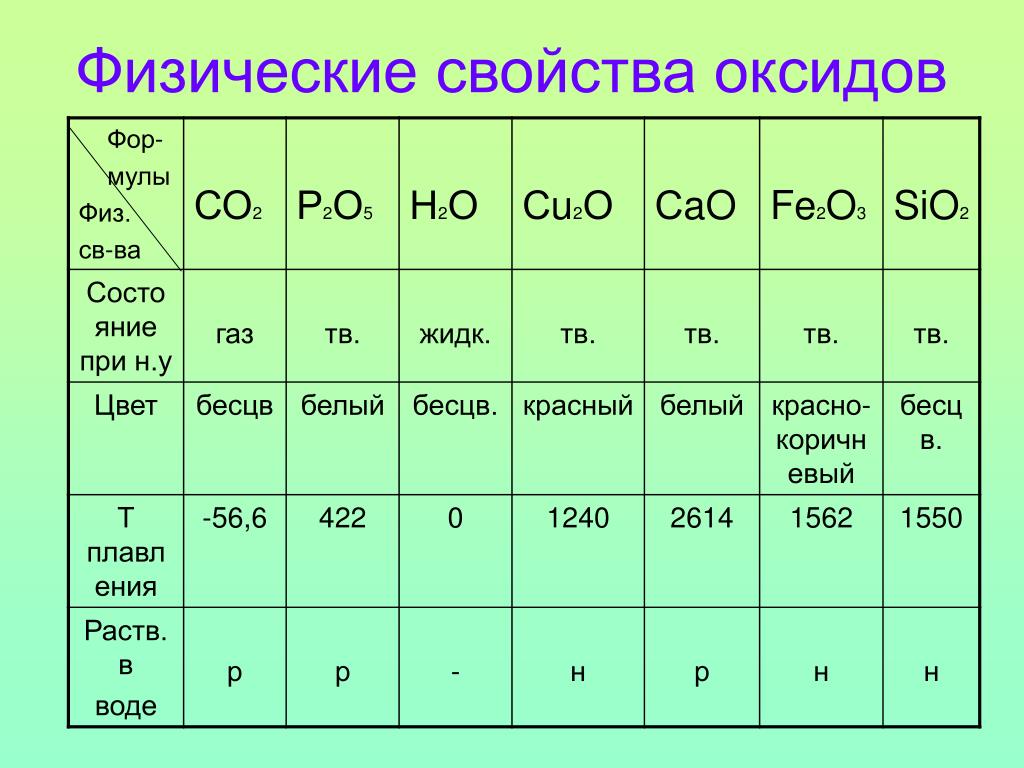
Разнообразны физические свойства оксидов. Одни из них являются газообразными веществами (СО2, ЗО , N0 и др.), другие — жидко- [c.147]
ОКСИДЫ Физические свойства оксидов [c.226]
Каковы физические свойства оксидов азота [c. 392]
392]
По химическому строению молекулы, химическим и физическим свойствам оксид углерода проявляет большое сходство с молекулярным азотом. Молекулы СО и N2 изоэлектронны, имеют равные молекулярные массы, высокий порядок связи и относятся к самым прочным двухатомным частицам. В отличие от СО2 оксид углерода не обладает кислотной природой. Для него наиболее характерны реакции окисления и присоединения. Первые обусловлены степенью окисления углерода в С0(+2), а вторые — неподеленными электронными парами атомов углерода и кислорода. [c.360]
Физические свойства оксидов [c.3]
Сравните физические свойства оксидов меди и м елеза.
Физические свойства оксидов углерода [c.136]
Одинаковы ли физические свойства оксида фосфора и свойства составляющих его простых веществ Ответ поясните. [c.39]
ФС Таблица 8.6. Физические свойства оксидов азота [c. 79]
79]
ФС Таблица 10S. Физические свойства оксидов хлора [c.117]
ФС Таблица 19.2. Физические свойства оксидов ванадия [c.162]
ФС Таблица 22.2. Физические свойства оксидов железа [c.180]ФС Таблица 22.12. Физические свойства оксидов платиновых металлов [c.189]
Соединения свинца Оксиды свинца — РЬО, РЬОг и РЬз04 ФС Таблица 7.13. Физические свойства оксидов свинца [c.72]
Физические свойства оксидов хлора [311, 317] [c.15]
Подробное ознакомление с физическими свойствами оксидов -металлов VI группы необходимо для правильной оценки возможности их эксплуатации. [c.346]
За счет добавочной электронной пары внешний слой атома углерода становится завершенным, и молекула СО получает такое же строение, как молекула азота. Поэтому все физические свойства оксида углерода (П) и азота оказываются очень близкими. [c.369]
Поэтому все физические свойства оксида углерода (П) и азота оказываются очень близкими. [c.369]
Физические свойства. Оксид углерода (И) — бесцветный ядовитый газ, не имеет запаха и вкуса, чуть легче воздуха молекула его неполярна, поэтому имеет низкую температуру кипения и малую растворимость в воде. Оксид углерода (П) кипит при — 192°С. [c.369]
Известно, что по физическим свойствам оксид углерода (II) и азот очень сходны между собой. Однако, в отличие от азота, угарный газ сильно ядовит. Запахом он, однако, также не обладает. Предложите способ обнаружения количественной примеси оксида углерода (II) в азоте.
Известно, что по физическим свойствам оксид углерода (П) и азот очень сходны между собой. Объясните причины подобного сходства, исходя из строения молекул СО и N2. [c.119]
Физические свойства оксидов изменяются закономерно и соответственно изменению свойств элементов по периодам и группам. На рис. 80 представлена зависимость температуры плавления оксидов от порядкового номера элемента. При обычной температуре оксиды металлов — твердые кристаллические вещества, оксиды неметаллов могут быть в газообразном (SO2, СО и др.), в жидком (Н2О и др.) и твердом (Р2О3, Р2О5, Si02 и др.) агрегатных состояниях. [c.239]
На рис. 80 представлена зависимость температуры плавления оксидов от порядкового номера элемента. При обычной температуре оксиды металлов — твердые кристаллические вещества, оксиды неметаллов могут быть в газообразном (SO2, СО и др.), в жидком (Н2О и др.) и твердом (Р2О3, Р2О5, Si02 и др.) агрегатных состояниях. [c.239]
По физическим свойствам оксид серы (И) — бесцветный газ, который при —120° С превращается в жидкость оранжево-красного цвета при этом он полимеризуется в димер состава S2O2, который при нагревании газообразного оксида уже не дает. [c.568]
На двух ближайших уроках рассматривались важнейшие свойства оксидов углерода (II и IV ). Чтобы учащиеся лучше запомнили эти свойства, им предлагают в ко1ще второго урока выполнить самостоятельную работу с составлением обобщающих таблиц и записью соответствующих выводов. Так как первый вариант заданий, касающийся физических свойств оксидов, проще, его можно предложить выполнить из двух рядом сидящих учащихся тому, который слабее. [c.135]
[c.135]
Физические свойства оксидов, халькогенидов и ниобатов свя-Ваны с наличием микрофаз и микропримесей и с отклонением от стехиометрии состава, возникающим в процессе синтеза и термической обработки образца. В настоящей работе описаны методы определения микрофаз в различных неорганических соединениях йодистом серебре, окиси цинка, ниобате лития, селениде кадмия, сульфиде свинца, а также микронримеси меди в пленках селенида кадмия. Выделение микрофаз проводят путем обработки кристаллов основного вещества соответствующими растворителями. Ос иовная задача определения фаз заключается в выборе селективного растворителя. Для контроля полноты растворения фаз проводили многократную обработку проб.
Свойства. Разнообразны физические свойства оксидов. Одни из них являются газообразными веществами (СО2, 502, и др.), другие —жидкостями (ЫаОз, N02, сцо, и др.), третьи — твердыми (все основные и амфотерные оксиды, некоторые кислотные оксиды — РгОб, 5Ю2 и др. ). [c.118]
). [c.118]
Свойства оксидов металлов
Теплофизические свойства оксидов металлов
В таблице представлены теплофизические свойства оксидов (спеченных окислов) металлов при различной температуре. Даны значения свойств следующих плотных спеченных окислов: оксиды алюминия и магния Al 2O3, MgO, оксид кальция CaO, оксид кремния SiO2, оксид никеля NiO, оксид титана TiO, оксид циркония ZrO2, оксид урана UO2, оксид тория ThO2, оксид плутония PuO2
Теплопроводность спеченных окислов в таблице указана при температуре от 127 до 1727 °С в зависимости от пористости. Коэффициент линейного теплового расширения (КТР) указан при температуре от 300 до 400 К. Плотность оксидов металлов дана при комнатной температуре.
Теплопроводность спеченных оксидов металлов зависит от чистоты и кристаллической структуры исходных порошков, метода и степени прессования и режимов спекания.
В таблице даны следующие свойства оксидов металлов:
- температура плавления, К;
- коэффициент линейного теплового расширения (КТР), 1/град;
- плотность, кг/м3;
- пористость, %;
- коэффициент теплопроводности, Вт/(м·град).
Основные свойства оксидов металлов
В таблице приведены основные свойства оксидов металлов при комнатной температуре.
Свойства указаны для следующих оксидов металлов: Al2O3, MgO, TiO, Ti2O3, TiO2, ZrO2, оксид цинка ZnO, оксиды железа FeO, Fe3O4, Fe2O3, NiO, оксид меди CuO, оксид ванадия V2O5, оксид вольфрама WO3, оксид марганца MnO 2, оксид бария BaO2.
Даны следующие свойства оксидов металлов:
- молекулярная масса оксида;
- плотность, кг/м3;
- температура плавления, К;
- теплота плавления, кДж/кг;
- температура кипения, К;
- теплота испарения при кипении, кДж/кг;
- температура полиморфного превращения, К;
- теплота полиморфного превращения, кДж/кг.
Теплопроводность плотных спеченных оксидов металлов
В таблице представлены значения теплопроводности плотных спеченных оксидов металлов (пористость равна нулю) в зависимости от температуры.
Теплопроводность дана для следующих оксидов металлов: оксид алюминия Al2O3, оксид бериллия BeO, оксид кальция CaO, оксид кремния SiO2, оксид магния MgO, оксид никеля NiO, оксид титана TiO2, оксид циркония ZrO2. Теплопроводность окислов металлов приведена при температуре от 100 до 2000 К.
Видно, что в основном, теплопроводность оксидов снижается при росте температуры. В таблице также указана плотность оксидов металлов (оксидная керамика) при комнатной температуре.
В таблице также указана плотность оксидов металлов (оксидная керамика) при комнатной температуре.
Влияние нейтронного облучения на теплопроводность спеченных оксидов металлов
В таблице представлены значения теплопроводности плотных спеченных оксидов металлов до и после облучения потоком быстрых нейтронов.
Теплопроводность оксидов дана при комнатной температуре и при сверхнизких температурах (5…100 К).
Значения указаны для следующих оксидов металлов: BeO, Al2O3, SiO2 (α-кварц), плавленый кварц, ZrSiO4, шпинель, форстерит, фарфор, слюда.
Как видно из таблицы, значение коэффициента теплопроводности оксидов металлов при их облучении потоком быстрых нейтронов, в основном снижается.
Теплоемкость оксидов металлов
В таблице указаны значения истинной и средней удельных теплоемкостей оксидов металлов в зависимости от температуры.
Теплоемкости (размерность кДж/(кг·град)) даны при температуре от 0 до 1500°С.
Значения представлены для следующих оксидов металлов (компонентов огнеупорных материалов и шлаков): SiO2, Al2O3, Fe2O3, FeO, MgO, MnO, CaO.
Примечание: Истинная теплоемкость соответствует указанной температуре, а значение средней теплоемкости Cm приведено для интервала температуры от 0°С до указанной в таблице. По данным таблицы видно, что удельная (массовая) теплоемкость оксидов металлов при увеличении их температуры также увеличивается.
Источники:
- Физические величины. Справочник. А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др.; Под ред. И. С. Григорьева, Е. З. Мейлихова. — М.: Энергоатомиздат, 1991. — 1232 с.
- Чиркин В. С. Теплофизические свойства материалов ядерной техники. М.: Атомиздат, 1967 — 474 с.
- Шелудяк Ю. Е., Кашпоров Л. Я. и др. Теплофизические свойства компонентов горючих систем. М.: 1992. — 184 с.
- Казанцев Е. И. Промышленные печи.
 Справочное руководство для расчетов и проектирования.
Справочное руководство для расчетов и проектирования.
Физические свойства оксидов. Распространенность в природе и использование оксидов. Влияние на окружающую среду и здоровье человека.
Тема: Физические свойства оксидов. Распространенность в природе и использование оксидов. Влияние на окружающую среду и здоровье человека.
Цель:
1) образовательная – познакомить учащихся с физическими свойствами оксидов, их распространением в природе и использованием, влияние на окружающую среду и здоровье человека;
2) воспитательная – воспитывать добросовестность, способность к преодоление трудностей, трудолюбие, экологическую культуру;
3) развивающая – развитие умения классифицировать неорганические вещества, составлять названия веществ по формуле и наоборот; развивать умение анализировать, сравнивать, выделять главное и делать выводы, устанавливать зависимость между составом и свойствами вещества; формировать самообразовательную, информативную и творческую компетентность.
Тип урока: комбинированный урок.
Оборудование: периодическая система химических элементов Д. И. Менделеева, компьютер, образцы оксидов как демонстрационный материал.
Демонстрации:
7. Образцы оксидов.
Ход урока
І. Организационный момент
Сегодняшний урок я хочу начать словами одного из самых выдающихся физиков XX века, лауреата Нобелевской премии Альберта Эйнштейна: Logic will get you from A to B. Imagination will take you anywhere. Логика может привести Вас от пункта А к пункту Б, а воображение – куда угодно…
Поэтому я всем вам желаю уверенности, добросовестного труда и успехов на сегодняшнем уроке.
На сегодняшнем уроке действует необычная система баллов. За правильные ответ вы будете получать не оценки, а вкусняшки.
ІІ. Проверка домашнего задания. Актуализация опорных знаний
А теперь, представьте: середина XIII века, старинный замок, а в нем разместилась огромная химическая лаборатория, в которой день и ночь работают выдающиеся алхимики того времени, и они позволили нам поработать в этом замке. Но, перед тем как отправиться в замок и начать там работу, мы должны убедиться, хватит ли у вас знаний. Давайте вспомним, что вы изучали на прошлых уроках.
1. Индивидуальное задание
Среди предложенных веществ выберите отдельно оксиды, кислоты, основания, соли и запишите их в соответствующие колонки таблицы:
К2O, H2S, CO, Fe(OH)2, Na2SО3, SO2, HNO3, Al2(SO4)3, ZnO, NaOH
Оксиды | Кислоты | Основания | Соли |
|
|
|
|
2. Беседа «Мозговой штурм»
Беседа «Мозговой штурм»
1. Распределите вещества на 2 группы. Какие особенности веществ вы для этого использовали?
Mg, O2, BaO, C, FeSO4, CuO, H2CO3, NaOH, Al, H2, Fe2O3.
2. Что такое простые вещества?
3. Как классифицируют простые вещества?
4. Что такое сложные вещества?
5. С какими сложными веществами вы встречались раньше?
6. Какие вещества называют оксидами?
ІІІ. Мотивация учебной деятельности
На дворе зима. Наш организм для повышения иммунитета нуждается в витамине С, то есть аскорбиновой кислоте, содержащейся в цитрусовых, шиповнике, смородине. В морозную погоду необходимо в свой рацион включить калорийные продукты такие как: мясо, рыбу, разнообразные супы и бульоны, но не забывайте к ним добавить натрий хлорид. Не злоупотребляйте газированными напитками, так как они негативно действуют на зубную эмаль и желудок . .. Наверняка вы догадались, что упомянутые мной соединения относятся к…(основным классам неорганических соединений). Но сегодня мы детальнее остановимся на одном из них. Запишите тему урока «Физические свойства оксидов. Распространенность в природе и использование оксидов. Влияние на окружающую среду и здоровье человека».
.. Наверняка вы догадались, что упомянутые мной соединения относятся к…(основным классам неорганических соединений). Но сегодня мы детальнее остановимся на одном из них. Запишите тему урока «Физические свойства оксидов. Распространенность в природе и использование оксидов. Влияние на окружающую среду и здоровье человека».
Цель:
На сегодняшнем уроке мы познакомимся с физическими свойствами оксидов, их распространением в природе и использованием, а также узнаем как они влияют на окружающую среду и здоровье человека. Мы будем воспитывать в себе экологическую культуру Будем развивать умения классифицировать неорганические вещества, составлять названия веществ по формуле и наоборот; развивать умение анализировать, сравнивать, выделять главное и делать выводы, устанавливать зависимость между составом и свойствами вещества;
ІV. Изучение нового материала
— Что такое оксиды? (Оксиды – это сложные вещества, состоящие из атомов двух химических элементов, один из которых – Оксиген).
— Какие типы химической связи в неорганических веществах вам известны?
— Какие типы кристаллических решеток вам известны?
— Каким образом свойства веществ зависят от типа кристаллической решетки?
Свойства оксидов, как и других веществ, зависят от их строения, то есть от того, из каких частиц они состоят (атомов, молекул, ионов).
В ионных оксидах противоположно заряженные ионы сильно притягиваются между собой, поэтому эти оксиды при обычных условиях являются твердыми, имеют высокую температуру плавления, большинство нерастворимые в воде, другие с ней реагируют.
Между молекулами притяжения очень слабое, поэтому оксиды с молекулярным строением характеризуются невысокими температурами плавления и кипения, различным агрегатным состоянием при обычных условиях, растворимости в воде, некоторые имеют запах.
Оксиды с атомной строением являются твердыми, с высокими температурами плавления и кипения, нерастворимые в воде.
Ионные оксиды (СаО, Na2O), молекулярные (H2O, SO2, CO2), атомные (SiO2).
Совместное составление опорной схемы.
1. Демонстрация образцов оксидов: CuO, Cr2O3, Fe2O3, SiО2, MnO2.
Сравните представлены образцы оксидов. Чем они отличаются?
По окраске (MnO2и CuO – черные, Fe2O3 – бурый, Cr2O3 – зеленый, SiО2 – темно-коричневый)
2. Использование и распространение оксидов (с. 154-155)
Работа в парах. Проработайте материал учебника «Использование и распространение оксидов» и установите соответствие.
1. Н2О
2. Al2O3
3. SiO2
4. CO2
CO2
5. SO2
6. NO2
7. Fe2O3
8. СаО
9. MgО
10. ZnO
А) Производство стекла.
В) Изготовление лекарственных препаратов;
Д) Содержится в воздухе в виде водяного пара;
Т) Образуется при извержений вулканов.
Ж) Для обработки металлических поверхностей;
И) Участвует в процессе фотосинтеза;
О) Причина возникновения кислотных дождей;
З) Изготовление ферромагнитных покрытий;
Э) Основа для изготовления белой краски.
Ь) Производство извести.
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
д | ж | а | и | т | о | з | ь | в | э |
3. Игра «Шифровальщик». Необходимо как можно быстрее расшифровать выражение о самом распространенном оксиде. Принцип шифрования – каждая цифра означает букву. Используйте для этого ответ из предыдущего задания.
Игра «Шифровальщик». Необходимо как можно быстрее расшифровать выражение о самом распространенном оксиде. Принцип шифрования – каждая цифра означает букву. Используйте для этого ответ из предыдущего задания.
9 | 6 | 1 | 3 | – | 10 | 5 | 6 |
| 2 | 4 | 7 | н | 8 | ! |
в | о | д | а | э | т | о | ж | и | з | ь |
Остановимся болем детально на этом оксиде. Так как вода нужна абсолютно всем живым существам – людям, животным, насекомым, растениям. Но больше всех используем воду мы – люди: не только для гигиены и приготовления пищи, но и для изготовления лекарств, производства различных вещей необходимых человеку. Без воды невозможно обойтись ни на одном предприятии – фабрике или заводе.
Но больше всех используем воду мы – люди: не только для гигиены и приготовления пищи, но и для изготовления лекарств, производства различных вещей необходимых человеку. Без воды невозможно обойтись ни на одном предприятии – фабрике или заводе.
Как видите без воды жизнь была бы невозможна.
Вы уже знаете что именно деятельность человека способствует загрязнению воды (отходы промышленных предприятий, плохие очистные сооружения, бытовой мусор, сточные воды, утечка нефти при добыче на берегах и с судов, ядохимикаты и минеральные удобрения, дождь смывает с полей). Поэтому именно человеку и нужно исправить это положение.
А сейчас время новостей! У нас прямое включение с телеканалом 1+1. Давайте послушаем, что нам подготовили корреспонденты.
4. Видео
5. Физкультминутка
А теперь перерыв, проведем спортивный химический диктант, который поможет проверить, насколько хорошо вы усвоили то, что мы изучали на сегодняшнем уроке.
Вопросы:
1. Если вода – это сложное вещество, то хлопните в ладоши. (Да)
Если вода – это сложное вещество, то хлопните в ладоши. (Да)
2. Если вода самое распространенное вещество на планете, топнете ногой. (Да)
3. Если карбон(IV) оксид выделяется в атмосферу в результате дыхания организмов, подморгните. (Да)
4. Если силиций(IV) оксид содержится в воздухе в виде пара, взмахните руками. (Нет)
5. Если магний оксид используют для изготовления лекарственных препаратов, пожмите руку своему соседу. (Да)
6. Если алюминий оксид причина возникновения кислотных дождей, закройте правый глаз ладонью. (Нет)
7. Если нитроген(IV) оксид образуется при извержении вулканов, во время грозы и в результате техногенной деятельности, то помашите нашим гостям левой рукой. (Да)
V. Обобщение и систематизация знаний
1. Письмо с Новой почты:
1. Карбон (II) оксид известный в народе как угарный газ. Он блокирует действие гемоглобина, вызывая удушье. Где будет размещаться угарный газ в помещении. Ответ подтвердите расчетами.
Ответ подтвердите расчетами.
Mr(воздуха)=29
Mr(СО)=28
2. Рубин издавна считается классическим ювелирным камнем и решается в каратах. Наибольший ювелирный рубин имел массу 400 каратов (1 карат-0,2 г). Определите массу алюминия, который находился в данном рубине.
2. QR-код. Запишите химические формулы оксидов, исторические названия которых:
негашеная известь,
«сухой лед»,
угарный газ,
углекислый газ.
Дайте им научные названия.
Оксид кальция (окись кальция, негашёная известь) – белое кристаллическое вещество, формула CaO. CaO еще называют – «кипелка». Именно отсюда вошло в обиход понятие «кипельно белый цвет», что значит белее белого. Такой цвет имеет негашеная известь, которая буквально «кипит» при взаимодействии с водой, выделяя при этом большое количество тепла.
«Сухой лёд» – твёрдый карбон (ІV) оксид CO2, при обычных условиях (атмосферном давлении и комнатной температуре) переходящий в газообразное состояние, минуя жидкую фазу. По внешнему виду напоминает лёд (отсюда название).
По внешнему виду напоминает лёд (отсюда название).
Карбон(II) оксид – (угарный газ, окись углерода, оксид углерода(II)) – бесцветный чрезвычайно токсичный газ без вкуса и запаха, легче воздуха (при нормальных условиях). Химическая формула – CO.
Карбон(IV) оксид (диоксид углерода или двуокись углерода, также углекислый газ, углекислота, оксид углерода(IV), угольный ангидрид) – бесцветный газ (в нормальных условиях), почти без запаха (в больших концентрациях с кисловатым «содовым» запахом), с химической формулой CO2.
3. «Химическая ловушка»
ТБ – Ты в химкабинет пришел,
Так запомни, кроха
Безопасность хорошо!
Быть безруким плохо!
Если ты во все подряд
окунаешь пальчик,
Про такого говорят:
«Бестолковый мальчик!»
Если пробуешь на вкус
Ты все непременно,
Может, мальчик, ты не трус,
Но глупец отменный!
Не подумайте, что я
С мальчиками строже:
Что мальчишкам здесь нельзя
И девчонкам тоже!
1. Как вы думаете, можно ли потушить пожар силой мысли?
Как вы думаете, можно ли потушить пожар силой мысли?
NaHCO3 + CH3COOH = CH3COONa + CO2 + H2O
Применение углекислого газа особенно востребовано в системах пожаротушения. Он заполняется в углекислотные газовые огнетушители и при возгорании позволяет изолировать очаг пожара от источника кислорода. Горение не может долго продолжаться без подпитки воздухом, а газификация углекислотой не даст ему проникнуть к огню.
2. (NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
Реакция термического разложения дихромата аммония с образованием азота, хром(III) оксида и воды. Реакция протекает при температуре 168-185°C.
Лабораторный метод получения азота – «Вулкан Беттгера»
VI. Домашнее задание
1. 1-6 баллов – §29, с. 153-156 прочитать, с. 157 №5, 7
157 №5, 7
2. 7-9 баллов – подготовится к диспуту «Влияние оксидов на окружающую среду и здоровье человека»:
І вариант – положительное влияние оксидов;
ІІ вариант – негативное влияние оксидов.
3. 10-12 баллов – «Химическая ловушка» – придумать рекламу хром(ІІІ) оксида.
VII. Подведение итогов урока
Я желаю, чтобы хорошее настроение не покидало вас. А для этого:
— Ешьте бананы. В их мякоти содержатся вещества, благодаря которым возникает чувство радости и спокойствия. Это происходит благодаря входящему в состав бананов триптофану, который преобразуется в организме в серотонин. А серотонин известен, в первую очередь, тем, что расслабляет, повышает настроение и заставляет человека чувствовать себя счастливее.
— Ешьте апельсины. Они стабилизируют настроение, устраняют депрессию, печаль, тревогу.
— И, конечно, шоколад. Он улучшает настроение и успокаивает «исстрадавшуюся» нервную систему. Организм реагирует на сладкое лакомство усиленной выработкой гормонов счастья (серотонина) и эндорфинов (которые снимают психологическое напряжение и боль).
Организм реагирует на сладкое лакомство усиленной выработкой гормонов счастья (серотонина) и эндорфинов (которые снимают психологическое напряжение и боль).
— Старайтесь смотреть на вещи оптимистично. УЛЫБАЙТЕСЬ! Учителя, которые улыбаются и которым улыбаются, живут на 4 года дольше!
Дополнительное задание 1. Составьте уравнение реакций горения магния, лития и углерода в кислороде. Укажите названия полученных оксидов.
2.2.2.12. Химия / КонсультантПлюс
В системе естественнонаучного образования химия как учебный предмет занимает важное место в познании законов природы, формировании научной картины мира, создании основы химических знаний, необходимых для повседневной жизни, навыков здорового и безопасного для человека и окружающей его среды образа жизни, а также в воспитании экологической культуры.
Успешность изучения химии связана с овладением химическим языком, соблюдением правил безопасной работы при выполнении химического эксперимента, осознанием многочисленных связей химии с другими предметами школьного курса.
Программа включает в себя основы неорганической и органической химии. Главной идеей программы является создание базового комплекса опорных знаний по химии, выраженных в форме, соответствующей возрасту обучающихся.
В содержании данного курса представлены основополагающие химические теоретические знания, включающие изучение состава и строения веществ, зависимости их свойств от строения, прогнозирование свойств веществ, исследование закономерностей химических превращений и путей управления ими в целях получения веществ и материалов.
Теоретическую основу изучения неорганической химии составляет атомно-молекулярное учение, Периодический закон Д.И. Менделеева с краткими сведениями о строении атома, видах химической связи, закономерностях протекания химических реакций.
В изучении курса значительная роль отводится химическому эксперименту: проведению практических и лабораторных работ, описанию результатов ученического эксперимента, соблюдению норм и правил безопасной работы в химической лаборатории.
Реализация данной программы в процессе обучения позволит обучающимся усвоить ключевые химические компетенции и понять роль и значение химии среди других наук о природе.
Изучение предмета «Химия» в части формирования у обучающихся научного мировоззрения, освоения общенаучных методов (наблюдение, измерение, эксперимент, моделирование), освоения практического применения научных знаний основано на межпредметных связях с предметами: «Биология», «География», «История», «Литература», «Математика», «Основы безопасности жизнедеятельности», «Русский язык», «Физика», «Экология».
Первоначальные химические понятия
Предмет химии. Тела и вещества. Основные методы познания: наблюдение, измерение, эксперимент. Физические и химические явления. Чистые вещества и смеси. Способы разделения смесей. Атом. Молекула. Химический элемент. Знаки химических элементов. Простые и сложные вещества. Валентность. Закон постоянства состава вещества. Химические формулы. Индексы. Относительная атомная и молекулярная массы. Массовая доля химического элемента в соединении. Закон сохранения массы веществ. Химические уравнения. Коэффициенты. Условия и признаки протекания химических реакций. Моль — единица количества вещества. Молярная масса.
Относительная атомная и молекулярная массы. Массовая доля химического элемента в соединении. Закон сохранения массы веществ. Химические уравнения. Коэффициенты. Условия и признаки протекания химических реакций. Моль — единица количества вещества. Молярная масса.
Кислород. Водород
Кислород — химический элемент и простое вещество. Озон. Состав воздуха. Физические и химические свойства кислорода. Получение и применение кислорода. Тепловой эффект химических реакций. Понятие об экзо- и эндотермических реакциях. Водород — химический элемент и простое вещество. Физические и химические свойства водорода. Получение водорода в лаборатории. Получение водорода в промышленности. Применение водорода. Закон Авогадро. Молярный объем газов. Качественные реакции на газообразные вещества (кислород, водород). Объемные отношения газов при химических реакциях.
Вода. Растворы
Вода в природе. Круговорот воды в природе. Физические и химические свойства воды. Растворы. Растворимость веществ в воде. Концентрация растворов. Массовая доля растворенного вещества в растворе.
Растворы. Растворимость веществ в воде. Концентрация растворов. Массовая доля растворенного вещества в растворе.
Основные классы неорганических соединений
Оксиды. Классификация. Номенклатура. Физические свойства оксидов. Химические свойства оксидов. Получение и применение оксидов. Основания. Классификация. Номенклатура. Физические свойства оснований. Получение оснований. Химические свойства оснований. Реакция нейтрализации. Кислоты. Классификация. Номенклатура. Физические свойства кислот. Получение и применение кислот. Химические свойства кислот. Индикаторы. Изменение окраски индикаторов в различных средах. Соли. Классификация. Номенклатура. Физические свойства солей. Получение и применение солей. Химические свойства солей. Генетическая связь между классами неорганических соединений. Проблема безопасного использования веществ и химических реакций в повседневной жизни. Токсичные, горючие и взрывоопасные вещества. Бытовая химическая грамотность.
Бытовая химическая грамотность.
Строение атома. Периодический закон и периодическая система химических элементов Д.И. Менделеева
Строение атома: ядро, энергетический уровень. Состав ядра атома: протоны, нейтроны. Изотопы. Периодический закон Д.И. Менделеева. Периодическая система химических элементов Д.И. Менделеева. Физический смысл атомного (порядкового) номера химического элемента, номера группы и периода периодической системы. Строение энергетических уровней атомов первых 20 химических элементов периодической системы Д.И. Менделеева. Закономерности изменения свойств атомов химических элементов и их соединений на основе положения в периодической системе Д.И. Менделеева и строения атома. Значение Периодического закона Д.И. Менделеева.
Строение веществ. Химическая связь
Электроотрицательность атомов химических элементов. Ковалентная химическая связь: неполярная и полярная. Понятие о водородной связи и ее влиянии на физические свойства веществ на примере воды. Ионная связь. Металлическая связь. Типы кристаллических решеток (атомная, молекулярная, ионная, металлическая). Зависимость физических свойств веществ от типа кристаллической решетки.
Ионная связь. Металлическая связь. Типы кристаллических решеток (атомная, молекулярная, ионная, металлическая). Зависимость физических свойств веществ от типа кристаллической решетки.
Химические реакции
Понятие о скорости химической реакции. Факторы, влияющие на скорость химической реакции. Понятие о катализаторе. Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ; изменению степеней окисления атомов химических элементов; поглощению или выделению энергии. Электролитическая диссоциация. Электролиты и неэлектролиты. Ионы. Катионы и анионы. Реакции ионного обмена. Условия протекания реакций ионного обмена. Электролитическая диссоциация кислот, щелочей и солей. Степень окисления. Определение степени окисления атомов химических элементов в соединениях. Окислитель. Восстановитель. Сущность окислительно-восстановительных реакций.
Неметаллы IV — VII групп и их соединения
Положение неметаллов в периодической системе химических элементов Д. И. Менделеева. Общие свойства неметаллов. Галогены: физические и химические свойства. Соединения галогенов: хлороводород, хлороводородная кислота и ее соли. Сера: физические и химические свойства. Соединения серы: сероводород, сульфиды, оксиды серы. Серная, сернистая и сероводородная кислоты и их соли. Азот: физические и химические свойства. Аммиак. Соли аммония. Оксиды азота. Азотная кислота и ее соли. Фосфор: физические и химические свойства. Соединения фосфора: оксид фосфора (V), ортофосфорная кислота и ее соли. Углерод: физические и химические свойства. Аллотропия углерода: алмаз, графит, карбин, фуллерены. Соединения углерода: оксиды углерода (II) и (IV), угольная кислота и ее соли. Кремний и его соединения.
И. Менделеева. Общие свойства неметаллов. Галогены: физические и химические свойства. Соединения галогенов: хлороводород, хлороводородная кислота и ее соли. Сера: физические и химические свойства. Соединения серы: сероводород, сульфиды, оксиды серы. Серная, сернистая и сероводородная кислоты и их соли. Азот: физические и химические свойства. Аммиак. Соли аммония. Оксиды азота. Азотная кислота и ее соли. Фосфор: физические и химические свойства. Соединения фосфора: оксид фосфора (V), ортофосфорная кислота и ее соли. Углерод: физические и химические свойства. Аллотропия углерода: алмаз, графит, карбин, фуллерены. Соединения углерода: оксиды углерода (II) и (IV), угольная кислота и ее соли. Кремний и его соединения.
Металлы и их соединения
Положение металлов в периодической системе химических элементов Д.И. Менделеева. Металлы в природе и общие способы их получения. Общие физические свойства металлов. Общие химические свойства металлов: реакции с неметаллами, кислотами, солями. Электрохимический ряд напряжений металлов. Щелочные металлы и их соединения. Щелочноземельные металлы и их соединения. Алюминий. Амфотерность оксида и гидроксида алюминия. Железо. Соединения железа и их свойства: оксиды, гидроксиды и соли железа (II и III).
Электрохимический ряд напряжений металлов. Щелочные металлы и их соединения. Щелочноземельные металлы и их соединения. Алюминий. Амфотерность оксида и гидроксида алюминия. Железо. Соединения железа и их свойства: оксиды, гидроксиды и соли железа (II и III).
Первоначальные сведения об органических веществах
Первоначальные сведения о строении органических веществ. Углеводороды: метан, этан, этилен. Источники углеводородов: природный газ, нефть, уголь. Кислородсодержащие соединения: спирты (метанол, этанол, глицерин), карбоновые кислоты (уксусная кислота, аминоуксусная кислота, стеариновая и олеиновая кислоты). Биологически важные вещества: жиры, глюкоза, белки. Химическое загрязнение окружающей среды и его последствия.
Типы расчетных задач:
1. Вычисление массовой доли химического элемента по формуле соединения.
Установление простейшей формулы вещества по массовым долям химических элементов.
2. Вычисления по химическим уравнениям количества, объема, массы вещества по количеству, объему, массе реагентов или продуктов реакции.
3. Расчет массовой доли растворенного вещества в растворе.
Примерные темы практических работ:
1. Лабораторное оборудование и приемы обращения с ним. Правила безопасной работы в химической лаборатории.
2. Очистка загрязненной поваренной соли.
3. Признаки протекания химических реакций.
4. Получение кислорода и изучение его свойств.
5. Получение водорода и изучение его свойств.
6. Приготовление растворов с определенной массовой долей растворенного вещества.
7. Решение экспериментальных задач по теме «Основные классы неорганических соединений».
8. Реакции ионного обмена.
9. Качественные реакции на ионы в растворе.
10. Получение аммиака и изучение его свойств.
11. Получение углекислого газа и изучение его свойств.
12. Решение экспериментальных задач по теме «Неметаллы IV — VII групп и их соединений».
13. Решение экспериментальных задач по теме «Металлы и их соединения».
Оксиды. Классификация оксидов. Названия оксидов
Оксиды — это сложные неорганические соединения, состоящие из двух элементов, один из которых кислород (в степени окисления -2).
Например, Na2O, B2O3, Cl2O7 относятся к оксидам. Все перечисленные вещества содержат кислород и еще один элемент. Вещества Na2O2, H2SO4, HCl не относятся к оксидам: в первом степень окисления кислорода равна -1, в составе второго не два, а три элемента, а третье вообще не содержит кислорода.
Если вы не понимаете смысл термина «степень окисления», ничего страшного. Во-первых, можно обратиться к соответствующей статье на этом сайте. Во-вторых, даже без понимания этого термина можно продолжать чтение. Временно можете забыть про упоминание о степени окисления.
Получены оксиды практически всех известных на сегодняшний день элементов, кроме некоторых благородных газов и «экзотических» трансурановых элементов. Более того, многие элементы образуют несколько оксидов (для азота, например, их известно шесть).
Более того, многие элементы образуют несколько оксидов (для азота, например, их известно шесть).
Номенклатура оксидов
Мы должны научиться называть оксиды. Это очень просто.Пример 1. Назовите следующие соединения: Li2O, Al2O3, N2O5, N2O3.
Li2O — оксид лития,
Al2O3 — оксид алюминия,
N2O5 — оксид азота (V),
N2O3 — оксид азота (III).
Обратите внимание на важный момент: если валентность элемента постоянна, мы НЕ упоминаем ее в названии оксида. Если валентность меняется, следует обязательно указать ее в скобках! Литий и алюминий имеют постоянную валентность, у азота валентность переменная; именно по этой причине названия окислов азота дополнены римскими цифрами, символизирующими валентность.
Задание 1. Назовите оксиды: Na2O, P2O3, BaO, V2O5, Fe2O3, GeO2, Rb2O. Не забывайте, что существуют элементы как с постоянной, так и с переменной валентностью.
Не забывайте, что существуют элементы как с постоянной, так и с переменной валентностью.
Еще один важный момент: вещество F2O правильнее называть не «оксид фтора», а «фторид кислорода»!
Физические свойства оксидов
Физические свойства весьма разнообразны. Обусловлено это, в частности, тем, что в оксидах могут проявляться разные типы химической связи. Температуры плавления и кипения варьируются в широких пределах. При нормальных условиях оксиды могут находиться в твердом состоянии (CaO, Fe2O3, SiO2, B2O3), жидком состоянии (N2O3, H2O), в виде газов (N2O, SO2, NO, CO).
Разнообразна окраска: MgO и Na2O белого цвета, CuO — черного, N2O3 — синего, CrO3 — красного и т. д.
Расплавы оксидов с ионным типом связи хорошо проводят электрический ток, ковалентные оксиды, как правило, имеют низкую электропроводность.
Классификация оксидов
Все существующие в природе оксиды можно разделить на 4 класса: основные, кислотные, амфотерные и несолеобразующие. Иногда первые три класса объединяют в группу солеобразующих оксидов, но для нас это сейчас несущественно. Химические свойства оксидов из разных классов отличаются весьма сильно, поэтому вопрос классификации очень важен для дальнейшего изучения этой темы!
Начнем с несолеобразующих оксидов. Их нужно запомнить: NO, SiO, CO, N2O. Просто выучите эти четыре формулы!
Для дальнейшего продвижения мы должны вспомнить, что в природе существуют два типа простых веществ — металлы и неметаллы (иногда выделяют еще группу полуметаллов или металлоидов). Если вы четко понимаете, какие элементы относятся к металлам, продолжайте читать эту статью. Если есть малейшие сомнения, обратитесь к материалу «Металлы и неметаллы» на этом сайте.
Итак, сообщаю вам, что все амфотерные оксиды являются оксидами металлов, но не все оксиды металлов относятся к амфотерным. Я перечислю наиболее важные из них: BeO, ZnO, Al2O3, Cr2O3, SnO. Список не является полным, но перечисленные формулы следует обязательно запомнить! В большинстве амфотерных оксидов металл проявляет степень окисления +2 или +3 (но есть исключения).
Я перечислю наиболее важные из них: BeO, ZnO, Al2O3, Cr2O3, SnO. Список не является полным, но перечисленные формулы следует обязательно запомнить! В большинстве амфотерных оксидов металл проявляет степень окисления +2 или +3 (но есть исключения).
В следующей части статьи мы продолжим говорить о классификации; обсудим кислотные и основные оксиды.
Продолжение статьи →
Физические и химические свойства оксидов?
РЕШЕНИЕ
Физические и химические свойства оксидов очень отличаются. При комнатной температуре большинство оксидов являются твердыми веществами, например, меди (II) оксид CuO черного цвета, кальций оксид CaO белого цвета, хром (III) оксид Cr2O3 темно-зеленого цвета. Некоторые оксиды являются жидкостями, например, водород оксид (вода h3O и Cl2O7 являются бесцветными жидкостями, а некоторые — газообразными веществами, например карбон (IV) оксид CO2 является газом без цвета, а азот (IV) оксид NO2 являются бурым газом. Некоторые оксиды являются веществами с молекулярным строением, другие имеют ионную строение
Некоторые оксиды являются веществами с молекулярным строением, другие имеют ионную строение
Физические и химические свойства оксидов
Физические и химические свойства оксидов очень отличаются. При комнатной температуре большинство оксидов являются твердыми веществами, например, меди (II) оксид CuO черного цвета, кальций оксид CaO белого цвета, хром (III) оксид Cr2O3 темно-зеленого цвета. Некоторые оксиды являются жидкостями, например, водород оксид (вода h3O и Cl2O7 являются бесцветными жидкостями, а некоторые — газообразными веществами, например карбон (IV) оксид CO2 является газом без цвета, а азот (IV) оксид NO2 являются бурым газом. Некоторые оксиды являются веществами с молекулярным строением, другие имеют ионную строение.
Основные и кислотные оксиды проявляют разные свойства. Основные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, с кислотами. С водой непосредственно реагируют оксиды щелочных металлов (оксиды лития, натрия, калия, рубидия и цезия и окислы щелочноземельных металлов (оксиды кальция, стронция и бария. Рассмотрим примеры уравнений типовых химических реакций, которые подтвержт указанные свойства основных оксидов.
Рассмотрим примеры уравнений типовых химических реакций, которые подтвержт указанные свойства основных оксидов.
1. Взаимодействие основного оксида с кислотным оксидом с образованием соли
CaO + SiO2 CaSiO3
2. Взаимодействие основного оксида с амфотерными оксидом с образованием соли
Na2O + Al2O3 2NaAlO2
3. Взаимодействие основного оксида с водой с образованием основания:
BaO + h3O = Ba (OH) 2
4. Взаимодействие основного оксида с кислотой с образованием соли и воды:
MgO + 2HCl = MgCl2 + h3O
Кислотные оксиды могут вступать в реакции с основными и амфотерными оксидами, с растворимыми в воде основаниями (щелочами. Многие кислотных оксидов взаимодействуют с водой (исключением является кремний (IV) оксид SiO2. Рассмотрим примеры уравнений типовых химических реакций, которые подтвержт указанные свойства кислотных оксидов.
1. Взаимодействие кислотного оксида с основным оксидом с образованием соли
CO2 + Na2O = Na2CO3
2. Взаимодействие кислотного оксида с амфотерными оксидом с образованием соли
SO3 + ZnO = ZnSO4
3. Взаимодействие кислотного оксида с водой с образованием кислоты:
Взаимодействие кислотного оксида с водой с образованием кислоты:
P2O5 + 3h3O = 2h4PO4
4. Взаимодействие кислотного оксида со щелочью с образованием соли и воды:
SO2 + 2KOH = K2SO3 + h3O
Амфотерными оксидам присущи свойства как основных, так и кислотных оксидов. То есть они могут реагировать как с кислотными, так и с основными оксидами с образованием солей. Кроме того, амфотерные оксиды могут взаимодействовать как с кислотами, так и со щелочами с образованием солей и воды. Например:
ZnO + h3SO4 = ZnSO4 + h3O
Оксид калия | справочник Пестициды.ru
Информация
Традиционно содержание Калия в удобрениях выражают содержанием Оксида калия. Все свойства Калия, как питательного элемента описаны в статье Калий.
Подробнее »
Химические и физические свойства
Оксид калия – твердое кристаллическое вещество, образующее бесцветные кристаллы. Имеет две устойчивые кристаллические модификации: кубическую (до 372°С) и гексагональную (выше 372°С).
Имеет две устойчивые кристаллические модификации: кубическую (до 372°С) и гексагональную (выше 372°С).
- Температура плавления – 740°С.
- Плотность – 2,32 г/см3.
Оксид калия на воздухе расплавляется и, поглощая CO2, дает K2CO3. Бурно взаимодействует с водой с образованием КОН. Реагирует с эфиром и спиртом.
При температуре 250°С вступает в реакцию с H2. При этом образуются КОН. При этой же температуре взаимодействует с NH3, образуя КОН и KNH2.
Трехмерная модель молекулыТрехмерная модель молекулы
Энергично вступает в реакции взаимодействия с галогенами, расплавленной серой, различными кислотами. При нагревании с оксидами бора, алюминия, кремния образует соответственно бораты, алюминаты и полисиликаты.
При нагревании с NO2 образуется смесь KNO3 и KNO2.
Оксид калия получают:
- Нагреванием К с твердыми КОН, K2O2, KNO2. Например, 2KNO2+ 6К → 4К2O+ N2.
- При нагревании смеси KN3 и KNO2. 3KN3 + KNO2 → 2K2O + 5N2
- Окислением K, растворенного в жидком аммиаке, кислородом. 2K + O2 → 2K2O[3]
Содержание оксида калия в почве и удобрениях
Доступность калия для растений зависит от формы доступности калия в почве. Катионы ППК и водорастворимые соединения калия являются основными источниками калийного питания растений. В этой связи степень обеспеченности почвы калием для нужд питания растений выражают содержанием в подвижной форме и через оксид калия K2O. Эта величина обозначает суммарное количество обменного и водорастворимого кальция в мг/кг почвы. [1]
[1]
Удобрения содержат различное количество оксида калия. Например, хлористый калий включает в себя 57–60 % калия в пересчете на K2O. Фиксированный почвой калий из удобрений доступен для растений. При этом степень его доступности тем выше, чем больше его фиксировано почвой.[2]
Калийные удобрения отличаются высокой растворимостью в воде. При внесении в почву они быстро растворяются и на основании обменных реакций вступают во взаимодействие с ППК. Часть калия удобрений переходит в необменные фиксированные почвенные соединения.[2]
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Оксид натрия | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Оксид натрия
Номер продукта: Все применимые коды продуктов American Elements, например. NA-OX-80
Номер CAS: 1313-59-3
Соответствующие установленные области применения вещества: Научные исследования и разработки
Данные о поставщике:
Los Angeles Weburn 908847 10 , CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка: +1 800-424-9300
Международный: +1 703 -527-3887
РАЗДЕЛ 2.ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси в соответствии с 29 CFR 1910 (OSHA HCS)
GHS05 Коррозия
Skin Corr. 1B h414 Вызывает серьезные ожоги кожи и повреждения глаз.
Глазная плотина. 1 ч418 Вызывает серьезное повреждение глаз.
Опасности, не классифицированные иначе Нет данных
Элементы маркировки СГС, включая меры предосторожности
Пиктограммы опасности
GHS05
Сигнальное слово Опасно
Краткая характеристика опасности
h414 Вызывает серьезные ожоги кожи и повреждения глаз.
Меры предосторожности
P260 Не вдыхать пыль/дым/газ/туман/пары/аэрозоль.
P303+P361+P353 При попадании на кожу (или волосы): Немедленно снять всю загрязненную одежду. Промойте кожу водой/душем.
P305+P351+P338 ПРИ ПОПАДАНИИ В ГЛАЗА: Осторожно промывать глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскать.
P301+P330+P331 ПРИ ПРОГЛАТЫВАНИИ: прополоскать рот. Не вызывает рвоту.
P405 Магазин заперт.
P501 Утилизируйте содержимое/контейнер в соответствии с местными/региональными/национальными/международными нормами.
Классификация WHMIS
D2B — Токсичный материал, вызывающий другие токсические эффекты
E — Коррозионный материал (острые эффекты) = 3
Воспламеняемость = 0
Физическая опасность = 2
Прочие опасности
Результаты оценки PBT и vPvB
PBT: н/д
vPvB: н/д
РАЗДЕЛ 3.
 СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ6 Вещества
№ CAS/ Название вещества:
1313-59-3 Оксид натрия
Идентификационный номер(а):
Номер ЕС: 215-208-9
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Описание мер первой помощи
Общая информация Немедленно удалить все одежда, испачканная продуктом.
При вдыхании:
Обеспечить пациента свежим воздухом. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь к врачу.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь к врачу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Проконсультируйтесь с врачом.
При проглатывании:
Обратиться за медицинской помощью.
Информация для врача
Наиболее важные симптомы и эффекты, как острые, так и замедленные
Вызывает сильные ожоги кожи.
Вызывает серьезные повреждения глаз.
Указание на необходимость немедленной медицинской помощи и специального лечения:
Данные отсутствуют
РАЗДЕЛ 5. ПРОТИВОПОЖАРНЫЕ МЕРЫ
Средства пожаротушения
Подходящие средства пожаротушения CO2, песок, огнетушащий порошок.Не используйте воду.
Неподходящие средства пожаротушения из соображений безопасности Вода
Особые опасности, связанные с веществом или смесью
Бурно реагирует с водой
Если этот продукт возникнет при пожаре, могут быть высвобождены следующие вещества:
Рекомендации для пожарных
содержал респиратор.
Носите полностью защитный непроницаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры предосторожности для персонала, защитное снаряжение и порядок действий в чрезвычайных ситуациях
Использовать средства индивидуальной защиты.Держите незащищенных людей подальше.
Обеспечьте достаточную вентиляцию.
Меры предосторожности по охране окружающей среды: Не допускайте попадания материала в окружающую среду без официального разрешения.
Методы и материалы для локализации и очистки:
Использовать нейтрализующий агент.
Утилизировать загрязненный материал как отходы в соответствии с разделом 13.
Обеспечить достаточную вентиляцию.
Не смывать водой или моющими средствами на водной основе.
Предотвращение вторичных опасностей: Никаких специальных мер не требуется.
Ссылка на другие разделы
См. Раздел 7 для информации о безопасном обращении
См. Раздел 8 для информации о средствах индивидуальной защиты.
Информацию об утилизации см. в Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Работать под сухим защитным газом.
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Обеспечьте хорошую вентиляцию на рабочем месте.
Информация о защите от взрывов и пожаров: данные отсутствуют
Условия безопасного хранения, включая любые несовместимости
Требования, которым должны удовлетворять складские помещения и емкости: Особых требований нет.
Информация о хранении в одном общем хранилище:
Не хранить вместе с кислотами.
Хранить вдали от воздуха.
Хранить вдали от воды/влаги.
Дополнительная информация об условиях хранения:
Хранить в сухом инертном газе.
Этот продукт чувствителен к влаге.
Этот продукт чувствителен к воздействию воздуха.
Беречь от влаги и воды.
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в хорошо закрытых контейнерах.
Особое конечное использование (я) Нет данных
РАЗДЕЛ 8.КОНТРОЛЬ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация о конструкции технических систем:
Правильно работающий химический вытяжной шкаф, предназначенный для опасных химикатов и имеющий среднюю скорость не менее 100 футов в минуту.
Параметры управления
Компоненты с предельными значениями, требующими контроля на рабочем месте:
Нет.
Дополнительная информация: Нет данных
Средства контроля воздействия
Средства индивидуальной защиты
Соблюдайте стандартные меры защиты и гигиены при обращении с химическими веществами.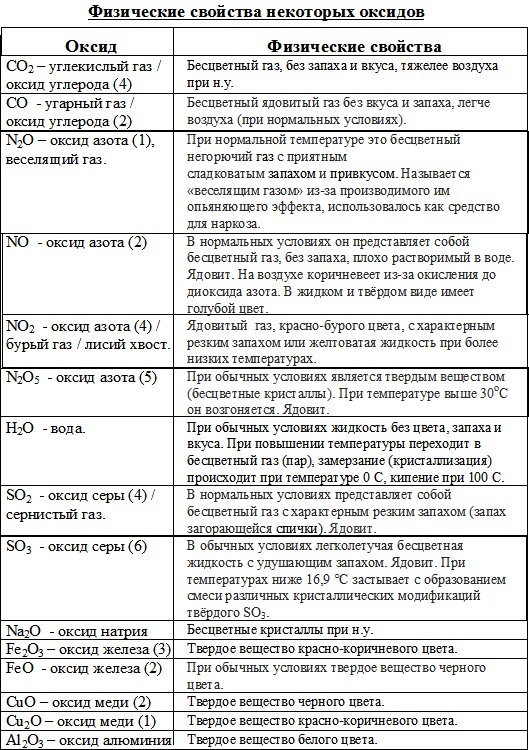
Хранить вдали от пищевых продуктов, напитков и кормов.
Немедленно снимите всю испачканную и загрязненную одежду.
Мыть руки перед перерывами и по окончании работы.
Избегать контакта с глазами и кожей.
Поддерживайте эргономически подходящую рабочую среду.
Дыхательное оборудование: Используйте подходящий респиратор при наличии высоких концентраций.
Защита рук:
Непроницаемые перчатки
Проверяйте перчатки перед использованием. №
Выбор подходящих перчаток зависит не только от материала, но и от качества.Качество будет варьироваться от производителя к производителю.
Время проникновения материала перчаток (в минутах) Данные отсутствуют
Защита глаз:
Плотно прилегающие защитные очки
Полная защита лица
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физических и химических свойствах
Внешний вид:
Форма: Порошок, шарики или твердое вещество в различных формах
Цвет: от белого до серого
Запах: Без запаха
Порог запаха: Нет данных доступный.
pH: неприменимо
Точка плавления/диапазон плавления: >400 °C (>752 °F) (разл.)
Точка/диапазон кипения: данные отсутствуют газа) Данные отсутствуют.
Температура воспламенения: Данные отсутствуют.
Температура разложения: Данные отсутствуют.
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: Данные отсутствуют
Верхний: Данные отсутствуют
Давление паров: Н/Д
Плотность при 20 °C (68 °F): 2.27 г/см 3 (18,943 фунта/гал)
Относительная плотность Данные отсутствуют.
Плотность паров Н/Д
Скорость испарения Н/Д
Растворимость в / Смешиваемость с
Вода: Реагирует бурно
Коэффициент распределения (н-октанол/вода): Данные отсутствуют.
Вязкость:
Динамическая: Н/Д
Кинематика: Н/Д
Другая информация Данные отсутствуют
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность Бурно реагирует с водой.
Химическая стабильность Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать: Разложение не происходит, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций Реагирует бурно с водой
Условия, которых следует избегать Нет данных
Несовместимые материалы:
Кислоты
Воздух
Вода/влага
Опасные продукты разложения: Оксид углерода и диоксид углерода
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
токсикологические эффекты
Острая токсичность: Проглатывание вызывает сильное разъедающее действие на рот и горло и опасность перфорации пищевода и желудка.
Значения LD/LC50, важные для классификации: Нет данных
Раздражение или коррозия кожи: Вызывает сильные ожоги кожи.
Раздражение или коррозия глаз: Вызывает серьезное повреждение глаз.
Сенсибилизация: Сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевых клеток: Эффекты неизвестны.

Канцерогенность: Данные классификации канцерогенных свойств этого материала от EPA, IARC, NTP, OSHA или ACGIH отсутствуют.
Репродуктивная токсичность: Эффекты неизвестны.
Специфическая токсичность для системы органов-мишеней — многократное воздействие: Эффекты неизвестны.
Специфическая токсичность для системы органов-мишеней — однократное воздействие: Эффекты неизвестны.
Опасность при вдыхании: Эффекты неизвестны.
От подострой до хронической токсичности: Эффекты неизвестны.
Дополнительная токсикологическая информация: Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Акватоксичность: данные отсутствуют
Стойкость и способность к разложению данные отсутствуют
Потенциал биоаккумуляции данные отсутствуют
Подвижность в почве данные отсутствуют выпущены в окружающую среду без официальных разрешений.
Не допускайте попадания неразбавленного продукта или больших количеств в грунтовые воды, водотоки или канализационные системы.
Избегайте попадания в окружающую среду.
Результаты оценки PBT и vPvB
PBT: н/д
vPvB: н/д
Другие неблагоприятные воздействия Данные отсутствуют
РАЗДЕЛ 13. РЕКОМЕНДАЦИИ ПО УТИЛИЗАЦИИ
Методы обработки отходов
Рекомендация Для обеспечения надлежащей утилизации обратитесь к официальным правилам.
Неочищенная упаковка:
Рекомендация: Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, IMDG, IATA UN1825
Надлежащее отгрузочное наименование ООН
DOT Монооксид натрия
IMDG, IATA SODIUM MONOXIDE
Класс(ы) опасности при транспортировке 5 007 Коррозионные вещества 8 DOT 9000
Этикетка 8
Класс 8 (C6) Коррозионные вещества
Этикетка 8
IMDG, IATA
Класс 8 Коррозионные вещества.
Этикетка 8
Группа упаковки
DOT, IMDG, IATA II
Опасность для окружающей среды: N/A
Особые меры предосторожности для пользователя Предупреждение: Коррозионные вещества
Номер EMS: FA,SB
Группы разделения Щелочи
Транспортировка навалом в соответствии с Приложением II к MARPOL73 /78 и Код IBC N/A
Транспорт/Дополнительная информация:
DOT
Загрязнитель морской среды (DOT): №
«Модельный регламент ООН»: UN1825, Монооксид натрия, 8, II
РАЗДЕЛ 15.
 НОРМАТИВНАЯ ИНФОРМАЦИЯ
НОРМАТИВНАЯ ИНФОРМАЦИЯ Правила безопасности, охраны здоровья и окружающей среды/законодательные акты, относящиеся к веществу или смеси
Элементы маркировки СГС, включая меры предосторожности
Пиктограммы опасности
GHS05
Сигнальное слово Опасно
Краткая характеристика опасности
h414 Вызывает серьезные ожоги кожи и повреждение глаз.
Меры предосторожности
P260 Не вдыхать пыль/дым/газ/туман/пары/аэрозоль.
P303+P361+P353 При попадании на кожу (или волосы): Немедленно снять всю загрязненную одежду.Промойте кожу водой/душем.
P305+P351+P338 ПРИ ПОПАДАНИИ В ГЛАЗА: Осторожно промывать глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскать.
P301+P330+P331 ПРИ ПРОГЛАТЫВАНИИ: прополоскать рот. Не вызывает рвоту.
P405 Магазин заперт.
P501 Утилизируйте содержимое/контейнер в соответствии с местными/региональными/национальными/международными нормами.
Национальные правила
Все компоненты этого продукта перечислены в Реестре химических веществ Агентства по охране окружающей среды США.
Все компоненты этого продукта перечислены в Канадском перечне веществ для внутреннего потребления (DSL).
Раздел 313 SARA (списки конкретных токсичных химических веществ) Вещество не указано.
California Proposition 65
Proposition 65 — Химические вещества, вызывающие рак Вещество не указано.
Prop 65 — Токсичность для развития Вещество не указано.
Prop 65 — Токсичность для развития, женский пол Вещество не указано.
Prop 65 — Токсичность для развития, мужчины Вещество не указано.
Информация об ограничении использования: Только для использования технически квалифицированными лицами.
Другие правила, ограничения и запретительные положения
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (ЕС) № 1907/2006. Вещество не указано.
Необходимо соблюдать условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования
.
Вещество не указано.
Приложение XIV Регламента REACH (требуется разрешение на использование) Вещество не указано.
Оценка химической безопасности: Оценка химической безопасности не проводилась.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности.Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКИЕ ПРАВА 1997-2021 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Свойства металлических и неметаллических элементов — Металлы и неметаллы — Eduqas — GCSE Combined Science Revision — Eduqas
Металлы расположены в левой части периодической таблицы, а неметаллы — в правой.
Физические свойства
В таблице приведены некоторые типичные свойства металлов и неметаллов.
| Металлы | 0.0.0.1:0.1.0.$0.$2.$2.$1.$0.$1″> Non-Metals | ||
|---|---|---|---|
| 04 | |||
| Высокие точки плавления | Низкие точки плавления | ||
| Хорошие проводники электричества | Плохие проводники электричества | ||
| Хорошие проводники нагрева | плохие проводники нагрева | ||
| высокая плотность | |||
| Низкая плотность | Низкая плотность | Низкая плотность | Например:
Вещество с высокой плотностью означает, что оно имеет большую массу для своего размера. Податливые вещества можно согнуть или придать им форму без разрушения, в то время как хрупкие вещества рассыпаются при сгибании или ударе. Пластичный означает, что вещество может быть вытянуто в длинную проволоку, не ломаясь и не ломаясь. Химические свойства0.0.0.1:0.1.0.$0.$3.$1″> Металлы и неметаллы также можно отличить по некоторым химическим свойствам. Наиболее распространенным химическим свойством является тип оксида, который образует элемент. Металлы образуют оксиды, которые являются основными, а неметаллы образуют оксиды, которые являются кислотными. Например, сера и углерод являются неметаллами. Они реагируют с кислородом с образованием диоксида серы и диоксида углерода. Эти соединения представляют собой газы, присутствующие в воздухе и растворяющиеся в дождевой воде, делая ее кислой. Некоторые оксиды не растворяются в воде, поэтому не влияют на цвет индикатора, добавляемого в воду.
Металлы также более подвержены коррозии, чем неметаллы. Это означает, что неметаллы с меньшей вероятностью реагируют с водой или кислотами, чем металлы. Оксиды азота | Национальный реестр загрязнителейОписание Оксиды азота представляют собой смесь газов, состоящую из азота и кислорода. Двумя наиболее токсикологически значимыми соединениями являются оксид азота (NO) и диоксид азота (NO 2 ). Двуокись азота производится для производства азотной кислоты. Большая часть азотной кислоты используется в производстве удобрений, а часть используется в производстве взрывчатых веществ как для военных целей, так и для горнодобывающей промышленности. Информация о веществеНазвание вещества: Оксиды азота Номер CASR: нет данных Молекулярная формула: NO, NO 2 , N 2 O и N 2 O 5 Синонимы: NO: оксид азота, оксид азота, монооксид азота, монооксид азота NO 2 : азота двуокись Физические свойстваNO: острый, сладкий, бесцветный газ Температура плавления: -163.6°С Температура кипения: -151,8°C Относительная плотность: 1,04 (воздух = 1) NO2: красновато-коричневый газ с раздражающим запахом. Температура плавления: -9,3°C Температура кипения: 21,15°C Плотность пара: 1,58 Химические свойстваNO горит только при нагревании с водородом и образует азотную кислоту (сильную кислоту) при растворении в воде. NO 2 умеренно растворим в воде с образованием азотистой кислоты (слабой кислоты). Дополнительная информацияНациональный реестр загрязнителей ( NPI ) содержит данные обо всех источниках выбросов оксидов азота в Австралии. Описание Низкий уровень оксидов азота может раздражать глаза, нос, горло и легкие, что может привести к кашлю, одышке, усталости и тошноте. Воздействие также может привести к скоплению жидкости в легких в течение 1-2 дней после воздействия. Вдыхание высоких уровней оксидов азота может вызвать быстрое жжение, спазмы и отек тканей в горле и верхних дыхательных путях, снижение оксигенации тканей, накопление жидкости в легких и, возможно, даже смерть. Контакт с кожей или глазами с высокими концентрациями оксидов газообразного азота или жидкого диоксида азота может привести к серьезным ожогам. Вход в телоОксиды азота могут вдыхаться или всасываться через кожу. ВоздействиеБольшинство людей подвергаются воздействию оксидов азота при вдыхании загрязненного воздуха. Люди, которые живут рядом с источниками возгорания, такими как угольные электростанции или районы с интенсивным движением автотранспорта, или живут в домохозяйствах, которые сжигают много дров или используют керосиновые обогреватели или газовые плиты, могут подвергаться воздействию более высоких уровней оксидов азота.Рабочие, занятые на объектах, где используются сварочные материалы, производится азотная кислота или некоторые взрывчатые вещества, могут во время работы вдыхать оксиды азота. В табачном дыме обнаружены диоксид азота и оксид азота. Стандарты воздействия на рабочем месте Safe Work Australia устанавливает стандарты воздействия свинца и соединений на рабочем месте посредством стандартов воздействия на рабочем месте переносимых по воздуху загрязняющих веществ. Двуокись азота
Окись азота
Закись азота
Руководство по питьевой водеАвстралийские рекомендации по питьевой воде включают следующие рекомендации по приемлемому качеству воды: Нитриты
Нитраты
ОписаниеЧрезмерный уровень оксидов азота, особенно диоксида азота (NO 2 ), может привести к гибели растений и корней и повредить листья многих сельскохозяйственных культур. NO 2 является повреждающим компонентом фотохимического смога. Чрезмерные уровни увеличивают кислотность дождя (снижают рН) и, таким образом, снижают рН поверхностных и грунтовых вод и почвы. Пониженный pH может иметь вредные последствия, возможно даже смерть, для различных биологических систем. Вход в окружающую средуОксиды азота являются частью биогеохимического круговорота азота и обнаруживаются в воздухе, почве и воде. В атмосфере оксиды азота быстро уравновешиваются до диоксида азота (NO 2 ), который в конечном итоге образует кислотные дожди. В стратосфере оксиды азота играют решающую роль в поддержании уровня озона. Озон образуется в результате фотохимической реакции между диоксидом азота и кислородом. Где это заканчивается Оксиды азота быстро разрушаются при взаимодействии с другими веществами, находящимися в воздухе. Руководство по охране окружающей среды В 1999 году были установлены следующие стандарты качества атмосферного воздуха для двуокиси азота: Промышленные источникиПромышленными источниками оксидов азота являются электроснабжение, горнодобывающая промышленность, добыча нефти и газа, обрабатывающая промышленность и производство нефти. Диффузные источники и промышленные источники, включенные в данные о диффузных выбросах Различные сельскохозяйственные (как возделывание, так и кормление животных) и лесные хозяйства (как «выжигание», так и сплошные рубки) увеличивают скорость естественных процессов, в результате которых образуются оксиды азота. Природные источникиБиологический цикл азота включает процессы, в которых в качестве промежуточных продуктов образуются оксид азота и закись азота. Термические процессы в атмосфере (во время молнии или лесных пожаров) приводят к образованию оксидов азота. Источники транспортаОксиды азота присутствуют в выхлопных газах всех транспортных средств, в том числе автомобилей, газонокосилок, кораблей/лодок, самолетов и железных дорог. Потребительские товарыНитратсодержащие удобрения содержат оксиды азота. Источники, использованные при подготовке этой информации
: свойства, производство и применениеГлинозем , широко известный как оксид алюминия (Al 2 O 3 ) , представляет собой инертный, белый аморфный материал без запаха, часто используемый в промышленной керамике. Благодаря своим выдающимся свойствам глинозем внёс свой вклад в значительное число приложений, продлевающих жизнь и улучшающих жизнь общества.Он широко используется в медицине и современной войне [1]. Оксид алюминия представляет собой термически нестабильное и нерастворимое соединение, встречающееся в природе в различных минералах, таких как корунд , кристаллический вариант оксида, и боксит , который считается его основной алюминиевой рудой [1]. Здесь вы узнаете о:
Свойства оксида алюминияБлагодаря своим превосходным механическим, химическим и термическим свойствам оксид алюминия выделяется среди многих сопоставимых материалов, предлагая равные или лучшие решения для недорогостоящего производства и производства. Его производительность зависит от следующих свойств [1], [2], [3]: Как производится оксид алюминия?Оксид алюминия часто производится по процессу Байера, что означает переработку боксита для получения глинозема. Следующее обратимое химическое уравнение описывает основы процесса Байера: Этот процесс начинается с сушки измельченного и промытого боксита, обычно содержащего 30–55 % Al2O3 [4]. Боксит растворяют в едком натре с образованием суспензии, нагреваемой до температуры около 230–520 ° F (110–270 ° C). Отфильтрованный раствор оксида алюминия (гидроксид алюминия) затем перекачивается или перекачивается в баки-осадители, где он охлаждается и начинает высеваться. Эти затравки стимулируют процесс осаждения, что позволяет сформировать твердые кристаллы гидроксида алюминия. Весь гидроксид алюминия, который оседает на дне бака, удаляется. Остатки едкого натра вымываются из гидроксида алюминия, который проходит различные уровни фильтрации.Наконец, его нагревают, чтобы полностью удалить лишнюю воду. После прохождения стадии охлаждения получается мелкий белый порошок [5]. Процесс Байера обобщен на рисунке 1, где показаны все этапы и то, что происходит на каждом этапе. Рис. 1. Процесс Байера в его современной форме (2017 г.), поскольку к исходному процессу Байера 1892 г. добавляются этапы удаления кремнезема и оксалата. Воспроизведено с рисунка 3. Применение оксида алюминияБольшая часть производимого оксида алюминия используется для образования металлического алюминия .Кислород обычно катализирует коррозию в реакции с металлическим алюминием. Однако при связывании с кислородом с образованием оксида алюминия образуется защитное покрытие, предотвращающее дальнейшее окисление. Это повышает прочность и делает материал менее уязвимым к износу [6]. Отрасли, в которых используется оксид алюминия, включают: Медицинская промышленность Из-за твердости, биоинертности и химических свойств оксида алюминия он является предпочтительным материалом для подшипников при замене тазобедренного сустава, а также в качестве протезов, бионических имплантатов, протезных заменителей глаза, армирующих тканей, зубных коронок, абатментов, мостов и других зубных имплантатов.Он также используется в лабораторном оборудовании и инструментах, таких как тигли, печи и другое лабораторное оборудование [1]. Прочность и легкость оксида алюминия способствуют улучшению бронежилетов, таких как нагрудники, а также брони для транспортных средств и самолетов, что является его крупнейшим рынком сбыта. Оксид алюминия также используется в синтетическо-сапфировых пуленепробиваемых окнах и баллистике [1]. Электротехническая и электронная промышленностьЕго высокие температуры плавления и кипения, в дополнение к его превосходным термостойким свойствам, делают оксид алюминия востребованным в производстве высокотемпературной изоляции печей и электрических изоляторов.Пленки оксида алюминия также являются жизненно важными компонентами в производстве микрочипов. Некоторые из других его применений включают изоляторы свечей зажигания, микроэлектрические подложки и изолирующие радиаторы [1]. Производство драгоценных камней Оксид алюминия является ценным элементом при образовании рубинов и сапфиров. Поскольку глинозем химически инертен, его используют в качестве наполнителя в пластмассах, кирпичах и других тяжелых глиняных изделиях, таких как печи для обжига. Из-за своей чрезвычайной прочности и твердости он часто используется в качестве абразива для наждачной бумаги. Он также является экономичным заменителем технических алмазов [6]. Оксиды алюминия также используются для производства компонентов трубопроводов, таких как колена, тройники, прямые трубы, гидроциклоны, редукторы, патрубки и клапаны.Другие области применения включают производство различных обрабатывающих инструментов, режущих инструментов, оболочек термопар, износостойких рабочих колес насосов и отражательных пластин [1]. [1] А.Дж. Ruys, Глиноземная керамика: биомедицинские и клинические применения , Великобритания: Woodhead Publishing, 2018. [2] CeramTec, Самый известный оксидный керамический материал , CeramTec, Германия, дата обращения: 28 октября 2019 г. [В сети] Доступно: https://www.ceramtec.com/ceramic-materials /оксид алюминия/# [3] American Elements, Оксид алюминия , American Elements, USA, n.d., Дата обращения: 28 октября 2019 г. [В сети] Доступно: https://www.americanelements.com/aluminum-oxide-1344-28-1 [4] Guichon Valves, Alumina — Процесс производства глинозема , Guichon Valves, Франция, дата обращения: 28 октября 2019 г. [В сети] Доступно: https://guichon-valves.com/faqs/alumina -процесс-производства-глинозема/ [5] «Aluminum», nd, Дата обращения: 28 октября 2019 г. [В сети] Доступно: http://www.madehow.com/Volume-5/Aluminum.html [6] «Оксид алюминия», н.d., Дата обращения: 28 октября 2019 г. Физические свойства оксидов переходных металлов, синтезированных методом плавающей зоны и искровым плазменным спеканиемАннотация Оксиды переходных металлов в последние несколько десятилетий привлекают все большее внимание из-за богатых физических свойств, которые они проявляют. Оксиды переходных металлов со структурой перовскита AMO₃ представляют особый интерес для разработки функциональных материалов в современных технологиях, поскольку для настройки физических свойств AMO3 можно использовать множество способов.Монокристаллы Y₁₋ₓLaₓTiO₃ выращивают методом плавающей зоны для изучения магнитного перехода от ферромагнитного в YTiO₃ к антиферромагнитному G-типу в LaTiO₃. Y₁₋ₓ LaₓTiO₃ показывает аналогичную магнитную фазовую диаграмму с семейством RTiO3, а магнетизм и температуру перехода можно точно настроить, изменяя легирование La x. Измеряя изменение температуры магнитного перехода на монокристаллических образцах при одноосном напряжении, можно выявить корреляцию между искажениями решетки и кооперативным орбитальным упорядочением. Кислород (O) – Химические свойства, воздействие на здоровье и окружающую среду Газообразный химический элемент, условное обозначение: O, атомный номер: 8 и атомный вес 15,9994.Он представляет большой интерес, поскольку является важнейшим элементом в процессах дыхания большинства живых клеток и в процессах горения. Это самый распространенный элемент в земной коре. Почти одну пятую (по объему) воздуха составляет кислород. Несвязанный газообразный кислород обычно существует в форме двухатомных молекул O 2 , но он также существует в трехатомной форме O 3 , называемой озоном. При нормальных условиях кислород представляет собой бесцветный, без запаха и безвкусный газ; он конденсируется в светло-голубую жидкость.Кислород является частью небольшой группы газов, буквально парамагнитных, и он самый парамагнитный из всех. Жидкий кислород также слегка парамагнитен. Кислород является реакционноспособным и образует оксиды со всеми другими элементами, кроме гелия, неона, аргона и криптона. Умеренно растворим в воде (30 см 3 на 1 л воды растворяют) при 20°С. Применение Кислород можно отделить от воздуха путем фракционного сжижения и перегонки.Основные применения кислорода в порядке важности: 1) плавка, рафинирование и производство стали и других металлов; 2) производство химикатов путем контролируемого окисления; 3) ракетный двигатель; 4) медико-биологическое жизнеобеспечение; 5) добыча полезных ископаемых, производство и изготовление изделий из камня и стекла. Кислород в окружающей среде Земная кора состоит в основном из кремнекислородных минералов, и многие другие элементы находятся там в виде их оксидов. Почти все химические вещества, за исключением инертных газов, связываются с кислородом, образуя соединения. Вода, H 2 O, и кремнезем, SiO 2 , основной компонент песка, являются одними из наиболее распространенных бинарных соединений кислорода. Кислород необходим для всех форм жизни, поскольку он входит в состав ДНК и почти всех других биологически важных соединений. Является ли это еще более драматичным в том смысле, что животные должны получать ежеминутное снабжение газом, чтобы выжить? Кислород в легких подхватывается атомом железа в центре гемоглобина в крови и таким образом транспортируется туда, где он необходим. Каждому человеку для дыхания необходим кислород, но, как и во многих других случаях, слишком много кислорода вредно. Если человек подвергается воздействию большого количества кислорода в течение длительного времени, может произойти повреждение легких. Высококонцентрированные источники кислорода способствуют быстрому воспламенению и поэтому представляют опасность пожара и взрыва в присутствии топлива. Подробнее о кислороде в воде Назад к периодической таблице . см. также кислородный генератор Рекомендуемая литература для кислорода .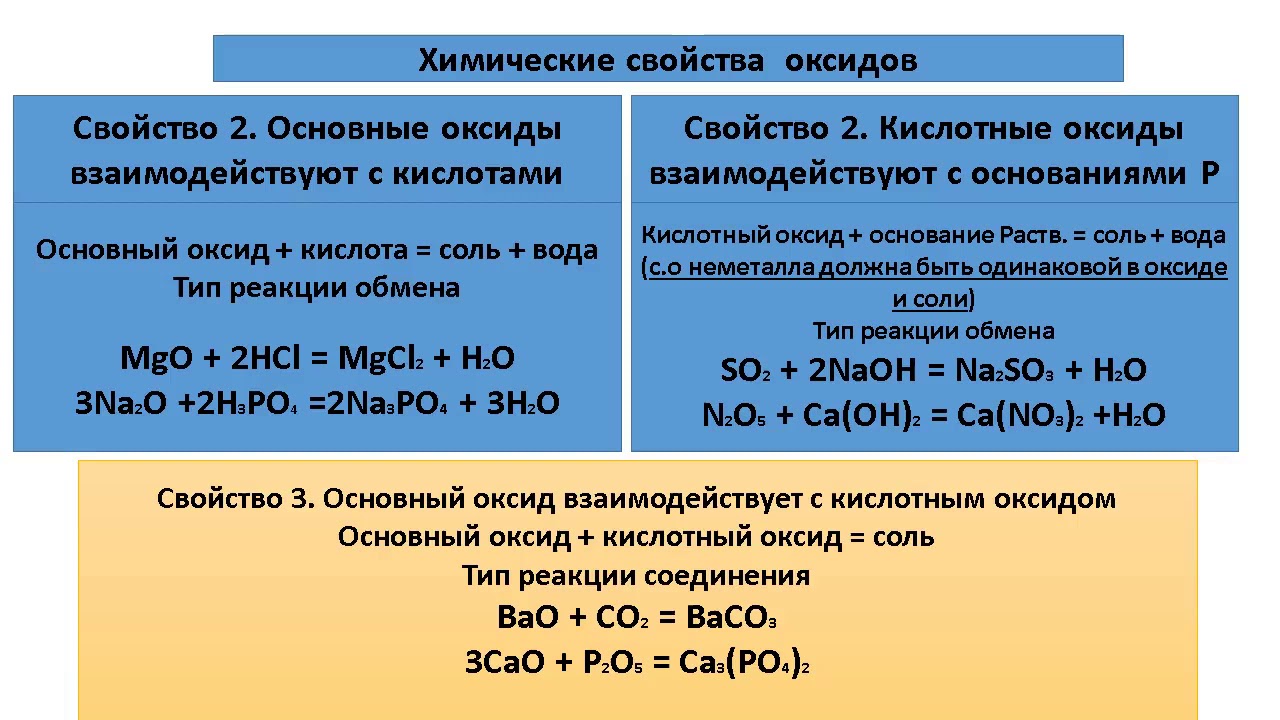 |

 Другими газами, принадлежащими к этой группе, являются монооксид азота (или закись азота, N 2 O) и пятиокись азота (NO 5 ).
Другими газами, принадлежащими к этой группе, являются монооксид азота (или закись азота, N 2 O) и пятиокись азота (NO 5 ).

 Эти стандарты подходят только для использования на рабочих местах и не ограничиваются какой-либо конкретной отраслью или операцией.Убедитесь, что вы понимаете, как интерпретировать стандарты, прежде чем использовать их.
Эти стандарты подходят только для использования на рабочих местах и не ограничиваются какой-либо конкретной отраслью или операцией.Убедитесь, что вы понимаете, как интерпретировать стандарты, прежде чем использовать их.
 Двуокись азота может образовывать азотную кислоту на солнце и является основным компонентом кислотных дождей, тропосферного озона и смога. Оксиды азота реагируют в почве и воде с образованием азотной кислоты.
Двуокись азота может образовывать азотную кислоту на солнце и является основным компонентом кислотных дождей, тропосферного озона и смога. Оксиды азота реагируют в почве и воде с образованием азотной кислоты. Деятельность по сжиганию топлива, например, для отопления, и курение сигарет также являются диффузными источниками оксидов азота.
Деятельность по сжиганию топлива, например, для отопления, и курение сигарет также являются диффузными источниками оксидов азота.


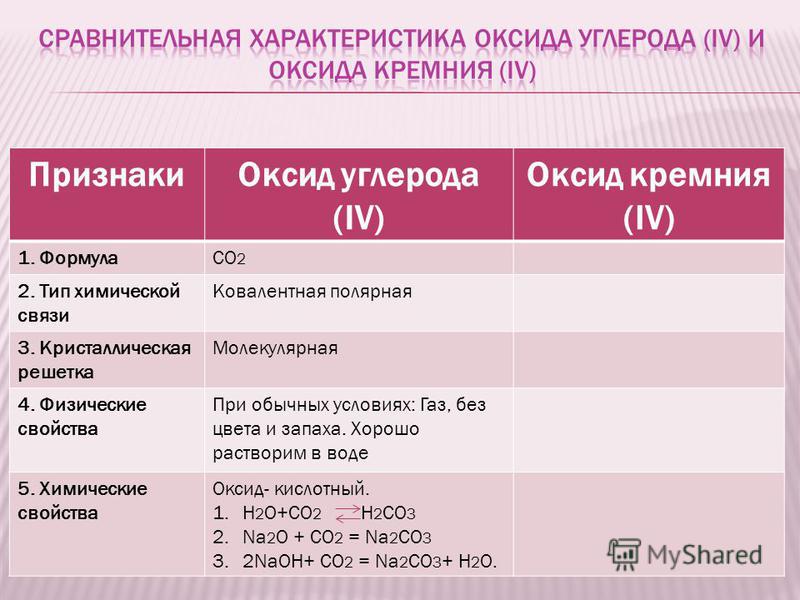 Эта смесь затем фильтруется для удаления остатков, называемых примесями «красного шлама».
Эта смесь затем фильтруется для удаления остатков, называемых примесями «красного шлама». 1 (стр. 51) исх. 1.
1 (стр. 51) исх. 1. 
 Его кристаллическая форма, корунд, является основным элементом для этих драгоценных камней. Рубины обязаны своим темно-красным цветом примесям хрома, в то время как сапфиры получают различные цвета из-за следов железа и титана [6].
Его кристаллическая форма, корунд, является основным элементом для этих драгоценных камней. Рубины обязаны своим темно-красным цветом примесям хрома, в то время как сапфиры получают различные цвета из-за следов железа и титана [6].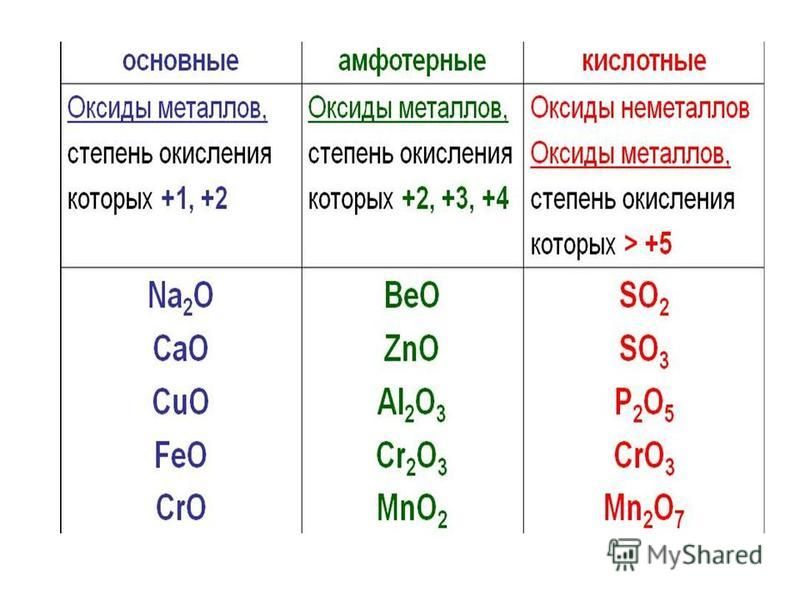
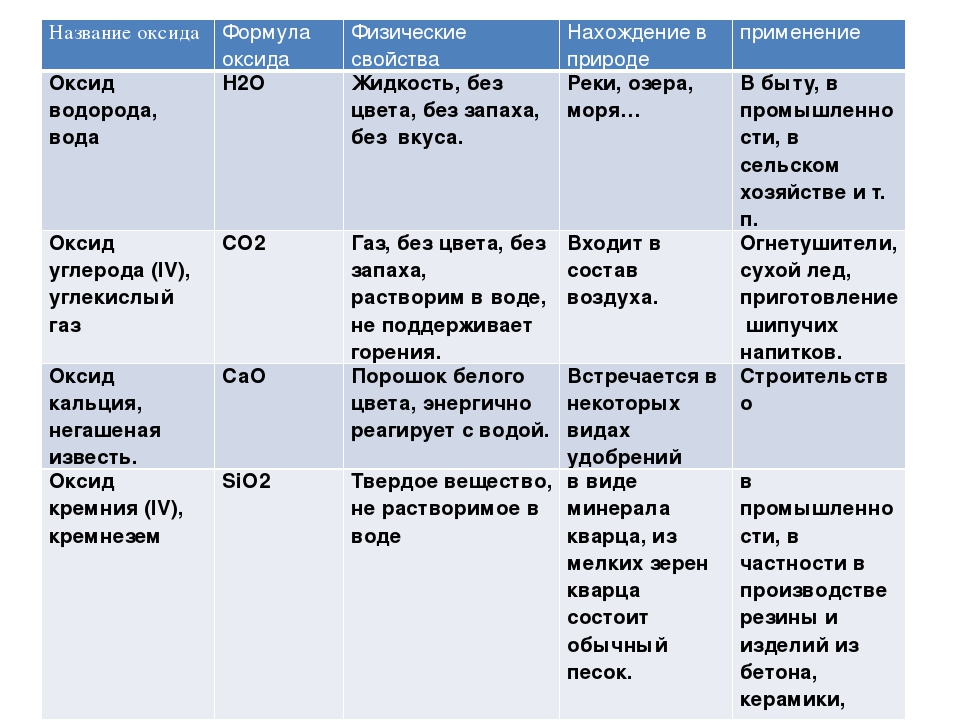 [Онлайн] Доступно: https://aluminumsulfate.net/aluminum-oxide
[Онлайн] Доступно: https://aluminumsulfate.net/aluminum-oxide Двойной перовскит CaMnTi₂O₆ является первым столбчатым перовскитом, упорядоченным по A-узлу, проявляющим сегнетоэлектрические свойства. Искровое плазменное спекание (SPS) используется для успешного синтеза Ca₂₋ₓMnₓTi₂O₆ на уровне граммов, который имеет ту же кристаллическую структуру и аналогичные высокотемпературные [индекс c] сегнетоэлектрические свойства. С помощью дифракции нейтронов получена подробная информация о структуре и определена движущая сила сегнетоэлектричества. Вдохновленные успешным синтезом двойного перовскита Ca₂₋ₓMnₓTi₂O₆, с помощью SPS также получены перовскиты La₁₋ₓPrₓRuO₃.Замена La более мелким редкоземельным ионом Pr приводит к переходу от блуждающего к локализованному электронному поведению. Проведено систематическое исследование физических свойств и обнаружен необычный переход металл-изолятор второго рода в La₁₋ₓPrₓRuO3. Шпинели A²⁺V₂O₄ имеют наименьшую щель, обусловленную электрон-электронными корреляциями в одновалентных шпинелях, и длина связи VV в этих шпинелях уменьшается по мере замещения катиона A-позиции катионами в порядке A = Cd, Mn , Fe, Mg, Zn, Co.
Двойной перовскит CaMnTi₂O₆ является первым столбчатым перовскитом, упорядоченным по A-узлу, проявляющим сегнетоэлектрические свойства. Искровое плазменное спекание (SPS) используется для успешного синтеза Ca₂₋ₓMnₓTi₂O₆ на уровне граммов, который имеет ту же кристаллическую структуру и аналогичные высокотемпературные [индекс c] сегнетоэлектрические свойства. С помощью дифракции нейтронов получена подробная информация о структуре и определена движущая сила сегнетоэлектричества. Вдохновленные успешным синтезом двойного перовскита Ca₂₋ₓMnₓTi₂O₆, с помощью SPS также получены перовскиты La₁₋ₓPrₓRuO₃.Замена La более мелким редкоземельным ионом Pr приводит к переходу от блуждающего к локализованному электронному поведению. Проведено систематическое исследование физических свойств и обнаружен необычный переход металл-изолятор второго рода в La₁₋ₓPrₓRuO3. Шпинели A²⁺V₂O₄ имеют наименьшую щель, обусловленную электрон-электронными корреляциями в одновалентных шпинелях, и длина связи VV в этих шпинелях уменьшается по мере замещения катиона A-позиции катионами в порядке A = Cd, Mn , Fe, Mg, Zn, Co. Расчет теории функционала плотности (DFT) и транспортные свойства CoV₂O₄ под давлением показывают, что CoV₂O₄ может находиться на пересечении между поведением локализованных электронов и блуждающих электронов. Для выяснения этого ряд шпинелей AV₂O₄ (A = Cd, Mn, Fe, Mg, Zn, Co) изучен методом in situ рентгенографии высокого давления и дифракции нейтронов при различных температурах.
Расчет теории функционала плотности (DFT) и транспортные свойства CoV₂O₄ под давлением показывают, что CoV₂O₄ может находиться на пересечении между поведением локализованных электронов и блуждающих электронов. Для выяснения этого ряд шпинелей AV₂O₄ (A = Cd, Mn, Fe, Mg, Zn, Co) изучен методом in situ рентгенографии высокого давления и дифракции нейтронов при различных температурах.
 Этот кислород хранится не в виде газообразного кислорода, а в виде химического хлората натрия.
Этот кислород хранится не в виде газообразного кислорода, а в виде химического хлората натрия. Среди соединений, содержащих более двух элементов, наиболее распространены силикаты, из которых состоит большинство горных пород и почв.Другими соединениями, широко распространенными в природе, являются карбонат кальция (известняк и мрамор), сульфат кальция (гипс), оксид алюминия (бокситы) и различные оксиды железа, которые используются в качестве источника металла.
Среди соединений, содержащих более двух элементов, наиболее распространены силикаты, из которых состоит большинство горных пород и почв.Другими соединениями, широко распространенными в природе, являются карбонат кальция (известняк и мрамор), сульфат кальция (гипс), оксид алюминия (бокситы) и различные оксиды железа, которые используются в качестве источника металла. Вдыхание 50-100% кислорода при нормальном давлении в течение длительного периода времени вызывает повреждение легких. Те люди, которые работают с частым или потенциально высоким воздействием чистого кислорода, должны пройти проверку функции легких до начала работы и после нее. Кислород обычно хранится при очень низких температурах, поэтому следует носить специальную одежду, чтобы предотвратить замерзание тканей тела.
Вдыхание 50-100% кислорода при нормальном давлении в течение длительного периода времени вызывает повреждение легких. Те люди, которые работают с частым или потенциально высоким воздействием чистого кислорода, должны пройти проверку функции легких до начала работы и после нее. Кислород обычно хранится при очень низких температурах, поэтому следует носить специальную одежду, чтобы предотвратить замерзание тканей тела.