Общая характеристика оснований — урок. Химия, 8–9 класс.
В \(1754\) году французский химик Г. Руэль (\(1703\)–\(1770\)) ввёл термин «основание», подразумевая, что к соединениям данного класса относится любое вещество, которое способно взаимодействовать с кислотами, образуя соли.
Гийом Франсуа Руэль
\(1703\)–\(1770\)
Позже значение этого термина неоднократно уточнялось. Одно из определений, которым пользуются в настоящее время, звучит так:
Основаниями называют сложные вещества, в состав которых входят металлические химические элементы, соединённые с одной или несколькими гидроксогруппами (группами атомов \(-OH\)).
Исходя из этого, общую химическую формулу оснований можно изобразить следующим образом:
M(OH)n,
где \(M\) — знак металлического химического элемента,
а \(n\) — индекс, численно совпадающий с валентностью металла.
Основания относятся к электролитам, то есть к веществам, растворы и расплавы которых проводят электрический ток.
С точки зрения теории электролитической диссоциации, основания — электролиты, которые, диссоциируя, из отрицательно заряженных ионов образуют только гидроксид-ионы.
Номенклатура оснований
Название основания состоит из слова «гидроксид» и названия металлического химического элемента в родительном падеже. Если металлический элемент имеет переменную валентность, то последняя указывается римскими цифрами в скобках без пробела сразу же после названия металла.Пример:
NaOH — гидроксид натрия,
Fe(OH)2 — гидроксид железа(\(II\)),
Fe(OH)3 — гидроксид железа(\(III\)).
Классификация оснований
Растворимые в воде основания называют щелочами.
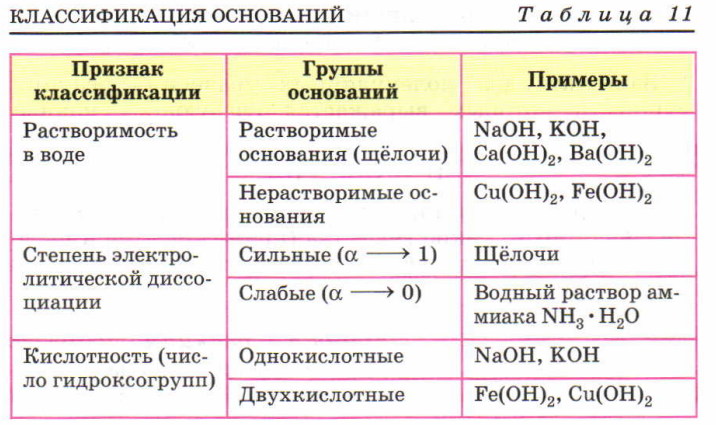
По их способности растворяться в воде основания делят на растворимые и практически нерастворимые.
Примеры: NaOH — гидроксид натрия, KOH — гидроксид калия, Ca(OH)2 — гидроксид кальция. | Примеры: Cu(OH)2 — гидроксид меди(\(II\)), Fe(OH)2 — гидроксид железа(\(II\)), Fe(OH)3 — гидроксид железа(\(III\)). |
Источники:
https://upload.wikimedia.org/wikipedia/commons/d/d5/Guillaume-Fran%C3%A7ois_Rouelle.jpg
Свойства оснований
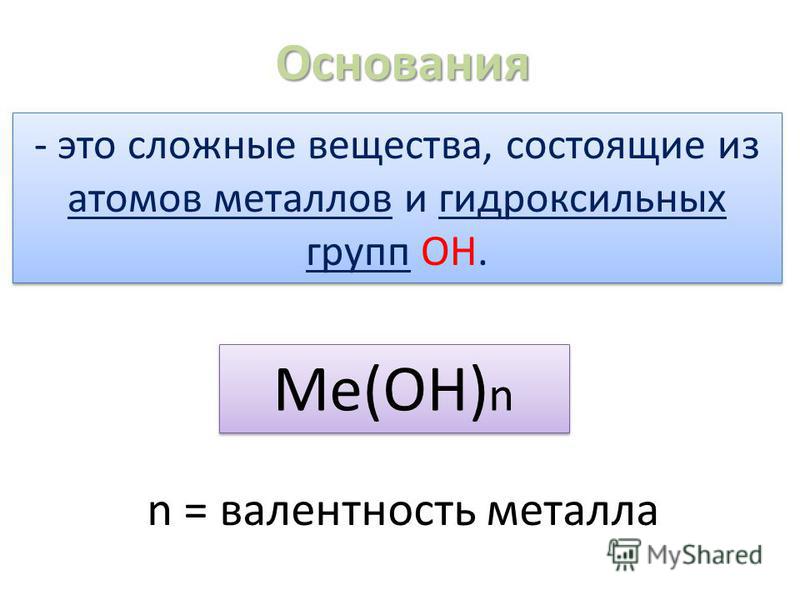
Основания – сложные вещества, состоящие из атома металла и одной или нескольких гидроксильных групп. Общая формула оснований Ме(ОН)n. Основания (с точки зрения теории электролитической диссоциации) – это электролиты, диссоциирующие при растворении в воде с образованием катионов металла и гидроксид-ионов ОН–.
Классификация. По растворимости
в воде основания делят на щелочи
(растворимые в воде основания) и нерастворимые в воде основания.
Щелочи образуют щелочные и щелочно-земельные металлы, а также
некоторые другие элементы-металлы. По кислотности (числу ионов
ОН–,
образующихся при полной диссоциации, или количеству ступеней
диссоциации) основания подразделяют на
однокислотные (при полной диссоциации получается один ион
ОН Среди многокислотных оснований различают
двухкислотные (например,
Sn(OH)2),
трехкислотные (Fe(OH)3)
и четырехкислотные (Th(OH)4).
Однокислотным является, например, основание КОН.
Среди многокислотных оснований различают
двухкислотные (например,
Sn(OH)2),
трехкислотные (Fe(OH)3)
и четырехкислотные (Th(OH)4).
Однокислотным является, например, основание КОН.
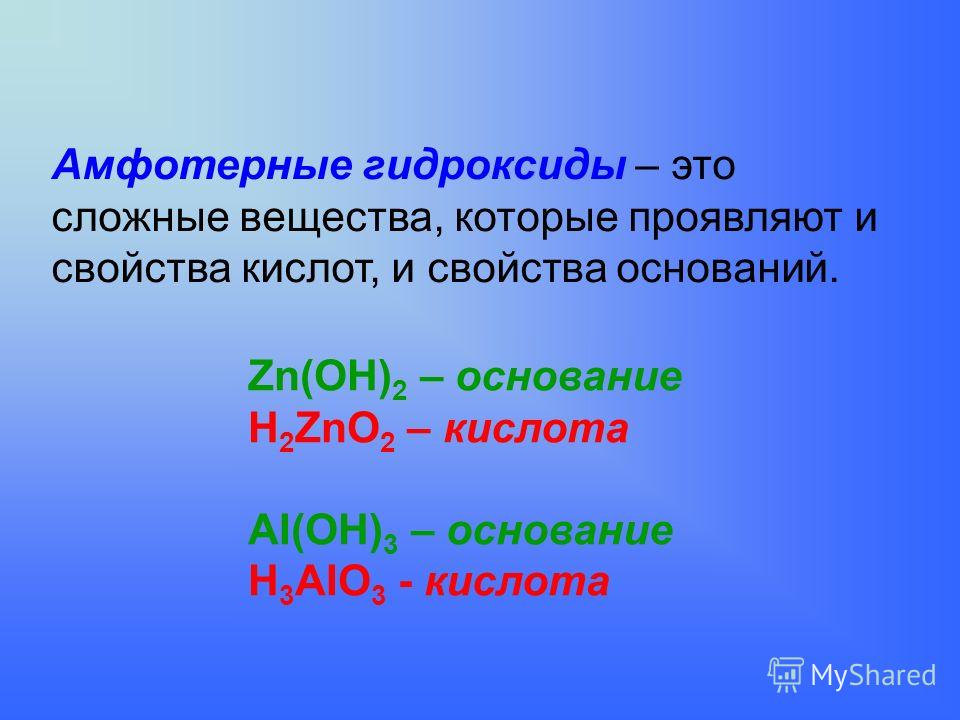
Выделяют группу гидроксидов, которые проявляют химическую двойственность. Они взаимодействую как с основаниями, так и с кислотами. Это амфотерные гидроксиды (см. таблицу 1).
Таблица 1 — Амфотерные гидроксиды
| Амфотерный гидроксид (основная и кислотная форма) |
Комплексный ион |
|
|
Zn(OH)2 / H2ZnO2 |
ZnO2 (II) |
[Zn(OH)4]2– |
|
Al(OH)3 / HAlO2 |
AlO2 (I) |
[Al(OH)4]–, [Al(OH)6]3– |
|
|
BeO2 (II) |
[Be(OH)4]2– |
|
Sn(OH)2 / H2SnO2 |
SnO2 (II) |
[Sn(OH)4]2– |
|
Pb(OH)2 / H2PbO2 |
PbO2 (II) |
[Pb(OH)4]2– |
|
Fe(OH)3 / HFeO2 |
FeO2 (I) |
[Fe(OH)4]–, [Fe(OH)6]3– |
|
Cr(OH)3 / HCrO2 |
CrO2 (I) |
[Cr(OH)4]–, [Cr(OH)6]3– |
Физические свойства. Основания —
твердые вещества различных цветов и различной растворимости в воде.
Основания —
твердые вещества различных цветов и различной растворимости в воде.
Химические свойства оснований
1) Диссоциация: КОН + nН2О К+×mН2О + ОН–×dН2О или сокращенно: КОН К+ + ОН–.
Многокислотные основания диссоциируют по нескольким ступеням (в основном диссоциация протекает по первой ступени). Например, двухкислотное основание Fe(OH)2диссоциирует по двум ступеням:
Fe(OH)2FeOH+ + OH– (1 ступень);
FeOH+Fe2+ + OH– (2 ступень).
2) Взаимодействие с индикаторами (щелочи окрашивают фиолетовый лакмус в синий цвет, метилоранж – в желтый, а фенолфталеин – в малиновый):
индикатор + ОН– (щелочь) окрашенное
соединение.
3) Разложение с образованием оксида и воды (см. таблицу 2). Гидроксиды щелочных металлов устойчивы к нагреванию (плавятся без разложения). Гидроксиды щелочно-земельных и тяжелых металлов обычно легко разлагаются. Исключение составляет Ba(OH)2, у которого tразл достаточно высока (примерно 1000 °C).
Zn(OH)2 ZnO + H2O.
Таблица 2 — Температуры разложения некоторых гидроксидов металлов
| Гидроксид | tразл, °C | Гидроксид | tразл, °C | Гидроксид | tразл, °C |
| LiOH | 925 | Cd(OH)2 | 130 | Au(OH) 3 | 150 |
| Be(OH)2 | 130 | Pb(OH)2 | 145 | Al(OH)3 | >300 |
| Ca(OH)2 | 580 | Fe(OH)2 | 150 | Fe(OH)3 | 500 |
| Sr(OH)2 | Zn(OH)2 | 125 | Bi(OH)3 | 100 | |
| Ba(OH)2 | 1000 | Ni(OH)2 | 230 | In(OH)3 | 150 |
4) Взаимодействие щелочей с некоторыми металлами (например, Al и Zn):
В растворе: 2Al + 2NaOH + 6H2O ® 2Na[Al(OH)4] + 3H2
2Al + 2OH–+ 6H2О ® 2[Al(OH)4]– + 3H2.
При сплавлении: 2Al + 2NaOH + 2H2O 2NaAlО2 + 3H2.
5) Взаимодействие щелочей с неметаллами:
6NaOH + 3Cl2 5NaCl + NaClO3 + 3H2O.
6) Взаимодействие щелочей с кислотными и амфотерными оксидами:
2NaOH + СО2®
Na2CO3 + H2O
2OH–+
CO2
®
CO3
В растворе: 2NaOH + ZnO
+ H2O
®
Na2[Zn(OH)4]
2OH–+ ZnO
+ H2О
®
[Zn(OH)4]2–.
При сплавлении с амфотерным оксидом: 2NaOH + ZnO Na2ZnO2 + H2O.
7) Взаимодействие оснований с кислотами:
H2SO4+ Ca(OH)2 ® CaSO4¯ + 2H2O 2H+ + SO42–+ Ca2+ +2OH– ® CaSO4¯ + 2H2O
H2SO4+ Zn(OH)2 ® ZnSO4 + 2H2O 2H+ + Zn(OH)2 ® Zn2+ + 2H2O.
8) Взаимодействие щелочей с амфотерными гидроксидами (см. таблицу 1):
В растворе: 2NaOH + Zn(OH)2 ® Na2[Zn(OH)4] 2OH– + Zn(OH)2 ® [Zn(OH)4]2–
При сплавлении: 2NaOH +
Zn(OH)2
Na2ZnO2 +
2H2O.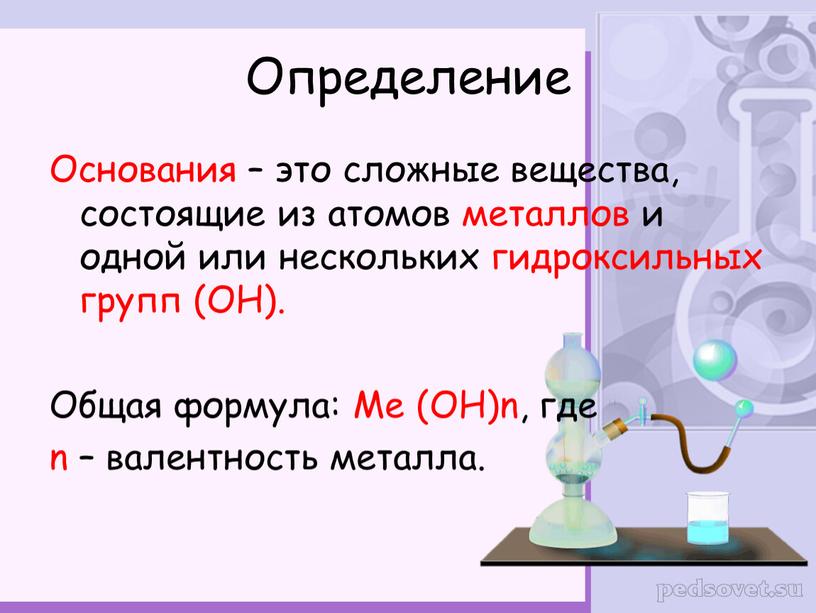
9) Взаимодействие щелочей с солями. В реакцию вступают соли, которым соответствует нерастворимое в воде основание:
CuSО4 + 2NaOH ® Na2SO4 + Cu(OH)2¯ Cu2++ 2OH– ® Cu(OH)2¯.
Получение. Нерастворимые в воде основания получают путем взаимодействия соответствующей соли со щелочью:
2NaOH + ZnSО4 ® Na2SO4 + Zn(OH)2¯ Zn2++ 2OH– ® Zn(OH)2¯.
Щелочи получают:
1) Взаимодействием оксида металла с водой:
Na2O + H2O
®
2NaOH
CaO + H2O
®
Ca(OH)2.
2) Взаимодействием щелочных и щелочно-земельных металлов с водой:
2Na + H2O ® 2NaOH + H2 Ca + 2H2O ® Ca(OH)2 + H2.
3) Электролизом растворов солей:
2NaCl + 2H2O H2 + 2NaOH + Cl2.
4) Обменным взаимодействием гидроксидов щелочно-земельных металлов с некоторыми солями. В ходе реакции должна обязательно получаться нерастворимая соль.
Ba(OH)2+ Na2CO3®
2NaOH + BaCO3¯
Ba2+
+ CO32–
®
BaCO3¯.
Л.А. Яковишин
Кислоты и основания — Электронный учебник K-tree
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое pH раствора, какими общими свойствами обладают кислоты и основания.
Простым языком, кислота — это всё что с H, а основание — c OH. НО! Не всегда. Что бы отличать кислоту от основания необходимо… запомнить их! Сожалею. Что бы хоть как то облегчить жизнь, три наших друга, Аррениус и Бренстед с Лоури, придумали две теории, которые зовутся их именем.
Как металлы и неметаллы, кислоты и основания — это разделение веществ по схожим свойствам. Первая теория кислот
и оснований принадлежала швецкому учёному Аррениусу. Кислота по Аррениусу — это класс веществ, которые
в реакции с водой диссоциируют (распадаются), образовывая катион водорода H+. Основания Аррениуса в водном растворе образуют
анионы OH—. Следующая теория в 1923 году была предложена учёными Бренстедом и Лоури. Теория Бренстеда-Лоури
определяет кислотами вещества, способные в реакции отдавать протон (протоном в реакциях называют катион водорода). Основания,
соответственно, — это вещества, способные принять протон в реакции. Актуальная на данный момент теория — теория Льюиса.
Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя
аддукты Льюиса (аддукт — это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
Основания Аррениуса в водном растворе образуют
анионы OH—. Следующая теория в 1923 году была предложена учёными Бренстедом и Лоури. Теория Бренстеда-Лоури
определяет кислотами вещества, способные в реакции отдавать протон (протоном в реакциях называют катион водорода). Основания,
соответственно, — это вещества, способные принять протон в реакции. Актуальная на данный момент теория — теория Льюиса.
Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя
аддукты Льюиса (аддукт — это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила справедливы для кислот и оснований.
Диссоциация
Диссоциация – это процесс распада вещества на ионы в растворах или расплавах. Например, диссоциация соляной кислоты — это распад
HCl на H+ и Cl—.
Например, диссоциация соляной кислоты — это распад
HCl на H+ и Cl—.
Свойства кислот и оснований
Кислоты, содержащие водород, в водном растворе выделяют катионы водорода. Основания, содержащие гидроксид-ион, в водном растворе выделяют анион OH—.
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется газ.
Часто используемые кислоты:
H2O, H3O+, CH3CO2H, H2SO4, HSO4−, HCl, CH3OH, NH3
Часто используемые основания:
OH−, H2O, CH3CO2−, HSO4−, SO42−, Cl−
Сильные и слабые кислоты и основания
Сильные кислоты
Такие кислоты, которые полностью диссоциируют в воде, производя катионы водорода H+ и анионы. Пример сильной кислоты — соляная кислота HCl:
Пример сильной кислоты — соляная кислота HCl:
HCl(р-р) + H2O(ж) → H3O+(р-р) + Cl—(р-р)
Примеры сильных кислот: HCl, HBr, HF, HNO3, H2SO4, HClO4
Список сильных кислот
- HCl — соляная кислота
- HBr — бромоводород
- HI — йодоводород
- HNO3 — азотная кислота
- HClO4 — хлорная кислота
- H2SO4 — серная кислота
Слабые кислоты
Растворяются в воде только частично, например, HF:
HF(р-р) + h3O(ж) → h4O+(р-р) + F—(р-р) — в такой реакции более 90% кислоты не диссоциирует:
[H3O+]=[F—] < 0,01M для вещества 0,1М
Сильную и слабую кислоту можно различить измеряя проводимость растворов: проводимость зависит от количества ионов,
чем сильнее кислота тем она более диссоциирована, поэтому чем сильнее кислота тем выше проводимость.
Список слабых кислот
- HF фтороводородная
- H3PO4 фосфорная
- H2SO3 сернистая
- H2S сероводородная
- H2CO3 угольная
- H2SiO3 кремниевая
Сильные основания
Сильные основания полностью диссоциируют в воде:
NaOH(р-р) + H2O ↔ NH4
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены, щёлочноземельные металлы) группы.
Список сильных оснований
- NaOH гидроксид натрия (едкий натр)
- KOH гидроксид калия (едкое кали)
- LiOH гидроксид лития
- Ba(OH)2 гидроксид бария
- Ca(OH)2 гидроксид кальция (гашеная известь)
Слабые основания
В обратимой реакции в присутствии воды образует ионы OH—:
NH3 (р-р) + H2O ↔ NH+4 (р-р) + OH—(р-р)
Большинство слабых оснований — это анионы:
F—(р-р) + H2O ↔ HF(р-р) + OH—(р-р)
Список слабых оснований
- Mg(OH)2 гидроксид магния
- Fe(OH)2 гидроксид железа (II)
- Zn(OH)2 гидроксид цинка
- NH4OH гидроксид аммония
- Fe(OH)3 гидроксид железа (III)
Реакции кислот и оснований
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и
основания, результирующий раствор будет нейтральным.
Пример:
H3O+ + OH— ↔ 2H2O
Слабое основание и слабая кислота
Общий вид реакции:
Слабое основание(р-р) + H2O ↔ Слабая кислота(р-р) + OH—(р-р)
Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства основания:
HX(р-р) + OH—(р-р) ↔ H2O + X—(р-р)
Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
NH3 (р-р) + H+ ↔ NH4
Диссоциация воды
Диссоциация — это распад вещества на составляющие молекулы. Свойства кислоты или основания зависят от
равновесия, которое присутствует в воде:
Свойства кислоты или основания зависят от
равновесия, которое присутствует в воде:
H2O + H2O ↔ H3O+(р-р) + OH—(р-р)
Kc = [H3O+][OH—]/[H2O]2
Константа равновесия воды при t=25°: Kc = 1.83⋅10-6, также имеет место следующее равенство: [H3O+][OH—] = 10-14, что называется константой диссоциации воды. Для чистой воды [H3O+] = [OH—] = 10-7, откуда -lg[H3O] = 7.0.
Данная величина (-lg[h3O]) называется pH — потенциал водорода. Если pH < 7, то вещество имеет кислотные свойства, если pH > 7, то вещество имеет основные свойства.
Способы определения pH
Инструментальный метод
Специальный прибор pH-метр — устройство, трансформирующее концентрацию протонов в растворе в электрический
сигнал.
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора, используя несколько индикаторов можно добиться достаточно точного результата.
Соль
Соль — это ионное соединение образованное катионом отличным от H+ и анионом отличным от O2-. В слабом водном растворе соли полностью диссоциируют.
Что бы определить кислотно-щелочные свойства раствора соли, необходимо определить, какие ионы присутствуют в растворе и рассмотреть их свойства: нейтральные ионы, образованные из сильных кислот и оснований не влияют на pH: не отдают ионы ни H+, ни OH— в воде. Например, Cl—, NO—3, SO2-4, Li+, Na+, K+.
Анионы, образованные из слабых кислот, проявляют щелочные свойства (F—, CH3COO—,
CO2-3), катионов с щелочными свойствами не существует.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного основания, в основном состоят из:
- Смесь слабой кислоты, соответствующей соли и слабого основания
- Слабое основание, соответствующая соль и сильная кислота
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание с соответствующей солью, при этом необходимо учесть:
- Интервал pH в котором буфферный раствор будет эффективен
- Ёмкость раствора — количество сильной кислоты или сильного основания, которые можно добавить не повлияв на pH раствора
- Не должно происходить нежелаемых реакций, которые могут изменить состав раствор
Тест:
Химия
ОСНОВАНИЯ
Оглавление:
1. Определение
Определение
2. Классификация
3. Электролитическая
диссоциация
4. Получение
5. Важнейшие химические
свойства
6. Задания
7. Ответы
| Основания – это сложные вещества, состоящие из катионов металлов и одного или нескольких гидроксид-анионов (ОН—) |
КЛАССИФИКАЦИЯ
1. По растворимости в воде различают растворимые основания (щёлочи) и нерастворимые основания.
2. По числу гидроксид-анионов различают однокислотные, двухкислотные и трёхкислотные основания.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Растворимые основания при растворении в воде
диссоциируют на катионы металлов и гидроксид-анионы.
NaOH → Na+ +
OH—
KOH → K+ + OH—
Ba(OH)2 → Ba2+
+ 2OH—
ПОЛУЧЕНИЕ
Соль + щёлочь = основание + другая соль
CuSO4 + 2NaOH = Cu(OH)2 +
Na2SO4
K2CO3
+ Ba(OH)2 = 2КОН+BaCO3
Получение щелочей:
1. Активный металл + вода = щёлочь + водород
2Na+2H2O
= 2NaOH + H2↑
2. Основный оксид + вода = щёлочь
Li2O + H2O
= 2LiOH
ВАЖНЕЙШИЕ ХИМИЧЕСКИЕ СВОЙСТВА
1. Реакция нейтрализации: основание +
кислота = соль + вода
NaOH +
HCl = NaCl + H2O
2. Щёлочь + соль = основание + другая соль
2NaOH + CuSO4 = Cu(OH)2 +
Na2SO4
3. Щёлочь + кислотный оксид = соль + вода
Щёлочь + кислотный оксид = соль + вода
2NaOH +
SO3 = Na2SO4
+ H2O
4. Нерастворимые основания разлагаются при нагревании:
основание = оксид металла + вода
Cu(OH)2
= CuO + H2O
5. Растворы щелочей (благодаря диссоциации на ионы) изменяют
окраску индикаторов:
Лакмус: синий→розовый
Фенолфталеин: бесцветный→малиновый
ЗАДАНИЯ
Задание 1. Из приведённого перечня выберите
основания, назовите их, определите тип.
1) NaOH 2)
Li2O 3) Ba(OH)2 4)
CuSO4 5) P2O5 6) Al(OH)3
7) HCl 8) C2H5OH
Задание 2. С какими из перечисленных веществ
может реагировать а) NaOH б)
Cu(OH)2
1)Na2O 2)SO3 3)H2O
4)NaOH 5)H2SO4 6)Na2SO4
7) HCl 8) AlCl3
ОТВЕТЫ.
Наверх
Презентация по химии на тему «Основания, их состав и классификация. Химические свойства и применение оснований»
Основания, их состав и классификация. Химические свойства и применение оснований.
8 класс
Преподаватель:
Жиенгалиева Айдана Болатовна
Запомни!
Основания – это сложные вещества, состоящие из атомов металлов и одной или нескольких гидроксогрупп (ОН).
Например: NaOH , Ca(OH) 2 , Fe(OH) 3 …
Химические формулы некоторых оснований
Название и символ
металла
Валентность металла в гидроксидах
Натрий , Na
Барий , Ва
Железо , Fe (III)
Кальций, Са
Алюминий , Al
Рубидий ,Rb
I
II
III
II
III
I
Химическая формула оснований
Название оснований
NaOH
Ba(OH) 2
Fe(OH) 3
Са (OH) 2
Al(OH) 3
RbOH
Гидроксид натрия
Гидроксид бария
Гидроксид железа ( III )
Гидроксид кальция
Гидроксид алюминия
Гидроксид рубидия
Укажите соответствующие названия данным основаниям
KOH
Гидроксид кальция
Гидроксид железа (III)
Mg(OH) 2
Ca(OH) 2
Г идроксид натрия
Г идроксид магния
Fe(OH) 3
NaOH
Г идроксид калия
Классификация
Основания
Растворимые в воде (щелочи)
NaOH , Ca(OH) 2
LiOH, Ba(OH) 2
Нерастворимые в воде
Cu(OH) 2 , Mg(OH) 2
Fe(OH) 3 , Zn(OH) 2
Амфотерные
Zn(OH) 2 , Pb(OH) 2
Al(OH) 3
Способы получения оснований
Получение оснований
Растворимых (щелочи)
нерастворимых
1. Активный металл + вода = щелочь + водород
Активный металл + вода = щелочь + водород
2 Li + 2HOH = 2LiOH + H 2
2. Оксид активного металла + вода = щелочь:
СаО + НОН = Са(ОН) 2
3.Электролиз растворов хлоридов активных металлов:
2 NaCl + 2H 2 O = H 2 + Cl 2 + NaOH
1. Соль (в растворе) + щелочь = нерастворимое основание + другая соль (в состав соли должен входить металл, способный образовывать нерастворимое основание):
FeCl 3 + 3NaOH = Fe(OH) 3 + 3NaCl
Изменение цвета разных индикаторов под воздействием растворов кислот и оснований
Индикатор
Цвет индикаторов в среде
Кислой
Лакмус
щелочной
Красный
Фенолфталеин
Бесцветный
нейтральной
Метиловый оранжевый
Синий
Малиновый
Фиолетовый
Розовый
Бесцветный
Желтый
Оранжевый
Химические свойства оснований
- основание + кислота = соль + вода ( р-я нейтрализации)
2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O
- щелочь + кислотный оксид = соль + вода
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
- щелочь + соль = новая соль + нерастворимое основание
3NaOH + FeCl 3 = 3NaCl + Fe(OH) 3
4. Нерастворимые в воде основания при нагревании разлагаются на оксид и воду
Нерастворимые в воде основания при нагревании разлагаются на оксид и воду
Cu(OH) 2 = t С uO + H 2 O
Применение
NaOH — г идроксид натрия ( едкий натр, каустическая сода ) , применяется в промышленности для изготовления мыла, искусственного шелка, бумаги, красителей, а также для очистки бензина, керосина и т.д.
КОН – гидроксид калия, как и едкий натр, применяется главным образом для изготовления мыла, но только жидкого…
Са(ОН) 2 – гидроксид кальция (гашенная известь) широко используется в строительном деле. При смешивании его с водой образуется так называемое известковое молоко, которое широко используют в химической промышленности, например при производстве сахара, соды и т.д
Проверь свои знания
Закончите уравнения химических реакций, схемы которых приведены ниже:
1. К OH + HCl =
К OH + HCl =
2. Zn(OH) 2 + HCl =
3. NaOH + SO 2 =
4. MgSO 4 + NaOH =
5. Cu(OH) 2 =
Урок окончен!
Спасибо за внимание!
Урок по теме «Основание». 8-й класс
Цели урока:
- Образовательные:
- сформировать представления о классе сложных веществ – основаниях, их составе, общей формуле и их названиях, классификации оснований по растворимости в воде, качественном определении растворимых оснований индикаторами;
- познакомить с физическими свойствами, значением в жизни человека и применением некоторых оснований; научить составлять формулы оснований и называть их, определять по составу соединения принадлежность его к классу оснований, индикаторами определять растворимые основания – щелочи;
- учить работать с растворами щелочей, соблюдая
правила ТБ и ОТ.

- Развивающие: развивать мышление обучающихся, умение анализировать, сравнивать, обобщать, выделять существенные признаки и свойства объектов, классифицировать факты, делать выводы.
- Воспитательные: продолжить формирование познавательного интереса к предмету через использование нестандартных фор обучения и создания ситуации успеха, работа в паре, взаимопроверка.
Планируемый результат.
Предметные умения:
- в познавательной сфере: давать определения понятий основания, индикатор; научиться называть основания, различать растворимые и нерастворимые основания, определять с помощью индикаторов растворимые основания;
- в трудовой сфере: планировать и проводить химический эксперимент;
УУД:
- личностные: умение управлять своей познавательной деятельностью
- регулятивные: устанавливать целевые приоритеты; планировать пути достижения целей; самостоятельно оценивать правильность выполнения действия по ходу его реализации;
- познавательные: давать определение понятиям, строить классификацию на основе дихотомического деления, осуществлять сравнение, устанавливать причинно-следственные связи;
- коммуникативные: формулировать собственное мнение и позицию, аргументировать и координировать её с позициями партнёров в сотрудничестве, работать в группе — устанавливать рабочие отношения, эффективно сотрудничать
Технология: технология критического
мышления через чтение и письмо,
системно-деятельный подход, проблемное обучение.
Тип урока: урок открытия новых знаний
ХОД УРОКА
1. Этап подготовительной подготовки для работы на уроке
– Здравствуйте ребята! Сейчас вам будет предложено задание по изученному материалу, и оно позволит нам перейти к изучению нового материала.
2. Стадия вызова
Учитель: На слайде и у вас на столе есть задания, где приведены формулы веществ CuO, NaOH, H2, Fe, H2O, O2, Ca(OH)2, SO2, Cu(OH)2, AI (OH)3
- Выберите из списка простые вещества?
- Выпишите из списка оксиды и выпишите их в столбик
- Назовите оксиды.
- Ответы учеников
- Показать слайд с эталоном ответа.
Учитель: Дайте определение оксидов?
Учитель: Дайте определение простым и
сложным веществам. Приведите примеры.
Приведите примеры.
Учитель: Какие вещества вы не выписали
из списка?
Ученики: NaOH, Ca(OH)2, Cu(OH)2, AI (OH)3Почему? (Так как мы их не изучали)
Учитель: Сравните их состав, что общего
и какие различия? (Общее: состоят из трех
элементов, содержат группу атомов ОН и металл.
Отличие – в состав входит разный металл).
Учитель: Как вы думаете, эти вещества
можно отнести к бинарным соединениям? Почему?
Учитель: Как вы думаете, эти вещества
можно отнести к отдельному классу соединений.
Учитель: Давайте попытаемся
сформулировать тему и цель нашего урока
3. Стадия осмысления
1. Определение, номенклатура (название) оснований.
Учитель: Ребята, чтобы ответить на эти
вопросы нужно прочитать текст параграфа 19 стр. 98-99 до пункта о гидроксиде натрия.
98-99 до пункта о гидроксиде натрия.
Ответы учащихся после прочтения первого фрагмента параграфа
- Дайте определение основаниям? (Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид-ионов).
- Что собой представляет гидроксогруппа? (Гидроксогруппа представляет собой сложный ион, заряд которого 1–)
- Как посчитали заряд гидроксид-иона? (– 2 + 1 = – 1)
- Какой общей формулой можно выразить состав основания? (М(ОН)n, где М – металл, n – число групп ОН– и в то же время численное значение заряда иона (степени окисления) металла).
- Как называют основания? (Названия оснований состоят из слова гидроксид и наименования металла в родительном падеже с указанием СО, если переменная).
- Назовите вещества, которые мы не выписали из ранее предложенного списка NaOH, Ca(OH)2, Cu(OH)2, AI(OH)3?
2. Растворимость оснований в воде.
Растворимость оснований в воде.
Учитель: Для того чтобы ответить на вопрос о растворимости оснований в воде, мы выполним с вами химический эксперимент по инструктивной карте.
Инструктивная карточка для выполнения эксперимента
- Изучить правила ТБ при работе с щелочами. (на столе)
- Проверьте наличие необходимого оборудования: пробирочный штатив с пробирками, твердые гидроксид натрия, гидроксид меди (II), гидроксид кальция, вода. Выпишите названия выданных оснований в предложенную таблицу.
- Прилейте в пробирки воды до половины каждой пробирки. Перемешайте содержимое стеклянной палочкой.
- Сделайте вывод о растворимости оснований и оформите отчет в таблице
| Исследуемое вещество | Формула | Цвет | Отношение к воде |
| Гидроксид натрия | NаОН | Белое | Хорошо растворимое |
| Гидроксид меди (II) | Cu(ОН)2 | Синее | Нерастворимое |
| Гидроксид кальция | Са(ОН)2 | Белое | Малорастворимое |
– На какие группы основания делят по отношению
к воде? Приведите примеры. (Растворимые
(щелочи), малорастворимые и нерастворимые).
(Растворимые
(щелочи), малорастворимые и нерастворимые).
Растворимые основания в воде называются щелочами.
3. Физические свойства оснований, применение. Качественные реакции
Учитель: Ребята, чтобы ответить на эти вопросы нужно прочитать текст параграфа 19 стр. 99-101 с пункта гидроксид натрия и до конца. Применение оснований можно составить схему.
Ответы учащихся после прочтения первого фрагмента параграфа
- Перечислите физические свойства гидроксида натрия
- Перечислите физические свойства гидроксида калия
- Перечислите физические свойства гидроксида кальция
- Как называют прозрачный раствор гидроксида кальция? (Известковая вода).
- Как можно распознать углекислый газ? (Пропустить углекислый газ через известковую воду, она помутнеет)
- Какие реакции называются качественными?
- Как можно распознать растворы щелочей?
- Какие индикаторы вы знаете?
Инструкция по проведению химического исследования «Изменение окраски индикаторов в растворах щелочей»
Порядок действий.
- Проверьте наличие необходимого оборудования: 3 пробирки с раствором гидроксида натрия, растворы метилового оранжевого, фенолфталеина, лакмуса, штатив с пробирками.
- Прилейте в первую пробирку раствор метилового оранжевого. Как изменилась окраска?
- Прилейте во 2-ю пробирку раствор фенолфталеина. Как изменилась окраска?
- Прилейте в 3-ю пробирку раствор лакмуса. Как изменилась окраска?
- Оформите отчет в виде таблице
Что делали |
Что наблюдали |
| В первую пробирку прилили к раствору гидроксида натрия м/о | м/о стал желтый |
| Во вторую пробирку прилили в раствору гидроксида натрия ф/ф | ф/ф стал малиновый |
| К третьей пробирке прилили к раствору гидроксида натрия лакмус | Лакмус стал фиолетовый |
Вывод: по эксперименту Как определить растворы щелочей и использованием индикаторов??
4. Закрепление изученного материала.
Рефлексия
Закрепление изученного материала.
Рефлексия
Учитель: Сейчас мы проведем Контрольное тестирование. Посмотрим, как вы усвоили новую тему. За данную работу будут выставлена оценка
Основанием является:
1) Na2O 2) NaNO3 3) O2 4) NaOH
Нерастворимым основанием является:
1) NaOH 2) Cu(OH)2 3) Ca(OH)2 4) KOH
Фенолфталеин будет малиновым в растворе:
1) KOH 2) Cu(OH)2 3) K2O 4) H2O
Учитель: С каким классов веществ мы сегодня познакомились?
Учитель: Дайте определение основаниям? (Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид-ионов). СЛАЙД
Учитель: Какие бывают основания по растворимости в воде?
Учитель: С помощью, каких веществ можно распознавать растворы щелочей?
Учитель: Пригодятся нам эти вещества в жизни? Где применяют основания? (СХЕМА)
5. Домашнее задание: Учебник Габриелян
О.С. Химия. 8 класс. М.: Дрофа, 2009г. § 19 стр. упр. 2, 3,4.
(Слайд)
Домашнее задание: Учебник Габриелян
О.С. Химия. 8 класс. М.: Дрофа, 2009г. § 19 стр. упр. 2, 3,4.
(Слайд)
6. Итог урока
Учитель: Ребята, вы мне сегодня помогли провести урок. Мне понравилось, как вы работали на уроке.
Учитель: Ребята закончите следующие фразы
- Я узнал …
- Я научился …
- Я понял, что могу …
- Мне понравилось …
- Для меня стало новым …
- Меня удивило …
- У меня получилось …
- Я приобрёл …
- Мне захотелось …
- Меня воодушевило …
Оценки за урок выставляются наиболее активно работавшим на уроке учащимся и по итогам проверки работы.
Приложение 1
Щелочь. Основания. Свойства оснований
Нерастворимое основание: гидроксид меди
Основания — называют электролиты, в растворах которых отсутствуют анионы, кроме гидроксид-ионов (анионы — это ионы, которые имеют отрицательный заряд, в данном случае — это ионы OH — ). Названия оснований состоят из трёх частей: слова гидроксид, к которому добавляют название металла (в родительном падеже). Например, гидроксид меди (Cu(OH)2).
Для некоторых оснований могут используются старые названия, например гидроксид натрия (NaOH) — натриевая щелочь.
Названия оснований состоят из трёх частей: слова гидроксид, к которому добавляют название металла (в родительном падеже). Например, гидроксид меди (Cu(OH)2).
Для некоторых оснований могут используются старые названия, например гидроксид натрия (NaOH) — натриевая щелочь.
Едкий натр, гидроксид натрия, натриевая щелочь, каустическая сода — всё это одно и тоже вещество, химическая формула которого NaOH. Безводный гидроксид натрия — это белое кристаллическое вещество. Раствор — прозрачная жидкость, на вид ничем не отличимая от воды. При использовании будьте осторожны! Едкий натр сильно обжигает кожу!
В основу классификации оснований положена их способность растворяться в воде. От растворимости в воде зависят некоторые свойства оснований. Так, основания, растворимые в воде, называют щелочью. К ним относятся
гидроксиды натрия (NaOH), гидроксид калия (KOH), лития (LiOH), иногда к их числу прибавляют и гидроксид кальция (Ca(OH)2)), хотя на самом деле — это малорастворимое вещество белого цвета (гашенная известь).
Так, основания, растворимые в воде, называют щелочью. К ним относятся
гидроксиды натрия (NaOH), гидроксид калия (KOH), лития (LiOH), иногда к их числу прибавляют и гидроксид кальция (Ca(OH)2)), хотя на самом деле — это малорастворимое вещество белого цвета (гашенная известь).
Получение оснований
Получение оснований и щелочей может производиться различными способами. Для получения щелочи можно использовать химическое взаимодействие металла с водой.
Такие реакции протекают с очень большим выделением тепла, вплоть до воспламенения (воспламенение происходит по причине выделения водорода в процессе реакции).
2Na + 2H2O → 2NaOH + H2
Негашенная известь — CaOCaO + H2O → Ca(OH)2
Но в промышленности эти методы не нашли практического значения, конечно кроме получения гидроксида кальция Ca(OH)2.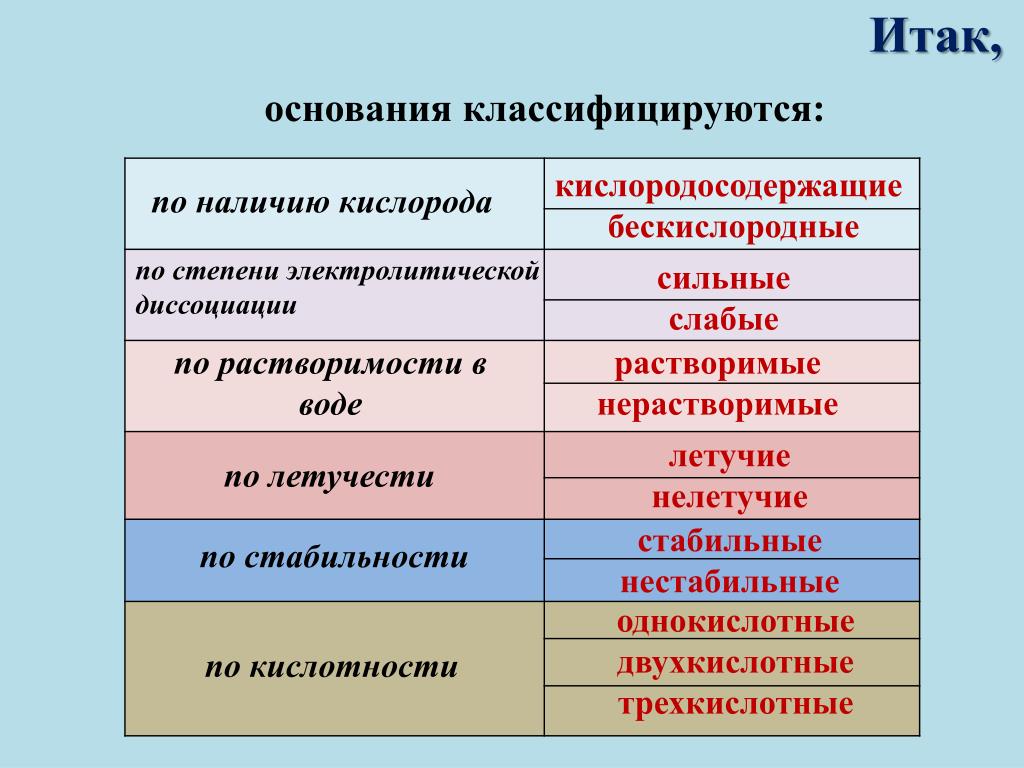 Получение гидроксида натрия и гидроксида калия связано с использованием электрического тока. При электролизе водного раствора хлорида натрия или калия на катоде выделяются водород, а на аноде — хлор, при этом в растворе, где происходит электролиз, накапливается щелочь!
Получение гидроксида натрия и гидроксида калия связано с использованием электрического тока. При электролизе водного раствора хлорида натрия или калия на катоде выделяются водород, а на аноде — хлор, при этом в растворе, где происходит электролиз, накапливается щелочь!
KCl + 2H2O →2KOH + H2 + Cl2 (эта реакция проходит при пропускании электрического тока через раствор).
Нерастворимые основания осаждают щелочами из растворов соответствующих солей.
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Свойства оснований
Щелочи устойчивы к нагреванию. Гидроксид натрия можно расплавить и расплав довести до кипения, при этом он разлагаться не будет.
Щелочи легко вступают в реакцию с кислотами, в результате которого образуется соль и вода. Эта реакция ещё носит название — реакция нейтрализации
Эта реакция ещё носит название — реакция нейтрализации
KOH + HCl → KCl + H2O
Щёлочи взаимодействуют с кислотными оксидами, в результате которой образуется соль и вода.
2NaOH + CO2 → Na2CO3 + H2O
Нерастворимые основания, в отличии от щелочей, термически не стойкие вещества. Некоторые из них, например, гидроксид меди, разлагаются при нагревании,
Cu(OH)2 + CuO → H2O
другие — даже при комнатной температуре (например, гидроксид серебра — AgOH).
Нерастворимые основания взаимодействуют с кислотами, реакция происходит лишь в том случае, если соль, которая образуется при реакции, растворяется в воде.
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Растворение щелочного металла в воде с изменение цвета индикатора на ярко-красный
Щелочные металлы — такие металлы, которые при взаимодействии с водой образуют щелочь. К типичному представителю щелочных металлов относится натрий Na. Натрий легче воды, поэтому его химическая реакция с водой происходит на её поверхности. Активно растворяясь в воде, натрий вытесняет из неё водород, при этом образуя натриевую щелочь (или гидроксид натрия) — едкий натр NaOH.
Реакция протекает следующим образом:
К типичному представителю щелочных металлов относится натрий Na. Натрий легче воды, поэтому его химическая реакция с водой происходит на её поверхности. Активно растворяясь в воде, натрий вытесняет из неё водород, при этом образуя натриевую щелочь (или гидроксид натрия) — едкий натр NaOH.
Реакция протекает следующим образом:
2Na + 2H2O → 2NaOH + H2
Подобным образом ведут себя все щелочные металлы. Если перед началом реакцией в воду добавить индикатор фенолфталеин, а затем опустить в воду кусочек натрия, то натрий будет скользить по воде, оставляя за собой ярко розовый след образовавшейся щелочи (щелочь окрашивает фенолфталеин в розовый цвет)
Гидроксид железа
Гидроксид железа является основанием. Железо, в зависимости от степени его окисления, образует два разных основания: гидроксид железа, где железо может иметь валентности (II) — Fe(OH)2 и (III) — Fe(OH)3. Как и основания, образованные большинством металлов, оба основания железа не растворимы в воде.
Как и основания, образованные большинством металлов, оба основания железа не растворимы в воде.
Гидроксид железа 3-х валентного
Гидроксид железа (II) — белое студенистое вещество (осадок в растворе), которое обладает сильными восстановительными свойствами. К тому же, гидроксид железа (II) очень не стойкий. Если к раствору гидроксида железа (II) добавить немного щёлочи, то выпадет зелёный осадок, который достаточно быстро темнеет о превращается в бурый осадок железа (III).
Гидроксид железа (III) имеет амфотерные свойства, но кислотные свойства у него выражены значительно слабее. Получить гидроксид железа (III) можно в результате химической реакции обмена между солью железа и щёлочью. Например
Fe2(SO4)3 + 6 NaOH → 3 Na2SO4 +2 Fe(OH)3
База(химия) — Энциклопедия Нового Света
В химии основание считается веществом, которое может принимать протоны или любое химическое соединение, которое дает ионы гидроксида (ОН — ) в растворе. Его также обычно называют любым веществом, которое может реагировать с кислотой, чтобы уменьшить или нейтрализовать ее кислотные свойства, изменить цвет индикаторов (например, сделать красную лакмусовую бумагу синей), быть скользким на ощупь в растворе, иметь горький вкус, реагировать с кислотами с образованием солей и способствуют определенным химическим реакциям (например,г. основной катализ). Примерами простых оснований являются гидроксид натрия и аммиак. Гидроксид натрия (NaOH), также известный как едкий натр или щелочь, диссоциирует в воде с образованием ионов гидроксида (OH —) и ионов натрия (Na + ).
Его также обычно называют любым веществом, которое может реагировать с кислотой, чтобы уменьшить или нейтрализовать ее кислотные свойства, изменить цвет индикаторов (например, сделать красную лакмусовую бумагу синей), быть скользким на ощупь в растворе, иметь горький вкус, реагировать с кислотами с образованием солей и способствуют определенным химическим реакциям (например,г. основной катализ). Примерами простых оснований являются гидроксид натрия и аммиак. Гидроксид натрия (NaOH), также известный как едкий натр или щелочь, диссоциирует в воде с образованием ионов гидроксида (OH —) и ионов натрия (Na + ).
имеют множество практических применений, и некоторые из них обычно используются дома. Хозяйственный аммиак – привычное чистящее средство. Щелок используется для очистки засоров и стоков раковин. Гидроксид калия, также называемый едким калием, используется для изготовления мягкого мыла, которое легко растворяется в воде. Гидроксид магния в воде (также называемый магнезиальным молоком) используется как антацид или слабительное.
Гидроксид магния в воде (также называемый магнезиальным молоком) используется как антацид или слабительное.
Щелочь и основание
Истоки понятий
Термин «щелочь» происходит от арабского слова al qalīy , означающего «прокаленный пепел». Считалось, что эта растительная зола обладает такими свойствами, как способность обращать вспять действие кислот и моющая способность. Таким образом, щелочь изначально считалась антитезой кислоты. Образование солей в результате реакции кислоты и щелочи привело к мнению, что соли могут быть получены из двух компонентов противоположной природы.
Однако не все некислотные компоненты обладают щелочными свойствами. Примерами являются оксиды и гидроксиды тяжелых металлов. Отсюда и родилось понятие «база». Впервые это понятие было введено французским химиком Гийомом Франсуа Руэлем в 1754 г. Он отметил, что кислоты, которые в те времена представляли собой в основном летучие жидкости, например уксусную кислоту, превращались в твердые соли только при соединении с определенными веществами. Эти вещества образовали конкретную основу , для соли, [1] , отсюда и название.
Эти вещества образовали конкретную основу , для соли, [1] , отсюда и название.
Путаница между основанием и щелочью
Термины «основание» и «щелочь» часто используются взаимозаменяемо, потому что наиболее распространенными основаниями являются щелочи. Обычно говорят об «измерении щелочности почвы», когда на самом деле имеется в виду измерение pH (основного свойства). Точно так же основания, которые не являются щелочами, такие как аммиак, иногда ошибочно называют щелочными.
Обратите внимание, что не все или даже большинство солей, образованных щелочными металлами, являются щелочными; это обозначение относится только к тем солям, которые являются основными.
Хотя большинство электроположительных оксидов металлов являются основными, только растворимые оксиды щелочных и щелочноземельных металлов можно правильно назвать щелочами.
Это определение щелочи как основной соли щелочного металла или щелочноземельного металла кажется наиболее распространенным, основываясь на словарных определениях, [2] однако существуют противоречивые определения термина щелочь. К ним относятся:
К ним относятся:
- Любое водорастворимое основание [3] Щелочь, Farlex, 2008.Проверено 8 апреля 2008 г. Это более точно называется базой Аррениуса.
- Раствор основания в воде. [4]
Определения кислот и оснований
Кислоты и основания образуют комплементарные пары, поэтому их определения необходимо рассматривать вместе. Существуют три общие группы определений: определения Аррениуса , определения Бренстеда-Лоури и определения Льюиса в порядке возрастания общности.
- Аррениус : Согласно этому определению, кислота — это вещество, которое увеличивает концентрацию иона гидроксония (H 3 O + ) при растворении в воде, а основания — это вещества, которые увеличивают концентрацию ионов гидроксида ( ОН — ).Это определение ограничивает кислоты и основания веществами, которые могут растворяться в воде. Около 1800 года многие французские химики, в том числе Антуан Лавуазье, ошибочно полагали, что все кислоты содержат кислород.
 Действительно, современное немецкое слово для обозначения кислорода — Sauerstoff (буквально «кислое вещество»). Английские химики, в том числе сэр Гемфри Дэви, в то же время считали, что все кислоты содержат водород. Шведский химик Сванте Аррениус использовал это убеждение для разработки этого определения кислоты.
Действительно, современное немецкое слово для обозначения кислорода — Sauerstoff (буквально «кислое вещество»). Английские химики, в том числе сэр Гемфри Дэви, в то же время считали, что все кислоты содержат водород. Шведский химик Сванте Аррениус использовал это убеждение для разработки этого определения кислоты. - Brønsted-Lowry : Согласно этому определению, кислота является донором протона (водородного ядра), а основание является акцептором протона (водородного ядра).Говорят, что кислота диссоциирует после отдачи протона. Кислота и соответствующее основание называются сопряженными кислотно-основными парами. Бренстед и Лоури сформулировали это определение, которое включает нерастворимые в воде вещества, не подпадающие под определение Аррениуса.
- Lewis : Согласно этому определению, кислота является акцептором электронной пары, а основание является донором электронной пары. (Их часто называют «кислотами Льюиса [5] » и «основаниями Льюиса [6] », и они являются электрофилами [7] и нуклеофилами [8] соответственно в органической химии; Льюис основания также являются лигандами в координационной химии.
 ) Кислоты Льюиса включают вещества без переносимых протонов (т. Е. H + ионов водорода), такие как хлорид железа (III), и, следовательно, определение кислоты по Льюису имеет более широкое применение, чем определение Бренстеда-Лоури. Определение Льюиса также можно объяснить с помощью теории молекулярных орбиталей. В общем, кислота может получить пару электронов на своей низшей незанятой орбитали (НСМО) с высшей занятой орбитали (ВЗМО) основания. То есть ВЗМО от основания и НСМО от кислоты объединяются в связывающую молекулярную орбиталь.Это определение было разработано Гилбертом Н. Льюисом.
) Кислоты Льюиса включают вещества без переносимых протонов (т. Е. H + ионов водорода), такие как хлорид железа (III), и, следовательно, определение кислоты по Льюису имеет более широкое применение, чем определение Бренстеда-Лоури. Определение Льюиса также можно объяснить с помощью теории молекулярных орбиталей. В общем, кислота может получить пару электронов на своей низшей незанятой орбитали (НСМО) с высшей занятой орбитали (ВЗМО) основания. То есть ВЗМО от основания и НСМО от кислоты объединяются в связывающую молекулярную орбиталь.Это определение было разработано Гилбертом Н. Льюисом.
Общие свойства
Некоторые общие свойства оснований включают:
- Вкус : Горький вкус (в отличие от кислого вкуса кислот и сладости альдегидов и кетонов)
- Прикосновение : Ощущение слизи или мыла на пальцах
- Реакционная способность :Каустическая [9] по органическим веществам, бурно реагируют с кислотными или восстанавливаемыми веществами
- Электропроводность : Водные растворы или расплавленные основания диссоциируют на ионы и проводят электричество
- Лакмусовая бумажка : Красные основания окрашивают лакмусовую бумагу в синий цвет.
 {-}] \over [BH]}}
{-}] \over [BH]}}
Константа равновесия Kb также называется базовой константой ионизации. Это относится к реакции, в которой основание образует свою сопряженную кислоту путем удаления иона H + из воды.pH (нечистой) воды является мерой ее кислотности. В чистой воде примерно одна из десяти миллионов молекул диссоциирует на ионы гидроксония (H 3 O + ) и ионы гидроксида (OH — ) в соответствии со следующим уравнением:
- 2H 2 O(l) ⇌ H 3 O + (водн.) + OH — (водн.)
Основание принимает (удаляет) ионы гидроксония 3 90 4 906 [906] 9000 O + ) из раствора, либо отдает в раствор ионы гидроксида [11] (OH — ).Оба действия снизят концентрацию ионов гидроксония и, таким образом, повысят pH. Напротив, кислота отдает в раствор ионы H 3 O + или принимает OH − , тем самым снижая pH.

Например, если 1 моль гидроксида натрия (40 г) растворить в 1 литре воды, концентрация ионов гидроксида станет [OH − ] = 1 моль/л. Следовательно, [H + ] = 10 — 14 моль/л, а pH = -log 10 – 14 = 14. 14
Базовая прочность
A «Сильное основание» полностью гидролизуется, депротонируя кислоты в кислотно-щелочной реакции и, следовательно, повышая рН раствора до 14. Соединения с рН более 13 называются сильными основаниями. Сильные основания, как и сильные кислоты, воздействуют на живые ткани и вызывают серьезные ожоги. Они реагируют на кожу иначе, чем кислоты, поэтому, хотя сильные кислоты вызывают коррозию, мы говорим, что сильные основания являются едкими. Типичными примерами сильных оснований являются гидроксиды щелочных и щелочноземельных металлов, таких как NaOH и Ca(OH) 2 .Очень сильные основания способны депротонировать даже очень слабокислые С-Н группы в отсутствие воды. Супероснования — это класс особо основных соединений, а гарпунные основания — это особый класс сильных оснований с плохой нуклеофильностью.

Примеры сильных оснований (гидроксидных соединений) в убывающей силе:
- Гидроксид калия (КОН)
- Гидроксид бария (Ba(OH) 2 )
- Гидроксид цезия (CsOH)
- Гидроксид натрия (NaOH)
- Гидроксид стронция (Sr(OH) 2 )
- Гидроксид кальция (Ca(OH) 2 )
- Гидроксид лития (LiOH)
- Гидроксид рубидия (RbOH)
Катионы этих сильных оснований появляются в группах 1 и 2 периодической таблицы (щелочные и щелочноземельные металлы).
Еще более прочные основания:
- Гидрид натрия (NaH)
- Диизопропиламид лития (LDA) (C 6 H 14 LiN)
- Амид натрия (NaNH 2 )
A «Слабое основание» не полностью ионизируется в растворе. Когда основание ионизируется, оно поглощает ион водорода из окружающей его воды, оставляя после себя ион ОН-. Слабые основания имеют более высокую концентрацию H + , чем сильные основания. Слабые основания находятся в химическом равновесии так же, как и слабые кислоты.Базовая константа ионизации K b указывает на прочность основания. К более сильным основаниям относятся крупные K b s. pH основания больше 7 (где 7 — нейтральное число, ниже 7 — кислота), обычно до 14.
Типичным примером слабого основания является аммиак, который используется для очистки.
Слабые основания находятся в химическом равновесии так же, как и слабые кислоты.Базовая константа ионизации K b указывает на прочность основания. К более сильным основаниям относятся крупные K b s. pH основания больше 7 (где 7 — нейтральное число, ниже 7 — кислота), обычно до 14.
Типичным примером слабого основания является аммиак, который используется для очистки.Примеры слабых оснований:
- Аланин (C 3 H 5 O 2 NH 2 )
- Аммиак (вода) (NH 3 (NH 4 OH))
- Диметиламин ((CH 3 ) 2 NH)
- Этиламин (C 2 H 5 NH 2 )
- Глицин (C 2 H 3 O 2 NH 2 )
- Гидразин (N 2 H 4 )
- Метиламин (CH 3 NH 2 )
- Триметиламин ((CH 3 ) 3 N)
Кислотно-основная нейтрализация
Основания можно рассматривать как химическую противоположность кислот.
 Реакция между кислотой и основанием называется нейтрализацией. Основания и кислоты рассматриваются как противоположности, потому что эффект кислоты заключается в увеличении концентрации ионов гидроксония (H 3 O + ) в воде, тогда как основания уменьшают эту концентрацию. Основания реагируют с кислотами с образованием солей и воды.
Реакция между кислотой и основанием называется нейтрализацией. Основания и кислоты рассматриваются как противоположности, потому что эффект кислоты заключается в увеличении концентрации ионов гидроксония (H 3 O + ) в воде, тогда как основания уменьшают эту концентрацию. Основания реагируют с кислотами с образованием солей и воды.Положительный ион соли образуется из основания, а отрицательный ион – из кислоты. При рассмотрении гидроксида металла в качестве основания общая реакция выглядит следующим образом:
- HX(aq) + MOH(aq) → MX(aq) + HOH(l)
- кислота
Сильная кислота HCl (соляная кислота) реагирует с сильным основанием NaOH (гидроксид натрия) с образованием NaCl (соль = хлорид натрия) и воды.Если количества кислоты и основания находятся в правильном стехиометрическом соотношении, то реакция будет полностью нейтрализована, при этом и кислота, и основание потеряют свои соответствующие свойства.

- HCl (AQ) + NaOH (AQ) → NaCL (AQ) + H 2 O (L) 2 O (L) 2 O (L) 2 O (L) O (L)
- Сильная прочная соленая вода
- кислотная база
соли сильных оснований и слабых кислотыСильное основание NaOH (гидроксид натрия) добавляют к слабой кислоте CH 3 COOH (уксусной кислоте) в 1 л раствора с образованием NaCH 3 COO (ацетат натрия) и воды.
- CH 3 COOH (AQ) + NAOH (AQ) → Nach 3 COO (AQ) + H 2 O (L) 2 O (L) 2 O (L) 9
- Слабая слабая соленая вода
- кислотная база
- NH 3 (AQ) + HCl (AQ) → NH 4 CL (AQ) CL (AQ) CL (AQ)
- Слабая прочная соль
- Базовая кислота
- NH 4 + (AQ) + H 2 O (L) ↔ H 3 O + (AQ) + NH 3 (AQ) K A (NH 4 + ) = 5.6 x 10-10
- F — (AQ) + H 2 O (L) ↔ HF (AQ) + OH — (AQ) K B (F — ) = 1.4 х 10-11
- гидроксид натрия (часто называемый «едким натром»)
- гидроксид калия (обычно называемый «калий»)
- щелочь (общий термин для любого из двух предыдущих или даже для смеси)
- карбонат кальция (иногда называемый «свободной известью»)
- гидроксид магния является примером нетипичной щелочи: это слабое основание (не определяется фенолфталеином) и плохо растворяется в воде.
- Na 2 CO 3 + H 2 O → 2 Na + + HCO 3 — + OH — 8
- NH 3 + H 2 O → NH 4 + + OH —
- Теории кислотно-основных реакций
- Кислота
- ↑ Уильям Б. Дженсен, «Происхождение терминологической базы», Journal of Chemical Education , 1130 83(8) (август 2006 г.
 ).
). - ↑ Alkali, Lexico Publishing Group, LLC. Проверено 8 апреля 2008 г.
- ↑ Алкали, Тискали, 2008.Проверено 8 апреля 2008 г.
- ↑ Кислоты, основания и соли, КриссТал, 2005. Проверено 8 апреля 2008.
- ↑ Вещество, способное принять пару электронов для образования новой связи.
- ↑ Вещество, которое может отдать пару электронов для образования новой связи.
- ↑ Химическое соединение или группа, которые притягиваются к электронам и имеют тенденцию принимать электроны.
- ↑ Химическое соединение или группа, которая притягивается к ядрам и имеет тенденцию отдавать или делиться электронами.
- ↑ Способен гореть, разъедать, растворяться или разъедать при химическом воздействии.
- ↑ Гидратированный ион водорода, h4O + . Также называется ионом гидроксония.
- ↑ Ион ОН — , характерный для основных гидроксидов. Также называется ионом гидроксила.
- ↑ Дж. В. Мур, К.
 Л. Станицкий и П. К. Юрс, 2002, Химия и молекулярная наука , Нью-Йорк: Колледж Харкорт.
Л. Станицкий и П. К. Юрс, 2002, Химия и молекулярная наука , Нью-Йорк: Колледж Харкорт. - Браун, Теодор Э., Х. Юджин ЛеМэй и Брюс Э. Берстен. Химия: Центральная наука (10-е издание). Река Аппер-Сэдл, Нью-Джерси: Prentice Hall, 2005. ISBN 0-131096869- .
- Corwin, CH Введение в химические концепции и соединения (3-е изд.). Река Аппер-Сэдл, Нью-Джерси: Prentice Hall, 2001. ISBN 0130874701
- Макмерри, Дж., и Р. К. Фэй. Химия (4-е изд.). Река Аппер-Сэдл, Нью-Джерси: Prentice Hall, 2004. ISBN 0131402080
- Moore, J.W., C.L. Stanitski, and P.C. Jurs. Химия Молекулярная наука . Нью-Йорк: Колледж Харкорт, 2002. ISBN 0030320119 .
- Окслейд, Крис. Кислоты и основания (Химические вещества в действии). Библиотека Хайнемана, 2002 г. ISBN 1588101940
- CurTiPot – Диаграммы кислотно-щелочного равновесия, расчет pH и моделирование и анализ кривых титрования – бесплатное ПО
- Описание химических свойств оснований
- Список обычных бытовых применений для оснований
- Опишите роль баз в океане
- Последнее обновление
- Сохранить как PDF
- 14.1: Prelude — Sour Patch Kids
- Sour Patch Kids — это мягкие конфеты с покрытием из инвертного сахара и кислого сахара (комбинация лимонной кислоты, винной кислоты и сахара). Слоган конфеты «Кислый. Сладкий. Пропало» относится к ее вкусу от кислого до сладкого.
- 14.2: Кислоты — свойства и примеры
- Кислоты очень распространены в некоторых продуктах, которые мы едим. Цитрусовые, такие как апельсины и лимоны, содержат лимонную кислоту и аскорбиновую кислоту, более известную как витамин С. Газированные газированные напитки содержат фосфорную кислоту. Уксус содержит уксусную кислоту. Ваш собственный желудок использует соляную кислоту для переваривания пищи. Кислоты представляют собой отдельный класс соединений из-за свойств их водных растворов.

- 14.3: Основания – свойства и примеры
- Под основанием понимают вещество, которое может принимать протоны, или любое химическое соединение, которое дает гидроксид-ионы (ОН-) в растворе.Его также обычно называют любым веществом, которое может реагировать с кислотой, чтобы уменьшить или нейтрализовать ее кислотные свойства, изменить цвет индикаторов (например, сделать красную лакмусовую бумагу синей), быть скользким на ощупь в растворе, иметь горький вкус, реагировать с кислотами с образованием солей и промотируют определенные химические реакции (например, основной катализ).
- 14.4: Молекулярные определения кислот и оснований
- Хотя свойства кислот и оснований были известны уже давно, именно Сванте Аррениус в 1880-х годах определил, что свойства кислот обусловлены присутствием ионов водорода, а свойства оснований обусловлены присутствием гидроксид-ионов.
- 14.
 5: Реакции кислот и оснований
5: Реакции кислот и оснований - При соединении кислоты и основания образуются вода и соль. Соли представляют собой ионные соединения, содержащие положительный ион, отличный от H+, и отрицательный ион, отличный от гидроксид-иона, OH-. Реакции двойного замещения такого типа называются реакциями нейтрализации. Однако растворы солей не всегда имеют рН 7. В процессе, известном как гидролиз, ионы, образующиеся при соединении кислоты и основания, могут реагировать с водой с образованием слабокислых или щелочных растворов.
- 14.
- 14.7: Сильные и слабые кислоты и основания
- Кислоты классифицируются как сильные и слабые в зависимости от их ионизации в воде. Сильная кислота – это кислота, полностью ионизированная в водном растворе. Слабая кислота – это кислота, которая лишь слегка ионизируется в водном растворе. Уксусная кислота (содержится в уксусе) — очень распространенная слабая кислота.
- 14.
 8: Вода — кислота и основание в одном
8: Вода — кислота и основание в одном - Вода представляет собой интересное соединение во многих отношениях.Здесь мы рассмотрим его способность вести себя как кислота или основание. В некоторых случаях молекула воды принимает протон и, таким образом, действует как основание Бренстеда-Лоури.
- 14.
- 14.9: Буферные растворы, устойчивые к изменению pH
- Буферный раствор — это раствор, устойчивый к резким изменениям pH. Буферы делают это за счет того, что состоят из определенных пар растворенных веществ: либо слабая кислота плюс соль, полученная из этой слабой кислоты, либо слабое основание плюс соль этого слабого основания.
- 14.9: Шкалы рН и рОН — способы выражения кислотности и щелочности
- рН и рОН определяются как отрицательный логарифм концентрации ионов водорода и концентрации гидроксида соответственно. Знание любого из них может быть использовано для расчета либо [H+], либо [OH-].
 pOH связан с pH и может быть легко рассчитан из pH.
pOH связан с pH и может быть легко рассчитан из pH.
- 14.10: Кислотно-основное титрование
- Кислотно-основное титрование — это лабораторные процедуры, используемые для определения концентрации раствора. Одним из стандартных лабораторных упражнений по общей химии является кислотно-основное титрование.При кислотно-основном титровании кислоту известной концентрации (стандартный раствор) медленно добавляют к основанию неизвестной концентрации (или наоборот). В основу добавляют несколько капель индикаторного раствора. Индикатор по изменению цвета сигнализирует о нейтрализации основания (когда [H+] = [OH-]).
- Кислотный дождь можно нейтрализовать основными минералами, такими как известняк. (Известняк в основном состоит из карбоната кальция. [3] )
- В скрубберах, используемых на электростанциях, используются основания (например, гидроксид кальция) для уменьшения выделения оксидов серы (разновидность кислотного загрязнителя), образующихся на электростанции.
- Антациды содержат основания (чаще всего карбонат кальция), которые реагируют с желудочной кислотой для лечения изжоги и расстройства желудка. [4]
- Гидроксид натрия и гидроксид калия используются для изготовления мыла.
 [5]
[5] - Гипохлорит натрия (NaOCl) является основным ингредиентом отбеливателя для белья. [6]
- Бикарбонат натрия (пищевая сода) используется для получения газов для разрыхления хлеба и хлебобулочных изделий, а также в некоторых огнетушителях. [7]
- ↑ Химия LibreTexts.(11 июля 2018 г.). Обзор кислот и оснований [онлайн].
- ↑ Химия LibreTexts. (11 июля 2018 г.). Органические кислоты и органические основания [онлайн], Доступно: https://chem.
 libretexts.org/Textbook_Maps/Organic_Chemistry/Map%3A_Organic_Chemistry_(McMurry)/chapter_02%3A_Polar_Covalent_Bonds%3B_Acids_and_Bases/2.10_Органические_кислоты_и_органические_основания#Аммиак_как_слабое_основание
libretexts.org/Textbook_Maps/Organic_Chemistry/Map%3A_Organic_Chemistry_(McMurry)/chapter_02%3A_Polar_Covalent_Bonds%3B_Acids_and_Bases/2.10_Органические_кислоты_и_органические_основания#Аммиак_как_слабое_основание - ↑ Geology.com. (11 июля 2018 г.). Известняк [онлайн], Доступно: https://geology.com/rocks/limestone.shtml
- ↑ Библиографические тексты по химии. (11 июля 2018 г.). Изжога [онлайн], доступно: https://chem.libretexts.org/Textbook_Maps/General_Chemistry/Map%3A_A_Molecular_Approach_(Tro)/16%3A_Acids_and_Bases/16.01%3A_Heartburn
- ↑ Ogden Publications Inc. (11 июля 2018 г.). Живая Мать-Земля: рецепт мыла с медом и пчелиным воском [онлайн], доступно: https://www.motherearthliving.com/health-and-wellness/beauty-recipes/honey-and-beeswax-soap-recipe-ze0z1506zdeb
- ↑ Хлорокс. (11 июля 2018 г.). Что такое отбеливатель? [онлайн], доступно: https://www.clorox.com/how-to/laundry-basics/bleach-101/bleach/
- ↑ Piper Fire Protection Inc.
 (11 июля 2018 г.). Типы огнетушителей и их назначение . [онлайн]. Доступно: http://www.piperfire.com/types-of-fire-extinguishers-and-what-they-do/
(11 июля 2018 г.). Типы огнетушителей и их назначение . [онлайн]. Доступно: http://www.piperfire.com/types-of-fire-extinguishers-and-what-they-do/ - ↑ Взято из «Энергия: ее использование и окружающая среда» — Р.А. Хинрихс и М. Клейнбах, «Кислотный дождь», в Energy: its Use and the Environment , 5th ed. Торонто, Онтарио. Канада: Брукс/Коул, 2006 г., глава 8, раздел C, стр. 252–256.
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
- Горький вкус (в отличие от кислого вкуса кислот)
- Ощущение слизи или мыла на пальцах (скользкость)
- Многие основания реагируют с кислотами и осаждают соли.
- Сильные основания могут бурно реагировать с кислотами. Разлитую кислоту можно безопасно нейтрализовать с помощью мягкого основания.
- Основания окрашивают лакмусовую бумагу в красный цвет в синий цвет
- Основания – это вещества, содержащие оксиды или гидроксиды металлов
- Основания, растворимые в воде, образуют щелочи (растворимые основания)
Кинетическая кислотность
Наиболее распространенная кислотно-щелочная терминология, pK a , отражает равновесную кислотность, экстраполированную или нормированную на воду.В следующем уравнении основание B: (–) M (+) отрывает протон от кислоты HA с образованием сопряженной пары кислота-основа (A: (–) M (+) ) и BH). Скорость отрыва протона вперед k f , а скорость обратного переноса протона k r .
. Этот тип равновесия обычно характеризуется константой равновесия K eq , которая представляет собой отношение констант скорости (k f / k r ).Если H-A является более слабой кислотой, чем H-B, равновесие будет лежать влево, и K eq будет меньше 1,
Этот тип равновесия обычно характеризуется константой равновесия K eq , которая представляет собой отношение констант скорости (k f / k r ).Если H-A является более слабой кислотой, чем H-B, равновесие будет лежать влево, и K eq будет меньше 1,H-A + B: (–) M (+) A: (–) M (+) + B-H (кислота 1 ) (основа 1 ) 11
(основание 2 ) (кислота 2 ) В случаях, когда H-A намного слабее, чем H-B, K eq может быть слишком мал для измерения, но при определенных обстоятельствах можно определить скорость отрыва прямого протона.Если в качестве растворителя для реакции используется меченая изотопами кислота, сопряженная с основанием (B-D в следующих уравнениях), то любое происходящее отщепление протона будет отмечено превращением H-A в DA.
 Уравнение, заштрихованное зеленым цветом, показывает начальную потерю протона, а второе уравнение описывает быстрое дейтерирование промежуточного сопряженного основания, A: (-) . По мере протекания этих реакций реагент H-A будет все чаще обозначаться как D-A, а скорость изотопного обмена будет указывать кинетическую кислотность H-A.Предполагается, что кинетическая кислотность примерно пропорциональна равновесной (термодинамической) кислотности, но это не всегда верно.
Уравнение, заштрихованное зеленым цветом, показывает начальную потерю протона, а второе уравнение описывает быстрое дейтерирование промежуточного сопряженного основания, A: (-) . По мере протекания этих реакций реагент H-A будет все чаще обозначаться как D-A, а скорость изотопного обмена будет указывать кинетическую кислотность H-A.Предполагается, что кинетическая кислотность примерно пропорциональна равновесной (термодинамической) кислотности, но это не всегда верно.растворитель = B-D H-A + B: (–) M (+) A: (–) M (+) + B-H D-A + B: (–) M (+) 1
1
A: (–) M (+) + B-D На следующей диаграмме показан поучительный пример этих принципов.Первое уравнение, заштрихованное желтым цветом, дает важную информацию о тяжелой воде (оксиде дейтерия), которая будет использоваться в качестве растворителя в нашем эксперименте.
 Тяжелая вода во многом похожа на воду, но на 10% плотнее и в десять раз слабее кислоты. Основанием будет служить 1 молярная концентрация дейтероксида натрия, а слабой кислотой — эквимолярное количество 3,3-диметил-1-бутина. Наиболее кислый водород в этом углеводороде (красный цвет) находится в положении С-1. На практике нам пришлось бы использовать сорастворитель для полного растворения углеводорода в тяжелой воде, но это было опущено для упрощения обсуждения.
Тяжелая вода во многом похожа на воду, но на 10% плотнее и в десять раз слабее кислоты. Основанием будет служить 1 молярная концентрация дейтероксида натрия, а слабой кислотой — эквимолярное количество 3,3-диметил-1-бутина. Наиболее кислый водород в этом углеводороде (красный цвет) находится в положении С-1. На практике нам пришлось бы использовать сорастворитель для полного растворения углеводорода в тяжелой воде, но это было опущено для упрощения обсуждения.
Второе уравнение описывает существенные изменения, ожидаемые при объединении этих реагентов в тяжелом водном растворителе. Поскольку терминальный алкин является гораздо более слабой кислотой, чем тяжелая вода, кислотно-основное равновесие не благоприятствует сопряженному с ним основанию. Тем не менее, если образуется ацетилид-анион, даже в низкой концентрации, он должен реагировать быстро, отрывая дейтерий от соседней молекулы оксида дейтерия. Результатом будет наблюдаемый обмен дейтерия на водород, свидетельствующий о том, что произошла кислотно-щелочная реакция.
Заштрихованное зеленым поле содержит уравнения, которые помогают нам интерпретировать экспериментальные результаты. Чтобы оценить равновесную кислотность субстрата, нам потребуется измерить константу равновесия K eq для начального кислотно-щелочного равновесия, показанного в верхней части заштрихованного прямоугольника. Поскольку мы знаем K a 3,3-диметил-1-бутина и тяжелой воды, мы можем оценить K eq , разделив первое (10 -25 ) на второе (10 -17). ).Этот расчет показывает K eq , который было бы трудно измерить напрямую из-за его малой величины (10 -8 ). В самом деле, равновесная концентрация аниона ацетилида оценивается как всего 2*10 -10 М.
. Если мы исследуем этот эксперимент с точки зрения кинетики, то получим легко наблюдаемые признаки терминальной алкиновой кислотности. Последние три строки уравнений в зеленой заштрихованной рамке поясняют это.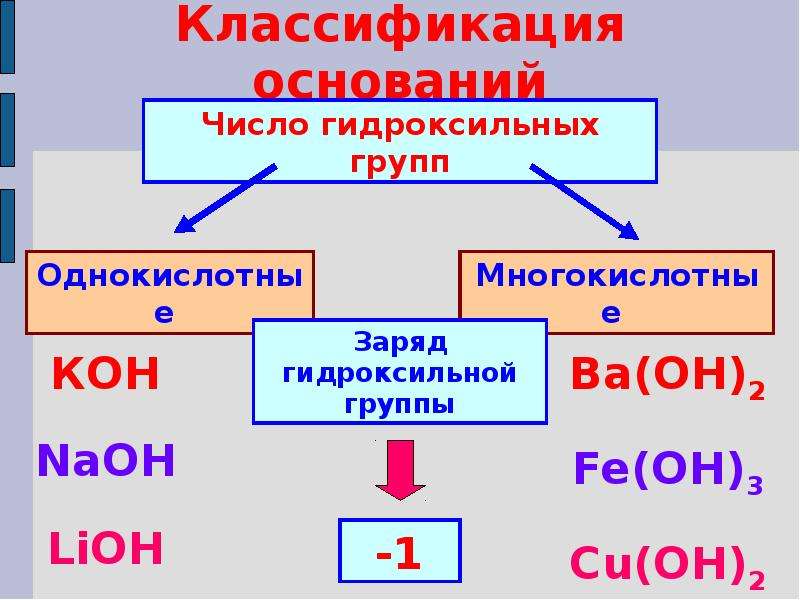 Поскольку K eq представляет собой отношение констант прямой и обратной скоростей, можно сделать вывод о скорости отрыва терминального протона от алкина.Это приводит к заключению, что будет происходить достаточно быстрый водородно-дейтерийный обмен, хотя ацетилид-анион никогда не присутствует в концентрациях, превышающих 10 -9 M.
Поскольку K eq представляет собой отношение констант прямой и обратной скоростей, можно сделать вывод о скорости отрыва терминального протона от алкина.Это приводит к заключению, что будет происходить достаточно быстрый водородно-дейтерийный обмен, хотя ацетилид-анион никогда не присутствует в концентрациях, превышающих 10 -9 M.Этот пример также демонстрирует ограничения метода изотопного обмена. Субстрат 3,3-диметил-1-бутин также имеет девять других атомов водорода (окрашены оранжевым цветом), которые не обмениваются с дейтерием в этих условиях. Мы знаем, что эти атомы водорода гораздо менее кислые (K a ок.10 -48 ), и интересно рассмотреть их возможное участие в кислотно-основных реакциях по предыдущему анализу. Расчетное K экв. для такого образования карбанионов составляет примерно 10 -30 , принимая во внимание девятикратное увеличение концентрации. Это означает концентрацию одного карбаниона на каждые 10 9 литров раствора.
 Кинетический анализ также обескураживает. Константа форвардного курса оценивается как 10 -20 Ms -1 .Следовательно, время, необходимое для обмена половины этих водородов на дейтерий, составит около 100 столетий!
Кинетический анализ также обескураживает. Константа форвардного курса оценивается как 10 -20 Ms -1 .Следовательно, время, необходимое для обмена половины этих водородов на дейтерий, составит около 100 столетий!
Для изучения кинетической кислотности чрезвычайно слабых кислот (pK a s = 30—50) необходимо использовать гораздо более сильные основания, которые, конечно, имеют гораздо более слабые сопряженные кислоты. Для этой цели использовали амид-анионы (pK a s = 26–36).Сравнивая скорости водородного обмена для различных соединений в одинаковых условиях, можно составить таблицы относительной кинетической кислотности.Об интересном примере такого исследования сообщается для группы нитроалканов, имеющих кислые α-водороды. Удаление α-водорода основанием приводит к образованию сопряженного основания, называемого аци-анионом , как показано здесь.
R 2 CH-NO 2 + B: (–) M (+) R 2 C=NO 2 (–) M (+) + B-H нитросоединение аци-конъюгированное основание По сравнению с терминальным алкином, рассмотренным выше, такие нитроалканы являются относительно сильными С-Н кислотами.
 Поскольку они являются более сильными кислотами, чем вода, эксперименты по кинетическому обмену должны проводиться в более мягких условиях, чем те, которые используются для терминального алкина. Это достигается использованием меньших концентраций основания и снижением температуры реакции обмена. Точное значение pK и 2-нитропропана, нитроэтана и нитрометана можно измерить непосредственно в водном растворе. Эти кинетические и равновесные кислотности перечислены в таблице справа. Обратите внимание, что для этих трех соединений кинетическая кислотность изменяется противоположно равновесной кислотности.Кинетический порядок, по-видимому, отражает стерические затруднения и стабильность карбаниона; тогда как равновесие способствует увеличению замещения двойной связи аци-аниона.
Поскольку они являются более сильными кислотами, чем вода, эксперименты по кинетическому обмену должны проводиться в более мягких условиях, чем те, которые используются для терминального алкина. Это достигается использованием меньших концентраций основания и снижением температуры реакции обмена. Точное значение pK и 2-нитропропана, нитроэтана и нитрометана можно измерить непосредственно в водном растворе. Эти кинетические и равновесные кислотности перечислены в таблице справа. Обратите внимание, что для этих трех соединений кинетическая кислотность изменяется противоположно равновесной кислотности.Кинетический порядок, по-видимому, отражает стерические затруднения и стабильность карбаниона; тогда как равновесие способствует увеличению замещения двойной связи аци-аниона.Соединение PK относительная ставка
0 9CH 3 NO 2 2 2 10.  2
2120 CH 3 CH 2 NO 2 8.5 20 (CH 3 ) 2 CHNO 2 7 1,0 Катализируемые основанием исследования изотопного обмена соединений, включающих более одного набора кислых атомов водорода, дают дополнительные сведения о создании и использовании нуклеофильных сопряженных оснований. Кетоны представляют собой множество примеров образования региоизомерных енолятных оснований, и на следующей диаграмме показаны два таких случая. Как было отмечено в исследовании нитроалканов, атомы водорода на α-метильной группе заменяются быстрее, чем на более замещенных α-атомах углерода.Уравнения на диаграмме показывают только начальный продукт от одной биржи. Эти продукты имеют дополнительные а-водороды, которые также обмениваются последующими реакциями такого рода, так что полная замена всех а-водородов на дейтерий происходит за короткое время.
Относительная стабильность полученных енолятов увеличивается при замещении енолятной двойной связи. Уравнения, показывающие равновесные концентрации этих изомерных енолятов, будут отображаться при нажатии кнопки Toggle Equations .Для определения равновесия енолят-анионов для этих кетонов использовали объемистый сильноосновной бис(триметилсилил)амид натрия (pK a = 26).Если нажать кнопку Toggle Equations второй раз, выше отобразятся относительные скорости α-водородного обмена для некоторых замещенных циклогексанонов. Опять же, менее замещенные α-углероды обмениваются быстрее, но обнаружено, что в равновесных условиях преобладают более сильно замещенные еноляты.Третий щелчок кнопки Toggle Equations отобразит энергетический профиль для случая 2-метилциклогексанона, который должен прояснить различие между кинетической и равновесной кислотностью. Также показаны два других примера. Эти дисплеи могут циклически повторяться.
Большинство карбоновых кислот дают сопряженные основания, которые стабилизируются за счет делокализации заряда на соседних гетероатомах. Эта резонансная стабилизация требует значительной структурной реорганизации исходного соединения, что, в свою очередь, создает энергетический барьер, замедляющий скорость отрыва протона.Например, альфа-углерод кетона или сложного эфира должен подвергаться повторной гибридизации по мере образования енолят-аниона. Стереоэлектронные потребности этого изменения были описаны выше, и неудивительно, что образование енолят-аниона происходит намного медленнее, чем эквивалентный перенос протона между спиртами и другими гидроксильными соединениями. Скорости депротонирования фенола и нитрометана, соединений с почти одинаковыми pK и (10,0), представляют собой поучительный пример этого фактора структурной реорганизации.Кислый протон в феноле связан с кислородом, поэтому депротонирование требует небольшого изменения структуры и происходит очень быстро.

Соли слабых оснований и сильных кислотСлабые основания реагируют с сильными кислотами с образованием кислых растворов солей. Сопряженная кислота слабого основания определяет его рН. Например, NH 3 (аммиак) добавляют к HCl (соляной кислоте) с образованием NH 4 Cl (хлорид аммония).

, как только соль, это реагирует с водой , в результате чего получается слабокислый раствор.
Соли слабых оснований и слабых кислотРастворы солей, содержащие кислотные катионы и основные анионы, такие как NH 4 F (фторид аммония), имеют две возможные реакции:
Поскольку К а (NH 4 + ) > К b (F — ), реакция аммиака с водой более благоприятна.
 Поэтому полученный раствор слабокислый.
Поэтому полученный раствор слабокислый.Щелочи
Соли щелочных металлов
Большинство основных солей представляют собой соли щелочных металлов, типичными примерами которых являются:
Щелочная почва
Почва со значением pH выше 7,4 обычно считается щелочной. Это свойство почвы может проявляться естественным образом благодаря наличию щелочных солей. Хотя некоторые растения предпочитают слегка щелочную почву (включая овощи, такие как капуста, и кормовые, такие как буйволиная трава), большинство растений предпочитают умеренно кислую почву (pH от 6,0 до 6,8), а щелочная почва может вызвать проблемы.

Щелочные озера
В щелочных озерах (разновидность соленых озер) в результате испарения естественные щелочные соли концентрируются, часто образуя корку слабоосновной соли на большой площади.
Примеры щелочных озер:
Щелочность негидроксидов
И карбонат натрия, и аммиак являются основаниями, хотя ни одно из этих веществ не содержит групп OH − . Это потому, что оба соединения принимают H + при растворении в воде:
Основания как гетерогенные катализаторы
Основные вещества могут быть использованы в качестве нерастворимых гетерогенных катализаторов химических реакций.Примерами являются оксиды металлов, такие как оксид магния, оксид кальция и оксид бария, а также фторид калия на оксиде алюминия и некоторые цеолиты.
 Многие переходные металлы являются хорошими катализаторами, многие из которых образуют основные вещества. Основные катализаторы использовались для гидрирования, миграции двойных связей, восстановления Меервейна-Понндорфа-Верле, реакции Михаэля и многих других реакций.
Многие переходные металлы являются хорошими катализаторами, многие из которых образуют основные вещества. Основные катализаторы использовались для гидрирования, миграции двойных связей, восстановления Меервейна-Понндорфа-Верле, реакции Михаэля и многих других реакций.Практическая базовая химия
Помимо использования в промышленности, базы имеют множество применений в быту.Антациды используются для нейтрализации кислотности желудка; садоводы используют такие основания, как известь (CaO), чтобы сделать почву более щелочной. Мягкие основы используются для очистки всего, от посуды и одежды до автомобилей и домашней собаки.
Нейтрализация кислотности желудка
Антацид представляет собой основание, которое используется для нейтрализации избытка желудочной кислоты. Рекомендуемая доза – это количество основания, необходимое для нейтрализации некоторых , но не всей желудочной кислоты.
Кислотно-основное Химический состав некоторых антацидов:
Соединение Химическая формула Химическая реакция Гидроксид алюминия Ал(ОН) 3 Al(OH) 3 (т) + 3 HCl(водн.  ) ——> AlCl 3 (водн.) + 3 H 2 O(ж)
) ——> AlCl 3 (водн.) + 3 H 2 O(ж)Карбонат кальция СаСО 3 CaCO 3 (т) + 2 HCl (водн.) ——> CaCl 2 (водн.) + H 2 O (ж) + CO 2 (г) Карбонат магния MgCO 3 MgCO 3 (т) + 2 HCl (водн.) ——> MgCl 2 (водн.) + H 2 O (ж) + CO 2 (г) Гидроксид магния Мг(ОН) 2 Mg(OH) 2 (т) + 2 HCl (водн.) ——> MgCl 2 (водн.) + 2 H 2 O(ж) Бикарбонат натрия NaHCO 3 NaHCO 3 (водн.) + HCl (водн.) ——> NaCl (водн.) + H 2 O(л) + CO 2 (г) Бытовые чистящие средства
Большинство чистящих составов, таких как средства для мытья посуды, чистящие порошки, стиральные порошки и чистящие средства для духовок, являются основными.
 Много десятилетий назад домашнее мыло с щелочью использовалось для очистки одежды и кожи людей. Самое близкое к щелочному мылу, которое мы видим сегодня, — это средство для мытья посуды. Для действительно сложных работ по уборке дома требуются химически агрессивные чистящие средства. Для удаления грязи, жира или пятен используются высокоосновные чистящие средства. Очистители сточных вод и духовки находятся на другом конце спектра pH, имея pH 12 или выше. Обычно они содержат сильное основание, такое как NaOH, которое реагирует с жирами и жирами с образованием растворимого мыла.Все сильнощелочные растворы, как в лаборатории, так и в домашних условиях, опасны, и с ними следует всегда обращаться с осторожностью. [12]
Много десятилетий назад домашнее мыло с щелочью использовалось для очистки одежды и кожи людей. Самое близкое к щелочному мылу, которое мы видим сегодня, — это средство для мытья посуды. Для действительно сложных работ по уборке дома требуются химически агрессивные чистящие средства. Для удаления грязи, жира или пятен используются высокоосновные чистящие средства. Очистители сточных вод и духовки находятся на другом конце спектра pH, имея pH 12 или выше. Обычно они содержат сильное основание, такое как NaOH, которое реагирует с жирами и жирами с образованием растворимого мыла.Все сильнощелочные растворы, как в лаборатории, так и в домашних условиях, опасны, и с ними следует всегда обращаться с осторожностью. [12] См. также
Примечания
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
Внешние ссылки
Все ссылки получены 31 декабря 2021 г.

Кредиты
New World Encyclopedia писатели и редакторы переписали и дополнили статью Wikipedia в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно быть выполнено в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в New World Encyclopedia :
Примечание.
База На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.
На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.по химии: определение и пример — видео и расшифровка урока
Свойства и примеры основ
Основы имеют тенденцию быть горькими на вкус и скользкими на ощупь. В домашних условиях мы используем основания в качестве чистящих средств и антацидных препаратов. Общие примеры основ, которые можно найти дома, включают мыло; щелочь, которая содержится, например, в чистящих средствах для духовок; молочко магнезии; и Тумс. Каждый из них имеет значение pH выше семи, может принимать свободный водород и может нейтрализовать кислоты.
Основания в действии
Поскольку основания противоположны кислотам, причем кислоты выделяют свободные ионы водорода в водном растворе, а основания способны принимать эти ионы водорода, основания можно использовать для нейтрализации кислот.
Карбонат кальция, содержащийся в Tums, нейтрализует желудочную кислоту, растворяясь в водном растворе кальция и ионов карбоната.
 Положительно заряженные свободные ионы водорода, вызывающие кислотность, присоединяются к ионам, образуя бикарбонат.Концентрация положительно заряженных свободных ионов водорода снижается, что снижает кислотность и повышает уровень pH в желудке.
Положительно заряженные свободные ионы водорода, вызывающие кислотность, присоединяются к ионам, образуя бикарбонат.Концентрация положительно заряженных свободных ионов водорода снижается, что снижает кислотность и повышает уровень pH в желудке.Аналогичная серия кислотонейтрализующих реакций происходит в гораздо большем масштабе в наших океанах. Когда воздух соприкасается с поверхностью океана, содержащиеся в воздухе газы растворяются в океанской воде. Один из этих газов, углекислый газ, является естественным компонентом воздуха, который также имеет постоянно увеличивающийся антропогенный компонент.
Увеличение содержания углекислого газа в воздухе снижает способность океана нейтрализовать кислоту. Когда углекислый газ растворяется в океане, он реагирует с водой с образованием угольной кислоты. Это заставляет ион водорода диссоциировать с образованием бикарбоната, который может дополнительно диссоциировать ион водорода с образованием карбоната. В идеале для образования карбоната кальция морскими организмами должно быть достаточно карбоната.
 Это то же вещество, что и в Тумсе, и из него состоят раковины большей части морских обитателей Земли.
Это то же вещество, что и в Тумсе, и из него состоят раковины большей части морских обитателей Земли.При использовании карбоната кальция в качестве антацидного препарата мы узнали, что он растворяется с образованием кальция и карбоната, а ионы карбоната присоединяются к ионам водорода для нейтрализации кислоты. Тот же самый процесс происходит в океане. При увеличении давления углекислого газа на океан образуется больше ионов водорода, и pH океана снижается.
В настоящее время уровень pH океана примерно на 0,1 единицы pH ниже доиндустриального pH. Повышенная кислотность приводит к усилению нейтрализации кислоты основным карбонатом кальция, обнаруженным в океане, но снижает доступность карбоната и вызывает растворение оболочек карбоната кальция.
Краткий обзор урока
Основания — это вещества, которые при растворении в воде имеют уровень pH выше семи, имеют горький вкус и скользкие на ощупь. Они реагируют с кислотами, принимая ионы H+, что дает основаниям возможность нейтрализовать кислоты.
 Основания обычно встречаются в чистящих средствах и антацидных препаратах. В природе важный пример нейтрализации кислоты основанием происходит в океане.
Основания обычно встречаются в чистящих средствах и антацидных препаратах. В природе важный пример нейтрализации кислоты основанием происходит в океане.Краткое руководство по базовым решениям
Основания имеют pH больше 7. Основания Функция Нейтрализовать кислоты рН Больше 7 Ионы водорода Поглотить/принять Вкус Горький Сенсорный экран Скользкий Примеры Мыло, щелочь, магнезиальное молоко, Тумс, карбонат кальция в океане Результаты обучения
Вы закончили урок! Продолжайте повторять, пока не почувствуете, что готовы:
14: Кислоты и основания — Химия LibreTexts
Кислоты и щелочи — это обычные вещества, содержащиеся во многих предметах повседневного обихода, от фруктовых соков и безалкогольных напитков до мыла.
 В этой главе мы рассмотрим свойства кислот и оснований и узнаем о химической природе этих важных соединений. Мы расскажем о pH и о том, как рассчитать pH раствора.
В этой главе мы рассмотрим свойства кислот и оснований и узнаем о химической природе этих важных соединений. Мы расскажем о pH и о том, как рассчитать pH раствора.База (химия) — Energy Education
Рисунок 1. Отбеливатель имеет рН около 12-13.Основание или щелочь — это любое вещество, которое будет реагировать с водой с образованием ОН — [1] Как правило, растворы оснований в воде имеют рН выше 7.
В воде всегда есть некоторое количество ионов H + и OH — в растворе из-за самоионизации воды.
 В базовых растворах ОН — будет больше, чем Н + . Более концентрированные основания будут содержать больше OH — в растворе. Следуя шкале pH, более щелочной раствор — раствор с большим количеством OH — — будет иметь значение pH на выше . Кислоты могут реагировать с основаниями в реакции нейтрализации, где H + из кислоты реагируют с OH — основания с образованием раствора с более низкой концентрацией OH — — и более низким pH — чем исходный базовое решение.
В базовых растворах ОН — будет больше, чем Н + . Более концентрированные основания будут содержать больше OH — в растворе. Следуя шкале pH, более щелочной раствор — раствор с большим количеством OH — — будет иметь значение pH на выше . Кислоты могут реагировать с основаниями в реакции нейтрализации, где H + из кислоты реагируют с OH — основания с образованием раствора с более низкой концентрацией OH — — и более низким pH — чем исходный базовое решение.Наиболее распространенными неорганическими основаниями являются гидроксиды (содержащие в своем составе OH –), такие как гидроксид натрия, NaOH или гидроксид кальция, Ca(OH) 2 . Однако существуют некоторые органические основания, такие как молекулы на основе аммиака, такие как амины, которые не содержат непосредственно OH –: любой OH – в растворе этих молекул образуется в результате реакции с водой.
 [2]
[2] Использование
Способность оснований нейтрализовать кислоты очень полезна, так как многие реакции и промышленные процессы имеют кислотные отходы.Некоторые примеры использования оснований для нейтрализации нежелательных кислот:
Помимо нейтрализации, основания также используются в химических реакциях:
Чтобы узнать больше о кислотах и основаниях, см. Chemistry LibreText.
Моделирование Phet
Университет Колорадо любезно разрешил нам использовать следующую симуляцию Phet. Исследуйте эту симуляцию, чтобы увидеть, как работает рН кислот и оснований.
Для дальнейшего чтения
Чтобы узнать больше о кислотах и основаниях, см. Chemistry LibreText.
Ссылки
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно.Ниже приведены наиболее распространенные причины:
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.
 Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
База (химия) Факты для детей
Основание — это вещество, которое может принимать ион водорода (H+) от другого вещества.
 Химическое вещество может принять протон, если он имеет отрицательный заряд или если в молекуле есть электроотрицательный атом, такой как кислород, азот или хлор, который богат электронами.Как и кислоты, некоторые основания являются сильными, а другие слабыми. Слабые основания менее склонны принимать протоны, в то время как сильные основания быстро принимают протоны в растворе или от других молекул. Кислота является «химической противоположностью» основания. Кислота – это вещество, которое отдает атом водорода основанию.
Химическое вещество может принять протон, если он имеет отрицательный заряд или если в молекуле есть электроотрицательный атом, такой как кислород, азот или хлор, который богат электронами.Как и кислоты, некоторые основания являются сильными, а другие слабыми. Слабые основания менее склонны принимать протоны, в то время как сильные основания быстро принимают протоны в растворе или от других молекул. Кислота является «химической противоположностью» основания. Кислота – это вещество, которое отдает атом водорода основанию.Основания имеют pH выше 7,0. Слабые основания обычно имеют значение pH 7–9, тогда как сильные основания имеют значение pH 9–14.
Как работают базы
Основания можно использовать для нейтрализации кислот.Когда основание, часто OH – , принимает протон от кислоты, оно образует безвредную молекулу воды. Когда все кислоты и основания реагируют с образованием молекул воды и других нейтральных солей, это называется нейтрализацией. Кислоты также могут быть использованы для нейтрализации оснований.

Каждое основание имеет сопряженную кислоту, образованную присоединением атома водорода к основанию. Например, NH 3 (аммиак) представляет собой основание, а его сопряженная кислота представляет собой ион аммония, NH 4 + . Слабое основание образует сильную сопряженную кислоту, а сильное основание образует более слабую сопряженную кислоту.Поскольку аммиак является умеренно сильным основанием, аммоний является значительно более слабой кислотой.
Характеристики
Базы имеют следующие характеристики:
Некоторые обычные предметы домашнего обихода являются основами.
 Например, каустическая сода и очиститель канализации изготавливаются из гидроксида натрия, сильного основания. Аммиак или очиститель на основе аммиака, такой как средство для мытья окон и стекол, является основным. Эти более сильные основания могут вызвать раздражение кожи. Другие основы, такие как кулинарные ингредиенты, бикарбонат натрия (пищевая сода) или винный камень, являются основными, но они не вредны и подходят для приготовления пищи.
Например, каустическая сода и очиститель канализации изготавливаются из гидроксида натрия, сильного основания. Аммиак или очиститель на основе аммиака, такой как средство для мытья окон и стекол, является основным. Эти более сильные основания могут вызвать раздражение кожи. Другие основы, такие как кулинарные ингредиенты, бикарбонат натрия (пищевая сода) или винный камень, являются основными, но они не вредны и подходят для приготовления пищи.При работе с основаниями всегда следует надевать перчатки. При появлении раздражения кожи пораженный участок следует тщательно промыть холодной водой.Если это не устранит проблему, как можно скорее обратитесь за медицинской помощью.
Сильные основания
Сильное основание – это основание, которое при попадании в воду выделяет ион гидроксида ОН–. Их восемь.
Картинки для детей
Кислоты и основания
Согласно теории Бренстеда кислота является донором протона , а основание является акцептором протона .
 В кислотно-щелочной реакции каждая сторона равновесия имеет кислотный и основной реагент или продукт, и это могут быть нейтральные частицы или ионы.
В кислотно-щелочной реакции каждая сторона равновесия имеет кислотный и основной реагент или продукт, и это могут быть нейтральные частицы или ионы.Структурно родственные кислотно-основные пары, такие как {H-A и A: (–) } или {B: (–) и B-H}, называются сопряженными парами . Вещества, которые могут служить как кислотами, так и основаниями, такие как вода, называются амфотерными .
Кислотность
Относительную силу группы кислот можно оценить, измерив степень реакции, в которую вступает каждый член с общим основанием. Вода прекрасно служит общей основой для таких определений.Таким образом, для кислоты H-A ее сила пропорциональна степени ее реакции с основной водой, которая определяется константой равновесия K eq .Поскольку эти исследования обычно экстраполируются на высокие разведения, молярная концентрация воды (55,5) является постоянной и может быть исключена из знаменателя.
 Полученное значение K называется константой кислотности , K a . Ясно, что сильные кислоты имеют большие K a , чем более слабые кислоты.Действительно, если ГК полностью ионизирована в растворе, K a стремится к бесконечности ([HA] близок к нулю). Из-за очень большого диапазона кислотных сил (более 10 40 ) обычно используется логарифмическая шкала кислотности (pK a ). Более сильные кислоты имеют меньшие или более отрицательные значения pK a , чем более слабые кислоты.
Полученное значение K называется константой кислотности , K a . Ясно, что сильные кислоты имеют большие K a , чем более слабые кислоты.Действительно, если ГК полностью ионизирована в растворе, K a стремится к бесконечности ([HA] близок к нулю). Из-за очень большого диапазона кислотных сил (более 10 40 ) обычно используется логарифмическая шкала кислотности (pK a ). Более сильные кислоты имеют меньшие или более отрицательные значения pK a , чем более слабые кислоты.Во всех вышеприведенных примерах вода выступает в качестве общего основания, а самая слабая кислота и самое слабое основание будут преобладать и обязательно будут по одну сторону равновесия).В идеале следует использовать кислоты с концентрацией не более 0,1 М. Поскольку вода амфотерна, она может подвергаться автопротолизу, как показано в следующем уравнении. Автоионизация показана Keq, и, рассматривая концентрацию воды, как и раньше, константа кислотности (K a ) для воды обозначена K w (константа воды).
 Таким образом, pH чистой воды составляет 7,0.
Таким образом, pH чистой воды составляет 7,0.Диапазон сильных кислот, которые можно различить, ограничен. Таким образом, кислоты, которые сильнее катиона гидроксония, H 3 O (+) , и слабые кислоты, имеющие сопряженные основания сильнее, чем гидроксид-анион, OH (–) , не могут быть измерены непосредственно в водном растворе.Если сильная кислота (ГК) имеет Ka = 100, 0,1 М раствор в воде полностью ионизируется, давая концентрацию гидроксония 100 и концентрацию [ГК] 10 -4 . Аналогичный раствор кислоты в 10 3 раз более сильной был бы неощутимо другим из-за этого выравнивающего эффекта растворителя. Термин выравнивающий эффект относится к влиянию амфотерного растворителя, такого как вода, на измерения кислотности и щелочности. Сила сильной кислоты нивелируется основностью растворителя, а основность сильных оснований также ограничивается кислотностью растворителя.
Поскольку многие органические реакции либо происходят в водной среде (живые клетки), либо гасятся или обрабатываются в воде, важно учитывать, как сопряженная равновесная кислотно-щелочная смесь изменяется в зависимости от pH.
 Эту информацию предоставляет простое соотношение, известное как уравнение Хендерсона-Хассельбальха .
Эту информацию предоставляет простое соотношение, известное как уравнение Хендерсона-Хассельбальха .Когда pH водного раствора или смеси равен pK a кислотного компонента, концентрации форм конъюгатов кислоты и основания должны быть равными (логарифм 1 равен 0).Если pH будет снижен на две или более единиц относительно pK a , концентрация кислоты будет выше 99%. С другой стороны, если pH (относительно pK a ) повышается на две или более единиц, концентрация основания конъюгата будет выше 99%. Следовательно, смеси кислых и некислотных соединений легко разделяются путем регулирования рН водного компонента в двухфазной экстракции растворителем.
Основность
В водном растворе основание представляет собой растворенное вещество, которое увеличивает концентрацию гидроксид-ионов.Алкоксиды металлов, такие как NaOCH 3 и KOC(CH 3 ) 3 , реагируют с водой с образованием сольватированных катионов металлов, а также алкоксид- и гидроксид-ионов. Эти 100% ионизации делают такие соединения очень сильными основаниями. Многие нейтральные основания являются соединениями азота. Для этого мы можем записать равновесие щелочной кислоты, которое определяет K b и соответствующее pK b , как показано для аммиака в первом уравнении ниже. Однако более распространенная процедура состоит в том, чтобы сообщать кислотности сопряженных кислот оснований, как показано во втором уравнении (эти сопряженные кислоты обычно представляют собой «ониевые» катионы).Значения pK и для оснований в этой системе пропорциональны базовой силе основания. Обратите внимание, что в таких соотношениях pK a + pK b = 14.
Эти 100% ионизации делают такие соединения очень сильными основаниями. Многие нейтральные основания являются соединениями азота. Для этого мы можем записать равновесие щелочной кислоты, которое определяет K b и соответствующее pK b , как показано для аммиака в первом уравнении ниже. Однако более распространенная процедура состоит в том, чтобы сообщать кислотности сопряженных кислот оснований, как показано во втором уравнении (эти сопряженные кислоты обычно представляют собой «ониевые» катионы).Значения pK и для оснований в этой системе пропорциональны базовой силе основания. Обратите внимание, что в таких соотношениях pK a + pK b = 14. Большинство простых алкиламинов имеют pK a в диапазоне от 9,5 до 11,0, а их водные растворы являются основными (имеют pH от 11 до 12, в зависимости от концентрации). Первые четыре соединения в следующей таблице, включая аммиак, попадают в эту категорию. Последние шесть соединений (закрашенные клетки) являются значительно более слабыми основаниями вследствие трех факторов.
 Первым из них является гибридизация азота. В пиридине азот гибридизован sp 2 , а в нитрилах (последняя запись) sp-гибрид азота является частью тройной связи. В каждом из этих соединений (заштриховано красным) несвязывающая электронная пара локализована на атоме азота, но увеличение s-характера приближает ее к ядру азота, уменьшая ее склонность связываться с протоном. Во-вторых, анилин и п-нитроанилин (первые две структуры, заштрихованные зеленым) являются более слабыми основаниями из-за делокализации несвязывающей электронной пары азота в ароматическое кольцо (и нитрозаместитель).Это та же самая делокализация, которая приводит к активации бензольного кольца в сторону электрофильного замещения. Действительно, анилин является более слабым основанием, чем циклогексиламин, примерно в миллион раз, по тому же фактору, по которому фенол является более сильной кислотой, чем циклогексанол. Эта делокализация электронной пары сопровождается некоторой регибридизацией атома азота аминогруппы, но делокализация электронной пары, вероятно, является основным фактором пониженной основности этих соединений.
Первым из них является гибридизация азота. В пиридине азот гибридизован sp 2 , а в нитрилах (последняя запись) sp-гибрид азота является частью тройной связи. В каждом из этих соединений (заштриховано красным) несвязывающая электронная пара локализована на атоме азота, но увеличение s-характера приближает ее к ядру азота, уменьшая ее склонность связываться с протоном. Во-вторых, анилин и п-нитроанилин (первые две структуры, заштрихованные зеленым) являются более слабыми основаниями из-за делокализации несвязывающей электронной пары азота в ароматическое кольцо (и нитрозаместитель).Это та же самая делокализация, которая приводит к активации бензольного кольца в сторону электрофильного замещения. Действительно, анилин является более слабым основанием, чем циклогексиламин, примерно в миллион раз, по тому же фактору, по которому фенол является более сильной кислотой, чем циклогексанол. Эта делокализация электронной пары сопровождается некоторой регибридизацией атома азота аминогруппы, но делокализация электронной пары, вероятно, является основным фактором пониженной основности этих соединений. Подобная делокализация электронных пар ответственна за очень низкую основность (и нуклеофильную реакционную способность) амидных атомов азота (последняя структура, заштрихованная зеленым цветом).
Подобная делокализация электронных пар ответственна за очень низкую основность (и нуклеофильную реакционную способность) амидных атомов азота (последняя структура, заштрихованная зеленым цветом).Теория Льюиса
Согласно теории Льюиса кислота является акцептором электронной пары , а основание является донором электронной пары . Основания Льюиса также являются основаниями Бренстеда; однако многие кислоты Льюиса, такие как BF 3 , AlCl 3 и Mg 2+ , не являются кислотами Бренстеда. Продукт кислотно-основной реакции Льюиса представляет собой нейтральный, диполярный или заряженный комплекс, который может быть стабильной ковалентной молекулой. Как показано в верхней части следующего рисунка, координационная ковалентная связь фосфористого основания Льюиса с борсодержащей кислотой Льюиса создает комплекс, в котором формальный заряд бора отрицательный, а заряд фосфора положительный.В этом комплексе бор приобретает неоновую валентную оболочечную конфигурацию, а фосфор — аргоновую.
 Два примера кислотно-основного равновесия Льюиса, которые играют роль в химических реакциях, показаны в уравнениях 1 и 2 ниже.
Два примера кислотно-основного равновесия Льюиса, которые играют роль в химических реакциях, показаны в уравнениях 1 и 2 ниже. В первом примере атом алюминия с дефицитом электронов связывается с ковалентным атомом хлора, разделяя одну из его несвязывающих пар валентных электронов, и, таким образом, достигает аргоноподобного октета валентной оболочки.Поскольку это разделение является односторонним (хлор отдает оба электрона), как алюминий, так и хлор имеют формальные заряды, как показано. Если связь углерод-хлор в этом комплексе разрывается, и оба электрона связи остаются с более электроотрицательным атомом (хлором), углерод приобретает положительный заряд. Мы называем такие виды углерода как карбокатионы . Карбкатионы также являются кислотами Льюиса, как показывает обратная реакция. Если заместители (R) у этих атомов невелики, комплекс будет благоприятствовать равновесию.
 Однако стерические затруднения объемных заместителей могут препятствовать образованию комплексов. Полученная смесь несвязанных пар кислота/основание Льюиса была названа «разорванной» и демонстрирует необычное химическое и каталитическое поведение. Комбинация P(t-Butyl) 3 и B(C 6 F 5 ) 3 является примером.
Однако стерические затруднения объемных заместителей могут препятствовать образованию комплексов. Полученная смесь несвязанных пар кислота/основание Льюиса была названа «разорванной» и демонстрирует необычное химическое и каталитическое поведение. Комбинация P(t-Butyl) 3 и B(C 6 F 5 ) 3 является примером.
Многие карбокатионы (но не все) также могут действовать как кислоты Бренстеда. Уравнение 3 иллюстрирует это двойное поведение для (CH 3 ) 3 C(+) ; кислотный центр Льюиса окрашен в красный цвет, а три из девяти кислых атомов водорода окрашены в оранжевый цвет.В роли кислоты Бренстеда карбокатион отдает протон основанию (гидроксид-аниону) и превращается в стабильную нейтральную молекулу, имеющую двойную углерод-углеродную связь.Терминология, связанная с номенклатурой кислот и оснований Льюиса, часто используется химиками-органиками. Здесь термин электрофил соответствует кислоте Льюиса, а нуклеофил соответствует основанию Льюиса.

Электрофил : Атом, ион или молекула с дефицитом электронов, которые имеют сродство к паре электронов и будут связываться с основанием или нуклеофилом.
Нуклеофил : Атом, ион или молекула, у которых есть электронная пара, которая может быть донором при связывании с электрофилом (или кислотой Льюиса).Некоторая путаница в различении основности (силы основания) и нуклеофильности (силы нуклеофила) неизбежна. Поскольку основность — менее хлопотное понятие; с него удобно начинать.
Основность относится к способности основания принимать протона . Основность может быть связана с pK a соответствующей конъюгированной кислоты.Самые сильные основания имеют самые слабые сопряженные кислоты и , наоборот, . В кислотно-щелочном равновесии преобладают самая слабая кислота и самое слабое основание, и они обязательно будут находиться по одну сторону от равновесия.
Растворители, такие как уксусная кислота, ацетонитрил и нитрометан, часто используются для изучения очень сильных кислот.
 Точно так же для изучения кислотности очень слабых кислот можно использовать очень слабокислые растворители, такие как диметилсульфоксид (ДМСО), ацетонитрил, толуол, амины и аммиак.Измерения в этих растворителях можно экстраполировать на воду, и многие из них имеют большие погрешности. Как для кислот, так и для оснований указанные значения pK и , экстраполированные на воду, являются приблизительными. Таблица некоторых основных реагентов показана ниже. Диапазон основ впечатляет, покрывая более пятидесяти степеней десяти!
Точно так же для изучения кислотности очень слабых кислот можно использовать очень слабокислые растворители, такие как диметилсульфоксид (ДМСО), ацетонитрил, толуол, амины и аммиак.Измерения в этих растворителях можно экстраполировать на воду, и многие из них имеют большие погрешности. Как для кислот, так и для оснований указанные значения pK и , экстраполированные на воду, являются приблизительными. Таблица некоторых основных реагентов показана ниже. Диапазон основ впечатляет, покрывая более пятидесяти степеней десяти!Основание I (–) Cl (–) H 2 O CH 3 CO 2 (–) RS (–) CN (–) Только чтение (–) NH 2 (–) CH 3 (–) Соед. Кислота
HI HCl Н 3 О (+) CH 3 CO 2 H RSH HCN ROH NH 3 CH 4 pK a -9 -7 -1,7 4,8 8 9.1 16 33 48 Нуклеофильность является более сложным свойством. Обычно под ним понимают скорость реакции замещения в галогенсодержащий атом углерода эталонного алкилгалогенида, такого как CH 3 -Br. Таким образом, нуклеофильность реагента Nu: (–) в следующей реакции замещения варьируется, как показано на диаграмме ниже. Диапазон реакционной способности, охватываемый этими реагентами, превышает 5000 раз, причем наиболее реакционноспособным является тиолат.
 Ясно, что между этими нуклеофильностями и основностями, обсуждавшимися выше, есть существенные различия.
Ясно, что между этими нуклеофильностями и основностями, обсуждавшимися выше, есть существенные различия.Нуклеофильность: CH 3 CO 2 (–) < Cl (–) < Br (–) < N 3 (–) < CH 3 O (–) < CN (–) < I (–) < CH 3 S (–)
Задокументированы некоторые полезные тенденции:
(i) Для данного элемента отрицательно заряженные частицы являются более нуклеофильными (и основными), чем эквивалентные нейтральные частицы.
(ii) Для данного периода таблицы Менделеева нуклеофильность (и основность) уменьшается при движении слева направо.
(iii) Для данной группы таблицы Менделеева нуклеофильность возрастает сверху вниз ( , т. е. с увеличением размера),
е. с увеличением размера),
, хотя существует зависимость от растворителя из-за водородных связей. Основность изменяется противоположным образом.Для двух или более молекул, включающих нуклеофильные атомы одного и того же вида и заряда, более сильное основание обычно является более сильным нуклеофилом.Так, 2,2,2-трифторэтоксид (pK a 12) является более слабым основанием и нуклеофилом, чем этоксид (pK a 16). Заметное исключение из этого правила возникает, когда вицинальный (соседний) атом несет несвязывающую электронную пару. Двумя распространенными примерами этого исключения, называемого альфа-эффектом , являются ион гидроксида (pK a 15,7) по сравнению с ионом гидропероксида (pK a 11,6) и аммиак (pK a 9,3) по сравнению с гидразином (pK a 9,3). и 8.0). В каждой из этих пар более слабое основание является более сильным нуклеофилом.

Сольватация нуклеофильных анионов заметно влияет на их реакционную способность. Приведенные выше нуклеофильности были получены в результате реакций в растворе метанола. Полярные протонные растворители, такие как вода и спирты, сольватируют анионы за счет взаимодействия водородных связей, как показано на диаграмме справа. Эти сольватированные соединения более стабильны и менее реакционноспособны, чем несольватированные «голые» анионы. Полярные апротонные растворители, такие как ДМСО (диметилсульфоксид), ДМФА (диметилформамид) и ацетонитрил, не сольватируют анионы почти так же хорошо, как метанол, но обеспечивают хорошую сольватацию сопутствующих катионов.Следовательно, большинство обсуждаемых здесь нуклеофилов быстрее реагируют в растворах, приготовленных из этих растворителей. Такие эффекты растворителя более выражены для малых основных анионов, чем для больших слабоосновных анионов. Таким образом, для реакции в растворе ДМСО наблюдается следующий порядок реакционной способности:
Нуклеофильность: I (–) < Br (–) < Cl (–) ~ N 3 (–) < CH 3 CO 2 (–) < CN (–) ~ CH 3 S (–) < CH 3 O (–) В отличие от порядка метанола (показанного выше), этот порядок примерно соответствует возрастанию основности.
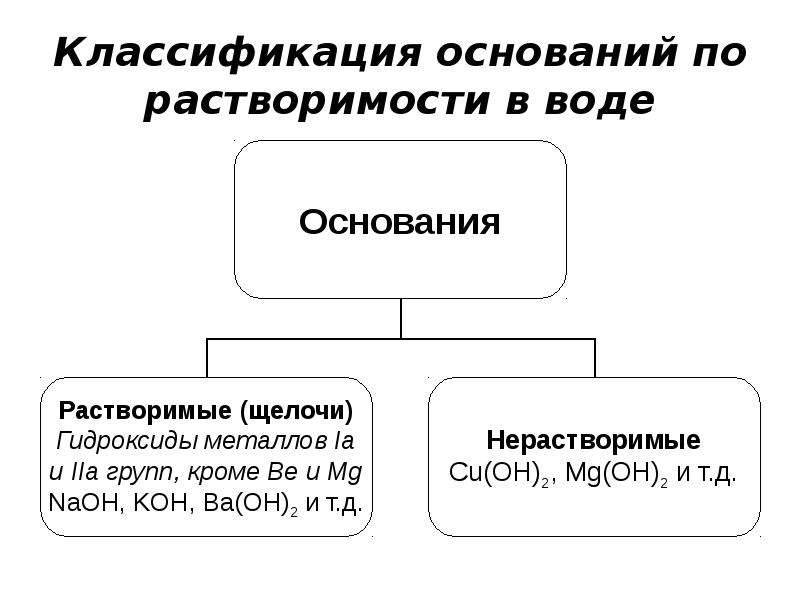 Нейтральные основания, такие как аммиак и простые первичные и вторичные амины, имеют одинаковую основность (pKa = от 9 до 11) и также являются хорошими нуклеофилами. В реакциях с бромистым метилом в метаноле их нуклеофильность больше Cl (–) и меньше N 3 (–) . В слабоосновных апротонных растворителях они реагируют с умеренными электрофилами, такими как алкилгалогениды (Cl, Br и I) и карбонильными группами (альдегиды, кетоны, сложные эфиры и ангидриды), давая четвертичные соли из первых и имины, енамины и амиды из последних. .Третичные амины и объемные вторичные амины являются более бедными нуклеофилами и ведут себя исключительно как основания.
Нейтральные основания, такие как аммиак и простые первичные и вторичные амины, имеют одинаковую основность (pKa = от 9 до 11) и также являются хорошими нуклеофилами. В реакциях с бромистым метилом в метаноле их нуклеофильность больше Cl (–) и меньше N 3 (–) . В слабоосновных апротонных растворителях они реагируют с умеренными электрофилами, такими как алкилгалогениды (Cl, Br и I) и карбонильными группами (альдегиды, кетоны, сложные эфиры и ангидриды), давая четвертичные соли из первых и имины, енамины и амиды из последних. .Третичные амины и объемные вторичные амины являются более бедными нуклеофилами и ведут себя исключительно как основания.Эффект растворителя
Кислоты
Ионизация группы кислот в данном растворителе может быть использована как мера силы кислоты, и в таких случаях растворитель служит общим эталонным основанием. Определение значений К а и рК а для любой системы растворителей можно проводить так же, как и в воде; однако кислотности, полученные для группы кислот, измеренные в разных растворителях, обычно будут разными как по числовому значению для каждой, так и иногда по относительному порядку.
A–H
кислота+ Сол:
растворитель
A: (–)
сопряженное основание+ Sol–H (+)
конъюгированная кислотаСуществует несколько факторов, влияющих на измерения кислотности в воде и других растворителях. Эти:
1. При ионизации кислоты образуются ионы. Растворители с большой диэлектрической проницаемостью способствуют образованию и разделению зарядов.
2. Сопряженная кислота из растворителя представляет собой катион, который стабилизируется за счет ассоциации с другими молекулами растворителя, явление, называемое сольватацией.
3. Сопряженным основанием кислоты является анион, который в большинстве случаев также стабилизируется сольватацией. В качестве примеров рассмотрим следующие данные, полученные для шести сильных кислот в трех обычных растворителях.
В качестве примеров рассмотрим следующие данные, полученные для шести сильных кислот в трех обычных растворителях.Экспериментальный pK
a Значения некоторых сильных кислот в различных растворителяхСоединение H 2 O ДМСО CH 3 CN HClO 4 2
–10* –10* 1.6 CF 3 SO 3 H –10* –10* 2,6 HBr –9 0,8 5,8 HCl –7 1,8 10,4 H 2 SO 4 –3 1,4 7,9 CF 3 CO 2 H –0,25 3,5 12.  7
7* Хлорная кислота и трифторметансульфокислота полностью ионизируются в воде и ДМСО.
Значение pK a , равное –10, является приблизительным и предназначено для отражения высокой степени диссоциации.Все три растворителя имеют довольно высокие диэлектрические постоянные, но вода (ε = 80) значительно больше, чем ДМСО (ε = 46,7) или ацетонитрил (ε = 37,5). Более высокая кислотность (более низкий pK a ) последних четырех соединений в воде может быть связана с диэлектрической разницей; однако основным фактором считается превосходная сольватация анионов, обеспечиваемая водой.И ДМСО, и ацетонитрил являются плохими растворителями для анионной сольватации, следовательно, ионизационное равновесие, показанное выше, будет смещено влево.
Полезно сначала сосредоточиться на pK a различиях между водой и ДМСО. Мы делаем это, потому что вода и ДМСО имеют одинаковую основность, поэтому стабилизация растворителя, сопряженного с кислотой, не должна существенно различаться.
 HBr и HCl демонстрируют pK a с в ДМСО, что примерно на 9-10 крат больше положительного, чем в воде, а более слабая кислота второго периода HF показывает еще большее изменение (pK a = 3.17 в воде и 15 в ДМСО). Все сопряженные основания этих кислот представляют собой одноатомные анионы. Поскольку отрицательный заряд локализован, стабилизация анионов сольватацией, вероятно, является наиболее важным фактором в установлении положения этих равновесий. Напротив, сопряженные основания из серной кислоты и трифторуксусной кислоты внутренне стабилизированы за счет делокализации заряда по двум или трем атомам кислорода. Таким образом, сольватация менее важна, и сдвиг кислотности в ДМСО снижается до 4 степеней десяти.
HBr и HCl демонстрируют pK a с в ДМСО, что примерно на 9-10 крат больше положительного, чем в воде, а более слабая кислота второго периода HF показывает еще большее изменение (pK a = 3.17 в воде и 15 в ДМСО). Все сопряженные основания этих кислот представляют собой одноатомные анионы. Поскольку отрицательный заряд локализован, стабилизация анионов сольватацией, вероятно, является наиболее важным фактором в установлении положения этих равновесий. Напротив, сопряженные основания из серной кислоты и трифторуксусной кислоты внутренне стабилизированы за счет делокализации заряда по двум или трем атомам кислорода. Таким образом, сольватация менее важна, и сдвиг кислотности в ДМСО снижается до 4 степеней десяти.
Когда растворителем является ацетонитрил, измеренные pK a с этих кислот показывают дальнейшее увеличение, и даже самые сильные кислоты диссоциируют не полностью. Это изменение может быть в значительной степени связано с уменьшением сольватации кислоты, сопряженной с растворителем, которая является основным видом катионов в разбавленных растворах. Поскольку как катионные, так и анионные частицы от кислотной ионизации плохо стабилизируются сольватацией, равновесие диссоциации лежит далеко влево (слабая ионизация).
Поскольку как катионные, так и анионные частицы от кислотной ионизации плохо стабилизируются сольватацией, равновесие диссоциации лежит далеко влево (слабая ионизация).Экспериментальный pK
a s для некоторых слабых кислот в различных растворителяхСоединение H 2 O ДМСО CH 3 CN C 4 5 6
H17 29 42 CF 3 CH 2 OH 12,4 23,5 33,5 C 6 H 5 C≡CH 19 29 40.6 C 4 H 9 SH 10,5 17 28,6 CH 3 CO 2 H 4,8 12,8 22,3 C 6 H 5 CO 2 H 4,2 11,1 20,7 C 6 H 5 OH 10 18 26,6 C 6 H 5 SH 6.  6
610,3 20,6 Большинство органических соединений являются гораздо более слабыми кислотами, чем рассмотренные выше сильные кислоты. Поэтому представляет интерес определить изменения кислотности, происходящие при исследовании таких соединений в тех же трех растворителях. Первые четыре соединения в этой таблице (заштрихованные светло-зеленым цветом) представляют собой слабые кислоты, имеющие сопряженные основания, в которых заряд локализован на одном атоме (O, C и S). Замена растворителя с воды на ДМСО снижает кислотность на 10-12 степеней десяти для атомов второго периода (С и О) и на 6.5 для третьего периода сульфгидрильной кислоты. Как и в более кислых случаях, рассмотренных выше, сольватация сопряженных анионов оснований является важным стабилизирующим фактором в воде, хотя меньшая плотность заряда серы снижает ее значение. Дальнейшее увеличение pK a , которое происходит в растворах ацетонитрила, по сравнению с ДМСО, является довольно равномерным (10—12 единиц) и немного больше, чем сдвиг, обнаруженный для сильных кислот.

Последние четыре соединения (заштрихованные синим цветом) имеют сопряженные основания, стабилизированные за счет делокализации заряда.Здесь снижение кислотности при переходе от воды к ДМСО снижается до 7–8 степеней десяти для кислорода и менее 4 для серы. Как отмечалось ранее, делокализация заряда внутри аниона снижает важность стабилизации сольватации. Увеличение pK a , обнаруженное для растворов в ацетонитриле, остается примерно таким же и может быть связано с плохой сольватацией в этом растворителе.За исключением производного ацетилена, все предыдущие соединения представляют собой гетероатомные кислоты.Аналогичные измерения для группы активированных угольных кислот показывают согласие с предыдущим анализом и иллюстрируют способ, которым делокализация анионного заряда уменьшает разницу pK a между измерениями воды и ДМСО. Обратите внимание на почти идентичность второго и третьего примеров в следующей таблице. Как и ожидалось, увеличение pK a при переходе в ацетонитрил из ДМСО остается примерно постоянным (около 11).

Экспериментальный pK
a s для некоторых карбоновых кислот в различных растворителяхСоединение H 2 O ODMSO 3 CN 3 CN (CH 3 CO) 2 CH 2 9 13.3 24,4 (N≡C) 2 CH 2 11.2 11.2 11.2 22.2 (C 6 H 5 SO 2 ) 2 CH 2 11,6 12,2 23,2 (C 2 H 5 OCO) 2 CH 2 13,5 16,4 27,8 C 4 H 4 CH 2 15. 0
18,0 31,2 Основания
Наиболее распространенное обозначение относительной силы нейтрального основания (B:) в терминах pK a соответствующих сопряженных кислот (эти сопряженные кислоты часто называют «ониевыми» катионами) . Следующее уравнение показывает равновесие, связанное с этим соотношением. Обратите внимание, что сильные основания будут иметь слабокислые сопряженные кислоты, поэтому pK a пропорциональна силе нейтрального основания.B–H (+)
конъюгированная кислота+ Sol:
растворитель
B:
основание+ Sol–H (+)
сопряженная кислотаОпределенные ранее факторы, влияющие на кислотность, теперь можно пересмотреть для этого нового равновесия.
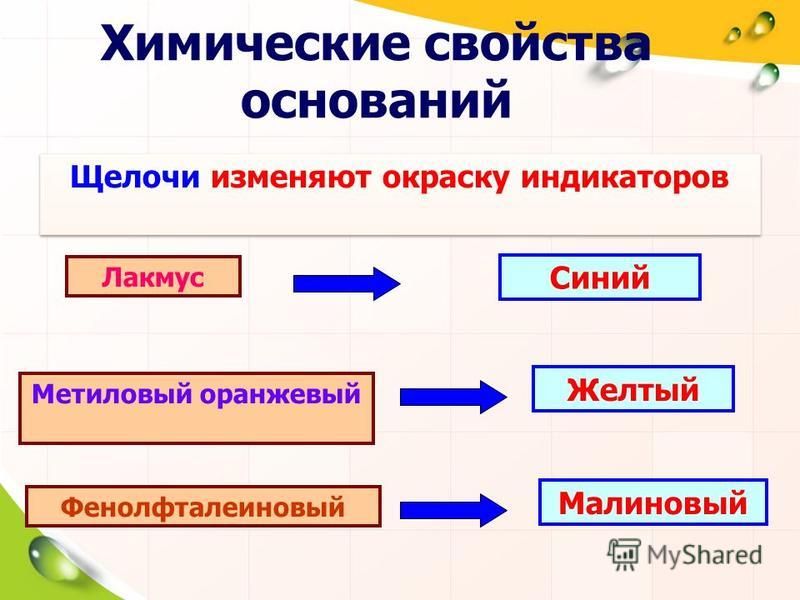
1. Ионы присутствуют в обеих частях уравнения. Следовательно, различия в диэлектрической проницаемости растворителя должны быть относительно неважным фактором.
2. Сопряженные катионы основания и растворителя стабилизируются сольватацией. Это будет решающим фактором и связано с основностью растворителя.
3. В приведенном выше уравнении нет анионов; однако для нейтрализации заряда требуется противоион. Поскольку в обеих частях уравнения будет присутствовать один и тот же анион, его влияние на это равновесие будет аннулировано.В следующей таблице приведены значения pK и для некоторых важных азотистых оснований, некоторые структуры которых показаны справа.В примерах с триэтиламином и DABCO в верхней части таблицы катионный заряд относительно локализован на одном атоме азота. Заряд в лутидине может быть делокализован на атомах углерода кольца за счет ароматической стабилизации. Последние три примера представляют собой соединения, в которых заряд делокализован резонансом (протонирование происходит в голубом азоте) или внутренней водородной связью (протонная губка).

В отличие от более ранних примеров кислоты pK a s, значения для этих катионов аммония почти идентичны в воде и растворителях ДМСО.Действительно, тот факт, что большинство ДМСО pK a s немного ниже, чем их водные аналоги, предполагает, что ДМСО является немного более щелочным, чем вода. В ацетонитриле все значения рК и примерно на 10 единиц выше, чем значения ДМСО.pK
a s для некоторых видов аммония в различных растворителяхAmmonium Cation H 2 O CH 3 CN 3 CN(C 2 H 5 ) 3 N-H (+) 10.75 9,0 18,5 DABCO–H (+) 8,8 8,9 18,3 Лутидин–H (+) 6,3 4,45 14 ДБУ–Н (+) 12 12 24,3 [(CH 3 ) 2 N] 2 C=NR–H 5 (6)
5 (6)
13,8 13,6 23.  3
3Протонная губка–H (+) 12,3 7,5 ок. 18 Отмеченное выше влияние растворителя на кислотность и щелочность может вызвать неожиданные изменения в простых кислотно-щелочных равновесиях. Если уксусную кислоту и триэтиламин смешать вместе в воде, происходит быстрый перенос протона с почти количественным образованием ацетата триэтиламмония. Сопряженные кислоты различаются по силе на 10 6 , и наиболее слабая из них находится в равновесии.Когда те же самые два соединения объединяются в растворе ДМСО, происходит незначительный перенос протона, поскольку уксусная кислота теперь более чем в 10 3 раз слабее кислоты, чем катион триэтиламмония.
Функция кислотности Hammett
Ионизационные измерения водных растворов кислот (и оснований) обычно ограничиваются диапазоном pH от 1,5 до 13. Относительные значения более сильных кислот (и оснований) требуют использования других растворителей, а из-за различий в диэлектрических постоянных, сольватации, и других отклонений от идеальности, непротиворечивых отношений не добиться.
В идеале H или обеспечивает количественную меру силы кислоты для неводных и концентрированных водных кислот Бренстеда. Функция кислотности является мерой кислотности среды или системы растворителей, обычно выражаемой в терминах ее способности отдавать протоны основанию известной основности. Выход из этой ситуации предложил Луи Хэмметт (Колумбийский университет). Hammett предложил использовать ряд слабых индикаторных оснований, в которых соотношение [B]/[BH + ] можно было определить колориметрически благодаря характерно окрашенной сопряженной кислоте. Когда отношение [B] к [BH + ] становится особенно малым и экспериментально невозможно точно измерить, другой, менее основной индикатор, перекрывающий первый, может служить для расширения диапазона кислотности. Дополнительные более слабые индикаторные основания позволили бы перепрыгнуть через шкалу кислотности, расширив ее примерно в 10 10 раз.С этой целью функция кислотности H o была определена, как показано в следующем уравнении.
Выход из этой ситуации предложил Луи Хэмметт (Колумбийский университет). Hammett предложил использовать ряд слабых индикаторных оснований, в которых соотношение [B]/[BH + ] можно было определить колориметрически благодаря характерно окрашенной сопряженной кислоте. Когда отношение [B] к [BH + ] становится особенно малым и экспериментально невозможно точно измерить, другой, менее основной индикатор, перекрывающий первый, может служить для расширения диапазона кислотности. Дополнительные более слабые индикаторные основания позволили бы перепрыгнуть через шкалу кислотности, расширив ее примерно в 10 10 раз.С этой целью функция кислотности H o была определена, как показано в следующем уравнении. В разбавленных водных растворах преобладающими кислотами являются H 3 O + , поэтому шкала pH является наиболее часто используемой функцией кислотности в таких системах.В концентрированной серной кислоте преобладающим видом кислоты является H 3 SO 4 + , гораздо более сильная кислота, таким образом, H o является расширением шкалы pKa для очень сильных кислот.
Ключевым фактором для измерения значимого значения H или является выбор подходящего растворителя. Идеально. желателен слабоосновной протонный растворитель, имеющий большую диэлектрическую проницаемость, значительную степень автопротолиза и хорошую сольватацию ионов. Нестандартным выбором Хэммета стала безводная серная кислота .Несмотря на очевидные опасения по поводу коррозионной активности, гигроскопичности и вязкости, выбор оказался удачным, о чем свидетельствуют следующие характеристики. Поскольку следы воды нежелательны, необходимо титрование SO 3 (дымящая серная кислота) до максимальной точки плавления.
В разбавленных водных растворах преобладающими кислотами являются H 3 O + , поэтому шкала pH является наиболее часто используемой функцией кислотности в таких системах.В концентрированной серной кислоте преобладающим видом кислоты является H 3 SO 4 + , гораздо более сильная кислота, таким образом, H o является расширением шкалы pKa для очень сильных кислот.
Ключевым фактором для измерения значимого значения H или является выбор подходящего растворителя. Идеально. желателен слабоосновной протонный растворитель, имеющий большую диэлектрическую проницаемость, значительную степень автопротолиза и хорошую сольватацию ионов. Нестандартным выбором Хэммета стала безводная серная кислота .Несмотря на очевидные опасения по поводу коррозионной активности, гигроскопичности и вязкости, выбор оказался удачным, о чем свидетельствуют следующие характеристики. Поскольку следы воды нежелательны, необходимо титрование SO 3 (дымящая серная кислота) до максимальной точки плавления.
Автопротолиз
2 H 2 SO 4 H 3 S Так 4 (+) + HSO 4 (-)Свойства безводной серной кислоты точка плавления автопротолиз
константадиэлектрик
константаpKa 10.3 ºC K ap = 2,7 10 -4 ~100 -2,8 В следующих таблицах перечислены некоторые индикаторные основания Hammett и H или некоторых очень сильных кислот или «суперкислот». РКа индикаторных оснований определяли в водных растворах сильных кислот H 2 SO 4 и HClO 4 . Значения Ho были определены в безводной серной кислоте, а значения сильнее -16 являются оценочными.

Константы индикатора Хэммета (pKa) Индикатор90 572 Н 2 SO 4 / Вода HClO 4 / Вода р-нитроанилин 1,11 1,11 0-нитроанилин -0.20 -0,19 п-Нитродифениланилин -2,38 — 2,4-Дихлор-6-нитроаниин -3,22 2,4-динитроанилиновым -4,38 -4,33 Benzalacetophenone -5,61 р-Benzoyldiphenyl -6,19 — 6-Bromo-2,4-DiitroaniLine -6.59 — Anthraquinone -8.  15
15— 2,4,6-тринитроанилина -9.29 — Ho для некоторых сильных кислот (pKa) + Хо +кислота Серная кислота хлорной кислоты -13,0 хлорсульфокислоты -13,8 трифторметансульфокислоты (CF 3 SO 3 H) -14,6 Фторид водорода -15.1 фторсульфоновая кислота -15.6 Superacids H (CXB 11 Y 5 Z 6 ) ~ -19 ~ -19 Magic Acid (FSO 3 H ·SbF 5 ) -21 Фторсурьмяная кислота (HSbF 6 ) -21 Прочные основания
Химикам-органикам нужны основания различной силы в качестве реагентов, адаптированных к требованиям конкретных реакций.
 Нейтральные соединения азота могут охватывать диапазон основности примерно 10 10 , как показано в следующей таблице. Пиридин обычно используется в качестве поглотителя кислоты в реакциях, которые производят побочные продукты минеральной кислоты. Его основность и нуклеофильность могут быть модифицированы стерическими затруднениями, как в случае лутидина (pK a = 6,3), или стабилизацией резонанса, как в случае 4-диметиламинопиридина (pK a = 9,2). Основание Хюнига относительно ненуклеофильно (из-за стерических затруднений) и, как и DBU, часто используется в качестве основания в реакциях элиминации E2, проводимых в неполярных растворителях.Основание Бартона представляет собой сильное слабонуклеофильное нейтральное основание, которое служит в тех случаях, когда электрофильное замещение DBU или других аминовых оснований является проблемой.
Нейтральные соединения азота могут охватывать диапазон основности примерно 10 10 , как показано в следующей таблице. Пиридин обычно используется в качестве поглотителя кислоты в реакциях, которые производят побочные продукты минеральной кислоты. Его основность и нуклеофильность могут быть модифицированы стерическими затруднениями, как в случае лутидина (pK a = 6,3), или стабилизацией резонанса, как в случае 4-диметиламинопиридина (pK a = 9,2). Основание Хюнига относительно ненуклеофильно (из-за стерических затруднений) и, как и DBU, часто используется в качестве основания в реакциях элиминации E2, проводимых в неполярных растворителях.Основание Бартона представляет собой сильное слабонуклеофильное нейтральное основание, которое служит в тех случаях, когда электрофильное замещение DBU или других аминовых оснований является проблемой.Наиболее сильными основаниями, доступными химикам-органикам, являются соли алкоксидов щелочных металлов, такие как трет-бутоксид калия (pK a = от 16 до 19), алкилы щелочных металлов, такие как реактивы Гриньяра, н-бутиллитий и димсил натрия (pK a ).
 = 28 до 40 выше), и амидные соли щелочных металлов, такие как LDA (pK a = от 30 до 40) и гидрид натрия (pK a ~ 42).Все эти мощные основания являются потенциальными нуклеофилами (некоторые в большей степени, чем другие) и имеют частично ионные связи с металлами. Основания в этих диапазонах pKa используются для превращения слабых кислот C-H в пригодные для использования реагенты карбанион-металл.
= 28 до 40 выше), и амидные соли щелочных металлов, такие как LDA (pK a = от 30 до 40) и гидрид натрия (pK a ~ 42).Все эти мощные основания являются потенциальными нуклеофилами (некоторые в большей степени, чем другие) и имеют частично ионные связи с металлами. Основания в этих диапазонах pKa используются для превращения слабых кислот C-H в пригодные для использования реагенты карбанион-металл.
———————————-Слабые C-H кислоты + Соединение 90 573 рКнитрометан 10,2 диэтилмалонат 13 Циклопентадиен 16 Ацетон 20 Ацетилен 25 Ацетонитрило 25 диметилсульфон 28 ДМСО * 35 трифенилметановых 33 толуол 41 Бензол 43 Этан 49
* ДМСО = ДиметилсульфоксидНекоторые примеры препаратов алкилметаллов вместе с аналогичными металлическими амидами показаны в следующих уравнениях.
 Во всех случаях используются инертные растворители, такие как бензол, циклогексан, тетрагидрофуран и эфир. Поскольку эти реакции идут до конца, стрелки равновесия не рисуются.
Во всех случаях используются инертные растворители, такие как бензол, циклогексан, тетрагидрофуран и эфир. Поскольку эти реакции идут до конца, стрелки равновесия не рисуются.
йодид метила магния: CH 3 I + MG — > CH 3 MGI (эфирный раствор)
Butyl литий: 2 Li + C 4 H 9 x — > C 4 H 9 Li + LiX (где X = Cl, Br)
Тритил натрия*: (C 6 H 5 ) 3 CCl + 2 Na 04 (C 60 0 4 > 90 0 90 6 h 5 ) 5 ) 3 CNA + NaCl
Dimsyl натрий: CH 3 SUCH 3 + NAH — > CH 3 SUCH 2 NA + H 2
LDA : [(CH 3 ) 2 ) CH] 2 NH + C 4 H 9 LI — > [(CH 3 ) 2 ) CH] 2 NLI + C 4 H 4 H 10 10
Lihmds: {(CH 3 ) 3 Si} 2 NH + C 4 H 9 Li — > {(CH 3 ) 3 Si} 2 NLi + C 4 H 10
* Этот анион имеет красный цвет и служит индикатором. Это также одноэлектронный восстановитель.
Это также одноэлектронный восстановитель.
Алкилирование нитрила: RCH 2 CN + LDA — > RCHCNLi + {(CH 3 ) 2 )C} 2 NH;
RCHCNLi + R’X — > R’RCCHCN + LiX
Альдегиды, кетоны и сложные эфиры, имеющие активированные C-H группы, могут быть аналогичным образом превращены в сопряженные с ними основания с последующим алкилированием или присоединением к электрофильным функциям.
——————Слабые N-H кислоты + Соединение +рК пиррола 16 Анилин 27 ГМДС * 27 Аммиак 34 Пирролидин ALIGN = «центр»>35 Диизопропиламин 35.7 ТМФ* 37 Водород, H 2 ~ 42
*ТМП = 2,2,6,6-тетраметилпиперидин
*ГМДС = Бис(триметилсилил)аминНеионогенные супероснования
Недавно был получен и изучен новый класс неметаллических слабонуклеофильных нейтральных оснований. Некоторые примеры показаны на следующей диаграмме.
Некоторые примеры показаны на следующей диаграмме.
Основным центром в основании Verkade является атом фосфора, сопряженная кислота стабилизирована трансаннулярной связью с азотом.Сила этих оснований может быть изменена заместителями на фланкирующих атомах азота. Фосфазеновые основания Швезингера увеличивают свою силу по мере добавления дополнительных фосфазеновых звеньев в сопряжении с основным участком (голубой атом азота). Все pK и для этих оснований измерены в ацетонитриле.

