Основание (химия) — Википедия
Материал из Википедии — свободной энциклопедии
У этого термина существуют и другие значения, см. Основание.Основание — химическое соединение, способное образовывать ковалентную связь с протоном (основание Брёнстеда) либо с вакантной орбиталью другого химического соединения (основание Льюиса)[1]. В узком смысле под основаниями понимают осно́вные гидроксиды — сложные вещества, при диссоциации которых в водных растворах отщепляется только один вид анионов — гидроксид-ионы OH−[2].
Частным случаем оснований являются щёлочи — гидроксиды щелочных, щелочноземельных металлов, а также некоторых других элементов, например, таллия. Реакции оснований с кислотами называют реакциями нейтрализации.
Понятие основания сформировалось в XVII веке и было впервые введено в химию французским химиком Гийомом Франсуа Руэлем в 1754 году. Он отметил, что кислоты, известные в те времена как летучие жидкости (например, уксусная или соляная кислоты), превращаются в кристаллические соли только в сочетании с конкретными веществами.
ru.wikipedia.org
Основания — это… Что такое Основания?
Основа́ния — класс химических соединений.
- Основания — (осно́вные гидрокси́ды) — вещества, молекулы которых состоят из ионов металлов или иона аммония и одной (или нескольких) гидроксогруппы (гидроксида) -OH. В водном растворе диссоциируют с образованием катионов и анионов ОН—. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами.
- Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.
- В органической химии по традиции основаниями называют также вещества, способные давать аддукты («соли») с сильными кислотами, например, многие алкалоиды описывают как в форме «алкалоид-основание», так и в виде «солей алкалоидов».
- В статье смысл термина основание раскрывается в первом, наиболее широко используемом значении — осно́вные гидрокси́ды.
Способы получения оснований
- Получение щелочи при реакции сильноосновного оксида с водой
Так как только сильноосновные оксиды способны реагировать с водой, этот способ можно использовать исключительно для получения сильных оснований или щелочей.
CaO(т) + H2O(ж) → Ca(OH)2(p)Слабоосновные и амфотерные оксиды с водой не реагируют, и поэтому соответствующие им гидроксиды таким способом получить нельзя.
- Косвенное получение основания (гидроксида) при реакции соли со щелочью
Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
- Получение щелочи при реакции замещения типичного металла с водой.
Ca+2H2O=Ca(OH)2+H2
Классификация оснований
- Растворимые в воде основания (щёлочи)
LiOH, NaOH, KOH, Ca(OH)2 , Ba(OH)2 , Sr(OH)2 , Ra(OH)2, CsOH, RbOH, FrOH
- Практически нерастворимые в воде гидрооксиды
Mg(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3 , Be(OH)2
- Другие основания
NH3 × H2O
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые, или гидроксиды типичных металлов и не типичных.
Химические свойства
1. Действие на индикаторы: лакмус — синий, метилоранж — жёлтый, фенолфталеин — малиновый,
2. Основание + кислота = Соли + вода Примечание:реакция не идёт, если и кислота, и щёлочь слабые. NaOH + HCl = NaCl + H2O
3. Щёлочь + кислотный или амфотерный оксид = соли + вода 2NaOH + SiO2 = Na2SiO3 + H2O
4. Щёлочь + соли = (новое)основание + (новая) соль прим-е:исходные вещества должны быть в растворе, а хотя бы 1 из продуктов реакции выпасть в осадок или мало растворяться. Ba(OH)2 + Na2SO4 = BaSO4+ 2NaOH
5.Слабые основания при нагреве разлагаются: Cu(OH)2+Q=CuO + H2O
6.При нормальных условиях невозможно получить гидроксиды серебра и ртути, вместо них в реакции появляются вода и соответствующий оксид: AgNO3 + 2NaOH(p) → NaNO3+Ag2O+H2O
См. также
Гидроксид
Wikimedia Foundation. 2010.
Химическое основание — это… Что такое Химическое основание?
Основа́ния — класс химических соединений.
- Основания — (осно́вные гидрокси́ды) — вещества, молекулы которых состоят из ионов металлов или иона аммония и одной (или нескольких) гидроксогруппы (гидроксида) -OH. В водном растворе диссоциируют с образованием катионов и анионов ОН—. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами.
- Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.
- В органической химии по традиции основаниями называют также вещества, способные давать аддукты («соли») с сильными кислотами, например, многие алкалоиды описывают как в форме «алкалоид-основание», так и в виде «солей алкалоидов».
- В статье смысл термина основание раскрывается в первом, наиболее широко используемом значении — осно́вные гидрокси́ды.
Способы получения оснований
- Получение щелочи при реакции сильноосновного оксида с водой
Так как только сильноосновные оксиды способны реагировать с водой, этот способ можно использовать исключительно для получения сильных оснований или щелочей.
CaO(т) + H2O(ж) → Ca(OH)2(p)Слабоосновные и амфотерные оксиды с водой не реагируют, и поэтому соответствующие им гидроксиды таким способом получить нельзя.
- Косвенное получение основания (гидроксида) при реакции соли со щелочью
Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
CuSO4(p) + 2NaOH(p) → Cu(OH)2(т)↓ + Na2SO4(p)- Получение щелочи при реакции замещения типичного металла с водой.
Ca+2H2O=Ca(OH)2+H2
Классификация оснований
- Растворимые в воде основания (щёлочи)
LiOH, NaOH, KOH, Ca(OH)2 , Ba(OH)2 , Sr(OH)2 , Ra(OH)2, CsOH, RbOH, FrOH
- Практически нерастворимые в воде гидрооксиды
Mg(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3 , Be(OH)2
- Другие основания
NH3 × H2O
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые, или гидроксиды типичных металлов и не типичных.
Химические свойства
1. Действие на индикаторы: лакмус — синий, метилоранж — жёлтый, фенолфталеин — малиновый,
2. Основание + кислота = Соли + вода Примечание:реакция не идёт, если и кислота, и щёлочь слабые. NaOH + HCl = NaCl + H2O
3. Щёлочь + кислотный или амфотерный оксид = соли + вода 2NaOH + SiO2 = Na2SiO3 + H2O4. Щёлочь + соли = (новое)основание + (новая) соль прим-е:исходные вещества должны быть в растворе, а хотя бы 1 из продуктов реакции выпасть в осадок или мало растворяться. Ba(OH)2 + Na2SO4 = BaSO4+ 2NaOH
5.Слабые основания при нагреве разлагаются: Cu(OH)2+Q=CuO + H2O
6.При нормальных условиях невозможно получить гидроксиды серебра и ртути, вместо них в реакции появляются вода и соответствующий оксид: AgNO3 + 2NaOH(p) → NaNO3+Ag2O+H2O
См. также
Гидроксид
Wikimedia Foundation. 2010.
dic.academic.ru
Конспект «Основания (названия, получение, свойства)»
«Основания (названия, получение, свойства)»
Ключевые слова конспекта: названия оснований, получение оснований, химические свойства.
Основаниями или гидроксидами называют соединения металлов с гидроксогруппами ОН (одна или несколько групп ОН на каждый атом металла М, т.е. МОН или М(ОН)n). Гидроксогруппа ОН – это ион, ее заряд равен 1–, валентность I.
Названия оснований
В названии основания два слова: КОН – гидроксид калия. Если металл имеет переменную валентность, то ее указывают римской цифрой в скобках: Сг(ОН)3 – гидроксид хрома(III).
Чтобы составить формулу гидроксида по названию соединения, надо знать заряд катиона металла Мn+. Число гидроксогрупп в формуле равно величине этого заряда: М(ОН)n. Заряды катионов металлов можно узнать из таблицы растворимости.
Например, в гидроксиде калия заряд иона калия 1+, К+, поэтому формула КОН. В гидроксиде бария ион бария Ва2+, формула Ва(ОН)2.
Щелочи – это растворимые в воде основания (LiOH, NaOH, КОН, Ва(ОН) 2, Са(ОН)2 ). Щелочи – очень едкие вещества, вызывают ожоги. При работе с ними надо особенно тщательно соблюдать правила техники безопасности, надевать очки и перчатки.
Для распознавания растворов щелочей используют индикаторы.

Индикаторы – это органические красители, изменяющие окраску в зависимости от состава раствора. Так, бесцветный раствор фенолфталеина в растворе щелочи становится малиновым. Фиолетовый раствор лакмуса в растворах щелочей становится синим, а оранжевый раствор метилоранжа приобретает интенсивно желтый цвет.
Нерастворимые основания – это практически нерастворимые в воде вещества, например гидроксид железа(III), гидроксид меди(II), гидроксид магния.
Основные оксиды – это оксиды, которым соответствуют основания. Если элемент образует несколько оксидов, то оксид, соответствующий низшей степени окисления, является основным оксидом. Например, СrО и МnО – основные оксиды.
Формулы основных оксидов можно вывести, вычитая необходимое число молекул воды из формулы основания. Например, для формул основных оксидов Na2O, СаО, Fe2O3:
а) 2NaOH – Н2O = Na2O;
б) Са(ОН)2 – Н2O = СаО;
в) 2Fe(OH)3 – ЗН2O = Fe2O3.

Получение оснований
Растворимые основания получают:
а) реакцией оксидов щелочных и щелочноземельных металлов с водой: ВаО + Н2O = Ва(ОН)2;
б) взаимодействием активных металлов (электроотрицательность которых 1,2 и меньше) с водой: 2 Li + 2Н2O = 2LiOH + Н2 ↑;
в) электролизом водного раствора соли, например хлорида натрия; при пропускании постоянного электрического тока через раствор на катоде выделяется водород, на аноде – хлор, а в растворе остается гидроксид натрия:
2NaCl + 2Н2O →электролиз→ Н2 ↑ + 2NaOH + Cl2 ↑.
Нерастворимые основания получают по реакции обмена растворимых солей со щелочами:
CuCl2 + 2NaOH = Cu(OH)2 ↓ + 2NaCl.
Химические свойства оснований
Нерастворимые основания – довольно неустойчивые соединения. Нагревание (300–400 °С) приводит к потере ими воды. Например, голубой гидроксид меди(II) при нагревании отщепляет воду и превращается в черный оксид меди(II):
Сu(ОН)2 → t → СuО + Н2O.


Конспект урока «Основания».
Следующая тема: «».
Основания (названия, получение, свойства)
5 (100%) 2 vote[s]uchitel.pro
Основания. Химические свойства и получение
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Основания – сложные вещества, которые состоят из катиона металла Ме+ (или металлоподобного катиона, например, иона аммония NH4+) и гидроксид-аниона ОН—.
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания. Также есть неустойчивые основания, которые самопроизвольно разлагаются.
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Например, оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий), кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например, калий реагирует с водой очень бурно:
2K0 + 2H2+O → 2K+OH + H20
3. Электролиз растворов некоторых солей щелочных металлов. Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
либо
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например, гидроксид меди (II) взаимодействует с сильной соляной кислотой:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
Cu(OH)2 + CO2 ≠
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например, гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
2Fe(OH)3 = Fe2O3 + 3H2O
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например, гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4Fe+2(OH)2 + O20 + 2H2O → 4Fe+3(O-2H)3
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O
2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли, а в растворе – комплексные соли.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например, при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
NaOH + Al(OH)3 = NaAlO2 + 2H2O
А в растворе образуется комплексная соль:
NaOH + Al(OH)3 = Na[Al(OH)4]
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (как правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
либо:
щёлочь + кислотный оксид(избыток) = кислая соль
Например, при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
2NaOH + CO2 = Na2CO3 + H2O
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе, при условии, что в продуктах образуется газ или осадок. Такие реакции протекают по механизму ионного обмена.
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Например, гидроксид натрия взаимодействует с сульфатом меди в растворе:
Cu2+SO42- + 2Na+OH— = Cu2+(OH)2—↓ + Na2+SO42-
Также щёлочи взаимодействуют с растворами солей аммония.
Например, гидроксид калия взаимодействует с раствором нитрата аммония:
NH4+NO3— + K+OH— = K+NO3— + NH3↑ + H2O
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид, взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла.
Например, избыток сульфата цинка реагирует в растворе с гидроксидом калия:
ZnSO4 + 2KOH = Zn(OH)2↓ + K2SO4
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей. Таким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
ZnSO4 + 4KOH = K2[Zn(OH)4] + K2SO4
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например, гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
KHSO3 + KOH = K2SO3 + H2O
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH +Si0 + H2+O= NaCl— + Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
Поделиться ссылкой:
chemege.ru
Общая характеристика оснований — урок. Химия, 8–9 класс.
В \(1754\) году французский химик Г. Руэль (\(1703\)–\(1770\)) ввёл термин «основание», подразумевая, что к соединениям данного класса относится любое вещество, которое способно взаимодействовать с кислотами, образуя соли.
Гийом Франсуа Руэль
\(1703\)–\(1770\)
Позже значение этого термина неоднократно уточнялось. Одно из определений, которым пользуются в настоящее время, звучит так:
Основаниями называют сложные вещества, в состав которых входят металлические химические элементы, соединённые с одной или несколькими гидроксогруппами (группами атомов \(-OH\)).
Исходя из этого, общую химическую формулу оснований можно изобразить следующим образом:
M(OH)n,
где \(M\) — знак металлического химического элемента,
а \(n\) — индекс, численно совпадающий с валентностью металла.
Основания относятся к электролитам, то есть к веществам, растворы и расплавы которых проводят электрический ток.
С точки зрения теории электролитической диссоциации, основания — электролиты, которые, диссоциируя, из отрицательно заряженных ионов образуют только гидроксид-ионы.
Номенклатура оснований
Название основания состоит из слова «гидроксид» и названия металлического химического элемента в родительном падеже. Если металлический элемент имеет переменную валентность, то последняя указывается римскими цифрами в скобках без пробела сразу же после названия металла.Пример:
NaOH — гидроксид натрия,
Fe(OH)2 — гидроксид железа(\(II\)),
Fe(OH)3 — гидроксид железа(\(III\)).
Классификация оснований
Растворимые в воде основания называют щелочами.
По их способности растворяться в воде основания делят на растворимые и практически нерастворимые.
Примеры: NaOH — гидроксид натрия, KOH — гидроксид калия, Ca(OH)2 — гидроксид кальция. | Примеры: Cu(OH)2 — гидроксид меди(\(II\)), Fe(OH)2 — гидроксид железа(\(II\)), Fe(OH)3 — гидроксид железа(\(III\)). |
www.yaklass.ru
Урок 29. Понятие об основаниях – HIMI4KA
В уроке 29 «Понятие об основаниях» из курса «Химия для чайников» познакомимся с новым классом химических веществ — основаниями, а также узнаем о новом типе химических реакций — реакциях обмена.

Как вы уже знаете, при взаимодействии активных металлов и их оксидов с водой образуются основания — соединения, не принадлежащие ни к одному из известных вам до сих пор классов: оксидов, солей или кислот.
Основания как сложные вещества
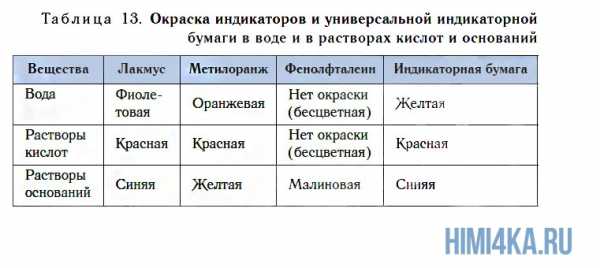
Испытаем с помощью индикатора раствор, полученный в результате реакции оксида кальция CaO с водой. Для этого прибавим к нему 1—2 капли раствора метилового оранжевого. Окраска раствора изменится с оранжевой на желтую (рис. 111).

Это свидетельствует о том, что в полученном растворе присутствует не кислота, а какое-то новое вещество, изменяющее цвет индикатора. Подобно оксиду кальция, с водой реагируют и некоторые другие оксиды, например оксид натрия Na2O:
В результате взаимодействия оксидов кальция и натрия с водой образуются вещества Са(ОН)2 и NaОН. Они похожи тем, что в их состав входят атомы металлов и группы ОН, называющиеся гидроксогруппами (от греческого слова «hydor», которое означает «вода»). Такие вещества относятся к классу оснований.
Основания — сложные вещества, состоящие из атомов металлов и гидроксогрупп.
Валентность гидроксогруппы равна единице. Зная это, легко составить формулу любого основания: число групп ОН в формуле основания всегда равно валентности атома металла, например:
В то же время по формуле основания можно легко определить валентность атомов содержащегося в нем металла — она равна числу гидроксогрупп в формуле данного основания. Например, в формуле основания Fe(OH)2 две гидроксогруппы, следовательно, валентность атома железа в этом веществе равна II, а в основании Cr(OH)3 валентность атомов хрома равна III.
Как же называются основания? Известно, что продукты соединения воды с веществами называются гидратами. Если с водой соединяются оксиды металлов, то образуются гидраты оксидов металлов, или сокращенно гидроксиды металлов. Поэтому вещества Ca(OH)2 и NaOH, образующиеся при взаимодействии оксидов кальция и натрия с водой, называются «гидроксид кальция» и «гидроксид натрия».
По растворимости в воде основания делятся на растворимые и нерастворимые. Растворимые в воде основания называют щелочами. К их числу относятся KOH, NaOH, Ca(OH)2, Ba(OH)2 и некоторые другие.
Обнаружить присутствие растворимых в воде оснований (щелочей) можно по изменению окраски индикаторов. Кроме известных вам лакмуса и метилоранжа, для этих целей можно использовать еще один индикатор — фенолфталеин. Он не имеет окраски в воде и в растворе кислоты, но в присутствии щелочей этот индикатор окрашивается в малиновый цвет (см. рис. 111, табл. 13).
Реакция нейтрализации
Как было показано, растворимые в воде основания — щёлочи — легко обнаружить с помощью индикаторов. Однако если к раствору гидроксида натрия NaOH прибавить фенолфталеин, а затем хлороводородную кислоту, то появившаяся вначале малиновая окраска после добавления кислоты исчезает (рис. 112).

Это свидетельствует о том, что кислота как бы уничтожила, или нейтрализовала, основание. Реакцию между кислотой и основанием, протекающую в этом случае, называют реакцией нейтрализации:
Реакция нейтрализации — это реакция между основанием и кислотой, в результате которой образуются соль и вода.
Реакция нейтрализации не относится ни к одному из известных вам до сих пор типов реакций (разложения, соединения, замещения). Это реакция нового типа — реакция обмена.
Реакциями обмена называются реакции между сложными веществами, в ходе которых они обмениваются своими составными частями.
Основание состоит из атомов металла и гидроксогрупп, а кислота — из атомов водорода и кислотного остатка. В результате реакции исходные вещества обменялись своими составными частями (рис. 113):
Краткие выводы урока:
- Основания — сложные вещества, состоящие из атомов металлов и гидроксогрупп.
- Реакция между основанием и кислотой, в ходе которой образуются соль и вода, называется реакцией нейтрализации.
- Реакция обмена — реакция между сложными веществами, в результате которой они обмениваются своими составными частями.
Надеюсь урок 29 «Понятие об основаниях» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
