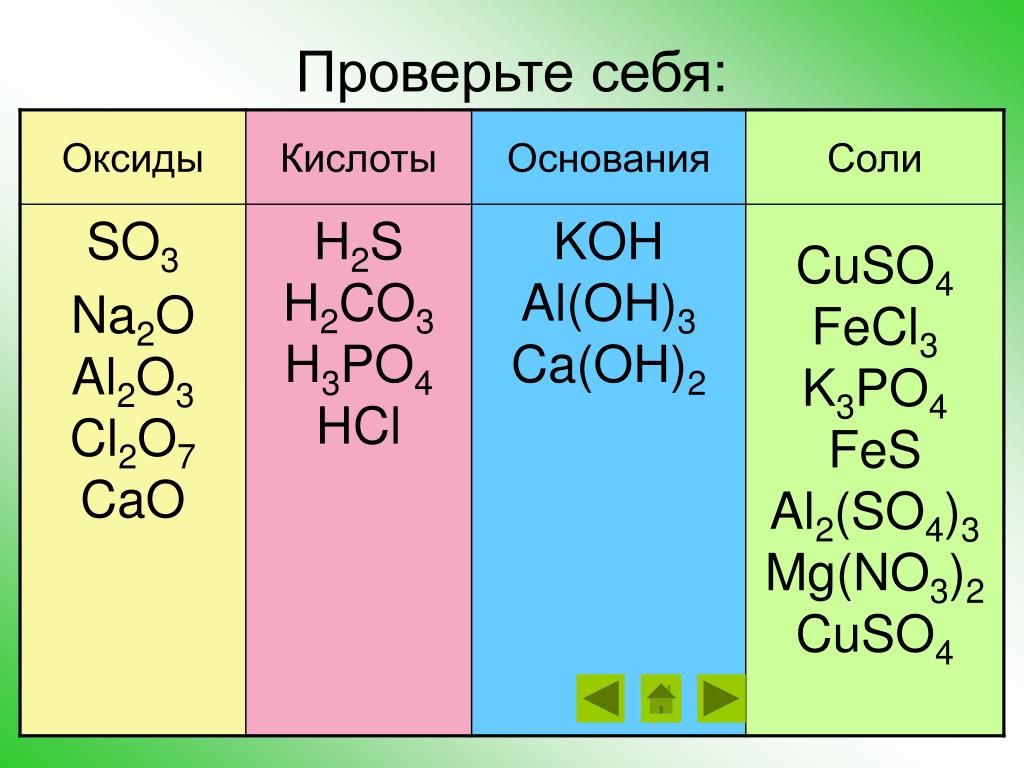
Химические свойства основных классов неорганических соединений. Оксиды, кислоты, основания, соли
Кислотные оксиды
- Кислотный оксид + вода = кислота (исключение — SiO2)
SO3 + H2O = H2SO4
Cl2O7 + H2O = 2HClO4 - Кислотный оксид + щелочь = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O - Кислотный оксид + основный оксид = соль
CO2 + BaO = BaCO3
SiO2 + K2O = K2SiO3
Основные оксиды
- Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + H2O = Ca(OH)2
Na2O + H2O = 2NaOH - Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl2 + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O - Основный оксид + кислотный оксид = соль
MgO + CO2 = MgCO3
Na2O + N2O5 = 2NaNO3
Амфотерные оксиды
- Амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
ZnO + H2SO4 = ZnSO4 + H2O - Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K2ZnO2 + H2O (Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4])
Al 2O3 + 2NaOH = 2NaAlO2 + H2O (Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]) - Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3 - Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO2)2
Кислоты
- Кислота + основный оксид = соль + вода
2HNO3 + CuO = Cu(NO3)2 + H2O
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O - Кислота + амфотерный оксид = соль + вода
3H2SO4 + Cr2O3 = Cr2
2HBr + ZnO = ZnBr2 + H2O - Кислота + основание = соль + вода
H2SiO3 + 2KOH = K2SiO3 + 2H2O
2HBr + Ni(OH)2 = NiBr2 + 2H2O - Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH)3 = CrCl3 + 3H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O - Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO3 = CaBr2 + H2O + CO2
H2S + K2SiO3 = K2S + H2SiO3 - Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
2HCl + Zn = ZnCl2 + H2
H 2SO4 (разб. ) + Fe = FeSO4 + H2
) + Fe = FeSO4 + H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
Амфотерные гидроксиды
- Амфотерный гидроксид + кислота = соль + вода
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Be(OH)2 + 2HCl = BeCl2 + 2H2O - Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O - Амфотерный гидроксид + щелочь = соль (в водном растворе)
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Sn(OH)2
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Щелочи
- Щелочь + кислотный оксид = соль + вода
Ba(OH)2 + N2O5 = Ba(NO3)2 + H2O
2NaOH + CO2 = Na2СO3 + H2O - Щелочь + кислота = соль + вода
3KOH + H3PO4 = K3PO4 + 3H2O
Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O - Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na2ZnO2 + H2O (Правильнее: 2NaOH + ZnO + H2O = Na2[Zn(OH)4]) - Щелочь + амфотерный гидроксид = соль (в водном растворе)
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4] - Щелочь + растворимая соль = нерастворимое основание + соль
Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3KOH + FeCl3 = Fe(OH)3 + 3KCl - Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2
2KOH + 2Al + 6H2O = 2K[Al(OH)4] + 3H2
Соли
- Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (H - Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO3)2 + K2S = PbS + 2KNO3
СaCl2 + Na2CO3 = CaCO3 + 2NaCl - Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3 - Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.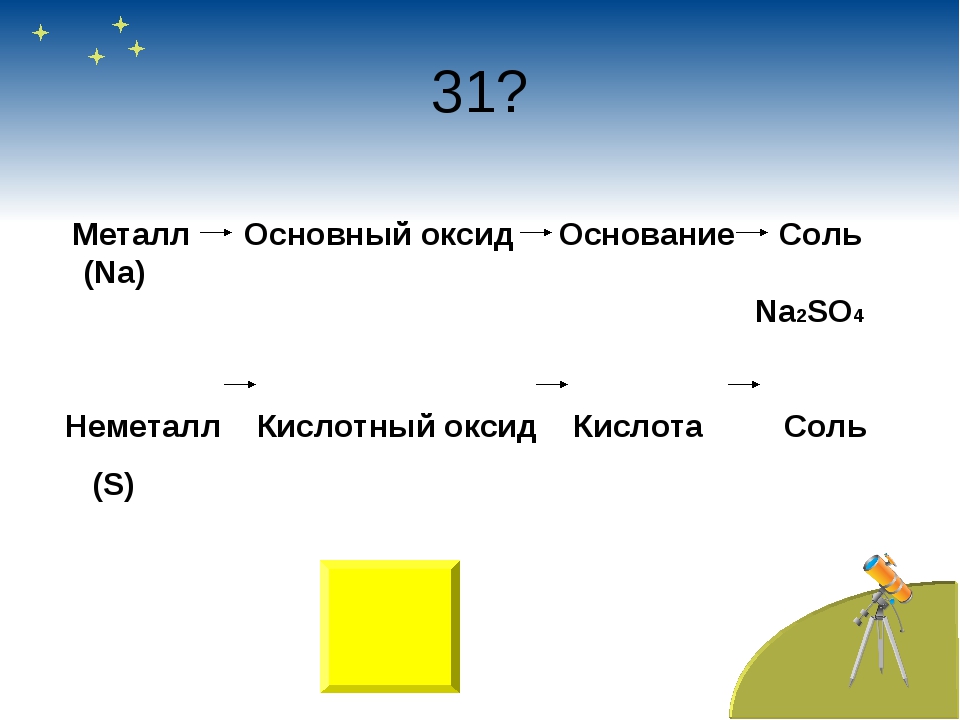
Возможно, вам также будут интересны другие разделы справочника по химии:
Химические свойства оксидов для ЕГЭ 2021 / Блог / Справочник :: Бингоскул
Классификация оксидов:
1 группа — несолеобразующие — N2O, NO, CO, SiO.
2 группа — солеобразующие:
- Основные — это такие оксиды, которым соответствуют основания. Оксиды металлов, степень окисления которых +1, +2 : Na2O, CaO, CuO, FeO, CrO. Реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания: 1) щелочные металлы; 2) щелочноземельные металлы; 3) некоторые — CrO, MnO, FeO. Типичные реакции основных оксидов:
- Основный оксид + кислота → соль + вода (реакция обмена).
- Основный оксид + кислотный оксид → соль (реакция соединения)
- Основный оксид + вода → щелочь (реакция соединения).
- Кислотные —— это такие оксиды, которым соответствуют кислоты. Оксиды неметаллов. Оксиды металлов, степень окисления которых > +5: SO2, SO3, P2O5, CrO3, Mn2O7. Реагируют с избытком щелочи с образованием соли и воды. Типичные реакции кислотных оксидов:
- Кислотный оксид + основание → соль + вода (реакция обмена).
- Кислотный оксид + основный оксид → соль (реакция соединения).
- Кислотный оксид + вода → кислота (реакция соединения)
- Амфотерные — это оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Оксиды металлов, степень окисления которых +2, +3, +4: BeO, ZnO, Al2O3, Cr2O3, MnO2. Взаимодействуют как с кислотами так и с основаниями.
 Реагируют с основными и кислотными оксидами. Амфотерные оксиды с водой непосредственно не соединяются. Типичные реакции амфотерных оксидов:
Реагируют с основными и кислотными оксидами. Амфотерные оксиды с водой непосредственно не соединяются. Типичные реакции амфотерных оксидов: - Амфотерный оксид + кислота → соль + вода (реакция обмена).
- Амфотерный оксид + основание → соль + вода или комплексное соединение.
Оксид углерода 2 и 4
Оксид углерода(II) в химическом отношении – инертное вещество. Не реагирует с водой, однако при нагревании с расплавленными щелочами образует соли муравьиной кислоты: CO + NaOH = HCOONa.
Взаимодействие с кислородом
При нагревании в кислороде сгорает красивым синим пламенем: 2СО + О2 = 2СО2.
Взаимодействие с водородом: СО + Н2 = С + Н2О.
Взаимодействие с другими неметаллами. При облучении и в присутствии катализатора взаимодействует с галогенами: СО + Cl2 = COCl2 (фосген). и серой СО + S = COS (карбонилсульфид).
Восстановительные свойства
СО – энергичный восстановитель. Восстанавливает многие металлы из их оксидов:
C+2O + CuO = Сu + C+4O2.
Взаимодействие с переходными металлами
С переходными металлами образует карбонилы:
- Ni + 4CO = Ni(CO)4;
- Fe + 5CO = Fe(CO)5.
Оксид углерода (IV) (углекислый газ, диоксид углерода, двуокись углерода,угольный ангидрид) — CO2, бесцветный газ (в нормальных условиях), без запаха, со слегка кисловатым вкусом. Химически оксид углерода (IV) инертен.
Окислительные свойства
С сильными восстановителями при высоких температурах проявляет окислительные свойства. Углем восстанавливается до угарного газа: С + СО2 = 2СО.
Магний, зажженный на воздухе, продолжает гореть и в атмосфере углекислого газа: 2Mg + CO2 = 2MgO + C.
Свойства кислотного оксида
Типичный кислотный оксид. Реагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
- Na2O + CO2 = Na2CO3,
- 2NaOH + CO2 = Na2CO3 + H2O,
- NaOH + CO2 = NaHCO3.
Качественна реакция — для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
В начале реакции образуется белый осадок, который исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат: CaCO3 + H2O + CO2 = Сa(HCO3)2.
Изучай химические свойства
Решай с ответами:
Реакции ионного обмена и условия их осуществления
Химические свойства оксидов: основных, амфотерных, кислотных
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления ($–2$).
Общая формула оксидов: $Э_{m}O_n$, где $m$ — число атомов элемента $Э$, а $n$ — число атомов кислорода. Оксиды могут быть твердыми (песок $SiO_2$, разновидности кварца), жидкими (оксид водорода $H_2O$), газообразными (оксиды углерода: углекислый $CO_2$ и угарный $CO$ газы). По химическим свойствам оксиды подразделяются на солеобразующие и несолеобразующие.
Несолеобразующими называются такие оксиды, которые не взаимодействуют ни со щелочами, ни с кислотами и не образуют солей. Их немного, в их состав входят неметаллы.
Солеобразующими называются такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
Среди солеобразующих оксидов различают оксиды

Основные оксиды — это такие оксиды, которым соответствуют основания. Например: $CaO$ соответствует $Ca(OH)_2, Na_2O — NaOH$.
Типичные реакции основных оксидов:
1. Основный оксид + кислота → соль + вода (реакция обмена):
$CaO+2HNO_3=Ca(NO_3)_2+H_2O$.
2. Основный оксид + кислотный оксид → соль (реакция соединения):
$MgO+SiO_2{→}↖{t}MgSiO_3$.
3. Основный оксид + вода → щелочь (реакция соединения):
$K_2O+H_2O=2KOH$.
Кислотные оксиды — это такие оксиды, которым соответствуют кислоты. Это оксиды неметаллов:
N2O5 соответствует $HNO_3, SO_3 — H_2SO_4, CO_2 — H_2CO_3, P_2O_5 — H_3PO_4$, а также оксиды металлов с большим значением степеней окисления: ${Cr}↖{+6}O_3$ соответствует $H_2CrO_4, {Mn_2}↖{+7}O_7 — HMnO_4$.
Типичные реакции кислотных оксидов:
1. Кислотный оксид + основание → соль + вода (реакция обмена):
$SO_2+2NaOH=Na_2SO_3+H_2O$.
2. Кислотный оксид + основный оксид → соль (реакция соединения):
$CaO+CO_2=CaCO_3$.
3. Кислотный оксид + вода → кислота (реакция соединения):
$N_2O_5+H_2O=2HNO_3$.
Такая реакция возможна, только если кислотный оксид растворим в воде.
Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Это $ZnO, Al_2O_3, Cr_2O_3, V_2O_5$. Амфотерные оксиды с водой непосредственно не соединяются.
Типичные реакции амфотерных оксидов:
1. Амфотерный оксид + кислота → соль + вода (реакция обмена):
$ZnO+2HCl=ZnCl_2+H_2O$.
2. Амфотерный оксид + основание → соль + вода или комплексное соединение:
$Al_2O_3+2NaOH+3H_2O{=2Na[Al(OH)_4],}↙{\text»тетрагидроксоалюминат натрия»}$
$Al_2O_3+2NaOH={2NaAlO_2}↙{\text»алюминат натрия»}+H_2O$.
Новости школы -Подготовка к ЕГЭ по химии. Часть А-3.
Характерные химические свойства неорганических веществ
различных классов
Обязательный минимум знаний
Схема 2
Классификация неорганических веществ
Вещества
Простые Сложные
Металлы Благородные Оксиды Соли
газы
Неметаллы Кислоты Основания
Схема 3
Оксиды и их классификация
Оксиды – бинарные соединения с кислородом в с. о. – 2
о. – 2
Несолеобразующие Солеобразующие
N2O, NO, CO 1. Основные – оксиды металлов в с.о. +1, +2
(оксиды металлов IА и IIА групп но не ZnO,
BeO), оксиды металлов в низших с.о. (СrO, FeO)
2. Кислотные – оксиды неметаллов (N2O5, SO2,
SO3) и металлов с высокой с.о. +5,+6,+7, (CrO3, Mn2O7).
3. Амфотерные — ZnO, BeO, Al2O3,
оксиды металлов в промежуточных с.о. (Cr2O3, Fe2O3).
Таблица 2
Характерные химические свойства солеобразующих оксидов
Гр. Оксидов Свойства | Основные оксиды | Кислотные оксиды | Амфотерные оксиды |
Образуют соль и воду в реакции обмена при взаимодействии | с кислотами | с основаниями | и с кислотами, и с основаниями |
Образуют соль в реакции соединения при взаимодействии | с кислотными и амфотерными оксидами | с основными и амфотерными оксидами | с основными и кислотными оксидами |
Образуют растворимый гидроксид при взаимодействии с водой | щелочи | кислородсодержащие кислоты | не взаимодействуют с водой |
Основания
Основания (в свете атомно-молекулярного учения) – сложные вещества, состоящие из металла и гидроксогрупп.
Основания (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы металла и анионы гидроксогрупп.
Основания (в свете протонной теории) – акцепторы катионов водорода.
Таблица 3
Классификация оснований
Характерные химические свойства оснований
и амфотерных гидроксидов
1. 1) Основание (или амфотерный гидроксид) + кислота = соль + вода
2) Бескилородное основание (аммиак, амины) + кислота = соль
2. Основание + кислотный оксид = соль + вода
3. Щелочь + растворимая соль = новая соль + новое основание (если образуется осадок или газ)
4. Щелочь + амфотерный гидроксид = соль + вода
t
5. Нерастворимые основания (или амфотерный гидроксид) =
= оксид металла + вода
Кислоты
Кислоты (в свете атомно-молекулярного учения) – сложные вещества, состоящие из атомов водорода и кислотного остатка.
Кислоты (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка.
Кислоты (в свете протонной теории) – доноры катионов водорода.
Характерные химические свойства кислот
1. Кислота + металл = соль + водород, если:
— металл находится в ряду напряжений до водорода,
— образуется растворимая соль,
— кислота растворима,
Примечания:
· щелочные металлы для реакций с растворами кислот не берут, так как они взаимодействуют, в первую очередь, с водой,
· азотная кислота любой концентрации и концентрированная серная кислота взаимодействует с простыми веществами по-особому (см. табл. 5)
табл. 5)
2. Кислота + оксид металла (основный или амфотерный) = соль + вода
3. Кислота + основание (гидроксид или бескислородное основание) = соль +
+ вода (для бескилородных оснований — только соль).
4. Кислота + соль = новая кислота + новая соль (если образуется осадок, газ или слабый электролит).
Таблица 4
Классификация кислот
Соли
Соли (в свете атомно-молекулярного учения) – сложные вещества, состоящие из ионов металла и кислотного остатка.
Соли (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы металла и анионы кислотного остатка.
Примечание. Эти определения справедливы только для нормальных или средних солей.
Схема 4
Классификация солей
Соли
Средние Кислые Основные Двойные Комплексные
или нормальные Сa (HCO3)2, (CuOH)CO3, (NH4)2Fe (SO4)2, K3[Fe (CN)6]
NaCl, K2SO4, NaHSO4, Al (OH)2Cl, KAl (SO4)2, K4[Fe (CN)6]
CaCO3, RCOONa KH2PO4 Fe (OH)SO4 KCl∙NaCl
Характерные химические свойства солей
1. Соль + кислота = новая кислота + новая соль (если образуется осадок или газ).
2. Растворимая соль + щелочь = новая соль + новое основание (если образуется осадок или газ)
3. Соль1 (раствор) + соль2 (раствор) = соль3 + соль4 (если образуется осадок)
4. Соль (раствор) + металл = новая соль + новый металл, если:
Соль (раствор) + металл = новая соль + новый металл, если:
· металл находится в ряду напряжений до металла соли,
· образуется растворимая соль.
Примечание: щелочные металлы для реакций с растворами солей не берут, так как они взаимодействуют, в первую очередь, с водой.
Примеры тестовых заданий и
рекомендации к их выполнению
1. Только солеобразующие оксиды находятся в ряду
1) P2O5, ZnO, NO
2) CO, N2O5, Na2O
3) Al2O3, N2O, N2O3
4) SiO2, BeO, CaO
Это задание следует выполнить методом исключения тех рядов веществ, в которых содержаться формулы несолеобразующих оксидов, так как таких оксидов немного и их нужно знать. Исключаются варианты ответов 1-3. Ответ 4.
2. Амфотерными гидроксидами являются вещества, формулы которых
1) CsOH и Cr (OH)2
2) KOH и Ca (OH)2
3) Be (OH)2и Cr (OH)3
4) NaOH и Mg (OH)2
Это задание также следует выполнить методом исключения тех пар веществ, в которых содержатся формулы щелочей, так как таких веществ в школьном курсе изучается немного и их следует знать. Ответ 3.
3. Кислотными оксидами являются вещества, формулы которых
1) N2O3, N2O5, CrO3
2) Cr2O3, CrO, N2O
3) NO, Na2O, P2O5
4) SiO2, BeO, CaO
Для быстрого определения верного ответа из предложенных вариантов необходимо исключить те, в которых встречаются оксиды металлов в с. о. +1, +2, +3, т.е. варианты 2, 3, 4. В первом варианте также встречается оксид металла CrO3, но в с.о. +6, т.е. кислотный оксид. Ответ 1.
о. +1, +2, +3, т.е. варианты 2, 3, 4. В первом варианте также встречается оксид металла CrO3, но в с.о. +6, т.е. кислотный оксид. Ответ 1.
4. Содержит все три типа гидроксидов ряд веществ, формулы которых
1) H2SO4, Ca (OH)2, NaOH
2) Cr (OH)3, Cr (OH)2, H2CrO4
3) NaOH, HNO3, Mg (OH)2
4) KOH, HClO4, Ba (OH)2
Достаточно сложное, многофакторное задание, которое требует знания ряда химических понятий: гидрооксиды (это понятие объединяет основания, амфотерные гидрооксиды и кислородсодержащие кислоты), зависимость свойств оксидов и гидроксидов металлов от величины с.о. (как правило, оксид и гидроксид с низшей с.о. проявляют основные свойства, с высшей – кислотные, с промежуточной — амфотерные), а, следовательно, и знание понятия с.о. Экзаменующийся должен найти ряд формул, в котором будут записаны основание, кислота и амфотерный гидроксид. Следовательно, можно исключить те ряды, в которых содержится два гидроксида одного типа: 1,3,4, — т.к. они содержат по два основания каждый. Ответ 2.
5. Формулы только кислых солей записаны в ряду
1) K2SO4, KOH, H2SO4, NaHCO3
2) Fe (HSO4)2, CaHPO4, CaCO3, Ca (OH)NO3
3) NH4HSO4, NH4NO3, (NH4)2HPO4, (NH4)2 CO3
4) NaH2PO4, Na2HPO4, NaHCO3, NaHS
Для быстрого определения верного ответа нужно ориентироваться на ключевое словосочетание «кислая соль», т. е. соль, содержащая атом водорода в составе кислотного остатка. Все четыре соли должны отвечать этому требованию. Ответ 4.
е. соль, содержащая атом водорода в составе кислотного остатка. Все четыре соли должны отвечать этому требованию. Ответ 4.
6. Двухосновная, растворимая, кислородсодержащая, сильная и стабильная кислота имеет формулу
1) H2SO3 2) H2S 3) H2SO4 4) H2S2O3
Условию задания отвечает вариант 3, т.к. любому школьнику известно, что сернистая кислота нестабильна, а сероводородная – слабая. Тиосерная кислота для обычного школьника представляет собой «экзотику», поэтому необходимо остановиться на привычной и хорошо известной серной кислоте. Ответ 3.
7. Средняя соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
1) Сa (НСO3)2, Be (OH)2, Fe (OH)Cl2
2) K2CO3, Н3AlO3, Cu (OH)NO3
3) NaHSO3, H3CrO3, Fe (OH)SO4
4) ZnSO4, H3PO4, Cr (OH)Cl2
Для успешного выполнения этого задания необходимо мысленно разделить предложенные ответы на три подстолбика. Анализируя первый столбик, приходим к выводу, что условию задания не соответствуют ответ 3. При анализе второго подстолбика исключаем варианты ответов 1 и 4, следовательно, верный ответ – 2 (обращаем внимание, что амфотерный гидроксид может быть записан как Аl (OH)3, так и Н3AlO3 или HAlO2∙H2O). Ответ 2.
Ответ 2.
8. Формулы средней, кислой и основной солей соответственно записаны в ряду
1) Cu (HSO4)2, Cu (OH)NO3, CuCl2
2) CaCO3, Ca (HCO3)2, Ca (OH)Cl
3)FeSO4, Fe (OH) Cl, Fe (OH)2Cl
4) BaSO4, Ba (OH)NO3, Ba (H2PO4)2
Успешное выполнение этого задания зависит от ключевого слова «соответственно», которое задает порядок поиска верного ответа: средняя, кислая и основная соли. Методика поиска может строиться на нахождении средней соли в первом вертикальном подстолбике (основной соли в последнем подстолбике, или кислой соли в среднем подстолбике). Ответ 2.
9. В следующей характеристике гидроксида бария неверно положение
1) кислородсодержащее основание, щелочь
2) сильное двухкислотное основание
3) способно образовать два ряда солей – средние и основные
4) летучее, непрочное соединение
Ключевым словосочетанием к выполнению задания является «неверно положение», оно и позволит определить искомый ответ. Ответ 4.
10. Оксиду фосфора (V) не соответствует кислота, формула которой
1) H3PO4 2) H4P2O7 3)H3PO3 4) HPO3
Ключом к решению этого задания является положение о том, что с.о. элемента, образующего оксид и соответствующий ему гидроксид (в нашем случае – фосфорные кислоты), должны быть одинаковы. Этому условию не отвечает ответ 3, который и будет правильным. Ответ 3.
Этому условию не отвечает ответ 3, который и будет правильным. Ответ 3.
11. Соль и водород образуются при взаимодействии разбавленной серной кислоты с каждым из металлов ряда
1) Al, Zn, Cu 2) Zn, Fe, Pb 3) Mg, Zn, Fe 4) Pb, Cu, Ag
Разбавленная серная кислота проявляет характерные свойства кислот, а потому не будет реагировать с металлами, стоящими в ряду напряжений после водорода, что автоматически исключает ответы 1 и 4. Варианты 2 и 3 предлагают металлы, стоящие в ряду напряжений до водорода. Какой выбрать? Очевидно, следует исключить из числа вероятных ответ 2, так как он содержит свинец, а сульфат свинца (II) – практически нерастворимая соль, о чем свидетельствует соответствующая клеточка в таблице растворимости. Ответ 3.
12. При термическом разложении нерастворимых оснований образуются
1) оксид неметалла и вода
2) водород и оксид металла
3) вода и оксид металла
4) металл и вода
Как неверные, должны быть исключены ответы 1, 2 и 4. Ответ 3.
13. С раствором хлорида меди (II) не реагирует
1) Mg 2) Zn 3) Fe 4) Ag
Легкое заданий на знание ряда напряжений металлов. Ответ 4.
14. С раствором сульфата меди (II) не реагирует
1)Pb 2)Zn 3) Fe 4) Mg
Задание аналогично предыдущему, но с учетом условий протекания реакций между раствором соли и металлом. Реакция идет, если образующаяся соль растворима в воде. Следовательно, верный ответ 1, так как сульфат свинца (II) практически не растворим. Ответ 1.
Реакция идет, если образующаяся соль растворима в воде. Следовательно, верный ответ 1, так как сульфат свинца (II) практически не растворим. Ответ 1.
15. Основание образуется при взаимодействии с водой оксида, формула которого
1) Fe2O3 2) CuO 3) CaO 4) FeO
В основе поиска верного ответа лежит знание о том, что оксиды металлов взаимодействуют с водой лишь в случае образования растворимого гидроксида – щелочи. Следовательно, это должен быть оксид щелочного или щелочноземельного металла. Ответ 3.
16. Серебро из раствора нитрата серебра вытесняют все металлы ряда
1) Na, Cr, Zn 2) K, Fe, Cu 3) Fe, Zn, Cu 4) Zn, Fe, Au
Задание на знание свойств солей и ряда напряжений металлов. Обратите внимание на тот факт, что медь в ряду напряжений стоит после водорода, но перед серебром. Ответ 3.
17. При взаимодействии меди с концентрированной серной кислотой образуются
1) CuSO4, SO2, H2O
2) CuSO4, H2
3) CuO, SO2, H2O
4) Cu2SO4, SO2, H2O
Задание на знание свойств концентрированной серной кислоты, которая при взаимодействии с металлами, стоящими в ряду напряжений до и после водорода, образует соль, воду и один из продуктов восстановления сульфат-иона (SO2, S или H2S). Это знание позволит выбрать ответы 1 и 4. Более вероятен ответ 1, так как серная кислота – сильный окислитель и образование Cu2SO4 неневозможно. Ответ 1.
Ответ 1.
18. Железо способно вытеснять из растворимых солей – нитратов магния, свинца (II), меди (II), ртути (II), серебра – металлы
1) Mg, Pb, Cu, Hg, Ag
2) Pb, Cu, Hg, Ag
3) Cu, Hg, Ag
4) Hg, Ag
Задание на знание свойств солей и ряда напряжений металлов. Ответ 2.
19. Медь не взаимодействует с
1) разбавленной серной кислотой
2) концентрированной серной кислотой
3) разбавленной азотной кислотой
4) концентрированной азотной кислотой
Так как разбавленная серная кислота проявляет характерные свойства растворов кислот, то она не взаимодействует с металлами, стоящими в ряду напряжений металлов после водорода. Верный ответ, записанный в вариантах первым, позволит другие ответы не рассматривать. Ответ 1.
20. И с гидроксидом натрия, и с соляной кислотой реагирует
1) СaO 2) BeO 3) SiO2 4) P2O5
И с кислотой, и со щелочью взаимодействует амфотерный оксид. Ответ 2.
21. С гидроксидом бария реагирует ряд веществ, имеющих формулы
1) NaCl, Na2SO4, Na2CO3
2) HNO3, NaOH, K2SO4
3) ZnO, K2O, CO2
4) Al (OH)3, CuSO4, HCl
Так как Ba (OH)2 – щелочь, то знание свойств растворимых оснований и особенностей протекания реакций с их участием позволит определить верный ответ – 4. К такому результату можно прийти, исключив варианты 2 (он включает щелочь) и 3 (он, кроме амфотерного и кислотного, включает основный оксид). Остаются варианты 1 и 4. Все соединения первого варианта – соли, но если две последние соли образуют осадок с гидроксидом бария, то первая – нет. Ответ 4.
Остаются варианты 1 и 4. Все соединения первого варианта – соли, но если две последние соли образуют осадок с гидроксидом бария, то первая – нет. Ответ 4.
22. Сульфат железа (II) не может быть получен взаимодействием
1) железа с разбавленной серной кислотой
2) железа с раствором медного купороса
3) железа с раствором сульфата магния
4) гидроксида железа (II) с разбавленной серной кислотой
Задание на знание свойств классов неорганических соединений: кислот, солей, гидроксидов. Это знание позволит определить верный ответ. Ответ 3.
23. Веществами, при взаимодействии которых образуется соль, являются
1) щелочь и основный оксид
2) основный оксид и вода
3) кислотный оксид и щелочь
4) кислотный оксид и вода
Несложное задание на знание химических свойств оксидов. Ответ 3.
24. В цепочке превращений
S →X1→SO3→X2→CuSO4→X3→CuO→Cu
веществами X1,X2 и X3 являются соответственно
1) H2S, H2SO4, Cu (OH)2
2) FeS, H2SO4, Cu (OH)2
3) SO2, H2SO4, CuCl2
4) SO2, H2SO4, Cu (OH)2
Ответы 1 и 2 следует отбросить, так как при окислении сероводорода и сульфида железа (II) образуется не SO3, а SO2. В варианте 3 первые два искомых вещества указаны верно, а CuCl2 — нет, поскольку эту соль превратить в оксид в одну стадию нельзя. Ответ 4.
В варианте 3 первые два искомых вещества указаны верно, а CuCl2 — нет, поскольку эту соль превратить в оксид в одну стадию нельзя. Ответ 4.
25. В цепочке превращений
Сa → X1 → Ca (OH)2 →X2 →Ca (HCO3)2 → X2 → CaO
веществами X1, X2 являются соответственно
1) CaCl2, СaCO3,
2) CaO, Ca (NO3)2
3) CaО, СaCO3
4) CaО, Ca3 (PO4)2
Вещество X1 определить несложно – это CaO. Вещество X2 – не может быть никакой другой солью, кроме карбоната, так как следующее звено представляет собой кислую соль угольной кислоты – гидрокарбонат кальция. Ответ 3.
26. В цепочке превращений
Zn → X1 → Zn (NO3)2 → X2 → Na2ZnO2 →ZnCl2→AgCl→X3
веществами X1, X2 и X3 являются соответственно
1) ZnCl2, ZnO, Ag
2) ZnO, Zn (OH)2, Ag
3) ZnSO4, Zn (OH)2, PbCl2
4) ZnO, Zn (OH)2, AgNO3
Рассуждения, аналогичные приведенным выше, но с учетом амфотерности гидроксида цинка, позволят определить вещества X1, X2 — ZnO, Zn (OH)2 соответственно.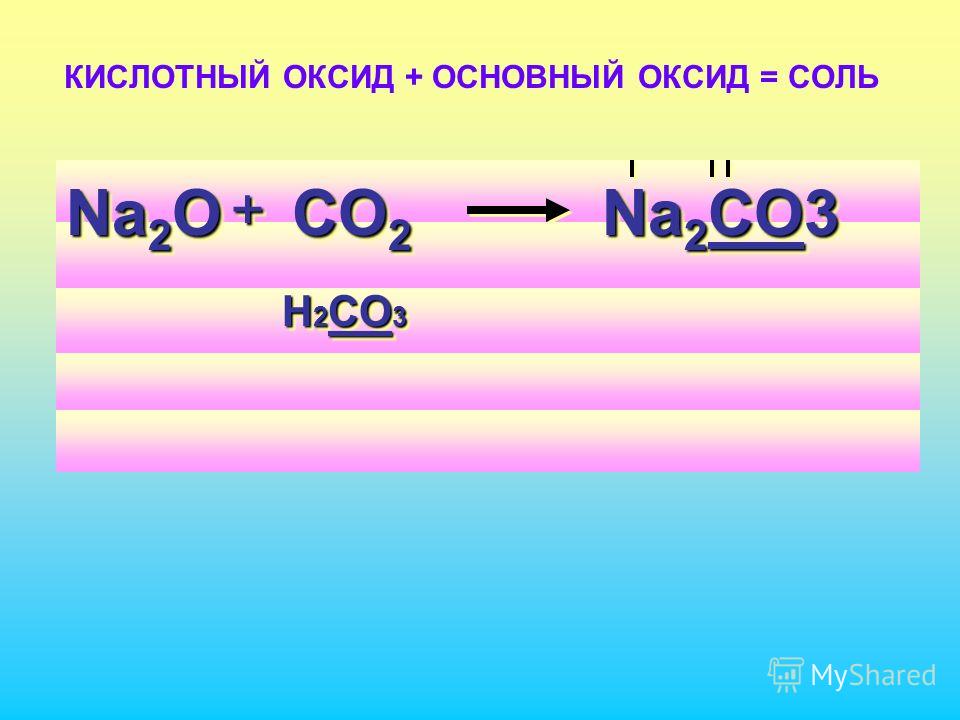 Вещество X3 средней солью быть не может, так как AgCl нерастворим. Это даст возможность исключить ответы 3 и 4. Теперь, даже не зная способности хлорида серебра к разложению, нетрудно выбрать верный ответ. Ответ 2.
Вещество X3 средней солью быть не может, так как AgCl нерастворим. Это даст возможность исключить ответы 3 и 4. Теперь, даже не зная способности хлорида серебра к разложению, нетрудно выбрать верный ответ. Ответ 2.
27. В схеме превращений
X1 X2 X3
AlCl3 → Al (OH)3 → NaAlO2 → AlCl3
веществами X1,X2 и X3 являются соответственно
1) H2O, NaOH, NaCl
2) H2O, Cu (OH)2, HCl
3) NaOH, NaCl, HCl
4) NaOH, Na2O, HCl
Непростое задание на знание свойств солей и амфотерных гидроксидов. Для выпускников определение X2 представляет сложность, т.к.существует стереотип, что амфотерные гидрооксиды выступают в роли кислот при взаимодействии со щелочами – т.е. NaAlO2 можно получить взаимодействием Al (OH)3 с NaOH. Однако автор тестового задания уже использовал это соединение для X1 и в качестве X2 предложил Na2O. Ответ 4.
28. Вещество, которое может реагировать с фосфорной кислотой, гидроксидом натрия и цинком, имеет формулу
1) Al (OH)3 2) Ba (NO3)2 3) CuCl2 4) NaHCO3
Для решения этого задания необходимо отнести каждое из предложенных веществ к соответствующей группе: амфотерный нерастворимый гидроксид, две средние соли, кислая соль. Со всеми перечисленными в условии веществами реагирует только CuCl2. Ответ 3.
Со всеми перечисленными в условии веществами реагирует только CuCl2. Ответ 3.
29. Веществу, которое может реагировать с хлором, нитратом серебра и ацетатом свинца, соответствует формула
1) KI 2) Cu 3) K2SO4 4) NaF
Задание более сложное, чем 28, так как требует знания о «ряде активности галогенов» (каждый предыдущий галоген вытесняет каждый последующий из растворов галогеноводородных кислот и их солей), а также знание номенклатуры солей органических кислот: ацетату свинца соответствует формула (CH3COO)2Pb. Обращение к таблице растворимости и учет условий взаимодействия растворов солей между собой позволят прийти к правильному решениию. Ответ 1.
30. Верны ли следующие суждения применительно к солям
А) В результате взаимодействия кислых солей со щелочами образуются средние соли
Б) В результате взаимодействия средних солей с основаниями образуются кислые соли
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Второе утверждение неверно, т.к. результатом взаимодействия средних солей с основаниями образуются не кислые соли, а основные. Первое суждение верно. Ответ 1.
Задания для самостоятельной работы
1. В перечне веществ
1) N2O
2) N2O5
3) N2O3
4) CO2
5) NO
6) CO
к несолеобразующим оксидам относятся вещества, формулы которых обозначены цифрами:
1) 1,4,6 2) 3,5,6 3) 1,5,6 4) 4,5,6
2. Амфотерными оксидами являются вещества
Амфотерными оксидами являются вещества
1) оксид серы (IV), оксид железа (III)
2) оксид цинка, оксид кальция
3) оксид хрома (III), оксид бериллия
4) оксид алюминия, оксид магния
3. Основными оксидами являются вещества
1) оксид кальция, оксид хрома (II)
2) оксид калия, оксид олова (IV)
3) оксид меди (I), оксид алюминия
4) оксид бериллия, оксид железа (П)
4. Содержит все три типа гидроксидов ряд веществ
1) H3AlO3, Fe (OH)3, H2SO4
2) H2ZnO2, H3PO4, Ba (OH)2
3) H2BeO2, HCI, Cu (OH)2
4) H2CO3, H2CrO4, NaOH
5. Формулы только основных солей записаны в ряду
1) (CaOH)2SO4, Ca (OH)2, CaOHCl
2) Fe (OH)3, Fe (OH)2NO3, [Fe (OH)2]SO4
3) MnOHNO3, CuOHCl2, Mg (OH)2
4) FeOHCl2, FeOHCl, [Fe (OH)2]SO4
6. Двухкислотное, растворимое, нелетучее и стабильное основание имеет формулу
1) Mg (OH)2 2) NH3 3) NaOH 4) Ва (ОН)2
7. Кислая соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
1) Na2SO4, Be (OH)2, Fe (OH)Cl2
2) K2CO3, Н3AlO3, Cu (OH)NO3
3) NaHSO3, H3CrO3, Fe (OH)SO4
4) ZnSO4, H3PO4, Cr (OH)Cl2
8. Формулы средней, кислой и основной солей соответственно записаны в ряду
1) Cu (HSO4)2, Cu (OH)NO3, CuCl2
2) CaCO3, Ca (HCO3)2, Ca (OH)Cl
3) FeSO4, Fe (OH) Cl, Fe (OH)2Cl
4) BaSO4, Ba (OH)NO3, Ba (H2PO4)2
9. Гидроксид алюминия – это
Гидроксид алюминия – это
1) амфотерный гидроксид
2) трехкислотное основание
3) щелочь
4) летучее основание
10. Оксиду марганца (VII) соответствует гидроксид, формула которого
1) Mn (OH)2 2) MnO (OH) 3) H2MnO4 4) HMnO4
11. Водород можно получить при взаимодействии
1) меди с разбавленной азотной кислотой
2) свинца с концентрированной азотной кислотой
3) цинка с концентрированной серной кислотой
4) алюминия с концентрированным раствором гидроксида калия
12. При термическом разложении нитрата серебра образуются
1) оксид серебра и оксид азота (V)
2) серебро, оксид азота (IV) и кислород
3) серебро, азот и кислород
4) оксид серебра, оксид азота (II) и кислород
13. С раствором щелочи не реагирует
1) Mg 2) Zn 3) Al 4) Be
14. С раствором сульфата меди (II) взаимодействует
1) Pb 2) Hg 3) Fe 4) Ag
15. Взаимодействием соответствующего оксида с водой нельзя получить
1) Cu (OH)2 2) Ba (OH)2 3) H2SO4 4) NaOH
16. Медь из раствора сульфата меди (II) вытесняет все металлы ряда
1) Na, Cr, Zn
2) K, Fe, Cu
3) Fe, Zn, Al
4) Zn, Fe, Au
17. При взаимодействии меди с концентрированной азотной кислотой образуются
1) CuO, NO2, H2O
2) Cu (NO3)2, H2
3) Cu (NO3)2, NO, H2O
4) Cu (NO3)2, NO2, H2O
18. Окислительно-восстановительная реакция протекает при разложении соли, формула которой
Окислительно-восстановительная реакция протекает при разложении соли, формула которой
1) NH4Cl 2) KMnO4 3) CaCO3 4) (CuOH)2CO3
19. C концентрированной азотной кислотой при комнатной температуре не взаимодействует
1) медь
2) железо
3) серебро
4) цинк
20. С раствором серной кислоты реагируют все три вещества набора
1) СaO, NaOH, KCl
2) Cu (OH)2, HCl, CH3COONa
3) BaCl2, Zn, SiO2
4) MgCO3, Fe, Al (OH)3
21. И с соляной кислотой, и с водой реагирует
1) аммиак 2) хлор 3) никель 4) карбонат кальция
22. Сульфат железа (III) может быть получен взаимодействием железа с
1) разбавленной серной кислотой
2) раствором сульфата меди (II)
3) хлором
4) серой
23. Веществами, при взаимодействии которых не образуется соль, являются
1) кислотный оксид и щелочь
2) кислотный оксид и вода
3) основный оксид и кислота
4) кислота и основание
24. В цепочке превращений
Ca →X1→Ca (OH)2 → X2→ CaO → X3→ AgCl
веществами X1,X2 и X3 являются соответственно
1) CaO, CaCO3, CaCl2
2) CaSO4, CaCO3, CaCl2
3) CaO, CaSO4, CaCl2
4) CaO, Ca (HCO3), CaCO3
25. В цепочке превращений
N2 → X1 → NO →X2 → HNO3
веществами X1, X2 являются соответственно
1) N2O, NO2
2) NO2, NH3
3) N2O3, N2O
4) NH3, NO2
26. В цепочке превращений
В цепочке превращений
Al → X1 → Al2 (SO4)3 → X2 → KAlO2 →AlCl3→X2®Al2O3
веществами X1 и X2 являются соответственно
1) AlCl3, AlN
2) Al (OH)3, KAl (SO4)2
3) Al2O3, Al2S3
4) Al2O3, Al (OH)3
27. В схеме превращений
X1 X2 X3
SO2 → SO3 → H2SO4 → (NH4)2SO4
веществами X1,X2 и X3 являются соответственно
1) O2, H2O, NH3
2) NO2, H2, NH3
3) O2, H2O, N2
4) O2, H2, NH3∙H2O
28. Вещество, которое может реагировать с соляной кислотой, гидроксидом калия и алюминием, имеет формулу
1) Cl2 2) H2SO4 3) Сr2O3 4) Na2CO3
29. При нагревании не разлагается на простые вещества
1) аммиак 2) хлорид натрия 3) оксид ртути (II) 4) иодоводород
30. Верны ли следующие суждения применительно к кислотам
А) Любую кислоту можно получить растворением соответствующего кислотного оксида в воде
Б) Кислоты способны взаимодействовать со щелочами
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
03 Октябрь 2011, 15532 просмотра.
Комментарии
Основной оксид — это.
 .. Что такое Основной оксид?
.. Что такое Основной оксид?- Основной оксид
Осно́вные оксиды – оксиды, образующие соли при взаимодействии с кислотами или кислотными оксидами. К ним относятся:
Металлы в основных оксидах обычно проявляют валентность I и II.
Характерные реакции
- СаO + H2O = Са(OH)2
- Основные оксиды взаимодействуют с кислотами, образуя соотвествующие соли:
- CaO + 2HCl = CaCl2 + H2O
- Na2O + CO2 = Na2CO3
- Li2O+Al2O3 = 2LiAlO2
Все основные оксиды
См. также
Ссылки
Оксиды.
Wikimedia Foundation. 2010.
- Основной капитал
- Основной тензор
Смотреть что такое «Основной оксид» в других словарях:
основной оксид — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN basic oxide … Справочник технического переводчика
Оксид кальция(II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Оксид кальция (II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Оксид магния(II) — Оксид магния Оксид магния (жжёная магнезия, периклаз), MgO бесцветные кристаллы, нерастворимые в воде, пожаро и взрывобезопасен.
 Основная форма минерал периклаз. Содержание 1 Свойства 2 … Википедия
Основная форма минерал периклаз. Содержание 1 Свойства 2 … ВикипедияОксид магния (II) — Оксид магния Оксид магния (жжёная магнезия, периклаз), MgO бесцветные кристаллы, нерастворимые в воде, пожаро и взрывобезопасен. Основная форма минерал периклаз. Содержание 1 Свойства 2 … Википедия
Оксид — (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся… … Википедия
Оксид углерода(II) — Оксид углерода(II) … Википедия
Оксид свинца(II) — Общие … Википедия
Оксид-сульфат титана — Общие Систематическое наименование Оксид сульфат титана Традиционные названия Основной сернокислый титан; оксосульфат титана; сульфат титанила Химическая формула TiOSO4 Физические свойства … Википедия
Оксид хрома(III) — Оксид хрома(III) … Википедия
Классификация неорганических веществ, подготовка к ЕГЭ по химии
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты
(в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
- Основные
- Амфотерные (греч. ἀμφότεροι — двойственный)
- Кислотные
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль)
Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3,
Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
Примеры: BeO, ZnO, Al2O3,
Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль)
ZnO + KOH → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой, так как продукт реакции — H2SiO3 является нерастворимой кислотой.
Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
SO3 + H2O → H2SO4 (сохраняем СО серы +6)
SO2 + H2O → H2SO3 (сохраняем СО серы +4)
Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования. К таким оксидам относят:
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли
и воды, так и с основаниями — с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких температурах вода испаряется, и комплексная соль образоваться не может)
Кислоты
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную
и сернистую кислоты в разложившемся виде — виде газа и воды.
Пишите угольную
и сернистую кислоты в разложившемся виде — виде газа и воды.
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не обманешь :)
K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Соли
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2)
- Смешанные — содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные — содержат комплексный катион или анион — атом металла, связанный с несколькими лигандами: Na[Cr(OH)4] (тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли.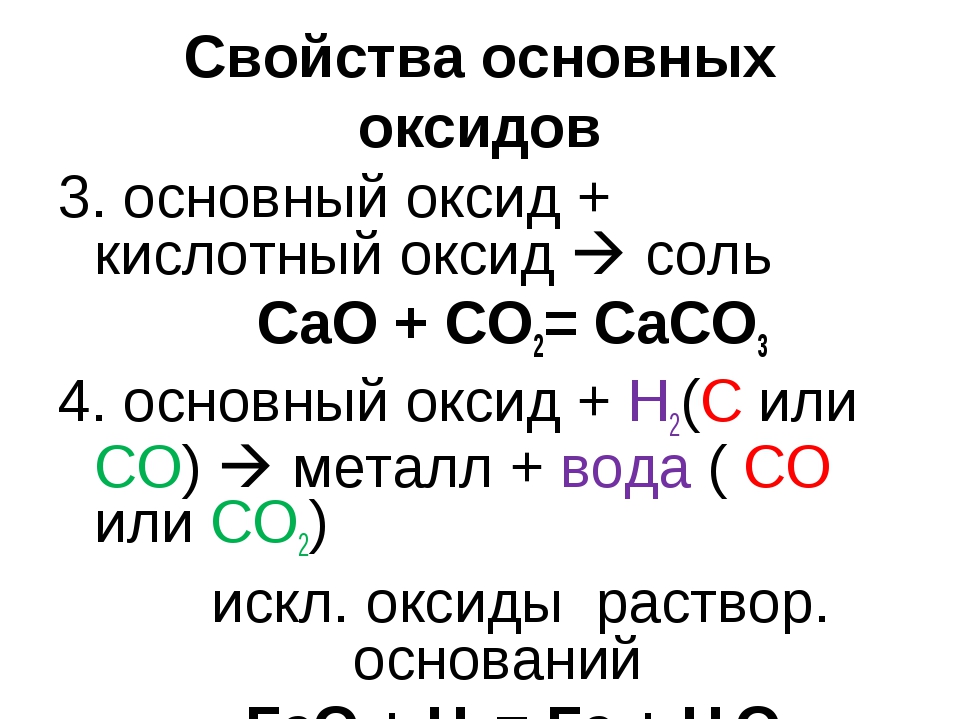 В этом случае более
активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
В этом случае более
активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)
Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в избытке — получается кислая соль, если же в избытке дано основание — средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделяется газ или образуется слабый электролит (вода), то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота — соляная, вытесняет слабую — угольную)
MgCl2 + LiOH → Mg(OH)2↓ + LiCl
K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
Чтобы сделать из кислой соли — среднюю соль, нужно добавить соответствующее основание:
KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Урок-путешествие «Генетическая связь между классами веществ»
Цели:
- Сформировать понятие о генетической связи и генетическом ряде.
- Рассмотреть генетические ряды металлов и неметаллов.
- Обобщить знания об основных классах неорганических веществ.
- Продолжить формирование навыков проведения эксперимента, развивать мышление, заставить детей задуматься о воздействии человека на состояние окружающей среды.
Оборудование и реактивы:
- карта путешествия,
- рисунок реки на доске,
- магнитная доска,
- карточки для схем и с формулами кислот,
- штативы с пробирками,
- 3 стакана,
- колба,
- ложечка для сжигания веществ,
- сера, СаО,
- вода, NaOH, HCl,
- универсальный индикатор,
- лимон,
- уксус,
- кефир,
- сода пищевая,
- пачка поваренной соли,
- мыло,
- спиртовка.
ХОД УРОКА
I. Организационный момент. Объявление темы и целей урока. Запись в тетради темы урока.
II. Обобщение знаний по изученным классам веществ.
У каждого из вас на столе лежит оценочный лист.
Быстро подпишите их. В течение всего урока вы
будете выполнять задания и отмечать результаты в
своих оценочных листах.
1-я станция: Кислоты.
Выберите из предметов, которые находятся на столе, что относится к кислотам, и кратко расскажите о них.
Ученик: выбирает лимон, уксус, кефир. Рассказ ученика о кислотах.
Задание. Терминологический диктант. (Если ученик ответил про себя правильно, ставит себе в оценочном листе +, если неправильно, то -).
Учитель: Я показываю формулу кислоты, вы сначала ее называете, затем отвечаете на вопрос: какая она по основности? (азотная, серная, угольная, кремниевая, азотистая, соляная). (Показывает карточки с формулами кислот).
Задание. Перед нами на доске мы видим реку. Это Река Знаний. Задание вам — перейти через реку, где это возможно, т. е. дописать возможные уравнения реакций, и поставить в этом месте мостик. Где реакция не идет, объясните, почему, там мостик не ставим. Если ответ правильный, садитесь и ставите себе в оценочном листе +, если неправильный, то — . Вещества называем и объясняем, почему эта реакция идет. Все остальные ученики записывают реакции в тетрадь.
Типичные реакции кислот.
2-я станция : Основания.
Учитель: выбрать из предметов, что можно связать с классом оснований и кратко рассказать об этих веществах.
Ученик: выбирает мыло. Рассказ об основаниях.
Задание: Эксперимент. Мы сейчас с вами дали определения кислот и оснований. А как распознать среди трех выданных веществ, где находится кислота, где — основание, а где — вода?
Ученик: действует на растворы универсальным индикатором. Делает вывод.
Садится, ставит себе +.
Задание: перейти реку. Типичные реакции оснований.
3-я станция: Оксиды.
Ребята, какие группы оксидов мы с вами изучили?
Мы с вами составляли в тетради схему
соответствия и взаимодействия кислот, оснований,
кислотных оксидов и основных оксидов. Пока один
из вас будет рассказывать об оксидах, кто-то
пойдет к магнитной доске и составит эту схему.
Пока один
из вас будет рассказывать об оксидах, кто-то
пойдет к магнитной доске и составит эту схему.
1-й ученик: на магнитной доске составляет схему.
2-й ученик (в это время): выбирает песок, глину и воду. Рассказ об оксидах.
3-й ученик: рассказ об оксиде водорода (воде).
4-й ученик: рассказ об оксиде серы (IV) — сернистом газе.
Фронтальный опрос. (Результаты оформляются в оценочном листе).
- Ребята, к каким оксидам относится сернистый газ SO2?
- Какой кислоте он соответствует?
- С какими классами веществ взаимодействуют кислотные оксиды?
Проверяем схему на магнитной доске.
Задание. Перейти реку Знаний. Типичные реакции оксидов.
4-я станция: Соли.
Учитель: что на нашем столе относится к солям? Выберите и расскажите об одной из самых известных вам солей — хлориде натрия.
Задание: Установите соответствия: (сначала выполняют все на оценочных листах, затем один выходит и пишет ответ на доске)
Названия кислот Названия солей
| 1. Соляная | А. Сульфаты |
| 2. Серная | Б. Карбонаты |
| 3. Угольная | В. Хлориды |
| 4. Азотная | Г. Сульфиды |
| 5. Сероводородная | Д. Нитраты |
Ответ: 1В, 2А, 3Б, 4Д, 5Г.
2. Соответствие движению (игра)
Учитель называет, учащиеся выполняют соответствующее действие (действия записаны на доске).
| класс соединений | действие |
| кислота | правая рука |
| основание | левая рука |
| кислотный оксид | правое ухо |
| основный оксид | левое ухо |
| соль | хлопок в ладоши |
а) Гидроксид кальция, оксид азота (V), фосфорная
кислота, нитрат магния, гидроксид меди (II), оксид
натрия, серная кислота, хлорид серебра.
III. Изучение нового материала.
Учитель: Оценочные листы убрали в сторону.
Работаем в тетради.
Мы с вами записали тему урока: «Генетическая связь», а что это такое?
Между оксидами, кислотами, основаниями и солями имеется глубокая связь. Зная свойства веществ, можно легко перейти от одного класса соединений к другому.
| Генетической называют связь между веществами разных классов, основанную на их взаимопревращениях и отражающую единство их происхождения, т. е. генезис веществ. |
Вначале давайте наши сведения о классификации веществ представим в виде схемы. (Составляем вместе с классом схему «Классификация неорганических веществ» на магнитной доске)
5-я станция. Генетический рад неметаллов.
| Генетический ряд неметаллов отражает взаимосвязь веществ разных классов, в основу которой положен один неметалл. |
Их можно выделить две разновидности.
1. Генетический ряд неметаллов, которым соответствует растворимая кислота, может быть отражен в виде такой цепочки превращений:
неметалл —> кислотный —> оксид —> кислота —> соль
Например, генетический ряд фосфора:
или генетический ряд серы:
S – SO3 – h4SO4 – BaSO4
Ученик: рассказ о сере.
Учитель: Демонстрационный опыт «Получение сернистого газа, сернистой кислоты, сульфита свинца».
2. Генетический ряд неметаллов, которым соответствует нерастворимая кислота, может быть представлен с помощью такой цепочки превращений:
Неметалл —> кислотный оксид —> соль —>
кислота —> кислотный оксид —> неметалл.
Так как из изученных нами кислот нерастворима только кремниевая кислота, в качестве примера последнего генетического ряда рассмотрим генетический ряд кремния:
| Si | SiO2 | Na2SiO3 | h3SiO3 | SiO2 | Si |
6-я станция: Генетический ряд металлов.
| Генетический ряд металлов отражает взаимосвязь веществ разных классов, в основу которой положен один и тот же металл. |
Различают две разновидности генетического ряда металлов.
1. Генетический ряд металлов, которым в качестве гидроксида соответствует щелочь. В общем виде такой ряд может быть представлен следующей цепочкой превращений:
металл —> основный оксид —> основание (щелочь) —> соль
Например, генетический ряд кальция:
Ca — CaO — Ca(OH)2 — Ca3(PO4)2
Учащиеся выполняют лабораторный опыт: »Осуществление цепочки Ca — CaO — Ca(OH)2 — Ca3(PO4)2 » по карточке-инструкции, записывают уравнения реакций.
2. Генетический ряд металлов, которым соответствует нерастворимое основание. Можно представить следующей цепочкой превращений:
металл —> основный оксид —> соль —> основание —> основный оксид —> металл.
Например, генетический ряд меди:
| Cu | CuO | CuCl2 | Cu(OH)2 | CuO | Cu |
Учитель выполняет демонстрационный опыт
»Осуществление цепочки Cu CuO CuCl2 Cu(OH)2 CuO Cu «.
Задание: уравнения реакций записать в ионном виде в тетради и на доске.
7-я станция: Закрепительная. Компьютерная презентация.
1 слайд. Определение генетической связи.
2 слайд. Схема «Классификация неорганических веществ»
3 слайд. Генетический ряд металлов.
4 слайд. Генетический ряд неметаллов.
5 слайд. Что это за вещества?
6 слайд. Кислотные дожди.
7 слайд. Запишите уравнения реакций…
8 слайд. Домашнее задание.
П. 42, №№ 2,3 — письменно
Выставление оценок за урок.
Кислотно-основное поведение оксидов
На этой странице обсуждаются реакции оксидов элементов периода 3 (натрия в хлор) с водой, а также с кислотами или основаниями, где это необходимо (как и раньше, аргон опускается, потому что он не образует окись).
Краткое описание тенденции
Оксиды: Представляющие интерес оксиды приведены ниже:
| Na 2 O | MgO | Al 2 O 3 | SiO 2 | П 4 О 10 | СО 3 | Класс 2 O 7 |
| П 4 О 6 | СО 2 | класс 2 O |
Тенденцию кислотно-щелочного поведения можно резюмировать следующим образом:
Кислотность увеличивается слева направо, от сильно основных оксидов слева до сильнокислых справа, с амфотерным оксидом (оксидом алюминия) в середине.Амфотерный оксид — это оксид, который проявляет как кислотные, так и основные свойства.
Эта тенденция применима только к самым высоким оксидам отдельных элементов (см. Верхнюю строку таблицы) с наивысшими степенями окисления для этих элементов. Для других оксидов картина менее ясна. Кислотность неметаллических оксидов определяется в терминах кислотных растворов, образующихся в реакциях с водой — например, триоксид серы реагирует с водой с образованием серной кислоты. Однако все они будут реагировать с основаниями, такими как гидроксид натрия, с образованием солей, таких как сульфат натрия, как подробно описано ниже.
Оксид натрия
Оксид натрия — простой сильноосновной оксид. Он является основным, поскольку содержит ион оксида, O 2-, который является очень сильным основанием с высокой тенденцией к объединению с ионами водорода.
Реакция с водой : Оксид натрия экзотермически реагирует с холодной водой с образованием раствора гидроксида натрия. Концентрированный раствор оксида натрия в воде будет иметь pH 14.
\ [Na_2O + H_2O \ стрелка вправо 2NaOH \]
Реакция с кислотами: Оксид натрия, как сильное основание, также реагирует с кислотами.Например, он реагирует с разбавленной соляной кислотой с образованием раствора хлорида натрия.
\ [Na_2O + 2HCl \ стрелка вправо 2NaCl + H_2O \]
Оксид магния
Оксид магния — еще один простой основной оксид, который также содержит ионы оксида. Однако он не такой сильно основной, как оксид натрия, потому что ионы оксида не так слабо связаны. В оксиде натрия твердое вещество удерживается вместе за счет притяжения между ионами 1+ и 2-. В оксиде магния притяжение составляет от 2+ до 2- ионов.Из-за более высокого заряда металла требуется больше энергии, чтобы разорвать эту ассоциацию. Даже с учетом других факторов (таких как энергия, выделяемая при ионно-дипольном взаимодействии между катионами и водой), общий эффект заключается в том, что реакции с участием оксида магния всегда будут менее экзотермическими, чем реакции оксида натрия.
Реакция с водой: На первый взгляд кажется, что порошок оксида магния не реагирует с водой. Однако pH полученного раствора составляет около 9, что указывает на образование гидроксид-ионов.Фактически, в реакции образуется некоторое количество гидроксида магния, но, поскольку этот компонент почти нерастворим, фактически растворяется небольшое количество гидроксид-ионов. Реакция показана ниже:
\ [MgO + H_2O \ стрелка вправо Mg (OH) _2 \]
Реакция с кислотами: Оксид магния реагирует с кислотами, как и предполагалось для простого оксида металла. Например, он реагирует с теплой разбавленной соляной кислотой с образованием раствора хлорида магния.
\ [MgO + 2HCl \ стрелка вправо MgCl_2 + H_2O \]
Оксид алюминия
Описание свойств оксида алюминия может сбивать с толку, поскольку он существует в нескольких различных формах.Одна из этих форм очень инертна (химически известна как альфа-Al 2 O 3 ) и производится при высоких температурах. Следующие ниже реакции касаются более реакционноспособных форм молекулы. Оксид алюминия амфотерный. Он вступает в реакцию как с основанием, так и с кислотой.
Реакция с водой: Оксид алюминия не растворяется в воде и не реагирует подобно оксиду натрия и оксиду магния. Ионы оксида слишком прочно удерживаются в твердой решетке, чтобы реагировать с водой.
Реакция с кислотами: Оксид алюминия содержит ионы оксида и поэтому реагирует с кислотами так же, как оксиды натрия или магния. Оксид алюминия реагирует с горячей разбавленной соляной кислотой с образованием раствора хлорида алюминия.
\ [Al_2O_3 + 6HCl \ стрелка вправо 2AlCl_3 + 3H_2O \]
Эта и другие реакции демонстрируют амфотерную природу оксида алюминия.
Реакция с основаниями: Оксид алюминия также проявляет кислотные свойства, как показано в его реакциях с основаниями, такими как гидроксид натрия. Существуют различные алюминаты (соединения, в которых алюминий является компонентом отрицательного иона), что возможно, потому что алюминий может образовывать ковалентные связи с кислородом. Это возможно, потому что разница электроотрицательностей между алюминием и кислородом мала, в отличие от разницы между натрием и кислородом, например (электроотрицательность увеличивается за период)
Существуют различные алюминаты (соединения, в которых алюминий является компонентом отрицательного иона), что возможно, потому что алюминий может образовывать ковалентные связи с кислородом. Это возможно, потому что разница электроотрицательностей между алюминием и кислородом мала, в отличие от разницы между натрием и кислородом, например (электроотрицательность увеличивается за период)
Оксид алюминия реагирует с горячим концентрированным раствором гидроксида натрия с образованием бесцветного раствора тетрагидроксоалюмината натрия:
\ [Al_2O_3 + 2NaOH + 3H_2O \ стрелка вправо 2NaAl (OH) _4 \]
Диоксид кремния (оксид кремния (IV))
Кремний слишком похож по электроотрицательности на кислород, чтобы образовывать ионные связи.Следовательно, поскольку диоксид кремния не содержит оксидных ионов, он не имеет основных свойств. На самом деле он очень слабокислый, реагирует с сильными основаниями.
Реакция с водой: Диоксид кремния не реагирует с водой из-за термодинамических трудностей разрушения его ковалентной сетевой структуры.
Реакция с основаниями : Диоксид кремния реагирует с горячим концентрированным раствором гидроксида натрия, образуя бесцветный раствор силиката натрия:
\ [SiO_2 + 2NaOH \ стрелка вправо Na_2SiO_3 + h3O \]
В другом примере реакции кислого диоксида кремния с основанием, извлечения железа в доменной печи, оксид кальция из известняка реагирует с диоксидом кремния с образованием жидкого шлака, силиката кальция:
\ [SiO_2 + CaO \ стрелка вправо CaSiO_3 \]
Оксиды фосфора
Здесь рассматриваются два оксида фосфора: оксид фосфора (III) P 4 O 6 и оксид фосфора (V) P 4 O 10 .
Оксид фосфора (III): Оксид фосфора (III) реагирует с холодной водой с образованием раствора слабой кислоты, H 3 PO 3 — известной как фосфористая кислота, ортофосфористая кислота или фосфоновая кислота:
\ [P_4O_6 + 6H_2O \ rightarrow 4H_3PO_3 \]
Структура полностью протонированной кислоты показана ниже:
Протоны остаются связанными до тех пор, пока не будет добавлена вода; даже в этом случае, поскольку фосфорная кислота является слабой кислотой, некоторые молекулы кислоты депротонируются. Фосфорная кислота имеет pK a , равное 2,00, что является более кислым, чем обычные органические кислоты, такие как этановая кислота (pK a = 4,76).
Фосфорная кислота имеет pK a , равное 2,00, что является более кислым, чем обычные органические кислоты, такие как этановая кислота (pK a = 4,76).
Маловероятно, что оксид фосфора (III) непосредственно взаимодействует с основанием. В фосфористой кислоте два атома водорода в группах -ОН являются кислотными, а третий атом водорода — нет. Следовательно, есть две возможные реакции с основанием, таким как гидроксид натрия, в зависимости от количества добавленного основания:
\ [NaOH + H_3PO_3 \ rightarrow NaH_2PO_3 + H_2O \]
\ [2NaOH + H_3PO_3 \ rightarrow Na_2HPO_3 + 2H_2O \]
В первой реакции только один из протонов реагирует с гидроксид-ионами основания.Во втором случае (используя вдвое больше гидроксида натрия) реагируют оба протона.
Если вместо этого оксид фосфора (III) взаимодействует непосредственно с раствором гидроксида натрия, возможны те же соли:
\ [4NaOH + P_4O_6 + 2H_2O \ стрелка вправо 4NaH_2PO_3 \]
\ [9NaOH + P_4O_6 \ стрелка вправо 4Na_2HPO_3 + 2H_2O \]
Оксид фосфора (V): Оксид фосфора (V) бурно реагирует с водой с образованием раствора, содержащего смесь кислот, природа которой зависит от условий реакции.Обычно рассматривается только одна кислота, фосфорная (V) кислота, H 3 PO 4 (также известная как фосфорная кислота или ортофосфорная кислота).
\ [P_4O_ {10} + 6H_2O \ rightarrow 4H_3PO_4 \]
На этот раз полностью протонированная кислота имеет следующую структуру:
Фосфорная (V) кислота — еще одна слабая кислота с pK a , равным 2,15, что незначительно слабее, чем фосфористая кислота. Растворы каждой из этих кислот с концентрацией около 1 моль дм -3 имеют pH около 1.
Оксид фосфорной кислоты (V) также вряд ли будет напрямую реагировать с основанием, но гипотетические реакции рассматриваются. В кислотной форме молекула имеет три кислотные -ОН группы, которые могут вызывать трехстадийную реакцию с гидроксидом натрия:
\ [NaOH + H_3PO_4 \ rightarrow NaH_2PO_4 + H_2O \]
\ [2NaOH + H_3PO_4 \ rightarrow Na_2HPO_4 + 2H_2O \]
\ [3NaOH + H_3PO_4 \ rightarrow Na_3PO_4 + 3H_2O \]
Подобно оксиду фосфора (III), если оксид фосфора (V) взаимодействует непосредственно с раствором гидроксида натрия, образуется такая же возможная соль, как на третьей стадии (и только эта соль):
\ [12NaOH + P_4O_ {10} \ rightarrow 4Na_3PO_4 + 6H_2O \]
Оксиды серы
Рассматриваются два оксида: диоксид серы SO 2 и триоксид серы SO 3 .
Диоксид серы: Диоксид серы хорошо растворяется в воде, реагируя с образованием раствора сернистой кислоты (также известной как серная (IV) кислота), H 2 SO 3 , как показано в реакции ниже. Этот вид существует только в растворе, и при любой попытке его изолировать выделяется диоксид серы.
\ [SO_2 + H_2O \ стрелка вправо H_2SO_3 \]
Протонированная кислота имеет следующую структуру:
Сернистая кислота также является относительно слабой кислотой с pK и около 1.8, но немного сильнее, чем две указанные выше фосфорсодержащие кислоты. Достаточно концентрированный раствор сернистой кислоты имеет pH около 1.
.Диоксид серы также напрямую реагирует с основаниями, такими как раствор гидроксида натрия. Барботирование диоксида серы через раствор гидроксида натрия сначала образует раствор сульфита натрия, а затем раствор гидросульфита натрия, если диоксид серы находится в избытке.
\ [SO_2 + 2NaOH \ стрелка вправо Na_2SO_3 + H_2O \]
\ [Na_2SO_3 + H_2O \ rightarrow 2NaHSO_3 \]
Другая важная реакция диоксида серы — с основным оксидом кальция с образованием сульфита кальция (также известного как сульфат кальция (IV)).Это один из важных методов удаления диоксида серы из дымовых газов на электростанциях.
\ [CaO + SO_2 \ стрелка вправо CaSO_3 \]
Триоксид серы: Триоксид серы бурно реагирует с водой с образованием тумана из капель концентрированной серной кислоты.
\ [SO_3 + H_2O \ rightarrow H_2SO_4 \]
Чистая, полностью протонированная серная кислота имеет структуру:
Серная кислота — сильная кислота, и растворы обычно имеют pH около 0.{2-} (водн.) \]
Это полезно, если вы понимаете причину, по которой серная кислота является более сильной кислотой, чем серная кислота. Вы можете применить те же рассуждения к другим кислотам, которые вы найдете на этой странице.
Серная кислота сильнее серной кислоты, потому что, когда ион водорода теряется из одной из групп -ОН серной кислоты, отрицательный заряд, оставшийся на кислороде, распространяется (делокализуется) по иону за счет взаимодействия с кислородом с двойной связью. атомы. Отсюда следует, что большее количество атомов кислорода с двойной связью в ионе делает возможной большую делокализацию; большая делокализация приводит к большей стабильности, что снижает вероятность рекомбинации иона с ионом водорода и его превращения в неионизированную кислоту.
Серная кислота имеет только один кислород с двойной связью, тогда как серная кислота имеет два; дополнительная двойная связь обеспечивает гораздо более эффективную делокализацию, гораздо более стабильный ион и более сильную кислоту. Серная кислота проявляет все реакции, характерные для сильной кислоты. Например, при реакции с гидроксидом натрия образуется сульфат натрия; в этой реакции оба кислых протона реагируют с гидроксид-ионами, как показано:
\ [2NaOH + H_2SO_4 \ стрелка вправо Na_2SO_4 + 2H_2O \]
В принципе, гидросульфат натрия можно получить, используя вдвое меньше гидроксида натрия; в этом случае удаляется только один из кислых атомов водорода.
Сам по себе триоксид серы также напрямую реагирует с основаниями, такими как оксид кальция, с образованием сульфата кальция:
\ [CaO + SO_3 \ стрелка вправо CaSO_4 \]
Эта реакция аналогична описанной выше реакции с диоксидом серы.
Оксиды хлора
Хлор образует несколько оксидов, но здесь рассматриваются только два (оксид хлора (VII), Cl 2 O 7 и оксид хлора (I), Cl 2 O). Оксид хлора (VII) также известен как гептоксид дихлора, а оксид хлора (I) — как монооксид дихлора.
Оксид хлора (VII): Оксид хлора (VII) является высшим оксидом хлора — атом хлора находится в максимальной степени окисления +7. Он продолжает тенденцию высших оксидов элементов периода 3 к тому, чтобы быть более сильными кислотами. Оксид хлора (VII) реагирует с водой, давая очень сильную кислоту, хлорную (VII) кислоту, также известную как хлорная кислота.
Оксид хлора (VII) реагирует с водой, давая очень сильную кислоту, хлорную (VII) кислоту, также известную как хлорная кислота.
\ [Cl_2O_7 + H_2O \ стрелка вправо 2HClO_4 \]
Как и в серной кислоте, pH типичных растворов хлорной кислоты составляет около 0.Нейтральная хлорная (VII) кислота имеет следующую структуру:
Когда ион хлората (VII) (перхлорат-ион) образуется в результате потери протона (например, в реакции с водой), заряд делокализован по каждому атому кислорода в ионе. Это делает ион очень стабильным, а хлорную (VII) кислоту очень сильной.
Хлорная (VII) кислота реагирует с раствором гидроксида натрия с образованием раствора хлората натрия (VII):
\ [NaOH + HClO_4 \ стрелка вправо NaClO_4 + h3O \]
Сам оксид хлора (VII) также непосредственно реагирует с раствором гидроксида натрия с образованием того же продукта:
\ [2NaOH + Cl_2O_7 \ стрелка вправо 2NaClO_4 + H_2O \]
Оксид хлора (I): Оксид хлора (I) намного менее кислый, чем оксид хлора (VII).- \) также известна как хлорноватистая кислота.
\ [Cl_2O + H_2O \ rightleftharpoons 2HOCl \]
Структура хлорноватой (I) кислоты в точности такая, как показано ее формулой HOCl. У него нет атомов кислорода с двойными связями и нет способа делокализации заряда по отрицательному иону, образовавшемуся в результате потери водорода. Следовательно, образовавшийся отрицательный ион не очень стабилен и легко восстанавливает свой протон, чтобы превратиться в кислоту. Хлорная (I) кислота очень слабая (pK a = 7,43) и реагирует с раствором гидроксида натрия с образованием раствора хлората натрия (I) (гипохлорита натрия):
\ [NaOH + HOCl \ rightarrow NaOCl + H_2O \]
Оксид хлора (I) также напрямую реагирует с гидроксидом натрия с образованием того же продукта:
\ [2NaOH + Cl_2O \ стрелка вправо 2NaOCl + H_2O \]
Неорганическая химия — Почему Cr2O3 амфотерный, а CrO — нет?
Основной оксид — это оксид, который растворяется в воде с образованием растворимого гидроксида. По этой причине основные оксиды хорошо растворимы. Кислотные оксиды — это оксиды, которые растворяются в воде с образованием сильных кислот. Обычно ковалентные оксиды образуют кислые оксиды, поскольку элемент, с которым связан кислород, является электроотрицательным. По мере увеличения заряда электроотрицательность увеличивается, и, таким образом, оксид становится кислым. Это также относится к элементам, имеющим несколько оксидов. Поскольку окисления нет. увеличивается, увеличивается заряд и, таким образом, оксиды становятся кислыми. Эта ссылка содержит полезную информацию по этой теме:
По этой причине основные оксиды хорошо растворимы. Кислотные оксиды — это оксиды, которые растворяются в воде с образованием сильных кислот. Обычно ковалентные оксиды образуют кислые оксиды, поскольку элемент, с которым связан кислород, является электроотрицательным. По мере увеличения заряда электроотрицательность увеличивается, и, таким образом, оксид становится кислым. Это также относится к элементам, имеющим несколько оксидов. Поскольку окисления нет. увеличивается, увеличивается заряд и, таким образом, оксиды становятся кислыми. Эта ссылка содержит полезную информацию по этой теме:
Поскольку кислотность катиона быстро растет с ростом заряда, d-блок элементы с широким диапазоном степеней окисления могут иметь один или несколько оксидов, которые проявляют только основные свойства, и один или несколько оксиды, проявляющие только кислотные свойства.{-}}) $.
Итак, эмпирическое правило заключается в том, что по мере увеличения степени окисления заряд металла увеличивается, кислотный характер увеличивается. Также основной оксид растворим в воде, кислотный оксид не растворяется в воде. Это может быть использовано для различения кислотного и основного оксида.
Неорганическая химия — Почему оксид алюминия амфотерный?
Я буду использовать подход, который был включен в следующую книгу для ответа на этот вопрос: Нажатие стрелы в неорганической химии; логический подход к химии элементов основной группы
Для начала, пожалуйста, прочтите мой ответ на этот вопрос: Почему хромат стабилен в основной среде, а дихромат — в кислой среде? прочитать предисловие к этому методу, включая возможные проблемы.
По сути, в книге говорится об определении типа реакционной способности неорганических молекул по их структуре. Хотя это может не отражать со 100% точностью реальный путь реакции, мы можем считать, что это довольно хорошее приближение того, что происходит в действительности. В то время как полностью правильный механизм может быть обнаружен только экспериментально, мы можем получить вероятный механизм , применив подход, основанный на толкании стрелы, и это должно, по крайней мере, отражать реальный путь в достаточной степени, если не полностью. -} $, который здесь можно назвать алюминатным ионом.-} $, чтобы сформировать еще один крот из $ \ ce {AlOCl} $ (показано на следующей диаграмме).
-} $, который здесь можно назвать алюминатным ионом.-} $, чтобы сформировать еще один крот из $ \ ce {AlOCl} $ (показано на следующей диаграмме).
После этого $ \ ce {AlOCl} $ может быть вовлечен в повторяющийся процесс протонирования, атаки хлоридом и удаления воды с получением конечных продуктов следующим образом:
Продукты этих реакций могут быть проверены на оксиды алюминия и галлия соответственно на их страницах в Википедии.
Итак, мы можем видеть, что одной из основных причин амфотерной природы оксидов может быть их мостиковая структура, которая позволяет им реагировать как с кислотами, так и с основаниями, как показано выше.
Теперь, переходя к оксиду индия, формула этого соединения, как указано здесь, — $ \ ce {In2O3} $, которая имеет сходство с формулой $ \ ce {Al2O3} $ и $ \ ce {Ga2O3} $, которую мы указано выше. Итак, я ожидал, что этот оксид по крайней мере будет обладать некоторыми амфотерными свойствами. Это действительно так, как указано здесь для гидроксида индия (поскольку гидроксиды представляют собой просто гидратированные формы их оксидов, мы можем ожидать аналогичной природы и для оксида индия):
Результат убедительно показал, что In (OH) 3 имеет лишь незначительную амфотерность, будучи гораздо более щелочным, чем кислотный.
Кроме того, на странице Википедии об оксиде индия четко указано, что этот оксид растворим в кислотах, но не в щелочах. Это вполне ожидаемо, потому что, когда вы двигаетесь вниз по группе, элементы имеют тенденцию становиться более металлическими по своей природе, и, следовательно, их оксиды также имеют тенденцию становиться более основными. Следовательно, для оксида индия (III) целесообразно иметь амфотерный оксид, слегка стремящийся к основному концу. Реакция между кислотой и $ \ ce {In2O3} $ должна следовать общей схеме, которая проиллюстрирована выше для $ \ ce {Al2O3} $ и $ \ ce {HCl} $, и должна давать аналогичные продукты.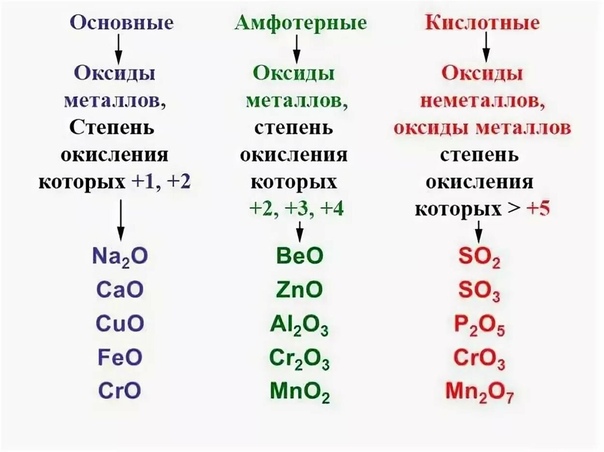 Это действительно так, как видно здесь
Это действительно так, как видно здесь
Что касается таллия, из-за эффекта инертной пары он обычно образует оксид, в котором таллий находится в степени окисления +1, с формулой $ \ ce {Tl2O} $, как указано здесь. Это не укладывается в общую формулировку $ \ ce {Al2O3} $ и $ \ ce {Ga2O3} $, которую мы обсуждали выше. Следовательно, можно было бы ожидать, что этот оксид просто станет более основным, чем другие члены группы (поскольку это оксид самого низшего элемента группы), и не будет демонстрировать особых признаков амфотерной природы.Это соответствует тому, что здесь сказано.
Прежде чем закончить ответ, я хотел бы повторить то, что я сделал в начале ответа:
Все эти пути — просто возможные механизмы, и без проведения экспериментов невозможно узнать, верны они или нет. Однако это весьма вероятные предположения, и можно ожидать, что эти пути представляют реальные механизмы с хорошим приближением
КИСЛОТО-ОСНОВНОЕ ПОВЕДЕНИЕ ОКСИДОВ ПЕРИОДА 3 На этой странице рассматриваются реакции оксидов элементов периода 3 (натрия в хлор) с водой, а также с кислотами или основаниями, где это необходимо.Очевидно, что аргон не используется, потому что он не образует оксид. Краткое описание тенденции Оксиды Мы будем рассматривать следующие оксиды:
| |||||||||||||||
Примечание: Если вы еще не были там, возможно, вам будет интересно просмотреть страницу о структурах и физических свойствах оксидов Периода 3 в качестве полезного введения, прежде чем идти дальше.  Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу позже, если вы решите перейти по этой ссылке. | |||||||||||||||
Тенденция кислотно-щелочного поведения Тенденция кислотно-щелочного поведения показана в различных реакциях, но в виде простого обобщения:
Для этой простой тенденции вы должны смотреть только на самые высокие оксиды отдельных элементов. Это те, которые находятся в верхнем ряду выше, и там, где элемент находится в максимально возможной степени окисления. Картина не так проста, если вы включите и другие оксиды. Для оксидов неметаллов их кислотность обычно рассматривается в терминах кислотных растворов, образующихся при их реакции с водой — например, триоксид серы реагирует с образованием серной кислоты.Однако все они будут реагировать с основаниями, такими как гидроксид натрия, с образованием солей, таких как сульфат натрия. Все эти реакции подробно рассматриваются на оставшейся части этой страницы. | |||||||||||||||
Предупреждение: Остальная часть этой страницы содержит довольно много деталей о различных оксидах. Не упускайте из виду общую тенденцию в отношении самых высоких оксидов за этот период, когда смотрите на все эти детали. Важно знать, что ваша программа говорит по этой теме, а также изучать прошлые работы и схемы отметок — иначе вы в конечном итоге увязнете в массе деталей, о которых вам действительно не нужно знать.Если вы готовитесь к экзамену в Великобритании (уровень A или его эквивалент) и у вас нет ничего из этого, перейдите по этой ссылке, прежде чем идти дальше, чтобы узнать, как их получить. | |||||||||||||||
Химия индивидуальных оксидов Оксид натрия Оксид натрия — простой сильноосновной оксид. Он является основным, поскольку содержит ион оксида, O 2-, который является очень сильным основанием с высокой тенденцией к объединению с ионами водорода. Реакция с водой Оксид натрия экзотермически реагирует с холодной водой с образованием раствора гидроксида натрия. В зависимости от концентрации он будет иметь pH около 14. Реакция с кислотами Оксид натрия, как сильное основание, также вступает в реакцию с кислотами. Например, он будет реагировать с разбавленной соляной кислотой с образованием раствора хлорида натрия. Оксид магния Оксид магния также является простым основным оксидом, поскольку он также содержит ионы оксида.Однако он не такой щелочной, как оксид натрия, потому что ионы оксида не так свободны. В случае оксида натрия твердое вещество удерживается вместе за счет притяжения между ионами 1+ и 2-. В случае оксида магния притяжение составляет от 2+ до 2-. Чтобы их сломать, требуется больше энергии. Даже с учетом других факторов (таких как энергия, выделяемая, когда положительные ионы притягиваются к воде в образовавшемся растворе), общий эффект этого заключается в том, что реакции с участием оксида магния всегда будут менее экзотермическими, чем реакции оксида натрия. Реакция с водой Если встряхнуть немного белого порошка оксида магния с водой, ничего не произойдет — похоже, он не вступит в реакцию. Однако, если вы проверите уровень pH жидкости, вы обнаружите, что он находится где-то около 9, что свидетельствует о слабощелочной активности. Должна быть какая-то небольшая реакция с водой с образованием гидроксид-ионов в растворе. В реакции образуется некоторое количество гидроксида магния, но он почти нерастворим, поэтому в раствор фактически попадает не так много гидроксид-ионов. Реакция с кислотами Оксид магния реагирует с кислотами так же, как и любой простой оксид металла. Например, он реагирует с теплой разбавленной соляной кислотой с образованием раствора хлорида магния. Оксид алюминия Описание свойств оксида алюминия может сбивать с толку, поскольку он существует в нескольких различных формах. Одна из этих форм очень инертна.Химически он известен как альфа-Al 2 O 3 и производится при высоких температурах. Далее мы предполагаем одну из наиболее реактивных форм. Оксид алюминия амфотерный . Он вступает в реакцию как с основанием, так и с кислотой. Реакция с водой Оксид алюминия не реагирует с водой простым образом в том смысле, в каком реагируют оксид натрия и оксид магния, и не растворяется в ней.Хотя он все еще содержит ионы оксида, они слишком прочно удерживаются в твердой решетке, чтобы реагировать с водой. | |||||||||||||||
Примечание: Однако некоторые формы оксида алюминия действительно очень эффективно поглощают воду. Я не смог установить, связано ли это поглощение только с такими вещами, как водородные связи, или происходит настоящая химическая реакция с образованием какого-то гидроксида. Если у вас есть надежная информация по этому поводу, не могли бы вы связаться со мной по адресу, указанному на странице об этом сайте. | |||||||||||||||
Реакция с кислотами Оксид алюминия содержит ионы оксида и поэтому реагирует с кислотами так же, как оксиды натрия или магния. Это означает, например, что оксид алюминия будет реагировать с горячей разбавленной соляной кислотой с образованием раствора хлорида алюминия. В этой (и подобных реакциях с другими кислотами) оксид алюминия показывает основную сторону своей амфотерной природы. Реакция с основаниями Оксид алюминия также имеет кислую природу, и это проявляется в реакции с основаниями, такими как раствор гидроксида натрия. Образуются различные алюминаты — соединения, в которых алюминий находится в отрицательном ионе. Это возможно, потому что алюминий обладает способностью образовывать ковалентные связи с кислородом. В случае натрия между натрием и кислородом существует слишком большая разница в электроотрицательности для образования чего-либо, кроме ионной связи.Но электроотрицательность увеличивается по мере прохождения периода, а разница электроотрицательностей между алюминием и кислородом меньше. Это позволяет образовывать ковалентные связи между ними. | |||||||||||||||
Примечание: Если вас не устраивает электроотрицательность, вы найдете объяснение, если перейдете по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу позже. | |||||||||||||||
С горячим концентрированным раствором гидроксида натрия оксид алюминия реагирует с образованием бесцветного раствора тетрагидроксоалюмината натрия. | |||||||||||||||
Примечание: Вы можете найти множество других формул, приведенных для продукта этой реакции. Они варьируются от NaAlO 2 (который является дегидратированной формой той, что указан в уравнении) до Na 3 Al (OH) 6 (который представляет собой совершенно другой продукт). То, что вы действительно получите, будет зависеть от таких вещей, как температура и концентрация раствора гидроксида натрия. В любом случае, правда почти наверняка намного сложнее, чем что-либо из вышеперечисленного.Это тот случай, когда было бы неплохо узнать, что ваши экзаменаторы цитируют в своих вспомогательных материалах или схемах выставления оценок, и придерживаться этого. При необходимости получите такую информацию от экзаменаторов (если вы изучаете курс в Великобритании), перейдя по ссылкам на странице учебных программ. | |||||||||||||||
Диоксид кремния (оксид кремния (IV)) К тому времени, когда вы дойдете до кремния в течение периода, электроотрицательность увеличится настолько, что уже не будет достаточной разницы в электроотрицательности между кремнием и кислородом для образования ионных связей. Диоксид кремния не имеет основных свойств — не содержит оксидных ионов и не вступает в реакцию с кислотами. Вместо этого он очень слабокислый, реагируя с сильными основаниями. Реакция с водой Диоксид кремния не реагирует с водой из-за сложности разрушения гигантской ковалентной структуры. Реакция с основаниями Диоксид кремния реагирует с раствором гидроксида натрия, но только если он горячий и концентрированный.Образуется бесцветный раствор силиката натрия. Вы также можете быть знакомы с одной из реакций, происходящих при извлечении железа в доменной печи — в которой оксид кальция (из известняка, который является одним из сырьевых материалов) реагирует с диоксидом кремния с образованием жидкого шлака, силиката кальция. Это также пример реакции кислого диоксида кремния с основанием. Важно! Что касается остальных оксидов, мы в основном будем рассматривать результаты их реакции с водой с образованием растворов различных кислот. Когда мы говорим о кислотности оксидов, возрастающей по мере перехода, скажем, от оксида фосфора (V) к триоксиду серы к оксиду хлора (VII), мы обычно говорим о возрастающей силе кислот, образующихся при их реакции. с водой. Оксиды фосфора Мы собираемся рассмотреть два оксида фосфора, оксид фосфора (III), P 4 O 6 , и оксид фосфора (V), P 4 O 10 . Оксид фосфора (III) Оксид фосфора (III) реагирует с холодной водой с образованием раствора слабой кислоты, H 3 PO 3 , известной как фосфористая кислота, ортофосфорная кислота или фосфоновая кислота. Его реакция с горячей водой намного сложнее. | |||||||||||||||
Примечание: Обратите внимание на окончание «-ous» в первых двух именах. Это не орфографическая ошибка — это правда! Его используют, чтобы отличить его от фосфорной кислоты, которая совершенно иная (см. Ниже). Названия фосфорсодержащих кислот просто кошмар! (На самом деле, насколько я понимаю, фосфорные кислоты в целом всегда были и продолжают быть полным кошмаром!) Не беспокойтесь об этих названиях на этом уровне. Просто убедитесь, что вы можете написать формулы, если вам это нужно — и будьте благодарны за то, что вам не нужно больше о них знать! | |||||||||||||||
Чистая неионизированная кислота имеет структуру: Водороды не выделяются в виде ионов, пока вы не добавите в кислоту воду, и даже в этом случае их не так много, потому что фосфористая кислота является лишь слабой кислотой. Фосфорная кислота имеет pK a , равное 2,00, что делает ее более сильной, чем обычные органические кислоты, такие как этановая кислота (pK a = 4,76). | |||||||||||||||
Примечание: Если вы знаете о pK a , но не очень уверены, вы можете перейти по этой ссылке, но это, вероятно, займет у вас много времени. Все, что вам действительно нужно знать по этой теме, это то, что чем ниже значение pK a , тем сильнее кислота. | |||||||||||||||
Маловероятно, что вы когда-нибудь прореагируете напрямую оксидом фосфора (III) с основанием, но вам может потребоваться знать, что произойдет, если вы прореагируете образовавшуюся фосфористую кислоту с основанием. В фосфористой кислоте два атома водорода в группах -ОН являются кислыми, а другой — нет. Это означает, что вы можете получить две возможные реакции, например, с раствором гидроксида натрия в зависимости от используемых пропорций. В первом случае только один из кислых атомов водорода прореагировал с гидроксид-ионами основания. Во втором случае (с использованием вдвое большего количества гидроксида натрия) прореагировали оба. Если бы вы реагировали непосредственно оксид фосфора (III) с раствором гидроксида натрия, а не сначала производили кислоту, вы бы получили те же возможные соли. | |||||||||||||||
Примечание: Проверьте свой учебный план, прошлые работы и схемы отметок, прежде чем слишком увязнуть в этом! Перейдите по этой ссылке, чтобы узнать, как получить их, если у вас их еще нет (только для учебных программ в Великобритании). | |||||||||||||||
Оксид фосфора (V) Оксид фосфора (V) бурно реагирует с водой с образованием раствора, содержащего смесь кислот, природа которой зависит от условий.Обычно мы просто рассматриваем одну из них, фосфорную (V) кислоту, H 3 PO 4 , также известную как фосфорная кислота или ортофосфорная кислота. На этот раз чистая неионизированная кислота имеет структуру: Фосфорная (V) кислота также является слабой кислотой с pK a , равным 2,15. Это делает его на слабее фосфористой кислоты. Растворы обеих этих кислот с концентрацией около 1 моль дм -3 будут иметь pH около 1. Опять же, вы вряд ли когда-нибудь прореагируете этот оксид с основанием, но вполне можно ожидать, что вы узнаете, как фосфорная (V) кислота реагирует с чем-то вроде раствора гидроксида натрия. Если вы посмотрите на структуру, вы увидите, что она имеет три группы -OH, и каждая из них имеет кислый атом водорода. Вы можете провести реакцию с гидроксидом натрия в три стадии, причем один за другим эти атомы водорода вступают в реакцию с ионами гидроксида. Опять же, если бы вы реагировали непосредственно оксидом фосфора (V) с раствором гидроксида натрия, а не сначала производили кислоту, вы бы получили те же возможные соли. Это становится смешным, поэтому я приведу только один пример из возможных уравнений: | |||||||||||||||
Примечание: Если на экзамене вам задают вопрос, в котором вам просто нужно написать уравнение реакции гидроксида натрия с фосфорной (V) кислотой, какое уравнение вам следует написать? Это не имеет особого значения — все они совершенно верны. В каждом случае это просто зависит от пропорций двух используемых вами реагентов. Если вы действительно хотите быть уверенным, проверьте прошлые документы и отметьте схемы. Я нашел один вопрос о реакции между оксидом натрия и фосфорной (V) кислотой, где схема маркировки принимала любое из возможных уравнений — чего я и ожидал. (Я знаю, что не давал вам этот конкретный набор уравнений, но их нетрудно вычислить, если вы понимаете принцип, и я не могу привести каждое отдельное кислотно-основное уравнение. Это уже давно страница будет длиться вечно, и все в отчаянии сдадутся задолго до конца! Вот почему вы пытаетесь понять химию, а не изучать ее как попугай.) Пожалуйста, не тратьте время на изучение уравнений — или, по крайней мере, до тех пор, пока вы не узнаете и не поймете всю остальную химию, которую вам нужно знать и понимать! У любого уравнения очень мало шансов пройти экзамен, даже если оно входит в вашу конкретную программу. Жизнь слишком коротка, чтобы тратить время на изучение уравнений. Знайте, как их решить, если вам нужно. | |||||||||||||||
Оксиды серы Мы собираемся рассмотреть диоксид серы, SO 2 , и триоксид серы, SO 3 . Диоксид серы Диоксид серы хорошо растворяется в воде, реагируя с ней, давая раствор, известный как серная кислота, который традиционно имеет формулу H 2 SO 3 . Однако основным веществом в растворе является просто гидратированный диоксид серы — SO 2 , xH 2 O. Спорный вопрос, существует ли вообще в растворе какая-либо H 2 SO 3 как таковая. Сернистая кислота также является слабой кислотой с pK a около 1.8 — немного сильнее, чем две указанные выше фосфорсодержащие кислоты. Достаточно концентрированный раствор сернистой кислоты снова будет иметь pH около 1. . | |||||||||||||||
Примечание: Значения pK и , указанные для серной кислоты в различных источниках, несколько различаются — от 1,77 до 1,92. У меня нет возможности узнать, что из этого правильное. Ионизация «серной кислоты» включает ионизацию гидратированного комплекса, и вам не нужно беспокоиться об этом на этом уровне. | |||||||||||||||
Диоксид серы также будет напрямую реагировать с основаниями, такими как раствор гидроксида натрия. Если диоксид серы барботируют через раствор гидроксида натрия, сначала образуется раствор сульфита натрия, а затем раствор гидросульфита натрия, когда диоксид серы оказывается в избытке. | |||||||||||||||
Примечание: Сульфит натрия также называют сульфатом натрия (IV).Гидросульфит натрия также является гидросульфатом натрия (IV) или бисульфитом натрия. Обратите внимание, что уравнения для этих реакций отличаются от примеров фосфора. В этом случае мы реагируем непосредственно между оксидом и гидроксидом натрия, потому что мы, скорее всего, поступаем именно так. | |||||||||||||||
Другая важная реакция диоксида серы — с основным оксидом кальция с образованием сульфита кальция (сульфата кальция (IV)).Это лежит в основе одного из методов удаления диоксида серы из дымовых газов на электростанциях. Трехокись серы Триоксид серы бурно реагирует с водой с образованием тумана из концентрированных капель серной кислоты. | |||||||||||||||
Примечание: Если вы знаете о контактном процессе производства серной кислоты, вы знаете, что триоксид серы всегда преобразуется в серную кислоту с помощью кругового процесса, чтобы избежать проблемы сернокислотного тумана. Если вам интересно, вы можете найти подробную информацию о процессе обращения в другом месте на этом сайте, но это не относится к текущей теме. | |||||||||||||||
Чистая неионизированная серная кислота имеет структуру: Серная кислота — сильная кислота, и растворы обычно имеют pH около 0. Кислота реагирует с водой, давая ион гидроксония (ион водорода в растворе, если хотите) и ион сероводорода.Эта реакция проходит практически на 100%. Второй водород удалить труднее. На самом деле ион гидросульфата является относительно слабой кислотой, по силе близкой к кислотам, которые мы уже обсуждали на этой странице. На этот раз вы получите равновесие: Серная кислота, конечно, имеет все реакции сильной кислоты, с которыми вы знакомы из вводных курсов химии. Например, нормальная реакция с раствором гидроксида натрия заключается в образовании раствора сульфата натрия, в котором оба кислых водорода реагируют с ионами гидроксида. В принципе, вы также можете получить раствор гидросульфата натрия, используя вдвое меньше гидроксида натрия и просто реагируя с одним из двух кислых водородов в кислоте. На практике лично я никогда этого не делал — на данный момент не вижу особого смысла! Сам по себе триоксид серы также вступает в непосредственную реакцию с основаниями с образованием сульфатов. Например, он будет реагировать с оксидом кальция с образованием сульфата кальция. Это похоже на реакцию с диоксидом серы, описанную выше. Оксиды хлора Хлор образует несколько оксидов, но единственные два, упомянутые в любой из учебных программ уровня A Великобритании, — это оксид хлора (VII), Cl 2 O 7 , и оксид хлора (I), Cl 2 O. Хлор ( VII) оксид также известен как гептоксид дихлора, а оксид хлора (I) — как монооксид дихлора. Оксид хлора (VII) Оксид хлора (VII) — это высший оксид хлора — хлор находится в максимальной степени окисления +7.Он продолжает тенденцию высших оксидов элементов периода 3 к тому, чтобы быть более сильными кислотами. Оксид хлора (VII) реагирует с водой с образованием очень сильной кислоты, хлорноватой (VII) кислоты, также известной как хлорная кислота. PH типичных растворов, как и серной кислоты, будет около 0, .Неионизированная хлорная (VII) кислота имеет структуру: Вероятно, вам это не понадобится для целей UK A level (или его эквивалентов), но это полезно, если вы понимаете причину, по которой хлорная (VII) кислота является более сильной кислотой, чем хлорная (I) кислота (см. Ниже) .Вы можете применить те же рассуждения к другим кислотам на этой странице. Когда ион хлората (VII) (перхлорат-ион) образуется в результате потери иона водорода (например, когда он реагирует с водой), заряд может быть делокализован по каждому атому кислорода в ионе. Это делает его очень стабильным и означает, что хлорная (VII) кислота очень сильна. | |||||||||||||||
Примечание: Это похоже на делокализацию, которая происходит в этаноат-ионе, образующемся, когда этановая кислота ведет себя как слабая кислота.Вы найдете это более подробно на странице, посвященной органическим кислотам. Используйте кнопку НАЗАД в браузере, если вы решите перейти по этой ссылке. | |||||||||||||||
Хлорная (VII) кислота реагирует с раствором гидроксида натрия с образованием раствора хлората натрия (VII). Сам оксид хлора (VII) также реагирует с раствором гидроксида натрия с образованием того же продукта. Оксид хлора (I) Оксид хлора (I) намного менее кислый, чем оксид хлора (VII).Он до некоторой степени реагирует с водой с образованием хлорноватистой (I) кислоты HOCl, также известной как хлорноватистая кислота. | |||||||||||||||
Примечание: Вы также можете найти хлорную (I) кислоту, записанную как HClO. Форма, которую я использовал, более точно отражает способ соединения атомов. | |||||||||||||||
Структура хлорноватой (I) кислоты в точности такая, как показано ее формулой HOCl. У него нет атомов кислорода с двойными связями и нет способа делокализации заряда по отрицательному иону, образовавшемуся в результате потери водорода. Это означает, что образовавшийся отрицательный ион не очень стабилен и легко восстанавливает свой водород, чтобы превратиться в кислоту. Хлорная (I) кислота очень слабая (pK a = 7,43). Хлорная (I) кислота реагирует с раствором гидроксида натрия с образованием раствора хлората натрия (I) (гипохлорита натрия). Оксид хлора (I) также напрямую реагирует с гидроксидом натрия с образованием того же продукта.
В меню «Период 3».. . В меню «Неорганическая химия». . . В главное меню. . . © Джим Кларк 2005 (последнее изменение — ноябрь 2015 г.) | |||||||||||||||
Оксиды | Введение в химию
Цель обучения
- Обсудите химические свойства оксидов.
Ключевые моменты
- Оксиды металлов обычно содержат анион кислорода в степени окисления -2.
- Благородные металлы (такие как золото или платина) ценятся, потому что они сопротивляются прямому химическому соединению с кислородом, а такие вещества, как оксид золота (III), должны образовываться косвенным путем.
- Поверхность большинства металлов состоит из оксидов и гидроксидов в присутствии воздуха.
- Металлы имеют тенденцию образовывать основные оксиды, неметаллы — кислые оксиды, а амфотерные оксиды образуются элементами, расположенными на границе между металлами и неметаллами (металлоидами).
Термины
- пассивация Самопроизвольное образование твердой нереактивной поверхностной пленки (обычно оксида или нитрида), которая препятствует дальнейшей коррозии.
- оксид — бинарное химическое соединение кислорода с другим химическим элементом.
- кокс Твердый остаток от обжига угля в коксовой печи; используется в основном в качестве топлива и при производстве стали, а ранее в качестве бытового топлива.
Химические свойства оксидов
Оксид — это химическое соединение, которое содержит по крайней мере один атом кислорода и еще один элемент в своей химической формуле. Оксиды металлов обычно содержат анион кислорода в степени окисления -2.Большая часть земной коры состоит из твердых оксидов в результате окисления элементов кислородом воздуха или воды. При сжигании углеводородов образуются два основных оксида углерода: монооксид углерода (CO) и диоксид углерода (CO 2 ). Даже материалы, которые считаются чистыми элементами, часто имеют оксидное покрытие. Например, алюминиевая фольга образует тонкую пленку из Al 2 O 3 (называемую пассивирующим слоем), которая защищает фольгу от дальнейшей коррозии.
Кислород демонстрирует высокую реакционную способность
Из-за своей электроотрицательности кислород образует прочные химические связи почти со всеми элементами с образованием соответствующих оксидов.Благородные металлы (такие как золото или платина) ценятся, потому что они сопротивляются прямому химическому соединению с кислородом, а такие вещества, как оксид золота (III), должны образовываться косвенными путями. Двумя независимыми путями коррозии элементов являются гидролиз и окисление кислородом. Сочетание воды и кислорода еще более агрессивно. Практически все элементы горят в атмосфере кислорода или богатой кислородом среде. В присутствии воды и кислорода (или просто воздуха) некоторые элементы, например натрий, быстро и даже опасно реагируют с образованием гидроксидных продуктов.Отчасти по этой причине щелочные и щелочноземельные металлы не встречаются в природе в их металлической форме. Цезий настолько реактивен с кислородом, что используется в качестве геттера в электронных лампах. Растворы калия и натрия используются для дезоксигенации и обезвоживания некоторых органических растворителей.
Пассивация
Поверхность большинства металлов состоит из оксидов и гидроксидов в присутствии воздуха. Как упоминалось выше, хорошо известным примером является алюминиевая фольга, покрытая тонкой пленкой оксида алюминия, которая пассивирует металл, замедляя дальнейшую коррозию.Слой оксида алюминия может быть увеличен до большей толщины с помощью процесса электролитического анодирования. Хотя твердый магний и алюминий медленно реагируют с кислородом в STP, они, как и большинство металлов, горят на воздухе, создавая очень высокие температуры.
Полимерные и мономерные молекулярные структуры
Оксиды большинства металлов имеют полимерную структуру с поперечными связями M-O-M. Поскольку эти поперечные связи являются прочными, твердые вещества, как правило, нерастворимы в растворителях, хотя они подвержены воздействию кислот и оснований.Формулы часто обманчиво просты. Многие из них нестехиометрические. В этих оксидах координационное число оксидного лиганда составляет 2 для большинства электроотрицательных элементов и 3–6 для большинства металлов.
Диоксид кремния Диоксид кремния (SiO 2 ) — один из наиболее распространенных оксидов на поверхности земли. Как и большинство оксидов, он имеет полимерную структуру.Хотя большинство оксидов металлов являются полимерными, некоторые оксиды являются мономерными молекулами. Самые известные молекулярные оксиды — это углекислый газ и окись углерода.Пятиокись фосфора — более сложный молекулярный оксид с обманчивым названием, формула которого P 4 O 10 . Некоторые полимерные оксиды (диоксид селена и триоксид серы) деполимеризуются с образованием молекул при нагревании. Тетроксиды редки, и известно только пять примеров: четырехокись рутения, четырехокись осмия, четырехокись гассия, четырехокись иридия и четырехокись ксенона. Известно много оксианионов, таких как полифосфаты и полиоксометаллаты. Оксикатионы встречаются реже, например, нитрозоний (NO + ).Конечно, известно много соединений как с оксидами, так и с другими группами. Для переходных металлов известно много оксокомплексов, а также оксигалогенидов.
Кислотно-основные реакции
Оксиды подвержены действию кислот и оснований. Те, на кого воздействуют только кислоты, являются основными оксидами; те, на которые воздействуют только основания, являются кислыми оксидами. Оксиды, которые реагируют как с кислотами, так и с основаниями, являются амфотерными. Металлы имеют тенденцию образовывать основные оксиды, неметаллы — кислые оксиды, а амфотерные оксиды образуются элементами, расположенными на границе между металлами и неметаллами (металлоидами).
Другие окислительно-восстановительные реакции
Металлы «извлекаются» из оксидов путем химического восстановления. Распространенным и дешевым восстановителем является углерод в виде кокса. Наиболее ярким примером является выплавка железной руды.
Оксиды, такие как оксид железа (III) (или ржавчина, состоящая из гидратированных оксидов железа (III) Fe 2 O 3 · nH 2 O и оксид-гидроксид железа (III) FeO (OH), Fe (OH) 3 ), образуются при соединении кислорода с железом.
Оксиды металлов можно восстанавливать органическими соединениями.Этот окислительно-восстановительный процесс является основой многих важных преобразований в химии, таких как детоксикация лекарств ферментами P450 и производство этиленоксида, который превращается в антифриз. В таких системах металлический центр передает оксидный лиганд органическому соединению с последующей регенерацией оксида металла, часто кислородом воздуха.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
видов оксидов, основных оксидов, кислых оксидов. Получение оксидов. Оксиды азота
Свойства оксидов
Оксиды — сложные химические вещества, представляющие собой простые химические соединения элементов с кислородом. Они солеобразующие и солей не образуют .
Существует 3 типа солеобразующих оксидов: Основные оксиды (от слова «Основа»), кислые оксиды и Амфотерные оксиды .Примером оксидов, не образующих соли, могут быть: NO (оксид азота) — бесцветный газ без запаха. Его образуют электрические бури в атмосфере. CO (окись углерода) газ без запаха, образуется при сгорании угля. Обычно его называют оксидом углерода.
Есть и другие оксиды, не образующие солей.
Теперь рассмотрим каждый тип солеобразующих оксидов.
Основные оксиды
Основные оксиды -это сложные химические оксиды, которые образуют соли при химической реакции с кислотами или кислыми оксидами и не вступают в реакцию с основаниями или основными оксидами.Например, к основным оксидам относятся следующие:
K 2 O (оксид калия), CaO (оксид кальция), FeO (двухвалентный оксид железа).
Рассмотрим химических свойств оксидов примеров
1. Реакция с водой:
— реагирует с водой и образует основание (или щелочь)
CaO + H 2 O → Ca (OH) 2 (реакция, известная как известкование, выделяет большое количество тепла!)
2.реагирует с кислотами:
реакция с кислотой и форма соли и воды (раствор соли в воде)
CaO + H 2 SO 4 → CaSO 4 + H 2 O (Кристаллы этого вещества CaSO 4 повсеместно известны как «гипс Парижа»).
3. реагирует с кислыми оксидами: образует соли
CaO + CO 2 → CaCO 3 (Это вещество, известное как мел!)
Кислые оксиды
Кислотные оксиды — это сложные химические оксиды, которые образуют соли при химических реакциях с основаниями или основными оксидами и не реагируют с кислотными оксидами.
Примеры кислых оксидов могут быть:
CO 2 (всем известный диоксид углерода), P 2 O 5 — оксид фосфора (образуется в воздухе при сгорании белого фосфора), SO 3 — оксид серы (VI) — вещество, используемое для серной кислота
— химическая реакция с водой
CO 2 + H 2 O → H 2 CO 3 — это вещество — углекислота — одна из слабых кислот, ее добавляют в газированную воду для «пузырьков» газа.С повышением температуры растворимость газа в воде уменьшается, а избыток выходит в виде пузырьков.
— реакция со щелочами (основаниями):
CO 2 + 2NaOH → Na 2 CO 3 + H 2 O — образующееся вещество (соль) широко используется в сельском хозяйстве. Это называется кальцинированной сода или стиральная сода, это отличное очищающее средство от пригоревших кастрюль, жира, ожогов. Голыми руками работать не рекомендую!
— реакция с основными оксидами:
CO 2 + MgO → MgCO 3 получается соль — карбонат магния, также называемый «горькой солью».
Амфотерные оксиды
Амфотерные оксиды — это сложное химическое вещество, также оксиды, которые образуют соли при химических реакциях с кислотами (или кислотных оксидов ) и с основаниями (или основных оксидов ). Наиболее часто употребляется слово «амфотерный» для оксидов металлов .
Пример амфотерные оксиды может быть:
ZnO — оксид цинка (белый порошок, часто используемый в медицине для изготовления масок и кремов), Al 2 O 3 — оксид алюминия (также называемый «глиноземом»).
Химические свойства амфотерных оксидов уникальны тем, что они могут вступать в химическую реакцию, подходящую как основания и кислоты. Например:
— реакция с кислым оксидом:
ZnO + H 2 CO 3 → ZnCO 3 + H 2 O — Образующееся вещество, состав соли карбоната цинка в воде.
— основание реакции:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O — полученное вещество представляет собой двойную соль натрия и цинка.
Получение оксидов
Получение оксидов производят различными способами. Это может происходить физическими и химическими методами. Самый простой способ — химическая реакция простых элементов с кислородом. Например, в результате процесса горения одним из продуктов этой химической реакции являются оксидов .
Например, если раскаленные железные стержни (можно взять цинк Zn, олово Sn, свинец Pb, медь Cu, это на самом деле то, что у вас есть) поместить в колбу с кислородом, произойдет химическая реакция окисления, которая сопровождается яркой вспышкой и искрами.Продукт реакции — черный порошок оксида железа FeO (Например, если бы это было железо):
2Fe + O 2 → 2FeO
Совершенно аналогичные химические реакции окисления для других металлов и неметаллов, такие как:
Цинк горит в кислороде с образованием оксида цинка
2Zn + O 2 → 2ZnO
При сжигании угля образуются два оксида: оксид углерода и диоксид углерода
2C + O 2 → 2CO — образование окиси углерода.
C + O 2 → CO 2 — образование диоксида углерода.Этот газ образуется, когда кислород доступен в более чем достаточных количествах, то есть в любом случае сначала происходит реакция с образованием монооксида углерода, а затем монооксид углерода окисляется до диоксида углерода.
Получение оксидов можно осуществить другим способом — реакцией химического разложения. Например, для получения оксида железа или оксида алюминия необходимо поджечь соответствующую основу этих металлов в огне.
Fe (OH) 2 → FeO + H 2 O
Оксид алюминия — оксид корунда-железа (III).Поверхность планеты Марс имеет красновато-оранжевый цвет из-за наличия в почве оксида железа (III) Оксид алюминия — корунд Растворы оксидов 2Al (OH) 3 → Al 2 O 3 + 3H 2 O,
а также разложение отдельных кислот:
H 2 CO 3 → H 2 O + CO 2 — разложение угольной кислоты
H 2 SO 3 → H 2 O + SO 2 — разложение серной кислоты
Производство оксидов может осуществляться из солей металлов при сильном нагревании:
CaCO 3 → CaO + CO 2 — при поджиге мела получают оксид кальция (или известь) и диоксид углерода.
2Cu (NO 3 ) 2 → 2CuO + 4NO 2 + O 2 — в этой реакции разложения получается два оксида: CuO (черный цвет) и азот NO 2 (его еще называют коричневый газ, потому что он действительно коричневый).
Другой способ получения оксидов с помощью окислительно-восстановительной реакции, например
Cu + 4HNO 3 (конц.) → Cu (NO 3 ) 2 + 2NO 2 + 2H 2 O
S + 2H 2 SO 4 (конц.) → 3SO 2 + 2H 2 O
Оксиды хлора
Молекула ClO 2 Молекула Cl 2 O 7 Закись азота N 2 ON Диоксид азота N 2 O 3 Ангидрид азота N 2 O 5 Коричневый газ NO 2Известны оксидов хлора : Cl 2 O, ClO 2 , Cl 2 O 6 , Cl 2 O 7 . Все они, кроме Cl 2 O 7 , имеют желтый или оранжевый цвет и не являются устойчивыми, особенно ClO 2 Cl 2 O 6 .Все оксидов хлора взрывоопасны и являются очень сильными окислителями.
Реагируя с водой, они образуют соответствующие кислородсодержащие и хлорные кислоты:
Итак, Cl 2 O — кислота хлора, оксид хлорноватистой кислоты.
Cl 2 O + H 2 O → 2HClO — Хлорноватистая кислота
ClO 2 — кислота оксид хлора хлорноватистая и чарнаватная кислота в результате химической реакции с водой образует две кислоты:
ClO 2 + H 2 O → HClO 2 + HClO 3
Cl 2 O 6 также является кислым оксидом хлора чарнавати и хлорной кислотой:
Cl 2 O 6 + H 2 O → HClO 3 + HClO 4
Наконец, Cl 2 O 7 представляет собой бесцветную жидкость кислотный оксид хлора хлорноватой кислоты:
Cl 2 O 6 + H 2 O → HClO 3 + HClO 4
а, Cl 2 O 7 — жидкость бесцветная — кислый оксид хлора хлорная кислота:
Cl 2 O 7 + H 2 O → 2HClO 4
Оксиды азота
Азот — это газ, который образует с кислородом 5 различных соединений — 5 оксидов .Например:
— N 2 O — азот смешанный . Имеет другое название, в медицине известен как веселящий газ , или закись азота . Газ бесцветен, сладок и приятен на вкус. NO окись азота представляет собой бесцветный газ без запаха и вкуса.
— N 2 O 3 — азотистый ангидрид — бесцветное кристаллическое вещество
— НЕТ 2 — диоксид азота .Другое его название — коричневый газ — газ действительно имеет ржаво-коричневый цвет
— N 2 O 5 — азотный ангидрид голубая жидкость, кипящая при температуре 3,5 0 C
Из всех перечисленных соединений азота наибольший интерес для промышленности представляют NO — монооксид азота, а NO 2 — диоксид азота. Окись азота (NO) Закись азота N 2 O не реагирует с водой и щелочами. Азотистый ангидрид (N 2 O 3 ) при реакции с водой образует слабую и нестабильную азотистую кислоту HNO 2 , которая на воздухе постепенно превращается в более стабильное химическое вещество азотная кислота
Рассмотрим некоторые из химических свойств оксидов азота : Реакция с водой:
2NO 2 + H 2 O → HNO 3 + HNO 2 образуются 2 кислоты: азотная кислота HNO 3 и азотистая кислота.
Реакция с щелочью:
2NO 2 + 2NaOH → NaNO 3 + NaNO 2 + H 2 O — образование двух солей: нитрата натрия NaNO 3 и нитрита натрия
Реакция с солями:
2NO 2 + Na 2 CO 3 → NaNO 3 + NaNO 2 + CO 2 — образовались две соли: нитрат натрия и нитрит натрия, а также диоксид углерода.
Получите диоксид азота (NO 2 ) из оксида азота (NO) химической реакцией соединения c кислород:
2НО + O 2 → 2НО 2
Оксиды железа
Железо образует два оксида : FeO — оксид железа (2-валентный) — черный порошок, который получают восстановлением оксида углерода оксида железа (3-валентного) в соответствии со следующей химической реакцией:
Fe 2 O 3 + CO → 2FeO + CO 2
Это основной оксид, легко вступающий в реакцию с кислотами.Обладает восстанавливающими свойствами и быстро окисляется до оксида железа (3-валентный).
4FeO + O 2 → 2Fe 2 O 3
Оксиды железа (3-валентные) — красно-коричневый порошок (гематит), обладающий амфотерными свойствами (вступает в реакцию с кислотами и щелочами). Но кислотные свойства этого оксида выражены настолько слабо, что чаще всего его используют как основной оксид .
Также существует смешанных оксидов железа Fe 3 O 4 .Он образуется при горении железа, хорошо проводит электрический ток и обладает магнитными свойствами (его называют магнитным гематитом или магнетитом).
Если железо сжигается, в реакции образуются два оксида: оксид железа , (III) и (II) валентность.
Диоксид серы
Диоксид серы SO 2Диоксид серы SO 2 — или сернистый газ — это кислотных оксидов , но он не образует кислоту, хотя прекрасно растворяется в воде — 40 л оксида серы в 1 л воды (для удобства составления химических уравнений такой раствор называется серной кислотой).
В норме это бесцветный газ с резким удушающим запахом горящей серы. При температуре -10 0 C он может быть переведен в жидкое состояние.
В присутствии катализатора оксида ванадия (V 2 O 5 ) диоксид серы присоединяет кислород и превращается в триоксид серы
2SO 2 + O 2 → 2SO 3
Растворенный в воде диоксид серы — SO 2 окисляется очень медленно, превращаясь в серную кислоту
Если диоксид серы проходит через раствор щелочи, такой как гидроксид натрия, то сульфит натрия (или гидросульфит, это зависит от того, сколько вы берете щелочи и диоксида серы)
NaOH + SO 2 → 2NaHSO 3 — диоксид серы взято больше, чем необходимо
2NaOH + SO 2 → Na 2 SO 3 + H 2 O
Если диоксид серы не реагирует с водой, то почему его водный раствор дает кислую реакцию ?! Да не реагирует, но он сам окисляется в воде и добавляет кислород.И оказывается, что в воде накапливаются атомы водорода, которые дают кислую реакцию (это можно проверить по какому-нибудь индикатору!)
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.

