Периодическая таблица химических элементов Менделеева: группы, периоды, металлы и неметаллы в ПСХЭ
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.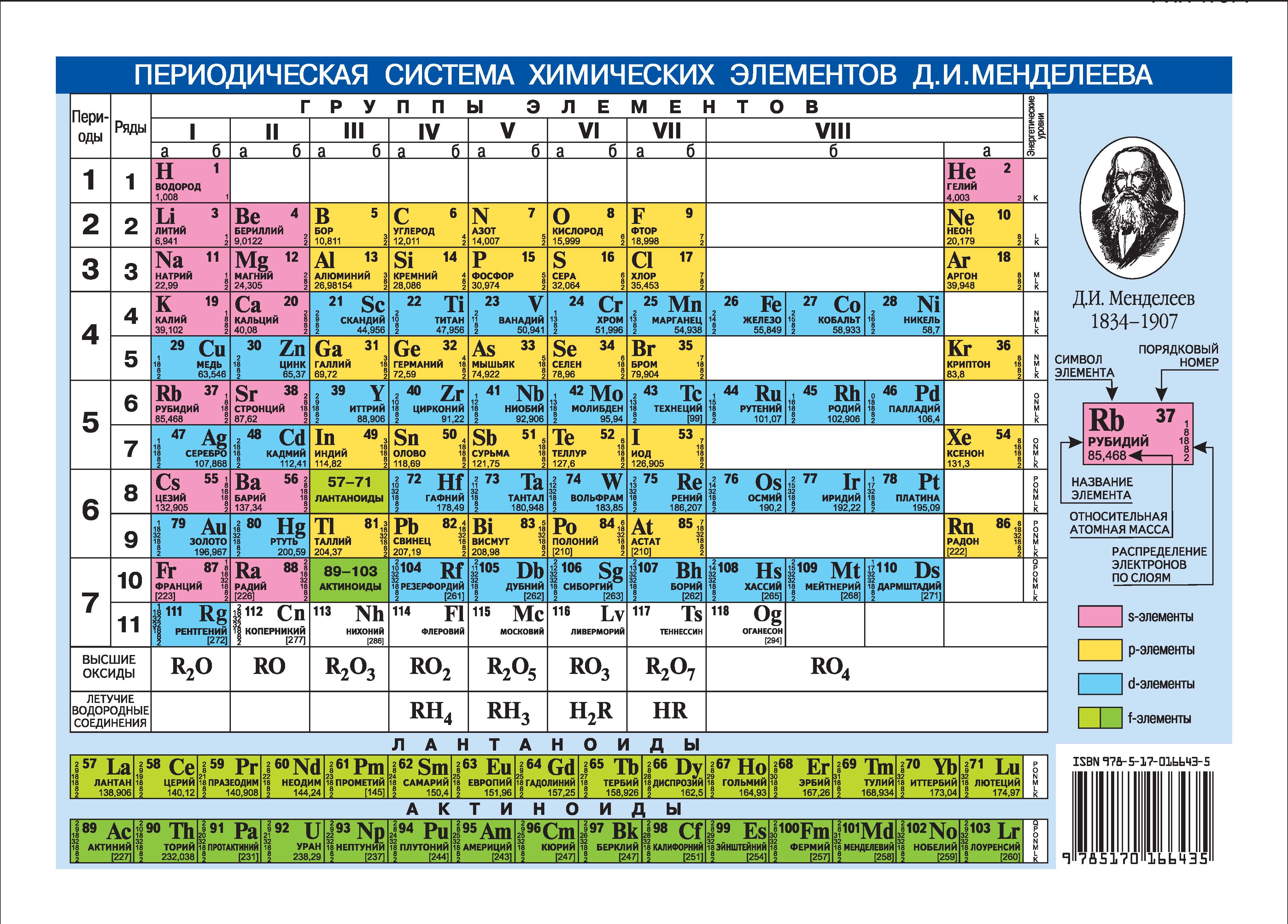
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
<<Форма демодоступа>>
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.![]()
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил. Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов
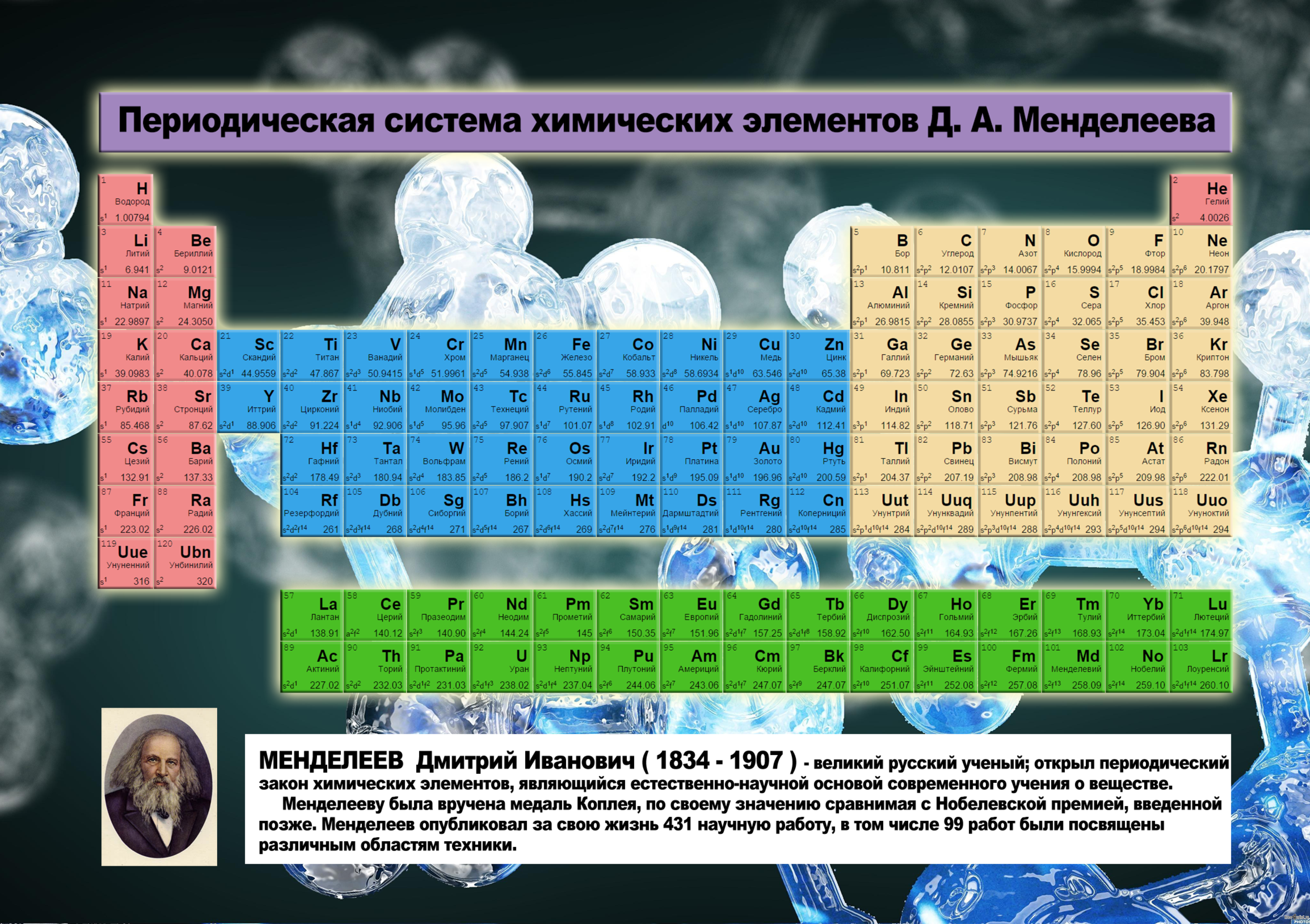
Периодическая таблица химических элементов
На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов. В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп. Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу. Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
- Металлические свойства усиливаются, неметаллические ослабевают.

- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.
Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы
Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду
CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.Щелочноземельные металлы
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных.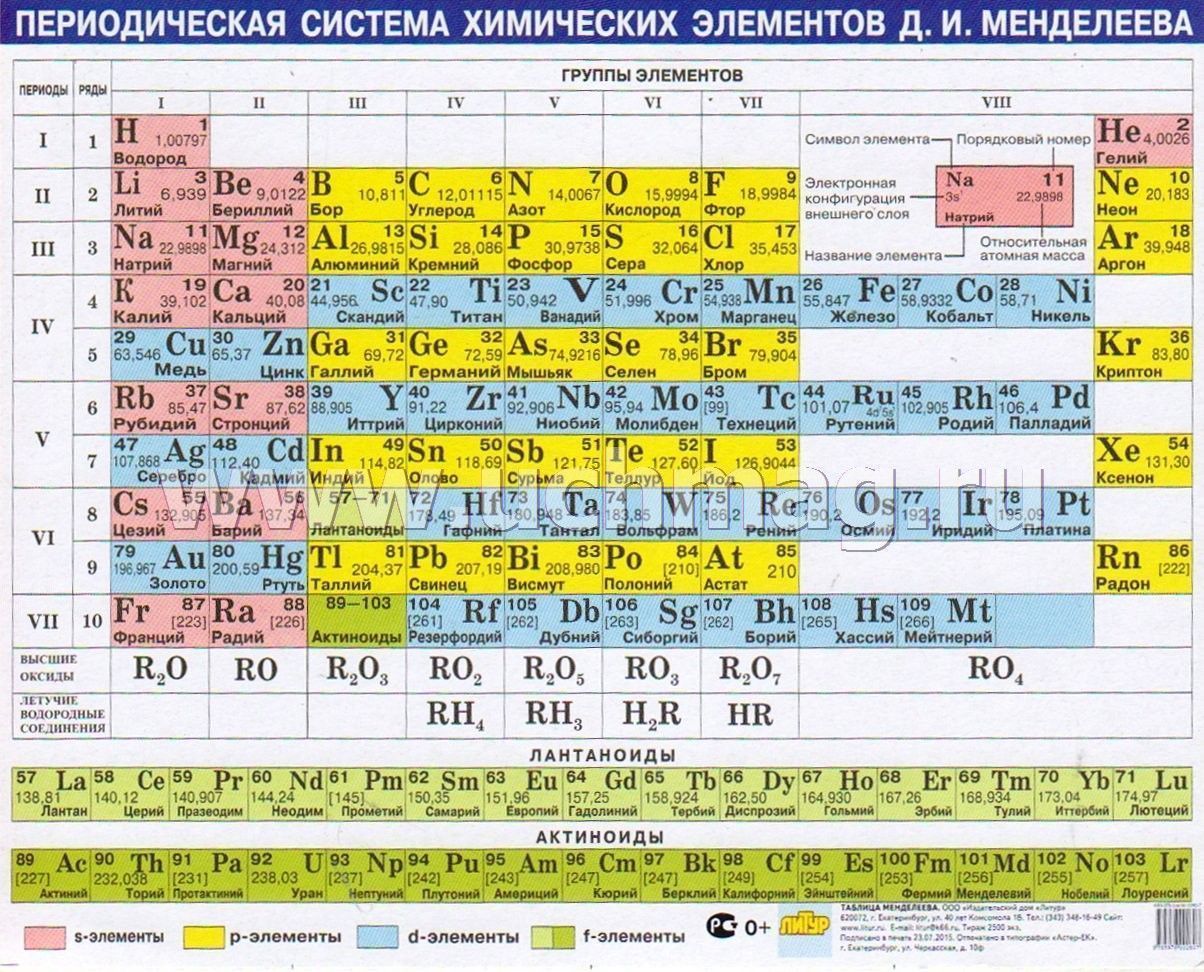 Ионы магния и кальция обусловливают жёсткость воды.
Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы
Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество.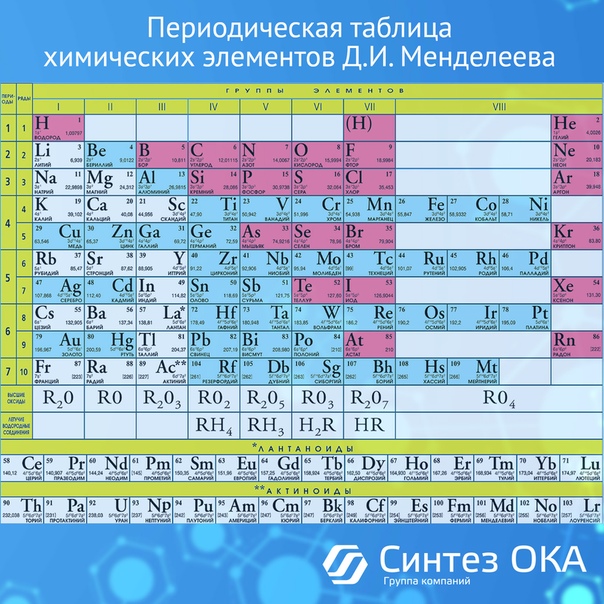 Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
Правый верхний угол таблицы до инертных газов занимают неметаллы. Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода
Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы).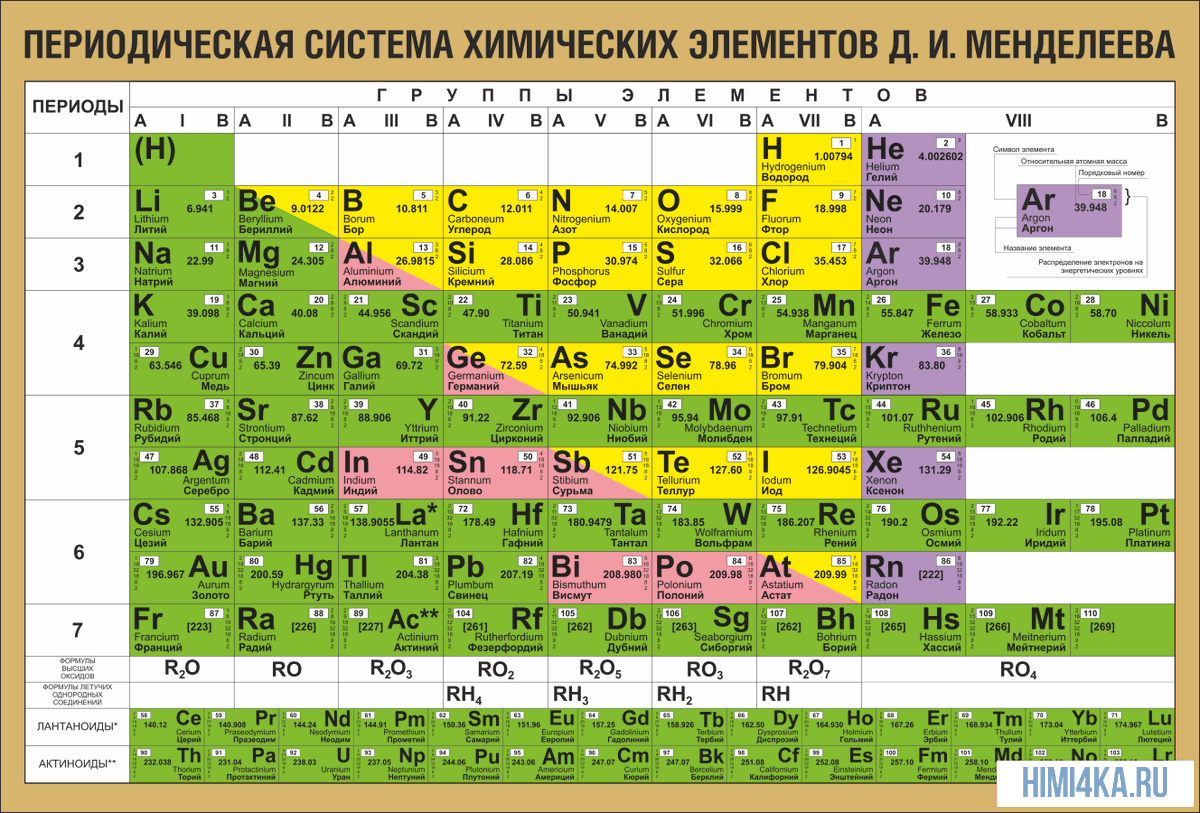 Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота
Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода
Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены
Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы
Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
2. Периодический закон и Периодическая система
Периодический закон и Периодическая система химических элементов
Д.И. Менделеева
Дополнительные видеоуроки, рекомендованные к просмотру
1. Между положением элемента в периодической системе и его электронным строением существует связь.
2. Порядковый номер элемента в периодической системе равен заряду ядра атома (следовательно, порядковый номер показывает число протонов в ядре и число электронов в атоме).
3. Каждый период начинается элементом, в атомах которого начинает застраиваться новый электронный слой, причём номер этого слоя равен номеру периода (следовательно, номер периода показывает число электронных слоёв в атомах элементов данного периода).
4. Элементы, атомы которых обладают сходными по строению электронными оболочками, попадают в одну подгруппу периодической системы. У всех элементов главных подгрупп электронами заполняется внешний электронный слой, причём число электронов на этом слое равно номеру группы.
У элементов I и II групп электронами заполняется s–подуровень, поэтому они называются s–элементами. У элементов III — VIII групп происходит заполнение р-подуровня, поэтому эти элементы относятся к семейству р-элементов. У элементов побочных подгрупп происходит заполнение электронами d–подуровня предпоследнего слоя, а у лантаноидов и актиноидов f-подуровня предпредпоследнего слоя.
5. Свойства элементов определяются их строением. Элементы, имеющие на последнем слое 1 – 2 электрона являются металлическими, 2 – 5 электронов – переходными, 4 – 8 электронов – неметаллическими.
В периоде с возрастанием заряда ядра атомов металлические свойства уменьшаются, а неметаллические усиливаются. Это связано с увеличением числа электронов на последнем слое.
Это связано с увеличением числа электронов на последнем слое.
Закономерности Периодической системы химических элементов [1*]
Периодическое повторение свойств элементов объясняется периодическим повторением числа электронов на внешнем энергетическом уровне и повторением электронных структур атома.
Химическая активность элементов определяется строением внешнего электронного слоя. Активность галогенов объясняется нехваткой 1 электрона до завершения внешнего слоя. У инертных элементов внешний электронный слой завершён, поэтому они химически неактивны. У атомов щелочных металлов 1 электрон на последнем слое является как бы лишним.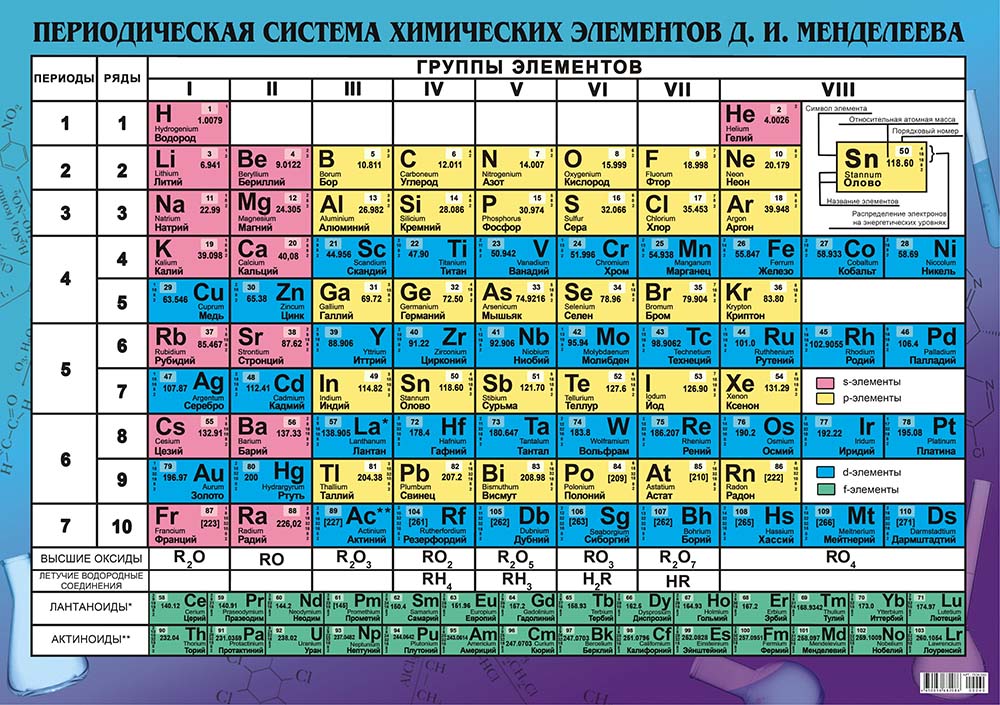
Использованные интернет-источники
Использованная литература
Периодическая система элементов — Периодическая система химических элементов, периодическая система элементов Менделеева
Периодическая система химических элементов. — систематизированные названия хим элементов, основнаые показатели, значения и свойства хим. элементов. Chemical family of elements of the periodic table. Ниже приведён длинный вариант (длиннопериодная форма), утверждённый Международным союзом теоретической и прикладной химии (IUPAC) в качестве основного.
Идея организовать элементы в порядке возрастания веса их атомов. Химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом.
Закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме.
Сейчас используем понятие атомного числа (количества протонов) для того, чтобы правильно упорядочить систему элементов, это решает техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
Короткая форма таблицы, содержащая восемь групп элементов, была официально отменена ИЮПАК в 1989 году. Несмотря на рекомендацию использовать длинную форму, короткая форма продолжила приводиться в большом числе российских справочников и пособий и после этого времени. Из современной иностранной литературы короткая форма исключена полностью, вместо неё используется длинная форма. Такую ситуацию некоторые исследователи связывают в том числе с кажущейся рациональной компактностью короткой формы таблицы, а также с инерцией, стереотипностью мышления и невосприятием современной международной информации.
Периодический закон Дмитрия Ивановича Менделеева является фундаментальным законом описывающим периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс (весов).
Открыт Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс (весов).
Термин «периодический закон» Менделеев впервые употребил в ноябре 1870, а в октябре 1871 дал окончательную формулировку Периодического закона: «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса». Графическое табличное выражение периодического закона — периодическая система элементов разработанна Дмитрием Ивановичем Менделеевым.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ | Кафедра загальної та неорганічної хімії
Периодическая классификация элементов была предложена в 1869 году Дмитрием Ивановичем Менделеевым, выдающимся ученым — химиком. Он предположил, что если расставить известные элементы в порядке увеличения относительной атомной массы, их химические и другие свойства будут регулярно повторяться. Он разработал удобную и компактную таблицу которая, к тому же, позволяла предвидеть свойства еще неизвестных элементов. В 1871 году он разработал более адекватную версию таблицы, где оставил пробелы, надеясь, что они будут в свое время заполнены элементами, еще неизвестными и предсказал с чрезвычайной точностью свойства таких элементов, как галлий, скандий и германий.
Он разработал удобную и компактную таблицу которая, к тому же, позволяла предвидеть свойства еще неизвестных элементов. В 1871 году он разработал более адекватную версию таблицы, где оставил пробелы, надеясь, что они будут в свое время заполнены элементами, еще неизвестными и предсказал с чрезвычайной точностью свойства таких элементов, как галлий, скандий и германий.
Он также предсказал отсутствующий элемент с относительной атомной массой около 100. Это оказался технеций — самый легкий элемент, не имеющий устойчивых изотопов. Предсказания Менделеева были подтверждены бельгийским химиком-аналитиком Жаном Севре Стасом, который выполнил наиболее точные в то время измерения относительных атомных масс некоторых элементов.
За это открытие Менделеев, вместе с Лотаром Майером, получил медаль Дэви — награду Лондонского Королевского Общества.
В 2016 году стало известно об официальном внесении четырех новых химических элементов в периодической таблице Менделеева, о чем извещает Международный союз теоретической и прикладной химии (IUPAC).
После того, как в январе 2016 официально подтвердили существование этих элементов, исследовательские команды, их открывшие, предложили свои названия и условное обозначение из двух букв. Традиционно химические элементы называют по имени мифологического существа, минерала, геологической формации, страны или местности, в честь ученого или по их свойствам.
Элемент 113 предложили назвать нихонием (до его временной названием был унунтрий). Его синтезировала команда Косуке Мориты в лаборатории RIKEN путем бомбардировки висмутовых мишеней ядрами цинка-70 (эксперименты поставили в 2004 и 2012). Назван в честь Японии, этот элемент впервые может увековечить Восточную Азию в периодической таблице.
Ученые из России и США, открывшие элементы 115 и 117 (до сих пор — унунпентий и унунсептий), предложили для них названия московий (Mc) и теннессин (Ts). Оба элемента получили благодаря сотрудничеству между Институтом ядерных исследований (Россия) и Ок-Риджськой и Ливерморской национальной лабораторией (США) в 2010 году.
Российская команда также предложила название «оганессон» и условное обозначение Og для элемента 118 (временно — унуноктий). Его предлагают в честь академика Юрия Оганесяна, который возглавлял эксперимент по его синтезу.
Ученые получили считанные атомы каждого из этих элементов. Они существовали лишь доли секунды и сразу распались на меньшие, более стабильные ядра. Однако ученых не покидает надежда, что среди группы транфермиевих элементов, то есть элементов с атомным номером> 100, существует так называемый «островок стабильности» — стабильный, долговременный элемент, который может существовать даже в природе. «Островок стабильности» — прямое следствие из оболочечной теории строения атомного ядра, за которую Мария Гелперт-Майер и Ганс Йенсен были удостоены Нобелевской премии по физике 1963 года.
Исследовательские команды, которые открывают новые элементы, вносят предложения относительно названий. Однако официально элементы называет только IUPAC. Международный союз ждет пять месяцев, чтобы получить отзывы на названия от общественности и научных сообществ. Если не будет массовых протестов, то их, скорее всего, утвердят в ноябре. Последний раз периодическая таблица пополнилась флеровием (Fl, 114) и ливерморием (Lv, 116).
Если не будет массовых протестов, то их, скорее всего, утвердят в ноябре. Последний раз периодическая таблица пополнилась флеровием (Fl, 114) и ливерморием (Lv, 116).
Таким образом, седьмой период периодической системы теперь полностью завершен.
Расположение металлов и неметаллов в Периодической системе
Черным цветом изображены металлы,
красным цветом — неметаллы,
зеленым — элементы с амфотерными свойствами.
Расположение семей элементов в Периодической системе
s-элементы — малиновый цвет,
p-элементы — желтый цвет,
d-элементы — голубой цвет,
f-элементы — зеленый цвет.
Пирамидальное расположение элементов
Области применения элементов
Окислительные и восстановительные свойства
Краткий конспект подготовки к ЗНО по химии №4 Периодический закон и периодическая система химических элементов Д.
 И. Менделеева
И. МенделееваПодготовка к ВНО. Химия.
Конспект 4. Периодический закон и периодическая система химических элементов Д. И. Менделеева
Открытие Периодического закона
Основной закон химии – Периодический закон был открыт Д.И. Менделеевым в 1869 году в то время, когда атом считался неделимым, и о его внутреннем строении ничего не было известно. В основу Периодического закона Д.И. Менделеев положил атомные массы (ранее – атомные веса) и химические свойства элементов. Расположив 63 известных в то время элемента в порядке возрастания их атомных масс, Д. И. Менделеев получил естественный (природный) ряд химических элементов, в котором он обнаружил периодическую повторяемость химических свойств. Например, свойства типичного металла лития повторялись у элементов натрия и калия , свойства типичного неметалла фтора – у элементов хлора , брома , иода .
У некоторых элементов Д. И. Менделеев не обнаружил химических аналогов (например, у алюминия и кремния ), поскольку такие аналоги в то время были еще неизвестны. Для них он оставил в естественном ряду пустые места и на основе периодической повторяемости предсказал их химические свойства. После открытия соответствующих элементов (аналога алюминия – галлия , аналога кремния – германия и др.) предсказания Д. И. Менделеева полностью подтвердились.
Для них он оставил в естественном ряду пустые места и на основе периодической повторяемости предсказал их химические свойства. После открытия соответствующих элементов (аналога алюминия – галлия , аналога кремния – германия и др.) предсказания Д. И. Менделеева полностью подтвердились.
Периодический закон в формулировке Д.И. Менделеева
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Периодическая система химических элементов
На основе Периодического закона Д.И. Менделеев создал Периодическую систему химических элементов. Она состоит из 7 периодов и 8 групп (короткопериодный вариант таблицы).
Периоды – это горизонтальные ряды таблицы. Они подразделяются на малые и большие.
В малых периодах находится 2 элемента (1-й период) или 8 элементов (2-й, 3-й периоды), В больших периодах – 18 элементов (4-й, 5-й периоды) или 32 элемента (6-й, 7-й период).
Группы – это вертикальные последовательности элементов, они нумеруется римской цифрой от I до VIII и русскими буквами А и Б. Короткопериодный вариант Периодической системы включает подгруппы элементов (главную и побочную).
Подгруппа – это совокупность элементов, являющихся безусловными химическими аналогами; часто элементы подгруппы обладают высшей степенью окисления, отвечающей номеру группы.
В А-группах химические свойства элементов могут меняться в широком диапазоне от неметаллических к металлическим (например, в главной подгруппе V группы азот – неметалл, а висмут – металл).
В Периодической системе типичные металлы расположены в IА группе (),
IIА () и IIIА ().
Некоторые элементы А-групп (бериллий , алюминий , германий , сурьма , полоний и другие), а также многие элементы Б-групп проявляют и металлические, и неметаллические свойства (явление амфотерности).

Некоторые главные подруппы имеют свои особенные названия:
| I-a | Щелочные металлы |
| II-a | Щелочноземельные металлы |
| V-a | Пниктогены |
| VI-a | Халькогены |
| VII-a | Галогены |
| VIII-a | Благородные (инертные) газы |
В каждой ячейке, соответствующей элементу, представлены: химический символ, название, порядковый номер, соответствующий числу протонов в атоме, относительная атомная масса.
Число электронов в атоме соответствует числу протонов. Количество нейтронов в атоме можно найти, по разности меду относительной атомной массой и количеством протонов, т.е. порядкового номера.
У каждой группы есть формула высшего оксида, т.е. оксиды с максимальной степенью окисления элементов. Эта информация написана внизу таблицы.
Например, для элементов V группы, формула высшего оксида: . Это .
По составу высшего оксида элемента можно определить его свойства. Оксиды состава – основные, – чаще всего – амфотерные. Остальные оксиды – кислотные. Чем выше степень окисления элемента , чем ярче выраженными кислотными свойствами обладает его оксид.
Таким образом, кислотность высших оксидов элементов главных подгрупп увеличивается по периоду слева направо.
В таблице отражен состав летучих водородных соединений. Такие соединения образуют элементы IV-VII групп, причем только легких.
Изменение атомного радиуса
В группах: Для элементов главных подгрупп, сверху вниз увеличивается число энергетических уровней. Энергетический уровень – это и есть расстояние, на котором находится электрон от ядра. Значит, по группе вниз атомный радиус увеличивается.
В периодах: По периоду номер энергетического уровня, на котором находятся валентные электроны, остается неизменным, но число валентных электронов увеличивается, а также растет и заряд ядра.
Значит, электроны электростатически сильнее притягиваются к ядру. Поэтому радиус атома уменьшается.
Закономерности изменения периодических свойств
| Параметр | По группе вниз | По периоду вправо |
| Заряд ядра | Увеличивается | Увеличивается |
| Число валентных электронов | Не меняется | Увеличивается |
| Число энергетических уровней | Увеличивается | Не меняется |
| Радиус атома | Увеличивается | Уменьшается |
| Электроотрицательность | Уменьшается | Увеличивается |
| Металлические свойства | Увеличиваются | Уменьшаются |
| Степень окисления в высшем оксиде | Не меняется | Увеличивается |
|
Степень окисления в водородных соединениях (для элементов IV-VII групп) |
Не меняется | Увеличивается |
Современная формулировка закона: свойства химических элементов, простых веществ, также состав и свойства соединений находятся в периодической зависимости от значений зарядов ядер атомов.
Тесты подготовки к ЗНО:
Online-тест подготовки к ЗНО по химии №4 «Периодический закон»
Периодический закон и периодическая система химических элементов Д. И. Менделеева Периодический закон
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА — естественная система химических элементов, созданная гениальным русским химиком Д. И. Менделеевым. Расположив элементы в последовательности возрастания атомных масс и сгруппировав элементы с аналогичными свойствами, Д. И. Менделеев составил таблицу элементов, закономерности которой теоретически вытекают из сформулированного им периодического закона Физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, находятся в периодической зависимости от их атомного веса (1869—1871 гг.). Периодический закон и периодическая система элементов Д. И. Менделеева позволяют установить свя ь между всеми химическими элементами, предсказать существование ранее неизвестных элементов и описать их свойства. Как впоследствии стало известно, периодичность в изменении свойств элементов обусловлена числом электронов в атоме, электронной структурой атома, периодически изменяющейся по мере возрастания числа электронов. Число электронов равно положительному заряду атомного ядра это число равно порядковому (атомному) номеру элемента в периодической системе элементов Д. И. Менделеева. Отсюда современная формулировка периодического закона Свойства элементов, а также свойства образованных ими простых и сложных соединений находятся в периодической зависимости от величины зарядов их атомных ядер (2) . Поскольку атомные массы элементов, как правило, возрастают в той же последовательности, что и заряды атомных ядер, современная форма таблицы периодической системы элементов полностью совпадает с менделеевской, где аргон, кобальт, теллур расположены не в порядке возрастания атомной массы, а на основе их химических свойств. Это несоответствие рассматривалось противниками Д. И. Менделеева как недостаток его системы, но, как позже было доказано, закономерность нарушается в связи с изотопным составом элементов, что также предвидел Д.
Как впоследствии стало известно, периодичность в изменении свойств элементов обусловлена числом электронов в атоме, электронной структурой атома, периодически изменяющейся по мере возрастания числа электронов. Число электронов равно положительному заряду атомного ядра это число равно порядковому (атомному) номеру элемента в периодической системе элементов Д. И. Менделеева. Отсюда современная формулировка периодического закона Свойства элементов, а также свойства образованных ими простых и сложных соединений находятся в периодической зависимости от величины зарядов их атомных ядер (2) . Поскольку атомные массы элементов, как правило, возрастают в той же последовательности, что и заряды атомных ядер, современная форма таблицы периодической системы элементов полностью совпадает с менделеевской, где аргон, кобальт, теллур расположены не в порядке возрастания атомной массы, а на основе их химических свойств. Это несоответствие рассматривалось противниками Д. И. Менделеева как недостаток его системы, но, как позже было доказано, закономерность нарушается в связи с изотопным составом элементов, что также предвидел Д. И. Менделеев. Периодический закон и периодическая система элементов [c.188]
И. Менделеев. Периодический закон и периодическая система элементов [c.188]
Развитие химии в период творческой деятельности Д. И. Менделеева привело ученого к выводу, что свойства химических элементов определяются их атомной массой, т. е. величиной, характеризующей относительную массу атома. Поэтому в основу систематики элементов он положил именно атомный вес, как фактор, от которого зависят физические и химические свойства элементов. Д. И. Менделеев сформулировал периодический закон так свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов . Вслед за открытием закона Д. И. Менделеев опубликовал периодическую систему элементов, в которой вертикальные ряды сходных элементов назвал группами, а горизонтальные ряды, в пределах которых закономерно изменяются свойства элементов от типичного металла до типичного неметалла,— периодами.
 Современная периодическая система химических элементов Д. И. Менделеева состоит из семи периодов и восьми групп и содержит 105 элементов. Порядковый номер элемента в периодической системе не только определяет его положение в таблице, но и отражает важнейшее свойство атомов — величину заряда их ядер. Поэтому периодический закон Д. И. Менделеева в настоящее время формулируется так свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядер атомов элементов. [c.43]
Современная периодическая система химических элементов Д. И. Менделеева состоит из семи периодов и восьми групп и содержит 105 элементов. Порядковый номер элемента в периодической системе не только определяет его положение в таблице, но и отражает важнейшее свойство атомов — величину заряда их ядер. Поэтому периодический закон Д. И. Менделеева в настоящее время формулируется так свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядер атомов элементов. [c.43]Развивая основной закон химии — периодический закон, его автор, Д. И. Менделеев разработал также систему элементов , основанную на их атомном весе и химическом сходстве. Благодаря этому ученым удалось установить взаимосвязь между всеми химическими элементами, предугадать и открыть новые химические элементы. Ниже приводится краткий обзор свойств элементов главных подгрупп периодической системы, начиная с галогенов (табл. 13). [c.58]
Признавая единство между всеми химическими элементами, Менделеев, подобно своим предшественникам, тоже подчеркивает непрерывность в переходе от элемента к элементу. Но вместе с тем он считает, что это не простая непрерывность, а периодическая повторяемость свойств по спирали, т. е. непрерывность в новом качестве. Все распределение элементов представляет непрерывность и отвечает до некоторой степени спиральной функции [29]. В связи с этим элементы с переходными свойствами занимают свое законное место в середине системы. На концах системы элементов, — пишет он, — отвечающей закону периодичности, помещаются, таким образом, наиболее между собою качественно различные элементы, а в середине — злементы, во многом между собой сходные [29]. Это имеет место как во всей системе в целом, так и в периодах, рядах. Окислы четных рядов при той же форме (что и для нечетных. — О. П.) обладают основными свойствами в большей мере, чем окислы, нечетных рядов. А этим последним преимущественно свойственен кислотный характер. Поэтому элементы, исключительно дающие основания, как щелочные, будут в начале периодов, а также чисто кислотные элементы, каковы галоиды, на конце больших периодов.
Но вместе с тем он считает, что это не простая непрерывность, а периодическая повторяемость свойств по спирали, т. е. непрерывность в новом качестве. Все распределение элементов представляет непрерывность и отвечает до некоторой степени спиральной функции [29]. В связи с этим элементы с переходными свойствами занимают свое законное место в середине системы. На концах системы элементов, — пишет он, — отвечающей закону периодичности, помещаются, таким образом, наиболее между собою качественно различные элементы, а в середине — злементы, во многом между собой сходные [29]. Это имеет место как во всей системе в целом, так и в периодах, рядах. Окислы четных рядов при той же форме (что и для нечетных. — О. П.) обладают основными свойствами в большей мере, чем окислы, нечетных рядов. А этим последним преимущественно свойственен кислотный характер. Поэтому элементы, исключительно дающие основания, как щелочные, будут в начале периодов, а также чисто кислотные элементы, каковы галоиды, на конце больших периодов.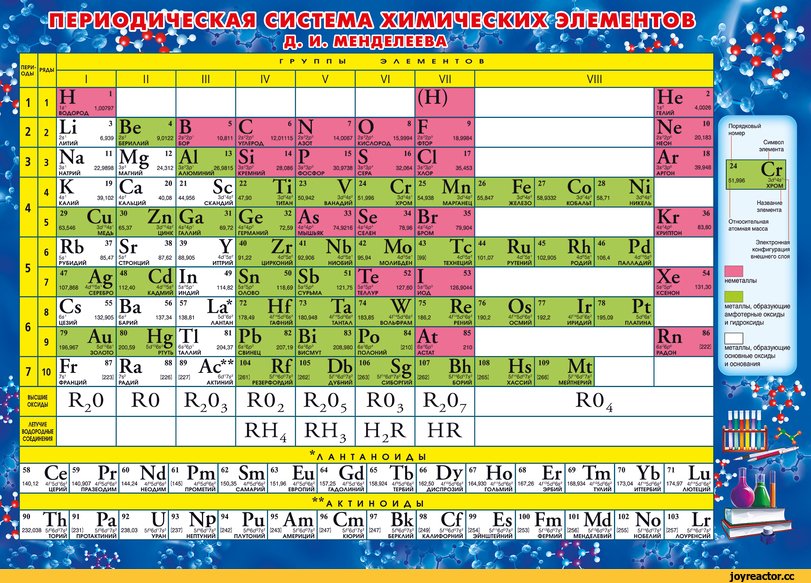 Притом наиболее ясный кислотный характер] свойственен элементам с малым атомным весом из нечетных рядов, основной же — тяжелейшим и четным [30]. [c.231]
Притом наиболее ясный кислотный характер] свойственен элементам с малым атомным весом из нечетных рядов, основной же — тяжелейшим и четным [30]. [c.231]
Закон перехода количества в качество, как заключает Менделеев, проявляется ие только при переходе от одного элемента к другому этот закон действует и в отношениях элементов горизонтальных и вертикальных разрезов периодической системы. Как стало ясно, периодическая система характеризуется единством двух ее основных разрезов — горизонтального и вертикального первый построен по принципу расположения элементов в порядке количественного возрастания атомных весов, второй — по принципу объединения элементов в естественные группы по качественному, т. е. химическому сходству элементов. Единство горизонтального и вертикального разрезов выражается в переходе от одной естественной группы к другой, что и отражает закон перехода количественных изменений в качественные.
 [c.326]
[c.326]Во втором варианте таблицы Менделеев поместил только один элемент из лантаноидов — Се. Для остальных забронировал места. Впоследствии, когда их было известно уже 11 (1902 1903), он включает в таблицу только два — Се и УЬ, так как не мог окончательно определиться, куда их поместить. В 1903 г. он писал Тут мое мнение ни на чем не остановилось, и здесь я вижу одну из труднейших задач, представляемых периодической закономерностью . Возникает вопрос а в чем собственно заключается трудность задачи Ведь есть (как считает автор) естественная система химических элементов, сформулирован главный закон, лежащий в ее основе, — бери, пользуйся Но почему же они не срабатывают А дело в том, что в основе системы лежит не только периодическая законность (дифференциация), но и непрерывная законность (интеграция). Трудность размещения в Периодической [c.71]
Таким качественным скачком стало познание строения атома и, как следствие, познание физической причины повторяемости свойств химических элементов. Как теперь известно, она зависит от повторяемости в строении электронной оболочки атома, а не от атомного веса, как считал Д. И. Менделеев и его современники. Было установлено, что повторяемость свойств от периода к периоду является зеркальным отображением структуры электронной оболочки от квантового слоя к слою. Оказалось, что этим повторяемость не ограничивается кроме квантовых слоев в электронной оболочке есть еще и подслои. Они тоже вызывают повторяемость химических свойств уже внутри периодов системы. Табличная модель системы уже не была в состоянии отражать наглядно эти вторичные виды повторяемости, а формулировка Периодического закона не была адекватной смыслу явления. [c.148]
Как теперь известно, она зависит от повторяемости в строении электронной оболочки атома, а не от атомного веса, как считал Д. И. Менделеев и его современники. Было установлено, что повторяемость свойств от периода к периоду является зеркальным отображением структуры электронной оболочки от квантового слоя к слою. Оказалось, что этим повторяемость не ограничивается кроме квантовых слоев в электронной оболочке есть еще и подслои. Они тоже вызывают повторяемость химических свойств уже внутри периодов системы. Табличная модель системы уже не была в состоянии отражать наглядно эти вторичные виды повторяемости, а формулировка Периодического закона не была адекватной смыслу явления. [c.148]
В сентябре 1876 г. Лекок де Буабодран повторил опыты очистил металл и нашел плотность его равной 5,94 (по современным, 5,91), а атомную массу 69,9 (современное значение 69,72). Я полагаю,— писал он,— что нет необходимости настаивать на исключительной важности подтверждения теоретических взглядов Д. Менделеева относительно плотности нового элемента В третьем издании Основ химии (1877) впервые в периодической системе химических элементов вместо прежнего 68 , стоит Са 68 . Признаюсь,— писал Д. И. Менделеев в мае 1880 г.,— что я не думал видеть в течение моей жизни такого блистательного доказательства периодического закона, какое доставило ото открытие г. Лекок де Буабодрана Открытие галлия было первым толчком ко всеобщему признанию периодического закона. [c.273]
Менделеева относительно плотности нового элемента В третьем издании Основ химии (1877) впервые в периодической системе химических элементов вместо прежнего 68 , стоит Са 68 . Признаюсь,— писал Д. И. Менделеев в мае 1880 г.,— что я не думал видеть в течение моей жизни такого блистательного доказательства периодического закона, какое доставило ото открытие г. Лекок де Буабодрана Открытие галлия было первым толчком ко всеобщему признанию периодического закона. [c.273]
Периодическая система химических элеменюв Д. И. Менделеева завоевала к себе доверие после подтверждения прогнозов, сделанных на ее основе. До Периодической системы Менделеева. — пишет В. И. Семишин [5, с. 14], — открытие новых элементов являлось чистой случайностью, Периодическая система ясно указала, какие элементы остались еще не открытыми». Сам Менделеев писал по этому поводу «Периодическая законность первая дала воз.можность видеть неоткрытые еще элементы в такой дали, до которой невооруженное этой законностью химическое зрение до тех пор не достигало» [11, с.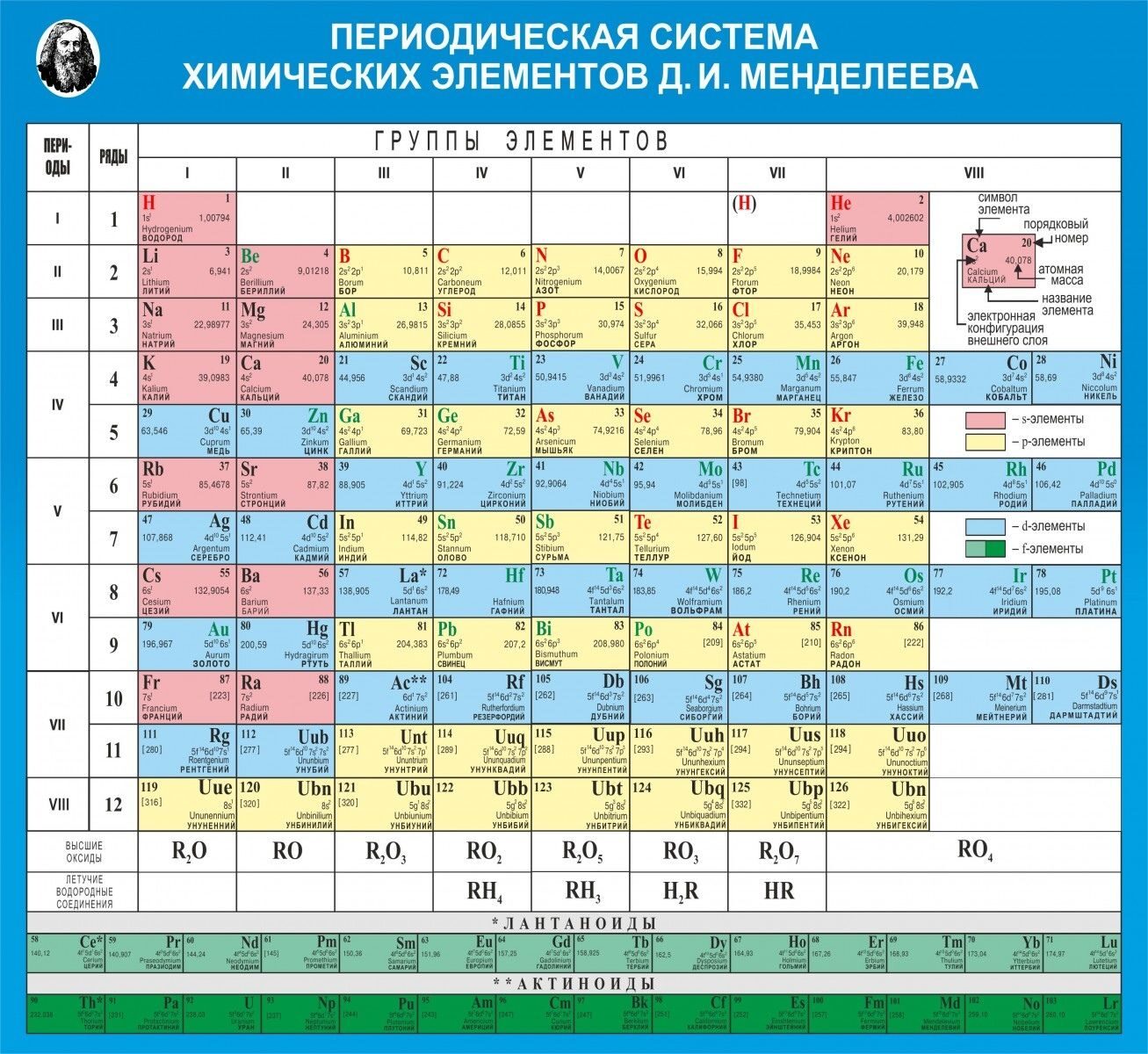 9]. Первым подтверждением предвидений Менделеева стало открытие галлия Лекоком де Буободраном [c.164]
9]. Первым подтверждением предвидений Менделеева стало открытие галлия Лекоком де Буободраном [c.164]
Б. М. Кедров постоянно подчеркивает, что Д. И. Менделеев построил Периодическую систему на основе Периодического закона. Получается, что Периодический закон дан ученому от бога или открылся по наитию. Но это уже мистика, которую Менделеев не признавал. Кедров, как-то, оставил без внимания им же приведенные слова Менделеева …разместив их (элементы) в ряд, я увидел повторяемость . Суть Периодического закона и состоит в повторяемости свойств химических элементов. Не разместив их в ряд, Менделеев не увидел бы повторяемость, не открыл бы Периодический закон В логической творческой последовательности Менделеева ряд — первичное, а Периодический закон — вторичное. Но этот ряд Кедров не считает за систему и, вообще, не признает этапом в познавательной цепочке. Ставить Периодический закон впереди Периодической системы все равно, что ставить телегу впереди лошади [c. 48]
48]
V Периодическая система химических элементов Менделеев явилась теоретической основой современных физико-химич-е-ских представлений об инертных газах, о новых редкоземельных элементах, изотопах, радиоактивных элементах. Великий химик понимал, что периодический закон ждет не только новых приложений, но и усовершенствований, подробной разработки и свежих сил Признавая сложную природу элементов, он считал, что в дальнейшем будут найдены более точные внутренние связи между количеством и качеством, но основной смысл Периодического закона сохранится. Вероятно, говорил он, при более точном изучении можно най-ги объ яснения для невыясненных еще кажущихся неправильностей в изменении атомных весов. Можно ожидать, что Периодический закон пройдет через ряд пертурбаций, но это не может вызвать сомнений в правильности закона. [c.363]
Уже Дальтон пытался представить все химические превращения вещества в виде единой цепи, которая была не чем иным, как узловой линией отношения меры химически сложных веществ.
 Продолжая ту же мысль и распространяя ее на химические элементы, Менделеев, как это видно из приведенного выше его высказывания, пришел к открытию периодического закона химических элементов. Построенная Менделеевым на основе этого закона периодическая система элементов по сути дела выступала как узловая линия отношения меры химических элементов, каждый из которых представлен атомом определенного вида (качеством) и наделен определенным атомным весом (количеством). [c.13]
Продолжая ту же мысль и распространяя ее на химические элементы, Менделеев, как это видно из приведенного выше его высказывания, пришел к открытию периодического закона химических элементов. Построенная Менделеевым на основе этого закона периодическая система элементов по сути дела выступала как узловая линия отношения меры химических элементов, каждый из которых представлен атомом определенного вида (качеством) и наделен определенным атомным весом (количеством). [c.13]При составлении периодической системы на основе открытого периодического закона Д. И. Менделеев обнаружил, что положение- многих химических элементов по своим свойствам не соответствует их атомным весам. [c.197]
Хотя Менделеев ушел из профессуры Технологического института еще в декабре 1866 г., однако некоторое время (до 1872 г.) он продолжал в нем чтение лекций это могло быть связано с тем, что как раз в 1868 г. он писал главы, посвященные углероду и углеродистым соединениям, в том числе и углеводородам для своих Основ химии (см.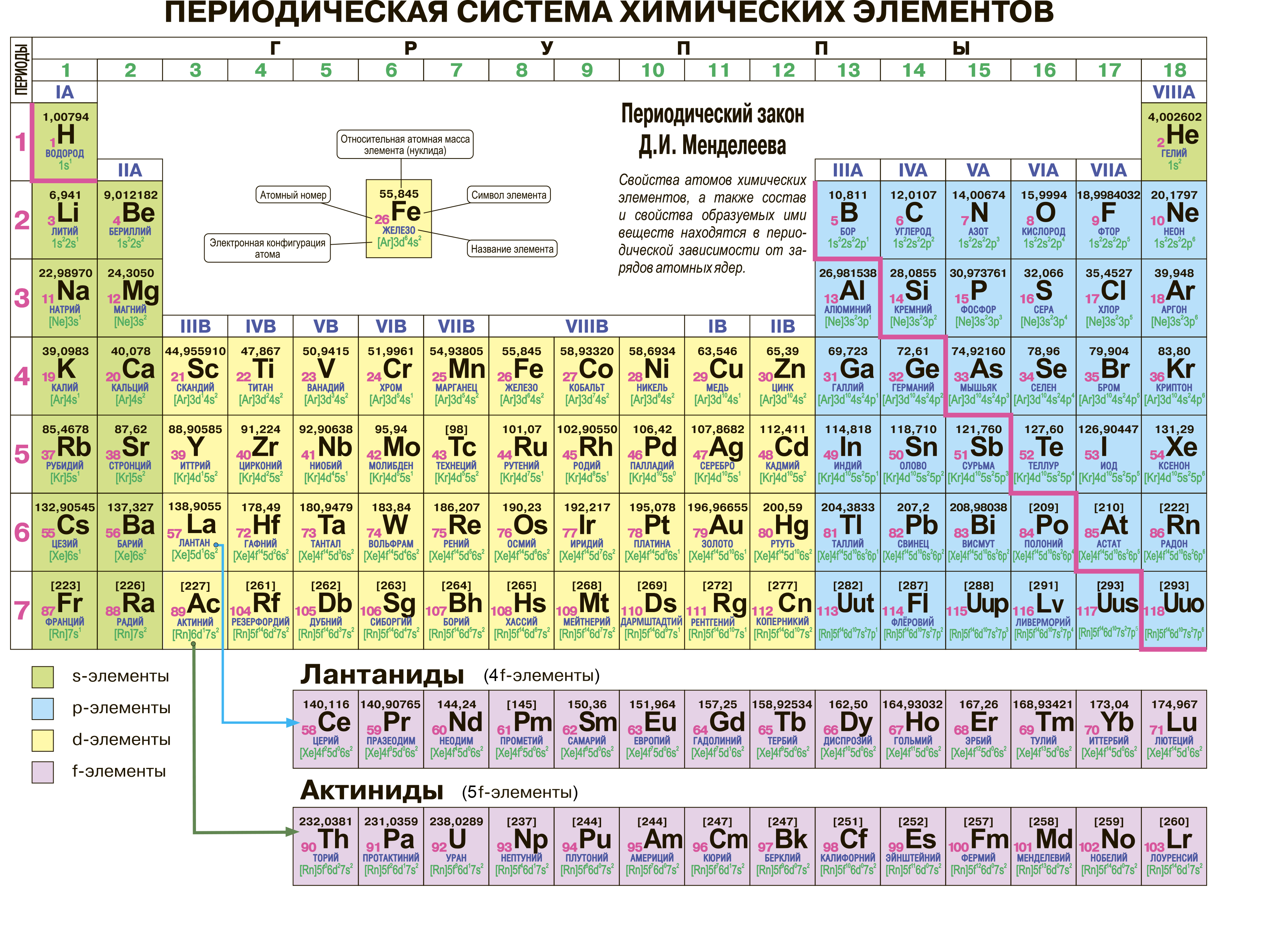 ч. 1, гл. XVI). Главным вопросом и в этих лекциях и в соответствующих главах Основ химии было стремление противопоставить ставшему уже господствующим среди органиков теоретическому представлению об атомности эмпирическое (иЛи, как его называл Менделеев, — реальное) понятие предела. При этом свою теорию пределов (см. доб. 4j и 4к), которая первоначально была выдвинута лишь для органических соединений, Менделеев стремится распространить теперь и на неорганические. В этой связи он особое внимание уделяет металлоорганическим соединениям, которые представляют собой как бы естественный мост, переброшенный между обоими классами химических веществ. Между тем учение об атомности в том виде, как оно развивалось в 60-х годах, было ограничено лишь областью органической химии и базировалось на признании, что атомность С=4, Н = 1, 0 = 2, N = 3. Поскольку перед Менделеевым к концу 60-х годов все настойчивее возникала задача — охватить единой системой все элементы, он, естественно, должен был опираться на такие представления, которые охватывали бы все вообще классы химических веществ, а не только одни соединения углерода.
ч. 1, гл. XVI). Главным вопросом и в этих лекциях и в соответствующих главах Основ химии было стремление противопоставить ставшему уже господствующим среди органиков теоретическому представлению об атомности эмпирическое (иЛи, как его называл Менделеев, — реальное) понятие предела. При этом свою теорию пределов (см. доб. 4j и 4к), которая первоначально была выдвинута лишь для органических соединений, Менделеев стремится распространить теперь и на неорганические. В этой связи он особое внимание уделяет металлоорганическим соединениям, которые представляют собой как бы естественный мост, переброшенный между обоими классами химических веществ. Между тем учение об атомности в том виде, как оно развивалось в 60-х годах, было ограничено лишь областью органической химии и базировалось на признании, что атомность С=4, Н = 1, 0 = 2, N = 3. Поскольку перед Менделеевым к концу 60-х годов все настойчивее возникала задача — охватить единой системой все элементы, он, естественно, должен был опираться на такие представления, которые охватывали бы все вообще классы химических веществ, а не только одни соединения углерода. Вот почему от первой статьи о пределах (1861 г.) (доб. 4j) идет прямая линия через лекции по органической химии (1868 г.) (доб. 2п) и соответствующие главы Основ химии (1868 г.) к статье О количестве кислорода в соляных окислах и об атомности элементов (1869 г.) (ст, 4), в которой Менделеев впервые связал с периодическим законом общее свойство кислородных, а затем и водородных соединений всех элементов достигать точно установленного предела. [c.613]
Вот почему от первой статьи о пределах (1861 г.) (доб. 4j) идет прямая линия через лекции по органической химии (1868 г.) (доб. 2п) и соответствующие главы Основ химии (1868 г.) к статье О количестве кислорода в соляных окислах и об атомности элементов (1869 г.) (ст, 4), в которой Менделеев впервые связал с периодическим законом общее свойство кислородных, а затем и водородных соединений всех элементов достигать точно установленного предела. [c.613]
В 1869 г. русский ученый Д. И. Менделеев составил таблицу, включающую большинство известных элементов, в которой элементы были сгруппированы в нескольких горизонтальных рядах так, что вертикальные столбцы включали элементы, сходные по химическим свойствам. Эта таблица, которую Менделеев назвал системой элементов, сегодня называется Периодической системой химических злементов (ее современный вид приведен на переднем форзаце). Кроме того, им был открыт и сформулирован фундаментальный закон природы — закон периодичности . Это основной химический закон, который называется Периодическим законом. [c.100]
Это основной химический закон, который называется Периодическим законом. [c.100]
Таким образом, изучение химических и физических свойств редкоземельных элементов и, как результат, их расположение в одной клетке периодической системы свидетельствовали о нивелировке индивидуальности указанных элементов. Между тем именно признание индивидуальности, самобытности элементов, даже при наличии периодического закона, установившего взаимосвязь между всеми элементами, являлось достоянием химии XIX века. Вот почему в 80-х годах Менделеев высказывался против применения… многими… периодического закона для индукции единства материи, элементы образующей 2. [c.58]
По химическим свойствам бериллий во многом сходен с алюминием (диагональное сходство в периодической системе элементов), в частмости, как и алюминий, №риллий химически растворяется в растворах щелочей, но не подвергается действию конц. HNOj (пассивируется). Поэтому Ве долгое время считали трехвалеюмын и приписывали ему неправильную атомную массу. Эту ошибку исправил Д. И. Менделеев при открытии Периодического закона. [c.331]
Эту ошибку исправил Д. И. Менделеев при открытии Периодического закона. [c.331]
Так же необоснованно. мнение Макса Лауэ, автора книги История физики , который считает, будто Л. Мейер полностью разделяет с Д. И. Ме делеевым честь открытия периодической системы химических элементов. На ошибочных позицийх стоит и Н. А. Шостьин, заявляющи11. что Л. Мейер разделяет с Д. И. Менделеевым славу открытия периодического закона (Н. А. Ш о с т ь и н. Д. И. Менделеев и проблемы измерения, 1947, стр. 60). [c.348]
ПЕРИОДИЧЕСКАЯ СИСТЁМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ, упорядоченное множество хим. элементов, их естеств. классификация, являющаяся табличиь7м выражением периодического закона Менделеева. Прообразом периодич. системы х м. элементов (П.с.) послужила таблица Опыт системы элементов, основанной на их атомном весе и химическом сходстве , составленная Д. И. Менделеевым I марта 1869 (рис. I). В послед, годы ученый совершенствовал таблнну, развил представления о периодах и группах элементов и о месте элемента в системе. В 1870 Менделеев назвал систему естественной, а в 1871 Периодической. В результате уже тогда П.с. во многом приобрела совр. структурные очертания. Опираясь на нее, Менделеев предсказал существование и св-ва ок. 10 неизвестных эле.ментов эти прогнозы впоследствии подтвердились. [c.482]
В 1870 Менделеев назвал систему естественной, а в 1871 Периодической. В результате уже тогда П.с. во многом приобрела совр. структурные очертания. Опираясь на нее, Менделеев предсказал существование и св-ва ок. 10 неизвестных эле.ментов эти прогнозы впоследствии подтвердились. [c.482]
Н. Бора. На химическом этапе закон периодичности и система Д. И. Менделеева рассматриваются в форме естественной системы химических элементов, вскрывающей и отражающей наблюдаемые отношения между элементами. Единство всех этих элементов в природе рассматривается как всеобщая взаимосвязь. Сам Д. И. Менделеев так говорил об этом …Периодический закон, опираясь на твердую и здоровую почву опытных исследований, создался совер-Ц енно помимо какого-либо представления о природе элементов…. Естествознание нашло, после великого труда исследователей, индивидуальность химических элементов и потому оно может ныне ие только анализировать, но и синте ировать, понимать и охватывать как общее, единое, так и индивидуа. аьное, множественное. Единое и общее, как время и простраь ство, как сила и движение, изменяется последовательно, допускает интерполяцию, являя все промежуточные фазы. Множественное, индивидуальное… как дальтонов-ские кратные отношения — характеризуются другим способом в нем везде видны — при связующем общем — свои скачки, разрывы сплошности [И -, с. 221—222] Считается, что на физическом этапе эволюции идей о периодичности — этапе, который был подготовлен открытием и мпирическим обоснованием естественной системы элементов, появилась фундаментальная теория периодической системы. [c.49]
аьное, множественное. Единое и общее, как время и простраь ство, как сила и движение, изменяется последовательно, допускает интерполяцию, являя все промежуточные фазы. Множественное, индивидуальное… как дальтонов-ские кратные отношения — характеризуются другим способом в нем везде видны — при связующем общем — свои скачки, разрывы сплошности [И -, с. 221—222] Считается, что на физическом этапе эволюции идей о периодичности — этапе, который был подготовлен открытием и мпирическим обоснованием естественной системы элементов, появилась фундаментальная теория периодической системы. [c.49]
После возвращения из Карлсруэ Менделеев (1863) бь 1 избран профессором Технологического института в Петербурге, а через 2 года — профессором Петербургского университета. Подготавливая лекции по общей химии, Менделеев впервые поставил перед собой задачу найти наиболее ясную и строго научную классификацию химических элементов. Эта предварительная работа впоследствии привела его к открытию периодического закона элементов и к созданию периодической систе. мы (1869), сделавшим его и.мя бессмертным. В дальнейшем химия развивалась на основании периодической системы элементов, созданной гениальным русским ученым. [c.90]
мы (1869), сделавшим его и.мя бессмертным. В дальнейшем химия развивалась на основании периодической системы элементов, созданной гениальным русским ученым. [c.90]
Том I озаглавлен Д. И. Менделеев. Периодический закон. Естественная система элементов (рукописи и таблицы) . Публикуемые материалы охватывают период с середины февраля 1869 г. до середины декабря 1871 г. (по старому стилю), т. е. почти три года (1869, 1870 и 1871). Это были годы наиболее интенсивной работы Д. И. Менделеева над периодическим законом. Публикуемые материалы дают достаточно полное представление о том, как развивалась творческая мысль Д. И. Менделеева. В них ярко отразились глубина, многосторонность и смелость мысли великого русского ученого. Достаточно указать, что эти материалы говорят о том, как за четверть века до открытия инертных газов Д. И. Менделеев предвидел существование по крайней мере двух элементов с атомными весами 20 (между фтором и натрием) и 36 (между хлором и калием), причем он относил их к числу четно-атомных элементов это были будущие неон и аргон.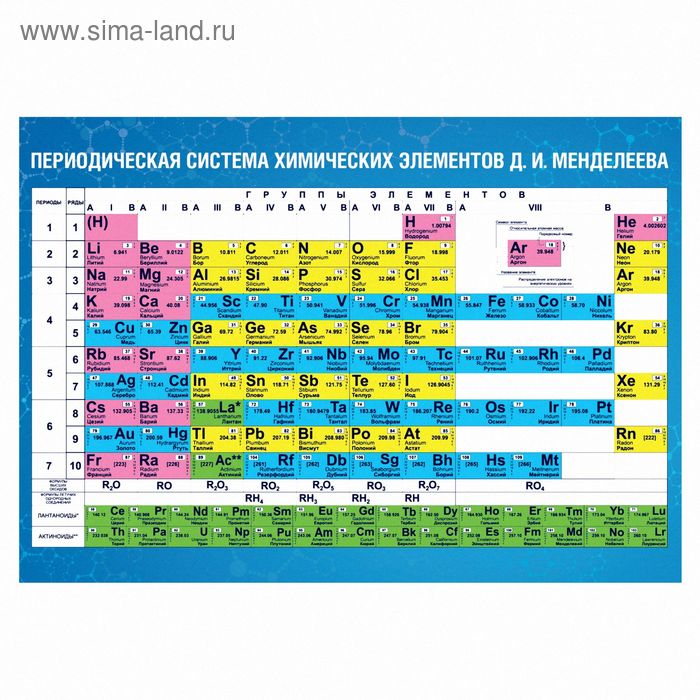 Далее, до последнего времени считалось, что диагональное направление в системе элементов было впервые введено в XX в. геохимиками в связи с исследованием близости радиусов ионов элементов, расположенных по диагонали в менделеевской системе элементов. Публикуемые таблицы, составленные самим Д. И. Менделеевым, доказывают, что именно он впервые детально исследовал это направление еще в 1870 г. Исключительный интерес представляет критика Д. И. Менделеевым вульгарно-механистической концепции аддитивности свойств соединений, в частности, их удельных объемов по отношению к атомным объемам простых веществ. Эти высказывания Д. И. Менделеева касаются и гипотезы Праута, согласно которой атомный вес элемента есть арифметическая сумма весов водородных атомов, из которых складываются все элементы. Критикуя этот механистический взгляд на образование элементов, Д. И. Менделеев формулирует положение об изменчивости веса атомов в зависимости от выделения энергии при образовании или разложении химических элементов.
Далее, до последнего времени считалось, что диагональное направление в системе элементов было впервые введено в XX в. геохимиками в связи с исследованием близости радиусов ионов элементов, расположенных по диагонали в менделеевской системе элементов. Публикуемые таблицы, составленные самим Д. И. Менделеевым, доказывают, что именно он впервые детально исследовал это направление еще в 1870 г. Исключительный интерес представляет критика Д. И. Менделеевым вульгарно-механистической концепции аддитивности свойств соединений, в частности, их удельных объемов по отношению к атомным объемам простых веществ. Эти высказывания Д. И. Менделеева касаются и гипотезы Праута, согласно которой атомный вес элемента есть арифметическая сумма весов водородных атомов, из которых складываются все элементы. Критикуя этот механистический взгляд на образование элементов, Д. И. Менделеев формулирует положение об изменчивости веса атомов в зависимости от выделения энергии при образовании или разложении химических элементов.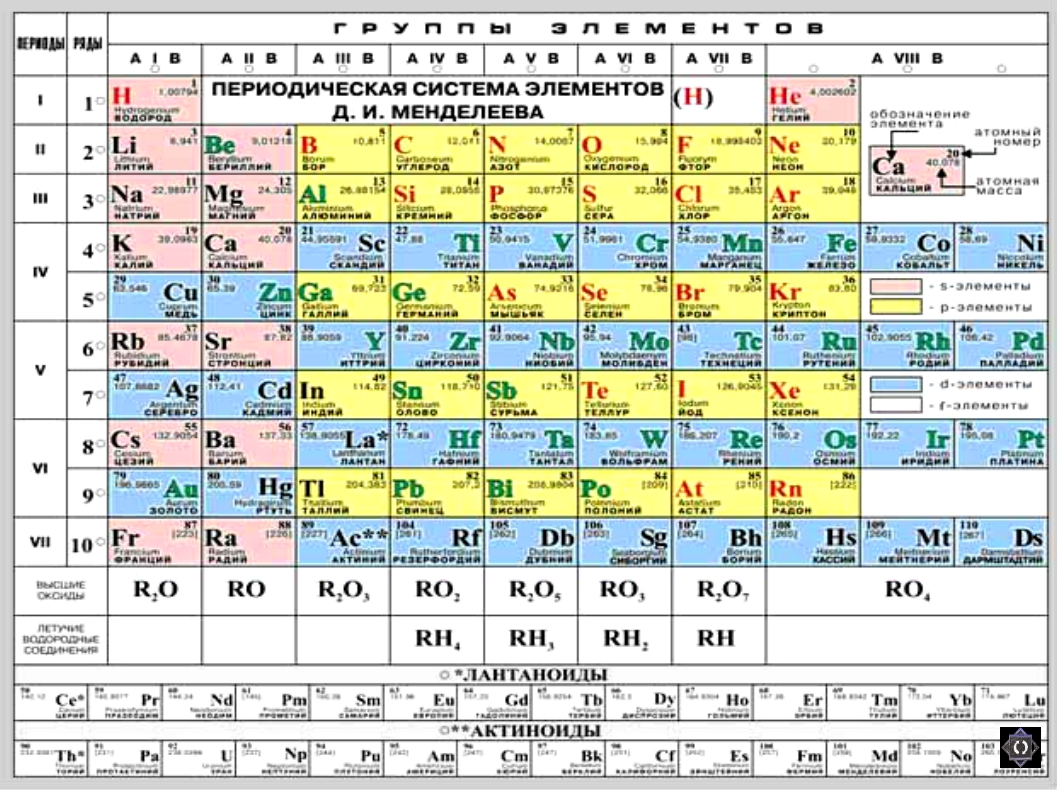 Тем самым Д. И. Менделеев гениально предвидит явление, известное ныне как дефект массы, наблюдаемое при ядерных превращениях. [c.9]
Тем самым Д. И. Менделеев гениально предвидит явление, известное ныне как дефект массы, наблюдаемое при ядерных превращениях. [c.9]
Периодический закон Д. И. Менделеева был общепризнан, хотя имелись и некоторые аномалии. Так, согласно периодическому закону, свойства элементов находятся в периодической зависимости от их атомных весов, и поэтому не может быть двух элементов с одинаковым атомным весом и разными химическими и физическими свойствами. Однако это наблюдается у кобальта и никеля порядок расположения по возрастающему атомному весу нарушен для теллура и иода. Д. И. Менделеев предполагал, что атомный вес теллура не верен, но это не подтвердилось, и теллур должен быть помещен в периодической системе до иода, хотя у него атомный вес больше. Кроме того, было неясно положение в периодической системе VIII группы и редкоземельных элементов, а также не нашлось места для инертных газов, открытых в самом конце XIX века. [c.91]
Когда Д.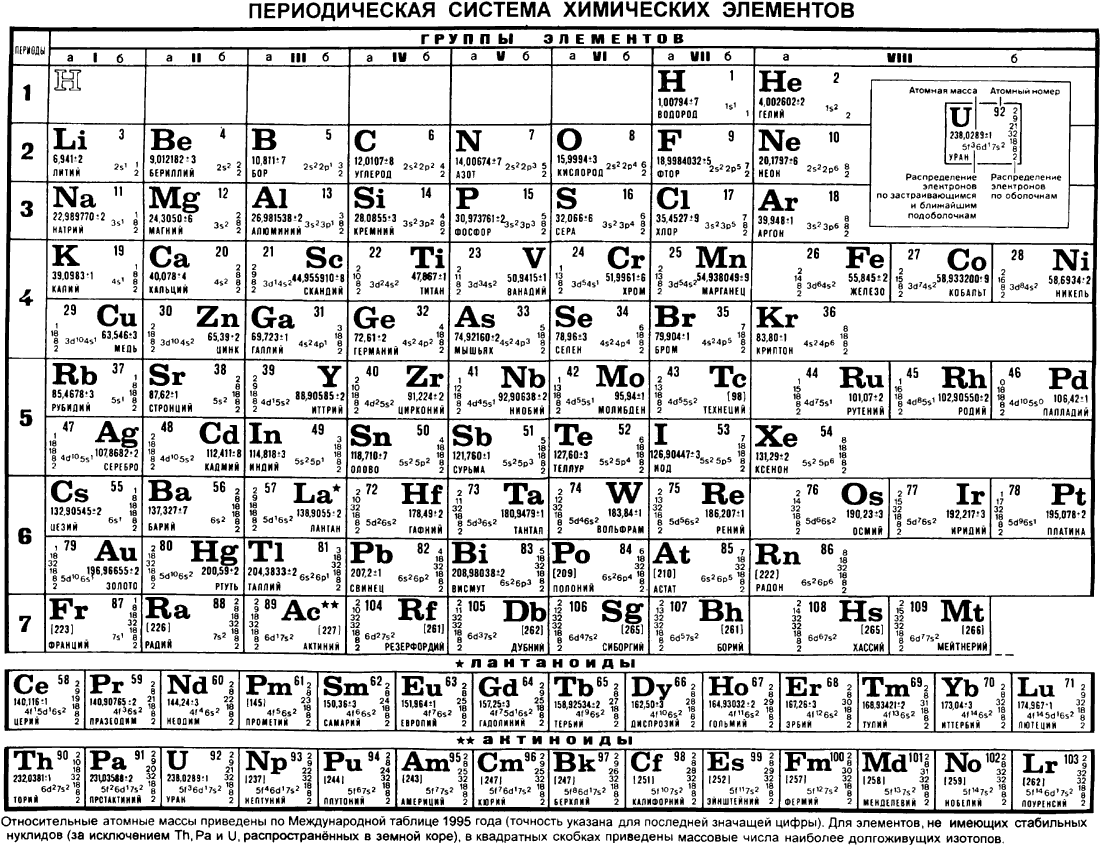 И. Менделеевым был открыт периодический закон (1869 г.), было известно 63 химических элемента. Д. И. Менделеев предсказал существование 12 новых элементов и для трех из них (Оа, Ое, 8с) подробно описал свойства. К 1925 г. были обнаружены в природе почти все элементы, расположенные в периодической системе до урана. Основой для поиска и установления химической природы элементов служил периодический закон и метод предсказания, использованный Д. И. Менделеевым. [c.15]
И. Менделеевым был открыт периодический закон (1869 г.), было известно 63 химических элемента. Д. И. Менделеев предсказал существование 12 новых элементов и для трех из них (Оа, Ое, 8с) подробно описал свойства. К 1925 г. были обнаружены в природе почти все элементы, расположенные в периодической системе до урана. Основой для поиска и установления химической природы элементов служил периодический закон и метод предсказания, использованный Д. И. Менделеевым. [c.15]
Выражением периодического закона является периодическая система химических элементов. Она раскрывает глубокую связь между всеми химическими элементами и показывает, что элементы, будучи подчинены единому закону, внутренне едины по своей природе. Внутренняя взаимосвязь элементов друг с другом выражается, в частности, в том факте, что свойства химических элементов могут быть, как это сделал Д. И. Менделеев, приближенно предсказаны. [c.5]
Наличие пустых клеток в системе элементов привело Менделеева к выводу о существовании неизвестных химических элементов, соответствующих этим незаполненным местам. Основываясь на периодическом законе, Менделеев не только предсказал существование таких химических элементов, но и подробно описал физико-химические свойства некоторых из них и даже их соедине-]1ий. Последующие исследования подтвердили правильность его научных предсказаний. [c.18]
Основываясь на периодическом законе, Менделеев не только предсказал существование таких химических элементов, но и подробно описал физико-химические свойства некоторых из них и даже их соедине-]1ий. Последующие исследования подтвердили правильность его научных предсказаний. [c.18]
В конце 70-х и начале 80-х годов были получены новые важные результаты в изучении различных сторон химии урана. Г. Роско получил иС . Циммерман опубликовал в 1881 г. работу об определении плотности паров иВг4 и иСЦ рассчитанный из этих данных атомный вес урана оказался равным 240 [19]. Работа Циммермана явилась важным подтверждением точки зрения Менделеева. В четвертом издании Основ химии (1881 г.), подводя итоги дискуссии о положении урана в периодической системе химических элементов, Менделеев назвал Циммермана одним из укрепителей периодического закона . [c.27]
Отпос. к периодпч. закону из Предисловия (с. VII—VIII, IX, X) и гл. 4, 5, 15, 21, под загл. Выписки из 7-го издания Основ химии . — Избр. соч. Т. 2. 1934, с. 442—462 с табл., 1 л. факс, и илл. прим. ред. с. 446. (3) Табл. (с. IX) (а) под загл. Периоды кимических элементов, считая атомный вес кислорода О = 16.— В кн. Д. И. Менделеев. Периодический закон. М.-Л., 1926, с. 157. (См. JV 1494) (б) под загл, Периодическая система элементов, считая атомный вес кислорода О = 16. — В кн. Д. И. Менделеев. 1834—1934. Периодический закон химических элементов. М.—Л., 1934, с. 230. (См. 1496). (4) Относ, к периодич. закону, под загл, Таблицы элементов из седьмого издания (ноябрь 1902 г.). —В кн. Д. И. Менделеев. Периодический закон. М., 1958, отд. Добавления, с. 362—365 коммент. и прим. с. 684, 712 ( Доб. 7а ) библиогр. указания с. 735 ( Доб. А ), 745, № 37. (См. № 1503). См. также коммепт. в кн. Д. И. М-в. Периодич. закон. Дополнит, материалы. М., 1960, с. 515—516. ( К доб. 7а ) [c.189]
— Избр. соч. Т. 2. 1934, с. 442—462 с табл., 1 л. факс, и илл. прим. ред. с. 446. (3) Табл. (с. IX) (а) под загл. Периоды кимических элементов, считая атомный вес кислорода О = 16.— В кн. Д. И. Менделеев. Периодический закон. М.-Л., 1926, с. 157. (См. JV 1494) (б) под загл, Периодическая система элементов, считая атомный вес кислорода О = 16. — В кн. Д. И. Менделеев. 1834—1934. Периодический закон химических элементов. М.—Л., 1934, с. 230. (См. 1496). (4) Относ, к периодич. закону, под загл, Таблицы элементов из седьмого издания (ноябрь 1902 г.). —В кн. Д. И. Менделеев. Периодический закон. М., 1958, отд. Добавления, с. 362—365 коммент. и прим. с. 684, 712 ( Доб. 7а ) библиогр. указания с. 735 ( Доб. А ), 745, № 37. (См. № 1503). См. также коммепт. в кн. Д. И. М-в. Периодич. закон. Дополнит, материалы. М., 1960, с. 515—516. ( К доб. 7а ) [c.189]
Менделеевское определение элемента носило теорети-ческш характер. Вместе с периодической системой оно обобщало всё предшествующее развитие химии-, им охватывались более чем полувековые работы химиков по изучению атомных весов, область учения о валентности и работы по определению состава солеобразных соединений пм охватывались попытки классифицировать химические элементы, открытия изоморфизма (сходство кристаллической формы веществ), изучение атомных объёмов и т. д. и т. д. Все эти исследования, обогащая представление об атомах, концентрировались, как в фокусе, в менделеевской системе, где они выступили теоретически обобщённо, обнаружив свою подчинённость единой закономерности. Менделеев был прав, говоря Таким образом периодическая законность прямо вытекла из запаса обобщений и проверенных сведений, существовавших к концу 60-х годов, она есть их свод в одно более или менее систематическое, цельное выражение . [c.153]
д. и т. д. Все эти исследования, обогащая представление об атомах, концентрировались, как в фокусе, в менделеевской системе, где они выступили теоретически обобщённо, обнаружив свою подчинённость единой закономерности. Менделеев был прав, говоря Таким образом периодическая законность прямо вытекла из запаса обобщений и проверенных сведений, существовавших к концу 60-х годов, она есть их свод в одно более или менее систематическое, цельное выражение . [c.153]
Ключом К определению предполагаемых свойств у не открытых еще элементов и к исправлению атомных весов, у известных уже элементов служил Менделееву все тот же признак места элемента в системе. Понимая под местом в системе совокупность отношений известного или ожидаемого элемента с его соседями по периодической системе (или — совокупность его атоманалогий ), Менделеев непосредственно отсюда выводил те свойства, которые закономерно, со строгой необходимостью вытекали из того факта, что данный элемент занял или должен был занять определенное место в периодической системе.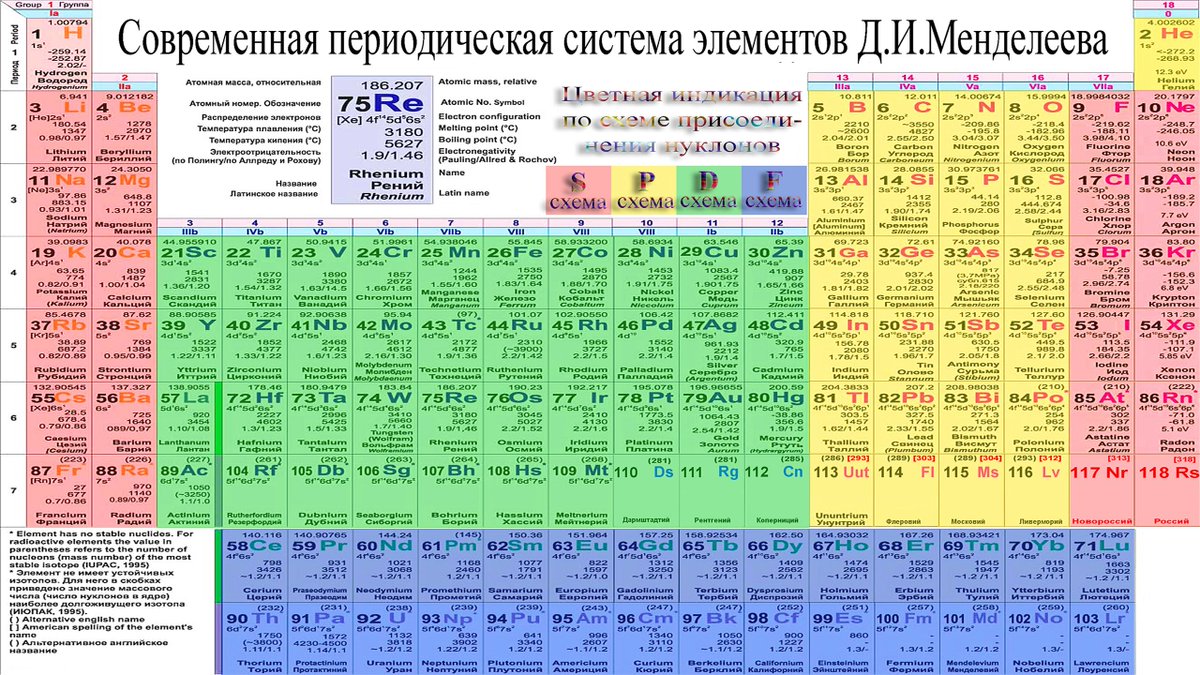 Тем самым свойства отдельного элемента с необходимостью вытекали из общего периодического закона и определялись (через место элемента в системе) этим общим законом природы. Позднее в статье под аналогичным заглавием Периодическая законность химических элементов (1898) Менделеев писал, что для неизвестных элементов, судя по их месту в системе, должно было ждать не только определенных атомных весов и данных окислов и др. соединений, но и совершенно ясно предвидимых свойств для множества их соединений. Свойства эти легко выводить на основании периодической законности для неизвестных элементов, если они (т. е. их места.— . К.) окружены уже известными [11, стр. 425] (курсив мой, как и в последующих цитатах из работ Менделеева.— Б. К.). [c.202]
Тем самым свойства отдельного элемента с необходимостью вытекали из общего периодического закона и определялись (через место элемента в системе) этим общим законом природы. Позднее в статье под аналогичным заглавием Периодическая законность химических элементов (1898) Менделеев писал, что для неизвестных элементов, судя по их месту в системе, должно было ждать не только определенных атомных весов и данных окислов и др. соединений, но и совершенно ясно предвидимых свойств для множества их соединений. Свойства эти легко выводить на основании периодической законности для неизвестных элементов, если они (т. е. их места.— . К.) окружены уже известными [11, стр. 425] (курсив мой, как и в последующих цитатах из работ Менделеева.— Б. К.). [c.202]
Открытие периодического закона и создание системы химически элементов имело огромное значение не только дл.ч химии, но и для всего естествознания в целом. Открытие Д. И. Менделеева обогатило человеческое знание одной из фундаментальных закономерностей природы. Оценивая значение открытия Д. И. Менделеева, Ф. Энгельс писал Менделеев, применив… закон о переходе количества в качество, совершил научный подвиг, который смело можно поставить рядом с открытием Леверье, вычислившего орбиту еще не известной планеты — Нептуна (Маркс К. и Энгельс Ф. Соч.— Т. 20.— С. 389). [c.22]
Оценивая значение открытия Д. И. Менделеева, Ф. Энгельс писал Менделеев, применив… закон о переходе количества в качество, совершил научный подвиг, который смело можно поставить рядом с открытием Леверье, вычислившего орбиту еще не известной планеты — Нептуна (Маркс К. и Энгельс Ф. Соч.— Т. 20.— С. 389). [c.22]
Эти открытия позволили еще глубже вскрыть диалектику в области атомов и химических элементов. Менделеев начал вскрывать эту диалектику, подорвав первую черту старых метафизических воззрений. Опираясь на периодический закон Менделеева, позднейшие физики и химики довели до конца дело, начатое Менделеевым. Основной закон радиоактивных превращений элементов ( правило сдвига ) был открыт после того, когда в 1913 г. физики прибегли к периодической системе Менделеева для объяснения определенной последовательности в смене продуктов радиоактивного распада в различных радиоактивных рядах ( семействах ). Точно так же самое понятие изотопы (что значит одинаковоместные ) было введено в том же 1913 г. , после того как было найдено, что химически одинаковые члены радиоактивных рядов попадают на одно и то же место менделеевской системы, несмотря на то, что они обладают различными атомными весами. [c.272]
, после того как было найдено, что химически одинаковые члены радиоактивных рядов попадают на одно и то же место менделеевской системы, несмотря на то, что они обладают различными атомными весами. [c.272]
Ясно что периодический закон Менделеев открыл, руководствуясь не однИ М только методом индукции. Он анализировал и обобщал прежние достижения физики и химии, исследовал попытки своих предшественников систематизировать химические элементы. Изучая старые классификации, Менделеев тут же синтезировал свои наблюдения, анализировал и синтезировал противоположные свойства химических элементов. Он различал химические элементы по их изменяющимся свойствам и одновременно синтезировал их в группы, разлагал общие групповые свойства и вскрывал закономерности изменения свойств. В периодической системе Менделеев дедуцировал свойства элементов из свойств предшествующих и последующих элементов как в ряду, так и в группе. Ни один из его предшественников не мог дойти до открытия периодического закона по той причине, что все они пользовались только индуктивным методом. Петтенкофер, Ленссен и другие ученые, основываясь на индукции, объединили элементы лишь в отдельные несвязные группы. Для Менделеева дедукция является не менее важным методом научного познания, чем индукция. Свой метод он противопоставлял одностороннему синтезу, не основанному на анализе. Он писал, что древние мыслители хотели сразу охватить самые основные категории изучения и потому не добились цели. Первоначальные обобщения, как показывает история науки, не опираются, говорил Менделеев, на точные данные, оттого они весьма шатки. [c.214]
Петтенкофер, Ленссен и другие ученые, основываясь на индукции, объединили элементы лишь в отдельные несвязные группы. Для Менделеева дедукция является не менее важным методом научного познания, чем индукция. Свой метод он противопоставлял одностороннему синтезу, не основанному на анализе. Он писал, что древние мыслители хотели сразу охватить самые основные категории изучения и потому не добились цели. Первоначальные обобщения, как показывает история науки, не опираются, говорил Менделеев, на точные данные, оттого они весьма шатки. [c.214]
Закон Менделеева оказался могучим орудием предвидения в области ядерных процессов. Опираясь на этот закон, удалось найти ключ к теоретическому пониманию ядерных процессов. Высказывания великого ученого о значении урана и тория и их места в периодической системе подтверждаются открытиями ядерных процессов. Между всеми известными химическими элементами уран выдается тем,— писал Менделеев,— что обладает наивысшим атомным весом. .. Этим обстоятельствам ныне, когда периодическая система элементов оправдывается е разнообразнейших сторон, мне кажется, должно приписать немалое значение для того интереса, который, очевидно, возрастает по отношению к урану, особенно с тех пор, как с ним оказались связанными два из важнейших — во множестве отношений — открытия физики и химии нашего времени, а именно открытие аргоновых элементов (особенно гелия) и радиоактивных веществ. Те и другие представляют своего рода неожиданность и крайность, какими-то, еще глубоко сокрытыми способами, связанные с крайностью в эволюции элементов самого урана. Наивысшая, из известных, концентрация массы весомого вещества в неделимую массу атома, существующая в уране, уже а priori должна влечь за собою выдающиеся особенности… Убежденный в том, что исследование урана, начиная с его природных источников, поведет еще ко многим новым открытиям, я смело рекомендую тем, кто ищет пред- [c.366]
.. Этим обстоятельствам ныне, когда периодическая система элементов оправдывается е разнообразнейших сторон, мне кажется, должно приписать немалое значение для того интереса, который, очевидно, возрастает по отношению к урану, особенно с тех пор, как с ним оказались связанными два из важнейших — во множестве отношений — открытия физики и химии нашего времени, а именно открытие аргоновых элементов (особенно гелия) и радиоактивных веществ. Те и другие представляют своего рода неожиданность и крайность, какими-то, еще глубоко сокрытыми способами, связанные с крайностью в эволюции элементов самого урана. Наивысшая, из известных, концентрация массы весомого вещества в неделимую массу атома, существующая в уране, уже а priori должна влечь за собою выдающиеся особенности… Убежденный в том, что исследование урана, начиная с его природных источников, поведет еще ко многим новым открытиям, я смело рекомендую тем, кто ищет пред- [c.366]
С этой целью Менделеев привлек представление о световом, или мировом, эфире, пытаясь с его помощью объяснить прежде всего радиоактивные явления. Трактуя мировой эфир как обычный, но очень легкий химический элемент, Менделеев пытается определить его место в периодической системе и тем самым связать понятие мирового эфира с периодическим законом. Этой попытке с ждево было стать лебединой песнью химико-механического взгляда на элементы. Под все нараставшими ударами, которые наносились новыми физическими открытиями, старая химико-механическая картина мира рушилась с неудержимой силой. На смену ей шла новая, по тем временам, электромагнитная картина мира и связанная с нею химико-электрическая трактовка химических элементов и их периодического закона. Эта картина оставалось господствующей в науке до исхода первой четверти XX в. и лишь во второй его четверти подверглась в свою очередь, коренной ломке благодаря созданию квантовой механики и развитию ядерной физики. При этом были восстановлены, но на новой основе, накоторые положения, которые Менделеев связывал с химико-механической трактовкой элементов, и прежде всего признание онре-деляющей роли массы как фундаментального свойства частиц материи.
Трактуя мировой эфир как обычный, но очень легкий химический элемент, Менделеев пытается определить его место в периодической системе и тем самым связать понятие мирового эфира с периодическим законом. Этой попытке с ждево было стать лебединой песнью химико-механического взгляда на элементы. Под все нараставшими ударами, которые наносились новыми физическими открытиями, старая химико-механическая картина мира рушилась с неудержимой силой. На смену ей шла новая, по тем временам, электромагнитная картина мира и связанная с нею химико-электрическая трактовка химических элементов и их периодического закона. Эта картина оставалось господствующей в науке до исхода первой четверти XX в. и лишь во второй его четверти подверглась в свою очередь, коренной ломке благодаря созданию квантовой механики и развитию ядерной физики. При этом были восстановлены, но на новой основе, накоторые положения, которые Менделеев связывал с химико-механической трактовкой элементов, и прежде всего признание онре-деляющей роли массы как фундаментального свойства частиц материи. Ныне это положение применяется в ядерной физике при характеристике атомных ядер и элементарных частиц. [c.539]
Ныне это положение применяется в ядерной физике при характеристике атомных ядер и элементарных частиц. [c.539]
Сегодня принято говорить о специфичности Периодического закона, об обособленности его от других законов природы, даже возвышении над ними Такое мнение ошибочно. Б. М. Кедров впервые указал на то, что Периодический закон вливается в более широкое явление природы — повторяемость в развитии, что отождествляется с повиточностью в спирали. Д. И. Менделеев, по объективным причинам, не мог подняться до такого уровня понимания системы. Он не располагал знаниями об истинных причинах противоречивого развития ряда химических элементов. В качестве непрерывной основы у него выступал атомный вес. Однако впоследствии оказалось, что он растет в естественном [c.151]
Ко времени опубликования периодической системы элементов было известно всего 5—6 редких земель окись и закись церия и окислы лантана, иттрия, эрбия и так называемого дидима. Лантан, эрбий и дидим были открыты Мосандером, выделившим их в 1839— 1842 гг.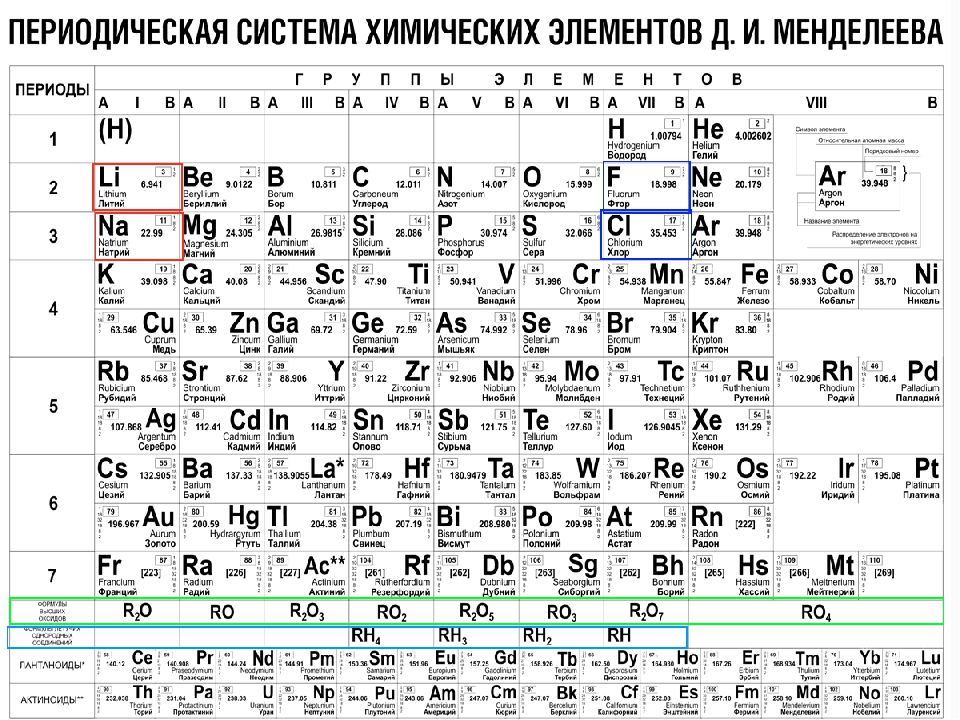 из окислов церия и иттрия. Все эти элементы были изучены очень мало. Без особых оснований, главным образом по сходству внешнего вида, всем им приписывалась формула НО, а высшему окислу церия—Сез04. Их атомные веса также были значительно занижены — раза в полтора против истинной величины. Редкие земли привлекли к себе внимание Менделеева прежде всего тем, что они не укладывались в периодический закон … при этой формуле основных окисей и при соответственных атомных весах этих металлов нет возможности поместить их в системе, не разрушая ее стройности …, говорит он в своей знаменитой статье Естественная система элементов и применение ее к указанию свойств некоторых элементов [6]. Но Д. И. Менделеев убежден в правильности периодической системы. Он неоднократно подчеркивает ее естественный характер и общность, позволяющую охватить с единой точки зрения все химические элементы. Наконец, ценность периодической системы заключается, по его мнению, в том, что до сих пор химия не обладала средством предугадывать существование новых, простых тел, [c.
из окислов церия и иттрия. Все эти элементы были изучены очень мало. Без особых оснований, главным образом по сходству внешнего вида, всем им приписывалась формула НО, а высшему окислу церия—Сез04. Их атомные веса также были значительно занижены — раза в полтора против истинной величины. Редкие земли привлекли к себе внимание Менделеева прежде всего тем, что они не укладывались в периодический закон … при этой формуле основных окисей и при соответственных атомных весах этих металлов нет возможности поместить их в системе, не разрушая ее стройности …, говорит он в своей знаменитой статье Естественная система элементов и применение ее к указанию свойств некоторых элементов [6]. Но Д. И. Менделеев убежден в правильности периодической системы. Он неоднократно подчеркивает ее естественный характер и общность, позволяющую охватить с единой точки зрения все химические элементы. Наконец, ценность периодической системы заключается, по его мнению, в том, что до сих пор химия не обладала средством предугадывать существование новых, простых тел, [c. 29]
29]
Открытие д. и. Менделеевым периодического закона обобщило химические знания, накопленные к середине XIX в., и обусловило бурное развитие многих областей химии. Химическая наука стала развиваться в новых направлениях, которые ранее не были возможны. В частности, открытие периодического закона поставило вопрос о полноте и пределах периодической системы, в результате чего внимание многих химиков было привлечено к исследованию элементов, замыкавших в то время таблицу. Сам Д. И. Менделеев придавал исключительное значение исследованию химии урана и призывал развивать работы в этой области. Примечательно, что именно исследования урана привели к обнаружению нового явления — радиоактивности и к рождению новой области науки — радиохимии. Несомненно, что открытие радиоактивности и последовавшее за ним бурное развитие радиохимии неразрывно связаны с той революцией в области химии, которую произвел периодический закон Д. И. Метгде-леева. [c.213]
Документ изменен: Mon May 24 09:53:26 2021. Размер: 142,227 bytes. Посещение N 10669 с 03.03.2008 |
About — Ptable
About — PtableКак мне процитировать это в моей библиографии?
APA
Дая, М. (1997, 1 октября). Периодическая таблица — Таблица .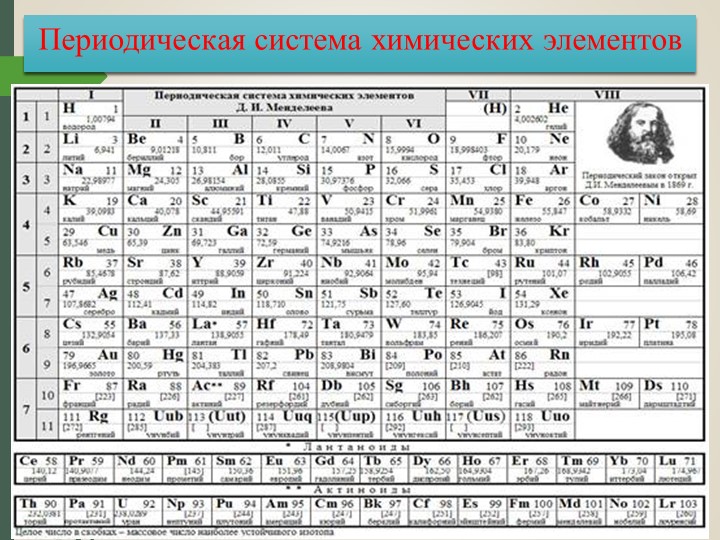 Таблица. https://ptable.com
Таблица. https://ptable.com MLA
Дая, Майкл. Периодическая таблица — Таблица . Ptable, 1 октября 1997 г., ptable.com. Доступ 25 декабря 2021 г.Чем отличается Ptable?
- Настоящее веб-приложение
- Многие другие периодические таблицы используют слово «интерактивные» для описания самих себя, не предлагая ничего, кроме ссылок на страницы с данными об элементах.Рецензии великолепны, и Ptable передает их тщательно отобранной и быстро пересматриваемой Википедии. Ptable сияет, когда используется как настоящее приложение, более интерактивное и динамичное, чем любое другое приложение. Продолжайте читать, чтобы узнать обо всех интересных вещах, которые вы можете делать с помощью Ptable, чтобы оживить творение Менделеева.
- Боковая панель или верхняя панель
- Если вы предпочитаете данные над таблицей, рядом с ней или предпочитаете видеть таблицу отдельно, Ptable поможет вам.Выберите кнопки верхней или боковой панели в правом верхнем углу или щелкните логотип Ptable, чтобы скрыть все свойства.
- Темный режим
- Глаза горят от того, что вы смотрите в свой ноутбук во время ночного домашнего задания? Щелкните значок темного режима в правом верхнем углу, чтобы немного облегчить себе жизнь в ночи.
- Устанавливаемое приложение для автономного использования
- Как на мобильном устройстве, так и на настольном компьютере, вы можете установить Ptable с помощью команды «добавить на рабочий стол» или на рабочем столе 🕀 справа в адресной строке.Вы сможете просматривать свойства, изотопы и смешивать соединения в автономном режиме.
- Читайте, просматривая
- Хотите узнать об элементах, просматривая таблицу? Окна записи могут быть оторваны или прикреплены к краям (в зависимости от настроек блокировщика всплывающих окон), чтобы можно было одновременно использовать таблицу во время чтения.
- Мгновенное изменение макетов
- Используйте флажки в верхней части страницы для динамического переключения между простым , с именами , с электронной конфигурацией и встроенными внутренними переходными металлами .
 Когда вы изменяете размер своего браузера, размер Ptable изменяется вместе с ним.
Когда вы изменяете размер своего браузера, размер Ptable изменяется вместе с ним.
- Страницы свойств
- Наведите указатель мыши на любой элемент на , мгновенно обновите свойства , а также увеличьте вид этого элемента с его электронной конфигурацией. При необходимости доступны единицы преобразования.
- Выберите данные
- Хотите увидеть электронные конфигурации для всех элементов одновременно? Любое выбранное свойство заменяет атомный вес для всех элементов в таблице.
- Визуализируйте тенденции
- Увеличивается или уменьшается атомный радиус с группой? Выберите его, и цвет всех элементов изменится пропорционально их значениям.
- Надежные исходные данные
- Данные получены из первоисточников и тщательно подобранных библиотек, таких как превосходная Wolfram | Alpha. Макет и представление были проверены ведущим в мире академиком Менделеева Эриком Шерри и соответствуют официальному макету, предложенному IUPAC, еще одним органом по стандартизации, с которым Ptable поддерживает новые стандартные атомные веса.
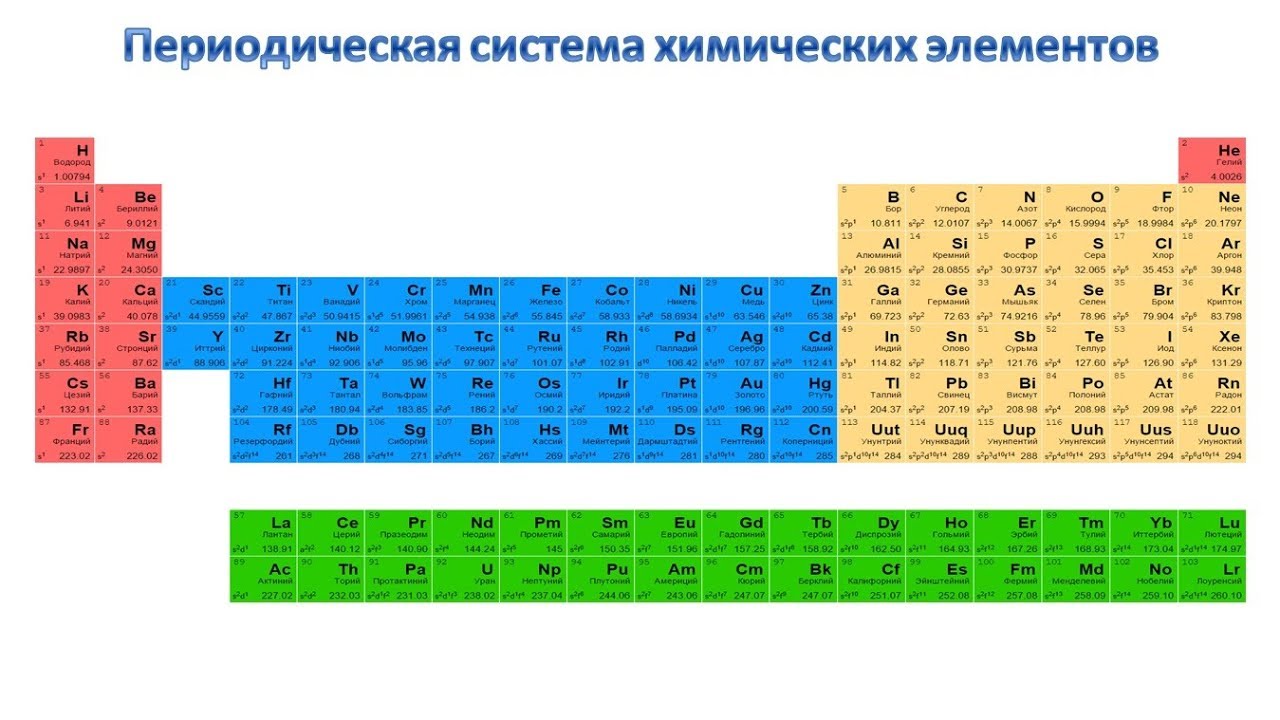 Значащие цифры сохраняются. в показаниях, когда позволяет место. Однако переводы и названия элементов, отличные от английского, следует считать не более надежными, чем Википедия.
Значащие цифры сохраняются. в показаниях, когда позволяет место. Однако переводы и названия элементов, отличные от английского, следует считать не более надежными, чем Википедия.
- Ползунок состояния вещества
- Перетащите ползунок над неметаллами и просмотрите состояние вещества каждого элемента при этой температуре.
- Машина времени
- Выберите год открытия, чтобы использовать ползунок для возврата во времени, и отобразит только элементы, обнаруженные к этому году.
- Подмножества свойств
- После выбора свойства в области ползунка отображаются связанные подмножества. После выбора радиуса доступны ковалентные, эмпирические, расчетные и ван-дер-ваальсовы радиусы. В целом, область ползунка демонстрирует еще 17 свойств в дополнение к показанным 15, не считая первых 30 энергий ионизации, что позволяет эффективно функционировать на нескольких уровнях и в нескольких измерениях.
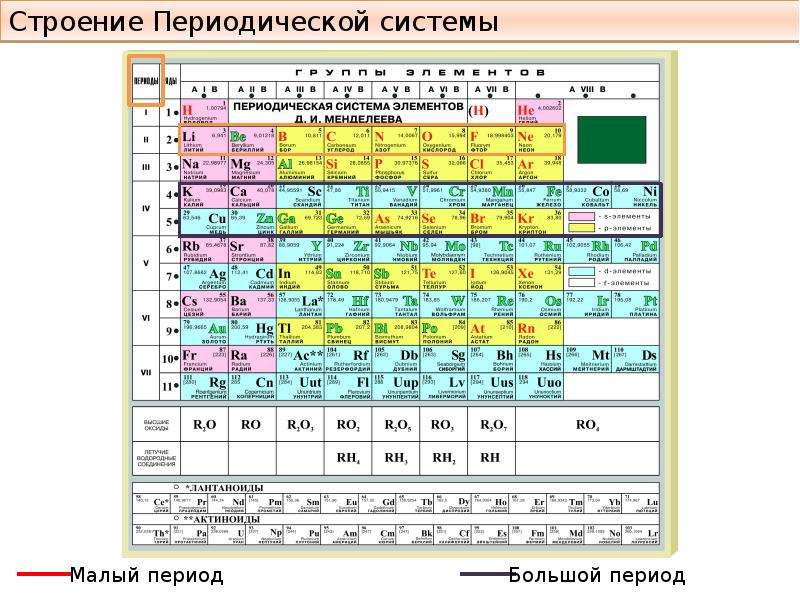
- Орбитали
- Полное считывание орбиталей для основного состояния каждого элемента, квантовых чисел, состояний окисления и диаграммы в соответствии с правилами Хунда .Наведите указатель мыши на каждую пару электронов, чтобы получить трехмерное изображение этой орбитали , которую вы можете перетащить, чтобы повернуть, или наведите указатель мыши на элемент, чтобы увидеть его самую высокую занятую атомную орбиталь.
- Изотопы
- Щелкните элемент в виде изотопов, чтобы наложить на выбранные или все известные изотопы . Наведите курсор на , пролистайте как колода карт , поскольку обновляются 12 свойств, включая период полураспада. Границы указывают на основной режим распада. Перетащите их, чтобы лучше расположить.
- Смешивание соединений
- Щелкните элементы на вкладке соединений, чтобы увидеть возможные соединения, которые они образуют, вместе со статьями Википедии, если они доступны.
 По мере того, как вы сужаете область поиска, другие элементы, которые не образуют соединения с выбранными вами элементами, будут тускнеть. Элементы, которые действительно объединяются, покажут количество потенциальных соединений в области их атомной массы. Цвета имитируют цвета стандартных моделей клюшек и мячей.
По мере того, как вы сужаете область поиска, другие элементы, которые не образуют соединения с выбранными вами элементами, будут тускнеть. Элементы, которые действительно объединяются, покажут количество потенциальных соединений в области их атомной массы. Цвета имитируют цвета стандартных моделей клюшек и мячей.
- Поиск соединения
- Введите номер CAS или название соединения, чтобы найти все подходящие соединения.Во время поиска элементы, не входящие в состав, будут тускнеть. Набрав
acidв поле поиска области ползунка, затемнятся все, кроме неметаллов. Глядя на числа в области атомной массы, мы можем видеть, что существует около 300-400 кислот, и большинство из них содержат водород, углерод и кислород.
- Поиск формулы
- Введите формулу в поле поиска области ползунка, чтобы найти все соединения, соответствующие этим элементам, независимо от порядка их ввода. Требуйте точную формулу, отрегулировав миниатюрные элементы в области ползунка или введя номера нижних индексов формулы.
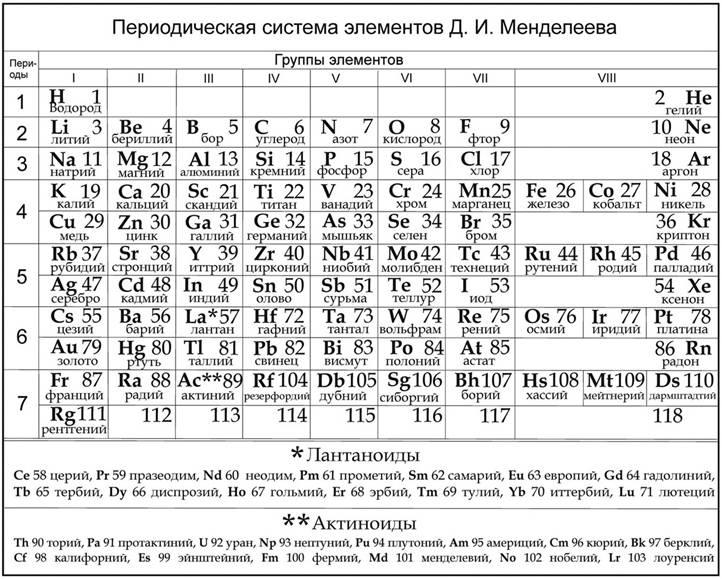
- Десятки языков
- Названия элементов на десятках языков. Если ваш браузер отправляет заголовок на совместимом языке, будет автоматически обслуживать сайт на том языке, который вы предпочитаете . Установите другой язык в раскрывающемся списке. Почему важно, чтобы периодическая таблица Менделеева была представлена на столь многих языках?
- Происхождение символа
- Почему свинец Pb и ртуть Hg? Выберите латинский перевод, чтобы увидеть происхождение символов элементов.
- Мгновенный поиск
- Не можете найти элемент? Введите его имя, символ или атомный номер в поле вверху справа, и мгновенно выделит . Вы даже можете выполнить расширенный поиск. Если ввести
~ 200на первой вкладке, будет найден элемент с атомным весом, ближайшим к 200. При поиске= 3в Орбиталях будут выделены все элементы со степенью окисления +3. Даже такие выражения, как> 1000или400-800, ограничивают результаты этими диапазонами для каждого свойства на каждой вкладке, включая разветвленные изотопы.
- Для мобильных устройств и планшетов
- Макеты для телефона и планшета позволяют просматривать на ходу как в портретной, так и в альбомной ориентации.
- Глубокие ссылки
- Хотите сохранить URL-адрес для определенной визуализации или отправить кому-нибудь ссылку на список просматриваемых вами результатов составного поиска? Просто отправьте им URL-адрес в адресной строке, и они увидят то, что вы видите.
- Версия для печати
- Распечатайте любой вид или визуализацию, которые вы можете увидеть.Таблица стилей печати позаботится об удалении постороннего беспорядка. Просто не забудьте распечатать фоновые цвета, выбрать альбомную ориентацию и минимизировать поля.
- Последние новые элементы
- В день открытия или синтеза нового элемента мы предоставим вам подробную информацию. Мы даже следим за новыми, более точными относительными атомными весами, поскольку IUPAC публикует их, и поддерживаем связь с известными учеными-химиками и органами по стандартизации относительно компоновки таблицы и категоризации элементов, которые намного более гибкие, чем вы можете себе представить.
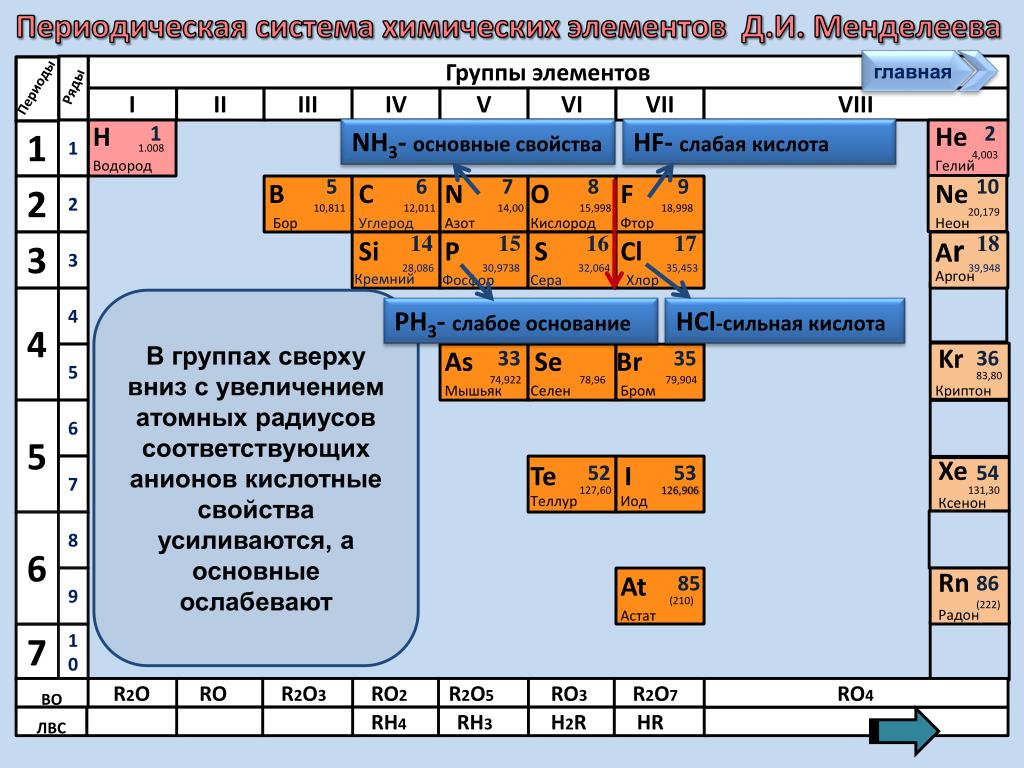
- Маленький и быстрый
- Созданный с нуля, чтобы быть чрезвычайно быстрым и эффективным, Ptable — это чистый JavaScript, созданный без фреймворков или библиотек. Сила других сайтов и их скорость по-прежнему основаны на мире, построенном на библиотеках. Из-за этого они никогда не будут такими мощными или быстрыми, как Ptable.
- Доступна клавиатура
- Не пользуетесь мышью? Клавиши вкладки и стрелки на клавиатуре открывают полную функциональность сайта .Enter и Escape открывают и закрывают окно Википедии, веерные изотопы или фиксируют элементы на месте, как и следовало ожидать.
- Гибкий интерфейс
- Если вы предпочитаете навести курсор мыши или щелкнуть мышью, чтобы просмотреть данные, сайт подойдет вам, предлагая интерфейс щелчка для блокировки на вкладках «Свойства» и «Электроны». При наведении указателя происходит доступ к большей части интерактивности до первого щелчка, который блокирует просматриваемый вами элемент на месте до тех пор, пока не будет щелкнуть другой или не будет щелкнуть тот же элемент еще раз, чтобы вернуться в режим наведения.
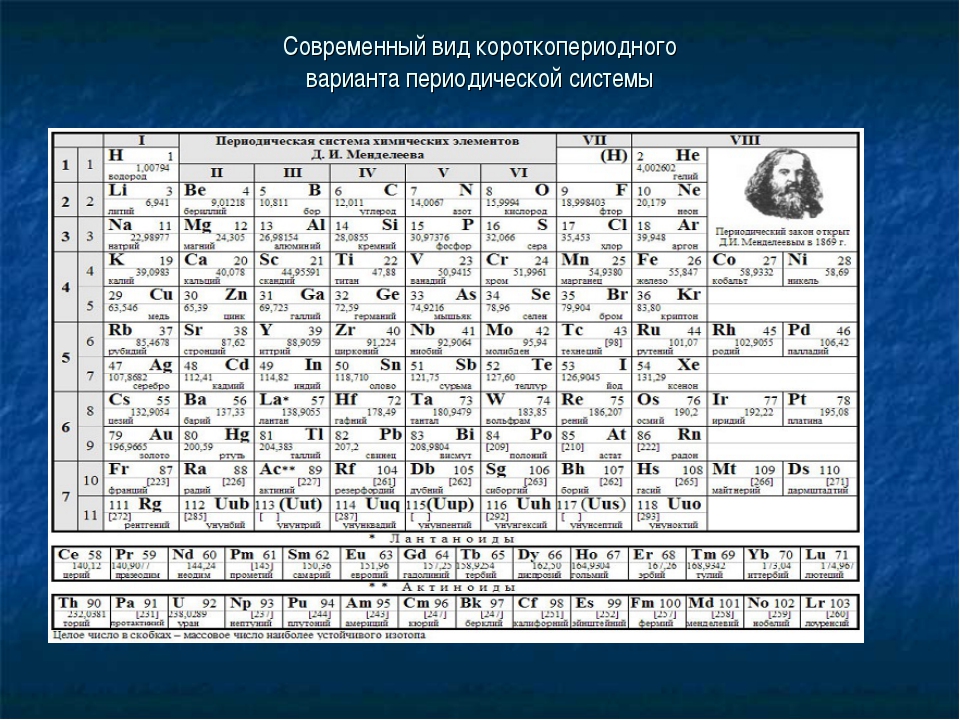 Наведение никогда не требуется для отображения данных или интерактивности; щелчки делают все, что важно для планшетов и интерактивных досок, таких как SMART Board.
Наведение никогда не требуется для отображения данных или интерактивности; щелчки делают все, что важно для планшетов и интерактивных досок, таких как SMART Board.
Можно купить плакат?
Да! Наш плакат с таблицей Менделеева доступен и разработан для удобочитаемости на расстоянии. Он отлично сочетается с нашими бесплатными распечатками и планами уроков.
Можно распечатать?
PDF-файл можно распространять в печатном виде без разрешения при условии, что он или все, что в него включено, не продано ни за какие деньги.Он также должен предлагаться в исходном виде без дополнительной или удаленной торговой марки. Свяжитесь со мной, если это неясно, или чтобы узнать о включении этого в публикуемые материалы. Скорее всего, я позволю вам использовать его, но запрошу копию того, во что он входит, но только если вы попросите.
Можно ссылку на него?
Пожалуйста, сделайте! Ссылки других людей сделали его достаточно популярным в поисковых системах, чтобы вы смогли его найти.
Могу ли я загрузить его на свой сайт?
Вы можете создать или встроить сайт во фрейм, используя (меняя высоту и ширину по желанию), но не сохраняет сайт или какую-либо его часть, а затем предлагает их другим через электронные средства , включая, помимо прочего, веб-сайт, компакт-диск , или флэш-накопитель. Хотя сама таблица Менделеева является общественным достоянием, авторское право на созданное мной веб-приложение и его дизайн принадлежат мне, а Ptable является охраняемым законом товарным знаком и защищен международным законом об авторском праве, действующим во всем мире.
Вторичный воспроизведение в образовательном контексте разрешено.Например, можно записать и аннотировать видео с сайта, чтобы проиллюстрировать периодические тенденции, а затем загрузить его на YouTube.
Я научился программировать много лет назад, просматривая исходники и видя, как создаются сайты. Если вам действительно интересно, как работает Ptable, свяжитесь со мной, и я предоставлю вам соответствующий не запутанный источник для изучения.
Когда это было сделано?
Ptable имеет богатую историю, уходящую корнями в сентябрь 1997 года, за год до основания Google.Он был представлен как часть обложки HTML и опубликован в Интернете 1 октября 1997 года. Простые описания элементов словаря были добавлены позже в декабре. Версия, использующая HTML 4 и CSS, была представлена в марте 1999 года (революционная в то время) и заменила исходную версию в сентябре 2004 года. В августе 2005 года произошла интеграция с Википедией и добавление других языков. Позже в сентябре было добавлено динамическое переключение макета. Первый макет, который не требовал прокрутки, был доступен только в октябре 2006 года.В течение лета 2007 года интерактивность была радикально усилена за счет свойств, электронов и изотопов, после чего в 2012 году были добавлены соединения. Карантин 2020 года был потрачен на полную реконструкцию, и улучшения продолжаются в наш нынешний период времени. Наслаждайтесь историческими версиями или просмотрите журнал последних изменений.
Этот веб-сервер хранит только стандартные журналы доступа. Они не передаются никаким организациям, и никакая личная информация не собирается. Google Analytics также отслеживает посещения и пользователей, а Bugsnag используется для отчетов об ошибках.Файлы cookie хранят настройки сайта, такие как макет и тема.
Пожертвования
Если вы не являетесь поклонником одного рекламного баннера, вы можете сделать пожертвование на Patreon или купить мне кофе. Также будет полезно, если вы купите плакат и оставите положительный отзыв. Хотите еще больше? Напишите мне письмо, в котором расскажите, что вам нравится или не нравится в Ptable, как он вам помог и что бы вы хотели добавить. Вы также можете отправить Ptable открытку. Вы даже можете получить в ответ что-нибудь забавное.
PtablePO Box 10002
Knoxville, TN
- Около
- Что нового
- Вопросы
- Продукты
- Плакат
- Планы уроков
- Убрать рекламу
- Редакции
- Таблица Менделеева
- Печать PDF
- Изображение
- Задействовать
- Discord
- Твиттер
- Контакт
Ptable — Changelog
8 сентября 2021 г.

Мобильный макет страницы выбора языка изображения.
Изотоп хрома 93 после завершения трехмерного преобразования.
23 июня 2021 г.
Добавьте изображения в карту сайта. Лучше данные DublinCore.
Канонические ссылки для подстраниц.
22 июня 2021 г.
Удалите бессмысленные идентификаторы конфигурации SVG.
Симпатичный список IP-адресов Discord, подключенных через CDN.
12 июня 2021 г.
Используйте определение для секретов, так что их отсутствие очевидно.
11 июня 2021 г.
Присоединяется отслеживание IP через Cloudflare или Discord.
7 июня 2021 г.
Ошибка вложения HTML.
4 июня 2021 г.
Обновленные переводы.
Надеюсь, ненужные свойства выравнивания.
Составная анимация для обновления данных.
символов Unicode в #Properties запускает обновление свойства при загрузке.
Обозначьте объявления так, чтобы они соответствовали допустимой рекламе.
Проверьте отсутствие статей в рабочем процессе сборки ZIM.
2 июня 2021 г.
Создавать журнал изменений из git при выпуске.
Меньше разрывов строк при сборке. Проверка цветных заголовков.
Диммер цвета. Измените размер блоков SVG, чтобы использовать схему rgba.
31 мая 2021 г.
Отсутствует подчеркивание в ссылке для записи крупным планом.
Исправлена проблема специфичности длительности анимации сияния.
Удалите исправление мерцания для Edge на основе Blink.
Разрыв с усилием на серийном ключе для русского языка.
Избегайте хрома 1111799 с min-width: 0.
Предварительно загрузите водород в крупную фигуру.
30 мая 2021 г.
Обновите узел package-lock.
Дождитесь перехода вместо setTimeout, чтобы сфокусировать поиск.
28 мая 2021 г.
Используйте localStorage вместо cookie для темы и макета.
27 мая 2021 г.
Уродливый mod_rewrite so / something? Lang = получает ошибку 404.
Изотопная нагрузка мигает в инвертированной цветовой анимации abbr.
Переход от вкладки к отключенному свойству изотопа не приводит к очистке цветов.
Синхронизировать нижние колонтитулы подстраницы с основным сайтом.
26 мая 2021 г.
Локализуйте дополнительный текст справки.Практически полный перевод на китайский язык.
ЗИМ раздельный для ж и ж-тв.
Используйте местное имя источника записи вместо веса.
Перестать отвечать на любой URL-адрес со строкой запроса lang.
Измените выходной каталог ZIM и предупредите о старых архивах.
Изменить срок действия записи, исправить 404, расширить поля.
Отдельные манифесты разработчика и продукта. Добавляйте скриншоты.
24 мая 2021 г.
Пустые свойства при закрытии обдуваемых изотопов.
Пустые свойства при закрытых веерных изотопах.
23 мая 2021 г.
Вернуть активную вкладку к LinkText до тех пор, пока цветовая схема не будет широко поддерживаться.
22 мая 2021 г.
Исправьте неправильные имена в Википедии для групп 15-17.
Темный режим для Википедии с правильным цветом рамки рамки.
Не показывать рекламу покупателям Microsoft Store.
Используйте переопределения цветовой схемы и стиля, чтобы сделать Википедию темной.
Связать состояния и сделать доступными как серию.
Ожидать обратного вызова в режиме ожидания перед статистикой.
21 мая 2021 г.
Дождитесь ожидания перед удалением скрытых позиций табуляции.
Рисуйте стрелки, только когда активна вкладка «Электроны».
Обновляйте ползунки так быстро, как позволяет rAF.
Измените широкую анимацию для ожидания rAF для каждого шага.
Обновление крупным планом и в сторону так быстро, как позволяет rAF.
Перетащите изотопную змейку так быстро, как позволяет rAF.
Разбейте изменение размера текста, ожидая rAF и rIC.
20 мая 2021 г.
Сгенерируйте файл карты сайта статически с помощью Bash.
Используйте requestAnimationFrame для ошибки изменения размера Chrome.
Обновите пакеты узлов.
Вспышать только текст справки, если он изменился.
Остановитесь на орбите на более низкой скорости и двигайтесь только по горизонтали.
19 мая 2021 г.
Отключите внешние ссылки для записи в полноэкранной интеграции.
Вспышка веса при изменении.
Используйте необязательное связывание свойств.
Старая версия: подавлять события Analytics.
Открыть все внешние ссылки iframe в новой вкладке.
Минимальная высота для OL вызвала мобильный CLS при заполнении.
Орбитальный одновременный рыскание / тангаж и меньший импульс при выпуске.
18 мая 2021 г.
Сообщайте Web Vitals в Google Analytics.
Проверьте заголовки типа содержимого и языка после сборки.
Старая версия. Отправлять 404 при неправильном запросе.
Используйте переменные Apache, чтобы упростить перенос DocRoot.
17 мая 2021 г.

Из-за конфликтов с /etc/mime.types .pt не отправляется как HTML.
Правильно отключите логарифмический выбор плавления / кипения.
Цветные электроны / Конфигурация электронов на орбитали с наивысшей энергией.
Новые орбитали с этикетками на роликах и осях.
Пользовательский синтаксический анализатор accept-language соответствует строгому только для zh.
16 мая 2021 г.
Карта ж-> ж-ханс и ж-тв-> ж-хант. Отправьте 404 при неправильном запросе.
Включить заголовок bash для сценариев оболочки.
Кэшировать SVG при установке. Нет начального блеска для снижения FID.
15 мая 2021 г.
Переведите текст справки о свойствах.
Цветная расширенная электронная конфигурация исключениями Madelung.
Надеюсь, что скрытое переполнение не делало ничего важного.
Используйте перекрестное происхождение, чтобы манифест в .dev не нуждался в исключении.
Обновите библиотеку PHP Patreon до версии 1.0.
AdSense поддерживает 4 новых языка.
Скрыть пароли. Перенести сервер на сборку. Надежная чистка кеша.
14 мая 2021 г.
Лучше удерживать нижний колонтитул, когда экран шире верхней панели.
Поддержка ptable.dev в потоке аутентификации Patreon.
Используйте CSS вместо JavaScript для настройки полноэкранной интеграции.
Добавить описания в список каталогов изображений.
13 мая 2021 г.
Плавное сворачивание рекламы в уведомление о блокировке рекламы.
Переключитесь на базовую аутентификацию, чтобы lighthouse мог посещать .dev по URL-адресу.
Уменьшить текст в скобках на изображении. Переместите изображение PHP в dev.
Сделайте Cloudflare worker модулем локального узла.
10 мая 2021 г.
Ошибка e.key undefined после нажатия на поле номера заказа?
Поиск на развернутой странице мобильных RTL-языков.
9 мая 2021 г.
Treeshaking удаляет код, зависящий от transitionend.
Попробуйте Simple Analytics, но загрузите всю статистику после загрузки.
Сделайте Bugsnag локальным модулем.Нет отдельной сборки узла d3.
7 мая 2021 г.
Пожертвуйте cookie SameSite и совместимость с ptable.dev.
Обработайте несколько ошибок с помощью catch.
6 мая 2021 г.
Обновите пакеты npm, включая d3, до 2.0.
Переименуйте каталог stage в dev.
Ошибка, если палитра цветов оставалась открытой во время возврата к Серии.
Отслеживание нулевой ошибки property_input.
5 мая 2021 г.
Более очевидное предупреждение об отключении свойства изотопа.
Замените серый вырез синим контуром для обозначения наведения и фокусировки.
Переместить нижний колонтитул раскрывающегося меню в нижнюю часть нового более узкого заголовка.
Таблица опиралась на имена, чтобы расширить ее до ширины на боковой панели. Очевидно в ж.
Определите встроенный баннер авторских прав JavaScript.
Старая версия: не индексировать. Не определяйте ориентацию. Используйте местную Википедию.
Создайте исходные карты и загрузите их в Bugsnag.
Переключатель верхней / боковой панели правильно округлен на языках RTL.
Удалите ручные brotli и трюки MIME с двойным расширением.
Значок глобуса для выбора языка.
1 мая 2021 г.
Переместите AdSense с отложенного заголовка на после загрузки.
30 апреля 2021 г.
Неопределенный язык переменной вызывает ошибку при установке.
Зарезервируйте 2/3 ширины стола под высоту на мобильном устройстве, чтобы уменьшить CLS.
29 апреля 2021 г.
Предварительно загрузите дополнительный модуль JS.
Электронная почта и все цветные значки ссылок являются внутренними ссылками.
Гонка между мной и AdSense JS за определение окна.adsbygoogle.
Для производства всегда запускайте PHP из каталога stage.
Импортировать дополнительно из необходимого. Загружайте трехмерные орбитали только после того, как нажмете вкладку «Электроны».
Сборка до стадии подготовки или производства.
Обновление зависимости подключаемого модуля накопительного баннера.
Отдельные файлы журналов для подготовки и производства.
Звоните домой только 10% времени. Откажитесь от блокировки домена.
Сократите время блокировки, не запустив перекомпоновку после измерения scrollWidth.
Добавить значок общего доступа. Уведомление об уменьшении закрытых объявлений.
Иконки нижнего колонтитула для Patreon, Etsy, ACS, вопросы, изображение.
Подготовьте промежуточную среду с паролем в ptable.dev.
28 апреля 2021 г.
Отправляйте наведения на ближайший LI, если они попадают на A.
Наследовать размер шрифта для формы номера заказа.
Не принудительно перезагружать новую доступную версию.
Откажитесь от ссылок без анти-шаблона «https:».
Другая максимальная высота для мобильных объявлений с сокращенным текстом рекламного блока.
Загрузить AdSense в голове с задержкой. Загрузите аналитику с помощью defer.
Загрузить дополнительный JS напрямую, а не после загрузки.
Нет выбора на ползунке. Ограничьте выбор отдельными элементами.
Увеличенный широкий значок. Приложение идеально подходит для размещения без рекламы и нижнего колонтитула.
26 апреля 2021 г.
Исправьте ошибки интеграции Patreon. Скрыть рекламу от плательщиков рулонов.
Удалите Plausible и попробуйте Cloudflare Analytics.
Вертикальное поле более узкое, чем горизонтальное, на логотипе Ptable для уменьшения заголовка.
В разделе «Изотопы» уточните количество и запись с помощью «единиц».
Локализация многих жестко запрограммированных строк.
Удалить стили из пользовательского интерфейса системных форм, так как они обрабатываются по цветовой схеме.
Использовать цветовую схему с темным режимом и передать ее окнам записи.
Замените —неважный цвет темы на CSS с именем color GrayText.
Вставить настоящие якоря для «Википедии», чтобы ссылки получали цвет по умолчанию.
Зависимости пакетов обновления.
18 апреля 2021 г.
Меньшая высота заголовка, но больший текст заголовка.
16 апреля 2021 г.
Замените активный цвет вкладки на LinkText. Контур рамки для вики, подчеркивание для перехода на страницу.
Очистка текста подстраницы.
5 апреля 2021 г.
Удалите ненужное выравнивание: концы и объясните, почему остались другие.
Точный интервал SVG нижнего колонтитула.
29 января 2021 г.
Ссылка на рисунке горит в темном режиме перед наведением курсора.
Используйте ссылки «Пряжа», чтобы узнать о пасхальных яйцах.
23 ноября 2020
Сначала конвертируйте единицы измерения в системе Mathematica.
20 ноября 2020
Преобразуйте значения Mathematica в единицы перед вставкой в базу данных.
Точное соответствие порядку плакатов. Значки нижнего колонтитула SVG. Контуры ссылок.
30 октября 2020 г.
Кнопка «Скрыть рекламу» показывает сообщение о блокировке рекламы.
27 октября 2020 г.
Верните рекламу. Собственный API для совместного использования.
15 сентября 2020
Предотвращение перехода к фокусируемым держателям стрелок, когда не на вкладке «Электроны».
Разобрать заглавные буквы и удалить пробел, чтобы применить к подмножеству.
Добавьте правдоподобную статистику, чтобы увидеть занижение данных в Google Analytics.
14 сентября 2020
Запретить Firefox переходить на http: //0.0.0.atomic при перетаскивании.
Верните .json в свойства. Всегда включайте строку запроса в канонический.
Рабочий Cloudflare читает accept-language на /, подзапросы? Lang, добавляет различные accept-language.
8 сентября 2020
Уменьшите размер и позвоните домой.
6 сентября 2020
Добавьте уровни энергии электронов к изображению SVG.
4 сентября 2020 г.
Создавайте изображения SVG для всех языков и перенаправляйте старые PNG.
3 сентября 2020 г.
На других вкладках сохраните последнюю зависшую орбиту и активируйте ее при переключении.
Если нет мин. / Макс. (Firefox
Позиционирование ключевой области по ширине без min / max ().
2 сентября 2020 г.
Организуйте orbital JS для совместной работы.
31 августа 2020
Иностранные переводы текста новой верстки.
При посещении lang = en кешируйте это вместо / и всегда запускайте PWA с? Lang =.
Используйте значок SVG везде, где это возможно.Добавить функции в about.
Переместить подгонку текста после того, как краска сохраняет сдвиг макета.
Defer Bugsnag. Должен по-прежнему загружаться перед скриптами модуля.
30 августа 2020
Кодировать URL-адреса хеша или средство проверки хеша не будут соответствовать им на других языках.
Сделайте отложенные стили встроенными и вкладку «Свойство по умолчанию», чтобы свести к минимуму Google CLS.
Запуск обновления ошибки режима письма в Chrome также при изменении высоты.
Некоторые браузеры поддерживают модули ES6, но не IntersectionObserver.
Состояние восстановления Firefox отправляет ввод до того, как установлен флажок?
Обработка ошибок 404 при поиске сложных гонок.Больше отчетов об ошибках.
Остановить ползунок +/- повторить, даже если покинул границу кнопки.
Отступ на верхней панели поврежден, смещение для источника анимации записи.
Используйте щелчки / табуляцию для изменения орбиты вместо наведения.
Ссылка для перенаправления с демонстрацией новой функции YouTube.
Изображения Google не могут видеть высоту и ширину, указанные в стиле SVG.
29 августа 2020
Используйте цвета CPK в варианте JMol на вкладке «Соединения».
Поддерживайте температуру жидкого гелия 0K с нулевым расплавлением. Удалите ненужный сцинот.
ResizeObserver все еще завис в цикле. Попробуйте отловить ошибку import ().
28 августа 2020
Отменить регистрацию сервис-воркера в домене www. URL-адрес свойств не соответствует кешу.
Перенаправить с www на не-www. Устранение проблемы CORS.
27 августа 2020
Удерживайте +/- для повторения нажатий на ползунки температуры и года.
Остановить вращение на новой орбите, так как производительность низкая. Раздавил на мобильном телефоне.
Зафиксируйте твердый гелий на 0K и синхронизируйте минимальные / максимальные пределы с состоянием на входе.
Добавить удельную активность в базу данных изотопов.
Вид по умолчанию для сломанных соединений и 404 для старых.
Прикрепите ResizeObserver к окну вместо легенды серии, чтобы избежать зацикливания.
Отключить режим записи Устранение ошибок Chrome застряло в цикле ResizeObserver.
Norsk имеет языковой стандарт, в котором первые две буквы отличаются от кода языка ISO.
Предотвратить перетаскивание изотопов, если выбрана запись.
Более тонкий вариант поиска на боковой панели и одинаковый размер шрифта в ключе свойств.
Если поиск соответствует и атомарному, и свойству, не показывать выбор.
Orbital теперь замедляется до полной остановки.
26 августа 2020
Некоторые браузеры модулей не поддерживают кеши или serviceWorker.
Переместить подстраницы в / новый, так как там старые ссылки. Замените изображение PNG на SVG.
Не удалось использовать Enter для добавления элемента в составной элемент.
Раса стилей может отображать вкладку соединения-приманки для изотопа.
Перемещение изображений из старого в новое.
25 августа 2020
Исправить ошибку хэша плохой вкладки. Указывайте старые на новые подстраницы.
Орбитальный масштаб нового размера.Скрыть рекламу, уведомление без текста.
Поиск предоставляет вариант «атомарный / свойство» только в случае неоднозначных результатов.
Периодическая таблица: это больше, чем просто химия и физика
Кредит: welcomia / shutterstock.com
Это Международный год Периодической таблицы Менделеева, и хотя меня (точно) обвиняли в том, что я фанат физики, я здесь, чтобы сказать вам, что эта знаменитая таблица касается не только физики, химии и других наук. .Это также касается математики, инженерии и даже ненаучных областей знаний, включая историю, географию и происхождение слов.
Во-первых, краткий обзор того, что такое таблица Менделеева. Это таблица всех химических строительных блоков вещества. На сегодняшний день люди наблюдали 118 как естественных, так и искусственно созданных. Каждый из этих строительных блоков, известных как атомные элементы, содержит положительно заряженное ядро (известное как ядро), которое (обычно) окружено облаком отрицательно заряженных частиц, называемых электронами.Если немного приблизить ядро, мы находим положительно заряженные частицы, известные как протоны, и нейтральные частицы, известные как нейтроны.
Единственная особенность, которая определяет атомный элемент, — это его атомный номер, то есть количество протонов в его ядре. Водород имеет один протон, поэтому его атомный номер равен 1, а уран имеет 92, поэтому его атомный номер… 92. Если имеется равное количество электронов и протонов, атом электрически нейтрален. Если электронов меньше или больше, чем протонов, атом электрически заряжен и известен как ион.
Официальная таблица Менделеева NIST.
Кредит: Н. Ганачек / NIST
У каждого атома может быть несколько различных версий, известных как изотопы, в которых в ядре разное количество нейтронов. Например, водород обычно имеет только один протон и не имеет нейтронов, но изотоп, известный как дейтерий или «тяжелый водород», также содержит один нейтрон.
Изотоп дейтерия помогает создавать более тяжелые элементы внутри звезд, делает некоторые лекарства более эффективными и может быть ключевым ингредиентом для получения чистой термоядерной энергии.Он был обнаружен в 1930-х годах в Национальном институте стандартов и технологий (NIST, тогда известный как Национальное бюро стандартов), где он был обнаружен Гарольдом Юри из Колумбийского университета, который получил Нобелевскую премию за свой подвиг.
(Увы, Фердинанд Брикведде из NIST не получил приза. Ничего страшного.)
Итак, вы уже можете видеть важность этого изотопа в астрономии, фармацевтике и энергетике. И все же, несмотря на его важность, это большая редкость по сравнению с обычным водородом, наиболее распространенным ингредиентом воды, большинства звезд и Вселенной в целом.Удивительно, как один элемент в таблице Менделеева содержится в таком количестве разных вещей в нашем мире.
В 1869 году русский химик Дмитрий Менделеев создал первую периодическую таблицу, расположив атомные элементы в столбцы и строки. Атомарные элементы в одних и тех же столбцах и строках имеют определенные общие свойства. Например, атомы в крайнем правом столбце, известные как благородные газы, могут сильно различаться по массе от легких (гелий) до тяжелых (например, радон), но их объединяет то, что они обычно не участвуют в химических реакциях. .
Гений Менделеева состоял в том, что он оставил места для элементов, которые еще не были открыты, и тем самым он предсказал их существование, например, галлий в 1875 году и германий в 1886 году. Как вы, возможно, догадались, последний был назван в честь Германии ( Родина первооткрывателя Клеменса Винклера). Что касается первого, Поль Эмиль Лекок де Буабодран назвал элемент «галлией» в честь Галлии, региона железного века, который включает современную Францию.
Итак, если вы любите историю, литературу и слова, периодическая таблица Менделеева для вас.Некоторые элементы названы в честь городов: Стронций происходит из шотландской деревни Стронтиан, где был обнаружен минерал, содержащий элемент. Некоторые взяли свои имена из мифологии. Элемент ванадий назван в честь норвежской богини Ванадис. Недавно открытые элементы, как правило, называются в честь реальных людей, таких как мейтнерий (австрийско-шведский физик Лизе Мейтнер была соавтором ядерного деления). Именование элементов после мест также было в тренде. Например, теннессин поступает из штата Теннесси, где находится Национальная лаборатория Ок-Ридж, которая выполнила ключевую работу по производству этого конкретного элемента.
Крупным планом — сфера из почти чистого кремния.
Кредит: NIST
Если вам нравится инженерное дело, таблица Менделеева — идеальное место для инноваций. Полупроводниковая промышленность использовала периодическую таблицу, чтобы выйти за рамки стандартных устройств на основе кремния. Инженеры-полупроводники использовали различные комбинации элементов из столбцов III и V периодической таблицы для создания новых полупроводниковых сплавов, таких как нитрид галлия (GaN) и нитрид индия (InN), каждый из которых имеет разные преимущества.Например, нитрид галлия может излучать свет с большим количеством длин волн, включая синий свет, используемый в экранах смартфонов. Нитрид индия может поглощать свет в более узком диапазоне длин волн, что делает его отличным кандидатом для солнечных элементов, поскольку он поглощает определенные длины волн света, наиболее распространенного от солнца.
И, конечно же, материаловедение. Инженеры любят комбинировать легкий металлический титан с другими элементами, такими как алюминий, для создания сплавов для самолетов и других транспортных средств.Сплавы магния и других элементов, таких как золото, находят применение в медицинских имплантатах для восстановления костей. Эти сплавы хороши тем, что они поддаются биологическому разложению, поэтому они исчезают после того, как послужили опорой для роста новых костей.
NIST’s Materials Genome Initiative — это современное воплощение духа периодической таблицы Менделеева, использующее вычислительные мощности, в том числе искусственный интеллект, для объединения элементов в новые материалы для желаемых приложений, таких как менее дорогие в производстве никелевые монеты и «Металлические стекла» для более прочных строительных материалов.
Точное хронометрирование может не быть чем-то, что вы ассоциируете с периодической таблицей, но исследователям NIST, создающим современные атомные часы, это может быть первое, что приходит на ум. С 1967 года вторые определялись атомными часами с использованием атомов цезия. Если на атомы цезия воздействовать микроволновым излучением с частотой 9 192 631 770 герц (циклов в секунду), они изменят квантовые энергетические состояния. Используя электронный детектор для измерения изменения состояния атомов, ученые NIST удерживают генерируемую частоту привязанной к атомному переходу, обеспечивая очень стабильный частотный выход.
Атомные часы позволяют нам точно разделить секунду на миллиардные доли и более. Точные измерения времени полезны для отметки времени финансовых транзакций, синхронизации обмена данными и данных, а также для навигации с использованием глобальной системы позиционирования (GPS). В последнее время исследователи NIST создают часы с другими атомами, такими как стронций, иттербий, ртуть и алюминий. Исследователи изменяют квантовые состояния этих атомов с помощью оптического излучения с частотами в сотни триллионов циклов в секунду (намного выше, чем микроволновое излучение, используемое в цезиевых часах).Эти «оптические часы» позволяют разделить секунды на еще более мелкие интервалы, что может быть полезно для таких вещей, как обнаружение подземных геологических отложений и даже темной материи.
Трехмерные (3-D) квантовые газовые атомные часы JILA состоят из световой сетки, образованной тремя парами лазерных лучей. Пакет из двух столов используется для настройки оптических компонентов вокруг вакуумной камеры. Здесь показан верхний стол, на котором устанавливаются линзы и другая оптика.Синий лазерный луч возбуждает кубическое облако атомов стронция, расположенное за круглым окном в центре стола. Атомы стронция сильно флуоресцируют при возбуждении синим светом.
Кредит: G.E. Марти / Джила
Если вы любите числа, ну, конечно, таблица Менделеева ими заполнена. Каждый атом в таблице имеет множество величин. Помимо атомного номера, есть атомный вес и энергия ионизации (количество энергии, необходимое для удаления электрона из этого атома).
Как мы получили такие точные числа? По мере того, как физики разрабатывали квантовую теорию, они производили высокоточные (и удивительно правильные) вычисления уровней энергии электронов в атомах. Среди прочего, химики определили, как расположение электронов в атомах влияет на химические реакции. Вся эта работа ученых была связана с современной математикой.
Однако после того, как ученые разработали основы, оставалось еще много работы для понимания свойств каждого из элементов.Кто причастен? Ученые-измерители, такие как люди, работающие в NIST.
Математик NIST Джим Симс объяснил мне: «Как люди« стандартов », мы те, кто собирает в мире экспериментальные и теоретические данные об атомных свойствах элементов и критически оценивает их, чтобы получить наилучшую оценку чисел в стол в любое время. Математика, безусловно, входит в этот анализ, и, что более важно, любое вычисление атомной структуры в значительной степени зависит как от математики, так и от вычислительной науки.”
Я спросил Джима, какие достижения в математике привели к созданию таблицы Менделеева, которую мы знаем сегодня. «Скорее, чем какой-либо конкретный пример, — сказал он, — все, что я могу придумать, — это тот факт, что современная физика, химия и математика тесно взаимосвязаны».
И я сделаю еще один шаг, сказав, что очень много других областей взаимосвязаны в периодической таблице. Одна небольшая таблица — это одновременно источник знаний и плацдарм для творчества во многих областях. Это гораздо больше, чем просто плакат на уроке химии в старшей школе; это план на будущее.
Печатную версию официальной таблицы Менделеева NIST можно скачать здесь.
См. Видеоролики NIST и другие ресурсы по Международному году Периодической таблицы элементов здесь.
Пришло время перевернуть таблицу Менделеева?
Лотар Мейер, немецкий химик, создал частичную периодическую таблицу в 1864 году, а более полную версию — в 1869 году. «Структурно таблицы Мейера и Менделеева были очень похожи, — сказал Алан Рок, историк науки из Университета Кейс Вестерн Резерв. выступивший с докладом о Мейере в музее А.Юбилейный симпозиум C.S.
Изначально периодичность таблицы и ее замечательные предсказательные способности казались «нумерологической загадкой», — сказал доктор Рок. В 20 веке периодичность стала объяснять квантовая физика — в частности, физика того, как электроны вращаются вокруг ядра. Литий, натрий и калий, которые хорошо совпадают в первом вертикальном столбце таблицы — группа первая, щелочные металлы, рубидий, цезий и франций — все имеют по одному электрону во внешней электронной оболочке.
Оба химика за многие годы построили множество таблиц, изменяя их в ответ на новые открытия и более точные данные. В конце концов Менделеев победил. Когда в шаблонах его таблиц появлялись пробелы, он предсказывал, что должно появиться. Некоторые ошибались, но он точно предсказал существование трех элементов: галлия, германия и скандия.
«Предсказание психологически драматично, — сказал доктор Шерри. «Если ученый что-то предсказывает, и это сбывается, в некотором смысле этот ученый знает секреты природы или почти знает будущее.
Но наука редко развивается революционным путем, сказал доктор Скерри: «Наука — это деятельность, осуществляемая сотнями тысяч исследователей, и все они вносят свой вклад в общую картину, которая в конечном итоге вырисовывается».
Это была тема юбилейного симпозиума. Бриджит Ван Тиггелен, историк химии из Института истории науки в Филадельфии, обсудила работу Иды Ноддак, немецкого химика, открывшего рений, и Лизы Мейтнер, австрийско-шведского физика, которая вместе с Отто Ганом открыла протактиний.Доктор Ван Тиггелен — редактор новой книги «Женщины в их стихии», в которой исследуется более 30 подобных историй, включая, конечно же, историю Марии Кюри, которая открыла два элемента, радий и полоний, и дважды выиграла приз. Нобелевская премия.
«Мы представляем историю как коммунальное предприятие», — сказал д-р Ван Тиггелен.
So long, alchemy
Среди множества достижений периодическая таблица Менделеева позволила химии, наконец, избавиться от привкуса алхимии. В этом отношении Ньютон мало помог: он был одержим «химией» — синонимом алхимии, согласно Оксфордскому словарю английского языка — и поиском философского камня, который мог бы преобразовывать неблагородные металлы в золото.
Краткая история периодической таблицы
Периодическая таблица элементов часто встречается в классах, коридорах кампуса и библиотеках, но это больше, чем табличная организация чистых веществ. Ученые могут использовать эту таблицу для анализа реакционной способности элементов, прогнозирования химических реакций, понимания тенденций изменения периодических свойств различных элементов и размышлений о свойствах тех, которые еще предстоит открыть.
В современной таблице Менделеева элементы упорядочены по атомным номерам и периодическим свойствам.Несколько ученых работали более века, чтобы собрать элементы в этот формат.
Викимедиа
Среди ученых, которые работали над созданием таблицы элементов, были Антуан Лавуазье, Иоганн Вольфанг Доберейнер, Джон Ньюлендс и Генри Мозли (слева направо).
В 1789 году французский химик Антуан Лавуазье попытался сгруппировать элементы как металлы и неметаллы. Сорок лет спустя немецкий физик Иоганн Вольфанг Дёберейнер обнаружил сходство физических и химических свойств некоторых элементов.Он расположил их в группы по три в порядке возрастания атомного веса и назвал их триадами, заметив, что некоторые свойства среднего элемента, такие как атомный вес и плотность, приблизительно соответствуют среднему значению этих свойств в двух других в каждой триаде.
Прорыв произошел с публикацией пересмотренного списка элементов и их атомных масс на первой международной конференции по химии в Карлсруэ, Германия, в 1860 году. Они пришли к выводу, что водороду будет присвоен атомный вес 1, а атомный вес другого элементы будут определены путем сравнения с водородом.Например, углерод, который в 12 раз тяжелее водорода, будет иметь атомную массу 12.
Дмитрий Менделеев
Лотар Мейер
Британский химик Джон Ньюлендс был первым, кто организовал элементы в периодическую таблицу с возрастанием атомных масс. Он обнаружил, что каждые восемь элементов обладают схожими свойствами, и назвал это законом октав. Он расположил элементы в восьми группах, но не оставил пробелов для неоткрытых элементов.
В 1869 году русский химик Дмитрий Менделеев создал структуру, которая стала современной периодической таблицей, оставив пробелы для элементов, которые еще не были обнаружены.Располагая элементы в соответствии с их атомным весом, если он обнаруживал, что они не вписываются в группу, он переставлял их. Менделеев предсказал свойства некоторых неоткрытых элементов и дал им такие названия, как «эка-алюминий» для элемента со свойствами, подобными алюминию. Позже эка-алюминий был открыт как галлий. Некоторые несоответствия остались; положение некоторых элементов, таких как йод и теллур, не могло быть объяснено.
Немецкий химик Лотар Мейер создал версию таблицы Менделеева, аналогичную таблице Менделеева в 1870 году.Он оставил пробелы для неоткрытых элементов, но так и не предсказал их свойства. Лондонское королевское общество наградило медалью Дэви в 1882 году Менделееву и Мейеру. Позднее открытие элементов, предсказанных Менделеевым, включая галлий (1875 г.), скандий (1879 г.) и германий (1886 г.), подтвердило его предсказания, и его периодическая таблица получила всеобщее признание. В 1955 году в его честь 101-й элемент был назван менделевием.
Викимедиа
Периодическая таблица Менделеева 1869 года на русском языке с названием, которое переводится как «Эксперимент над системой элементов… на основании их атомного веса и химического сходства «.
Представления о субатомных частицах не существовало в 19, , годах. В 1913 году английский физик Генри Мозли использовал рентгеновские лучи для измерения длин волн элементов и сопоставил эти измерения с их атомными номерами. Затем он переставил элементы в периодической таблице на основе атомных номеров. Это помогло объяснить различия в более ранних версиях, в которых использовались атомные массы.
В периодической таблице горизонтальные ряды называются периодами, причем металлы находятся в крайнем левом углу, а неметаллы — в правом.Вертикальные столбцы, называемые группами, состоят из элементов со схожими химическими свойствами. Таблица Менделеева предоставляет информацию об атомной структуре элементов и химическом сходстве или различии между ними. Ученые используют стол для изучения химических веществ и разработки экспериментов. Он используется для разработки химикатов, используемых в фармацевтической и косметической промышленности, и батарей, используемых в технологических устройствах.
ЮНЕСКО объявила 2019 год Международным годом Периодической таблицы Менделеева в ознаменование 150-летия -й -й годовщины публикации Менделеева.Исследователи и учителя со всего мира воспользовались этой возможностью, чтобы поразмышлять о важности периодической таблицы Менделеева и распространить информацию о ней в классах и за ее пределами. Семинары и конференции побуждали людей использовать знания периодической таблицы для решения проблем в области здравоохранения, технологий, сельского хозяйства, окружающей среды и образования. Издательства организовывали ежемесячные мероприятия, такие как конкурсы викторин, подкасты, разделы с личными историями и туры по отраслевым сайтам. Эти инициативы продемонстрировали, как элементы являются неотъемлемой частью нашей повседневной жизни: лекарства, пестициды и литиевые батареи.
На своем веб-сайте, посвященном празднованию этого праздника, ЮНЕСКО написала: «Периодическая таблица химических элементов — это больше, чем просто справочник или каталог всех известных атомов во Вселенной; по сути, это окно во вселенную, помогающее расширить наше понимание мира вокруг нас ».
Периодическая таблица элементов и химия
Ключ периодической таблицы
X | X | X | X | Щелочные металлы | Щелочноземельные металлы | Переходные металлы | Прочие металлы | Металлоиды | Прочие неметаллы | Галогены | Благородные газы | Лантаноиды |
Периодическая таблица
«Если все элементы расположены в порядке их атомного веса, получается периодическое повторение свойств.Это выражается законом периодичности ».Дмитрий Менделеев, Основы химии, Vol. 2, 1902, П. Ф. Кольер, стр. 17. «У нас есть доказательство того, что в атоме есть фундаментальная величина, которая постепенно увеличивается при переходе от одного элемента к другому. Эта величина может быть только зарядом центрального положительного ядра, существование которого у нас уже есть определенное доказательство ».
Генри Мозли, Philosophical Magazine, Vol. 26, 1913, стр. 1030. «Химический состав атома зависит только от количества электронов, которое равно количеству протонов и называется атомным номером.Химия — это просто числа, идея, которая понравилась бы Пифагору. Если вы атом с одним протоном, вы водород; два, гелий; ….. »
Карл Саган, Космос, 1980, Рэндом Хаус, стр. 223. Фото: НАСА.
Автор: Дуг Стюарт
Периодическая таблица, которую мы используем сегодня, основана на таблице, разработанной и опубликованной Дмитрием Менделеевым в 1869 году.
Менделеев обнаружил, что может расположить 65 элементов, известных на тот момент, в сетке или таблице так, чтобы каждый элемент имел:
1.Атомный вес выше, чем у того, что слева. Например, магний (атомный вес 24,3) помещен справа от натрия (атомный вес 23,0):
Истинная основа Периодической таблицы
В 1913 году химия и физика были перевернуты вверх ногами. Некоторые крупные нападающие, в том числе Менделеев, серьезно говорили об элементах легче водорода и элементах между водородом и гелием. Визуализация атома была общедоступной, и оправдание Менделеева периодической таблицы, основанной на атомных весах, разваливалось по швам.
Это история о том, как Генри Мозли принес свет во тьму.
2. Подобные химические свойства с другими элементами в том же столбце — другими словами, аналогичные химические реакции. Магний, например, помещается в колонку щелочноземельных металлов вместе с другими элементами, чьи реакции аналогичны:
Менделеев понял, что стол перед ним лежит в самом сердце химии. Более того, Менделеев увидел, что его таблица неполная — были места, где должны были быть элементы, но их никто не обнаружил.
Точно так же, как можно сказать, что Адамс и Леверье открыли планету Нептун на бумаге, Менделеев можно было сказать, что он открыл германий на бумаге. Он назвал этот новый элемент eka-Silicon , после наблюдения зазора в периодической таблице между кремнием и оловом:
Точно так же Менделеев открыл галлий ( эка -алюминий) и скандий ( эка -бор) на бумаге, потому что он предсказал их существование и их свойства еще до их фактических открытий.
Изображение периодической таблицы
Щелкните изображение, чтобы увеличить
Хотя Менделеев совершил решающий прорыв, он почти не продвинулся дальше. Оглядываясь назад, мы знаем, что периодическая таблица Менделеева была основана на ложных рассуждениях. Менделеев ошибочно полагал, что химические свойства определяются атомным весом. Конечно, это было совершенно разумно, если принять во внимание научное знание 1869 года.
В 1869 году сам электрон не был открыт — этого не происходило еще 27 лет.
Фактически, потребовалось всего 44 года, чтобы найти правильное объяснение закономерностей в периодической таблице Менделеева …
Подробнее … Продолжение таблицы Менделеева
Периодическая таблица — New World Encyclopedia
Периодическая таблица химических элементов представляет собой табличное отображение химических элементов. Возможно, это , символ химии , который многое говорит о физических и химических свойствах известных элементов.Появление таблицы Менделеева произошло одновременно с развитием научного понимания состава вещества. В своем нынешнем виде он во многом обязан квантовой механике. Электронные структуры, полученные из квантовой механики, используются для теоретического объяснения экспериментально наблюдаемых периодических изменений свойств элементов. Таблица Менделеева — один из важнейших компонентов нашего понимания Вселенной и лежит в основе всей химии.
История
- Основная статья: История периодической таблицы
Исходная таблица была создана без знания внутренней структуры атомов, а путем сопоставления физических и химических свойств элементов с атомной массой.Если элементы упорядочены по атомной массе, то можно наблюдать определенную периодичность или регулярное повторение физических и химических свойств. Первым, кто распознал эти закономерности, был немецкий химик Иоганн Вольфганг Дёберейнер, который в 1829 году заметил ряд триад подобных элементов:
| Элемент | Молярная масса (г / моль) | Плотность (г / см³) | Коэффициент (см³ / моль) |
|---|---|---|---|
| хлор | 35.4527 | 0,003214 | 11030 |
| бром | 79,904 | 3,122 | 25,6 |
| йод | 126. | 4,93 | 25,7 |
| кальций | 40.078 | 1,54 | 26,0 |
| стронций | 87,62 | 2,64 | 33,2 |
| барий | 137.327 | 3,594 | 38,2 |
За этим последовал английский химик Джон Ньюлендс, который в 1865 году заметил, что элементы подобного типа повторяются с интервалом в восемь, что он сравнивал с октавами музыки, хотя его закон октав высмеивал. его современники. Наконец, в 1869 году немец Юлиус Лотар Мейер и русский профессор химии Дмитрий Иванович Менделеев почти одновременно разработали первую таблицу Менделеева, упорядочив элементы по массе.Однако Менделеев построил несколько элементов из строгой массовой последовательности, чтобы лучше соответствовать свойствам их соседей в таблице. Он также исправил ошибки в значениях нескольких атомных масс и предсказал существование и свойства нескольких новых элементов в пустых ячейках своей таблицы. Позже Менделеев был подтвержден открытием электронной структуры элементов в конце девятнадцатого и начале двадцатого веков. Современный стол основан на таком понимании электронных структур.
В 1913 году Генри Мозли изменил таблицу в соответствии с атомным номером, чтобы улучшить наблюдаемую периодичность химических свойств по всей таблице. В сегодняшней таблице используется этот порядок по атомному номеру (числу протонов). Разработка Менделеевым и Мозли периодической таблицы Менделеева была одним из величайших достижений современной химии. Химики смогли качественно объяснить поведение элементов и предсказать существование еще неоткрытых.
В 1940-х годах Гленн Т.Сиборг идентифицировал трансурановые лантаноиды и актиниды, которые могут быть помещены в таблицу или ниже (см. Различные возможные варианты расположения ниже).
Методы отображения таблицы Менделеева
Стандартная таблица Менделеева
Состояние при стандартной температуре и давлении
- Элементы с красной нумерацией — газы.
- Элементы, обозначенные зеленым цветом, являются жидкостями.
- Элементы, пронумерованные черным цветом, являются сплошными.
Естественное происхождение
Элементы без границ еще не обнаружены / синтезированы.
Элементы с пунктирными границами не встречаются в природе (синтетические элементы).
Элементы с пунктирными границами возникают естественным образом в результате распада других химических элементов.
- Элементы с твердыми границами старше Земли (первоэлементы).
- Примечание: Хотя калифорний (Cf, 98) не является исконным для Земли, он (и продукты его распада) действительно возникает естественным образом: его электромагнитное излучение регулярно наблюдается в спектрах сверхновых.
Другие изображения
- Стандартная таблица (показанная выше) дает основную информацию.
- Вертикальная таблица для удобства чтения в веб-браузерах.
- В большой таблице приведены основные сведения, а также полные имена элементов и атомные массы.
- Таблица со встроенным F-блоком возвращает лантаноиды и актиниды в таблицу.
- Электронные конфигурации
- Металлы и неметаллы
- Периодическая таблица, заполненная блоками
- Список элементов с указанием атомного номера и атомной массы
- Список элементов по электроотрицательности
- Таблица Менделеева
Структура таблицы
Каждый элемент появляется в поле, которое содержит символ элемента и его атомный номер.Многие таблицы также включают атомную массу, а некоторые также содержат дополнительную информацию. Фундаментальный порядок элементов — это список в соответствии с их атомным номером (числом протонов). По состоянию на 2005 год в таблице содержится 116 химических элементов, открытия которых подтвердились. Из них 94 естественным образом обнаружены на Земле, а остальные — синтетические элементы, искусственно созданные в лабораториях. Следуя этому базовому порядку, элементы расположены в таблице, содержащей определенные столбцы и строки, известные как группы и периоды соответственно (см. Таблицу выше).
Группы
Столбцы таблицы известны как групп или семейств . Все элементы в группе имеют похожие свойства. Размещение элементов в группах — один из наиболее важных способов их классификации. В пределах группы есть некоторые различия в свойствах, но изменения относительно невелики по мере того, как один из них идет вниз (или вверх) по группе. Каждая группа элементов образует так называемую химическую серию .
Существует три способа нумерации групп таблицы Менделеева.Стандартная система Международного союза теоретической и прикладной химии (IUPAC) состоит в том, чтобы просто пронумеровать их от 1 до 18, как в таблице выше. Есть также две старые системы, использующие римские цифры. Римские числовые названия — это оригинальные традиционные названия групп; стандартная система IUPAC заменяет старые имена в попытке уменьшить путаницу, создаваемую двумя старыми, но взаимно сбивающими с толку схемами. У некоторых групп есть особые названия (см. Ниже). Группы 1, 2, 13, 14, 15, 16, 17 и 18 также известны как основная группа или репрезентативные элементы, а группы с 3 по 12 являются переходными металлами.
Существует значительная путаница вокруг двух старых используемых систем (старый IUPAC и CAS), в которых римские цифры сочетаются с буквами. В старой системе IUPAC буквы A и B обозначались слева (A) и справа (B) от таблицы, в то время как в системе CAS буквы A и B обозначали элементы основной группы (A) и переходные металлы. (В). Первая система часто использовалась в Европе, а вторая — в Америке. Новая схема ИЮПАК была разработана для замены обеих систем, поскольку в них использовались одни и те же имена для обозначения разных вещей.
Группы периодической таблицы следующие (в скобках показаны старые системы: европейская и американская):
- Группа 1 (IA, IA): щелочные металлы
- Группа 2 (IIA, IIA): щелочноземельные металлы
- Группа 3 (IIIA, IIIB)
- Группа 4 (IVA, IVB)
- Группа 5 (ВА, ВБ)
- Группа 6 (VIA, VIB)
- Группа 7 (VIIA, VIIB)
- Группа 8 (VIII)
- Группа 9 (VIII)
- Группа 10 (VIII)
- Группа 11 (IB, IB): чеканные металлы (название не рекомендовано ИЮПАК)
- Группа 12 (IIB, IIB)
- Группа 13 (IIIB, IIIA): группа бора
- Группа 14 (IVB, IVA): углеродная группа
- Группа 15 (VB, VA): пниктогены (название не рекомендовано IUPAC) или группа азота.
- Группа 16 (VIB, VIA): халькогены
- Группа 17 (VIIB, VIIA): галогены
- Группа 18 (Группа 0): благородные газы
Периоды
Строки таблицы называются точками.Именно в последовательных периодах мы наблюдаем периодичность свойств элементов. Каждый период имеет полный набор свойств. Например, больше металлических элементов встречается слева от периода, а меньше металлических элементов — справа; или оксиды элементов слева являются основными, а для элементов справа — кислотными. Периоды просто нумеруются от 1 до 7 сверху вниз.
Электронная структура
Форма периодической таблицы и размещение элемента в определенной группе или периоде определяется электронной структурой атомов элемента.Фактически, химические и физические свойства элемента зависят от его электронной структуры. Таким образом, именно электронные структуры элементов являются источником наблюдаемой периодичности свойств, а также групп и периодов периодической таблицы.
Электронные структуры элементов происходят из квантовой механики. Квантово-механическое описание атома предполагает, что электроны имеют сложную, но точную организацию, окружающую атомное ядро. Электроны организованы в основном в оболочек увеличивающегося размера и энергии, которые нумеруются последовательно, начиная с 1 как с наименьшей энергией.Оболочки содержат подоболочек , которые могут быть представлены буквами. Наиболее распространенными подоболочками являются s , p и d . Подоболочки, в свою очередь, состоят из орбиталей , где каждая орбиталь может содержать два электрона.
Особое значение имеют электроны в самой высокоэнергетической (самой внешней) оболочке. Это электроны, которые определяют положение элемента в таблице и в первую очередь отвечают за свойства элемента.В элементах основной группы эти внешние электроны известны как валентные электроны. Все элементы в данной группе имеют одинаковое количество валентных электронов, но по мере того, как вы спускаетесь по группе, они располагаются в последовательно более высоких оболочках. Это то, что придает элементам в группе схожие свойства. Например, все элементы основной группы с четырьмя валентными электронами входят в группу 14, начиная с углерода. Все они имеют валентные электроны в s- и p-подоболочках. Эти четыре s- и p-электрона будут вести себя одинаково независимо от оболочки, в которой они находятся.
В дополнение к разделению таблицы на группы и периоды, таблица может быть разделена на блоки (см. Периодическая таблица, заполненная блоками), где последняя подоболочка, в которой находятся внешние электроны атома, определяет «блок», которому он принадлежит. Углерод, например, находится в p-блоке, потому что его последние электроны находятся в p-подоболочке.
Общее количество электронных оболочек атома определяет период, которому он принадлежит. Поскольку каждая оболочка разделена на разные подоболочки, по мере того, как мы перебираем элементы по атомному номеру, подоболочки будут заполняться электронами примерно в порядке, показанном в таблице ниже (в таблице числа относятся к оболочке, а буквы — к подоболочке. ):
| Корпус: | S | G | F | D | P |
| Период | |||||
| 1 | 1 с | ||||
| 2 | 2с | 2p | |||
| 3 | 3с | 3 пол. | |||
| 4 | 4s | 3d | 4p | ||
| 5 | 5s | 4д | 5p | ||
| 6 | 6с | 4f | 5д | 6p | |
| 7 | 7с | 5f | 6d | 7p | |
| 8 | 8с | 5 г | 6f | 7д | 8p |
Отсюда и структура таблицы.Поскольку самые удаленные электроны определяют химические свойства, электроны с одинаковым числом валентных электронов сгруппированы вместе.
См. Также
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Баума, Дж. 1989. Периодическая таблица элементов, ориентированная на приложения. J. Chem. Эд. 66: 741.
- Cotton, F. Albert, G. Wilkinson, C.A. Мурильо и М. Бохманн. 1999. Продвинутая неорганическая химия , 6-е изд.Нью-Йорк: Вили. ISBN 0471199575
- Гринвуд, Н. Н. и А. Эрншоу. 1997. Химия элементов , 2-е изд. Оксфорд: Баттерворт-Хайнеманн. ISBN 0750633654
- Мазурс, Эдвард Г. 1974. Графические изображения периодической системы за сто лет. Университет, Алабама: Университет Алабамы Press. ISBN 0817332006
- Скерри, Эрик Р. 2007. Периодическая таблица: ее история и ее значение. Оксфорд: Издательство Оксфордского университета.ISBN 978-0195305739
Внешние ссылки
Все ссылки получены 7 февраля 2019 г.
Кредиты
Энциклопедия Нового Света писателей и редакторов переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, , так и на самоотверженных добровольцев Фонда Викимедиа.

 И.Менделеева: Новые подходы
И.Менделеева: Новые подходы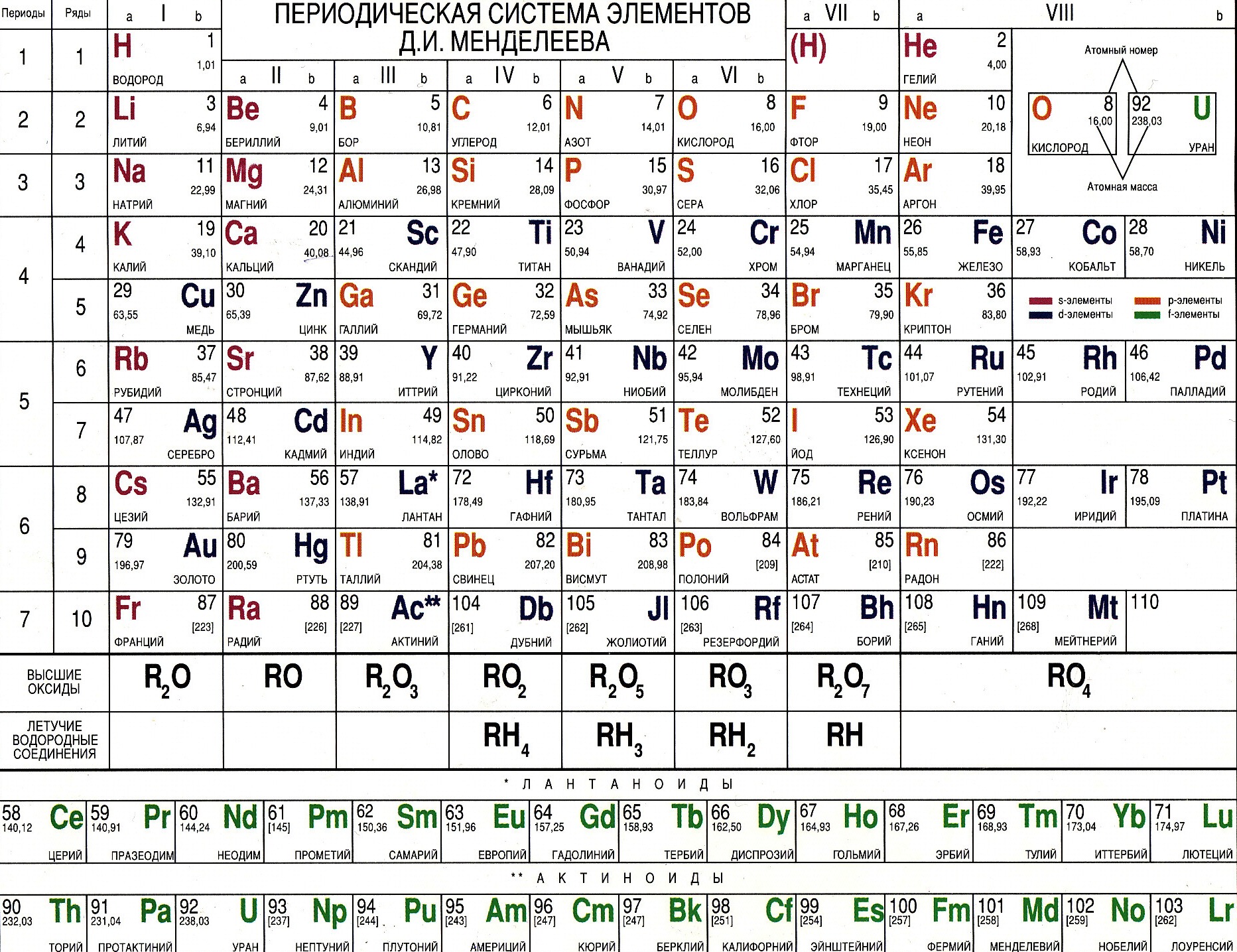 05.2021 | Всего: 567 назв.
05.2021 | Всего: 567 назв. — С.488-490. — Библиогр.: 14 назв.
— С.488-490. — Библиогр.: 14 назв.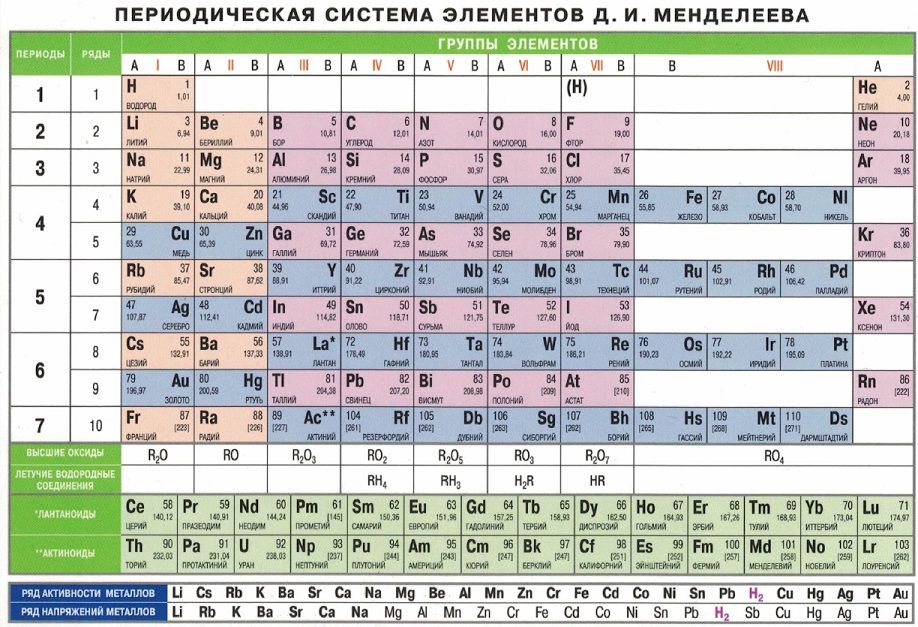 Х юбил. Менделеевского съезда. — М.: Наука, 1969. — С.318-335. — Библиогр.: 87 назв.
Х юбил. Менделеевского съезда. — М.: Наука, 1969. — С.318-335. — Библиогр.: 87 назв.
 Г. Деятельностный подход в изучении закономерностей Периодической системы химических элементов Д.И. Менделеева // Лидеры образования. — 2015. — N 1.
Г. Деятельностный подход в изучении закономерностей Периодической системы химических элементов Д.И. Менделеева // Лидеры образования. — 2015. — N 1. 2004: сб. — М.: Наука, 2005. — С.399-404. — Библиогр.: 3 назв.
2004: сб. — М.: Наука, 2005. — С.399-404. — Библиогр.: 3 назв.
 А. Мироздание. Единая фундаментальная физика 21-го века: теории познания материального мира: философия, жизнь и судьба земного человечества. — Изд. 12-е, испр. и доп. — М.: Буки Веди, 2014, — 240 с. — Библиогр.: 31 назв.
А. Мироздание. Единая фундаментальная физика 21-го века: теории познания материального мира: философия, жизнь и судьба земного человечества. — Изд. 12-е, испр. и доп. — М.: Буки Веди, 2014, — 240 с. — Библиогр.: 31 назв. — М., 1985. — 24 с.
— М., 1985. — 24 с.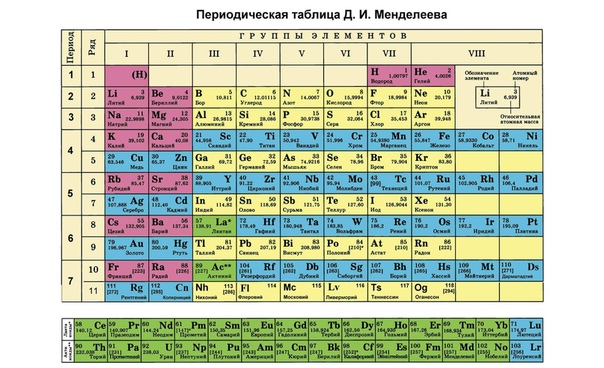 — 2019. — N 7. — С.10-15.
— 2019. — N 7. — С.10-15.
 Периодический закон в биологии. — С.79-118.
Периодический закон в биологии. — С.79-118. Таблица является естественной классификацией химических элементов. Обсуждается эмпирический закон периодичности химических элементов.
Таблица является естественной классификацией химических элементов. Обсуждается эмпирический закон периодичности химических элементов. По сути, расшифрована электронная структура атома. Определены основные атомные константы большинства элементов таблицы Д.И. Менделеева. Предложена естественная классификация атомов по признаку их электронного строения. Показана основополагающая роль атома в понимании электронного строения вещества и процессов структурообразования и химической эволюции. Заложены теоретические основы науки и вещества.
По сути, расшифрована электронная структура атома. Определены основные атомные константы большинства элементов таблицы Д.И. Менделеева. Предложена естественная классификация атомов по признаку их электронного строения. Показана основополагающая роль атома в понимании электронного строения вещества и процессов структурообразования и химической эволюции. Заложены теоретические основы науки и вещества. 5-23. — Библиогр.: 6 назв.
5-23. — Библиогр.: 6 назв. Одновременно авторы рискнули высказать ряд гипотез об истоках органического вещества и происхождения жизни.
Одновременно авторы рискнули высказать ряд гипотез об истоках органического вещества и происхождения жизни. А. Менделеев (Максвелл, Мендель, Мендельсон) и периодизация энергии // Естеств. и техн. науки. — 2019. — №1(127). — С.12-16. — Библиогр.: 12 назв.
А. Менделеев (Максвелл, Мендель, Мендельсон) и периодизация энергии // Естеств. и техн. науки. — 2019. — №1(127). — С.12-16. — Библиогр.: 12 назв. Р., Глазов В.М. Периодический закон и физические свойства электронных расплавов. — М.: Наука, 1978. — 307 с. — Библиогр.: 647 назв.
Р., Глазов В.М. Периодический закон и физические свойства электронных расплавов. — М.: Наука, 1978. — 307 с. — Библиогр.: 647 назв.
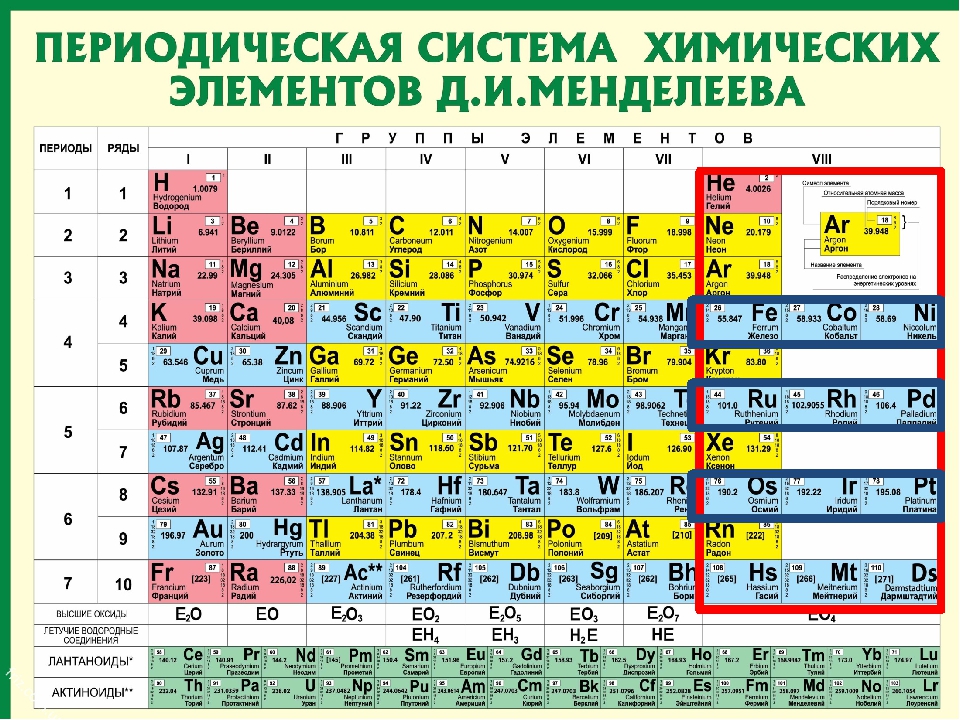 — 2019. — Т.89, N 4. — С.495-496.
— 2019. — Т.89, N 4. — С.495-496. И. Менделеева // Система «Планета Земля»: 200 лет Священному союзу. — М.: ЛЕНАНД, 2015. — С.546-554.
И. Менделеева // Система «Планета Земля»: 200 лет Священному союзу. — М.: ЛЕНАНД, 2015. — С.546-554.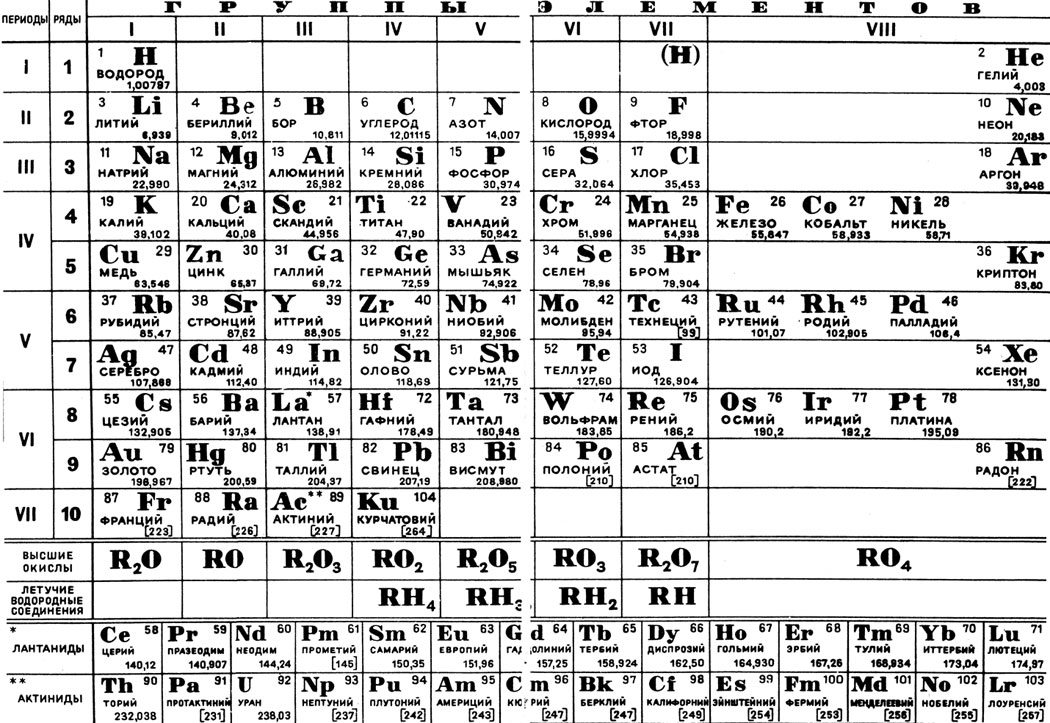 материалы всерос. науч.-практ. конф. молодых ученых, посвященной 150-летию открытия Периодического закона химических элементов Д. И. Менделеевым, г. Грозный, 29 апр. 2019. — Грозный: Изд-во Чеченского гос. ун-та, 2019. — С.147-152. — Библиогр.: 15 назв.
материалы всерос. науч.-практ. конф. молодых ученых, посвященной 150-летию открытия Периодического закона химических элементов Д. И. Менделеевым, г. Грозный, 29 апр. 2019. — Грозный: Изд-во Чеченского гос. ун-та, 2019. — С.147-152. — Библиогр.: 15 назв. Новая форма системы с 1989 г. принята мировым научным сообществом, однако российское образование и наука в значительной мере и сегодня находятся на отживших представлениях в публикации и использовании системы.
Новая форма системы с 1989 г. принята мировым научным сообществом, однако российское образование и наука в значительной мере и сегодня находятся на отживших представлениях в публикации и использовании системы.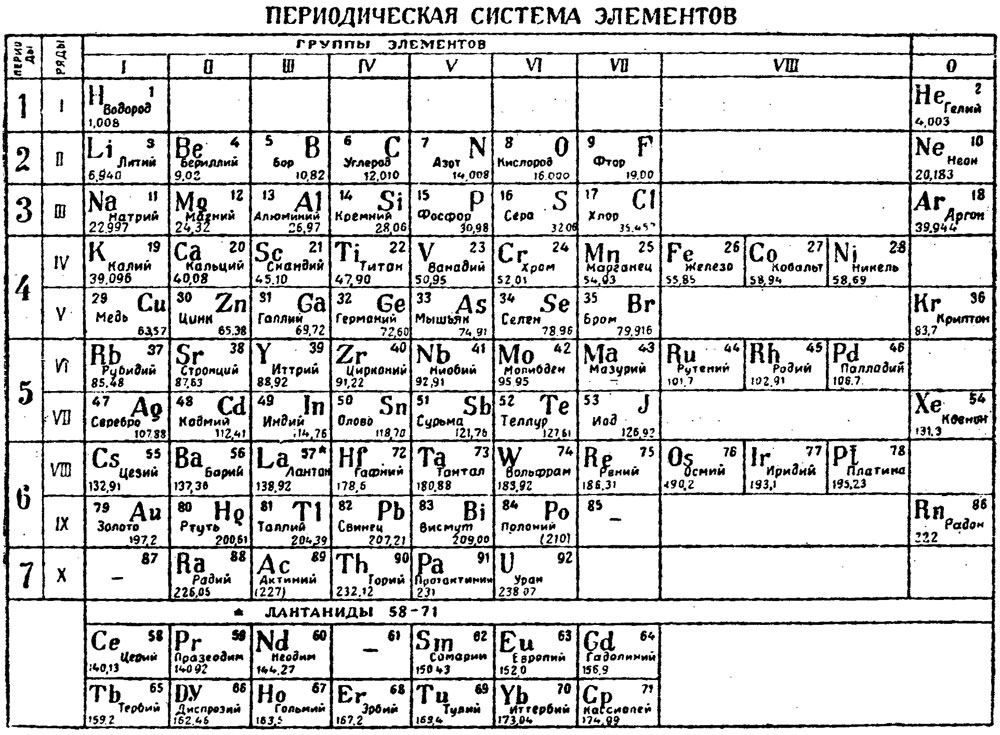 — 2017. — N 9. — С.84-89. — Библиогр.: 31 назв.
— 2017. — N 9. — С.84-89. — Библиогр.: 31 назв.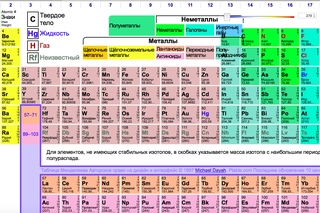 Б. О взаимосвязи токсичности и особенностей электронной природы элементов в таблице Д.И. Менделеева // Периодический закон Д.И. Менделеева в современных трудах ученых транспортных вузов: сб. науч. тр. — СПб.: ПГУПС, 2009. — С.12-15. — Библиогр.: 1 назв.
Б. О взаимосвязи токсичности и особенностей электронной природы элементов в таблице Д.И. Менделеева // Периодический закон Д.И. Менделеева в современных трудах ученых транспортных вузов: сб. науч. тр. — СПб.: ПГУПС, 2009. — С.12-15. — Библиогр.: 1 назв.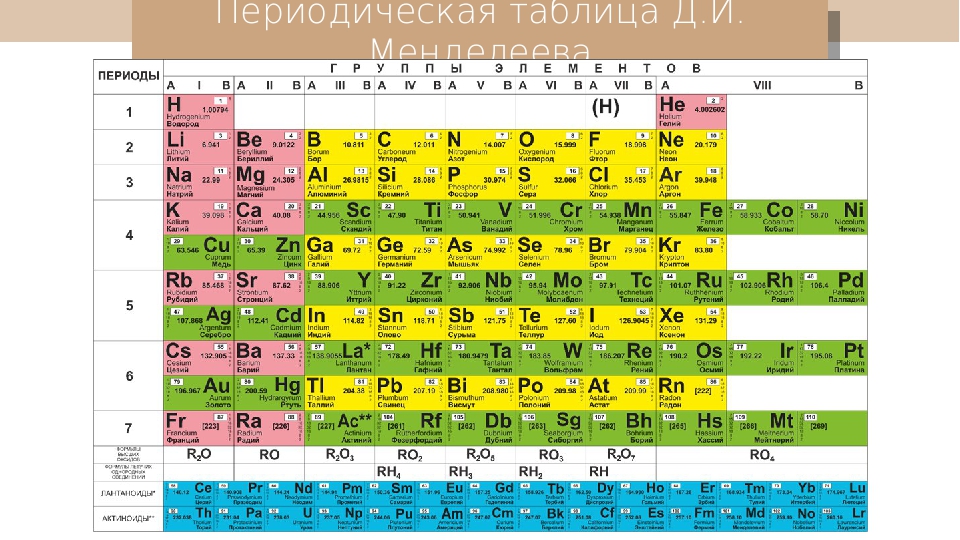 Сер. химии и технологии. — 2018. — N 4(430). — С.150-154. — Библиогр.: 9 назв.
Сер. химии и технологии. — 2018. — N 4(430). — С.150-154. — Библиогр.: 9 назв.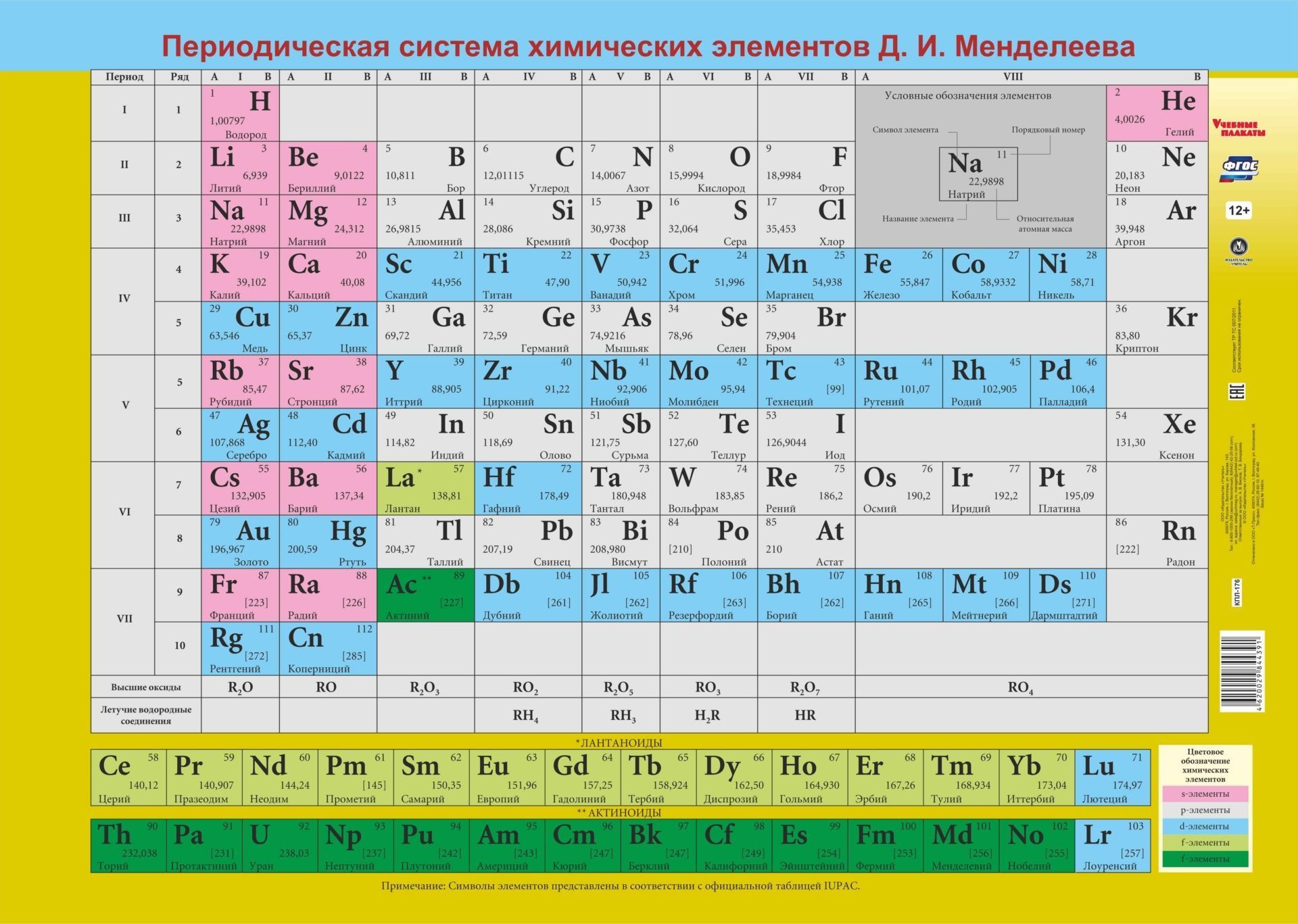 — М.: Наука, 1969. — С.71-98. — Библиогр.: 30 назв.
— М.: Наука, 1969. — С.71-98. — Библиогр.: 30 назв.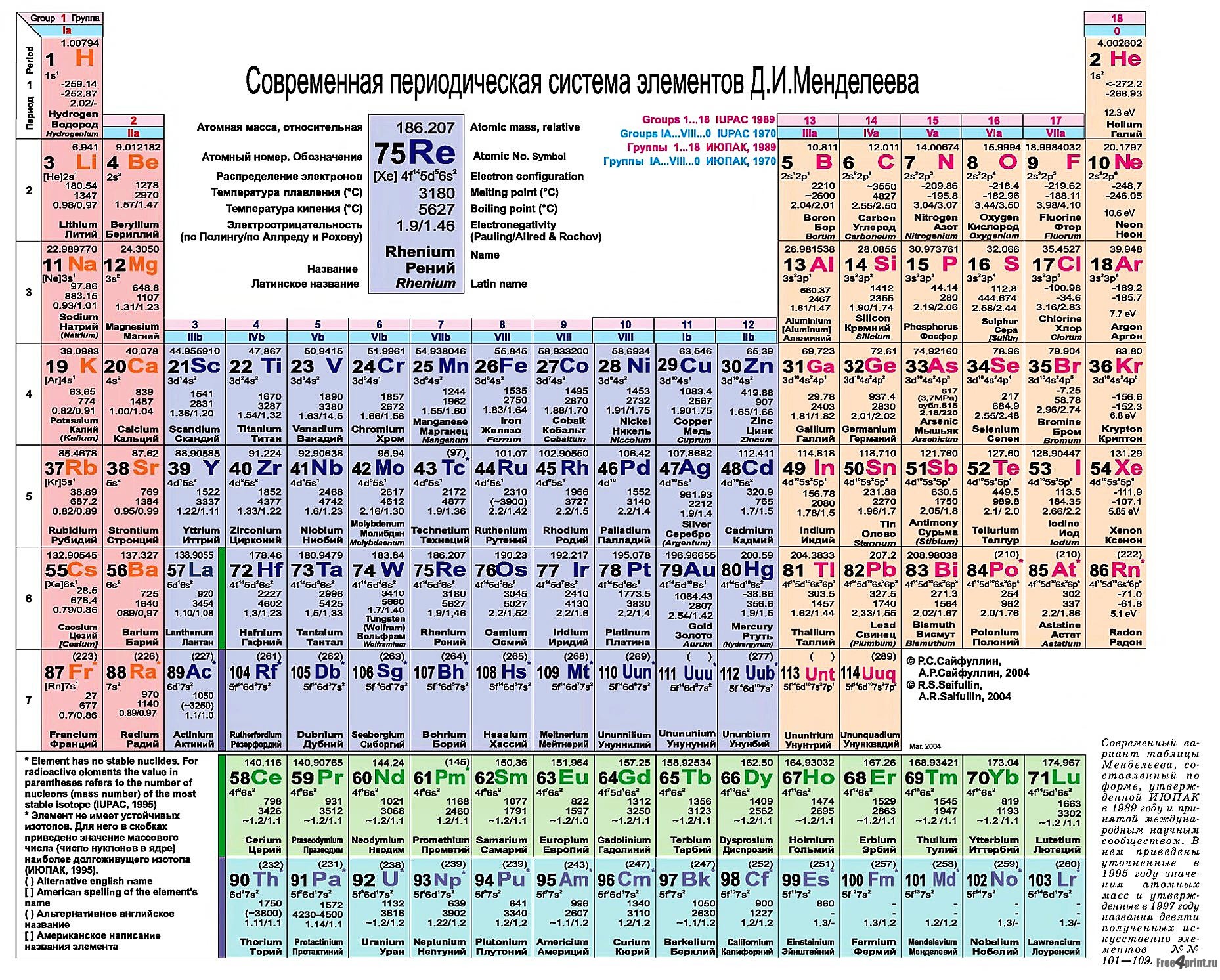 Т. Количественное выражение Периодического закона Д.И. Менделеева // Хим. волокна. — 2005. — N 3. — С.57-60. — Библиогр.: 6 назв.
Т. Количественное выражение Периодического закона Д.И. Менделеева // Хим. волокна. — 2005. — N 3. — С.57-60. — Библиогр.: 6 назв. Вып.1. — М.: Знание, 1970. — С.11-36. — (На обл.: Новое в жизни, науке, технике. Серия: Химия.4).
Вып.1. — М.: Знание, 1970. — С.11-36. — (На обл.: Новое в жизни, науке, технике. Серия: Химия.4). И. Менделеева в свете течения эволюции у атомов химических элементов. — Таганрог: изд-во «Нюанс» (ИП Кучма Ю.Д.), 2012. — 32 с.
И. Менделеева в свете течения эволюции у атомов химических элементов. — Таганрог: изд-во «Нюанс» (ИП Кучма Ю.Д.), 2012. — 32 с.
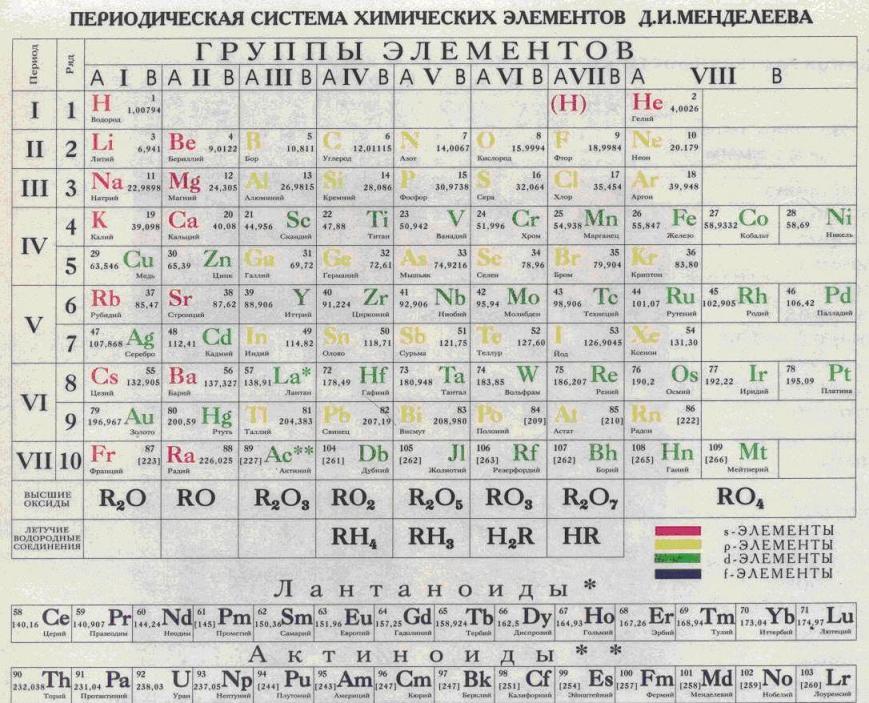 (К 50-летию со дня смерти Д.И. Менделеева). — Куйбышев: Куйбышев. гос. мед. ин-т, 1958. — 16 с.
(К 50-летию со дня смерти Д.И. Менделеева). — Куйбышев: Куйбышев. гос. мед. ин-т, 1958. — 16 с. 3(12). — С.27-33. — Библиогр.: 12 назв.
3(12). — С.27-33. — Библиогр.: 12 назв.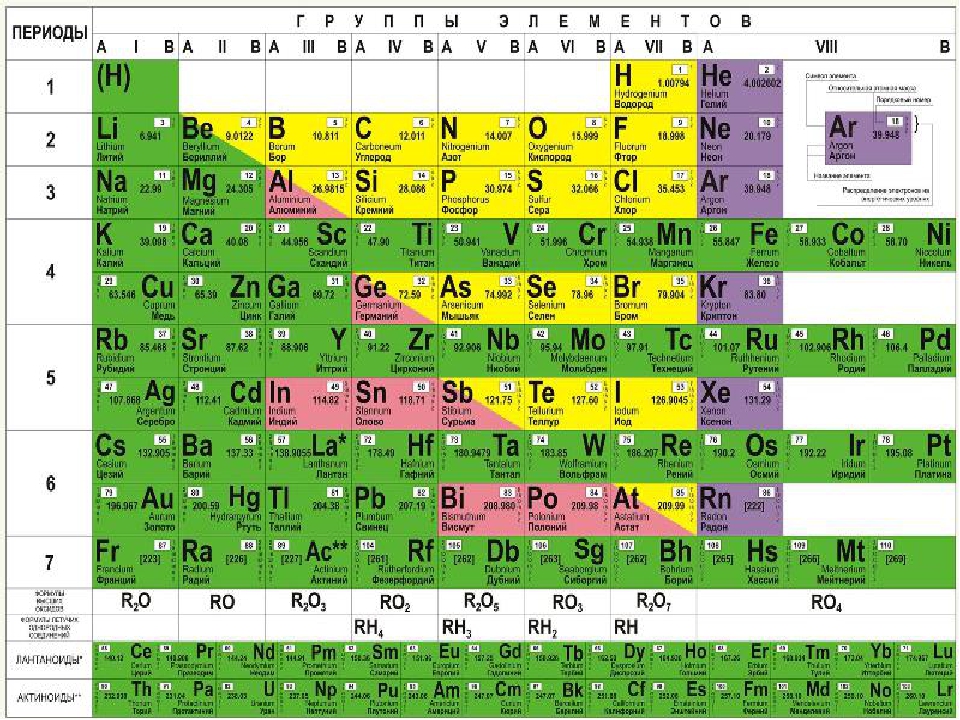 Э. Периодический закон и проблема прогноза свойств новых элементов. — Новосибирск: НГПУ, 2003. — 123 с. — Библиогр.: 68 назв.
Э. Периодический закон и проблема прогноза свойств новых элементов. — Новосибирск: НГПУ, 2003. — 123 с. — Библиогр.: 68 назв.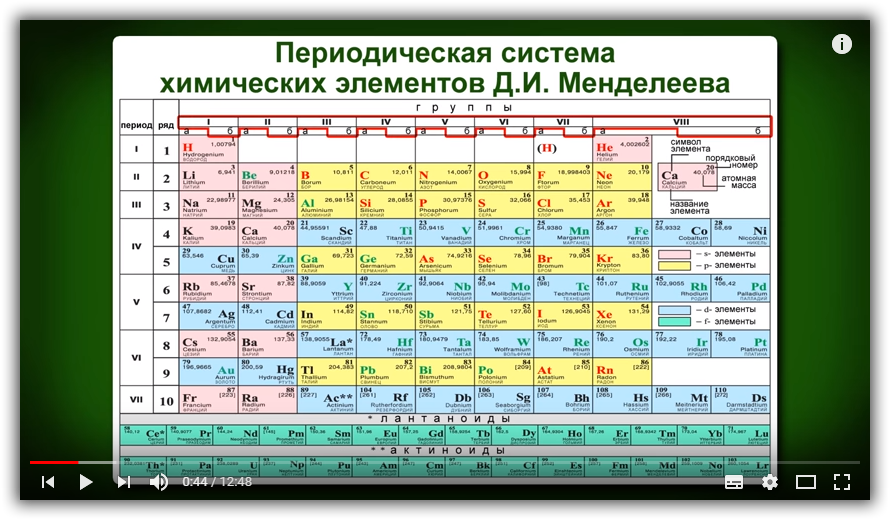 : 13 назв. — Деп. в ВИНИТИ 02.07.90. — N 3716-В90.
: 13 назв. — Деп. в ВИНИТИ 02.07.90. — N 3716-В90. — 24 с.
— 24 с. Атомы, ядра, элементарные частицы: сб. ст. — М.: Атомиздат, 1970. — С.72-158. — Библиогр.: 13 назв.
Атомы, ядра, элементарные частицы: сб. ст. — М.: Атомиздат, 1970. — С.72-158. — Библиогр.: 13 назв. Нанопринципы волновой техники. — М.: Б.и., 2007. — 14 с.
Нанопринципы волновой техники. — М.: Б.и., 2007. — 14 с. — С.89-106.
— С.89-106.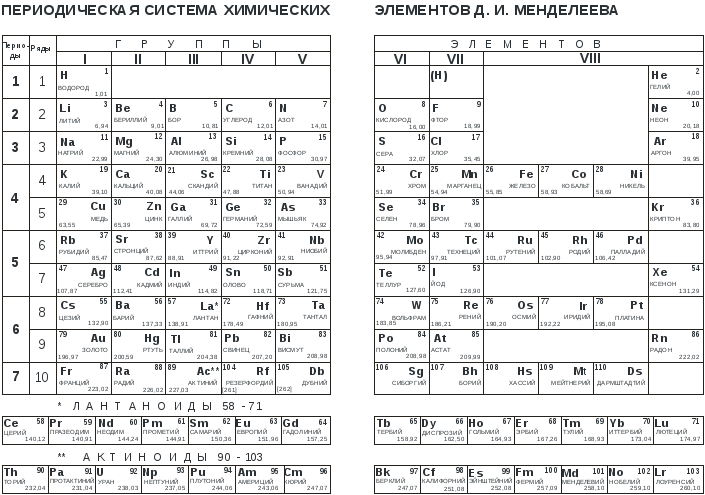 Эти формулы, сгруппированные автором на единой логико-математической основе, и представлены в виде Системной алгебры Периодического закона (САПЗ), которая позволила вернуть Периодическому закону необоснованно отнятый принцип достаточного основания.
Эти формулы, сгруппированные автором на единой логико-математической основе, и представлены в виде Системной алгебры Периодического закона (САПЗ), которая позволила вернуть Периодическому закону необоснованно отнятый принцип достаточного основания.
 — М.: РУДН, 2004. — С.425-428.
— М.: РУДН, 2004. — С.425-428. : 5 назв.
: 5 назв. Остров Стабильности за пределами таблицы Менделеева // Наука и жизнь. — 2012. — N 7. — С.10-11.
Остров Стабильности за пределами таблицы Менделеева // Наука и жизнь. — 2012. — N 7. — С.10-11. : 9 назв.
: 9 назв. : 22 назв.
: 22 назв.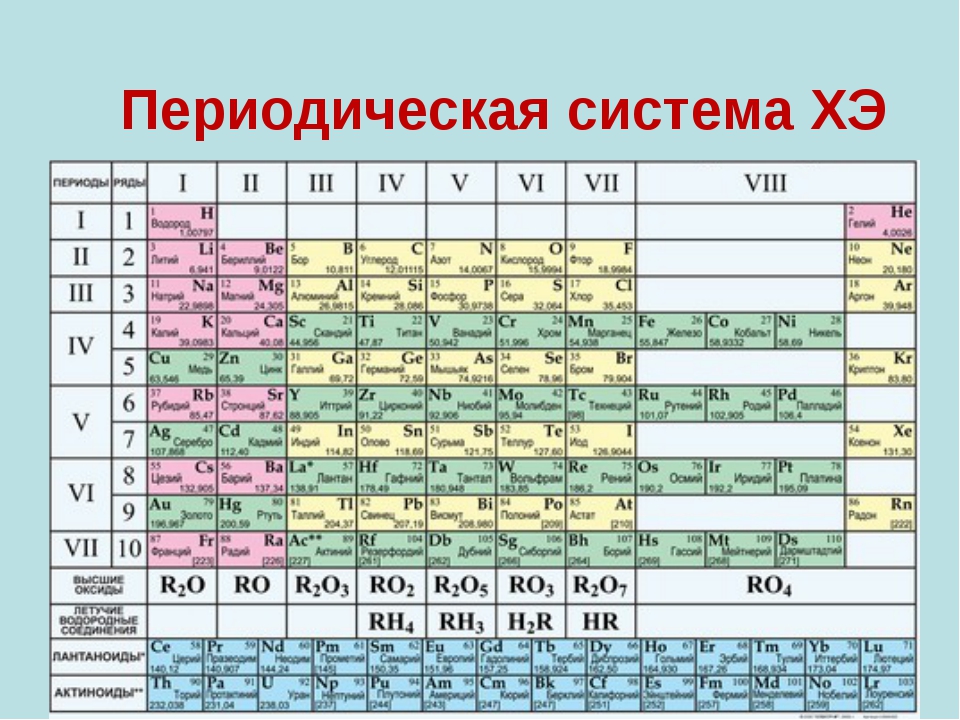 — 156 с. — Библиогр.: 45 назв.
— 156 с. — Библиогр.: 45 назв. Такая фигура в науке называется магическим кубом пятого порядка. Количество отрезков, сумма чисел в которых дает константу, может достигать 325. Поэтому проблема заключается в том, чтобы найти такой куб, при подстановке в который химических элементов они образовали бы группы с одинаковыми свойствами. Это сложная математическая задача. Однако, если ученым ЮУрГУ удастся ее решить, мы узнаем точное число химических элементов во Вселенной и получим возможность предсказывать физические и химические свойства еще не обнаруженных опытным путем элементов.
Такая фигура в науке называется магическим кубом пятого порядка. Количество отрезков, сумма чисел в которых дает константу, может достигать 325. Поэтому проблема заключается в том, чтобы найти такой куб, при подстановке в который химических элементов они образовали бы группы с одинаковыми свойствами. Это сложная математическая задача. Однако, если ученым ЮУрГУ удастся ее решить, мы узнаем точное число химических элементов во Вселенной и получим возможность предсказывать физические и химические свойства еще не обнаруженных опытным путем элементов. Н., Горбунов А.И., Филиппов Г.Г. Рецензия на книгу Т.П. Кораблевой и Д.В. Королькова «Теория периодической системы» // Вестн. МГТУ им. Н.Э. Баумана. Сер. Естеств. науки. — 2007. — N 3(26). — С.124-125.
Н., Горбунов А.И., Филиппов Г.Г. Рецензия на книгу Т.П. Кораблевой и Д.В. Королькова «Теория периодической системы» // Вестн. МГТУ им. Н.Э. Баумана. Сер. Естеств. науки. — 2007. — N 3(26). — С.124-125.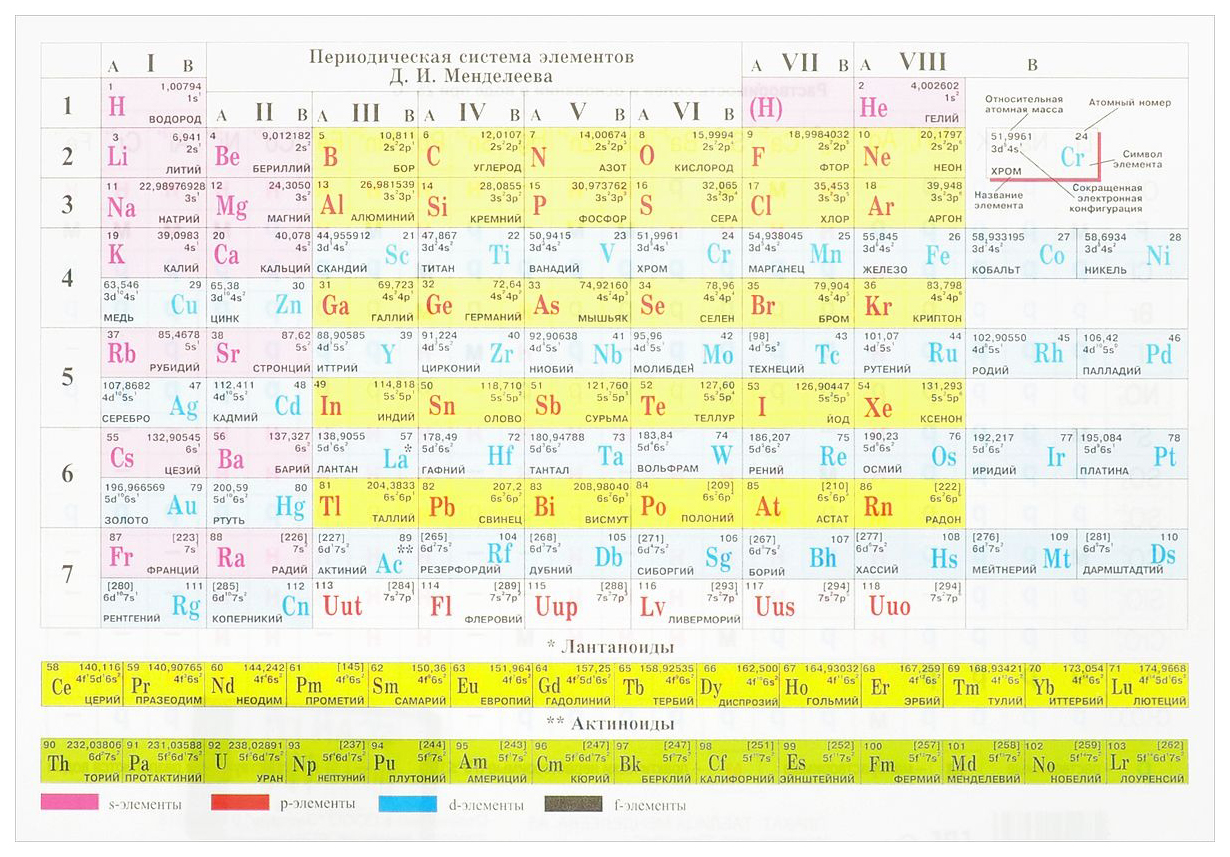 — С.51-57. — Библиогр.: 4 назв.
— С.51-57. — Библиогр.: 4 назв.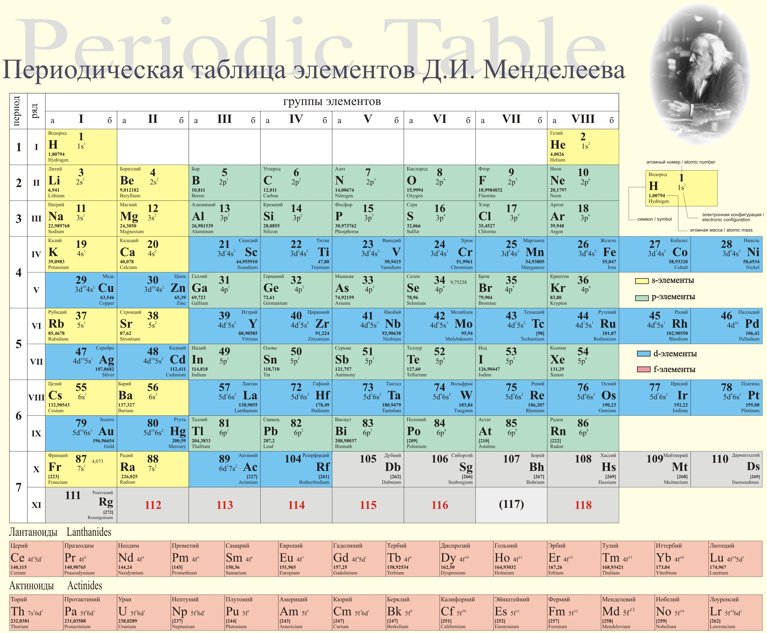 Г., Горбунов А.И. О формулировке Периодического закона Д.И. Менделеева // Журн. физ. химии. — 1998. — Т.72, N 7. — C.1334-1336. — Библиогр.: 6 назв.
Г., Горбунов А.И. О формулировке Периодического закона Д.И. Менделеева // Журн. физ. химии. — 1998. — Т.72, N 7. — C.1334-1336. — Библиогр.: 6 назв. докл. на пленарных заседаниях Х юбил. Менделеевского съезда. — М.: Наука, 1971. — С.75-84. — Библиогр.: 16 назв.
докл. на пленарных заседаниях Х юбил. Менделеевского съезда. — М.: Наука, 1971. — С.75-84. — Библиогр.: 16 назв.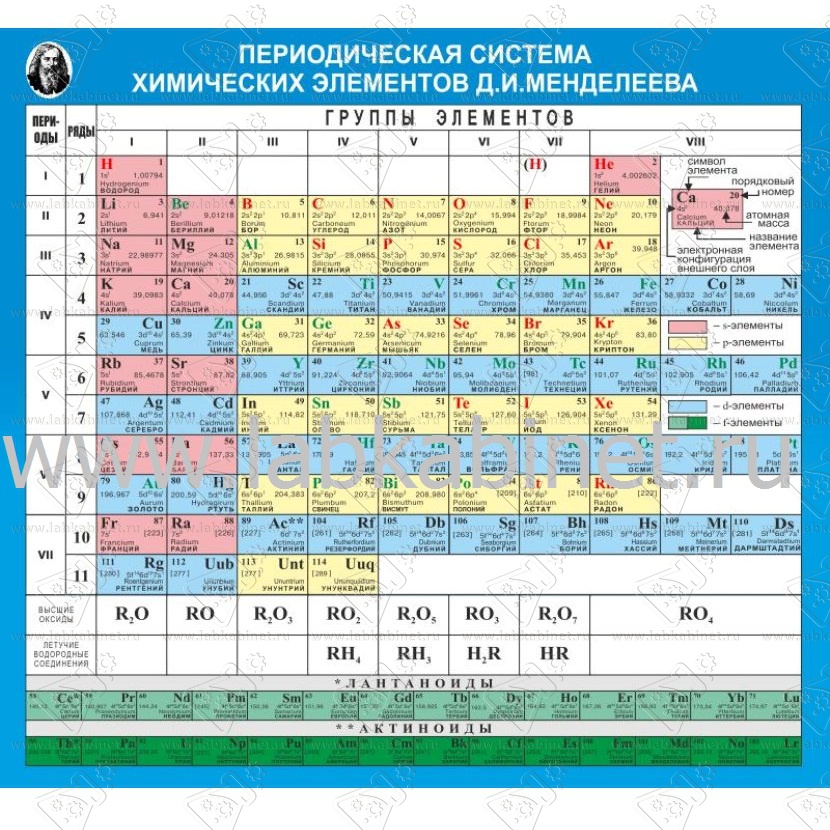 — 2019. — N 2. — С.17-33. — Библиогр.: 19 назв.
— 2019. — N 2. — С.17-33. — Библиогр.: 19 назв. А. Создание уникальных биосенсоров и Периодическая таблица. — С.25-26.
А. Создание уникальных биосенсоров и Периодическая таблица. — С.25-26. науч. журн. — 2005. — N 5(133). — С.64-70. — Библиогр.: 6 назв.
науч. журн. — 2005. — N 5(133). — С.64-70. — Библиогр.: 6 назв.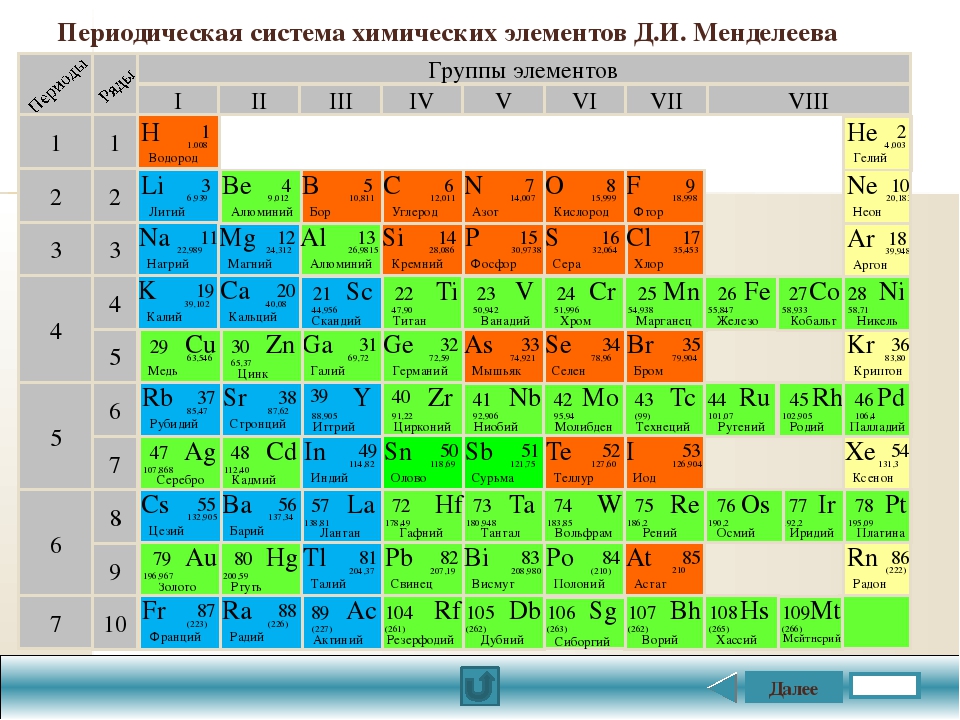 — С.75-83. — Библиогр.: 23 назв.
— С.75-83. — Библиогр.: 23 назв.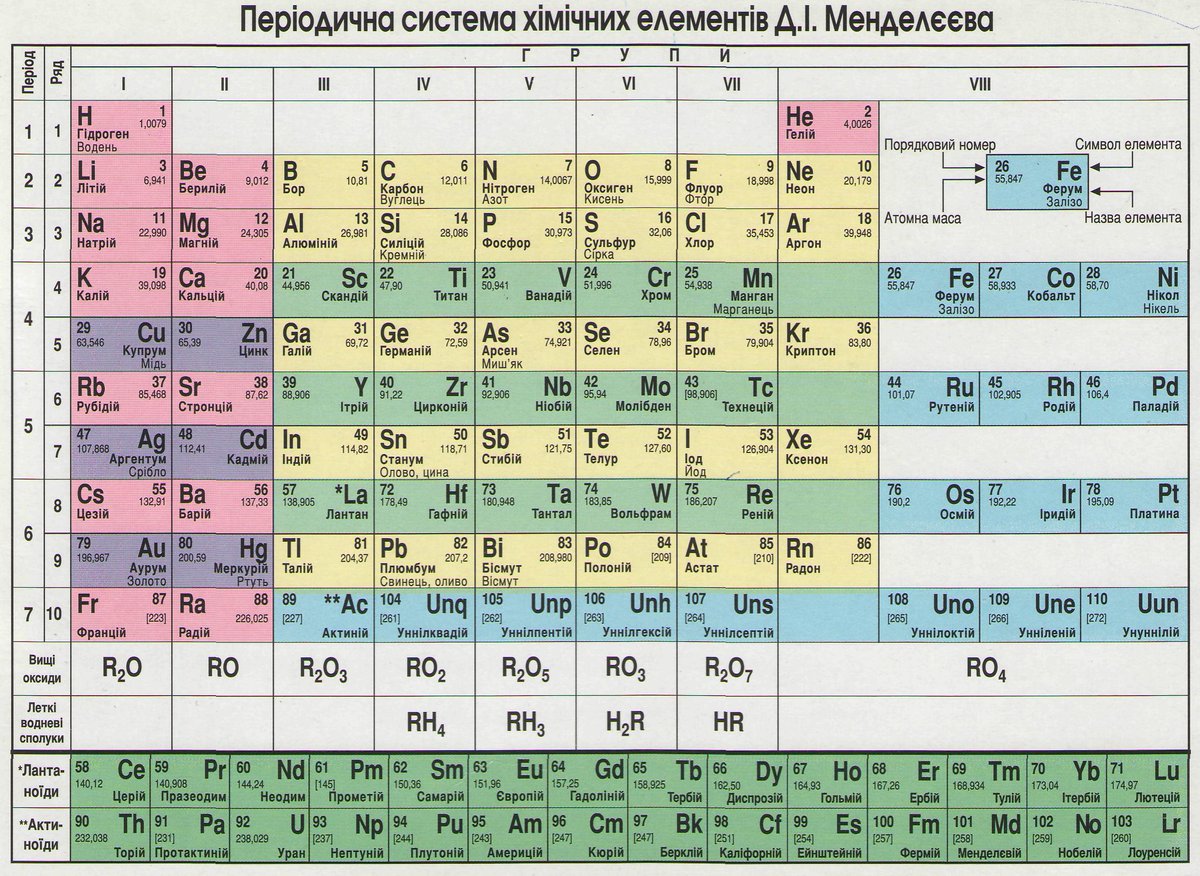 науч. журн. — 2005. — N 30(158). — С.60-67. — Библиогр.: 16 назв.
науч. журн. — 2005. — N 30(158). — С.60-67. — Библиогр.: 16 назв. 568 НО
568 НО — С.3-5.
— С.3-5.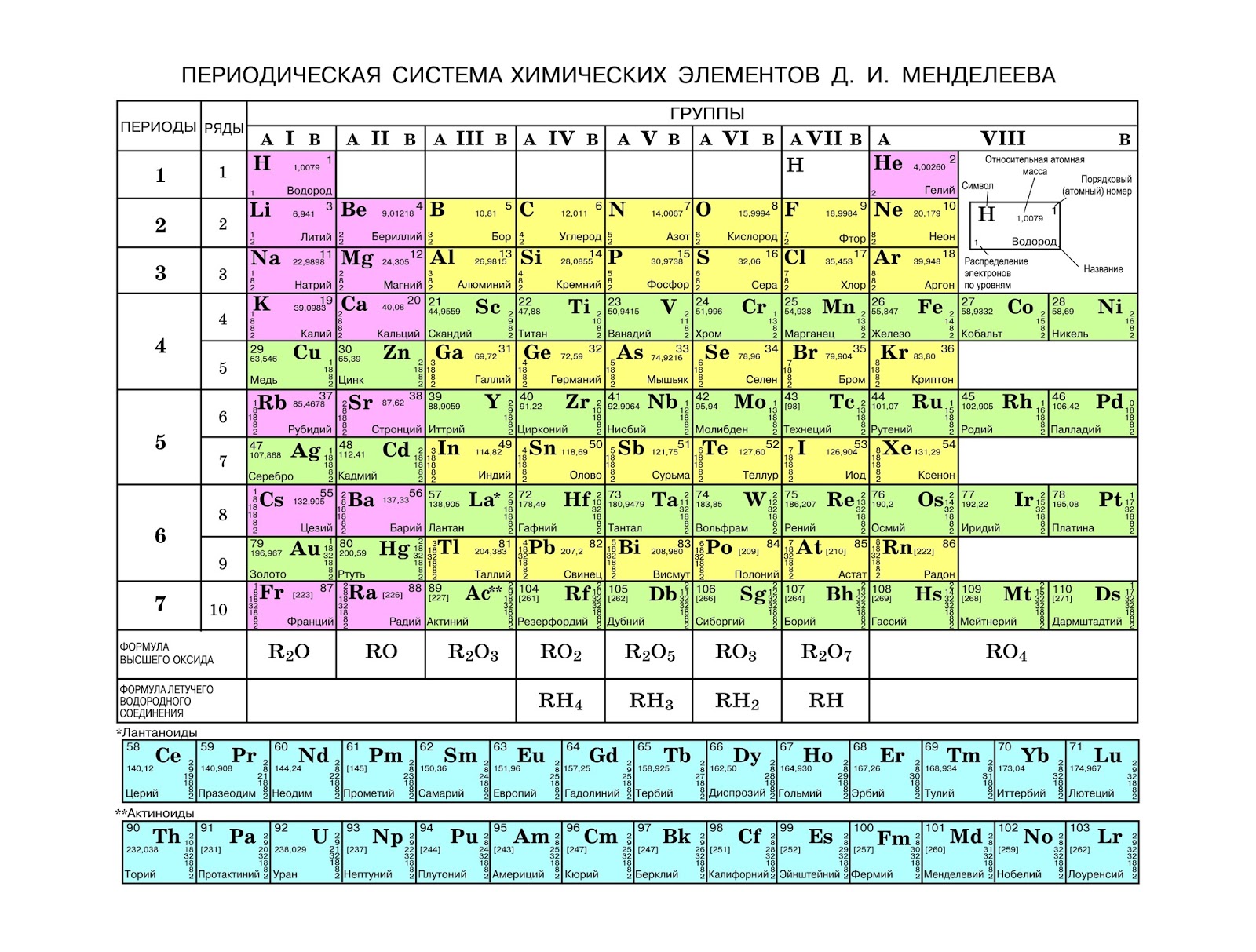 Проанализированы свойства сверхтяжелых химических элементов, а также свойства элементов в гипотетическом четырехмерном пространстве.
Проанализированы свойства сверхтяжелых химических элементов, а также свойства элементов в гипотетическом четырехмерном пространстве. И. Менделеева. Рассматривается авторский вариант многоуровневой системы физических величин с размерностными взаимосвязями между ними.
И. Менделеева. Рассматривается авторский вариант многоуровневой системы физических величин с размерностными взаимосвязями между ними. 2019: сб. тез. IX науч.-техн. конф. студентов, аспирантов и молодых ученых в рамках мероприятий, посвященных 150-летию открытия Периодического закона химических элементов Д. И. Менделеевым. — СПб.: СПбГТИТУ, 2019. — С.6. — Библиогр.: 2 назв.
2019: сб. тез. IX науч.-техн. конф. студентов, аспирантов и молодых ученых в рамках мероприятий, посвященных 150-летию открытия Периодического закона химических элементов Д. И. Менделеевым. — СПб.: СПбГТИТУ, 2019. — С.6. — Библиогр.: 2 назв.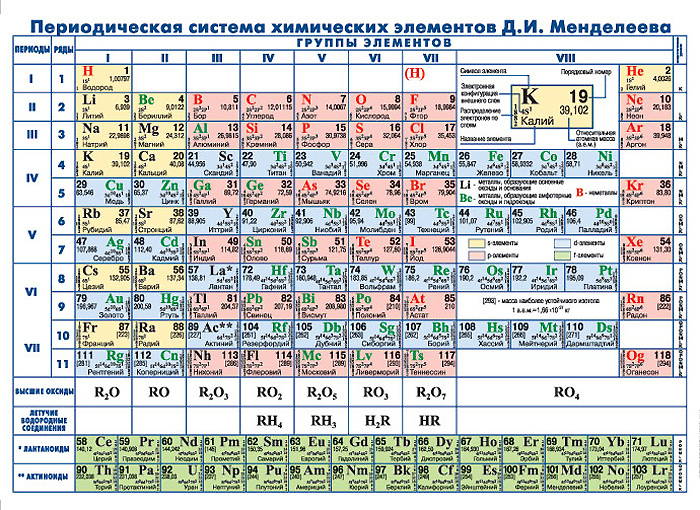 дис. … канд. хим. наук / Киевск. технол. ин-т легкой пром-сти. — Киев, 1969. — 21 с.
дис. … канд. хим. наук / Киевск. технол. ин-т легкой пром-сти. — Киев, 1969. — 21 с.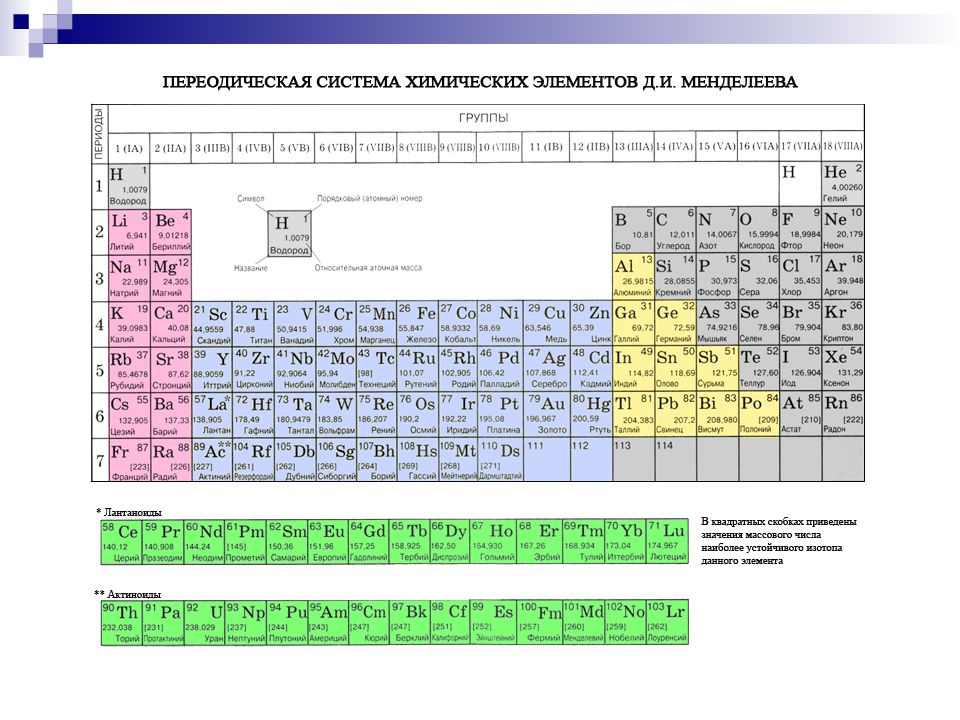 И. Менделеева // Журн. общей химии. — 1954. — Т.24, вып.5. — С.745-751. — Библиогр.: 14 назв.
И. Менделеева // Журн. общей химии. — 1954. — Т.24, вып.5. — С.745-751. — Библиогр.: 14 назв. — 11 с.
— 11 с. Успенская. — М.: Октопус, 2010. — С.79-103. — Библиогр.: 9 назв.
Успенская. — М.: Октопус, 2010. — С.79-103. — Библиогр.: 9 назв. — С.128-203. — Библиогр.: 8 назв.
— С.128-203. — Библиогр.: 8 назв.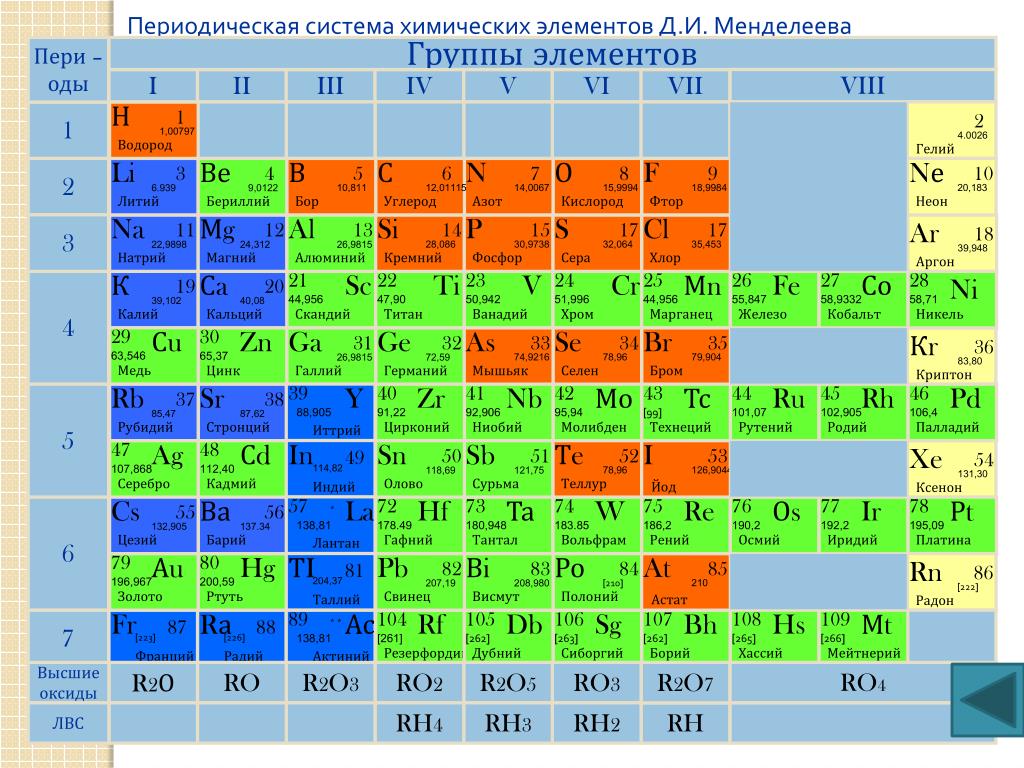 — М.: Наука, 1971. — С.40-53. — Библиогр.: 5 назв.
— М.: Наука, 1971. — С.40-53. — Библиогр.: 5 назв. ун-т. — СПб.: Наука, 2008. — 409 с. — Библиогр.: с.393-404.
ун-т. — СПб.: Наука, 2008. — 409 с. — Библиогр.: с.393-404. Н.Э. Баумана, 2019. — С.650-653. — Библиогр.: 6 назв.
Н.Э. Баумана, 2019. — С.650-653. — Библиогр.: 6 назв.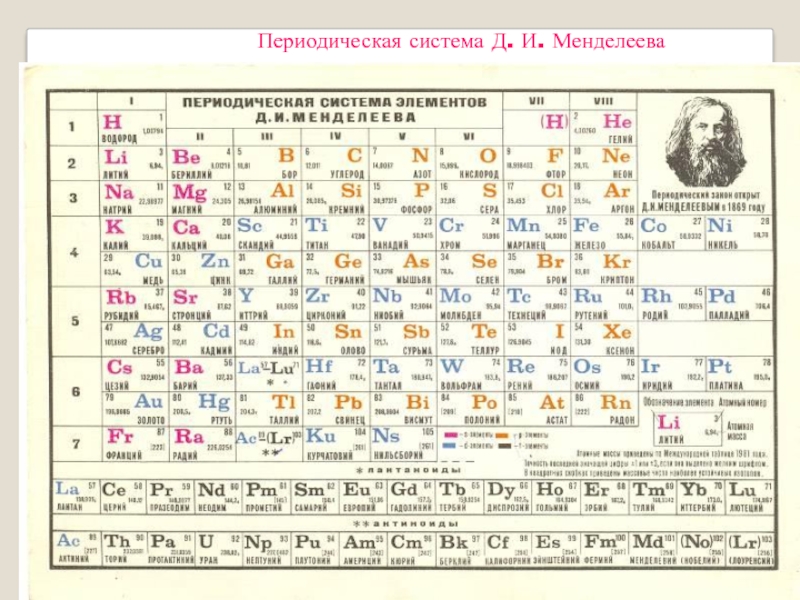 т.н., профессора В. И. Терехова, Новосибирск, 27-29 авг. 2019: тез. докл. — Новосибирск: Институт теплофизики, 2019. — С.140. — Библиогр.: 4 назв.
т.н., профессора В. И. Терехова, Новосибирск, 27-29 авг. 2019: тез. докл. — Новосибирск: Институт теплофизики, 2019. — С.140. — Библиогр.: 4 назв. И., Нечаев В.В., Путилов В.Я. и др. // Повышение надежности и эффективности эксплуатации электрических станций и энергетических систем: ЭНЕРГО-2010: тр. всерос. науч.-практ. конф., Москва, 1-3 июня 2010. В 2 т. Т.2, секции 5-9. — М.: МЭИ, 2010. — С.235-238. — Библиогр.: 4 назв.
И., Нечаев В.В., Путилов В.Я. и др. // Повышение надежности и эффективности эксплуатации электрических станций и энергетических систем: ЭНЕРГО-2010: тр. всерос. науч.-практ. конф., Москва, 1-3 июня 2010. В 2 т. Т.2, секции 5-9. — М.: МЭИ, 2010. — С.235-238. — Библиогр.: 4 назв. — 1994. — N 3(15). — С.54-58. — Библиогр.: 6 назв.
— 1994. — N 3(15). — С.54-58. — Библиогр.: 6 назв. вузов. Физ. — 2019. — Т.63, N 11. — С.132-136.
вузов. Физ. — 2019. — Т.63, N 11. — С.132-136. 750/2)
750/2) : 12 назв.
: 12 назв. 781/1)
781/1) К., Столповский М.А., Кильдибаева С.Р., Мусакаев Н.Г. // Теплофизика и физическая гидродинамика: 4 всерос. науч. конф. с элементами школы молодых ученых, Ялта, 15-22 сент. 2019: тез. докл. — Новосибирск: Ин-т теплофизики, 2019. — С.90. — Библиогр.: 3 назв.
К., Столповский М.А., Кильдибаева С.Р., Мусакаев Н.Г. // Теплофизика и физическая гидродинамика: 4 всерос. науч. конф. с элементами школы молодых ученых, Ялта, 15-22 сент. 2019: тез. докл. — Новосибирск: Ин-т теплофизики, 2019. — С.90. — Библиогр.: 3 назв.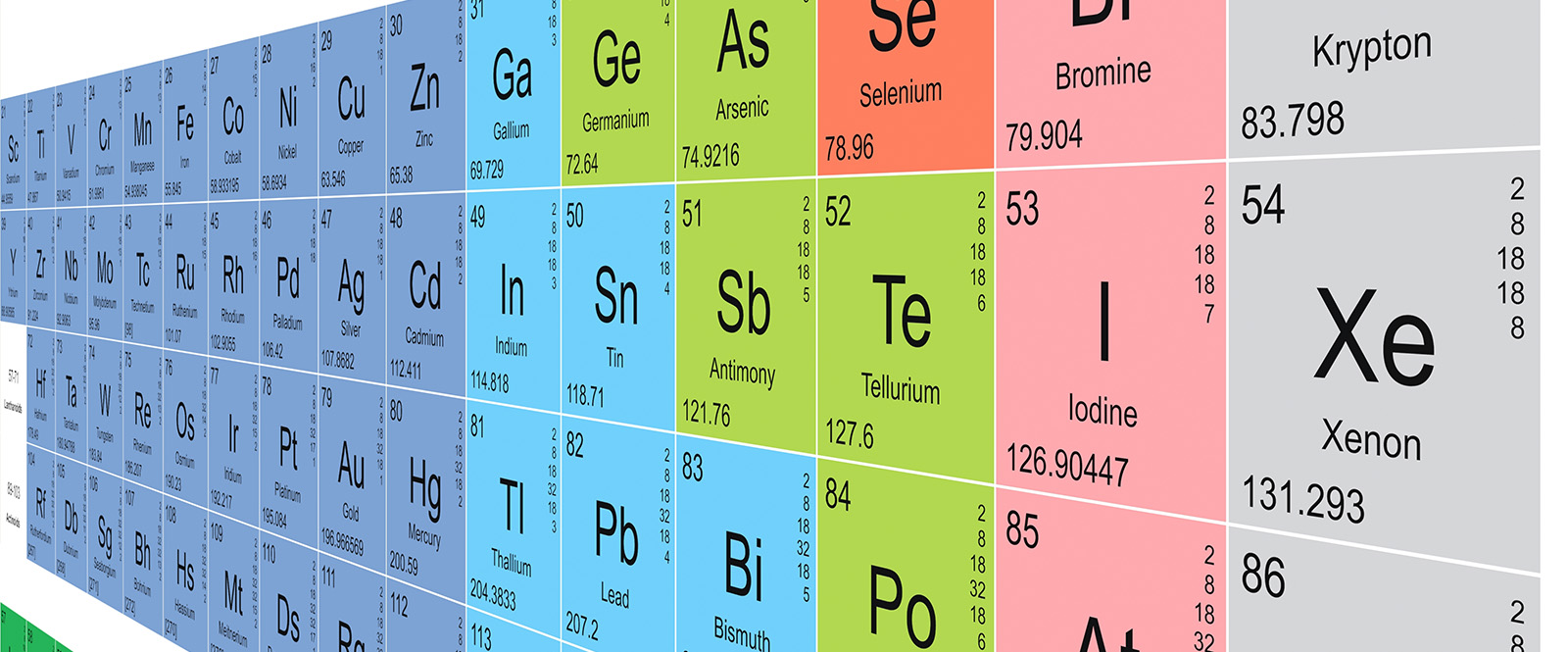 В., Кондратьева О.Е., Киселева О.А., Иванова А.А. // Электр. ст. — 2020. — N 7. — С.14-20. — Библиогр.: 27 назв.
В., Кондратьева О.Е., Киселева О.А., Иванова А.А. // Электр. ст. — 2020. — N 7. — С.14-20. — Библиогр.: 27 назв.