Наука: Наука и техника: Lenta.ru
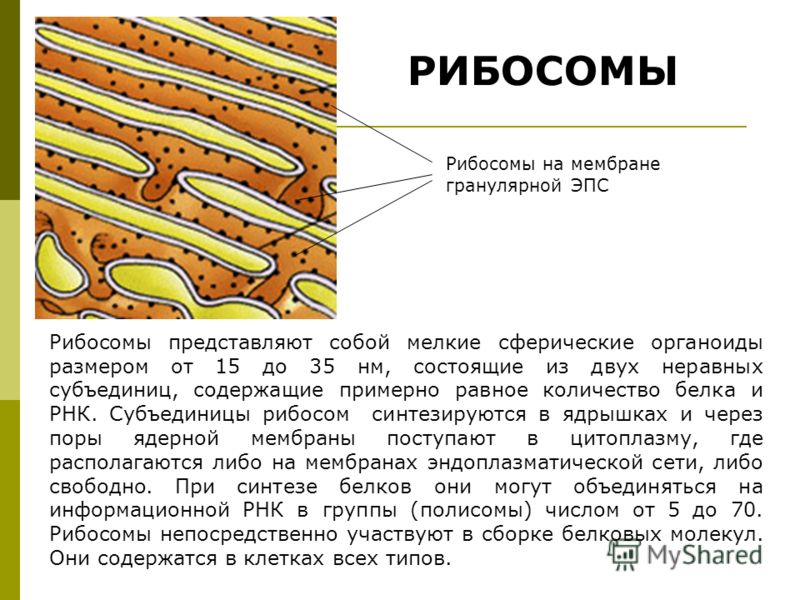
Ученые из Кембриджского университета получили новые доказательства в пользу гипотезы РНК-мира. Оказалось, что небольшие аминокислотные цепочки, соединяясь с РНК, улучшают их каталитические свойства, позволяя им становиться менее зависимыми от токсичных ионов. А это необходимое условие для формирования первых клеток. «Лента.ру» рассказывает о работе, опубликованной в журнале Nature.
Согласно гипотезе РНК-мира, жизнь возникла из простой биологической системы, в которой не было ДНК и белковых молекул. Она состояла из комплексов РНК, способных не только хранить генетическую информацию, но и осуществлять катализ химических реакций (в этом случае они назывались рибозимами). Иными словами, они сочетали в себе функции ДНК и ферментов. Потом объединение РНК с пептидами и дезоксирибонуклеиновой кислотой привело к возникновению одноклеточных организмов. Возникает, однако, вопрос: в чем была выгода от взаимодействия между РНК-миром и белками?
Материалы по теме:
Рибозимы, называемые РНК-полимеразами, как считается, составляли основное население РНК-мира.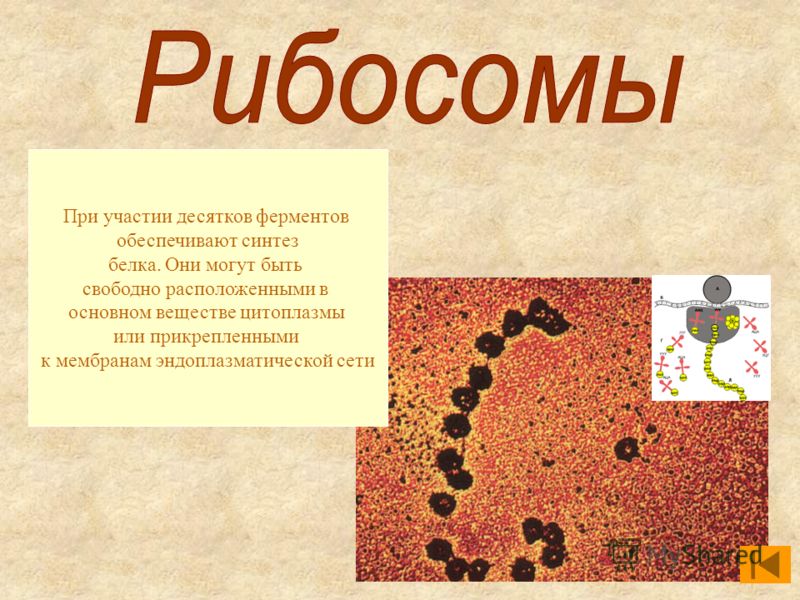 Они представляли собой репликаторы — объекты, способные самовоспроизводиться. Ресурсами для этого служили нуклеотиды в первичном бульоне. Вначале рибозимы с трудом копировали себя, поскольку их каталитические способности были не развиты. Они совершали ошибки, в результате чего возникали рибозимы с мутациями. Эти изменения могли лишить РНК-полимеразу способности к катализу, однако в некоторых случаях это качество, напротив, улучшалось. С течением времени рибозимы все быстрее и точнее воспроизводились, становились все более многочисленными и выигрывали конкуренцию за ресурсы.
Они представляли собой репликаторы — объекты, способные самовоспроизводиться. Ресурсами для этого служили нуклеотиды в первичном бульоне. Вначале рибозимы с трудом копировали себя, поскольку их каталитические способности были не развиты. Они совершали ошибки, в результате чего возникали рибозимы с мутациями. Эти изменения могли лишить РНК-полимеразу способности к катализу, однако в некоторых случаях это качество, напротив, улучшалось. С течением времени рибозимы все быстрее и точнее воспроизводились, становились все более многочисленными и выигрывали конкуренцию за ресурсы.
Таким образом, рибозимы представляли собой первичные геномы, поскольку хранили в себе генетическую информацию о своей собственной последовательности. Позднее они инкапсулировались внутри частиц, образованных липидными мембранами, что привело к формированию первой протоклетки. Ученые умеют синтезировать аналоги РНК-полимеразного рибозима, которые катализируют синтез других рибозимов, или даже копировать короткие последовательности рибонуклеотидов.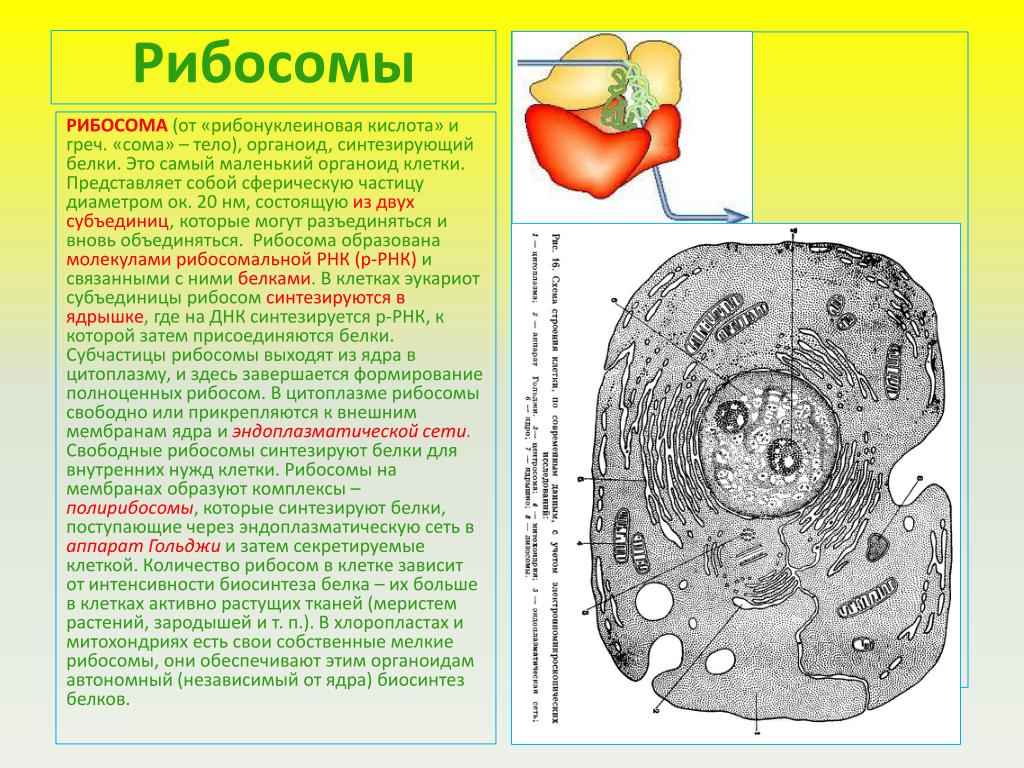 Однако получить рибозим-репликатор до сих пор не удается.
Однако получить рибозим-репликатор до сих пор не удается.
Рибосома Thermus thermophilus
Изображение: Public Domain / Wikimedia
Есть и другая проблема. Синтезированные в лабораториях рибозимы активны только при очень высоких концентрациях ионов магния, которые разрушают липидные мембраны. Это значит, что существует фундаментальная несовместимость между рибонуклеиновыми РНК-полимеразами и процессами формирования протоклеток.
Ситуацию спасает тот факт, что РНК-молекулы не были изолированы от многих других химических соединений, например пептидов. Рибозимы могли кооперироваться с аминокислотными последовательностями, что влияло на их функции. В пользу этого говорит и то, что активность таких рибозимов, как сплайсосомы (вырезают интроны из созревающей матричной РНК), рибосомы (участвуют в синтезе белков) и рибонуклеазы Р (катализируют деградацию РНК), зависит от родственных белков. Исследования показали, что некоторые белки, связывающиеся с рибозимами, вызывают изменения в их вторичной структуре и функциях. Так, в случае с рибонуклеазами Р белки могут снижать необходимую для их активности концентрацию ионов магния. Учитывая это, ученые решили выяснить, могут ли пептиды повлиять на функции РНК-полимеразных рибозимов похожим образом, уменьшив их зависимость от магния.
Так, в случае с рибонуклеазами Р белки могут снижать необходимую для их активности концентрацию ионов магния. Учитывая это, ученые решили выяснить, могут ли пептиды повлиять на функции РНК-полимеразных рибозимов похожим образом, уменьшив их зависимость от магния.
Чтобы ответить на этот вопрос, необходимо выбрать не любые белки, а только те, что когда-то взаимодействовали с рибозимами РНК-мира. Ученые обратились к структуре рибосом, представляющих собой своего рода молекулярный реликт. Результаты исследований указывают на то, что рибосомы в их современном виде имелись уже у LUCA — общего предка всех современных форм жизни.
Строение субъединиц рибосомы Thermus thermophilus
Изображение: Philipp Holliger / Cambridge
В строении рибосомы, образованной белками, рибонуклеиновыми кислотами и ионами, записана ее эволюция. Так, основа большой рибосомной субъединицы обогащена ионами магния. Постепенно она обрастала дополнительными модулями, в которых ионы заменялись пептидами. По мнению ученых, связь между рибозимами и аминокислотными цепями отражает историю эволюции РНК-мира и его переход к РНК-пептидному миру. Именно поэтому было проанализировано действие пептидов из рибосом, которые считаются самыми древними белковыми последовательностями на Земле.
По мнению ученых, связь между рибозимами и аминокислотными цепями отражает историю эволюции РНК-мира и его переход к РНК-пептидному миру. Именно поэтому было проанализировано действие пептидов из рибосом, которые считаются самыми древними белковыми последовательностями на Земле.
Исследователи определили множество пептидов из обеих субъединиц рибосомы бактерии Thermus thermophilus, что усиливали активность РНК-полимеразного рибозима Z, который осуществляет копирование РНК-молекул.
Изображение мембранных пузырьков, полученное с помощью флуоресцентной микроскопии
Изображение: MRC Laboratory of Molecular Biology / Cambridge / United Kingdom
Однако самым значительным действием обладал гомополимерный лизиновый декапептид (К10) — аминокислотная последовательность из десяти молекул лизинов. Он поддерживал функции рибозима при низких концентрациях ионов магния, образуя пептидно-рибозимный комплекс. Ученые предположили, что это обусловлено стабилизацией промежуточных веществ в каталитическом цикле.
Чтобы проверить, мог ли этот пептид способствовать активности рибозимов внутри мембранного компартмента, исследователи провели эксперимент. Были получены стабильные пузырьки, состоящие из фосфолипидов и диацилглицеринов, внутрь которых инкапсулировали РНК. При концентрации ионов магния 10 миллимоль (безопасной для мембраны) и при наличии К10 наблюдался синтез РНК, катализируемый рибозимом. В отсутствие магния синтеза, однако, не происходило.
Это указывает на то, что пептиды действительно позволяли рибозимам осуществлять каталитическую активность при низких концентрациях токсичных ионов. В результате зависимость РНК-полимераз от неорганических молекул уменьшалась, что способствовало их эволюции и, в конечном итоге, — эволюции клеток.
Контрольная работа за 1 полугодие в 10 классе
Контрольная работа за 1 полугодие в 10 классе
1 вариант
1.Плотная оболочка отсутствует в клетках
1)грибов
2)птиц
3)растений
4)бактерий
5)земноводных
6)пресмыкающихся
2. Какую функцию выполняет в клетке плазматическая мембрана?
Какую функцию выполняет в клетке плазматическая мембрана?
1)отграничивает содержимое клетки
2)участвует в биосинтезе белка
3)осуществляет поступление веществ в клетку
4)участвует в процессе окисления веществ
5)способствует ускорению химических реакций в клетке
6)обеспечивает удаление ряда веществ из клетки
3.Установите соответствие
Строение и функция клетки Органоид
А)расщепление сложных органических веществ 1)лизосома
Б)окисление органических веществ 2)митохондрия
В)имеет множество крист
Г)отграничена от цитоплазмы одной мембраной
Д)при расщеплении белков, жиров, углеводов высвобождается
энергия, которая рассеивается в виде тепла.
4.какие функции в клетке выполняют углеводы?
1)каталитическую
2)энергетическую
3)двигательную
4)структурную
5)запасающую
6)сократительную
5.Как называют составную часть метаболизма, в результате которой синтезируется АТФ?
1)анаболизм
2)энергетический обмен
3)катаболизм
4)пластический обмен
5)диссимиляция
6)ассимиляция
6. Какие утверждения являются верными?
Какие утверждения являются верными?
1)Ядрышко и рибосомы участвуют в синтезе белка
2)Хромопласты придают окраску плодам и осенним листьям
3)Лизосомы формируются в ЭПС
4)Рибосомы – это мембранные органоиды
5)В аппарате Гольджи происходит химическая модификация ферментов
6)В формировании веретена деления в клетках животных участвуют центриоли
7. Почему погибает клетка при удалении из нее ядра?
8. Каково значение знаний о химическом составе организмов?
2 вариант
1.Какую функцию выполняет в клетке ядро?
1)осуществляет поступление веществ в клетку
2)в нем локализованы хромосомы
3)участвует в синтезе молекул иРНК
4)происходит синтез молекул ДНК
5)участвует в процессе фотосинтеза
6)участвует в синтезе молекул АТФ
2.Каково строение и функции митохондрий?
1)участвуют в расщеплении биополимеров до мономеров
2)используют энергию солнечного света в реакциях синтеза веществ
3)способствуют передвижению веществ в клетке
4)имеют кристы, на которых расположены ферменты
5)участвуют в окислении органических веществ до углекислого газа и воды
6)имеют молекулы ДНК
3. Установите соответствие
Установите соответствие
Строение и функция клетки Часть клетки
А)Обеспечивает связь между клетками растений 1)ядро
Б)регулирует процессы жизнедеятельности в клетке 2)цитоплазма
В)составляет внутреннюю среду клетки
Г)обеспечивает связь между органоидами клетки
Д)служит местом расположения органоидов
4.Какие функции в клетке выполняют хлоропласты?
1)синтез углеводов
2)синтез органических веществ из неорганических
3)синтез липидов
4)синтез белков
5)расщепление органических веществ до мономеров
6)использование энергии солнечного света для синтеза органических веществ
Е)содержит наследственную информацию
5.Как называют составную часть метаболизма, в результате которой происходит синтез сложных органических веществ?
1)анаболизм
2)энергетический обмен
3)катаболизм
4)пластический обмен
5)диссимиляция
6)ассимиляция
6.Какие утверждения являются верными?
1) Хромосомы участвуют в формировании рибосом
2) В животных клетках отсутствует гликокаликс
3)Ядерная оболочка осуществляет обмен веществ между ядром и цитоплазмой
4) Растительная и животная клетки имеют сходный химический состав
5) В синтезе АТФ участвуют митохондрии, рибосомы и хлоропласты
6) В растительных клетках вакуоли крупные, заполнены клеточным соком
7. Почему клетку считают целостной биосистемой?
Почему клетку считают целостной биосистемой?
8. Почему белки в организме человека используются в качестве источника энергии только в том случае, когда израсходованы углеводы и жиры?
Ответы 1 вариант
1-2,5,6
2-1,3,6
3-12211
4-2,4,5
6-2,5,6
7 -1. Ядро управляет процессами жизнедеятельности в клетке, т.к. в нем расположены хромосомы, а в них молекулы ДНК – носители наследственной информации;
2. Отрезок молекулы ДНК – ген контролирует синтез белка, определяющего признаки организма
8 – 1)знания о содержании гемоглобина, железа в крови необходимы, чтобы не допускать уменьшения их количества, заболевания малокровием;
2) определение состава аминокислот и их последовательности расположения в инсулине позволило использовать инсулин свиней, близкий по составу с человеческим, для больных диабетом людей.
Ответы 2 вариант
1-2,3,4
2.-4,5,6
3-212221
4.-1,2,6
5-1,4,6
6- 3,4,6
7- Все структуры клетки связаны между собой:
1. Ядро связано с рибосомами, в которые поступает иРНК, несущая наследственную информацию о синтезируемом белке;
Ядро связано с рибосомами, в которые поступает иРНК, несущая наследственную информацию о синтезируемом белке;
2.Органоиды располагаются в цитоплазме, которая способствует осуществлению связи между ними;
3. Цитоплазматическая мембрана обеспечивает поступление вещества в клетку, в ее органоиды и удаление продуктов обмена.
8- 1)Белки выполняют в организме человека разнообразные функции: каталитическую, строительную, транспортную, двигательную и др;
2)Чрезмерное расходование белков может привести к нарушению процессов жизнедеятельности в организме, нарушению названных выше функций.
Лаборатория структуры и функции рибосом
Bulygin K.N., Timofeev I.O., Malygin A.A., Graifer D.M., Meschaninova M.I., Venyaminova A.G., Krumkacheva O.A., Fedin M.V., Frolova L.Yu., Karpova G.G., Bagryanskaya E.G. Two alternative conformations of mRNA in the human ribosome during elongation and termination of translation as revealed by EPR spectroscopy. Comp. Struct. Biotech. J. 2021. V.19. P. 4702–4710. Doi: 10.1016/j.csbj.2021.08.024. IF=7. 271 (Q1).
Comp. Struct. Biotech. J. 2021. V.19. P. 4702–4710. Doi: 10.1016/j.csbj.2021.08.024. IF=7. 271 (Q1).
Gopanenko A.V., Kolobova A.V., Meschaninova M.I., Venyaminova A.G., Tupikin A.E., Kabilov M.R., Malygin A.A., Karpova G.G. Knockdown of the mRNA encoding the ribosomal protein eL38 in mammalian cells causes a substantial reorganization of genomic transcription. Biochimie. 2021a. V. 184. P. 132-142. Doi: 10.1016/j.biochi.2021.02.017. IF=4.079 (Q1).
Gopanenko A.V., Kolobova A.V., Tupikin A.E., Kabilov M.R., Malygin A.A., Karpova G.G. Knockdown of the ribosomal protein eL38 in HEK293 cells changes the translational efficiency of specific genes. Int. J. Mol. Sci. 2021b. V. 22. 4531. Doi: 10.3390/ijms22094531. IF=5.923 (Q1).
Graifer D., Karpova G. Eukaryotic protein uS19: a component of the decoding site of ribosomes and a player in human diseases. Biochem. J. 2021. V. 478. P. 997–1008. Doi: 10.1042/BCJ20200950. IF=3.857 (Q2).
Ochkasova A.
Babaylova E.S., Gopanenko A.V., Bulygin K.N., Tupikin A.E., Kabilov M.R., Malygin A.A., Karpova G.G. mRNA regions where 80S ribosomes pause during translation elongation in vivo interact with protein uS19, a component of the decoding site. Nucleic Acids Res. 2020a. V. 48. P. 912–923. Doi: 10.1093/nar/gkz1145. IF=16,97 (Q1).
Bulygin K., Malygin A., Gopanenko A., Graifer D., Karpova G. The functional role of the C-terminal tail of the human ribosomal protein uS19. Biochim. Biophys. Acta — Gene Regulatory Mechanisms. 2020. V. 1863. 194490. Doi: 10.1016/j.bbagrm.2020.194490. IF=4.49 (Q1).
Gopanenko A.V., Malygin A.A., Kossinova O.A., Tupikin A.E., Kabilov M.R., Karpova G.G. Degenerate consensus sequences in the 3′-untranslated regions of cellular mRNAs as specific motifs potentially involved in the YB-1-mediated packaging of these mRNAs.
Gopanenko A.V., Kolobova A.V., Meschaninova M.I., Venyaminova A.G., Tupikin A.E., Kabilov M.R., Malygin A.A., Karpova G.G. Knockdown of the Ribosomal Protein eL29 in Mammalian Cells Leads to Significant Changes in Gene Expression at the Transcription Level. Cells. 2020b. V. 9. 1228. Doi: 10.3390/cells9051228. IF=6.6 (Q2).
Babaylova E.S., Kolobova A.V., Gopanenko A.V., Tupikin A.E., Kabilov M.R., Malygin A.A. and Karpova G.G. The human ribosomal protein eL29 binds in vivo to the cognate mRNA by interacting with its coding sequence, as revealed from in-cell cross-linking data. Biochimie. 2020b. V. 177. P.68-77. Doi: 10.1016/j.biochi.2020.07.019. IF=4.079 (Q1).
Graifer, D. and Karpova, G. Ribosomal protein uS3 in cell biology and human disease: Latest insights and prospects. BioEssays. 2020. 2000124. Doi: 10.1002/bies.202000124. IF=4.345 (Q1).
Graifer D. M., Malygin A.A., Karpova G.G. Hydroxylation of protein constituents of the human translation system: structural aspects and functional assignments. Future Med. Chem. 2019. V. 11. P. 357-369. Doi: 10.4155/fmc-2018-0317. IF=3.08 (Q2)
M., Malygin A.A., Karpova G.G. Hydroxylation of protein constituents of the human translation system: structural aspects and functional assignments. Future Med. Chem. 2019. V. 11. P. 357-369. Doi: 10.4155/fmc-2018-0317. IF=3.08 (Q2)
Ochkasova A.S., Meschaninova M.I., Venyaminova A.G., Ivanov A.V., Graifer D.M., Karpova G.G. The human ribosome can interact with the abasic site in mRNA via a specific peptide of the uS3 protein located near the mRNA entry channel. Biochimie. 2019. V. 158. P. 117-125. Doi: 10.1016/j.biochi.2018.12.015. IF=4.079 (Q2)
Babaylova E., Malygin A., Gopanenko A., Graifer D., Karpova G. Tetrapeptide 60–63 of human ribosomal protein uS3 is crucial for translation initiation. Biochim. Biophys. Acta — Gene Regulatory Mechanisms. 2019. V. 1862. 194411. Doi: 10.1016/j.bbagrm.2019.194411. IF=4.49 (Q1)
Malygin A.A., Krumkacheva O.A., Graifer D.M., Timofeev I.O., Ochkasova A.S., Meschaninova M.I., Venyaminova A.G., Fedin M. V., Bowman M., Karpova G.G., Bagryanskaya E.G. Exploring the interactions of short RNAs with the human 40S ribosomal subunit near the mRNA entry site by EPR spectroscopy. Nucleic Acids Res. 2019. V. 47. P. 11850–11860. Doi: 10.1093/nar/gkz1039. IF=16,97 (Q1)
V., Bowman M., Karpova G.G., Bagryanskaya E.G. Exploring the interactions of short RNAs with the human 40S ribosomal subunit near the mRNA entry site by EPR spectroscopy. Nucleic Acids Res. 2019. V. 47. P. 11850–11860. Doi: 10.1093/nar/gkz1039. IF=16,97 (Q1)
Спортивная адаптология — Департамент физической культуры и спорта
Виктор Николаевич Селуянов, МФТИ, лаборатория «Информационные технологии в спорте»Развитие науки приводит к появлению моделей объекта исследования, с помощью которых познаются новые свойства или разрабатываются инновационные технологии, создается теория. Для построения ТФП необходимо построить модель идеальной клетки, мышечного волокна, мышцы, нервно-мышечного аппарата, сердечно-сосудистой системы, дыхательной системы, эндокринной и иммунной, пищеварительной.
Идеальная клетка
Все клетки животных устроены в первом приближении одинаково. Клетка, например, мышечное волокно имеет мембрану — сарколемму. В саркоплазме имеются все обычные органеллы и многочисленные ядра (мышечное волокно — многоядерная клетка). Специфическими органеллами являются миофибриллы.
Специфическими органеллами являются миофибриллы.
Структурными компонентами клетки являются:
— плазма, прозрачная жидкость с включением белков в виде ферментов метаболизма углеводов, аминокислот, жиров (липидов) и др. веществ, а также тРНК. В плазме происходит с помощью рибосом и полирибосом строительство новых органелл.
— мембраны клетки состоят из жира (40 %) и белка (60 %). Белковые включения выполняют функции: белков-переносчиков,белков-ферментов, рецепторов, структурной основы.
— митохондрии — энергетические станции клетки, занимаются ресинтезом молекул АТФ с помощью окислительного фосфорилирования. Они потребляют кислород, углеводы, жиры и выделяют углекислый газ, воду, и ресинтезированные молекулы АТФ. Продукты метаболизма также могут проникать через мембраны митохондрий цитоплазму.
— эндоплазматическая сеть — совокупность мембран, трубочек, вакуолей. Различают гранулярную и гладкую эндоплазматическую сеть. В гранулярной ЭПС происходит синтез мембранных белков и др. компонентов клетки. Гладкая ЭПС участвует в синтезе липидов, хорошо развита в клетках эндокринной системы. Возможна связь и с синтезом гликогена.
компонентов клетки. Гладкая ЭПС участвует в синтезе липидов, хорошо развита в клетках эндокринной системы. Возможна связь и с синтезом гликогена.
— комплекс Гольджи — сеть мембран, выполняющих секреторную функцию.
— лизосомы — шаровидные структуры, содержащие гидролитические ферменты (протеиназы, глюкозидазы, фосфатазы, нуклеазы, липазы). Лизосомы участвуют в процессах внутриклеточного переваривания. Особенно активным становятся лизосомы при закислении клетки, увеличении концентрации ионов водорода.
— рибосомы — элементарные аппараты синтеза белков.
— микротрубочки — фибриллярные образования, выполняют роль каркасных структур.
— глобулы гликогена — запас углеводов в клетке.
— капельки жира — запас жира в клетке.
— ядро — система генетически детерминации синтеза белка. Включает хроматин, ядрышки, кариоплазму и ядерную оболочку. Хроматин содержит ДНК, здесь образуются иРНК, в ядрышках образуется рибосомальная рРНК.
После выяснения структуры клетки можно рассмотреть физиологические процессы в клетке. С точки зрения теории физической подготовки интерес представляют процессы катаболизма и анаболизма.
С точки зрения теории физической подготовки интерес представляют процессы катаболизма и анаболизма.
Анаболизм обеспечивается ДНК и полирибосомами, активизируется анаболизм с помощью стероидных гормонов. Для физического развития особенно важны соматотропин (гормон роста) и тестостерон. Стероидные гормоны проникают только в активные клетки.
Катаболизм в клетке обеспечивается лизосомами. Они становятся особенно активными при закислении клетки — появлении в них ионов водорода. В этом случае увеличиваются поры в мембранах, ускоряются как процессы диффузии, так и активного транспорта.
Таким образом, физическое развитие активных клеток обеспечивается повышением концентрации стероидных гормонов в крови, при минимизации катаболизма (закисления крови). Для тренера появляется первые принципы построения тренировочного процесса:
1. Управление активностью ЦНС и мышц обеспечивается управление эндокринной системой (концентрацией стероидных гормонов — соматотропина и тестостерона в организме спортсменов).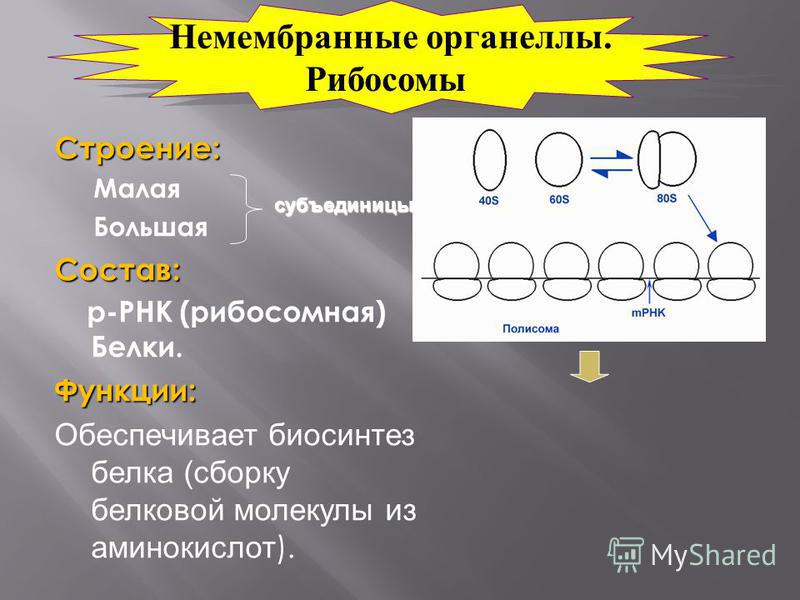
2. Управление концентрацией гормонов в крови приводит к адаптационным перестройкам в мышечных волокнах (росту миофибрилл и митохондрий).
Эндокринная система
Эндокринная система включает несколько желез: гипофиз, шишковидная, надпочечники, гонады, поджелудочная и др. При выполнении физических упражнений в коре головного мозга возникает психическое напряжение (стресс), что вызывает активизацию гипоталамуса и активизацию работы гипофиза. Передняя доля гипофиза выделяет в кровь соматотропин, тиреотропин, АКТГ, фолликулостимулирующий (ФСГ) и лютеинезирующий (ЛГ) гормоны.
Соматотропин (гормон роста) — проникая в мышечные волокна стимулирует синтез миофибрилл, активизируется синтез в сухожилиях и костной ткани.
ФСГ, ЛГ — активизируют гонады, что ведет к выделению в кровь тестостерона, который в мышечных волокнах активизирует синтез миофибрилл.
Хорошо известно, что концентрация соматотропина и тестостерона растет при выполнении силовых, скоростно-силовых и скоростных упражнений, а также от массы активных мышц. Поэтому развитие мышечных волокон наиболее интенсивно происходит при выполнении предельных и околопредельных по психическому напряжению упражнений при минимизации степени закисления (катаболизма) МВ.
Поэтому развитие мышечных волокон наиболее интенсивно происходит при выполнении предельных и околопредельных по психическому напряжению упражнений при минимизации степени закисления (катаболизма) МВ.
Отсюда следует следующий педагогический принцип спортивной тренировки:
3. Наиболее эффективными (стрессорными) являются физические упражнения, выполняемые с предельным или околопредельным психическим напряжением (интенсивностью).
Иммунная система
Иммунная система включает костный мозг, тимус, лимфатические узлы и др. Костный мозг отвечает за строительство форменных элементов крови. Важнейшими факторами нормализации функционирования костного мозга являются тестостерон и витамин В12. Поэтому стрессорные нагрузки являются стимуляторами активности и развития костного мозга, а значит иммунной системы.
Мышца
Мышца состоит из мышечных волокон. Мышечные волокна принято классифицировать на быстрые и медленные. Определить мышечную композицию можно с помощью биопсии.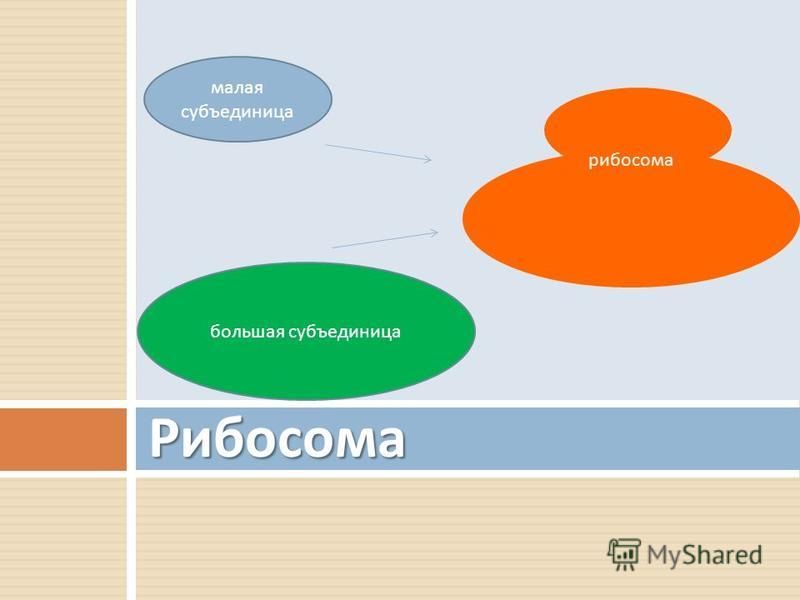 Делают биопсию из латеральной головки четырехглавой мышцы бедра. Кусочек мышечной ткани быстро замораживают, потом делают тонкие срезы и обрабатывают химически по определенной технологии. Обычно определяют активность миозиновой АТФазы — фермента разрушающего молекулу АТФ. Затем смотрят поперечные срезы мышечных волокон и видят окраску — черные, серые и белые МВ. Подсчитывают долю на определенной поверхности или из 200 единиц МВ одинаковой окраски. Эта мышечная композиция наследуется. Нельзя практически существенно менять АТФазную активность МВ. В экспериментах с электромиостимуляцией временно можно изменять АТФазную активность, но практического значения эти эксперименты пока не имеют.
Делают биопсию из латеральной головки четырехглавой мышцы бедра. Кусочек мышечной ткани быстро замораживают, потом делают тонкие срезы и обрабатывают химически по определенной технологии. Обычно определяют активность миозиновой АТФазы — фермента разрушающего молекулу АТФ. Затем смотрят поперечные срезы мышечных волокон и видят окраску — черные, серые и белые МВ. Подсчитывают долю на определенной поверхности или из 200 единиц МВ одинаковой окраски. Эта мышечная композиция наследуется. Нельзя практически существенно менять АТФазную активность МВ. В экспериментах с электромиостимуляцией временно можно изменять АТФазную активность, но практического значения эти эксперименты пока не имеют.
Важно отметить, что каждая мышца имеет свою собственную унаследованную мышечную композицию, поэтому взятие биопсии из одной мышцы не может дать полной картины одаренности спортсмена. Педагогическое наблюдение и тестирование может дать более полную информацию о таланте спортсмена, чем лабораторное обследование. Например, набор тестов для легкоатлетов — прыжок с места на двух ногах, многоскоки с ноги на ногу, метание ядра вперед и назад, метание гранаты, позволят в сравнении с нормами оценить одаренность различных мышечных групп у данного спортсмена. Если большинство мальчиков 11–12 лет прыгает в длину с места на 200 см, а один из них прыгнул на 250 см, то нет сомнений, что этот мальчик имеет в мышцах разгибателях суставов ног высокий процент быстрых МВ.
Например, набор тестов для легкоатлетов — прыжок с места на двух ногах, многоскоки с ноги на ногу, метание ядра вперед и назад, метание гранаты, позволят в сравнении с нормами оценить одаренность различных мышечных групп у данного спортсмена. Если большинство мальчиков 11–12 лет прыгает в длину с места на 200 см, а один из них прыгнул на 250 см, то нет сомнений, что этот мальчик имеет в мышцах разгибателях суставов ног высокий процент быстрых МВ.
Существует способ классификации МВ по другим ферментам. Особый интерес представляет классификация МВ по активности ферментов митохондрий. В этом случае говорят об окислительных, промежуточных и гликолитических МВ. Эта мышечная композиция не наследуется, поскольку окислительные мышечные волокна легко превращаются в гликолитические при прекращении тренировок. Митохондрии разрушаются, стареют и через 20 дней от 100 % остается только 50 % и т. д. Спортивная форма теряется без тренировок очень быстро.
Мышечное волокно имеет специфические органеллы — миофибриллы.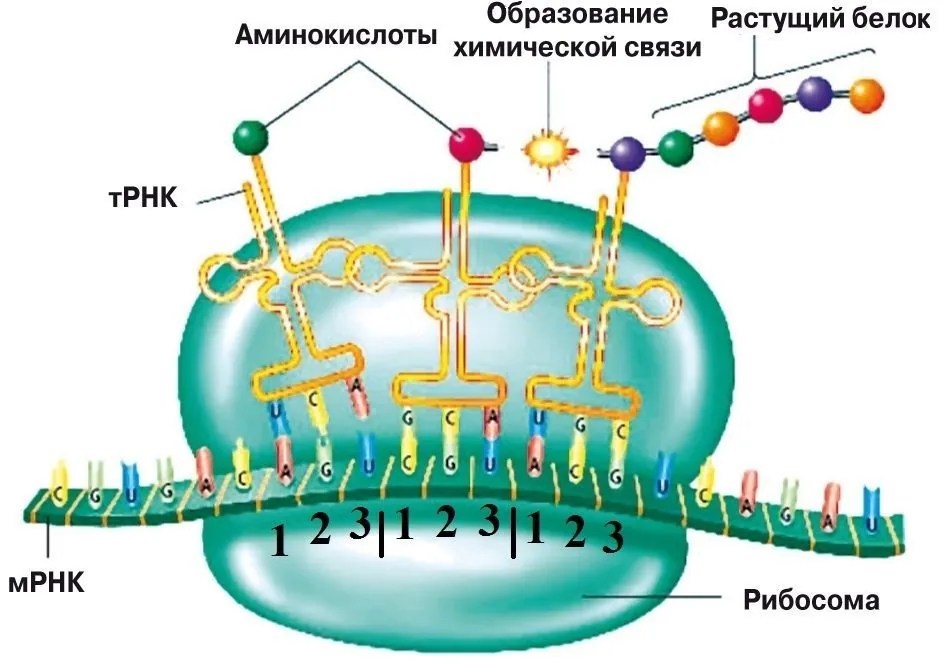 Миофибриллы у всех животных одинаковые по строению и различаются только по длине (количеству саркомеров). Поперечное сечение всех миофибрилл одинаковое. Поэтому сила сокращения мышечного волокна зависит от количества миофибрилл в нем.
Миофибриллы у всех животных одинаковые по строению и различаются только по длине (количеству саркомеров). Поперечное сечение всех миофибрилл одинаковое. Поэтому сила сокращения мышечного волокна зависит от количества миофибрилл в нем.
Саркомер — последовательный компонент миофибриллы, состоит из нитей актина и миозина. Из миозина выходят веточки с головками. Головка миозина является одновременно ферментом для разрушения молекул АТФ и КрФ. При разрушении молекулы АТФ образуется АДФ, Ф, Н и энергия. Для ресинтеза молекулы АТФ нужна энергия, она берется из молекулы КрФ, которая при разрушении преобразуется в свободный Кр, неорганический фосфат (Ф) и энергию.
Сокращение саркомера и миофибриллы возникает при выходе из цистерн кальция. Он прикрепляется к активным центрам актина и освобождает их для создания мостика между актином и миозином. Головка миозина, при прикреплении к актину, поворачивается на 45 градусов, что обеспечивает скольжение нитей по отношению друг к другу. Отрыв головки миозина от актина требует затраты энергии, которая берется из процесса разрушения молекулы АТФ ферментом — миозиновой АТФазой.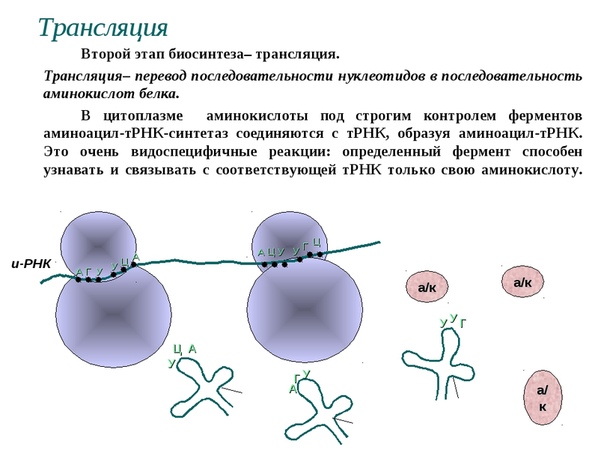 Вслед за этим креатинфосфокиназа разрушает КрФ и энергия этой молекулы идет на ресинтез АТФ. Свободный креатин и неорганический фосфат проникает сквозь миофибриллу к митохондриям или ферментам гликолиза и приводят к запуску гликолиза и окислительному фосфорилированию.
Вслед за этим креатинфосфокиназа разрушает КрФ и энергия этой молекулы идет на ресинтез АТФ. Свободный креатин и неорганический фосфат проникает сквозь миофибриллу к митохондриям или ферментам гликолиза и приводят к запуску гликолиза и окислительному фосфорилированию.
Выход кальция из цистерн происходит при активации МВ. После прекращения электрической стимуляции МВ в цистернах закрываются поры, а кальциевые насосы продолжают закачивать атомы кальция в цистерны. Через 50–100 мс большая часть ионов кальция закачивается обратно в цистерны. Этот процесс называют расслаблением мышцы.
Молекулы АТФ крупные, поэтому очень медленно перемещаются по МВ. Посредником между миофибриллами и митохондриями по доставке энергии являются молекулы КрФ. Эти молекулы маленькие и легко перемещаются по МВ. Российские ученые (Сакс с соав., 1977) назвали этот механизм креатинфосфатным челноком.
Поэтому прием креатина с пищей позволяет повысить его концентрацию в МВ. В результате существенно ускоряются метаболические процессы в МВ.
Модель биоэнергетических процессов в мышечных волокнах разного типа
В гликолитических мышечных волокнах имеется запас молекул АТФ в миофибриллах, запас молекул АТФ около митохондрий, запас молекул АТФ в саркоплазме. Имеется запас молекул КрФ, глобул гликогена и капелек жира. Масса митохондрий в гликолитических МВ (ГМВ) мала, поскольку необходима только для жизни этих клеток в покое.
Активизация биохимических процессов начинается с момента прохождения электрических импульсов по мембранам МВ. Открываются поры в цистернах, выходит кальций в саркоплазму, кальций прикрепляется к актину, образуются актин-миозиновые мостики, тратится АТФ и КрФ. Свободный креатин и неорганический фосфат выходят из миофибрилл и используют энергию саркоплазматических молекул АТФ для ресинтеза КрФ. Молекулы АТФ ресинтезируются в ходе анаэробного гликолиза. Гликолиз начинается с разрушения молекулы глюкозы или гликогена, а заканчивается образованием пирувата. Пируват, из-за отсутствия митохондрий, преобразуется в лактат.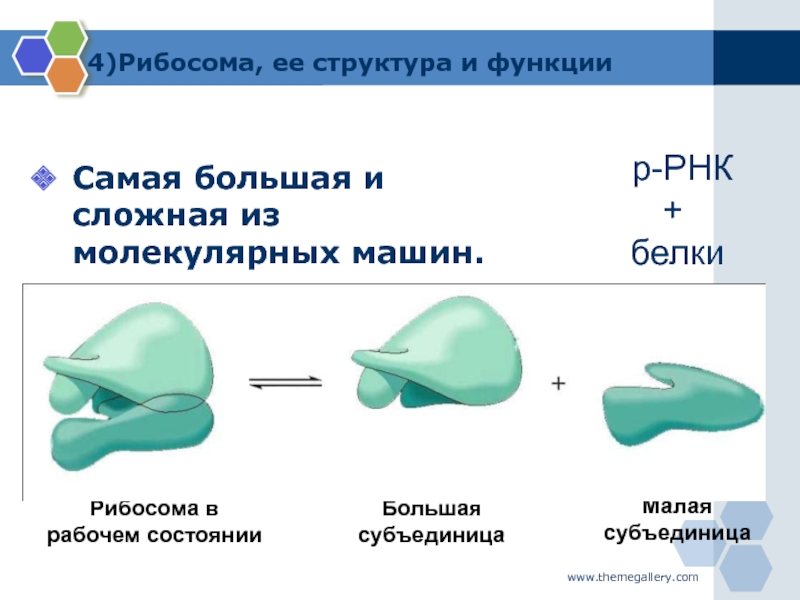 Соединение аниона лактата с протоном водорода приводит к образованию молочной кислоты, которая может в таком виде выходить в кровь. В крови молекула молочной кислоты диссоциирует, поэтому между концентрацией водорода и лактата имеется высокая корреляционная связь (R = 0,99).
Соединение аниона лактата с протоном водорода приводит к образованию молочной кислоты, которая может в таком виде выходить в кровь. В крови молекула молочной кислоты диссоциирует, поэтому между концентрацией водорода и лактата имеется высокая корреляционная связь (R = 0,99).
Ионы водорода образуются при распаде саркоплазматических и других молекул АТФ.
Активность ГМВ приводит к накоплению в саркоплазме продуктов метаболизма Н, Кр, Ф, Ла, Пир и др.
Запасов миофибриллярных АТФ хватает на 1–2 с, КрФ 5–20 с (в зависимости от режима сокращения и расслабления МВ). Затем усиливается гликолиз, но мощность его не более 50 % от максимума, а из-за накопления ионов водорода нарушается процесс образования актин-миозиновых мостиков и через 30 с они практически полностью перестают образовываться. Это явление обычно определяют как локальное мышечное утомление. ГМВ определяют как утомляемые мышечные волокна.
Окислительные мышечные волокна устроены точно также как и гликолитические мышечные волокна. Основное различие связано с массой митохондрий. В ОМВ масса митохондрий находится в предельном соотношении с миофибриллами, что обеспечивает максимальное потребление кислорода одним килограммом ОМВ около 0,3 л/мин.
Основное различие связано с массой митохондрий. В ОМВ масса митохондрий находится в предельном соотношении с миофибриллами, что обеспечивает максимальное потребление кислорода одним килограммом ОМВ около 0,3 л/мин.
Активизация ОМВ приводит к образованию актин — миозиновых мостиков и затратам энергии молекул АТФ. Концентрация миофибриллярных молекул АТФ поддерживается КрФ. Поддержание концентрации КрФ обеспечивается двумя путями:
— молекулами АТФ ресинтезируемыми в митохондриях,
— молекулами АТФ ресинтезируемыми в аэробном гликолизе.
Этот процесс развивается в течение 45–60 с. К этому времени одновременно может идти как гликолиз, так и окисление жиров. Но по мере функционирования митохондрий в саркоплазме накапливается цитрат, поэтому начинается ингибирование ферментов гликолиза и ОМВ полностью переходит на липолиз.
Липолиз использует запасы жира в капельках, запаса этого жира у нормальных людей хватает на 30–50 мин. Жирные кислоты крови медленно поступают в МВ, поэтому не могут полностью обеспечить мышечную деятельность высокой интенсивности.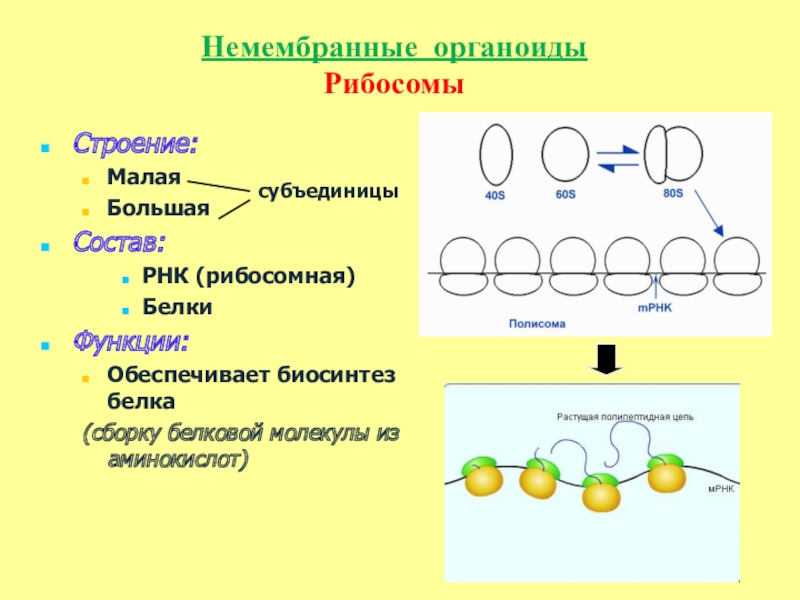
Митохондрии поглощают АДФ, Ф, кислород, пируват, жирные кислоты, глицерол, ионы водорода и выделяют ресинтезированные молекулы АТФ, углекислый газ и воду. Поэтому ОМВ не закисляются, не утомляются.
Окисление жиров в ОМВ может прекратиться, если в саркоплазме появятся ионы лактата. В этом случае окисление жиров ингибируется, а лактат становится субстратом окисления. Лактат с помощью лактатдегидрогеназы сердечного типа превращается в пируват, а тот, через ацетил-коэнзима, поступает в митохондрии. Пируват также начинает образовываться в ходе гликолиза из глюкозы и гликогена.
Лактат может попасть в ОМВ только при одновременном функционировании ГМВ и ОМВ.
Биомеханические свойства мышечных волокон связаны с эмпирическими законами:
— «сила — длина»,
— «сила — скорость»,
— «сила — время активации»,
— «сила — время расслабления»,
— «сила — энергия упругой деформации».
Эти законы надо учитывать при анализе соревновательной деятельности.
Нервно-мышечный аппарат
Сердце и кровообращение
Деятельность сердца и сосудов обеспечивает кровообращение — непрерывное движение крови в организме. В своем движении кровь проходит по большому и малому кругам кровообращения. Большой круг начинается от левого желудочка сердца, включает аорту, отходящие от нее артерии, артериолы, капилляры, вены и заканчивается полыми венами, впадающими в правое предсердие. Малый круг кровообращения начинается от правого желудочка, далее — легочная артерия, легочные артериолы, капилляры, вены, легочная вена, впадающая в левое предсердие.
Функцией сердца является ритмическое нагнетание в артерии крови. Сокращение мышечных волокон (миокардиоцитов) стенок предсердий и желудочков называют систолой, а расслабление — диастолой.
Количество крови, выбрасываемое левым желудочком сердца в минуту, называется минутным объемом кровотока (МОК). В покое он составляет в норме 4–5 л/мин. Разделив МОК на частоту сердечных сокращений в минуту (ЧСС), можно получить ударный объем кровотока или сердца (УОС). В покое он составляет 60–70 мл крови за удар.
В покое он составляет 60–70 мл крови за удар.
Частота и сила сокращений зависит от нервной, гуморальной (адреналин) регуляции и биомеханических условий работы желудочков.
При вертикальном положении тела имеется механический фактор — сила тяжести крови, затрудняющий работу сердца, приток венозной крови к правому предсердию. В нижних конечностях скапливается до 300–800 мл крови.
При мышечной работе минутный объем кровотока растет за счет увеличения ЧСС и УОС. Заметим, что УОС достигает максимума при ЧСС 120–150 уд/мин, а максимум ЧСС бывает при 180–200 и более уд/мин. МОК достигает 18–25 л/мин у нетренированных лиц при достижении максимальной ЧСС (Физиология мышечной деятельности, 1982). В этот момент сердце доставляет организму максимум кислорода:
VO2 = МОК×Нв×0,00134 = 20×160×0,00134 = 4,288 л/мин
Здесь Нв — содержание гемоглобина в крови, г/л крови; 0,00134 — кислородная емкость гемоглобина в артериальной крови.
Если бы мышцы нетренированного человека могли бы полностью использовать весь приходящий кислород, то этот человек мог бы стать мастером спорта по бегу на длинные дистанции (бегуны мирового класса потребляют кислород на уровне анаэробного порога 4,0–4,5 л/мин).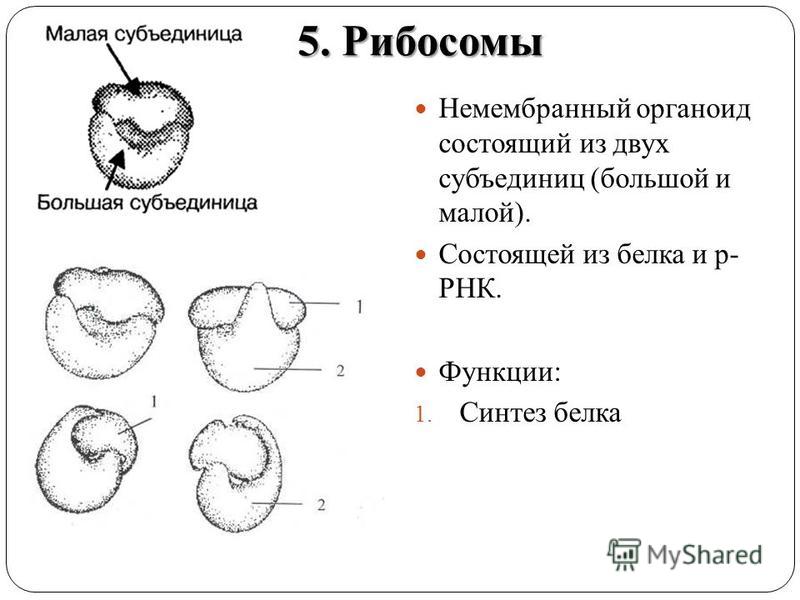 Однако, в мышцах мало митохондрий, поэтому максимальное потребление кислорода (МПК) у нетренированного мужчины составляет 3–3,5 л/мин (45–50 мл/кг/мин), у нетренированной женщины — 2–2,2 л/мин (40–45 мл/кг/мин). На уровне анаэробного порога потребление кислорода составляет в среднем 60–70 % МПК, что в 2 раза меньше, чем у мастеров спорта (Аулик И. В., 1990; Спортивная физиология, 1986).
Однако, в мышцах мало митохондрий, поэтому максимальное потребление кислорода (МПК) у нетренированного мужчины составляет 3–3,5 л/мин (45–50 мл/кг/мин), у нетренированной женщины — 2–2,2 л/мин (40–45 мл/кг/мин). На уровне анаэробного порога потребление кислорода составляет в среднем 60–70 % МПК, что в 2 раза меньше, чем у мастеров спорта (Аулик И. В., 1990; Спортивная физиология, 1986).
Кровеносные сосуды
Сердце при сокращении (систоле) выталкивает кровь в аорту и легочную артерию, растягивая их и создавая давление крови (Р). Движению крови препятствует сосудистое (периферическое) сопротивление. Максимальное давление называется систолическим артериальным давлением (САД), минимальное — диастолическим артериальным давлением (ДАД). В условиях покоя в норме САД = 120 мм рт. ст., ДАД = 80 мм рт. ст. Между растяжимостью (эластичностью) артерий и давлением крови в сосудах имеется обратная зависимость. Чем растяжимее артерии, тем больше крови может быть нагнетено без увеличения артериального давления (АД). При артериосклерозе стенка аорты менее эластична, поэтому надо сильнее нагнетать кровь (тот же объем крови, как у здорового человека), чтобы она дальше прошла по сосудам. Сопротивление кровотоку зависит от вязкости крови и, главным образом, от просвета сосудов. Увеличение напряжения мышц вызывает перекрытие сосудов — увеличение сосудистого сопротивления. Накопление в крови мышц продуктов анаэробных процессов (рН, рСО2, уменьшение рО2 и др. ) приводит к рабочей гиперемии — расширению кровеносных сосудов, т. е. уменьшению АД (Физиология мышечной деятельности, 1981).
При артериосклерозе стенка аорты менее эластична, поэтому надо сильнее нагнетать кровь (тот же объем крови, как у здорового человека), чтобы она дальше прошла по сосудам. Сопротивление кровотоку зависит от вязкости крови и, главным образом, от просвета сосудов. Увеличение напряжения мышц вызывает перекрытие сосудов — увеличение сосудистого сопротивления. Накопление в крови мышц продуктов анаэробных процессов (рН, рСО2, уменьшение рО2 и др. ) приводит к рабочей гиперемии — расширению кровеносных сосудов, т. е. уменьшению АД (Физиология мышечной деятельности, 1981).
Нервный контроль и гуморальный наиболее важны в управлении функциями сосудистой системы. Симпатические нервные волокна иннервируют гладкие мышцы в стенках артериальных и венозных сосудов, особенно мелких. Кровоток через капилляры определяется местными факторами.
Сосудосуживающий эффект связан с выделением из окончаний адренэргических симпатических волокон норадреналина, который вызывает эффект сокращения гладкомышечных сосудистых клеток, имеющих альфа-рецепторы на мембране (почки, печень, желудочно-кишечный тракт, легкие, кожа). Сосудорасширительный эффект (вазодилятацию) вызывает действие норадреналина и адреналина на гладкомышечные клетки, имеющие бета-рецепторы (сосуды скелетных мышц, сердца, надпочечников) (Физиология человека, 1998).
Сосудорасширительный эффект (вазодилятацию) вызывает действие норадреналина и адреналина на гладкомышечные клетки, имеющие бета-рецепторы (сосуды скелетных мышц, сердца, надпочечников) (Физиология человека, 1998).
Реакция организма спортсмена на упражнения разной интенсивности
Каждый спортсмен может себя протестировать, участвуя в соревнованиях на различные дистанции. Зная скорость бега и время можно построить график личных рекордов. Если ось времени представлена как логарифм от времени, то получается график из двух прямых. Первая прямая характеризует максимальные скоростно-силовые способности, вторая — наклонная прямая, характеризует аэробные возможности спортсмена.
Таким образом, никаких 4 или 5 зон мощности у отдельных спортсменов нет, поэтому классическое представлении о зонах мощности на кривой мировых рекордов является ошибочным. На полулогарифмическом графике мировых рекордов по легкой атлетике можно видеть четыре прямые соответствующие 4 лучшим спортсменам мира, т. е. каждый прямолинейный отрезок представляет индивидуальную кривую рекордов. Первая — спринтеров, вторая бегунов на средние дистанции, третья — бегунов на длинные дистанции и четвертая — марафонцев.
е. каждый прямолинейный отрезок представляет индивидуальную кривую рекордов. Первая — спринтеров, вторая бегунов на средние дистанции, третья — бегунов на длинные дистанции и четвертая — марафонцев.
НОБЕЛЕВСКАЯ ПРЕМИЯ ПО ХИМИИ 2009 ГОДА. МОЛЕКУЛЯРНАЯ ФАБРИКА ИЗ ДОБЕЛКОВОГО МИРА
В этом году Нобелевская премия по химии присуждена американцу Тому Стайцу из Йельского университета, британскому учёному Венкатраману Рамакришнану из лаборатории молекулярной биологии в Кембридже и профессору Института Вейцмана (Израиль) Аде Йонат. Эти исследователи определили структуру рибосомы.Наука и жизнь // Иллюстрации
Венкатраман Рамакришнан.
Клетка содержит десятки тысяч рибосом размером около 25 нм. Некоторые из них прикреплены к мембранам эндоплазматической сети, другие — локализованы в цитоплазме.
Для кристаллографии рибосом используется рентгеновское синхротронное излучение.
Атомарная структура бактериальной рибосомы. Молекулы рибосомных РНК окрашены в оранжевый цвет, белки малой субчастицы — в голубой, белки большой субчастицы — в зелёный.
Молекулы рибосомных РНК окрашены в оранжевый цвет, белки малой субчастицы — в голубой, белки большой субчастицы — в зелёный.
Работа рибосомы происходит в несколько стадий: связывание аминоацил-тРНК, перенос пептида с пептидил-тРНК на аминоацил-тРНК, транслокация (перемещение мРНК на один кодон и тРНК из А-участка в Р-участок), уход «пустой» тРНК.
‹
›
Что такое рибосома и как она работает? Зачем нужно её изучать и, в частности, почему было так важно определить структуру этого громадного макромолекулярного комплекса? Как можно использовать полученные знания на практике? Постараемся ответить на эти вопросы.
НУКЛЕОТИДНЫЙ И АМИНОКИСЛОТНЫЙ «АЛФАВИТЫ»
Наверное, все слышали, что информация о том, как построить организм, хранится в ДНК — своеобразной «библиотеке» живой клетки. Белки — это главные молекулярные «работники» в клетке: они осуществляют превращение веществ и энергии, отвечают за движение клетки, образуют её «скелет», участвуют в передаче наследственной информации, выполняют множество других функций. Для своей жизнедеятельности в каждый момент времени клетка использует лишь небольшую часть генетической информации. «Текущие указания» копируются с отдельных участков ДНК в виде коротких «сообщений» — молекул мРНК (матричной РНК).
Для своей жизнедеятельности в каждый момент времени клетка использует лишь небольшую часть генетической информации. «Текущие указания» копируются с отдельных участков ДНК в виде коротких «сообщений» — молекул мРНК (матричной РНК).
Рибосома — небольшое внутриклеточное образование неправильной формы, составленное из двух неравных «половинок». Она выполняет очень важную функцию: «читает» мРНК-сообщения, а затем по этим «сообщениям» синтезирует белковые молекулы. Такой процесс называется трансляцией. Задача, стоящая перед рибосомой, очень сложная. Ведь белки состоят не из нуклеотидов, а из принципиально других строительных блоков — аминокислот. Причём нуклеотидов всего четыре, а аминокислот — двадцать.
Как же информация, содержащаяся в четырёх нуклеотидах, превращается в аминокислотный код? Дело в том, что каждая аминокислота зашифрована тремя «буквами» — нуклеотидами. Из четырёх букв нуклеотидного алфавита можно составить 64 трёхбуквенных «слова» — кодона.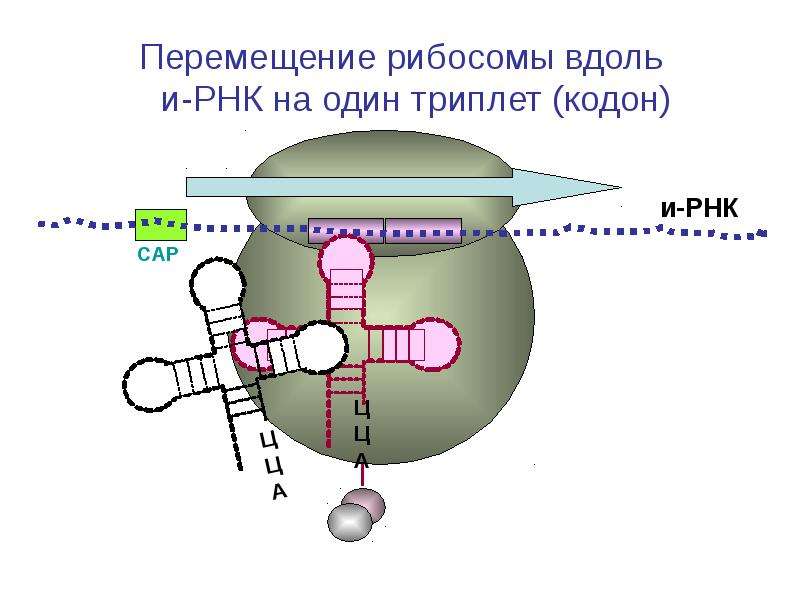 Каждому кодону соответствует своя специфичная аминокислота. Поскольку кодонов (64) больше, чем аминокислот (20), некоторые аминокислоты кодируются несколькими кодонами. За расшифровку генетического кода Маршаллу Ниренбергу, Гобинду Коране и Роберту Холли была присуждена Нобелевская премия по медицине 1968 года.
Каждому кодону соответствует своя специфичная аминокислота. Поскольку кодонов (64) больше, чем аминокислот (20), некоторые аминокислоты кодируются несколькими кодонами. За расшифровку генетического кода Маршаллу Ниренбергу, Гобинду Коране и Роберту Холли была присуждена Нобелевская премия по медицине 1968 года.
ТРАНСЛЯЦИЯ В РИБОСОМЕ
По каким признакам рибосома узнаёт кодоны, как она «помнит», какому кодону какая аминокислота соответствует? Как это ни парадоксально, рибосома сама ничего не «знает» и не «помнит». В клетке имеются специальные небольшие молекулы РНК, называемые транспортными или тРНК, которые переносят «на себе» аминокислоты и распознают соответствующий этой аминокислоте кодон на молекуле мРНК. Каждая тРНК переносит только «свою» аминокислоту. Идея о том, что тРНК могут быть своеобразным «адаптером» между кодоном и аминокислотой, была предложена в пятидесятые годы американским учёным, будущим нобелевским лауреатом Френсисом Криком.
Трансляция генетической информации в рибосоме происходит так. Специальные ферменты прочной химической связью «пришивают» к молекуле тРНК соответствующую аминокислоту. При этом тРНК сворачивается в структуру, похожую на рогалик или на букву Г. На концах такого «рогалика» находятся аминокислота и так называемый антикодон. Антикодон распознаёт соответствующий кодон в мРНК, таким образом доставляя аминокислоту к месту «сборки» белковой молекулы.
Специальные ферменты прочной химической связью «пришивают» к молекуле тРНК соответствующую аминокислоту. При этом тРНК сворачивается в структуру, похожую на рогалик или на букву Г. На концах такого «рогалика» находятся аминокислота и так называемый антикодон. Антикодон распознаёт соответствующий кодон в мРНК, таким образом доставляя аминокислоту к месту «сборки» белковой молекулы.
По сути, тРНК служат клеточными «переводчиками» с нуклеотидного «языка» на аминокислотный. Работа рибосомы сводится к тому, чтобы подобрать молекулу тРНК, соответствующую той аминокислоте, которая необходима для построения белковой цепочки в данный момент. Этот процесс считывания информации называется декодированием. Его осуществляет меньшая из двух неравных субчастиц, из которых состоит рибосома. На большей субчастице происходит сшивание аминокислот в цепочку — новую белковую молекулу.
КАК УСТРОЕНА РИБОСОМА. НАЧАЛО ПУТИ
Как рибосома справляется с таким огромным числом взаимодействующих молекул и как устроен этот молекулярный «завод»? С химической точки зрения рибосома представляет собой смесь РНК и белков. Она состоит из трёх разновидностей молекул РНК, с рибосомными РНК связаны многочисленные рибосомные белки. У бактерий в состав малой субчастицы входит 21 уникальный белок, а большой — 33. Общая масса рибосомы измеряется мегадальтонами. В отличие от сравнимых по массе вирусных частиц рибосома не имеет никаких элементов симметрии, что чрезвычайно усложняет изучение её структуры.
Она состоит из трёх разновидностей молекул РНК, с рибосомными РНК связаны многочисленные рибосомные белки. У бактерий в состав малой субчастицы входит 21 уникальный белок, а большой — 33. Общая масса рибосомы измеряется мегадальтонами. В отличие от сравнимых по массе вирусных частиц рибосома не имеет никаких элементов симметрии, что чрезвычайно усложняет изучение её структуры.
Исследовать устройство рибосомы учёные начали давно. Поначалу для этого использовали метод электронной микроскопии, который в СССР успешно применяли член-корреспондент РАН Николай Андреевич Киселёв (заведующий лабораторией Института кристаллографии им.
В. А. Шубникова РАН) и профессор Виктор Дмитриевич Васильев (Институт белка РАН). В настоящее время используется усовершенствованная методика, получившая название криоэлектронной микроскопии. С помощью этого метода в конце 90-х годов ХХ века две ведущие лаборатории — Марина Ван Хилла в Англии и Иохима Франка в США — преодолели рубеж разрешающей способности 20 ангстрем. Сейчас разрешение криоэлектронной микроскопии приближается к 5—7 ангстремам. Стало возможным «увидеть» спирали РНК и отдельные домены белков, но всё же этого недостаточно, чтобы понять детали строения рибосомы.
Сейчас разрешение криоэлектронной микроскопии приближается к 5—7 ангстремам. Стало возможным «увидеть» спирали РНК и отдельные домены белков, но всё же этого недостаточно, чтобы понять детали строения рибосомы.
Одновременно проводились химические исследования структуры рибосомы. Так, в лаборатории академика Алексея Алексеевича Богданова, в группе профессора Ольги Анатольевны Донцовой (химический факультет МГУ), с помощью химических сшивок было точно определено окружение молекул мРНК в рибосоме. В Германии Ричард Бримакомб (Институт молекулярной генетики им. Макса Планка), сопоставляя результаты криоэлектронной микроскопии и химического сшивания, создал модель структуры рибосомы, как оказалось в дальнейшем, достаточно точную.
Эти работы, безусловно, были полезны для понимания структуры и функции рибосомы. Однако в конце 1990-х всё сообщество учёных, изучающих рибосомы, жило в предчувствии новой эры — эры, когда структура рибосомы будет определена с атомарным разрешением. Такую точность мог дать только рентгеноструктурный анализ. Этот метод успешно применялся для определения пространственных структур белков и небольших РНК, но для того, чтобы «замахнуться» на рибосому, уникальный по сложности объект, нужна была большая смелость. Такая смелость зародилась в сердцах учёных более двадцати лет назад в двух лабораториях — Ады Йонат и Александра Сергеевича Спирина.
Такую точность мог дать только рентгеноструктурный анализ. Этот метод успешно применялся для определения пространственных структур белков и небольших РНК, но для того, чтобы «замахнуться» на рибосому, уникальный по сложности объект, нужна была большая смелость. Такая смелость зародилась в сердцах учёных более двадцати лет назад в двух лабораториях — Ады Йонат и Александра Сергеевича Спирина.
В лаборатории Спирина Марат Юсупов получил кристаллы рибосомных субчастиц, пригодные для рентгеноструктурного анализа. Увы, в нашей стране у него не было шансов определить структуру рибосом — в первую очередь из-за отсутствия необходимого сверхдорогостоящего оборудования. Чтобы продолжить исследования, Юсупов вынужден был уехать в лабораторию Ноллера в США, где вместе с женой Гульнарой, так же как и нынешние нобелевские лауреаты, определил структуру рибосомы. Можно, конечно, в очередной раз порассуждать о том, могла ли структура рибосомы быть определена в России. Учитывая то, что происходило с нашей наукой в 1990-е годы, да и происходит в настоящее время, определить структуру рибосомы в России было просто невозможно. И виноват тут конечно же не Нобелевский комитет.
И виноват тут конечно же не Нобелевский комитет.
НОБЕЛЕВСКАЯ ГОНКА ЗА СТРУКТУРОЙ
За рубежом исследования структуры рибосомы продолжались. Долгое время усилия Ады Йонат вызывали сочувственные улыбки рибосомологов. Определение атомарной структуры рибосомы в конце 1980-х и даже в начале 1990-х казалось романтической мечтой. В это время Том Стайц и Венкатраман Рамакришнан были заняты определением пространственных структур более простых макромолекул. И вот во второй половине 1990-х стало ясно, что приборная, вычислительная и методическая база рентгеноструктурного анализа «доросла» до того уровня, когда определение атомарной структуры рибосомы оказалось реальностью. Именно тогда началась «великая гонка» за структурой рибосомы.
Эта гонка увенчалась ошеломляющим успехом. Сразу четыре научные группы почти одновременно опубликовали структуру рибосомных субчастиц. Группы Йонат (журнал «Cell», статья получена 23 июня 2000 года) и Рамакришнана (журнал «Nature», статья получена 14 июля 2000 года) опубликовали структуры малой субчастицы рибосомы термофильной бактерии Thermus thermophilus c разрешением около 3 ангстрем.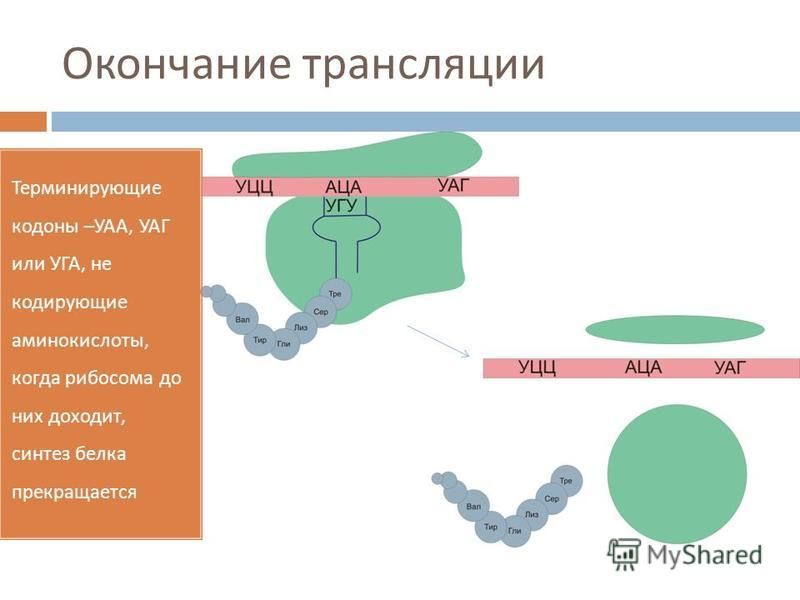 Группа Стайца определила структуру большой субчастицы рибосомы галофильной археи Haloarcula marismotrui с разрешением 2,4 ангстрема (журнал «Science», статья получена 29 июня 2000 года), а группа Ноллера определила структуру всей рибосомы, то есть комплекса обеих субчастиц, мРНК и трёх тРНК с разрешением 5,5 ангстрема (журнал «Science», статья получена 21 февраля 2001 года). Всего лишь полугодовое отставание и проигрыш в разрешении стоили Ноллеру исключения из списка нобелевских лауреатов. Пожалуй, если кто и может жаловаться на несправедливость Нобелевского комитета, так это именно Харри Ноллер. Ведь кроме определения структуры на его счету десятки важнейших открытий в области работы рибосомы.
Группа Стайца определила структуру большой субчастицы рибосомы галофильной археи Haloarcula marismotrui с разрешением 2,4 ангстрема (журнал «Science», статья получена 29 июня 2000 года), а группа Ноллера определила структуру всей рибосомы, то есть комплекса обеих субчастиц, мРНК и трёх тРНК с разрешением 5,5 ангстрема (журнал «Science», статья получена 21 февраля 2001 года). Всего лишь полугодовое отставание и проигрыш в разрешении стоили Ноллеру исключения из списка нобелевских лауреатов. Пожалуй, если кто и может жаловаться на несправедливость Нобелевского комитета, так это именно Харри Ноллер. Ведь кроме определения структуры на его счету десятки важнейших открытий в области работы рибосомы.
ЗАЧЕМ НУЖНО ЗНАТЬ СТРУКТУРУ РИБОСОМЫ
Что ж, структуру рибосомы было определить сложно. Другой вопрос — был ли в этом какой-либо смысл. Бесспорно, структура рибосомы не просто обогатила наше понимание взаимодействия РНК и белков, она подняла это понимание на принципиально новый уровень. Подтвердилось то, о чём учёные догадывались уже давно: в рибосоме не только структурную, но и все другие основные функции выполняет РНК. Почему это интересно? Это доказывает то, что рибосома пришла к нам из добелкового, так называемого РНК-мира.
Подтвердилось то, о чём учёные догадывались уже давно: в рибосоме не только структурную, но и все другие основные функции выполняет РНК. Почему это интересно? Это доказывает то, что рибосома пришла к нам из добелкового, так называемого РНК-мира.
Долгое время учёным было непонятно, в какой последовательности возникли механизмы передачи наследственной информации в живой клетке. ДНК не может копировать сама себя, для этого ей требуются белковые молекулы. В свою очередь, для синтеза белков требуется кодирующая их РНК, считываемая с ДНК также с помощью белков. В результате все три основные биомолекулы оказываются связанными между собой причинно-следственными связями.
Выходом из этого парадокса стала гипотеза РНК-мира, выдвигавшаяся именитыми учёными несколько раз и получившая первое экспериментальное подтверждение после открытия каталитических РНК американским химиком Томасом Чеком и канадцем Сидни Альтманом. За это открытие обоим была присуждена в 1989 году Нобелевская премия (см. Григорович С. // Наука и жизнь, 2004, № 2).
Григорович С. // Наука и жизнь, 2004, № 2).
Идея РНК-мира заключается в том, что, до того как возникли белки и позднее ДНК, и каталитические функции, и функции хранения наследственной информации выполняли молекулы РНК. Сейчас благодаря открытию новых нобелевских лауреатов стало окончательно ясно, что рибосома пришла к нам из РНК-мира. Собственно, её возникновение и ознаменовало начало белкового мира, ведь рибосома — это построенная на основе РНК машина для производства белков.
Но это всё теория науки. А может ли расшифровка структуры рибосомы быть полезной людям сегодня? Оказывается, её практический эффект очень значителен. Дело в том, что рибосома — это мишень воздействия для большого числа антибиотиков. Сразу после опубликования структуры рибосомных субчастиц научные группы нынешних нобелевских лауреатов начали изучать структуры комплексов рибосомы с различными антибиотиками.
На основе этих работ стало возможным проектировать и создавать новые антибиотики, влияющие на работу рибосомы. Для этого в США создана компания «Rib-X», научными консультантами которой стали нобелевские лауреаты 2009 года Том Стайц и Венки Рамакришнан. Компания уже объявила о том, что два новых антибиотика вышли на последнюю стадию клинических испытаний.
Для этого в США создана компания «Rib-X», научными консультантами которой стали нобелевские лауреаты 2009 года Том Стайц и Венки Рамакришнан. Компания уже объявила о том, что два новых антибиотика вышли на последнюю стадию клинических испытаний.
***
Определение структуры рибосомы с атомарным разрешением — это безусловный прорыв в области фундаментальной науки, а также уникальная возможность конструировать и создавать новые лекарственные препараты. Можно ещё раз восхититься этим достижением нобелевских лауреатов и пожелать им дальнейших открытий.
РАБОТА РИБОСОМЫ: ОТ ТРАНСЛЯЦИИ ДО ТРАНСЛОКАЦИИ
Механизм трансляции довольно сложен. Вкратце, в процессе работы рибосомы тРНК проходит по щели между двумя рибосомными субчастицами, последовательно попадая в три тРНК-связывающих «кармана». В первом «кармане» (А-участок) связывается комплекс тРНК и аминокислоты (аминоацил-тРНК), во втором «кармане» (Р-участок) находится тРНК, пришедшая на рибосому при считывании предыдущего кодона (пептидил-тРНК). С этой тРНК связана не только «своя» аминокислота, но и вся белковая молекула, синтезированная на данный момент. Собственно процесс сшивки цепочки аминокислот заключается в переносе растущего пептида с этой тРНК на только что прибывшую в первый «карман» комплекса тРНК с аминокислотой. При этом вновь прибывшая тРНК присоединяет к себе весь синтезированный рибосомой белок. Та тРНК, которая несла белковую молекулу, становится «пустой».
С этой тРНК связана не только «своя» аминокислота, но и вся белковая молекула, синтезированная на данный момент. Собственно процесс сшивки цепочки аминокислот заключается в переносе растущего пептида с этой тРНК на только что прибывшую в первый «карман» комплекса тРНК с аминокислотой. При этом вновь прибывшая тРНК присоединяет к себе весь синтезированный рибосомой белок. Та тРНК, которая несла белковую молекулу, становится «пустой».
После переноса белковой молекулы на новую тРНК необходимо передвинуть мРНК на один кодон. Вместе с этим образовавшийся комплекс тРНК со строящимся белком тоже должен переместиться из первого кармана во второй, освобождая место для тРНК со следующей аминокислотой. «Пустая» тРНК при этом переходит в третий «карман» (Е-участок). Этот сложнейший молекулярный процесс называется транслокацией. Механизм транслокации предложил патриарх отечественной рибосомологии академик Александр Сергеевич Спирин, основатель института белка РАН и директор с 1967 по 2001 год. Согласно модели Спирина, в процессе синтеза белка субчастицы рибосомы перемещаются относительно друг друга. Позже эту догадку блестяще подтвердил другой патриарх рибосомологии американский учёный Харри Ноллер, директор центра молекулярной биологии РНК Университета Калифорнии. Наконец, движение рибосомных субчастиц относительно друг друга зафиксировал с помощью криоэлектронной микроскопии немецкий учёный, работающий в США (профессор Колумбийского университета), Иохим Франк. Несмотря на длительное изучение, процесс транслокации до сих пор скрывает много загадок, которые исследователям рибосомы предстоит решить в будущем.
Согласно модели Спирина, в процессе синтеза белка субчастицы рибосомы перемещаются относительно друг друга. Позже эту догадку блестяще подтвердил другой патриарх рибосомологии американский учёный Харри Ноллер, директор центра молекулярной биологии РНК Университета Калифорнии. Наконец, движение рибосомных субчастиц относительно друг друга зафиксировал с помощью криоэлектронной микроскопии немецкий учёный, работающий в США (профессор Колумбийского университета), Иохим Франк. Несмотря на длительное изучение, процесс транслокации до сих пор скрывает много загадок, которые исследователям рибосомы предстоит решить в будущем.
Что участвует в формировании рибосом. Рибосомы — строение и функции. Что будем делать с полученным материалом
), состоят из большой и малой субъединиц.
Схема синтеза рибосом в клетках эукариот .
1. Синтез мРНК рибосомных белков РНК полимеразой II. 2. Экспорт мРНК из ядра. 3. Узнавание мРНК рибосомой и 4. синтез рибосомных белков. 5. Синтез предшественника рРНК (45S — предшественник) РНК полимеразой I. 6. Синтез 5S pРНК РНК полимеразой III. 7. Сборка большой рибонуклеопротеидной частицы, включающей 45S-предшественник, импортированные из цитоплазмы рибосомные белки, а также специальные ядрышковые белки и РНК, принимающие участие в созревании рибосомных субчастиц. 8. Присоединение 5S рРНК, нарезание предшественника и отделение малой рибосомной субчастицы. 9. Дозревание большой субчастицы, высвобождение ядрышковых белков и РНК. 10. Выход рибосомных субчастиц из ядра. 11. Вовлечение их в трансляцию.
5. Синтез предшественника рРНК (45S — предшественник) РНК полимеразой I. 6. Синтез 5S pРНК РНК полимеразой III. 7. Сборка большой рибонуклеопротеидной частицы, включающей 45S-предшественник, импортированные из цитоплазмы рибосомные белки, а также специальные ядрышковые белки и РНК, принимающие участие в созревании рибосомных субчастиц. 8. Присоединение 5S рРНК, нарезание предшественника и отделение малой рибосомной субчастицы. 9. Дозревание большой субчастицы, высвобождение ядрышковых белков и РНК. 10. Выход рибосомных субчастиц из ядра. 11. Вовлечение их в трансляцию.
Рибосомы представляют собой нуклеопротеид , в составе которого соотношение РНК/белок составляет 1:1 у высших животных и 60-65:35-40 у бактерий. Рибосомная РНК составляет около 70 % всей РНК клетки. Рибосомы эукариот включают четыре молекулы рРНК, из них 18S , 5,8S и 28S рРНК синтезируются в ядрышке РНК-полимеразой I в виде единого предшественника (45S), который затем подвергается модификациям и нарезанию. 5S рРНК синтезируются РНК-полимеразой III в другой части генома и не нуждаются в дополнительных модификациях. Почти вся рРНК находится в виде магниевой соли, что необходимо для поддержания структуры; при удалении ионов магния рибосома подвергается диссоциации на субъединицы.
Почти вся рРНК находится в виде магниевой соли, что необходимо для поддержания структуры; при удалении ионов магния рибосома подвергается диссоциации на субъединицы.
РНК большой субъединицы
Высокомолекулярная РНК, составляющая структурную основу большой субъединицы рибосомы, обозначается как 23S рРНК (в случае бактериальных рибосом) или 23S-подобная рРНК (в других случаях). Бактериальная 23S рРНК, также как и 16S рРНК, представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. В то же время 23S-подобная рРНК цитоплазматических рибосом эукариот состоит из двух прочно ассоциированных полирибонуклеотидных цепей — 28S и 5,8S рРНК (5,8S рРНК является структурным эквивалентом 5′-концевого ~160-нуклеотидного сегмента 23S рРНК, который оказался «отщеплён» в виде ковалентно обособленного фрагмента). 23S-подобная рРНК рибосом пластидов растений также состоит из двух прочно ассоциированных полирибонуклеотидных цепей и содержит 4,5S рРНК — структурный эквивалент 3′-концевого сегмента 23S рРНК. Известны случаи и ещё более глубоко зашедшей фрагментированности РНК, примером чего может служить 23S-подобная рРНК цитоплазматических рибосом некоторых протистов. Так, у Crithidia fasciculata она состоит из 7 отдельных фрагментов, а у Euglena gracilis — из 14.
Известны случаи и ещё более глубоко зашедшей фрагментированности РНК, примером чего может служить 23S-подобная рРНК цитоплазматических рибосом некоторых протистов. Так, у Crithidia fasciculata она состоит из 7 отдельных фрагментов, а у Euglena gracilis — из 14.
Кроме вышеуказанной 23S(-подобной) рРНК, большая субъединица обычно содержит также относительно низкомолекулярную РНК — так называемую 5S рРНК. В отличие от вышеупомянутых 5,8S и 4,5S рРНК, 5S рРНК менее прочно ассоциирована с 23S(-подобной) рРНК, транскрибируется с отдельного гена и, таким образом, не может быть рассмотрена как отщеплённый фрагмент высокополимерной рРНК. 5S рРНК входит в состав большой субъединицы цитоплазматических рибосом всех прокариот и эукариот, но, по-видимому, не является непременной составляющей любой функциональной рибосомы, так как 5S рРНК отсутствуют в митохондриальных рибосомах млекопитающих (так называемых «минирибосомах»).
Число нуклеотидных звеньев, как и константы седиментации, для образцов 23S и 23S-подобных рРНК из различных источников могут существенно различаться. Например, 23S рРНК Escherichia coli состоит из 2904 нуклеотидных остатков, цитоплазматическая 26S рРНК Saccharomyces cerevisiae — из 3392, митохондриальная 26S рРНК Saccharomyces cerevisiae — из 3273, цитоплазматическая 28S рРНК Homo sapiens — из 5025. Большие субъединицы митохондриальных рибосом млекопитающих содержат относительно короткие 23S-подобные рРНК — всего 1560-1590 нуклеотидных остатков. Молекула 5,8S рРНК комплекса 28S 5,8S рРНК, характерного для цитоплазматических эукариотических рибосом, имеет длину около 160 нуклеотидных остатков. Длина 5S рРНК довольно консервативна и составляет 115-125 нуклеотидных остатков.
Например, 23S рРНК Escherichia coli состоит из 2904 нуклеотидных остатков, цитоплазматическая 26S рРНК Saccharomyces cerevisiae — из 3392, митохондриальная 26S рРНК Saccharomyces cerevisiae — из 3273, цитоплазматическая 28S рРНК Homo sapiens — из 5025. Большие субъединицы митохондриальных рибосом млекопитающих содержат относительно короткие 23S-подобные рРНК — всего 1560-1590 нуклеотидных остатков. Молекула 5,8S рРНК комплекса 28S 5,8S рРНК, характерного для цитоплазматических эукариотических рибосом, имеет длину около 160 нуклеотидных остатков. Длина 5S рРНК довольно консервативна и составляет 115-125 нуклеотидных остатков.
Рибосомные белки
Помимо рРНК, рибосома содержит также около 50 (прокариотические рибосомы) или 80 (цитоплазматические рибосомы эукариот) различных белков . Почти каждый из этих белков представлен лишь одной копией на каждую рибосому. Преобладают умеренно-осно́вные белки. Большинство рибосомных белков эволюционно консервативны, многие белки рибосом из различных источников могут быть соотнесены как гомологи , что учитывается в современной универсальной номенклатуре рибосомных белков. Рибосома на 30-50 % состоит из белка.
Рибосома на 30-50 % состоит из белка.
Низкомолекулярные компоненты
Кроме биополимеров (РНК и белков) в состав рибосом входят также некоторые низкомолекулярные компоненты. Это молекулы воды, ионы металлов (главным образом Mg 2+ — до 2 % сухой массы рибосомы), ди- и полиамины (такие как путресцин , кадаверин , спермидин, спермин — могут составлять до 2,5 % сухой массы рибосомы).
Механизм трансляции
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав третичную структуру рибосомной РНК бактерии Escherichia coli , высказали обоснованное предположение, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот . Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы .
Примечания
- , с.
 109.
109. - , с. 120-121.
- , с. 110.
- , с. 110-111.
- , с. 133-134.
- , с. 136-137.
- , с. 84-85.
- , с. 84.
- Sievers A. , Beringer M. , Rodnina M. V. , Wolfenden R. The ribosome as an entropy trap. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2004. — 25 May (vol. 101 , no. 21 ). — P. 7897-7901 . — DOI :10.1073/pnas.0402488101 . — PMID 15141076 . [исправить]
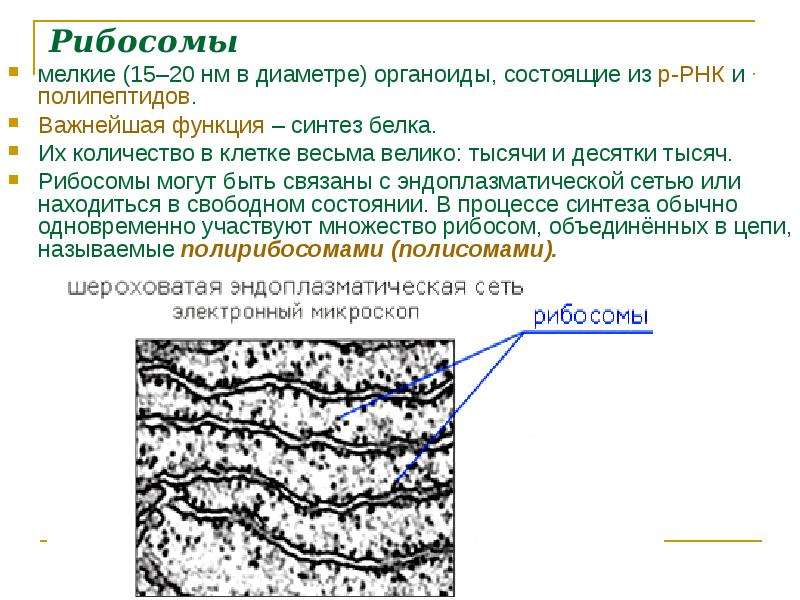
Которые состоят из РНК и белков. Они отвечают за биосинтез белков . В зависимости от уровня белка в конкретной клетке, количество рибосом может достигать миллионов.
Отличительные характеристики
Рибосомы обычно состоят из двух субъединиц: большой субъединицы и малой субъединицы. Рибосомные субъединицы синтезируются в ядрышко и пересекают ядерную мембрану в через ядерные поры. Эти две субъединицы объединяются, когда рибосома присоединяется к матричной РНК (мРНК) во время синтеза белка. Рибосомы вместе с другой молекулой РНК, транспортной РНК (тРНК), помогают преобразовать кодирующие белок мРНК в белки. Рибосомы связывают аминокислоты вместе для образования полипептидных цепей, которые модифицируются далее, прежде чем станут функциональными белками.
Рибосомы вместе с другой молекулой РНК, транспортной РНК (тРНК), помогают преобразовать кодирующие белок мРНК в белки. Рибосомы связывают аминокислоты вместе для образования полипептидных цепей, которые модифицируются далее, прежде чем станут функциональными белками.
Расположение в клетке
Есть два места, где рибосомы обычно существуют в : суспендированы в цитозоле (свободные рибосомы) и связаны с эндоплазматическим ретикулумом (связанные рибосомы). В обоих случаях рибосомы обычно образуют агрегаты, называемые полисомами или полирибосомами во время синтеза белка. Полирибосомы представляют собой кластеры рибосом, которые присоединяются к молекуле мРНК во время биосинтеза белка.
Это позволяет синтезировать сразу несколько копий белка из одной молекулы мРНК. Свободные рибосомы обычно производят белки, функционирующие в цитозоле (жидкий компонент цитоплазмы), тогда как связанные рибосомы обычно синтезируют белки, которые экспортируются из клетки или включаются в .
Интересно, что свободные рибосомы и связанные рибосомы взаимозаменяемы, и клетка может изменять их число в соответствии с потребностями метаболизма.
Органеллы, такие как и в эукариотических организмах, имеют свои собственные рибосомы, которые больше похожи на рибосомы, обнаруженные у бактерий. Субъединицы, содержащие рибосомы в митохондриях и хлоропластах, меньше (30S — 50S), чем субъединицы, обнаруженные во всей остальной части клетки (40S — 60S).
Рибосомы и протеин
Синтез белка протекает под воздействием процессов транскрипции и трансляции. В транскрипции генетический код, содержащийся в ДНК, транскрибируется в версию РНК кода, известного как матричная РНК (мРНК). В трансляции вырабатывается растущая аминокислотная цепь, также называемая полипептидной цепью. Рибосомы помогают трансформировать мРНК и связывать аминокислоты вместе для получения полипептидной цепи, которая в конечном итоге становится полностью функционирующим белком. Белки — очень важные биологические полимеры в наших клетках, поскольку они задействованы практически во всех функциях.
На заре развития жизни на Земле все клеточные формы были представлены бактериями. Они всасывали органические вещества, растворённые в первичном океане, через поверхность тела.
Они всасывали органические вещества, растворённые в первичном океане, через поверхность тела.
Со временем некоторые бактерии приспособились производить органические вещества из неорганических. Для этого они использовали энергию солнечного света. Возникла первая экологическая система, в которой эти организмы были производителями. В результате этого в атмосфере Земли появился кислород, выделяемый этими организмами. С его помощью можно из той же самой пищи получить гораздо больше энергии, а добавочную энергию использовать на усложнение строения тела: разделение тела на части.
Одно из важных достижений жизни — разделение ядра и цитоплазмы. В ядре находится наследственная информация. Специальная мембрана вокруг ядра позволила защитить от случайных повреждений. По мере необходимости цитоплазма получает из ядра команды, направляющие жизнедеятельность и развитие клетки.
Организмы, у которых ядро отделено от цитоплазмы, образовали надцарство ядерных (к ним относятся — растения, грибы, животные).
Таким образом, клетка — основа организации растений и животных — возникла и развилась в ходе биологической эволюции.
Даже не вооружённым глазом, а ещё лучше под лупой можно видеть, что мякоть зрелого арбуза состоит из очень мелких крупинок, или зёрнышек. Это клетки — мельчайшие «кирпичики», из которых состоят тела всех живых организмов, в том числе и растительных.
Жизнь растения осуществляется соединённой деятельностью его клеток, создающих единое целое. При многоклеточности частей растения существует физиологическое разграничение их функций, специализация различных клеток в зависимости от местоположения их в теле растения.
Растительная клетка отличается от животной тем, что имеет плотную оболочку, покрывающую внутреннее содержимое со всех сторон. Клетка не является плоской (как её принято изображать), она скорей всего похожа на очень маленький пузырёк, наполненный слизистым содержимым.
Строение и функции растительной клетки
Рассмотрим клетку как структурно-функциональную единицу организма. Снаружи клетка покрыта плотной клеточной стенкой, в которой имеются более тонкие участки — поры. Под ней находится очень тонкая плёнка — мембрана, покрывающая содержимое клетки — цитоплазму. В цитоплазме есть полости — вакуоли, заполненные клеточным соком. В центре клетки или около клеточной стенки расположено плотное тельце — ядро с ядрышком. От цитоплазмы ядро отделено ядерной оболочкой. По всей цитоплазме распределены мелкие тельца — пластиды.
Снаружи клетка покрыта плотной клеточной стенкой, в которой имеются более тонкие участки — поры. Под ней находится очень тонкая плёнка — мембрана, покрывающая содержимое клетки — цитоплазму. В цитоплазме есть полости — вакуоли, заполненные клеточным соком. В центре клетки или около клеточной стенки расположено плотное тельце — ядро с ядрышком. От цитоплазмы ядро отделено ядерной оболочкой. По всей цитоплазме распределены мелкие тельца — пластиды.
Строение растительной клетки
Строение и функции органоидов растительной клетки
| Органоид | Рисунок | Описание | Функция | Особенности |
Клеточная стенка или плазматическая мембрана | Бесцветная, прозрачная и очень прочная | Пропускает в клетку и выпускает из клетки вещества. | Клеточная мембрана полупроницаемая | |
Цитоплазма | Густое тягучее вещество | В ней располагаются все другие части клетки | Находится в постоянном движении | |
Ядро (важная часть клетки) | Округлое или овальное | Обеспечивает передачу наследственных свойств дочерним клеткам при делении | Центральная часть клетки | |
Сферической или неправильной формы | Принимает участие в синтезе белка | |||
Резервуар, отделённый от цитоплазмы мембраной. | Накапливаются запасные питательные вещества и продукты жизнедеятельности ненужные клетке. | По мере роста клетки мелкие вакуоли сливаются в одну большую (центральную) вакуоль | ||
Пластиды | Хлоропласты | Используют световую энергию солнца и создают органические из неорганических | Форма дисков, отграниченных от цитоплазмы двойной мембраной | |
Хромопласты | Образуются в результате накопления каротиноидов | Жёлтые, оранжевые или бурые | ||
Лейкопласты | Бесцветные пластиды | |||
Ядерная оболочка | Состоит из двух мембран (наружная и внутренняя) с порами | Отграничивает ядро от цитоплазмы | Даёт возможность осуществляться обмену между ядром и цитоплазмой |
Живая часть клетки — это ограниченная мембраной, упорядоченная, структурированная система биополимеров и внутренних мембранных структур, участвующих в совокупности метаболических и энергетических процессов, осуществляющих поддержание и воспроизведение всей системы в целом.
Важной особенностью является то, что в клетке нет открытых мембран со свободными концами. Клеточные мембраны всегда ограничивают полости или участки, закрывая их со всех сторон.
Современная обобщенная схема растительной клетки
Плазмалемма (наружная клеточная мембрана) — ультрамикроскопическая плёнка толщиной 7,5 нм., состоящая из белков, фосфолипидов и воды. Это очень эластичная плёнка, хорошо смачивающаяся водой и быстро восстанавливающая целостность после повреждения. Имеет универсальное строение, т.е.типичное для всех биологических мембран. У растительных клеток снаружи от клеточной мембраны находится прочная, создающая внешнюю опору и поддерживающая форму клетки клеточная стенка. Она состоит из клетчатки (целлюлозы) — нерастворимого в воде полисахарида.
Плазмодесмы растительной клетки, представляют собой субмикроскопические канальцы, пронизывающие оболочки и выстланные плазматической мембраной, которая таким образом переходит из одной клетки в другую, не прерываясь.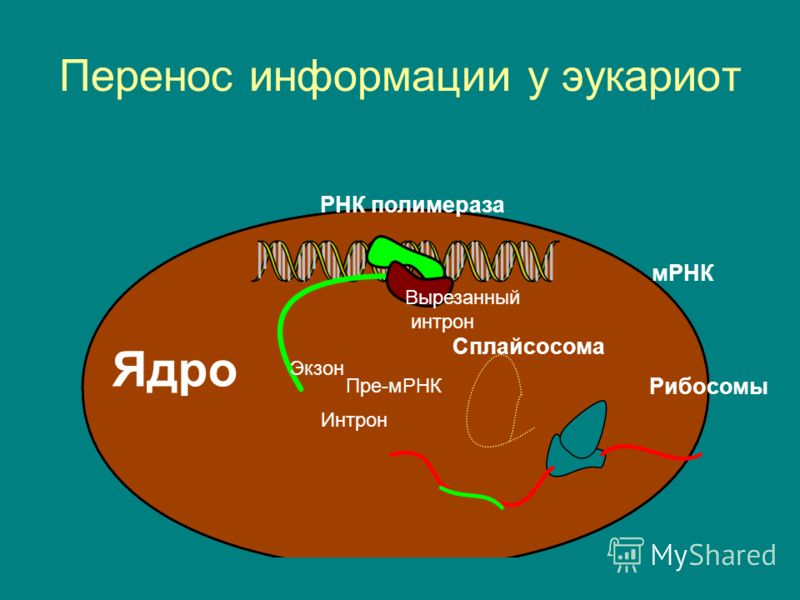 С их помощью происходит межклеточная циркуляция растворов, содержащих органические питательные вещества. По ним же идёт передача биопотенциалов и другой информации.
С их помощью происходит межклеточная циркуляция растворов, содержащих органические питательные вещества. По ним же идёт передача биопотенциалов и другой информации.
Порами называют отверстия во вторичной оболочке, где клетки разделяют лишь первичная оболочка и срединная пластинка. Участки первичной оболочки и срединную пластинку, разделяющие соседствующие поры смежных клеток, называют поровой мембраной или замыкающей пленкой поры. Замыкающую пленку поры пронизывают плазмодесменные канальцы, но сквозного отверстия в порах обычно не образуется. Поры облегчают транспорт воды и растворенных веществ от клетки к клетке. В стенках соседних клеток, как правило, одна против другой, образуются поры.
Клеточная оболочка имеет хорошо выраженную, относительно толстую оболочку полисахаридной природы. Оболочка растительной клетки продукт деятельности цитоплазмы. В её образовании активное участие принимает аппарат Гольджи и эндоплазматическая сеть.
Строение клеточной мембраны
Основу цитоплазмы составляет ее матрикс, или гиалоплазма, — сложная бесцветная, оптически прозрачная коллоидная система, способная к обратимым переходам из золя в гель.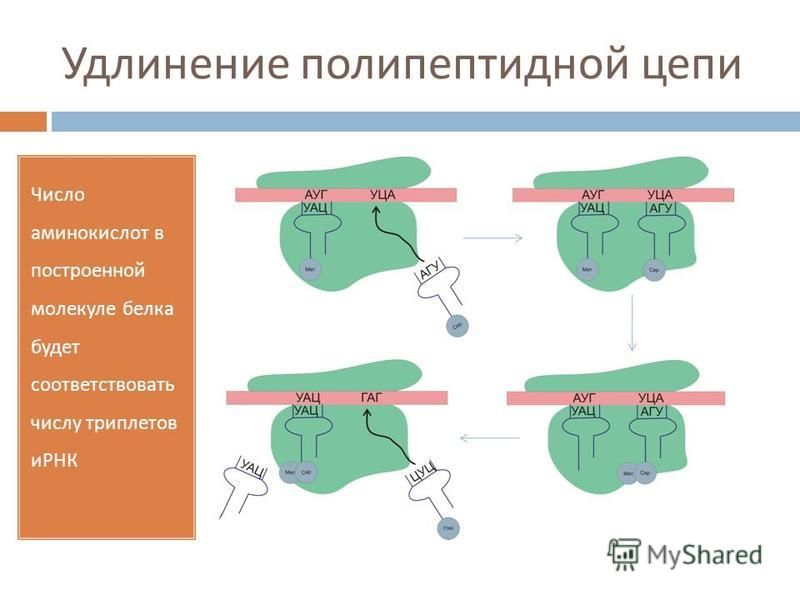 Важнейшая роль гиалоплазмы заключается в объединении всех клеточных структур в единую систему и обеспечении взаимодействия между ними в процессах клеточного метаболизма.
Важнейшая роль гиалоплазмы заключается в объединении всех клеточных структур в единую систему и обеспечении взаимодействия между ними в процессах клеточного метаболизма.
Гиалоплазма (или матрикс цитоплазмы) составляет внутреннюю среду клетки. Состоит из воды и различных биополимеров (белков, нуклеиновых кислот, полисахаридов, липидов), из которых основную часть составляют белки различной химической и функциональной специфичности. В гиалоплазме содержатся также аминокислоты, моносахара, нуклеотиды и другие низкомолекулярные вещества.
Биополимеры образуют с водой коллоидную среду, которая в зависимости от условий может быть плотной (в форме геля) или более жидкой (в форме золя), как во всей цитоплазме, так и в отдельных ее участках. В гиалоплазме локализуются и взаимодействуют между собой и средой гиалоплазмы различные органеллы и включения. При этом расположение их чаще всего специфично для определенных типов клеток. Через билипидную мембрану гиалоплазма взаимодействует с внеклеточной средой. Следовательно, гиалоплазма является динамической средой и играет важную роль в функционировании отдельных органелл и жизнедеятельности клеток в целом.
Следовательно, гиалоплазма является динамической средой и играет важную роль в функционировании отдельных органелл и жизнедеятельности клеток в целом.
Цитоплазматические образования – органеллы
Органеллы (органоиды) — структурные компоненты цитоплазмы. Они имеют определённую форму и размеры, являются обязательными цитоплазматическими структурами клетки. При их отсутствии или повреждении клетка обычно теряет способность к дальнейшему существованию. Многие из органоидов способны к делению и самовоспроизведению. Размеры их настолько малы, что их можно видеть только в электронный микроскоп.
Ядро
Ядро — самая заметная и обычно самая крупная органелла клетки. Оно впервые было подробно исследовано Робертом Броуном в 1831 году. Ядро обеспечивает важнейшие метаболические и генетические функции клетки. По форме оно достаточно изменчиво: может быть шаровидным, овальным, лопастным, линзовидным.
Ядро играет значительную роль в жизни клетки. Клетка, из которой удалили ядро, не выделяет более оболочку, перестаёт расти и синтезировать вещества. В ней усиливаются продукты распада и разрушения, вследствие этого она быстро погибает. Образование нового ядра из цитоплазмы не происходит. Новые ядра образуются только делением или дроблением старого.
В ней усиливаются продукты распада и разрушения, вследствие этого она быстро погибает. Образование нового ядра из цитоплазмы не происходит. Новые ядра образуются только делением или дроблением старого.
Внутреннее содержимое ядра составляет кариолимфа (ядерный сок), заполняющая пространство между структурами ядра. В нём находится одно или несколько ядрышек, а также значительное количество молекул ДНК, соединённых со специфическими белками — гистонами.
Строение ядра
Ядрышко
Ядрышко — как и цитоплазма, содержит преимущественно РНК и специфические белки. Важнейшая его функция заключается в том, что в нём происходит формирование рибосом, которые осуществляют синтез белков в клетке.
Аппарат Гольджи
Аппарат Гольджи — органоид, имеющий универсальное распространение во всех разновидностях эукариотических клеток. Представляет собой многоярусную систему плоских мембранных мешочков, которые по периферии утолщаются и образуют пузырчатые отростки. Он чаще всего расположен вблизи ядра.
Аппарат Гольджи
В состав аппарата Гольджи обязательно входит система мелких пузырьков (везикул), которые отшнуровываются от утолщённых цистерн (диски) и располагаются по периферии этой структуры. Эти пузырьки играют роль внутриклеточной транспортной системы специфических секторных гранул, могут служить источником клеточных лизосом.
Функции аппарата Гольджи состоят также в накоплении, сепарации и выделении за пределы клетки с помощью пузырьков продуктов внутриклеточного синтеза, продуктов распада, токсических веществ. Продукты синтетической деятельности клетки, а также различные вещества, поступающие в клетку из окружающей среды по каналам эндоплазматической сети, транспортируются к аппарату Гольджи, накапливаются в этом органоиде, а затем в виде капелек или зёрен поступают в цитоплазму и либо используются самой клеткой, либо выводятся наружу. В растительных клетках Аппарат Гольджи содержит ферменты синтеза полисахаридов и сам полисахаридный материал, который используется для построения клеточной оболочки. Предполагают, что он участвует в образовании вакуолей. Аппарат Гольджи был назван так в честь итальянского учёного Камилло Гольджи, впервые обнаружившего его в 1897 году.
Предполагают, что он участвует в образовании вакуолей. Аппарат Гольджи был назван так в честь итальянского учёного Камилло Гольджи, впервые обнаружившего его в 1897 году.
Лизосомы
Лизосомы представляют собой мелкие пузырьки, ограниченные мембраной основная функция которых — осуществление внутриклеточного пищеварения. Использование лизосомного аппарата происходит при прорастании семени растения (гидролиз запасных питательных веществ).
Строение лизосомы
Микротрубочки
Микротрубочки — мембранные, надмолекулярные структуры, состоящие из белковых глобул, расположенных спиральными или прямолинейными рядами. Микротрубочки выполняют преимущественно механическую (двигательную) функцию, обеспечивая подвижность и сокращаемость органоидов клетки. Располагаясь в цитоплазме, они придают клетке определённую форму и обеспечивают стабильность пространственного расположения органоидов. Микротрубочки способствуют перемещению органоидов в места, которые определяются физиологическими потребностями клетки. Значительное количество этих структур расположено в плазмалемме, вблизи клеточной оболочки, где они участвуют в формировании и ориентации целлюлозных микрофибрилл оболочек растительных клеток.
Значительное количество этих структур расположено в плазмалемме, вблизи клеточной оболочки, где они участвуют в формировании и ориентации целлюлозных микрофибрилл оболочек растительных клеток.
Строение микротрубочки
Вакуоль
Вакуоль — важнейшая составная часть растительных клеток. Она представляет собой своеобразную полость (резервуар) в массе цитоплазмы, заполненную водным раствором минеральных солей, аминокислот, органических кислот, пигментов, углеводов и отделённую от цитоплазмы вакуолярной мембраной — тонопластом.
Цитоплазма заполняет всю внутреннюю полость только у самых молодых растительных клеток. С ростом клетки существенно изменяется пространственное расположение вначале сплошной массы цитоплазмы: у неё появляются заполненные клеточным соком небольшие вакуоли, и вся масса становится ноздреватой. При дальнейшем росте клетки отдельные вакуоли сливаются, оттесняя к периферии прослойки цитоплазмы, в результате чего в сформированной клетке находится обычно одна большая вакуоль, а цитоплазма со всеми органеллами располагаются около оболочки.
Водорастворимые органические и минеральные соединения вакуолей обусловливают соответствующие осмотические свойства живых клеток. Этот раствор определённой концентрации является своеобразным осмотическим насосом для регулируемого проникновения в клетку и выделения из неё воды, ионов и молекул метаболитов.
В комплексе со слоем цитоплазмы и её мембранами, характеризующимися свойствами полупроницаемости, вакуоль образует эффективную осмотическую систему. Осмотически обусловленными являются такие показатели живых растительных клеток, как осмотический потенциал, сосущая сила и тургорное давление.
Строение вакуоли
Пластиды
Пластиды — самые крупные (после ядра) цитоплазматические органоиды, присущие только клеткам растительных организмов. Они не найдены только у грибов. Пластиды играют важную роль в обмене веществ. Они отделены от цитоплазмы двойной мембранной оболочкой, а некоторые их типы имеют хорошо развитую и упорядоченную систему внутренних мембран.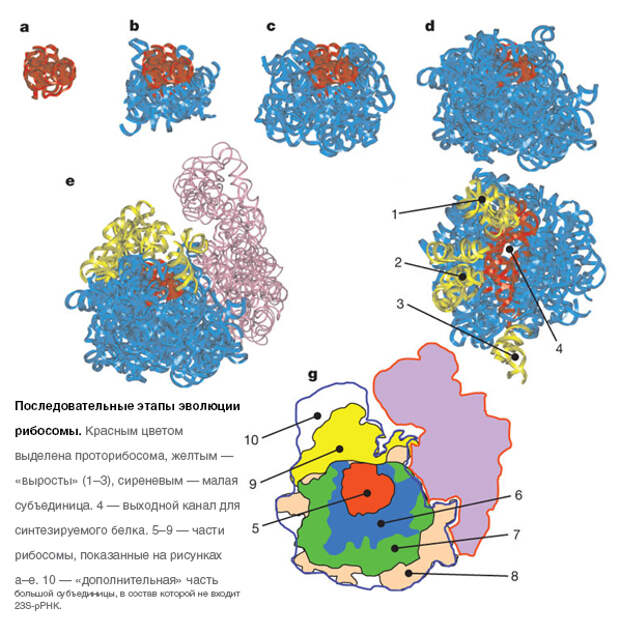 Все пластиды едины по происхождению.
Все пластиды едины по происхождению.
Хлоропласты — наиболее распространённые и наиболее функционально важные пластиды фотоавтотрофных организмов, которые осуществляют фотосинтетические процессы, приводящие в конечном итоге к образованию органических веществ и выделению свободного кислорода. Хлоропласты высших растений имеют сложное внутреннее строение.
Строение хлоропласта
Размеры хлоропластов у разных растений неодинаковы, но в среднем диаметр их составляет 4-6 мкм. Хлоропласты способны передвигаться под влиянием движения цитоплазмы. Кроме того, под воздействием освещения наблюдается активное передвижение хлоропластов амебовидного типа к источнику света.
Хлорофилл — основное вещество хлоропластов. Благодаря хлорофиллу зелёные растения способны использовать световую энергию.
Лейкопласты (бесцветные пластиды) представляют собой чётко обозначенные тельца цитоплазмы. Размеры их несколько меньше, чем размеры хлоропластов. Более и однообразна и их форма, приближающая к сферической.
Строение лейкопласта
Встречаются в клетках эпидермиса, клубнях, корневищах. При освещении очень быстро превращаются в хлоропласты с соответствующим изменением внутренней структуры. Лейкопласты содержат ферменты, с помощью которых из излишков глюкозы, образованной в процессе фотосинтеза, в них синтезируется крахмал, основная масса которого откладывается в запасающих тканях или органах (клубнях, корневищах, семенах) в виде крахмальных зёрен. У некоторых растений в лейкопластах откладываются жиры. Резервная функция лейкопластов изредка проявляется в образовании запасных белков в форме кристаллов или аморфных включений.
Хромопласты в большинстве случаев являются производными хлоропластов, изредка — лейкопластов.
Строение хромопласта
Созревание плодов шиповника, перца, помидоров сопровождается превращением хлоро- или лейкопластов клеток мякоти в каратиноидопласты. Последние содержат преимущественно жёлтые пластидные пигменты — каратиноиды, которые при созревании интенсивно синтезируются в них, образуя окрашенные липидные капли, твёрдые глобулы или кристаллы.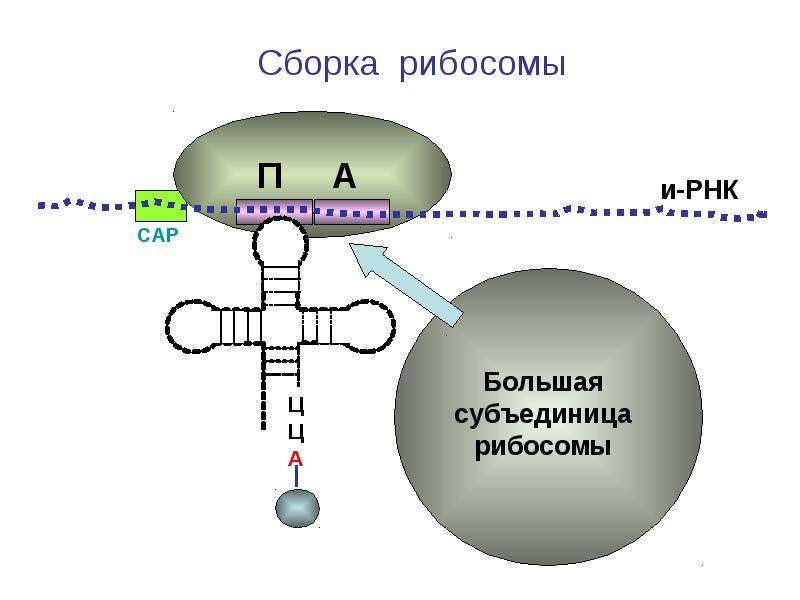 Хлорофилл при этом разрушается.
Хлорофилл при этом разрушается.
Митохондрии
Митохондрии — органеллы, характерные для большинства клеток растений. Имеют изменчивую форму палочек, зёрнышек, нитей. Открыты в 1894 году Р. Альтманом с помощью светового микроскопа, а внутреннее строение было изучено позднее с помощью электронного.
Строение митохондрии
Митохондрии имеют двухмембранное строение. Внешняя мембрана гладкая, внутренняя образует различной формы выросты — трубочки в растительных клетках. Пространство внутри митохондрии заполнено полужидким содержимым (матриксом), куда входят ферменты, белки, липиды, соли кальция и магния, витамины, а также РНК, ДНК и рибосомы. Ферментативный комплекс митохондрий ускоряет работу сложного и взаимосвязанного механизма биохимических реакций, в результате которых образуется АТФ. В этих органеллах осуществляется обеспечение клеток энергией — преобразование энергии химических связей питательных веществ в макроэргиеские связи АТФ в процессе клеточного дыхания. Именно в митохондриях происходит ферментативное расщепление углеводов, жирных кислот, аминокислот с освобождением энергии и последующим превращением её в энергию АТФ. Накопленная энергия расходуется на ростовые процессы, на новые синтезы и т. д. Митохондрии размножаются делением и живут около 10 дней, после чего подвергаются разрушению.
Именно в митохондриях происходит ферментативное расщепление углеводов, жирных кислот, аминокислот с освобождением энергии и последующим превращением её в энергию АТФ. Накопленная энергия расходуется на ростовые процессы, на новые синтезы и т. д. Митохондрии размножаются делением и живут около 10 дней, после чего подвергаются разрушению.
Эндоплазматическая сеть
Эндоплазматическая сеть — сеть каналов, трубочек, пузырьков, цистерн, расположенных внутри цитоплазмы. Открыта в 1945 году английским учёным К. Портером, представляет собой систему мембран, имеющих ультрамикроскопическое строение.
Строение эндоплазматической сети
Вся сеть объединена в единое целое с наружной клеточной мембраной ядерной оболочки. Различают ЭПС гладкую и шероховатую, несущую на себе рибосомы. На мембранах гладкой ЭПС находятся ферментные системы, участвующие в жировом и углеводном обмене. Этот тип мембран преобладает в клетках семян, богатых запасными веществами (белками, углеводами, маслами), рибосомы прикрепляются к мембране гранулярной ЭПС, и во время синтеза белковой молекулы полипептидная цепочка с рибосомами погружается в канал ЭПС. Функции эндоплазматической сети очень разнообразны: транспорт веществ как внутри клетки, так и между соседними клетками; разделение клетки на отдельные секции, в которых одновременно проходят различные физиологические процессы и химические реакции.
Функции эндоплазматической сети очень разнообразны: транспорт веществ как внутри клетки, так и между соседними клетками; разделение клетки на отдельные секции, в которых одновременно проходят различные физиологические процессы и химические реакции.
Рибосомы
Рибосомы — немембранные клеточные органоиды. Каждая рибосома состоит из двух не одинаковых по размеру частичек и может делиться на два фрагмента, которые продолжают сохранять способность синтезировать белок после объединения в целую рибосому.
Строение рибосомы
Рибосомы синтезируются в ядре, затем покидают его, переходя в цитоплазму, где прикрепляются к наружной поверхности мембран эндоплазматической сети или располагаются свободно. В зависимости от типа синтезируемого белка рибосомы могут функционировать по одиночке или объединяться в комплексы — полирибосомы.
Строение растительной клетки изучает наука — физиология растений. Клетка является основной структурной единицей как растительного , так и животного организма . Она представляет собой наименьшую часть организма, обладающую свойствами живого
Она представляет собой наименьшую часть организма, обладающую свойствами живого
Одноклеточные и многоклеточные растения
Есть растения одноклеточные и многоклеточные . К первым относятся некоторые , состоящие только из одной клетки, и в этом случае такая клетка несет в себе все присущие ей функции. Многоклеточные растения представляют собой не простую сумму клеток, а единый организм , в котором они образуют различные ткани и органы, находящиеся во взаимодействии друг с другом.Структурные элементы растительной клетки
Клетки растений весьма разнообразны как по размерам и форме, так и по выполняемым ими функциям, но в основном состоят из одних и тех же частей. Строение взрослой растительной клетки.- — оболочка,
- — срединная пластинка,
- — межклетник,
- — плазмодесмы,
- — плазмалемма,
- — тонопласт,
- — вакуоля,
- — цитоплазма,
- — капелька масла,
- — митохондрия,
- — хлоропласт,
- — граны в хлоропласте,
- — крахмальное зерно в хлоропласте,
- — ядро,
- — ядерная оболочка,
- — ядрышко,
- — хроматин.
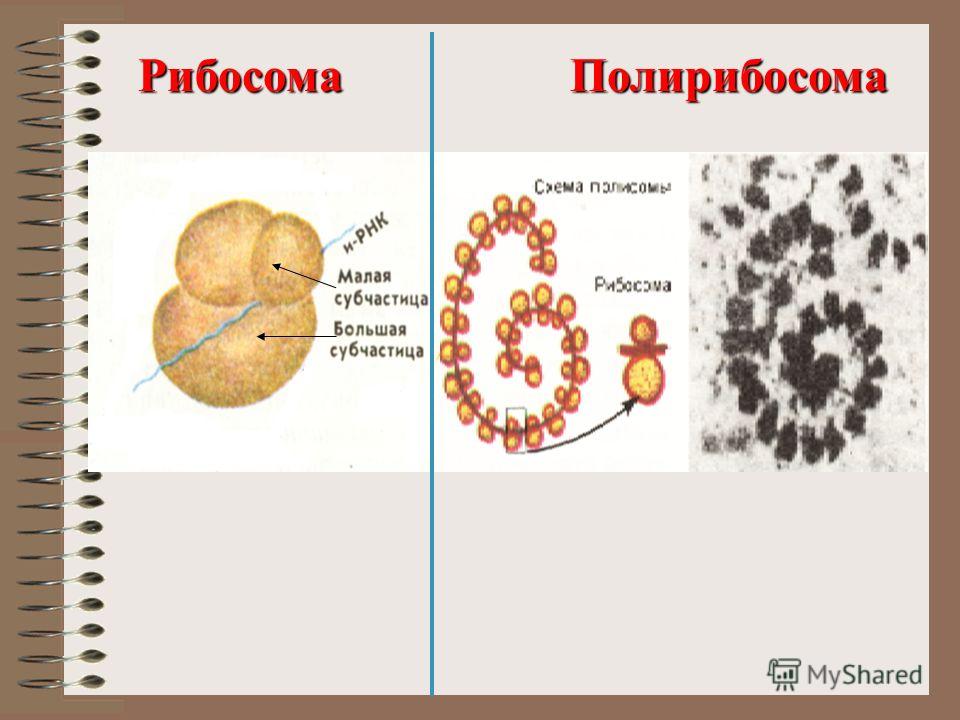
- оболочки,
- протоплазмы,
- вакуоли.
Протоплазма
Протоплазма — это живое вещество организма; в ней протекают сложнейшие реакции обмена, характерные для жизни. В протоплазме находится большое количество мембран-пленок, в образовании которых большую роль играют соединения белков с фосфатидами (жироподобными веществами). Благодаря наличию мембран у протоплазмы имеются огромные внутренние поверхности, на которых и протекают процессы адсорбции (поглощения) и десорбции (выделения) веществ и их передвижение, происходящие с большой скоростью. Большое количество мембран, разделяющих содержимое клетки, позволяет различным веществам, находящимся в клетке, не перемешиваться и передвигаться одновременно в противоположных направлениях.
Однако физико-химические свойства мембран непостоянны; они непрерывно изменяются в зависимости от внутренних и внешних условий, что дает возможность саморегулирования биохимических процессов.
Большое количество мембран, разделяющих содержимое клетки, позволяет различным веществам, находящимся в клетке, не перемешиваться и передвигаться одновременно в противоположных направлениях.
Однако физико-химические свойства мембран непостоянны; они непрерывно изменяются в зависимости от внутренних и внешних условий, что дает возможность саморегулирования биохимических процессов.Химический состав протоплазмы
Химический состав протоплазмы очень сложен. Она состоит из органических и неорганических соединений, находящихся как в коллоидном, так и в растворенном состоянии. Удобным объектом для изучения химического состава протоплазмы является плазмодий фикомицетов, представляющий собой голую, лишенную оболочки протоплазму. Ниже приведен суммарный состав протоплазмы фикомицетов (в % от сухого веса): Водорастворимые органические вещества………………………………………………… 40,7 Из них: сахара……………………………………………………… ……………………………………….. 14,2
белки………………………………………………………………………………………………………………. 22
аминокислоты, органические основания и другие азотные соединения….. 24,3
Не растворимые в воде органические вещества……………………………………….. 55,9
Из них: нуклеопротеиды……………………………………………………………………………….. 32,2
свободные нуклеиновые кислоты……………………………………………………………….. 2,5
глобулины (простые белки) …………………………………………………………………………… 0,5
липопротеиды………………………………………………………………………………………………… 4,8
нейтральные жиры………………………………………………………………………………………… 6,8
фитостеролы (высокомолекулярные спирты) ….
……………………………………….. 14,2
белки………………………………………………………………………………………………………………. 22
аминокислоты, органические основания и другие азотные соединения….. 24,3
Не растворимые в воде органические вещества……………………………………….. 55,9
Из них: нуклеопротеиды……………………………………………………………………………….. 32,2
свободные нуклеиновые кислоты……………………………………………………………….. 2,5
глобулины (простые белки) …………………………………………………………………………… 0,5
липопротеиды………………………………………………………………………………………………… 4,8
нейтральные жиры………………………………………………………………………………………… 6,8
фитостеролы (высокомолекулярные спирты) ….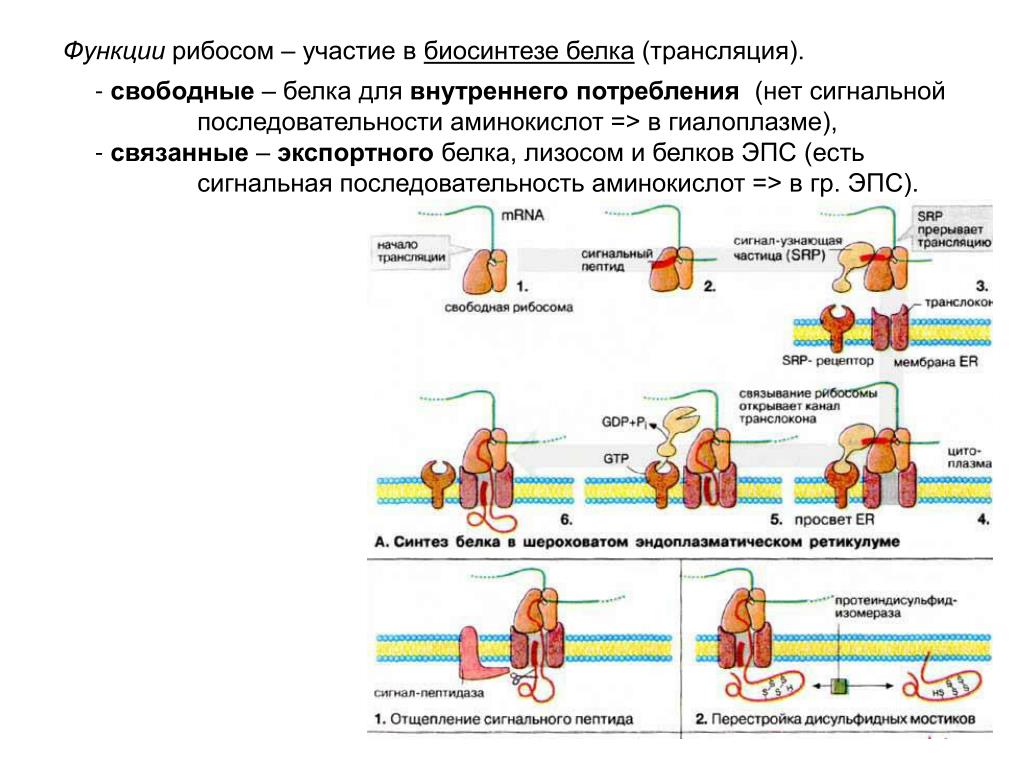 …………………………………………… 3.2
фосфатиды……………………………………………………………………………………………………….. 1,3
другие органические вещества………………………………………………………………………. 4,6
Минеральные вещества………………………………………………………………………………….. 3,4
Химический состав протоплазмы близок к приведенному выше, но он может изменяться в зависимости от вида, возраста и органа растения.
В протоплазме содержится до 80% воды (в протоплазме покоящихся семян — 5-15%). Она пропитывает всю коллоидную систему протоплазмы, являясь ее структурным элементом. В протоплазме все время происходят химические реакции, для протекания которых необходимо, чтобы реагирующие соединения были в растворе.
…………………………………………… 3.2
фосфатиды……………………………………………………………………………………………………….. 1,3
другие органические вещества………………………………………………………………………. 4,6
Минеральные вещества………………………………………………………………………………….. 3,4
Химический состав протоплазмы близок к приведенному выше, но он может изменяться в зависимости от вида, возраста и органа растения.
В протоплазме содержится до 80% воды (в протоплазме покоящихся семян — 5-15%). Она пропитывает всю коллоидную систему протоплазмы, являясь ее структурным элементом. В протоплазме все время происходят химические реакции, для протекания которых необходимо, чтобы реагирующие соединения были в растворе.Цитоплазма
Основной частью протоплазмы является цитоплазма , представляющая собой полужидкое содержимое клетки и заполняющее ее внутреннее пространство.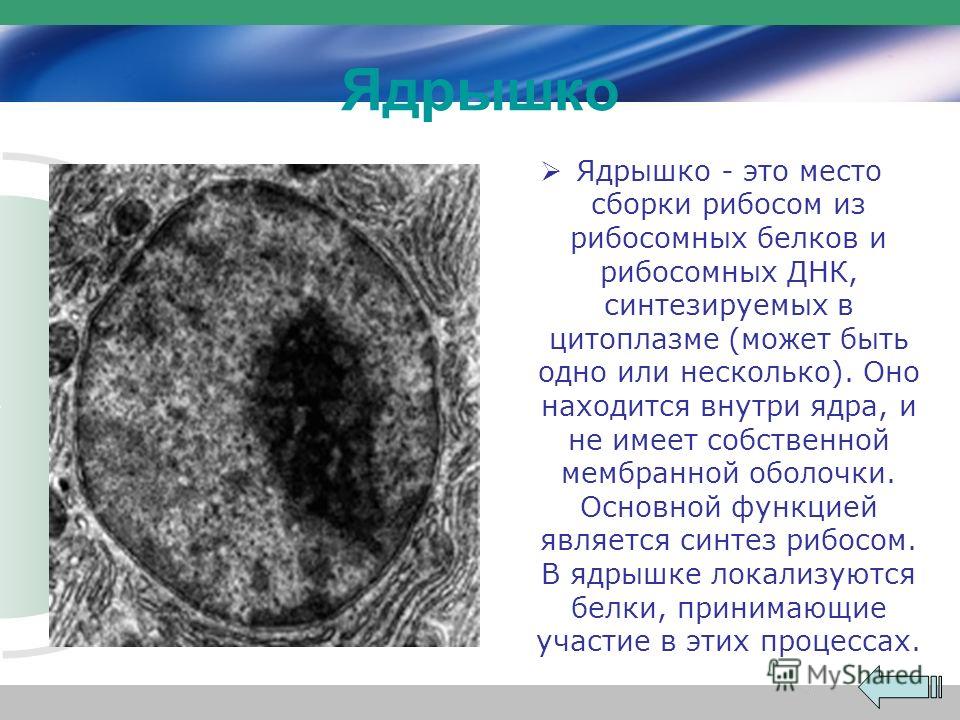 В цитоплазме расположены ядро, пластиды, митохондрии (хондриосомы), рибосомы и аппарат Гольджи.
Наружная мембрана цитоплазмы, граничащая с клеточной оболочкой, называется плазмалеммой. Плазмалемма легко пропускает воду и многие ионы, но задерживает крупные молекулы.
На границе цитоплазмы с вакуолью тоже образуется мембрана, называемая тонопластом.
В цитоплазме расположена эндоплазматическая сеть, представляющая собой систему ветвящихся мембран, соединенных с наружной мембраной. Мембраны эндоплазматической сети образуют каналы и расширения, на поверхности которых и протекают все химические реакции.
Важнейшие свойства цитоплазмы — вязкость и эластичность. Вязкость цитоплазмы изменяется в зависимости от температуры: при повышении температуры вязкость уменьшается и, наоборот, при понижении — увеличивается. При большой вязкости обмен веществ в клетке снижается, при малой — возрастает.
Эластичность цитоплазмы проявляется в ее способности возвращаться к исходной форме после деформации, что указывает на определенную структуру цитоплазмы.
В цитоплазме расположены ядро, пластиды, митохондрии (хондриосомы), рибосомы и аппарат Гольджи.
Наружная мембрана цитоплазмы, граничащая с клеточной оболочкой, называется плазмалеммой. Плазмалемма легко пропускает воду и многие ионы, но задерживает крупные молекулы.
На границе цитоплазмы с вакуолью тоже образуется мембрана, называемая тонопластом.
В цитоплазме расположена эндоплазматическая сеть, представляющая собой систему ветвящихся мембран, соединенных с наружной мембраной. Мембраны эндоплазматической сети образуют каналы и расширения, на поверхности которых и протекают все химические реакции.
Важнейшие свойства цитоплазмы — вязкость и эластичность. Вязкость цитоплазмы изменяется в зависимости от температуры: при повышении температуры вязкость уменьшается и, наоборот, при понижении — увеличивается. При большой вязкости обмен веществ в клетке снижается, при малой — возрастает.
Эластичность цитоплазмы проявляется в ее способности возвращаться к исходной форме после деформации, что указывает на определенную структуру цитоплазмы. Цитоплазма способна к движению, которое тесно связано с окружающими условиями. Основу движения составляет сократимость белков цитоплазмы клеток. Повышение температуры ускоряет движение цитоплазмы, отсутствие кислорода останавливает его. Вероятно, движение цитоплазмы тесно связано с превращением веществ и энергии в растении.
Способность цитоплазмы реагировать на внешние условия и приспосабливаться к ним называется раздражимостью.
Наличие раздражимости характеризует живой организм. Ответная реакция цитоплазмы на воздействие температуры, света и влаги требует затраты энергии, которая выделяется в процессе дыхания. Листочки стыдливой мимозы при механическом раздражении быстро складываются, но при частом повторении раздражения перестают на него реагировать; последнее, по-видимому, объясняется недостатком энергии. Раздражимость цитоплазмы- основа всех видов движения и других явлений жизнедеятельности раст.
Цитоплазма способна к движению, которое тесно связано с окружающими условиями. Основу движения составляет сократимость белков цитоплазмы клеток. Повышение температуры ускоряет движение цитоплазмы, отсутствие кислорода останавливает его. Вероятно, движение цитоплазмы тесно связано с превращением веществ и энергии в растении.
Способность цитоплазмы реагировать на внешние условия и приспосабливаться к ним называется раздражимостью.
Наличие раздражимости характеризует живой организм. Ответная реакция цитоплазмы на воздействие температуры, света и влаги требует затраты энергии, которая выделяется в процессе дыхания. Листочки стыдливой мимозы при механическом раздражении быстро складываются, но при частом повторении раздражения перестают на него реагировать; последнее, по-видимому, объясняется недостатком энергии. Раздражимость цитоплазмы- основа всех видов движения и других явлений жизнедеятельности раст.Ядро
Ядро — важнейший и самый крупный органоид клетки. Размеры ядра зависят от вида растения и состояния клетки (у высших растений в среднем от 5 до 25 мк). Форма ядра чаще всего шаровидная, у вытянутых клеток — овальная.
Живая клетка обычно имеет только одно ядро, но у высших растений сильно вытянутые клетки (из которых образуются лубяные волокна) содержат по нескольку ядер. В молодых клетках, не имеющих вакуоли, ядро обычно занимает центральное положение, у взрослых при образовании вакуолей оно отодвигается к периферии.
Ядро представляет собой коллоидную систему, но более вязкую, чем цитоплазма. Оно отличается от цитоплазмы и по химическому составу; в ядре содержатся основные и кислые белки и различные ферменты, а также большое количество нуклеиновых кислот, дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК). ДНК преобладает в ядре и обычно не содержится в цитоплазме.
Ядро отделяется от цитоплазмы тонкой оболочкой, или ядерной мембраной, в которой находятся отверстия — поры. Через поры осуществляется обмен между ядром и цитоплазмой. Под мембраной находится ядерный сок, в который погружены одно или несколько ядрышек и хромосомы.
Форма ядра чаще всего шаровидная, у вытянутых клеток — овальная.
Живая клетка обычно имеет только одно ядро, но у высших растений сильно вытянутые клетки (из которых образуются лубяные волокна) содержат по нескольку ядер. В молодых клетках, не имеющих вакуоли, ядро обычно занимает центральное положение, у взрослых при образовании вакуолей оно отодвигается к периферии.
Ядро представляет собой коллоидную систему, но более вязкую, чем цитоплазма. Оно отличается от цитоплазмы и по химическому составу; в ядре содержатся основные и кислые белки и различные ферменты, а также большое количество нуклеиновых кислот, дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК). ДНК преобладает в ядре и обычно не содержится в цитоплазме.
Ядро отделяется от цитоплазмы тонкой оболочкой, или ядерной мембраной, в которой находятся отверстия — поры. Через поры осуществляется обмен между ядром и цитоплазмой. Под мембраной находится ядерный сок, в который погружены одно или несколько ядрышек и хромосомы.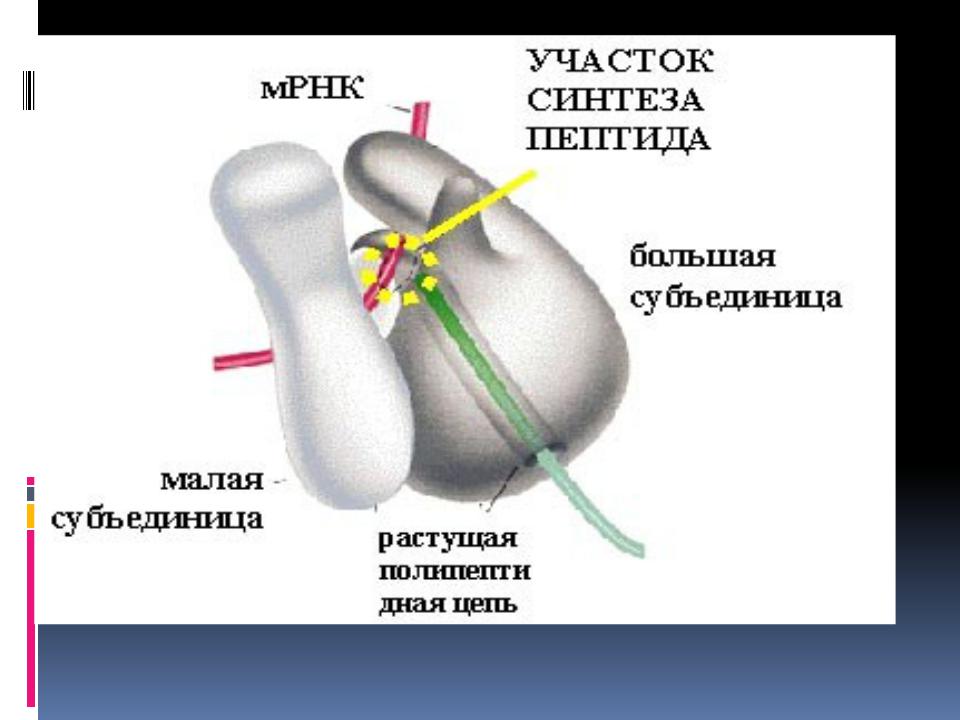 В ядрышке содержатся рибонуклеиновая кислота (РНК), которая принимает участие в синтезе белка, и фосфорсодержащие белки.
Ядро принимает участие во всех жизненных процессах клетки; при его удалении клетка отмирает.
В ядрышке содержатся рибонуклеиновая кислота (РНК), которая принимает участие в синтезе белка, и фосфорсодержащие белки.
Ядро принимает участие во всех жизненных процессах клетки; при его удалении клетка отмирает.Пластиды
Пластиды имеются только в растительных клетках. Они хорошо видны в обычный микроскоп, так как более плотные и иначе преломляют свет, чем цитоплазма. Во взрослой растительной клетке различают 3 типа пластид:- хлоропласты, имеющие зеленую окраску,
- хромопласты желтые или оранжевые,
- лейкопласты — бесцветные.
Митохондрии
Митохондрии встречаются во всех живых клетках и расположены в цитоплазме. Форма их весьма разнообразна и изменчива, размеры 0,2-5 мк. Количество митохондрий в клетке колеблется от десятков до нескольких тысяч. Они более плотны, чем цитоплазма, и имеют иной химический состав; в них содержится 30-40% белка, 28-38% липоидов и 1 — .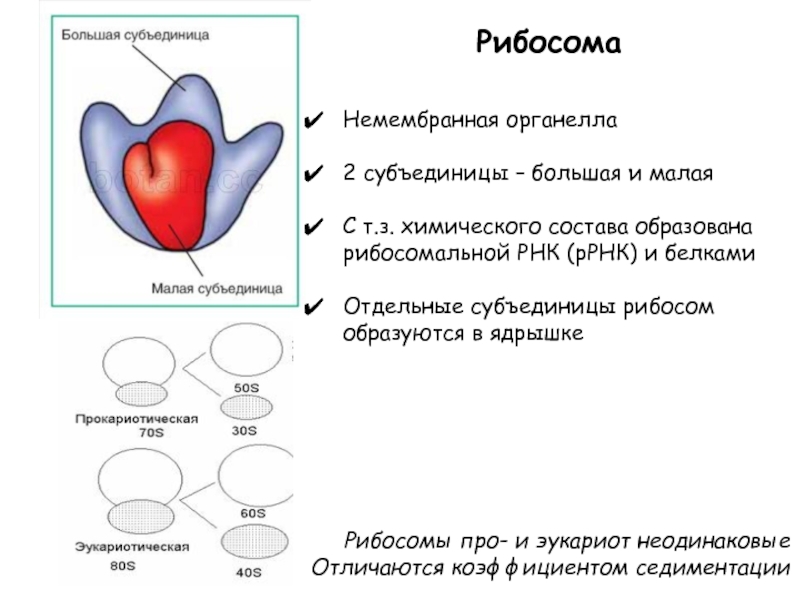 6% рибонуклеиновой кислоты.
Митохондрии передвигаются в клетке вместе с цитоплазмой, но в некоторых клетках, по-видимому, они способны и к самостоятельному движению. Роль митохондрий в обмене веществ клетки очень велика.
Митохондрии являются центрами, в которых происходит дыхание и образование макроэргических связей, заключенных в аденозинтрифосфорной кислоте (АТФ) и имеющих большой запас энергии (стр. 70, 94-96).
Освобождение и перенос образующейся энергии происходят с участием большого числа ферментов, находящихся в митохондриях.
6% рибонуклеиновой кислоты.
Митохондрии передвигаются в клетке вместе с цитоплазмой, но в некоторых клетках, по-видимому, они способны и к самостоятельному движению. Роль митохондрий в обмене веществ клетки очень велика.
Митохондрии являются центрами, в которых происходит дыхание и образование макроэргических связей, заключенных в аденозинтрифосфорной кислоте (АТФ) и имеющих большой запас энергии (стр. 70, 94-96).
Освобождение и перенос образующейся энергии происходят с участием большого числа ферментов, находящихся в митохондриях.Аппарат Гольджи
В цитоплазме находится аппарат Гольджи , форма которого различна в разных клетках. Он может быть в виде дисков, палочек, зернышек. Аппарат Гольджи имеет много полостей, окруженных двухслойной оболочкой. Роль его сводится к накоплению и выведению из клетки различных веществ, вырабатываемых клеткой.Рибосомы
Рибосомы — это субмикроскопические частицы, имеющие форму зернышек размером до 0,015 мк. Рибосомы содержат много белка (до 55%) и богаты рибонуклеиновой кислотой (35%), что составляет 65% всей рибонуклеиновой кислоты (РНК), находящейся в клетке. В рибосомах из аминокислот синтезируются белки, что возможно только при наличии РНК. Рибосомы находятся в цитоплазме, ядре, пластидах и, возможно, в митохондриях.
Химический состав органоидов. В настоящее время благодаря созданию центрифуг, имеющих огромную скорость вращения (десятки тысяч оборотов в минуту), можно отделять различные части клетки друг от друга, так как они имеют разный удельный вес. Поэтому стало возможным изучать биохимические свойства каждой части клетки.
Для сравнения химического состава органоидов клетки приводим данные (табл. 1).
В рибосомах из аминокислот синтезируются белки, что возможно только при наличии РНК. Рибосомы находятся в цитоплазме, ядре, пластидах и, возможно, в митохондриях.
Химический состав органоидов. В настоящее время благодаря созданию центрифуг, имеющих огромную скорость вращения (десятки тысяч оборотов в минуту), можно отделять различные части клетки друг от друга, так как они имеют разный удельный вес. Поэтому стало возможным изучать биохимические свойства каждой части клетки.
Для сравнения химического состава органоидов клетки приводим данные (табл. 1).Химический состав органоидов растительной клетки (в °/о от сухого вещества)
| Органоид | Белки | Липоиды | Нуклеиновые кислоты | Примечание |
| Цитоплазма | 80-95 | 2-3 | 1-2 | Большая часть нуклеиновых кислот — ДНК |
| Ядра | 50-80 | 8-40 | 10-30 | |
| Пластиды | 30-45 | 20-40 | 0,5-3,0 | |
| Митохондрии | 30-40 | 25-38 | 1-6 | |
| Рибосомы | 50-57 | 3-4 | 35 |
Клеточная оболочка
Характерный признак растительной клетки — наличие прочной оболочки, которая придает клетке определенную форму и предохраняет протоплазму от повреждений. Оболочка может расти только при участии протоплазмы. Клеточная оболочка молодых клеток состоит в основном из целлюлозы (клетчатки), гемицеллюлоз и пектиновых веществ.
Молекулы целлюлозы имеют вид длинных цепочек, собранных в мицеллы, расположение которых неодинаково у разных клеток. У волокон льна, конопли и других, представляющих собой вытянутые в длину клетки, мицеллы целлюлозы расположены вдоль клетки под некоторым углом. У клеток с одинаковым диаметром мицеллы расположены по всем направлениям в виде сетки. В межмицеллярных пространствах оболочки находится вода.
В процессе жизни растительного организма в строении клеточной оболочки могут происходить изменения: оболочка может утолщаться и химически изменяться. Утолщение оболочки идет изнутри за счет жизнедеятельности протоплазмы, причем оно происходит не по всей внутренней поверхности клетки; всегда остаются не утолщенные места — поры, состоящие только из тонкой целлюлозной оболочки.
Через поры, расположенные в соседних клетках друг против друга, проходят тончайшие нити цитоплазмы — плазмодесмы, благодаря которым осуществляется обмен между клетками.
Оболочка может расти только при участии протоплазмы. Клеточная оболочка молодых клеток состоит в основном из целлюлозы (клетчатки), гемицеллюлоз и пектиновых веществ.
Молекулы целлюлозы имеют вид длинных цепочек, собранных в мицеллы, расположение которых неодинаково у разных клеток. У волокон льна, конопли и других, представляющих собой вытянутые в длину клетки, мицеллы целлюлозы расположены вдоль клетки под некоторым углом. У клеток с одинаковым диаметром мицеллы расположены по всем направлениям в виде сетки. В межмицеллярных пространствах оболочки находится вода.
В процессе жизни растительного организма в строении клеточной оболочки могут происходить изменения: оболочка может утолщаться и химически изменяться. Утолщение оболочки идет изнутри за счет жизнедеятельности протоплазмы, причем оно происходит не по всей внутренней поверхности клетки; всегда остаются не утолщенные места — поры, состоящие только из тонкой целлюлозной оболочки.
Через поры, расположенные в соседних клетках друг против друга, проходят тончайшие нити цитоплазмы — плазмодесмы, благодаря которым осуществляется обмен между клетками.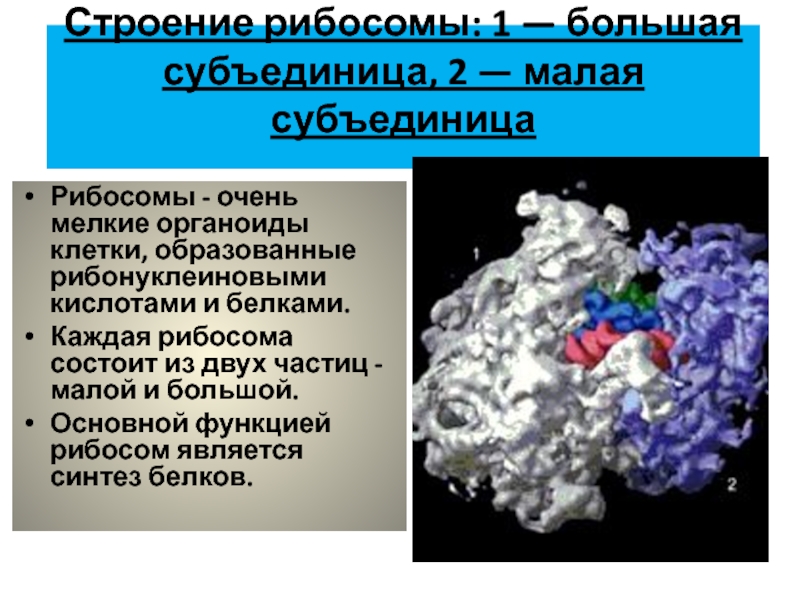 Однако при очень сильном утолщении оболочек резко затрудняется обмен, в клетке остается очень мало протоплазмы, и такие клетки отмирают, например лубяные волокна льна и конопли.
В оболочке клетки могут происходить также химические изменения в зависимости от характера растительной ткани. В покровных тканях — эпидермисе — происходит кутинизация. При этом в межмицеллярных пространствах целлюлозной оболочки накапливается кутин — жироподобное вещество, трудно проницаемое для газов и воды.
Однако кутинизация не приводит к отмиранию клеток, так как отложения кутина не захватывают всей поверхности клетки. В клетках покровной ткани кутинизируется только наружная стенка, образуя так называемую кутикулу.
В оболочках клеток может также откладываться суберин — пробковое вещество, тоже жироподобное и непроницаемое для воды и газов. Отложение суберина, или опробковение, происходит быстро по всей поверхности оболочки, это нарушает обмен клетки и приводит к ее отмиранию. Может происходить и одревеснение оболочки.
Однако при очень сильном утолщении оболочек резко затрудняется обмен, в клетке остается очень мало протоплазмы, и такие клетки отмирают, например лубяные волокна льна и конопли.
В оболочке клетки могут происходить также химические изменения в зависимости от характера растительной ткани. В покровных тканях — эпидермисе — происходит кутинизация. При этом в межмицеллярных пространствах целлюлозной оболочки накапливается кутин — жироподобное вещество, трудно проницаемое для газов и воды.
Однако кутинизация не приводит к отмиранию клеток, так как отложения кутина не захватывают всей поверхности клетки. В клетках покровной ткани кутинизируется только наружная стенка, образуя так называемую кутикулу.
В оболочках клеток может также откладываться суберин — пробковое вещество, тоже жироподобное и непроницаемое для воды и газов. Отложение суберина, или опробковение, происходит быстро по всей поверхности оболочки, это нарушает обмен клетки и приводит к ее отмиранию. Может происходить и одревеснение оболочки. В этом случае она пропитывается лигнином, который приводит к остановке роста клетки, а в дальнейшем, при более сильном одревеснении, и к ее отмиранию.
В этом случае она пропитывается лигнином, который приводит к остановке роста клетки, а в дальнейшем, при более сильном одревеснении, и к ее отмиранию.Клеточный сок
Молодая растительная клетка полностью заполнена протоплазмой, но по мере роста клетки в ней появляются вакуоли, заполненные клеточным соком . Вначале вакуоли возникают в большом количестве в виде мелких капелек, затем отдельные вакуоли начинают сливаться в одну центральную и протоплазма оттесняется к стенкам клетки.Изменения происходящие в растительной клетке при ее росте.
- — молодая клетка,
- — образование вакуолей,
- — слияние вакуолей и оттеснение протоплазмы к оболочке.
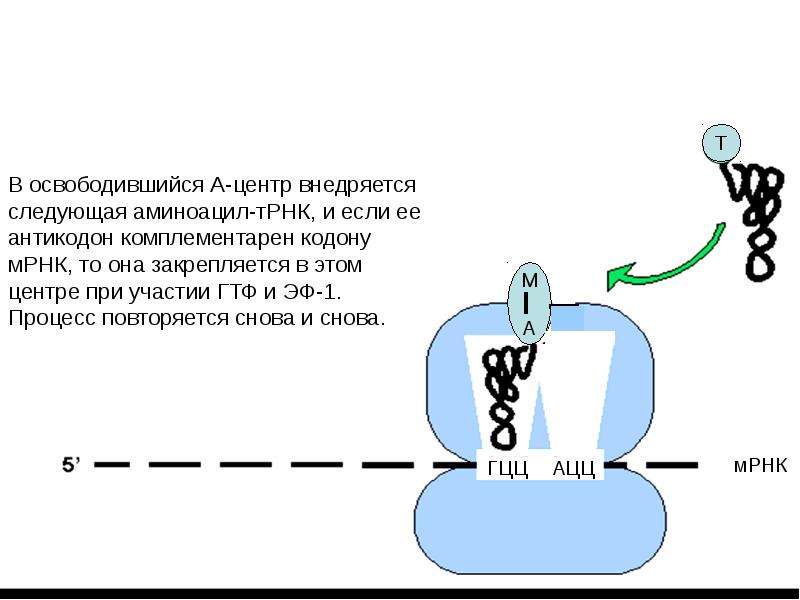
Каждая клетка любого организма имеет сложную структуру, включающую в себя множество компонентов.
Вкратце о строении клетки
Она состоит из мембраны, цитоплазмы, органоидов, которые в них расположены, а также ядра (кроме прокариотов), в котором находятся молекулы ДНК. Кроме того, над мембраной имеется дополнительная защитная структура. В животных клетках во всех остальных — У растений она состоит из целлюлозы, у грибов — из хитина, у бактерий — из муреина. Мембрана состоит из трех слоев: двух фосфолипидных и белкового между ними.
В ней есть поры, благодаря которым осуществляется перенос веществ внутрь и наружу. Возле каждой поры расположены специальные транспортные белки, которые пропускают в клетку только определенные вещества. Органоидами животной клетки являются:
Рибосома — это что?
Раз уж мы говорим о ней в данной статье, то вполне логично задать такой вопрос. Рибосома — это органоид, который может быть расположен на внешней стороне стенок комплекса Гольджи. Нужно уточнить еще, что рибосома — это органоид, который содержится в клетке в очень больших количествах. В одной может находиться до десяти тысяч.
Нужно уточнить еще, что рибосома — это органоид, который содержится в клетке в очень больших количествах. В одной может находиться до десяти тысяч.
Где находятся данные органоиды?
Итак, как уже говорилось, рибосома — это структура, которая находится на стенках комплекса Гольджи. Также она может свободно передвигаться по цитоплазме. Третий вариант, где может располагаться рибосома — мембрана клетки. И те органоиды, которые находятся в этом месте, практически не покидают его и являются стационарными.
Рибосома — строение
Как же выглядит данная органелла? Она похожа на телефон с трубкой. Рибосома эукариот и прокариот состоит из двух частей, одна из которых больше, другая — меньше. Но эти две ее составляющие не соединяются вместе, когда она находится в спокойном состоянии. Это происходит только тогда, когда рибосома клетки непосредственно начинает выполнять свои функции. О функциях мы поговорим позже. Рибосома, строение которой описывается в статье, также имеет в своем составе информационную РНК и Данные вещества необходимы для того, чтобы записывать на них информацию о нужных клетке белках. Рибосома, строение которой мы рассматриваем, не имеет собственной мембраны. Ее субъединицы (так называются две ее половины) ничем не защищены.
Рибосома, строение которой мы рассматриваем, не имеет собственной мембраны. Ее субъединицы (так называются две ее половины) ничем не защищены.
Какие функции выполняет в клетке данный органоид?
То, за что отвечает рибосома, — синтез белка. Он происходит на основе информации, которая записана на так называемой матричной РНК (рибонуклеиновой кислоте). Рибосома, строение которой мы рассмотрели выше, объединяет свои две субъединицы только на время синтеза белка — процесса под названием трансляция. Во время данной процедуры синтезируемая полипептидная цепь находится между двумя субъединицами рибосомы.
Где они формируются?
Рибосома — органоид, который создается ядрышком. Данная процедура происходит в десять этапов, на протяжении которых постепенно формируются белки малой и большой субъединиц.
Каким образом происходит формирование белков?
Биосинтез белков происходит в несколько этапов. Первый из них — это активация аминокислот. Всего их существует двадцать, при комбинировании их разными методами можно получить миллиарды различных белков. На протяжении данного этапа из аминокислот формируется аминоалиц-т-РНК. Данная процедура невозможна без участия АТФ (аденозинтрифосфорной кислоты). Также для осуществления этого процесса необходимы катионы магния.
На протяжении данного этапа из аминокислот формируется аминоалиц-т-РНК. Данная процедура невозможна без участия АТФ (аденозинтрифосфорной кислоты). Также для осуществления этого процесса необходимы катионы магния.
Второй этап — полипептидной цепи, или процесс объединения двух субъединиц рибосомы и поставка к ней необходимых аминокислот. В данном процессе также принимают участие ионы магния и ГТФ (гуанозинтрифосфат). Третий этап называется элонгацией. Это непосредственно синтез полипептидной цепи. Происходит методом трансляции. Терминация — следующий этап — это процесс распада рибосомы на отдельные субъединицы и постепенное прекращение синтеза полипептидной цепочки. Далее идет последний этап — пятый — На этой стадии из простой цепи аминокислот формируются сложные структуры, которые уже и представляют собой готовые белки. В данном процессе участвуют специфические ферменты, а также кофакторы.
Структура белка
Так как рибосома, строение и функции которой мы разобрали в этой статье, отвечает за синтез белков, то давайте рассмотрим подробнее их структуру. Она бывает первичной, вторичной, третичной и четвертичной. — это определенная последовательность, в которой располагаются аминокислоты, формирующие данное органическое соединение. представляет собой сформированные из полипептидных цепочек альфа-спирали и бета-складки. Третичная структура белка предусматривает определенную комбинацию альфа-спиралей и бета-складок. Четвертичная же структура заключается в формировании единого макромолекулярного образования. То есть комбинации альфа-спиралей и бета-структур формируют глобулы либо фибриллы. По этому принципу можно выделить два типа белков — фибриллярные и глобулярные.
Она бывает первичной, вторичной, третичной и четвертичной. — это определенная последовательность, в которой располагаются аминокислоты, формирующие данное органическое соединение. представляет собой сформированные из полипептидных цепочек альфа-спирали и бета-складки. Третичная структура белка предусматривает определенную комбинацию альфа-спиралей и бета-складок. Четвертичная же структура заключается в формировании единого макромолекулярного образования. То есть комбинации альфа-спиралей и бета-структур формируют глобулы либо фибриллы. По этому принципу можно выделить два типа белков — фибриллярные и глобулярные.
К первым относятся такие, как актин и миозин, из которых сформированы мышцы. Примерами вторых могут служить гемоглобин, иммуноглобулин и другие. напоминают собой нить, волокно. Глобулярные больше похожи на клубок сплетенных между собой альфа-спиралей и бета-складок.
Что такое денатурация?
Каждый наверняка слышал это слово. Денатурация — это процесс разрушения структуры белка — сначала четвертичной, затем третичной, а после — и вторичной. В некоторых случаях происходит и ликвидация первичной структуры белка. Данный процесс может происходить вследствие воздействия на данное органическое вещество высокой температуры. Так, денатурацию белка можно наблюдать при варке куриных яиц. В большинстве случаев этот процесс необратим. Так, при температуре выше сорока двух градусов начинается денатурация гемоглобина, поэтому сильная гипертермия опасна для жизни. Денатурацию белков до отдельных нуклеиновых кислот можно наблюдать в процессе пищеварения, когда с помощью ферментов организм расщепляет сложные органические соединения на более простые.
В некоторых случаях происходит и ликвидация первичной структуры белка. Данный процесс может происходить вследствие воздействия на данное органическое вещество высокой температуры. Так, денатурацию белка можно наблюдать при варке куриных яиц. В большинстве случаев этот процесс необратим. Так, при температуре выше сорока двух градусов начинается денатурация гемоглобина, поэтому сильная гипертермия опасна для жизни. Денатурацию белков до отдельных нуклеиновых кислот можно наблюдать в процессе пищеварения, когда с помощью ферментов организм расщепляет сложные органические соединения на более простые.
Вывод
Роль рибосом очень сложно переоценить. Именно они являются основой существования клетки. Благодаря данным органоидам она может создавать белки, которые ей необходимы для самых разнообразных функций. формирующиеся рибосомами, могут играть защитную роль, транспортную, роль катализатора, строительного материала для клетки, ферментативную, регуляторную (многие гормоны имеют белковую структуру). Поэтому можно сделать вывод, что рибосомы выполняют одну из самых важных функций в клетке. Поэтому их и так много — клетке всегда нужны продукты, синтезируемые данными органоидами.
Поэтому можно сделать вывод, что рибосомы выполняют одну из самых важных функций в клетке. Поэтому их и так много — клетке всегда нужны продукты, синтезируемые данными органоидами.
Рибосомы как фабрики белкового синтеза
Рибосомная РНК — высокополимерное соединение, молекула ее содержит 4000—6000 нуклеотидов. Она в соединении с белком образует внутри клетки особые субмикроскопические гранулы— рибосомы. Рибосома является фабрикой белкового синтеза , куда в качестве сырья доставляются аминокислоты. Установлено, что роль матрицы принадлежит особому типу рибонуклеиновых кислот — информационной РНК. Размер ее молекул широко варьирует, имея в среднем от 500 до 1500 нуклеотидов. и-РНК синтезируется на молекулах ДНК в ядре клетки. Из ядра они проникают в протоплазму к рибосомам и, взаимодействуя с ними, участвуют в синтезе белка. Если молекулы й-РНК служат матрицей для синтеза белков, то они должны содержать информацию о данном белке, зашифрованную определенным кодом. Но все различие между видами информационной РНК заключается в разной последовательности чередования четырех азотистых оснований (У, Ц, А и Г). Однако и белки, несмотря на их огромное многообразие, отличаются друг от. друга в своей первичной структуре только порядком расположения аминокислот. Это привело к заключению, что последовательность расположения четырех видов азотистых оснований на молекуле РНК определяет последовательность расположения 20 видов аминокислот в полипептидной цепи синтезируемого белка, или, другими словами, что каждая из 20 аминокислот может занять на данной матрице только определенное место кодированное сочетанием нескольких азотистых оснований. [c.123]
Но все различие между видами информационной РНК заключается в разной последовательности чередования четырех азотистых оснований (У, Ц, А и Г). Однако и белки, несмотря на их огромное многообразие, отличаются друг от. друга в своей первичной структуре только порядком расположения аминокислот. Это привело к заключению, что последовательность расположения четырех видов азотистых оснований на молекуле РНК определяет последовательность расположения 20 видов аминокислот в полипептидной цепи синтезируемого белка, или, другими словами, что каждая из 20 аминокислот может занять на данной матрице только определенное место кодированное сочетанием нескольких азотистых оснований. [c.123]
Глава 8 РИБОСОМЫ КАК ФАБРИКИ БЕЛКОВОГО СИНТЕЗА [c.102]
Рибосомы как фабрики белкового синтеза [c.103]
Синтез белков до некоторой степени напоминает сборочный конвейер, в котором рибосомы все время передвигаются относительно информационной РНК, доставляя аминоацил-тРНК — реальные строительные блоки для сборки белковых молекул. Рибосома представляет собой маленькую фабрику, в которой компактно упакованные белки и тРНК образуют несколько активных центров, способных осуществлять многочисленные каталитические функции. Различные группы дополнительных факторов участвуют в работе рибосомы на каждой из трех стадий белкового синтеза инициации, элонгации и терминации. Энергия для биосинтеза белка обеспечивается гидролизом GTP. [c.72]
Рибосома представляет собой маленькую фабрику, в которой компактно упакованные белки и тРНК образуют несколько активных центров, способных осуществлять многочисленные каталитические функции. Различные группы дополнительных факторов участвуют в работе рибосомы на каждой из трех стадий белкового синтеза инициации, элонгации и терминации. Энергия для биосинтеза белка обеспечивается гидролизом GTP. [c.72]
Первоначально рибосомы выделяли в виде нескольких различных структур их описывали по-разному-как клеточные органеллы, как микросомные частицы, как рибону-клеопротеины или просто как белоксинтезирующие машины. На деле же это макромолекулярные комплексы с определенной структурой, которые совместно с некоторыми вспомогательными факторами обладают определенными ферментативными активностями, необходимыми для различных этапов белкового синтеза. Вкратце рибосому можно представить как маленькую передвижную фабрику, которая, передвигаясь вдоль матрицы, осуществляет синтез пептидных связей. При этом с необычайно большой скоростью в рибосому входят (и выходят из нее) молекулы тРНК, несущие аминокислоты кроме того, с рибосомой циклически связываются (и отделяются от нее) факторы элонгации. [c.102]
При этом с необычайно большой скоростью в рибосому входят (и выходят из нее) молекулы тРНК, несущие аминокислоты кроме того, с рибосомой циклически связываются (и отделяются от нее) факторы элонгации. [c.102]
Рибосомы представляют собой сложную молекулярную машину ( фабрику ) синтеза белка. Для выяснения тонких механизмов синтеза белка в рибосомах необходимы более точные сведения о структуре и функциях всех компонентов рибосом. В последнее время получены данные, свидетельствующие о вероятной пространственной трехмерной структуре как целых рибосом, так и их субчастиц. В частности, выяснено, что форму и размеры 30S и 40S субчастиц рибосом предопределяют не белковые молекулы этих частиц, а третичная структура входящих в их состав 16S и 18S рРНК. Более того, по данным акад. A. . Спирина, для сохранения пространственной морфологической модели всей 30S субчастицы оказалось достаточным наличие только двух белков (из 21), содержащихся в определенных топографических участках молекулы 16S рРНК.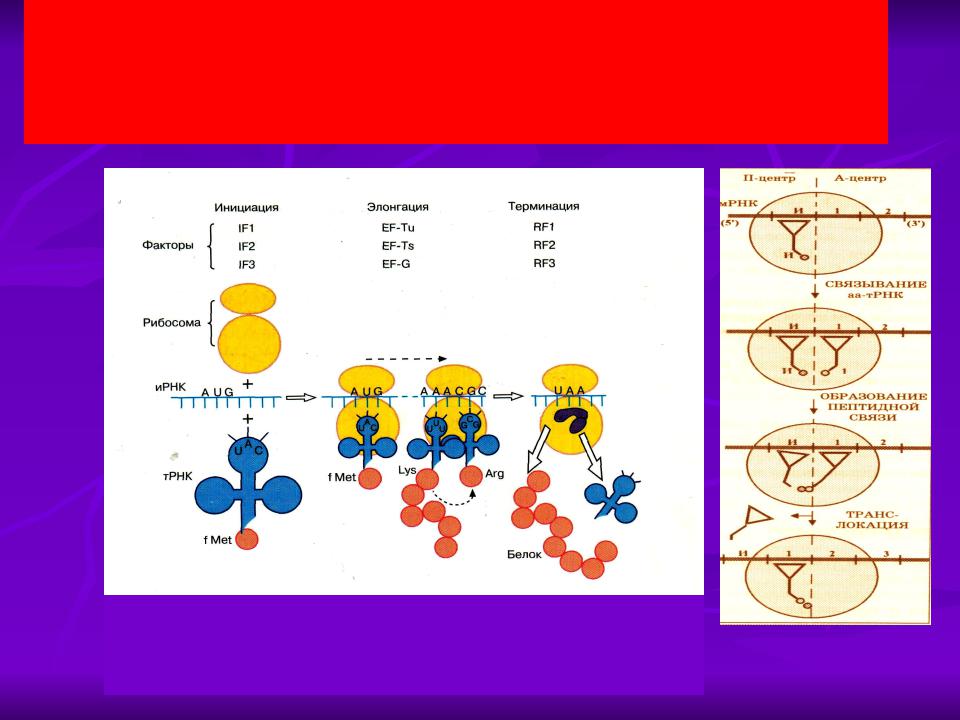 [c.515]
[c.515]
Форма, организация и функции клетки, т. е. ее жизнь, определяются ее белковым составом и активностью индивидуальных белков. Отсюда следует, что генетические инструкции должны содержать информацию, необходимую для точного синтеза набора белков, характерных для данной клетки. Эта информация закодирована в структуре очень больших молекул дезоксирибонуклеино-кислоты. При делении клетки необходимо точное воспроизведение этих молекул с последующим равным распределением информации между дочерними клетками. Эта информация должна-быть передана от ядра к белковым фабрикам — рибосомам. Изменения химической структуры дезоксирибонуклеиновой кислоты выявляются в виде мутаций в последующих поколениях. Наибольший вклад в расшифровку механизмов наследственности внесли работы, проведенные на непатогенной кишечной бактерии Es heri hia oli и на бактериофагах (бактериальных вирусах) последние обладают лишь ограниченным количеством генетической информации, содержащейся в нуклеиновой кислоте, которая окружена специфической белковой оболочкой они способны к самовоспроизведению только путем использования синтетического аппарата жи- [c.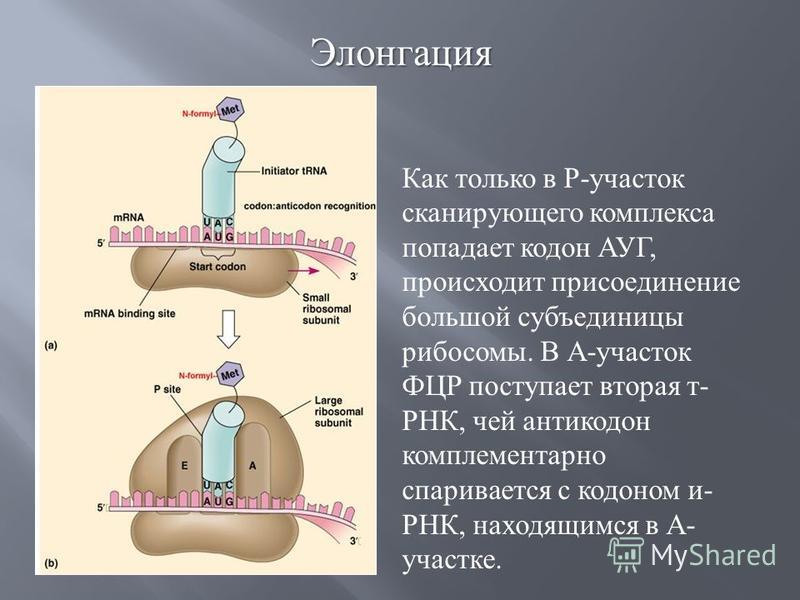 17]
17]
рибосом — обзор | ScienceDirect Topics
Инактивация рибосом.
Белки, ингибирующие рибосомы (RIP), являются противовирусными веществами, поскольку они ингибируют синтез белка, блокируя заключительные фазы внутриклеточного развития вируса. RIP специфически инактивируют рибосомы, что приводит к блокированию синтеза белка на фазе элонгации. Первичная структура RIP, выделенного из разных источников, очень гомологична, что позволяет сделать вывод о том, что ингибирующая активность данных пептидов в определенной степени коррелирует с первичной структурой их активных центров, ответственных за связывание рибосом.
Первоначально предполагалось, что RIP неактивны в гомологичных рибосомах. Однако низкая рибосомная активность лукача ( Phytolacca americana ) в экспериментах по внеклеточной трансляции привела к открытию, что рибосомы ланча фактически инактивируются RIPs (PAP-1) во время высвобождения. Рибосомы других растений также блокируются действием их собственного RIP в аналогичных условиях. Однако следует отметить, что рибосомы лука все еще достаточно устойчивы к добавлению их собственных RIP (PAP-1) и гораздо более чувствительны к действию RIP, выделенных из других растений.Тем не менее, тритин, RIP пшеницы, не инактивирует рибосомы пшеницы, и поэтому изолированные рибосомы пшеницы сохраняют высокую активность.
Однако следует отметить, что рибосомы лука все еще достаточно устойчивы к добавлению их собственных RIP (PAP-1) и гораздо более чувствительны к действию RIP, выделенных из других растений.Тем не менее, тритин, RIP пшеницы, не инактивирует рибосомы пшеницы, и поэтому изолированные рибосомы пшеницы сохраняют высокую активность.
Полученные к настоящему времени экспериментальные данные позволяют сделать вывод, что RIP обладают специфической активностью по отношению к рибосомам, выделенным из разных видов растений. По-видимому, рибосомы имеют определенные структурные особенности, которые могут распознаваться или не распознаваться различными RIP. Однако механизмы функционирования этих белков не так просты: имеются данные, что PAP-S (RIP из семян лани) подавляет рост клеток моркови в жидкой культуре, а такая же концентрация PAP-1 стимулирует рост клеток риса.
Временной интервал противовирусной активности довольно узок, поэтому противовирусная активность большинства RIP проверяется путем инокуляции растений смесью этих белков и вирусного препарата или препарата вирусной РНК. Обработка растений RIP через некоторое время после инокуляции не предотвратит развитие вирусной инфекции. Например, защитный эффект не может быть обнаружен, если RIP из лука (PAP-1) применяется через 30–50 минут после инокуляции протопластов табака вирусом табачной мозаики (TMV).Следовательно, RIP активны только на очень ранних стадиях жизненного цикла вируса. Хорошо известно, что рибосомы хозяина могут связывать вирусную РНК почти сразу после того, как вирус РНК потерял свою оболочку. Возможно, трансляционный комплекс (вирусная РНК-рибосома) уже невосприимчив к действию RIP, и пока этот комплекс существует, RIP неактивны.
Обработка растений RIP через некоторое время после инокуляции не предотвратит развитие вирусной инфекции. Например, защитный эффект не может быть обнаружен, если RIP из лука (PAP-1) применяется через 30–50 минут после инокуляции протопластов табака вирусом табачной мозаики (TMV).Следовательно, RIP активны только на очень ранних стадиях жизненного цикла вируса. Хорошо известно, что рибосомы хозяина могут связывать вирусную РНК почти сразу после того, как вирус РНК потерял свою оболочку. Возможно, трансляционный комплекс (вирусная РНК-рибосома) уже невосприимчив к действию RIP, и пока этот комплекс существует, RIP неактивны.
Рибосома — обзор | ScienceDirect Topics
1.29.4
Важность 5 ‘- UTR и вторичная структура в 5′-UTR области мРНК Рибосома обычно рекрутируется в 5′-UTR мРНК млекопитающих в кэп-зависимом Таким образом, для начала синтеза белка собранной рибосомой необходимо присутствие определенных консенсусных областей, окружающих стартовый кодон AUG. Элементы в 5′-UTR, такие как стабильные шпильки, открытые рамки считывания и внутренние сайты входа в рибосомы (IRES), могут быть сконструированы так, чтобы влиять на инициацию трансляции.
Элементы в 5′-UTR, такие как стабильные шпильки, открытые рамки считывания и внутренние сайты входа в рибосомы (IRES), могут быть сконструированы так, чтобы влиять на инициацию трансляции.
Как и в случае с последовательностью, окружающей стоп-кодон, последовательность, окружающая стартовый кодон AUG, имеет решающее значение для точности продукции rP. В клетках млекопитающих большинство мРНК содержит консенсусную последовательность Козака (GCCGCCACC ATG G). Эта последовательность замедляет сканирование рибосом в кодоне инициации, может значительно повысить вероятность эффективного инициирования и помогает предотвратить сканирование с утечкой, которое приводит к продукции неаутентичного белка.По этой причине последовательность Козака обычно встраивают в 5′-UTR мРНК для продукции в клетках млекопитающих.
Во время клеточного стресса кэп-зависимая трансляция белков подавляется несколькими путями. Однако во время стресса не вся трансляция прекращается, и один из механизмов преодоления блока трансляции заключается в использовании независимого от кэпа механизма рекрутирования рибосом через IRES. IRES, которые были впервые обнаружены как часть механизма захвата хозяина, трансляции клеток в пикорнавирусах, присутствуют в 5′-UTR ряда мРНК, кодирующих клеточные белки, которые играют роль в критических процессах контроля, таких как рост и гибель клеток.Специфические IRES реагируют на специфические стрессовые стимулы, включая гипоксию, стресс ER и недостаток питательных веществ. Это предотвращение ингибирования трансляции позволяет белкам, которые являются ключевыми для клеточного ответа на конкретный стресс, с которым сталкивается клетка, продолжать вырабатываться, а клетке сохранять свою целостность посредством различных изменений окружающей среды.
IRES, которые были впервые обнаружены как часть механизма захвата хозяина, трансляции клеток в пикорнавирусах, присутствуют в 5′-UTR ряда мРНК, кодирующих клеточные белки, которые играют роль в критических процессах контроля, таких как рост и гибель клеток.Специфические IRES реагируют на специфические стрессовые стимулы, включая гипоксию, стресс ER и недостаток питательных веществ. Это предотвращение ингибирования трансляции позволяет белкам, которые являются ключевыми для клеточного ответа на конкретный стресс, с которым сталкивается клетка, продолжать вырабатываться, а клетке сохранять свою целостность посредством различных изменений окружающей среды.
Было показано, что вирусные IRES имеют разные требования к каноническому фактору инициации для их активности, и было обнаружено, что это дифференциальное требование распространяется на клеточные IRES.Внутри клетки находится группа вспомогательных белков, называемых факторами, активирующими IRES trans (ITAF), некоторые из которых обычно необходимы для активности IRES (например, белок, связывающий полипиримидиновый тракт), а другие более специфичны. Было высказано предположение, что способность разных IRES реагировать на разные стрессовые стимулы зависит от изменений в экспрессии и локализации ITAFs [13]. В конце культивирования клеток млекопитающих, когда клетки подвергаются стрессу, кэп-зависимая трансляция, включая трансляцию любой рекомбинантной мРНК, будет значительно снижена.IRES уже использовались вместе с альтернативным сплайсингом для разработки дицистронных систем экспрессии, которые связывают селектируемые маркеры с экспрессией интересующего рекомбинантного гена, такого как маркер селекции глутаминсинтазы в клетках NS0. Можно предусмотреть стратегию инженерии, при которой рекомбинантные мРНК конструируются, включающие специфические IRES, и экспрессируются в клетках с индивидуальным репертуаром ITAF, позволяя рекомбинантной мРНК использовать независимую от кэпа трансляцию, когда кэп-зависимая трансляция ингибируется.В отличие от потенциальных преимуществ IRES, присутствие стабильных вторичных структур, таких как шпильки, в 5′-UTR может значительно снизить эффективность cap-зависимой инициации трансляции; в результате эти структуры обычно удаляются из 5′-UTR.
Было высказано предположение, что способность разных IRES реагировать на разные стрессовые стимулы зависит от изменений в экспрессии и локализации ITAFs [13]. В конце культивирования клеток млекопитающих, когда клетки подвергаются стрессу, кэп-зависимая трансляция, включая трансляцию любой рекомбинантной мРНК, будет значительно снижена.IRES уже использовались вместе с альтернативным сплайсингом для разработки дицистронных систем экспрессии, которые связывают селектируемые маркеры с экспрессией интересующего рекомбинантного гена, такого как маркер селекции глутаминсинтазы в клетках NS0. Можно предусмотреть стратегию инженерии, при которой рекомбинантные мРНК конструируются, включающие специфические IRES, и экспрессируются в клетках с индивидуальным репертуаром ITAF, позволяя рекомбинантной мРНК использовать независимую от кэпа трансляцию, когда кэп-зависимая трансляция ингибируется.В отличие от потенциальных преимуществ IRES, присутствие стабильных вторичных структур, таких как шпильки, в 5′-UTR может значительно снизить эффективность cap-зависимой инициации трансляции; в результате эти структуры обычно удаляются из 5′-UTR.
6.4: Синтез белков — Биология LibreTexts
Транскрипция
Транскрипция — это первая часть центральной догмы молекулярной биологии: ДНК → РНК . Это передача генетических инструкций ДНК на мРНК.Транскрипция происходит в ядре клетки. Во время транскрипции создается цепь мРНК, которая комплементарна цепи ДНК, называемой геном. Ген можно легко идентифицировать по последовательности ДНК. Ген содержит три основных участка: промотор, кодирующую последовательность (рамку считывания) и терминатор. Есть и другие части гена, которые показаны на рисунке \ (\ PageIndex {3} \).
Рисунок \ (\ PageIndex {3} \): основные компоненты гена. 1. промотор, 2. инициация транскрипции, 3.5 ‘передняя нетранслируемая область, 4. сайт стартового кодона трансляции, 5. кодирующая белок последовательность, 6. область стоп-кодона трансляции, 7. 3’ нижележащая нетранслируемая область и 8. терминатор.Шаги транскрипции
Транскрипция происходит в три этапа, называемых инициацией, удлинением и прекращением.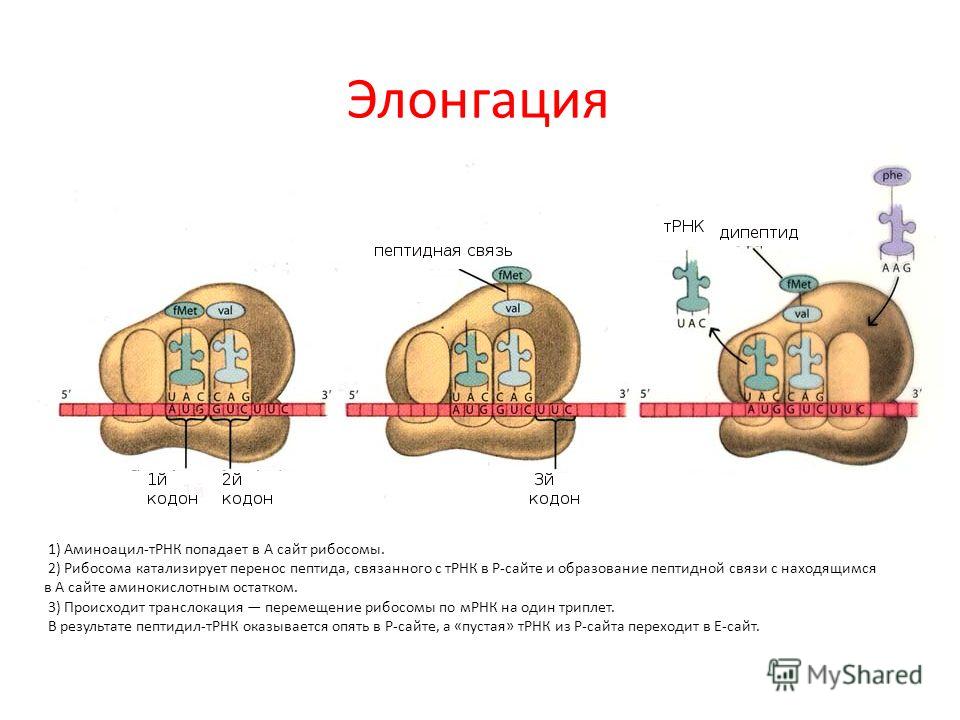 Шаги показаны на рисунке \ (\ PageIndex {4} \).
Шаги показаны на рисунке \ (\ PageIndex {4} \).
- Инициирование — это начало транскрипции. Это происходит, когда фермент РНК-полимераза связывается с областью гена, называемой промотором .Это дает сигнал ДНК раскручиваться, чтобы фермент мог «читать» основания в одной из цепей ДНК. Фермент готов к созданию цепи мРНК с комплементарной последовательностью оснований. Промотор не является частью образующейся мРНК .
- Элонгация — это добавление нуклеотидов к цепи мРНК.
- Окончание — это окончание транскрипции. Когда РНК-полимераза транскрибирует терминатор, он отделяется от ДНК. После этого шага цепь мРНК завершена. Рисунок \ (\ PageIndex {4} \): Транскрипция происходит в три этапа — инициация, удлинение и завершение.
Обработка мРНК
У эукариот новая мРНК еще не готова к трансляции.На этом этапе она называется пре-мРНК, и она должна пройти дополнительную обработку, прежде чем покинет ядро в виде зрелой мРНК.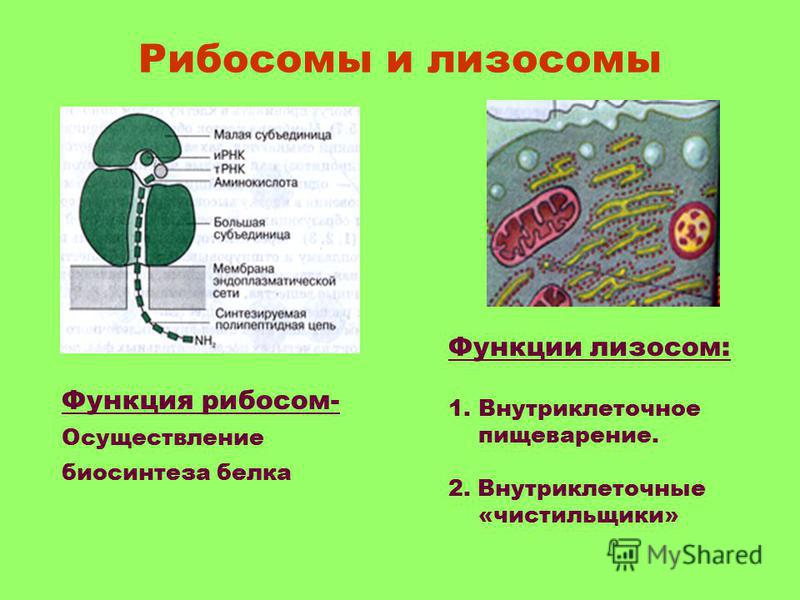 Обработка может включать добавление 5 ‘крышки, сращивание, редактирование и 3’ хвоста полиаденилирования (поли-A). Эти процессы по-разному модифицируют мРНК. Такие модификации позволяют использовать один ген для производства более чем одного белка. Смотрите рисунок \ (\ PageIndex {5} \), как вы читаете ниже:
Обработка может включать добавление 5 ‘крышки, сращивание, редактирование и 3’ хвоста полиаденилирования (поли-A). Эти процессы по-разному модифицируют мРНК. Такие модификации позволяют использовать один ген для производства более чем одного белка. Смотрите рисунок \ (\ PageIndex {5} \), как вы читаете ниже:
- 5′-кэп защищает мРНК в цитоплазме и помогает прикреплять мРНК к рибосоме для трансляции.
- Сплайсинг удаляет интроны из последовательности мРНК, кодирующей белок. Интроны — это области, которые не кодируют белок. Оставшаяся мРНК состоит только из областей, называемых экзонами , которые кодируют белок.
- Редактирование изменяет некоторые нуклеотиды в мРНК. Например, человеческий белок APOB, который помогает транспортировать липиды в крови, имеет две разные формы из-за редактирования. Одна форма меньше другой, потому что редактирование добавляет более ранний стоп-сигнал в мРНК.
- Полиаденилирование добавляет к мРНК «хвост».
 Хвост состоит из цепочки As (адениновых оснований). Он сигнализирует об окончании мРНК. Он также участвует в экспорте мРНК из ядра и защищает мРНК от ферментов, которые могут ее разрушить.
Хвост состоит из цепочки As (адениновых оснований). Он сигнализирует об окончании мРНК. Он также участвует в экспорте мРНК из ядра и защищает мРНК от ферментов, которые могут ее разрушить.
Перевод
Перевод — это вторая часть центральной догмы молекулярной биологии: РНК -> Белок .Это процесс, в котором генетический код в мРНК считывается для создания белка. Перевод показан на рисунке \ (\ PageIndex {6} \). После того, как мРНК покидает ядро, она перемещается на рибосому, которая состоит из рРНК и белков. Трансляция происходит на рибосомах, плавающих в цитозоле, или на рибосомах, прикрепленных к грубому эндоплазматическому ретикулуму. Рибосома считывает последовательность кодонов в мРНК, а молекулы тРНК доставляют аминокислоты к рибосоме в правильной последовательности.
Чтобы понять роль тРНК, вам нужно больше узнать о ее структуре. Каждая молекула тРНК имеет антикодон для содержащейся в ней аминокислоты. Антикодон комплементарен кодону аминокислоты. Например, аминокислота лизин имеет кодон AAG, поэтому антикодоном является UUC. Следовательно, лизин будет переноситься молекулой тРНК с антикодоном UUC. Везде, где кодон AAG появляется в мРНК, временно связывается антикодон UUC тРНК. Связываясь с мРНК, тРНК отдает свою аминокислоту. С помощью рРНК между аминокислотами образуются связи, когда они одна за другой переносятся на рибосому, образуя полипептидную цепь.Цепочка аминокислот продолжает расти, пока не будет достигнут стоп-кодон.
Каждая молекула тРНК имеет антикодон для содержащейся в ней аминокислоты. Антикодон комплементарен кодону аминокислоты. Например, аминокислота лизин имеет кодон AAG, поэтому антикодоном является UUC. Следовательно, лизин будет переноситься молекулой тРНК с антикодоном UUC. Везде, где кодон AAG появляется в мРНК, временно связывается антикодон UUC тРНК. Связываясь с мРНК, тРНК отдает свою аминокислоту. С помощью рРНК между аминокислотами образуются связи, когда они одна за другой переносятся на рибосому, образуя полипептидную цепь.Цепочка аминокислот продолжает расти, пока не будет достигнут стоп-кодон.
Рибосомы, которые только что состоят из рРНК (рибосомальной РНК) и белка, были классифицированы как рибозимы, потому что рРНК обладает ферментативной активностью. РРНК важна для активности пептидилтрансферазы, связывающей аминокислоты. Рибосомы состоят из двух субъединиц — рРНК и белка. Большая субъединица имеет три активных сайта, называемых сайтами E, P и A.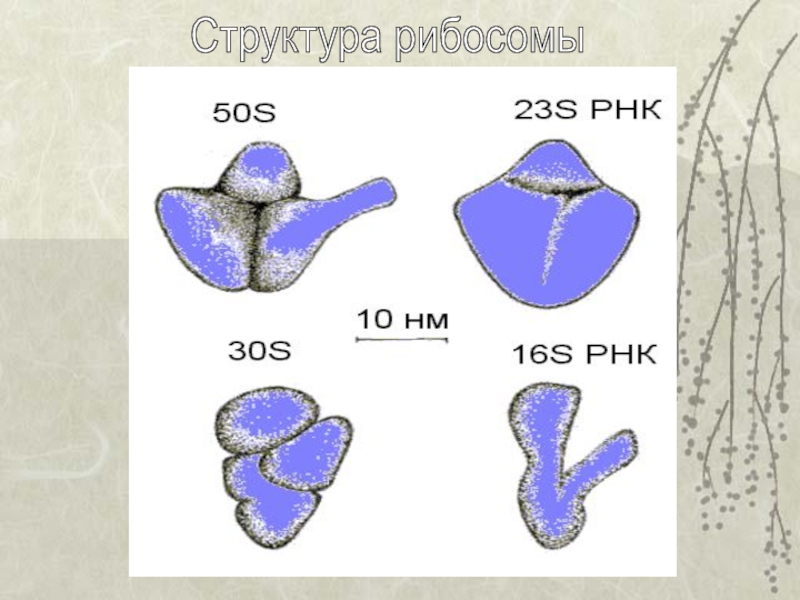 Эти сайты важны для каталитической активности рибосом.
Эти сайты важны для каталитической активности рибосом.
Так же, как и синтез мРНК, синтез белка можно разделить на три фазы: инициация, удлинение и завершение.Помимо матрицы мРНК, в процесс трансляции вносят вклад многие другие молекулы, такие как рибосомы, тРНК и различные ферментативные факторы
Инициирование трансляции: Маленькая субъединица связывается с сайтом выше (на 5′-стороне) начала мРНК. Он продолжает сканировать мРНК в направлении 5 ‘-> 3’, пока не встретит кодон START (AUG). Прикрепляется большая субъединица, и тРНК инициатора, несущая метионин (Met), связывается с сайтом P на рибосоме.
Удлинение трансляции: Рибосома сдвигает один кодон за раз, катализируя каждый процесс, который происходит в трех сайтах. На каждом этапе заряженная тРНК входит в комплекс, полипептид становится на одну аминокислоту длиннее, а незаряженная тРНК уходит. Энергия каждой связи между аминокислотами происходит от GTP, молекулы, подобной АТФ. Вкратце, рибосомы взаимодействуют с другими молекулами РНК, образуя цепочки аминокислот, называемые полипептидными цепями, из-за пептидной связи, которая образуется между отдельными аминокислотами.Внутри рибосомы в процессе трансляции участвуют три сайта: A, P и E. Удивительно, но аппарату трансляции E. coli требуется всего 0,05 секунды для добавления каждой аминокислоты, а это означает, что полипептид из 200 аминокислот может быть транслирован всего за 10 секунд.
Вкратце, рибосомы взаимодействуют с другими молекулами РНК, образуя цепочки аминокислот, называемые полипептидными цепями, из-за пептидной связи, которая образуется между отдельными аминокислотами.Внутри рибосомы в процессе трансляции участвуют три сайта: A, P и E. Удивительно, но аппарату трансляции E. coli требуется всего 0,05 секунды для добавления каждой аминокислоты, а это означает, что полипептид из 200 аминокислот может быть транслирован всего за 10 секунд.
Прекращение трансляции : Прекращение трансляции происходит, когда встречается стоп-кодон (UAA, UAG или UGA) (см. Рисунок \ (\ PageIndex {7} \). Когда рибосома встречает стоп-кодон, растущий полипептид высвобождается с помощью различных рилизинг-факторов субъединицы рибосомы диссоциируют и покидают мРНК.После завершения трансляции многих рибосом мРНК разрушается, поэтому нуклеотиды можно повторно использовать в другой реакции транскрипции.
Другие жизни рибосомных белков | Human Genomics
Лодиш Х., Берк А., Зипурски С.Л., Мацудаира П. и др.: Молекулярная клеточная биология. 2000, W.H. Freeman and Co., Нью-Йорк, штат Нью-Йорк, 4
Google Scholar
Циммерманн Р.А.: Двойная жизнь рибосомных белков. Клетка.2003, 115: 130-132. 10.1016 / S0092-8674 (03) 00804-3.
CAS Статья PubMed Google Scholar
Wool IG: Экстрарибосомные функции рибосомных белков. Trends Biochem Sci. 1996, 21: 164-165.
CAS Статья PubMed Google Scholar
Асеев Л.В., Левандовская А.А., Чуфистова Л.С., Скапцова Н.В. и др .: Новая регуляторная цепь в оперонах рибосомных белков: S2-опосредованный контроль экспрессии rpsB-tsf in vivo .РНК. 2008, 14: 1882-1894. 10.1261 / rna.1099108.
PubMed Central CAS Статья PubMed Google Scholar

Grundy FJ, Henkin TM: Ген rpsd , кодирующий рибосомный белок S4, аутогенно регулируется в Bacillus subtilis . J Bacteriol. 1991, 173: 4595-4602.
PubMed Central CAS PubMed Google Scholar
Ван Ф., Андерсон Д.Е., Барниц Р.А., Сноу А и др.: Рибосомный белок S3: субъединица домена KH в комплексах NF-kappaB, который опосредует селективную регуляцию гена. Клетка. 2007, 131: 927-939. 10.1016 / j.cell.2007.10.009.
CAS Статья PubMed Google Scholar
Mukhopadhyay R, Ray PS, Arif A, Brady AK, et al: Ось DAPK-ZIPK-L13a представляет собой модуль отрицательной обратной связи, регулирующий экспрессию воспалительных генов. Mol Cell.2008, 32: 371-382. 10.1016 / j.molcel.2008.09.019.
PubMed Central CAS Статья PubMed Google Scholar
Могридж Дж., Гринблатт Дж .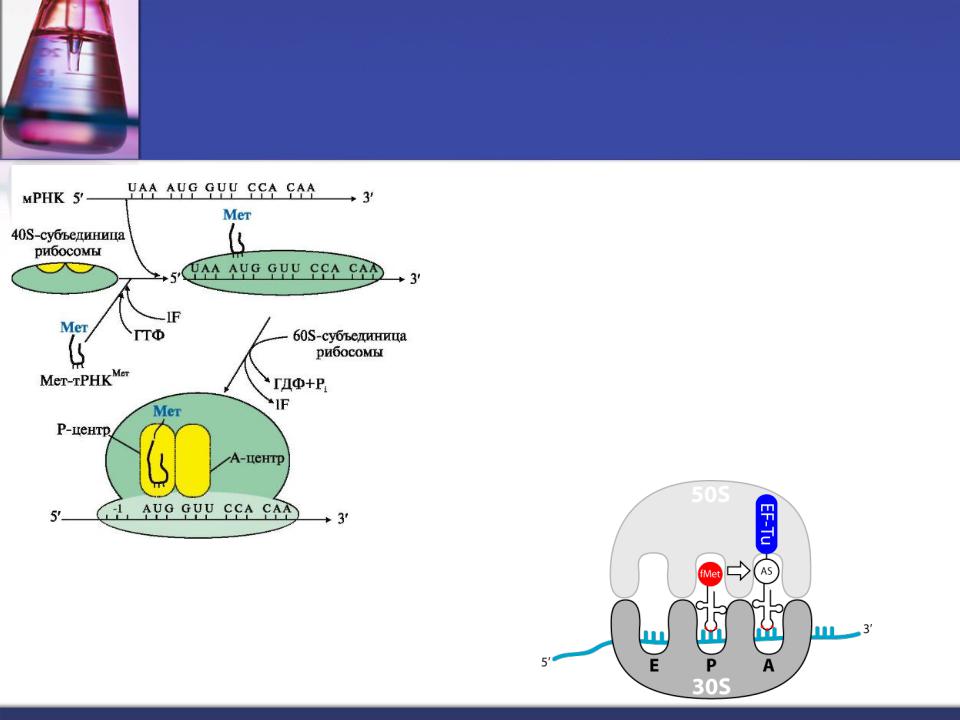 : Специфическое связывание рибосомного белка S1 Escherichia coli с транскрипционной антитерминаторной РНК boxA. J Bacteriol. 1998, 180: 2248-2252.
: Специфическое связывание рибосомного белка S1 Escherichia coli с транскрипционной антитерминаторной РНК boxA. J Bacteriol. 1998, 180: 2248-2252.
PubMed Central CAS PubMed Google Scholar
Суходолец М.В., Гарджес С.Взаимодействие РНК-полимеразы Escherichia coli с рибосомным белком S1 и Sm-подобной АТФазой Hfq. Биохимия. 2003, 42: 8022-8034. 10.1021 / bi020638i.
CAS Статья PubMed Google Scholar
Торрес М., Кондон С., Балада Дж. М., Сквайрс С. и др.: Рибосомный белок S4 — это фактор транскрипции, свойства которого очень похожи на NusA, белок, участвующий в антитерминации как рибосомных, так и рибосомных РНК.EMBO J. 2001, 20: 3811-3820. 10.1093 / emboj / 20.14.3811.
PubMed Central CAS Статья PubMed Google Scholar
Уоррен Ф., Дас А: Формирование устойчивого к терминации транскрипционного комплекса в локусе фаг-лямбда-орех: эффекты измененной трансляции и рибосомной мутации.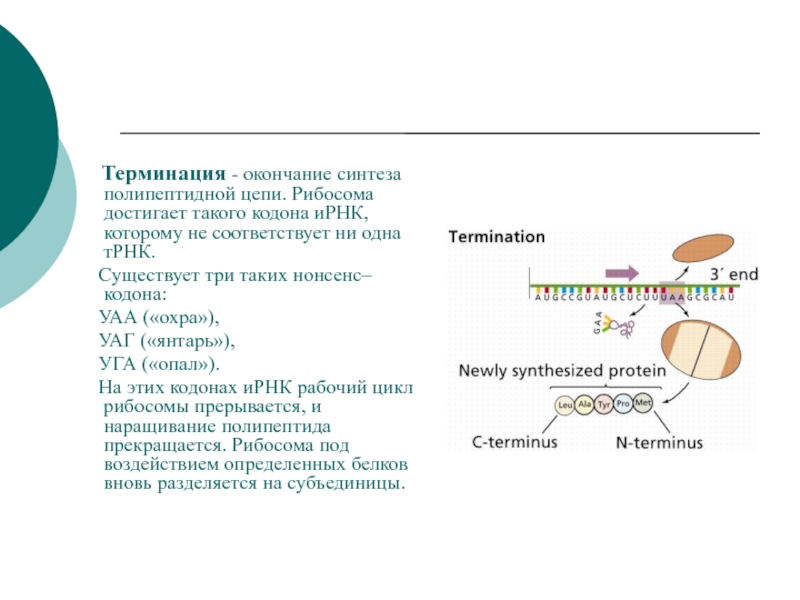 Proc Natl Acad Sci USA. 1984, 81: 3612-3616. 10.1073 / pnas.81.12.3612.
Proc Natl Acad Sci USA. 1984, 81: 3612-3616. 10.1073 / pnas.81.12.3612.
PubMed Central CAS Статья PubMed Google Scholar
Лай, доктор медицины, Сюй Дж .: Рибосомные белки и колоректальный рак. Curr Genomics. 2007, 8: 43-49. 10.2174 / 138920207780076938.
PubMed Central CAS Статья PubMed Google Scholar
Tabb-Massey A, Caffrey JM, Logsden P, Taylor S, et al: Рибосомные белки Rps0 и Rps21 из Saccharomyces cerevisiae имеют перекрывающиеся функции при созревании 3′-конца 18S рРНК. Nucleic Acids Res. 2003, 31: 6798-6805.10.1093 / нар / gkg899.
PubMed Central CAS Статья PubMed Google Scholar
Gray JP, Davis JW, Gopinathan L, Leas TL, et al: Рибосомный белок rpL11 связывает и ингибирует транскрипционную активность рецептора-альфа, активируемого пролифератором пероксисом.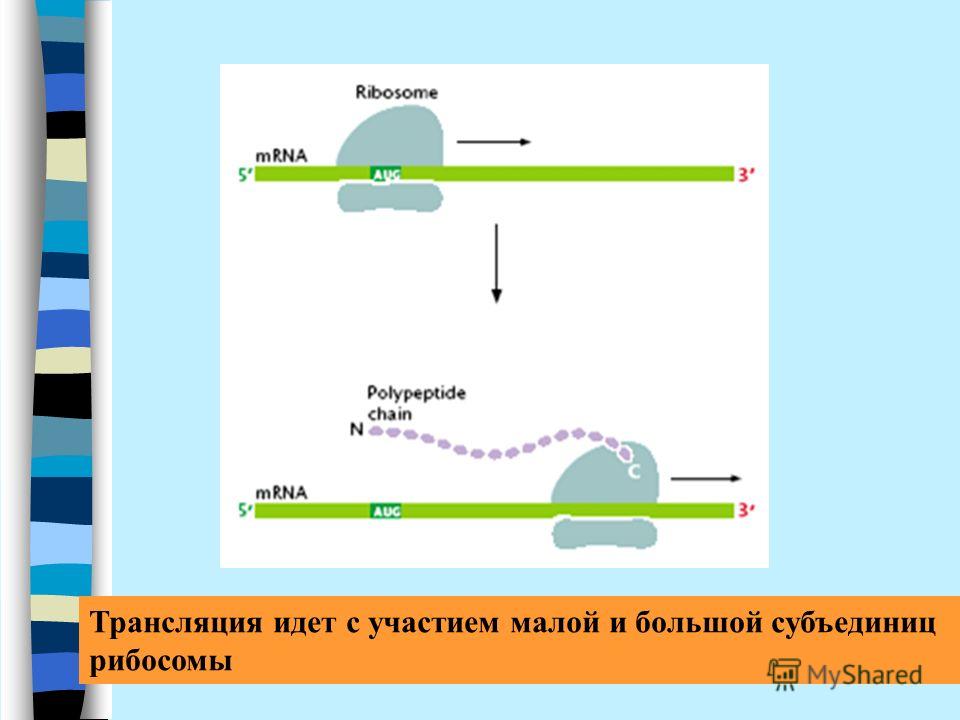 Toxicol Sci. 2006, 89: 535-546. 10.1093 / toxsci / kfj040.
Toxicol Sci. 2006, 89: 535-546. 10.1093 / toxsci / kfj040.
CAS Статья PubMed Google Scholar
Ли З, Паулович А.Г., Вулфорд Дж. Л.: Ингибирование по обратной связи гена дрожжевого рибосомного белка CRY2 опосредуется нуклеотидной последовательностью и вторичной структурой пре-мессенджера-РНК CRY2. Mol Cell Biol. 1995, 15: 6454-6464.
PubMed Central CAS Статья PubMed Google Scholar
Clodi E, Semrad K, Schroeder R: Анализ активности шаперона РНК in vivo с использованием новой ловушки для сворачивания РНК. EMBO J.1999, 18: 3776-3782. 10.1093 / emboj / 18.13.3776.
PubMed Central CAS Статья PubMed Google Scholar
Малыгин А.А., Парахневич Н.М., Иванов А.В., Eperon IC и др. Рибосомный белок S13 человека регулирует экспрессию собственного гена на этапе сплайсинга по механизму обратной связи. Nucleic Acids Res. 2007, 35: 6414-6423. 10.1093 / нар / гкм701.
Nucleic Acids Res. 2007, 35: 6414-6423. 10.1093 / нар / гкм701.
PubMed Central CAS Статья PubMed Google Scholar
Lindstrom MS: Новые функции рибосомных белков в ген-специфической транскрипции и трансляции. Biochem Biophys Res Commun. 2009, 379: 167-170. 10.1016 / j.bbrc.2008.12.083.
Артикул PubMed Google Scholar
Эберт Б.Л., Претц Дж., Боско Дж., Чанг С.Й. и др.: Идентификация RPS14 как гена синдрома 5q (-) с помощью скрининга РНК-интерференции. Природа. 2008, 451: 252-253. 10.1038 / 451252a.
Артикул Google Scholar
Ян Х.С., Хеннинг Д., Вальдес BC: Функциональное взаимодействие между РНК-геликазой II Gu альфа и рибосомным белком L4. FEBS J. 2005, 272: 3788-3802. 10.1111 / j.1742-4658.2005.04811.x.
CAS Статья PubMed Google Scholar
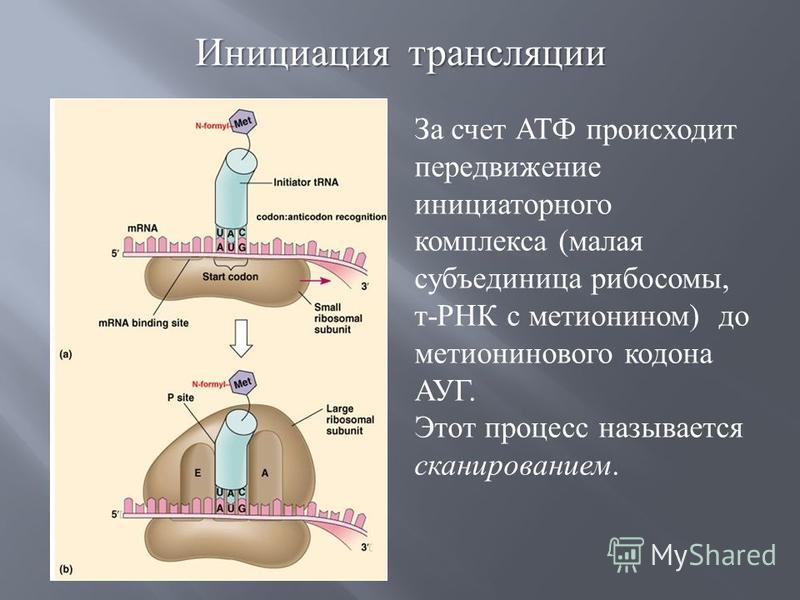
Jinksrobertson S, Nomura M: Рибосомный белок-S4 действует в транс как трансляционный репрессор для регулирования экспрессии альфа-оперона в Escherichia coli . J Bacteriol. 1982, 151: 193-202.
CAS Google Scholar
Mattheakis LC, Nomura M: Регулирование обратной связи оперона spc в Escherichia coli : Трансляционное связывание и процессинг матричной РНК. J Bacteriol. 1988, 170: 4484-4492.
PubMed Central CAS PubMed Google Scholar
Бенард Л., Мати Н., Грюнберг-Манаго М., Эресманн Б. и др.: Идентификация в псевдоузле U.Мотив G необходим для регуляции экспрессии рибосомного белка S15. Proc Natl Acad Sci USA. 1998, 95: 2564-2567. 10.1073 / pnas.95.5.2564.
PubMed Central CAS Статья PubMed Google Scholar
Mazumder B, Sampath P, Seshadri V, Maitra RK, et al: Регулируемое высвобождение L13a из 60S рибосомной субъединицы как механизм транскрипт-специфичного контроля трансляции.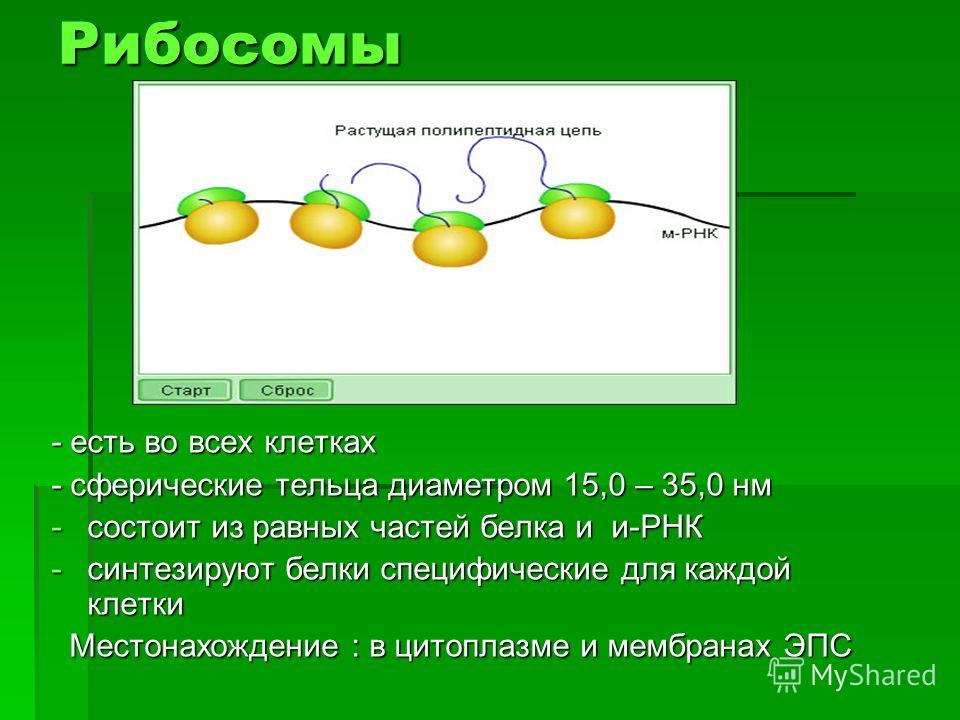 Клетка. 2003, 115: 187-198. 10.1016 / S0092-8674 (03) 00773-6.
Клетка. 2003, 115: 187-198. 10.1016 / S0092-8674 (03) 00773-6.
CAS Статья PubMed Google Scholar
Panagiotidis CA, Huang SC, Canellakis ES: Связь экспрессии рибосомных белков S20 и L34 с биосинтезом полиаминов в Escherichia coli . Int J Biochem Cell Biol. 1995, 27: 157-168. 10.1016 / 1357-2725 (94) 00068-М.
CAS Статья PubMed Google Scholar
Wickner RB, Ridley SP, Fried HM, Ball SG: Рибосомный белок L3 участвует в репликации или поддержании генома киллерной двухцепочечной РНК Saccharomyces cerevisiae . Proc Natl Acad Sci USA. 1982, 79: 4706-4708. 10.1073 / pnas.79.15.4706.
PubMed Central CAS Статья PubMed Google Scholar
Yacoub A, Augeri L, Kelley MR, Doetsch PW, et al: A Drosophila рибосомный белок содержит 8-оксогуанин и активность репарации ДНК абазических участков. EMBO J. 1996, 15: 2306-2312.
EMBO J. 1996, 15: 2306-2312.
PubMed Central CAS PubMed Google Scholar
Хегде В., Ядавилли С., Дойч В.А.: Нокдаун рибосомного белка S3 защищает человеческие клетки от генотоксического стресса. Ремонт ДНК. 2007, 6: 94-99. 10.1016 / j.dnarep.2006.09.004.
CAS Статья PubMed Google Scholar
Yacoub A, Kelley MR, Deutsch WA: Drosophila рибосомный белок PO содержит апуриновую / апиримидиновую эндонуклеазную активность.Nucleic Acids Res. 1996, 24: 4298-4303. 10.1093 / нар / 24.21.4298.
PubMed Central CAS Статья PubMed Google Scholar
Moorthamer M, Chaudhuri B: Идентификация рибосомного белка L34 как нового ингибитора Cdk5. Biochem Biophys Res Commun. 1999, 255: 631-638. 10.1006 / bbrc.1999.0145.
CAS Статья PubMed Google Scholar
Takagi M, Absalon MJ, McLure KG, Kastan MB: Регулирование трансляции и индукции p53 после повреждения ДНК рибосомным белком L26 и нуклеолином. Клетка. 2005, 123: 49-63. 10.1016 / j.cell.2005.07.034.
CAS Статья PubMed Google Scholar
Neumann F, Krawinkel U: Конститутивная экспрессия человеческого рибосомного белка L7 останавливает клеточный цикл в G (1) и индуцирует апоптоз в клетках Т-лимфомы Jurkat. Exp Cell Res.1997, 230: 252-261. 10.1006 / excr.1996.3417.
CAS Статья PubMed Google Scholar
Чен Ф.В., Иоанну Ю.А.: Рибосомные белки в пролиферации клеток и апоптозе. Int Rev Immunol. 1999, 18: 429-448. 10.3109 / 08830189909088492.
CAS Статья PubMed Google Scholar
Офир-Розенфельд Y, Боггс К., Майкл Д., Кастан М.Б. и др.: Mdm2 регулирует трансляцию мРНК p53 посредством ингибирующих взаимодействий с рибосомным белком L26.Mol Cell. 2008, 32: 180-189. 10.1016 / j.molcel.2008.08.031.
PubMed Central CAS Статья PubMed Google Scholar
Чен Д., Чжан З., Ли М., Ван В. и др.: Рибосомный белок S7 как новый модулятор взаимодействия p53-MDM2: связывание с MDM2, стабилизация белка p53 и активация функции p53. Онкоген. 2007, 26: 5029-5037. 10.1038 / sj.onc.1210327.
CAS Статья PubMed Google Scholar
McGowan KA, Li JZ, Park CY, Beaudry V, et al: Рибосомные мутации вызывают темную кожу, опосредованную p53, и плейотропные эффекты. Нат Жене. 2008, 40: 963-970. 10.1038 / нг.188.
PubMed Central CAS Статья PubMed Google Scholar
He H, Sun Y: Рибосомный белок S27L является прямой мишенью p53, которая регулирует апоптоз. Онкоген. 2007, 26: 2707-2716. 10.1038 / sj.onc.1210073.
CAS Статья PubMed Google Scholar
Warner JR, McIntosh KB: Насколько распространены экстрарибосомные функции рибосомных белков ?. Mol Cell. 2009, 34: 3-11. 10.1016 / j.molcel.2009.03.006.
PubMed Central CAS Статья PubMed Google Scholar
Ван М., Ху Й. Дж., Стернс МЭ: RPS2: новая терапевтическая мишень при раке простаты. J Exp Clin Cancer Res. 2009, 28: 6-10.1186 / 1756-9966-28-6.
PubMed Central Статья PubMed Google Scholar
Naora H: Участие рибосомных белков в регуляции роста клеток и апоптоза: модуляция трансляции или рекрутирование для экстра-рибосомной активности ?. Immunol Cell Biol. 1999, 77: 197-205. 10.1046 / j.1440-1711.1999.00816.x.
CAS Статья PubMed Google Scholar
Касаи Х., Надано Д., Хидака Е., Хигучи К. и др.: Дифференциальная экспрессия рибосомных белков в нормальной и неопластической толстой кишке человека. J Histochem Cytochem.2003, 51: 567-573. 10.1177 / 002215540305100502.
CAS Статья PubMed Google Scholar
Wang YX, Cheong D, Chan S, Hooi SC: ген рибосомного белка L7a активирован, но не слит с рецептором тирозинкиназы в виде химерного онкогена trk в колоректальной карциноме человека. Int J Oncol. 2000, 16: 757-762.
CAS PubMed Google Scholar
Zheng SE, Yao Y, Dong Y, Lin F и др.: Понижающая регуляция рибосомного белка L7A в остеосаркоме человека. J Cancer Res Clin Oncol. 2009, 135: 1025-1031. 10.1007 / s00432-008-0538-4.
CAS Статья PubMed Google Scholar
Кобаяши Т., Сасаки Ю., Осима Ю., Ямамото Н. и др.: Активация гена рибосомного белка L13 при раке желудочно-кишечного тракта человека. Int J Mol Med. 2006, 18: 161-170.
CAS PubMed Google Scholar
Wang Q, Yang CH, Zhou J, Wang XQ и др.: Клонирование и характеристика полноразмерной кДНК рибосомного белка L15 человека, которая сверхэкспрессируется при раке пищевода. Ген. 2001, 263: 205-209. 10.1016 / S0378-1119 (00) 00570-9.
CAS Статья PubMed Google Scholar
Wang H, Zhao LN, Li KZ, Ling R, et al: Сверхэкспрессия рибосомного белка L15 связана с пролиферацией клеток при раке желудка. BMC Рак.2006, 6: 91-10.1186 / 1471-2407-6-91.
PubMed Central Статья PubMed Google Scholar
Генри JL, Coggin DL, King CR: Высокий уровень экспрессии рибосомного белка L19 в опухолях груди человека, которые сверхэкспрессируют Erbb-2. Cancer Res. 1993, 53: 1403-1408.
CAS PubMed Google Scholar
Bee A, Ke YQ, Forootan S, Lin K, et al: Рибосомный белок L19 является прогностическим маркером рака простаты человека.Clin Cancer Res. 2006, 12: 2061-2065. 10.1158 / 1078-0432.CCR-05-2445.
CAS Статья PubMed Google Scholar
Кондо Н., Шуда М., Танака К., Вакацуки Т. и др.: Повышенная экспрессия мРНК рибосомных белков S8, L12, L23a, L27 и L30 в гепатоцеллюлярной карциноме человека. Anticancer Res. 2001, 21: 2429-2433.
CAS PubMed Google Scholar
Де Бортоли М., Кастеллино Р.К., Лу XY, Дейо Дж. И др.: Результат медуллобластомы отрицательно связан со сверхэкспрессией EEF1D, RPL30 и RPS20 на длинном плече хромосомы 8. Рак BMC. 2006, 6: 223-10.1186 / 1471-2407-6-223.
PubMed Central Статья PubMed Google Scholar
Драпчинская Н., Густавссон П., Андерссон Б., Петтерссон М. и др. Ген, кодирующий рибосомный белок S19, мутирован при анемии Даймонда-Блэкфана.Нат Жене. 1999, 21: 169-75. 10.1038 / 5951.
CAS Статья PubMed Google Scholar
Gazda HT, Sheen MR, Vlachos A, Choesmel V, et al: Мутации рибосомных белков L5 и L11 связаны с волчьей пастью и аномалиями больших пальцев у пациентов с анемией Даймонда-Блэкфана. Am J Hum Genet. 2008, 83: 769-780. 10.1016 / j.ajhg.2008.11.004.
PubMed Central CAS Статья PubMed Google Scholar
Данилова Н., Сакамото К.М., Лин С.: Дефицит рибосомного белка S19 у рыбок данио приводит к аномалиям развития и дефектному эритропоэзу через активацию семейства белков p53. Кровь. 2008, 112: 5228-5237. 10.1182 / кровь-2008-01-132290.
CAS Статья PubMed Google Scholar
Ватанабе М., Зинн А.Р., Пейдж Д.К., Нишимото Т.: Функциональная эквивалентность человеческих X-кодируемых и Y-кодируемых изоформ рибосомного белка-S4 согласуется с ролью в синдроме Тернера.Нат Жене. 1993, 4: 268-271. 10.1038 / ng0793-268.
CAS Статья PubMed Google Scholar
Zhang WY, Hawse J, Huang QL, Sheetz N, et al: Снижение экспрессии рибосомных белков в возрастной катаракте человека. Инвестируйте Ophthalmol Vis Sci. 2002, 43: 198-204.
PubMed Central PubMed Google Scholar
Кенмочи Н., Йошихама М., Хига С., Танака Т.: Ген рибосомного белка L6 человека в критической области для синдрома Нунан.J Hum Genet. 2000, 45: 290-293. 10.1007 / с100380070018.
CAS Статья PubMed Google Scholar
Оливер Э. Р., Сондерс Т.Л., Тарле С.А., Глейзер Т. Дефект рибосомного белка L24 в области живота и хвоста (Bst), мышь Minute. Разработка. 2004, 131: 3907-3920. 10.1242 / dev.01268.
PubMed Central CAS Статья PubMed Google Scholar
Schadt EE, Molony C, Chudin E, Hao K, et al: Картирование генетической архитектуры экспрессии генов в печени человека. PLoS Biol. 2008, 6: 1020-1032.
CAS Статья Google Scholar
Бирн М.Э .: Роль рибосомы в развитии. Trends Plant Sci. 2009, 14: 512-519. 10.1016 / j.tplants.2009.06.009.
CAS Статья PubMed Google Scholar
Чакраборти А., Уэчи Т., Хига С., Торихара Х и др.: Потеря рибосомного белка L11 влияет на эмбриональное развитие рыбок данио через p53-зависимый апоптотический ответ. PLoS One. 2009, 4: e4152-10.1371 / journal.pone.0004152.
PubMed Central Статья PubMed Google Scholar
Curran SP, Ruvkun G: Регулирование продолжительности жизни с помощью эволюционно законсервированных генов, необходимых для жизнеспособности. Plos Genet. 2007, 3: e56-10.1371 / journal.pgen.0030056.
PubMed Central Статья PubMed Google Scholar
Murphy CT, McCarroll SA, Bargmann CI, Fraser A, et al: Гены, которые действуют ниже DAF-16, чтобы влиять на продолжительность жизни Caenorhabditis elegans . Природа. 2003, 424: 277-284. 10.1038 / природа01789.
CAS Статья PubMed Google Scholar
Canto C, Auwerx J: ограничение калорийности, SIRT1 и долголетие.Trends Endocrinol Metab. 2009, 20: 325-331. 10.1016 / j.tem.2009.03.008.
PubMed Central CAS Статья PubMed Google Scholar
Веллаи Т., Такач-Веллаи К., Чжан Ю., Ковач А.Л. и др.: Генетика: Влияние киназы TOR на продолжительность жизни у C. elegans . Природа. 2003, 426: 620-
CAS Статья PubMed Google Scholar
Stanfel MN, Shamieh LS, Kaeberlein M, Kennedy BK: Путь TOR достигает своей зрелости. Biochim Biophys Acta. 2009, 1790: 1067-1074. 10.1016 / j.bbagen.2009.06.007.
PubMed Central CAS Статья PubMed Google Scholar
Селман С., Туллет JMA, Визер Д., Ирвин Е. и др.: Передача сигналов киназы 1 рибосомного протеина S6 регулирует продолжительность жизни млекопитающих. Наука. 2009, 326: 140-144. 10.1126 / science.1177221.
CAS Статья PubMed Google Scholar
Исследование показывает ключевой этап синтеза белка
На этом изображении молекул, участвующих в трансляции генов в белки, показана рибосома в прозрачной визуализации.На переднем плане изображены информационная РНК (зеленый), фактор удлинения EF-G (коричневый) и четыре последовательных положения транспортной РНК, когда она перемещается справа налево во время транслокации (темно-синий, голубой, красный и серый) . Позиции тРНК похожи на четыре кадра молекулярного фильма, описывающего ее движение через рибосому во время синтеза белка. (Изображение любезно предоставлено Х. Ноллером)
Ученые из Калифорнийского университета в Санта-Круз поймали рибосому, молекулярную машину, вырабатывающую белок, необходимую для всей жизни, в ключевом переходном состоянии, которое долгое время ускользало от исследователей.Теперь ученые впервые могут увидеть, как рибосома выполняет точные механические движения, необходимые для преобразования генетического кода в белки без ошибок.
«Это то, чем занимается вся эта область на протяжении последнего десятилетия», — сказал Гарри Ноллер, профессор молекулярной биологии Зиншеймера в Калифорнийском университете в Санта-Круз. «Мы захватили рибосому посреди ее движения во время транслокации, что является самым интересным, глубоким и сложным, что делает рибосома.«
Понимание рибосом важно не только из-за их решающей роли в качестве белковых фабрик всех живых клеток, но также потому, что многие антибиотики действуют, нацеливаясь на бактериальные рибосомы. Исследования рибосом, проведенные Ноллером и другими, привели к разработке новых антибиотиков, перспективных для использования против устойчивых к лекарствам бактерий.
Лаборатория Ноллера известна своей новаторской работой по выяснению атомной структуры рибосомы, которая состоит из длинных цепочек РНК и белков, переплетенных вместе в сложные складки.Используя рентгеновскую кристаллографию, его группа показала, что рибосома находится в различных конформациях, поскольку она взаимодействует с другими молекулами. Новое исследование, проведенное докторантом Цзе Чжоу, опубликовано в номере журнала Science от 28 июня.
Чтобы создать новый белок, генетические инструкции сначала копируются из последовательности ДНК гена в молекулу информационной РНК. Затем рибосома «считывает» последовательность на информационной РНК, сопоставляя каждый трехбуквенный «кодон» генетического кода с конкретным строительным блоком белка, одной из 20 аминокислот.Таким образом, рибосома строит молекулу белка с точной последовательностью аминокислот, указанной геном. Сопоставление кодонов с аминокислотами осуществляется с помощью молекул транспортной РНК, каждая из которых несет определенную аминокислоту к рибосоме и выравнивает ее с совпадающим кодоном на информационной РНК.
«Большой вопрос состоял в том, чтобы понять, как информационная РНК и транспортная РНК синхронно перемещаются через рибосому, когда информационная РНК транслируется в белок», — сказал Ноллер.«РНК-переносчики представляют собой большие макромолекулы, а у рибосомы есть движущиеся части, которые позволяют ей перемещать их быстро и точно со скоростью 20 в секунду».
Ключевой этап, называемый транслокацией, происходит после образования связи, соединяющей новую аминокислоту с растущей белковой цепью. Затем передающая РНК оставляет эту аминокислоту позади и перемещается к следующему сайту на рибосоме вместе с синхронным движением информационной РНК, чтобы привести следующий кодон и связанную с ним аминокислоту в положение для образования связи.Новое исследование показывает, что рибосома находится на ключевом этапе этого процесса.
«Это дает нам снимки промежуточного состояния в движении», — сказал Ноллер. «Теперь мы можем видеть, как рибосома делает это с помощью вращательного движения маленькой субъединицы, и мы можем видеть, что выглядит как« собачки »храпового механизма, который предотвращает проскальзывание трансляционной рамки считывания».
Многие антибиотики нарушают функцию бактериальной рибосомы, предотвращая или замедляя это транслокационное движение.Понимание структурных и динамических деталей этого движения может помочь исследователям разработать новые антибиотики.
Транслокация включает два этапа (как показала лаборатория Ноллера в 1989 году). Шаг первый — это движение «акцепторного конца» тРНК (где он несет аминокислоту). Это приводит к гибридному состоянию, когда два конца тРНК находятся в двух разных сайтах на рибосоме: «конец антикодона» все еще выстраивается с совпадающим кодоном мРНК в одном сайте, в то время как конец акцептора перемещается на следующий. сайт.Шаг второй — движение антикодонного конца тРНК вместе с матричной РНК, которая продвигается на один кодон. На втором этапе требуется катализатор, называемый фактором удлинения G (EF-G). Новое исследование показывает, что рибосома находится в середине второго шага, с ней связан EF-G, а тРНК находится на полпути между гибридным и конечным состоянием.
Ноллер потратил десятилетия, пытаясь понять, как работает рибосома. По его словам, возможность увидеть, как он движется, — это захватывающий момент.
«Это одно из самых фундаментальных движений во всей биологии, лежащее в основе всего механизма трансляции генетического кода, и теперь мы понимаем его вплоть до молекулярного уровня», — сказал Ноллер.«Этот механизм должен был существовать вокруг происхождения жизни, какой мы ее знаем».
Помимо Ноллера и Чжоу, соавторами статьи являются постдокторант Лаура Ланкастер и исследователь Джон Пол Донохью. Работа поддержана грантами Национальных институтов здравоохранения.
Biology4Kids.com: Структура клетки: Рибосомы
Клеткам необходимо производить белков, . Белковые ферменты ускоряют биологические процессы.Другие белки поддерживают клеточные функции и находятся в мембранах. Белки даже составляют большую часть ваших волос. Когда клетке нужно производить белки, она ищет рибосомы. Рибосомы являются строителями белков или синтезаторами белков клетки. Они похожи на строителей, которые соединяют по одной аминокислоте за раз и выстраивают длинные цепочки.
Рибосомы особенные, потому что они встречаются как у прокариот, так и у эукариот. Хотя такая структура, как ядро, встречается только у эукариот, каждой клетке необходимы рибосомы для производства белков.Поскольку у прокариот нет мембраносвязанных органелл, рибосомы свободно плавают в цитозоле.
Рибосомы встречаются во многих местах эукариотической клетки. Вы можете обнаружить их плавающими в цитозоле. Эти плавающие рибосомы производят белки, которые будут использоваться внутри клетки. Другие рибосомы находятся в эндоплазматической сети. Эндоплазматический ретикулум с прикрепленными рибосомами называется грубым ER. Под микроскопом он выглядит ухабистым. Присоединенные рибосомы образуют белки, которые будут использоваться внутри клетки, и белки, предназначенные для экспорта из клетки.К ядерной оболочке также прикреплены рибосомы. Эти рибосомы синтезируют белки, которые попадают в перинуклеарное пространство.
Каждая рибосома состоит из двух частей или субъединиц. У эукариот ученые идентифицировали субъединицы 60-S (большие) и 40-S (маленькие). Несмотря на то, что рибосомы имеют немного разные структуры у разных видов, их функциональные области очень похожи.Например, у прокариот рибосомы немного меньше, чем у эукариот.Модель 60-S / 40-S отлично подходит для эукариотических клеток, в то время как прокариотические клетки имеют рибосомы, состоящие из 50-S и 30-S субъединиц. Это небольшая разница, но одна из многих, которые вы найдете в двух разных типах ячеек. Ученые использовали это различие в структуре рибосом для разработки лекарств, которые могут убивать прокариотические микроорганизмы, вызывающие заболевания. Существуют даже структурные различия между рибосомами, обнаруженными в митохондриях, и свободными рибосомами.
Когда рибосомы используются в процессе синтеза белка? Когда клетке необходимо производить белок, в ядре создается мРНК.Затем мРНК отправляется из ядра в рибосомы. Когда приходит время производить белок, две субъединицы объединяются и соединяются с мРНК. Субъединицы фиксируются на мРНК и запускают синтез белка.
Процесс создания белков довольно прост. Во-первых, вам нужна аминокислота. Еще одна нуклеиновая кислота, которая живет в клетке, — это РНК-переносчик . тРНК связана с аминокислотами, плавающими вокруг клетки. С помощью инструкций по предложению мРНК рибосома соединяется с тРНК и извлекает одну аминокислоту.Затем тРНК высвобождается обратно в клетку и присоединяется к другой аминокислоте. Рибосома выстраивает длинную аминокислотную (полипептидную) цепь, которая в конечном итоге станет частью более крупного белка.
Клетки мозга из клеток кожи (видео Кембриджского университета)
Полезные справочные ссылки
Encyclopedia.com:http://www.encyclopedia.com/topic/Ribosomes.aspx
Википедия:
http: // en.wikipedia.org/wiki/Ribosomes
Encyclopædia Britannica:
http://www.britannica.com/EBchecked/topic/502164/ribosome
генов dev18005 891..895
% PDF-1.4 % 44 0 объект > эндобдж 41 0 объект > поток Acrobat Distiller 7.0 (Windows) Arbortext Advanced Print Publisher 9.0.223 / W2021-12-31T04: 33: 06-08: 002009-04-21T11: 05: 53 + 05: 302021-12-31T04: 33: 06-08: 00application / pdf

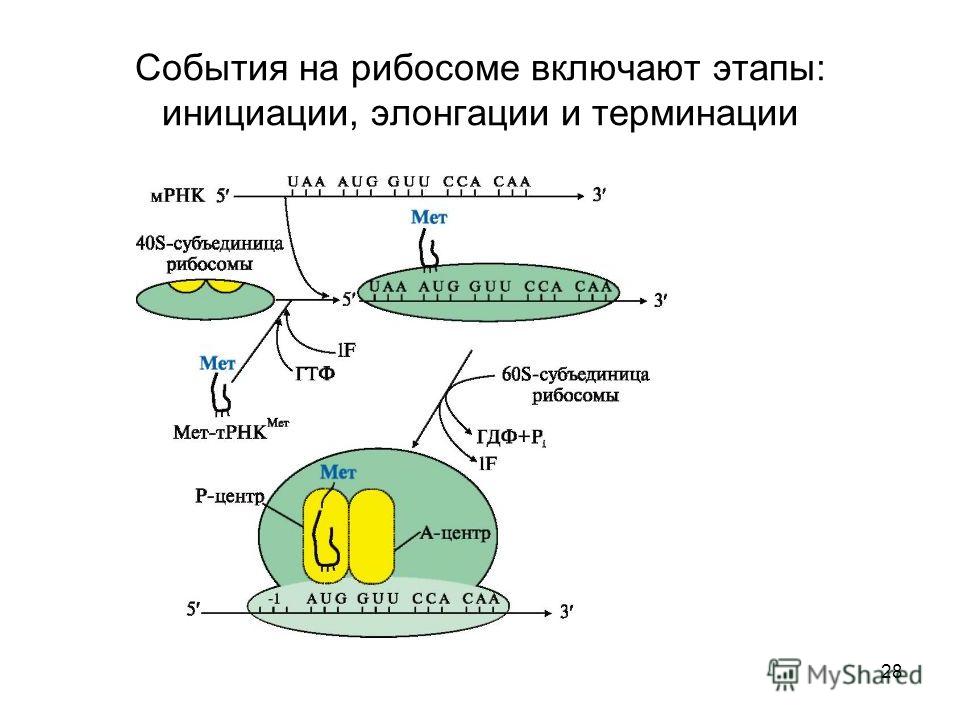 Содержит клеточный сок
Содержит клеточный сок