1.4 Схема электролитической диссоциации электролита с ковалентными связями, роль воды в этом процессе.
1.5 Определение водородного показателя. Его математическая выражение, какая реакция среды возникает при различных уровнях значения рН
|
1.6 Главное условие обратимости и не обратимости реакций обменного разложения
.Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO 3 = 2KCl + 3O
2 ↑Реакция прекратится тогда, когда весь хлорат калия превратится в хлорид калия и кислород. Необратимых реакций не так много. Большинство реакций являются обратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака из водорода и азота:
,
∆H = -46,2 кДж / моль
В технике обратимые реакции, как правило, невыгодны. Поэтому различными методами (изменение температуры, давления и др.) их делают практически необратимыми.
Необратимыми называются такие реакции, при протекании которых:
1) образующиеся продукты уходят из сферы реакции — выпадают в виде осадка, выделяются в виде газа, например
ВаСl2 + Н 2
Na 2CO 3 + 2HCl = 2NaCl + CO2 ↓ + H2O
2) образуется малодиссоциированное соединение, например вода:
НСl + NаОН = Н2О + NаСl
3) реакция сопровождается большим выделением энергии, например горение магния
Mg + 1/2 О2 = МgО, ∆H = -602,5 кДж / моль
В уравнениях необратимых реакций между левой и правой частями ставится знак равенства или стрелка.
В случае необратимости: 1) образуется слабый электролит типо воды, угольной кислоты и тд 2NaOH+SO3 = Na2SO4 +h3O
2) выпадает осадок типо CaCO3, BaSO4 и тд Na2SO4+Ba(OH)2=2Na(OH)+BaSO4
3) выделяется газ ——————- практически все остальные реакции являются обратимыми
Химические реакции заключаются во взаимодействии реагентов с образованием продуктов реакциию. Не следует, однако, полагать, что направление химической реакции только одно. В действительности, химические реакции протекают и в прямом, и в обратном направлениях:
РеагентыПродукты |
Все химические реакции, в принципе, обратимы. Это означает, что в реакционной смеси протекает как взаимодействие реагентов, так и взаимодействие продуктов. В этом смысле различие между реагентами и продуктами условное. Направление протекания химической реакции определяется условиями ее проведения (температурой, давлением,концентрацией веществ). Многие реакции имеют одно преимущественное направление и для проведения таких реакций в противоположном направлении требуются экстремальные условия. В подобных реакциях происходит почти полное превращение реагентов в продукты. Пример. Железо и сера при умеренном нагревании реагируют между собой с образованием сульфида железа (II), FeS при таких условиях устойчив и практически не разлагается на железо и серу:
Fe + S FeS |
Пример. Реакция синтеза аммиака является обратимой:
N2 + 3H2 2NH3 |
При 200 атм и 400 0С достигается максимальное и равное 36% (по объему) содержание Nh4 в реакционной смеси. При дальнейшем повышении температуры вследствие усиленного протекания обратной реакции объемная доля аммиака в смеси уменьшается. Прямая и обратная реакции протекают одновременно в противоположных направлениях.
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия. |
\
studfiles.net
. Какую роль играет вода в поцессе электрической диссоциации
Вода — великолепный проводник был есть и будет. Другое значение имеет уже непосредственных химический состав воды.
Молекулы воды представляют собой дипольные частицы, и при растворении в ней веществ с ионной структурой молекулы воды как бы «растаскивают» катионы и анионы, образуя вокруг них гидратные оболочки (см. рисунок). В этом и заключается процесс электролитической диссоциации. Такой раствор очень хорошо проводит электрический ток. <img data-lsrc=»//otvet.imgsmail.ru/download/13376233_53ec594a82b5dbc1b73a79fa72218290_120x120.jpg» data-big=»1″ src=»//otvet.imgsmail.ru/download/875a8375f91de049494d6073098e8a2f_1200b2d142c40d73cc8d0d8774ec0753.jpg»>
touch.otvet.mail.ru
Электролитическая диссоциация кислот, оснований и солей в водных растворах » mozok.click
Электролитическая диссоциация кислот
При растворении в воде кислоты, соли и основания диссоциируют на положительно и отрицательно заряженные ионы (катионы и анионы). Определим характерные общие признаки диссоциации электролитов каждого класса соединений.
Кислоты, как вы помните, состоят из Гидрогена и кислотного остатка, соединенных ковалентной полярной связью. В предыдущем параграфе на примере растворения гидроген хлорида мы рассмотрели, как под действием молекул воды полярная связь превращается в ионную, и кислота распадается на катионы Гидрогена и хлорид-ионы.
Таким образом, с точки зрения теории электролитической диссоциации Аррениуса,
Кислоты — это электролиты, при диссоциации которых образуются катионы Гидрогена и анионы кислотного остатка.
Подобно хлоридной кислоте протекает диссоциация и других кислот, например нитратной:
При диссоциации молекулы сульфатной кислоты число катионов Гидрогена вдвое превышает число анионов кислотного остатка — сульфат-ионов. Заряд аниона равен -2 (в формулах ионов записывают «2-»):
Названия анионов, образующихся при диссоциации кислот, совпадают с названиями кислотных остатков. Они приведены в таблице растворимости на форзаце.
Легко заметить, что при диссоциации различных кислот образуются различные анионы, но катионы только одного типа — катионы Гидрогена H+. Значит, именно катионы Гидрогена определяют характерные свойства кислот — кислый вкус, изменение окраски индикаторов, реакции с активными металлами, основными оксидами, основаниями и солями.
Многоосновные кислоты диссоциируют ступенчато, отщепляя ионы Гидрогена последовательно, друг за другом. Например, в растворе сульфатной кислоты протекают следующие процессы:
Как видно из приведенных уравнений диссоциации многоосновной кислоты, анионы, образующиеся при ступенчатой диссоциации на первой стадии, содержат ионы Гидрогена. Это отражено в названии анионов: HSO— — гидрогенсульфат-ион.
Электролитическая диссоциация ортофосфатной кислоты проходит в три стадии:
Суммарное уравнение диссоциации ортофосфатной кислоты имеет вид:
Таким образом, каждой многоосновной кислоте соответствует несколько анионов, и все они одновременно присутствуют в растворе.
Обратите внимание, что в некоторых уравнениях диссоциации стоят двунаправленные стрелки. Что они означают, вы узнаете в следующем параграфе.
Электролитическая диссоциация оснований
Основания состоят из катионов металлического элемента и гидроксид-анионов. При диссоциации оснований эти ионы переходят в раствор. Число гидроксид-ионов, образующихся при диссоциации, равно заряду иона металлического элемента. Таким образом, с точки зрения теории электролитической диссоциации
Основания — это электролиты, которые диссоциируют на катионы металлического элемента и гидроксид-анионы.
Рассмотрим уравнения диссоциации оснований на примере диссоциации натрий и барий гидроксидов:
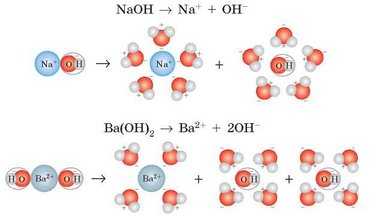
При диссоциации оснований образуются анионы одного типа — гидроксид-ионы, определяющие все характерные свойства растворов щелочей: способность менять окраску индикаторов, реагировать с кислотами, кислотными оксидами и солями.
Электролитическая диссоциация солей
Соли образованы катионами металлического элемента и анионами кислотного остатка. При растворении солей в воде эти ионы переходят в раствор.
Соли — это электролиты, которые диссоциируют на катионы металлического элемента и анионы кислотного остатка.
Рассмотрим диссоциацию солей на примере диссоциации калий нитрата:
Аналогично диссоциируют и другие соли, например нитрат кальция и калий ортофосфат:
В уравнениях диссоциации солей заряд катиона по абсолютной величине равен степени окисления металлического элемента, а заряд аниона — сумме степеней окисления элементов в кислотном остатке. Например, купрум(П) сульфат распадается на ионы
а феррум(Ш) нитрат — на ионы
Заряд катионов металлических элементов в большинстве случаев можно определить по Периодической системе. Заряды катионов металлических элементов главных подгрупп обычно равны номеру группы, в которой расположен элемент:
Металлические элементы побочных подгрупп обычно образуют несколько ионов, например Fe2+, Fe3+.
Заряды кислотных остатков проще определять по числу ионов Гидрогена в составе молекулы кислоты, как вы это делали в 8 классе. Заряды некоторых кислотных остатков приведены в таблице растворимости на форзаце.
Обратите внимание, что в уравнениях диссоциации кислот, оснований и солей суммарный заряд катионов и анионов должен быть равен нулю, поскольку любое вещество является электронейтральным.
Ступенчатая диссоциация обусловливает возможность существования кислых и основных солей. Кислые соли содержат ионы Гидрогена, как кислоты. Именно поэтому такие соли называют кислыми. А в основных солях содержатся гидроксид-ионы, как в основаниях.
На первой стадии диссоциации сульфатной кислоты образуется гидрогенсульфат-ион HSO-, благодаря чему существуют кислые соли: NaHSO4 (натрий гидрогенсульфат), Al(HSO4)3 (алюминий гидрогенсульфат) и др. Для ортофосфатной кислоты также характерны кислые соли K2HPO4 (калий гидрогенортофосфат) или KH2PO4 (калий дигидрогенортофосфат).
В растворах кислые соли диссоциируют в две стадии:
Кислые соли характерны только для многоосновных кислот, поскольку они диссоциируют ступенчато. Единственным исключением является одноосновная кислота — флуоридная. Благодаря водородным связям в растворе этой кислоты присутствуют частицы H2F2, и флуоридная кислота может образовывать кислую соль состава KHF2.
Некоторые нерастворимые гидроксиды образуют катионы, в которых имеется гидроксид-ион. Например, алюминий содержится в составе катиона AlOH2+, благодаря чему существует соль состава AlOHCl2 (алюминий гидроксохлорид). Такую соль называют основной.
Ключевая идея
Контрольные вопросы
100. Дайте определение кислотам, основаниям и солям с точки зрения теории электролитической диссоциации.
101. В чем особенность диссоциации многоосновных кислот по сравнению с одноосновными? Объясните на примере сульфатной кислоты.
Задания для усвоения материала
102. В результате диссоциации молекулы кислоты образовался ион с зарядом 3—. Сколько ионов Гидрогена при этом образовалось?
103. Составьте уравнения электролитической диссоциации кислот: карбонатной, бромидной, нитритной. Назовите образующиеся анионы.
104. Какие из приведенных кислот будут диссоциировать ступенчато: HCl, H2CO3, HNO3, H2S, H2SO3? Ответ подтвердите уравнениями реакций.
105. Составьте уравнения диссоциации солей: магний нитрата, алюминий хлорида, барий бромида, натрий карбоната, натрий ортофосфата.
106. Приведите по одному примеру солей, при диссоциации которых количеством вещества 1 моль образуется: а) 2 моль ионов; б) 3 моль ионов; в) 4 моль ионов; г) 5 моль ионов. Запишите уравнения диссоциации.
107. Запишите заряды ионов в веществах: a) Na2S, Na2SO4, Na3PO4, AlPO4;
б) NaHSO4, Mg(HSO4)2, CaHPO4, Ba(OH)2. Назовите эти вещества.
108. Составьте уравнения электролитической диссоциации веществ: калий гидроксида, барий сульфида, феррум(Ш) нитрата, магний хлорида, алюминий сульфата.
109. Составьте формулу вещества, при диссоциации которого образуются ионы Кальция и гидроксид-ионы.
110. Из перечня веществ выпишите отдельно электролиты и неэлектролиты: HCl, Ca, Cr2(SO4)3, Fe2O3, Mg(OH)2, CO2, Sr(OH)2, Sr(NO3)2, P2O5, H2O. Составьте уравнения диссоциации электролитов.
111. При диссоциации некоего нитрата образовался 1 моль катионов с зарядом 2+. Какое количество вещества нитрат-ионов при этом образовалось?
112. Составьте формулы и запишите уравнения диссоциации феррум(П) сульфата и феррум(Ш) сульфата. Чем отличаются эти соли?
113. Приведите по одному примеру уравнений диссоциации солей в соответствии со схемами (буквой М обозначен металлический элемент, а Х — кислотный остаток): а) МХ ^ М2+ + Х2-; б) МХ3 ^ М3+ + 3Х—;
в) М3Х ^ 3М+ + Х3-; г) М2Х3 ^ 2М3+ + 3Х2-.
114. В растворе присутствуют ионы K+, Mg2+, NO-, SO4—. Какие вещества растворили? Приведите два варианта ответа.
115*. Составьте уравнения диссоциации тех электролитов, которые образуют хлорид-ионы: CrCl3, KClO3, BaCl2, Ca(ClO)2, HClO4, MgOHCl.
Это материал учебника Химия 9 класс Григорович
mozok.click
Процесс электролитической диссоциации — Справочник химика 21
Можно ли рассматривать процесс электролитической диссоциации как обратимую реакцию [c.74]Большое значение для развития физической химии имели работы И. А. Каблукова (1857—1942), который, исходя из гидратной теории Д. И. Менделеева, установил явление гидратации ионов электролитов в водных растворах и сущность химического взаимодействия в процессах электролитической диссоциации (1891). Им впервые были выполнены работы по исследованию поведения электролитов в неводных растворах. Каблуков организовал первую кафедру физической химии в сельскохозяйственном вузе и начал читать систематический курс физической химии будущим агрономам. [c.9]
Рассматривая процесс электролитической диссоциации как процесс обратимый, так как из отдельных положительных и отрицательных ионов вновь могут образоваться молекулы, мы можем определить его незавершенность, введя понятие степени диссоциации. [c.188]
Отметьте роль воды в процессе электролитической диссоциации. [c.163]
Ионообменные смолы — это высокомолекулярные нерастворимые соединения, способные набухать в водных растворах, поглощая значительное количество воды, и высвобождать ионы в процессе электролитической диссоциации. Высвободившиеся ионы замещаются на другие присутствующие в растворе ионы, имеющие большее сродство к ионообменнику. Процесс ионного обмена обратим, и [c.340]
Объясните процесс электролитической диссоциации в воде веществ с ионным типом связи. Приведите примеры. [c.74]
Процесс электролитической диссоциации изображают, пользуясь химическими уравнениями. Наиример, диссоциация НС1 выразится уравнением [c.234]
Для молекул более сложного строения, способных диссоциировать на несколько ионов, процесс электролитической диссоциации идет ступенчато и степеней диссоциации может быть несколько. В качестве примера можно рассмотреть процесс электролитической диссоциации серной кислоты [c.190]
При растворении ионных соединений происходит образование сольватированных ионов, или процесс электролитической диссоциации. В процессе электролитической диссоциации важная роль принадлежит растворителю. Она заключается в разрушении электролита, сольватации образующихся ионов и создании условий для разобщения ионов противоположного знака. При этом чем полярнее молекулы растворителя, тем легче протекает электролитическая диссоциация. При растворении ковалентных полярных соединений образование сольватированных ионов связано с гете-ролитическим разрывом связей. Электронная пара, осуществляющая ковалентную связь, в этом случае целиком остается у одного из атомов или группы атомов, т. е. происходит процесс А I В- -А+- -В или А В- -А — -В+ [c.224]
Дальнейшему развитию физической химии способствуют работы в этой области ряда советских ученых И. А. Каблукова, который установил явление гидратации ионов электролитов в водных растворах и химического взаимодействия в процессах электролитической диссоциации и др. Н. С. Курнакова, изучавшего физикохимические свойства систем в зависимости от их состава и явившегося создателем физико-химического анализа и др. Н. А. Шилова, выполнившего ряд работ в области кинетики сопряженных химических реакций и адсорбции растворенных веществ из растворов и др. [c.6]
Некоторые вещества, называемые электролитами, обладают способностью при растворении в соответствующих растворителях, например в воде (к которой первоначально и относилась теория Аррениуса), распадаться иа противоположно заряженные частицы—ионы. Распад электролитов на ионы при растворении был назван процессом электролитической диссоциации, отсюда и теория Аррениуса называется теорией электролитической диссоциации. [c.34]
О неполной диссоциации на ионы многих электролитов в растворе говорит также и возрастание эквивалентной электропроводности с разбавлением. При повышении концентрации, наоборот, эквивалентная электропроводность уменьшается. Поэтому процесс электролитической диссоциации можно считать обратимым. [c.166]
Из табл. 8.2 видно, что уравнение процесса электролитической диссоциации сильного электролита записывается с указанием его практической необратимости приводится лишь одна стрелка —>, направленная от молекулярной формы электролита к его ионам. Электролитическая диссоциация электролитов средней силы и слабых записывается с указанием ее обратимости используются две, противоположно направленные, стрелки. [c.237]
Термодинамические характеристики (298 К) процесса электролитической диссоциации в водных растворах следующие [c.76]
Химические связи между комплексными и простыми ионами в процессе электролитической диссоциации сравнительно легко раскрываются и подчиняются известным правилам о валентности. Связи, приводящие к образованию комплексных ионов, получили название донорно-акцепторных связей. Возникновение донорно-акцепторных связей рассмотрим на примере образования хлорида аммония [c.132]
Рассчитайте ЛС для каждой ступени диссоциации. Что можно сказать о силе электролита По какой ступени идет преимущественно процесс электролитической диссоциации [c.77]
Константа диссоциации слабой кислоты в водном растворе сложным образом зависит от температуры. Часто в интервале О—60°С наблюдается максимум (у уксусной и муравьиной кислот при 25 °С, у пропионовой кислоты при 20 С, у масляной при 10 °С. Предложено несколько объяснений появления мак
www.chem21.info
Электролитическая диссоциация
Вещества, растворы (или расплавы) которых проводят электрический ток, называются э л е к т р о л и т а м и. Нередко электролитами называют и сами растворы этих веществ. Эти растворы (расплавы) электролитов являются проводниками второго рода, так как передача электричества осуществляется в них движением и о н о в — заряженных частиц. Частица, заряженная положительно называется катионом (Са+2), частица несущая отрицательный заряд — анионом (ОН־). Ионы могут быть простые (Са+2, Н+) и сложные (РО4 ־3, НСО3־2).
Основоположником теории электролитической диссоциации является шведский ученый С. Аррениус. Согласно теории электролитической диссоциацией называется распад молекул на ионы при их растворении в воде, причем это происходит без воздействия электрического тока. Однако эта теория не отвечала на вопросы: какие причины обусловливают появление в растворах ионов и почему положительные ионы, сталкиваясь с отрицательными, не образуют нейтральных частиц.
Свой вклад в развитие этой теории внесли русские ученые: Д.И. Менделеев, И. А. Каблуков – сторонники химической теории растворов, обращавшие внимание на влияние растворителя в процессе диссоциации. Каблуков утверждал, что растворенное вещество взаимодействует с растворителем (процесс с о л ь в а т а ц и и) образуя продукты переменного состава (с о л ь в а т ы).
Сольват представляет собой ион, окруженный молекулами растворителя (сольватная оболочка), которых может быть разное количество (именно за счет этого достигается переменный состав). Если растворителем является вода, то процесс взаимодействия молекул растворенного вещества и растворителя называется г и д р а т а ц и е й, а продукт взаимодействия — г и д р а т о м.
Таким образом, причиной электролитической диссоциации является сольватация (гидратация). И именно сольватация (гидратация) ионов препятствует обратному соединению в нейтральные молекулы.
Количественно процесс диссоциации характеризуется величиной степени электролитической диссоциации (α), которая представляет собой отношение количества распавшегося на ионы вещества к общему количеству растворенного вещества. Отсюда следует, что для сильных электролитов α = 1 или 100 % (в растворе присутствуют ионы растворенного вещества), для слабых электролитов 0 < α < 1 (в растворе присутствуют наряду с ионами растворенного вещества и его недиссоциированные молекулы), для неэлектролитов α = 0 (ионы в растворе отсутствуют). Помимо природы растворенного вещества и растворителя величина α зависит от концентрации раствора и температуры.
Если растворителем является вода, к сильным электролитам относятся:
1) все соли;
2) следующие кислоты: HCl, HBr, HI, H2SO4, HNO3, HClO4;
3) следующие основания: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Процесс электролитической диссоциации является обратимым, следовательно, его можно охарактеризовать величиной константы равновесия, которая, в случае слабого электролита, называется константой диссоциации (КД).
Чем больше эта величина, тем легче электролит распадается на ионы, тем больше его ионов в растворе. Например: HF ═ H+ + F־
 .
.
Эта величина постоянная при данной температуре и зависит от природы электролита, растворителя.
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Например, молекулы серной кислоты в первую очередь отщепляют один катион водорода:
H2SO4 ═ Н+ + HSO4־.
Отщепление второго иона по уравнению
HSO4־═ Н+ + SO4־2
идет уже значительно труднее, так как ему приходится преодолевать притяжение со стороны двухзарядного иона SO4־2, который, конечно, притягивает к себе ион водорода сильнее, чем однозарядный ион HSO4־ . Поэтому вторая ступень диссоциации происходит в гораздо меньшей степени, чем первая.
Основания, содержащие более одной гидроксильной группы в молекуле, тоже диссоциируют ступенчато. Например:
Ba(OH)2 ═ BaOH+ + OH— ;
BaOH+ = Ba2+ + OH—.
Средние (нормальные) соли всегда диссоциируют на ионы металлов и кислотных остатков:
CaCl2 = Ca2+ + 2Cl— ;
Na2SO4 = 2Na+ + SO42-.
Кислые соли, подобно многоосновным кислотам, диссоциируют ступенчато. Например:
NaHCO3 = Na+ + HCO3— ;
HCO3— = H+ + CO32-.
Однако степень диссоциации по второй ступени очень мала, так что раствор кислой соли содержит лишь незначительное число ионов водорода.
Основные соли диссоциируют на ионы основных и кислотных остатков. Например:
Fe(OH)Cl2 = FeOH2+ + 2Cl—.
Вторичной диссоциации ионов основных остатков на ионы металла и гидроксила почти не происходит.
studfiles.net
Электролитическая диссоциация
Вещества, растворы (или расплавы) которых проводят электрический ток, называются э л е к т р о л и т а м и. Нередко электролитами называют и сами растворы этих веществ. Эти растворы (расплавы) электролитов являются проводниками второго рода, так как передача электричества осуществляется в них движением и о н о в — заряженных частиц. Частица, заряженная положительно называется катионом (Са+2), частица несущая отрицательный заряд — анионом (ОН־). Ионы могут быть простые (Са+2, Н+) и сложные (РО4 ־3, НСО3־2).
Основоположником теории электролитической диссоциации является шведский ученый С. Аррениус. Согласно теории электролитической диссоциацией называется распад молекул на ионы при их растворении в воде, причем это происходит без воздействия электрического тока. Однако эта теория не отвечала на вопросы: какие причины обусловливают появление в растворах ионов и почему положительные ионы, сталкиваясь с отрицательными, не образуют нейтральных частиц.
Свой вклад в развитие этой теории внесли русские ученые: Д.И. Менделеев, И. А. Каблуков – сторонники химической теории растворов, обращавшие внимание на влияние растворителя в процессе диссоциации. Каблуков утверждал, что растворенное вещество взаимодействует с растворителем (процесс с о л ь в а т а ц и и) образуя продукты переменного состава (с о л ь в а т ы).
Сольват представляет собой ион, окруженный молекулами растворителя (сольватная оболочка), которых может быть разное количество (именно за счет этого достигается переменный состав). Если растворителем является вода, то процесс взаимодействия молекул растворенного вещества и растворителя называется г и д р а т а ц и е й, а продукт взаимодействия — г и д р а т о м.
Таким образом, причиной электролитической диссоциации является сольватация (гидратация). И именно сольватация (гидратация) ионов препятствует обратному соединению в нейтральные молекулы.
Количественно процесс диссоциации характеризуется величиной степени электролитической диссоциации (α), которая представляет собой отношение количества распавшегося на ионы вещества к общему количеству растворенного вещества. Отсюда следует, что для сильных электролитов α = 1 или 100 % (в растворе присутствуют ионы растворенного вещества), для слабых электролитов 0 < α < 1 (в растворе присутствуют наряду с ионами растворенного вещества и его недиссоциированные молекулы), для неэлектролитов α = 0 (ионы в растворе отсутствуют). Помимо природы растворенного вещества и растворителя величина α зависит от концентрации раствора и температуры.
Если растворителем является вода, к сильным электролитам относятся:
1) все соли;
2) следующие кислоты: HCl, HBr, HI, H2SO4, HNO3, HClO4;
3) следующие основания: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Процесс электролитической диссоциации является обратимым, следовательно, его можно охарактеризовать величиной константы равновесия, которая, в случае слабого электролита, называется константой диссоциации (КД).
Чем больше эта величина, тем легче электролит распадается на ионы, тем больше его ионов в растворе. Например: HF ═ H+ + F־
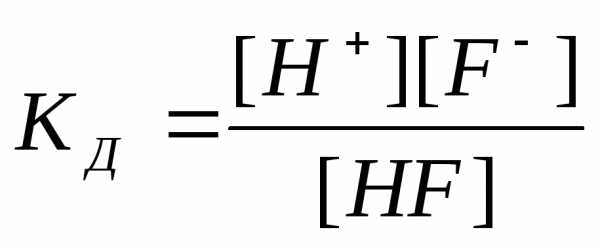 .
.
Эта величина постоянная при данной температуре и зависит от природы электролита, растворителя.
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Например, молекулы серной кислоты в первую очередь отщепляют один катион водорода:
H2SO4 ═ Н+ + HSO4־.
Отщепление второго иона по уравнению
HSO4־═ Н+ + SO4־2
идет уже значительно труднее, так как ему приходится преодолевать притяжение со стороны двухзарядного иона SO4־2, который, конечно, притягивает к себе ион водорода сильнее, чем однозарядный ион HSO4־ . Поэтому вторая ступень диссоциации происходит в гораздо меньшей степени, чем первая.
Основания, содержащие более одной гидроксильной группы в молекуле, тоже диссоциируют ступенчато. Например:
Ba(OH)2 ═ BaOH+ + OH— ;
BaOH+ = Ba2+ + OH—.
Средние (нормальные) соли всегда диссоциируют на ионы металлов и кислотных остатков:
CaCl2 = Ca2+ + 2Cl— ;
Na2SO4 = 2Na+ + SO42-.
Кислые соли, подобно многоосновным кислотам, диссоциируют ступенчато. Например:
NaHCO3 = Na+ + HCO3— ;
HCO3— = H+ + CO32-.
Однако степень диссоциации по второй ступени очень мала, так что раствор кислой соли содержит лишь незначительное число ионов водорода.
Основные соли диссоциируют на ионы основных и кислотных остатков. Например:
Fe(OH)Cl2 = FeOH2+ + 2Cl—.
Вторичной диссоциации ионов основных остатков на ионы металла и гидроксила почти не происходит.
studfiles.net
Диссоциация электролитическая полярных молекул — Справочник химика 21
Механизм электролитической диссоциации — распада молекул или кристаллов растворяемого вещества на ионы под влиянием молекул растворителя — был понят несколько позднее, благодаря исследованиям различных ученых, в том числе русских В. А. К и с т я-ковского и И. А. Каблукова. Согласно современным воззрениям, такой распад является результатом взаимодействия полярных молекул растворителя, например воды, с молекулами или кристаллической решеткой растворяемого вещества. Молекулы растворителя атакуют кристаллическую решетку, разрушая ее и переводя составные части решетки (ионы) в раствор в форме сольватированных [c.68]Электролитическая- диссоциация воды. Полярные молекулы воды могут диссоциировать, проявляя при этом свою амфотер-ность [c.203]
При растворении ионных соединений происходит образование сольватированных ионов, или процесс электролитической диссоциации. В процессе электролитической диссоциации важная роль принадлежит растворителю. Она заключается в разрушении электролита, сольватации образующихся ионов и создании условий для разобщения ионов противоположного знака. При этом чем полярнее молекулы растворителя, тем легче протекает электролитическая диссоциация. При растворении ковалентных полярных соединений образование сольватированных ионов связано с гете-ролитическим разрывом связей. Электронная пара, осуществляющая ковалентную связь, в этом случае целиком остается у одного из атомов или группы атомов, т. е. происходит процесс А I В- -А+- -В или А В- -А — -В+ [c.224]
Другим примером влияния полярной структуры молекул на свойства вещества может служить хорошо известное явление электролитической диссоциации. Здесь также играет роль взаимодействие полярных молекул растворителя (и, в частности, воды) с сильно полярными молекулами электролитов. [c.81]
Электролитическая диссоциация легче происходит в растворителях с более высокой диэлектрической проницаемостью, так как в них ослабевает взаимодействие между ионами. Необходимо отметить, что высокая диэлектрическая проницаемость растворителя облегчает диссоциацию, но не вызывает ее. Активную роль в процессе диссоциации выполняют полярные молекулы растворителя. [c.214]
Механизм электролитической диссоциации ионных соединений упрощенно можно представить след
www.chem21.info
