Соли в химии
Соли в химии:
Самая знакомая нам соль — это пищевая (поваренная). Мы также очень хорошо чувствуем соль языком, как и кислоты.
Но помимо этой соли есть еще огромное множество солей, которые не стоит пробовать (как и кислоты), чтобы избежать печальных последствий.
Соли — это те образовавшиеся остатки от кислот и металлов. Металл (который приходит на место водорода в кислоте) в формуле соли этот металл записывается на первом месте, например, Na2SO3
Читаются соли так: сначала кислотный остаток, потом металл: Na2SO3 — сульфит натрия.
У солей от бескислородных кислот суффикс всегда -ид (K2S — сульфид калия, KCl — хлорид калия). Ид — созвучно с царством мертвых Аид (у древних греков), в котором, видимо, тоже не было кислорода.
У кислорордосодержащих суффикс: -ит

Даже слышно, как название становится суровее (суффикс —ат)(а степень окисления больше), при увеличении количества кислорода. И наоборот мягче, когда кислорода меньше, как и меньше степень окисления (-ит).
Пример получения поваренной соли (хлорид натрия) из натрия и соляной кислоты.
2Na + 2HCl = 2NaCl + H2 ↑
Заметьте, что валентность (способность образовывать связи с атомами) тоже связана с кислотным остатком: Na2SO3 — II и NaCl — I.
Если валентность у металла переменная, то она обязательно указывается в скобках рядом с солью.
И аналогично кислоте, к кислотному остатку подбирается валентность металла.
Какие-то кислотные остатки могут повторяться несколько раз, тогда их записывают в скобках, чтобы не спутать показатели: Cu(NO3)2 (читать: купрум эн о три дважды или просто нитрат меди), Ca3(PO4)2 (кальций три пэ о четыре дважды или фосфат кальция).
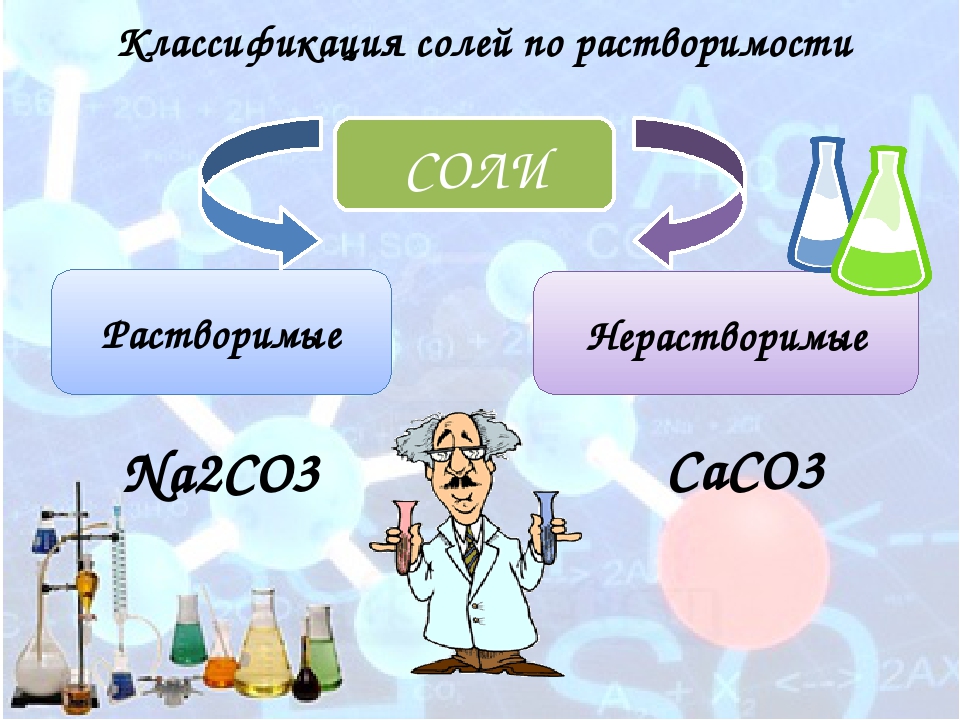
Все соли твердые
В основном, хорошо растворяются в воде
Соли могут выделяться из растворов вместе с молекулами воды. Тогда такую воду называют кристаллизационной (наполненной кристаллами соли), а такие соли кристаллогидратами (кристалл + вода (гидрат)). После получения такую соль нагревают и она теряет воду (обезвоживается).
Если соль растворить в воде, то атом одного металла вытесняется (замещается) другим более активным металлом (вспоминаем таблицу).
Исключение — это калий, кальций и натрий, которые из-за своей активности вступают с реакцией с водой.
Соли используются в быту (марганцовка, поваренная соль, сода,…), для удобрения, получения металлов и кислот, в качестве лекарств и строительных материалов и т.д.
Редактировать этот урок и/или добавить задание Добавить свой урок и/или заданиеДобавить интересную новость
Гидролиз в химии — что это такое? Примеры и определение
Определение гидролиза
Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». |
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
| Гидролиз солей — это реакция взаимодействия ионов соли с Н+ и ОН− ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный. |
Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
Начнем с того, что любая соль включает основание — амфотерный гидроксид, и кислотный остаток.
Например:
сульфат меди CuSO4состоит из основания Cu(ОН)2и кислоты h3SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
хлорид цинка ZnCl2состоит из основания Zn(ОН)2 и кислоты HCI;
карбонат натрия Na2CO3состоит из основания NaOH и кислоты h3CO3.
В жизни первым разрушается самое слабое, и гидролиз в химии действует по тому же принципу. В ходе этой реакции распадаются более слабые соединения (основания или кислотные остатки). Слабый катион или слабый анион вступают во взаимодействие с ионами воды и связывают один из них или оба. В растворе образуется избыток ионов H+ или гидроксильная группа OH− .
Запоминаем!
Важное условие гидролиза — наличие в составе соли слабого иона.
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так: XY + HOH ↔ XH + HOY В данном случае:
|
Индикаторы среды раствора
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
Важно!
В учебном материале и в задачах вместо словосочетания «среда раствора» можно встретить «водородный показатель pH». По сути это одно и то же. В нейтральной среде pH = 7, в кислой среде с избытком положительно заряженных ионов водорода H + — pH меньше 7, а в щелочной среде с избытком отрицательно заряженных ионов OH− — pH больше 7.
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Гидролиз по катиону. Как мы помним, гидролизация происходит только при наличии слабого иона, в данном случае — иона основания. Его катион вступает в реакцию и связывает гидроксид-ионы воды OH−. В итоге образуется раствор с избытком ионов водорода H+.
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Пример:
Нитрат аммония NH4NO3 состоит из слабого основания NH4OH и сильного кислотного остатка HNO3, поэтому он гидролизуется по катиону, то есть его катион NH4+ связывает ионы воды OH−.
Молекулярное уравнение: NH4NO3 + H2O ↔ NH4OH + HNO 3
Ионное уравнение: NH4+ + NO3− + HOH ↔ NH4OH + H+ + NO3−
Соль с сильным основанием и слабой кислотой
Гидролиз по аниону. Если слабым оказывается ион кислотного остатка, его отрицательно заряженная частица (анион) взаимодействует с катионом водорода H+ в молекуле воды. В итоге получается раствор с повышенным содержанием OH−.
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Пример:
Нитрат калия KNO2 отличается сильным основанием KOH и слабым кислотным остатком HNO2, поэтому он гидролизуется по аниону. Другими словами, анион кислоты NO2− связывает ионы воды H+.
Молекулярное уравнение: KNO
Ионное уравнение: K+ + NO2− + HOH ↔ HNO2 + K+ + OH−
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH− а анион кислоты связывает ионы H+
Среда водного раствора: нейтральная, слабокислая или слабощелочная.
Реакция индикаторов: могут не изменить свой цвет.
Пример:
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4+ + CN− + HOH ↔ NH4OH + HCN
Среда в данном случае будет слабощелочной.
Обобщим все эти сведения в таблице гидролиза солей.
Важно!
При взаимодействии гидрофосфатов с водой среда всегда будет щелочной. Дигидрофосфаты, гидросульфиты и гидросульфаты всегда дают кислую среду, независимо от силы основания. Например, гидросульфит натрия имеет сильное основание и слабую кислоту, исходя из чего можно было бы предположить образование щелочной среды. Но ввиду особенностей диссоциации в водном растворе pH будет меньше 7 (кислая среда).
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Важно!
Определить среду водного раствора, получившегося в результате гидролиза кислых солей, бывает непросто.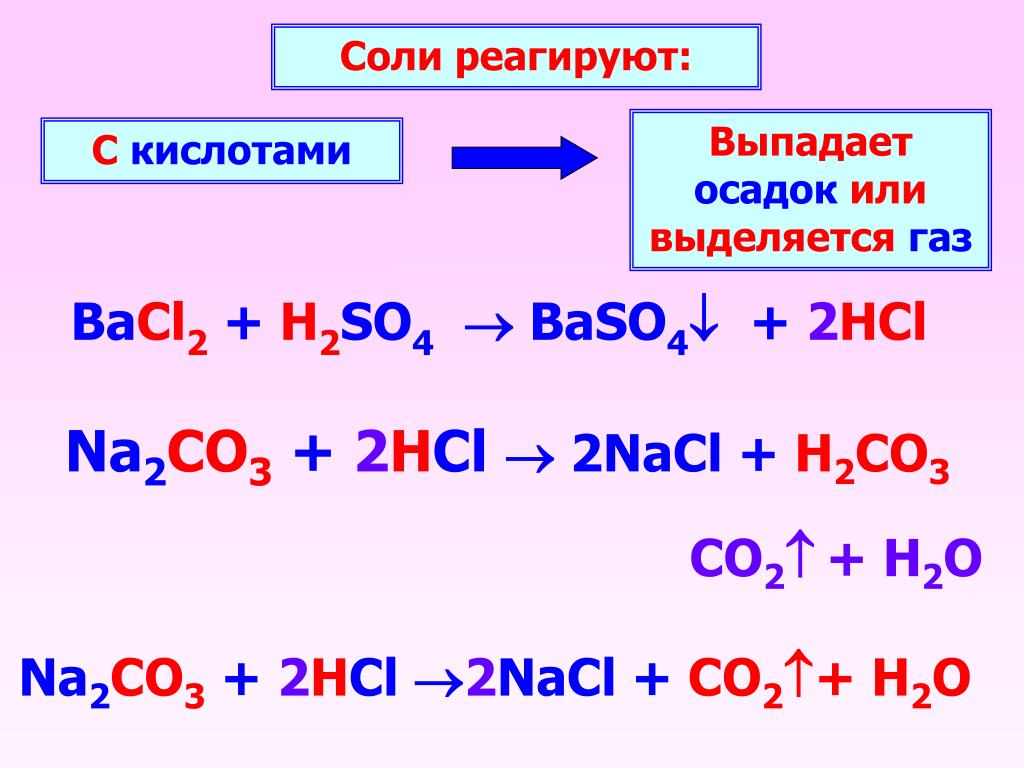 В данном случае кроме гидролизации одновременно идет диссоциация аниона соли, и какой будет среда — зависит от преобладания того или иного процесса. Если преобладает гидролиз — среда щелочная, если диссоциация — кислая.
В данном случае кроме гидролизации одновременно идет диссоциация аниона соли, и какой будет среда — зависит от преобладания того или иного процесса. Если преобладает гидролиз — среда щелочная, если диссоциация — кислая.
Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Al2S3+ 6H2O= 2AL(OH)3↓ + 3H2S↑
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимые реакции при взаимодействии с водой имеют место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
CaC2+ 2H2O= Ca(OH)2+ C2H2↑
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h = nгидр/nобщ.* 100% h — степень гидролиза, nгидр. — количество гидролизованного вещества, nобщ. — общее количество растворенного в воде вещества. |
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.

Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
Соли. Состав и название солей
Цель: повторить ранее изученные классы неорганических соединений «Оксиды», «Основания», «Кислоты»; познакомить с новым классом неорганических соединений «Соли».
Задачи:
- Обучающая – повторить состав, название и классификацию оксидов, оснований, кислот; познакомить с понятием «соль», названием и составом основных солей.
- Воспитательная – показать значение солей
в жизни человека; воспитывать чувство
взаимопомощи, бережное отношение к слуховой
аппаратуре; напомнить учащимся о правилах охраны
труда.
- Развивающая – развивать умение связно отвечать на вопросы, проводить сравнения, делать выводы, расширять словарь по теме: «Соли».
- Коррекционная – работать над развитием слухового восприятия, следить за внятностью и слитностью произношения, совершенствовать фразовую речь.
Основные виды работы: фронтальный опрос в виде беседы, игра, демонстрация химических реактивов, работа с дидактическими карточками.
Оборудование: таблицы «Химические элементы», «Кислоты и соли», «Растворимость кислот, оснований и солей в воде»; химические реактивы «Соли», «Химическое лото», дидактические карточки с заданиями.
ХОД УРОКА
I. Организационный момент
1. Приветствие.
2. [Ты слышишь?]
3. – При работе на уроке следите за ударением,
правилами орфоэпии, произношением.
4. – Посмотрите на план урока. Мы будем:
(– Повторять пройденный материал.)
(– Изучать новую тему.)
(– Выполнять практическую работу.)
II. Фронтальный опрос
– Давайте вспомним [пройденный
материал].
[Какие классы неорганических соединений вы
знаете?] (Оксиды, основания, кислоты)
[Какой главный химический элемент в оксидах?]
(Кислород)
[Что входит в состав оснований?] (Атомы металла и
гидроксогруппы)
[Из чего состоят кислоты?] (Из атомов водорода и
кислотного остатка)
– Перед вами формулы неорганических соединений.
Давайте определим, к какому классу относится
каждая из них.
NaOH H2SO4 P2O5
– Назовите класс соединений, название
вещества, прочитайте формулу, определите состав,
определите валентность.
(Основание, гидроксид натрия, натрий о аш, состоит
из атомов металла и гидроксогруппы, валентность
натрия – I, гидроксоруппы – I)
(Кислота , серная кислота, аш два эс о
четыре , состоит из атомов водорода и
атомов кислотного остатка ,
валентность водорода – I , кислотного
остатка – II)
(Оксид, оксид фосфора, пэ два о пять, состоит из
атомов неметалла и кислорода, валентность
фосфора – V, кислорода – II)
III. Слуховой диктант
– Сейчас будет [слуховой диктант].
[Простое вещество, металл, кислород, водород, неметалл, сложное вещество, основание, оксид железа, кислота, гидроксид калия, оксид серы, соляная кислота, кислотный остаток.]
IV. Сообщение нового материала
– Сегодня мы познакомимся с еще одним
классом неорганических соединений – это соли.
– Понятие «соль» мы встречали недавно, при
изучении кислот.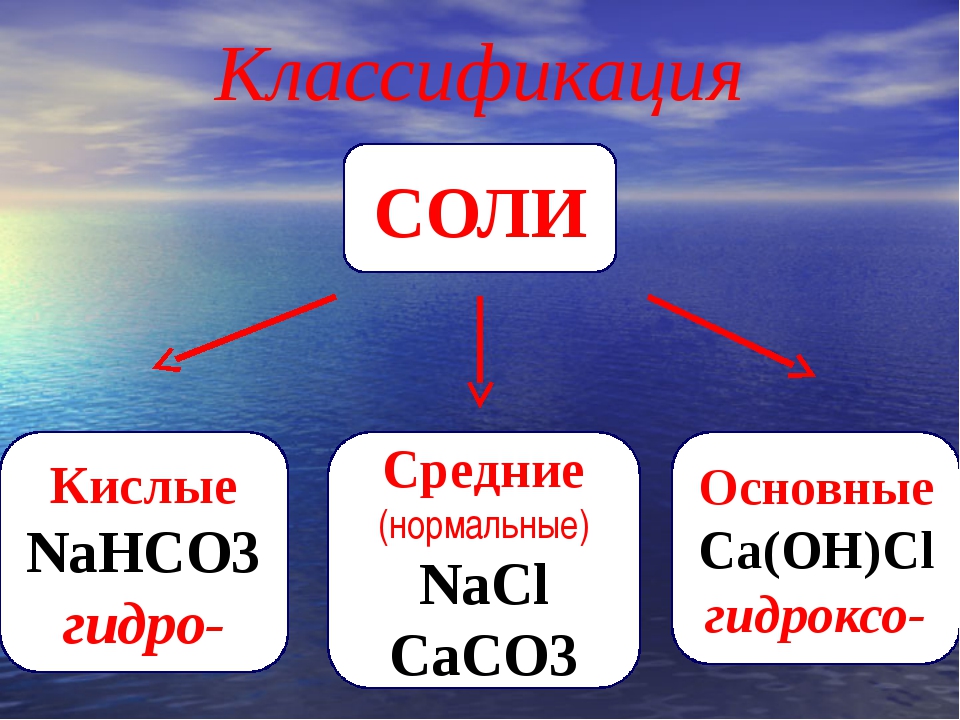 А с какими солями вы
встречаетесь каждый день? (У нас дома есть соль –
поваренная или пищевая).
А с какими солями вы
встречаетесь каждый день? (У нас дома есть соль –
поваренная или пищевая).
– А еще мел. Это тоже соль.
– Давайте посмотрим на поваренную соль и мел.
[Какой цвет у поваренной соли, мела?] (Белый)
[Какое агрегатное состояние у поваренной
соли, мела?] (Твердое)
– Растворимость этих веществ вы определите
сами. Давайте вспомним [Правила техники
безопасности. Как мы работаем со стеклянной
посудой?] (Работать нужно осторожно, чтобы не
разбить стекло и не порезаться).
(В двух стаканах вода. Добавим в один немного
поваренной соли, а в другой – мел и перемешаем
стеклянной палочкой.
– Посмотрите, как растворяется поваренная соль и
мел? (Соль растворилась, а мел – нет)
– Значит, cоли бывают растворимые и
нерастворимые.
– Поваренная соль имеет химическую формулу NaCl
и химическое название «хлорид натрия». Это
соль соляной кислоты, потому что кислотный
остаток у них одинаковый.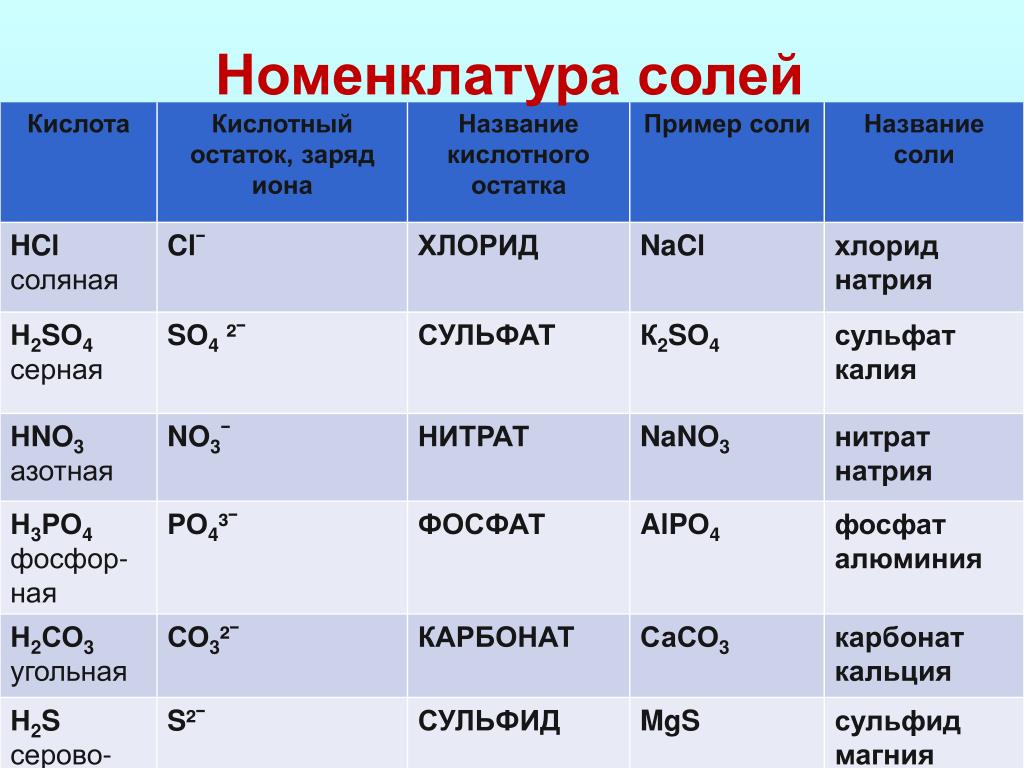 Еще в составе есть атом
металла. Определите валентность. По таблице
растворимости подтвердите, что хлорид натрия –
растворимая соль. (Ионы металла пересекаются с
ионами кислотного остатка, и на пересечении
стоит буква Р)
Еще в составе есть атом
металла. Определите валентность. По таблице
растворимости подтвердите, что хлорид натрия –
растворимая соль. (Ионы металла пересекаются с
ионами кислотного остатка, и на пересечении
стоит буква Р)
У вас на столах есть карточки. Запишите первую
соль, которую мы узнали.
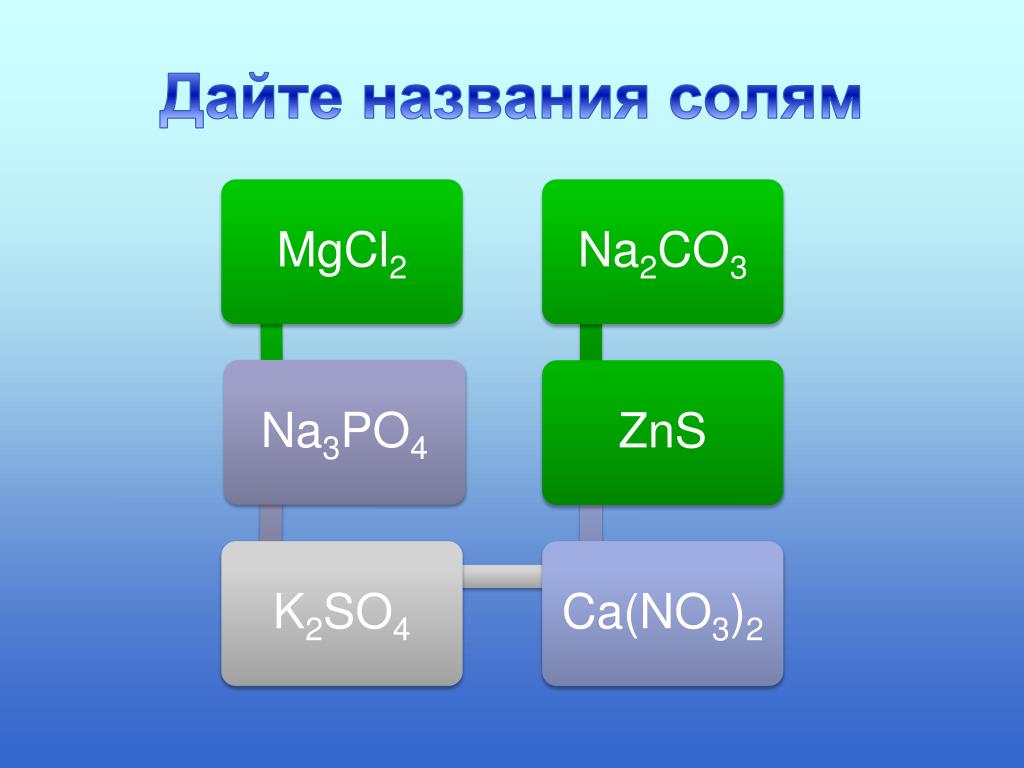
Названия солей
Химическая формула соли |
Название соли |
Солью какой кислоты является |
– Мел имеет химическую формулу CaCO3 и химическое
название «карбонат кальция». Это соль угольной
кислоты, потому что кислотный остаток у них
одинаковый. Также в составе атом металла.
Определите валентность. Определите
растворимость. В карточках запишите вторую соль.
Это соль угольной
кислоты, потому что кислотный остаток у них
одинаковый. Также в составе атом металла.
Определите валентность. Определите
растворимость. В карточках запишите вторую соль.
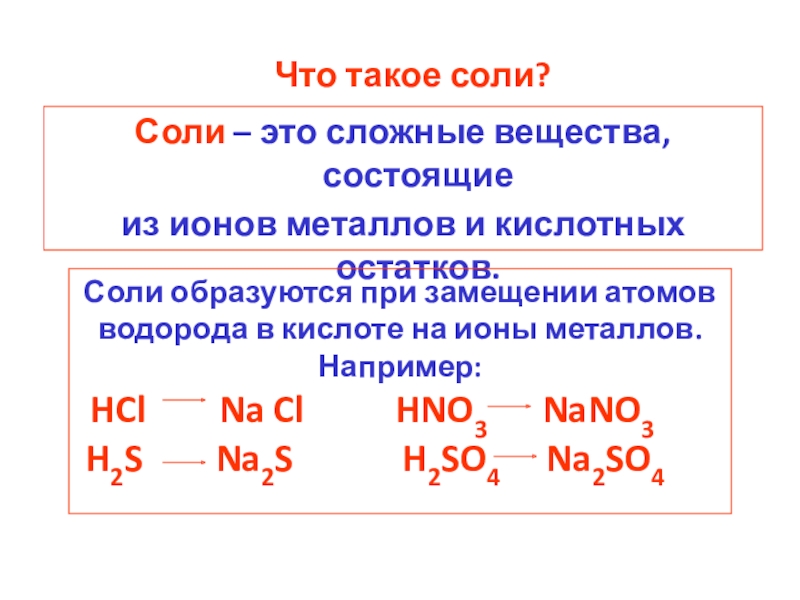
[Соль – это простое или сложное вещество?]
(Сложное, оно состоит из нескольких химических
элементов)
– Откройте тетрадь и запишите тему и
определение: «Соли – сложные вещества, состоящие
из атомов металла и кислотного остатка».
– Давайте повторим, какие соли мы узнали сегодня.
На одном кубике записаны атомы металлов, на
другом – атомы кислотного остатка. Соберите
формулы солей. Составьте формулу новой соли и
запишите данные в карточку.
(К + NO3 – нитрат калия, соль азотной
кислоты;
Сu + SO4 – cульфат меди, соль серной кислоты;
Fe + PO4 – фосфат железа, соль фосфорной
кислоты;
Zn + S – сульфид цинка, соль сероводородной
кислоты)
– С другими солями мы познакомимся на
следующем уроке.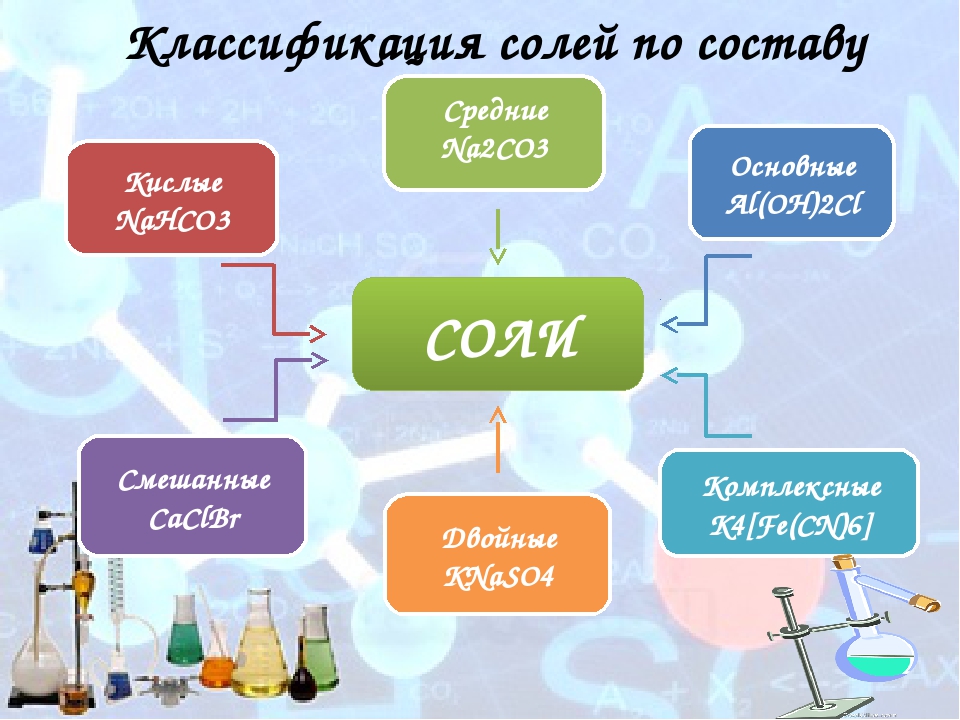
V. Итог урока
– Мы с вами узнали последний,
четвертый класс неорганических соединений.
Давайте сделаем вывод.
Соли – твердые вещества с разной растворимостью
в воде. Какие соли мы узнали? Где они применяются?
(Хлориды, карбонаты; хлорид натрия применяется
как приправа к пище, при мариновании; карбонат
кальция применяется при строительстве, входит в
состав красок и шпатлевок в отделочных работах).
– За работу на уроке:
VI. Домашнее задание
– Выучите определение солей.
– Дайте название и определите растворимость
следующих солей:
KCl СuCO3
Список литературы:
1. Программа курса химии для 8-9 классов
общеобразовательных учреждений. Гара Н.Н.
Программы общеобразовательных учреждений.
Химия. – М.: Просвещение, 2008. – 56с.
2. Учебник. Рудзитис Г.Е Химия:
неорганическая химия: учебник для 8 класса
общеобразовательных учреждений/ Г.Е Рудзитис, Ф.Г
Фельдман. – 12-е изд., исправленное – М.:
Просвещение, 2008. – 176с.
Учебник. Рудзитис Г.Е Химия:
неорганическая химия: учебник для 8 класса
общеобразовательных учреждений/ Г.Е Рудзитис, Ф.Г
Фельдман. – 12-е изд., исправленное – М.:
Просвещение, 2008. – 176с.
Другие ресурсы:
СD-диск: Уроки химии Кирилла и Мефодия. 8-9 класс. –
М.: ООО Кирилл и Мефодий. – 2002.
Краткий конспект подготовки к ЗНО по химии №11 Соли
Подготовка к ВНО. Химия.
Конспект 11. Соли
Соли – это электролиты, в результате диссоциации их водных растворов образуются катионы металлов и анионы кислотных остатков.
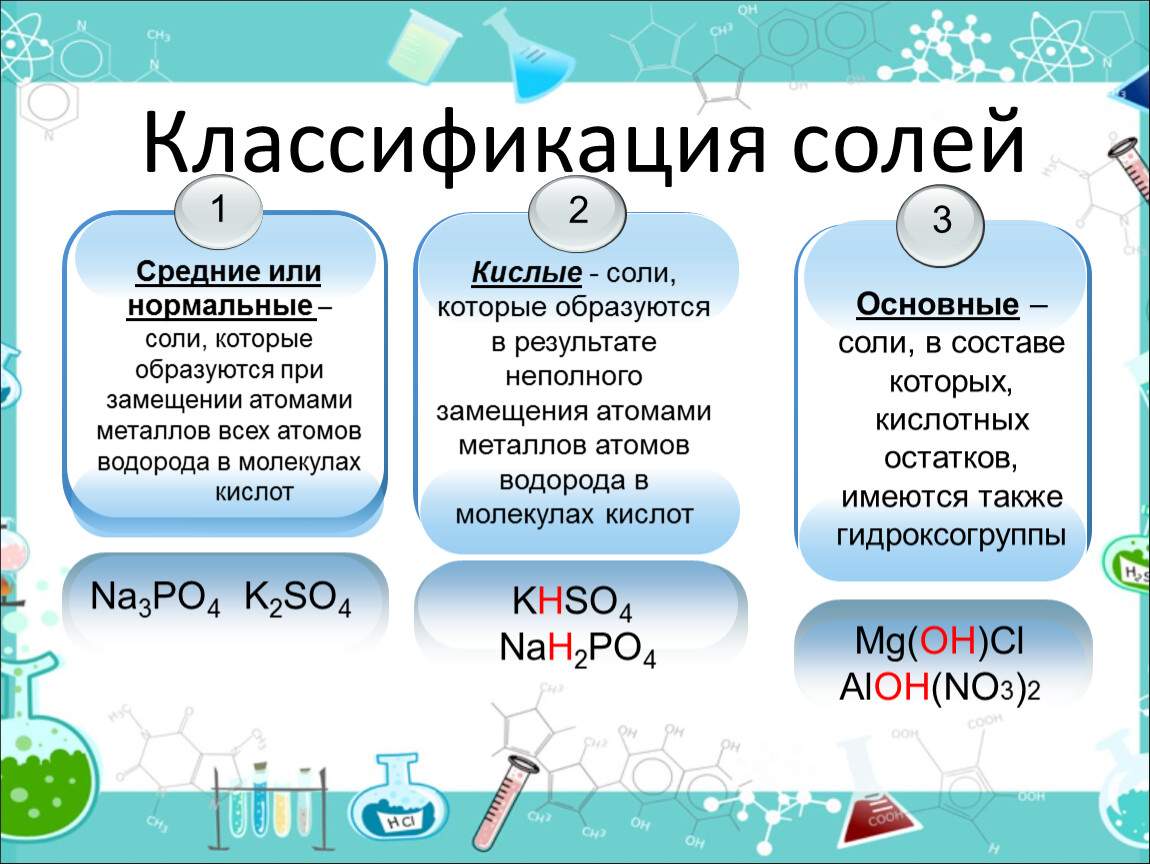
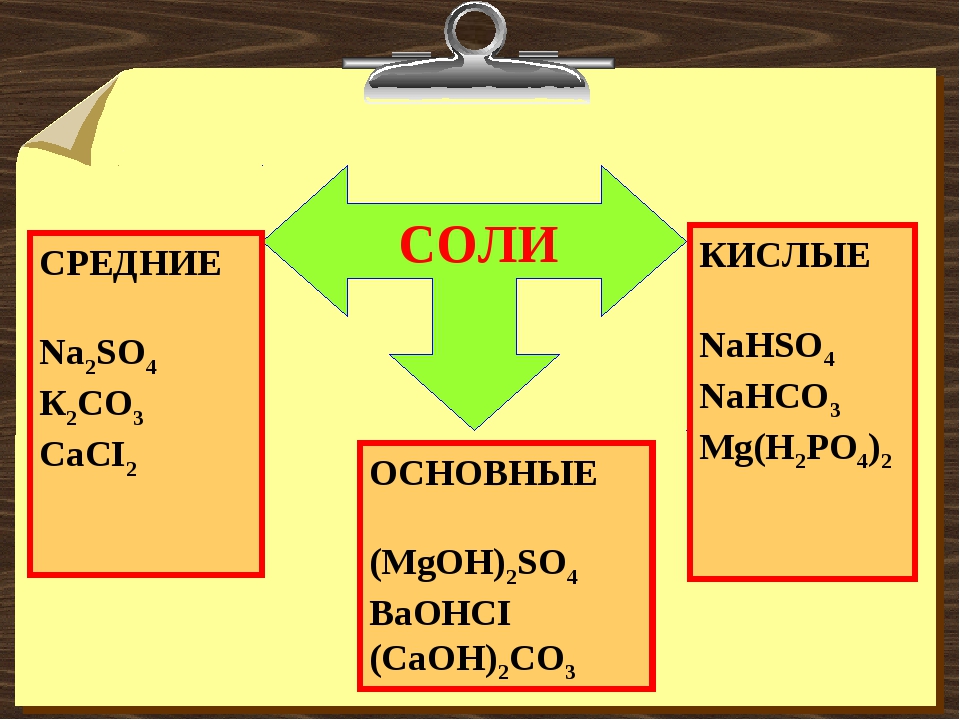
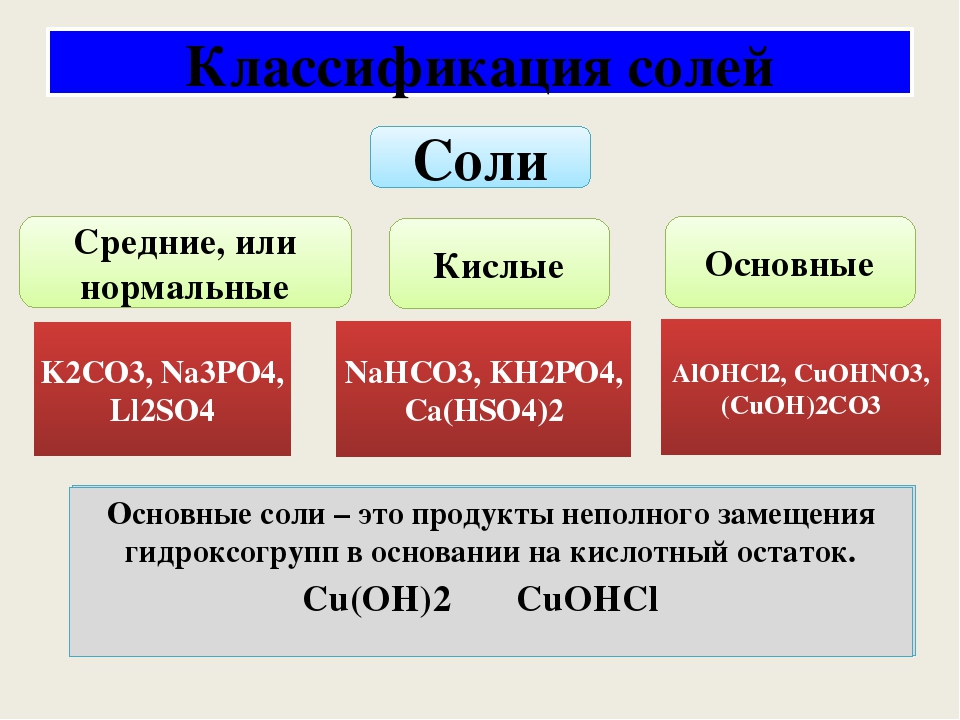
Классификация солей
Соли бывают:
1. Средние
2. Кислые
3. Основные
4. Двойные
5. Смешанные
6. Комплексные
Средние соли
В состав солей входят катионы металлов и кислотные остатки. Если кислотный остаток не содержит водорода, соли называют средними
Если кислотный остаток не содержит водорода, соли называют средними
– сульфат кальция
– нитрат свинца(II)
– ортофосфат кальция
– карбонат меди(II)
– нитрат лантана(III)
Средние соли – продукты полной нейтрализации кислот основаниями:
↓ .
Кислые соли – продукты неполной нейтрализации:
Соли, содержащие кислотные остатки с незамещенными атомами водорода, называются кислыми, например:
– гидросульф т кальция
– гидрокарбонат железа(II)
– дигидроортофосфат бария
– гидроортофосфат бария
Основные соли.
Соли, содержащие в своем составе гидроксогруппы, называются оснóвными, например:
– дигидроксид-сульфат кальция
– дигидроксид-карбонат димеди
Оснóвные соли – продукты неполной нейтрализации:
Возможна и дальнейшая нейтрализация основных солей избытком кислотного гидроксида
Двойные и смешанные соли
Известны также соли, содержащие два химически разных катиона – двойные соли или аниона – смешанные соли.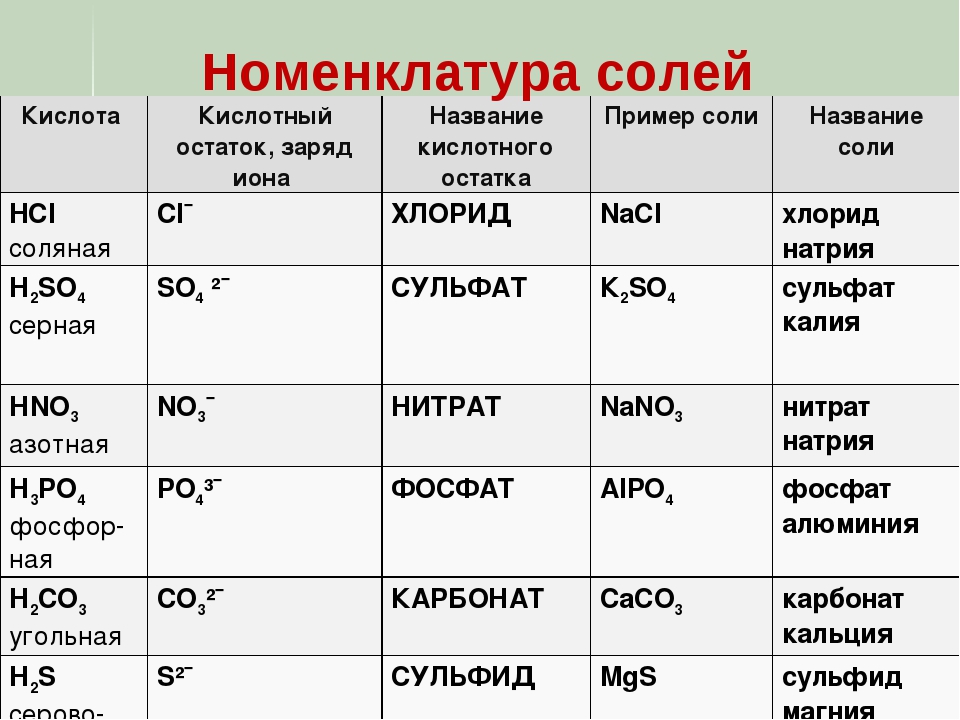 Примеры:
Примеры:
– сульфат алюминия-калия
– сульфат диаммония-железа(II)
– метасиликат алюминия-лития
– хлорид-гипохлорит кальция
– гидрокарбонат-карбонат натрия
– нитрат-иодат натрия
Часто двойные и смешанные соли малорастворимы в воде. Многие двойные и смешанные соли могут быть получены путем совместной кристаллизации при охлаждении из растворе смеси солей. Например:
Соли в природе
Очень многие соли, используемые химиками, встречаются в природе.
Природные соли можно классифицировать следующим образом.
Минеральные соли.
| Бинарные соединения | Сульфиды, галогениды |
| Соли с анионом, содержащим неметалл (металлоид) | Карбонаты, сульфаты, фосфаты, нитраты, бораты, арсенаты, силикаты, алюмосиликаты. |
| Соли с анионом, содержащим металл |
Хроматы, вольфраматы, молибдаты, ванадаты. |
Физические свойства
В обычных условиях все соли – это твердые бесцветные вещества.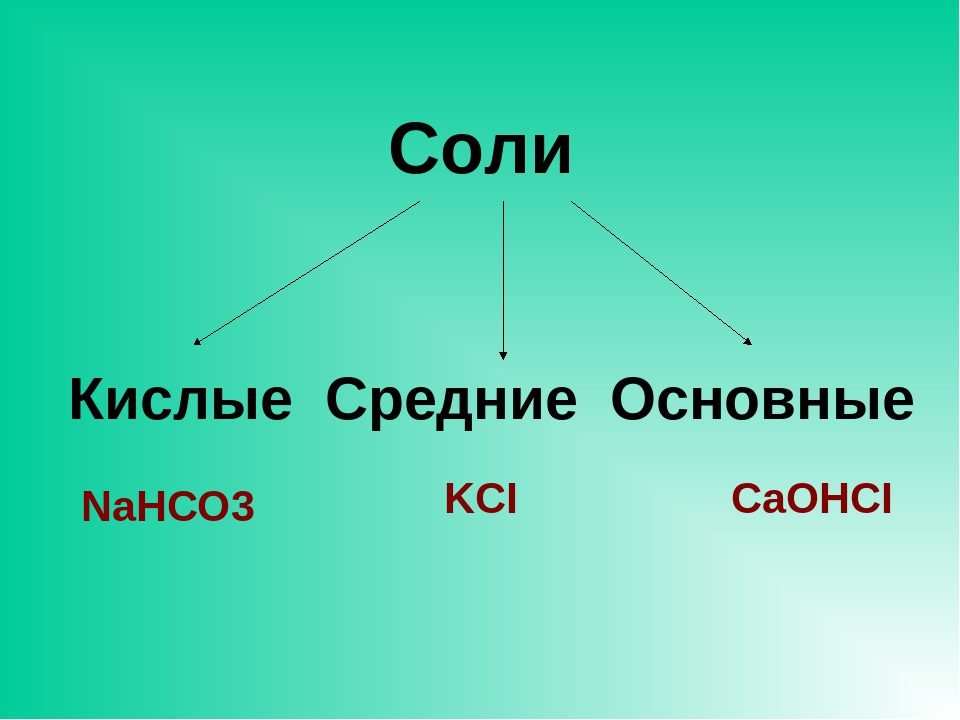 Но некоторые ионы придают им окраску. Например, соли двухвалентной меди, трехвалентного хрома и никеля окрашены в зеленый цвет Перманганаты – фиолетовые. Бихроматы – красно-оранжевые, а хроматы – желтые, соли кобальта – розовые.
Но некоторые ионы придают им окраску. Например, соли двухвалентной меди, трехвалентного хрома и никеля окрашены в зеленый цвет Перманганаты – фиолетовые. Бихроматы – красно-оранжевые, а хроматы – желтые, соли кобальта – розовые.
Растворимость солей может быть различной. Хорошо растворимы нитраты, почти все соли щелочных металлов и аммония.
Химические свойства солей
1. Взаимодействие с металлами.
Более активные восстановители вытесняют менее активные из раствора их солей. Активность метала можно определить в электрохимическом ряду напряжения металлов.
Однако щелочные и щелочноземельные металлы реагируют с растворами солей иначе.
Эти металлы сначала реагируют с водой. При этом образуется щелочь и выделяется водород.
↑, образующаяся щелочь реагирует с раствором соли, если получается нерастворимый гидроксид.
↓
2. Реагируют со щелочами.
↓
3. Реакция с кислотами (если образуется осадок или газ)
Реакция с кислотами (если образуется осадок или газ)
↓ (качественная реакция на галогеноводородные кислоты.)
↓ (качественная реакция на серную кислоту и её соли.)
↑ (качественная реакция на карбонаты)
4. Реагируют с кислотами (с более сильными или менее летучими).
(тв.)(конц.) ↑
(тв.) (конц.)
↑
5. Реагируют с солями.
↓
6. Разложение при нагревании.
7. Гидролиз
Некоторые соли способны подвергаться необратимому гидролизу в водных растворах.
2Al(NO3)3 +3 Na2S + 6h3O = 2Al(OH)3↓ +3h3S↑ + 6NaNO3
Химические свойства кислых солей
Кислые соли, как правило, растворимы в воде лучше, чем средние соли. Например, гидрокарбонат кальция растворим в воде, а карбонат кальция – нет. Дигидропроизводные кислот растворимы в воде лучше гидропроизводных соответствующих кислот.
1. Разлагаются при нагревании.
Ca(НCO 3)2 CaСO3↓ + CO2 ↑+ Н2О
2. Взаимодействую с основаниями с получением средних солей.
Ca(НCO 3)2 +Сa(OH)2 = 2CaСO3↓ + 2Н2О
Nah3PO4 + 2NaOH = Na3PO4 + 2h3O
3. Кислые соли вступают в такие же реакции, как и средние. Обменные реакции друг с другом.
↓
Получение средних солей
1. Взаимодействие гидроксидов с кислотами.
2. Реакция кислотных оксидов со щелочами.
3. Реакция основного оксида с кислотой.
4. Реакция металла и неметалла (соли бескислородных кислот)
Методы получения кислых солей
1. Неполная нейтрализация многоосновных кислот.
2. Взаимодействие средних солей с оксидами.
↓
Тесты подготовки к ЗНО:
Online-тест подготовки к ЗНО по химии№13 «Классы неорганических соединений. Соли»
Соли»
Соли, растворимость и устойчивость Реакции солей в воде.
Соль можно определить как соединение, которое образуется в результате реакции между кислотой и основанием, но не является водой. В данном разделе будут рассмотрены те свойства солей, которые связаны с ионными равновесиями.
реакции солей в воде
Несколько позже будет показано, что растворимость—это относительное понятие. Однако для целей предстоящего обсуждения мы можем грубо подразделить все соли на растворимые и нерастворимые в воде.
Некоторые соли при растворении в воде образуют нейтральные растворы. Другие соли образуют кислые либо щелочные растворы. Это обусловлено протеканием обратимой реакции между ионами соли и водой, в результате которой образуются сопряженные кислоты либо основания. Окажется ли раствор соли нейтральным, кислым или щелочным-зависит от типа соли. В этом смысле существуют четыре типа солей.
В этом смысле существуют четыре типа солей.
Соли, образуемые сильными кислотами и слабыми основаниями. Соли этого типа при растворении в воде образуют кислый раствор. В качестве примера приведем хлорид аммония Nh5Cl. При растворении этой соли в воде ион аммония действует как
Избыточное количество ионов h4O+, образуемое в этом процессе, обусловливает кислые свойства раствора.
Соли, образуемые слабой кислотой и сильным основанием. Соли этого типа при растворении в воде образуют щелочный раствор. В качестве примера приведем ацетат натрия Ch4COONa1 Ацетат-ион действует как основание, акцептируя протон у воды, которая выступает в этом случае в роли кислоты:
Избыточное количество ионов ОН-, образующихся в этом процессе, обусловливает щелочные свойства раствора.
Соли, образуемые сильными кислотами и сильными основаниями. При растворении в воде солей этого типа образуется нейтральный раствор. В качестве примера приведем хлорид натрия NaCl. При растворении в воде эта соль полностью ионизируется, и, следовательно, концентрация ионов Na+ оказывается равной концентрации ионов Cl-. Поскольку ни тот, ни другой ион не вступает в кислотно-основные реакции с водой, в растворе не происходит образования избыточного количества ионов h4O+ либо ОН . Поэтому раствор оказывается нейтральным.
При растворении в воде эта соль полностью ионизируется, и, следовательно, концентрация ионов Na+ оказывается равной концентрации ионов Cl-. Поскольку ни тот, ни другой ион не вступает в кислотно-основные реакции с водой, в растворе не происходит образования избыточного количества ионов h4O+ либо ОН . Поэтому раствор оказывается нейтральным.
Соли, образуемые слабыми кислотами и слабыми основаниями. Примером солей такого типа является ацетат аммония. При растворении в воде ион аммония реагирует с водой как кислота, а ацетат-ион реагирует с водой как основание. Обе эти реакции описаны выше. Водный раствор соли, образованной слабой кислотой и слабым основанием, может быть слабокислым, слабощелочным либо нейтральным в зависимости от относительных концентраций ионов h4O+ и ОН-, образуемых в результате реакций катионов и анионов соли с водой. Это зависит от соотношения между значениями констант диссоциации катиона и аниона.
Оглавление:
Соль и ее применение
Соль – необходимая приправа к пище и применяется в качестве средства, предохраняющего пищевые продукты от порчи.
В организме человека натрий необходим для сокращения мышц, в том числе сердца, перистальтики кишечника и передачи сигналов нервными клетками. Образующаяся из хлоридного иона соляная кислота необходима для пищеварения; этот ион присутствует и в амилазе слюны. Основная функция соли заключается в регуляции осмотического давления и перемещения жидкости в клетки и из них. В здоровом организме концентрация соли варьирует лишь в очень узких пределах.
ВОЗ (Всемирная организация здравоохранения) рекомендует ежедневно потреблять не более 6 граммов соли. В настоящее время учеными диетологами сформулировано положение, что потреблять поваренную соль надо в меру, соблюдая баланс натрия с калием и магнием.
Пищевая промышленность использует соль для консервирования, выпечки, обработки муки и других продуктов, для хранения мяса, соления рыбы, производства масла и придания вкуса пищевым продуктам.
Помимо потребления соли в пищевой промышленности, продукт в больших объемах используется химической промышленностью, где водный раствор NaCl посредством электролиза разлагается с получением хлора, водорода и каустической соды, также соль применяется для производства кальцинированной соды.
Кроме того, хлорид натрия используется в черной и цветной металлургии, машиностроении и металлообработке, борьбе с обледенением дорог, в производстве охлаждающих растворов, в медицине, косметологии, мыловарении, при обработке мехов и сыромятных кож, нефтяной промышленности для разморозки грунта и др.
Помимо этого, соль активно используют в бытовых и промышленных установках ионообменного умягчения воды, используемых на заводах по производству безалкогольных напитков, на молокозаводах, пивоваренных заводах, табачных фабриках, фармацевтических фабриках, котельных и иных производствах и др., а также в системах водоподготовки домов и городских квартир.
Значительное количество соли используется для нужд теплоэнергетики, в частности при химической очистке воды для котлов тепловых станций.
Помимо указанных направлений потребления поваренной соли стоит отметить потребление продукта животными. Животные нуждаются в соли не меньше человека. Нехватка соли замедляет рост молодых животных, а у зрелых вызывает вялость, снижение надоев молока и потерю веса.
Поскольку корма и листья растений содержат мало соли, следует добавлять ее в корм домашним животным. На современных фермах соль обогащают также витаминами и минеральными веществами, необходимыми для здоровья скота.
Соль всегда была одним из самых ценных продуктов. В VI веке римский историк и советник короля остготов Кассиодор заметил: «Соль необходима всем, в то время как без золота многие могут обойтись». Владельцы месторождений соли оказывались могущественнее монархов, из-за соли вспыхивали войны, образовывались и разрушались государства, ей платили налоги, а раздачей соли гасили крестьянские бунты. На производстве соли в России приобрели капиталы династии Строгановых, на соляных варницах отбывали ссылку декабристы.
В Средние века города, государства и княжества облагали торговцев огромными налогами за провоз соли через их территорию. Это приводило к войнам, и даже стало причиной основания некоторых городов, например, Мюнхена в 1158 году.
Соль (хлорид натрия NaCl) отвечает за важнейшие функции организма: поддержание давления и работы сердца, проницаемость клеточных мембран, передачу нервных импульсов, сокращение мышечных волокон, поддержание в норме состава крови, участие в процессах пищеварения и работе органов чувств. В организме взрослого человека содержится около 300 г. соли, недостаток поступления NaCl смертельно-опасен для человеческого организма. Полное отсутствие соли человек может выдержать не более 10-11 суток.
В организме взрослого человека содержится около 300 г. соли, недостаток поступления NaCl смертельно-опасен для человеческого организма. Полное отсутствие соли человек может выдержать не более 10-11 суток.
Помимо пищевой промышленности, соль в больших объемах используется химической промышленностью для производства хлора, каустической и кальцинированной соды, продукции нефтехимического комплекса, органического синтеза, стекольного, глиноземного и других производств.
Хлорид натрия используется в черной и цветной металлургии, машиностроении и металлообработке, борьбе с обледенением дорог, в производстве охлаждающих растворов, в медицине, косметологии, мыловарении, при обработке мехов и сыромятных кож, нефтяной промышленности, животноводстве. Значительное количество соли используется для нужд теплоэнергетики, в частности, при химической очистке воды для котлов тепловых станций.
Минеральные соли — Справочник химика 21
Выделение жидкого полимера из водной дисперсии осуществляется также, как и выделение эластомеров, разрушением гидроокиси магния минеральными кислотами. Выделенный полимер отмывается от кислоты и минеральных солей водой с применением в этом процессе центрифуг. Отмывка жидкого полимера от кислоты должна тщательно контролироваться, так как эта стадия процесса оказывает существенное влияние на свойства жидкого тиокола и его вулканизатов. Сушка жидких каучуков осуществляется в вакууме в аппаратах пленочного типа при темпера-ту ре пе выше 70—80 С [18]. [c.557]
Выделенный полимер отмывается от кислоты и минеральных солей водой с применением в этом процессе центрифуг. Отмывка жидкого полимера от кислоты должна тщательно контролироваться, так как эта стадия процесса оказывает существенное влияние на свойства жидкого тиокола и его вулканизатов. Сушка жидких каучуков осуществляется в вакууме в аппаратах пленочного типа при темпера-ту ре пе выше 70—80 С [18]. [c.557]
Биоразложение пролитого масла. В зависимости от химической структуры (ароматические углеводороды, нафтены, парафины), содержания гетероорганических соединений и присадок, молекулярной массы и т д., на минеральные масла по-разному воздействуют кислород и микроорганизмы (бактерии, грибки). В аэробных условиях скорость разложения зависит от содержания минеральных солей и микроэлементов, температуры и величины pH. В случае углеводородов, растворенных в воде, скорость их разложения определяется химической структурой и содержанием кислорода в воде.
 Олефины и ароматические соединения окисляются до кислородосодержащих соединений (спиртов, кетонов, фенолов, карбоновых кислот) в сравнительно короткий срок. На биологическое разложение углеводородов расходуется кислород с образованием аммиака, сероводорода и соли двухвалентного железа и марганца в сложившихся восстановительных условиях. [c.229]
Олефины и ароматические соединения окисляются до кислородосодержащих соединений (спиртов, кетонов, фенолов, карбоновых кислот) в сравнительно короткий срок. На биологическое разложение углеводородов расходуется кислород с образованием аммиака, сероводорода и соли двухвалентного железа и марганца в сложившихся восстановительных условиях. [c.229]Адсорбция ПАВ усиливается в результате образования ионных или молекулярных ассоциатов в адсорбционном слое, а также в присутствии минеральных солей в растворе вследствие уменьшения ККМ, снижается с увеличением pH раствора. [c.218]
Для предупреждения проникновения пыли в помещения сушильных цехов необходимо надежно герметизировать оборудование, а загрузочные устройства сушилок обеспечивать местными отсосами пыли. Чтобы повысить безопасность сушки веществ, не выдерживающих необходимых температур, в ряде случаев эти продукты смешивают с наполнителями. Например, для устранения взрывоопасности пыли некоторые органические красители смешивают перед сушкой с определенным количеством минеральных солей. [c.150]
[c.150]
Скорость проникновения минеральных солей в бактериальную клетку зависит от степени диссоциации на ионы, pH окружающей среды, электрического заряда бактерий. [c.100]
Анализ работы установок огневого обезвреживания [5.29, 5.62, 5.63] показывает при обезвреживании в печах типа ОС твердых, жидких и газообразных отходов, содержащих только органические соединения, можно обеспечить санитарные требования при обезвреживании отходов, содержащих неорганические и органические соединения, в результате переработки которых образуются минеральные соли или соединения галогенов, серы, фосфора, установки должны быть снабжены системами очистки газов утилизация теплоты газов возможна только через стенку аппаратов [5.62, 5.71]. [c.499]
Механические примеси содержатся в сырой нефти (глина, песок, минеральные соли) и заносятся в нефтепродукты при ее переработке.
 [c.163]
[c.163]Благоприятными для скорости полимеризации являются применение мономеров с высокой концентрацией, увеличение количества эмульгатора и молекулярной массы жирной кислоты (до определенного значения), применение активной гидроперекиси, низкое содержание минеральных солей в водной фазе, отсутствие кислорода в системе и др. [c.254]
Следует иметь в виду, что образующийся латекс должен обладать высокой агрегативной устойчивостью к механическим и термическим воздействиям в процессе сополимеризации и при отгонке мономеров. Устойчивость латекса регулируется многими параметрами, оказывающими влияние на размер латексных частиц и степень насыщенности их поверхности количеством эмульгатора и минеральных солей в растворе, pH водной фазы, конверсией мономеров и пр. [c.254]
Белки, жиры, углеводы — основные компоненты пищи и источники энергии для всего живого Другие вещества — витамины и минеральные соли — не менее важны, хотя они и нужны организму в микроскопических количе- [c. 269]
269]
Водные дисперсии высокомолекулярных полимеров подвергаются отмывке многократной декантацией от избытка полисульфида, хлорида натрия и других минеральных солей, а также от низкомолекулярных полимеров с концевыми ОН- и 5 Ма-группами, которые растворены в растворе полисульфида натрия. [c.556]
Объедините результаты, полученные первой и второй группой. Рассчитайте процентное содержание углеводов в молоке. Масса цельного молока складывается из четырех частей массы воды, массы углеводов, массы жиров и массы белков. (Минеральных солей в молоке всего около 1%, и их можно не учитывать.) Теперь переходите к части 4. [c.266]
Широко применяются отходы нефтеперерабатывающей и нефтехимической промышленности, например, в качестве пено-гаснтелей — окисленный парафин, мылонафт кальция (смесь нафтеновых кислот, неомыляемых веществ и минеральных солей), крошка бутадиенстирольного каучука (пеногаситель РС) и полиэтилена (пеногаситель ПЭС). [c.185]
[c.185]
Теперь вы готовы обсуждать содержание в продуктах питания минеральных солей, которых там следовые количества. Зачем они нужны организму [c.276]
Для удаления органических веществ, мешающих проведению анализа, образцы продуктов питания прокаливают при высокой температуре. Органические соединения при этом сгорают с образованием воды и диоксида углерода. Минеральные соли, в частности соли железа, остаются в золе и затем растворяются в соляной кислоте. [c.280]
Витамины и минеральные соли — это незаменимые вещества, присутствующие в продуктах питания в небольших количествах с самого начала. Некоторые пищевые продукты, особенно подвергнутые переработке (например, пе- [c.280]
Уплотнение породы может происходить не только за счет возрастающего с глубиною давления, но и вследствие цементации. Это влечет за собою уменьшение объема пустот и вытеснение жидкости и газа из первоначально занятых ими пор. Степень цементации растет с глубиной под действием циркуляции на глубине более насыщенных минеральными солями вод. [c.194]
Степень цементации растет с глубиной под действием циркуляции на глубине более насыщенных минеральными солями вод. [c.194]
Предварительная подготовка тяжелого сырья к каталитической переработке может быть осуществлена различными способами. В АзНИИ НП в 1953 г. с целью разработки метода подготовки сырья для каталитического крекинга, при котором снижаются одновременно содержание асфальто-смо-листых веществ и минеральных солей в сырье, направляемом на каталитический крекинг, изучена переработка мазутов по трем вариантам, включающим ступень подготовки сырья и собственно каталитического крекинга [c.244]
Синтетические алюмосиликатные катализаторы более устойчивы при переработке сернистого сырья. Как правило, процессы формирования структуры этих катализаторов проводят при температуре прокаливания 700—800° С. Вследствие этого при регенерации катализатора при температурах, не превышающих 650° С, заметной дегидратации поверхности не происходит.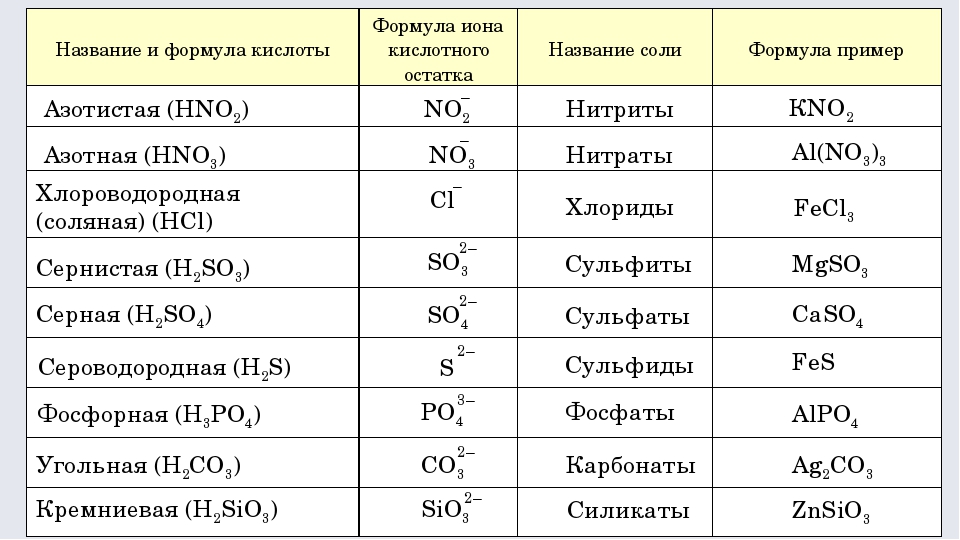 Однако при переработке сернистого сырья происходит так называемое вторичное отравление катализатора продуктами коррозии аппаратуры. В процессе каталитического крекинга при переработке сернистого сырья или сырья, содержащего минеральные соли, в связи с большой подачей пара происходит интенсивная коррозия стенок аппаратов (реакторов и регенераторов). Продукты коррозии в виде сернистого железа, окислов железа и других соединений в мелкодисперсном состоянии захватываются потоком паров или газов и переносятся на катализатор. Они прочно удерживаются на внешней поверхности гранул катализатора, проникают в его поры и препятствуют доступу паров и газов к внутренней новерхности катализатора, т. е. снижают его дегидрирующую активность. Происходит необратимая потеря активности катализатора, так как простыми физическими методами эти отложения не удается удалить. [c.19]
Однако при переработке сернистого сырья происходит так называемое вторичное отравление катализатора продуктами коррозии аппаратуры. В процессе каталитического крекинга при переработке сернистого сырья или сырья, содержащего минеральные соли, в связи с большой подачей пара происходит интенсивная коррозия стенок аппаратов (реакторов и регенераторов). Продукты коррозии в виде сернистого железа, окислов железа и других соединений в мелкодисперсном состоянии захватываются потоком паров или газов и переносятся на катализатор. Они прочно удерживаются на внешней поверхности гранул катализатора, проникают в его поры и препятствуют доступу паров и газов к внутренней новерхности катализатора, т. е. снижают его дегидрирующую активность. Происходит необратимая потеря активности катализатора, так как простыми физическими методами эти отложения не удается удалить. [c.19]
При обработке стоков, содержащих ПАВ, концентрирование можно проводить до более высоких концентраций, чем для неорганических солей, без заметного снижения селективности.
 Неионогенные и катионоактивные ПАВ задерживаются ацетатцеллюлозными мембранами лучше, чем анионоактивные. При очистке сточных вод, содержащих минеральные соли, целесообразно такое комбинирование потоков, при котором в стоках, поступающих на очистку, будет содержаться эффективная добавка ПАВ. Другим вариантом очистки сточных вод, содержащих органические и неорганические вещества, может служить схема [198], представленная на рис. У1-24. [c.323]
Неионогенные и катионоактивные ПАВ задерживаются ацетатцеллюлозными мембранами лучше, чем анионоактивные. При очистке сточных вод, содержащих минеральные соли, целесообразно такое комбинирование потоков, при котором в стоках, поступающих на очистку, будет содержаться эффективная добавка ПАВ. Другим вариантом очистки сточных вод, содержащих органические и неорганические вещества, может служить схема [198], представленная на рис. У1-24. [c.323]Так называемая хлоридная коррозия наблюдается, главным образом, в печах первичной переработки при недостаточной очистке нефти от пластовой воды с растворенными в ней минеральными солями. [c.147]
Следует иметь в виду, что в случае переработки тяжелых видов сырья содержание в нем минеральных солей, отрав-ЛЯЮШ.ИХ катализатор, должно быть минимальным. [c.21]
Действие ингибитора на реальную пластовую воду оценивают методом выпаривания, сравнением масс получающихся при этом отложений минеральных солей, при добавке ингибитора и без него. [c.240]
[c.240]
ПЕЧИ ПРОИЗВОДСТВА МИНЕРАЛЬНЫХ СОЛЕЙ- [c.95]
Поступающее на нефтетехнологические установки нефтяное сырье значительно различается по физико-химическим константам углеводородному составу, плотности, вязкости, содержанию растворимых в нефтях минеральных солей, газа, серы, парафина, механических примесей и др. Кроме углерода и водорода, которые обычно составляют 95—97 вес. % (в том числе С —84—85 вес. %, И—12—14 вес. %), в нефти находится не менее 3—4 вес. % побочных элементов и соединений — кислорода, фосфора, серы, газа, воды и др. [c.23]
К материалам, из которых изготовляют аппараты и оборудова-ниедля современных процессов первичной переработки нефти, предъявляют жесткие требования. Это обусловлено ростом производительности комбинированных установок, переработкой нефти с большим содержанием минеральных солей, серы, парафина и др., а также влиянием аппаратов, оборудования, механизмов, приборов контроля и автоматики на технологический режим отдельных узлов и показатели установки. По мере укрупнения установок абсолютный расход металла резко увеличивается, а удельный его расход заметно снижается. Наличие в нефтях минеральных солей, механических примесей, серы и сернистых соединений вызывает необходимость расходования значительных количеств дефицит-ны иметаллов. [c.164]
По мере укрупнения установок абсолютный расход металла резко увеличивается, а удельный его расход заметно снижается. Наличие в нефтях минеральных солей, механических примесей, серы и сернистых соединений вызывает необходимость расходования значительных количеств дефицит-ны иметаллов. [c.164]
По составу буровые сточные воды в большинстве случаев представляют собой многокомпонентные системы. Количественные соотношения между минеральными и органическими загрязнителями изменяются в нифоких пределах и зависят от типа и системы обработки буровых растворов, системы водопотребления и др. Основные загрязнители — химические реагенты, нефтепродукты и растворимые минеральные соли. Содержание химических реагентов изменяется от 2 до 50 тыс. мг/л. [c.195]
Минерализация сточных вод отрицательно влияет иа ионообменное иоглощенпе ПАВ. Наиример, при постепенном иовы-шении содержания минеральных солей в растворе до 16 мг экв/л наблюдается резкое падение динамической емкости анионита ЭДЭ-ЮП. При дальнейшем повьпнении концентрации минеральных солей в растворе снижение емкости анионита замедляется и в области концентраций 20—40 мг экв/л динамическая емкость становится практически постоянной. [c.219]
При дальнейшем повьпнении концентрации минеральных солей в растворе снижение емкости анионита замедляется и в области концентраций 20—40 мг экв/л динамическая емкость становится практически постоянной. [c.219]
При производстве нефтепродуктов в них могут попасть продукты коррозии, катализаторная крошка и пыль, мельчайшие частицы отбеливающей глины, минеральные соли. Загрязнение нефти и нефтепродуктов может происходить также при хранении и транспорте (главным образом, песок и глина при открытом хранении и перевозке в водотечных судах). В рецептуру присадок к маслам и некоторых сортов консистентных смазок входят минеральные вещества. [c.163]
При сульфитной варке целлюлозы варочная кислота (растворенный в воде SO2 с добавкой окиси кальция) растворяет все компоненты древесины, кроме целлюлозы. В раствор переходят пентозные и гексозные сахара, лигнин, минеральные соли и др. Этот раствор называют сульфитным щелоком. Переработкой его получают этиловый спирт и ряд других продуктов. [c.28]
[c.28]
Реакцию проводят в водной среде при 50 °С в присутствии катализаторов — минеральных солей щелочных или щелочноземельных металлов (Na l, a la, K l, NagSOi и т. д.) . После отгонки непрореагировавшей окиси этилена выкристаллизовавшийся продукт промывают водой и высушивают выход теоретический т. пл. 112— 112,5 °С. Синтез можно проводить и в безводной среде . В этом случае кристаллизация продукта происходит при выливании реакционной массы в воду выход 96%. [c.33]
Говоря о перспективах усовершенствования диоксанового синтеза, целесообразно остановиться на отработанном в опытно-промышленном масштабе (опытный цех Ефремовского завода) варианте технологии синтеза ДМД с использованием в качестве сырья высококонцентрированного газообразного формальдегида. Полезность такого приема станет очевидной, если принять во внимание, что при использовании формальдегида в виде35—40%-ного водного раствора приходится пропускать через всю систему синтеза ДМД значительные количества воды, которая, пройдя реакторы, загрязняется большим количеством трудноудаляемых органических веществ (ВПП, формальдегид и т. д.) и минеральных солей. [c.708]
д.) и минеральных солей. [c.708]
Горизонтальная полоса обра ювалась вследствие осаждения на стенках раковины солей жирных кислот. Вертикальные полосы, вероятнее всего, представляют собой минеральные соли, выпадав1 ие из капающей воды. [c.84]
Неправильное питание можно определить как нарушение оптимального соотношения между гкктупающими в организм белками, витаминами, минеральными солями и другими веществами. Питание может быть неправильным даже при достаточно калорийной пище. Если бы табл. IV. 1 учитывала людей с неполноценным, н1. пр ишльным питанием, как изменился бы общий результат [c.237]
Растворимость индивидуальных углеводородов в различных растворителях швисит от их природы, молекулярного веса и температуры. Та , растворимость их в воде крайне низка. С повышением температуры она возрастает, а в области критических температур снижается. Наибольшей растворимостью в воде обладают диеновые углеводороды, за ними следуют ароматические и олефины. Наимень-В1ую растворимость проявляют парафиновые углеводороды. В одном и том же гомологическом ряду растворимость в воде углеводородов возрастает с увеличением их молекулярного веса. Углеводородные газы растворяются в воде в незначительных количествах. С повышением давления (рис. 39) и понижением температуры (табл. 9) растворимость углеводородных газов в воде повышается, а в присутствии растворенных в воде минеральных солей — понижается. [c.87]
Наимень-В1ую растворимость проявляют парафиновые углеводороды. В одном и том же гомологическом ряду растворимость в воде углеводородов возрастает с увеличением их молекулярного веса. Углеводородные газы растворяются в воде в незначительных количествах. С повышением давления (рис. 39) и понижением температуры (табл. 9) растворимость углеводородных газов в воде повышается, а в присутствии растворенных в воде минеральных солей — понижается. [c.87]
Таким источником является главным образом растш ельность нашей планеты, а также двуоксид углерода в биосфере и в залежках минеральных солей углекислоты. Переход к у ке наметившемуся в научных разработках замещению природных газообразных, жидких и твердt.ix углеводородов органическим материалом ископаемых углей и сланцев и том б олее переход к органическим материалам из растительного сырья будет, по-видимому, осуще- [c.352]
Сера в керосине может иметь двоякое присхождеиие она можег быть, во-первых, первичной, т. е. попадать в виде сернистых соединений, предсуществовавших в нефти и не выделенных недостаточной очисткой. Во-вторых, сера может присутствовать в виде соединений, заключающих окисленную се ру сульфонафтеновых кислот серноэфирных, может быть, и сульфонов И полных эфиров серной кислоты [Гейслер и Деннштедт (142)]. Все эти соединения вторичного характера и главная масса их удаляется хорошей промывкой очищаемого керосина щелочью и водой. Сюда же можно отнести и сульфатную серу в виде минеральных солей, взвешенных В керосине. Эта последняя форма встречается редко, но может иметь некоторое значение в особых случаях. Определение ее производится по Конрадсону (143), но в виду редкости здесь не приводится. [c.207]
е. попадать в виде сернистых соединений, предсуществовавших в нефти и не выделенных недостаточной очисткой. Во-вторых, сера может присутствовать в виде соединений, заключающих окисленную се ру сульфонафтеновых кислот серноэфирных, может быть, и сульфонов И полных эфиров серной кислоты [Гейслер и Деннштедт (142)]. Все эти соединения вторичного характера и главная масса их удаляется хорошей промывкой очищаемого керосина щелочью и водой. Сюда же можно отнести и сульфатную серу в виде минеральных солей, взвешенных В керосине. Эта последняя форма встречается редко, но может иметь некоторое значение в особых случаях. Определение ее производится по Конрадсону (143), но в виду редкости здесь не приводится. [c.207]
Большое число исследований посвящено разделению и концентрированию водных растворов минеральных солей [I —12]. Ниже приведены данные, полученные [163] на ацетатцеллюлозных мембранах прп давлении 10 МПа и температуре раствора 20 °С (ко1щентрация исходного раствора составляла 0,05 моль/л) [c. 280]
280]
Если низкая летучесть вещества с водяным партм обусловлена заметной его растворимостью в воде, эффективность перегонки можно увеличить по крайней мере в несколько раз, добавляя в перегонную колбу минеральные соли, например хлорид натрия. Эффект добавки тем заметнее, чем выше концентрация соли. Увеличение содержания перегоняемого продукта в паровой фазе при добавлении хлорида натрия обусловлена не только уменьшением раствори- мости вещества в воде, но также повышением температуры кипения смеси. [c.141]
6.1: Сахар и соль — Химия LibreTexts
Хлорид натрия, также известный как поваренная соль, представляет собой ионное соединение с химической формулой \(\ce{NaCl}\), представляющее соотношение ионов натрия и хлорида 1:1. Он широко используется в качестве приправы и консерванта пищевых продуктов. Соль можно получить, соединив вместе два очень реакционноспособных элемента: металлический натрий (\(\ce{Na (s)}\) и газообразный хлор (\(\ce{Cl2 (g)}\).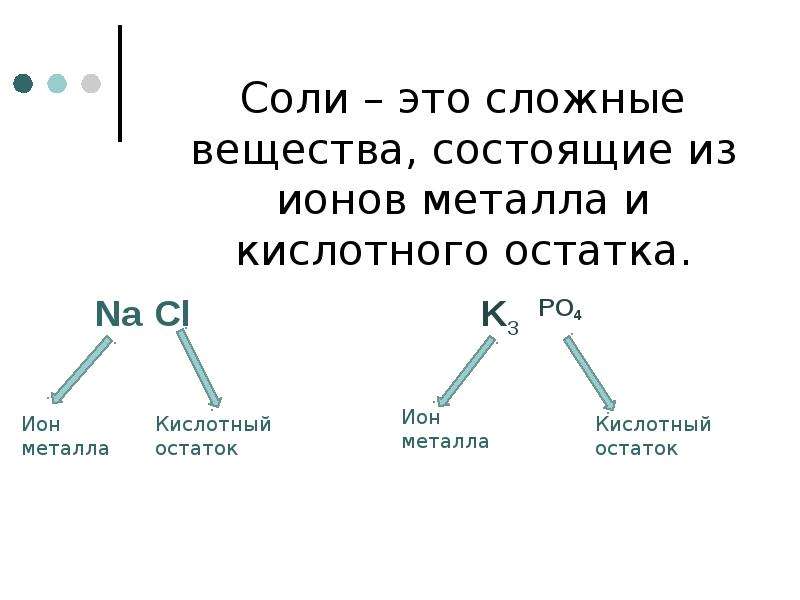
\[ \ce{2Na (т) + Cl2(г) \rightarrow 2NaCl (т)} \label{eq1}\]
Натрий (рис. \(\PageIndex{1a}\)) — очень активный металл; при возможности он будет реагировать с потом на ваших руках и образовывать гидроксид натрия, который является очень едким веществом.Элемент хлор (рис. \(\PageIndex{1b}\)) представляет собой бледно-желтый едкий газ, который нельзя вдыхать из-за его ядовитой природы. Однако соедините эти два опасных вещества, и они вступят в реакцию, образуя ионное соединение хлорида натрия (рис. \(\PageIndex{1c}\)), известное просто как соль.
Рисунок \(\PageIndex{1}\): Натрий + хлор = хлорид натрия (a) Натрий — очень активный металл. б) Хлор — бледно-желтый ядовитый газ. в) Вместе натрий и хлор образуют хлорид натрия — соль, которая необходима для нашего выживания.{−}}\) ионы необходимы для правильного функционирования нервов и дыхания. Оба этих иона поставляются солью. Вкус соли — один из основных вкусов; соль, вероятно, самый древний известный ароматизатор и один из немногих камней, которые мы едим.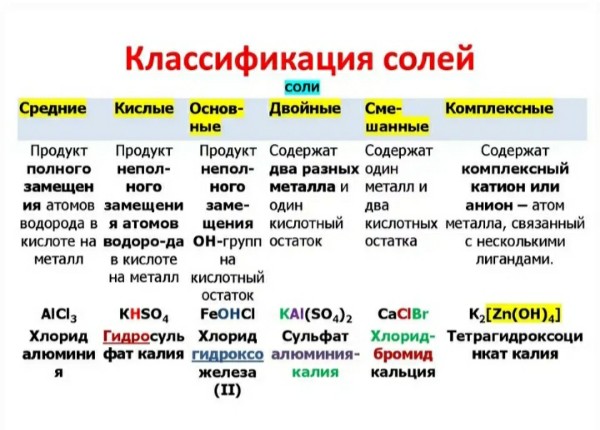 Ясно, что когда элементарный натрий и хлор объединяются (уравнение \ref{eq1}), полученный продукт соли имеет радикально разные свойства (как физические, так и химические). Эта реакция впечатляет (видео \(\PageIndex{1}\)).
Ясно, что когда элементарный натрий и хлор объединяются (уравнение \ref{eq1}), полученный продукт соли имеет радикально разные свойства (как физические, так и химические). Эта реакция впечатляет (видео \(\PageIndex{1}\)).Видео \(\PageIndex{1}\): Изготовление поваренной соли с использованием металлического натрия и газообразного хлора
Другим соединением является сахар, который является общим названием сладких растворимых углеводов, многие из которых используются в пищевых продуктах.Сахар имеет химическую формулу \(\ce{C12h32O11}\) и состоит из элементов, отличных от соли: углерода, водорода и кислорода. Хотя сахар качественно напоминает поваренную соль (которую часто путают на кухне), они имеют совершенно разные физические и химические свойства. Существуют различные виды сахара, полученные из разных источников. Хотя сахар состоит из углерода, водорода и кислорода, его гораздо труднее синтезировать из составляющих элементов, чем поваренную соль (уравнение \ref{eq1}).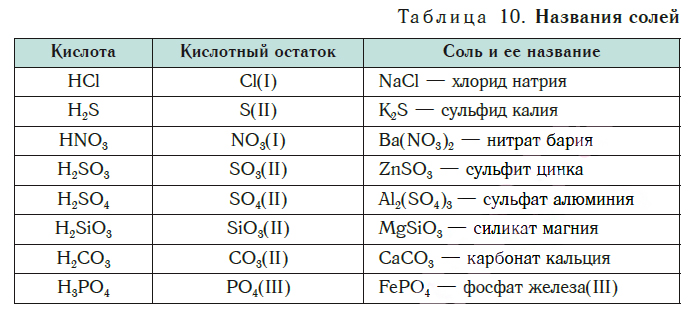 Однако термическое разложение значительно проще и может быть представлено как дегидратация сахарозы до чистого углерода и водяного пара в уравнении \ref{eq2} и продемонстрировано в видео \(\PageIndex{2}\).
Однако термическое разложение значительно проще и может быть представлено как дегидратация сахарозы до чистого углерода и водяного пара в уравнении \ref{eq2} и продемонстрировано в видео \(\PageIndex{2}\).
\[\ce{C12h32O11 (т) + теплота → 12C (т) + 11h3O (г)} \label{eq2}\]
Видео \(\PageIndex{2}\): Научный эксперимент на кухне показывает, что происходит с молекулами сахара при нагревании. Эксперимент не подвел!
Как и соль, сахар имеет совершенно иные свойства (как физические, так и химические), чем составляющие его элементы.Это центральная особенность химических реакций, о которых пойдет речь в этой главе.
Авторы и авторство
Как определить соль? — Библиотека соли
Говоря прямо, соль — это то, что мы используем в повседневной жизни в основном для приготовления пищи или приправы, верно? Однако как определить соль в химии?
Как Koyuncu Salt, ведущий экспортер соли в Турции, мы объясним такие важные темы, как; как определить соль? Как проще всего определить соль при анализе соли? И как сделать простой анализ соли? Начнем.
Что такое соль в химии?
Чтобы ответить на вопрос «Как определить соль?» нужно понимать, что означает соль в химии. В химии соль — это химическое соединение, полученное в результате реакции кислоты с основанием. Соль состоит из двух противоположно заряженных ионов; положительный ион (катион) основания и отрицательный ион (анион) кислоты.
Химическая реакция , в результате которой образуется соль, называется нейтрализацией, которая происходит между кислотой и основанием.Обычно соль также относится к поваренной соли, которая состоит из натрия и хлорида (NaCl). Обычно соль состоит из положительных ионов металла (Na1+) и отрицательных ионов неметалла (CI1-).
Как соль связывается вместе?
Прежде всего, вам нужно понять, как образуются ионы, чтобы понять, как соль связывается вместе. Ионы образуются двумя способами.
Положительный ион : Когда атом теряет электрон, он становится катионом. Потеряв отрицательно заряженный электрон, атом становится положительным.
Потеряв отрицательно заряженный электрон, атом становится положительным.
Отрицательный ион : Атом может получить электрон, чтобы стать анионом, что происходит из-за правила октета , как обычно говорят химики. Это означает, что атом может обрести устойчивость благодаря восьми валентным, или внешним, электронам. Потеря или приобретение электронов для образования иона — способ достижения этого.
Итак, когда металлический натрий встречается с газообразным хлоридом, они оба образуют ионы, и происходит реакция. В результате натрий приобретает положительный заряд, и два противоположно заряженных иона связываются вместе.
Свойства соли
На вопрос «как определить соль?» можно ответить. путем проведения солевого анализа. Тем не менее, мы обсудим темы анализа соли и «как сделать простой анализ соли?» далее в статье. А пока давайте рассмотрим свойства соли, которые в первую очередь делают соль «солью».
● Соль имеет строго упорядоченное формирование молекул, что придает ей вид кристаллической структуры или белого кристаллического порошка.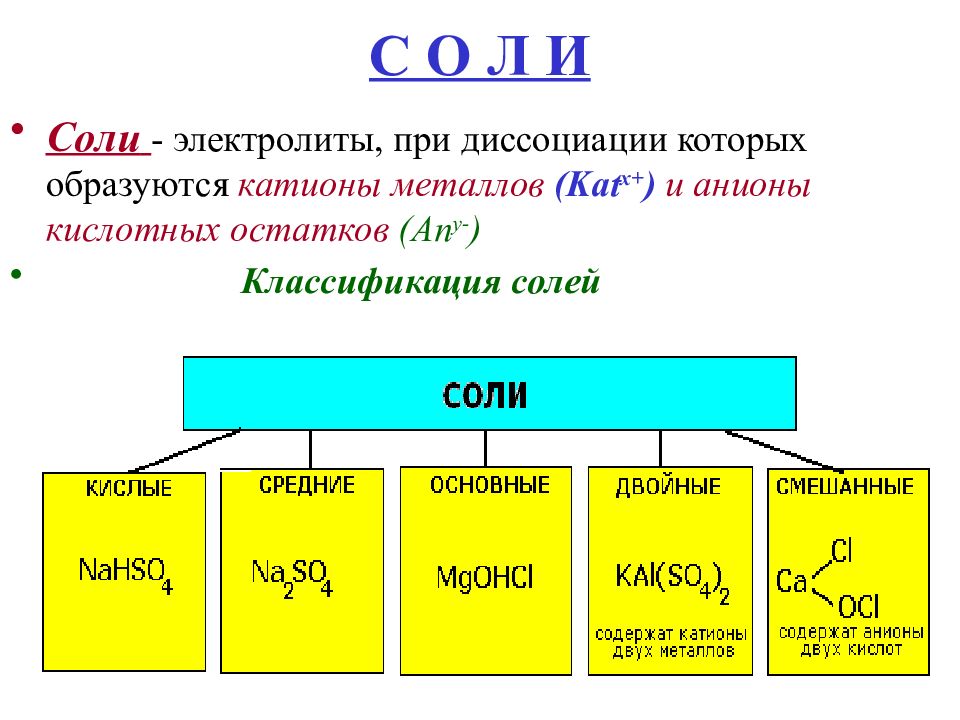
● Соль имеет прозрачную и бесцветную форму.
● Растворяется в воде при определенных условиях.
● Соль также гигроскопична, что означает, что она может поглощать влагу из влажной атмосферы (относительная влажность выше 75% или высыхание)
● Плавится при 801°C.
● Он начинает испаряться при температуре немного выше 1413°C.
● Соль является электролитом. Растворяясь в воде, соль создает свободно текущие ионы и заставляет воду проводить электричество.
Теперь, когда мы рассмотрели основную информацию о том, как идентифицировать соль как химическое соединение в целом, мы можем углубиться в детали того, «как вы можете идентифицировать соль?» путем определения солевого анализа.
Что такое анализ соли?
Также известный как систематический качественный анализ или качественный неорганический анализ , анализ солей представляет собой идентификацию катиона и аниона неорганической соли. Этот анализ проводится путем систематической серии тестов и наблюдений, чтобы доказать отсутствие или присутствие катионов и анионов.
Этот анализ проводится путем систематической серии тестов и наблюдений, чтобы доказать отсутствие или присутствие катионов и анионов.
Как сделать простой анализ соли?
Как указано выше в определении анализа соли, соль может быть идентифицирована путем проведения анализа соли, который выявляет ее катионы и анионы. Тогда как проще всего определить соль при анализе соли? Давайте разобьем анализ соли на этапы, чтобы получить лучший ответ на вопрос «Как вы проводите простой анализ соли?»
Шаг #1 Добудьте неорганическую соль, которую вы идентифицируете.
Шаг №2 Проведите предварительные тесты на анионы, пока не получите положительный результат.
Шаг № 3 Проведите предварительные тесты на катионы, как только вы получите положительные результаты предварительных тестов на анионы, и тестируйте, пока не получите положительный результат.
Шаг № 4 Проведите подтверждающие тесты для обоих после получения положительных результатов.
Шаг #5 Как только вы идентифицируете катионы и анионы, получите химическую формулу соли, уравновесив заряды.
Как определить простую соль
Существует определенная базовая процедура определения соли, которой можно следовать.
1. Посмотрите на внешний вид соединения
.Обычно соединение появляется в твердой форме. Более того, как мы упоминали ранее в свойствах соли, ее форма кристаллическая, а цвет прозрачный или белый. Однако ионы переходных элементов могут быть окрашены. Например;
2. Проверка эффекта нагрева
Нагрейте соединение в пробирке. Вызывает ли нагревание конденсацию жидкости внутри трубки? Скорее всего, это вода, а это значит, что соединение, которое у вас есть, является гидратом.Если при нагревании выделяется газ, то следует обратить внимание на его цвет и запах.
3. Проведите испытание на пламя
Проведение испытания пламенем — еще один способ ответить на вопрос «Как проще всего идентифицировать соль при анализе соли?» Растворы ионов могут вызывать изменение цвета пламени в зависимости от характеристики атома.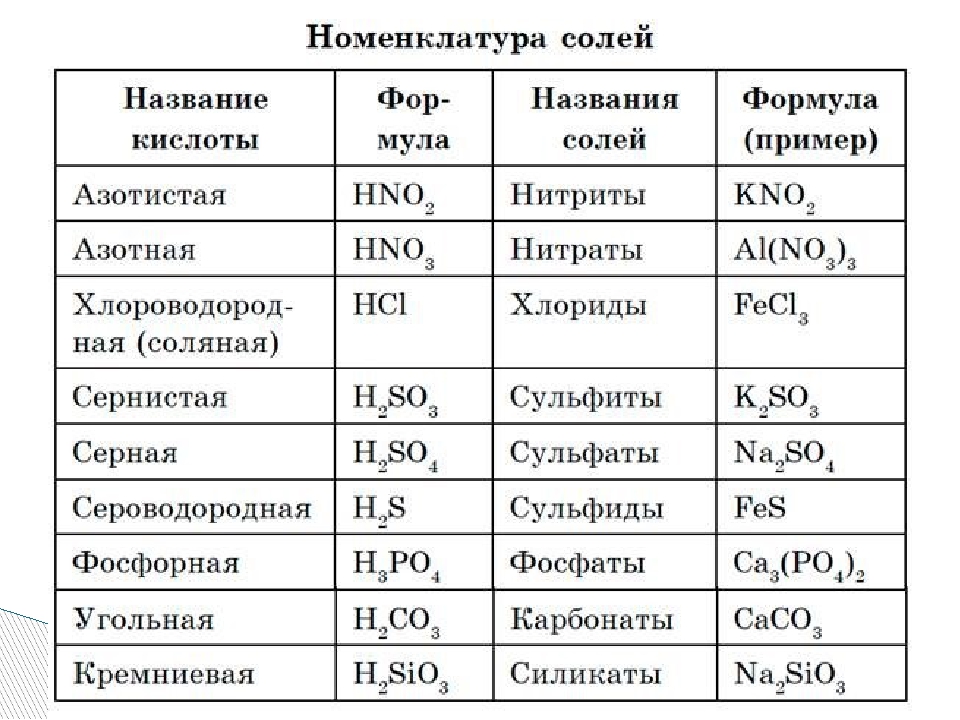
Для этого испытания растворы ионов смешивают с концентрированной HCl и затем нагревают на проволочном пламени (никель или хром).
4.Проверьте его реакцию с соляной кислотой
HCl по каплям добавляют к раствору до тех пор, пока тест не покажет реакцию лакмусовой бумаги на кислую. Наблюдайте за любой реакцией. Любой катион, который образует нерастворимый хлорид, образует осадок.
5. Обратите внимание на растворимость в воде
Как сделать простой анализ соли? Вы можете поместить небольшой шпатель соединения в 1 мл воды, чтобы проверить его растворимость в воде. Если растворимо, соединение растворяется после значительного перемешивания.
Если какое-то количество растворяется, а какое-то нет, то соединение является умеренно растворимым. Он также может быть нерастворимым, и в этом случае соединение вообще не растворяется.
Вот некоторые способы определения соли. Если вас интересуют различные применения и типы соли, вы можете прочитать наши статьи « Применение соли в промышленности » и « Кошерная соль: что особенного в кошерной соли?» Почему это называется кошерным? ”
6.
 Ситовой анализ
Ситовой анализИспользуя различные сита, соль можно определить по размеру гранул.
7. Анализ влажности
Запускается с взвешиванием соли при комнатной температуре. После этого соль будет нагрета до 140 градусов по Цельсию. Это приведет к полной потере влаги.
Вес нагретой соли будет измерен повторно. Разница между первым измерением и вторым измерением дает нам влажность, поэтому вы можете получить соотношение влаги в соли.
Свойства соли Как соль связывается вместе? Что такое соль в химии? Как можно определить соль? анализ соли
Переписывание учебников с щепоткой соли | Research
Два исследователя из России использовали вычислительную мощность, чтобы предсказать, как производные поваренной соли бросают вызов химическим принципам, подвергаясь колоссальному сжатию. В продолжение предыдущей работы по исследованию экзотического поведения хлоридов натрия при высоком давлении Габриэле Салех и Артем Оганов из Московского физико-технического института представили теоретическую модель, которую можно использовать для прогнозирования свойств и поведения субгалогенидов щелочных металлов в целом. Это привело к таким открытиям, как новые фазы Na 3 Cl и ионы хлорида в степени окисления -2.
В продолжение предыдущей работы по исследованию экзотического поведения хлоридов натрия при высоком давлении Габриэле Салех и Артем Оганов из Московского физико-технического института представили теоретическую модель, которую можно использовать для прогнозирования свойств и поведения субгалогенидов щелочных металлов в целом. Это привело к таким открытиям, как новые фазы Na 3 Cl и ионы хлорида в степени окисления -2.
Несоответствие между свойствами соединений при атмосферном и высоком давлении затрудняет прогнозирование их поведения.«Химия высокого давления непредсказуема, — объясняет Салех. «Большинство химических правил нарушается при высоком давлении». Как показано ранее, когда обычная поваренная соль (NaCl) подвергается экстремальному давлению, такие соединения, как NaCl 7 и Na 3 Cl, становятся более стабильными и, следовательно, образуются. Это нарушает наше базовое понимание химической стехиометрии, которая «запрещает» эти соединения.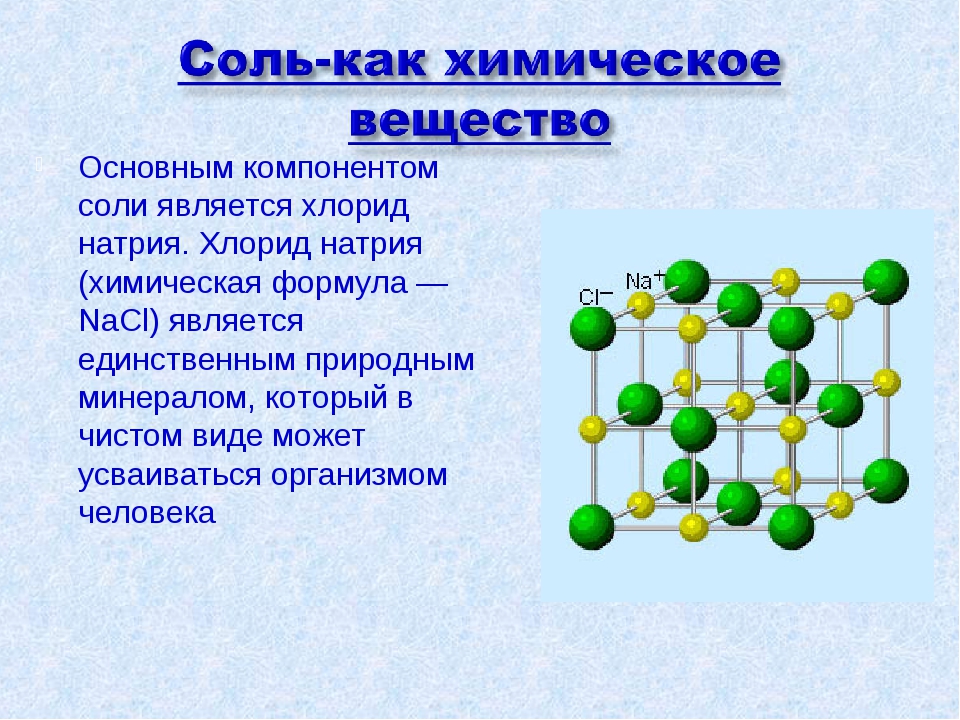
Используя групповой вычислительный алгоритм (USPEX), несколько соединений A 3 Y (A = Li, Na, K и Y = F, Cl и Br) были взяты и теоретически подвергнуты воздействию давления до 350 ГПа.В таких условиях это скопление может привести к новым соединениям, таким как Na 4 Cl 3 ; некоторые соединения, такие как K 3 Cl и K 3 Br, имеют другую структуру по сравнению с аналогичными соединениями натрия и лития из-за более энергетически доступных d-орбиталей. Возможно, одним из самых необычных наблюдений было увеличение координационного числа хлора с восьми до десяти. Эта причудливая и незарегистрированная степень окисления -2 связана с результирующей стабильностью упаковки атомов по сравнению с энергетическим штрафом за обременение атомов хлора дополнительными электронами.
Пол Макмиллан, химик твердого тела из Университетского колледжа Лондона, Великобритания, говорит, что результаты «выходят за рамки принципов валентности, установленных более 200 лет назад». «Наряду с аналогичными прогнозами, сделанными другими исследователями, включая Криса Пикарда [Кембриджский университет, Великобритания] и Янмин Ма [Университет Цзилинь, Китай], они открывают новое видение» связи под давлением. А Джулия Контрерас-Гарсия, химик-теоретик и химик высокого давления из Университета Пьера и Марии Кюри, Франция, отмечает, что работа демонстрирует, как «обычная химическая интуиция терпит неудачу, но подтверждаются более общие правила — металлические связи уменьшают свою размерность и высокие координация предпочтительнее, чтобы уменьшить громкость.
«Наряду с аналогичными прогнозами, сделанными другими исследователями, включая Криса Пикарда [Кембриджский университет, Великобритания] и Янмин Ма [Университет Цзилинь, Китай], они открывают новое видение» связи под давлением. А Джулия Контрерас-Гарсия, химик-теоретик и химик высокого давления из Университета Пьера и Марии Кюри, Франция, отмечает, что работа демонстрирует, как «обычная химическая интуиция терпит неудачу, но подтверждаются более общие правила — металлические связи уменьшают свою размерность и высокие координация предпочтительнее, чтобы уменьшить громкость.
Теперь задача состоит в том, чтобы распространить эти предсказания на другие материалы, присутствующие во Вселенной, а также обновить правила для учета соединений высокого давления. Оганов спокойно принимает этот вызов: «Нарушать классические правила — это очень весело». «Когда я впервые рассказал экспериментаторам о наших предсказаниях, они подумали, что мы сошли с ума». Однако обширные испытания их модели доказали обратное. «Теперь они не сомневаются ни в одном слове!»
«Теперь они не сомневаются ни в одном слове!»
Наименование солей — Получение солей — GCSE Chemistry (Single Science) Revision — Other
Соль – это любое соединение, образованное нейтрализацией кислоты основанием.
Название соли состоит из двух частей. Первая часть происходит из металла, оксида металла или карбоната металла. Вторая часть исходит от кислоты.
Вы всегда можете определить название соли, взглянув на реагенты:
- азотная кислота всегда дает соли, оканчивающиеся на нитрат и содержащие нитрат ион, NO 3-
- 0.0.0.1:0.1.0.$0.$1.$3.$1″> соляная кислота всегда дает соли которые оканчиваются на хлорид и содержат хлорид ион, Cl —
- серная кислота всегда дает соли, которые оканчиваются на сульфат и содержат сульфат ион, SO 4 2-
Например, если оксид калия реагирует с серной кислотой, продуктами будут сульфат калия и вода.
В таблице показаны некоторые другие примеры:
| Металл | Кислотные | Соль | ||
|---|---|---|---|---|
| натрия гидроксида | вступает в реакцию с | Hydro 28xfgxzhbze.0.0.0.1:0.1.0.$0.$1.$6.$2.$0.$2.$1″> хлорной кислота | , чтобы сделать | хлорид натрия |
| Медь оксида | вступает в реакцию с | Hydro хлорной кислота | , чтобы сделать | 28xfgxzhbze.0.0.0.1:0.1.0.$0.$1.$6.$2.$1.$4″> хлорид меди |
| натрия гидроксид | реагирует с | SULF Ученая кислота | , чтобы сделать | сульфат натрия 0.0.0.1:0.1.0.$0.$1.$6.$2.$2.$4.$0″>
|
| Zinc Оксид 5 | реагирует на | Sulf УЗИКИ УЗИКИСделать | Зинк Сульфат |
Обратите внимание, что аммиачные формы 0.0.0.1:0.1.0.$0.$1.$7.$1″> соли аммония при реакции с кислотами.Например, аммиак реагирует с соляной кислотой с образованием хлорида аммония .
Почему вода растворяет соль? | Глава 5: Молекула воды и растворение
Сделать модель кристалла соли.
Спроецируйте изображение Кристалл хлорида натрия.
Напомните учащимся, что зеленые шарики обозначают отрицательные ионы хлора, а серые – положительные ионы натрия.
Спросите студентов:
- Что такого в молекулах воды и ионах в соли, что может сделать воду способной растворять соль?
- Положительный и отрицательный полярные концы молекулы воды притягиваются к отрицательным ионам хлора и положительным ионам натрия в соли.
Раздайте каждому учащемуся лист с заданиями.

Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания.Разделы «Объясните это с помощью атомов и молекул» и «Возьми это» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Вопрос для расследования
Как соль растворяется в воде?
Материалы
- Лист активности с ионами натрия и хлорида и молекулами воды
- Плотная бумага любого цвета
- Ножницы
- Лента или клей
Процедура
Сделать модель кристалла соли
- Вырежьте ионы и молекулы воды.
- Расположите ионы на листе плотной бумаги так, чтобы они представляли собой двухмерный кристалл соли. Пока не приклеивайте эти кусочки.
Спроецируйте изображение и предложите учащимся смоделировать, что происходит, когда соль растворяется в воде.

Покажите учащимся серию из четырех рисунков, чтобы объяснить процесс растворения соли в воде.
Спроецируйте изображение Хлорид натрия, растворяющийся в воде.
Укажите, что несколько молекул воды могут расположиться рядом с ионом и помочь удалить его из кристалла. Покажите учащимся, что положительная часть молекулы воды будет притягиваться к отрицательному иону хлорида, а отрицательная часть молекулы воды будет притягиваться к положительному иону натрия.
Смоделируйте, как вода растворяет соль
Посмотрите на картинки, на которых показано, как молекулы воды растворяют соль.Затем расположите молекулы воды вокруг ионов натрия и хлорида в правильной ориентации. Положительная часть молекул воды должна находиться рядом с отрицательным ионом хлора. Отрицательная часть молекул воды должна находиться рядом с положительным ионом натрия.
- Переместите молекулы воды и ионы натрия и хлорида, чтобы смоделировать, как вода растворяет соль.

- Прикрепите молекулы и ионы к бумаге, чтобы изобразить соль, растворяющуюся в воде.
Спроектируйте анимацию «Растворение хлорида натрия в воде».
Укажите, что молекулы воды притягиваются к ионам натрия и хлорида кристалла соли. Объясните, что положительный участок молекулы воды притягивается к отрицательному иону хлора. Вода отрицательной области молекулы воды притягивается к положительному иону натрия. Растворение происходит, когда притяжение между молекулами воды и ионами натрия и хлорида превышает притяжение ионов друг к другу. Это заставляет ионы отделяться друг от друга и тщательно смешиваться с водой.
Расскажите учащимся, что количество вещества, которое может раствориться в жидкости (при определенной температуре), называется растворимостью. Укажите сходство слов растворяться и растворяться. Также скажите им, что растворенное вещество называется растворенным. Вещество, которое растворяет, называется растворителем.
Предложите учащимся провести эксперимент, чтобы выяснить, вода или изопропиловый спирт лучше растворяют соль.

Попросите учащихся сделать прогноз:
- Подумайте о полярности молекул воды и молекул спирта. Как вы думаете, спирт растворяет соль так же хорошо, лучше или хуже, чем вода?
Обсудите, как провести тест для сравнения того, как вода и спирт растворяют соль. Убедитесь, что учащиеся идентифицируют такие переменные, как:
- Количество использованной воды и спирта
- Количество соли, добавляемой к каждой жидкости
- Температура каждой жидкости
- Количество перемешивания
Вопрос для изучения
Является ли спирт таким же хорошим, лучшим или худшим растворителем соли, чем вода?
Материалы для каждой группы
- Вода
- Изопропиловый спирт (70% или выше)
- Соль
- Весы
- 2 прозрачных пластиковых стаканчика
- 2 маленьких пластиковых стаканчика
- Градуированный цилиндр
Процедура
- В отдельные чашки отмерьте два образца соли весом по 5 г каждый.
- Поместите по 15 мл воды и спирта в отдельные чашки.
Одновременно добавьте воду и спирт к образцам соли.
- Вращайте обе чашки одинаковым образом в течение примерно 20 секунд и проверьте количество растворенной соли.
- Покрутите еще 20 секунд и проверьте. Покрутите последние 20 секунд и проверьте.
- Осторожно слейте воду и спирт из чашек и сравните количество нерастворенной соли, оставшейся в каждой чашке.
Ожидаемые результаты
В чашке с водой будет меньше нерастворенной соли, чем спирта. Это означает, что в воде растворено больше соли, чем в спирте.
Обсудите, как различия в полярности спирта и воды объясняют, почему вода лучше растворяет соль, чем спирт.
Подробнее о полярности читайте в разделе истории учителя.
Спросите студентов:
- Спирт так же хорошо, лучше или хуже растворяет соль, чем вода?
- Спирт не растворяет соль так хорошо, как вода.
- Откуда ты знаешь?
- В чашке со спиртом осталось еще соли.
- Подумайте о полярности воды и спирта, чтобы объяснить, почему вода растворяет больше соли, чем спирт.
- Предложите учащимся посмотреть на модели молекул воды и спирта в листах с заданиями.
Напомните учащимся, что в изопропиловом спирте атом кислорода связан с атомом водорода, поэтому он имеет некоторую полярность, но не такую большую, как вода. Поскольку вода более полярна, чем спирт, она лучше притягивает положительные ионы натрия и отрицательные ионы хлорида, чем спирт. Вот почему вода растворяет больше солей, чем спирт. Другой способ сказать это состоит в том, что растворимость соли больше в воде, чем в спирте.
Предложите учащимся сравнить растворимость двух различных ионных веществ в воде.
Сравните растворимость ионных веществ карбоната кальция (CaCO 3 ) и карбоната натрия (Na 2 CO 3 ) в воде.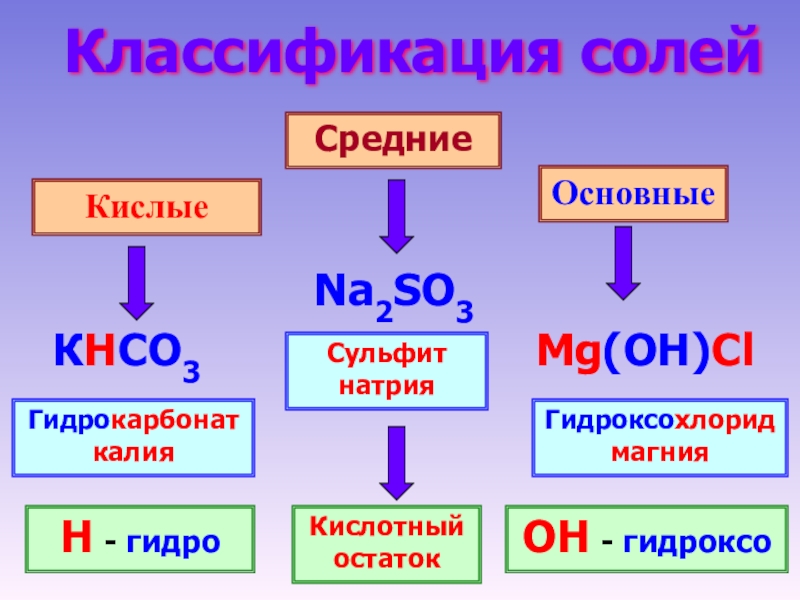
Спросите студентов:
- Как можно сравнить растворимость хлорида кальция и карбоната кальция?
- Учащиеся должны предложить отмерить равные количества каждого вещества и добавить равные количества воды при одинаковой температуре.
Вопрос для изучения
Все ли ионные вещества растворяются в воде?
Материалы для каждой группы
- Карбонат натрия
- Карбонат кальция
- Вода
- 2 прозрачных пластиковых стаканчика
- 2 маленьких пластиковых стаканчика
- Весы
Процедура
- Этикетируйте две прозрачные пластиковые чашки с карбонатом натрия и карбонатом кальция.
- Отмерьте по 2 г карбоната натрия и карбоната кальция и поместите их в соответствующие чашки.
- Отмерьте по 15 мл воды в каждую из двух пустых чашек.
Одновременно налейте воду в чашки с карбонатом натрия и карбонатом кальция.
- Аккуратно взболтайте обе чашки.

Ожидаемые результаты
Карбонат натрия растворится, а карбонат кальция — нет.Объясните, что не все твердые вещества, связанные ионными связями, растворяются в воде.
Обсудите наблюдения учащихся.
Спросите студентов:
- Все ли ионные вещества растворяются в воде? Откуда вы знаете?
- Поскольку карбонат кальция не растворяется в воде, учащиеся должны понимать, что не все ионные вещества растворяются в воде.
Объясните, что на молекулярном уровне ионы, из которых состоит карбонат кальция, так сильно притягиваются друг к другу, что притяжение молекул воды не может их разъединить.Это хорошо, потому что карбонат кальция — это материал, из которого сделаны морские раковины и птичьи яйца. Фосфат кальция — еще одно ионное твердое вещество, которое не растворяется в воде. Это также хорошо, потому что это материал, из которого сделаны кости и зубы.
Карбонат натрия полностью распадается на ионы, которые растворяются в воде, образуя раствор. Ионы натрия и карбоната не оседают на дно и не могут быть отфильтрованы из воды.
Ионы натрия и карбоната не оседают на дно и не могут быть отфильтрованы из воды.
Но карбонат кальция не распадается на ионы. Вместо этого он просто смешивается с водой. Если дать достаточно времени, карбонат кальция осядет на дно или его можно будет отфильтровать из воды. Карбонат натрия, растворенный в воде, является хорошим примером раствора, а нерастворенный карбонат кальция представляет собой смесь, а не раствор.
Примечание. Карбонат-ион отличается от одноатомных ионов, таких как натрий (Na + ) и хлорид (Cl — ), которые учащиеся видели до сих пор.Ион карбоната (CO 3 2− ) состоит из более чем одного атома. Эти типы ионов, называемые многоатомными ионами, состоят из группы ковалентно связанных атомов, которые действуют как единое целое. Обычно они приобретают или теряют один или несколько электронов и действуют как ион. Другим распространенным многоатомным ионом является ион сульфата (SO 4 2-).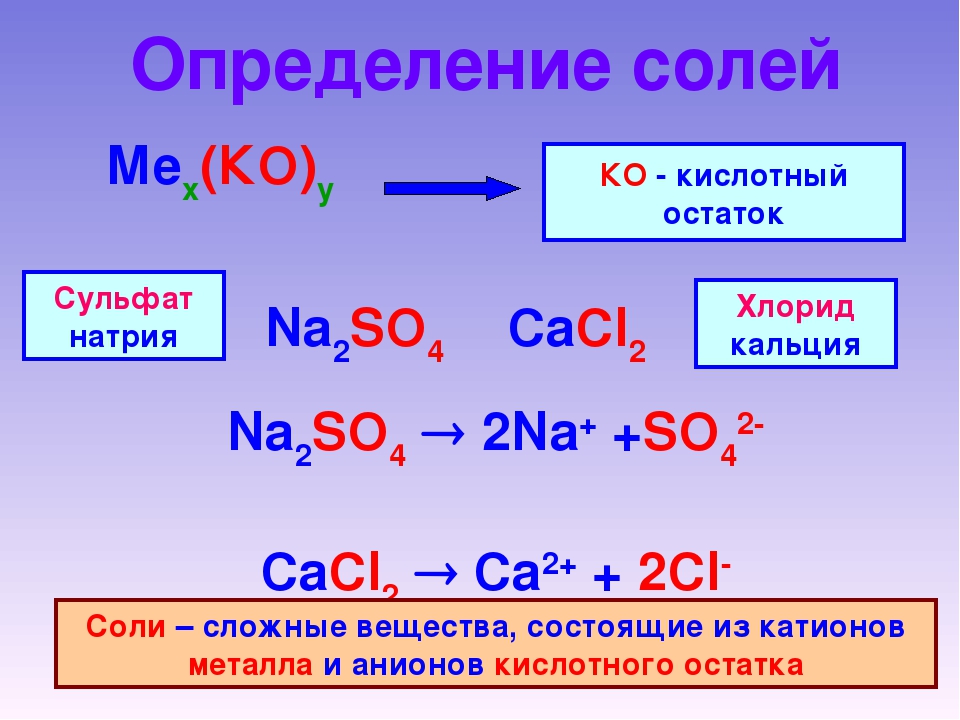 Этот ион входит в состав английской соли в виде сульфата магния (MgSO 4 ) и многих удобрений в виде сульфата калия (K 2 SO 4 ).Вы можете решить, хотите ли вы познакомить учащихся с этими двумя распространенными многоатомными ионами.
Этот ион входит в состав английской соли в виде сульфата магния (MgSO 4 ) и многих удобрений в виде сульфата калия (K 2 SO 4 ).Вы можете решить, хотите ли вы познакомить учащихся с этими двумя распространенными многоатомными ионами.
Безопасность при работе с солью – Информация о безопасности при использовании хлорида натрия
Информация и советы по безопасности при использовании хлорида натрия
Хлорид натрия — это химическое название соли или поваренной соли. Это белое кристаллическое минеральное вещество, которое используется в качестве приправы ко многим продуктам питания, а также во многих ситуациях на рабочем месте для самых разных целей.
Растворы хлорида натрия используются в медицине для лечения или предотвращения потери натрия, вызванной обезвоживанием, чрезмерным потоотделением или другими проблемами.Эти растворы используются для внутривенных (IV) инфузий и инъекций для промывания катетера. В виде солевого раствора хлорид натрия используется для очистки таких предметов, как контактные линзы.
В виде солевого раствора хлорид натрия используется для очистки таких предметов, как контактные линзы.
Меры предосторожности при работе с хлоридом натрия
Хотя хлорид натрия в настоящее время не считается опасным для здоровья, при работе с химическим веществом следует соблюдать следующие меры предосторожности, чтобы избежать любых потенциальных опасностей:
- Рабочая зона должна иметь достаточную вытяжную вентиляцию.Регулярно пылесосьте пыль, чтобы свести к минимуму возможность ее воздействия в воздухе.
- Избегайте контакта с глазами и надевайте защитные очки, если/когда возможен контакт с глазами.
- Избегать контакта с кожей и носить защитную одежду и перчатки.
Управление воздействием хлорида натрия
Хотя известно, что обычное обращение с хлоридом натрия не имеет каких-либо значительных последствий или опасностей для здоровья, в случае воздействия следует соблюдать следующие правила лабораторной практики:
1) Попадание в глаза
При необходимости снимите контактные линзы. Немедленно промойте большим количеством воды в течение не менее пяти минут. Обратитесь за медицинской помощью, если раздражение возникает и не проходит.
Немедленно промойте большим количеством воды в течение не менее пяти минут. Обратитесь за медицинской помощью, если раздражение возникает и не проходит.
2) Контакт с кожей
Снимите загрязненную одежду и промойте пораженный участок большим количеством воды с мылом. Обратитесь за медицинской помощью, если кожа становится раздраженной или появляется сыпь.
3) Вдыхание
Вынести пострадавшего из зоны воздействия и вывести на свежий воздух. Обратитесь за медицинской помощью, если у подвергшегося воздействию человека возникли трудности с дыханием.
4) Проглатывание
Не вызывать рвоту. Если человек в сознании, прополоскать рот большим количеством воды и дать выпить несколько стаканов воды. Обратитесь за медицинской помощью при появлении неблагоприятных симптомов.
Безопасное обращение с разливами хлорида натрия
В случае разлива хлорида натрия необходимо принять следующие меры:
- Пропылесосьте или подметите участок.
 Избегайте сухой уборки или других методов, при которых поднимается пыль.
Избегайте сухой уборки или других методов, при которых поднимается пыль. - Поместить в закрывающийся контейнер и промаркировать для утилизации.
- Очистите поверхность водой с моющим средством.
Надлежащее хранение хлорида натрия
Хлорид натрия следует хранить в прохладном, сухом, хорошо проветриваемом помещении в надежно закрытой таре. Обязательно держите это химическое вещество подальше от чрезмерного тепла.
Для получения дополнительной информации о хлориде натрия и других химических веществах выполните поиск в нашей базе данных паспортов безопасности материалов здесь.
Соль | Encyclopedia.com
СОЛЬ. Поскольку соль необходима для жизни, действует как пищевой консервант и обладает уникальным ароматом, люди были озабочены ею с самого начала письменной истории.Желание получить соль политическим или военным путем повлияло на историю стран Азии, Африки, Европы, Южной Америки и Ближнего Востока. Действительно, соль использовалась в качестве валюты и в некоторых древних обществах имела большую ценность, чем золото. Этому минералу приписывалось даже религиозное и магическое значение.
Действительно, соль использовалась в качестве валюты и в некоторых древних обществах имела большую ценность, чем золото. Этому минералу приписывалось даже религиозное и магическое значение.
В химии термин «соль» обычно относится к любому соединению, образующемуся в результате взаимодействия кислоты и основания. В области геологии и сельского хозяйства термин «соль» используется как синоним слова «минерал».Хотя многие соли необходимы для здоровья человека (например, хлорид калия, гидроксид натрия), в следующих параграфах термин «соль» будет относиться конкретно к неорганическому, белому кристаллическому веществу, известному как хлорид натрия (сокращенно NaCl). если не указано иное. Она также известна как поваренная соль, каменная соль, морская соль и физиологический раствор. Читатель должен знать, что некоторые параграфы ниже относятся к хлориду натрия, тогда как другие относятся к натрию, минералу/иону/электролиту.
Когда хлорид натрия попадает в организм, он почти полностью диссоциирует на составляющие его частицы, ионы натрия и хлорида.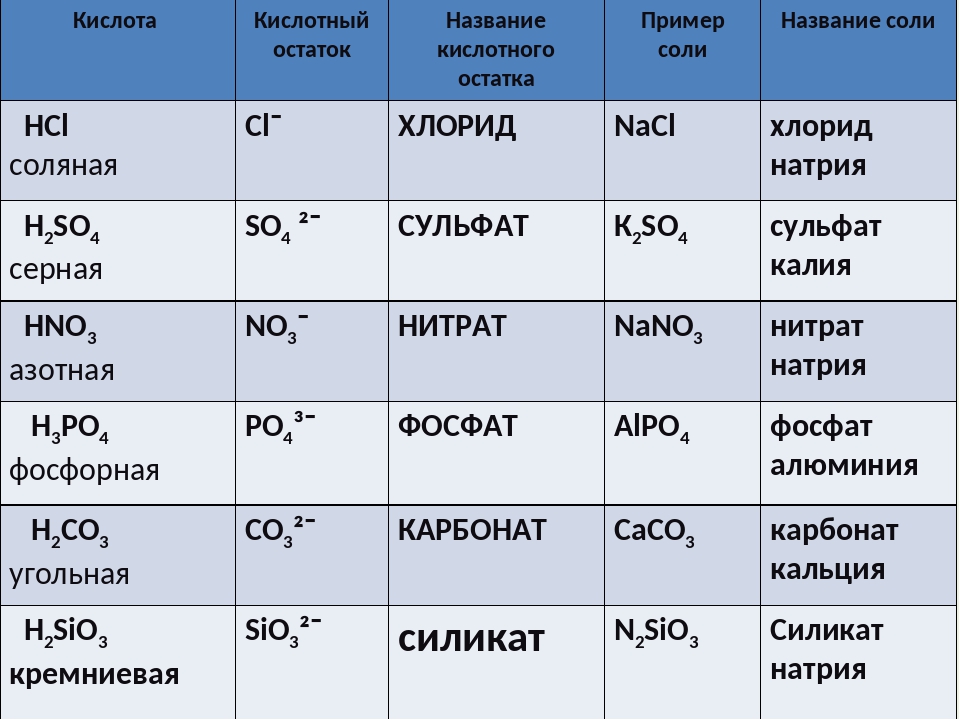 Хлорид натрия растворим в воде и глицерине. Натрий является наиболее распространенным ионом в крови. Как электрически заряженные частицы, положительно заряженный натрий (Na + ) и отрицательно заряженный хлорид (Cl — ) классифицируются как электролиты, потому что они проводят электричество при растворении в воде.
Хлорид натрия растворим в воде и глицерине. Натрий является наиболее распространенным ионом в крови. Как электрически заряженные частицы, положительно заряженный натрий (Na + ) и отрицательно заряженный хлорид (Cl — ) классифицируются как электролиты, потому что они проводят электричество при растворении в воде.
Пищевая соль
Натрий присутствует во многих продуктах, которые обычно потребляются в западной диете, включая переработанное мясо для сэндвичей, сыр, консервированные овощи, маринованные продукты, соленые закуски и безалкогольные напитки.Другие источники натрия не так хорошо известны: приправы, соусы, пищевая сода, разрыхлитель и хлеб. В ресторанной еде, блюдах быстрого питания и китайской кухне уровень натрия может быть очень высоким. Только около 10 процентов натрия в западных диетах связано с солью, добавляемой за столом.
Содержание натрия в растениях и овощах зависит от множества факторов. К ним относятся зрелость растений, генетика, методы ведения сельского хозяйства, засоленность почвы, плодородие почвы, pH почвы, скорость просачивания воды через почву, а также метеорологические факторы, такие как осадки, облачность и солнечный свет.
Сегодня для большинства американцев употребление в пищу консервированных и обработанных пищевых продуктов стало образом жизни. Хлорид натрия является наиболее распространенной пищевой добавкой. Приблизительно 75 процентов натрия в западных диетах поступает из обработанных пищевых продуктов. Поскольку соли всех видов, включая хлорид натрия, очень стабильны, практически невозможно удалить натрий из продуктов, консервированных в стеклянной или металлической таре. Фактически, добавление натрия может происходить как во время приготовления домашней еды, так и в коммерческих процессах.Например, возможно, что овощ содержит только 2 мг натрия на 100 г на лозе, но может содержать от 2 до 310 раз больше после консервирования. Такие процессы, как добавление солевого раствора для предотвращения обесцвечивания овощей (т. е. засаливания) или использование солей натрия в качестве технологических добавок, также приводят к добавлению натрия в конечный продукт.
Соль в пищевой промышленности
В конце девятнадцатого и начале двадцатого веков, до того, как появились современные методы обработки, консервирование пищевых продуктов состояло в основном из тепловой стерилизации, используемой в сочетании с добавлением соли и специй. Соль использовалась для подавления роста нежелательных бактерий. Сегодня натрий добавляют в обработанные пищевые продукты в нескольких формах. Нитрат натрия и нитрит натрия добавляют к мясу в качестве консервантов. Одноосновный цитрат натрия добавляется в качестве буферного агента pH. И фумарат натрия, и натриевая соль яблочной кислоты добавляются в пищу в качестве буферных агентов и усилителей вкуса. Эти соли используются вместе с многочисленными другими пищевыми добавками в Соединенных Штатах (например, антиоксидантами, стабилизаторами, красителями, подсластителями, ферментами и эмульгаторами) под руководством Министерства здравоохранения США.С. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов.
Соль использовалась для подавления роста нежелательных бактерий. Сегодня натрий добавляют в обработанные пищевые продукты в нескольких формах. Нитрат натрия и нитрит натрия добавляют к мясу в качестве консервантов. Одноосновный цитрат натрия добавляется в качестве буферного агента pH. И фумарат натрия, и натриевая соль яблочной кислоты добавляются в пищу в качестве буферных агентов и усилителей вкуса. Эти соли используются вместе с многочисленными другими пищевыми добавками в Соединенных Штатах (например, антиоксидантами, стабилизаторами, красителями, подсластителями, ферментами и эмульгаторами) под руководством Министерства здравоохранения США.С. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов.
Фергус Клайдсдейл, профессор Массачусетского университета в Амхерсте, объяснил в 1988 году, что потеря натрия во время обработки происходит исключительно из-за выщелачивания (то есть экстракции, промывки или фильтрации). Консервирование, варка, приготовление на пару, бланширование и варка — процессы, которые с наибольшей вероятностью вызывают выщелачивание натрия и других солей.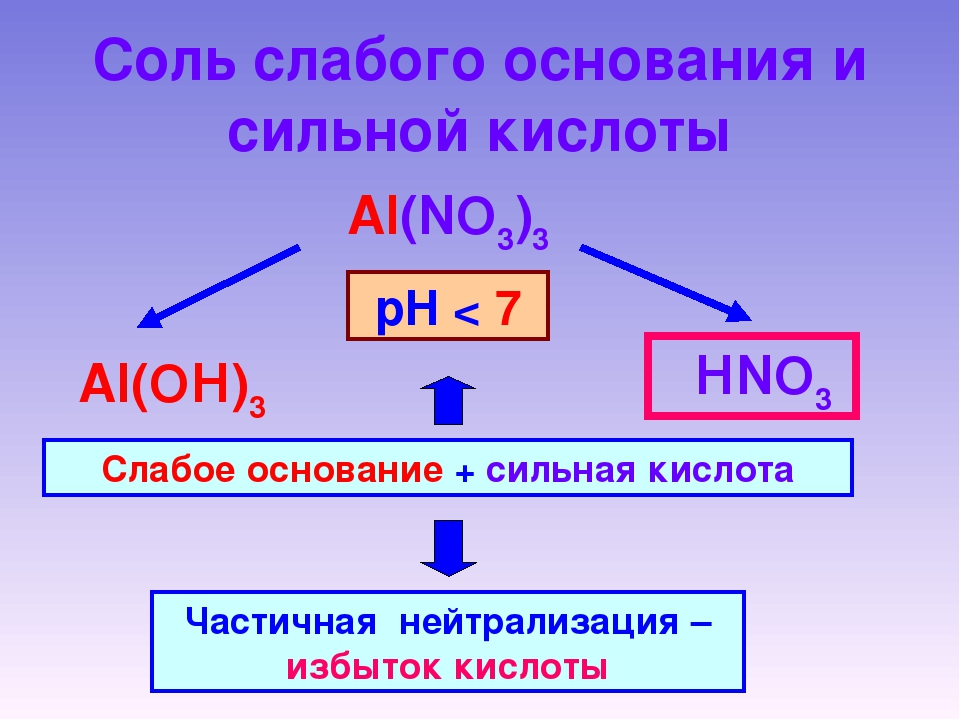 Однако степень потери этих электролитов зависит от пищевого продукта, типа обработки и свойств каждого иона.Количество воды, используемой в данном коммерческом процессе, также влияет на потери минералов. При приготовлении на пару, например, используется меньше воды, чем при кипячении. Кроме того, общее время обработки может повлиять на потери натрия из пищевых продуктов. Кратковременные процедуры, скорее всего, дадут меньше соли, чем длительные.
Однако степень потери этих электролитов зависит от пищевого продукта, типа обработки и свойств каждого иона.Количество воды, используемой в данном коммерческом процессе, также влияет на потери минералов. При приготовлении на пару, например, используется меньше воды, чем при кипячении. Кроме того, общее время обработки может повлиять на потери натрия из пищевых продуктов. Кратковременные процедуры, скорее всего, дадут меньше соли, чем длительные.
Различные другие соли (например, хлорид калия, хлорид магния, нитрат натрия, бензоат натрия и ацетат натрия) добавляются в пищевые продукты во время промышленной обработки. Они служат для консервирования мяса, придают или усиливают вкус многих продуктов, уменьшают комкование сухих продуктов, стабилизируют рН (то есть при использовании с джемами, желатинами, выпечкой, пастеризованным сыром), обогащают питательными веществами и улучшают текстуру.Нитрит натрия, например, вступает в реакцию с мясными пигментами, давая характерный розовый цвет. В хлебе и хлебобулочных изделиях соль выполняет множество функций, включая контроль скорости брожения в дрожжевых продуктах. Ферментированные овощи, такие как квашеная капуста, требуют соли для вкуса и для извлечения воды и других питательных веществ из растительной ткани с образованием рассола, в котором процветают желательные организмы и подавляются нежелательные. Плотность и цвет фруктов и овощей сохраняются кальциевой солью молочной кислоты.В сырных продуктах соль добавляют в творог или наносят на поверхность сыра для удаления сыворотки и замедления образования кислоты. Сорбиновая кислота и ее соли являются антимикробными агентами, подавляющими рост
бактерии; плесень в сыре, колбасах, фруктах, желе, хлебе и пирожных; и дрожжи в заправках для салатов, томатных продуктах, сиропах, конфетах и шоколадном сиропе.
В хлебе и хлебобулочных изделиях соль выполняет множество функций, включая контроль скорости брожения в дрожжевых продуктах. Ферментированные овощи, такие как квашеная капуста, требуют соли для вкуса и для извлечения воды и других питательных веществ из растительной ткани с образованием рассола, в котором процветают желательные организмы и подавляются нежелательные. Плотность и цвет фруктов и овощей сохраняются кальциевой солью молочной кислоты.В сырных продуктах соль добавляют в творог или наносят на поверхность сыра для удаления сыворотки и замедления образования кислоты. Сорбиновая кислота и ее соли являются антимикробными агентами, подавляющими рост
бактерии; плесень в сыре, колбасах, фруктах, желе, хлебе и пирожных; и дрожжи в заправках для салатов, томатных продуктах, сиропах, конфетах и шоколадном сиропе.
Биологические и физиологические аспекты
Различные минералы в организме человека служат для поддержания кислотно-щелочного баланса, объема крови и проницаемости клеточных мембран, а также обеспечивают составные части костей и зубов. Хлорид натрия важен для поддержания надлежащей концентрации жидкостей организма (то есть осмоляльности), ускорения движения жидкости между клетками, улучшения всасывания глюкозы и обеспечения надлежащего проведения импульсов по нервным и мышечным тканям.
Хлорид натрия важен для поддержания надлежащей концентрации жидкостей организма (то есть осмоляльности), ускорения движения жидкости между клетками, улучшения всасывания глюкозы и обеспечения надлежащего проведения импульсов по нервным и мышечным тканям.
Жидкости организма бывают внутриклеточными (т. е. существующими внутри мышц и органов) и внеклеточными (т. е. циркулирующей кровью и интерстициальной жидкостью, находящейся между клетками). Для выполнения своих функций ткани организма поддерживают внутриклеточные и внеклеточные ионы в различных концентрациях.Это требует значительной энергии, примерно одной трети всего метаболизма в состоянии покоя, и осуществляется молекулами, встроенными в клеточные мембраны по всему телу; эти большие белковые молекулы известны как насосы, потому что их действие вызывает неравномерное распределение иона внутри и снаружи мембраны. В крови концентрации некоторых ионов (например, калия и кальция) поддерживаются в узких пределах. Таблица 1 иллюстрирует эти концепции для натрия, хлорида, калия (K + ) и магния (Mg 2+ ). Хлорид является наиболее распространенным отрицательным ионом, который соединяется с натрием во внеклеточной жидкости. Натрий и хлорид составляют более 80% всех частиц внеклеточной жидкости. Калий, магний и фосфат являются наиболее распространенными внутриклеточными ионами. Калий ускоряет энергетический обмен и участвует в синтезе белков и запасной формы углеводов (то есть гликогена). Магний обеспечивает эффективное функционирование химических реакций и биохимических процессов в организме.Приблизительно 60 процентов магния организма содержится в скелете в сочетании с кальцием и фосфором; на самом деле, 99 процентов всего кальция содержится в костях и зубах. Остальной магний присутствует в эритроцитах и мышцах, поддерживая транспортировку и хранение кислорода.
Хлорид является наиболее распространенным отрицательным ионом, который соединяется с натрием во внеклеточной жидкости. Натрий и хлорид составляют более 80% всех частиц внеклеточной жидкости. Калий, магний и фосфат являются наиболее распространенными внутриклеточными ионами. Калий ускоряет энергетический обмен и участвует в синтезе белков и запасной формы углеводов (то есть гликогена). Магний обеспечивает эффективное функционирование химических реакций и биохимических процессов в организме.Приблизительно 60 процентов магния организма содержится в скелете в сочетании с кальцием и фосфором; на самом деле, 99 процентов всего кальция содержится в костях и зубах. Остальной магний присутствует в эритроцитах и мышцах, поддерживая транспортировку и хранение кислорода.
Концентрация ионов в поте и моче, которые являются основными путями потери, может заметно различаться у разных людей. Этот большой диапазон присутствует в поте и моче, потому что диета, активные физические упражнения, хронические физические тренировки и акклиматизация к теплу изменяют потерю этих ионов, особенно натрия и хлора, в потовых железах и почках.
Метаболизм натрия
Натрий настолько тесно связан с другими внутриклеточными ионами, внеклеточными ионами и водой, что трудно рассматривать факторы, которые независимо регулируют его метаболизм. Тем не менее, следующий текст ограничивается регулированием удержания и выведения натрия.
| Натрий, хлорид, калий и концентрации ионов магния (ммоль / л) в внутриклеточной жидкости и в четырех внеклеточных жидкости | ||||||
| натрий | | Калий + | | магния + | ||
| внутриклеточной жидкости | 8 | 150 | 31 | 10 | ||
| внеклеточной жидкости | ||||||
| Пот 15-53 | 4-8 2-5 | 15-70 | ||||
| мочи | 39-224 | 43-60 | 8-10 | 39-218 | ||
| 96-110 | 3 | 96-110 | 3-6 | 3-6 | 1–2 | 135–145 |
| Слюна | 11–45 | 11–23 | 0.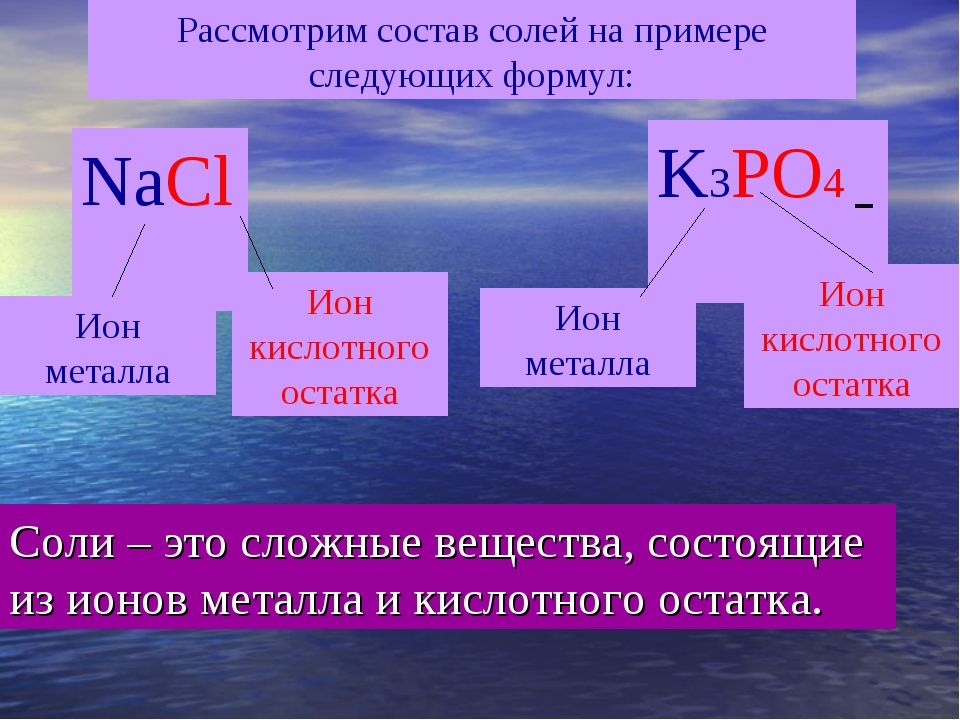 1–0,4 1–0,4 | 10–75 | ||
В состоянии покоя почки фильтруют циркулирующую кровь со скоростью от 1,0 до 1,5 л/мин, заставляя почки продуцировать около 180 л жидкости в течение 24-часового периода. Поскольку средний объем мочи у здоровых взрослых составляет 1,3 л/сут, почти весь почечный фильтрат реабсорбируется и возвращается в кровоток. Количество натрия, выделяемого с мочой, зависит от потребности организма в натрии. Если избыток натрия потребляется без воды, почки выделяют мочу с высокой концентрацией натрия.Если потребление натрия с пищей ограничено, почки способны вырабатывать разбавленную мочу, которая поддерживает концентрацию натрия в жидкостях организма на нормальном уровне.
Баланс натрия во всем организме поддерживается в широком диапазоне диетических и экологических условий, в первую очередь благодаря действию гормона альдостерона на почки. Когда содержание натрия в рационе высокое, содержание натрия в моче увеличивается, чтобы вывести его избыток. При низком уровне натрия в рационе альдостерон соответствующим образом снижает потерю натрия с мочой.Таким образом, дефицит натрия встречается редко, даже среди людей, придерживающихся диеты с очень низким содержанием натрия (см. ниже). Организм может испытывать дефицит натрия, когда потери с потом большие и постоянные, или когда болезнь (например, хроническая диарея, почечная болезнь) приводит к неадекватной задержке натрия почками. После значительных изменений уровня натрия в рационе также адаптируются концентрации следующих гормонов, предполагая, что они минимизируют нарушения баланса внеклеточной жидкости и ионов: ренина, ангиотензина II, предсердного натрийуретического пептида и оксида азота.Последнее соединение играет ключевую роль в поддержании кровяного давления, регулируя экскрецию натрия и воды в почках. Несмотря на наши знания об этих фактах, ученые не могут объяснить точный механизм, с помощью которого мозг оценивает уровень натрия в организме.
При низком уровне натрия в рационе альдостерон соответствующим образом снижает потерю натрия с мочой.Таким образом, дефицит натрия встречается редко, даже среди людей, придерживающихся диеты с очень низким содержанием натрия (см. ниже). Организм может испытывать дефицит натрия, когда потери с потом большие и постоянные, или когда болезнь (например, хроническая диарея, почечная болезнь) приводит к неадекватной задержке натрия почками. После значительных изменений уровня натрия в рационе также адаптируются концентрации следующих гормонов, предполагая, что они минимизируют нарушения баланса внеклеточной жидкости и ионов: ренина, ангиотензина II, предсердного натрийуретического пептида и оксида азота.Последнее соединение играет ключевую роль в поддержании кровяного давления, регулируя экскрецию натрия и воды в почках. Несмотря на наши знания об этих фактах, ученые не могут объяснить точный механизм, с помощью которого мозг оценивает уровень натрия в организме.
Предсказуемая последовательность событий возникает, когда нормальный человек ограничивает потребление натрия (например, 230 мг в день).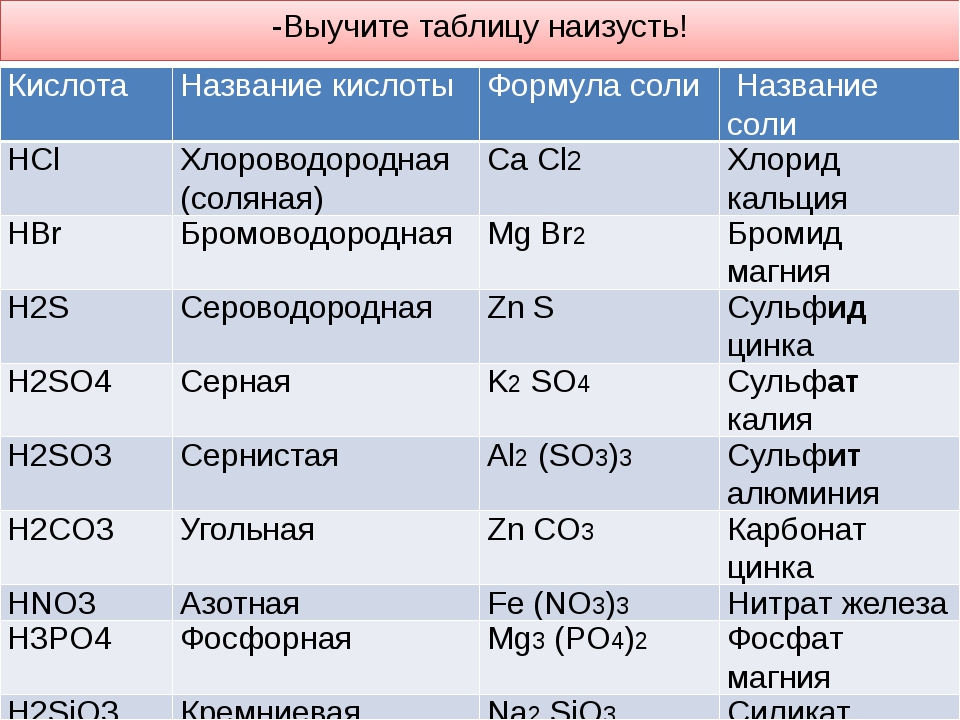 В первые дни ограничения соли уровень натрия в моче постепенно снижается примерно до пятого дня, когда 24-часовые потери становятся небольшими (например, 115 мг или менее).Этот человек обычно теряет 1 или 2 кг массы тела, что связано с потерей натрия и соответствующего объема воды. Изначально,
редуцированная вода тела поступает почти исключительно из внеклеточной жидкости; с течением времени объем внутриклеточной жидкости также сокращается. В течение следующих нескольких дней концентрация натрия в моче остается низкой, и организм продолжает максимизировать сохранение соли до тех пор, пока не установится сниженный баланс натрия во всем организме. Уровни натрия в поте снижаются так же, как и в моче во время диетических ограничений; оба связаны с действием гормона альдостерона.
В первые дни ограничения соли уровень натрия в моче постепенно снижается примерно до пятого дня, когда 24-часовые потери становятся небольшими (например, 115 мг или менее).Этот человек обычно теряет 1 или 2 кг массы тела, что связано с потерей натрия и соответствующего объема воды. Изначально,
редуцированная вода тела поступает почти исключительно из внеклеточной жидкости; с течением времени объем внутриклеточной жидкости также сокращается. В течение следующих нескольких дней концентрация натрия в моче остается низкой, и организм продолжает максимизировать сохранение соли до тех пор, пока не установится сниженный баланс натрия во всем организме. Уровни натрия в поте снижаются так же, как и в моче во время диетических ограничений; оба связаны с действием гормона альдостерона.
Токсичность
Как и практически все питательные вещества и соединения, соль может быть вредной или даже смертельной в больших количествах. Прямой контакт с хлоридом натрия может вызвать раздражение кожи, а при нагревании до высоких температур выделяется пар, раздражающий глаза. При нагревании до разложения выделяет токсичные пары хлорида и двуокиси натрия (Na 2 O). При употреблении в больших количествах хлорид натрия может вызвать раздражение желудка. Кроме того, лабораторные эксперименты показали следующие дозозависимые эффекты: 50 мг/24 ч, раздражение кожи у кроликов; 100 мг/24 ч, умеренное раздражение глаз у кроликов; 125 мл/л — ингибирование синтеза ДНК в изолированных клетках человека; 27 мг/кг массы тела, аборт человеческого плода; и 3000 мг/кг массы тела, смертельная пероральная доза для 50 процентов тестируемых животных.Хлорид калия вызывает физиологические реакции в следующих дозах: 500 мг/24 ч, легкое раздражение глаз у кроликов; 125 г/л — гибель клеток легких у хомяков; 2600 мг/кг массы тела, смертельная пероральная доза для 50 процентов тестируемых животных. Хлористый кальций является летальным для 50% животных, испытанных в дозе 1000 мг/кг массы тела при пероральном введении и в дозе 264 мг/кг массы тела внутрибрюшинно. Исследования показали, что хлорид магния является смертельным для 50 процентов крыс, испытанных при пероральной дозе 2800 мг/кг массы тела.
При нагревании до разложения выделяет токсичные пары хлорида и двуокиси натрия (Na 2 O). При употреблении в больших количествах хлорид натрия может вызвать раздражение желудка. Кроме того, лабораторные эксперименты показали следующие дозозависимые эффекты: 50 мг/24 ч, раздражение кожи у кроликов; 100 мг/24 ч, умеренное раздражение глаз у кроликов; 125 мл/л — ингибирование синтеза ДНК в изолированных клетках человека; 27 мг/кг массы тела, аборт человеческого плода; и 3000 мг/кг массы тела, смертельная пероральная доза для 50 процентов тестируемых животных.Хлорид калия вызывает физиологические реакции в следующих дозах: 500 мг/24 ч, легкое раздражение глаз у кроликов; 125 г/л — гибель клеток легких у хомяков; 2600 мг/кг массы тела, смертельная пероральная доза для 50 процентов тестируемых животных. Хлористый кальций является летальным для 50% животных, испытанных в дозе 1000 мг/кг массы тела при пероральном введении и в дозе 264 мг/кг массы тела внутрибрюшинно. Исследования показали, что хлорид магния является смертельным для 50 процентов крыс, испытанных при пероральной дозе 2800 мг/кг массы тела.
Консерванты, известные как сульфиты (см. Натрий и гипертония ниже), могут вызывать вредные побочные эффекты при употреблении в больших количествах. Исследования с участием лабораторных животных показали, что сульфиты могут ингибировать некоторые биохимические реакции организма и замедлять рост всего тела у младенцев; вызвать желудочно-кишечные расстройства; и вызывают обратимую анемию, дефицит питательных веществ (например, тиамина) и генные мутации. Смертельная пероральная доза бисульфита натрия (50% подопытных животных) составила 498 мг/кг массы тела у крыс и 300 мг/кг массы тела у мышей.
Глутамат натрия (MSG) добавляется в пищу поварами для усиления различных вкусов. Этот эффект больше всего проявляется в мясных и овощных супах, соусах, подливках и смесях специй. Уровни глутамата натрия в пищевых продуктах колеблются от примерно 0,3 процента в шпинате и помидорах до примерно 10 процентов в сыре пармезан и 20 процентов в обезвоженных суповых смесях. Некоторые потребители также добавляют дополнительный глутамат натрия в пищу в виде соусов. На это могут сильно влиять культурные предпочтения в еде. В Корее и на Тайване, например, средний взрослый потребляет в шесть-десять раз больше глутамата натрия каждый день, чем средний человек в Соединенных Штатах.Поскольку натрий является частью молекулярной структуры глутамата натрия, он становится доступным в виде свободного, метаболически активного натрия. Таким образом, люди, которые придерживаются диеты с ограниченным содержанием натрия (см. Натрий и гипертония ниже), должны контролировать как естественный уровень глутамата натрия в продуктах, так и количество, которое намеренно добавляется. Глутамат натрия также вызывает нежелательные побочные эффекты у некоторых людей, включая жар, покалывание, стеснение, головную боль, отек печени и ощущение давления в верхней части тела или на лице.Это явление часто связано с употреблением китайской еды из-за высокого содержания в ней глутамата натрия. Токсичность глутамата натрия широко изучалась, и она относительно низка по сравнению с другими солями.
На это могут сильно влиять культурные предпочтения в еде. В Корее и на Тайване, например, средний взрослый потребляет в шесть-десять раз больше глутамата натрия каждый день, чем средний человек в Соединенных Штатах.Поскольку натрий является частью молекулярной структуры глутамата натрия, он становится доступным в виде свободного, метаболически активного натрия. Таким образом, люди, которые придерживаются диеты с ограниченным содержанием натрия (см. Натрий и гипертония ниже), должны контролировать как естественный уровень глутамата натрия в продуктах, так и количество, которое намеренно добавляется. Глутамат натрия также вызывает нежелательные побочные эффекты у некоторых людей, включая жар, покалывание, стеснение, головную боль, отек печени и ощущение давления в верхней части тела или на лице.Это явление часто связано с употреблением китайской еды из-за высокого содержания в ней глутамата натрия. Токсичность глутамата натрия широко изучалась, и она относительно низка по сравнению с другими солями. Было подсчитано, например, что средний взрослый человек весом 70 кг должен был бы потреблять более 3 фунтов глутамата натрия за один раз, чтобы испытать токсический эффект. Однако это не означает, что вредных последствий не существует. Большое количество глутамата натрия было связано с судорогами, рвотой и повреждением нервных клеток у исследовательских животных, хотя существуют большие различия между видами.Исследования показали, что глутамат натрия является смертельным для 50 процентов протестированных крыс при пероральном употреблении в дозе 17 300 мг/кг массы тела. Таким образом, при употреблении в обычных количествах глутамат натрия не вызывает болезни или токсичности. Поскольку объем этой статьи не позволяет подробно рассматривать токсичность других солей, читатель может обратиться к книге «Токсикология пищевых добавок » для получения дополнительной информации.
Было подсчитано, например, что средний взрослый человек весом 70 кг должен был бы потреблять более 3 фунтов глутамата натрия за один раз, чтобы испытать токсический эффект. Однако это не означает, что вредных последствий не существует. Большое количество глутамата натрия было связано с судорогами, рвотой и повреждением нервных клеток у исследовательских животных, хотя существуют большие различия между видами.Исследования показали, что глутамат натрия является смертельным для 50 процентов протестированных крыс при пероральном употреблении в дозе 17 300 мг/кг массы тела. Таким образом, при употреблении в обычных количествах глутамат натрия не вызывает болезни или токсичности. Поскольку объем этой статьи не позволяет подробно рассматривать токсичность других солей, читатель может обратиться к книге «Токсикология пищевых добавок » для получения дополнительной информации.
Натрий и гипертония
Поскольку почки регулируют объем циркулирующей крови, они тесно связаны с возникновением высокого кровяного давления (то есть гипертонии). Это заболевание часто связано с избыточной задержкой внеклеточной жидкости, особенно в кровотоке. По неизвестным причинам сопротивление току крови через почки увеличивается в 2-4 раза. И, к сожалению, хотя кровяное давление можно снизить с помощью рецептурных препаратов, почки не выделяют нормальное количество соли и воды с мочой. Этот скудный выход мочи вызывает задержку воды и натрия до тех пор, пока артериальное давление снова не поднимется до повышенного уровня. Лечение этой задержки жидкости и электролитов часто включает диуретики, которые заметно увеличивают ежечасные потери воды и солей с мочой.Учитывая эти факты, возникла многоэтапная научная гипотеза. Эта концепция предполагает, что высокое потребление натрия с пищей (1) перегружает способность почек выводить натрий и приводит к задержке жидкости, (2) увеличивает секрецию эндокринных желез (то есть натрийуретического гормона), (3) ингибирует функцию клеточных мембран, ( 4) увеличивает концентрацию натрия внутри клеток и уровень кальция в гладких мышцах, окружающих кровеносные сосуды, что (5) впоследствии увеличивает сопротивление кровотоку и кровяное давление.
Это заболевание часто связано с избыточной задержкой внеклеточной жидкости, особенно в кровотоке. По неизвестным причинам сопротивление току крови через почки увеличивается в 2-4 раза. И, к сожалению, хотя кровяное давление можно снизить с помощью рецептурных препаратов, почки не выделяют нормальное количество соли и воды с мочой. Этот скудный выход мочи вызывает задержку воды и натрия до тех пор, пока артериальное давление снова не поднимется до повышенного уровня. Лечение этой задержки жидкости и электролитов часто включает диуретики, которые заметно увеличивают ежечасные потери воды и солей с мочой.Учитывая эти факты, возникла многоэтапная научная гипотеза. Эта концепция предполагает, что высокое потребление натрия с пищей (1) перегружает способность почек выводить натрий и приводит к задержке жидкости, (2) увеличивает секрецию эндокринных желез (то есть натрийуретического гормона), (3) ингибирует функцию клеточных мембран, ( 4) увеличивает концентрацию натрия внутри клеток и уровень кальция в гладких мышцах, окружающих кровеносные сосуды, что (5) впоследствии увеличивает сопротивление кровотоку и кровяное давление.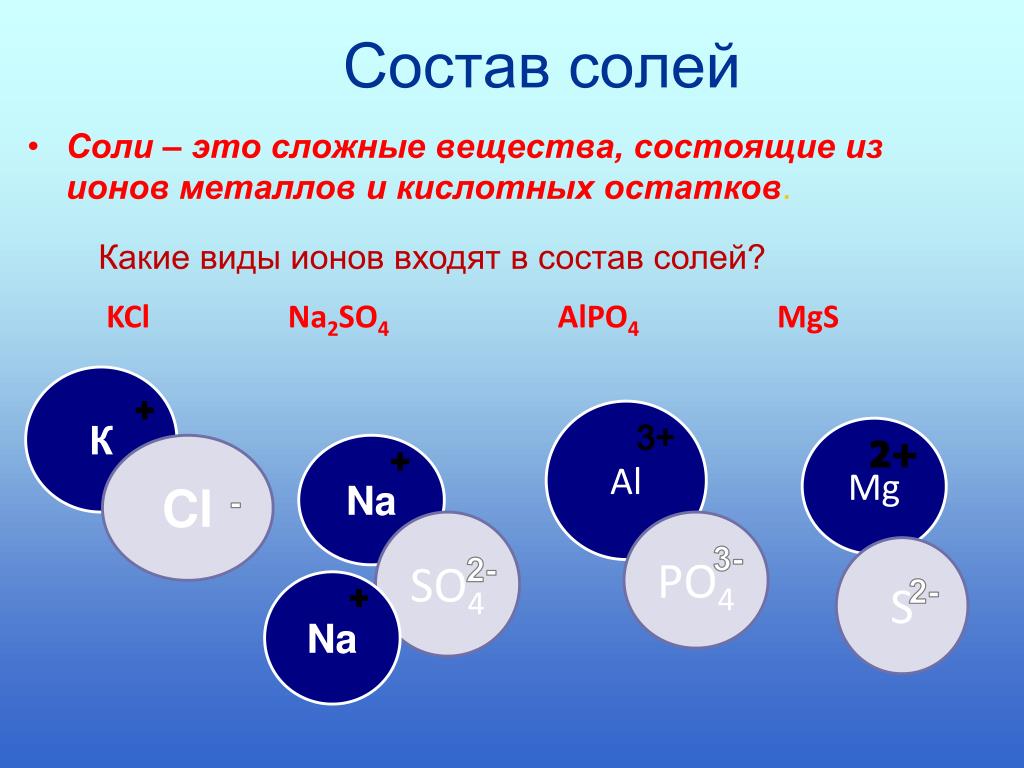 Интересно, что некоторые исследования показывают, что гипертония может зависеть от сосуществования натрия и хлорида в рационе. Потребление хлористых солей (например,
хлорид калия и хлорид кальция) связан с гипертонией так же, как и натрий.
Интересно, что некоторые исследования показывают, что гипертония может зависеть от сосуществования натрия и хлорида в рационе. Потребление хлористых солей (например,
хлорид калия и хлорид кальция) связан с гипертонией так же, как и натрий.
Сорок три миллиона американцев живут с постоянно высоким кровяным давлением, определяемым как показания 140/90 мм рт. ст. или выше; это составляет 24 процента взрослого населения Соединенных Штатов. Это делает его одним из самых распространенных сегодня заболеваний.Высокое кровяное давление увеличивает риск инсульта, сердечных заболеваний и почечной недостаточности. Люди с семейной историей гипертонии, пожилые люди, мужчины среднего возраста и чернокожие женщины среднего возраста подвергаются наибольшему риску. Тем не менее, все уязвимы, потому что артериальное давление обычно повышается с возрастом.
Важно признать, что наследственность играет решающую роль в гипертонии и что на это сложное заболевание влияет множество различных генов. Современная мудрость гласит, что без этих генов у человека не разовьется высокое кровяное давление.Такие люди, у которых артериальное давление повышается при увеличении потребления натрия, чувствительны к соли. Это объясняет, почему существуют большие различия в реакциях человека на хлорид натрия.
Современная мудрость гласит, что без этих генов у человека не разовьется высокое кровяное давление.Такие люди, у которых артериальное давление повышается при увеличении потребления натрия, чувствительны к соли. Это объясняет, почему существуют большие различия в реакциях человека на хлорид натрия.
Несколько факторов играют роль в снижении высокого кровяного давления. Например, у взрослых с гипертонией одно занятие аэробикой (45 минут) снижает артериальное давление на 12–24 часа. Здоровая диета (с высоким содержанием фруктов, овощей, нежирных молочных продуктов, с низким содержанием насыщенных и общих жиров) также снижает артериальное давление.Но наибольшее внимание уделялось соли. Существует большое количество доказательств и консенсус в научном сообществе о том, что диетический хлорид натрия является фактором риска высокого кровяного давления, независимо от других факторов риска, таких как алкоголь и ожирение. В течение последних 25 лет многочисленные профессиональные организации и группы по защите интересов поддерживали сокращение содержания натрия в пищевых продуктах промышленного производства, в том числе Американская академия педиатрии, Американский колледж кардиологии, Центр исследований пищевых продуктов, Американский колледж профилактической медицины, Американский фонд здравоохранения, Национальный Альянс пожилых людей и Национальная городская коалиция.
В странах с низким содержанием натрия в рационе высокое кровяное давление встречается редко. Согласно клиническим исследованиям, когда взрослые гипертоники снижают потребление соли, их кровяное давление обычно снижается, хотя и не всегда до нормального уровня. Дополнительные данные свидетельствуют о том, что диета с высоким содержанием соли усугубляет другие заболевания, включая астму, рак желудка, камни в почках и остеопороз. Таким образом, употребление диеты с низким содержанием соли для многих людей снизит риск развития или обострения хронического заболевания, такого как сердечно-сосудистый инсульт.
Лица, находящиеся на диете с ограничением натрия, часто употребляют другие соли вместо хлорида натрия. Это увеличивает ежедневное потребление калия, потому что заменители соли обычно содержат высокий процент хлорида калия. Эта диетическая стратегия предлагает потенциальную пользу для здоровья в виде снижения артериального давления и снижения риска инсульта. Однако для некоторых людей использование заменителя соли, содержащего калий, может вызвать болезнь или смерть. Людям с заболеваниями, принимающим лекарства и пожилым людям следует сообщить, что эти заменители соли следует использовать только для улучшения вкуса, а не для приготовления пищи.Сульфиты также следует учитывать. Эти соединения сохраняют пищу, замедляя порчу, прогорклость или обесцвечивание, и поэтому относятся к категории антиоксидантов. По крайней мере три сульфита обычно используются в качестве пищевых добавок: сульфит натрия (Na 2 SO 3 ), метабисульфит натрия (Na 2 S 2 O 5 ) и бисульфит натрия (NaHSO 3 ) . Поскольку эти консерванты содержат натрий, который становится свободным и метаболически активным в клетках, каждый из них вносит свой вклад в общую натриевую нагрузку рациона.
Людям с заболеваниями, принимающим лекарства и пожилым людям следует сообщить, что эти заменители соли следует использовать только для улучшения вкуса, а не для приготовления пищи.Сульфиты также следует учитывать. Эти соединения сохраняют пищу, замедляя порчу, прогорклость или обесцвечивание, и поэтому относятся к категории антиоксидантов. По крайней мере три сульфита обычно используются в качестве пищевых добавок: сульфит натрия (Na 2 SO 3 ), метабисульфит натрия (Na 2 S 2 O 5 ) и бисульфит натрия (NaHSO 3 ) . Поскольку эти консерванты содержат натрий, который становится свободным и метаболически активным в клетках, каждый из них вносит свой вклад в общую натриевую нагрузку рациона.
К сожалению, снижение содержания соли в пищевых продуктах для ограничения потребления натрия влияет на качество и свойства пищевых продуктов. Например, в мясоперерабатывающей промышленности снижение содержания хлорида натрия приводит к ухудшению сцепления мяса и удерживанию воды, а также к сокращению срока годности. Эти и другие нежелательные эффекты объясняют, почему производители пищевых продуктов обычно добровольно не снижают уровень хлорида натрия в своих продуктах.
Эти и другие нежелательные эффекты объясняют, почему производители пищевых продуктов обычно добровольно не снижают уровень хлорида натрия в своих продуктах.
Управление потреблением натрия с пищей
По сравнению со средним суточным потреблением в США, которое составляет от 2300 до 6900 мг/сутки,
физиологическая потребность в натрии (от 40 до 300 мг/день) и потребление, необходимое для хорошего здоровья (500 мг/день), очень малы.Фактически, количество натрия только в свежих овощах может быть достаточным для удовлетворения основных потребностей взрослого человека. Восемь простых процедур делают сокращение потребления соли эффективным. Во-первых, готовьте с небольшим количеством добавленной соли. Во-вторых, добавляйте мало соли или вообще не добавляйте ее в пищу за обеденным столом. В-третьих, ограничьте потребление соленых продуктов, таких как картофельные чипсы, соленые орехи, крендели с солью, попкорн, соевый соус, соус для стейков, чесночный соус, маринованные продукты и вяленое мясо. В-четвертых, попросите шеф-повара исключить соль из ваших блюд в ресторане.В-пятых, узнавайте о продуктах, содержащих большое количество натрия, и ищите продукты с низким содержанием натрия при покупке крекеров, соуса для макарон, консервированных овощей, хлеба и других коммерческих продуктов. В-шестых, развивайте вкус несоленого вкуса пищи. Вкусовые предпочтения в отношении соленой пищи можно изменить, проявив терпение. В-седьмых, оцените свой рацион, внимательно прочитав этикетки на продуктах, чтобы определить содержание натрия. Это может быть особенно полезно в проходах супермаркета, потому что вы не можете есть то, что не покупаете.В-восьмых, составьте в уме список продуктов, которых вы будете избегать, потому что они содержат слишком много натрия. Вот несколько примеров, представленных в единицах миллиграммов на 100 г пищи: жареный хрустящий бекон, 2400; пищевая сода, 9000; говяжий бульонный кубик, 24 000; болонья, 1300; сельдерейная соль, 28 000; вяленая ветчина, 1100; маринованный укроп, 1400; сосиски, 1100; свинина соленая, 1800; зеленые маринованные оливки, 2400; и плавленый сыр, 1500.
В-четвертых, попросите шеф-повара исключить соль из ваших блюд в ресторане.В-пятых, узнавайте о продуктах, содержащих большое количество натрия, и ищите продукты с низким содержанием натрия при покупке крекеров, соуса для макарон, консервированных овощей, хлеба и других коммерческих продуктов. В-шестых, развивайте вкус несоленого вкуса пищи. Вкусовые предпочтения в отношении соленой пищи можно изменить, проявив терпение. В-седьмых, оцените свой рацион, внимательно прочитав этикетки на продуктах, чтобы определить содержание натрия. Это может быть особенно полезно в проходах супермаркета, потому что вы не можете есть то, что не покупаете.В-восьмых, составьте в уме список продуктов, которых вы будете избегать, потому что они содержат слишком много натрия. Вот несколько примеров, представленных в единицах миллиграммов на 100 г пищи: жареный хрустящий бекон, 2400; пищевая сода, 9000; говяжий бульонный кубик, 24 000; болонья, 1300; сельдерейная соль, 28 000; вяленая ветчина, 1100; маринованный укроп, 1400; сосиски, 1100; свинина соленая, 1800; зеленые маринованные оливки, 2400; и плавленый сыр, 1500.
Тщательный выбор продуктов с низким содержанием натрия также окажется полезным.В таблице 2 представлено сравнение содержания натрия в нескольких овощах в свежем и консервированном виде. Очевидно, что люди, желающие снизить общее содержание натрия в рационе, должны по возможности заменять консервированные овощи свежими. Исключением из этой рекомендации являются овощи, которые теряют натрий во время обработки из-за выщелачивания. Это обеспечивает дополнительное преимущество, гарантируя, что другие пищевые питательные вещества не будут потеряны во время коммерческой упаковки (то есть, выщелачивания, кипячения, бланширования).
Еще один отличный способ снизить потребление натрия — изменить методы приготовления пищи в домашних условиях. Многие специи, травы и другие ароматизаторы не содержат значительного количества натрия, но их можно использовать для улучшения вкуса блюд с низким содержанием натрия. К ним относятся душистый перец, базилик, лавровый лист, зеленый лук, корица, гвоздика, карри, укроп, чеснок, имбирь, лук-порей, лимонный сок, мята, горчица, мускатный орех, экстракт апельсина, орегано, паприка, петрушка, перец, мята перечная, душистый перец, мак.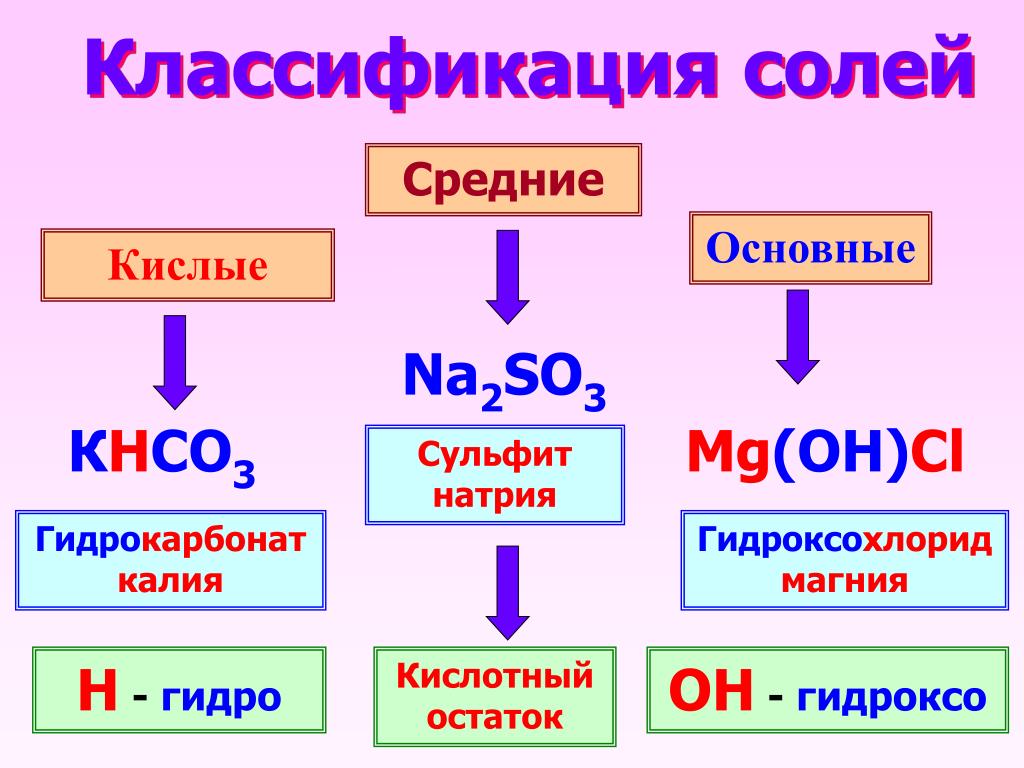 семена, сахарин, шафран, шалфей, кунжут, коричневый и белый сахар, эстрагон, экстракт ванили и вино.
семена, сахарин, шафран, шалфей, кунжут, коричневый и белый сахар, эстрагон, экстракт ванили и вино.
При определении количества натрия, потребляемого человеком, часто не учитывают подземные воды. Однако содержание натрия в государственных и частных водоносных горизонтах в Соединенных Штатах сильно варьируется от одного места к другому. Хотя большинство источников воды содержат менее 20 мг натрия на литр, что является незначительным входом в суточную норму натрия, некоторые районы Аризоны, Техаса и Иллинойса сообщают о 325 to
| Содержание натрия (миллиграммы на чашку) в овощах: Свежий по сравнению с консервированной | ||
| Свежий, сырые | Консервированные | |
| спаржи | 4 | 285 |
| Свекла | 57 | 36 |
| Морковь | 31 | 280 |
| Зеленые бобы | 8 | 536 |
| Зеленый горошек | 2 | 236 |
| Лима бобы | 1 | 310 |
| Сладкий картофель | 24 | 48 |
| Помидоры | 2 | 18 | Томатный сок | 2 | 230 |
432 мг натрия на литр грунтовых вод. Учитывая тот факт, что средний взрослый человек потребляет более 2 л жидкости каждый день, это может означать, что некоторые американцы получают более 1 г натрия в день только из водопроводной воды. Если для снижения жесткости местной воды используется умягчитель воды (например, удаление минерального карбоната кальция), содержание натрия может увеличиться.
Учитывая тот факт, что средний взрослый человек потребляет более 2 л жидкости каждый день, это может означать, что некоторые американцы получают более 1 г натрия в день только из водопроводной воды. Если для снижения жесткости местной воды используется умягчитель воды (например, удаление минерального карбоната кальция), содержание натрия может увеличиться.
Лица, соблюдающие диету с низким содержанием соли, также должны быть обеспокоены адекватностью других питательных веществ. Было подсчитано, что в 40 процентах всех диет с низким содержанием натрия отсутствуют другие необходимые питательные вещества, особенно белок, витамины группы В, рибофлавин и кальций.Эти недостатки возникают в результате удаления продуктов питания, содержащих натрий.
Ограничение соли и дефицит натрия
Как отмечалось выше, базовая физиологическая потребность в натрии составляет от 40 до 300 мг/день, а количество, рекомендуемое для хорошего здоровья, составляет 500 мг/день. Полевые исследования, проведенные между 1931 и 1962 годами, подтвердили, что взрослые могут придерживаться диеты с низким содержанием натрия и оставаться здоровыми. Интересно, что некоторые из этих популяций жили в тропическом климате, где потери с потом были велики, в том числе энергичные воины-масаи Африки, которые потребляли менее 1955 мг натрия в день, жители тропической Нигерии, потреблявшие менее 2760 мг натрия в сутки. -часовой период, и галилейские натуралисты, потребляющие всего 736 мг натрия в день.
Интересно, что некоторые из этих популяций жили в тропическом климате, где потери с потом были велики, в том числе энергичные воины-масаи Африки, которые потребляли менее 1955 мг натрия в день, жители тропической Нигерии, потреблявшие менее 2760 мг натрия в сутки. -часовой период, и галилейские натуралисты, потребляющие всего 736 мг натрия в день.
Трудно вывести из организма натрий. Действие гормона альдостерона на почки и относительно большое суточное потребление натрия на душу населения в западной диете по сравнению с базовыми физиологическими потребностями вполне адекватны для поддержания уровня натрия в организме. Таким образом, дефицит натрия встречается редко, но может возникнуть в трех чрезвычайных ситуациях. Первый включает в себя ограничение соли в рационе в качестве терапии заболеваний (например, гипертонии или застойной сердечной недостаточности).Возможность истощения натрия при этих заболеваниях не является противопоказанием к использованию диеты с низким содержанием натрия, когда это возможно, но важно, чтобы пациент находился под тщательным наблюдением.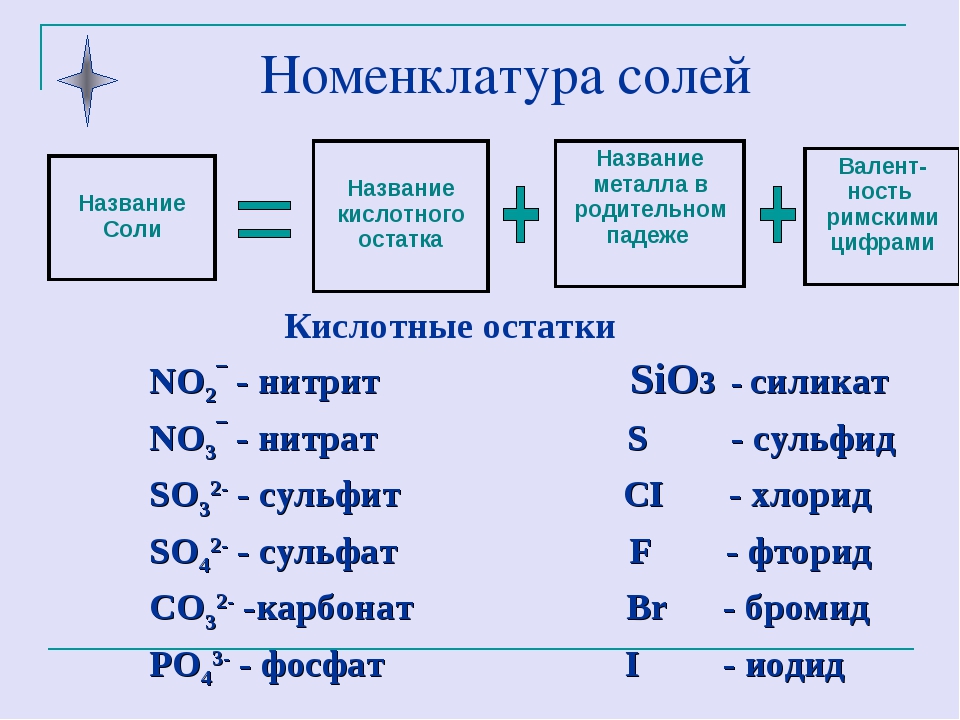 В течение первых нескольких недель диеты с ограничением соли желательны частые измерения концентрации натрия в сыворотке крови.
рацион питания. Снижение уровня натрия в сыворотке должно вызвать повторную оценку. Второе обстоятельство связано с заболеваниями почек или желез внутренней секреции, нарушающими нормальный баланс натрия, такими как болезнь Аддисона или несахарный диабет.Третья ситуация, связанная с горячими средами, рассматривается в следующем разделе.
В течение первых нескольких недель диеты с ограничением соли желательны частые измерения концентрации натрия в сыворотке крови.
рацион питания. Снижение уровня натрия в сыворотке должно вызвать повторную оценку. Второе обстоятельство связано с заболеваниями почек или желез внутренней секреции, нарушающими нормальный баланс натрия, такими как болезнь Аддисона или несахарный диабет.Третья ситуация, связанная с горячими средами, рассматривается в следующем разделе.
Жаркая среда преувеличивает потери соли
Упражнения или работа в прохладной среде увеличивают потерю пота и потребление воды, но психологическое влечение к питью и водно-электролитные гормоны регулируют общее содержание воды в организме в пределах >0,2 процента (>150 г) от нормы массы тела каждый день. Объем плазмы крови регулируется в пределах > 0,7 процента (> 25 г) в последующие дни.
Во время упражнений легкой и средней интенсивности в жарких условиях произвольное потребление воды не соответствует потерям воды. Большинство людей производят от 0,8 до 1,3 л пота в час, но выпивают только от одной трети до трех четвертей этого количества. Таким образом, если упражнения в жаркой среде являются длительными и напряженными, может произойти потеря массы тела на 3-5 процентов. Это важно, потому что на этих уровнях снижаются как выносливость, так и сила.
Большинство людей производят от 0,8 до 1,3 л пота в час, но выпивают только от одной трети до трех четвертей этого количества. Таким образом, если упражнения в жаркой среде являются длительными и напряженными, может произойти потеря массы тела на 3-5 процентов. Это важно, потому что на этих уровнях снижаются как выносливость, так и сила.
Таблица 1 показывает, что пот содержит натрий, хлорид и другие минералы. На самом деле пот содержит более сорока различных органических соединений. Что касается содержания хлорида натрия, то у здоровых взрослых людей существуют значительные индивидуальные различия.Физически подготовленные спортсмены, акклиматизированные к жаре (то есть приспособленные к упражнениям в жаркой среде), обычно теряют от 400 до 800 мг хлорида натрия на литр пота. Напротив, пот нездоровых, неакклиматизированных взрослых людей содержит от 1000 до 3000 мг хлорида натрия на литр. Эта разница возникает из-за того, что физическая тренировка и акклиматизация к теплу снижают концентрацию солей в поте.
Солевой баланс во время физических упражнений и труда
В таблице 3 приведены оценки количества жидкости и солей, теряемых с потом, при различных видах деятельности, выполняемых в жарких условиях.Очевидно, что потери воды и хлорида натрия увеличиваются пропорционально продолжительности и интенсивности упражнений. Для справки в Таблице 4 описаны отдельные питательные вещества, потребляемые взрослым населением США. Потребление хлорида натрия составляет в среднем от 4600 до 12700 мг, а потребление воды в среднем составляет 2,5 л/день. Сравнивая эти две таблицы, становится очевидным, что 30 минут легкой работы в саду дают небольшую потерю жидкости и натрия, которую можно компенсировать обычным питанием. Ультрамарафон, для прохождения которого требуется от 20 до 30 часов, включает в себя экстраординарную соль (от 14 400 до 70 000 мг NaCl) и воду (18,000 мг).от 0 до 35,0 л), которые намного превышают нормальное 24-часовое потребление пищи. Очевидно, что во время и после ультрамарафона требуется постоянное потребление жидкости и электролитов для восполнения потерянных питательных веществ.
Три водно-электролитных нарушения связаны с натрием (тепловое истощение, тепловые судороги и гипонатриемия, связанная с физической нагрузкой)
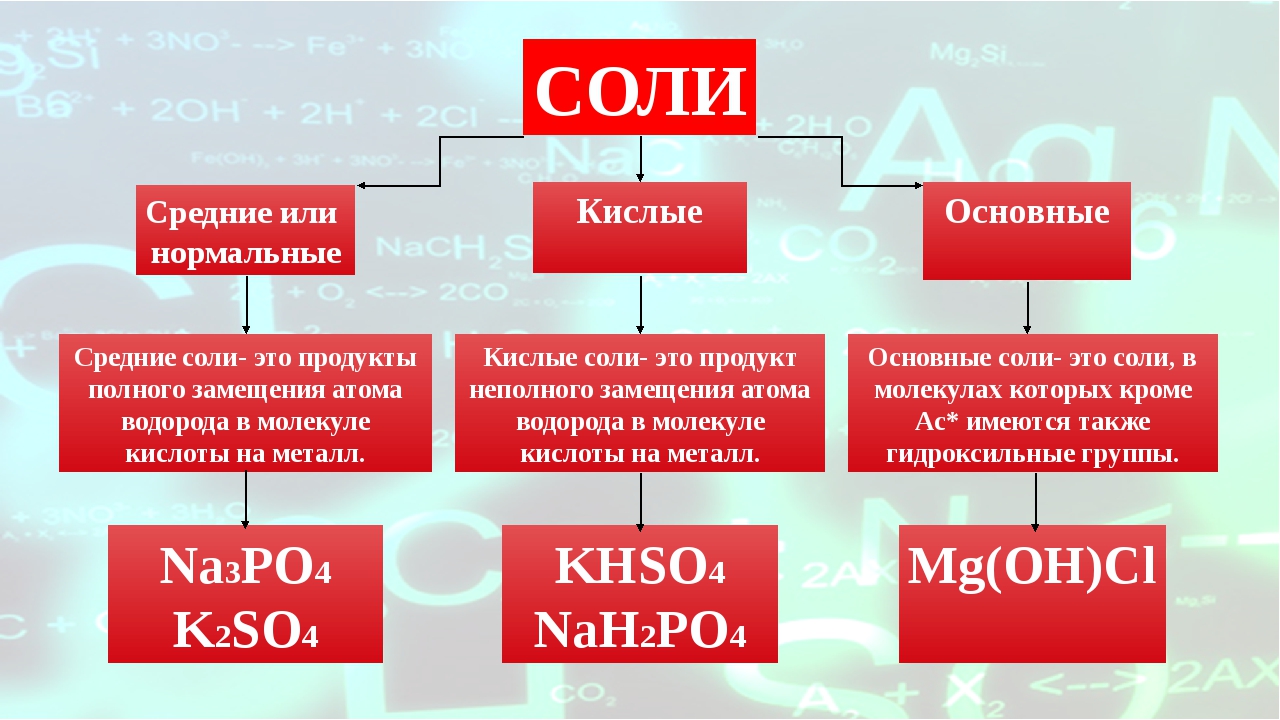 8-1.5
8-1.5 0–35,0
0–35,0 и стали наиболее распространенными заболеваниями среди спортсменов и рабочих в жарких условиях. Тепловое истощение, неспособность продолжать упражнения в жару, в первую очередь представляет собой расстройство, связанное с истощением жидкости, при котором происходят большие потери натрия, воды или смешанные натрий-вода во время воздействия тепла при физической нагрузке. Тепловые судороги чаще всего возникают в брюшной стенке и крупных мышцах конечностей и связаны с истощением запасов натрия в организме. Лечение этих двух тепловых заболеваний включает восполнение потерь хлорида натрия и воды с потом и мочой.Гипонатриемия при нагрузке включает снижение концентрации натрия в сыворотке (<130 мЭкв/л) и представляет собой заметное разведение внеклеточной жидкости. Это расстройство, в отличие от двух предыдущих, связано с гипергидратацией. Спортсмены
Тепловые судороги чаще всего возникают в брюшной стенке и крупных мышцах конечностей и связаны с истощением запасов натрия в организме. Лечение этих двух тепловых заболеваний включает восполнение потерь хлорида натрия и воды с потом и мочой.Гипонатриемия при нагрузке включает снижение концентрации натрия в сыворотке (<130 мЭкв/л) и представляет собой заметное разведение внеклеточной жидкости. Это расстройство, в отличие от двух предыдущих, связано с гипергидратацией. Спортсмены
| Потребление отдельных питательных веществ в Соединенных Штатах (мг в день), опубликованное Национальным исследовательским советом в 1989 г. | |||
| хлорид натрия | 4,600-12,700 | ||
| натрия 1,800-5,000 | |||
| калия 2,500-3,400 | |||
| магния 207-329 | |||
| Кальций | 530–1,179 | ||
a Потребление воды взрослым весом 70 кг составляет примерно 2. 5 л/день с твердой пищей и жидкостью. 5 л/день с твердой пищей и жидкостью. | |||
или рабочие, которые потребляют и удерживают большой объем чистой воды (например, 10 л за 5 часов), могут испытывать ряд опасных для жизни физиологических изменений, которые сигнализируют об интоксикации водой. Наиболее серьезными последствиями являются кома, жидкость в легких (отек легких) и отек головного мозга (отек мозга).
Восполнение потери соли в результате физических упражнений
Лицам, занимающимся физическими упражнениями более двух часов и не страдающим гипертонией, следует немного увеличить потребление соли (см. Таблицу 3).Точно так же, если потеря веса на 3% и более связана с потерей жидкости во время работы или физических упражнений, следует ожидать незначительного дефицита натрия. Простейшим способом восполнить этот дефицит после тренировки является добавление соли в пищу и выбор более соленых продуктов. Консервированный суп, например, содержит от 1950 до 2450 мг хлорида натрия; консервированный томатный сок содержит 1525 мг. Напитки, заменяющие жидкость-электролит, содержат от 150 до 300 мг, а 1 процент нежирного молока содержит 300 мг хлорида натрия. Также разумно есть больше фруктов, таких как бананы и арбузы, чтобы восполнить потерянный калий.
Напитки, заменяющие жидкость-электролит, содержат от 150 до 300 мг, а 1 процент нежирного молока содержит 300 мг хлорида натрия. Также разумно есть больше фруктов, таких как бананы и арбузы, чтобы восполнить потерянный калий.
См. также Оценка состояния питания ; Состав кузова ; Электролиты ; Рыба соленая ; Мясо соленое ; Микробиология ; Минералы ; Питание ; Натрий ; Жажда .
БИБЛИОГРАФИЯ
Аппель, Лоуренс Дж., Томас Дж. Мур, Ева Обарзанек, Уильям М. Воллмер, Лаура П. Светки, Фрэнк М. Сакс, Джордж А. Брей, Томас М.Фогт, Джеффри А. Катлер, Марлен М. Виндхаузер, Лин Пао-Хва и Нджери Каранджа. «Клиническое исследование влияния диеты на кровяное давление». Медицинский журнал Новой Англии 336 (1997): 1117–1124.
Бускирк, Элсворт и Уильям Б. Фаркуар. «Натрий в упражнениях и спорте». В Macroelements, Water, and Electrolytes , под редакцией Джуди А.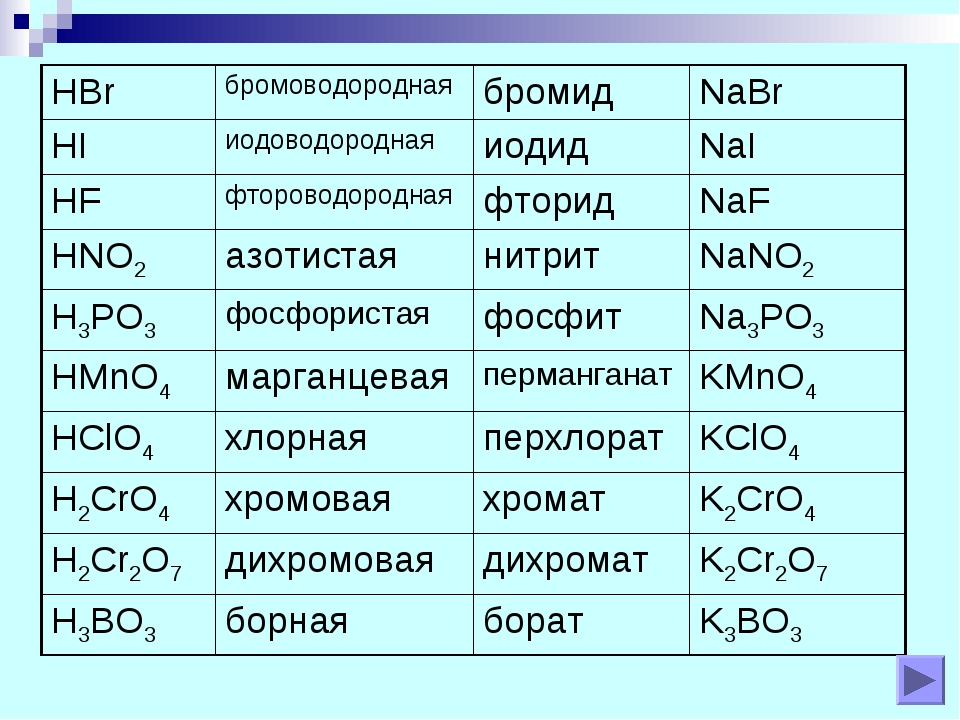 Дрискелл и Айры Волински, стр. 109–136. Бока-Ратон, Флорида: CRC Press, 1999.
Дрискелл и Айры Волински, стр. 109–136. Бока-Ратон, Флорида: CRC Press, 1999.
Клайдсдейл, Фергус М. «Минералы: их химия и судьба в продуктах питания.В Trace Minerals in Foods , под редакцией Кеннета Т. Смита, стр. 57–94. Нью-Йорк: Марсель Деккер, 1988.
Даль, Л.К. «Соль и гипертензия». 1972): 234–244.
Дентон, Дерек. «Соль в истории: символические, социальные и физиологические аспекты». В The Hunger for Salt, , стр. 76–90.
Фриман, Томас М. и Оуэн В. Грегг Потребление натрия — проблемы с питанием .Сент-Пол, Миннесота: Американская ассоциация химиков-зерновых, 1982.
Грили, Александра. Щепотка разногласий встряхивает диетическую соль . Публикация здравоохранения и социальных служб HE20.4010/A:SA3/3. Роквилл, штат Мэриленд: Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, 1997.
Хаббард, Роджер В. и Лоуренс Э. Армстронг. «Тепловые болезни: биохимические, ультраструктурные и жидкостно-электролитные соображения».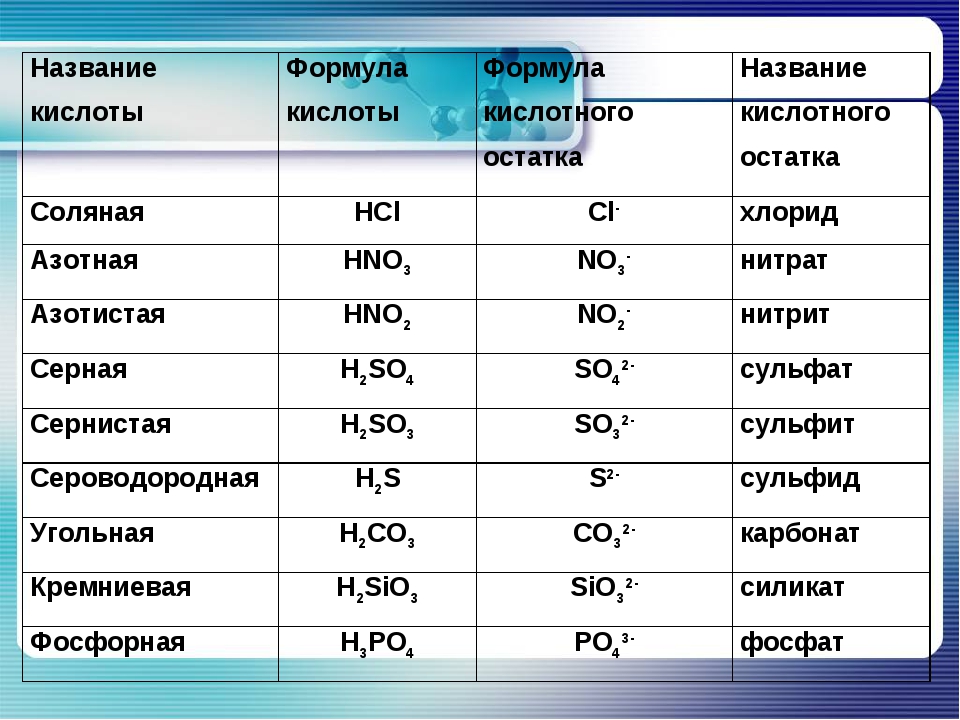 В Физиология работоспособности человека и экологическая медицина в земных экстремальных условиях под редакцией Кента Б.Пандольф, Майкл Н. Савка и Ричард Р. Гонсалес, стр. 305–360. Индианаполис: Benchmark Press, 1988.
В Физиология работоспособности человека и экологическая медицина в земных экстремальных условиях под редакцией Кента Б.Пандольф, Майкл Н. Савка и Ричард Р. Гонсалес, стр. 305–360. Индианаполис: Benchmark Press, 1988.
Мага, Джозеф А. и Энтони Т. Ту. Пищевая добавка Токсикология . Нью-Йорк: М. Деккер, 1995.
Миллер, Роджер В. Меню с низким содержанием натрия проходят школьные тесты. Публикация здравоохранения и социальных служб 85-2204. Роквилл, Мэриленд: Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, 1985.
Национальный исследовательский совет. Совет по продовольствию и питанию. Диеты с ограничением натрия. Обоснование, осложнения и практические аспекты их использования .Публикация № 325. Вашингтон, округ Колумбия: Национальный исследовательский совет, 1954.
Национальный исследовательский совет. Рекомендуемые пищевые нормы , 10-е изд. Вашингтон, округ Колумбия: National Academy Press, 1989.
Софос, Джон Н. и С. Рахарджо. «Соли». В Food Additive Toxicology , под редакцией Джозефа А. Мага и Энтони Т. Ту, стр. 235–268. Нью-Йорк: М. Деккер, 1995.
Тейлор, Реджинальд Дж. Пищевые добавки . Чичестер, Англия: John Wiley & Sons, 1980.
Тейлор-Толберт, Надин С., Дональд Р. Денгел, Майкл Д. Браун, Стив Д. Коул, Ричард Э. Пратли, Роберт Э. Феррелл и Джеймс М. Хагберг. «Амбулаторное артериальное давление после интенсивной физической нагрузки у пожилых мужчин с эссенциальной гипертонией». Американский журнал гипертонии 13 (2000): 44–51.
Продовольственная и сельскохозяйственная организация Объединенных Наций. Спецификации идентификации и чистоты некоторых пищевых добавок . Рим: Организация Объединенных Наций, 1986.
Палата представителей США. Натрий в продуктах питания и высокое кровяное давление . Комитет по науке и технологиям, документ № 84-015O. Вашингтон, округ Колумбия: Типография правительства США, 1981.
Лоуренс Э. Армстронг
Два рецепта с низким содержанием натрия
В апрельском выпуске журнала FDA Consumer за 1985 год в качестве примеров блюд с низким содержанием натрия были приведены два рецепта. которые легко приготовить. Первый описывает запеченные обеденные булочки и дает 100 порций: 3¼ унции активных сухих дрожжей, 2 литра воды, 7¼ фунтов универсальной муки, 1⅓ стакана сахара, 1 столовая ложка соли.Обычно в рецепте такого размера используется 4 столовые ложки соли, в результате чего содержание натрия составляет 295 мг в каждой булочке. При уменьшении количества соли на 25 процентов каждая булочка содержит всего 73 мг натрия.
Второй рецепт описывает котлеты из сосисок с низким содержанием натрия и рассчитан на 16 порций. Смешайте 1 фунт говяжьего фарша с 1 столовой ложкой лимонного сока, ¼ чашки сухих хлебных крошек, ¼ чайной ложки шалфея, 1⁄ 4 чайной ложки имбиря, 1 чайной ложки чесночного порошка, 1 чайной ложки лукового порошка и ½ чайной ложки жидкого дыма.