Создатель первой синтетической клетки Крейг Вентер рассказал о перспективах применения своей работы
Синтетический геном позволит создать экономически выгодное биотопливо, сделать за час вакцину от нового штамма гриппа, а также новые пищевые продукты, считает пионер синтетической биологии Крейг Вентер. Он, однако, полагает, что время использования секвенирования генома в рутинном здравоохранении еще не пришло.
В эти дни в Сан-Диего проходит конференция Американского химического общества, объединяющего около 11 тыс. исследователей-химиков по всему миру. Самые интересные темы, как водится, лежат на стыке наук — химии, биологии, материаловедения, физики. Пленарные доклады были посвящены технологиям регенеративной медицины для пожилых людей и пострадавших от травм, созданию синтетических кровеносных сосудов, возможностям химии в криминалистике, а также перспективам производства водорода для альтернативной энергетики с помощью АЭС.
В Сан-Диего Вентер выступил с обзорным докладом «От чтения к написанию генетического кода», в котором задал ориентиры для направления работ с использованием синтетической клетки.
Он выразил уверенность, что искусственный генетический код откроет людям XXI века новые виды топлива, высокоэффективные лекарства, продукты, источники питьевой воды и многое другое.
Вентер также был одним из лидеров гонки в расшифровке генома человека. Его частный исследовательский проект Celera Genomics ноздря к ноздре шел с государственным Human Genome Project. В результате, когда были расшифрованы 23 тыс. человеческих геномов, два научных коллектива заключили мир и в 2001 году одновременно выступили с публикациями.
«Геномика — очень быстро развивающаяся область, и мои научные группы прокладывают путь от чтения генетического кода — секвенирования генома бактерий, людей, растений и других организмов — к его написанию и созданию синтетических клеток для различных применений.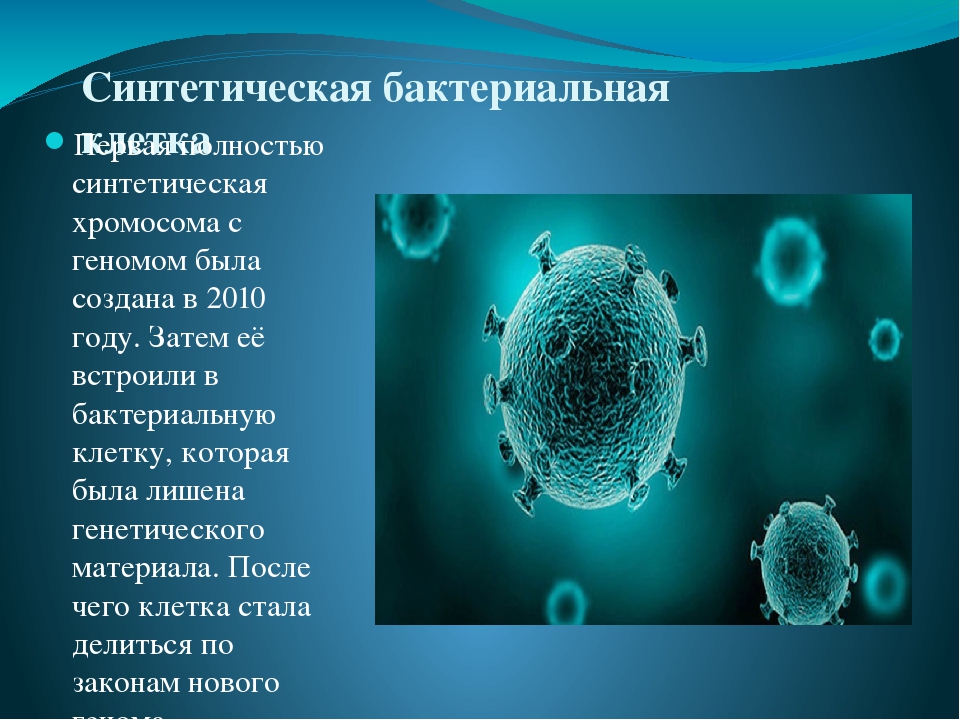 Уже сейчас мы можем с нуля создавать синтетические бактериальные клетки, которые планируем приспособить для эффективного производства вакцин, лекарств и биотоплив», — заявил Вентер.
Уже сейчас мы можем с нуля создавать синтетические бактериальные клетки, которые планируем приспособить для эффективного производства вакцин, лекарств и биотоплив», — заявил Вентер.
Работы Крейга Вентера принадлежат к новой области «синтетической биологии», которая объединяет в себе и химию, и медицину, и геномику, и ряд других традиционных научных дисциплин. Синтетическая биология появилась из генной инженерии, ставшей сейчас уже довольной привычной: можно вставить один-два новых гена в геном растения или бактерии.
Эти гены могут, например, «научить» помидоры вызревать, не становясь мягкими, или «заставить» бактерии производить искусственный человеческий инсулин для больных диабетом.
Синтетическая биология замахивается на большее — создать целый геном, перепрограммировать целые организмы или даже создавать новые.
Сообщение о создании первой полностью синтетической бактериальной клетки в 2010 году было опубликовано в авторитетном научном журнале Science группой ученых из некоммерческого Института Крейга Вентера. С помощью четко разработанного компьютерного алгоритма ученым удалось создать полностью синтетическую хромосому с геномом.
С помощью четко разработанного компьютерного алгоритма ученым удалось создать полностью синтетическую хромосому с геномом.
Когда ее встроили в бактериальную клетку, лишенную генетического материала, она начала функционировать по предписанным новым геномом законам, делиться и размножаться.
Для создания практических коммерческих приложений синтетического генома Вентер создал отдельную компанию Synthetic Genomics Inc. (SGI). Одна из ее амбициозных задач — создать микроводоросли, которые будут захватывать атмосферный диоксид углерода гораздо эффективнее, чем существующие в природе. В свою очередь, именно микроводоросли считаются наиболее перспективным источником биотоплив.
Другая важная задача — модификация генома бактерий для создания эффективных и безвредных вакцин против новых штаммов гриппа в течение часов, а не месяцев, как это происходит сегодня. Создание такой технологии смогло бы победить главное преимущество вируса гриппа — его потрясающую изменчивость.
Медики начинают бег наперегонки с эпидемией, пытаясь создать новую вакцину. Вентер надеется обогнать грипп, научившись создавать вакцину за несколько часов.
Другой крупный генетический проект Института Вентера — изучение человеческого микробиома. Под этим термином подразумевается расшифровка генома миллиардов бактерий, живущих в теле человека, а также изучение их роли в поддержании нашего здоровья и развитии болезней.
Вместе с тем Вентер сомневается в точности работы устройств для рутинного секвенирования генома, которые могут предоставить эту услугу в любой больнице. Он считает, что пройдут годы, пока полное секвенирование генома человека станет достаточно точным и быстрым, чтобы найти свое место в обычном здравоохранении.
BBC Russian — Наука и техника
Живую клетку удалось синтезировать американским ученым — впервые в мире. Исследователи «построили» генетическую программу бактерии и ввели ее в клетку, исполнившую роль матки.
Исследователи «построили» генетическую программу бактерии и ввели ее в клетку, исполнившую роль матки.
Получившийся в результате микроб выглядел и вел себя в полном соответствии с тем «диктатом», который осуществлялся через синтезированную ДНК, то есть как бы превратился в микроб другого вида.
Специалисты надеются, что со временем они смогут создавать бактериальные клетки, которые будут вырабатывать медикаменты и топливо и даже, возможно, абсорбировать парниковые газы.
Это событие, отчет о котором публикует журнал Science, называют прорывом в науке, однако скептики говорят, что синтез живых организмов влечет за собой немалый риск.
Нажать Ваше мнение
Генетический код
Работой руководил доктор Крейг Вентер, создатель института генных исследований с отделениями в американских штатах Мэриленд и Калифорния. Раньше он с коллегами уже создавал синтетический геном бактерии и пересаживал геном одной бактерии в другую.
Раньше он с коллегами уже создавал синтетический геном бактерии и пересаживал геном одной бактерии в другую.
Нажать Схема эксперимента
Даже некоторых ученых беспокоит то, что у нас недостаточно средств для измерения рисков, которые могут представлять собой столь новые организмы, когда они окажутся «на воле»
Сюзан Уоттс,
редактор отдела науки Би-би-си
Теперь же ученые совместили оба метода с целью создания «синтетической клетки» — так они сами называют свое творение, несмотря на то, что действительно синтетическим является не вся клетка, а только ее геном.
Доктор Вентер сравнил эту работу с написанием программного обеспечения для клетки: ученые скопировали геном существующей бактерии, затем расшифровали его, разложили по полочкам все составляющие, а потом при помощи «синтезирующей машины» химическим путем изготовили копию.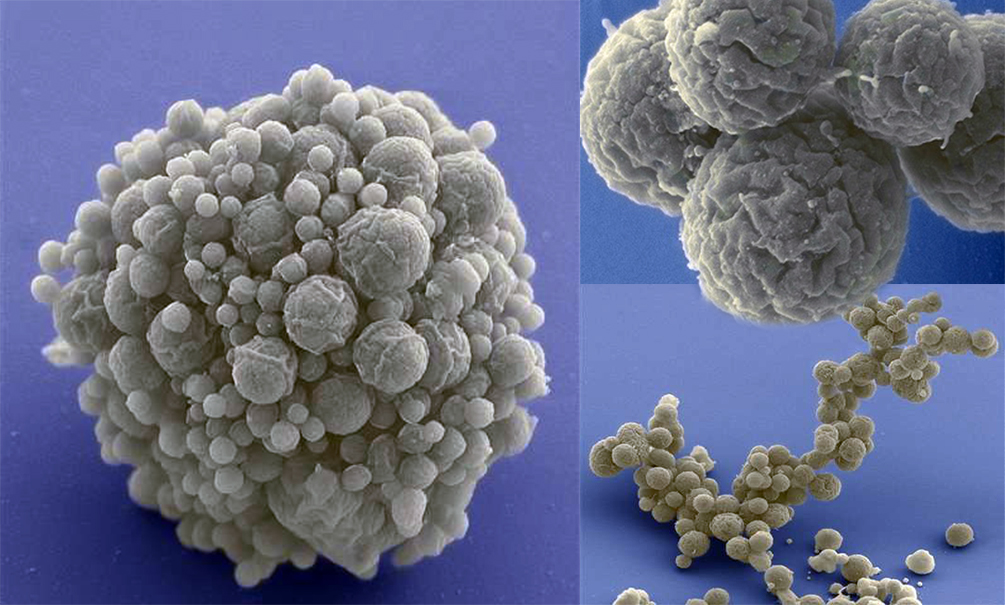
«Теперь мы получаем возможность брать нашу синтетическую хромосому и трансплантировать ее в клетку-реципиент, то есть в другой организм, — объясняет доктор Вентер в интервью Би-би-си. — Как только эта новая программа внедряется в клетку, клетка ее считывает и превращается в тот вид, который прописан в этом генетическом коде».
Новая бактерия воспроизвела себя более миллиарда раз; в результате появились ее копии, содержащие синтетическую ДНК и подконтрольные ей.
«Впервые синтетическая ДНК взяла на себя полный контроль над клеткой», — говорит доктор Вентер.
Нажать Письма со всего мираНажать
Новая промышленная революция?
Он и его коллеги надеются со временем научиться проектировать и строить новые бактерии, которые будут выполнять полезные для человека функции.
[Эти технологии] позволят нам оторваться от нефтяной соски и хотя бы частично сократить урон окружающей среде
Крейг Вентер, автор исследования
«Я думаю, потенциально это новая промышленная революция, — говорит ученый. — Если мы сумеем заставить клетки производить то, что нам нужно, они позволят нам оторваться от нефтяной соски и хотя бы частично сократить урон окружающей среде, улавливая углекислоту».
— Если мы сумеем заставить клетки производить то, что нам нужно, они позволят нам оторваться от нефтяной соски и хотя бы частично сократить урон окружающей среде, улавливая углекислоту».
Доктор Вентер и его сотрудники уже работают в союзе с фармакологическими и топливными компаниями над созданием хромосом для бактерий, которые смогут производить топливо и вакцины.
Скептики, однако, предупреждают: не стоит преувеличивать потенциальные выгоды синтеза организмов.
Так, доктор Хелен Уоллес из британской организации Genewatch UK, наблюдающей за исследованиями в области генетики, заявила в интервью Би-би-си, что синтетические бактерии могут быть опасными.
«Если выпустить новые организмы в окружающую среду, вреда может выйти больше, чем пользы, — говорит она. — Выпуская их в зоны загрязнений — с целью очистки, — вы, по сути, создаете загрязнение иного рода. Мы не знаем, как такие организмы поведут себя на свободе».
Червивый фрукт?
При этом доктор Уоллес обвиняет доктора Вентера в том, что он пытается замолчать вероятные проблемы. «Он не бог, — объясняет она. — Он вообще-то вполне себе человек, он пытается добиться того, чтобы в его технологию инвестировали средства, и избежать возможных ограничений на ее использование».
На это доктор Вентер отвечает, что он сам «инициирует дискуссии» о регулировании этой относительно новой научной сферы и об этических нормах его деятельности.
В будущем [эти технологии] могут использоваться для создания самого мощного биооружия
Профессор Джулиан Савулеску
«В 2003 году, когда мы произвели первый синтетический вирус, он стал объектом пристального рассмотрения в смысле этичности его использования и прошел все ступени, вплоть до Белого дома, — напоминает ученый. — Кроме того, наши работы тщательно проверялись, в том числе и в Национальной академии наук [США], а итоги проверок вылились в детальный отчет по этой новой области. Мы считаем эти проблемы очень важными и призываем к продолжению дискуссий, в которых намерены участвовать».
— Кроме того, наши работы тщательно проверялись, в том числе и в Национальной академии наук [США], а итоги проверок вылились в детальный отчет по этой новой области. Мы считаем эти проблемы очень важными и призываем к продолжению дискуссий, в которых намерены участвовать».
Доктор Гос Миклем, генетик из Кембриджского университета в Великобритании, называет достижение американских коллег «безусловной вехой». Однако, добавляет он, «уже имеется большое количество простых, недорогих, эффективных и зрелых методов генетической инженерии целого ряда организмов. Таким образом, на сегодняшний день этот подход вряд ли вытеснит существующие методики генной инженерии».
Что касается этических дискуссий вокруг синтетической, или искусственной, жизни, то они будут продолжаться.
Профессор Джулиан Савулеску из Центра практической этики при Оксфордском университете отмечает: эта область науки находится «в отдаленном будущем, но она реальна и важна».
«Но и риски тоже беспрецедентны, — продолжает эксперт. — Нужны новые стандарты оценки рисков такого рода радикальных исследований и защиты от нецелевого их использования в военных или террористических целях. В будущем они могут использоваться для создания самого мощного биооружия, какое только можно себе представить. Задача состоит в том, чтобы съесть фрукт, но не червя».
Синтез живой клетки: как это было
Ученые расшифровали код хромосомы клетки бактерии, «прочитав» каждую букву генетического кода при помощи компьютера
Ученые скопировали этот код и воссоздали новую синтетическую хромосому, сложив вместе участки ДНК
Затем хромосому вложили в бактериальную клетку, которая стала делиться.
 Синтетическую бактерию можно использовать для создания новых видов топлива и лекарств
Синтетическую бактерию можно использовать для создания новых видов топлива и лекарств
Нажать Вернуться в статью
Изображая бога Ученые создали первый организм с искусственным геномом: Наука и техника: Lenta.ru
В четверг, 20 мая, в журнале Science появилась очень необычная работа. В ней сообщалось, что группе исследователей удалось создать организм с синтетическим геномом. Ученые получили обыкновенную на вид бактерию, которая ничем не отличалась от других бактерий за исключением одного: ее ДНК — молекула, определяющая все свойства клетки, — была от первой и до последней «буквы» синтезирована искусственно.
Представьте: обычный дождливый октябрьский вечер 2158 года. Житель, скажем, Северного Чертанова возвращается к себе и домой и решает, что топливо в его машине ему окончательно разонравилось.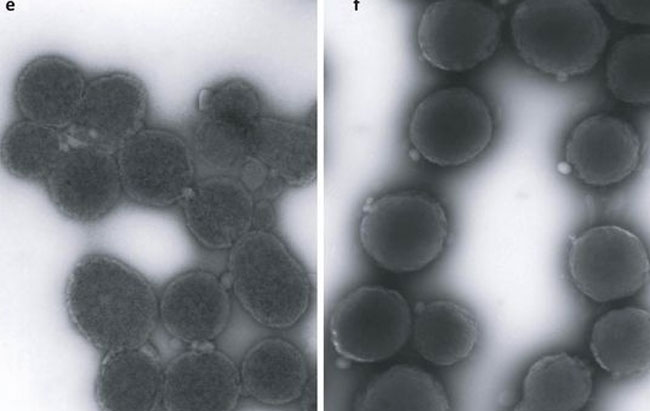 Он подходит к компьютеру и пишет заявку в компанию, чтобы ему прислали новых бактерий, которые вырабатывают более качественное горючее. Написанное кажется полным бредом, однако не исключено, что такое или почти такое будущее человечеству открывает новая работа, появившаяся в журнале Science.
Он подходит к компьютеру и пишет заявку в компанию, чтобы ему прислали новых бактерий, которые вырабатывают более качественное горючее. Написанное кажется полным бредом, однако не исключено, что такое или почти такое будущее человечеству открывает новая работа, появившаяся в журнале Science.
Работа называется «Создание бактериальной клетки, которая контролируется химически синтезированным геномом». Схема проведенного учеными эксперимента очень проста: они взяли несколько банок реактивов, синтезировали из них геном бактерии и вставили его в клетку другой бактерии, из которой заранее удалили собственную ДНК. На реализацию этой несложной схемы на практике у исследователей ушел не один год.
Читатель может спросить, а зачем вообще ученые взялись за такую странную задачу — синтезировать de novo то, что и так уже создано природой? Ответ на этот вопрос очень прост: потому что этой работой руководил Крейг Вентер (Craig Venter). Это имя хорошо известно тем, кто связан с биологией или когда-то интересовался проектом «Геном человека».
Яркая личность
Крейг Вентер занялся наукой после службы в армии и возвращения из Вьетнама. Молодого ветерана интересовала биохимия, и именно в этой области он получил сначала степень бакалавра, а потом доктора философии (с некоторыми оговорками — аналог нашей степени кандидата наук, в данном случае биологических). Вентер не был «классическим» ученым, который не вылезает из своей лаборатории и всячески избегает любой административной и коммерческой деятельности. В 1998 году будущий создатель искусственного генома принял участие в организации биотехнологической компании Celera Genomics.
Именно в Celera Genomics была впервые определена полная геномная последовательность живого организма — дебютантом стал микроорганизм Haemophilus influenzae. Компания занялась расшифровкой бактериальных геномов не просто так — в 1990 году был запущен глобальный проект по определению последовательности ДНК Homo sapiens «Геном человека». На момент создания Celera Genomics сотни ученых из разных стран мира не смогли полностью расшифровать последовательность ни одной из 23 пар хромосом человека. В 1999 году была «сделана» самая маленькая (как считалось тогда) 23-я хромосома. Причиной столь медленного прогресса являлось несовершенство технологий секвенирования (определения последовательности) ДНК.
В 1999 году была «сделана» самая маленькая (как считалось тогда) 23-я хромосома. Причиной столь медленного прогресса являлось несовершенство технологий секвенирования (определения последовательности) ДНК.
Крейг Вентер изучает образцы, собранные во время морской экспедиции. Фото с сайта jcvi.org
Lenta.ru
Вентер разработал новый подход к секвенированию, названный методом «дробовика» (shotgun sequencing), который оказался намного эффективнее традиционных методов. В 2000 году благодаря «дробовику» была завершена черновая расшифровка генома человека. Однако генетические данные не были выложены в общий доступ, как это принято в научной среде, — Вентер изначально планировал продавать расшифрованные им последовательности. Меркантильный подход к столь важной для человечества проблеме вызвал у ученых негодование, и в конце концов Вентер был вынужден открыть полученную им информацию.
Сразу после завершения проекта «Геном человека» Вентер ушел из Celera Genomics по не до конца ясным причинам (ходят более чем упорные слухи, что Вентер покинул компанию из-за конфликта с руководством) и основал институт имени себя. Параллельно он организовал морскую экспедицию на корабле Sorcerer II, в ходе которой обнаружил тысячи новых видов живых существ.
Параллельно он организовал морскую экспедицию на корабле Sorcerer II, в ходе которой обнаружил тысячи новых видов живых существ.
Основными проектами Крейга Вентера и его института стали создание организма с минимальным геномом и организма, геном которого будет создан учеными искусственно. Первое направление подразумевает получение жизнеспособного существа, в геноме которого присутствуют только самые необходимые гены. Иными словами, удаление любого из них неминуемо должно приводить к гибели такого генетического «спартанца». Этот проект пока находится в стадии разработки. А вот второе направление — по созданию существа с химически синтезированным геномом — завершилось успехом.
Дело техники
Для того чтобы отличать «неестественную» ДНК от «естественной», ученые не точно воссоздавали геном M. mycoides: в некоторые регионы, которые не кодируют гены, они вставляли специальные «флажки», представляющие собой короткие фрагменты ДНК определенной последовательности. Предварительно исследователи убедились, что вставка «флажков» не влияет на жизнеспособность бактерий.
На роль первого искусственного существа, как многие СМИ уже окрестили продукт экспериментов Вентера, была выбрана паразитическая бактерия Mycoplasma mycoides. Микроорганизмы из рода Mycoplasma являются излюбленными модельными организмами Вентера из-за своего генома — он у них очень маленький. ДНК M. mycoides состоит всего лишь из миллиона нуклеотидов — элементарных «кирпичиков», а, например, ДНК человека включает три миллиарда нуклеотидов. Раньше исследователи из института имени Крейга Вентера работали с бактериями M. genitalium, однако они очень медленно растут, и ученые переключились на более «расторопных» M. mycoides.
Первой частью работы стало определение последовательности генома M. mycoides. Хотя еще десять лет назад молекулярные биологи выбивались из сил, пытаясь «прочитать» человеческие хромосомы, сейчас секвенирование стало совершенно рутинной операцией, не требующей особых усилий. Правда, для создания организма с синтетическим геномом исследователи расшифровывали ДНК намного более тщательно, чем обычно. То есть они определили полную геномную последовательность M. mycoides не один или два раза, а как минимум десять. Такие повторные эксперименты позволяют обнаружить и исправить ошибки, неизбежно присутствующие при однократном «прочтении».
То есть они определили полную геномную последовательность M. mycoides не один или два раза, а как минимум десять. Такие повторные эксперименты позволяют обнаружить и исправить ошибки, неизбежно присутствующие при однократном «прочтении».
На следующей стадии эксперимента Вентер и его коллеги, используя полученную и выверенную последовательность ДНК M. mycoides как образец, начали химически синтезировать геном этой бактерии из отдельных нуклеотидов, созданных промышленным способом — в буквальном смысле на фабрике. Но несмотря на колоссальную скорость развития молекулярно-биологических технологий синтезировать за раз очень длинные последовательности ученые пока не умеют: когда цепь ДНК дорастает до нескольких сотен тысяч нуклеотидов, она начинает путаться и рваться. По этой причине исследователи синтезировали целый геном M. mycoides по кусочкам – авторы назвали их кассетами — длиной около тысячи нуклеотидов, а потом собирали геномный паззл воедино.
Колонии Mycoplasma mycoides, полученные при помощи вставки искусственного генома в клетки M.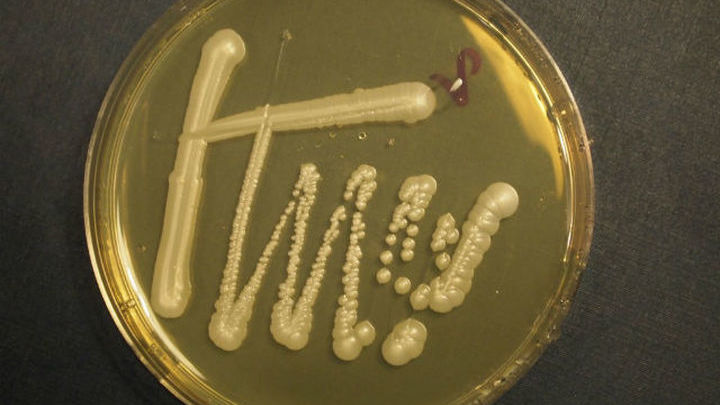 capricolum. Фото авторов исследования
capricolum. Фото авторов исследования
Lenta.ru
В качестве устройств для сборки кассет ученые использовали живые клетки – их ферментативные системы «склеивают» фрагменты ДНК с такой точностью, которой невозможно добиться при химическом соединении. «Склейку» проводили в три этапа: сначала ученые совмещали кассеты по тысяче нуклеотидов и получали фрагменты длиной в 10 тысяч «букв». Потом эти «заготовки» соединяли друг с другом, чтобы получить фрагменты в 100 тысяч нуклеотидов, которые, наконец, объединяли в целый геном. Все эти операции проводили сначала в клетках кишечной палочки, потом, когда генетический полуфабрикат дорос до сотен тысяч нуклеотидов, в клетках дрожжей.
На последней стадии эксперимента ученые поместили созданный ими геном M. mycoides в лишенные ДНК клетки «родственных» бактерий M. capricolum. Так как все свойства живых существ, в том числе и видовая принадлежность, определяются их ДНК, после вставки в клетку M. capricolum генома M. mycoides «на выходе» должны были получиться… правильно, M. mycoides. Именно так и вышло: «гибриды» выглядели как настоящие M. mycoides, с той же скоростью поглощали питательные вещества, росли теми же темпами и даже состав их белков практически не отличался от белков M. mycoides, появившихся на свет обычным способом.
mycoides «на выходе» должны были получиться… правильно, M. mycoides. Именно так и вышло: «гибриды» выглядели как настоящие M. mycoides, с той же скоростью поглощали питательные вещества, росли теми же темпами и даже состав их белков практически не отличался от белков M. mycoides, появившихся на свет обычным способом.
Если бы ученые помещали химически синтезированный геном в клетку бактерии того же вида, результаты эксперимента нельзя было бы трактовать однозначно. Например, можно было бы заявить, что сходство «гибридов» с M. mycoides определяется не только ДНК, но и, например, регуляторными белками, оставшимися в клетках «обычных» M. mycoides.
Зачем?
В своей статье Крейг Вентер пишет, что полученные им и его сотрудниками результаты, во-первых, важны как наглядное доказательство того, что ДНК содержит исчерпывающую информацию об организме, а во-вторых, умение создавать организмы, генетическая программа которых от начала и до конца прописана человеком, сулит, по мнению Вентера, очень заманчивые перспективы практического применения. Например, ученый планирует создать водоросли, которые могли бы синтезировать не только питательные вещества, необходимые им самим, но также множество полезных для человека соединений. Кроме того, Вентер видит у своей технологии большое фармацевтическое будущее: бактерии с синтетическим геномом могут в промышленных масштабах производить новые лекарства.
Например, ученый планирует создать водоросли, которые могли бы синтезировать не только питательные вещества, необходимые им самим, но также множество полезных для человека соединений. Кроме того, Вентер видит у своей технологии большое фармацевтическое будущее: бактерии с синтетическим геномом могут в промышленных масштабах производить новые лекарства.
Однако энтузиазм ученого разделяют далеко не все его коллеги. Например, биолог Евгений Нудлер, профессор биохимии Нью-Йоркского университета и заведующий московской лабораторией молекулярных механизмов старения «Геронлаб», считает, что прямого практического приложения в обозримом будущем эта работа не имеет. «Чудесные организмы, о которых говорит Вентер, можно получить и более простыми способами, которые доступны в любой лаборатории. Сегодня мы умеем изменять гены, всячески тасовать их, вставлять и убирать из генома огромные куски. Для того чтобы сделать, например, бактерию-производителя лекарств, совершенно не обязательно заново создавать целый геном», — рассказал Нудлер «Ленте. Ру». Он также отметил, что технология Вентера неоправданно сложна: «Чем больше фрагмент ДНК, который вы вставляете в геном, тем сложнее его «запихнуть» в клетку. Поэтому намного проще добавить в бактерию только несколько важных вам генов, чем пытаться вставить в нее целый новый геном».
Ру». Он также отметил, что технология Вентера неоправданно сложна: «Чем больше фрагмент ДНК, который вы вставляете в геном, тем сложнее его «запихнуть» в клетку. Поэтому намного проще добавить в бактерию только несколько важных вам генов, чем пытаться вставить в нее целый новый геном».
Что касается создания при помощи «генетического программирования» водорослей и других организмов, у которых есть ядро (бактериальная ДНК ничем не отгорожена от остального содержимого клетки), то это, по мнению Нудлера, пока остается столь же недостижимой задачей, как и раньше. «ДНК эукариот (так называют организмы, имеющие ядро, к которым относятся все растения, животные и в том числе человек) устроена намного сложнее, чем бактериальная ДНК. Разработанная Вентером технология просто не будет работать для этих организмов», — объяснил он.
Похожее мнение высказал и биолог Константин Северинов, профессор и заведующий лабораторией в университете Ратгерса, а также лабораториями в институте молекулярной генетики и институте биологии гена: «Для того чтобы повторить этот эксперимент для организмов, клетки которых имеют ядро, потребуется, во-первых, создать «работающие» искусственные хромосомы — в отличие от бактерий, у эукариот с ДНК связано гораздо больше различных белков и большое количество информации имеет эпигенетический характер, то есть не закодировано в самой последовательности ДНК, а, во-вторых, придумать метод помещения ДНК в ядро, из которого удалены предсуществующие хромосомы. Пока у ученых нет технологий, которые позволяют это делать. В качестве альтернативы можно пытаться создавать искусственное ядро, а это исключительно сложная задача».
Пока у ученых нет технологий, которые позволяют это делать. В качестве альтернативы можно пытаться создавать искусственное ядро, а это исключительно сложная задача».
И тем не менее, Северинов видит в работе Вентера определенный практический смысл: «На сегодня у нас секвенированы геномы тысяч различных живых существ, однако эффективно работать (то есть направленно изменять гены) ученые могут, на самом деле, только с несколькими модельными организмами — кишечной палочкой и небольшим числом других бактерий, дрожжами, червяком-нематодой, лягушкой, мухой и мышью. Используя предложенный Вентером подход, можно было бы брать химически синтезированные мутационные варианты генома неизученных микроорганизмов, помещать их в клетку-реципиент и исследовать свойства таких вариантов. Впрочем, это потребует очень значительного удешевления существующей технологии. А собственно к написанию генетических программ и созданию действительно новых организмов работа Вентера отношения не имеет. Пока он всего лишь реализовал уже существующую в природе программу».
Несмотря на то что однозначного признания результатов Вентера в научном сообществе нет и многие исследователи относятся к ним скептически, работой по созданию синтетического генома уже заинтересовались на самом высшем государственном уровне. Барак Обама распорядился создать специальную комиссию по изучению этического аспекта создания живых клеток при помощи искусственно созданной ДНК. Так что не исключено, что в обозримом будущем дискуссии о работе Вентера перетекут из чисто практической плоскости в философскую.
Создана первая бактерия с синтетической ДНК — Российская газета
Создавать новые белки, которых нет в природе, а возможно даже новые формы жизни обещает исследование американских ученых из Института Scripps. Как известно, все живое на планете «стоит» на четырех основаниях ДНК. Эти четыре «буквы» — A, C, G и T (нуклеиновые основания аденин, цитозин, тимин и гуанин) составляют генетический код. Соединяясь в определенных сочетаниях, они кодируют белки, из которых состоят клетки человека и бактерии, китов и бабочек.
Ученые давно пытаются дополнить природу. Каким-то образом вшить в ДНК организма новые нуклеиновые основания, чтобы расширить возможности генетического кода и научиться создавать новые, не существующие в природе белки, клетки или даже целые организмы. Этот трюк удался группе под руководством профессора Флойда Ромесберга. Они создали искусственные основания ДНК, назвав их просто X и Y. Кстати, по химическому строению они почти не имеют ничего общего с четырьмя природными основаниями ДНК. И тем не менее после многих изощренных попыток ученым удалось внедрить «чужаков» в ДНК живых клеток. Но даже не это стало в 2014 году мировой сенсацией. Прорывом оказалась способность такого синтетического генома передаваться по наследству потомству. Причем совершенно естественным путем, как и в случае с четырьмя природными нуклеотидами.
И вот только что группа Флойда Ромесберга сообщила в журнале Nature о новой сенсации. Им удалось заставить полусинтетическую бактерию, ДНК которой содержала Х и У, производить новые белки, которых нет в природе. Любой организм использует четыре буквы «алфавита ДНК», чтобы производить белки. На сегодня известны 20 природных аминокислот, из которых строятся белки. Но синтетическая бактерия, по сообщению ряда СМИ, способна синтезировать белки, содержащие 152 новых аминокислоты. А раз так, то ей по силам сделать еще вчера казавшееся фантастикой — создавать новые молекулы, которые могут в корне изменить, к примеру, фармакологию. Ведь появляются огромные возможности для разработки принципиально новых лекарств. А может быть, речь уже можно вести о создании новых форм жизни.
Любой организм использует четыре буквы «алфавита ДНК», чтобы производить белки. На сегодня известны 20 природных аминокислот, из которых строятся белки. Но синтетическая бактерия, по сообщению ряда СМИ, способна синтезировать белки, содержащие 152 новых аминокислоты. А раз так, то ей по силам сделать еще вчера казавшееся фантастикой — создавать новые молекулы, которые могут в корне изменить, к примеру, фармакологию. Ведь появляются огромные возможности для разработки принципиально новых лекарств. А может быть, речь уже можно вести о создании новых форм жизни.
Речь уже может идти о создании новых форм жизни
Чтобы проиллюстрировать эту особенность полусинтетических организмов, ученые заставили бактерии произвести на свет особый флуоресцентный белок, светящийся в темноте. Он стал первой молекулой, созданной полусинтетическим организмом с расширенным генетическом кодом.
Комментарий
Константин Северинов, доктор биологических наук, профессор Сколковского института науки и технологий (SkolTech), профессор Университета Ратгерса (США):
— Конечно, это технически очень серьезная и важная работа, но, как всегда бывает, «слухи» о ее значимости сильно преувеличены. На самом деле о кодировании 152 новых аминокислот и тем более получении новых белков, содержащих эти аминокислоты, речи пока не идет. Пока только продемонстрирована принципиальная возможность такого подхода, и в один известный белок введены две неприродные аминокислоты за счет расширения генетического кода. Дальнейшее расширение потребует кропотливой работы, а достижение теоретически возможного максимума кодирования займет годы. Более того,это может вообще не произойти, потому что не будет нужного количества аминокислот.
На самом деле о кодировании 152 новых аминокислот и тем более получении новых белков, содержащих эти аминокислоты, речи пока не идет. Пока только продемонстрирована принципиальная возможность такого подхода, и в один известный белок введены две неприродные аминокислоты за счет расширения генетического кода. Дальнейшее расширение потребует кропотливой работы, а достижение теоретически возможного максимума кодирования займет годы. Более того,это может вообще не произойти, потому что не будет нужного количества аминокислот.
Особо надо подчеркнуть, что это работа с непонятным конечным результатом. Никто не сказал, что введение новых аминокислот действительно приведет к появлению новых белков с заданными свойствами. По сути, мы очень мало знаем, как последовательности аминокислот определяют свойства белковых молекул. Допустим, я хочу создать белок, который убивает раковые клетки. Но создать его с чистого листа, как это делал бы инженер в конструкторском бюро, практически невозможно. Синтетические биологи работают фактически вслепую, методом тыка и не знают, что получится.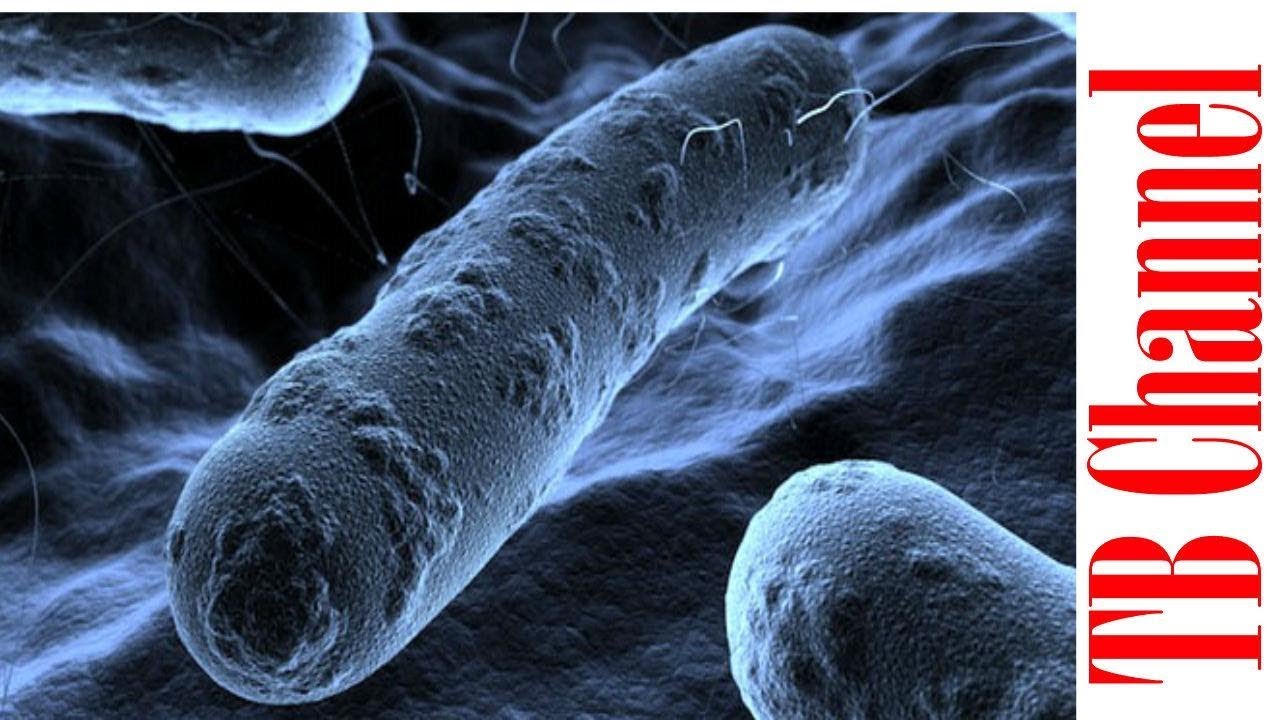 Можно искать годами, а потом попасть в «десятку», а можно и не попасть совсем. С тем же успехом можно посадить обезьяну за машинку, и она, может быть, за миллион лет настучит «Войну и мир». Ведь именно так и работала эволюция, в ходе которой отобрались прекрасно работающие белки в наших клетках. Но на это потребовались миллиарды лет. А синтетическая биология только делает первые шаги.
Можно искать годами, а потом попасть в «десятку», а можно и не попасть совсем. С тем же успехом можно посадить обезьяну за машинку, и она, может быть, за миллион лет настучит «Войну и мир». Ведь именно так и работала эволюция, в ходе которой отобрались прекрасно работающие белки в наших клетках. Но на это потребовались миллиарды лет. А синтетическая биология только делает первые шаги.
|
|
Открытия XXI века | Технологии
За 15 лет с начала нового тысячелетия люду и не заметили, что попали в иной мир: мы живем в другой солнечной системе, умеем ремонтировать гены и управлять протезами силой мысли, ничего этого в xx столетии не было.
ФИЗИКА
Глобальное потепление быстрее, чем ожидалось
В 2015 году ученые из Всемирного центра мониторинга ледников при Цюрихском университете, Швейцария, под руководством доктора Михаэля Цемпа, работая совместно с коллегами из 30 стран, установили, что темп таяния ледников на Земле к настоящему времени, по сравнению с усредненными показателями за XX век,
вырос в два-три раза.
ГЕНЕТИКА
Геном человека полностью секвенирован
Проект “Человеческий геном”, The Human Genome Project, начался в 1990 году, в 2000-м был выпущен рабочий черновик структуры генома, полный геном, в 2003 году. Однако и сегодня дополнительный анализ некоторых участков еще не закончен. В основном он был выполнен в университетах и исследовательских центрах США, Канады и Великобритании. Секвенирование генома имеет решающее значение для разработки лекарств и понимания того, как устроено человеческое тело.
Однако и сегодня дополнительный анализ некоторых участков еще не закончен. В основном он был выполнен в университетах и исследовательских центрах США, Канады и Великобритании. Секвенирование генома имеет решающее значение для разработки лекарств и понимания того, как устроено человеческое тело.
МАТЕМАТИКА
Доказана теорема Пуанкаре
В 2002 году российский математик Григорий Перельман доказал теорему Пуанкаре, одну из семи задач тысячелетия — важные математические проблемы, решение которых не найдено в течение десятков лет. Перельман показал, что исходная трехмерная поверхность, если в ней нет разрывов, обязательно будет эволюционировать в трехмерную сферу. За эту работу он получил престижную “медаль Филдса”, аналог Нобелевской премии в математике.
АСТРОНОМИЯ
Открыта карликовая планета Эрида
Впервые Эриду сфотографировали еще 21 октября 2003 года, но заметили на снимках только в начале 2005-го. Ее открытие стало последней каплей в спорах о судьбе Плутона, продолжать ли его считать планетой, что изменило привычный образ Солнечной системы.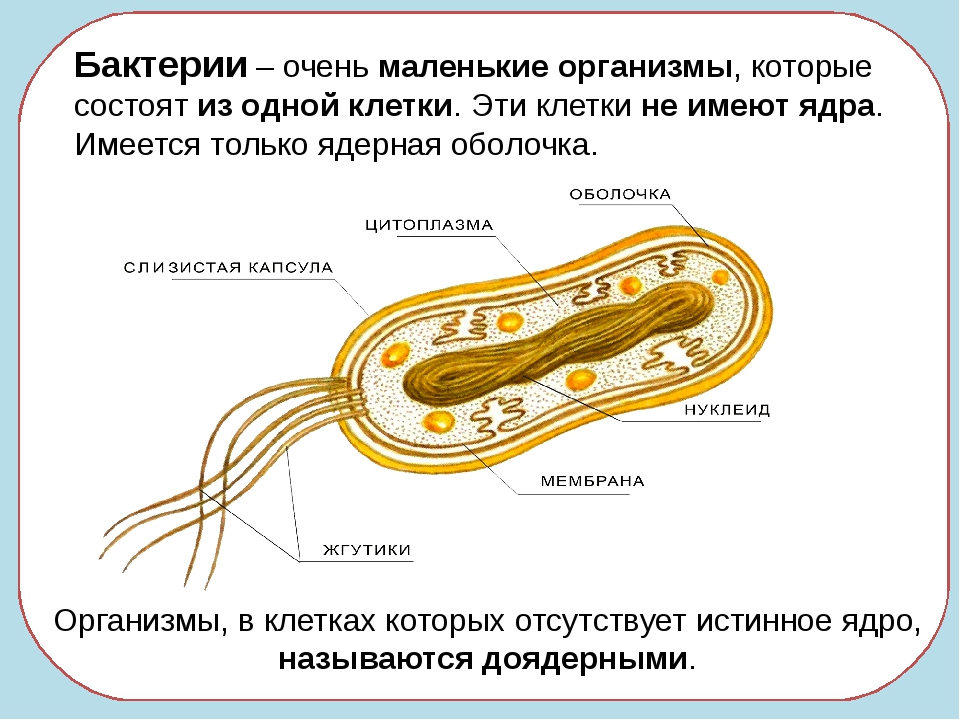
ПАЛЕОНТОЛОГИЯ
Впервые обнаружены мягкие ткани динозавра
Молекулярный палеонтолог Университета Северной Каролины Мэри Швейцер в 2005 году в окаменевшей конечности подростка
тираннозавра из Монтаны, возрастом 65 млн лет обнаружила мягкие ткани. Ранее считалось, что любые белки разложатся максимум за несколько тысяч лет, поэтому никто их в окаменелостях и не искал. После этого мягкие ткани (коллаген) были обнаружен в других древнейших образцах.
Мэри Швейцер руководила научной группой, которая описала коллаген, выденный из бедренной кости Tyrannosaurus rex.
МЕДИЦИНА
По дыханию распознана ранняя стадия рака легких
Около года назад группа израильских, американских и британских ученых разработала устройство, которое способно точно идентифицировать рак легких и определить, в какой стадий находится. Основой устройства стал анализатор дыхания со встроенным наночипом NaNose, способный “вынюхать” раковую опухоль с 90-процентной точностью, даже когда раковый узелок практически незаметен. В скором времени стоит ожидать анализаторов, которые смогут по “запаху” определять и другие виды рака.
В скором времени стоит ожидать анализаторов, которые смогут по “запаху” определять и другие виды рака.
БИОЛОГИЯ
Удачно записаны и перезаписаны воспоминания
Начиная с 2010 года несколько исследовательских групп сша, франции, германии научились записывать в мозг мышей ложные воспоминания, стирать реальные, а также превращать приятные воспоминания в неприятные. До человеческого мозга дело пока не дошло, но осталось недолго.
ФИЗИКА
Обнаружена квантовая телепортация
Такая телепортация отличается от телепортации, о которой любят говорить фантасты, — при ней материя или энергия не передаются на расстояние. Эксперименты по передаче квантовых состояний на большие расстояния были удачно проведены за последние
15 лет не менее чем десятком научных групп. Квантовая телепортация очень важна для создания сверхзащищенных шифров и квантовых компьютеров.
БИОЛОГИЯ
Создана первая синтетическая бактериальная клетка
В 2010 году ученые из Института Крейга Вентера, который был одним из лидеров гонки по расшифровке человеческого генома, создали первую полностью синтетическую хромосому с геномом. Когда ее встроили в бактериальную клетку, лишенную генетического материала, она начала функционировать и делиться по предписанным новым геномом законам. В перспективе синтетический геном позволит создавать вакцины против новых вирусных штаммов за часы, а не за недели, производить эффективное биотопливо, новые пищевые продукты и т.д.
Когда ее встроили в бактериальную клетку, лишенную генетического материала, она начала функционировать и делиться по предписанным новым геномом законам. В перспективе синтетический геном позволит создавать вакцины против новых вирусных штаммов за часы, а не за недели, производить эффективное биотопливо, новые пищевые продукты и т.д.
МЕДИЦИНА
Разработано первое полностью автономное искусственное сердце
Специалисты американской компании Abiomed разработали первое в мире полностью автономное постоянное искусственное сердце для имплантаций AbioCor. Искусственное сердце предназначено для пациентов, у которых невозможно лечение собственного сердца или имплантация донорского.
АСТРОНОМИЯ
Обнаружена вода на Марсе
В 2005 году аппарат “Марс Экспресс” Европейского космического агентства обнаружил большие залежи водяного льда недалеко от поверхности — это очень важно для последующей колонизации Красной планеты
БИОЛОГИЯ
Получены “этичные” (не из эмбрионов) плюрипотентные стволовые клетки
В 2012 году Синъя Яманака совместно с Джоном Гёрдоном стали лауреатами Нобелевской премии за открытие 2006 года — получение плюрипотентных стволовых клеток мыши путем эпигенетического перепрограммирования. За последующее десятилетие не менее десятка научных групп добились впечатляющих
За последующее десятилетие не менее десятка научных групп добились впечатляющих
успехов в данной области, в том числе с человеческими клетками. Это предвещает скорые прорывы в терапии рака, регенеративной медицине, а также в клонировании человека или его органов.
БИОНИКА
Созданы биомеханические устройства и протезы, контролируемые усилием мысли
В 2013 году появились первые опытные образцы “умных” протезов с обратной связью — эмуляцией осязательных ощущений, — которые позволяют человеку чувствовать то, что “ощущает” протез. В 2010-х годах созданы и отдельные от человека устройства, управляемые только через мысленный интерфейс иногда с инвазивными контактами, но чаще это похоже на головной обруч с сухим электродом.
Американец Зак Вотер испытал бионический ножной протез, поднявшись по лестнице на 103-й этаж небоскреба Уиллис-тауэр, расположенного в Чикаго.
20 важнейших открытий XXI века
Версия для печатиВ новом тысячелетии люди и не заметили, что попали в иной мир.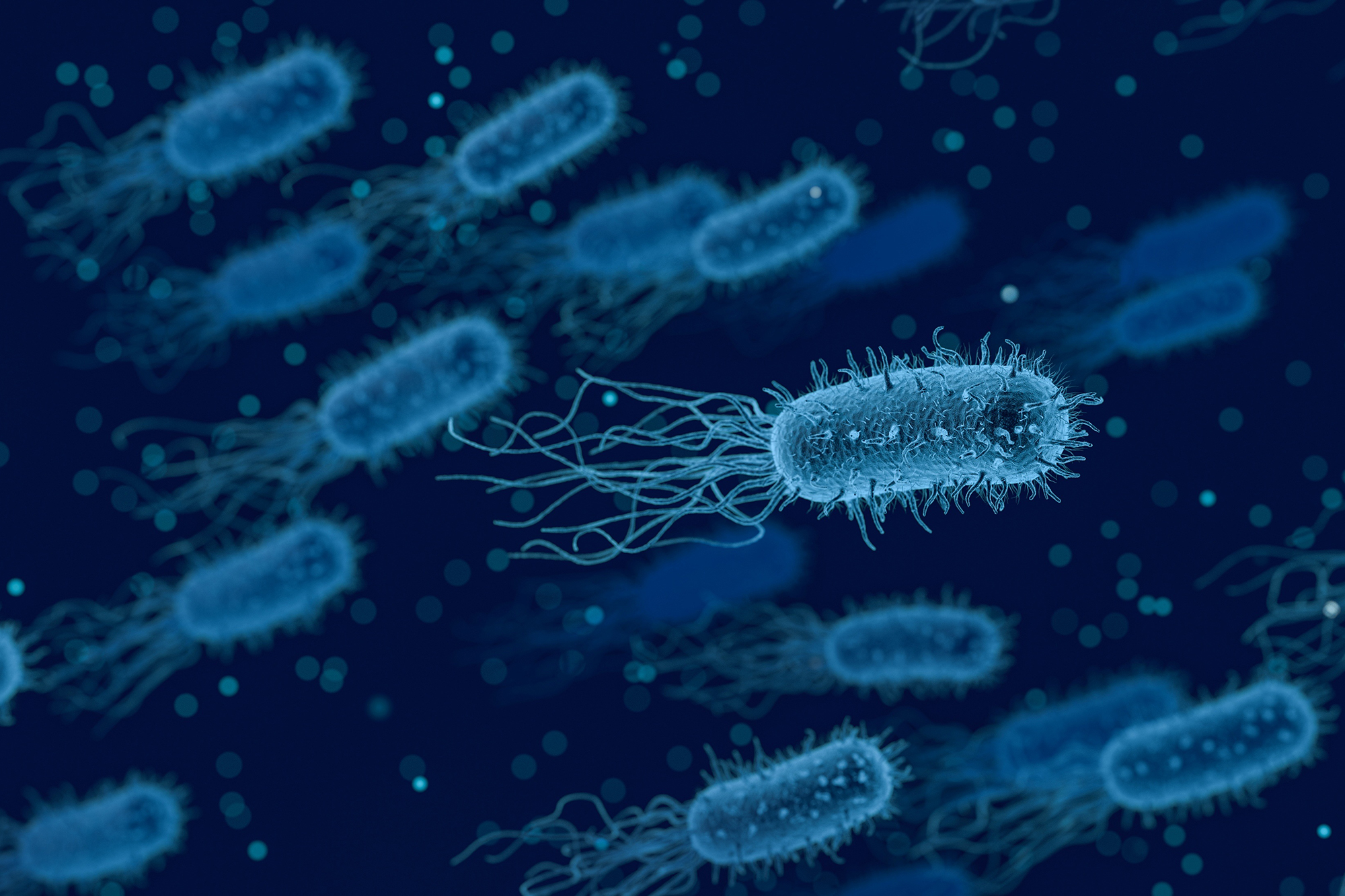
Мы живем в другой Солнечной системе, умеем ремонтировать гены и управлять протезами силой мысли. Ничего этого в XX столетии не было.
ГЕНЕТИКА
Геном человека полностью секвенирован
Робот сортирует ДНК человека в чашках Петри для проекта The Human Genome
Проект «Человеческий геном» (The Human Genome Project) начался в 1990 году, в 2000-м был выпущен рабочий черновик структуры генома, полный геном — в 2003 году. Однако и сегодня дополнительный анализ некоторых участков еще не закончен. В основном он был выполнен в университетах и исследовательских центрах США, Канады и Великобритании. Секвенирование генома имеет решающее значение для разработки лекарств и понимания того, как устроено человеческое тело.
Генная инженерия вышла на новый уровень
В последние годы был разработан революционный метод манипуляции ДНК при помощи так называемого CRISP-механизма. Эта методика позволяет избирательно редактировать определенные гены, что раньше было невозможно.
В тему: Свинья или Тигр: будущее Украины
МАТЕМАТИКА
Доказана теорема Пуанкаре
В 2002 году российский математик Григорий Перельман доказал теорему Пуанкаре, одну из семи задач тысячелетия (важные математические проблемы, решение которых не найдено в течение десятков лет). Перельман показал, что исходная трехмерная поверхность (если в ней нет разрывов) обязательно будет эволюционировать в трехмерную сферу. За эту работу он получил престижную «медаль Филдса», аналог Нобелевской премии в математике.
Открыта карликовая планета Эрида
Впервые Эриду сфотографировали еще 21 октября 2003 года, но заметили на снимках только в начале 2005-го. Ее открытие стало последней каплей в спорах о судьбе Плутона (продолжать ли его считать планетой или нет), что изменило привычный образ Солнечной системы (см. стр. 142–143).
Обнаружена вода на Марсе
В 2005 году аппарат «Марс Экспресс» Европейского космического агентства обнаружил большие залежи водяного льда недалеко от поверхности — это очень важно для последующей колонизации Красной планеты.
ФИЗИКА
Глобальное потепление — быстрее, чем ожидалось
В 2015 году ученые из Всемирного центра мониторинга ледников при Цюрихском университете (Швейцария) под руководством доктора Михаэля Цемпа, работая совместно с коллегами из 30 стран, установили, что темп таяния ледников на Земле к настоящему времени, по сравнению c усредненными показателями за XX век, вырос в два-три раза.
Обнаружена квантовая телепортация
Такая телепортация отличается от телепортации, о которой любят говорить фантасты, — при ней материя или энергия не передаются на расстояние. Эксперименты по передаче квантовых состояний на большие расстояния были удачно проведены за последние 15 лет не менее чем десятком научных групп. Квантовая телепортация очень важна для создания сверхзащищенных шифров и квантовых компьютеров.
Экспериментально подтверждено существование графена
Его двумерная (толщиной в один атом) кристаллическая решетка проявляет необычные электрофизические свойства. Впервые графен был получен Андреем Геймом и Константином Новоселовым в 2004 году (Нобелевская премия за 2010-й). Его планируется использовать в электронике (в сверхтонких и сверхбыстрых транзисторах), композитах, электродах и т. д. Кроме того, графен — второй по прочности материал на свете (на первом месте — карбин).
Впервые графен был получен Андреем Геймом и Константином Новоселовым в 2004 году (Нобелевская премия за 2010-й). Его планируется использовать в электронике (в сверхтонких и сверхбыстрых транзисторах), композитах, электродах и т. д. Кроме того, графен — второй по прочности материал на свете (на первом месте — карбин).
Доказано существование кварк-глюонной плазмы
В 2012 году эксперименты физиков, работающих с ускорителем RHIC в Брукхейвенской национальной лаборатории (США), попали в Книгу рекордов Гиннесса с формулировкой «за самую высокую температуру, полученную в лабораторных условиях». Сталкивая ионы золота на ускорителе, ученые добились возникновения кварк-глюонной плазмы с температурой 4 триллиона °С (в 250 тысяч раз горячее, чем в центре Солнца). Спустя примерно микросекунду после Большого взрыва Вселенная была наполнена как раз такой плазмой.
Найден бозон Хиггса
Существование этой элементарной частицы, отвечающей за массу всех прочих частиц, теоретически было предсказано Питером Хиггсом еще в 1960-х годах. А найдена она была во время экспериментов на Большом адронном коллайдере в 2012-м (за что Хиггс, совместно с Франсуа Энглером, получил Нобелевскую премию 2013 года).
А найдена она была во время экспериментов на Большом адронном коллайдере в 2012-м (за что Хиггс, совместно с Франсуа Энглером, получил Нобелевскую премию 2013 года).
БИОЛОГИЯ
Людей поделили на три энтеротипа
В 2011 году ученые из Германии, Франции и нескольких других исследовательских центров доказали, что по генетике населяющих нас бактерий люди делятся на три категории, или энтеротипа. Энтеротип человека проявляется в разной реакции на еду, лекарства и диеты, и потому стало ясно, что никаких универсальных рецептов в этих областях существовать не может.
Создана первая синтетическая бактериальная клетка
В 2010 году ученые из Института Крейга Вентера (был одним из лидеров гонки по расшифровке человеческого генома) создали первую полностью синтетическую хромосому с геномом. Когда ее встроили в бактериальную клетку, лишенную генетического материала, она начала функционировать и делиться по предписанным новым геномом законам. В перспективе синтетический геном позволит создавать вакцины против новых вирусных штаммов за часы, а не за недели, производить эффективное биотопливо, новые пищевые продукты и т. д.
В перспективе синтетический геном позволит создавать вакцины против новых вирусных штаммов за часы, а не за недели, производить эффективное биотопливо, новые пищевые продукты и т. д.
Удачно записаны и перезаписаны воспоминания
Начиная с 2010 года несколько исследовательских групп (США, Франция, Германия) научились записывать в мозг мышей ложные воспоминания, стирать реальные, а также превращать приятные воспоминания в неприятные. До человеческого мозга дело пока не дошло, но осталось недолго.
Получены «этичные» (не из эмбрионов) плюрипотентные стволовые клетки
В 2012 году Синъя Яманака совместно с Джоном Гёрдоном стали лауреатами Нобелевской премии за открытие 2006 года — получение плюрипотентных стволовых клеток мыши путем эпигенетического перепрограммирования. За последующее десятилетие не менее десятка научных групп добились впечатляющих успехов в данной области, в том числе с человеческими клетками. Это предвещает скорые прорывы в терапии рака, регенеративной медицине, а также в клонировании человека (или его органов).
Это предвещает скорые прорывы в терапии рака, регенеративной медицине, а также в клонировании человека (или его органов).
ПАЛЕОНТОЛОГИЯ
Впервые обнаружены мягкие ткани динозавра
Мэри Швейцер руководила научной группой, которая описала коллаген, выделенный из бедренной кости Tyrannosaurus reх
Молекулярный палеонтолог Университета Северной Каролины Мэри Швейцер в 2005 году в окаменевшей конечности подростка-тираннозавра из Монтаны (возрастом 65 млн лет) обнаружила мягкие ткани. Ранее считалось, что любые белки разложатся максимум за несколько тысяч лет, поэтому никто их в окаменелостях и не искал. После этого мягкие ткани (коллаген) были обнаружены и в других древнейших образцах.
У людей обнаружены гены неандертальцев и «денисовского человека»
Участники международного симпозиума «Переход к верхнему палеолиту в Евразии: культурная динамика и развитие рода Homo» осматривают место раскопок в центральном зале Денисовой пещеры
Из работ двух научных групп стало ясно, что от 1 до 3% генома среднестатистического европейца или азиата восходит к неандертальцам. Но у каждого современного индивидуума присутствуют несхожие неандертальские аллели (различные формы одного и того же гена), поэтому общая сумма «неандертальских» генов куда выше, до 30%. «Наследники» неандертальцев (скрещивание происходило около 45 тысяч лет назад) — в основном европейцы; у азиатов в геноме присутствуют следы скрещивания с еще одним гоминидом — «денисовским человеком». Самые «чистые» Homo sapiens — уроженцы Африканского континента.
Но у каждого современного индивидуума присутствуют несхожие неандертальские аллели (различные формы одного и того же гена), поэтому общая сумма «неандертальских» генов куда выше, до 30%. «Наследники» неандертальцев (скрещивание происходило около 45 тысяч лет назад) — в основном европейцы; у азиатов в геноме присутствуют следы скрещивания с еще одним гоминидом — «денисовским человеком». Самые «чистые» Homo sapiens — уроженцы Африканского континента.
В тему: Терабайты — «нефть» будущего. Метод анализа больших данных меняет социальную реальность
МЕДИЦИНА
По дыханию распознана ранняя стадия рака легких
Год назад группа израильских, американских и британских ученых разработала устройство, которое способно точно идентифицировать рак легких и определить, в какой стадии он находится. Основой устройства стал анализатор дыхания со встроенным наночипом NaNose, способный «вынюхать» раковую опухоль с 90-процентной точностью, даже когда раковый узелок практически незаметен. В скором времени стоит ожидать анализаторов, которые смогут по «запаху» определять и другие виды рака.
В скором времени стоит ожидать анализаторов, которые смогут по «запаху» определять и другие виды рака.
Разработано первое полностью автономное искусственное сердце
Специалисты американской компании Abiomed разработали первое в миреполностью автономное постоянное искусственное сердце для имплантаций (AbioCor). Искусственное сердце предназначено для пациентов, у которых невозможно лечение собственного сердца или имплантация донорского.
БИОНИКА
Созданы биомеханические устройства и протезы, контролируемые усилием мысли
Американец Зак Вотер испытал бионический ножной протез, поднявшись по лестнице на 103-й этаж небоскреба Уиллис-тауэр, расположенного в Чикаго
В тему: Как родная. Бионический протез руки с обратной связью
В 2013 году появились первые опытные образцы «умных» протезов с обратной связью (эмуляцией осязательных ощущений), которые позволяют человеку чувствовать то, что «ощущает» протез. В 2010-х годах созданы и отдельные от человека устройства, управляемые только через мысленный интерфейс (иногда с инвазивными контактами, но чаще это похоже на головной обруч с сухим электродом), — компьютерные игры и тренажеры, манипуляторы, транспорт и пр.
В 2010-х годах созданы и отдельные от человека устройства, управляемые только через мысленный интерфейс (иногда с инвазивными контактами, но чаще это похоже на головной обруч с сухим электродом), — компьютерные игры и тренажеры, манипуляторы, транспорт и пр.
ЭЛЕКТРОНИКА
Перейден петафлопсный барьер
В 2008 году новый суперкомпьютер в Лос-Аламосе (США) заработал со скоростью более квадриллиона (тысяча триллионов) операций в секунду. Следующий барьер, эксафлопсный (квинтиллион операций в секунду) будет достигнут в ближайшие годы. Системы с такой невероятной скоростью необходимы в первую очередь для высокопроизводительных вычислений — обработки данных научных экспериментов, климатического моделирования, финансовых операций и т. д.
Фото: Alamy, SPL, Newscom / Legion Media, SPL / Legion Media (X2), Photo courtesy of North Carolina State University, Reuters / Pix- Stream, Александр Кряжев / РИА Новости, Reuters / Pix-Stream, Michael Hoch, Maximilien Brice / © 2008 CERN, for the benefit of the CMS Collaboration, AP / East News
—
Опубликовано в журнале Вокруг света
В тему:
Первая самовоспроизводящаяся синтетическая бактериальная клетка
Наука о геноме значительно расширила наше понимание биологического мира. Это позволяет исследователям «читать» генетический код организмов из всех ветвей жизни, определяя последовательность четырех букв, составляющих ДНК. Секвенирование геномов теперь стало рутиной, что привело к появлению тысяч геномов в общедоступных базах данных. По сути, ученые оцифровывают биологию, преобразуя А, С, Т и G химического состава ДНК в единицы и нули в компьютере.Но можно ли обратить процесс вспять и начать с 1 и 0 в компьютере, чтобы определить характеристики живой клетки? Мы взялись ответить на этот вопрос.
Это позволяет исследователям «читать» генетический код организмов из всех ветвей жизни, определяя последовательность четырех букв, составляющих ДНК. Секвенирование геномов теперь стало рутиной, что привело к появлению тысяч геномов в общедоступных базах данных. По сути, ученые оцифровывают биологию, преобразуя А, С, Т и G химического состава ДНК в единицы и нули в компьютере.Но можно ли обратить процесс вспять и начать с 1 и 0 в компьютере, чтобы определить характеристики живой клетки? Мы взялись ответить на этот вопрос.
В области химии, после того как химики определили структуру нового химического соединения, следующим важным шагом является попытка синтезировать химическое вещество. Это доказывает, что синтетическая структура выполняет ту же функцию, что и исходный материал. До сих пор это было невозможно в области геномики. Структуры были определены путем чтения генетического кода, но их никогда не удавалось проверить с помощью независимого синтеза.
В 2003 году JCVI успешно синтезировала небольшой вирус, поражающий бактерии. К 2008 году команда JCVI смогла синтезировать небольшой бактериальный геном; однако в то время они не смогли активировать этот геном в клетке.
К 2008 году команда JCVI смогла синтезировать небольшой бактериальный геном; однако в то время они не смогли активировать этот геном в клетке.
Колонии трансформированной бактерии Mycoplasma mycoides .
Изображение предоставлено Институтом Дж. Крейга Вентера.
Теперь эта научная группа во главе с доктором. Крейг Вентер, Гамильтон Смит и Клайд Хатчисон сделали последний шаг в своем стремлении создать первую синтетическую бактериальную клетку.В публикации в журнале Science Дэниел Гибсон, доктор философии , и группа из 23 дополнительных исследователей описывают этапы синтеза генома Mycoplasma mycoides из 1,08 миллиона пар оснований, сконструированного из четырех флаконов с химическими веществами, составляющими ДНК. Этот синтетический геном был «запущен» в клетку, чтобы создать первую клетку, полностью контролируемую синтетическим геномом.
Сборка синтетического генома M. mycoides у дрожжей. Рисунок из Gibson, DG, JI Glass, et al. 2010. Создание бактериальной клетки, управляемой химически синтезированным геномом. Наука, Опубликовано в Интернете 20 мая 2010 г.
2010. Создание бактериальной клетки, управляемой химически синтезированным геномом. Наука, Опубликовано в Интернете 20 мая 2010 г.
Просмотр PDF в высоком разрешении.
Работа по созданию первой синтетической бактериальной клетки была непростой и заняла у этой команды примерно 15 лет. Попутно им пришлось разработать новые инструменты и методы для создания больших сегментов генетического кода и научиться трансплантировать геномы, чтобы преобразовать один вид в другой. Синтетический М. из 1,08 млн пар оснований.mycoides геном представляет собой самую большую химически определенную структуру, когда-либо синтезированную в лаборатории.
Хотя эта первая конструкция, получившая название M. mycoides JCVI-syn1.0, является доказательством концепции, инструменты и технологии, разработанные для создания этой клетки, имеют большие перспективы для применения во многих критических областях. В ходе этой работы команда обдумывала, обсуждала и участвовала в независимом обзоре этических и социальных последствий своей работы.
Негативно окрашенные трансмиссионные электронные микрофотографии делящихся M.микоиды JCVI-syn1. Свежефиксированные клетки окрашивали с использованием 1% уранилацетата на чистом углеродном субстрате, визуализировали с помощью просвечивающего электронного микроскопа JEOL 1200EX при 80 кэВ. Электронные микрофотографии были предоставлены Томом Диринком и Марком Эллисманом из Национального центра исследований микроскопии и визуализации Калифорнийского университета в Сан-Диего.
Просмотр JPEG высокого разрешения.
Возможность регулярно писать программное обеспечение жизни откроет новую эру в науке, а вместе с ней и новые продукты и приложения, такие как современное биотопливо, технология очистки воды, новые вакцины и лекарства.Эта область уже оказывает влияние на некоторые из этих областей и будет продолжать это делать до тех пор, пока эта мощная новая область науки будет использоваться с умом. Для процветания этой области необходимы непрерывный и интенсивный обзор и диалог со всеми слоями общества, от Конгресса до специалистов по биоэтике и обычных людей.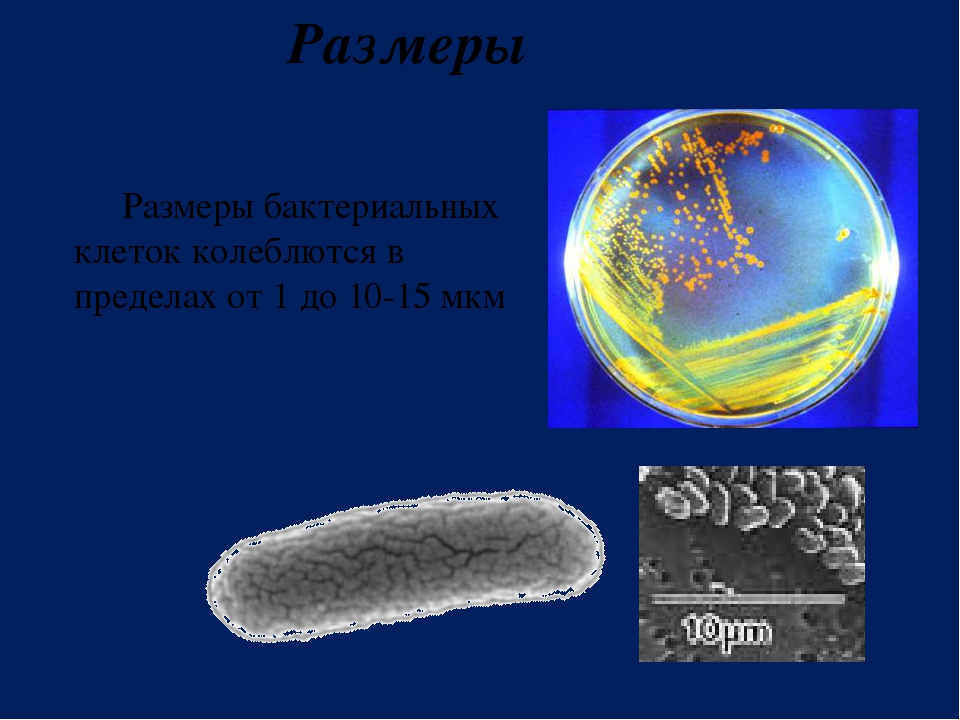
Финансирование
Этот проект финансировался Synthetic Genomics, Inc.
ученых создали первый синтетический бактериальный геном — крупнейшая химически определенная структура синтезирована в лаборатории — ScienceDaily
Группа из 17 исследователей из J.Институт Крейга Вентера (JCVI) создал крупнейшую искусственную структуру ДНК путем синтеза и сборки 582 970 пар оснований генома бактерии Mycoplasma genitalium JCVI-1.0. Эта работа, опубликованная сегодня в журнале Science Дэном Гибсоном, доктором философии и соавторами, является вторым из трех ключевых шагов на пути к цели команды — созданию полностью синтетического организма. На следующем этапе, который продолжается в JCVI, команда попытается создать живую бактериальную клетку, полностью основанную на синтетическом геноме.
Команда достигла этого технического подвига, создав химическим путем фрагменты ДНК в лаборатории и разработав новые методы сборки и воспроизведения сегментов ДНК. После нескольких лет работы по совершенствованию химической сборки команда обнаружила, что они могут использовать гомологичную рекомбинацию (процесс, который клетки используют для восстановления повреждений своих хромосом) у дрожжей Saccharomyces cerevisiae для быстрого построения полной бактериальной хромосомы из больших субсборок.
«Это выдающееся достижение — технологическое чудо, которое стало возможным только благодаря уникальной и опытной команде JCVI», — сказал Дж.Крейг Вентер, доктор философии, президент и основатель JCVI. «Хэм Смит, Клайд Хатчисон, Дэн Гибсон, Гвин Бендерс и другие члены этой команды посвятили последние несколько лет разработке и совершенствованию новых методов и техник, которые, как мы полагаем, будут широко использоваться для развития области синтетической геномики».
Строительные блоки ДНК — аденин (A), гуанин (G), цитозин (C) и тиамин (T) — непростые химические вещества для искусственного синтеза в хромосомы. По мере того, как нити ДНК становятся длиннее, они становятся все более хрупкими, что затрудняет работу с ними.До сегодняшней публикации самая большая синтезированная ДНК содержала всего 32 000 пар оснований. Таким образом, создание синтетической версии генома бактерий M. genitalium, состоящей из более чем 580 000 пар оснований, представляло собой сложную задачу. Тем не менее, команда JCVI обладает опытом во многих технических областях и глубоким биологическим пониманием нескольких видов микоплазм.
Тем не менее, команда JCVI обладает опытом во многих технических областях и глубоким биологическим пониманием нескольких видов микоплазм.
«Когда мы начали эту работу несколько лет назад, мы знали, что это будет сложно, потому что мы ступаем на неизвестную территорию», — сказал Гамильтон Смит, М.Д., старший автор публикации. «Благодаря специальной командной работе мы показали, что создание больших геномов теперь осуществимо и масштабируемо, что позволяет разрабатывать важные приложения, такие как биотопливо».
Методы создания синтетического M. genitalium
Процесс синтеза и сборки синтетической версии хромосомы M. genitalium начался сначала с повторного секвенирования нативного генома M. genitalium, чтобы гарантировать, что команда начала с безошибочной последовательности.Получив эту правильную версию нативного генома, команда специально разработала фрагменты химически синтезированной ДНК для создания 101 «кассеты» из 5000–7000 пар оснований генетического кода. Чтобы отличить синтетический геном от нативного, команда создала «водяные знаки» в синтетическом геноме. Это короткие вставленные или замещенные последовательности, которые кодируют информацию, обычно не встречающуюся в природе. Другие изменения, которые команда внесла в синтетический геном, включали разрушение гена для блокировки инфекционности.Чтобы получить кассеты, команда JCVI работала в основном с компанией Blue Heron Technology, занимающейся синтезом ДНК, а также с DNA 2.0 и GENEART.
Чтобы отличить синтетический геном от нативного, команда создала «водяные знаки» в синтетическом геноме. Это короткие вставленные или замещенные последовательности, которые кодируют информацию, обычно не встречающуюся в природе. Другие изменения, которые команда внесла в синтетический геном, включали разрушение гена для блокировки инфекционности.Чтобы получить кассеты, команда JCVI работала в основном с компанией Blue Heron Technology, занимающейся синтезом ДНК, а также с DNA 2.0 и GENEART.
Отсюда команда разработала пятиэтапный процесс сборки, в котором кассеты соединялись вместе в подсборки, чтобы создавать все более и более крупные части, которые в конечном итоге объединялись для создания цельного синтетического генома M. genitalium. На первом этапе наборы из четырех кассет были соединены для создания 25 подсборок, каждая из которых содержала около 24 000 пар оснований (24 т.п.н.).Эти фрагменты размером 24 т.п.н. были клонированы в бактерию Escherichia coli для получения достаточного количества ДНК для следующих этапов и проверки последовательности ДНК.
Следующий шаг включал объединение трех фрагментов по 24 т.п.н. вместе для создания 8 собранных блоков, каждый из которых содержит около 72 000 пар оснований. Эти 1/8 фрагменты всего генома были снова клонированы в E. coli для производства ДНК и секвенирования ДНК. Третий этап включал объединение двух фрагментов 1/8 вместе для получения больших фрагментов размером примерно 144 000 пар оснований или 1/4 всего генома.
На этом этапе команда не могла получить половинные клоны генома E. coli, поэтому команда экспериментировала с дрожжами и обнаружила, что они хорошо переносят большие чужеродные молекулы ДНК, и что они могут собирать фрагменты вместе путем гомологичной рекомбинации. Этот процесс использовался для сборки последних кассет, от 1/4 фрагментов генома до конечного генома из более чем 580 000 пар оснований. Окончательная хромосома была снова секвенирована, чтобы подтвердить полную точную химическую структуру.
Синтетический M. genitalium имеет молекулярную массу 360 110 килодальтон (кДа). Буквы генома M. genitalium JCVI-1.0, напечатанные шрифтом 10 пунктов, занимают 147 страниц.
Буквы генома M. genitalium JCVI-1.0, напечатанные шрифтом 10 пунктов, занимают 147 страниц.
«Это захватывающий прогресс для нашей команды и поля. Тем не менее, мы продолжаем работать над достижением конечной цели — вставить синтетическую хромосому в клетку и запустить ее для создания первого синтетического организма», — сказал Дэн Гибсон, ведущий автор.
Исследования по созданию синтетического штамма M.genitalium JCVI-1.0 финансировалась Synthetic Genomics, Inc.
Предыстория/основные вехи исследований JCVI в области синтетической геномики
Работа, описанная Gibson et al. берет свое начало в исследованиях доктора Вентера и его коллег в середине 1990-х годов после секвенирования M. genitalium и начала работы над проектом минимального генома. Эта область исследований, направленная на изучение минимальных генетических компонентов, необходимых для поддержания жизни, началась с M. genitalium, потому что это бактерия с наименьшим из известных нам геномов, которую можно выращивать в чистой культуре. Эта работа была опубликована в журнале Science в 1995 году.
Эта работа была опубликована в журнале Science в 1995 году.
В 2003 г. д-р. Вентер, Смит и Хатчисон добились первых значительных успехов в разработке синтетического генома благодаря своей работе по сборке бактериофага ΦX174 (phi X) из 5386 пар оснований. Они сделали это, используя короткие одноцепочечные синтетически коммерчески доступные ДНК (известные как олигонуклеотиды) и используя адаптацию полимеразной цепной реакции (ПЦР), известную как сборка полимеразного цикла (PCA), для построения генома phi X.Команда произвела синтетический phi X всего за 14 дней.
В июне 2007 г. было достигнуто еще одно крупное достижение, когда исследователи JCVI во главе с Кэрол Лартиг, доктором философии, объявили о результатах работы над методами трансплантации генома, позволяющими им трансформировать один тип бактерий в другой тип, определяемый трансплантированной хромосомой. Работа была опубликована в журнале Science, и в ней описывались методы и приемы, используемые для изменения одного вида бактерий, Mycoplasma capricolum, на другой, Mycoplasma mycoides Large Colony (LC), путем замены генома одного организма геномом другого.
Трансплантация генома была первым важным шагом в области синтетической геномики, поскольку это ключевой механизм, с помощью которого химически синтезированные хромосомы могут быть активированы в жизнеспособные живые клетки. Сегодняшнее объявление об успешном синтезе генома M. genitalium — это второй шаг, ведущий к следующим экспериментам по пересадке полностью синтетической бактериальной хромосомы в живой организм и «запуску» клетки.
Этические соображения
С самого начала стремления понять и построить синтетический геном, Dr.Вентер и его команда были обеспокоены социальными проблемами, связанными с работой. В 1995 г., когда группа занималась исследованием минимального генома, эта работа подверглась серьезной этической проверке группой экспертов Пенсильванского университета (Cho et al., Science, декабрь 1999 г.: том 286, № 5447, стр. 2087). – 2090). Независимые обсуждения биоэтической группы, опубликованные одновременно с научным исследованием минимального генома, привели к единогласному решению об отсутствии веских этических причин, по которым работа не должна продолжаться, пока участвующие ученые продолжают участвовать в общественном обсуждении.
Д-р Вентер и команда JCVI продолжают работать со специалистами по биоэтике, внешними политическими группами, членами и сотрудниками законодательных органов, а также с общественностью, чтобы способствовать обсуждению и пониманию социальных последствий их работы и области синтетической геномики в целом. Таким образом, политическая группа JCVI вместе с Центром стратегических и международных исследований (CSIS) и Массачусетским технологическим институтом (MIT) финансировалась за счет гранта Фонда Альфреда П. Слоана на 20-месячное исследование, которое исследовали риски и преимущества этой новой технологии, а также возможные меры предосторожности для предотвращения злоупотреблений, включая биотерроризм.После нескольких семинаров и публичных сессий в октябре 2007 года группа опубликовала отчет, в котором изложены возможности для этой области и ее исследователей.
Безупречное творение: рождение первой синтетической клетки
Юэн Каллауэй
Возрождение жизни: синие колонии указывают на успешно пересаженный геном
(Изображение: JCVI)
Впервые учёные создали жизнь с нуля — ну вроде того.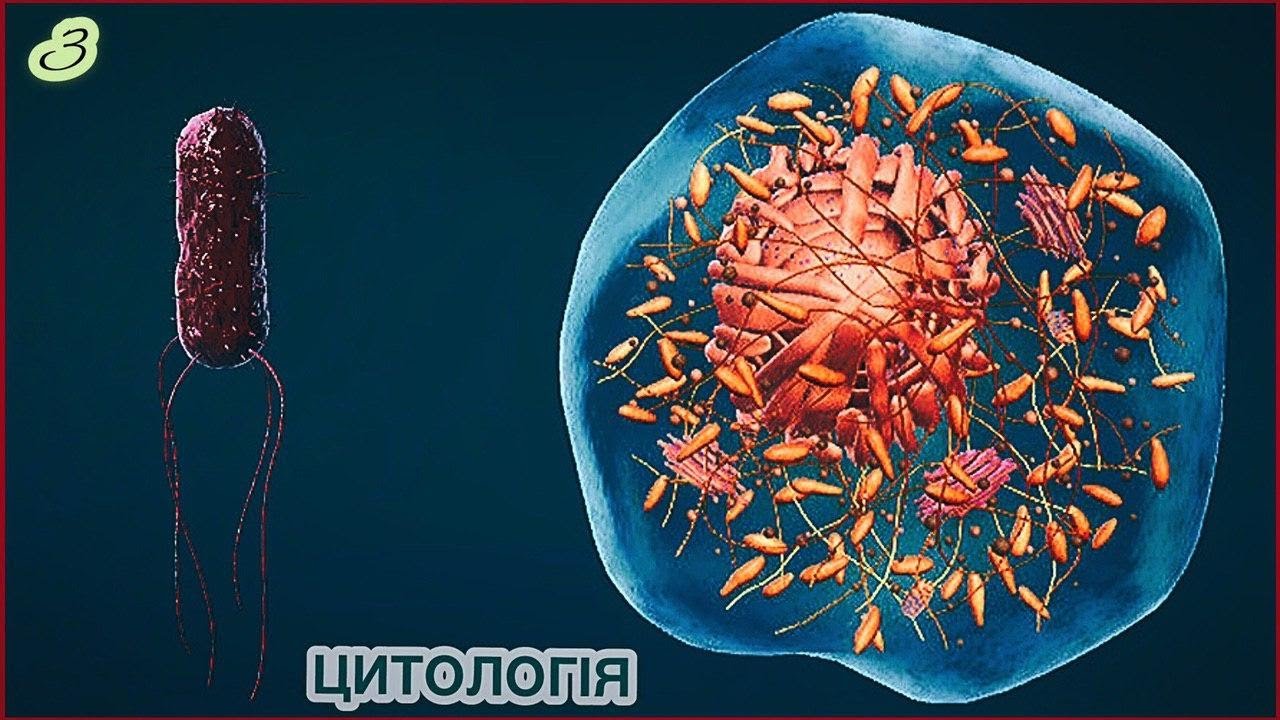 Команда Крейга Вентера из Института Дж. Крейга Вентера в Роквилле, штат Мэриленд, и Сан-Диего, Калифорния, создала бактериальный геном из более мелких субъединиц ДНК, а затем пересадила его целиком в другую клетку. Итак, в чем именно состоит наука, стоящая за первой синтетической клеткой, и каково ее более широкое значение?
Команда Крейга Вентера из Института Дж. Крейга Вентера в Роквилле, штат Мэриленд, и Сан-Диего, Калифорния, создала бактериальный геном из более мелких субъединиц ДНК, а затем пересадила его целиком в другую клетку. Итак, в чем именно состоит наука, стоящая за первой синтетической клеткой, и каково ее более широкое значение?
Что сделала команда Вентера?
Клетка была создана путем сшивания генома козьего патогена под названием Mycoplasma mycoides из небольших фрагментов ДНК, синтезированных в лаборатории, и вставки генома в пустую цитоплазму родственной бактерии.Трансплантированный геном загрузился в своей клетке-хозяине, а затем снова и снова делился, образуя миллиарды клеток M. mycoides .
Вентер и его команда ранее совершали оба подвига — создание синтетического генома и трансплантацию генома из одной бактерии в другую — но на этот раз они объединили их.
«Это первая самовоспроизводящаяся клетка на планете, родителем которой является компьютер», — говорит Вентер, имея в виду тот факт, что его команда преобразовала геном клетки, который существовал в виде данных на компьютере, в живой организм.
Как они могут быть уверены, что новые бактерии — это то, что они задумали?
Вентер и его команда ввели в свой синтезированный геном несколько отличительных маркеров. Все они были обнаружены в синтетической клетке при ее секвенировании.
Эти маркеры не производят никаких белков, но содержат имена 46 ученых, участвующих в проекте, и несколько цитат, записанных секретным кодом. Маркеры также содержат ключ к коду.
Взломайте код, и вы сможете прочитать сообщения, но в качестве подсказки Вентер раскрыл цитаты: «Жить, ошибаться, падать, побеждать, воссоздавать жизнь из жизни», из книги Джеймса Джойса «Портрет художника в юности» ; «Видеть вещи не такими, какие они есть, а такими, какими они могли бы быть», — это взято из American Prometheus , биографии физика-ядерщика Роберта Оппенгеймера; и знаменитые слова Ричарда Фейнмана & двоеточие; «То, что я не могу построить, я не могу понять.
Значит ли это, что они создали жизнь?
Это зависит от того, как вы определяете «создание» и «жизнь». Команда Вентера создала новый геном из последовательностей ДНК, которые изначально были созданы машиной, но бактерии и дрожжевые клетки были использованы для сшивания и дублирования миллионов пар оснований, содержащихся в нем. Клетка, в которую затем был пересажен синтетический геном, содержала собственные белки, липиды и другие молекулы.
Команда Вентера создала новый геном из последовательностей ДНК, которые изначально были созданы машиной, но бактерии и дрожжевые клетки были использованы для сшивания и дублирования миллионов пар оснований, содержащихся в нем. Клетка, в которую затем был пересажен синтетический геном, содержала собственные белки, липиды и другие молекулы.
Сам Вентер утверждает, что он не создал жизнь.«Мы создали первую синтетическую клетку», — говорит он. «Мы определенно не создали жизнь с нуля, потому что использовали реципиентную клетку для загрузки синтетической хромосомы».
Согласны вы или нет — вопрос философский, а не научный, поскольку нет никакой биологической разницы между синтетическими бактериями и настоящими, — говорит Энди Эллингтон, биолог-синтетик из Техасского университета в Остине. «У бактерий не было души, и не было какого-то анимистического свойства бактерий, которые менялись», — говорит он.
Что можно сделать с синтетической клеткой?
Работа Вентера была доказательством принципа, но будущие синтетические клетки можно было бы использовать для создания лекарств, биотоплива и других полезных продуктов. Он сотрудничает с Exxon Mobil в производстве биотоплива из водорослей и с Novartis в создании вакцин.
Он сотрудничает с Exxon Mobil в производстве биотоплива из водорослей и с Novartis в создании вакцин.
«Уже в следующем году вакцину против гриппа можно будет производить синтетическим путем, — говорит Вентер.
Эллингтон также считает, что синтетические бактерии имеют потенциал в качестве научного инструмента.По его словам, было бы интересно создать бактерии, которые производят новую аминокислоту — химические единицы, из которых состоят белки, — и посмотреть, как эти бактерии эволюционируют по сравнению с бактериями, производящими обычный набор аминокислот. «Мы можем задать эти вопросы о клетках-киборгах так, как никогда раньше».
Сколько стоило создание жизни?
Около 40 миллионов долларов. Дешево для божества, дорого, если вы лаборант, желающий создать собственную синтетическую бактерию.«Не похоже, что в ближайшем будущем обычная лаборатория сможет это сделать», — говорит Эллингтон.
Это напоминает мне монстра Франкенштейна! Безопасны ли синтетические клетки?
Да. Команда Вентера извлекла гены, которые позволяют M. mycoides вызывать заболевания у коз. Бактерия также была искалечена, поэтому маловероятно, что она будет расти за пределами лаборатории. Однако некоторые ученые обеспокоены тем, что синтетические организмы потенциально могут попасть в окружающую среду или быть использованы биотеррористами.
Команда Вентера извлекла гены, которые позволяют M. mycoides вызывать заболевания у коз. Бактерия также была искалечена, поэтому маловероятно, что она будет расти за пределами лаборатории. Однако некоторые ученые обеспокоены тем, что синтетические организмы потенциально могут попасть в окружающую среду или быть использованы биотеррористами.
Эллингтон отмахивается от этих опасений, отмечая, что сложность создания клеток выходит за рамки возможностей всех потенциальных биотеррористов. «Это не реальная угроза, — говорит он. «Если вы не Крейг Вентер с командой из 20 постдоков, вы не собираетесь этого делать».
Однако Джордж Черч, биолог-синтетик из Гарвардской медицинской школы, призывает к усилению наблюдения, лицензированию и дополнительным мерам для предотвращения случайного высвобождения синтетической жизни. «Каждый в экосистеме синтетической биологии должен иметь лицензию, как и все в авиационной системе.
Ссылка на журнал: Наука , DOI: 10. 1126/наука.1190719
1126/наука.1190719
Еще на эту тему:
Синтетический бактериальный геном завладевает клеткой
На последнем этапе команда под руководством Дэниела Г. Гибсона, Гамильтона О. Смита и доктора Вентера сообщает в четверг в номере журнала Science, что синтетическая ДНК захватывает бактериальную клетку точно так же, как это делала природная ДНК, заставляя клетку генерировать белки, указанные в генетической информации новой ДНК, а не в своем собственном геноме.
Команда заказала фрагменты ДНК длиной 1000 единиц у Blue Heron, компании, которая специализируется на синтезе ДНК, и разработала метод сборки более коротких фрагментов в полный геном. Стоимость проекта составила 40 миллионов долларов, большая часть которых была оплачена Synthetic Genomics, компанией, основанной доктором Вентером.
Но бактерия, используемая группой Вентер, непригодна для производства биотоплива, и доктор Вентер сказал, что перейдет на другие организмы. Synthetic Genomics заключила контракт с Exxon на производство биотоплива из водорослей. Exxon готова потратить до 600 миллионов долларов, если все этапы будут выполнены. Доктор Вентер сказал, что попытается построить «полный геном водорослей, чтобы мы могли варьировать от 50 до 60 различных параметров роста водорослей, чтобы создавать сверхпродуктивные организмы».
Exxon готова потратить до 600 миллионов долларов, если все этапы будут выполнены. Доктор Вентер сказал, что попытается построить «полный геном водорослей, чтобы мы могли варьировать от 50 до 60 различных параметров роста водорослей, чтобы создавать сверхпродуктивные организмы».
Во время кругосветного путешествия на яхте доктор Вентер проанализировал ДНК многих микробов в морской воде и теперь имеет библиотеку из около 40 миллионов генов, в основном из водорослей. По его словам, эти гены станут ресурсом, позволяющим водорослям, содержащимся в неволе, производить полезные химические вещества.
Некоторые другие ученые говорят, что помимо сборки большого фрагмента ДНК, доктор Вентер не открыл ничего нового. «На мой взгляд, Крейг несколько преувеличил важность этого», — сказал Дэвид Балтимор, генетик из Калифорнийского технологического института. Он описал результат как «техническое проявление силы», вопрос масштаба, а не научный прорыв.
«Он не создал жизнь, а лишь подражал ей», — сказал доктор Балтимор.
Подход доктора Вентера «не обязательно находится на пути» к производству полезных микроорганизмов, сказал Джордж Черч, исследователь генома из Гарвардской медицинской школы.Лерой Худ из Института системной биологии в Сиэтле назвал отчет доктора Вентера «блестящим», но сказал, что сначала нужно понять гены и сети более низкого уровня, прежде чем пытаться создавать целые организмы с нуля.
В 2002 году Эккард Уиммер из Университета штата Нью-Йорк в Стоуни-Брук синтезировал геном вируса полиомиелита. Геном сконструировал живой вирус полиомиелита, который заражал и убивал мышей. Работа доктора Вентера над бактерией аналогична в принципе, за исключением того, что длина генома вируса полиомиелита составляет всего 7500 единиц, а геном бактерии более чем в 100 раз длиннее.
Первая минимальная синтетическая бактериальная клетка
Исследователи из Института Дж. Крейга Вентера (JCVI) и компании Synthetic Genomics, Inc. (SGI) объявили сегодня о разработке и создании первой минимальной синтетической бактериальной клетки JCVI-syn3. 0.
0.
Используя первую синтетическую клетку Mycoplasma mycoides JCVI-syn1.0 (созданную той же командой в 2010 г.), JCVI-syn3.0 был разработан в процессе проектирования, сборки и тестирования с использованием генов из JCVI-syn1.0. Новая минимальная синтетическая клетка содержит 531 560 пар оснований и всего 473 гена, что делает ее самым маленьким геномом среди всех организмов, которые можно выращивать в лабораторных средах. Из этих генов 149 имеют неизвестную биологическую функцию. Для сравнения, первая синтетическая клетка, M. mycoides JCVI-syn1.0, имеет 1,08 миллиона пар оснований и 901 ген.
Статья с описанием этого исследования опубликована в печатной версии журнала Science от 25 марта ведущими авторами Клайдом А. Хатчисоном, III, доктором философии. и Рэй-Юань Чуанг, доктор философии.D., старший автор Дж. Крейг Вентер, доктор философии, и старшая команда Гамильтона О. Смита, доктора медицины, Дэниела Г. Гибсона, доктора философии, и Джона И. Гласса, доктора философии.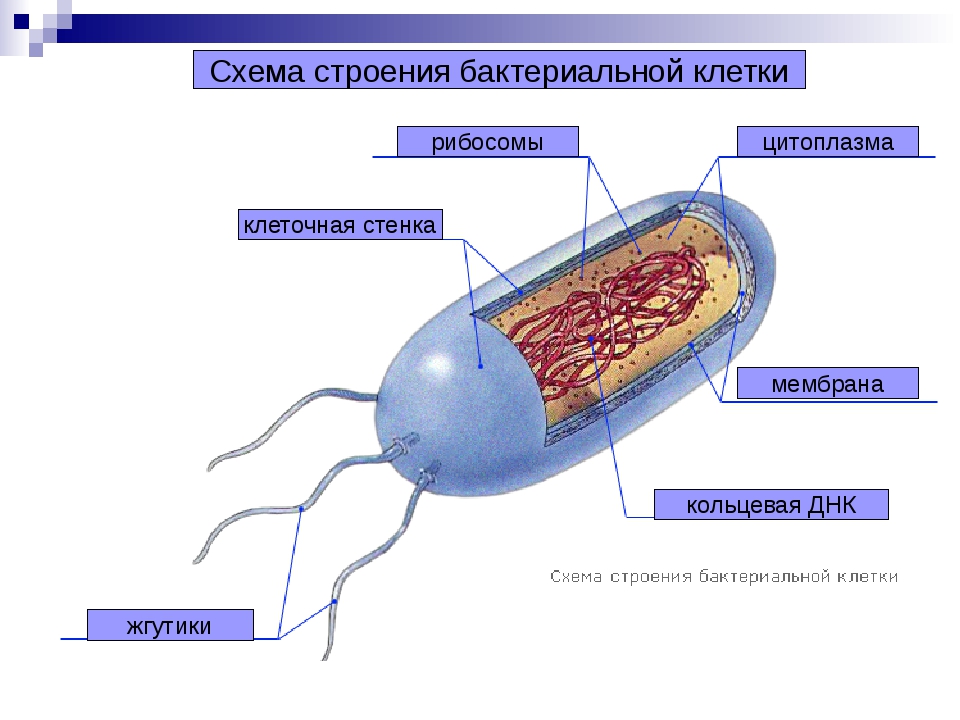
«Наша попытка спроектировать и создать новый вид, в конечном итоге успешная, показала, что 32% генов, необходимых для жизни в этой клетке, имеют неизвестную функцию, и показала, что многие из них высоко консервативны у многих видов. Все исследования биоинформатики за последние 20 лет недооценили количество необходимых генов, сосредоточив внимание только на известном мире.Это важное наблюдение, которое мы привносим в изучение генома человека», — сказал д-р Вентер, основатель, исполнительный председатель и главный исполнительный директор JCVI.
Исследование по конструированию первой минимальной синтетической клетки в JCVI стало кульминацией 20-летних исследований, которые начались в 1995 году после секвенирования генома первого свободноживущего организма Haemophilus influenza, за которым последовало секвенирование Mycoplasma genitalium. Сравнение этих двух геномов выявило общий набор из 256 генов, который, по мнению команды, может быть минимальным набором генов, необходимых для жизнеспособности. В 1999 году д-р Хатчисон возглавил группу, которая опубликовала статью, описывающую использование глобальных методов мутагенеза транспозонов для идентификации несущественных генов у M. genitalium.
В 1999 году д-р Хатчисон возглавил группу, которая опубликовала статью, описывающую использование глобальных методов мутагенеза транспозонов для идентификации несущественных генов у M. genitalium.
За последние 50 лет более 2000 публикаций рассматривали минимальные клетки и их использование для разъяснения первых принципов биологии. С самого начала цель команды JCVI заключалась в создании минимальной операционной системы клетки для понимания биологии, а также в создании желаемого шасси для использования в промышленных приложениях.Создание первой синтетической клетки в 2010 году не повлияло на новые принципы дизайна генома, поскольку геном M. mycoides был в основном воспроизведен, как и в природе. Скорее, он установил рабочий процесс для создания и тестирования конструкций всего генома, включая минимальную клетку, снизу вверх, начиная с последовательности генома.
Чтобы создать JCVI-syn3.0, команда использовала подход к дизайну всего генома и химическому синтезу с последующей трансплантацией генома для проверки жизнеспособности клетки. Их первая попытка минимизировать геном началась с простого подхода с использованием информации из биохимической литературы и некоторых ограниченных работ по мутагенезу транспозонов, но это не привело к созданию жизнеспособного генома.Усовершенствовав методы транспозонов, они обнаружили набор квазисущественных генов, необходимых для устойчивого роста, что объяснило неудачу их первой попытки.
Их первая попытка минимизировать геном началась с простого подхода с использованием информации из биохимической литературы и некоторых ограниченных работ по мутагенезу транспозонов, но это не привело к созданию жизнеспособного генома.Усовершенствовав методы транспозонов, они обнаружили набор квазисущественных генов, необходимых для устойчивого роста, что объяснило неудачу их первой попытки.
Чтобы облегчить отладку нефункциональных сокращенных сегментов генома, команда построила геном из восьми сегментов за раз, чтобы каждый можно было протестировать по отдельности, прежде чем объединять их для создания минимального генома. Команда также исследовала порядок генов и то, как он влияет на рост и жизнеспособность клеток, отметив, что содержание генов более важно для жизнеспособности клеток, чем порядок генов.Они прошли три цикла проектирования, создания и тестирования, гарантируя, что квазиосновные гены остались, что в итоге привело к созданию жизнеспособной, самовоспроизводящейся минимальной синтетической клетки, содержащей всего 473 гена, 35 из которых кодируют РНК. Кроме того, клетка содержит уникальную последовательность гена 16S.
Кроме того, клетка содержит уникальную последовательность гена 16S.
Команде удалось определить биологическую функцию большинства генов, при этом 41% из них отвечает за информацию об экспрессии генома, 18% — за структуру и функцию клеточной мембраны, 17% — за цитозольный метаболизм и 7% — за сохранение информации о геноме. .Однако неожиданным 149 генам не удалось присвоить конкретную биологическую функцию, несмотря на интенсивное изучение. Это остается областью постоянной работы для исследователей.
«Эта работа представляет собой результат более чем пятилетней работы удивительно талантливой группы людей. Наша цель — создать клетку, для которой известна точная биологическая функция каждого гена», — сказал доктор Хатчисон, заслуженный профессор JCVI.
Команда приходит к выводу, что основным результатом этой минимальной клеточной программы являются новые инструменты и полуавтоматические процессы для синтеза всего генома.Многие из этих инструментов и услуг синтетической биологии коммерчески доступны через SGI и SGI-DNA, включая службу создания синтетической ДНК, специализирующуюся на построении больших и сложных фрагментов ДНК, включая комбинаторные генные библиотеки, программное обеспечение для геномики Archetype, наборы для сборки Gibson и BioXp, который настольный прибор для получения точных синтетических фрагментов ДНК.
«Эта статья знаменует собой важный шаг к нашей способности проектировать и создавать синтетические организмы снизу вверх с предсказуемыми результатами.Инструменты и знания, полученные в результате этой работы, будут необходимы для создания производственных платформ следующего поколения для широкого круга дисциплин», — сказал д-р Гибсон, вице-президент DNA Technologies, SGI, доцент, JCVI.
Другие исследователи, участвовавшие в этой статье, принимали непосредственное участие в этой работе на протяжении большей части последнего десятилетия. Нынешние и бывшие ученые JCVI и SGI: Чак Мерриман, доктор философии, Рэй-Юань Чуанг, доктор философии, Владимир Носков, доктор философии, Насира Асад-Гарсия, Джон Гилл, Кришна Каннан, доктор философии.Д., Богумил Карас, доктор философии, Ли Ма, Чжи-Цин Ци, доктор философии, Р. Александр Рихтер, доктор философии, Лиджи Сун, доктор философии, Йо Судзуки, доктор философии, Билляна Цветанова, к.б.н. и Ким Уайз, доктор философии.
Другими авторами статьи являются: Томас Дж. Диринк и Марк Х. Эллисман, доктор философии, Калифорнийский университет, Сан-Диего, Национальный центр исследований микроскопии и визуализации; Джеймс Ф. Пеллетье, Центр битов и атомов и факультет физики Массачусетского технологического института; Элизабет А. Стрихальски, Национальный институт стандартов и технологий.
Диринк и Марк Х. Эллисман, доктор философии, Калифорнийский университет, Сан-Диего, Национальный центр исследований микроскопии и визуализации; Джеймс Ф. Пеллетье, Центр битов и атомов и факультет физики Массачусетского технологического института; Элизабет А. Стрихальски, Национальный институт стандартов и технологий.
Эта работа финансировалась SGI, фондом JCVI и программой Living Foundries Агентства перспективных исследовательских проектов Министерства обороны США, HR0011-12-C-0063.
Об Институте Дж. Крейга Вентера
JCVI — это некоммерческий исследовательский институт в Роквилле, штат Мэриленд, и Ла-Хойя, Калифорния, занимающийся развитием науки геномики; понимание его значения для общества; и сообщение этих результатов научному сообществу, общественности и политикам.Основанный Дж. Крейгом Вентером, доктором философии, JCVI является домом для примерно 200 ученых и сотрудников, обладающих опытом в области человеческой и эволюционной биологии, генетики, биоинформатики / информатики, информационных технологий, высокопроизводительного секвенирования ДНК, исследований в области геномной политики и окружающей среды. и общественное образование в области науки и научной политики. JCVI является организацией 501 (c) (3). Для получения дополнительной информации посетите веб-сайт http://www.JCVI.org.
и общественное образование в области науки и научной политики. JCVI является организацией 501 (c) (3). Для получения дополнительной информации посетите веб-сайт http://www.JCVI.org.
Подпишитесь на Astrobiology в Твиттере.
ИСТОЧНИК: Дж.Институт Крейга Вентера Пресс-релиз
«Минимальная» клетка повышает ставки в гонке за использование синтетической жизни
Творение Крейга Вентера появилось благодаря тому, что методы редактирования генов CRISPR открывают альтернативные способы возиться со строительными блоками жизни.
Биолог-синтетик Крейг Вентер, чья команда два десятилетия назад приступила к поиску возможности свести жизнь к минимуму.Предоставлено: Michael Lewis/Corbis Outline
Предприниматель в области геномики Крейг Вентер создал синтетическую клетку, содержащую наименьший геном среди всех известных независимых организмов. Эта клетка, функционирующая с 473 генами, является важной вехой в 20-летнем стремлении его команды сократить жизнь до самого необходимого и, соответственно, создать жизнь с нуля.
Эта клетка, функционирующая с 473 генами, является важной вехой в 20-летнем стремлении его команды сократить жизнь до самого необходимого и, соответственно, создать жизнь с нуля.
Вентер, один из основателей компании, стремящейся использовать синтетические клетки для производства промышленных товаров, говорит, что этот подвиг предвещает создание индивидуальных клеток для производства лекарств, топлива и других продуктов.Но стремительное развитие мощных методов «редактирования генов», позволяющих относительно легко и избирательно воздействовать на геномы, поднимает щекотливый вопрос: зачем создавать новые формы жизни, когда можно просто изменить то, что уже существует?
Каждая клетка JCVI-syn3.0 содержит всего 473 гена, меньше, чем любой другой независимый организм. Авторы и права: Томас Диринк и Марк Эллисман/NCMIR/UCSD
В отличие от первых синтетических клеток, сделанных в 2010 году 1 , в которых команда Вентера в J. Институт Крейга Вентера в Ла-Хойя, Калифорния, скопировал существующий бактериальный геном и пересадил его в другую клетку, геном минимальных клеток не похож ни на что в природе. Вентер говорит, что клетка, описанная в статье, опубликованной 24 марта Science 2 , представляет собой совершенно новый искусственный вид.
Институт Крейга Вентера в Ла-Хойя, Калифорния, скопировал существующий бактериальный геном и пересадил его в другую клетку, геном минимальных клеток не похож ни на что в природе. Вентер говорит, что клетка, описанная в статье, опубликованной 24 марта Science 2 , представляет собой совершенно новый искусственный вид.
«Идея построения полных геномов — одна из мечтаний и обещаний синтетической биологии», — говорит Пол Фримонт, биолог-синтетик из Имперского колледжа Лондона, который не участвует в работе.
Дизайн и синтез геномов с нуля остается нишевым занятием и технически сложным делом. Напротив, использование редактирования генома стремительно растет — и его самый известный инструмент, CRISPR-Cas9, уже набрал обороты в промышленности, сельском хозяйстве и медицине, отмечает Джордж Черч, ученый-геном из Гарвардской медицинской школы в Бостоне, штат Массачусетс, который работает с КРИСПР. «С гораздо меньшими усилиями появился CRISPR, и вдруг CRISPR практикуют 30 000 человек, если не больше.
Микробиологи только начали охарактеризовывать бактериальную иммунную систему, которую ученые в конечном итоге объединили и назвали CRISPR, когда команда Вентера начала свои усилия по сокращению жизни до самого необходимого. В статье 1995 года Science команда Вентера секвенировала геном Mycoplasma genitalium , микроба, передающегося половым путем, с самым маленьким геномом среди всех известных свободноживущих организмов 3 , и нанесла на карту его 470 генов. Инактивируя гены один за другим и проверяя, может ли бактерия еще функционировать, группа сократила этот список до 375 генов, которые казались важными.
Один из способов проверить эту гипотезу — создать организм, содержащий только эти гены. Поэтому Вентер вместе со своими близкими коллегами Клайдом Хатчисоном и Гамильтоном Смитом и их командой задался целью создать минимальный геном с нуля, соединив вместе химически синтезированные сегменты ДНК. Усилия потребовали разработки новых технологий, но к 2008 году они использовали этот метод для создания того, что было по существу точной копией генома M. genitalium , которая также включала десятки нефункциональных фрагментов ДНК «водяных знаков» 4. .
genitalium , которая также включала десятки нефункциональных фрагментов ДНК «водяных знаков» 4. .
Но вялый рост естественных клеток M. genitalium побудил их переключиться на более плодовитые Mycoplasma mycoides . На этот раз они не только синтезировали ее геном и поставили водяные знаки со своими именами и известными цитатами, но и имплантировали его в другую бактерию, лишенную собственного генома.
Полученные в результате клетки JCVI-syn1.0 были представлены 1 в 2010 году и провозглашены — многие говорят преувеличенно — рассветом синтетической жизни.(Этот подвиг побудил президента США Барака Обаму инициировать обзор биоэтики, а Ватикан усомниться в утверждении Вентера о том, что он создал жизнь.) более 1 миллиона оснований ДНК — это совсем не минимум.
Клетки JVCI-syn1.0 были провозглашены зарей синтетической жизни в 2010 году. Авторы и права: Томас Диринк и Марк Эллисман/NCMIR/UCSD
В попытке достичь своей давней цели по разработке минимального генома команда Вентера разработала и синтезировала 483 000 оснований, 471 ген M.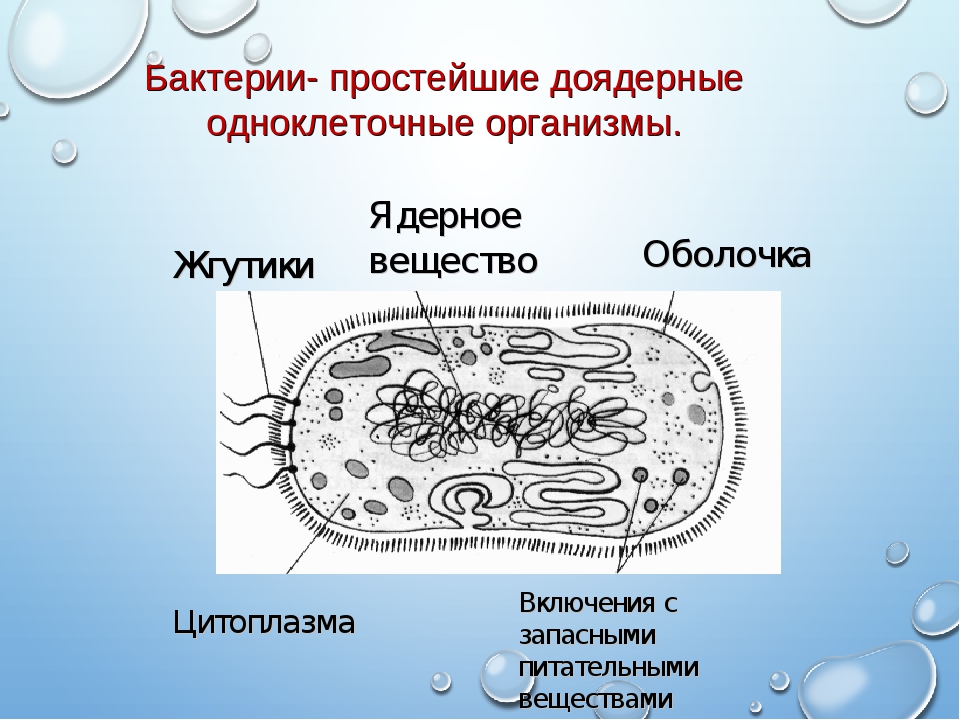 mycoides , из которой были удалены гены, отвечающие за выработку питательных веществ, которые можно было получить извне, и другие генетические «обломки». Но это не дало жизнеспособного организма.
mycoides , из которой были удалены гены, отвечающие за выработку питательных веществ, которые можно было получить извне, и другие генетические «обломки». Но это не дало жизнеспособного организма.
В качестве следующего шага команда разработала цикл «проектирование-сборка-и-тестирование». Он разбил геном M. mycoides на восемь сегментов ДНК, смешал и сопоставил их, чтобы увидеть, какие комбинации дают жизнеспособные клетки; уроки, извлеченные из каждого цикла, сообщали, какие гены были включены в следующий дизайн.Этот процесс выявил последовательности ДНК, которые не кодируют белки, но которые все еще необходимы, поскольку они управляют экспрессией основных генов, а также пары генов, выполняющих одну и ту же важную задачу — когда такие гены удаляются по одному, оба ошибочно кажутся быть необязательным.
В конце концов, команда наткнулась на конструкцию из 531 000 оснований и 473 генов, которая стала известна как JCVI-syn3.0 (syn2.0 был менее упрощенным промежуточным звеном). Syn3.0 имеет респектабельное время удвоения 3 часа, по сравнению, например, с 1 часом для M.mycoides и 18 часов для M. genitalium .
Syn3.0 имеет респектабельное время удвоения 3 часа, по сравнению, например, с 1 часом для M.mycoides и 18 часов для M. genitalium .
«Эта старая цитата Ричарда Фейнмана «то, что я не могу создать, я не понимаю», теперь служит этому принципу», — говорит Мартин Фуссенеггер, биолог-синтетик из Швейцарского федерального технологического института (ETH) в Цюрихе, Швейцария. «Вы можете добавить гены и посмотреть, что произойдет».
Поскольку почти все его питательные вещества поступают через среду для выращивания, основные гены syn3.0, как правило, связаны с клеточными функциями, такими как создание белков, копирование ДНК и построение клеточных мембран.Поразительно, но Вентер говорит, что его команда не смогла определить функцию 149 генов в геноме syn3.0, многие из которых обнаружены в других формах жизни, включая человека. «Мы не знаем о трети основной жизни, и мы пытаемся разобраться в этом сейчас», — говорит он.
Клетки Syn3.0 удваиваются каждые 3 часа. Авторы и права: Томас Диринк и Марк Эллисман/NCMIR/UCSD
Авторы и права: Томас Диринк и Марк Эллисман/NCMIR/UCSD
Это потрясло Фюссенеггера. «Мы секвенировали все на этой планете, но до сих пор не знаем 149 генов, наиболее важных для жизни!» он говорит.«Это самая крутая вещь, которую я хочу знать».
Длительное влияние Syn3.0 на синтетическую биологию остается открытым вопросом. «Я думаю, что это своего рода момент Джорджа Мэллори», — говорит Черч, имея в виду английского альпиниста, который умер в 1924 году, пытаясь стать первым человеком, поднявшимся на Эверест. «Потому что он там» — так он объяснил восхождение на Эверест».
Черч говорит, что методы редактирования генома останутся предпочтительным выбором для большинства приложений, требующих небольшого количества генетических изменений, тогда как дизайн генома будет полезен для специализированных приложений, таких как перекодирование всего генома для включения новых аминокислот.Фуссенеггер считает, что редактирование генома будет предпочтительным подходом к терапии, но написание геномов с нуля понравится ученым, интересующимся, например, фундаментальными вопросами эволюции геномов.
Даже Вентер признает, что геном syn3.0, хотя и новый, был разработан методом проб и ошибок, а не основан на фундаментальном понимании того, как построить функционирующий геном. Но он ожидает быстрых улучшений и считает, что синтез генома с нуля станет предпочтительным подходом к управлению жизнью.«Если вы хотите внести некоторые изменения, CRISPR — отличный инструмент», — говорит он. «Но если вы действительно создаете что-то новое и пытаетесь спроектировать жизнь, CRISPR вам не поможет».
Об этой статье
Процитировать эту статью
Callaway, E. «Минимальная» клетка поднимает ставки в гонке за использование синтетической жизни. Природа 531, 557–558 (2016). https://doi.org/10.1038/531557a
Загрузить цитату
Поделиться этой статьей
Любой, с кем вы поделитесь следующей ссылкой, сможет прочитать этот контент:
Получить ссылку для общего доступа Извините, ссылка для общего доступа в настоящее время недоступна доступны для этой статьи.
Предоставлено инициативой Springer Nature SharedIt по обмену контентом.
Дальнейшее чтение
Системы биоизоляции нового поколения для искусственных организмов
- Чон Ук Ли
- Клемент Т.Ю. Чан
- Джеймс Дж. Коллинз
Природа Химия Биология (2018)
Синтетическая биология: минимум клеток, максимум знаний
Если бы мы могли составить карту и понять каждый молекулярный процесс в клетке, мы бы лучше поняли фундаментальные принципы жизни. В конечном итоге мы могли бы использовать эти знания для проектирования и создания искусственных организмов. Очевидным способом начать это начинание является изучение минимальных клеток, природных или синтетических организмов, которые содержат только самый минимум генетической информации, необходимой для выживания. Строя и изучая эти очень упрощенные клетки — настолько простые, что их называют «атомами водорода в биологии» (Morowitz, 1984), — мы сможем проанализировать все молекулярные механизмы, необходимые для поддержания клеточной жизни.
В конечном итоге мы могли бы использовать эти знания для проектирования и создания искусственных организмов. Очевидным способом начать это начинание является изучение минимальных клеток, природных или синтетических организмов, которые содержат только самый минимум генетической информации, необходимой для выживания. Строя и изучая эти очень упрощенные клетки — настолько простые, что их называют «атомами водорода в биологии» (Morowitz, 1984), — мы сможем проанализировать все молекулярные механизмы, необходимые для поддержания клеточной жизни.
Выяснение двойной спирали ДНК в 1953 году и последующее расшифровка генетического кода сделали возможным связать молекулярные процессы с последовательностями ДНК (рис. 1).В свою очередь, полногеномное секвенирование выявило совокупность молекулярных ролей, закодированных в геномах большого числа организмов, начиная с 1995 г., когда были созданы первые полные бактериальные геномы (Fleischmann et al., 1995; Fraser et al., 1995) и затем расширяется благодаря методам секвенирования следующего поколения (McGuire et al. , 2008; Spencer, 2008). Тем не менее, это также показало, что мы не знаем или можем только догадываться о роли многих генов, которые необходимы для жизни.
, 2008; Spencer, 2008). Тем не менее, это также показало, что мы не знаем или можем только догадываться о роли многих генов, которые необходимы для жизни.
Синтетическая биология и минимальные клетки: историческая перспектива.
Выяснение двойной спирали ДНК ознаменовало начало эры молекулярной биологии, и стало возможным изучать молекулярные механизмы, лежащие в основе наблюдаемых фенотипов. Методы секвенирования ДНК улучшились, что привело к секвенированию всего генома в конце 1990-х годов. Методы математического моделирования клеток были разработаны в 1980-х и 1990-х годах, и можно было реконструировать компьютерные модели метаболических сетей (также известные как модели метаболизма в масштабе генома или GEM).Решающий момент произошел в 2008 г. (красный) с созданием первого искусственного генома, имитирующего генетическую информацию M.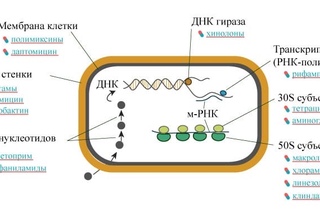 genitalium , свободноживущего несинтетического организма с наименьшим геномом. Благодаря разработкам в методах секвенирования следующего поколения это сопровождалось появлением крупномасштабных предприятий по секвенированию генома, таких как микробиом человека и проекты 1000 геномов. Достижения в синтезе, сборке и трансплантации всего генома помогли вскоре после этого создать первую клетку с полностью синтетическим геномом.В совокупности эти достижения ознаменовали расцвет синтетической биологии.
genitalium , свободноживущего несинтетического организма с наименьшим геномом. Благодаря разработкам в методах секвенирования следующего поколения это сопровождалось появлением крупномасштабных предприятий по секвенированию генома, таких как микробиом человека и проекты 1000 геномов. Достижения в синтезе, сборке и трансплантации всего генома помогли вскоре после этого создать первую клетку с полностью синтетическим геномом.В совокупности эти достижения ознаменовали расцвет синтетической биологии.
В 2008 году, когда были инициированы крупномасштабные проекты секвенирования, группа ученых из Института Дж. Крейга Вентера (JCVI) искусственно воссоздала геном бактерии. Команда сделала фрагменты ДНК в лаборатории, а затем использовала комбинацию химических и биологических методов, чтобы собрать фрагменты «в правильном порядке», используя генетическую информацию бактерий Mycoplasma genitalium в качестве шаблона (Gibson et al., 2008). Это стало важной точкой разветвления в истории биологии: в то время как предыдущие десятилетия были сосредоточены на получении как можно большего количества знаний о природных организмах, создание генома с нуля в лаборатории продемонстрировало потенциал для создания синтетических клеток (рис. 1). Это сместило синтетическую биологию, область, в которой исследователи пытаются создавать биологические объекты, в сторону инженерной дисциплины, которая могла бы работать в масштабе генома. Затем та же команда создала Mycoplasma mycoides JCVI-syn1.0 — первая живая клетка с полностью искусственной хромосомой (Gibson et al., 2010). В обоих случаях искусственная генетическая информация точно воспроизводила информацию, обнаруженную в бактериях дикого типа.
Это стало важной точкой разветвления в истории биологии: в то время как предыдущие десятилетия были сосредоточены на получении как можно большего количества знаний о природных организмах, создание генома с нуля в лаборатории продемонстрировало потенциал для создания синтетических клеток (рис. 1). Это сместило синтетическую биологию, область, в которой исследователи пытаются создавать биологические объекты, в сторону инженерной дисциплины, которая могла бы работать в масштабе генома. Затем та же команда создала Mycoplasma mycoides JCVI-syn1.0 — первая живая клетка с полностью искусственной хромосомой (Gibson et al., 2010). В обоих случаях искусственная генетическая информация точно воспроизводила информацию, обнаруженную в бактериях дикого типа.
Следующей целью было собрать воедино искусственный геном, содержащий только те гены, которые абсолютно необходимы для жизни и роста. В 2016 году, после нескольких лет разработки и тестирования, генетическая информация в JCVI-syn1. 0 была сокращена, чтобы получить M. mycoides JCVI-syn3.0, который содержит самый маленький геном среди всех свободноживущих организмов (Hutchison et al. ., 2016). Примечательно, что первоначально сообщалось, что JCVI-syn3.0 содержит 149 генов, роль которых была неизвестна. С тех пор это число сократилось до 91, и дальнейшее сокращение этого числа по-прежнему представляет собой следующую задачу в синтетической биологии (Danchin and Fang, 2016).
0 была сокращена, чтобы получить M. mycoides JCVI-syn3.0, который содержит самый маленький геном среди всех свободноживущих организмов (Hutchison et al. ., 2016). Примечательно, что первоначально сообщалось, что JCVI-syn3.0 содержит 149 генов, роль которых была неизвестна. С тех пор это число сократилось до 91, и дальнейшее сокращение этого числа по-прежнему представляет собой следующую задачу в синтетической биологии (Danchin and Fang, 2016).
Теперь в eLife Зан Лютей-Шультен и его коллеги из JCVI, Иллинойсского университета в Урбана-Шампейне, Калифорнийского университета в Сан-Диего и Университета Флориды, включая Мариан Брейер в качестве первого автора, сообщают о первом вычислительном или модель «in silico» для синтетического минимального организма (Breuer et al., 2019). Команда реконструировала полный набор химических реакций, происходящих в организме (то есть его метаболизм). Это усилие устраняет разрыв между последовательностями ДНК и молекулярными процессами на уровне всей биологической системы.
Брейер и др. выполнили свою работу по моделированию M. mycoides JCVI-syn3.0A, надежной вариации JCVI-syn3.0, которая содержит еще 11 генов. Это было необходимо, потому что редукция генома включает в себя большое количество генетических модификаций, которые, как правило, производят более слабые клетки, которые труднее выращивать в лабораторных условиях (Choe et al., 2019). Чтобы создать свою вычислительную модель, команда использовала биохимические знания, легко доступные для родительского штамма JCVI-syn1.0, и определила оставшиеся гены-кандидаты, которые участвуют в метаболизме JCVI-syn3.0A. Затем эти гены были связаны с клеточными химическими реакциями, и шаг за шагом была смоделирована вся метаболическая сеть. Этот подход объединяет обширные знания о метаболизме JCVI-syn3.0A в единый очень ценный ресурс сообщества, который может помочь выяснить недостающие роли в метаболической сети и интегрировать экспериментальные данные.
Как только была получена модель в масштабе генома, стало возможным использовать ее для компьютерного моделирования различных клеточных фенотипов. Вкратце, модель in silico представляет оптимальное метаболическое состояние клетки как задачу оптимизации, к которой применяются ограничения. Например, метаболические модели ограничены балансом реагентов и продуктов в данной химической реакции (стехиометрия) и скоростью превращения метаболитов (ограничения потока). Брейер и соавт.смоделировали фенотип роста JCVI-syn3.0A путем оптимизации производства клеточной биомассы, а затем сопоставили прогнозы с реальными данными, такими как результаты количественных протеомных исследований. В частности, они сравнили гены, которые модель считала важными, с выделенными при систематической мутации генома JCVI-syn3.0A. Это выявило 30 генов, необходимых для выживания, но роль которых неизвестна. Понимание того, что делают эти гены, является следующим приоритетом в усилиях по завершению характеристики всех молекулярных процессов в клетке.
Вкратце, модель in silico представляет оптимальное метаболическое состояние клетки как задачу оптимизации, к которой применяются ограничения. Например, метаболические модели ограничены балансом реагентов и продуктов в данной химической реакции (стехиометрия) и скоростью превращения метаболитов (ограничения потока). Брейер и соавт.смоделировали фенотип роста JCVI-syn3.0A путем оптимизации производства клеточной биомассы, а затем сопоставили прогнозы с реальными данными, такими как результаты количественных протеомных исследований. В частности, они сравнили гены, которые модель считала важными, с выделенными при систематической мутации генома JCVI-syn3.0A. Это выявило 30 генов, необходимых для выживания, но роль которых неизвестна. Понимание того, что делают эти гены, является следующим приоритетом в усилиях по завершению характеристики всех молекулярных процессов в клетке.
В целом, модель и экспериментальные данные в целом согласовывались с их идентификацией основных генов; тем не менее, идеальное совпадение не было достигнуто, как и в случае, когда подобные вычислительные модели применяются к естественным организмам. Тем не менее, можно предположить, что если бы этот стандарт был в пределах досягаемости, он был бы достигнут в первую очередь для минимальных клеток. Для повышения качества прогнозирования необходимо применять более точные ограничения, а для этого потребуется дополнительная информация. Например, полностью определенная среда, содержащая только необходимые питательные вещества для JCVI-syn3.0A должен быть сгенерирован. Также было бы полезно иметь точный состав биомассы, то есть подробный отчет о доле основных молекул и метаболитов в клетке. Наконец, многие биохимические процессы, такие как изоферменты (когда ферменты с разной структурой катализируют одну и ту же реакцию) или неразборчивые реакции (когда фермент может участвовать во многих реакциях), должны быть тщательно исследованы.
Тем не менее, можно предположить, что если бы этот стандарт был в пределах досягаемости, он был бы достигнут в первую очередь для минимальных клеток. Для повышения качества прогнозирования необходимо применять более точные ограничения, а для этого потребуется дополнительная информация. Например, полностью определенная среда, содержащая только необходимые питательные вещества для JCVI-syn3.0A должен быть сгенерирован. Также было бы полезно иметь точный состав биомассы, то есть подробный отчет о доле основных молекул и метаболитов в клетке. Наконец, многие биохимические процессы, такие как изоферменты (когда ферменты с разной структурой катализируют одну и ту же реакцию) или неразборчивые реакции (когда фермент может участвовать во многих реакциях), должны быть тщательно исследованы.
Такое моделирование на основе ограничений может иметь ключевое значение для создания рабочих геномов с нуля, и в этом отношении модель, созданная Breuer et al.— это первый из многих шагов к идеальному отражению синтетической клетки in silico. Затем моделирование может быть расширено за пределы метаболизма, чтобы включить другие наборы биологических процессов, такие как механизм экспрессии генов. Это помогло бы определить ключевые ограничения и компромиссы, с которыми клеткам приходится сталкиваться в борьбе за жизнь. В свою очередь, эти ограничения могут стать основой, необходимой для искусственного конструирования все более сложных организмов, подобно тому, как атом водорода проложил путь к пониманию поведения более сложных элементов.




 Для того чтобы получить целый геном M. mycoides, исследователи сначала синтезировали его отдельные
Для того чтобы получить целый геном M. mycoides, исследователи сначала синтезировали его отдельные Статья с описанием работы опубликована в журнале Science. Коротко эксперимент описывает портал Nature News.
Статья с описанием работы опубликована в журнале Science. Коротко эксперимент описывает портал Nature News.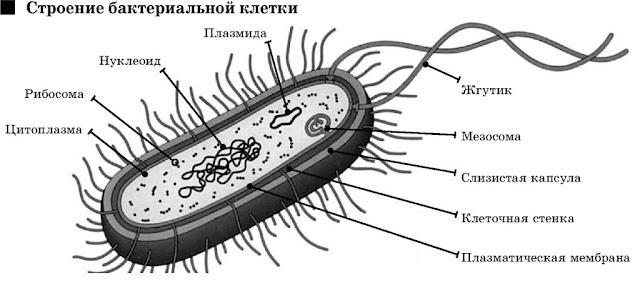

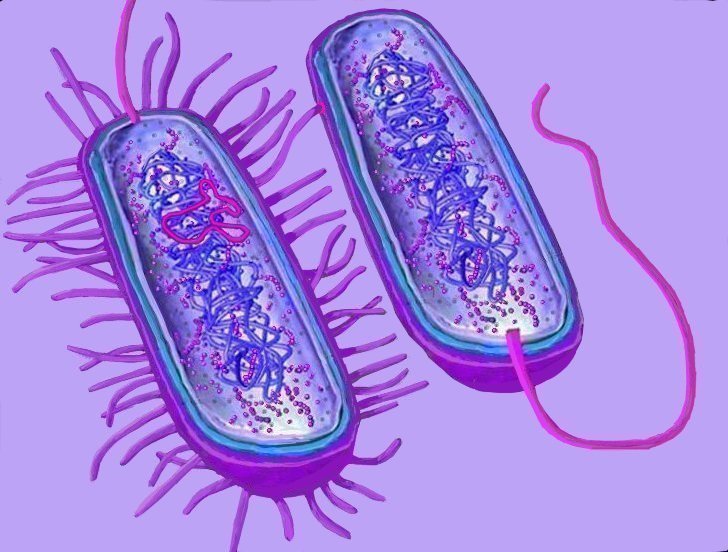
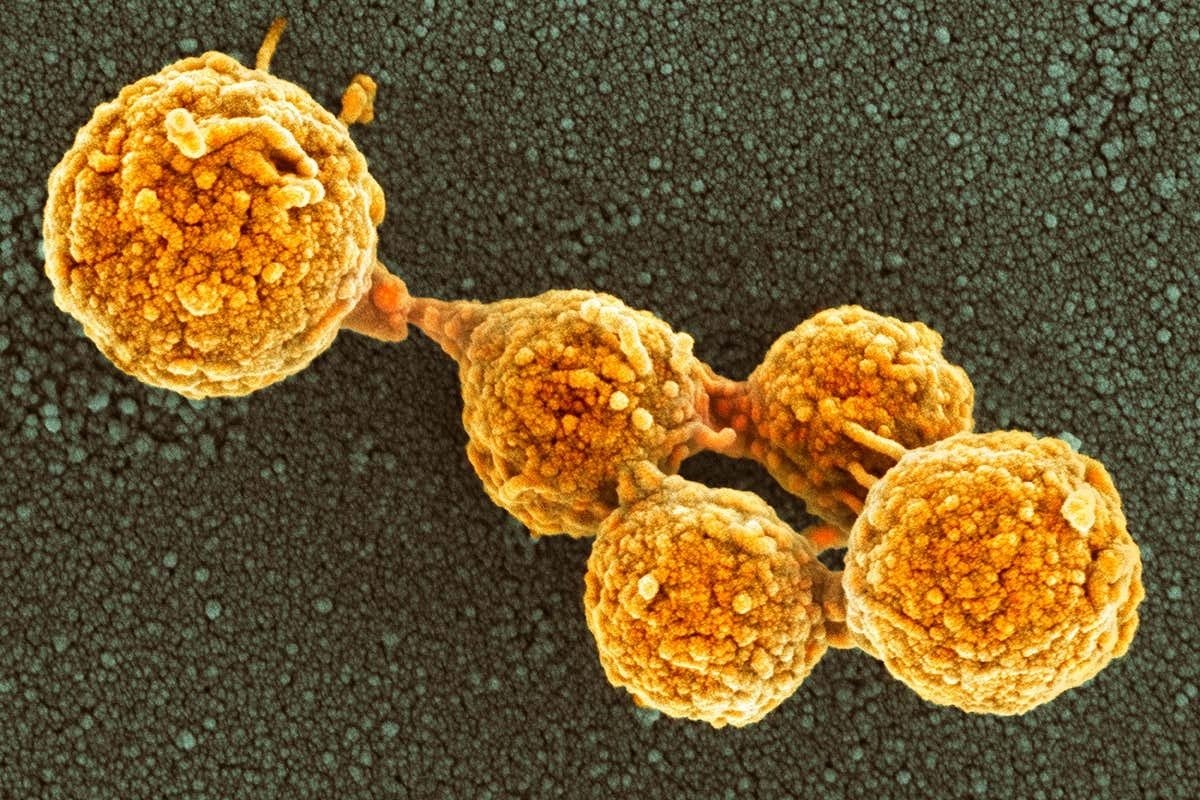 В новой работе, о которой Вентер отчитался в четверг в журнале Science, ученые объединили два этих метода и получили полноценную клетку с синтезированной генетической информацией
В новой работе, о которой Вентер отчитался в четверг в журнале Science, ученые объединили два этих метода и получили полноценную клетку с синтезированной генетической информацией