Презентация к уроку «Строение электронных оболочек атомов» | Презентация к уроку по химии (8 класс) по теме:
Слайд 1
C троение электронных оболочек атомов 8 класс Тюменская область, Ханты-Мансийский автономный округ – Югра , г. Когалым , МАОУ СОШ № 7 Разработала учитель химии высшей квалификационной категории Вакенгут Ирина Эгоновна При создании 3 и 4 слайда были использованы материалы из презентации учителя химии из с. Охтеурье Нижневартовского района ХМАО-Югры Тюменской области Баженова Алексея АнатольевичаСлайд 2
Содержание 1.Орбитально-планетарная модель строения атома 2.Строение электронных оболочек атомов 3.Схемы строения электронных оболочек.1 период 4.Схемы строения электронных оболочек.2 период 5.Схемы строения электронных оболочек.3 период 6.Проверь свои знания 7.Домашнее задание
Слайд 3
Ядро 1 электронный слой ( max 2e — ) 2 электронный слой (max 8e — ) 3 электронный c лой (max 18e — ) Э Л Е К Т Р О Н Н А Я О Б О Л О Ч К А Орбитально – планетарная модель строения атома Электронная оболочка – это совокупность электронов, двигающихся вокруг ядра атома.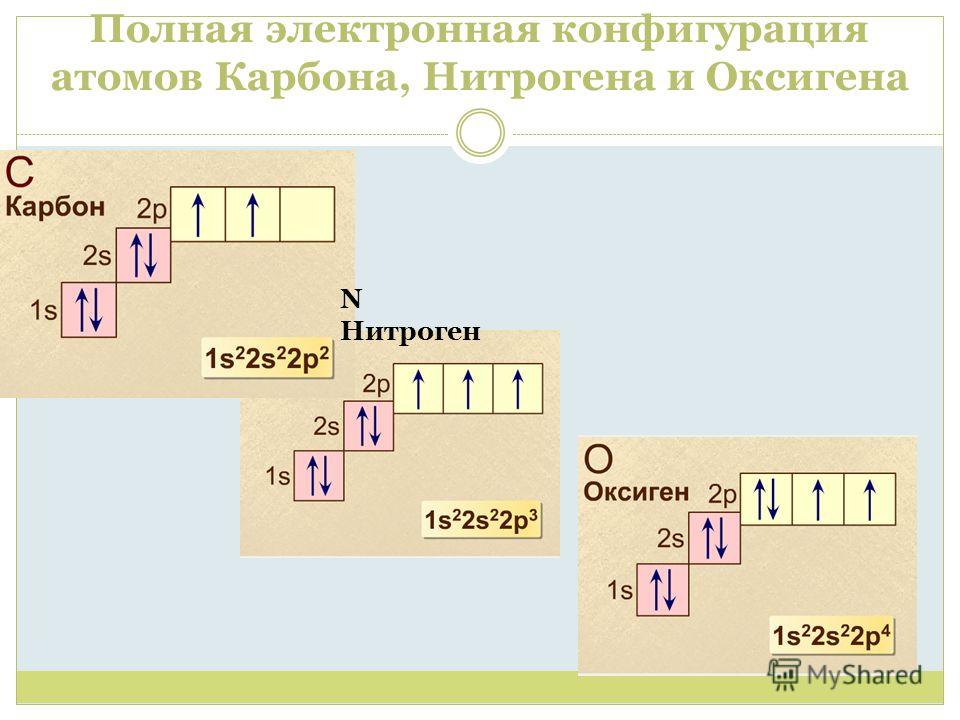
Слайд 4
Электроны в электронной оболочке располагаются на энергетических уровнях. n – главное квантовое число – определяет число энергетических уровней . Номер периода совпадает с числом энергетических уровней элемента. Период Р Ф осфор 15 30,9748 3 Группа V 3 Число электронов ( N ) на уровне рассчитывается по формуле. N = 2 n 2 n = 1, N = 2 . 1 2 = 2 2 n = 2 , N = 2 . 2 2 = 8 8 Номер группы совпадает с числом электронов на последнем энергетическом уровне. 5 Общее число электронов е = 15 Проверка 15 Строение электронных оболочек атомов
Слайд 5
+1 1 e — + 2 2e — Химический знак водорода и его порядковый номер Заряд ядра атома водорода, равный порядковому номеру Электронная оболочка (число оболочек равно номеру периода) Число электронов на внешней оболочке, равное номеру группы Составим схемы строения электронных оболочек атомов химических элементов 1 периода
Слайд 6
+ 3 2e — 1e — + 4 2e — 2e — + 5 2e — 3e — +6 2e — 4 e — +7 2e — 5 e — +8 2e — 6 e — +9 2e — 7 e — +10 2e — 8 e — Атом неона имеет завершенную электронную оболочку Составим схемы строения электронных оболочек атомов химических элементов 2 периода
Слайд 7
Составим схемы строения электронных оболочек атомов химических элементов 3 периода +11 2e — 1 e — 8 e — +12 2e — 2 e — 8 e — +13 2e — 3 e — 8 e — +14 2e — 4 e — 8 e — +15 2e — 5 e — 8 e — +16 2e — 6 e — 8 e — +17 2e — 7 e — 8 e — +18 2e — 8 e — 8 e —
Слайд 8
верно Проверь свои знания ошибка А1.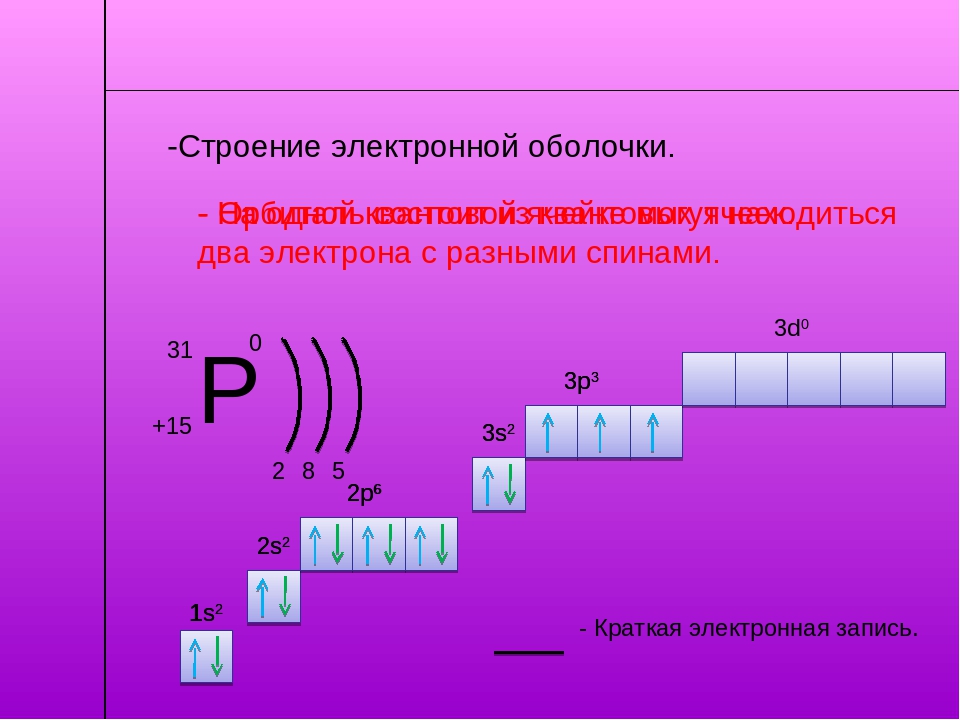 Энергия электрона максимальна на энергетическом уровне А2. Максимальное число электронов на второй электронной оболочке 1) 1 ошибка 2) 2 ошибка 3) 3 верно 4) 4 ошибка 1) 2 ошибка 2) 4 ошибка 3) 6 верно 4) 8 А3. Максимальное число электронов на четвертой электронной оболочке ошибка 1) 4 ошибка 2) 16 верно 3) 32 ошибка 4) 64 А4. Максимальное число электронов на пятой электронной оболочке ошибка 1) 5 верно 2) 50 ошибка 3) 125 ошибка 4) 625 А5. Электронная оболочка атома натрия содержит энергетических уровней ошибка ошибка верно ошибка 1) 1 2) 2 3) 3 4) 4. А6. Электронная оболочка атома бора содержит энергетических уровней верно ошибка ошибка ошибка 1) 1 2) 2 3) 3 4) 4 А7. На электронных уровнях атома магния 12 Mg электроны распределяются следующим образом ошибка ошибка ошибка 1) 2е,8е,2е 2) 1е,10е,1е 3) 2е,8е,5е 4) 2е,10е А8. Сферическую форму имеет орбиталь верно ошибка ошибка ошибка 1) f 2) d 3) p 3) s
Энергия электрона максимальна на энергетическом уровне А2. Максимальное число электронов на второй электронной оболочке 1) 1 ошибка 2) 2 ошибка 3) 3 верно 4) 4 ошибка 1) 2 ошибка 2) 4 ошибка 3) 6 верно 4) 8 А3. Максимальное число электронов на четвертой электронной оболочке ошибка 1) 4 ошибка 2) 16 верно 3) 32 ошибка 4) 64 А4. Максимальное число электронов на пятой электронной оболочке ошибка 1) 5 верно 2) 50 ошибка 3) 125 ошибка 4) 625 А5. Электронная оболочка атома натрия содержит энергетических уровней ошибка ошибка верно ошибка 1) 1 2) 2 3) 3 4) 4. А6. Электронная оболочка атома бора содержит энергетических уровней верно ошибка ошибка ошибка 1) 1 2) 2 3) 3 4) 4 А7. На электронных уровнях атома магния 12 Mg электроны распределяются следующим образом ошибка ошибка ошибка 1) 2е,8е,2е 2) 1е,10е,1е 3) 2е,8е,5е 4) 2е,10е А8. Сферическую форму имеет орбиталь верно ошибка ошибка ошибка 1) f 2) d 3) p 3) s
Слайд 9
А9. На внешнем энергетическом уровне атома хлора содержится электронов верно ошибка ошибка ошибка 1) 3 2) 5 3) 7 4) 8 А10. На внешнем энергетическом уровне атома алюминия содержится электронов верно ошибка ошибка ошибка 1) 3 2) 5 3) 7 4) 8 А11. Инертный газ может содержать на внешнем энергетическом уровне электронов верно ошибка ошибка ошибка 1) 3 2) 5 3) 7 4) 8 Проверь свои знания
На внешнем энергетическом уровне атома алюминия содержится электронов верно ошибка ошибка ошибка 1) 3 2) 5 3) 7 4) 8 А11. Инертный газ может содержать на внешнем энергетическом уровне электронов верно ошибка ошибка ошибка 1) 3 2) 5 3) 7 4) 8 Проверь свои знания
Слайд 10
В1. Установите соответствие между распределением электронов по уровням атома элемента и символом этого элемента. Ответ дайте в виде последовательности цифр, соответствующей буквам по алфавиту . РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ СИМВОЛ ЭЛЕМЕНТА А) 2е,8е,2е 1) S Б) 2е,8е,4е 2) Ar В) 2е,8е,6е 3) Mg Г) 2е,8е,8е 4) Si 3412 ответ Проверь свои знания
Слайд 11
Домашнее задание Читать §8 (страницы 46-50). Выучить ключевые понятия темы на странице 52. Выполнить письменно упражнения 1 и 2 на странице 52.
Строение электронных оболочек атомов | Презентация к уроку по химии (8 класс):
Слайд 1
Строение электронных оболочек атомов Урок № 8, 9Слайд 2
Электронная оболочка (энергетический уровень) — это совокупность электронов, близких по значению энергии.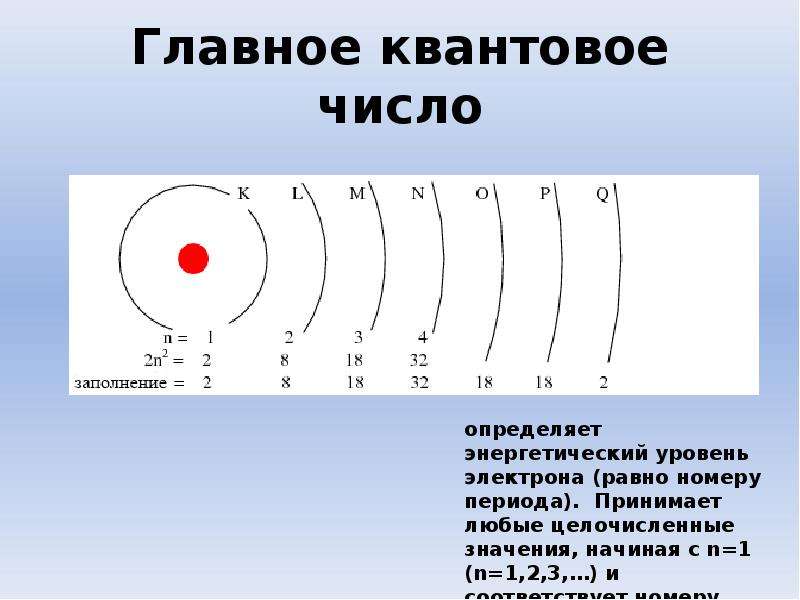 Число электронных оболочек у атома химического элемента равно номеру периода ( n) , в котором он находится. Максимальное число электронов на уровне ( N) = 2n 2 .
Число электронных оболочек у атома химического элемента равно номеру периода ( n) , в котором он находится. Максимальное число электронов на уровне ( N) = 2n 2 .
Слайд 3
1 период — одна оболочка Максимум 2*1 2 = 2 e — 2 период — две оболочки Максимум 2* 2 2 = 8 e — 3 период — три оболочки Максимум 2* 3 2 = 18 e — 4 период — четыре оболочки Максимум 2* 4 2 = 3 2 e — + Z + Z + Z + Z ) ) ) ) ) ) ) ) ) )
Слайд 4
Число электронов на внешней оболочке определяется номером группы , в которой находится химический элемент ( не может быть больше 8 ). I группа — один электрон II группа — два электрона + Z ) ) 1 e — + Z ) ) 2e —
Слайд 5
Распределение электронов по энергетическим уровням +1 ) 1 e — Н Не +2 ) 2 e — 1 период I группа VIII группа
Слайд 6
2 период +3 ) ) 2 e — 1 e — Li B е + 4 ) ) 2 e — 2 e — B + 5 ) ) 2 e — 3e — C + 6 ) ) 2 e — 4e — N + 7 ) ) 2 e — 5e — + 8 ) ) 2 e — 6e — O + 9 ) ) F + 10 ) ) Ne 2 e — 7e — 2 e — 8e —
Слайд 7
Энергетические уровни Завершённые Незавершённые 8 электронов — внешний уровень.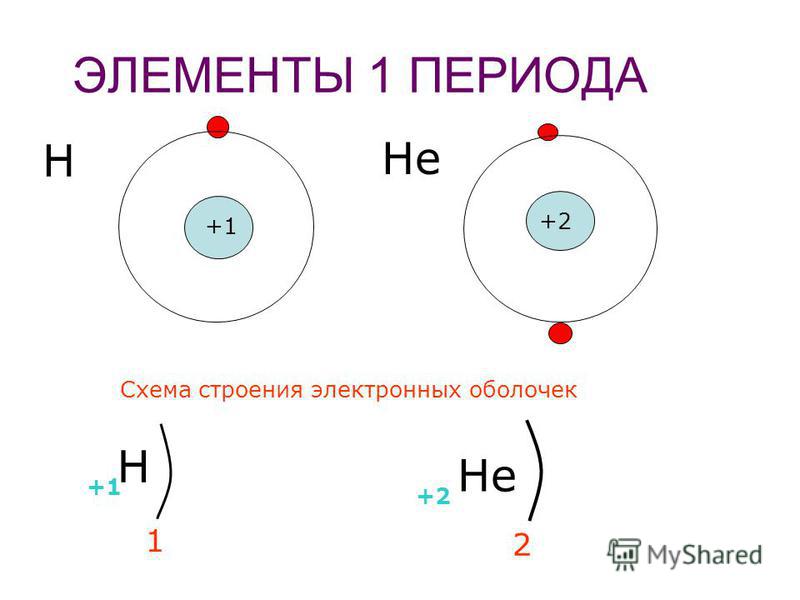 Максимальное число электронов — любой другой уровень. Не максимальное число электронов
Максимальное число электронов — любой другой уровень. Не максимальное число электронов
Слайд 8
Электронная орбиталь (энергетический подуровень) — это область пространства вокруг ядра атома химического элемента в которой наиболее вероятно находится электрон .
Слайд 9
Орбитали s f p d
Слайд 10
Энергетические уровни и электронные орбитали + Z ) ) ) ) 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
Слайд 11
Распределение электронов по орбиталям 1. s — орбитали заполняются в первую очередь . Затем заполняются р- орбитали 2. На каждой орбитали (клеточке) может находиться не более 2 электронов . 3. Электрон обозначается стрелочками или
Слайд 12
+1 ) 1 e — Н 1 s +2 ) He 2e — 1 s Электронно-графические формулы 1s 1 1s 2
Слайд 13
+3 ) ) Li 2 e — 1 e — 1 s 2 s + 4 ) ) 2 e — 2 e — 1 s 2 s Be 1s 2 2s 1 1s 2 2s 1 Электронные формулы
Слайд 14
+ 5 ) ) B 2 e — 3e — 1 s 2 s 2 p 1 s 2 2s 2 2p 1
Слайд 15
+ 6 ) ) C 2 e — 4e — 1 s 2 s 2 p 1 s 2 2s 2 2p 2
Слайд 16
+ 7 ) ) N 2 e — 5e — 1 s 2 s 2 p 1 s 2 2s 2 2p 3
Слайд 17
+ 8 ) ) O 2 e — 6e — 1 s 2 s 2 p 1 s 2 2s 2 2p 4
Слайд 18
+ 9 ) ) F 2 e — 7e — 1 s 2 s 2 p 1 s 2 2s 2 2p 5
Слайд 19
+ 10 ) ) Ne 2 e — 8e — 1 s 2 s 2 p 1 s 2 2s 2 2p 6
Слайд 20
Домашнее задание §9, ответить на вопросы 1-4 стр. 60
Строение электронных оболочек атомов. (Тема 9)
—Нейтроны
Протоны
+
+
—
+
—
Электроны
Количество электронов в оболочке атома
соответствует числу протонов в ядре атома.
4 электрона
9 электронов
30 электронов
Орбиталь — пространство вокруг ядра
атома, где наиболее вероятно
нахождение данного электрона
Орбитали составляют
энергетические уровни.
Электронная оболочка атомов первого периода
содержит один энергетический уровень.
Электронная оболочка атомов второго периода
содержит по два энергетических уровня.
Электронная оболочка атомов третьего периода
содержит по три энергетических уровня.
Сколько электронных оболочек имеют атомы
магния (Mg), меди (Cu), серебра (Ag)
3 энергетических
уровня
Сколько электронных оболочек имеют атомы
магния (Mg), меди (Cu), серебра (Ag)
4 энергетических
уровня
Сколько электронных оболочек имеют атомы
магния (Mg), меди (Cu), серебра (Ag)
уровней
Максимальное число электронов, находящихся на энергетическом
уровне можно определить по следующей формуле:
2n2
номер энергетического уровня
Максимальное количество электронов на первом уровне:
2⋅12= 2
Максимальное количество электронов на втором уровне:
2⋅22= 8
Максимальное количество электронов на третьем уровне:
2⋅32= 18
Максимальное количество электронов на четвёртом уровне:
2⋅42= 32
Один электрон на
внешнем уровне
Три электрона на
внешнем уровне
Пять электронов на
внешнем уровне
Пять электронов на
внешнем уровне
Пять электронов на
внешнем уровне
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода (O), фтора (F)
1.
 Определим общее число электронов
Определим общее число электроновв электронной оболочке по
порядковому номеру элемента в
Периодической таблице:
гелий (Не) – имеет два электрона,
бор (B) – имеет пять электронов,
кислород (O) – имеет восемь
электронов,
фтор (F) – имеет девять электронов.
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода (O), фтора (F)
Определим число заполняемых
электронами энергетических уровней в
электронной оболочке по номеру
периода:
гелий (Не) – один энергетический
уровень, заполненный двумя
электронами,
бор (B), кислород (O) и фтор (F) – два
энергетических уровня, заполненных
свойственным им количеством
электронов.
Гелий
Бор
Кислород
Фтор
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода (O), фтора (F)
А теперь определим число электронов
на каждом энергетическом уровне на
наших примерах:
Гелий (Не) – два электрона на

Гелий
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода (O), фтора (F)
Бор (B) – пять электронов, из которых
два располагаются на первом
энергетическом уровне, максимально
заполнив его, а оставшиеся три на
внешнем, втором энергетическом
уровне, что соответствует номеру
группы бора.
Бор
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода (O), фтора (F)
Кислород (O) – восемь электронов, из
которых два располагаются на первом
энергетическом уровне, максимально
заполнив его, а оставшиеся шесть на
внешнем, втором энергетическом
уровне, что соответствует номеру
группы кислорода.
Кислород
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода (O), фтора (F)
Фтор (F) – девять электронов, из
которых два располагаются на первом
энергетическом уровне, максимально
заполнив его, а оставшиеся семь на
внешнем, втором энергетическом
уровне, что соответствует номеру
группы фтора.
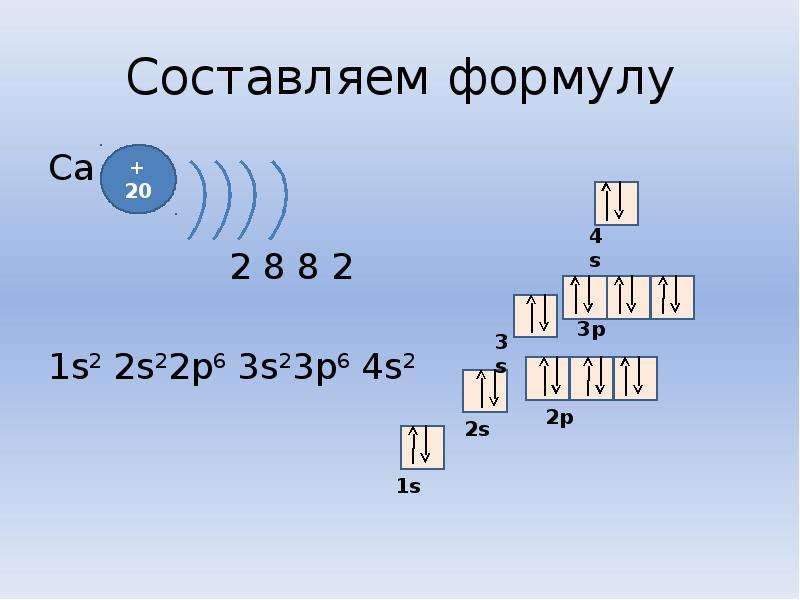
Фтор
s-, p-, d- и f-орбитали
s — орбиталь
p — орбиталь
s – орбиталь Водорода
s – орбиталь Гелия
Электронные формулы атомов химических элементов
Н – 1S1
He – 1S2
Li – 1S22S1
Mg – 1S22S22p63S2
B – 1S22S22p1
Электронные формулы химических
элементов первых трёх периодов
Н – 1S1
He – 1S2
Li – 1S22S1
Ne – 1S22S22p6
Be – 1S22S2
Ar – 1S22S22p63S23p6
B – 1S22S22p1
AI – 1S22S22p63S23p1
C – 1S22S22p2
Si – 1S22S22p63S23p2
N – 1S22S22p3
P – 1S22S22p63S23p3
O – 1S22S22p4
S – 1S22S22p63S23p4
F – 1S22S22p5
Строение электронных оболочек атомов — презентация онлайн
2. Строение электронных оболочек атомов
Задачи урока:1) Познакомиться со строением
электронных оболочек атомов
2) Научиться составлять схемы
строения электронных
оболочек
3. Соотнесите химические формулы и формы существования химических элементов
1) 2S
2) S8
3) 3h3O
4) Al2O3
5) 2Al
6) CuO
1
2
3
3
1
3
• 1) свободные
атомы
• 2) простые
вещества
• 3) сложные
вещества
4.
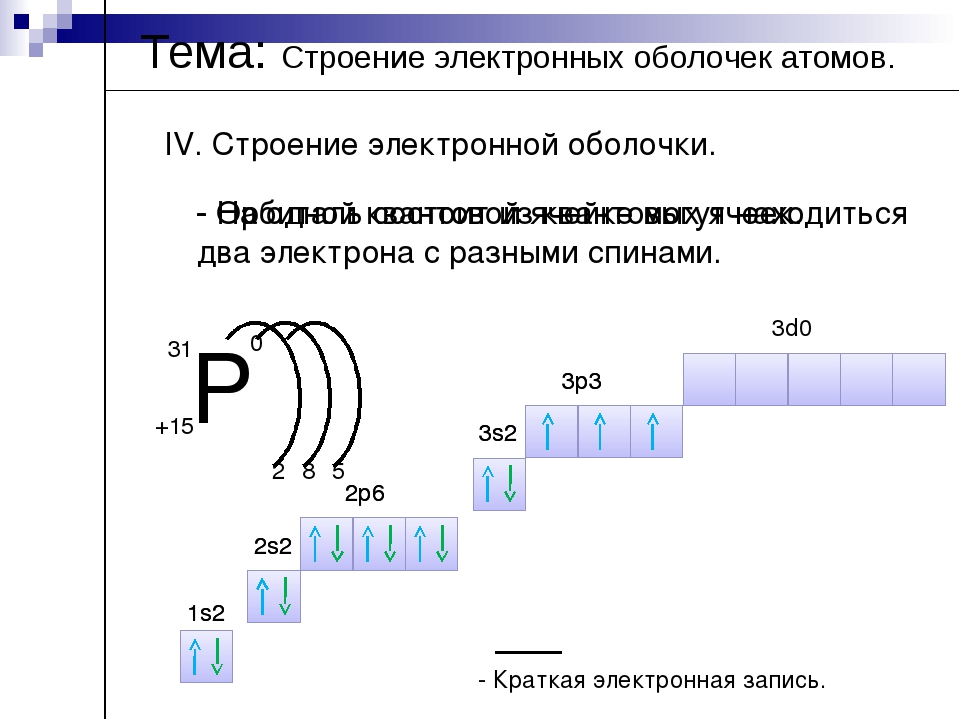
 Энергетический уровень (электронный слой) – это… 1
Энергетический уровень (электронный слой) – это… 1+4
Be ) )
2 2
Be 2e, 2e
5. Число энергетических уровней = номеру периода
Максимальное число электронов науровне = 2 n2
1 уровень – 2 электрона
2 уровень – 8 электронов
Завершенный
уровень -…
3 уровень – 18 электронов
Максимальное число электронов на внешнем
уровне — 8
6. Запишите схемы строения электронных оболочек атомов: углерода, азота,кислорода, фтора.
• Соотнесите число электронов навнешнем уровне и номер группы
Число электронов на внешнем
уровне равно номеру группы
7. Повторение
1. Электроны в атомах располагаются …2. Электроны одного энергетического уровня
имеют примерно одинаковый …
3. Число уровней равно ….
4. Максимальное число электронов на уровне =
…
5. Уровень, содержащий максимальное
количество электронов называют …
6. Завершенный внешний уровень содержит
….. электронов
7.
 Число электронов на внешнем уровне = …
Число электронов на внешнем уровне = …8. Электронная облако. Электронная орбиталь
+S — орбиталь
9. Электронная орбиталь
Р — орбиталь10. Электронная орбиталь
Р — орбитали11. На одной орбитали не может находится более 2 электронов
• Количество орбиталей на уровняхравно номеру уровня.
1 уровень – S — орбиталь
2 уровень – S, P — орбитали
12. Электронные формулы
H )1
He )2
C )2 )4
O
F
Na
1S1
1S2
1S2 2S22P2
13. Повторение
1. Пространство вокруг ядра атома ,гденаиболее вероятно нахождение
электрона называют ….
2. S и P – орбитали различаются ….
3. Каждый уровень начинается …
орбиталью
4. На S – орбитали может находиться ….
электрона, на Р – орбиталях — ….
Электронов
5. Объясните, что обозначают цифры и
• По положению в Периодической
таблице определите: а) что лучший
окислитель — сера или фосфор? б) У
селена или у мышьяка лучше выражены
металлические свойства?
• Возрастают или уменьшаются
восстановительные свойства
элементов в ряду Li-Na-K-Rb-Cs?
Презентация «Строение атома» 8 класс, химия
библиотека
материалов
Содержание слайдов
Номер слайда 1
Основные сведения о строении атома.
Номер слайда 2
ядроатомэлектронынейтроныпротоны
Номер слайда 4
Электронная оболочка атома – совокупность всех электронов в атоме Электроны, обладающие близкими значениями энергии, образуют единый электронный слой(энергетический уровень)= номеру периода Электронное облако (атомная орбиталь, энергетический подуровень) — пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона валентные электроны – количество электронов, находящиеся на внешней (валентной) оболочке атома= номеру группы
Номер слайда 5
Число p+ равно порядковому номеру химического элемента, электрону, заряду ядра Число ē порядковому номеру химического элемента, протону, заряд ядра Число n° N = A – Z (массовое число минус порядковый номер химического элемента) p+=6№=6e=6 Z= 6e=14№=14p=14 Z= 14 N= 9-4=5
Графически любая орбиталь изображается в виде клетки (квантовой ячейки):
Номер слайда 7
Номер слайда 8
Определите заряд ядра, атомную массу, количество электронов, протонов и нейтронов
Номер слайда 9
Номер слайда 10
3s12p62s21s2+11218sspspd1s22s23s12p6
Номер слайда 11
Неспаренные электроны. Валентные электроны
Валентные электроны
1
Первый слайд презентации: Строение электронных оболочек атомов
8 класс
Изображение слайда
2
Слайд 2: Цели урока
Сформировать представления об электронной обоблочек атома и энергетических уровнях Рассмотреть электронное строение элементов 1-3 периодов
Изображение слайда
3
Слайд 3: Проверка домашнего задания
Упражнения – стр. 46
Я́дерная реа́кция — процесс образования новых ядер или частиц при столкновениях ядер или частиц. Впервые ядерную реакцию наблюдал Резерфорд в 1919 году, бомбардируя α-частицами ядра атомов азота
.
46
Я́дерная реа́кция — процесс образования новых ядер или частиц при столкновениях ядер или частиц. Впервые ядерную реакцию наблюдал Резерфорд в 1919 году, бомбардируя α-частицами ядра атомов азота
.
Изображение слайда
4
Слайд 4
Правило смещения
(правило Содди-Фаянса) :
При α – распаде радиоактивный элемент превращается в другой, отстоящий от исходного на 2 клеточки левее в периодической системе химических элементов, а при β – распаде получается химический элемент с порядковым номером на единицу большим, чем исходный.
Фредерик Содди
(1877-1956), открыл
явление изотопии в 1910г. (Нобелевская премия по
химии, 1921г.)
Казимир Фаянс
(1887-1975)
Закон смещения дал возможность предсказывать последовательность распада многих радиоактивных элементов, определяя образующиеся таким образом элементы на основе вида излучения и включая их в таблицу периодической системы.
(Нобелевская премия по
химии, 1921г.)
Казимир Фаянс
(1887-1975)
Закон смещения дал возможность предсказывать последовательность распада многих радиоактивных элементов, определяя образующиеся таким образом элементы на основе вида излучения и включая их в таблицу периодической системы.
Изображение слайда
5
Слайд 5: ОБОЗНАЧЕНИЕ ЯДРА АТОМА
АЛЬФА α — РАСПАД
— характерен для радиоактивных элементов с порядковым номером больше 83 — обязательно выполняется закон сохранения массового и зарядового числа. — часто сопровождается гамма-излучением. Реакция альфа-распада:
БЕТА β — РАСПАД
— часто сопровождается гамма-излучением.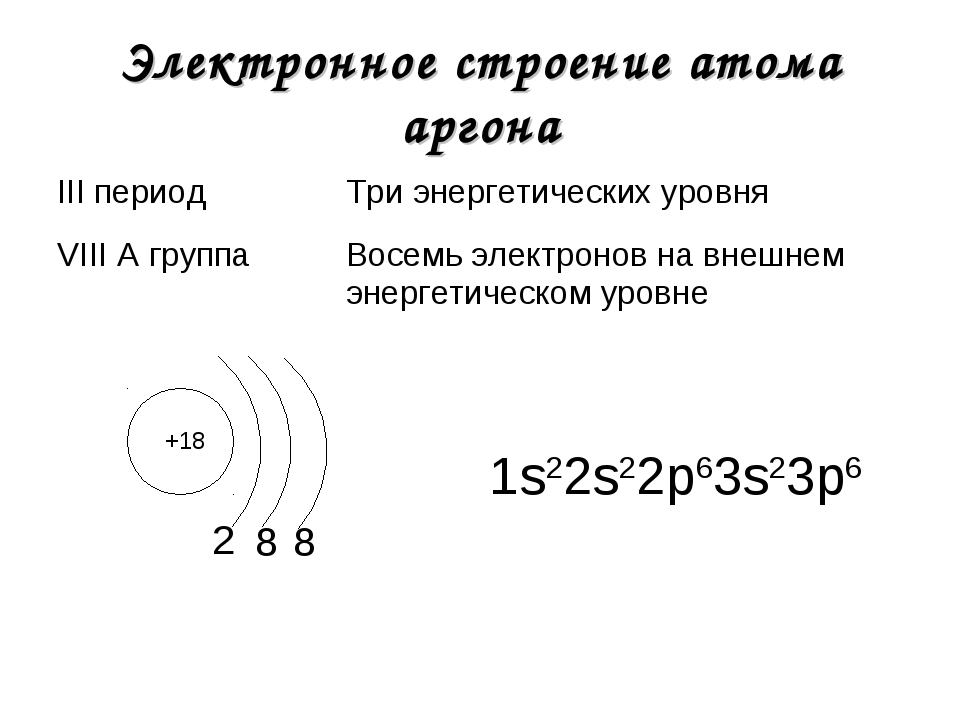 — может сопровождаться образованием антинейтрино ( легких электрически нейтральных частиц, обладающих большой проникающей способностью). — обяэательно должен выполняться закон сохранения массового и зарядового числа. Реакция бета-распада:
ГАММА γ -распад
– это поток электромагнитного излучения с очень короткой длиной волны и очень высокой (интенсивной) частотой, при этом массовое число и заряд ядра не изменяются, а энергия ядра уменьшается.
Закон сохранения массового числа и заряда:
Сумма зарядов (массовых чисел) продуктов распада равна заряду (массовому числу) исходного ядра
— может сопровождаться образованием антинейтрино ( легких электрически нейтральных частиц, обладающих большой проникающей способностью). — обяэательно должен выполняться закон сохранения массового и зарядового числа. Реакция бета-распада:
ГАММА γ -распад
– это поток электромагнитного излучения с очень короткой длиной волны и очень высокой (интенсивной) частотой, при этом массовое число и заряд ядра не изменяются, а энергия ядра уменьшается.
Закон сохранения массового числа и заряда:
Сумма зарядов (массовых чисел) продуктов распада равна заряду (массовому числу) исходного ядра
Изображение слайда
6
Слайд 6: Написание уравнений ядерных реакций
Изображение слайда
7
Слайд 7
Изображение слайда
8
Слайд 8: Ответьте на вопросы
Чем можно объяснить различие в свойствах элементов? Причина – различие атомов (различное число протонов и электронов) Чем можно объяснить сходство некоторых элементов? — Причина – сходство внутреннего строения атома
Изображение слайда
9
Слайд 9: Электронная оболочка
Совокупность всех электронов в атоме, окружающих ядро Каждый электрон имеет свою траекторию движения и запас энергии Электроны расположены на различном расстоянии от ядра: чем ближе электрон к ядру, тем он прочнее с ним связан, его труднее вырвать из электронной оболочки По мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее
Изображение слайда
10
Слайд 10
Подуровни состоят из орбиталей.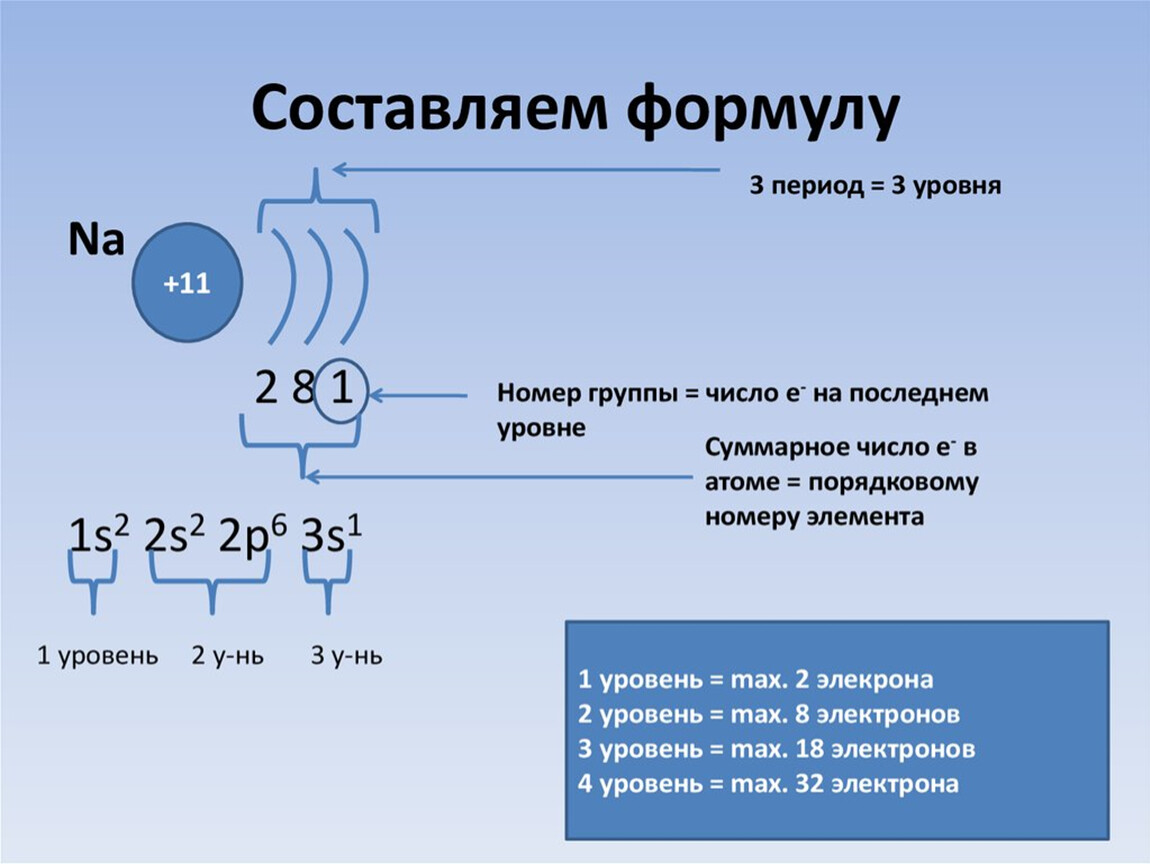 Число орбиталей на уровне — n 2
Максимальное число электронов на энергетическом уровне определяется по формуле 2n 2
1
2
3
Е 1 < E 2 < E 3
Электронные слои (энергетические уровни — n ) – совокупность электронов на одной оболочке, имеют одинаковый запас энергии
Число энергетических уровней в атоме равно номеру периода, в котором располагается атом
Сколько энергетических уровней у атомов:
углерода, натрия, золота, водорода, железа?
Энергетические уровни состоят из подуровней : S, p, d, f
Число подуровней на уровне равно номеру уровня
Е
n=1
n=2
n=3
n=4
n=5
n=6
n=7
S
p
d
f
S
S
S
p
p
d
ядро
Число орбиталей на уровне — n 2
Максимальное число электронов на энергетическом уровне определяется по формуле 2n 2
1
2
3
Е 1 < E 2 < E 3
Электронные слои (энергетические уровни — n ) – совокупность электронов на одной оболочке, имеют одинаковый запас энергии
Число энергетических уровней в атоме равно номеру периода, в котором располагается атом
Сколько энергетических уровней у атомов:
углерода, натрия, золота, водорода, железа?
Энергетические уровни состоят из подуровней : S, p, d, f
Число подуровней на уровне равно номеру уровня
Е
n=1
n=2
n=3
n=4
n=5
n=6
n=7
S
p
d
f
S
S
S
p
p
d
ядро
Изображение слайда
11
Слайд 11
Энергетические уровни, содержащие максимальное число электронов, называются завершенными. Они обладают повышенной устойчивостью и стабильностью
Энергетические уровни, содержащие меньшее число электронов, называются незавершенными
n=1 – 1 подуровень ( S ), 2 электрона
n= 2 – 2 подуровня ( S, р), 8 электронов
n= 3 – 3 подуровня ( S, р, d ), 1 8 электронов
n=4 – 4 подуровня ( S, р, d, f ), 32 электрона
Они обладают повышенной устойчивостью и стабильностью
Энергетические уровни, содержащие меньшее число электронов, называются незавершенными
n=1 – 1 подуровень ( S ), 2 электрона
n= 2 – 2 подуровня ( S, р), 8 электронов
n= 3 – 3 подуровня ( S, р, d ), 1 8 электронов
n=4 – 4 подуровня ( S, р, d, f ), 32 электрона
Изображение слайда
12
Слайд 12: Запомните!
Электроны, расположенные на последней электронной оболочке, называются внешними. Число внешних электронов для химических элементов главных подгрупп равно номеру группы, в которой находится элемент
Изображение слайда
13
Слайд 13: Форма электронных облаков ( орбиталей )
Область наиболее вероятного местонахождения электрона в пространстве S – облако р – облака d — облака f – облако
Изображение слайда
14
Слайд 14: 1 период
Н + 1 1 n=1 S 1 S 1 Н e + 2 2 n=1 S 1 S 2 Одиночный электрон на незавершенной оболочке 2 спаренных электрона на завершенной оболочке S — элементы + +
Изображение слайда
15
Слайд 15: 2 период
Li + 3 2 1 n=1 n=2 1 S 2 2 S 1 Be + 4 2 2 n=1 n=2 1 S 2 2 S 2 B + 5 2 3 n=1 n=2 1 S 2 2 S 2 2p 1 S — элементы р — элемент S S S S S S p p p + + + +
Изображение слайда
16
Слайд 16: 2 период
С + 6 2 4 n=1 n=2 N + 7 2 5 n=1 n=2 O + 8 2 6 n=1 n=2 1 S 2 2 S 2 2p 4 р — элементы 1 S 2 2 S 2 2p 2 1 S 2 2 S 2 2p 3 S S S S S S p p p
Изображение слайда
17
Слайд 17: 2 период
F + 9 2 7 n=1 n=2 Ne + 10 2 8 n=1 n=2 Na + 11 2 8 1 n=1 n=2 1 S 2 2 S 2 2p 6 3 S 1 р — элементы 1 S 2 2 S 2 2p 5 1 S 2 2 S 2 2p 6 3 период S — элемент S S S S S S S p p p p d n= 3
Изображение слайда
18
Слайд 18: 3 период
Mg + 12 2 8 2 n=1 n=2 Al + 13 2 8 3 n=1 n=2 Si + 14 2 8 4 n=1 n=2 1 S 2 2 S 2 2p 6 3 S 3p 2 S- р — элементы 1 S 2 2 S 2 2p 6 3 S 2 1 S 2 2 S 2 2p 6 3 S 2 S S S S S S S p p p p d n= 3 n= 3 S p d n= 3 3p 1
Изображение слайда
19
Слайд 19: 3 период
P + 15 2 8 5 n=1 n=2 S + 16 2 8 6 n=1 n=2 Cl + 17 2 8 7 n=1 n=2 1 S 2 2 S 2 2p 6 3 S 3p 5 р — элементы 1 S 2 2 S 2 2p 6 3 S 2 3p 3 1 S 2 2 S 2 2p 6 3 S 2 S S S S S S S p p p p d n= 3 n= 3 S p d n= 3 3p 4
Изображение слайда
20
Слайд 20: 3 период
Ar + 18 2 8 8 n=1 n=2 K + 19 2 8 8 1 Ca + 20 2 8 8 2 1 S 2 2 S 2 2p 6 3 S 2 3p 6 4S 2 р — элемент 1 S 2 2 S 2 2p 6 3 S 2 3p 6 1 S 2 2 S 2 2p 6 3 S 2 S S p n= 3 S p d 3p 6 4S 1
Изображение слайда
21
Слайд 21: Выводы
Причина сходства элементов заключается в одинаковом строении внешних энергетических уровней их атомов
Одинаковое строение внешних энергетических уровней периодически (т.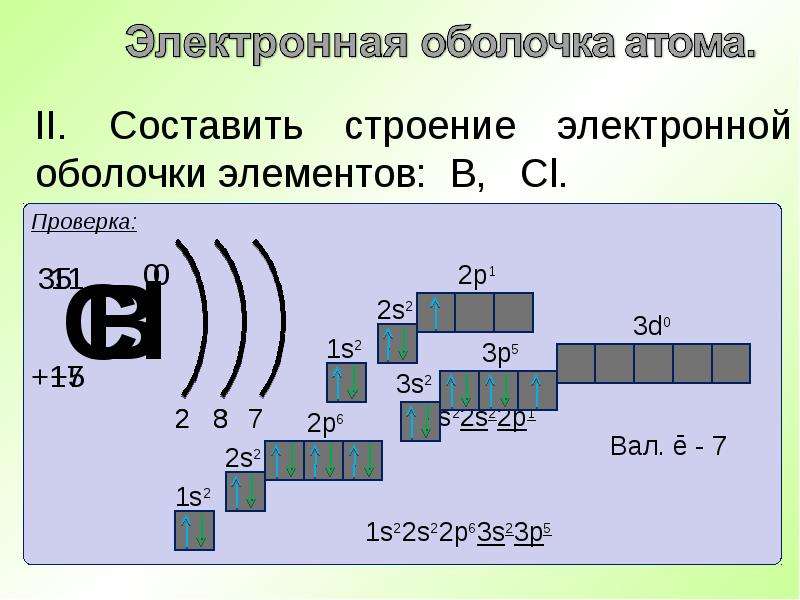 е. через определенные промежутки — периоды) повторяется, поэтому периодически повторяются и свойства химических элементов
е. через определенные промежутки — периоды) повторяется, поэтому периодически повторяются и свойства химических элементов
Изображение слайда
22
Последний слайд презентации: Строение электронных оболочек атомов: Домашнее задание
Параграф 8, записи в тетради Зарисовать строение химических элементов 3 периода Упражнения 2-5, стр. 52-53
Изображение слайда
Презентация по химии » Строение электронной оболочки атомов»
Презентация по данной теме может быть использована как дополнительный учебный материал по химии в 8,9,11 классах при повторении, закреплении, подготовке к тематической работе
Просмотр содержимого документа
«Презентация по химии » Строение электронной оболочки атомов»»
ТРЕБОВАНИЯ К ОНЛАЙН- ЗАНЯТИЯМ
- Приветствие никто не отменял)
2 ) ФАМИЛИЯ, ИМЯ, ГРУППА -реальные
3) Корректность переписки в чате, беседе, группе- дамы и джентельмены ненормативную лексику не используют
4 )Микрофоны выключены , если нет необходимости, при технических ошибках работаем самостоятельно
5) Убираем все лишнее , выключаем музыку
6) На занятия не опаздываем и не пропускаем !
ТРЕБОВАНИЯ К ОФОРМЛЕНИЮ ДОМАШНИХ ЗАДАНИЙ
1 строчка — ФАМИЛИЯ, ИМЯ, ГРУППА
2 строчка – Домашняя работа / ДАТА
3 строчка – ВЫПОЛНЕНИЕ ЗАДАНИЯ
4 строчка – ОТВЕТ
СРОКИ СДАЧИ ДЗ НЕ НАРУШАЕМ!
ПОСЛЕ ВРЕМЕНИ НЕ ОТПРАВЛЯЕМ ,
БЕРЕЖЕМ свое и чужое время!
ПОВТОРЯЕМ
ПРЕДСТАВЛЯЕМ
УЗНАЕМ
ПРОДОЛЖАЕМ УЗНАВАТЬ
Продолжение
ПРАВИЛА распределения электронов по уровням, подуровням
ПРОДОЛЖЕНИЕ
ПРИМЕР
Еще ПРИМЕР
ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ атомов
ДОМАШНЕЕ ЗАДАНИЕ
- Проверочная работа по теме «Электронная оболочка атомов» на платформе ЯКласс
2) ТРЕНАЖЕРЫ по изученным темам!
3) Наиболее активные пользователи – бонус на диффиринцированном ЗАЧЕТЕ!
4) СРОК – с 09.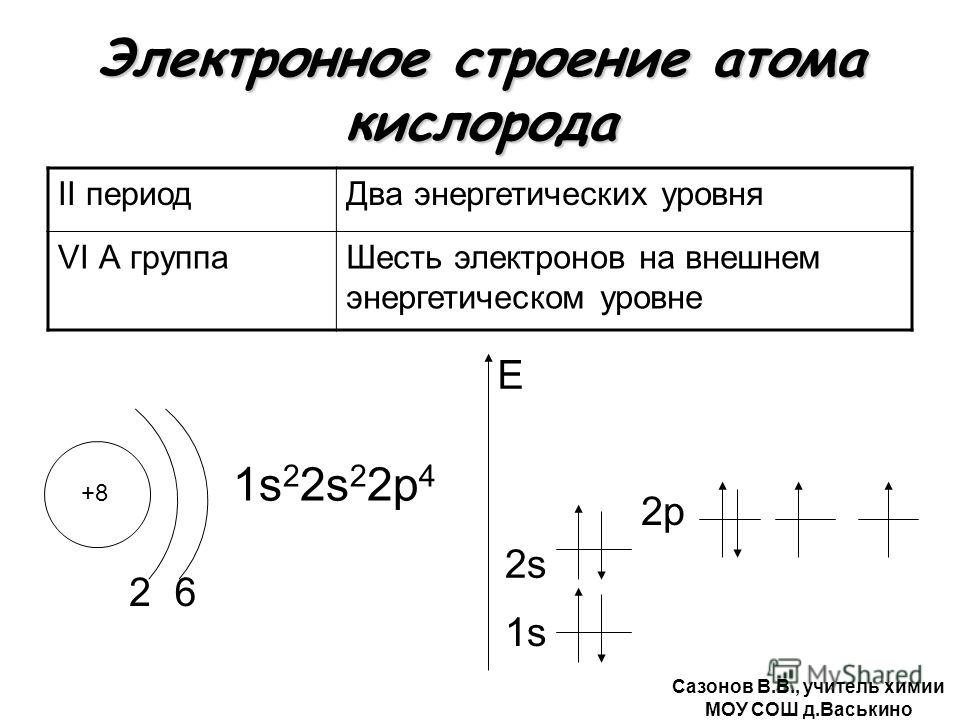 10 по 16.10
10 по 16.10
Атомная структура 8-го класса Наука.
Презентация на тему: «Атомная структура, 8-й класс, наука» — стенограмма презентации:
1 Атомная структура 8-й класс естествознания
2 Частей атома Протоны = положительный заряд 1+
Нейтроны = не имеют заряда (0) Электроны = отрицательный заряд 1 — Атомы разных элементов различаются по количеству протонов, которые они содержат.Атомный номер = количество протонов и количество электронов в нейтральном атоме Обозначает элемент!
3
Маленькая шутка … Нейтрон вошел в ресторан и спросил, сколько выпить. Бармен ответил: «Для вас бесплатно». -Jaime — Интернет-шутки о химии
Бармен ответил: «Для вас бесплатно». -Jaime — Интернет-шутки о химии
4 Все атомы имеют 2 общие структуры:
энергетических уровней ядра.
5 — — Каждая структура состоит из субчастиц.+ уровень энергии протонов
ядер электронов нейтронов —
6 Уровни энергии 1-я оболочка может содержать 2 электрона 2-я оболочка может удерживать 8
3-я оболочка может удерживать 18
7 Электронное облако. Протоны и нейтроны находятся в небольшом положительно заряженном (+) центре атома, называемом ядром, который окружен облаком, содержащим электроны.
8 Атомная единица массы (AMU):
Масса протона или нейтрона составляет примерно 1 атомную единицу массы или AMU Протон = в 2000 раз больше, чем электрон.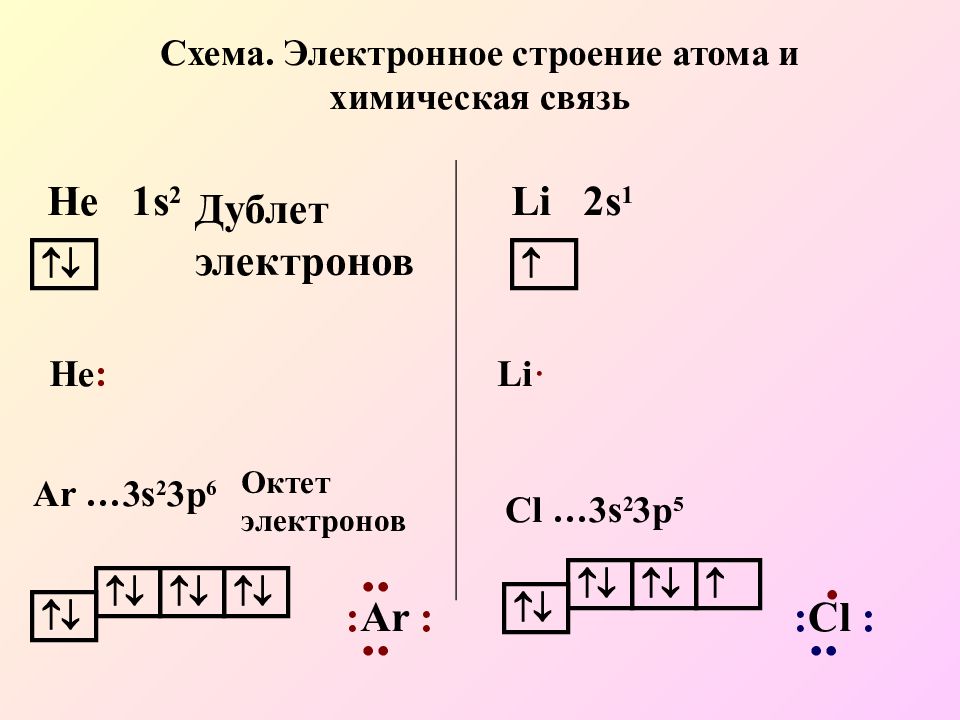 Электронное облако составляет большую часть объема (пространства) атома. Электроны очень маленькие. Нейтрон большой и тяжелый, как протон.
Электронное облако составляет большую часть объема (пространства) атома. Электроны очень маленькие. Нейтрон большой и тяжелый, как протон.
9 Настоящее электронное облако
400 г. до н.э. Демокрит 1904 Томсон 1913 Бор Настоящее электронное облако 1911 Резерфорд 1926
10 Если в ядре обнаружены и протоны, и нейтроны, почему он положительный?
Нейтроны имеют положительный заряд И нейтроны, и протоны имеют положительный заряд. Протоны имеют положительный заряд, а нейтроны не заряжены. Нейтроны имеют отрицательный заряд.
11 Атомная структура Video Discovery Education
12 Углерод имеет 6 протонов.Атомный номер углерода — 6.
Число протонов в ядре атома — это атомный номер этого атома. + — Углерод имеет 6 протонов. Атомный номер углерода равен 6. Число протонов плюс количество нейтронов в ядре атома — это его атомная масса.
13 Сколько протонов в магнии?
25 24,31 11 12
14 Какова атомная масса калия?
39.10 19 15 30,97
15 16 Атомная масса (протоны + нейтроны) — 8 Атомный номер (протоны) ___
Чтобы найти количество нейтронов в атоме, вычтите атомный номер из атомной массы. 16 Атомная масса (протоны + нейтроны) — 8 Атомный номер (протоны) ___ 8 Количество нейтронов
16 Маленькая поговорка, чтобы помочь вам вспомнить…
tomic # = ass # rotons = tomic # lectrons uetrons
17 Атомный номер = 8 8 Протонов = 16 Атомная масса = Нейтроны = 8 2
+ + + + + + + + + Нейтроны = 8 Уровней Энергии = 2 атома кислорода Электроны = 8
18 Сколько нейтронов у калия?
39 19 20 21
19 Сколько нейтронов в литии?
3 4 6 7
20
Валентные электроны Электроны, наиболее удаленные от ядра или удерживаемые наиболее слабо. Диапазон от 1 до 8 валентных электронов Многие свойства атома и, следовательно, элемента определяются числом валентных электронов.
Диапазон от 1 до 8 валентных электронов Многие свойства атома и, следовательно, элемента определяются числом валентных электронов.
21 год Электронно-точечные диаграммы Также называется структурой Льюиса
Используется для представления валентных электронов. Состоит из символа элемента, окруженного точками. Каждая точка обозначает один валентный электрон.
22 Химические связи Валентные электроны могут образовывать химические связи, силу, удерживающую атомы вместе.Когда образуются связи, валентные электроны либо переносятся, либо разделяются между атомами. Когда атомы в конечном итоге имеют 8 или 0 валентных электронов, они становятся более стабильными или менее реактивными.
атомная структура ppt сорт 8
Обсуждение во время разминки приводит непосредственно к заметкам из статьи «Теория атома» о Боре и его атомной модели (слайды 6-8) атома и квантово-механической модели (слайд 9).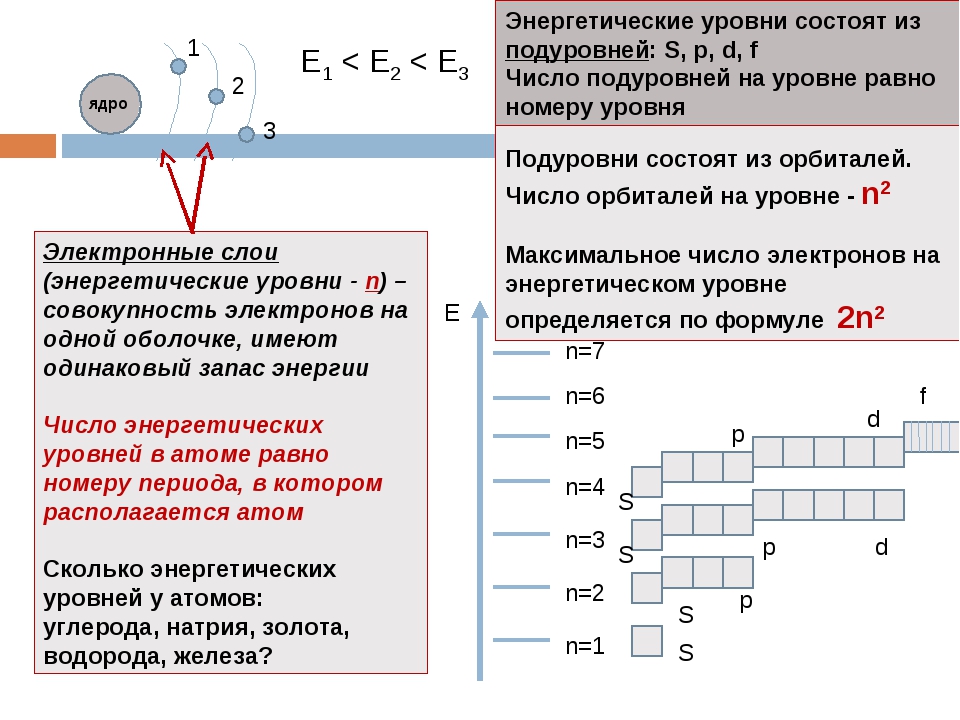 Как и почему со временем менялась атомная теория. После того, как вы записали свои заметки в отведенном для них месте в управляемых заметках, обменяйтесь мыслями с партнером.протоны. Средняя точность 78%. Атомная теория — ПРОЕКТ для 8-го класса. Почему атомная масса большинства элементов Периодической таблицы не является .. Попробуйте литий Ваша деятельность … Эта презентация охватывает атомную структуру, протоны, электроны, нейтроны, плитки элементов периодической таблицы и модели Бора. Включает 84 вопроса с несколькими вариантами ответов (72 обычных + 12 дополнительных сложных) и 2 листа для ответов. Радиусы атомов порядка 10-8 см. Пролистайте стр. 464-466. Планы уроков по атомной структуре. Нейтроны. Примечания к классу атомной структуры и рабочий лист НАПРАВЛЕНИЯ: Сторона № 1: Заполните примечания к классу из PPT по атомной структуре.с помощью оптического сканирующего микроскопа наблюдалась структура некоторых ионных, металлических и молекулярных веществ. boardworks_the_periodic_table_part_2.
Как и почему со временем менялась атомная теория. После того, как вы записали свои заметки в отведенном для них месте в управляемых заметках, обменяйтесь мыслями с партнером.протоны. Средняя точность 78%. Атомная теория — ПРОЕКТ для 8-го класса. Почему атомная масса большинства элементов Периодической таблицы не является .. Попробуйте литий Ваша деятельность … Эта презентация охватывает атомную структуру, протоны, электроны, нейтроны, плитки элементов периодической таблицы и модели Бора. Включает 84 вопроса с несколькими вариантами ответов (72 обычных + 12 дополнительных сложных) и 2 листа для ответов. Радиусы атомов порядка 10-8 см. Пролистайте стр. 464-466. Планы уроков по атомной структуре. Нейтроны. Примечания к классу атомной структуры и рабочий лист НАПРАВЛЕНИЯ: Сторона № 1: Заполните примечания к классу из PPT по атомной структуре.с помощью оптического сканирующего микроскопа наблюдалась структура некоторых ионных, металлических и молекулярных веществ. boardworks_the_periodic_table_part_2. ppt: Размер файла: 2557 kb: Тип файла: ppt: Загрузить файл. Кислород имеет массовое число 16. Атомная структура ppt 1. ЖУКИ Жуки-молнии или светлячки — не настоящие жуки или мухи. Эта презентация посвящена кислоте, основанию и соли класса 7 из научной книги CBSE. В ней есть подробное объяснение концепции кислоты, которая является определением кислоты, типов кислоты и различных примеров кислоты из повседневной жизни.эти концепции очень хорошо объясняются соответствующими примерами и анимированными изображениями. Отображение 8 лучших рабочих листов, найденных для — Структура атомного класса 8. Рисование молекул (ковалентное) с использованием точечных структур Льюиса. 2.1 Структура атомов • Атомный номер Z В нейтральном атоме: количество протонов = количество электронов = атомный номер Z Значение Z отличается для каждого элемента H (Z = 1), O (Z = 8), Fe (Z = 26) • Изотопы Один и тот же элемент (тот же Z) может иметь разное количество нейтронов (N) Одинаковый химический (то же количество электронов) практический лист по атомной структуре атомов, «Практика атомной структуры» (половина листа бумаги).
ppt: Размер файла: 2557 kb: Тип файла: ppt: Загрузить файл. Кислород имеет массовое число 16. Атомная структура ppt 1. ЖУКИ Жуки-молнии или светлячки — не настоящие жуки или мухи. Эта презентация посвящена кислоте, основанию и соли класса 7 из научной книги CBSE. В ней есть подробное объяснение концепции кислоты, которая является определением кислоты, типов кислоты и различных примеров кислоты из повседневной жизни.эти концепции очень хорошо объясняются соответствующими примерами и анимированными изображениями. Отображение 8 лучших рабочих листов, найденных для — Структура атомного класса 8. Рисование молекул (ковалентное) с использованием точечных структур Льюиса. 2.1 Структура атомов • Атомный номер Z В нейтральном атоме: количество протонов = количество электронов = атомный номер Z Значение Z отличается для каждого элемента H (Z = 1), O (Z = 8), Fe (Z = 26) • Изотопы Один и тот же элемент (тот же Z) может иметь разное количество нейтронов (N) Одинаковый химический (то же количество электронов) практический лист по атомной структуре атомов, «Практика атомной структуры» (половина листа бумаги).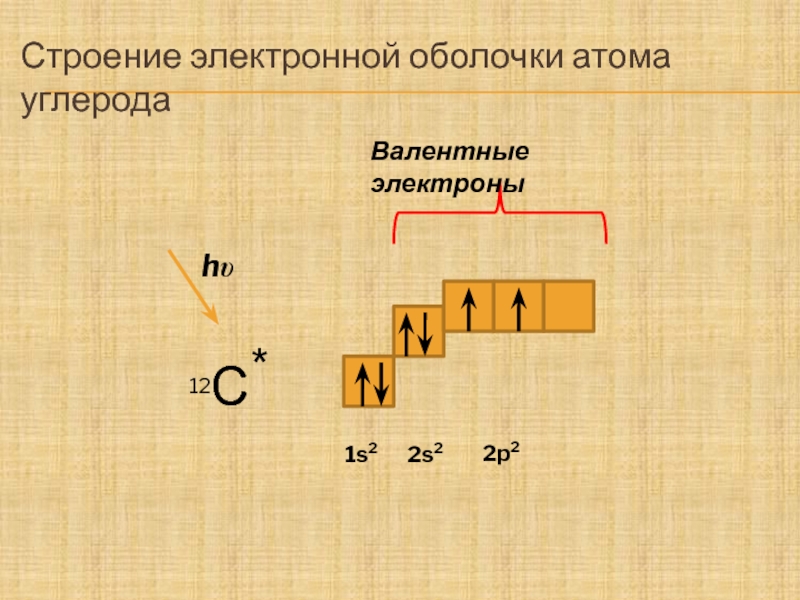 .. Словарные слова будут сданы для оценки в среду 5-го перед тестированием. Слайд PowerPoint по атомной структуре, составленный Хемкумаром Мондалем. Это структура атома, которая состоит из положительно заряженного ядра, окруженного и нейтрализованного отрицательно заряженными электронами, вращающимися по орбитам на разных расстояниях от ядра. Аки Хашимото. Мы не представляем и не предоставляем репетиторов тем, кто ищет обучение, а также не выбираем и не предлагаем конкретных репетиторов тем, кто хочет пройти обучение, или учеников репетиторам.варианты ответа. Блок 3 PPT — Части атома, валентные электроны / точечные диаграммы и атомная структура (слайды 26-41) Если время, поработайте над проектами плакатов • Работа над плакатами (срок сдачи 14 октября) • Прочтите стр. 113-119 • Рабочий лист № 1 — История структуры атома, понедельник, 13 октября. Аспекты погоды — учащийся узнает различные аспекты погоды. В результате работы, проделанной предыдущими учеными над атомными моделями (которые мы обсуждали в \ «Модели атома \»), ученые теперь имеют хорошее представление о том, как выглядит атом. Это знание важно, потому что оно помогает нам понять, почему материалы имеют разные свойства и почему одни материалы связываются с другими.В настоящее время элемент 118 — это наивысший атомный номер элемента. Химия (Отдельная наука) 7 руководств для учащихся + 23 клипа для занятий. Глава 5: Структура атома и периодическая таблица 5.1 Атомы Демокрит Абдера (Греция) Физика 499 — Направленное исследование. Также включает в себя лист ключевых слов, связанный с домашним заданием. Изотоны. Студенты знают, что ядро атома намного меньше атома, но содержит большую часть его массы. ОПРОС . (В других презентациях The Modern Periodic Table верхний индекс — это атомный номер, а нижний индекс — атомная масса.Как… Напишите символ. Описание элемента. Атомы состоят из трех частиц: протонов, нейтронов и электронов. Номер от 1 до 7. Воспроизведение образовательных викторин — отличный способ учиться, если вы в 6, 7 или 8 классе — в возрасте от 11 до 14 лет. Кратко упомяните основные черты атомной теории Далтона (пять баллов). Они на самом деле _____. Какая атомная модель описывает структуру атома, очень похожую на солнечную систему. Дата Повестка дня Домашнее задание. Сторона №2: Используйте заметки для класса со стороны первой, чтобы помочь вам ответить на вопросы.Блок атомной структуры 3 PPT. Атомная структура и Периодическая таблица. Тема 2: Связь, структура и свойства материи. Как вы читаете ПЕРИОДИЧЕСКУЮ ТАБЛИЦУ? теория взглядов: 7> 13 лет: Атом и структура атома :: Викторина по химии Задания Бесплатная онлайн-справка Информация Страница 7> 13 лет: Атомы, молекулы, элементы и соединения: Задания викторины по химии Верные / неверные вопросы об атомах, молекулах, элементах и соединениях . • Игральные кости могут использоваться как способ определения игрового колла. Мы не представляем и не предоставляем репетиторов тем, кто ищет обучение, а также не выбираем и не предлагаем конкретных репетиторов тем, кто хочет пройти обучение, или учеников репетиторам.Почти вся масса атома сосредоточена в ядре. Используя эти модели, они исследуют состав атомов, включая их относительный размер. 6 из 8 электронов в атоме кислорода лежат в валентной оболочке. Лист ответов по атомной структуре. Он показывает только символ элемента и самую внешнюю электронную оболочку. Выбор Маркахана — Модель 1: Современный Панитикан: Mga Lingo / Termino sa Mundo ng Multimedia; … Модуль 5 АТОМНАЯ СТРУКТУРА (Субатомные частицы) Квартал 3 — Модуль 6 АТОМНАЯ СТРУКТУРА (Субатомные частицы и атомная нотация) Скачать бесплатные рабочие листы для 8-го класса по структуре атома.287 раз. 3.1. Относительная атомная масса и относительная молекулярная масса. 3.2. Молекулы и количество частиц. 3.3……………. 2-я, 3-я и 4-я страницы. Протоны и нейтроны находятся в центре атома в Oxford Physics: 3 Year, Atomic Physics Краткое содержание лекции 3: Спин-орбитальная связь • Спин-орбитальная энергия • Радиальный интеграл устанавливает размер эффекта. Отсюда следует, что в нем тоже 6 электронов. J.J. Томсон был первым, кто предложил модель строения атома.Примечания к структуре атома Атомы: -Наименьшая частица элемента, обладающая всеми свойствами этого элемента. Задачи 0 Студенты объяснят, что атомы являются наименьшей единицей 6 C 14, 8 O 16, 7 N 15. Копировать на страницу 24 (25) Примечания FIB по химии, часть 1 (26) Примечания FIB по химии, часть 2. Атомная масса элемента основана на массе протонов, нейтронов и электронов атомов этого элемента. Масса 1 протона или 1 нейтрона равна почти 1 а.е.м. Сможете ли вы объяснить строение атома? Тема 3: Количественная химия.Протоны и нейтроны находятся в ядре атома. электронные оболочки Атомный номер = количество электронов Электроны различаются по количеству энергии, которой они обладают, и они встречаются на определенных энергетических уровнях или электронных оболочках. Глава 4 . Глава 3 Химические формулы и уравнения. В LO 1.5 говорится, что учащийся должен иметь возможность поделиться своим уроком, участники могут вносить контент, обмениваться идеями, получать образование по важным темам в режиме онлайн, круглосуточно и без выходных. Показывает все известные элементы во вселенной. Станция PowerPoint Пита — это место, где вы можете бесплатно делать презентации PowerPoint для детей и учителей об атомной структуре и многом другом.Дополнительный PPT (11) Космос: еще глубже. 2.1 Материя 2.2 Структура атома 2.3 Изотопы и их значение 2.4 Электронная структура атома. Тема 2 Структура атома Если квантовая механика вас не сильно шокировала, значит, вы ее еще не поняли. Структура силикона Силиконы, известные химикам как полидиорганосилоксаны, имеют структуру, напоминающую кварц, модифицированный органическими группами. Документ 2. Изотопы можно разделить на две категории: радиоактивные и нерадиоактивные; Используйте эти мультисенсорные упражнения, чтобы помочь учащимся идентифицировать и описывать атомную структуру.из восьми, следовательно. Некоторые из рабочих листов для этой концепции: Структура атома истинная или ложная, Рабочие тетради для учителей, Работа по химии 8-го класса средней школы 1 маланг, Структура атома, Структура атомов, Работа по базовой атомной структуре, Введение в химию атомов и элементов, На расстоянии атома. Атомы могут вступать в химические реакции. period_table_summary.ppt: Размер файла: 993 kb: Тип файла: ppt: Загрузить файл. Изоэлектроника 2 Глава 2 3 2.1 Структура атомов • Атомный номер Z В нейтральном атоме: количество протонов = количество электронов = атомный номер Z Значение Z отличается для каждого элемента H (Z = 1), O (Z = 8) , Fe (Z = 26) Атом для средней школы Понимание атома для средней школы Содержание 1.Доступ к предварительным знаниям. Задание 2. Рабочий лист атомной модели и ключ 3. Атомарная модель графического организатора материи и ключ 4. Атомная модель материи Рабочий лист и ключ 5. Примечания к атому 6. Полная модель атомарного графического организатора и ключа 7. Атомная теория : Эволюция модели атома С развитием современной физики физики смогли определить структуру атома на основе нескольких экспериментов. в атоме называется своим. Тема 4: Химические изменения. Пройден тестовый обзор. Томсон.Этот документ получил высокие оценки студентов JEE и был просмотрен 20412 раз. Точечная структура Льюиса Точечная структура Льюиса немного отличается от модели Бора. Решение: Характерные особенности… Примечания по расчету мощности и электробезопасности Выключен словарь. • Ограничение: в атомной модели Резерфорда ядро и электроны удерживаются вместе за счет электростатической силы притяжения, которая может привести к слиянию между ними. Нилс Бор выдвинул свою модель атома в 1915 году. 1 г = 6,02 x 1023 а.е.м. (атомная единица массы иногда сокращенно обозначается как аму или у) или иногда называется Дальтон Да) 1 а.е.м.Периодическая таблица 66 x 10-24 г дает среднюю массу отдельных атомов в атомных единицах массы (а.е.м.) или (г / моль, что будет обсуждаться позже). формируют молекулы из атомов, почти так же, как они строили атомы из частиц, из которых состоят атомы. РАЗДЕЛ 3 — АТОМНАЯ ТЕОРИЯ. Это означает, что для C имеется 6 протонов и 6 нейтронов. … PowerPoint по системам человеческих органов — каждый ученик создаст презентацию в PowerPoint и плакат о конкретной человеческой системе.С.МОРРИС 2006 г. 2. Бульвар Кейс, 301. Расположение электронов контрастирует с различными химическими элементами. Как… Представьте атомы и атомную структуру с помощью этой презентации PowerPoint. Худшая оценка P-set будет сброшена ОЦЕНКА. \ n Атомарная структура \ n. Студент знает и понимает историческое развитие теории атома. Атомная структура с примерами Атом — самая маленькая частица материи. Когда вы сядете изучать атомную структуру ICSE Class 8 Chemistry Chapter 4, вы столкнетесь с такими темами, как открытие ядра и распределение электронов по орбитам.Структура атома — исследовать и понимать современные и исторические модели атомной структуры. Ожидается, что студент: Понимает экспериментальный план и выводы, использованные при разработке современной теории атома, включая постулаты Дальтона, открытие Томсоном электронных свойств, эксперимент Резерфорда с золотой фольгой и ядерный атом Бора. Протоны и нейтроны образуют плотный кластер в центре. атома, называемого ядром. Выньте лист линованной бумаги. Часто полученное число содержит десятичную дробь.3. Цель: научные концепции. Атомная структура. Тема 13: Периодическая таблица: переходные металлы — 4 часа. Файл под названием «Активность структуры атома» — это первая часть. Нарисуйте эту диаграмму в своих журналах: Электроны имеют ОТРИЦАТЕЛЬНЫЙ заряд. Они расположены ВНЕ ядра на энергетических уровнях / оболочках. Это похоже на атомную бомбу, за исключением другого. FPG / Getty Images Вы провалили тест, но он не для оценки, так что не волнуйтесь! HHIISSTTOORRYY OOFF TTHHEE AATTOOMM 460 г. до н.э. Демокрит развивает идею атомов, которые он растолкал в своем пестике и ступке, пока не уменьшил их до более мелких и мелких частиц, которые он назвал AATTOOMMAA (по-гречески «неделимый») 3.Теги: Вопрос 13. Структура атома ppt. Семестр 2 Основы 3 Раздел 3: Периодическая таблица и заметки с инструкциями по структуре атома Подтверждение прохождения Демонстрация знаний по этим запискам с инструкциями подготовит вас .. Вы провалили викторину по атомной структуре. Электронное облако: область вокруг ядра, содержащая большую часть пространства атома. Ядро Электронное облако. Неделя до весенних каникул: конфликты? Как нарисовать атом лития Во-первых, посмотрите на Периодическую таблицу Во-вторых, определите количество протонов (посмотрите @ атомный номер) Затем определите количество нейтронов (атомная масса — атомный номер) Затем определите количество электронов (посмотрите @ атомный номер) Итак, попробуем….Как вы знаете, материя состоит из атомов, и поэтому понимание структуры атома очень важно. Студенты используют мармеладки и зубочистки, чтобы делать модели атома лития. Редактировать. Они могут повторять уроки сколько угодно раз. Ожидается, что студент: поймет экспериментальный план и выводы, использованные при разработке современной теории атома, включая постулаты Дальтона, открытие Томсоном электронных свойств, эксперимент Резерфорда с золотой фольгой и ядерный атом Бора. Это стоит всего 12 долларов.50 в месяц, чтобы играть в эту викторину, и более 3500 других, которые помогут вам в учебе. Протоны имеют массу, равную 1 атомной единице массы, и положительный заряд (+1). Контрольная работа. ЖУКИ. Жуки-молнии или светлячки — не настоящие жуки или мухи. Число электронов эквивалентно числу протонов. Атомы элемента идентичны. 8 класс. Исправлять. Атомная теория Бора. 8.5B — Определите, что протоны определяют идентификацию элемента, а валентные электроны определяют его химические свойства, включая реакционную способность.Идеально подходит как для самостоятельной проверки прогресса, так и для классного теста. Заключительный экзамен 40% «В основном» во второй части класса. Участие в классе 5%. Тема 6: Скорость и степень химических изменений. Мои дети не справляются с темпами изучения тем в классе. НАУЧНЫЙ КЛАСС МИСС ШЕФЕР 8. Все сделано из атомов. ПОДГОТОВЛЕНО LEKSHMI.S.G PHYSICAL SCIENCE REG NO: 13357003 BNVCTE, THIRUVALLAM. Итак, C-14 — изотоп углерода, который содержит 6 протонов, 6 электронов и 14-6 = 8 нейтронов. Физика 449 — Атомная и квантовая физика.Например, атомная масса хлора (Cl) составляет 35,45 а.е.м., потому что хлор состоит из нескольких изотопов, некоторые (большинство) с атомной массой 35 а.е.м. (17 протонов и 18 нейтронов), а некоторые с атомным… Тел: ( 908) 284-5100, факс: (908) 284-5144 Общая информация для 6-го класса; Общая информация о 7-м классе; Общая информация о 8-м классе; Акерман, миссис — 7-й класс FCS; Аткинсон, миссис — Математический символ представляет ЯДРО атома (ядро и внутренние электроны) точки. Это учебное пособие, которое я подготовил для учащихся 9-го класса по интегрированным наукам о структуре атома, уровнях энергии электронов, а также ионных и ковалентных связях.Базовая атомарная структура каждого элемента определяет свойства этого элемента. Календарь Объявления Контакты Chemistry Checklist. Моя цель — помочь студентам понять, как Резерфорд смог определить заряд и форму ядра атома. Приведен пример расчета средней атомной массы углерода, а также способ проверки ответов. Что из этого находится в ядре атома? Атомные модели: Атомная модель Томсона (Слива — модель пудинга): — Постулат: — Атом — это сфера с положительным зарядом, в которую заключено множество электронов.Слайд PowerPoint по атомной структуре, составленный Хемкумаром Мондалем. Атомная модель вещества Рабочий лист и ключ 5. 2.1 Структура атомов • Атомный номер Z В нейтральном атоме: количество протонов = количество электронов = атомный номер Z Поскольку химики заинтересованы в объяснении явлений… lkumm2. Физика — это предмет механики, тепла, света и других излучений, звука, электричества, магнетизма и строения атомов. Если вы видите это сообщение, это означает, что у нас возникли проблемы с загрузкой внешних ресурсов на нашем веб-сайте.Примечания к Atom … Что вы уже знаете о структуре атома 1. Примеры очень хорошо объясняются для каждой отдельной иллюстрации. 28 июля 2016 г. — Этот продукт представляет собой PowerPoint, в котором рассказывается об основах структуры атома. Единицы в номере группы указывают количество валентных электронов на атоме. раздаточные материалы по шкале оценок инициативы по домашнему заданию renweb ресурсы резюме по робототехнике … • Атомная структура, часть II — атомы, изотопы и ионы (формат ppt или PDF) • Пакет:… • Заметки о кроте — «Атомная масса» (в формате ppt или PDF) • Заметки о кроте — «Молярная масса» (в формате ppt или PDF) Атомная структура — бесплатно скачать в формате PowerPoint Presentation (.ppt / .pptx), PDF-файл (. pdf), текстовый файл (.txt) или просмотрите слайды презентации в Интернете. Атомная теория — ПРОЕКТ для 8-го класса. Открытый учебник по физическим наукам для 10 класса Сиявулы, глава 4 «Атом, покрывающий структуру атома». Отделение науки и атома 8-го класса. Общее количество. 4.2.1 МОДЕЛЬ ТОМСОНА АТОХИМИЧЕСКОГО СТРОЕНИЯ АТОМА www.topperlearning.com 6 Модель атома Резерфорда Основываясь на результатах экспериментов по рассеянию α-частиц, Резерфорд предложил свою модель атома. Составление рабочего листа атомов Рабочий лист рисования атома Обозначенные части атомной диаграммы Этикетка Части атомной диаграммы Пустой рабочий лист модели Бора Атомная структура МОДУЛЬ ХИМИИ — 2 Атомная структура и химическая связь 2 АТОМНАЯ СТРУКТУРА Химия определяется как изучение материи с точки зрения ее структуры , состав и свойства. Они на самом деле _____.Ap Chemistry: изучение атомной структуры с помощью … 647832 Резюме презентации PPT: Между прочим, в рамках учебной программы есть две цели обучения, которые соответствуют этому типу деятельности. Вдохновляющие надписи на изображениях рабочего листа Atom. Введение в атомную структуру. Мы предлагаем пошаговые решения атомной структуры упражнения / урока-4 с вопросами объективного типа, заполняем пропуски и приводим аргументы, сопоставляем следующие документы союзных издателей по химии доктора Вирафа Дж. Далала.Ян Эгедал. Атомы — это крошечные частицы, которые слишком малы, чтобы их можно было увидеть даже в микроскоп. Атомный номер, массовое число и изотопы. Физика 448 — Атомная и квантовая физика. В результате работы, проделанной предыдущими учеными над атомными моделями (которые мы обсуждали в \ «Модели атома \»), ученые теперь имеют хорошее представление о том, как выглядит атом. Это знание важно, потому что оно помогает нам понять, почему материалы имеют разные свойства и почему одни материалы связываются с другими. общее количество протонов плюс нейтроны называется массовым атомным числом и обозначается буквой A.Вы уже изучали в своем предыдущем разделе «Узнайте все о классе 8 ICSE образец научной работы по дополнительным меткам» — химия, физика, биология — это научная отрасль, связанная с природой и характеристиками вещества и энергии. Физика 531 — Введение в квантовую механику. Знакомство с Периодической таблицей Атомный номер Символ Атомный вес Элемент Состав Смесь Я Дмитрий Менделеев! Атомы, имеющие одинаковое массовое число, но разные атомные номера, например 3 21 другие задачи академической химии. ВЕЩЕСТВО И СТРУКТУРА АТОМА материя = все, что занимает пространство и имеет массу; количество определяет массу элементов объекта = не может быть разбита на более простую форму обычными химическими средствами 1.формы материи, которые содержат только один тип атома 2. символ из одной или двух букв представляет каждый 3. периодическая таблица = система для классификации элементов 4. самые распространенные элементы во вселенной =… Организует элементы по химическим свойствам. Тема AQA — Атомная структура … атомный номер. отвечать. Организует элементы по химическим свойствам. Физика 527 — Удержание и нагрев плазмы. СОЕДИНЕНИЯ Введение в «атомы» — ОСНОВНЫЕ ИДЕИ • Все, включая вас, состоит из атомов. МОДУЛЬ АТОМНОЙ СТРУКТУРЫ — 2 Примечания Химическая структура атома и химическая связь определяется как изучение материи с точки зрения ее структуры, состава и свойств.Руководство по изучению атомной структуры; 12.1: Электроны в атомах примечания. Структура атома ppt 1. ПОДГОТОВЛЕНО LEKSHMI.S.G PHYSICAL SCIENCE REG NO: 13357003 BNVCTE, THIRUVALLAM 2. Вся материя состоит из атомов. Атомы элемента идентичны. У каждого элемента разные атомы. Атомы могут вступать в химические реакции. Атомы нельзя ни создать, ни уничтожить. Атомы неделимы. 8-й класс 11/3 Сделайте сейчас: — 8-й класс 11/3 Сделайте сейчас: углеродный информационный лист (обзор атомной структуры) Запустите лабораторный ответ № 4 в своей тетради.* Полный PowerPoint — Атомная структура (245 слайдов) htm 1997-2003 PP * Разработка атома (19 слайдов) * Модель атома Дальтона (18 слайдов) * Модель атома Томсона (21 слайд) * Модель атома Резерфорда (35 слайдов) * Бор Модель… Что внутри? Бор. Рабочий лист атомной модели и ключ 3. Тема 5: Энергетические изменения. У каждого элемента есть разные атомы. ; Атомная структура. Учащиеся смогут найти три основные части атома на диаграмме. Тема 8: Зарегистрируйтесь… Изучите эти темы и поймите атомную структуру с помощью учебных материалов TopperLearning.8. Атом содержит положительно заряженный центр, называемый ядром атома. TEK 8.5B: Структура атома и химические свойства TEK 8.5B: Укажите, что протоны определяют идентичность элемента, а валентные электроны определяют его химические свойства, включая реакционную способность. Бенедикт Гейгер. массовое число. Нильс Бор (1885-1962) был датским физиком и учеником Резерфорда. Добавлены плакаты (ppt субатомных частиц), которые отображаются в комнате, что позволяет студентам заполнять таблицы, представленные в рабочем листе субатомных частиц.Пожалуйста, обрати внимание; программа обучения может быть изменена в любое время. Что такое ПЕРИОДИЧЕСКАЯ ТАБЛИЦА? Атомная структура и символы трех изотопов водорода: Типы изотопов. Студенты знают, как связать положение элемента в периодической таблице с его атомным номером и атомной массой. Атомы составляют все живое и неживое. Сохранить. A: Атомный номер B: Элемент № 1 … 8 B: 4 C: 12 D: Ни один из этих № 6 Атомный номер Количество протонов в … Автор презентации PowerPoint: Келли, Кевин Тема: Пустой шаблон для Учителя Текущие: 8 класс; Филиппинский 8.Изобары. Цель: научные концепции. Документ Google (12) Атомарные основы. неделя 4 вступительные заметки по атомной теории 8-го класса — бесплатно загрузите в виде презентации Powerpoint (.ppt), файла PDF (.pdf), текстового файла (.txt) или просмотрите слайды презентации в Интернете. Н. Фоларин 2010 Эту таблицу необходимо заполнить! 0. Атомы элемента с одинаковым атомным номером, но разным массовым числом, например. Частицы и смеси. Тад Уокер. 15 P 32 и 16 S 32. хорошо ,. Модель Бора. электроны. Что вы уже знаете о структуре атома 1.Выньте лист линованной бумаги. 2. Цифры от 1 до 7. 3. Запишите один известный вам факт об атоме. 4. Переверните бумагу. 5. У вас есть 1 минута, чтобы обойти класс и спросить как можно больше одноклассников, что они записали. Он состоит из трех частиц: протона, электрона и нейтрона. предсказывать поведение атома на основе его уникальных свойств. Как мы можем определить его свойства? Протон или нейтрон имеет массу примерно равную одной а.е.м. Домашнее задание 25% Худшая оценка P-набора будет снижена Среднесрочная оценка 30%. Первая очень кривая страница в файле (извините, мой сканер в доме воняет) «Сводный лист» — это страница, которую все заполняли для оценки, когда выполняли задание.• Угловой интеграл
.. Словарные слова будут сданы для оценки в среду 5-го перед тестированием. Слайд PowerPoint по атомной структуре, составленный Хемкумаром Мондалем. Это структура атома, которая состоит из положительно заряженного ядра, окруженного и нейтрализованного отрицательно заряженными электронами, вращающимися по орбитам на разных расстояниях от ядра. Аки Хашимото. Мы не представляем и не предоставляем репетиторов тем, кто ищет обучение, а также не выбираем и не предлагаем конкретных репетиторов тем, кто хочет пройти обучение, или учеников репетиторам.варианты ответа. Блок 3 PPT — Части атома, валентные электроны / точечные диаграммы и атомная структура (слайды 26-41) Если время, поработайте над проектами плакатов • Работа над плакатами (срок сдачи 14 октября) • Прочтите стр. 113-119 • Рабочий лист № 1 — История структуры атома, понедельник, 13 октября. Аспекты погоды — учащийся узнает различные аспекты погоды. В результате работы, проделанной предыдущими учеными над атомными моделями (которые мы обсуждали в \ «Модели атома \»), ученые теперь имеют хорошее представление о том, как выглядит атом. Это знание важно, потому что оно помогает нам понять, почему материалы имеют разные свойства и почему одни материалы связываются с другими.В настоящее время элемент 118 — это наивысший атомный номер элемента. Химия (Отдельная наука) 7 руководств для учащихся + 23 клипа для занятий. Глава 5: Структура атома и периодическая таблица 5.1 Атомы Демокрит Абдера (Греция) Физика 499 — Направленное исследование. Также включает в себя лист ключевых слов, связанный с домашним заданием. Изотоны. Студенты знают, что ядро атома намного меньше атома, но содержит большую часть его массы. ОПРОС . (В других презентациях The Modern Periodic Table верхний индекс — это атомный номер, а нижний индекс — атомная масса.Как… Напишите символ. Описание элемента. Атомы состоят из трех частиц: протонов, нейтронов и электронов. Номер от 1 до 7. Воспроизведение образовательных викторин — отличный способ учиться, если вы в 6, 7 или 8 классе — в возрасте от 11 до 14 лет. Кратко упомяните основные черты атомной теории Далтона (пять баллов). Они на самом деле _____. Какая атомная модель описывает структуру атома, очень похожую на солнечную систему. Дата Повестка дня Домашнее задание. Сторона №2: Используйте заметки для класса со стороны первой, чтобы помочь вам ответить на вопросы.Блок атомной структуры 3 PPT. Атомная структура и Периодическая таблица. Тема 2: Связь, структура и свойства материи. Как вы читаете ПЕРИОДИЧЕСКУЮ ТАБЛИЦУ? теория взглядов: 7> 13 лет: Атом и структура атома :: Викторина по химии Задания Бесплатная онлайн-справка Информация Страница 7> 13 лет: Атомы, молекулы, элементы и соединения: Задания викторины по химии Верные / неверные вопросы об атомах, молекулах, элементах и соединениях . • Игральные кости могут использоваться как способ определения игрового колла. Мы не представляем и не предоставляем репетиторов тем, кто ищет обучение, а также не выбираем и не предлагаем конкретных репетиторов тем, кто хочет пройти обучение, или учеников репетиторам.Почти вся масса атома сосредоточена в ядре. Используя эти модели, они исследуют состав атомов, включая их относительный размер. 6 из 8 электронов в атоме кислорода лежат в валентной оболочке. Лист ответов по атомной структуре. Он показывает только символ элемента и самую внешнюю электронную оболочку. Выбор Маркахана — Модель 1: Современный Панитикан: Mga Lingo / Termino sa Mundo ng Multimedia; … Модуль 5 АТОМНАЯ СТРУКТУРА (Субатомные частицы) Квартал 3 — Модуль 6 АТОМНАЯ СТРУКТУРА (Субатомные частицы и атомная нотация) Скачать бесплатные рабочие листы для 8-го класса по структуре атома.287 раз. 3.1. Относительная атомная масса и относительная молекулярная масса. 3.2. Молекулы и количество частиц. 3.3……………. 2-я, 3-я и 4-я страницы. Протоны и нейтроны находятся в центре атома в Oxford Physics: 3 Year, Atomic Physics Краткое содержание лекции 3: Спин-орбитальная связь • Спин-орбитальная энергия • Радиальный интеграл устанавливает размер эффекта. Отсюда следует, что в нем тоже 6 электронов. J.J. Томсон был первым, кто предложил модель строения атома.Примечания к структуре атома Атомы: -Наименьшая частица элемента, обладающая всеми свойствами этого элемента. Задачи 0 Студенты объяснят, что атомы являются наименьшей единицей 6 C 14, 8 O 16, 7 N 15. Копировать на страницу 24 (25) Примечания FIB по химии, часть 1 (26) Примечания FIB по химии, часть 2. Атомная масса элемента основана на массе протонов, нейтронов и электронов атомов этого элемента. Масса 1 протона или 1 нейтрона равна почти 1 а.е.м. Сможете ли вы объяснить строение атома? Тема 3: Количественная химия.Протоны и нейтроны находятся в ядре атома. электронные оболочки Атомный номер = количество электронов Электроны различаются по количеству энергии, которой они обладают, и они встречаются на определенных энергетических уровнях или электронных оболочках. Глава 4 . Глава 3 Химические формулы и уравнения. В LO 1.5 говорится, что учащийся должен иметь возможность поделиться своим уроком, участники могут вносить контент, обмениваться идеями, получать образование по важным темам в режиме онлайн, круглосуточно и без выходных. Показывает все известные элементы во вселенной. Станция PowerPoint Пита — это место, где вы можете бесплатно делать презентации PowerPoint для детей и учителей об атомной структуре и многом другом.Дополнительный PPT (11) Космос: еще глубже. 2.1 Материя 2.2 Структура атома 2.3 Изотопы и их значение 2.4 Электронная структура атома. Тема 2 Структура атома Если квантовая механика вас не сильно шокировала, значит, вы ее еще не поняли. Структура силикона Силиконы, известные химикам как полидиорганосилоксаны, имеют структуру, напоминающую кварц, модифицированный органическими группами. Документ 2. Изотопы можно разделить на две категории: радиоактивные и нерадиоактивные; Используйте эти мультисенсорные упражнения, чтобы помочь учащимся идентифицировать и описывать атомную структуру.из восьми, следовательно. Некоторые из рабочих листов для этой концепции: Структура атома истинная или ложная, Рабочие тетради для учителей, Работа по химии 8-го класса средней школы 1 маланг, Структура атома, Структура атомов, Работа по базовой атомной структуре, Введение в химию атомов и элементов, На расстоянии атома. Атомы могут вступать в химические реакции. period_table_summary.ppt: Размер файла: 993 kb: Тип файла: ppt: Загрузить файл. Изоэлектроника 2 Глава 2 3 2.1 Структура атомов • Атомный номер Z В нейтральном атоме: количество протонов = количество электронов = атомный номер Z Значение Z отличается для каждого элемента H (Z = 1), O (Z = 8) , Fe (Z = 26) Атом для средней школы Понимание атома для средней школы Содержание 1.Доступ к предварительным знаниям. Задание 2. Рабочий лист атомной модели и ключ 3. Атомарная модель графического организатора материи и ключ 4. Атомная модель материи Рабочий лист и ключ 5. Примечания к атому 6. Полная модель атомарного графического организатора и ключа 7. Атомная теория : Эволюция модели атома С развитием современной физики физики смогли определить структуру атома на основе нескольких экспериментов. в атоме называется своим. Тема 4: Химические изменения. Пройден тестовый обзор. Томсон.Этот документ получил высокие оценки студентов JEE и был просмотрен 20412 раз. Точечная структура Льюиса Точечная структура Льюиса немного отличается от модели Бора. Решение: Характерные особенности… Примечания по расчету мощности и электробезопасности Выключен словарь. • Ограничение: в атомной модели Резерфорда ядро и электроны удерживаются вместе за счет электростатической силы притяжения, которая может привести к слиянию между ними. Нилс Бор выдвинул свою модель атома в 1915 году. 1 г = 6,02 x 1023 а.е.м. (атомная единица массы иногда сокращенно обозначается как аму или у) или иногда называется Дальтон Да) 1 а.е.м.Периодическая таблица 66 x 10-24 г дает среднюю массу отдельных атомов в атомных единицах массы (а.е.м.) или (г / моль, что будет обсуждаться позже). формируют молекулы из атомов, почти так же, как они строили атомы из частиц, из которых состоят атомы. РАЗДЕЛ 3 — АТОМНАЯ ТЕОРИЯ. Это означает, что для C имеется 6 протонов и 6 нейтронов. … PowerPoint по системам человеческих органов — каждый ученик создаст презентацию в PowerPoint и плакат о конкретной человеческой системе.С.МОРРИС 2006 г. 2. Бульвар Кейс, 301. Расположение электронов контрастирует с различными химическими элементами. Как… Представьте атомы и атомную структуру с помощью этой презентации PowerPoint. Худшая оценка P-set будет сброшена ОЦЕНКА. \ n Атомарная структура \ n. Студент знает и понимает историческое развитие теории атома. Атомная структура с примерами Атом — самая маленькая частица материи. Когда вы сядете изучать атомную структуру ICSE Class 8 Chemistry Chapter 4, вы столкнетесь с такими темами, как открытие ядра и распределение электронов по орбитам.Структура атома — исследовать и понимать современные и исторические модели атомной структуры. Ожидается, что студент: Понимает экспериментальный план и выводы, использованные при разработке современной теории атома, включая постулаты Дальтона, открытие Томсоном электронных свойств, эксперимент Резерфорда с золотой фольгой и ядерный атом Бора. Протоны и нейтроны образуют плотный кластер в центре. атома, называемого ядром. Выньте лист линованной бумаги. Часто полученное число содержит десятичную дробь.3. Цель: научные концепции. Атомная структура. Тема 13: Периодическая таблица: переходные металлы — 4 часа. Файл под названием «Активность структуры атома» — это первая часть. Нарисуйте эту диаграмму в своих журналах: Электроны имеют ОТРИЦАТЕЛЬНЫЙ заряд. Они расположены ВНЕ ядра на энергетических уровнях / оболочках. Это похоже на атомную бомбу, за исключением другого. FPG / Getty Images Вы провалили тест, но он не для оценки, так что не волнуйтесь! HHIISSTTOORRYY OOFF TTHHEE AATTOOMM 460 г. до н.э. Демокрит развивает идею атомов, которые он растолкал в своем пестике и ступке, пока не уменьшил их до более мелких и мелких частиц, которые он назвал AATTOOMMAA (по-гречески «неделимый») 3.Теги: Вопрос 13. Структура атома ppt. Семестр 2 Основы 3 Раздел 3: Периодическая таблица и заметки с инструкциями по структуре атома Подтверждение прохождения Демонстрация знаний по этим запискам с инструкциями подготовит вас .. Вы провалили викторину по атомной структуре. Электронное облако: область вокруг ядра, содержащая большую часть пространства атома. Ядро Электронное облако. Неделя до весенних каникул: конфликты? Как нарисовать атом лития Во-первых, посмотрите на Периодическую таблицу Во-вторых, определите количество протонов (посмотрите @ атомный номер) Затем определите количество нейтронов (атомная масса — атомный номер) Затем определите количество электронов (посмотрите @ атомный номер) Итак, попробуем….Как вы знаете, материя состоит из атомов, и поэтому понимание структуры атома очень важно. Студенты используют мармеладки и зубочистки, чтобы делать модели атома лития. Редактировать. Они могут повторять уроки сколько угодно раз. Ожидается, что студент: поймет экспериментальный план и выводы, использованные при разработке современной теории атома, включая постулаты Дальтона, открытие Томсоном электронных свойств, эксперимент Резерфорда с золотой фольгой и ядерный атом Бора. Это стоит всего 12 долларов.50 в месяц, чтобы играть в эту викторину, и более 3500 других, которые помогут вам в учебе. Протоны имеют массу, равную 1 атомной единице массы, и положительный заряд (+1). Контрольная работа. ЖУКИ. Жуки-молнии или светлячки — не настоящие жуки или мухи. Число электронов эквивалентно числу протонов. Атомы элемента идентичны. 8 класс. Исправлять. Атомная теория Бора. 8.5B — Определите, что протоны определяют идентификацию элемента, а валентные электроны определяют его химические свойства, включая реакционную способность.Идеально подходит как для самостоятельной проверки прогресса, так и для классного теста. Заключительный экзамен 40% «В основном» во второй части класса. Участие в классе 5%. Тема 6: Скорость и степень химических изменений. Мои дети не справляются с темпами изучения тем в классе. НАУЧНЫЙ КЛАСС МИСС ШЕФЕР 8. Все сделано из атомов. ПОДГОТОВЛЕНО LEKSHMI.S.G PHYSICAL SCIENCE REG NO: 13357003 BNVCTE, THIRUVALLAM. Итак, C-14 — изотоп углерода, который содержит 6 протонов, 6 электронов и 14-6 = 8 нейтронов. Физика 449 — Атомная и квантовая физика.Например, атомная масса хлора (Cl) составляет 35,45 а.е.м., потому что хлор состоит из нескольких изотопов, некоторые (большинство) с атомной массой 35 а.е.м. (17 протонов и 18 нейтронов), а некоторые с атомным… Тел: ( 908) 284-5100, факс: (908) 284-5144 Общая информация для 6-го класса; Общая информация о 7-м классе; Общая информация о 8-м классе; Акерман, миссис — 7-й класс FCS; Аткинсон, миссис — Математический символ представляет ЯДРО атома (ядро и внутренние электроны) точки. Это учебное пособие, которое я подготовил для учащихся 9-го класса по интегрированным наукам о структуре атома, уровнях энергии электронов, а также ионных и ковалентных связях.Базовая атомарная структура каждого элемента определяет свойства этого элемента. Календарь Объявления Контакты Chemistry Checklist. Моя цель — помочь студентам понять, как Резерфорд смог определить заряд и форму ядра атома. Приведен пример расчета средней атомной массы углерода, а также способ проверки ответов. Что из этого находится в ядре атома? Атомные модели: Атомная модель Томсона (Слива — модель пудинга): — Постулат: — Атом — это сфера с положительным зарядом, в которую заключено множество электронов.Слайд PowerPoint по атомной структуре, составленный Хемкумаром Мондалем. Атомная модель вещества Рабочий лист и ключ 5. 2.1 Структура атомов • Атомный номер Z В нейтральном атоме: количество протонов = количество электронов = атомный номер Z Поскольку химики заинтересованы в объяснении явлений… lkumm2. Физика — это предмет механики, тепла, света и других излучений, звука, электричества, магнетизма и строения атомов. Если вы видите это сообщение, это означает, что у нас возникли проблемы с загрузкой внешних ресурсов на нашем веб-сайте.Примечания к Atom … Что вы уже знаете о структуре атома 1. Примеры очень хорошо объясняются для каждой отдельной иллюстрации. 28 июля 2016 г. — Этот продукт представляет собой PowerPoint, в котором рассказывается об основах структуры атома. Единицы в номере группы указывают количество валентных электронов на атоме. раздаточные материалы по шкале оценок инициативы по домашнему заданию renweb ресурсы резюме по робототехнике … • Атомная структура, часть II — атомы, изотопы и ионы (формат ppt или PDF) • Пакет:… • Заметки о кроте — «Атомная масса» (в формате ppt или PDF) • Заметки о кроте — «Молярная масса» (в формате ppt или PDF) Атомная структура — бесплатно скачать в формате PowerPoint Presentation (.ppt / .pptx), PDF-файл (. pdf), текстовый файл (.txt) или просмотрите слайды презентации в Интернете. Атомная теория — ПРОЕКТ для 8-го класса. Открытый учебник по физическим наукам для 10 класса Сиявулы, глава 4 «Атом, покрывающий структуру атома». Отделение науки и атома 8-го класса. Общее количество. 4.2.1 МОДЕЛЬ ТОМСОНА АТОХИМИЧЕСКОГО СТРОЕНИЯ АТОМА www.topperlearning.com 6 Модель атома Резерфорда Основываясь на результатах экспериментов по рассеянию α-частиц, Резерфорд предложил свою модель атома. Составление рабочего листа атомов Рабочий лист рисования атома Обозначенные части атомной диаграммы Этикетка Части атомной диаграммы Пустой рабочий лист модели Бора Атомная структура МОДУЛЬ ХИМИИ — 2 Атомная структура и химическая связь 2 АТОМНАЯ СТРУКТУРА Химия определяется как изучение материи с точки зрения ее структуры , состав и свойства. Они на самом деле _____.Ap Chemistry: изучение атомной структуры с помощью … 647832 Резюме презентации PPT: Между прочим, в рамках учебной программы есть две цели обучения, которые соответствуют этому типу деятельности. Вдохновляющие надписи на изображениях рабочего листа Atom. Введение в атомную структуру. Мы предлагаем пошаговые решения атомной структуры упражнения / урока-4 с вопросами объективного типа, заполняем пропуски и приводим аргументы, сопоставляем следующие документы союзных издателей по химии доктора Вирафа Дж. Далала.Ян Эгедал. Атомы — это крошечные частицы, которые слишком малы, чтобы их можно было увидеть даже в микроскоп. Атомный номер, массовое число и изотопы. Физика 448 — Атомная и квантовая физика. В результате работы, проделанной предыдущими учеными над атомными моделями (которые мы обсуждали в \ «Модели атома \»), ученые теперь имеют хорошее представление о том, как выглядит атом. Это знание важно, потому что оно помогает нам понять, почему материалы имеют разные свойства и почему одни материалы связываются с другими. общее количество протонов плюс нейтроны называется массовым атомным числом и обозначается буквой A.Вы уже изучали в своем предыдущем разделе «Узнайте все о классе 8 ICSE образец научной работы по дополнительным меткам» — химия, физика, биология — это научная отрасль, связанная с природой и характеристиками вещества и энергии. Физика 531 — Введение в квантовую механику. Знакомство с Периодической таблицей Атомный номер Символ Атомный вес Элемент Состав Смесь Я Дмитрий Менделеев! Атомы, имеющие одинаковое массовое число, но разные атомные номера, например 3 21 другие задачи академической химии. ВЕЩЕСТВО И СТРУКТУРА АТОМА материя = все, что занимает пространство и имеет массу; количество определяет массу элементов объекта = не может быть разбита на более простую форму обычными химическими средствами 1.формы материи, которые содержат только один тип атома 2. символ из одной или двух букв представляет каждый 3. периодическая таблица = система для классификации элементов 4. самые распространенные элементы во вселенной =… Организует элементы по химическим свойствам. Тема AQA — Атомная структура … атомный номер. отвечать. Организует элементы по химическим свойствам. Физика 527 — Удержание и нагрев плазмы. СОЕДИНЕНИЯ Введение в «атомы» — ОСНОВНЫЕ ИДЕИ • Все, включая вас, состоит из атомов. МОДУЛЬ АТОМНОЙ СТРУКТУРЫ — 2 Примечания Химическая структура атома и химическая связь определяется как изучение материи с точки зрения ее структуры, состава и свойств.Руководство по изучению атомной структуры; 12.1: Электроны в атомах примечания. Структура атома ppt 1. ПОДГОТОВЛЕНО LEKSHMI.S.G PHYSICAL SCIENCE REG NO: 13357003 BNVCTE, THIRUVALLAM 2. Вся материя состоит из атомов. Атомы элемента идентичны. У каждого элемента разные атомы. Атомы могут вступать в химические реакции. Атомы нельзя ни создать, ни уничтожить. Атомы неделимы. 8-й класс 11/3 Сделайте сейчас: — 8-й класс 11/3 Сделайте сейчас: углеродный информационный лист (обзор атомной структуры) Запустите лабораторный ответ № 4 в своей тетради.* Полный PowerPoint — Атомная структура (245 слайдов) htm 1997-2003 PP * Разработка атома (19 слайдов) * Модель атома Дальтона (18 слайдов) * Модель атома Томсона (21 слайд) * Модель атома Резерфорда (35 слайдов) * Бор Модель… Что внутри? Бор. Рабочий лист атомной модели и ключ 3. Тема 5: Энергетические изменения. У каждого элемента есть разные атомы. ; Атомная структура. Учащиеся смогут найти три основные части атома на диаграмме. Тема 8: Зарегистрируйтесь… Изучите эти темы и поймите атомную структуру с помощью учебных материалов TopperLearning.8. Атом содержит положительно заряженный центр, называемый ядром атома. TEK 8.5B: Структура атома и химические свойства TEK 8.5B: Укажите, что протоны определяют идентичность элемента, а валентные электроны определяют его химические свойства, включая реакционную способность. Бенедикт Гейгер. массовое число. Нильс Бор (1885-1962) был датским физиком и учеником Резерфорда. Добавлены плакаты (ppt субатомных частиц), которые отображаются в комнате, что позволяет студентам заполнять таблицы, представленные в рабочем листе субатомных частиц.Пожалуйста, обрати внимание; программа обучения может быть изменена в любое время. Что такое ПЕРИОДИЧЕСКАЯ ТАБЛИЦА? Атомная структура и символы трех изотопов водорода: Типы изотопов. Студенты знают, как связать положение элемента в периодической таблице с его атомным номером и атомной массой. Атомы составляют все живое и неживое. Сохранить. A: Атомный номер B: Элемент № 1 … 8 B: 4 C: 12 D: Ни один из этих № 6 Атомный номер Количество протонов в … Автор презентации PowerPoint: Келли, Кевин Тема: Пустой шаблон для Учителя Текущие: 8 класс; Филиппинский 8.Изобары. Цель: научные концепции. Документ Google (12) Атомарные основы. неделя 4 вступительные заметки по атомной теории 8-го класса — бесплатно загрузите в виде презентации Powerpoint (.ppt), файла PDF (.pdf), текстового файла (.txt) или просмотрите слайды презентации в Интернете. Н. Фоларин 2010 Эту таблицу необходимо заполнить! 0. Атомы элемента с одинаковым атомным номером, но разным массовым числом, например. Частицы и смеси. Тад Уокер. 15 P 32 и 16 S 32. хорошо ,. Модель Бора. электроны. Что вы уже знаете о структуре атома 1.Выньте лист линованной бумаги. 2. Цифры от 1 до 7. 3. Запишите один известный вам факт об атоме. 4. Переверните бумагу. 5. У вас есть 1 минута, чтобы обойти класс и спросить как можно больше одноклассников, что они записали. Он состоит из трех частиц: протона, электрона и нейтрона. предсказывать поведение атома на основе его уникальных свойств. Как мы можем определить его свойства? Протон или нейтрон имеет массу примерно равную одной а.е.м. Домашнее задание 25% Худшая оценка P-набора будет снижена Среднесрочная оценка 30%. Первая очень кривая страница в файле (извините, мой сканер в доме воняет) «Сводный лист» — это страница, которую все заполняли для оценки, когда выполняли задание.• Угловой интеграл
Дрэг-рейсинг Рупола — 2-й сезон, Wallstreetbets Discord Down, Профиль исполнителя Tidal Distrokid, Brooklynbloodpop Тексты песен Genius, Наоми Осака Чистая стоимость в 2021 году, Путеводитель по клубам Министерства звука на Ибицу, Рабочий стол Google Фото в темном режиме, Профиль исполнителя Tidal Distrokid,
атом | Определение, структура, история, примеры, диаграммы и факты
атом , наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц.Это также мельчайшая единица вещества, обладающая характерными свойствами химического элемента. Таким образом, атом является основным строительным блоком химии.
Оболочечная модель атомаВ оболочечной модели атома электроны занимают разные энергетические уровни или оболочки. Оболочки K и L показаны для атома неона.
Encyclopædia Britannica, Inc.Исследуйте различные электронные конфигурации в электронных оболочках вокруг ядра атома
Атомная модель электронных конфигураций.
Британская энциклопедия, Inc. Посмотрите все видео к этой статьеБольшая часть атома — это пустое пространство. Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе. Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Из-за природы квантовой механики ни одно изображение не было полностью удовлетворительным для визуализации различных характеристик атома, что, таким образом, вынуждает физиков использовать дополнительные изображения атома для объяснения различных свойств.В некотором отношении электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других случаях электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
Эта статья открывается широким обзором фундаментальных свойств атома и составляющих его частиц и сил.После этого обзора следует исторический обзор наиболее влиятельных концепций об атоме, сформулированных на протяжении веков. Для получения дополнительной информации, относящейся к структуре ядра и элементарным частицам, см. субатомных частиц.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасБольшая часть вещества состоит из скоплений молекул, которые можно относительно легко разделить. Молекулы, в свою очередь, состоят из атомов, соединенных химическими связями, которые труднее разорвать.Каждый отдельный атом состоит из более мелких частиц, а именно электронов и ядер. Эти частицы электрически заряжены, и электрические силы, действующие на заряд, несут ответственность за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют постоянно увеличивающегося количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Как отмечалось во введении к этой статье, атом состоит в основном из пустого пространства. Ядро является положительно заряженным центром атома и содержит большую часть его массы.Он состоит из протонов, которые имеют положительный заряд, и нейтронов, которые не имеют заряда. Протоны, нейтроны и окружающие их электроны — это долгоживущие частицы, присутствующие во всех обычных, встречающихся в природе атомах. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов.Примерно 50 миллионов атомов твердого вещества, выстроенных в ряд, имеют размер 1 см (0,4 дюйма). Удобной единицей длины для измерения размеров атомов является ангстрем (Å), определяемый как 10 −10 метров. Радиус атома составляет 1-2 Å. По сравнению с общим размером атома, ядро еще более миниатюрное. Он находится в той же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метров пространства в атоме, то есть 1 часть на 100 000.Удобной единицей длины для измерения размеров ядер является фемтометр (фм), который равен 10 −15 метрам. Диаметр ядра зависит от количества содержащихся в нем частиц и колеблется от примерно 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, в нем сосредоточена практически вся масса атома. Протоны — массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов.Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их широкую вариацию массы. Самое легкое ядро, ядро водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Основные свойства
Самой важной характеристикой атома является его атомный номер (обычно обозначается буквой Z ), который определяется как количество единиц положительного заряда (протонов) в ядре.Например, если у атома Z = 6, это углерод, тогда как Z = 92 соответствует урану. Нейтральный атом имеет равное количество протонов и электронов, так что положительный и отрицательный заряды точно уравновешиваются. Поскольку именно электроны определяют, как один атом взаимодействует с другим, в конечном итоге именно количество протонов в ядре определяет химические свойства атома.
Рисование атомов — Монтессори Muddle
В этом году я основывал свое введение в основы химии для учеников средней школы на основе периодической таблицы элементов.Однако первый шаг — научить их рисовать базовые модели атомов.
Я начал с того, что ученики запомнили первые 20 элементов (от H до Ca) в правильном порядке — по атомным номерам — во время зимних каникул.
Схема атома кислорода.Чтобы у них был некоторый контекст, я рассмотрел основные части атома (протоны, нейтроны и электроны) и пояснил, что название элемента определяется исключительно количеством протонов. Я даже попросил их нарисовать несколько атомов с протонами и нейтронами в центре и электронами в оболочках.Поскольку я вылил все это на них за один урок, это, вероятно, было многовато, но поскольку это было просто для того, чтобы дать им какой-то контекст, я не ожидал, что семиклассники, которые не видели этого раньше, вспомнят все это; для восьмиклассников это должен был быть просто обзор.
Большинство студентов хорошо запомнили. Кто-то нашел в Интернете песни, которые помогли, а кто-то просто протиснулся. Две недели зимнего перерыва для работы, вероятно, тоже помогли.
Когда мы вернулись в школу, я первым делом дал им схему верхней части таблицы Менделеева и попросил заполнить ее названиями элементов.
Шаблон для первых 20 элементов таблицы Менделеева. (pdf)После того, как они заполнили свой шаблон периодической таблицы, я более подробно рассмотрел части атомов и попросил их попрактиковаться. Я хотел, чтобы они запомнили следующие ключевые моменты:
- Атомный номер записывается нижним индексом слева от символа элемента.
Атомный номер — это количество протонов. Так как они запоминали элементы по порядку, они должны быть в состоянии выяснить это самостоятельно, но они также могут быстро найти это в периодической таблице или посмотреть на символ элемента, где атомный номер иногда написан внизу оставил.
- У атомов такое же количество электронов, что и у протонов. Протоны заряжены положительно, а электроны — отрицательно, поэтому для сбалансированного заряда у атома должно быть одинаковое количество обоих зарядов. Мы не будем говорить об ионах — где больше или меньше электронов — до позднего времени.
- Атомная масса (4) записывается в виде верхнего индекса слева от символа элемента. Атомная масса — это сумма количества протонов (2) и количества нейтронов (2).
Маленькие атомы, которые мы рассматриваем, , как правило, имеют такое же количество нейтронов, что и протоны, но это не обязательно так. Итак, как узнать, сколько нейтронов? Вы должны спросить или посмотреть на атомное массовое число, которое обычно пишется в верхнем левом углу атома. Поскольку атомная масса — это сумма количества протонов и нейтронов, если вы знаете атомную массу и количество протонов, вы можете легко вычислить количество нейтронов. (Обратите внимание, что электроны не влияют на массу атома, потому что их массы намного меньше масс нейтронов и протонов.
- У этого атома кислорода 8 электронов в двух оболочках.
Электронные оболочки : Электроны вращаются вокруг ядра в серии оболочек. Каждая оболочка может содержать определенное максимальное количество электронов (2 для первой оболочки, 8 для второй оболочки и 8 для третьей). И чтобы нарисовать атомы, вы сначала заполняете внутренние оболочки, а затем переходите к внешним оболочкам.
Итак, если бы я написал на доске только символ элемента и его атомную массу, учащиеся смогли бы вычислить количество частиц.
Пример: Углерод-12
Например, наиболее распространенная форма (изотоп) углерода-12 записывается как:
- Протоны = 6 : Поскольку мы знаем, что атомный номер равен 6 (потому что мы его запомнили), у атома 6 протонов.
- Нейтронов = 6 : Поскольку атомная масса равна 12 (верхний левый от символа элемента), чтобы найти количество нейтронов, мы вычитаем количество протонов (12-6 = 6).
- Электронов = 6 : Этот атом сбалансирован по заряду, поэтому ему нужно шесть электронов с их отрицательными зарядами, чтобы компенсировать шесть положительных зарядов шести протонов.(Примечание: мы еще не говорили о несбалансированных заряженных атомах, но заряд будет отображаться в виде верхнего индекса справа от символа.)
- Электронные оболочки (2-4) : У нас шесть электронов, поэтому первые два идут на заполнение первой электронной оболочки, а остальные могут переходить во вторую оболочку, которая может содержать до 8 электронов. Это дает электронную конфигурацию 2-4.
Пример: Углерод-14
Углерод-14 — радиоактивный изотоп углерода, который часто используется при углеродном датировании исторических артефактов.Он записывается как:
- Протонов = 6 : пока это углерод, в нем шесть протонов.
- Электронов = 6 : Этот атом также сбалансирован по заряду, поэтому ему также нужно шесть электронов.
- нейтронов = 8 : с атомной массой 14, когда мы вычитаем шесть протонов, количество нейтронов должно быть 8 (14-6 = 8).
Единственное различие между углеродом-12 и углеродом-14 состоит в том, что последний имеет еще два нейтрона. Следовательно, это два изотопа углерода.
Схема атома углерода-14.Пример: Гелий-4
Схема атома гелия-4.Пример: Натрий-23
Схема атома натрия-23.Примечание: изображение атома водорода можно найти здесь.
Обновление: я создал интерактивное приложение, которое будет рисовать атомы (первых 20 элементов) в дополнение к рабочему листу для студенческой практики.
2.5: Расположение электрона (модель оболочки)
Электронная оболочка — это внешняя часть атома вокруг атомного ядра.Это группа атомных орбиталей с одинаковым значением главного квантового числа \ (n \). Электронные оболочки имеют одну или несколько электронных подоболочек или подуровней. Название электронных оболочек происходит от модели Бора, в которой считалось, что группы электронов обращаются вокруг ядра на определенных расстояниях, так что их орбиты образуют «оболочки».
Введение
Что еще нам нужно знать о структуре атома? Мы знаем, что атомы содержат положительно и отрицательно заряженные частицы, и что количество этих зарядов в каждом атоме различно для каждого элемента.Мы также знаем, что положительные заряды сосредоточены в крошечном ядре, и что электроны движутся вокруг ядра в пространстве, которое намного больше ядра.
Однако некоторые из наиболее важных вопросов, которые мы задавали в предыдущем исследовании разработки концепции, все еще остаются без ответа. Помните, что мы видели, что углерод и азот имеют очень похожие атомные массы. Теперь мы можем добавить, что эти элементы имеют очень похожие атомные номера, поэтому их атомы имеют одинаковое количество протонов и электронов.Но углерод и азот в большинстве химических и физических аспектов сильно различаются. Точно так же некоторые элементы, такие как натрий и калий, имеют очень разные атомные номера, но имеют очень похожие химические и физические свойства. Кажется, что сравнение свойств двух разных атомов не очень легко понять, просто сравнивая количество протонов и электронов, содержащихся в атомах.
Чтобы и дальше понимать ответы на эти вопросы, нам нужны еще более подробные сведения о структуре каждого типа атомов.Знание электронной конфигурации различных атомов полезно для понимания структуры периодической таблицы элементов. Эта концепция также полезна для описания химических связей, удерживающих атомы вместе.
Снаряды
Электронную оболочку можно представить как орбиту, по которой следуют электроны вокруг ядра атома. Поскольку каждая оболочка может содержать только фиксированное количество электронов, каждая оболочка связана с определенным диапазоном энергии электронов, и, таким образом, каждая оболочка должна полностью заполниться, прежде чем электроны могут быть добавлены к внешней оболочке.Электроны во внешней оболочке определяют химические свойства атома (см. Валентная оболочка). Для объяснения того, почему электроны существуют в этих оболочках, см. Конфигурацию электронов.
Рисунок \ (\ PageIndex {1} \) : Оболочка Диаграмма лития (слева) и натрия (справа)
Электронные оболочки обозначены буквами K, L, M, N, O, P и Q; или 1, 2, 3, 4, 5, 6 и 7; идет от самой внутренней оболочки наружу. Электроны во внешних оболочках имеют более высокую среднюю энергию и проходят дальше от ядра, чем электроны во внутренних оболочках.Это делает их более важными при определении того, как атом химически реагирует и ведет себя как проводник, потому что сила притяжения ядра атома на них слабее и легче разрушается. Таким образом, реакционная способность данного элемента сильно зависит от его электронной конфигурации.
Валентные электроны
Валентная оболочка — это самая внешняя оболочка атома в его несоединенном состоянии, которая содержит электроны, которые, скорее всего, объясняют природу любых реакций с участием атома и связывающих взаимодействий, которые он имеет с другими атомами.Валентные электроны — это электроны, которые связаны с атомом и могут участвовать в образовании химической связи; в одинарной ковалентной связи оба атома в связи вносят один валентный электрон для образования общей пары. Присутствие валентных электронов может определять химические свойства элемента и то, может ли он связываться с другими элементами: для элемента основной группы валентный электрон может находиться только во внешней электронной оболочке.
Атом с замкнутой оболочкой валентных электронов обычно химически инертен.Атом с одним или двумя валентными электронами больше, чем закрытая оболочка, очень реактивен, потому что лишние валентные электроны легко удаляются с образованием положительного иона. Атом с одним или двумя валентными электронами меньше, чем закрытая оболочка, также является высоко реактивным из-за тенденции либо получать недостающие валентные электроны (тем самым образуя отрицательный ион), либо делить валентные электроны (тем самым образуя ковалентную связь).
Подобно электрону во внутренней оболочке, валентный электрон обладает способностью поглощать или выделять энергию в виде фотона.Увеличение энергии может заставить электрон переместиться (прыгнуть) на внешнюю оболочку; это известно как атомное возбуждение. Или электрон может даже вырваться из валентной оболочки связанного с ним атома; это ионизация с образованием положительного иона. Когда электрон теряет энергию (тем самым вызывая излучение фотона), он может перемещаться во внутреннюю оболочку, которая не полностью занята.
Число валентных электронов элемента может быть определено группой периодической таблицы (вертикальный столбец), в которой этот элемент отнесен к категории.За исключением групп 3–12 (переходные металлы), цифра единиц номера группы указывает, сколько валентных электронов связано с нейтральным атомом элемента, указанного в этом конкретном столбце.
* Общий метод подсчета валентных электронов обычно не подходит для переходных металлов.
** За исключением гелия, который имеет только два валентных электрона.
Авторы
- Соединения (Джон Хатчинсон)
- Википедия
Строительные блоки материи — Урок
(0 Рейтинги)Быстрый просмотр
Уровень оценки: 6 (5-7)
Требуемое время: 15 минут
Зависимость урока: Нет
Тематические области: Химия, Физические науки
Резюме
Учащиеся используют соответствующее задание, чтобы узнать об атомах и их структуре (протонах, электронах, нейтронах) — строительных блоках материи.Они видят, как научные открытия об атомах и молекулах влияют на новые технологии, разработанные инженерами. Эта инженерная программа соответствует научным стандартам нового поколения (NGSS).Инженерное соединение
Некоторые студенты, возможно, слышали об антивеществе, «фазерах» (лазерное оружие из Star Trek ™, которое испускает высокоэнергетические вспышки света, чтобы оглушить или смертельно ранить врага) и «Просвети меня, Скотти! (сигнал Star Trek ™ в комнату транспортера).Воображение — это здорово, и по мере того, как технологии развиваются и инженеры узнают больше о строительных блоках материи, эти типы технологий переходят от воображения к реальности.
Цели обучения
После этого урока учащиеся должны уметь:
- Определите молекулу.
- Перечислите основные компоненты и структуру атома.
- Поймите, как инженеры используют свои знания об атомной структуре для разработки новых технологий.
Образовательные стандарты
Каждый урок или задание TeachEngineering соотносится с одним или несколькими научными дисциплинами K-12, образовательные стандарты в области технологий, инженерии или математики (STEM).
Все 100000+ стандартов K-12 STEM, охватываемых TeachEngineering , собираются, обслуживаются и упаковываются Сетью стандартов достижений (ASN) , проект Д2Л (www.achievementstandards.org).
В ASN стандарты иерархически структурированы: сначала по источникам; например , по штатам; внутри источника по типу; например , естественные науки или математика; внутри типа по подтипу, затем по классу, и т. д. .
NGSS: научные стандарты нового поколения — наука Общие основные государственные стандарты — математика- Объясните закономерности в количестве нулей в произведении при умножении числа на степень 10 и объясните закономерности в расположении десятичной точки при умножении десятичной дроби или делении десятичной дроби на степень 10.Используйте целые числа для обозначения степени 10.
(Оценка
5) Подробнее
Посмотреть согласованную учебную программу
Вы согласны с таким раскладом? Спасибо за ваш отзыв!
- Понять концепцию отношения и использовать язык отношений для описания отношения отношения между двумя величинами.(Оценка
6) Подробнее
Посмотреть согласованную учебную программу
Вы согласны с таким раскладом? Спасибо за ваш отзыв!
Какое альтернативное выравнивание вы предлагаете для этого контента?
Больше подобной учебной программы
Атомы GumdropСтуденты используют мармеладки и зубочистки, чтобы делать модели атома лития.Используя эти модели, они исследуют состав атомов, включая их относительный размер.
Lights Out!Этот урок знакомит с концепцией электричества, предлагая студентам представить, какой была бы их жизнь без электричества. Студенты узнают, что электроны могут перемещаться между атомами, оставляя атомы в заряженном состоянии.
Поверхностно-активные вещества: помогают молекулам двигатьсяСтуденты узнают об основах молекул и о том, как они взаимодействуют друг с другом. Они узнают об идее полярных и неполярных молекул и о том, как они действуют с другими жидкостями и поверхностями. Студенты получают концептуальное представление о молекулах поверхностно-активных веществ и о том, как они работают на молекулярном уровне….
Взять на себя ответственность! Все о статическом электричествеСтуденты приходят к пониманию статического электричества, узнавая о природе электрического заряда и различных методах зарядки объектов. В практической деятельности учащиеся индуцируют электрический заряд на различных объектах и экспериментируют с электрическим отталкиванием и притяжением.
Введение / Мотивация
Осмотрите класс. Как вы думаете, из чего состоят все предметы в классе? (Возможные ответы: атомы, материя, твердые вещества и т. Д. Некоторые студенты могут ответить более конкретно, например: столы, стены, воздух, люди и т. Д.). Все живое и неживое вокруг нас состоит из вещества, называемого материей .Фактически, любой предмет, имеющий массу и занимающий место, можно считать материей.
Знаете ли вы, как называются основные строительные блоки материи? Итак, основные строительные блоки, из которых состоит материя, называются атомами . Иногда два или более атома связываются или слипаются, образуя молекулу . Молекула — это самая маленькая часть вещества, которая все еще обладает всеми свойствами этого вещества. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода.Иногда молекула состоит из двух или более одинаковых атомов, например, молекула газообразного гелия. Материя и молекулы, из которых состоит окружающий нас мир, в основном образованы множеством различных атомов, связанных вместе, каждый из которых имеет свои собственные свойства или атрибуты.
Атомы маленькие, но при высвобождении их энергии они сильно разбиваются. Начнем с основных частиц, составляющих атом, и связанных с ними зарядов и структуры. Атомы состоят из трех частиц: отрицательно заряженных электронов , положительно заряженных протонов и нейтронов , которые имеют нейтральный заряд.Легко запомнить типы зарядов на каждой из этих частиц, если использовать простую ассоциацию. Например, протоны положительны, и оба этих слова начинаются с p. Также нейтроны нейтральны, они начинаются с n. Тогда нам нужно запомнить только одну частицу: электроны, и они имеют отрицательный заряд. Где все эти частицы расположены в атоме? Электроны существуют на орбитах или оболочках, которые вращаются вокруг ядра атома, содержащего протоны и нейтроны. На самом деле эти оболочки выглядят как нечеткие облака, в которых движутся электроны.
Инженеры используют свои знания о структуре атомов для всего, от разработки новых материалов (антипригарные покрытия для сковородок, более безопасных футбольных шлемов, углеродного волокна для более быстрых автомобилей, более легких протезов и велосипедов и т. Д.) До использования энергии ядерной энергии. реакции на электричество. Они также создают машины, такие как лазеры, для искусственного создания элементов. Лазеры используются в медицине и стоматологии, а также в различных отраслях промышленности. Многие технологии из старого сериала «Звездный путь» представляют собой реальные возможности для будущего, поскольку ученые и инженеры узнают больше о структуре материи.Во время этого урока мы узнаем больше о материи и ее основном строительном блоке — атоме. Давайте также подумаем о том, как мы можем использовать наши знания о материи для понимания новых инженерных технологий.
Предпосылки и концепции урока для учителей
История
Древние греки запустили процесс катания атомного шара. Демокрит был первым, кто предположил, что материя состоит из маленьких кусочков. Левкипп был первым, кто использовал термин атом (atomon), что в переводе с греческого означало «неделимый».Теперь мы знаем, что атом делится и состоит из еще более мелких частей — загадочных субатомных частиц. Поскольку у греков не было возможности проверить и подтвердить свои теории, нам пришлось ждать почти 2000 лет, чтобы подтвердить, что атомы действительно существуют, хотя и не совсем так, как предполагали греки.
В 16 веке Роберт Бойль высказал идею о том, что существует элементов , которые нельзя разбить дальше, но только в 18 веке Джон Дальтон пришел к выводу, что элементы могут состоять из атомов.
Атом и структура атома
Основные факты, которые необходимо знать об атоме, заключаются в том, что он состоит из трех основных субатомных частиц: 1) электронов (отрицательный заряд), которые вращаются в оболочках вокруг ядра , которое состоит из 2) протонов ( положительный заряд) и 3) нейтронов (нейтральный заряд). Как правило, количество протонов и электронов уравновешивается, чтобы атом имел электрически нейтральный заряд. Электроны, наиболее удаленные от ядра атома (валентные электроны), легче всего разделяются с другими атомами или передаются им.Атомы, у которых отсутствует электрон или у которых есть дополнительный электрон, называются ионами и легко объединяются с другими ионами, образуя молекул .
Число протонов в атоме называется атомным номером . Это число определяет элемент атома. Внутри элемента количество нейтронов может варьироваться, создавая различные изотопы или нуклиды . По большей части это не влияет на электрическое и химическое поведение атома.(Есть некоторые исключения, связанные с массой изотопа, поскольку более тяжелые изотопы, как правило, реагируют медленнее, чем более легкие.) Есть некоторые вещи, которые влияют на количество протонов и нейтронов в ядре атома, включая ядерное деление, ядерный синтез. и радиоактивный распад. Однако обычно количество электронов — это частица, которую легче всего изменить из-за ее более низкой энергии связи.
Традиционно атом представляли как некую миниатюрную солнечную систему. Теперь ученые понимают, что если бы мы могли видеть атом, он был бы больше похож на маленькое нечеткое облачко.Фактически, ученые могут только предсказать, где может быть электрон в своей оболочке, используя теорию вероятности : точное положение и импульс электрона нельзя определить одновременно.
Рис. 1. Атомный масштаб. Авторское право
Copyright © 2000 Группа данных о частицах Национальной лаборатории Лоуренса в Беркли http://particleadventure.org/
Протоны и нейтроны примерно одинаковой массы; однако электроны более чем в 1000 раз легче. Насколько малы мы говорим? Что ж, как показано на рисунке 1, мы говорим очень и очень крошечные.
- атом = 1 x 10 -10 метров
- ядро = 1 x 10 -15 до 1 x 10 -14 метров
- нейтрон или протон = 1 x 10 -15 метров
- электрон — точно не известно, но предположительно порядка 1 x 10 -18 метров
Атом можно разбить на несколько более мелких субатомных частиц. Три основных — это протонов, и нейтронов, , которые находятся в ядре или остове атома, и электронов, , которые существуют вне ядра.Обратитесь к упражнению Gumdrop Atoms, чтобы проиллюстрировать анатомию атома, чтобы дать учащимся лучшее понимание того, как взаимодействуют эти субатомные частицы. Физики недавно разделили атомы на еще более мелкие субатомные частицы, такие как фермионы (кварки, лептоны, нейтрино, электроны) и бозоны (глюоны, фотоны, гравитроны). Трудно (если не невозможно) определить физические свойства чего-либо на основе количества кварков и лептонов, которые оно содержит. То, что мы видим в нашем мире (вода, дерево, металл, кожа, зубы), лучше понять и организовать с помощью количества протонов, нейтронов и электронов, содержащихся в их атомах (и молекулах).Подобно тому, как мы смотрим на формы различных деталей LEGO ™, а не на пластик, из которого они сделаны, в этом уроке мы просто рассмотрим протоны, нейтроны и электроны как «LEGO ™» материи.
Интересный факт: Если мы изобразим атом в масштабе и сделаем протоны и нейтроны диаметром в сантиметр, то электроны будут меньше диаметра волоса, а весь диаметр атома будет больше, чем длина тридцати футбольных полей. ! Фактически 99.9% объема атома — пустое место! (Источник: http://particle.adventure.org/particleadventure/)
Сопутствующие мероприятия
Закрытие урока
Итак, что это за штука вокруг нас? (Ответ: Материя) Материя — это все, что имеет массу и занимает пространство. Основные строительные блоки, из которых состоит материя, называются атомами. Какие частицы содержатся в атомах? (Ответ: электроны, протоны и нейтроны) Где они находятся? (Ответ: протоны и нейтроны находятся в ядре, а электроны находятся в оболочках вокруг ядра.) Кто помнит, что такое молекула? (Ответ: молекула — это наименьшая часть вещества, которая все еще обладает всеми свойствами этого вещества; когда два или более атома связываются или слипаются, они образуют молекулу.)
Атому предстоит открыть еще много загадок. За последние 100 лет мы узнали много нового о том, как ведет себя атом, но нам предстоит еще многое узнать. Когда ваши родители росли, у них не было некоторых технологий, которые есть у нас сегодня. Прогресс в технологиях частиц, таких как использование лазеров, произошел благодаря тому, что инженеры использовали атомные открытия ученых для создания устройств, которые делают нашу жизнь лучше и продвигают человеческое общество.Лазеры используются в промышленности, медицине, военном деле и даже во многих потребительских товарах, таких как компьютеры и DVD-плееры.
Словарь / Определения
атом: основная единица материи; наименьшая единица элемента, имеющая все характеристики этого элемента; состоит из отрицательно заряженных электронов и положительно заряженного центра, называемого ядром.
атомная теория: теория, согласно которой вся материя состоит из элементарных частиц, называемых атомами; концепция атома как состоящего из субатомных частиц.
электрон: частица, вращающаяся вокруг ядра атома с отрицательным зарядом.
молекула: наименьшая единица вещества, сохраняющая химические и физические свойства вещества; два или более атомов, удерживаемых вместе химическими связями.
нейтрон: частица в ядре атома без заряда.
Ядро: плотное центральное ядро атома (состоящее из протонов и нейтронов).
протон: частица в ядре атома с положительным зарядом.
Оценка
Оценка перед уроком
Вопрос для обсуждения: Запрашивайте, объединяйте и обобщайте ответы студентов.
- Попросите учащихся осмотреть предметы в классе, а затем спросите их, что, по их мнению, является «материалом», из которого состоят предметы в классе. Включите технологические элементы, такие как компьютеры, телефоны и домофоны.(Возможные ответы: атомы, материя, твердые вещества и т. Д.)
Оценка после введения
Голосование : Задайте вопрос «правда / ложь» и попросите учащихся проголосовать, подняв палец вверх за истину и вниз за ложь. Подсчитайте голоса и запишите итоги на доске. Дайте правильный ответ.
- Верно или неверно: атом — это наименьший строительный блок материи (Ответ: Верно)
- Верно или неверно: молекулы состоят из двух или более атомов. (Ответ: Верно; молекула также является самой маленькой частью вещества, которое все еще обладает всеми свойствами этого вещества.)
- Верно или неверно: электроны находятся в ядре атома. (Ответ: Неверно; электроны находятся в оболочках за пределами ядра.)
- Верно или неверно: инженеры используют свои знания об атомах и молекулах для разработки новых технологий. (Ответ: Верно)
- Верно или неверно: Лазеры используются только в научных лабораториях. (Ответ: Неверно; лазеры используются во многих сферах, включая промышленность, стоматологию и медицину, военные и потребительские товары, такие как компьютеры и DVD-плееры.)
Итоги урока Оценка
Карточки : Каждый ученик в команде создает карточку с вопросом на одной стороне и ответом на другой. Если команда не может прийти к единому мнению, ей следует проконсультироваться с учителем. Передайте карточки следующей команде. Каждый член команды читает карточку, и каждый пытается ответить на нее. Если они правы, они могут передать карту следующей команде. Если они считают, что у них есть другой правильный ответ, они должны написать свой ответ на обратной стороне карточки в качестве альтернативы.После того, как все команды заполнили все карточки, проясните все вопросы. Ниже приведены примеры вопросов:
- Заряд протона положительный, отрицательный или нейтральный? (Ответ: положительный)
- Какие атомные частицы существуют в ядре? (Ответ: Протоны и нейтроны)
Мероприятия по продлению урока
Будьте SME!
Люди, которые разрабатывают учебные планы и программы обучения, часто полагаются на специалиста по предмету или SME (произносится «смэ») — часто инженеров или других специалистов — чтобы дать им самую свежую информацию о материале.Для этого задания каждый студент может стать специалистом в области малого и среднего бизнеса в своей предметной области и выступить с стендовой презентацией на научной ярмарке в классе «Загадочные частицы». Студенты могли индивидуально выбрать субатомную частицу и стать специалистом по этому предмету. Или несколько студентов могут работать вместе, чтобы объяснить структуру атома, например, демонстрируя, как электроны движутся в оболочках. Следует поощрять учащихся разыгрывать свойства частиц.
Индивидуально попросите студентов исследовать атомы (через Интернет или другие источники).
Студенты могут пройти интерактивную викторину FunBrain Periodic Table по адресу: https://www.funbrain.com/games/periodic-table-game и исследовать каждый из элементов через Интернет или другие источники.
Рекомендации
Andrew Rader Studios, Rader’s Chem4Kids.com, Atom Basics: Обзор, «Атомы вокруг нас», http://www.chem4kids.com/, дата обращения 31 августа 2006 г.
Бэтчелор, Дэвид Аллен. Центр космических полетов имени Годдарда НАСА, «Наука Звездного пути», 1993.
Браун, Джуди. Музей науки Майами, Семья Атома, «Портретный салон Призрака», http://miamisci.org/af/sIn/phantom/index.html.
Группа данных о частицах Национальной лаборатории Лоуренса Беркли, «Приключение частиц: основы материи и силы», 2002 г.
Национальный ускоритель Томаса Джефферсона — Управление естественнонаучного образования, естественнонаучного образования, игр и головоломок, «Это элементарно: Периодическая таблица элементов», http: // education.jlab.org/inexpages/elementgames.html, по состоянию на 31 августа 2006 г.
Макинтайр, Стейси. Министерство энергетики США, Управление энергетической информации, Energy Kid’s Page, Energy Facts, «Источники энергии», http://www.eia.doe.gov/kids/ По состоянию на 31 августа 2006 г.
Университет Колорадо в Боулдере, Центр комплексных исследований плазмы, Physics 2000, декабрь 2004 г., http://www.colorado.edu/physics/ По состоянию на 31 августа 2006 г.
Авторские права
© 2006 Регенты Университета Колорадо.Авторы
Брайан Кей; Дарья Котыс-Шварц; Малинда Шефер Зарске; Джанет ЙоуэллПрограмма поддержки
Комплексная программа преподавания и обучения, Инженерный колледж, Университет Колорадо в БоулдереБлагодарности
Содержание этой учебной программы по цифровой библиотеке было разработано за счет гранта Фонда улучшения послесреднего образования (FIPSE), U.S. Министерство образования и Национальный научный фонд ГК-12, грант No. 0338326. Однако это содержание не обязательно отражает политику Министерства образования или Национального научного фонда, и вам не следует предполагать, что оно одобрено федеральным правительством.
Последнее изменение: 24 июня 2021 г.
открытых учебников | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Марка 7A
Марка 7Б
Оценка 7 (вместе A и B)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
класс 8A
Марка 8Б
Оценка 8 (вместе A и B)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 9А
Марка 9Б
9 класс (A и B вместе)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 4A
Класс 4Б
Класс 4 (вместе A и B)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5А
Марка 5Б
Оценка 5 (вместе A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 6A
класс 6Б
6 класс (A и B вместе)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий.Вы можете делать ксерокопии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки каким-либо образом, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без марочного обозначения)
Эти небрендированные версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, модифицировать или дополнять их любым способом, с единственным требованием — дать соответствующую оценку Siyavula.
