Свойства оснований, кислот, солей и оксидов
Кислоты в свете ТЭД
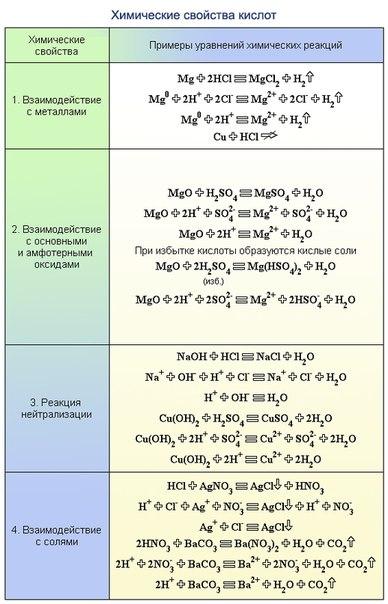
Химические свойства кислот.
Кислота Р., Н. + Ме(ОН)х Р., Н. = соль + вода (р. Обмена, р. Нейтрализации, если Ме(ОН)х— щелочь)
Кислота Р.+ МехОу (степень окисления Ме от +1до +4) = сольР. + вода (р. Обмена,)
Кислота Р.+ соль Р. иногда Н.= новая кислота + новая соль (р. Обмена, ↓, ↑-СО2, SO2, Н2S, кислота сильнее новой кислоты)
Кислота + Ме = соль + Н2↑ (р.

Способы получения
Кислотный оксид + вода = кислота (кислородсодержащие кислоты)
НеМе + Н2= НхнеМе (бескислородные кислоты)
Соль + кислота = новая кислота + новая соль↓
Основания в свете ТЭД
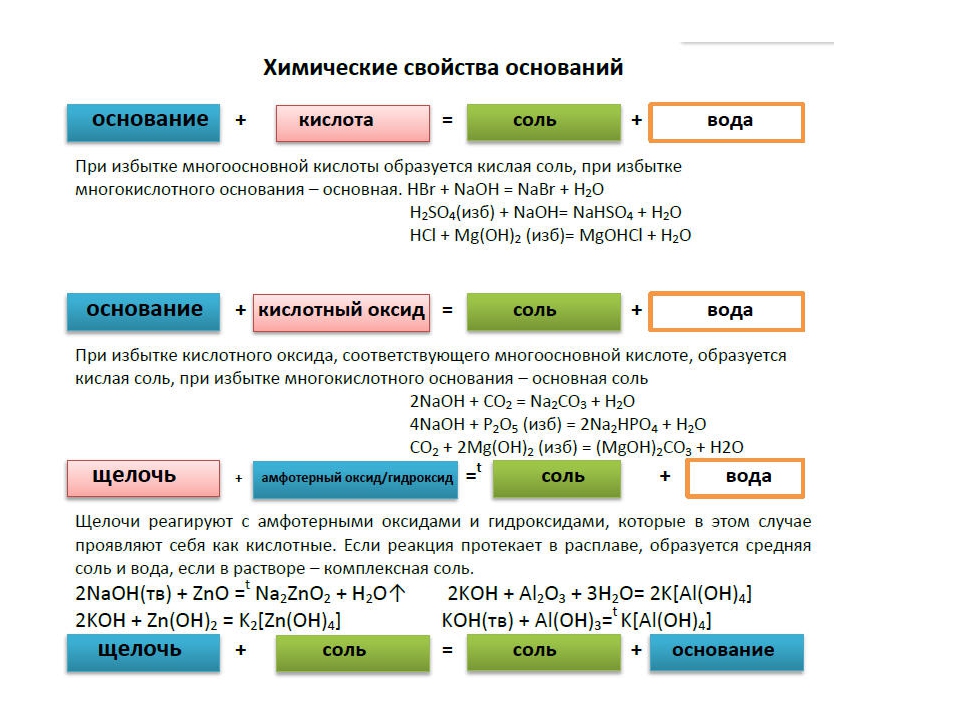
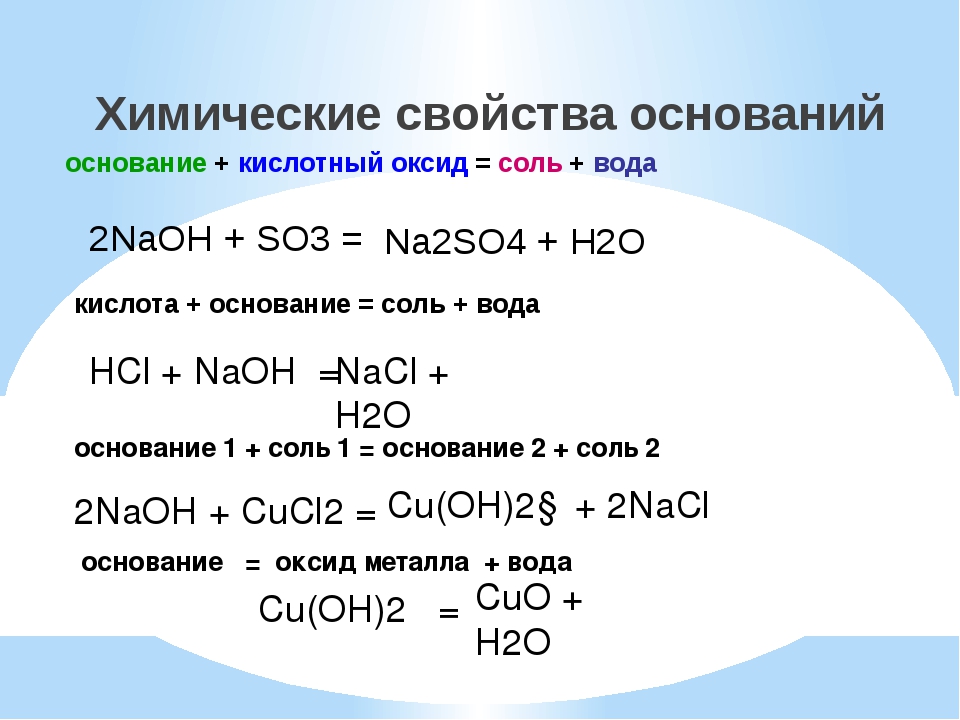
Химические свойства оснований.
Кислота Р., Н. + Ме(ОН)х Р., Н. = соль + вода (р. Обмена, р. Нейтрализации, если Ме(ОН) х— щелочь)
Основание Р.+ МехОу (степень окисления Ме от +5 до +7) = соль + вода (р.
 Обмена)
Обмена)
Основание Р.+ неМехОу = соль + вода (р. Обмена)
Основание Р.+ соль Р.= новое основание + новая соль (р. Обмена, ↓, ↑-NH3)
Нерастворимое основание t= неМехОу + Н2О↑ (р. Разложения)
Оксид Ме + вода = щелочь (Li2O, Na2O, K2O, Rb2O, Cs2O, CaO, BaO, SrO)
Щелочной 2Ме + 2Н2О= 2МеОН Р + Н2↑ (щелочь) ( Li, Na, K, Rb, Cs)
Щелочноземельный Ме + 2Н2О= Ме(ОН) Р (щелочь) + Н2↑ (Ca, Ba, Sr)
Соль р + основание р = новое основание↓+ новая соль
Соли, их классификация, свойства в свете ТЭД
Соли
Свойства солей
1.![]() Соль + кислота = другая соль + другая кислота (↓ или ↑ CO2, SO2, H2S)
Соль + кислота = другая соль + другая кислота (↓ или ↑ CO2, SO2, H2S)
2. Соль (р) + щелочь = другая соль + другое основание (↓ или ↑ NH3)
3. Соль1 (р) + соль2 (р) = соль3 + соль4 (↓ )
4. Соль (р) + металл (более активный, но не IA, IIA-подгрупп) = другая соль (р) + другой металл (менее активный)
5. Некоторые соли могут разлагаться при прокаливании.
СаСО3 = СаО + СО2
(CuOH)2 СО3 CuO + CO2 + H2O
2NaHCO3Na2CO3 + CO2 + H2O
MeNO3 —
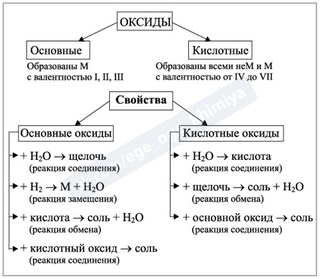
Оксиды, их классификация, свойства в свете ТЭД
Оксиды
Несолеобразующие Солеобразующие
CO, N2O, NO, SiO,
Основные Амфотерные Кислотные
Ме+1,+2xOy Ме+3,+4xOy Ме>+4xOy
НЕМеxOy
Химические свойства основных оксидов
1. О.О + кислота = соль + вода
О.О + кислота = соль + вода
2. O.O+ вода = щелочь!!!
3. О.О + К.О = соль
4. О.О + А.О = соль
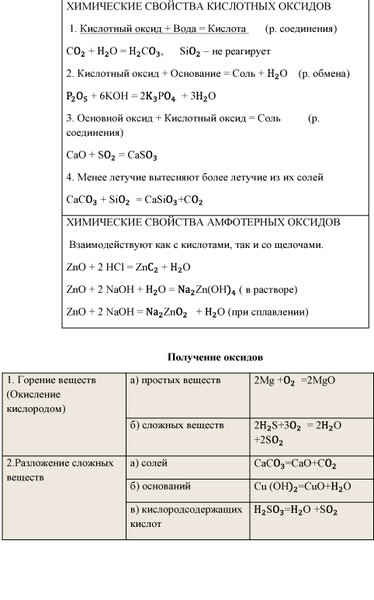
Химические свойства кислотных оксидов
1. К.О + основание = соль + вода
2. К.O+ вода = кислота (искл. SiO2)
3. О.О + К.О = соль
4. K.О + А.О = соль
5. K.O + соль летучих К.О= новая соль + летучий К.О↑
Химические свойства амфотерных оксидов
1. А.О + щелочь = соль + вода
А.О + кислота = соль + вода
2. А.O+ вода = реакция не идет
3. А.О + К.О = соль
4. А.О + О.О = соль
5. А.O + соль летучих К.О= новая соль + летучий К.О↑
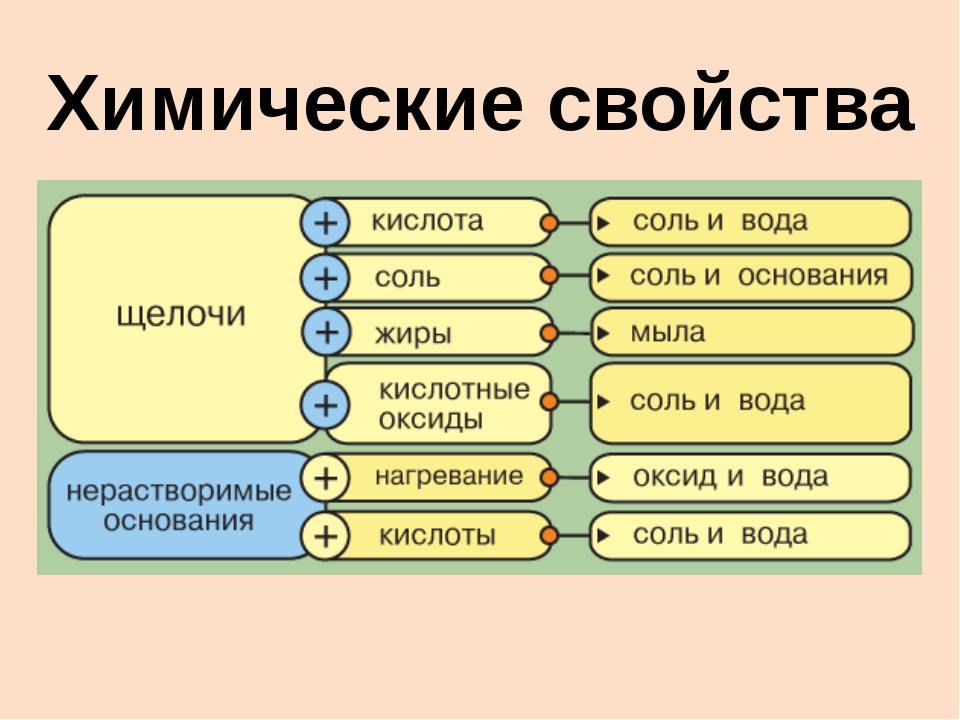
Химические свойства оснований — урок. Химия, 8–9 класс.
Химические свойства гидроксида металла во многом зависят от того, к какой группе он принадлежит — к щелочам или к нерастворимым основаниям.
Общие химические свойства щелочей
1. Кристаллы щелочей при растворении в воде полностью диссоциируют, то есть распадаются на положительно заряженные ионы металла и отрицательно заряженные гидроксид-ионы.
A) Например, при диссоциации гидроксида натрия образуются положительно заряженные ионы натрия и отрицательно заряженные гидроксид-ионы:
NaOH→Na++OH−.
Б) Процесс диссоциации гидроксида кальция отображается следующим уравнением:
Ca(OH)2→Ca2++2OH−.
2. Растворы щелочей изменяют окраску индикаторов.
Фактически с индикатором взаимодействуют гидроксид-ионы, содержащиеся в растворе любой щёлочи. При этом протекает химическая реакция с образованием нового продукта, признаком протекания которой является изменение окраски вещества.
Изменение окраски индикаторов в растворах щелочей
Индикатор | Изменение окраски индикатора |
| Лакмус | Фиолетовый лакмус становится синим |
| Фенолфталеин | Беcцветный фенолфталеин становится малиновым |
Универсальный индикатор | Универсальный индикатор становится синим |
Видеофрагмент:
Действие щелочей на индикаторы |
3. Щёлочи взаимодействуют с кислотами, образуя соль и воду.
Реакция нейтрализации — частный случай реакции обмена: при взаимодействии щелочи и кислоты образуются соль и вода.
А) Например, при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода: NaOH+HCl→NaCl+h3O.
Видеофрагмент:
Взаимодействие гидроксида натрия с соляной кислотой |
Б) Если нейтрализовать гидроксид кальция азотной кислотой, образуются нитрат кальция и вода:
Ca(OH)2+2HNO3→Ca(NO3)2+2h3O.
4. Щёлочи взаимодействуют с кислотными оксидами, образуя соль и воду.
А) Например, при взаимодействии гидроксида кальция с оксидом углерода(\(IV\)) т. е. углекислым газом, образуются карбонат кальция и вода:
е. углекислым газом, образуются карбонат кальция и вода:
Ca(OH)2+CO2→CaCO3↓+h3O.
Обрати внимание!
При помощи этой химической реакции можно доказать присутствие оксида углерода(\(IV\)): при пропускании углекислого газа через известковую воду (насыщенный раствор гидроксида кальция) раствор мутнеет, поскольку выпадает осадок белого цвета — образуется нерастворимый карбонат кальция.
Б) При взаимодействии гидроксида натрия с оксидом фосфора(\(V\)) образуются фосфат натрия и вода:
6NaOH+P2O5→2Na3PO4+3h3O.
5. Щёлочи могут взаимодействовать с растворимыми в воде солями.
Обрати внимание!
Реакция обмена между основанием и солью возможна в том случае, если оба исходных вещества растворимы, а в результате образуется хотя бы одно нерастворимое вещество (выпадает осадок).
А) Например, при взаимодействии гидроксида натрия с сульфатом меди(\(II\)) образуются сульфат натрия и гидроксид меди(\(II\)):
2NaOH+CuSO4→Na2SO4+Cu(OH)2↓.
Б) При взаимодействии гидроксида кальция с карбонатом натрия образуются карбонат кальция и гидроксид натрия:
Ca(OH)2+Na2CO3→CaCO3↓+2NaOH.
6. Малорастворимые щёлочи при нагревании разлагаются на оксид металла и воду.
Например, если нагреть гидроксид кальция, образуются оксид кальция и водяной пар:
Ca(OH)2⟶t°CaO+h3O↑.
Общие химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с кислотами, образуя соль и воду.
А) Например, при взаимодействии гидроксида меди(\(II\)) с серной кислотой образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+h3SO4→CuSO4+2h3O.
Б) При взаимодействии гидроксида железа(\(III\)) с соляной (хлороводородной) кислотой образуются хлорид железа(\(III\)) и вода:
Fe(OH)3+3HCl→FeCl3+3h3O.
Видеофрагмент:
Взаимодействие гидроксида железа(\(III\)) с соляной кислотой |
2. Некоторые нерастворимые основания могут взаимодействовать с некоторыми кислотными оксидами, образуя соль и воду.
Например, при взаимодействии гидроксида меди(\(II\)) с оксидом серы(\(VI\)) образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+SO3⟶t°CuSO4+h3O.
3. Нерастворимые основания при нагревании разлагаются на оксид металла и воду.
А) Например, при нагревании гидроксида меди(\(II\)) образуются оксид меди(\(II\)) и вода:
Cu(OH)2⟶t°CuO+h3O.
Видеофрагмент:
Разложение гидроксида меди(\(II\)) |
Б) Гидроксид железа(\(III\)) при нагревании разлагается на оксид железа(\(III\)) и воду:
2Fe(OH)3⟶t°Fe2O3+3h3O.
Химические свойства солей, кислот, оснований. Квест по химии
Министерство образования Тверской области ГБП ОУ «Торжокский государственный промышленно-гуманитарный колледж» Дисциплина «Химия» | |
|
|
МЕТОДИЧЕСКАЯ РАЗРАБОТКА ТЕМА ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ, СОЛЕЙ, ОСНОВАНИЙ
| |
| |
Торжок, 2018
| |
Министерство образования Тверской области ГБП ОУ «Торжокский государственный промышленно-гуманитарный колледж» | ||
Рецензент должность, место работы __. | УТВЕРЖДАЮ зам. директора по УМР _____________ О.В.Гамелько __. __. 2018
| |
МЕТОДИЧЕСКАЯ РАЗРАБОТКА ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ, СОЛЕЙ, ОСНОВАНИЙ
Составлена в соответствии с ФГОС СПО
| ||
Содержание
Пояснительная записка
Информационная карта урока
Задания квеста
Пояснительная записка
В ходе урока используется квест.
В своем классическом значении квест (от англ. quest – поиск) – это командная игра, в которой востребованы эрудиция, сообразительность, креативность и нестандартное мышление. Идея игры проста – команды, перемещаясь в реальном или виртуальном пространстве, выполняют различные задания. Игра включает в себя последовательность точек (локаций) и задач, объединенных общим сценарием. Выполнив задание, команда получает направление на следующую точку или задание, и таким образом продвигается к финишу. Количество точек (уровней) и их сложность определяется для каждой игры в соответствии с ее целью и сюжетными особенностями. Используя свои знания, интеллект, смекалку, команда игроков должна стремиться выполнить все задания и преодолеть маршрут за определенное время.
Квест обладает всеми преимуществами
игры как таковой, то есть дает возможность реализовать все плюсы игрового
обучения. Это и пробуждение активности учащихся, и организация свободного
творческого пространства, и формирование навыков принятия самостоятельных и коллективных
решений. Не стоит забывать и о мотивационных возможностях состязательного
характера игры, который, как правило, присутствует в любом квесте.
Не стоит забывать и о мотивационных возможностях состязательного
характера игры, который, как правило, присутствует в любом квесте.
Игровая ситуация задается на старте квеста и может быть очень разнообразной. Выбирая сюжет игры, необходимо учитывать несколько важных условий. Прежде всего, он определяется целями проведения квеста – как учебными, так и воспитательными. Немаловажен возраст учащихся и психологические особенности группы. Но какими бы ни были сюжет и задачи квеста, важно изначально проектировать его многовариантность, динамику и драматургию, а в ходе проведения стараться поддерживать атмосферу игры, аккуратно управлять ей, не допуская превращение увлекательного приключения в бесконечную череду утомительных учебных заданий.
Квест
– это всегда поиск. В буквальном смысле – играющим нужно найти
месторасположение объекта, опознавательные знаки, информацию, отдельные детали
и т.д. И эта задача, безусловно, развивает не только наблюдательность и
внимание, но и привычку внимательного всматривания в окружающий мир. Квест
убеждает в том, что вокруг нас много интересного, что не всегда бросается в
глаза, что стоит стать чуть зорче, и увидишь больше, чем остальные. При этом,
хотя игра носит командный характер, для достижения нужного результата важна
поисковая работа каждого из участников. Зачастую в этих условиях неожиданно
ярко проявляют себя обычно пассивные учащиеся, не обладающие большим багажом
знаний, но обнаруживающие в игре наблюдательность или способность быстро
ориентироваться в пространстве.
Квест
убеждает в том, что вокруг нас много интересного, что не всегда бросается в
глаза, что стоит стать чуть зорче, и увидишь больше, чем остальные. При этом,
хотя игра носит командный характер, для достижения нужного результата важна
поисковая работа каждого из участников. Зачастую в этих условиях неожиданно
ярко проявляют себя обычно пассивные учащиеся, не обладающие большим багажом
знаний, но обнаруживающие в игре наблюдательность или способность быстро
ориентироваться в пространстве.
Исследовательские
возможности квеста определяются и полной самостоятельностью учащихся, которая
является обязательным условием этого типа игры. Учитель выступает здесь лишь
дистанционным модератором – он не направляет действия участников, не участвует
в определении стратегии поиска, не распределяет роли внутри группы. Все это
студентам приходится делать самим для успешного достижения результата. В
поисках ответа на заданный вопрос или решения задачи ими определяются
оптимальные способы действия, актуализируются накопленные знания, анализируется
информация и устанавливаются причинно-следственные связи. При этом результат
игры может быть гораздо объемнее, чем достижение заданной на старте цели. В
поле зрения участников часто оказываются не имеющие отношения к сюжету, но
интересные детали и обстоятельства, возникают дополнительные вопросы, которые
могут стать предметом дальнейшего обсуждения и исследования.
Чтобы максимально использовать исследовательскую составляющую квеста, важно организовать его поэтапную рефлексию. По завершении игры можно обсудить ее фактические результаты, обозначить самые сложные и самые интересные задания, отметить самых активных, изобретательных и эрудированных участников. Возможно на этом же этапе предположить возможные темы дальнейших исследований. Зачастую катализатором интересных идей здесь становятся запомнившиеся участникам вопросы или неожиданные наблюдения.
Таким образом, возможности
образовательного квеста достаточно широки. Стоит заметить, что, рискнув взяться
за подготовку подобных игр, немало приобретает и сам учитель. Открываются
интересные факты, рождаются новые идеи. И как всякий творческий процесс,
создание квеста – это увлекательное и вдохновляющее, хотя и трудоемкое занятие.
И как всякий творческий процесс,
создание квеста – это увлекательное и вдохновляющее, хотя и трудоемкое занятие.
ТЕМА:
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ, СОЛЕЙ, ОСНОВАНИЙ
ЦЕЛИ Изучить химические свойства неорганических веществ | Развить познавательный интерес, активность. Формировать навыки принятия самостоятельных и коллективных решений
| Воспитать научное мировоззрение |
СОДЕРЖАНИЕ 1. ОРГ.МОМЕНТ 2. АКТУАЛИЗАЦИЯ ЗНАНИЙ 3. УСВОЕНИЕ НОВЫХ ЗНАНИЙ -КЛАССИФИКАЦИЯ — КВЕСТ «ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ, СОЛЕЙ, ОСНОВАНИЙ» — ИТОГИ КВЕСТА — ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ ИЗУЧЕННОГО МАТЕРИАЛА —
| МЕТОДИЧЕСКИЙ ИНСТРУМЕНТАРИЙ — видеосюжет -ЛСМ (формулы веществ) -ПСХЭ — маршрутные листы — листы с заданиями в конвертах — указатели — слова ключевой фразы
| Назвать классы неорганических веществ, Распределять вещества по классам Характеризовать свойства различных классов веществ Организовывать совместное взаимодействие |
КВЕСТ
В ИТОГЕ ВЫПОЛНЕНИЯ ЗАДАНИЙ У ВАС ПОЛУЧИТСЯ
ФОРМУЛА ВЕЩЕСТВА. ЕЕ НЕОБХОДИМИО НАЗВАТЬ. ЗАДАНИЯ ДОЛЖНЫ БЫТЬ ЗАПИСАНЫ В
ТЕТРАДЬ ПО ХИМИИ КАЖДОМУ СТУДЕНТУ ГРУППЫ!
ЕЕ НЕОБХОДИМИО НАЗВАТЬ. ЗАДАНИЯ ДОЛЖНЫ БЫТЬ ЗАПИСАНЫ В
ТЕТРАДЬ ПО ХИМИИ КАЖДОМУ СТУДЕНТУ ГРУППЫ!
Разделение на группы
1.Определить тип оксида по формулам и разделиться по группам: несолеобразующие оксиды, кислотные оксиды, амфотерные оксиды, основные оксиды.
NO | CO | NO2 | SiO | SiO | NO |
N2O | SiO2 | N2O3 | CO2 | N2O | SO3 |
ZnO | ZnO | AL2O3 | ZnO | AL2O3 | ZnO |
K2O | CaO | Fe2O3 | Li2O | CaO | CaO |
МАРШРУТНЫЕ ЛИСТЫ
1 | Задание
| Где ключевое слово и следующее задание |
старт — кислоты | Химические
свойства кислот. ВНИМАНИЕ: ЗАПИСЫВАТЬ ВЫПОЛНЕННЫЕ ЗАДАНИЯ ВСЕМ СТУДЕНТАМ В ТЕТРАДЬ ПО ХИМИИ | Задание у преподавателя |
| Химические свойства солей | Задание у преподавателя |
| Химические свойства оснований | финиш |
2 | Задание
| Где ключевое слово и следующее задание |
старт — кислоты | Химические свойства кислот ВНИМАНИЕ: ЗАПИСЫВАТЬ ВЫПОЛНЕННЫЕ ЗАДАНИЯ ВСЕМ СТУДЕНТАМ В ТЕТРАДЬ ПО ХИМИИ
| Задание у преподавателя |
| Химические свойства солей | Задание у преподавателя |
| Химические свойства оснований | финиш |
3 | Задание
| Где ключевое слово и следующее задание |
старт — соли | Химические свойства кислот ВНИМАНИЕ: ЗАПИСЫВАТЬ ВЫПОЛНЕННЫЕ ЗАДАНИЯ ВСЕМ СТУДЕНТАМ В ТЕТРАДЬ ПО ХИМИИ | Задание у преподавателя |
| Химические свойства солей | Задание у преподавателя |
| Химические свойства оснований | финиш |
4 | Задание
| Где ключевое слово и следующее задание |
старт — основания | Химические свойства кислот ВНИМАНИЕ: ЗАПИСЫВАТЬ ВЫПОЛНЕННЫЕ ЗАДАНИЯ ВСЕМ СТУДЕНТАМ В ТЕТРАДЬ ПО ХИМИИ
| Задание у преподавателя |
| Химические свойства солей | Задание у преподавателя |
| Химические свойства оснований | финиш |
| Задание
| ||||||||||||
1 | Химические
свойства кислот. 1.Продолжите УХР 1.Реакция нейтрализации HCL+Cu(OH)2= 2 взаимодействие с оксидами металлов Fe2O3 +H2 SO4= 3. взаимодействие с металлами Mg+H2 SO4= 4. Взаимодействие с солями CaCL2+H3PO4=
2.Заполните таблицу
| ||||||||||||
2 | Химические
свойства солей. 1.Продолжите УХР 1.с металлами
Fe+СuSO4 = 2 взаимодействие с основаниями СuSO4+Ba(OH)2= 3. Взаимодействие с солями BaCL2+FeSO4=
2.Заполните таблицу
| ||||||||||||
3 | Химические свойства оснований. 1.Продолжите УХР 1.Реакция нейтрализации HCL+Cu(OH)2= H2 SO4+Cu(OH)2= 2 взаимодействие с оксидами неметаллов NaOH+CO2= 3. Ba(OH)2+Na2SO4=
2.Заполните таблицу
|
Ключевые фразы:
NaOH |
H2C03 |
HNO2 |
Al 2(SO4)3 |
Задания
Третий лишний
BaCl2, H3PO4, H Cl
BaCl2, AlPO4, H Cl
Ba(OH)2, Al(OH)3, H Cl
Ba(OH)2, Al(OH)3, KOH
Вопросы
Какой элемент входит в состав всех оксидов?
Самый известный оксид?
Какой элемент входит в состав всех кислот?
Формула углекислого газа?
Формула гидроксидной группы?
Определение кислот с точки зрения электролитической диссоциации?
Формула поваренной соли.
Формула серной кислоты.
ЗАПОЛНИТЕ ТАБЛИЦУ
| Класс вещества | Название | Mr | W(%)O |
NaOH |
|
|
|
|
HCl |
|
|
|
|
NO2 |
|
|
|
|
Al 2(SO4)3 |
|
|
|
|
НАПИШИТЕ УРАВНЕНИЯ ДИССОЦИАЦИИ
BaCl2, H3PO4, H Cl, Ba(OH)2, Al(OH)3
ПРОДОЛЖИТЕ УХР
BaCl2 + H2SO4=
Al2 (SO4)3+ KOH=
ZnSO4+KOH=
BaCl2 + H3PO4=
КЛЮЧ
BaCl2 + H2SO4=Ba SO4+ HCl
Al2 (SO4)3+ 6KOH= 2Al(OH)3+ 3K2SO4
ZnSO4+2KOH= Zn(OH)2+ K2SO4
3BaCl2 + 2H3PO4=Ba3(PO4)2+ 6HCl
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации. Рассмотрим в свете теории электролитической диссоциации свойства веществ, которые в водных растворах проявляют свойства электролитов. [c.239]
Рассмотрим в свете теории электролитической диссоциации свойства веществ, которые в водных растворах проявляют свойства электролитов. [c.239]С точки зрения теории электролитической диссоциации, все общие характерные свойства кислот (кислый вкус, изменение цвета индикатора, взаимодействие с основаниями, основными оксидами, солями) обусловлены ионами водорода Н+, точнее ионами гидроксония НзО+. [c.127]
Кислотами с позиций теории электролитической диссоциации называются вещества, диссоциирующие в растворах с образованием ионов водорода, С точки зрения протонной теории кислот и оснований к кислотам относятся вещества, способные отдавать ион водорода, т, е. быть донорами прогонов,, Наиболее характерное химическое свойство кислот — их способность реагировать с основаниями (а также с основными и амфотерными оксидами) с образованием солей, например [c.31]
С точки зрения теории электролитической диссоциации свойства растворов оснований (мыльность на ощупь, изменение цвета индикаторов, взаимодействие с кислотами, кислотными оксидами, солями) обусловлены гидроксид-ионами ОН . [c.200]
[c.200]
В пользу такой трактовки реакции нейтрализации свидетельствует тот факт, что тепловой эффект ее для сильных кислот и сильных оснований практически один и тот же (57,3 кДж/моль). Однако введенное Аррениусом и Оствальдом определение кислот и оснований не является достаточно общим. Например, из формулы аммиака NHз, с точки зрения теории электролитической диссоциации, никак не следует, что это вещество способно проявлять основные свойства, особенно в отсутствие воды. Однако известно, что газообразный аммиак вступает в реакцию нейтрализации с газообразным хлористы.м водородом с образованием средней соли Nh5 1. [c.94]
Они-то и определяют характерные для кислот свойства разбавленные растворы кислот обладают кислым вкусом, изменяют цвет индикатора и при взаимодействии с основаниями образуют соли. С точки зрения теории электролитической диссоциации кислотами называются электролиты, образующие в водных растворах положительно заряженные ионы водорода (гидроксония) и не дающие никаких других положительных ионов.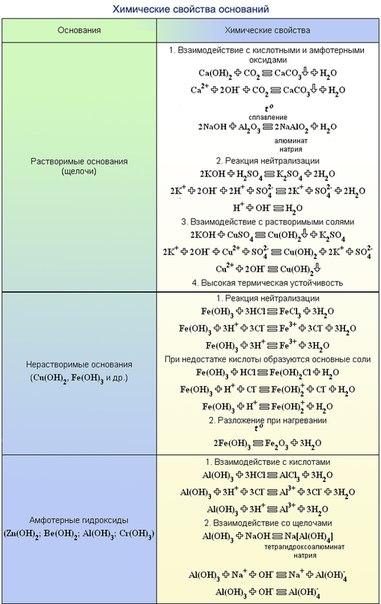 [c.73]
[c.73]
кислот, оснований и солей | Свойства кислот, оснований и солей
Кислоты, основания и соли влияют как на химию, так и на нашу повседневную жизнь. Их легко узнать по вкусу; то есть кислоты имеют кислый вкус, а основания горький вкус, а сами соли имеют соленый вкус.
Кислоты обычно содержатся во многих веществах, включая различные продукты питания, но их присутствие очень заметно во многих фруктах, например:
Помимо них, есть некоторые кислоты, которые широко используются в лаборатории, такие как соляная кислота, серная кислота и азотная кислота.
Обычно основания содержатся в бытовых чистящих средствах только для удаления жира с окон и полов, а также в мыле, зубной пасте, яичных белках, жидкостях для мытья посуды и бытовом аммиаке.
Наше тело содержит некоторые очень распространенные кислоты в желудке, такие как разбавленная соляная кислота, которая вызывает расстройство желудка. Когда содержимое нашего желудка становится слишком кислым, у нас обычно возникает расстройство желудка и ощущение жжения в желудке.
Когда содержимое нашего желудка становится слишком кислым, у нас обычно возникает расстройство желудка и ощущение жжения в желудке.
Кислоты и основания также регулируют некоторые метаболические процессы в организме человека посредством процесса равновесия. Укусы пчел имеют кислую природу, а укусы ос — щелочную природу.
Все кислоты при взаимодействии с металлами выделяют газообразный водород. Водород обычно является общим для всех кислот.
кислоты + металл = соль + водорода
Свойства кислот
HCl + H 2 O → H + + CL —
Zn + 2HCl → ZnCl₂ + H₂
При взаимодействии кислот с известняком (CaCO₃) образуется углекислый газ.
 Например, HCl реагирует с известняком с образованием угольной кислоты и хлорида кальция.
Например, HCl реагирует с известняком с образованием угольной кислоты и хлорида кальция.
CaCO₃ + 2HCl → CaCl₂ + CO₂ + H₂O
Кислоты подразделяются на органические и неорганические. Лучшим примером органической кислоты является уксусная кислота CH3COOH, а неорганическими кислотами являются те, которые производятся из минералов; например, серная кислота H₂SO₄, соляная кислота и т. д.
На основе количества ионов водорода кислоты можно классифицировать следующим образом:
1.+ }\] ионов на моль кислоты, \[ex — {H_3}P{O_4}\].
На основании способности отдавать ионы водорода кислоты можно классифицировать как:
Сильные кислоты: Эти кислоты полностью (100%) ионизируются в водных растворах. — \]
— \]
Слабые основания: Это основания, которые частично ионизированы, и равновесие в основном направлено в сторону реагентов, т.е.- \]
Свойства солей:
Соли образуются в результате соединения кислоты и основания в результате реакции нейтрализации.
Кислотная и основная природа солей обычно зависит от кислоты и основания, из которых соль образовалась в реакции нейтрализации.
Пример:
\[NaOH + HCl \to NaCl + {H_2}O\]
\[HCl{\text{}} + {\text{}}N{H_4}OH{\ текст {}} \to {\text{}}N{H_4}Cl{\text{}} + {\text{}}{H_2}O\]
\[C{H_3}COOH{\text{} } + {\text{}}NaOH{\text{}} \to {\text{}}C{H_3}COONa{\text{}} + {\text{}}{H_2}O\]
\ [C{H_3}COOH{\text{}} + {\text{}}N{H_4}OH{\text{}} \to {\text{}}C{H_3}COON{H_4} + {\text { }}{H_2}O\]
Наиболее известной или распространенной солью является хлорид натрия или поваренная соль, которая образуется в результате сочетания сильного основания гидроксида натрия и сильной соляной кислоты.
\[HC{l_{(водн.)}} + NaO{H_{(водн.)}} \to NaC{l_{(водн.)}} + {H_2}{O_{(водн.)}}\]
Другие примеры включают соль Эпсома \[(MgS{O_4})\], которая используется в солях для ванн, нитрат аммония \[(N{H_4}N{O_3})\] используется в качестве удобрения, и пищевая сода \[(NaHC {O_3})\] используется в кулинарии.
рН раствора соли также зависит от силы кислот и оснований, которые объединяются в реакции нейтрализации.
Добавление кислот или оснований в воду:
Процесс растворения кислоты или основания в воде является сильно экзотермическим.Поскольку при этой реакции обычно выделяется много тепла, необходимо соблюдать особую осторожность при смешивании концентрированных кислот с водой, особенно при смешивании с водой азотной или серной кислоты.
Правила: Кислоту следует добавлять в воду медленно при непрерывном и постоянном перемешивании, иначе смесь может выплеснуться, что в свою очередь вызовет ожоги.
Стеклянный контейнер также может разбиться из-за чрезмерного нагревания, что может привести к повреждению.- })\] на единицу объема, тем самым легко рассеивая эффект тепла.
Кислоты и основания — Викиверситет
В химии соединение может быть кислотой или основанием. Кислоты и основания играют очень важную роль в химии. Они описывают большой класс веществ. Понимание их свойств позволяет нам рационализировать закономерности, встречающиеся в химии.
Контрастные свойства кислот и щелочей[edit | править источник]
Вот список, который противопоставляет их свойства:
- Кислоты окрашивают синюю лакмусовую бумагу в красный цвет.Основания окрашивают красную лакмусовую бумажку в синий цвет.
- Кислоты выделяют ионы H+ (водорода) в воду; основания выделяют ионы ОН- (гидроксид) в воде.
- Кислоты обычно имеют кислый вкус из-за кислого иона H+; основания имеют горький вкус из-за иона ОН-; но они могут иметь и другие вкусы в зависимости от другой части молекулы.

- Основы обычно имеют мыльную природу.
- Кислоты разъедают активные металлы; Основания денатурируют белок.
- Кислоты имеют pH менее 7 ; Основания имеют pH выше 7
Сходные свойства кислот и щелочей[править | править источник]
Вот список свойств, общих как для кислот, так и для оснований.
- Когда вы растворяете кислоту или основание в воде, образуются ионы.Благодаря этому вода лучше проводит электричество.
- Чем сильнее кислота (или основание), тем больше образуется ионов, поэтому проводимость раствора увеличивается.
- Они оба могут проводить электричество.
- При взаимодействии кислоты с основанием образуется соль
- Они оба могут нести и делиться ионами
Кислоты реагируют с металлами группы 1 и 2 с образованием газообразного водорода.
Кислоты с pH менее 3 взорвутся при реакции с «Раствором Дойера».
Примеры обычных вещей, которые являются кислотными[edit | править источник]
- Цитрусовые (апельсины, лимоны, лаймы)
- Яблоки
- Ананасы
- Манго
- Вода и безалкогольные напитки (Двуокись углерода реагирует в воде с образованием угольной кислоты)
- Желудочные кислоты
- Уксус
- Жидкие очистители канализации, содержащие серную кислоту (Rooto)
- Мыло
- Зубная паста
- Любая кислая конфета
- Отбеливатель
Вещи, уникальные для Alkalis (основания)[edit | править источник]
Основания кажутся скользкими и мыльными, потому что они гидролизуют сложные эфиры жирных кислот кожи (реакция омыления).
Примеры обычных вещей, которые являются щелочами[edit | править источник]
- Мыло для рук
- Щелок
- Пищевая сода
- Отбеливатель
- Шпинат
- Средство для мытья окон
- Жало осы
- Очиститель канализации (Drano, Red Devil)
- Зубная паста
Единица: — 9 Кислота, основание и соль
Единица:- 9
Кислота, основание и соль
#.Ответьте на следующие вопросы: —
1. Дайте определение кислотам с примерами.
Ответ: Вещества, дающие ионы водорода (H + ) при растворении в воде и кислые при тестировании, известные как кислоты. Например: соляная кислота (HCl), серная кислота (H 2 SO 4 ), азотная кислота (HNO 3 ), угольная кислота (H 2 CO 3 ) и т. д.
2. Почему HCl является кислотой?
Почему HCl является кислотой?
Ответ: HCl называется кислотой, потому что она дает ионы водорода (H + ) при растворении в воде и является кислой в тесте
HC1 ⇋ H + +C1
3.H 2 SO 4 является кислотой, почему?
Ответ: h3SO4 называется кислотой, потому что при растворении в воде дает ионы Н + и при испытании является кислой.
H 2 SO 4 ⇋ 2 H + + SO 4
4. Напишите типы кислот в зависимости от их силы.
Ответ: В зависимости от силы кислоты делятся на два типа:
я. Сильная кислота
ii.Слабая кислота
5. Дайте определение сильной кислоте с примерами.
Ответ: Те кислоты, которые подвергаются почти полной ионизации в водном растворе с образованием большей концентрации ионов водорода (H + ), называются сильными кислотами. Например: соляная кислота (HCl), серная кислота (H 2 SO 4 ), азотная кислота (HNO 3 ) и т. д.
Например: соляная кислота (HCl), серная кислота (H 2 SO 4 ), азотная кислота (HNO 3 ) и т. д.
6. Напишите любые две характеристики сильных кислот.
Ответ: я . Они имеют низкое значение рН.
ii. Сильные кислоты имеют высокую степень ионизации и очень легко проводят электричество.
7. Дайте определение слабой кислоты с примерами.
Ответ: Те кислоты, которые производят меньшую концентрацию ионов водорода (H + ) из-за меньшей ионизации в водном растворе, называются слабыми кислотами. Например: уксусная кислота (CH 3 COOH), муравьиная кислота (HCOOH), угольная кислота (HCO 3 ) и т. д.
8. Напишите любые две характеристики слабых кислот.
Ответ:
я. Они имеют высокое значение pH.
III. Слабые кислоты имеют низкую степень ионизации. Поэтому они плохой проводник электричества.
9. Почему кислоты называют донорами протонов?
Ответ: Кислоты называются протонными, потому что при растворении в воде они дают ион H + или протон.
10. Лимонный сок имеет кислый вкус, почему?
Ответ: Лимонный сок имеет кислый тест, потому что он содержит ионы H + , которые дают кислый тест.
11. Различайте сильные и слабые кислоты.
Ответ: Различия между сильной кислотой и слабой кислотой заключаются в следующем:
| Сильная кислота | Слабая кислота |
| 1. Он подвергается почти полной ионизации для повышения концентрации ионов водорода. | 1. Он подвергается очень меньшей ионизации, что приводит к меньшей концентрации ионов водорода.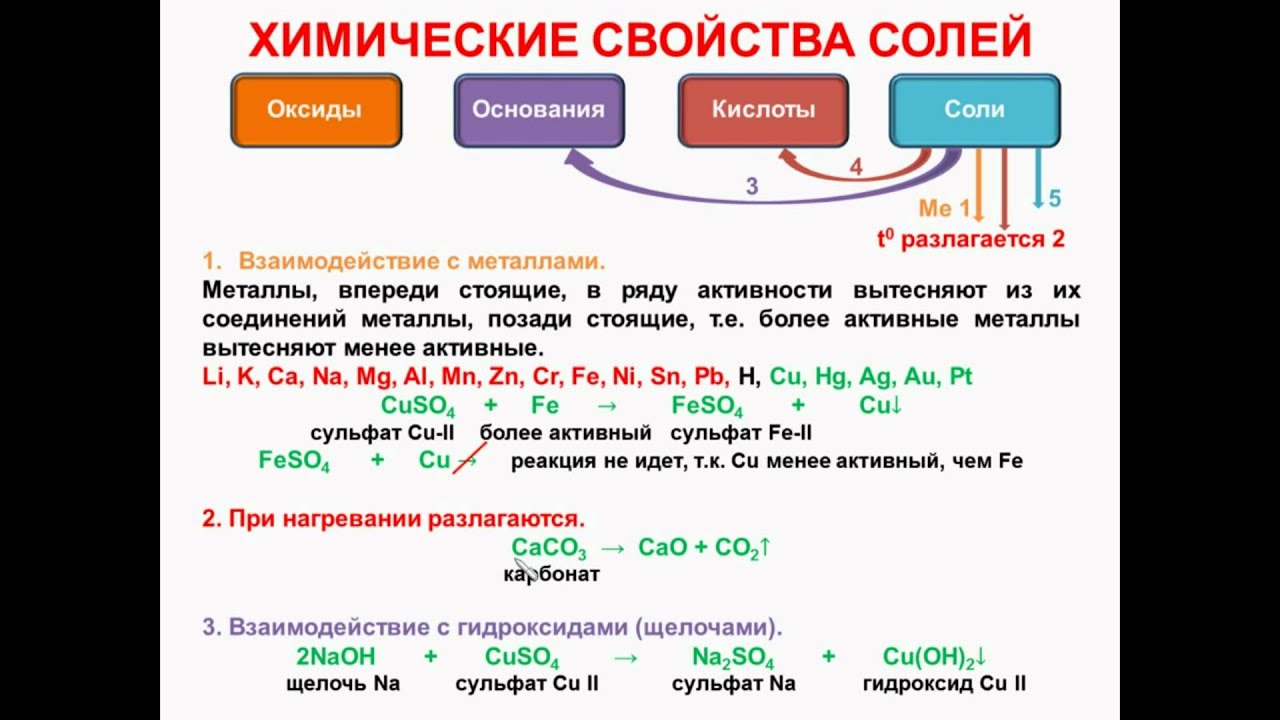 |
| 2.Они имеют меньшее значение pH. | 2. У них больше значение pH. |
| 3. Они хорошо проводят электричество. | 3. Плохо проводят электричество. |
| 4. Они более агрессивны по своей природе. | 4. Они менее агрессивны по своей природе. |
12. Дайте определение органической кислоте на примерах.
Ответ: Кислоты, получаемые из живых организмов и содержащие в своей молекулярной структуре углерод, называются органическими кислотами.Например: винная кислота, лимонная кислота, уксусная кислота, муравьиная кислота и т. д.
13. Дайте определение неорганической кислоты с примерами.
Ответ: Кислоты, полученные из минералов, обнаруженных в земной коре, и не содержащие в своей молекулярной структуре атомов углерода, называются неорганическими кислотами. Например: соляная кислота (HCl), серная кислота (H 2 SO 4 ), азотная кислота (HNO 3 ) и т.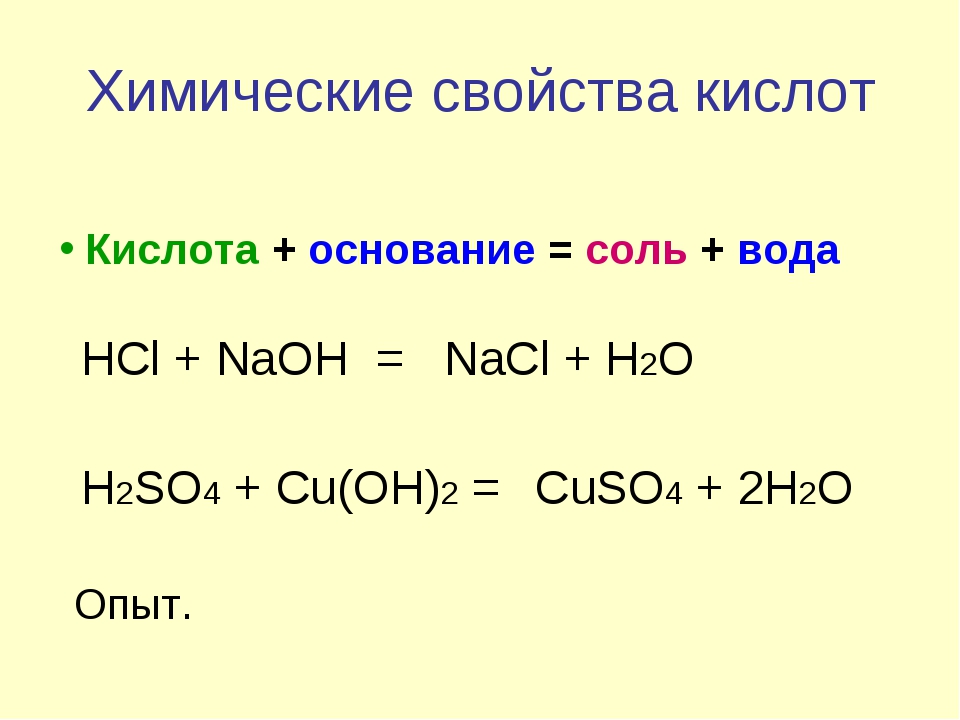 д.
д.
14. Различайте органическую кислоту и минеральную кислоту (неорганическую кислоту).
Ответ: Различия между органической и неорганической кислотой следующие:
| Органическая кислота | Минеральная кислота |
| 1. Их получают из живых организмов, то есть растений и животных. | 1. Их получают из минералов, присутствующих в земной коре. |
| 2. Это слабые кислоты. | 2. Большинство из них являются сильными кислотами. |
| 3.Они плохой проводник электричества. Пример: лимонная кислота | 3. Они являются плохими и хорошими проводниками электричества. Пример: Азотная кислота |
15. Напишите физические свойства кислот.
Ответ: Физические свойства кислоты следующие:
i. . Кислые на вкус.
. Кислые на вкус.
ii. Сильные кислоты вызывают коррозию.
III. Кислота превращает синюю лакмусовую бумажку в красную, светло-желтую окраску метилоранжа в красную,
фенолфталеин до бесцветного, а фиолетовый капустный сок до красного.
16. Запишите применение различных кислот.
Ответ:
| С.Н. | Кислоты | Использование |
| 1 | Серная кислота | Используется для химических удобрений, лекарств и моющих средств. |
| 2 | Соляная кислота | Используется для отбеливания в текстильной промышленности для изготовления клея. и т.д. |
| 3 | Угольная кислота | Используется в безалкогольных напитках, таких как газированная вода, кока-кола и т. д. |
| 4 | Уксусная кислота | Содержится в уксусе, который используется для ароматизации. |
| 5 | Винная кислота | Используется в хлебопекарной промышленности. |
| 6 | Борная кислота | Используется для промывания глаз и ран. |
| 7 | Азотная кислота | Производство химических удобрений, взрывчатых веществ и пластмасс. |
| 8 | Карболовая кислота | Используется как антисептик и убийца микробов. |
| 9 | Лимонная кислота | Используется как источник витамина С. |
| 10 | Аскорбиновая кислота | Используется при лечении обследования. |
17. Какая кислота содержится в желудке человека?
Ответ: Кислота содержит ионы водорода (H + ).Эти ионы стимулируют вкусовые рецепторы нашего языка, определяя кислый вкус. Итак, вкус кислоты кислый.
18. Почему HCl хранят в пластиковых или стеклянных бутылках?
Почему HCl хранят в пластиковых или стеклянных бутылках?
Ответ: HCl не реагирует с пластиком или стеклом. Так хранится в пластиковой или стеклянной бутылке
.19. Почему H 2 SO4 4 называют королем химической или королевской водой?
Ответ: Серная кислота (H 2 SO 4 ) широко используется в промышленности и химических лабораториях.
используется в промышленности и лабораториях. Поэтому его называют королем химикатов.
20. Определите базы с примерами.
Ответ: Оксиды и гидроксиды металлов, горькие на вкус и дающие ион гидроксила (ОН – ) при растворении в воде, называются основаниями. Например: оксид натрия (Na 2 O), оксид кальция (Cao), оксид железа (Fe 2 0 3 ) и оксид алюминия (Al 2 O 3 ),
21. NaOH называют основанием, почему?
NaOH называют основанием, почему?
Ответ: Гидроксид натрия (NaOH) имеет горький вкус и при растворении в воде дает гидроксильные ионы (OH). Итак, NaOH называется основанием.
NaOH ⇋ Na + + OH –
22. Вода считается не только основанием, но и кислотой. Почему?
Ответ: При разложении воды образуется ион водорода (H + ), подобный кислоте, и ион гидроксила (OH), подобный основанию. Итак, вода считается и кислотой, и основанием.Н 2 О ⇋ Н + + ОН –
23. Дайте определение щелочи на примере.
Ответ: Гидроксиды, образующиеся в результате реакции воды и водорастворимых оснований, являются щелочами. Например: гидроксид натрия (NaOH), гидроксид аммония (NH 4 OH), гидроксид кальция (Ca(OH) 2 ) и гидроксид калия (KOH)
24. Различайте основания и щелочи.
Различайте основания и щелочи.
Ответ: Различия между основаниями и щелочами следующие:
| Основания | Щелочи |
| 1.Все оксиды металлов называются основаниями. | 1. Водорастворимые оксиды и гидроксиды металлов называются щелочами. |
| 2. Они могут растворяться или не растворяться в воде. | 2. Растворимы в воде. |
| 3. Все основания не являются щелочами. | 3. Все щелочи являются основаниями. |
| 4. Они более или менее реактивны. | 4. Как правило, они более реактивны. |
25.Все щелочи являются основаниями, но не все основания являются щелочами, почему?
Ответ: Водорастворимые и нерастворимые оксиды металлов являются основаниями, но только водорастворимые оксиды металлов являются щелочами. Итак, все щелочи являются основаниями, но не все основания являются щелочами.
Итак, все щелочи являются основаниями, но не все основания являются щелочами.
26. Различайте кислоту и основание.
Ответ: Различия между кислотой и основанием следующие:
| Кислота | Основания |
| 1.Кислота дает ион водорода (H + ) при растворении в воде. | 1. Основание дает ион гидроксила (OH – ) при растворении в воде |
| 2. Кислые на вкус. | 2. Основы горьковатые на вкус. |
| 3. Кислоты окрашивают синюю лакмусовую бумажку в красную. | 3. Основания меняют красную лакмусовую бумажку на синюю. |
| 4. Значение рН кислот менее 7. | 4. Значение pH оснований больше 7. |
27. Почему основания (щелочи) горькие на вкус?
Ответ: Основание (щелочь) содержит ион OH – , который стимулирует вкусовые сосочки языка, которые обнаруживают горький вкус. Поэтому базы имеют горький вкус.
Поэтому базы имеют горький вкус.
28. Напишите любые два метода определения вкуса щелочи?
Ответ: Методы определения вкуса щелочей следующие:
я. Когда красную лакмусовую бумажку опускают в щелочь, она становится синей.
ii. При добавлении к щелочи нескольких капель фенолфталеина раствор окрашивается в розовый цвет.
29. Запишите типы оснований.
Ответ: Типы оснований следующие:
я. Сильные основания
ii. Слабые основания
30. Определите сильные основания с примерами.
Ответ: Те основания, которые подвергаются наиболее полной ионизации с образованием высокой концентрации гидроксида (ОН – ), называются сильными основаниями.Например: гидроксид натрия (NaOH), кальций (Ca(OH) 2 ) и гидроксид калия (KOH) и т. д.
31. Определите слабые основания с примерами.
Ответ: Те основания, которые не подвергаются почти полной ионизации с образованием меньшего количества гидроксила (ОН – ), называются слабыми основаниями. Например: гидроксид железа (Fe(OH) 3 ), гидроксид аммония (NH 4 OH), гидроксид меди (Cu(OH) 2 ) и т. д.
32.Запишите физические свойства оснований.
Ответ: Физические свойства оснований следующие:
я. Основы имеют горький вкус и ощущение мыльности при прикосновении.
ii. Они превратили лакмусовую бумагу в синюю, бесцветный фенолфталеин в розовый, метиловый оранжевый в светло-желтый, а фиолетовый капустный сок в зеленый.
33. Напишите любые четыре химических свойства оснований.
Ответ: Химические свойства оснований следующие:
34.Запишите употребление bases.
Ответ: Базы используются следующим образом:
С. Н. Н. | Основания | Использование |
| 1 | Сода каустическая (NaOH) | Используется для производства мыльной бумаги и вискозы. Он также используется при переработке нефтепродуктов. |
| 2 | Едкий кали (КОН) | Используется для приготовления мягкого мыла. |
| 3 | Гидроксид аммония (NH 4 OH) | Используется для изготовления химических удобрений. Он также используется в качестве лабораторного реагента. |
| 4 | Негашеная известь (CaO) | Используется для смягчения жесткой воды. |
| 5 | Гашеный (Ca(OH) 2 ) | Используется для побелки зданий. Его твердая форма используется для штукатурки и хлорки. |
| 6 | Гидроксид магния (Mg(OH) 2 ) | Используется как антацид для снижения повышенной кислотности желудка. |
| 7 | Гидроксид алюминия (Al(OH) 3 ) | Используется как антацид для снижения повышенной кислотности желудка. |
35. Какая основа используется в антацидах для снижения повышенной кислотности желудка?
Ans: Гидроксид магния (Mg(OH) 2 ) и гидроксид алюминия (Al(OH) 3 ) используются в качестве антацида для снижения повышенной кислотности желудка.
36. Напишите название щелочи, которая используется для балансировки pH желудка человека.
Ответ: Mg(OH) 2 используется для балансировки pH желудка человека.
37. Дайте определение соли на примерах.
Ответ: Соединение, образованное частичной или полной заменой одного или нескольких атомов водорода кислоты одним или несколькими атомами металлов или положительными радикалами.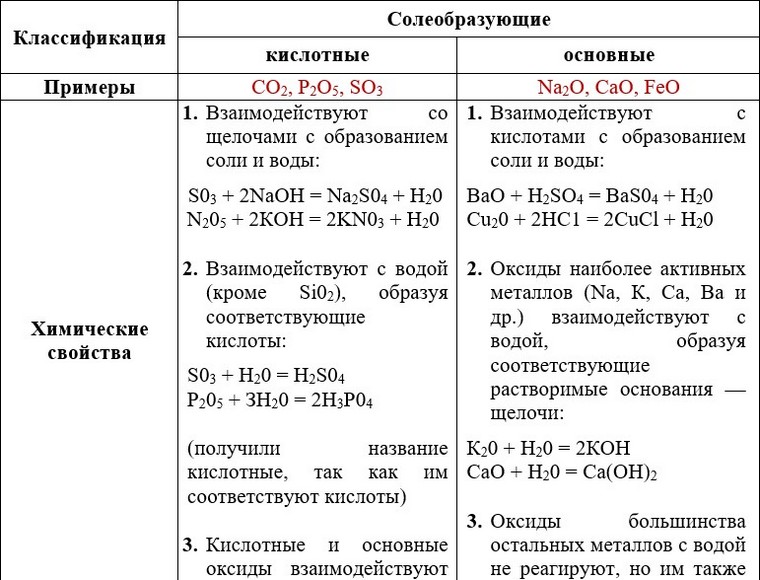 Например: хлорид натрия (NaCl), сульфат натрия (Na 2 SO 4 ), сульфат магния (MgSO 4 ) и т. д.ИЛИ, Соединение, которое образуется комбинацией положительных ионов основания и отрицательных ионов кислоты, называется солью.
Например: хлорид натрия (NaCl), сульфат натрия (Na 2 SO 4 ), сульфат магния (MgSO 4 ) и т. д.ИЛИ, Соединение, которое образуется комбинацией положительных ионов основания и отрицательных ионов кислоты, называется солью.
38. Запишите основные виды соли.
Ответ: В зависимости от значения pH различают три типа солей. Они следующие:
я. Нейтральная или обычная соль
ii. Кислая соль
III. Основная соль
39. Определите нормальную или нейтральную соль с примерами.
Ответ: Те соли, которые получают реакцией сильных кислот и сильных оснований или слабой кислоты и слабых оснований, называются нейтральными или нормальными солями.Для примеров: хлорид натрия (NaCl), сульфат калия (K 2 SO 4 ), нитрат калия (Kno 3 ), карбонат аммония ((NH 4 ) 2 CO 3 ), хлорид калия (KCl) и т. д.
д.
40. Раствор медного купороса имеет кислотную природу. Почему?
Ответ: Сульфат меди представляет собой соль, образованную сильной кислотой h3SO4 и слабым основанием Cu(OH)2.Таким образом, это кислая соль, и она проявляет свойства кислоты.
41. Определите кислые соли с примерами.
Ответ: Те соли, которые образуются в результате реакции сильных кислот и слабых оснований, называются кислыми солями. Например: бисульфат натрия (NaHSO 4 ), сульфат меди (CuSO 4 ), нитрат аммония (NHỌNO 3 ) и т. д.
42. NaHSO 4 является кислой солью, почему?
Ответ: NaHSO 4 содержит заменяемый атом водорода.Итак, это кислая соль.
43. Дайте определение основным солям на примерах.
Ответ: Те соли, которые образуются в результате реакции слабых кислот и сильных оснований, называются основными солями. Для примеров: карбонат натрия (Na 2 CO 3 3 ), Карбонат кальция [CA (HCO 3 ) 2 ), ацетат натрия (CH 3 Coona) и т.д.
44. Дайте определение гидратированных солей с примерами.
Ответ: Соли, содержащие определенные молекулы воды, называются гидратированными солями. Например: сульфат меди (CuSO 4 .7H 2 O), сульфат кальция (CaSO 4 .5H 2 2 2 и т.д. 45. Напишите любые два различия между кислыми и основными солями Ответ: Различия между кислыми и основными солями заключаются в следующем: 46. Напишите любые два различия между кислыми и нейтральными солями. Ответ: Различия между кислыми и нейтральными солями заключаются в следующем: нейтральная соль. 47. Напишите любые два различия между основными и нормальными солями. Ответ: Различия между основными солями и нормальными солями заключаются в следующем: 48. Напишите любые четыре физических свойства солей. Ответ: Физические свойства соли следующие: я. ii. Большинство солей растворимы в воде, но некоторые из них нерастворимы. III. Раствор соли может проводить электричество. iv. Нормальные соли нейтральны по отношению к индикатору, но некоторые из них могут быть либо кислыми, либо основными. 49. Напишите любые четыре способа получения солей. Ответ: Способы получения солей следующие: я. Прямым соединением элементов (металлов и неметаллов) Fe+S → FeS (сульфат железа) 2Na + CI 2 → 2NaCl (хлорид натрия) ii.При действии кислот на металл Zn + H 2 SO 4 → ZnSO 4 + H 2 Mg + 2HCl → MgCl 2 + H 2 iii. Реакцией кислоты на оксиды металлов. MgO + H 2 SO 4 → MgSO 4 + H 2 O FeO + 2HCl → FeCl 2 + H 2 O iv. NaOH + HCl → NaCl + H 2 O 2NaOH + H 2 SO 4 → Na 2 SO 4 + 2H 2 O в.При действии кислоты на карбонат металла CaCO 3 + 2HCl → CaCl 2 + H 2 O + CO 2 ZnCO 3 + 2HCl → ZnCl 2 + H 2 O + CO 2 50. Запишите основные области применения соли. Ответ: Соли используются следующим образом: 51. Нельзя долго хранить рассол в металлической посуде, почему? Ответ: Рассол содержит слабую кислоту, которая медленно вступает в реакцию с металлическими соединениями и вызывает их коррозию.Поэтому рассол нельзя долго хранить в металлической посуде. 52. Почему уксусная кислота является слабой кислотой? Ответ: Уксусная кислота является слабой кислотой с низкой степенью ионизации. Он производит низкую концентрацию ионов водорода в своем растворе. Итак, уксусная кислота является слабой кислотой. 53. Напишите сбалансированное химическое уравнение реакции между сильным основанием и слабой кислотой. Также упоминается тип соли, полученной в реакции. Ответ: Гидроксид натрия является сильным основанием, а угольная кислота является слабой кислотой и химическая реакция между ними есть, 2NaOH + H 2 CO 3 → 2 CO 3 + 0 H (Сильное основание) (Слабая кислота) (Основная соль) (Вода) (Na 2 CO 3 ). 54.Напишите сбалансированное химическое уравнение между сильной кислотой и слабым основанием. Также укажите тип соли, полученной в реакции. Ответ: Соляная кислота является сильной кислотой, а гидроксид аммония является слабым основанием, и реакция между ними: HCI + NH 4 OH → NH 4 Cl + H 2 O (Сильная кислота) (Слабое основание) (Кислотная соль) (Вода) (NH 4 Cl). 55. Что такое реакция нейтрализации? Напишите любые два его примера. Ответ: Химическая реакция, при которой кислота взаимодействует с основанием, оба из которых разрушают или нейтрализуют свои свойства из соли и воды, называется реакцией нейтрализации. Например: i..NaOH + HNO 3 → NaNO 3 + H 2 O ii. 56.Напишите любые четыре применения реакции нейтрализации. Ответ: Любые четыре применения реакции нейтрализации следующие: я. Люди используют гидроксид магния для снижения повышенной кислотности. ii. Фермеры используют известь для нейтрализации кислотности почвы. III. Медоносные пчелы и муравьи вводят в организм муравьиную кислоту. Его можно нейтрализовать с помощью мыла. iv. Уксусная кислота используется для нейтрализации щелочи, введенной шмелями в нашу кожу. 57. Сельскохозяйственная известь используется на кислых полях. Почему? Ответ: Сельскохозяйственная известь используется на кислых полях, потому что известь является щелочной по своей природе, она вступает в реакцию с кислой почвой, и кислотность почвы снижается. Учебники Английский Класс 7А Класс 7Б Класс 7 (объединенные А и В) Африкаанс Граад 7А Граад 7Б Graad 7 (A en B saam) Пособия для учителя Учебники Английский Класс 8А Класс 8Б Класс 8 (объединенные А и В) Африкаанс Граад 8А Граад 8Б Graad 8 (A en B saam) Пособия для учителей Учебники Английский Класс 9А Марка 9Б Класс 9 (объединенные А и В) Африкаанс Граад 9А Граад 9Б Graad 9 (A en B saam) Пособия для учителя Учебники Английский Класс 4А Класс 4Б Класс 4 (объединенные А и В) Африкаанс Граад 4А Граад 4Б Graad 4 (A en B saam) Пособия для учителей Учебники Английский Категория 5А Класс 5Б Категория 5 (объединенные А и В) Африкаанс Граад 5А Граад 5Б Graad 5 (A en B saam) Пособия для учителя Учебники Английский Класс 6А Класс 6Б Класс 6 (объединенные A и B) Африкаанс Граад 6А Граад 6Б Graad 6 (A en B saam) Пособия для учителя Эти книги не только бесплатны, но и имеют открытую лицензию! Один и тот же контент, но разные версии (фирменные или нет) имеют разные лицензии, как объяснено: Вам разрешается и поощряется свободное копирование этих версий. Узнайте здесь больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников. Эти версии одного и того же контента без торговой марки доступны для вас, чтобы вы могли делиться, адаптировать, преобразовывать, изменять или развивать их любым способом, при единственном требовании — отдать должное Сиявуле. … середина бумаги… … Буферы регулируют малейшее изменение уровня рН. Мы используем буферы, чтобы успокоить изжогу после того, как мы что-то съели. Заключение 2. Кислота — это соединение, которое при растворении в воде дает ион гидроксония [h4O]+ в качестве единственного положительно заряженного иона. HCl+h3O⇌h4O++Cl– h3SO4+2h3O⇌2h4O++SO42– Примечание: На практике кислоты растворяются в воде с образованием иона H+ или протона. Поскольку ион H+ или протон не могут существовать независимо в водном растворе, они связываются с молекулой воды, образуя ион гидроксония. HCl⇌h3OH++Cl– h3O+H+⇌h4O+(ион гидроксония) 2.2 Классификация кислот I. На основании своих источников. Кислоты в основном получают из природных источников.По одной основе их исходные кислоты бывают двух типов а) Минеральные кислоты б) Органические кислоты (а) Минеральные кислоты: Кислоты, которые получают из горных пород и минералов, называются минеральными кислотами. (б) Органические кислоты: Кислоты, присутствующие в животных и растениях, известны как органические кислоты. Список обычно используемых кислот вместе с их химической формулой и типичным применением приведен ниже Имя Тип Химическая формула Где найдено или использовано Угольная кислота Минеральная кислота H 2 CO 3 В безалкогольных напитках и шипучих продуктах, В желудке в виде желудочного сока, используется в кожевенной промышленности Азотная кислота Минеральная кислота HNO 3 Используется в производстве взрывчатых веществ. (ТНТ, Нитроглицерин) и удобрения (нитрат аммония, нитрат кальция, очистка Au, Ag.) Соляная кислота Минеральная кислота HC л При очистке поваренной соли, в текстильной промышленности в качестве отщепляющего агента, для приготовления царской водки смеси HC l и HNO 3 в соотношении 3 : 1 Серная кислота Минеральная кислота Н 2 SO 4 Обычно используется в автомобильных аккумуляторах, при производстве удобрений (сульфат аммония, суперфосфат), моющих средств и т. д., в красках, пластмассах, лекарствах, при производстве искусственного шелка, при переработке нефти. Фосфорная кислота Минеральная кислота Н 3 Заказ на поставку 4 Используется в антикоррозийных красках и удобрениях. Муравьиная кислота Органическая кислота HCOOH(CH 2 O 2 ) Содержится в укусах муравьев и пчел, используется при дублении кожи, в препаратах для лечения подагры суставов. Уксусная кислота Органическая кислота CH 3 COOH(C 2 H 4 O 2 ) Содержащийся в уксусе растворитель, используемый в производстве красок и духов Молочная кислота Органическая кислота CH 3 CH(OH)COOH(C 3 H 6 O 3 ) Отвечает за сквашивание молока в твороге. Бензойная кислота Органическая кислота С 6 Н 5 СООН Используется для консервации пищевых продуктов. Лимонная кислота Органическая кислота С 6 Н 8 О Присутствует в лимонах, апельсинах и цитрусовых. II. На основе присутствующих в них элементов Плавиковая кислота: HF III. HNO3+h3O⇌h4O++NO3–1[нитрат] HNO3+NaOH⇌h3O+NaNO3[ Нитрат натрия ] Примеры: HCl, HF, HBr, CH 3 COOH, HCOOH, HNO3 h3SO4+h3O⇌h4O++HSO4–1[Бисульфат] HSO4–1+h3O⇌h4O++SO42–[сульфат] (2) Двухосновная кислота образует два ряда солей. (i) Соль кислоты с одним заменяемым ионом H+. h3SO4+NaOH⟶h3O+NaHSO4 [гидросульфат натрия] (ii) Нормальная соль без заменяемого иона H+. h3SO4+2NaOH⟶2h3O+Na2SO4 [Сульфат натрия – нормальная соль Примеры: h3SO4, h3SO3, h3CO3, h3S, h4PO3, (COOH)2 (щавелевая кислота) и т. д. h4PO4+h3O⇌=h4O++h3PO4–1[Дигидрофосфат] h3PO4–1+h3O⇌h4O++HPO42–[ Моногидрофосфат] HPO42–+h3O⟶h4O++PO43–[ Фошат] (2) Трехосновная кислота образует три ряда солей. (i) Соль кислоты с двумя заменяемыми ионами H+. h4PO4+NaOH⟶h3O+Nah3PO4[ дигидрофосфат натрия ] (ii) Кислотная соль с одним заменяемым ионом H+. h4PO4+2NaOH⟶2h3O+Na2HPO4[ гидрофосфат натрия ] (iii) Нормальная соль без замещаемого иона водорода h4PO4+3NaOH⟶3h3O+Na3PO4[фосфат натрия] Примеры: h4PO4, h4PO5 IV. На базе гос. 1.Твердые вещества Фосфорная кислота H 3 PO 4 Борная кислота H 3 BO 3 2. Жидкости Соляная кислота HC л Серная кислота H 2 SO 4 Азотная кислота HNO 3 В. Степень ионизации кислоты (α) = Количество ионизированных молекул Общее количество молекул кислоты VI. На основе ионизации кислоты (i) Азотная кислота (ii) Соляная кислота (iii) Серная кислота. (ii) Сернистая кислота (iii) Сероводород (iv) Уксусная кислота (v) Муравьиная кислота (vi) Щавелевая кислота (vii) Синильная кислота Примеры: 1. Соляная кислота HC л Азотная кислота HNO 3 Углекислота H 2 CO 3 Сернистая кислота H 2 SO 3 2.Жидкости Серная кислота H 2 SO 4 Фосфорная кислота H 3 PO 4 2.3 Способы получения кислот Водород + Неметалл ⟶ Кислота h3+Cl2⟶ солнечный свет 2HCl h3+Br2→Электроразряд2HBr h3+I2vap → Электрический разряд 2HI h3+S (кипячение) →h3 S Примечание: Кислоты, содержащие водород и один неметалл, называются Hydracids. 2. Путем растворения оксидов неметаллов в воде Оксид неметалла + Вода → Кислота CO2+h3O⟶h3CO3SO2+h3O⟶h3SO3SO3+h3O⟶h3SO4P2O5+3h3O⟶2h4PO42NO2+h3O⟶HNO2+HNO3 Примечание: Кислоты, содержащие водород, один неметалл и кислород, называются оксикислотами. 3. При нагревании солей более летучей кислоты с менее летучей кислотой: Соль более летучей кислоты + менее летучая → кислота Соль + более летучая кислота 2NaNO3+h3SO4 (конц.) ⟶ΔNa2SO4+2HNO32NaCl+h3SO4(конц.)⟶ΔNa2SO4+2HCl 4.Окислением неметаллов оксикислотами: (i) S+6HNO3⟶∆h3SO4+2h3O+6NO2 (ii) P+5HNO3⟶∆h4PO4+2h3O+5NO2 (iii) 2P+5h3SO4⟶∆2h4PO4+2h3O+5SO2 2.4 Общие свойства кислот (1) Вкус: Кислоты имеют резкий кислый вкус. Оксид металла + Минеральная кислота (разбавленная) → Соль металла + H3O Na2O+ 2HNO3 (разбавленный) s → 2NaNO3+h3OCuO+h3SO4 → CuSO4+h3O (6) Действие с гидроксидами металлов: Все гидроксиды металлов реагируют с разбавленными минеральными кислотами с образованием только соответствующих солей и воды. Гидроксид металла + Минеральная кислота (разбавленная) → Соль металла + вода NaOH +HCl (ди) ⟶ NaCl+h3OCu(OH)2 + h3SO4 (дил) (7) Действие с карбонатами металлов или гидрокарбонатами металлов: Все карбонаты металлов или гидрокарбонаты металлов реагируют с разбавленными минеральными кислотами с образованием соответствующих солей, воды и двуокиси углерода. Карбонат металла / + Кислота (разбавленная) → Соль металла + Вода + CO2(г) Гидрокарбонат металла K2CO3 + 2HCL (DIL) ⟶ 2KCL + H3O + CO2KCO3 + HNO3 (DIL) ⟶ KNO3 + H3O + CO2CUCO3 + H3SO4 (DI) ⟶ CUSO4 + H3O + CO2 (8) Действие с сульфитами металлов/гидросульфитами металлов: Все сульфиты металлов или гидросульфиты металлов реагируют с разбавленными минеральными кислотами с образованием соответствующих солей, воды и газообразного диоксида серы. Сульфит металла/ + Кислота (разбавленная) → Соль металла + вода + SO2 (г) K2SO3 + 2HCL (DIL) ⟶ 2KCL + H3O + SO2KHSO3 + HCl (DIL) ⟶ KCL + H3O + SO2CUSO3 + H3SO4 (DIL) ⟶ CUSO4 + H3O + SO2 (9) Действие с сульфидами металлов/гидросульфидами металлов: Все сульфиды металлов или гидросульфиды металлов реагируют с разбавленными минеральными кислотами с образованием соответствующих солей и сероводорода. K2 S + 2HCL (DIL) ⟶ 2KCL + H3 SKHS + HCl (DII) ⟶ KCL + H3 SCUS + H3SO4 (DIL) ⟶ CUSO4 + H3 S 10) Взаимодействие с активными металлами: Минеральные кислоты (разбавленные) реагируют с активными металлами с образованием соответствующих солей и газообразного водорода. 2AL + 6HCL (DIL) ⟶ 2ALCL3 + 3H3FE + H3SO4 (DIL) ⟶ FESO4 + H3 2.5 Использование кислот Кислоты Использовать 1. Уксусная кислота 2.Лимонная кислота 3. Винная кислота 4. Щавелевая кислота 5. Углекислота 6. Борная кислота Кулинария Консервирование пищевых продуктов; безалкогольные напитки Разрыхлитель Средство для удаления чернил Безалкогольные напитки Промывание глаз 2.6 Основания Щелочь: Основание, растворимое в воде, называется щелочью. (i) Оксид натрия Na2O+h3O⇌2Na++2OH– (ii) Оксид калия K2O+h3O⇌2 K++2OH– (iii) Оксид кальция CaO+h3O⇌Ca+2+2OH– (iv) Гидроксид натрия NaOH⇌Na++OH– (iv) Гидроксид натрия KOH⇌K++OH (vi) Гидроксид кальция Ca(OH)2⇌Ca+2+2OH– 2.7 Классификация кислот/щелочей II На основании степени диссоциации (i) Гидроксид калия KOH⇌K++OH– (ii) Гидроксид натрия NaOH⇌Na++OH– (ii) Слабые основания: Щелочи, которые подвергаются частичной диссоциации в водном растворе с образованием низких концентраций гидроксильных ионов, называются слабыми щелочами. (i) Гидроксид аммония Nh5OH⇌Nh5++OH– (ii) Гидроксид кальция Ca(OH)2⇌Ca+2+2OH– (iii) Гидроксид магния Mg(OH)2⇌Mg+2+2OH– III.На основе концентрации LiOH⇌Li++OH– ; NaOH⇌Na++OH– Двухосновные кислоты: Гидроксид магния Mg(OH)2⇌Mg+2+2OH– Двухосновные кислоты: гидроксид железа – Fe (OH)2 – Cu(OH)2 Трикислотные основания: Основания, одна молекула которых полностью реагирует с тремя ионами H+ (водн.) с образованием соли и воды, так как единственные продукты называются трикислотными основаниями. 2.8 Общие методы получения оснований или щелочей Металл + кислород → Оксид металла [основной оксид] 4K + O2 → 2K2O 2Cu + O2 →∆ 2CuO 2. Воздействием воды/пара на активные металлы Металл + вода / пар → Основной гидроксид / оксид + H3 (G) 2NA + 2H3O → 2NAOH + H33FE + 4H3O → Δ Fe3O4 + 4H3 3.Растворением оксидов высокоактивных металлов в воде Оксид активного металла + Вода ⟶ Раствор щелочи Na2O+h3O→2NaOHCaO+h3O→CaOH3 4. Растворением газообразного аммиака в воде Nh4 + h3O ⟶ Nh5OH Раствор растворимой соли. + Раствор едкой щелочи. → Нерастворимое металлическое + солевое основание 5. При сильном нагревании карбонатов металлов [исключение: Na2CO3 ; K2CO3] Карбонат металла→теплоОсновной оксид+CO2gCaCO3→теплоCaO+CO2CuCO3→теплоCuO+CO2 6. Нитрат металла ⟶ тепло Основной оксид + Двуокись азота +O2(г) 2CaNO32 ⟶ нагрев 2CaO + 4NO2 + O2 2CuNO32⟶ нагрев 2CuO + 4NO2+ O2 2.9 Общие свойства растворимых оснований или щелочей Zn(s)+2NaOH(aq) ⟶ Na2ZnO2(aq) цинкат натрия + h3( g) Sn(т)+2NaOH(водн.) ⟶ Na2SnO2(водн.)Станнит натрия + h3(г) 2Al(s)+2NaOH+2h3O ⟶ 2NaAlO2(aq)Метаалюминат натрия + 3h3( г) 2. Действие с оксидами неметаллов 2NaOH(водн.)+CO2(г)⟶Na3CO3(водн.)+h3O(л)Ca(OH)2(тв)+SO2г⟶CaSO3(водн.)+h3O(л)Ca(OH)2(тв)+ CO2(г)⟶CaCO3(т)+h3O(т) 3.Действие с кислотами: Щелочной раствор + Кислота → Соль + Вода Ca(OH)2 + 2HNO3 ⟶ CaNO32 + h3ONh5OH + HCl ⟶ Nh5Cl + H3O 9000 5. Соль аммония + Щелочи → Соль металлов + вода + аммиак 2Nh5Cl + Ca(OH)2 ⟶ CaCl2+ h3O+Nh4Nh52SO4 + 2KOH ⟶ K2SO4+ 2h3O+Nh4 2.10 Использование некоторых обычных щелочей Имя Коммерческий Наименование Химическая Формула Использование Гидроксид натрия Каустическая сода NaOH В производстве мыла, бумаги, целлюлозы, вискозы, при переработке нефти и т. д. Гидроксид калия Едкий кали КОН В щелочных аккумуляторных батареях, производстве мыла, абсорбции CO 2 газа и т. Гидроксид кальция Гашеная известь Са(ОН) 2 При производстве хлорки для смягчения жесткой воды и т.п. Гидроксид магния Молоко магнезии Мг(ОН) 2 В качестве антацида для снижения кислотности желудка Гидроксид алюминия Ал(ОН) 3 В качестве пенообразователя в огнетушителях. Гидроксид аммония НХ 4 ОХ Для удаления жирных пятен с тканей и очистки оконных стекол. Нейтрализация: Химическая реакция, в которой ионы гидроксония [H+ (водные) ионы] кислоты и гидроксильные (OH–) ионы основания объединяются с образованием неионизированных молекул воды, называется нейтрализацией. Кислота + Основание ⟶ Соль + Вода HNO3+KOH⟶KNO3+h3O 2.11 Проводящая природа растворов кислот и оснований Лампа не будет светиться, если в стакане находится раствор глюкозы (C6h22O6) или этилового спирта (C2H6O). Это означает, что оба они не будут давать никаких ионов в растворе. Кислоты Основания 1.Кислый на вкус. 2. Изменение цвета индикаторов и др. Лакмус из синего становится красным, фенолфталеин остается бесцветным. 3. Показывает электролитическую проводимость в водном растворе. 4. Кислотные свойства исчезают при взаимодействии с основаниями (нейтрализация). 5. Кислоты разлагают карбонатные соли. 1. Горький на вкус. 2. Изменение цвета индикаторов, например, лакмус из красного в синий, фенолфталеин из бесцветного в розовый. 3. Проявляет электролитическую проводимость в водных растворах. 4. Основные свойства исчезают при взаимодействии с кислотами (Нейтрализация). 5. Отсутствие разложения карбонатных солей основаниями. 2.12 Роль воды в ионизации кислот и оснований отрицательный заряд (δ–) на атоме кислорода и частичный положительный заряд (δ+) на атомах водорода.Они будут пытаться образовать своего рода оболочку вокруг атомов водорода, а также атомов хлора, присутствующих в кислоте, и таким образом способствовать их разделению в виде ионов. Эти ионы называются гидратированными ионами. HCl(г)+вода⟶H+(водн.)+Clгидратированные ионыводн. Через эти ионы проходит электрический ток. То же самое относится и к другим кислотам, а также к основаниям. Таким образом, мы заключаем, что кислоты – 2.13 Нейтрализация Кислота + → + Примечание: H + + H3O → H4O + HX + H3O → H4O + + X-yous Hydronium Hydronium Hyalody Hyalide Ion Точно так же основания также диссоциируют в водных растворах. Однако не все основания растворяются в воде.Основания, растворяющиеся в воде, называются щелочами. Таким образом, можно сказать, что «не все основания являются щелочами, но все щелочи являются основаниями». Щелочи растворяются в воде и образуют ионы ОН–. KOH(s)⟶ Watr K+(водн.)+OH–(водн.) Эти гидроксид-ионы (ионы ОН-) могут свободно существовать в воде или водном растворе. Эти ионы водорода (H+) и гидроксила (OH-) реагируют друг с другом в реакциях нейтрализации с образованием воды. Следовательно, реакции нейтрализации с точки зрения ионов водорода и гидроксида можно представить как: HX + M OH → MX + HOH (или) H+ + OH–h3O(l) Применение нейтрализации (ii) Жала пчел и муравьев содержат муравьиную кислоту. Его разъедающее и ядовитое действие можно нейтрализовать, натирая мылом, содержащим NaOH (щелочь). III. Метиловый апельсин Образец Синий лакмус раствор Раствор красного лакмуса Фенолфталеин Метиловый оранжевый HCl Меняется на красный Без изменения цвета Остается бесцветным Меняется на красный HNO3 Меняется на красный Без изменения цвета Остается бесцветным Меняется на красный NaOH Без изменения цвета Изменения в синий цвет Меняется на светло-розовый Без изменения цвета КОН Без изменения цвета Изменения в синий цвет Меняется на светло-розовый Без изменения цвета 2. i) рН раствора можно определить как отрицательный логарифм концентрации ионов Н+. pH=log1H+ Если [H+] = 10–м M, то pH=–logH–=–log10–m=[–(–m)]=m ∵logaa–n=–n (i) Аналогичным образом, pOH раствора можно определить как отрицательный логарифм концентрации ионов OH–. (ii) pOH раствора также определяется как логарифм обратной величины концентрации ионов OH–. pOH=log1OH– Примечание: pH + pOH = 14 Диапазон pH для обычных жидкостей Вещества Диапазон pH Вещества Диапазон pH 1) Желудочный сок 1.0 – 3,0 10) Молоко 6,3 – 6,6 2) Кровь (человеческая) 7,3 – 7,5 11) Помидор 4,0 3) Морская вода 8. 12) Черный кофе 5,0 4) Слюна (человеческая) 6,5 – 7,5 13) Молоко магнезии 10,5 5) Слезы 7.4 14) Яблоки 2,9 – 3,3 6) Моча (человеческая) 4,8 – 8,4 15) Уксус 2,4 – 3,4 7) Дождевая вода 6.0 16) Газированная вода Менее 7,0 8) Безалкогольные напитки 2,0 – 4,0 17) Тонкий кишечник (человек) Приблизительно 8. 9) Лимоны 2,2 – 2,4 Природа раствора и диапазон pH а) Если рН < 7, раствор кислый. Кроме того, если диапазон pH составляет pH=0 → Кислотный7Нейтральный→Основной14 Влияние температуры на pH: Повышение температуры снижает pH водного раствора. (ii) Изменение pH приводит к разрушению зубов 2.16 Соли Ca(OH)+h3SO4→CaSO4+h3O2Ca(OH)2+4HNO3→2CaNO32+2h3ONaOH+HCl→NaCl+h3O Классификация солей (ii) Кислые соли (ii) Сырье для химических соединений Na2CO3 + 10h3O ⟶ Na2CO3·10h3OНатрий карбонат (Вода) (Стиральная сода) (b) Применение 2Nh4(г)+h3O(ж)+CO2(г)⟶Nh52CO3(вод)Nh52CO3(вод)+2NaCI(вод)⟶Na2CO3(вод)+2Nh5Cl(вод)Na2CO3(вод)+h3O(ж)+CO2 (г)⟶2NaHCO3(т) (b) Свойства 2NaHCO3(т)→Na2CO3(т)+CO2(г)+h3O (c) Применение (ii) Он в основном используется при лечении разлития кислоты и в медицине в качестве бикарбоната соды, который действует как антацид. 2NaHCO3(водн.)+h4SO4(водн.)⟶Na2SO4(водн.)+2h3O(л)+2CO2(г) Отбеливающий порошок Ca(OH)2(aq)+Cl2 ⟶313 K Ca(OCl)Cl(s)+h3O(g) гашеная известь Применение 2CaSO4·2h3O⟶373 KCaSO42·h3O+3h3O (OR) Гипс Гипс 2CaSO4·2h3O ⟶373 KCaSO4.1/2h3O+3/4h3O Гипс Гипс Температура тщательно контролируется, так как при более высокой температуре гипс полностью обезвоживается. Свойства обезвоженного гипса совершенно иные, чем у парижского гипса. (i) Действие с водой: При растворении в воде кристаллизуется и образует гипс CaSO4·12h3O+32h3O⟶CaSO4·2h3O (c) Применение CUSO4 · 5H3O ⟶ CUSO4 + 5H3HYDRADED Сульфат сульфата меди безводного сульфата меди) Многие основы и кислоты, такие как малиновая кислота в яблоках, соляная кислота в желудочных соках, винная кислота в тамаринде, молочная кислота в молоке и молочных продуктах, лимонная кислота во фруктах, таких как лимон, апельсин и т. д., встречаются в природе. Аналогичным образом, многие основания встречаются в природе, например, известковая вода. Кроме того, в нашей повседневной жизни используются различные разновидности кислот, например, пищевая сода для приготовления торта и других предметов, стиральная сода для чистки, борная кислота для стирки, уксус или уксусная кислота на кухне и т. Кислота- Кислота определяется как вещество, которое нейтрализует основания, окрашивает лакмус в красный цвет и имеет кислый вкус. Основание- Вещество называется основанием, если оно нейтрализует кислоты или окрашивает красную лакмусовую бумагу в синий цвет и если его водный раствор имеет горький вкус. Соль- Соль представляет собой нейтральное вещество, соленое на вкус, водный раствор которого не влияет на лакмус. Слово «кислота» происходит от латинского слова «acere» или «acidus», что означает «кислый». Натуральные кислоты: Эти типы кислот получают из природных источников, таких как продукты животного происхождения и фрукты. Например. винная, лимонная, молочная кислоты и т. д. Минеральные кислоты: Кислоты, которые получают из минералов и обычно используют в лабораториях, называются минеральными кислотами. Например, серная кислота (H 2 SO 4 ), соляная кислота (HCl) и азотная кислота (HNO 3 ) и т. д. Моноосновная кислота – Кислоты, образующие 1 моль ионов H+ на моль кислоты, экс-HCl Двухосновная кислота – Кислоты, образующие 2 моля ионов H+ на моль кислоты, ex-H 2 SO 4 Трипротонная кислота – Кислоты, образующие 3 моля ионов H+ на моль кислоты, ex-H 3 PO 4 Сильные кислоты — Кислоты, которые полностью ионизируются в водных растворах, называются сильными кислотами. Слабые кислоты- Слабые кислоты в равновесном состоянии лишь частично ионизированы в растворе. В равновесном состоянии концентрация иона водорода меньше и молекулы кислоты присутствуют в значительном количестве, например, HF, CH 3 COOH HCl + H 2 O → H + + Cl — Zn + 2HCl → ZnCl 2 + H 2 CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O Основы мыльные на ощупь и горькие на вкус. Основание в их водном растворе образует ион гидроксила (ОН–). Красная лакмусовая бумажка становится синей при контакте с основанием. Сильные основания- Это основания, которые образуют гидроксид-ионы при полной ионизации в воде, например, гидроксид натрия NaOH(s) ⇔ Na+(aq)+OH-(aq ) NH 3 (водн.)+H 2 O(л) ⇔ NH 4 +(водн. Кислые соли Основные соли 1.  Соли, образующиеся при взаимодействии сильных кислот и слабых оснований, называются кислыми солями.
Соли, образующиеся при взаимодействии сильных кислот и слабых оснований, называются кислыми солями. 1. Те соли, которые образуются при взаимодействии слабых кислот и сильных оснований, называются основными солями 2. Значение pH кислой соли меньше 7. 2. Значение pH основной соли больше 7. Кислые соли Нейтральные соли 1.Соли, которые образуются при взаимодействии сильных кислот и слабых оснований, называются кислыми солями. 1. Соли, которые образуются при взаимодействии сильных кислот и сильных оснований или слабой кислоты и слабых оснований, называются 2.  Значение pH кислой соли менее 7.
Значение pH кислой соли менее 7. 2. Значение pH нейтральной соли равно 7. Основные соли Нормальные соли 1. Соли, образующиеся при взаимодействии слабых кислот и сильных оснований, называются основными солями. 1. Соли, которые получают реакцией сильных кислот и сильных оснований или слабой кислоты и слабых оснований, называются нормальными солями. 2.Значение pH основной соли больше 7. 2. Значение pH обычной соли равно 7.  Соли на вкус соленые, но некоторые горькие или менее вкусные.
Соли на вкус соленые, но некоторые горькие или менее вкусные.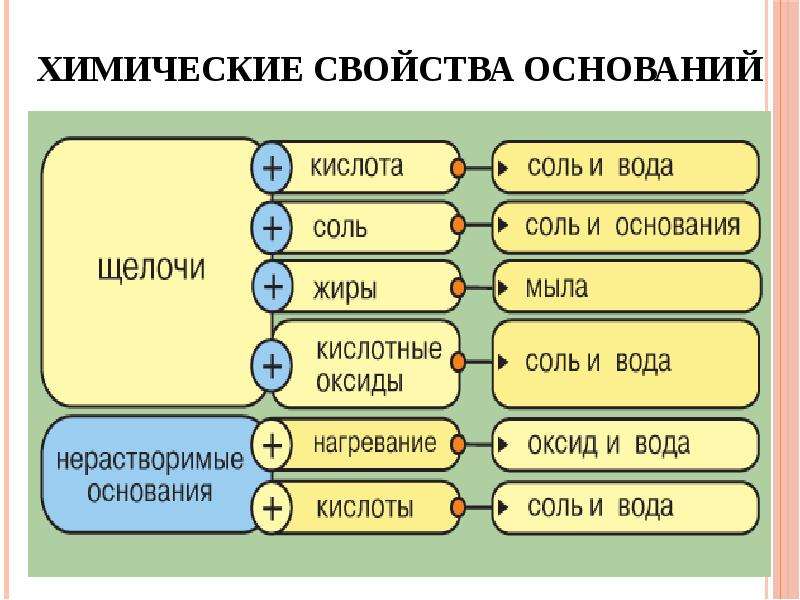 Путем нейтрализации кислоты и гидроксида (основания)
Путем нейтрализации кислоты и гидроксида (основания) С.Н. Соли Использование 1 Хлорид натрия (NaCl). Используется для консервации быстро разлагающихся вещей в качестве консерванта. 2 Карбонат натрия (NaCO 3 ) Используется для производства мыла, моющих средств и очков. 
3 Сульфат меди (CuSO 4 .5h3O) Используется в гальванике. 4 Бикарбонат натрия (NaHCO 3 ) Используется при подготовке банковской силы. 5 нитрат серебра (AgNO 3 ) Используется в качестве лабораторного реагента. 6 Бромид серебра (AgBr) Используется в фотографии. 7 Сульфат кальция (CaSO 4 .7H 2 O) Используется для гипсования сломанных костей тела, а также для изготовления керамики и цемента. 8 Хлорид аммония NH 4 CI Используется в качестве хорошего электролита в сухих элементах. 9 Сульфат железа (CaSO 4 .7H 2 O) Применяется в медицине при железодефицитной анемии. 10 Нитрат калия (KNO 3 ) Используется в качестве удобрения. 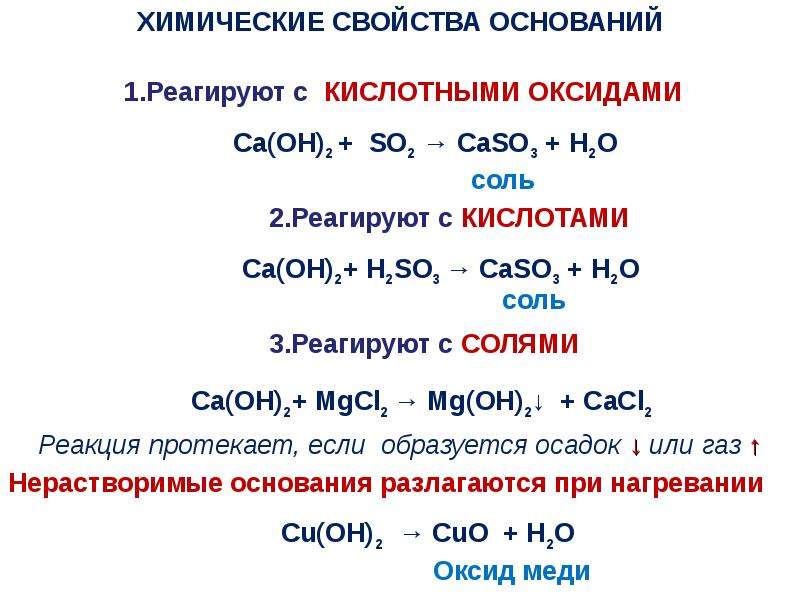

 Ca (OH) 2 + 2HCl → CaCl 2 + 2H 2 O
Ca (OH) 2 + 2HCl → CaCl 2 + 2H 2 O открытых учебников | Сиявула
Математика
Наука
Лицензирование нашей книги
CC-BY-ND (фирменные версии)
 Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный. CC-BY (версии без торговой марки)
 Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported. Кислоты, Основания, Соли — 1614 Слов
Введение
Мир, в котором мы живем, полон химических веществ и элементов, просто мы их просто не замечаем.В повседневной жизни есть кислоты, основания и соли. Некоторые могут не знать, как их увидеть или даже что они собой представляют. Вы можете добавить пищевую соду в уксус, чтобы посмотреть, что произойдет потом. Мы солим нашу еду, чтобы сделать ее вкуснее. В каждом океане на земле есть соль. Вокруг нас так много кислот, оснований и солей, а мы их просто не видим. Мы едим нейтрализатор, когда у нас изжога из-за кислоты в желудке. Наука вокруг нас.
Наблюдаемые свойства кислот
Кислота — это вещество, которое разъедает вещи и придает вещам кислый вкус при сгорании.Слово «кислота» происходит от латинского слова «acidus», что означает «кислый». Кислота, которая может проводить электричество, называется электролитом. Когда кислота проводит электричество, электроны проходят через каждый атом и так далее. Чтобы проверить, является ли вещество кислотой, используйте лакмусовую бумажку. Лакмусовая бумажка может идентифицировать кислоты. При производстве лакмусовой бумаги, содержащей древесную целлюлозу, используется химическое вещество, которое извлекают из некоторых других лишайников. Если вещество представляет собой кислоту, то синяя лакмусовая бумажка станет красной.Также кислоту можно определить по ее химическим свойствам. Кислоты реагируют с металлами с образованием соли и водорода.
Когда кислота проводит электричество, электроны проходят через каждый атом и так далее. Чтобы проверить, является ли вещество кислотой, используйте лакмусовую бумажку. Лакмусовая бумажка может идентифицировать кислоты. При производстве лакмусовой бумаги, содержащей древесную целлюлозу, используется химическое вещество, которое извлекают из некоторых других лишайников. Если вещество представляет собой кислоту, то синяя лакмусовая бумажка станет красной.Также кислоту можно определить по ее химическим свойствам. Кислоты реагируют с металлами с образованием соли и водорода.
Наблюдаемые свойства оснований
Подобно кислотам, основания можно идентифицировать по их физическим и химическим свойствам. Если кислоты на вкус кислые, то основания на вкус горькие. При прикосновении к основанию оно кажется мыльным и скользким. Реакция жирных кислот и основания делает основание скользким. Идентифицировать основание — это почти то же самое, что лакмусовой бумажкой идентифицировать кислоту.Красная лакмусовая бумажка синяя, на т. ..
..
Некоторые из самых сложных вещей в жизни являются самыми простыми. Вы должны сначала понять, что это за вещь. Кислоты, основания и соли просты, но кажутся такими трудными для понимания. Кислоты и основания — это просто приобретение и потеря протона. Есть три разные модели, которые помогают нам понять, что такое кислоты и основания, без этих трех моделей мы не смогли бы понять, что они из себя представляют.Бог создает вещи, чтобы узнать о них и понять их, чтобы мы могли приблизиться к Нему. Бог создал вселенную, чтобы Он мог быть прославлен. Бог хочет, чтобы мы узнали о Его творении и поклонялись Ему, а не творению. Люди думают, что вселенная возникла случайно, но как это могло произойти случайно, этого не могло быть. Кислоты, основания и соли. Материал для практических занятий
 1 Кислоты
1 Кислоты 



1. Гидрациды (бинарные кислоты) : Гидрациды содержат водород и неметаллический элемент, кроме кислорода.
Примеры:
Соляная кислота: HCl
Бромистоводородная кислота: HBr
Йодоводородная кислота: HI
Сероводород: h3S
(Сероводородная кислота)
неметаллический элемент.
Примеры:
h3SO4 (серная кислота), HNO 3 (азотная кислота), H 3 PO 4 (фосфорная кислота),
h3SO3 (серная кислота).
HC l O (хлорноватистая кислота), HClO 2 (хлористая кислота)
HClO3 (хлористая кислота), HC l O 4 (хлорная кислота)
h3CO3 (угольная кислота), CH 3003 900 (уксусная кислота) На основе основности кислоты
На основе основности кислоты
Основность: Число ионов гидроксония [H+(aq)], которое может быть высвобождено одной молекулой кислоты при полной ионизации, называется ее основностью.На основании основности кислоты можно классифицировать следующим образом:
(a) Одноосновные кислоты:
Определение: Когда одна молекула кислоты при полной ионизации образует один ион гидроксония [H+(aq)], тогда кислоту называют одноосновной.
Характеристики одноосновной кислоты:
(1) Одноосновная кислота ионизируется в один этап в водном растворе.
(2) Одноосновная кислота образует только простую соль или нормальную соль
(b) Двухосновные кислоты:
Определение: Когда одна молекула кислоты при полной ионизации образует два иона гидроксония [2H+(aq) ], то говорят, что кислота является двухосновной кислотой.
Характеристики двухосновной кислоты:
(1) Двухосновная кислота ионизируется в два этапа в водном растворе.
(c) Трехосновные кислоты:
Определение: Когда одна молекула кислоты при полной ионизации образует три иона гидроксония [3H+(aq)], тогда говорят, что кислота является трехосновной кислотой.
Характеристики трехосновной кислоты:
(1) Трехосновная кислота ионизируется в три этапа в водном растворе.
 На основе силы кислоты
На основе силы кислоты
Кислоты подвергаются ионизации в водном растворе. Степень ионизации обозначается .
Математически,
Сильные кислоты: Кислоты, которые подвергаются почти полной ионизации в водном растворе, в результате чего образуется высокая концентрация ионов H+ (водн.), называются сильными кислотами.
Примечание: Любая кислота со степенью ионизации 30% или выше является сильной кислотой.
Примеры:
Слабые кислоты: Кислоты, которые подвергаются частичной ионизации в водном растворе, так что их степень ионизации не превышает 30%, называются слабыми кислотами.
Примеры:
(i) Углекислота
VII На основе концентрации кислоты
Мера количества воды, присутствующей в данном образце кислоты, называется концентрацией.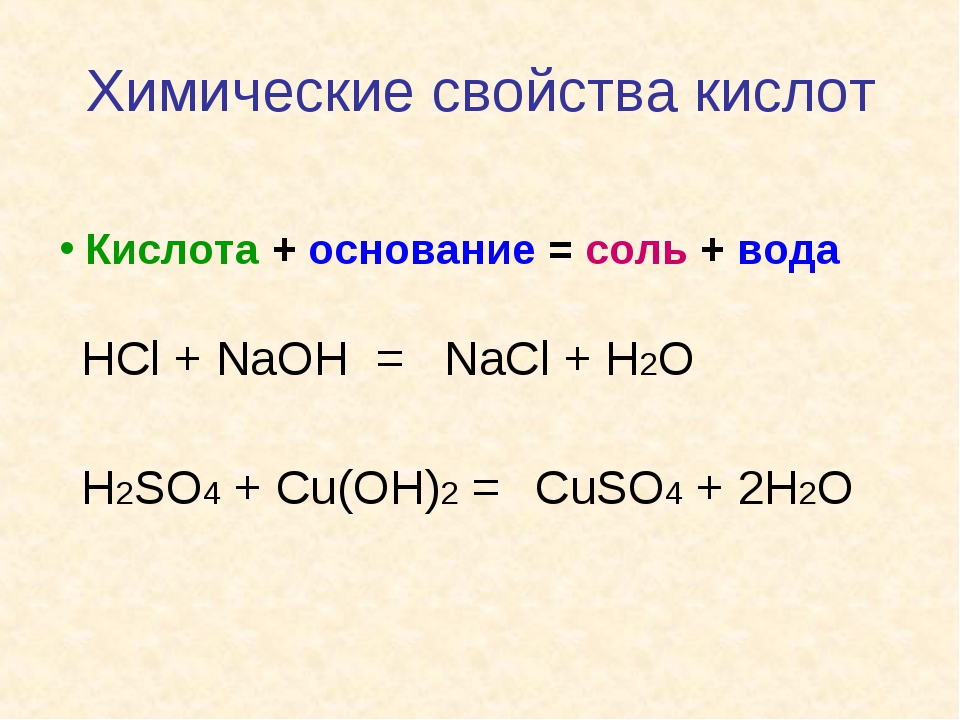
В зависимости от концентрации кислоты классифицируются следующим образом:
Концентрированная кислота: Образец кислоты, который содержит очень мало воды или совсем не содержит воды, называется концентрированной кислотой.
Разбавленная кислота: Образец кислоты, который содержит намного больше воды, чем ее собственный вес, называется разбавленной кислотой.
Примечание: Следует иметь в виду, что концентрация кислоты просто говорит о количестве воды в кислоте. Его не следует путать с силой кислоты, которая определяется мерой концентрации ионов H+ (водн.) в водном растворе.
(1) Сильная кислота останется сильной кислотой, даже если она разбавлена, поскольку она производит высокую концентрацию ионов H+ (водн.).
(2) Слабая кислота останется слабой кислотой даже при концентрировании, поскольку она не дает высокой концентрации ионов H+ (водн.).
VIII На основе волатильности  Летучий
Летучий
1. Прямым синтезом водорода с неметаллами: 
(2) Действие индикаторов: Вещества, которые используются для идентификации кислот или щелочей по изменению их цвета, называются индикаторами.
(i) Кислоты окрашивают синюю лакмусовую бумагу в красный цвет.
(ii) Кислоты окрашивают раствор метилового оранжевого в розовый цвет.
(iii) Кислоты обесцвечивают щелочной розовый фенолфталеин в водном растворе.
(3) Воздействие на кожу: Сильные минеральные кислоты разъедают кожу и вызывают болезненные ожоги.
(i) Конц. серная кислота окрашивает кожу в черный цвет.
(ii) Конц. азотная кислота окрашивает кожу в желтый цвет.
(iii) Конц. соляная кислота окрашивает кожу в янтарный цвет.
Примечание: Все минеральные кислоты не вызывают коррозию. Например, угольная кислота используется в производстве безалкогольных напитков.
(4) Действие электрического тока: Все водные растворы минеральных кислот являются хорошими проводниками электричества. Они разлагаются с выделением водорода на катоде.
(5) Действие с оксидами металлов: Все оксиды металлов реагируют с разбавленными минеральными кислотами с образованием только соответствующих солей металлов и воды.

Гидросульфит металла
Сульфид металла/+ Кислота (разбавленная) → Соль металла + Сероводород(г)
Сероводород металла 
Металл Кислота (разбавленная) → Соль металла + водород (г)
Основание: Соединение, которое реагирует с ионами гидроксония [H+ (водн. )] кислоты с образованием соли и воды как единственных продуктов, называется основанием.(или)
)] кислоты с образованием соли и воды как единственных продуктов, называется основанием.(или)
Основание представляет собой соединение, которое принимает протоны [H+ (водн.)] с образованием соли и воды в качестве единственных продуктов.
Примеры:
1. Все оксиды металлов (простые оксиды) являются основаниями.
2. Все гидроксиды металлов (также гидроксид аммония) являются основаниями.
Современное представление о щелочи: Соединение, которое при растворении в воде образует ионы ОН- в виде только отрицательных ионов, называется щелочью.
Помните: Все щелочи являются основаниями, но не все основания являются щелочами.
Например, гидроксид калия [KOH] является основанием. Однако, поскольку он растворяется в воде с образованием ионов ОН-, следовательно, это щелочь. С другой стороны, гидроксид цинка является основанием. Однако он не растворяется в воде и, следовательно, не является щелочью.
Однако он не растворяется в воде и, следовательно, не является щелочью.
Примеры щелочей:
I По силе действия:
Щелочи (растворимые основания) подвергаются диссоциации в водном растворе.
Степень диссоциации щелочи в водном растворе называется силой щелочи.
Математически,
Степень диссоциации щелочи (α) = Количество диссоциированных молекул щелочи Общее количество молекул щелочи
На основании степени диссоциации основания классифицируются следующим образом:
(i) Сильные основания: Основания, которые подвергаются почти полной диссоциации в водном растворе с образованием с высокой концентрацией гидроксильных ионов (ОН–) называются сильными щелочами.
Примеры:
Примеры:
Мера количества воды, присутствующей в данной пробе щелочи, называется концентрацией.
В зависимости от концентрации щелочи классифицируются следующим образом:
(i) Концентрированная щелочь: Образец основания, который содержит очень мало воды или совсем не содержит воды, называется концентрированной щелочью.
(ii) Разбавленная щелочь: Образец щелочи, который содержит намного больше воды, чем его собственный вес, называется разбавленной щелочью.
Например, раствор щелочи с концентрацией менее 1 моль/л называется разбавленной щелочью.
IV На основании кислотности основания/щелочи:
Кислотность: Количество гидроксильных ионов [ОН– ион], которое дает одна молекула кислоты при полной диссоциации в воде, называется ее кислотностью щелочи.
На основании основности основания можно разделить на:
Монокислотные основания:
Определение: Когда одна молекула основания при полной диссоциации в воде образует один ион гидроксила [OH–водн.], тогда основание называется монокислотным основанием.
Примечание: Монокислотное основание диссоциирует в водном растворе за одну стадию, если оно является растворимым основанием.
Примеры:
Определение: Когда одна молекула щелочи при полной диссоциации в воде образует два гидроксильных иона [2OH–водн. ], или основание, одна молекула которого полностью реагирует с двумя ионами гидроксония с образованием соли а вода как единственный продукт называется двухкислой щелочью/основанием.
], или основание, одна молекула которого полностью реагирует с двумя ионами гидроксония с образованием соли а вода как единственный продукт называется двухкислой щелочью/основанием.
Примечание: Диссоциация щелочей происходит только в одну стадию.
Примеры:
Двухосновные щелочи: Гидроксид кальция Ca(OH)2⇌Ca+2+2OH–
Примеры: Гидроксид алюминия [Al(OH)3], Гидроксид железа [Fe(OH)3]
1. Воздействием кислорода на металлы
Воздействием кислорода на металлы
AlCl3 + 3NaOH⟶ Al(OH)3↓ + 3NaClCuSO4 + 2NaOH⟶ Cu(OH)2↓ + Na2SO4 Нагревом нитратов металлов от кальция до меди в электрохимическом ряду
Нагревом нитратов металлов от кальция до меди в электрохимическом ряду
1. Вкус: Щелочи имеют горький вкус.
2. Прикосновение: Щелочи имеют мыльный привкус i.э., когда их раствор ощущается между кончиками пальцев.
3. Влияние индикаторов:
(i) Растворы щелочей окрашивают кислый красный раствор лакмуса в синий цвет.
(ii) Растворы щелочи окрашивают кислый раствор метилового оранжевого в желтый цвет.
(iii) Растворы щелочей окрашивают раствор фенолфталеина в розовый цвет.
(iv) Растворы щелочи превращают куркумную бумагу в коричневый цвет по сравнению с ее первоначальным желтым цветом.
1. Воздействие на металлы
Такие металлы, как цинк, олово и алюминий, реагируют с сильными щелочами, такими как NaOH (каустическая сода), KOH (едкий кали), с выделением газообразного водорода.
Кислоты реагируют с оксидами металлов, а основания реагируют с оксидами неметаллов с образованием соли и воды.
Пример:  Действие с солями аммония
Действие с солями аммония  д.
д.
Кислоты – это вещества, содержащие в своих молекулах один или несколько атомов водорода, которые могут высвобождать ионы H+ в воде. Точно так же основания — это вещества, которые содержат одну или несколько гидроксильных групп в своих молекулах, из которых они могут высвобождать ионы OH– в воде. Следовательно, поскольку ионы являются носителями заряда, водные растворы как кислот, так и оснований являются проводниками электричества.
Эксперимент
В стеклянный стакан налейте разбавленный раствор соляной кислоты (HC l ). Закрепите два маленьких железных гвоздя в резиновой пробке стакана, как показано на рисунке. Подсоедините гвозди к клеммам 6-вольтовой батареи через лампочку. Включите ток, и лампочка начнет светиться. Это показывает, что электрический ток прошел через раствор кислоты. Поскольку ток переносится движением ионов, это показывает, что раствор HC l ионизируется с образованием ионов H+ и Cl–. Ток сможет проходить и в том случае, если в стакане находится разбавленная h3SO4 (ионы H+ выделяются в водном растворе). Точно так же водные растворы, содержащие NaOH или KOH, также будут проводящими из-за высвобождения ионов OH–.
Ток сможет проходить и в том случае, если в стакане находится разбавленная h3SO4 (ионы H+ выделяются в водном растворе). Точно так же водные растворы, содержащие NaOH или KOH, также будут проводящими из-за высвобождения ионов OH–.
Сравнение свойств кислот и оснований 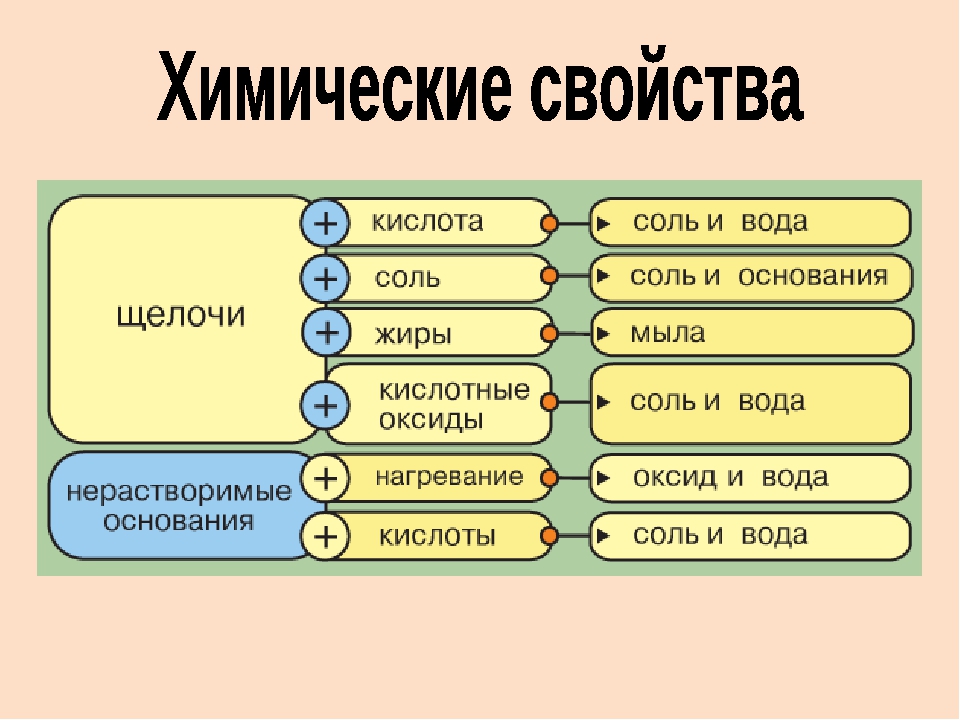
Вещества могут действовать как кислоты и основания только в присутствии воды (или) в водном растворе. В сухом состоянии, которое также называют безводным, эти признаки не проявляются.На самом деле вода помогает ионизации кислот или оснований, разделяя ионы. Это также известно как диссоциация и объясняется на основе теории, называемой теорией кислот и оснований Аррениуса.
В сухом состоянии соляная кислота известна как газообразный хлористый водород, т.е. HC l (g). Он не в состоянии давать ионы Н+. Поэтому кислотный характер не проявляется. Теперь пропустим газ через набранную в стакан воду с помощью стеклянной трубки. Молекулы h3O имеют полярную природу, что означает, что они имеют частичный
Поэтому кислотный характер не проявляется. Теперь пропустим газ через набранную в стакан воду с помощью стеклянной трубки. Молекулы h3O имеют полярную природу, что означает, что они имеют частичный
(i) могут выделять ионы H+ только в водном растворе.
(ii) основание может выделять ионы OH- только в водном растворе.
(iii) гидратация способствует высвобождению ионов из кислот и оснований.
Вы, должно быть, заметили, что таблетки антацида используются при несварении желудка. Антацид содержит гидроксид магния, который является мягким основанием. Гидроксид магния нейтрализует действие избытка соляной кислоты, образующейся в желудке при расстройстве желудка. Следовательно, это помогает облегчить боль.
Антацид содержит гидроксид магния, который является мягким основанием. Гидроксид магния нейтрализует действие избытка соляной кислоты, образующейся в желудке при расстройстве желудка. Следовательно, это помогает облегчить боль.
Знаете ли вы, что на самом деле происходит, когда кислоты и основания реагируют друг с другом?
Когда кислоты смешиваются с основаниями, они нейтрализуют или отменяют действие друг друга.Продукты, образующиеся при смешении кислот с основаниями, — это соль и вода.
Процесс обработки кислоты основанием с образованием соли и воды называется нейтрализацией.
Общую реакцию нейтрализации можно записать следующим образом:
Во время реакции выделяется много тепла. Следовательно, это экзотермический процесс.Знаете ли вы, что все кислоты генерируют водород (H+), а все основания генерируют ионы гидроксила (OH–) в своих водных растворах?
Ионы Н+ не могут существовать независимо; скорее они объединяются с молекулами воды (h3O) с образованием ионов гидроксония (h4O+).
(i) Люди особенно пожилого возраста страдают от проблем с кислотностью в желудке, вызванных главным образом выделением избыточного количества желудочного сока, содержащего HCl. Кислотность нейтрализуют антацидные таблетки, содержащие гидрокарбонат натрия (пищевая сода), гидроксид магния и т. д.
Кислотность нейтрализуют антацидные таблетки, содержащие гидрокарбонат натрия (пищевая сода), гидроксид магния и т. д.
(iii) Укусы ос содержат щелочь, и ее ядовитое действие можно нейтрализовать кислотой, такой как уксусная кислота (присутствует в уксусе).
(iv) Фермеры обычно нейтрализуют кислотность почвы, вызванную кислотными дождями, добавляя в почву гашеную известь (гидроксид кальция).
2.14 Индикаторы
Индикатор указывает на характер конкретного раствора, будь то кислый, основной или нейтральный. Кроме того, индикатор отражает также изменение характера раствора с кислого на основной и наоборот. Индикаторы – это в основном окрашенные органические вещества, выделенные из различных растений. Несколько распространенных кислотно-основных индикаторов:
I. Лакмус
Лакмус
Лакмус — это пурпурный краситель, который извлекается из лишайника, растения, принадлежащего к разновидности таллофитных.Он также может быть нанесен на бумагу в виде полосок и доступен в виде синих и красных полосок. Синяя лакмусовая полоска при погружении в раствор кислоты приобретает красный цвет. Точно так же красная полоска при погружении в раствор основания становится синей.
II. Фенолфталеин
Он также является органическим красителем и имеет кислотную природу. В нейтральном или кислом растворе он остается бесцветным, а в щелочном растворе цвет индикатора меняется на розовый.
Метиловый апельсин — краситель оранжевого (желтого) цвета и основа в природе.В кислой среде цвет индикатора становится красным, а в щелочной или естественной среде цвет остается неизменным.
IV. Сок краснокочанной капусты
В натуральной среде имеет фиолетовый цвет, а в кислой среде становится красным или розовым. В основной или щелочной среде его цвет меняется на зеленый.
В основной или щелочной среде его цвет меняется на зеленый.
V. Сок куркумы
Он имеет желтый цвет и остается таким же в нейтральной и кислой среде. В основной среде его цвет становится красноватым или темно-коричневым. 15 Концепция pH
15 Концепция pH
Шкала для измерения концентрации ионов водорода в растворе, называемая шкалой pH , была разработана S.P.L. Сорренсен. Буква «p» в значении pH означает «potenz» на немецком языке, что означает «мощность». По шкале рН мы можем измерить рН от 0 (очень кислая среда) до 14 (очень щелочная среда). pH следует рассматривать просто как число, указывающее на кислую или щелочную природу раствора. Чем выше концентрация ионов водорода, тем ниже шкала рН.
Характеристики шкалы pH: –
(i) Для кислого раствора, pH < 7
(ii) Для щелочного раствора, pH > 7
(iii) Для нейтрального раствора, pH = 7
pH = – log[H+]
(ii) pH раствора также определяется как логарифм обратной величины концентрации ионов H+. 
pOH=–logOH  5
5 0
0
Кислотность и щелочность раствора можно выразить через концентрацию ионов [H+], концентрацию ионов [OH–] (или) его pH.
(i) от 0 до 3,5, раствор представляет собой сильную кислоту
(ii) от 3,5 до 7, раствор представляет собой слабую кислоту.
б) Если рН = 7, раствор нейтрален.
в) Если рН > 7, раствор щелочной. Кроме того, если диапазон рН составляет
(i) от 7 до 10,5, раствор является слабым основанием.
(ii) от 10,5 до 14 раствор представляет собой сильное основание.
Влияние концентрации: Если концентрация [H+] увеличивается в 10 раз, pH уменьшается на 1 единицу, а если концентрация [H+] уменьшается в 10 раз, pH увеличивается на 1 единицу.
В общем, если коэффициент изменения [H+] равен «m», изменение в единицах pH составляет log10 m.
В целом, если pH изменяется на p единиц, коэффициент изменения [H+] составляет 10p.
Значение pH в повседневной жизни
(i) pH в нашей пищеварительной системе
Разбавленная соляная кислота, вырабатываемая в нашем желудке, помогает перевариванию пищи.Однако избыток кислоты вызывает расстройство желудка и приводит к боли и раздражению. рН пищеварительной системы в желудке снизится. Избыточную кислоту можно нейтрализовать с помощью антацидов, которые рекомендуют врачи. На самом деле, это группа соединений (основных по своей природе) и практически не имеющих побочных эффектов. Очень популярным антацидом является «Молоко магнезии», представляющее собой нерастворимый гидроксид магния. Гидроксид алюминия и гидрокарбонат натрия также могут быть использованы для той же цели.Эти антациды вернут pH системы к нормальному значению. pH крови человека колеблется от 7,36 до 7,42. он поддерживается растворимыми бикарбонатами и угольной кислотой, присутствующими в крови. Они известны как буферы .
Гидроксид алюминия и гидрокарбонат натрия также могут быть использованы для той же цели.Эти антациды вернут pH системы к нормальному значению. pH крови человека колеблется от 7,36 до 7,42. он поддерживается растворимыми бикарбонатами и угольной кислотой, присутствующими в крови. Они известны как буферы .
Белая эмаль на наших зубах состоит из нерастворимого фосфата кальция, который является довольно твердым. На него не влияет вода. Однако, когда pH во рту падает ниже 5,5, эмаль подвергается коррозии.Вода будет иметь прямой доступ к корням и произойдет разрушение зубов. Бактерии, присутствующие во рту, расщепляют сахар, который мы едим в той или иной форме, до кислот, молочная кислота — одна из них. Образование этих кислот вызывает снижение рН. Поэтому рекомендуется избегать употребления хирургической пищи, а также содержать рот в чистоте, чтобы в нем не было сахара и частиц пищи. Зубные пасты содержат некоторые основные ингредиенты, которые помогают нейтрализовать действие кислот, а также повышают рН во рту.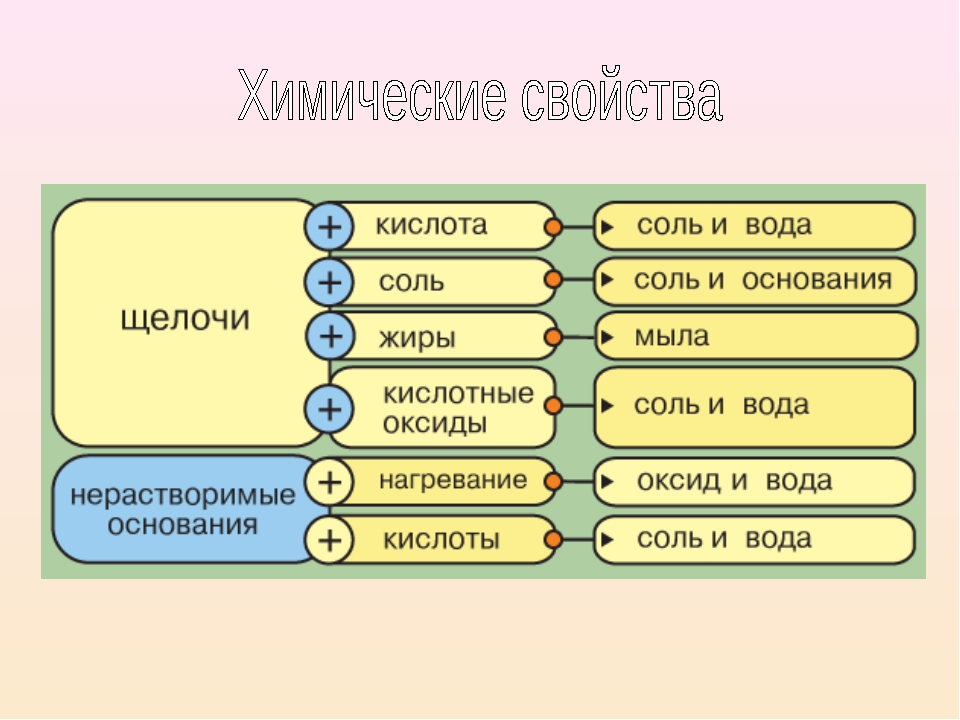
(iii) Роль рН в лечении укусов насекомых
Укусы пчел и муравьев содержат метановую кислоту (или муравьиную кислоту). При укусе они вызывают сильную боль и раздражение. Лечение заключается в протирании пораженного участка мылом. Гидроксид натрия, присутствующий в мыле, нейтрализует кислоту, введенную в организм, и, таким образом, возвращает pH к исходному уровню, принося облегчение человеку, который был ужален. Точно так же эффект от укусов ос, содержащих щелочь, нейтрализуется применением уксуса, представляющего собой этановую кислоту (или уксусную кислоту)
(iv) рН почвы и рост растений
Рост растений в определенной почве также связан с его рН.На самом деле, разные растения предпочитают разный диапазон pH для своего роста. поэтому очень важно обеспечить почве правильный pH для их здорового роста. Почвы с высоким содержанием минералов железа или с растительностью имеют тенденцию становиться кислыми. pH этой почвы может достигать 4. Кислотный эффект можно нейтрализовать «известкованием почвы», которое осуществляется путем добавления гидроксида кальция. Все они являются основными по своей природе и обладают нейтрализующим эффектом. Точно так же почва с избытком известняка или мела обычно щелочная.Иногда его рН достигает 8,3, что очень вредно для роста растений. Чтобы уменьшить щелочной эффект, лучше добавить немного разлагающейся органики (компост или навоз). На рН почвы также влияют кислотные дожди и использование удобрений. Поэтому обработка почвы очень важна.
Кислотный эффект можно нейтрализовать «известкованием почвы», которое осуществляется путем добавления гидроксида кальция. Все они являются основными по своей природе и обладают нейтрализующим эффектом. Точно так же почва с избытком известняка или мела обычно щелочная.Иногда его рН достигает 8,3, что очень вредно для роста растений. Чтобы уменьшить щелочной эффект, лучше добавить немного разлагающейся органики (компост или навоз). На рН почвы также влияют кислотные дожди и использование удобрений. Поэтому обработка почвы очень важна.
Вещество, образующееся при нейтрализации кислоты основанием, называется солью.
Пример
Соли классифицируются на основе химических формул, а также значений pH.
(a) Классификация на основе химических формул
(i) Нормальные соли
Нормальная соль – это та, которая не содержит ионизируемых атомов водорода или гидроксильной группы.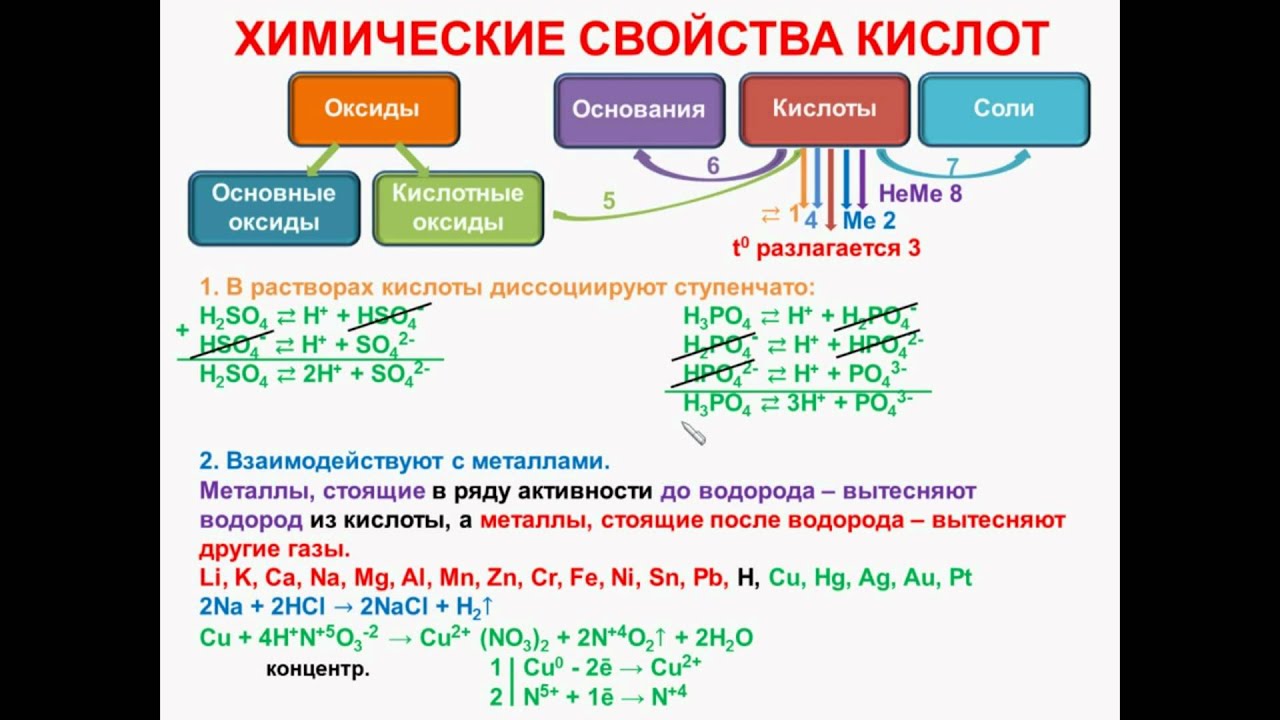 Это означает, что он образовался в результате полной нейтрализации кислоты основанием.
Это означает, что он образовался в результате полной нейтрализации кислоты основанием.
Например, для NaCl, KCl, NaNO2, K2 SO4 и т. д.
Кислая соль все еще содержит некоторое количество замещаемых атомов водорода. Это означает, что нейтрализация кислоты основанием не завершена.Например, гидросульфат натрия (NaHSO4), гидрокарбонат натрия (NaHCO3) и т. д.
(iii) Основные соли
Основная соль по-прежнему содержит некоторые заменяемые гидроксильные группы. Это означает, что нейтрализация основания кислотой неполная. Например, основной нитрат свинца Pb(OH)NO3. основной хлорид свинца, Pb(OH)Cl и т. д.
Классификация на основе значений pH
Соли образуются в результате реакции между кислотами и основаниями. В зависимости от природы кислот и оснований или от значений рН растворы солей бывают трех типов.
(i) Нейтральные солевые растворы
Солевые растворы сильных кислот и сильных оснований нейтральны и имеют рН, равный 7. Они не изменяют цвет лакмусового раствора.
Они не изменяют цвет лакмусового раствора.
Например: NaCl, NaNO3, Na2SO4 и т. д.
(ii) Кислые солевые растворы
Солевые растворы сильных кислот и слабых оснований имеют кислую природу и имеют рН менее 7. Они изменяют цвет синего лакмусового раствора на красный .
Например, для (Nh5)2SO4, Nh5Cl и т. д.
В обеих этих солях основание Nh5OH слабое, а кислоты h3SO4 и HC l сильные.
(iii) Растворы основных солей
Растворы солей сильных оснований и слабых кислот имеют щелочную природу и имеют рН более 7. Они изменяют окраску красного лакмусового раствора на синий.
Например, для Na2CO3, K3PO4 и т. д.
В обеих солях основания NaOH и KOH являются сильными, а кислоты h3CO3 и h4PO4 – слабыми.
Использование солей:
(i) в качестве поваренной соли,
(ii) в производстве масла и сыра.
(iii) В кожевенной промышленности.
(iv) В производстве стиральной и пищевой соды.
(v) Для получения гидроксида натрия электролизом рассола.
(vi) Каменную соль рассыпают по льду, чтобы растопить его в холодных странах.
2.17 Некоторые важные химические соединения
Хлорид натрия – поваренная соль (поваренная соль)
Хлорид натрия (NaC l ), также называемый поваренной солью или поваренной солью, является наиболее важной частью нашего рациона. Химически он образуется в результате реакции между растворами гидроксида натрия и соляной кислоты. Морская вода является основным источником хлорида натрия, где он присутствует в растворенной форме вместе с другими растворимыми солями, такими как хлориды и сульфаты кальция и магния.его отделяют некоторыми подходящими методами. Месторождения солей находятся в разных частях мира и известны как каменная соль. В чистом виде это белое кристаллическое твердое вещество, однако оно часто бывает коричневым из-за присутствия примесей.
(a) Применение:
(i) Необходим для жизни
Хлорид натрия совершенно необходим для жизни. Биологически он выполняет ряд функций, таких как сокращение мышц, проведение нервных импульсов в нервной системе, а также превращается в соляную кислоту, которая помогает перевариванию пищи в желудке.Когда мы потеем, вместе с водой теряется хлорид натрия. Это приводит к мышечным судорогам. Его потерю необходимо соответствующим образом компенсировать, давая пациенту определенные солевые препараты. Порошок электрола является важным заменителем поваренной соли.
Биологически он выполняет ряд функций, таких как сокращение мышц, проведение нервных импульсов в нервной системе, а также превращается в соляную кислоту, которая помогает перевариванию пищи в желудке.Когда мы потеем, вместе с водой теряется хлорид натрия. Это приводит к мышечным судорогам. Его потерю необходимо соответствующим образом компенсировать, давая пациенту определенные солевые препараты. Порошок электрола является важным заменителем поваренной соли.
Хлорид натрия также является очень полезным сырьем для различных химических веществ. К ним относятся соляная кислота (HCl), стиральная сода (Na2CO3·10h3O), пищевая сода (NaHCO3) и др. При электролизе крепкого раствора соли (рассола) получают едкий натр, хлор и водород.Кроме того, он используется в кожевенной промышленности для дубления кожи. В сильные морозы по обледенелым дорогам рассыпают каменную соль, чтобы растопить лед. он также используется в качестве удобрения для сахарной свеклы.
Сода для стирки
Химическое название
Декагидрат карбоната натрия
Химическая формула: Na2CO3. 10х3О
(а) Препарат
Карбонат натрия перекристаллизовывают путем растворения в воде с получением стиральной соды — основной соли.
(i) Используется в качестве очищающего средства в бытовых целях.
(ii) Используется для смягчения жесткой воды и регулирования pH воды.
(iii) Используется в производстве стекла.
(iv) Благодаря своим моющим свойствам он используется в качестве компонента некоторых сухих мыльных порошков.
(v) Он также находит применение в фотографии, текстильной и бумажной промышленности и т. д.
(vi) Он используется в производстве буры (Na 2 B 4 O 7 . 10H 2 O)
Пищевая сода
Пищевая сода представляет собой гидрокарбонат натрия или бикарбонат натрия (NaHCO 3 ).
(a) Получение
Получают как промежуточный продукт при получении карбоната натрия по методу Сольве. В этом процессе насыщенный раствор хлорида натрия в воде насыщают аммиаком, а затем в жидкость пропускают газообразный диоксид углерода. Хлорид натрия превращается в бикарбонат натрия, который, будучи менее растворимым, выделяется из раствора.
(i) Это белое кристаллическое вещество, образующее с водой щелочной раствор.Водный раствор бикарбоната натрия нейтрален к метиловому оранжевому, но дает розовую окраску с фенолфталеиновым оранжевым. (Фенолфталеин и метиловый оранжевый — красители, используемые в качестве кислотно-щелочных индикаторов.)
(ii) При нагревании выше 543 К превращается в карбонат натрия.
(i) Используется в производстве разрыхлителя. Разрыхлитель представляет собой смесь гидротартарата калия и бикарбоната натрия. Во время приготовления хлеба выделение углекислого газа приводит к тому, что хлеб поднимается (набухает).
Разрыхлитель представляет собой смесь гидротартарата калия и бикарбоната натрия. Во время приготовления хлеба выделение углекислого газа приводит к тому, что хлеб поднимается (набухает).
(iii) Это важное химическое вещество в текстильной, кожевенной, бумажной и керамической промышленности.
(iv) Он также используется в огнетушителях определенного типа. На следующей схеме показан огнетушитель, который использует NaHCO3 и h3SO4 для производства газа CO2. Огнетушитель состоит из конического металлического контейнера (А) с соплом (Z) на одном конце. В контейнере хранится крепкий раствор NaHCO3.Стеклянная ампула (P), содержащая h3SO4, прикреплена к ручке (K) и помещена в раствор NaHCO3. Ампулу можно разбить, ударив по ручке. Как только кислота вступает в контакт с раствором NaHCO3, образуется газ CO2. Когда внутри контейнера создается достаточное давление, газ CO2 выбрасывается через сопло (A). Поскольку CO 2 не поддерживает горение, небольшое возгорание можно потушить, направив сопло в сторону огня. Газ получают по следующей реакции.
Поскольку CO 2 не поддерживает горение, небольшое возгорание можно потушить, направив сопло в сторону огня. Газ получают по следующей реакции.
Отбеливающий порошок имеет коммерческое название «хлоридная известь» или «хлорированная известь». В основном это оксихлорид кальция, имеющий следующую формулу CaOCl2:
Отбеливающий порошок получают пропусканием хлора через гашеную известь при 313 К.
(i) Широко используется в качестве отбеливателя в бумажной и текстильной промышленности.
(ii) Он также используется для дезинфекции воды, чтобы очистить ее от микробов.
(iii) Используется для получения хлороформа.
(iv) Он также используется для придания шерсти устойчивости к усадке.
Гипс
(a) Приготовление
Его получают путем нагревания гипса (CaSO4. 2h3O) примерно до 373 К в больших стальных котлах с механической мешалкой или во вращающейся печи.
(б) Недвижимость
Когда тонкоизмельченный гипс смешивают с водой и превращают в пасту, он быстро застывает в твердую массу.В процессе его объем также немного увеличивается. Эти свойства находят множество применений. Добавление воды превращает гипс обратно в гипс.
Добавление воды превращает гипс обратно в гипс.
(i) Используется в лабораториях для герметизации зазоров, где требуется герметичность.
(ii) Он также используется для изготовления игрушек, косметических средств и слепков статуй.
(iii) Используется в качестве гипса для вправления сломанных костей.
(iv) Он также находит применение при изготовлении форм для гончарных изделий.
(iv) Он также используется для придания гладкости поверхностям и для создания рисунков на стенах и потолках.
Гидратированные соли – соли, содержащие кристаллизационную воду
Некоторые соли содержат определенное количество некоторых молекул h3O, свободно связанных с их собственными молекулами. Они известны как гидратированные соли и имеют кристаллическую природу. Присутствующие молекулы h3O известны как «кристаллизационная вода».
В окрашенных кристаллических и гидратированных солях молекулы кристаллизационной воды также определяют их характерный цвет. Так, при нагревании гидратной соли ее цвет изменяется, так как удаляются молекулы кристаллизационной воды и соль становится безводной. Например, возьмем несколько кристаллов медного купороса i.е. гидратированного медного купороса в сухой пробирке или кипяченой пробирке. Нагрейте трубку снизу. Соль превратится в белый безводный порошок, а на стенках пробирки появятся капельки воды. Охладите пробирку и снова добавьте несколько капель воды. Белый безводный порошок снова приобретет синюю окраску.
Например, возьмем несколько кристаллов медного купороса i.е. гидратированного медного купороса в сухой пробирке или кипяченой пробирке. Нагрейте трубку снизу. Соль превратится в белый безводный порошок, а на стенках пробирки появятся капельки воды. Охладите пробирку и снова добавьте несколько капель воды. Белый безводный порошок снова приобретет синюю окраску. Определение, свойства и важные вопросы
кислоты, основания и соли: определения
 д. Многие кислот, таких как HCl, H 2 SO 4 и т. д., и щелочей, таких как NaOH, KOH и т. д., используются в лабораториях, но эти кислоты не потребляются в домашнем хозяйстве.Образование соли и воды происходит после реакции нейтрализации, когда эти основания и кислоты смешиваются в правильных и определенных пропорциях. Некоторые соли, такие как NaCl, KCl и т. д., встречаются в природе в виде отложений природных горных пород или в морской воде.
д. Многие кислот, таких как HCl, H 2 SO 4 и т. д., и щелочей, таких как NaOH, KOH и т. д., используются в лабораториях, но эти кислоты не потребляются в домашнем хозяйстве.Образование соли и воды происходит после реакции нейтрализации, когда эти основания и кислоты смешиваются в правильных и определенных пропорциях. Некоторые соли, такие как NaCl, KCl и т. д., встречаются в природе в виде отложений природных горных пород или в морской воде. Что такое кислоты?
 Кислоты кислые на вкус. Кислота считается веществом, которое содержит ионы гидроксония (H 3 O+), способные к ионизации в водном растворе. Кислоты диссоциируют в своем водном растворе и образуют составляющие их ионы, как показано на следующем рисунке.
Кислоты кислые на вкус. Кислота считается веществом, которое содержит ионы гидроксония (H 3 O+), способные к ионизации в водном растворе. Кислоты диссоциируют в своем водном растворе и образуют составляющие их ионы, как показано на следующем рисунке. Классификация кислот на основе их происхождения
Классификация кислот на основе количества ионов водорода
 Так, при равновесии концентрация ионов водорода достигает максимума, а концентрация молекул кислоты становится очень малой; например, HCl, HNO 3 , HClO 4
Так, при равновесии концентрация ионов водорода достигает максимума, а концентрация молекул кислоты становится очень малой; например, HCl, HNO 3 , HClO 4 Свойства кислот
 Например, при взаимодействии HCl с известняком образуются хлорид кальция и угольная кислота.
Например, при взаимодействии HCl с известняком образуются хлорид кальция и угольная кислота. Что такое базы?
Классификация на основе силы оснований
Слабые основания- Это основания, в которых равновесие преимущественно направлено в сторону реагентов и они частично ионизированы, т.е.г., аммиак в воде
 )+OH-(водн.)
)+OH-(водн.) Свойства оснований обычно
8 показывают значение pH более 7, являются коррозионными по своей природе и горькими на вкус. Обычно они кажутся очень мыльными и скользкими.
Что такое соли?
Когда происходит реакция нейтрализации оснований и кислот, образуется соль. Соли состоят из положительно заряженных ионов, называемых катионами, и отрицательно заряженных ионов, называемых анионами. Соли бывают неорганическими или органическими по своей природе. Эти ионы, присутствующие в относительном количестве, делают природу соли нейтральной.
Химические реакции, показанные в приведенных ниже уравнениях, показывают образование соли. Основания диссоциируют в своем водном растворе с образованием составляющих их ионов, представленных в следующих примерах.
Сила кислот и оснований, которые объединяются в реакции нейтрализации, определяет рН раствора соли.
Свойства солей
- В результате реакции нейтрализации соли образуются в результате соединения кислоты и основания.
- Кислотный и основной характер солей обычно зависит от кислоты и основания, из которых соль выделилась в реакции нейтрализации.
Пример:
- NaOH + HCl → NaCl + H 2 O
- HCl + NH 4 OH → NH 4 CL + H 2 O 8 CH 3 COOH + NAOH → CH 3 COONA + H 2 O
- CH 3 CHOOH + NH 4 OH + NH 4 OH → CH 3 COONH 4 + H 2 o
HCl(водн.)+NaOH(водн.)→NaCl(водн.)+H 2 O(л)
Другие примеры включают:
- Пищевая сода (NaHCO 3 ) используется в кулинарии.

- Нитрат аммония (NH 4 NO 3 ), который используется в качестве удобрения, и
- Английская соль (MgSO 4 ), которая используется в солях для ванн,
Вопрос: Что такое соль? (2 балла)
Ответ : В химии соль – это вещество, полученное реакцией основания и кислоты.Соли состоят из отрицательных ионов (анионов) кислот и положительных ионов (катионов) оснований. Реакция основания и кислоты называется реакцией нейтрализации.
Вопросы: Является ли NH 4 Cl основной солью? (2 балла)
Ответ : Хлорид аммония (химическая формула NH 4 Cl) является кислой солью, поскольку представляет собой соль слабого основания (т. е. гидроксида аммония) и сильной кислоты (т. е. соляной кислоты)
Вопрос: Какие бывают 2 типа кислот? (2 балла)
Ответ : Органические кислоты и неорганические кислоты представляют собой два типа кислот. Вообще говоря, неорганические кислоты сильнее, чем органические кислоты.
Вообще говоря, неорганические кислоты сильнее, чем органические кислоты.
Вопрос: Является ли соль кислой или щелочной? (2 балла)
Ответ : Соль является основной только тогда, когда она содержит слабокислотное сопряженное основание. Например, хлорид натрия содержит хлорид (Cl-), сопряженное основание HCl.
Вопрос: Что происходит, когда Fe реагирует с HCl? (3 балла)
Ответ : В данном случае металлом является железо, а кислотой является разбавленная соляная кислота.Хлорид железа и водород образуются при добавлении к железным опилкам разбавляющей соляной кислоты. В этой реакции водород из соляной кислоты заменяется железом с образованием газообразного водорода и хлорида железа.
Вопрос: 15 мл воды и 10 мл серной кислоты необходимо смешать в химическом стакане:
- Объяснить метод, которого следует придерживаться.
- Как называется этот процесс? (2 балла)
Ответ : а) Кислоту следует добавлять в воду медленно, чтобы предотвратить разбрызгивание смеси.

 __. 2018
__. 2018


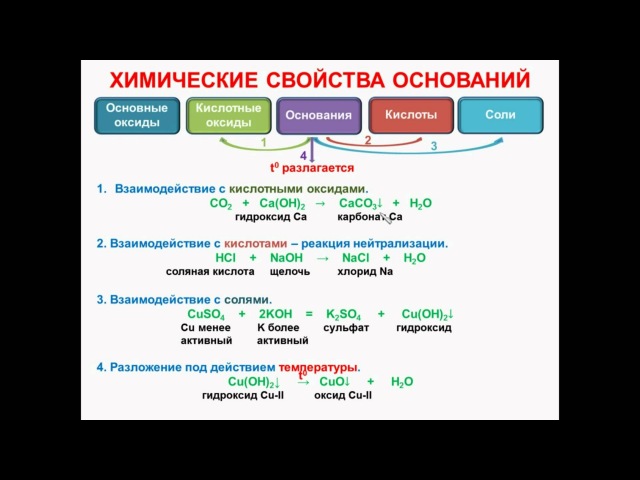 Взаимодействие с солями
Взаимодействие с солями