Урок 5. химический состав клетки — Биология — 5 класс
Биология, 5 класс
Урок 5. Химический состав клетки
Перечень вопросов, рассматриваемых на уроке:
- Урок посвящён изучению химического состава клетки.
Ключевые слова:
Клетка, химический состав, неорганические и органические вещества, вода, минеральные соли, белки, жиры, углеводы, нуклеиновые кислоты
Тезаурус:
Химический элемент – это атомы одного и того же вида.
Органические вещества – это вещества, которые входят в состав живых организмов и образуются только при их участии.
Неорганические вещества – это вещества, которые входят в состав неживой природы и могут образовываться без участия живых организмов.
Обязательная и дополнительная литература по теме
- Биология. 5–6 классы. Пасечник В. В., Суматохин С. В., Калинова Г. С. и др. / Под ред. Пасечника В. В. М.
- Биология. 6 класс. Теремов А. В., Славина Н. В. М.: Бином, 2019.
- Биология. 5 класс. Мансурова С. Е., Рохлов В. С., Мишняева Е. Ю. М.: Бином, 2019.
- Биология. 5 класс. Суматохин С. В., Радионов В. Н. М.: Бином, 2014.
- Биология. 6 класс. Беркинблит М. Б., Глаголев С. М., Малеева Ю. В., Чуб В. В. М.: Бином, 2014.
- Биология. 6 класс. Трайтак Д. И., Трайтак Н. Д. М.: Мнемозина, 2012.
- Биология. 6 класс. Ловягин С. Н., Вахрушев А. А., Раутиан А. С. М.: Баласс, 2013.
Теоретический материал для самостоятельного изучения
Сейчас на Земле известно более ста химических элементов. Из их атомов состоят все вещества, встречающиеся на Земле. 80 химических элементов обнаружены в составе живых организмов. При этом четыре из них – углерод, водород, азот и кислород составляют около 98 % массы любого организма. Остальные химические элементы встречаются в живых организмах в малых количествах.
Клетки всех живых организмов состоят из одних и тех же химических элементов. Эти же элементы входят и в состав объектов неживой природы. Сходство состава указывает на общность живой и неживой природы.
Эти же элементы входят и в состав объектов неживой природы. Сходство состава указывает на общность живой и неживой природы.
На этом уроке вы узнаете, из каких химических элементов состоят клетки живых организмов, и какие изменения претерпевают эти химические соединения по мере роста и развития клеток.
В клетках живых организмов больше всего содержится таких химических элементов, как углерод, водород, кислород и азот. Вместе они составляют до 98 % массы клетки. Около 2 % массы клетки приходится на восемь элементов: калий, натрий, кальций, хлор, магний, железо, фосфор и серу. Остальные химические элементы содержатся в клетках в очень малых количествах.
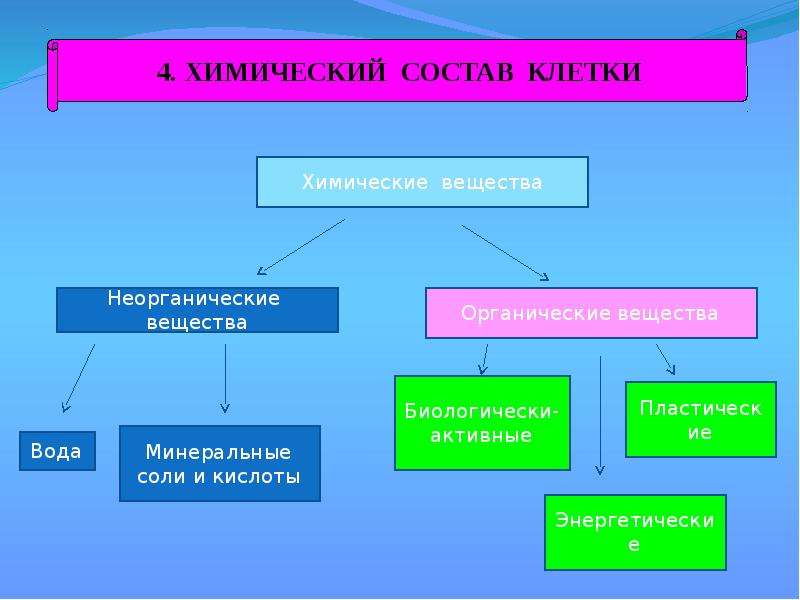
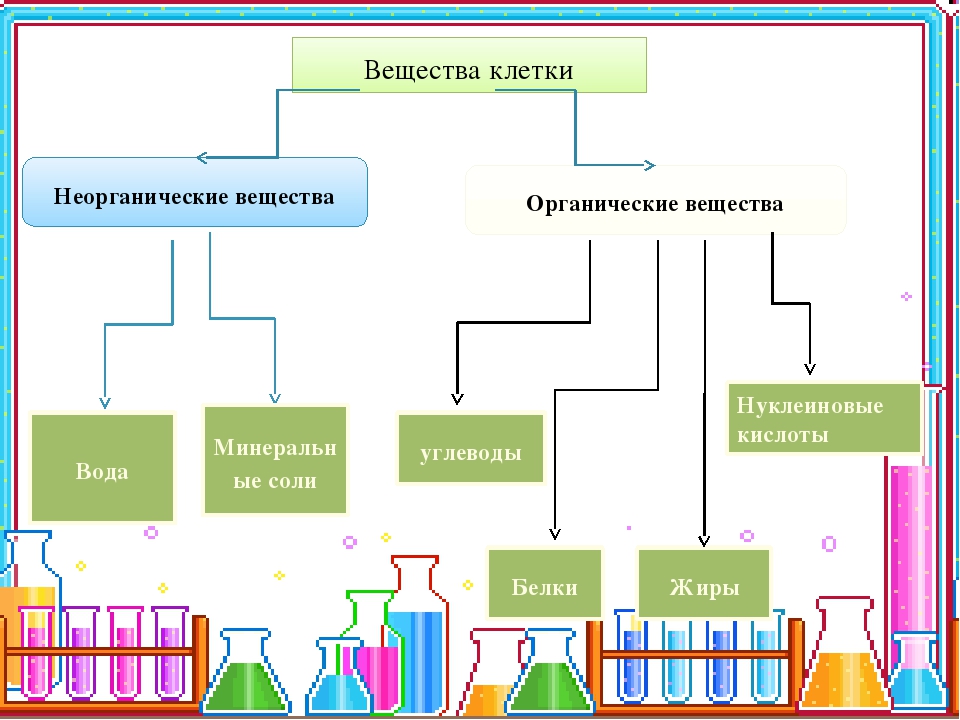
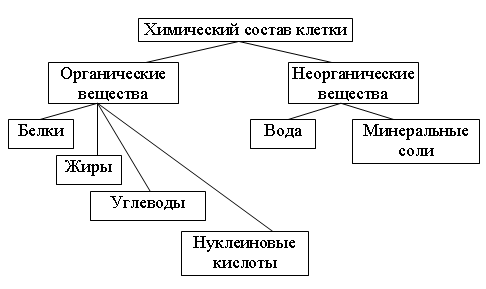
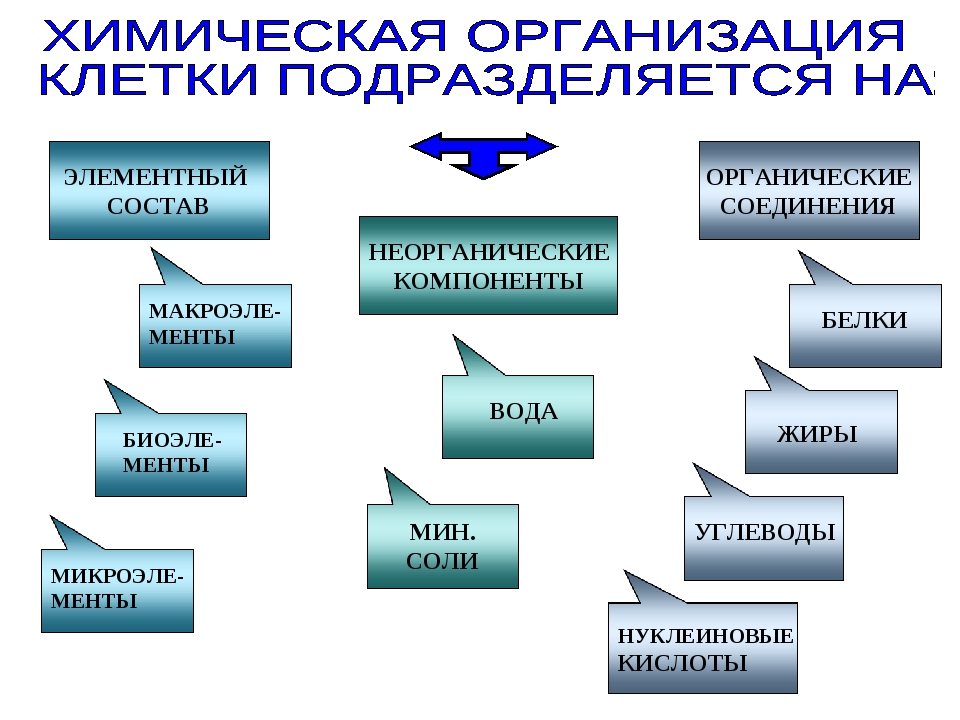
Химические элементы, соединяясь между собой, образуют неорганические (вода и минеральные соли) и органические
Значение каждого из веществ, содержащегося в клетке уникально. Вода придаёт клетке упругость, определяет её форму, участвует в обмене веществ. Неорганические вещества используются для синтеза органических молекул. При недостатке минеральных веществ важнейшие процессы жизнедеятельности клеток нарушаются. Углеводы придают прочность клеточным оболочкам, а также служат запасающими веществами. Белки входят в состав разнообразных клеточных структур, регулируют процессы жизнедеятельности и тоже могут запасаться в клетках. Жиры откладываются в клетках. При расщеплении жиров освобождается необходимая живым организмам энергия. Нуклеиновые кислоты играют ведающую роль в сохранении наследственной информации.
Неорганические вещества используются для синтеза органических молекул. При недостатке минеральных веществ важнейшие процессы жизнедеятельности клеток нарушаются. Углеводы придают прочность клеточным оболочкам, а также служат запасающими веществами. Белки входят в состав разнообразных клеточных структур, регулируют процессы жизнедеятельности и тоже могут запасаться в клетках. Жиры откладываются в клетках. При расщеплении жиров освобождается необходимая живым организмам энергия. Нуклеиновые кислоты играют ведающую роль в сохранении наследственной информации.
Клетка – это миниатюрная природная лаборатория, в которой синтезируются и претерпевают изменения различные химические соединения. Сходство химического состава клеток разных организмов доказывает единство живой природы.
Разбор типового тренировочного задания:
Тип задания: Сортировка элементов по категориям
Текст вопроса: Расставьте названия веществ в таблицу:
Органические вещества | Неорганические вещества |
Варианты ответов:
Белки
Вода
Углеводы
Жиры
Кислород
Правильный вариант ответа:
Органические вещества | Неорганические вещества |
белки углеводы жиры | вода кислород |
Разбор типового контрольного задания
Тип задания: Выделение цветом
Текст вопроса: Выделите цветом вещества, входящие в состав живых организмов:
Варианты ответов:
- Вода
- Пластик
- Белки
- Жиры
- Нефть
- Углеводы
- ДНК и РНК
Правильный вариант ответа:
1) Вода
3) Белки
4) Жиры
6) Углеводы
7) ДНК и РНК
Тема 2.
 2. Химический состав клетки.
2. Химический состав клетки.1. Дайте определения понятий.
Клетка – элементарная единица живого, обладающая всеми признаками организма: способностью к размножению, росту, обмену веществ и энергией с окружающей средой, раздражимостью, постоянством химического сотсава.
Макроэлементы – элементы, количество которых в клетке составляет до 0.001% от массы тела. Примеры – кислород, углерод, азот, фосфор, водород, сера, железо, натрий, кальций и др.
Микроэлементы – элементы, количество которых в клетке составляет от 0.001% до 0.000001% от массы тела. Примеры – бор, медь, кобальт, цинк, йод и др.
Ультрамикроэлементы – элементы, содержание которых в клетке не превышает 0.000001% от массы тела. Примеры – золото, ртуть, цезий, селен и др.
3. О чем говорит научный факт сходства элементарного химического состава живой и неживой природы?
Это указывает на общность живой и неживой природы.
Неорганические вещества. Роль воды и минеральных веществ в жизнедеятельности клетки.
1. Дайте определения понятий.
Неорганические вещества – это вода, минеральные соли, кислоты, анионы и катионы, присутствующие как в живых, так и в неживых организмах.
Вода – одно из самых распространенных неорганических веществ в природе, молекула которого состоит из двух атомов водорода и одного атом кислорода.
2. Нарисуйте схему «Строение воды».
3. Какие особенности строения молекул воды придают ей уникальные свойства, без которых невозможна жизнь?
Структура молекулы воды образована двумя атомами водорода и одним атомом кислорода, которые образуют диполь, то есть вода имеет две полярности «+»и»-«.Это способствует ее проницаемости через стенки мембраны, способностью растворять химические вещества. Кроме того, диполи воды связываются водородными связями друг с другом, что обеспечивает ее способность быть в различных агрегатных состояниях, а также — растворять или не растворять различные вещества.
4. Заполните таблицу «Роль воды и минеральных веществ в клетке».
5. Каково значение относительного постоянства внутренней среды клетки в обеспечении процессов ее жизнедеятельности?
Постоянство внутренней среды клетки называется гомеостазом. Нарушение гомеостаза влечёт к повреждению клетки или к её смерти, в клетке постоянно происходит пластический обмен и энергетический обмен, это две составляющие метаболизма, и нарушение этого процесса ведёт к повреждению или к гибели всего организма.
6. В чем состоит назначение буферных систем живых организмов и каков принцип их функционирования?
Буферные системы поддерживают определенное значение рН (показатель кислотности) среды в биологических жидкостях. Принцип функционирования заключается в том, что рН среды зависит от концентрации протонов в этой среде (Н+). Буферная система способна поглощать или отдавать протоны в зависимости от их поступления в среду извне или, напротив, удаления из среды, при этом рН не будет изменяться.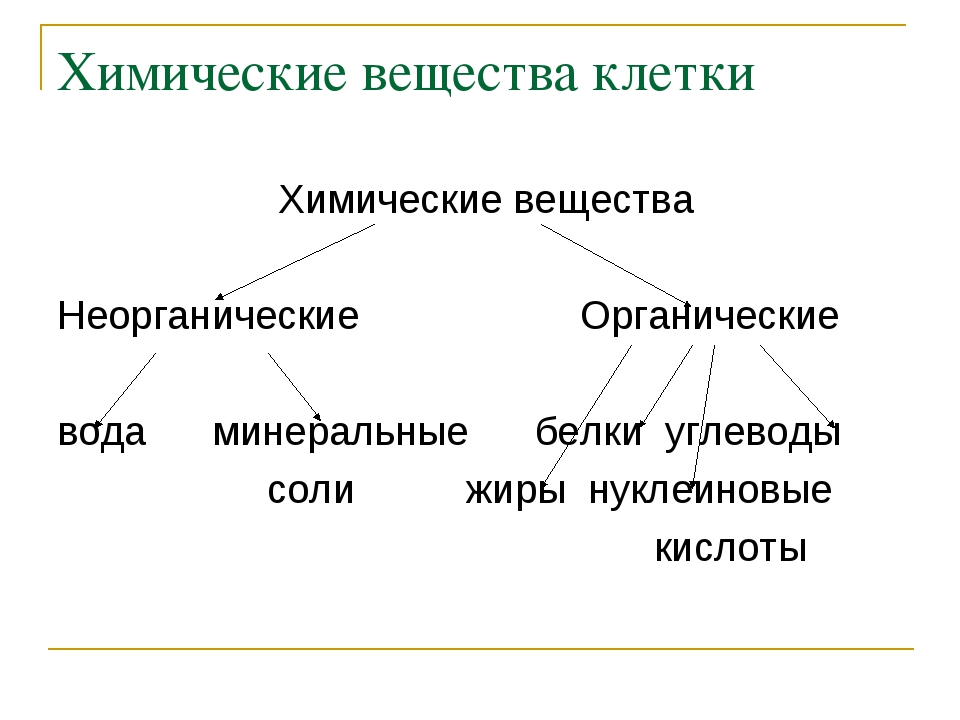 Наличие буферных систем необходимо в живом организме, так как из-за изменения условий окружающей среды рН может сильно меняться, а большинство ферментов работает только при определенном значении рН.
Наличие буферных систем необходимо в живом организме, так как из-за изменения условий окружающей среды рН может сильно меняться, а большинство ферментов работает только при определенном значении рН.
Примеры буферных систем:
карбонатно-гидрокарбонатная (смесь Na2СО3 и NaHCO3)
Органические вещества. Роль углеводов, липидов и белков в жизнедеятельности клетки.
1. Дайте определения понятий.
Органические вещества – это вещества, в состав которых обязательно входит углерод; они входят в состав живых организмов и образуются только при их участии.
Белки – высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью.
Липиды – обширная группа природных органических соединений, включающая жиры и жироподобные вещества. Молекулы простых липидов состоят из спирта и жирных кислот, сложных — из спирта, высокомолекулярных жирных кислот и других компонентов.
Углеводы – это органические вещества, в своем составе имеющие карбонильную и несколько гидроксильных групп и иначе называемые сахарами.
2. Впишите в таблицу недостающую информацию «Строение и функции органических веществ клетки».
3. Что понимают под денатурацией белка?
Денатурация белка – это утрата белком своей природной структуры.
Нуклеиновые кислоты, АТФ и другие органические соединения клетки.
1. Дайте определения понятий.
Нуклеиновые кислоты – это биополимеры, состоящие из мономеров – нуклеотидов.
АТФ – это соединение, состоящее из азотистого основания аденина, углевода рибозы и трех остатков фосфорной кислоты.
Нуклеотид – это мономер нуклеиновой кислоты, который состоит из фосфатной группы, пятиуглеродного сахара (пентозы) и азотистого основания.
Макроэргическая связь – это связь между остатками фосфорной кислоты в АТФ.
Комплементарность – это пространственное взаимное соответствие нуклеотидов.
Нуклеиновые кислоты состоят из большого количества повторяющихся нуклеотидов и имеют массу 10.000 до нескольких миллионов углеродных единиц.
3. Охарактеризуйте особенности строения молекулы нуклеотида.
Нуклеотид представляет собой соединение из трех компонентов: остатка фосфорной кислоты, пятиуглеродного сахара (рибозы), и одного из азотистых соединений (аденин, гуанин, цитозин, тимин или урацил).
4. Какое строение имеет молекула ДНК?
ДНК – двойная спираль, состоящая из множества нуклеотидов, которые последовательно соединяются между собой за счет ковалентных связей между дезоксирибозой одного и остатком фосфорной кислоты другого нуклеотида. Азотистые основания, которые располагаются по одну сторону от остова одной цепи, связаны Н-связями с азотистыми основаниями второй цепи по принципу комплементарности.
5. Применив принцип комплементарности, постройте вторую цепочку ДНК.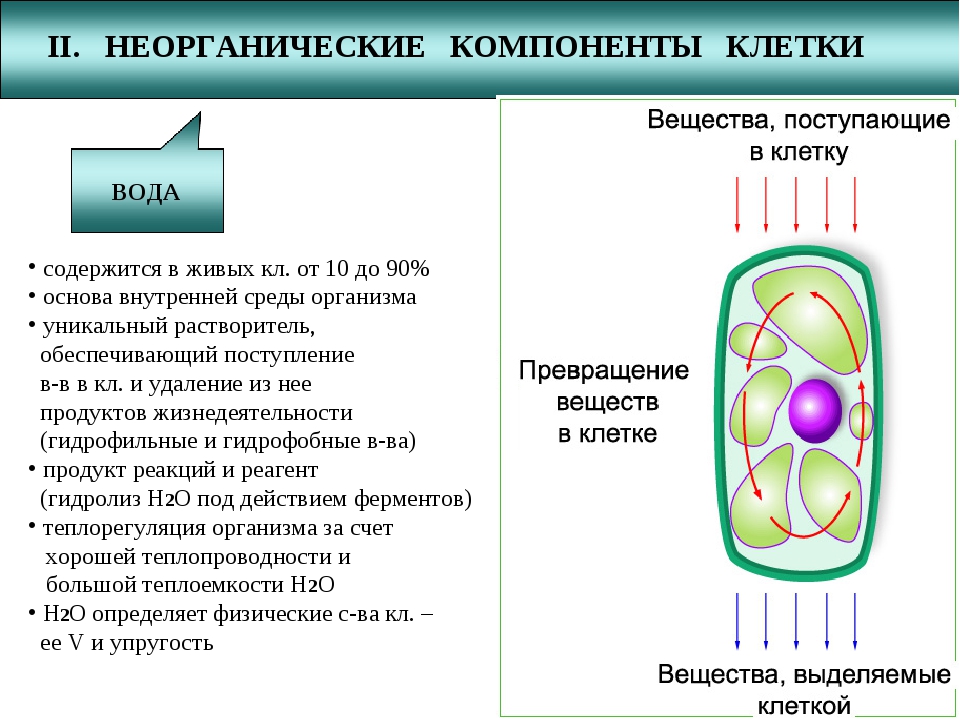
Т-А-Т-Ц-А-Г-А-Ц-Ц-Т-А-Ц
А-Т-А-Г-Т-Ц-Т-Г-Г-А-Т-Г.
6. Каковы основные функции ДНК в клетке?
При помощи четырех типов нуклеотидов в ДНК записана вся важная информация в клетке об организме, которая передается последующим поколениям.
7. Чем молекула РНК отличается от молекулы ДНК?
РНК представляет собой одинарную цепь меньшего, чем ДНК, размера. В нуклеотидах находится сахар рибоза, а не дезоксирибоза, как в ДНК. Азотистым основанием, вместо тимина, является урацил.
8. Что общего в строении молекул ДНК и РНК?
И РНК, и ДНК являются биополимерами, состоящими из нуклеотидов. В нуклеотидах общим в строении является наличие остатка фосфорной кислоты и оснований аденина, гуанина, цитозина.
9. Заполните таблицу «Типы РНК и их функции в клетке».
10. Что такое АТФ? Какова его роль в клетке?
АТФ – аденозинтрифосфат, макроэргическое соединение. Его функции – универсальный хранитель и переносчик энергии в клетке.
Его функции – универсальный хранитель и переносчик энергии в клетке.
11. Каково строение молекулы АТФ?
АТФ состоит из трех остатков фосфорной кислоты, рибозы и аденина.
12. Что представляют собой витамины? На какие две большие группы их разделяют?
Витамины – биологически активные органические соединения, играющие важную роль в процессах обмена веществ. Их разделяют на водорастворимые (С, В1, В2 и др.) и жирорастворимые (А, Е и др.).
13. Заполните таблицу «Витамины и их роль в организме человека».
Органические и неорганические вещества клетки их функции: таблица
Химическая организация клеток: неорганические и органические вещества и их роль в жизнедеятельности клетки
Неорганические вещества клетки и их роль. Химические элементы и их роль в клетке
Из известных ныне около 110 химических элементов в состав клетки входит около 60. В соответствии с их количественным содержанием они делятся на три группы.
Таблица 7 Группы химических элементов клетки
| Макроэлементы | Микроэлементы | Ультрамикроэлементы |
| Количество определяется десятками процентов | Количество определяется десятыми и сотыми долями процента | Количество определяется тысячными долями процента и менее |
| Углерод, азот, водород, кислород | Натрий, калий, кальций, магний, железо, сера, фосфор, хлор | Кадмий, медь, цинк, фтор, кобальт и др. |
| Входят в состав основных органических веществ (белки, липиды, углеводы, нуклеиновые кислоты), а также в состав многих неорганических соединений | Входят в состав органических и неорганических соединений (сложные белки, пигменты, фосфолипиды, нуклеиновые кислоты, неорганические соли и др.) | Входят в состав ферментов, гормонов, витаминов и др. |
Вода и ее роль в клетке
Содержание воды в клетках различных тканей колеблется от 20% (в костной ткани) до 85% (в нервной ткани).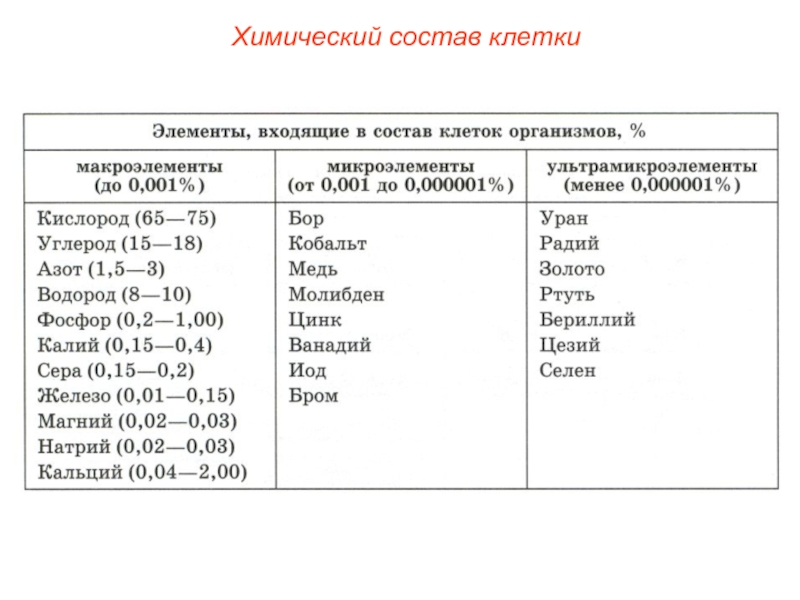
Молекула воды полярная (является диполем), что делает ее хорошим растворителем. Полярность и нелинейность молекулы воды определяется тем, что атомы водорода и кислорода, входящие в ее состав, различны по размерам и электроотрицательности.
Вода – хороший растворитель. Электростатическое притяжение между полярными молекулами воды и ионами сильнее, чем притяжение между катионом и анионом. В водном растворе ионы гидратируются.
Вещества, молекулы которых полярны и легко взаимодействуют с молекулами воды, называются гидрофильными. Вещества, молекулы которых неполярны и не могут растворяться в воде, называют гидрофобными.
В воде такие вещества взаимодействуют друг с другом, образуя комплексы таким образом, чтобы с водой соприкасалась как можно меньшая поверхность.
Молекулы воды способны образовывать водородные связи. Одна молекула может образовать водородные связи с 4 другими молекулами воды.
Способность молекул воды образовывать водородные связи обеспечивает ряд ее свойств:
- высокая удельная теплоемкость;
- вязкость и поверхностное натяжение;
- несжимаемость.
Удельная теплоемкость – количество тепла, необходимое для повышения температуры 1 кг воды на 1°С, очень велика. Большое количество энергии тратится на разрыв водородных связей.
Водородные связи являются причиной вязкости воды, а также обеспечивают силы поверхностного натяжения: на поверхности воды из-за сильного притяжения ее молекул возникают силы сцепления, направленные внутрь воды.
Таблица 8 Свойства воды
| Свойства воды | Роль воды, определяемая этим свойством |
| Молекулы воды являются диполями, вода – полярное вещество | Вода – хороший растворитель |
| Вода несжимаема | Вода обеспечивает тургор клеток |
| Вода обладает высокой теплоемкостью и теплопроводностью | Вода участвует в теплорегуляции клетки |
| Вода обладает текучестью | Вода переносит растворенные в ней вещества |
Другие функции воды в клетке:
- Среда для протекания химических реакций
- Участник и продукт химических реакций
- Источник водорода и кислорода в фотосинтезе цианобактерий и эукариот
- Снижает силу трения в некоторых структурах
Неорганические соли и их роль в клетке
В большинстве клеток и тканей соли присутствуют в растворенном состоянии, т. е. в виде катионов и анионов. Некоторые ткани содержат нерастворимые соли в составе своего межклеточного вещества (например, костная ткань животных).
е. в виде катионов и анионов. Некоторые ткани содержат нерастворимые соли в составе своего межклеточного вещества (например, костная ткань животных).
Основными катионами клеток являются К+, Na+, Ca2+, Mg2+, основными анионами – Cl-, HPO24-, h3PO4-, HCO-3.
Катионы и анионы распределены неравномерно между клеткой и внеклеточной средой, что является необходимым условием существования клетки. Так, содержание ионов калия существенно выше внутри клетки, а ионов натрия – во внеклеточной среде.
Таблица 9 Значение некоторых ионов в клетке
| Ионы натрия, калия и хлора | Участвуют в формировании нервных импульсов |
| Ионы калия, кальция, магния | Активируют ряд ферментов |
| Ионы кальция |
|
| Ионы магния | Входят в состав хлорофилла |
| Ионы железа Fe2+ | Входят в состав гемоглобина |
| Ионы цинка | Входят в состав гормона поджелудочной железы инсулина |
| Ионы иода | Входят в состав гормона щитовидной железы тироксина |
| Анионы HPO24-, h3PO4-, HCO-3 | Входят в состав буферных систем клетки, которые поддерживают рН на постоянном уровне |
| Анионы РО43- | Входят в состав ряда органических веществ: нуклеотидов, фосфолипидов и др.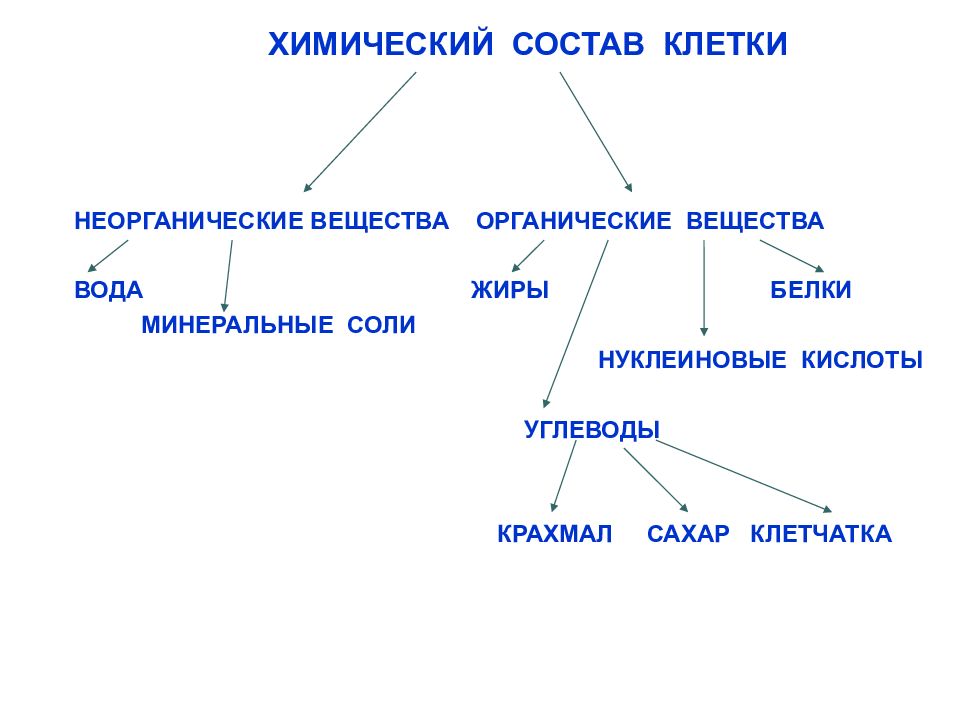 |
Углеводы и их роль в клетке
Эти соединения имеют общую формулу Cn(h3O)n, где n>3
Таблица 10 Классификация углеводов и их свойства
| Характеристика | Моносахариды | Полисахариды первого порядка | Полисахариды второго порядка |
| Строение | Состоят из одной молекулы, которая может включать 3 (триозы), 4 (тетрозы), 5 (пентозы) или 6 (гексозы) атомов углерода | Состоят из 2–4 остатков моносахаридов | Состоят из большого числа остатков моносахаридов |
| Свойства | Имеют кристаллическую форму, хорошо растворимы в воде, имеют сладкий вкус | Имеют кристаллическую форму, хорошо растворимы в воде, имеют сладкий вкус | Не имеют кристаллической формы, нерастворимы в воде |
| Примеры | Пентозы – рибоза, дезоксирибоза. Гексозы – глюкоза, фруктоза, галактоза | Дисахариды – сахароза, мальтоза, лактоза | Крахмал, целлюлоза, гликоген, хитин |
Функции углеводов
- Структурная (целлюлоза входит в состав клеточной стенки клеток растений, хитин входит в состав панциря членистоногих, клеточной стенки клеток грибов).
- Энергетическая (при окислении углеводов выделяется энергия).
- Запасающая (откладываются в запас – крахмал у растений, гликоген у животных).
Липиды и их роль в клетке
Липиды или жиры – это сложные эфиры трехатомного спирта глицерина и высокомолекулярных карбоновых кислот (жирных кислот).
Молекула липида состоит из гидрофильной головки, в состав которой входит глицерин, остаток фосфорной кислоты (фосфолипид) или углевод (гликолипид), и двух гидрофобных хвостов, состоящих из остатков жирных кислот (рис. 12).
Рисунок 12 – Схема молекулы фосфолипида: 1 – жирнокислотные хвосты; 2 – полярная головка
Функции липидов
- Структурная (входят в состав мембран).
- Энергетическая (при окислении липидов выделяется энергия).
- Запасающая (откладываются в запас).
- Защитная (липиды образуют прослойки между внутренними органами – сальники).
- Терморегулирующая (липиды обладают низкой теплопроводностью и, образуя теплоизоляционный слой, способствуют сохранению тепла).

- Являются источником эндогенной воды.
Белки и их роль в клетке
Белки представляют собой полимеры, мономерами которых являются аминокислоты. В природе существует около 300 аминокислот, но в белках обнаружено только 20 из них. Особенностью аминокислот является наличие аминогруппы (Nh3) и карбоксильной группы (СООН). Участки молекул, лежащие вне амино- и карбоксильной групп и определяющие специфику аминокислоты, называются радикалом.
Аминокислоты, которые не могут синтезироваться в организме человека, называются незаменимыми. К незаменимым относятся гистидин, лейцин, изолейцин, лизин, метионин, фенилаланин, треонин, триптофан, валин.
Аминокислоты, входящие в состав белков, можно разбить на две группы, в зависимости от того, каким является их радикал – полярным или неполярным. К неполярным аминокислотам относятся аланин, валин, изолейцин, лейцин, метионин, пролин, триптофан, фенилаланин. Полярными аминокислотами являются все остальные, например, аргинин, аспарагин, аспарагиновая кислота, гистидин, лизин, тирозин, треонин и др.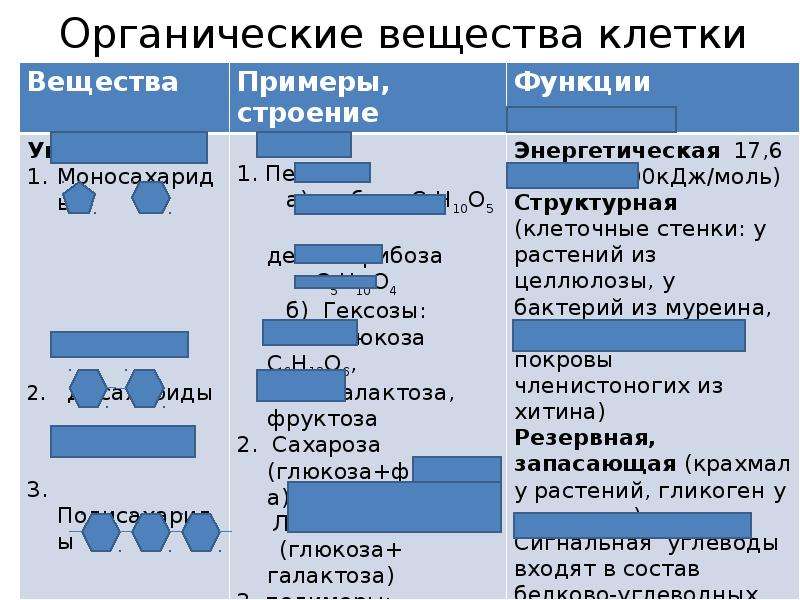
Соединение аминокислот в цепь происходит за счет амино- и карбоксильной групп, при этом образуется пептидная связь.
Пептидная связь – прочная ковалентная связь. Разнообразие белков определяется аминокислотами, которые входят в состав белка.
Таблица 11 Уровни организации белковой молекулы
| Уровень организации | Описание | Основные взаимодействия |
| Первичная | линейная последовательность аминокислот | пептидные связи |
| Вторичная | спирально закрученная молекула | водородные связи |
| Третичная | глобула (шарообразная молекула) | гидрофобные взаимодействия, электростатические взаимодействия, дисульфидные связи |
| Четвертичная | объединение нескольких глобул в единый комплекс | гидрофобные взаимодействия |
Первичная структура белка образуется в результате биосинтеза на рибосомах, однако в таком состоянии белки в клетке не существуют. Они приобретают более высокие уровни организации – вторичную, третичную или четвертичную структуры.
Они приобретают более высокие уровни организации – вторичную, третичную или четвертичную структуры.
Вторичная структура представляет собой спирально закрученную молекулу. Между витками спирали образуются водородные связи (между кислородом карбоксильной группы и водородом аминогруппы). Водородные связи гораздо слабее ковалентных, но их образуется большое количество, поэтому они обеспечивают образование довольно прочной структуры.
Третичная структура белка представляет собой глобулу – шарообразную структуру. Связи, поддерживающие третичную структуру, довольно слабые. Они возникают, в частности, в результате гидрофобного взаимодействия. Это взаимодействие связано с силами притяжения между неполярными участками белка в водной среде. Гидрофобные остатки некоторых аминокислот в водном растворе сближаются, «слипаются» и тем самым стабилизируют структуру белка.
Внутри белковой глобулы оказываются гидрофобные остатки аминокислот, а на поверхности глобулы – гидрофильные.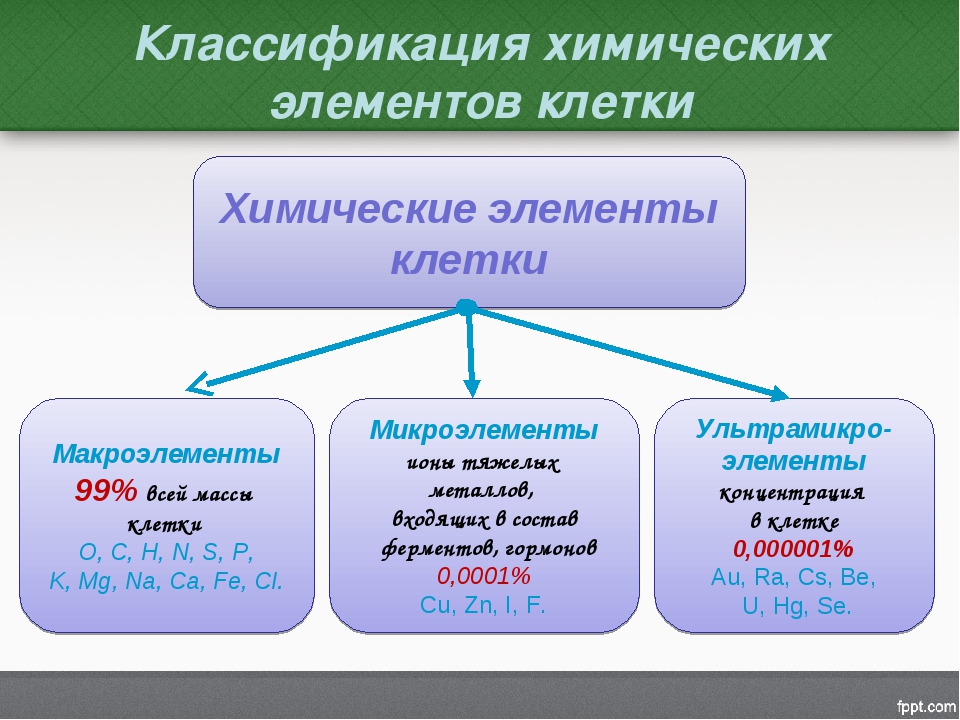 Кроме гидрофобного взаимодействия в поддержании третичной структуры участвуют электростатические силы между заряженными участками аминокислот.
Кроме гидрофобного взаимодействия в поддержании третичной структуры участвуют электростатические силы между заряженными участками аминокислот.
Между атомами серы, которую содержат некоторые аминокислоты, образуются ковалентные дисульфидные мостики. Третичная структура не является конечной. К макромолекуле белка могут присоединяться макромолекулы такого же белка или молекулы других белков. Такая структура называется четвертичной (рис. 13).
Рисунок 13 – Уровни организации молекул белка
Начиная со вторичной структуры пространственные конформации белка поддерживаются слабыми взаимодействиями. Под воздействием внешних факторов (изменение температуры, солевого состава среды, рН, под действием радиации и иных факторов) слабые связи, стабилизирующие макромолекулу, рвутся, что приводит к изменению структуры белка. Этот процесс называется денатурацией. Денатурация может быть обратимой и необратимой
Функции белка
Белки выполняют наиболее разнообразные функции по сравнению с другими веществами клетки.
- Структурная – белки входят в состав биомембран и ряда органоидов, например, рибосом. Белки соединительных тканей обеспечивают их прочность и эластичность: кератин шерсти и волос, коллаген сухожилий, хрящей и др.
- Ферментативная – белки являются биокатализаторами, которые ускоряют протекание биохимических реакций в клетке (далее – подробно).
- Транспортная – многие белки являются транспортерами ряда веществ, например, гемоглобин переносит кислород; многие белки клеточных мембран образуют транспортные системы клетки: каналы, обменники, насосы.
- Регуляторная – белки-регуляторы контролируют процессы, происходящие в клетке. Например, гормоны пептидной или белковой природы (гормон роста, инсулин и др.), влияя на продукцию или активность белков-ферментов, управляют обменными процессами в клетке.
- Двигательная – белки осуществляют движения клеток или их частей, например белки мышечной ткани актин и миозин обеспечивают движение мышц.
- Защитная функция белков реализуется антителами, интерфероном и фибриногеном.

- Антитела, вырабатываемые лимфоцитами, противостоят возбудителям болезней.
- Интерферон – белок, приостанавливающий размножение вирусов.
- Фибриноген – растворимый белок плазмы крови, на последнем этапе свертывания крови переходящий в нерастворимый белок фибрин, который участвует в образовании тромба.
- Рецепторную или сигнальную функцию выполняют специфические белки, встроенные в биомембраны, которые реагируют с химическими веществами (например, гормонами или нейромедиаторами), вызывая изменение функционирования клетки.
- Энергетическая – белки после их расщепления на аминокислоты и дезаминирования (реакция отщепления аминогруппы) служат субстратами для реакций энергетического обмена. Дезаминирование аминокислот – отщепление аминогруппы, которая преобразуется в аммиак, а затем в мочевину.
Белки-ферменты
Фермент – биологический катализатор белковой природы, ускоряющий биохимические процессы в клетке.
Субстрат – вещество, с которым взаимодействует фермент.
Ферментативная реакция проходит по следующей схеме:
В ходе ферментативной реакции образуется фермент-субстратный комплекс, который распадается на свободный фермент и продукт реакции. Таким образом, фермент не расходуется в ходе реакции.
Фермент имеет центр для связывания субстрата, который называют активным центром. Субстрат и фермент подходят друг к другу, как ключ к замку.
Для активизации фермента необходимы специальные вещества, в роли которых могут выступать витамины (никотиновая кислота, витамины группы В), ионы металлов и др.
Кроме активаторов, известны вещества, которые, напротив, снижают скорость ферментативной реакции или вообще прекращают ее. Эти вещества называются ингибиторами.
Скорость ферментативной реакции зависит от ряда факторов внешней среды, в частности от температуры, и рН среды, а также от наличия ингибиторов. Максимальная скорость ферментативной реакции отмечается при оптимальных значениях температуры и рН, а также в отсутствие ингибиторов.
Фермент активен при определенной температуре среды. Увеличение или уменьшение температуры приводит к снижению скорости ферментативной реакции. Оптимальная температура для ферментов человеческого организма 37–380С. Кроме того, для каждого фермента существует оптимальное значение рН, при котором трехмерная структура фермента в области активного центра принимает необходимую форму.
Нуклеиновые кислоты и их роль в клетке
Нуклеиновые кислоты были открыты в конце XIX века Мишером. Их структура была изучена уже в ХХ веке. Расшифровка структуры ДНК связана с именами Уотсона и Крика (1953).
Различают дезоксирибонуклеиновую (ДНК) и рибонуклеиновую (РНК) кислоты. Мономерами нуклеиновых кислот (НК) являются нуклеотиды. В состав каждого нуклеотида входят азотистое основание, пентоза, остаток фосфорной кислоты.
Азотистые основания разделяются на две группы – производные пурина и производные пиримидина. К пуриновым азотистым основаниям относятся аденин и гуанин, к пиримидиновым принадлежат тимин, цитозин и урацил.
Пентозы (пятиуглеродные моносахариды) представлены рибозой и дезоксирибозой.
Соединение нуклеотидов в цепь происходит благодаря эфирным связям, которые образуются между остатками пентоз и фосфорной кислоты. Таким образом, формируется сахарно-фосфорный скелет молекулы (рис. 14).
Таблица 12 Сравнительная характеристика ДНК и РНК
| Признак | ДНК | РНК |
| Локализация в клетке | Ядро, митохондрии, хлоропласты | Ядро, митохондрии, хлоропласты, цитоплазма, рибосомы |
| Локализация в ядре | Хромосомы | Ядрышко |
| Вид молекулы | Двойная правозакрученная спираль (две полинуклеотидные цепи, соединенные водородными связями) | Одна полинуклеотидная цепь |
| Мономеры | Дезоксирибонуклеотиды | Рибонуклеотиды |
| Строение мономера | ||
| Пуриновые азотистые основания | Аденин, гуанин | Аденин, гуанин |
| Пиримидиновые азотистые основания | Тимин, цитозин | Урацил, цитозин |
| Пентоза | Дезоксирибоза | Рибоза |
| Остаток фосфорной кислоты | имеется | имеется |
| Свойства | Стабильность, способность к самоудвоению | Лабильность |
| Функции |
| Различны для разных видов РНК
|
Двойная спираль ДНК образуется благодаря наличию водородных связей между комплементарными азотистыми основаниями разных цепей (рис. 14).
14).
Комплементарными являются такие азотистые основания, пространственная конфигурация которых позволяет образовывать им между собой водородные связи.
Комплементарную пару образуют одно пуриновое и одно пиримидиновое основания.
Комплементарные пары- аденин – тимин
- тимин – аденин
- гуанин – цитозин
- цитозин – гуанин
- аденин – урацил (при образовании и-РНК)
Между тимином и аденином образуется две, а между гуанином и цитозином – три водородные связи.
Рисунок 14 – Структура РНК и ДНК
Содержание химических элементов в клетке
Вода и другие неорганические вещества, их роль в жизнедеятельности клетки. Органические вещества, их роль в клетке. Самоудвоение ДНК
К неорганическим соединениям клетки относятся вода и различные соли.
В среднем в клетке содержится около 80% воды: в клетках эмбриона воды до 95%, в клетках старых организмов — 60%, то есть количество воды зависит от интенсивности обмена веществ.
Количество воды зависит также от вида ткани: в нейронах ее 85%, в костях — не более 20%. При потере организмом 20% воды наступает смерть. Вода определяет тургор (упругость) тканей, создает среду для химических реакций, участвует в реакциях гидролиза, в световой фазе фотосинтеза, в терморегуляции, является хорошим растворителем.
По отношению к воде различают вещества гидрофильные (полярные вещества) — хорошо растворимые в воде и гидрофобные (неполярные вещества) — плохо растворимые в воде.
Роль солей в организме заключается в обеспечении трансмембранной разности потенциалов (вследствие разницы во внутри- и внеклеточной концентрации ионов калия и натрия), создании буферных свойств (за счет наличия в цитоплазме анионов фосфорной и угольной кислоты), в создании осмотического давления клетки и т.д.
В состав неорганических веществ клетки входят микроэлементы (их доля составляет менее 0,1%). К ним относятся цинк, марганец и кобальт, которые входят в состав активных центров ферментов; железо в составе гемоглобина; магний в составе хлорофилла; йод в составе гормонов щитовидной железы и др.
К органическим веществам клетки относятся белки, углеводы, жиры, нуклеиновые кислоты.
Белки— это гетерополимеры, состоящие из 20 различных мономеров — природных альфа-аминокислот.
Белки — нерегулярные полимеры.
Общее строение аминокислоты может быть представлено следующим образом: R—CCNh3)—СООН. Аминокислоты в белке связаны пептидной связью —N(H)—С(=0). Аминокислоты разделяют на заменимые, синтезирующиеся в самом организме, и незаменимые, которые животный организм получает с пищей.
Среди белков различают протеины — состоят только из аминокислот и протеиды — содержат небелковую часть (например, гемоглобин, который состоит из белка глобина и порфирина — гема).
В строении молекулы белка различают первичную структуру — последовательность аминокислотных остатков; вторичную — как правило, это спиральная структура (альфа-спираль), которая удерживается множеством водородных связей, возникающих между находящимися близко друг от друга С=0 и NH-группами.
Другой тип вторичной структуры — бета-слой, или складчатый слой, — это две параллельные полипептидные цепи, связанные водородными связями, перпендикулярными цепям. Третичная структура белковой молекулы — это пространственная конфигурация, напоминающая компактную глобулу. Она поддерживается ионными, водородными и дисульфидными (S=S) связями, а также гидрофобными взаимодействиями. Четвертичная структура образуется при взаимодействии нескольких глобул (например, молекула гемоглобина состоит из четырех таких субъединиц).
Третичная структура белковой молекулы — это пространственная конфигурация, напоминающая компактную глобулу. Она поддерживается ионными, водородными и дисульфидными (S=S) связями, а также гидрофобными взаимодействиями. Четвертичная структура образуется при взаимодействии нескольких глобул (например, молекула гемоглобина состоит из четырех таких субъединиц).
Утрата белковой молекулой своей структуры называется денатурацией; она может быть вызвана температурой, обезвоживанием, облучением и т.д. Если при денатурации первичная структура не нарушается, то при восстановлении нормальных условий полностью воссоздается структура белка.
Функции белков в клетке очень разнообразны.
Они играют роль катализаторов, то есть ускоряют химические реакции в организме (ферменты ускоряют реакции в десятки и сотни тысяч раз). Белки выполняют также строительную функцию (входят в состав мембран и органоидов клетки, а также в состав внеклеточных структур, например, волокна коллагена в соединительной ткани).
Движение организмов обеспечивается специальными белками (актином и миозином). Белки выполняют также транспортную функцию (например, гемоглобин транспортирует 02). Белки входят в состав иммунной системы организма (антитела и антигены), обеспечивают свертывание крови (например, белок фибриноген плазмы крови), то есть выполняют защитную функцию.
Они служат одним из источников энергии (при распаде 1 г белка выделяется 17,6 кДж энергии). Различают также регуляторную функцию белков, так как многие гормоны являются белками (например, гормоны гипофиза, поджелудочной железы и т.д.).
Кроме того, в организме имеются еще и резервные белки, являющиеся источником питания для развития плода.
Углеводы — это органические соединения, в состав которых входят водород, углерод и кислород.
Образуются из воды и углекислого газа в процессе фотосинтеза в хлоропластах зеленых растений (у бактерий в процессе бактериального фотосинтеза или хемосинтеза).
Различают моносахариды (глюкоза, фруктоза, галактоза, рибоза, дезоксирибоза), дисахариды (сахароза, мальтоза), полисахариды (крахмал, клетчатка, гликоген, хитин).
Углеводы выполняют следующие функции: являются источником энергии (при распаде 1 г глюкозы освобождается 17,6 кДж энергии), выполняют строительную функцию (целлюлозная оболочка в растительных клетках, хитин в скелете насекомых и в клеточной стенке грибов), входят в состав ДНК, РНК и АТФ в виде дезоксирибозы и рибозы.
Обычно в клетке животных организмов содержится около 1% углеводов (в клетках печени до 5%), а в растительных клетках до 90%.
Жиры и липиды относятся к группе неполярных органических соединений, то есть являются гидрофобными веществами. Жиры — это триглицериды высших жирных кислот, липиды — большой класс органических веществ с гидрофобными свойствами (например, холестерин). К липидам относят фосфолипиды (в их молекуле один или два остатка жирных кислот замещены группами, содержащими фосфор, а иногда также азот) и стероиды (в основе их структуры лежат 4 углеродных кольца).
Эти соединения выполняют энергетическую функцию (при распаде 1 г жира выделяется 38,9 кДж), структурную (являются основой биологических мембран), защитную (защита от ударов, теплорегуляция, гидроизоляция).
АТФ — это аденозинтрифосфат, нуклеотид, относящийся к группе нуклеиновых кислот.
Концентрация АТФ в клетке мала (в среднем 0,04%; в скелетных мышцах 0,5%). Молекула АТФ состоит из адени- на, рибозы и трех остатков фосфорной кислоты.
При гидролизе остатка фосфорной кислоты выделяется энергия:
Связь между остатками фосфорной кислоты является макроэргической, при ее расщеплении выделяется примерно в 4 раза больше энергии, чем при расщеплении других связей.
Энергию АТФ клетка использует в процессах биосинтеза, при движении, при производстве тепла, при проведении нервных импульсов, в процессе фотосинтеза и т.д.
АТФ является универсальным аккумулятором энергии в живых организмах.
ДНК (дезоксирибонуклеиновая кислота) — это молекула, состоящая из двух спирально закрученных полинуклеотидных цепей. ДНК образует правую спираль шириной примерно 20 ангстрем, длиной несколько сотен микрон и молекулярной массой
дальтон. Структура ДНК была расшифрована Д. Уотсоном и Ф. Криком в 1953 г. Мономером ДНК является дезоксирибонуклеотид, состоящий из азотистого основания (аденина (А), цитозина (Ц), тимина (Т) или гуанина (Г)), пентозы (дезоксирибозы) и фосфата.
Уотсоном и Ф. Криком в 1953 г. Мономером ДНК является дезоксирибонуклеотид, состоящий из азотистого основания (аденина (А), цитозина (Ц), тимина (Т) или гуанина (Г)), пентозы (дезоксирибозы) и фосфата.Нуклеотиды соединяются в цепь за счет остатков фосфорной кислоты, расположенных между пентозами; в полинуклеотиде может быть до 30 тыс. нуклеотидов. Последовательность нуклеотидов одной цепи комплементарна, то есть соответствует последовательности в другой цепи. Цепи удерживаются за счет водородных связей между комплементарными азотистыми основаниями: по две водородные связи между А и Т и по три между Г и Ц. В интерфазе перед делением клетки происходит репликация (редупликация) ДНК: ДНК раскручивается с одного конца, и на каждой цепи синтезируется новая комплементарная цепь; это ферментативный процесс, идущий с использованием энергии АТФ.
ДНК содержится в основном в ядре; к внеядерным формам ДНК относятся митохондриальная и пластидная.
РНК (рибонуклеиновая кислота) — это молекула, состоящая из одной цепи нуклеотидов.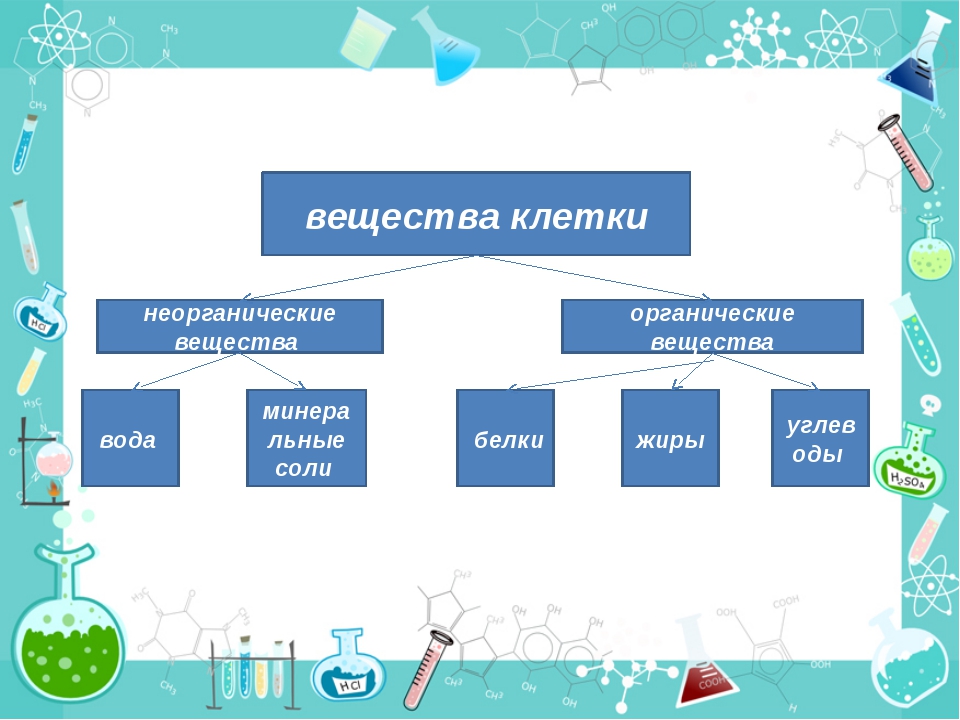 Рибонуклеотид состоит из одного из четырех азотистых оснований, но вместо тимина (Т) в РНК урацил (У), а вместо дезоксирибозы — рибоза.
Рибонуклеотид состоит из одного из четырех азотистых оснований, но вместо тимина (Т) в РНК урацил (У), а вместо дезоксирибозы — рибоза.
В клетке имеются разные виды РНК: тРНК (транспортная — транспортирует аминокислоты к рибосомам), и РНК (информационная — переносит информацию о последовательности аминокислот с ДНК на белок), рРНК (рибосомальная — входит в состав рибосом), митохондриальная РНК и др.
Перед делением клетки происходит удвоение ДНК для того, чтобы обеспечить нормальный набор генов в обеих образующихся клетках.
Удвоение ДНК получило название редупликации.
При редупликации водородные связи между комплементарными азотистыми основаниями аденином-тимином и гуанином-цитозином разрываются специальным ферментом. Нити, составляющие двойную спираль ДНК, расходятся, и к каждому нуклеотиду обеих нитей последовательно подстраиваются комплементарные нуклеотиды.
Подстраивающиеся нуклеотиды соединяются в две нити ДНК, каждая из которых представляет копию разошедшихся нитей ДНК.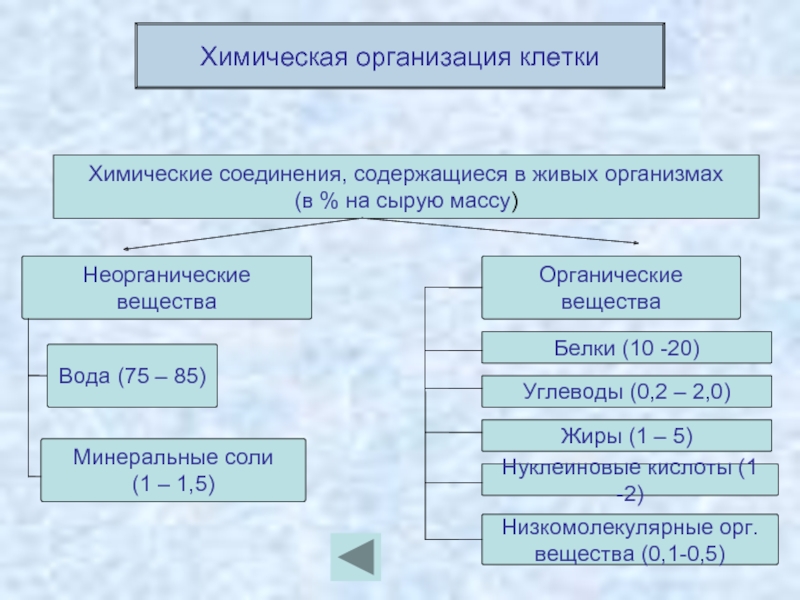 Таким образом, в результате редупликации возникают две одинаковые двойные спирали ДНК, состоящие из нити «материнской» молекулы и вновь синтезированной нити.
Таким образом, в результате редупликации возникают две одинаковые двойные спирали ДНК, состоящие из нити «материнской» молекулы и вновь синтезированной нити.
В процессе удвоения ДНК участвует много ферментов. Как на любой синтез в клетке, на редупликацию затрачивается энергия АТФ.
Органические и неорганические вещества
Организм человека и животных состоит из органических и неорганических веществ, что определяется тем в каком виде потребляются и усваиваются ими жидкости и продукты питания.
Органические и неорганические вещества имеют общие и различные свойства.
Неорганические вещества растворяются в воде и впитываются растениями . В растениях неорганические вещества меняют свое состояние и переходят в органическое вещество.
Это тот же самый химический элемент, но его связи меняются после того, как из жидкости он попадает в клетку растения, т.е.
в структуру растительного вещества. Органические вещества, попадающие с растительной пищей в организм человека и животных, идентичны химическим элементам живой материи.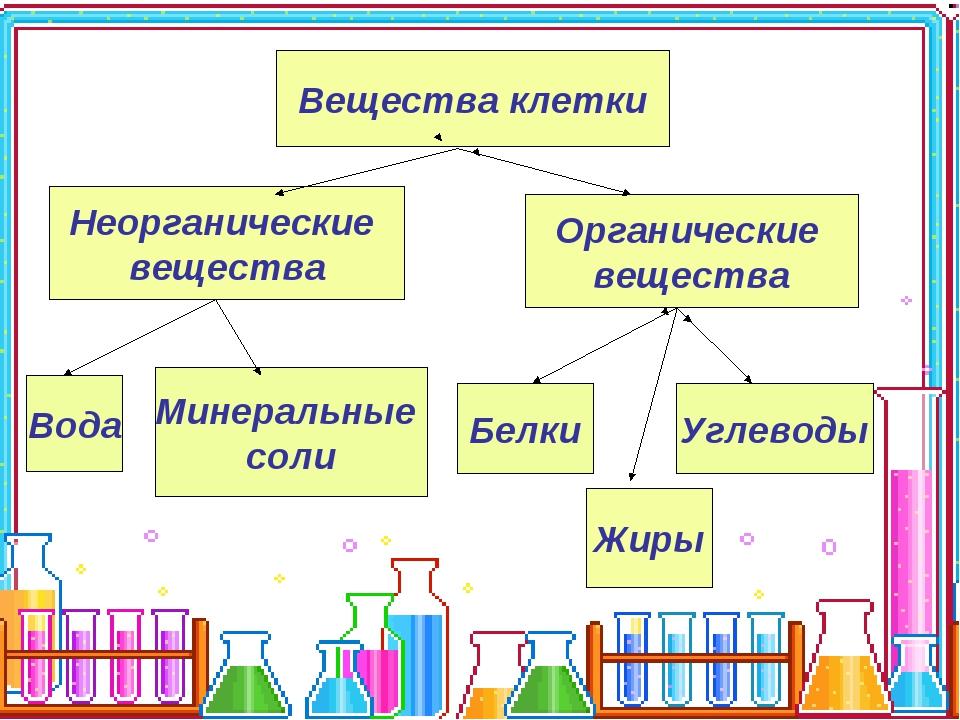 Усваиваясь организмом из растительной пищи, химические элементы сохраняют природные свойства живой материи, т.е. органическое состояние.
Усваиваясь организмом из растительной пищи, химические элементы сохраняют природные свойства живой материи, т.е. органическое состояние.
Живой организм может усваивать вещества из воздуха, жидкостей, растительной и животной пищи. С воздухом и водой живой организм получает в основном неорганические вещества, которые могут входить в состав клеток живого организма, если своевременно не были удалены из него.
Неорганические вещества отсутствуют в чистой дождевой воде, в дистиллированной воде и в свежеприготовленных соках ягод, фруктов и овощей. При хранении соков ягод, фруктов и овощей химические элементы утрачивают органическое состояние и переходят в неорганические вещества. Только растение имеет свойство длительное время, а именно до полного созревания, сохранять химические элементы в органическом состоянии.
Неорганические соединения.1.Вода, её свойства и значение для биологических процессов.
Вода — универсальный растворитель.
Она имеет высокую теплоёмкость и одновременно высокую для жидкостей теплопроводность. Эти свойства делают воду идеальной жидкостью для подержания теплового равновесия организма.
Эти свойства делают воду идеальной жидкостью для подержания теплового равновесия организма.
Благодаря полярности своих молекул вода выступает в роли стабилизатора структуры.
Вода — источник кислорода и водорода , она является основной средой где протекают биохимические и химические реакции, важнейшим реагентом и продуктом биохимических реакций.
Для воды характерна полная прозрачность в видимом участке спектра, что имеет значение для процесса фотосинтеза, транспирации.
Вода практически не сжимается, что очень важно для придания формы органам, создания тургора и обеспечения определённого положения органов и частей организма в пространстве.
Благодаря воде возможно осуществление осмотических реакций в живых клетках.
Вода — основное средство передвижения веществ в организме ( кровообращение, восходящий и нисходящий токи растворов по телу растения и т.д.).
Минеральные вещества.В составе живых организмов современными методами химического анализа обнаружено 80 элементов периодической системы.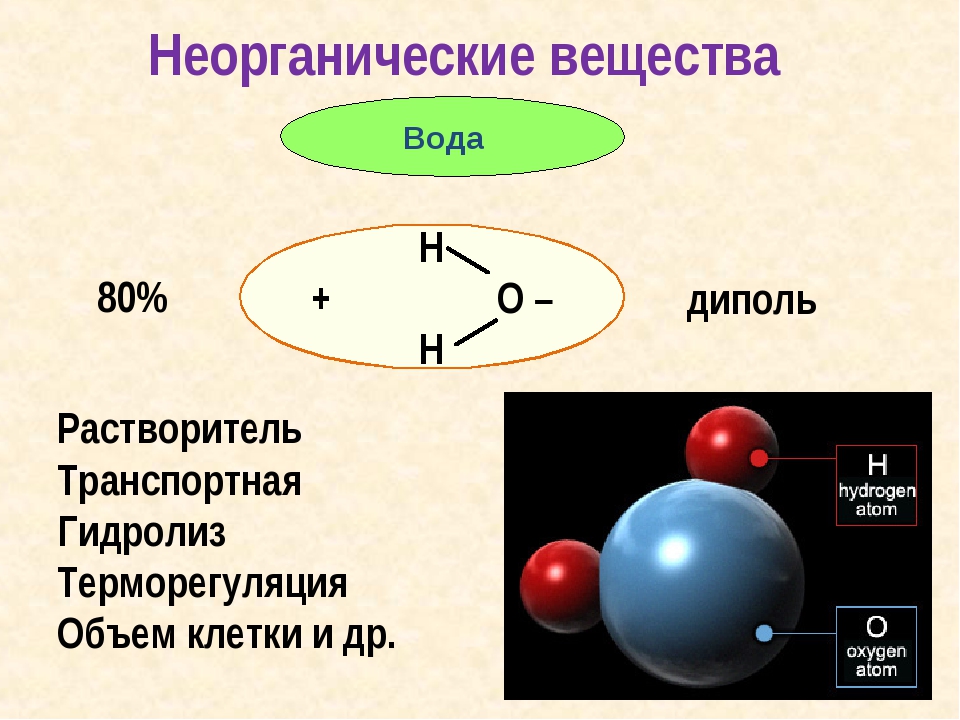
По количественному составу их разделяют на три основные группы.
Макроэлементы составляют основную массу органических и неорганических соединений, концентрация их колеблется от 60% до 0.001% массы тела (кислород, водород, углерод, азот, сера, магний, калий, натрий, железо и др.).
Микроэлементы — преимущественно ионы тяжёлых металлов.
Неорганические вещества и их роль в клетке
Вода. Из неорганических веществ, входящих в состав клетки, важнейшим является вода. Количество ее составляет от 60 до 95% общей массы клетки. Вода играет важнейшую роль в жизни клеток и живых организмов в целом. Помимо того что она входит в их состав, для многих организмов это еще и среда обитания.
Роль воды в клетке определяется ее уникальными химическими и
физическими свойствами, связанными главным образом с малыми
размерами молекул, с полярностью ее молекул и с их
способностью образовывать друг с другом водородные связи.
Вода как компонент биологических систем выполняет следующие важнейшие функции:
-
Вода—универсальный растворитель для полярных
веществ, например солей, Сахаров, спиртов, кислот и др.
Вещества, хорошо растворимые в воде, называются
гидрофильными. Когда вещество переходит в раствор,
его молекулы или ионы получают возможность двигаться более
свободно; соответственно возрастает реакционная
способность вещества. Именно по этой причине большая часть
химических реакций в клетке протекает в водных растворах.
Ее молекулы участвуют во многих химических реакциях,
например при образовании или гидролизе полимеров. В
процессе фотосинтеза вода является донором электронов,
источником ионов водорода и свободного кислорода.
- Неполярные вещества вода не растворяет и не смешивается с ними, поскольку не может образовывать с ними водородные связи. Нерастворимые в воде вещества называются гидрофобными. Гидрофобные молекулы или их части отталкиваются водой, а в ее присутствии притягиваются друг к другу. Такие взаимодействия играют важную роль в обеспечении стабильности мембран, а также многих белковых молекул, нуклеинов вых кислот и ряда субклеточных структур.
- Вода обладает высокой удельной теплоемкостью. Для разрыва водородных связей, удерживающих молекулы воды, требуется поглотить большое количество энергии. Это свойство обеспечивает поддержание теплового баланса организма при значительных перепадах температуры в окружающей среде. Кроме того, вода отличается высокой теплопроводностью, что позволяет организму поддерживать одинаковую температуру во всем его объеме.
- Вода характеризуется высокой теплотой парообразования, т. е. способностью молекул уносить с собой значительное количество тепла при одновременном охлаждении организма. Благодаря этому свойству воды, проявляющемуся при потоотделении у млекопитающих, тепловой одышке у крокодилов и других животных, транспирации у растений, предотвращается их перегрев.
- Для воды характерно исключительно высокое поверхностное натяжение. Это свойство имеет очень важное значение для адсорбционных процессов, для передвижения растворов по тканям (кровообращение, восходящий и нисходящий токи в растениях). Многим мелким организмам поверхностное натяжение позволяет удерживаться на воде или скользить по ее поверхности.
- Вода обеспечивает передвижение веществ в клетке и организме, поглощение веществ и выведение продуктов метаболизма.
- У растений вода определяет тургор клеток, а у некоторых животных выполняет опорные функции, являясь гидростатическим скелетом (круглые и кольчатые черви, иглокожие).
- Вода — составная часть смазывающих жидкостей (синовиальной — в суставах позвоночных, плевральной — в плевральной полости, перикардиальной — в околосердечной сумке) и слизей (облегчают передвижение веществ по кишечнику, создают влажную среду на слизистых оболочках дыхательных путей). Она входит в состав слюны, желчи, слез, спермы и др.
Минеральные соли. Неорганические вещества в клетке, кроме воды, прецспавлевы минеральными солями. Молекулы солей в водном растворе распадаются на катионы и анионы. Наибольшее значение имеют катионы (К+, Na+, Са2+, Mg:+, NH4+) и анионы (С1 , Н2Р04-, НР042- , НС03-, NO32—, SO42- ) Существенным является не только содержание, но и соотношение ионов в клетке.
Разность между количеством катионов и анионов на поверхности и внутри клетки обеспечивает возникновение потенциала действия, что лежит в основе возникновения нервного и мышечного возбуждения. Разностью концентрации ионов по разные стороны мембраны обусловлен активный перенос веществ через мембрану, а также преобразование энергии.
Анионы фосфорной кислоты создают фосфатную буферную систему, поддерживающую рН внутриклеточной среды организма на уровне 6,9.
Угольная кислота и ее анионы формируют бикарбонатную буферную систему, поддерживающую рН внеклеточной среды (плазма крови) на уровне 7,4.
Некоторые ионы участвуют в активации ферментов, создании осмотического давления в клетке, в процессах мышечного сокращения, свертывании крови и др.
Ряд катионов и анионов необходим дпясинтеза важных органических веществ (например, фосфолипидов, АТФ, нуклеоти-дов, гемоглобина, гемоцианина, хлорофилла и др.), а также аминокислот, являясь источниками атомов азота и серы.
Источник : Н.А. Лемеза Л.В.Камлюк Н.Д. Лисов «Пособие по биологии для поступающих в ВУЗы»
Химический состав клетки: неорганические вещества
Чем различается химический состав тел живой и неживой природы? Организмы состоят из клеток. Клетки разных организмов обладают сходным химическим составом. В таблице представлены основные химические элементы, обнаруженные в клетках живых организмов.
| Содержание химических элементов в клетке | ||||
| Кислород | 65-75 | Кальций | 0,04-2,00 | |
| Углевод | 15-18 | Магний | 0,02-0,03 | |
| Водород | 8-10 | Натрий | 0,02-0,03 | |
| Азот | 1,5-3,0 | Железо | 0,01-0,015 | |
| Фосфор | 0,2-1,0 | Цинк | 0,0003 | |
| Азот | 1,5-3,0 | Железо | 0,01-0,015 | |
| Калий | 0,15-0,4 | Медь | 0,0002 | |
| Сера | 0,15-0,2 | Иод | 0,0001 | |
| Хлор | 0,05-0,10 | Фтор | 0,0001 | |
По содержанию в клетке можно выделить три группы элементов. В первую группу входят кислород, углерод, водород и азот. На их долю приходится почти 98% всего состава клетки. Во вторую группу входят калий, натрий, кальций, сера, фосфор, магний, железо, хлор. Их содержание в клетке составляет десятые и сотые доли процента. Элементы этих двух групп относят к макроэлементам (от греч. macros — большой).
Остальные элементы, представленные в клетке сотыми и тысячными долями процента, входят в третью группу. Это микроэлементы (от греч. micros — малый).
Каких-либо элементов, присущих только живой природе, в клетке не обнаружено. Все перечи 1000 сленные химические элементы входят и в состав неживой природы. Это указывает на единство живой и неживой природы.
Недостаток какого-либо элемента может привести к заболеванию и даже гибели организма, так как каждый элемент играет определенную роль. Макроэлементы первой группы составляют основу биополимеров — белков, углеводов, нуклеиновых кислот, а также липидов, без которых жизнь невозможна. Сера входит в состав некоторых белков, фосфор — в состав нуклеиновых кислот, железо — в состав гемоглобина, а магний — в состав хлорофилла. Кальций играет важную роль в обмене веществ.
Часть химических элементов, содержащихся в клетке, входит в состав неорганических веществ — минеральных солей и воды.
Минеральные соли находятся в клетке, как правило, в виде катионов (K+, Na+, Ca2+, Mg2+) и анионов (HPO42-, H2PO4—, Сl—, HCO3), соотношение которых определяет важную для жизнедеятельности клеток кислотность среды. (У многих клеток среда слабощелочная и ее pH почти не изменяется, так как в ней постоянно поддерживается определенное соотношение катионов и анионов.)
Из неорганических веществ в живой природе огромную роль играет вода.
Без воды жизнь невозможна. Она составляет значительную массу большинства клеток. Много воды содержится в клетках мозга и эмбрионов человека: воды более 80%; в клетках жировой ткани — всего 40%. К старости содержание воды в клетках снижается. Человек, потерявший 20% воды, погибает.
Уникальные свойства воды определяют ее роль в организме. Она участвует в теплорегуляции, которая обусловлена высокой теплоемкостью воды — потреблением большого количества энергии при нагревании.
Чем определяется высокая теплоемкость воды?
B молекуле воды атом кислорода ковалентно связан с двумя атомами водорода. Молекула воды полярна, так как атом кислорода имеет частично отрицательный заряд, а каждый из двух атомов водорода имеет частично положительный заряд. Между атомом кислорода одной молекулы воды и атомом водорода другой молекулы образуется водородная связь. Водородные связи обеспечивают соединение большого числа молекул воды. При нагревании воды значительная часть энергии расходуется на разрыв водородных связей, что и определяет ее высокую теплоемкость.
Вода — хороший растворитель. Благодаря полярности ее молекулы взаимодействуют с положительно и отрицательно заряженными ионами, способствуя тем самым растворению вещества. По отношению к воде все вещества клетки делятся на гидрофильные и гидрофобные.
Гидрофильными (от греч. hidor — вода и fileo — люблю) называют вещества, которые растворяются в воде. К ним относят ионные соединения (например, соли) и некоторые неионные соединения (например, сахара).
Гидрофобными (от греч. hidor — вода и fobos — страх) называют вещества, нерастворимые в воде. К ним относят, например, липиды.
Вода играет большую роль в химических реакциях, протекающих в клетке в водных растворах. Она растворяет ненужные организму продукты обмена веществ и тем самым способствует выводу их из организма. Большое содержание воды в клетке придает ей упругость. Вода способствует перемещению различных веществ внутри клетки или из клетки в клетку.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
6. Неорганические вещества клетки. Биология. Общая биология. 10 класс. Базовый уровень
6. Неорганические вещества клетки
Вспомните!
Что такое неорганические вещества?
Какими физическими и химическими свойствами обладает вода?
Что называют ионами, анионами и катионами?
Значительная часть соединений, входящих в состав клетки, встречается в больших количествах только в живой природе. Это органические вещества. Однако есть соединение, которое одинаково характерно как для живой, так и для неживой природы. Это вода (рис. 9).
Вода. Считается, что миллиарды лет тому назад в первичном океане на нашей планете зародилась жизнь и вся дальнейшая эволюция природы была неразрывно связана с водой. Уникальные свойства этой относительно небольшой молекулы позволили нашей планете стать такой, какая она есть сейчас. Все жители Земли, растения и животные, грибы и бактерии, обязаны воде жизнью. В чём же заключается особенность этого вещества?
Молекула воды – это диполь, т. е. на одной стороне молекулы сосредоточен частичный положительный заряд, а на другом конце – частичный отрицательный (рис. 10). Именно эта особенность строения молекулы воды определяет её свойство универсального растворителя. Любые вещества, имеющие заряженные группы, растворяются в воде (рис. 11). Такие соединения называют гидрофильными (от греч. hydros – вода и phileo – люблю). Большинство веществ, присутствующих в клетке, относится к этой группе, например соли, аминокислоты, сахара, белки, простые спирты. Когда вещество переходит в раст вор, его реакционная способность увеличивается. Однако есть соединения, которые в воде растворяются очень плохо или вовсе не растворяются. Такие вещества называют гидрофобными (от греч. hydros – вода и phobos – страх), к ним относятся, в частности, жиры (липиды), жироподобные вещества (липоиды), полисахариды и некоторые белки.
Рис. 9. Вещества, входящие в состав живых организмов
Рис. 10. Диполь. Схематичное изображение молекулы воды
Рис. 11. Растворение в воде хлорида натрия
Большинство процессов, которые протекают внутри клетки, могут осуществляться только в водной среде. Но вода не только обеспечивает условия химических реакций, она сама участвует во многих метаболических процессах. В реакциях гидролиза[1] белки расщепляются до аминокислот, а крахмал – до глюкозы. Высвобождение энергии в организме происходит при взаимодействии с водой главной энергетической молекулы – АТФ. Вода участвует в реакциях фотосинтеза и в синтезе АТФ в митохондриях.
Отрицательные и положительные полюсы разных молекул воды притягиваются друг к другу, что приводит к образованию водородных связей. Наличие этих связей придаёт воде структурированность, что объясняет многие её необычные свойства: высокую температуру кипения, плавления, высокую теплоёмкость.
Сочетание высокой теплоёмкости и теплопроводности делает воду идеальной жидкостью для поддержания теплового равновесия. Тепло быстро и равномерно распределяется между всеми частями организма.
Рис. 12. Уменьшение количества воды в клетках приводит к увяданию растений
Высокая интенсивность испарения приводит к быстрой потере тепла и предохраняет от перегрева: испарение у растений и потоотделение у животных являются защитными реакциями и позволяют при минимальной потере воды существенно снизить температуру тела.
Практически полная несжимаемость воды обеспечивает поддержание формы клетки (рис. 12), а вязкость придаёт воде свойства смазки.
Высокая сила поверхностного натяжения воды обеспечивает восходящий и нисходящий транспорт веществ в растениях и движение крови в капиллярах. Многие мелкие организмы легко удерживаются и передвигаются по поверхности воды благодаря наличию плёнки поверхностного натяжения.
Полость тела круглых червей заполнена жидкостью, находящейся под давлением и образующей гидроскелет, что придаёт этим организмам постоянную форму. Свойство несжимаемости воды используется медузами, чьё тело на 95 % состоит из этого вещества.
Жидкость в подчерепном пространстве предохраняет от сотрясения головной мозг, а околоплодные воды в матке защищают и поддерживают плод у млекопитающих.
Жидкость в околосердечной сумке – перикарде – облегчает движения сердца при его сокращениях, а в плевральной полости снижает трение при дыхании.
Благодаря высокому тургорному давлению растительные ткани обладают упругостью, а стебли травянистых растений поддерживают вертикальное положение.
Соли. Важную роль в жизнедеятельности клетки играют минеральные соли, представленные в основном катионами калия (K+), натрия (Na+), кальция (Ca2+), магния (Mg2+) и анионами соляной (Сl–), угольной (HCO3–), фосфорной (HPO42–, H2PO4–) и некоторых других кислот. Многие ионы неравномерно распределены между клеткой и окружающей средой, так, например, в цитоплазме концентрация ионов калия в 20–30 раз выше, чем снаружи, а концентрация ионов натрия внутри клетки, наоборот, в 10 раз ниже. Именно благодаря существованию подобных градиентов концентраций осуществляются многие важные процессы жизнедеятельности, такие как возбуждение нервных клеток, сокращение мышечных волокон. После гибели клетки концентрация катионов снаружи и внутри быстро выравнивается.
Анионы слабых кислот (HCO3–, HPO42–) участвуют в поддержании кислотно-щелочного баланса (рН) клетки. Анионы фосфорной кислоты необходимы для синтеза нуклеотидов и нуклеиновых кислот.
Минеральные соли в живых организмах находятся не только в виде ионов, но и в твёрдом состоянии. Кости нашего скелета в основном состоят из фосфатов кальция и магния. Раковины моллюсков формируются из карбоната кальция.
Вопросы для повторения и задания
1. Каковы особенности пространственной организации молекул воды, обусловливающие её биологическое значение?
2. В чём заключается биологическая роль воды?
3. Какие вещества называют гидрофильными; гидрофобными? Приведите примеры.
4. Какие вещества поддерживают pH клетки на постоянном уровне? Объясните, почему жизнедеятельность клетки возможна только при определённом значении pH.
5. Расскажите о роли минеральных солей в жизнедеятельности клетки.
Подумайте! Выполните!
1. Почему при работе в горячих цехах для утоления жажды рекомендуют пить минеральную или подсоленную воду?
2. Известно, что ионный состав внутреннего содержимого клетки имеет большое сходство с ионным составом морской воды. Какой вывод можно из этого сделать?
3. Как изменяется количество воды в теле человека с возрастом?
4. Вспомните из курса биологии растений, какие структуры покровной ткани растений обеспечивают испарение воды. Каков принцип их работы?
5. Выполните исследовательскую работу «Изучение процесса осмоса в растительных клетках». Исследуйте влияние гипо– и гипертонических растворов на мембрану типичной вакуолизированной растительной клетки.
Работа с компьютером
Обратитесь к электронному приложению. Изучите материал и выполните задания.
Повторите и вспомните!
Растения
Поглощение корнями воды и минеральных веществ. Большая часть воды с растворёнными в ней минеральными веществами поглощается корнем с помощью корневых волосков в зоне всасывания. Всасывание воды происходит пассивно, посредством осмоса, так как концентрация осмотически активных веществ (минеральных солей и органических веществ) в клетках корня больше, чем в почвенном растворе. Интенсивность поглощения воды корневыми волосками называют сосущей силой (S). Она равна разнице между осмотическим (P) и тургорным (T) давлением: S = P – T. Когда осмотическое давление равно тургорному (P = T), то S = 0 и вода перестаёт поступать в корневой волосок. Если же концентрация веществ в почвенном растворе будет выше, чем внутри клеток корня, то вода будет выходить из клеток и растение завянет (см. рис. 12). Такое явление наблюдается при засухе или при неумеренном внесении удобрения в почву.
Животные
Первично– и вторичноводные животные. Кроме систематического деления на классы, подтип Позвоночные обычно условно подразделяют ещё на две группы, не имеющие таксономического значения: первичноводные (анамнии) и первичноназемные (амниоты). Жизнь и размножение животных, относящихся к анамниям, неразрывно связаны с водой. В качестве органов дыхания у них в течение всей жизни или на личиночной стадии функционируют жабры. При развитии оплодотворённой яйцеклетки не образуются защитные зародышевые оболочки. К этой группе относят классы Круглоротые, Хрящевые рыбы, Костные рыбы, Земноводные.
Размножение первичноназемных животных не связано с водой. Жаберного дыхания нет ни на одной из жизненных стадий. При развитии зародыша формируются зародышевые оболочки. К группе амниот относят классы Пресмыкающиеся, Птицы, Млекопитающие.
Вторичноводными называют амниот, которые вернулись к обитанию в воде. Такими животными, например, являются китообразные, которые полностью перешли к водному образу жизни. Их передние конечности превратились в ласты, задние – редуцированы.
Человек
Водный и минеральный обмены. Ткани взрослого человека содержат в среднем до 60 % воды. В сутки организм человека теряет около 2,0–2,5 л воды. В составе мочи выводится 1,2–1,5 л, с потом – около 0,5–0,7 л, с парами воздуха через лёгкие – 0,3–0,5 л, через кишечник с калом – около 0,1 л. Столько же воды в сумме организм получает с питьём (1,0 л) и пищей (1,0 л), а часть воды образуется при обмене белков, жиров, углеводов (0,3–0,4 л). Для нормальной жизнедеятельности важно, чтобы поступление воды полностью покрывало её расход. Отношение количества потреблённой воды к количеству выделенной называют водным балансом. Обезвоживание организма приводит к быстрой гибели, без воды человек может прожить не более 5–6 дней. Однако обильное избыточное питьё тоже вредно, оно повышает нагрузку на организм и нарушает работу сердца и почек.
Минеральные соли поступают в организм человека с пищей и водой. И хотя они составляют не более 4 % от массы тела, набор их очень разнообразен. В сутки в организм человека должно поступать не менее 4,4 г натрия, 5 г хлора, 2 г калия, 1 г кальция, 1 г фосфора, 0,2 г железа. Из различных минеральных солей специально в пищу мы добавляем только поваренную соль (NaCl), около 10 г в сутки. Все остальные минеральные соли содержатся в натуральных продуктах. Вода и растворённые в ней минеральные соли всасываются по всему желудочно-кишечному тракту, но больше всего в тонком кишечнике.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРесМинеральные вещества | Tervisliku toitumise informatsioon
В человеческом организме установлено наличие более 70 химических элементов. Достоверно установлена потребность в более чем 20 биоэлементах. Для обеспечения достаточного количества этих элементов крайне важно, чтобы питание было разнообразным.
Встречающиеся в организме минеральные вещества можно условно разделить на две группы:
- Содержание макроэлементов в организме составляет более 0,01%. Ими являются фосфор (P), кальций (Ca), натрий (Na), калий (K), магний (Mg), сера (S), хлор (Cl) (см Таблица 1).
- Содержание микроэлементов – менее 0,01%, у некоторых даже 0,00001.
Потребность в некоторых микроэлементах установлена, это железо (Fe), цинк (Zn), медь (Cu), йод (I), селен (Se) , марганец (Mn), молибден (Mo), фтор (F), хром (Cr), кобальт (Co), кремний (Si), ванадий (V), бор (B), никель (Ni), мышьяк (As) и олово (Sn).
Помимо них в организме обнаружен целый ряд элементов, функция которых пока не ясна, их появление в организме может быть обусловлено загрязнением окружающей среды и частым соприкосновением с ними. Например, люди, работающие в теплицах, постоянно контактируют с химическими веществами, различные элементы могут быть признаком разного рода заболеваний. В числе таких элементов алюминий (Al), стронций (Sr), барий (Ba), рубидий (Rb), палладий (Pd), бром (Br).
В организм могут попадать и тяжелые, т.е. ядовитые металлы, такие как кадмий (Cd), ртуть (Hg) или свинец (Pb).
Минеральные вещества в нашем организме являются важными компонентами скелета, биологических жидкостей и энзимов и способствуют передаче нервных импульсов.
Люди и животные получают различные биологические элементы из пищи, воды и окружающего воздуха, самостоятельно синтезировать минеральные вещества живые организмы не могут. В растениях минеральные вещества накапливаются из почвы, и их количество зависит от места произрастания и наличия удобрений. В питьевой воде также имеются минеральные вещества, и их содержание зависит от места, откуда получают воду.
Несмотря на то, что человек нуждается в небольших количествах минеральных веществ (макроэлементов в миллиграммах и граммах, микроэлементов – в милли- и микрограммах), в его организме, тем не менее, отсутствуют достаточные запасы минеральных веществ, чтобы нормально перенести их долговременный дефицит. Потребность в минеральных веществах зависит также от возраста, пола и прочих обстоятельств (см Таблица 2). Например, повышенная потребность в железе у женщин связана с менструациями и беременностью, а спортсменам требуется больше натрия, потому что он интенсивно выводится с потом.
Чрезмерные количества минеральных веществ могут привести к сбоям в работе организма, потому что, будучи компонентами биоактивных соединений, они оказывают влияние на регуляторные функции. Получать чрезмерные количества минеральных веществ (за исключением натрия) с пищей практически невозможно, однако это может произойти при чрезмерном употреблении биологически активных добавок и обогащенных минеральными веществами продуктов.
Усвоению минеральных веществ могут препятствовать:
- злоупотребление кофе,
- употребление алкоголя,
- курение,
- некоторые лекарства,
- некоторые противозачаточные таблетки,
- определенные вещества, встречающиеся в некоторых продуктах, например, в ревене и шпинате.
Потери минеральных веществ при тепловой обработке продуктов питания значительно меньше, чем потери витаминов. Однако при рафинировании или очистке часть минеральных веществ удаляется. Поэтому важно есть больше цельнозерновых и нерафинированных продуктов. Минеральные вещества могут образовывать соединения с другими веществами, содержащимися в продуктах питания (например, с оксалатами в ревене), в результате чего организм не может их усвоить.
Таблица 1
Названия и источники важнейших минеральных веществ
Обозначение | Название | Лучшие источники * |
Макроэлементы | ||
Na | натрий | поваренная соль (NaCl), готовая еда, сыр, ржаной хлеб, консервы, мясные продукты, оливки, картофельные чипсы |
K | калий | растительные продукты: сушеные фрукты и ягоды, орехи, семена, топинамбур, картофель, редис, капуста, зеленые овощи, мука «Кама», свёкла, банан, ржаной хлеб, смородина, томаты |
Ca | кальций | молоко и молочные продукты (особенно сыр), миндаль, орехи, семена, рыба (с костями), шпинат |
Mg | магний | орехи, семена, мука «Кама», ржаной хлеб, шпинат, бобовые, греча, цельнозерновые продукты, свинина, говядина и курятина, банан, брокколи |
P | фосфор | семена, орехи, молочные продукты (особенно сыр), печень, птица, говядина, ржаной хлеб, рыба, цельнозерновые продукты, бобовые |
S | сера | продукты с белками, содержащими аминокислоты метионин (зерновые, орехи) и цистеин (мясо, рыба, соевые бобы, зерновые) |
Cl | хлор | поваренная соль |
Микроэлементы | ||
Fe | железо | печень, кровяная колбаса, семечки, яйца, изюм, ржаной хлеб, нежирная говядина и свинина, цельнозерновые продукты, греча, клубника |
Zn | цинк | печень, мясо, мука «Кама», семена, орехи, сыр, ржаной хлеб, бобовые, дары моря (крабы, салака), цельнозерновые продукты, яйца |
Cu | медь | печень, какао-порошок, мясо, бобовые, цельнозерновые продукты, семена, орехи, греча, ржаной хлеб, лосось, авокадо, свёкла, дары моря |
I | йод | йодированная соль, рыба и другие дары моря, сыр, яйца, некоторые виды ржаного хлеба и йогурта |
Se | селен | арахис, печень, рыба и дары моря, семена подсолнечника, мясо |
* Количество, содержащееся в 100 г продукта, покрывает не менее 10% суточной потребности взрослой женщины
Таблица 2
Рекомендуемые в зависимости от возраста суточные нормы потребления важнейших минеральных веществ
Возраст | Натрий, мг | Кальций, мг | Калий, г | Магний, мг | Железо, мг | Цинк, мг | Медь, мг | Йод, мкг | Селен, мкг |
Дети |
|
|
|
|
|
|
|
|
|
6–11 месяцев | до 650 | 550 | 1,1 | 80 | 8 | 5 | 0,3 | 60 | 15 |
12–23 месяца | до 830 | 600 | 1,4 | 85 | 8 | 6 | 0,3 | 90 | 25 |
2–5 лет | до 1580 | 600 | 1,8 | 120 | 8 | 6 | 0,4 | 90 | 30 |
6–9 лет | до 1580 | 700 | 2 | 200 | 9 | 7 | 0,5 | 120 | 30 |
Женщины |
|
|
|
|
|
|
|
|
|
10–13 лет | до 2400 | 900 | 2,9 | 300 | 11 | 8 | 0,7 | 150 | 40 |
14–17 лет | до 2400 | 900 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
18–30 лет | до 2400 | 900 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
31–60 лет | до 2400 | 800 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
61–74 лет | до 2400 | 800 | 3,1 | 320 | 10 | 9 | 0,9 | 150 | 50 |
> 75 лет | до 2400 | 800 | 3,1 | 320 | 10 | 9 | 0,9 | 150 | 50 |
Беременные | до 2400 | 900 | 3,1 | 360 | 15 | 10 | 1 | 175 | 60 |
Кормящие матери | до 2400 | 900 | 3,1 | 360 | 15 | 11 | 1,3 | 200 | 60 |
Мужчины |
|
|
|
|
|
|
|
|
|
10–13 лет | до 2400 | 900 | 3,3 | 300 | 11 | 11 | 0,7 | 150 | 40 |
14–17 лет | до 2400 | 900 | 3,5 | 380 | 11 | 12 | 0,9 | 150 | 60 |
18–30 лет | до 2400 | 900 | 3,5 | 380 | 10 | 9 | 0,9 | 150 | 60 |
31–60 лет | до 2400 | 800 | 3,5 | 380 | 10 | 9 | 0,9 | 150 | 60 |
61–74 лет | до 2400 | 800 | 3,5 | 380 | 10 | 10 | 0,9 | 150 | 60 |
> 75 лет | до 2400 | 800 | 3,5 | 380 | 10 | 10 | 0,9 | 150 | 60 |
* Для 18–20-летних рекомендуемая суточная доза составляет 900 мг кальция и 700 мг фосфора.
** Потребность в железе зависит от потери железа при менструациях. Для женщин в постменопаузе рекомендуемая дневная доза железа составляет 10 мг.
*** Для достижения сбалансированного содержания железа во время беременности в организме женщины должны иметься запасы железа как минимум на 500 мг больше, чем до беременности. В двух последних триместрах беременности, в зависимости от уровня железа в организме, может потребоваться дополнительный прием железа.
**** На самом деле, селена можно потреблять больше указанной в таблице рекомендованной дозы, поскольку селен по-разному всасывается из разных источников и происходит постоянное обеднение им поверхности, т.е. таблицы питательной ценности продуктов «не поспевают» за истинным положением дел (в них зачастую указываются значения больше реальных).
Максимальные разовые безопасные дозы минеральных веществ и пищевых добавок:
| Минеральное вещество | Доза |
|---|---|
| Кальций (мг) | 2500 |
| Фосфор (мг) | 3000 |
| Калий (мг) | 3,7* |
| Железо (мг) | 60 |
| Цинк (мг) | 25 |
| Медь (мг) | 5 |
| Йод (мкг) | 600 |
| Селен (мкг) | 300 |
* Только из биоактивных добавок или обогащенной пищи
2.4 Неорганические соединения, необходимые для функционирования человека — анатомия и физиология
Цели обучения
К концу этого раздела вы сможете:
- Сравнить и сопоставить неорганические и органические соединения
- Определите свойства воды, которые делают ее жизненно важной
- Объясните роль солей в функционировании организма
- Различайте кислоты и основания и объясняйте их роль в pH
- Обсудить роль буферов в поддержании гомеостаза pH в организме
Концепции, которые вы изучили до сих пор в этой главе, управляют всеми формами материи и будут работать в качестве основы как для геологии, так и для биологии.Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения бывают либо неорганическими, либо органическими.
- Неорганическое соединение — это вещество, не содержащее ни углерода, ни водорода. Многие неорганические соединения действительно содержат атомы водорода, такие как вода (H 2 O) и соляная кислота (HCl), вырабатываемая вашим желудком. Напротив, только несколько неорганических соединений содержат атомы углерода.Двуокись углерода (CO 2 ) — один из немногих примеров.
- Органическое соединение — это вещество, содержащее как углерод, так и водород. Органические соединения синтезируются ковалентными связями в живых организмах, в том числе в организме человека. Вспомните, что углерод и водород являются вторым и третьим по распространенности элементами в вашем теле. Вскоре вы обнаружите, как эти два элемента сочетаются в пищевых продуктах, которые вы едите, в соединениях, составляющих структуру вашего тела, и в химических веществах, которые подпитывают ваше функционирование.
В следующем разделе рассматриваются четыре группы неорганических соединений, необходимых для жизни: вода, соли, кислоты и основания. Органические соединения рассматриваются далее в этой главе.
Вода
До 70 процентов веса взрослого человека составляет вода. Эта вода содержится как внутри клеток, так и между клетками, из которых состоят ткани и органы. Несколько функций делают воду незаменимой для жизнедеятельности человека.
Вода как смазка и амортизатор
Вода является основным компонентом многих смазочных жидкостей организма.Подобно тому, как масло смазывает петлю двери, вода в синовиальной жидкости смазывает работу суставов тела, а вода в плевральной жидкости помогает легким расширяться и отскакивать при дыхании. Водянистая жидкость помогает пище течь по пищеварительному тракту и обеспечивает отсутствие трения при движении соседних органов брюшной полости.
Вода также защищает клетки и органы от физических травм, смягчая, например, мозг внутри черепа и защищая нежную нервную ткань глаз.Вода также смягчает развивающийся плод в утробе матери.
Вода как теплоотвод
Радиатор — это вещество или объект, которые поглощают и рассеивают тепло, но не испытывают соответствующего повышения температуры. В организме вода поглощает тепло, выделяемое в результате химических реакций, без значительного повышения температуры. Более того, когда температура окружающей среды стремительно растет, вода, хранящаяся в организме, помогает ему сохранять прохладу. Этот охлаждающий эффект возникает, когда теплая кровь из ядра тела течет к кровеносным сосудам под кожей и переносится в окружающую среду.В то же время потовые железы выделяют теплую воду вместе с потом. Когда вода испаряется в воздух, она уносит тепло, а затем более холодная кровь с периферии циркулирует обратно к сердцевине тела.
Вода как компонент жидких смесей
Смесь — это комбинация двух или более веществ, каждое из которых сохраняет свою химическую идентичность. Другими словами, составляющие вещества не связаны химически в новое, более крупное химическое соединение. Эту концепцию легко представить, если вы подумаете о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их в миске, очевидно, что они не связываются с образованием нового соединения.Воздух в помещении, которым вы дышите, представляет собой газовую смесь, содержащую три отдельных элемента — азот, кислород и аргон — и одно соединение — диоксид углерода. Есть три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента; это растворы, коллоиды и суспензии.
Чтобы клетки тела выжили, они должны оставаться влажными в жидкости на водной основе, называемой раствором. В химии жидкий раствор состоит из растворителя, который растворяет вещество, называемое растворенным веществом.Важной характеристикой растворов является их однородность; то есть молекулы растворенного вещества равномерно распределяются по всему раствору. Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды. Соотношение сахара и воды в левой части стакана будет таким же, как соотношение сахара и воды в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара к воде изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.
Вода считается «универсальным растворителем», и поэтому считается, что жизнь не может существовать без воды. Вода, безусловно, является самым распространенным растворителем в организме; практически все химические реакции организма происходят между соединениями, растворенными в воде. Поскольку молекулы воды полярны, с областями положительного и отрицательного электрического заряда, вода легко растворяет ионные соединения и полярные ковалентные соединения. Такие соединения называют гидрофильными или «водолюбивыми».Как было сказано выше, сахар хорошо растворяется в воде. Это связано с тем, что молекулы сахара содержат области полярных водородно-кислородных связей, что делает его гидрофильным. Неполярные молекулы, которые с трудом растворяются в воде, называются гидрофобными или «водобоязненными».
Концентрации растворенных веществ
В химии описаны различные смеси растворенных веществ и воды. Концентрация данного растворенного вещества — это количество частиц этого растворенного вещества в данном пространстве (кислород составляет около 21 процента атмосферного воздуха).В кровотоке человека концентрация глюкозы обычно измеряется в миллиграммах (мг) на децилитр (дл), а у здорового взрослого человека в среднем составляет около 100 мг / дл. Другой метод измерения концентрации растворенного вещества — его молярность, которая составляет моль (M) молекул на литр (L). Моль элемента — это его атомный вес, а моль соединения — это сумма атомных весов его компонентов, называемая молекулярной массой. Часто используемый пример — вычисление моля глюкозы по химической формуле C6h22O6.Согласно периодической таблице, атомный вес углерода (C) составляет 12,011 грамма (г), а в глюкозе шесть атомов углерода, что дает общий атомный вес 72,066 г. Проведя те же вычисления для водорода (H) и кислорода (O), молекулярная масса равна 180,156 г («грамм молекулярной массы» глюкозы). Когда вода добавляется для получения одного литра раствора, у вас есть один моль (1М) глюкозы. Это особенно полезно в химии из-за отношения родинок к «числу Авогадро». В моль любого раствора столько же частиц: 6.02 × 10 23 . Многие вещества в кровотоке и других тканях тела измеряются в тысячных долях моля или миллимолях (мМ).
Коллоид представляет собой смесь, которая чем-то похожа на тяжелый раствор. Частицы растворенного вещества состоят из крошечных сгустков молекул, достаточно больших, чтобы сделать жидкую смесь непрозрачной (поскольку частицы достаточно большие, чтобы рассеивать свет). Знакомые примеры коллоидов — молоко и сливки. В щитовидной железе гормон щитовидной железы хранится в виде густой белковой смеси, также называемой коллоидом.
Суспензия представляет собой жидкую смесь, в которой более тяжелое вещество временно суспендировано в жидкости, но со временем оседает. Такое отделение частиц от суспензии называется седиментацией. Пример седиментации происходит в анализе крови, который устанавливает скорость седиментации или скорость седиментации. Тест измеряет, как быстро красные кровяные тельца в пробирке выделяются из водянистой части крови (известной как плазма) в течение определенного периода времени. Быстрое осаждение клеток крови обычно не происходит в здоровом организме, но некоторые заболевания могут вызывать слипание клеток крови, и эти тяжелые скопления клеток крови оседают на дно пробирки быстрее, чем нормальные клетки крови.
Роль воды в химических реакциях
Два типа химических реакций включают образование или потребление воды: дегидратационный синтез и гидролиз.
- При дегидратационном синтезе один реагент отдает атом водорода, а другой реагент отдает гидроксильную группу (ОН) при синтезе нового продукта. При образовании их ковалентной связи в качестве побочного продукта выделяется молекула воды (рис. 2.4.1). Это также иногда называют реакцией конденсации.
- При гидролизе молекула воды разрушает соединение, разрывая его связи. Сама вода расщепляется на H и OH. Одна часть разорванного соединения затем связывается с атомом водорода, а другая часть связывается с гидроксильной группой.
Эти реакции обратимы и играют важную роль в химии органических соединений (о чем мы поговорим ниже).
Рисунок 2.4.1 — Дегидратационный синтез и гидролиз: Мономеры, основные единицы для построения более крупных молекул, образуют полимеры (два или более химически связанных мономера).(а) При дегидратационном синтезе два мономера ковалентно связаны в реакции, в которой один отдает гидроксильную группу, а другой — атом водорода. Молекула воды выделяется как побочный продукт во время реакций дегидратации. (b) При гидролизе ковалентная связь между двумя мономерами расщепляется путем присоединения атома водорода к одному и гидроксильной группы к другому, что требует участия одной молекулы воды.Соли
Напомним, что соли образуются, когда ионы образуют ионные связи.В этих реакциях один атом отдает один или несколько электронов и, таким образом, становится положительно заряженным, тогда как другой атом принимает один или несколько электронов и становится отрицательно заряженным. Теперь вы можете определить соль как вещество, которое при растворении в воде диссоциирует на ионы, отличные от H + или OH —. Этот факт важен для отличия солей от кислот и оснований, обсуждаемых далее.
Типичная соль NaCl полностью диссоциирует в воде (рисунок 2.4.2). Положительные и отрицательные области молекулы воды (концы водорода и кислорода соответственно) притягивают отрицательные ионы хлорида и положительные ионы натрия, отталкивая их друг от друга.Опять же, в то время как неполярные и полярные ковалентно связанные соединения распадаются на молекулы в растворе, соли диссоциируют на ионы. Эти ионы являются электролитами; они способны проводить электрический ток в растворе. Это свойство имеет решающее значение для функции ионов при передаче нервных импульсов и стимулировании сокращения мышц.
Рисунок 2.4.2 — Диссоциация хлорида натрия в воде: Обратите внимание, что кристаллы хлорида натрия диссоциируют не на молекулы NaCl, а на катионы Na + и анионы Cl — , каждый из которых полностью окружен молекулами воды.Многие другие соли важны для организма. Например, соли желчных кислот, вырабатываемые печенью, помогают расщеплять пищевые жиры, а соли фосфата кальция образуют минеральную часть зубов и костей.
Кислоты и основания
Кислоты и основания, как и соли, диссоциируют в воде с образованием электролитов. Кислоты и основания могут сильно изменить свойства растворов, в которых они растворены.
Кислоты
Кислота — это вещество, выделяющее ионы водорода (H + ) в растворе (Рисунок 2.4.3 a ). Поскольку у атома водорода есть только один протон и один электрон, положительно заряженный ион водорода — это просто протон. Этот одиночный протон с большой вероятностью участвует в химических реакциях. Сильные кислоты — это соединения, которые выделяют весь свой H + в растворе; то есть они полностью ионизируются. Соляная кислота (HCl), которая выделяется из клеток слизистой оболочки желудка, является сильной кислотой, поскольку она выделяет весь свой H + в водянистую среду желудка.Эта сильная кислота помогает пищеварению и убивает микробы, попавшие в организм. Слабые кислоты не ионизируются полностью; то есть некоторые из их ионов водорода остаются связанными внутри соединения в растворе. Пример слабой кислоты — уксус или уксусная кислота; он называется ацетатом после того, как отдает протон.
Рисунок 2.4.3. — Кислоты и основания: (a) В водном растворе кислота диссоциирует на ионы водорода (H + ) и анионы. Почти каждая молекула сильной кислоты диссоциирует, образуя высокую концентрацию H + .(b) В водном растворе основание диссоциирует на гидроксильные ионы (OH — ) и катионы. Почти каждая молекула сильного основания диссоциирует, образуя высокую концентрацию OH — .Основания
A base — это вещество, которое выделяет гидроксильные ионы (OH — ) в растворе, или вещество, которое принимает H +, уже присутствующий в растворе (см. Рисунок 2.4.3 b ). Ионы гидроксила (также известные как ионы гидроксида) или другие основные вещества объединяются с присутствующим H + с образованием молекулы воды, тем самым удаляя H + и снижая кислотность раствора.Сильные основания высвобождают большую часть или все свои гидроксильные ионы; слабые основания выделяют только некоторые гидроксильные ионы или поглощают только несколько H + . Пища, смешанная с соляной кислотой из желудка, сожгла бы тонкий кишечник (следующий участок пищеварительного тракта после желудка), если бы не высвобождение бикарбоната (HCO 3 — ), слабого основания, которое привлекает Н + . Бикарбонат принимает часть протонов H +, тем самым снижая кислотность раствора.
Концепция pH
Относительную кислотность или щелочность раствора можно определить по его pH. pH раствора представляет собой отрицательный десятичный логарифм концентрации иона водорода (H + ) в растворе. Например, раствор с pH 4 имеет концентрацию H + , которая в десять раз больше, чем у раствора с pH 5. То есть раствор с pH 4 в десять раз более кислый, чем раствор с pH 5. Понятие pH станет более понятным, когда вы изучите шкалу pH, как показано на рисунке 2.4.4. Шкала состоит из серии приращений от 0 до 14.Раствор с pH 7 считается нейтральным — ни кислым, ни основным. Чистая вода имеет pH 7. Чем ниже число ниже 7, тем кислее раствор или тем выше концентрация H + . Концентрация ионов водорода при каждом значении pH в 10 раз отличается от следующего значения pH. Например, значение pH 4 соответствует концентрации протонов 10 –4 M или 0,0001M, а значение pH 5 соответствует концентрации протонов 10 –5 M или 0.00001M. Чем выше число выше 7, тем более щелочной (щелочной) раствор или тем ниже концентрация H + . Например, человеческая моча в десять раз более кислотная, чем чистая вода, а HCl в 10 000 000 раз кислотнее воды.
Рисунок 2.4.4 Шкала pHБуферы
pH крови человека обычно находится в диапазоне от 7,35 до 7,45, хотя обычно его определяют как pH 7,4. При таком слегка щелочном pH кровь может снижать кислотность, возникающую из-за того, что двуокись углерода (CO 2 ) постоянно попадает в кровоток триллионами клеток тела.Гомеостатические механизмы (наряду с выдыханием CO 2 во время дыхания) обычно поддерживают pH крови в этом узком диапазоне. Это очень важно, потому что колебания — либо слишком кислые, либо слишком щелочные — могут привести к опасным для жизни расстройствам.
Все клетки организма зависят от гомеостатической регуляции кислотно-щелочного баланса при pH примерно 7,4. Таким образом, в организме есть несколько механизмов для этой регуляции, включая дыхание, выделение химических веществ с мочой и внутреннее высвобождение химических веществ, которые в совокупности называются буферами, в жидкости организма.Буфер представляет собой раствор слабой кислоты и ее конъюгированного основания. Буфер может нейтрализовать небольшое количество кислот или оснований в жидкостях организма. Например, если есть даже небольшое снижение pH жидкости организма ниже 7,35, буфер в жидкости — в данном случае действующий как слабое основание — будет связывать избыточные ионы водорода. Напротив, если pH поднимается выше 7,45, буфер будет действовать как слабая кислота и вносить ионы водорода.
Гомеостатический дисбаланс
Избыточная кислотность кислот и оснований, крови и других жидкостей тела известна как ацидоз.Распространенными причинами ацидоза являются ситуации и нарушения, которые снижают эффективность дыхания, особенно способность человека полностью выдыхать, что вызывает накопление CO 2 (и H + ) в кровотоке. Ацидоз также может быть вызван метаболическими проблемами, которые снижают уровень или функцию буферов, которые действуют как основания или способствуют выработке кислот. Например, при тяжелой диарее из организма может выводиться слишком много бикарбоната, в результате чего кислоты накапливаются в жидкостях организма.У людей с плохо управляемым диабетом (неэффективное регулирование уровня сахара в крови) кислоты, называемые кетонами, вырабатываются в качестве топлива для организма. Они могут накапливаться в крови, вызывая серьезное заболевание, называемое диабетическим кетоацидозом. Почечная недостаточность, печеночная недостаточность, сердечная недостаточность, рак и другие заболевания также могут вызывать метаболический ацидоз.
Напротив, алкалоз — это состояние, при котором кровь и другие жидкости организма слишком щелочные (щелочные). Как и в случае ацидоза, основной причиной являются респираторные расстройства; однако при респираторном алкалозе уровни углекислого газа падают слишком низко.Заболевания легких, передозировка аспирином, шок и обычное беспокойство могут вызвать респираторный алкалоз, который снижает нормальную концентрацию H + .
Метаболический алкалоз часто возникает в результате продолжительной сильной рвоты, которая вызывает потерю ионов водорода и хлорида (как компонентов HCl). Лекарства также могут вызвать алкалоз. К ним относятся диуретики, которые заставляют организм терять ионы калия, а также антациды при приеме в чрезмерных количествах, например, при стойкой изжоге или язве.
Обзор главыНеорганические соединения, необходимые для функционирования человека, включают воду, соли, кислоты и основания. Эти соединения неорганические; то есть они не содержат ни водорода, ни углерода. Вода — это смазка и подушка, теплоотвод, компонент жидких смесей, побочный продукт реакций синтеза дегидратации и реагент в реакциях гидролиза. Соли — это соединения, которые при растворении в воде диссоциируют на ионы, отличные от H + или OH —.Напротив, кислоты выделяют в растворе H + , делая его более кислым. Основания принимают H + , тем самым делая раствор более щелочным (едким).
pH любого раствора — это его относительная концентрация H + . Раствор с pH 7 нейтрален. Растворы с pH ниже 7 являются кислотами, а растворы с pH выше 7 — основаниями. Изменение одной цифры на шкале pH (например, от 7 до 8) представляет десятикратное увеличение или уменьшение концентрации H + .У здорового взрослого человека pH крови колеблется от 7,35 до 7,45. Механизмы гомеостатического контроля, которые важны для поддержания крови в здоровом диапазоне pH, включают химические вещества, называемые буферами, слабые кислоты и слабые основания, высвобождаемые, когда pH крови или других жидкостей организма колеблется в любом направлении за пределами этого нормального диапазона.
Контрольные вопросы Вопросы критического мышленияpH лимонного сока равен 2, а pH апельсинового сока равен 4.Какой из них более кислый и насколько? Что это значит?
Лимонный сок в сто раз более кислый, чем апельсиновый сок. Это означает, что в лимонном соке концентрация ионов водорода в сто раз выше.
Во время вечеринки Эли проигрывает пари и вынужден выпить бутылку лимонного сока. Вскоре после этого он начинает жаловаться на затрудненное дыхание, и его друзья отвозят его в местное отделение неотложной помощи. Там ему внутривенно вводят раствор бикарбоната.Почему?
Лимонный сок, как и любая кислота, выделяет ионы водорода в растворе. Поскольку избыток H + попадает в пищеварительный тракт и всасывается в кровь, pH крови Эли падает ниже 7,35. Напомним, что бикарбонат — это буфер, слабое основание, которое принимает ионы водорода. Вводя бикарбонат внутривенно, врач отделения неотложной помощи помогает поднять pH крови Эли до нейтрального.
Неорганические соединения, необходимые для функционирования человека — Анатомия и физиология
OpenStaxCollege
Цели обучения
К концу этого раздела вы сможете:
- Сравнить и сопоставить неорганические и органические соединения
- Определите свойства воды, которые делают ее жизненно важной
- Объясните роль солей в функционировании организма
- Различайте кислоты и основания и объясняйте их роль в pH
- Обсудить роль буферов в поддержании гомеостаза pH в организме
Концепции, которые вы изучили до сих пор в этой главе, управляют всеми формами материи и будут работать в качестве основы как для геологии, так и для биологии.Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения бывают либо неорганическими, либо органическими.
- Неорганическое соединение — это вещество, не содержащее ни углерода, ни водорода. Многие неорганические соединения действительно содержат атомы водорода, такие как вода (H 2 O) и соляная кислота (HCl), вырабатываемая вашим желудком. Напротив, только несколько неорганических соединений содержат атомы углерода.Двуокись углерода (CO 2 ) — один из немногих примеров.
- Таким образом, органическое соединение — это вещество, содержащее как углерод, так и водород. Органические соединения синтезируются ковалентными связями в живых организмах, в том числе в организме человека. Вспомните, что углерод и водород являются вторым и третьим по распространенности элементами в вашем теле. Вскоре вы обнаружите, как эти два элемента сочетаются в пищевых продуктах, которые вы едите, в соединениях, составляющих структуру вашего тела, и в химических веществах, которые подпитывают ваше функционирование.
В следующем разделе рассматриваются три группы неорганических соединений, необходимых для жизни: вода, соли, кислоты и основания. Органические соединения рассматриваются далее в этой главе.
До 70 процентов веса взрослого человека составляет вода. Эта вода содержится как внутри клеток, так и между клетками, из которых состоят ткани и органы. Несколько функций делают воду незаменимой для жизнедеятельности человека.
Вода как смазка и подушка
Вода является основным компонентом многих смазочных жидкостей организма.Подобно тому, как масло смазывает петлю двери, вода в синовиальной жидкости смазывает работу суставов тела, а вода в плевральной жидкости помогает легким расширяться и отскакивать при дыхании. Водянистая жидкость помогает пище течь по пищеварительному тракту и обеспечивает отсутствие трения при движении соседних органов брюшной полости.
Вода также защищает клетки и органы от физических травм, смягчая, например, мозг внутри черепа и защищая нежную нервную ткань глаз.Вода также смягчает развивающийся плод в утробе матери.
Вода как теплоотвод
Радиатор — это вещество или объект, которые поглощают и рассеивают тепло, но не испытывают соответствующего повышения температуры. В организме вода поглощает тепло, выделяемое в результате химических реакций, без значительного повышения температуры. Более того, когда температура окружающей среды стремительно растет, вода, хранящаяся в организме, помогает ему сохранять прохладу. Этот охлаждающий эффект возникает, когда теплая кровь из ядра тела течет к кровеносным сосудам под кожей и переносится в окружающую среду.В то же время потовые железы выделяют теплую воду вместе с потом. Когда вода испаряется в воздух, она уносит тепло, а затем более холодная кровь с периферии циркулирует обратно к сердцевине тела.
Вода как компонент жидких смесей
Смесь — это комбинация двух или более веществ, каждое из которых сохраняет свою химическую идентичность. Другими словами, составляющие вещества не связаны химически в новое, более крупное химическое соединение. Эту концепцию легко представить, если вы подумаете о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их в миске, очевидно, что они не связываются с образованием нового соединения.Воздух в помещении, которым вы дышите, представляет собой газовую смесь, содержащую три отдельных элемента — азот, кислород и аргон — и одно соединение — диоксид углерода. Есть три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента. Это растворы, коллоиды и суспензии.
Чтобы клетки тела выжили, они должны оставаться влажными в жидкости на водной основе, называемой раствором. В химии жидкий раствор состоит из растворителя, который растворяет вещество, называемое растворенным веществом. Важной характеристикой растворов является их однородность; то есть молекулы растворенного вещества равномерно распределяются по всему раствору.Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды. Соотношение сахара и воды в левой части стакана будет таким же, как соотношение сахара и воды в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара к воде изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.
Вода считается «универсальным растворителем», и поэтому считается, что жизнь не может существовать без воды.Вода, безусловно, является самым распространенным растворителем в организме; практически все химические реакции организма происходят между соединениями, растворенными в воде. Поскольку молекулы воды полярны, с областями положительного и отрицательного электрического заряда, вода легко растворяет ионные соединения и полярные ковалентные соединения. Такие соединения называют гидрофильными или «водолюбивыми». Как уже говорилось выше, сахар хорошо растворяется в воде. Это связано с тем, что молекулы сахара содержат области полярных водородно-кислородных связей, что делает его гидрофильным.Неполярные молекулы, которые с трудом растворяются в воде, называются гидрофобными или «водобоязненными».
Концентрации растворенных веществ
В химии описаны различные смеси растворенных веществ и воды. Концентрация данного растворенного вещества — это количество частиц этого растворенного вещества в данном пространстве (кислород составляет около 21 процента атмосферного воздуха). В кровотоке человека концентрация глюкозы обычно измеряется в миллиграммах (мг) на децилитр (дл), а у здорового взрослого человека в среднем составляет около 100 мг / дл.Другой метод измерения концентрации растворенного вещества — его молярность, которая составляет моль (M) молекул на литр (L). Моль элемента — это его атомный вес, а моль соединения — это сумма атомных весов его компонентов, называемая молекулярной массой. Часто используемый пример — вычисление моля глюкозы по химической формуле C 6 H 12 O 6 . Согласно периодической таблице, атомный вес углерода (C) составляет 12,011 грамма (г), а в глюкозе шесть атомов углерода, что дает общий атомный вес 72.066 г. Проведя те же вычисления для водорода (H) и кислорода (O), молекулярная масса равна 180,156 г («грамм молекулярной массы» глюкозы). Когда вода добавляется для получения одного литра раствора, у вас есть один моль (1М) глюкозы. Это особенно полезно в химии из-за отношения родинок к «числу Авогадро». В моль любого раствора столько же частиц: 6,02 × 10 23 . Многие вещества в кровотоке и других тканях тела измеряются в тысячных долях моля или миллимолях (мМ).
Коллоид — это смесь, которая чем-то похожа на тяжелый раствор. Частицы растворенного вещества состоят из крошечных сгустков молекул, достаточно больших, чтобы сделать жидкую смесь непрозрачной (поскольку частицы достаточно большие, чтобы рассеивать свет). Знакомые примеры коллоидов — молоко и сливки. В щитовидной железе гормон щитовидной железы хранится в виде густой белковой смеси, также называемой коллоидом.
Суспензия — это жидкая смесь, в которой более тяжелое вещество временно суспендировано в жидкости, но со временем оседает.Такое отделение частиц от суспензии называется седиментацией. Пример седиментации происходит в анализе крови, который устанавливает скорость седиментации или скорость седиментации. Тест измеряет, как быстро красные кровяные тельца в пробирке выделяются из водянистой части крови (известной как плазма) в течение определенного периода времени. Быстрое осаждение клеток крови обычно не происходит в здоровом организме, но некоторые заболевания могут вызывать слипание клеток крови, и эти тяжелые скопления клеток крови оседают на дно пробирки быстрее, чем нормальные клетки крови.
Роль воды в химических реакциях
Два типа химических реакций включают образование или потребление воды: дегидратационный синтез и гидролиз.
- При дегидратационном синтезе один реагент отдает атом водорода, а другой реагент отдает гидроксильную группу (ОН) при синтезе нового продукта. При образовании их ковалентной связи в качестве побочного продукта выделяется молекула воды ([ссылка]). Это также иногда называют реакцией конденсации.
- При гидролизе молекула воды разрушает соединение, разрывая его связи. Сама вода расщепляется на H и OH. Одна часть разорванного соединения затем связывается с атомом водорода, а другая часть связывается с гидроксильной группой.
Эти реакции обратимы и играют важную роль в химии органических соединений (о чем мы поговорим ниже).
Дегидратация, синтез и гидролиз
Мономеры, основные единицы для построения более крупных молекул, образуют полимеры (два или более химически связанных мономера).(а) При дегидратационном синтезе два мономера ковалентно связаны в реакции, в которой один отдает гидроксильную группу, а другой — атом водорода. Молекула воды выделяется как побочный продукт во время реакций дегидратации. (b) При гидролизе ковалентная связь между двумя мономерами расщепляется путем присоединения атома водорода к одному и гидроксильной группы к другому, что требует участия одной молекулы воды.
Напомним, что соли образуются, когда ионы образуют ионные связи.В этих реакциях один атом отдает один или несколько электронов и, таким образом, становится положительно заряженным, тогда как другой атом принимает один или несколько электронов и становится отрицательно заряженным. Теперь вы можете определить соль как вещество, которое при растворении в воде диссоциирует на ионы, отличные от H + или OH —. Этот факт важен для отличия солей от кислот и оснований, обсуждаемых далее.
Типичная соль NaCl полностью диссоциирует в воде ([ссылка]). Положительные и отрицательные области молекулы воды (концы водорода и кислорода соответственно) притягивают отрицательные ионы хлорида и положительные ионы натрия, отталкивая их друг от друга.Опять же, в то время как неполярные и полярные ковалентно связанные соединения распадаются на молекулы в растворе, соли диссоциируют на ионы. Эти ионы являются электролитами; они способны проводить электрический ток в растворе. Это свойство имеет решающее значение для функции ионов при передаче нервных импульсов и стимулировании сокращения мышц.
Диссоциация хлорида натрия в воде
Обратите внимание, что кристаллы хлорида натрия диссоциируют не на молекулы NaCl, а на катионы Na + и анионы Cl — , каждый из которых полностью окружен молекулами воды.
Многие другие соли важны для организма. Например, соли желчных кислот, вырабатываемые печенью, помогают расщеплять пищевые жиры, а соли фосфата кальция образуют минеральную часть зубов и костей.
Кислоты и основания, как и соли, диссоциируют в воде с образованием электролитов. Кислоты и основания могут сильно изменить свойства растворов, в которых они растворены.
Кислоты
Кислота — это вещество, которое выделяет ионы водорода (H + ) в растворе ([ссылка] a ).Поскольку у атома водорода есть только один протон и один электрон, положительно заряженный ион водорода — это просто протон. Этот одиночный протон с большой вероятностью участвует в химических реакциях. Сильные кислоты — это соединения, которые выделяют весь свой H + в растворе; то есть они полностью ионизируются. Соляная кислота (HCl), которая выделяется из клеток слизистой оболочки желудка, является сильной кислотой, поскольку она выделяет весь свой H + в водянистую среду желудка. Эта сильная кислота помогает пищеварению и убивает микробы, попавшие в организм.Слабые кислоты не ионизируются полностью; то есть некоторые из их ионов водорода остаются связанными внутри соединения в растворе. Пример слабой кислоты — уксус или уксусная кислота; он называется ацетатом после того, как отдает протон.
Кислоты и основания
(a) В водном растворе кислота диссоциирует на ионы водорода (H + ) и анионы. Почти каждая молекула сильной кислоты диссоциирует, образуя высокую концентрацию H + . (b) В водном растворе основание диссоциирует на гидроксильные ионы (OH — ) и катионы.Почти каждая молекула сильного основания диссоциирует, образуя высокую концентрацию OH — .
Базы
Основание — это вещество, которое выделяет гидроксильные ионы (OH — ) в растворе, или вещество, которое принимает H + , уже присутствующий в растворе (см. [Ссылка] b ). Ионы гидроксила (также известные как ионы гидроксида) или другие основные вещества объединяются с присутствующим H + с образованием молекулы воды, тем самым удаляя H + и снижая кислотность раствора.Сильные основания высвобождают большую часть или все свои гидроксильные ионы; слабые основания выделяют только некоторые гидроксильные ионы или поглощают только несколько H + . Пища, смешанная с соляной кислотой из желудка, сожгла бы тонкий кишечник, следующую часть пищеварительного тракта после желудка, если бы не высвобождение бикарбоната (HCO 3 — ), слабого основания, которое привлекает H + . Бикарбонат принимает часть протонов H + , тем самым снижая кислотность раствора.
Концепция pH
Относительную кислотность или щелочность раствора можно определить по его pH. PH раствора — это отрицательный десятичный логарифм концентрации ионов водорода (H + ) в растворе. Например, раствор с pH 4 имеет концентрацию H + , которая в десять раз больше, чем у раствора с pH 5. То есть раствор с pH 4 в десять раз более кислый, чем раствор с pH 5. Понятие pH станет более понятным, когда вы изучите шкалу pH, как показано в [ссылка].Шкала состоит из серии приращений от 0 до 14. Раствор с pH 7 считается нейтральным — ни кислым, ни основным. Чистая вода имеет pH 7. Чем ниже число ниже 7, тем кислее раствор или тем выше концентрация H + . Концентрация ионов водорода при каждом значении pH в 10 раз отличается от следующего значения pH. Например, значение pH 4 соответствует концентрации протонов 10 –4 M или 0,0001M, а значение pH 5 соответствует концентрации протонов 10 –5 M или 0.00001M. Чем выше число выше 7, тем более щелочной (щелочной) раствор или тем ниже концентрация H + . Например, человеческая моча в десять раз более кислотная, чем чистая вода, а HCl в 10 000 000 раз кислотнее воды.
Шкала pH
Буферы
pH крови человека обычно находится в диапазоне от 7,35 до 7,45, хотя обычно его определяют как pH 7,4. При таком слегка щелочном pH кровь может снижать кислотность, возникающую из-за того, что двуокись углерода (CO 2 ) постоянно попадает в кровоток триллионами клеток тела.Гомеостатические механизмы (наряду с выдыханием CO 2 во время дыхания) обычно поддерживают pH крови в этом узком диапазоне. Это очень важно, потому что колебания — либо слишком кислые, либо слишком щелочные — могут привести к опасным для жизни расстройствам.
Все клетки организма зависят от гомеостатической регуляции кислотно-щелочного баланса при pH примерно 7,4. Таким образом, в организме есть несколько механизмов для этой регуляции, включая дыхание, выделение химических веществ с мочой и внутреннее высвобождение химических веществ, которые в совокупности называются буферами, в жидкости организма.Буфер представляет собой раствор слабой кислоты и сопряженного с ней основания. Буфер может нейтрализовать небольшое количество кислот или оснований в жидкостях организма. Например, если есть даже небольшое снижение pH жидкости организма ниже 7,35, буфер в жидкости — в данном случае действующий как слабое основание — будет связывать избыточные ионы водорода. Напротив, если pH поднимается выше 7,45, буфер будет действовать как слабая кислота и вносить ионы водорода.
Гомеостатический дисбаланс
Кислоты и основания
Чрезмерная кислотность крови и других жидкостей организма известна как ацидоз.Распространенными причинами ацидоза являются ситуации и нарушения, которые снижают эффективность дыхания, особенно способность человека полностью выдыхать, что вызывает накопление CO 2 (и H + ) в кровотоке. Ацидоз также может быть вызван метаболическими проблемами, которые снижают уровень или функцию буферов, которые действуют как основания или способствуют выработке кислот. Например, при тяжелой диарее из организма может выводиться слишком много бикарбоната, в результате чего кислоты накапливаются в жидкостях организма.У людей с плохо управляемым диабетом (неэффективное регулирование уровня сахара в крови) кислоты, называемые кетонами, вырабатываются в качестве топлива для организма. Они могут накапливаться в крови, вызывая серьезное заболевание, называемое диабетическим кетоацидозом. Почечная недостаточность, печеночная недостаточность, сердечная недостаточность, рак и другие заболевания также могут вызывать метаболический ацидоз.
Напротив, алкалоз — это состояние, при котором кровь и другие жидкости организма слишком щелочные (щелочные). Как и в случае ацидоза, основной причиной являются респираторные расстройства; однако при респираторном алкалозе уровни углекислого газа падают слишком низко.Заболевания легких, передозировка аспирином, шок и обычное беспокойство могут вызвать респираторный алкалоз, который снижает нормальную концентрацию H + .
Метаболический алкалоз часто возникает в результате продолжительной сильной рвоты, которая вызывает потерю ионов водорода и хлорида (как компонентов HCl). Лекарства также могут вызвать алкалоз. К ним относятся диуретики, которые заставляют организм терять ионы калия, а также антациды при приеме в чрезмерных количествах, например, при стойкой изжоге или язве.
Неорганические соединения, необходимые для функционирования человека, включают воду, соли, кислоты и основания. Эти соединения неорганические; то есть они не содержат ни водорода, ни углерода. Вода — это смазка и подушка, теплоотвод, компонент жидких смесей, побочный продукт реакций синтеза дегидратации и реагент в реакциях гидролиза. Соли — это соединения, которые при растворении в воде диссоциируют на ионы, отличные от H + или OH —. Напротив, кислоты выделяют в растворе H + , делая его более кислым.Основания принимают H + , тем самым делая раствор более щелочным (едким).
pH любого раствора — это его относительная концентрация H + . Раствор с pH 7 нейтрален. Растворы с pH ниже 7 являются кислотами, а растворы с pH выше 7 — основаниями. Изменение одной цифры на шкале pH (например, от 7 до 8) представляет десятикратное увеличение или уменьшение концентрации H + . У здорового взрослого человека pH крови колеблется от 7,35 до 7,45. Механизмы гомеостатического контроля, важные для поддержания крови в здоровом диапазоне pH, включают химические вещества, называемые буферами, слабые кислоты и слабые основания, высвобождаемые, когда pH крови или других жидкостей организма колеблется в любом направлении за пределами этого нормального диапазона.
CH 4 — метан. Это соединение ________.
- неорганическое
- органический
- реактивная
- кристалл
Что из следующего, вероятнее всего, будет равномерно распределено в воде в гомогенном растворе?
- ионы натрия и ионы хлорида
- молекул NaCl
- кристаллов соли
- эритроцитов
Дженни смешивает тесто для блинов, затем добавляет шоколадную стружку.Ожидая, когда приготовятся первые несколько блинов, она замечает, как шоколадная стружка опускается на дно прозрачной стеклянной миски. Тесто с шоколадной крошкой является примером ________.
- растворитель
- растворенное вещество
- раствор
- подвеска
Вещество распадается на K + и Cl — в растворе. Вещество a (n) ________.
- кислота
- база
- соль
- буфер
Тай три года, и в результате «желудочного недуга» его рвало около 24 часов.Его pH крови 7,48. Что это значит?
- Кровь Тая слегка кислая.
- Кровь Тая слабощелочная.
- Кровь Тая очень кислая.
- Кровь Тая в пределах нормы
pH лимонного сока составляет 2, а pH апельсинового сока — 4. Какой из них более кислый и насколько? Что это значит?
Лимонный сок в сто раз более кислый, чем апельсиновый сок. Это означает, что в лимонном соке концентрация ионов водорода в сто раз выше.
Во время вечеринки Эли проигрывает пари и вынужден выпить бутылку лимонного сока. Вскоре после этого он начинает жаловаться на затрудненное дыхание, и его друзья отвозят его в местное отделение неотложной помощи. Там ему внутривенно вводят раствор бикарбоната. Почему?
Лимонный сок, как и любая кислота, выделяет ионы водорода в растворе. Когда избыток H + попадает в пищеварительный тракт и всасывается в кровь, pH крови Эли падает ниже 7,35. Напомним, что бикарбонат — это буфер, слабое основание, которое принимает ионы водорода.Вводя бикарбонат внутривенно, врач отделения неотложной помощи помогает поднять pH крови Эли до нейтрального.
Глоссарий
- кислота
- соединение, выделяющее ионы водорода (H + ) в растворе
- основание
- соединение, которое принимает ионы водорода (H + ) в растворе
- буфер
- Раствор, содержащий слабую кислоту или слабое основание, противодействующий широким колебаниям pH жидкостей организма
- коллоид
- жидкая смесь, в которой частицы растворенного вещества состоят из сгустков молекул, достаточно больших, чтобы рассеивать свет
- неорганическое соединение
- Вещество, не содержащее ни углерода, ни водорода
- органическое соединение
- Вещество, содержащее как углерод, так и водород
- pH
- отрицательный логарифм концентрации иона водорода (H + ) в растворе
- раствор
- гомогенная жидкая смесь, в которой растворенное вещество растворено в молекулах в растворителе
- подвеска
- жидкая смесь, в которой частицы, распределенные в жидкости, оседают с течением времени
Неорганическое соединение — определение и примеры
Определение
существительное
множественное число: неорганические соединения
Химическое соединение без ковалентных связей углерод-углерод (CC) и углерод-водород (CH)
Подробности
Обзор
Химическое соединение относится к любому веществу, состоящему из двух или более элементов, которые химически связаны друг с другом.Элемент , в свою очередь, относится к элементу, состоящему только из одного типа атомов. Элементы, которые удерживаются вместе химической связью, образуют соединение. Один из способов классификации соединений — определить их как органических или неорганических . Как правило, органическое соединение представляет собой тип соединения, содержащего атом углерода. И наоборот, неорганическое соединение будет таким, которое не содержит углерода.
Витализм против выводов Велера
Одна из преобладающих теорий первых веков — витализм .Согласно этой теории, живые существа обладали своего рода жизненной силой — vis-vitalis , которая отделяла их от неживых существ. Эта жизненная сила позволяла им производить определенные химические вещества, которые неживые существа не могли производить. Химические вещества, производимые живыми существами, были названы органическими , поскольку они произошли от организмов. Те, которые можно было получить из неживых существ, были названы неорганическими , что означает «неорганические». Это была фундаментальная граница, которая отделяла органические от неорганических соединений.Под неорганическими соединениями понимались соединения, не полученные от организмов. Они могут быть получены, например, из геологических систем, например отложения и руды.
Это убеждение существовало на протяжении многих веков, пока Фридрих Вёлер (1800–1882) не оспорил его с помощью эмпирических данных своих экспериментов. В одном из своих экспериментов он обнаружил, что мочевину, которую когда-то считали производимой только живыми существами, можно производить из неорганических предшественников. В 1828 году он обнаружил, что мочевину можно химически получить из солей цианата калия и сульфата аммония.Это считается решающим поворотным моментом, который позже привел к развитию современной органической химии.
Путаница
На пике витализма существовала четкая граница между органическими и неорганическими соединениями. Из-за дискредитации витализма химики так и не пришли к консенсусу по поводу современного определения органических и неорганических соединений. Простое утверждение, что органическое соединение — это любое соединение, содержащее атом углерода, не будет абсолютно правильным, поскольку это будет намека на включение некоторых углеродсодержащих неорганических соединений.База данных неорганических кристаллических структур, база данных данных о неорганических кристаллических структурах, основанная Гюнтером Бергерхоффом и И.Д. Брауном в 1978 году, определила неорганических соединений углерода как соединения, содержащие либо C-H, либо C-C связи, но не оба вместе. 1 К неорганическим углеродсодержащим соединениям относятся: карбонаты, цианиды, цианаты, карбиды, тиоцианаты, монооксид углерода и диоксид углерода. Аллотропы углерода , как и алмаз, не соединения, а чистый элемент углерода.Таким образом, это не неорганические соединения, а неорганические вещества.
Органические и неорганические соединения
Обобщенные различия между органическими и неорганическими соединениями показаны ниже:
| Органические соединения | Неорганические соединения | |
| Наличие в основном атомов углерода | атомыВ основном отсутствуют атомы углерода | |
| Химическая связь | Ковалентная связь; в основном со связями углерод-водород (C-H) | В основном с ионными связями; в основном отсутствуют связи CH |
| Происхождение | По сути, биологическое (в результате биологической активности) | Химическое (в результате лабораторных работ или экспериментов) или геологическое (в результате естественного процесса, не связанного с жизнью) |
| Соль образование | Не может образовывать соль | Может образовывать соль |
| Атомы металлов | Не содержат атомов металлов | Могут содержать атомы металлов |
| Другие особенности | В большинстве водных растворов плохие проводники тепла и электричество | В основном хорошие проводники тепла и электричества |
| Примеры | углеводы, жиры, белки, нуклеиновые кислоты, мочевина, четыреххлористый углерод | хлорид натрия, латунь, стекло, карбонаты, цианиды, цианаты, карбиды , тиоцианаты, монооксид углерода, диоксид углерода, вода |
Типы неорганических соединений
Химическое соединение — это вещество, состоящее из атомов или ионов двух или более элементов, которые химически связаны вместе, тогда как химический элемент — это вещество только одного типа атомов. Большинство элементов являются неорганическими, но технически не являются неорганическими соединениями, поскольку они состоят только из одного типа атомов.Таким образом, классификация неорганических соединений влечет за собой группировку веществ, состоящих из более чем одного типа атомов. И наоборот, простые неорганические вещества (не обязательно соединения) типичны как металл или неметалл . Однако нет четкого различия между металлами и неметаллами.
Большинство неорганических соединений являются ионными соединениями. Это означает, что химическая связь, удерживающая атомы вместе, является ионной связью. На основе составляющих неорганических соединений ионные соединения можно разделить на основания, кислоты и соли.Ионная связь — это связь, при которой происходит полный перенос электрона от одного атома к другому. Это электростатическое притяжение между противоположно заряженными ионами, то есть катионом и анионом. Катион — это положительно заряженный ион, а анион — отрицательно заряженный ион. Например, хлорид натрия представляет собой ионное соединение, в котором катион Na + и анион Cl — удерживаются вместе ионной связью . Ионное соединение, содержащее ионы водорода (H + ), классифицируется как кислота.И наоборот, ионное соединение, содержащее гидроксид (OH —) или оксид (O 2-), классифицируется как основание. Ионное соединение, образованное кислотно-основными реакциями без этих ионов, называется солью .
Вода, безусловно, является одним из важнейших неорганических соединений для всего живого. Это соединение, состоящее из двух атомов водорода и одного атома кислорода. Однако это не ионное соединение, а молекула, удерживаемая ковалентной связью между водородом и кислородом .
Исследования
Изучение свойств и синтеза органических соединений известно как органическая химия , тогда как изучение свойств и синтеза в неорганической химии называется неорганической химией .
Дополнительный
Этимология
- назван в честь раннего представления о том, что неорганические соединения не имеют биологического происхождения
Дополнительная литература
Сравнить
См. Также
9000 Machine4Ссылка
Wayback- 9000.(2017, 1 января). База данных неорганических кристаллов: научное руководство. Получено из PDF
© Biology Online. Контент предоставлен и модерируется Biology Online Editors
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Неорганические соединения — обзор
15.1.1 Фикормедиация и создание биопродуктов с добавленной стоимостью
Органические и неорганические соединения накапливаются в окружающей среде в результате сельскохозяйственной, промышленной и бытовой деятельности.Неконтролируемое распространение необработанных отходов жизнедеятельности человека и сельскохозяйственных стоков являются наиболее распространенными источниками загрязнения воды и почвы. Накопились экологические и экологические последствия загрязнения человека и необработанных отходов, которые необходимо устранить, чтобы избежать дальнейших негативных последствий. Чтобы смягчить последствия промышленного и муниципального загрязнения, практика очистки сточных вод должна значительно расшириться и в глобальном масштабе. Из-за недостатков во многих наших современных методах очистки воды качество пресной воды становится такой же серьезной проблемой, как и ее дефицит.Практика очистки отходов помогает уменьшить загрязнение воды и почвы из-за перегрузки питательными веществами и других токсичных загрязнителей. Неочищенные сточные воды содержат в растворе питательные вещества, которые вызывают эвтрофикацию экосистемы или доставляют токсичные соединения в окружающую среду. Эвтрофные условия стимулируют дисбаланс экосистемы, который, если его не устранить, может обостриться и создать условия, угрожающие здоровью человека. Помимо потенциальных негативных последствий перегрузки биогенными веществами, трудно устранить последствия загрязнения воды и почвы тяжелыми металлами и химическими веществами.
Потребность в рентабельных средствах удаления или нейтрализации опасных соединений растет с каждым днем. База данных известных соединений в Химической реферативной службе (CAS) в настоящее время пополняется из известных 66 миллионов зарегистрированных соединений с добавлением около 12 000 новых соединений каждый день (CAS, 2012). Сброс этих соединений в водоемы или их распыление на почву сильно повлиял на окружающую среду и будет продолжаться. Промышленность и человеческое развитие уже повлияли на качество почвы и воды во всем мире.Рост урбанизации и индустриализации, в частности, привел к возникновению экологических проблем, связанных с городскими отходами. Городские сточные воды являются значительным источником ухудшения состояния окружающей среды из-за бытовых продуктов и фармацевтических препаратов, а также эвтрофикации в результате перегрузки биогенными веществами.
Микроводоросли и цианобактерии положительно реагируют на широкий спектр органических и неорганических загрязнителей. Эти организмы способны удалять соединения из раствора за счет биоаккумуляции соединений в теле клетки, а также на поверхности клетки, в дополнение к активности минерализации, связанной с метаболизмом клетки.Водоросли и цианобактерии могут расти в воде с низкой или высокой питательной ценностью, а также в более суровых экосистемах, таких как высокая или гипер-соленость или экстремальный pH. В дополнение к универсальным механизмам выживания каждого организма, некоторые виды микроводорослей обладают способностью использовать как автотрофию, так и гетеротрофию, что делает их миксотрофными в правильных условиях. В присутствии высоких уровней загрязнителей водоросли и цианобактерии испытывают физиологические изменения (Fogg, 2001), а также генетические реакции (Gonzalez et al., 2012), которые позволяют водорослям быстро размножаться или цвести. Эта адаптация делает микроводоросли и цианобактерии идеальными для устранения загрязнителей окружающей среды, а также для связывания CO 2 . Phycoremediation — это использование определенных видов микроводорослей или макроводорослей для удаления или биоразложения дополнительных соединений окружающей среды. Phycoremediation — важный инструмент для обработки загрязненной почвы и воды, и он охватывает множество применений, которые включают, помимо прочего, стабилизацию кислотного загрязнения, удаление металлов в загрязненных водах, удаление избыточных питательных веществ из воды и разложение. или связывание токсичных соединений из воды и почвы.
Для того, чтобы фоновая медиация могла эффективно контролировать загрязняющие вещества, необходимо выбрать использование определенных видов или комбинации видов, которые способны лечить загрязнение или благоприятно взаимодействовать с ним. Такие качества, как устойчивость к экстремальным температурам, потенциал для продуктов с добавленной стоимостью (таких как липиды, углеводы и / или белки), миксотрофия и седиментация, являются ключевыми элементами для исследования. Исследователи изучили очистку сточных вод, загрязненных рядом источников, чтобы изучить задачи, выполняемые различными видами водорослей на каждой стадии процесса очистки (Abdel-Raouf et al., 2012). В таблице 15.1 представлены эти исследования с указанием типа сточных вод, которые исследовались в каждом исследовании. Эти исследования демонстрируют, что для каждой задачи, связанной с утилизацией определенных отходов, может быть несколько видов, способных выполнить эту задачу.
Таблица 15.1. Диапазон Phycoremediation
| Сектор | Организм | Ссылка | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Коммунальные сточные воды | ||||||||||||||||||||||||||||||||||||
| N / P удаление | Euidocapna650 9065 Euidocapna 6 Sengar et al.(2011) | |||||||||||||||||||||||||||||||||||
| Эндокринные разрушители | Anabaena cylindrica , Chlorococcus , S. platensis , Chlorella , S. quadricauda , Anabaena v.| Моча | Spirulina Plantensis | Ying et al., (2011) | Сельское хозяйство | Отходы птицы | C. Vulgaris 9065 Murugesan et al.(2010a, b) | Органические пестициды | Обширный каталог | Subashchandrabose et al. (2013) | Свиной навоз | Scendesmus intermediateus , Nannochloris sp. | Jimenez-Perez et al. (2004) | Промышленность | Тяжелые металлы | Anabaena variabilis | Parameswari et al. (2010) | Spirogya | Gupta et al.(2001) | Кожевенное растение | C. Vulgaris | Rao et al. (2011) | Альгинат | Chroococcus turgidus | Sivasubramanian et al. (2009) | Пищевая промышленность | Оливковая мельница | Scenedesmus obliqus | Hodaifa et al. (2013) | | |||||||
Следует отметить, что успешное культивирование водорослей и цианобактерий зависит не только от питательных веществ, присутствующих в данной экосистеме.Сочетание сложных факторов окружающей среды и их взаимодействия влияют на развитие клеток водорослей и цианобактерий. Такие факторы, как pH воды или почвы (Азов и Шелеф, 1987), доступность и интенсивность света, температура и множество биотических факторов, действующих в воде и почве, влияют на развитие клеток водорослей.
Использование фоновой медиации для очистки сточных вод предлагает решения некоторых проблем, связанных с традиционными методами очистки. Некоторые из недостатков традиционных методов обработки связаны с изменчивостью химической эффективности в зависимости от удаляемого соединения или питательного вещества.Другой недостаток традиционных методов очистки, включающих химическую очистку, заключается в том, что химические вещества, используемые для обработки воды, выбрасываются в окружающую среду. Некоторые из этих химикатов остаются активными, что приводит к разной степени экологического ущерба от воздействия «очищенных» сточных вод. Кроме того, De la Noue et al. (1992) указали, что при утилизации богатой питательными веществами воды (обработанной или необработанной) возникают экономические потери, совпадающие с потерей ценных питательных веществ, которые можно было бы восстановить, переработать и использовать повторно.Тела клеток водорослей удерживают питательные вещества в процессе фитомедиации, а полученная биомасса делает питательные вещества доступными для сбора и повторного использования (Pizarro et al., 2006). Собранные питательные вещества в виде биомассы водорослей можно использовать для множества экономически ценных целей, включая, помимо прочего, восстановление почвы, органические удобрения, ферментативные процессы и другие сельскохозяйственные / промышленные процессы.
Неорганические соединения — обзор
3.35.3.1 Воздух и твердые частицы
Органические и неорганические соединения в воздухе могут вызывать кислотные дожди и проблемы со здоровьем, такие как респираторные или аллергические заболевания.Истощение озонового слоя хлорфторуглеродными соединениями и глобальное потепление из-за парниковых газов также являются серьезными проблемами. Пробы воздуха для анализа окружающей среды в основном можно разделить на газы и твердые частицы. Группа газов в совокупности относится к газообразным веществам, образующимся при сгорании, синтезе или разложении материалов, или к веществам, встречающимся в природе. Типичные газообразные вещества в атмосферной среде включают SO 2 , NO, CO и углеводороды. Твердые частицы можно разделить на ультрамелкие частицы (≤0.1 мкм), PM-2,5 (≤2,5 мкм), PM-10 (≤10 мкм), крупные частицы (2,5–10 мкм) и общие взвешенные твердые частицы (TSP) (≤50 мкм).
Методы отбора проб газообразного воздуха можно разделить на абсорбционные и адсорбционные. Абсорбция может осуществляться с использованием пропитанных фильтров, импинджеров или денудеров. При использовании пропитанного фильтра проба воздуха отбирается при прохождении через фильтр, обработанный химическими веществами, которые вступают в реакцию с определенными газообразными материалами. Затем пропитанный фильтр погружают в абсорбирующий раствор для извлечения образцов.Импинджер — это устройство для сбора химических веществ, содержащихся в воздухе, путем барботирования воздуха в жидкую среду. Поскольку отбор проб проводится в жидкой фазе, дальнейшая экстракция не требуется, что является преимуществом по сравнению с другими методами. Сообщалось о случае сбора альдегидов путем пропускания воздуха через раствор, содержащего дериватизирующий агент, и их анализа с помощью КЭ. 47 Денюдер — это устройство, основанное на разнице скоростей диффузии газообразных и твердых частиц.Поскольку скорость диффузии молекул газа в тысячи раз выше, чем у твердых частиц, большая часть газа поглощается покрытием на внутренней стенке трубки, и большая часть твердых частиц проходит. Газообразные карбонилы собирали денудером, покрытым 2,4-динитрофенилгидразином. 48 Образец, собранный денудером, экстрагировали ацетонитрилом (ACN), сушили, повторно растворяли в ACN и затем вводили в систему CE. В случае адсорбции молекулы газа адсорбируются на поверхности адсорбента за счет межмолекулярных взаимодействий.В качестве адсорбента обычно используют активированный уголь, органический полимер или силикагель. Новый монолитный полимерный материал был использован в качестве адсорбента для обнаружения низкомолекулярных аминов из окружающего воздуха. 49
Для отбора проб твердых частиц используются фильтры, инерционные импакторы или циклоны. Фильтрация — это наиболее часто используемый метод улавливания взвешенных частиц в воздухе для определения твердых примесей, так как он прост в выполнении и недорого.Как правило, фильтры, используемые для отбора проб аэрозольных частиц, подразделяются на волокнистые фильтры, пористые мембранные фильтры и фильтры с гранулированным слоем в соответствии с их характерными структурами и применением. Волокнистые фильтры обычно изготавливаются из стекла, кварца, полимера или целлюлозы с размером пор 0,01–10 мкм. Основными механизмами этой фильтрации являются диффузия, перехват и удар волокном. Волокнистый фильтр имеет относительно низкий перепад давления по сравнению с другими фильтрами. Неорганические ионы, такие как хлорид, нитрат, малонат, ацетат и органические кислоты, были проанализированы путем отбора проб с использованием стекловолоконного фильтра с последующей экстракцией водой в ультразвуковой ванне. 50 Фильтр из кварцевого волокна используется для сбора карбоновой кислоты, 51 низкомолекулярных аминов, 49 неорганических анионов, 52 или бензойной кислоты из аэрозолей, 53 и затем обрабатывается ультразвуком в воде или органическом растворителе. для извлечения интересующих аналитов. Для очень гидрофобных веществ, таких как полициклические ароматические углеводороды (ПАУ), собранный образец извлекается из фильтра с использованием растворителя бензол / этанол (3: 1). Затем, после испарения бензола, аналит растворяют, используя ACN для анализа CE. 54 При анализе неорганических ионов (например, K + , Cl — , Na + ), содержащихся в воздушной пыли, образцы собирают с помощью устройства для фильтрации воздуха. После обработки образца пыли ацетоном для обезжиривания пыль сушат, экстрагируют водой и подвергают центрифугированию для анализа с СЕ. 55 Импакторный метод основан на инерции и осаждении и позволяет собирать разнообразный массив частиц. Частицы в потоке ламинарного потока ускоряются соплом и резко меняют направление на выходе с помощью ударной пластины.В это время крупные частицы с относительно большей силой инерции покидают линию тока и прилипают к пластине ударного элемента. Между тем, мелкие частицы с меньшей силой инерции проходят через линию тока и не прилипают к пластине ударного элемента. В то время как обычный ударный элемент имеет одно ускоряющее сопло и одну пластину ударного элемента, каскадный ударный элемент оснащен несколькими ускоряющими соплами и пластинами ударного элемента, расположенными вертикально, чтобы обеспечить сбор частиц разных размеров. Сообщалось об анализе распределения по размерам, проведенном CE с использованием каскадного ударного элемента. 50 Циклонный метод основан на разнице моментов инерции. Воздух, подаваемый на входе, закручивается вниз в конусообразную сборную секцию. Затем воздух меняет направление и движется вверх по оси циклона, выбрасывая его через выходное отверстие. В это время крупные частицы прилипают к стенке циклона и собираются из-за относительно большой инерции, тогда как мелкие частицы покидают систему.
В дополнение к автономному соединению сбора проб и предварительной обработки с CE, существует уникальный метод, который позволяет прямое определение газов с помощью CE с использованием кольцевой проволочной петли. 56,57 Этот метод представляет собой революционный метод обработки образцов, который может быть совмещен с CE. Растворимые ионогенные атмосферные газы можно напрямую измерить этим методом. Как показано на рис. 8, когда небольшая круглая проволочная петля расположена на конце капилляра из плавленого кварца и петля погружается в раствор, а затем вынимается, образуется жидкая пленка. Эта жидкая пленка может использоваться в качестве абсорбера для сбора пробы газа из камеры для пробы, а также может использоваться в качестве микрорезервуара для сообщения жидкости с капилляром.В качестве собирающей среды можно использовать H 2 O 2 или рабочий буфер, а также воду. SO 2 может быть собран при концентрации 50 частей на миллиард в течение 60 с.
Рис. 8. Микрофотография жидкой пленки, сформированной в виде петли. Для облегчения визуализации была сделана тонкая пленка водным раствором малахитового зеленого. Масштаб обозначается диаметром проволоки 100 мкм.
Перепечатано из Dasgupta, P.K .; Кар, С. Анал. Chem. 1995 , 67 , 3853–3860; с разрешения.Функциональная компартментализация и метаболическое разделение в прокариотической клетке
Значение
В типичной прокариотической клетке сотни метаболитов присутствуют и взаимопревращаются одновременно, некоторые из них служат аллостерическими регуляторами для несвязанных реакций или случайными субстратами для разнородных ферментов или являются прямо реактивными и токсичными. . Хотя некоторое пространственное разделение прокариотических клеток было предложено давно, известно лишь несколько примеров. У многих бактерий ключевая карбоксилаза цикла Кальвина-Бенсона находится в карбоксисомах, концентрируя CO 2 и истощая O 2 , в то время как другие ферменты цикла находятся в цитоплазме.Археон Ignicoccus hospitalis имеет двухмембранную структуру с возбужденной внешней мембраной. Здесь мы показываем, что фиксация CO 2 в этом организме происходит в периферическом цитоплазматическом компартменте, отделенном от обработки информации, происходящей в центральном цитоплазматическом компартменте.
Abstract
Прокариотическая клетка традиционно рассматривается как «мешок ферментов», однако ее организация намного сложнее, чем в этом упрощенном представлении. К настоящему времени известны различные микрокомпартменты, инкапсулирующие метаболические ферменты или пути для бактерий .Эти микрокомпоненты, как правило, небольшие, они инкапсулируют и концентрируют только несколько ферментов, таким образом защищая клетку от токсичных промежуточных продуктов или предотвращая нежелательные побочные реакции. Гипертермофильный, строго анаэробный Crenarchaeon Ignicoccus hospitalis — необычный организм, обладающий двумя мембранами: внутренней и активированной внешней мембраной. Наружная мембрана (называемая здесь внешней цитоплазматической мембраной) содержит ферменты, участвующие в генерации протонного градиента и синтезе АТФ.Эти две мембраны разделены межмембранным отсеком, функция которого неизвестна. Основные информационные процессы, такие как репликация ДНК, синтез РНК и биосинтез белка, расположены внутри «цитоплазмы» или центрального цитоплазматического компартмента.
