Таблица «Белки» (для учащихся 10 классов)
МКОУ «Новокаякентская СОШ»
с. Новокаякент
Каякентский район Республика Дагестан.
Таблица «Белки»
(для учащихся 10 классов)
Автор: учитель биологии
МКОУ «Новокаякентская СОШ»
Умалатова Равганият Бийбулатовна
с.Новокаякент
2017 г.
Пояснительная записка
Данная таблица «Белки» рекомендуется для учащихся 10 класса. Материал можно использовать при прохождении темы «Органические вещества». Таблица включает информацию о белках. В таблице содержится информация о строении, уровнях структурной организации белков, классификации белков по структуре и химическому составу и функциях, выполняемых белками.
Задачи: ознакомление учащихся строением, уровнями структурной организации белков, классификации белков по структуре и химическому составу и функциями выполняемыми белками.
Таблица «Белки»
БелкиБелки— азотсодержащие органические соединения, макромолекулы, гетерополимеры, мономером является аминокислота.
Аминокислота В состав белков входит 20 аминокислот
заменимые незаменимые
синтезируются в организме не синтезируются в организме,
должны поступать с пищей
Уровни структурной организации белков
Классификация белков
Белки по структуре
Фибриллярные Глобулярные
(молекулы вытянутые) (молекулы в форме клубка- глобулы)
Белки (по химическому составу)
Простые Сложные
(в составе только аминокислоты) (в составе есть небелковая часть)
Денатурация – утрата белковой молекулы своей структуры, вплоть до первичной.
Функции белков:
1.Структурная 6.Регуляторная
2.
3.Двигательная 8.Запасающая
4.Транспортная 9.Рецепторная
5.Защитная
Источники информации:
1.Общая биология: учебник для 10-11кл. В.Б.Захаров, С.Г.Мамонтов, Н.И.Сонин. -М.: Дрофа,2006.
2.Биология 10 класс: поурочные планы. Автор-составитель О Л.Ващенко,2007.
Издательство «Учитель».
3.Биология в таблицах и схемах/ А.Ю. Ионцева, А.Б.Торгалов.-М.:Эксмо,2012.-352с.
http://multiring.ru/course/biochemistry/70216/33042.gif
https://ds03.infourok.ru/uploads/ex/0e20/000453df-af5e5eea/hello_html_m16f37346.png
http://fiz.na5bal.ru/pars_docs/refs/1/176/176_html_7c3ff021.jpg
Роль белков, жиров и углеводов в организме человека
2 Видеолекторий на тему: «Роль белков, жиров и углеводов в организме человека»
Белки, жиры и углеводы играют важную роль в организме человека.
Белки—сложные вещества, состоящие из аминокислот. Являются неизменной составляющей частью рациона. Это главный строительный материал, без которого невозможен рост мускулатуры и тканей в целом. Белки подразделяются на 2 категории:
Животный, который поступает из продуктов животного происхождения. К этой категории можно отнести мясо, птицу, рыбу, молоко, творог и яйца.
Растительный, который организм получает из растений. Здесь стоит выделить рожь, овсянку, грецкие орехи, чечевицу, фасоль, сою и морские водоросли.
Жиры — это органические соединения, отвечающие за «резервный фонд» энергии в организме, главные поставщики энергии в периоды дефицита пищи и болезней, когда организм получает малый объем питательных элементов или же не получает их вовсе. Жиры необходимы для эластичности кровеносных сосудов, благодаря чему полезные элементы быстрее проникают к тканям и клеткам, способствуют нормализации состояния кожных покровов, ногтевых пластин и волос.
Углеводы — это главный источник энергии для людей. В зависимости от количества структурных единиц углеводы делятся на простые и сложные. Углеводы, называемые простыми или «быстрыми», легко усваиваются организмом и повышают уровень сахара в крови, что может повлечь набор лишнего веса и ухудшение метаболизма.
Сложные углеводы состоят из множества связанных сахаридов, включая в себя от десятков до сотен элементов. Подобные углеводы считаются полезными, поскольку при переваривании в желудке они отдают свою энергию постепенно, обеспечивая стабильное и долговременное чувство насыщения.
Также важную роль в организме играют витамины и микроэлементы, которые не включены в структуру тканей, однако без их участия не выполнялись бы многие жизненно важные функции, происходящие в человеческом организме.
Практически все жизненные процессы в нашем теле находятся в зависимости от того, что мы употребляем в пищу. Достаточно богаты углеводами свежие фрукты. Необходимо избегать чрезмерного употребления сладостей, мучных изделий, сахара. Рациональное питание имеет существенное значение – и это подразумевает не только своевременное употребление вкусно приготовленной еды, но и включение в ежедневный рацион оптимального соотношения таких важных для правильной жизнедеятельности веществ, как белки, жиры, углеводы, витамины и микроэлементы. От гармоничного сочетания всех этих веществ зависит поддержание нормальной жизнедеятельности человека.
ФГБНУ НЦПЗ. Диссертации. Ташматов Баходир Абдурахимович. Клинико-биологическое изучение мембраноактивного белка сыворотки крови больных шизофренией.
АКАДЕМИЯ МЕДИЦИНСКИХ НАУК СССР
ВСЕСОЮЗНЫЙ НАУЧНЫЙ ЦЕНТР ПСИХИЧЕСКОГО ЗДОРОВЬЯ
На правах рукописи
ТАШМАТОВ БАХОДИР АБДУРАХИМОВИЧ
КЛИНИКО-БИОЛОГИЧЕСКОЕ ИЗУЧЕНИЕ
МЕМБРАНОАКТИВНОГО БЕЛКА СЫВОРОТКИ
КРОВИ БОЛЬНЫХ ШИЗОФРЕНИЕЙ
14. 00.18 — «Психиатрия»
00.18 — «Психиатрия»
АВТОРЕФЕРАТ
диссертации на соискание ученой степени доктора медицинских наук
МОСКВА- 1991 ГОД
Работа выполнена на кафедре психиатрии Ташкентского государственного медицинского института (ректор-профессор Даминэв Т. А., зав. кафедрой — профессор Алимов X. А.), в лаборатории «Биофизика клетки» Института физиологии АН УзССР (директор-академик АН УзССР Ташмухамедов Б. А.) и Институте химии растительных веществ АН УзССР (директор-профессор Арипов X. Н.)
Официальные оппоненты:
доктор медицинских наук, профессор Вертоградова О. П.
доктор биологических наук, профессор Лидеман Р. Р.
Ведущее учреждение — Всесоюзный научно-исследовательский институт общей и судебной психиатрии им. В. П. Сербского МЗ СССР.
Защита состоится «11» марта 1991 г. на заседании специализированного совета Д 001.30.01 при Всесоюзном научном центре психического здоровья АМН СССР по адресу: Москва, Каширское шоссе, 34.
С диссертацией можно ознакомиться в библиотеке ВНЦПЗ АМН СССР.
Автореферат разослан «» 1991 г.
Ученый секретарь специализированного совета, кандидат медицинских наук
ЛОСЕВА Т. М.
ВВЕДЕНИЕ
Актуальность проблемы. Фундаментальные достижения в области биологии, биохимии, биофизики существенно повлияли на
развитие исследований в области психиатрии и привели к появлению биологического направления изучения патогенеза шизофрении. Благодаря биологическим поискам сущности шизофрении было
L.Flataker ,1963), вызывать психические расстройства у здоровых добровольцев (R&.Heath, 1954), приводить к гемолизу куриных эритроцитов и увеличению коэффициента лактат/пируват
(С.
 Е.Frohman, 1967; А.В.Снежневский и М.Е.Вартанян, 1975;
Е.Frohman, 1967; А.В.Снежневский и М.Е.Вартанян, 1975;Д.В.Лозовский, 1971). Поиски причин указанных нарушений привели к обнаружению в крови больных шизофренией белкового вещества — «фактора плазмы» или «сывороточного фактора». Дальнейшее
изучение свойств биологически активного сывороточного фактора
показало универсальность его действия, которая выражалась в
способности повреждать клеточные мембраны (Р.Р.Лидеман, 1972;
Г.И.Коляскина, 1975; И.В.Домашнева, 1971; Е.И.Солнцева, 1973;
Попытки исследователей, направленные на выделение из крови больных шизофренией сывороточного фактора и изучение его физико-химической природы, не увенчались успехом. Несмотря набольшую интенсивность этих исследований, они не привели к обнаружению «шизофренического токсина». С одной стороны, полученные результаты, по целому ряду причин оказались весьма неоднозначными, а порой и диаметрально противоположными, с другой стороны, до настоящего времени остается неясным вопрос о роли и месте сывороточного фактора в этиопатогенезе шизофрении, источнике его происхождения и в какой степени сывороточный фактор сопровождает болезнь на всем ее протяжении. Еще более разноречивы мнения исследователей о механизме действия сывороточного фактора на мозговые структуры.
Отсутствие единой точки зрения на проблему сывороточного фактора, на наш взгляд, объясняется, во-первых, тем, что, в исследованиях, направленных на поиск специфической, биологически активной белковой субстанции, имеющей определенное значение в патогенезе шизофрении, применялась цельная сыворотка. Во-вторых, используемые для решения проблемы сывороточного фактора тест-системы были биологически неоднородными, что также приводило к неоднозначным результатам.
Таким образом, проблема сывороточного фактора переросла в значительно более широкую проблему биологических особенностей сыворотки крови при шизофрении.
Необходимо подчеркнуть, что важность изучения природы шизофрении диктуется ее распространенностью, тяжестью течения, неблагоприятным исходом с ранней инвалидизацией.
 Поэтому изучение сущности этого заболевания имеет очень большое значение для решения принципиальных практических и теоретических вопросов психиатрии.
Поэтому изучение сущности этого заболевания имеет очень большое значение для решения принципиальных практических и теоретических вопросов психиатрии.Тема диссертации входит в государственную программу научных исследований (государственная регистрация № 01860036328,
шифр 27.01).
Задачи исследования.
В соответствии с поставленной целью основные задачи исследования сводились к следующему:
- Выделение из сыворотки крови больных шизофренией белкового вещества, биологическая активность которого выявлялась при помощи надежной тест-системы, позволяющей количественно оценивать степень биологической активности в зависимости от клинического состояния больных.
- Исследование мембраноактивных свойств сывороточного белка больных различными клиническими формами и типами течения шизофренического процесса.
- Влияние коррелятивной связи между результатами исследования мембраноактивных СВОЙСТВ сыворотки крови больных шизофренией и основными клиническими характеристиками заболевания, имея в виду клиническую форму и тип течения.
- Изучение физико-химических свойств мембраноактивного белка сыворотки крови больных шизофренией, включающее определение молекулярной массы, аминокислотного состава, термолабильности, спонтанной инактивации вторичной структуры.
Научная новизна работы.
Научная новизна работы определяется ее основными результатами, В работе впервые в психиатрии использован метод выявления биологической активности при помощи искусственных бислойных липидных мембран, являющихся моделью биологических мембран, и метод изучения вторичной структуры мембраноактивного белка больных шизофренией при помощи спектрополяриметра.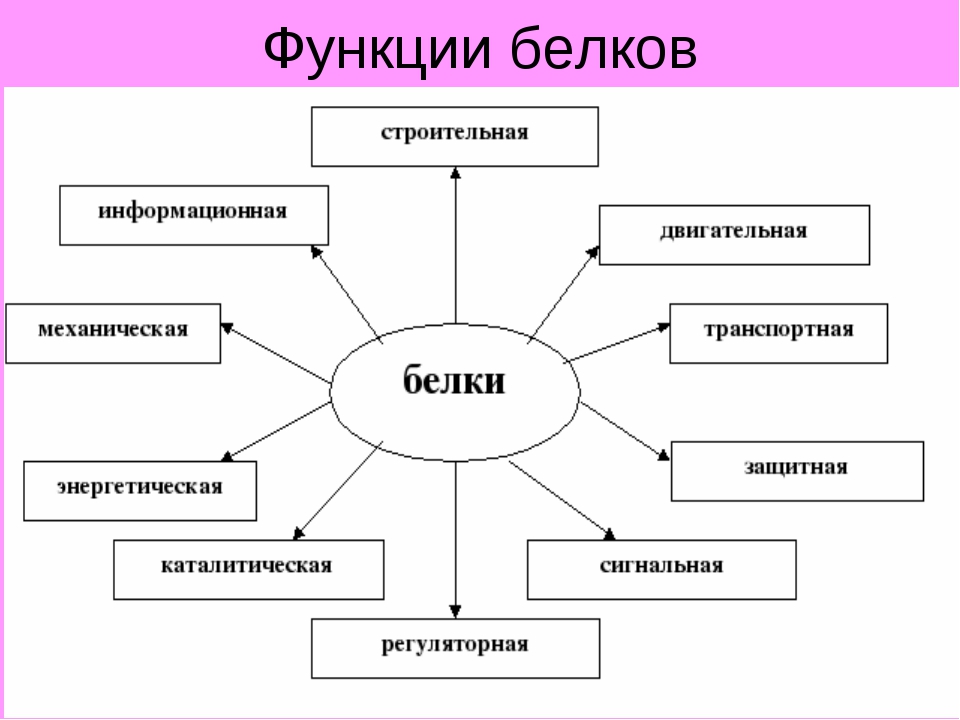
В процессе выделения из крови больных шизофренией мембраноактивного белка был получен белок с высокой степенью чистоты.
Гомогенность его доказана как методом аналитического электрофореза в полиакриламидном геле, так и определением Nh3-концевой аминокислоты. Это позволило определить молекулярную массу и аминокислотный состав этого белка.
Кроме того, в работе показано, что мембраноактивный белок является двухкомпонентным белковым соединением. Используя молекулярные фильтры, удалось разделить низкомолекулярную часть от высокомолекулярной. Доказано, что низкомолекулярный компонент белка является ответственным за мембранную активность, тогда как высокомолекулярный компонент такой активностью не обладал.
В диссертации впервые изучены физико-химические особенности низкомолекулярного компонента мембраноактивного белка — молекулярная масса, аминокислотный состав, вторичная структура, способность к каналообразованию в мембранах. По уровню, результаты диссертации являются новыми, имеющими важное народнохозяйственное значение. Теоретическая и практическая значимость. В работе выявлена способность глобулиновой фракции сыворотки крови больных шизофренией увеличивать удельную проводимость бислойной липидной мембраны (БЛМ), интенсивность которой зависит от клинических параметров заболевания. Указанной способностью глобулиновая фракция сыворотки крови больных другими психозами и здоровых лиц не обладала. Эти различия могут служить дополнительным тестом для диагностики шизофрении.
Кроме того, выявленные в работе различные показатели биологической активности сывороточного фактора при различных конических проявлениях заболевания позволяют логично обосновывать существующую верификацию шизофрении.
Изучение мембраноактивного белка позволило доказать его двухкомпонентность и исследовать физико-химические свойства низкомолекулярного компонента белка. В работе показано, что в низкомолекулярном компоненте происходят существенные информационные перестройки и наблюдается ярко выраженное изменение вторичной структуры этого компонента.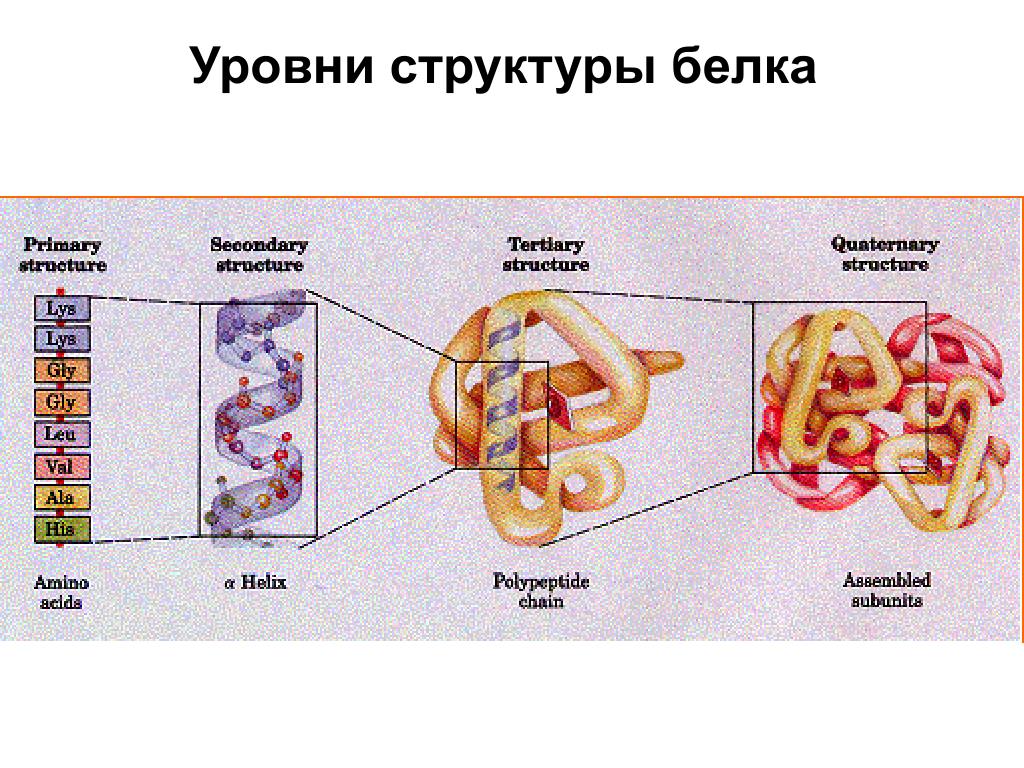 Эти данные указывают на высокую ценность результатов диссертации.
Эти данные указывают на высокую ценность результатов диссертации.
Реализация (внедрение). Результаты работы имеют прикладное значение и могут быть использованы в масштабах отрасли.
Метод изучения мембраноактивных свойств сывороточного белка больных шизофренией при помощи БЛМ, являющихся надежной тест-системой, может быть рекомендован для его использования во всех биохимических лабораториях психиатрических учреждений. Результаты исследования этим методом могут служить дополнительным критерием для комплексной диагностики шизофрении.
Кроме того, выявленные с помощью спектрополяриметра выраженные конформационные сдвиги в структуре низкомолекулярного компонента сывороточного белка больных шизофренией требуют дальнейшего более глубокого изучения с поиском причины этого феномена.
Продолжение научных исследований по указанной проблеме осуществляется на кафедре психиатрии Ташкентского государственного медицинского института № I, Институте физиологии АН УзССР и Институте химии растительных веществ АН УзССР.
Апробация диссертации. Материалы диссертации доложены на научно-практической конференции врачей Городской клинической психиатрическое больницы ГУЗ Ташгорисполкома (1986 год), на заседании Республиканского научного общества невропатологов и психиатров Узбекистана (1987 год), на П съезде невропатологов и психиатров Узбекистана (1987 год), на Международном симпозиуме молодых ученых, посвященном вопросам судебной психиатрии -ВНИИ общей и судебной психиатрии им. В.П.Сербского (стендовый доклад, 1988 год).
Публикации.
Материалы диссертации опубликованы в восьми научных статьях в республиканских и центральных изданиях.
Структура диссертации. Диссертация изложена на 200 страницах машинописного текста, из них 162 страницы основного текста. Она состоит из введения, обзора литературы, глав собственного исследования, заключения, выводов, перечня использованной литературы и приложения. Библиографический указатель включает 185 отечественных и 127 зарубежных работ. Всего использовано 312 литературных источников. Работа иллюстрирована 26 рисунками и 4 таблицами.
Библиографический указатель включает 185 отечественных и 127 зарубежных работ. Всего использовано 312 литературных источников. Работа иллюстрирована 26 рисунками и 4 таблицами.
Материал и методы исследования. Были обследованы 104 больных различными клиническими формами и типом течения шизофрении, 15 больных психозами нешизофренической этиологии и 37 практически здоровых лиц. Клиническое наблюдение и исследование больных проводилось в Городской клинической психиатрической больнице Главупрздрава Ташгорисполкома в период с 1979 года по 1990 год.
Для обследования были взяты только те больные, у которых психический статус в момент госпитализации характеризовался продуктивной симптоматикой и где можно было в первую очередь думать о шизофреническом процессе, Уточнение особенностей течения и состояния больных в каждом случае осуществлялось автором после исследования сыворотки крови.
Оценка формы заболевания и статуса больного проводилась в соответствии с классификацией форм шизофрении, предложенной А.В.Снежневским и сотрудниками Института психиатрии АМН СССР (1960,1975,1985 гг.). Согласно этой классификации, клинический материал, представленный больными шизофренией, характеризовался типом течения и клиническими проявлениями, при-водимыми в таблице I.
Вторую группу исследованных составили 15 больных, из которых у 8 был диагностирован алкогольный делирий. У остальных 7 больных при госпитализации предполагалась шизофрения, но в процессе клинического наблюдения и исследования этот диагноз был исключен.
Третья группа была представлена практически здоровыми. Это — студенты медицинского института и медицинские работники.
Для выделения из сыворотки крови больных шизофренией биологически активного сывороточного белка и аналогичного белка у представителей П- и Ш групп был использован метод ионообменной хроматографии на колонке с ДЭАЭ-целлюлозой (Т.Дэвени, Я. Гергей, I97S).
Для очистки биологически активной белковой фракции и получения сывороточного α2-глобулина в очищенном виде использовался метод ппепапативного диск-электрофореза (Г. Маурер, 1971).
Маурер, 1971).
Таблица № 1
Клиническая характеристика обследованных больных шизофренией
|
Тип течения |
Клинические проявления (симптоматика) |
Кол-во больных |
Муж. |
Жен. |
повторн. госпит. |
наслед. отягощ. |
Инвалид- ность |
|
I.Непрерывно- прогредиентный |
|
75 72,1% |
51 68,0% |
24 32,0% |
51 63,0% |
28 37,3% |
34 45,3% |
|
1. |
1.Неврозоподобная |
5 |
3 |
2 |
2 |
1 |
— |
|
2.Паранойяльная |
12 |
8 |
4 |
7 |
3 |
— |
|
|
2.Умеренно-прогредиентная |
Галлкщинаторно-параноидная:
|
|
|
|
|
|
|
|
А. |
23 |
12 |
11 |
15 |
9 |
10 |
|
|
Б.Бредовой вариант |
18 |
15 |
3 |
12 |
7 |
10 |
|
|
3.Злокачественная |
1.Гебефреническая |
8 |
5 |
3 |
7 |
5 |
6 |
|
Конечные (исходные) состояния |
9 |
8 |
1 |
8 |
3 |
8 |
|
|
II. прогредиентный (шубообразная) |
1.Параноидная |
19 18,2% |
11 57,9% |
8 42,1% |
12 63,2% |
7 36,8% |
6 18,2% |
|
|
|
|
|
|
|
||
|
III. Периодический (рекуррентный) |
I. Кататоно-онейроидная |
10 9,6% |
6 60% |
4 40% |
2 20% |
1 10% |
— |
|
ИТОГО: |
104 |
68 |
36 |
65 |
36 |
40 |
|
Гомогенность мембраноактивного белка — α2-глобулина определяли методом аналитического электрофореза в полиакри- . ламидном геле (Г.Маурер, 1971), способностью вызывать анти-тела (Т.Дэвени, Я.Гергеи, 1976) и методомопределения Nh3-концевой аминокислоты (Protein sequence dermination, 1975).
ламидном геле (Г.Маурер, 1971), способностью вызывать анти-тела (Т.Дэвени, Я.Гергеи, 1976) и методомопределения Nh3-концевой аминокислоты (Protein sequence dermination, 1975).
В качестве теста для выявления биологической активности сывороточного α2-глобулина были использованы искусственные бислойные фосфолипидные мембраны — БЛМ (R.Mueller, D.Rubin, 1963).
Для разделения мембраноактивного белка и аналогичного белка здоровых людей на двухкомпонентную систему использовали мембранные концентраторы ФМ-2 отечественного производства с молекулярными фильтрами «Владипор» различной разрешающей способности.
Для определения физико-химических свойств мембраноактивного α2-глобулина использовали аминокислотный анализатор., фирмы «Бекман» (США) и спектрополяриметр Jasep J. (Япония).
Статистическую обработку полученных результатов исследований проводили параметрическим методом.
Выделение мембраноактивного белка из сыворотки крови больных шизофренией.
Для выделения биологически- активного белка из сыворотки крови больных шизофренией были использованы классические методы аналитической химий белка: ионообменная хроматография на колонке с ДЭАЭ-целлюлозой, препаративный и аналитический электрофорез.
Для ионообменной хроматографии использовалась порошкообразная ДЭАЭ-целлюлоза ДЭ-32 фирмы «Peaнал» (ВНР). Подготовленной к работе целлюлозой заполняли колонку, размером I х 60 см.
Хроматография проводилась по методу Т.Дэвени и Я.Гергей (1976). Полученные 4 белковые фракции больных шизофренией, другими психозами и здоровых лиц были исследованы на наличие биологической активности. Было выявлено, что только III белковая фракция сыворотки крови больных шизофренией обладала мембрано-активными свойствами, проявляющимися в способности увеличивать удельную проводимость искусственных бислойных липидных мембран (БЛМ).
Изучение гомогенности биологически активной 3 белковой фракции, содержащей в основном α -глобулины, больных шизофренией и неактивной у больных другими психозами и здоровых яиц при помощи аналитического электрофореза в полиакриламидном геле показало, что эта фракция является смесью разнородных белков.
Дальнейшая очистка Ш белковой фракции проводилась при помощи препаративного диск-электрофореза у 86 больных шизофренией, 6 больных другими психозами и 21 здорового. В результате был выделен гомогенный белок, сохранявший мембраноактивные свойства у больных шизофренией.
Как известно, гомогенность изучаемого материального-субстрата является самым первым и необходимым условием для изучения его структуры. В связи с этим, гомогенности полученного белка придавалось особое значение. Гомогенность мембраноактивного белка проверялась тремя параллельными способами: анали-. тическим электрофорезом в полиакриламидном геле, определением свободного Nh3 -конца в молекуле белка и количеством линий преципитации при двойной двумерной диффузии в агаровом геле по Ухтерлони, после получения иммунной сыворотки у кроликов.
Исследования показали, что полученный после препаративного диск-электрофореза белок, мембраноактивный у больных шизофренией и неактивный у больных другими психозами и здоровых лиц, является гомогенным. По своей электрофоретической подвижности указанный белок относится к группе α2-глобулина.
Выбор и использование тест-системы для выявления мембраноактивных свойств сывороточного белка больных шизофренией.
В отечественной и зарубежной литературе описано много способов обнаружения биологической активности сывороточных белков больных шизофренией. Так, биологическую активность «фактора плазмы» некоторые исследователи выявили по снижению скорости взбегания обученных крыс но отвесной веревке, возникновению психических расстройств у здоровых добровольцев, гемолизу куриных эритроцитов и связанных с ним увеличением коэффициента лактат/пируват.
Работами отечественных исследователей было выявлено, что в основе упомянутых многоплановых эффектов лежит способность сывороточных белков больных шизофренией повреждать, прежде всего мембраны клеточных и субклеточных структур.
Не умаляя достоинств каждого метода исследований, следует все же сказать,_ что некоторые из них отличались недостаточной информативностью, трудностью дифференциации и проведения корреляции полученных результатов с различными клиническими проявлениями и течением шизофренического процесса. .
.
Кроме того, результаты исследований некоторыми указанными методами вызывали определенные трудности в цифровых выражениях, способных максимально объективизировать верификацию шизофрении.
Все изложенное послужило причиной поиска новых, современных методов выявления биологической активности сыворотки крови больных шизофренией. В своем поиске такого метода, мы руководствовались доказанной способностью сывороточных белков больных шизофренией повреждать клеточные мембраны.
Р.Мюллер с соавторами (1963) впервые выявили, что липиды, спонтанно образующие ламеллярные слои, способны формировать бислойные структуры на небольших отверстиях в тонких гидрофобных материалах. Авторы с помощью простой электроизмерительной техники охарактеризовали важнейшие электрические параметры этих мембран, получивших название бислойных липидных мембран — БЛМ. Было обнаружено, что по своим электрическим характеристикам и ряду других физико-химических свойств, БЛМ близки к биологическим мембранам.
В психиатрической литературе каких-либо указаний на использование этого метода для выявления биологической активности сывороточных белков больных шизофренией обнаружено не было.
В специальной литературе имеются сообщения о многих биологически активных соединениях, вызывающих изменение проводимости БЛМ. При сопоставлении результатов исследования мембраноактивных свойств Ш белковой фракций сыворотки крови больных шизофренией и данными литературы по изучению биологически активных соединений методом БЛМ, можно видеть, что в обоих случаях отмечается изменение проводимости БЛМ.
Таблица 2
Сравнительная характеристика увеличения проводимости БЛМ при воздействии мембраноактивных веществ и Ш белковой фракции сыворотки крови больных шизофренией
|
Вещество |
Концентрация (М) |
Удельная проводимость (q)БЛМ: ом—1 см -2
|
|
Контроль (Ш белковая фракция сыворотки крови здоровых лиц) |
1,0•10 -5 |
2,34•10 -10 |
|
ЦТАБ (цетилтриметиламмония бромид) |
1,0•10 -5 |
(1,4±0,2)•10 -6 |
|
АНС (1-анилино-8-нафта-линсульфонат) |
3,0•10 -5 |
(5,4±0,5)•10 -7 |
|
ЛК (линолевая кислота) в н-декак |
4,2•10 -1 |
(1,0±0,3)•10 -7 |
|
Яд паука Steatoda Paykulliana |
1,0•10 -5
|
(5,0±0,3)•10 -5 |
|
Грамицидин А |
4,0•10 -6 |
(1,8±0,5)•10 -5 |
|
Аламетицин |
4,0•10 -6 |
(3,2±0,3)•10 -4 |
|
Ш белковая фракция сыворотки крови больных шизофренией |
1,0•10 -5 |
(1,7±0,3)•10 -9 |
Как видно из приведенных данных, Ш белковая фракция сыворотки крови больных шизофренией обладает такими же мембраноактивными свойствами, что и известные биологически активные соединения. Это и послужило причиной окончательного выбора метода бислойных липидных мембран в качестве тест — объекта для выявления мембранотропной активности сыворотки крови больных шизофренией.
Это и послужило причиной окончательного выбора метода бислойных липидных мембран в качестве тест — объекта для выявления мембранотропной активности сыворотки крови больных шизофренией.
Результаты собственных исследований и клинико-биологические корреляции.
Для изучения мембраноактивных свойств 3 белковой фракции и гомогенного α2 -глобулина сыворотки крови больных шизофренией использовались БЛМ, полученные по методу Р.Мюллера с соавторами (1963). Для измерения электропроводимости БЛМ применялась электрическая схема, описанная Е.А.Либерманом (1970).
В среде, содержащей 100 мМ KCL и 5 мМ TPИС-HCL ,pH 7,5, проводимость БЛМ без сывороточных белков составляла 1-2,34•10-10ом-1см-2.
Во всех случаях после добавления в среду 2,0 мл концентрированной на роторном испарителе Ш белковой фракции больных шизофренией наблюдалось увеличение удельной проводимости БЛМ почти на I порядок ( 4,6±0,5•10-9ом-1см-2). Аналогичные изменения проводимости БЛМ, индуцированной Ш белковой фракцией больных шизофренией, наблюдались и в присутствии в среде ионов натрия.
Результаты исследования мембраноактивных свойств Ш белковой фракции больных шизофренией в зависимости от типа течения и клинических проявлений представлена в таблице 3.
Тип течения и клинические проявления
§ 10. Классификация белков
§ 10. КЛАССИФИКАЦИЯ БЕЛКОВ
Существуют несколько подходов к классификации белков: по форме белковой молекулы, по составу белка, по функциям. Рассмотрим их.
Классификация по форме белковых молекул
По форме белковых молекул различают фибриллярные белки и глобулярные белки.
Фибриллярные белки представляют собой длинные нитевидные молекулы, полипептидные цепи которых вытянуты вдоль одной оси и скреплены друг с другом поперечными сшивками (рис. 18,б). Эти белки отличаются высокой механической прочностью, нерастворимы в воде. Они выполняют главным образом структурные функции: входят в состав сухожилий и связок (коллаген, эластин), образуют волокна шелка и паутины (фиброин), волосы, ногти, перья (кератин).
Они выполняют главным образом структурные функции: входят в состав сухожилий и связок (коллаген, эластин), образуют волокна шелка и паутины (фиброин), волосы, ногти, перья (кератин).
В глобулярных белках одна или несколько полипептидных цепей свернуты в плотную компактную структуру – клубок (рис. 18,а). Эти белки, как правило, хорошо растворимы в воде. Их функции многообразны. Благодаря им осуществляются многие биологические процессы, о чем подробнее будет изложено ниже.
Рис. 18. Форма белковых молекул:
а – глобулярный белок, б – фибриллярный белок
Классификация по составу белковой молекулы
Белки по составу можно разделить на две группы: простые и сложные белки. Простые белки состоят только из аминокислотных остатков и не содержат других химических составляющих. Сложные белки, помимо полипептидных цепей, содержат другие химические компоненты.
К простым белкам относятся РНКаза и многие другие ферменты. Фибриллярные белки коллаген, кератин, эластин по своему составу являются простыми. Запасные белки растений, содержащиеся в семенах злаков, – глютелины, и гистоны – белки, формирующие структуру хроматина, принадлежат также к простым белкам.
Среди сложных белков различают металлопротеины, хромопротеины, фосфопротеины, гликопротеины, липопротеины и др. Рассмотрим эти группы белков подробнее.
Металлопротеины
К металлопротеинам относят белки, в составе которых имеются ионы металлов. В их молекулах встречаются такие металлы, как медь, железо, цинк, молибден, марганец и др. Некоторые ферменты по своей природе являются металлопротеинами.
Хромопротеины
В составе хромопротеинов в качестве простетической группы присутствуют окрашенные соединения. Типичными хромопротеинами являются зрительный белок родопсин, принимающий участие в процессе восприятие света, и белок крови гемоглобин (Hb), четвертичная структура которого рассмотрена в предыдущем параграфе. В состав гемоглобина входит гем, представляющий собой плоскую молекулу, в центре которой расположен ион Fe2+ (рис. 19). При взаимодействии гемоглобина с кислородом образуется оксигемоглобин. В альвеолах легких гемоглобин насыщается кислородом. В тканях, где содержание кислорода незначительно, оксигемоглобин распадается с выделением кислорода, который используется клетками:
В состав гемоглобина входит гем, представляющий собой плоскую молекулу, в центре которой расположен ион Fe2+ (рис. 19). При взаимодействии гемоглобина с кислородом образуется оксигемоглобин. В альвеолах легких гемоглобин насыщается кислородом. В тканях, где содержание кислорода незначительно, оксигемоглобин распадается с выделением кислорода, который используется клетками:
.
Гемоглобин может образовывать соединение с оксидом углерода (II), которое называется карбоксигемоглобином:
.
Карбоксигемоглобин не способен присоединять кислород. Вот почему происходит отравление угарным газом.
Гемоглобин и другие гем-содержащие белки (миоглобин, цитохромы) называют еще гемопротеинами из-за наличия в их составе гема (рис. 19).
Рис. 19. Гем
Фосфопротеины
Фосфопротеины в своем составе содержат остатки фосфорной кислоты, связанные с гидроксильной группой аминокислотных остатков сложноэфирной связью (рис. 20).
Рис. 20. Фосфопротеин
К фосфопротеинам относится белок молока казеин. В его состав входят не только остатки фосфорной кислоты, но и ионы кальция. Фосфор и кальций необходимы растущему организму в больших количествах, в частности, для формирования скелета. Кроме казеина, в клетках много и других фосфопротеинов. Фосфопротеины могут подвергаться дефосфорилированию, т.е. терять фосфатную группу:
фосфопротеин + Н2 протеин + Н3РО4
Дефосфорилированные белки могут при определенных условиях быть снова фосфорилированы. От наличия фосфатной группы в их молекуле зависит их биологическая активность. Одни белки проявляют свою биологическую функцию в фосфорилированном виде, другие – в дефосфорилированном. Посредством фосфорилирования – дефосфорилирования регулируются многие биологические процессы.
Липопротеины
К липопротеинам относятся белки, содержащие ковалентно связанные липиды. Эти белки встречаются в составе клеточных мембран. Липидный (гидрофобный) компонент удерживает белок в мембране (рис. 21).
Рис. 21. Липопротеины в клеточной мембране
К липопротеинам относят также белки крови, участвующие в транспорте липидов и не образующие с ними ковалентную связь.
Гликопротеины
Гликопротеины содержат в качестве простетической группы ковалентно связанный углеводный компонент. Гликопротеины разделяют на истинные гликопротеины и протеогликаны. Углеводные группировки истинных гликопротеинов содержат обычно до 15 – 20 моносахаридных компонентов, у протеогликанов они построены из очень большого числа моносахаридных остатков (рис. 22).
Рис. 22. Гликопротеины
Гликопротеины широко распространены в природе. Они встречаются в секретах (слюне и т.д.), в составе клеточных мембран, клеточных стенок, межклеточного вещества, соединительной ткани и т.д. Многие ферменты и транспортные белки являются гликопротеинами.
Классификация по функциям
По выполняемым функциям белки можно разделить на структурные, питательные и запасные белки, сократительные, транспортные, каталитические, защитные, рецепторные, регуляторные и др.
Структурные белки
К структурным белкам относятся коллаген, эластин, кератин, фиброин. Белки принимают участие в формировании клеточных мембран, в частности, могут образовывать в них каналы или выполнять другие функции ( рис. 23).
Рис. 23. Клеточная мембрана.
Питательные и запасные белки
Питательным белком является казеин, основная функция которого заключается в обеспечении растущего организма аминокислотами, фосфором и кальцием. К запасным белкам относятся яичный белок, белки семян растений. Эти белки потребляются во время развития зародышей. В организме человека и животных белки в запас не откладываются, они должны систематически поступать с пищей, в противном случае может развиться дистрофия.
К запасным белкам относятся яичный белок, белки семян растений. Эти белки потребляются во время развития зародышей. В организме человека и животных белки в запас не откладываются, они должны систематически поступать с пищей, в противном случае может развиться дистрофия.
Сократительные белки
Сократительные белки обеспечивают работу мышц, движение жгутиков и ресничек у простейших, изменение формы клеток, перемещение органелл внутри клетки. Такими белками являются миозин и актин. Эти белки присутствуют не только в мышечных клетках, их можно обнаружить в клетках практически любой ткани животных.
Транспортные белки
Гемоглобин, рассмотренный в начале параграфа, является классическим примером транспортного белка. В крови присутствуют и другие белки, обеспечивающие транспорт липидов, гормонов и иных веществ. В клеточных мембранах находятся белки, способные переносить через мембрану глюкозу, аминокислоты, ионы и некоторые другие вещества. На рис. 24 схематически показана работа переносчика глюкозы.
Рис. 24. Транспорт глюкозы через клеточную мембрану
Белки-ферменты
Каталитические белки, или ферменты, представляют собой самую многообразную группу белков. Почти все химические реакции, протекающие в организме, протекают при участии ферментов. К настоящему времени открыто несколько тысяч ферментов. Более подробно они будут рассмотрены в следующих параграфах.
Защитные белки
К этой группе относятся белки, защищающие организм от вторжения других организмов или предохраняющие его от повреждений. Иммуноглобулины, или антитела, способны распознавать проникшие в организм бактерии, вирусы или чужеродные белки, связываться с ними и способствовать их обезвреживанию.
Другие компоненты крови, тромбин и фибриноген, играют важную роль в процессе свертывания крови. Они предохраняют организм от потери крови при повреждении сосудов. Под действием тромбина от молекул фибриногена отщепляются фрагменты полипептидной цепи, в результате этого образуется фибрин:
Они предохраняют организм от потери крови при повреждении сосудов. Под действием тромбина от молекул фибриногена отщепляются фрагменты полипептидной цепи, в результате этого образуется фибрин:
фибриноген фибрин.
Образовавшиеся молекулы фибрина агрегируют, формируя длинные нерастворимые цепи. Сгусток крови вначале является рыхлым, затем он стабилизируется за счет межцепочечных сшивок. Всего в процессе свертывания крови участвует около 20 белков. Нарушения в структуре их генов является причиной такого заболевания, как гемофилия – сниженная свертываемость крови.
Рецепторные белки
Клеточная мембрана является препятствием для многих молекул, в том числе и для молекул, предназначенных для передачи сигнала внутрь клеток. Тем не менее клетка способна получать сигналы извне благодаря наличию на ее поверхности специальных рецепторов, многие из которых являются белками. Сигнальная молекула, например, гормон, взаимодействуя с рецептором, образует гормон-рецепторный комплекс, сигнал от которого передается далее, как правило, на белковый посредник. Последний запускает серию химических реакций, результатом которых является биологический ответ клетки на воздействие внешнего сигнала (рис. 25).
Рис.25. Передача внешних сигналов в клетку
Регуляторные белки
Белки, участвующие в управлении биологическими процессами, относят к регуляторным белкам. К ним принадлежат некоторые гормоны. Инсулин и глюкагон регулируют уровень глюкозы в крови. Гормон роста, определяющий размеры тела, и паратиреоидный гормон, регулирующий обмен фосфатов и ионов кальция, являются регуляторными белками. К этому классу белков принадлежат и другие протеины, участвующие в регуляции обмена веществ.
Интересно знать! В плазме некоторых антарктических рыб содержатся белки со свойствами антифриза, предохраняющие рыб от замерзания, а у ряда насекомых в местах прикрепления крыльев находится белок резилин, обладающий почти идеальной эластичностью. В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
Советы по здоровому питанию — Роспотребнадзор
Нужно ли всем считать калории? Каждую калорию, конечно — нет! Но нужно иметь общие представления, что и почем! И эти нужно знать уже с детства. Мы же учим детей чистить зубы по утрам и мыть руки перед едой и это становится частью их жизни!
Есть ли здоровые продукты? Если да, то к ним в первую очередь следует отнести яблоки. И если так, то попробуйте в течение 2 недель есть только яблоки – результат: резкое снижение веса, потеря иммунитета, симптомы анемии и другие признаки белково-калорийной недостаточности. Или сливочное масло – один жир! Но, «паутинка»
|
Рацион здорового питания обеспечивается разнообразием продуктов |
сливочного масла (2-3 грамма), нанесенная на кусок свежего ржаного хлеба – вкус умопомрачительный, но не только. Дополнительно 20-25 килокалорий (около 1% потребности в энергии взрослого) и вполне ощутимые количества витамина А (около 2% от потребности взрослого). И таких примеров можно привести множество.
Из этого следует, что каждый продукт уникален по химическому составу и нет ни одного из них, который бы полностью удовлетворил потребности взрослого человека во всех необходимых для обеспечения здоровья пищевых и биологически активных веществах. Только комбинация различных продуктов способна решить эту задачу. Иными словами, нельзя говорить о здоровых или вредных для здоровья пищевых продуктах – только рацион в целом может быть классифицирован как здоровый или опасный для здоровья. Причем однократное или кратковременное нарушение не ведет к серьезным последствиям и при наличии знаний будет легко компенсировано. Речь здесь идет о долговременных и регулярных нарушениях, т.е. о сложившейся системе питания.
Речь здесь идет о долговременных и регулярных нарушениях, т.е. о сложившейся системе питания.
Немного о химии пищевых продуктов
Итак, попробуем разобраться «что и почем». Начнем с интегрального показателя – калорийности, которая определяется присутствием основных пищевых веществ или макронутриентов: белков, жиров и углеводов.
|
Калорийность 1 грамма пищевых веществ: белок — 4 ккал жир – 9 ккал углеводы – 4 ккал |
Следует сразу обратить Ваше внимание на то, что калорийность жиров более чем
в два раза выше калорийности белков или углеводов. Именно поэтому продукты, содержащие жир являются более калорийными. Большинство сырых или отварных овощей и фруктов имеют низкую калорийность, но в процессе их приготовления, как правило, используют жир, что приводит к значительному возрастанию калорийности. Типичный пример – отварной картофель – 75 ккал, а картофельные чипсы – 531 ккал на 100 грамм продукта! (см таблицу 1). Продукты животного происхождения, обычно, имеют более высокую калорийность, связанную с большим содержанием жира.
Белок – важнейший из компонентов пищи. В организме человека он расщепляется на аминокислоты, из которых уже сам организм синтезирует свои специфические тысячи белков, которые выполняют многообразные функции. Все множество белков – это различные комбинации 20 аминокислоты, часть аминокислот могут превращаться одна в другую и только 10 незаменимы для ребенка и 8 для взрослого, т.е. не синтезируются организмом человека. Именно последние должны поступать изо дня в день в течение всей нашей жизни. Нашему организму все равно, из каких продуктов они будут получены: мясо или картофель, молоко или горох, рыба или хлеб и т.д.. Важно, чтобы организм имел доступ к всем заменимым и незаменимым аминокислотам, отсутствие или недостаток только одной аминокислоты приведет к полной остановке синтеза белка и вызовет поломку всего организма. Именно поэтому белковому компоненту рациона придается столь пристальное внимание.
Нашему организму все равно, из каких продуктов они будут получены: мясо или картофель, молоко или горох, рыба или хлеб и т.д.. Важно, чтобы организм имел доступ к всем заменимым и незаменимым аминокислотам, отсутствие или недостаток только одной аминокислоты приведет к полной остановке синтеза белка и вызовет поломку всего организма. Именно поэтому белковому компоненту рациона придается столь пристальное внимание.
Следует знать, что белок содержится главным образом в продуктах животного происхождения: мясе, рыбе, молочных продуктах, птице, яйцах. В значительных количествах полноценный белок присутствует в бобовых (горох, фасоль, чечевица, соя), орехах и семечках (см. таблица 1) О том, сколько нужно человеку белка, а также других пищевых веществ можно узнать из Методических рекомендаций «Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации», которые находятся на сайте Роспотребнадзора
Таблица 1. Содержание основных пищевых веществ и энергетическая ценность некоторых пищевых продуктов
|
Продукты |
Содержание, г в 100 продукта |
Энергетическая ценность, ккал |
||
|
Белок |
Жир |
Углеводы |
||
|
Огурцы |
0,8 |
0,1 |
2,5 |
14 |
|
Белокочанная капуста |
1,8 |
0,1 |
4,7 |
28 |
|
Белые грибы |
3,7 |
1,7 |
1,1 |
34 |
|
Молоко 1,0% жирности |
3,0 |
1,0 |
4,8 |
40 |
|
Апельсин |
0,9 |
0,2 |
8,1 |
43 |
|
Молоко 3,2% жирности |
2,9 |
3,2 |
4,7 |
60 |
|
Виноград |
0,6 |
0,6 |
15,4 |
72 |
|
Картофель отварной |
2,0 |
0,4 |
15,8 |
75 |
|
Треска отварная по |
18,0 |
0,8 |
0,0 |
79 |
|
Банан |
1,5 |
0,5 |
21,0 |
96 |
|
Каша манная вязкая |
2,2 |
3,0 |
16,3 |
100, |
|
Творог нежирный |
22,0 |
0,6 |
3,3 |
110 |
|
Яйцо отварное |
12,7 |
11,5 |
0,8 |
157 |
|
Творог полужирный 9,0% жирности |
18,0 |
9,0 |
3,0 |
169 |
|
Антрекот из говядины |
29,6 |
11,2 |
0 |
220 |
|
Сельдь атлантическая жирная |
17,7 |
19,5 |
0 |
248 |
|
Свиная отбивная, зажаренная |
27,2 |
16,0 |
0 |
261 |
|
Батон нарезной из муки .в.с. |
7,6 |
2,8 |
51,4 |
262 |
|
Колбаса вареная Телячья |
13,2 |
28,4 |
0,4 |
310 |
|
Сардельки Свиные |
10,1 |
31,6 |
1,8 |
332 |
|
Сыр Костромской |
25,6 |
26,0 |
0 |
343 |
|
Творожная масса с изюмом |
6,8 |
21,6 |
29,9 |
343 |
|
Сахар-песок |
0 |
0 |
100 |
400 |
|
Картофельные чипсы |
8,1 |
33,9 |
51,5 |
531 |
|
Конфеты шоколадные |
7,0 |
30,7 |
57,0 |
533 |
|
Фундук |
15,0 |
61,5 |
9,4 |
651 |
|
Масло сливочное «Вологодское» |
0,5 |
82,5 |
1,0 |
750 |
|
Шпик свиной соленый |
1,4 |
90,0 |
0 |
816 |
|
Масло подсолнечное (растительное) |
0 |
100 |
0 |
900 |
Жиры, поступающие с пищей — являются концентрированным источником энергии. Но они выполняют и пластические функции, являясь строительным материалом для синтеза биологических мембран клеток и субклеточных структур. Из отдельных жирных кислот организм синтезирует также соединения, регулирующие многие процессы, включая механизмы иммунитета, аллергии и др. Жиры растительного и животного происхождения имеют различный состав жирных кислот, определяющий их физические свойства и физиолого-биохимические эффекты. Жирные кислоты подразделяются на два основных класса — насыщенные и ненасыщенные.
Насыщенные жирные кислоты содержатся преимущественно в жирах животного происхождения, ненасыщенные – в растительных маслах и рыбе.
С высоким потреблением насыщенных жирных кислот связывают развитие ожирения, диабета и сердечно-сосудистых заболеваний, поэтому потребление их следует ограничивать.
Наличие ненасыщенные жирные кислоты характерно для растительных масел и рыбы. Среди них по характеру двойных связей выделяют семейства омега-3 и омега-6 полиненасыщенные жирные кислоты. Потребление полиненасыщенных жирных кислот омега-3 и омега-6 способствует профилактике сердечно-сосудистых заболеваний. Поэтому потребление 1-2 столовых ложек растительного масла представляется крайне необходимым для обеспечения здоровья. Аналогичными эффектами обладает и жир рыб, поэтому рекомендуется потребление как минимум 3-х порций рыбы в неделю.
Углеводы в организме человека выполняют в основном энергетическую функцию. Они широко представлены в растительных продуктах (см таблицу 1) в виде сложных углеводов (крахмал) и простых сахаров.
Фрукты и овощи содержат как простые сахара, так и крахмал. Все зерновые продукты: мука, крупы и макароны содержат в основном крахмал.
Разумеется, рафинированный сахар, также как и кондитерские изделия является источниками простых углеводов – этот сахар получил определение как «добавленный сахар». Действительно он добавляется в различные напитки, включая чай и кофе, входит в рецептуры конфет, пирожных и тортов, многих видов выпечки, мороженого и широкого ассортимента молочных продуктов. К сожалению, потребление добавленного сахара ассоциирует с развитием диабета, ожирения, кариеса, сердечно-сосудистых заболеваний и поэтому в рационе, если мы стремимся к здоровью, количество всех вышеперечисленных вкусностей следует ограничивать.
В составе сложных углеводов выделяются и неусвояемые полисахариды – пищевые волокна, одним из представителей которых является клетчатка. Эти углеводы перевариваются в толстом кишечнике в незначительной степени, но существенно влияют на процессы переваривания, усвоения и эвакуацию пищи, а также на поддержание состава нормальной микрофлоры кишечника. Основными источниками пищевых волокон являются фрукты и овощи, продукты из «неочищенных» зерновых и продукты переработки зерновых — отруби.
Для нормальной жизнедеятельности организму человека требуется несколько сотен различных соединений – это витамины и минеральные вещества, а также множество биологически активных веществ. Подробно это тема будет освещена на отдельной странице.
Переходим к планированию своего питания
И так, получив общие представления о химии пищевых продуктов, теперь попробуем разобраться в том, как часто и в каких количествах следует включать тот или иной продукт или блюдо в повседневный рацион.
В следующей таблицы представлены основные группы пищевых продуктов и общие рекомендации по их количественному потреблению средним человеком.
|
Группа продуктов |
Основные пищевые вещества |
Комментарии |
|
Хлеб, зерновые и картофель |
Простые и сложные углеводы, белок, пищевые волокна (клетчатка), витамины группы В |
Представители этой группы должны употребляться каждый день, в каждый прием пищи |
|
Овощи и фрукты. |
Простые и сложные углеводы, пищевые волокна (клетчатка), витамин С, каротиноиды и другие полезные соединения |
Должны потребляться в любом виде 5 и более раз в день. В ежедневном рационе здорового питания должно содержаться не менее 400 г этих продуктов |
|
Мясо, птица, рыба, яйца и бобовые |
Один из главных источников белка, легкоусвояемой формы железа, витамина В12 |
Должны обязательно включаться в ежедневный рацион в количестве 120-150 г в готовом виде в 1-3 приема пищи. Яйцо- 3-5 раз в неделю по 1 шт. Бобовые — также хороший источник белка |
|
Молочные продукты |
Единственно значимый источник кальция, содержит белок, витамины группы В |
Должны потребляться в количестве до 500 мл в день. Творог (50-100г), сыр также рекомендуются для ежедневного потребления. Лучше использовать низкожирные сорта. |
|
Жиры |
Растительные масла – источники полиненасыщенных жирных кислот и витамина Е. Животные жиры следует ограничивать |
Полиненасыщенные жирные кислоты обеспечивают профилактику сердечно-сосудистых заболеваний. Необходимы 1-2 столовые ложки для заправки овощных салатов. Для приготовления пищи лучше использовать другие виды жира. |
|
Сахар и кондитерские изделия |
Простые углеводы, насыщенные жиры |
Способствуют развитию ожирения, диабета, сердечно-сосудистых заболеваний! Рекомендуется употреблять ограничено и только в том случае, если в рационе питания присутствуют все выше перечисленные продукты. Ежедневно следует потреблять не более 50 г сахара |
В качестве источника «пустых» калорий в группе продуктов, окрашенной в красный свет, следует рассматривать не только сахар и кондитерские изделия, но и алкогольные напитки. Специалисты рекомендуют ограничить потребление крепких напитков до 30-50 мл или вина до 150 мл для, или пива до 330 мл в день. Помните, что алкогольные напитки, как правило, не содержат незаменимых для организма человека веществ, а риск от потребления алкоголя значительно превосходит возможную пользу, кроме того – это источник дополнительных калорий (1 г алкоголя = 7 килокалориям).
Для наглядности группы продуктов в таблице окрашены в разные цвета — использована идея светофора:
зеленый — ешь, не опасайся! Источники важнейших компонентов здорового рациона питания. Необходимо употреблять в каждый прием пищи,
желтый — ешь, но будь внимательным! источники важнейших компонентов здорового рациона питания. Необходимо употреблять каждый день по несколько раз, но при этом быть внимательным! Продукты этих групп содержат жир, потребление которого следует ограничивать!
красный — осторожно, подстерегает опасность! Источники легкоусвояемых углеводов и жира! Можно употреблять в ограниченном количестве только в том случае, если нет проблем с избыточным весом.
Какое количество продуктов необходимо потреблять.
Объем необходимой для обеспечения здоровья пищи и энергии определяется возрастом, полом и уровнем физической активности. Лицам с низким уровнем физической активности (ведущим малоподвижный образ жизни), а также имеющим избыточную массу тела или ожирение необходимы меньшие количества продуктов и наоборот, молодым людям, а также людям, ведущим активный образ жизни при нормальном весе требуется большие количествапродуктов. Потребности женщин меньше чем у мужчин, молодые люди нуждаются в большем количестве пищи, чем пожилые.
Как самостоятельно оценить уровень физической активности и величину энерготрат?
Если Ваша обычная повседневная активности в быту, как и работа не требуют особенных физических нагрузок и вы ежедневно тратите менее 30 минут на занятия физкультурой или специально ходите в течение этого времени быстрым шагом, то вы относитесь к группе людей с низкой физической активностью. К сожалению, число таких людей растет! Вам требуется менее 2000 ккал в сутки.
30-60 минут ежедневных физических упражнений позволяют повысить физическую человека активность до средней.
К группе с высокой физической активности можно отнести тех, кто регулярно занимается физкультурой или спортом более одного часа в день или профессиональная деятельность которых связана с высокими энерготратами (это главным образом рабочие специальности с немеханизированным трудом).
Подробную информацию о потребностях различных групп населения в энергии и пищевых веществах можно найти в Методических рекомендациях «Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации», размещенного на сайте Роспотребнадзора.
Оптимальные наборы суточного рациона питания
В следующей таблице приводятся группы продуктов, веса или объемы условных порций различных пищевых продуктов, а также количество порций каждой группы продуктов для женщины и мужчины с различным уровнем физической активности.
В качестве условных порций пищи для простоты использования приняты:
объем стакана = чашки = полупорционной глубокой тарелки, эквивалентные 250 мл продукта,
размер колоды игральных карт, соответствующий 80-100 г вареного мяса или рыбы,
столовой ложки = 20-25 мл
. чайной ложки = 5 мл
Задача по планированию питания будет заключаться в том, чтобы выбрать для себя внутри каждой группы те продукты, которые Вам больше нравятся и в таком количестве условных порций, которое соответствует вашей физической активности.
|
Группа продуктов |
Вес или объем одной порции |
Количество условных порций для |
||
|
Женщины с низкой физической активностью |
мужчины с низкой физической активностью |
мужчины со средней физической активностью |
||
|
Хлеб, зерновые и картофель 1-ая группа |
1- 2 кусочка хлеба 1/2 стакана (чашки, полупорционной тарелки) готовой каши 1 стакан (чашка, полупорционная тарелка) картофеля в готовом виде 1 чашка (полупорционная тарелка) супа |
4-6 |
6-8 |
8-10 |
|
Овощи и фрукты 2-ая группа |
1 овощ или фрукт (кусок) среднего размера 1/2-1 стакан (чашка, полупорционная тарелка) вареных или сырых овощей 1 чашка (полупорционная тарелка) овощного супа 1/2 стакана (чашки) фруктового сока |
4-5 |
5-6 |
5-6 |
|
Молочные продукты 3-я группа |
1 стакан (чашка, 250 мл) молока или кисломолочного продукта с жирностью 1,5%, 1 кусок (30 г) сыра жирностью 20% и менее |
2-3 |
3 |
3-4 |
|
Мясо, птица, рыба, бобовые и яйца 4-ая группа |
85-90 г мяса или рыбы в готовом виде (110-130 г в сыром виде) , 1/2 ножки курицы или грудной части курицы 1 сосиска, 1/2-1 стакан (чашка, полупорционная тарелка) отварных бобовых, 1 яйцо |
2 |
2 |
2-3 |
|
Жиры и масла 5-ая группа |
1 ст.л. растительного масла или майонеза 2 ст.л. орехов или семечек |
1-2 |
2 |
2-3 |
|
Сахар и кондитер-ские изделия 6-ая группа |
|
1-2 конфеты или 1 пирожное Сахар также содержится во многих молочных продуктах, фруктовых консервах, варенье, безалкогольных напитках |
||
В суточном рационе должны присутствовать группы продуктов окрашенные в зеленый и желтый цвет. По каждой группе желательно набрать указанное число условных порций, число которых за сутки составит
— для женщины с нормальной массой тела и низкой физической активностью 16-18;
— для мужчины с нормальной массой тела и низкой физической активностью 20-23;
— для мужчины с нормальной массой тела и средней физической активностью 25-27.
Большее количество — 30-35 порций необходимо подросткам и физически активным мужчинам. Увеличение числа порций должно производиться главным образом за счет групп продуктов, окрашенных в зеленый цвет.
Пример планирования питания для женщины с низкой физической активностью на один день:
|
Группы продуктов |
Наименование и количество продуктов |
Ко-во условных порций |
|
1-ая группа |
Хлеб пшеничный – 3 куска Хлеб ржаной – 2 куска Суп с макаронами – 1 тарелка Каша геркулесовая – ¼ тарелки Картофель отварной– ¼ тарелки Всего по группе; |
2 1 1 ½ ½ 5 |
|
2-ая группа |
Яблоко – 1 шт Апельсин – 1 шт Сок томатный – 1 стакана Салат из св. овощей – ½ тарелки Отварные овощи – ½ тарелки Всего по группе |
1 1 2 ½ ½ 5 |
|
3-ья группа |
Молоко для кофе и каши – ½ стакана Йогурт – ½ стакана Кефир – 1 стакан Запеканка творожная – как ½ колоды карт Кусочек сыра – 15 г Всего по группе |
½ ½ 1 ½
½ 3 |
|
4-ая группы |
Мясо отв. как ¼ колоды карт Сосиска – 1 шт Рыба соленая как ½ колоды карт Буженина как ¼ колоды карт Всего по группе |
¼ 1 ½ ¼ 2 |
|
5-ая группа |
Масло растительное для картофеля — 1/2 ст ложка Майонез для салата — 1/2 ст ложка Масло сливочное для каши 5 г Спрэд на хлеб – 5 г Всего по группе
|
½
½ ¼ ¼ 1½
|
|
|
ИТОГО по всем группам |
16½ |
|
6-ая группа |
Шоколадная конфета – 1шт. |
Ко-во порций не рассчитывается |
Важным является также вопрос о том, в каком виде предпочтительнее употреблять тот или иной пищевой продукт. Конечно, в свежем, сыром продукте больше полезных веществ. Хранение, транспортировка, любые виды термической обработки приводят к «потерям» пищевых веществ, но не все виды продуктов принято и целесообразно есть в сыром виде, более того термическая обработка нередко позволяет освободиться от компонентов, которые могут вызвать нежелательные для здоровья последствия или повысить усвояемость некоторых пищевых веществ.
Соблюдаете ли Вы основные законы о питании
Проверить выполнение 1-го Закона о питании, требующего соблюдения равновесия между энергией, поступающей с пищей и энергией, которую Вы расходуете на физическую активность можно даже без каких-либо специальных исследований. Достаточно ущипнуть себя за живот – если кожная складка превысит толщину пальца (около 2 см), то Вы нарушаете 1-ый Закон науки о питании и Вам необходимо сократить количество условных порций до минимального значения, особенно из групп продуктов, обозначенным желтым и красным цветом, обращая особое внимание на содержание жира в них. Кроме этого необходимо увеличить ежедневную физическую активность. Помните, что наиболее калорийными являются продукты, которые содержат жир и сахара.
Более сложной представляется проверка выполнения 2-го Закона науки о питании. Для этого необходимо установить обеспеченность организма пищевыми веществами с помощью специальных тестов, выполнение которых возможно только в специальных условиях. Но, косвенными способами можно получить информацию, которой будет вполне достаточно для оценки адекватности вашего рациона. Такая оценка особенно важна для тех людей, физическая активность которых является низкой или очень низкой.
Если Вы включаете в свой рацион питания 500 мл молока, то получаете качественный белок, почти половину необходимой для Вас потребности в кальции, более трети витамина В2; полторы порции мяса, кроме высококачественного белка обеспечат почти половину потребности в железе и почти полностью в витамине В12; порция салата из моркови «насытит» Вас суточной потребностью в каротиноидах. Более подробно об этом будет рассказано в следующих разделах.
Но все же витаминов и минеральных веществ может оказаться недостаточно, особенно в том случае если физическая активность человека очень низкая и для обеспечения организма энергией требуется не очень большой объем пищи. Какой же выход? Необходимо включать в рацион обогащенные витаминами и минеральными веществами продукты массового потребления: хлебобулочные изделия, молоко и молочные продукты, напитки или применять витамино-минеральные комплексы.
ФУНКЦИИ БЕЛКОВ. «БИОЛОГИЧЕСКАЯ ХИМИЯ», Березов Т.Т., Коровкин Б.Ф.
Белки выполняют множество самых разнообразных функций, характерных для живых организмов, с некоторыми из которых мы познакомимся более подробно при дальнейшем изучении курса. Ниже рассматриваются главные и в некотором смысле уникальные биологические функции белков, несвойственные или лишь частично присущие другим классам биополимеров.
Каталитическая функция. К 1995 г. было идентифицировано более 3400 ферментов. Большинство известных в настоящее время ферментов, называемых биологическими катализаторами, является белками. Эта функция белков, хотя и не оказалась уникальной, определяет скорость химических реакций в биологических системах.
Транспортная функция. Дыхательная функция крови, в частности перенос кислорода, осуществляется молекулами гемоглобина – белка эритроцитов. В транспорте липидов принимают участие альбумины сыворотки крови. Ряд других сывороточных белков образует комплексы с жирами, медью, железом, тироксином, витамином А и другими соединениями, обеспечивая их доставку в соответствующие органы-мишени.
Защитная функция. Основную функцию защиты в организме выполняет иммунная система, которая обеспечивает синтез специфических защитных белков-антител в ответ на поступление в организм бактерий, токсинов, вирусов или чужеродных белков. Высокая специфичность взаимодействия антител с антигенами (чужеродными веществами) по типу белок-белковое взаимодействие способствует узнаванию и нейтрализации биологического действия антигенов. Защитная функция белков проявляется и в способности ряда белков плазмы крови, в частности фибриногена, к свертыванию. В результате свертывания фибриногена образуется сгусток крови, предохраняющий от потери крови при ранениях.
Сократительная функция. В акте мышечного сокращения и расслабления участвует множество белковых веществ. Однако главную роль в этих жизненно важных процессах играют актин и миозин – специфические белки мышечной ткани. Сократительная функция присуща не только мышечным белкам, но и белкам цитоскелета, что обеспечивает тончайшие процессы жизнедеятельности клеток (расхождение хромосом в процессе митоза).
Структурная функция. Белки, выполняющие структурную (опорную) функцию, занимают по количеству первое место среди других белков тела человека. Среди них важнейшую роль играют фибриллярные белки, в частности коллаген в соединительной ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке и др. Большое значение имеют комплексы белков с углеводами в формировании ряда секретов: мукоидов, муцина и т.д. В комплексе с липидами (в частности, с фосфолипидами) белки участвуют в образовании биомембран клеток.
Гормональная функция. Обмен веществ в организме регулируется разнообразными механизмами. В этой регуляции важное место занимают гормоны, синтезируемые не только в железах внутренней секреции, но и во многих других клетках организма (см. далее). Ряд гормонов представлен белками или полипептидами, например гормоны гипофиза, поджелудочной железы и др. Некоторые гормоны являются производными аминокислот.
Питательная (резервная) функция. Эту функцию выполняют так называемые резервные белки, являющиеся источниками питания для плода, например белки яйца (овальбумины). Основной белок молока (казеин) также выполняет главным образом питательную функцию. Ряд других белков используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы метаболизма.
Можно назвать еще некоторые другие жизненно важные функции белков. Это, в частности, экспрессия генетической информации, генерирование и передача нервных импульсов, способность поддерживать онкотическое давление в клетках и крови, буферные свойства, поддерживающие физиологическое значение рН внутренней среды, и др.
Таким образом, из этого далеко не полного перечня основных функций белков видно, что указанным биополимерам принадлежит исключительная и разносторонняя роль в живом организме. Если попытаться выделить главное, решающее свойство, которое обеспечивает многогранность биологических функций белков, то следовало бы назвать способность белков строго избирательно, специфически соединяться с широким кругом разнообразных веществ. В частности, эта высокая специфичность белков (сродство) обеспечивает взаимодействие ферментов с субстратами, антител с антигенами, транспортных белков крови с переносимыми молекулами других веществ и т.д. Это взаимодействие основано на принципе биоспецифического узнавания, завершающегося связыванием фермента с соответствующей молекулой субстрата, что содействует протеканию химической реакции. Высокой специфичностью действия наделены также белки, которые участвуют в таких процессах, как дифференцировка и деление клеток, развитие живых организмов, определяя их биологическую индивидуальность.
Предыдущая страница | Следующая страница
СОДЕРЖАНИЕ
|
Органоиды |
Строение |
Функции |
|
Мебранные структуры |
||
|
Наружная клеточная мембрана |
Ультрамикроскопическая пленка, состоящая из двух мономолекулярных слоев белка и расположенного между ними бимолекулярного слоя лнпидов. Цельность липидного слоя может прерываться белковыми молекулами — «порами» |
Изолирует клетку от окружающей среды, обладает избирательной проницаемостью, регулирует процесс поступления веществ в клетку; обеспечивает обмен веществ и энергии с внешней средой, способствует соединению клеток в ткани, участвует в пиноцитозе (поступление жидких веществ)и фагоцитозе; регулирует водный баланс клетки и выводит из нее конечные продукты жизнедеятельности1 |
|
Эндоплазматическая сеть (ЭС, ЭПС) |
Ультрамикроскопическая система мембран, образующих трубочки, канальцы, цистерны, пузырьки. Строение мембран универсальное (как и наружной), вся сеть объединена в единое целое с наружной мембраной ядерной оболочки и наружной клеточной мембраной. Гранулярная ЭС несет рибосомы, гладкая — лишена их |
Обеспечивает транспорт веществ как внутри клетки, так и между соседними клетками. Делит клетку на отдельные секции. в которых одновременно происходят различные физиологические процессы и химические реакции. Гранулярная ЭПС участвует в синтезе белка. Жиры и углеводы синтезируются на гладкой (агранулярной) ЭПС. В каналах ЭПС образуются сложные молекулы белка, синтезируются жиры, транспортируется АТФ |
|
Двумембранные структуры |
||
|
Митохондрии |
Микроскопические органеллы, имеющие двухмембранное строение. Внешняя мембрана гладкая, внутренняя — образует различной формы выросты — кристы. В матриксе митохондрии (полужидком веществе) находятся ферменты, рибосомы, ДНК, РНК |
Универсальная органелла, являющаяся дыхательным и энергетическим центром. В процессе кислородного (окислительного) этапа диссимиляции в матриксе с помощью ферментов происходит расщепление органических веществ с освобождением энергии, которая идет на синтез АТФ (на кристах) |
|
Лейкопласты |
Микроскопические органеллы, имеющие двумембранное строение. Внутренняя мембрана образует 2-3 выроста. Форма округлая. Бесцветны |
Характерны для расти тельных клеток. Служат местом отложения запасных питательных веществ, главным образом крахмальных зерен. На свету их строение усложняется и они преобразуются в хлоропласты. Образуются из пропластид |
|
Хлоропласты |
Микроскопические органеллы, имеющие двумембранное строение. Наружная мембрана гладкая. Внутренняя мембрана образует систему двухслойных пластин — тилакоидов стромы и тилакоидов гран. В мембранах тилакоидов гран между слоями молекул белков и липидов сосредоточены пигменты — хлорофилл и каротиноиды. В белковолипидном матриксе находятся собственные рибосомы. ДНК, РНК. Форма хлоропластов чечевице-образная. Окраска зеленая1 |
Характерны для растительных клеток. Органеллы фотосинтеза, способные создавать из неорганических веществ (СО2 и Н2О) при наличии световой энергии и пигмента хлорофилла органические вещества — углеводы и свободный кислород. Синтез собственных белков. Могут образоваться из пропластид или лейкопластов, а осенью перейти в хромопласты (красные и оранжевые плоды, красные и желтые листья) |
|
Хромопласты |
Микроскопические органеллы, имеющие двумембранное строение. Собственно хромопласты имеют шаровидную форму, а образовавшиеся из хлоропластов принимают форму кристаллов каротиноидов, типичную для данного вида растения. Окраска красная, оранжевая, желтая |
Характерны для растительных клеток. Придают лепесткам цветков окраску, привлекательную для насекомых-опылителей. В осенних листьях и зрелых плодах, отделяющихся от растения, содержатся кристаллические каротиноиды — конечные продукты обмена |
|
Одномембранные структуры |
||
|
Аппарат |
Микроскопические одномембранные органеллы, состоящие из стопочки плоских цистерн, по краям которых ответвляются трубочки, отделяющие мелкие пузырьки |
В общей системе мембран любых клеток — наиболее подвижная и изменяющаяся органелла. В цистернах накапливаются продукты синтеза, распада и вещества, поступившие в клетку, а также вещества, которые выводятся из клетки. Упакованные в пузырьки, они поступают в цитоплазму: одни используются, другие выводятся наружу. В растительной клетке участвует в построении клеточной стенки |
|
Лизосомы |
Микроскопические одномембранные органеллы округлой формы. Их число зависит от жизнедеятельности клетки и ее физиологического состояния. В лизосомах находятся лизирующие (растворяющие) ферменты, синтезированные на рибосомах |
Переваривание пищи, попавшей в животную клетку при фагоцитозе и пиноцитозе. Защитная функция. В клетках любых организмов осуществляют автолиз (саморастворение органелл), особенно в условиях пищевого или кислородного голодания. У животных рассасывается хвост. У растений растворяются органеллы при образовании пробковой ткани. сосудов древесины |
|
Немембранные структуры |
||
|
Клеточный центр |
Ультрамикроскопическая органелла немембранного строения. Состоит из двух центриолей. Каждая имеет цилиндрическую форму, стенки образованы девятью триплетами трубочек, а в середине находится однородное вещество. Центриоли расположены перпендикулярно друг к другу |
Принимает участие в делении клеток животных и низших растений. В начале деления (в профазе) центриоли расходятся к разным полюсам клетки. От центриолей к центромерам хромосом отходят нити веретена деления. В анафазе эти нити притягивают хроматиды к полюсам. После окончания деления центриоли остаются в дочерних клетках, удваиваются и образуют клеточный центр |
|
Органоиды движения |
Реснички — многочисленные цитоплазматические выросты на поверхности мембраны |
Удаление частичек пыли (реснитчатый эпителий верхних дыхательных путей), передвижение (одноклеточные организмы) |
|
Жгутики — единичные цитоплазматические выросты на поверхности клетки |
Передвижение (сперматозоиды, зооспоры, одноклеточные организмы) |
|
|
Ложные ножки (псевдоподии) — амебовидные выступы цитоплазмы |
Образуются у животных в разных местах цитоплазмы для захвата пищи, для передвижения |
|
|
Миофибриллы — тонкие нити до 1 см длиной и больше |
Служат для сокращения мышечных волокон, вдоль которых они расположены |
|
|
Цитоплазма, осуществляющая струйчатое и круговое движение |
Перемещение органелл клетки по отношению к источнику света (при фотосинтезе), тепла, химического раздражителя |
|
|
Структуры |
Строение |
Функции |
|
Ядерная оболочка |
Двухслойная пористая. Наружная мембрана переходит в мембраны ЭС. Свойственна всем клеткам животных и растений, кроме бактерий и сине-зеленых, которые не имеют ядра |
Отделяет ядро от цитоплазмы. Регулирует транспорт веществ из ядра в цитоплазму (РНК, субъединицы рибосом) и из цитоплазмы в ядро (белки, жиры. углеводы, АТФ, вода, ионы) |
|
Хромосомы (хроматин) |
В интерфазной клетке хроматин имеет вид мелкозернистых нитевидных структур, состоящих из молекул ДНК и белковой (нуклеопротеидной) обкладки. В делящихся клетках хроматиновые структуры спирал изуются и образуют хромосомы. Хромосома состоит из двух хроматид и после деления ядра становится однохроматидной. К началу следующего деления у каждой хромосомы достраивается вторая хроматида. Хромосомы имеют первичную перетяжку, на которой расположена центромера; перетяжка делит хромосому на два плеча одинаковой или разной длины. У ядрышковых хромосом есть вторичная перетяжка |
Хроматиновые структуры — носители ДНК-ДНК состоит из участков — генов, несущих наследственную информацию и передающихся от предков к потомкам через половые клетки. Совокупность хромосом, а следовательно, и генов половых клеток родителей передается детям, что обеспечивает устойчивость признаков, характерных •для данной популяции, вида. В хромосомах синтезируются ДНК, РНК, что служит необходимым фактором передачи наследственной информации при делении клеток и построении молекул белка |
|
|
||
|
Ядрышко |
Шаровидное тело, напоминающее клубок нитей. Состоит из белка и РНК. Образуется на вторичной перетяжке ядрышковой хромосомы. При делении клеток распадается |
Формирование половинок рибосом из рРНК и белка. Половинки (субъединицы) рибосом через поры в ядерной оболочке выходят в цитоплазму и объединяются в рибосомы |
|
Ядерный сок (кариолимфа) |
Полужидкое вещество, представляющее коллоидный раствор белков, нуклеиновых кислот, углеводов, минеральных солей. Реакция кислая |
Участвует в транспорте веществ и ядерных структур, заполняет пространство между ядерными структурами; во время деления клеток смешивается с цитоплазмой |
Глава 2: Структура белка — химия
Глава 2: Структура белка 2.1 Структура и свойства аминокислот 2.2 Образование пептидной связи и структура первичного белка 2.3 Структура вторичного белка 2.4 Супервторичная структура и белковые мотивы2,5 Структура третичного и четвертичного белка 2.6 Сворачивание, денатурация и гидролиз белков 2.7 Ссылки
2.1 Структура и свойства аминокислот
Белки являются одной из наиболее распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами.Каждая клетка живой системы может содержать тысячи различных белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются. Однако все они представляют собой полимеры альфа-аминокислот, расположенные в линейной последовательности и связанные друг с другом ковалентными связями.
Структура альфа-аминокислотОсновным строительным блоком белков являются альфа (α) аминокислоты . Как следует из их названия, они содержат функциональную группу карбоновой кислоты и функциональную группу амина.Обозначение альфа используется, чтобы указать, что эти две функциональные группы отделены друг от друга одной углеродной группой. Помимо амина и карбоновой кислоты, альфа-углерод также присоединен к водороду и одной дополнительной группе, которая может различаться по размеру и длине. На схеме ниже эта группа обозначена как R-группа. В живых организмах в качестве строительных блоков белка используются 20 аминокислот. Они отличаются друг от друга только положением R-группы. Основная структура аминокислоты показана ниже:
Рисунок 2.1 Общая структура альфа-аминокислоты
Всего в белковые структуры обычно включаются 20 альфа-аминокислот (рис. 2.x). Различные R-группы имеют разные характеристики в зависимости от природы атомов, включенных в функциональные группы. Есть R-группы, которые преимущественно содержат углерод и водород и очень неполярны или гидрофобны. Другие содержат полярные незаряженные функциональные группы, такие как спирты, амиды и тиолы. Некоторые аминокислоты являются основными (содержащие функциональные аминогруппы) или кислотными (содержащими функциональные группы карбоновых кислот).Эти аминокислоты способны образовывать полные заряды и могут взаимодействовать с ионами. Каждая аминокислота может быть сокращена с использованием трехбуквенного и однобуквенного кода.
Рис. 2.2 Структура 20 альфа-аминокислот, используемых в синтезе белка. R-групп обозначены обведенными / окрашенными участками каждой молекулы. Цвета указывают на определенные классы аминокислот: гидрофобные — зеленый и желтый, гидрофильные полярные незаряженные — оранжевый, гидрофильные кислые — синие, гидрофильные основные — розовые.
Щелкните здесь, чтобы загрузить версию таблицы аминокислот
Неполярные (гидрофобные) аминокислоты
Неполярные аминокислоты можно в значительной степени подразделить на два более конкретных класса: алифатические аминокислоты и ароматические аминокислоты . алифатических аминокислот (глицин, аланин, валин, лейцин, изолейцин и пролин) обычно содержат разветвленные углеводородные цепи, от самого простого глицина до более сложных структур лейцина и валина.Пролин также классифицируется как алифатическая аминокислота, но обладает особыми свойствами, поскольку углеводородная цепь циклизована с концевым амином, создавая уникальную 5-членную кольцевую структуру. Как мы увидим в следующем разделе, посвященном первичной структуре, пролин может значительно изменить трехмерную структуру из-за структурной жесткости кольцевой структуры, когда он включен в полипептидную цепь и обычно находится в областях белка, где возникают складки или повороты.
Ароматические аминокислоты (фенилаланин, тирозин и триптофан), , как следует из их названия, содержат ароматические функциональные группы в своей структуре, что делает их в значительной степени неполярными и гидрофобными из-за высокого содержания углерода / водорода. Однако следует отметить, что гидрофобность и гидрофильность представляют собой скользящую шкалу, и каждая из различных аминокислот может иметь разные физические и химические свойства в зависимости от своей структуры. Например, гидроксильная группа, присутствующая в тирозине, увеличивает его реакционную способность и растворимость по сравнению с фенилаланином.
Метионин, одна из серосодержащих аминокислот обычно классифицируется как неполярные, гидрофобные аминокислоты, поскольку концевая метильная группа создает функциональную группу тиоэфира, которая обычно не может образовывать постоянный диполь внутри молекулы и сохраняет низкую растворимость.
Полярные (гидрофильные) аминокислотыПолярные гидрофильные аминокислоты можно подразделить на три основных класса: полярные незаряженные, кислотные и основные функциональные группы.В пределах полярного незаряженного класса боковые цепи содержат гетероатомы (O, S или N), которые способны образовывать постоянные диполи в R-группе. К ним относятся гидроксил- и сульфоксилсодержащих аминокислот, серин, треонин и цистеин и амидосодержащих аминокислот, глутамина и аспаригина. Две аминокислоты, глутаминовая кислота (глутамат) и аспарагиновая кислота (аспартат) составляют кислые аминокислоты и содержат боковые цепи с функциональными группами карбоновых кислот, способными полностью ионизоваться в растворе.Основные аминокислоты , лизин, аргинин и гистидин содержат функциональные аминогруппы, которые можно протонировать для обеспечения полного заряда.
Многие из аминокислот с гидрофильными R-группами могут участвовать в активных сайтах ферментов. Активный центр является частью фермента, которая напрямую связывается с субстратом и осуществляет реакцию. Белковые ферменты содержат каталитических групп , состоящих из R-групп аминокислот, которые способствуют образованию и разрушению связей.Аминокислоты, которые играют значительную роль в специфичности связывания активного сайта, обычно не примыкают друг к другу в первичной структуре, но образуют активный сайт в результате сворачивания при создании третичной структуры, как вы увидите позже в глава.
Белковые структуры, построенные из основных аминокислот, могут состоять из сотен аминокислот. Таким образом, для простоты 20 аминокислот, используемых для синтеза белка, имеют аббревиатуры как трехбуквенного, так и однобуквенного кода (Таблица 2.1). Эти сокращения обычно используются для обозначения белковых последовательностей в биоинформатических и исследовательских целях.
Таблица 2.1 Сокращения α-аминокислотМысленный вопрос: Триптофан содержит функциональную группу амина, почему триптофан не является основным?
Ответ: Триптофан содержит индольную кольцевую структуру, которая включает функциональную группу амина. Однако из-за близости и электроноакцепторной природы ароматической кольцевой структуры неподеленная пара электронов на азоте недоступна для принятия протона.Вместо этого они участвуют в образовании связей p- в нескольких различных резонансных структурах, возможных для индольного кольца. На рис. 2.3A показаны четыре возможные резонансные структуры для индола. И наоборот, в структуре имидазольного кольца, обнаруженной в гистидине, есть два атома азота, один из которых участвует в образовании резонансных структур (азот № 1 на рисунке 2.3B) и не может принимать протон, а другой (азот № 3 ), которая имеет неподеленную пару электронов, которая может принять протон.
Рис. 2.3. Сравнение структурной доступности неподеленной пары электронов на азоте для принятия протона в кольцевой структуре индола и иммидизола . (A) Показаны четыре резонансные структуры индольной кольцевой структуры, демонстрирующие, что неподеленная пара электронов на азоте участвует в образовании pi -связей. (B) Кольцевая структура имидазола имеет один азот (1), который участвует в резонансных структурах (не показаны) и не может принимать протон, в то время как второй азот (3) имеет неподеленную пару электронов, доступных для принятия протона. как показано.
Разберись самостоятельно:В приведенном выше примере опишите с помощью химической диаграммы, почему амидные атомы азота, содержащиеся в аспарагине и глутамине, не являются основными.
Альфа-аминокислоты — хиральные молекулы
Если вы изучите структуру альфа-углерода в каждой из аминокислот, вы заметите, что все аминокислоты, за исключением глицина, являются хиральными молекулами (Рисунок 2.4) Хиральная молекула — это молекула, которая не накладывается на свое зеркальное отображение. Подобно левой и правой руке с большим пальцем и пальцами в одном порядке, но они являются зеркальными, а не одинаковыми, к хиральным молекулам прикреплены одни и те же элементы в том же порядке, но они являются зеркальными, а не одинаковыми. Версии хиральных молекул с зеркальным отображением обладают физическими свойствами, которые почти идентичны друг другу, что делает их очень трудными для отличия друг от друга или разделения.Из-за этой природы им дано специальное название стереоизомера — энантиомеры , и фактически сами соединения получили такое же название! Эти молекулы действительно различаются тем, как они вращают простой поляризованный свет, и тем, как они реагируют и взаимодействуют с биологическими молекулами. Молекулы, вращающие свет в правостороннем направлении, называются правовращающими и обозначаются буквой D. Молекулы, которые вращают свет в левом направлении, называются левовращающими и обозначаются буквой L, чтобы отличить один энантиомер от другого.D- и L-формы аланина показаны на рисунке 2.4B.
Хотя большинство аминокислот могут существовать как в левосторонней, так и в правосторонней формах, жизнь на Земле состоит почти исключительно из левосторонних аминокислот. Протеогенные аминокислоты, включенные в белки рибосомами, всегда находятся в L-конформации. Некоторые бактерии могут включать D-аминокислоты в пептиды, не кодируемые рибосомами, но D-аминокислоты в природе используются редко. Интересно, что когда мы обсудим структуру сахаров в главе XX, мы обнаружим, что сахара, которые включены в углеводные структуры, почти исключительно находятся в D-конформации.Никто не знает, почему это так. Однако доктор. Джон Кронин и Сандра Пиццарелло показали, что из аминокислот, которые падают на Землю из космоса на метеоритах, больше находится в L-конформации, чем в D-конформации. Таким образом, тот факт, что мы состоим преимущественно из L-аминокислот, может быть вызван аминокислотами из космоса.
Почему аминокислоты в космосе благоприятствуют L-конформации? Никто точно не знает, но известно, что излучение также может существовать в левосторонней и правосторонней формах. Итак, существует теория под названием гипотеза Боннера , которая предполагает, что преобладающие формы излучения в космосе (т. Е.от вращающейся нейтронной звезды, например) может привести к селективному образованию гомохиральных молекул, таких как L-аминокислоты и D-сахара. Это все еще спекулятивно, но недавние открытия метеоритов делают эту гипотезу гораздо более правдоподобной.
Рисунок 2.4 Хиральность аминокислот. За исключением простейшей аминокислоты, глицина, все другие аминокислоты, которые включены в белковые структуры, имеют хиральную природу. (A) Демонстрирует хиральность структуры основной альфа-аминокислоты при использовании неспецифической R-группы.(B) Пара энантиомеров D- и L-аланина, верхняя диаграмма представляет модель шара и клюшки, а нижняя диаграмма представляет линейную структуру.
Изображение (A) из NASA
Обратите внимание, что обозначения D и L — это особые термины, используемые для того, как молекула вращает простой поляризованный свет. Это не означает абсолютную стереоконфигурацию молекулы. Абсолютная конфигурация относится к пространственному расположению атомов хирального молекулярного объекта (или группы) и его стереохимическому описанию e.грамм. R или S , имея в виду Rectus или Sinister соответственно.
Абсолютные конфигурации хиральной молекулы (в чистом виде) чаще всего получают с помощью рентгеновской кристаллографии. Альтернативными методами являются оптическая вращательная дисперсия, колебательный круговой дихроизм, использование реагентов хирального сдвига в протонном ЯМР и визуализации кулоновского взрыва. После получения абсолютной конфигурации назначение R или S основано на правилах приоритета Кан – Ингольда – Прелога, , которые можно просмотреть, перейдя по ссылке и на рисунке 2.5. Все хиральные аминокислоты, кроме цистеина, также находятся в S-конформации. Цистеин содержит атом серы, из-за чего R-группа имеет более высокий приоритет, чем функциональная группа карбоновой кислоты, что приводит к R-конформации для абсолютной стереохимии. Однако цистеин действительно вращает простой поляризованный свет в левовращающем или левовращающем направлении. Таким образом, R- и S-обозначения не всегда соответствуют D- и L-конформации.
Рисунок 2.5 Абсолютная конфигурация определяется обозначениями Rectus (R) и Sinister (S). В системе Кан-Ингольда Прелога для наименования хиральных центров группы, присоединенные к хиральному центру, ранжируются в соответствии с их атомным номером, причем самый высокий атомный номер получает наивысший приоритет (A на диаграмме выше), а самый низкий атомный номер получает самый низкий приоритет (D на диаграмме выше). Затем зритель с самым низким приоритетом не видит, чтобы правильно сориентировать молекулу для дальнейшей оценки.Затем отслеживается путь приоритетов №1, №2 и №3 (соответствующих A, B и C выше). Если путь идет по часовой стрелке, хиральному центру присваивается R-обозначение, тогда как если путь идет против часовой стрелки, ему присваивается S-обозначение.
Изображение из Википедия
Аминокислоты — цвиттерионы
В химии цвиттер-ион представляет собой молекулу с двумя или более функциональными группами, из которых по крайней мере одна имеет положительный, а другая отрицательный электрический заряд, а суммарный заряд всей молекулы равен нулю при определенном pH.Поскольку они содержат по крайней мере один положительный и один отрицательный заряд, цвиттерионы также иногда называют внутренними солями . Заряды на различных функциональных группах уравновешивают друг друга, и молекула в целом может быть электрически нейтральной при определенном pH. Значение pH, при котором это происходит, называется изоэлектрической точкой .
В отличие от простых амфотерных соединений, которые могут образовывать только или катионные или анионные частицы, цвиттерион одновременно имеет оба ионных состояния.Аминокислоты являются примерами цвиттерионов (рис. 2.6). Эти соединения содержат аммониевую и карбоксилатную группы, и их можно рассматривать как возникающие в результате своего рода внутримолекулярной кислотно-основной реакции: аминогруппа депротонирует карбоновую кислоту.
Рис. 2.6 Аминокислоты — это цвиттерионы. Аминокислота содержит как кислотные (фрагмент карбоновой кислоты), так и основные (фрагмент амина) центры. Изомер справа — это цвиттерионная форма.
Поскольку аминокислоты являются цвиттерионами, а некоторые из них также содержат потенциал для ионизации в своих R-группах, их состояние заряда in vivo , и, таким образом, их реакционная способность может варьироваться в зависимости от pH, температуры и статуса сольватации локальных микросреда, в которой они расположены.Таблица стандартных значений pK и для аминокислот показана в таблице 2.1 и может использоваться для прогнозирования состояния ионизации / заряда аминокислот и получаемых ими пептидов / белков. Однако следует отметить, что статус сольватации в микроокружении аминокислоты может изменять относительные значения pK a этих функциональных групп и обеспечивать уникальные реактивные свойства в активных центрах ферментов (таблица 2.1). Более подробное обсуждение эффектов десольватации будет дано в главе XX, посвященной механизмам ферментативных реакций.
Таблица 2.1Версия для печати значений pKa
Как видно из Таблицы 2.1, семь аминокислот содержат R-группы с ионизируемыми боковыми цепями и обычно находятся в активных центрах ферментов. Напомним, что pK a определяется как pH, при котором ионизированная и неионизированная формы ионизируемой функциональной группы в молекуле существуют в равных концентрациях. Таким образом, когда функциональная группа сдвигается выше или ниже ее значения pK — , произойдет сдвиг в концентрациях ионизированных и неионизированных форм, в пользу одного состояния по сравнению с другим.На рис. 2.7 показаны различные R-группы в их неионизированном и ионизированном состояниях и их предпочтительные состояния выше или ниже значения pK a .
Рис. 2.7 Ионизируемые функциональные группы в обычных аминокислотах. Во всех аминокислотах как функциональная группа карбоновой кислоты (C-конец), так и функциональная группа амина (N-конец) способны к ионизации. Кроме того, семь аминокислот (аспарагиновая кислота, глутаминовая кислота, аргинин, гистидин, лизин, тирозин и цистеин) также содержат ионизируемые функциональные группы в своих R-группах.Предпочтительные состояния функциональной группы показаны либо выше, либо ниже их соответствующих значений pK a .
Обычно ионизируемая группа будет благоприятствовать протонированному состоянию в условиях pH ниже ее соответствующих значений pK a и будет благоприятствовать депротонированному состоянию в условиях pH выше ее соответствующего значения pK a . Таким образом, значения pK и могут использоваться для помощи в прогнозировании общих зарядовых состояний аминокислот и их результирующих пептидов / белков в определенной среде.Например, если мы посмотрим на кривую титрования основной аминокислоты, гистидина (рис. 2.8). При достижении каждого pK a состояние заряда аминокислоты изменяется в пользу депротонированного состояния. Таким образом, гистидин будет медленно прогрессировать от общего заряда +2 при очень низком pH (полностью протонированный) до общего заряда -1 при очень высоком pH (полностью депротонирован).
Рис. 2.8. Состояние ионизации гистидина в средах с различным pH. (A) Кривая титрования гистидина от низкого pH до высокого pH.Указывается каждая точка эквивалентности (pK a ). (B) Показывает благоприятное состояние ионизации гистидина после прохождения каждого pK значения .
Изображение адаптировано из L. Van Warren
Дополнительная практика:
Нарисуйте глутаминовую кислоту и спрогнозируйте общее состояние заряда аминокислоты при pH = 1, pH = 3, pH = 7 и pH = 12.
Образование цистеиновых и дисульфидных связей
Цистеин также является уникальной аминокислотой, поскольку эта боковая цепь способна подвергаться обратимой окислительно-восстановительной ( редокс ) реакции с другими остатками цистеина, создавая ковалентную дисульфидную связь в окисленном состоянии (Рисунок 2.9). Вспомните, что когда молекулы окисляются, они теряют электроны, а когда молекулы восстанавливаются, они приобретают электроны. Во время биологических окислительно-восстановительных реакций ионы водорода ( протонов ) часто удаляются с электронами из молекулы во время окисления и возвращаются во время восстановления. Таким образом, если реакция теряет или набирает протоны, это хороший признак того, что она также теряет или приобретает электроны и что происходит окислительно-восстановительная реакция.Таким образом, получение или потеря протонов может быть простым способом идентифицировать этот тип реакции.
Дисульфидные связи являются неотъемлемой частью образования трехмерной структуры белков и поэтому могут сильно влиять на функцию получаемого белка. В клеточных системах образование / разрыв дисульфидной связи является ферментно-опосредованной реакцией и может использоваться в качестве механизма для контроля активности белка. Дисульфидные связи будут обсуждаться более подробно в разделе 2.xx данной главы и в главе XX.
Рис. 2.9. Цистеин может окисляться с образованием дисульфидных связей. Во время образования дисульфидной связи два цистеина окисляются с образованием молекулы цистина. Это требует потери двух протонов и двух электронов.
обратно в начало2.2 Образование пептидных связей и структура первичного белка
Внутри клеточных систем белки связаны между собой большим ферментным комплексом, который содержит смесь РНК и белков.Этот комплекс называется рибосомой . Таким образом, поскольку аминокислоты связаны друг с другом, чтобы сформировать определенный белок, они расположены в очень определенном порядке, который диктуется генетической информацией, содержащейся в молекуле информационной РНК (мРНК). Этот специфический порядок аминокислот известен как первичная последовательность белка . Механизм трансляции, используемый рибосомой для синтеза белков, будет подробно обсуждаться в главе XX.В этой главе основное внимание будет уделено химической реакции, происходящей во время синтеза, и физическим свойствам полученных пептидов / белков.
Первичная последовательность белка связана вместе с использованием синтеза дегидратации (потеря воды), которые объединяют карбоновую кислоту вышележащей аминокислоты с аминогруппой нижележащей аминокислоты с образованием амидной связи (рис. 2.10). ). Аналогично, обратная реакция — это гидролиз и требует включения молекулы воды для разделения двух аминокислот и разрыва амидной связи.Примечательно, что рибосома служит ферментом, который опосредует реакции синтеза дегидратации, необходимые для построения белковых молекул, тогда как класс ферментов, называемых протеазами , необходим для гидролиза белка.
В белковых структурах амидная связь между аминокислотами известна как пептидная связь . Последующие аминокислоты будут добавлены на конце карбоновой кислоты растущего белка.Таким образом, белки всегда синтезируются направленным образом, начиная с амина и заканчивая хвостом карбоновой кислоты. Новые аминокислоты всегда добавляются к хвосту карбоновой кислоты, а не к амину первой аминокислоты в цепи. Направленность синтеза белка определяется рибосомой и известна как синтез N- в C .
Рисунок 2.10 Формирование пептидной связи. Добавление двух аминокислот для образования пептида требует синтеза дегидратации.
Как отмечалось выше в разделе цвиттерионов, амидные связи имеют резонансную структуру, которая не позволяет неподеленной пары электронов азота действовать как основание (рис. 2.11).
Рисунок 2.11 Резонансная структура амида. Во время амидного резонанса неподеленные пары электронов азота участвуют в образовании pi -связи, причем карбонильный углерод образует двойную связь. Таким образом, амидные атомы азота не являются основными. Кроме того, связь C-N в амидной структуре зафиксирована в пространстве и не может вращаться из-за характера связи p-.
Изображение из В.К. Чанг
Вместо этого они участвуют в образовании связи p- с карбонильным углеродом. Кроме того, связь C-N в амидной структуре зафиксирована в пространстве и не может вращаться из-за характера связи p-. Это создает фиксированные физические положения R-групп в растущем пептиде либо в конформации цис или транс . Поскольку R-группы могут быть довольно объемными, они обычно чередуются по обе стороны от растущей белковой цепи в конформации транс .Конформация цис предпочтительна только для одной конкретной аминокислоты, пролина . Это связано с циклической структурой R-группы пролина и стерическими препятствиями, которые создаются, когда пролин принимает конформацию trans (рис. 2.12). Таким образом, остатки пролина могут иметь большое влияние на трехмерную структуру полученного пептида.
Рисунок 2.12. Конформация Cis и Trans R-групп аминокислот. Верхняя диаграмма отображает конформации цис и транс двух соседних аминокислот, обозначенных как X и Y, которые обозначают любую из 20 аминокислот, за исключением пролина. В конформации trans R-группа от аминокислоты X повернута в сторону и находится на другой стороне молекулы по сравнению с R-группой от аминокислоты Y. Эта конформация дает наименьшее количество стерических препятствий по сравнению с cis конформация, в которой R-группы расположены с одной стороны и в непосредственной близости друг от друга.На нижней диаграмме любая аминокислота X расположена перед остатком пролина. Из-за циклизации пролиновой R-группы с амидным азотом в основной цепи это смещает положение пролиновой R-группы, чтобы она была ближе к R-группе от аминокислоты X, когда она принимает конформацию trans . Таким образом, пролин отдает предпочтение конформации цис , которая имеет меньшие стерические препятствия.
Белки представляют собой очень большие молекулы, содержащие множество аминокислотных остатков, связанных вместе в очень определенном порядке.Размер белков варьируется от 50 аминокислот до самого большого известного белка, содержащего 33 423 аминокислоты. Макромолекулы, содержащие менее 50 аминокислот, известны как пептиды (рис. 2.13).
Рис. 2.13. Пептиды и белки — это макромолекулы, построенные из длинных цепочек аминокислот, соединенных вместе амидными связями. Порядок и природа аминокислот в первичной последовательности белка определяют структуру укладки белка на основе окружающей среды белка (то есть, если он находится внутри клетки, он, вероятно, окружен водой в очень полярной среде. , тогда как если белок встроен в плазматическую мембрану, он будет окружен очень неполярными углеводородными хвостами).
Благодаря большому количеству аминокислот, которые могут быть включены в каждое положение в белке, существуют миллиарды различных возможных комбинаций белков, которые можно использовать для создания новых белковых структур! Например, подумайте о трипептиде, полученном из этого пула аминокислот. В каждой позиции есть 20 различных опций, которые могут быть включены. Таким образом, общее возможное количество образующихся трипептидов будет 20 × 20 × 20 или 20 3 , что равно 8000 различных вариантов трипептидов! А теперь подумайте, сколько вариантов было бы для небольшого пептида, содержащего 40 аминокислот.Будет 20 40 вариантов или ошеломляющая 1,09 X 10 52 возможных вариантов последовательности! Каждый из этих вариантов будет различаться по общей форме белка, поскольку природа боковых цепей аминокислот помогает определить взаимодействие белка с другими остатками в самом белке и с окружающей его средой.
Характер аминокислот по всему белку помогает белку складываться и формировать его трехмерную структуру. Именно эта трехмерная форма требуется для функциональной активности белка (т.е. форма белка = функция белка ). Для белков, находящихся в водной среде клетки, гидрофобные аминокислоты часто находятся внутри структуры белка, тогда как водолюбивые гидрофильные аминокислоты будут на поверхности, где они могут связываться водородом и взаимодействовать с молекулами воды. Пролин уникален, потому что он имеет единственную R-группу, которая образует циклическую структуру с аминогруппой в основной цепи. Эта циклизация заставляет пролин принимать конформацию цис , а не конформацию транс внутри остова.Этот сдвиг в структуре часто означает, что пролины представляют собой положения, в которых происходят изгибы или изменения направления внутри белка. Метионин уникален тем, что он служит исходной аминокислотой почти для всех многих тысяч белков, известных в природе. Цистеины содержат тиоловые функциональные группы и, таким образом, могут окисляться другими остатками цистеина с образованием ковалентных дисульфидных связей в структуре белка (рис. 2.14). Дисульфидные мостики добавляют дополнительную стабильность трехмерной структуре и часто требуются для правильного сворачивания и функционирования белка (Рисунок 2.14).
Рисунок 2.14 Дисульфидные связи. Дисульфидные связи образуются между двумя остатками цистеина в пептидной или белковой последовательности или между различными пептидными или белковыми цепями. В приведенном выше примере изображены две пептидные цепи, которые образуют гормон инсулин. Дисульфидные мостики между двумя цепями необходимы для правильного функционирования этого гормона по регулированию уровня глюкозы в крови.
Изображение предоставлено: CNX OpenStax через Wikimedia Commons
Форма и функция белка
Первичная структура каждого белка приводит к уникальному паттерну сворачивания, который характерен для этого конкретного белка.Таким образом, первичная последовательность — это линейный порядок аминокислот, поскольку они связаны вместе в белковой цепи (рис. 2.15). В следующем разделе мы обсудим сворачивание белка, которое приводит к образованию вторичных, третичных, а иногда и четвертичных белковых структур.
Рис. 2.15. Первичная структура белка представляет собой линейную последовательность аминокислот.
(кредит: модификация работы Национального исследовательского института генома человека)
обратно в начало2.3 Структура вторичного белка
В предыдущем разделе мы отметили жесткость, создаваемую связью CN в амидной связи, когда аминокислоты соединяются друг с другом, и узнали, что это приводит к тому, что R-группы аминокислот благоприятствуют конфромации транс (за исключением пролина, который поддерживает конформацию цис ). Эта жесткость каркаса белка ограничивает потенциал сворачивания и структуру получаемого белка. Однако связи, прикрепленные к α-углероду, могут свободно вращаться и вносить свой вклад в гибкость и уникальные паттерны сворачивания, наблюдаемые внутри белков.Чтобы оценить возможные модели вращения, которые могут возникнуть вокруг α-углерода, обычно измеряются торсионные углы Phi (Φ) и Psi (ψ). Угол кручения Phi (Φ) измеряет вращение вокруг связи α-углерод-азот, оценивая угол между двумя соседними карбонильными атомами углерода, когда вы смотрите прямо вниз по связи α-углерод-азот в плоскость бумаги (рис. 2.16). ). И наоборот, торсионный угол Psi (ψ) измеряет вращение вокруг связи α-углерод — карбонильный углерод, оценивая угол между двумя соседними атомами азота, когда вы смотрите прямо вниз на связь α-углерод — карбонильный углерод (Рисунок 2.16).
Рисунок 2.16 Торсионные углы Phi (Φ) и Psi (ψ). (A) Торсионный угол Phi (Φ) является мерой вращения вокруг связи между α-углеродом и амидным азотом. Он измеряется как угол между двумя карбонильными атомами углерода, примыкающими к связи, показанный на нижней панели. (B) Торсионный угол Psi (ψ) является мерой вращения вокруг связи между α-углеродом и карбонильным углеродом. Он измеряется как угол между двумя атомами азота, примыкающими к связи, показанный на нижней панели.
В то время как связи вокруг α-углерода могут вращаться свободно, предпочтительные торсионные углы ограничены меньшим набором возможностей, поскольку соседние атомы избегают конформаций, которые имеют высокие стерические препятствия, связанные с ними. Г. Рамачандран создал компьютерные модели небольших пептидов для определения стабильных конформаций торсионных углов Phi (Φ) и Psi (ψ). На основе своих результатов он создал так называемый график Рамачандрана, который графически отображает области перекрытия наиболее благоприятных торсионных углов Phi (Φ) и Psi (ψ) (Рисунок 2.17)
Рис. 2.17 График Рамачандрана. Благоприятный и очень благоприятный торсионные углы Phi (Φ) и Psi (ψ) обозначены желтым и красным цветом соответственно. Указаны углы связи для общих вторичных белковых структур.
Изображение изменено с: J. Cooper
Внутри каждого белка небольшие участки белка могут принимать специфические повторяющиеся паттерны сворачивания. Эти специфические мотивы или узоры называются вторичной структурой .Двумя наиболее распространенными вторичными структурными особенностями являются альфа-спираль и бета-гофрированный лист (рис. 2.18). Внутри этих структур внутримолекулярные взаимодействия, особенно водородная связь между амином основной цепи и карбонильными функциональными группами, имеют решающее значение для поддержания трехмерной формы.
Рис. 2.18. Вторичные структурные особенности в структуре белка. Правая альфа-спираль и бета-складчатый лист являются общими структурными мотивами, обнаруженными в большинстве белков.Они удерживаются вместе за счет водородной связи между амином и карбонильным кислородом в основной цепи аминокислоты.
Изображение изменено из: The School of Biomedical Sciences Wiki
Альфа-спираль
Для альфа-спиральных структур очень распространена правая спираль, тогда как левые спирали очень редки. Это связано с торсионными углами Phi (Φ) и Psi (ψ), необходимыми для получения левой альфа-спиральной структуры.Чтобы получить правильную ориентацию левой спирали, белку пришлось бы изгибаться и закручиваться под множеством неблагоприятных углов. Таким образом, они не очень распространены в природе.
Для правой альфа-спирали каждый виток спирали содержит 3,6 аминокислотных остатка (рис. 2.19). Группы R (вариантные группы) полипептида выступают из цепи α -спираль. Основная цепь полипептида образует повторяющуюся спиральную структуру, которая стабилизируется водородными связями между кислородом карбонила и водородом амина.Эти водородные связи возникают с регулярными интервалами, по одной водородной связи на каждую четвертую аминокислоту, и заставляют основную цепь полипептида образовывать спираль. Каждая аминокислота продвигает спираль вдоль своей оси на 1,5 Å. Каждый виток спирали состоит из 3,6 аминокислот; следовательно, шаг спирали составляет 5,4 Å. На спираль приходится в среднем десять аминокислотных остатков. Различные аминокислоты имеют разную склонность к образованию α -спирали. Аминокислоты, которые предпочитают принимать спиральные конформации в белках, включают метионин, аланин, лейцин, глутамат и лизин.Пролин и глицин почти не склонны к образованию спиралей.
Рис. 2.19. Структура правой альфа-спирали. (A) Модель шара и рукояти, вид сбоку. Всего для образования одного витка спирали α требуется 3,6 аминокислоты. Водородная связь между кислородом карбонила и азотом 4-й аминокислоты стабилизирует спиральную структуру. На показанной структуре черные атомы представляют собой альфа-углерод, серый — карбонильные углероды, красный — кислород, синий — азот, зеленый — R-группы и светло-фиолетовый — атомы водорода.(B) Расширенный вид сбоку, линейная структура и модель заполнения пространства (C) Расширенный вид сверху, линейная структура и модель заполнения пространства
Изображение A изменено с: Максим Изображение B и C взято: Генри Якубовски
Ключевые моменты об альфа-спирали:
- Альфа-спираль более компактна, чем полностью вытянутая полипептидная цепь с углами phi / psi 180 o
- В белках среднее количество аминокислот в спирали составляет 11, что дает 3 витка.
- Левая альфа-спираль, хотя и разрешенная при осмотре графика Рамачандрана, наблюдается редко, поскольку аминокислоты, используемые для построения структуры белка, являются L-аминокислотами и смещены в сторону образования правой спирали. Когда левосторонние спирали все же образуются, они часто имеют решающее значение для правильного сворачивания белка, стабильности белка или непосредственно участвуют в формировании активного центра.
Рисунок 2.20 Левосторонняя структура альфа-спирали. На этой диаграмме левая альфа-спираль, показанная желтым цветом, является частью витка шпильки в структуре белка и стабилизирована двумя дисульфидными мостиками, показанными желтым цветом.
Рисунок из: Annavarapu, S., Nanda, V. (2009) BMC Struct Biol 9, 61
- Ядро спирали плотно набито. В спирали нет отверстий и пор.
- Все R-группы простираются наружу и от оси спирали. R-группы могут быть гидрофильными или гидрофобными и могут располагаться в определенных положениях на спирали, образуя амфипатические области на белке, или полностью гидрофобные спирали могут также проходить через плазматическую мембрану, как показано на рис. 2.21
Рис. 2.21. Расположение R-групп внутри альфа-спиральных структур. R-группы могут быть расположены внутри альфа-спирали для создания амфипатических областей внутри белка, где гидрофильные остатки расположены с одной стороны спирали, а гидрофобные — с другой, как показано на виде сбоку (A) или сверху вниз ( ДО Н.Э).R-группы также могут быть полностью гидрофобными в альфа-спиралях, охватывающих плазматическую мембрану, как показано на (D).
Рисунок изменен по: Khara, J.S., et al. (2017) Acta Biomat 57: 103-114 и Ryu, H., et al. (2019) Int J Mol Sci 20 (6) 1437
- Некоторые аминокислоты чаще встречаются в альфа-спиралях, чем другие. Вот аминокислоты, которые обычно НЕ обнаруживаются в альфа-спиральных структурах: Gly слишком мал и конформационно гибок, чтобы его можно было найти с высокой частотой в альфа-спиралях, тогда как Pro слишком жесткий и в цис -конформация. Pro часто нарушает спиральную структуру, вызывая изгибы белка. Некоторые аминокислоты с боковыми цепями, которые могут связывать Н-связь ( Ser, Asp, и Asn ) и не слишком длинные, по-видимому, действуют как конкуренты донора и акцептора Н-связи основной цепи и дестабилизируют альфа спирали. R-группы с ранним ветвлением, такие как Val и Ile, , дестабилизируют альфа-спираль из-за стерических взаимодействий объемных боковых цепей с основной цепью спирали.
- Краткое изложение склонности аминокислот к альфа-спиралям (а также к бета-структуре)
- Альфа-кератины, основной компонент волос, кожи, меха, клювов и ногтей, почти полностью представляют собой альфа-спираль.
Jmol: обновлено Изолированная спираль из антифриза белка Jmol14 (Java) | JSMol (HTML5)
Бета-гофрированный лист: В β-складчатом листе «складки» образованы водородными связями между атомами в основной цепи полипептидной цепи.Группы R присоединены к атомам углерода и простираются выше и ниже складок складки в конформации trans . Складчатые сегменты выстраиваются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом азота в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе остова пептида (рис. 2.21).
Рис. 2.21. Конструкция бета-гофрированного листа. β-гофрированный лист может быть ориентирован в параллельной или антипараллельной ориентации, как показано на (A) выше, с β-гофрированным листом, представленным красными стрелками.Направление стрелки указывает ориентацию белка, при этом стрелка проходит в направлении от N к C. Водородная связь между карбонилом основной цепи и функциональными аминогруппами основной цепи стабилизировала как антипараллельные (B слева), так и параллельные (B справа) β-складчатые листовые структуры.
Изображение (A) из: Xenoblast Изображение (B) из: Fvasconcellos
Другие мотивы вторичной структуры:
Другие важные вторичные структуры включают витков, петель, шпильки и гибких линкеров .Существует множество различных классификаций витков в структуре белка, включая α-витков, β-витков, γ-витков, δ-витков и π-витков . β-витки (наиболее распространенная форма) обычно содержат четыре аминокислотных остатка (рис. 2.22). Пролин и глицин обычно встречаются в поворотных мотивах, поскольку цис-конформация пролина способствует более резким конформационным изгибам, в то время как минимальная боковая цепь глицина позволяет более плотно упаковывать аминокислоты, чтобы способствовать структуре поворота.
Рис. 2.22. Схема β-витков типа I и II.
Изображение из: Muskid
ω-петля — это универсальный термин для более длинной, протяженной или нерегулярной петли без фиксированной внутренней водородной связи. Шпилька , , , — это особый случай поворота, при котором направление основной цепи белка меняется на противоположное и фланкирующие элементы вторичной структуры взаимодействуют друг с другом. Например, шпилька beta соединяет две антипараллельные β-нити с водородными связями.Иногда повороты обнаруживаются внутри гибких линкеров или петель, соединяющих белковые домены. Линкерные последовательности различаются по длине и обычно богаты полярными незаряженными аминокислотами. Гибкие линкеры позволяют соединительным доменам свободно скручиваться и вращаться, чтобы рекрутировать своих связывающих партнеров через динамику белковых доменов.
обратно в начало2.4 Супервторичная структура и белковые мотивы
Между вторичной структурой и третичной структурой белков находятся более крупные трехмерные особенности, которые были идентифицированы во множестве различных белковых структур.Они известны как супервторичная структура и как белок мотивы . Супервторичная структура обычно состоит из двух вторичных структур, связанных между собой витком, и включает спираль-поворот-спираль, спираль-петля-спираль, α-α-углы, β-β-углы и β-шпилька-β (рисунок 2.23).
Рисунок 2.23 Примеры сверхвторичных структур. (A) β-шпилька-β-структуры характеризуются резким поворотом шпильки, который не нарушает водородные связи двух β-складчатых листовых структур.(B) Предполагаемая структура спирали-поворот-спираль белка Taspase1, (C) угловая структура α-α, присутствующая в белке Myoglobin.
Изображение A предоставлено: Isabella Daidone Изображение B: Johannes van den Boom, et al. (2016) PLosONE 11 (3): e0151431
Изображение C изменено с: Belles14104
Белковые мотивы представляют собой более сложные структуры, созданные из вторичных и супервторичных структурных компонентов, повторяющихся модальностей, визуализируемых во многих белковых структурах.
Бета-нити имеют тенденцию закручиваться в правильном направлении, чтобы минимизировать конформационную энергию. Это приводит к образованию интересных структурных мотивов, обнаруженных во многих типах белков. Две из этих структур включают скрученные листы или седла, а также бета-стволы (рис. 2.24).
Рис. 2.24 Общие структурные мотивы бета-нити. (A) Скрученный лист для правой руки, вид сверху и сбоку, (B) Вид сбоку бета-ствола и (C) Вид сверху бета-ствола
Автор изображения: Генри Якубовски
Структурные мотивы могут выполнять определенные функции в белках, такие как обеспечение связывания субстратов или кофакторов.Например, складка Россмана отвечает за связывание с кофакторами нуклеотидов, такими как никотинамидадениндинуклеотид (NAD + ) (рис. 2.25). Складка Россмана состоит из шести параллельных бета-нитей, которые образуют протяженный бета-лист. Первые три нити соединены α-спиралями, в результате чего получается структура бета-альфа-бета-альфа-бета. Этот образец дублируется один раз, чтобы получить перевернутый тандемный повтор, содержащий шесть нитей. В целом жилы расположены в порядке 321456 (1 = N-концевой, 6 = C-концевой).Пять скрученных нитей, подобных Россманну, расположены в порядке 32145. Общая третичная структура складки напоминает трехслойный сэндвич, в котором начинка состоит из удлиненного бета-листа, а два ломтика хлеба образованы соединяющимися параллельными альфа-буквами. спирали.
Рис. 2.25. Складка Россмана. (A) Структура никотинамидадениндинуклеотида (NAD + ) (B) Диаграмма складки Россмана (спирали A-F красные и нити 1-6 желтые) из E.coli фермент малатдегидрогеназа. Показано, что кофактор NAD + связывается как молекула, заполняющая пространство. (C) Схематическая диаграмма шестицепочечной складки Россмана.
Изображение изменено с: Boghog
Одной из особенностей складки Россмана является ее специфичность связывания кофакторов. Наиболее консервативный сегмент складок Россмана — это первый бета-альфа-бета сегмент. Поскольку этот сегмент находится в контакте с ADP-частью динуклеотидов, таких как FAD, NAD и NADP, его также называют «ADP-связывающей бета-бета складкой».
Интересно, что подобные структурные мотивы не всегда имеют общего эволюционного предка и могут возникать в результате конвергентной эволюции. Так обстоит дело с TIM Barrel, консервативной белковой складкой, состоящей из восьми α-спиралей и восьми параллельных β-цепей, которые чередуются вдоль пептидного остова. Структура названа в честь триозофосфатизомеразы, консервативного метаболического фермента. Бочки TIM — одна из самых распространенных белковых складок. Одна из самых интригующих особенностей представителей этого класса белков заключается в том, что хотя все они демонстрируют одну и ту же третичную складку, между ними очень мало сходства последовательностей.По крайней мере 15 различных семейств ферментов используют этот каркас для создания соответствующей геометрии активного сайта, всегда на С-конце восьми параллельных бета-цепей цилиндра.
Рисунок 2.26 Ствол TIM. цилиндров TIM считаются α / β-складками белка, потому что они включают в себя чередующийся паттерн α-спиралей и β-цепей в одном домене. В цилиндре TIM спирали и нити (обычно по 8 штук) образуют соленоид, который изгибается вокруг себя и замыкается в форме пончика, топологически известной как тороид.Параллельные β-нити образуют внутреннюю стенку бублика (следовательно, β-цилиндр), тогда как α-спирали образуют внешнюю стенку бублика. Каждая β-нить соединяется со следующей соседней нитью в цилиндре через длинную правую петлю, которая включает одну из спиралей, так что раскрашивание ленты N-C на виде сверху (A) происходит в радужном порядке вокруг бочка. Ствол TIM можно также рассматривать как состоящий из 8 перекрывающихся правосторонних супервторичных структур β-α-β, как показано на виде сбоку (B).
Изображение изменено с: WillowW
Хотя ленточная диаграмма TIM Barrel показывает отверстие в центральном ядре белка, боковые цепи аминокислот на этом изображении не показаны (рис. 2.26). Ядро белка на самом деле плотно упаковано, в основном с объемными гидрофобными аминокислотными остатками, хотя необходимо несколько глицинов, чтобы дать пространство для маневра для сильно ограниченного центра из 8 приблизительных повторов, чтобы соответствовать друг другу. В упаковочных взаимодействиях между цепями и спиралями также преобладает гидрофобность, и разветвленные алифатические остатки валина, лейцина и изолейцина составляют около 40% от общего количества остатков в β-цепях.
По мере того, как наши знания о бесчисленном множестве структурных мотивов, обнаруженных в природной сокровищнице белковых структур, продолжают расти, мы продолжаем понимать, как структура белка связана с функцией, и у нас есть возможность лучше охарактеризовать вновь приобретенные последовательности белка с помощью in silico технологии.
обратно в начало2,5 Структура третичного и четвертичного белка
Полная трехмерная форма всего белка (или сумма всех вторичных структурных мотивов) известна как третичная структура белка и является уникальной и определяющей особенностью этого белка (Рисунок 2.27). В первую очередь, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R, обнаруженных в задействованных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур, таких как альфа-спираль. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Незаряженные неполярные боковые цепи могут образовывать гидрофобные взаимодействия.Взаимодействие между боковыми цепями цистеина может приводить к образованию дисульфидных связей.
Рисунок 2.27. Структура третичного белка. Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионные связи, водородные связи и дисульфидные связи.
Изображение: Школа биомедицинских наук Wiki
Все эти взаимодействия, сильные и слабые, определяют окончательную трехмерную форму белка.Когда белок теряет свою трехмерную форму, он обычно больше не функционирует.
В природе некоторые белки образуются из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру . Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, из-за которых он в основном собирается в шар.Инсулин начинается как единый полипептид и теряет некоторые внутренние последовательности во время клеточного процессинга, которые образуют две цепи, удерживаемые вместе дисульфидными связями, как показано на рисунке 2.14. Затем три из этих структур группируются, образуя неактивный гексамер (рис. 2.28). Гексамерная форма инсулина — это способ для организма хранить инсулин в стабильной и неактивной конформации, чтобы он был доступен для высвобождения и реактивации в мономерной форме.
Рисунок 2.28 Инсулиновый гормон — хороший пример четвертичной структуры. Инсулин вырабатывается и хранится в организме в виде гексамера (единица из шести молекул инсулина), а активной формой является мономер. Гексамер представляет собой неактивную форму с долговременной стабильностью, которая служит средством защиты высокореактивного инсулина, но при этом остается легкодоступным.
Рисунок: Исаак Йонемото
Прогнозирование паттерна сворачивания белка на основе его первичной последовательности является чрезвычайно сложной задачей из-за присущей аминокислотным остаткам гибкости, которые можно использовать для образования различных вторичных признаков.Как описано Fujiwara и др., Классификация SCOP (структурная классификация белков) и SCOPe (расширенная версия) являются основными базами данных, предоставляющими подробные и всесторонние описания всех известных структур белков. Классификация SCOP основана на иерархических уровнях: первые два уровня, семейство и суперсемейство , описывают близкие и дальние эволюционные отношения, тогда как третий, крат , описывает геометрические отношения и структурные мотивы внутри белка.В рамках схемы складчатой классификации большинство белков отнесено к одному из четырех структурных классов: (1) все α-спирали, (2) все β-листы, (3) α / β для белков с дисперсными структурами и (4) α + β для белков с участками, в которых преобладает тот или иной тип паттерна.
На основании их формы, функции и местоположения белки в широком смысле могут быть охарактеризованы как волокнистые, глобулярные, мембранные или неупорядоченные.
Волокнистые белки характеризуются удлиненной структурой белка.Эти типы белков часто объединяются в филаменты или пучки, образуя структурные каркасы в биологических системах. У животных два наиболее распространенных семейства волокнистых белков — это α-кератин и коллаген.
α-кератин α-кератин — ключевой структурный элемент, из которого состоят волосы, ногти, рога, когти, копыта и внешний слой кожи. Благодаря своей плотно намотанной структуре, он может функционировать как один из самых прочных биологических материалов и находить различное применение у млекопитающих, от хищных когтей до волос для тепла.α-кератин синтезируется путем биосинтеза белка с использованием транскрипции и трансляции, но когда клетка созревает и наполняется α-кератином, она умирает, создавая прочную несосудистую единицу ороговевшей ткани.
Первые последовательности α-кератинов были определены Ханукоглу и Фуксом. Эти последовательности показали, что существует два различных, но гомологичных семейства кератинов, которые были названы кератином типа I и кератином типа II. У человека 54 гена кератина, 28 из которых кодируют тип I, а 26 — тип II. Белки типа I являются кислыми, что означает, что они содержат больше кислых аминокислот, таких как аспарагиновая кислота, в то время как белки типа II являются основными, что означает, что они содержат больше основных аминокислот, таких как лизин. Эта дифференциация особенно важна для α-кератинов, потому что при синтезе его субъединицы димера, спиральной спирали , одна белковая спираль должна быть типа I, а другая — типа II (рис. 2.29). Даже в пределах типа I и II есть кислые и основные кератины, которые особенно дополняют друг друга в каждом организме.Например, в коже человека K5, α-кератин типа II, соединяется в основном с K14, α-кератином I типа, с образованием комплекса α-кератина клеточного слоя эпидермиса.
Димеры Coiled-coil затем собираются в протофиламенты, очень стабильный левосторонний сверхспиральный мотив, который далее мультимеризуется, образуя филаменты, состоящие из множества копий мономеров кератина (рис. 2.29). Основная сила, которая удерживает структуры coiled-coil, связанные друг с другом, — это гидрофобные взаимодействия между аполярными остатками вдоль спиральных сегментов кератина.
Рисунок 2.29. Формирование промежуточной нити. Промежуточные филаменты состоят из супспирального комплекса α-кератина. Первоначально два мономера кератина (A) образуют структуру димера спиральной спирали (B) Два димера спиральной спирали соединяются, образуя шахматный тетрамер (C), тетрамеры начинают соединяться вместе (D), в конечном итоге формируя лист из восьми тетрамеров (E ). Затем лист из восьми тетрамеров скручивают в левую спираль, образуя конечную промежуточную нить (E). Электронная микрофотография промежуточной нити показана в верхнем левом углу.
Автор изображения: Правительство США
Коллаген
Волокнистый белок Коллаген является наиболее распространенным белком у млекопитающих, составляя от 25% до 35% всего белка в организме. Он находится преимущественно во внеклеточном пространстве в различных соединительных тканях организма. Коллаген содержит уникальную четвертичную структуру из трех белковых цепей, соединенных вместе, образуя тройную спираль.В основном он находится в фиброзных тканях, таких как сухожилия, связки и кожа.
В зависимости от степени минерализации коллагеновые ткани могут быть жесткими (кость), податливыми (сухожилия) или иметь градиент от жесткого к податливому (хрящ). Его также много в роговице, кровеносных сосудах, кишечнике, межпозвонковых дисках и дентине зубов. В мышечной ткани он служит основным компонентом эндомизия. Коллаген составляет от одного до двух процентов мышечной ткани и составляет 6% веса сильных сухожильных мышц.Фибробласт — наиболее распространенная клетка, вырабатывающая коллаген. Желатин, который используется в пище и промышленности, представляет собой необратимо гидролизованный коллаген. Кроме того, в качестве пищевых добавок используются порошки частично или полностью гидролизованного коллагена. Коллаген имеет множество медицинских применений при лечении заболеваний костей и кожи.
Название collagen происходит от греческого ( kólla ), что означает «клей», и суффикса -gen , что означает «производство». Это относится к раннему использованию соединения в процессе кипячения кожи и сухожилий лошадей и других животных для получения клея.
Более 90% коллагена в организме человека относится к типу I. Однако по состоянию на 2011 год было идентифицировано, описано и разделено на несколько групп в соответствии с формируемой ими структурой 28 типов коллагена. Пять наиболее распространенных типов:
- Тип I: кожа, сухожилие, сосудистая сеть, органы, кость (основной компонент органической части кости)
- Тип II: хрящ (основной коллагеновый компонент хряща)
- Тип III: сетчатый (основной компонент ретикулярных волокон), обычно встречается вместе с типом I
- Тип IV: образует базальную пластинку, секретируемый эпителием слой базальной мембраны
- Тип V: клеточные поверхности, волосы и плацента
Здесь мы сосредоточимся на уникальных свойствах коллагена типа I.Коллаген I типа имеет необычный аминокислотный состав и последовательность:
- Глицин содержится почти в каждом третьем остатке.
- Пролин составляет около 17% коллагена.
- Коллаген содержит две необычные производные аминокислоты, не вставленные непосредственно во время трансляции. Эти аминокислоты находятся в определенных местах относительно глицина и посттрансляционно модифицируются различными ферментами, оба из которых требуют витамина С в качестве кофактора (рис. 2.30).
- Гидроксипролин, производный от пролина
- Гидроксилизин, полученный из лизина — в зависимости от типа коллагена различное количество гидроксилизинов гликозилировано (в основном с присоединенными дисахаридами).
Рисунок 2.30. Гидроксилирование пролина и лизина во время посттрансляционной модификации коллагена типа I. Ферменты пролилгидроксилаза и лизилгидроксилаза необходимы для гидроксилирования остатков пролина (A) и лизина (B) соответственно. (Примечание: хотя положение 3 показано выше, пролиловые остатки альтернативно могут быть гидроксилированы в положении 4). Ферменты гидроксилазы модифицируют аминокислотные остатки после того, как они были включены в белок в качестве посттрансляционной модификации, и требуют витамина С (аскорбата) в качестве кофактора.(C) Дальнейшая модификация остатков гидроксилизина путем гликозилирования может привести к включению дисахарида (галактоза-глюкоза) в гидрокси-кислород.
Большинство коллагена образуется аналогичным образом. Процесс синтеза коллагена типа I описан ниже и демонстрирует сложность сворачивания и обработки белка (рис. 2.31).
- Внутри камеры
- Во время трансляции на рибосомах вдоль грубого эндоплазматического ретикулума (RER) образуются альфа-цепи двух типов: альфа-1 и альфа-2 цепи.Эти пептидные цепи (известные как препроколлаген) имеют регистрирующие пептиды на каждом конце и сигнальный пептид.
- Полипептидные цепи высвобождаются в просвет RER.
- Сигнальные пептиды расщепляются внутри RER, и теперь эти цепи известны как про-альфа-цепи.
- Внутри просвета происходит гидроксилирование аминокислот лизина и пролина. Этот процесс зависит от кофактора аскорбиновой кислоты (витамина С).
- Происходит гликозилирование определенных остатков гидроксилизина.
- Тройная альфа-спиральная структура образована внутри эндоплазматического ретикулума из двух цепей альфа-1 и одной цепи альфа-2.
- Проколлаген доставляется в аппарат Гольджи, где он упаковывается и секретируется путем экзоцитоза.
- Вне камеры
- Регистрационные пептиды расщепляются, а тропоколлаген образуется проколлагеновой пептидазой.
- Множественные молекулы тропоколлагена образуют фибриллы коллагена посредством ковалентного сшивания (альдольная реакция) лизилоксидазой, которая связывает остатки гидроксилизина и лизина.Множественные коллагеновые фибриллы образуют коллагеновые волокна.
- Коллаген может быть прикреплен к клеточным мембранам через несколько типов белков, включая фибронектин, ламинин, фибулин и интегрин.
Рисунок 2.31. Синтез коллагена типа I. Полипептидные цепи синтезируются в эндоплазматическом ретикулуме и высвобождаются в просвет, где они гидроксилируются и гликозилируются. Тройная спираль проколлагена формируется и транспортируется через аппарат Гольджи, где подвергается дальнейшей обработке.Проколлаген секретируется во внеклеточный матрикс, где расщепляется на тропоколлаген. Тропоколлаген собирается в коллагеновые фибриллы, где происходит сшивание и водородные связи с образованием конечного коллагенового волокна.
Изображение изменено: E.V. Вонг и Британская энциклопедия
Дефицит витамина С вызывает цингу, серьезное и болезненное заболевание, при котором дефектный коллаген препятствует образованию прочной соединительной ткани. Десны портятся и кровоточат, с потерей зубов; кожа меняет цвет, а раны не заживают.До 18 века это состояние было печально известно среди длительных военных, особенно военно-морских, экспедиций, во время которых участников лишали продуктов, содержащих витамин С.
Аутоиммунное заболевание, такое как красная волчанка или ревматоидный артрит, может поражать здоровые волокна коллагена. Кортизол стимулирует расщепление коллагена до аминокислот, предполагая, что стресс может усугубить эти болезненные состояния.
Многие бактерии и вирусы выделяют факторы вирулентности, такие как фермент коллагеназа, который разрушает коллаген или препятствует его производству.
обратно в началоГлобулярные белки
Глобулярные белки или сферопротеины представляют собой сферические («шарообразные») белки и являются одним из распространенных типов белков. Глобулярные белки в некоторой степени растворимы в воде (образуют коллоиды в воде), в отличие от волокнистых или мембранных белков. Существует несколько классов складок глобулярных белков, поскольку существует множество различных архитектур, которые могут складываться в примерно сферическую форму.
Термин глобин может более конкретно относиться к белкам, включая глобиновую складку. Глобиновая складка представляет собой обычную трехмерную складку в белках и определяет суперсемейство глобиноподобных белков (рис. 2.32). Эта складка обычно состоит из восьми альфа-спиралей, хотя некоторые белки имеют дополнительные продолжения спиралей на концах. Глобиновая складка встречается в одноименных семействах глобиновых белков: гемоглобинах и миоглобинах, а также в фикоцианинах.Поскольку миоглобин был первым белком, структура которого была решена, глобиновая складка была, таким образом, первой обнаруженной белковой складкой. Поскольку глобиновая складка содержит только спирали, она классифицируется как полностью альфа-белковая складка.
Рисунок 2.32 Глобиновая складка. (A) Пример глобиновой складки, переносящего кислород белка миоглобина (PBD ID 1MBA) из моллюска Aplysia limacina. (B) Структура тетрамерного белка гемоглобина, содержащего в общей сложности четыре глобиновых складки.
Изображение A: Википедия Изображение B: Zephyris
Термин глобулярный белок довольно старый (датируется, вероятно, 19-м веком) и теперь несколько архаичен, учитывая сотни тысяч белков и более элегантный и описательный словарь структурных мотивов. Сферическая структура индуцируется третичной структурой белка. Неполярные (гидрофобные) аминокислоты молекулы связаны внутри молекулы, тогда как полярные (гидрофильные) аминокислоты связаны снаружи, что позволяет диполь-дипольным взаимодействиям с растворителем, что объясняет растворимость молекулы.
В отличие от волокнистых белков, которые выполняют преобладающую структурную функцию, глобулярные белки могут действовать как:
- Ферменты, катализируя органические реакции, происходящие в организме в мягких условиях и с высокой специфичностью. Эту роль выполняют разные эстеразы.
- Посланники, передающие сообщения для регулирования биологических процессов. Эту функцию выполняют гормоны, то есть инсулин и т. Д.
- Транспортеры других молекул через мембраны
- Запасы аминокислот.
- Регуляторные роли также выполняются глобулярными белками, а не волокнистыми белками.
- Структурные белки, например актин и тубулин, которые являются глобулярными и растворимыми как мономеры, но полимеризуются с образованием длинных жестких волокон
Многие из белков, которые будут подробно описаны в следующих главах, относятся к этому классу белков.
Мембранные белкиМембранные белки — это белки, которые являются частью биологических мембран или взаимодействуют с ними.Они включают: 1) интегральные мембранные белки, которые являются частью мембраны или постоянно прикреплены к ней, и 2) периферические мембранные белки, которые временно прикрепляются к мембране через интегральные белки или липидный бислой. Интегральные мембранные белки далее классифицируются как трансмембранные белки, которые проходят через мембрану, или интегральные монотопные белки, которые прикрепляются только к одной стороне мембраны.
Мембранные белки, такие как растворимые глобулярные белки, волокнистые белки и неупорядоченные белки, являются обычными. Обладая символической важностью в медицине, мембранные белки являются мишенью для более 50% всех современных лекарственных препаратов. Подсчитано, что 20–30% всех генов в большинстве геномов кодируют мембранные белки. По сравнению с другими классами белков, определение структур мембранных белков остается проблемой в значительной степени из-за сложности создания экспериментальных условий, которые могут сохранить правильную конформацию белка в изоляции от его нативной среды (рис. 2.33).
Мембранные белки выполняют множество функций, жизненно важных для выживания организмов:
- Белки мембранных рецепторов передают сигналы между внутренней и внешней средой клетки.
- Транспортные белки перемещают молекулы и ионы через мембрану. Их можно разделить на категории в соответствии с базой данных классификации транспортеров.
- Мембранные ферменты могут обладать многими активностями, такими как оксидоредуктаза, трансфераза или гидролаза.
- Молекулы клеточной адгезии позволяют клеткам идентифицировать друг друга и взаимодействовать.Например, белки, участвующие в иммунном ответе.
Рис. 2.33. Схематическое изображение трансмембранных белков. 1. одиночная трансмембранная α-спираль (битопический мембранный белок) 2. политопный трансмембранный α-спиральный белок 3. политопный трансмембранный β-листовой белок. Мембрана представлена светло-коричневым цветом.
Интегральные мембранные белки постоянно прикреплены к мембране. Такие белки можно отделить от биологических мембран только с использованием детергентов, неполярных растворителей или иногда денатурирующих агентов.Их можно классифицировать в зависимости от их отношения к бислою:
- Интегральные политопные белки — это трансмембранные белки, которые проходят через мембрану более одного раза. Эти белки могут иметь различную трансмембранную топологию. Эти белки имеют одну из двух структурных архитектур:
- белков спирального пучка, которые присутствуют во всех типах биологических мембран;
- бета-цилиндрических белков, которые обнаружены только в наружных мембранах грамотрицательных бактерий, а также в наружных мембранах митохондрий и хлоропластов.
- Битопические белки — это трансмембранные белки, которые проходят через мембрану только один раз. Трансмембранные спирали из этих белков имеют значительно отличающиеся распределения аминокислот от трансмембранных спиралей политопных белков.
- Интегральные монотопные белки представляют собой интегральные мембранные белки, которые прикреплены только к одной стороне мембраны и не охватывают весь путь.
Рисунок 2.34 Схематическое изображение различных типов взаимодействия между монотопными мембранными белками и клеточной мембраной. 1. взаимодействие амфипатической α-спирали, параллельной плоскости мембраны (плоская спираль мембраны) 2. взаимодействие гидрофобной петлей 3. взаимодействие ковалентно связанного липида мембраны ( липидирование ) 4. электростатические или ионные взаимодействия с мембранные липиды.
Автор изображения: : Foobar
Белки периферической мембраны временно присоединяются либо к липидному бислою, либо к интегральным белкам за счет комбинации гидрофобных, электростатических и других нековалентных взаимодействий.Периферические белки диссоциируют после обработки полярным реагентом, например раствором с повышенным pH или высокой концентрацией соли.
Интегральные и периферические белки могут быть посттрансляционно модифицированы с добавлением жирных кислот, диацилглицериновых или пренильных цепей или GPI (гликозилфосфатидилинозитол), которые могут быть закреплены в липидном бислое.
Неупорядоченные белкиВнутренне неупорядоченный белок ( IDP ) — это белок, не имеющий фиксированной или упорядоченной трехмерной структуры (Рисунок 2.35). IDP охватывают спектр состояний от полностью неструктурированного до частично структурированного и включают случайные клубки, (предварительно) расплавленные глобулы и большие многодоменные белки, соединенные гибкими линкерами. Они составляют один из основных типов белков (наряду с глобулярными, волокнистыми и мембранными белками).
Рис. 2.35. Конформационная гибкость в белке SUMO-1 (PDB: 1a5r). Центральная часть показывает относительно упорядоченную структуру. Напротив, N- и C-концевые области (левая и правая соответственно) демонстрируют «внутреннее нарушение», хотя короткая спиральная область сохраняется в N-концевом хвосте.Были преобразованы десять альтернативных моделей ЯМР. Элементы вторичной структуры: α-спирали (красные), β-тяжи (синие стрелки).
Автор изображения: Лукаш Козловский
Открытие IDP бросило вызов традиционной парадигме структуры белка, согласно которой функция белка зависит от фиксированной трехмерной структуры. Эта догма была поставлена под сомнение в течение последних двадцати лет в результате все большего количества данных из различных областей структурной биологии, предполагающих, что динамика белков может иметь большое значение для таких систем.Несмотря на отсутствие стабильной структуры, IDP представляют собой очень большой и функционально важный класс белков. В некоторых случаях IDP могут принимать фиксированную трехмерную структуру после связывания с другими макромолекулами. В целом, IDP во многом отличаются от структурированных белков и, как правило, обладают различными свойствами с точки зрения функции, структуры, последовательности, взаимодействий, эволюции и регуляции.
В 1930-1950 годах первые структуры белка были решены с помощью кристаллографии белков.Эти ранние структуры предполагали, что фиксированная трехмерная структура может обычно требоваться для обеспечения биологических функций белков. Утверждая, что белки имеют только одну однозначно определенную конфигурацию, Мирски и Полинг не признали, что работа Фишера поддержала бы их тезис с его моделью «Замок и ключ» (1894). Эти публикации закрепили центральную догму молекулярной биологии в том, что последовательность определяет структуру, которая, в свою очередь, определяет функцию белков.В 1950 году Каруш написал о «конфигурационной адаптивности», что противоречит всем предположениям и исследованиям XIX века. Он был убежден, что белки имеют более одной конфигурации на одном уровне энергии и могут выбирать одну при связывании с другими субстратами. В 1960-х годах парадокс Левинталя предположил, что систематический конформационный поиск длинного полипептида вряд ли приведет к единственной свернутой структуре белка в биологически значимых временных масштабах (то есть от секунд до минут). Любопытно, что для многих (малых) белков или белковых доменов относительно быстрая и эффективная рефолдинг может наблюдаться in vitro .Как указано в «Догме Анфинсена» 1973 года, фиксированная трехмерная структура этих белков уникально кодируется в их первичной структуре (аминокислотной последовательности), является кинетически доступной и стабильной в ряде (близких) физиологических условий и, следовательно, может рассматриваться как нативное состояние таких «упорядоченных» белков.
В последующие десятилетия, однако, многие крупные белковые области не могли быть отнесены к наборам рентгеновских данных, что указывает на то, что они занимают несколько позиций, которые усредняются на картах электронной плотности.Отсутствие фиксированных уникальных положений относительно кристаллической решетки предполагало, что эти области были «неупорядоченными». Спектроскопия ядерного магнитного резонанса белков также продемонстрировала наличие больших гибких линкеров и концов во многих решенных структурных ансамблях. Сейчас общепринято, что белки существуют как ансамбль подобных структур с некоторыми областями более ограниченными, чем другие. Внутренне неструктурированные белки (IUP) занимают крайний конец этого спектра гибкости, тогда как IDP также включают белки со значительной тенденцией к локальной структуре или гибкими многодоменными сборками.Эти высокодинамичные неупорядоченные области белков впоследствии были связаны с функционально важными явлениями, такими как аллостерическая регуляция и ферментативный катализ.
Многие неупорядоченные белки обладают аффинностью связывания со своими рецепторами, регулируемыми посттрансляционной модификацией, поэтому было высказано предположение, что гибкость неупорядоченных белков облегчает различные конформационные требования для связывания модифицирующих ферментов, а также их рецепторов. Внутреннее нарушение особенно обогащено белками, участвующими в передаче клеточных сигналов, транскрипции и ремоделировании хроматина.
Гибкие линкерыНеупорядоченные области часто встречаются в виде гибких линкеров или петель, соединяющих домены. Линкерные последовательности сильно различаются по длине, но обычно богаты полярными незаряженными аминокислотами. Гибкие линкеры позволяют соединяющим доменам свободно скручиваться и вращаться, чтобы рекрутировать их связывающих партнеров через динамику белковых доменов. Они также позволяют своим партнерам по связыванию вызывать более крупномасштабные конформационные изменения с помощью аллостерии на большие расстояния.
Линейные мотивыЛинейные мотивы — это короткие неупорядоченные сегменты белков, которые опосредуют функциональные взаимодействия с другими белками или другими биомолекулами (РНК, ДНК, сахарами и т. Д.).). Многие роли линейных мотивов связаны с клеточной регуляцией, например, с контролем формы клеток, субклеточной локализацией отдельных белков и регулируемым обменом белков. Часто посттрансляционные модификации, такие как фосфорилирование, настраивают сродство (не редко на несколько порядков величины) отдельных линейных мотивов к специфическим взаимодействиям. В отличие от глобулярных белков IDP не имеют пространственно расположенных активных карманов. Тем не менее, в 80% IDP (~ 3 дюжины), подвергнутых детальной структурной характеристике с помощью ЯМР, присутствуют линейные мотивы, называемые PreSMos (предварительно структурированные мотивы), которые являются временными вторичными структурными элементами, примированными для распознавания мишени.В нескольких случаях было продемонстрировано, что эти временные структуры становятся полными и стабильными вторичными структурами, например спиралями, после связывания мишени. Следовательно, PreSMos являются предполагаемыми активными сайтами IDP.
Фальцовка и переплет сцепкаМногие неструктурированные белки претерпевают переходы в более упорядоченные состояния при связывании со своими мишенями. Спаренная укладка и связывание могут быть локальными и включать только несколько взаимодействующих остатков, или они могут включать весь домен белка.Недавно было показано, что спаренная укладка и связывание позволяют захоронить большую площадь поверхности, что было бы возможно только для полностью структурированных белков, если бы они были намного больше. Более того, определенные неупорядоченные области могут служить «молекулярными переключателями» в регуляции определенных биологических функций, переключаясь на упорядоченную конформацию при распознавании молекул, например, при связывании малых молекул, связывании ДНК / РНК, ионных взаимодействиях.
Нарушение связанного состояния (нечеткие комплексы)Внутренне неупорядоченные белки могут сохранять свою конформационную свободу, даже если они специфически связываются с другими белками.Структурный беспорядок в связанном состоянии может быть статическим или динамическим. В нечетких комплексах структурная множественность необходима для функционирования, и манипулирование связанной неупорядоченной областью изменяет активность. Конформационный ансамбль комплекса модулируется посредством посттрансляционных модификаций или белковых взаимодействий. Специфичность ДНК-связывающих белков часто зависит от длины нечетких областей, которая варьируется путем альтернативного сплайсинга. Внутренне неупорядоченные белки адаптируют множество различных структур in vivo в соответствии с условиями клетки, создавая структурный или конформационный ансамбль.
Следовательно, их структуры сильно функционально связаны. Однако только несколько белков полностью неупорядочены в своем естественном состоянии. Нарушение в основном обнаруживается в внутренне неупорядоченных областях (IDR) внутри хорошо структурированного белка. Термин «внутренне неупорядоченный белок» (IDP), следовательно, включает белки, которые содержат IDR, а также полностью неупорядоченные белки.
Наличие и вид белкового нарушения кодируется его аминокислотной последовательностью.В целом, IDP характеризуются низким содержанием объемных гидрофобных аминокислот и высокой долей полярных и заряженных аминокислот, обычно называемой низкой гидрофобностью. Это свойство приводит к хорошему взаимодействию с водой. Кроме того, высокие чистые заряды способствуют беспорядку из-за электростатического отталкивания, возникающего из-за одинаково заряженных остатков. Таким образом, неупорядоченные последовательности не могут в достаточной степени скрыть гидрофобное ядро, чтобы сложиться в стабильные глобулярные белки. В некоторых случаях гидрофобные кластеры в неупорядоченных последовательностях дают ключи для идентификации областей, которые подвергаются сопряженной укладке и связыванию (см. Биологические роли).
Многие неупорядоченные белки обнаруживают области без какой-либо регулярной вторичной структуры. Эти области можно назвать гибкими по сравнению со структурированными петлями. В то время как последние являются жесткими и содержат только один набор углов Рамачандрана, IDP включают несколько наборов углов. Термин гибкость также используется для хорошо структурированных белков, но описывает другое явление в контексте неупорядоченных белков. Гибкость структурированных белков связана с равновесным состоянием, в то время как у ВПЛ это не так.Многие неупорядоченные белки также обнаруживают последовательности низкой сложности, то есть последовательности с избыточным представлением нескольких остатков. В то время как последовательности низкой сложности являются сильным признаком нарушения, обратное не обязательно верно, то есть не все неупорядоченные белки имеют последовательности низкой сложности. Неупорядоченные белки имеют низкое содержание предсказанной вторичной структуры.
обратно в начало2.6 Сворачивание, денатурация и гидролиз белков
Сворачивание белка — это физический процесс, посредством которого белковая цепь приобретает свою естественную трехмерную структуру, конформацию, которая обычно является биологически функциональной, быстрым и воспроизводимым образом (Рисунок 2.36). Это физический процесс, с помощью которого полипептид сворачивается в свою характерную и функциональную трехмерную структуру из случайного клубка. Каждый белок существует в виде развернутого полипептида или случайной спирали при трансляции из последовательности мРНК в линейную цепочку аминокислот. У этого полипептида отсутствует какая-либо стабильная (долговечная) трехмерная структура (левая часть первого рисунка). Поскольку полипептидная цепь синтезируется рибосомой, линейная цепь начинает складываться в свою трехмерную структуру.Сворачивание начинает происходить даже при трансляции полипептидной цепи. Аминокислоты взаимодействуют друг с другом, образуя четко определенную трехмерную структуру, свернутый белок (правая часть рисунка), известный как нативное состояние. Полученная трехмерная структура определяется аминокислотной последовательностью или первичной структурой (догма Анфинсена).
Рисунок 2.36 Белок до и после сворачивания
Автор изображения: DrKjaergaard
Правильная трехмерная структура важна для функционирования, хотя некоторые части функциональных белков могут оставаться развернутыми или, как в случае IDP, оставаться гибкими, поэтому важна динамика белков.Неспособность свернуться в нативную структуру обычно приводит к образованию неактивных белков, но в некоторых случаях неправильно свернутые белки имеют модифицированную или токсичную функциональность. Считается, что несколько нейродегенеративных и других заболеваний являются результатом накопления неправильно свернутых белков, таких как амилоидные фибриллы, обнаруженные у пациентов с болезнью Альцгеймера.
Сворачивание — это спонтанный процесс, который в основном управляется гидрофобными взаимодействиями, образованием внутримолекулярных водородных связей, силами Ван-дер-Ваальса, и ему противостоит конформационная энтропия.Процесс сворачивания часто начинается совместно с трансляцией, так что N-конец белка начинает сворачиваться, в то время как C-концевой участок белка все еще синтезируется рибосомой; однако молекула белка может самопроизвольно складываться во время или после биосинтеза. Хотя эти макромолекулы можно рассматривать как «сворачивающиеся сами по себе», процесс также зависит от растворителя (вода или липидный бислой), концентрации солей, pH, температуры, возможного присутствия кофакторов и молекулярных шаперонов.Белки будут иметь ограничения на их способность к складыванию из-за ограниченных углов изгиба или возможных конформаций, как описано в графике Рамачандрана.
Рисунок 2.37 Гидрофобный коллапс. В компактной складке (справа) гидрофобные аминокислоты (показаны черными сферами) схлопываются к центру, чтобы защитить себя от водной среды.
Изображение: Tomixdf
Сворачивание белка должно быть термодинамически благоприятным внутри клетки, чтобы реакция была спонтанной.Поскольку известно, что сворачивание белка является спонтанной реакцией, оно должно принимать отрицательное значение свободной энергии Гиббса. Свободная энергия Гиббса при сворачивании белка напрямую связана с энтальпией и энтропией. Для возникновения отрицательного значения ΔG и для того, чтобы сворачивание белка стало термодинамически благоприятным, тогда либо энтальпия, либо энтропия, либо оба условия должны быть благоприятными.
Сведение к минимуму количества гидрофобных боковых цепей, подверженных воздействию воды, является важной движущей силой процесса складывания. Гидрофобный эффект (рис. 2.37) — это явление, при котором гидрофобные цепи белка схлопываются в ядро белка (вдали от гидрофильной среды). В водной среде молекулы воды имеют тенденцию к агрегированию вокруг гидрофобных областей или боковых цепей белка, создавая водные оболочки из упорядоченных молекул воды. Упорядочение молекул воды вокруг гидрофобной области увеличивает порядок в системе и, следовательно, способствует отрицательному изменению энтропии (уменьшению энтропии в системе).Молекулы воды фиксируются в этих водных клетках, что приводит к гидрофобному коллапсу или сворачиванию внутрь гидрофобных групп (рис. 2.38).
Рис. 2.38. Образование клатрата воды. Хлороформ является гидрофобным соединением, таким образом, когда он растворяется в воде с образованием гидрата, гидрофобная гидратация сопровождается отрицательным изменением энтропии из-за повышенного порядка в окружающей воде и положительного изменения теплоемкости, что часто приводит к положительному ΔG. Подобные водные клетки могут объединяться вокруг гидрофобных белковых остатков до правильного сворачивания.
Гидрофобный коллапс возвращает энтропию в систему за счет разрушения водяных клеток, что освобождает упорядоченные молекулы воды. Множество гидрофобных групп, взаимодействующих внутри ядра глобулярно свернутого белка, вносит значительный вклад в стабильность белка после сворачивания из-за сильно накопленных сил Ван-дер-Ваальса (особенно сил Лондонской дисперсии).Гидрофобный эффект существует как движущая сила в термодинамике только при наличии водной среды с амфифильной молекулой, содержащей большую гидрофобную область. Прочность водородных связей зависит от их окружения; таким образом, водородные связи, заключенные в гидрофобное ядро, вносят больший вклад, чем водородные связи, находящиеся в водной среде, для стабильности нативного состояния.
ШапероныМолекулярные шапероны представляют собой класс белков, которые помогают в правильной укладке других белков in vivo (рис.39). Шапероны существуют во всех клеточных компартментах и взаимодействуют с полипептидной цепью, чтобы позволить сформироваться нативной трехмерной конформации белка; однако сами шапероны не включены в окончательную структуру белка, которому они помогают. Шапероны могут способствовать сворачиванию, даже когда возникающий полипептид синтезируется рибосомой. Молекулярные шапероны действуют путем связывания для стабилизации нестабильной в других отношениях структуры белка в его пути фолдинга, но шапероны не содержат необходимой информации, чтобы знать правильную нативную структуру белка, которому они помогают; скорее, шапероны работают, предотвращая неправильные складчатые конформации.
Рис. 2.39. Вид сверху комплекса бактериальных шаперонов GroES / GroEL, модель
Автор изображения: Википедия
Таким образом, шапероны на самом деле не увеличивают частоту отдельных шагов, участвующих в пути сворачивания к нативной структуре; вместо этого они работают, уменьшая возможные нежелательные агрегации полипептидной цепи, которые в противном случае могли бы замедлить поиск подходящего промежуточного соединения, и они обеспечивают более эффективный путь для полипептидной цепи, чтобы принять правильные конформации.Шапероны не следует путать с катализаторами сворачивания, которые на самом деле катализируют в противном случае медленные шаги в пути сворачивания. Примерами катализаторов фолдинга являются протеин-дисульфидные изомеразы и пептидил-пролилизомеразы, которые могут участвовать в образовании дисульфидных связей или взаимном превращении между стереоизомерами цис и транс соответственно.
Показано, что шапероныимеют решающее значение в процессе сворачивания белка in vivo , потому что они обеспечивают белок с помощью, необходимой для принятия его правильных выравниваний и конформаций, достаточно эффективно, чтобы стать «биологически релевантными».Это означает, что полипептидная цепь теоретически может складываться в свою нативную структуру без помощи шаперонов, как продемонстрировали эксперименты по укладке белков, проведенные in vitro ; , однако, этот процесс оказывается слишком неэффективным или слишком медленным, чтобы существовать в биологических системах; следовательно, шапероны необходимы для сворачивания белка in vivo. Наряду со своей ролью в содействии формированию нативных структур, шапероны, как было показано, участвуют в различных ролях, таких как транспорт белков, деградация и даже позволяют денатурированным белкам, подвергающимся воздействию определенных внешних денатурирующих факторов, возможность перекомплектироваться в их правильные нативные структуры.
Денатурация белкаПолностью денатурированный белок не имеет ни третичной, ни вторичной структуры, однако последовательность первичного белка остается нетронутой, и белок существует в виде случайной спирали (рис. 2.39). При определенных условиях некоторые белки могут складываться заново; однако во многих случаях денатурация необратима. Клетки иногда защищают свои белки от денатурирующего воздействия тепла с помощью ферментов, известных как белков теплового шока (тип шаперона), , которые помогают другим белкам как в сворачивании, так и в том, чтобы оставаться свернутыми (Рисунок 2.40). Белки теплового шока экспрессируются в ответ на повышенные температуры или другие стрессы. Некоторые белки вообще никогда не сворачиваются в клетках, кроме как с помощью шаперонов, которые либо изолируют отдельные белки, чтобы их укладка не прерывалась взаимодействиями с другими белками, либо помогают разворачивать неправильно свернутые белки, позволяя им повторно складываться в правильную нативную структуру. Эта функция имеет решающее значение для предотвращения риска осаждения в нерастворимые аморфные агрегаты.
Рисунок 2.40 Денатурация белка. На рисунке (1) изображен правильно свернутый интактный белок. На этапе (2) к системе подводится тепло, превышающее порог поддержания внутримолекулярных белковых взаимодействий. На этапе (3) показан развернутый или денатурированный белок. Цветные области денатурированного белка соответствуют окрашенным областям природного свернутого белка, показанного на (1).
Схема предоставлена: Scurran15
Внешние факторы, участвующие в денатурации белка или нарушении нативного состояния, включают температуру, внешние поля (электрические, магнитные), скученность молекул и даже ограничение пространства, которые могут иметь большое влияние на сворачивание белков.Высокие концентрации растворенных веществ, экстремальные значения pH, механические силы и присутствие химических денатурирующих веществ также могут способствовать денатурации белка. Эти отдельные факторы вместе классифицируются как стрессы. Показано, что шапероны существуют в возрастающих концентрациях во время клеточного стресса и помогают правильному сворачиванию возникающих белков, а также денатурированных или неправильно свернутых.
При некоторых условиях белки не будут сворачиваться в свои биохимически функциональные формы.Температуры выше или ниже диапазона, в котором обычно живут клетки, вызывают разворачивание или денатурирование термически нестабильных белков (вот почему кипячение делает яичный белок непрозрачным). Однако термостабильность белков далеко не постоянна; например, были обнаружены гипертермофильные бактерии, которые растут при температурах до 122 ° C, что, конечно, требует, чтобы их полный набор жизненно важных белков и белковых ансамблей был стабильным при этой температуре или выше.
ГидолизГидролиз — это разрушение последовательности первичного белка путем добавления воды для преобразования отдельных мономерных звеньев аминокислот (Рисунок 2.41).
Рисунок 2.41 Гидролиз белков. В реакции гидролиза вода добавляется через амидную связь, включающую группу -ОН с карбонильным углеродом и реформируя карбоновую кислоту. Водород из воды преобразовывает амин.
Белки участвуют во многих клеточных функциях. Белки могут действовать как ферменты, которые увеличивают скорость химических реакций. Фактически, 99% ферментативных реакций внутри клетки опосредуются белками.Таким образом, они являются неотъемлемой частью процессов создания или разрушения клеточных компонентов. Белки также могут действовать как структурный каркас внутри клетки, помогая поддерживать клеточную форму. Белки также могут участвовать в клеточной передаче сигналов и коммуникации, а также в переносе молекул из одного места в другое. В экстремальных обстоятельствах, таких как голодание, белки также могут использоваться в качестве источника энергии внутри клетки.
обратно в начало2.7 источников
OpenStax, Белки. OpenStax CNX. 30 сентября 2016 г. http://cnx.org/contents/bf17f4df-605c-4388-88c2-25b0f000b0ed@2.
Файл: Хиральность руками.jpg. (2017, 16 сентября). Wikimedia Commons, бесплатное хранилище мультимедиа . Получено 17:34, 10 июля 2019 г. с сайта https://commons.wikimedia.org/w/index.php?title=File:Chirality_with_hands.jpg&oldid=258750003.
авторов Википедии. (2019, 6 июля). Цвиттерион. В Википедия, Бесплатная энциклопедия .Получено 21:48, 10 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Zwitterion&oldid=9721
.авторов Википедии. (2019, 8 июля). Абсолютная конфигурация. В Википедия, Бесплатная энциклопедия . Получено в 15:28, 14 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Absolute_configuration&oldid=2423
.Структурная биохимия / фермент / активный сайт. (2019, 1 июля). Викиучебники, бесплатный учебник, проект . Получено 16:55, 16 июля 2019 г., с сайта https: // en.wikibooks.org/w/index.php?title=Structural_Biochemistry/Enzyme/Active_Site&oldid=3555410.
Структурная биохимия / Белки. (2019, 24 марта). Викиучебники, бесплатный учебник, проект . Получено в 19:16, 18 июля 2019 г., с сайта https://en.wikibooks.org/w/index.php?title=Structural_Biochemistry/Proteins&oldid=3529061.
Fujiwara, K., Toda, H., and Ikeguchi, M. (2012) Зависимость склонности аминокислот к α-спирали и β-слою от общего типа белковой складки. BMC Структурная биология 12:18.Доступно по адресу: https://bmcstructbiol.biomedcentral.com/track/pdf/10.1186/1472-6807-12-18
авторов Википедии. (2019, 16 июля). Кератин. В Википедия, Бесплатная энциклопедия . Получено 17:50, 19 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Keratin&oldid=
8340.авторов Википедии. (2019, 13 июля). Альфа-кератин. В Википедия, Бесплатная энциклопедия . Получено 18:17, 19 июля 2019 г., с https://en.wikipedia.org/w/index.php? title = Альфа-кератин & oldid = 7410
Инициатива открытого обучения. (2019) Покровные уровни организации. Университет Карнеги Меллон. В анатомии и физиологии. Доступно по адресу: https://oli.cmu.edu/jcourse/webui/syllabus/module.do?context=43480020ca6010f804da8baf7ba.
авторов Википедии. (2019, 16 июля). Коллаген. В Википедия, Бесплатная энциклопедия . Получено в 03:42, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Collagen&oldid=
9954.авторов Википедии.(2019, 2 июля). Россманн фолд. В Википедия, Бесплатная энциклопедия . Получено в 16:01, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Rossmann_fold&oldid=8788
.авторов Википедии. (2019, 30 мая). Ствол ТИМ. В Википедия, Бесплатная энциклопедия . Получено в 16:46, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=TIM_barrel&oldid=899459569
.авторов Википедии. (2019, 16 июля). Сворачивание белков. В Википедия, Бесплатная энциклопедия .Получено 18:30, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Protein_folding&oldid=4145
.авторов Википедии. (2019, 11 июня). Глобулярный белок. В Википедия, Бесплатная энциклопедия . Получено в 18:49, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Globular_protein&oldid=0467
.авторов Википедии. (2019, 11 июля). Внутренне неупорядоченные белки. В Википедия, Бесплатная энциклопедия . Получено 19:52, 20 июля 2019 г., с https: // en.wikipedia.org/w/index.php?title=Intrinsically_disordered_proteins&oldid=2287
2.3: Структура и функции — Белки I
Синтез белков происходит в рибосомах и происходит путем присоединения карбоксильного конца первой аминокислоты к аминоконцу следующей (рис. 2.19). Конец белка, который имеет свободную α-аминогруппу, называют аминоконцом или N-концом. Другой конец называется карбоксильным концом или С-концом, поскольку он содержит единственную свободную α-карбоксильную группу.Все другие α-аминогруппы и α-карбоксильные группы связаны с образованием пептида. Рис. 2.19. Связывание аминокислот посредством связей образования пептидных связей, которые соединяют соседние аминокислоты вместе. Белки синтезируются, начиная с аминоконца и заканчивая карбоксильным концом.
Схематично на рисунке 2.18 мы можем видеть, как последовательные R-группы белка расположены в чередующейся ориентации по обе стороны от полипептидной цепи. Подобная организация R-групп не случайна.Стерические затруднения могут возникать, когда последовательные R-группы ориентированы на одной стороне пептидного остова (рис. 2.20)
Первичная структура
Первичная структура является решающим фактором общей конформации белка. Первичная структура любого белка достигла своего текущего состояния в результате мутации и отбора в течение эволюционного времени. Первичная структура белков определяется последовательностью кодирующей ее ДНК в геноме. Области ДНК-специфических белков известны как кодирующие области (или гены).
Последовательности оснований этих областей непосредственно определяют последовательность аминокислот в белках с однозначным соответствием между кодонами (группами из трех последовательных оснований) в ДНК и аминокислотами в кодируемом белке. Последовательность кодонов в ДНК, скопированная в информационную РНК, определяет последовательность аминокислот в белке. (Рисунок 2.21).
Рисунок 2.21 — От РНК к аминокислотам — генетический код WikipediaПорядок, в котором аминокислоты соединяются вместе при синтезе белка, начинает определять набор взаимодействий между аминокислотами, даже когда синтез происходит.То есть полипептид может сворачиваться даже в процессе производства. Порядок структур R-группы и результирующие взаимодействия очень важны, потому что ранние взаимодействия влияют на более поздние взаимодействия. Это потому, что взаимодействия начинают создавать структуры — вторичные и третичные. Если спиральная структура (вторичная структура), например, начинает формироваться, возможности взаимодействия конкретной аминокислоты R-группы могут быть другими, чем если бы спираль не образовалась (рис. 2.22). Взаимодействия R-группы также могут вызывать изгибы в полипептидной последовательности (третичной структуре), и эти изгибы могут создавать (в некоторых случаях) возможности для взаимодействий, которые были бы невозможны без изгиба, или предотвращать (в других случаях) аналогичные возможности взаимодействия.
Вторичная структура
По мере того, как синтез белка прогрессирует, взаимодействия между аминокислотами, близкими друг к другу, начинают происходить, что приводит к возникновению локальных паттернов, называемых вторичной структурой. Эти вторичные структуры включают хорошо известные α-спираль и β-тяжи. Оба были предсказаны Линусом Полингом, Робертом Кори и Германом Брэнсоном в 1951 году. Каждая структура имеет уникальные особенности.
α-спираль
Рисунок 2.22 — α-Спираль. Водородные связи (пунктирные линии) между кислородом карбонила и водородом амина стабилизируют структуру.Изображение Алейи Кимα-Спираль имеет спиральную структуру с 3,6 аминокислотами на оборот спирали (5 витков спирали = 18 аминокислот). Спирали преимущественно правосторонние — только в редких случаях, например, в последовательностях с большим количеством глицинов, могут образовываться левые α-спирали. В α-спирали водородные связи образуются между группами C = O и группами N-H в основной цепи полипептида, которые находятся на расстоянии четырех аминокислот. Эти водородные связи являются основными силами, стабилизирующими α-спираль.
Рисунок 2.23 — α-спирали в белке со структурным доменом лейциновой молнии.Α-Спирали показаны синим и зеленым цветом и связаны с двойной спиралью ДНК коричневого цвета.Мы используем термины «подъем», «повторение» и «шаг» для описания параметров любой спирали. Повторение — это количество остатков в спирали, прежде чем она начнет повторяться. Для α-спирали повторение составляет 3,6 аминокислоты на оборот спирали. Подъем — это расстояние, на которое спираль поднимается с добавлением каждого остатка. Для α-спирали это 0,15 нм на аминокислоту. Шаг — это расстояние между полными витками спирали.Для α-спирали это 0,54 нм. Стабильность α-спирали повышается за счет присутствия аминокислоты аспартата.
Рисунок 2.24 — Скульптура α-спирали за пределами дома, где прошло детство Линуса Полинга, Википедия Рисунок 2.25 — Винтовое колесо, представляющее α-спираль. Используется однобуквенный генетический код. Спираль начинается с серина №77 справа и заканчивается лизином №92 справа внизу. Гидрофобные аминокислоты показаны желтым цветом, а ионизирующие аминокислоты — синим. Гидрофобные аминокислоты имеют тенденцию взаимодействовать друг с другом, а не с ионизирующими аминокислотами.Википедияβ-прядь / лист
Рисунок 2.26 — β-прядьСпираль — это, конечно, трехмерный объект. Уплощенная форма спирали в двух измерениях — обычное описание β-нити. У β-прядей есть изгибы, а не витки, которые иногда называют складками, как складки на занавеске. β-нити могут быть организованы для образования тщательно организованных структур, таких как листы, бочки и другие конструкции.
β-цепочечные структуры более высокого порядка иногда называют супервторичными структурами), поскольку они включают взаимодействия между аминокислотами, не близкими по первичной последовательности.Эти структуры также стабилизируются водородными связями между карбонильными атомами кислорода и атомами водорода аминогрупп в основной цепи полипептида (рис. 2.28). В структуре более высокого порядка нити могут быть расположены параллельно (ориентации от амино к карбоксилу одинаковы) или антипараллельно (ориентации от амино к карбоксилу противоположны друг другу (на рисунке 2.27 направление нити показано стрелкой на ленте). диаграммы).
Обороты
Рисунок 2.27 — Изображения на ленте супервторичных β-листов (A-D) и расположения α-спиралей (E-F) Изображение от Aleia KimПовороты (иногда называемые обратными поворотами) — это тип вторичной структуры, которая, как следует из названия, вызывает поворот в структуре полипептидной цепи.Повороты в конечном итоге приводят к возникновению третичной структуры, вызывая прерывания во вторичных структурах (α-спирали и β-цепи) и часто служат связующими областями между двумя областями вторичной структуры в белке. Пролин и глицин по очереди играют общие роли, обеспечивая меньшую гибкость (начало поворота) и большую гибкость (облегчение поворота) соответственно.
Рисунок 2.28 — Компоненты β-листа в параллельном расположении. Водородные связи желтого цвета. Изображение Алейи КимСуществует по крайней мере пять типов поворотов, из которых множество вариаций приводит к множеству разных поворотов.Пять типов поворотов:
• δ-витки — концевые аминокислоты разделены одной пептидной связью
• γ-витки — разделение двумя пептидными связями
• β-витки — разделение тремя пептидными связями
• α-витки — разделение четырьмя пептидными связями
• π-витки — разделение пятью связями
Из них β-витки являются наиболее распространенной формой, а δ-витки являются теоретическими, но маловероятными из-за стерических ограничений. На рисунке 2.29 изображен β-разворот.
3 10 спирали
Рисунок 2.29 — β-виток. R-группы показаны оранжевым цветом, атомы водорода — желтым, атомы углерода — углем, атомы азота — фиолетовым, а атомы кислорода — зеленым. Стабилизирующая водородная связь обозначена пунктирной линией. Image by Aleia KimПомимо α-спирали, β-цепей и различных поворотов, в белках видны и другие регулярные, повторяющиеся структуры, но встречаются гораздо реже. Спираль 3 10 является четвертой по распространенности вторичной структурой в белках, составляя около 10-15% всех спиралей.Спираль получила свое название от того факта, что она содержит 10 аминокислот в 3-х витках. Это правша. Водородные связи образуются между аминокислотами, разнесенными на три остатка. Чаще всего спираль 3 10 появляется на аминовом или карбоксильном конце α-спирали. Как и α-спираль, спираль 3 10 стабилизируется присутствием аспартата в ее последовательности.
Рисунок 2.30 — Вид сверху на 310 Helix. Карбонильные группы выделены красным цветом и направлены вверх. Обратите внимание на почти идеальную 3-кратную симметрию Википедии (Рисунок 2).31 — Резонанс пептидной связи Википедия Рисунок 2.32 — π-спираль Википедияπ-спирали
Рисунок 2.33 — Плоскости (светло-голубые), определяемые характером двойной связи пептидной связи Изображение Алейи Кимπ-спираль можно рассматривать как особый тип α-спирали. Некоторые источники описывают это как α-спираль с дополнительной аминокислотой, застрявшей в ней (рис. 2.32). π-спирали не совсем редки, они встречаются по крайней мере один раз в 15% всех белков. Как и α-спираль, π-спираль правосторонняя, но если α-спираль содержит 18 аминокислот в 5 витках, то π-спираль имеет 22 аминокислоты в 5 витках.π-спирали обычно не растягиваются на очень большие расстояния. Большинство из них имеют длину всего около 7 аминокислот, и последовательность почти всегда находится в середине α-спиральной области.
Участки в Рамачандране
Рисунок 2.34 — Углы вращения ω, ψ и φ на пептидном изображении, сделанном Алейей КимВ 1963 году Г. Рамачандран, Ч. Рамакришнан и В. Сасисекхаран описали новый способ описания структуры белка. Если рассматривать основу полипептидной цепи, она состоит из повторяющегося набора из трех связей.Последовательно (в направлении от амино к карбоксилу) они представляют собой 1) вращающуюся связь (ψ) между α-углеродом и α-карбоксилом, предшествующую пептидной связи (см. ЗДЕСЬ), 2) невращающуюся пептидную связь (ω) между α -карбоксильная и α-аминная группы), и 3) вращающаяся связь (φ) между α-амином и α-углеродом, следующая за пептидной связью (см. ЗДЕСЬ). Обратите внимание на рисунки 2.33 и 2.34, что направление от амино к карбоксилу справа налево.
Присутствие карбонильного кислорода в α-карбоксильной группе позволяет пептидной связи существовать в виде резонансной структуры, что означает, что она некоторое время ведет себя как двойная связь.Двойные связи, конечно, не могут вращаться, но связи по обе стороны от них имеют некоторую свободу вращения. Углы φ и ψ ограничены определенными значениями, потому что некоторые углы приведут к стерическим затруднениям. Кроме того, каждый тип вторичной структуры имеет характерный диапазон значений φ и ψ.
Рисунок 2.35 — Теоретический график Рамачандрана Изображение Пенелопы ИрвингРамачандран и его коллеги выполнили теоретические расчеты энергетической стабильности всех возможных углов от 0 ° до 360 ° для каждого из углов φ и ψ и нанесли результаты на график Рамачандрана (также называемый график φ-ψ), очерчивая области углов, которые теоретически были наиболее стабильными (Рисунок 2.35).
Были идентифицированы три основные области стабильности, соответствующие углам φ-ψ β-тяжей (вверху слева), правым α-спиралям (внизу слева) и левым α-спиралям (вверху справа). Графики предсказанной стабильности удивительно точны по сравнению с углами φ-ψ реальных белков.
Прогноз вторичной структуры
Таблица 2.3 — Относительные тенденции каждой аминокислоты находиться во вторичной структуре. Более высокие значения указывают на большую тенденцию. Изображение Пенелопы Ирвинг
Сравнивая первичную структуру (аминокислотные последовательности) с известными трехмерными белковыми структурами, можно подсчитать каждый раз, когда аминокислота обнаруживается в α-спирали, β-цепи / листе или витке.Компьютерный анализ тысяч этих последовательностей позволяет определить вероятность появления любой данной аминокислоты в каждой из этих структур. Используя эти тенденции, можно с точностью до 80% предсказать области вторичной структуры в белке, основываясь исключительно на аминокислотной последовательности.
Это видно в таблице 2.3. Наличие в первичной последовательности трех последовательных аминокислот с относительной тенденцией выше единицы является индикатором того, что эта область полипептида находится в соответствующей вторичной структуре.Онлайн-ресурс для предсказания вторичных структур под названием PSIPRED доступен ЗДЕСЬ.
Гидрофобность
Таблица 2.4 — Оценка гидропатии
Химический состав аминокислотных R-групп влияет на структуры, в которых они чаще всего встречаются. Подмножества их химических свойств могут дать ключ к разгадке структуры, а иногда и клеточного местоположения. Ярким примером является гидрофобность (склонность к предотвращению образования воды) некоторых R-групп. Учитывая водную среду клетки, такие R-группы вряд ли находятся на внешней поверхности свернутого белка.
Однако это правило не выполняется для областей белка, которые могут быть встроены в липидные бислои мембран клеток / органелл. Это связано с тем, что области таких белков, которые образуют трансмембранные домены, находятся в гидрофобной среде в середине липидного бислоя.
Не удивительно, что сканирование первичных последовательностей на предмет определенных размеров / разнесенных участков гидрофобных аминокислот может помочь идентифицировать белки, обнаруженные в мембранах. В таблице 2.4 показаны значения гидрофобности для R-групп аминокислот.В этом наборе шкала изменяется от положительных значений (гидрофобные) до отрицательных (гидрофильные). График гидропатии KyteDoolittle для мембранного белка протоонкогена RET показан на рисунке 2.36. Две области белка очень гидрофобны, что видно из пиков около аминокислот 5-10 и 630-640. Можно разумно ожидать, что такие области будут располагаться либо внутри свернутого белка, либо быть частью трансмембранных доменов.
Случайные катушки
Фигура 2.36 График гидропатии Кайта-Дулиттла для протоонкогена RET WikipediaНекоторые участки белка не предполагают регулярной, различимой структуры и, как иногда говорят, не имеют вторичной структуры, хотя могут иметь водородные связи. Такие сегменты описываются как находящиеся в случайных спиралях и могут иметь текучесть в своей структуре, что приводит к тому, что они имеют несколько стабильных форм. Случайные катушки можно идентифицировать с помощью спектроскопических методов, таких как круговой дихроизм Wikipedia и ядерный магнитный резонанс (ЯМР), при котором наблюдаются отличительные сигналы.См. Также метаморфические белки (ЗДЕСЬ) и белки с внутренней неупорядоченностью (ЗДЕСЬ).
Рисунок 2.37 — Изображение β-шпильки на ленте. Показаны две бирюзовые β-нити, взаимодействующие друг с другом.Надвторичная структура
Другой элемент структуры белка сложнее классифицировать, поскольку он включает элементы вторичной и третичной структуры. Названные супервторичной структурой (или структурными мотивами), эти структуры содержат множество соседних компонентов вторичной структуры, расположенных определенным образом и проявляющихся во множестве белков.Поскольку существует множество способов создания вторичных структур из разных первичных структур, аналогичные мотивы могут возникать из разных первичных последовательностей. Пример структурного мотива показан на рис. 2.37.
Третичная структура
Рисунок 2.38 — Сворачивание полипептидной цепиБелки отличаются друг от друга последовательностью составляющих их аминокислот. Последовательность аминокислот белка определяет форму белка, поскольку химические свойства каждой аминокислоты являются силами, которые вызывают межмолекулярные взаимодействия, чтобы начать создавать вторичные структуры, такие как α-спирали и β-цепи.Последовательность также определяет повороты и случайные спирали, которые играют важную роль в процессе сворачивания белка.
Поскольку форма важна для функции белка, последовательность аминокислот определяет все свойства, которыми обладает белок. По мере того как синтез белка продолжается, отдельные компоненты вторичной структуры начинают взаимодействовать друг с другом, создавая складки, сближающие аминокислоты, которые не находятся рядом друг с другом в первичной структуре (рис. 2.38). На третичном уровне структуры взаимодействия между R-группами аминокислот в белке, а также между основной цепью полипептида и боковыми группами аминокислот играют роль в укладке.
Глобулярные белки
Рисунок 2.39 — Разворачивание (денатурация) белка WikipediaСворачивание приводит к появлению различных трехмерных форм в неволокнистых белках. Эти белки называют глобулярными. Глобулярный белок стабилизируется теми же силами, которые управляют его образованием. К ним относятся ионные взаимодействия, водородные связи, гидрофобные силы, ионные связи, дисульфидные связи и металлические связи. Обработка, такая как нагревание, изменение pH, моющие средства, мочевина и меркаптоэтанол, подавляют стабилизирующие силы и заставляют белок разворачиваться, теряя свою структуру и (обычно) свою функцию (Рисунок 2.39). Благодаря способности тепла и моющих средств денатурировать белки, мы готовим пищу и моем руки перед едой — такая обработка денатурирует белки в микроорганизмах на наших руках. У организмов, которые живут в среде с высокой температурой (более 50 ° C), есть белки с изменениями стабилизирующих сил — дополнительные водородные связи, дополнительные солевые мостики (ионные взаимодействия) и компактность могут играть роль в предотвращении развертывания этих белков.
Силы стабилизации белка
Прежде чем рассматривать процесс сворачивания, давайте рассмотрим некоторые силы, которые помогают стабилизировать белки.
Водородные связи
Рисунок 2.40 — Водородные связи (пунктирные линии) между двумя молекулами уксусной кислотыВодородные связи возникают в результате частично заряженных атомов водорода, находящихся в ковалентных связях. Это происходит, когда атом, с которым связан водород, имеет большую электроотрицательность, чем сам водород, в результате чего водород имеет частичный положительный заряд, потому что он не может удерживать электроны близко к себе (рис. 2.40).
Частично заряженный таким образом водород притягивается к атомам, таким как кислород и азот, которые имеют частичный отрицательный заряд из-за большей электроотрицательности и, таким образом, удерживают электроны ближе к себе.Частично положительно заряженные атомы водорода называются донорами, а частично отрицательные атомы, к которым они притягиваются, называются акцепторами. (См. Рисунок 1.30).
Рисунок 2.41 — Водородная связь в жидкой воде ВикипедияОтдельные водородные связи намного слабее ковалентных, но в совокупности они могут оказывать сильное воздействие. Рассмотрим жидкую воду, которая содержит огромное количество водородных связей (рис. 2.41). Эти силы помогают воде оставаться жидкой при комнатной температуре. Другие молекулы, не имеющие водородных связей с молекулярной массой, равной или большей, чем вода, например, метан или диоксид углерода, являются газами при той же температуре.Таким образом, межмолекулярные взаимодействия между молекулами воды помогают «удерживать» воду вместе и оставаться жидкостью. Примечательно, что только повышение температуры воды до кипения преодолевает силы водородных связей, позволяя воде стать полностью газообразной.
Водородные связи являются важными силами в биополимерах, которые включают ДНК, белки и целлюлозу. Все эти полимеры при кипячении теряют свою естественную структуру. Водородные связи между аминокислотами, которые близки друг к другу по первичной структуре, могут давать регулярные повторяющиеся структуры, такие как спирали или складки, в белках (вторичная структура).
Ионные взаимодействия
Ионные взаимодействия являются важными силами, стабилизирующими структуру белка, которые возникают в результате ионизации R-групп в аминокислотах, составляющих белок. К ним относятся карбоксиламинокислоты (ЗДЕСЬ), амино-аминокислоты, а также сульфгидрил цистеина и иногда гидроксил тирозина.
Гидрофобные силы
Гидрофобные силы стабилизируют структуру белка в результате взаимодействий, которые способствуют исключению воды.Неполярные аминокислоты (обычно находящиеся внутри белков) способствуют связыванию друг с другом, и это имеет эффект исключения воды. Исключенная вода имеет более высокую энтропию, чем вода, взаимодействующая с гидрофобными боковыми цепями. Это связано с тем, что вода выравнивается очень регулярно и определенным образом при взаимодействии с гидрофобными молекулами.
Когда вода не может вступать в подобные взаимодействия, она становится гораздо более неупорядоченной, чем если бы она могла ассоциироваться с гидрофобными областями.Частично по этой причине гидрофобные аминокислоты находятся во внутренней части белка — поэтому они могут исключать воду и увеличивать энтропию.
Дисульфидные связи
Рисунок 2.42 — Формирование дисульфидной связиДисульфидные связи, которые образуются, когда две сульфгидрильные боковые цепи цистеина сближаются, ковалентно соединяют вместе различные участки белка и могут придать большую прочность всей структуре (рисунки 2.42 и 2.43) . Ода структуре белка от Кевина Ахерна Двадцать крошечных аминокислот A определяют белок разными способами Их порядок в пептидной цепи определяет формы, которые приобретают белки И когда они скручиваются, это оставляет меня веселым, потому что это делает структуры вторичными. Это третично, мне сказали, что происходит, когда белок сворачивается. Но сложенные цепи просто страшны. Собранные вместе четвертичные. Они — чудеса природы, это точно. Создание проблем, лечение. Дурак может сочинять пептидные стихи. Но белки происходят из рибоземов. Эти соединенные остатки цистеина иногда называют цистин.Дисульфидные связи — самая сильная из сил, стабилизирующих структуру белка.
Рисунок 2.43 — Цистин — два цистеина, соединенные дисульфидной связьюсилы Ван-дер-Ваальса
силы Ван-дер-Ваальса — это термин, используемый для описания различных слабых взаимодействий, в том числе вызванных притяжением между полярной молекулой и переходным диполем или между двумя временными диполями. Силы Ван-дер-Ваальса динамичны из-за флуктуирующего характера притяжения и, как правило, слабы по сравнению с ковалентными связями, но могут быть значительными на очень коротких расстояниях.
Посттрансляционные модификации
Посттрансляционные модификации могут также приводить к образованию ковалентных связей, стабилизирующих белки. Гидроксилирование лизина и пролина в нитях коллагена может привести к сшиванию этих групп, и полученные ковалентные связи помогают укрепить и стабилизировать коллаген.
Складные модели
Две популярные модели сворачивания белков в настоящее время исследуются. В первой (модель диффузионного столкновения) процесс начинается с момента зародышеобразования, за которым следует образование вторичной структуры.Столкновения между вторичными структурами (как в β-шпильке на рис. 2.37) позволяют начать складывание. Напротив, в модели нуклеации-конденсации вторичные и третичные структуры образуются вместе.
Сворачивание белков происходит довольно быстро (от 0,1 до 1000 секунд) и может происходить во время синтеза — аминный конец белка может начать складываться еще до того, как образуется карбоксильный конец, хотя это не всегда так.
Процесс складывания
Фигура 2.44 Энергетическая модель сворачивания сворачивающейся воронки WikipediaПредполагается, что сворачивание белка происходит в энергетическом ландшафте «сворачивающейся воронки», в котором нативное состояние свернутого протеина соответствует минимально возможной свободной энергии в условиях среды (обычно водного растворителя), в которой белок растворяется. Как видно на диаграмме (рис. 2.44), энергетическая воронка имеет множество локальных минимумов (провалов), в которых сворачивающийся белок может попасть в ловушку при движении вниз по энергетическому графику. Вероятно, играют роль другие факторы, такие как температура, электрические / магнитные поля и пространственные особенности.
Если внешние силы влияют на локальные минимумы энергии во время складывания, это может повлиять на процесс и конечный продукт. Как скорость автомобиля, едущего по дороге, влияет на безопасность поездки, так и энергетические соображения влияют на процесс складывания и направляют его, что в некоторых случаях приводит к появлению полностью функциональных, правильно сложенных белков и ошибочно сложенных «ошибок» в других.
Застрял
По мере того, как процесс складывания приближается к минимуму энергии (нижняя часть воронки на Рисунке 2.44), белок может «застрять» в любом из локальных минимумов и не достичь конечного свернутого состояния. Хотя свернутое состояние, как правило, более организовано и, следовательно, имеет меньшую энтропию, чем развернутое состояние, существуют две силы, которые преодолевают уменьшение энтропии и продвигают процесс вперед.
Первый — это величина уменьшения энергии, как показано на графике. Поскольку ΔG = ΔH -TΔS, уменьшение ΔH может преодолеть отрицательное значение ΔS, чтобы сделать ΔG отрицательным и подтолкнуть процесс складывания вперед.Благоприятные (пониженные) энергетические условия возникают с образованием ионных связей, водородных связей, дисульфидных связей и металлических связей во время процесса сворачивания. Кроме того, гидрофобный эффект увеличивает энтропию, позволяя гидрофобным аминокислотам внутри свернутого белка исключать воду, тем самым противодействуя влиянию упорядочения структуры белка, делая ΔS менее отрицательным.
Прогноз структуры
Компьютерные программы очень хорошо предсказывают вторичную структуру исключительно на основе аминокислотной последовательности, но с трудом определяют третичную структуру с использованием той же информации.Частично это связано с тем, что вторичные структуры имеют повторяющиеся точки стабилизации на основе геометрии, и любая регулярная вторичная структура (например, α-спираль) очень мало меняется от одной к другой. Однако складчатые структуры имеют огромное количество возможных структур, как показывает парадокс Левинталя.
Спектроскопия
Из-за нашей неспособности точно предсказать третичную структуру на основе аминокислотной последовательности, структуры белков фактически определяются с использованием методов спектроскопии.В этих подходах белки подвергаются различным формам электромагнитного излучения, и способы их взаимодействия с излучением позволяют исследователям определять координаты атомов с разрешением Ангстрема по плотности электронов (см. Рентгеновскую кристаллографию) и тому, как взаимодействуют спины ядер (см. ЯМР).
Парадокс Левинталя
В конце 1960-х Сайрус Левинталь обрисовал масштабы сложности проблемы сворачивания белка. Он указал, что для белка из 100 аминокислот он будет иметь 99 пептидных связей и 198 соображений для углов φ и ψ.Если бы каждая из них имела только три конформации, это привело бы к 3198 различным возможным сверткам или 2,95×1094.
Даже если учесть разумное количество времени (одна наносекунда) для каждой возможной складки, потребуется больше времени, чем возраст Вселенной, чтобы выбрать все из них, что ясно означает, что процесс складывания не происходит путем последовательной случайной выборки. и что попытки определить структуру белка путем случайной выборки были обречены на провал. Левинталь, следовательно, предположил, что сворачивание происходит в результате последовательного процесса, который начинается с события зародышеобразования, которое быстро направляет процесс и мало чем отличается от воронкообразного процесса, изображенного на рисунке 2.44.
Болезни неправильного сворачивания белков
Рисунок 2.45 — Неправильная укладка нормального белка PRPc, индуцированная PRPsc. Изображение Пенелопы Ирвинг. Правильная укладка белков важна для их функции. Отсюда следует, что неправильная укладка белков (также называемая протеопатией) может иметь последствия. В некоторых случаях это может просто привести к неактивному белку. Неправильная упаковка белков также играет роль при многих заболеваниях, таких как коровье бешенство, болезнь Альцгеймера, болезнь Паркинсона и болезнь Крейтцфельда-Якоба.Многие, но не все заболевания неправильной укладки поражают ткани мозга.
Рисунок 2.46 — Коровы с коровьим бешенством теряют способность стоятьНерастворимые отложения
Неправильно свернутые белки обычно образуют агрегаты, называемые амилоидами, которые вредны для тканей, содержащих их, потому что они меняют свой цвет с растворимых на нерастворимые в воде и образуют отложения. Процесс неправильного свертывания (рис. 2.45) не совсем ясен, но во многих случаях было продемонстрировано, что «затравочный» белок, который неправильно свернут, может вызывать такое же неправильное свертывание в других копиях того же белка.Эти протеины семян известны как прионы, и они действуют как инфекционные агенты, приводя к распространению болезни. Список заболеваний человека, связанных с неправильной упаковкой белков, длинен и продолжает расти. Ссылка на Википедию ЗДЕСЬ.
Прионы
Рисунок 2.47 — Диффузный амилоидоз в кровеносном сосуде (красные точки) WikipediaПрионы — это инфекционные белковые частицы, вызывающие трансмиссивные губчатые энцефалопатии (TSE), наиболее известной из которых является коровье бешенство. Другие проявления включают болезнь, скрепи, у овец и болезни человека, такие как болезнь Крейтцфельда-Якоба (CJD), фатальная семейная бессонница и куру.Белок, участвующий в этих заболеваниях, — это мембранный белок, называемый PrP. PrP закодирован в геноме многих организмов и содержится в большинстве клеток организма. PrPc — это название, данное структуре PrP, которая является нормальной и не связана с заболеванием. PrPSc — это название неправильно свернутой формы того же белка, которое связано с развитием симптомов заболевания (рис. 2.45).
Неправильно сложено
Неправильно свернутый PrPSc связан с заболеваниями TSE и действует как инфекционная частица.Третья форма PrP, называемая PrPres, может быть обнаружена в TSE, но не заразна. «Res» PrPres указывает на то, что он устойчив к протеазам. Стоит отметить, что все три формы PrP имеют одинаковую аминокислотную последовательность и отличаются друг от друга только способами складывания полипептидных цепей. Наиболее опасно неправильно свернутой формой PrP является PrPSc из-за его способности действовать как инфекционный агент — затравочный белок, который может вызывать неправильную укладку PrPc, тем самым превращая его в PrPSc.
Функция
Фигура 2.48 — Одна модель распространения прионов WikipediaФункция PrPc неизвестна. Мыши, лишенные гена PrP, не имеют серьезных отклонений. У них действительно проявляются проблемы с долговременной памятью, что указывает на функцию PrPc. Стэнли Прусинер, открывший прионы и придумавший этот термин, получил Нобелевскую премию по медицине в 1997 году за свою работу. Я думаю, что если бы я случайно оказался на протеине А, составляющем прион, я бы его скрутил и, ради бога, не дай ему делать ошибки складывания
Амилоиды
Амилоиды — это совокупность неправильно свернутых белковых агрегатов, обнаруженных в организме человека.Вследствие неправильной укладки они нерастворимы и вызывают около двадцати заболеваний человека, включая важные неврологические, связанные с прионами. Заболевания включают (пораженный белок в скобках) — болезнь Альцгеймера (амилоид β), болезнь Паркинсона (α-синуклеин), болезнь Хантингтона (хантингтин), ревматоидный артрит (сывороточный амилоид A), фатальную семейную бессонницу (PrPSc) и другие.
Аминокислотная последовательность играет роль в амилоидогенезе. Полипептиды, богатые глутамином, часто встречаются в прионах дрожжей и человека.Тринуклеотидные повторы важны при болезни Хантингтона. Если последовательность не является фактором, гидрофобная ассоциация между β-листами может играть роль.
Амилоид β
Рисунок 2.49 — HuntingtinAmyloid β относится к совокупности небольших белков (36-43 аминокислоты), которые, по-видимому, играют роль в болезни Альцгеймера. (Другим фактором является тау-белок.) Фактически, они являются основными компонентами амилоидных бляшек, обнаруживаемых в головном мозге пациентов, страдающих этим заболеванием, и возникают в результате протеолитического расщепления более крупного гликопротеина-предшественника амилоида, называемого амилоидным предшественником белка, интегральной мембраны. белок нервных клеток, функция которых неизвестна.Эту функцию выполняют две протеазы, β-секретаза и γ-секретаза. Амилоидные β-белки неправильно свернуты и, по-видимому, вызывают неправильную укладку других белков и, таким образом, преципитируют и образуют амилоид, характерный для этого заболевания. Бляшки токсичны для нервных клеток и вызывают деменцию, характерную для этого заболевания.
Считается, что агрегация белков амилоида β во время неправильной укладки приводит к генерации активных форм кислорода, и что это является средством, с помощью которого нейроны повреждаются.Неизвестно, какова реальная функция амилоида β. Аутосомно-доминантные мутации в белке приводят к раннему началу заболевания, но это происходит не более чем в 10% случаев. Стратегии лечения заболевания включают ингибирование секретаз, которые генерируют пептидные фрагменты из белка-предшественника амилоида.
Хантингтин
Хантингтин является центральным геном болезни Хантингтона. Белок, сделанный из него, богат глутамином, с 6-35 такими остатками в форме дикого типа.При болезни Хантингтона этот ген мутирует, увеличивая количество глутаминов в мутантном белке от 36 до 250. Размер белка зависит от количества глутаминов в мутантном белке, но белок дикого типа содержит более 3100 аминокислот. кислоты и молекулярный вес около 350 000 Да. Его точная функция неизвестна, но хантингтин содержится в нервных клетках, причем самый высокий уровень находится в мозге. Считается, что он, возможно, играет роль в транспорте, передаче сигналов и защите от апоптоза.Хантингтин также необходим для раннего эмбрионального развития. Внутри клетки хантингтин локализован в основном в микротрубочках и везикулах.
Тринуклеотидный повтор
Ген хантингтина содержит множество копий последовательности CAG (называемой тринуклеотидными повторами), которая кодирует множество глутаминов в белке. Болезнь Хантингтона возникает, когда при копировании ДНК гена образуются дополнительные копии последовательности CAG. Расширение повторяющихся последовательностей может происходить из-за скольжения полимеразы относительно матрицы ДНК во время репликации.В результате могут быть созданы несколько дополнительных копий тринуклеотидного повтора, в результате чего будут получены белки с различным числом остатков глутамина. Без проблем можно выдержать до 35 повторов. Однако количество повторов может увеличиваться в течение жизни человека по тому же механизму. Люди с 36-40 повторами начинают проявлять признаки болезни, а если их больше 40, болезнь будет присутствовать.
Молекулярные шапероны
Важность правильного сворачивания белков подчеркивается заболеваниями, связанными с неправильным сворачиванием белков, поэтому неудивительно, что клетки расходуют энергию для облегчения правильного сворачивания белков.Клетки используют два класса белков, известных как молекулярные шапероны, для облегчения такого складывания в клетках. Молекулярные шапероны бывают двух видов: шапероны и шаперонины. Примером первой категории является класс белков Hsp70. Hsp означает «белок теплового шока», исходя из того факта, что эти белки впервые были обнаружены в больших количествах в клетках, которые на короткое время подвергались воздействию высоких температур. Hsps помогает клеткам при стрессах, возникающих в результате теплового шока и воздействия окислительных условий или токсичных тяжелых металлов, таких как кадмий и ртуть.Однако они также играют важную роль в нормальных условиях, когда они способствуют правильной укладке полипептидов, предотвращая аберрантные взаимодействия, которые могут привести к неправильной укладке или агрегации. Белки Hsp70 обнаружены почти во всех клетках и используют гидролиз АТФ, чтобы стимулировать структурные изменения формы шаперона, чтобы приспособиться к связыванию белков-субстратов. Связывающий домен Hsp70s содержит структуру β-бочонка, которая обвивает полипептидную цепь субстрата и имеет сродство к гидрофобным боковым цепям аминокислот.Как показано на рисунке 2.50, Hsp70 связывается с полипептидами, когда они выходят из рибосом во время синтеза белка. Связывание субстрата стимулирует гидролиз АТФ, чему способствует другой белок теплового шока, известный как Hsp40. Гидролиз АТФ заставляет Hsp70 принимать закрытую конформацию, которая помогает экранировать открытые гидрофобные остатки и предотвращать агрегацию или локальную неправильную укладку.
После завершения синтеза белка АДФ высвобождается и заменяется АТФ, что приводит к высвобождению белка-субстрата, который затем позволяет полипептиду полной длины правильно складываться.
Рисунок 2.50 — Действие Hsp70 (синий), способствующее правильному сворачиванию белка (оранжевый) Изображение Алейи КимПри тепловом шоке
Во время теплового шока или окислительного стресса белки Hsp70 связываются с развернутыми гидрофобными областями белков, аналогичным образом предотвращая их агрегацию и позволяя им правильно складываться. Когда белки повреждены, Hsp70 привлекает ферменты, которые убиквитинируют поврежденный белок, чтобы нацелить их на разрушение в протеасомах. Таким образом, белки Hsp70 играют важную роль не только в том, чтобы белки были правильно уложены, но и в том, что поврежденные или нефункциональные белки удаляются путем деградации в протеасоме.
шаперонины
Второй класс белков, участвующих в помощи другим белкам в правильной укладке, известен как шаперонины. Есть две основные категории шаперонинов — класс I (обнаруженный в бактериях, хлоропластах и митохондриях) и класс II (обнаруженный в цитозоле эукариот и архебактерий). Наиболее изученными шаперонинами являются сложные белки GroEL / GroES, обнаруженные в бактериях (рис. 2.51).
Рисунок 2.51 — Вид снизу на GroEL (слева) и GroEL / GroES-комплекс (справа) WikipediaGroEL / GroES, возможно, не в состоянии отменить агрегированные белки, но, облегчая правильную укладку, она обеспечивает конкуренцию за неправильную укладку как процесс и может уменьшить или устраните проблемы, возникающие из-за неправильного складывания.GroEL представляет собой 14-мерное кольцо с двойным кольцом с гидрофобной областью, которое может способствовать складыванию субстратов размером 15-60 кДа. GroES — это одиночный гептамер, который связывается с GroEL в присутствии АТФ и действует как прикрытие над GroEL. Гидролиз АТФ шаперонинами вызывает большие конформационные изменения, которые влияют на связывание субстратных белков и их укладку. Точно неизвестно, как шаперонины сворачивают белки. Пассивные модели постулируют, что шаперониновый комплекс функционирует инертно, предотвращая неблагоприятные межмолекулярные взаимодействия или накладывая ограничения на пространства, доступные для возникновения складок.Активные модели предполагают, что структурные изменения в комплексе шаперонина вызывают структурные изменения в белке-субстрате.
Расщепление белков
Рисунок 2.52 — 26S протеасома. Активный сайт показан красным цветом WikipediaДругой белковый комплекс, который играет важную роль в динамике продолжительности жизни белков, — это протеасома (рис. 2.52). Протеасомы, обнаруженные у всех эукариот и архей, а также у некоторых бактерий, разрушают ненужные или поврежденные белки путем протеолитической деградации.Протеасомы помогают регулировать концентрацию некоторых белков и разрушать те, которые неправильно свернуты. Путь протеасомной деградации играет важную роль в клеточных процессах, которые включают прохождение клеточного цикла, модуляцию экспрессии генов и ответ на окислительный стресс.
Деградация в протеасоме дает короткие пептиды длиной от семи до восьми аминокислот. Важную роль играют треониновые протеазы. Распад этих пептидов дает отдельные аминокислоты, облегчая их рециклинг в клетках.Белки нацелены на деградацию в протеасомах эукариот путем присоединения к множеству копий небольшого белка, называемого убиквитином (8,5 кДа — 76 аминокислот). Фермент, катализирующий реакцию, известен как убиквитинлигаза. Образовавшаяся полиубиквитиновая цепь связывается протеасомой, и начинается деградация. Убиквитин получил свое название из-за того, что он повсеместно обнаруживается в эукариотических клетках.
Убиквитин
Рисунок 2.53 — Убиквитин (боковые цепи лизина показаны желтым) WikipediaУбиквитин (Рисунок 2.53) представляет собой небольшой (8,5 кДа) многофункциональный белок, обнаруженный в эукариотических клетках. Обычно он добавляется к белкам-мишеням под действием ферментов убиквитинлигазы (E3 на рисунке 2.54). Могут быть добавлены одна (убиквитинирование) или несколько (полиубиквитинирование) молекул убиквитина. Присоединение убиквитина происходит через боковую цепь одного из семи различных остатков лизина в убиквитине.
Добавление убиквитина к белкам имеет множество эффектов, наиболее известным из которых является нацеливание белка на деградацию в протеасоме.Протеасомное нацеливание наблюдается, когда полиубиквитинирование происходит по лизинам №29 и 48. Полиубиквитинирование или моноубиквитинирование по другим лизинам может приводить к измененному клеточному расположению и измененным межбелковым взаимодействиям. Последние могут влиять на воспаление, перенос эндоцитов, трансляцию и репарацию ДНК.
Рисунок 2.54 — Путь убиквитинирования целевого белка-субстрата Изображение Пера ЯкобсонаНарушение функции убиквитинлигазы
Паркин — это белок, связанный с болезнью Паркинсона, который при мутации связан с наследственной формой заболевания, называемой аутосомно-рецессивной ювенильной болезнью Паркинсона.Функция белка неизвестна, но он является компонентом системы убиквитинлигазы E3, ответственной за перенос убиквитина от белка E2 к боковой цепи лизина на белке-мишени. Считается, что мутации в паркине приводят к протеасомной дисфункции и, как следствие, неспособности расщеплять белки, вредные для дофаминергических нейронов. Это приводит к гибели или нарушению работы этих нейронов, что приводит к болезни Паркинсона.
Внутренне неупорядоченные белки
Фильм 2.1 — Динамическое движение цитохрома C в растворе Wikipedia
Как видно из множества примеров, описанных в другом месте книги, трехмерная структура белков важна для их функции. Но становится все более очевидным, что не все белки складываются в стабильную структуру. Исследования так называемых внутренне неупорядоченных белков (IDP) за последние несколько десятилетий показали, что многие белки являются биологически активными, даже если они не могут складываться в стабильные структуры.Тем не менее, другие белки демонстрируют области, которые остаются развернутыми (области IDP), даже когда остальная часть полипептида складывается в структурированную форму.
Внутренне неупорядоченные белки и неупорядоченные области внутри белков были известны уже много лет, но рассматривались как аномалия. Только недавно, с осознанием того, что IDP и IDP области широко распространены среди эукариотических белков, было признано, что наблюдаемое нарушение является «особенностью, а не ошибкой».
Фильм 2.2 SUMO-1, белок с внутренне неупорядоченными участками Wikipedia
Сравнение IDP показывает, что у них общие характеристики последовательности, которые, по-видимому, благоприятствуют их неупорядоченному состоянию. То есть, подобно тому, как некоторые аминокислотные последовательности могут способствовать сворачиванию полипептида в конкретную структуру, аминокислотные последовательности IDP способствуют тому, чтобы они оставались развернутыми. Видно, что области IDP содержат мало гидрофобных остатков и необычно богаты полярными остатками и пролином. Присутствие большого количества заряженных аминокислот в IDP может ингибировать фолдинг за счет отталкивания зарядов, в то время как отсутствие гидрофобных остатков затрудняет формирование стабильного гидрофобного ядра, а пролин препятствует образованию спиральных структур.Наблюдаемые различия между аминокислотными последовательностями в IDP и структурированных белках были использованы для разработки алгоритмов для прогнозирования того, будет ли данная аминокислотная последовательность неупорядоченной.
Какое значение имеют внутренне неупорядоченные белки или области? Тот факт, что это свойство закодировано в их аминокислотных последовательностях, предполагает, что их нарушение может быть связано с их функцией. Гибкая, мобильная природа некоторых IDP-регионов может играть решающую роль в их функции, позволяя переход к складчатой структуре при связывании с белком-партнером или при посттрансляционной модификации.Некоторые ответы можно найти в исследованиях нескольких хорошо известных белков с участками IDP. Области IDP могут повышать способность белков, подобных lac-репрессору, перемещаться по ДНК для поиска специфических сайтов связывания. Гибкость IDP также может быть преимуществом во взаимодействиях белок-белок, особенно для белков, которые, как известно, взаимодействуют со многими различными белками-партнерами.
Рисунок 2.55 — Денатурация и ренатурация рибонуклеазы ВикипедияНапример, р53 имеет области IDP, которые могут позволить белку взаимодействовать с множеством функциональных партнеров.Сравнение известных функций белков с предсказаниями нарушений в этих белках предполагает, что IDP и области IDP могут непропорционально функционировать в передаче сигналов и регуляции, в то время как более структурированные белки смещены в сторону катализа и транспорта. Интересно, что многие белки, обнаруженные как в рибосомах, так и в сплайсосомах, имеют IDP-области, которые могут играть роль в правильной сборке этих комплексов. Несмотря на то, что ВПЛ не изучались интенсивно в течение очень долгого времени, то немногое, что о них известно, предполагает, что они играют важную и недооцененную роль в клетках.
Метаморфические белки
Другая группа белков, которая недавно изменила наше представление о структуре и функции белков, — это так называемые метаморфические белки. Эти белки способны образовывать более одного стабильного свернутого состояния, начиная с одной аминокислотной последовательности. Хотя это правда, что множественные свернутые конформации не исключаются законами физики и химии, метаморфические белки — относительно новое открытие. Конечно, было известно, что прионные белки способны складываться в альтернативные структуры, но метаморфические белки, по-видимому, могут переключаться между двумя стабильными структурами.Хотя в некоторых случаях метаморфный белок подвергается этому переключению в ответ на связывание другой молекулы, некоторые белки могут выполнять этот переход самостоятельно. Интересный пример — сигнальная молекула лимфотактин. Лимфотактин выполняет две биологические функции, которые выполняются двумя его конформерами — мономерной формой, связывающей рецептор лимфотактина, и димерной формой, связывающей гепарин. Возможно, такое переключение более распространено, чем предполагалось.
Рефолдинг денатурированных белков
Вся информация о фолдинге белка содержится в аминокислотной последовательности белка.Тогда может показаться любопытным, что большинство белков не сворачиваются в свою правильную, полностью активную форму после того, как они были денатурированы +++ и денатурант удален. На самом деле некоторые так и поступают. Хорошим примером является бычья рибонуклеаза (рис. 2.55). Его каталитическая активность очень устойчива к воздействию тепла и мочевины, и попытки денатурировать его не очень хорошо. Однако, если обработать фермент β-меркаптоэтанолом (который разрывает дисульфидные связи) перед обработкой мочевиной и / или нагреванием, активность теряется, что указывает на то, что ковалентные дисульфидные связи помогают стабилизировать общую структуру фермента, и когда они разрываются, денатурация может легко произойти.Когда смесь снова остывает до комнатной температуры, со временем некоторая активность ферментов снова появляется, указывая на то, что рибонуклеаза снова свернулась в новых условиях.
Интересно, что ренатурация произойдет максимально, если во время процесса в растворе останется небольшое количество β-меркаптоэтанола. Причина этого в том, что β-меркаптоэтанол позволяет восстанавливать (и разрушать) случайные неправильные дисульфидные связи во время процесса складывания. Без него эти дисульфидные связи будут препятствовать образованию правильных складок.
Необратимая денатурация
Однако большинство ферментов не ведут себя как бычья рибонуклеаза. После денатурирования их активность не может быть восстановлена до какой-либо значительной степени. Существует не так много способов инактивации РНКазы. Она стабильна как в горячем, так и в холодном состоянии, потому что дисульфиды плотно удерживаются. Если вы хотите, чтобы она остановилась, используйте горячий меркаптоэтанол. Это может показаться противоречащим идее о том, что информация о сворачивании является неотъемлемой частью последовательности аминокислот в белке.Это не.
Большинство ферментов не восстанавливаются должным образом после денатурации по двум причинам. Во-первых, нормальное сворачивание может происходить по мере образования белков. Взаимодействия между аминокислотами на ранней стадии синтеза не «сбиваются с толку» взаимодействиями с аминокислотами на более поздних этапах синтеза, потому что эти аминокислоты не присутствуют в начале процесса.
Роль шаперонинов
В других случаях процесс сворачивания некоторых белков в клетке зависел от действия белков-шаперонинов (см. ЗДЕСЬ).В отсутствие шаперонинов происходят взаимодействия, которые могут приводить к неправильной укладке, что препятствует правильной укладке. Таким образом, раннее сворачивание и помощь шаперонинов устраняют некоторые потенциальные взаимодействия «неправильного сворачивания», которые могут происходить, если вся последовательность присутствует в момент начала сворачивания.
Четвертичная структура
Четвертый уровень структуры белка — это четвертичная структура. Это относится к структурам, которые возникают в результате взаимодействий между множеством полипептидов.Единицы могут быть идентичными множественными копиями или могут быть разными полипептидными цепями. Гемоглобин взрослого человека является хорошим примером белка с четвертичной структурой, состоящего из двух идентичных цепей, называемых α, и двух идентичных цепей, называемых β.
Хотя α-цепи очень похожи на β-цепи, они не идентичны. Как α-, так и β-цепи также связаны с одной полипептидной цепью в родственном белке, называемом миоглобином. И миоглобин, и гемоглобин имеют сходство в связывании кислорода, но их поведение по отношению к молекуле значительно различается.Примечательно, что множественные субъединицы гемоглобина (с четвертичной структурой) по сравнению с одиночной субъединицей миоглобина (без четвертичной структуры) вызывают эти различия.
Список литературы
1. https://en.wikipedia.org/wiki/Van_der_W aals_force 105
Что такое белки и для чего они нужны ?: MedlinePlus Genetics
Белки — это большие сложные молекулы, которые играют важную роль в организме. Они выполняют большую часть работы в клетках и необходимы для структуры, функции и регулирования тканей и органов тела.
Белки состоят из сотен или тысяч более мелких единиц, называемых аминокислотами, которые связаны друг с другом длинными цепями. Существует 20 различных типов аминокислот, которые можно комбинировать для получения белка. Последовательность аминокислот определяет уникальную трехмерную структуру каждого белка и его конкретную функцию. Аминокислоты кодируются комбинациями трех строительных блоков ДНК (нуклеотидов), определяемых последовательностью генов.
Белки можно описать в соответствии с их широким спектром функций в организме, перечисленных в алфавитном порядке:
Функция | Описание | Пример |
|---|---|---|
Антитело | Антитела связываются с определенными инородными частицами, такими как вирусы и бактерии, чтобы защитить организм. | Иммуноглобулин G (IgG) |
Фермент | Ферменты осуществляют почти все тысячи химических реакций, протекающих в клетках. Они также помогают формированию новых молекул, считывая генетическую информацию, хранящуюся в ДНК. | Фенилаланин гидроксилаза |
Мессенджер | Белки-мессенджеры, такие как некоторые типы гормонов, передают сигналы для координации биологических процессов между различными клетками, тканями и органами. | Гормон роста |
Конструктивный элемент | Эти белки обеспечивают структуру и поддержку клеток. В большем масштабе они также позволяют телу двигаться. | Актин |
Транспортировка / хранение | Эти белки связывают и переносят атомы и небольшие молекулы внутри клеток и по всему телу. | Ферритин |
Незаменимые аминокислоты: таблица, сокращения и структура
Аминокислота AlaАланин, обнаруженный в белке в 1875 году, составляет 30% остатков в шелке.Его низкая реакционная способность способствует простой, удлиненной структуре шелка с небольшим количеством поперечных связей, что придает волокнам прочность, сопротивление растяжению и гибкость. В биосинтезе белков участвует только l-стереоизомер.
Аминокислота ArgВ организме человека аргинин вырабатывается при переваривании белков. Затем он может быть преобразован человеческим организмом в оксид азота, химическое вещество, которое, как известно, расслабляет кровеносные сосуды.
Благодаря своему сосудорасширяющему действию аргинин был предложен для лечения людей с хронической сердечной недостаточностью, высоким уровнем холестерина, нарушением кровообращения и высоким кровяным давлением, хотя исследования по этим направлениям все еще продолжаются.Аргинин также может быть получен синтетическим путем, и родственные аргинину соединения можно использовать для лечения людей с дисфункцией печени из-за их роли в стимулировании регенерации печени. Хотя аргинин необходим для роста, но не для поддержания организма, исследования показали, что аргинин имеет решающее значение для процесса заживления ран, особенно у людей с плохим кровообращением.
Аминокислота AsnВ 1806 году аспарагин был очищен из сока спаржи, что сделало его первой аминокислотой, выделенной из природного источника.Однако только в 1932 году ученые смогли доказать, что аспарагин присутствует в белках. Только l-стереоизомер участвует в биосинтезе белков млекопитающих. Аспарагин важен для удаления токсичного аммиака из организма.
Аминокислота AspОбнаруженная в белках в 1868 году аспарагиновая кислота обычно содержится в белках животных, однако только l-стереоизомер участвует в биосинтезе белков. Растворимость этой аминокислоты в воде обусловлена наличием рядом с активными центрами ферментов, таких как пепсин.
Аминокислота CysЦистеин особенно богат белками волос, копыт и кератином кожи, он был выделен из мочевого камня в 1810 году и из рога в 1899 году. Впоследствии он был химически синтезирован. и структура решена в 1903–1904 гг.
Серосодержащая тиоловая группа в боковой цепи цистеина является ключевой для его свойств, обеспечивая образование дисульфидных мостиков между двумя пептидными цепями (как в случае с инсулином) или образование петли в одной цепи, влияя на окончательную структуру белка.Две молекулы цистеина, связанные между собой дисульфидной связью, составляют аминокислоту цистин, которая иногда указывается отдельно в общих списках аминокислот. Цистеин вырабатывается в организме из серина и метионина и присутствует только в l-стереоизомере в белках млекопитающих.
Люди с генетическим заболеванием цистинурия не могут эффективно реабсорбировать цистин в кровоток. Следовательно, в их моче накапливается высокий уровень цистина, где он кристаллизуется и образует камни, которые блокируют почки и мочевой пузырь.
Глутамин был впервые выделен из свекольного сока в 1883 году, выделен из белка в 1932 году и впоследствии химически синтезирован в следующем году. Глютамин — самая распространенная в нашем организме аминокислота, которая выполняет несколько важных функций. У людей глутамин синтезируется из глутаминовой кислоты, и этот этап преобразования жизненно важен для регулирования уровня токсичного аммиака в организме, образуя мочевину и пурины.
Аминокислота GluГлутаминовая кислота была выделена из пшеничного глютена в 1866 году и химически синтезирована в 1890 году.Обычно встречается в белках животных, только l-стереоизомер встречается в белках млекопитающих, которые люди способны синтезировать из обычного промежуточного соединения α-кетоглутаровой кислоты. Мононатриевая соль l-глутаминовой кислоты, глутамат натрия (MSG) обычно используется в качестве приправы и усилителя вкуса. Карбоксильная боковая цепь глутаминовой кислоты способна действовать как донор и акцептор аммиака, который токсичен для организма, обеспечивая безопасную транспортировку аммиака в печень, где он превращается в мочевину и выводится почками.Свободная глутаминовая кислота также может разлагаться до диоксида углерода и воды или превращаться в сахара.
Аминокислота GlyГлицин был первой аминокислотой, выделенной из белка, в данном случае желатина, и единственной неактивной оптически (без d- или l-стереоизомеров). Структурно простейшая из α-аминокислот, она очень инертна при включении в белки. Тем не менее, глицин играет важную роль в биосинтезе аминокислоты серина, кофермента глутатиона, пуринов и гема, жизненно важной части гемоглобина.
His аминокислотаГистидин был выделен в 1896 году, и его структура была подтверждена химическим синтезом в 1911 году. Гистидин является прямым предшественником гистамина, а также важным источником углерода в синтезе пуринов. При включении в белки боковая цепь гистидина может действовать как акцептор и донор протонов, передавая важные свойства при объединении с ферментами, такими как химотрипсин, и ферментами, участвующими в метаболизме углеводов, белков и нуклеиновых кислот.
Для младенцев гистидин считается незаменимой аминокислотой, взрослые могут в течение короткого времени обходиться без диетического питания, но по-прежнему считается незаменимой.
Аминокислота IleИзолейцин был выделен из патоки свекловичного сахара в 1904 году. Гидрофобная природа боковой цепи изолейцина важна для определения третичной структуры белков, в которые он включен.
У людей, страдающих редким наследственным заболеванием, называемым болезнью мочи кленового сиропа, есть дефектный фермент в пути разложения, который является общим для изолейцина, лейцина и валина.Без лечения метаболиты накапливаются в моче пациента, вызывая характерный запах, который и дал название состоянию.
Leu АминокислотаЛейцин был выделен из сыра в 1819 году и из мышц и шерсти в кристаллическом состоянии в 1820 году. В 1891 году он был синтезирован в лаборатории.
Только l-стереоизомер появляется в белке млекопитающих и может расщепляться на более простые соединения ферментами организма. Некоторые связывающие ДНК белки содержат области, в которых лейцины расположены в конфигурации, называемые лейциновыми застежками-молниями.
Lys АминокислотаЛизин был впервые выделен из казеина молочного белка в 1889 году, а его структура была выяснена в 1902 году. Лизин важен для связывания ферментов с коферментами и играет важную роль в функционировании гистонов.
Многие зерновые культуры содержат очень мало лизина, что привело к его дефициту у некоторых групп населения, которые сильно зависят от них в продуктах питания, а также у вегетарианцев и людей, сидящих на низкожирной диете. Следовательно, были предприняты усилия по разработке штаммов кукурузы, богатых лизином.
Met аминокислотаМетионин был выделен из казеина молочного белка в 1922 году, и его структура была решена путем лабораторного синтеза в 1928 году. Метионин является важным источником серы для многих соединений в организме, включая цистеин и таурин. Связанный с содержанием серы, метионин помогает предотвратить накопление жира в печени и помогает выводить токсины и шлаки метаболизма.
Метионин — единственная незаменимая аминокислота, которая не присутствует в значительных количествах соевых бобов и поэтому производится коммерчески и добавляется во многие продукты из соевого шрота.
Аминокислота PheФенилаланин был впервые выделен из природного источника (ростки люпина) в 1879 году и впоследствии химически синтезирован в 1882 году. Организм человека обычно способен расщеплять фенилаланин на тирозин, однако у людей с наследственным заболеванием фенилкетонурия (PKU), фермент, который выполняет это преобразование, неактивен. Если не лечить, фенилаланин накапливается в крови, вызывая задержку умственного развития у детей. Примерно 10 000 детей рождаются с этим заболеванием, поэтому диета с низким содержанием фенилаланина в раннем возрасте может облегчить его последствия.
Pro-аминокислотаВ 1900 году пролин был синтезирован химическим путем. На следующий год он был выделен из казеина из молочного белка, и его структура оказалась такой же. Люди могут синтезировать пролин из глутаминовой кислоты, которая присутствует только как l-стереоизомер в белках млекопитающих. Когда пролин включается в белки, его особая структура приводит к резким изгибам или перегибам в пептидной цепи, что в значительной степени способствует окончательной структуре белка. Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Аминокислота SerСерин был впервые выделен из белка шелка в 1865 году, но его структура не была установлена до 1902 года. Люди могут синтезировать серин из других метаболитов, включая глицин, хотя только l-стереоизомер присутствует в белках млекопитающих. Серин важен для биосинтеза многих метаболитов и часто важен для каталитической функции ферментов, в которые он включен, включая химотрипсин и трипсин.
Нервные газы и некоторые инсектициды действуют путем объединения с остатком серина в активном центре ацетилхолинэстеразы, полностью подавляя фермент.Активность эстеразы важна для расщепления нейромедиатора ацетилхолина, в противном случае повышается опасно высокий уровень, что быстро приводит к судорогам и смерти.
Thr аминокислотаТреонин был выделен из фибрина в 1935 году и синтезирован в том же году. Только l-стереоизомер появляется в белках млекопитающих, где он относительно инертен. Хотя он играет важную роль во многих реакциях у бактерий, его метаболическая роль у высших животных, включая человека, остается неясной.
Аминокислота TrpСтруктура триптофана, выделенная из казеина (молочного белка) в 1901 году, была установлена в 1907 году, но только l-стереоизомер присутствует в белках млекопитающих. В кишечнике человека бактерии расщепляют пищевой триптофан, выделяя такие соединения, как скатол и индол, которые придают фекалиям неприятный аромат. Триптофан превращается в витамин B3 (также называемый никотиновой кислотой или ниацином), но не в достаточной степени, чтобы поддерживать наше здоровье. Следовательно, мы также должны принимать витамин B3, несоблюдение этого правила приводит к его дефициту, называемому пеллагрой.
Аминокислота TyrВ 1846 году тирозин был выделен в результате разложения казеина (сырного белка), после чего он был синтезирован в лаборатории, а его структура была определена в 1883 году. Присутствует только в l-стереоизомере в белки млекопитающих, люди могут синтезировать тирозин из фенилаланина. Тирозин является важным предшественником гормонов надпочечников адреналина и норадреналина, гормонов щитовидной железы, включая тироксин, а также пигмента волос и кожи меланина.В ферментах остатки тирозина часто связаны с активными центрами, изменение которых может изменить специфичность фермента или полностью уничтожить активность.
Страдающие тяжелым генетическим заболеванием фенилкетонурией (ФКУ) не могут преобразовать фенилаланин в тирозин, в то время как у пациентов с алкаптонурией метаболизм тирозина нарушен, и моча становится отчетливой и темнеет при контакте с воздухом.
Val аминокислотаСтруктура валина была установлена в 1906 году после его первого выделения из альбумина в 1879 году.В белке млекопитающих появляется только l-стереоизомер. Валин может разлагаться в организме на более простые соединения, но у людей с редким генетическим заболеванием, называемым болезнью мочи кленового сиропа, неисправный фермент прерывает этот процесс и может оказаться фатальным при отсутствии лечения.
«Периодическая таблица» белков помогает понять структуру
«Периодическая таблица» белков помогает понять структуру
Роберт Сандерс, специалист по связям со СМИ | 18 февраля 2003 г.,
БЕРКЛИ — Ученые из Калифорнийского университета в Беркли и Национальной лаборатории Лоуренса Беркли сделали первый удар по «периодической таблице» белковых структур — организованной карте строительных блоков, которые снова и снова используются для построения миллиардов сложные белки, из которых состоит жизнь на Земле.
| Белок канцерогенного онкоген под названием ras является одним из примеров сложная трехмерная геометрия белка. (Кредит: Сунг-Хоу Ким / Калифорнийский университет в Беркли) |
Трехмерная карта отображает сходства и различия между строительными блоками, позволяя ученым визуализировать вселенную возможных белковых структур — множество возможных поворотов, поворотов и складок — и увидеть эволюционные изменения, которые могли произойти со временем.Карта может помочь им понять взаимосвязь между всеми белками в природе так же, как периодическая таблица элементов дала химикам основу для понимания взаимосвязи молекул.
«Это очень хороший способ организовать и визуализировать всю белковую вселенную», — сказал Сунг-Хоу Ким, профессор химии Калифорнийского университета в Беркли и глава отдела структурной биологии Отделения физических биологических наук Национальной лаборатории Лоуренса Беркли.«Основное влияние этого исследования будет концептуальным, дающим глобальное представление о структуре белка и о том, как могли развиваться различные структуры».
Поскольку понимание молекулярных функций белков является ключом к пониманию клеточных функций, карта открывает перспективы для ряда областей биологии и биомедицинских исследований, включая разработку более эффективных фармацевтических препаратов с меньшим количеством побочных эффектов, сказал Ким.
«Эту карту можно использовать, чтобы помочь разработать лекарство, действующее на конкретный белок, и определить, на какие другие белки с похожей структурой это лекарство также может повлиять», — сказал он.
Ким и его коллеги, аспиранты Калифорнийского университета в Беркли Цзинтун Хоу и Грегори Симс, а также научный сотрудник Чао Чжан опубликовали свою карту на этой неделе в раннем онлайн-выпуске Proceedings of the National Academy of Sciences (PNAS). Статья будет размещена на веб-сайте PNAS где-то между 18 и 21 февраля.
Ким является участником инициативы Health Sciences Initiative Калифорнийского университета в Беркли, которая объединяет физические науки вместе с биологическими науками для решения проблем здравоохранения. 21 века.Он также является членом Калифорнийского института количественных биомедицинских исследований (QB3), совместного усилия трех кампусов Калифорнийского университета и частного сектора, использующего количественные науки для интеграции нашего понимания биологических систем на всех уровнях сложности.
По мере того, как количество организмов с полностью секвенированными геномами превышает 100, а к концу года ожидается еще 600, ученые наводнены последовательностями генов для белков. Один только геном человека насчитывает около 40 000 генов.
Тем не менее, последовательности генов — это только отправная точка в понимании организма. Уникальный белок, кодируемый каждым геном, — настоящая рабочая лошадка. Белки — это одновременно и дом, и домработница, функция каждого из которых определяется его трехмерной структурой и тем, как он взаимодействует с другими белками. Однако на сегодняшний день ученым известна структура — складки и изгибы — всего около 20 000 белков самых разных организмов. Среди всех организмов на Земле может быть до триллиона различных белков.
Многие когда-то думали, что, обладая достаточной вычислительной мощностью, ученые в конечном итоге смогут предсказать структуру белка только по аминокислотной последовательности. «Эта цель очень далека от достижения, если это вообще возможно», — сказал Ким.
Как химик структуры белка, Ким исследовал несколько схем предсказания, но отказались от них после того, как поняли, что белки, содержащие всего лишь 10-процентная идентичность в последовательности может иметь почти одинаковую структуру.Вместо этого он начал искать глобальный взгляд на белковую вселенную. это, по крайней мере, позволило бы ему исключить некоторые предсказанные структуры и поиск только в области структур, одобренных природой.
Другие тоже искали принцип организации, каталогизируя типы складок и скручиваний — структурные домены или мотивы, как называет их Ким, — общие для большинства белков. Но ни один из предыдущих результатов нельзя было понять с эволюционной точки зрения.
Метод его группы включал математическое сравнение каждого мотива со всеми остальными мотивами, вычисляя их несходство как меру структурного «расстояния» между данной парой мотивов. Чем меньше сходства, тем больше структурная дистанция пары. Затем группа нашла такое расположение в пространстве, что физическое расстояние между мотивами соответствовало их структурному «расстоянию». На получившейся карте складки или мотивы, наиболее похожие друг на друга, структурно связанные, оказываются рядом друг с другом.
Хотя структурные биологи предсказывают, что может быть 10 000 или более различных мотивов или строительных блоков, только около 1000 в настоящее время распознаются из 20 000 известных белковых структур. Поскольку задействованные вычисления были очень интенсивными, группа Кима выбрала для «картирования» подмножество из них — 500 наиболее распространенных мотивов, которые являются строительными блоками примерно 80 процентов всех известных белковых структур.
«Я предполагаю, что три четверти белков большинства организмов имеют структурные мотивы среди этих 500», — сказал он.Мотивы представляют собой существенные различия в складывании. Альфа-спираль — это один из распространенных структурных элементов белковых мотивов, состоящий из спиральной спирали аминокислот, подобной скрученной вправо ленте. Для мотива с двумя спиралями две параллельные спирали представляют собой мотив, отличный от двух антипараллельных спиралей.
| Трехмерный сюжет почти 500 строительных блоков или мотивов в сложенном виде белки, демонстрирующие кластеризацию, которая, по-видимому, связана к эволюции сложных складок.Каждая сфера представляет семейство белков, демонстрирующее аналогичные складки. Белковые складки которые принадлежат альфа-спирали, бета-листу и альфа / бета class в основном сгруппированы вокруг трех отдельных осей, (красный, желтый и голубой соответственно). Большинство белковых складок класса альфа + бета (синий), которые представляют собой случайную смесь альфа-спиралей и бета-листов, попадают в плоскость между осями альфа и бета.Альфа- и бета-оси приблизительно пересекаются в одной точке, обозначенной зеленый шар. (Источник: Сун-Хоу Ким / Калифорнийский университет в Беркли) |
Работа с 498 различными мотивами требовала больших вычислительных ресурсов — группа Кима занимала все компьютеры лаборатории более недели для одного набора вычислений — но она предоставила трехмерную карту белковой вселенной, которая удивила даже Кима. По сути, различные мотивы группируются в четыре группы, которые при трехмерном изображении напоминают три сигары, связанные вместе одним концом, причем четвертая сигара выступает из плоскости трех других.Область пересечения трех сигар содержит простые складки, а более сложные складки расположены ближе к концам сигар.
«Я этого не ожидал», — сказал он. «Другие исследования показали три кластера белков, каждый с разными структурными элементами, но в нашем случае мы видим четыре четко разделенных группы, и каждая группа имеет удлиненное распределение, которое показывает, как она могла развиваться.
« Распределение не является случайным. . Развивались только определенные классы. Похоже, что архитектурные ограничения структуры сыграли ограничительную роль в ранней эволюции.»
Один эволюционный путь развился на основе структуры альфа-спирали. Другой путь развился из основного бета-листа, пары расположенных бок о бок цепей аминокислот, стабилизированных связями по их длине. Третий путь представляет собой, по сути, случайное сочетание альфа спирали и бета-листы.
Четвертый путь, который отклоняется от третьего примерно на одну треть пути вдоль своего кластера, кажется, развился позже. Он представляет собой определенное сочетание одной альфа-спирали и двух бета-листов, которые использовались как удобный модуль для создания более крупных белков.
«Если другие мотивы состоят из кирпичей, эта четвертая группа мотивов состоит из готовых блоков из множества кирпичиков, используемых для создания белков», — сказал Ким.
Чтобы увидеть, реальны ли очевидные эволюционные отношения, предложенные картой, Ким и его группа сравнили графики белков трех отдельных организмов. Солеволюбивый микроб Halobacterium из примитивной группы под названием Archea содержал белки с более простыми структурными мотивами, в то время как более развитая бактерия, Chlamydia, имела более сложные мотивы в своих белках.Среди бактерий одна из самых ранних, обитатель горячих источников Аквифекс, не имела такого количества сложных модулей, как хламидия, более развитая бактерия.
«Кажется, на карту встроены нечеткие часы эволюции», — сказал Ким. «Это показывает, что альфа-спирали и бета-листы развиваются рано, затем они начали смешиваться, и, наконец, одна из смесей взлетела».
С точки зрения предсказания структуры неизвестных белков, глобальная карта белков, которую построила группа Кима, показывает типы складок, которые могут существовать в белках, и устраняет многие возможные альтернативы, которые природа никогда не использовала.
Следующая цель Кима — добавить на карту менее распространенные складки или строительные блоки. Фактически, его группа уже добавила намного больше складок и обнаружила, что они занимают ту же самую «оболочку» из четырех удлиненных кластеров в пространстве складок, предполагая, что эта «карта», построенная из 498 наиболее распространенных складок, является хорошим представлением для всех белки. Центр структурного генома в Беркли, которым он руководит, был основан два с половиной года назад вместе с восемью аналогичными центрами в Соединенных Штатах для поиска других 9000 или около того структурных мотивов или семейств во вселенной структур белков.Эти центры финансируются Инициативой по структуре белка Национальных институтов здравоохранения.
Он также хочет взглянуть на карты складок белков многих отдельных организмов, чьи геномы были секвенированы, чтобы увидеть различия в распределении складок белков.
«Это только начало, первое представление о распределении белков. Предстоит еще много заняться добычей полезных ископаемых», — сказал Ким. «Это такой новый способ осмысления белковой вселенной, что некоторым людям трудно это понять.Но другие очарованы этим глобальным взглядом на белковую вселенную ».
Проект финансировался Национальным научным фондом и Национальным институтом здравоохранения через Центр структурного генома Беркли.
Открыта Периодическая таблица белковых комплексов
Новая таблица Менделеева представляет систематический, упорядоченный вид сборки белков, предоставляя визуальный инструмент для понимания биологической функции.[EMBL-EBI / Spencer Phillips]
Переместите Менделеева, в науке появилась новая таблица Менделеева. В отличие от исходной таблицы Менделеева, которая организовывала химические элементы, новая таблица Менделеева организует белковые комплексы или, точнее, топологии четвертичной структуры. Хотя есть и другие различия между старой и новой периодической таблицей, у них есть по крайней мере одна важная особенность — предсказательная сила.
Когда Менделеев представил свою периодическую таблицу, он предсказал, что, когда будут открыты новые химические элементы, они заполнят белые пятна в его таблице.Аналогичные прогнозы делает команда ученых, создавшая новую таблицу Менделеева. Эта команда, состоящая из ученых из кампуса Wellcome Genome и Кембриджского университета, утверждает, что ее периодическая таблица показывает области пространства четвертичной структуры, которые еще предстоит заселить.
Периодическая таблица белковых комплексов не только предлагает новый взгляд на огромное разнообразие структур, которые белки могут создавать в природе, но также указывает, какие структуры могут быть открыты в следующий раз.Более того, это может указать белковых инженеров на совершенно новые структуры, которых никогда не было в природе, но которые можно было бы создать.
Новая таблица появилась 11 декабря в журнале Science в статье, озаглавленной «Принципы сборки раскрывают периодическую таблицу белковых комплексов». «Принципы сборки», упомянутые в этом заголовке, сводятся к трем основным типам сборки: димеризация, циклизация и добавление гетеромерных субъединиц. При димеризации одна субъединица белкового комплекса удваивается и становится двумя; при циклизации — субъединицы белкового комплекса из трех или более кольца; и при добавлении гетеромерной субъединицы два разных белка связываются друг с другом.
Эти шаги, повторяющиеся в различных комбинациях, дают начало огромному количеству белков разных видов. «Эволюция привела к появлению огромного разнообразия белковых комплексов, и это может показаться немного хаотичным», — объяснил Джо Марш, доктор философии, ранее работавший в Геномном кампусе Wellcome, а теперь из Отделения генетики человека MRC Эдинбургского университета. . «Но если вы разберете шаги, предпринимаемые белками для превращения в комплексы, то есть несколько основных правил, которые могут объяснить почти все сборки, которые люди наблюдали до сих пор.”
Авторы статьи в Science отметили, что многие белковые комплексы спонтанно собираются посредством упорядоченных путей in vitro, и эти пути имеют сильную тенденцию к эволюционному сохранению. «[Существует] сильное сходство, — добавили авторы, — между сборкой белкового комплекса и эволюционными путями, причем пути сборки часто отражают эволюционную историю, и наоборот. Это говорит о том, что может быть полезно рассмотреть типы белковых комплексов, которые эволюционировали, с точки зрения возможных путей сборки.”
Чтобы исследовать это обоснование, авторы исследовали фундаментальные этапы сборки белковых комплексов, используя эксперименты по масс-спектрометрии с электрораспылением, литературные данные по сборке и крупномасштабный анализ структур белковых комплексов. В конечном итоге они выработали свой подход к объяснению наблюдаемого распределения известных белковых комплексов в пространстве четвертичной структуры. Они настаивают на том, что этот подход обеспечивает основу для понимания их эволюции.
«Кроме того, он может внести значительный вклад в прогнозирование и моделирование четвертичных структур, определяя, какие топологии с наибольшей вероятностью будут приняты комплексом с заданной стехиометрией, потенциально обеспечивая ограничения для стыковки нескольких субъединиц и гибридных методов», — заключили авторы. .«И, наконец, это может помочь в биоинженерии белковых комплексов, определяя, какие топологии с наибольшей вероятностью будут стабильными и, следовательно, какие типы необходимых интерфейсов необходимо разработать».
Строки и столбцы периодической таблицы элементов, называемые периодами и группами, первоначально определялись атомной массой и химическими свойствами каждого элемента, а затем атомным номером и электронной конфигурацией. Напротив, строки и столбцы периодической таблицы белковых комплексов соответствуют количеству различных типов субъединиц и количеству повторений этих субъединиц.Следует отметить, что новая таблица не является периодической в том же смысле, что и периодическая таблица элементов. В принципе, это бессрочно.
Хотя нет никаких теоретических ограничений для пространства топологии четвертичных структур в любом измерении, сокращенная версия таблицы, представленной в статье Science, может вместить подавляющее большинство известных структур. Более того, когда создатели таблицы сравнили большое количество согласованных топологий с наблюдаемыми структурами, они обнаружили, что около 92% известных структур белковых комплексов были совместимы с их моделью.
«Несмотря на свою сильную предсказательную силу, основная модель периодической таблицы не учитывает около 8% известных структур белковых комплексов», — признали авторы. «Более половины этих исключений возникает в результате ошибок присваивания четвертичной структуры.
«Преимущество этого подхода состоит в том, что он подчеркивает вероятные несоответствия четвертичной структуры, в частности, путем выявления небиективных комплексов с четной стехиометрией субъединиц. Однако остается около 4% известных структур, которые верны, но не совместимы с периодической таблицей.Авторы добавили, что исключения из их модели интересны сами по себе и являются предметом текущих исследований.
Биологическая структура и функция возникают в результате масштабирования неконтролируемого обучения до 250 миллионов белковых последовательностей
Значимость
Изучение биологических свойств на основе данных последовательностей является логическим шагом на пути к генеративному и предсказательному искусственному интеллекту для биологии.Здесь мы предлагаем масштабировать модель глубокого контекстного языка с обучением без учителя до последовательностей, охватывающих эволюционное разнообразие. Мы обнаружили, что без предварительных знаний в усвоенных представлениях появляется информация о фундаментальных свойствах белков, таких как вторичная структура, контакты и биологическая активность. Мы показываем, что выученные представления полезны в тестах для удаленного обнаружения гомологии, предсказания вторичной структуры, дальнодействующих контактов остаток-остаток и мутационного эффекта.Обучение неконтролируемому представлению обеспечивает ультрасовременное контролируемое предсказание мутационного эффекта и вторичной структуры и улучшает современные функции для предсказания контактов на большие расстояния.
Abstract
В области искусственного интеллекта сочетание масштаба данных и возможностей модели, обеспечиваемое неконтролируемым обучением, привело к значительным достижениям в обучении представлений и статистической генерации. В науках о жизни ожидаемый рост секвенирования обещает беспрецедентные данные о разнообразии естественных последовательностей.Моделирование белкового языка в масштабе эволюции — логический шаг к предсказательному и генеративному искусственному интеллекту для биологии. С этой целью мы используем обучение без учителя для обучения модели глубокого контекстного языка на 86 миллиардах аминокислот в 250 миллионах белковых последовательностей, охватывающих эволюционное разнообразие. Полученная модель содержит информацию о биологических свойствах в своих представлениях. Представления узнаются только из данных последовательности. Выученное пространство репрезентации имеет многомасштабную организацию, отражающую структуру от уровня биохимических свойств аминокислот до удаленной гомологии белков.Информация о вторичной и третичной структуре закодирована в представлениях и может быть идентифицирована линейными проекциями. Репрезентативное обучение создает функции, которые обобщаются для целого ряда приложений, обеспечивая ультрасовременное контролируемое прогнозирование мутационного эффекта и вторичной структуры и улучшая современные функции для прогнозирования контактов на большие расстояния.
Рост числа белковых последовательностей в общедоступных базах данных на протяжении десятилетий следовал экспоненциальной тенденции, создавая глубокое представление о широте и разнообразии белковых последовательностей на протяжении всей жизни.Эти данные являются многообещающей площадкой для изучения прогнозных и генеративных моделей биологии с использованием искусственного интеллекта. Мы сосредоточимся здесь на том, чтобы подогнать одну модель ко многим различным последовательностям, полученным на разных этапах развития. Соответственно, мы изучаем нейронные сети с высокой пропускной способностью, исследуя, что можно узнать о биологии белков при масштабном моделировании эволюционных данных.
Идея о том, что биологические функции и структура регистрируются в статистике белковых последовательностей, выбранных в ходе эволюции, имеет долгую историю (1–3).Из возможных случайных возмущений последовательности эволюция склоняется к выбору тех, которые согласуются с приспособленностью (4). Ненаблюдаемые переменные, которые определяют приспособленность белка, такие как структура, функция и стабильность, оставляют запись в распределении наблюдаемых природных последовательностей (4).
Раскрытие информации, закодированной в вариациях белковой последовательности, — давняя проблема биологии. Аналогичная проблема в области искусственного интеллекта — понимание естественного языка, где гипотеза распределения утверждает, что семантика слова может быть получена из контекстов, в которых оно появляется (5).
Недавно было показано, что методы, основанные на самоконтроле, форме обучения без учителя, в которой контекст в тексте используется для предсказания пропущенных слов, материализовали представления значения слов, которые могут быть обобщены для задач естественного языка (6⇓⇓– 9). Возможность изучать такие представления значительно улучшается с большими наборами обучающих данных (10, 11).
Последовательности белков являются результатом процесса, сильно отличающегося от естественного языка. Неясно, эффективны ли модели и целевые функции для передачи естественного языка через различия между доменами.Мы исследуем этот вопрос, обучая высокопроизводительные языковые модели Transformer на эволюционных данных. Мы исследуем полученные неконтролируемые представления на наличие биологических принципов организации и информации о внутренних биологических свойствах. Мы находим метрическую структуру в пространстве представлений, которая согласуется с принципами организации на масштабах от физико-химической до отдаленной гомологии. Мы также обнаружили, что вторичная и третичная белковая структура может быть идентифицирована в репрезентациях.Структурные свойства, захваченные изображениями, обобщаются по складкам. Мы применяем представления к ряду задач прогнозирования и обнаруживаем, что они улучшают современные функции приложений.
Предпосылки
Выравнивание и поиск последовательностей — стандартная основа для сравнительного и статистического анализа данных биологических последовательностей (12⇓⇓ – 15). Поиск в больших базах данных, содержащих информацию об эволюционном разнообразии, объединяет связанные последовательности в множественное выравнивание последовательностей (MSA).Внутри семейств последовательностей мутационные паттерны несут информацию о функциональных сайтах, стабильности, третичных контактах, связывании и других свойствах (2-4). Консервативные сайты коррелируют с функциональной и структурной важностью (2). Локальный биохимический и структурный контексты отражаются в предпочтении отдельных классов аминокислот (16). Коваринг-мутации связаны с функцией, третичными контактами и связыванием (4).
Перспектива вывода биологической структуры и функции из эволюционной статистики мотивировала развитие машинного обучения на отдельных семействах последовательностей.Анализ прямого связывания (17⇓ – 19) позволяет вывести ограничения на структуру белка путем подгонки генеративной модели в форме марковского случайного поля (MRF) к последовательностям в MSA белка. Для соответствия MRF были разработаны различные методы (20–23). Этот подход также можно использовать для вывода функциональных ограничений (24, 25), а генеративная картина может быть расширена за счет включения скрытых переменных (26).
В последнее время самоконтроль стал основным направлением в исследованиях искусственного интеллекта.В отличие от контролируемого обучения, которое требует ручного аннотирования каждой точки данных, методы с самоконтролем используют немаркированные наборы данных и, следовательно, могут использовать гораздо большие объемы данных. Самостоятельное обучение использует прокси-задачи для обучения, такие как предсказание следующего слова в предложении с учетом всех предыдущих слов (8, 9, 11, 27, 28) или предсказание слов, которые были замаскированы из их контекста (6, 29).
Увеличение размера набора данных и емкости модели показало улучшения в изученных представлениях.В недавней работе методы самоконтроля, используемые в сочетании с большими данными и моделями с высокой пропускной способностью, дали новые современные результаты, приближающиеся к человеческим возможностям при различных тестах ответов на вопросы и семантических рассуждений (6) и генерации связного естественного текста (11 ).
В этой статье исследуются подходы к языковому моделированию с самоконтролем, которые продемонстрировали современную производительность при решении ряда задач обработки естественного языка, применяя их к данным о белках в форме немеченых аминокислотных последовательностей.Поскольку белковые последовательности используют небольшой словарь из 20 канонических элементов, проблема моделирования больше похожа на модели языка на уровне символов (30, 31), чем на модели на уровне слов. Подобно естественному языку, белковые последовательности также содержат дальнодействующие зависимости, что мотивирует использование архитектур, которые обнаруживают и моделируют удаленный контекст (32).
Масштабирование языковых моделей до 250 миллионов разнообразных белковых последовательностей
Большие базы данных белковых последовательностей содержат разнообразные последовательности, отобранные на протяжении всей жизни.В наших экспериментах мы исследуем наборы данных, содержащие до 250 миллионов последовательностей из базы данных UniParc (33), которая содержит 86 миллиардов аминокислот. Эти данные сопоставимы по размеру с большими текстовыми наборами данных, которые используются для обучения архитектур нейронных сетей высокой емкости на естественном языке (6, 11). Чтобы моделировать данные эволюции с точностью, архитектуры нейронных сетей должны обладать емкостью и индуктивными смещениями, чтобы представлять их широту и разнообразие.
Мы исследуем Transformer (32), который превратился в мощную архитектуру модели общего назначения для изучения представлений и генеративного моделирования, превосходящую по производительности рекуррентные и сверточные архитектуры в настройках естественного языка.Мы используем глубокий преобразователь (6), взяв в качестве входных аминокислотные последовательности символов.
Трансформатор обрабатывает входные данные через серию блоков, которые чередуют самовнимание с соединениями с прямой связью. Самовнимание позволяет сети создавать сложные представления, включающие контекст из всей последовательности. Поскольку самовнимание явно конструирует попарные взаимодействия между всеми позициями в последовательности, архитектура Transformer напрямую представляет взаимодействия остаток-остаток.
Мы обучаем модели, используя цель моделирования маскированного языка (6). Каждая входная последовательность искажается заменой части аминокислот специальным токеном маски. Сеть обучена предсказывать недостающие токены из поврежденной последовательности: ℒMLM = Ex∼XEM∑i∈M − logp (xi | x / M). [1] Для каждой последовательности x мы выбираем набор индексов M, чтобы замаскировать , заменяя истинный токен в каждом индексе i токеном маски. Для каждого замаскированного токена мы независимо минимизируем отрицательную логарифмическую вероятность истинной аминокислоты xi с учетом замаскированной последовательности x / M в качестве контекста.Интуитивно, чтобы сделать прогноз для замаскированной позиции, модель должна идентифицировать зависимости между замаскированным сайтом и немаскированными частями последовательности.
Оценка языковых моделей.
Мы начинаем с обучения серии Transformers на всех последовательностях в UniParc (33), держа случайную выборку из 1 M последовательностей для проверки. Мы используем эти модели повсюду, чтобы исследовать свойства представлений и информацию, полученную во время предварительного обучения.
Для сравнительной оценки эффективности обобщения различных языковых моделей мы используем UniRef50 (34), кластеризацию UniParc с 50% идентичностью последовательностей.Для оценки случайным образом отбирается удерживаемый набор из 10% кластеров UniRef50. Набор данных оценки состоит из репрезентативных последовательностей этих кластеров. Все последовательности, принадлежащие удерживаемым кластерам, удаляются из наборов данных для предварительного обучения.
Мы исследуем влияние лежащего в основе разнообразия последовательностей в данных до обучения. Кластеризация UniParc показывает степенное распределение размеров кластеров (35), подразумевая, что большинство последовательностей принадлежит небольшой части кластеров.Обучение с использованием кластеризации последовательностей приводит к переназначению потерь при моделировании замаскированного языка в сторону более разнообразного набора последовательностей. Мы используем UniRef (34) для создания трех наборов данных для предварительного обучения с разными уровнями разнообразия: 1) набор данных с низким разнообразием (UR100) использует репрезентативные последовательности UniRef100, 2) набор разреженных данных с высоким разнообразием (UR50 / S) использует репрезентативный UniRef50. последовательности, и 3) набор данных с большим разнообразием и плотностью (UR50 / D) равномерно отбирает последовательности UniRef100 по кластерам UniRef50.
В Таблице 1 представлены характеристики моделирования на удерживаемых последовательностях UniRef50 в серии экспериментов, исследующих различные классы моделей, количество параметров и наборы данных для предварительного обучения. Модели сравниваются с использованием показателя экспоненциальной кросс-энтропии (ECE), который представляет собой экспоненту потерь модели, усредненных на один токен. В случае трансформатора это 2ℒMLM. ECE описывает среднюю неопределенность модели среди своего набора опций для каждого прогноза: от одного для идеальной модели до 25 (количество уникальных токенов аминокислот в данных) для полностью случайного прогноза.Чтобы измерить сложность обобщения оценочного набора, мы обучаем серию моделей n -грамм в диапазоне длин контекста и настроек сглаживания Лапласа на UR50 / S. Лучшая модель n -грамм имеет ECE 17,18 с размером контекста четыре.
Таблица 1.Оценка языковых моделей для обобщения на удерживаемые кластеры UniRef50
В качестве базового уровня мы обучаем двунаправленные языковые модели рекуррентной долгосрочной краткосрочной памяти (LSTM) (9), которые являются современным уровнем для рекуррентных моделей в текстовом домене.В отличие от стандартных LSTM с авторегрессией слева направо, эти модели используют весь контекст последовательности, что делает их сопоставимыми с изучаемыми нами трансформаторами. Мы оцениваем малую модель с ~ 25 M параметров и большую модель с ~ 113 M параметрами. Обученные на наборе данных UR50 / S, малые и большие модели LSTM имеют ECE 14,4 и 13,5 соответственно.
Мы также обучаем два небольших трансформатора, 12-слойный (параметры 85,1 M) и шестислойный трансформатор (параметры 42,6 M) в наборе данных UR50 / S. Обе модели Transformer имеют лучшие значения ECE (10.45 и 11.79 соответственно), чем малая и большая модель LSTM, несмотря на то, что большая LSTM имеет больше параметров. Эти результаты показывают, что Transformer обеспечивает более точное моделирование белковых последовательностей для сопоставимого числа параметров.
Мы обучаем высокопроизводительные 34-слойные трансформаторы (примерно 670 M параметров) на трех наборах данных с разным разнообразием. Модель Transformer с высокой пропускной способностью, обученная на наборе данных UR50 / S, превосходит модели Transformers меньшего размера, что указывает на улучшение языкового моделирования с увеличением емкости модели.Трансформаторы, обученные на двух наборах данных с большим разнообразием, UR50 / S и UR50 / D, улучшают обобщение по набору данных с низким разнообразием UR100. Лучший трансформер, обученный на самом разнообразном и плотном наборе данных, достигает ECE 8,46, что означает, что интуитивно модель выбирает среди ~ 8,46 аминокислот для каждого прогноза.
Мы также обучаем серию 34-уровневых моделей трансформаторов на 0,1, 1 и 10% набора данных UR50 / S, видя ожидаемую взаимосвязь между увеличением данных и улучшенной производительностью обобщения.Недостаточное соответствие наблюдается даже для самых крупных моделей, обученных на 100% UR50 / S, что указывает на потенциал для дополнительных улучшений с моделями с более высокой производительностью.
Трансформатор ЭСМ-1б.
Наконец, мы выполняем систематическую оптимизацию гиперпараметров модели на 100 M параметрических моделях, чтобы определить надежный набор гиперпараметров. Поиск гиперпараметров подробно описан в SI Приложение , раздел B. Мы масштабируем гиперпараметры, идентифицированные этим поиском, для обучения модели с ~ 650 M параметрами (33 уровня) в наборе данных UR50 / S, в результате чего получаем ESM-1b. Трансформатор.
Мультимасштабная организация в представлениях последовательностей
На вариацию, наблюдаемую в больших наборах данных последовательностей белков, влияют процессы во многих масштабах, включая свойства, которые напрямую влияют на приспособленность, такие как активность, стабильность, структура, связывание и другие свойства при выборе (25, 36), а также вклады филогенетических ошибок (37), экспериментальных ошибок и ошибок отбора (38, 39) и источников шума, таких как случайный генетический дрейф (40).
Обучение без учителя может кодировать лежащие в основе факторы, которые, хотя и не наблюдаются, полезны для объяснения вариаций в последовательностях, наблюдаемых моделью во время предварительного обучения.Мы исследуем репрезентативное пространство сети на нескольких уровнях от биохимической до эволюционной гомологии, чтобы искать признаки биологической организации.
Нейронные сети содержат индуктивные смещения, которые придают структуру представлениям. Случайно инициализированные сети могут создавать функции, которые хорошо работают без какого-либо обучения (41). Чтобы понять, как процесс обучения формирует представления, необходимо сравнить представления до и после их обучения.Кроме того, в самих данных последовательностей ожидается базовый уровень внутренней организации в результате систематических ошибок в аминокислотном составе. Чтобы разобраться в роли частотного смещения в данных, мы также сравниваем с базовым уровнем, который отображает каждую последовательность в вектор нормализованного количества аминокислот.
Обучение кодирует биохимические свойства.
Нейронная сеть Transformer представляет идентичность каждой аминокислоты во входных и выходных вложениях. Входные вложения проецируют входные токены аминокислот в первый блок Transformer.Выходные вложения проецируют окончательные скрытые представления обратно в логарифмические вероятности. Взаимозаменяемость аминокислот в рамках данного структурного или функционального контекста в белке зависит от их биохимических свойств (36). Можно ожидать, что самоконтроль уловит эти закономерности для построения пространства репрезентации, отражающего биохимические знания.
Чтобы выяснить, научилась ли сеть кодировать физико-химические свойства в своих представлениях, мы проецируем весовую матрицу последнего слоя встраивания сети в два измерения с t-распределенным стохастическим встраиванием соседей (t-SNE) (42).На рис. 1 структура встраиваемого пространства отражает биохимическую взаимозаменяемость с четкой кластеризацией гидрофобных и полярных остатков, ароматических аминокислот и организацией по молекулярной массе и заряду.
Рис. 1.Биохимические свойства аминокислот представлены в выходных вложениях модели Transformer, визуализированных здесь с помощью t-SNE. Благодаря неконтролируемому обучению остатки группируются в гидрофобные, полярные и ароматические группы и отражают общую организацию по молекулярной массе и заряду.Визуализация 36-слойного Трансформера, обученного на UniParc.
Биологические вариации закодированы в репрезентативном пространстве.
Каждый белок может быть представлен как отдельный вектор путем усреднения по скрытому представлению в каждой позиции в его последовательности. Вложения белков представляют последовательности как точки в многомерном пространстве. Каждая последовательность представлена в виде одной точки, а последовательности, назначенные сетью аналогичным представлениям, отображаются на близлежащие точки. Мы исследуем, как гомологичные гены представлены в этом пространстве.
Структура и функция ортологичных генов, вероятно, сохранятся, несмотря на расхождение их последовательностей (43). На рис. 2 A мы находим, что обучение формирует пространство представления так, что ортологичные гены группируются. Рис. 2 A показывает двумерную проекцию пространства представления модели с использованием t-SNE. До обучения организация ортологичных белков в пространстве представления модели является диффузной. Ортологические гены группируются в заученном репрезентативном пространстве.
Рис. 2.Представления последовательности белка кодируют и организуют биологические вариации. ( A ) Каждая точка представляет ген, и каждый ген окрашен в соответствии с ортологической группой, к которой он принадлежит (размерность уменьшается на t-SNE). Ортологические группы генов плотно сгруппированы в обученном пространстве репрезентации. Напротив, необученное репрезентативное пространство и униграммы не отражают сильную организацию эволюционными отношениями. ( B ) Гены, соответствующие общей биологической вариации, связаны линейно в обученном пространстве репрезентации.Гены окрашены в соответствии с их ортологической группой, а их виды обозначены меткой символа. PCA восстанавливает ось вида (горизонтальную) и ось ортологии (вертикальную) в обученном пространстве репрезентации, но не в нетренированном пространстве или пространстве униграммы. Представления взяты из 36-слойной модели Transformer, обученной на UniParc.
Мы исследуем, кодирует ли обучение без учителя биологические вариации в структуре пространства представления. Мы применяем анализ главных компонентов (PCA) для определения основных направлений вариации в репрезентациях, выбирая четыре ортологичных гена у четырех видов для поиска направлений вариации.Рис. 2 B показывает, что уменьшение линейной размерности восстанавливает виды и ортологию в качестве основных осей вариации в пространстве представления после обучения. Эта форма структуры отсутствует в представлениях до тренировки.
Чтобы количественно исследовать структуру пространства представления, мы оцениваем восстановление ближайшего соседа с помощью запросов на подобие векторов. Если биологические свойства кодируются в независимых направлениях в пространстве представления, то белки, соответствующие уникальной биологической вариации, связаны линейной векторной арифметикой.В приложении SI , рис. S1 мы обнаруживаем, что обучение улучшает восстановление целевых белков при запросах, закодированных как линейные преобразования по осям видов или генов.
Обучение кодирует удаленную гомологию.
Удаленно гомологичные белки имеют структурное сходство, несмотря на расхождение их последовательностей. Если структурная гомология закодирована в метрической структуре пространства представления, то расстояние между белками отражает степень их структурного родства.
Мы исследуем, позволяет ли пространство репрезентации обнаруживать удаленную гомологию на уровне суперсемейства (белки, которые принадлежат к разным семействам, но находятся в одном суперсемействе) и складчатости (белки, которые принадлежат к разным суперсемействам, но имеют одинаковую укладку). Мы создаем набор данных для оценки удаленного обнаружения гомологии с помощью SCOPe (структурная классификация белков — расширенная) (44). Следуя стандартной практике (45), мы исключаем складки, подобные Россманну (c.2 — c.5, c.27 и 28, c.30 и 31) и четырех- или восьмилопастные β-винты (b.66 — b.70).
Неконтролируемый классификатор на расстоянии от запроса измеряет плотность гомологичных белков в окрестности запрашиваемой последовательности. Для каждого домена выполняется запрос на подобие векторов для всех других доменов, ранжируя их по расстоянию до домена запроса. Для оценки на уровне складки любой домен с одинаковой складкой является положительным, любой домен с другой складкой — отрицательным, и домены, принадлежащие к одному и тому же суперсемейству, исключаются.Для оценки на уровне суперсемейства любой домен с одним и тем же суперсемейством является положительным, любой домен с другим суперсемейством — отрицательным, и домены, принадлежащие к тому же семейству, исключаются. Мы указываем площадь под кривой ROC (AUC) для классификатора и Hit-10 (46), что дает вероятность восстановления удаленного гомолога в 10 результатах с наивысшим рейтингом.
Таблица 2 показывает, что запросы вектора ближайшего соседа с использованием представлений могут обнаруживать удаленные гомологи, которые находятся на уровне свертки, с производительностью, аналогичной HHblits (15), современной методике, основанной на скрытой марковской модели (HMM).На уровне суперсемейства, где сходство последовательностей выше, производительность HMM лучше, но вложения Transformer близки. Методы быстрого векторного поиска ближайшего соседа позволяют искать миллиарды последовательностей на предмет сходства с запрашиваемым белком за миллисекунды (47).
Таблица 2.Удаленное обнаружение гомологии
Обучение кодирует выравнивание в пределах семейства белков.
MSA идентифицирует соответствующие сайты в семействе родственных последовательностей (23). Эти соответствия дают картину эволюционной изменчивости на разных участках в семействе последовательностей.Модель получает в качестве входных данных отдельные последовательности и не получает доступа к семейству связанных последовательностей, кроме как через обучение. Мы исследуем, кодируют ли окончательные скрытые представления последовательности информацию о семействе, к которому она принадлежит.
Информация о семействе может появиться в сети посредством присвоения аналогичных представлений позициям в различных последовательностях, которые выровнены в MSA семейства. Используя набор MSA структурно связанных последовательностей в Pfam (48), мы сравниваем распределение косинусных сходств представлений между парами остатков, которые выровнены в семейном MSA, с фоновым распределением косинусных сходств между невыровненными парами остатков.Большая разница между выровненными и невыровненными дистрибутивами подразумевает, что представления используют общие функции для связанных сайтов во всех последовательностях семейства.
Рис. 3 A изображает распределение значений косинусного сходства между выровненными и невыровненными позициями в репрезентативном семействе для обученной модели и базовых линий. Обучение без учителя приводит к заметному сдвигу между распределениями выровненных и невыровненных пар. Фиг. 3 B и C показывают, что эти тенденции сохраняются при ограничениях, что пары остатков (1) имеют одинаковую аминокислотную идентичность или (2) имеют разные аминокислотные идентичности.
Рис. 3.Окончательные представления от обученных моделей неявно выравнивают последовательности. Распределения косинусного сходства изображены для окончательных представлений остатков из последовательностей в семействе Pfam PF01010. Различия между выровненным (темно-синий) и невыровненным (светло-синий) распределениями подразумевают, что обученные представления Transformer являются мощным дискриминатором между выровненными и невыровненными позициями в последовательностях. Напротив, представления до обучения не разделяют выровненные (темно-красный) и невыровненные позиции (светло-красный).( A ) Общее распределение; распределение при ограничении, что пары остатков имеют ( B ) одинаковую аминокислотную идентичность; или ( C ) разные аминокислотные идентичности. AUC для 128 семейств Pfam указаны в приложении SI, таблица S1.
Мы оцениваем различия между выровненными и невыровненными распределениями по 128 семействам Pfam, используя AUC в качестве показателя различительной способности между выровненными и невыровненными парами. SI Приложение , таблица S1 показывает количественное улучшение средней AUC после неконтролируемого обучения, подтверждая идею о том, что самоконтроль кодирует информацию о MSA последовательности в ее представление последовательности.
Прогнозирование вторичной структуры и третичных контактов
Есть основания полагать, что неконтролируемое обучение приведет к тому, что представления модели будут содержать структурную информацию. Основная структура белка — это скрытая переменная, которая влияет на паттерны, наблюдаемые в данных последовательности. Например, локальная вариация последовательности зависит от вторичной структуры (16), а третичная структура вводит зависимости более высокого порядка в выборе аминокислот в разных сайтах внутри белка (49, 50).Хотя модель не может наблюдать структуру белка напрямую, она наблюдает закономерности в последовательностях обучающих данных, которые определяются структурой. В принципе, сеть может сжимать вариации последовательности, фиксируя общность структурных элементов данных, тем самым кодируя структурную информацию в представлениях.
Линейные проекции.
Мы начинаем с идентификации информации о структуре белка, которая линейно кодируется в представлениях.Использование линейных проекций гарантирует, что информация исходит из представлений Transformer, что позволяет напрямую проверять структурное содержание представлений. Сравнивая представления Трансформера до и после предварительного обучения, мы можем идентифицировать информацию, которая появляется в результате обучения без учителя.
Мы проводим пятикратный эксперимент с перекрестной проверкой, чтобы изучить обобщение структурной информации на уровне семьи, суперсемейства и складки.Для каждого из трех уровней мы построили набор данных из 15 297 белковых структур, используя базу данных SCOPe. Мы разделяем структуры на пять частей, разбивая их по семействам, суперсемействам и складываем соответственно. Пятикратная перекрестная проверка выполняется независимо для каждого из уровней структурной устойчивости.
Чтобы обнаружить информацию о вторичной структуре, мы подгоняем логистическую регрессию к скрытым представлениям, используя метки вторичной структуры с восемью классами. Чтобы обнаружить информацию о третичной структуре, мы подгоняли две отдельные линейные проекции к скрытым представлениям пар позиций в последовательности, взяв их скалярное произведение для регрессии бинарной переменной, указывающей, находятся ли позиции в контакте в трехмерной структуре белка.Нейронные представления сравниваются с 1) проекциями профиля последовательности и 2) неконтролируемыми контактами, предсказанными реализацией CCMpred (51) анализа прямой связи. MSA для базовых показателей генерируются из базы данных UniClust30 (52) с использованием трех итераций поиска HHblits. Для вторичной структуры мы сообщаем о восьми классах точности. Для контактной точности мы сообщаем о максимальной L-дальнодействующей точности, то есть о точности прогнозов наивысшего ранга L (длины белка) для контактов с разделением последовательностей не менее 24 остатков.
В таблице 3 показаны результаты экспериментов по перекрестной проверке. Перед предварительным обучением можно обнаружить минимальную информацию о вторичной структуре и контактах. После предварительного обучения проекции восстанавливают информацию о вторичной структуре и дальних контактах, которая распространяется на семьи, суперсемейства и складки. Распределения точности прогноза вторичной структуры с восемью классами ( SI, приложение , рис. S2) и распределения точности top-L для прогнозирования контакта на большие расстояния ( SI, приложение , рис.S3) демонстрируют, что предварительное обучение приводит к увеличению структурной информации по всему распределению тестовых доменов. Таблица 3 показывает, что проекции представлений Transformer восстанавливают больше структуры, чем проекции профиля последовательности. Для контактов на большие расстояния проекции лучших моделей трансформаторов имеют более высокую точность, чем контакты, предсказанные CCMpred на всех уровнях структурного обобщения. По мере того, как уровень структурного разделения становится более удаленным, вторичная структура мало деградирует, при этом производительность на уровне семейства аналогична уровню складки.Для долгосрочных контактов, хотя обобщение снижено на кратном уровне по сравнению с семейным уровнем, лучшие модели по-прежнему отражают больше структуры, чем неконтролируемый базовый уровень. Обучение с более разнообразными последовательностями (наборы данных UR50) улучшает обучение как вторичной структуре, так и дальнодействующим контактам, с более выраженным эффектом на дальние контакты.
Таблица 3.Линейные проекции
На рис. 4 показаны трехклассовые проекции вторичной структуры для двух доменов, принадлежащих вытянутым складкам.Перед предварительным обучением проекции дают бессвязное предсказание вторичной структуры. После предварительного обучения проекции восстанавливают когерентное предсказание с большинством ошибок, возникающих на границах областей вторичной структуры. На рис. 5 сравнивается прогнозируемая карта контактов с прогнозами CCMpred. Выступы трансформатора восстанавливают сложные схемы контактов, в том числе дальние контакты. Дальнейшие визуализации предполагаемых контактов для восьми случайно выбранных тестовых белков показаны в приложении SI , рис.S7.
Рис. 4.Вторичная структура (линейные проекции). Примеры прогнозов для удерживаемых складок. Неконтролируемое предварительное обучение кодирует вторичную структуру в представления. После предварительного обучения линейные проекции восстанавливают вторичную структуру (левый столбец). Без предварительного обучения восстанавливается мало информации (правый столбец). ( A ) d1nt4a_ Фосфоглицерат-мутазоподобная складка; ( B ) d3wr7a_ Ацил-КоА N-ацилтрансферазы складываются. Цвета указывают на класс вторичной структуры, определяемый выступом: спираль (красный), нить (зеленый) и спираль (синий).Интенсивность цвета указывает на уверенность. Используются изображения от Трансформатора ESM-1b.
Рис. 5.Контакты остаток – остаток (линейные выступы). ( Слева, ) Предсказания Top-L для примера d1n3ya_ с сохраненным уровнем свёртки с vWA-подобной свёрткой. Истинные срабатывания отображаются синим цветом, ложные срабатывания — красным, накладываются на карту наземных контактов серым цветом. ESM-1b Трансформаторные проекции под диагональю, прогнозы CCMpred над диагональю. ( Справа ) Распределение точности (верхний L, дальний), сравнивающее проекции ESM-1b с CCMpred по всем доменам в пяти тестовых разделах со структурным сопротивлением на уровне сгиба.Визуализированный домен отмечен знаком ×.
Глубокая нейронная сеть.
Мы обучаем глубокие нейронные сети предсказывать вторичную структуру и контакты из представлений. Мы выбираем современные нейронные архитектуры для решения обеих задач. Эти нисходящие модели обучаются с контролируемой потерей, чтобы предсказать либо вторичную структуру, либо карту контактов на основе предварительно обученных представлений. Архитектура нисходящей модели остается неизменной для экспериментов с разными представлениями и базовыми линиями, чтобы можно было проводить сравнение.
Для прогнозирования вторичной структуры мы заменяем линейный слой глубокой нейронной сетью, используя архитектуру модели, введенную методом NetSurf (53). Для третичной структуры мы прогнозируем двоичную карту контактов на основе скрытого представления последовательности. Мы используем расширенную сверточную остаточную сеть, аналогичную современным методам предсказания третичной структуры (54–56).
В таблице 4 сравниваются представления для прогнозирования вторичной структуры. Мы оцениваем модели на тестовом наборе CB513 (57) и доменах CASP13 (58).Для сравнения мы также повторно реализовали метод NetSurf. Модели обучаются на наборе обучающих данных NetSurf, который применяет 25% -ное удержание идентичности последовательности с CB513 и временное удержание с CASP13. Функции Transformer сравниваются до и после неконтролируемого предварительного обучения с функциями из базовых показателей LSTM. Их также сравнивают с профилями HMM, используемыми NetSurf. Лучшие характеристики Transformer (71,6%) соответствуют характеристикам профилей HMM (71,2%) и превышают опубликованные характеристики RaptorX (70.6%) в том же тесте (53), подразумевая, что модели белкового языка могут создавать характеристики, которые напрямую конкурируют с профилями последовательностей для предсказания вторичной структуры.
Таблица 4.Восьмиклассная точность прогнозирования вторичной структуры на тестовых наборах CB513 и CASP13
В таблице 5 показаны характеристики различных представлений для прогнозирования дальних контактов верхнего L на панели тестов с использованием набора поездов RaptorX ( 59). Для сравнения мы обучаем ту же архитектуру, используя возможности RaptorX (54, 59).Тестовые наборы Test (59) и CASP11 (60) оцениваются с удержанием идентичности последовательности на уровне 25%, тестовый набор CASP12 (61) реализует временное удержание со структурными обучающими данными, а эксперимент CASP13 (58) реализует полное временное удержание как предтренировочных, так и обучающих данных. Что касается прогнозирования контактов, то лучшие функции обучения представлению не обеспечивают сопоставимой производительности с современными функциями RaptorX (50,2 против 59,4, соответственно, на тестовом наборе RaptorX).
Таблица 5.Top-L, точность контакта на больших расстояниях.
В тестах вторичных структур трансформаторные представления дают более высокую точность, чем базовые линии LSTM с сопоставимым количеством параметров. Для предсказания контактов представления Transformer обеспечивают более высокую точность, чем LSTM, при этом даже самые маленькие представления Transformer превосходят LSTM с большим количеством параметров. Разнообразие данных предварительного обучения также оказывает сильное влияние, поскольку наборы данных с большим разнообразием обеспечивают значительные улучшения по сравнению с наборами данных с низким разнообразием.Относительная производительность представлений одинакова для всех четырех тестов контактов с использованием различных методологий удержания.
Связь между языковым моделированием и структурным обучением.
Чтобы исследовать взаимосвязь между целью языкового моделирования и информацией о структуре в модели, подбираются линейные проекции для вторичной структуры и контактов с использованием представлений из моделей Transformer, взятых из контрольных точек на траекториях их предварительного обучения.Мы используем трансформаторы, обученные на UR50 / S. Мы подбираем прогнозы и оцениваем с разделением поездов и тестов, реализованным с помощью первого раздела набора данных структурных удержаний на уровне свертки. Для каждой модели на рис. 6 показана линейная взаимосвязь между целью языкового моделирования и информацией о структуре, которая сохраняется в ходе предварительного обучения. Линейная посадка близка к идеальной как для вторичной структуры, так и для контактов. Аналогичный эксперимент также проводится для вторичной структуры с глубокой нейронной сетью вместо линейной проекции с использованием обучающих последовательностей NetSurf и набора тестов CB513.Линейная взаимосвязь между точностью вторичной структуры и ECE моделирования языка также наблюдается для головы глубинного прогнозирования ( SI Приложение , рис. S4). Таким образом, для данной модели и набора данных для предварительного обучения точность языкового моделирования, измеренная с помощью ECE, является хорошим показателем структурного содержания представлений. Поскольку производительность задачи языкового моделирования повышается с увеличением емкости модели, это предполагает, что дальнейшее масштабирование может улучшить результаты задач прогнозирования структуры.
Фиг.6.Взаимосвязь между целью языкового моделирования и структурой обучения. Восьмиклассная точность прогнозирования вторичной структуры ( слева, ) и точность прогнозирования контактов на верхнем уровне L ( справа, ) как функция предварительного обучения ECE. Производительность оценивается по вытянутым складкам. Линейные проекции подбираются с использованием контрольных точек модели в ходе предварительного обучения на UR50 / S. Линейная взаимосвязь для каждой модели указывает на то, что для данной модели и набора данных предварительного обучения язык моделирования ECE является хорошим показателем структурного содержания представлений.Улучшение ECE модели приводит к увеличению информации о структуре. Это устанавливает связь между целью языкового моделирования и структурным обучением без учителя.
Предварительная подготовка для одного или нескольких семей.
Мы сравниваем тренировки по эволюционной статистике с тренировками по отдельным семействам белков. Мы предварительно обучаем отдельные 12-слойные модели трансформера на множественном выравнивании последовательностей Pfam трех наиболее распространенных в природе доменов длиной более 100 аминокислот: АТФ-связывающего домена АТФ-связывающих кассетных транспортеров, домена протеинкиназы и регулятора ответа. домен-получатель.Мы проверяем способность моделей, обученных на одном семействе белков, обобщать информацию о вторичной структуре внутри семейства и вне его, оценивая последовательности с наземными метками истинности из семейства, на котором была обучена модель, или из альтернативных семейств. Модели оцениваются с использованием линейных проекций. Во всех случаях модель, обученная на последовательностях внутри семейства, имеет более высокую точность, чем модели, обученные на последовательностях вне семейства ( SI, приложение , таблица S2), что указывает на плохую обобщенность при обучении на отдельных семействах MSA.Что еще более важно, модель, обученная для всего разнообразия последовательностей UniParc, имеет более высокую точность, чем точность модели для одного семейства, даже на одном наборе оценочных данных для одного семейства. Это говорит о том, что представления, полученные из полного набора данных, обобщают информацию о вторичной структуре, изученной вне семейства последовательностей.
Комбинация функций
Функции, обнаруженные с помощью неконтролируемого моделирования языка белков, могут быть объединены с современными функциями для их дальнейшего улучшения.Современные методы используют информацию, полученную из MSA. Мы объединяем эту информацию с характеристиками модели Transformer.
Мы исследуем три подхода для включения информации из обучения репрезентации. Для каждой входной последовательности x: 1) direct использует окончательное скрытое представление непосредственно из преобразователя, 2) avg берет среднее значение окончательного скрытого представления в каждой позиции по последовательностям из MSA x, и 3) cov создает признаки для каждой пары позиций, используя нецентрированную ковариацию по последовательностям из MSA x после уменьшения размерности окончательных скрытых представлений с помощью PCA.Обратите внимание, что direct и avg создают признаки для каждой позиции по x, а cov создают признаки для каждой пары позиций.
Вторичная структура.
Современные методы предсказания вторичной структуры обладают высокой точностью для задачи предсказания восьми классов. Мы исследуем, можно ли улучшить производительность, объединив функции Transformer с профилями последовательности. Таблица 6 показывает, что объединение представлений с профилями дополнительно повышает точность, что приводит к современным характеристикам прогнозирования вторичной структуры.
Таблица 6.Комбинация функций (прогнозирование вторичной структуры)
Мы устанавливаем базовый уровень производительности, повторно внедряя методику Klausen et al. (53) с использованием тех же функций, что дало точность 71,2% (по сравнению с опубликованными характеристиками 72,1%) на испытательном наборе CB513. Затем мы добавляем функции Transformer, используя методы комбинации direct и avg ; они обеспечивают абсолютное улучшение точности на 0,9 и 2,5% соответственно. Это говорит о том, что функции Transformer содержат информацию, отсутствующую в функциях, производных от MSA.
Контакты остаток – остаток.
Глубокие нейронные сети сделали возможным недавний прорыв в предсказании белковых контактов и третичной структуры (54, 56). Современные нейронные сети для третичной структуры и предсказания контактов используют глубокие остаточные архитектуры с двумерными свертками над попарными картами признаков для вывода предсказания контакта или потенциала расстояния для каждой пары остатков (54, 56, 59).
В самых современных методах используются различные входные функции, наборы обучающих данных и контрольные сигналы.Чтобы провести контролируемое сравнение, мы исправляем стандартную архитектуру, обучающий набор данных, несколько выравниваний последовательностей и набор базовых входных функций для всех экспериментов, к которым мы добавляем предварительно обученные функции из модели Transformer. Для базовых функций мы используем набор функций RaptorX, который включает в себя оценочную матрицу для конкретной позиции (PSSM), прогнозирование вторичной структуры с тремя состояниями, однократное встраивание последовательности, соединения модели Поттса с корректировкой среднего продукта, взаимную информацию, попарный контакт. потенциал и прогнозируемая доступность.RaptorX был лучшим методом предсказания контактов в соревнованиях CASP12 и CASP13 (54). Наборы для обучения и оценки такие же, как и в предыдущем разделе.
Таблица 7 показывает, что добавление функций трансформатора из 34-уровневой модели, обученной на UR50 / S, последовательно приводит к улучшению во всех тестовых наборах. В таблице показаны значения максимальной точности с большой точностью, указывающие среднее значение и стандартное отклонение по пяти различным модельным семенам. Direct дает небольшое улучшение по сравнению с некоторыми тестовыми наборами. Avg лучше прямого, а cov обеспечивает дополнительный выигрыш. Например, cov дает абсолютное улучшение на 3,9% на тестовом наборе RaptorX и на 1,8% улучшение на тестовом наборе CASP13, оцененном с временными задержками как для точной настройки, так и для данных предварительного обучения. Дополнительные результаты и показатели для прогнозирования контактов приведены в приложении SI , таблица S3.
Таблица 7.Комбинация признаков (предсказание контакта)
Прогнозирование мутационных эффектов
Пейзаж мутационной пригодности обеспечивает глубокое понимание биологии.Сочетание секвенирования следующего поколения с экраном мутагенеза позволяет параллельно считывать десятки тысяч вариантов одного белка (62). Детализация и охват этих экспериментов дает представление о ландшафте мутационной пригодности отдельных белков, давая количественные отношения между последовательностью и функцией белка. Мы адаптируем языковую модель белка Transformer для прогнозирования количественного эффекта мутаций.
Во-первых, мы исследуем прогнозирование эффекта внутрибелкового варианта, когда ограниченная выборка мутаций используется для прогнозирования эффекта ненаблюдаемых мутаций.Этот параметр полезен в приложениях белковой инженерии (63). Мы оцениваем представления на двух наборах данных глубокого мутационного сканирования, используемых новейшими современными методами прогнозирования вариантных эффектов, Envision (64) и DeepSequence (26). В совокупности данные включают более 700 000 измерений эффекта вариантов из более чем 100 крупномасштабных экспериментальных наборов данных по мутагенезу.
Точная настройка трансформатора дает предсказатель мутационных эффектов, сравнимый с результатами Envision.Envision (64) для обобщения полагается на структурные и эволюционные особенности белка. Мы оцениваем, может ли Transformer достичь аналогичных результатов обобщения без прямого доступа к структурным особенностям. Используется та же методология разделения данных для обучения и оценки, что и у Gray et al. (64), чтобы можно было сравнить результаты. Мы используем 34-слойный трансформатор, обученный на UR50 / S. На рис. 7 показано, что точно настроенный трансформатор превосходит Envision по характеристикам на 10 из 12 белков. Для каждого белка доля p = 0.8 данных используются для обучения, а остальные данные используются для тестирования. Мы сообщаем среднее значение и стандартное отклонение для пятикратной перекрестной проверки в приложении SI, приложение , таблица S5. Результаты, изменяющие долю данных, используемых для обучения, представлены в приложении SI , рис. S5.
Рис. 7.Репрезентативное обучение дает возможность современного контролируемого предсказания количественного эффекта мутаций. ( Левый ) Набор данных Envision (65). ( Справа ) Набор данных DeepSequence (26).Представления-преобразователи (34-слойные, UR50 / S) сравниваются с двунаправленной языковой моделью LSTM (большая модель, UR50 / S). Для каждого белка сообщается результат пятикратной перекрестной проверки. Для каждого раздела контролируемая точная настройка выполняется на 80% мутационных данных для белка, а результаты оцениваются на оставшихся 20%. Представления-преобразователи превосходят базовые представления LSTM в обоих наборах данных. Для каждого набора данных также показаны современные методы. Gray et al.(65) — это контролируемый метод, использующий структурные, эволюционные и биохимические особенности, обученный по тому же протоколу, что и для Transformer. Riesselman et al. (26) — это метод обучения без учителя на MSA каждого белка. Среднее и стандартное отклонение по пяти разделам для модели трансформатора и базовой линии LSTM.
Мы также оцениваем, используя ту же методологию пятикратной перекрестной проверки, в экспериментах по глубокому мутационному сканированию, собранных для DeepSequence (26). Точно настроенная модель Transformer превосходит точно настроенные базовые параметры LSTM.Мы не можем сравнивать напрямую, но мы также включаем производительность исходного метода DeepSequence, который является неконтролируемым и представляет собой современное состояние для этого набора данных.
Обобщение на новый ландшафт фитнеса.
Мы анализируем способность трансформера распространяться на фитнес-ландшафт нового белка. Следуя протоколу, представленному в Envision, мы используем анализ исключения по одному: чтобы оценить производительность для данного белка, мы обучаем данные по оставшимся белкам n-1 и тестируем оставшийся белок. SI Приложение , рис. S6 показывает, что предсказания Transformer на основе необработанных последовательностей работают лучше, чем Envision для пяти из девяти задач.
Связанные работы
Одновременно с препринтом этой работы Rives et al. (65), два связанных препринта Alley et al. (66) и Heinzinger et al. (67) также предложили моделирование белкового языка, хотя и в меньшем масштабе. Эти работы вместе с Rao et al. (68), были оценены на различных последующих задачах. Rives et al. (65) впервые предложили моделирование языка белков с помощью Transformers.Alley et al. (66) и Heinzinger et al. (67) обучить LSTM на UniRef50. Рао и др. (68) обучили 12-слойную модель трансформатора (38 M параметров) на Pfam (48). Исходные данные в этой статье сопоставимы с этими моделями. Большие модели трансформаторов, обученные в этой статье, значительно больше, чем в этих связанных работах.
Мы сравниваем результаты с соответствующими работами в таблице 8. Heinzinger et al. (67), Alley et al. (66) и Rao et al. (68) оценивают модели для различных последующих задач и наборов тестов.Мы извлекаем веса для вышеупомянутых моделей, оценивая их непосредственно в нашей кодовой базе по сравнению с панелью наборов тестов, используемых в этой статье для удаленной гомологии, предсказания вторичной структуры и предсказания контактов, с теми же данными обучения и архитектурами моделей. Это позволяет напрямую сравнивать изображения. Таблица 8 показывает, что трансформаторы большой емкости имеют хорошие характеристики для вторичной структуры и предсказания контактов, значительно превосходящие Alley et al. (66), Heinzinger et al.(67) и Rao et al. (68). Небольшие модели трансформаторов, обученные в качестве базовых, также имеют более высокие характеристики, чем методы с сопоставимыми номерами параметров.
Таблица 8.Сравнение с моделями родственного языка белков
Встраивание белковых последовательностей было предметом недавних исследований в области белковой инженерии (69). Беплер и Бергер (70) предварительно обучили LSTM на последовательностях белков, добавив наблюдение со стороны контактов для получения встраивания. После нашего препринта родственные работы основывались на его исследовании моделирования белковых последовательностей, изучении генеративных моделей (71, 72), внутренних представлений трансформеров (73) и приложений обучения репрезентации и генеративного моделирования, таких как классификация (74, 75). , предсказание мутационных эффектов (80) и дизайн последовательностей (76⇓ – 78).
Обсуждение
Одной из целей искусственного интеллекта в биологии могло бы стать создание управляемых прогностических и генеративных моделей, которые могут читать и генерировать биологические данные на своем родном языке. Соответственно, потребуются исследования методов, которые могут изучать внутренние биологические свойства непосредственно из белковых последовательностей, которые могут быть переданы для прогнозирования и генерации.
Мы исследовали глубокое обучение в процессе эволюции в масштабе крупнейших баз данных последовательностей белков, обучая модели контекстного языка на основе 86 миллиардов аминокислот из 250 миллионов последовательностей.Пространство репрезентаций, полученных из последовательностей высокопроизводительными сетями, отражает биологическую структуру на нескольких уровнях, включая уровни аминокислот, белков и эволюционной гомологии. Информация о вторичной и третичной структуре интернализируется и представлена в сети. Знание внутренних биологических свойств возникает без надзора — во время предварительного обучения не подается никакого обучающего сигнала, кроме последовательностей.
Мы обнаружили, что сети, которые были обучены на основе эволюционных данных, обобщают: информацию можно извлекать из представлений с помощью линейных проекций, глубоких нейронных сетей или путем адаптации модели с использованием супервизии.Точная настройка дает результаты, соответствующие современным достижениям в прогнозировании вариантов активности. Прогнозы делаются непосредственно из последовательности с использованием функций, которые были автоматически изучены языковой моделью, а не выбраны знанием предметной области.
Мы обнаружили, что предварительное обучение обнаруживает информацию, которой нет в современных функциях. Изученные функции могут быть объединены с функциями, используемыми современными методами прогнозирования структуры, для улучшения результатов. Эмпирическим путем мы обнаруживаем, что функции, обнаруженные более крупными моделями, лучше работают при выполнении последующих задач.Transformer превосходит LSTM с аналогичной емкостью в тестах. Увеличение разнообразия обучающих данных приводит к значительным улучшениям представлений.
Хотя модели белкового языка, которые мы изучаем, сопоставимы по масштабу с теми, которые используются в текстовой области, наши эксперименты еще не достигли предела масштаба. Мы заметили, что даже модели с самой высокой производительностью, которые мы обучили (с параметрами от ~ 650 до 700 M), не соответствовали наборам данных последовательности из-за недостаточной емкости модели.Связь, которую мы обнаруживаем между точностью языкового моделирования и информацией о структуре, закодированной в представлениях, предполагает, что модели с большей емкостью дадут лучшие представления. Эти результаты предполагают потенциал для дальнейшего масштабирования модели и разнообразия данных, включая последовательности из метагеномики.
Сочетание генеративных моделей высокой производительности с синтезом генов и характеристикой высокой пропускной способности может способствовать генеративной биологии. Обученные нами модели можно использовать для генерации новых последовательностей (79).Если нейронные сети могут передавать знания, полученные из белковых последовательностей, для разработки функциональных белков, это может быть связано с прогнозирующими моделями для совместной генерации и оптимизации последовательностей для желаемых функций. Размер текущих данных о последовательностях и их прогнозируемый рост указывают на возможность генеративной модели общего назначения, которая может конденсировать всю статистику последовательностей, усваивая и интегрируя фундаментальные химические и биологические концепции, включая структуру, функцию, активность, локализацию, связывание и динамику. , чтобы генерировать новые последовательности, которые ранее не встречались в природе, но которые являются биологически активными.
Благодарности
Мы благодарим Тристана Беплера, Ричарда Бонно, Йилун Ду, Владимира Глигориевича, Анику Гупту, Омера Леви, Яна Пейкона, Хетунандана Камисетти, Лоренса ван дер Маатена, Итана Переса, Одеда Регева, Невилла Санджана за отзывы и отзывы о рукописи и содержательных беседах. Мы благодарим Jinbo Xu за то, что он поделился функциями RaptorX и помог с CASP13. Мы благодарим Майкла Клаузена за предоставленный обучающий код NetSurf. А. была поддержана в Нью-Йоркском университете грантом NSF № 1339362.
Сноски
Вклад авторов: A.R., J. Meier, T..S., S.G., Z.L., M.O., C.L.Z., J. Ma, and R.F. спланированное исследование; A.

 Вялотекущая шизофрения
Вялотекущая шизофрения Галлюцинаторный вариант
Галлюцинаторный вариант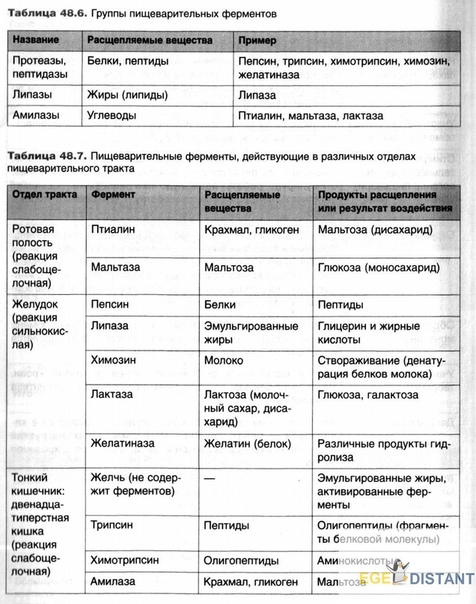 Присутпообразно-
Присутпообразно-