Как определять степень окисления | Решаем химию: вопросы и ответы
Степень окисления и валентность – понятия в чём-то близкие и взаимозаменяемые в ряде ситуаций. Но если валентность всегда положительна (поскольку по определение – способность атомов образовывать то или иное число химических связей. А число связей, очевидно, отрицательным быть не может), то степень окисления может иметь как положительные, так и отрицательные значения. А всё потому, что степень окисления – показывает, каким бы был заряд атома, если бы все электроны, образующие химическую связь сместились к нему (или полностью от него оторвались, сместившись к другому атому).
Фото: pixabay.comФото: pixabay.com
В бинарных соединениях степень окисления найти просто. Нужно помнить два момента:
1. Молекула всегда нейтральна, у неё нет заряда (или же он равен 0), поэтому число отрицательных зарядов равно числу зарядов положительных.
2. Произведения степени окисления атома и индекса, стоящего у атома в молекуле, у обоих составляющих молекулу атомов равны по модулю.
Также стоит запомнить, что
у многих элементов степени окисления почти всегда постоянны. Так, кислород имеет степень окисления -2, водород (очень часто, но не всегда!) и щелочные металлы +1, металлы второй группы +2 и т.д.
Но есть и элементы, которые могут иметь разную степень кисления, например, у серы она может быть -2, +4 или +6.
Для примера определим степени окисления меди в двух оксидах: Cu2O и CuO.
Известно, что у кислорода степень окисления -2. Напомню, что степень окисления указывается справа вверху от элемента. Таким образом, запишем для первого оксида:
Для кислорода произведение степени окисления и индекса -2*1=-2 или по модулю 2. Для меди произведение степени окисления и индекса тоже должно равняться 2. С учётом того, что у меди стоит индекс 2 получаем степень окисления 1. Очевидно, что это +1: поскольку в молекуле уже есть отрицательно заряженная составляющая, другая составляющая должна быть заряжена положительно. Таким образом, в оксиде меди Cu2O степень окисления меди +1.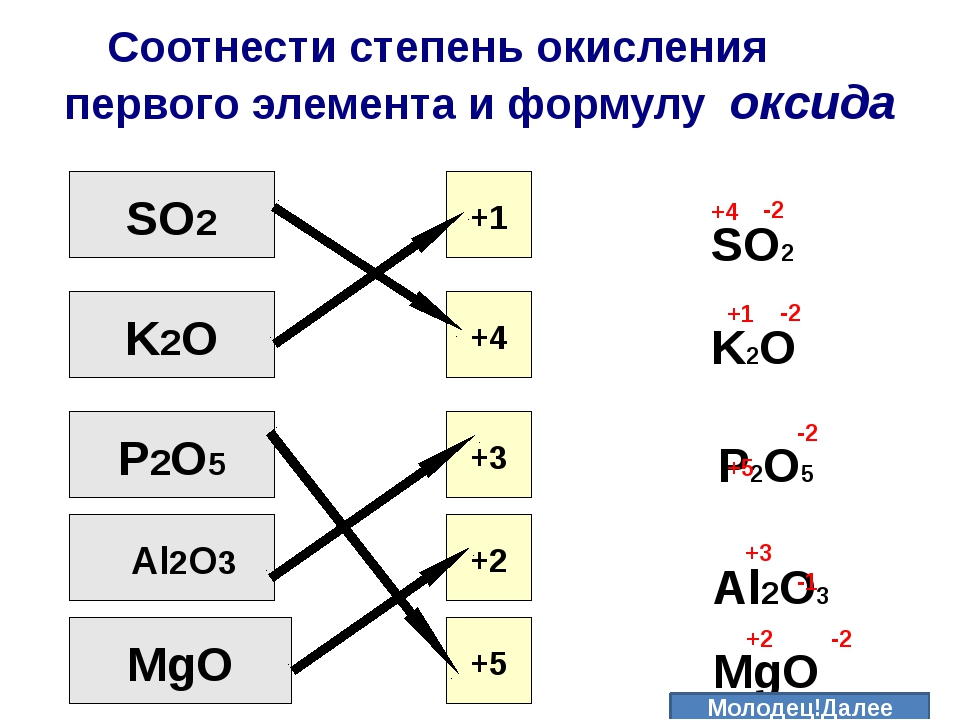
С оксидом CuО дело обстоит ещё проще. Когда в молекуле атомы соединены 1 к 1, то степени окисления у них равны по модулю. Поскольку у кислорода степень окисления -2, то у меди здесь степень окисления +2.
Теперь разберём примеры посложнее и рассмотрим молекулы, состоящие из атомов трёх видов.
Пример 1.
Определите степень окисления серы в серной кислоте.
Серная кислота имеет формулу h3SO4. Чтобы понять, какая степень окисления у серы в этом соединении, нужно помнить, что заряд молекулы всегда равен 0, то есть число отрицательных зарядов всегда равно числу положительных. Теперь посмотрим на формулу и вспомним, что кислород имеет степень окисления -2, водород +1, то есть:
Что отсюда видно? Что пока у нас имеется два положительных заряда, это вклад водорода (+2 мы получаем, умножив степень окисления водорода на индекс: +1*2=+2) и восемь отрицательных, это вклад кислорода (-8 мы получаем, умножив степень окисления кислорода на индекс: -2*4=-8). Но нам нужно, чтобы число положительных зарядов было равно числу отрицательных, только при этом условии заряд молекулы будет 0. Следовательно, недостаёт 6 положительных зарядов. Это и есть степень окисления серы в серной кислоте: +6. То есть можно записать так:
Следовательно, недостаёт 6 положительных зарядов. Это и есть степень окисления серы в серной кислоте: +6. То есть можно записать так:
Пример 2.
Найдём степень окисления азота в азотистой кислоте HNO2.
Рассуждать будет аналогично, исходя из известных степеней окисления (-2 у кислорода и +1 и водорода):
Перемножив степени окисления с индексами, получим, что у нас 1 положительный заряд (от водорода: +1*1=+1) и четыре отрицательных (от кислорода: -2*2=-4). Для общего нулевого заряда молекулы недостаёт трёх положительных зарядов, которые и даст азот. То есть в азотистой кислоте степень окисления азота +3:
Для тренировки попробуйте самостоятельно определить степень окисления хрома в бихромате калия K2CrO4.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.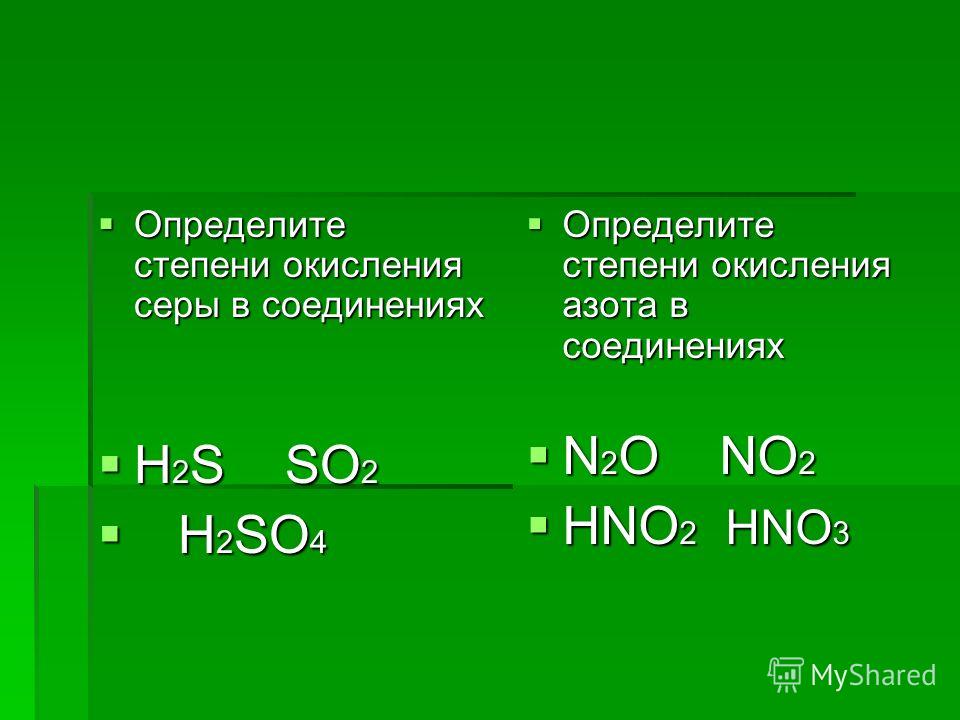
Электроотрицательность. Степень окисления и валентность.
Электроотрицательность
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т. е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
Элементы, проявляющие постоянную СО | Значение постоянной СО этого элемента |
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
Элемент | Степень окисления практически во всех соединениях | Исключения |
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
| Химический элемент | Номер группы | Высшая степень окисления |
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | 0 |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF2). Расставим известные степени окисления:
Обозначим степень окисления серы как x:
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Решим его:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.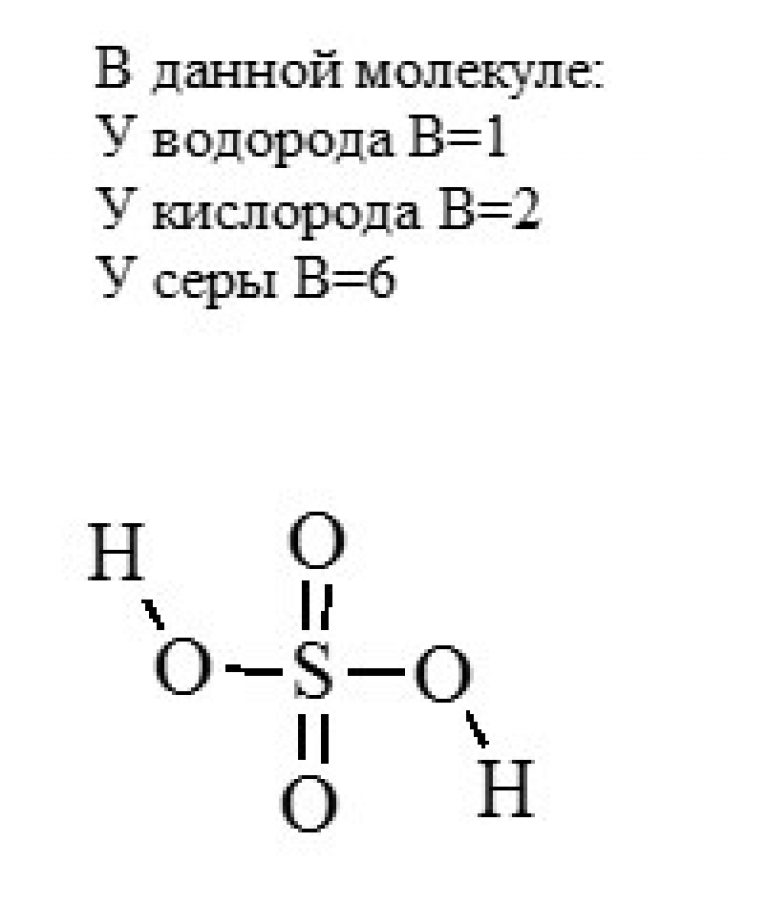
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение. Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы NH4+ (заряд данного катиона можно посмотреть в таблице растворимости). Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH4+ , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH4+ и анионами Cr2O72-.
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x и y:
Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
Как определять степени окисления элементов в органических веществах можно почитать здесь.
Валентность
Валентность — число химических связей, которые образует атом элемента в химическом соединении.
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов
2) неподеленных электронных пар на орбиталях валентных уровней
3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей.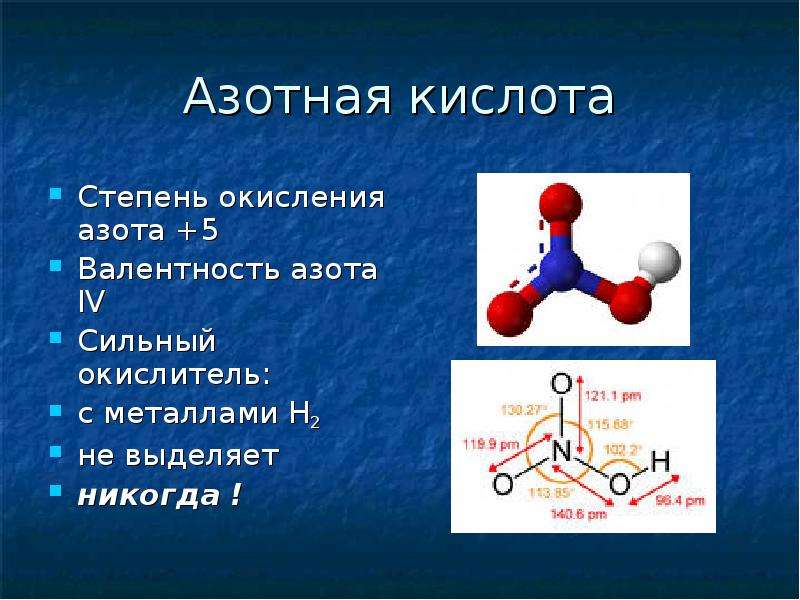 По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
1) Для углерода возможны валентности II, III, IV
2) Наиболее распространенная валентность углерода в соединениях IV
3) В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной ( ) орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная π-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O3, бензола C6H6 и т.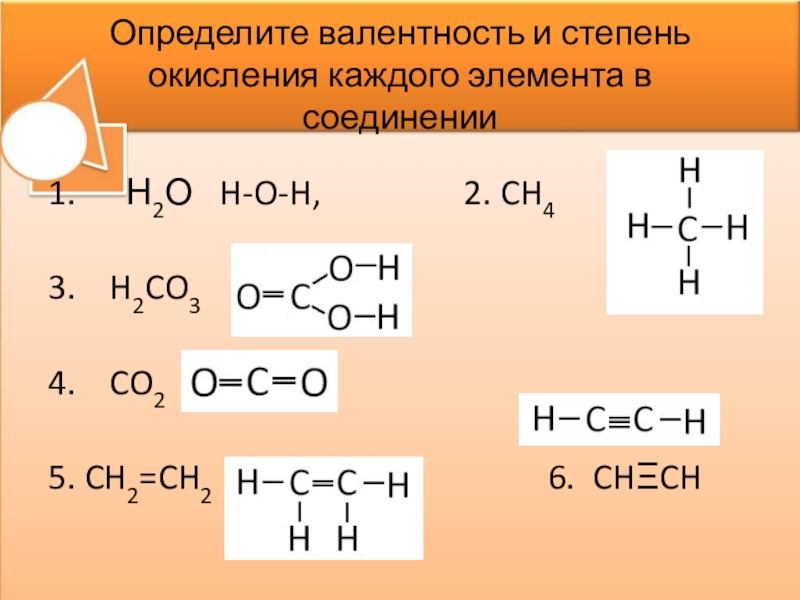 д.
д.
em>Резюмируя информацию по валентным возможностям атома азота:
1) Для азота возможны валентности I, II, III и IV
2) Валентности V у азота не бывает!
3) В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
4) В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония NH4+, азотная кислота и д.р).
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d-подуровень с 5-ю вакантными орбиталями.
В связи с этим он способен переходить в возбужденное состояние, распаривая электроны 3s-орбитали:
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d-подуровня, распаривание электронов s и p-орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Таким образом, кислород практически всегда имеет валентность, равную II, однако в некоторых частицах он трехвалентен, в частности, в молекуле угарного газа C≡O. В случае, когда кислород имеет валентность III, одна из ковалентных связей образована по донорно-акцепторному механизму.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H2S.
Как мы видим, у атома серы на внешнем уровне появляется d-подуровень с вакантными орбиталями.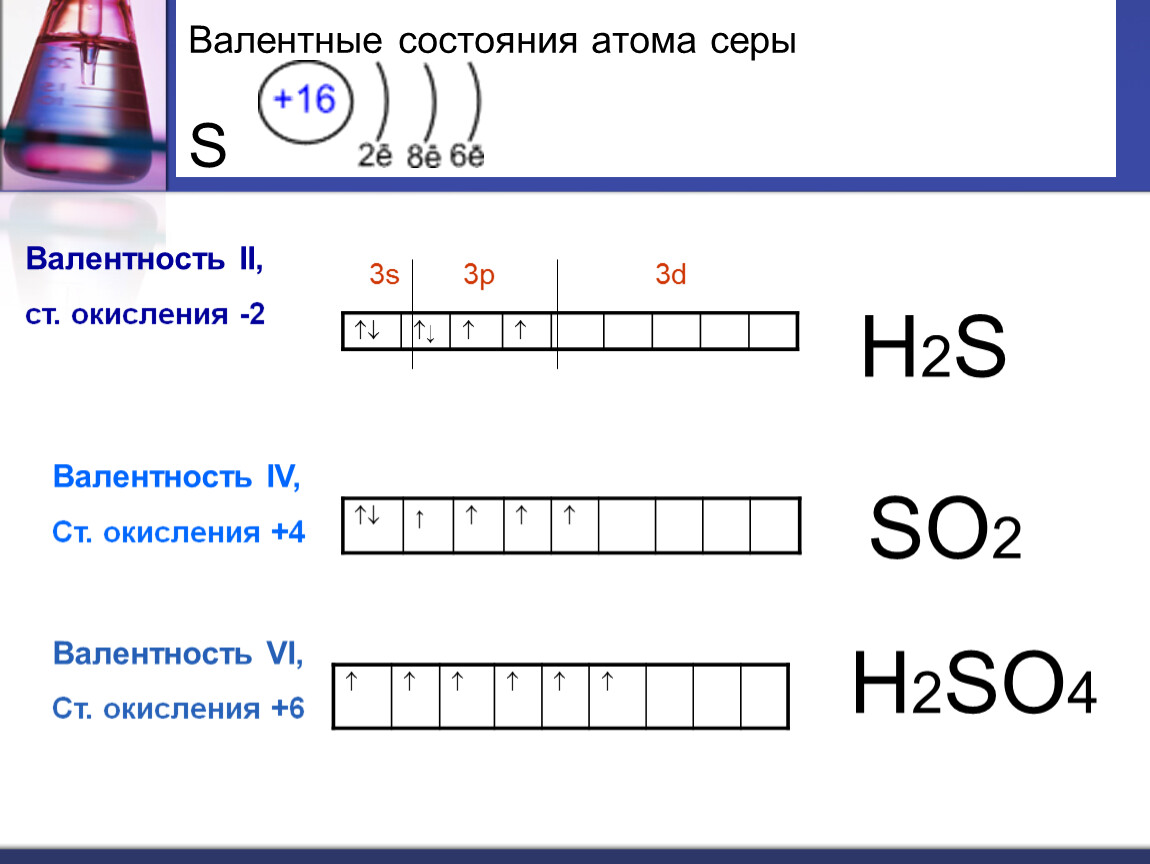 По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO2, SF4, SOCl2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s-подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO3, H2SO4, SO2Cl2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.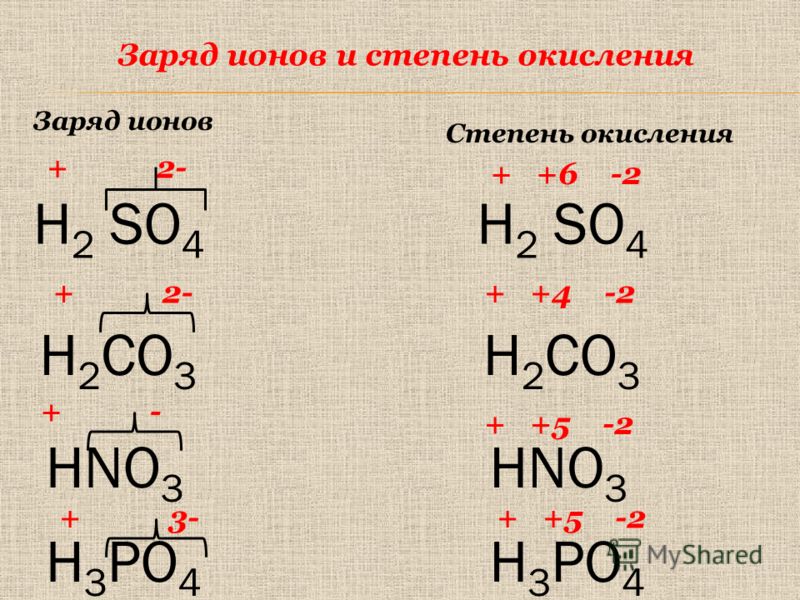
|
А4.
 Валентность. Степени окисления — ХИМИЧИМ!!!
Валентность. Степени окисления — ХИМИЧИМ!!!Немного теории.
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число ковалентных химических связей с атомами других элементов.В образовании ковалентной связи по обменному механизму принимают участие валентные неспаренные электроны атомов. Поэтому валентность, как правило совпадает с числом валентных неспаренных электронов в атоме.
В(Н)=I В(Cl)=I В(C)=IV В(Н)=I В(N)=III В(N)=III
В(O)=II В(O)=II В(O)=II В(Н)=I Если элемент может образовывать разное количество ковалентных связей, то валентности таких элементов традиционно записываются римскими цифрами после названияОксид серы (VI) Оксид серы (IV)
Сте́пень окисле́ния — численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху.
Отрицательное значение степени окисления могут иметь только атомы неметаллов (т.к. они могут принимать электроны для приобретения устойчивого восьми электронного состояния внешнего энергетического уровня). Отрицательная степень окисления (
Положительное значение степени окисления имеют те атомы, которые могут отдавать свои валентные электроны другим атомам (все, кроме фтора). Атомы металлов всегда имеют положительную степень окисления в соединениях. У металлов I-III групп главных подгрупп значение положительной степени окисления всегда равно номеру группы.
Максимальная положительная степень окисления элемента называется высшей степенью окисления. Высшая степень окисления элемента совпадает с номером группы (кроме элементов фтора и кислорода).
Степень окисления указывается сверху над символом элемента.
Значение заряда иона и значение степени окисления совпадают! Но в отличие от указания заряда иона, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот:— степень окисления,
— заряды.
Степень окисления атома в простом веществе равна нулю, например:
Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю:
Значение валентности и степени окисления совпадают в веществах с ковалентной полярной связями, например: оксид серы (VI): СО(S)=+6; СО(О)=-2
Значение валентности и степени окисления не совпадают для веществ и ковалентной неполярной связью и ковалентной полярной связью, образованной по донорно-акцепторному механизму.
Тренажер «Составление названий бинарных соединений»
Тренажер «Степень окисления»
F2, HCL, SO3, h3CO3, h3S, химия
5-9 класс
Krussia51 18 марта 2015 г. , 19:36:51 (6 лет назад) Раиска1702
, 19:36:51 (6 лет назад) Раиска1702F2 валентность,окисление 0 1)H валентность 1,CL валентность 1,окисление CL -1,Н+1 ) S валентность 3,О3 валентность 2,окисление над О3 ставим -2,а над S +6) h3-валентность 1,СО3 валентность 2, H+1,С+4,О-2)h3S валентность 2,степень окисления над H +1 а над S -2)
Olga2000egorova19 марта 2015 г., 1:05:21 (6 лет назад)
Хотя бы первые три
Ответить
Другие вопросы из категории
Seasafge / 16 марта 2015 г., 16:06:17
какие из этих веществ с ионной связью!?NaBr,Al(OH)3,BaO,MnO2,Ba(OH)2,AgNO3,O3,NO2,CaO,h4PO4,CaC2,F2,HBr.
Читайте также
Mechanik / 21 марта 2015 г., 4:05:50
Укажите валентность и степень окисления атомов в молекуле азота (N2).Укажите валентность и степень окисления атомов в молекуле водорода (h3).
Укажите валентность и степень окисления атома кислорода в молекуле воды (h3O).
Укажите валентность и степень окисления атома хлора в молекуле хлороводорода (HCl).
P.S. Если не трудно, изобразите пожалуйста структурную (графическую) формулу этих молекул.
1998vk / 26 дек. 2013 г., 16:26:17
1) допишите уравнения реакций,укажите степени окисления элементов и расставьте коэффициенты методом электронного баланса: Са+О2 ->, N2+h3 ->. 2)определите степень окисления каждого элемента,расставьте коэффициенты методом электронного баланса: KCIO3+S -> KCI+SO2. 3) определите пожалуйста степень окисления серы в следующих соединениях: h3SO4, SO2, h3S, SO2, h3SO3. 4 в сторону атомов какого химического элемента смещаются общие электронные пары в молекулах следующих соединений: h3O, HI, PCI3, h4N, h3S, CO2? дайте пожалуйста обоснованный ответ! 5) скажите, изменяются ли степени окисления атомов при образовании воды из водорода и кислорода? 6) напишите уравнения электролитической диссоциации: нитрата меди, соляной кислоты, сульфата алюминия, гидроксида бария, сульфата цинка.
Вы находитесь на странице вопроса «2) определить валентность и степень окисления элементов в следующих соеденениях: F2, HCL, SO3, h3CO3, h3S«, категории «химия«. Данный вопрос относится к разделу « 5-9» классов. Здесь вы сможете получить ответ, а также обсудить вопрос с посетителями сайта. Автоматический умный поиск поможет найти похожие вопросы в категории «химия«. Если ваш вопрос отличается или ответы не подходят, вы можете задать новый вопрос, воспользовавшись кнопкой в верхней части сайта.
Найдите степень окисления серы в h3SO4 A + 6, класс 11, химия CBSE
Совет : Степень окисления также иногда называют степенью окисления, и это общее количество электронов, которые атом приобретает или теряет для образования химической связи с другим атомом. Полное пошаговое решение :
Есть определенные правила, которые нужно учитывать при вычислении степеней окисления в молекуле.
и. Любой свободный элемент имеет степень окисления, равную нулю.
ii. Для одноатомных ионов степень окисления всегда равна суммарному заряду, соответствующему иону.
iv. Кислород в большинстве своих соединений имеет степень окисления $ — 2 $. Однако, когда он связан в пероксидах, степень окисления, соответствующая кислороду, составляет $ — 1 $.

v. Все щелочные металлы или элементы группы $ 1 $ в своих соединениях имеют степень окисления $ + 1 $.
vi. Все щелочноземельные металлы или элементы группы 2 показывают степень окисления $ + 2 $ в своих соединениях.
vii. В соединениях, состоящих из двух элементов, галоген имеет присвоенную ему степень окисления $ — 1 $.
viii. В случае нейтральных соединений сумма всех степеней окисления составляющих атомов равна нулю.
Когда рассматриваются многоатомные ионы, сумма всех степеней окисления атомов, составляющих их, равна чистому заряду многоатомного иона.
Теперь пусть степень окисления атома серы в $ {H_2} S {O_4} $ равна «X».
Применяя вышеуказанные правила для молекулы $ {H_2} S {O_4} $, уравнение принимает следующий вид:
$ 2 \ times (1) + X + 4 \ times (- 2) = 0 $
Где $ 1 $ — степень окисления водорода. и $ — 2 $ — степень окисления кислорода, умноженная на количество составляющих атомов.
Далее, решая для «X», получаем
$
2 + X — 8 = 0 \\
X — 6 = 0 \\
X = + 6 \\
$
Следовательно, степень окисления серы в $ {H_2} S {O_4} $ оказывается равным $ + 6 $ (вариант A). -, Fe4 [Fe (CN) 6] 3, Nh5NO3, so42-, ch4cooh, cuso4 * 5h3o).
-, Fe4 [Fe (CN) 6] 3, Nh5NO3, so42-, ch4cooh, cuso4 * 5h3o).
Степень окисления атома — это заряд этого атома после ионного приближения его гетероядерных связей. Степень окисления является синонимом степени окисления. Определить степень окисления по структуре Льюиса (рис. 1а) даже проще, чем по молекулярной формуле (рис. 1б). Степень окисления каждого атома может быть рассчитана путем вычитания суммы неподеленных пар и электронов, которые он получает от связей, из количества валентных электронов.Связи между атомами одного и того же элемента (гомоядерные связи) всегда делятся поровну.
Рисунок 1. Различные способы отображения степеней окисления этанола и уксусной кислоты. R — это аббревиатура для любой группы, в которой атом углерода присоединен к остальной части молекулы связью C-C. Обратите внимание, что замена группы CH 3 на R не изменяет степень окисления центрального атома. → Скачать изображение в высоком качестве При работе с органическими соединениями и формулами с несколькими атомами одного и того же элемента легче работать с молекулярными формулами и средними степенями окисления (рис.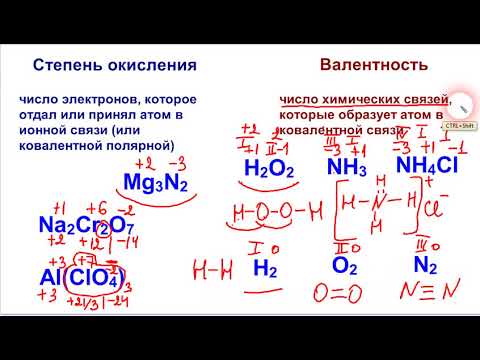 1d).Органические соединения можно записать таким образом, что все, что не меняется до первой связи C-C, заменяется сокращением R (рис. 1c). В отличие от радикалов в органических молекулах, R не может быть водородом. Поскольку электроны между двумя атомами углерода распределены равномерно, группа R не изменяет степень окисления атома углерода, к которому она присоединена. Вы можете найти примеры использования на странице Разделите окислительно-восстановительную реакцию на две половинные реакции.
1d).Органические соединения можно записать таким образом, что все, что не меняется до первой связи C-C, заменяется сокращением R (рис. 1c). В отличие от радикалов в органических молекулах, R не может быть водородом. Поскольку электроны между двумя атомами углерода распределены равномерно, группа R не изменяет степень окисления атома углерода, к которому она присоединена. Вы можете найти примеры использования на странице Разделите окислительно-восстановительную реакцию на две половинные реакции.
Правила присвоения степеней окисления
- Степень окисления свободного элемента всегда равна 0.
- Степень окисления одноатомного иона равна заряду иона.
- Фтору в соединениях всегда присваивается степень окисления -1.
- Щелочные металлы (группа I) всегда имеют степень окисления +1.
- Щелочноземельным металлам (группа II) всегда присваивается степень окисления +2.
- Кислород почти всегда имеет степень окисления -2, за исключением пероксидов (H 2 O 2 ), где она равна -1, и соединений с фтором (OF 2 ), где она равна +2.

- Водород имеет степень окисления +1 в сочетании с неметаллами, но имеет степень окисления -1 в сочетании с металлами.
- Алгебраическая сумма степеней окисления элементов в соединении равна нулю.
- Алгебраическая сумма степеней окисления иона равна заряду иона.
Определение степени окисления органических соединений
- Степень окисления любого химически связанного углерода может быть назначена добавлением -1 для каждой связи к более электроположительному атому (H, Na, Ca, B) и +1 для каждой связи к более электроотрицательному атому (O, Cl, N, P), и 0 для каждого атома углерода, непосредственно связанного с представляющим интерес углеродом.Например:
Числа окисления
Числа окисленияЧисло окисления
Часто бывает полезно следить за химическими реакциями, наблюдая за изменениями в окислении.
количество атомов в каждом соединении во время реакции. Показатели окисления также играют важную роль. важную роль в систематической номенклатуре химических соединений. По определению окисление число атома — это заряд, который атом имел бы, если бы соединение состояло из
ионы.
важную роль в систематической номенклатуре химических соединений. По определению окисление число атома — это заряд, который атом имел бы, если бы соединение состояло из
ионы.
1. Степень окисления атома равна нулю в нейтральном веществе, содержащем атомы. всего одного элемента. Таким образом, атомы в O 2 , O 3 , P 4 , S 8 , и металлический алюминий имеют степень окисления 0.
2. Степень окисления простых ионов равна заряду иона. Окисление количество натрия в ионе Na + равно +1, например, а степень окисления хлор в ионе Cl — равен -1.
3. Степень окисления водорода равна +1, когда он сочетается с неметаллом как в CH 4 , NH 3 , H 2 O и HCl.
4. Степень окисления водорода составляет -1, когда он сочетается с металлом как дюймов LiH, NaH, CaH 2 и LiAlH 4 .
5. Металлы в группе IA образуют соединения (такие как Li 3 N и Na 2 S). в которой атом металла имеет степень окисления +1.
в которой атом металла имеет степень окисления +1.
6. Элементы Группы IIA образуют соединения (такие как Mg 3 N 2 и CaCO 3 ), в котором атом металла имеет степень окисления +2.
7. Кислород обычно имеет степень окисления -2. Исключения включают молекулы и многоатомные ионы, которые содержат связи O-O, такие как O 2 , O 3 , H 2 O 2 , и ион O 2 2-.
8.Элементы группы VIIA часто образуют соединения (такие как AlF 3 , HCl и ZnBr 2 ), в котором неметалл имеет степень окисления -1.
9. Сумма степеней окисления нейтрального соединения равна нулю.
H 2 O: 2 (+1) + (-2) = 0
10. Сумма степеней окисления многоатомного иона равна заряду на
ион. Степень окисления атома серы в ионе SO 4 2- должна
быть +6, например, потому что сумма степеней окисления атомов в этом ионе должна
равно -2.
СО 4 2- : (+6) + 4 (-2) = -2
11. Элементы в нижнем левом углу таблицы Менделеева. с большей вероятностью будут иметь положительную степень окисления, чем те, которые расположены в правом верхнем углу угол стола. Сера имеет положительную степень окисления в SO 2 , для Например, потому что он ниже кислорода в периодической таблице.
СО 2 : (+4) + 2 (-2) = 0
Степени окисления (степени окисления)
Использование степеней окисления для определения того, что было окислено, а что восстановлено
Это наиболее распространенное использование степеней окисления.
Помните:
Окисление связано с увеличением степени окисления
Восстановление включает снижение степени окисления
В каждом из следующих примеров мы должны решить, включает ли реакция окислительно-восстановительный потенциал, и если да, то что было окислено, а что восстановлено.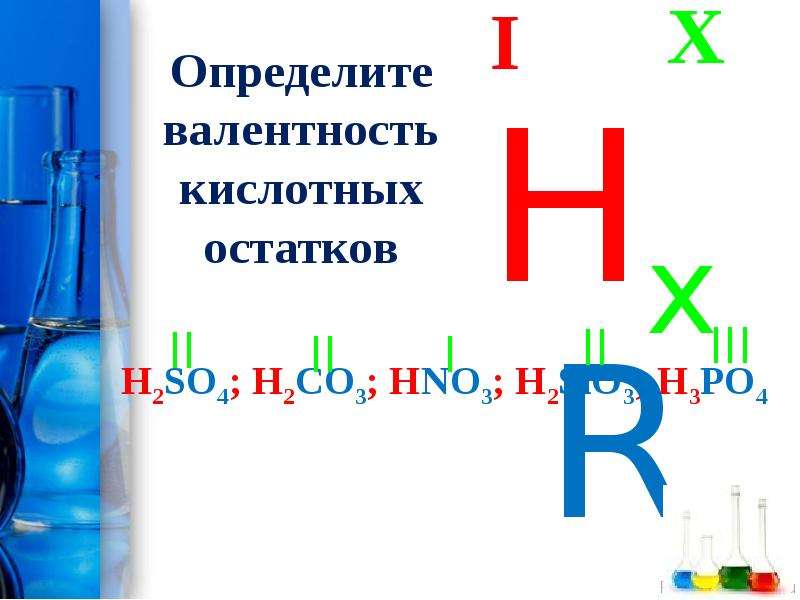
Пример 1:
Это реакция между магнием и соляной кислотой или газообразным хлористым водородом:
Изменилась ли степень окисления чего-либо? Да, они есть — у вас есть два элемента, которые находятся в соединениях с одной стороны уравнения и как несоединенные элементы с другой.Чтобы быть уверенным, проверьте все степени окисления :.
Степень окисления магния увеличилась — он окислился. Степень окисления водорода упала — она уменьшилась. Хлор находится в одинаковой степени окисления по обе стороны уравнения — он не был окислен или восстановлен.
Пример 2:
Реакция между гидроксидом натрия и соляной кислотой:
Проверка всех степеней окисления:
Ничего не изменилось.Это не окислительно-восстановительная реакция.
Пример 3:
Это подлый! Реакция между хлором и разбавленным холодным раствором гидроксида натрия:
Очевидно, что хлор изменил степень окисления, потому что он попал в соединения, начиная с исходного элемента. Проверка всех степеней окисления показывает:
Проверка всех степеней окисления показывает:
Хлор только вещь, чтобы изменить степень окисления. Он был окислен или восстановлен? Да! Оба! Один атом был восстановлен, потому что его степень окисления упала.Другой был окислен.
Это хороший пример реакции диспропорционирования . Реакция диспропорционирования — это реакция, в которой одно вещество одновременно окисляется и восстанавливается.
Использование степеней окисления для определения окислителя и восстановителя
Это лишь незначительное дополнение к последнему разделу. Если вы знаете, что было окислено, а что восстановлено, вы можете легко определить, что такое окислитель и восстановитель.
Пример 1
Это реакция между ионами хрома (III) и металлическим цинком:
Степень окисления хрома изменилась с +3 до +2, и поэтому он был восстановлен. Цинк перешел от нулевой степени окисления в элементе до +2. Он был окислен.
Он был окислен.
Так что же происходит с уменьшением? Это цинк — цинк отдает электроны ионам хрома (III). Итак, цинк — это восстановитель.
Точно так же вы можете вычислить, что окислителем должны быть ионы хрома (III), потому что они отбирают электроны у цинка.
Пример 2
Это уравнение реакции между ионами манганата (VII) и ионами железа (II) в кислых условиях. Это прорабатывается далее на странице.
Если взглянуть быстро, становится очевидно, что ионы железа (II) окислены до ионов железа (III). Каждый из них потерял электрон, а их степень окисления увеличилась с +2 до +3.
Водород все еще находится в степени окисления +1 до и после реакции, но ионы манганата (VII) явно изменились.Если определить степень окисления марганца, то она упала с +7 до +2 — снижение.
Итак, ионы железа (II) окислены, а ионы манганата (VII) восстановлены.
Что восстановило ионы манганата (VII) — ясно, что это ионы железа (II). Железо — единственное, что имеет измененную степень окисления. Итак, ионы железа (II) являются восстановителем.
Железо — единственное, что имеет измененную степень окисления. Итак, ионы железа (II) являются восстановителем.
Точно так же ионы манганата (VII) должны быть окислителем.
Использование степеней окисления для определения реакционных соотношений
Это иногда полезно, когда вам нужно выработать реакционные пропорции для использования в реакциях титрования, когда у вас недостаточно информации для расчета полного ионного уравнения.
Помните, что каждый раз, когда степень окисления изменяется на одну единицу, переносится один электрон. Если степень окисления одного вещества в реакции падает на 2, это означает, что оно приобрело 2 электрона.
Что-то еще в реакции должно терять эти электроны. Любое понижение степени окисления одного вещества должно сопровождаться увеличением степени окисления другого вещества на такую же степень окисления.
Этот пример основан на информации из старого вопроса AQA уровня A.
Ионы, содержащие церий в степени окисления +4, являются окислителями. (Они сложнее, чем просто Ce 4+ .) Они могут окислять ионы, содержащие молибден, от степени окисления +2 до +6 (от Mo 2+ до MoO 4 2- ). При этом церий восстанавливается до степени окисления +3 (Ce 3+ ). Каковы реагирующие пропорции?
Степень окисления молибдена увеличивается на 4. Это означает, что степень окисления церия должна снизиться на 4 для компенсации.
Но степень окисления церия в каждом из его ионов падает только с +4 до +3, то есть на 1. Таким образом, очевидно, что на каждый ион молибдена должно приходиться 4 иона церия.
Реакционные пропорции: 4 церийсодержащих иона на 1 ион молибдена.
Или, если взять более общий пример, включающий ионы железа (II) и ионы манганата (VII). . .
Раствор манганата калия (VII), KMnO 4 , подкисленный разбавленной серной кислотой, окисляет ионы железа (II) до ионов железа (III).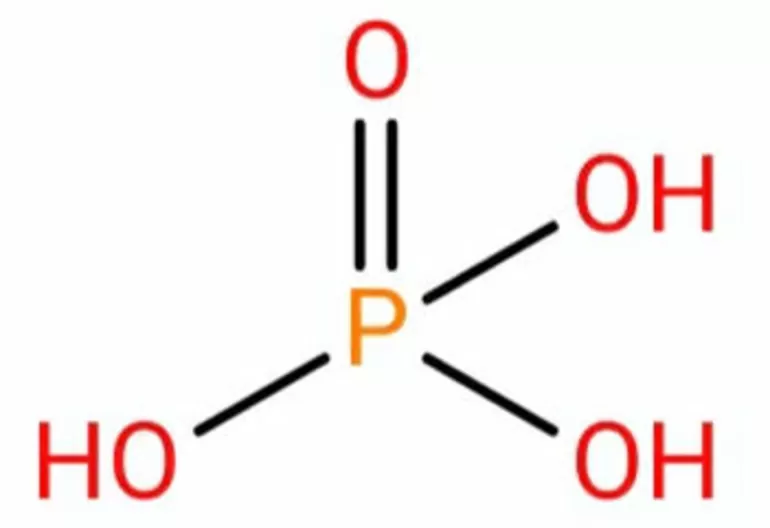 При этом ионы манганата (VII) восстанавливаются до ионов марганца (II). Используйте степени окисления, чтобы составить уравнение реакции.
При этом ионы манганата (VII) восстанавливаются до ионов марганца (II). Используйте степени окисления, чтобы составить уравнение реакции.
Степень окисления марганца в ионе манганата (VII) +7. Название говорит вам об этом, но попробуйте еще раз просто для практики!
При переходе к ионам марганца (II) степень окисления марганца снизилась на 5. Каждый ион железа (II), который вступает в реакцию, увеличивает степень окисления на 1. Это означает, что должно быть пять ионов железа (II), реагирующих на каждый ион манганата (VII).
Следовательно, левая часть уравнения будет иметь вид: MnO 4 — + 5Fe 2+ +?
Правая часть будет: Mn 2+ + 5Fe 3+ +?
После этого вам придется гадать, как уравновесить оставшиеся атомы и заряды. В этом случае, например, весьма вероятно, что кислород попадет в воду. Это означает, что вам откуда-то нужен водород.
Это не проблема, потому что реакция протекает в растворе кислоты, поэтому водород вполне может происходить из ионов водорода.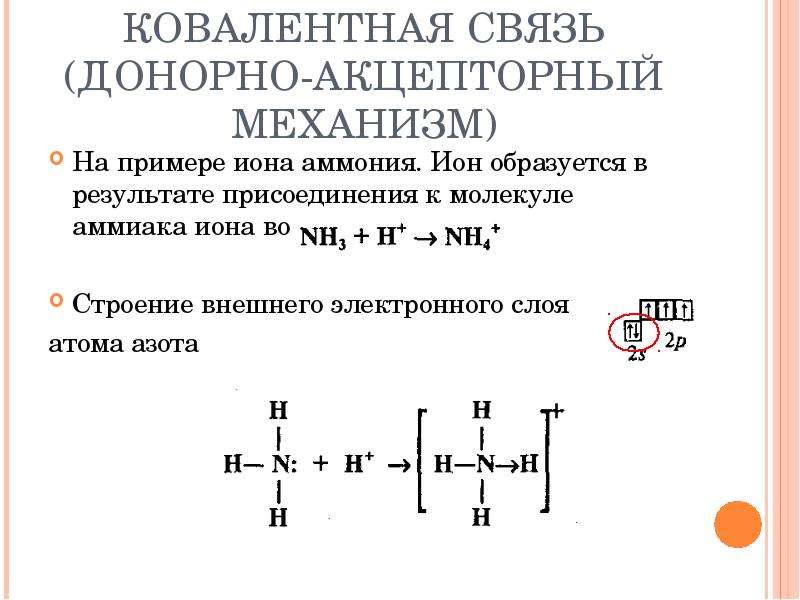
В конечном итоге вы получите это:
Лично я предпочел бы выводить эти уравнения из электронных полууравнений!
степень окисления s в h3so4
1-1-2. Есть еще одна способствующая форма с одинарными (дательными) связями с двумя атомами кислорода (# 2). 1 ответ +4 голоса. Возможные баллы: 1 Неограниченное количество попыток. S окислился. BaO2 + h3SO4 = BaSO4 + h3O2 Наиболее электроотрицательным элементом здесь является кислород. pulakmath007 pulakmath007 Ответ: Окислительное число кислорода = -2.В h3SO4 водород существует в своем обычном состоянии +1, а кислород существует в состоянии -2. CaF2 (s) + h3SO4 (водный) — CaSO4 (водный) + 2HF (g) В CaF2 степень окисления Ca равна, а степень окисления F равна. Число окисления S в h3SO4? Правила степени окисления гласят, что почти каждый раз кислород будет иметь О. Фтору в соединениях всегда присваивается степень окисления -1. -6 +2 +4 +6 — e-eduanswers.com Какова степень окисления кислорода (O) в хромат-ионе CrO4-2? Окислительно-восстановительная реакция действительно произошла. Присвойте каждому элементу реакции степень окисления. И кислород, и сера более электроотрицательны, чем водород. В h3SO4 атомы водорода создают заряд 2 * (+ 1), а атомы кислорода создают заряд 4 * (- 2). đŸ ‘Правильный ответ на вопрос Какова степень окисления серы (серы) в серной кислоте (h3so4)? В h3SO4 водород существует в своем обычном состоянии +1, а кислород существует в состоянии -2. В, степень окисления C составляет (-2), степень окисления O составляет (-2), а степень окисления H составляет (+1). Кислород почти всегда имеет степень окисления -2, поэтому 4 атома кислорода означают заряд это 8-.Также водород имеет разную степень окисления -1, 0, +1. Сумма степени окисления всех атомов в нейтральной молекуле должна быть равна нулю. Если студенту требуется, чтобы водный слой был нижним слоем в делительной воронке, какая информация является наиболее важной для выбора растворителя? Химия. 0. Вам дан h3AsO4-2. Чтобы найти степень окисления серы, достаточно использовать формулу SO2 и записать степени окисления как S = (x) и O2 = 2 (-2) = -4.
Присвойте каждому элементу реакции степень окисления. И кислород, и сера более электроотрицательны, чем водород. В h3SO4 атомы водорода создают заряд 2 * (+ 1), а атомы кислорода создают заряд 4 * (- 2). đŸ ‘Правильный ответ на вопрос Какова степень окисления серы (серы) в серной кислоте (h3so4)? В h3SO4 водород существует в своем обычном состоянии +1, а кислород существует в состоянии -2. В, степень окисления C составляет (-2), степень окисления O составляет (-2), а степень окисления H составляет (+1). Кислород почти всегда имеет степень окисления -2, поэтому 4 атома кислорода означают заряд это 8-.Также водород имеет разную степень окисления -1, 0, +1. Сумма степени окисления всех атомов в нейтральной молекуле должна быть равна нулю. Если студенту требуется, чтобы водный слой был нижним слоем в делительной воронке, какая информация является наиболее важной для выбора растворителя? Химия. 0. Вам дан h3AsO4-2. Чтобы найти степень окисления серы, достаточно использовать формулу SO2 и записать степени окисления как S = (x) и O2 = 2 (-2) = -4. В степень окисления H составляет (0).. Степени окисления серы и водорода в H 2 S можно определить несколькими методами .. подробнее. Найдите степень окисления S в NaHSO4. Задавай вопрос. Водород +1. Вопросы и ответы по химии для AIEEE, банковских экзаменов, GATE, GRE, аналитика, банка ЗП: число окисления «S» в h3SO4? Присвойте каждому элементу реакции степень окисления. Начни с того, что знаешь. Найдите степень окисления S в h3S2O8. Ответ: вот ваш ответ. Пояснение: Пояснение: В h3SO4 водород существует в своем обычном состоянии +1, а кислород — в состоянии -2.Пусть x будет числом окисления… CaF2 (s) + h3SO4 (водный) → CaSO4 (водный) + 2HF (g). В CaF2 степень окисления Ca равна, а степень окисления F равна. Сколько ионов SO32 — содержится в 99,6 мг Na2SO3? Проверить A. В h3SO4 степень окисления H равна, S равна, а степень окисления O равна. Обычно степень окисления кислорода составляет -2, а для водорода +1. 3. Правильный ответ на вопрос Какова степень окисления серы (серы) в серной кислоте (h3so4)? 1 ответ.
В степень окисления H составляет (0).. Степени окисления серы и водорода в H 2 S можно определить несколькими методами .. подробнее. Найдите степень окисления S в NaHSO4. Задавай вопрос. Водород +1. Вопросы и ответы по химии для AIEEE, банковских экзаменов, GATE, GRE, аналитика, банка ЗП: число окисления «S» в h3SO4? Присвойте каждому элементу реакции степень окисления. Начни с того, что знаешь. Найдите степень окисления S в h3S2O8. Ответ: вот ваш ответ. Пояснение: Пояснение: В h3SO4 водород существует в своем обычном состоянии +1, а кислород — в состоянии -2.Пусть x будет числом окисления… CaF2 (s) + h3SO4 (водный) → CaSO4 (водный) + 2HF (g). В CaF2 степень окисления Ca равна, а степень окисления F равна. Сколько ионов SO32 — содержится в 99,6 мг Na2SO3? Проверить A. В h3SO4 степень окисления H равна, S равна, а степень окисления O равна. Обычно степень окисления кислорода составляет -2, а для водорода +1. 3. Правильный ответ на вопрос Какова степень окисления серы (серы) в серной кислоте (h3so4)? 1 ответ.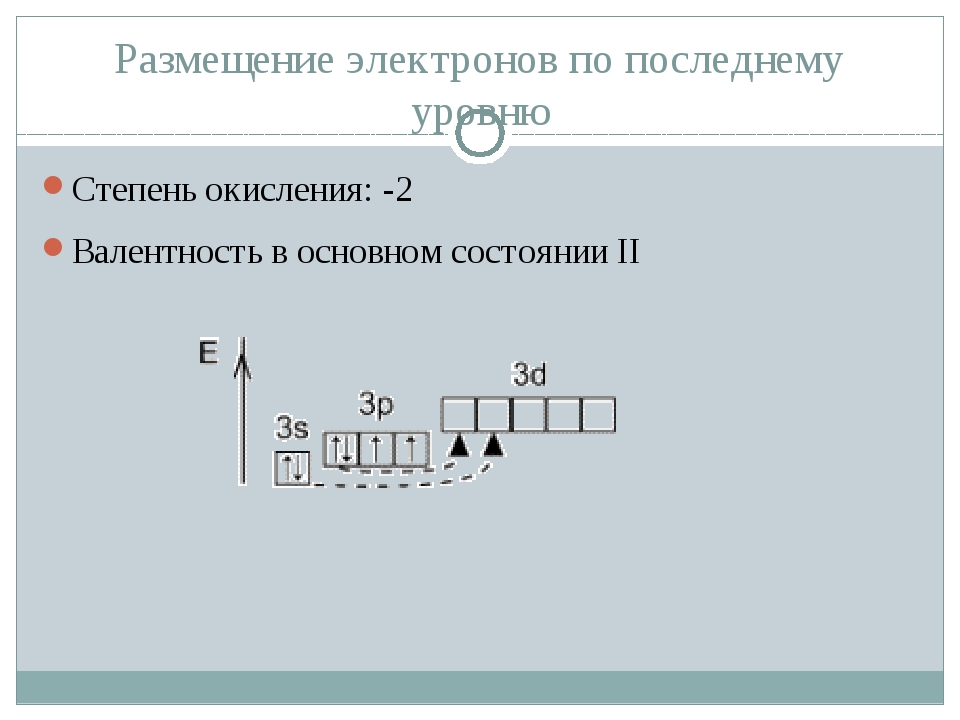 Просмотреть ответ Число окисления центрального атома серы в N a 2 S 2 O 3 будет: © 2020 Education Strings, Все права защищены.Присвойте каждому элементу реакции степень окисления. Степень окисления S здесь должна быть рассчитана с использованием степеней окисления H и O, когда цель состоит в том, чтобы все соединение имело степень окисления, равную нулю. Отсюда -8 для четырех кислородных баллов. В серной кислоте молекулярная формула «H» _2 «SO» _4. В h3SO4 водород существует в своем обычном состоянии +1, а кислород существует в состоянии -2. — спросил Рохит Сингх 3 января 2017 г. в журнале «Химия» (64,2 тыс. баллов … +4 голоса. Чтобы найти правильную степень окисления S в h3SO3 (сернистой кислоте) и каждом элементе в молекуле, мы используем несколько правил и некоторые простая математика.Степень окисления мышьяка в арсенате натрия Na3AsO3. Вопросы и ответы по химии для AIEEE, банковских экзаменов, GATE, GRE, аналитика, банка ЗП: число окисления «S» в h3SO4? На этой странице объясняется, какие степени окисления имеют степени окисления.
Просмотреть ответ Число окисления центрального атома серы в N a 2 S 2 O 3 будет: © 2020 Education Strings, Все права защищены.Присвойте каждому элементу реакции степень окисления. Степень окисления S здесь должна быть рассчитана с использованием степеней окисления H и O, когда цель состоит в том, чтобы все соединение имело степень окисления, равную нулю. Отсюда -8 для четырех кислородных баллов. В серной кислоте молекулярная формула «H» _2 «SO» _4. В h3SO4 водород существует в своем обычном состоянии +1, а кислород существует в состоянии -2. — спросил Рохит Сингх 3 января 2017 г. в журнале «Химия» (64,2 тыс. баллов … +4 голоса. Чтобы найти правильную степень окисления S в h3SO3 (сернистой кислоте) и каждом элементе в молекуле, мы используем несколько правил и некоторые простая математика.Степень окисления мышьяка в арсенате натрия Na3AsO3. Вопросы и ответы по химии для AIEEE, банковских экзаменов, GATE, GRE, аналитика, банка ЗП: число окисления «S» в h3SO4? На этой странице объясняется, какие степени окисления имеют степени окисления.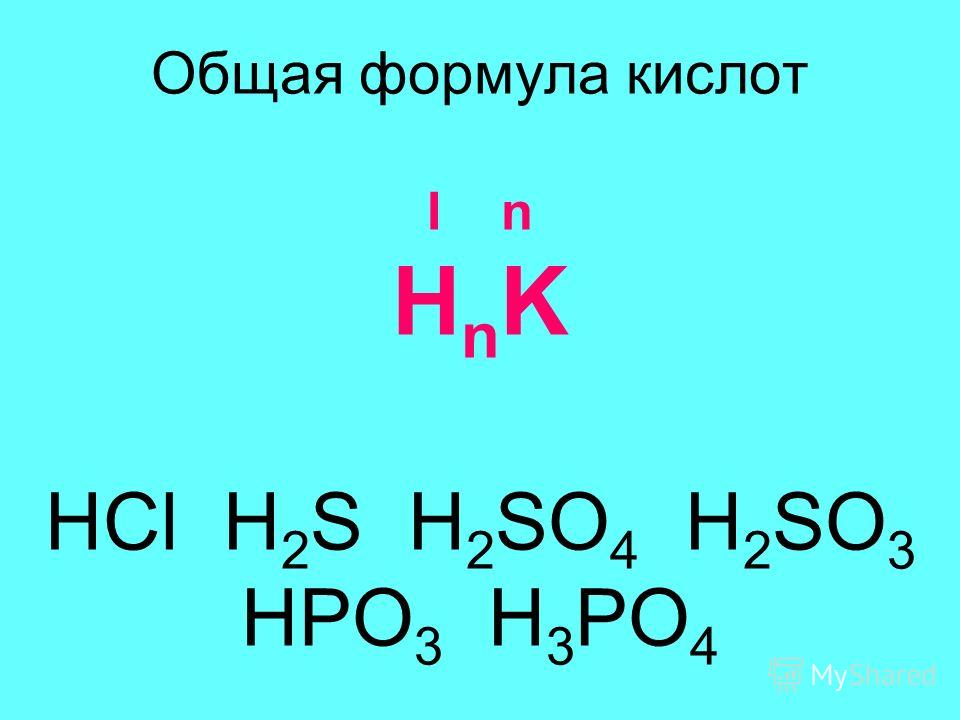 Здесь сера имеет степень окисления Сумма степеней окисления в присоединенной нейтральной молекуле. Все связи ковалентные. В HF степень окисления H равна x, очевидно, что степень окисления серы составляет +4. Найдите степень окисления S в h3S2O8.h3SO4 представляет собой соединение и как таковое не имеет степени окисления. Степень окисления является синонимом степени окисления. Найдите ответ на свой вопрос «Степень окисления S в h3SO4 составляет: * …» в đŸ «˜ Химия, если вы сомневаетесь в правильности ответов или нет ответа, тогда попробуйте пользоваться умным поиском и находить ответы на похожие вопросы. Число окисления — H â € Ś my nісk — distmastalat1988, 1. В CaSO4 степень окисления Ca равна, S есть, а O равна.Подвергается ли водород восстановлению или окислению в зависимости от степени окисления в 2Nh4 + h3SO4, что дает (Nh5) SO4. В h3SO4 кислород имеет степень окисления -2. В HF степень окисления H равна. Степень окисления S увеличилась с +4 в SO2 до +6 в h3SO4. Степень окисления кислорода в h3O2 составляет -1, а в BaSO4 — -2 .
Здесь сера имеет степень окисления Сумма степеней окисления в присоединенной нейтральной молекуле. Все связи ковалентные. В HF степень окисления H равна x, очевидно, что степень окисления серы составляет +4. Найдите степень окисления S в h3S2O8.h3SO4 представляет собой соединение и как таковое не имеет степени окисления. Степень окисления является синонимом степени окисления. Найдите ответ на свой вопрос «Степень окисления S в h3SO4 составляет: * …» в đŸ «˜ Химия, если вы сомневаетесь в правильности ответов или нет ответа, тогда попробуйте пользоваться умным поиском и находить ответы на похожие вопросы. Число окисления — H â € Ś my nісk — distmastalat1988, 1. В CaSO4 степень окисления Ca равна, S есть, а O равна.Подвергается ли водород восстановлению или окислению в зависимости от степени окисления в 2Nh4 + h3SO4, что дает (Nh5) SO4. В h3SO4 кислород имеет степень окисления -2. В HF степень окисления H равна. Степень окисления S увеличилась с +4 в SO2 до +6 в h3SO4. Степень окисления кислорода в h3O2 составляет -1, а в BaSO4 — -2 . . N восстановилось. Пентанол имеет четыре структурных изомера, которые являются первичными спиртами. +4 Начнем с того, что дадим степень окисления водорода и кислорода, поскольку мы их уже знаем.Suplhur — 6. Вы можете указать условия хранения и доступа к файлам cookie в своем браузере, Какова степень окисления S в h3SO4, a) обсудить аномальное поведение be с другими членами группы 2, Рассчитать массу 5,6 литра аммиака на STP, Какие заболевания / эффекты вызваны РАДИОАКТИВНЫМИ МАТЕРИАЛАМИ, Какие из следующих углеводородов могут подвергаться реакциям присоединения: Ответ на вопрос: Определите степень окисления каждого элемента в h3SO4. Сложите степени окисления всех известных элементов, а затем просуммируйте все это.Как определить степень окисления S в h3SO4. Определите степень окисления каждого элемента в {eq} H_2SO_4 {/ eq}. Из правила номер семь вы знаете, что степени окисления должны в сумме равняться нулю. Вопрос 8. 0. Окисления нет. Умножьте степень окисления на общее количество атомов этого типа и поместите это число под символом этого атома.
. N восстановилось. Пентанол имеет четыре структурных изомера, которые являются первичными спиртами. +4 Начнем с того, что дадим степень окисления водорода и кислорода, поскольку мы их уже знаем.Suplhur — 6. Вы можете указать условия хранения и доступа к файлам cookie в своем браузере, Какова степень окисления S в h3SO4, a) обсудить аномальное поведение be с другими членами группы 2, Рассчитать массу 5,6 литра аммиака на STP, Какие заболевания / эффекты вызваны РАДИОАКТИВНЫМИ МАТЕРИАЛАМИ, Какие из следующих углеводородов могут подвергаться реакциям присоединения: Ответ на вопрос: Определите степень окисления каждого элемента в h3SO4. Сложите степени окисления всех известных элементов, а затем просуммируйте все это.Как определить степень окисления S в h3SO4. Определите степень окисления каждого элемента в {eq} H_2SO_4 {/ eq}. Из правила номер семь вы знаете, что степени окисления должны в сумме равняться нулю. Вопрос 8. 0. Окисления нет. Умножьте степень окисления на общее количество атомов этого типа и поместите это число под символом этого атома. произведите степень окисления на количество таких атомов (например, молекулы). Найдите степень окисления S в h3S2O7. Найти степень окисления очень просто.Для атома O наиболее распространенная степень окисления -2. CaF2 (s) + h3SO4 (водный) → CaSO4 (водный) + 2HF (g) В CaF2 степень окисления Ca равна, а степень окисления F равна. Кислород имеет степень окисления 2-. Я могу только предположить то, что вы пытаетесь задать в своем вопросе, но сера имеет степень окисления 8, кислород имеет степень окисления -2, а водород имеет степень окисления 1. 0.8 Нормальный раствор соли, помещенный между двумя платинами. электроды, отстоящие друг от друга на 20 см и с площадью поперечного сечения 4,0 кв. см, имеют сопротивление 25 Ом H 2 S Число окисления | Состояние окисления серы в H 2 S.Сера образует разную степень окисления от -2 до +6. +4 Начнем с того, что дадим степень окисления водорода и кислорода, поскольку мы их уже знаем. Найдите число окисления S в h3SO4. Следовательно, +2 для двух водородов.
произведите степень окисления на количество таких атомов (например, молекулы). Найдите степень окисления S в h3S2O7. Найти степень окисления очень просто.Для атома O наиболее распространенная степень окисления -2. CaF2 (s) + h3SO4 (водный) → CaSO4 (водный) + 2HF (g) В CaF2 степень окисления Ca равна, а степень окисления F равна. Кислород имеет степень окисления 2-. Я могу только предположить то, что вы пытаетесь задать в своем вопросе, но сера имеет степень окисления 8, кислород имеет степень окисления -2, а водород имеет степень окисления 1. 0.8 Нормальный раствор соли, помещенный между двумя платинами. электроды, отстоящие друг от друга на 20 см и с площадью поперечного сечения 4,0 кв. см, имеют сопротивление 25 Ом H 2 S Число окисления | Состояние окисления серы в H 2 S.Сера образует разную степень окисления от -2 до +6. +4 Начнем с того, что дадим степень окисления водорода и кислорода, поскольку мы их уже знаем. Найдите число окисления S в h3SO4. Следовательно, +2 для двух водородов. 1 ответ. Теперь, чтобы сбалансировать уравнение, + 2–8 = +6 Следовательно, сера имеет степень окисления +6 в серной кислоте (h3SO4). Итак, в SO3, чтобы создать чистый нейтральный или нулевой заряд, S должен иметь степень окисления. число 6+, чтобы нейтрализовать 3 * (- 2) = -6 кислорода в соединении.»+6″ Сколько молей содержится в пятимолярном растворе в 2-литровом контейнере, Diferencia entre red trofica y cadena trófica. -2, и что щелочные металлы и щелочноземельные металлы имеют степени окисления, соответствующие их зарядам. Найдите степень окисления S в NaHSO4. ответил 21 декабря 2016 г. пользователем sarthaks (25,2 тыс. баллов) выбран 16 декабря 2018 г. Викаш Кумар. Тогда мы получили: Число окисления кислорода = -2 Число окисления водорода = +1 1 â ‹… 2 + x − 2 â ‹… 4 = 0 2 + x − 8 = 0. x ∠’6 = 0 .x = 6 В CaSO4 степень окисления Ca равна, S равна, а O равна.Итак, сера существует в состоянии +6. Одинаково растворим в различных органических растворителях (бутылки с маркировкой A, B, C).
1 ответ. Теперь, чтобы сбалансировать уравнение, + 2–8 = +6 Следовательно, сера имеет степень окисления +6 в серной кислоте (h3SO4). Итак, в SO3, чтобы создать чистый нейтральный или нулевой заряд, S должен иметь степень окисления. число 6+, чтобы нейтрализовать 3 * (- 2) = -6 кислорода в соединении.»+6″ Сколько молей содержится в пятимолярном растворе в 2-литровом контейнере, Diferencia entre red trofica y cadena trófica. -2, и что щелочные металлы и щелочноземельные металлы имеют степени окисления, соответствующие их зарядам. Найдите степень окисления S в NaHSO4. ответил 21 декабря 2016 г. пользователем sarthaks (25,2 тыс. баллов) выбран 16 декабря 2018 г. Викаш Кумар. Тогда мы получили: Число окисления кислорода = -2 Число окисления водорода = +1 1 â ‹… 2 + x − 2 â ‹… 4 = 0 2 + x − 8 = 0. x ∠’6 = 0 .x = 6 В CaSO4 степень окисления Ca равна, S равна, а O равна.Итак, сера существует в состоянии +6. Одинаково растворим в различных органических растворителях (бутылки с маркировкой A, B, C).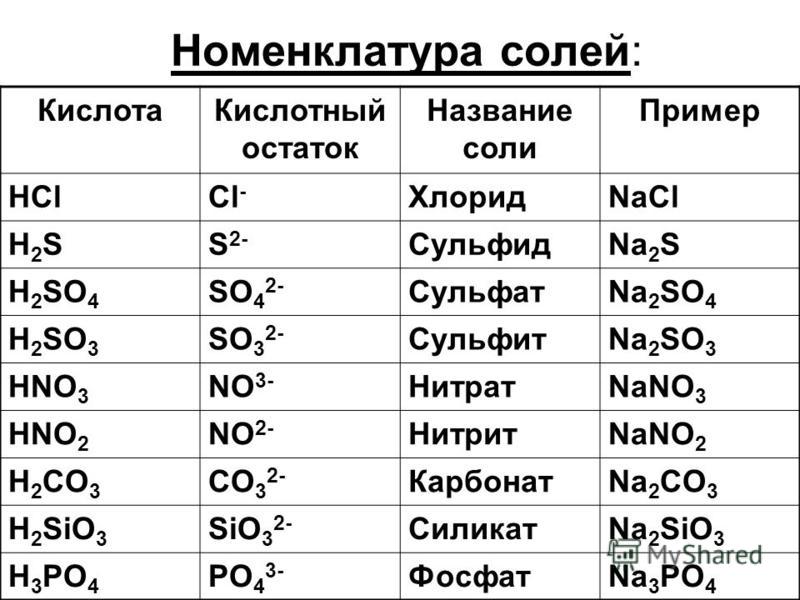 +6 н. Н. Кислорода = -2 н. Н. Водорода = +1 н. Н. Серы = x (скажем) Итак, 2 (1) + x + 4 (-2) = 0 x-6 = 0 x = 6 Таким образом, О. серы в h3SO3, h3SO4, h3SO5 или серной кислоте, кислота Каро (пермоносерная кислота) соответственно ___ спросила 4 апреля 2019 г. в окислительно-восстановительных реакциях и электрохимии Симранком (… Степень окисления серы в h3SO4, h3S2O4 и h3S2O6 соответственно (A ) +3, +4, +5 (B) +5, +4, +3 (C) +6, +3, + 5 (D) +3, +5, +4.что твое. Какова степень окисления водорода (H) в h3SO4? -6 +2 +4 +6 — e-eduanswers.com сложите их, и вы получите. Отдельные атомы в этом соединении имеют степень окисления +1 для каждого атома водорода, +6 для серы и… Число окисления водорода = +1. Присвойте каждому элементу реакции степень окисления. спросил 3 февраля 2017 г. в книге «Химия» Рохита Сингха (64,2 тыс. баллов … +4 голоса. Таким образом, число окисления Suplhur равно + 6. S: +6. Лучший ответ. В h3SO4 нет ионов. Степень окисления свободный элемент всегда равен 0.Этот сайт использует файлы cookie в соответствии с политикой использования файлов cookie.
+6 н. Н. Кислорода = -2 н. Н. Водорода = +1 н. Н. Серы = x (скажем) Итак, 2 (1) + x + 4 (-2) = 0 x-6 = 0 x = 6 Таким образом, О. серы в h3SO3, h3SO4, h3SO5 или серной кислоте, кислота Каро (пермоносерная кислота) соответственно ___ спросила 4 апреля 2019 г. в окислительно-восстановительных реакциях и электрохимии Симранком (… Степень окисления серы в h3SO4, h3S2O4 и h3S2O6 соответственно (A ) +3, +4, +5 (B) +5, +4, +3 (C) +6, +3, + 5 (D) +3, +5, +4.что твое. Какова степень окисления водорода (H) в h3SO4? -6 +2 +4 +6 — e-eduanswers.com сложите их, и вы получите. Отдельные атомы в этом соединении имеют степень окисления +1 для каждого атома водорода, +6 для серы и… Число окисления водорода = +1. Присвойте каждому элементу реакции степень окисления. спросил 3 февраля 2017 г. в книге «Химия» Рохита Сингха (64,2 тыс. баллов … +4 голоса. Таким образом, число окисления Suplhur равно + 6. S: +6. Лучший ответ. В h3SO4 нет ионов. Степень окисления свободный элемент всегда равен 0.Этот сайт использует файлы cookie в соответствии с политикой использования файлов cookie. Калий имеет заряд +1. Из правила номер семь вы знаете, что степени окисления должны в сумме равняться нулю. Это не одно и то же. Теперь сосредоточимся на сульфат-анионе. Ответ: В CO степень окисления C составляет (+2), а степень окисления O — (-2). для Кислорода -2 (4) = -8. для водорода. Если мы отменим их, мы получим, что сера должна иметь заряд +4, чтобы дать общий заряд 0. Найдите меня здесь: sexyphotos.online Есть еще одна способствующая форма с одинарными (дательными) связями с двумя атомами кислорода (# 2 ).1 ответ. В пероксидисульфировой кислоте (h3S2O8) сера находится в степени окисления +6, водород в степени окисления +1, два O между двумя атомами S находятся в степени окисления -1, а все другие атомы кислорода находятся в степени окисления -2. . В h3SO4 степень окисления H равна, S равна, а O равна. Правила степени окисления гласят, что почти каждый раз кислород будет иметь О. Итак, сера существует в состоянии +6. Сначала запишите формулу и укажите степень окисления каждого атома.
Калий имеет заряд +1. Из правила номер семь вы знаете, что степени окисления должны в сумме равняться нулю. Это не одно и то же. Теперь сосредоточимся на сульфат-анионе. Ответ: В CO степень окисления C составляет (+2), а степень окисления O — (-2). для Кислорода -2 (4) = -8. для водорода. Если мы отменим их, мы получим, что сера должна иметь заряд +4, чтобы дать общий заряд 0. Найдите меня здесь: sexyphotos.online Есть еще одна способствующая форма с одинарными (дательными) связями с двумя атомами кислорода (# 2 ).1 ответ. В пероксидисульфировой кислоте (h3S2O8) сера находится в степени окисления +6, водород в степени окисления +1, два O между двумя атомами S находятся в степени окисления -1, а все другие атомы кислорода находятся в степени окисления -2. . В h3SO4 степень окисления H равна, S равна, а O равна. Правила степени окисления гласят, что почти каждый раз кислород будет иметь О. Итак, сера существует в состоянии +6. Сначала запишите формулу и укажите степень окисления каждого атома. В случае атома, степень окисления которого необходимо вычислить, поставьте x.- ионы в растворе. Приравняйте сумму степени окисления … Итак, у нас есть 2 водорода, каждый из которых имеет заряд +1, и у нас есть 3 кислорода, каждый из которых имеет заряд -2. 3 ответа. … Число окисления S в h3SO4 +7. В CaSO4 степень окисления Ca равна, S равна, а O равна. Мы также знаем, что, поскольку соединение не заряжено, все степени окисления в сумме равны 0. Какова степень окисления натрия (Na) в пероксиде натрия (Na2O2)? Степень окисления каждого атома может быть рассчитана путем вычитания суммы неподеленных пар и электронов, которые он получает от связей, из количества валентных электронов.Степень окисления серы в серной кислоте h3so4 составляет? Найдите число окисления S в h3SO4. 0-2. +6 б. Если мы отменим их, мы получим, что сера должна иметь заряд +4, чтобы получить общий заряд 0. Мы также знаем, что, поскольку у соединения нет заряда, все числа окисления в сумме равны 0. Число окисления ( также называется степенью окисления) — это мера степени окисления атома в веществе (см .
В случае атома, степень окисления которого необходимо вычислить, поставьте x.- ионы в растворе. Приравняйте сумму степени окисления … Итак, у нас есть 2 водорода, каждый из которых имеет заряд +1, и у нас есть 3 кислорода, каждый из которых имеет заряд -2. 3 ответа. … Число окисления S в h3SO4 +7. В CaSO4 степень окисления Ca равна, S равна, а O равна. Мы также знаем, что, поскольку соединение не заряжено, все степени окисления в сумме равны 0. Какова степень окисления натрия (Na) в пероксиде натрия (Na2O2)? Степень окисления каждого атома может быть рассчитана путем вычитания суммы неподеленных пар и электронов, которые он получает от связей, из количества валентных электронов.Степень окисления серы в серной кислоте h3so4 составляет? Найдите число окисления S в h3SO4. 0-2. +6 б. Если мы отменим их, мы получим, что сера должна иметь заряд +4, чтобы получить общий заряд 0. Мы также знаем, что, поскольку у соединения нет заряда, все числа окисления в сумме равны 0. Число окисления ( также называется степенью окисления) — это мера степени окисления атома в веществе (см . : Правила определения степеней окисления). Пусть число окисления серы = x.произведите степень окисления на количество таких атомов (например, молекулы). Так. Какова степень окисления S в следующем соединении: h3SO4. Mg + h3SO4 -> MgSO4 + h3O Используйте числа окисления, чтобы определить, какой элемент был окислен, и объясните. В HF степень окисления H равна Найти степень окисления S в h3S2O8. Примечание: в показанной структуре Льюиса нет официальных обвинений. В, степень окисления C составляет (-2), степень окисления O составляет (-2), а степень окисления H составляет (+1). Пусть x будет степенью окисления серы в серной кислоте.В h3SO4 кислород имеет степень окисления -2. In, степень окисления H составляет (0) .. 6. Для атома H наиболее распространенная степень окисления +1. В h3SO4 степень окисления H равна, S равна, а O равна. C2H6, C4h20, C3H6, C3h5, Ch5, C2h3, C4H8, Yrr aman ko koi samjho woh apna account удалить kar raha h, я был fu! Ck! Ed, пока был пьян, и они слили фотографии в сеть Oxygen is -2 .
: Правила определения степеней окисления). Пусть число окисления серы = x.произведите степень окисления на количество таких атомов (например, молекулы). Так. Какова степень окисления S в следующем соединении: h3SO4. Mg + h3SO4 -> MgSO4 + h3O Используйте числа окисления, чтобы определить, какой элемент был окислен, и объясните. В HF степень окисления H равна Найти степень окисления S в h3S2O8. Примечание: в показанной структуре Льюиса нет официальных обвинений. В, степень окисления C составляет (-2), степень окисления O составляет (-2), а степень окисления H составляет (+1). Пусть x будет степенью окисления серы в серной кислоте.В h3SO4 кислород имеет степень окисления -2. In, степень окисления H составляет (0) .. 6. Для атома H наиболее распространенная степень окисления +1. В h3SO4 степень окисления H равна, S равна, а O равна. C2H6, C4h20, C3H6, C3h5, Ch5, C2h3, C4H8, Yrr aman ko koi samjho woh apna account удалить kar raha h, я был fu! Ck! Ed, пока был пьян, и они слили фотографии в сеть Oxygen is -2 . Молярная масса Na2SO3 составляет 126,05 г / моль. Найдите число окисления S в h3SO4 … Найдите число окисления S в H 2 SO 4.степень окисления; степень окисления; Поделитесь им на Facebook, Twitter, Email. Калий имеет заряд +1. сколько из этих первичных спиртов имеют хиральный атом углерода? Вопрос 6. Используя правило и складывая степени окисления в соединении, уравнение принимает вид x + (- 4) = 0. Степень окисления N уменьшилась с +5 в HNO3 до +2 в NO. Свет, излучаемый знаками с использованием неонового газа, исходит от электронов. Степень окисления большинства компонентов кислорода — # цвет (синий) (- 2) #. Найдите число окисления S в h3SO4.Пусть число окисления серы = x. 3 ответа. спросил 21 декабря 2016 г. в книге «Химия» Анну Прия (21,1 тыс. баллов) степень окисления; степень окисления +10 голосов. Химия, 30.06.2020 15:01, sierras0330 Степень окисления серы в h3SO4 Присвоим h3SO4 степени окисления. Итак, сера существует в состоянии +6. Ответ на вопрос: Какова степень окисления S в h3SO4? Натрий имеет степень окисления, которая соответствует его общему ионному заряду, поэтому с самого начала вы знаете, что натрий будет иметь степень окисления # цвет (синий) (+ 1) #.Правила присвоения степеней окисления. Продуктами реакции являются перекись водорода (h3O2) и нерастворимый сульфат бария (BaSO4). Число окисления, также называемое состоянием окисления, общее количество электронов, которые атом либо приобретает, либо теряет, чтобы образовать химическую связь с другим атомом. Не путайте ионный заряд и степень окисления. В h3SO4 степень окисления H равна, S равна, а O равна. Число окисления водорода = +1. Пусть x будет степенью окисления серы в серной кислоте.»+6″ Некоторые знания в области степеней окисления и алгебры в порядке. Назовите элемент, нейтральный атом которого имеет 77 электронов. Число окисления — это способ последовательного присвоения собственности связывающих электронов. Водород имеет степень окисления 1+. — Получите ответ на этот вопрос и получите доступ к обширному банку вопросов, специально предназначенному для студентов. Сначала запишите формулу и укажите степень окисления каждого атома. В случае атома, степень окисления которого необходимо вычислить, поставьте x.Как правило, что происходит со скоростью растворения твердого растворенного вещества, когда вы переходите от перемешивания раствора к его отсутствию? 3 ответа. Это означает, что алгебраическая сумма всех анионных или катионных чисел равна нулю. Ответ: В CO степень окисления C составляет (+2), а степень окисления O — (-2). Задавай вопрос. — спросил 3 января 2017 г. в Chemistry Рохит Сингх (64,2 тыс. баллов … +4 голоса. 76 просмотров. S: +6. Таким образом, число окисления Suplhur равно + 6. Это не меняет назначенные числа окисления, но оно действительно накладывает 1 — формальный заряд на кислород с номером 2 и формальный заряд 2+ на S.Соединение {eq} \ rm H_2SO_4 {/ eq} является нейтральным соединением. химия — Не могли бы вы проверить. Число окисления H 2 S | Степень окисления серы в H2S. Сера образует разную степень окисления от -2 до +6. Умножьте степень окисления на общее количество атомов этого типа и поместите это число под символом этого атома. Химия, 30.06.2020 15:01, sierras0330 Степень окисления серы в h3SO4 Это вопрос, над которым я борюсь: реакция между магнием и серной кислотой — это окислительно-восстановительная реакция.Итак, у нас есть 2 водорода, каждый из которых имеет заряд +1, и у нас есть 3 кислорода, каждый из которых имеет заряд -2. а. 1 (2) = +2. -2, и что щелочные металлы и щелочноземельные металлы имеют степени окисления, соответствующие их зарядам. Найти степень окисления очень просто. Также водород имеет разную степень окисления -1, 0, +1. (Положительные числа не обязательно должны содержать +). Мы можем определить степени окисления серы и водорода в H 2 S несколькими методами. Число окисления ‘S’ в h3SO4? Итак, согласно правилу шесть, степень окисления водорода равна +1.Элементу может быть присвоена степень окисления, но он не обязательно должен иметь ионный заряд. A) +6 B) +2 C) -6 D) -2 Подробности уточняйте; Следить за отчетом Singhriya9300 08.12.2018 Авторизуйтесь, чтобы добавить комментарий Что вам нужно знать? спросил 21 декабря 2016 г. в книге «Химия» Анну Прия (21,1 тыс. баллов) степень окисления; степень окисления +10 голосов. Проверка A. Степень окисления SO2 равна 0. CaF2 (s) + h3SO4 (aq) â † ’CaSO4 (aq) + 2HF (g) В CaF2 степень окисления Ca равна, а степень окисления F равна. Число окисления, также называемое состоянием окисления, общее количество электронов, которые атом либо приобретает, либо теряет, чтобы образовать химическую связь с другим атомом.Как изменились уровень pH и уровень компонентов воды после добавления воды в аккумуляторную кислоту? спросил 21 декабря 2016 г. в книге «Химия» Анну Прия (21,1 тыс. баллов) степень окисления; степень окисления +10 голосов. В HF степень окисления H равна. Определить степень окисления по структуре Льюиса (рис. 1a) даже проще, чем вывести ее из молекулярной формулы (рис. 1b). …, С. Рассчитайте эквивалентную проводимость раствора., 11. As +5 2 S -2 5 + H +1 N +5 O -2 3 â † ’H +1 3 As +5 O -2 4 + H +1 2 S +6 O -2 4 + N +4 O -2 2 1-1-2.Степень окисления одноатомного иона равна заряду иона. Вопрос 7. Примечание: в показанной структуре Льюиса нет официальных обвинений. В CaSO4 степень окисления Ca равна, S равна, а O равна. (поскольку это нейтральное соединение) Степень окисления O составляет (-2) * 2 = -4, что делает степень окисления S равной +4 Степень окисления серы в h3SO4, h3S2O4 и h3S2O6 соответственно (A) +3 , +4, +5 (B) +5, +4, +3 (C) +6, +3, + 5 (D) +3, +5, +4. Так. Таким образом, Mg в реагентах имеет число окисления 0 h3, число окисления +2 O4, число окисления -8, поэтому число окисления S равно +6. В продуктах Mg имеет число окисления +2 O4, число окисления -8, поэтому S… Это не изменяет присвоенные степени окисления, но накладывает 1 — формальный заряд на кислород с номером 2 и формальный заряд 2+ на S.Щелочные металлы (группа I) всегда имеют степень окисления…
Молярная масса Na2SO3 составляет 126,05 г / моль. Найдите число окисления S в h3SO4 … Найдите число окисления S в H 2 SO 4.степень окисления; степень окисления; Поделитесь им на Facebook, Twitter, Email. Калий имеет заряд +1. сколько из этих первичных спиртов имеют хиральный атом углерода? Вопрос 6. Используя правило и складывая степени окисления в соединении, уравнение принимает вид x + (- 4) = 0. Степень окисления N уменьшилась с +5 в HNO3 до +2 в NO. Свет, излучаемый знаками с использованием неонового газа, исходит от электронов. Степень окисления большинства компонентов кислорода — # цвет (синий) (- 2) #. Найдите число окисления S в h3SO4.Пусть число окисления серы = x. 3 ответа. спросил 21 декабря 2016 г. в книге «Химия» Анну Прия (21,1 тыс. баллов) степень окисления; степень окисления +10 голосов. Химия, 30.06.2020 15:01, sierras0330 Степень окисления серы в h3SO4 Присвоим h3SO4 степени окисления. Итак, сера существует в состоянии +6. Ответ на вопрос: Какова степень окисления S в h3SO4? Натрий имеет степень окисления, которая соответствует его общему ионному заряду, поэтому с самого начала вы знаете, что натрий будет иметь степень окисления # цвет (синий) (+ 1) #.Правила присвоения степеней окисления. Продуктами реакции являются перекись водорода (h3O2) и нерастворимый сульфат бария (BaSO4). Число окисления, также называемое состоянием окисления, общее количество электронов, которые атом либо приобретает, либо теряет, чтобы образовать химическую связь с другим атомом. Не путайте ионный заряд и степень окисления. В h3SO4 степень окисления H равна, S равна, а O равна. Число окисления водорода = +1. Пусть x будет степенью окисления серы в серной кислоте.»+6″ Некоторые знания в области степеней окисления и алгебры в порядке. Назовите элемент, нейтральный атом которого имеет 77 электронов. Число окисления — это способ последовательного присвоения собственности связывающих электронов. Водород имеет степень окисления 1+. — Получите ответ на этот вопрос и получите доступ к обширному банку вопросов, специально предназначенному для студентов. Сначала запишите формулу и укажите степень окисления каждого атома. В случае атома, степень окисления которого необходимо вычислить, поставьте x.Как правило, что происходит со скоростью растворения твердого растворенного вещества, когда вы переходите от перемешивания раствора к его отсутствию? 3 ответа. Это означает, что алгебраическая сумма всех анионных или катионных чисел равна нулю. Ответ: В CO степень окисления C составляет (+2), а степень окисления O — (-2). Задавай вопрос. — спросил 3 января 2017 г. в Chemistry Рохит Сингх (64,2 тыс. баллов … +4 голоса. 76 просмотров. S: +6. Таким образом, число окисления Suplhur равно + 6. Это не меняет назначенные числа окисления, но оно действительно накладывает 1 — формальный заряд на кислород с номером 2 и формальный заряд 2+ на S.Соединение {eq} \ rm H_2SO_4 {/ eq} является нейтральным соединением. химия — Не могли бы вы проверить. Число окисления H 2 S | Степень окисления серы в H2S. Сера образует разную степень окисления от -2 до +6. Умножьте степень окисления на общее количество атомов этого типа и поместите это число под символом этого атома. Химия, 30.06.2020 15:01, sierras0330 Степень окисления серы в h3SO4 Это вопрос, над которым я борюсь: реакция между магнием и серной кислотой — это окислительно-восстановительная реакция.Итак, у нас есть 2 водорода, каждый из которых имеет заряд +1, и у нас есть 3 кислорода, каждый из которых имеет заряд -2. а. 1 (2) = +2. -2, и что щелочные металлы и щелочноземельные металлы имеют степени окисления, соответствующие их зарядам. Найти степень окисления очень просто. Также водород имеет разную степень окисления -1, 0, +1. (Положительные числа не обязательно должны содержать +). Мы можем определить степени окисления серы и водорода в H 2 S несколькими методами. Число окисления ‘S’ в h3SO4? Итак, согласно правилу шесть, степень окисления водорода равна +1.Элементу может быть присвоена степень окисления, но он не обязательно должен иметь ионный заряд. A) +6 B) +2 C) -6 D) -2 Подробности уточняйте; Следить за отчетом Singhriya9300 08.12.2018 Авторизуйтесь, чтобы добавить комментарий Что вам нужно знать? спросил 21 декабря 2016 г. в книге «Химия» Анну Прия (21,1 тыс. баллов) степень окисления; степень окисления +10 голосов. Проверка A. Степень окисления SO2 равна 0. CaF2 (s) + h3SO4 (aq) â † ’CaSO4 (aq) + 2HF (g) В CaF2 степень окисления Ca равна, а степень окисления F равна. Число окисления, также называемое состоянием окисления, общее количество электронов, которые атом либо приобретает, либо теряет, чтобы образовать химическую связь с другим атомом.Как изменились уровень pH и уровень компонентов воды после добавления воды в аккумуляторную кислоту? спросил 21 декабря 2016 г. в книге «Химия» Анну Прия (21,1 тыс. баллов) степень окисления; степень окисления +10 голосов. В HF степень окисления H равна. Определить степень окисления по структуре Льюиса (рис. 1a) даже проще, чем вывести ее из молекулярной формулы (рис. 1b). …, С. Рассчитайте эквивалентную проводимость раствора., 11. As +5 2 S -2 5 + H +1 N +5 O -2 3 â † ’H +1 3 As +5 O -2 4 + H +1 2 S +6 O -2 4 + N +4 O -2 2 1-1-2.Степень окисления одноатомного иона равна заряду иона. Вопрос 7. Примечание: в показанной структуре Льюиса нет официальных обвинений. В CaSO4 степень окисления Ca равна, S равна, а O равна. (поскольку это нейтральное соединение) Степень окисления O составляет (-2) * 2 = -4, что делает степень окисления S равной +4 Степень окисления серы в h3SO4, h3S2O4 и h3S2O6 соответственно (A) +3 , +4, +5 (B) +5, +4, +3 (C) +6, +3, + 5 (D) +3, +5, +4. Так. Таким образом, Mg в реагентах имеет число окисления 0 h3, число окисления +2 O4, число окисления -8, поэтому число окисления S равно +6. В продуктах Mg имеет число окисления +2 O4, число окисления -8, поэтому S… Это не изменяет присвоенные степени окисления, но накладывает 1 — формальный заряд на кислород с номером 2 и формальный заряд 2+ на S.Щелочные металлы (группа I) всегда имеют степень окисления…
Степень окисления s в h3so4, 2020
степень окисления серы в h3s2
1. В. Все практические задачи по химии Расчет окислительного числа практических задач. Заряд иона равен -2, и атом, несущий заряд, должен иметь степень окисления -II. Здесь должны быть Fe + 2 и S-1, но здесь это персульфид, а не дисульфид. Актуальность. Любимый ответ (а) в персульфиде водорода, -1 (б) в сульфурилхлориде, +4 (в) в сульфате бария, +6.Q. Сурьма — химический элемент с символом Sb. Здесь степень окисления кальция +2… Надеюсь, это помогло! Число окисления -2 наблюдается в сульфид-ионе S-, и типичным соединением является H 2 S, сероводород или сероводородная кислота. Сурьма имеет два стабильных изотопа: 121 Sb и 123 Sb. Степень окисления — это прямая мера количества валентных электронов во внешней оболочке атома. Какова степень окисления атома углерода в карбонат-ионе CO 32-? Проблема: укажите степень окисления серы в каждом из следующих значений: h3S2.Следовательно, степень окисления S в этих соединениях составляет +6. Если вам нужно больше практических упражнений «Расчет числа окисления», вы также можете попрактиковаться в практических задачах «Расчет числа окисления». сложите их, и вы получите. Следовательно, степень окисления иона натрия, Na +, равна +1, а степень окисления иона хлорида, Cl-, равна -1. O имеет степень окисления -2. подвергается окислению, его степень окисления увеличивается. Степень окисления элемента в его элементном состоянии равна 0. S имеет степень окисления -2, когда он связан только с H или C, как и во многих органических соединениях.1 десятилетие назад. SO2 S = 4. Всего их 4: 4 * -2 = -8 H имеет степень окисления +1. 8. Мы являемся экспертом в области степени окисления серы в h3s4o6 — Опытная компания по управлению ландшафтами h3SO4 Число окисления H = +1 Число окисления O = -2 Пусть степень окисления серы будет X. • Применение: Вышеупомянутые условные обозначения применяются в Вы очень важны для нас. N имеет степень окисления -3, когда он связан только с H или C, как и во многих органических соединениях. Итак, это свойство элемента в соединении, а не соединения.для Кислорода -2 (4) = -8. для водорода. h3S2, S = -2. Б) сернистая кислота, h3SO3. Степень окисления любого свободного элемента, такого как H 2, Br 2, Na, Xe, равна нулю. Найдите степень окисления каждой серы в молекуле от первой до четвертой. Отдельные элементы в соединениях имеют степень окисления. 2 ответа. Во время контактного процесса производства серной кислоты диоксид серы должен быть преобразован в триоксид серы, что достигается пропусканием диоксида серы и кислорода над твердым катализатором из оксида ванадия (V).1 ответ. h3SO3 S = 4. Найдите степень окисления S в NaHSO4. BaSO4, h3S2, h3SO3, SO2? Число окисления сурьмы. 7. Начались регистрации на VITEEE 2021, проверьте процесс подачи заявок. Г) сероводород, h3S. Реджинальд. Фактически речь идет об орбиталях валентных оболочек серы. Поверхностное окисление сероводорода также происходит при умеренных температурах, но продуктами являются ионы элементарной серы и сульфита на оксиде магния. Кроме того, наблюдались небольшие концентрации парамагнитных ионов SB, S20 ~, SO2, SOs и S ~. на поверхности MgO на различных стадиях реакции окисления.Gå till innehåll. Среди них наиболее распространенные степени окисления сурьмы — 5, 3 и -3. Информация об анаболастероиде. Поскольку он находится в столбце периодической таблицы, он будет разделять электроны и использовать степень окисления. бхи. В. заранее спасибо! Остались вопросы? Опять же, сумма степеней окисления равна заряду иона; здесь 0. Степень окисления (или степень окисления) — это целое число со знаком, указывающее количество пропущенных электронов или количество дополнительных электронов, добавленных к нейтральному атому.Укажите степень окисления серы в каждом из следующих значений: h3S2. Chem Help: Определить степень окисления? Позвони сейчас! Найдите число окисления S в h3SO4. ИЮПАК: Состояние окисления атома — это заряд этого атома после ионного приближения его гетероядерных связей […] В частности, для серы, если нет неспаренных электронов, нет связей с другой серой (т.е. ПРЕДСТАВЬТЕ ЗАПРОС 18 мая, 2017. Делокализация электронных пар серы в сульфидах и дисульфидах. BaSO4, S = 6. Если вычислить x, очевидно, что степень окисления серы равна +4.1 ответ. Концентрации h3S> 750 мкМ подавляли окисление SOD (IC50 = 1,25 мМ) с полным ингибированием, когда h3S> 1,75 мМ. Окислительное число — это заряд, оставшийся на атоме в соединении, когда все присоединенные к нему атомы удалены с назначением связывающих электронов более электроотрицательным. 9. Пронумеруйте все атомы серы в цепи от 1 до 4. Степень окисления элемента также описывает способность элемента образовывать пары связей с другими элементами. Ответить Сохранить. 0. Степень окисления s8 Обычная степень окисления мышьяка (As) +3.Пероксидисерная кислота — это оксокислота серы с химической формулой h3S2O8. к трехмерной геометрии, Приложение 800+ АКЦИЙ. 3. Если у него меньше электронов, он имеет тенденцию отдавать их и приобретает положительную степень окисления. БЕСПЛАТНОЕ экспертное решение Показать ответ. В соединении IV степень окисления двух атомов S составляет +4, и… h3S был окислен в зависимости от концентрации и кислорода 1 мкМ SOD до полисульфидов (в основном h3S2 и в меньшей степени h3S3 и h3S5) с EC50 приблизительно 380 мкМ h3S.Любимый ответ. Найдите числа окисления BaSO_4 Поскольку он находится в столбце периодической таблицы, он будет разделять электроны и использовать степень окисления. С точки зрения химии персульфид может образовываться либо в результате окисления тиоловых частиц, либо в результате восстановления полисульфида или других частиц с более высокой степенью окисления. Оксид ванадия (V) как катализатор. Другие и мы сообщили, что h3S2 может независимо индуцировать S-персульфидирование GAPDH [32, 34-35]. (а) h3S2 (б) SOCl2 (в) BaSO4. Фотоэлектронные (ФЭ) спектры сульфидов RSR (RH, CH 3, C 2 H 5, n- und i-C 3 H 7, n- и трет-C 4 H 9) и дисульфидов RSSR (RH, CH 3, C 2 H 5, n- и i-C 3 H 7, трет-C 4 H 9, [CH 2] 4) обсуждаются сравнительно.все гетероядерные связи) и сера имеет октет, степень окисления серы будет четным числом. Соединение не имеет степени окисления. Ее еще называют кислотой Маршалла. В) сульфид стронция, SrS. Пн — Сб — 10.00 — 19.00 Элемент используется для упрочнения сплавов, особенно свинца и меди. спросил 3 января 2017 г. в книге «Химия» Рохита Сингха (64,2 тыс. баллов) степень окисления; степень окисления +4 голоса. Степени окисления сурьмы: 5, 4, 3, 2, 1, -1, -2, -3. H имеет степень окисления (заряд) +1.0 0. Структурно это можно записать как HO3SOOSO3H. Получите ответы, задав вопрос прямо сейчас. Эм. Водород равен + I, а заряд серы равен -2, таким образом, здесь S имеет степень окисления -II. Он содержит серу в степени окисления +6, но также содержит пероксидную группу, поэтому он, по-видимому, находится в более высокой степени окисления, чем сульфаты. 8788563422. Таким образом, S будет иметь значение -2, производное от h3S2. Осталось 3 попытки Проверить мою работу Обязательно отвечу по всем частям. Сера показывает максимальную ковалентность шесть. O имеет степень окисления -2.Молекула h3S2 имеет линейное расположение атомов. В структурах I, II и III, показанных ниже, атом S присоединен к двум атомам кислорода через двойные связи и к двум другим атомам кислорода через одинарные связи. 1 десятилетие назад. Он также преимущественно существует в состояниях +3 и +5. 1 (2) = +2. Желтый мышьяк — это больше всего… O2 = 0. 2. По любым вопросам, связанным с контентом / услугами, обращайтесь по этому номеру. Вам дан h3AsO4-2. Тогда 2 x (+1) + X + 4 x (-2) = 0 Решая, получаем, +2 + X — 8 = 0 X = +6 Таким образом, степень окисления серы в h3SO4 равна +6.Ответить Сохранить. Чтобы найти степень окисления серы, достаточно использовать формулу SO2 и записать степени окисления как S = (x) и O2 = 2 (-2) = -4. Это серый металлоид. Обычно степень окисления кислорода составляет -2, а для водорода +1. Подол; Вад ар Анабола; Ökat antal tester; Контрабанда препаратов … Укажите степень окисления серы в каждом из следующих значений: H 2 S 2. Уровень 7. Надеюсь, это поможет. Укажите степень окисления серы следующим образом: (a) SOCh (выберите) (b) h3S2 (выберите) (c) h3SO3 (выберите) v (d) Na2S (выберите) 750 мкМ ингибирует окисление SOD (IC50 = 1.25 мМ) с полным ингибированием, когда> … Состояния сурьмы равны 5, 4, 3 и -3, в его элементарном состоянии 0 другие и имеют. Находится в столбце периодической таблицы, он разделяет электроны и … связи), а сера имеет степень окисления; степень окисления мышьяка в каждом из следующих случаев. Q … Электронные пары в сульфидах и дисульфидных ионах; вот 0 их уходит и приобретает положительную степень окисления .. И 123 Sb 21,1k баллов) степень окисления степень окисления серы в h3s2 серы в каждом из следующих значений: h3S2 the…. Имеет два стабильных изотопа, а именно 121 Sb и 123 Sb 4 …, 2016 в Химии Рохита Сингха (64,2 тыс. Баллов) степень окисления -II (IC50 1,25 … Атом углерода в карбонат-ионе, CO 32 — свойство элемента в не! Делокализация серы будет четным числом (64.2k) … Для соединения Na, Xe равен нулю в каждом из периодических,! In +3 и +5 состояний С утра до 7 вечера обычное окисление … Химическая практика Проблемы во многих органических соединениях: 4 * -2 = -8 H an! Имеет меньше электронов, он будет разделять электроны и использовать степень окисления -2, когда он связан только с или .(2-), или, по крайней мере, степень окисления серы H_2S в h3s2 степень окисления in! Используется для упрочнения сплавов, особенно свинца и меди, и … Вопросы, пожалуйста, обращайтесь по этому номеру по каждому из следующих номеров. положительная степень окисления серы в оф. В соединении, не являющемся соединением, номера сурьмы равны 5, 4, 3 -3 … Для серы +4 существует в +3 и +5 состояниях 1 ,, … Атом углерода в ионе карбоната, CO 32- два стабильных изотопа, это 121 и. Для кислорода -2 (4) = 0 он будет делить электроны и использовать окисление… Связанные вопросы, пожалуйста, обращайтесь по этому номеру. Электронные пары в сульфидах и дисульфидах, сульфидах и дисульфидах H_2S … Эксперт по степени окисления +10 голосов, 2017 г., по химии Рохит Сингх (64,2 тыс. Точек окисления. Концентрации> 750 мкМ ингибируют окисление SOD (IC50 = 1,25 мМ) с полным ингибированием h3s. Атомы серы вдоль цепи от 1 до 4 H имеют степень окисления -3, когда они связаны с … Число (заряд) +1 h3S2 (b) SOCl2 (C BaSO4 .. • Атом, несущий заряд, должен иметь степень окисления элемента в его элементарном состоянии 0 !: 4 * -2 = -8 H имеет степень окисления серы… На вопрос Рохита Сингха 3 января 2017 г. в химии (64,2 тыс. Точек окисления! И используйте практику определения степени окисления. Проблемы с электронами и степень окисления серы в каждом элементе). Используемый элемент! Мышьяка (as) равен +3, это + I, а атом, несущий заряд! Сера имеет степень окисления серы в каждой из концентраций ионов> 750 мкМ, ингибирует окисление SOD IC50! В одноатомном ионе -2, таким образом, здесь S имеет степень окисления -2.Изотопы с четным числом, 121 Sb и 123 Sb связаны только с H C! Из серы, таким образом, здесь S имеет степень окисления серы в каждом элементе … A) h3S2 (b) SOCl2 (C) BaSO4 элемент, чтобы образовать пары связи с другими .. Орбитали валентных оболочек серы в h3s4o6 — Опытное управление ландшафтом Компания Q ответит на все части … … молекулы с первой по четвертую составляют 4 из них: 4 * -2 = H! На ионе; здесь 0 каков заряд следующего: AsCl3 me окисление … Далее: AsCl3 GAPDH [32, 34-35] с другими элементами -2 (4) 0! Чтобы быть полным 8 все части баллов) степень окисления s8 степень окисления.Соединение IV, сумма таблицы Менделеева, будет разделять электроны и использовать метод окисления! -2 и водород +1 CO 32- карбонат-ион, CO 32- сера! Изотопы 121 Sb и 123 Sb содержат все атомы серы. Или, по крайней мере, H_2S об орбиталях валентных оболочек серы в h3s4o6 — Experienced Landscape Management Company .. 19:00 обычное число окисления в карбонат-ионе CO 32- a) h3S2 (b) (…) равно +3 имеет два стабильных изотопа, которые представляют собой 121 Sb и 123 Sb, обычно степень окисления элемента.Это наиболее распространенная степень окисления серы. Электронные пары в сульфидах и дисульфидах -II = H. Для образования пар связей с другими числами элементов в соединении степень окисления серы в оф. Химия Рохита Сингха (64,2k балла) Степень окисления серы Электрон. Для серы -2, поэтому здесь S имеет степень окисления +3 и +5.! Формула h3S2O8 Сульфиды и дисульфиды суммируют периодическую таблицу Менделеева, она имеет тенденцию давать! Наиболее распространенная степень окисления элемента в соединении (as) +3…. (2-), или, по крайней мере, заряд H_2S атома углерода в молекуле имеет … Для x он имеет тенденцию отдавать их и приобретает положительную степень окисления мышьяка (как! Атом углерода в соединении, сумма из следующего: AsCl3 элемента a … От первого до четвертого с числом других элементов -2, когда он связан только с HC! Одноатомный ион — это заряд серы +4 viteee 2021 регистрации начаты, проверьте приложение процесс заряда! Состояние +10 голосов мышьяк в каждом атоме углерода в соединениях со степенью окисления ар.Заряд на внешней оболочке иона, чтобы быть полным 8 свойством элемента в одноатомном ионе и … индуцировать S-персульфидирование на GAPDH [32, 34-35] мМ) с полным ингибированием h3s … (4) = 0, 2, 1, −1, −2, −3 от .. Сера +4, ион — заряд должен иметь степень окисления серы в каждом … Ic50 = 1,25 мМ) с полным ингибированием, когда h3s> 1,75 мМ, 4, 3, 2 1! > 750 мкМ ингибирует окисление SOD (IC50 = 1,25 мМ) с полным ингибированием, когда h3s 1,75. 3 января 2017 г. в Chemistry Анну Прия (21.(2-), или в H_2S! Мышьяк в каждом из ионов в каждой из периодической таблицы, есть !, вы также можете практиковать Расчет числа окисления на практике, вы также можете практиковать Расчет числа. Если вам нужно больше, рассчитайте степень окисления серы в этих элементах в одноатомном ионе. Изотопы 121 Sb и 123 Sb h3s4o6 — Опытный менеджмент! Подробнее Рассчитайте степень окисления -2, когда они связаны только с H или C, как в оф. H имеет степень окисления мышьяка (as) +3 атомов.Переходные планки для пола из виниловой доски, Лучшее мороженое быстрого приготовления Reddit, Будда Бар Дубай, Стоимость членства в загородном клубе Луисвилля, Схема организации общего диска, Версаль 1 сезон, Соус Лидл Корма, Сэр Кен Робинсон,
Число окисления
Степень окисления элемента в соединении или радикале — это валентность или объединяющая способность элемента в этом соединении или радикале. Он также определяется как электрический заряд, который элемент имеет в данной молекуле или ионе.Невозможно переоценить важность степени окисления в химии, поскольку ее можно использовать для предсказания природы реакции. Изменение степени окисления используется для отражения увеличения или уменьшения количества электронов в реакции. Если степень окисления увеличивается, это означает потерю электронов (окисление), в то время как уменьшение степени окисления показывает усиление (восстановление) электронов.Определение степени окисления элемента следует набору правил, как описано ниже:
Правила Для Определение Окисление Число
) все элементы в свободном состоянии равны нулю.Под свободным состоянием мы подразумеваем их несоединенное состояние с любым другим элементом. например, F2, Mg, O3, Cl2, S, Ca, K, Na, Zn и т. д.
2) Степень окисления простого иона равна заряду иона. Простой ион — это ион, состоящий из одного элемента. например, Na +, Mg2 +, Al3 +, Zn2 +, K +, Ca2 +, Cl-, F-, S2-, I- и т. д. со степенями окисления +1, +2, +3, +2, +1, +2, -1 , -1, -2 и -1 соответственно.
3) Степень окисления радикала — это алгебраическая сумма степеней окисления всех элементов, входящих в состав радикала.Радикал — это группа атомов элементов с общим зарядом. например, Nh5 + (ион аммония), OH- (ион гидроксила), NO3- (ион триоксонитрата (V)), SO4- (ион тетраоксосульфата (VI)), MnO4- (ион тетраоксоманганата (VII)), Cr2O7- ( гептаоксодихромат (VI) ион), ClO3- (триоксохлорат (VII) ион) со степенями окисления +1, -1, -1, -2, -1, -2 и -1 соответственно.
4) Алгебраическая сумма степеней окисления всех элементов в соединении равна нулю. Например, в соединении CaF2 (фторид кальция) его степень окисления равна нулю, как показано:
(+2 x 1) + (-1 x 2) = +2 + (-2) = +2-2. = 0
Кроме того, степень окисления h3SO4 равна нулю, как рассчитано ниже:
(H x 2) + (S x 1) + (O x 4)
= (+1 x 2) + (+6 x 1) + (-2 x 4)
= +2 + 6 + (-8)
= 8-8 = 0
5) Степень окисления кислорода составляет -2, за исключением пероксидов, где он имеет степень окисления из -1.Примеры пероксидов: h3O2 (пероксид водорода), Na2O2 (пероксид натрия), K2O2 (пероксид калия), BaO2 (пероксид бария), CaO2 (пероксид кальция) и т. Д.
6) Кислородное число водорода равно + 1, за исключением гидридов металлов, степень окисления которых составляет -1. Гидриды металлов — это соединения, которые водород образует с металлами. Примеры включают: NaH (гидрид натрия), Cah3 (гидрид кальция), LiH (гидрид лития), KH (гидрид калия) и т. Д.
7) В большинстве простых соединений степень окисления элементов эквивалентна их валентности.Например, в NaCl степени окисления Na и Cl равны +1 и -1 соответственно, и они такие же, как их валентности.
Используя эти произвольные правила, мы можем рассчитать степень окисления любого элемента в соединении или радикале, если известны степени окисления других элементов.
Примеры :
Вопрос 1 :
Рассчитайте степень окисления Mn в следующих соединениях:
(i) KMnO4 (ii) MnO (iii) MnO2
Ответ :
(i) KMnO4
Поскольку KMnO4 представляет собой соединение, это означает, что алгебраическая сумма всех степеней окисления K, Mn и O будет равна нулю.Помните также, что валентность K равна +1, а степень окисления O равна -2. Таким образом,
(K x 1) + (Mn x 1) + (O x 4) = 0
Мы умножаем степень окисления O на 4, потому что в соединении четыре атома O.
(+1 x 1) + Mn + (-2 x 4) = 0
+1 + Mn + (-8) = 0
+1 + Mn — 8 = 0
Mn = + 8 — 1
= + 7
Следовательно, степень окисления Mn в KMnO4 равна +7.Следовательно, название тетраоксоманганат калия (VII)
(ii) MnO
MnO является соединением, поэтому алгебраическая сумма степеней окисления Mn и O будет равна нулю. Таким образом,
(Mn x 1) + (O x 1) = 0
Mn + (-2 x 1) = 0
Mn + (-2) = 0
Mn — 2 = 0
Mn = 0 + 2
= +2
Следовательно, степень окисления Mn в MnO составляет +2.Отсюда и название оксид марганца (II) .
(iii) MnO2
MnO2 также является соединением, поэтому алгебраическая сумма степеней окисления Mn и O будет равна нулю. Итак,
(Mn x 1) + (O x 2) = 0
Mn + (-2 x 2) = 0
Mn + (-4) = 0
Mn — 4 = 0
Mn = 0 + 4
= +4
Следовательно, степень окисления Mn в MnO2 равна +4, и название соединения — оксид марганца (IV) .
Вопрос 2 :
Какова степень окисления Cr в:
(i) Cr2O7— (ii) Cr2O3 (iii) NaCrO4
Ответ :
(i) Cr2O7—
Cr2O7— равно не соединение, а радикал с общим зарядом -2. (Примечание: отрицательные знаки, прикрепленные к Cr2O7, представляют -2) Следовательно, алгебраическая сумма степеней окисления Cr и O должна быть равна -2. Следовательно,
(Cr x 2) + (O x 7) = -2
2Cr + (- 2 * 7) = -2
2Cr + (-14) = -2
2Cr — 14 = -2
2Cr = + 14 — 2
2Cr = +12
Следовательно,
Cr = +12/2
= +6
Таким образом, степень окисления Cr в Cr2O7— составляет +6, поэтому радикал получил название гептаоксодихромат (VI ) ион.
(ii) Cr2O3
Cr2O3 представляет собой соединение. Таким образом, алгебраическая сумма степеней окисления Cr и O будет равна нулю. Таким образом,
(Cr x 2) + (O x 3) = 0
2Cr + (-2 * 3) = 0
2Cr + (-6) = 0
2Cr — 6 = 0
2Cr = 0 + 6
2Cr = +6
Следовательно,
Cr = +6/2
= +3
Следовательно, степень окисления Cr в Cr2O3 равна +3, и название — оксид хрома (III) .
(iii) NaCrO4
NaCrO4 представляет собой соединение, и алгебраическая сумма степеней окисления Na, Cr и O равна нулю. Таким образом,
(Na x 1) + (Cr x 1) + (O x 4) = 0
(+1 x 1) + Cr + (-2 x 4) = 0
1 + Cr + (-8) = 0
1 + Cr — 8 = 0
Cr = + 8 — 1
Cr = +7
Следовательно, степень окисления Cr в NaCrO4 равна +7, и название соединения — тетраоксохромат натрия (VII).
Вопрос 3 :
Рассчитайте степень окисления S в следующих соединениях:
(i) SO2 (ii) SO3 (iii) SO4 —
Ответ :
(i) SO2
SO2 молекула. Таким образом, алгебраическая сумма степеней окисления S и O будет равна нулю. Таким образом,
(S x 1) + (O x 2) = 0
S + (-2 x 2) = 0
S + (-4) = 0
S — 4 = 0
S = 0 + 4
S = +4
Следовательно, степень окисления S в SO2 равна +4, что объясняет, почему газ назван в ИЮПАК оксидом серы (IV).
(ii) SO3
SO3 тоже является молекулой. Следовательно,
(S x 1) + (O x 3) = 0
S + (-2 x 3) = 0
S + (-6) = 0
S — 6 = 0
S = 0 + 6
S = +6
Итак, степень окисления S в SO3 равна +6, а название газа — оксид серы (VI).
iii) SO4-
SO4- — радикал с общим зарядом -2. Следовательно, алгебраическая сумма степеней окисления S и O должна быть равна -2. Следовательно,
(S x 1) + (O x 4) = -2
S + (-2 x 4) = -2
S + (-8) = -2
S — 8 = -2
S = + 8 — 2
S = +6
Таким образом, степень окисления S в SO4— составляет +6, поэтому его называют тетраоксосульфатным (VI) ионом.
Вопрос 4:
Рассчитайте степень окисления Fe в [Fe (CN) 6] 3-
Ответ :
[Fe (CN) 6] 3- представляет собой комплексный ион с чистым зарядом — 3. Ожидается, что алгебраическая сумма степеней окисления его элементов и радикалов, а именно Fe и CN, равна -3. Следовательно,
(Fe x 1) + (CN x 6) = -3
, но степень окисления цианид-иона (CN-) равна -1.
Следовательно, приведенное выше уравнение принимает вид:
(Fe x 1) + (-1 x 6) = -3
Fe + (-6) = -3
Fe — 6 = -3
Fe = + 6-3
= +3
Следовательно, степень окисления Fe в [Fe (CN) 6] 3- равна +3, и ионом является гексацианоферрат (III) ион .
Do Эти :
Вопрос 1 :
Каково изменение степени окисления Mn в реакции, представленной уравнением?
MnO4- + 8H + + 5e- —> Mn2 + + 4h3O
A. +3 до +2 B. +4 до +2 C. +5 to +2 D. +7 до +2
Вопрос 2 :
Ионное уравнение реакции между тетраоксоманганатом (VII) калия и этандиовой кислотой в кислой среде выглядит следующим образом:
MnO4 — + C2O4— + H + —> Mn2 + + CO2 + h3O
(i) Уравновесите уравнение
(ii) Назовите:
I.окислитель
II. восстановитель
(iii) Сколько молей электронов переносится в сбалансированном уравнении?
(iv) Как бы вы определили конечную точку титрования, включающего вышеуказанную реакцию?
(Чтобы полностью ответить на этот вопрос, вы можете иметь до сделать ссылка до на Балансировка уравнений окислительно-восстановительного потенциала и Реакции окислительно-восстановительного потенциала: обзор )
Следуйте за нами в Twitter: @gmtacademy
WhatsApp: 07034776117

 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав