Вода. Свойства воды
Здравствуйте, мои юные друзья. Я очень рад снова встретиться с вами. Помните, прошлый раз мы беседовали о воздухе, а сегодня я предлагаю вам послушать мой рассказ о воде. А назову я его так: «Вода. Свойства воды».
Вашу Землю не зря называют голубой планетой. Вода — одно из самых распространённых на ней веществ. В этом легко убедиться, если посмотреть на фотоснимки Земли из Космоса. Думаю, что вашу планету можно было бы назвать Океанией, потому что три четвертых всей ее поверхности занимают воды. На вашей планете вода находится везде: в воздухе, в почве, в океанах и морях, реках и озерах и даже в живых организмах. Много воды и в теле человека.
Вы, земляне, не представляете себе жизни без воды. Организм человека должен получать
 Вода также нужна
вам, чтобы приготовить пищу, умыться, постирать одежду, сделать уборку в
доме.
Вода также нужна
вам, чтобы приготовить пищу, умыться, постирать одежду, сделать уборку в
доме.Велико значение воды и в хозяйственной жизни. Без воды не было бы ни хлеба, ни одежды, ни бумаги. Электрическая энергия, которую вы сегодня используете везде, часто вырабатывается тоже с помощью падающей воды.
Вода издавна служит вам широкой и удобной дорогой. Много столетий на вашей планете морские и речные пути связывали между собой страны и населенные пункты, давая возможность передвигаться, осваивать новые земли, наиболее быстрым и дешевым способом перевозить товары на большие расстояния.
Вода на Земле является естественной средой обитания для многих живых существ. Одни из них живут в солёной воде, другие — в пресной.
Какими
же свойствами обладает вода? Чтобы выяснить это, я провел
несколько опытов.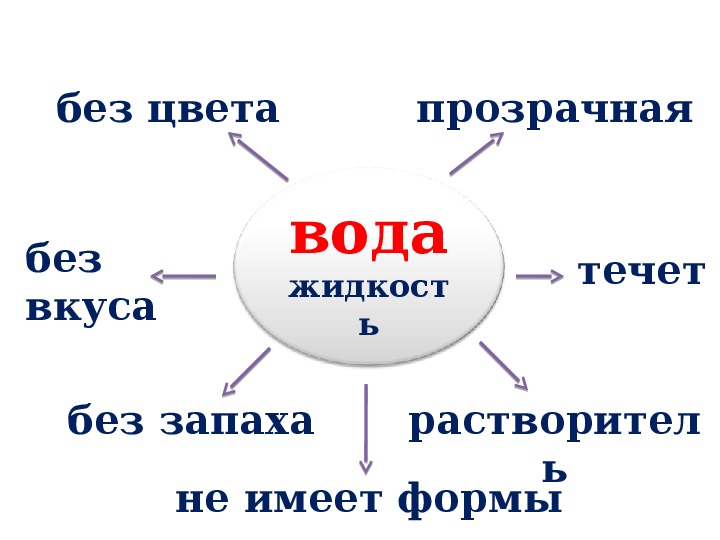 Результаты записывал в свой блокнот.
Результаты записывал в свой блокнот.
Опыт 1. Сначала я взял стакан с водой, потом опустил в него монетку. Монетка была видна сквозь слой воды. Значит, вода прозрачна. И в этом вы не раз убеждались, когда смотрели на домашний аквариум. Ведь сквозь воду можно увидеть и водоросли, и песок, и камешки, и рыбок.
Опыт 2. Я взял стакан с водой и веер из цветных полосок. Стал сравнивать цвет воды в стакане с цветом полосок. Оказалось, что цвет воды совершенно не совпадал ни с одним из цветов. Я сделал вывод, что вода бесцветна.
Опыт 3. Я снова взял стакан воды, а ещё пирожки, конфеты и чашечку кофе. Я поочерёдно понюхал все эти предметы. Оказалось, что
Опыт
4. Снова мне пригодился стакан с водой. Я добавил туда кусочек сахара и
размешал. Через несколько минут увидел, что сахар пропал, растворился в
воде. Вывод: вода — растворитель.
Дальше мне не стало интересно, все ли вещества растворяет вода?
На этот раз я бросил в стакан с чистой водой немного самого обыкновенного песка. Хорошо размешал. Подождал несколько минут и ещё раз размешал. Песок не растворился в воде. Значит, вода растворяет не все вещества.
Потом я подумал: как ведёт себя вода, если её нагреть?
На этот раз я взял колбу с трубкой, заполненную подкрашенной водой. Опустил колбу в горячую воду. Через некоторое время подкрашенная вода стала подниматься по трубочке. Следовательно, вода расширяется при нагревании.
Что будет, если воду охладить? Эту же колбу с трубочкой я поставил в тарелку со льдом. Вода в трубочке начала опускаться. Значит, вода при охлаждении сжимается.
Свойства воды
Давайте
ещё раз посмотрим на то, что я записал в свой блокнот. Вода
— прозрачная, бесцветная жидкость, не имеющая запаха. Вода
— растворитель, но растворяет не все вещества. При нагревании вода
расширяется, при охлаждении — сжимается.
Вода
— прозрачная, бесцветная жидкость, не имеющая запаха. Вода
— растворитель, но растворяет не все вещества. При нагревании вода
расширяется, при охлаждении — сжимается.
Свойства воды — урок. Окружающий мир, 3 класс.
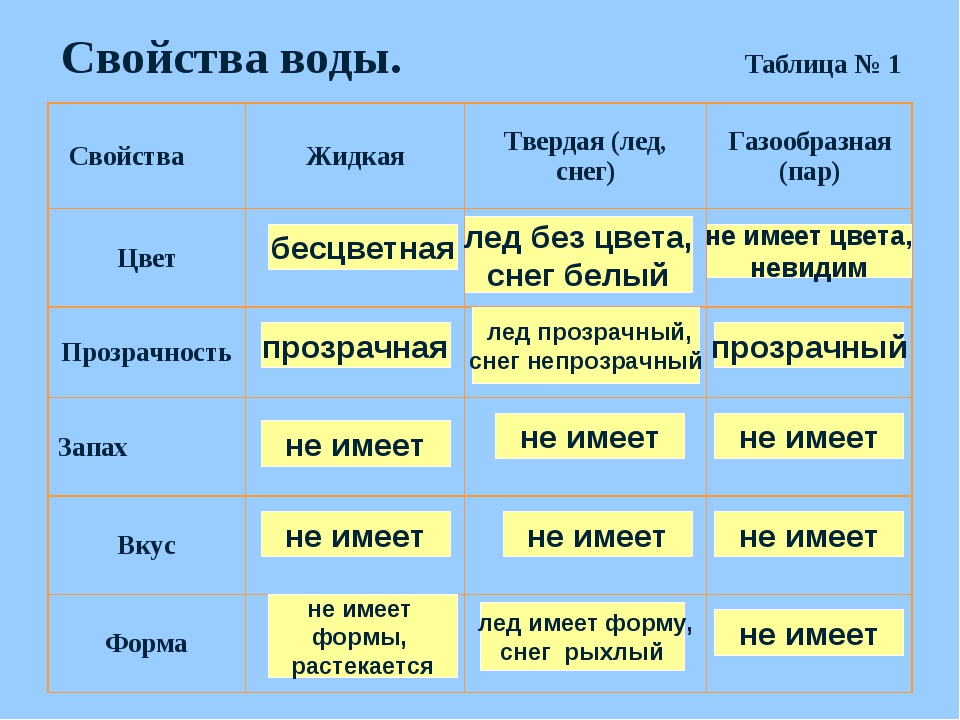
Вода — самое распространённое вещество на нашей планете. Вспомним её свойства.
При комнатной температуре вода жидкая. Она принимает форму сосуда, в котором находится.
Рис. \(1\). Вода принимает форму сосуда
Вода текучая, как и все жидкости. Поэтому на земле есть реки, ручьи и водопады, а в наш дом она может поступать по водопроводу.
Рис. \(2\). Вода текучая
Вода бесцветная и прозрачная, и мы хорошо видим обитателей водоёма или аквариума.
Рис. . \(3\). Вода бесцветная и прозрачная
. \(3\). Вода бесцветная и прозрачная
Вода не имеет запаха и вкуса.
Вода растворяет многие вещества. Если в воду насыпать соль и перемешать, то соль как бы пропадает. Вода остаётся прозрачной, но становится солёной. Это происходит потому, что частицы соли перемешиваются с частицами воды.
Рис. \(4\). Вода — растворитель
Растворяются в воде и другие вещества: сахар, уксус, спирт.
Но известно много веществ, которые в воде не растворяются. Если смешать с водой песок, то вода станет мутной, а песок через некоторое время осядет на дне сосуда.
Рис. \(5\). Вода и песок
Не растворяется в воде мел и некоторые жидкости, например, растительное масло и бензин.
Для очистки воды от примесей твёрдых веществ используется фильтрование. Мутную воду пропускают через фильтр (специальную бумагу или ткань). На фильтре оседают твёрдые частицы, а вода становится чистой.
Мутную воду пропускают через фильтр (специальную бумагу или ткань). На фильтре оседают твёрдые частицы, а вода становится чистой.
Рис. \(6\). Фильтрование
При нагревании вода расширяется, а при охлаждении сжимается.
Рис. \(7\). Сжатие воды при охлаждении
Источники:
Рис. 1. Вода принимает форму сосуда https://image.shutterstock.com/image-photo/water-splash-pitcher-into-glass-600w-158373875.jpg
Рис. 2. Вода текучая https://image.shutterstock.com/image-photo/water-tap-faucet-flow-bathroom-600w-1833087562.jpg
Рис. 3. Вода бесцветная и прозрачная https://www.shutterstock.com/ru/image-photo/goldfish-fishbowl-716133220
Рис. 4. Вода — растворитель https://www.shutterstock.com/ru/image-photo/pouring-sugar-into-saucepan-boiling-water-162244724
Рис. 5. Вода и песок https://www.shutterstock.com/ru/image-photo/science-experiment-heterogeneous-mixture-water-sand-1490431379
5. Вода и песок https://www.shutterstock.com/ru/image-photo/science-experiment-heterogeneous-mixture-water-sand-1490431379
Рис. 6. Фильтрование © ЯКласс
Рис. 7. Сжатие воды при охлаждении © ЯКласс
Конспект «Вода и свойства воды»
Конспект урока
Тема: Вода, вода, кругом вода.
Цель: Познакомить учащихся с некоторыми свойствами воды; показать значение воды
для живых организмов; воспитывать бережное отношение к природе.
Ход урока: 1. Организационный момент.
Улыбнемся друг другу, пожелаем хорошего дня и начнем наш урок.
2. Проверка домашнего задания.
Загадка: Без чего человек не проживет и часа?
Дети: Воздух.
Учитель$: Правильно, о воздухе.
— Что Вы можете рассказать о воздухе?
— Какие свойства, состав воздуха сможете назвать?
-Отлично
3.Формирование новых понятий.
Эпиграф урока: «Нельзя сказать, что ты необходима для жизни, ты — сама жизнь…
Ты — самое большое богатство на свете…» Антуан де$ Сент-Экзюпери
У: Кто-то догадался о чем речь? А теперь послушайте другую загадку.
$ Загадка: Я и туча, и туман
И ручей, и океан
Я летаю и бегу
И стеклянной быть могу.
У: О чём идёт речь?
Д: О воде.У: Чему посвящен наш урок?
Рассмотрите рисунки и расскажите о том, где в природе встречается вода?Для чего она нужна? Обо всём об этом мы сейчас узнаем.
История о воде.
У: Послушайте одну историю.(Рассказывают дети)
Однажды в одном прекрасном, цветущем краю жили и радовались жизн$ью люди.Но случилась беда. Постепенно райский уголок стал пропадать. Погибли леса и цветущие сады, но самое страшное было ещё впереди, постепенно стали пересыхать водоёмы. Жизнь в этом, когда-то цветущем месте стала невозможной. И люди стали покидать свои родные места. Но многие из них были просто не в состоянии пройти большое расстояние, а без воды им грозила верная смерть. И тогда один человек взялся спасти свой народ. Ведь его родители были уже старыми и $немощными.
Он отправился в долгий путь. Много дней и ночей без отдыха и пищи шёл он, чтобы скорее добраться до ценного источника. Он сумел достать целебный напиток.
Но случилось непредвиденное. Сосуд, в котором он нес воду, опрокинулся, а вода вылилась.
Парень: Ах, что же я сделал, что же мне теперь делать без воды, ведь мой народ может погибнуть?
Тогда вода сказала: Не печал$ься, я вернусь к тебе снова, совершив свои превращения: испарение, конденсацию, осадки. А ты наблюдай за происходящим и чини сосуд.
У: Ребята, давайте поможем нащему герою быстрее добраться до истины и выяснить что такое вода. Вы готовы помочь? Тогда в путь. Как вы думаете, что такое вода?
Д: Жидкость.
У: Что ещё можно сказать о воде? Проведём опыты.
Опыт1:
У: У вас на столе стаканы с водой. Возьмите стаканы в руки, что стало с водой.
Д: Вода плещется.
У: Потому что она жидкая.
У: Определите вкус.
Д: Без вкуса.
У: А Если у воды есть вкус?
Д: значит вода загрязнена.
У: Определите запах.
Д: Без запаха.
У: Опустите ложку. Что вы видите?
Д: Видно ложку.
У: Это говорит о том, что вода прозрачная.
Запишем наши выводы в тетрадь.
4. Обобщение:
У: Еще раз сделаем вывод о свойствах воды.
Д: Жидкость без вкуса, без запаха, без цвета} все это свойство воды.
У: В каком состоянии бывает вода?
У: В нормальном состоянии она жидкость, а под воздействием температуры она меняет свое состояние, при 0° — лёд, а при 100°- пар.
У: Давайте проведём опыт и убедимся в этом.
1 опыт: У: Нагреем воду, подставим зеркало. Что вы увидели?
Д: На зеркале появились капельки.
У: Под воздействием высокой температуры вода превратилась в пар
2 опыт: У: Вытрите доску мокрой тряпкой.
У$: Что вы увидели?
Д: След от тряпки быстро исчез.
У: Вода с доски быстро испарилась, то есть превратилась в пар – прозрачный,бесцветный газ.
У: Следующее наблюдение: вы принесли с собой кусочки льда. А что такое лёд?
Д: Лёд – это тоже вода, только в замороженном состоянии.
$5. Вывод: Вода может быть в трёх состояниях: твердом, жидком, газообразном.
У: Поговорим о главном свойстве воды. Вода – один из самых сильных растворителей. Что значит растворитель?
Д: Она способна растворить какие –то предметы.
У:Она способна растворить любую горную породу на земной поверхности в зависимости
от того, что и в каком количестве растворено в воде.
У: Проведём ещё несколько опытов и убедимся, что вода является сильным растворителем.
$
Дети растворяют в воде соль, сахар, перманганат калия (марганцовка).
У: Ребята, а вы знаете, откуда пришла к нам вода. Тогда послушайте стихотворение. (Читает ребенок)
Тогда послушайте стихотворение. (Читает ребенок)
Спросил на днях
Малыш-сосед
У струйки, льющейся из крана:
«Откуда ты?»
Вода в ответ: «Издалека, из океана»
Пот$ом малыш гулял в лесу
Росой искрилася поляна.
— Откуда ты? – спросил росу.
— Поверь, и я из океана.
— Ты газировка, что шипишь?
И из бурлящего стакана
Донесся шепот: «Знай, малыш.-
И я пришла из океана$».
На поле лёг туман седой.
Малыш спросил и у тумана:
— Откуда ты? Ты кто такой?
— И я, дружок, из океана!
Удивительно, не так ли?
В супе, в чае, в каждой капле,
В звонкой льдинке. и в дождинке,
И в росинке, и в снежинке.
Нам откроется всегда
Океанская вода!
У: Ребята, а какую мы пьём воду?
Д: Очищенную пресн$ую воду ту, что течёт из крана.
У: Чтобы попасть к нам из крана в дом, вода проходит долгий путь.
Большая часть нашей планеты покрыта водой. Но не вся вода, которая существует в природе, пригодна для пития. От нерационального использования, питьевой воды на земле с каждым годом становиться меньше.
Главное хранилище пресной воды на планете являются ледники. $Ледники содержат около 130 млн. кубометров воды. Крупным резервуаром пресной воды являются и болота.
Д: А разве можно пить болотную воду, она же грязная и не пригодная для пития?
У: Для того, чтобы она стала пригодной сначала её нужно очистить, ведь в ней находиться большое количество вредных микробов, минеральных и органических примесей.
Воду очищают на специальных станциях. Сначала её фильтруют через слой песка. Затем обрабатывают окислит$елем – хлором или озоном. Особенно строго следят за качеством питьевой воды в период таяния снегов и весенних паводков, т.к. в воду попадают различные примеси и удобрения с полей. Самой вкус$ной считается родниковая вода.
Самой вкус$ной считается родниковая вода.
Чистая пресная вода – большая ценность но, к сожалению, её природные ресурсы исчерпаемы, поэтому воду нужно беречь, разумно расходовать и защищать от загрязнения.
Помните, без воды нет жизни на земле.
Вода: Ну к$ак? Поняли. Что такое вода? Смотрите, как ярко светит солнце, сейчас часть меня испариться и легким облачком поднимется вверх, а часть просочиться в почву.
Ждите меня! (убегает).
У: Мы с вами употребляем пресную воду, которая образуется в результате чудесных превращений.
Послушайте рассказ о превращении воды.
После стирки мама вылила воду на траву. И вода высохла, как ей и полагается. А когда вода высыхает, она превращается в пар.
У: — А вы знаете, что такое пар?
Это маленькие-маленькие капли. А так как они легкие. Совсем-совсем легкие, то они все поднимаются к верху.
У : Вода не просто высыхает а, просочившись в землю, следует закону всемирного тяготения. Часть её опускается до водоносного слоя грунтовых вод. Люди роют колодцы и достают воду из этих слоёв. Если вода попадёт в нескальные породы — получаются родники. В течение дня вода луж, озёр, морей, влага, содержащаяся в растениях и животных нагревается солнцем и испаряется. Ускоряет испарение и ветер. Поднимая$сь пар, охлаждается и конденсируется – превращается в капельки. Облако – это ка$пельки воды. Если вода конденсируется у поверхности земли – это туман.
Часть её опускается до водоносного слоя грунтовых вод. Люди роют колодцы и достают воду из этих слоёв. Если вода попадёт в нескальные породы — получаются родники. В течение дня вода луж, озёр, морей, влага, содержащаяся в растениях и животных нагревается солнцем и испаряется. Ускоряет испарение и ветер. Поднимая$сь пар, охлаждается и конденсируется – превращается в капельки. Облако – это ка$пельки воды. Если вода конденсируется у поверхности земли – это туман.
У: Проведём опыт.
Опыт:
Нальём в бутылку горячую воду, сверху накроем её льдом, внутри образовался туман.
У: Так испаряется вода из ручья, из пруда, из большого моря, отовсюду поднимаются облачка пара. На верху в небе, они соединяются в большое облако. Облака лёгкие, и ветер
переносит их порой на очень большие расстояния. Из облака вода возвращается на землю в виде дождя и снега. Так происходит круговорот воды в природе.
У: Послушайте рассказ.
Дело было летом. Было жарко. На горе лежал теплый ветер и грелся на солнышке.
Было жарко. На горе лежал теплый ветер и грелся на солнышке.
А там сзади, за лесом, прятался холодный ветер.
Теплому ветру было жарко, он уже совсем высох и был легкий, как перышко. И чем теплее грело солнце, тем легче он становился. И когда теплый ветер уже не мог вынести жары. Он поднялся и улетел к верху. Этого как раз и ждал холодный ветер и сейчас же выскочил из-за леса. И полетел туда, где раньше лежал теплый ветер. Но посмотри, что делает холодный ветер! Он схватил нашу тучу и стал носиться с ней по небу.
А как только он схватил тучу, она сразу потемнела. И везде стали появляться другие чёрные тучи.
Что же делали наши капельки? Они испу$гались холодного ветра и быстро побежали друг к другу. И вот из них уже получились капельки побольше. Те опять испугались, опять бросились друг к другу, и из них получились капельки ещё больше. И так они сливались до тех пор, пока не получились большие тяжёлые капли, такие капли слишком $тяжёлые, чтоб продолжить парение и они стали падать на землю.
Вот так образуются водные капли, которые падают на землю в виде дождя.
У: А что такое дождь, дождь это осадки. Водяные капельки парят в небе, если холодает, капельки сливаются: сотни, тысячи и образуют одну полновесную каплю, от тяжести они падают на землю.
Есть такие места на земле, где человек под дождём остаётся совершенно сухим, потому что и сам дождь сухой. Это явление набл$юдается в пустыне, где воздух совершенно сух. Облака здесь – редкое явление, и ещё реже выпадает дождь. Но даже когда это бывает, дождевые капли часто испаряются в воздухе, не достигнув земли. Вы видите как идёт дождь, стоите под ним, но не чувствуете.
У: А какие осадки ещё бывают?
Д: Туман, снег, град, роса, иней.
$У: Туман – это скопление в атмосфере капелек воды, настолько мелких, что они висят в воздухе. Иногда вме$сто капелек в виде тумана в воздухе взвешены ледяные кристаллы. Туман образуется в результате либо конденсации водяного пара, либо из-за испарения в холодный воздух воды с водоемов.
У: Если температура внутри облака ниже точки замерзания, то образуются не капельки воды, а сразу ледяные кристаллики шестигранных снежинок. Снег – это вода, замерзшая
в виде мельчайших очень красивых кристалликов льда. Только лёд прозрачный. А снег белый. Почему так происходит?
У: Кристаллики их, к$оторых образуется снег, беспорядочно обращены в разные стороны, они отражают свет по всем направлениям и не задерживают ни малейшей части падающего на них белого цвета и целиком отражают его, поэтому снег и кажется нам белым.
Физкультминутка.
У: Град – явление кратковременное. Длиться он обычно несколько минут, часто с перерывами. Однако бывают и иные случаи.
н: в 1959 году в США град шёл в течении 1.5 часов и образовал на поверхности земли завалы льда высотой около полуметра. Самая большая градина в мире была найдена во время ле$тней грозы в 1902 году в Китае. Её вес достигал 4.5 кг.
У: Роса́ — вид атмосферных осадков, образующихся на поверхности земли, растениях, п$редметах, крышах зданий, автомобилях и других предметах.
У: И́ней — вид атмосферных осадков, представляющих собой тонкий слой ледяных $кристаллов, образующийся из водяного пара атмосферы. Часто сопровож$дается туманом.
Вода: Вот и вернулась я к тебе, набирай скорее, не зевай, спасай свой народ!
Но только ответь на мой вопрос и вы ребята помогите, откуда надо набрать воды для питья – из лужи, морскую, из реки, из болота, из родника?
Д: Из родника.
Рефлексия: (На доске облако и темная туча)
У: Если вы все поняли на уроке, то нужно повесить капельку на облачко, нет- на тучку)
ВыводУ: Что нового и интересного в$ы узнали о воде? Назовите свойства воды. Назовите
в каком состоянии может быть вода? Назовите что такое конденсация, круговорот воды
в природе? Назовите виды осадков?
Вывод:
У: Вода – важнейший дар природы, источник жизни. Когда её мало – снижаются урожаи растений, продуктивность животных: когда её нет – отсутствует жизнь.
Когда её мало – снижаются урожаи растений, продуктивность животных: когда её нет – отсутствует жизнь.
Главное хранилище вод – Мировой океан. Запасы пр$есной воды невелики. Да и то большая часть её находиться в твёрдом состоянии в виде ледников Антарктиды, Арктики, и на горах. Если лёд равномерно распределить он покроет землю слоем в 53 метра, а если растопить, то уровень мирового океана поднимется на 64 метра. Но это не значит, ч$то воду не нужно беречь. По прогнозам учёных к 2040 году цена на воду будет приравниваться цене нефти.
Трудно с уверенностью утверждать о том, что роль и важность воды регламентированы для нас абсолютно. На всей суше ни растения, ни животные, ни, тем не менее, человек, не смогут порвать все связи с океанами, мор$ями и реками, потому что они не способны выжить без воды, без питьевой воды. Что было бы с нами? В таком случае жизнь на нашей планете не имела способность бы даже появиться. Непосредственно воде планета обязана возникновением и развитием жизни, в таком случае, не будь ее, не было бы и нас. Отсюда следует, что$ ни один живой организм не выжил бы, а жизнь бы не возникла. Не будь воды, не знали бы мы ее строения, ее свойств, ее значимости, ее характеристик, не знали бы мы что есть жизнь.
Отсюда следует, что$ ни один живой организм не выжил бы, а жизнь бы не возникла. Не будь воды, не знали бы мы ее строения, ее свойств, ее значимости, ее характеристик, не знали бы мы что есть жизнь.
Берегите воду! Вода незаменима ни одними сокровищами мира. И тогда наша голубая от воды планета Земля будет в надежных руках.
Конспект урока по окружающему миру на тему «Вода. Свойства воды. Берегите воду! » 3 класс
/data/files/x1604394280.pptx (Презентация. Вода.)Тема: Вода. Свойства воды. Берегите воду! (УМК «Школа России»)
Коновалова Евгения Валерьевна
МАОУ Омутинская СОШ №2
Цель: обобщить и расширить знания учащихся о воде, об использовании воды человеком и мерах ее охраны.
Задачи:
1) изучить свойства воды;
2) воспитывать бережное отношение к водным ресурсам.
3)развитие наблюдательности, умение сравнивать, анализировать, обобщать;
4)развитие познавательного интереса детей в процессе экспериментирования, установление причинно-следственной зависимости, умение делать выводы.
Планируемые результаты:
Познавательные УУД:
-поиск и выделение необходимой информации из текста в соответствии с заданием;
-умение определять и различать свойства воды;
-рассказывать о загрязнении воды с помощью модели;
— способность и умение учащихся производить простые логические действия (анализ, сравнение).
Коммуникативные УУД:
—умение объяснять свой выбор, строить фразы, отвечать на поставленный вопрос, аргументировать;
-умение высказывать предложения о том, почему нужно беречь воду;
-умение формулировать выводы из изученного материала, отвечать на итоговые вопросы и оценивать достижения на уроке;
-умение работать в группах, учитывая позицию собеседника;
-организовать и осуществить сотрудничество с учителем и сверстниками.
Регулятивные УУД:
-развивать способность принимать и сохранять учебную задачу;
-различать способ и результат действия, выполнять учебные действия, вносить коррективы в действия.
Личностные УУД:
— учебно-познавательный интерес к новому учебному материалу;
-ориентация на понимание причин успеха в учебной деятельности;
— ориентироваться на бережное отношение к природе, формировать позицию эколога;
-способность к самооценке на основе критериев успешности учебной деятельности.
Оборудование: интерактивная панель, презентация, таблицы, наклейки, лабораторная посуда: стаканы, фильтры, стеклянные палочки, воронки.
Материалы: вода, сахар, песок, грушевая эссенция.
План урока
I. Организационный момент.
Организационный момент.
II. Введение в тему урока.
1. Актуализация знаний.
III. Работа по теме урока.
1.Беседа о том, что такое вода.
IV. Физкультминутка.
V. Практическая часть.
1.Инструктаж по технике безопасности.
2. Проведение опытов.
3. Игра «Береги воду!».
VI. Итог урока.
VII. Рефлексия.
VIII. Домашнее задание.
Конспект урока
I.Организационный момент
II.Актуализация знаний.
Самоопределение к деятельности
— Назовите самую главную жидкость на земле. (Вода.)
(Вода.)
— В каких трех состояниях находится вода в природе?
— Приведите примеры воды в природе, находящейся в ком состоянии. (Водоемы наземные, водоемы подземные дождь, роса.)
— Приведите примеры воды в природе, находящейся в твердом состоянии. (Снег, иней, ледник на вершине горы, град лед.)
— Приведите примеры воды в природе, находящейся в газ образном состоянии. (Пар, туман.)
— Почему вода? Докажите.
— Сегодня на уроке будем говорить о воде и ее свойствах.
III.Работа по теме урока
1. Беседа
Что такое вода
Если быстро раскрутить глобус, покажется, будто он одноцветный — голубой. А все потому, что этой краски на нем много больше, чем желтой, белой, зеленой, коричневой. Голубой краской изображена на глобусе вода — все моря и океаны нашей планеты. Они занимают в два раза больше места, чем суша.
Они занимают в два раза больше места, чем суша.
Океаны, моря, бесчисленные озера и реки, речки… Не ели ком ли много на свете воды? Нет, как раз столько, сколько ну но, чтобы наша планета не замерзла. Ведь Мировой океан что-то вроде гигантского котла центрального отопления Земли ! Солнце все лето греет его воду, а зимой эта прогретая вода степенно отдает свое тепло Земле. Чем не отопление? Без неё на Земле наступят такие жестокие морозы, что погибнет все живое: и звери, и птицы, и леса, и поля…
Есть у Мирового океана и другая великая забота — поить Землю. Воду пьют все на свете поля, все на свете леса. Без нее не могут жить ни звери, ни птицы, ни люди.
Но вода не только всех поит, она еще и кормит. Моря-океаны днем и ночью бороздят тысячи больших и малых рыболовных судов.
Вода работает на гидроэлектростанциях — добывает электрический ток.
И моет всех тоже вода. Умываются люди, умываются машины, принимают душ города и дороги. ..
..
А еще вода — самая широкая, самая удобная дорога. По бесчисленным рекам, по океанам и морям день и ночь плывут суда— плывут тяжелые грузы и пассажиров.
Без воды не замесить тесто для хлеба, не приготовить бетон идя стройки, не сделать ни бумагу для книжек и тетрадок, ни ткань для одежды, ни резину, ни металл, ни пластмассу, ни лекарства, ни конфеты — ничего не сделаешь без воды!
Вот она какая, вода!
— Какую роль играет вода на Земле? (Вода греет, поит, кормит, моет Землю, добывает электрический ток, вода — это дорога, вода нужна на промышленных предприятиях.)
— Прочитайте текст в учебнике на с. 51.
— Кроме Мирового океана, где еще есть вода? (Вода входит в состав любого живого организма.)
— Как узнать, сколько воды в организме человека? (Нужно массу тела разделить на 3, а полученное число умножить на 2.)
— Вычислите, сколько воды в вашем организме. (Ученики выполняют задание.)
(Ученики выполняют задание.)
IV. Физкультминутка.
V. Практическая часть.
1. Инструктаж по технике безопасности.
2. Практическая часть.
Опыт 1. «Вода прозрачная»
Перед детьми стакан с водой. Доказать, что вода в стакане прозрачная.
Через стакан с водой показать рисунок, определить, что изображено на рисунке.
Вывод: Вода прозрачная, через нее видны предметы.
Опыт № 2. «Вода не имеет цвета, но её можно покрасить».
Налить в несколько стаканов воду. Какого цвета вода? (У воды нет цвета, она прозрачная). Воду можно подкрасить, добавив в неё краску. (Дети наблюдают за окрашиванием воды). Какого цвета стала вода? (Красная, синяя, жёлтая, красная). Цвет воды зависит от того, какого цвета краску добавили в воду.
Вывод: Вода не имеет цвета. Что может произойти с водой, если в неё добавить краску? (Вода легко окрашивается в любой цвет).
Что может произойти с водой, если в неё добавить краску? (Вода легко окрашивается в любой цвет).
Опыт № 3 «Запах воды»
Стакан чистой воды, стакан с лимонной эссенцией.
Чем пахнет вода? После ответов попросите их понюхать воду в стаканах
Вывод: Вода не имеет запаха, она пахнет тем веществом, которое в нее добавлено.
Опыт 4 «Вода-растворитель»
В один стакан с водой насыпать речной песок, размешать. Растворился песок или нет? В другой стаканчик насыплем ложечку сахарного песка, размешаем его. Что наблюдаем? В третий стаканчик насыплем измельченный мел и размешаем. В каком из стаканчиков произойдет растворение?
Вывод: Бывают вещества хорошо растворимые, малорастворимые и нерастворимые в воде.
Опыт № 5. «Как очистить воду»
Взять сосуд с воронкой, на дно воронки положить бумажную салфетку, вату, слой бинта.
Взять другой сосуд с грязной водой и переливать её через воронку в пустой сосуд. Грязь будет оседать на фильтре, а сосуд наполнится чистой водой.
Затем ещё раз пропустить через фильтр и получим чистую воду.
Дети проводят опыт самостоятельно.
Вывод: Воду можно профильтровать.
3. Игра «Береги воду!»
Бережное отношение к воде
Воды на Земле одновременно и много, и мало. Ее много в морях и океанах, но морская соленая вода непригодна для питья, а также для многих технических производств и сельского хозяйства. Для людей и промышленности нужна пресная чистая вода.
Пресной воды существенно меньше, и треть населения земли испытывает в ней острый недостаток. Основные запасы пресной воды сосредоточены в полярных льдах. Ограниченные запасы пресной воды еще больше сокращаются из-за загрязнения.
Вопросы:
Свойство воды, которое мы используем каждый день? (вода растворитель)
Какая вода пригодна для питья? (пресная)
Почему нельзя пить воду из реки, озера, пруда? Прочитайте текст на с. 60—62.
60—62.
Может ли человек прожить без воды? (нет)
Ограничены ли запасы воды? (ограничены)
Сколько воды в день нужно человеку для разных нужд? Найдите в учебнике на с.59. (20-50 л.)
Сколько воды в день нужно семье из четырех человек? (80-200 л.)
Как люди охраняют воду от загрязнения?
Как каждый человек должен беречь воду?
VI. Итог урока.
— Почему вода — самая главная жидкость на свете?
Вода — одно из главных богатств на Земле. Трудно представить, что стало бы с нашей планетой, если бы исчезла пресная вода. А такая угроза существует. От загрязнения воды страдает живое, опасно это и для жизни человека. Поэтому воду — наше главное богатство — надо беречь!
— Что нового вы узнали на уроке?
VII. Рефлексия.
Игра «Три М».
Учащимся предлагается назвать три момента, которые у них получились хорошо в процессе урока, и предложить одно действие, которое улучшит их работу на следующем уроке.
VIII. Домашнее задание.
В учебнике, прочитать текст на с. 51—54. Выполнить задание в рабочей тетради №7.
Приложение 1.
СВОЙСТВА ВОДЫ | |
Что делаем | Вывод |
Опыт 1.Проверили прозрачность воды. | |
Опыт 2. Определили цвет воды. | |
Опыт 3. Проверили есть ли запах у воды. | |
Опыт 4.Изучили растворимость веществ в воде. | |
Опыт 5. Фильтруем воду. | |
Оценка выполненной работы | |
СВОЙСТВА ВОДЫ | |
Что делаем | Вывод |
Опыт 1.Проверили прозрачность воды. | |
Опыт 2. Определили цвет воды. | |
Опыт 3. Проверили есть ли запах у воды. | |
Опыт 4.Изучили растворимость веществ в воде. | |
Опыт 5. Фильтруем воду. | |
Оценка выполненной работы | |
Урок окружающего мира по теме «Вода в природе. Основные свойства воды». 3-й класс
Цель: знакомство с основными свойствами воды и использование их человеком.
Задачи:
Образовательные:
Развивающие:
- учить наблюдать, сравнивать, делать выводы;
- развивать познавательный интерес, наблюдательность и любознательность детей;
- способствовать развитию логического мышления.
Воспитательные:
- учить бережному отношению к воде и её экономии;
- воспитывать умение работать в коллективе.

Оборудование:
-
Полоски цветной бумаги: голубая, синяя, белая, зелёная.
- Глобус.
- Набор лабораторного оборудования.
- Вещества для проведения опытов: вода, соль, сахар, речной песок.
- Тетрадь на печатной основе по курсу “Окружающий мир”, учебник “Мир вокруг нас” 3 класс автор А.А.Плешаков.
- Тесты для проверки домашнего задания.
- Презентация.
Тип урока: урок-исследование.
Форма проведения урока: групповая.
Приложение 1
Ход урока
1. Организационный момент.
Ну-ка проверь, дружок,
Ты готов начать урок?
Всё ль на месте,
Всё ль в порядке,
Ручка, книжка и тетрадка?
Все ли правильно сидят?
Все ль внимательно глядят?
Каждый хочет получать
Только лишь оценку “5”.
Речевая разминка.
– Какое сейчас время года?
– Назовите осенние месяцы?
– Изменилась ли температура воздуха с наступлением осени?
– Можно ли купаться в эту пору? Если нет, то почему?
– С каких деревьев уже опадают листья?
– Продолжите осенние приметы:
– Гром в сентябре (к тёплой осени).
– Много рябины (к дождливой осени).
– Что вы испытываете, глядя на яркие разноцветные наряды деревьев?
3. Проверка домашнего задания.
Работа учащихся с тестами. Тест у каждого обучающегося. Учитель читает задание вслух, учащиеся про себя, затем обводят в кружок правильный ответ.
Тест:
1. Что такое воздух?
а) Воздух – смесь газов. Состоит из азота, кислорода и углекислого газа;
б) Воздух – вещество, в котором много других веществ, например, кислорода, воды, облаков, пыли, туч, углекислого газа.
2. В каком случае основные свойства воздуха указаны верно?
а) голубой цвет, хорошо проводит тепло, упругий, не имеет запаха, прозрачный;
б) бесцветный, плохо проводит тепло, не имеет запаха, прозрачный.
3. Что происходит с воздухом при нагревании?
а) при нагревании воздух расширяется?
б) при нагревании воздух сжимается.
4. Какой воздух мы поглощаем при дыхании?
а) углекислый газ?
б) кислород;
в) азот.
4. Сообщение темы и задач урока.
Вещество, о котором мы будем говорить сегодня на уроке, вы узнаете из загадки:
Без чего не может мама
Ни готовить, ни стирать?
Без чего, мы скажем прямо,
Человеку умирать?
Чтобы дождик лился с неба,
Чтоб росли колосья хлеба,Чтоб варились кисели,
Чтобы не было беды –
Жить нельзя нам без … (воды).Вы догадались верно. Тема нашего урока – вода.
Как бы вы объяснили название темы?
Что вы знаете о воде?
Что хотели бы узнать? (Выслушиваются ответы учащихся)
5. Проблемная ситуация.
В одной из русских народных сказок, героине дают задание “принести воды в решете”. Как вы думаете, она справилась с заданием или нет?
Послушайте ещё одну загадку:
Я и льдинка голубая,
Я и капля дождевая,
Я снежинка вырезная,
Я по травке разлита.
Догадайся, кто же я? (Вода)
Сегодня на уроке вам предстоит стать исследователями воды, провести опыты, узнать о свойствах воды и получить ответы на некоторые свои ответы.
6. Ассоциативный ряд.
– Какие ассоциации у вас возникают, когда вы произносите слово “вода”?
Запишите эти слова. (Ручей, море, река, озеро, снег, град, иней, родник).
Ни умыться, ни напиться
Без воды.
Листику не распуститься
Без воды.
Без воды прожить не могут
Птица, зверь и человек.
И поэтому всегда
Всем везде нужна – Вода!
7. Рассказ учителя с использованием презентации.
– Как вы думаете, много ли воды на Земле?
Посмотрите на глобус. Такой видят космонавты Землю из космоса. Если быстро вращать глобус, то покажется, что он одноцветный – голубой. А всё потому, что краски на нем больше, чем белой, зеленой, коричневой. Голубым цветом изображены моря, океаны нашей планеты.
Вода занимает 3/4 поверхности земного шара. Вода повсюду. Толстый слой воздуха окутывает сплошной оболочкой весь земной шар. И в воздухе находится много воды, пара облаков, туч.
Вода есть и под Землей (родники). Огромные скопления льда находятся у
Северного и Южного полюсов. Там лед на суше и в океане.
Вода входит в состав любого живого организма. Достаточно помять лист растения в руках, и мы обнаружим в нем влагу. Вода содержится во всех частях растений. Вспомни, как много сока в плодах – арбузе, апельсине, лимоне. Этот сок – вода с растворенными в ней различными веществами. Но даже в сухих семенах растений есть вода, хотя не в таком большом количестве.
В теле животных вода обычно составляет больше половины массы. Тело медузы на 90–95% состоит из воды.
Много воды и в теле человека. Наше тело почти на 2\3 состоит из воды. Вода входит в состав крови, которая разносит по всему организму питательные вещества. Испаряясь с поверхности нашей кожи, вода регулирует температуру нашего тела. Вода необходима нашему организму для удаления разных вредных веществ.
Много ли воды в твоем теле, ты можешь сосчитать: массу твоего тела нужно разделить на 3 и полученное число умножить на 2.
Живой организм постоянно расходует воду и нуждается в её пополнении. Например, человеку в сутки требуется 2 литра воды.
Например, человеку в сутки требуется 2 литра воды.
Воду пьют поля и леса. Без неё не могут жить ни звери, ни птицы, ни люди.
Но вода не только поит, но и кормит – по морям, океанам днем и ночью плывут тысячи рыболовных судов.
Вода добывает электрический ток, работая на электростанции. Вода моет всех людей, города, машины, дороги. А еще вода – это самая большая и удобная дорога. По ней днем и ночью плывут суда, везут разные грузы, пассажиров.
Без воды не замесить тесто для хлеба, не приготовить бетон для стройки, не сделать ни бумагу, ни ткань для одежды, ни резину, ни конфеты, ни лекарства – ничего не сделать без воды.
Вот она какая, вода!
Вода – краса всей природы. Эту красоту мы видим повсюду: и в тихой заводи рек, и в глубине рек, и в широте морей и океанов. Реки придают особую красоту местности, по которой они протекают, ни в одной стране мира нет такого количества рек, как у нас.
Какие реки вы знаете?
Покажите их на карте России.
Назовите реки нашей области.
Озёра называют голубыми глазами Земли. Гордостью нашей страны является озеро Байкал.
А знаете ли вы, что озеро Байкал хранит в себе 1/5 пресной воды и более 80% запасов поверхностной воды нашей страны.
Какие моря и океаны вы знаете. Покажите их на карте.
Знаете ли вы, где ещё на Земле встречается вода?
Многим кажется, что они хорошо знают воду. Но оказывается, не так всё просто в природе. В ней ещё много тайн. Учёные стараются разгадать их. А мы пока начнём с простого и постараемся определить свойства воды.
8. Практическая работа.
– Выясним свойства воды, выполняя практическую работу. Постараемся заполнить таблицу, которую вы видите на доске:
| № п/п | Вопрос | Предполагаемые ответы | Ответы после опыта |
| 1 | Какова прозрачность воды? | ||
| 2 | Имеет ли вода запах? | ||
| 3 | Какого цвета вода? | ||
| 4 | Что произойдёт с солью, если её бросить в воду? | ||
| 5 | Можно ли очистить мутную воду? | ||
| 6 | Что произойдёт с водой при нагревании и при охлаждении? | ||
| 7 | Что произойдёт, если воду вылить из посуды? |
Опыт 1.
Какова прозрачность воды?
Подумайте, как можно проверить прозрачность воды?
Какой можно поставить опыт?
В стакан с водой опустите ложку. Видна ли она? О каком свойстве воды это
говорит?
Вывод: она прозрачна.
Опыт 2.
Какого цвета вода?
На столе у вас лежат цветные полоски бумаги. С их помощью мы определим цвет воды. Приложи и сравни цвет воды и цвет каждой полоски.
– Можно ли сказать, что вода синяя, зеленая, красная, желтая, белая? (Нет, цвет воды не совпадает ни с одной из полосок.)
– Как вы видите, вода не окрашена ни в один из этих цветов.
– Каков же цвет воды?
Вывод: вода бесцветна.
Опыт 3.
Каков запах воды?
Когда мама печёт пироги, аппетитный запах ты почувствуешь за дверями квартиры. Тонкий аромат издают духи, цветы.
А чем пахнет чистая вода? Понюхай её и сделай вывод.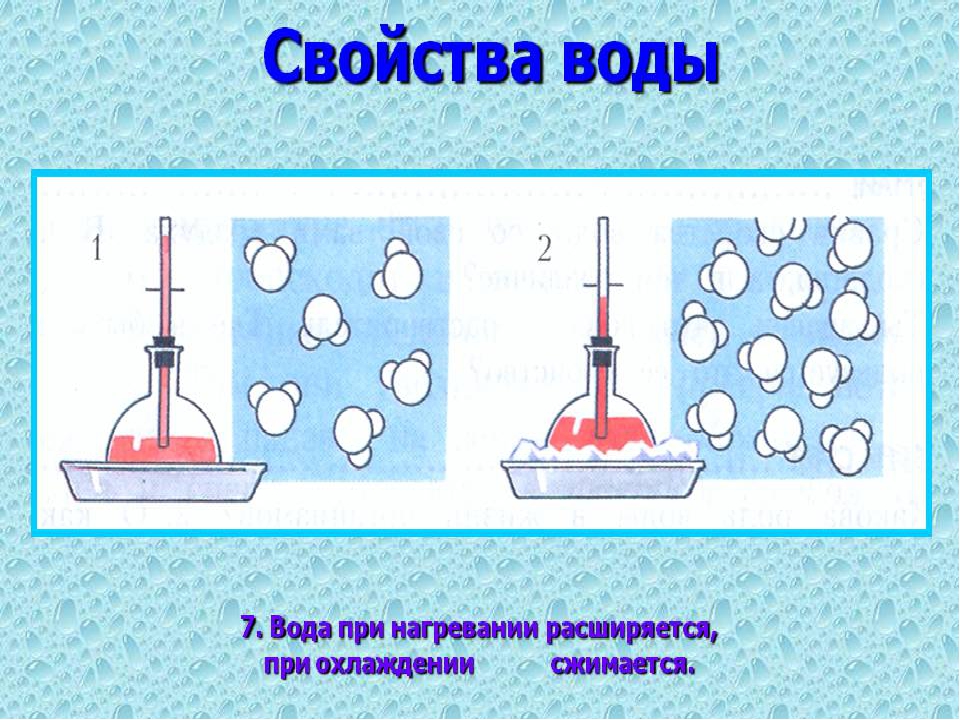
Вывод: вода не имеет запаха.
Опыт 4.
Насыпь в один стакан с водой сахара. Помешай воду.
Что можно заметить?
О чем говорит этот опыт? (Вода растворила сахар.)
Вывод: вода – растворитель.
Вода – универсальный растворитель. Растворяет почти все, даже металлы, например, даже серебро. С давних пор известно народное средство, которым залечивали наружные раны и лечили желудочно-кишечные заболевания. Эту воду можно получить в домашних условиях: опустить в стакан с водой серебряную ложку. Через некоторое время мельчайшие частицы серебра растворятся – этого глазом увидеть нельзя.
Подумайте, где в быту, в жизни, человек использует это свойство воды?
Учитель готовит два стакана: первый – марганцовка, второй – порошок.
Вода растворила марганцовку и порошок. Марганцовку для дезинфекции ран, порошок для лечения больных.
Опыт 5.
Что произойдет с водой, если её вылить из посуды? (Она растекается в
разные стороны.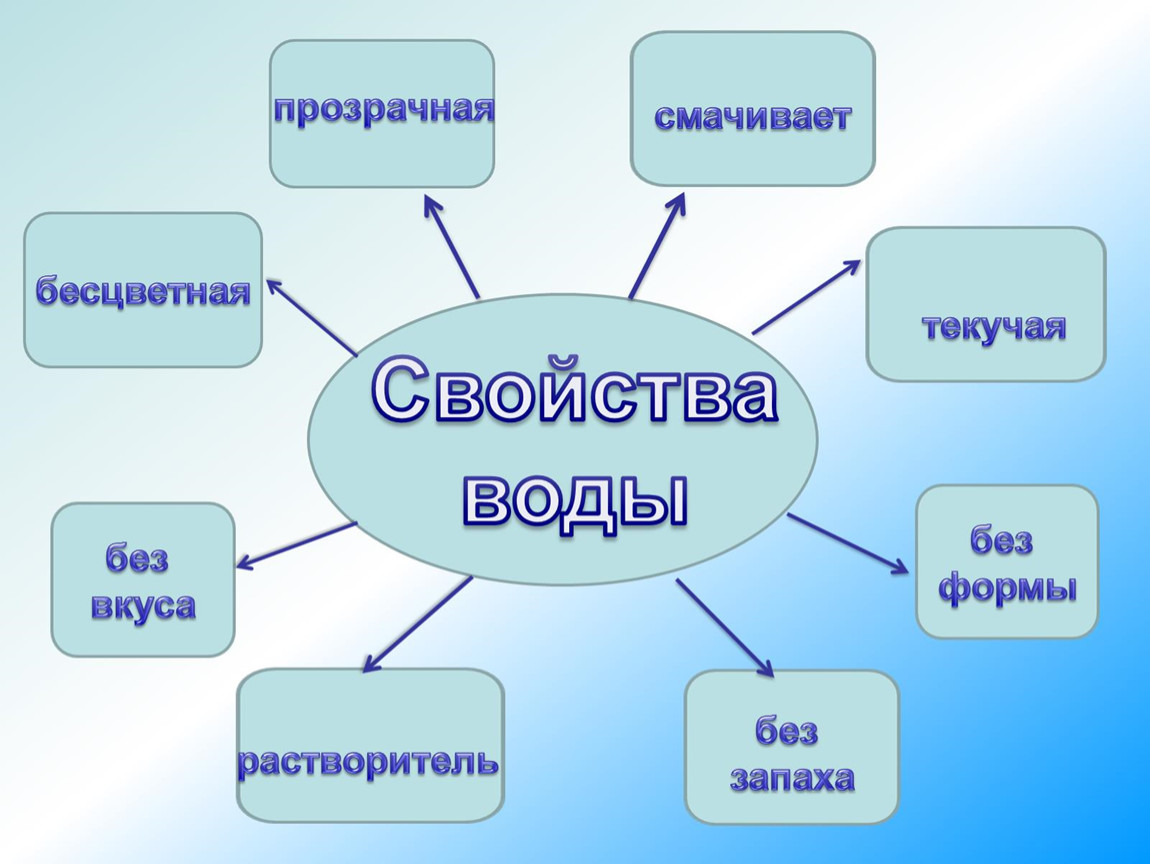 )
)
Что будет происходить с этой водой, если наклонить эту поверхность? (Вода стекает под уклон.)
Можно ли воду из одного стакана перелить в другой?
Во всех этих случаях появляется одно и тоже свойство воды.
Какое?
Вывод: вода течёт (свойство – текучесть.)
Именно этим свойством мы пользуемся, когда умываемся, пьем чай.
Опыт 6.
Насыпаем в стакан с водой мел.
Что произошло?
В воде не растворился мел, есть вещества, которые в воде не растворяются.
Приготовьте фильтр.
Объяснение слова фильтр.
Фильтр – это приспособление для очистки воды. Наш фильтр сделан из ваты. Я
буду вливать мутную воду в воронку. Наблюдайте за водой, которая вытекает из
воронки. Проверьте её на прозрачность. Нерастворенные вещества остались на
фильтре. Такая очистка воды называется фильтрованием. В быту для очистки воды
применяются более совершенные фильтры, чем наш.
Вывод: не растворившиеся вещества остаются на фильтре, а вода проходит через него.
Опыт 7.
Что происходит с водой при нагревании и охлаждении?
Вывод: вода при нагревании расширяется, а при охлаждении сжимается.
В старших классах на уроках физики будете ставить опыты и узнаете еще об одном свойстве воды.
9. Физкультминутка.
Льется чистая водица,
Мы умеем сами мыться.
Порошок зубной берём,
Крепко щеткой зубы трём.
Моем шею, моем уши,
После вытремся посуше.
– О каких свойствах воды вы узнали? (Вода – растворитель, текучесть воды.)
10. Подведение учащихся к выводу.
Для человека очень важно знать свойства воды, так как в своей деятельности он
очень тесно соприкасается со всем живым на нашей планете, чья жизнь невозможна
без воды. Вода – одно из главных богатств на Земле. Трудно представить, что
стало бы с нашей планетой, если бы исчезла пресная вода. А такая угроза
существует. От загрязнения воды страдает все живое, она вредна для жизни
человека. Поэтому воду – наше главное богатство, надо беречь!
Вода – одно из главных богатств на Земле. Трудно представить, что
стало бы с нашей планетой, если бы исчезла пресная вода. А такая угроза
существует. От загрязнения воды страдает все живое, она вредна для жизни
человека. Поэтому воду – наше главное богатство, надо беречь!
Дома следить, чтобы вода не лилась понапрасну.
Чтобы уберечь водоёмы от загрязнения, сточные воды предприятий, ферм, фабрик, заводов пропускают через очистные сооружения. Каждый человек должен беречь воду.
11. Итог урока.
– Много ли воды на Земле?
– Где встречается вода?
– Как можно очистить воду от мути?
– Что нужно делать, чтобы не загрязнять наши водоёмы?
– Как нужно вести себя во время отдыха на реке, чтобы не засорять и не загрязнять её?
– Каковы основные свойства воды?
– Какие свойства воды использует человек?
– Может ли человек жить без воды?
Чтение вывода по учебнику с.52.
12. Домашнее задание.
Домашнее задание.
Ответить на вопросы “Проверь себя” с.52; подготовить сообщения: “Айсберг”, “Туман”.
Урок и презентация «…И про воду. Свойства воды» УМК «Школа России»; 3 класс — Окружающий мир — Начальные классы
ХОД УРОКА
(Слайд 1)
(Слайд 2)
1. Организационный момент
(Звучит песня «Ужасно интересно»)
Уч-ль: Вот опять звенит звонок – начинается урок. Встали ровно и красиво, тихо сели.
Я желаю всем удачи –
За работу! В добрый час!
2. Минута календаря
Уч-ль: Наш урок мы начнем с минуты календаря. Посмотрите в окно.
Скажите, какая погода за окном?
А какой сегодня день?
А кто-нибудь из вас знает, что это за день – 14 октября?
(Слайд 3)
Я ведь не случайно задала этот вопрос. Сегодня 14 октября – Покров. «На Покров до обеда – осень, а после обеда – зимушка-зима». В старину к Покрову крестьянин старался утеплить свой дом: и завалинки привалить, и рамы промазать. «На Покров натопи хату без дров» — говорил народ. Не утеплишь жилье – настрадаешься в холоде.
Не утеплишь жилье – настрадаешься в холоде.
(Щелчок)
По Покрову судили о зиме. «Каков Покров, такова и зима». Ветер с севера дует – к холодной зиме, с юга – к теплой, с запада – снежной, а при переменном ветре и зима будет постоянная. На Покров много мудрых примет у старых людей. Вот одна из них: «Если лист с дуба и березы на Покров упадет чисто – к легкому году, а не чисто – к строгой зиме». И вот сегодня, когда пойдете из школы домой, обязательно посмотрите на березу. А когда наступит зима, то эту примету, мы с вами и проверим.
(Щелчок- картинки уходят со слайда)
3. Сообщение темы и цели урока
Есть много вопросов
У детей и взрослых.
Как найти ответ?
Да очень просто!
В клубе «Почемучек»
Мы рады видеть вас
Приходите!
Адрес: 3 «А» класс
Уч-ль: Ой, ребята, тише, тише. Что-то странное я слышу. Гость какой-то к нам спешит, очень сильно он шумит!
(Щелчок)
(Звук прилета Бабы-Яги. Появляется она)
Баба-Яга: А-а-а! Сами пришли, а меня не пригласили. Бессовестные, хотите меня неучем оставить? Вот я вас сейчас заколдую, и вы ничего не узнаете!
Бессовестные, хотите меня неучем оставить? Вот я вас сейчас заколдую, и вы ничего не узнаете!
Швабра – дабра – кадабра!
Покер – докер – доминокер!
Ничего нового вы не узнаете!
Уч-ль: Неправда, мы все узнаем, не заколдуешь ты нас! Правда, ребята? Не мешай нам Баба-Яга. О чем мы сегодня с вами узнаем? А узнаем мы много интересного о…, а в общем, отгадаете загадку – сами узнаете. Вы готовы? Тогда слушайте:
(Слайд 4)
Не конь, а бежит,
Не лес, а шумит.
Догадались что это такое?
Уч-ся: Вода
Уч-ль: Правильно, это вода.
(Слайд 5)
Полный текст материала Урок и презентация «…И про воду. Свойства воды» УМК «Школа России»; 3 класс смотрите в скачиваемом файле.
На странице приведен фрагмент.
Спасибо за Вашу оценку. Если хотите, чтобы Ваше имя
стало известно автору, войдите на сайт как пользователь
и нажмите Спасибо еще раз. Ваше имя появится на этой стрнице.
Есть мнение?
Оставьте комментарий
Железо — общая характеристика элемента, химические свойства железа и его соединений
Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия). Металл средней активности, восстановитель.
И. Менделеева с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия). Металл средней активности, восстановитель.
Основные степени окисления — +2, +3
Простое вещество железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
Химические свойства простого вещества — железа:
Ржавление и горение в кислороде
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O 2 + 6H 2 O → 4Fe(OH) 3
Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II, III):
3Fe + 2O 2 → Fe 3 O 4
3Fe+2O 2 →(Fe II Fe 2 III )O 4 (160 °С)
2) При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H 2 O – t° → Fe 3 O 4 + 4H 2
3) Железо реагирует с неметаллами при нагревании:
2Fe+3Cl 2 →2FeCl 3 (200 °С)
2Fe + 3Br 2 – t° → 2FeBr 3
Fe + S – t° → FeS (600 °С)
Fe+2S → Fe +2 (S 2 -1 ) (700°С)
4) В ряду напряжений стоит левее водорода, реагирует с разбавленными кислотами НСl и Н 2 SO 4 , при этом образуются соли железа(II) и выделяется водород:
Fe + 2HCl → FeCl 2 + H 2 (реакции проводятся без доступа воздуха, иначе Fe +2 постепенно переводится кислородом в Fe +3 )
Fe + H 2 SO 4 (разб.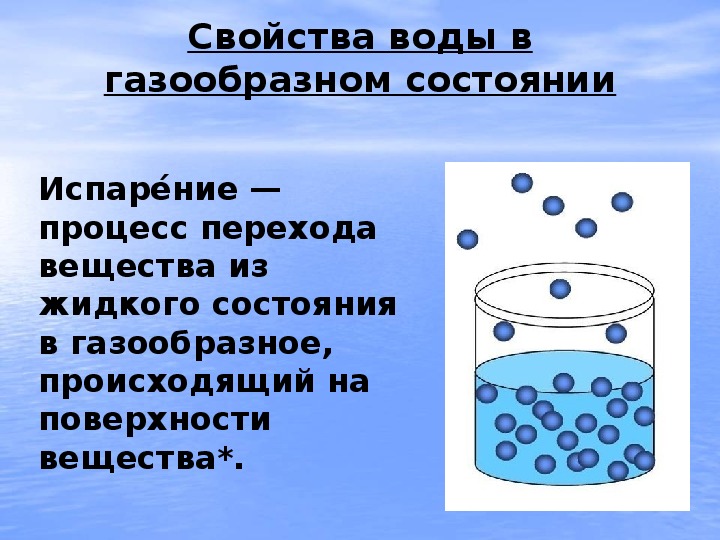 ) → FeSO 4 + H 2
) → FeSO 4 + H 2
В концентрированных кислотах–окислителях железо растворяется только при нагревании, оно сразу переходит в катион Фе 3+ :
2Fe + 6H 2 SO 4 (конц.) – t° → Fe 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O
Fe + 6HNO 3 (конц.) – t° → Fe(NO 3 ) 3 + 3NO 2 + 3H 2 O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).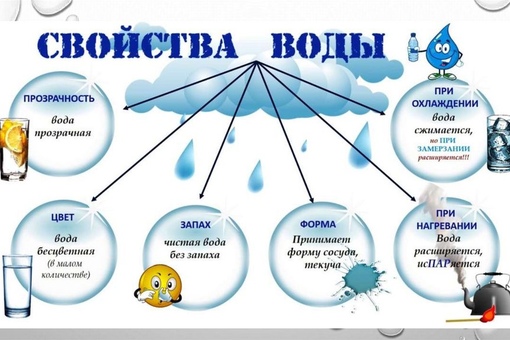
Железный гвоздь, погруженный в голубоватый раствор медного купороса, постепенно покрывается налетом красной металлической меди
5) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO 4 → FeSO 4 + Cu
6)
Амфотерность железа проявляется только в концентрированных щелочах при кипячении:
Fе + 2NaОН (50 %) + 2Н 2 O= Nа 2 [Fе(ОН) 4 ]↓+ Н 2 ↑
и образуется осадок тетрагидроксоферрата(II) натрия.
Техническое железо — сплавы железа с углеродом: чугун содержит 2,06-6,67 % С, сталь 0,02-2,06 % С, часто присутствуют другие естественные примеси (S, Р, Si) и вводимые искусственно специальные добавки (Мn, Ni, Сr), что придает сплавам железа технически полезные свойства — твердость, термическую и коррозионную стойкость, ковкость и др .
Доменный процесс производства чугунаДоменный процесс производства чугуна составляют следующие стадии:
а) подготовка (обжиг) сульфидных и карбонатных руд — перевод в оксидную руду:
FeS 2 →Fe 2 O 3 (O 2 ,800°С, -SO 2 ) FeCO 3 →Fe 2 O 3 (O 2 ,500-600°С, -CO 2 )
б) сжигание кокса при горячем дутье:
С (кокс) + O 2 (воздух) →СO 2 (600—700°С) СO 2 + С (кокс) ⇌ 2СО (700—1000 °С)
в) восстановление оксидной руды угарным газом СО последовательно:
Fe 2 O 3 →(CO) (Fe II Fe 2 III )O 4 →(CO) FeO →(CO) Fe
г) науглероживание железа (до 6,67 % С) и расплавление чугуна:
Fе (т ) →( C ( кокс) 900—1200°С) Fе (ж) (чугун, t пл 1145°С)
В чугуне всегда в виде зерен присутствуют цементит Fe 2 С и графит.
Передел чугуна в сталь проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева; температура процесса 1700-2000 °С. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (СО 2 , SО 2 ), либо связываются в легко отделяемый шлак — смесь Са 3 (РO 4 ) 2 и СаSiO 3 . Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Получение чистого железа в промышленности — электролиз раствора солей железа, например:
FеСl 2 → Fе↓ + Сl 2 ↑ (90°С) (электролиз)
(существуют и другие специальные методы, в том числе восстановление оксидов железа водородом).
Чистое железо применяется в производстве специальных сплавов, при изготовлении сердечников электромагнитов и трансформаторов, чугун — в производстве литья и стали, сталь — как конструкционный и инструментальный материалы, в том числе износо-, жаро- и коррозионно-стойкие.
Оксид железа(II) F еО . Амфотерный оксид с большим преобладанием основных свойств. Черный, имеет ионное строение Фе 2+ O 2- . При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой. Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок. Уравнения важнейших реакций:
Амфотерный оксид с большим преобладанием основных свойств. Черный, имеет ионное строение Фе 2+ O 2- . При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой. Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок. Уравнения важнейших реакций:
4FеО ⇌(Fe II Fe 2 III ) + Fе (560—700 °С , 900—1000°С)
FеО + 2НС1 (разб.) = FеС1 2 + Н 2 O
ФеО + 4ННО 3 ( конц . ) = Fе(NO 3 ) 3 +NO 2 ↑ + 2Н 2 O
) = Fе(NO 3 ) 3 +NO 2 ↑ + 2Н 2 O
FеО + 4NаОН =2Н 2 O + N а 4 F е O 3(красн .) триоксоферрат(II) (400—500 °С)
FеО + Н 2 =Н 2 O + Фе (особо чистое) (350°С)
FеО + С (кокс) = Фе + СО (выше 1000 °С)
ФеО + СО = Фе + СО 2 (900°С)
4FеО + 2Н 2 O (влага) + O 2 (воздух) →4FеО(ОН) (t)
6ФеО + O 2 = 2(Fe II Fe 2 III )O 4 (300—500°С)
Получение в лаборатории : термическое разложение соединений железа (II) без доступа воздуха:
Fе(ОН) 2 = FеО + Н 2 O (150-200 °С)
FеСОз = FеО + СO 2 (490-550 °С)
Оксид дижелеза (III) – железа( II ) ( Fe II Fe 2 III )O 4 .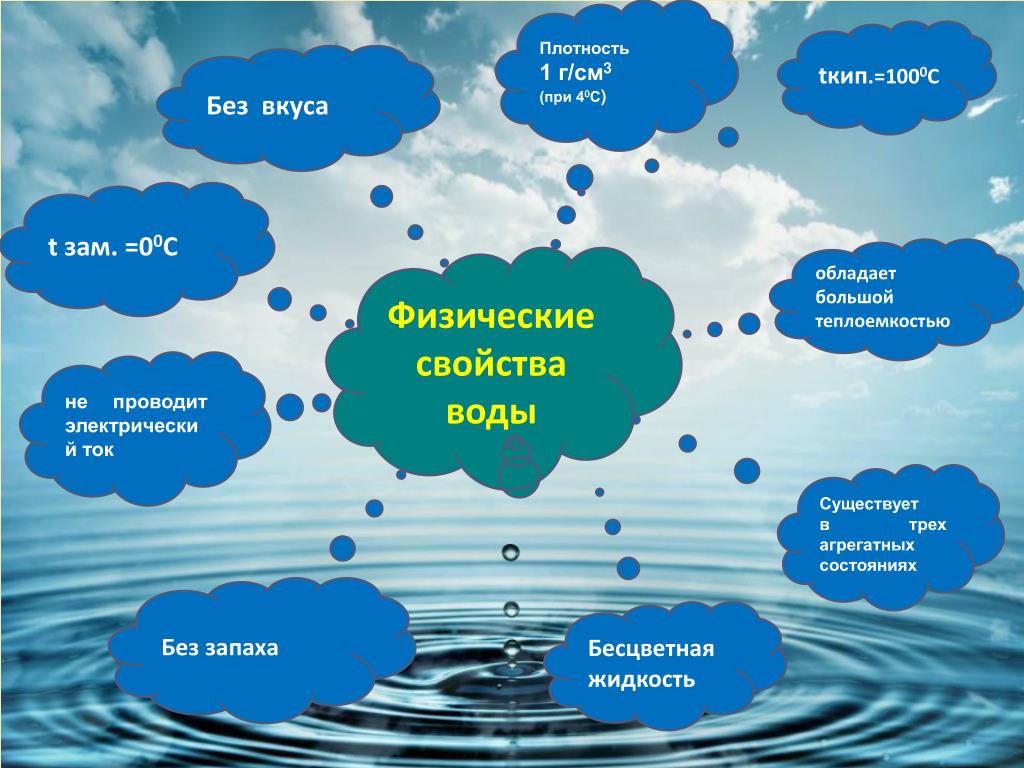 Двойной оксид. Черный, имеет ионное строение Fe 2+ (Fе 3+ ) 2 ( O 2- ) 4 . Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок ( железный сурик ), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий ( чернение, воронение ). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто-формулы Fe 3 O 4 не рекомендуется.
Двойной оксид. Черный, имеет ионное строение Fe 2+ (Fе 3+ ) 2 ( O 2- ) 4 . Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок ( железный сурик ), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий ( чернение, воронение ). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто-формулы Fe 3 O 4 не рекомендуется. Уравнения важнейших реакций:
Уравнения важнейших реакций:
2(Fe II Fe 2 III )O 4 = 6ФеО + O 2 (выше 1538 °С)
(Fe II Fe 2 III )O 4 + 8НС1 (разб.) = FеС1 2 + 2FеС1 3 + 4Н 2 O
(Fe II Fe 2 III )O 4 +10НNO 3 (конц. ) =3Fе(NO 3 ) 3 + NO 2 ↑+ 5Н 2 O
) =3Fе(NO 3 ) 3 + NO 2 ↑+ 5Н 2 O
(Fe II Fe 2 III )O 4 + O 2 (воздух) = 6Fе 2 O 3 (450-600°С)
(Fe II Fe 2 III )O 4 + 4Н 2 = 4Н 2 O + 3Фе (особо чистое, 1000 °С)
(Fe II Fe 2 III )O 4 + СО =ЗFеО + СO 2 (500—800°C)
(Fe II Fe 2 III )O4 + Fе ⇌4FеО (900—1000 °С , 560—700 °С)
Получение: сгорание железа (см. ) на воздухе.
) на воздухе.
В природе — оксидная руда железа магнетит.
Оксид железа(III) F е 2 О 3 . Амфотерный оксид с преобладанием основных свойств. Красно-коричневый, имеет ионное строение (Фе 3+ ) 2 (O 2- ) 3. Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе. Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Фе 2 O 3 nН 2 О. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды — шпинели (технические продукты называются ферритами). Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла.
Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды — шпинели (технические продукты называются ферритами). Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла.
Уравнения важнейших реакций:
6Fе 2 O 3 = 4(Fe II Fe 2 III )O 4 +O 2 (1200—1300 °С)
Fе 2 O 3 + 6НС1 (разб. ) →2FеС1 3 + ЗН 2 O (t) (600°С,р)
) →2FеС1 3 + ЗН 2 O (t) (600°С,р)
Fе 2 O 3 + 2NaОН (конц.) →Н 2 O+ 2 N а F е O 2 (красн.) диоксоферрат(III)
Fе 2 О 3 + МО=(М II Fе 2 II I )O 4 (М=Сu, Мn, Fе, Ni, Zn)
Fе 2 O 3 + ЗН 2 =ЗН 2 O+ 2Фе (особо чистое, 1050—1100 °С)
Fе 2 O 3 + Fе = ЗFеО (900 °С)
3Fе 2 O 3 + СО = 2(Fe II Fе 2 III )O 4 + СO 2 (400—600 °С)
Получение в лаборатории — термическое разложение солей железа (III) на воздухе:
Fе 2 (SO 4 ) 3 = Fе 2 O 3 + 3SO 3 (500-700 °С)
4{Fе(NO 3 ) 3 9 Н 2 O} = 2Fе a O 3 + 12NO 2 + 3O 2 + 36Н 2 O (600-700 °С)
В природе — оксидные руды железа гематит Fе 2 O 3 и лимонит Fе 2 O 3 nН 2 O
Гидроксид железа (II) F е(ОН) 2 . Амфотерный гидроксид с преобладанием основных свойств. Белый (иногда с зеленоватым оттенком), связи Фе — ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов.
Амфотерный гидроксид с преобладанием основных свойств. Белый (иногда с зеленоватым оттенком), связи Фе — ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов.
Уравнения важнейших реакций:
Fе(OН) 2 = FеО + Н 2 O (150-200 °С, в атм.N 2 )
Fе(ОН) 2 + 2НС1 (разб.) =FеС1 2 + 2Н 2 O
Fе(ОН) 2 + 2NаОН (> 50%) = Nа 2 [Fе(ОН) 4 ] ↓ (сине-зеленый) (кипячение)
4Fе(ОН) 2 (суспензия) + O 2 (воздух) →4FеО(ОН)↓ + 2Н 2 O (t)
2Fе(ОН) 2 (суспензия) +Н 2 O 2 (разб. ) = 2FеО(ОН)↓ + 2Н 2 O
) = 2FеО(ОН)↓ + 2Н 2 O
Fе(ОН) 2 + КNO 3 (конц.) = FеО(ОН)↓ + NO↑+ КОН (60 °С)
Получение : осаждение из раствора щелочами или гидратом аммиака в инертной атмосфере:
Fе 2+ + 2OH (разб.) = F е(ОН) 2 ↓
Fе 2+ + 2(NH 3 Н 2 O) = F е(ОН) 2 ↓ + 2NH 4
Метагидроксид железа F еО(ОН). Амфотерный гидроксид с преобладанием основных свойств. Светло-коричневый, связи Фе — О и Фе — ОН преимущественно ковалентные. При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Фе 2 O 3 nН 2 O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в ФеО(ОН). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Фе(ОН) 2 . Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе.
Амфотерный гидроксид с преобладанием основных свойств. Светло-коричневый, связи Фе — О и Фе — ОН преимущественно ковалентные. При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Фе 2 O 3 nН 2 O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в ФеО(ОН). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Фе(ОН) 2 . Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе.
Соединение состава Fе(ОН) 3 не известно (не получено).
Уравнения важнейших реакций:
Fе 2 O 3 . nН 2 O→( 200-250 °С, — H 2 O ) FеО(ОН)→( 560-700° С на воздухе , -h3O) →Fе 2 О 3
FеО(ОН) + ЗНС1 (разб.) =FеС1 3 + 2Н 2 O
FeO(OH)→ Fe 2 O 3 . nH 2 O -коллоид (NаОН (конц.) )
nH 2 O -коллоид (NаОН (конц.) )
FеО(ОН)→ N а 3 [ F е(ОН) 6 ] белый , Nа 5 [Fе(OН) 8 желтоватый (75 °С, NаОН ( т) )
2FеО(ОН) + Fе(ОН) 2 =( Fe II Fe 2 III )O 4 + 2Н 2 O (600—1000 °С)
2FеО(ОН) + ЗН 2 = 4Н 2 O+ 2Фе (особо чистое, 500—600 °С)
2FеО(ОН) + ЗВr 2 + 10КОН = 2К 2 FеO 4 + 6Н 2 O + 6КВr
Получение: осаждение из раствора солей железа(Ш) гидрата Фе 2 О 3 nН 2 O и его частичное обезвоживание (см. выше).
выше).
В природе — оксидная руда железа лимонит Fе 2 O 3 nН 2 О и минерал гётит FеО(ОН).
Феррат калия К 2 F еО 4 . Оксосоль. Красно-фиолетовый, разлагается при сильном нагревании. Хорошо растворим в концентрированном растворе КОН, реагирует с кипящей водой, неустойчив в кислотной среде. Сильный окислитель.
Сильный окислитель.
Качественная реакция — образование красного осадка феррата бария. Применяется в синтезе ферритов — промышленно важных двойных оксидов железа (III) и других металлов.
Уравнения важнейших реакций:
4К 2 FеO 4 = 4КФеО 2 + 3O 2 + 2К 2 O (700 °С)
4К 2 FеO 4 + 6Н 2 O (гор.) =4ФеО(ОН)↓ + 8КОН + 3O 2 ↑
FеО 4 2- + 2OН + (разб. ) =4Fе 3+ + 3O 2 ↑+10Н 2 O
) =4Fе 3+ + 3O 2 ↑+10Н 2 O
FеО 4 2- + 2(NH 3 . Н 2 O) →2FеО(ОН)↓ + N 2 ↑+ 2Н 2 O+ 4OН —
FеО 4 2- + Ва 2+ = ВаFеO 4 (красн.)↓ (в конц. КОН)
Получение : образуется при окислении соединений железа, например метагидроксида ФеО(ОН), бромной водой, а также при действии сильных окислителей (при спекании) на железо
Fе + 2КОН + 2КNO 3 = К 2 F е O 4 + 3КNO 2 + H 2 O (420 °С)
и электролизе в растворе:
электролиз
Fе + 2КОН (конц.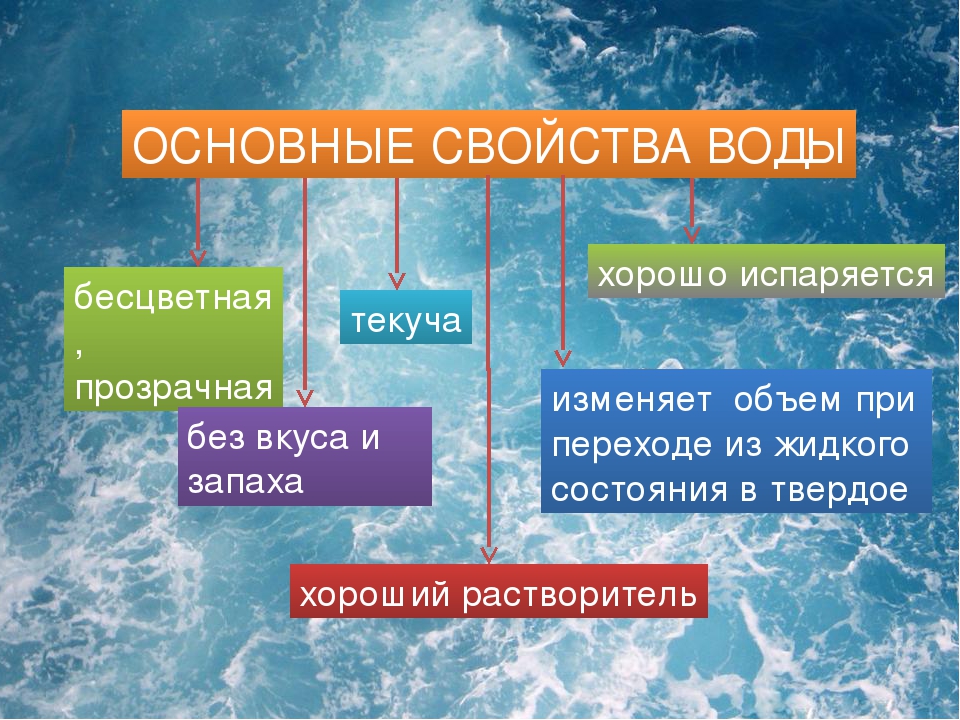 ) + 2Н 2 O→ЗН 2 ↑ + К 2 F е O 4 ( электролиз)
) + 2Н 2 O→ЗН 2 ↑ + К 2 F е O 4 ( электролиз)
(феррат калия образуется на аноде).
Качественные реакции на ионы F е 2+ и F е 3+
Обнаружение ионов Фе 2+ и Fе 3+ в водном растворе проводят с помощью реактивов К 3 [Fе(СN) 6 ] и К 4 [Fе(СN) 6 ] соответственно; в обоих случаях выпадает синий продукт одинакового состава и строения, КФе III [Fе II (СN) 6 ]. В лаборатории этот осадок называют берлинская лазурь , или турнбуллева синь :
В лаборатории этот осадок называют берлинская лазурь , или турнбуллева синь :
Fе 2+ + К + + [Fе(СN) 6 ] 3- = КFе III [Fе II (СN) 6 ]↓
Fе 3+ + К + + [Fе(СN) 6 ] 4- = КFе III [Fе II (СN) 6 ]↓
Химические названия исходных реактивов и продукта реакций:
К 3 Fе III [Fе(СN) 6 ]- гексацианоферрат (III) калия
К 4 Fе III [Fе (СN) 6 ]- гексацианоферрат (II) калия
КFе III [Fе II (СN) 6 ]- гексацианоферрат (II) железа (Ш) калия
Кроме того, хорошим реактивом на ионы Фе 3+ является тиоцианат-ион НСС — , железо (III) соединяется с ним, и появляется ярко-красная («кровавая») окраска:
Fе 3+ + 6NСS — = [Фе(НСС) 6 ] 3-
Этим реактивом (например, в виде соли КНСС) можно обнаружить даже следы железа (III) в водопроводной воде, если она проходит через железные трубы, покрытые изнутри ржавчиной.
Свойства воды: Урок для детей — Видео и стенограмма урока
Полярность воды
Молекулы воды называются полярными . Это означает, что один конец молекулы воды заряжен положительно, а другой — отрицательно. Если вы когда-нибудь смотрели на аккумулятор, то знаете, что он примерно такой: один конец положительный, а другой отрицательный. В молекуле воды положительные и отрицательные заряды притягиваются друг к другу, что заставляет молекулы слипаться.
Вода также считается универсальным растворителем или веществом, способным растворять другие вещества, на что влияет его полярность.
Вы когда-нибудь сыпали соль в воду? Или видели, как пищевой краситель роняли в воду? И соль, и пищевой краситель растворяются в воде или становятся частью воды. Однако это не тот случай, когда вы добавляете масло в воду. Вода — полярное вещество, масло — неполярное. Таким образом, вместо того, чтобы смешиваться, масло плавает поверх воды.
Однако это не тот случай, когда вы добавляете масло в воду. Вода — полярное вещество, масло — неполярное. Таким образом, вместо того, чтобы смешиваться, масло плавает поверх воды.
Поверхностное натяжение
Верхний слой воды действует как эластичный или эластичный лист. Это называется поверхностным натяжением , и это происходит из-за притяжения между молекулами или липкой природы молекул, как мы только что описали. Этот эластичный лист также иногда называют «невидимой кожей воды». Благодаря этому поверхностному натяжению мелкие насекомые могут ходить по воде. Вы когда-нибудь видели, как жук ходит по пруду? Если да, то вы смотрите на поверхностное натяжение.
Капиллярное действие
Вода может не только растворять другие вещества, но и двигаться вверх против силы тяжести в небольших пространствах. Подумайте о цветке: он получает воду из земли, и эта вода поднимается по стеблю, чтобы обеспечить водой и питанием остальную часть растения. Это называется капиллярным действием — способностью воды двигаться вверх по поверхностным волокнам твердого тела независимо от других сил.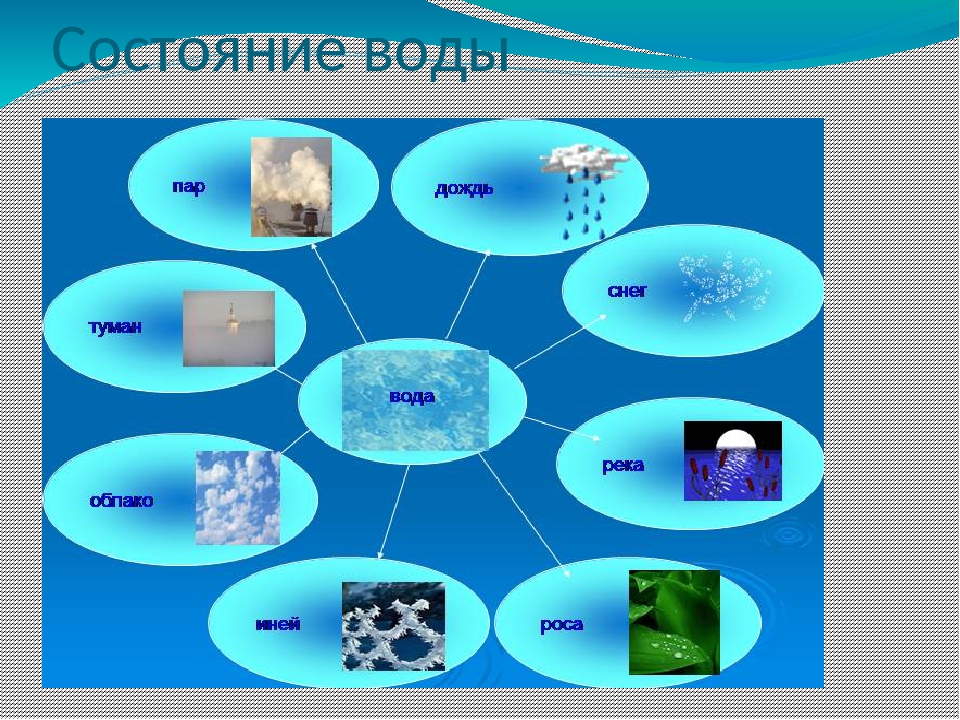
Плотность
Вода – одно из немногих веществ, плотность которого в твердом состоянии меньше, чем в жидком.Подумайте о заливке цемента: сначала он жидкий, но когда он высыхает и затвердевает, он образует твердую породу, которая намного тяжелее жидкого цемента. Но вода другая. Когда вы кладете кубик льда (твердый) в воду (жидкость), что он делает? Он плавает, что говорит нам о том, что твердый куб менее плотный, чем жидкая вода. Это одно из уникальных свойств воды. Лед в твердом состоянии легче или менее плотный, чем вода в жидком состоянии.
Краткий обзор урока
В следующий раз, когда вы будете пить воду или пойдете купаться в озере, подумайте о свойствах воды.Вода может растворять многие вещества, такие как соль и пищевой краситель, из-за своей полярности и поверхностного натяжения. Он может обеспечить растения необходимыми питательными веществами из-за своего капиллярного действия, и это единственное вещество, которое легче в твердом состоянии (льде) по сравнению с его жидкой формой (водой).
Особые свойства воды: Календарь проекта
*Примечание для учителя: Этот календарь предоставляется в качестве руководства и может быть адаптирован к потребностям вас и ваших учеников.
________________________________________________________________
День 1Учащиеся посмотрят видео-урок BLOSSOMS «В какой воде быстрее растает кубик льда: в пресной или в соленой?» и принять участие в мероприятиях, представленных на этом уроке.Подготовку учителя к проведению этого урока можно найти в разделе «Видеоруководство для учителя» в 12:08. Сегодняшняя домашняя работа будет посвящена тому, что ученики усвоили на этом уроке и что они знают о воде.
- Инструкции по загрузке или потоковой передаче видеороликов BLOSSOMS (формат PDF, формат Word)
- Домашнее задание для 1-го дня (формат PDF, формат Word)
________________________________________________________________
День 2 Сегодня основное внимание будет уделено переходу от видеоурока BLOSSOMS к этому разделу проектного обучения, а также оценке предварительных знаний учащихся о воде. Студенты будут участвовать в обсуждении всего класса, посвященном их выполненному домашнему заданию. Затем учащиеся знакомятся с модулем PBL, объясняя, что первая часть будет включать в себя обзор уникальных свойств воды с практическими лабораторными работами и демонстрациями, а вторая часть будет включать в себя работу в группах для глубокого исследования одного свойства воды (или, возможно, два), что интересует их больше всего. Сейчас самое время показать приведенную ниже презентацию Power Point «Особые свойства воды. Почему вода является хорошим местом для жизни» в качестве введения к урокам, которые будут представлены в течение следующих пяти дней.Работая со студентами над четырьмя уроками воды, часто напоминайте им, что в конечном итоге им нужно будет выбрать одно свойство, которое их больше всего интересует, для исследования в рамках своего проекта. Учащиеся должны просмотреть Раздаточный материал к уроку платежеспособности в качестве домашнего задания
Студенты будут участвовать в обсуждении всего класса, посвященном их выполненному домашнему заданию. Затем учащиеся знакомятся с модулем PBL, объясняя, что первая часть будет включать в себя обзор уникальных свойств воды с практическими лабораторными работами и демонстрациями, а вторая часть будет включать в себя работу в группах для глубокого исследования одного свойства воды (или, возможно, два), что интересует их больше всего. Сейчас самое время показать приведенную ниже презентацию Power Point «Особые свойства воды. Почему вода является хорошим местом для жизни» в качестве введения к урокам, которые будут представлены в течение следующих пяти дней.Работая со студентами над четырьмя уроками воды, часто напоминайте им, что в конечном итоге им нужно будет выбрать одно свойство, которое их больше всего интересует, для исследования в рамках своего проекта. Учащиеся должны просмотреть Раздаточный материал к уроку платежеспособности в качестве домашнего задания
- Заметки учителя, день 2 (формат PDF, формат Word)
- Особые свойства воды.
 Почему вода является хорошим местом для жизни (формат PDF, формат PPT)
Почему вода является хорошим местом для жизни (формат PDF, формат PPT) - Раздаточный материал для учащихся по уроку платежеспособности (формат PDF, формат Word)
________________________________________________________________
День 3Вода как «универсальный растворитель» — это первый урок, посвященный особым свойствам воды.В сегодняшней лабораторной демонстрации учащиеся рассмотрят различные растворы некоторых распространенных соединений, растворенных в воде, и проверят их способность проводить электричество. См. документ Урок первый, часть 1. Результаты помогут учащимся собрать доказательства того, как вода способна растворять определенные материалы, и косвенно доказать существование ионов и ионных связей. Чтобы учащиеся лучше поняли сегодняшний урок, было бы хорошо, если бы они изучили этот ресурс интерактивного моделирования PHET в один из этих двух дней, либо в классе, либо дома.
- Урок первый: часть 1 (формат PDF, формат Word)
- Урок 1 Возможные идеи проекта (формат PDF)
________________________________________________________________
День 4 Сегодня, после повторения понятий, представленных на предыдущем уроке, учащиеся продолжат и завершат свое лабораторное исследование воды как «Универсального растворителя». См. документ «Урок первый, часть 2». Сегодняшняя лаборатория будет посвящена растворенным газам в воде.Хотя понятие растворенных газов в воде часто трудно понять, учащиеся проведут простой эксперимент, который проверит наличие растворенных газов в образце воды путем «нерастворения» любых газов в растворе. Должно быть время, чтобы повторить этот первый урок о растворимости воды и ответить на любые вопросы.
См. документ «Урок первый, часть 2». Сегодняшняя лаборатория будет посвящена растворенным газам в воде.Хотя понятие растворенных газов в воде часто трудно понять, учащиеся проведут простой эксперимент, который проверит наличие растворенных газов в образце воды путем «нерастворения» любых газов в растворе. Должно быть время, чтобы повторить этот первый урок о растворимости воды и ответить на любые вопросы.
- Урок первый. Часть 2 (формат PDF, формат Word)
________________________________________________________________
Дни 5-6Эти два дня посвящены уроку «Липкость воды» с упором на когезию, адгезию и поверхностное натяжение.Студенты будут вовлечены в деятельность, демонстрирующую свойства когезии и адгезии, а также явления капиллярного действия и поверхностного натяжения воды. Этот урок с несколькими идеями для демонстрации можно найти в документе Lesson Two . Также предлагается, чтобы учащимся было полезно посмотреть следующее видео, чтобы лучше понять представленные концепции: «Вода: полярная молекула»
- Второй урок (формат PDF, формат Word)
- Урок второй Возможные идеи проекта (формат PDF, формат Word)
________________________________________________________________
День 7 После рассмотрения представлений о липкости воды сегодняшний урок будет посвящен высокой теплоемкости воды — количеству тепловой энергии, необходимому для повышения температуры воды. Благодаря обсуждениям и демонстрациям учащиеся придут к пониманию важных явлений, которые они видят вокруг, например, почему вода отлично охлаждает вещи и почему, когда она теплая, она остается теплой. См. документ «Урок третий».
Благодаря обсуждениям и демонстрациям учащиеся придут к пониманию важных явлений, которые они видят вокруг, например, почему вода отлично охлаждает вещи и почему, когда она теплая, она остается теплой. См. документ «Урок третий».
- Третий урок (формат PDF, формат Word)
- Урок 3 Возможные идеи проекта (формат PDF, формат Word)
________________________________________________________________
День 8 После повторения понятий, представленных на предыдущем уроке, сегодня учащиеся узнают, насколько уникальна вода — и как удачно для тех из нас, кто живет на Земле, — что лед плавает.См. документ Урок четвертый. Благодаря этому уроку учащиеся поймут важность этого свойства на молекулярном и глобальном уровне. Здесь было бы хорошо вернуть учащихся к тому, что они узнали из вступительного видеоурока BLOSSOMS о термохалинной циркуляции. (См. документ ниже) Чтобы помочь учащимся лучше понять фазовые переходы на молекулярном уровне, предложите им изучить следующую симуляцию PHET либо в классе, либо дома. Домашнее задание будет заключаться в том, чтобы учащиеся представили свои отзывы о четырех уроках «Особые свойства воды».(см. раздаточный материал)
Домашнее задание будет заключаться в том, чтобы учащиеся представили свои отзывы о четырех уроках «Особые свойства воды».(см. раздаточный материал)
- Урок четвертый (формат PDF, формат Word)
- Морской лед и циркуляция океана (формат PDF, формат Word)
- Урок четвертый Возможные идеи проекта (формат PDF, формат Word)
- Раздаточный материал с домашним заданием на 8 день (формат PDF, формат Word)
________________________________________________________________
День 9 Теперь учащиеся переходят от четырех уроков к проектной фазе этого раздела. В ходе обсуждения всего класса, посвященного домашнему заданию, будет важно изучить их опыт лабораторных работ, прояснить любые оставшиеся вопросы и начать понимать, какие свойства воды каждый учащийся может захотеть исследовать дальше.Это обсуждение также должно легко перетекать во введение к Основному вопросу этого раздела ПОО. Когда учащиеся сообщают о теме, в которой они заинтересованы, учитель может помочь им увидеть, как их темы сосредоточены вокруг общего основного вопроса: «Почему уникальные свойства воды так важны для жизни на Земле и как эти свойства влияют на жизнь?» наша жизнь и общество?» Подробнее о вопросе вождения читайте здесь.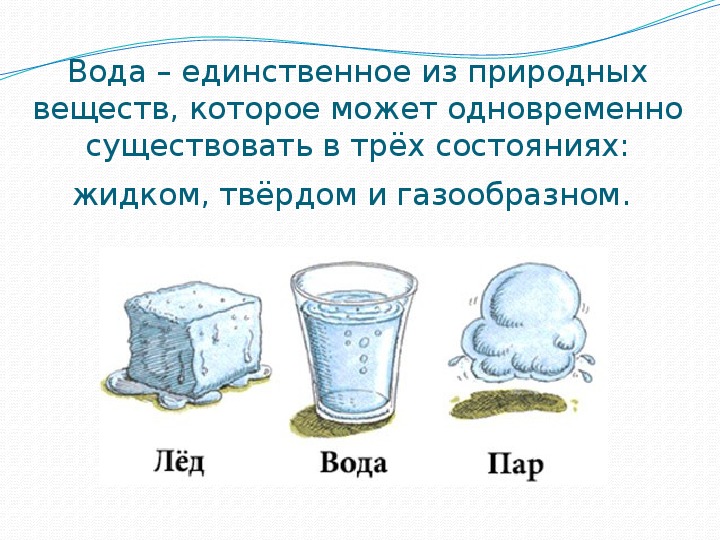 В целом, это закрепленный вопрос, который напоминает учащимся о цели, к которой они должны стремиться.Ожидается, что к концу занятия учащиеся будут разделены на четыре большие группы по свойствам воды, которые их больше всего интересуют. В качестве домашнего задания учащиеся в каждой из четырех больших групп могут исследовать темы проекта, отвечающие на ведущий вопрос, используя соответствующий раздаточный материал «Потенциальные идеи проекта» , чтобы начать свое мышление.
В целом, это закрепленный вопрос, который напоминает учащимся о цели, к которой они должны стремиться.Ожидается, что к концу занятия учащиеся будут разделены на четыре большие группы по свойствам воды, которые их больше всего интересуют. В качестве домашнего задания учащиеся в каждой из четырех больших групп могут исследовать темы проекта, отвечающие на ведущий вопрос, используя соответствующий раздаточный материал «Потенциальные идеи проекта» , чтобы начать свое мышление.
- Урок 1 Идеи потенциальных проектов (формат PDF)
- Урок 2 Идеи для потенциальных проектов (формат PDF)
- Урок 3 Идеи для потенциальных проектов (формат PDF)
- Тема урока 4 «Возможные проекты» (в формате PDF)
________________________________________________________________
Дни 10-11 Сегодня каждая большая группа начнет обсуждать свои идеи для дальнейших исследований, связанных с каждым из четырех свойств. Целью каждой крупной группы Property of Water будет согласование 5 или 6 возможных тем для изучения и исследования проекта. К концу этих двух дней каждый студент присоединится к команде из 3 или 4 человек по теме проекта, которая его или ее волнует! Как только это будет выполнено, эти новые студенческие команды встретятся, чтобы обсудить и начать сужать фокус темы своего проекта. Они также потратят время на развитие новых навыков, которые помогут им более успешно работать в своих командах, готовясь к запуску своих проектов.Мы предлагаем использовать командные контракты, которые представляют собой документы, в которых указано, на что согласятся команды и что произойдет, если они не будут придерживаться этих заявлений. Попросите команды заключить свои командные контракты для предстоящего проекта. В качестве домашнего задания студенческие команды должны начать поиск источников информации по их конкретной теме. Источники могут включать газеты, веб-сайты, книги, онлайн-статьи или экспертов из их сообщества.
Целью каждой крупной группы Property of Water будет согласование 5 или 6 возможных тем для изучения и исследования проекта. К концу этих двух дней каждый студент присоединится к команде из 3 или 4 человек по теме проекта, которая его или ее волнует! Как только это будет выполнено, эти новые студенческие команды встретятся, чтобы обсудить и начать сужать фокус темы своего проекта. Они также потратят время на развитие новых навыков, которые помогут им более успешно работать в своих командах, готовясь к запуску своих проектов.Мы предлагаем использовать командные контракты, которые представляют собой документы, в которых указано, на что согласятся команды и что произойдет, если они не будут придерживаться этих заявлений. Попросите команды заключить свои командные контракты для предстоящего проекта. В качестве домашнего задания студенческие команды должны начать поиск источников информации по их конкретной теме. Источники могут включать газеты, веб-сайты, книги, онлайн-статьи или экспертов из их сообщества. Учащиеся также должны подумать о том, есть ли члены сообщества, которые могут быть заинтересованы в результатах их проектов и должны быть приглашены на Заключительное мероприятие.
Учащиеся также должны подумать о том, есть ли члены сообщества, которые могут быть заинтересованы в результатах их проектов и должны быть приглашены на Заключительное мероприятие.
- Пустой командный контракт (формат PDF)
________________________________________________________________
День 12 В первую очередь сегодня студенческие команды должны прийти к единому мнению по теме своего водного проекта. Затем они будут ознакомлены с требованиями этих проектов. Раздайте копии целей проекта , критерия презентации и критерия сотрудничества каждому учащемуся и обсудите их со всем классом.Эти документы могут быть адаптированы преподавателями в соответствии с уровнем и потребностями учащихся. Чтобы помочь учащимся выполнять задание и вовремя, мы предлагаем использовать журнал задач, живой список задач, который позволяет командам (и учителю) легко узнать, что было сделано, что находится в процессе и что только что началось. .. Подробнее об этом полезном инструменте можно прочитать здесь. В течение оставшейся части урока студенческие команды будут работать, чтобы четко определить тему своего проекта.
.. Подробнее об этом полезном инструменте можно прочитать здесь. В течение оставшейся части урока студенческие команды будут работать, чтобы четко определить тему своего проекта.
- Цели отдела водного проекта (формат PDF, формат Word)
- Рубрика презентации (формат PDF, формат Word)
- Рубрика о сотрудничестве (формат PDF, формат Word)
- Журнал заданий учащихся (формат PDF, формат Word)
________________________________________________________________
Дни 13-15 Студенческие команды работают над своим проектом Презентация Первоначальный проект , следя за соблюдением требований, перечисленных в документах Цели и Рубрики.В течение этих дней учитель будет направлять учащихся в их работе, а у команд будет возможность встретиться со своим учителем для получения отзывов, указаний и предложений о том, как лучше всего выполнить требования проекта. Копия проектного предложения и первоначальный проект для презентации завершены и представлены до 15-го дня.
- Начальный проект презентации (формат PDF, формат Word)
________________________________________________________________
Дни 16-20Под руководством учителя студенческие команды продолжают работу над своими презентациями, строго следуя требованиям, изложенным в документах «Цели» и «Рубрики».К 20 дню исследование завершено, слайд-шоу закончено, сценарий отредактирован и в окончательном виде, репетирована презентация и подготовлена библиография. Опросник для размышлений учащихся распространяется.
- Документ для размышлений учащихся (формат PDF, формат Word)
________________________________________________________________
День 21 Заключительное событие: Обычно последний день презентации работы PBL является праздником.Это заключительное мероприятие в идеале проводится в течение более длительного периода, чем один класс, например, после школы, где присутствуют родители, заинтересованные стороны, сообщество и другие школьные должностные лица. Здесь ученики демонстрируют свои работы. Если такой временной интервал невозможен, проведите это публичное мероприятие в обычное время занятий, но постарайтесь убедиться, что заинтересованные стороны присутствуют во время классного мероприятия. Крайне важно иметь внешние связи в качестве части аудитории, наблюдающей за присутствующими студентами. Или, если заинтересованные стороны невозможны, пригласите администрацию и других взрослых, которые являются частью школы.
Здесь ученики демонстрируют свои работы. Если такой временной интервал невозможен, проведите это публичное мероприятие в обычное время занятий, но постарайтесь убедиться, что заинтересованные стороны присутствуют во время классного мероприятия. Крайне важно иметь внешние связи в качестве части аудитории, наблюдающей за присутствующими студентами. Или, если заинтересованные стороны невозможны, пригласите администрацию и других взрослых, которые являются частью школы.
________________________________________________________________
День 22Сданы необходимые документы, в том числе Анкета для размышлений учащихся. Полный список продуктов, подлежащих сдаче, см. в документе Цели проекта по водным ресурсам.
________________________________________________________________
Свойства воды и полярность воды Урок
Свойства воды
Одной из особенностей нашей планеты является наличие жидкой воды. Вода имеет основополагающее значение для всей жизни; без него все живое погибло бы.
Вода имеет основополагающее значение для всей жизни; без него все живое погибло бы.
Вода покрывает около 70 % поверхности Земли и составляет 65-75 % нашего тела (вода составляет 82 % нашей крови). Хотя вода может показаться скучной – без цвета, вкуса и запаха – она обладает удивительными свойствами, которые делают ее необходимой для поддержания жизни.
(Наша потребность в воде и морских животных, которые живут в воде, делают разливы нефти такими разрушительными.)
Химический состав воды H 2 O – два атома водорода и один атом кислорода.Свойства воды особенные из-за того, как ее атомы соединяются вместе, образуя молекулу воды, и из-за того, как молекулы взаимодействуют друг с другом.
Полярность воды
Когда два атома водорода связываются с кислородом, они прикрепляются к вершине молекулы, как уши Микки Мауса. Эта молекулярная структура придает молекуле воды полярность или неравномерный электрический заряд, который притягивает другие атомы.
Конец молекулы с двумя атомами водорода заряжен положительно.Другой конец, с кислородом, заряжен отрицательно. Так же, как в магните, где северные полюса притягиваются к южным («противоположности притягиваются»), положительный конец молекулы воды соединится с отрицательным концом других молекул.
Что это значит для нас? Полярность воды позволяет ей очень легко растворять другие полярные вещества. Когда полярное вещество помещается в воду, положительные концы его молекул притягиваются к отрицательным концам молекул воды, и наоборот.Притяжение заставляет молекулы нового вещества однородно смешиваться с молекулами воды.
Вода растворяет больше веществ, чем любая другая жидкость, даже самая сильная кислота! Из-за этого ее часто называют «универсальным растворителем». Растворяющая способность воды очень важна для жизни на Земле. Куда бы ни шла вода, она несет с собой растворенные химические вещества, минералы и питательные вещества, которые используются для поддержания жизни.
Из-за своей полярности молекулы воды сильно притягиваются друг к другу, что придает воде высокое поверхностное натяжение .Молекулы на поверхности воды «слипаются», образуя своего рода «кожу» на воде, достаточно прочную, чтобы выдерживать очень легкие предметы. Насекомые, которые ходят по воде, пользуются этим поверхностным натяжением.
Поверхностное натяжение заставляет воду собираться в капли, а не растекаться тонким слоем.
Он также позволяет воде проходить через корни и стебли растений, термометры и мельчайшие кровеносные сосуды в вашем теле. Когда одна молекула движется вверх, она «тянет» за собой другие.
Три состояния материи
Вода — один из четырех элементов и единственное природное вещество, которое может существовать во всех трех агрегатных состояниях — твердом, жидком и газообразном — при температурах, обычно встречающихся на Земле.
Многие другие вещества должны быть перегреты или охлаждены для изменения состояния.
Вода в газообразном состоянии постоянно присутствует в нашей атмосфере в виде водяного пара. Жидкое состояние встречается повсеместно в реках, озерах и океанах.
Твердое состояние воды, льда, уникально. Большинство жидкостей сжимаются при охлаждении, потому что молекулы движутся медленнее и имеют меньше энергии, чтобы сопротивляться притяжению друг к другу. Когда они превращаются в твердые тела, они образуют плотно упакованные кристаллы, которые намного плотнее, чем первоначально была жидкость.
Вода так не действует. Когда она замерзает, она расширяется : молекулы выстраиваются в линию, образуя очень «открытую» кристаллическую структуру, которая менее плотна, чем жидкая вода.
Вот почему лед плавает.И хорошо, что получается! Если бы вода действовала как большинство других жидкостей, озера и реки замерзли бы, и вся жизнь в них умерла бы.
Три других свойства воды
Вода имеет высокую удельную теплоемкость. То есть, в отличие от воздуха, вода может поглощать много тепла, не меняя температуры. Вот почему плавание так освежает в жаркий день.
То есть, в отличие от воздуха, вода может поглощать много тепла, не меняя температуры. Вот почему плавание так освежает в жаркий день.
Вода также теряет тепло медленнее, чем воздух. В результате летом вода в озерах и океанах обычно бывает самой холодной в начале сезона и самой теплой в конце сезона (после многих дней поглощения солнечной энергии).
Температура кипения воды (212°F или 100°C на уровне моря) зависит от высоты над уровнем моря. Как правило, чем выше высота, тем ниже температура кипения воды. Например, в Денвере, штат Колорадо (5 280 футов), вода закипает при 202,4 ° F. На горе Эверест в Непале (29 012 футов) вода кипит при 156 ° F.
Проекты по науке о воде:
2.2 Вода – Концепции биологии – 1-е канадское издание
К концу этого раздела вы сможете:
- Описать свойства воды, имеющие решающее значение для поддержания жизни
Посмотрите видео о том, зачем нам нужен кислород и как он создает проблемы для живых существ.
Вы когда-нибудь задумывались, почему ученые тратят время на поиски воды на других планетах? Это потому, что вода необходима для жизни; даже мельчайшие следы его на другой планете могут указывать на то, что жизнь могла существовать или существовала на этой планете. Вода — одна из наиболее распространенных молекул в живых клетках и наиболее важная для жизни, какой мы ее знаем. Примерно 60–70 процентов вашего тела состоит из воды. Без него жизни просто не было бы.
Атомы водорода и кислорода в молекулах воды образуют полярные ковалентные связи.Общие электроны проводят больше времени, связанного с атомом кислорода, чем с атомами водорода. У молекулы воды нет общего заряда, но есть небольшой положительный заряд на каждом атоме водорода и небольшой отрицательный заряд на атоме кислорода. Из-за этих зарядов слегка положительные атомы водорода отталкиваются друг от друга и образуют уникальную форму. Каждая молекула воды притягивает другие молекулы воды из-за положительных и отрицательных зарядов в разных частях молекулы. Вода также притягивает другие полярные молекулы (например, сахара), образуя водородные связи. Когда вещество легко образует водородные связи с водой, оно может растворяться в воде и называется гидрофильным («водолюбивым»). Водородные связи нелегко образуются с неполярными веществами, такими как масла и жиры. Эти неполярные соединения являются гидрофобными («водобоязненными») и не растворяются в воде.
Вода также притягивает другие полярные молекулы (например, сахара), образуя водородные связи. Когда вещество легко образует водородные связи с водой, оно может растворяться в воде и называется гидрофильным («водолюбивым»). Водородные связи нелегко образуются с неполярными веществами, такими как масла и жиры. Эти неполярные соединения являются гидрофобными («водобоязненными») и не растворяются в воде.
Водородные связи в воде позволяют ей поглощать и выделять тепловую энергию медленнее, чем многие другие вещества. Температура является мерой движения (кинетической энергии) молекул. Чем больше движение, тем выше энергия и, следовательно, выше температура. Вода поглощает большое количество энергии, прежде чем ее температура повысится. Повышенная энергия разрушает водородные связи между молекулами воды. Поскольку эти связи могут создаваться и разрушаться быстро, вода поглощает увеличение энергии и изменения температуры лишь в минимальной степени.Это означает, что вода смягчает изменения температуры внутри организмов и в окружающей их среде. По мере поступления энергии баланс между образованием и разрушением водородных связей смещается в сторону разрушения. Больше связей разрывается, чем образуется. Этот процесс приводит к высвобождению отдельных молекул воды на поверхности жидкости (например, водоема, листьев растения или кожи организма) в процессе, называемом испарением . Испарение пота, состоящего на 90 процентов из воды, позволяет охлаждать организм, так как разрыв водородных связей требует затрат энергии и отводит тепло от тела.
Поскольку эти связи могут создаваться и разрушаться быстро, вода поглощает увеличение энергии и изменения температуры лишь в минимальной степени.Это означает, что вода смягчает изменения температуры внутри организмов и в окружающей их среде. По мере поступления энергии баланс между образованием и разрушением водородных связей смещается в сторону разрушения. Больше связей разрывается, чем образуется. Этот процесс приводит к высвобождению отдельных молекул воды на поверхности жидкости (например, водоема, листьев растения или кожи организма) в процессе, называемом испарением . Испарение пота, состоящего на 90 процентов из воды, позволяет охлаждать организм, так как разрыв водородных связей требует затрат энергии и отводит тепло от тела.
Наоборот, по мере уменьшения молекулярного движения и снижения температуры выделяется меньше энергии для разрыва водородных связей между молекулами воды. Эти связи остаются неповрежденными и начинают формировать жесткую решетчатую структуру (например, лед) (рис. 2.8 a ). В замороженном виде лед менее плотный, чем жидкая вода (молекулы находятся дальше друг от друга). Это означает, что лед плавает на поверхности водоема (рис. 2.8 б ). В озерах, прудах и океанах лед образуется на поверхности воды, создавая изолирующий барьер, защищающий животных и растения от замерзания в воде.Если бы этого не произошло, растения и животные, живущие в воде, замерзли бы в глыбе льда и не могли бы свободно передвигаться, что сделало бы жизнь при низких температурах затруднительной или невозможной.
2.8 a ). В замороженном виде лед менее плотный, чем жидкая вода (молекулы находятся дальше друг от друга). Это означает, что лед плавает на поверхности водоема (рис. 2.8 б ). В озерах, прудах и океанах лед образуется на поверхности воды, создавая изолирующий барьер, защищающий животных и растения от замерзания в воде.Если бы этого не произошло, растения и животные, живущие в воде, замерзли бы в глыбе льда и не могли бы свободно передвигаться, что сделало бы жизнь при низких температурах затруднительной или невозможной.
Поскольку вода полярна, имеет небольшие положительные и отрицательные заряды, ионные соединения и полярные молекулы могут легко растворяться в ней.Таким образом, вода — это то, что называют растворителем — веществом, способным растворять другое вещество. Заряженные частицы будут образовывать водородные связи с окружающим слоем молекул воды. Это называется сферой гидратации и служит для разделения или диспергирования частиц в воде. В случае поваренной соли (NaCl), смешанной с водой, ионы натрия и хлорида разделяются или диссоциируют в воде, и вокруг ионов образуются сферы гидратации. Положительно заряженный ион натрия окружен частично отрицательно заряженными атомами кислорода в молекулах воды.Отрицательно заряженный ион хлора окружен частично положительными зарядами атомов водорода в молекулах воды. Эти сферы гидратации также называют гидратными оболочками. Полярность молекулы воды делает ее эффективным растворителем и играет важную роль в ее многочисленных ролях в живых системах.
Заряженные частицы будут образовывать водородные связи с окружающим слоем молекул воды. Это называется сферой гидратации и служит для разделения или диспергирования частиц в воде. В случае поваренной соли (NaCl), смешанной с водой, ионы натрия и хлорида разделяются или диссоциируют в воде, и вокруг ионов образуются сферы гидратации. Положительно заряженный ион натрия окружен частично отрицательно заряженными атомами кислорода в молекулах воды.Отрицательно заряженный ион хлора окружен частично положительными зарядами атомов водорода в молекулах воды. Эти сферы гидратации также называют гидратными оболочками. Полярность молекулы воды делает ее эффективным растворителем и играет важную роль в ее многочисленных ролях в живых системах.
Вы когда-нибудь наполняли стакан водой до самого верха, а затем медленно добавляли еще несколько капель? Прежде чем перелиться через край, вода на самом деле образует куполообразную форму над краем стакана. Эта вода может оставаться над стеклом благодаря свойству когезии . При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-воздух (газ), хотя в стекле больше нет места. Когезия порождает поверхностное натяжение , способность вещества выдерживать разрыв при натяжении или напряжении. Когда вы бросаете небольшой клочок бумаги на каплю воды, бумага плавает поверх капли воды, хотя объект плотнее (тяжелее), чем вода.Это происходит из-за поверхностного натяжения, создаваемого молекулами воды. Когезия и поверхностное натяжение удерживают молекулы воды неповрежденными, а предмет плавает на поверхности. Можно даже «поплавать» стальной иглой поверх стакана с водой, если поместить ее осторожно, не нарушая поверхностного натяжения.
Эта вода может оставаться над стеклом благодаря свойству когезии . При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-воздух (газ), хотя в стекле больше нет места. Когезия порождает поверхностное натяжение , способность вещества выдерживать разрыв при натяжении или напряжении. Когда вы бросаете небольшой клочок бумаги на каплю воды, бумага плавает поверх капли воды, хотя объект плотнее (тяжелее), чем вода.Это происходит из-за поверхностного натяжения, создаваемого молекулами воды. Когезия и поверхностное натяжение удерживают молекулы воды неповрежденными, а предмет плавает на поверхности. Можно даже «поплавать» стальной иглой поверх стакана с водой, если поместить ее осторожно, не нарушая поверхностного натяжения.
 Обратите внимание на углубление в воде вокруг иглы.
Обратите внимание на углубление в воде вокруг иглы.Эти когезионные силы также связаны со свойством воды прилипать или притяжением между молекулами воды и другими молекулами. Это наблюдается, когда вода «поднимается» по соломинке, помещенной в стакан с водой. Вы заметите, что вода кажется выше по бокам соломинки, чем в середине. Это происходит потому, что молекулы воды притягиваются к соломинке и поэтому прилипают к ней.
Силы сцепления и сцепления важны для поддержания жизни.Например, благодаря этим силам вода может течь от корней к верхушкам растений, питая их.
Концепция в действии
Чтобы узнать больше о воде, посетите Геологическую службу США «Наука о воде для школ: все о воде»! Веб-сайт.
pH раствора является мерой его кислотности или щелочности. Вы, вероятно, использовали лакмусовую бумагу , бумагу, обработанную натуральным водорастворимым красителем, чтобы ее можно было использовать в качестве индикатора pH, чтобы проверить, сколько кислоты или основания (щелочность) существует в растворе. Возможно, вы даже использовали его, чтобы убедиться, что вода в открытом бассейне правильно очищена. В обоих случаях этот тест pH измеряет количество ионов водорода, присутствующих в данном растворе. Высокие концентрации ионов водорода приводят к низкому pH, тогда как низкие уровни ионов водорода приводят к высокому pH. Общая концентрация ионов водорода обратно пропорциональна его рН и может быть измерена по шкале рН (рис. 2.11). Следовательно, чем больше ионов водорода, тем ниже pH; и наоборот, чем меньше ионов водорода, тем выше рН.
Возможно, вы даже использовали его, чтобы убедиться, что вода в открытом бассейне правильно очищена. В обоих случаях этот тест pH измеряет количество ионов водорода, присутствующих в данном растворе. Высокие концентрации ионов водорода приводят к низкому pH, тогда как низкие уровни ионов водорода приводят к высокому pH. Общая концентрация ионов водорода обратно пропорциональна его рН и может быть измерена по шкале рН (рис. 2.11). Следовательно, чем больше ионов водорода, тем ниже pH; и наоборот, чем меньше ионов водорода, тем выше рН.
Шкала рН колеблется от 0 до 14. Изменение на одну единицу по шкале рН соответствует изменению концентрации ионов водорода в 10 раз, изменение на две единицы соответствует изменению концентрации ионов водорода в 10 раз. коэффициент 100. Таким образом, небольшие изменения pH представляют большие изменения концентрации ионов водорода. Чистая вода нейтральна. Он не является ни кислым, ни основным, и имеет рН 7,0. Все, что ниже 7,0 (в диапазоне от 0,0 до 6,9), является кислым, а все, что выше 7. 0 (от 7,1 до 14,0) – щелочной. Кровь в ваших венах слабощелочная (pH = 7,4). Среда в желудке очень кислая (pH = 1–2). Апельсиновый сок слабокислый (pH = примерно 3,5), тогда как пищевая сода имеет щелочную реакцию (pH = 9,0).
0 (от 7,1 до 14,0) – щелочной. Кровь в ваших венах слабощелочная (pH = 7,4). Среда в желудке очень кислая (pH = 1–2). Апельсиновый сок слабокислый (pH = примерно 3,5), тогда как пищевая сода имеет щелочную реакцию (pH = 9,0).
Кислоты представляют собой вещества, которые обеспечивают ионы водорода (H + ) и снижают pH, тогда как основания обеспечивают ионы гидроксида (OH – ) и повышают pH.Чем сильнее кислота, тем легче она отдает H + . Например, соляная кислота и лимонный сок очень кислые и легко выделяют H + при добавлении к воде. И наоборот, основания — это те вещества, которые легко отдают ОН — . Ионы OH – объединяются с H + с образованием воды, которая повышает pH вещества. Гидроксид натрия и многие бытовые чистящие средства очень щелочные и быстро выделяют OH – при попадании в воду, тем самым повышая pH.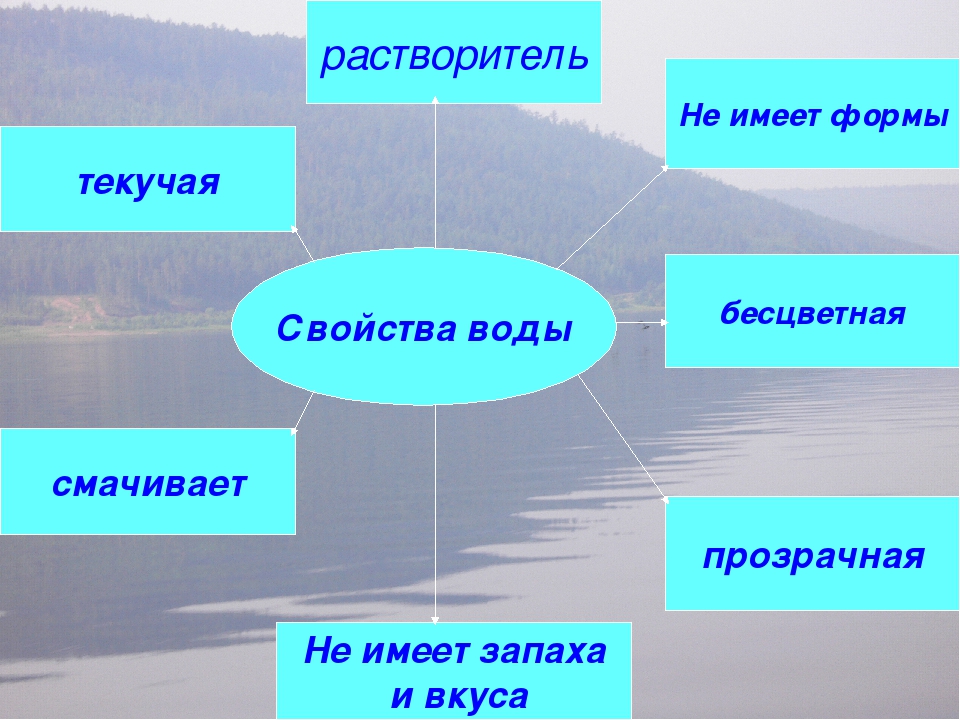
Большинство клеток в нашем организме функционируют в очень узком интервале шкалы рН, обычно в пределах от 7,2 до 7,6. Если pH тела выходит за пределы этого диапазона, дыхательная система работает со сбоями, как и другие органы тела. Клетки больше не функционируют должным образом, а белки разрушаются. Отклонение за пределы диапазона pH может вызвать кому или даже смерть.
Так как же мы можем глотать или вдыхать кислотные или щелочные вещества и не умирать? Буферы — это ключ. Буферы легко поглощают излишки H + или OH – , тщательно поддерживая pH тела в вышеупомянутом узком диапазоне. Углекислый газ является частью важной буферной системы в организме человека; он поддерживает pH в нужном диапазоне. Эта буферная система включает анион угольной кислоты (H 2 CO 3 ) и бикарбоната (HCO 3 – ). Если в организм попадает слишком много H + , бикарбонат соединяется с H + , образуя угольную кислоту и ограничивая снижение pH. Аналогичным образом, если в систему ввести слишком много ОН – , угольная кислота быстро диссоциирует на бикарбонат и ионы Н + . Ионы H + могут соединяться с ионами OH – , ограничивая увеличение pH. Хотя угольная кислота является важным продуктом этой реакции, ее присутствие мимолетно, потому что угольная кислота высвобождается из организма в виде углекислого газа каждый раз, когда мы дышим. Без этой буферной системы рН в нашем организме будет слишком сильно колебаться, и мы не сможем выжить.
Аналогичным образом, если в систему ввести слишком много ОН – , угольная кислота быстро диссоциирует на бикарбонат и ионы Н + . Ионы H + могут соединяться с ионами OH – , ограничивая увеличение pH. Хотя угольная кислота является важным продуктом этой реакции, ее присутствие мимолетно, потому что угольная кислота высвобождается из организма в виде углекислого газа каждый раз, когда мы дышим. Без этой буферной системы рН в нашем организме будет слишком сильно колебаться, и мы не сможем выжить.
Вода обладает многими свойствами, которые имеют решающее значение для поддержания жизни. Он полярен, что позволяет образовывать водородные связи, которые позволяют ионам и другим полярным молекулам растворяться в воде. Таким образом, вода является отличным растворителем. Водородные связи между молекулами воды придают воде способность удерживать тепло лучше, чем многие другие вещества. По мере повышения температуры водородные связи между водой постоянно разрываются и восстанавливаются, что позволяет общей температуре оставаться стабильной, хотя в систему добавляется повышенная энергия. Силы сцепления воды учитывают свойство поверхностного натяжения. Все эти уникальные свойства воды важны в химии живых организмов.
Силы сцепления воды учитывают свойство поверхностного натяжения. Все эти уникальные свойства воды важны в химии живых организмов.
рН раствора является мерой концентрации ионов водорода в растворе. Раствор с большим количеством ионов водорода является кислым и имеет низкое значение рН. Раствор с большим количеством гидроксид-ионов является основным и имеет высокое значение рН. Шкала рН колеблется от 0 до 14, при этом рН 7 является нейтральным. Буферы представляют собой растворы, которые смягчают изменения pH при добавлении в буферную систему кислоты или основания.Буферы важны в биологических системах из-за их способности поддерживать постоянный уровень рН.
кислота: вещество, которое отдает ионы водорода и поэтому снижает рН
адгезия: притяжение между молекулами воды и молекулами другого вещества
основание: вещество, которое поглощает ионы водорода и поэтому повышает рН
буфер: раствор, устойчивый к изменению pH за счет поглощения или выделения ионов водорода или гидроксида
когезия: межмолекулярные силы между молекулами воды, вызванные полярной природой воды; создает поверхностное натяжение
испарение: высвобождение молекул воды из жидкой воды с образованием водяного пара
гидрофильный: описывает вещество, которое растворяется в воде; водолюбивый
гидрофобный: описывает вещество, которое не растворяется в воде; боящийся воды
лакмусовая бумага: фильтровальная бумага, обработанная натуральным водорастворимым красителем, чтобы ее можно было использовать в качестве индикатора pH
Шкала pH: шкала от 0 до 14, которая измеряет приблизительную концентрацию ионов водорода в веществе
растворитель: вещество, способное растворять другое вещество
поверхностное натяжение: сила сцепления на поверхности тела жидкости, которая препятствует разделению молекул
температура: мера молекулярного движения
Ссылки
Хамфри, В. , Dalke, A. и Schulten, K., «VMD-Visual Molecular Dynamics», J. Molec. Графика , 1996, вып. 14, стр. 33-38. http://www.ks.uiuc.edu/Research/vmd/
, Dalke, A. и Schulten, K., «VMD-Visual Molecular Dynamics», J. Molec. Графика , 1996, вып. 14, стр. 33-38. http://www.ks.uiuc.edu/Research/vmd/
Атрибуция СМИ
- Рисунок 2.7 Гаутам Догра
- Рисунок 2.8
- ледяная решетка Джейн Уитни
- (б) Карлоса Понте
- Рисунок 2.10 Кори Занкера
- Рисунок 2.11 Эдварда Стивенса
Плотность воды | Глава 3: Плотность
Тебе это нравится? Не нравится ? Пожалуйста, найдите время, чтобы поделиться с нами своими отзывами.Спасибо!
Урок 3.3
Ключевые понятия
- Так же, как и твердые тела, жидкости также имеют свою плотность.
- Объем жидкости можно измерить непосредственно мерным цилиндром.
- Молекулы разных жидкостей имеют разный размер и массу.
- Масса и размер молекул жидкости, а также то, насколько плотно они упакованы вместе, определяют плотность жидкости.

- Как и твердое тело, плотность жидкости равна массе жидкости, деленной на ее объем; Д = м/об.
- Плотность воды 1 грамм на кубический сантиметр.
- Плотность вещества одинакова независимо от размера образца.
Сводка
Учащиеся измеряют объем и массу воды, чтобы определить ее плотность. Затем они измеряют массу различных объемов воды и обнаруживают, что плотность всегда одинакова.Учащиеся строят график зависимости объема и массы воды.
Цель
Учащиеся смогут измерить объем и массу воды и вычислить ее плотность. Учащиеся смогут объяснить, что, поскольку любой объем воды всегда имеет одинаковую плотность при данной температуре, эта плотность является характерным свойством воды.
Оценка
Загрузите лист с заданиями учащегося и раздайте по одному учащемуся, если это указано в задании.Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и ваши ученики носите правильно подобранные очки.
Материалы для каждой группы
- Градуированный цилиндр, 100 мл
- Вода
- Весы в граммах (могут измерять более 100 г)
- Пипетка
Материалы для демонстрации
- Вода
- Два одинаковых ведра или больших контейнера
Проведите демонстрацию, чтобы представить идею плотности воды.
Материалы
- Вода
- Два одинаковых ведра или больших контейнера
Подготовка учителей
Наполните одно ведро наполовину, а в другое добавьте примерно 1 стакан воды.
Процедура
- Выберите ученика, который поднимет оба ведра с водой.
- Спросите у студента-добровольца, какое ведро имеет большую массу.
Ожидаемые результаты
Ведро, в котором больше воды, имеет большую массу.
Спросите студентов:
- В уроках 3.1 — Что такое плотность? и 3.2 — Метод вытеснения воды, вы нашли плотность твердых тел, измерив их массу и объем.
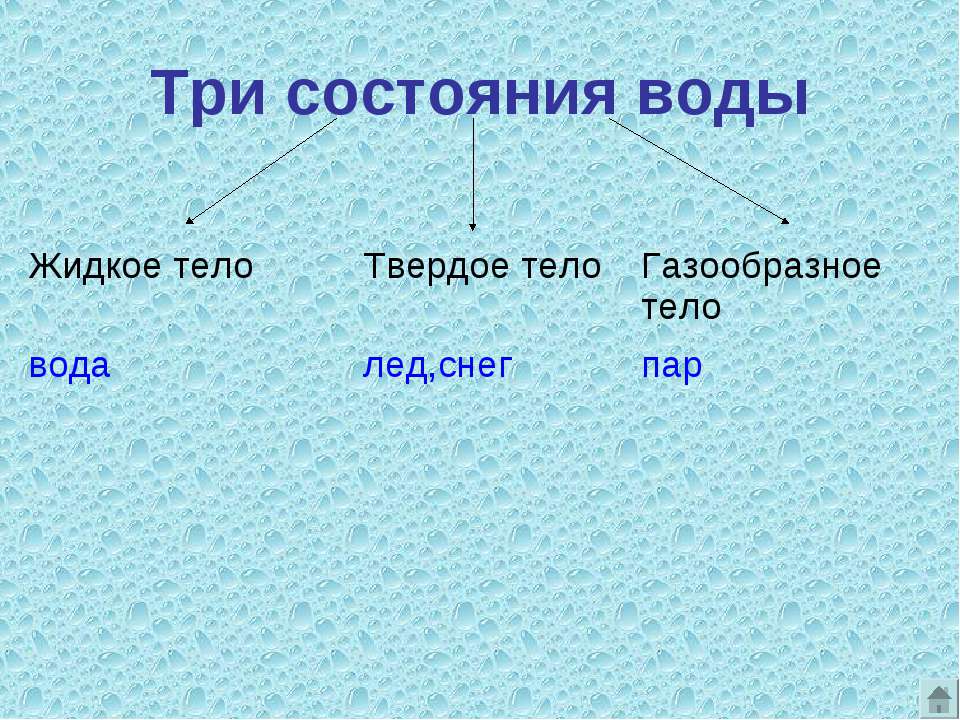 Как вы думаете, может ли жидкость, например вода, иметь плотность?
Как вы думаете, может ли жидкость, например вода, иметь плотность? - Учащиеся должны понять, что вода имеет объем и массу. Поскольку D=m/v, вода также должна иметь плотность.
- Как, по-вашему, можно найти плотность такой жидкости, как вода?
- Не ожидается, что учащиеся смогут полностью ответить на этот вопрос на данном этапе.Он задуман как повод к расследованию. Но учащиеся могут понять, что сначала им нужно каким-то образом найти массу и объем воды.
- Могут ли маленькое и большое количество воды, поднятые вашим одноклассником, иметь одинаковую плотность?
- Учащиеся могут указать, что ведро с большим количеством воды имеет большую массу, но больший объем. Ведро с меньшей массой имеет меньший объем. Поэтому возможно, что разное количество воды может иметь одинаковую плотность.
Дайте каждому учащемуся рабочий лист.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания. Разделы «Объясните это с помощью атомов и молекул» и «Воспримите это» в листе с заданиями будут выполняться в классе, в группах или индивидуально в зависимости от ваших инструкций.
 Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.Обсудите с учащимися, как найти объем и массу воды.
Скажите учащимся, что они попытаются определить плотность воды.
Спросите студентов:
- Какие две вещи нужно знать, чтобы найти плотность воды?
- Учащиеся должны понимать, что для определения плотности воды им нужны как объем, так и масса образца воды.
- Как можно измерить объем воды?
- Предложите учащимся использовать мерный цилиндр для измерения объема в миллилитрах.Напомните учащимся, что каждый миллилитр равен 1 см 3 .
- Как можно измерить массу воды?
- Предложите учащимся использовать весы для измерения массы в граммах. Скажите учащимся, что они могут найти массу, взвесив воду. Однако, поскольку вода является жидкостью, она должна находиться в каком-то контейнере. Таким образом, чтобы взвесить воду, они также должны взвесить контейнер.
 Объясните учащимся, что им придется вычесть массу пустого мерного цилиндра из массы цилиндра и воды, чтобы получить массу только воды.
Объясните учащимся, что им придется вычесть массу пустого мерного цилиндра из массы цилиндра и воды, чтобы получить массу только воды.
Предложите учащимся найти массу различных объемов воды, чтобы показать, что плотность воды не зависит от размера образца.
Вопрос для расследования
Имеют ли разное количество воды одинаковую плотность?
Материалы для каждой группы
- Градуированный цилиндр, 100 мл
- Вода
- Весы в граммах (могут измерять более 100 г)
- Пипетка
Процедура
- Найдите массу пустого мерного цилиндра.Запишите массу в граммах в таблице на рабочем листе.
Налейте 100 мл воды в мерный цилиндр. Постарайтесь быть максимально точным, убедившись, что мениск находится прямо на отметке 100 мл. Используйте пипетку, чтобы добавить или удалить небольшое количество воды.
- Взвесьте мерный цилиндр с водой. Запишите массу в граммах.

- Найдите массу только воды, вычитая массу пустого градуированного цилиндра.Запишите массу 100 мл воды в таблицу.
- Используйте массу и объем воды для расчета плотности. Запишите плотность в г/см 3 в таблице.
- Сливайте воду, пока в мерном цилиндре не будет 50 мл воды. Если вы случайно вылили слишком много, добавляйте воду, пока не дойдете до 50 мл.
Найдите массу 50 мл воды. Запишите массу в лист активности. Рассчитайте и запишите плотность.
- Затем слейте воду, пока в мерном цилиндре не будет 25 мл воды. Найдите массу 25 мл воды и запишите ее в таблицу. Рассчитайте и запишите плотность.
Таблица 1. Нахождение плотности различных объемов воды. Объем воды 100 миллилитров 50 миллилитров 25 миллилитров Масса мерного цилиндра + вода (г) Масса пустого мерного цилиндра (г) Масса воды (г) Плотность воды (г/см 3 ) Ожидаемые результаты
Плотность воды должна быть близка к 1 г/см 3 .
 Это верно для 100, 50 или 25 мл.
Это верно для 100, 50 или 25 мл.Спросите студентов:
- Посмотрите на свои значения плотности на диаграмме. Одинакова ли плотность различных объемов воды?
- Помогите учащимся увидеть, что большинство различных значений плотности близки к 1 г/см 3 . Они могут задаться вопросом, почему не все их значения точно равны 1 г/см 3 . Одной из причин может быть неточность измерения. Другая причина заключается в том, что плотность воды меняется в зависимости от температуры.Вода имеет наибольшую плотность при 4 °C и при этой температуре имеет плотность 1 г/см 3 . При комнатной температуре, около 20–25 °C, плотность составляет около 0,99 г/см 3 .
- Какова плотность воды в г/см3?
- Ответы учащихся могут различаться, но в основном их значения должны быть около 1 г/см 3 .
Предложите учащимся начертить свои результаты.
Помогите учащимся построить график данных на листе с заданиями.
 По оси x должен быть объем, а по оси y масса.
По оси x должен быть объем, а по оси y масса.Когда учащиеся наносят свои данные на график, должна быть прямая линия, показывающая, что при увеличении объема масса увеличивается на ту же величину.
Обсудите наблюдения учащихся, данные и графики.
Спросите студентов:
- Используйте свой график, чтобы найти массу 40 мл воды. Какова плотность этого объема воды?
- Масса 40 мл воды равна 40 граммам.Поскольку D = m/v и mL = см 3 , плотность воды равна 1 г/см 3 .
- Выберите объем от 1 до 100 мл. Используйте свой график, чтобы найти массу. Какова плотность этого объема воды?
- Независимо от того, весят ли ученики 100, 50, 25 мл или любое другое количество, плотность воды всегда будет равна 1 г/см 3 .
Скажите учащимся, что плотность – это характерное свойство вещества. Это означает, что плотность вещества одинакова независимо от размера образца.
Спросите студентов:
- Является ли плотность характерным свойством воды? Откуда вы знаете?
- Плотность является характеристическим свойством воды, поскольку плотность любой пробы воды (при одной и той же температуре) всегда одинакова.
 Плотность 1 г/см 3 .
Плотность 1 г/см 3 .
Объясните, почему плотность пробы воды любого размера всегда одинакова.
Спроецируйте изображение Плотность воды.
Молекулы воды имеют одинаковую массу и размер. Молекулы воды также упакованы довольно близко друг к другу. Они упакованы одинаково во всей пробе воды. Итак, если объем воды имеет определенную массу, удвоенный объем будет иметь удвоенную массу, трехкратный объем будет иметь трехкратную массу и т. д. Независимо от того, какой размер пробы воды вы измеряете, соотношение между массой и объемом всегда будет одинаковым. Поскольку D=m/v, плотность одинакова для любого количества воды.
Проект анимации «Жидкая вода».
Молекулы воды всегда в движении. Но в среднем они упакованы везде одинаково. Следовательно, соотношение между массой и объемом одинаково, что делает плотность одинаковой. Это верно независимо от размера выборки или места, откуда вы ее выбираете.
Предложите учащимся подумать, равна ли плотность большого куска твердого вещества плотности меньшего куска.

Дайте учащимся время рассчитать плотность каждого из трех образцов, нарисованных на листе с заданиями, и ответить на соответствующие вопросы.
Спросите студентов:
- Плотность жидкости не зависит от размера образца. Может ли это быть верно и для твердых тел? Рассчитайте плотность каждого из трех образцов, чтобы выяснить это.
- Да. Плотность твердого вещества одинакова независимо от размера образца.
- Образец А имеет массу 200 г. Какова плотность образца А?
- Д = м/об
- D = 200 г/100 см 3
- D = 2 г/см 3
- Если вы разрежете образец A пополам и осмотрите только одну половину, вы получите образец B. Какова плотность образца B?
- Если учащиеся не знают массу, скажите им, что это половина массы образца А.Поскольку образец А весил 200 г, образец В составляет половину объема и, следовательно, половину массы (100 г).
- Д = м/об
- D = 100 г/50 см 3
- D = 2 г/см 3
- Если вы разрежете образец B пополам, вы получите образец C.
 Какова плотность образца C?
Какова плотность образца C? - Д = м/об
- Г = 50 г/25 см 3
- D = 2 г/см 3
ПЛАН УРОКА «СВОЙСТВА ВОДЫ» — ПОЛНЫЙ НАУЧНЫЙ УРОК С ИСПОЛЬЗОВАНИЕМ МЕТОДА ОБУЧЕНИЯ 5E
В конце этого плана урока «Свойства воды» учащиеся смогут определить физические и химические свойства воды и описать, насколько важны свойства воды. к динамике планеты.Каждый урок разработан с использованием метода обучения 5E, чтобы обеспечить максимальное понимание учащимися.
Следующий пост проведет вас через все этапы и мероприятия из свойств плана урока по воде.
В начале урока класс проведет «Думай-пары-поделись», чтобы обсудить цель.
Учитель поможет развеять любые заблуждения о свойствах воды. Некоторые основные заблуждения заключаются в том, что учащиеся думают, что объекты плавают в воде, потому что они легче воды.Не всегда — подумайте о поверхностном натяжении. Кроме того, студенты считают, что молекулы льда холоднее молекул воды. Действительно молекулы льда имеют меньшую кинетическую энергию, чем молекулы воды.
Действительно молекулы льда имеют меньшую кинетическую энергию, чем молекулы воды.
Расчетное время занятия: 20-30 минут
РАЗВЕДКА
Эта студенческая лаборатория создана для того, чтобы учащиеся могли начать изучать свойства воды. Четыре станции считаются входными станциями, где учащиеся изучают новую информацию о свойствах воды, а четыре станции являются выходными станциями, где учащиеся будут демонстрировать свое мастерство в отношении входных станций.Каждая из станций дифференцирована, чтобы бросить вызов учащимся, использующим другой стиль обучения. Вы можете прочитать больше о том, как я создал лабораторию станции здесь.
ИССЛЕДУЙ!
Учащиеся будут работать в парах, чтобы лучше понять, что это значит, когда вода описывается как обладающая поверхностным натяжением. Учащиеся будут следовать указаниям на карточках с заданиями, проводя мини-лабораторную работу по поверхностному натяжению с помощью капельницы и монеты.
ПОСМОТРЕТЬ!
На этой станции учащиеся будут смотреть семиминутный видеоролик, объясняющий свойства воды.Затем учащиеся ответят на вопросы, связанные с видео, и запишут свои ответы в лист лабораторной станции. Например: Опишите, что такое водородная связь. Что такое поверхностное натяжение? Приведите два примера из видео того, как свойства воды важны для жизни на Земле.
ИССЛЕДУЙТЕ!
Исследовательская станция позволит учащимся взаимодействовать с симуляцией, позволяющей им создавать молекулы воды. Он научит студентов полярности и тому, как молекулы могут быть слиты с помощью химической связи.Затем учащимся будет предложено ответить на несколько вопросов, основанных на проведенном ими исследовании.
ПРОЧИТАЙТЕ ЭТО!
Эта станция предоставит учащимся одностраничное чтение о капиллярном действии. В чтении студенты узнают, что такое капиллярное действие и почему оно важно в нашей повседневной жизни. Есть 4 дополнительных вопроса, на которые учащиеся должны ответить, чтобы продемонстрировать понимание прочитанного предмета.
ОЦЕНИТЕ ЭТО!
Станция оценки — это место, куда учащиеся доказывают свое мастерство в изучении концепций, изученных в лаборатории.Вопросы составлены в стандартном формате с несколькими вариантами ответов. Некоторые вопросы включают: Что лучше всего иллюстрирует электрический заряд молекулы воды? Какое свойство воды отвечает за капиллярное действие? Почему хороший пример свойства воды называется поверхностным натяжением? Какой ответ лучше всего описывает сплоченность?
НАПИШИТЕ ЭТО!
Учащиеся, которые могут ответить на открытые вопросы о лабораторной работе, действительно понимают изучаемые концепции.На этом этапе учащиеся будут отвечать на три карточки с заданиями: Опишите, что означает полярность с точки зрения свойства воды. Что такое испарение и как оно способствует выживанию видов? Какие свойства воды позволяют организмам выживать подо льдом?
ИЗОБРАЖАЙТЕ ЭТО!
Эта станция понравится вашим ученикам-зрителям. Сначала учащиеся должны будут выполнить часть, посвященную исследовательской станции, потому что учащимся нужно будет нарисовать модель, показывающую 4 молекулы воды, связанные вместе. Студенты могут использовать компьютерное устройство для справки.
Студенты могут использовать компьютерное устройство для справки.
ОРГАНИЗУЙТЕ ЭТО!
Станция организации позволяет вашим учащимся размещать карточки, содержащие определения к правильному словарному слову, которое оно описывает.
Расчетное время занятий для исследования: 1-2, 45-минутные уроки
ОБЪЯСНЕНИЕ
Объяснение станет намного более увлекательным для класса, как только они закончат лабораторию исследовательской станции.Во время пояснительной части учитель прояснит любые неправильные представления о свойствах воды с помощью интерактивной презентации PowerPoint, опорных диаграмм и интерактивных заданий в тетради. Свойства урока воды включает в себя PowerPoint с разбросанными повсюду заданиями, чтобы заинтересовать учащихся.
Студенты также будут взаимодействовать со своими журналами, используя шаблоны INB для свойств воды. Каждое задание INB предназначено для того, чтобы помочь учащимся разделить информацию для лучшего понимания концепции. Свойства шаблона INB для воды позволяют учащимся сосредоточить свои заметки на изучении словарного запаса и его определений.
Свойства шаблона INB для воды позволяют учащимся сосредоточить свои заметки на изучении словарного запаса и его определений.
Расчетное время занятий для исследования: 2-3, 45-минутные уроки
РАЗРАБОТКА
Уточняющий раздел метода обучения 5E предназначен для того, чтобы дать учащимся выбор того, как они могут доказать свое владение концепцией. Когда учащимся предоставляется выбор, «покупка» намного выше, чем когда учитель сообщает им проект, который им предстоит создать.Уточняющий проект позволит учащимся создать презентацию, чтобы рассказать о свойствах воды. Расчетное время занятий для проработки: 2–3 занятия по 45 минут (также можно использовать в качестве домашнего проекта)
ОЦЕНКА
Последняя часть модели 5E предназначена для оценки понимания учащимися. В каждый урок 5E входит домашнее задание, оценивание и модифицированное оценивание. Исследования показали, что домашняя работа должна быть значимой и применимой к реальной деятельности, чтобы быть эффективной. Когда это возможно, я предпочитаю давать открытые оценки, чтобы по-настоящему оценить понимание учащимся.
Когда это возможно, я предпочитаю давать открытые оценки, чтобы по-настоящему оценить понимание учащимся.
Расчетное время занятий для проработки: 1, 45 минут занятий
СКАЧАТЬ ПОЛНЫЙ УРОК СЕЙЧАС
Полный урок доступен для скачивания в моем магазине TpT. Сэкономьте себе массу времени и возьмите его сейчас.
Свойства материи: от макро до наномасштаба
1. Активизировать предварительные знания учащихся о свойствах материи и наномасштабе.
Спросите: Что такое свойство материи? Выяснить у учащихся, что свойства материи — это характеристики, определяющие поведение различных типов материи. Уникальные комбинации свойств делают их похожими или отличными от других типов материи. Спросите: Какие примеры? (Примеры учащихся могут различаться, но могут включать цвет, площадь поверхности, массу и вес.)
Расскажите о свойствах, которые будут в центре внимания демонстрации, написав их на доске: цвет, видимый свет, реакционная способность, отношение площади поверхности к объему и поверхностное натяжение. Всем классом кратко обсудите, что означает каждое свойство. Объясните, что ничего страшного, если учащиеся еще не полностью понимают свойства. Они узнают о них больше на протяжении всего занятия. Напишите на доске термин «наномасштаб» и предложите парам учащихся обсудить, что, по их мнению, означает этот термин. Затем всем классом попросите студентов поделиться вслух некоторыми своими идеями. Предложите учащимся разбить термин на его корневые слова, нано и масштаб. Устраните любые неправильные ответы и убедитесь, что они понимают, что наномасштаб имеет какое-то отношение к измерениям.
Всем классом кратко обсудите, что означает каждое свойство. Объясните, что ничего страшного, если учащиеся еще не полностью понимают свойства. Они узнают о них больше на протяжении всего занятия. Напишите на доске термин «наномасштаб» и предложите парам учащихся обсудить, что, по их мнению, означает этот термин. Затем всем классом попросите студентов поделиться вслух некоторыми своими идеями. Предложите учащимся разбить термин на его корневые слова, нано и масштаб. Устраните любые неправильные ответы и убедитесь, что они понимают, что наномасштаб имеет какое-то отношение к измерениям.
2. Предложите учащимся просмотреть и обсудить видеоролик NISE Net «Введение в Nano».
Скажите учащимся, что в следующий раз они посмотрят видео, которое расскажет им больше о наноразмерах и свойствах материи. Когда они просматривают видео NISE Net «Введение в нано» (3 мин. 10 сек.), попросите их посмотреть и послушать слова, которые включают или относятся к «нано», «свойствам» и «масштабу». Пусть они запишут эти слова на своей бумаге. После просмотра обсудите видео в классе.Спросите: Какие слова вы записали? Ответы будут разными, но они должны включать термины «наномасштаб», «нанотехнология», «нанометр» и «наночастица».
Пусть они запишут эти слова на своей бумаге. После просмотра обсудите видео в классе.Спросите: Какие слова вы записали? Ответы будут разными, но они должны включать термины «наномасштаб», «нанотехнология», «нанометр» и «наночастица».
Предложите учащимся в своих работах расположить термины макрос , нано и микро в порядке от большего к меньшему. Объясните, что объекты в макромасштабе самые большие, и мы можем видеть их невооруженным глазом. Объекты в микромасштабе требуют, чтобы мы использовали специальные инструменты, такие как оптические микроскопы, чтобы увидеть их.Мельчайшие объекты, такие как атомы и молекулы, имеют наномасштаб. Спросите: Из видео вы помните, насколько велик нанометр по сравнению с метром? Поднимите метровую палочку и объясните, что нанометр (нм) — это единица длины, эквивалентная одной миллиардной (10 -9 ) метра. Для сравнения объясните, что один дюйм равен 25,4 нанометра, а толщина листа бумаги, на котором они пишут, составляет примерно 100 000 нанометров. В этом наномасштабе (1-100 нм) ученые могут изменять отдельные атомы и молекулы.Эти изменения могут привести к изменению физических, химических, биологических и оптических свойств вещества. Спросите: Из того, что вы узнали из видео, какие типы нанотехнологий создают ученые, изменяя свойства материи? Добивайтесь от студентов нанотехнологий, включая лекарства, лекарства от рака, более дешевую и чистую энергию, системы фильтрации воды и грязеотталкивающую одежду.
В этом наномасштабе (1-100 нм) ученые могут изменять отдельные атомы и молекулы.Эти изменения могут привести к изменению физических, химических, биологических и оптических свойств вещества. Спросите: Из того, что вы узнали из видео, какие типы нанотехнологий создают ученые, изменяя свойства материи? Добивайтесь от студентов нанотехнологий, включая лекарства, лекарства от рака, более дешевую и чистую энергию, системы фильтрации воды и грязеотталкивающую одежду.
3. Раздайте рабочий лист «Свойства наночастиц» и проведите демонстрацию.
В зависимости от имеющегося у вас времени занятий и учебных потребностей, определите, хотите ли вы, чтобы ваши ученики выполняли все или только некоторые из демонстраций, перечисленных в шаге 4 ниже. Объясните учащимся, что в оставшейся части задания они будут использовать серию видеороликов и практических демонстраций (демонстраций), чтобы дополнительно изучить, как определенные свойства материи различаются на макро- и наноуровне.
Попросите учащихся вспомнить разницу между макро- и наноразмерами, обсуждавшуюся на шаге 2.Объясните учащимся, что, хотя они и не могут увидеть, что происходит в наномасштабе, демонстрации и видеоролики будут служить моделями, демонстрирующими, как свойства изменяются в разных масштабах. При необходимости уточните, что такое модель, и/или приведите примеры.
Раздайте рабочий лист Nano Properties и прочитайте вслух указания. Попросите учащихся заполнить первую колонку названиями демонстраций, которые они будут делать. Ответьте на любые вопросы, убедившись, что учащиеся понимают, что делать во время и после каждой демонстрации.При необходимости еще раз просмотрите значение каждого свойства. (ПРИМЕЧАНИЕ. Если нет особой причины, демонстрации следует выполнять в порядке, указанном в рабочем листе. Поскольку задание написано, Золото , Алюминий и Растения и ткани являются демонстрационными видео. практические демонстрации: Солнцезащитный крем , Пузырьки , Чашки для воды и Таблетки антацида .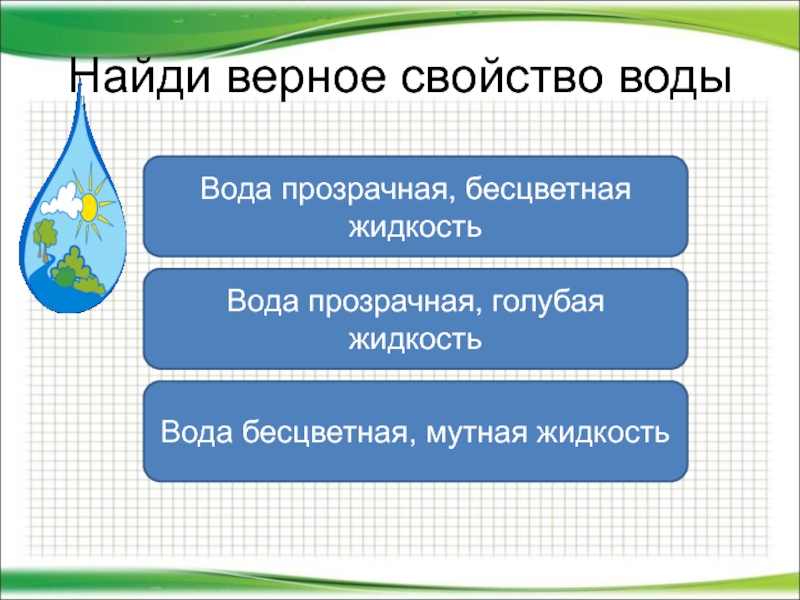 За исключением Солнцезащитного крема и Таблеток антацида , все практические материалы сопровождаются соответствующим видео, поэтому, если или время ограничено, их можно было бы сделать в виде демонстраций только видео.)
За исключением Солнцезащитного крема и Таблеток антацида , все практические материалы сопровождаются соответствующим видео, поэтому, если или время ограничено, их можно было бы сделать в виде демонстраций только видео.)
4. Предложите учащимся понаблюдать за демонстрацией и заполнить рабочий лист «Свойства наночастиц».
При проведении демонстраций см. инструкции и информацию, приведенные здесь, а также в ключе рабочего листа Nano Properties.
а. Золото :
- Видеодемонстрация: видео NISE Net, «Intro to Nano»
- Время: Видео — 3 минуты 10 секунд
- Свойства: цвет, видимый свет
- Инструкции: эта демонстрация включена в видео «Введение в Nano», показанное на шаге 2.После просмотра видео учащиеся должны заполнить рабочий лист в небольших группах или всем классом.
б. Алюминий :
- Видеодемонстрация: видео NISE Net, «Нано и я: алюминий»
- Время: Видео — 33 секунды
- Свойства: реакционная способность, отношение площади поверхности к объему
- Инструкции: после просмотра видео учащиеся должны заполнить рабочий лист небольшими группами или всем классом.

c. Солнцезащитный крем :
- Практическая демонстрация: с этой демонстрацией не связано видео.
- Время: 2-3 минуты
- Свойства: видимый свет
- Инструкции: Разделите учащихся на небольшие группы и раздайте образцы солнцезащитных средств, содержащих оксид цинка или диоксид титана. Каждая группа должна получить прозрачный образец (наночастицы) и непрозрачный образец (более крупные частицы). Скажите им, чтобы они применяли небольшое количество каждого из них, а затем сравнивали и сопоставляли то, что они наблюдают.Учащиеся должны заполнить рабочий лист небольшими группами или всем классом.
d. Пузыри :
- Практическое занятие и видео-демонстрация: видео NISE Net «Что такое Nano в пузырьках?»
- Время: Практика — 5 минут; Видео — 38 секунд
- Свойства: видимый свет, поверхностное натяжение
- Инструкции: Разделите учащихся на небольшие группы и раздайте им образцы мыльной воды и соломинки.
 Предложите учащимся поэкспериментировать с формированием пузырей и наблюдением за ними.После заполнения разделов «наблюдения» и «свойства» их рабочих листов просмотрите видео всем классом. Затем учащиеся должны заполнить рабочий лист небольшими группами или всем классом.
Предложите учащимся поэкспериментировать с формированием пузырей и наблюдением за ними.После заполнения разделов «наблюдения» и «свойства» их рабочих листов просмотрите видео всем классом. Затем учащиеся должны заполнить рабочий лист небольшими группами или всем классом.
e. Чашки для воды :
- Практическое занятие и демо-видео: видео NISE Net, «Нано и я — гравитация»
- Время: Практика — 5 минут; Видео — 32 секунды
- Свойства: поверхностное натяжение
- Инструкции: Разделите учащихся на небольшие группы и раздайте им простую воду, а также большие и маленькие «чашки».Сообщите учащимся, что чашка обычного размера представляет макромасштаб, а маленькая чашка (крышка от зубной пасты или маленький наперсток) представляет наномасштаб. Попросите студентов наполнить свои чашки водой и медленно вылить их, записывая свои наблюдения за тем, что происходит. После заполнения разделов «наблюдения» и «свойства» их рабочих листов просмотрите видео всем классом.
 Объясните, что статическое электричество, подобно гравитации и поверхностному натяжению, ведет себя по-разному в макро- и наномасштабах. Затем учащиеся должны заполнить рабочий лист небольшими группами или всем классом.Если позволяет время, учащиеся могут поэкспериментировать со сравнением поверхностного натяжения мыльной воды (из демонстрации Bubbles) и обычной воды.
Объясните, что статическое электричество, подобно гравитации и поверхностному натяжению, ведет себя по-разному в макро- и наномасштабах. Затем учащиеся должны заполнить рабочий лист небольшими группами или всем классом.Если позволяет время, учащиеся могут поэкспериментировать со сравнением поверхностного натяжения мыльной воды (из демонстрации Bubbles) и обычной воды.
ф. Таблетки антацида :
- Практическая демонстрация: с этой демонстрацией не связано видео.
- Время: Практика — 5 минут
- Свойства: реакционная способность, отношение площади поверхности к объему
- Инструкции: Разделите учащихся на небольшие группы, дав каждой группе две прозрачные чашки с простой водой (равного объема), две прозрачные пустые чашки, две таблетки антацида, лист бумаги и инструмент для измельчения одной из таблеток (внутри бумажной ).Скажите учащимся положить всю таблетку в одну из пустых чашек, а вторую таблетку раздавить и добавить в другую пустую чашку.
 Скажите учащимся, что они будут добавлять в таблетки две капли пищевого красителя и равные объемы воды. Прежде чем добавить воду, попросите учащихся предсказать, что произойдет, если воду добавить в каждую из чашек. Напомните им лить воду примерно с одинаковой скоростью. Учащиеся должны заполнить рабочий лист небольшими группами или всем классом.
Скажите учащимся, что они будут добавлять в таблетки две капли пищевого красителя и равные объемы воды. Прежде чем добавить воду, попросите учащихся предсказать, что произойдет, если воду добавить в каждую из чашек. Напомните им лить воду примерно с одинаковой скоростью. Учащиеся должны заполнить рабочий лист небольшими группами или всем классом.
г. Растения и ткани :
- Демонстрационное видео: видео NISE Net, «На мне нет пятен»
- Время: Видео — 3 минуты 43 секунды
- Свойства: поверхностное натяжение
- Инструкции: после просмотра видео учащиеся должны заполнить рабочий лист небольшими группами или всем классом. Вместо того, чтобы сразу смотреть видео, его можно превратить в практическую демонстрацию, предоставив учащимся образцы различных салатов и зелени из продуктового магазина.Используя пипетки и воду, они могут экспериментировать с тем, какие листья или листья салата являются водостойкими и водоотталкивающими.
 Сытная зелень, такая как капуста и листовая капуста, отталкивает воду, а более мягкие листья салата, такие как айсберг, впитывают воду.
Сытная зелень, такая как капуста и листовая капуста, отталкивает воду, а более мягкие листья салата, такие как айсберг, впитывают воду.
5. Предложите учащимся обдумать и обсудить то, что они узнали о свойствах материи и наномасштабе.
Предложите учащимся выбрать два свойства, о которых они узнали в демонстрациях, и обсудить с партнером другие примеры этих свойств, которые они наблюдали.Например, учащиеся могли видеть, как скрепка плавает или тонет в чашке с водой в зависимости от того, как она была помещена в воду. Это пример поверхностного натяжения. Студенты могли видеть цвета радуги (спектр видимого света) после дождя или наблюдать, как сахар или соль быстрее растворяются в горячей воде (реактивность).
Затем попросите пары учащихся перечислить не менее трех примеров продуктов или применений нанотехнологий и поделиться ими со всем классом. Предложите учащимся придумать приложения для нанотехнологий, которые не обсуждались в демонстрационных материалах.
В заключение подчеркнем, что понимание того, как различные свойства материи изменяются на наноуровне, является ключевым компонентом нанотехнологии. Применение нанотехнологий весьма разнообразно и коренным образом меняет многие аспекты науки и промышленности, включая энергетику, науку об окружающей среде, национальную безопасность, транспорт, безопасность пищевых продуктов, информационные технологии и медицину. Чем больше ученые узнают о свойствах наноразмеров, тем больше область нанонауки будет продолжать расти.
.