Тренажер по химии «Валентность химических элементов» (8 класс)
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Вербина Вера ДмитриевнаМесто работы (полное наименование ОУ, город, область), должность
ГОУ РК «Республиканский центр образования»
г. Сыктывкар Республика Коми
учитель химии
Предмет
химия
Класс
8 класс
Название материала
Тренажер «Валентность химических элементов»
Вид ресурса (разработка учебного занятия, дидактический материал, тренажер, методические рекомендации, статья и т.п.)
тренажер
УМК, авторы образовательной программы
любой
Цель, задачи авторского материала (урока, презентации, видеоролика, внеклассного мероприятия и т.п.)
Цель: закрепление и обобщение знаний по теме «Валентность химических элементов».
Задачи:
— систематизировать знания о валентности химических элементов;
— развивать навыки самоконтроля;
— способствовать формированию мотивации и позитивного интереса к изучению химии.
Среда, редактор, в котором выполнен продукт
MS Office PowerPoint 2007
Как реализуется на уроке (время и место, форма использования)
При изучении и повторении темы «Валентность химических элементов».
Краткое описание, методические рекомендации по использованию
Тренажер состоит из 10 заданий в форме теста. Тренажер можно использовать на уроках химии с целью тренировки, закрепления знаний и самоконтроля учащихся по теме «Валентность», а также контроля, выявления и ликвидации пробелов в усвоении материала темы.
Перед выполнением теста у учащихся есть возможность пройти по ссылке и повторить тему, просмотрев видеоурок.
В навигации по тренажеру и оценке ответов участвует Химик, который говорит голосом попугая Кеши. При правильном ответе он говорит: «Прелестно! Прелестно!», при неверном – другую фразу из мультфильма. Включение данного героя в тренажер призвано улучшить настроение, вызвать улыбку учащихся.
Список используемых источников
Урок по теме: Валентность 8 класс | План-конспект урока по химии (8 класс) на тему:
Открытый урок по теме: «Валентность химических элементов».
Тип урока: комбинированный, изучение нового материала
Цель урока: сформировать понятие валентность и умение определять валентность по химическим формулам и составлять химические формулы по валентности.
Задачи урока
I. Образовательные.
1. Познакомить учащихся с понятием валентность;
2. Сформировать и закрепить умение определять валентность по химическим формулам;
3. Сформировать и закрепить умение составлять формулы, зная валентность химических элементов.
II. Воспитательные.
Показать единство материального мира
III. Развивающие.
Умение записывать химические формулы веществ, зная валентность элементов, входящих в состав данного вещества. Приобретение навыков самостоятельной работы.
Основные понятия: валентность,
Оборудование: таблицы и схемы
Используемая литература:
Учебник «Химия 8 класс» под редакцией Е.Е. Минченкова
Учебник «Химия 8 класс» Н.Е. Кузнецова
План урока:
- Организационный момент (3 мин)
приветствие; отметить отсутствующих.
- Постановка проблемного вопроса (3 мин)
- Актуализация знаний, (беседа 10 мин)
- Объяснение нового материала по теме «Валентность химических элементов» (15 мин)
- Закрепление материала, повторение ключевых моментов.
 Подведение итогов: ответ на проблемный вопрос (5 мин)
Подведение итогов: ответ на проблемный вопрос (5 мин) - Домашнее задание (1 мин)
Сегодня мы с вами повторим материал, который изучали на прошлом уроке «Химическая формула». Относительная молекулярная масса». Потренируемся в вычислении относительной молекулярной массы. А затем перейдем к изучению новой темы.
Итак, первый вопрос: что такое химическая формула? (предполагаемый ответ – химическая формула – это запись, выражающая качественный и количественный состав данного вещества).
А что такое, качественный и количественный состав вещества? (предполагаемый ответ – качественный состав – это какие элементы входят в состав данного вещества, а количественный – в каком соотношении).
Что такое, индекс и коэффициент в химической формуле? (предполагаемый ответ – индекс обозначает число атомов каждого химического элемента, входящего в состав молекулы, пишется справа внизу от символа элемента. Коэффициент – обозначает количество атомов или молекул, пишется перед символом элемента).
Что означает следующая запись:
2Сl, 2Сl2, 3Сl2, 5НСl
Предполагаемый ответ:
2Сl – два атома хлора;
2Сl2 – две молекулы хлора;
3Сl2 – три молекулы хлора;
5НСl – пять молекул хлороводорода.
Следующий вопрос: Что такое относительная молекулярная масса, как она обозначается и как рассчитывается?
Предполагаемый ответ – относительная молекулярная масса – показывает во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода; обозначается Мr. Относительная молекулярная масса равна сумме относительных атомных масс элементов, входящих в состав молекулы вещества, с учетом индексов.
Давайте рассчитаем Мr молекулы следующего вещества:
Мr(Al2(SO4)3) = Ar(Al)2 + Ar(S)3 + Ar(O)12 = 54 + 96 + 192 = 342
Значит относительная молекулярная масса Al2(SO4)3 равна 342.
Итак, а теперь переходим к изучению новой темы. В конце урока мы напишем небольшую самостоятельную работу по новой теме, поэтому слушайте внимательно и переписывайте записи с доски. Запишите тему урока: «Валентность химических элементов».
Запишите тему урока: «Валентность химических элементов».
Только что мы с вами вспомнили, что такое химическая формула. Каждое вещество имеет свою химическую формулу, которая выражает его качественный и количественный состав, т.е. какие элементы и в каком количестве входят в состав одной молекулы данного вещества.
А как же узнают состав каждого вещества. С помощью сложных экспериментов. Однако, зная валентность можно составить формулу любого вещества. Итак, запишем, что же такое валентность:
Валентность – это способность атомов удерживать при себе определенное число атомов других элементов.
Валентность атома водорода принята за единицу.
I I I I
НСl h3O Nh4 Ch5
Cледовательно, атом водорода не может присоединять больше одного атома другого элемента, но другие элементы могут присоединять один (НСl), два (h3O), три (Nh4), четыре (Ch5) и более атомов водорода (показать шаростержневые модели этих молекул).
Валентность обозначается римской цифрой, которая ставится над знаком химического элемента в формуле вещества.
А кислород? Атом кислорода всегда двухвалентен.
II II II
h3O SO3 CO2
Атомы одних химических элементов имеют постоянную валентность, а других переменную (т.е. в разных соединениях один и тот же элемент может проявлять разную валентность):
VI IV II
SO3 SO2 h3S
В учебнике на странице 25 в таблице приведены валентности химических элементов в соединениях. Жирным шрифтом обозначены те элементы, которые имеют постоянную валентность (Na, К, Н, О и др.).
Зная формулы веществ, состоящих из двух элементов, и валентность одного из них, можно определить валентность другого элемента. Например, СuO – оксид меди (II). Мы знаем, что валентность кислорода равна двум. Если на один атом кислорода приходится один атом меди, значит, валентность меди тоже равна двум.
Например, СuO – оксид меди (II). Мы знаем, что валентность кислорода равна двум. Если на один атом кислорода приходится один атом меди, значит, валентность меди тоже равна двум.
Запишем правила определения валентности по формулам их соединений.
Правила определения валентности элементов в соединениях:
1. Записать химическую формулу вещества и указать валентность известного элемента.
Например, оксид углерода (IV) имеет формулу – СО2, валентность кислорода постоянна и равна двум, записываем над символом кислорода II
II
СО2
2. Найти наименьшее общее кратное (НОК) между известным значением валентности и индексом этого элемента.
Для этого умножаем валентность известного элемента на индекс при этом элементе:
2 × II = 4 – это и есть НОК
3. Наименьшее общее кратное разделить на индекс другого элемента, полученное число и есть значение валентности.
Индекс при атоме углерода равен 1, значит:
4 : 1 = IV – это и есть валентность атома углерода
IV II
СО2
Разберем еще один пример:
II
Fe2O3
1. Валентность кислорода постоянна и равна II.
2. НОК: 3 × II = 6
3. 6 : 2 = III – это и есть валентность атома железа
III II
Fe2O3
Определим валентность химических элементов в следующих соединениях:
СаО ZnCl2
N2O3 Li2S
Nh4 Mg3P2
Валентность атомов кислорода вы уже знаете, а валентность других элементов, имеющих постоянную валентность, находим по таблице.
Вы уже умеете определять валентность химических элементов в соединениях, формулы которых известны. А теперь рассмотрим как, зная валентность составить химические формулы.
А теперь рассмотрим как, зная валентность составить химические формулы.
Для составления химической формулы, нужно знать валентность элементов в данном соединении. Валентности некоторых элементов представлены в таблице учебника.
Правила составления химических формул по валентности:
1. Записать химические знаки элементов, входящих в состав соединения, и указать их валентности.
Например, составим формулу оксида алюминия – соединения алюминия с кислородом. Запишем знаки химических элементов:
Аl..O..
Валентность кислорода равна двум, валентность алюминия постоянна, находим значение валентности по таблице учебника, она равна трем. Записываем валентности:
III II
Аl..O..
2. Определить НОК чисел, обозначающих валентность обоих элементов.
НОК – наименьшее из целых положительных чисел, делящееся без остатка на каждое из данных целых чисел.
НОК II и III – 6
3. Разделить НОК на валентность каждого элемента, полученные числа обозначают индексы соответствующих элементов.
6 : II = 3, т.е. индекс при атоме кислорода равен 2
6 : III = 2, т.е. индекс при атоме алюминия равен 3.
4. Записать полученные индексы справа внизу у знаков химических элементов.
III II
Аl2O3
Разберем еще один пример: соединение серы с водородом, при чем валентность серы указана, так как сера имеет переменную валентность.
II
Н..S..
1.Записываем валентность атома водорода:
I II
Н..S..
2. Находим НОК, оно равно двум
3. Находим индексы элементов:
2 : II = 1, т.е. индекс при атоме серы равен 1
2 : I = 2, т. е. индекс при атоме водорода равен 2
е. индекс при атоме водорода равен 2
4. Записываем формулу с учетом индексов:
I II
Н2S
В названии веществ, имеющих переменную валентность, в скобках пишут валентность данного элемента в этом соединении:
СuO – оксид меди (II)
Cu2O – оксид меди (I)
Расставим индексы в формулах следующих соединений:
II III
К..S.. Мg..N..
IV I
Мg..Si.. С..Сl..
II I I
Fe..Сl.. Са..F..
Итак, сегодня на уроке мы узнали, что такое валентность, как определить валентность элементов, формула которого известна, и наоборот, зная валентность составить химическую формулу. Сейчас мы проверим, как вы усвоили данную тему, для этого напишем самостоятельную работу.
На работу вам остается 10 минут.
Домашнее задание §4, 5 задания №№ 3, 4 стр. 28; задачник: 1-99, 1-100
I вариант
1. Определите валентность химических элементов в следующих соединениях:
СО, ZnS, SiН4
2. Расставьте индексы в химических формулах следующих соединений:
а) K..O..
I
б) Аl..I..
V I
в) Р..Cl..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) железа (II)
б) азота (IV)
4. Составьте химические формулы соединений с хлором (I) следующих элементов (символ хлора в данных формулах ставится на второе место):
а) бария
б) железа (III)
II вариант
1. Определите валентность химических элементов в следующих соединениях:
HBr, Ca3P2, MgCl2
2. Расставьте индексы в химических формулах следующих соединений:
Расставьте индексы в химических формулах следующих соединений:
VI
а) S..O..
III I
б) Fe..Cl..
I II
в) Cu..S..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) калия
б) кремния(IV)
4. Составьте химические формулы соединений с хлором (I) следующих элементов (символ хлора в данных формулах ставится на второе место):
а) алюминия
б) кальция
III вариант
1. Определите валентность химических элементов в следующих соединениях:
NO, Na2S, СaCl2
2. Расставьте индексы в химических формулах следующих соединений:
I II
а) Ag..S..
II
б) Аl..S..
IV
в) Si..H..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) хлора (VII)
б) бария
4. Составьте химические формулы соединений с серой (II) следующих элементов (символ серы в данных формулах ставится на второе место):
а) железа (III)
б) меди (II)
IV вариант
1. Определите валентность химических элементов в следующих соединениях:
NaI, SiCl4, MgS
2. Расставьте индексы в химических формулах следующих соединений:
I
а) N..O..
I
б) Ba..Cl..
IV
в) Si..O..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) cеры(VI)
б) углерода(II)
4. Составьте химические формулы соединений с бромом (I) следующих элементов (символ брома в данных формулах ставится на второе место):
а) cеребра (I)
б) алюминия
Урок №14-15. Валентность химических элементов.
 Определение валентности элементов по формулам бинарных соединений. Составление химических формул бинарных соединений по валентности
Определение валентности элементов по формулам бинарных соединений. Составление химических формул бинарных соединений по валентностиВалентность – это способность атомов присоединять к себе определенное число других атомов.
Валентность – определяется номером группы (число химических связей в структурной формуле вещества).
Валентность
Структурная формула вещества отображает порядок соединения атомов между собой, согласно их валентностям, т.е. химическое строение. | |
| | Na – одновалентен (одна связь) H – одновалентен (одна связь) O – двухвалентен (две связи у каждого атома) S – шестивалентна (образует шесть связей с соседними атомами) |
Правила определения валентности элементов в соединениях
1. Валентность водорода принимают за I (единицу).
2. Кислород в своих соединениях проявляет валентность II.
3. Высшая валентность равна номеру группы Nгруппы (исключения, N, O, F — для этих элементов характерна только низшая валентность).
4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 — Nгруппы
Определение валентности металлов
(характерны валентности – постоянная и переменная)
Металлы главных (А) подгрупп I(А), II(А), III(А) | Характерна
высшая постоянная валентность. В = Nгруппы | Металл |
Металлы побочных (Б) подгрупп I(Б)-VIII(Б) | Характерна переменная валентность. В – указывается в названии вещества. Например, оксид марганца (VII), хлорид хрома (II). |
Определение валентности неметаллов
(характерны валентности – высшая, низшая, переменная)
Характерны высшая валентность В = N группы | Неметалл ставится в этом случае на первое место в формуле |
Характерна низшая валентность 8 — N группы | Неметалл ставится в этом случае на второе место в формуле |
Характерна переменная валентность. В – указывается в названии вещества. Например, оксид серы (IV), сульфид фосфора (III). | Неметалл ставится в этом случае на первое место в формуле |
Запомните! Низшую валентность проявляет тот элемент — неметалл, который находится в таблице Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже.
Если данное правило не работает. То следует воспользоваться информацией о бинарных формулах веществ (оксидах, хлоридах, сульфидах и др.).
Бинарная химическая
формула – это формула химического соединения, в состав которого входят два
вида атомов. | ||
ОКСИДЫ | СУЛЬФИДЫ | ХЛОРИДЫ |
Оксид – это сложное вещество, в состав которого входят два вида атомов, одним из которых является кислород, с валентностью (II). Na2О | Сульфид – это сложное вещество, в состав которого входят два вида атомов, одним из которых является сера, с валентностью (II). K2S | Хлорид – это сложное вещество, в состав которого входят два вида атомов, одним из которых является хлор, с валентностью (I). FeCl3 |
Общая формула где Э – элемент; Х – валентность элемента | Общая формула где Э – элемент; Х – валентность элемента | Общая формула где Э – элемент; Х – валентность элемента |
* Другие бинарные соединения: ЭxFy — фторид; ЭxBry —бромид; ЭxIy –йодид; ЭxNy –нитрид; ЭxPy –фосфид; ЭxHy –гидрид (у элемента на второй позиции низшая валентность).
Алгоритм составления формулы соединения оксида фосфора
Последовательность действий | Составление формулы оксида фосфора |
1. | Р О |
2. Определить валентности элементов | V II |
3. Найти наименьшее общее кратное численных значений валентностей | 5•2 = 10 |
4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов | 10 : 5 = 2 10 : 2 = 5 P : О = 2 : 5 |
5. Записать индексы при символах элементов | Р2 О5 |
6. Формула соединения (оксида) | Р2О5 |
Для составления формулы вещества можно воспользоваться следующим алгоритмом:
В=Nгруппы | В=8-Nгруппы |
Ах | Ву |
Запомните! Если элемент А – металл побочной подгруппы или неметалл с переменной валентностью, валентность А определяем не по таблице Менделеева, а согласно названию вещества. Например, оксид серы (IV), сульфид фосфора (III).
«Валентность. Определение валентности по формулам»
Цели урока.
Дидактические:
- опираясь на знания учащихся, повторить понятия “химическая формула”;
- способствовать формированию у учащихся понятия “валентность” и умению определять валентность атомов элементов по формулам веществ;
- акцентировать внимание школьников на
возможности интеграции курсов химии, математики.

Развивающие:
- продолжить формирование умений формулировать определения;
- разъяснять смысл изученных понятий и объяснять последовательность действий при определении валентности по формуле вещества;
- способствовать обогащению словарного запаса, развитию эмоций, творческих способностей;
- развивать умение выделять главное, существенное, сравнивать, обобщать, развивать дикцию, речь.
Воспитательные:
- воспитывать чувство товарищества, умение работать коллективно;
- повысить уровень эстетического воспитания учащихся;
- ориентировать учащихся на здоровый образ жизни.
Планируемые результаты обучения:
- Учащиеся должны уметь формулировать определение “валентность”, знать валентность атомов водорода и кислорода в соединениях, определять по ней валентность атомов других элементов в бинарных соединениях,
- Уметь разъяснять смысл понятия “валентность” и последовательность действий при определении валентности атомов элементов по формулам веществ.
Понятия, впервые вводимые на уроке: валентность, постоянная и переменная валентность.
Организационные формы: беседа, индивидуальные задания, самостоятельная работа.
Средства обучения: алгоритм определения валентности.
Демонстрационное оборудование: шаростержневые модели молекул хлороводорода, воды, аммиака, метана.
Оборудование для учащихся: на каждом столе “Алгоритм определения валентности”.
Опережающее задание: индивидуальное
задание – подготовить сообщение на тему
“Эволюция понятия “валентность”.
Ход урока
I. Ориентировочно-мотивационный этап.
1. Фронтальная беседа с учащимися по пройденной теме “Химическая формула”.
Задание: Что здесь написано? (Демонстрация учителем формул, отпечатанных на отдельных листах).
2. Индивидуальная работа по карточкам трёх учащихся по теме “Относительная молекулярная масса”. (Выполняют решение на доске). Проверка учителем.
Карточка № 1. Рассчитайте относительную молекулярную массу данных веществ: NaCl, K2O.
Справочные данные:
- Аr (Na) = 23
- Аr (Cl) = 35,5
- Аr (K) = 39
- Аr (O) = 16
Карточка № 2. Рассчитайте относительную молекулярную массу данных веществ: CuO, SO2.
Справочные данные:
- Аr (Cu) = 64
- Аr (O) = 16
- Аr (S) =3 2
Карточка № 3. Рассчитайте относительную молекулярную массу данных веществ: CH4, NO.
Справочные данные:
- Аr (С) = 12
- Аr (H) = 1
- Аr (N) = 14
- Аr (O) = 16
3. Самостоятельная работа учащихся в тетрадях.
Задача информационно-вычислительного характера (условие записано в раздаточном материале).
Эффективность зубных паст в профилактике
кариеса можно сравнить по содержанию в них
активного фтора, способного взаимодействовать с
зубной эмалью. Зубная паста “Crest” (производство
США) содержит, как указано на упаковке, SnF2, а
зубная паста “FM extra DENT” (производство Болгария)
содержит NaF. Вычислите, какая из этих двух паст
более сильнодействующее средство для
профилактики кариеса.
Проверка: один учащийся устно читает решение.
II. Операционно-исполнительный этап.
1. Объяснение учителя. Постановка проблемы.
Понятие о валентности.
– До сих пор мы пользовались готовыми формулами, приведёнными в учебнике. Химические формулы можно вывести на основании данных о составе веществ. Но чаще всего при составлении химических формул учитываются закономерности, которым подчиняются элементы, соединяясь между собой.
Задание: сравните качественный и количественный состав в молекулах: HCl , H2O, NH3, CH4.
Беседа с учащимися:
– Что общего в составе молекул?
Предполагаемый ответ: Наличие атомов водорода.
– Чем они отличаются друг от друга?
Предполагаемый ответ:
- HCl – один атом хлора удерживает один атом водорода,
- H2O – один атом кислорода удерживает два атома водорода,
- NH3 – один атом азота удерживает три атома водорода,
- CH4 – один атом углерода удерживает четыре атома водорода.
Демонстрация шаростержневых моделей.
Проблема: Почему различные атомы удерживают различное количество атомов водорода?
(Выслушиваем варианты ответов учащихся).
Вывод: У атомов разная способность удерживать определённое количество других атомов в соединениях. Это и называется валентностью. Слово “валентность” происходит от лат. valentia – сила.
Запись в тетради:
Валентность – это свойство атомов удерживать определённое число других атомов в соединении.
Валентность обозначается римскими цифрами.
Записи на доске и в тетрадях:
I I |
I II H2O |
I III H3N |
I IV H4C |
Валентность атома водорода принята за единицу, а у кислорода – II.
2. Эволюция понятия “валентность” (сообщение учащегося).
– В начале XIX века Дж. Дальтоном был сформулирован закон кратных отношений, из которого следовало, что каждый атом одного элемента может соединяться с одним, двумя, тремя и т.д. атомами другого элемента (как, например, в рассмотренных нами соединениях атомов с водородом).
В середине XIX века, когда были определены точные относительные веса атомов (И.Я. Берцелиус и др.), стало ясно, что наибольшее число атомов, с которыми может соединяться данный атом, не превышает определённой величины, зависящей от его природы. Эта способность связывать или замещать определённое число других атомов и была названа Э.Франклендом в 1853 г. “валентность”.
Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом водорода был выбран в качестве стандарта, обладающего валентностью, равной 1.
В конце 50-х гг. XIX вeка А.С. Купер и А.Кекуле постулировали принцип постоянной четырёхвалентности углерода в органических соединениях. Представления о валентности составили важную часть теории химического строения А.М. Бутлерова в 1861 г.
Периодический закон Д.И. Менделеева в 1869 г.
вскрыл зависимость валентности элемента от его
положения в периодической системе.
Вклад в эволюцию понятия “валентность” в разные годы внесли В.Коссель, А.Вернер, Г.Льюис.
Начиная с 30-х гг. XX века представления о природе и характере валентности постоянно расширялись и углублялись. Существенный прогресс был достигнут в 1927 г., когда В.Гейтлер и Ф.Лондон выполнили первый количественный квантово-химический расчёт молекулы водорода H2.
3. Определение валентности атомов элементов в соединениях.
Правило определения валентности: число единиц валентностей всех атомов одного элемента равно числу единиц валентности всех атомов другого элемента.
Алгоритм определения валентности.
Алгоритм определения валентности |
Пример |
|
| 1. Запишите формулу вещества. | H2S, Cu2O | |
| 2. Обозначьте известную валентность элемента | I H2S, |
II |
| 3. Найдите число единиц валентности атомов известного элемента, умножив валентность элемента на количество его атомов | 2 I H2S |
2 |
| 4. Поделите число единиц валентности атомов на количество атомов другого элемента. Полученный ответ и является искомой валентностью | 2 I II H2S |
2 |
5. Сделайте проверку, то есть
подсчитайте число единиц валентностей каждого
элемента Сделайте проверку, то есть
подсчитайте число единиц валентностей каждого
элемента |
I II H2S (2=2) |
I II Cu2O (2=2) |
4. Упражнение: определить валентность элементов в веществах (тренажёр: ученики цепочкой выходят к доске). Задание в раздаточном материале.
SiH4, CrO3, H2S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr, Cl2O5, Cl2O7, РН3, K2O, Al2O3, P2O5, NO2, N2O5, Cr2O3, SiO2, B2O3, SiH4, Mn2O7, MnO, CuO, N2O3.
III. Оценочно-рефлексивный этап.
Первичная проверка усвоения знаний.
В течение трёх минут необходимо выполнить одно из трёх заданий по выбору. Выбирайте только то задание, с которым вы справитесь. Задание в раздаточном материале.
- Репродуктивный уровень (“3”). Определите валентность атомов химических элементов по формулам соединений: NH3, Au2O3, SiH4, CuO.
- Прикладной уровень (“4”). Из приведённого ряда выпишите только те формулы, в которых атомы металлов двухвалентны: MnO, Fe2O3 , CrO3, CuO, K2O, СаH2.
- Творческий уровень (“5”). Найдите
закономерность в последовательности формул: N2O,
NO, N2O3 и проставьте валентности над
каждым элементом.

Проверка выборочная. Консультант из числа учащихся по готовому шаблону проверяет 4 тетради учащихся.
Работа над ошибками. Ответы на обратной стороне доски.
IV. Подведение итогов урока.
Беседа с учащимися:
- Какую проблему мы поставили в начале урока?
- К какому выводу мы пришли?
- Дать определение “валентности”.
- Чему равна валентность атома водорода? Кислорода?
- Как определить валентность атома в соединении?
Оценка работы учащихся в целом и отдельных учащихся.
Домашнее задание: § 4, стр. 23–25, упр. на стр. 25.
– Благодарю за урок. До свидания.
Урок 6. Валентность – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х·1 = II·2, откуда х = IV.
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II, так как х·1 = II·1, откуда х = II:
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV, а азота — III.
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 (IV·III).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.

Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Конспект и презентация к уроку «Валентность».
Открытый урок по химии
учителя Т.Б. Онищенко
Класс: 8 «Б»
Автор УМК: О.С. Габриелян
Тема: Валентность
Тип урока: комбинированный, освоение новых знаний.
Цель урока:
1.Сформировать понятие валентность
2.Способствовать формированию умения составлять формулы по валентности и определять валентность атомов элементов по формулам веществ;
3.Акцентировать внимание школьников на возможности интеграции курсов химии, математики.
Задачи урока:
образовательные:
— обеспечить формирование представления о валентности;
— обеспечить знания обучающихся о валентности элементов;
— обеспечить умение обучающихся определять валентность элементов по периодической системе;
— обеспечить умение обучающихся определять валентность элементов по формулам и составлять формулы по валентности.
воспитательные:
создать условия для:
— воспитания сознательного и серьезного отношения обучающихся к учебной дисциплине;
— воспитания умения участвовать в обсуждении, отстаивать свою точку зрения, уважая точку зрения других людей;
— воспитания умения слушать других, культуры речи, общения;
— воспитания способности сопереживать товарищам при их неудачах, радоваться их успехам;
— воспитания потребности в овладении специальными знаниями, умениями, навыками;
— воспитания таких качеств личности, как ответственное отношение к порученному делу, умение объективно оценивать результаты своего труда;
— воспитания веры в свои силы и потребности раскрыть потенциальные способности;
— воспитания умения управлять собой, своим поведением.
развивающие:
создать условия для:
— развития мышления обучающихся, умения анализировать, сравнивать, обобщать, систематизировать, выделять существенные признаки и свойства объектов, классифицировать факты, делать выводы;
— развития у обучающихся рефлексивной деятельности;
— развития у обучающихся умений формулировать проблемы, предлагать пути их решения.
Критерии достижения цели урока: обучающийся знает понятие «валентность», умеет пользоваться периодической системой для нахождения валентности элементов; умеет: определять валентность элементов по формуле и составлять формулы по валентности.
Технология: технология развития критического мышления, системно-деятельностный подход.
Основные понятия: валентность, структурные формулы веществ, шаростержневые модели молекул.
Материально-техническое обеспечение: компьютер, мультимедийный проектор, презентация Power Point, наборы для составления шаростержневых моделей молекул.
Этап | Содержание | Деятельность учителя | Деятельность ученика |
Организационный момент | Здравствуйте, садитесь. Итак, начинаем урок. Мир, в котором мы живем, удивителен, прекрасен, разнообразен. Познавая его, мы познаем себя. | Приветствует учащихся | Приветствуют учителя и гостей |
Актуализация опорных знаний | Слайд 1 — H2O, CH4, СuCL2 – молекулярные формулы веществ. Давайте вспомним, из чего состоит и что показывает молекулярная формула вещества. Молекулярная формула вещества состоит из химических символов элементов и индексов и показывает качественный и количественный состав молекулы До сих пор мы пользовались готовыми химическими формулами веществ. Что необходимо знать, чтобы самим составить формулу вещества? CLxOyX -? Y — ? (слайд 2) Нужно знать индексы для химических элементов. Учитель дает определение валентности: Валентность – это способность атомов присоединять к себе определенное число других атомов (слайд 3) Как вы думаете с чем это связано? Это связано со строением атомов. | Вызывает учащихся, следит за правильностью ответов. Вызов Помогает назвать тему урока. Помогает поставить цели. | Работа в группах и ответы. Выдвигают свои версии. Называют тему и цели урока. |
Изучение нового материала. | Познакомимся с правилом составления формул по валентности Объясняет обозначение валентности. Перед вами на столах Алгоритм определения валентности по формуле (слайд 4) Определение валентность – это число связей которые образует атом с другими атомами при образовании вещества. CL2O7 (слайд 5) Перед вами на столах таблица с элементами, имеющими постоянную и переменную валентность. Задания группам 1. Используя данные таблицы с элементами, имеющими постоянную и переменную валентность, составить молекулярные формулы веществ из предложенного списка. Перед вами листы самопроверки. Определите, верно ли составлены формулы. Найдите и исправьте допущенные ошибки. Подсчитайте заработанные баллы. Демонстрация слайда IV I СН4 — метан C – H – H – H – H — верно ? (слайд 7) Почему? Структурные формулы веществ (слайд 9) Физминутка Сколько связей образует атом азота и атом кислорода? Давайте изобразим это графической формулой… 2. Задание Используя составленные вами молекулярные формулы составьте структурные формулы веществ. Используя листы самопроверки. Определите, верно ли составлены формулы. Найдите и исправьте допущенные ошибки. Подсчитайте заработанные баллы. | Показывает алгоритм составления формул по валентности Объясняет последовательность действий. Проверяет правильность составления формулы Показывает элементы, имеющими постоянную и переменную валентность. Дает задания группам Объясняет последовательность действий проведения самопроверки Помогает сделать вывод Ставит проблемный вопрос Объясняет смысл структурной формулы вещества (слайд 9) Организует проведение физминутки Организует и направляет работу в группах | Читают со слайда и Изучают алгоритм составления формул по валентности На доске по алгоритму составляют формулы молекул бинарных соединений Оценивают правильность выполненного задания Изучают таблицы Составляют молекулярные формулы веществ из предложенного списка. Проверяют и оценивают результат выполненной работы. Делают вывод: Зная валентность элемента мы можем составлять формулы Предлагают варианты ответов Изучают структурные формулы веществ Проводят физминутки Составляют структурные формулы веществ Исправляют допущенные ошибки. Оценивают работу группы. |
Первичное закрепление материала | 3. Перед вами наборы для составления шаростержневых моделей молекул. Используя знание валентности, структурные формулы, соберите шаростержневые модели молекул Давайте вместе сделаем вывод урока: Знание валентности позволяет узнать_________ молекулы и её_______(структуру). Знание валентностипомогает построить ________модели молекул. (слайд 10) | Организует и направляет работу в группах Устно инструктирует учащихся Следит за выполнение задания | Составляют шаростержневые модели молекул Учащиеся разных групп представляют модели молекул Делают вывод: Знание валентности позволяет составить молекулярные и структурные формулы веществ. Шаростержневые модели молекул помогли лучше понять понятие «Валентность» |
ДЗ | П18 Домашнее задание (слайд 11) Определить валентность химических элементов: SiH4, CrO3, H2S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr, Cl2O5, Cl2O7, РН3, P2O5, NO2, N2O5, SiO2, B2O3, MnO, CuO . Составьте формулу химического соединения: Хлор и натрий Кислород и водород Железо и кислород Алюминий и бром Калий и сера Фосфор и кислород Кремний и водород Фосфор и хлор | Объясняет выполнение Дз | Слушают, делают запись в дневник. |
Рефлексия. | Давайте вместе оценим нашу совместную работу (проводится пофамильно по вопросам): — Как работал на уроке?- мнение ученика и одноклассников — Какую (и почему) ставлю себе оценку? — Были ли ошибки в ответе (если да, то какие)? — Итоговая скорректированная учителем оценка | Анализирует результат урока. | Оценивают свою работу и работу членов группы. |
Раздаточный материал
Алгоритм составления формул по валентности (слайд 4)
Таблица валентности некоторых химических элементов (слайд 6)
Бланк для выполнения задания
Химические элементы | Молекулярная формула вещества | Структурная формула вещества | Баллы |
Водород и хлор (I) | |||
Магний и хлор (I) | |||
Азот (III) и водород | |||
Углерод (IV) и хлор (I) | |||
Медь (II) и кислород | |||
Углерод (IV)и кислород | |||
Алюминий и кислород | |||
Всего: |
4
Презентация по химии к уроку «Валентность».
 8 класс.
8 класс.
Валентность химических элементов.
1.Валентность водорода равна единице
I
I
I
I
НCl Н 2 O NH 3 CH 4
2. Валентность кислорода равна двум
II
II
II
SO 3 CuO CO 2
Валентность некоторых химических элементов в химических соединениях
С постоянной валентностью
Валентность
I
Химические элементы
Примеры формул соединений
H, Na, K, Li
II
H 2 O, Na 2 O
III
O, Be, Mg, Ca, Ba, Zn,
MgO, CaO
Al, B
Al 2 O 3
Валентность некоторых химических элементов в химических соединениях
C переменной валентностью
Валентность
Химические элементы
I и II
Примеры формул соединений
С u
II и III
Fe , С o, Ni
II и IV
Cu 2 O, CuO
FeO, Fe 2 O 3
Sn, Pb
III и V
P
SnO, SnO 2
II, III и VI
PH 3 , P 2 O 5
Cr
II, IV и VI
S
CrO, Cr 2 O 3 , CrO 3
H 2 S, SO 2 , SO 3
Определение валентности элементов по формулам их соединений.
СO 2
4
6
II
IV
III
II
Fe 2 O 3
2 х II =
3 х II =
4
6
: 1 = IV
: 2 = III
6
4
Определите валентности химических элементов в следующих соединениях:
СaO ZnСl 2
NH 3 Li 2 S
N 2 O 3 Mg 3 P 2
II
II
I
II
I
III
I
II
III
II
III
II
Cоставление химических формул по валентности:
6
2
II
III
II
I
Аl O
H S
3
2
2
: III =2
6
2
:I = 2
: II = 3
: II =1
6
2
Расставьте индексы в формулах следующих соединений:
K S Mg N
Mg Si C Cl
Fe Cl Ca F
II
III
I
II
. .
.
..
..
..
2
3
2
IV
II
I
IV
..
..
..
..
2
4
II
I
I
II
..
..
..
..
2
2
Составьте химические формулы соединений с кислородом следующих химических элементов:
— ZnO
а) цинка
б) меди(I)
в) фосфора(V)
г) натрия
— Cu 2 O
— P 2 O 5
— Na 2 O
Составьте химические формулы соединений с водородом следующих химических элементов:
— NH 3
а) азота(III)
б) хлора(I)
в) углерода(IV)
г) фосфора(III)
— HCl
— CH 4
— PH 3
Валентных электронов и уровней энергии атомов элементов — стенограмма видео и урока
Валентные электроны и уровни энергии
Электрон — один из наиболее важных факторов, определяющих, как атом будет реагировать с другим атомом или молекулой. Один электрон может полностью изменить свойства атома.
Например, у натрия есть один внешний электрон, расположенный на орбитали 3 s . С этим внешним электроном натрий очень блестящий, серебристый и чрезвычайно взрывоопасен в воде. Это настолько опасно, что вы, вероятно, никогда не увидите его в элементарной, нейтральной форме.
И если вы обнаружите, что натолкнетесь на натрий, вы, вероятно, увидите, что он хранится в каком-то масле, чтобы он не вступал в реакцию с влагой в воздухе.
Так где вы видели натрий? Возможно, сегодня днем вы побрызгали свою еду! Если вы добавите в пищу соль (или хлорид натрия), вы почувствуете, что такое натрий без этого внешнего электрона 3 s .
Натрий в своей серебристой форме легко теряет внешние 3 s электрона, превращая его в ион натрия с положительным зарядом 1.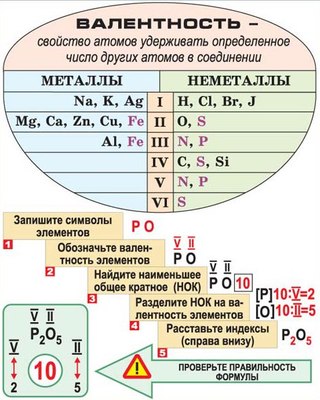 Натрий, у которого на один электрон меньше, чем у протона, будет иметь положительный заряд, равный единице, потому что протоны заряжены положительно, а электроны — отрицательно. Этот ион натрия с 10 электронами полностью отличается от нейтрального металлического натрия со всеми 11 электронами.
Натрий, у которого на один электрон меньше, чем у протона, будет иметь положительный заряд, равный единице, потому что протоны заряжены положительно, а электроны — отрицательно. Этот ион натрия с 10 электронами полностью отличается от нейтрального металлического натрия со всеми 11 электронами.
Ион натрия имеет соленый привкус и совершенно не вступает в реакцию с водой. Вы потребляете его каждый день, и это очень важно, потому что он играет важную роль в нервных функциях вашего тела и балансе жидкости.
Валентные электроны
Это было лишь краткое введение в то, как электронная структура влияет на функцию и реакционную способность (и даже вкус) атома. Как уже упоминалось, расположение и количество электронов являются важными факторами, определяющими реакцию атома.
Однако самая важная информация об электронах связана с крайними электронами, или валентными электронами .
- Внутренние электроны в атоме обычно крепко удерживаются ядром, и они обычно не собираются участвовать в очень многих реакциях.
- Внешние электроны играют ключевую роль во всех химических реакциях.
Этот маленький электрон натрия 3 s является самым важным электроном натрия. Это будет тот, который либо присутствует (во взрывоопасном металлическом натрии), либо отсутствует (в ионе натрия в хлориде натрия в вашей поваренной соли). Этот урок сосредоточится на двух наиболее важных аспектах этих валентных электронов: количестве валентных электронов и энергии валентных электронов.1) относится к валентным электронам
Число валентных электронов
Как уже упоминалось, у натрия есть один валентный электрон (это 3 s электронов), что является одной из причин его реакционной способности и нестабильности. Если у натрия один валентный электрон, то сколько у калия? Ответ тоже один!
Однако это 4 s электрон. Фактически, все атомы в первом столбце периодической таблицы имеют один валентный электрон, и все атомы в первом столбце периодической таблицы являются чрезвычайно реактивными и будут иметь тенденцию терять этот внешний электрон и становиться более стабильными.
Поскольку количество валентных электронов очень важно (в отличие от внутренних), они иногда представлены в точечных диаграммах Льюиса , как показано. На точечных диаграммах Льюиса показаны символы атомов с их валентными электронами. Натрий представлен символом Na, и, поскольку у него есть один валентный электрон, 3 s электрон, этот электрон представлен точкой рядом с символом.
Переходя ко второму столбцу, вы заметите, что магний имеет электронную конфигурацию, которая заканчивается на 3 s 2, что означает, что в магнии есть два валентных электрона.Опять же, эти два электрона чрезвычайно важны, поэтому иногда магний представлен как Mg с двумя точками вокруг него.
Обратите внимание, как точки представлены в символе на противоположных сторонах друг от друга. Итак, все элементы во втором столбце будут иметь два валентных электрона. Далее мы пропустим блок d . Причина, по которой мы пропускаем его, двоякая: во-первых, существует менее предсказуемая закономерность в количестве валентных электронов, которая выходит за рамки этого урока; и, во-вторых (и это наиболее важно), электроны d не играют такой большой роли в реакциях, как электроны s и p .
Переходя к 13-му столбцу, который начинается с бора, вы заметите, что есть три внешних электрона: два электрона s и один электрон p . Все атомы в этом семействе будут иметь три валентных электрона. Вы начинаете видеть формирование паттерна?
Все элементы семейства углерода будут иметь четыре валентных электрона, элементы семейства азота — пять, элементы семейства кислорода — шесть, галогены будут иметь семь валентных электронов и, кроме гелия, элементы в последний столбец — благородные газы — будет иметь восемь валентных электронов (два электрона s и шесть электронов p ).
Как видите, количество валентных электронов в атоме связано со столбцом, в котором он находится в периодической таблице.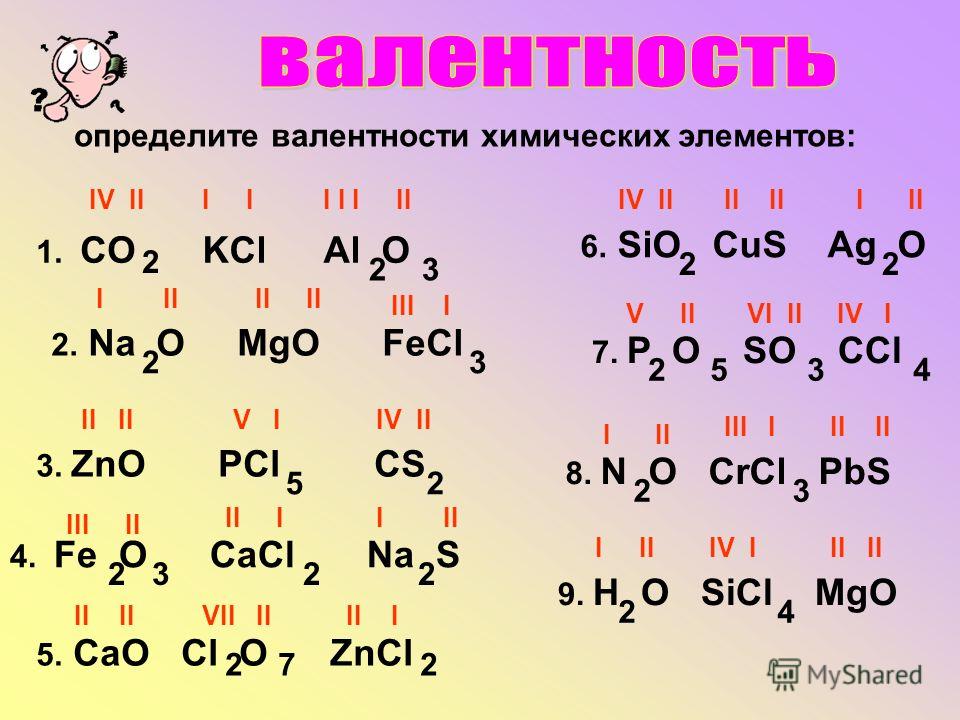 Когда в атоме восемь валентных электронов, говорят, что он имеет октетов и электронов. Атомы с полным октетом имеют орбитали s и p , которые полностью заполнены электронами, поэтому они чрезвычайно стабильны.
Когда в атоме восемь валентных электронов, говорят, что он имеет октетов и электронов. Атомы с полным октетом имеют орбитали s и p , которые полностью заполнены электронами, поэтому они чрезвычайно стабильны.
Обратите внимание, что точечные диаграммы Льюиса заполняют внешние оболочки, сначала помещая по четыре электрона по одному с каждой стороны, а затем начиная их спаривать с добавлением пятого электрона. Это представление поможет нам позже, когда мы будем обсуждать химическую связь.
Энергия валентных электронов
Помимо количества валентных электронов у атома, энергия, которую они имеют (или уровень энергии, на котором они находятся), является последним битом информации, который помогает предсказать реакцию атома.Давайте взглянем на первый столбец элементов. Все они имеют один валентный электрон, но их валентные электроны располагаются все дальше и дальше от ядра по мере того, как вы движетесь вниз по периодической таблице.
Например, один валентный электрон в литии находится на орбитали 2 s . Это число 2 — главное квантовое число, которое представляет размер орбитали. Орбиталь 2 s будет намного меньше орбитали 4 s в калии, которая удерживает его валентный электрон.Это означает, что валентный электрон в калии будет иметь больше энергии и находиться дальше от ядра, чем валентный электрон в литии.
Какая разница? Что ж, как вы могли заметить из примера с натрием, элементы в первом столбце собираются избавиться от своих внешних электронов как можно быстрее. Один только внешний электрон, летающий вокруг, делает этот атом очень химически нестабильным. Его способность вступать в химическую реакцию напрямую зависит от того, насколько легко он может избавиться от внешнего электрона.
Калий с большей вероятностью избавится от своего внешнего электрона, чем литий, потому что его внешний электрон находится на орбитали 4 s , которая намного дальше от внутреннего притяжения положительно заряженного ядра. Литий будет держаться за свой электрон 2 s сильнее, чем калий будет держаться за свой электрон 4 s , потому что электрон 2 s ближе к внутреннему притяжению положительно заряженного ядра. Это делает калий гораздо более активным, чем литий.Если вы поместите крошечный кусочек лития в воду, он может просто шипеть, но если вы добавите такое же количество калия в воду, он, вероятно, лопнет или взорвется.
Литий будет держаться за свой электрон 2 s сильнее, чем калий будет держаться за свой электрон 4 s , потому что электрон 2 s ближе к внутреннему притяжению положительно заряженного ядра. Это делает калий гораздо более активным, чем литий.Если вы поместите крошечный кусочек лития в воду, он может просто шипеть, но если вы добавите такое же количество калия в воду, он, вероятно, лопнет или взорвется.
Как вы могли заметить, строка, в которой находится элемент, будет представлять уровень энергии валентных электронов. Элементы в первом ряду (водород и гелий) будут иметь внешние электроны на первом энергетическом уровне.Их главное квантовое число — 1.
Элементы во втором ряду (от лития до неона) будут иметь валентные электроны на втором уровне энергии с главным квантовым числом 2. Тенденция продолжается вплоть до седьмой строки. Помните, что последние два ряда действительно входят в шестой и седьмой ряды.
Краткое содержание урока
Самая важная особенность атома, которая помогает предсказать его химические свойства, — это расположение и количество его электронов, а точнее его валентных электронов или внешних электронов.Внешние электроны — это те, которые участвуют в химических реакциях, изменяя свойства атома или молекулы.
Столбец, в котором находится элемент в периодической таблице, будет указывать, сколько у него валентных электронов, и сейчас, когда мы будем считать по столбцам, мы пропустим блок d . Строка, в которой находится элемент, будет указывать уровень энергии внешних электронов. Наконец, поскольку валентные электроны так важны, они могут быть представлены символически в точечных диаграммах Льюиса .
Цели урока
После просмотра этого урока вы должны уметь:
- Определить валентных электронов и определить, сколько элементов имеет
- Понять важность того, сколько валентных электронов имеет элемент.

- Объясните, как изобразить количество валентных электронов на точечной диаграмме Льюиса
- Опишите значение орбитального положения валентных электронов в элементе
Валентность, молекулярная формула и химическая реакция | Примечания, видео, контроль качества и тесты | 8 класс> Наука> Материя
Валентность, молекулярная формула и химическая реакция
Валентность
Объединяющая способность элементов или радикалов с другими элементами или радикалами с образованием молекулы элемента или соединения называется валентностью.Такие числа, как 1, 2, 3, 4, 5 и 6, представляют валентность.
Валентная оболочка и валентные электроны
Самая внешняя орбита или оболочка атома называется валентной оболочкой, а количество электронов, присутствующих в валентной оболочке атома, называется валентными электронами.
Дуплет и октет
Расположение двух электронов в K-оболочке называется дуплетом. Он химически инертен, потому что имеет полное количество электронов в своей K-оболочке.
За исключением гелия, другие инертные газы имеют 8 электронов в валентной оболочке. Такое расположение стабильной группы из 8 электронов в их валентной оболочке называется октетом.
Молекулярная формула
Молекулярная формула определяется как символическое представление молекулы вещества.
Молекулярная формула элемента: Молекулярная формула элемента определяется как символическое представление, которое показывает фактическое количество атомов в одной молекуле элемента.
Молекулярная формула соединения: Молекулярная формула соединения определяется как символическое представление, которое показывает фактическое количество атомов различных элементов, присутствующих в одной молекуле соединения.
Химическая реакция
Процесс химического изменения называется химической реакцией. Те вещества, которые принимают участие в химической реакции, называются реагентами. Те вещества, которые образуются в результате химической реакции, называются продуктами.
Те вещества, которые принимают участие в химической реакции, называются реагентами. Те вещества, которые образуются в результате химической реакции, называются продуктами.
Словесное уравнение
Химическая реакция, которая выражается в терминах полных названий молекул реагента и продукта, называется словесным уравнением. Например, водород реагирует с кислородом с образованием воды.
Водород + кислород → Вода
(Реагенты) (Продукты)
Формульное уравнение
Химическое уравнение, которое записывается в виде символов путем записи их молекулярной формулы, называется формульным уравнением.
Нагрев Хлорат калия → Хлорид калия + кислород
KClO 3 → KCl + O 2
Способы записи химической реакции
Шаг 1. Напишите словесное уравнение.
Нагреть Хлорат калия → Хлорид калия + кислород
Шаг 2: Преобразуйте словесное уравнение в формульное уравнение.
KClO 3 → KCl + O 2
Шаг 3: Подсчитайте количество атомов, ионов и т. Д. В реагенте и продукте и сделайте их равными, указав перед ними подходящее число.
2KClO 3 → 2KCl + 3O 2
Химия I | Губернаторская школа естественных наук и математики
АТОМНАЯ СТРУКТУРА И ЯДЕРНЫЕ ПРОЦЕССЫ
H.C.2A.1
Создайте атом: атом, символ и игра
Интерактивное моделирование
Сравните субатомные частицы по массе, местоположению, заряду, электрическому притяжению и влиянию на свойства атома.
Chemthink — атомная структура
Интерактивное моделирование
В этом учебном пособии и наборе вопросов Chemthink вы исследуете атомную структуру и пройдете короткую викторину. Темы включают: массу, заряд и функцию субатомных частиц; и протоны, нейтроны и электроны. Также включает в себя заметки для заполнения пустых полей и короткую викторину.
Темы включают: массу, заряд и функцию субатомных частиц; и протоны, нейтроны и электроны. Также включает в себя заметки для заполнения пустых полей и короткую викторину.
Игра «Атомы»
Игра, уровни испытаний, исследовательская песочница и ресурсы учителя
В игре «Атомы» учащиеся создают атомы увеличивающегося размера, добавляя протоны к ядру и электроны к атомным орбиталям, обнаруживая порядок заполнения.
Масштаб Вселенной
Интерактивный
Этот интерактивный инструмент позволяет студенту исследовать относительные размеры объектов во Вселенной, от самой наблюдаемой Вселенной до длины доски. Это моделирование может помочь учащимся представить себе масштаб молекул воды, электронов, кварков и т. Д. Щелкнув объект, учащиеся могут прочитать неформальную аннотацию с описанием объекта и увидеть его размер в метрах, а также единицы измерения, обычно используемые в этом диапазоне масштабов.
H.C.2A.2
Периодическая таблица элементов
Интерактивный план урока
Исследуйте свойства различных элементов с помощью интерактивной таблицы Менделеева и викторины.
Молекулярные формы
Интерактивный план и план урока
Интерактивное упражнение объясняет теорию отталкивания электронных пар валентной оболочки.
H.C.2A.3
Постройте атом: атом, символ и игра
Интерактивное моделирование
Используйте модели Бора и квантово-механическую структуру атома, чтобы проиллюстрировать, как электроны распределяются в атомах.
H.C.2B.1
H.C.2B.2
H.C.2B.3
Ядерная химия, часть 2: Синтез и деление — ускоренный курс по химии
Видео
Продолжая наш взгляд на ядерную химию, Хэнк использует этот эпизод, чтобы рассказать о синтезе и делении.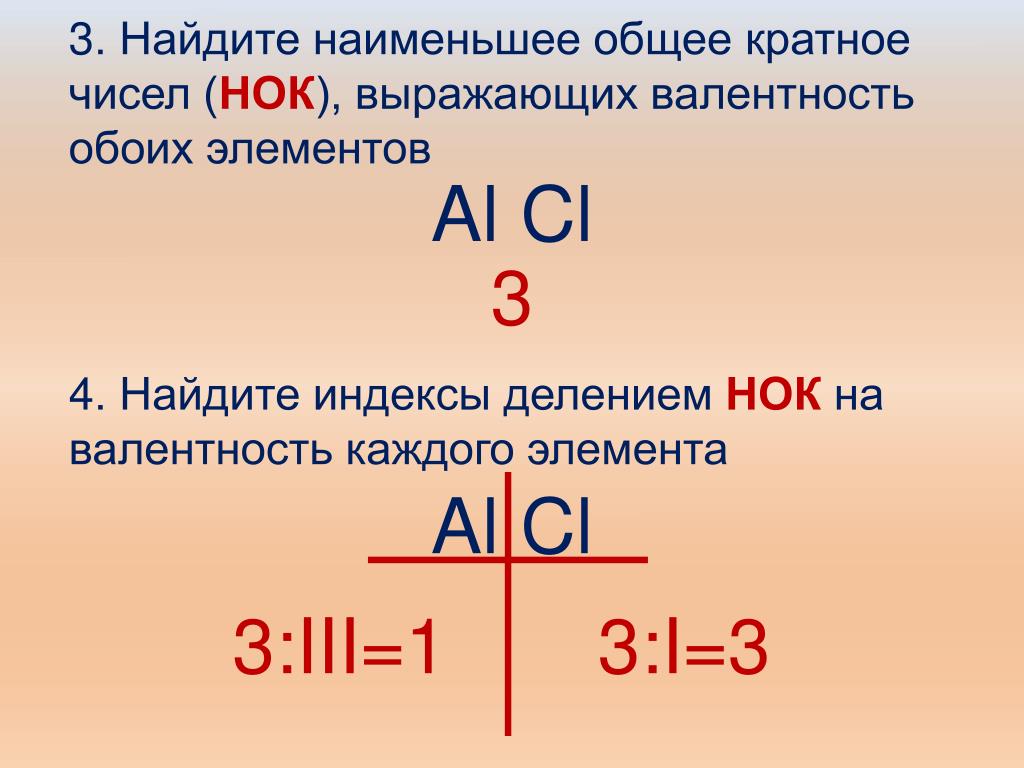 Что они имеют в виду, как работают, их плюсы, минусы и опасности. Кроме того, E = mc2, дефект массы и применение деления и синтеза в реальном мире!
Что они имеют в виду, как работают, их плюсы, минусы и опасности. Кроме того, E = mc2, дефект массы и применение деления и синтеза в реальном мире!
5 вещей, которые вы не ожидаете от ядерного реактора
Видео
Знаете ли вы, что ядерный реактор — это не то же самое, что атомная электростанция? То, на что способен ядерный реактор, может вас удивить.
Внутри ядерного реактора Массачусетского технологического института
Видео
Вы когда-нибудь задумывались, что на самом деле происходит в ядерном реакторе изо дня в день? Получите инсайдерский тур по Массачусетскому технологическому институту!
Ядерная реакция: деление
Видео, справочная информация и вопросы для обсуждения
Этот фрагмент видео, адаптированный из FRONTLINE, представляет исследование, которое привело к созданию первой атомной бомбы, а затем и к производству ядерной энергии. В повествовании подробно рассказывается, почему при расщеплении ядер определенного изотопа урана (U-235) выделяется огромное количество энергии, которую можно использовать для выработки электричества.
H.C.2B.4
СВЯЗЫВАЮЩИЕ И ХИМИЧЕСКИЕ ФОРМУЛЫ
H.C.3A.1
Ковалентная связь
Интерактивный план и план урока
Исследуйте силы притяжения и отталкивания, которые действуют на атомные частицы, и то, как совместное использование электронов может удерживать атомы вместе и как два атома водорода взаимодействуют друг с другом, создавая ковалентную связь.
Ионная связь
Интерактивный план и план урока
Изучите, как перенос электронов между атомами создает ионы и как взаимное притяжение этих заряженных частиц формирует ионные связи.
Chemthink — Ionic Bonding
Интерактивное моделирование
В этом руководстве Chemthink вы изучите ионную связь и пройдете небольшую викторину. Темы включают: как образуются ионы и почему они слипаются; трехмерная форма ионного кристалла; и подсчет ионов в кристалле для определения ионной формулы. Также имеется страница для заполнения пустых заметок.
Темы включают: как образуются ионы и почему они слипаются; трехмерная форма ионного кристалла; и подсчет ионов в кристалле для определения ионной формулы. Также имеется страница для заполнения пустых заметок.
Игра ковалентного связывания
Игра, уровни испытаний, исследовательская песочница и ресурсы учителя
В игре «Ковалентное связывание» игроки связывают атомы вместе, чтобы создать целевые молекулы с уникальной полярностью связи и молекулярной формой.
Ions Game
Игра, уровни испытаний, исследовательская песочница и ресурсы учителя
В игре Ions учащиеся формируют стабильные ионы, пытаясь добавить или удалить электроны с любого уровня энергии, одновременно контролируя энергию ионизации для создания целевых катионов и анионов .
Ionic Bonding Game
Игра, уровни испытаний, исследовательская песочница и ресурсы учителей
В игре «Ionic Bonding» игроки связывают ионы вместе для создания целевых ионных соединений с определенным соотношением катионов и анионов.
Игра Acids & Bases
Игра, уровни испытаний, исследовательская песочница и ресурсы для учителей
В игре Acids & Bases игроки удаляют протоны из кислот и добавляют протоны к основаниям для создания целевых ионов и молекул.
H.C.3A.2
Периодическая таблица элементов
Интерактивная
Связанная с гиперссылкой информация о каждом элементе — просто щелкните элемент в периодической таблице. А также версии для скачивания и для печати.
Ковалентная связь
Интерактивный план и план урока
Исследуйте силы притяжения и отталкивания, которые действуют на атомные частицы, и то, как совместное использование электронов может удерживать атомы вместе и как два атома водорода взаимодействуют друг с другом, создавая ковалентную связь.
Игра ковалентного связывания
Игра, уровни испытаний, исследовательская песочница и ресурсы учителя
В игре «Ковалентное связывание» игроки связывают атомы вместе, чтобы создать целевые молекулы с уникальной полярностью связи и молекулярной формой.
Ions Game
Игра, уровни испытаний, исследовательская песочница и ресурсы учителя
В игре Ions учащиеся формируют стабильные ионы, пытаясь добавить или удалить электроны с любого уровня энергии, одновременно контролируя энергию ионизации для создания целевых катионов и анионов .
Ionic Bonding Game
Игра, уровни испытаний, исследовательская песочница и ресурсы учителей
В игре «Ionic Bonding» игроки связывают ионы вместе для создания целевых ионных соединений с определенным соотношением катионов и анионов.
H.C.3A.3
Ковалентная связь
Интерактивный план и план урока
Исследуйте силы притяжения и отталкивания, которые действуют на атомные частицы, и то, как совместное использование электронов может удерживать атомы вместе и как два атома водорода взаимодействуют друг с другом, создавая ковалентную связь.
Игра ковалентного связывания
Игра, уровни испытаний, исследовательская песочница и ресурсы учителя
В игре «Ковалентное связывание» игроки связывают атомы вместе, чтобы создать целевые молекулы с уникальной полярностью связи и молекулярной формой.
Ions Game
Игра, уровни испытаний, исследовательская песочница и ресурсы учителя
В игре Ions учащиеся формируют стабильные ионы, пытаясь добавить или удалить электроны с любого уровня энергии, одновременно контролируя энергию ионизации для создания целевых катионов и анионов .
Ionic Bonding Game
Игра, уровни испытаний, исследовательская песочница и ресурсы учителей
В игре «Ionic Bonding» игроки связывают ионы вместе для создания целевых ионных соединений с определенным соотношением катионов и анионов.
H.C.3A.4
H.C.3A.5
Chemthink — Образование ионов
Интерактивное моделирование
В этом руководстве по Chemthink вы изучите образование ионов и пройдете небольшую викторину. Темы включают: подсчет протонов, нейтронов и электронов; и точечная структура Льюиса для ионов. Также включает в себя заметки для заполнения пустых полей.
MolView
Интерактивный
С помощью этого ресурса учащиеся могут использовать инструменты в левой части экрана, чтобы нарисовать двухмерную органическую молекулу, а затем, нажав кнопку «2D в 3D», студенты могут непосредственно наблюдать соответствующее трехмерное изображение. модель мяча и клюшки.Программа ориентирована на обозначение линий органических молекул, однако, нажав кнопку «C-H» в верхней части экрана, студенты могут переключать обозначение скелетной формулы. Дополнительные «Инструменты» включают «Информационную карту», в которой указаны химическое название, формула, молекулярный вес, процентный состав, а в некоторых случаях даже описание его реального применения.
H.C.3A.6
H.C.3A.7
СОСТОЯНИЕ ВОПРОСА
H.C.4A.1
Состояния вещества
Интерактивное моделирование
Измените температуру или объем контейнера и посмотрите соответствующую диаграмму давление-температура. Свяжите силы, действующие на молекулы, с потенциалом взаимодействия.
Состояния материи: основы; Состояния и изменения фаз
Интерактивное моделирование
Используйте модели для объяснения расположения и движения частиц в твердых телах, жидкостях и газах.
Фазы материи
Интерактивный план и план урока
Узнайте о твердых телах, жидкостях и газах и о том, как на них влияет добавление и отвод тепловой энергии.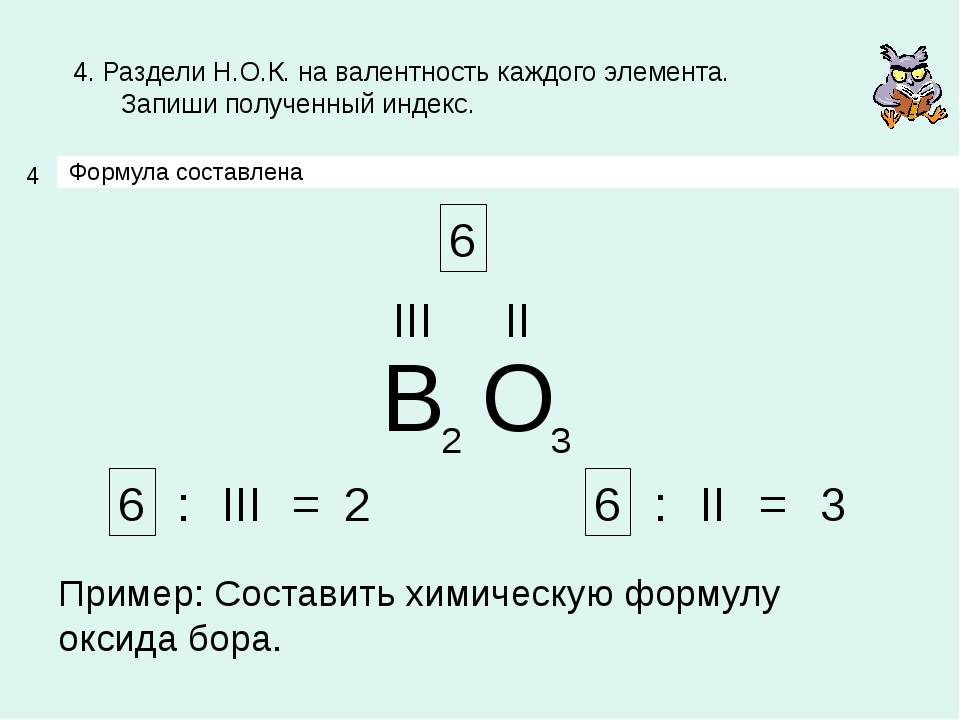
Моделирование плавления и кипения
Интерактивное моделирование
Наблюдайте за движением и температурой молекул воды в этом моделировании, когда тепло подводится к стакану, содержащему кубик льда.
Моделирование воды
Интерактивное моделирование
Изучите поведение молекул воды, когда они отскакивают, рикошетят и притягиваются друг к другу (двухмерное моделирование — не показывает образование кристаллов льда).
IMFs Game
Game, уровни задач, исследовательская песочница и ресурсы учителей
В игре «Межмолекулярные силы» (IMFs) игроки используют одиночные атомы или строят молекулы целевой полярности для создания IMF.
Игра смены фаз
Игра, уровни испытаний, исследовательская песочница и ресурсы учителя
В игре «Смена фазы» игроки согласовывают последовательность фаз в каждой цели, добавляя или удаляя энергию, чтобы влиять на движение частиц и IMF.
H.C.4A.2
Игра смены фаз
Игра, уровни испытаний, исследовательская песочница и ресурсы учителя
В игре «Смена фазы» игроки согласовывают последовательность фаз в каждой цели, добавляя или удаляя энергию, чтобы влиять на движение частиц и IMF.
H.C.4A.3
Состояния вещества: основы и фазовые изменения
Интерактивное моделирование
Используйте модель для объяснения поведения газов, включая отношения между давлением, объемом и температурой.
Игра смены фаз
Игра, уровни испытаний, исследовательская песочница и ресурсы учителя
В игре «Смена фазы» игроки согласовывают последовательность фаз в каждой цели, добавляя или удаляя энергию, чтобы влиять на движение частиц и IMF.
РЕШЕНИЯ, КИСЛОТЫ И ОСНОВАНИЯ
H. C.5A.1
C.5A.1
Растворы для сахара и соли
Интерактивное моделирование
Что происходит, когда в воду добавляют сахар и соль? Всыпьте сахар, встряхните соль и выпарите воду, чтобы увидеть влияние на концентрацию и проводимость.Увеличьте масштаб, чтобы увидеть, как растворяются различные соединения сахара и соли. Увеличьте еще раз, чтобы изучить роль воды.
IMFs Game
Game, уровни задач, исследовательская песочница и ресурсы учителей
В игре «Межмолекулярные силы» (IMFs) игроки используют одиночные атомы или строят молекулы целевой полярности для создания IMF.
Игра смены фаз
Игра, уровни испытаний, исследовательская песочница и ресурсы учителя
В игре «Смена фазы» игроки согласовывают последовательность фаз в каждой цели, добавляя или удаляя энергию, чтобы влиять на движение частиц и IMF.
Игра Acids & Bases
Игра, уровни испытаний, исследовательская песочница и ресурсы для учителей
В игре Acids & Bases игроки удаляют протоны из кислот и добавляют протоны к основаниям для создания целевых ионов и молекул.
H.C.5A.2
Gizmos Feel the Heat
Интерактивное моделирование
Зарегистрировавшись для бесплатной учетной записи, учащиеся могут получить доступ к этому интерактивному моделированию, которое позволяет учащимся изучать эндотермические и экзотермические процессы путем растворения выбранных солей в воде.
Игра смены фаз
Игра, уровни испытаний, исследовательская песочница и ресурсы учителя
В игре «Смена фазы» игроки согласовывают последовательность фаз в каждой цели, добавляя или удаляя энергию, чтобы влиять на движение частиц и IMF.
H.C.5A.3
Концентрация
Интерактивное моделирование
Наблюдайте, как раствор меняет цвет, когда вы смешиваете химикаты с водой.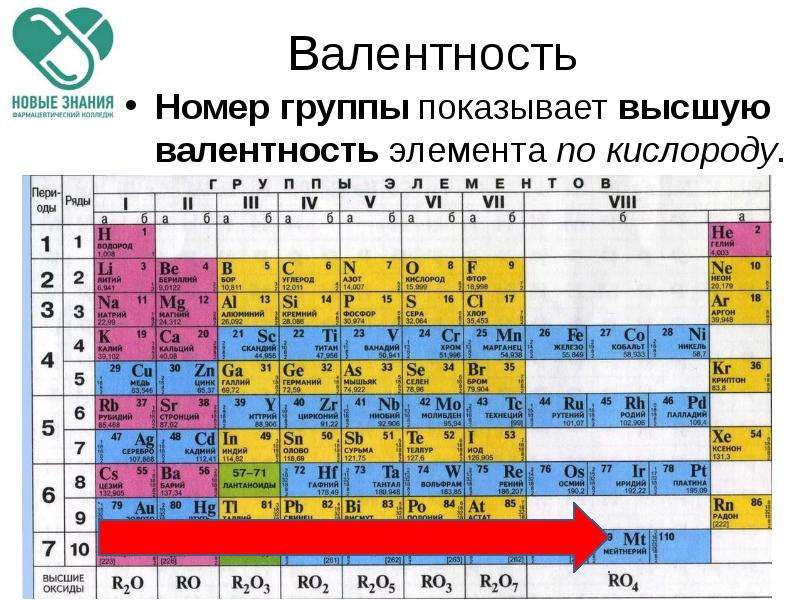 Затем проверьте молярность с помощью измерителя концентрации.Какими способами можно изменить концентрацию раствора? Переключайте растворенные вещества, чтобы сравнить различные химические вещества и узнать, насколько концентрированными вы можете достичь, прежде чем достигнете насыщения!
Затем проверьте молярность с помощью измерителя концентрации.Какими способами можно изменить концентрацию раствора? Переключайте растворенные вещества, чтобы сравнить различные химические вещества и узнать, насколько концентрированными вы можете достичь, прежде чем достигнете насыщения!
H.C.5A.4
Игра Acids & Bases
Игра, уровни испытаний, исследовательская песочница и ресурсы для учителей
В игре Acids & Bases игроки удаляют протоны из кислот и добавляют протоны к основаниям для создания целевых ионов и молекул.
Шкала pH
Интерактивное моделирование
Проверьте pH таких вещей, как кофе, слюна и мыло, чтобы определить, является ли каждый из них кислым, щелочным или нейтральным.Визуализируйте относительное количество гидроксид-ионов и ионов гидроксония в растворе. Переключение между логарифмической и линейной шкалами. Выясните, влияет ли изменение объема или разбавление водой на pH.
Gizmos Feel the Heat
Интерактивное моделирование
Зарегистрировавшись для бесплатной учетной записи, учащиеся могут получить доступ к этому интерактивному моделированию, которое позволяет учащимся изучать эндотермические и экзотермические процессы путем растворения выбранных солей в воде.
ХИМИЧЕСКИЕ РЕАКЦИИ
H.C.6A.1
Равновесная игра
Игра, уровни испытаний, исследовательская песочница и ресурсы учителя
В равновесной игре игроки нарушают реакции на изменение равновесия и вызывают изменения в системе для соответствия игровым целям.
H.C.6A.2
Подкисление океана и морская жизнь
Видео
Демонстрирует, что по мере того, как океан поглощает больше углекислого газа из атмосферы, некоторым организмам с панцирем становится труднее строить раковины.
H.C.6A.3
H.C.6A.4
Пиротехника: это элементаль
Интерактивный план урока
Интерактивная таблица Менделеева фокусируется на некоторых элементах, наиболее часто используемых при создании фейерверков, и на том, как они используются для создания потрясающих эффектов.
Подкисление океана и морская жизнь
Видео с вопросами для обсуждения
Визуализируйте воздействие увеличения концентрации углекислого газа в океане на морские организмы, подвергшиеся воздействию панциря.Видео и дополнительные материалы включают в себя химические реакции, происходящие по мере того, как больше атмосферного углекислого газа поглощается морской средой, что приводит к подкислению океана.
ТЕРМОХИМИЯ И ХИМИЧЕСКАЯ КИНЕТИКА
H.C.7A.1
Эксперимент с удельной теплоемкостью
Интерактивный
Выберите один из трех различных материалов и соберите виртуальные данные об изменении массы и температуры.Затем рассчитайте удельную теплоемкость выбранного материала на основе собранных данных.
H.C.7A.2
H.C.7A.3
H.C.7A.4
Урок в девятом классе Задание по вопросу «Связывание»
Я начинаю урок с демонстрации Brainpop: Chemical Formulas. Я показываю это, чтобы представить концепцию, согласно которой различные элементы могут приобретать, терять или делиться электронами, образуя химические связи.Это короткое 4:30-минутное видео, в котором хорошо рассмотрены части атома и показано электростатическое притяжение. Мне также нравится, что в нем говорится о «липкости» молекул — термин, который я часто использую для описания свойств ионов и соединений. Я также использую «липкий» во время IMF, который является следующей единицей после склеивания.
Brainpop — отличный ресурс, посвященный различным темам, связанным с наукой, которые рассказывают два мультипликационных персонажа, Тим и Моби (робот, использующий невербальную коммуникацию).Большинство видеороликов длятся 3-5 минут и содержат викторины и задания, которые можно распечатать. Обычно я использую видео в качестве введения, но они очень эффективны и в качестве краткого обзора.
В целом они нравятся детям, и они могут вести достойную беседу в классе по ключевым вопросам. Единственное предостережение заключается в том, что для этого требуется членский взнос в размере около семи долларов в месяц, но я считаю, что этот взнос полностью оправдывает свою цену. В качестве альтернативы видео я прикрепил ссылку на видео YouTube, в котором для описания различных типов связи используется песня.
После видео я не даю им викторину, которую предлагает веб-сайт Brainpop , а вместо этого участвую в кратком обсуждении того, о чем было видео. Обсуждая видео вместо того, чтобы задавать вопросы, у студентов появляется любопытство о том, как развивается химическая связь, которая может способствовать дальнейшему обучению.
Большая часть разговора сосредоточена на идее, что молекулы липкие (потому что Тим шутит) и что атомы могут терять или приобретать электроны, чтобы стать стабильными.Студентам трудно понять эту концепцию, потому что они только что узнали, что количество протонов и электронов равно, что делает атомы нейтральными. Однако по мере того, как мы продвигаемся через единицу, они обычно улавливают ее, как только нарисована большая картина, что атомы не остаются нейтральными в процессе связывания.
Мне нравится заканчивать обсуждение вопросом: «Какие элементы объединяются, чтобы образовать различные типы соединений»? Они не уверены, потому что они просто изучают периодическую таблицу Менделеева, но этот вопрос дает им правильное представление о следующем занятии.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА И ПЛАН УРОКА ПО РЕАКТИВНОСТИ — ПОЛНЫЙ УРОК НАУКИ С ИСПОЛЬЗОВАНИЕМ МЕТОДА 5E ИНСТРУКЦИИ
В конце этой периодической таблицы и плана урока по реактивности учащиеся смогут определить, что валентные электроны определяют химические свойства атома, включая реакционную способность и интерпретировать расположение периодической таблицы, чтобы объяснить, как свойства используются для классификации элементов (включая группы и периоды). Каждый урок разработан с использованием метода обучения 5E для обеспечения максимального понимания учащимися.
Каждый урок разработан с использованием метода обучения 5E для обеспечения максимального понимания учащимися.
Следующий пост проведет вас через каждый из шагов и действий из периодической таблицы и плана урока реактивности.
В начале урока класс проведет «Think-Pair-Share», чтобы обсудить цель.
Преподаватель поможет прояснить любые заблуждения о таблице Менделеева и реакционной способности. Некоторые серьезные заблуждения связаны с тем, что студенты не понимают, что все вещи состоят из комбинаций этих элементов, и студенты не понимают, что валентные электроны — это то, что определяет реактивность элементов.
Расчетное время занятия для помолвки: 20-30 минут
РАЗВЕДКА
Эта лаборатория станции, ориентированная на студентов, создана, чтобы студенты могли начать изучать периодическую таблицу и реактивность. Четыре из станций считаются входными станциями, где студенты изучают новую информацию о периодической таблице и реактивности, а четыре из станций являются выходными станциями, где студенты будут демонстрировать свое мастерство входных станций.Каждая из станций отличается, чтобы бросить вызов студентам, использующим разный стиль обучения. Вы можете узнать больше о том, как я организовал лаборатории станции здесь.
УЗНАЙТЕ ЭТО!
Студенты будут работать в парах, чтобы лучше понять, как расположены элементы в периодической таблице. У учащихся будут карточки, которые они разложат, чтобы лучше понять, что значит быть в группе или периоде. Студенты интерпретируют эту идею как способ показать реактивность и то, как элементы обладают одинаковыми свойствами.Студенты, наконец, возьмут эту информацию и применит ее к реальной периодической таблице.
ПОСМОТРИТЕ!
На этой станции студенты будут смотреть семиминутный видеоролик, объясняющий устройство таблицы Менделеева. Затем студенты ответят на вопросы, связанные с видео, и запишут свои ответы в листах лабораторных станций.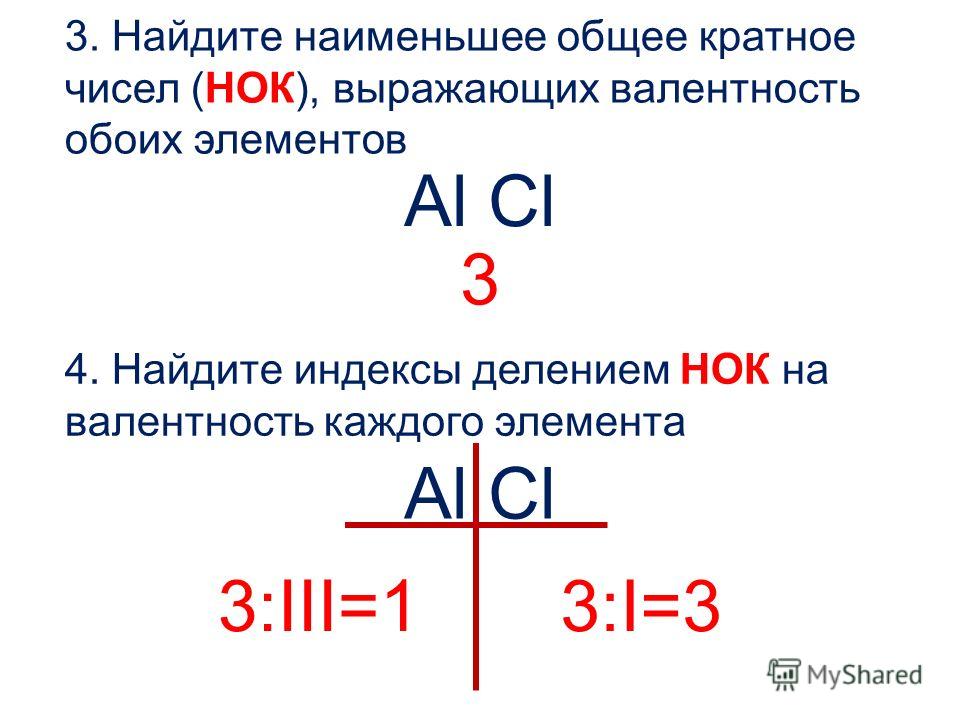 Например: Что означает атомный номер в периодической таблице? Какая часть атома позволяет одному атому реагировать с другим? Что верно для элементов, находящихся в одном столбце (группе / семействе)?
Например: Что означает атомный номер в периодической таблице? Какая часть атома позволяет одному атому реагировать с другим? Что верно для элементов, находящихся в одном столбце (группе / семействе)?
ИССЛЕДУЙТЕ ЭТО!
Исследовательская станция позволит студентам проводить исследования о построении и организации периодической таблицы.Студенты узнают о периодах, группах и фактах об элементах. Затем студентам будет предложено ответить на несколько вопросов, основанных на проведенном ими исследовании.
ПРОЧИТАЙТЕ!
Эта станция предоставит студентам одну страницу для чтения о периодической таблице. В ходе чтения студенты узнают, как устроена таблица Менделеева. Студенты будут знать, как называются вертикальные столбцы, а также горизонтальные строки. Учащиеся ответят на 4 дополнительных вопроса, чтобы продемонстрировать понимание предмета при чтении.
ОЦЕНИТЬ!
Станция для оценки — это место, куда студенты отправляются, чтобы доказать свое мастерство в концепциях, которые они изучали в лаборатории. Вопросы составлены в стандартизированном формате с несколькими вариантами ответов. Некоторые вопросы включают: Что не верно в отношении всех этих элементов? Какой элемент имеет 2 валентных электрона и находится в периоде 4? Какие два элемента обладают схожими свойствами? Какой элемент самый реактивный?
НАПИШИТЕ!
Студенты, которые могут ответить на открытые вопросы о лаборатории, действительно понимают изучаемые концепции.На этой станции студенты будут отвечать на три карточки с заданиями: Объяснить, что такое валентный электрон. Чем периоды и группы отличаются друг от друга? Как определить, имеют ли элементы одинаковые химические свойства?
ИЛЛЮСТРИРУЙТЕ ЭТО!
Вашим ученикам-наставникам понравится эта станция. Студенты раскрашивают разделы периодической таблицы. Студенты будут раскрашивать определенные периоды и группы, чтобы показать, что они понимают, как устроена таблица Менделеева. Студенты также пометят определенные группы, периоды и места, где можно найти элементы с одинаковым количеством валентных электронов.
Студенты также пометят определенные группы, периоды и места, где можно найти элементы с одинаковым количеством валентных электронов.
ОРГАНИЗУЙТЕ ЭТО!
Станция «организовать it» позволяет вашим ученикам размещать карточки под другими карточками с названиями двух определенных элементов. Эти карты будут описывать информацию, относящуюся к элементам, которые можно интерпретировать по их расположению в периодической таблице.
Расчетное время занятий для исследования: 1-2, 45-минутные занятия
ПОЯСНЕНИЕ
Объясняющие задания станут намного более увлекательными для класса, когда они завершат лабораторию на исследовательской станции.Во время объяснения учитель проясняет любые неправильные представления о периодической таблице и реактивности с помощью интерактивной PowerPoint, якорных диаграмм и интерактивных заданий с записной книжкой. Таблица Менделеева и план урока реактивности включают PowerPoint с упражнениями, разбросанными повсюду, чтобы студенты были вовлечены. Учащиеся также будут взаимодействовать со своими журналами, используя шаблоны INB для периодической таблицы и реактивности. Каждое занятие INB призвано помочь студентам разделить информацию на части для лучшего понимания концепции.Периодическая таблица и шаблоны INB реактивности позволяют студентам сосредоточить свои заметки на изучении разницы между группами и периодами, а также на заметках о периодической таблице и реактивности. Расчетное время занятий для исследования: 2-3 часа занятий по 45 минут
РАЗРАБОТКА
Раздел, посвященный разработке метода обучения 5E, предназначен для того, чтобы дать учащимся возможность выбрать, как они могут доказать свое владение концепцией. Когда ученикам предоставляется выбор, их «участие» намного больше, чем когда учитель говорит им о проекте, который им предстоит создать.Проект разработки позволит студентам создать презентацию, чтобы рассказать о периодической таблице и реактивности. Расчетное время занятий на проработку: 2–3 урока по 45 минут (также можно использовать в качестве домашнего проекта)
ОЦЕНКА
Последняя часть модели 5E — оценка понимания учащимися. В каждый урок 5E входит домашнее задание, оценка и модифицированная оценка. Исследования показали, что домашнее задание должно быть значимым и применимым к реальной деятельности, чтобы быть эффективным.Когда это возможно, мне нравится давать открытые оценки, чтобы по-настоящему оценить понимание учащимся.
Расчетное время занятий на проработку: 1, 45 минут урока
СКАЧАТЬ ПОЛНЫЙ УРОК СЕЙЧАС
Полную версию урока можно загрузить в моем магазине TpT. Сэкономьте кучу времени и возьмите его сейчас.
Borders, Jennie / Honors Chemistry
~ Рабочие листы для практики (Это дополнительные рабочие листы, которые дадут вам дополнительную практику по различным темам.У меня есть ключи к рабочим листам, доступные в классе.)* БЛОК 2 (главы 4, 5 и 6)
* Блок 2 — Структура атома (главы 4)~ Обучающие видео
~ Рабочие листы для практики (Это необязательные рабочие листы, которые дадут вам дополнительную практику по различным темам. У меня есть ключи к рабочим листам, доступным в классе.)* Блок 2 — Электроны (Глава 5)
~ Обучающие видео
~ Рабочие листы для практики (Это необязательные рабочие листы, которые дадут вам дополнительную практику по различным темам.У меня есть ключи к рабочим листам, доступные в классе.)
* Блок 2 — Периодическая таблица (Глава 6)
~ Обучающее видео
~ Рабочие листы для практики (Это дополнительные рабочие листы, которые дадут вам дополнительную практику по различным темам. У меня есть ключи к рабочим листам, доступным в классе.)
* БЛОК 3 (главы 7, 8 и 9)* Блок 3 — Ионная связь (Глава 7)
~ Обучающие видео
~ Рабочие листы для практики (Это необязательные рабочие листы, которые дадут вам дополнительную практику по различным темам.У меня есть ключи к рабочим листам, доступные в классе.)
* Блок 3 — Ковалентное связывание (Глава 8)
~ Обучающие видео
~ Рабочие листы для практики (Это дополнительные рабочие листы, которые дадут вам дополнительную практику по различным темам. У меня есть ключи к рабочим листам, доступным в классе.)
* Блок 3 — Номенклатура (Группа 9)
~ Обучающие видео
~ Рабочие листы для практики (Это необязательные рабочие листы, которые дадут вам дополнительную практику по различным темам.У меня есть ключи к рабочим листам, доступные в классе.)
* Среднесрочная (годичные)
* БЛОК 4
* Блок 4 — Родинки (Группа 10)
~ Обучающие видео
~ Рабочие листы для практики (Это необязательные рабочие листы, которые дадут вам дополнительную практику по различным темам. У меня есть ключи к рабочим листам, доступным в классе.)
* Блок 4 — Химические реакции (Глава 11)
~ Обучающие видео
~ Рабочие листы для практики (Это дополнительные рабочие листы, которые дадут вам дополнительную практику по различным темам. У меня есть ключи к рабочим листам, доступным в классе.)
* Блок 4 — Стехиометрия (Глава 12)
~ Обучающие видео
~ Рабочие листы для практики (Это необязательные рабочие листы, которые дадут вам дополнительную практику по различным темам.У меня есть ключи к рабочим листам, доступные в классе.)
* БЛОК 5
* Блок 5 — Состояния вещества (главы 13 и 15)
~ Обучающие видео
~ Рабочие листы для практики (Это дополнительные рабочие листы, которые дадут вам дополнительную практику по различным темам. У меня есть ключи к рабочим листам, доступным в классе.)
* Блок 5 — Газовые законы (Глава 14)
~ Обучающие видео
~ Рабочие листы для практики (Это необязательные рабочие листы, которые дадут вам дополнительную практику по различным темам.У меня есть ключи к рабочим листам, доступные в классе.)
* БЛОК 6
* Блок 6 — Решения (Глава 16)
~ Обучающие видео
~ Рабочие листы для практики (Это дополнительные рабочие листы, которые дадут вам дополнительную практику по различным темам. У меня есть ключи к рабочим листам, доступным в классе.)
* Блок 6 — Термохимия (Группа 17)
~ Обучающие видео
~ Рабочие листы для практики (Это необязательные рабочие листы, которые дадут вам дополнительную практику по различным темам.У меня есть ключи к рабочим листам, доступные в классе.)
* Блок 6 — Кислоты и основания (Группа 19)
~ Рабочие листы для практики (Это дополнительные рабочие листы, которые дадут вам дополнительную практику по различным темам. У меня есть ключи к рабочим листам, доступным в классе.)
~ Обучающие видео
* Итоговый экзамен
* Раздаточные материалы лаборатории
Лаборатории 1-го семестра
*** Лаборатория 7 — Лаборатория воздушных шаров VSEPR (Было 4 разные лабораторные группы для отличников и обычных, поэтому убедитесь, что вы выбрали правильный файл ниже) (Глава 8)
Лаборатории 2-го семестра
Периодическая таблица и модели уровней энергии | Глава 4: Периодическая таблица и связь
Познакомьте студентов с идеей о том, что электроны окружают ядро атома в областях, называемых энергетическими уровнями.
Обсудите со студентами, что на втором уроке они сосредоточились на количестве протонов, нейтронов и электронов в атомах каждого элемента. В этом уроке они сосредоточатся на расположении электронов в каждом элементе.
Спроецировать изображение Поперечное сечение уровня энергии.
Объясните студентам, что электроны окружают ядро атома в трех измерениях, делая атомы сферическими. Они могут думать об электронах как о находящихся на разных уровнях энергии, подобных концентрическим сферам вокруг ядра.Поскольку эти сферы очень сложно показать, уровни энергии обычно показаны в двух измерениях.
Подробнее о моделях уровня энергии читайте в разделе «История учителя».
Спроецировать изображение Атом кислорода.
Скажите студентам, что эта модель энергетического уровня представляет атом. Ядро представлено точкой в центре, которая содержит как протоны, так и нейтроны. Меньшие точки, окружающие ядро, представляют электроны на энергетических уровнях.Сообщите учащимся, что они узнают больше об электронах и уровнях энергии позже на этом уроке.
Попросите учащихся взглянуть на Периодическую таблицу элементов 1–20, которые они использовали в уроке 2, чтобы ответить на следующий вопрос:
- Можете ли вы определить, какой атом представляет эта модель?
- Если учащиеся не могут ответить на этот вопрос, укажите, что существует 8 электронов. Поскольку нейтральные атомы в периодической таблице имеют такое же количество электронов, что и протоны, у атома должно быть 8 протонов.Число протонов такое же, как и атомный номер, поэтому атом — это кислород.
Попросите группы работать вместе, чтобы разместить каждую карту с ее правильным атомом.
Покажите учащимся, что у вас есть 80 карточек (по 4 на каждый из первых 20 элементов). Прежде чем раздавать карточки, объясните, что каждая карточка содержит информацию об электронах и уровнях энергии первых 20 элементов таблицы Менделеева. Задача учеников — внимательно прочитать карточку, выяснить, какой элемент она описывает, и положить карточку в то место в комнате, где находится этот элемент.Напомните учащимся, что им нужно будет подсчитать электроны, чтобы идентифицировать каждый атом. Как только учащиеся поймут свое задание, раздайте карточки группам.
Обсудите размещение карт для двух или трех атомов.
После того, как все карты были размещены на 20 различных атомах, выберите два или три атома и проверьте, правильно ли были размещены карты. Этот обзор поможет укрепить представления о структуре атомов и поможет студентам определить количество протонов и электронов в каждом атоме.
Раздайте каждому учащемуся листок с Периодической таблицей уровней энергии. Эта таблица содержит модели уровней энергии для первых 20 элементов. Электроны включены только для атомов в начале и в конце каждого периода.
Спроецируйте Периодическую таблицу уровней энергии и обсудите расположение электронов по мере того, как учащиеся заполняют свой рабочий лист.
Спроецировать изображение Периодическая таблица уровней энергии.
Изображение, которое вы проецируете, содержит все электроны для элементов 1–20. Однако периодическая таблица в таблице активности содержит электроны только для элементов в начале и в конце каждого периода. Обсудите расположение электронов на энергетических уровнях этих атомов и попросите учащихся заполнить электроны для других атомов.
Примечание. На диаграммах уровней энергии электроны равномерно распределены по уровням. В некоторых книгах они показаны таким образом, а в других — парами.Спаривание электронов означает, что электроны находятся на отдельных орбиталях в пределах каждого энергетического уровня. На уровне средней школы учащимся не обязательно изучать электронные орбитали. Эта информация предлагается для того, чтобы вам было понятнее, почему электроны часто показаны парами на диаграммах уровней энергии и на точечных диаграммах, используемых в качестве дополнения в конце этой главы. Орбиталь определяет область на уровне энергии, где высока вероятность обнаружения пары электронов.На каждой орбитали может быть максимум два электрона. Вот почему электроны часто изображаются парами на уровне энергии.
Скажите студентам, что строки в периодической таблице называются точками.
Период 1
- Водород
- Объясните, что водород имеет 1 протон и 1 электрон. 1 электрон находится на первом энергетическом уровне.
- Гелий
- Объясните, что гелий имеет 2 протона и 2 электрона.2 электрона находятся на первом энергетическом уровне.
Период 2
- Литий
- Объясните, что у лития 3 протона и 3 электрона. На первом энергетическом уровне 2 электрона, а на втором — 1 электрон. Объясните, что первый энергетический уровень может иметь только 2 электрона, поэтому следующий электрон в литии находится на следующем (втором) уровне.
- Неон
- Объясните, что у неона 10 протонов и 10 электронов.На первом уровне энергии 2 электрона, а на втором — 8 электронов.
- Бериллий-фтор
- Помогите учащимся указать правильное количество электронов на энергетических уровнях для остальных атомов в периоде 2.
Период 3
- Натрий
- Объясните, что у натрия 11 протонов и 11 электронов. Есть 2 электрона на первом уровне энергии, 8 электронов на втором уровне и 1 электрон на третьем уровне энергии.Объясните, что второй энергетический уровень может иметь только 8 электронов, поэтому следующий электрон в натрия должен находиться на следующем (третьем) уровне.
- Аргон
- Объясните, что аргон имеет 18 протонов и 18 электронов. Есть 2 электрона на первом уровне энергии, 8 электронов на втором уровне и 8 электронов на третьем уровне энергии. Попросите учащихся заполнить модель энергетического уровня аргона в своей периодической таблице.
- Магний-хлор
- Помогите студентам указать правильное количество электронов на энергетических уровнях для остальных атомов в периоде 3.
Период 4
- Калий
- Объясните, что у калия 19 протонов и 19 электронов. Есть 2 электрона на первом уровне энергии, 8 электронов на втором уровне, 8 электронов на третьем уровне энергии и 1 на четвертом уровне энергии. Объясните: после того, как на третьем энергетическом уровне будет 8 электронов, следующий электрон перейдет на четвертый уровень.
- Кальций
- Помогите студентам указать правильное количество электронов в энергетических уровнях кальция.
Примечание: учащиеся могут задаться вопросом, почему энергетический уровень может удерживать только определенное количество электронов. Ответ на этот вопрос выходит далеко за рамки химического подразделения средней школы. Он включает в себя представление об электронах как о трехмерных волнах и о том, как они будут взаимодействовать друг с другом и с ядром.
Попросите учащихся найти закономерности в строках и столбцах первых 20 элементов периодической таблицы.
Продолжайте проецировать изображение Периодическая таблица уровней энергии для элементов 1–20 и попросите учащихся просмотреть свои листы действий, чтобы найти закономерности в количестве электронов на каждом уровне энергии.
Попросите учащихся взглянуть на точки (пересекающиеся строки).
Количество уровней энергии за каждый период
- Атомы в первом периоде имеют электроны на одном энергетическом уровне.
- Атомы во втором периоде имеют электроны на двух уровнях энергии.
- Атомы в третьем периоде имеют электроны на трех уровнях энергии.
- Атомы в четвертом периоде имеют электроны на 4 уровнях энергии.
Как электроны заполняют энергетические уровни
- Первый уровень энергии = 1, 2
- Второй энергетический уровень = 1, 2, 3,… 8
- Третий энергетический уровень = 1, 2, 3,… 8
- Четвертый энергетический уровень = 1, 2
Подробнее о таблице Менделеева читайте в разделе «Информация об учителе».
Определенное количество электронов переходит на уровень до того, как на следующем уровне могут быть электроны.После того, как первый энергетический уровень содержит 2 электрона (гелий), следующие электроны переходят на второй энергетический уровень. После того, как второй энергетический уровень имеет 8 электронов (неон), следующие электроны переходят на третий энергетический уровень. После того, как на третьем энергетическом уровне будет 8 электронов (аргон), следующие 2 электрона переходят на четвертый энергетический уровень.
Примечание. Третий энергетический уровень может фактически содержать до 18 электронов, поэтому он не заполняется, когда на нем 8 электронов. Но когда третий уровень содержит 8 электронов, следующие 2 электрона переходят на четвертый уровень.Затем, хотите верьте, хотите нет, еще 10 электронов продолжают заполнять остаток третьего уровня. Студентам не обязательно это знать.
Попросите учащихся посмотреть на группы (столбцы вниз).
Скажите студентам, что вертикальные столбцы в периодической таблице называются группами или семьями.
Попросите учащихся сравнить количество электронов на внешнем энергетическом уровне атомов в группе. Студенты должны понимать, что каждый атом в группе имеет одинаковое количество электронов на внешнем энергетическом уровне.Например, водород, литий, натрий и калий имеют 1 электрон на внешнем энергетическом уровне. Сообщите учащимся, что эти электроны на внешнем энергетическом уровне называются валентными электронами. Это электроны, отвечающие за связывание, которые студенты изучат на следующем уроке.
Сравните химическую реакцию различных элементов и соотнесите это с их расположением в таблице Менделеева.
Скажите студентам, что атомы в периодической таблице в одном столбце, называемом группой, обладают определенными характеристиками и могут реагировать аналогичным образом.
Спроецировать видео «Натрий в воде и калий в воде».
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#sodium_in_water
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#potasium_in_water
Студенты увидят, что, хотя калий реагирует более энергично, чем натрий, реакции аналогичны. Попросите учащихся взглянуть на периодическую таблицу, чтобы увидеть, где находятся натрий и калий по отношению друг к другу.
Спроецируйте видео «Кальций в воде».
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#calcium_in_water
Студенты увидят, что эта реакция отличается от реакции натрия и калия. Попросите их найти кальций в периодической таблице и указать, что он находится в другой группе, чем натрий и калий.
Спроецировать видео «Натрий в кислоте и калий в кислоте».
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#sodium_in_acid
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#potassium_in_acid
Покажите, что натрий реагирует с кислотой, а затем калий реагирует с кислотой. HCl — это соляная кислота. HNO3 — это азотная кислота. Каждая кислота используется в двух разных концентрациях. Убедитесь, что учащиеся понимают, что натрий и калий реагируют аналогичным образом, хотя калий реагирует более энергично.
Спроецировать видео «Кальций в кислоте».
www.middleschoolchemistry.com//multimedia/chapter4/lesson3#calcium_in_acid
Укажите, что кальций реагирует иначе, чем натрий и калий.



 Написать символы элементов
Написать символы элементов

 Записывают формулы в таблицу.
Записывают формулы в таблицу.