Газ водород, физические свойства водорода, химические свойства водорода.
Продажа Производство ДоставкаГазообразный
Жидкий
Водород (лат. Hydrogenium; обозначается символом H) — первый элемент периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H — протон. Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Три изотопа водорода имеют собственные названия: 1H — протий (Н), 2H — дейтерий (D) и 3H — тритий (радиоактивен) (T).
Простое вещество водород — H2 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и рядеметаллов: железе, никеле, палладии, платине.
ИсторияВыделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки.
Лавуазье дал водороду название hydrogène — «рождающий воду». Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии сломоносовским «кислородом».
РаспространённостьВодород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех атомов (8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %).
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~ 52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 %.
ПолучениеПромышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения. Так, кислород, имеющийся в свободном состоянии, получают физическим способом — выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Основной промышленный способ получения водорода — реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре (легко убедиться, что при пропускании метана даже через кипящую воду никакой реакции не происходит):
СН4 + 2Н2O = CO2↑ + 4Н2 −165 кДж
В лаборатории для получения простых веществ используют не обязательно природное сырьё, а выбирают те исходные вещества, из которых легче выделить необходимое вещество. Например, в лаборатории кислород не получают из воздуха. Это же относится и к получению водорода. Один из лабораторных способов получения водорода, который иногда применяется и в промышленности, — разложение воды электротоком.
Например, в лаборатории кислород не получают из воздуха. Это же относится и к получению водорода. Один из лабораторных способов получения водорода, который иногда применяется и в промышленности, — разложение воды электротоком.
Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
В промышленности2NaCl + 2H2O → H2↑ + 2NaOH + Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000 °C:
H2O + C ? H2 + CO
3.Из природного газа.
Конверсия с водяным паром:
CH4 + H2O ? CO + 3H2 (1000 °C)
Каталитическое окисление кислородом:
2CH4 + O2 ? 2CO + 4H2
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
В лаборатории1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
Zn + 2HCl → ZnCl2 + H2↑
2.Взаимодействие кальция с водой:
Ca + 2H2O → Ca(OH)2 + H2↑
3.Гидролиз гидридов:
NaH + H2O → NaOH + H2↑
4.Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ + 2e− → H2↑ + 2H2O
Физические свойстваВодород может существовать в двух формах (модификациях) — в виде орто- и пара- водорода. В молекуле ортоводорода o-H2 (т.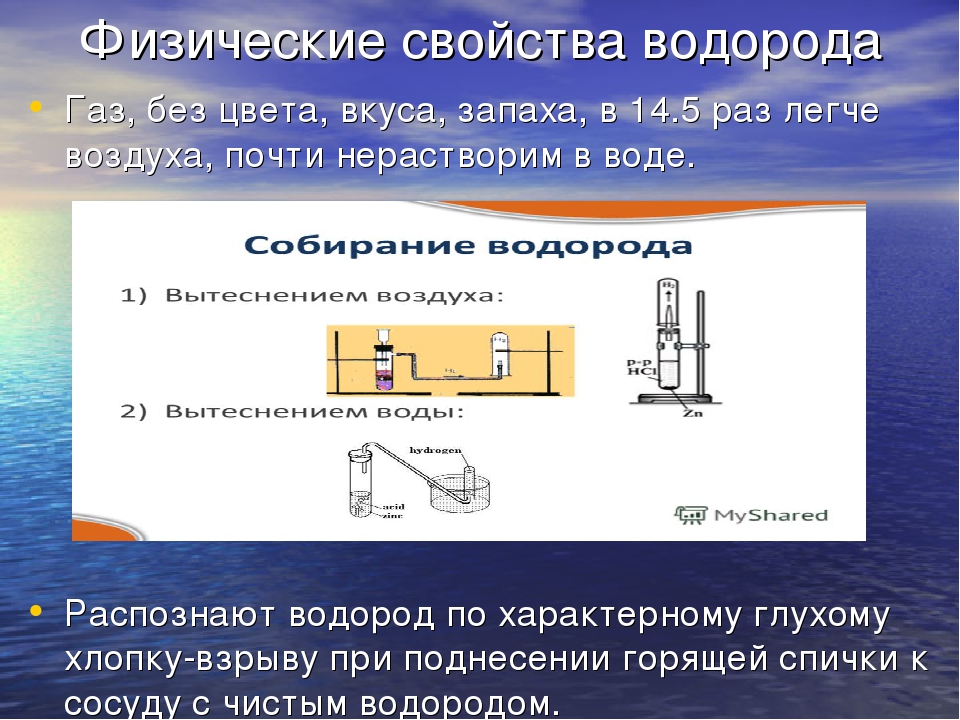 пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o
пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвездной среды — с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.у.), температура кипения −252,76 °C, удельная теплота сгорания 120.9×106 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация).
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см3) и текучая (вязкость при −253 °C 13,8 спуаз). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см3 (при −262 °C) — снегоподобная масса, кристаллы гексогональной сингонии,пространственная группа P6/mmc, параметры ячейки a=3,75 c=6,12. При высоком давлении водород переходит в металлическое состояние.
ИзотопыВодород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1H — протий (Н), 2Н — дейтерий (D), 3Н — тритий (радиоактивный) (T).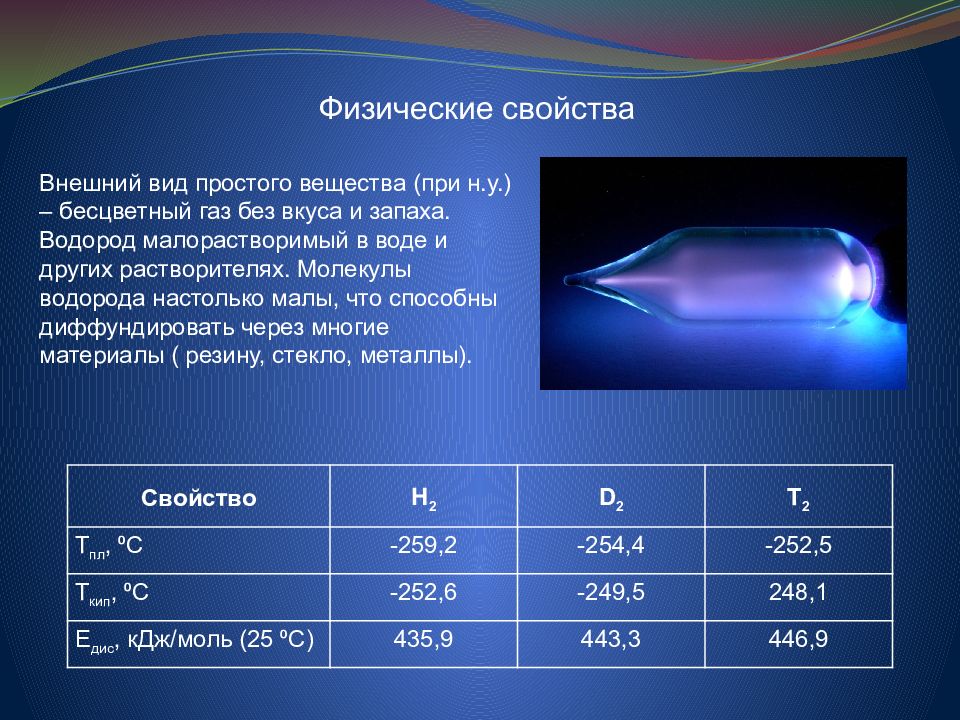
Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 %. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет. Тритий содержится в природе в очень малых количествах.
В литературе также приводятся данные об изотопах водорода с массовыми числами 4 — 7 и периодами полураспада 10−22 — 10−23 с.
Природный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
|
|
Температура |
Температура |
Тройная |
Критическая |
Плотность |
|
H2 |
13.96 |
20,39 |
13,96 / 7,3 |
32,98 / 1,31 |
70,811 / 1,316 |
|
D |
16,65 |
22,13 |
16,60 / 12,8 |
35,91 / 1,48 |
114,80 / 1,802 |
|
HT |
|
22,92 |
17,63 / 17,7 |
37,13 / 1,57 |
158,62 / 2,310 |
|
D2 |
18,65 |
23,67 |
18,73 / 17,1 |
38,35 / 1,67 |
162,50 / 2,230 |
|
DT |
|
24. |
19,71 / 19,4 |
39,42 / 1,77 |
211,54 / 2,694 |
|
T2 |
20,63 |
25,04 |
20,62 / 21,6 |
40,44 / 1,85 |
260,17 / 3,136 |
Дейтерий и тритий также имеют орто- и пара- модификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и пара- модификаций.
Химические свойстваДоля диссоциировавших молекул водорода
Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Н2 = 2Н − 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
Ca + Н2 = СаН2
и с единственным неметаллом — фтором, образуя фтороводород:
F2 + H2 = 2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
О2 + 2Н2 = 2Н2О
Он может «отнимать» кислород от некоторых оксидов, например:
CuO + Н2 = Cu + Н2O
Записанное уравнение отражает восстановительные свойства водорода.
N2 + 3H2 → 2NH3
С галогенами образует галогеноводороды:
F2 + H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
C + 2H2 → CH4
Взаимодействие со щелочными и щёлочноземельными металламиПри взаимодействии с активными металлами водород образует гидриды:
2Na + H2 → 2NaH
Ca + H2 → CaH2
Mg + H2 → MgH2
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Взаимодействие с оксидами металлов (как правило, d-элементов)Оксиды восстанавливаются до металлов:
CuO + H2 → Cu + H2O
Fe2O3 + 3H2 → 2Fe + 3H2O
WO3 + 3H2 → W + 3H2O
Гидрирование органических соединенийМолекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр.Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр.Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением . Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
Особенности обращенияВодород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водородпожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75(74) % объёмных.
ЭкономикаСтоимость водорода при крупнооптовых поставках колеблется в диапазоне 2-5$ за кг.
Атомарный водород используется для атомно-водородной сварки.
Химическая промышленность- При производстве аммиака, метанола, мыла и пластмасс
- При производстве маргарина из жидких растительных масел
- Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ)
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколькокатастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
ТопливоВодород используют в качестве ракетного топлива.
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар.
Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
«Жидкий водород» («ЖВ») — жидкое агрегатное состояние водорода, с низкой удельной плотностью 0.07 г/см³ и криогенными свойствами с точкой замерзания 14.01 K (−259.14 °C) и точкой кипения 20.28 K (−252.87 °C). Является бесцветной жидкостью без запаха, которая при смешивании с воздухом относится к взрывоопасным веществам с диапазоном коэффициента воспламенения 4-75 %. Спиновое соотношение изомеров в жидком водороде составляет: 99,79 % —параводород; 0,21 % — ортоводород. Коэффициент расширения водорода при смене агрегатного состояния на газообразное составляет 848:1 при 20°C.
Как и для любого другого газа, сжижение водорода приводит к уменьшению его объема. После сжижения «ЖВ» хранится в термически изолированных контейнерах под давлением. Жидкий водород (англ. Liquid hydrogen, Lh3, LH2) активно используется в промышленности, в качестве формы хранения газа, и в космическойотрасли, в качестве ракетного топлива.
Жидкий водород (англ. Liquid hydrogen, Lh3, LH2) активно используется в промышленности, в качестве формы хранения газа, и в космическойотрасли, в качестве ракетного топлива.
Первое документированное использование искусственного охлаждения в 1756 году было осуществлено английским ученым Вильямом Калленом, Гаспар Монж первым получил жидкое состояние оксида серы в 1784 году, Майкл Фарадей первым получил сжиженный аммиак, американский изобретатель Оливер Эванс первым разработал холодильный компрессор в 1805 году, Яков Перкинс первым запатентовал охлаждающую машину в 1834 году и Джон Гори первым в США запатентовалкондиционер в 1851 году. Вернер Сименс предложил концепцию регенеративного охлаждения в 1857 году, Карл Линде запатентовал оборудование для получения жидкого воздуха с использованием каскадного «эффекта расширения Джоуля — Томсона» и регенеративного охлаждения [6] в 1876 году. В 1885 году польскийфизик и химик Зигмунд Вро?блевский опубликовал критическую температуру водорода 33 K, критическое давление 13. 3 атм. и точку кипения при 23 K. Впервыеводород был сжижен Джеймсом Дьюаром в 1898 году с использованием регенеративного охлаждения и своего изобретения, cосуда Дьюара. Первый синтез стабильного изомера жидкого водорода — параводорода — был осуществлен Полом Хартеком и Карлом Бонхеффером в 1929 году.
3 атм. и точку кипения при 23 K. Впервыеводород был сжижен Джеймсом Дьюаром в 1898 году с использованием регенеративного охлаждения и своего изобретения, cосуда Дьюара. Первый синтез стабильного изомера жидкого водорода — параводорода — был осуществлен Полом Хартеком и Карлом Бонхеффером в 1929 году.
Водород при комнатной температуре состоит в основном из спинового изомера, ортоводорода. После производства, жидкий водород находится в метастабильном состоянии и должен быть преобразован в параводородную форму, для того чтобы избежать взрывоопасной экзотермической реакции, которая имеет место при его изменении при низких температурах. Преобразование в параводородную фазу обычно производится с использованием таких катализаторов, как оксид железа, оксид хрома, активированный уголь, покрытых платиной асбестов, редкоземельных металлов или путем использования урановых или никелевых добавок.
ИспользованиеЖидкий водород может быть использован в качестве формы хранения топлива для двигателей внутреннего сгорания и топливных элементов. Различные подлодки(проекты «212А» и «214», Германия) и концепты водородного транспорта были созданы с использованием этой агрегатной формы водорода (см. например «DeepC»или «BMW h3R»). Благодаря близости конструкций, создатели техники на «ЖВ» могут использовать или только модифицировать системы, использующие сжиженный природный газ («СПГ»). Однако из-за более низкой объемной плотности энергии для горения требуется больший объем водорода, чем природного газа. Если жидкий водород используется вместо «СПГ» в поршневых двигателях, обычно требуется более громоздкая топливная система. При прямом впрыске увеличившиеся потери во впускном тракте уменьшают наполнение цилиндров.
Различные подлодки(проекты «212А» и «214», Германия) и концепты водородного транспорта были созданы с использованием этой агрегатной формы водорода (см. например «DeepC»или «BMW h3R»). Благодаря близости конструкций, создатели техники на «ЖВ» могут использовать или только модифицировать системы, использующие сжиженный природный газ («СПГ»). Однако из-за более низкой объемной плотности энергии для горения требуется больший объем водорода, чем природного газа. Если жидкий водород используется вместо «СПГ» в поршневых двигателях, обычно требуется более громоздкая топливная система. При прямом впрыске увеличившиеся потери во впускном тракте уменьшают наполнение цилиндров.
Жидкий водород используется также для охлаждения нейтронов в экспериментах по нейтронному рассеянию. Массы нейтрона и ядра водорода практически равны, поэтому обмен энергией при упругом столкновении наиболее эффективен.
Преимущества
Преимуществом использования водорода является «нулевая эмиссия» его применения. Продуктом его взаимодействия с воздухом является вода.
Продуктом его взаимодействия с воздухом является вода.
Один литр «ЖВ» весит всего 0.07 кг. То есть его удельная плотность составляет 70.99 г/л при 20 K. Жидкий водород требует криогенной технологии хранения, такой как специальные термически изолированные контейнеры и требует особого обращения, что свойственно для всех криогенных материалов. Он близок в этом отношении к жидкому кислороду, но требует большей осторожности из-за пожароопасности. Даже в случае с контейнерами с тепловой изоляцией, его тяжело содержать при той низкой температуре, которая требуется для его сохранения в жидком состоянии (обычно он испаряется со скоростью 1 % в день). При обращении с ним также нужно следовать обычным мерам безопасности при работе с водородом — он достаточно холоден для сжижения воздуха, что взрывоопасно.
Ракетное топливоЖидкий водород является распространенным компонентом ракетных топлив, которое используется для реактивного ускорения ракет-носителей и космических аппаратов. В большинстве жидкостных ракетных двигателях на водороде, он сначала применяется для регенеративного охлаждения сопла и других частей двигателя, перед его смешиванием с окислителем и сжиганием для получения тяги. Используемые современные двигатели на компонентах H2/O2 потребляют переобогащенную водородом топливную смесь, что приводит к некоторому количеству несгоревшего водорода в выхлопе. Кроме увеличения удельного импульсадвигателя за счет уменьшения молекулярного веса, это еще сокращает эрозию сопла и камеры сгорания.
В большинстве жидкостных ракетных двигателях на водороде, он сначала применяется для регенеративного охлаждения сопла и других частей двигателя, перед его смешиванием с окислителем и сжиганием для получения тяги. Используемые современные двигатели на компонентах H2/O2 потребляют переобогащенную водородом топливную смесь, что приводит к некоторому количеству несгоревшего водорода в выхлопе. Кроме увеличения удельного импульсадвигателя за счет уменьшения молекулярного веса, это еще сокращает эрозию сопла и камеры сгорания.
Такие препятствия использования «ЖВ» в других областях, как криогенная природа и малая плотность, являются также сдерживающим фактором для использования в данном случае. На 2009 год существует только одна ракета-носитель (РН «Дельта-4»), которая целиком является водородной ракетой. В основном «ЖВ» используется либо на верхних ступенях ракет, либо на блоках, которые значительную часть работы по выводу полезной нагрузки в космос выполняют в вакууме. В качестве одной из мер по увеличению плотности этого вида топлива существуют предложения использования шугообразного водорода, то есть полузамерзшей формы «ЖВ».
В качестве одной из мер по увеличению плотности этого вида топлива существуют предложения использования шугообразного водорода, то есть полузамерзшей формы «ЖВ».
Водород
| Водород | |
|---|---|
| Атомный номер | 1 |
| Внешний вид простого вещества | газ без цвета, вкуса и запаха |
| Свойства атома | |
|
Атомная масса (молярная масса) |
1,00794 а.е.м. (г/моль) |
| Радиус атома | 79 пм |
|
Энергия ионизации (первый электрон) |
1311,3 кДж/моль (эВ) |
| Электронная конфигурация | 1s1 |
| Химические свойства | |
| Ковалентный радиус | 32 пм |
| Радиус иона | 54 (−1 e) пм |
|
Электроотрицательность (по Полингу) |
2,20 |
| Электродный потенциал | |
| Степени окисления | 1, −1 |
| Термодинамические свойства простого вещества | |
|
Плотность вещества |
0,0000899 (при 273K (0 °C)) г/см³ |
| Молярная теплоёмкость | 14,235 Дж/(K·моль) |
| Теплопроводность | 0,1815 Вт/(м·K) |
| Температура плавления | 14,01K |
| Теплота плавления | 0,117 кДж/моль |
| Температура кипения | 20,28K |
| Теплота испарения | 0,904 кДж/моль |
| Молярный объём | 14,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,780 c=6,167 Å |
| Отношение c/a | 1,631 |
| Температура Дебая | 110 K |
| H | 1 |
| 1,00794 | |
| 1s1 | |
| Водород | |
Водород является первым элементом периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H— протон. Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H— протон. Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Трое из пяти изотопов водорода имеют собственные названия: 1H— протий (Н), 2H— дейтерий (D) и 3H— тритий (радиоактивен) (T).
Простое вещество водород— H2— лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине.
История водорода
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и М. В. Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Г. Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик А. Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Французский химик А. Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия водород
Лавуазье дал водороду название hydrogène (отὕδωρ— «вода» и γενναω— «рождаю»)— «рождающий воду». Русское наименование «водород» предложил химик М.Ф.Соловьев в 1824 году— по аналогии с ломоносовским «кислородом».
Распространённость водорода
Во Вселенной
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92% всех атомов (8% составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1%). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1%— это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17% (второе место после кислорода, доля атомов которого равна ~52%). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005% по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50%.
Получение Водорода
Промышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения. Так, кислород, имеющийся в свободном состоянии, получают физическим способом— выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Так, кислород, имеющийся в свободном состоянии, получают физическим способом— выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Основной промышленный способ получения водорода— реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре (легко убедиться, что при пропускании метана даже через кипящую воду никакой реакции не происходит):
СН4 +2Н2O =CO2↑ +4Н2 −165 кДж
В лаборатории для получения простых веществ используют не обязательно природное сырьё, а выбирают те исходные вещества, из которых легче выделить необходимое вещество. Например, в лаборатории кислород не получают из воздуха. Это же относится и к получению водорода. Один из лабораторных способов получения водорода, который иногда применяется и в промышленности,— разложение воды электротоком.
Один из лабораторных способов получения водорода, который иногда применяется и в промышленности,— разложение воды электротоком.
Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
Получение водорода в промышленности
1.Электролиз водных растворов солей:
2NaCl +2H2O → H2↑ +2NaOH +Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C:
H2O +C ⇄ H2↑ +CO↑
3.Из природного газа.
Конверсия с водяным паром:
CH4 +H2O ⇄ CO↑ +3H2↑ (1000°C)
Каталитическое окисление кислородом:
2CH4 +O2 ⇄ 2CO↑ +4H2↑
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
Получение водорода в лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
Zn +2HCl → ZnCl2 +H2↑
2. Взаимодействие кальция с водой:|
Взаимодействие кальция с водой:|
Ca +2H2O → Ca(OH)2 +H2↑
3.Гидролиз гидридов:
NaH +H2O → NaOH +H2↑
4.Действие щелочей на цинк или алюминий:
2Al +2NaOH +6H2O → 2Na[Al(OH)4] +3H2↑
Zn +2KOH +2H2O → K2[Zn(OH)4] +H2↑
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ +2e— → H2↑ +2H2O
Дополнительная информация про Водород
Биореактор для производства водорода
Физические свойства Водорода
Спектр излучения водорода
Эмиссионный спектр водорода
Равновесная мольная концентрация пара-водорода
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвездной среды— с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.у.), температура кипения −252,76 °C, удельная теплота сгорания 120.9·106 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов на 1объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Фазовая диаграмма водорода
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см3) и текучая (вязкость при −253 °C 13,8 спуаз). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79% пара-Н2, 0,21% орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см3 (при −262 °C) — снегоподобная масса, кристаллы гексогональной сингонии, пространственная группа P6/mmc, параметры ячейки a=3,75 c=6,12. При высоком давлении водород переходит в металлическое состояние.
Изотопы
Давление пара для различных изотопов водорода
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1H— протий (Н), 2Н— дейтерий (D), 3Н— тритий (радиоактивный) (T).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1и 2. Содержание их в природе соответственно составляет 99,9885±0,0070% и 0,0115 ± 0,0070%. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет. Тритий содержится в природе в очень малых количествах.
В литературе также приводятся данные об изотопах водорода с массовыми числами 4— 7и периодами полураспада 10−22— 10−23 с.
Природный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
|
Температура плавления, K |
Температура кипения, K |
Тройная точка, K /kPa |
Критическая точка, K /kPa |
Плотность жидкий /газ, кг/м³ |
|
|---|---|---|---|---|---|
| H2 | 13.95 | 20,39 | 13,96 /7,3 | 32,98 /1,31 | 70,811 /1,316 |
| HD | 16,60 | 22,13 | 16,60 /12,8 | 35,91 /1,48 | 114,80 /1,802 |
| HT | 22,92 | 17,63 /17,7 | 37,13 /1,57 | 158,62 /2,310 | |
| D2 | 18,62 | 23,67 | 18,73 /17,1 | 38,35 /1,67 | 162,50 /2,230 |
| DT | 24.38 | 19,71 /19,4 | 39,42 /1,77 | 211,54 /2,694 | |
| T2 | 25,04 | 20,62 /21,6 | 40,44 /1,85 | 260,17 /3,136 |
Дейтерий и тритий также имеют орто- и пара- модификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и пара- модификаций.
Химические свойства
Доля диссоциировавших молекул водорода
Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
- Н2 =2Н − 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
- Ca +Н2 =СаН2
и с единственным неметаллом— фтором, образуя фтороводород:
- F2 +H2 =2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
- О2 +2Н2 =2Н2О
Он может «отнимать» кислород от некоторых оксидов, например:
- CuO +Н2 =Cu +Н2O
Записанное уравнение отражает восстановительные свойства водорода.
- N2 +3H2 → 2NH3
С галогенами образует галогеноводороды:
- F2 +H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
- Cl2 +H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
- C +2H2 → CH4
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
- 2Na +H2 → 2NaH
- Ca +H2 → CaH2
- Mg +H2 → MgH2
Гидриды— солеобразные, твёрдые вещества, легко гидролизуются:
- CaH2 +2H2O → Ca(OH)2 +2H2↑
Взаимодействие с оксидами металлов (как правило, d-элементов)
Оксиды восстанавливаются до металлов:
- CuO +H2 → Cu +H2O
- Fe2O3 +3H2 → 2Fe +3H2O
- WO3 +3H2 → W+3H2O
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы навзывают реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, гигантскими планетами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением. Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
Особенности обращения
|
Водород при смеси с воздухом образует взрывоопасную смесь— так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21%. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение. Взрывоопасные концентрации водорода с кислородом возникают от 4% до 96% объёмных. При смеси с воздухом от 4% до 75(74)% объёмных. |
Применение водорода
Атомарный водород используется для атомно-водородной сварки.
Химическая промышленность
При производстве аммиака, метанола, мыла и пластмасс
Пищевая промышленность
При производстве маргарина из жидких растительных масел.
Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ)
Авиационная промышленность
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XXв. произошло несколько катастроф, когда дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием.
Топливо
Водород используют в качестве ракетного топлива. Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Водород, Hydrogenium, Н (1)
Как горючий (воспламеняемый) воздух водород известен довольно давно. Его получали действием кислот на металлы, наблюдали горение и взрывы гремучего газа Парацельс, Бойль, Лемери и другие ученые XVI— XVIII вв. С распространением теории флогистона некоторые химики пытались получить водород в качестве «свободного флогистона». В диссертации Ломоносова «О металлическом блеске» описано получение водорода действием «кислотных спиртов» (например, «соляного спирта», т. е. соляной кислоты) на железо и другие металлы; русский ученый первым (1745) выдвинул гипотезу, о том что водород («горючий пар»— vapor inflammabilis) представляет собой флогистон. Кавендиш, подробно исследовавший свойства водорода, выдвинул подобную же гипотезу в 1766 г. Он называл водород «воспламеняемым воздухом», полученным из «металлов» (Inflammable air from metals), и полагал, как и все флогистики, что при растворении в кислотах металл теряет свой флогистон. Лавуазье, занимавшийся в 1779 г. исследованием состава воды путем ее синтеза и разложения, назвал водород Hydrogine (гидроген), или Hydrogene (гидрожен), от греч. гидор— вода и гайноме— произвожу, рождаю.
Номенклатурная комиссия 1787 г. приняла словопроизводство Hydrogene от геннао, рождаю. В «Таблице простых тел» Лавуазье водород (Hydrogene) упомянут в числе пяти (свет, теплота, кислород, азот, водород) «простых тел, относящихся ко всем трем царствам природы и которые следует рассматривать как элементы тел»; в качестве старых синонимов названия Hydrogene Лавуазье называет горючий газ (Gaz inflammable), основание горючего газа. В русской химической литературе конца XVIII и начала XIX в. встречаются два рода названий водорода: флогистические (горючий газ, горючий воздух, воспламенительный воздух, загораемый воздух) и антифлогистические (водотвор, водотворное существо, водотворный гас, водородный гас, водород). Обе группы слов представляют собой переводы французских названий водорода.
Изотопы водорода были открыты в 30-x годах текущего столетия и быстро приобрели большое значение в науке и технике. В конце 1931 г. Юри, Брекуэдд и Мэрфи исследовали остаток после длительного выпаривания жидкого водорода и обнаружили в нем тяжелый водород с атомным весом 2. Этот изотоп назвали дейтерием (Deuterium, D) от греч.— другой, второй. Спустя четыре года в воде, подвергнутой длительному электролизу, был обнаружен еще более тяжелый изотоп водорода 3Н, который назвали тритием (Tritium, Т), от греч.— третий.
Свойства водорода — урок. Химия, 8–9 класс.
Физические свойства
Водород имеет молекулярное строение. Его молекула h3 состоит из двух атомов, соединённых ковалентной неполярной связью.
При комнатной температуре водород представляет собой бесцветный газ без запаха и вкуса. Это самое лёгкое вещество на Земле. Его плотность равна примерно \(0,9\) г/дм³. Водород в \(14,5\) раз легче воздуха.
В воде водород растворяется плохо (примерно \(2\) объёма на \(100\) объёмов воды), но может поглощаться некоторыми металлами. Например, \(1\) объём палладия может растворить до \(900\) объёмов водорода.
Температура кипения водорода низкая. Она равна \(–253\) °С. Ниже температура кипения только у гелия.
Молекулы водорода благодаря своей малой массе и размерам могут проникать сквозь стенки сосуда, в котором он содержится. Заполненный водородом шарик через некоторое время сдувается. При температуре \(300\)–\(600\) °С водород способен диффундировать сквозь стенки стеклянного или металлического сосуда.
Химические свойства
При комнатной температуре химическая активность водорода низкая. Она значительно повышается при нагревании.
1. Взаимодействие с простыми веществами-неметаллами (кроме фосфора, кремния, инертных газов).
- Водород реагирует с кислородом. При этом образуется вода:
2h3+O2=t2h3O.
Смесь водорода с кислородом или с воздухом взрывоопасна.
- При освещении или нагревании идёт реакция с хлором, и образуется хлороводород:
h3+Cl2=hν2HCl.
Подобным образом водород реагирует и с другими галогенами: фтором, бромом, иодом.
- Если водород пропускать над нагретой серой, то образуется сероводород:
h3+S=th3S.
- В присутствии катализатора при повышенном давлении водород реагирует с азотом с образованием аммиака:
N2+3h3=t,p,k2Nh4.
Обрати внимание!
В реакциях с неметаллами водород является восстановителем.
2. Взаимодействие с простыми веществами-металлами.
При нагревании водород реагирует со щелочными и щелочноземельными металлами с образованием гидридов:
2Na+h3=t2NaH,
Ca+h3=tCah3.
Обрати внимание!
В реакциях с металлами водород является окислителем.
3. Взаимодействие со сложными веществами.
- Водород способен реагировать с оксидами металлов (кроме оксидов щелочных и щелочноземельных металлов, бериллия, магния, алюминия):
WO3+3h3=tW+3h3O,
CuO+h3=tCu+h3O.
- Водород реагирует с угарным газом с образованием метилового спирта:
CO+2h3→Ch4OH.
- Водород вступает в реакции со многими органическими веществами.
Физические и химические свойства водорода, получение и применение
Билет № 14
1. Водород: положение этого химического элемента в периодической системе, строение его атома и молекулы. Физические и химические свойства водорода, получение и применение
Водород находится в 1-м периоде, I группе, главной (А) подгруппе. Химический знак водорода обычно проставляют и в VII группе.
Это связано с тем, что ядро атома водорода представляет из себя протон (элементарную частицу), заряд его равен +1. Электронная оболочка имеет один уровень, на котором расположен один электрон. Водород, как и металлы I группы, легко окисляется. Валентность водорода равна I.
В то же время водороду недостает только одного электрона, чтобы заполнить внешний электронный уровень (т. к. на I уровне может разместиться только 2 электрона). В этом он сходен с галогенами. Водород-простое вещество, как и галогены, является неметаллом. Поэтому химический знак водорода помещают также в VII группу.
Молекула водорода состоит из двух атомов, связанных ковалентной неполярной связью.
Водород — газ, без цвета и запаха, легче воздуха. Растворимость в воде очень мала.
Химические свойства:
- Водород горит, образуется вода; смесь водорода с воздухом сгорает со взрывом:
2H2 + O2 = 2H2O - Водород продолжает гореть в атмосфере хлора (т. е. реагирует с хлором при нагревании), образуется хлороводород:
H2 + Cl2 = 2HCl
Сходным образом протекают реакции со многими неметаллами. - Водород восстанавливает металлы из их оксидов:
H2 + CuO = Cu + H2O
В этих трех реакциях водород является восстановителем.
Водород может выступать в роли окислителя при нагревании со щелочными металлами:
2Na + H2 = 2NaH (образуется гидрид натрия)
В лаборатории водород получают взаимодействием цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2↑
Водород собирают в сосуд, перевернутый кверху дном.
Чтобы проверить его на чистоту, пробирку с водородом подносят к пламени спиртовки. Чистый водород сгорает со звонким хлопком. Если водород смешан с воздухом, сгорает со взрывом.
Водород можно получить взаимодействием натрия, кальция с водой:
2Na + 2HOH = 2NaOH + H2↑
При отсутствии этих реактивов практикуется получение водорода взаимодействием алюминиевой стружки и воды (с добавлением щелочи, чтобы разрушить оксидную пленку).
В промышленности водород получают при разложении природного газа.
Перспективным считается получение водорода при разложении воды электрическим током, но этот метод дорого обходится из-за больших затрат электроэнергии.
Применение водорода:
- Синтез аммиака NH3 (производство азотной кислоты и азотных удобрений), соляной кислоты
- Получение металлов высокой чистоты (например, порошка железа для школьной химической лаборатории)
- Газовая резка и сварка металлов
Водород считается перспективным экологически чистым топливом для автомобильного и воздушного транспорта. Запасы нефти и газа на Земле исчерпаемы, а водород можно получать из воды.
2. Задача. Вычисление количества вещества газа, необходимого для реакции с определенным количеством вещества другого газа.
Пример:
Какое количество вещества водорода прореагирует с 4 моль кислорода?
Решение:
- Записываем уравнение реакции.
- Записываем над уравнением реакции имеющиеся данные, а под уравнением — число моль согласно уравнению (равно коэффициенту перед веществом):
x моль 4 моль
2H2 + O2 = 2H2O
2 моль 1 моль - Составляем пропорцию:
x моль — 4 моль
2 моль — 1 моль - Находим x:
x = 4 моль • 2 моль / 1 моль = 8 моль
Ответ: 8 моль.
автор: Владимир Соколов
Урок 13. водород: нахождение в природе, получение,его физические и химические свойства, применение — Химия — 8 класс
Конспект
Водород нахождение в природе, физические и химические свойства, получение и применение
Самым распространённым химическим элементом во Вселенной является водород. Солнце, звёзды, межзвёздное пространство – везде можно обнаружить водород.
Водород – самый лёгкий химический элемент, это первый элемент периодической системы Менделеева. Если два атома водорода соединятся друг с другом, получится простое вещество водород.
Encore il faut parler du cyclisme. Ce sport devient populaire parmi les gens ordinaires. En Europe les vélos sont en train de remplacer les autos. Le cyclisme, c’est utile et pratique. La France est connue par son Tour de France, la plus grande course de cyclisme qui se passe chaque été sur le territoire français.
Ещё в XVI-XVII веках многие учёные наблюдали выделение бесцветного газа при действии кислот на металлы. «При растворении какого-либо неблагородного металла, особенно железа, в кислотных спиртах из отверстия пробирки вырывается горючий пар», – писал Генри Кавендиш, который первый описал водород как индивидуальное вещество со своеобразными свойствами.
Первооткрыватели водорода получали водород действием разбавленных кислот на металлы. Именно этот способ используют и сейчас для получения водорода в лаборатории: Zn + 2HCl (соляная кислота) = ZnCl2 (хлорид цинка) + h3↑ (водород)
В промышленности водород получают из метана – основного компонента природного газа или конверсией угля: C + h3O → (1000°C) CO + h3
Получение водорода сопряжено с трудностями, которые связаны как с физическими, так и с химическими свойствами водорода. Если водорода надо много, то используют специальный аппарат – Аппарат Киппа. Водород можно собрать методом вытеснения воды, а как же можно понять, что сосуд заполнен водородом? Помогут химические свойства, водород – горючий газ. Можно его поджечь, но вначале водород ОБЯЗАТЕЛЬНО нужно проверить на чистоту. Чистый водород вспыхивает с характерным хлопком, а если он будет смешан с воздухом, то произойдёт взрыв. Так случилось во время полёта дирижабля «Гиндебург» в 1937 году, который за 34 секунды сгорел дотла из-за утечки водорода.
Водород является восстановителем металлов. Кислород металлы окисляет, превращает их в оксиды. А водород превращает оксиды снова в металлы.
Так в промышленности получают некоторые металлы, например, молибден: водород отнимает кислород и превращается в воду, а металл освобождается и становится простым веществом. MoO3 + 3h3 = Mo + 3h3O
Так получают кадмий, вольфрам, германий, галлий.
Водород является сырьём для получения большого количества веществ, в том числе аммиака, маргарина, до сих пор в небо поднимаются зонды, заполненные водородом, которые помогают прогнозировать изменения погоды, водород уже сейчас используется в ракетном топливе.
Место водорода в периодической системе Распространение в природе Физические свойства Изотопы водорода Получение водорода Химические свойства Гидриды
Пояснительная записка
Пояснительная записка Рабочая тетрадь рекомендована для студентов очной формы обучения, реализующих образовательную программу среднего (полного) общего образования технического профиля. Данная рабочая
ПодробнееПОЛОЖЕНИЕ ВОДОРОДА В ПС
ВОДОРОД 1 H 1 группа: ПОЛОЖЕНИЕ ВОДОРОДА В ПС Почему и в 1-ой, и в 17-ой группах ПС? Н: 1s 1 один валентный электрон, образует частицу H +,? ~10K, ~1,5 млн. атм металлический водород Н Н 17 группа: простое
ПодробнееВодород общие сведения
ВОДОРОД Лекция 12 Водород в ПС Водород общие сведения Простейший атом: 1 протон, 1 электрон 1s 1 Двойственное положение в ПС 1 группа Имеет 1 валентный электрон аналогия с щелочными металлами 17 группа
ПодробнееВодород общие сведения
ВОДОРОД Лекция 13 Водород в ПС Водород общие сведения Простейший атом: 1 протон, 1 электрон 1s 1 Двойственное положение в ПС 1 группа Имеет 1 валентный электрон аналогия с щелочными металлами 17 группа
ПодробнееГИДРОЛИЗ. Общие представления
ГИДРОЛИЗ Общие представления Гидролиз обменная реакция взаимодействия веществ с водой, приводящая к их разложению. Гидролизу могут подвергаться неорганические и органические вещества различных классов.
Подробнее18. Ионные реакции в растворах
18. Ионные реакции в растворах Электролитическая диссоциация. Электролитическая диссоциация это распад молекул в растворе с образованием положительно и отрицательно заряженных ионов. Полнота распада зависит
ПодробнееÓÄÊ :54 ÁÁÊ 24ÿ7 Ì 55
ÓÄÊ 373.167.1:54 ÁÁÊ 24ÿ7 Ì 55 Ì 55 Ìåøêîâà Î. Â. ÅÃÝ. Õèìèÿ : óíèâåðñàëüíûé ñïðàâî íèê / Î.Â. Ìåøêîâà. Ì. : ßóçà-ïðåññ, 2013. 352 ñ. (ÅÃÝ. Óíèâåðñàëüíûé ñïðàâî íèê). ISBN 978-5-99550-658-4 Ñïðàâî íèê
ПодробнееВарианты контрольных работ по «Химии»
Варианты контрольных работ по «Химии» Задание к контрольной работе составлено в 4 вариантах. Студент должен выполнить работу по варианту, номер которого соответствует начальной букве фамилии. Вариант 1
Подробнее1) IV 2) V 3) VI 4) VII
2 1. В ряду: Na Mg Al Si 1) увеличивается число энергетических уровней в атомах 2) усиливаются металлические свойства элементов 3) уменьшается высшая степень окисления элементов 4) ослабевают металлические
ПодробнееВажнейшие окислители и восстановители
Важнейшие окислители и восстановители Весьма важным является определение самой возможности протекания ОВР, а также установление продуктов реакции. В связи с этим следует отметить, что направление протекания
ПодробнееДмитрий Иванович Менделеев 27 января (8 февраля) 1834, Тобольск. родился
ХИМИЯ ЭЛЕМЕНТОВ Дмитрий Иванович Менделеев 27 января (8 февраля) 1834, Тобольск. родился Химик, физикохимик, физик, метролог, экономист, технолог, геолог, метеоролог, педагог, воздухоплаватель, приборостроитель,
ПодробнееID_589 1/6 neznaika.pro
Вариант 1 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Четыре электрона находятся во внешнем электронном слое атомов каждого из химических
ПодробнееКонтрольные работы по химии 8 класс
Итоговая контрольная работа по химии 8 класс Вариант подготовила Субханова Г. Р. Вариант 1 В задания 1-12 выберите только один правильный ответ. 1. Только простые вещества содержатся в наборе: 1) C, O
Подробнее5. Классификация неорганических веществ
5. Классификация неорганических веществ Оксиды сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. Оксиды получаются обычно при взаимодействии простых
ПодробнееВодородное топливо — Что такое Водородное топливо?
Lh3 является самым экологически чистым видом моторного топлива, поэтому его перспективы очевидны
Водородное топливоВ Австралии на бурых углях в штате Виктория отрабатывается технология технология газификации угля с последующим выделением водорода, вернее удаления серы, ртути и двуокиси углерода (СО2).
В Норвегии — Nel Hydrogen отрабатывает технологию использования ВИЭ для высокотемпературного электролиза для разделения воды на водород и кислород, который будет выбрасываться в атмосферу.
Kawasaki Heavy Industries разрабатывает морской танкер — водородовоз для транспортировки жидкого водорода ( LH2).
Водород
Водород (H) является самым распространенным элементом на Земле, но в обычных условиях он не встречается ни в виде водорода H, ни в виде газообразного водорода (H2).
Благодаря своим характеристикам он легко вступает в реакцию с другими органическими соединениями с образованием, например, воды (H2O).
Во время этой реакции образования воды из водорода и воздуха выделяется энергия, которую можно использовать в качестве электричества.
Чтобы сделать эту реакцию полезной для промышленного производства электроэнергии, необходимо произвести водород, например из воды путем разделения атомов на кислород и водород посредством электролиза.
Есть другие технологии:
- использование газов, оставшихся от химических процессов, например метана, угля, нефти и биомассы.
Экологичность — важный критерий производства водорода.
Чем больше оксидов углерода выделяется при производстве водорода, тем менее экологичным он будет считаться.
Для простоты каждый «сорт» произведенного по разным технологиям принято обозначать цветом, хотя правильнее — по углеродному следу.
Реакция взаимодействия водорода с кислородом происходит с выделением тепла.
Если взять 1 моль H2 (2 г) и 0,5 моль O2 (16 г) при стандартных условиях и возбудить реакцию, то согласно уравнению
Н2 + 0,5 О2= Н2О
после завершения реакции образуется 1 моль H2O (18 г) с выделением энергии 285,8 кДж/моль.
Для сравнения: теплота сгорания ацетилена — 1300 кДж/моль, пропана — 2200 кДж/моль.
1 м³ водорода весит 89,8 г (44,9 моль), поэтому для получения 1 м³ водорода будет затрачено 12832,4 кДж энергии.
1 кВт*ч = 3600 кДж, поэтому получим 3,56 кВт*ч электроэнергии.
Целесообразность перехода на водородное топливо можно оценить, сравнив имеющийся тариф на 1 кВт*ч электричества и, к примеру, стоимость 1 м³ газа или стоимость другого энергоносителя.
При сжигании водорода получается чистая вода.
То есть водородное топливо производится без вреда для окружающей среды, в отличие от газа или бензина.
Для получения водорода используют химические методы, в тч реакции разложения воды электрическим током.
Основной промышленный способ получения водорода — реакция с водой метана, который входит в состав природного газа.
Она проводится при высокой температуре:
СН4 + 2Н20 = CO2 + 4Н2 — 165 кДж
- 1.Электролиз водных растворов солей:
- 2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C:
- 3.Из природного газа.
- 4. Крекинг и реформинг углеводородов в процессе переработки нефти.
- 5. Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и соляную кислоту:
- 6.Взаимодействие кальция с водой:
- 7.Гидролиз гидридов:
- 8.Действие щелочей на цинк или алюминий:
- 9 .С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
- Биореактор для производства водорода
В молекуле ортоводорода (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны).
Разделить аллотропные формы водорода можно адсорбцией на активном угле при температуре жидкого азота.
При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону параводорода.
При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25).
Без катализатора превращение происходит медленно, что дает возможность изучить свойства отдельных аллотропных форм.
Молекула водорода двухатомна — Н₂. При обычных условиях — это газ без цвета, запаха и вкуса.
Водород — самый легкий газ, его плотность во много раз меньше плотности воздуха. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре.
Как самые легкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому.
Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в 7 раз выше теплопроводности воздуха.Химические свойства
Молекулы водорода Н₂ довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Н2=2Н — 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
Ca + Н2 = СаН2 и с единственным неметаллом — фтором, образуя фтороводород:
F2+H2=2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении.
Он может «отнимать» кислород от некоторых оксидов, например:
CuO + Н2 = Cu + Н20
Записанное уравнение отражает реакцию восстановления — процесс, в результате которого от соединения отнимается кислород; вещества, отнимающие кислород, называются восстановителями (при этом они сами окисляются).
Реакция восстановления противоположна реакции окисления.
Обе эти реакции всегда протекают одновременно как 1 процесс: при окислении (восстановлении) одного вещества обязательно одновременно происходит восстановление (окисление) другого.
N2 + 3H2 → 2 NH3С галогенами образует галогеноводороды:
F2 + H2 → 2 HF, реакция протекает со взрывом в темноте и при любой температуре, Cl2 + H2 → 2 HCl, реакция протекает со взрывом, только на свету.С сажей взаимодействует при сильном нагревании:
C + 2H2 → CH4Оксиды восстанавливаются до металлов:
CuO + H2 → Cu + H2O Fe2O3 + 3H2 → 2 Fe + 3H2O WO3 + 3H2 → W + 3H2OГеохимия водорода
Водород — самый распространенный элемент, и все элементы образуются из него в результате термоядерных и ядерных реакций.
На Земле содержание водорода понижено по сравнению с Солнцем.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением.
Он мигрирует в верхние слои атмосферы и улетучивается в космос.
- для атомно-водородной сварки,
- в пищевой промышленности, как пищевая добавка E949- упаковочный газ, для производства маргарина из жидких растительных масел,
- химической промышленности — при производстве аммиака, мыла и пластмасс,
- в качестве ракетного топлива,
Энергетика
Водороду уделяется такое пристальное внимание не зря.Подобно батареям, водород в основном используется как форма хранения энергии.
Они оба зависят от первичной энергии, такой как солнечная и ветровая, для зарядки или генерации, и при необходимости могут быть преобразованы в электричество.
Тем не менее, водород превосходит батареи по многим параметрам:
- более чистый производственный процесс,
- нулевое загрязнение после утилизации; более высокая плотность энергии.
При преобразовании водорода в электричество производится только вода и тепло.
Водород также имеет гораздо более высокую плотность энергии (33 кВт*ч / кг), чем батареи (около 1 кВт*ч / кг), и чем бензин и дизельное топливо (около 12 кВт*ч / кг), что делает его особенно выгодным для транспорта и в качестве мобильного энергоносителя
Пожароопасность и взрывоопасность
Водород при смеси с воздухом образует взрывоопасную смесь — гремучий газ.
Наибольшую взрывоопасность — при объемном отношении водорода и кислорода 2:1, или водорода и воздуха приближенно 2:5, так как в воздухе кислорода содержится примерно 21%.
Водород пожароопасен.
Свойства водорода | Введение в химию
Цель обучения
- Укажите различные виды реакций, в которых может участвовать водород, и обсудите его основные свойства
Ключевые моменты
- Водород — самый легкий элемент, который взрывается при концентрациях от 4 до 75 процентов по объему в присутствии солнечного света, пламени или искры.
- Несмотря на свою стабильность, водород образует множество связей и присутствует во многих различных соединениях.
- Существуют три встречающихся в природе изотопа водорода: протий, дейтерий и тритий, каждый из которых имеет разные свойства из-за разницы в количестве нейтронов в ядре.
Срок
- двухатомный, состоящий из двух атомов
Физические свойства водорода
Водород — самый маленький химический элемент, потому что он состоит только из одного протона в своем ядре. Его символ — H, а его атомный номер — 1.Его средний атомный вес 1,0079 а.е.м., что делает его самым легким элементом. Водород — самое распространенное химическое вещество во Вселенной, особенно в звездах и газовых планетах-гигантах. Однако одноатомный водород редко встречается на Земле из-за его склонности к образованию ковалентных связей с большинством элементов. При стандартной температуре и давлении водород является нетоксичным, неметаллическим, без запаха, вкуса, бесцветным и легковоспламеняющимся двухатомным газом с молекулярной формулой H 2 . Водород также широко распространен на Земле в форме химических соединений, таких как углеводороды и вода.
Водород имеет один протон и один электрон; самый распространенный изотоп протий ( 1 H) не имеет нейтронов. Водород имеет температуру плавления -259,14 ° C и точку кипения -252,87 ° C. Водород имеет плотность 0,08988 г / л, что делает его менее плотным, чем воздух. Он имеет две различные степени окисления (+1, -1), что позволяет ему действовать как окислитель, так и как восстанавливающий агент. Его ковалентный радиус 31,5 пм.
Водород существует в виде двух разных спиновых изомеров двухатомных молекул водорода, которые различаются относительным спином их ядер.Ортоводородная форма имеет параллельные спины; параводородная форма имеет антипараллельные спины. При стандартной температуре и давлении водородный газ состоит на 75 процентов из ортоводорода и на 25 процентов из параводорода. Водород доступен в различных формах, таких как сжатый газообразный водород, жидкий водород и жидкий водород (состоящий из жидкого и твердого), а также в твердой и металлической формах.
Атом водорода Многие химические свойства атома водорода возникают из-за его небольшого размера, таких как его склонность к образованию ковалентных связей, воспламеняемость и спонтанная реакция с окисляющими элементами.Химические свойства водорода
Газообразный водород (H 2 ) легко воспламеняется и может гореть в воздухе в очень широком диапазоне концентраций от 4 до 75 процентов по объему. Энтальпия сгорания водорода составляет -286 кДж / моль и описывается уравнением:
[латекс] 2 H_2 (г) + O_2 (г) \ rightarrow 2 H_2O (l) + 572 кДж (286 кДж / моль H_2) [/ латекс]
Водородный газ также может взорваться в смеси хлора (от 5 до 95 процентов). Эти смеси могут взорваться от искры, тепла или даже солнечного света.Температура самовоспламенения водорода (температура, при которой произойдет самовозгорание) составляет 500 ° C. Чистое водородно-кислородное пламя излучает ультрафиолетовый свет и невидимо невооруженным глазом. Таким образом, обнаружение утечки горящего водорода опасно и требует наличия детектора пламени. Поскольку водород плавучий в воздухе, водородное пламя быстро поднимается и причиняет меньший ущерб, чем углеводородное пламя. H 2 реагирует с окисляющими элементами, которые, в свою очередь, самопроизвольно и бурно реагируют с хлором и фтором с образованием соответствующих галогенидов водорода.
H 2 действительно образует соединения с большинством элементов, несмотря на свою стабильность. Участвуя в реакциях, водород может иметь частичный положительный заряд при взаимодействии с большим количеством электроотрицательных элементов, таких как галогены или кислород, но он может иметь частичный отрицательный заряд при взаимодействии с большим количеством электроположительных элементов, таких как щелочные металлы. Когда водородная связь с фтором, кислородом или азотом, она может участвовать в форме нековалентной (межмолекулярной) связи средней силы, называемой водородной связью, которая имеет решающее значение для стабильности многих биологических молекул.Соединения, которые имеют водородную связь с металлами и металлоидами, известны как гидриды .
Окисление водорода удаляет его электрон и дает ион H + . Часто H + в водных растворах называют ионом гидроксония (H 3 O + ). Этот вид играет важную роль в химии кислотно-щелочного соединения.
Изотопы водорода
Водород существует в природе в виде трех изотопов, обозначенных 1 H, 2 H и 3 H. 1 H встречается с распространением 99,98% и имеет официальное название протий. 2 H известен как дейтерий и содержит один электрон, один протон и один нейтрон (массовое число = 2). Дейтерий и его соединения используются в качестве нерадиоактивных меток в химических экспериментах и в растворителях для спектроскопии 1 H-ЯМР. 3 H известен как тритий и содержит один протон, два нейтрона и один электрон (массовое число = 3). Он радиоактивен и распадается на гелий-3 посредством бета-распада с периодом полураспада 12.32 года.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Первый элемент периодической таблицы. В нормальных условиях это бесцветный, без запаха и безвкусный газ, образованный двухатомными молекулами, H 2 . Атом водорода, обозначенный символом H, образован ядром с одной единицей положительного заряда и одним электроном.Его атомный номер 1, а атомный вес 1,00797 г / моль. Это одно из основных соединений воды и всего органического вещества, широко распространенное не только на Земле, но и во всей Вселенной. Существует три изотопа водорода: протий с массой 1, который содержится более чем в 99,985% природного элемента; дейтерий массой 2 содержится в природе примерно в количестве 0,015%, а тритий массой 3 встречается в природе в небольших количествах, но может быть искусственно получен в результате различных ядерных реакций. Использование: Наиболее важным применением водорода является синтез аммиака.Использование водорода быстро расширяется при очистке топлива, например при расщеплении водородом (гидрокрекинг), и при удалении серы. Огромные количества водорода расходуются на каталитическое гидрирование ненасыщенных растительных масел с получением твердого жира. Гидрирование используется в производстве органических химических продуктов. Огромные количества водорода используются в качестве ракетного топлива в сочетании с кислородом или фтором, а также в качестве ракетного двигателя, приводимого в движение ядерной энергией. Свойства: Обычный водород имеет молекулярную массу 2,01594 г. Как газ он имеет плотность 0,071 г / л при 0ºC и 1 атм. Его относительная плотность по сравнению с воздухом равна 0.0695. Водород — самое огнеопасное из всех известных веществ. Водород немного лучше растворяется в органических растворителях, чем в воде. Многие металлы поглощают водород. Поглощение водорода сталью может привести к тому, что сталь станет хрупкой, что приведет к сбоям в химическом технологическом оборудовании. При нормальной температуре водород является не очень реактивным веществом, если он не был каким-либо образом активирован; например, подходящим катализатором. При высоких температурах он очень реактивен. Хотя в основном это двухатомный водород, молекулярный водород диссоциирует на свободные атомы при высоких температурах.Атомарный водород — мощный восстановитель даже при температуре окружающей среды. Он реагирует с оксидами и хлоридами многих металлов, таких как серебро, медь, свинец, висмут и ртуть, с образованием свободных металлов. Он восстанавливает некоторые соли до металлического состояния, такие как нитраты, нитриты и цианид натрия и калия. Он реагирует с рядом элементов, металлов и неметаллов, с образованием гидридов, таких как NAH, KH, H 2 S и PH 3 . Атомарный водород производит перекись водорода H 2 O 2 с кислородом. Атомарный водород реагирует с органическими соединениями с образованием сложной смеси продуктов; с этиленом, C 2 H 4 , например, продуктами являются этан, C 2 H 6 , и бутан, C 4 H 10 . Тепло, выделяющееся при рекомбинации атомов водорода с образованием молекул водорода, используется для получения высоких температур при сварке с атомарным водородом. Водород реагирует с кислородом с образованием воды, и эта реакция чрезвычайно медленная при температуре окружающей среды; но если он ускоряется катализатором, например платиной, или электрической искрой, он создается с взрывной силой. Воздействие водорода: Пожар: Чрезвычайно легко воспламеняется. Многие реакции могут вызвать пожар или взрыв. Взрыв: Смеси газа и воздуха взрывоопасны. Пути воздействия: Вещество может всасываться в организм при вдыхании. Вдыхание: высокие концентрации этого газа могут вызвать дефицит кислорода в окружающей среде. Люди, дышащие такой атмосферой, могут испытывать такие симптомы, как головные боли, звон в ушах, головокружение, сонливость, потеря сознания, тошнота, рвота и угнетение всех органов чувств.Кожа пострадавшего может иметь синий цвет. При некоторых обстоятельствах может наступить смерть. Ожидается, что водород не вызывает мутагенности, эмбриотоксичности, тератогенности или репродуктивной токсичности. Существовавшие ранее респираторные заболевания могут усугубляться чрезмерным воздействием водорода. Риск при вдыхании: При потере герметичности опасная концентрация этого газа в воздухе будет достигнута очень быстро. Физическая опасность: Газ хорошо смешивается с воздухом, легко образуются взрывоопасные смеси.Газ легче воздуха. C химическая опасность: Нагревание может вызвать сильное возгорание или взрыв. Реагирует бурно с воздухом, кислородом, галогенами и сильными окислителями с опасностью пожара и взрыва. Металлические катализаторы, такие как платина и никель, значительно усиливают эти реакции. Высокие концентрации в воздухе вызывают дефицит кислорода с риском потери сознания или смерти. Перед входом в зону проверьте содержание кислорода. Предупреждение об отсутствии запаха при наличии токсичных концентраций.Измерьте концентрацию водорода с помощью подходящего газового детектора (обычный детектор легковоспламеняющихся газов не подходит для этой цели). Первая помощь: Пожар: Перекройте подачу; если это невозможно и нет риска для окружающей среды, дайте огню погаснуть; в остальных случаях тушить распылителем воды, порошком, углекислым газом. Взрыв: В случае пожара: охладить баллон, обрызгав водой. Боевой огонь из укрытых позиций. Вдыхание: свежий воздух, покой. Может потребоваться искусственное дыхание.Обратитесь за медицинской помощью. Кожа: Обратитесь за медицинской помощью. Водород в окружающей среде: Водород составляет 0,15% земной коры, он является основным компонентом воды. 0,5 ppm водорода H 2 и различные пропорции водяного пара присутствуют в атмосфере. Водород также является основным компонентом биомассы, составляя 14% по весу. Экологическая устойчивость: водород встречается в атмосфере естественным образом. Газ будет быстро рассеиваться в хорошо вентилируемых помещениях. Воздействие на растения или животных: Любое воздействие на животных может быть связано с недостатком кислорода в окружающей среде. Не ожидается никакого вредного воздействия на жизнь растений, за исключением заморозков, возникающих в присутствии быстро расширяющихся газов. Воздействие на водную флору и фауну: В настоящее время нет данных о влиянии водорода на водную жизнь. | |
Водород — Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: водород
(Promo)
Вы слушаете Химию в ее стихии, представленную вам журналом Chemistry World , журналом Королевского химического общества.
(Конец промо)
Мира Сентилингам
На этой неделе мы узнаем, что значит быть на вершине и номер один, когда мы встречаемся с Королем стихий. Вот Брайан Клегг.
Брайан Клегг
Забудьте, 10 Даунинг-стрит или 1600 Пенсильвания-авеню, самый престижный адрес во вселенной — номер один в периодической таблице, водород. В науке простоту и красоту часто приравнивают — и это делает водород таким же красивым, каким он есть, а единственный протон и одинокий электрон составляют самый компактный элемент из всех существующих.
Водород существует с тех пор, как атомы впервые образовались в результате Большого взрыва, и на сегодняшний день это самый распространенный элемент. Несмотря на миллиарды лет бесчисленных звезд, превращающих водород в гелий, он все еще составляет 75 процентов обнаруживаемого содержимого Вселенной.
Этот легкий, бесцветный, легковоспламеняющийся газ сохраняет свою уникальность тем, что имеет только названные изотопы (и некоторые из наиболее известных к тому же), дейтерий с добавленным нейтроном в ядре и тритий с двумя нейтронами.
Водород необходим для жизни, Вселенной и почти всего. На самом деле жизнь во многом зависит от этого. Без водорода у нас не было бы Солнца, которое давало бы нам тепло и свет. Не было бы никаких полезных органических соединений, которые могли бы формировать строительные блоки жизни. И этой самой важной субстанции для существования жизни, воды, не существовало бы.
Только благодаря особой уловке водорода мы вообще можем использовать воду. Водород образует слабые связи между молекулами, цепляясь за соседние атомы кислорода, азота или фтора.Именно эти водородных связей придают воде многие ее свойства. Если бы их не было, температура кипения воды была бы ниже -70 градусов по Цельсию. Жидкой воды на Земле не было бы.
Водород был невольным открытием Парацельса, швейцарского алхимика шестнадцатого века, также известного как Теофраст Филипп Ауреол Бомбаст фон Гогенхайм. Он обнаружил, что что-то легковоспламеняющееся пузырится из металлов, которые попадают в сильные кислоты, не зная о химической реакции, которая приводит к образованию солей металлов и высвобождению водорода, что ряд других ученых, включая Роберта Бойля, независимо друг от друга обнаружили за эти годы.
Однако первым, кто осознал, что водород — это уникальное вещество, которое он назвал «воспламеняющийся воздух», был Генри Кавендиш, благородный предок Уильяма Кавендиша, который позже дал свое имя той, которая впоследствии стала самой известной в мире физической лабораторией в Кембридже. . Между 1760-ми и 1780-ми годами Генри не только выделил водород, но и обнаружил, что при его сгорании он соединяется с кислородом (или, как его называли, «дефлогистированным воздухом»), образуя воду. Эти неуклюжие термины были отброшены французским химиком Антуаном Лавуазье, который навсегда изменил химическое название, назвав горючий воздух «водородом», геном или создателем гидроэнергии, водой.
Поскольку водород очень легкий, чистый элемент обычно не встречается на Земле. Он просто уплыл бы. Основные компоненты воздуха, азот и кислород, в четырнадцать и шестнадцать раз тяжелее, что придает водороду огромную плавучесть. Эта легкость водорода сделала его естественным для одного из первых практических применений — наполнения воздушных шаров. Ни один воздушный шар не взлетает так же хорошо, как водородный шар.
Первое такое воздушное судно было изобретено французским ученым Жаком Шарлем в 1783 году, вдохновившись успехом братьев Монгольфье за пару месяцев до того, как использовать водород в воздушном шаре из шелка, пропитанного резиной.У водорода, казалось, было гарантированное будущее в летательных аппаратах, подкрепленное изобретением дирижаблей, построенных на жестком каркасе, которые в Великобритании называются дирижаблями, но более известны под своим немецким прозвищем Цеппелины, в честь их восторженного промоутера Графа Фердинанда фон Цеппелина.
Эти дирижабли вскоре стали небесными лайнерами, безопасно и плавно доставляя пассажиров через Атлантику. Но, несмотря на предельную легкость водорода, у него есть еще одно свойство, убивающее дирижабли, — водород легко воспламеняется.Разрушение огромного дирижабля «Гинденбург», вероятно, в результате пожара, вызванного статическим электричеством, было замечено потрясенными зрителями по всему миру. Водородный дирижабль был обречен.
Тем не менее, водород остается игроком в области транспорта из-за высокой эффективности его сгорания. Многие из ракет НАСА, включая вторую и третью ступени Сатурн V программы Аполлона и главные двигатели космического корабля, работают за счет сжигания жидкого водорода с чистым кислородом.
Еще совсем недавно водород был предложен в качестве замены ископаемого топлива в автомобилях.Здесь у него есть большое преимущество перед горением бензина, так как он дает только воду. Выбросы парниковых газов отсутствуют. Наиболее вероятный способ использовать водород — не сжигать его взрывом, а использовать в топливном элементе, где электрохимическая реакция используется для выработки электричества для питания транспортного средства.
Однако не все уверены, что будущее за водородными автомобилями. Нам понадобится сеть водородных заправок, а он остается опасным взрывоопасным веществом. В то же время он менее эффективен, чем бензин, потому что литр бензина содержит примерно в три раза на больше полезной энергии, чем литр жидкого водорода (если вы используете сжатый газообразный водород, который может быть в десять раз больше) .Другая проблема — получение водорода. Он поступает либо из углеводородов, потенциально оставляющих остатки парниковых газов, либо из-за электролиза воды с использованием электричества, которое не может быть произведено чисто.
Но даже если мы не получим автомобили, работающие на водороде, у водорода все еще есть будущее в виде более впечатляющего источника энергии — ядерного синтеза, источника энергии солнца. Термоядерные электростанции далеки от практического применения, но дают надежду на получение чистой энергии в изобилии.
Как бы мы ни использовали водород, мы не можем отнять его первенство. Это numero uno, высший, король стихий.
Meera Senthilingam
Таким образом, это самый распространенный элемент, он необходим для жизни на Земле, питает космические ракеты и может помочь нам избавиться от ископаемых видов топлива. Вы можете понять, почему Брайан Клегг считает водород номером один. На следующей неделе мы встречаемся с хронометристом таблицы Менделеева.
Tom Bond
Одно из современных применений — атомные часы, хотя рубидий считается менее точным, чем цезий.Рубидиевая версия атомных часов использует переход между двумя состояниями сверхтонкой энергии изотопа рубидий-87. Эти часы используют микроволновое излучение, которое настраивается до тех пор, пока оно не соответствует сверхтонкому переходу, и в этот момент интервал между гребнями волн излучения может использоваться для калибровки самого времени.
Meera Senthilingam
А чтобы узнать больше о ролях рубидия, присоединяйтесь к Тому Бонду на следующей неделе в программе Chemistry in its Element. А пока я Мира Сентилингам, спасибо за внимание и до свидания.
(Промо)
(Окончание промо)
Свойства водорода — Каковы физические свойства водорода?
Свойства водорода — Каковы химические свойства водорода?
Факты и информация о свойствах водорода | |
| |||
ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА | |||
| При комнатной температуре водород представляет собой газ. Это бесцветный газ без вкуса и запаха. Это самый легкий газ. Это не растворим в воде. Это легко воспламеняется и горит синим пламенем, образуя воду. сжижение температура водорода -252 o C. Bond энергия H-H составляет 431 кДж / моль. Электро отрицательность водорода 2,1. Ионизация потенциал газообразного водорода составляет 13,54 электрон-вольт. | |||
| Для последняя информация, бесплатные компьютерные курсы и важные заметки посетите: www.citycollegiate.com | |||
ИСПОЛЬЗУЕТ ВОДОРОДА | |||
| Он используется как топливо. Это используется для производства удобрений. Это используется при приготовлении растительного топленого масла. Это используется как ракетное топливо. Это используется при получении аммиака (Nh4) и метанола (Ch4OH). Это используется при приготовлении кислородно-водородного пламени, которое используется при сварке из-за продукции высокой температуры. Это используется для наполнения метеозондов. Это используется для изготовления вольфрамовой нити. Это используется для приготовления низкой температуры в жидком состоянии. | |||
| Для последняя информация, бесплатные компьютерные курсы и важные заметки посетите: www.citycollegiate.com | |||
Вопрос: Напишите химическую формулу: | |||
| Пищевая сода: NaHCO3 (бикарбонат натрия) Стирка сода: Na2CO3.10х3О (карбонат натрия водный) Каустик сода: NaOH (гидроксид натрия) Гашеная известь: Ca (OH) 2 Quick известь: CaO Лайм камень: CaCO3 Доломит: CaCO3.MgCO3 Гипс: CaSO4.2h3O Эпсомит (EPSOM SALT): MgSO4 Магнезит: MgCO3 Гипс Парижа: CaSO4.1 / 2h3O | |||
| | ФОТОШОП | FLASH | SWISH | ЛЕН | ИНТЕРНЕТ | ФИЗИКА | ХИМИЯ | ГЛАВНАЯ | | |||
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Особые свойства водорода | Sciencing
Водород — это элемент, образующий двухатомную молекулу.Двухатомные молекулы состоят из двух атомов одного и того же элемента и обычно существуют, потому что элемент настолько реактивен, что ему необходимо связываться с другим атомом. Реакционная способность водорода способствует многим его уникальным свойствам.
Физические свойства водорода
Физические свойства водорода — это то, что можно наблюдать или измерять, например, его плотность 0,0000899 г / см. Температура плавления водорода составляет -259,2 ° C, а температура кипения -252,8 ° C. Водород — это бесцветный газ, который настолько легче воздуха, что он действительно может избежать гравитационного притяжения Земли и улететь в космос.Водород также является первым элементом в периодической таблице и имеет только один протон и один электрон. У водорода нет нейтронов.
Некоторые химические свойства водорода
Водород чрезвычайно горюч при контакте с кислородом. Это неметаллический элемент, но в некоторых ситуациях соединения ведет себя аналогично металлам. Водород уникален тем, что он может действовать как металл в ионном соединении, отдавать электроны неметаллу, с которым он связан, или как неметалл в молекулярном соединении, разделяя электроны с другим атомом.

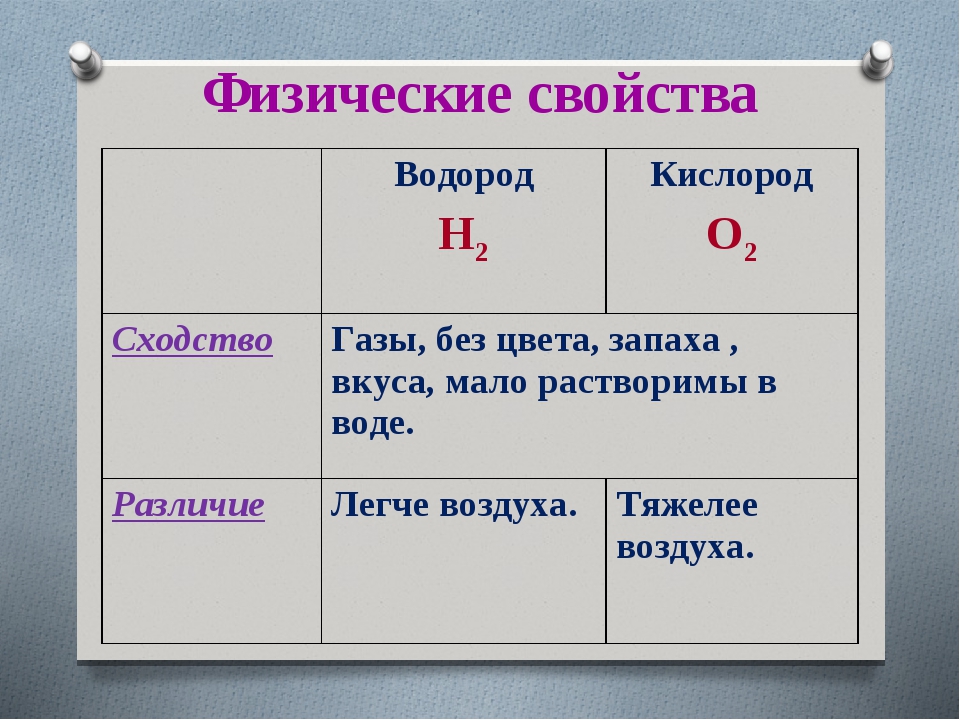 38
38