Урок 15. свойства оксидов неметаллов. свойства серной и азотной кислот. водородные соединения неметаллов — Химия — 11 класс
Химия, 11 класс
Урок № 15. Свойства оксидов неметаллов. Свойства серной и азотной кислот. Водородные соединения неметаллов
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению соединений неметаллов: оксидам неметаллов, кислородсодержащим кислотам и водородным соединениям неметаллов.
Глоссарий
Азотная кислота – HNO3 — представляет собой бесцветную «дымящуюся» на воздухе жидкость. Приобретает на воздухе желтоватый цвет из-за разложения на двуокись азота.
Аммиак – NH3 – бинарное химическое соединение азота с водородом, бесцветный токсичный газ с резким характерным запахом, 10%-ный раствор аммиака используют в медицине, называют нашатырным спиртом.
Высшие оксиды – оксиды, в которых элементы проявляют свою наибольшую валентность
Метан – CH4 — бинарное химическое соединение водорода и углерода. Бесцветный газ без запаха, основной компонент природного газа.
Серная кислота – H2SO4 – сильная двухосновная кислота. При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум). Мировое производство серной кислоты около 200 млн тонн в год. Самый крупный потребитель серной кислоты — производство минеральных удобрений.
Сернистый газ – SO2 – оксид серы IV. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Токсичен. Один из основных компонентов вулканических газов.
Серный газ – SO3 – оксид серы VI.
Сероводород – SH2 – бинарное химическое соединение водорода и серы. Бесцветный газ со сладковатым вкусом, обеспечивающий запах протухших куриных яиц.
Силан – SiH4 — бинарное химическое соединение водорода и кремния. Бесцветный газ с неприятным запахом.
Угарный газ – CO – монооксид углерода, оксид углерода II, бесцветный чрезвычайно токсичный газ без вкуса и запаха. Горюч. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей. Токсическое действие оксида углерода(II) обусловлено образованием карбоксигемоглобина — значительно более прочного карбонильного комплекса с гемоглобином, по сравнению с комплексом гемоглобина с кислородом.
Углекислый газ – CO2 – диоксид углерода, оксид углерода IV, бесцветный газ, почти без запаха, но в больших концентрациях приобретает кисловатый запах, знакомый нам по газировке. Является одним из парниковых газов.
Фосфин – PH3 — бинарное химическое соединение водорода и фосфора. Бесцветный ядовитый газ без запаха, однако примеси могут дать ему запах тухлой рыбы.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс].
 М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Соединения неметаллов с кислородом и водородом
Неметаллы (углерод, кислород, азот, сера, галогены) могут образовывать соединения как с кислородом (оксиды), так и с водородом. Водородные соединения являются газами или жидкостями, например, вода, аммиак, сероводород, соляная кислота. Оксиды могут быть газами (углекислый или сернистый газ), жидкостями (оксид хлора(VI) и (VIII)) или твёрдыми телами (оксид фосфора(V)).
Оксиды неметаллов
Типичными примерами оксидов неметаллов являются:
Сернистый газ (SO2), серный газ (SO3), угарный газ (CO), углекислый газ (CO
Оксиды неметаллов подразделяют на две группы – несолеобразующие (SiO, N2O, NO, CO, S2O, H2O) и солеобразующие (остальные).
Несолеобразующих оксидов немного, их обыкновенно образуют одновалентные и двухвалентные неметаллы.
Солеобразующие оксиды неметаллов при взаимодействии с водой дают соответствующую им кислоту. Исключение составляет оксид кремния IV, который нерастворим в воде. Соответствующую ему кремниевую кислоту получают косвенным путём — взаимодействием растворимых силикатов щелочных металлов с кислотами.
Высшие оксиды – это оксиды, в которых неметалл проявляет степень окисления, равную номеру группы.
Кислотные свойства оксидов. В пределах одного периода с увеличением номера группы наблюдается увеличение кислотных свойств высших оксидов и соответствующих им кислот. Например, для неметаллов третьего периода, кремниевая кислота является слабой, а хлорная кислота является одной из самых сильных.
Такая закономерность вытекает из периодического закона Менделеева. В периоде радиус атома неметалла уменьшается с увеличением номера группы, а заряд неметалла при этом увеличивается. Поэтому при движении по периоду слева направо связь между неметаллом и кислородом упрочняется, а связь неметалл-водород ослабевает, что даёт увеличение диссоциации кислоты.
Поэтому при движении по периоду слева направо связь между неметаллом и кислородом упрочняется, а связь неметалл-водород ослабевает, что даёт увеличение диссоциации кислоты.
В пределах одной главной подгруппы происходит ослабление кислотных свойств оксидов и кислот с увеличением номера периода.
Соединения неметаллов с водородом
Кроме соединений с кислородом, неметаллы образуют соединения с водородом. Например, метан (CH4), аммиак (NH3), вода (H2O), плавиковая кислота (HF), соляная кислота (HCl). Эти соединения представляют собой газы или жидкости.
В периодах слева направо кислотные свойства водородных соединений неметаллов в водных растворах усиливаются. Это связано с тем, что в этом направлении у атомов элементов увеличивается заряд ядра и уменьшается радиус.
В группах сверху вниз, по мере увеличения атомного радиуса, отрицательно заряженные анионы неметаллов всё слабее притягивают положительно заряженные ионы водорода. Таким образом, отщепление ионов водорода происходит проще и кислотность увеличивается.
Кислородосодержащие кислоты
Некоторые из рассматриваемых соединений при взаимодействии с водой образуют кислородосодержащие кислоты, такие как серная, азотная, фосфорная кислоты.
Азотная кислота также относится к кислородосодержащим кислотам, но не образуется при растворении соответствующих оксидов в воде. Для синтеза этой кислоты требуется более сложный процесс: смесь оксидов азота реагируют с водой с поглощением кислорода.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи на определение участников реакции.
Условие задания:
Оксид с формулой XO2 прореагировал с 14 г CaO (оксид неметалла был взят в избытке), при этом образовалось 30 г соли CaXO3.
1) Укажите порядковый номер элемента X.
2) Какая масса (в граммах) оксида неметалла прореагировала?
3) Укажите степень окисления неметалла в оксиде XO2 (без знака)
4) Укажите максимальную степень окисления элемента X (без знака)
Шаг первый:
Составим уравнение реакции оксида неметалла с основным оксидом:
XO2 + CaO → CaXO3
Стехиометрическое соотношение CaO к CaXO3 – 1:1
Шаг второй:
Определим количество вещества CaO: M(CaO) = 56 г/моль. Количество вещества n = m/M. n(CaO) = 14/56 = 0,25 моль.
Количество вещества n = m/M. n(CaO) = 14/56 = 0,25 моль.
Шаг третий
Определим молярную массу элемента X. Поскольку стехиометрическое соотношение CaO к CaXO
M(Ca) + M(X) + 3*M(O) = 120
40 + M(X) + 48 = 120
M(X) = 32 г/моль
Шаг четвёртый
Определяем элемент X. Находим в таблице Менделеева элемент с молярной массой 32 г/моль. Это сера, элемент с порядковым номером 16.
Шаг пятый
Определяем массу прореагировавшего XO2. Исходя из материального баланса:
m(XO2) + m(CaO) = m(CaXO3)
m(CaO) и m(CaXO3) известны из условия задачи. Определяем m(XO2).
m(XO2) = 30 – 14 = 16 г.
Шаг шестой
Определеяем степень окисления неметалла в оксиде XO2 (без знака). Степень окисления кислорода в оксидах = -2. Значит, степень окисления X = +4. Без знака: 4.
Шаг седьмой
Определяем максимальную степень окисления элемента X (без знака). Мы определили, что элемент X – это сера. Максимальную степень окисления элементы проявляют в высших оксидах. Высший оксид для серы это SO3. Степень окисления серы в нём = +6. Без знака: 6.
Ответ:
Порядковый номер элемента X – 16. Это сера.
m(XO2) = 16 г. Степень окисления неметалла в оксиде XO2 (без знака): 4. Максимальную степень окисления элемента X (без знака): 6.
- Решение задачи на установление соответствия между оксидами неметаллов и соответствующим им кислотам.
Условие задания:
Соедините между собой оксиды неметаллов и кислородсодержащие кислоты, соответствующие им.
Шаг первый:
Определим среди предложенных соединений оксиды неметаллов.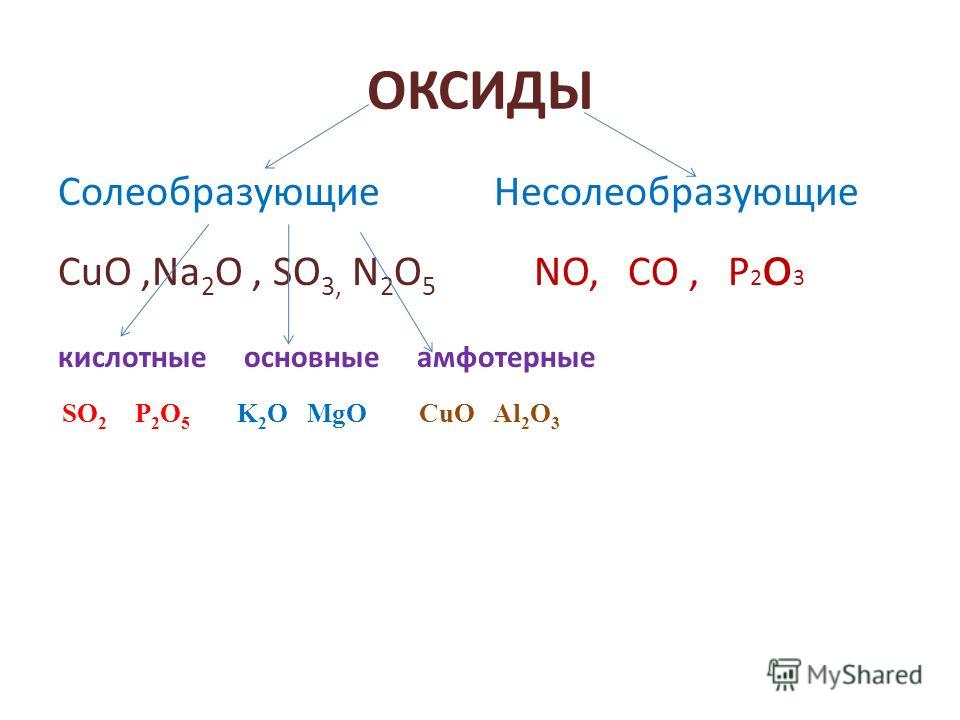
Шаг второй:
Определим соответствующие им кислоты. Такие кислоты получаются при взаимодействии оксидов с водой:
Cl2O + H2O → 2 HClO
SO2 + H2O → H2SO3
SO3 + H2O → H2SO3
CO2 + H2O → H2CO3
Шаг четвёртый:
Соединяем между собой оксиды неметаллов и кислородсодержащие кислоты, соответствующие им.
Ответ:
классификация, формулы и их свойства
Каждый школьник встречался с понятием «оксид» на уроках химии. От одного этого слова предмет начинал казаться чем-то неописуемо страшным. Но ничего страшного здесь нет. Высшие оксиды – это вещества, в которых содержатся соединения простых веществ с кислородом (в степени окисления -2). Стоит отметить, что они реагируют с:
- O2 (кислородом), в том случае, если элемент стоит не в высшей СО. К примеру, SO2 реагирует с кислородом (т. к. СО равна +4), а SO3 — нет (т. к. стоит в наивысшей степени окисления +6).
- H2 (водород) и C (углерод). Вступают в реакцию только некоторые оксиды.
- Водой в том случае, если получается растворимая щелочь или кислота.
Все оксиды вступают в реакцию с солями и неметаллами (за исключением вышеперечисленных веществ).
Стоит отметить, что некоторые вещества (например, оксид азота, оксид железа и оксид хлора) имеют свои особенности, т. е. их химические особенности могут отличаться от других субстанций.
Классификация оксидов
Они делятся на две ветки: те, кто могут образовывать соль, и те, кто образовывать ее не могут.
Примеры формул высших оксидов, которые не образуют солей: NO (окись азота двух валентная; газ без цвета, образующийся во время гроз), CO (угарный газ), N2O (оксид азота одновалентный), SiO (оксид кремния), S2O (оксид серы), вода.
Эти соединения могут реагировать с основаниями, кислотами и солеобразующими оксидами. Но при реагировании этих веществ никогда не образуется солей. Например:
CO (угарный газ) + NaOH (гидроксид натрия) = HCOONa (формиат натрия)
Солеобразующие оксиды делятся на три вида: кислотные, основания и амфотерные окислы.
Кислотные окиси
Кислотный высший оксид – это солеобразующий оксид, который соответствует кислоте. Например, у оксида серы шестивалентного (SO3) есть соответствующее ему химическое соединения – H2SO4. Эти элементы вступают в реакцию с оксидами основных и амфотерных свойств, основаниями и водой. Образуется соль или кислота.
- Со щелочными оксидами: CO2 (углекислый газ) + MgO (окись магния) = MgCO3 (горькая соль).
- С амфотерными окисями: P2О5 (окисел фосфора)+ Al2О3 (окисел алюминия) = 2AlPO4 (фосфат или ортофосфат алюминия).
- С основаниями (щелочами): CO2 (углекислый газ) + 2NaOH (едкий натр) = Na2CO3 (карбонат натрия или кальцинированная сода) + H2O (вода).
- С водой: CO2 (углекислый газ) + H2O = H2CO3 (угольная кислота, после реакции мгновенно распадается на углекислый газ и воду).
Оксиды кислот не вступают в реакцию друг с другом.
Основные оксиды
Основный высший оксид – это солеобразующий окисел металла, которому соответствует основание. Окислу кальция (CaO) соответствует гидроксид кальция (Ca(OH)2). Эти вещества взаимодействуют с окислами кислотного и амфотерного характера, кислотами (за исключением H2SiO3, так как кремниевая кислота нерастворимая) и водой.
- С кислотными оксидами: CaO (оксид кальция) + CO2 (углекислый газ) = CaCO3 (карбонат кальция или обычный мел).
- С амфотерной окисью: CaO (оксид кальция) + Al2O3 (окись алюминия) = Ca(AlO2)2 (алюминат кальция).

- С кислотами: CaO (окисел кальция) + H2SO4 (серная кислота) = CaSO4 (сульфат кальция или гипс) + H2O .
- С водой: CaO (оксид кальция) + H2O = Ca(OH)2 (гидроксид кальция или реакция гашения извести).
Не взаимодействуют между собой.
Амфотерные окиси
Амфотерный высший оксид – это окисел амфотерного металла. В зависимости от условий, он может проявить основные или кислотные свойства. Например, формулы высших оксидов, которые проявляют амфотерные свойства: ZnO (окисел цинка), Al2O3 (глинозем). Реагируют амфотерные окиси со щелочами, кислотами (так же за исключением кремниевой кислоты), основными и кислотными оксидами.
- С основаниями: ZnO (окисел цинка) + 2NaOH (основание натрия) = Na2ZnO2 (двойная соль цинка и натрия)+ H2O.
- С кислотами: Al2O3 (алюминия оксид) + 6HCl (соляная кислота) = 2AlCl3 (хлорид алюминия или хлористый алюминий) + 3H2O.
- С кислотными оксидами: Al2O3 (окисел алюминия) + 3SO3 (окисел серы шестивалентный) = Al2(SO4)3 (алюминиевые квасцы).
- С окислами основного характера: Al2O3 (окисел алюминия) + Na2O (окись натрия) = 2NaAlO2 (алюминат натрия).
Элементы высших оксидов амфотерного характера не взаимодействуют между собой и с водой.
Оксиды. Классификация оксидов. Названия оксидов
Оксиды — это сложные неорганические соединения, состоящие из двух элементов, один из которых кислород (в степени окисления -2).
Например, Na2O, B2O3, Cl2O7 относятся к оксидам. Все перечисленные вещества содержат кислород и еще один элемент. Вещества Na2O2, H2SO4, HCl не относятся к оксидам: в первом степень окисления кислорода равна -1, в составе второго не два, а три элемента, а третье вообще не содержит кислорода.
Если вы не понимаете смысл термина «степень окисления», ничего страшного. Во-первых, можно обратиться к соответствующей статье на этом сайте. Во-вторых, даже без понимания этого термина можно продолжать чтение. Временно можете забыть про упоминание о степени окисления.
Получены оксиды практически всех известных на сегодняшний день элементов, кроме некоторых благородных газов и «экзотических» трансурановых элементов. Более того, многие элементы образуют несколько оксидов (для азота, например, их известно шесть).
Номенклатура оксидов
Мы должны научиться называть оксиды. Это очень просто.Пример 1. Назовите следующие соединения: Li2O, Al2O3, N2O5, N2O3.
Li2O — оксид лития,
Al2O3 — оксид алюминия,
N2O5 — оксид азота (V),
N2O3 — оксид азота (III).
Обратите внимание на важный момент: если валентность элемента постоянна, мы НЕ упоминаем ее в названии оксида. Если валентность меняется, следует обязательно указать ее в скобках! Литий и алюминий имеют постоянную валентность, у азота валентность переменная; именно по этой причине названия окислов азота дополнены римскими цифрами, символизирующими валентность.
Задание 1. Назовите оксиды: Na2O, P2O3, BaO, V2O5, Fe2O3, GeO2, Rb2O. Не забывайте, что существуют элементы как с постоянной, так и с переменной валентностью.
Еще один важный момент: вещество F2O правильнее называть не «оксид фтора», а «фторид кислорода»!
Физические свойства оксидов
Физические свойства весьма разнообразны. Обусловлено это, в частности, тем, что в оксидах могут проявляться разные типы химической связи. Температуры плавления и кипения варьируются в широких пределах. При нормальных условиях оксиды могут находиться в твердом состоянии (CaO, Fe2O3, SiO2, B2O3), жидком состоянии (N2O3, H2O), в виде газов (N2O, SO2, NO, CO).
При нормальных условиях оксиды могут находиться в твердом состоянии (CaO, Fe2O3, SiO2, B2O3), жидком состоянии (N2O3, H2O), в виде газов (N2O, SO2, NO, CO).
Разнообразна окраска: MgO и Na2O белого цвета, CuO — черного, N2O3 — синего, CrO3 — красного и т. д.
Расплавы оксидов с ионным типом связи хорошо проводят электрический ток, ковалентные оксиды, как правило, имеют низкую электропроводность.
Классификация оксидов
Все существующие в природе оксиды можно разделить на 4 класса: основные, кислотные, амфотерные и несолеобразующие. Иногда первые три класса объединяют в группу солеобразующих оксидов, но для нас это сейчас несущественно. Химические свойства оксидов из разных классов отличаются весьма сильно, поэтому вопрос классификации очень важен для дальнейшего изучения этой темы!
Начнем с несолеобразующих оксидов. Их нужно запомнить: NO, SiO, CO, N2O. Просто выучите эти четыре формулы!
Для дальнейшего продвижения мы должны вспомнить, что в природе существуют два типа простых веществ — металлы и неметаллы (иногда выделяют еще группу полуметаллов или металлоидов). Если вы четко понимаете, какие элементы относятся к металлам, продолжайте читать эту статью. Если есть малейшие сомнения, обратитесь к материалу «Металлы и неметаллы» на этом сайте.
Итак, сообщаю вам, что все амфотерные оксиды являются оксидами металлов, но не все оксиды металлов относятся к амфотерным. Я перечислю наиболее важные из них: BeO, ZnO, Al2O3, Cr2O3, SnO. Список не является полным, но перечисленные формулы следует обязательно запомнить! В большинстве амфотерных оксидов металл проявляет степень окисления +2 или +3 (но есть исключения).
В следующей части статьи мы продолжим говорить о классификации; обсудим кислотные и основные оксиды.
Продолжение статьи →
Высший оксид — Большая Энциклопедия Нефти и Газа, статья, страница 1
Высший оксид
Cтраница 1
Высшие оксиды имеют кислый характер, низшие — основной. Существование ReCu и RejOj окончательно не установлено. [1]
Высший оксид V2Os — обладает ясно выраженным кислотным характером, диоксид VO2 амфотерен; оба низших оксида проявляют только основные свойства. Наибольшее значение имеют VzOs и его производные. [2]
Высший оксид V2Os — обладает ясно выраженным кислотным характером, диоксид VO2 амфотерен; оба низших оксида проявляют только основные свойства. Наибольшее значение имеют V2Os и его производные. [3]
Высший оксид V2O5 обладает ясно выраженным кислотным характером, диоксид VU2 амфотерен; оба низших оксида проявляют только основные свойства. Наибольшее значение имеют V2Os и его производные. [4]
Высший оксид V2O5 обладает ясно выраженным кислотным характером, диоксид VO2 амфотерен; оба низших оксида проявляют только основные свойства. Наибольшее значение имеют V2O5 и его производные. [5]
Высший оксид V2O5 — обладает ясно выраженным кислотным характером, диоксид VO2 амфотерен; оба низших оксида проявляют только основные свойства. Наибольшее значение имеют X Os и его производные. [6]
Высшие оксиды получаются обычно при непосредственном взаимодействии металлов с кислородом, низшие же ( преимущественно ванадия) при взаимодействии высших с соответствующими металлами. [7]
Высшие оксиды всех трех элементов имеют формулы ЭОз, отвечающие им кислоты — Н ЭСи. Растворимость, окислительное действие п сила кислот уменьшаются с ростом порядкового номера элемента. Молибден образует с фтором гексафторид MoF6, вольфрам — WF6, а также WCle и УВге. Связи в этих галогепидах ковалептные; они летучи и гидролизуются в воде. Молибден и вольфрам образуют пентагалогениды МоСЬ, VC15 и др. Хром реагирует со всеми галогенами, но не образует гексага-логенидов.
[8]
Растворимость, окислительное действие п сила кислот уменьшаются с ростом порядкового номера элемента. Молибден образует с фтором гексафторид MoF6, вольфрам — WF6, а также WCle и УВге. Связи в этих галогепидах ковалептные; они летучи и гидролизуются в воде. Молибден и вольфрам образуют пентагалогениды МоСЬ, VC15 и др. Хром реагирует со всеми галогенами, но не образует гексага-логенидов.
[8]
Высший оксид — Bi2O5 — еще менее устойчив, чем РЬО2, и в чистом виде не существует. [9]
Высший оксид Мп207 — это маслянистая темно-зеленая жидкость, которая легко разлагается со взрывом с выделением кислорода и образованием низших оксидов. [10]
Высший оксид обладает кислотными свойствами. [11]
Высший оксид ниобия Nb2O5 — белый порошок, нерастворимый в кислотах. [12]
Высшие оксиды рутения и осмия различаются между собой по своей устойчивости. Тетраоксид же рутения при нагревании быстро разлагается по уравнению: RuO, RuO2 O2, а при его соприкосновении со спиртом происходит взрыв. [13]
Высшие оксиды рения ( ReO3 и Re2O7) — кислотные, диоксид рения ReO2 — амфотерное соединение, a Re2O и ReO — основные оксиды. [14]
Высшие оксиды рения ( ReO3 и Re2O7) — кислотные, диоксид рения ReO2 — амфотерное соединение, a Re2O н ReO — основные оксиды. [15]
Страницы: 1 2 3 4
классификация, формулы и их свойства
Каждый школьник встречался с понятием «оксид» на уроках химии.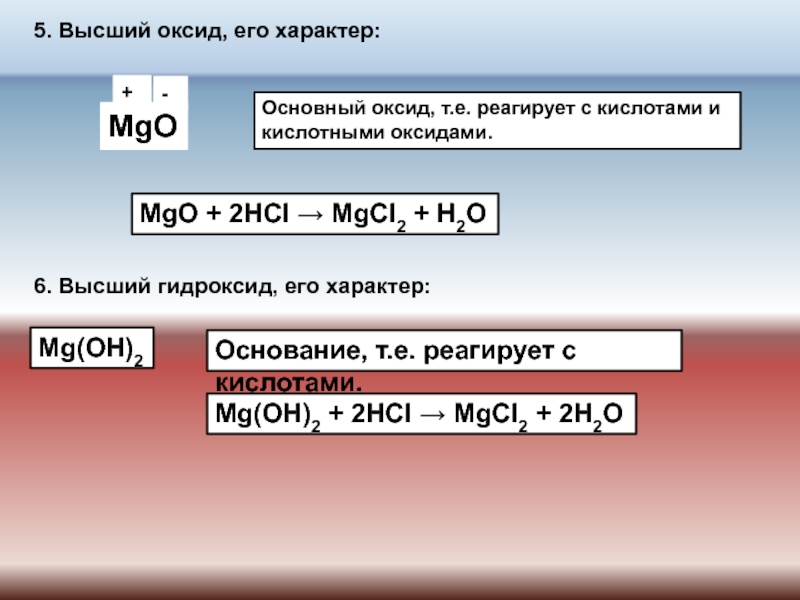 От одного этого слова предмет начинал казаться чем-то неописуемо страшным. Но ничего страшного здесь нет. Высшие оксиды – это вещества, в которых содержатся соединения простых веществ с кислородом (в степени окисления -2). Стоит отметить, что они реагируют с:
От одного этого слова предмет начинал казаться чем-то неописуемо страшным. Но ничего страшного здесь нет. Высшие оксиды – это вещества, в которых содержатся соединения простых веществ с кислородом (в степени окисления -2). Стоит отметить, что они реагируют с:
- O2 (кислородом), в том случае, если элемент стоит не в высшей СО. К примеру, SO2 реагирует с кислородом (т. к. СО равна +4), а SO3 — нет (т. к. стоит в наивысшей степени окисления +6).
- H2 (водород) и C (углерод). Вступают в реакцию только некоторые оксиды.
- Водой в том случае, если получается растворимая щелочь или кислота.
Все оксиды вступают в реакцию с солями и неметаллами (за исключением вышеперечисленных веществ).
Стоит отметить, что некоторые вещества (например, оксид азота, оксид железа и оксид хлора) имеют свои особенности, т. е. их химические особенности могут отличаться от других субстанций.
Классификация оксидов
Они делятся на две ветки: те, кто могут образовывать соль, и те, кто образовывать ее не могут.
Примеры формул высших оксидов, которые не образуют солей: NO (окись азота двух валентная; газ без цвета, образующийся во время гроз), CO (угарный газ), N2O (оксид азота одновалентный), SiO (оксид кремния), S2O (оксид серы), вода.
Эти соединения могут реагировать с основаниями, кислотами и солеобразующими оксидами. Но при реагировании этих веществ никогда не образуется солей. Например:
CO (угарный газ) + NaOH (гидроксид натрия) = HCOONa (формиат натрия)
Солеобразующие оксиды делятся на три вида: кислотные, основания и амфотерные окислы.
Кислотные окиси
Кислотный высший оксид – это солеобразующий оксид, который соответствует кислоте. Например, у оксида серы шестивалентного (SO3) есть соответствующее ему химическое соединения – H2SO4. Эти элементы вступают в реакцию с оксидами основных и амфотерных свойств, основаниями и водой.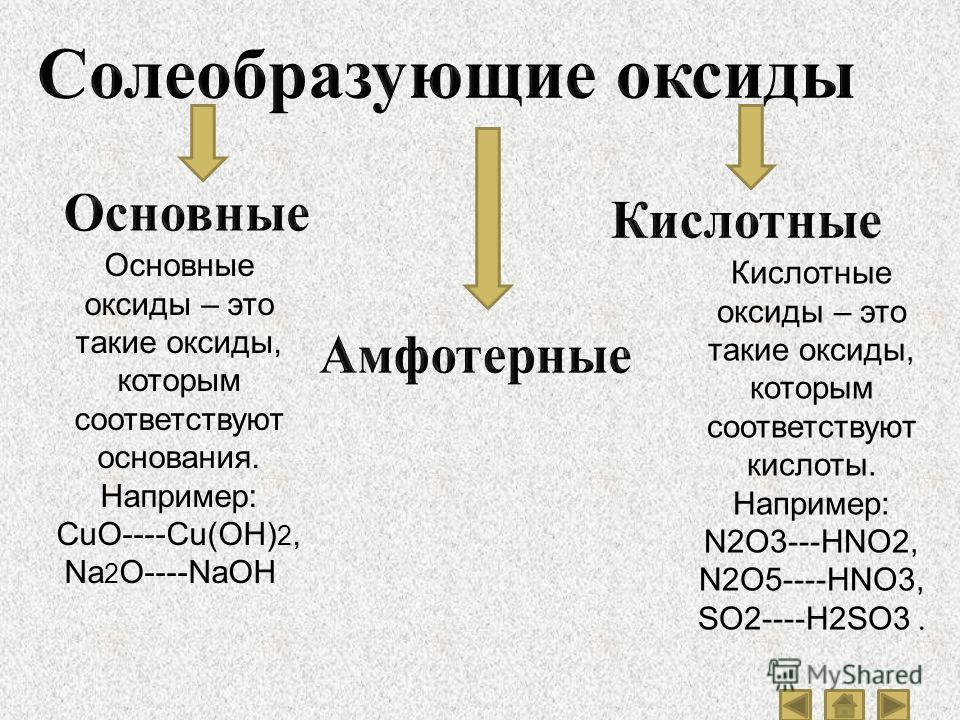 Образуется соль или кислота.
Образуется соль или кислота.
- Со щелочными оксидами: CO2 (углекислый газ) + MgO (окись магния) = MgCO3 (горькая соль).
- С амфотерными окисями: P2О5 (окисел фосфора)+ Al2О3 (окисел алюминия) = 2AlPO4 (фосфат или ортофосфат алюминия).
- С основаниями (щелочами): CO2 (углекислый газ) + 2NaOH (едкий натр) = Na2CO3 (карбонат натрия или кальцинированная сода) + H2O (вода).
- С водой: CO2 (углекислый газ) + H2O = H2CO3 (угольная кислота, после реакции мгновенно распадается на углекислый газ и воду).
Оксиды кислот не вступают в реакцию друг с другом.
Основные оксиды
Основный высший оксид – это солеобразующий окисел металла, которому соответствует основание. Окислу кальция (CaO) соответствует гидроксид кальция (Ca(OH)2). Эти вещества взаимодействуют с окислами кислотного и амфотерного характера, кислотами (за исключением H2SiO3, так как кремниевая кислота нерастворимая) и водой.
- С кислотными оксидами: CaO (оксид кальция) + CO2 (углекислый газ) = CaCO3 (карбонат кальция или обычный мел).
- С амфотерной окисью: CaO (оксид кальция) + Al2O3 (окись алюминия) = Ca(AlO2)2 (алюминат кальция).
- С кислотами: CaO (окисел кальция) + H2SO4 (серная кислота) = CaSO4 (сульфат кальция или гипс) + H2O .
- С водой: CaO (оксид кальция) + H2O = Ca(OH)2 (гидроксид кальция или реакция гашения извести).
Не взаимодействуют между собой.
Амфотерные окиси
Амфотерный высший оксид – это окисел амфотерного металла. В зависимости от условий, он может проявить основные или кислотные свойства. Например, формулы высших оксидов, которые проявляют амфотерные свойства: ZnO (окисел цинка), Al2O3 (глинозем). Реагируют амфотерные окиси со щелочами, кислотами (так же за исключением кремниевой кислоты), основными и кислотными оксидами.
Реагируют амфотерные окиси со щелочами, кислотами (так же за исключением кремниевой кислоты), основными и кислотными оксидами.
- С основаниями: ZnO (окисел цинка) + 2NaOH (основание натрия) = Na2ZnO2 (двойная соль цинка и натрия)+ H2O.
- С кислотами: Al2O3 (алюминия оксид) + 6HCl (соляная кислота) = 2AlCl3 (хлорид алюминия или хлористый алюминий) + 3H2O.
- С кислотными оксидами: Al2O3 (окисел алюминия) + 3SO3 (окисел серы шестивалентный) = Al2(SO4)3 (алюминиевые квасцы).
- С окислами основного характера: Al2O3 (окисел алюминия) + Na2O (окись натрия) = 2NaAlO2 (алюминат натрия).
Элементы высших оксидов амфотерного характера не взаимодействуют между собой и с водой.
Оксиды низшие — Справочник химика 21
Оксиды и гидроксиды. Оксиды ванадия, ниобия и тантала соответствуют различным окислительным числам. Наиболее характерными для всех элементов являются высшие оксиды Низшие оксиды [c.93]Однако субоксиды и оксиды низшей степени окисления -метал-лов образуют растворы в металлах, особенно в жидком состоянии. [c.279]
Изменение степени окисления изменяет и характер оксидов. Низшие оксиды обладают основным, оксиды промежуточной степени окисления — амфотерным, а высшей степени окисления — кислотным характером. Для марганца характерна легкая изменчивость степеней окисления и соединения марганца с кислородом в химических реакциях являются и окислителями, и восстано- [c.355]
Изменение степени окисления изменяет и характер оксидов. Низшие оксиды обладают основным, оксиды промежуточной степени окисления — амфотерным, а высшей степени окисления — кислотным характером. Для марганца характерна легкая изменчивость степеней окисления и соединения марганца с кислородом в химических реакциях являются и окислителями и восстановителями, Прочность оксидов -металлов VII группы может быть оценена их теплотой образования (—ДЯ , кДж/моль).
 [c.370]
[c.370]Предполагается, что пассивное состояние поверхности молибдена обеспечивается возможным образованием оксидов низших степеней окисления [c.118]
Одним из наиболее перспективных направлений органического синтеза в настоящее время является химия и технология эпоксидных соединений. Оксиды олефинов находят широкое применение в различных отраслях народного хозяйства благодаря своей высокой реакционной способности. К соединениям такого класса, производимым в настоящее время в крупнопромышленном масштабе (мировое производство более 10 млн. т/год), относятся оксиды низших олефинов — этилена и пропилена, которые применяются в производстве многоатомных спиртов для синтеза полиуретанов и гликолей. Все большее значение начинают приобретать также оксиды высших олефинов (Се—С18) линейного и циклического строения, используемые при синтезе различного типа поверхностно-активных веществ, алкидных смол, пластификаторов, присадок к маслам, стабилизаторов хлорированных продуктов и др. [c.241]
Оксиды низшей валентности при хлорировании могут образовать и хлорид, и высший оксид или только оксихлорид [c.11]
Изменение степени окисления изменяет и характер оксидов. Низшие оксиды обладают основным характером, оксиды промежуточной степени окисления — амфотерным, а высшей степени окисления — [c.355]
В ряде случаев это, как указано, связано с растворением пассивирующих слоев. Время активации зависит от толщины пассивирующего слоя и состава раствора. Активация металла катодным током, вероятно, связана с процессом восстановления оксидов либо до металла, либо до оксида низшей валентности, который растворяется в электролите. При восстановлении поверхностных оксидов катодным током рассчитывают количество электричества,, пошедшее на восстановление, а если известен состав оксида, то и толщину пассивирующего слоя. [c.357]
Сравнение значения теплового эффекта для оксида после активации- с тепловым эффектом окисления оксида низшей [c. 147]
147]
Из оксидов низших степеней окисления представляют интерес ЫЬОг и ТаОг. Эти оксиды так же, как и оксиды НЬгОз, ТагОв, нерастворимы в воде и кислотах. В отличие от оксидов высшей [c.519]
В результате циркуляции катализатора через окислительную и восстановительную атмосферы лишь часть ванадия находится в форме У2 Ъ (остально в в -де оксидов низших степеней валентности V, V ) Доля V 2 5 общем количестве оксидов ванадия зависит от условий в регенераторе, составляя иногда 13% С другой стороны, скорость образования ванадиевой кислоты зависит от концентрации V 2 5 воды в регенераторе, В современных двухступенчатых регенераторах на второй ступени регенерации обычио поддерживается высокая концентрация СО (низкое содержание V 2 5 низкая концентрация водяного пара, что минимизирует образование ванадиевой кислоты и сводит к минимуму отравляющее действие ванадия. [c.21]
Акцепторы кислорода (н свободных радикалов) легко получить в полимерах путем восстановления различных соединений металлов до чистых металлов или до их оксидов низшей валентности. Описаны методы восстановления соединений Ag, Си, Fe, Ni, Со и др. такими восстановителями, как Нг, СО, СН4ИТ. п. [118—124]. Последние получаются в полимерах при распаде карбонилов, формпатов, оксалатов и многих других соединений. Примером таких процессов может служить уже упомянутая выше реакция разложения формиата натрия [c.179]
Предложены прямые методы химического никелирования металлизированных участков керамических деталей [140]. По одному из них изделия обрабатывают в щелочном растворе, содержащем этилендиаминовые или трилонатные комплексы никеля и восстановители бораны и гидразингидрат, удаляющие оксидную пленку с поверхности. После этого происходит контактное выделение тонкого слоя никеля на металлизированной поверхности и химическое восстановление ионов никеля из раствора. Оксиды низшей степени окисленности молибдена(IV) и вольфрама (IV), находящиеся на поверхности металлизированных участков, могут быть переведены в растворимое состояние, если их окислить химической или термической обработкой до степени окисленности (VI). После окисления металлизиро- [c.205]
После окисления металлизиро- [c.205]
Защиту оборудования проводят путем обработки очищенной поверхности сильным восстановителем или сильным окислителем, чаще всего гидразином или нитритом натрия [252, с. 89]. Эту обработку обычно называют пассивацией металла. Гидраз1ин взаимодействует с оксидами железа, восстанавливая их до оксидов низшей валентности, создающих защитную пленку [реакция 104)]. Обычно поверхность металла обрабатывают циркулирующим раствором гидразина (0,3—0,5 мг/л N21 4) в течение 10—12 ч при рН = 9—9,5 и температуре 140— 150 °С [252, с. 98]. Иногда в раствор добавляют водный аммиак. [c.190]
Для стерилизации из газовой фазы чаще всего используются оксиды низших алкенов или их смеси с СО2 или галоидалканами. [c.310]
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Химия для самых маленьких. Шпаргалки. Детский сад, Школа. / / Периодическая система Менделеева. Высшие оксиды. Летучие водородные соединения. Растворимость, относительные молекулярные массы солей, кислот, оснований, оксидов, органических веществ. Ряды электроотрицательности, анионов, активности и напряжений металлов Поделиться:
| ||||||
| Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. Вложите в письмо ссылку на страницу с ошибкой, пожалуйста. | |||||||
| Коды баннеров проекта DPVA.ru Начинка: KJR Publisiers Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | ||||||
редкоземельных элементов | Использование, свойства и факты
Редкоземельный элемент , любой член группы химических элементов, состоящий из трех элементов в Группе 3 (скандий [Sc], иттрий [Y] и лантан [La]) и первый расширенный ряд элементов ниже основного тело периодической таблицы (церий [Ce] через лютеций [Lu]). Элементы от церия до лютеция называют лантаноидами, но многие ученые также, хотя и неправильно, называют эти элементы редкоземельными элементами.
Британская викторина
Периодическая таблица элементов
Проверьте свою связь с периодической таблицей элементов в этой викторине по всем 118 химическим элементам и их символам. Возможно, вы знакомы с химическими символами водорода и кислорода, но можете ли вы сопоставить такие низкопрофильные элементы, как гадолиний и эрбий, с их соответствующими символами?
Возможно, вы знакомы с химическими символами водорода и кислорода, но можете ли вы сопоставить такие низкопрофильные элементы, как гадолиний и эрбий, с их соответствующими символами?
Редкоземельные элементы обычно являются трехвалентными элементами, но некоторые из них имеют другие валентности.Церий, празеодим и тербий могут быть четырехвалентными; самарий, европий и иттербий, с другой стороны, могут быть двухвалентными. Многие вводные научные книги рассматривают редкоземельные элементы как настолько химически похожие друг на друга, что в совокупности их можно рассматривать как один элемент. В определенной степени это верно — около 25 процентов их использования основаны на этом близком сходстве, — но остальные 75 процентов использования редкоземельных элементов основаны на уникальных свойствах отдельных элементов. Более того, тщательное изучение этих элементов показывает огромные различия в их поведении и свойствах; е.g., температура плавления лантана, элемента-прототипа ряда лантаноидов (918 ° C, или 1684 ° F), намного ниже, чем температура плавления лютеция, последнего элемента в ряду (1663 ° C, или 3025 ° F). ° F). Эта разница намного больше, чем во многих группах таблицы Менделеева; например, точки плавления меди, серебра и золота различаются всего на 100 ° C (180 ° F).
Название редкоземельных элементов само по себе неправильное. Во время их открытия в 18 веке было обнаружено, что они являются компонентом сложных оксидов, которые в то время назывались «землями».Кроме того, эти минералы казались дефицитными, и поэтому эти недавно обнаруженные элементы были названы «редкоземельными элементами». На самом деле, этих элементов довольно много, и они присутствуют во многих пригодных для работы месторождениях по всему миру. 16 встречающихся в природе редкоземельных элементов попадают в 50-й процентиль содержания элементов. К началу 21 века Китай стал крупнейшим в мире производителем редкоземельных элементов. Австралия, Бразилия, Индия, Казахстан, Малайзия, Россия, Южная Африка и США также добывают и очищают значительные количества этих материалов.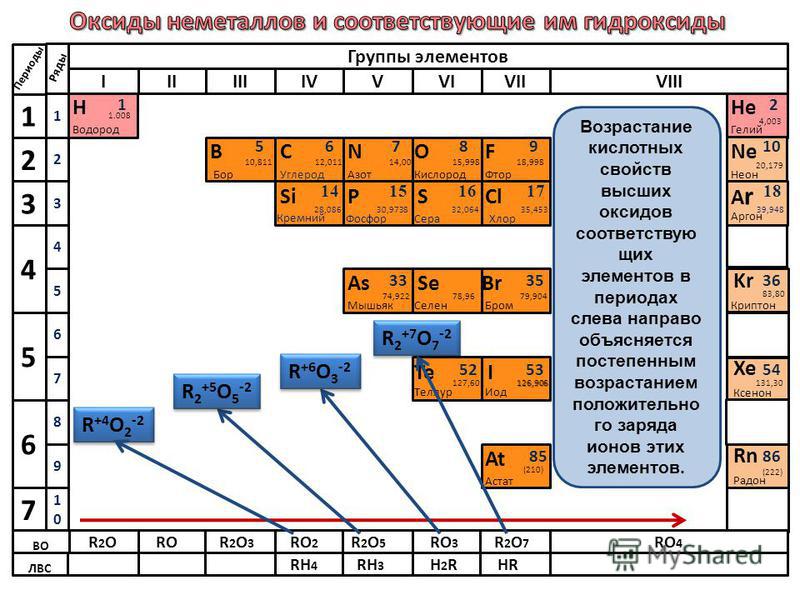
Многие люди не осознают, какое огромное влияние редкоземельные элементы оказывают на их повседневную жизнь, но практически невозможно избежать современной технологии, которая не содержит их. Даже такой простой продукт, как более легкий кремний, содержит редкоземельные элементы. Примером их распространения является современный автомобиль, один из крупнейших потребителей редкоземельных элементов. Десятки электродвигателей обычного автомобиля, а также динамики его звуковой системы используют постоянные магниты из неодима, железа и бора.В электрических датчиках используется оксид циркония, стабилизированный оксидом иттрия, для измерения и контроля содержания кислорода в топливе. Трехкомпонентный каталитический нейтрализатор использует оксиды церия для восстановления оксидов азота до газообразного азота и окисления моноксида углерода до диоксида углерода и несгоревших углеводородов до диоксида углерода и воды в продуктах выхлопа. Люминофоры в оптических дисплеях содержат оксиды иттрия, европия и тербия. Лобовое стекло, зеркала и линзы полируются оксидами церия. Даже бензин или дизельное топливо, которое используется в автомобиле, было очищено с использованием катализаторов крекинга на основе редкоземельных элементов, содержащих оксиды лантана, церия или смешанных редкоземельных элементов.Гибридные автомобили питаются от никель-лантановой металлогидридной аккумуляторной батареи и электрического тягового двигателя с постоянными магнитами, содержащими редкоземельные элементы. Кроме того, в современных мультимедийных и коммуникационных устройствах — сотовых телефонах, телевизорах и компьютерах — редкоземельные элементы используются в качестве магнитов для динамиков, жестких дисков и люминофоров для оптических дисплеев. Используемые количества редкоземельных элементов довольно малы (0,1–5 процентов по весу, за исключением постоянных магнитов, которые содержат около 25 процентов неодима), но они критически важны, и любое из этих устройств не будет работать так же хорошо или будет значительно тяжелее, если бы не редкоземельные элементы.
Открытие и история
Хотя редкие земли существуют с момента образования Земли, их существование не обнаруживалось до конца 18 века. В 1787 году лейтенант шведской армии Карл Аксель Аррениус обнаружил уникальный черный минерал в небольшом карьере в Иттерби (городок недалеко от Стокгольма). Этот минерал представлял собой смесь редкоземельных элементов, и первым отдельным элементом, который был выделен, был церий в 1803 году.
История отдельных редкоземельных элементов сложна и запутана, главным образом из-за их химического сходства. Многие «недавно открытые элементы» представляют собой не один элемент, а смеси шести различных редкоземельных элементов. Кроме того, были заявления об открытии большого количества других «элементов», которые должны были быть членами редкоземельного ряда, но не были.
Последний встречающийся в природе редкоземельный элемент (лютеций) был открыт в 1907 году, но исследование химии этих элементов было трудным, потому что никто не знал, сколько истинных редкоземельных элементов существует.К счастью, исследования датского физика Нильса Бора и английского физика Генри Гвина Джеффриса Мозли в 1913–1914 годах разрешили эту ситуацию. Теория атома водорода Бора позволила теоретикам показать, что существует только 14 лантаноидов. Экспериментальные исследования Мозли подтвердили существование 13 из этих элементов и показали, что 14-й лантаноид должен быть 61-м элементом и находиться между неодимом и самарием.
В 1920-е годы поиск 61-го элемента был интенсивным. В 1926 году группы ученых из Университета Флоренции, Италия, и Университета Иллинойса заявили, что открыли элемент 61, и назвали этот элемент флорентием и иллинием, соответственно, но их утверждения не могли быть независимо проверены.Шум от этих претензий и встречных исков в конце концов утих к 1930 году. Только в 1947 году, после расщепления урана, 61-й элемент был определенно изолирован и назван прометием учеными из Окриджской национальной лаборатории Комиссии по атомной энергии США в Теннесси. (Более подробная информация об открытии отдельных элементов содержится в статьях об этих элементах.)
(Более подробная информация об открытии отдельных элементов содержится в статьях об этих элементах.)
В течение 160 лет открытий (1787–1947) разделение и очистка редкоземельных элементов было трудным и длительным процессом. потребляющий процесс.Многие ученые потратили всю свою жизнь, пытаясь получить редкоземельный элемент с чистотой 99%, обычно путем фракционной кристаллизации, которая использует небольшие различия в растворимости соли редкоземельного элемента в водном растворе по сравнению с растворимостью соседнего элемента лантаноида.
Поскольку было обнаружено, что редкоземельные элементы являются продуктами деления атома урана, Комиссия по атомной энергии США приложила большие усилия для разработки новых методов разделения редкоземельных элементов.Однако в 1947 году Джеральд Э. Бойд и его коллеги из Окриджской национальной лаборатории и Фрэнк Гарольд Спеддинг и его коллеги из лаборатории Эймса в Айове одновременно опубликовали результаты, которые показали, что процессы ионного обмена предлагают гораздо лучший способ разделения редкоземельных элементов.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.

- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.
 Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie. - Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Что такое оксид? Определение и примеры
Оксид — это ион кислорода со степенью окисления, равной -2 или O 2- . Любое химическое соединение, содержащее O 2- в качестве аниона, также называется оксидом.Некоторые люди более широко применяют этот термин для обозначения любого соединения, в котором кислород выступает в качестве аниона. Оксиды металлов (например, Ag 2 O, Fe 2 O 3 ) являются наиболее распространенной формой оксидов, составляющей большую часть массы земной коры. Эти оксиды образуются, когда металлы реагируют с кислородом воздуха или воды. Хотя оксиды металлов являются твердыми веществами при комнатной температуре, образуются также газообразные оксиды. Вода — это оксид, который является жидкостью при нормальной температуре и давлении. Некоторые из оксидов, обнаруженных в воздухе, — это диоксид азота (NO 2 ), диоксид серы (SO 2 ), монооксид углерода (CO) и диоксид углерода (CO 2 ).
Ключевые выводы: определение оксидов и примеры
- Оксид относится либо к аниону кислорода 2 — (O 2- ), либо к соединению, содержащему этот анион.
- Примеры обычных оксидов включают диоксид кремния (SiO 2 ), оксид железа (Fe 2 O 3 ), диоксид углерода (CO 2 ) и оксид алюминия (Al 2 O 3 ) .
- Оксиды обычно бывают твердыми или газообразными.
- Оксиды образуются естественным образом, когда кислород из воздуха или воды реагирует с другими элементами.
Образование оксидов
Большинство элементов образуют оксиды. Благородные газы могут образовывать оксиды, но это происходит редко. Благородные металлы устойчивы к взаимодействию с кислородом, но в лабораторных условиях образуют оксиды. Естественное образование оксидов включает окисление кислородом или гидролиз. Когда элементы горят в богатой кислородом среде (например, металлы в термитной реакции), они легко образуют оксиды. Металлы также реагируют с водой (особенно щелочными металлами) с образованием гидроксидов.Большинство металлических поверхностей покрыто смесью оксидов и гидроксидов. Этот слой часто пассивирует металл, замедляя дальнейшую коррозию от воздействия кислорода или воды. Железо в сухом воздухе образует оксид железа (II), но гидратированные оксиды железа (ржавчина) Fe 2 O 3-x (OH) 2x образуются, когда присутствуют и кислород, и вода.
Металлы также реагируют с водой (особенно щелочными металлами) с образованием гидроксидов.Большинство металлических поверхностей покрыто смесью оксидов и гидроксидов. Этот слой часто пассивирует металл, замедляя дальнейшую коррозию от воздействия кислорода или воды. Железо в сухом воздухе образует оксид железа (II), но гидратированные оксиды железа (ржавчина) Fe 2 O 3-x (OH) 2x образуются, когда присутствуют и кислород, и вода.
Номенклатура
Соединение, содержащее оксид-анион, можно просто назвать оксидом. Например, CO и CO 2 оба являются оксидами углерода.CuO и Cu 2 O — оксид меди (II) и оксид меди (I) соответственно. В качестве альтернативы для обозначения можно использовать соотношение между катионом и атомами кислорода. Для именования используются греческие числовые префиксы. Итак, вода или H 2 O — это монооксид дигидрогена. CO 2 — диоксид углерода. СО — диоксид углерода.
Оксиды металлов также могут быть названы с использованием суффикса -a . Al 2 O 3 , Cr 2 O 3 и MgO представляют собой, соответственно, оксид алюминия, оксид хрома и оксид магния.
Для оксидов используются специальные названия, основанные на сравнении более низких и высоких степеней окисления кислорода. В соответствии с этим наименованием O 2 2- представляет собой пероксид, а O 2 — представляет собой супероксид. Например, H 2 O 2 — перекись водорода.
Строение
Оксиды металлов часто образуют структуры, подобные полимерам, где оксид связывает вместе три или шесть атомов металла. Полимерные оксиды металлов обычно нерастворимы в воде.Некоторые оксиды являются молекулярными. К ним относятся все простые оксиды азота, а также оксид углерода и диоксид углерода.
Что не является оксидом?
Чтобы быть оксидом, степень окисления кислорода должна быть -2, и кислород должен действовать как анион. Следующие ионы и соединения технически не являются оксидами, поскольку не соответствуют этим критериям:
Следующие ионы и соединения технически не являются оксидами, поскольку не соответствуют этим критериям:
- Дифторид кислорода (OF 2 ) : Фтор более электроотрицателен, чем кислород, поэтому он действует как катион (O 2+ ), а не как анион в этом соединении.
- Диоксигенил (O 2 + ) и его соединения : Здесь атом кислорода находится в степени окисления +1.
Источники
- Chatman, S .; Zarzycki, P .; Россо, К. М. (2015). «Самопроизвольное окисление воды на гранях кристаллов гематита (α-Fe2O3)». Прикладные материалы и интерфейсы ACS . 7 (3): 1550–1559. DOI: 10.1021 / am5067783
- Cornell, R.M .; Швертманн, У. (2003). Оксиды железа: структура, свойства, реакции, встречаемость и применение (2-е изд.). DOI: 10.1002 / 3527602097. ISBN 9783527302741.
- Кокс, П.А. (2010). Оксиды переходных металлов. Введение в их электронную структуру и свойства . Издательство Оксфордского университета. ISBN 9780199588947.
- Greenwood, N. N .; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4.
- ИЮПАК (1997 г.). Сборник химической терминологии (2-е изд.) («Золотая книга»). Составлено А. Д. Макнотом и А. Уилкинсоном. Научные публикации Блэквелла, Ox ford.
Тенденции в химии оксидов Учебник
Сноски
1 Мы будем рассматривать только «нормальные» оксиды. Помимо нормального оксида Na 2 O, натрий также образует ионный пероксид Na 2 O 2 .
Однако следует отметить, что при сгорании натрия Na 2 O также будет реагировать с O 2 с образованием Na 2 O 2 , поэтому основным продуктом сгорания натрия является Na 2 О 2 .
2 Ограничение подачи кислорода во время горения дает низший оксид, P 4 O 6 вместо P 5 O 10
3 При сгорании фосфора в избытке кислорода образуется оксид фосфора P 4 O 10 .
4 При сгорании серы образуется диоксид серы SO 2 (г) .
Окисление SO 2 до SO 3 кислородом происходит самопроизвольно, но очень медленно:
SO 2 (г) + ½O 2 (г) → SO 3 (л)
5 Некоторые оксиды хлора склонны к взрыву: ClO 2 , Cl 2 O, Cl 2 O 3 и Cl 2 O 7 .
Похоже, они более чувствительны к удару, чем термически.
Даже в этом случае ClO 2 и Cl 2 O оба используются в коммерческих целях в качестве отбеливающих агентов, в частности, для отбеливания бумаги и муки.
В промышленных масштабах ClO 2 получают экзотермической реакцией между хлоратом натрия примерно в 4 моль л. -1 H 2 SO 4 , содержащим 0,05-0,25 моль л иона хлорида -1 с диоксидом серы:
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4
Cl 2 O можно получить обработкой свежеприготовленного желтого оксида ртути или газообразным хлором раствор хлора в четыреххлористом углероде:
2Cl 2 + 2HgO → HgCl 2 .HgO + Cl 2 O
6 Существует только одна формула оксида алюминия, Al 2 O 3 , известная как оксид алюминия, однако существует ряд полиморфов и гидратированных разновидностей.
Существует 2 формы безводного Al 2 O 3 , известные как α -Al 2 O 3 и γ -Al 2 O 3 .
α -Al 2 O 3 очень твердый и устойчивый к гидратации и воздействию кислот.
γ -Al 2 O 3 более мягкий, легко впитывает воду и растворяется в кислотах.
Существует несколько гидратированных форм оксида алюминия, включая AlO.OH и Al (OH) 3 , но их получают в щелочных растворах, а не в реакции оксида алюминия с водой.
7 Реакция протекает в холодной воде. Если используется горячая вода, образуется ряд продуктов, таких как PH 3 , фосфорная кислота и элемент P.
8 Эта реакция протекает легко, что делает P 4 O 10 хорошим осушающим агентом, но при этом образуется смесь кислот, в зависимости от количества воды и других условий.
9 Нет сомнений в том, что газообразный SO 2 растворяется в воде, но кислота H 2 SO 3 не выделяется. Тем не менее, это уравнение обычно используется для описания реакции.
10 Двуокись углерода, CO 2 , является кислым оксидом, а монооксид углерода, CO, является нейтральным оксидом.
11 Диоксид азота, NO 2 , является кислым оксидом, но оксид азота, NO, и закись азота, N 2 O, являются нейтральными оксидами.
Молекулярные оксиды высоковалентных актинидов
Гринвуд Н.Н., Эрншоу А. (1997) Химия элементов. Баттерворт-Хайнеманн, Оксфорд. https://doi.org/10.1016/C2009-0-30414-6
Пеппер М., Бурстен Б.Е. (1991) Электронная структура актинидсодержащих молекул: вызов прикладной квантовой химии. Chem Rev 91: 719–741. https://doi.org/10.1021/cr00005a005
CAS Статья Google Scholar
Dolg M, Stoll H (1996) Расчеты электронной структуры молекул, содержащих атомы лантаноидов. В: Geschneider Jr KA, Eyring L (eds) Справочник по физике и химии редких земель, глава 152, том 22. Elsevier, Амстердам. https://doi.org/10.1016/S0168-1273(96)22009-4
Elsevier, Амстердам. https://doi.org/10.1016/S0168-1273(96)22009-4
Google Scholar
Долг М. (1998) Лантаноиды и актиниды. В: Аллинджер Н.Л., Кларк Т. и др. (Редакторы) Schleyer PvR. Энциклопедия вычислительной химии.Wiley, Chichester, стр. 1478–1486. https://doi.org/10.1002/0470845015.cla001
Google Scholar
Schreckenbach G, Hay PJ, Martin RL (1999) Расчеты функций плотности актинидных соединений: обзор последних достижений и применение к [UO 2 X 4 ] 2- (X = F, Cl, OH) и AnF 6 (An = U, Np, Pu). J Comput Chem 20: 70–90. https://doi.org/10.1002/(SICI)1096-987X(199)20:1%3C70::AID-JCC9%3E3.0.CO; 2-F
CAS Статья Google Scholar
Кальцояннис Н. (2003) Последние достижения в вычислительной химии актинидов. Chem Soc Rev 32: 9–16. https://doi.org/10.1039/B204253N
CAS Статья PubMed Google Scholar
Kaltsoyannis N, Hay PJ, Li J, Blaudeau JP, Bursten BE (2006) Теоретические исследования электронной структуры соединений актинидных элементов.В: Morss LR, Edelstein NM, Fuger J, Katz JJ (eds) Химия актинидных и трансактинидных элементов. Спрингер, Дордрехт, Нидерланды, стр. 1893–2012. https://doi.org/10.1007/1-4020-3598-5_17
Google Scholar
Heaven MC (2006) Исследование электронной структуры актинидов с помощью флуоресцентной и многофотонной ионизационной спектроскопии. Phys Chem Chem Phys 8: 4497–4509. https://doi.org/10.1039/B607486C
CAS Статья PubMed Google Scholar
Марсало Дж., Гибсон Дж. К. (2009) Газовая энергетика оксидов актиноидов: оценка нейтральных и катионных монооксидов и диоксидов от тория до кюрия. J. Phys Chem A 113: 12599–12606. https://doi.org/10.1021/jp2a
J. Phys Chem A 113: 12599–12606. https://doi.org/10.1021/jp2a
CAS Статья PubMed Google Scholar
Долг М., Сао Х (2009) Вычислительные методы: лантаноиды и актиниды. В: Соломон Э.И., Скотт Р.А., Кинг Р.Б. (ред.) Вычислительная неорганическая и биоинорганическая химия.Wiley, Chichester, стр. 503–516. https://doi.org/10.1002/0470862106.ia640
Google Scholar
Heaven MC, Гибсон Дж. К., Марсало Дж. (2011) Молекулярная спектроскопия и реакции актинидов в газовой фазе и криогенных матрицах. В: Эдельштейн Н.М., Фугер Дж., Морсс Л.Р. (ред.) Химия актинидных и трансактинидных элементов, том 6. Springer, Dordrecht, pp 4079–4156. https://doi.org/10.1007/978-94-007-0211-0_38
Google Scholar
Wang D, van Gunsteren WF, Chai Z (2012) Последние достижения в вычислительной химии актиноидов. Chem Soc Rev 41: 5836–5865. https://doi.org/10.1039/C2CS15354H
CAS Статья PubMed Google Scholar
Конингс Р.Д.М., Бенеш О., Ковач А., Манара Д., Седмидубский Д., Горохов Л., Иориш В.С., Юнгман В., Шенявская Е., Осина Е. (2014) Термодинамические свойства f-элементов и их соединений. Часть II. Оксиды лантаноидов и актинидов.Справочные данные J Phys Chem 43: 013101. https://doi.org/10.1063/1.4825256
CAS Статья Google Scholar
Ковач А., Конингс Р.Дж., Гибсон Дж. К., Инфанте И., Гальярди Л. (2015) Квантово-химические расчеты и экспериментальные исследования молекулярных оксидов актинидов. Chem Rev 115: 1725–1759. https://doi.org/10.1021/cr500426s
CAS Статья PubMed Google Scholar
Morss LR, Edelstein NM, Fuger J (eds) (2006) Химия актинидных и трансактинидных элементов. Спрингер, Дордрехт. https://doi.org/10.1007/1-4020-3598-5_5
Спрингер, Дордрехт. https://doi.org/10.1007/1-4020-3598-5_5
Heaven MC, Петерсон К.А. (2018) Исследование актинидных связей в газовой фазе: теория и спектроскопия. В: Гибсон Дж. К., де Йонг В. А. (ред.) Экспериментальные и теоретические подходы к химии актинидов. John Wiley & Sons, Inc., Хобокен, Нью-Джерси, стр. 1–52. https://doi.org/10.1002/978111
57.ch2Google Scholar
Дау П.Д., Василиу М., Петерсон К.А., Диксон Д.А., Гибсон Дж.К. (2017) Замечательно высокая стабильность катионов диоксида поздних актинидов: расширение химии до пятивалентного берклия и калифорния. Chem Eur J 23 (68): 17369–17378. https://doi.org/10.1002/chem.201704193
CAS Статья PubMed Google Scholar
Василиу М., Цзян Т., Гибсон Дж. К., Петерсон К.А., Диксон Д.А. (2020) Вычислительная оценка катионов диоксида актинида AnO 2 2+ для An = U до Lr: ограниченный диапазон стабильности шестивалентный актинильный фрагмент, [O = An = O] 2+ .Inorg Chem 59 (7): 4554–4566. https://doi.org/10.1021/acs.inorgchem.9b03690
CAS Статья PubMed Google Scholar
Li Y, Zou J, Xiong XG, Xie H, Tang Z, Ge M, Zhao Y, Liu H (2018) Анионная фотоэлектронная спектроскопия и химическая связь ThO 2 — и ThO 3 — . J. Chem Phys 148 (24): 244304. https://doi.org/10.1063/1.5030142
CAS Статья PubMed Google Scholar
Su J, Hu S, Huang W, Zhou M, Li J (2016) О степенях окисления металлических элементов в MO 3 — (M = V, Nb, Ta, Db, Pr, Gd, Pa) анионы. Sci China Chem 59 (4): 442–451. https://doi.org/10.1007/s11426-015-5481-z
CAS Статья Google Scholar

де Йонг В.А., Дау П.Д., Уилсон Р.Э., Марсало Дж., Ван Стипдонк М.Дж., Корковилос Т.А., Берден Дж., Мартенс Дж., Ооменс Дж., Гибсон Дж. К. (2017) Выявление разного химического состава протактиния и урана.Синтез молекулярного аниона тетроксида урана, UO 4 — . Inorg Chem 56 (6): 3686-3694. DOI: https: //doi.org/10.1021/acs.inorgchem.7b00144
Габельник С.Д., Риди Г.Т., Часанов М.Г. (1973) Инфракрасный спектр частиц паров оксида урана, изолированных в матрице. Chem Phys Lett 19 (1): 90–93. https://doi.org/10.1016/0009-2614(73)87070-8
CAS Статья Google Scholar
Габельник С.Д., Риди Г.Т., Часанов М.Г. (1973) Инфракрасные спектры матрично-изолированных частиц оксида урана.I. Область растяжения. J. Chem Phys 58 (10): 4468–4475. https://doi.org/10.1063/1.1679009
CAS Статья Google Scholar
Габельник С.Д., Риди Г.Т., Часанов М.Г. (1973) Инфракрасные спектры матрично-изолированных частиц оксида урана. II. Спектральная интерпретация и структура UO 3 . J. Chem Phys 59: 6397-6404. https://doi.org/10.1063/1.1680018
CAS Статья Google Scholar
Green DW (1980) Стандартные энтальпии образования газообразных оксидов тория, урана и плутония. Int J Thermophys 1 (1): 61–71. https://doi.org/10.1007/BF00506272
CAS Статья Google Scholar
Hunt RD, Andrews L (1993) Реакции испаренных импульсным лазером атомов урана с молекулярным кислородом: инфракрасные спектры UO, UO 2 , UO 3 , UO 2 + , UO 2 2+ и UO 3 -O 2 в твердом аргоне.J. Chem Phys 98 (5): 3690–3696. https://doi.org/10.1063/1.464045
CAS Статья Google Scholar

Zhou M, Andrews L, Ismail N, Marsden C (2000) Инфракрасные спектры UO 2 , UO 2 + и UO 2 — в сплошном неоне. J. Phys Chem. 104 (23): 5495–5502. https://doi.org/10.1021/jp000292q
CAS Статья Google Scholar
Green DW, Reedy GT, Gabelnick SD (1980) Инфракрасные спектры матрично-изолированных оксидов урана. III. Низкочастотные режимы. J. Chem Phys. 73 (9): 4207–4216. https://doi.org/10.1063/1.440704
CAS Статья Google Scholar
Pyykkö P, Li J, Runeberg N (1994) Квазирелятивистское псевдопотенциальное исследование видов, изоэлектронных уранилу и экваториальной координации уранила. J. Phys Chem. 98 (18): 4809–4813. https: // doi.org / 10.1021 / j100069a007
Артикул Google Scholar
Привалов Т., Шиммельпфенниг Б., Вальгрен У., Гренте И. (2002) Структура и термодинамика комплексов урана (VI) в газовой фазе: сравнение экспериментальных и неэмпирических данных. J. Phys Chem A 106 (46): 11277–11282. https://doi.org/10.1021/jp0260402
Зайцевский А.В. (2013) Молекулярные анионы фторидов и оксидов урана: релятивистский расчет из первых принципов.Радиохимия 55 (4): 353–356. https://doi.org/10.1134/S1066362213040012
CAS Статья Google Scholar
Su J, Li WL, Lopez GV, Jian T, Cao GJ, Li WL, Schwarz WHE, Wang LS, Li J (2016) Исследование электронной структуры и химической связи монооксидов урана с различным окислением состояния: UO x — и UO x (x = 3-5). J. Phys Chem A 120 (7): 1084–1096. https://doi.org/10.1021 / acs.jpca.5b11354
CAS Статья PubMed Google Scholar
Yang Y, Liu H, Zhang P (2016) Структурные и электронные свойства кластеров U n O m (n = 1-3, m = 1-3n): теоретическое исследование с использованием экранированных гибридная теория функционала плотности. J. Chem Phys 144 (18): 184304. https://doi.org/10.1063/1.4948779
J. Chem Phys 144 (18): 184304. https://doi.org/10.1063/1.4948779
CAS Статья PubMed Google Scholar
Ковач А. (2017) Релятивистское многореферентное квантово-химическое исследование электронной структуры молекул триоксида актинида. J. Phys Chem A 121: 2523–2530. https://doi.org/10.1021/acs.jpca.7b01344
CAS Статья PubMed Google Scholar
Миддлтон Р. (1977) Обзор отрицательных ионов от источника цезиевого распыления. Методы Nucl Inst 144 (3): 373–399. https://doi.org/10.1016/0029-554X(77)-5
CAS Статья Google Scholar
Марсало Дж., Сантос М., Пирес де Матос А., Гибсон Дж. К. (2009) Молекулярные уранаты: лазерный синтез анионов оксида урана в газовой фазе. Inorg Chem 48 (12): 5055–5057. https://doi.org/10.1021/ic
98
CAS Статья PubMed Google Scholar
Ronchi C, Capone F, Colle JY, Hiernaut JP (2000) Летучая молекула PuO 3 , наблюдаемая при сублимации диоксида плутония. J Nucl Mater 280 (1): 111–115. https: // doi.org / 10.1016 / S0022-3115 (00) 00058-1
CAS Статья Google Scholar
Straka M, Dyall KG, Pyykkö P (2001) Ab initio исследование тенденций связывания для f 0 видов оксифторида актинида. Счета Theor Chem. 106 (6): 393–403. https://doi.org/10.1007/s002140100295
CAS Статья Google Scholar
Gao T, Zhu ZH, Wang XL, Sun Y, Meng DQ (2004) Молекулярные структуры и молекулярные спектры PuO 3 и PuO 3 + .Acta Chim Sin 62 (5): 454–460
CAS Google Scholar
Зайцевский А. В., Титов А.В., Мальков С.С., Тананаев И.Г., Киселев Ю.М. (2013) О существовании оксидных молекул плутония в высших степенях окисления. Докл. Хим. 448 (1): 1–3. https://doi.org/10.1134/S0012500813010023
В., Титов А.В., Мальков С.С., Тананаев И.Г., Киселев Ю.М. (2013) О существовании оксидных молекул плутония в высших степенях окисления. Докл. Хим. 448 (1): 1–3. https://doi.org/10.1134/S0012500813010023
CAS Статья Google Scholar
Зайцевский А., Мосягин Н.С., Титов А.В., Киселев Ю.М. (2013) Моделирование релятивистской теории функционала плотности молекул высших оксидов плутония и америция.J. Chem Phys 139 (3): 034307. https://doi.org/10.1063/1.4813284
CAS Статья PubMed Google Scholar
Богуславски К., Реал Ф, Текмер П., Дюперрузель С., Гомес АСП, Легеза Ö, Эйерс П. В., Валле V (2017) О многореференсной природе оксидов плутония: PuO 2 2+ , PuO 2 , PuO 3 и PuO 2 (OH) 2 . Phys Chem Chem Phys 19: 4317–4329. https: // doi.org / 10.1039 / c6cp05429c
CAS Статья PubMed Google Scholar
Legeza Ö, Noack R, Sólyom J, Tincani L (2008) Применение квантовой информации в ренормализационной группе матрицы плотности. В: Fehske H, Schneider R, Weiße A (eds) Computational Multi-Part Physics, vol 739. Springer, Berlin / Heidelberg, pp 653–664. https://doi.org/10.1007/978-3-540-74686-7_24
Google Scholar
Li Q, Liu XY, Gao T, Zhu ZH, Fu YB, Wang XL, Sun Y (2000) Функция потенциальной энергии и стабильность PuO n + . Acta Phys-Chim Sin 16 (11): 987–991. https://doi.org/10.3866/PKU.WHXB20001106
Li Q, Liu XY, Wang R, Zhu ZH, Fu YB, Wang XL (2001) Исследование аналитической функции потенциальной энергии и стабильности PuO n + с помощью теории функционала плотности. Chin Phys 10 (6): 501–504
Статья Google Scholar

Gibson JK, de Jong WA, Dau PD, Gong Y (2017) Четырехвалентные тетроксиды актинидов NpO 4 — и PuO 4 —: окисление Pu (V) до Pu (VII) путем добавления электрона к PuO 4 . J. Phys Chem A 121 (47): 9156–9162. https://doi.org/10.1021/acs.jpca.7b09721
CAS Статья PubMed Google Scholar
Доманов В.П., Лобанов Ю.В. (2011) Образование летучего триоксида кюрия (VI) CmO 3 .Радиохимия 53 (5): 453–456. https://doi.org/10.1134/S1066362211050018
CAS Статья Google Scholar
Зайцевский А.А., Мосягин Н.С., Титов А.В., Киселев Ю.М. Тезисы докладов. В: Российско-Северный симпозиум по радиохимии, Москва, 21-24 октября 2013 г., 2013. Idea Print, p 36
Зайцевский А. (2015) Триоксиды плутония и трансплутония: молекулярные структуры, химическая связь и изомеры.Phys Chem Chem Phys 17: 24831–24836. https://doi.org/10.1039/C5CP02190A
CAS Статья PubMed Google Scholar
Зайцевский А.В., Скрипников Л.В., Титов А.В. (2016) Химическая связь и эффективные атомные состояния актинидов в молекулах высших оксидов. Менделеев Коммуна 26 (4): 307–308. https://doi.org/10.1016/j.mencom.2016.07.013
CAS Статья Google Scholar
Michelini MC, Marçalo J, Russo N, Gibson JK (2010) Газофазные реакции уранат-ионов, UO 2 —, UO 3 —, UO 4 — и UO 4 H — , с метанолом: конвергенция эксперимента и теории. Inorg Chem 49 (8): 3836–3850. https://doi.org/10.1021/ic0g
CAS Статья Google Scholar
Sokalska M, Prussakowska M, Hoffmann M, Gierczyk B, Frański R (2010) Необычный ион UO 4 — , образованный в результате индуцированной столкновением диссоциации [UO 2 (NO 3 ) ) 3 ] — , [UO 2 (ClO 4 ) 3 ] — , [UO 2 (CH 3 COO) 3 ] — ионы. J Am Soc Mass Spectrom 21 (10): 1789–1794. https://doi.org/10.1016/j.jasms.2010.06.018
J Am Soc Mass Spectrom 21 (10): 1789–1794. https://doi.org/10.1016/j.jasms.2010.06.018
CAS Статья PubMed Google Scholar
Zhai HJ, Kiran B, Cui LF, Li X, Dixon DA, Wang LS (2004) Электронная структура и химическая связь в кластерах MO n — и MO n (M = Mo, W; n = 3-5): фотоэлектронная спектроскопия и исследование ab initio. J Am Chem Soc 126 (49): 16134–16141. https: // doi.org / 10.1021 / ja046536s
CAS Статья PubMed Google Scholar
Chen Z-Y, Yang J-L (2007) Атомная и молекулярная хемосорбция кислорода в кластерах WO 4 — . Chin J Chem Phys 20 (1): 78–82. https://doi.org/10.1360/cjcp2007.20(1).78.5
CAS Статья Google Scholar
Pyykko P, Zhao Y (1991) Большой диапазон длин уранильных связей: ab initio расчеты на простых уран-кислородных кластерах.Inorg Chem 30 (19): 3787–3788. https://doi.org/10.1021/ic00019a046
CAS Статья Google Scholar
Bolvin H, Wahlgren U, Gropen O, Marsden CJ (2001) Ab Initio изучает две изоэлектронные молекулы NpO 4 — и UO 4 2- . J. Phys Chem A 105 (46): 10570-10576. https://doi.org/10.1021/jp011240j
Huang W., Xu W-H, Su J, Schwarz WHE, Li J (2013) Состояния окисления, геометрия и электронная структура четырехокиси плутония PuO 4 изомеры: октавалентный Pu жизнеспособен? Inorg Chem 52 (24): 14237–14245.https://doi.org/10.1021/ic402170q
CAS Статья PubMed Google Scholar
Groenewold GS, Cossel KC, Gresham GL, Gianotto AK, Appelhans AD, Olson JE, Van Stipdonk MJ, Chien W (2006) Связывание молекулярного O 2 с ди- и трилигированным [UO 2 ] + . J Am Chem Soc 128 (9): 3075–3084. https://doi.org/10.1021/ja0573209
J Am Chem Soc 128 (9): 3075–3084. https://doi.org/10.1021/ja0573209
CAS Статья PubMed Google Scholar
Leavitt CM, Bryantsev VS, Jong WA, Diallo MS, Goddard III WA, Groenewold GS, Stipdonk MJV (2009) Добавление H 2 O и O 2 к лигированным ацетоном и диметилсульфоксидом диоксокатионам уранила (V). J. Phys Chem A 113 (11): 2350–2358. https://doi.org/10.1021/jp807651c
CAS Статья PubMed Google Scholar
Брянцев В.С., де Йонг В.А., Коссель К.С., Диалло М.С., Годдард III ВА, Гроенвольд Г.С., Чиен В., Ван Стипдонк М.Дж. (2008) Двухэлектронная трехцентровая связь сбоку (η 2 ) супероксокомплексы уранила (V).J. Phys Chem. A 112: 5777–5780. https://doi.org/10.1021/jp804202q
CAS Статья PubMed Google Scholar
Rios D, Michelini MC, Lucena AF, Marçalo J, Bray TH, Gibson JK (2012) Уранил, нептунил и плутонил в газовой фазе: гидратация и окисление изучены экспериментально и теоретически. Inorg Chem 51 (12): 6603–6614. https://doi.org/10.1021/ic3001625
CAS Статья PubMed Google Scholar
Ricks AM, Gagliardi L, Duncan MA (2011) Оксо- и супероксокатионы урана, обнаруженные с помощью инфракрасной спектроскопии в газовой фазе. J. Phys Chem Lett. 2 (14): 1662–1666. https://doi.org/10.1021/jz2006868
CAS Статья Google Scholar
Momenteau M, Reed CA (1994) Синтетические гем-дикислородные комплексы. Chem Rev 94 (3): 659–698. https://doi.org/10.1021/cr00027a006
CAS Статья Google Scholar
Dau PD, Maurice R, Renault E, Gibson JK (2016) Гептавалентный нептуний в газофазном комплексе: (Np VII O 3 + ) (NO 3 —) 2 . Inorg Chem 55: 9830–9837. https://doi.org/10.1021/acs.inorgchem.6b01617
Inorg Chem 55: 9830–9837. https://doi.org/10.1021/acs.inorgchem.6b01617
CAS Статья PubMed Google Scholar
Jové J, He L, Proust J, Pagès M, Pyykkö P (1991) Мессбауэровская спектроскопия как ядерный зонд для твердотельной трансурановой химии.Дж. Сплавы. Compd. 177 (2): 285–309. https://doi.org/10.1016/0925-8388(91)
Артикул Google Scholar
Доманов В.П., Букланов Г.В., Лобанов Ю.В. (2002) Образование необычных оксидов U, Pu и Cf в условиях газовой термохроматографии. Радиохим 44 (2): 114–120. https://doi.org/10.1023/a:1019654825664
CAS Статья Google Scholar
Доманов В.П., Буклаев Г.В., Лобанов Ю.В. (2002) Новые экзотические оксиды плутония, обнаруженные с помощью газовой термохроматографии. J Nucl Sci Technol 39 (sup3): 579-584. https://doi.org/10.1080/00223131.2002.10875535
Першина В., Бастуг Т., Фрике Б., Варга С. (2001) Электронная структура и свойства оксидов группы 8 MO 4 , где M = Ru, Os, и элемент 108, Hs. J. Chem Phys 115 (2): 792–799. https://doi.org/10.1063/1.1379579
CAS Статья Google Scholar
Hübener S, Taut S, Vahle A, Bernhard G, Fanghänel T (2008) Термохроматографические исследования оксидов плутония. Radiochim Acta 96: 781–785. https://doi.org/10.1524/ract.2008.1522
CAS Статья Google Scholar
Никонов М.В., Киселев Ю.М., Тананаев И.Г., Мясоедов Б.Ф. (2011) Летучесть плутония при озонировании щелочных растворов гидроксокомплексов Pu (VI). Докл. Хим. 437 (1): 69–71. https://doi.org/10.1134/S0012500811030104
CAS Статья Google Scholar
Антонио М. Р., Уильямс К. В., Салливан Дж. А., Скантакумар С., Ху И-Дж., Содерхольм Л. (2012) Получение, стабильность и структурные характеристики плутония (VII) в щелочном водном растворе. Inorg Chem 51 (9): 5274–5281. https://doi.org/10.1021/ic300205h
В., Салливан Дж. А., Скантакумар С., Ху И-Дж., Содерхольм Л. (2012) Получение, стабильность и структурные характеристики плутония (VII) в щелочном водном растворе. Inorg Chem 51 (9): 5274–5281. https://doi.org/10.1021/ic300205h
CAS Статья PubMed Google Scholar
Шилов В.П., Федосеев А.М., Гоголев А.В. (2017) Устойчивость тетраоксидов химических элементов. Russ J Gen Chem 87 (10): 2265–2268.https://doi.org/10.1134/S1070363217100036
CAS Статья Google Scholar
Tsushima S (2008) Квантово-химические расчеты окислительно-восстановительного потенциала пары Pu (VII) / Pu (VIII). J. Phys Chem B 112 (41): 13059–13063. https://doi.org/10.1021/jp804856z
CAS Статья PubMed Google Scholar
Зайцевский А., Шварц WHE (2014) Структуры и стабильность изомеров AnO 4 , An = Pu, Am и Cm: исследование релятивистского функционала плотности.Phys Chem Chem Phys 16: 8997–9001. https://doi.org/10.1039/C4CP00235K
CAS Статья PubMed Google Scholar
Huang W, Pyykkö P, Li J (2015) Возможен ли октавалентный Pu (VIII)? Картирование ряда оксифторида плутония PuO n F 8–2n (n = 0–4). Inorg Chem 54: 8825–8831. https://doi.org/10.1021/acs.inorgchem.5b01540
CAS Статья PubMed Google Scholar
Хуанг В., Сюй В-Х, Шварц WHE, Ли Дж. (2016) О высших степенях окисления металлических элементов в молекулах MO 4 (M = Fe, Ru, Os, Hs, Sm и Pu). Inorg Chem 55: 4616–4625. https://doi.org/10.1021/acs.inorgchem.6b00442
CAS Статья PubMed Google Scholar
Доманов В.П. (2013) Возможность образования октавалентного кюрия в газовой фазе в виде летучего тетраоксида CmO 4 . Радиохимия 55 (1): 46–51. https://doi.org/10.1134/S1066362213010098
Радиохимия 55 (1): 46–51. https://doi.org/10.1134/S1066362213010098
CAS Статья Google Scholar
Pyykkö P, Runeberg N, Straka M, Dyall KG (2000) Может ли существовать гексоксид урана (XII), UO 6 (Oh)? Chem Phys Lett 328 (4-6): 415–419. https://doi.org/10.1016/S0009-2614(00)00958-1
Артикул Google Scholar
Xiao H, Hu H-S, Schwarz WHE, Li J (2010) Теоретические исследования геометрии, электронной структуры и стабильности UO 6 : октаэдрический гексоксид урана и его изомеры.J. Phys Chem. 114 (33): 8837–8844. https://doi.org/10.1021/jp102107n
CAS Статья PubMed Google Scholar
Burns PC, Hughes KA (2003) Studtite, [(UO 2 ) (O 2 ) (H 2 O) 2 ] (H 2 O) 2 : первая структура пероксидного минерала. Am Mineral 88 (7): 1165–1168. https://doi.org/10.2138/am-2003-0725
CAS Статья Google Scholar
Сережкина Л.Б., Савченков А.В., Сережкин В.Н. (2017) Стереохимия тория в кислородсодержащих соединениях. Russ J Inorg Chem 62 (5): 633–638. https://doi.org/10.1134/s0036023617050217
CAS Статья Google Scholar
Сережкин В.Н., Карасев М.О., Сережкина Л.Б. (2013) Причины нелинейности иона уранила в кристаллических структурах. Радиохимия 55 (2): 137–146. https://doi.org/10.1134/s106636221302001x
CAS Статья Google Scholar
Сережкин В.Н., Сережкина Л.Б. (2018) Стереохимия нептуния в кислородсодержащих соединениях. Радиохимия 60 (1): 1–12. https://doi.org/10.1134/s1066362218010010
CAS Статья Google Scholar

Сережкин В.Н., Пушкин Д.В., Сережкина Л.Б. (2018) Стереохимия плутония в кислородсодержащих соединениях. Радиохимия 60 (3): 221–232. https://doi.org/10.1134/s1066362218030013
CAS Статья Google Scholar
Сережкин В.Н., Сережкина Л.Б. (2018) Стереохимия америция и кюрия в кислородсодержащих соединениях. Радиохимия 60 (4): 335–344. https://doi.org/10.1134/s106636221804001x
CAS Статья Google Scholar
Сережкина Л.Б., Сережкин В.Н. (2018) Стереохимия Bk, Cf и Es в кислородсодержащих соединениях. Радиохимия 60 (5): 488–497. https://doi.org/10.1134/s106636221805003x
CAS Статья Google Scholar
Kresse G, Furthmüller J (1996) Эффективные итерационные схемы для ab initio вычислений полной энергии с использованием базисного набора плоских волн. Phys Rev B 54: 11169–11186. https://doi.org/10.1103/PhysRevB.54.11169
CAS Статья Google Scholar
Zhang C, Hu SX, Liu HT, Yang Y, Zhang P (2018) Связующие свойства и степени окисления плутония в Pu 2 O n (n = 1-8) молекул изучены с использованием экранированная гибридная теория функционала плотности.J. Phys Chem. 122 (16): 4085-4091. https://doi.org/10.1021/acs.jpca.7b12324
CAS Статья PubMed Google Scholar
Sullivan JC, Hindman JC, Zielen AJ (1961) Специфическое взаимодействие между Np (V) и U (VI) в водных средах с хлорной кислотой. J Am Chem Soc 83 (16): 3373–3378. https://doi.org/10.1021/ja01477a004
CAS Статья Google Scholar
Newton TW, Baker FB (1965) Комплекс уран (V) -уран (VI) и его влияние на скорость диспропорционирования урана (V). Inorg Chem 4 (8): 1166–1170. https://doi.org/10.1021/ic50030a017
https://doi.org/10.1021/ic50030a017
CAS Статья Google Scholar
Гийом Б., Бегун Г.М., Хан Р.Л. (1982) Рамановские спектрометрические исследования комплексов «катион-катион» пятивалентных актинидов в водных растворах перхлоратов. Inorg Chem 21 (3): 1159–1166. https: // doi.org / 10.1021 / ic00133a055
CAS Статья Google Scholar
Гийом Б., Хан Р.Л., Нартен А.Х. (1983) Исследования комплексов «катион-катион» растворов NpO 2 + методом рассеяния рентгеновских лучей на большие углы. Inorg Chem 22 (1): 109–111. https://doi.org/10.1021/ic00143a024
CAS Статья Google Scholar
Stoyer NJ, Hoffman DC, Stoyer NJ, Hoffman DC, Stoyer NJ, Hoffman DC, Silva RJ (2000) Катион-катионные комплексы PuO 2 + и NpO 2 + с Th 4+ и UO 2 2+ .Radiochim Acta 88 (36647): 279–282. https://doi.org/10.1524/ract.2000.88.5.279
CAS Статья Google Scholar
Gregoire-Kappenstein AC, Moisy P, Cote G, Blanc P (2003) Димеризация Np (V) и эффекты среды в концентрированных растворах. Radiochim Acta 91 (11): 665–672. https://doi.org/10.1524/ract.91.11.665.23472
CAS Статья Google Scholar
Den Auwer C, Grégoire-Kappenstein AC, Moisy P (2003) Катион-катионные взаимодействия Np (V). Новый вклад EXAFS-спектроскопии? Radiochim Acta 91 (12): 773–776. https://doi.org/10.1524/ract.91.12.773.23419
CAS Статья Google Scholar
Крот Н.Н., Григорьев М.С. (2004) Катион-катионное взаимодействие в кристаллических актинидных соединениях. Russ Chem Rev 73 (1): 89–100. https://doi.org/10.1070/RC2004v073n01ABEH000852
https://doi.org/10.1070/RC2004v073n01ABEH000852
CAS Статья Google Scholar
Forbes TZ, Wallace C, Burns PC (2008) Нептунильные соединения: геометрия многогранников, параметры валентности связей и структурная иерархия. Can Mineral 46 (6): 1623–1645. https://doi.org/10.3749/canmin.46.6.1623
CAS Статья Google Scholar
Jin GB (2013) Соединение смешанного валентного нептуния (IV / V) с шестичленными нептунильными кольцами, связанными катионами. Inorg Chem 52 (21): 12317–12319. https://doi.org/10.1021/ic4021492
Сережкин В.Н., Сидоренко Г.В., Пушкин Д.В., Сережкина Л.Б. (2014) Катион-катионные взаимодействия между ионами уранила (VI). Радиохимия 56 (2): 115–133. https://doi.org/10.1134/s1066362214020015
CAS Статья Google Scholar
Mougel V, Horeglad P, Nocton G, Pécaut J, Mazzanti M (2009) Стабильные пятивалентные разновидности уранила и селективная сборка полиметаллического смешанно-валентного уранилового комплекса посредством катион-катионных взаимодействий.Angew Chem Int Ed 48 (45): 8477–8480. https://doi.org/10.1002/anie.2007
CAS Статья Google Scholar
WebElements. Авторские права 1993-2019, Марк Винтер (Университет Шеффилда и WebElements Ltd, Великобритания). http://www.webelements.com. По состоянию на 20 мая 2020 г.
McKee ML, Swart M (2005) Исследование Hg 2 2+ и комплексов NpO 2 + и UO 2 2+ в растворе.Примеры катион-катионных взаимодействий. Inorg Chem 44 (20): 6975–6982. https://doi.org/10.1021/ic050224o
CAS Статья PubMed Google Scholar
Tecmer P, Hong SW, Boguslawski K (2016) Рассмотрение катион-катионного взаимодействия между двумя уранильными звеньями.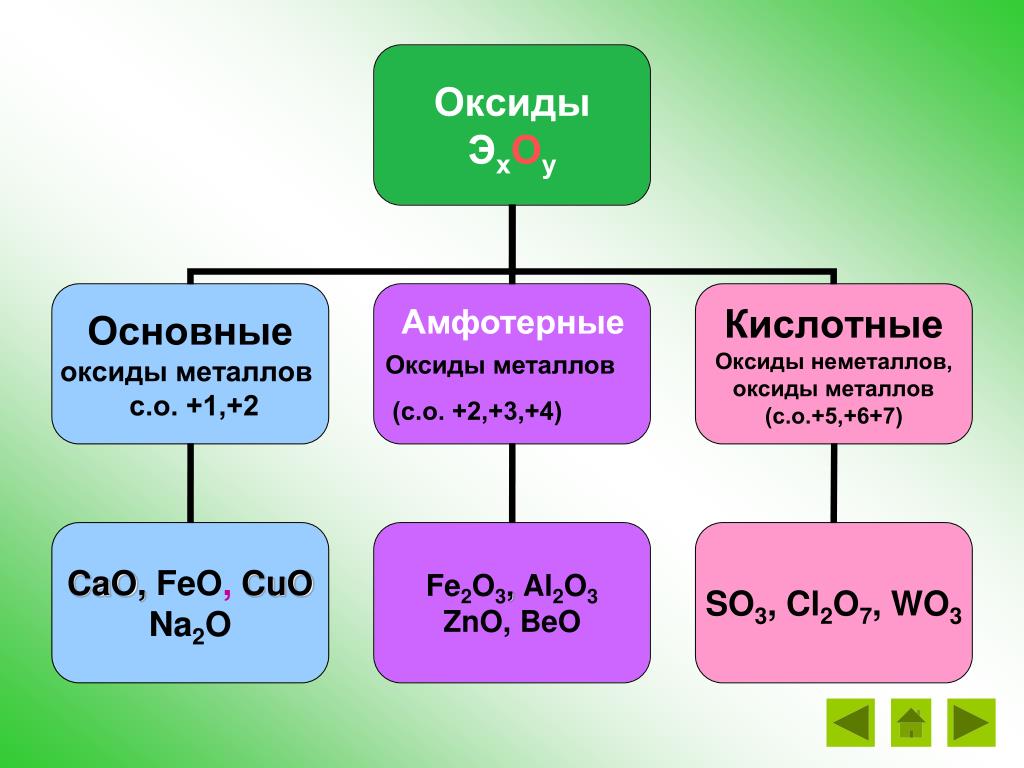 Phys Chem Chem Phys 18 (27): 18305–18311. https://doi.org/10.1039/C6CP03542F
Phys Chem Chem Phys 18 (27): 18305–18311. https://doi.org/10.1039/C6CP03542F
CAS Статья PubMed Google Scholar
Cousson A, Dabos S, Abazli H, Nectoux F, Pagès M, Choppin G (1984) Кристаллическая структура комплекса катион-катион нептунил (NpO 2 + ) с меллитовой кислотой: Na 4 (NpO 2 ) 2 Cl 12 O 12 · 8H 2 O. J Менее распространенный Met 99 (2): 233–240. https://doi.org/10.1016/0022-5088(84)
CAS Статья Google Scholar
Влайсавлевич Б., Миро П., Ма Д., Сигмон Г.Е., Бернс П.С., Крамер С.Дж., Гальярди Л. (2013) Синтез и характеристика первой двумерной структуры нептунила, стабилизированной боковыми катион-катионными взаимодействиями.Chem Eur J 19 (9): 2937–2941. https://doi.org/10.1002/chem.201204149
CAS Статья PubMed Google Scholar
achmańska A, Tecmer P, Legeza Ö, Boguslawski K (2019) Выяснение катион-катионных взаимодействий в нептунилдикатионах с использованием теории ab initio с несколькими ссылками. Phys Chem Chem Phys 21 (2): 744–759. https://doi.org/10.1039/c8cp04267e
CAS Статья PubMed Google Scholar
Madic C, Guillaume B, Morisseau JC, Moulin JP (1979) «Катион-катионные» комплексы пятивалентных актинидов-I. Спектрофотометрическое исследование комплексов нептуния (V) с ионами UO 2 2+ и NpO 2 2+ в водных растворах хлорной и азотной кислоты. J. Inorg Nucl Chem. 41 (7): 1027–1031. https://doi.org/10.1016/0022-1902(79)80082-2
CAS Статья Google Scholar
Фенг Р., Гленденинг Э.Д., Петерсон К.А. (2019) Взаимодействие катион-актинил-катион в газовой фазе: точное термохимическое исследование. Phys Chem Chem Phys 21 (15): 7953–7964. https://doi.org/10.1039/c9cp00760a
Phys Chem Chem Phys 21 (15): 7953–7964. https://doi.org/10.1039/c9cp00760a
CAS Статья PubMed Google Scholar
Somogyi A., Pasilis SP, Pemberton JE (2007) Ионизация уранил-цитратных комплексов электрораспылением: образование аддукта и ионно-молекулярные реакции в трехмерных ионных ловушках и приборах для захвата ионного циклотронного резонанса. Int J Mass Spectrom 265 (2): 281–294. https://doi.org/10.1016/j.ijms.2007.02.050
CAS Статья Google Scholar
Антиоксиданты вступают в реакцию с высшими оксидами азота, но не с оксидом азота: терапевтическое значение
Абстракция 1840 Стендовая сессия I, суббота, 1/5 (плакат 87)
ВВЕДЕНИЕ : Оксид азота (NO) обладает противовоспалительными свойствами в базовых условиях, где производство низкое.Однако остается загадкой, почему NO проявляет провоспалительные свойства при хроническом воспалении; условия, при которых продукция NO повышена. Исходя из этого, мы должны либо предположить, что противовоспалительное действие слабое и имеет незначительные последствия, либо другие факторы влияют на роль NO в хроническом воспалении. Мы предположили, что ответ на эту загадку может заключаться в превращении NO в другие, высшие оксиды азота (NO 2 , N 2 O 3 , ONOO —), которые гораздо более реактивны, чем сам NO. .Чтобы решить эту проблему, мы использовали антиоксиданты, чтобы свести на нет уровни оксидов азота и их клеточные последствия, а также тестирование на внутреннюю реактивность между видами. МЕТОДЫ : Уровни NO контролировали электрохимически с использованием микроэлектрода, который выборочно измерял уровни NO в растворе. Антиоксиданты инкубировали с NO в присутствии и в отсутствие кислорода. Скорость разложения NO (в присутствии кислорода) определяли вместе со спектральным анализом антиоксиданта.

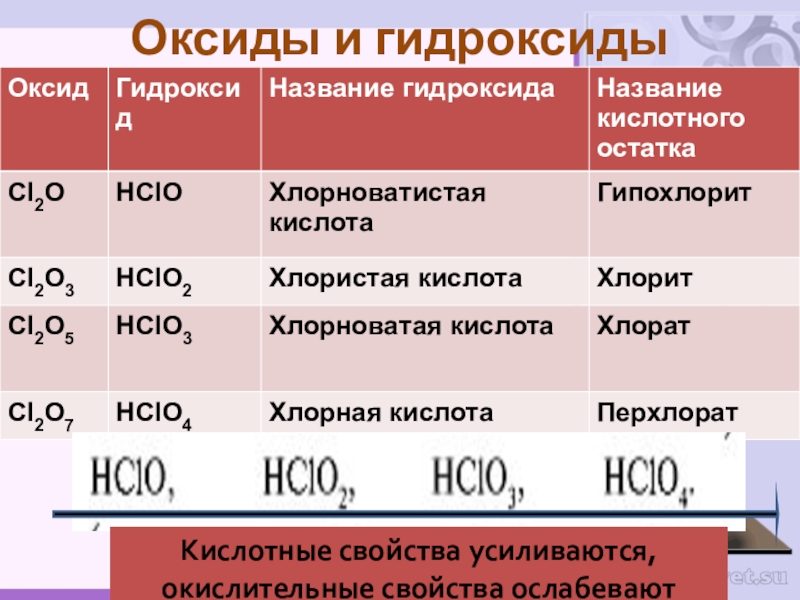 Таблица растворимости по химии. Летучие водородные соединения. Растворимость, относительные молекулярные массы солей, кислот, оснований, оксидов, органических веществ. Ряды: электроотрицательности, анионов, активности и напряжений металлов.
Таблица растворимости по химии. Летучие водородные соединения. Растворимость, относительные молекулярные массы солей, кислот, оснований, оксидов, органических веществ. Ряды: электроотрицательности, анионов, активности и напряжений металлов.