Реакции нейтрализации
Реакция нейтрализации (например, серной кислоты) в водоеме за счет бикарбонатов кальция протекает по формуле Са(НС03)24-Н2304=Са304+2Н20+2С02.[ …]
Нейтрализация известняком не всегда эффективна, так как в присутствии серной кислоты гипс, образующийся на поверхности частиц известняка, тормозит дальнейший ход реакции нейтрализации.[ …]
Реакция нейтрализации — это химическая реакция между веществами, имеющими свойства кислоты и основания, которая приводит к потере характерных свойств обоих соединений. Наиболее типичная реакция нейтрализации в водных растворах происходит между гидратированными ионами водорода и ионами гидроксида, содержащимися соответственно в сильных кислотах и основаниях: Н+ + 0Н =Н20. В результате концентрация каждого из этих ионов становится равной той, которая свойственна самой воде (около 10 7), т. е. активная реакция водной среды приближается к рН=7.[ …]
Реакция взаимодействия основания с кислотой, в результате которой получается соль и вода, является реакцией нейтрализации.[ …]
Нейтрализация фильтрацией заключается в том, что сточную жидкость пропускают через слой фильтрующего материала. При прохождении жидкости через такой фильтр реакция нейтрализации должна полностью заканчиваться. В качестве фильтрующего материала для нейтрализации кислот применяют известняк, мрамор и доломит. Этот способ имеет ряд преимуществ: он более прост и дешев, эффективен при неравномерной концентрации кислот в сточных водах.[ …]
Реакцию нейтрализации кислот можно проводить также и с помощью других реагентов типа оснований. Расход этих веществ для нейтрализации 1 г различных кислот (стехиометрично) приведен в табл. 6.[ …]
Реакция нейтрализации и вычисление по этой реакции количества неизвестного вещества имеет очень широкое применение в агрохимических лабораториях. Подобного рода вычисления возможны по всем химическим правильно составленным уравнениям.[ …]
Реакция нейтрализации протекает очень быстро, и при дальнейшем смешивании вся масса сточных вод приобретает одинаковое значение pH в течение нескольких минут.
Для нейтрализации вод первого типа могут быть использованы любые из указанных выше реагентов. При нейтрализации вод второго типа соли не только выпадают в осадок, но при больших концентрациях могут отлагаться на поверхности нейтрализующего материала и тормозить ход реакции. Нейтрализация вод третьего типа возможна только растворами щелочей.[ …]
При реакции нейтрализации серной кислоты с известью или мелом на 98 частей кислоты получаются 172 части двуводного гипса СаЗОд . 2Н20.[ …]
Способ нейтрализации фильтрованием состоит в том, что кислую сточную воду после предварительного осветления пропускают через слой нейтрализующего материала с такой скоростью, чтобы за время соприкосновения воды с материалом реакция нейтрализации закончилась.[ …]
В камере реакции не только нейтрализуется свободная кислота, но и заканчивается кристаллизация солей кальция и хлопье-образование гидроокисей металлов, что приводит к окончательной стабилизации pH. С этой точки зрения установка датчика после камер реакции является наиболее рациональной. Однако следует иметь в виду, что устройство устойчивой системы регулирования при помощи промышленных приборов крайне осложняется, если время транспортного запаздывания превышает 10— 15 мин. Исходя из этих соображений, нередко приходится отказываться от расположения датчика регулирующего прибора после камеры реакции, рассчитанной на более чем десятиминутное пребывание воды. В этом случае датчик регулирующего прибора можно устанавливать на выходе из смесителя или где-либо по пути движения воды между смесителем и камерой реакции (или отстойником)—там, где реакция нейтрализации прошла с наибольшей полнотой. В эксплуатационных условиях такое место легко найти путем испытания проб, взятых последовательно по пути движения воды, смешанной с реагентом. Там, где во взятой пробе величина pH остается неизменной после тщательного перемешивания, и замеряется значение регулирующего параметра.[ …]
Реагенты для нейтрализации кислых сточных вод выбирают в зависимости от вида кислот и их концентрации. Кроме того, учитывают, образуется ли в процессе реакции нейтрализации осадок. Для нейтрализации минеральных кислот применяют любой щелочной реагент, но чаще всего следующие: известь в виде пушонки или известкового молока, а также карбонаты кальция или магния в виде суспензии.[ …]
Кроме того, учитывают, образуется ли в процессе реакции нейтрализации осадок. Для нейтрализации минеральных кислот применяют любой щелочной реагент, но чаще всего следующие: известь в виде пушонки или известкового молока, а также карбонаты кальция или магния в виде суспензии.[ …]
Метод основан на реакции нейтрализации салициловой кислоты щелочью. Конец реакции фиксируется потенциометром.[ …]
Выбор реагента для нейтрализации кислых сточных вод зависит от вида кислот и их концентрации, а также от растворимости солей, образующихся в результате химической реакции. Для нейтрализации минеральных кислот применяют любой щелочной реагент, но чаще всего известь в виде пушонки или известкового молока и карбонаты кальция или магния в виде суспензии. Эти реагенты сравнительно дешевы и общедоступны, но имеют ряд недостатков: при этом обязательно устройство усреднителей перед нейтрализационной установкой, затруднительно регулирование дозы реагента по pH нейтрализованной воды, сложно реагентное хозяйство. Скорость реакции между раствором кислоты и твердыми частицами суспензии относительно невелика и зависит от размеров частиц и растворимости образующегося в результате реакции нейтрализации соединения. Поэтому окончательная активная реакция в жидкой фазе устанавливается не сразу, а по истечении некоторого времени (10—15 мин). Сказанное выше относится к сточным водам, содержащим сильные кислоты (Н2504, Н2503), кальциевые соли которых труднорастворимы в воде.[ …]
Чтобы контролировать реакцию нейтрализации, надо знать, какое количество кислоты или щелочи следует добавить в раствор для получения необходимого значения pH. Для решений этой проблемы может быть использован метод эмпирической оценки стехиометрических коэффициентов, которая осуществляется с помощью титрования.[ …]
Как видим, знаменитую реакцию аннигиляции е+ +е = 2Ь можно рассматривать, причем логично и обоснованно, как реакцию нейтрализации — вывод, по-моему, не только интересный, но и изящный. [ …]
[ …]
Для полного окончания реакции нейтрализации и флокуляции взвеси сточные воды, протекая через резервуар, перемешиваются сжатым воздухом (с целью окисления Ре2+ до Ре3+) или механическим путем. В флоку-лятор (или нейтрализующий резервуар) добавляют соответствующее количество флокулирующих средств, способствующих образованию плотных агломератов из легко осаждаемой взвеси. Флокулятор должен быть в три-шесть раз больше резервуара нейтрализатора.[ …]
Из представленных выше реакций нейтрализации можно подсчитать, что в стехиометрических условиях расход СаО на 1 г соответствующих соединений будет следующим: h3SO4 — 0,56 г; FeS04 — 0,37 г; НС1—0,77 г; FeCl2 — 0,44 г; HN03 — 0,44 г; Fe(N03h — 0,31 г; Н3РО4 —0,86 г.[ …]
Важно подчеркнуть, что в реакциях нейтрализации ОН-, образующихся при растворении карбонатов и силикатов, участвуют не только угольная кислота, но и органические кислоты (особенно фульво- и гуминовые), являющиеся агентом интенсивного разложения пород. Сильная диссоциация многих органических кислот приводит к увеличению в воде концентраций Н . Константы диссоциации таких распространенных в природе соединений, как фульво- и гуминовые кислоты, приближаются к и-10-3-«• 10″5. Это означает, что они могут снижать pH реальных подземных вод до 3 и менее. В связи с зтим такие органические кислоты интенсивно разлагают силикаты с разрушением их кристаллической решетки. Степень такого разложения тем больше, чем ниже минерализация подземных вод и чем более кислыми они являются.[ …]
Пример 6. Вычислить продолжительность реакции нейтрализации кислых растворов известковой суспензией, если реакция проводится в периодическом реакторе идеального смещения (РИС-П) .[ …]
Самую простую систему очистки на основе реакции нейтрализации можно представить в виде измельченного известняка, на который вылили раствор кислоты, а осадок собрали в отстойник.[ …]
Анализ колебаний концентраций и механизм реакций нейтрализации кислотных железосодержащих сточных вод послужили основанием для выбора параметров регулирования этого процесса. Стало очевидным, что регулировать подачу нейтрализующего реагента только по одному показателю pH недостаточно. Необходим второй параметр, который мог бы реагировать на наличие в воде сернокислого железа и влиять на подачу реагента в соответствии с его текущими концентрациями.[ …]
Стало очевидным, что регулировать подачу нейтрализующего реагента только по одному показателю pH недостаточно. Необходим второй параметр, который мог бы реагировать на наличие в воде сернокислого железа и влиять на подачу реагента в соответствии с его текущими концентрациями.[ …]
С целью обеспечения1 полноты и ускорения хода реакции нейтрализации и осаждения солей тяжелых металлов в камерах реакции производится непрерывное перемешивание сточных вод пропеллерными или лопастными мешалками с вертикальной осью вращения. Частота вращения мешалки принимается не менее 40 мин-1; при частоте вращения 150 мин-1 продолжительность контакта сточных вод, содержащих ионы тяжелых металлов может быть сокращена до 15 мин.[ …]
Процессы химического улавливания примесей используют для нейтрализации наиболее крупномасштабных загрязнителей окружающей среды: оксидов азота, сернистого ангидрида, сероводорода, галогенов и др. Поскольку конкретные реакции нейтрализации каждого из этих веществ индивидуальны, удобнее имеющиеся способы очистки рассматривать применительно к перечисленным основным газовым загрязнителям.[ …]
Как видим, все получается весьма строго и логично: в обоих случаях реакция нейтрализации сводится к со единению ионов лиония и лиата; в обеих реакциях получается в качестве продукта нейтрализации соль — хлористый калий.[ …]
Цри защелачивании нефти можно не учитывать расход реагентов на сероводород, так как в первую очередь в реакцию вступает хлористый водород как более сильная кислота.[ …]
Реактор можно рассматривать как изолированную систему (потери тепла в окружающую среду незначительные), а процессы нейтрализации, происходящие в нем, являются самопроизвольными и необратимыми. В реакторе будет выделяться в результате реакций нейтрализации около 2,5 Мкал/ч, что, очевидно, соответствует повышению свободной энергии активных веществ отходов при их образовании на промышленных предприятиях.[ …]
Излюбленное критическое замечание по отношению к теории сольвосистем заключалось в том, что она не может описывать кислотно-основные реакции не в «своем растворителе».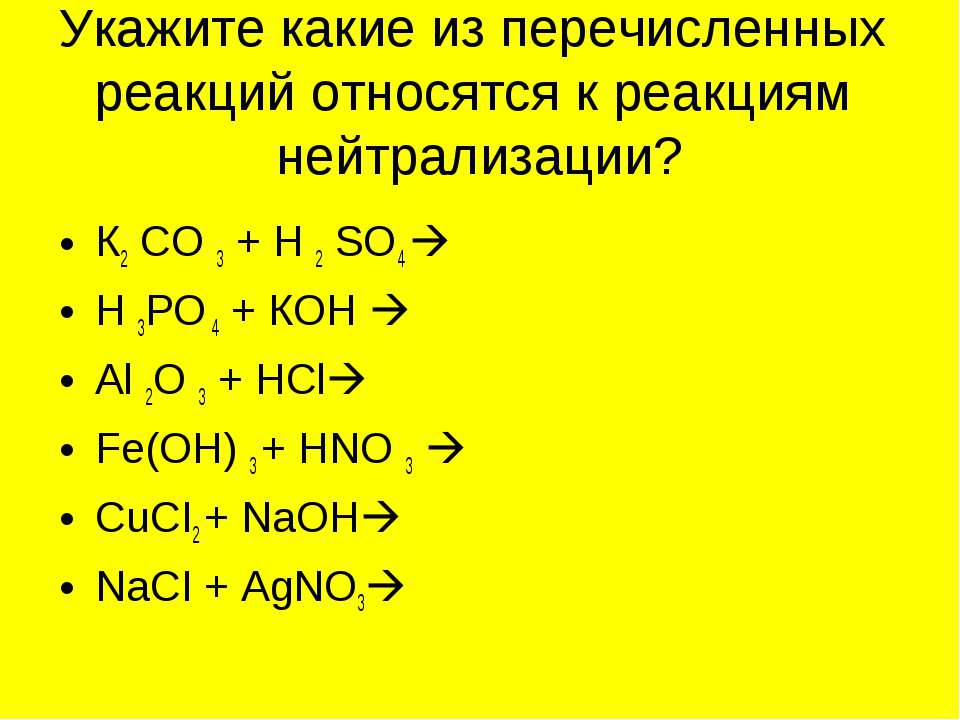 [ …]
[ …]
Для предупреждения коррозии канализационных очистных сооружений, нарушения биохимических процессов в биологических окислителях и водоисточниках, а также осаждения из сточных вся солей тяжелых металлов, кислые и щелочные воды подвергаются нейтрализации. Наиболее типичная реакция нейтрализации — это реакция между ионами водорода и гидроксила, приводящая к образованию малодиссоциированной воды; Н++ОЬГ = Н20. В результате реакции концентрация каяедого из этих ионов становится одинаковой (около 107), т.е. активная реакция водной среды приближается к pH = 7.[ …]
Основной причиной образования осадков является взаимодействие сточных вод с пластовыми, когда происходит изменение среды растворов в направлении приближения к pH пластовой воды, т. е. к равновесным пластовым условиям, как правило, близким к нейтральным. Нейтрализация сопровождается гидролизом компонентов сбросных вод. В отдельных случаях за счет контакта с кислыми и щелочными средами может происходить частичное растворение пород, слагающих пласт с последующими, практически неконтролируемыми вторичными образованиями осадков в результате реакций нейтрализации. Кроме того, одной из причин образования осадков может быть введение со сточными водами компонентов, реагирующих с компонентами пластовой воды, в результате чего образуются осадки даже без изменения среды растворов.[ …]
Электроды, используемые для титрования кислот и оснований, являются индикаторными по отношению к концентрации ионов водорода. Мы рассмотрим два типа электродов: сурьмяный и стеклянный, которые, на наш взгляд, могут с успехом применяться в санитарно-химическом анализе для реакции нейтрализации и определения pH растворов.[ …]
Нельзя, однако, согласиться, будто вся азотная кислота, выделяемая нитрифицирующими бактериями при окислении азотистой кислоты в почве, будет нейтрализоваться только за счет разложения фосфоритной муки. Даже в некарбонатных почвах почвенный раствор содержит бикарбонат кальция, который станет прежде всего участвовать в реакции нейтрализации (как наиболее подвижный) азотной кислоты. Кроме того, во всякой почве находится значительное количество обменнопоглощенного кальция, легко вытесняемого в раствор водородными ионами азотной кислоты с образованием кальциевой селитры.[ …]
Кроме того, во всякой почве находится значительное количество обменнопоглощенного кальция, легко вытесняемого в раствор водородными ионами азотной кислоты с образованием кальциевой селитры.[ …]
В клееной бумаге с проклейкой гидрофобным клеем внутри-волоконная диффузия, как свидетельствуют эксперименты, может осуществляться примерно в 1000 раз быстрее, чем через капилляры, проникновению воды в которые препятствуют гидрофобные частицы проклеивающего вещества. Добавление в воду раствора щелочи облегчает диффузию влаги в толщу бумажного листа, так как щелочь способствует набуханию волокон и, следовательно, внутриволоконнбму проникновению влаги. Кроме того, щелочь вступает в реакцию нейтрализации со свободной смолой канифольного клея, вследствие чего создаются условия, способствующие межволоконному проникновению влаги. Именно поэтому добавление в воду щелочного раствора способствует также капиллярному поднятию влаги в полосках бумаги, вертикально подвешенных над поверхностью влаги и касающихся этой поверхности.[ …]
При таком способе изготовления смесей их выпускают в гранулированном виде, что обеспечивает хорошую их рассеваемость и облегчает применение локальным способом при посеве и посадке растений (в рядки, лунки, борозды). Эти удобрения называются уже сложно-смешанными. Для приготовления их берут в желательной пропорции отвешенные количества простых или сложных порошковидных удобрений (простого или двойного суперфосфата, аммофоса или диаммофоса, аммиачной селитры или мочевины и хлористого калия) и основательно их перемешивают в особом бара-бане-грануляторе. При этом добавляют аммиак для нейтрализации свободной фосфорной кислоты суперфосфата. Реакция нейтрализации протекает с выделением тепла и разогреванием смеси, что способствует ее подсушиванию. Если в смесь не вводят аммофоса или диаммофоса, то ее обогащают жидкой фосфорной кислотой. Благодаря вращению барабана из перемешиваемых порошковидных удобрений образуются гранулы. Их охлаждают, просеивают и обрабатывают водоотталкивающими веществами (чтобы исключить отсыревание). Готовые смеси упаковывают в 5-слойные бумажные мешки или в мешки из полиэтилена. Для выпуска тукосмесей по этому принципу в СССР строится 12 больших заводов с автоматизацией процессов.[ …]
Готовые смеси упаковывают в 5-слойные бумажные мешки или в мешки из полиэтилена. Для выпуска тукосмесей по этому принципу в СССР строится 12 больших заводов с автоматизацией процессов.[ …]
Впрочем, отметив, что электрон в основных растворителях находится «в свободном состоянии», мы допустили некоторую неточность. Разумеется, такая ничтожная по размерам частица обладает электростатическим полем исключительно высокой напряженности, и поэтому она будет притягивать к себе полярные молекулы растворителя, то есть будет сольватирована. Сольвати-рованный электрон известен и в водных растворах, где он образуется, например, при облучении воды и водных растворов источниками радиоактивного излучения. Но если в воде сольватированный электрон существует весьма непродолжительное время (всегда «к его услугам» в воде имеется достаточно ионов Н30+, чтобы произошла реакция нейтрализации: Н30+ + £-> У2Н2 ■+ ’ + Н20), то в сильноосновных растворителях сольватированный электрон весьма устойчив. Так, растворы натрия в жидком аммиаке хранятся без каких-либо изменений физических и химических свойств в течение нескольких месяцев.[ …]
Серная кислота из заводского хранилища поступает в емкость, откуда погружным насосом подается в напорный бак, а затем в барабанный реактор. В соответствии с ГОСТом в сульфате алюминия ограничивается содержание свободной серной кислоты и нерастворимого остатка. Выполнение этих требований при непрерывном процессе возможно при наличии автоматической дозировки реагентов — суспензии гидроксида алюминия и серной кислоты. Центробежный насос непрерывно подает суспензию в циркуляционное кольцо, в верхней части которого расположена отборная коробка. Из отборной коробки часть суспензии поступает в барабанный реактор непрерывного действия, а избыток сливается в репульпатор. За счет теплоты разбавления серной кислоты и реакции нейтрализации гидроксида алюминия кислотой температура в реакторе поддерживается в пределах 95—115 °С. Продолжительность пребывания реакционной массы в реакторе составляет 25—40 мин. Плотность реакционной массы 1500 кг/м3. Производительность аппарата составляет 10000 кг/ч при скорости вращения барабана 0,18 с-1. По выходе из реактора концентрированный раствор сульфата алюминия с 13,5 % АЬОз поступает в распыливающие форсунки гранулятора кипящего слоя.[ …]
Плотность реакционной массы 1500 кг/м3. Производительность аппарата составляет 10000 кг/ч при скорости вращения барабана 0,18 с-1. По выходе из реактора концентрированный раствор сульфата алюминия с 13,5 % АЬОз поступает в распыливающие форсунки гранулятора кипящего слоя.[ …]
Реакция нейтрализации, изменение — Справочник химика 21
Реакциями нейтрализации в водных растворах являются все реакции между кислотами и основаниями, одним из продуктов которых является вода. Сущность реакции нейтрализации заключается в переносе иона водорода (протона) от кислоты к основанию. Кислотноосновные реакции сопровождаются изменением концентрации ионов Н+. Определение последней играет важную роль в методах кислотно-основного титрования. На практике очень часто вместо концентрации ионов водорода [Н+1 используют водородный показатель pH = = — lg [Н+]. Объясняется это тем, что физико-химические методы позволяют непосредственно определить именно pH раствора. По изменению pH раствора следят за [c.93]Реакции нейтрализации между сильными кислотами и щелочами протекают аналогично, независимо от их природы изменение AG реакции соответствует протеканию одного и того же процесса [c.207]
Как известно, реакция нейтрализации не сопровождается видимыми изменениями, например переменой окраски раствора. Поэтому для фиксирования точки эквивалентности приходится прибавлять к титруемому раствору какой-либо подходящий индикатор. [c.238]
Изменение окислительно-восстановительного потенциала в ходе реакции нейтрализации. Изменение величины pH в растворе окислителя и восстановителя часто сопровождается изменением окислительно-восстановительного потенциала. Когда проводят нейтра-лизационное титрование кислоты или основания, являющегося в то же время окислителем или восстановителем, то происходящее у точки эквивалентности резкое изменение величины pH раствора сопровождается таким же резким изменением окислительно-восстановительного потенциала. В таких случаях конец реакции нейтрализации можно находить, наблюдая за величиной окислительновосстановительного потенциала, или с помощью физических методов измерения, или же с помощью окислительно-восстановительных индикаторов. [c.352]
В таких случаях конец реакции нейтрализации можно находить, наблюдая за величиной окислительновосстановительного потенциала, или с помощью физических методов измерения, или же с помощью окислительно-восстановительных индикаторов. [c.352]
Нейтрализация в неводных средах. Выше было показано, что форма кривых изменения pH при реакции нейтрализации зависит от величины константы диссоциации нейтрализуемой кислоты или [c.39]
При кондуктометрическом титровании по изменению электрической проводимости контролируют взаимодействие титранта и определяемого в растворе вещества находят эквивалентные точки реакций нейтрализации, осаждения, окисления — восстановления, комплексообразования, вытеснения слабых кислот или оснований из их солей в водных и неводных растворах. В процессе одного кондуктометрического титрования можно определить содержание нескольких компонентов в смесях. [c.58]
Именно такого рода калориметры обычно применяют для измерений теплоемкостей, теплот растворения, разведения, нейтрализации, изменения агрегатных состояний, сгорания. В последнем случае реакции проводят при постоянном объеме в калориметрической бомбе. [c.51]
Конечную точку титрования в реакции нейтрализации определяют при помощи электрода, потенциал которого зависит от концентрации ионов водорода водородного, хингидронного, стеклянного, сурьмяного и т. п. В конечной точке титрования происходит резкое изменение потенциала электрода, характер которого зависит от константы диссоциации кислоты и основания и от концентрации раствора. Разработаны методы дифференциального потенциометрического титрования, когда фиксируется не потенциал электрода Е в функции от количества титранта V, а зависимость AE/AV от V. В точке эквивалентности AE/AV максимально. [c.277]
Во всех реакциях нейтрализации сильных кислот и оснований в водных растворах стандартное изменение энтальпии АН°= = —57,4 кДж/моль. Это также является доказательством того, что независимо от выбранной пары кислота — основание в растворе идет всегда одна и та же реакция. [c.383]
Это также является доказательством того, что независимо от выбранной пары кислота — основание в растворе идет всегда одна и та же реакция. [c.383]
Раздел физической химии, изучающий тепловые изменения при химических реакциях, называется термохимией. Начальные основы термохимии впервые были заложены М. В. Ломоносовым. Было установлено, что все химические реакции сопровождаются поглощением или выделением тепловой энергии. Реакции, идущие с выделением теплоты, получили название экзотермических, а с поглощением теплоты — эндотермических. К реакциям первого типа относятся горение угля, спирта, метана, реакции нейтрализации. Примеры эндотермических реакций разложение водяного пара, карбоната кальция, гидроксида меди, получение иодистого водорода, окиси азота из элементов. [c.56]
В работе следует определить концентрацию соляной кислоты по тепловому эффекту реакции нейтрализации. Термометрическое титрование основано на применении химических реакций, сопровождающихся выделением или поглощением теплоты. В результате взаимодействия веществ А и В выделяется или поглощается теплота и температура реакционной смеси меняется до тех пор, пока вещество А не прореагирует полностью После достижения стехиометрического соотношения А и В дальнейшее приливание титрованного раствора В не сопровождается реакцией, и температура реакционной смеси или остается постоянной, или плавно меняется за счет теплообмена с окружающей средой. На графике зависимости изменения температуры реакционной смеси от количества добавленного раствора В появится точка перегиба, позволяющая определить стехиометрическое количество вещества 13. [c.155]
Следует заметить, что влияние воды на кислотно-основной характер других растворителей можно просто объяснить реакцией нейтрализации более кислым растворителем другого растворителя, характеризующегося более выраженными основными свойствами. Поэтому наблюдаемое изменение кислотно-основных свойств растворителей, смешанных с водой, можно рассматривать лишь как частный случай влияния сорастворителей на положение и протяженность шкалы кислотности. [c.428]
[c.428]
Изменение энтальпии при прохождении процесса (реакция нейтрализации, растворение соли) равно [c.128]
Реакции гидролиза. Часто они представляют собой реакции, обратные реакциям нейтрализации. В связи с этим их можно определить как обменные реакции взаимодействия веществ с водой, сопровождающиеся изменением pH раствора. [c.40]
В связи с широким применением неводных растворителей применение единой шкалы кислотности приобретает большую роль. Кислотно-основные процессы получили распространение в химической промышленности (нейтрализация, гидролиз, травление металлов и т. п.). Регулированием кислотности добиваются увеличения скоростей реакции и изменения их механизма. В этом состоит, например, сущность кислотно-основного катализа. Величина кислотности стала одной из важных характеристик, используемых для автоматического контроля и регулирования большого числа процессов. [c.291]
Если составить элемент из электрода с постоянным потенциалом (например, нормального водородного или каломельного электрода) и электрода, опущенного в раствор, где меняется концентрация ионов, то по изменению электродвижущей силы этого элемента можно следить за изменением концентрации ионов в растворе. На этом основан метод потенциометрического титрования, применяющийся в химических количественных исследованиях реакций нейтрализации, осаждения и окисления-восстановления. [c.101]
Если при помощи подходящего электрода можно оценить изменение концентрации хотя бы одного вида ионов из числа участвующих в реакции, происходящее при титриметрическом определении (реакции нейтрализации, осаждения, комплексообразования и окисления — восстановления), то для определения точки эквивалентности можно применить метод потенциометрии. При определенных условиях метод пригоден для проведения дифференцированного титрования смесей веществ. [c.121]
При характеристике поведения любого химического соединения или класса веществ рассматривают основные реакции, в которые способны вступать эти вещества. Реакции принято подразделять на четыре основных типа по характеру изменений реагентов — реакции соединения, разложения, замещения и обмена. В последней группе обычно выделяют специфическую реакцию обмена — реакцию нейтрализации. [c.181]
Реакции принято подразделять на четыре основных типа по характеру изменений реагентов — реакции соединения, разложения, замещения и обмена. В последней группе обычно выделяют специфическую реакцию обмена — реакцию нейтрализации. [c.181]
В процессе реакции нейтрализации происходит изменение pH среды. Каждое из четырех рассмотренных равновесий в эквивалентной точке, когда соотношение исходных кислоты и основания соответствует стехиометрическому уравнению, характеризуется [c.272]
Изменение числа ионов, их подвижностей позволяет определить развитие реакций в растворах. Например, реакция нейтрализации, при которой очень легко подвижные ионы Н3О+ и ОН образуют мало диссоциирующую воду [c.201]
Потенциометрическое титрование. Это титрование кислот и оснований основано на фиксировании точки эквивалентности по резкому изменению потенциала индикаторного электрода в процессе реакции нейтрализации. Для кислотно-основного титрования применяется стеклянно-хлорсеребряная цепь, так же как и при потенциометрическом определении pH, [c.265]
МЛ Э сложных химических соединений (гидроксидов, солей и др.) вычисляют по данным реакций, идущих без изменения степени окисления элементов, входящих в состав реагирующих соединений. Например, ММЭ кислоты в реакции нейтрализации [c.14]
Вещества, претерпевающие, подобно К2СГО4, какое-либо легко различимое изменение при титровании (например, перемену окраски, выпадение в осадок и т. д.) и тем самым позволяющие фиксировать точку эквивалентности, называются индикаторами. К ним относятся, например, лакмус, фенолфталеин, метиловый оранжевый и некоторые другие вещества, употребляемые при реакции нейтрализации. [c.194]
д.) и тем самым позволяющие фиксировать точку эквивалентности, называются индикаторами. К ним относятся, например, лакмус, фенолфталеин, метиловый оранжевый и некоторые другие вещества, употребляемые при реакции нейтрализации. [c.194]
Данные по спектрам поглощения растворов солей показали, что молярные коэффициенты поглощения при разных длинах волн, рассчитываемые как DJ , не изменяются в широкой области концентраций электролита фх —оптическая плотность при длине волны X, с—концентрация раствора исследуемого электролита). Этот факт не мог быть объяснен теорией электролитической диссоциации Аррениуса, поскольку с уменьшением концентрации электролита должно было происходить увеличение степени диссоциации и, следовательно, изменение спектров поглощения. Полная диссоциация сильного электролита объясняла постоянство молярных коэффициентов поглощения, поскольку при всех концентрациях раствора светопоглощающими частицами оставались одни и те же ионы. Аналогичный характер имеет концентрационная зависимость вращения плоскости поляризации и ряда других свойств растворов сильных электролитов. Теория электролитической диссоциации не может объяснить постоянство теплот нейтрализации хлорной, соляной и других сильных кислот гидроксидами щелочных металлов. Однако это можно объяснить полной диссоциацией реагентов при всех концентрациях и протеканием реакции нейтрализации как взаимодействия ионов Н+ и ОН» по схеме Н+ + ОН = НгО. [c.438]
Реакции без изменения состояния окисления элементов чаще всего протекают в газовых и жидких растворах с участием ионов. Как известно, ионные реакции обратимы, и теоретически каждой системе ионов при данных условиях отвечает определенное состояние равновесия. Смещение химического равновесия (иногда практически нацело) происходит при уменьшении концентрации каких-либо ионов за счет образования относительно мало ионизирующихся молекул или комплексных ионов малорастворимых или летучих соединений правило Бертолле). Так, в реакции нейтрализации ионное равновесие смещается в сторону образования мало ионизирующихся молекул растворителя, например в водном растворе [c.207]
Так, в реакции нейтрализации ионное равновесие смещается в сторону образования мало ионизирующихся молекул растворителя, например в водном растворе [c.207]
Равнопесие гидролиза может быть смеш,ено также изменением температуры. Поскольку обратный гидролизу процесс — реакция нейтрализации — протекает с выделением теплоты, то реакция гидролиза представляет собой эндотермический процесс. Поэтому повышение температуры ведет к усилению гидролиза, а понижение температуры — к его ослаблению. [c.153]
Технологическая (или рабочая) машина представляет собой комплекс механизмов, предназначенных для выполнения технологического процесса в соответствии с заданной программой. В ходе техно-логиче кого процесса под воздействием рабочих органов машины изменяются качественные показатели предмета труда (физические свойства, форма, положение) при этом затрачивается полезная работа В машинах химических производств технологический процесс обычно носит сложный характер на предмет труда помимо M xaim ческого воздействия может накладываться какой-либо (или совокупность) типовой процесс химической технологии — химическое превращение, межфазный массообмен, нагрев, изменение агрегапного (фазового) состояния вещества и др. Например, в аммо-низаторах-грануляторах происходит не только процесс гранулирования окатыванием, т. е. получение сферических гранул из мелкодисперсного материала перемещением его частиц во вращающемся барабане, но и химическая реакция — нейтрализация жидким аммиаком фосфорной кислоты, содержащейся в пульпе, которая подается в гранулятор, а также сушка материала (тепломассообменный процесс). [c.7]
Прием количественного анализа, при котором концентрацию раствора кислоты или основания количественно определяют добавлением раствора известной концетраг и (нормальный, или титрующий раствор). Определенное количество (10 мл) анализируемого раствора помещают в стакан или широкогорлую коническую колбу Эрленмейера и добавляют туда несколько капель индикатора. Затем к раствору в колбе медленно прикапывают из бюретки титрующий раствор до тех пор, пока изменение окраски индикатора не покажет, что реакция нейтрализации закончена. В процессе титрования колбу следует постоянно покачивать, чтобы Жидкость в ней перемащивалась. По окончании реакции кран бюретки закрывают и по шкале бюретки устанавливают объем раствора, пошедший на титрование. Исходя из количества за- [c.237]
Затем к раствору в колбе медленно прикапывают из бюретки титрующий раствор до тех пор, пока изменение окраски индикатора не покажет, что реакция нейтрализации закончена. В процессе титрования колбу следует постоянно покачивать, чтобы Жидкость в ней перемащивалась. По окончании реакции кран бюретки закрывают и по шкале бюретки устанавливают объем раствора, пошедший на титрование. Исходя из количества за- [c.237]
Для определения истинного изменения температуры используют графический метод. Весь калориметрический процесс делят на три периода 1) предварительный период 5 мин 2) главный период, соответствующий протеканию термохимического опыта (растворению соли или реакции нейтрализации) 3) заключительный период— 5 мин. Помещивая воду в калориметре, наблюдают каждые 0,5 мин за температурой, которая изменяется в результате обмена с окружающей средой. Когда установится равномерный ход температуры, т. е. когда изменения температуры каждые 0,5 мин станут одинаковыми, начинают записывать температуру через каждые 0,5 мин с точностью до 0,005° (предварительный период). Производят 10 отсчетов. На одиннадцатом отсчете начинают растворение соли или другую реакцию для измерения теплового эффекта, не выключая секундомера п не прерывая записи температуры. Размешивают раствор и продолжают запись температуры (главный период). Если температура изменяется очень быстро, отсчет можно делать с точностью до О, Г. По окончании главного периода, когда ход температуры снова станет равномерным (заключительный период), делают еще 10 отсчетов и опыт заканчивают. Если отсчет очередного показания термометра во время опыта не был произведен, то следует подчеркнуть пропущенный отсчет и записать следующий на свое место, под своим порядковым номером. Иначе это сокра- [c.38]
Так как электролиты в воде диссоциируют на ионы, то реакции между электролитами в растворе надо рассматривать как процесс взаимодействия ионов. Для выражения таких реакций, наряду с молекулярными уравнениями, используются ионные уравпения. Ионное уравнение отражает суть тех основных изменений, которые происходят ири взаимодействии растворов, эле1 тролитов. В зависимости от силы электролитов и их растворимости реакции либо идут до конца, либо являются обратимыми. Рассмотрим это на примере реакции нейтрализации [c.75]
Ионное уравнение отражает суть тех основных изменений, которые происходят ири взаимодействии растворов, эле1 тролитов. В зависимости от силы электролитов и их растворимости реакции либо идут до конца, либо являются обратимыми. Рассмотрим это на примере реакции нейтрализации [c.75]
Изменение температуры влияет на гидролиз вследствие резкой температурной зависимости степени диссоциации воды. С повышением температуры концентрация Н — и ОН -ионов в растворе резко возрастает, вследствие чего увеличивается вероятность связывания их с образованием малодиссоци-ированной кислоты или основания. Поэтому с повыщением температуры гидролиз протекает полнее. Данный вывод подтверждается тем, что реакция нейтрализации экзотермична. Так как гидролиз является противоположным ей процессом, т. е. эндотермичен, то в соответствии с принципом Ле Шателье нагревание вызывает усиление гидролиза. [c.134]
Приведенное выше объяснение понятии окисление и восстановление позволяет сделать некоторые выводы. Поскольку обычно в химических реакциях проис ходит изменение электронного состояния молекул, все такие реакции можно рассматривать как частные слу чаи окислительно восстановительных процессов Наибо чее близки окислнтельно-восстановитсльиый процесс и реакция нейтрализации [3]. В обоих случаях сущностью [c.11]
| 1. |
Условия протекания ионных реакций
Сложность: лёгкое |
1 |
2.
|
Виды ионных уравнений
Сложность: лёгкое |
1 |
| 3. |
Составление ионных уравнений
Сложность: среднее |
3 |
| 4. |
Суть сокращённого ионного уравнения
Сложность: среднее |
4 |
5.
|
Реакция нейтрализации
Сложность: среднее |
4 |
| 6. |
Сокращённое ионное уравнение с образованием осадка сульфата бария
Сложность: среднее |
4 |
| 7. |
Основные понятия темы
Сложность: среднее |
3 |
8.
|
Сокращённое ионное уравнение с образованием осадка хлорида серебра
Сложность: среднее |
4 |
| 9. |
Признаки ионных реакций
Сложность: среднее |
4 |
| 10. |
Признаки ионных реакций
Сложность: среднее |
4 |
Тесты для педагогов по всем школьным предметам с ответами
Парники и теплицы
Тест предназначен для закрепления и/или проверки знаний по предмету «Профильный труд. Сельскохозяйственный труд» в 7 классе специальных (коррекционных) образовательных учреждений VIII вида по теме «Парники и теплицы» (Ковалёва Е.А. Технология. Сельскохозяйственный труд. 7 класс, учебник для общеобразовательных организаций, реализующих адаптированные основные общеобразовательные программы). Преимущества, которыми обладают тестовые задания: быстрота, простота, 100% охват учеников, выявление пробелов в знаниях каждого учащегося, обучающимся не нужно формулировать ответ и думать, как его записать
Сельскохозяйственный труд» в 7 классе специальных (коррекционных) образовательных учреждений VIII вида по теме «Парники и теплицы» (Ковалёва Е.А. Технология. Сельскохозяйственный труд. 7 класс, учебник для общеобразовательных организаций, реализующих адаптированные основные общеобразовательные программы). Преимущества, которыми обладают тестовые задания: быстрота, простота, 100% охват учеников, выявление пробелов в знаниях каждого учащегося, обучающимся не нужно формулировать ответ и думать, как его записать
Основные плодовые деревья
Тест предназначен для закрепления и/или проверки знаний по предмету «Профильный труд. Сельскохозяйственный труд» в 7 классе специальных (коррекционных) образовательных учреждений VIII вида по теме «Основные плодовые деревья» (Ковалёва Е.А. Технология. Сельскохозяйственный труд. 7 класс, учебник для общеобразовательных организаций, реализующих адаптированные основные общеобразовательные программы). Преимущества, которыми обладают тестовые задания: быстрота, простота, 100% охват учеников, выявление пробелов в знаниях каждого учащегося, обучающимся не нужно формулировать ответ и думать, как его записать
Минеральные удобрения
Тест предназначен для закрепления и/или проверки знаний по предмету «Профильный труд. Сельскохозяйственный труд» в 7 классе специальных (коррекционных) образовательных учреждений VIII вида по теме «Минеральные удобрения» (Ковалёва Е.А. Технология. Сельскохозяйственный труд. 7 класс, учебник для общеобразовательных организаций, реализующих адаптированные основные общеобразовательные программы). Преимущества, которыми обладают тестовые задания: быстрота, простота, 100% охват учеников, выявление пробелов в знаниях каждого учащегося, обучающимся не нужно формулировать ответ и думать, как его записать.
Получение семян огурца
Тест предназначен для закрепления и/или проверки знаний по предмету «Профильный труд. Сельскохозяйственный труд» в 9 классе специальных (коррекционных) образовательных учреждений VIII вида по теме «Получение семян огурца» (Ковалёва Е. А. Технология. Сельскохозяйственный труд. 9 класс, учебник для общеобразовательных организаций, реализующих адаптированные основные общеобразовательные программы). Преимущества, которыми обладают тестовые задания: быстрота, простота, 100% охват учеников, выявление пробелов в знаниях каждого учащегося, обучающимся не нужно формулировать ответ и думать, как его записать.
А. Технология. Сельскохозяйственный труд. 9 класс, учебник для общеобразовательных организаций, реализующих адаптированные основные общеобразовательные программы). Преимущества, которыми обладают тестовые задания: быстрота, простота, 100% охват учеников, выявление пробелов в знаниях каждого учащегося, обучающимся не нужно формулировать ответ и думать, как его записать.
Проверка состояния молодых плодовых деревьев
Тест предназначен для закрепления и/или проверки знаний по предмету «Профильный труд. Сельскохозяйственный труд» в 9 классе специальных (коррекционных) образовательных учреждений VIII вида по теме «Проверка состояния молодых плодовых деревьев» (Ковалёва Е.А. Технология. Сельскохозяйственный труд. 9 класс, учебник для общеобразовательных организаций, реализующих адаптированные основные общеобразовательные программы). Преимущества, которыми обладают тестовые задания: быстрота, простота, 100% охват учеников, выявление пробелов в знаниях каждого учащегося, обучающимся не нужно формулировать ответ и думать, как его записать.
Passive voice
Тест состоит из 10 вопросов. К каждому имеется 3 ответа и только один из них правильный
Лошади
Тест «Лошади» предназначен для закрепления и/или проверки знаний по предмету «Профессионально-трудовое обучение. Сельскохозяйственный труд» в 9 классе специальных (коррекционных) образовательных учреждений VIII вида по теме «Лошади» (Ковалёва Е.А. Технология. Сельскохозяйственный труд. 9 класс, учебник для общеобразовательных организаций, реализующих адаптированные основные общеобразовательные программы). Преимущества, которыми обладают тестовые задания: быстрота, простота, 100% охват учеников, выявление пробелов в знаниях каждого учащегося, обучающимся не нужно формулировать ответ и думать, как его записать.
Нервная система
Тестовое задание составлено в соответствии с обязательным минимумом содержания образования для основной школы. Тест может быт использован для закрепления и проверки знаний учащихся.
Чеснок
Тест «Чеснок» предназначен для закрепления и/или проверки знаний по предмету «Профессионально-трудовое обучение. Сельскохозяйственный труд» в 6 классе специальных (коррекционных) образовательных учреждений VIII вида по теме «Чеснок» (Ковалёва Е.А. Технология. Сельскохозяйственный труд. 6 класс, учебник для общеобразовательных организаций, реализующих адаптированные основные общеобразовательные программы). Преимущества, которыми обладают тестовые задания: быстрота, простота, 100% охват учеников, выявление пробелов в знаниях каждого учащегося, обучающимся не нужно формулировать ответ и думать, как его записать.
Ручные орудия и инвентарь для обработки почвы
Тест «Ручные орудия и инвентарь для обработки почвы» предназначен для закрепления, повторения и/или проверки знаний по предмету «Профессионально-трудовое обучение. Сельскохозяйственный труд» в 5 классах специальных (коррекционных) образовательных учреждений VIII вида по теме «Обработка почвы» (Ковалёва Е.А. Технология. Сельскохозяйственный труд. 5 класс, учебник для общеобразовательных организаций, реализующих адаптированные основные общеобразовательные программы). Преимущества, которыми обладают тестовые задания: быстрота, простота, 100% охват учеников, выявление пробелов в знаниях каждого учащегося, обучающимся не нужно формулировать ответ и думать, как его записать.
Фасоль
Тест «Фасоль» предназначен для закрепления и/или проверки знаний по предмету «Профессионально-трудовое обучение. Сельскохозяйственный труд» в 5 классе специальных (коррекционных) образовательных учреждений VIII вида по теме «Фасоль» (Ковалёва Е.А. Технология. Сельскохозяйственный труд. 5 класс, учебник для общеобразовательных организаций, реализующих адаптированные основные общеобразовательные программы). Преимущества, которыми обладают тестовые задания: быстрота, простота, 100% охват учеников, выявление пробелов в знаниях каждого учащегося, обучающимся не нужно формулировать ответ и думать, как его записать.
Простейшая переработка белокочанной капусты
Тест «Простейшая переработка белокочанной капусты» предназначен для закрепления и/или проверки знаний по предмету «Профессионально-трудовое обучение. Сельскохозяйственный труд» в 8 классе специальных (коррекционных) образовательных учреждений VIII вида по теме «Простейшая переработка белокочанной капусты» (Ковалёва Е.А. Технология. Сельскохозяйственный труд. 8 класс, учебник для общеобразовательных организаций, реализующих адаптированные основные общеобразовательные программы). Преимущества, которыми обладают тестовые задания: быстрота, простота, 100% охват учеников, выявление пробелов в знаниях каждого учащегося, обучающимся не нужно формулировать ответ и думать, как его записать.
Получение семян томата
Тест «Получение семян томата» предназначен для закрепления и/или проверки знаний по предмету «Профессионально-трудовое обучение. Сельскохозяйственный труд» в 9 классе специальных (коррекционных) образовательных учреждений VIII вида по теме «Получение семян томата» (Ковалёва Е.А. Технология. Сельскохозяйственный труд. 9 класс, учебник для общеобразовательных организаций, реализующих адаптированные основные общеобразовательные программы). Преимущества, которыми обладают тестовые задания: быстрота, простота, 100% охват учеников, выявление пробелов в знаниях каждого учащегося, обучающимся не нужно формулировать ответ и думать, как его записать.
Анализ: Антиген «е» вируса гепатита В (HB e Ag) Гепатит В: HB e Ag
Описание
Описание:Вирусный гепатит В (ВГВ, HBV) — заболевание печени, вызываемое ДНК-содержащим гепаднавирусом. Вирус передается от человека к человеку. Пути передачи: парентеральный (через кровь), половой, перинатальный (от матери к ребенку), контактно-бытовой. Гепатит В является одной из основных причин цирроза печени и гепатоцеллюлярной карциномы. Минимальное количество крови для инфицирования 0,0001 мл. Структура вируса очень сложная, он имеет несколько антигенов. HBsAg (поверхностный антиген) — появляется рано, за 1,5-2 месяца до первичных явлений, сохраняется 2-3 месяца. Если обнаруживается в сыворотке крови более 12 недель, то это неблагоприятный признак — хронизация процесса. Первично положительный результат тестирования на HВsAg исследуют в подтверждающей тест-системе на основе реакции нейтрализации. Отрицательный результат тестирования на HBsAg чаще всего свидетельствует об отсутствии гепатита В у обследуемого. Полностью диагноз инфекции при этом исключить нельзя, так как пациент может находиться в серонегативной стадии инкубационого периода, в результате мутации вируса («ускользающий ген HВsAg»). HВeAg (антиген инфекционности) — маркер репликации (размножения) вируса. Появляется на ранней стадии инфицирования вирусом гепатита В, его присутствии в сыворотке крови более 3-4 недель говорит повышенном риске патологических изменений в печени. Пациент в сыворотке крови, которого обнаруживается HВeAg, обладает наиболее опасен. Исчезновение HВeAg через 1,5-2 месяца сначала болезни свидетельствует о благоприятном ее течении. антитела HВeAg — появляются в крови через 2-3 недели от начала заболевания. Циркулируют в крови 3-5 лет. Наличие антител говорит о том, что завершилась репликация HВeAg. антитела HВsAg- показатель иммунитета к вирусу гепатита В или иммуного ответа на вакцинацию против гепатита В. В случае острого гепатита В антитела к HBsAg обнаруживаются у 80% пациентов через 1-3 месяца после появления HВsAg. антитела Ig M к ядерному антигену (anti-HBc Ig M )- появляются в крови через 1,5-2 месяца от начала острого периода инфекции. Их наличие подтверждает острый гепатит В. Сохраняются в сыворотке крови до 6 месяцев, если больше, то происходит хронизация процесса. антитела Ig G к ядерному антигену (anti-HBc Ig G) — длительно присутствующий маркер, который указывает на инфицирование гепатитом В или является признаком перенесенной инфекции. У пациентов с хронической инфекцией обычно наблюдается высокий титр антител, циркулируют пожизненно. Сроки исполнения: До 7 дней. Подготовка к исследованию: Кровь сдается натощак (спустя 4-5 часов после приема пищи).
Химия. Задания самостоятельной работы на 26.05.2020
7 класс Сам. работа «Основания. Реакция нейтрализации»
Вариант 1
1. Из приведённого ряда веществ выпишите формулы солей: K2SiO3, Ba(OH)2, Mg(NO3)2, Na2O, HNO3.
2. Составьте формулы оснований для металлов: Ni(II), Cr(III), Na, Zn.
3. Запишите уравнения всех реакций. Укажите, какая реакция является реакцией нейтрализации:
1) Mg + H2SO4 → 2) СaO + HNO3 → 3) KOH + H3PO4 →
4. Запишите уравнения всех реакций:
1) Al(OH)3 + H2CO4 → … + … 3) … + … → Li3PO4 + H2O
2) Cu(ОH)2 + HCl → … + … 4) … + … → Zn(NO3)2 + H2O
5. Напишите уравнения при помощи, которых можно осуществить превращения: Na → Na2O → NaOH → Na2SO3
__________________________________________________________________
7 класс Сам. работа «Основания. Реакция нейтрализации»
Вариант 2
1. Из приведённого ряда веществ выпишите формулы оснований: K3PO4, Mg(OH)2, H2SO3, NaOH, ZnO.
2. Составьте формулы оснований для металлов: Fe(III), Pb(II), Al, Li.
3. Запишите уравнения всех реакций. Укажите, какая реакция является реакцией нейтрализации:
1) K + H2CO4 → 2) ZnO + HCl → 3) Ba(OH)2 + H2SO3 →
4. Запишите уравнения всех реакций:
1) Ca(OH)2 + H2SO4 → … + … 3) … + … → MgCO3 + H2O
2) Fe(ОH)3 + HNO3→ … + … 4) … + … → AlPO4+ H2O
5. Напишите уравнения при помощи, которых можно осуществить превращения: K → K2O → KOH → K2SiO3
_________________________________________________________________
7 класс Сам. работа «Основания. Реакция нейтрализации»
Вариант 3
1. Из приведённого ряда веществ выпишите формулы кислот: H3PO4, Ca(OH)2, MgSO3, CO2, HNO3.
2. Составьте формулы оснований для металлов: Cu(II), Mn(II), Ba, K.
3. Запишите уравнения всех реакций. Укажите, какая реакция является реакцией нейтрализации:
1) Al + HBr → 2) BaO + HNO2→ 3) NaOH + H2SiO3 →
4. Запишите уравнения всех реакций:
1) Zn(OH)2 + HCl → … + … 3) … + … → FeSO4 + H2O
2) KОH + H2CO4→ … + … 4) … + … → Ca(NO3)3 + H2O
5. Напишите уравнения при помощи, которых можно осуществить превращения: Ba → BaO → Ba(OH)2 → BaCO3
1. Реакция нейтрализации
H2SO4 | + | 2 KOH | = | K2SO4 | + | 2 H2O |
2. Реакция кислот с основными оксидами.
H2SO4 | + | CuO | = | CuSO4 | + | H2O |
3. Реакция оснований с кислотными оксидами
Ca(OH)2 | + | CO2 | = | CaCO3↓ | + | H2O |
Если пропускать в раствор избыток СО2, то получается избыток угольной кислоты и нерастворимый карбонат кальция превращается в растворимую кислую соль – гидрокарбонат кальция Са(НСО3)2:
СаСО3 + Н2СО3 = Са(НСО3)2 (раствор)
4. Реакция основных и кислотных оксидов между собой:
5. Реакция кислот с солями.
H2S | + | CuCl2 | = | CuS↓ | + | 2 HCl |
6. Реакция оснований с солями.
3 NaOH | + | FeCl3 | = | Fe(OH)3↓ | + | 3 NaCl |
7. Реакция двух различных солей.
AgNO3 | + | KCl | = | AgCl↓ | + | KNO3 |
Выпавшую в осадок соль отфильтровывают, а оставшийся раствор упаривают и получают другую соль. Если же обе образующиеся соли хорошо растворимы в воде, то реакции не происходит: в растворе существуют лишь ионы, не взаимодействующие между собой:
NaCl + KBr = Na+ + Cl— + K+ + Br—
Если такой раствор упарить, то мы получим смесь солей NaCl, KBr, NaBr и KCl, но чистые соли в таких реакциях получить не удается.
8. Реакция металлов с кислотами.
Fe | + | H2SO4(разб.) | = | FeSO4 | + | H2 |
9. Реакция металлов с неметаллами.
10. Реакция металлов с солями.
Применение
• Соли соляной кислоты
Из этого вида солей чаще всего используют хлорид натрия и хлорид калия. Поваренную соль, которую мы с вами употребляем в пищу добывают из морской, озерной воды, а также на соляных шахтах. И если хлорид натрия мы употребляем в пищу, то в промышленности его используют для получения хлора и соды. А вот хлорид калия незаменим в сельском хозяйстве. Его применяют, как калийное удобрение.
• Соли серной кислоты
Что же касается солей серной кислоты, то они нашли широкое применение в медицине и строительстве. С ее помощью изготавливают гипс.
• Соли азотной кислоты
Соли азотной кислоты, или как их еще называют нитраты, применяются в сельском хозяйстве в качестве удобрений. Самыми значимыми среди этих солей является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Их еще называют селитрами.
• Ортофосфаты
Среди ортофосфатов, одним из наиболее важных, является ортофосфат кальция. Эта соль входит в основу таких минералов, как фосфориты и апатиты, которые необходимы при изготовлении фосфорных удобрений.
• Соли угольной кислоты
Соли угольной кислоты или карбонат кальция можно встретит в природе, в виде мела, известняка и мрамора. Его используют для изготовления извести. А вот карбонат калия применяется, как составляющая сырья при производстве стекла и мыла.
7. Химические свойства оксидов, определение, свойства, получение, номенклатура.
Оксиды – соединения элемента с кислородом, имеющим степень окисления – 2. общая формула оксидов ЭmOn, где m – число атомов элемента, а n – число атомов кислорода.
Классификация оксидов
Оксиды, не образующие кислот, оснований и солей при обычных условиях, называются несолеобразующими. К ним относят такие соединения, как N2O, NO, SiO, CO. Однако, последний при нагревании с твердым NaOH образует соль формиат натрия (HCOONa), что позволяет считать этот оксид солеобразующим.
Солеобразующие оксиды подразделяются на кислотные, основные и амфотерные (обладающие двойными свойствами).
Основные оксиды — это оксиды, которые взаимодействуют с кислотами с образованием соли и воды и которым соответствуют основания. Они образованы только металлами.
Например: Na2O; CaO; Fe2O3; CuO; Cu2O и т. д.
Кислотные оксиды — это оксиды, которые взаимодействуют с основаниями с образованием соли и воды и которым соответствуют кислоты. Они образованы в основном неметаллами и некоторыми металлами в своих высших степенях окисления.
Например: SO2; SO3; CO2; P2O5; SiO2; NO2; N2O5; и Mn2O7; CrO3.
Амфотерные оксиды — это оксиды, которые взаимодействуют как с кислотами так и с щелочами с образованием соли и воды, т.е. проявляют своиства основных и кислотных оксидов.
Например: ZnO; AI2O3; BeO; Cr2O3.
ZnO → Zn(OH)2 → h3ZnO2; AI2O3 → AI(OH)3 →h4AIO3;
BeO → Be(OH)2 → h3BeO2; Cr2O3 → Cr(OH)3 →h4CrO3.
Номенклатура оксидов
Если элемент, образующий оксид, имеет единственную валентность, то ее в названии оксида можно не указывать: Na2O – оксид натрия. Если же элемент образует несколько оксидов, то это необходимо: Mn2O7 – оксид марганца (VII). По систематической номенклатуре, требующей полного отражения состава соединения, оксиды называют так: CrO – хром оксид, Cr2O3 – дихром триоксид.
Химические свойства оксидов.
Основные | Амфотерные | Кислотные |
Основные-реагируют с избытком кислоты с образованием соли и воды.Основным оксидам соответствуют основания. 1.Взаимодействие с водой(оксиды щелочных и щелочноземельных мет.) CaO+H2O=Ca(OH)2 2.Все-с кислотами AI2O3+6HCl=2AlCl3+3H2O 3.С кислотнями оксидами CaO+CO2=CaCO3 4.С амфотерными оксидами Li2O+Al2O3=2LiAlO2 | Амфотерные (ZnO, Al2O3,Cr2O3, MnO2 ) 1.Взаимодействуют как с кислотами, так и с основаниями. ZnO+2HCl=ZnCl2+H2O ZnO+2NaOH+H2O=Na2[Zn(OH)4] 2.Реагируют с основными и кислотными оксидами ZnO+CaO=CaZnO2 ZnO+SiO2=ZnSiO3 | Кислотные-реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1.Большинство взаимодействуют с водой SO3+H2O=H2SO4 2.Со щелочами NaOH+SiO2=Na2SiO3+H2O 3.С основными оксидами SiO2+CaO=CaSiO3 4.С амфотерными оксидами Al2O3+3SO3=Al2(SO4)3 |
Получение оксидов.
Окисление кислородом | простых веществ | 2Mg +O2=2MgO |
сложных веществ | 2H2S+3O2=2H2O+2SO2 | |
Разложение | нагреванием солей | СaCO3=CaO+CO2 |
нагреванием оснований | Cu (OH)2=CuO+H20 | |
нагреванием кислородсодержащих кислот | H2SO3=H2O+SO2 | |
нагреванием высших оксидов | 4CrO3=Cr2O3+3O2 | |
Окисление низших оксидов | 4FeO+O2=2Fe2O3 | |
Вытеснение летучего оксида менее летучим | Na2CO3+SiO2=Na2SiO3+CO2 | |
Используют для краски
Нейтрализация — Химия LibreTexts
Одним из наиболее распространенных и широко используемых способов завершения реакции нейтрализации является титрование.-\)»>
\ [[OH -] = \ frac {0,4 \; ммоль} {10 \; мл + 14 \; мл} = 0,17 \; M \]
\ [pOH = -log_ {10} (0,17) = 1,8 \]
\ [pH = 14-1,8 = 12,2 \]
Мы собрали достаточно информации для построения кривой титрования.
Пример \ (\ PageIndex {1} \)
В этом случае мы будем говорить, что раствор основания находится в колбе Эрленмейера. Чтобы нейтрализовать этот щелочной раствор, вы должны добавить раствор кислоты из бюретки в колбу.В начале титрования, перед добавлением кислоты, необходимо добавить индикатор, чтобы изменение цвета сигнализировало о достижении точки эквивалентности.
Мы можем использовать точку эквивалентности для определения молярности и наоборот. Например, если мы знаем, что для нейтрализации 15 мл 0,0853 М раствора NaOH требуется 10,5 мл неизвестного раствора, мы можем определить молярность неизвестного раствора по следующей формуле:
\ [M_1V_1 = M_2V_2 \]
, где M 1 — молярность первого раствора, V 1 — объем первого раствора в литрах, M 2 — молярность второго раствора, а V 2 — объем второго раствора в литрах.Когда мы подставляем данные нам значения в задачу, мы получаем уравнение, которое выглядит следующим образом:
\ [(0,0835) (0,015) = M_2 (0,0105) \]
После решения для M 2 , мы видим, что молярность неизвестного раствора составляет 0,119 M. Из этой задачи мы видим, что для нейтрализации 15 мл 0,0835 M раствора NaOH необходимо 10,5 мл 0,19 M раствора неизвестного происхождения. необходим.
7.4: Кислотно-щелочная нейтрализация — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
- Кислотно-основная нейтрализация
- Реакции нейтрализации
- Желудочные антациды
- Кулинарные аспекты химии
- Резюме
- Участники
Цели обучения
- Напишите сбалансированные химические уравнения для реакций нейтрализации и определите, будет ли полученный раствор кислотным, основным или нейтральным.
Как мы видели в разделе о химических реакциях, когда кислота и основание смешиваются, они подвергаются реакции нейтрализации. Слово «нейтрализация», по-видимому, подразумевает, что стехиометрически эквивалентный раствор кислоты и основания будет нейтральным. Иногда это верно, но соли, которые образуются в этих реакциях, могут иметь собственные кислотные или основные свойства, как мы сейчас увидим.
Кислотно-щелочная нейтрализация
Раствор считается нейтральным, если он содержит равные концентрации ионов гидроксония и гидроксида.Когда мы смешиваем растворы кислоты и основания, происходит кислотно-щелочная реакция нейтрализации. Однако, даже если мы смешаем стехиометрически эквивалентные количества, мы можем обнаружить, что полученный раствор не является нейтральным. Он может содержать либо избыток ионов гидроксония, либо избыток гидроксид-ионов, поскольку природа образующейся соли определяет, будет ли раствор кислотным, нейтральным или основным. Следующие четыре ситуации иллюстрируют, как растворы с различными значениями pH могут возникать после реакции нейтрализации с использованием стехиометрически эквивалентных количеств:
- Сильная кислота и сильное основание, такие как HCl ( водн. ) и NaOH ( водн. ), будут реагировать с образованием нейтрального раствора, поскольку полученные конъюгированные партнеры имеют незначительную силу: \ [\ ce {HCl} ( водн.) + \ ce {NaOH} (водн.) ⇌ \ ce {NaCl} (водн.) + \ ce {h3O} (l) \]
- Сильная кислота и слабое основание дают слабокислый раствор не из-за задействованной сильной кислоты, а из-за сопряженной кислоты слабого основания.
- Слабая кислота и сильное основание дают слабощелочной раствор. Раствор слабой кислоты реагирует с раствором сильного основания с образованием сопряженного основания слабой кислоты и сопряженной кислоты сильного основания. Конъюгированная кислота сильного основания является более слабой кислотой, чем вода, и не влияет на кислотность полученного раствора. Однако сопряженное основание слабой кислоты является слабым основанием и слегка ионизируется в воде. Это увеличивает количество гидроксид-иона в растворе, образующемся в реакции, и делает его слегка щелочным.
- Слабая кислота плюс слабое основание могут давать кислотный, основной или нейтральный раствор. Это самый сложный из четырех типов реакций. Когда конъюгированная кислота и конъюгат основания имеют неодинаковые силы, раствор может быть либо кислотным, либо основным, в зависимости от относительной силы двух конъюгатов. Иногда слабая кислота и слабое основание будут иметь такую же силу , поэтому их соответствующие конъюгированные основание и кислота будут иметь одинаковую силу, и раствор будет нейтральным.Чтобы предсказать, будет ли конкретная комбинация кислотной, основной или нейтральной, необходимо сравнить табличные значения K конъюгатов.
Реакция нейтрализации
Это общий формат реакции нейтрализации:
Кислота + Основание → Соль + Вода
Важно отметить, что реакции нейтрализации — это просто особый тип окислительно-восстановительной реакции двойного вытеснения. Запомните правила написания реакций смещения.
- Выясните, какими будут реагенты и продукты.
- Катионы поменяются местами в продуктах для реакций двойного замещения.
- Элемент заменит катион в реагирующем соединении и приведет к новому продукту для однократных реакций замещения.
- Убедитесь, что все формулы соединений составлены правильно, исходя из степени окисления соответствующих элементов.
- Сбалансируйте уравнение.
Пример \ (\ PageIndex {6} \): Прогнозирование исхода реакции нейтрализации
Напишите сбалансированное химическое уравнение нейтрализации HCl с помощью Mg (OH). 2. Совет: реакции нейтрализации представляют собой специализированный тип реакции двойного замещения.
2HCl + Mg (OH) 2 → Mg (Cl) 2 + 2H 2 O
Поскольку HCl — сильная кислота, а Mg (OH) 2 — сильное основание, полученный раствор будет нейтральным.
Желудочные антациды
Наши желудки содержат раствор примерно 0,03 M HCl, который помогает нам переваривать пищу, которую мы едим. Чувство жжения, связанное с изжогой, является результатом утечки желудочной кислоты через мышечный клапан в верхней части желудка в нижнюю часть пищевода. Выстилка пищевода не защищена от разъедающего воздействия желудочной кислоты, как слизистая оболочка желудка, и результаты могут быть очень болезненными.Когда у нас изжога, мы чувствуем себя лучше, если уменьшаем избыток кислоты в пищеводе с помощью антацидов. Как вы уже догадались, антациды — это основы. Одним из наиболее распространенных антацидов является карбонат кальция CaCO 3 . Реакция,
\ [CaCO_3 (s) + 2HCl (водн.) ⇌CaCl_2 (водн.) + H_2O (l) + CO_2 (g) \]
не только нейтрализует желудочную кислоту, но и производит CO 2 ( г, ), что может вызвать удовлетворительную отрыжку.
Молоко магнезии представляет собой суспензию труднорастворимого основного гидроксида магния, Mg (OH) 2 .- ⇌ 2H_2O (l) \]
При этой реакции не образуется углекислый газ, но антациды, содержащие магний, могут оказывать слабительное действие. Некоторые антациды содержат гидроксид алюминия Al (OH) 3 в качестве активного ингредиента. Гидроксид алюминия имеет тенденцию вызывать запоры, а некоторые антациды используют гидроксид алюминия вместе с гидроксидом магния, чтобы сбалансировать побочные эффекты двух веществ.
Кулинарные аспекты химии
Кулинария — это синтетическая химия, которую можно употреблять в пищу.В кулинарном мире существует ряд примеров кислотно-щелочной химии. Одним из примеров является использование пищевой соды или бикарбоната натрия в выпечке. NaHCO 3 — это база. Когда он вступает в реакцию с кислотой, такой как лимонный сок, пахта или сметана в жидком тесте, в результате разложения образовавшейся углекислоты образуются пузырьки углекислого газа, и тесто «поднимается». Разрыхлитель представляет собой комбинацию бикарбоната натрия и одной или нескольких кислотных солей, которые вступают в реакцию, когда два химических вещества вступают в контакт с водой в жидком тесте.
Многие люди добавляют лимонный сок или уксус, которые являются кислотами, в приготовленную рыбу (рисунок \ (\ PageIndex {1} \)). Оказывается, в системе рыб есть летучие амины (основания), которые нейтрализуются кислотами с образованием нелетучих солей аммония. Это уменьшает запах рыбы, а также добавляет «кислый» вкус, который нам нравится.
Рисунок \ (\ PageIndex {1} \): Реакция нейтрализации происходит между лимонной кислотой в лимонах или уксусной кислотой в уксусе и основаниями в мясе рыбы.Маринование — это метод консервирования овощей в кислой среде естественного происхождения. Овощ, например огурец, помещают в герметичную банку, погруженную в рассол. Рассол способствует росту полезных бактерий и подавляет рост вредных бактерий. Полезные бактерии питаются крахмалом в огурце и производят молочную кислоту в качестве побочного продукта в процессе, называемом ферментацией. Молочная кислота в конечном итоге увеличивает кислотность рассола до уровня, который убивает любые вредные бактерии, которым необходима щелочная среда.Без вредных бактерий, потребляющих огурцы, они могут прожить гораздо дольше, чем если бы они были незащищенными. Побочный продукт процесса маринования изменяет вкус овощей из-за кислоты, делая их кислыми на вкус.
Резюме
Характерные свойства водных растворов кислот Бренстеда-Лоури обусловлены присутствием ионов гидроксония; водные растворы оснований Бренстеда-Лоури обусловлены присутствием гидроксид-ионов. Нейтрализация, которая происходит при объединении водных растворов кислот и оснований, является результатом реакции ионов гидроксония и гидроксида с образованием воды.Некоторые соли, образующиеся в реакциях нейтрализации, могут сделать растворы продуктов слабокислыми или слабощелочными.
Реакции нейтрализации — Вводная химия — 1-е канадское издание
Цели обучения
- Определите кислоту и основание.
- Определите реакцию нейтрализации и спрогнозируйте ее продукты.
В главе 3 «Атомы, молекулы и ионы», раздел 3.5 «Кислоты», мы определили кислоту как ионное соединение, содержащее H + в качестве катиона.Это немного неверно, но пока не будут разработаны дополнительные концепции, нужно подождать лучшего определения. Теперь мы можем переопределить кислоту: кислота — это любое соединение, которое увеличивает количество иона водорода (H + ) в водном растворе. Химическая противоположность кислоты — это основание. Эквивалентное определение основания состоит в том, что основание — это соединение, которое увеличивает количество гидроксид-иона (OH —) в водном растворе. Эти оригинальные определения были предложены Аррениусом (тем же человеком, который предложил диссоциацию ионов) в 1884 году, поэтому они упоминаются как определение Аррениуса кислоты и основания, соответственно.
Вы можете понять, что, основываясь на описании атома водорода, ион H + — это атом водорода, который потерял свой одинокий электрон; то есть H + — это просто протон. Действительно ли в водном растворе движутся голые протоны? Нет. Более вероятно, что ион H + прикрепился к одной (или нескольким) молекулам воды. Чтобы представить это химически, мы определяем ион гидроксония H 3 O + (водн.), Молекулу воды с присоединенным к ней дополнительным ионом водорода.как H 3 O + , который представляет собой дополнительный протон, присоединенный к молекуле воды. Мы используем ион гидроксония как более логичный способ появления иона водорода в водном растворе, хотя во многих химических реакциях H + и H 3 O + рассматриваются эквивалентно.
Реакция кислоты и основания называется реакцией нейтрализации. Хотя кислоты и основания имеют свой уникальный химический состав, кислота и основание нейтрализуют химический состав друг друга, образуя довольно безвредное вещество — воду.Фактически, общая реакция между кислотой и основанием —
.кислота + основание → вода + соль
, где термин «соль» обычно используется для определения любого ионного соединения (растворимого или нерастворимого), которое образуется в результате реакции между кислотой и основанием. (В химии слово соль относится не только к столовой соли.) Например, сбалансированное химическое уравнение реакции между HCl (водн.) И КОН (водн.) Составляет
HCl (водн.) + KOH (водн.) → H 2 O () + KCl (водн.)
, где соль — KCl.Подсчитав количество атомов каждого элемента, мы обнаружим, что в результате образуется только одна молекула воды. Однако в реакции между HCl (водн.) И Mg (OH) 2 (водн.) Требуются дополнительные молекулы HCl и H 2 O, чтобы сбалансировать химическое уравнение:
2 HCl (водн.) + Mg (OH) 2 (водн.) → 2 H 2 O () + MgCl 2 (водн.)
Здесь соль MgCl 2 . (Это одна из нескольких реакций, которые имеют место, когда антацид — основание — используется для лечения желудочного сока.)
Пример 11
Напишите реакции нейтрализации каждой кислоты и основания.
- HNO 3 (водн.) И Ba (OH) 2 (водн.)
- H 3 PO 4 (водн.) И Ca (OH) 2 (водн.)
Решение
Сначала мы напишем химическое уравнение с формулами реагентов и ожидаемых продуктов; тогда мы сбалансируем уравнение.
Ожидаемые продукты — вода и нитрат бария, поэтому начальная химическая реакция
.HNO 3 (водн.) + Ba (OH) 2 (водн.) → H 2 O (ℓ) + Ba (NO 3 ) 2 (водн.)
Чтобы сбалансировать уравнение, нам нужно понять, что будет две молекулы H 2 O, поэтому требуются две молекулы HNO 3 :
2HNO 3 (водн.) + Ba (OH) 2 (водн.) → 2H 2 O () + Ba (NO 3 ) 2 (водн.)
Это химическое уравнение сбалансировано.
Ожидаемые продукты — вода и фосфат кальция, поэтому исходное химическое уравнение —
.H 3 PO 4 (водн.) + Ca (OH) 2 (водн.) → H 2 O () + Ca 3 (PO 4 ) 2 (s)
Согласно правилам растворимости, Ca 3 (PO 4 ) 2 нерастворим, поэтому он имеет метку фазы. Чтобы сбалансировать это уравнение, нам нужны два иона фосфата и три иона кальция; мы получаем шесть молекул воды, чтобы сбалансировать уравнение:
2 H 3 PO 4 (водн.) + 3 Ca (OH) 2 (водн.) → 6 H 2 O (ℓ) + Ca 3 (PO 4 ) 2 ( с)
Это химическое уравнение сбалансировано.
Проверьте себя
Запишите реакцию нейтрализации между H 2 SO 4 (водн.) И Sr (OH) 2 (водн.).
Ответ
H 2 SO 4 (водн.) + Sr (OH) 2 (водн.) → 2 H 2 O () + SrSO 4 (водн.)
Реакции нейтрализации — это один из типов химических реакций, которые протекают, даже если один из реагентов не находится в водной фазе. Например, химическая реакция между HCl (водн.) И Fe (OH) 3 (s) все еще протекает в соответствии с уравнением
3 HCl (водн.) + Fe (OH) 3 (с) → 3 H 2 O () + FeCl 3 (водн.)
, хотя Fe (OH) 3 не растворяется.Когда понимаешь, что Fe (OH) 3 (s) является компонентом ржавчины, это объясняет, почему некоторые чистящие растворы для пятен ржавчины содержат кислоты — реакция нейтрализации дает продукты, которые растворимы и смываются. (Мойка кислотой, такой как HCl, является одним из способов удаления ржавчины и пятен ржавчины, но HCl следует использовать с осторожностью!)
Полные и чистые ионные реакции для реакций нейтрализации будут зависеть от того, растворимы ли реагенты и продукты, даже если кислота и основание реагируют.Например, в реакции HCl (водн.) И NaOH (водн.)
HCl (водн.) + NaOH (водн.) → H 2 O () + NaCl (водн.)
полная ионная реакция
H + (водн.) + Cl — (водн.) + Na + (водн.) + OH — (водн.) → H 2 O (ℓ) + Na + (водн.) + Cl — (водн.)
Ионы Na + (водн.) И Cl — (водн.) Являются ионами-наблюдателями, поэтому мы можем удалить их, чтобы получить
H + (водн.) + OH — (водн.) → H 2 O (ℓ)
как чистое ионное уравнение.Если бы мы хотели записать это в терминах иона гидроксония, H 3 O + (водн.), Мы бы записали это как
H 3 O + (водн.) + OH — (водн.) → 2H 2 O ()
За исключением введения дополнительной молекулы воды, эти два чистых ионных уравнения эквивалентны.
Однако для реакции между HCl (водн.) И Cr (OH) 2 (s), поскольку гидроксид хрома (II) нерастворим, мы не можем разделить его на ионы для полного ионного уравнения:
2 H + (водн.) + 2 Cl — (водн.) + Cr (OH) 2 (с) → 2 H 2 O () + Cr 2+ (водн.) + 2 Cl — (водн.)
Ионы хлорида являются здесь единственными ионами-наблюдателями, поэтому итоговое ионное уравнение равно
.2 H + (водн.) + Cr (OH) 2 (с) → 2 H 2 O () + Cr 2+ (водн.)
Пример 12
Щавелевая кислота, H 2 C 2 O 4 (s) и Ca (OH) 2 (s) реагируют очень медленно.Каково общее ионное уравнение между этими двумя веществами, если образующаяся соль нерастворима? (Анион в щавелевой кислоте — это оксалат-ион, C 2 O 4 2−.)
Решение
Продуктами реакции нейтрализации будут вода и оксалат кальция:
H 2 C 2 O 4 (с) + Ca (OH) 2 (с) → 2 H 2 O () + CaC 2 O 4 (с)
Поскольку ничего не растворяется, нет веществ, которые можно было бы разделить на ионы, поэтому итоговое ионное уравнение представляет собой уравнение трех твердых тел и одной жидкости.
Проверьте себя
Каково чистое ионное уравнение между HNO 3 (водн.) И Ti (OH) 4 (s)?
Ответ
4 H + (водн.) + Ti (OH) 4 (с) → 4 H 2 O (ℓ) + Ti 4+ (водн.)
Основные выводы
- Кислота по определению Аррениуса — это вещество, которое увеличивает количество H + в водном растворе.
- Основание по Аррениусу — это вещество, которое увеличивает количество OH — в водном растворе.
- Нейтрализация — это реакция кислоты и основания, в результате которой образуется вода и соль.
- Чистые ионные уравнения для реакций нейтрализации могут включать твердые кислоты, твердые основания, твердые соли и воду.
Упражнения
Какое определение кислоты дает Аррениус?
Каково определение основания по Аррениусу?
Предскажите продукты каждой перечисленной кислотно-щелочной комбинации.Предположим, что происходит реакция нейтрализации.
а) HCl и КОН
б) H 2 SO 4 и KOH
c) H 3 PO 4 и Ni (OH) 2
4. Предскажите продукты каждой перечисленной кислотно-щелочной комбинации. Предположим, что происходит реакция нейтрализации.
а) HBr и Fe (OH) 3
б) HNO 2 и Al (OH) 3
c) HClO 3 и Mg (OH) 2
5.Напишите сбалансированное химическое уравнение для каждой реакции нейтрализации в упражнении 3.
6. Напишите сбалансированное химическое уравнение для каждой реакции нейтрализации в упражнении 4.
7. Напишите сбалансированное химическое уравнение реакции нейтрализации каждой данной кислоты и основания. Включите соответствующие метки фаз.
а) HI (водн.) + КОН (водн.) →?
б) H 2 SO 4 (водн.) + Ba (OH) 2 (водн.) →?
8.Напишите сбалансированное химическое уравнение реакции нейтрализации каждой данной кислоты и основания. Включите соответствующие метки фаз.
а) HNO 3 (водн.) + Fe (OH) 3 (т) →?
б) H 3 PO 4 (водн.) + CsOH (водн.) →?
9. Напишите чистое ионное уравнение для каждой реакции нейтрализации в упражнении 7.
10. Напишите чистое ионное уравнение для каждой реакции нейтрализации в упражнении 8.
11. Напишите полные и чистые ионные уравнения для реакции нейтрализации между HClO 3 (водн.) И Zn (OH) 2 (s). Предположим, что соль растворима.
12. Напишите полные и чистые ионные уравнения для реакции нейтрализации между H 2 C 2 O 4 (s) и Sr (OH) 2 (водн.). Предположим, что соль нерастворима.
13. Объясните, почему итоговое ионное уравнение для реакции нейтрализации между HCl (водн.) И КОН (водн.) Такое же, как итоговое ионное уравнение для реакции нейтрализации между HNO 3 (водн.) И RbOH.
14. Объясните, почему итоговое ионное уравнение для реакции нейтрализации между HCl (водн.) И КОН (водн.) Отличается от итогового ионного уравнения для реакции нейтрализации между HCl (водн.) И AgOH.
15. Напишите полные и чистые ионные уравнения для реакции нейтрализации между HCl (водн.) И КОН (водн.), Используя ион гидроксония вместо H + . Какая разница при использовании иона гидроксония?
16.Напишите полные и чистые ионные уравнения для реакции нейтрализации между HClO 3 (водн.) И Zn (OH) 2 (s), используя ион гидроксония вместо H + . Предположим, что соль растворима. Какая разница при использовании иона гидроксония?
ответы
Кислота Аррениуса увеличивает количество ионов H + в водном растворе.
3.
а) KCl и H 2 O
б) K 2 SO 4 и H 2 O
c) Ni 3 (PO 4 ) 2 и H 2 O
5.
а) HCl + KOH → KCl + H 2 O
б) H 2 SO 4 + 2 KOH → K 2 SO 4 + 2 H 2 O
c) 2 H 3 PO 4 + 3 Ni (OH) 2 → Ni 3 (PO 4 ) 2 + 6 H 2 O
7.
а) HI (водн.) + КОН (водн.) → KCl (водн.) + H 2 O ()
б) H 2 SO 4 (водн.) + Ba (OH) 2 (водн.) → BaSO 4 (с) + 2 H 2 O (ℓ)
9.
а) H + (водн.) + OH — (водн.) → H 2 O ()
б) 2 H + (водн.) + SO 4 2− (водн.) + Ba 2+ (водн.) + 2 OH — (водн.) → BaSO 4 (т.) + 2 H 2 O (ℓ)
11. Полное ионное уравнение:
2 H + (водн.) + 2 ClO 3 — (водн.) + Zn 2+ (водн.) + 2 OH — (водн.) → Zn 2+ (водн.) + 2 ClO 3 — (водн.) + 2 H 2 O ()
Чистое ионное уравнение:
2 H + (водн.) + 2 OH — (водн.) → 2 H 2 O ()
13.Поскольку соли растворимы в обоих случаях, итоговая ионная реакция будет просто H + (водн.) + OH — (водн.) → H 2 O (ℓ).
15. Полное ионное уравнение:
H 3 O + (водн.) + Cl — (водн.) + K + (водн.) + OH — (водн.) → 2 H 2 O () + K + (водн.) + Cl — (водн.)
Чистое ионное уравнение:
H 3 O + (водн.) + OH — (водн.) → 2 H 2 O (ℓ)
Отличие заключается просто в наличии дополнительной молекулы воды в качестве продукта.
Реакции кислот, оснований и нейтрализации
4.12: Кислоты, основания и реакции нейтрализации
Кислотно-основная реакция — это реакция, в которой ион водорода H + передается от одного химического соединения к другому. Такие реакции имеют центральное значение для многочисленных природных и технологических процессов, начиная от химических превращений в клетках, озерах и океанах до промышленного производства удобрений, фармацевтических препаратов и других веществ, необходимых для общества.
Есть несколько способов определения кислоты. В контексте водных растворов кислота — это вещество, которое растворяется с образованием ионов водорода.
Это определение кислоты по Аррениусу, названное в честь шведского химика Сванте Аррениуса (1859–1927). Ион водорода, обозначенный символом H + , называется протоном. В растворе протоны химически соединяются с молекулами воды через неподеленные пары кислорода, образуя ионы гидроксония, H 3 O + .
Химическое уравнение ионизации кислоты записывается как
Кислоты, которые полностью реагируют с водой таким образом, называются сильными кислотами. HCl, HNO 3 и HBr — несколько примеров.
Большинство кислот, встречающихся в повседневной жизни, — это слабые кислоты. Лимонная кислота во фруктах, уксусная кислота в уксусе и молочная кислота в молоке — вот несколько примеров. Знакомый пример слабой кислоты — уксусная кислота, главный ингредиент пищевого уксуса.При растворении в воде в обычных условиях только около 1% молекул уксусной кислоты присутствует в ионизированной форме, CH 3 CO 2 —.
Использование двойной стрелки в приведенном выше уравнении обозначает аспект частичной реакции этого процесса.
Основание — это вещество, которое растворяется в воде с образованием гидроксид-ионов, OH — . Наиболее распространенными основаниями являются ионные соединения, состоящие из катионов щелочных или щелочноземельных металлов (группы 1 и 2) в сочетании с гидроксид-ионом, например NaOH и Ca (OH) 2 .В отличие от обсуждавшихся ранее кислотных соединений, эти соединения не вступают в химическую реакцию с водой; вместо этого они растворяются и диссоциируют, высвобождая ионы гидроксида непосредственно в раствор. Например, KOH и Ba (OH) 2 растворяются в воде и полностью диссоциируют с образованием катионов (K + и Ba 2+ соответственно) и гидроксид-ионов, OH —. Эти основания, наряду с другими гидроксидами, которые полностью диссоциируют в воде, считаются сильными основаниями.
Рассмотрим для примера растворение гидроксида натрия в воде:
Это уравнение подтверждает, что гидроксид натрия является основанием.При растворении в воде NaOH диссоциирует с образованием ионов Na + и OH —. Это также верно для любого другого ионного соединения, содержащего ионы гидроксида. Поскольку процесс диссоциации по существу завершается, когда ионные соединения растворяются в воде в типичных условиях, NaOH и другие ионные гидроксиды все классифицируются как сильные основания.
В отличие от ионных гидроксидов, некоторые соединения образуют ионы гидроксида при растворении в результате химической реакции с молекулами воды. Во всех случаях эти соединения реагируют только частично и поэтому классифицируются как слабые основания.Эти типы соединений также широко распространены в природе и являются важным сырьем в различных технологиях. Например, глобальное производство слабого основного аммиака обычно превышает 100 метрических тонн в год, потому что он широко используется в качестве сельскохозяйственных удобрений, сырья для химического синтеза других соединений и активного ингредиента в бытовых чистящих средствах. При растворении в воде аммиак частично реагирует с образованием гидроксид-ионов, как показано здесь:
Это, по определению, кислотно-основная реакция, включающая перенос ионов H + от молекул воды к молекулам аммиака.В типичных условиях только около 1% растворенного аммиака присутствует в виде ионов NH 4 + .
Реакция нейтрализации — это особый тип кислотно-основной реакции, в которой реагентами являются кислота и основание (но не вода), а продуктами часто являются соль и вода:
Чтобы проиллюстрировать реакцию нейтрализации, рассмотрим, что происходит, когда обычный антацид, такой как молоко магнезии (водная суспензия твердого Mg (OH) 2 ), проглатывается для облегчения симптомов, связанных с избытком желудочной кислоты (HCl):
Обратите внимание, что помимо воды в этой реакции образуется соль хлорид магния.H + ( водн. ) из кислоты (сильной или слабой) соединяется с OH — ( водн. ) из основания (или полученным реакцией слабого основания с водой) с образованием H 2 О ( л ). Например, реакция между водными растворами HCl (сильная кислота) и NaOH (сильное основание) записывается следующим образом:
И HCl, и NaOH подвергаются 100% ионизации. Таким образом, полное ионное уравнение может быть записано как:
Cl — и Na + называются ионами-наблюдателями, которые компенсируются, давая чистое ионное уравнение как:
Этот текст адаптирован из OpenStax Chemistry 2e, раздел: 4.2: Классификация химических реакций.
Реакции нейтрализации и чистые ионные уравнения для реакций нейтрализации
Цели обучения
- Определите реакцию нейтрализации.
- Напишите сбалансированные уравнения для реакций нейтрализации.
- Напишите чистые ионные уравнения для реакций нейтрализации.
Заливать бетон и обрабатывать его — грязная работа.При этом образуется много сточных вод с щелочным pH. Часто правила требуют, чтобы эти сточные воды очищались на месте. Один из практических способов нейтрализовать щелочной pH — это барботирование CO 2 в воду. Двуокись углерода образует в растворе слабую кислоту (угольную кислоту, H 2 CO 3 ), которая служит для снижения щелочного pH до более близкого к нейтральному.
Реакции нейтрализации и чистые ионные уравнения для реакций нейтрализации
Реакция нейтрализации — это реакция, в которой кислота и основание реагируют в водном растворе с образованием соли и воды.Водный хлорид натрия, который образуется в реакции, называется солью. Соль представляет собой ионное соединение, состоящее из катиона основания и аниона кислоты. Соль — это по существу любое ионное соединение, которое не является ни кислотой, ни основанием.
Сильная кислотно-сильная щелочная реакция
Когда равные количества сильной кислоты, такой как соляная кислота, смешиваются с сильным основанием, таким как гидроксид натрия, получается нейтральный раствор. Продукты реакции не обладают характеристиками ни кислоты, ни основания.Вот сбалансированное молекулярное уравнение.
Химические реакции, протекающие в водном растворе, более точно представляются чистым ионным уравнением. Полное ионное уравнение нейтрализации соляной кислоты гидроксидом натрия записывается следующим образом:
Поскольку и кислота, и основание сильны, они полностью ионизированы и записываются как ионы, как и NaCl, образующийся как продукт. Ионы натрия и хлора являются ионами-наблюдателями в реакции, оставляя следующее в качестве чистой ионной реакции.
Все реакции нейтрализации сильной кислоты сильным основанием упрощаются до чистой ионной реакции соединения иона водорода с ионом гидроксида с образованием воды.
Что делать, если кислота является дипротоновой кислотой, такой как серная кислота? Сбалансированное молекулярное уравнение теперь включает соотношение 1: 2 между кислотой и основанием.
Чтобы реакция была полной нейтрализацией, с H 2 SO 4 должно прореагировать вдвое большее количество молей NaOH. Соль сульфата натрия растворима, поэтому итоговая ионная реакция остается такой же.Для других полипротонных кислот или оснований с несколькими гидроксидами, таких как Ca (OH) 2 , встречаются различные мольные отношения.
Реакции с участием слабой кислоты или слабого основания
Реакции, в которых хотя бы один из компонентов является слабым, обычно не приводят к нейтральному раствору. Ниже показана реакция между слабой азотистой кислотой и сильным гидроксидом калия.
Чтобы написать чистое ионное уравнение, слабая кислота должна быть записана в виде молекулы, поскольку она не ионизируется в значительной степени в воде.Основание и соль полностью диссоциируют.
Единственным ионом-наблюдателем является ион калия, в результате чего получается чистое ионное уравнение:
Сильный гидроксид-ион по существу «заставляет» слабую азотистую кислоту ионизироваться. Ион водорода из кислоты соединяется с ионом гидроксида с образованием воды, оставляя нитрит-ион в качестве другого продукта. Полученный раствор не является нейтральным (pH = 7), а скорее слегка щелочным.
Реакции также могут включать слабое основание и сильную кислоту, в результате чего получается слабокислый раствор.Молекулярные и чистые ионные уравнения реакции соляной кислоты и аммиака показаны ниже.
Реакции между кислотами и основаниями, которые являются слабыми, могут привести к образованию нейтральных, кислых или основных растворов.
Сводка
- Определение нейтрализации.
- Приведены уравнения кислотно-щелочной нейтрализации.
- Приведены чистые ионные уравнения для реакций нейтрализации.
Практика
Задачи на листе по ссылке ниже:
http: // www.bbc.co.uk/bitesize/standard/chemistry/acids/reactions/revision/4/
Обзор
- Что такое реакция нейтрализации?
- Что такое соль?
- Напишите чистое ионное уравнение для нейтрализации сильной кислоты и сильного основания.
Глоссарий
- реакция нейтрализации: Реакция, в которой кислота и основание реагируют в водном растворе с образованием соли и воды.
- соль: Ионное соединение, состоящее из катиона основания и аниона кислоты.
Реакции нейтрализации — Вводная химия — 1-е канадское издание
Цели обучения
- Определите кислоту и основание.
- Определите реакцию нейтрализации и спрогнозируйте ее продукты.
В главе 3 «Атомы, молекулы и ионы», раздел 3.5 «Кислоты», мы определили кислоту как ионное соединение, содержащее H + в качестве катиона. Это немного неверно, но пока не будут разработаны дополнительные концепции, нужно подождать лучшего определения.Теперь мы можем переопределить кислоту: кислота — это любое соединение, которое увеличивает количество иона водорода (H + ) в водном растворе. Химическая противоположность кислоты — это основание. Эквивалентное определение основания состоит в том, что основание — это соединение, которое увеличивает количество гидроксид-иона (OH —) в водном растворе. Эти оригинальные определения были предложены Аррениусом (тем же человеком, который предложил диссоциацию ионов) в 1884 году, поэтому они упоминаются как определение Аррениуса кислоты и основания, соответственно.
Вы можете понять, что, основываясь на описании атома водорода, ион H + — это атом водорода, который потерял свой одинокий электрон; то есть H + — это просто протон. Действительно ли в водном растворе движутся голые протоны? Нет. Более вероятно, что ион H + прикрепился к одной (или нескольким) молекулам воды. Чтобы представить это химически, мы определяем ион гидроксония H 3 O + (водн.), Молекулу воды с присоединенным к ней дополнительным ионом водорода.как H 3 O + , который представляет собой дополнительный протон, присоединенный к молекуле воды. Мы используем ион гидроксония как более логичный способ появления иона водорода в водном растворе, хотя во многих химических реакциях H + и H 3 O + рассматриваются эквивалентно.
Реакция кислоты и основания называется реакцией нейтрализации. Хотя кислоты и основания имеют свой уникальный химический состав, кислота и основание нейтрализуют химический состав друг друга, образуя довольно безвредное вещество — воду.Фактически, общая реакция между кислотой и основанием —
.кислота + основание → вода + соль
, где термин «соль» обычно используется для определения любого ионного соединения (растворимого или нерастворимого), которое образуется в результате реакции между кислотой и основанием. (В химии слово соль относится не только к столовой соли.) Например, сбалансированное химическое уравнение реакции между HCl (водн.) И КОН (водн.) Составляет
HCl (водн.) + KOH (водн.) → H 2 O () + KCl (водн.)
, где соль — KCl.Подсчитав количество атомов каждого элемента, мы обнаружим, что в результате образуется только одна молекула воды. Однако в реакции между HCl (водн.) И Mg (OH) 2 (водн.) Требуются дополнительные молекулы HCl и H 2 O, чтобы сбалансировать химическое уравнение:
2 HCl (водн.) + Mg (OH) 2 (водн.) → 2 H 2 O () + MgCl 2 (водн.)
Здесь соль MgCl 2 . (Это одна из нескольких реакций, которые имеют место, когда антацид — основание — используется для лечения желудочного сока.)
Пример 11
Напишите реакции нейтрализации каждой кислоты и основания.
- HNO 3 (водн.) И Ba (OH) 2 (водн.)
- H 3 PO 4 (водн.) И Ca (OH) 2 (водн.)
Решение
Сначала мы напишем химическое уравнение с формулами реагентов и ожидаемых продуктов; тогда мы сбалансируем уравнение.
Ожидаемые продукты — вода и нитрат бария, поэтому начальная химическая реакция
.HNO 3 (водн.) + Ba (OH) 2 (водн.) → H 2 O (ℓ) + Ba (NO 3 ) 2 (водн.)
Чтобы сбалансировать уравнение, нам нужно понять, что будет две молекулы H 2 O, поэтому требуются две молекулы HNO 3 :
2HNO 3 (водн.) + Ba (OH) 2 (водн.) → 2H 2 O () + Ba (NO 3 ) 2 (водн.)
Это химическое уравнение сбалансировано.
Ожидаемые продукты — вода и фосфат кальция, поэтому исходное химическое уравнение —
.H 3 PO 4 (водн.) + Ca (OH) 2 (водн.) → H 2 O () + Ca 3 (PO 4 ) 2 (s)
Согласно правилам растворимости, Ca 3 (PO 4 ) 2 нерастворим, поэтому он имеет метку фазы. Чтобы сбалансировать это уравнение, нам нужны два иона фосфата и три иона кальция; мы получаем шесть молекул воды, чтобы сбалансировать уравнение:
2 H 3 PO 4 (водн.) + 3 Ca (OH) 2 (водн.) → 6 H 2 O (ℓ) + Ca 3 (PO 4 ) 2 ( с)
Это химическое уравнение сбалансировано.
Проверьте себя
Запишите реакцию нейтрализации между H 2 SO 4 (водн.) И Sr (OH) 2 (водн.).
Ответ
H 2 SO 4 (водн.) + Sr (OH) 2 (водн.) → 2 H 2 O () + SrSO 4 (водн.)
Реакции нейтрализации — это один из типов химических реакций, которые протекают, даже если один из реагентов не находится в водной фазе. Например, химическая реакция между HCl (водн.) И Fe (OH) 3 (s) все еще протекает в соответствии с уравнением
3 HCl (водн.) + Fe (OH) 3 (с) → 3 H 2 O () + FeCl 3 (водн.)
, хотя Fe (OH) 3 не растворяется.Когда понимаешь, что Fe (OH) 3 (s) является компонентом ржавчины, это объясняет, почему некоторые чистящие растворы для пятен ржавчины содержат кислоты — реакция нейтрализации дает продукты, которые растворимы и смываются. (Мойка кислотой, такой как HCl, является одним из способов удаления ржавчины и пятен ржавчины, но HCl следует использовать с осторожностью!)
Полные и чистые ионные реакции для реакций нейтрализации будут зависеть от того, растворимы ли реагенты и продукты, даже если кислота и основание реагируют.Например, в реакции HCl (водн.) И NaOH (водн.)
HCl (водн.) + NaOH (водн.) → H 2 O () + NaCl (водн.)
полная ионная реакция
H + (водн.) + Cl — (водн.) + Na + (водн.) + OH — (водн.) → H 2 O (ℓ) + Na + (водн.) + Cl — (водн.)
Ионы Na + (водн.) И Cl — (водн.) Являются ионами-наблюдателями, поэтому мы можем удалить их, чтобы получить
H + (водн.) + OH — (водн.) → H 2 O (ℓ)
как чистое ионное уравнение.Если бы мы хотели записать это в терминах иона гидроксония, H 3 O + (водн.), Мы бы записали это как
H 3 O + (водн.) + OH — (водн.) → 2H 2 O ()
За исключением введения дополнительной молекулы воды, эти два чистых ионных уравнения эквивалентны.
Однако для реакции между HCl (водн.) И Cr (OH) 2 (s), поскольку гидроксид хрома (II) нерастворим, мы не можем разделить его на ионы для полного ионного уравнения:
2 H + (водн.) + 2 Cl — (водн.) + Cr (OH) 2 (с) → 2 H 2 O () + Cr 2+ (водн.) + 2 Cl — (водн.)
Ионы хлорида являются здесь единственными ионами-наблюдателями, поэтому итоговое ионное уравнение равно
.2 H + (водн.) + Cr (OH) 2 (с) → 2 H 2 O () + Cr 2+ (водн.)
Пример 12
Щавелевая кислота, H 2 C 2 O 4 (s) и Ca (OH) 2 (s) реагируют очень медленно.Каково общее ионное уравнение между этими двумя веществами, если образующаяся соль нерастворима? (Анион в щавелевой кислоте — это оксалат-ион, C 2 O 4 2−.)
Решение
Продуктами реакции нейтрализации будут вода и оксалат кальция:
H 2 C 2 O 4 (с) + Ca (OH) 2 (с) → 2 H 2 O () + CaC 2 O 4 (с)
Поскольку ничего не растворяется, нет веществ, которые можно было бы разделить на ионы, поэтому итоговое ионное уравнение представляет собой уравнение трех твердых тел и одной жидкости.
Проверьте себя
Каково чистое ионное уравнение между HNO 3 (водн.) И Ti (OH) 4 (s)?
Ответ
4 H + (водн.) + Ti (OH) 4 (с) → 4 H 2 O (ℓ) + Ti 4+ (водн.)
Основные выводы
- Кислота по определению Аррениуса — это вещество, которое увеличивает количество H + в водном растворе.
- Основание по Аррениусу — это вещество, которое увеличивает количество OH — в водном растворе.
- Нейтрализация — это реакция кислоты и основания, в результате которой образуется вода и соль.
- Чистые ионные уравнения для реакций нейтрализации могут включать твердые кислоты, твердые основания, твердые соли и воду.
Упражнения
Какое определение кислоты дает Аррениус?
Каково определение основания по Аррениусу?
Предскажите продукты каждой перечисленной кислотно-щелочной комбинации.Предположим, что происходит реакция нейтрализации.
а) HCl и КОН
б) H 2 SO 4 и KOH
c) H 3 PO 4 и Ni (OH) 2
4. Предскажите продукты каждой перечисленной кислотно-щелочной комбинации. Предположим, что происходит реакция нейтрализации.
а) HBr и Fe (OH) 3
б) HNO 2 и Al (OH) 3
c) HClO 3 и Mg (OH) 2
5.Напишите сбалансированное химическое уравнение для каждой реакции нейтрализации в упражнении 3.
6. Напишите сбалансированное химическое уравнение для каждой реакции нейтрализации в упражнении 4.
7. Напишите сбалансированное химическое уравнение реакции нейтрализации каждой данной кислоты и основания. Включите соответствующие метки фаз.
а) HI (водн.) + КОН (водн.) →?
б) H 2 SO 4 (водн.) + Ba (OH) 2 (водн.) →?
8.Напишите сбалансированное химическое уравнение реакции нейтрализации каждой данной кислоты и основания. Включите соответствующие метки фаз.
а) HNO 3 (водн.) + Fe (OH) 3 (т) →?
б) H 3 PO 4 (водн.) + CsOH (водн.) →?
9. Напишите чистое ионное уравнение для каждой реакции нейтрализации в упражнении 7.
10. Напишите чистое ионное уравнение для каждой реакции нейтрализации в упражнении 8.
11. Напишите полные и чистые ионные уравнения для реакции нейтрализации между HClO 3 (водн.) И Zn (OH) 2 (s). Предположим, что соль растворима.
12. Напишите полные и чистые ионные уравнения для реакции нейтрализации между H 2 C 2 O 4 (s) и Sr (OH) 2 (водн.). Предположим, что соль нерастворима.
13. Объясните, почему итоговое ионное уравнение для реакции нейтрализации между HCl (водн.) И КОН (водн.) Такое же, как итоговое ионное уравнение для реакции нейтрализации между HNO 3 (водн.) И RbOH.
14. Объясните, почему итоговое ионное уравнение для реакции нейтрализации между HCl (водн.) И КОН (водн.) Отличается от итогового ионного уравнения для реакции нейтрализации между HCl (водн.) И AgOH.
15. Напишите полные и чистые ионные уравнения для реакции нейтрализации между HCl (водн.) И КОН (водн.), Используя ион гидроксония вместо H + . Какая разница при использовании иона гидроксония?
16.Напишите полные и чистые ионные уравнения для реакции нейтрализации между HClO 3 (водн.) И Zn (OH) 2 (s), используя ион гидроксония вместо H + . Предположим, что соль растворима. Какая разница при использовании иона гидроксония?
ответы
Кислота Аррениуса увеличивает количество ионов H + в водном растворе.
3.
а) KCl и H 2 O
б) K 2 SO 4 и H 2 O
c) Ni 3 (PO 4 ) 2 и H 2 O
5.
а) HCl + KOH → KCl + H 2 O
б) H 2 SO 4 + 2 KOH → K 2 SO 4 + 2 H 2 O
c) 2 H 3 PO 4 + 3 Ni (OH) 2 → Ni 3 (PO 4 ) 2 + 6 H 2 O
7.
а) HI (водн.) + КОН (водн.) → KCl (водн.) + H 2 O ()
б) H 2 SO 4 (водн.) + Ba (OH) 2 (водн.) → BaSO 4 (с) + 2 H 2 O (ℓ)
9.
а) H + (водн.) + OH — (водн.) → H 2 O ()
б) 2 H + (водн.) + SO 4 2− (водн.) + Ba 2+ (водн.) + 2 OH — (водн.) → BaSO 4 (т.) + 2 H 2 O (ℓ)
11. Полное ионное уравнение:
2 H + (водн.) + 2 ClO 3 — (водн.) + Zn 2+ (водн.) + 2 OH — (водн.) → Zn 2+ (водн.) + 2 ClO 3 — (водн.) + 2 H 2 O ()
Чистое ионное уравнение:
2 H + (водн.) + 2 OH — (водн.) → 2 H 2 O ()
13.Поскольку соли растворимы в обоих случаях, итоговая ионная реакция будет просто H + (водн.) + OH — (водн.) → H 2 O (ℓ).
15. Полное ионное уравнение:
H 3 O + (водн.) + Cl — (водн.) + K + (водн.) + OH — (водн.) → 2 H 2 O () + K + (водн.) + Cl — (водн.)
Чистое ионное уравнение:
H 3 O + (водн.) + OH — (водн.) → 2 H 2 O (ℓ)
Отличие заключается просто в наличии дополнительной молекулы воды в качестве продукта.
Нейтрализация
Влияние кислот и оснований на здоровье:
Кислоты и основания являются примерами коррозионных ядов, которые вступают в реакцию локально на клетках ткани. Химические вещества, которые являются очень простыми или очень кислые являются реактивными. Эти химические вещества могут вызвать сильные ожоги. Кислота для автомобильных аккумуляторов — это химическое кислотное вещество, обладающее реакционной способностью. Автомобильные аккумуляторы содержат более сильную форму некоторых из тех же кислота, которая находится под кислотным дождем.Бытовые очистители канализации часто содержат щелок, очень щелочное химическое вещество, обладающее реакционной способностью.
