Методическая разработка урока по химии «Закон постоянства состава вещества»
Предмет: химия
Класс: 8
УМК (название учебника, автор, год издания): Химия. Г.Е.Рудзитис, Ф.Г.Фельдман.
Москва «Просвещение» 2018
Уровень обучения: базовый
Тема: Закон постоянства состава вещества.
Общее количество часов, отведенное на изучение темы: 1
Место урока в системе уроков по теме: Урок № 1
Цель урока: углубить понятие «химический элемент»; закрепить умение определять относительную атомную массу элемента; познакомить обучающихся с законом постоянства состава вещества, свеществам постоянного и переменного состава; научиться на основе закона постоянства вещества производить различные расчеты; закрепить полученные знания на практике.
Задачи урока:
Образовательные:сформулировать четкое представление о законе постоянства состава вещества; знать алгоритмы решения расчетных задач; уметь пользоваться ПСХЭ при решении расчетных задач.
Развивающие:
уметь выделять главное, сопоставлять факты, формировать умение извлекать информацию из устного сообщения, презентации;
формировать умение анализировать данные, выявлять сущность наблюдаемых процессов, обобщать и делать выводы;
развивать умение формулировать и аргументировать собственное мнение, развивать самостоятельность;
продолжать формирование химической речи учащихся, творческого мышления, правил научного общения, умения прогнозировать результат деятельности;
организовывать самостоятельную деятельность, совершенствовать навыки самооценки знаний.

Воспитательные: воспитывать культуру интеллектуального труда; чувство ответственности, уверенности в себе, требовательности к себе; умение работать в парах.
Планируемые результаты:
Предметные:
знать закон постоянства состава вещества, уметь на основе закона постоянства состава вещества производить различные расчеты;
приобретение опыта использования различных методов изучения химических явлений: наблюдения за их превращениями при проведении несложных химических экспериментов с использованием лабораторного оборудования и приборов;
умение проводить и описывать самостоятельно выполненные химические эксперименты, используя родной язык и язык химии;
умение делать выводы и умозаключения из наблюдений, изученных химических закономерностей.
Метапредметные:
Личностные:
умение управлять своей познавательной деятельностью, определять общие и индивидуальные правила работы и поведения.

формирование ответственное отношение к учению и самообразованию на основе мотивации к обучению и познанию, осознанному выбору и построению индивидуальной траектории общения и обучения.
формирование коммуникативной компетентности в общении и сотрудничестве со сверстниками, взрослыми в процессе образовательной и учебно — исследовательской деятельности.
Познавательные:
умение создавать, применять и преобразовывать знаки и символы, модели и схемы для решения учебных и познавательных задач;
использование основных интеллектуальных операций: анализ и синтез, сравнение, обобщение, выявление причинно-следственных связей, поиск аналогов;
использование различных источников для получения химической информации;
постановка и формулирование цели и задач урока; формулирование и аргументация личного мнения
Регулятивные:
умение соотносить свои действия с планируемыми результатами, осуществлять контроль своей деятельности в процессе достижения результата, определять способы действий в рамках предложенных условий и требований, корректировать свои действия в соответствии с изменяющейся ситуацией, оценивать результаты решения поставленных задач и др.
осознанно и произвольно строить речевое высказывание в устной форме; аргументировано отвечать на вопросы, обосновывать свою точку зрения; слушать и понимать речь других; вступать в учебное сотрудничество с учителем.
Техническое обеспечение урока: компьютер, проектор
Дополнительное методическое и дидактическое обеспечение урока (возможны ссылки на интернет-ресурсы): презентация, Периодическая система химических элементов Д.И.Менделеева, знаки химических элементов, УМК: учебник для 8 класса Рудзитис Г.Е., Фельдман Ф.Г.
Содержание урока
I. Организационный момент
Приветствие. Проверка готовности класса и кабинета к уроку. Отсутствующие. Сообщаю, что у нас урок изучения нового материала.
Подготовка к проверке домашнего задания.
Вставьте в таблицу недостающие сведения о химических элементах
Знак
название
Произношение
«Адрес»
№3
…
….
….
…
.
….
Р
…
…
….
….
….
Кальций
…
…
…
…
…
Эн
…
…
…
…
…
4 период
3 группа
II. Проверка и актуализация знаний
Задание 1.
Химический диктант. Записать формулу химического элемента, его относительную атомную массу:
Натрий, барий, углерод, азот, хлор, бор, кальций, калий, литий, фтор
— Что означают записи (по карточкам)
— Какую информацию несёт химическая формула:
а) состав: качественный и количественный;
б) вещество: простое или сложное
Задание 2.
Химический язык. Части химического языка.
Задание 3.
История возникновения химических знаков.
Задание 4.
Дайте определение Na, Cu, Br по следующему плану:
- Название элемента.
Количество атомов элемента.
Количество моль его атомов.
Относительная атомная масса.
Атомный (порядковый) номер.
Задание 5.
Укажите количество атомов элементов: 8H, 6Mg,Cu, 4N,Li. Как называется цифра, стоящая перед элементом?
Задание 6.
Что такое относительная атомная масса? Единицы измерения.
Задание 7.
Определите относительную атомную массу для Ca, 3Al, О, 5P, Mn, 2Li.
Задание 8.
Напишите формулу для определения связи между абсолютной и относительной массами атома.
Чем различаются вещества молекулярного и немолекулярного строения?
Изучение нового материала
Вспомним, о чем мы вели речь на прошлом уроке?
Мы изучали знаки химических элементов, их произношение, порядковый номер; изучали, что такое «относительная атомная масса». Вспомним, что ученые прошлого пытались создать атомно-молекулярную теорию, но эти разработки во второй половине 18 века не продвинулись вперед. Для окончательного формирования этого учения не хватало знания законов, определяющих отношения между количеством веществ реагирующих друг с другом и образующихся при химических реакциях. Эти законы были открыты лишь в конце 18 в начале 19 века.
К основным законам химии относится закон постоянства состава:
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен.
Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г. Он писал: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь».
В этой формулировке закона, как и в приведенной выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения.Чтобы получить сульфид железа(II), мы смешивали железо и серу в соотношении 7:4. Если смешать их в другой пропорции, например 10:4, то химическая реакция произойдет, но 3 г железа в реакцию не вступит. Почему наблюдается такая закономерность? Известно, что в сульфиде железа(II) на каждый один атом железа приходится один атом серы
 ). Следовательно, для реакции нужно брать вещества в таких массовых соотношениях, чтобы сохранялось соотношение атомов железа и серы (1:1). Поскольку численные значения атомных масс Fe, S и их относительных атомных масс Ar(Fe), Ar(S) совпадают, можно записать:Ar(Fe):Ar(S) = 56:32 = 7:4.
). Следовательно, для реакции нужно брать вещества в таких массовых соотношениях, чтобы сохранялось соотношение атомов железа и серы (1:1). Поскольку численные значения атомных масс Fe, S и их относительных атомных масс Ar(Fe), Ar(S) совпадают, можно записать:Ar(Fe):Ar(S) = 56:32 = 7:4.Отношение 7:4 сохраняется постоянно, в каких бы единицах массы ни выражать массу веществ (г, кг, т, а.е.м.). Большинство химических веществ обладает постоянным составом.Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. По предложению Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона), вторые — бертоллидами (в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н2О, НCl, ССl4, СO2.
 Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
Cостав соединений молекулярной структуры, т.е. состоящих из молекул, — является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Физминутка
IV.Закрепление
На основе закона постоянства состава можно производить различные расчёты.
Задача №1
В каких массовых отношениях соединяются химические элементы в серной кислоте, химическая формула которой H2SO4?
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(H)=1, Ar(S)=32, Ar(O)=16.
Определим массовые отношения этих элементов в формуле H2SO4
m(H) : m(S) : m(O) = 2Ar(H) : Ar(S) : 4Ar(O) = 2 : 32 : 64 = 1 : 16 : 32
Таким образом, чтобы получить 49 г серной кислоты (1+16+32=49), необходимо взять 1 г — Н, 16 г — S и 32 г — О.
Задача №2
Водород соединяется с серой в массовых отношениях 1 : 16. Используя данные об относительных атомных массах этих элементов, выведите химическую формулу сероводорода.
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(H)=1, Ar(S)=32.
Обозначим количество атомов водорода в формуле — х, а серы — у: НхSу
m(H) : m(S) = хAr(H) : уAr(S)= х1 : у32 = (2*1) : (1*32) = 2 : 32 = 1 : 16
Следовательно, формула сероводорода Н2S
Задача №3
Выведите формулу сульфата меди, если массовые отношения в нём меди, серы и кислорода соответственно равны 2:1:2?
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(Cu)=64, Ar(S)=32, Ar(O)=16.
Обозначим количество атомов меди в формуле — х, серы — у, а кислорода — z: CuxSyOz
m(Cu) : m(S) : m(O) = хAr(Cu) : уAr(S) : zAr(O) = x64 : y32 : z16 = (1*64) : (1*32) : (4*16) = 64:32:64 = 2:1:2
Подведение итогов. Рефлексия. Выставление оценок.
Задание на дом: § 13 упражнение 1-3 с.46; решить задачу: чтобы получить сульфид железа, взяли железо массой 15 г и серу массой 8 г. Что останется неизрасходованным?
Конспект урока по химии для 8 класса. «Закон постоянства состава веществ. Химические формулы».
Конспект урока по химии для 8 класса.
Тема урока: «Закон постоянства состава веществ. Химические формулы».
Цели урока:
образовательная: ознакомить с учащихся с законом постоянства состава веществ и его применением; научить записывать химические формулы простых и сложных веществ, пользуясь химическими символами и индексами;
развивающая: продолжить развивать навыки анализа материала, умение делать выводы, обобщать, сравнивать, осознанно и обоснованно вести диалог;
воспитательная: продолжить воспитывать личность, способную критически мыслить в процессе обучения.
Тип урока: изучение нового материала.
Базовые понятия: химические формулы, индекс, коэффициент.
Оборудование: ИКТ, оценочные листы, опорные таблицы.
Учебник химия 8 класс, Г. Е. Рудзитис и Ф. Г. Фельдман, презентация, карточки с заданиями.
Межпредметные связи: с математикой, биологией, русским языком.
Ход урока.
Организационный момент (о работе с оценочными листами).
Актуализация ЗУН «Мозговой штурм» (индивидуальная и групповая работа).
Что такое вещества?
Какие вещества называются простыми?
Что такое молекула?
Что такое атом?
Дайте определение химического элемента.
Опрос домашнего задания (презентация).
Запишите химические знаки и русские названия следующих элементов:
I-вариант. II-вариант.
Натрий 1. Сера
Цинк 2. Фосфор
Ba 3. K
Ag 4. Mg
Правильный ответ.
I-вариант. II-вариант.
Na 1.S
Zn 2.P
Барий 3. Калий
Серебро 4. Магний
Взаимопроверка.
Игра «Называй не зевай».
Учитель предлагает таблички с химическими знаками, учащиеся называют элементы и произношение знака.
Работа у доски (два ученика). «Отгадай загадку». Правильно записанные символы элементов помогут составить искомое слово и прочитать по-русски. Запиши в строчку аш, о, це. Что у тебя на лице? (нос).
Це, о, калий на часок зашли в кафе и пили? (сок).
Изучение нового материала.
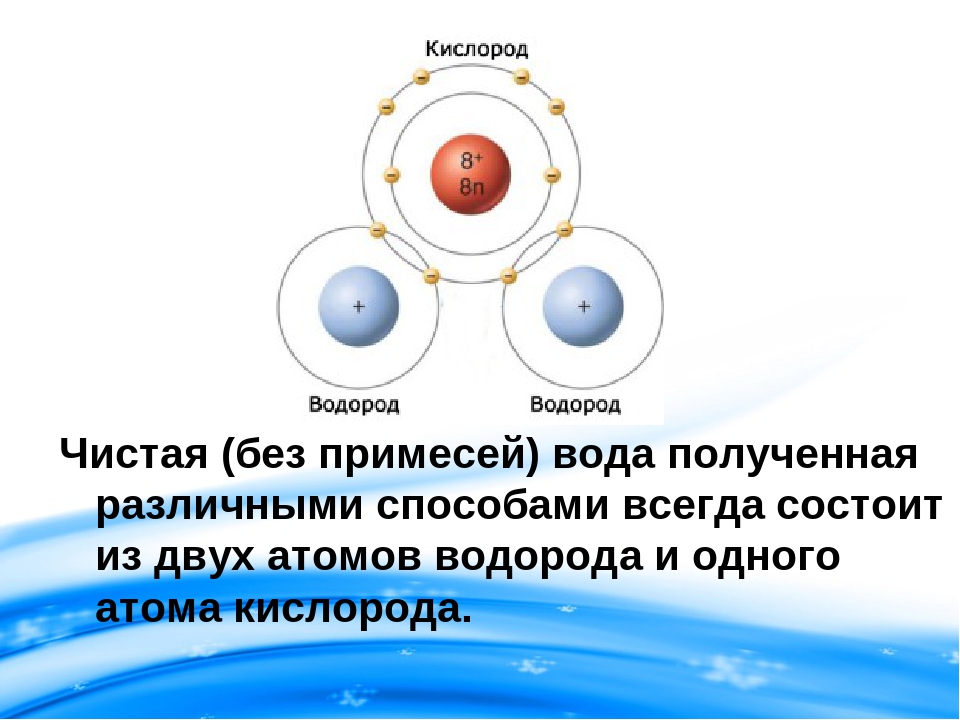
Проблема: различается ли по составу чистое вещество вода, текущая из крана, родниковая и полученная синтетическим путём? Эта проблема легла в основу открытия одного из законов химии.
 Какого? § 13 стр.45 (Закон постоянства состава веществ). Состав веществ записывают с помощью…(химических формул). Записывается тема урока. Целеполагание.
Какого? § 13 стр.45 (Закон постоянства состава веществ). Состав веществ записывают с помощью…(химических формул). Записывается тема урока. Целеполагание.Работа с учебником и презентацией. (учащиеся находят ответы в учебнике). Когда и кем был открыт закон постоянства состава веществ? Как читается закон? Учитель: Закон справедлив только для веществ молекулярного строения.
(Модель молекулы воды) Рассчитаем соотношение масс водорода и кислорода в молекуле воды. Ar(H)=1; Ar(O)=16; 2Ar (H) : Ar (O)= (2•1) : (1•16)= 1:8 Состав воды постоянен.
Задача № 1.
Сколько граммов и какого вещества останется, если смешать 8г кислорода и 3г водорода. Какого же значение закона постоянства состава веществ?
Задача № 2.
Определить массу водорода, реагирующего без остатка с 16г. кислорода.
Решение: 1г. водорода соединяется с 8г. кислорода.
х г. водорода — c 16г. кислорода.
1г. : х г. = 8г. : 16г.
: х г. = 8г. : 16г.
Х= (1•16) : 8 = 2г. водорода.
При изучении химии очень важно научиться составлять формулы химических веществ. Это химический язык, буквами в котором служат символы химических элементов, с помощью которого химики из разных стран могут общаться и понимать друг друга. Работа с учебником и у доски.
Учитель: Для изучения нового материала нам нужны понятия.
Химическая формула-это условная запись состава вещества посредством химических знаков и индексов.
Индекс-это цифра, которую записывают справа внизу у знака элемента, она показывает число атомов элемента, входящих в состав данного вещества.
Записать химические формулы воды, углекислого газа и кислорода, железа. Каково значение данных веществ в жизни человека?
Учитель: H2O если в составе молекулы один атом элемента, то индекс цифрой 1 не записывается.
Читается аш-два-о.
Одна молекула воды.
Суммарное число атомов в молекуле 3.
Для записи количества молекул или отдельных атомов используется коэффициент. Его ставят перед химической формулой или атомом, если молекула одна и атом один, то коэффициент 1 опускается.
3H2O три молекулы воды; читается три-аш-два-о; суммарное число атомов девять.
Ученик: (шаростержневая модель молекулы углекислого газа).
СO2 Читается? Число молекул?
Вопрос к классу: Вода и углекислый газ-простые или сложные вещества? Почему?
Ученик: (молекула кислорода состоит из двух атомов).
O2 Читается? Число молекул?
2О Что обозначает запись?
Формулы металлов обозначаются знаком: железа Fe.
Почему кислород и железо простые вещества?
Закрепление:
Составить формулу глюкозы, которая состоит из шести атомов углерода, двенадцати атомов водорода и шести атомов кислорода;
Прочитать;
Определить суммарное число атомов в молекуле.

Самостоятельная работа.
1. Составить формулы веществ, состоящих из:
I-вариант. II-вариант.
(мела) (серной кислоты)
одного атома кальция двух атомов водорода
одного атома углерода одного атома серы
трёх атомов кислорода четырёх атомов кислорода
2. Прочитать;
3. Определить суммарное количество атомов.
Правильный ответ.
CaCO3 H2SO4
кальций-це-о- три аш-два-эс-о-четыре
5 7
Взаимопроверка.
Выставление баллов и отметки по критериям (в оценочный лист и дневник).
Домашнее задание.
Изучить §13, 14 стр.47. Выполнить задания на стр.46 №*2; стр.49 №3, 4.
VII. Рефлексия. Своей работой на уроке: доволен (довольна)
я не совсем доволен (довольна)
я не доволен (не довольна), потому что…
Приложение 1.
Химическая формула. Валентность. Закон постоянства состава вещества. | План-конспект урока по химии (8 класс) на тему:
8 класс
Тема урока: Химическая формула. Валентность. Закон постоянства состава вещества.
Цель урока: сформировать у учащихся знания о валентности, сотавлении химических формул по валентности, познакомить с законом постоянства сотава вещества
Задачи урока:
-дать понятие о валентности химических элементов, научить учащихся определять валентность элементов в формуле вещества и сотавлять формулы веществ по валентности, познакомить с законом постоянства вещества
-формировать интерес к изучению химии, понимание важности закона постоянства состава вещества как для химии, так и для других наук
-развивать мышление, умение составлять химические формулы, определять валентность химических элементов
Вид урока: комбинированный
Методы урока: словесные, частично-поисковые, наглядные
Ход урока:
I. Организационный момент
Организационный момент
II. Актуализация опорных знаний
Химический диктант: записать формулу химического элемента, его относительную атомную массу:
Натрий, барий, углерод, азот, хлор, бор, кальций, калий, литий, фтор
— Что означают записи (по карточкам): 2СО2; 3Н2О; Н2; 4Н; 5Fe ?
— Какую информацию несёт химическая формула:
а) состав: качественный и количественный;
б) вещество: простое или сложное
в) соотношение атомов и т.д.?
III. Новая тема
Валентность – это способность атомов присоединять к себе определенное число других атомов.
С одним атомом одновалентного элемента соединяется один атом другого одновалентного элемента (HF, NaCl). С атомом двухвалентного элемента соединяются два атома одновалентного (h3O) или один атом двухвалентного (CaO). Значит, валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента.
Правила определения валентности
элементов в соединениях
Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
Учитель. Как определить валентность элемента, исходя из таблицы Д.И.Менделеева?
У металлов, находящихся в группах а, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая (схема).
Высшая валентность равна номеру группы.
Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент.
Учитель. Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
Валентность может быть постоянной (у элементов главных подгрупп таблицы Д.И.Менделеева) или переменной (у элементов побочных подгрупп в таблице), но с этим явлением вы познакомитесь чуть позже, а если интересуетесь, то почитайте учебник 9-го класса.
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений. Для этого удобно воспользоваться следующей таблицей.
Таблица
Алгоритм составления формулы соединения Р и О
Последовательность действий | Составление формулы оксида фосфора |
1. Написать символы элементов | Р О |
2. Определить валентности элементов | V II |
3. Найти наименьшее общее кратное численных значений валентностей | 5•2 = 10 |
4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов | 10 : 5 = 2, 10 : 2 = 5; P : О = 2 : 5 |
5. Записать индексы при символах элементов | Р2 О5 |
6. Формула соединения (оксида) | Р2О5 |
— Запомните еще два правила для составления химических формул соединений неметаллов между собой.
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже.(Демонстрация таблицы Д.И.Менделеева.)
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца.
Теперь вы сами можете написать формулы любых соединений металлов с неметаллами.
Закон постоянства состава веществ был открыт французским ученым Прустом в 1808 г. Вот как этот закон звучал в его изложении: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь».
Современная формулировка закона: каждое химически чистое вещество с молекулярным строением независимо от места нахождения и способа получения имеет один и тот же постоянный качественный и количественный состав.
IV. Закрепление:
Самостоятельная работа
Задание 1. Проверьте, правильно ли написаны формулы следующих соединений: Na2S, KBr, Al2O3, Mg3N2, MgO.
Задание 2. Напишите формулы соединений металлов с неметаллами: кальция с кислородом, алюминия с хлором, натрия с фосфором. Назовите эти соединения.
После выполнения работы ученики обмениваются тетрадями, происходит взаимопроверка. Учитель может выборочно проверить некоторые тетради, похвалить тех учащихся, которые справились быстрее всех и сделали меньше всего ошибок.
Беседа с учащимися по вопросам
1) Что такое валентность?
2) Почему валентность иногда называют атомностью элемента?
3) Чему равны валентности водорода и кислорода?
4) Какие два значения валентности могут проявлять неметаллы?
5) Как определить низшую и высшую валентности неметаллов?
6) Как найти наименьшее общее кратное между численными значениями валентностей?
7) Могут ли атомы в соединении иметь свободные валентности?
8) Какой из двух неметаллов в химической формуле их соединения занимает 1-е место, а какой – 2-е? Поясните на примере оксида NO2, используя таблицу Д.И.Менделеева.
Творческая работа в группах
Задание. Используя наборы для составления моделей молекул различных веществ, составьте формулы и модели молекул для следующих соединений:
1-я группа – меди и кислорода,
2-я группа – цинка и хлора,
3-я группа – калия и йода,
4-я группа – магния и серы.
После окончания работы один учащийся из группы отчитывается о выполненном задании и вместе с классом приводит анализ ошибок.
V. Домашнее задание:
§12-14, стр.33 №7, 10, стр.34 № 5
Урок №11. Закон постоянства состава веществ
I. НОВЫЙ МАТЕРИАЛ
К основным законам химии относится закон постоянства состава:
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен.
Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г
Он писал: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь».
В этой формулировке закона, как и в приведенной выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения.
Чтобы получить сульфид железа(II), мы смешивали железо
и серу в соотношении 7:4. Посмотрите видео-эксперимент. Если смешать их в другой пропорции, например 10:4, то
химическая реакция произойдет, но 3 г железа в реакцию не вступит. Почему
наблюдается такая закономерность? Известно, что в сульфиде железа(II) на каждый
один атом железа приходится один атом серы (демонстрация кристаллической решетки, рис.). Следовательно,
для реакции нужно брать вещества в таких массовых соотношениях, чтобы
сохранялось соотношение атомов железа и серы (1:1). Поскольку численные
значения атомных масс Fe, S и их относительных атомных масс Ar(Fe), Ar(S) совпадают, можно записать:Ar(Fe):Ar(S)
= 56:32 = 7:4.
Отношение 7:4 сохраняется постоянно, в каких бы единицах массы ни выражать
массу веществ (г, кг, т, а.е.м.). Большинство химических веществ обладает постоянным
составом.
Рис. Кристаллическая решетка сульфида железа(II)
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. По предложению Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона), вторые — бертоллидами (в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н2О, НCl, ССl4, СO2. Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
Cостав соединений молекулярной структуры, т.е. состоящих из молекул, — является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
II. На основе закона постоянства состава можно производить различные
расчёты.
Задача №1
В каких массовых отношениях соединяются химические элементы в серной кислоте,
химическая формула которой H2SO4?
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(H)=1, Ar(S)=32, Ar(O)=16.
Определим массовые отношения этих элементов в формуле H2SO4
m(H) : m(S) : m(O) = 2Ar(H) : Ar(S) : 4Ar(O) = 2 : 32 : 64 = 1 : 16 : 32
Таким образом, чтобы получить 49 г серной кислоты (1+16+32=49), необходимо
взять 1 г — Н, 16 г — S и 32 г — О.
Задача №2
Водород соединяется с серой в массовых отношениях 1 : 16. Используя данные об
относительных атомных массах этих элементов, выведите химическую формулу
сероводорода.
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(H)=1, Ar(S)=32.
Обозначим количество атомов водорода в формуле — х, а серы — у: НхSу
m(H) : m(S) = хAr(H) : уAr(S)= х1 : у32 = (2*1) : (1*32) = 2 : 32 = 1 : 16
Следовательно, формула сероводорода Н2S
Задача №3
Выведите формулу сульфата меди, если массовые отношения в нём меди, серы и
кислорода соответственно равны 2:1:2?
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(Cu)=64, Ar(S)=32, Ar(O)=16.
Обозначим количество атомов меди в формуле — х, серы — у, а кислорода — z: CuxSyOz
m(Cu) : m(S) : m(O) = хAr(Cu) : уAr(S) : zAr(O) = x64 : y32 : z16 = (1*64) :
(1*32) : (4*16) = 64:32:64 = 2:1:2
III. РЕШИТЕ
ЗАДАЧИ
№1. Применяя сведения об относительных атомных массах химических элементов, вычислите массовые отношения элементов в угольной кислоте, химическая формула которой H2CO3.
№2. Определите массу кислорода, реагирующего без остатка с 3 г водорода, если водород и кислород в данном случае соединяются соответственно в соотношении 1 : 8?
№3. Углерод и кислород в углекислом газе соединяются
в массовых отношениях 3 : 8.
Выведите химическую формулу углекислого газа
№4. Определите массу водорода, реагирующего без остатка с 48 г кислорода, если водород и кислород в данном случае соединяются в соотношеннии 1:8.
Конспект урока «Химическая формула. Валентность. Закон постоянства состава вещества» 8 класс
8 класс
Тема урока: Химическая формула. Валентность. Закон постоянства состава вещества.
Цель урока: сформировать у учащихся знания о валентности, сотавлении химических
формул по валентности, познакомить с законом постоянства сотава вещества
Задачи урока:
-дать понятие о валентности химических элементов, научить учащихся определять
валентность элементов в формуле вещества и сотавлять формулы веществ по
валентности, познакомить с законом постоянства вещества
-формировать интерес к изучению химии, понимание важности закона постоянства
состава вещества как для химии, так и для других наук
-развивать мышление, умение составлять химические формулы, определять валентность
химических элементов
Вид урока: комбинированный
Методы урока: словесные, частично-поисковые, наглядные
Ход урока:
I.Организационный момент
II. Актуализация опорных знаний
Химический диктант: записать формулу химического элемента, его относительную
атомную массу:
Натрий, барий, углерод, азот, хлор, бор, кальций, калий, литий, фтор
— Что означают записи (по карточкам): 2СО2; 3Н2О; Н2; 4Н; 5Fe ?
— Какую информацию несёт химическая формула:
а) состав: качественный и количественный;
б) вещество: простое или сложное
в) соотношение атомов и т.д.?
III. Новая тема
Валентность – это способность атомов присоединять к себе определенное число других
атомов.
С одним атомом одновалентного элемента соединяется один атом другого одновалентного
элемента (HF, NaCl). С атомом двухвалентного элемента соединяются два атома
одновалентного (H
2
O) или один атом двухвалентного (CaO). Значит, валентность элемента
можно представить как число, которое показывает, со сколькими атомами одновалентного
элемента может соединяться атом данного элемента.
Правила определения валентности
элементов в соединениях
Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой
воды Н
2
О к одному атому кислорода присоединено два атома водорода.
Конспект урока «Химическая формула. Валентность. Закон постоянства состава вещества»
Рабочий урок по химии. Данный урок проводился в 8 классе, при разработке использовались игровые формы. Информация для урока бралась из учебника и ресурсов интернета
Просмотр содержимого документа
«Конспект урока «Химическая формула. Валентность. Закон постоянства состава вещества»»
Химия
Урок 9 8 класс
Химическая формула. Валентность. Закон постоянства состава вещества
Цель урока: сформировать у учащихся знания о валентности, составлении химических формул по валентности, познакомить с законом постоянства состава вещества, формировать интерес к изучению химии, понимание важности закона постоянства состава вещества как для химии, так и для других наук; развивать мышление, умение составлять химические формулы, определять валентность химических элементов.
Оборудование: учебник, ПСХЭ
Ход урока:
Организация урока
Сообщение темы и цели урока
Анализ работы – оценки
Карточки — 5 ¹
Проверка домашнего задания §18 в. 5 с. 46 п
NA = 6,02 • 10 23 N = ύ • NA
N(H2O= 0,2 моль) = 0,2 • 6,02 • 10 23 = 1,204 • 1023
N(H2O= 2 моль) = 2 • 6,02 • 10 23 = 12,04 • 1023
N(H2O= 5 моль) = 5 • 6,02 • 10 23 = 30,1 • 1023
Изучение материала:
Натрий, барий, углерод, азот, хлор, бор, кальций, калий, литий, фтор
Вычислить молярную массу NaCl, Cl2, H2, HCl, Al2O3, P2O5, CuO
Информация из учебника с. 24 — записать
Что означают записи: 2СО2; 3Н2О; Н2; 4Н; 5Fe ?
Например: HF, NaCl 1 : 1, H2O 2 : 1 NH 3 1: 3 CH4 1: 4
Вывод: валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента.
Правила определения валентности элементов в соединениях
Валентность водорода принимают за I (единицу).
Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
Кислород в своих соединениях всегда проявляет валентность II.
Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
Как определить валентность элемента, исходя из таблицы Д.И.Менделеева?
У металлов, находящихся в группах А, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая
Высшая валентность равна номеру группы.
Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент.
Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений. Таблица 3 с. 32 учебника – анализ
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже.
Например, SO3, SiC.
2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца.
Закон постоянства состава веществ был открыт французским ученым Прустом в 1808 г.
Современная формулировка закона: каждое химически чистое вещество с молекулярным строением независимо от места нахождения и способа получения имеет один и тот же постоянный качественный и количественный состав.
Например: массовые отношения –
m(Fe) : m (S) = 56 а.е.м. : 32 а.е.м. = 56 г : 32 г = 7: 4
в. 6 с. 37
Рефлексия:
в. 3, 4, 5, 6, 10 с. 33
1) Что такое валентность?
2) Чему равны валентности водорода и кислорода?
3) Какие два значения валентности могут проявлять неметаллы?
4) Как определить низшую и высшую валентности неметаллов?
5) Какой из двух неметаллов в химической формуле их соединения занимает 1-е место, а какой – 2-е? Поясните на примере оксида NO2, используя таблицу Д.И.Менделеева.
VIII. Задание на дом: §12, 13, 14 в. 3, 4 с. 34 п.
Закон постоянства состава
Уже к началу XIX в. накопилось много данных о составе отдельных веществ и их изменениях. Развитие техники количественных измерений и методов химического анализа позволило определять соотношения элементов в соединениях. Французский химик Ж. Пруст (1754–1826) после тщательнейших экспериментов с рядом веществ установил закон постоянства состава– один из основных законов химии.
Согласно закону постоянства состава, всякое чистое вещество, независимо от способов его получения и нахождения в природе, имеет постоянный качественный и количественный состав.
Это означает, что все соединения содержат элементы в строго определенных весовых пропорциях, независимо от способа получения, Так, например, сернистый газ, полученный сжиганием серы, или действием кислот на сульфиты, или любым другим способом, всегда содержит одну весовую часть серы и одну весовую часть кислорода.
Закон постоянства состава веществ был установлен в результате семилетнего спора между Прустом и его оппонентом, французским химиком К. Бертолле (1748–1822), утверждавшим, что состав соединений зависит от способа их получения.
Бертолле в результате анализа растворов, которые он считал химическими соединениями, сделал общий вывод о существовании химических соединений переменного состава. Получалось, что два элемента могут образовать непрерывный ряд соединений с изменяющимися свойствами и составом.
Пруст утверждал, что состав чистого вещества всегда один и тот же, любое химическое вещество имеет всегда одни и те же свойства, одинаковую температуру плавления, кипения, удельный вес. Пруст заявлял, что природа даже через посредство людей никогда не производит соединений иначе, как только по весу и мере. Одни и те же соединения имеют всегда тождественный состав. Внешний их вид может быть различен, но свойства – никогда. Нет разницы между окисью железа из южного полушария и из северного, хлористое серебро из Перу совершенно тождественно хлористому серебру из Сибири; во всем мире имеется только один хлористый натрий, одна селитра и т.д. Проделав в течение 1799–1887 гг. массу анализов, Пруст доказал справедливость своих выводов.
Дальнейшее развитие химии показало, что закон постоянства состава характеризует соединения с молекулярной структурой, состав же соединений с немолекулярной структурой (атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
В начале XX в. русский химик Курнаков, изучая сплавы металлов, открыл соединения переменного состава. В дальнейшем было выяснено, что соединения переменного состава встречаются также среди оксидов, соединений металлов с серой, азотом, углеродом, водородом а также – среди других неорганических веществ, имеющих кристаллическую структуру. Вещества переменного состава были названы бертоллидами, в отличие от соединений постоянного состава –дальтонидов. Для многих соединений переменного состава установлены пределы, в которых может изменяться их состав. Так, в диоксиде титанаTiO2на единицу массы титана может приходиться от0,65до0,67единиц массы кислорода, что соответствует формулеТi O1,9 – 2,0 ( таб.4.1).
Таблица 4.1
ДАЛЬТОНИДЫ
(вещества постоянного состава)
примеры соединений
БЕРТОЛЛИДЫ
(вещества переменного состава)
примеры соединений
H2O
H Cl
C Cl4
CO2
Ti O1,9 – 2,0
V O0,9 –1,3
Таким образом, закон постоянства состава, в отличие от закона сохранения массы вещества, не является столь всеобщим. Однако для своего времени закон постоянства состава имел фундаментальное значение. Он привел к мысли о существовании молекул и подтвердил неделимость атомов. В самом деле, почему в сернистом газе весовое отношение серы и кислорода всегда 1:1, а не1,1:0,9или0,95:1.05? Этот результат легко объяснить, если предположить, что атомы серы соединяются с определенным числом атомов кислорода и образуют частицы сернистого газа (эти частицы впоследствии были названы молекулами).
5.1: Закон сохранения материи
Цели обучения
- Правильно определите закон применительно к науке.
- Укажите закон сохранения материи.
В науке закон — это общее утверждение, объясняющее большое количество наблюдений. Прежде чем быть принятым, закон должен быть многократно подтвержден при различных условиях. Поэтому законы считаются высшей формой научного знания и, как правило, считаются незыблемыми.Научные законы составляют основу научного знания. {\ text {Меркурий}}} _ {\ text {92.{\ text {Oxygen}}} _ {\ text {7,4 г}} \]
Другой способ сказать это: «В химической реакции материя не создается и не разрушается». Закон сохранения массы также известен как «закон неразрушимости материи».
Пример \ (\ PageIndex {1} \)
Если нагревание 10 граммов \ (\ ce {CaCO3} \) дает 4,4 г \ (\ ce {CO2} \) и 5,6 г \ (\ ce {CaO} \), покажите, что эти наблюдения согласуются с закон сохранения массы.
Образец карбоната кальция (CaCO 3 ).(Общественное достояние; Walkerma).
Решение
- Масса реагентов, \ (\ ce {CaCO3} \): \ (10 \, г \)
- Масса продуктов, \ (\ ce {CO2} \) и \ (\ ce {CaO} \): \ (4.4 \, g + 5.6 \, g = 10 \, g \).
Поскольку масса реагентов = массе продуктов, наблюдения согласуются с законом сохранения массы.
Что это значит для химии? При любом химическом изменении одно или несколько исходных веществ превращаются в другое вещество или вещества.И начальное, и конечное вещества состоят из атомов, потому что вся материя состоит из атомов. Согласно закону сохранения материи, материя не создается и не разрушается, поэтому после химического изменения у нас должно быть такое же количество и вид атомов , которые присутствовали до химического изменения.
Может показаться, что горение разрушает материю, но такое же количество или масса материи все еще существует после костра, как и раньше. На рис. 5.1.1 показано, что когда дерево горит, оно соединяется с кислородом и превращается не только в золу, но также в углекислый газ и водяной пар.Газы уносятся в воздух, оставляя после себя только пепел. Предположим, мы измерили массу древесины до того, как она сгорела, и массу золы после того, как она сгорела. Также предположим, что мы смогли измерить кислород, используемый огнем, и газы, выделяемые огнем. Что бы мы нашли? Общая масса вещества после пожара будет равна общей массе вещества до пожара.
Рисунок 5.1.1: Сжигание — это химический процесс. Пламя возникает в результате сгорания топлива.Изображения использованы с разрешения (CC BY-SA 2.5; Einar Helland Berger для огня и пепла).Упражнение \ (\ PageIndex {1} \)
- Каков закон сохранения материи?
- Как закон сохранения вещества применим к химии?
- Ответ:
Закон сохранения материи гласит, что в любой данной системе, которая закрыта для переноса материи, количество вещества в системе остается постоянным
- Ответ b:
Закон сохранения вещества гласит, что в химических реакциях общая масса продуктов должна равняться общей массе реагентов.
Ключевые вынос
Количество вещества в закрытой системе сохраняется.
Авторы и авторство
Упражнения
Выразите закон сохранения материи своими словами.
2. Объясните, почему концепция сохранения материи считается научным законом.
3. Гидроксид калия (\ (\ ce {KOH} \)) легко реагирует с диоксидом углерода (\ (\ ce {CO2} \)) с образованием карбоната калия (\ (\ ce {K2CO3} \)) и воды ( \ (\ ce {h3O} \)).Сколько граммов карбоната калия получается, если 224,4 г \ (\ ce {KOH} \) прореагировало с 88,0 г \ (\ ce {CO2} \). В результате реакции также было получено 36,0 г воды.
ответов
1. Материя не может быть создана или уничтожена.
2. Концепция является научным законом, потому что она основана на эксперименте.
3,276,4 г
5.1: Закон сохранения материи
- Последнее обновление
- Сохранить как PDF
- Резюме
- Упражнения на обзор концепции
- Ответы
- Упражнения
- Ответ
Навыки для развития
- Правильно определите закон применительно к науке.
- Укажите закон сохранения материи.
В науке закон — это общее утверждение, объясняющее большое количество наблюдений. Прежде чем быть принятым, закон должен быть многократно подтвержден при различных условиях. Поэтому законы считаются высшей формой научного знания и, как правило, считаются незыблемыми. Научные законы составляют основу научного знания.
Один научный закон, который обеспечивает основу для понимания химии, — это закон сохранения материи.Он утверждает, что в любой данной системе, которая закрыта для передачи материи (внутрь и наружу), количество вещества в системе остается постоянным. Кратко выразить этот закон можно, сказав, что количество вещества в системе сохранено .
Что это значит для химии? При любом химическом изменении одно или несколько исходных веществ превращаются в другое вещество или вещества. И начальное, и конечное вещества состоят из атомов, потому что вся материя состоит из атомов.Согласно закону сохранения материи, материя не создается и не разрушается, поэтому после химического изменения у нас должно быть такое же количество и тип атомов, что и до химического изменения.
Прежде чем рассматривать явные примеры закона сохранения материи, нам нужно изучить метод, который используют химики для представления химических изменений.
Сводка
Количество вещества в закрытой системе сохраняется.
Упражнения по обзору концепции
- Каков закон сохранения материи?
- Как закон сохранения вещества применим к химии?
ответов
- Закон сохранения материи гласит, что в любой данной системе, которая закрыта для передачи материи, количество вещества в системе остается постоянным
- Закон сохранения вещества гласит, что в химических реакциях общая масса продуктов должна равняться общей массе реагентов.
Упражнения
Выразите закон сохранения материи своими словами.
Объясните, почему концепция сохранения материи считается научным законом.
Ответ
1. Материя не может быть создана или уничтожена.
2. Согласно разделу 1.1, научный закон — это «описательное обобщение того, как некоторые аспекты природного мира ведут себя в указанных обстоятельствах.«Для сравнения, научная теория — это« хорошо обоснованное объяснение некоторого аспекта естественного мира, которое может включать в себя факты, законы, выводы и проверенные гипотезы ». Разница между законом и теорией не является четкой. огромное количество свидетельств и общепринято в научном сообществе. Закон более узкий, как это конкретное описание материи, тогда как теория может быть более широкой и часто часто включает больше объяснений почему. Теория атома объясняет причину, лежащую в основе закон сохранения вещества; в химических реакциях атомы просто перестраиваются, поэтому имеют одинаковую массу до и после.
IX; Сохранение материи и энергии
IX
Сохранение материи и энергии
Представление о том, что во всех разнообразных изменениях, которые мы воспринимаем как происходящие в материальном мире, должны быть постоянные элементы, которые остаются неизменными в течение всех этих изменений, имеет на протяжении всей истории науки была одной из руководящих идей, которые в конечном итоге привели к таким формулировкам, как те, которые содержатся в выражениях «Сохранение материи», «Сохранение веса», «Сохранение массы» и «Сохранение энергии».Принцип постоянства, выраженный в такой формуле, как «ничего не создается и ничего не разрушается», обычно рассматривался как априорный принцип, тесно связанный с принципом причинности. Сама общность этого априорного принципа помешала ему функционировать в качестве эффективного руководства для определения точных элементов перцептивного мира, которым присуща характеристика настойчивости во всех преобразованиях. Таким образом, действительные успехи научных исследований в этом порядке идей заключались в установлении путем эксперимента и соблюдения эмпирических законов закона сохранения массы и закона сохранения энергии.Установлено, что такие эмпирические законы выражают определенные факты, относящиеся к значительному, но ограниченному кругу наблюдаемых явлений, сохранение, которое они выражают, носит такой характер, что выражается количественно в числовой форме. Затем законы принимаются как гипотетические принципы в концептуальных теориях, которые относятся к более широкому кругу явлений, чем те, к которым в первую очередь применялась эмпирическая проверка.
Ценность законов в их общей форме должна зависеть от их успеха в выполнении своих функций описания и предсказания в отношении новых классов явлений, к которым они ориентировочно применяются.Принцип a priori в его общей форме, который я назвал метафизическим принципом, выражающим предполагаемую необходимость мышления, не должен приниматься как часть основ естествознания, независимо от его фактического влияния на умы ученых. следователи в прошлом. Основная трудность в отношении принципа сохранения материи, принципа, согласно которому материя не создается и не уничтожается, заключается в формировании четкого представления о том, что именно сохраняется.Если мы рассматриваем материю как конструкцию, включающую в себя комплекс физических свойств, расширение, цвет, твердость, проводимость тепла и электричества и т. Д., У нас есть достаточные и очевидные доказательства того, что эти свойства не остаются неизменными, но подвержены самым большим изменениям в том, что мы считаем одним и тем же та же материальная система. Что тогда следует понимать под утверждением, что материю нельзя ни создать, ни уничтожить; то есть по принципу сохранения материи? Если мы утверждаем, что неизменным остается субстратная субстанция, не отождествляемая ни с одним или всеми этими физическими свойствами, но рассматриваемая как их носитель, мы не только сводим принцип к принципу, зависящему от метафизической теории, но и удаляем из него все возможности. проверки.Тогда это становится чистым философским утверждением, которое не имеет прямого отношения к миру восприятия и, таким образом, находится вне области естествознания. Настоящий научный закон сохранения должен содержать указание на некоторое измеримое качество или свойство материи, которое, как можно убедиться, остается неизменным по величине во время реальных химических и двигательных преобразований, происходящих в физическом мире. Даже то, что считается первичным качеством материи, как протяженность, не сохраняется как измеримая величина, неизменная при всех преобразованиях.
Есть, однако, еще одно свойство, которое мы стали связывать со всей материей с весом; это оценивается по балансу, систематическое использование которого Лавуазье привело к тому, что было описано как революция в химической науке. Если, однако, мы понимаем сохранение материи как сохранение веса, мы сразу же сталкиваемся с трудностью, заключающейся в том, что вес того, что мы считаем одним и тем же предметом, при оценке с помощью пружинных весов, зависит от широты места, в котором это измеряется.Более того, в соответствии с теорией гравитации, вес сильно изменился бы, если бы вещество было перенесено на другую планету. Однако в химических превращениях, происходящих в какой-либо одной местности, проверка принципа сохранения материи состоит в проверке принципа сохранения веса. Для разных местностей различия в весе одного и того же объекта устраняются в соответствии с ньютоновской и галилеевой динамикой путем деления веса на ускорение свободного падения; это деление дает меру массы тела.Таким образом, теперь под сохранением материи понимается сохранение массы.
С понятием массы я уже более подробно разбирался в связи с Dynamics. Фактическая масса тела может рассматриваться как качество, которое может быть измерено как производное от двух измерений веса и ускорения. То, что масса тела — это количество вещества в нем, является тавтологическим утверждением, которое может использоваться только для обозначения того, что значение, приписываемое термину количество материи, состоит в том, что это масса, рассматриваемая как измеримое качество тела.Принцип сохранения материи, рассматриваемой как масса, имеет, однако, гораздо более широкий смысл, чем то, что она неизменна для одного и того же тела, в каком бы положении оно ни находилось, ни как бы оно ни двигалось. Он включает утверждение, что масса как измеримая величина не изменяется по количеству на протяжении всех химических и термических изменений, которые могут иметь место в изолированной материальной системе.
Таким образом, этот принцип подразумевает, что материя, как бы она ни была подразделена, фактически или концептуально может рассматриваться как обладающая качеством — массой или количеством вещества, которое можно измерить и которое остается неизменным в общем количестве во время всех движений и всех химических термических или других превращений.Единственное средство, которое у нас есть в абстрактной концептуальной схеме для представления этого предполагаемого качества, — это использование чисел по отношению к концептуальным телам в геометрическом пространстве. В своей абстрактной форме принцип утверждает неизменное свойство суммы таких чисел для концептуальных элементов ограниченной системы. Лишь в ограниченной степени этот общий закон был подтвержден экспериментально; поскольку трудности измерения и обеспечения полной изоляции веществ, которые подвергаются химическому превращению, очень велики, так как они подвержены ошибкам, которые трудно полностью учесть.Более того, сохранение массы при всех движениях может быть только косвенной проверкой в связи с проверкой адекватности конкретной динамической схемы.
Соответственно, этот принцип следует рассматривать как гипотезу, которая была приблизительно проверена в большом количестве случаев и которая, по мнению химика и физика, сохраняет силу как описывающая отношения в большом диапазоне реальных явлений, но в зависимости от возможных опровержение в случаях, когда используются более совершенные методы измерения в связи с электромагнитными или другими явлениями.
В новой электронной теории материи, о которой я расскажу позже, масса занимает совершенно иное положение, чем то, которое ей приписывают в механической теории, которая здесь обсуждалась. В соответствии с электронной теорией механические массы тел больше не постоянны, но имеют ощутимое изменение, когда тела приходят в движение со скоростями, сравнимыми со скоростью света.
Наброска истории доктрины сохранения материи достаточно, чтобы показать, что установление принципа сохранения массы в современной форме было результатом постепенной эволюции.Древние атомисты, не обладая принципом инерции, не делали различия между массой и весом. В этом они согласуются с широко распространенной точкой зрения, существующей даже сегодня. Например, Лукреций, следуя Демокриту в этом порядке идей, по-видимому, рассматривал вес как неизменную характеристику всей материи; в его стихотворении атомы движутся из-за своего веса; и это включает отождествление их массы с их весом. С другой стороны, школа Аристотеля радикально противоположна почти во всех отношениях взглядам атомистов, не считая, что вся материя имеет вес.У аристотелистов понятия материи и веса совершенно отличны друг от друга; вес рассматривается как случайное качество материи, например цвет или температура. По их мнению, вес является результатом двух противоположных качеств — тяжести и легкости. У огня нет тяжести, у земли нет легкости. У воды и воздуха один преобладает в воде, а другой — в воздухе. Платон заметил, что четыре элемента постоянно переходят друг в друга; таким образом, воздух и огонь связаны с преобразованием материи, например, когда вода кипит или когда горит дерево.
В средние века аристотелевские взгляды на материю были преобладающими, хотя можно найти следы влияния древних атомистов. Некоторые алхимики использовали рассуждения, основанные на учете веса; но они не придавали веса первостепенной важности, которой он стал обладать позже, и не верили в его неизменность во время преобразований. Действительно, некоторые из них прямо упоминают изменение веса как происходящее при трансмутации материи. Так, например, пишет Гебер (? Восьмой век А.D.): «Нашей уловкой мы легко делаем серебро из свинца; при трансформации последний не сохраняет свой вес, а превращается в новый вес ». Этот взгляд алхимиков не может быть объяснен как включающий просто ссылку на изменение удельного веса или на изменение веса, вызванное поглощением вещества из воздуха или огня; действительно, удельный вес и абсолютный вес постоянно путали друг с другом даже в семнадцатом веке. Пока вес тела считался просто случайным качеством, как и его цвет, было вполне естественно предположить, что его можно изменить без добавления или вычитания материи.Даже Бэкон придерживался взглядов, не сильно отличавшихся от взглядов алхимиков. В некоторых заявлениях он утверждал, что существуют абсолютно легкие тела и что изменение веса может сопровождать изменение состояния; но в других заявлениях, вероятно, следуя идеям атомистов, он утверждал постоянство веса. Всегда следует помнить, что у алхимиков и вообще у тех, кто находился под влиянием аристотелевской концепции субстанциальных форм, вопрос, оставался ли вес количественно постоянным во время трансформации, казался вопросом второстепенного значения; малейшее изменение качества представляло в их глазах гораздо больший интерес.Знание количественных отношений не имеет большого значения для приверженцев философской доктрины субстанциальных форм, поэтому вряд ли возможно рассматривать понятие постоянства массы, рассматриваемое в количественном отношении, как часть запаса идей тех, кто находился в подчинении у власти. влияние аристотелевских концепций. Поскольку представление о материи как о субстанции, лежащей в основе, отличной от случайного качества веса, не допускало количественного измерения, хотя субстанция считалась в некотором смысле сохраняющейся при всех изменениях.По мере постепенного освобождения от аристотелевских концепций концепция массы прояснилась. Он был сформулирован с терпимой ясностью Кеплером, а также Декартом, хотя у последнего, как и у аристотелевцев, вес оставался случайным свойством, которым не обладал всякая материя. То, что воздух имеет вес, было общепризнанным во времена Декарта, но огонь все еще считался лишенным веса. Поскольку материя Декарта была полнотой, количество материи определялось ее объемом; таким образом, он утверждает, что «когда кувшин полон золота или свинца, он не содержит больше вещества, чем когда мы думаем, что он пустой.Но он рассматривал земную материю как единственный вид, который следует учитывать в механическом воздействии, и поэтому в действительности он проводил различие между массой и объемом — массой, присущей только земной материи. Однако он не осознавал, что масса и вес находятся в фиксированном соотношении; фактически, название одной из глав его Принципов звучит так: « Что их вес не всегда соответствует их материи» , и здесь материю следует понимать как земную материю.В течение долгого периода после времен Декарта представление о том, что вес является случайным качеством материи, препятствовало всеобщему признанию сохранения веса, хотя мнения по этому поводу отнюдь не были единодушными даже во времена Декарта. Жан Рей в своих эссе, опубликованных до фактического появления Принципов Декарта, попытался продемонстрировать a priori , что вес сохраняется при каждой трансформации. Более того, он дал экспериментальное доказательство того, что воздух тяжелый и что при образовании извести увеличение веса происходит из-за материала, взятого из воздуха.Упорное неверие в неизменность веса проявляется в высказываниях многих писателей даже до конца восемнадцатого века. Таким образом, Гоббс заявляет, что «все случайности, кроме величия или расширения, могут быть порождены или уничтожены», тем самым не оставляя места для сохранения веса или массы. Лейбниц, у которого было четкое представление о механической массе, утверждает, что «вода содержит в равном объеме столько же вещества, что и ртуть, только к веществу, принадлежащему воде, добавляется постороннее нетяжелое вещество, которое находится между ее порами», поскольку это странная фантастика, чтобы все стало тяжелым.
Ньютон, не допускавший существования невесомой материи, экспериментально показал, что вес пропорционален массе тела; и Гюйгенс определенно утверждал, что количество материи измеряется ее весом. Раздельные направления работы физиков и химиков затрудняют выяснение взглядов физиков семнадцатого и восемнадцатого веков на природу химических явлений. Почти единственным исключением из этого разделения была работа Роберта Бойля, физика и химика, который, кажется, признает принцип сохранения веса, но не формулирует его явно.В семнадцатом веке, хотя обычно считалось, что воздух имеет вес, в целом не верили, что это справедливо для огня. Однако в восемнадцатом веке мы обнаруживаем, что Беркли рассматривал увеличение веса некоторых металлов при нагревании, например, в случае сурьмы, как результат огня в солнечных лучах; он заметил, что мы не знаем веса солнечного луча. Дидро заявил, что «огонь в наших печах значительно увеличивает вес некоторых веществ, таких как кальцинированный свинец.
Особой формой, которую понятие невесомой субстанции приняло в умах химиков того времени, была теория флогистона, вещества, изобретенного для объяснения тепловых явлений. Флогистон наделен отрицательным весом, и, поскольку он участвует во всех химических реакциях, нетрудно было понять, что его примесь с веществом препятствует сохранению веса при химическом превращении. Как мало внимания химики уделяли всем вопросам, касающимся количеств, иллюстрируется тем фактом, что один из главных французских химиков того времени Маккер, узнав, что Лавуазье готовит атаку на теорию флогистона, заявил, что его беспокоит момент, но успокоился, когда узнал, что возражения Лавуазье основаны исключительно на количественных соображениях.Определенное установление принципа сохранения материи путем систематического использования весов в основном принадлежит Лавуазье и может быть датировано его мемуарами о году «Превращение воды в землю» , опубликованными Французской академией в 1773 году. 1774 г. в работе, в которой, используя баланс, он решил между конкурирующими теориями Блэка и Мейера относительно того, что происходит при химических превращениях. Во-первых, применение принципа без явного указания «любая материя не может дать ничего в эксперименте, кроме полной ее массы», а затем «определение веса материалов и их продуктов до и после экспериментов является основой всего полезного и точного в химии.«В каждой операции есть равное количество вещества до и после операции».
В 1774 году Лавуазье описал начало своих фундаментальных открытий, касающихся горения. Он подтвердил, что различные металлы при нагревании в закрытом сосуде увеличиваются в весе и что количество воздуха в сосуде уменьшается; он показал, что потеря веса воздуха почти эквивалентна увеличению веса металла. Небольшое увеличение веса всего сосуда он правильно объясняет внешним отложением из-за пожара.Таким образом, он опровергает идею вмешательства стихии огня и показывает, что увеличение веса может происходить только с воздуха. Даже после того, как стал известен состав воды и явление, которое мы называем окислением, новые концепции Лавуазье только медленно восторжествовали. Похоже, они не были полностью приняты Пристли или Кавендишем. Шееле считал тепло соединением флогистона и кислорода; Он считал их обоих тяжелыми, но полагал, что вместе они дают начало неуловимой субстанции.Тепло, соединенное с очень небольшим количеством флогистона, превращается в свет, но соединенное с большим количеством, становится легковоспламеняющимся воздухом, то есть водородом. Даже Лавуазье показывает следы аналогичных представлений. Он считал кислород результатом сгорания весомого вещества и невесомого жидкого теплоносителя. Он рассматривал тепло как материальный элемент, содержащийся в газе, и его представление о газах было связано с помощью промежуточных гипотез с концепцией невесомых жидкостей.
После описанных мною превратностей принцип сохранения материи, измеряемой динамической массой, стал принят как эмпирический закон, применимый в широком диапазоне явлений, хотя некоторые химики утверждали, что это возможно. обнаруживать отклонения от закона, которые нельзя отнести к результату инструментальных погрешностей или мешающим факторам, которые трудно полностью учесть.Более того, поток света, который недавно был брошен на свойства радиоактивных веществ, подсказал взгляды, согласно которым динамическая масса больше не занимает своего прежнего положения как фундаментального и несводимого. Действительно, было высказано предположение, что в соответствии с электрической теорией материи не было бы ничего удивительного в изменении веса из-за химических реакций.
Происхождение принципа Сохранения Энергии намного более современно, чем у принципа Сохранения Материи.В своей общей форме принцип сохранения энергии восходит к середине девятнадцатого века, но в своей ограниченной форме как принцип механики в более узком смысле слова он находится в идеях Декарта Лейбница и особенно Гюйгенса. что мы находим его происхождение. Представление о материи сформировано здравым смыслом, но представление об энергии было создано Наукой для ее особых целей. Поэтому кажется вполне естественным, что доктрина сохранения энергии должна была возникнуть на гораздо более позднем этапе истории науки, чем доктрина сохранения материи, по крайней мере в грубой форме.Представление о работе, измеряемой произведением силы на смещение в направлении силы тела, на которое она действует, принадлежит Галилею, который показал, что в простых механических машинах работа сопротивления при смещении равна что власти. Он пришел к выводу, что с помощью таких машин невозможно создать работу, но он не показал, что работа не может быть уничтожена. Для случая падающего тела он дал формулу, которая выражает принцип энергии.
Следующий шаг в направлении установления общего принципа, относящегося к движению тел, был сделан Декартом, который попытался установить принцип сохранения движения через все изменения в физическом мире.В этой попытке он совершил ошибку, взяв сумму произведений масс на их скорости вместо квадратов скоростей как представление сохраняемой величины. На эту ошибку указал Лейбниц в трактате под названием «Краткая демонстрация замечательной ошибки Декарта и других в отношении Закона природы, согласно которой, по их мнению, Творец всегда сохраняет одну и ту же величину движения; чем, однако, полностью извращается наука о механике. Лейбниц различал простое давление (vis mortua) и силу движущегося тела (vis viva) , но он перепутал вопрос о правильной мере силы с вопросом о постоянстве количества движения и кинетической энергии тела. система. Ни декартова, ни лейбницевская мера эффективности движущегося тела не отождествляется, как заметил Лейбниц, с ньютоновской мерой силы. Лейбниц, как и Декарт, рассматривал сформулированный им принцип как охватывающий все явления Вселенной.Он оправдал принцип сохранения vis viva обращением к принципу причинности в том виде, в котором следствие равно причине.
Попытка продемонстрировать этот закон (он пишет) затмила бы его. В самом деле, каждый считает бесспорной аксиомой, что каждая действенная причина не может исчезнуть полностью или частично, не вызвав эффекта, равного потере. Представление о vis viva в том виде, в каком оно существует в движущемся теле, является чем-то абсолютно независимым и позитивным; что он остается в теле, даже если остальная часть Вселенной будет уничтожена.Тогда ясно, что если vis viva тела уменьшается или увеличивается при столкновении с другим телом, vis viva этого другого тела должна изменяться, увеличиваться или уменьшаться на ту же величину.
Его взгляд на масштабы принципа ясно виден в следующем отрывке:
Я утверждал, что в мире сохраняются активные силы. Высказывались возражения, что два мягких или неупругих тела при столкновении теряют часть своей силы. Отвечаю, что это не так. Верно, что «целое» теряет его в отношении своего полного движения, но части получают его, внутренне взволнованные силой столкновения.Таким образом, потеря наступает только внешне. Силы не уничтожены, а рассеяны по мельчайшим частям. Это не значит, что они были потеряны, это похоже на превращение больших монет в мелкие.
Истинность принципа ранее была продемонстрирована Гюйгенсом, который, однако, сформулировал его, не указав на большую общность его объема. В своем утверждении он проводил различие между сохранением vis viva и сохранением количества движения:
Количество движения, которым обладают два тела, может быть увеличено или уменьшено при их столкновении; но всегда остается одно и то же количество на той же стороне, если мы вычитаем количество противоположного движения.Сумма произведений каждого твердого тела, умноженная на квадрат его скорости, всегда одинакова до и после столкновения.
Следует отметить, что и для Декарта, и для Лейбница мир состоит только из движущейся материи и не существует действия на расстоянии. Следовательно, они не допускали существования того, что мы называем потенциальной энергией, так что для них принцип энергии заключался в постоянстве полной кинетической энергии. Следует также отметить, что Лейбниц в процитированном мною отрывке, говоря о диссипации молярной энергии между мельчайшими частицами тела, по-видимому, не считал это преобразование эквивалентным выделению тепла.
В восемнадцатом веке представление о тепле как о веществе постепенно развивалось на основе картезианской идеи теплового движения. Предполагалось, что количество этого вещества сохранится при переходе от одного тела к другому. Когда оно перестало проявляться с помощью термометра, тепло считалось Блэком все еще присутствующим, но как скрытое тепло, способное проявляться в определенных условиях, и поэтому его концепция скрытого тепла была аналогична нашей концепции потенциальной энергии.Даже изобретение паровой машины не произвело немедленного изменения в этой концепции субстанции тепла. Ватт и его последователи не смогли прийти к мнению, что тепловые изменения указывают на какую-либо связь между теплотой и механическим движением. Однако к концу века Лавуазье и Лаплас предварительно связали производство тепла трением с концепцией теплового движения и определили количество тепла как сумму произведений масс молекул на квадраты их скоростей.
В начале девятнадцатого века Рамфордом и Хамфри Дэви были получены прямые экспериментальные доказательства преобразования движения в тепло. Концепция скрытого vis viva , названная Понселе работой , была сформулирована (1803) Лазаром Карно; эта концепция теперь известна как потенциальная энергия. В 1839 году инженер Сеген в работе о строительстве железных дорог заметил, что:
Однако, поскольку принятая в настоящее время теория может привести к этому результату (вечный двигатель), мне кажется более естественным предположить, что определенное количество калорий исчезает в акт создания механической силы или мощности и наоборот; и что два явления связаны друг с другом условиями, которые приписывают им неизменные отношения.
Похоже, однако, что до Сегена принцип эквивалентности тепла и механической энергии в его обобщенном виде был задуман Сади Карно, который получил путем вычислений оценку механического эквивалента тепла. В своей более ранней работе Карно использовал материальную теорию тепла, и его более поздняя формулировка современной теории сохранилась только в рукописных примечаниях, которые оставались неопубликованными до 1871 года. Но именно экспериментальные исследования Джоуля, опубликованные в 1843 году, сделали вид для научного мира. теория эквивалентности тепловой и механической энергии.Полученные ранее Джоулем оценки количества рабочих шагов, эквивалентных теплу, необходимому для повышения температуры фунта воды на один градус по Фаренгейту, сильно расходились и варьировались от 742 до 1040; но в результате более поздней серии экспериментов он получил 770 шагов в качестве эквивалента; и это не сильно отличается от принятого сейчас значения. Джоуль, однако, не сомневался, что значение эквивалента существует как определенное число, несмотря на значительные различия в его экспериментальных определениях.Его уверенность в этом была проистекала из его убежденности в априорной необходимости.
Можно предположить, что a priori (он пишет) 1 , что такое абсолютное разрушение жизненной силы не может иметь места, потому что явно абсурдно предполагать, что силы, которыми Бог наделил материю, могут быть уничтожены не больше, чем это они могут быть созданы мужской волей; но не только этот аргумент остается решающим, как это должно быть для любого непредубежденного человека.Работа Дж. Р. Майера о сохранении энергии, появившаяся за год до первой публикации экспериментов Джоуля, была самой ранней публикацией по этой теме в ее современной форме. В 1843 г. на эту же тему вышла работа датского ученого А. Колдинга. Работы Майера в основном основывались на его философских идеях и не включали никаких экспериментальных проверок принципа, подобных тем, которые были у Джоуля. Он апеллирует к старой идее о том, что силы — это причины и что причина равна следствию.Его определение эквивалента тепла расчетом предполагает существование постоянного отношения эквивалентности, как это было в случае аналогичного расчета, сделанного Сади Карно. Колдинг предполагает, что энергия существует как нерушимая нематериальная субстанция. Таким образом, он пишет: 2 :Поскольку силы являются духовными и нематериальными существами, поскольку они являются сущностями, которые известны нам только своей властью над природой, эти сущности, несомненно, должны быть намного выше всех существующих материальных вещей; и поскольку очевидно, что только силами проявляется мудрость, которую мы воспринимаем, и что мы восхищаемся природой, эти силы должны быть связаны с духовной нематериальной и интеллектуальной силой, которая направляет ход природы; но если это так, то совершенно невозможно представить себе, чтобы эти силы были чем-то смертным или бренным.Следовательно, несомненно, они должны рассматриваться как абсолютно нетленные.
До сих пор область действия принципа сохранения энергии ограничивалась механической областью и эквивалентностью механической энергии и тепла, но в хорошо известном трактате, опубликованном Гельмгольцем в 1847 году, последовательно развивалось учение о том, что Сохранение энергии применимо ко всем физическим факультетам. Эта работа дает достаточно доказательств того, что такие авторы, как Джоуль Майер и Колдинг, первоначально считали этот принцип тем, который следует из принципа причинности.
В очень интересном отрывке во введении к своему трактату Гельмгольц пишет:
Целью этих наук (физических наук) является поиск законов, по которым различные процессы в природе сводятся к общим правилам и из правила могут быть определены заново. Эти правила, например, законы преломления или отражения света и законы Мариотта и Гей-Люссака для объема газов, очевидно, являются не чем иным, как общими понятиями, которыми охватываются все рассматриваемые явления.Их поиск — дело экспериментальной части нашей науки. Их теоретическая часть, с другой стороны, пытается найти неизвестные причины процессов по видимым эффектам; он пытается подчинить их закону причинности. Мы вынуждены и уполномочены делать это по тому принципу, что каждое изменение в природе должно иметь достаточную причину. Непосредственные причины, которым мы приписываем явления, могут быть неизменными или переменными; в последнем случае тот же принцип заставляет нас искать другие причины этой изменчивости и так далее, пока мы не придем к конечным причинам, которые действуют согласно неизменному закону, который, следовательно, каждый раз при одних и тех же внешних условиях производит одно и то же действие.Таким образом, конечной целью теоретических наук является поиск конечных неизменных причин процессов в природе. Здесь не может быть решено, могут ли все процессы быть сведены к таким (причинам), то есть является ли природа полностью понятной или в ней есть изменения, которые не подчиняются закону необходимой причинности и поэтому попадают в область спонтанности или свободы. Совершенно очевидно, что наука, цель которой — постичь природу, должна исходить из гипотезы о том, что она постижима, и должна исследовать и делать выводы в соответствии с этой гипотезой до тех пор, пока неопровержимые факты заставят ее признать пределы гипотезы.
Можно заметить, что мнения Гельмгольца относительно поиска эффективной причинной связи в природе, являющейся функцией теоретических частей естествознания, расходятся с точкой зрения, которую я придерживался в этих лекциях. Однако очень интересно отметить, что позднее Гельмгольц заявил, что он изменил мнения, выраженные в процитированном мною отрывке. Фактически, в примечании, приложенном к более позднему изданию его работы, он говорит:
Философские дискуссии во введении находились под более сильным влиянием эпистемологических взглядов Канта, чем я в настоящее время считаю правильными.Позже я пояснил себе, что принцип причинности на самом деле есть не что иное, как гипотеза о том, что все природные явления подчиняются закону.
Из этого утверждения следует, что Гельмгольц освободился от идеи, что эффективная причинность может быть найдена в природе с помощью науки, и что он, наконец, идентифицировал термин причинность с признанием неизменности последовательностей явлений.
Оставляя в стороне предполагаемую демонстрацию принципа энергии с помощью принципа причинности a priori , можно вывести этот принцип из классической системы механики, если предположить, что все явления движения регулируются центральные силы; в этом случае они образуют так называемую консервативную систему.В соответствии с этим предположением силы, действующие между каждой парой корпускул системы вдоль соединяющей их линии, равны по величине и противоположны по направлению; и величина такой силы зависит исключительно от расстояния между частицами. Вся энергия такой системы состоит из двух частей: кинетической энергии или энергии движения системы и потенциальной энергии или энергии положения, которая представляет способность сил системы совершать механическую работу.Принцип в форме того, что сумма кинетической энергии и потенциальной энергии системы постоянна для такой системы во время ее движения, следует как математическое следствие динамической схемы, было продемонстрировано Гельмгольцем в его трактате. Но что касается применения этого принципа в общей физике, следует отметить, что крайне сомнительно, можно ли в молекулярной или субмолекулярной области ограничить силы силами центрального типа. Например, не представляется возможным рассматривать явления остаточной деформации и кристаллизации как связанные только с такими силами.
Мы уже видели, что желание создавать графические образы механических явлений привело к нежеланию принимать понятие сил, действующих на расстоянии, как часть механической схемы. Та же самая тенденция привела к попыткам объяснить, что является явно потенциальной или скрытой энергией, как действительно сводимой к кинетической энергии небольших частей тел или среды, и, таким образом, в конечном итоге устранить различие между кинетической и потенциальной энергией; последнее рассматривается как менее конкретное или наглядное, чем первое.Но в соответствии с точкой зрения на характер концептуальных схем, принятой в этих лекциях, концепция потенциальной энергии как измеримой величины действительно находится на том же основании, что и концепция кинетической энергии; и, следовательно, даже если сведение двух концепций к одному все еще кажется желательным упрощением, такое сокращение уже не имеет такой же актуальности, как для тех, кто чувствует себя обязанным более реалистичную интерпретацию концепций динамической науки.
Принцип энергии часто рассматривался как следствие принципа невозможности вечного двигателя.Было предпринято очень много попыток, многие из которых были очень изобретательными, чтобы сконструировать машины, которые должны реализовывать вечный двигатель. Убеждение в невозможности вечного двигателя, однако, постепенно стало очень сильным среди ученых. Это было подтверждено Леонардо да Винчи Галилео Стевинусом и Лейбницем, последний из которых использовал его для установления принципа vis viva. В 1775 году Французская академия наук постановила, что представленные в Академию решения проблемы дублирования куба, трисекции угла, квадратуры окружности и конструкции машин, использующих вечное движение, больше не должны рассматриваться.В случае последней проблемы Академия основывала свое решение на априори основаниях, заявленных следующим образом:
Построение вечного двигателя абсолютно невозможно: даже если трение и сопротивление среды в конечном итоге не разрушили сопротивление среды. движущая сила эта сила может производить только эффект, равный ее причине; если тогда желательно, чтобы действие конечной силы продолжалось бесконечно, необходимо, чтобы сила была бесконечно малой за конечное время.Если абстрагировать трение и сопротивление телом, на которое когда-то было нанесено движение, оно всегда будет сохраняться; но это было бы, если бы не воздействовать на другие тела, и единственное вечное движение, возможное на основе этой гипотезы (которое, к тому же, не может быть реализовано в природе), было бы абсолютно бесполезным для объекта, к которому стремятся конструкторы вечного движения.
Гельмгольц показал, что принцип энергии выводится из принципа невозможности вечного движения. Однако эту невозможность он расценил как факт опыта, установленного многочисленными тщетными попытками построить вечный двигатель . Однако Пуанкаре указал, что только в случае обратимых явлений сохранение энергии следует из невозможности вечного движения. Общий принцип сохранения энергии изолированной системы во всех ее различных формах посредством всех физических и химических изменений, которым может подвергаться система, может рассматриваться только как гипотетический принцип, который можно использовать предварительно в качестве руководства в наших попытках описать концептуально различные процессы в трансформациях.Тот факт, что у нас нет уверенности в том, что нам известны все возможные формы энергии, которые могут возникать в физических явлениях, делает невозможным представить себе, что этот принцип допускает что-либо вроде полной эмпирической проверки.
История науки свидетельствует об открытии различных форм энергии, ранее не известных. В частности, наши знания о явлениях электричества, за исключением чисто тривиальных проявлений, восходят только к исследованиям Гилберта три столетия назад.Недавние открытия за последние несколько десятилетий; Рентгеновские лучи и радиоактивные вещества волн Герца познакомили нас с формами энергии, о существовании которых раньше и не подозревали. Уверены ли мы даже сейчас, что знакомы со всеми формами энергии, которые могут быть обнаружены в солнечной радиации и которые могут выходить за известные пределы светящихся тепловых и актинических лучей? Открытие рентгеновских лучей является одной из иллюстраций того факта, что форма энергии может долгое время оставаться неоткрытой, когда она, так сказать, находится на наших глазах; Крукс’трубки использовались за четверть века до открытия Рентгеном лучей, которые они вызывают.Мы видели, что в случае системы, состоящей из частиц, между которыми действуют центральные силы, зависящие только от их относительных расстояний, принцип энергии принимает простую форму: сумма кинетической энергии и потенциальной энергии постоянна; первая зависит только от скоростей частиц, а вторая — от их положения, но не от их скоростей; так что полную энергию можно только одним способом разделить на сумму двух компонентов. Но если, как в случае закона Вебера о взаимодействии двух электрических молекул, взаимное действие зависит не только от их расстояния, но также от их скоростей и от их ускорений, вторая часть энергии будет зависеть от скоростей и может содержать члены в зависимости от квадратов скоростей.В таком случае у нас нет средств различать члены, принадлежащие соответственно двум частям полной энергии. Пуанкаре указал 1 , что тогда у нас нет средств для определения энергии системы, потому что, если полная энергия системы постоянна, то это также и любая функция этой полной энергии; и такая функция могла бы быть заменена самой энергией и легла в основу измененного определения энергии системы. В таком случае не существует способа зафиксировать точное определение энергии как таковое, чтобы ее можно было разделить на две части, каждая из которых имеет определенную форму.Более того, если принцип энергии должен быть полезен, необходимо учитывать различия между механической энергией молярных тел и другими формами энергии, такими как тепловая, химическая и электрическая энергия. Это может быть сделано только в том случае, если можно разделить всю энергию системы на части, абсолютно разные по форме; часть, включающая только квадраты скоростей тел, другая часть, не зависящая от этих скоростей, а также от теплового и электрического состояний системы, и третья часть, не зависящая от скоростей и положений тел и зависящая только от их внутреннего состояния.Но случая электрической энергии за счет взаимного электрического действия тел достаточно, чтобы показать невозможность этого разделения на такие отдельные части. Ведь электростатическая энергия зависит не только от электрических зарядов тел, но и от их положения. Если тела находятся в движении, их электродинамическая энергия зависит не только от их состояний и положений, но и от их скоростей. Поэтому у нас нет очевидных средств выбора и разделения различных частей общей энергии желаемым образом.Вывод, сделанный Пуанкаре из этих соображений, состоит в том, что когда делается попытка расширить принцип сохранения энергии так, чтобы он охватил все явления, с которыми приходится иметь дело физике, мы сталкиваемся с трудностью определения энергии системы. уникальным образом, так что различные его части могут быть идентифицированы как относящиеся к различным явлениям, которые происходят в системе. Он отмечает, что, когда эта крайняя общность направлена на то, как кажется, от принципа не остается ничего, кроме высказывания: «есть нечто постоянное», и что в этой форме принцип выходит за рамки эксперимента и сводится к своего рода тавтологии.Эта критика уместна в отношении попытки Оствальда и других создать энергетическую науку, основанную на Принципе Энергии и Принципе Наименьшего Действия (или каком-либо другом подобном принципе), с целью избежать трудностей, связанных с гипотеза о существовании атомов. Фундаментальная концепция Энергетики состоит в том, что каждое изменение в изолированной системе регулируется двумя законами. Во-первых, сумма кинетической и потенциальной энергий постоянна при всех преобразованиях системы.Во-вторых, если система переходит от одной конфигурации в одно время к другой конфигурации в другое время, переход всегда происходит таким образом, что среднее значение разности двух видов энергии в интервале времени между двумя указанное время — минимум.
Уроки, которые следует извлечь из истории различных концепций, которые возникали в разное время в связи с постоянными усилиями, которые были предприняты для достижения ясных представлений о том, что именно сохраняется в материи и ее различных преобразованиях, в основном заключаются в следующем: о неадекватном характере априорных концепций, таких как принцип причинности, и о частичном характере эмпирической проверки принципов.Похоже, что когда будет достигнута максимальная четкость формулировки этих принципов как концептуальных законов, остается элемент сомнения, неуверенности и предположительности в отношении диапазона применимости как на практике, так и в теории этих законов в их функции. описания реальных изменений и преобразований в воспринимаемом мире.
Элементы и (первые) принципы в химии
Теперь, когда мы проследили APE через историю химии, мы можем обсудить его эпистемический статус.Это правда, согласно современной химии? Если это то, что можно узнать сейчас, когда это стало известно? Когда стало известно, были ли основания априори или апостериори? Современная химия однозначно подтверждает APE: элементы выживают в своих соединениях, потому что ядерный заряд, элементарное свойство, благодаря которому химия индивидуализировала элементы с 1923 года, сохраняется при химических изменениях (см. Обсуждение в Hendry 2006). Footnote 5 Поскольку факты, подтверждающие истинность APE, были открыты только в двадцатом веке, это должно считаться эмпирическим открытием.
Если APE истинно, то в принципе это может быть известно, но очень трудно сказать, что Лавуазье мог знать, что APE истинен. Трудно даже сказать, что он этому верил. Его теории, его методы (включая гравиметрию) и его способы описания химических изменений могут включать в себя презумпцию их истинности, но это не означает, что он утверждал бы это, если бы на него настаивали. Нельзя также сказать, что у него было бы какое-либо оправдание для утверждения его истинности, если бы оно подтверждалось фактами, которые стали известны только в двадцатом веке.Поэтому можно было бы сказать, что APE был доступен Лавуазье как негласное рабочее предположение о том, как должна работать теория композиции, но это не то же самое, что сказать, что он знал, что это правда. Такое предположение было бы «оправданным» только в том смысле, что его допустимо было делать при выполнении его программы исследования композиции. Это не то же самое, что оправдание в более традиционном эпистемологическом смысле (достаточное основание для веры). В поисках такого обоснования рабочего предположения в исследовательской программе до того, как эта программа запущена, телега ставится впереди лошади.Какое бы там ни было оправдание, оно появилось бы благодаря эмпирическому успеху программы.
APE — это, безусловно, естественный способ понять химический состав и изменения. Это может быть даже психологически естественным допущением — так же, как это естественно для младенцев после определенного этапа их когнитивного развития, — структурировать свой мир на основе постоянства объекта. Все это не означает, что APE может быть известен априори. Если предположить, что APE — это только психологическая тенденция, то дальнейшее размышление может позволить ему противостоять.Я думаю, что дальнейшие размышления действительно показывают, что APE можно сопротивляться: учение Аристотеля о химической комбинации отрицает APE, но при этом совершенно логично.
Согласно Аристотелю, элементы потенциально присутствуют только при объединении в микс. Footnote 6 Аристотель развил свою точку зрения в противоположность атомизму, согласно которой основные компоненты вещей остаются неизменными в более сложных телах, а различия между вещами объясняются их различным расположением.Аристотель утверждал, что если элементы объединяются для образования новой субстанции, а не просто сопоставляются, продукт должен быть однородным. Однако, если предполагается, что атомы неизменны, тогда (он утверждал) атомизм может приспособиться только к сопоставлению, и поэтому не может распознать различие между простым сопоставлением и подлинной комбинацией (Needham 2009). Положительное контрпредложение Аристотеля состоит в том, чтобы создать элементы из противоположных пар свойств: горячего и холодного, влажного и сухого. Элементы соответствуют максимальным степеням совместимости пар этих свойств: воздух — это горячее и влажное, вода — это холодное и влажное, огонь — горячее и сухое, а земля — холодное и сухое.В сочетании основные свойства элементов смешиваются, так что смесь будет иметь субмаксимальную степень тепла или холода, влажности или сухости. Поскольку смесь однородна, элементы фактически не присутствуют в смеси, потому что никакая часть смеси не обладает существенными свойствами каких-либо элементов. Что сохраняется? Нидхэм интерпретирует точку зрения Аристотеля как принимающую непрерывные изменения как части материи, обладающие свойствами вещества, включая способность снова проявлять элементарные свойства (2009).Только в этом смысле — потенциальности — можно сказать, что элементы находятся «в смеси».
Если APE является конституирующим принципом, который может быть известен априори, то что же он является конститутивным? Понятие элемента? Разборчивость (для нас) объяснения композиции Аристотеля является (опровержимым) свидетельством того, что это представление связно. Если объяснение Аристотеля логично, то оно не нарушает никаких рациональных ограничений на применение концепции элемента. В этом случае APE можно согласованно отрицать, и он не является составляющим для нашей концепции элемента.Теперь вместо этого можно было бы увидеть применимость концепции элемента в зависимости от непрерывности химических изменений: химические реакции включают изменение, но последовательное изменение требует непрерывности, что серия химических изменений имеет постоянный субъект , с которым это происходит. Это тоже было бы недостаточным оправданием для APE. Согласно Нидхему, у Аристотеля материя является продолжением: химические изменения — это вещи, которые происходят с частями материи. Следовательно, даже если непрерывность химических изменений является требованием для надлежащей применимости концепции химического элемента, ее можно удовлетворить, не предполагая, что элементы выживают в своих соединениях. Footnote 7
Этот аргумент можно было бы оспорить, указав, что концепции элементов радикально изменились на протяжении истории науки. Даже если рассказ Аристотеля понятен современному философу или ученому, возможно, он не был для Лавуазье. Мне не известно о положительном текстуальном обосновании этого утверждения в собственной работе Лавуазье. Рассмотрим по аналогии предположение Лавуазье о том, что кислотность обеспечивается присутствием кислорода. Должны ли мы сказать, что это предположение ложно или что это часть концепции кислотности Лавуазье? Если мы можем считать, что Лавуазье способен рассуждать о кислотах, то мы можем считать, что он ошибался в отношении природы кислот (я думаю, что можем).Тогда мы можем сказать, что предположение Лавуазье о кислотности оказалось ложным, как и все последующие теории, согласно которым свойство кислотности обеспечивается присутствием определенного элемента (см. Hendry 2005, 2010). Теперь Лавуазье рассуждает об элементах и их роли в химических изменениях способами, которые хорошо известны современной науке. APE ограничивал его рассуждения, но они могли оказаться ложными, поэтому более правдоподобно рассматривать это как фактическое предположение даже в системе Лавуазье.Это не нокдаун-аргумент, поскольку он основан на предшествующей позиции: исторические философы и ученые могут (иногда) рассуждать о том же самом мире, в котором мы находимся, и могут ошибаться в этом. Эта позиция может быть оспорена конкретными текстовыми доказательствами: что Лавуазье рассматривал кислород как концептуально (а не материально) составляющую кислотности, или что он рассматривал APE как концептуально составляющую элемент. Такие доказательства (насколько мне известно) полностью отсутствуют.
Вместо априорного регулирующего принципа, я бы сказал, что APE следует рассматривать как метафизический принцип, который, тем не менее, мог играть важную регулирующую и эвристическую роль в развитии теорий химического состава и структуры с восемнадцатого века. века и позже. Под «метафизическим» я подразумеваю «относящийся к существованию или реальности или относящийся к ним». Метафизический принцип — это общее или абстрактное утверждение о том, как обстоят дела, а не условность или необходимое предварительное условие для знания в какой-либо конкретной области.«Метафизичность» в этом смысле не означает непроверяемости или непроверяемости. Метафизические принципы может быть трудно проверить или проверить, и может быть даже невозможно проверить или проверить самостоятельно, но то же самое верно и для многих научных теорий. Метафизичность не исключает возможности быть неотъемлемой частью науки. Действительно, метафизические принципы часто четко формулируются учеными (рассмотрим, например, приверженность Ньютона абсолютному времени и пространству), но часто они не сформулированы, даже если они регулируют выводы ученого о категориях, которыми они управляют.Достоинство понимания APE как метафизического принципа как раз заключается в том, что его можно непрерывно прослеживать на протяжении истории химии, от того времени, когда он не был сформулирован (в работе Лавуазье), до времени, когда он был признан явно (в работе Менделеева). ).
Начиная с 1950-х годов философы Лондонской школы экономики разработали противоположные мнения о том, как это могло бы работать. Можно сказать, что проект определения роли метафизики в науке сам по себе был исследовательской программой в рамках широко реалистической философии науки, поддерживаемой (и сам по себе поддерживающей) широким взглядом на то, что единицы оценки в науке должны быть исследовательскими программами (т. Е. , серии теорий, а не отдельных теорий, разработанных в рамках таких программ).Поэтому в оставшейся части этого раздела я буду критически исследовать, примерно в хронологическом порядке, предложения Карла Поппера, Дж. У. Н. Уоткинса, Имре Лакатоса и Эли Захара.
Чтобы быть достойным своего имени, реалистическое описание роли метафизики в науке должно основываться на следующих общих принципах. Во-первых, метафизические теории или принципы должны рассматриваться как фактические утверждения: они (или, по крайней мере, некоторая их абстрактная часть) должны интерпретироваться реалистично, чтобы семантически соответствовать другим теоретическим утверждениям в науке, и их предполагаемые роль в науке должна зависеть от этой интерпретации.Во-вторых, роль метафизических теорий или принципов не должна сводиться к только психологической роли, заключающейся в том, чтобы привнести в сознание конкретного ученого конкретную проверяемую теорию. Утверждается, что наблюдение за падением яблока в его доме в Вулсторпе сыграло определенную роль в возникновении закона всемирного тяготения Ньютона. Footnote 8 Дремал перед огнем Августу Кекуле якобы было видение змеи, которая схватила свою собственную сказку, приняв форму кольца, которое, как он позже сказал, подсказало ему его знаменитую шестиугольную формулу. для бензола (см. Rocke 2010, глава 7).Согласно реалистической концепции, роль метафизических теорий не должна быть просто наводящей на размышления, как яблоко и змея для Ньютона и Кекуле. Чтобы поддержать реалистический вывод, эвристическая и регулирующая роль должна зависеть от содержания метафизического принципа, истолкованного буквально. В-третьих, если такие теории или принципы семантически наравне с проверяемыми научными утверждениями, и они могут играть роль в развитии теорий, которые не просто наводят на размышления, то в принципе должно быть возможно оценить роль конкретных метафизических теорий или принципов в конкретных научных разработках, во многом так же, как абстрактным, но все же научным принципам в физике приписывается эмпирический успех в теоретических разработках, в которых они играют важную роль.
Это предполагает взгляд на роль метафизики в науке, близкий по духу научному реализму, но требующий большего. Не каждый научный реалист может захотеть дать реалистическое описание роли метафизики в науке. Можно быть реалистом в науке, но думать, что метафизика оказывает на нее только вредное воздействие. Или можно допустить, что метафизические принципы могут (иногда) играть роль, но никогда так, чтобы обосновать аргумент в пользу их истинности. Я думаю, что метафизические принципы могут играть роль в эмпирической науке, что действительно позволяет им получить положительную поддержку.Осталось описать, как это вообще возможно.
В коротком, но хорошо известном отрывке в постскриптуме к «Логике научных открытий » Поппер попытался сформулировать роль метафизики в науке, но название раздела ясно показывает, что эта роль ограничена и не соответствует два из наших трех критериев реалистической концепции роли метафизики в науке: «Почему даже псевдонауки могут иметь смысл». Метафизические программы для науки »(1983, стр.189–93). Его обсуждение начинается с повторения его фальсификационистского критерия демаркации, который «выделяет те теории, которые могут быть серьезно обсуждены с точки зрения опыта» (1983, с. 189). Но ученый рискует пренебречь изучением псевдонаучных и метафизических теорий, которые не соответствуют этому критерию, из которого можно извлечь «что-то действительно интересное». Он утверждал, что пренебрежение к астрологии, например, может скрыть от ученого астрономические возможности, такие как влияние Луны на приливы и отливы, и признал, что Кеплер «принадлежал к астрологической традиции», хотя он «никогда не уставал выдвигать свои гипотезы. к остроумным и очень критическим тестам »(1983, с.190). Центральным примером «чрезвычайно важной метафизической теории» Поппера (1983, стр. 191) является атомизм:
Метафизический характер «корпускулярной теории», во всяком случае до Авогадро, ясен. Не было возможности опровергнуть это. Неспособность обнаружить тельца или какие-либо доказательства их существования всегда можно объяснить, указав на то, что они слишком малы, чтобы их можно было обнаружить. Только теория, которая привела к оценке размера молекул, была более или менее заблокирована, так что опровержение стало в принципе возможным.(Поппер, 1983, с. 191)
Согласно Попперу, атомизм является метафизической теорией не только потому, что он не поддается проверке, но и потому, что он «задумал мир в терминах обширного обобщения в высочайшем масштабе» (1983, p. 191) и « объяснил. известное в терминах неизвестного : оно сконструировало неизвестный и невидимый мир за нашим известным миром »(1983, p. 192). Для Поппера его ценность для науки заключалась в том, что его можно было дополнить дополнительными предположениями, чтобы его можно было проверить (1983, с.191). Следовательно, было бы «грубым заблуждением называть это бессмысленным; и очень рискованно отвергать его сразу, как это сделал Мах »(1983, с. 191). Конечно, став поддающимся проверке, атомизм стал научной теорией, но даже непроверяемая теория может« указать направление наших поисков, и своего рода объяснение, которое могло бы нас удовлетворить ». (1983, стр. 193). Таким образом, неопровержимое экзистенциальное утверждение «существует философский камень» (1983, стр. 193) «оказалось многообещающим и даже плодотворным в истории науки» (предположительно, благодаря его влиянию на алхимию), несмотря на то, что что это «никогда не было подтверждено и теперь никто не верит» (1983, с.193).
Из обсуждения Поппера стоит отметить три вещи. Во-первых, он никогда не отличает метафизику от лженауки. Оба они неопровержимы, и термины, в которых он характеризует метафизику (большая общность, объясняющая известное в терминах неизвестного или невидимого), несколько расплывчаты и едва ли отличаются от метафизики. Как признает Поппер, эти черты разделяют и многие научные теории. Во-вторых, ненаучная теория может быть полезной для науки двумя способами.Атомизм стал поддающимся проверке, когда он был расширен, чтобы стать проверяемым. Поступив так, она перестала быть метафизической, но другие теории остались непроверяемыми и все же наводили на мысль об эмпирической работе. Поппер не указывает, сделали ли они это, предлагая проверяемые гипотезы, но даже если бы они это сделали, эта роль позволила бы отнести их к (психологическому) контексту открытия. Об отношении Кеплера к астрологии он отмечает: «Здесь, как часто… важные гипотезы могут происходить из поистине фантастических идей: происхождение не имеет значения, пока гипотеза поддается проверке.'(1983, с. 191). В-третьих, если метафизические теории могут стать научными теориями, когда они дополнены дополнительными предположениями, то, похоже, статус теории как метафизической ей не присущ. Это кажется особенно верным, если, как в случае атомизма, дополнительные требования являются относительно низкими, например, оценка размера молекулы. Теперь Поппер фактически неверно определяет, как атомизм стал частью науки: проверяемые оценки физических свойств атомов стали доступны только в двадцатом веке в результате процесса триангуляции, задуманного Жаном Перреном (см. Nye 1972).Это произошло через много лет после того, как атомизм стал частью науки: широко атомистические теории молекулярной структуры можно было проверить, по крайней мере косвенно, химическими средствами с 1860-х годов, с помощью процесса, который Алан Рок назвал «подсчетом изомеров» (см. Rocke 2010, глава 7). ). Как и многие философы науки двадцатого века, Поппер имел тенденцию игнорировать химию.
По основному логическому пункту, что метафизическое (потому что непроверяемое) может стать научным (потому что проверяемым) просто путем соединения с другими утверждениями , Поппер явно прав.Более того, в двадцатом веке нужно было указать на это. Но следствием признания этой важной истины является то, что различие между научными и метафизическими теориями немедленно становится контекстуальным и, следовательно, исторически случайным, а не вневременной чертой их содержания или логической формы, потому что это зависит от того, была ли предложена конкретная теория. наряду с другими утверждениями, вместе с которыми это подразумевает некоторые эмпирически проверяемые последствия.Фактически, кажется, что различие между метафизикой и наукой полностью исчезает. Footnote 9 Другие теории, которые Поппер считал однозначно научными, такие как механика Ньютона, также не поддавались проверке в отдельности, требуя дополнения вспомогательными предположениями, и он явно охарактеризовал теорию эволюции Дарвина, которая для большинства других философов является частью науки, как «программа метафизических исследований» (1974, стр. 133–143).
Поппер справедливо отверг значение как аспект, по которому наука должна отличаться от ненаучной.Более того, идея о том, что метафизическая теория может стать проверяемой (и, следовательно, научной) путем дополнения, поддерживает наше первое условие: семантическое равенство метафизики и науки. Трудно понять, как добавление дополнительных посылок может волшебным образом превратить метафизику в науку, если эти две вещи существенно различаются по природе своего содержания или их логической форме. Однако для Поппера метафизическая теория, которая остается непроверяемой, не может быть частью науки. Несмотря на то, что можно назвать его «важным», трудно понять, чем его суггестивная роль отличается от роли яблока Ньютона или змеи Кекуле, поскольку, как мы видели, он также считал, что происхождение проверяемой теории «никогда имеет значение’.Эта странная и несколько противоречивая позиция относительно роли метафизики в науке навязана Попперу из-за того, что он придерживался фальсификационистского критерия демаркации. Метафизические принципы не могут быть полностью частью науки, потому что они не поддаются проверке.
Уоткинс использовал игрушечный пример — «доктрины призрачной вселенной» (1958, стр. 344) — для описания роли метафизики в науке, которая все еще в целом попперовская, но более тонкая, чем собственная точка зрения Поппера. Рассмотрим замок, который считается населенным привидениями.Поскольку оно включает экзистенциальное утверждение (« что-то есть » (стр. 344)), это убеждение неопровержимо, хотя оно также может быть «драматично, хотя и не окончательно подтверждено жутким опытом» (стр. 344). Некоторые метафизические теории являются или влекут за собой утверждения о тесно связанной форме, утверждает Уоткинс: те, которые «утверждают о завуалированном существовании чего-то во вселенной, о чем мы можем уловить подтверждающие проблески» (стр. 344). Поскольку они неопровержимо подтверждаемы, но неопровержимы, они «пользуются особой привилегией в борьбе идей за существование» (стр.344). Они «вненаучные», но могут влиять на развитие научных теорий.
Логическая форма типичной «доктрины вселенной с привидениями» включает в себя как универсальную, так и экзистенциальную количественную оценку (1958, стр. 346), относительно низкоуровневый пример из химии, заключающийся в том, что «для любого металла существует кислота, которая растворяет его». (1958, с. 346). Детерминизм часто понимается как утверждение, что «каждое событие имеет причину» (1958, стр. 348). Исходя из предположения, что причинное утверждение, такое как «X вызывает Y», требует наличия закона природы, который включает взаимосвязь между ними, детерминизм предписывает ученым искать законы природы (1958, стр.356). Точно так же механизм, понимаемый как утверждение, что «или каждое физическое изменение существуют смежные и одновременные факторы, вызывающие это изменение» (1958, стр. 350), предписывает ученым никогда не принимать «оккультные качества, действие на расстоянии, мгновенную передачу. или любые другие отклонения от принципа действия путем контакта »(1958, стр. 356).
Теперь может случиться так, что каждая метафизическая доктрина может быть выражена в этой форме или влечет за собой утверждение, которое может быть выражено в этой форме.Утверждение, что все метафизические утверждения в науке могут быть истолкованы как имеющие эту форму (т. Е. Доктрины преследуемой вселенной), могло бы быть вполне тривиальным, если бы не было никаких ограничений относительно того, какие классы сущностей можно было бы ввести для кванторов. Интересно, что это более сильное утверждение само по себе имеет ту же логическую форму, что и доктрины вселенной с привидениями, хотя и с кванторами второго порядка: для каждой метафизической теории существует класс сущностей, которые при количественной оценке позволяют сформулировать эквивалентное утверждение: форма вселенной с привидениями.Однако Уоткинс совершенно разумно никогда не предлагает, чтобы все метафизические утверждения могли быть выражены таким образом, делая лишь более слабое утверждение, что «эта структура является общей для ряда вненаучных идей, которые серьезно повлияли на развитие науки» (1958). , с. 344).
Суть композиционной программы в химии можно переформулировать в соответствии с предложением Уоткинса: для каждого составного вещества есть элементарные вещества, из которых оно (материально) состоит.Это утверждение, однако, является следствием более логически более сильного утверждения, которое химики после Лавуазье также поддержали бы: существуют элементарные вещества, из которых (материально) состоит каждое химическое вещество. По отдельности эти утверждения неопровержимы, но подтверждаемы, и работы химиков с 1790-х годов, заполнившие таблицу простых веществ Лавуазье, подтвердили их конкретными примерами. Попутно некоторые из простых веществ, придуманных Лавуазье, были удалены (калорийность, легкость), а индивидуальные требования к составу были пересмотрены (было принято, что кислота морской соли не содержала кислорода).Более того, как указывает Захар (2007, с. 139), метафизический характер доктрин вселенной Уоткинса проистекает не из содержащихся в них концепций или ненаблюдаемой природы сущностей, которые они количественно оценивают, а из их логической формы: «ибо каждая субстанция есть некоторая субстанция, в которой она растворяется » включает наблюдаемое отношение » x растворяет y », и тем не менее является столь же явно метафизическим (потому что не поддающимся анализу), как ‘каждое событие имеет причину’. Идея доктрины вселенной с привидениями кажется искренней чтобы осветить композиционную программу в химии и метафизический характер ее основных утверждений: экзистенциальное утверждение мотивирует поиск своего творца истины, которым может быть призрак, растворитель или несколько химических элементов.
Однако принятие Уоткинсом фальсификационистского критерия разграничения науки и ненаучности означает, что его точка зрения сталкивается с той же фатальной трудностью, что и точка зрения Поппера. Метафизика остается чем-то иным, чем наука: «между царством аналитических истин и царством эмпирических утверждений находится ничейная земля доктрин вселенной с привидениями» (1958, стр. 359). Это жесткое разделение влечет за собой, что даже там, где доктрина вселенной с привидениями играет важную роль в науке, это не может служить простым аргументом в пользу ее истинности, потому что (i) разные части науки могут поддерживать разные метафизические теории; (ii) эмпирические теории, поддерживающие метафизические теории, позволили бы им препятствовать конкуренции (1958, стр.363–365). Нельзя не думать, что если метафизические теории просто принять как часть науки, эти трудности исчезнут или, по крайней мере, представляют собой не больше трудностей, чем логические столкновения между успешными научными теориями.
Поппер рассматривал методологию программ научных исследований Лакатоса как развитие его идеи программы метафизических исследований. Footnote 10 Это несправедливо во многих отношениях, но для нашего настоящего обсуждения есть одно действительно важное различие между ними.В обзоре собранных статей Лакатоса Ян Хакинг отметил, что Лакатос совершил «отход от демаркационной проблемы Поппера» (1979, стр. 384):
Поппер пришел к неявному разделению на науку, метафизику и гадость. Метафизика — это серьезное предположение, которое когда-нибудь может привести к положительной науке. У логических позитивистов была наука и метафизика — гадость, но Поппер имел в виду лучший набор различий, о чем свидетельствует тот факт, что гадость теперь организовалась как нечто, отличное от умозрительной метафизики.Лакатос теперь готов объединить метафизику, которая становится наукой, с самой наукой, потому что это часть более широкого роста знания, которое его беспокоит. Таким образом, наука-метафизика противостоит гадости. (Взлом, 1979, стр. 384–385)
Здесь стоит сделать два комментария. Во-первых, идея о том, что «наука-метафизика противостоит гадости», вызывает не более фиксированную метафизику, чем фиксированную науку. Лакатос был убежденным фаллибилистом. Изменения возможны в любой области науки, включая метафизику.Исследовательская программа со связанной метафизикой может быть заменена в любое время более успешной исследовательской программой с совершенно иной метафизикой. Наука как Наука не имеет метафизических основ. Во-вторых, даже фраза «метафизика — наука противостоит дерьму» предполагает слишком большой контраст между наукой и метафизикой. Комментируя попперовцев Джозефа Агасси и Джона Уоткинса, Лакатос замечает
Я пошел намного дальше, чем они, в стирании разграничения между [Поппером] «наукой» и [Поппером] «метафизикой»: я даже больше не использую термин «метафизический».Я говорю только о научных исследовательских программах, твердое ядро которых неопровержимо не обязательно из-за синтаксиса, но, возможно, из-за методологических причин, не имеющих ничего общего с логической формой. (1970, стр. 184) Сноска 11
По мнению Лакатоса и Захара, метафизические допущения следует искать в самом сердце науки, в твердом ядре исследовательской программы (Захар 1989, с. 21; 2007, с. 138). В этом смысле они выше эмпирической схватки, но в то же время способны играть эвристическую и регулирующую роль в развитии конкретных научных теорий за счет их «предписывающего значения» структуры физических законов и объяснений (1989, с.21). Таким образом, согласно Захару, «Специальная теория относительности основана на метафизическом утверждении, что не существует привилегированной инерциальной системы отсчета». Это приводит к предписанию, что все теории должны принимать одну и ту же форму во всех инерциальных системах отсчета »(1989, с. 21). Поскольку исследовательская программа основана на ее твердом ядре, а исследовательские программы можно оценивать эмпирически, эмпирический успех исследовательской программы действительно должен отражаться на ее твердом ядре. Это отвечает на один важный вопрос, который, по словам Захара, «Поппер не задавал должным образом, не говоря уже о том, чтобы удовлетворительно ответить» (2007, стр.141): «Поддерживает ли эксперимент, подтверждающий теорию, принадлежащую программе, метафизику, лежащую в основе программы?» Отвечая на этот вопрос положительно, отчет Захара отвечает всем трем условиям реалистической концепции роли метафизики в науке.
Гостевой пост | Патент-О
(Сегодня PatentlyO начинает серию периодических гостевых постов профессора Кристала Шеппарда, посвященных обоснованию некоторых разделов Закона об изобретениях Америки.До того, как в этом году поступить в юридический колледж Линкольна Университета Небраски, д-р Шеппард был главным юрисконсультом по патентам, товарным знакам, судам и политике конкуренции в Судебном комитете Палаты представителей США. — JAR)
Автор А. Кристал Шепард
Поскольку пытливые умы хотят знать, я попытаюсь дать в серии сообщений понимание основных причин некоторых разделов Закона об изобретениях Америки, которые вызывают особую путаницу среди моих друзей и новых коллег, которым посчастливилось не делать этого. принимали участие в махинациях Закона об изобретениях Америки так же активно, как и на последних трех Конгрессах.
***
Я начинаю этот разговор с общего заявления — это мои воспоминания об обоснованиях и не отражают взгляды какого-либо конкретного члена Конгресса. Что еще более важно, не стреляйте в посыльного. Этот блог предназначен только для предоставления современного контекста, а не для всестороннего анализа, прежде чем ход времени искажает воспоминания. Я не буду защищаться; Я просто объясню.
Изменения в разделе 15 Закона об изобретениях Америки вызвали сильное недоумение и замешательство.Эта секция очевидна, и да, она раздваивалась и должна была быть раздвоенной. Требование наилучшего режима остается неизменным требованием для получения патента в соответствии с 35 U.S.C. § 112 абзац 1; однако, согласно новому закону, Best Mode больше не может использоваться в качестве защиты при любых действиях, связанных с действительностью или нарушением патента. В частности, неспособность изобретателя раскрыть свой лучший режим больше не является основанием для признания недействительной, отмены или признания иска не имеющим исковой силы, даже если позже будет установлено, что изобретатель, несомненно, знал о лучшем режиме и намеренно не раскрыл его Ведомство США по патентам и товарным знакам (USPTO) во время экспертизы.
Раздвоенная реформа — это компромисс, который решает законные проблемы судебного разбирательства с субъективным характером наилучшего режима без подрыва требования о полном раскрытии информации, которое представляет собой quid pro quo за предоставление монополии. Если бы Best Mode был полностью удален, Конгресс можно было бы рассматривать как устранение еще одного препятствия на пути защиты коммерческой тайны, перекрывающейся с монопольными правами.
Стимулирование удаления Best Mode из Раздела 112 Раздела 35 U.S.C. исходил из нескольких рекомендаций Конгрессу ограничить субъективные аспекты патентных споров. Я указываю на одну такую рекомендацию, которая оказала большое влияние, — это Патентная система A национальных академий для 21 st Century :
Среди факторов, которые увеличивают стоимость и снижают предсказуемость судебного разбирательства о нарушении патентных прав, есть вопросы, уникальные для патентной юриспруденции США, которые зависят от оценки настроения стороны на момент предполагаемого нарушения или времени выдачи патента. приложение … Поскольку защита [Лучший режим] зависит от исторических фактов и поскольку состояние ума изобретателя ‘ обычно может быть установлено только на основе косвенных доказательств, судебный процесс по [Лучший режим] — , особенно досудебное обнаружение — , может быть обширный и трудоемкий.[1]
Хотя в отчете Национальных академий также говорится, что полное устранение Best Mode может быть достигнуто без «существенного воздействия на основополагающие принципы, которые эти аспекты системы правоприменения должны были продвигать» [2]. Их и других основное возражение против Best Режим заключался в том, что это было ненужным бременем для судебных разбирательств, аналогичным несправедливому поведению, которое часто требовалось, но редко обнаруживалось.
Хотя лучший режим может быть излишне обременительным для судебных разбирательств, лучший режим не является лишним требованием.Он предназначен для реализации конституционной директивы о «содействии прогрессу науки и полезных искусств» [3] путем предотвращения получения изобретателем патентной защиты, «затруднения монополии» [4], при одновременном сокрытии коммерческой тайны для предпочтительные варианты осуществления. «Цель этого требования состоит в том, чтобы удержать изобретателей от подачи заявки на патент, в то же время скрывая от общественности предпочтительные варианты осуществления, которые, по сути, задумал изобретатель». [5] В требованиях к патентоспособности нет ничего, что предписывает раскрытие изобретателем их Лучшего Режима.
Ошибка Best Mode в судебном разбирательстве не является принципиальной ошибкой; это ошибка исполнения — трудность понимания того, что думает изобретатель.
Если кто-то верит в quid pro quo о полном раскрытии общественности в обмен на ограниченную монополию, то раскрытие наилучшего способа для изобретателя имеет важное значение. Если монополия — это пряник в обмен на разглашение того, что в противном случае оставалось бы скрытым как коммерческая тайна, то коммерческую тайну СЛЕДУЕТ разглашать для патентования.Изменение требования о наилучшем режиме для получения патента было бы значительным отклонением от политики и практики США, которое не требовалось для исправления предполагаемой проблемы.
Закон должен и по-прежнему требует раскрытия информации о наилучшем режиме, но исключил лучший режим из судебных разбирательств. Реформа решает проблемы, не нарушая требования о раскрытии информации.
Многие ученые подвергли сомнению тот факт, что в соответствии с новым законом на следующий день после выдачи патента изобретатель мог заявить, что да, на момент подачи заявки был известен лучший способ, который не был раскрыт, и все же преднамеренное неразглашение не влияет на претензии.Претензии не могут быть признаны недействительными, отменены или лишены исковой силы.
Было много критики, что Конгресс не рассматривал этот результат. Нет ничего более далекого от правды. Этот результат был полностью учтен лицами, принимающими решения.
По сути, вопрос заключался в том, как остановить изобретателей от лжи патентному ведомству о том, что у изобретателя нет наилучшего режима, когда изобретатель фактически имеет предпочтительный вариант воплощения? Более точный вопрос: если нет очевидных ответвлений, зачем изобретателю разглашать лучший режим, если он может сохранить его в качестве коммерческой тайны?
Конгресс принял это во внимание, но не включил это в законодательство по ряду причин.Я представляю некоторые из обсуждавшихся соображений.
- Предоставить USPTO право проводить расследования, когда от суда или третьей стороны представлены четкие доказательства того, что лучший режим был намеренно не раскрыт. Здесь контраргумент состоит в том, что ВПТЗ США еще менее удобно, чем суды, для такого субъективного определения. Кроме того, нецелесообразно передавать это определение из судов в ВПТЗ США.
- Представить доказательства преднамеренного сокрытия Best Mode для Управления по регистрации и дисциплине (OED) в USPTO с сдерживающим фактором, являющимся возможной потерей способности преследовать патенты, снятием с патентной защиты.Возможно, это уже возможно в возрасте до 35 лет США. § 32, Отстранение от практики или исключение из нее. Очевидный недостаток такой же, как и в первом примере; ВПТЗ США не подходит для субъективных запросов. Кроме того, это может привести к наказанию практикующего патента за ситуации, когда изобретатель умышленно скрывал, но практикующий патентовед не знал.
- Создайте механизм, идентичный тому, который в конечном итоге попал в раздел 12 Закона об изобретениях Америки — новый раздел 257 (e), в котором доказательства существенного мошенничества в ВПТЗ США должны быть переданы Генеральному прокурору для возможного судебного преследования в соответствии с 18 U. .SC § 1001, уголовный закон, предусматривающий наказание любого, кто сознательно и умышленно «создает или использует какие-либо фальшивые письменные материалы или документы, зная, что они содержат какие-либо материально ложные, вымышленные или мошеннические заявления или записи» по любому вопросу, находящемуся в юрисдикции исполнительной, законодательной , или судебная ветвь правительства США. Опять же, возможно, этот сдерживающий фактор, который составляет до пяти лет тюремного заключения, уже возможен до 18 лет США. § 1001 без каких-либо изменений в законе.
Обратите внимание, что все эти решения, возможно, уже возможны в соответствии с действующим законодательством.
Одно не выдвинутое предложение для ответа на загадку «когда нет очевидных ответвлений, зачем изобретателю разглашать лучший режим, если он может сохранить его в качестве коммерческой тайны?» это делает разветвления более очевидными. ВПТЗ США может добавить флажок в формы заявки, заявив: «Я (мы), изобретатель (-ы) не имеют предпочтительного наилучшего режима и осведомлены о том, что отказ от раскрытия наилучшего режима может привести к тюремному заключению на срок до пяти лет». Но это дело ВПТЗ США, а не Конгресса.
Решит ли проблему «флажок»? Нет. Но это позитивный акт, а не умышленное бездействие. Этот позитивный акт может быть полезен при выполнении 35 U.S.C. § 32 и 18 U.S.C. § 1001 в случае злоупотреблений и позволяет Конгрессу сохранить акцент США на полном раскрытии информации в обмен на правительственную субсидию на монополию.
В конце концов, я не согласен с критикой влияния нового закона на Best Mode. Но я категорически не согласен с тем, что Конгресс не рассматривал и не понимал последствий.
[1] Стивен А. Меррилл и др., Патентная система для 21 века, нет. 7, 121 (2004).
[2] См. Ид. на 7.
[3] U.S. Const. Изобразительное искусство. I, § 8, п. 8.
[4] Томас Джефферсон Исааку Макферсону, 13 августа 1813 г.
[5] Young Dental Mfg. Co., Inc. против Q3 Special Products, Inc., 112 F.3d 1137, 1144 (Fed. Cir. 1997).
А. Кристал Шеппард — доцент права юридического колледжа Линкольна Университета Небраски и бывший главный юрисконсульт по патентам, товарным знакам, судам и политике конкуренции Комитета Палаты представителей США по судебной системе. Ищите ее следующую публикацию PatentlyO о дополнительной экспертизе.
(PDF) Постоянство природных констант: обновления
26 Такеши Чиба
89) J.G. Уильямс, X.X. Ньюхолл и Дж. Дики, Phys. Ред. D 53 (1996) 6730.
90) J.G. Уильямс, С.Г. Турышев, Д.Х. Боггс, Phys. Rev. Lett. 93 (2004) 261101.
91) T. Damour, G.W. Гиббонс и Дж. Тейлор, Phys. Rev. Lett. 61 (1988) 1152.
92) Т. Дамур и Дж.Х. Тейлор, Astrophys.J. 366 (1991) 501.
93) K. Nordtvedt, Phys. Rev. Lett. 65 (1990) 953.
94) В. Каспи, Дж. Тейлор и М.Ф. Рыба, Astrophys.J. 428 (1994) 713.
95) J.P.W. Verbiest et al., Astrophys.J. 679 (2008) 675.
96) Теллер Э., Phys. Rev.73 (1948) 801.
97) J. Christensen-Dalsgaad, D.O. Гоф и М.Дж. Томпсон, Astrophys.J. 378 (1991) 413.
98) Д. Гюнтер, Л. М. Краусс и П. Демарк, Astrophys. J. 498 (1998) 871.
99) Э. Гарсия-Берро, С. Торрес, Л. Г. Альтхаус, И. Ренедо, П. Лорен-Агилар, А. Х. Корсико, Р.
Д. Рорманн, М. Саларис, Дж. Изерн, Nature 465 (2010 г.) ) 194.
100) Э. Гарсия-Берро, П. Лорен-Агилар, С. Торрес, Л. Г. Альтхаус и Дж. Изерн, JCAP 1105
(2011) 021.
101) SE Thorsett, Phys. Rev. Lett. 77 (1996) 1432.
102) P. Jofr´e, A. Reisenegger, R. Ferna´andez, Phys. Rev. Lett. 97 (2006) 131102.
103) T.P. Уокер, Г.Штайгман, Д.Н.Шрамм, К.А. Олив и Х.-С. Канг, Astrophys.J. 376
(1991) 51.
104) Ф.С. Accetta, L.M. Krauss, P. Romanelli, Phys. Lett. 248B (1990) 146.
105) К. Дж. Копи, А. Н. Дэвис, Л. М. Краусс, Phys. Rev. Lett. 92 (2004) 171301.
106) Р. Нагата, Т. Чиба, Н. Сугияма, Phys. Rev. D 66 (2002) 103510.
107) R. Nagata, T. Chiba, N. Sugiyama, Phys. Rev. D 69 (2004) 083512.
108) H. Cadendish, Phil. Пер. Рой. Soc.Лондон. 88 (1798) 469.
109) G.T. Gillies, Rep. Prog. Phys. 60 (1997) 151.
110) П.Дж. Мор, Б.Н. Taylor, Rev. Mod. Phys. 72 (2000) 351.
111) J.H. Гундлах, С. Мерковиц, Phys. Rev. Lett. 85 (2000) 2869.
112) T.J. Куинн, К. Говори, С.Дж. Ричман, Р. Дэвис, А. Пикард, Phys. Rev. Lett. 87
(2001) 111101.
113) St. Schlamminger, E. Holzschuh и W. K¨undig, Phys. Rev. Lett. 89 (2002) 161102.
114) T.R.Армстронг и М. Фитцджеральд, Phys. Rev. Lett. 91 (2003) 201101.
115) St. Schlamminger, E. Holzschuh, W. K¨undig, F. Nolting, R.E. Pixley, J. Schurr, U.
Straumann, Phys. Rev. D 74 (2006) 082001.
116) J. Luo et al., Phys. Rev. Lett. 102 (2009) 240801.
117) H.V. Parks, J.E. Faller, Phys. Rev. Lett. 105 (2010), 110801.
118) P.J. Mohr and B.N. Taylor, Rev. Mod. Phys. 77 (2005) 1.
119) П.Дж. Мор, Б.Н. Тейлор и Д. Ньюэлл, преподобныйМод. Phys. 80 (2008) 633.
120) The NIST Reference on Constants, Units, and Uncertainty,
http://physics.nist.gov/cuu/Constants/index.html
121) J.B. Fixler, G.T. Фостер, Дж.М. МакГирк, М.А.Касевич, Science, 315, 74 (2007).
122) Г. Лампорези, А. Бертольди, Л. Каччапуоти, М. Преведелли, Г. Тино. Rev. Lett.
100 (2008) 050801.
123) R. Thompson, Astron. Lett. 16 (1975) 3.
124) Б.Э.Дж. Пагель, пн. Нет. R. Astron.Soc. 179 (1977) 81с.
125) P. Tzanavaris et al., Phys. Rev. Lett. 95 (2005) 041301.
126) A. Y. Potekhin et al., Astrophys.J. 505 (1998) 523.
127) А.В. Иванчик и др., Astron. Lett. 28 (2002) 423.
128) W. Ubachs, E. Reinhold, Phys. Rev. Lett. 92 (2004) 101302.
129) А. Иванчик и др., Astron. и Astrophys. 440 (2005) 45.
130) E. Reinhold, R. Buning, U. Hollenstein, A. Ivanchik, P. Petitjean, W. Ubachs, Phys. Ред.
Lett.96 (2006) 151101.
131) Дж. Кинг, Дж. К. Уэбб, М. Мерфи, Р.Ф. Carswell, Phys. Rev. Lett. 101 (2008) 251304.
132) A.L. Malec et al., Mon. Нет. R. Astron. Soc. 403 (2010) 1541.
133) F. van Weerdenburg, M. T. Murphy, A. L. Malec, L. Kaper and W. Ubachs, Phys. Ред.
Lett. 106 (2011) 180802.
134) Дж. А. Кинг, М. Т. Мерфи, У. Убакс и Дж. К. Уэбб, Mon.Not.Roy.Astron.Soc. 417
(2011) 3010.
135) Дж. Ченгалур, Н. Канекар, Phys.Rev. Lett. 91 (2003) 241302.
136) J. Daring, Phys. Rev. Lett. 91 (2003) 011301.
Закон определенных пропорций — Закон множественных пропорций — Концепция
Закон определенных пропорций , также известный закон определенного состава, гласит, что независимо от количества чистое соединение всегда содержит одни и те же элементы в одинаковых пропорциях по массе. Закон множественных пропорций , также известный как закон Дальтона, гласит, что когда один элемент объединяется с другим, образуя более одного соединения, массовые доли элементов в этих соединениях представляют собой простые целые числа друг друга.
В этом сегменте давайте обсудим закон определенных и кратных пропорций. Но прежде чем мы это сделаем, давайте сделаем краткий обзор, чтобы напомнить нам, почему это важно.
Итак, мы должны помнить, что материя — это все, что занимает пространство и имеет массу, а также что закон сохранения массы говорит нам, что масса реагентов равна массе продуктов, потому что материя не создается и не разрушается.При этом мы можем сразу перейти к закону определенных пропорций, который также иногда называют законом определенного состава в зависимости от того, на что вы смотрите. Итак, в нем говорится, что независимо от количества чистое соединение всегда содержит одни и те же элементы в одинаковых пропорциях по массе, и поэтому просто услышать эти слова, вероятно, на самом деле не очень много, поэтому мы сделаем пример, который, надеюсь, будет пролить немного света на то, что именно это означает.
Итак, еще раз напоминаем, что закон сохранения массы применяется к соединениям, и масса соединения равна сумме масс элементов, составляющих соединение.Так что помните, что соединение — это всего лишь два элемента вместе. Итак, вода — это соединение, состоящее из водорода и кислорода. Так что, если мы собираемся, давайте применим здесь закон сохранения, основанный на массе воды, и давайте разберемся с этим. Итак, у нас есть одна молекула воды, состоящая из двух атомов водорода и одного атома кислорода. Итак, если вспомнить из периодической таблицы, водород весит около 1,008 грамма, кислород — около 16 граммов. Итак, если у нас есть два атома водорода, это означает, что масса каждого из них равна одному грамму, итого у нас есть два грамма водорода, а затем у нас есть один атом кислорода, его масса составляет 16 граммов.Итак, у нас есть 16 граммов кислорода. Это означает, что молярная масса воды составляет 18 граммов. Таким образом, отношение водорода к кислороду составляет 1: 8.
Итак, давайте продолжим и поговорим о законе множественных пропорций, который, возможно, немного сложнее, и он также известен как закон Далтона, и поэтому он очень важен, когда вы делаете стехиометрию, так что тогда вы балансируете. уравнения, и пытается выяснить молярные массы различных соединений, которые участвуют в реакции. Таким образом, это означает, что когда один элемент объединяется с другим, образуя более одного соединения, массовые отношения элементов в соединениях являются простыми целыми членами друг друга.Опять же, слова, вероятно, не имеют большого значения, но давайте проработаем пару примеров и посмотрим, проливает ли это немного света.
Итак, давайте посмотрим на угарный газ и углекислый газ. Итак, оба эти соединения состоят из одних и тех же элементов. Окись углерода состоит из углерода и кислорода, двуокись углерода состоит из углерода и кислорода, но очевидно, что они имеют разные свойства. Потому что мы знаем, что углекислый газ — это то, что находится в нашем воздухе и в наших телах, и мы дышим им, и это нормально.Однако окись углерода даже в довольно малых концентрациях может вызвать у вас IB] и убить вас. Итак, очевидно, что у них разные свойства. Так что, возможно, одна из причин, почему мы собираемся здесь увидеть именно это. Итак, в монооксиде углерода отношение кислорода к углероду составляет 1: 1. И снова молярная масса кислорода составляет 16 граммов, а масса углерода — 12 граммов. Итак, если мы посмотрим на углекислый газ, соотношение кислорода к углероду составляет 2: 1, это означает, что на каждый углерод приходится два атома кислорода, поэтому масса кислорода составляет 32 грамма, а масса углерода — 12 граммов.Итак, вы видите здесь, что соотношение здесь ровно в два раза выше, чем для монооксида углерода. Таким образом, мы можем применить ту же логику к разнице между водой и перекисью водорода, h3O2. Итак, снова вода и перекись водорода состоят из одних и тех же элементов, поэтому соединения одних и тех же элементов водорода и кислорода в воде и водорода и кислорода в перекиси водорода.
Итак, давайте посмотрим на отношение водорода к кислороду в воде 2: 1, а в перекиси — 2: 2 или, можно сказать, 1: 1, но для этих целей немного проще думать об этом как о 2: 2. .Итак, масса водорода снова составляет один грамм на водород, а у вас их два. Итак, масса здесь составляет два грамма на 16 граммов кислорода, а затем для перекиси, это два грамма водорода по той же причине, а каждый кислород равен 16, поэтому получается масса здесь 32. Снова вы видите, что отношения, массовые отношения выяснили, что h3O2 ровно вдвое больше воды.
Итак, это основы пропорций, и продолжайте работать над еще несколькими практическими задачами, которые вы можете быстро освоить.
