Кислород эффективный заряд ядра — Справочник химика 21
Катионы связаны с молекулами воды донорно-акцепторной связью донором являются атомы кислорода, имеющие две свободные электронные пары, акцептором — катионы, имеющие свободные электронные ячейки. Чем больше заряд иона и чем меньше его размер,тем значительнее будет катионная доля поляризующего действия К на Н2О. Анионы связаны с молекулами воды водородной связью. Сильное влияние может привести к полному отрыву протона — водородная связь становится ковалентной. Донорная активность А» будет тем значительнее, чем больше я и меньше га . В зависимости от силы поляризующего влияния К»» и А» на молекулы Н2О будут получаться различные результаты. Так, катионы элементов побочных подгрупп и непосредственно следующих за ними элементов подвергаются более интенсивному гидролизу, чем другие ионы одинаковых с ними заряда и радиуса, так как ядра первых менее эффективно экранируются -электро-нами.

Отталкивание между двумя р-электронами, находящимися в атоме кислорода на одной орбитали, настолько велико, что, несмотря на увеличение эффективного заряда ядра и уменьшение радиуса атома, отрыв одного из этих электронов осуществляется легче, чем отрыв р-электрона от атома азота. По аналогичной причине происходит нарушение общей последовательности изменения потенциалов ионизации при переходе от к 1 8 в третьем периоде и при переходе от к 8е в четвертом периоде. [c.100]
По мере заполнения данной оболочки, например 2/7-оболочки, ионизационный потенциал растет с увеличением атомного числа, а поскольку электроны данной оболочки очень мало экранируют друг друга, эффективный заряд ядра также растет. Надо отметить исключение в группе кислорода ионизационный потенциал О меньше, чем Н. Пока в р-оболочке имеются 3 или меньше электронов, они все могут находиться на различных из трех возможных р-орбит Рх> Ру Рх) что электростатическое отталкивание минимально.
Эффективный заряд атома, входящего в состав соединения, определяется как алгебраическая сумма его отрицательного электронного заряда и положительного заряда ядра. В настоящее время известно более десятка экспериментальных методов определения значений эффективных зарядов в большинстве своем с точностью (0,1 — 0,3)е, что соизмеримо с точностью вычисления этих зарядов в квантовой химии и теории твердого тела. В табл. 9 приведены данные по эффективным зарядам атомов, которые получены рентгеноспектральным методом д.пя ряда типичных неорганических веществ. Знаком отмечены эффективные заряды на металлических элементах, знаком — на электроотрицательных атомах. К чисто ионным соединениям близки только галогениды щелочных металлов, хотя и для них эффективные заряды не достигают единицы.
Чем объяснить уменьшение эффективного заряда ядра атома при переходе от гелия к литию от бериллия к бору от азота к кислороду [c.18]
На рис. 19 приведен график изменения потенциалов ионизации, в нем отчетливо выражена периодичность. Несоответствие изменения потенциалов ионизации изменению эффективного заряда ядра от азота к кислороду, от фосфора к сере обусловливается уже отмеченной повышенной устойчивостью наполовину заполненных р-орбиталей. Уменьшение ионизационных потенциалов в группах объясняется увеличением атомного радиуса. При [c.33]
При [c.33]
Способность атома фтора к захвату электрона можно объяснить исходя из одноэлектронной интерпретации энергии ионизации. На рис. 2.10 изображено изменение эффективного заряда ядра, который ощущают валентные электроны фтора, по мере их последовательного удаления. Кривая на графике экстраполирована к Е(,. Как видно из такой экстраполяции, на электрон, который легче всего удалить, действует эффективный заряд ядра, равный приблизительно 1,0, Это означает, что даже у отрицательного иона притяжение к ядру перевешивает отталкивание электронов. На рис. 2.10 приведен также график для кислорода. На этот раз полученное экстраполяцией зна-
Расстояния между ядрами атомов и угол между связями в мономерной молекуле Н2О измерены надежно и с достаточной точностью. Менее надежны данные о распределении эффективного электрического заряда. В соответствии с данными Бьеррума [5] положительный заряд ядра атома кислорода полностью экранирован электронами. Экранирована также основная часть заряда протонов. Таким образом, можно считать, что эффективные электрические заряды молекулы воды сосредоточены в верщинах тетраэдра, центр которого совпадает с центром молекулы, и находятся на расстоянии 0,99 А от ядра атома кислорода. Молекула воды имеет два положительных и два отрицательных полюса с эффективным зарядом 0,17 е каждый (е — заряд электрона), образующих почти правильный тетраэдр. Несмотря на то что эта модель довольно грубо описывает строение молекулы воды, на ее основе можно объяснить некоторые особенности структуры льда. Существуют и другие предположения о распределении электронного заряда в молекуле воды, подтвержденные Вер-веем [6а]. Во всяком случае, основой проверки любой теории, касающейся распределения электронного заряда, служит величина дипольного момента молекулы воды (1,87 Д), полученная в результате надежных экспериментов. [c.32]
Экранирована также основная часть заряда протонов. Таким образом, можно считать, что эффективные электрические заряды молекулы воды сосредоточены в верщинах тетраэдра, центр которого совпадает с центром молекулы, и находятся на расстоянии 0,99 А от ядра атома кислорода. Молекула воды имеет два положительных и два отрицательных полюса с эффективным зарядом 0,17 е каждый (е — заряд электрона), образующих почти правильный тетраэдр. Несмотря на то что эта модель довольно грубо описывает строение молекулы воды, на ее основе можно объяснить некоторые особенности структуры льда. Существуют и другие предположения о распределении электронного заряда в молекуле воды, подтвержденные Вер-веем [6а]. Во всяком случае, основой проверки любой теории, касающейся распределения электронного заряда, служит величина дипольного момента молекулы воды (1,87 Д), полученная в результате надежных экспериментов. [c.32]
Связь между атомами разных элементов всегда более или менее полярна, что обусловлено различием размеров и электроотрицательностей атомов.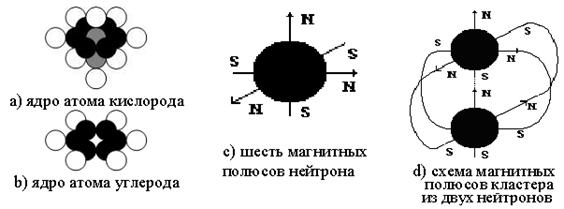 Например, в молекуле хлорида водорода НС1 связующее электронное облако смещено в сторону более электроотрицательного атома хлора. Вследствие этого заряд ядра водорода уже не компенсируется, а на атоме хлора электронная плотность становится избыточной по сравнению с зарядом ядра. Иными словами, атом водорода в НС1 поляризован положительно, а атом хлора отрицательно на атоме водорода возникает положительный заряд, на атоме хлора — отрицательный. Этот заряд б, называемый эффективным, можно установить экспериментально. Согласно имеющимся данным эффективный заряд на атоме водорода молекулы H l составляет бн =+0,18, а на атоме хлора Oq =—0,18 абсолютного заряда электрона. Можно сказать, что связь в молекуле НС1 имеет на 18% ионный характер, т. е. полярна. Ниже приведены значения эффективных зарядов на атомах кислорода в оксидах элементов 3-го периода
Например, в молекуле хлорида водорода НС1 связующее электронное облако смещено в сторону более электроотрицательного атома хлора. Вследствие этого заряд ядра водорода уже не компенсируется, а на атоме хлора электронная плотность становится избыточной по сравнению с зарядом ядра. Иными словами, атом водорода в НС1 поляризован положительно, а атом хлора отрицательно на атоме водорода возникает положительный заряд, на атоме хлора — отрицательный. Этот заряд б, называемый эффективным, можно установить экспериментально. Согласно имеющимся данным эффективный заряд на атоме водорода молекулы H l составляет бн =+0,18, а на атоме хлора Oq =—0,18 абсолютного заряда электрона. Можно сказать, что связь в молекуле НС1 имеет на 18% ионный характер, т. е. полярна. Ниже приведены значения эффективных зарядов на атомах кислорода в оксидах элементов 3-го периода
Как уже указывалось на стр. 132, атом кислорода в молекуле воды находится в состоянии хр -гибридизации. Поэтому валентный угол НОН (104,3°) близок к тетраэдрическому (109,5°). Электроны, образующие связи О—Н, смещены к более электроотрицательному атому кислорода. В результате атомы водорода приобретают эффективные положительные заряды, так что на этих атомах создаются два положительных полюса. Центры отрицательных зарядов неподеленных электронных пар атома кислорода, находящиеся на гибридных 5р -орбиталях, смещены относительно ядра атома и создают два отрицательных полюса (рис. 71). [c.199]
Электроны, образующие связи О—Н, смещены к более электроотрицательному атому кислорода. В результате атомы водорода приобретают эффективные положительные заряды, так что на этих атомах создаются два положительных полюса. Центры отрицательных зарядов неподеленных электронных пар атома кислорода, находящиеся на гибридных 5р -орбиталях, смещены относительно ядра атома и создают два отрицательных полюса (рис. 71). [c.199]
Эффективный заряд атома, входящего в состав соединения, определяется как алгебраическая сумма его отрицательного электрон-мого заряда и положительного заряда ядра. В настоящее время известно более десятка экспериментальных методов определения значений эффективных зарядов в большинстве своем с точностью 0,1 — Д,3 е, что соизмеримо с точностью вычисления этих зарядов в квантовой химии и теории твердого тела. В табл. 10 приведены данные по эффективным зарядам атомов, которые получены рентгеноспектральным методом для ряда типичных неорганических веществ.
 [c.84]
[c.84]Аналогично электрическому дипольному моменту двухатомной молекулы можно описать электрический дипольный момент связи. Например, в молекуле НдО каждая из связей О—Н имеет свой дипольный момент, равный произведению эффективного заряда атома Н на расстояние между ядрами О и Н и направленный от ядра атома кислорода к ядру атома водорода. [c.152]
Для тонких водных прослоек расчеты структурных изменений удалось пока осуществить лишь в немногих случаях. Антонченко, Давыдов и Ильин [109, 141] провели численные расчеты методом Монте-Карло, используя для описания межмолекулярных взаимодействий в воде потенциал Роулинсона. Он включает, кроме потенциала Леннард—Джонса, кулоновское взаимодействие между четырьмя эффективными электрическими зарядами в каждой молекуле воды. Два положительных заряда д = +0,328е расположены на атомах водорода на расстоянии 0,8743 А от атома кислорода. Два отрицательных заряда д = —0,328е расположены на расстояниях 0,25 А от центра атома кислорода на линии, перпендикулярной плоскости молекулы.
Поэтому можно считать, что взаимодействие между ядром атома водорода и долей электронной плотности (с зарядом, равным—1), которая находится вблизи этого ядра, т. е. как бы атомом водорода в молекуле воды, и ядром атома кислорода и долей электронной плотности (с зарядом, равным —8), находящейся вблизи этого ядра — как бы атомом кислорода в молекуле воды, — будет очень сильным, и его называют химической связью, которая связывает эти эффективные атомы в одно целое. Взаимодействие между эффективными атомами водорода в молекуле воды является значительно более слабым, чем в молекуле водорода, и поэтому считают, что эти атомы в молекуле воды не связаны друг с другом химическими связями, а оказывают друг на друга лишь взаимное влияние . [c.19]
Эффект сопряжения существенно изменяет энергию водородной связи молекул ароматических соединений с молекулами воды, что должно сильно отразиться на величине растворимости производных бензола в воде. Так, эффект оттягивания электронной плотности из ароматического ядра на введенную в молекулу фенола нитрогруппу приводит к повышению эффективного положительного заряда у атома кислорода, в результате чего энергия Н-связей между фенольной группой и молекулами воды значительно уменьшается. В соответствии с этим растворимость п-нитрофенола в 10 раз меньше растворимости фенола (табл. 7). [c.29]
Так, эффект оттягивания электронной плотности из ароматического ядра на введенную в молекулу фенола нитрогруппу приводит к повышению эффективного положительного заряда у атома кислорода, в результате чего энергия Н-связей между фенольной группой и молекулами воды значительно уменьшается. В соответствии с этим растворимость п-нитрофенола в 10 раз меньше растворимости фенола (табл. 7). [c.29]
Четыре атома кислорода в анионе СЮ , действуя как электрофильные лиганды, заметно притягивают к себе 5р -облака возникающих 0-связей и, таким образом, как бы оттягивают на себя часть электронного экрана, лежащего между пустой Зй-орбиталью атома хлора и его ядром. В результате эффективный ядерный заряд, способный действовать на электрон Зй-орбита-ли, заметно возрастает и потому заселение 3 -орбитали становится энергетически выгодным З -облако менее диффузно и способно прочнее связываться с ядром. На такие подготовленные в энергетическом смысле З -орби-тальные вакансии могут частично переходить электроны от неподеленных пар атомов кислорода. [c.281]
[c.281]
Второй период образует атомы от до Ne. В направлении — Ке растет эффективный заряд ядра, в связи с чем уменьшаются размеры атомов (см. Гшах), возрастает потенциал ионизации и осуществляется, начиная с В, переход к неметаллам. Потенциал ионизации отражает не только рост в ряду —Ке, но и особенности электронных конфигураций потенциал ионизации у бора ниже, чем у бериллия. Это указывает на упрочнение заполненных нодоболочек ( у бериллия). Более высокий потенциал ионизации азота по сравнению с кислородом указывает на повышенную прочность конфигурации р , в которой каждая орбиталь занята одним / -электроном. Аналогичные соотношения наблюдаются и в следующем периоде у соседей Mg—А1 и Р—5. У атомов второго периода отрыв электрона с внутреннего Ь -слоя требует такого высокого ПИ (75,62 эВ уже у лития), что в химических и оптических процес—сах участвуют только внешни электроны. Сродство к электрону в ряду Ы—Р имеет тенденцию к возрастанию. Но у берилжя оболочка заполнена, и сродство к электрону эндотермично так же, как и у гелия (1л ). Обладая самым высоким потенциалом ионизации ю всех неметаллов и высоким сродством к электрону, фтор является наиболее электроотрицательным элементом в периодической системе. Для атома неона СЭ (Ке)=—0,22 эВ. Оболочка з р атома Ке, электронный октет, характеризуется суммарным нулевым спином и нулевым орбитальным моментом (терм 5о). Все это, вместе с высоким потенциалом ионизации и отрицательным сродством к электрону, обусловливает инертность неона. Такая же з р конфигурация внешнего слоя характерна для вСех элементов нулевой группы. Исследования последних лет показывают, что 1 п, Хе,Кг и Аг дают химические соединения со фтором и кислородом. Очевидно, что з р конфигурация не влечет как непременное следствие химической инертности. Все атомы со спаренными электронами (терм о) — диамагниты (Не, Ве, Ке и т. д.). Конфигурации внешнего электронного слоя у атомов 2-го и 3-го периодов, стоящих в одних и тех же группах, одинаковы, чем объясняется близость химических свойств элементов, стоящих в одних и тех же группах (сравните Ка иЬ1 в табл.
Обладая самым высоким потенциалом ионизации ю всех неметаллов и высоким сродством к электрону, фтор является наиболее электроотрицательным элементом в периодической системе. Для атома неона СЭ (Ке)=—0,22 эВ. Оболочка з р атома Ке, электронный октет, характеризуется суммарным нулевым спином и нулевым орбитальным моментом (терм 5о). Все это, вместе с высоким потенциалом ионизации и отрицательным сродством к электрону, обусловливает инертность неона. Такая же з р конфигурация внешнего слоя характерна для вСех элементов нулевой группы. Исследования последних лет показывают, что 1 п, Хе,Кг и Аг дают химические соединения со фтором и кислородом. Очевидно, что з р конфигурация не влечет как непременное следствие химической инертности. Все атомы со спаренными электронами (терм о) — диамагниты (Не, Ве, Ке и т. д.). Конфигурации внешнего электронного слоя у атомов 2-го и 3-го периодов, стоящих в одних и тех же группах, одинаковы, чем объясняется близость химических свойств элементов, стоящих в одних и тех же группах (сравните Ка иЬ1 в табл. 5). Но наблюдается и различие элементы второго периода обладают постоянной валентностью, а третьего — переменной. Это связано с тем, что у атомов третьего периода есть вакантные -состояния в третьем квантовом слое, а во втором слое таких соединений нет. [c.62]
5). Но наблюдается и различие элементы второго периода обладают постоянной валентностью, а третьего — переменной. Это связано с тем, что у атомов третьего периода есть вакантные -состояния в третьем квантовом слое, а во втором слое таких соединений нет. [c.62]
Характеристика элемента. Бериллий, так же как и литий, относится к числу -элементов. Четвертый электрон, появляющийся в атоме Ве, помещается на 25-орбитали. Энергия ионизации бериллия выще, чем у лития, из-за большего заряда ядра. Эффективный заряд ядра, влияющий на четвертый -электрон, равен гэфф=1,66. В результате взаимодействия ядра с электронным окружением атом становится меньше (/ ве=1,ИА). Удалить электроны с 2 -орбиталп не просто первый потенциал ионизации почти в два раза больше, чем у лития, а второй потенциал так высок (18,2 эВ), что существование иона Ве + (с полной потерей двух электронов) практически невозможно. Даже в соединениях с фтором связи Ве—Р в значительной степени ковалентны, не говоря уже о связях с другими элементами. Следовательно, степень окисления -Ь2, приписываемая ему, величина условная. Для образования ковалентных связей бериллию необходимо разъединение (распаривание) 25-электронов. Чтобы это произошло, один из них должен перейти на более высокую 2р-орбиталь. Таким образом, когда атом бериллия переходит в такое состояние, его два электрона занимают две эквивалентные 5р-гибридизованные орбитали. Несмотря на то что связи бериллия в основном ковалентны даже в простых солях, все же был оценен его примерный ионный радиус 0,31 А. Это меньше, чем у атома водорода и иона Н+, и, следовательно, создает значительное поле положительного заряда и делает его способным прочно связывать анион кислорода, даже отнимая его у гидроксил-иона [c.205]
Следовательно, степень окисления -Ь2, приписываемая ему, величина условная. Для образования ковалентных связей бериллию необходимо разъединение (распаривание) 25-электронов. Чтобы это произошло, один из них должен перейти на более высокую 2р-орбиталь. Таким образом, когда атом бериллия переходит в такое состояние, его два электрона занимают две эквивалентные 5р-гибридизованные орбитали. Несмотря на то что связи бериллия в основном ковалентны даже в простых солях, все же был оценен его примерный ионный радиус 0,31 А. Это меньше, чем у атома водорода и иона Н+, и, следовательно, создает значительное поле положительного заряда и делает его способным прочно связывать анион кислорода, даже отнимая его у гидроксил-иона [c.205]
Эффективные заряды ядра и средние радкусы для подгрупп бериллия и кислорода в одноэлектронном приближении [c.70]
В принципе такие спектры сходны с ЯМР низкого разрешения. К примеру, химические сдвиги в спектрах ЯМР тоже зависят от эффективных зарядов атомов. Однако помимо данного фактора на них влияет такое множество других, что вьщелить эту зависимость в чистом виде оказывается довольно трудно. ЭСХА же трактуется значительно проще. Кроме того (не стоит забывать), рентген б равным успехом позволяет видеть сигналы не только углерода, но и любых других атомов, кроме водородных на рис. 84 вынесена лишь часть спектра, в котором есть еще линии и кислорода, и фтора. И если на ядрах последнего ЯМР тоже возможен, то кислород с его нулевым спином для ЯМР немой . Именно для таких элементов, особенно для серы с ее разнообразными, порой трудно доказуемыми валентными состояниями, рентгеноэлектронная спектроскопия применяется наиболее часто и успешно. [c.208]
Однако помимо данного фактора на них влияет такое множество других, что вьщелить эту зависимость в чистом виде оказывается довольно трудно. ЭСХА же трактуется значительно проще. Кроме того (не стоит забывать), рентген б равным успехом позволяет видеть сигналы не только углерода, но и любых других атомов, кроме водородных на рис. 84 вынесена лишь часть спектра, в котором есть еще линии и кислорода, и фтора. И если на ядрах последнего ЯМР тоже возможен, то кислород с его нулевым спином для ЯМР немой . Именно для таких элементов, особенно для серы с ее разнообразными, порой трудно доказуемыми валентными состояниями, рентгеноэлектронная спектроскопия применяется наиболее часто и успешно. [c.208]
Стабилизация феиоксид-анионов обусловлена эффектом сопряжения — делокализацией отрицательного заряда в результате его взаимодействия с я-орбнталями бензольного кольца. Феиоксид-анион можно поэтому представить набором граничных резонансных структур или в виде резонансного гибрида (схема 12.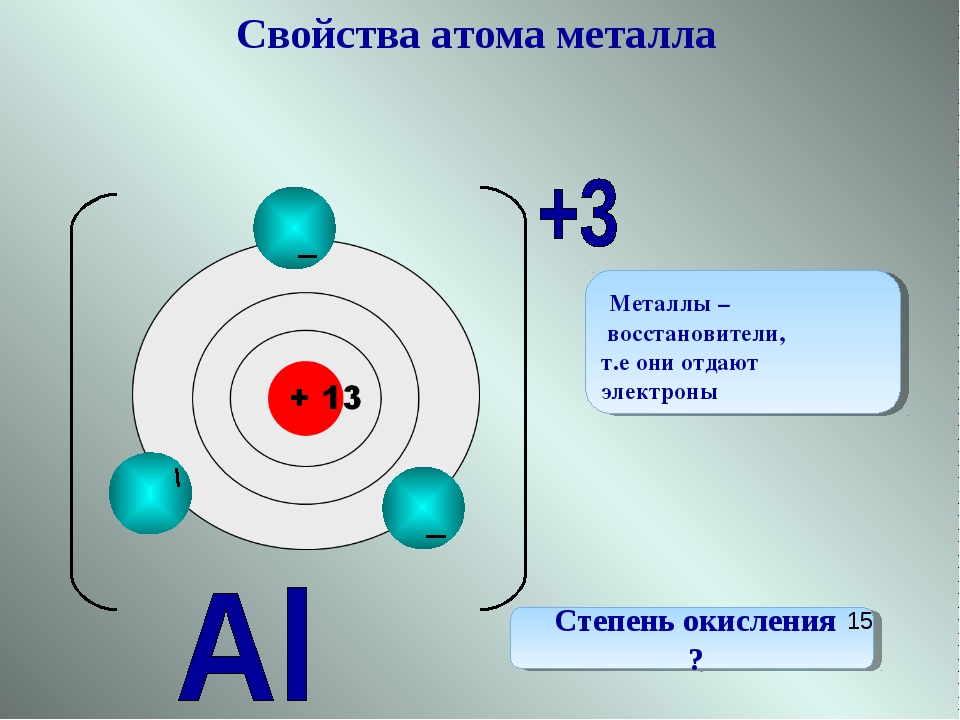 24, а). Делокализация в случае неионизированного фенола за счет неподеленной электронной пары атома кислорода в гидроксильной группе менее эффективна, так как она происходит с разделением зарядов (см. схему 12.24, б). Сопряженные с бензольным кольцом двойные связи увеличивают кислотность, как это наблюдается в случае введения в ядра-положение [c.429]
24, а). Делокализация в случае неионизированного фенола за счет неподеленной электронной пары атома кислорода в гидроксильной группе менее эффективна, так как она происходит с разделением зарядов (см. схему 12.24, б). Сопряженные с бензольным кольцом двойные связи увеличивают кислотность, как это наблюдается в случае введения в ядра-положение [c.429]
НАЧАЛА ФИЗИКИ
Смысл массового числа мы обсудим позже, а сейчас рассмотрим несколько примеров определения структуры атомов в планетарной модели.
Пример 36.1. Сколько электронов входит в состав атома: кислорода, железа, золота? Каков заряд ядра этих атомов?
Решение. Кислород, железо и золото занимают соответственно восьмое, двадцать шестое и семьдесят девятое место в таблице Менделеева. Поэтому заряд их ядра в единицах элементарного заряда равен: кислород — +8e, железо — +26e, золото — +79e (e — элементарный заряд, равный по абсолютной величине заряду электрона, но положительный). Точно таким же по величине (но отрицательным) должен быть суммарный заряд всех электронов в этих атомах. Поэтому в их состав входят соответственно 8, 26 и 79 электронов.
Точно таким же по величине (но отрицательным) должен быть суммарный заряд всех электронов в этих атомах. Поэтому в их состав входят соответственно 8, 26 и 79 электронов.
Однако планетарная модель атома также натолкнулась на принципиальные трудности. Согласно классической электродинамике, заряженная частица, движущаяся с ускорением, непрерывно излучает электромагнитные волны. Поэтому электроны, которые движутся вокруг ядра и, следовательно, имеют ускорение, должны были бы непрерывно терять энергию на излучение. Как показывают расчеты, за время 10−11 с электроны должны были бы потерять свою энергию и упасть на ядро. При этом в процессе падения на ядро электрон (в соответствии с классической электродинамикой) должен был бы излучать свет непрерывно изменяющейся частоты, и потому спектр излучаемого атомом света должен быть сплошным. Но это противоречит опыту. Спектр излучения атомов каждого элемента состоит из определенных спектральных линий.
Противоречия модели Резерфорда оказалось возможным разрешить, лишь отказавшись от ряда привычных представлений классической физики. Важнейший шаг в построении теории атома был сделан выдающимся датским физиком Н. Бором (1913). В основу своей теории атома Бор положил два постулата, которые противоречили классической физике1. Эти постулаты (которые сейчас называются постулатами Бора) могут быть сформулированы следующим образом.
Важнейший шаг в построении теории атома был сделан выдающимся датским физиком Н. Бором (1913). В основу своей теории атома Бор положил два постулата, которые противоречили классической физике1. Эти постулаты (которые сейчас называются постулатами Бора) могут быть сформулированы следующим образом.
1 Достаточно распространенный принцип построения физических теорий: если какой-то проблеме или явлению не находится объяснений, их принимают как данность и изучают их следствия в надежде, что когда-нибудь поймут и причину. Очень часто понять причину так и не удается, в этом случае первоначальную проблему или явление объявляют законом природы — постулатом.
КИСЛОРОД | Энциклопедия Кругосвет
Содержание статьиКИСЛОРОД, O (oxygenium), химический элемент VIA подгруппы периодической системы элементов: O, S, Se, Te, Po – член семейства халькогенов. Это наиболее распространенный в природе элемент, его содержание составляет в атмосфере Земли 21% (об. ), в земной коре в виде соединений ок. 50% (масс.) и в гидросфере 88,8% (масс.).
), в земной коре в виде соединений ок. 50% (масс.) и в гидросфере 88,8% (масс.).
Кислород необходим для существования жизни на земле: животные и растения потребляют кислород в процессе дыхания, а растения выделяют кислород в процессе фотосинтеза. Живая материя содержит связанный кислород не только в составе жидкостей организма (в клетках крови и др.), но и в составе углеводов (сахар, целлюлоза, крахмал, гликоген), жиров и белков. Глины, горные породы состоят из силикатов и других кислородсодержащих неорганических соединений, таких, как оксиды, гидроксиды, карбонаты, сульфаты и нитраты.
Историческая справка.
Первые сведения о кислороде стали известны в Европе из китайских рукописей 8 в. В начале 16 в. Леонардо да Винчи опубликовал данные, связанные с химией кислорода, не зная еще, что кислород – элемент. Реакции присоединения кислорода описаны в научных трудах С.Гейлса (1731) и П.Байена (1774). Заслуживают особого внимания исследования К. Шееле в 1771–1773 взаимодействия металлов и фосфора с кислородом. Дж.Пристли сообщил об открытии кислорода как элемента в 1774, спустя несколько месяцев после сообщения Байена о реакциях с воздухом. Название oxygenium («кислород») дано этому элементу вскоре после его открытия Пристли и происходит от греческих слов, обозначающих «рождающий кислоту»; это связано с ошибочным представлением о том, что кислород присутствует во всех кислотах. Объяснение роли кислорода в процессах дыхания и горения, однако, принадлежит А.Лавуазье (1777).
Шееле в 1771–1773 взаимодействия металлов и фосфора с кислородом. Дж.Пристли сообщил об открытии кислорода как элемента в 1774, спустя несколько месяцев после сообщения Байена о реакциях с воздухом. Название oxygenium («кислород») дано этому элементу вскоре после его открытия Пристли и происходит от греческих слов, обозначающих «рождающий кислоту»; это связано с ошибочным представлением о том, что кислород присутствует во всех кислотах. Объяснение роли кислорода в процессах дыхания и горения, однако, принадлежит А.Лавуазье (1777).
Строение атома.
Любой природный атом кислорода содержит 8 протонов в ядре, но число нейтронов может быть равно 8, 9 или 10. Наиболее распространенный из трех изотопов кислорода (99,76%) – это 168O (8 протонов и 8 нейтронов). Содержание другого изотопа, 188O (8 протонов и 10 нейтронов), составляет всего 0,2%. Этот изотоп используется как метка или для идентификации некоторых молекул, а также для проведения биохимических и медико-химических исследований (метод изучения нерадиоактивных следов). Третий нерадиоактивный изотоп кислорода 178O (0,04%) содержит 9 нейтронов и имеет массовое число 17. После того как в 1961 масса изотопа углерода 126C была принята Международной комиссией за стандартную атомную массу, средневзвешенная атомная масса кислорода стала равна 15,9994. До 1961 стандартной единицей атомной массы химики считали атомную массу кислорода, принятую для смеси трех природных изотопов кислорода равной 16,000. Физики за стандартную единицу атомной массы принимали массовое число изотопа кислорода 168O, поэтому по физической шкале средняя атомная масса кислорода составляла 16,0044 (см. также АТОМНАЯ МАССА).
Третий нерадиоактивный изотоп кислорода 178O (0,04%) содержит 9 нейтронов и имеет массовое число 17. После того как в 1961 масса изотопа углерода 126C была принята Международной комиссией за стандартную атомную массу, средневзвешенная атомная масса кислорода стала равна 15,9994. До 1961 стандартной единицей атомной массы химики считали атомную массу кислорода, принятую для смеси трех природных изотопов кислорода равной 16,000. Физики за стандартную единицу атомной массы принимали массовое число изотопа кислорода 168O, поэтому по физической шкале средняя атомная масса кислорода составляла 16,0044 (см. также АТОМНАЯ МАССА).
В атоме кислорода 8 электронов, при этом 2 электрона находятся на внутреннем уровне, а 6 электронов – на внешнем. Поэтому в химических реакциях кислород может принимать от доноров до двух электронов, достраивая свою внешнюю оболочку до 8 электронов и образуя избыточный отрицательный заряд (см. также АТОМА СТРОЕНИЕ).
также АТОМА СТРОЕНИЕ).
Молекулярный кислород.
Как большинство других элементов, у атомов которых для достройки внешней оболочки из 8 электронов не хватает 1–2 электронов, кислород образует двухатомную молекулу. В этом процессе выделяется много энергии (~490 кДж/моль) и соответственно столько же энергии необходимо затратить для обратного процесса диссоциации молекулы на атомы. Прочность связи O–O настолько высока, что при 2300° С только 1% молекул кислорода диссоциирует на атомы. (Примечательно, что при образовании молекулы азота N2 прочность связи N–N еще выше, ~710 кДж/моль.)
Электронная структура.
В электронной структуре молекулы кислорода не реализуется, как можно было ожидать, распределение электронов октетом вокруг каждого атома, а имеются неспаренные электроны, и кислород проявляет свойства, типичные для такого строения (например, взаимодействует с магнитным полем, являясь парамагнетиком).
Реакции.
В соответствующих условиях молекулярный кислород реагирует практически с любым элементом, кроме благородных газов. Однако при комнатных условиях только наиболее активные элементы реагируют с кислородом достаточно быстро. Вероятно, большинство реакций протекает только после диссоциации кислорода на атомы, а диссоциация происходит лишь при очень высоких температурах. Однако катализаторы или другие вещества в реагирующей системе могут способствовать диссоциации O2. Известно, что щелочные (Li, Na, K) и щелочноземельные (Ca, Sr, Ba) металлы реагируют с молекулярным кислородом с образованием пероксидов:
Однако при комнатных условиях только наиболее активные элементы реагируют с кислородом достаточно быстро. Вероятно, большинство реакций протекает только после диссоциации кислорода на атомы, а диссоциация происходит лишь при очень высоких температурах. Однако катализаторы или другие вещества в реагирующей системе могут способствовать диссоциации O2. Известно, что щелочные (Li, Na, K) и щелочноземельные (Ca, Sr, Ba) металлы реагируют с молекулярным кислородом с образованием пероксидов:
Получение и применение.
Благодаря наличию свободного кислорода в атмосфере наиболее эффективным методом его извлечения является сжижение воздуха, из которого удаляют примеси, CO2, пыль и т.д. химическими и физическими методами. Циклический процесс включает сжатие, охлаждение и расширение, что и приводит к сжижению воздуха. При медленном подъеме температуры (метод фракционной дистилляции) из жидкого воздуха испаряются сначала благородные газы (наиболее трудно сжижаемые), затем азот и остается жидкий кислород. В результате жидкий кислород содержит следы благородных газов и относительно большой процент азота. Для многих областей применения эти примеси не мешают. Однако для получения кислорода особой чистоты процесс дистилляции необходимо повторять. Кислород хранят в танках и баллонах. Он используется в больших количествах как окислитель керосина и других горючих в ракетах и космических аппаратах. Сталелитейная промышленность потребляет газообразный кислород для продувки через расплав чугуна по методу Бессемера для быстрого и эффективного удаления примесей C, S и P. Сталь при кислородном дутье получается быстрее и качественнее, чем при воздушном. Кислород используется также для сварки и резки металлов (кислородно-ацетиленовое пламя). Применяют кислород и в медицине, например, для обогащения дыхательной среды пациентов с затрудненном дыханием. Кислород можно получать различными химическими методами, и некоторые из них применяют для получения малых количеств чистого кислорода в лабораторной практике.
В результате жидкий кислород содержит следы благородных газов и относительно большой процент азота. Для многих областей применения эти примеси не мешают. Однако для получения кислорода особой чистоты процесс дистилляции необходимо повторять. Кислород хранят в танках и баллонах. Он используется в больших количествах как окислитель керосина и других горючих в ракетах и космических аппаратах. Сталелитейная промышленность потребляет газообразный кислород для продувки через расплав чугуна по методу Бессемера для быстрого и эффективного удаления примесей C, S и P. Сталь при кислородном дутье получается быстрее и качественнее, чем при воздушном. Кислород используется также для сварки и резки металлов (кислородно-ацетиленовое пламя). Применяют кислород и в медицине, например, для обогащения дыхательной среды пациентов с затрудненном дыханием. Кислород можно получать различными химическими методами, и некоторые из них применяют для получения малых количеств чистого кислорода в лабораторной практике.
Электролиз.
Один из методов получения кислорода – электролиз воды, содержащей небольшие добавки NaOH или H2SO4 в качестве катализатора: 2H2O ® 2H2 + O2. При этом образуются небольшие примеси водорода. С помощью разрядного устройства следы водорода в газовой смеси вновь превращают в воду, пары которой удаляют вымораживанием или адсорбцией.
Термическая диссоциация.
Важный лабораторный метод получения кислорода, предложенный Дж.Пристли, заключается в термическом разложении оксидов тяжелых металлов: 2HgO ® 2Hg + O2. Пристли для этого фокусировал солнечные лучи на порошок оксида ртути. Известным лабораторным методом является также термическая диссоциация оксосолей, например хлората калия в присутствии катализатора – диоксида марганца:
Диоксид марганца, добавляемый в небольших количествах перед прокаливанием, позволяет поддерживать требуемую температуру и скорость диссоциации, причем сам MnO2 в процессе не изменяется.
Используются также способы термического разложения нитратов:
а также пероксидов некоторых активных металлов, например:
2BaO2® 2BaO + O2
Последний способ одно время широко использовался для извлечения кислорода из атмосферы и заключался в нагревании BaO на воздухе до образования BaO2 с последующим термическим разложением пероксида. Способ термического разложения сохраняет свое значение для получения пероксида водорода.
| НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА | |
| Атомный номер | 8 |
| Атомная масса | 15,9994 |
| Температура плавления, °С | –218,4 |
| Температура кипения, °С | –183,0 |
| Плотность | |
| твердый, г/см3 (при tпл) | 1,27 |
| жидкий г/см3 (при tкип) | 1,14 |
| газообразный, г/дм3 (при 0° С) | 1,429 |
| относительная по воздуху | 1,105 |
| критическаяа, г/см3 | 0,430 |
| Критическая температураа, °С | –118,8 |
| Критическое давлениеа, атм | 49,7 |
| Растворимость, см3/100 мл растворителя | |
| в воде (0° С) | 4,89 |
| в воде (100° С) | 1,7 |
| в спирте (25° С) | 2,78 |
| Радиус, Å | 0,74 |
| ковалентный | 0,66 |
| ионный (О2–) | 1,40 |
| Потенциал ионизации, В | |
| первый | 13,614 |
| второй | 35,146 |
| Электроотрицательность (F = 4) | 3,5 |
а Температура и давление, при которых плотность газа и жидкости одинаковы. | |
Физические свойства.
Кислород при нормальных условиях – бесцветный газ без запаха и вкуса. Жидкий кислород имеет бледно-голубой цвет. Твердый кислород существует по крайней мере в трех кристаллических модификациях. Газообразный кислород растворим в воде и, вероятно, образует непрочные соединения типа O2ЧH2O, а возможно, и O2Ч2H2O.
Химические свойства.
Как уже упоминалось, химическая активность кислорода определяется его способностью диссоциировать на атомы O, которые и отличаются высокой реакционной способностью. Только наиболее активные металлы и минералы реагируют с O2 c высокой скоростью при низких температурах. Наиболее активные щелочные (IA подгруппы) и некоторые щелочноземельные (IIA подгруппы) металлы образуют с O2 пероксиды типа NaO2 и BaO2. Другие же элементы и соединения реагируют только с продуктом диссоциации O2. В подходящих условиях все элементы, исключая благородные газы и металлы Pt, Ag, Au, реагируют с кислородом. Эти металлы тоже образуют оксиды, но при особых условиях.
Эти металлы тоже образуют оксиды, но при особых условиях.
Электронная структура кислорода (1s22s22p4) такова, что атом O принимает для образования устойчивой внешней электронной оболочки два электрона на внешний уровень, образуя ион O2–. В оксидах щелочных металлов образуется преимущественно ионная связь. Можно полагать, что электроны этих металлов практически целиком оттянуты к кислороду. В оксидах менее активных металлов и неметаллов переход электронов неполный, и плотность отрицательного заряда на кислороде менее выражена, поэтому связь менее ионная или более ковалентная.
При окислении металлов кислородом происходит выделение тепла, величина которого коррелирует с прочностью связи M–O. При окислении некоторых неметаллов происходит поглощение тепла, что свидетельствует об их менее прочных связях с кислородом. Такие оксиды термически неустойчивы (или менее стабильны, чем оксиды с ионной связью) и часто отличаются высокой химической активностью. В таблице приведены для сравнения значения энтальпий образования оксидов наиболее типичных металлов, переходных металлов и неметаллов, элементов A- и B-подгрупп (знак минус означает выделение тепла).
В таблице приведены для сравнения значения энтальпий образования оксидов наиболее типичных металлов, переходных металлов и неметаллов, элементов A- и B-подгрупп (знак минус означает выделение тепла).
| Реакции | Энтальпии образования, кДж/моль |
| 4Na + O2 ® 2Na2Oa | –208 |
| 2Mg + O2 ® 2MgO | –297 |
| 4Al + 3O2 ® 2Al2O3 | –273 |
| Si + O2 ® SiO2 | –215 |
| 4P + 5O2 ® P4O10 | –151 |
| S + O2 ® SO2 | –74 |
| 2Cl2 + 7O2 ® 2Cl2O7 | +19 |
| 2Hg + O2 ® 2HgO | –45 |
| 2Cr + 3O2 ® 2CrO3 | –97 |
| 3Fe + 2O2 ® Fe3O4 | –140 |
a При нормальных условиях предпочтительнее образование Na2O2. | |
О свойствах оксидов можно сделать несколько общих выводов:
1. Температуры плавления оксидов щелочных металлов уменьшаются с ростом атомного радиуса металла; так, tпл (Cs2O) tпл (Na2O). Оксиды, в которых преобладает ионная связь, имеют более высокие температуры плавления, чем температуры плавления ковалентных оксидов: tпл (Na2O) > tпл (SO2).
2. Оксиды химически активных металлов (IA–IIIA подгрупп) более термически стабильны, чем оксиды переходных металлов и неметаллов. Оксиды тяжелых металлов в высшей степени окисления при термической диссоциации образуют оксиды с более низкими степенями окисления (например, 2Hg2+O ® (Hg+)2O + 0,5O2® 2Hg0 + O2). Такие оксиды в высоких степенях окисления могут быть хорошими окислителями.
3. Наиболее активные металлы взаимодействуют с молекулярным кислородом при повышенных температурах с образованием пероксидов:
Sr + O2® SrO2.
4. Оксиды активных металлов образуют бесцветные растворы, тогда как оксиды большинства переходных металлов окрашены и практически нерастворимы. Водные растворы оксидов металлов проявляют основные свойства и являются гидроксидами, содержащими OH-группы, а оксиды неметаллов в водных растворах образуют кислоты, содержащие ион H+.
5. Металлы и неметаллы A-подгрупп образуют оксиды со степенью окисления, соответствующей номеру группы, например, Na, Be и B образуют Na12O, BeIIO и B2IIIO3, а неметаллы IVA–VIIA подгрупп C, N, S, Cl образуют CIVO2, NV2O5, SVIO3, ClVII2O7. Номер группы элемента коррелирует только с максимальной степенью окисления, так как возможны оксиды и с более низкими степенями окисления элементов. В процессах горения соединений типичными продуктами являются оксиды, например:
2H2S + 3O2® 2SO2 + 2H2O
Углеродсодержащие вещества и углеводороды при слабом нагревании окисляются (сгорают) до CO2 и H2O. Примерами таких веществ являются топлива – древесина, нефть, спирты (а также углерод – каменный уголь, кокс и древесный уголь). Тепло от процесса горения утилизируется на производство пара (а далее электричества или идет на силовые установки), а также на отопление домов. Типичные уравнения для процессов горения таковы:
Примерами таких веществ являются топлива – древесина, нефть, спирты (а также углерод – каменный уголь, кокс и древесный уголь). Тепло от процесса горения утилизируется на производство пара (а далее электричества или идет на силовые установки), а также на отопление домов. Типичные уравнения для процессов горения таковы:
а) древесина (целлюлоза):
(C6H10O5)n + 6nO2® 6nCO2 + 5nH2O + тепловая энергия
б) нефть или газ (бензин C8H18 или природный газ CH4):
2C8H18 + 25O2® 16CO2 + 18H2O + тепловая энергия
CH4 + 2O2® CO2 + 2H2O + тепловая энергия
в) спирт:
C2H5OH + 3O2® 2CO2 + 3H2O + тепловая энергия
г) углерод (каменный или древесный уголь, кокс):
2C + O2® 2CO + тепловая энергия
2CO + O2® 2CO2 + тепловая энергия
Горению подвержены также ряд C-, H-, N-, O-содержащих соединений с высоким запасом энергии. Кислород для окисления может использоваться не только из атмосферы (как в предыдущих реакциях), но и из самого вещества. Для инициирования реакции достаточно небольшого активирования реакции, например удара или встряски. При этих реакциях продуктами горения также являются оксиды, но все они газообразны и быстро расширяются при высокой конечной температуре процесса. Поэтому такие вещества являются взрывчатыми. Примерами взрывчатых веществ служат тринитроглицерин (или нитроглицерин) C3H5(NO3)3 и тринитротолуол (или ТНТ) C7H5(NO2)3. См. также ХИМИЧЕСКОЕ И БИОЛОГИЧЕСКОЕ ОРУЖИЕ.
Кислород для окисления может использоваться не только из атмосферы (как в предыдущих реакциях), но и из самого вещества. Для инициирования реакции достаточно небольшого активирования реакции, например удара или встряски. При этих реакциях продуктами горения также являются оксиды, но все они газообразны и быстро расширяются при высокой конечной температуре процесса. Поэтому такие вещества являются взрывчатыми. Примерами взрывчатых веществ служат тринитроглицерин (или нитроглицерин) C3H5(NO3)3 и тринитротолуол (или ТНТ) C7H5(NO2)3. См. также ХИМИЧЕСКОЕ И БИОЛОГИЧЕСКОЕ ОРУЖИЕ.
Оксиды металлов или неметаллов с низшими степенями окисления элемента реагируют с кислородом с образованием оксидов высоких степеней окисления этого элемента:
Оксиды природные, полученные из руд или синтезированные, служат сырьем для получения многих важных металлов, например, железа из Fe2O3 (гематит) и Fe3O4 (магнетит), алюминия из Al2O3 (глинозем), магния из MgO (магнезия). Оксиды легких металлов используются в химической промышленности для получения щелочей или оснований. Пероксид калия KO2 находит необычное применение, так как в присутствии влаги и в результате реакции с ней выделяет кислород. Поэтому KO2 применяют в респираторах для получения кислорода. Влага из выдыхаемого воздуха выделяет в респираторе кислород, а KOH поглощает CO2. Получение оксида CaO и гидроксида кальция Ca(OH)2 – многотоннажное производство в технологии керамики и цемента.
Оксиды легких металлов используются в химической промышленности для получения щелочей или оснований. Пероксид калия KO2 находит необычное применение, так как в присутствии влаги и в результате реакции с ней выделяет кислород. Поэтому KO2 применяют в респираторах для получения кислорода. Влага из выдыхаемого воздуха выделяет в респираторе кислород, а KOH поглощает CO2. Получение оксида CaO и гидроксида кальция Ca(OH)2 – многотоннажное производство в технологии керамики и цемента.
Вода (оксид водорода).
Важность воды H2O как в лабораторной практике для химических реакций, так и в процессах жизнедеятельности требует особого рассмотрения этого вещества (см. также ВОДОРОД; ВОДА, ЛЕД И ПАР). Как уже упоминалось, при прямом взаимодействии кислорода и водорода в условиях, например, искрового разряда происходят взрыв и образование воды, при этом выделяется 143 кДж/(моль H2O).
Молекула воды имеет почти тетраэдрическое строение, угол H–O–H равен 104°30ў. Связи в молекуле частично ионные (30%) и частично ковалентные с высокой плотностью отрицательного заряда у кислорода и соответственно положительных зарядов у водорода:
Связи в молекуле частично ионные (30%) и частично ковалентные с высокой плотностью отрицательного заряда у кислорода и соответственно положительных зарядов у водорода:
Из-за высокой прочности связей H–O водород с трудом отщепляется от кислорода и вода проявляет очень слабые кислотные свойства. Многие свойства воды определяются распределением зарядов. Например, молекула воды образует с ионом металла гидрат:
Одну электронную пару вода отдает акцептору, которым может быть H+:
Молекулы воды связываются друг с другом в большие агрегаты (H2O)x слабыми водородными связями (энергия связи ~21 кДж)
Вода в такой системе водородных связей подвергается диссоциации в очень слабой степени, достигающей концентрации 10–7 моль/л. Очевидно, расщепление связи, показанное квадратными скобками, приводит к образованию гидроксид-иона OH– и иона гидроксония H3O+:
Пероксид водорода.
Другим соединением, состоящим только из водорода и кислорода, является пероксид водорода H2O2. Название «пероксид» принято для соединений, содержащих связь –O–O–. Пероксид водорода имеет строение асимметрично изогнутой цепи:
Пероксид водорода получают по реакции пероксида металла с кислотой
BaO2 + H2SO4® BaSO4 + H2O2
либо разложением пероксодисерной кислоты H2S2O8, которую получают электролитически:
Концентрированный раствор H2O2 может быть получен специальными методами дистилляции. Пероксид водорода используют как окислитель в двигателях ракет. Разбавленные растворы пероксида служат антисептиками, отбеливателями и мягкими окислителями. H2O2 добавляют ко многим кислотам и оксидам для получения соединений, аналогичных гидратам. В присутствии сильного окислителя (например, MnO2 или MnO4–) H2O2 окисляется, выделяя кислород и воду.
Оксоанионы и оксокатионы
– кислородсодержащие частицы, имеющие остаточный отрицательный (оксоанионы) или остаточный положительный (оксокатионы) заряд. Ион O2– имеет высокое сродство (высокую реакционную способность) к положительно заряженным частицам типа H+. Простейшим представителем стабильных оксоанионов является гидроксид-ион OH–. Это объясняет неустойчивость атомов с высокой зарядовой плотностью и их частичную стабилизацию в результате присоединения частицы с положительным зарядом. Поэтому при действии активного металла (или его оксида) на воду образуется OH–, а не O2–:
2Na + 2H2O ® 2Na+ + 2OH– + H2
или
Na2O + H2O ® 2Na+ + 2OH–
Более сложные оксоанионы образуются из кислорода с ионом металла или неметаллической частицей, имеющей большой положительный заряд, в результате получается низкозаряженная частица, обладающая большей стабильностью, например:
Озон.

Кроме атомарного кислорода O и двухатомной молекулы O2 существует третья форма кислорода – озон O3, содержащий три кислородных атома. Все три формы являются аллотропными модификациями. Озон образуется при пропускании тихого электрического разряда через сухой кислород: 3O2 2O3.
При этом образуется несколько процентов озона. Реакция катализируется ионами металлов. Озон имеет острый резкий запах, который можно обнаружить вблизи работающих электрических машин или в окрестности атмосферного электрического разряда. Газ имеет голубоватый цвет и конденсируется при –112° С в темноголубую жидкость, а при –193° С образуется темнопурпуровая твердая фаза. Жидкий озон слаборастворим в жидком кислороде, а в 100 г воды при 0° С растворяется 49 см3 O3. По химическим свойствам озон намного активнее кислорода и по окислительным свойствам уступает только O, F2 и OF2 (дифториду кислорода). При обычном окислении образуются оксид и молекулярный кислород O2. При действии озона на активные металлы в особых условиях образуются озониды состава K+O3–. Озон получают в промышленности для специальных целей, он является хорошим дезинфицирующим средством и используется для очистки воды и как отбеливатель, улучшает состояние атмосферы в закрытых системах, дезинфицирует предметы и пищу, ускоряет созревание зерна и фруктов. В химической лаборатории часто используют озонатор для получения озона, необходимого для некоторых методов химического анализа и синтеза. Каучук легко разрушается даже под действием малых концентраций озона. В некоторых промышленных городах значительная концентрация озона в воздухе приводит к быстрой порче резиновых изделий, если они не защищены антиоксидантами. Озон очень токсичен. Постоянное вдыхание воздуха даже с очень низкими концентрациями озона вызывает головную боль, тошноту и другие неприятные состояния.
При действии озона на активные металлы в особых условиях образуются озониды состава K+O3–. Озон получают в промышленности для специальных целей, он является хорошим дезинфицирующим средством и используется для очистки воды и как отбеливатель, улучшает состояние атмосферы в закрытых системах, дезинфицирует предметы и пищу, ускоряет созревание зерна и фруктов. В химической лаборатории часто используют озонатор для получения озона, необходимого для некоторых методов химического анализа и синтеза. Каучук легко разрушается даже под действием малых концентраций озона. В некоторых промышленных городах значительная концентрация озона в воздухе приводит к быстрой порче резиновых изделий, если они не защищены антиоксидантами. Озон очень токсичен. Постоянное вдыхание воздуха даже с очень низкими концентрациями озона вызывает головную боль, тошноту и другие неприятные состояния.
контрудар-13 — Перенесенная химия
которым предстоит вступить в связь. Ровно столько же атомов содержит эталон — 12 грамм углерода. 23 атомами бериллия и ни один атом не будет обделен. Ибо у обоих химически элементов по две “ответные части”.
23 атомами бериллия и ни один атом не будет обделен. Ибо у обоих химически элементов по две “ответные части”.
Если же предстоит соединить трехвалентный элемент с пятивалентным, надо взять пять моль первого элемента и три моль второго. Потому что у 5 моль трехвалентного элемента столько же “концов”, сколько у 3 моль пятивалентного. Нетрудно догадаться, да?
А как же узнать, сколько весит один моль того или иного вещества?
Да легко: 12 грамм углерода — это 1 моль (так решил Авогадро — должен же быть эталон). Что, по сути, означает: молярная масса углерода — 12 грамм на моль. Атом углерода имеет атомную массу 12 (смотрим ее в таблице Менделеева). Если вещество, например, вдвое тяжелее углерода, ясно, что один моль такого вещества (такое же количество атомов) будет весить ровно вдвое больше. Несложно догадаться, что любое вещество имеет молярную массу, равную его атомной массе. А атомная масса указана в таблице Менделеева. 23 атомов.
23 атомов.
Взвешиваем сколько нужно моль одного вещества и другого. Производим реакцию. Вся любовь.
Если же в реакции участвуют молекулы, суммируем массы всех атомов, входящих в состав молекулы. Например, вода — h3O. Смотрим таблицу Менделеева: водород весит 1 а.е.м. (атомная единица массы), кислород — 16.
В молекуле воды два атома водорода и один атом кислорода. Суммируем:
1 а.е.м первого атома водорода +1 а.е.м. второго атома водорода +16 а.е.м. атома кислорода =18 а.е.м.
Сие означает: один моль воды весит 18 грамм. И эти 18 грамм содержат столько же “структурных единиц”, сколько эталон — 12 грамм углерода. Просто? Пожалуй. Понятно, что верно и обратное утверждение:
сколько весит (в граммах) один моль любого вещества, столько нуклонов содержится суммарно в его молекулах.
А если вещество — газ? Его как взвесить?
Никак. В этом нет необходимости. Ибо 1 моль любого газа при нормальных условиях занимает объем 22,4 литра. Прикольно, да? Одинаковое количество молекул любого газа в одинаковых условиях занимает одинаковый объем. А что есть “нормальные условия”? 0 градусов по Цельсию и 1 атмосфера. Или один килограмм на квадратный сантиметр, если угодно.
Прикольно, да? Одинаковое количество молекул любого газа в одинаковых условиях занимает одинаковый объем. А что есть “нормальные условия”? 0 градусов по Цельсию и 1 атмосфера. Или один килограмм на квадратный сантиметр, если угодно.
Из вышеприведенного видно, что если испарить 18 грамм (1 моль) воды, она займет объем 22,4 литра.
Если мы хотим взорвать гремучий газ — смесь кислорода с водородом — нужно 22,4 литра кислорода смешать с 44,8 литра водорода. Надеть каску и поднести спичку. Смесь сгорит (точнее, взорвется) без остатка.
В цилиндры двигателя внутреннего сгорания засасывается воздух и впрыскивается топливо. Топливо сгорает, выделяется тепло и совершается работа — перемещается поршень. Если мы хотим ехать помедленнее, подаем в цилиндры меньше топлива — убираем ногу с педали акселератора (в народе — педаль газа). В этом случае части молекул кислорода не достается топливо и эти молекулы выходят из цилиндра не среагировав с ним — в виде того же кислорода.
Если же нам нужно ускориться — давим на педаль — впрыскиваем больше топлива. Когда мы давим педаль «в пол», уже каждая молекула кислорода находит себе молекулы топлива для реакции, а значит газ в цилиндре нагревается (а значит — и расширяется, давя на поршень) сильнее.
Но больше определенного количества топлива в цилиндр подавать нет смысла — для его сгорания просто не хватит кислорода в цилиндре. То есть, части молекул топлива не достанется молекул кислорода, не сгоревшая часть топлива вылетит в выхлопную трубу. И никакой прибавки мощности мы не получим. Если прибавка мощности таки нужна, требуется двигатель либо с большим объемом цилиндров (чтобы больше воздуха влезало), либо в цилиндры воздух придется подавать под давлением — с турбины или компрессора. Только в этом случае каждая молекула топлива найдет себе молекулу кислорода для окисления (сгорания).
В этом смысл молярных расчетов.
Вообще, смесь горючих газов с кислородом взрывается только при определенном диапазоне их соотношений. Если одного из газов слишком много или мало, взрыва не будет. Максимальная же мощность при взрыве выделяется при правильном соотношении газов, когда на каждую молекулу одного газа приходится молекула второго газа-реагента (если их валентность одинакова). Если же валентность разная, то при правильном соотношении их объемов с учетом валентности:
Если одного из газов слишком много или мало, взрыва не будет. Максимальная же мощность при взрыве выделяется при правильном соотношении газов, когда на каждую молекулу одного газа приходится молекула второго газа-реагента (если их валентность одинакова). Если же валентность разная, то при правильном соотношении их объемов с учетом валентности:
Схема атома кислорода
Ядра атомов водорода действительно состоят главным образом из одних протонов. Ядра атомов всех остальных элементов, кроме протонов, содержат еще и другие частицы — нейтроны.
Нейтроны электрически нейтральны, поэтому они не влияют на заряд атома. Но они влияют на атомный вес элемента, так как их масса примерно равна массе протонов. Таким образом, атомный вес складывается
Таким образом, атомный вес складывается
из массы всех протонов и нейтронов,
входящих в ядро атома данного эле-
Схема атома кислорода
мента.
Если атомный вес кислорода равен 16, а протонов в ядре 8, то нейтронов в ядре атома кислорода тоже 8. Следовательно, атом кислорода состоит из ядра, содержащего 8 протонов и 8 нейтронов, а вокруг этого ядра вращаются 8 электронов.
Вас, наверное, удивит, если вам скажут, что существует кислород с атомным весом 14, 15, 16, 17, 18 и 19. Это изотопы кислорода, которые встречаются в природе или могут быть получены искусственно.
Это изотопы кислорода, которые встречаются в природе или могут быть получены искусственно.
Слово «изотоп» означает — занимать одно и то же место. Все изотопы одного элемента располагаются в системе элементов Менделеева под одним номером.
Химические свойства изотопов одного и того же элемента настолько близки, что разделить их даже самыми сложными химическими методами почти невозможно.
Это объясняется прежде всего тем, что заряды ядер и строение внешней электронной оболочки атомов изотопов одного и того же элемента совершенно одинаковы. В ядрах содержится одинаковое число протонов, вокруг которых вращается одинаковое число электронов. Изотопы отличаются лишь числом нейтронов в их ядрах.
В ядрах содержится одинаковое число протонов, вокруг которых вращается одинаковое число электронов. Изотопы отличаются лишь числом нейтронов в их ядрах.
В настоящее время точно установлено, что почти все элементы представляют собой смеси изотопов. Так, например, известны 3 изотопа водорода с атомными весами 1, 2 и 3. Особенно интересен изотоп водорода с атомным весом 2. Он имеет свое особое название — дейтерий (D). Вода, в состав которой входит дейтерий, называется тя-
Физики измерили любовь к электронам у отдельных атомов
Схемы взаимодействия между двумя атомами, использовавшиеся в квантово-химических расчетах. Из этой расчетной энергии, энергии взаимодействия иглы с кремниевой поверхностью и с поверхностным атомом кислорода можно определить разность в электроотрицательности данного атома кислорода и кремния
Из этой расчетной энергии, энергии взаимодействия иглы с кремниевой поверхностью и с поверхностным атомом кислорода можно определить разность в электроотрицательности данного атома кислорода и кремния
Jo Onoda et al. / Nature Communications, 2017
Физики из Австрии и Австралии впервые напрямую измерили электроотрицательность отдельных атомов. Для этого исследователи использовали атомно-силовой микроскоп, с помощью которого измеряли взаимодействие между атомом на конце его иглы и атомом на поверхности образца. По словам ученых, результаты совпали с теоретическими предсказаниями, вычисленными еще Лайнусом Полингом в 1930-х годах. Исследование опубликовано в журнале Nature Communications, кратко о нем сообщает Chemistry World.
Электроотрицательность атома — количественная характеристика, которая показывает насколько сильно атом в связи стягивает к себе электронную плотность. К примеру, если взять два атома, у одного из которых электроотрицательность будет очень высокой (фтор), а у другого — очень низкой (цезий), то окажется, что электроны, образующие связь между этими атомами, полностью «перетянутся» к наиболее электроотрицательному атому. Связь станет ионной. Если наоборот взять два атома с одинаковой электроотрицательностью (два атома фтора или два атома водорода), то электронная плотность связи между ними будет распределена симметрично.
Это понятие позволяет делать предсказания о поведении и физических свойствах молекул. Например, у кислорода электроотрицательность выше, чем у водорода, поэтому в воде электронная плотность связей стянута к кислороду. Возникает поляризация в молекуле — отрицательный заряд на кислороде и положительный на водороде. В результате вода — полярный растворитель, высококипящий, способный растворять ионные соединения.
Понятие об электроотрицательности было известно еще во времена Авогадро и Берцелиуса, однако соответствующую количественную шкалу первым ввел Лайнус Полинг в 1932 году. Она была относительной — активным щелочным металлам (рубидию и цезию) были приписаны величины 0,7, фтору — 4. С помощью этой шкалы и уравнения Полинга можно оценить энергию связи меду двумя атомами. Сейчас есть абсолютные шкалы электроотрицательности, например, вводимые как среднее арифметическое между энергией ионизации (отрыва электрона от атома) и энергией сродства к электрону (присоединения электрона к нейтральному атому). Эти значения определяются из коллективных измерений свойств атомов.
Авторы новой работы предложили способ измерить электроотрицательность индивидуального атома в конкретном окружении напрямую, с помощью атомно-силового микроскопа. Последний представляет собой острую иглу, на конце которой может находиться всего лишь один атом и систему, которая позволяет очень точно определять положение этой иглы. С помощью кантилевера (иглы) микроскоп ощупывает поверхность образца. Благодаря высокой точности системы позиционирования система может изучать состояние и взаимодействие с иглой даже единичных атомов.
С помощью кантилевера (иглы) микроскоп ощупывает поверхность образца. Благодаря высокой точности системы позиционирования система может изучать состояние и взаимодействие с иглой даже единичных атомов.
Схема эксперимента по измерению энергии связи между иглой и поверхностными атомами. Иглу подносят к поверхности, а затем медленно отрывают. При этом можно определить силу, с которой поверхность притягивает к себе иглу в зависимости от высоты по изменению характерной частоты колебаний иглы.
Jo Onoda et al. / Nature Communications, 2017
Исследователи создали набор кремниевых подложек, на которые были помещены отдельные атомы кислорода, германия, алюминия и олова. Для измерения электроотрицательности использовались чрезвычайно тонкие кремниевые иглы. С их помощью авторы могли сравнивать относительные величины энергии связи между кантилевером и атомом и между кантилевером и остальной поверхностью. Эти энергии с помощью уравнения Полинга и квантово-химического моделирования можно перевести в разности электроотрицательности между кремнием и изучаемыми атомами.
С их помощью авторы могли сравнивать относительные величины энергии связи между кантилевером и атомом и между кантилевером и остальной поверхностью. Эти энергии с помощью уравнения Полинга и квантово-химического моделирования можно перевести в разности электроотрицательности между кремнием и изучаемыми атомами.
Результаты измерений энергии взаимодействия иглы с кремниевой частью подложки и с атомами германия, олова, алюминия, кислорода, кремния в окружении кислорода и кремния в окружении азота и кислорода. Наклон прямой определяет, положительна или отрицательна разность в электроотрицательности. На врезах ближайшее окружение исследуемого атома и скан поверхности.
Jo Onoda et al. / Nature Communications, 2017
Интересно, что методика позволяет оценить то, как меняется электроотрицательность атома в зависимости от его окружения. Так, авторы показали, что электроотрицательность кремния, окруженного атомами кислорода (как в кварце, SiO2) больше, чем у кремния, окруженного атомами кремния. Это позволяет определять химические свойства отдельных атомов в наночастицах катализаторов, и, в перспективе, лучше моделировать их поведение.
Атомно-силовой микроскоп позволяет не только измерять свойства атомов (например, силы Ван-дер-Ваальса), но и манипулировать ими в пространстве, например, запуская химические реакции или просто перемещая атомы с места на место. Так, химики из исследовательской лаборатории IBM (Цюрих) использовали микроскоп для первого синтеза триангулена и молекул аринов.
Владимир Королёв
Что у атома внутри
Валерия Сирота
«Квантик» №11, 2018
Слово «атом» по-гречески значит ‘неделимый’. Ещё древние греки придумали идею, что всё на свете, как из кирпичиков, сложено из крошечных «кусочков» — атомов. Но это было лишь одно из возможных предположений. Что это за кусочки и существуют ли они, никто не знал до XIX века, когда химики разобрались, что такое молекула, и составили список видов атомов — таблицу химических элементов.
А в самом конце XIX века вдруг выяснилось, что атом вовсе не неделимый! Он состоит из крошечного тяжёлого ядра и очень лёгких электронов, крутящихся вокруг. Потом оказалось, что и ядро можно разделить на части (хотя и очень трудно!): оно состоит из двух очень похожих видов частиц — протонов и нейтронов. Их массы почти равны, а у электрона масса почти в 2000 раз меньше (соотношение примерно как между человеком и мышкой).
Главное различие между этими частицами в том, что протоны притягивают электроны (и сами к ним притягиваются). А два протона (или два электрона) отталкиваются друг от друга с такой же силой. Эти силы называются электрическими. Нейтроны же вовсе не притягивают электроны, да и между собой и с протонами хоть и взаимодействуют, но совсем по-другому (про это мы скажем чуть ниже): в электрическом взаимодействии они не участвуют.
Договорились считать, что у протонов положительный электрический заряд, у электронов — отрицательный. А у нейтронов электрический заряд — ноль. Получается правило: одинаковые по знаку заряды отталкиваются, заряды разного знака — притягиваются.
Не путайте электрическую силу с гравитационным притяжением! В самом деле, все тела, имеющие массу, притягивают друг друга. Но эта сила крошечная даже для таких «средне-тяжёлых» тел, как, например, мы с вами. Большая она только тогда, когда одно из тел очень тяжёлое — звезда, планета или хотя бы астероид. А сила гравитационного притяжения протонов (и тем более протона и электрона) ничтожна.
Электрическая сила, напротив, очень велика: если бы можно было закрепить в каком-то месте протон (и воздух, конечно, убрать), а в трёх сантиметрах над ним поместить другой протон, то второй протон не упал бы вниз, а полетел бы вверх — отталкивание одного протона сильнее гравитационного притяжения всей Земли!
Обычно вещи вокруг нас не имеют электрического заряда — в них столько же электронов, сколько и протонов. Но от некоторых атомов электроны довольно легко отрываются. И вот если отодрать от атомов одного предмета тысячу или миллион-другой электронов и «прицепить» к атомам другого предмета, эти два предмета окажутся заряжены: один — положительно (в нём протонов больше, чем электронов), а другой — отрицательно (в нём лишние электроны). А ведь тысяча протонов, если они рядом, притягивают каждый электрон в тысячу раз сильнее, чем один протон. И начнут эти два предмета притягиваться друг к другу… Случалось вам видеть что-нибудь похожее? Например, когда вы старательно причёсываетесь пластмассовой расчёской, а волосы сами собой поднимаются ей навстречу?
И ещё. В отличие от, например, животных одного вида, которые всё-таки немножко отличаются друг от друга, все протоны (или все нейтроны, или электроны) совершенно одинаковы. Так что, например, электрон, «потерявший» свой атом, уже не сможет найти его среди других таких же…
Электрическое притяжение к протонам и держит электроны в атоме, не даёт им улететь. Как мы вскоре убедимся, оно же скрепляет атомы в молекулы. Но не только! Оно же заставляет молекулы одних тел действовать на молекулы других. Если не считать силы гравитационного притяжения, с которой все мы знакомимся с детства (глядя, как падают на пол выпущенные из руки игрушки), все остальные наблюдаемые нами физические явления вызваны как раз электрической силой. Упругость пружины, трение, прилипание разных вещей друг к другу или, наоборот, их взаимное отталкивание — за всё это отвечает взаимодействие электронов одних атомов с ядрами и электронами других.
Но вернёмся к нашим атомам. В нормальной ситуации атом электронейтрален, то есть не имеет заряда: у него электронов столько, сколько протонов в ядре. Если это не так (например, кто-то похитил у атома электрон или атом где-то захватил себе чужой), такой «калечный» атом называется ионом. Тогда он заряжен — положительно, если электронов не хватает, и отрицательно, если есть лишние.
Протоны притягивают к себе электроны и заставляют их вертеться вокруг ядра, не улетая далеко. А нейтроны в электрическом взаимодействии не участвуют. Зачем же они тогда нужны? Затем, чтобы «склеивать» протоны в ядре — ведь протоны отталкиваются друг от друга электрическими силами, и без нейтронов они бы разлетелись в разные стороны! Силы, которыми нейтроны удерживают протоны вместе, — уже не электрические. Они действуют только на очень маленьких расстояниях — внутри ядра.
Теперь можно догадаться, чем отличаются друг от друга разные сорта атомов: у них разное количество электронов. И, соответственно, протонов в ядре. Номер элемента в таблице Менделеева (число, написанное крупно в правом верхнем углу каждой клетки) — это число протонов в атомах этого элемента. А как узнать количество нейтронов? По массе атома, ведь массы протонов и нейтронов равны! Например, в атоме водорода — самом маленьком и самом лёгком — всего один протон. А в ядре атома гелия два протона, и при этом атом гелия в 4 раза тяжелее атома водорода. Электроны не в счёт — значит, в ядре гелия 2 нейтрона!
Масса атома — в единицах массы водорода — написана в каждой клетке внизу. Легко убедиться, что у нетяжёлых атомов нейтронов примерно столько же, сколько протонов. А у тяжёлых — нейтронов больше: всё труднее становится удерживать всю эту громоздкую конструкцию.
Но почему эта масса нецелая? Не может же, например, у хлора быть 18 с половиной нейтронов? Конечно, нет. Просто это значит, что в природе бывают атомы с 17 электронами, 17 протонами и 18 нейтронами, а бывают такие, у которых электронов и протонов столько же, а число нейтронов отличается. И те и другие — атомы хлора, ведь электронов и протонов столько же. Такие «подвиды» атомов одного вида называют изотопами. В таблице Менделеева написана средняя масса атомов каждого вида (с учётом распространённости их изотопов).
В большинстве клеток средняя масса близка к целому числу. Это значит, что, как правило, в природе больше всего какого-то одного изотопа атомов каждого вида, а атомы с другим количеством нейтронов встречаются не так уж часто. Почти всегда можно не обращать на них внимания и округлять массу до ближайшего целого числа.{3}_{1}\mathrm{H}\) — сверхтяжёлый водород, тритий.
Ну-ка, проверим — всё ли понятно?
Художник Мария Усеинова
А разобрались ли вы? Для проверки и чтобы понять, как непросто было до всего этого догадаться, предлагаем вам решить «контрольную задачу» в конце статьи.
Вообще-то, когда договаривались, про электроны и протоны ещё ничего не знали — это было лет за 150 до их открытия. Тогда положительным назвали заряд, который получается на стекле, если его потереть шёлковой тряпочкой. Теперь мы знаем, что электроны со стекла «убегают» на шёлк.
Зато на этих маленьких расстояниях они очень большие — надо ведь «победить» электрическое отталкивание! Поэтому они так и называются — «сильные силы» (strong force), сильное взаимодействие.
Тут мы чуть-чуть обманываем читателя, но это не беда: дальше придётся обманывать ещё сильнее…
3 — Маленькие и маленькие: структура вещества
Одно из слов, которое увлекало ученых в 1960-х, — «кварк».
Никто никогда не видел кварк и никоим образом не встречал его. Это слишком маленький, чтобы увидеть, и никто даже не уверен, что он существует. Однако ученые очень хотят построить огромные машины стоимостью в сотни миллионов долларов, чтобы попытаться найти кварки, если они существуют.
Это не первый раз, когда ученые ищут объекты, которыми они не были. конечно, существовали, и были слишком малы, чтобы увидеть, даже если они действительно существовали.Они делали это еще в самом начале девятнадцатого века.
В 1803 году английский химик Джон Далтон предположил, что многие химические вещества факты можно было бы объяснить, если бы можно было только предположить, что все было сделано состоит из крошечных частиц, слишком маленьких, чтобы их можно было увидеть под микроскопом. Эти частицы будет настолько маленьким, что не может быть ничего меньшего. Далтон назвал их частицы «атомы» от греческих слов, означающих «не способные к существованию. разделились дальше ». Предложение Дальтона стало называться« атомным теория.«
Сначала никто не был уверен, что атомы действительно существуют, но они действительно изменились. очень удобно. Судя по тому, что происходило в пробирках, химики решили что существует множество различных видов атомов.
Когда определенное вещество состоит только из одного вида атомов, это «элемент.» Например, железо — это элемент, состоящий только из атомы железа. Золото — это стихия; кислород в воздухе, которым мы дышим.
Атомы могут объединяться в группы, и эти группы называются «молекулами».» Атомы кислорода собираются в группы по два, и эти двухатомные кислородные группы называются молекулами кислорода. Кислород в воздухе состоит из молекул кислорода, не отдельных атомов кислорода.
Атомы разных элементов могут объединяться, образуя молекулы «соединений». Вода — это соединение с молекулами, состоящими из двух атомов водорода и одного кислорода. атом.
Далтон и последовавшие за ним химики девятнадцатого века считали, что каждый атом был просто круглым шариком.Не было причин думать, что есть что-то более того. Они вообразили, что если бы атом можно было увидеть под очень мощный микроскоп, он получился бы абсолютно гладким и блестящим, без метка.
Они также смогли сказать, что атом чрезвычайно мал. Они не были совершенно точно, насколько он был маленьким, но в настоящее время мы знаем, что это займет около 250 миллионов атомов уложены бок о бок, чтобы простираться на расстояние всего лишь один дюйм.
Главное отличие одного вида атома от другого в девятнадцатом века, лежали в их массе или весе.У каждого атома были свои особенности. масса, или «атомный вес». Атом водорода был самым легким из всех, и считалось, что он имеет атомный вес l. Атому кислорода было около шестнадцати раз массивнее атома водорода, поэтому он имел атомный вес 16. Ртуть атом имел атомный вес 200 и так далее.
По прошествии девятнадцатого века было обнаружено, что атомная теория объясняет все больше и больше вещей. Химики узнали, как устроены атомы внутри молекул и как создавать новые молекулы, чтобы образовывать вещества, которых не существовало в природа.
К концу столетия казалось, что атомная теория прочно утвердилась. Там Казалось, нет места для сюрпризов.
А потом, в 1896 году, случился огромный сюрприз, который поразил старую картину. вдребезги. Химики нового двадцатого века были вынуждены вступить в новую серия исследований, которые привели их вглубь крошечного атома.
В 1896 году французский физик Антуан Анри Беккерель, совершенно случайно обнаружил, что некая субстанция не обладает свойствами, когда-либо мечтал раньше.
Беккерель интересовался рентгеновскими лучами, которые были обнаружены только в годом ранее. У него были образцы вещества, содержащего атомы тяжелого металла. уран в его молекулах. Это вещество испускало собственный свет после того, как было подверглись воздействию солнечного света, и Беккерель задумался, может ли этот свет включать рентгеновские лучи.
Нет, но Беккерель обнаружил, что он испускает загадочное излучение своего рода; излучения, которые прошли сквозь черную бумагу и затуманили фотографический фильм.В конце концов выяснилось, что именно атомы урана Это. Атомы урана взрывались и бросали маленькие осколки самих себя. во всех направлениях.
Ученые никогда не ожидали, что атомы могут взорваться, но вот некоторые из них делали это. Было изобретено новое слово. Уран был «радиоактивным».
Были обнаружены другие примеры радиоактивности, и физики начали изучать новый феномен с большим интересом в начале двадцатого века.
Сразу стало ясно одно.Атом был , а не , просто твердый блестящий шар. это нельзя было разделить на более мелкие объекты. Каким бы маленьким он ни был, у него был сложный структура и состояла из множества объектов, все еще меньших, чем атомы. Это было для атома урана, взорвавшись, выбросило некоторые из этих более мелкие «субатомные частицы».
Одним из самых искусных из новых экспериментаторов был новозеландец Эрнест. Резерфорд. Он использовал субатомные частицы, которые вылетали из радиоактивных элементы и заставили их служить пулями.Он нацелил их на тонкие пленки металла и обнаружили, что они прошли сквозь металл без проблем. Атомов не было твердые блестящие шарики вообще. Действительно, они казались в основном пустым пространством.
Но потом, время от времени, одна из субатомных пуль отскакивала выкл резко. Он ударил что-то твердое и тяжелое где-то в атоме.
К 1911 году Резерфорд смог объявить, что атом не совсем пустой. космос. В самом центре атома было крошечное «атомное ядро». в нем содержится почти вся масса атома.Это ядро было настолько маленьким, что потребуется около 100000 из них, размещенных бок о бок, чтобы растянуться на ширина одного атома.
За пределами ядра, заполняя остальную часть атома, находился ряд очень легкие частицы, называемые «электронами». У каждого вида атома свое собственное определенное количество электронов. У атома водорода был только один электрон; у атома кислорода было восемь; у атома железа их двадцать шесть; уран у атома было девяносто два и так далее.
Все электроны, независимо от того, в каком атоме они находятся, одинаковы во всех способ.Все они, например, несут электрический заряд. Есть два вида электрических зарядов — положительных и отрицательных. Все электроны несут отрицательный электрический заряд. заряд и заряд всегда одного размера. Можно сказать, что каждый электрон имеет заряд всего -1.
Ядро атома тоже имеет электрический заряд, но положительный. Заряд на ядре просто уравновешивает заряд электронов. Атом водорода имеет одиночный электрон с зарядом -1. Следовательно, заряд на водороде ядро +1.
У атома кислорода восемь электронов с общим зарядом -8. Кислород ядро имеет заряд +8, следовательно. Итак, вы видите, что ядро железа должен иметь заряд +26, ядро урана — +92 и так далее.
Обе части атома — крошечное ядро в центре и вращающиеся электроны. извне — участвовали в необычных открытиях с тех пор, как Резерфорд сделал свой объявление в 1911 году. В этой главе, однако, мы собираемся затронуть только с ядром.
Естественно, физиков интересовало, действительно ли атомное ядро была единственной частицей. Он был настолько меньше атома, что казалось разумно предположить, что здесь наконец-то было что-то настолько маленькое, насколько могло быть. Однако атом оказался неожиданностью, и ученые не собирались останавливаться на достигнутом. тоже уверен в ядре.
Резерфорд бомбардировал атомы субатомными частицами в надежде что-то открыть о ядре, если он ударил их достаточно раз.
Он сделал. Время от времени, когда одна из его субатомных пуль попадает в ядро прямо, это ядро изменило свою природу. Он стал ядром другого разновидность атома. Резерфорд впервые обнаружил это в 1919 году.
Это превращение одного ядра в другое создавало впечатление, будто ядро должен был быть набором еще более мелких частиц. Произойдут изменения потому что набор еще более мелких частиц был разбит на части и перестроен.
Самым маленьким ядром было ядро атома водорода.Это был заряд +1 и действительно казалось, что он состоит из одной частицы. Ничего, Резерфорд это могло разрушить его (и мы не нашли способа сделать это даже сегодня). Резерфорд поэтому считал, что он состоит из одной частицы, которую он назвал «протон».
Заряд протона +1 был точно такой же, как у электрона, но противоположного вида. Это был положительный электрический заряд, а не отрицательный. один.
Однако большая разница между протоном и электроном заключалась в массе.Протон в 1836 раз массивнее электрона, хотя по сей день физики не знаю, почему так должно быть.
Вскоре стало ясно, что ядра разных атомов имеют разную электрическую заряды, потому что они состоят из разного количества протонов. Поскольку Ядро кислорода имело заряд +8, оно должно содержать восемь протонов. В то же самое Кстати, ядро железа содержало двадцать шесть протонов, а ядро урана — девяносто два. протоны.
Вот почему ядро содержит почти всю массу атома, путь.Ядро состоит из протонов, которые намного тяжелее, чем электроны, которые вращаются вне ядра.
Но тут возникла проблема, которая преследовала физиков на протяжении всего 1920-е гг. Протоны могли бы объяснить электрический заряд ядра, но не при всей своей массе. Поскольку ядро кислорода имело заряд +8, оно, следовательно, должен был содержать восемь протонов, но также имел массу, которая была в шестнадцать раз больше величиной с один протон и, следовательно, вдвое больше, чем все восемь протонов. собрать.Откуда взялась лишняя масса?
Ядро урана имело заряд +92 и, следовательно, должно было содержать девяносто два протоны. Однако масса ядра урана была в два с половиной раза больше, чем у ядра. отлично, как все эти девяносто два протона вместе взятые. Откуда это пришло?
Физики пытались объяснить это несколькими способами, которые оказались неудовлетворительными. Некоторые, однако, предполагали, что в ядре могут быть частицы, которые были тяжелыми, как протоны, но не несли электрического заряда.
Такие незаряженные частицы, если бы они существовали, увеличили бы массу ядер. без добавления электрического заряда. Они решат множество головоломок по поводу ядра, но была одна загвоздка.
Казалось, что невозможно обнаружить такие незаряженные частицы, если они существуют. Чтобы понять, почему это так, давайте посмотрим, как физики обнаруживали обычные заряженные частицы в 1920-е гг.
Физики использовали для этой цели несколько методов, но наиболее удобный был изобретен в 1911 году шотландским физиком Чарльзом Томсоном. Рис Уилсон.
Он начал свою карьеру с изучения погоды, и его заинтересовало, как облака пришел в форму. Облака состоят из крошечных капель воды (или частиц лед), но они не образуются легко в чистом воздухе. Вместо этого каждый формирует около крошечный кусочек пыли или песка, который плавает в верхней части воздуха. В отсутствие такой пыли облака не образовывались бы, даже если бы воздух был заполнен водяным паром до предела, который он мог удерживать, и многое другое.
Оказалось также, что капля воды образуется особенно легко, если она образовался вокруг куска пыли, несущего электрический заряд.
Имея это в виду, Уилсон построил небольшую камеру, в которой может быть введен влажный воздух. Если бы камера была расширена, воздух внутри будет расширяться и остывать. Холодный воздух не может удерживать много водяного пара, так как воздух остывший пар выходил наружу в виде крошечного тумана.
Но предположим, что влажный воздух, введенный в камеру, был полностью без пыль. Тогда, даже если бы камера была расширена и воздух охладился, туман все равно не форма.
Далее предположим, что субатомная частица пробивает стекло и полосы во влажный воздух в камере.Предположим также, что частица электрически заряженный.
Электрические заряды влияют друг на друга. Аналогичные обвинения (два отрицательных или два позитивных) отталкиваются друг от друга; отталкивать друг друга. Противоположные обвинения (a отрицательное и положительное) притягивают друг друга.
Если отрицательно заряженная частица, например электрон, летит по воздуху, он отталкивает другие электроны, к которым приближается. Он выталкивает электроны из атомов с которым он сталкивается. Положительно заряженная частица, как протон, притягивает электроны и вытягивает их из атома.В любом случае атомы на пути электрически заряженных частиц теряют электроны.
То, что осталось от атома, имеет положительный электрический заряд, потому что положительный заряд ядра теперь больше, чем отрицательный заряд оставшиеся электроны. Такой электрически заряженный атом называется «ионом».
Капли воды, которые образуются с особой легкостью около электрически заряженных частицы пыли также с особой легкостью образуются около ионов. Если субатомная частица проходит через влажный воздух в камере Вильсона так же, как этот воздух охлаждается, вокруг ионов, которые оставляет субатомная частица, образуются капли воды. в своем следе.Путь субатомной частицы можно сфотографировать и частицу можно обнаружить по оставленному ею следу.
Предположим, камера Вильсона расположена рядом с магнитом. Магнит вызывает движение субатомная частица изгибается на своем пути. Таким образом, он оставляет изогнутый след капель росы.
Кривая показывает объемы. Если частица несет положительный электрический заряд, он изгибается в одном направлении, и если он несет отрицательный электрический заряд, он изгибается в другом. Чем он массивнее, тем более плавно изгибается.Чем больше его заряд, тем круче он изгибается.
Физики сделали тысячи фотографий камер Тумана и изучили следы капель росы. Они познакомились с типами треков, какая-то частица осталась. По этим трекам они научились рассказывать, что происходит когда частица ударилась об атом или когда две частицы столкнулись друг с другом.
Но все это хорошо работало только для заряженных частиц. Предположим, что частица не несет электрического заряда.У него не будет тенденции тянуть или толкать электроны из атома. Атомы остались бы нетронутыми и незаряженными. Ионы не будут образуется, и капли воды не появляются. Другими словами, незаряженная частица пройдет через камеру Вильсона, не оставив никаких следов.
И все же, разве нельзя косвенно обнаружить незаряженную частицу? Предположим, вы столкнулись с тремя мужчинами, один из которых был невидим. Вы бы видели только два мужчин, и если бы никто из них не двинулся с места, у вас не было бы причин подозревать, что третий человек существовал.Если, однако, человек-невидимка внезапно толкнет одну из своих соседи, вы могли бы увидеть, как один из мужчин пошатнулся. Тогда вы можете решить, что третий мужчина присутствовал, но невидимый.
Нечто подобное случилось с физиками в 1930 году. Когда определенный металл так называемый бериллий, подвергся воздействию брызг субатомных частиц, радиации был произведен им, который не мог быть обнаружен камерой Вильсона.
Как тогда кто-нибудь узнал, что это радиация присутствует? Хорошо, если парафин были размещены на некотором расстоянии от бериллия, протоны выбивались из этого. Что-то должно было выбивать эти протоны.
В 1932 году английский физик Джеймс Чедвик утверждал, что излучение бериллий состоял из незаряженных частиц. Эти частицы были электрически нейтральные, и поэтому они были названы «нейтронами».
Нейтроны были быстро изучены не камерой Вильсона, а о которых они разбивали атомы, и многому научились. Было обнаружено, что нейтрон был массивной частицей, лишь немногим более массивной, чем протон.Если протон был в 1836 раз массивнее электрона, нейтрон был В 1839 раз массивнее электрона.
Физики обнаружили, что у них есть описание структуры ядро, которое было лучше, чем все, что было раньше. Ядро состояло как протонов, так и нейтронов. Именно нейтроны составили дополнительную масса ядра.
Таким образом, ядро кислорода имело заряд +8, но массу 16. Это было потому, что он состоял из 8 протонов и 8 нейтронов.Ядро урана имело заряд +92 при массе 238; он состоял из 92 протонов и 146 нейтронов. В атомное ядро, каким бы маленьким оно ни было, действительно состояло из еще более мелких частиц (кроме водорода). Действительно, ядра более сложных атомы состоят из пары сотен более мелких частиц.
Это не означает, что это не вызвало серьезных вопросов. протонно-нейтронная теория строения ядра. Например, все протоны положительно заряженные и положительно заряженные частицы отталкиваются друг от друга.Чем ближе они, тем сильнее они отталкиваются друг от друга. Внутри атомного ядра десятки протоны прижаты друг к другу так близко, что практически соприкасаются. Сила отталкивание должно быть огромным, и все же ядро не разлетается.
Физики начали задаваться вопросом, есть ли какое-то особое притяжение или сила, удерживающая протоны вместе. Эта сила должна была быть чрезвычайно сильной, чтобы преодолеть «электромагнитная сила», которая раздвигает протоны. Кроме того, новая сила должна была действовать только на очень малых расстояниях, поскольку, когда протоны были вне ядер, они отталкивались друг от друга без каких-либо признаков притяжения.
Такое сильное притяжение, которое может ощущаться только внутри ядер, называется «ядерная сила».
Может ли существовать такая ядерная сила? Японский физик Хидеки Юкава занялся проблема вскоре после открытия нейтрона. Он тщательно проработал такого рода вещи, которые могли бы объяснить такую чрезвычайно сильную и чрезвычайно сила ближнего действия.
В 1935 году он объявил, что если такая сила существует, то она может быть построена. вверх за счет постоянного обмена частицами протонами и нейтронами в ядро.Это было бы так, как если бы протоны и нейтроны подбрасывали частицы вперед и назад и крепко держались вместе, пока они были достаточно близко, чтобы бросать и ловить. Как только нейтроны и протоны оказались достаточно далеко друг от друга, так чтобы частицы не могли достичь, тогда ядерная сила больше не будет эффективный.
Согласно Юкаве, обменная частица должна иметь промежуточную массу. между протоном и электроном. Поэтому в конечном итоге он был назван «мезон» от греческого произведения, означающего «промежуточный».«
Но действительно ли существует мезон?
Лучший способ определить, существовала ли она и была ли теория Юкавы на самом деле правильным было обнаружить мезон внутри ядра, пока он был подброшен туда и обратно между протонами и нейтронами. К сожалению, это казалось невозможным. Обмен произошел так быстро, и было так сложно выяснить, что происходило глубоко внутри ядра, что казалось безнадежным.
Но, возможно, мезон можно как-то выбить из ядра и обнаружить. в открытую.Для этого действительно нужно заставить ядро подвергнуться тяжелое столкновение.
Согласно теории, разработанной немецко-швейцарским физиком Альбертом Эйнштейном, в 1905 году материя и энергия — две разные формы одного и того же. Иметь значение однако это очень концентрированная форма энергии. Потребовалась бы произведенная энергия сжигая двадцать миллионов галлонов бензина, чтобы получить одну унцию вещества.
Выбить мезон из ядра атома было бы очень похоже на создание количество вещества в мезоне.Производство такого количества материи не действительно требует много энергии, но эта энергия должна быть сконцентрирована в одном крошечное атомное ядро, и сделать это очень сложно.
На протяжении 1930-х и 1940-х годов физики создавали машины для выталкивания субатомные частицы электромагнитными силами и заставляют их двигаться быстрее и быстрее, накапливая все больше и больше энергии, пока, наконец, не рухнули — они были отправлены врезаясь в ядро.
Постепенно все больше и больше энергии концентрировалось в этих ускоряющихся частицах.Такая энергия измерялась в «электрон-вольтах», и частицы 1940-х годов с энергией десять миллионов электрон-вольт (10 Мэв). Это звучит вроде бы много, и это так, но этого все еще было недостаточно для образования мезонов.
К счастью, физиков не остановили. Есть естественная радиация («космические лучи») постоянно падают на Землю. Это состоит из субатомные частицы широкого диапазона энергий; некоторые из них чрезвычайно энергичный.
Они происходят где-то глубоко в космосе.Даже сегодня физики не совсем уверены в происхождении космических лучей или в том, что заставляет их обладать столько энергии. Тем не менее, энергию нужно использовать.
Космические лучи — не лучший ответ. Когда физики производят энергичные частицы, они могут направить их в желаемое место. Когда космические лучи бомбардируют Землю, они делают это без прицеливания. Физики должны ждать удачного удара; когда космический Лучевая частица с достаточной энергией случайно попадает в ядро справа способ.И тогда он должен надеяться, что кто-то с детекторным устройством окажется в нужном месте и в нужный момент.
Однако какое-то время казалось, что счастливый случай почти произошел. сразу. Даже когда Юкава объявлял о своей теории, американский физик Карл Дэвид Андерсон был высоко на Пике Пайк в Колорадо, изучая космические лучи.
Частицы космических лучей поражают атомы в воздухе и разносят другие частицы. из атомов в камеры Вильсона.Когда наконец появился шанс изучив тысячи сделанных фотографий, были обнаружены следы, которые изогнуты таким образом, чтобы показать, что частица, их вызвавшая, была тяжелее чем электрон, но легче протона. В 1936 году было объявлено что мезон был открыт.
К сожалению, быстро выяснилось, что этот мезон слишком легкий. быть частицей, к которой призывает теория Юкавы. Неправильно было в нескольких других пути тоже.
До 1947 года ничего не происходило.В том году английский физик Сесил Фрэнк Пауэлл изучал космические лучи далеко в Боливийских Андах. Он не был используя камеры облачности, но специальные фотографические химикаты, которые темнеют при в них ударила субатомная частица.
Когда он изучил следы в этих химикатах, он обнаружил, что и у него мезон, но более тяжелый, чем был обнаружен ранее. Когда-то был шанс для изучения нового мезона оказалось, что у него есть только свойства, предсказанные Юкава.
Первый открытый мезон, более легкий, получил название «мю-мезон.«Более тяжелым, что обнаружил Пауэлл, был пи-мезон». («Му» и «пи» — буквы греческого алфавита. Ученые часто используют греческие буквы и греческие слова при составлении научных названий.)
Все чаще сокращаются имена этих мезонов. Легкий называется «мюон», а тяжелый — «пион».
Новые мезоны — очень нестабильные частицы. Они не длятся долго, когда они сформированы. Пион длится всего около двадцати пяти миллиардных долей секунды и затем он распадается на более легкий мюон.Единственная причина, по которой пион может быть обнаружен вообще то, что когда он сформирован, он обычно движется с огромной скоростью, многие тысячи миль в секунду. Даже через миллиардную долю секунды у него есть шанс проехать несколько дюймов, оставляя при этом след. Изменение вида следа, который он оставляет к концу, показывает, что пион исчез, и мюон занял его место.
Мюон длится намного дольше, несколько миллионных долей секунды, а затем он разрушается, образуя электрон.Электрон стабилен и, если его оставить Сама по себе, останется неизменной навсегда.
К концу 1940-х годов атомное ядро, казалось, находилось в довольно хорошая форма. Он содержал протоны и нейтроны, и они удерживались вместе. пионы мигают вперед и назад. Химики определили количество протонов и нейтроны в каждом атоме, и все казалось в порядке.
Но казалось, что должно быть два типа ядер. все о нас и своего рода зеркальное отражение, которое в конце 1940-х годов еще никто не видимый.
Эта возможность была впервые предложена в 1930 году английским физиком, Поль Адриан Морис Дирак. Он вычислил, какой должна быть атомная структура. согласно последним теориям, и ему казалось, что каждая частица должна иметь противоположный номер. Эту противоположность можно было бы назвать «античастицей».
Помимо электрона, например, должен быть еще «антиэлектрон». который имел бы массу, как у электрона, но был бы противоположным в электрический заряд.Вместо заряда -1 у него будет один заряд +1.
В 1932 году К. Д. Андерсон (который позже открыл мюон) изучал космические лучи. Он заметил на одной из своих фотографий след в камере Вильсона, который он легко идентифицировался как электрон. Было только одно не так с этим; он изогнулся не в ту сторону. Это означало, что вместо этого у него был положительный заряд отрицательного.
Андерсон открыл антиэлектрон. Из-за своего положительного заряда его обычно называют «позитроном».»Существование антиэлектрона было убедительным доказательством в пользу теории Дирака, и со временем все больше и больше было обнаружено больше античастиц.
Обычный мюон, например, имеет отрицательный заряд -l, как и электрон, и его обычно называют «отрицательным мюоном». Есть антимюон, точно так же, как мюон, за исключением того, что он имеет положительный заряд +1, как и позитрон. Это «положительный мюон».
Обычный пион — это «положительный пион» с зарядом +1.В антипион — это «отрицательный пион» с зарядом -1.
К концу 1940-х годов казалось вполне разумным предположить, что были обычными ядрами, состоящими из протонов и нейтронов с положительными пионами, сдвигающимися туда и обратно среди них; и что были также сделаны «антинуклеи» набор «антипротонов» и «антинейтронов» со смещением антипионов назад и вперед.
Физики на самом деле не чувствовали, что им действительно нужно обнаруживать антипротоны и антинейтроны, чтобы убедиться в этом, но, конечно, они бы хотели.
Обнаружить антипротоны еще труднее, чем обнаружить пионы. Антипротон такой же массивный, как протон, а это значит, что он в семь раз массивнее пиона. Для образования антипротона требуется в семь раз больше энергии. как образовать пион.
Для образования пиона требовалось несколько сотен миллионов электрон-вольт, но для образования для антипротона потребуется несколько миллиардов электрон-вольт. (Миллиард электронов вольт сокращенно «Бэв.»)
Конечно, есть частицы космических лучей, которые содержат несколько Бэв энергии, даже несколько миллионов бэв.Однако чем выше требуемый уровень энергии, тем меньше процент частиц космических лучей, обладающих этой энергией. Шансы что один придет достаточно энергичный, чтобы выбить антипротоны из атомов просто когда физик ждал, чтобы сфотографировать результаты, были очень действительно маленький.
Однако машины для производства искусственных энергетических частиц становились все более популярными. еще больше и мощнее. К началу 1950-х годов устройства для получения субатомных были построены частицы с энергией в несколько Бэв.Один из них был завершен в Калифорнийском университете в марте 1954 года. производимых им частиц он получил название «Беватрон».
Почти сразу Bevatron был запущен в надежде, что он сможет производить антипротоны. Он использовался для ускорения протонов до тех пор, пока они не набрали 6 Бэв энергии. а затем эти протоны столкнулись с куском меди. Ответственные люди в этом проекте участвовали физик итальянского происхождения Эмилио Сегре и молодой американец, Оуэн Чемберлен.
При этом образовались мезоны; тысячи мезонов для всех возможных антипротон. Однако мезоны были намного легче антипротонов и двигались еще быстрее. Группа Segr� установила детекторные устройства, которые среагируют всего за несколько секунд. как правильно собирать тяжелые, медленно движущиеся, отрицательно заряженные частицы. Когда устройства обнаружения среагировали должным образом, только то, что было точно свойства, ожидаемые от антипротона, могли повернуть это путешествие.
К октябрю 1955 года устройства обнаружения сработали шестьдесят раз.Это могло бы быть не случайно. Антипротон был там, и было объявлено о его открытии.
Антипротон был двойником протона. Большая разница заключалась в том, что протон имел заряд +1, а антипротон имел заряд -1.
Как только было произведено достаточно антипротонов для исследования, было обнаружено, что иногда один прошел бы рядом с протоном, и противоположные заряды погасли бы. В протон станет нейтроном, а антипротон станет антинейтроном.
Вы могли бы задаться вопросом, как можно отличить антинейтрон от нейтрона, если оба не заряжены.Ответ таков: хотя нейтрон и антинейтрон без электрического заряда, они быстро вращаются, что заставляет их вести себя как крошечные магниты. Нейтрон подобен магниту, который указывает в одном направлении, в то время как антинейтрон подобен магниту, который указывает в противоположном направлении.
К середине 1950-х годов стало ясно, что антипротоны и антинейтроны существуют. Но могут ли они объединиться в антинуклеус?
Физики были уверены, что смогут, но окончательный ответ пришел только в 1965 году.В том же году в Брукхейвенских национальных лабораториях на Лонг-Айленде, штат Нью-Йорк, протоны с энергией 7 Бэв столкнулись с бериллиевой мишенью. Несколько выявлены и выявлены случаи контакта антипротона и антинейтрона.
В случае обычных частиц существует атомное ядро, состоящее из одного протона и одного нейтрона. Это ядро редкой разновидности водорода. атом, который называется «дейтерий». Комбинация протон-нейтрон поэтому называется «дейтрон».«
То, что образовалось в Брукхейвене, было «антидейтроном». это простейшее антиядро, которое может состоять более чем из одной частицы, но этого достаточно. Оказалось, что это возможно. Это было достаточным доказательством того, что Материя могла быть построена из античастиц так же, как она могла быть построена из обычных частицы. Материя, состоящая из античастиц, и есть «антивещество».
Когда впервые было высказано предположение о существовании античастиц, было естественным интересно, почему, если они могли существовать, их нигде не было вокруг нас.Когда они были обнаружены, наконец, они были обнаружены только в крошечных количествах и даже в этих количествах. длилось недолго.
Рассмотрим позитрон или антиэлектрон. Вокруг нас, в каждом атоме всего материя, которую мы можем увидеть и потрогать на Земле, — это обычные электроны. Нигде нет есть какие-то антиэлектроны, о которых можно было бы говорить. Иногда частицы космических лучей производят несколько человек или физики образуют несколько в лаборатории. Когда они это сделают, эти антиэлектроны исчезают быстро.
По мере того, как антиэлектрон движется вперед, он обязательно столкнется с одним из триллионы обычных электронов в непосредственной близости от него.Это сделает это возможно за миллионную долю секунды.
Когда электрон встречает антиэлектрон, обе частицы исчезают. Они противоположности и отменить. Это похоже на то, что колышек падает в отверстие, в которое он точно входит. Колышек и отверстие исчезают, и не остается ничего, кроме плоской поверхности.
Однако в случае электрона и антиэлектрона не все исчезает. И у электрона, и у антиэлектрона есть масса, точно такое же количество одинаковых вид масса. (Пока мы знаем только об одном виде массы.) Когда электрон и антиэлектроны уравновешиваются, масса остается, и она превращается в энергию.
Это происходит со всеми другими частицами и античастицами. Положительный мюон отменит отрицательный мюон; отрицательный пион аннулирует положительный пион; ан антипротон отменит протон и так далее. В каждом случае исчезают обе частицы. и энергия занимает их место. Естественно, что чем массивнее частицы, тем появляется большее количество энергии.
Процесс также можно повернуть вспять.Когда сосредоточено достаточно энергии в небольшое пространство, из него могут образовываться частицы. Частица никогда не образуется из энергии, однако. Если электрон образуется, антиэлектрон должны формироваться одновременно. Если протон образуется, антипротон должен быть сформировались в то же время.
Когда Сегре и Чемберлен приступили к формированию антипротонов, им пришлось разрешить за вдвое больше энергии, чем хватило бы только на антипротон. После все они должны были одновременно образовать протон.
Так как это так, астрономы столкнулись с довольно серьезной проблемой. Они имеют разработал множество теорий о том, как возникла Вселенная, но во всех теориях Казалось бы, вместе с частицами должны образовываться античастицы. Антивещества должно быть столько же, сколько материи.
Где все это антивещество? Кажется, его нет рядом. Возможно, это соединяется с материей и превращается в энергию. В таком случае, почему все обычное дело о нас осталось позади.Должно быть равное количество каждого, и каждый набор должен полностью нейтрализовать другой.
Некоторые астрономы предполагают, что существует две отдельные вселенные, одна из которых из материи (нашей) и другой из антивещества. Другие астрономы думаю, что существует только одна вселенная, но некоторые ее части (например, части, расположенные рядом мы сами) являются материей, а другие части — антивеществом.
Что заставило материю и антивещество разделиться на разные части Вселенная, или даже в разные вселенные, пока никто не может сказать.Это может даже возможно, что по какой-то причине мы не понимаем, только материю, а не антивещество, был сформирован с самого начала.
Проблема Вселенной была чем-то для астрономов, тем не мение. В 1947 году физики были вполне удовлетворены тем, что сосредоточились на частицах. и античастицы и оставьте вселенную в покое.
И у физиков того года, казалось, было много поводов для удовлетворения. Если бы они проигнорировали проблему того, как возникла Вселенная и просто сконцентрировались о том, как это было сейчас, они чувствовали, что могут объяснить все с точки зрения всего чуть больше десятка частиц.Некоторые из этих частиц у них были фактически обнаружен. Некоторые из них не имели, но в любом случае были уверены.
Конечно, не все было абсолютно понятно, но какие загадки существовали Они надеялись, что это должно быть выяснено без особых проблем.
Частицы, которые они знали или сильно подозревали, что скоро узнают, распались на три группы в зависимости от их массы. Были частицы света, частицы среднего размера и тяжелые частицы. В конечном итоге они были предоставлены Греческие имена от слов, означающих легкий, средний и тяжелый: «лептоны», «мезоны» и «барионы».«
Лептоны, или легкие частицы, включают электрон и антиэлектрон, конечно. Чтобы объяснить некоторые наблюдаемые факты об электронах, Австрийский физик Вольфганг Паули в 1931 году предположил, что частицы другого вида тоже существовали. Это был очень маленький, возможно, совсем без массы, и уж точно бесплатно. Его назвали «нейтрино». Эта крошечная частица была наконец, обнаружен в 1956 году. Было не только нейтрино, но и «антинейтрино».
Хотя мюон сначала считался мезоном, вскоре его признали. как своего рода тяжелый электрон.Все его свойства, кроме массы, были идентичны те из электрона. Наряду с мюоном нейтрино или антинейтрино также формируется так же, как и в случае электрона. В 1962 году это мюоннейтрино было найдено. отличаться от электронного нейтрино.
Можно упомянуть еще две частицы. Свет вместе с другим излучением похожий на него (как, например, рентгеновские лучи) ведет себя в некотором роде так, как если бы он были составлены из частиц. Эти частицы называются «фотонами».
Для фотона нет античастицы; нет антифотона.Фотон действует как своя собственная противоположность. Если бы вам пришлось сложить лист бумаги посередине и положить частицы с одной стороны и античастицы с другой, у вас будет положить фотон прямо на складку.
Кроме того, физики предполагают, что причина, по которой различные объекты притягиваются друг друга гравитационно, потому что есть крошечные частицы, называемые «гравитонами» летают между ними. Некоторые свойства гравитона проработаны. теоретически; например, это собственная античастица.Гравитон такой однако крошечный, и его так сложно определить, что он еще не обнаружен.
Это полный список лептонов на данный момент:
- гравитон
- фотон
- электрон и антиэлектрон
- электрон-нейтрино и электрон-антинейтрино
- отрицательный мюон и положительный мюон
- мюон-нейтрино и мюон-антинейтрино
Лептоны создают для физиков некоторые проблемы.Действительно ли существует гравитон? Почему существует мюон; какова цель чего-то просто тяжелого электрон? Почему и чем мюонные нейтрино отличаются от электронных нейтрино? Эти загадки интригуют, но не доводят физиков до отчаяния.
В 1947 году стали известны только три частицы, которые теперь будут считается мезонами. Двое из них были положительным пионом и отрицательным антипионом. Третьим был нейтральный пион, который, подобно фотону и гравитону, был его собственная античастица.
В 1947 году было известно всего четыре частицы, которые теперь можно было бы классифицировать как барионы. Это протон, антипротон, нейтрон и антинейтрон. Оба антипротона и антинейтрон фактически еще не был обнаружен, но физики уверен, что они существовали.
Ситуация с ядром казалась особенно улаженной. Ядро состояло из протонов и нейтронов, удерживаемых пионами, и антинуклеус, состоящий из антипротонов и антинейтронов, удерживаемых вместе антипионов.Все вроде бы хорошо.
Но в 1947 году, в том самом году, когда был открыт пион и очевидное решение проблемы ядра, началась новая серия открытий это снова расстроило тележку с яблоками.
Два английских физика, Джордж Диксон Рочестер и Клиффорд Чарльз Батлер, изучая космические лучи с помощью облачных камер в 1947 году, наткнулся на странную V-образную отслеживать. Как будто какая-то нейтральная частица, не оставившая следов, внезапно разбита на две частицы, каждая из которых имела заряд и оставляла след, и которые поспешил в разные стороны.
Частица, которая двигалась в одном направлении и образовывала одну ветвь Ви казался пионом, но другой был чем-то новым. От природы след, который он оставил, он казался массивным, как тысяча электронов или как три полтора пиона. Он был вдвое меньше протона.
Ничего подобного о существовании такой частицы никогда не подозревалось. Он поймал мир физиков врасплох, и сначала все, что можно было сделать, было дать ему имя. Это было названо «V-частица», и столкновение это было «V-событие».«
Когда физики узнали о V-событиях, они начали их наблюдать и, конечно, вскоре обнаружились и дополнительные. К 1950 г. были обнаружены V-частицы. которые казались на самом деле более массивными, чем протоны или нейтроны. Это было еще один шок. Почему-то физики считали само собой разумеющимся, что протоны и нейтроны были самыми массивными частицами.
Пораженные физики начали внимательно изучать новые частицы. В первая открытая V-частица, которая была вдвое меньше протон, как было обнаружено, имеет определенные свойства, очень похожие на свойства пиона.Таким образом, новая частица была классифицирована как мезон. Он получил название «К-мезон». и название быстро сократилось до «каон». Было четыре это: положительный каон, отрицательный антикаон, нейтральный каон и нейтральный антикаон.
Другие V-частицы, открытые в начале 1950-х годов, были все более массивными. чем протон, и были сгруппированы как «гипероны». Было три их вида, и каждому было дано название греческой буквы. В Самыми легкими были «лямбда-частицы», которые составляли около 20 процентов тяжелее протонов.Они были двух видов: лямбда и антиламбда. оба они незаряженные.
Следующими по свету были «сигма-частицы», которые были почти 30 процентов тяжелее протона. Была положительная сигма, отрицательная и нейтраль, и у каждой была своя античастица. Это означало всего шесть сигма-частиц.
Наконец, были «частицы xi», которые были на 40 процентов тяжелее. чем протон. Были отрицательная xi частица и нейтральная (нет положительной разновидность), и у каждой была своя античастица, всего четыре.
Все эти гипероны, даже дюжина их, обладали многими свойствами, напоминающими те из протона и нейтрона. Поэтому они были объединены с ними как барионы. В то время как в 1947 году было известно или предполагалось четыре бариона, шестнадцать в 1957 году.
Но потом все стало еще сложнее. Отчасти потому, что физики создавали машины, способные производить частицы с большим количеством больше энергии. Это означало, что ядра врезались с большим и большим большая сила, и можно было превратить энергию во всевозможные частицы.
Более того, физики разрабатывали новые и более совершенные средства обнаружения частицы. В 1952 году молодой американский физик Дональд Артур Глейзер получил диплом идея чего-то, что оказалось лучше камеры Вильсона. Это было, на самом деле, скорее наоборот, чем камера Вильсона.
Камера Вильсона содержит газ, который может стать частично жидким. Заряженные частицы, проносясь сквозь них, помогают жидкости формироваться и оставлять следы капель воды.
Но предположим, что все было наоборот.Предположим, есть камера, в которой жидкость, которая была на грани кипения и превращалась в газ. Заряженные частицы проходя через жидкость, образует ионы. Жидкость сразу вокруг ион будет кипеть с особой легкостью и образовывать маленькие пузырьки газа. Следы были бы пузырьками газа в жидкости, а не каплями жидкости в газе.
Этот новый вид детектирующего устройства получил название «пузырьковая камера».
Преимущество пузырьковой камеры в том, что в ней содержится много жидкости. плотнее воздуха в камере Вильсона.В нем больше атомов и молекул. жидкость, с которой сталкивается летящая частица. Образуется больше ионов и более четкий след остается позади. Частицы, которые едва ли можно увидеть в облаке камеры очень отчетливо видны в пузырьковой камере.
Используя пузырьковые камеры и обнаружив множество других видов следов, физики к 1960 году начали подозревать, что в существование очень кратко. Они никогда не были обнаружены, но если они там не существовали не было способа объяснить обнаруженные следы.
Эти новые частицы действительно были очень недолговечными. До сих пор самые нестабильные частицы, которые были обнаружены, длились миллиардную долю секунды или около того. Что им хватило времени, чтобы оставить видимые следы в пузырьковой камере.
Новые частицы, однако, распались примерно за стотысячную долю секунды. миллиардной миллиардной секунды. За это время частица имеет только шанс пройти ширину ядра, прежде чем разрушиться.
Эти новые частицы были названы «резонансными частицами» и разными разновидностей выведено в большом количестве с 1960 года.К настоящему времени их больше известно сто барионов, которые тяжелее протонов. Самые тяжелые закончились вдвое массивнее протонов.
Некоторые из новых частиц — мезоны, все они тяжелее пиона. Их около шестидесяти.
В 1960-х годах перед физиками встала проблема поиска некоторых способ учета большого количества массивных частиц, для которых они могли не думать ни о каком использовании и чье существование они не могли предсказать.
Сначала все, что могли сделать физики, — это изучить способ, которым одна частица распался на другой; или способ, которым одна частица была встроена в другой, когда была добавлена энергия.Некоторые изменения могут произойти, а некоторые изменения не мог. Частица A может превратиться в частицы B и C, но никогда не превратиться в частицы D и E.
Физики пытались разработать правила, объясняющие, почему некоторые изменения могут иметь место, а некоторые не смогли. Например, нейтрон не может превратиться в только протон, потому что протон имеет положительный электрический заряд и не может быть сделанным из ничего.
Однако нейтрон может превратиться в протон и электрон.В этом В этом случае одновременно образуется положительный и отрицательный заряд. Все вместе, их можно было бы рассматривать как уравновешивающие друг друга, так что это было бы так, как будто нет заряд у всех образовался.
Но затем, чтобы уравновесить некоторые другие качества, такие как вращение частицы, требовалось. В итоге выяснилось, что нейтрон должен был распасться на три частицы: протон, электрон и антинейтрино.
Для объяснения было достаточно таких вещей, как электрический заряд и спин частицы. события, которые были известны в былые времена, когда только дюжина или около того разных частицы были известны.Чтобы объяснить все события, происходившие среди почти 200 частиц, нужно было разработать больше правил. Такие количества, как «изотопный спин, «гиперзаряд», «четность» и т. д. должны были быть учтено.
Есть даже что-то под названием «странность». Каждая частица задано «число странностей», и если это сделано правильно, получается из того, что всякий раз, когда одна группа частиц превращается в другую, общая Число странностей не меняется.
Понятие странности прояснило, что на самом деле существует два вида ядерных сил.Тот, который был впервые предложен Юкавой, и в котором участвовал pions был чрезвычайно сильным. Однако в течение 1950-х годов он стал ясно, что ядерная сила была намного слабее, всего около сотни триллионных от сильного.
Изменения, произошедшие под действием сильной ядерной силы, приняли разместить очень быстро — достаточно долго, чтобы позволить резонансной частице сломаться вниз. Изменения, произошедшие под действием слабого ядерного взаимодействия потребовалось гораздо больше времени — по крайней мере, миллиардную долю секунды или около того.
Только барионы и мезоны могут принимать участие в сильных изменениях сил. Лептоны участвовали только в изменениях слабой силы. Барионы и мезоны поэтому иногда их объединяют как «адроны».
Даже когда физики постепенно выработали правила, показывающие, какая частица изменения могли произойти, а то, что не могло произойти, были очень неудовлетворены. Они не понимали, почему должно быть так , а также частиц.
Все больше и больше физиков задавались вопросом, действительно ли реальное количество частиц было неважно.Возможно, частицы существуют в семьях, и они должны концентрироваться на семействах частиц.
Например, первыми двумя открытыми барионами были протон и нейтрон. Они казались двумя совершенно разными частицами, потому что существовала важная непохожесть на них. Протон имел положительный электрический заряд, а нейтрон не имел никакого электрического заряда.
Это казалось огромной разницей. Из-за этого протон мог быть легко обнаруживается в камере Вильсона, а нейтрон — нет.Из-за этого протон при приближении к магниту следовала изогнутой траектории, а нейтрон — нет.
И все же, когда было обнаружено сильное ядерное взаимодействие, было обнаружено, что оно воздействовали на протоны и нейтроны точно так же, как будто не было никакой разницы между ними. Если рассматривать протон и нейтрон с точки зрения только сильная ядерная сила, они близнецы.
Может ли быть тогда, что мы должны рассматривать протон и нейтрон как два формы одиночной частицы, которую мы могли бы назвать «нуклон» (потому что он находится в ядре)? Конечно, это могло бы упростить дело.
Вы можете понять, что это означает, если рассмотреть людей. Конечно, муж и жена — это два разных человека, очень разных по важности. К однако люди, работающие с подоходным налогом, — это всего лишь одна комбинация налогоплательщиков, когда они подать совместную декларацию. Неважно, зарабатывает ли муж деньги, или жена, или оба составляют половину; в свою очередь, все это смешано в одну кучу. Для Для целей налогообложения у нас просто есть налогоплательщик в двух разных формах: муж и жена.
После 1960 года, когда начали появляться резонансные частицы, физики начали думать все более серьезно о семействах частиц.В 1961 году два физика, Мюррей Гелл-Манн в США и Юваль Нееман в Израиле, работая отдельно, придумал очень похожую схему для формирования семейств частиц.
Для этого нужно было взять все различные свойства частиц, которые физики разработали и систематизировали их очень регулярно. Было восемь разных виды свойств, с которыми работал Гелл-Манн, чтобы создать семейный образец. В шутку он назвал свою систему «Восьмеричным путем» после фразы в учении индийского религиозного лидера Будды.Более официальное название его схемы — это «SU (3) симметрия».
Самый известный пример SU (3) -симметрии — Гелл-Манн. приготовили семейство из десяти частиц. Эту семью из десяти человек можно представить следующим образом. Представьте себе треугольник, состоящий из четырех объектов внизу и трех объектов вверху. их, два объекта над ними и один объект сам по себе на вершине.
Четыре объекта внизу — это четыре связанных «дельта-частицы». каждый примерно на 30 процентов тяжелее протона.Главное различие между ними это электрический заряд. Четыре дельта-частицы имеют заряды -1, 0, +1, и +2.
Выше расположены три «сигма-частицы» более массивные, чем дельты. и с зарядами -1, 0 и +1. Выше расположены две «частицы xi», которые еще более массивны и имеют заряды -1 и 0. Наконец, при вершина треугольника — единственная частица, наиболее массивная из всех и который имеет заряд -1. Гелл-Манн назвал эту последнюю частицу «омегамином». частица, потому что «омега» — последняя буква греческого алфавита. и потому, что частица имеет отрицательный электрический заряд.
Обратите внимание, что существует регулярный путь увеличения массы и количества отдельные частицы идут вниз. Заметьте также, что существует регулярный шаблон для электрические заряды: -1, 0, +1, +2 для первого набора; затем -1, 0, + 1; тогда -1, 0; наконец -1.
Другие свойства также регулярно меняются с места на место в шаблон. Все действительно очень аккуратно. Была только одна проблема. Из из десяти частиц в этом семействе были известны только девять. Десятая частица, омегамин на вершине никогда не наблюдался.Если бы его не было, то весь узор был испорчен. Гелл-Манн предположил, что он действительно существует; что если люди искали и точно знали, что искали, они это найдут.
Если модель Гелл-Манна верна, нужно уметь вычислить все свойства омега-минуса, взяв те значения, которые вписываются в шаблон. Когда это было сделано, выяснилось, что у омега-минуса есть быть самой необычной частицей, потому что некоторые ее свойства еще не походили ни на что видимый.
Во-первых, если бы он поместился на своем месте в верхней части треугольника у него должно быть необычное число странности. Дельты внизу треугольника имели число странности 0, сигмы над ними — необычность. число -1, а x — одно из -2. Омега-минус частица при поэтому верхняя часть должна иметь число странности -3. Без странностей такое большое количество когда-либо встречалось, и физики едва ли могли сами поверили, что так и будет.
Тем не менее, его начали искать.
Инструмент для этой цели находился в Брукхейвене, где в начале 1960-х гг. Было введено в действие огромное новое устройство для ускорения частиц. Это могло бы ускорять частицы до точки, при которой они будут обладать энергией до 33
Bev. Это было более чем в пять раз больше энергии, чем было достаточно. произвести антипротоны несколькими годами ранее.
В ноябре 1963 года этот прибор был запущен в поисках омега-минуса. частица.Наряду с этим была новая пузырьковая камера, содержащая жидкий водород. Водород был жидким только при очень низких температурах, на сотни градусов ниже обычный ноль.
Преимущество использования жидкого водорода состояло в том, что ядра водорода были состоит из отдельных протонов (за исключением очень редкой дейтериевой формы элемента). Ничто другое не могло доставить столько протонов, сжатых в такое маленькое пространство, без любые нейтроны, которые могут запутать дело.
Пузырьковая камера с жидким водородом была почти семи футов в поперечнике и содержала более 900 литров жидкого водорода.Было бы очень мало того, что могло бы ускользнуть Это.
Физикам нужно было вычислить, какие столкновения частиц могут иметь место. достаточная энергия плюс все необходимые свойства для образования частицы омега-минус, если бы он вообще мог быть сформирован. Вы должны были бы столкнуться с укажите необходимое число странности, например, -3. Также было бы быть столкновением, которое не принесет никакого количества чего-то, что называется «изотопным спин », так как изотопный спин омега-минуса должен был бы быть равен 0, если бы он был чтобы соответствовать модели Гелл-Манна.
В конце концов было решено, что нужно разбить высокоэнергетический негатив. каоны в протоны. Если все пойдет правильно, должно произойти случайное столкновение. производят протон, положительный каон, нейтральный каон и омега-минус частицу.
Таким образом, в жидкий водород попал пучок отрицательных каонов 5 БэВ. пузырчатую камеру и к 30 января 1964 г. взятый. Ни в одном из них не было обнаружено ничего необычного.
Однако 31 января появилась фотография, на которой ряд следов были получены, что, казалось, указывает на то, что омега-минус частица была образовались и распались с образованием других частиц.Если точно известно и легко за распознанными частицами следили в обратном направлении, и было вычислено, какого типа частиц, из которых они, должно быть, пришли, а затем последовали за ними назад, мы достигли очень кратковременного существования омега-минус частицы.
Несколько недель спустя на другой фотографии было показано другое сочетание следов. который может быть преобразован в омега-минус частицу.
Другими словами, была обнаружена частица, которая распалась на две части. различные пути.Оба пути разрушения были возможны для омега-минус частицы. если бы он обладал точно такими же свойствами, как предсказал Гелл-Манн. С тех пор ряд других омега-минус частиц были обнаружены, все с точно предсказанным характеристики.
В этом не было сомнений. Омега-минус частица действительно существовала. Это никогда не был обнаружен, потому что он формировался так редко и просуществовал очень недолго. Теперь, когда физикам точно сказали, что искать и где искать. для этого, однако, они его нашли.
Физики теперь удовлетворены тем, что им приходится иметь дело с семействами частиц. Есть споры, как именно расположить эти семьи, конечно, но это, вероятно, будет исправлено.
Но можно ли еще упростить дело? Это часто случалось в истории науки о том, что когда все становится очень сложным, все может быть Сделано проще благодаря некоторым фундаментальным открытиям.
Например, существуют бесчисленные миллионы различных видов материалов. на Земле, но химики в конце концов обнаружили, что все они образовались из сотни или около того разных видов элементов, и что все элементы были составлены в основной, из трех видов частиц: протонов, нейтронов и электронов.
В двадцатом веке, когда физики все более пристально смотрели на эти субатомных частиц и обнаружил, что всего существует около двухсот из них, естественно, они начали думать о том, чтобы пойти еще глубже. Что лежит за пределами протонов а нейтроны?
Это случай копания вниз в маленькую, маленькую и маленькую. Сначала к атомам, затем к ядру, затем к протону. и нейтрон, а теперь еще к чему-то?
Гелл-Манн, разрабатывая свои семейные модели, обнаружил, что он может организовать их, позволяя каждой частице состоять из трех разных символов в разных комбинации.Он начал задаваться вопросом, были ли эти разные символы просто математическими. удобствами, или если они были реальными объектами.
Например, вы можете записать один доллар как 1 доллар, что равносильно написанию 100 °. Казалось бы, в долларе сто центов, и конечно есть. Но означает ли это, что если вы возьмете газету долларовую купюру и аккуратно разорвите ее на части, вы найдете сто центов в этом? Конечно нет!
Тогда вопрос был в том, если бы вы разорвали протон на части, нашли бы вы три объекты меньшего размера, которые представляли три символа, используемые Гелл-Манном.
Гелл-Манн решил дать частицам хотя бы имя. Он подумал отрывка из книги «Поминки по Финнегану» Джеймса Джойса. Это очень сложно книга, в которой слова намеренно скручены, чтобы дать им более одного имея в виду. Отрывок, который он придумал, был предложением, которое гласило: «Три кварка для марки Muster ».
Поскольку для каждой из различных барионы, в 1963 году Гелл-Манн решил назвать их «кварками».«
Если бы кварки соответствовали картине, у них было бы очень много удивительные свойства. Самым удивительным было то, что они должны были иметь дробную электрические заряды.
Когда электрон был впервые обнаружен, его электрический заряд был установлен на уровне -1. для простоты. С тех пор все новые обнаруженные частицы либо никакого электрического заряда или иметь такой же, как у электрона. или точным кратным этому заряду. То же самое и с положительными зарядами.
Другими словами, частицы могут иметь заряды 0, -1, +1, -2, +2 и так далее. То, что никогда не наблюдалось, было дробным зарядом. Ни одна частица не имеет когда-либо было обнаружено, что заряд +11/2 или -21/3.
И все же дробный заряд — это именно то, что должны были иметь кварки. Сборы -1/3 и + 2/3 должны быть среди них.
Сейчас ведутся огромные поиски кварков, потому что, если они будут найдены, они будут значительно упростить физику представление о структуре материи.
Есть одна важная трудность. Теория Гелл-Манна объясняет это довольно просто. что когда кварки объединяются, чтобы сформировать обычные субатомные частицы, процесс выделяет много энергии. Фактически, почти вся масса кварков выделяется в виде энергии, и только одна тридцатая остается для образования частицы. Это означает, что кварки в тридцать раз массивнее частиц, которые они производят.
(Звучит странно, но подумайте. Предположим, вы видите три воздушных шара взорвался почти до разрыва.Вы бы предположили, что их можно было сжать в небольшую коробку длиной всего дюйм в каждом направлении? Все, что вам нужно можно было бы выпустить воздух из воздушных шаров, а то, что осталось, легко может быть упакован в небольшую коробку. Точно так же, когда объединяются три кварка, вы «позволяете масса вышла, а то, что осталось, легко поместится в протон.)
Если вы хотите образовать кварк, разделив протон или другую частицу, тогда вы должны предоставить всю энергию, которую кварки отдали в первом место.Вы должны предоставить достаточно энергии, чтобы сформировать группу из тридцати частиц. раз массивнее протона. Вам понадобится как минимум в пятнадцать раз больше энергии, достаточной для образования протона и антипротона в 1950-х годах, и, вероятно, даже больше.
На Земле нет ни одного инструмента, даже Брукхейвенского колосса 33 Бэв, который может поставлять необходимую энергию. У физиков есть две вещи, которые они могут сделать. Первый, они могут обратиться к астрономам и попросить их следить за любыми признаками кварков в космосе.Есть частицы космических лучей с достаточной энергией, чтобы образовать кварки. Большинство частиц космических лучей — протоны, и если две из них столкнутся вместе достаточно сложно, они могут дробиться на кварки.
Однако это случалось очень редко, и до сих пор астрономы обнаружили ничего, что они могли бы идентифицировать как кварки. Вторая возможность — построить устройство, которое будет производить частицы с энергией, достаточной для образования кварков. В В январе 1967 года правительство США объявило о планах строительства таких инструмент в Уэстоне, штат Иллинойс.
Это будет огромное устройство, почти в милю в поперечнике. Пройдет шесть или семь лет на строительство и будет стоить 375 миллионов долларов. Как только он будет завершен, он будет стоимость эксплуатации 60 миллионов долларов в год.
Но когда это будет сделано, физики надеются, что это создаст потоки частиц. с энергиями до 200 Бэв. Этого может быть достаточно, чтобы произвести кварки или показать что их, вероятно, не существует.
Физики ожидают завершения работы над новым прибором со значительными затратами времени. волнение, и все остальные тоже должны быть взволнованы.Пока что каждое новое продвижение в изучении атома означал важные открытия на благо человечества.
Изучая атомы в первую очередь, химики научились составлять разнообразные красители и лекарства, удобрения и взрывчатые вещества, сплавы и пластмассы чего никогда не существовало в природе.
Закопавшись в атоме и изучив электрон, физики сделали возможным производство таких устройств, как радио и телевидение.
Изучение атомного ядра дало нам различные ядерные бомбы.Эти конечно, не очень приятные вещи, но то же самое знание дало и нам атомные электростанции. Это может сделать возможным производство настолько дешевых энергия, которую наша старая планета может достичь к новой эре комфорта и простота.
Сейчас физики пытаются найти кварки, лежащие за пределами субатомных частица. Мы не можем предсказать, к чему это приведет, но это кажется очевидным. результаты, которые могут изменить мир даже больше, чем пластик и телевидение, и атомная энергия.
Придется подождать и посмотреть. Один раз. новое устройство введено в действие в Уэстон, возможно, нам не придется долго ждать.
Из: Открытие двадцатого века Исаака Азимова
Фермилаб | Наука | Пытливые умы
Физика Вопросы, которые задают люди Фермилаб
Частицы и их свойства
Вопрос:
Я надеялся, что вы поможете мне узнать, как вычислить число
протонов, число нейтронов и число электронов
конкретный атом.Например, кислород 8 O 16, я не знаю, как вычислить
это из. Заранее благодарим за помощь.
— D
Ответ:
Уважаемый D:
Ключевые свойства атома (например, кислорода) описываются атомной Число (которое равно 8 для кислорода) и общее количество нуклонов (которое равно 16 для кислорода). Атомный номер дает количество протонов в атоме. В количество нуклонов дает общее количество протонов плюс нейтроны в атом.Число нуклонов всегда очень близко к атомному весу атом (что составляет 15,9994 для кислорода).
Вот простой способ запомнить это:
Поскольку атом электрически нейтрален, у него всегда одно и то же количество
электроны (отрицательный заряд) и протоны (положительный заряд). Нейтроны
конечно, нейтральны.
Теперь вы можете выяснить, сколько электронов, протонов и нейтронов в кислороде: Атомный номер (всегда меньший из двух) — 8.Следовательно, 8 протоны. Поскольку атом нейтрален, также имеется 8 электронов. Число нуклонов (которое является большим из двух чисел, потому что оно учитывает все нуклоны, а не только протоны): 16. Это общее количество протонов и нейтроны. Вычтите количество протонов (8), и вы получите количество нейтронов, что тоже 8.
Другой пример: железо, которое составляет 26 Fe 56. В нем 26 протонов, 26 электронов, и 56-26 = 30 нейтронов.
Чтобы найти атомные и групповые номера многих других элементов, вы можете посмотреть следующий веб-сайт: http: // www.webelements.com/
С наилучшими пожеланиями,
Курт
Вернуться на главную страницу вопросов о физике
ионов — Эффективный ядерный заряд атома кислорода (O) по сравнению с анионом кислорода (O2-)
Размер аниона больше по сравнению с его родительским атомом, потому что эффективный ядерный заряд первого меньше, чем второй.
Это не лучшее объяснение.Размер аниона больше, потому что, как написал Путник в комментарии, эффективный заряд ядра почти такой же (если учесть только заряд ядра и внутренние электроны), и между валентными электронами больше отталкивания.
Размер атомов фтора меньше, чем размер атомов натрия, потому что эффективный заряд ядра у фтора больше, чем у натрия.
Это типичное объяснение самого большого скачка размеров атомов. Имеет смысл, что когда вы добавляете электроны к данному ядру, частица становится больше.Логично, что при спуске группы атомы становятся больше. Что требует объяснения, так это уменьшение размеров за один период.
Таким образом, сравнивая F и Na (или любой другой элемент группы 17 и следующий элемент группы 1), мы переходим от высокоэффективного заряда ядра (ядро и внутренние электроны вместе имеют заряд +7) к низкому эффективному заряду ядра (ядро и вместе взятые внутренние электроны имеют заряд +1). Вдобавок к этому внешние электроны также находятся в следующей более высокой оболочке в Na (3-й период) по сравнению с F (2-й период).2 +} $, количество электронов останется прежним, но заряд ядра (и эффективный заряд) изменится, поэтому вы должны сосредоточиться на этом. Сравнение атомов в группе, например $ \ ce {Li, Na, K, Rb} $, эффективный заряд ядра аналогичен (соответствует аналогичному химическому составу валентных электронов), и вы должны сосредоточиться на валентных электронах, занимающих все более высокие оболочки.
Сравнение нейтральных атомов в порядке их атомного номера, например $ \ ce {O, F, Ne, Na, Mg} $, все меняется.В течение определенного периода доминирует возрастающий эффективный заряд ядра (делая атомы все меньше и меньше). При переходе от одного периода к следующему резкое уменьшение эффективных ядер является наиболее выраженным эффектом (помимо использования следующей оболочки), что приводит к большему радиусу.
| |
Фактов о кислороде | Живая наука
Вдохните… выдохните.Ах. Ура кислороду, элементу, который поддерживает большую часть жизни на Земле.
Элемент № 8 Периодической таблицы элементов — это бесцветный газ, составляющий 21 процент атмосферы Земли. Поскольку кислород есть повсюду, легко списать его со счетов как тупой и инертный; Фактически, это самый реактивный из неметаллических элементов.
Земля была насыщена кислородом в течение от 2,3 до 2,4 миллиардов лет, и, согласно исследованию, финансируемому НАСА в 2007 году, уровень начал расти, по крайней мере, 2,5 миллиарда лет назад.Никто не знает, почему этот благоприятный для легких газ внезапно стал важной частью атмосферы, но возможно, что геологические изменения на Земле привели к тому, что кислород, производимый фотосинтезирующими организмами, обитающими вокруг, а не потреблялся в геологических реакциях, согласно исследователям исследования. .
Just the Facts
- Атомный номер (количество протонов в ядре): 8
- Атомный символ (в Периодической таблице элементов): O
- Атомный вес (средняя масса атома): 15.9994
- Плотность: 0,001429 грамма на кубический сантиметр
- Фаза при комнатной температуре: газ
- Точка плавления: минус 361,82 градуса по Фаренгейту (минус 218,79 градуса по Цельсию)
- Точка кипения: минус 297,31 градуса по Фаренгейту (минус)
- градусов по Цельсию Количество изотопов (атомов одного элемента с разным количеством нейтронов): 11; три стабильных
- Наиболее распространенные изотопы: О-16 (естественное содержание 99,757%)
Дыхание жизни
По данным Национального ускорительного центра Томаса Джефферсона, кислород является третьим по распространенности элементом во Вселенной.Однако его реакционная способность делала его относительно редким в атмосфере ранней Земли.
Цианобактерии — организмы, которые «дышат» с помощью фотосинтеза, поглощают углекислый газ и выдыхают кислород, как современные растения. Цианобактерии, вероятно, были ответственны за первый кислород на Земле, событие, широко известное как Великое событие окисления.
Фотосинтез цианобактериями, вероятно, продолжался до того, как в атмосфере Земли накопился значительный уровень кислорода; исследование, опубликованное в марте 2014 года в журнале Nature Geoscience, показало, что 2.Камни возрастом 95 миллиардов лет, обнаруженные в Южной Африке, содержали оксиды, для образования которых требовался свободный кислород. Эти породы изначально находились в мелководных морях, что позволяет предположить, что кислород в результате фотосинтеза впервые начал накапливаться в морской среде примерно за полмиллиарда лет до того, как он начал накапливаться в атмосфере примерно 2,5 миллиарда лет назад.
Сегодняшняя жизнь сильно зависит от кислорода, но первоначальное накопление этого элемента в атмосфере было не чем иным, как катастрофой. Новая атмосфера вызвала массовое вымирание анаэробов, организмов, которым не нужен кислород.Анаэробы, которые не смогли адаптироваться или выжить в присутствии кислорода, вымерли в этом новом мире. [Инфографика: Атмосфера Земли сверху вниз]
Быстрая перемотка вперед — путь вперед. Первые предположения о существовании кислорода как элемента у людей появились в 1608 году, когда голландский изобретатель Корнелиус Дреббель сообщил, что нагревание селитры (нитрата калия) высвобождает газ, согласно Королевскому химическому обществу (RSC). Подлинность этого газа оставалась загадкой до 1770-х годов, когда три химика пришли к его открытию более или менее одновременно.Английский химик и священнослужитель Джозеф Пристли изолировал кислород, освещая оксид ртути солнечным светом и собирая газ, образующийся в результате реакции. Он отметил, что в этом газе свеча горела ярче, по данным RSC, благодаря роли кислорода в горении.
Пристли опубликовал свои открытия в 1774 году, опередив швейцарского ученого Карла Вильгельма Стила, который фактически выделил кислород в 1771 году и написал о нем, но не опубликовал работу. Третьим первооткрывателем кислорода был Антуан-Лоран де Лавуазье, французский химик, давший этому элементу название.Слово происходит от греческого «окси» и «гены», что означает «кислотообразующий».
Кислород состоит из восьми электронов: два вращаются вокруг ядра во внутренней оболочке атома и шесть — во внешней оболочке. Самая внешняя оболочка может содержать в общей сложности восемь электронов, что объясняет тенденцию кислорода реагировать с другими элементами: его внешняя оболочка неполная, и электроны, таким образом, могут принимать (и отдавать).
Кто знал?
- Как газ, кислород прозрачен. Но как жидкость он бледно-голубой.
- Если вы когда-нибудь задумывались, на что похоже плавание в бассейне с жидким кислородом, ответ: очень, очень холодно, по словам Карла Цорна из Национального ускорительного центра Томаса Джефферсона. Кислород должен опуститься до минус 297,3 F (минус 183,0 C), чтобы стать жидким, поэтому обморожение может стать проблемой.
- Слишком мало кислорода проблематично. Так что это уже перебор. По данным Университета Флориды и компании Air Products, вдыхание 80-процентного кислорода в течение более 12 часов раздражает дыхательные пути и в конечном итоге может вызвать смертельное скопление жидкости или отек.
- Кислород — одно крепкое печенье: исследование 2012 года, опубликованное в журнале Physical Review Letters, показало, что молекула кислорода (O2) может выдерживать давление, в 19 миллионов раз превышающее атмосферное.
- Самый низкий уровень кислорода, когда-либо зарегистрированный в крови человека, был измерен около вершины Эвереста в 2009 году. Уровень артериального кислорода у альпинистов в среднем составлял 3,28 кПа. Сравните это с нормальным значением от 12 до 14 килопаскалей, и термин «зона смерти» для альпинистов имеет много смысла.Результаты были опубликованы в Медицинском журнале Новой Англии.
- Слава богу, в атмосфере 21 процент кислорода. Около 300 миллионов лет назад, когда уровень кислорода достиг 35 процентов, насекомые смогли вырасти до сверхкрупных размеров: представьте себе стрекоз с размахом крыльев ястребов.
Текущие исследования
Кислород образуется в сердцах звезд в результате слияния ядра углерода-12 и ядра гелия-4 (также известного как альфа-частица). Однако только недавно ученым удалось заглянуть в ядро кислорода и разгадать его структуру.
В марте 2014 года физик из Университета штата Северная Каролина Дин Ли и его коллеги сообщили, что они выяснили ядерную структуру кислорода-16, наиболее распространенного изотопа кислорода, в его основном состоянии (состоянии, в котором находятся все электроны. на минимально возможных уровнях энергии) и в его первом возбужденном состоянии (следующий энергетический уровень вверх).
Почему это должно иметь значение? Что ж, понять, как в звездах образуются ядра — от углерода до кислорода и более тяжелых элементов — значит понять, как соединяются вместе сами строительные блоки Вселенной.Ли и его команда первоначально обнаружили, что ядро молекулы углерода-12 с его шестью протонами и шестью нейтронами на самом деле состоит из трех кластеров частиц, каждый с двумя протонами и двумя нейтронами. Исследователи пришли к выводу, что если углерод-12 имеет три из этих так называемых альфа-кластеров, то кислород-16, вероятно, будет иметь четыре, учитывая, что он содержит восемь протонов и восемь нейтронов.
Используя моделирование на суперкомпьютере и числовую решетку, исследователи смогли увидеть, как частицы в ядре кислорода-16 будут располагаться.Они обнаружили, что в основном состоянии кислорода-16 действительно есть четыре альфа-кластера, аккуратно расположенных в виде тетраэдра.
«Эти альфа-кластеры похожи на маленькие нечеткие сферы этих четырех частиц или этих нуклонов, и эти нечеткие сферы любят соприкасаться друг с другом посредством некоторого поверхностного взаимодействия», — сказал Ли Live Science. Конфигурация тетраэдра позволяет им получиться красивыми и уютными.
Но была еще одна квантовая тайна, которую нужно было разгадать. Основное состояние кислорода-16 и первое возбужденное состояние имеют необычную особенность.У них обоих одинаковый спин — величина, показывающая, как вращаются частицы. У них также есть положительная четность, способ обозначить симметрию. Представьте, что во всей вселенной меняются местами налево и направо, но при этом субатомные частицы должны оставаться в одной и той же форме. Частицы с положительной четностью смогут смотреть в эту зеркальную вселенную и видеть себя такими, какие они есть. Частицы с отрицательной четностью должны будут перевернуться, чтобы они не оказались в обратном направлении, как строка текста, читаемая в зеркале.
«Тайна заключалась в том, почему два нижних состояния кислорода-16 имеют нулевой спин и положительную четность», — сказал Ли, учитывая, что состояния разные.
Моделирование дало ответ: в возбужденном состоянии кислород-16 перестраивает свое ядро так, чтобы он вообще мало походил на основное состояние. Вместо тетраэдрического расположения альфа-частицы располагаются в квадратной или почти квадратной плоскости.
«Их внутренние внутренние структуры были разными, — сказал Ли. Совершенно другая конфигурация объясняет, как спин и четность могут оставаться такими же — ядра идут разными путями к одному и тому же результату.
Есть еще больше квантовых взаимодействий в ядре кислорода-16, которые необходимо распутать, сказал Ли, и предстоит обнаружить более мелкие детали.
«На самом деле, в таких маленьких штуках, как ядра, творится довольно много интересных вещей, — сказал он. «И есть истории, которые рассказывают о том, как они создаются, и теперь мы начинаем иметь возможность обратиться к ним».
Ли работает над рождением кислорода в звездах; Другое направление исследований кислорода сосредоточено на роли элемента в жизни на Земле. Вскоре после Великого окислительного события около 2,4 миллиарда лет назад уровни кислорода, возможно, достигли или превысили сегодняшние уровни, прежде чем рухнуть, сказал Дэниел Миллс, докторант Северного центра эволюции Земли при Университете Южной Дании.Животный мир появился гораздо позже, простейшие животные появились около 600 миллионов лет назад.
Несмотря на теории о том, что повышение содержания кислорода открыло путь к существованию животных, история кажется гораздо более сложной. Животные не появились во время первого значительного скачка уровня кислорода на Земле 2,4 миллиарда лет назад. А в феврале 2014 года Миллс и его коллеги сообщили в журнале PNAS, что современные губки все еще могут дышать, есть и даже повышать уровень кислорода до 0.От 5 до 4 процентов того, что находится сегодня в атмосфере Земли. Миллс сказал Live Science, что губки — это, вероятно, самое похожее живое животное на первых животных на Земле.
Открытие того, что губкам не нужен высокий уровень кислорода для жизни, предполагает, что что-то еще способствовало возникновению первой животной жизни — хотя повышение уровня кислорода вполне могло быть необходимо для достижения того разнообразия и экосистем, которое мы наблюдаем сегодня, сказал Миллс. . Он добавил, что даже в современную эпоху такие животные, как нематоды-черви, процветают в районах океана с низким содержанием кислорода.
«Очевидно, эволюция животных — это нечто большее, чем достаточный запас кислорода», — сказал Миллс.
Дополнительные ресурсы
Следите за Live Science @livescience , Facebook и Google+ .
Конфигурация молекулы воды
Конфигурация молекулы воды
Молекула воды состоит из двух атомов водорода и одного атома кислорода.Одно-единственное электронное кольцо вокруг ядра каждого атома водорода имеет только один электрон. Отрицательный заряд электрона уравновешивается положительным зарядом одного протона в ядре водорода. Электронное кольцо водорода на самом деле предпочло бы иметь два электрона для создания стабильной конфигурации. Кислород, с другой стороны, имеет два электронных кольца с внутренним кольцом, имеющим 2 электрона, что холодно, потому что это стабильная конфигурация. Внешнее кольцо, с другой стороны, имеет 6 электронов, но хотелось бы иметь еще 2, потому что во втором электронном кольце 8 электронов являются стабильной конфигурацией.Чтобы уравновесить отрицательный заряд 8 (2 + 6) электронов, ядро кислорода имеет 8 протонов. Водород и кислород хотели бы иметь стабильные электронные конфигурации, но не как отдельные атомы. Они могут выйти из этого затруднительного положения, если согласятся делиться электронами (своего рода энергетический «договор»). Итак, кислород разделяет один из своих внешних электронов с каждым из двух атомов водорода, и каждый из двух атомов водорода разделяет один и единственный электрон с кислородом. Это называется ковалентной связью. Каждый атом водорода думает, что у него два электрона, а атом кислорода думает, что у него 8 внешних электронов.Все счастливы, не так ли?
Рисунок 1. Молекула воды
Источник: Морин Фейнман
Однако оба атома водорода находятся на одной стороне от атома кислорода, так что положительно заряженные ядра атомов водорода остаются открытыми, так сказать, оставляя этот конец молекулы воды со слабым положительным зарядом. Между тем, на другой стороне молекулы избыточные электроны атома кислорода придают этому концу молекулы слабое отрицательное изменение.По этой причине молекулу воды называют «диполярной» молекулой. Вода является примером полярного растворителя (одного из лучших), способного растворять большинство других соединений из-за неравномерного распределения заряда молекулы воды. В растворе слабая положительно заряженная сторона одной молекулы воды будет притягиваться к слабой отрицательно заряженной стороне другой молекулы воды, и две молекулы будут удерживаться вместе так называемой слабой водородной связью. В диапазоне температур морской воды слабые водородные связи постоянно разрушаются и реформируются.Это придает воде некоторую структуру, но позволяет молекулам легко скользить друг по другу, превращая ее в жидкость.
атомов и элементов
Атомная структура
Атомы — это основные строительные блоки всего, что нас окружает. Они бывают разных видов, называемых элементами, но каждый атом имеет определенные общие характеристики. Все атомы имеют плотное центральное ядро, называемое атомным ядром. Ядро образуют частицы двух видов: протоны с положительным электрическим зарядом и нейтроны без заряда.У всех атомов есть по крайней мере один протон в их ядре, и количество протонов определяет, к какому элементу типа относится атом. Например, у атома кислорода 8 протонов. Если бы вы каким-то образом смогли изменить протонное число этого атома на 7, , даже если бы все остальное осталось прежним, , это больше не был бы атом кислорода, это был бы азот. По этой причине мы перечисляем различные элементы по их протонным или атомным номерам. Периодическая таблица элементов — это таблица всех элементов, которые были обнаружены до сих пор, в порядке их атомного номера.
Помимо протонов и нейтронов, все атомы имеют электроны, отрицательно заряженные частицы, которые перемещаются в пространстве, окружающем положительно заряженное ядро ядра. Электроны обычно изображаются на рисунках намного меньшими, чем протоны или нейтроны, потому что их масса намного меньше. На самом деле масса электрона настолько мала, что не учитывается в массе атома. Однако сила заряда отдельного электрона равна силе заряда одиночного протона, и, несмотря на свою небольшую массу, электроны важны для уравновешивания заряда атома.Если специально не указано иное, атомы всегда имеют то же количество электронов, что и протоны; следовательно, вы можете узнать номер электрона, посмотрев на атомный номер. Но в отличие от протонов, количество электронов может измениться и действительно может измениться , не влияя на тип элемента, которым является атом!
Теперь мы знаем, как найти число протонов и число электронов для данного атома, но как насчет нейтронов? Сколько нейтронов у атомов данного элемента? Это НЕ всегда то же самое, что количество протонов и электронов.Например, у водорода есть один протон и один электрон, но у него вообще нет нейтронов! Мы определяем это, глядя на атомную массу. Несмотря на то, что атом настолько мал, что вам потребуется почти миллион, чтобы увидеть даже крошечную точку на экране вашего компьютера, каждый крошечный атом определенно имеет массу и занимает пространство. Эта масса исходит от ядра. Каждый протон и нейтрон имеют примерно одинаковую массу, измеряемую в дальтонах или атомных единицах массы (амус). Поскольку единица измерения определяется одним протоном, 1 протон = 1 нейтрон = 1 дальтон = 1 а.е.м.У электронов есть масса, но она почти в 2000 раз меньше массы протона. Ни в одном из известных нам атомов не хватает электронов, чтобы повлиять на общую массу; следовательно, полная масса равна сумме протонов и нейтронов в атоме.
Поскольку мы можем найти количество протонов и атомную массу атома, глядя на информацию о его элементе в периодической таблице, мы можем вычислить количество нейтронов в этом атоме, вычитая количество протонов из атомной массы.
Когда количество нейтронов у отдельных атомов одного и того же элемента различно, каждый атом называется изотопом. Когда вы читаете периодическую таблицу, указанная атомная масса представляет собой среднюю атомную массу для всех изотопов этого элемента, встречающихся в природе. Например, атомная масса углерода в периодической таблице составляет 12,01. Углерод не может содержать 6,01 нейтрона, потому что у вас не может быть части нейтрона. Значение превышает 6, потому что, хотя большинство атомов углерода имеют 6 нейтронов, некоторые атомы углерода находятся с 7 нейтронами, а другие — с 8 нейтронами.Для наших целей мы округляем атомную массу до ближайшего целого числа, чтобы вычислить количество нейтронов.
Атомная структура
Это видео показывает, как атомы и их компоненты работают вместе.
Валентные электроны
Теперь, когда у вас была возможность поработать с атомами в целом, давайте копнем немного глубже. Электроны остаются в атоме из-за их притяжения к положительному заряду протонов, но они не так тесно связаны с атомом, как протоны или нейтроны.Электроны — сложные частицы, потому что им нужно много места в атоме, и, тем не менее, они также привязаны к определенной области внутри этого атома. Хотя рисунки, с которыми мы работали, показывают ядро как видимый объект среднего размера в центре атома, на самом деле оно очень крошечное, и большая часть атома — это пространство вокруг ядра, в котором движутся электроны.
Из-за общего отрицательного заряда электроны отталкиваются друг от друга, если подходят слишком близко. В то же время электроны притягиваются к положительному заряду ядра.Детали энергии и положения электронов могут быть очень сложными, но мы сосредоточимся только на том, что нам нужно понять, чтобы изучать молекулы жизни.
Электроны расположены в энергетических оболочках (также известных как электронные оболочки) вокруг ядра атома. Хотя у электронов много места, все они хотят быть как можно ближе к притягивающему их положительному заряду ядра. В то же время электроны отталкиваются друг от друга из-за своего отрицательного заряда, и лишь немногие из них могут приблизиться к ядру в любой момент времени.Фактически, только два электрона могут поместиться в трехмерном пространстве, ближайшем к ядру. Это пространство называется первой энергетической оболочкой. Если в атоме три электрона, первые два будут находиться в первой энергетической оболочке. Третий электрон должен будет обосноваться на второй энергетической оболочке, трехмерном пространстве немного дальше от ядра, где он будет один. В этом примере одинокий электрон называется валентным электроном, а внешняя энергетическая оболочка, содержащая любые электроны, называется валентной оболочкой.
Вторая энергетическая оболочка достаточно велика, чтобы удерживать до восьми электронов, сгруппированных парами внутри четырех электронных орбиталей или пространств, где электроны проводят большую часть своего времени. Это означает, что если во второй энергетической оболочке есть только один электрон, остается много дополнительного места.
Когда энергетическая оболочка заполнена не полностью, электрон (ы) в этой оболочке не так стабилен и с большей вероятностью вступит в реакцию. По этой причине атомы имеют тенденцию реагировать с другими атомами способами, которые заполняют или опустошают их валентную оболочку, чтобы получить стабильность полной внешней энергетической оболочки.Атомы могут делать это, приобретая или теряя электроны, превращаясь в ионы, или разделяя электроны с другими атомами для образования стабильных ассоциаций.
Используя число электронов и энергетические оболочки, мы можем определить количество валентных электронов для любого данного атома и его ожидаемый уровень реактивности. Работая с приведенным ниже примером, вы должны помнить, что, хотя мы рисуем энергетические оболочки в виде кругов вокруг атомного ядра, это не означает, что это реальный путь электрона. Стиль концентрического круга рисования энергетических оболочек предназначен для обозначения среднего расстояния, на котором электроны в этой энергетической оболочке вращаются вокруг ядра.На самом деле электроны не движутся по круговой орбите, как показано на рисунке, а перемещаются по гораздо более сложным путям вокруг атомного ядра.
Постройте атом
Используйте это упражнение, чтобы попрактиковаться в чтении таблицы Менделеева для создания нескольких атомов.
Что такое валентность?
В этом упражнении вы рассчитаете количество валентных электронов в атомах, используя периодическую таблицу элементов.
