Разбор слова по составу ЗАТЯНУЛ .
Составь верное утверждение.Произношение слов с сочетаниями чт, чH,Щн, ГК, rч нужнотак как пишется словозапомнить
стр 68-70 — умная страничка4класс срочноооооо
Семь чудес Казахсатан. БЫСТРЕЕЕ АТО Я НА УРОКЕ
Фразеологическая загадка. Его любимый праздник — масленица. Его тянут за хвост, если делают что-то очень медленно, а иногда под хвост ему бросают слов … а и деньги, которые не ценят. Иногда он сидит в мешке, а когда чего-то мало, говорят, что это он наплакал.
Фразеологическая загадка. Умные люди советуют тратить его на дело. Оно само работает на нас и показывает, каким предстанет перед нами будущее. Иногда … оно не ждет, а иногда терпит. Его можно хорошо провести, а можно выиграть. Некоторые измеряют его в денежном эквиваленте, а другие утверждают, что оно дороже золота.
Фразеологическая загадка. М.Ю. Лермонтов точно подметил, что у наших они «на макушке»; а вообще-то они есть даже у стен.
Ответьте на вопросы из 4 класса,пожалуйста ( В.Т. Голубь )
2.Выберите правильный вариант ответа, в котором знаки препинания на месте пропусков расставлены верно: Для счастливого человека всё чудеса (1) и прохл … адное утро(2) и горящий костёр (3) и чай с лимоном.
Фразеологическая загадка. Не белье, а можно вешать. Не орех, а может раскалываться. Не игрушка, а можно ломать. Она бывает горячей, дырявой, садовой. … Лучше, если их две. Если вас что-то беспокоит, она болит. А если человек кого-то подвел, ее могут намылить или даже снять.
Текст Б ЛУНА И СОЛНЦЕ Луна обратилась к светилу: — Здравствуй! Как твое имя? — Мое имя — Солнце! Я освещаю планеты, чтобы на них было хоть немного све
… та! Я отдаю им свое тепло.
Бессоюзное сложное предложение (БСП)
Бессоюзное сложное предложение (БСП) – это сложное предложение, в котором простые предложения объединены в одно целое по смыслу и интонационно, без помощи союзов или союзных слов.
Пример. Подул сильный и резкий ветер, небо затянуло тучами.
Классификация БСП по значению:
Вид БСП |
Пояснение |
Пример |
БСП со значением последовательности |
Выражает последовательность действий. |
Подул сильный и резкий ветер, небо затянуло тучами. |
БСП со значением пояснения |
В такие предложения может быть мысленно подставлен союз а именно. Второе предложение поясняет первое. |
Со мною происходит что-то непонятное: я тревожусь без причины. |
БСП со значением дополнения |
Второе предложение дополняет первое, оно содержит дополнительную информацию. |
Я вошёл в дом: там было чисто и прохладно. |
БСП со значением причины |
Второе предложение называет причину первого. От первого предложения можно поставить вопрос почему? |
Я обиделась на него: он был виноват передо мной. |
БСП со значением условия |
Первое предложение содержит условие, может быть подставлен союз если. |
Захочу – всё будет по-моему. |
БСП со значением следствия |
Второе предложение содержит следствие событий, о которых говорится в первой части. |
Прошёл ледяной дождь – столько деревьев поломало. |
БСП со значением времени |
В первое предложение может быть подставлен союз когда. |
Дождь перестал – дети побежали на улицу. |
БСП со значением сопоставления |
Во второе предложение может быть подставлен союз а. |
Делу время – потехе час. |
Знаки препинания в БСП:
Образец синтаксического разбора БСП:
[ ] – [ ].
Повествовательное, невосклицательное, БСП, состоящее из двух предикативных частей; соотносится со сложноподчиненным предложением, БСП неоднородного состава, со следственными отношениями между частями;
1-я часть – двусоставная, распространенная, полная, неосложненная,
2-я часть – двусоставная, распространенная, полная, неосложненная.
Комментарии:
Добавить комментарий
Контрольные работы по русскому языку 4 класс
Контрольный диктант по теме «Повторение»
Доброе дело.
На пригорке росла одинокая берёза. Осенний ветер больно её хлестал. Пришли на пригорок ребята. Они выкопали ямы, посадили яблони. А чтобы защитить яблоньки от ветра, посадили рябину, берёзу, ёлку. Часто школьники приходили в молодой сад. То побелят стволы известью, то зажгут дымные костры. Выросли большие деревья. Зацвели молоденькие яблони. Люди любовались садом. Осенью из сада шёл аромат яблок.
СЛОВА ДЛЯ СПРАВОК: росла, аромат.
Грамматические задания:
Контрольное списывание по теме «Части речи»
Белка и лиса. Над норой лисы жила белка. Белка прыгала по веткам и дразнила старую лису. Однажды утром лиса легла на полянку перед сосной, будто мертвая. Любопытная белочка бросила в лису шишку. Лиса не поднялась. За шишкой полетела ветка. Лиса не двигалась. Тогда белка совсем близко пробежала около лисы. Лиса быстро вскочила. Но охота не удалась. Белочка чуть не очутилась в зубах хитрой лисицы.
Любопытная белочка бросила в лису шишку. Лиса не поднялась. За шишкой полетела ветка. Лиса не двигалась. Тогда белка совсем близко пробежала около лисы. Лиса быстро вскочила. Но охота не удалась. Белочка чуть не очутилась в зубах хитрой лисицы.
Грамматические задания:
Четвёртое предложение разобрать по членам предложения, обозначить части речи
Выписать из текста три словосочетания, определить главное слово
Контрольный диктант по теме «Имя существительное»
Зимой
В деревне мороз запушил деревья снежком. Огромный пруд зима затянула гладким льдом. Ребята размели каток. Коньки у всех готовы. Ловко и легко скользят ребятишки по льду. На Коле и Вите спортивные костюмы. У бегунов блестят от счастья глазки. Старшие ребята разъехались в разные стороны. Малыши катаются цепью. По льду бегает за ребятами Шарик и всем мешает. Весело и радостно звучат детские голоса.
Грамматические задания:
Последнее предложение разберите по членам.
Первое и второе предложения по вариантам разберите по частям речи.
Выпишите три имени существительных в единственном числе, укажите склонение, падеж, род. Запишите их во множественном числе родительного, дательного и предложного падежей.
По вариантам выполнить морфологический разбор слов: на Коле, по льду.
Контрольный диктант по теме «Имя прилагательное»
Лесной голосок
В солнечный день я бродил в берёзовом перелеске. Вдали послышался знакомый лесной голосок. Это куковала кукушка. Я её слышал много раз. Но никогда не видел, какая она из себя.
Гляжу – через поляну летит птица.
 Хвост у неё длинный, сама серая, грудка в тёмных пестринках. Может, это ястребёнок? А птица подлетела к соседнему дереву, села на сучок и закуковала. Вот она какая – кукушка!
Хвост у неё длинный, сама серая, грудка в тёмных пестринках. Может, это ястребёнок? А птица подлетела к соседнему дереву, села на сучок и закуковала. Вот она какая – кукушка!Грамматические задания:
Первое предложение разобрать по членам предложения.
Выписать четыре словосочетания (прил+сущ) только в именительном падеже.
По вариантам выполнить морфологический разбор слов: в темных, к соседнему
Контрольный диктант по теме «Глагол»
Совесть
Нина не приготовила уроки, решила не идти в школу, а украдкой пошла в рощу. Она положила завтрак и книги под куст, а сама побежала за красивой бабочкой.
На тропинке Нине встретился малыш. В руке он держал букварь с тетрадкой. Девочка решила подшутить над ним и назвала малыша прогульщиком.
Оказалось, что мальчик убегал от собаки и заблудился. Нина провела его через рощу. Забрать завтрак и книги она постыдилась и оставила их под кустом.
Прибежала собака. Книги не тронула, а завтрак съела. Нина заплакала. Она не жалела завтрак, её грызла беспощадная совесть.
По А. Гайдару
Грамматические задания:
1. Выписать из текста три глагола, указать их время, лицо, число и род
2. Поставить глаголы в неопределенную форму: пришла, идёт, посмотрит
Итоговый контрольный диктант.
Клюква.
Кислая и очень полезная для здоровья ягода клюква растёт летом, а собирают её поздно осенью. Самая сладкая клюква бывает весной, когда пролежит всю зиму в снегу.
В начале апреля отправились дети на болото. Сначала дорога была широкая. Потом она превратилась в узкую тропку. Вдоль тропы стояли сухие травы. Можно долго ходить по болоту и не понять, что под ногами клюква. Ягоды прячутся в болотных кочках и не видны. Наклонился взять одну ягодку, а вытянул длинную зелёную ниточку с многими клюквинками.
Грамматическое задание.
Выписать по одному слову с орфограммами в корне: парным согласным, безударным гласным, непроизносимым согласным. Подобрать проверочные слова, обозначить орфограммы.
Подобрать проверочные слова, обозначить орфограммы.
Обозначь грамматическую основу в третьем предложении.
Разобрать по составу: 1 вариант – болотных, собирают, клюквинками, 2 вариант – ниточку, пролежит, сладкая.
Морфологический разбор слова «затянуть»
Часть речи: Инфинитив
ЗАТЯНУТЬ — слово может быть как одушевленное так и неодушевленное, смотрите по предложению в котором оно используется.
Начальная форма слова: «ЗАТЯНУТЬ»
| Слово | Морфологические признаки |
|---|---|
| ЗАТЯНУТЬ |
|
Все формы слова ЗАТЯНУТЬ
ЗАТЯНУТЬ, ЗАТЯНУЛ, ЗАТЯНУЛА, ЗАТЯНУЛО, ЗАТЯНУЛИ, ЗАТЯНУ, ЗАТЯНЕМ, ЗАТЯНЕШЬ, ЗАТЯНЕТЕ, ЗАТЯНЕТ, ЗАТЯНУТ, ЗАТЯНУВ, ЗАТЯНУВШИ, ЗАТЯНЕМТЕ, ЗАТЯНИ, ЗАТЯНИТЕ, ЗАТЯНУВШИЙ, ЗАТЯНУВШЕГО, ЗАТЯНУВШЕМУ, ЗАТЯНУВШИМ, ЗАТЯНУВШЕМ, ЗАТЯНУВШАЯ, ЗАТЯНУВШЕЙ, ЗАТЯНУВШУЮ, ЗАТЯНУВШЕЮ, ЗАТЯНУВШЕЕ, ЗАТЯНУВШИЕ, ЗАТЯНУВШИХ, ЗАТЯНУВШИМИ, ЗАТЯНУТЫЙ, ЗАТЯНУТОГО, ЗАТЯНУТОМУ, ЗАТЯНУТЫМ, ЗАТЯНУТОМ, ЗАТЯНУТАЯ, ЗАТЯНУТОЙ, ЗАТЯНУТУЮ, ЗАТЯНУТОЮ, ЗАТЯНУТА, ЗАТЯНУТОЕ, ЗАТЯНУТО, ЗАТЯНУТЫЕ, ЗАТЯНУТЫХ, ЗАТЯНУТЫМИ, ЗАТЯНУТЫ
Разбор слова в тексте или предложении
Если вы хотите разобрать слово «ЗАТЯНУТЬ» в конкретном предложении или тексте, то лучше использовать
морфологический разбор текста.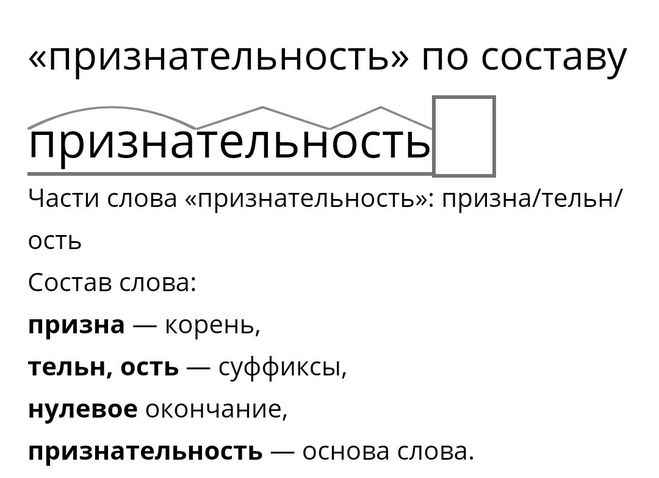
Примеры предложений со словом «затянуть»
1
Нужно только затянуть в себя резины, поглубже, с воздухом затянуть, и быстро закрутить охвостья.
Парус (сборник), Владимир Шапко, 2015г.2
Чем настойчивее народ призывают затянуть пояс на пустом животе, тем явственнее у него желание затянуть пояс на шее пузатых толстосумов.
Взрослые сказки детских людей. Книга для ума и души, Вольдемар Афористичный3
теперь хомут, затянуть супонь, насадить седёлку с металлическим арчаком, слабым пинком заставить поджать живот, затянуть на брюхе чересседельник;
Просветленный хаос (тетраптих), Борис Хазанов, 2017г.
4
Дисциплиной меня не удивишь: сказано потуже затянуть пояс – затянул, вдохнуть глубже – вдыхаю и принимаюсь за работу.
Меблированная пустыня (сборник), Леонид Финкель, 2017г.5
Сопит, чертыхается, никак не может затянуть подпругу.
В окопах Сталинграда, Виктор Некрасов, 1946г.Найти еще примеры предложений со словом ЗАТЯНУТЬ
Морфологический разбор слова «затянули»
Часть речи: Глагол в личной форме
ЗАТЯНУЛИ — слово может быть как одушевленное так и неодушевленное, смотрите по предложению в котором оно используется.
Начальная форма слова: «ЗАТЯНУТЬ»
| Слово | Морфологические признаки |
|---|---|
| ЗАТЯНУЛИ |
|
Все формы слова ЗАТЯНУЛИ
ЗАТЯНУТЬ, ЗАТЯНУЛ, ЗАТЯНУЛА, ЗАТЯНУЛО, ЗАТЯНУЛИ, ЗАТЯНУ, ЗАТЯНЕМ, ЗАТЯНЕШЬ, ЗАТЯНЕТЕ, ЗАТЯНЕТ, ЗАТЯНУТ, ЗАТЯНУВ, ЗАТЯНУВШИ, ЗАТЯНЕМТЕ, ЗАТЯНИ, ЗАТЯНИТЕ, ЗАТЯНУВШИЙ, ЗАТЯНУВШЕГО, ЗАТЯНУВШЕМУ, ЗАТЯНУВШИМ, ЗАТЯНУВШЕМ, ЗАТЯНУВШАЯ, ЗАТЯНУВШЕЙ, ЗАТЯНУВШУЮ, ЗАТЯНУВШЕЮ, ЗАТЯНУВШЕЕ, ЗАТЯНУВШИЕ, ЗАТЯНУВШИХ, ЗАТЯНУВШИМИ, ЗАТЯНУТЫЙ, ЗАТЯНУТОГО, ЗАТЯНУТОМУ, ЗАТЯНУТЫМ, ЗАТЯНУТОМ, ЗАТЯНУТАЯ, ЗАТЯНУТОЙ, ЗАТЯНУТУЮ, ЗАТЯНУТОЮ, ЗАТЯНУТА, ЗАТЯНУТОЕ, ЗАТЯНУТО, ЗАТЯНУТЫЕ, ЗАТЯНУТЫХ, ЗАТЯНУТЫМИ, ЗАТЯНУТЫ
Разбор слова в тексте или предложении
Если вы хотите разобрать слово «ЗАТЯНУЛИ» в конкретном предложении или тексте, то лучше использовать
морфологический разбор текста.
Примеры предложений со словом «затянули»
1
Нужно только затянуть в себя резины, поглубже, с воздухом затянуть, и быстро закрутить охвостья.
Парус (сборник), Владимир Шапко, 2015г.2
Чем настойчивее народ призывают затянуть пояс на пустом животе, тем явственнее у него желание затянуть пояс на шее пузатых толстосумов.
Взрослые сказки детских людей. Книга для ума и души, Вольдемар Афористичный3
теперь хомут, затянуть супонь, насадить седёлку с металлическим арчаком, слабым пинком заставить поджать живот, затянуть на брюхе чересседельник;
Просветленный хаос (тетраптих), Борис Хазанов, 2017г.
4
Дисциплиной меня не удивишь: сказано потуже затянуть пояс – затянул, вдохнуть глубже – вдыхаю и принимаюсь за работу.
Меблированная пустыня (сборник), Леонид Финкель, 2017г.5
Музыканты снова затянули пронзительную мелодию, любимую песнь бывшего царя царей Дария.
Огни на курганах, Василий Ян, 1932-1941г.Найти еще примеры предложений со словом ЗАТЯНУЛИ
«Звонкие и глухие согласные в корне слова»
Диктант
Редкая лошадка .
Пони любят все детишки. Это маленькая лошадка. У пони короткие ножки, маленькая головка. У лошадки гладкая шерсть. А какой добрый взгляд! Малышка бежит по дорожке и тянет тележку. У пони лёгкий бег.
Вот пришла повозка. Туда сели мальчики и девочки. Пони делает круг за кругом. Дети рады. (49слов. )
Слова для справок: кучер, тележка, вожжи.
Задание:
1. Подчеркнуть слова с парными согласными в корне:
1-й вариант:Д и Т
2-й вариант:Ж и Ш.
2. Разобрать слова по составу: ЛОШАДКА, ГЛАДКАЯ.
3. К словам ЛЁГКИЙ, ДОРОЖКА приписать проверочные
Диктант
Дорога
Глеб запряг в телегу лошадку. Мы тронулись в путь. Узкая дорожка шла через поле. Воронок бежал лёгкой рысью. Вокруг раскинулся овёс. За полями начинался низкий кустарник. Проехали редкий лесок. Вот и деревня Редькино. На краю избушка. Тут живёт дедушка Тарас. Огород у деда большой. Созрели морковка, репка, горох. (49 слов.)
Слова для справок: телега, лёгкой.
Задание:
1. В первом предложении подчеркнуть подлежащее и сказуемое.
2. Разобрать по составу слово МОРКОВКА, ЛОШАДКА.
3. Выписать 5 слов со звонкими согласными в корне.
Диктант
Дятел
Часто раздаётся стук в лесу. Это дятел строит гнездо. Дятел долбит своим крепким носом мягкое дерево. Кусочки коры и весь сор дятел выбрасывает вон. Птенцы дятла растут на гладком дне гнезда. От этого у них мозоли на пятках. Молодые дятлы ловко цепляются за стенки своими острыми когтями и вылезают из гнезда. (52 слова)
Задание:
1. Выписать из диктанта два слова с парными согласными. Написать проверочные слова.
2. Разобрать данное предложение по членам предложения: Это дятел строит гнездо.
Тема: «Однокоренные слова»
Диктант
Осень
По календарю ноябрь – последний месяц осени. С каждым днем все крепче утренние морозы. Под ногами уже хрустит тонкий ледок.
Речка у берегов замерзла. На озерах появились широкие полосы льда. И пруд затянуло льдом. Небо часто покрыто серыми тучами. Солнце редко светит и совсем не греет землю. (47 слов).
Задание:
1. Разобрать слова по составу:
1-й вариант:ЛЕДОК — , ПЕРЕХОД—.
2-й вариант:МОРОЗЫ — , ПОЛЕТ — .
2. К слову МОРОЗ, подобрать родственные слова.
Тема: «Непроверяемые гласные и согласные»
Диктант
Дар природы
Леса, рощи, сады — дар природы человеку. Чистый воздух лесов полезен для здоровья. Он придает людям силы. Деревья сохраняют влагу, защищают почву и посевы от ветров.
Пусть каждый школьник посадит дерево у дома или у школы. Оно принесет людям радость и красоту. Охрана природы-нужное дело. (45 слов)
Задание:
1. Выписать из текста словарные слова, подчеркнуть в них непроверяемые гласные и согласные.
2. Данное предложение разобрать по членам предложения: Деревья сохраняют влагу, защищают почву и посевы от ветров.
3. Разобрать по составу слово: ШКОЛЬНИК.
Диктант
Лоси
Закатилось солнышко за горизонт. На краю болота стоит лосиха с лосенком. Досыта наелись они сочной травы. Задремала старая лосиха. Пищат над болотом комары. Спасаясь от комаров, прячутся лоси иногда в воду. Они проходят через болота, овраги, переплывают реки и лесные озера. Их можно увидеть на окраинах селений и городов.
(49слов) (По И, Соколову-Микитову)
Слова для справок: досыта, переплывают.
Задание:
1. Выписать слова с непроверяемыми безударными гласными; подчеркните буквы, правописание которых надо запомнить.
2. Выписать из текста однокоренные слова с корнем ЛОСЬ.
3. Разобрать по составу слово: СОЛНЫШКО.
Тема: «Приставки и предлоги»
Диктант
Синица
Синица влетела в сад. На дереве она нашла большого жука. Синица схватила его с ветки. Вдруг с крыши спрыгнул кот. Синица увидала у дорожки кота. Кот залез под куст и следил за синицей. В сад вбежала собака. Она ‘набросилась на кота.Синица слетела с дерева.
(45слов.)
Задание:
1. Выписать из текста 5 слов с приставками и 5 слов с предлогами.
2. Данное предложение разобрать по членам предложения: Синица увидала у дорожки кота.
Диктант
Воробей
Лёня увидал у старого сарая воробья. Он сильно дрожал от холода. Лёня взял воробья. Он принёс его в школу. Ребята положили воробья в шапку. Он отогрелся. Ребята покормили воробья. Потом воробей вспорхнул. Он сел на окно. Анна Сергеевна открыла окно. Воробей вылетел. Он весело зачирикал. (45 слов)
Задание:
1. Выписать из текста 5 слов с приставками, приставки выделить.
2. Подчеркнуть в тексте предлоги.
3. Данное предложение разобрать по членам предложения: Ребята положили воробья в шапку.
Тема: «Разделительный Ъ»
Диктант
Лосиха
Мы обходили участок. Дорога шла на подъем. Под кустом лежал лосенок. Он был нездоров. Мы взяли лосёнка ни руки, но вдруг услышали рев. К нам бежала разъяренная лосиха. Шерсть стояла дыбом, ноздри от ярости раздулись.
Мы отпустили лосенка. Мелкими шажками он побежал к матери. Семья объединилась. (46 слов)
Слова для справок: нездоров, к нам.
Задание:
1. Выписать из текста слова с Ъ.
2. Выписать из текста 3 слова с безударными гласными в корне.
3. Выписать из текста однокоренные слова с корнем ЛОСЬ.
Диктант
Сказка
В давние времена суслик и ворона были друзьями. Вместе они запасали на зиму колосья и съедобные травы. Раз улетела ворона в гости к сестрам и братьям. А суслик закрыл вход в нору и пошел спать. Стала ворона звать друга. Но суслик крепко спал. Осталась ворона без съестного припаса. И дружба врозь.
(52 слова) (По НСацджиеву)
Слово для справок: врозь
Задание:
1. Подчеркните в тексте предлоги.
2. Выписать из текста 5 слов с приставками.
3. К слову ЗИМА подобрать родственные слова.
Тема: «Части речи»
Диктант
Зимой в лесу
На дворе мороз. Сильный ветер крутит хлопья снега. В лесу затихли голоса птиц. Только пестрый дятел стучит по коре своим крепким клювом.
Холодно и голодно зверям зимой. Медведь залез в берлогу. Лиса скрылась в нору. Бедный заяц дрожит под кустом. Голодные волки рыщут по лесу. (49 слов)
Задание:
1. Разобрать предложение по членам предложения. Указать в нем части речи:
1-й вариант: Бедный заяц дрожит под кустом.
2-й вариант: Голодные волки рыщут по лесу.
2. Выписать из текста по 5 имен существительных и по 5 глаголов.
3. Разобрать по составу слова: ГОЛОДНЫЕ, КРЕПКИМ.
Диктант
Зимний лес
Чудесен русский лес зимой! Белый пушистый снег повис на ветвях деревьев. Смолистые шишки украшают вершины елей. Шустрые синицы пищат в сучьях. На сугробах видны узоры заячьих и лисьих следов.
Вот бежит через дорогу белка. Прыгнула на сосну, махнула хвостом. Полетела лёгкая снежная пыль. Постучал молоточком по стволу дятел. (50 слов.)
(По И. Соколову-Микитову.)
Слова для справок: смолистые, чудесен.
Задание:
1. Разобрать предложение по членам предложения. Указать в нем части речи: Шустрые синицы пищат в сучьях.
2. Разобрать по составу слова: СНЕЖНЫЕ, ЗИМНИЙ.
3. К словам «ЗИМОЙ — , СНЕГ — , НА ВЕТВЯХ — , СЛЕДОВ — , ЛЕГКАЯ –» записать проверочные слова.
Диктант
Узнай зверька
В наших лесах живёт робкий зверёк. Летом на нём серенькая лёгкая шубка. К зиме он меняет её на пушистую беленькую. Она спасает зверька от мороза. Жилья у бедняги нет. Что у зверька на обед? Горькая кора осинки или берёзки.
Хорошо служат ему длинные ноги. Большими прыжками убегает трусишка от врагов. (52 слова.)
Слова для справок: на нём, ему.
Задание:
1. 1-е разобрать предложение по членам предложения. Указать в нем части речи:
2. Разобрать по составу слова: БЕРЕЗКИ, ШУБКА, ВРАГОВ.
3. Как назван в тексте зверек? Выписать эти слова ….
Дом под кронами дубов.старый пруд затянуло ряской. спустившись2 сюда из сада, мы спугнули плескавшихся3 здесь диких уток. неожиданно одна из них тяжело плюхнулась в пруд и поплыла, быстро-быстро рассекая зеленую воду. мне хотело пройти к разрушенному кирпичному дому, со всех сторон заросшему липами и дубами4. валентин петрович купил его, чтобы построить дом, напоминавший ему отцовский. пройдя вдоль берега пруда, мы наблюдали за скользящими в тине серебристыми карасями. невдалеке2 проглядывали остатки то ли плотины, то ли водопровода. вскоре наша тропинка устремилась к дому, обрушенные3 стены которого выглядывали сквозь кусты. над полуобвалившимся домом наконец-то загорелось ласковое солнце. среди редких облаков пролетел коршун. он вдруг недоброжелательно, заставив меня вздрогнуть от неожиданности, прикрикнул на нас с высоты. это был удивительный миг. и мне впервые было приятно слышать голоса дикой природы.мы осторожно побродили внутри заброшенного холодного дома по темным разломанным, сгнившим доскам, и петрович поделился планами его обустройства. 2 – разбор по составу3 – морфологический разбор4 – синтаксический разбор — Знания.site
Дом под кронами дубов.
Старый пруд затянуло ряской. Спустившись2 сюда из сада, мы спугнули плескавшихся3 здесь диких уток. Неожиданно одна из них тяжело плюхнулась в пруд и поплыла, быстро-быстро рассекая зеленую воду. Мне хотело пройти к разрушенному кирпичному дому, со всех сторон заросшему липами и дубами4. Валентин Петрович купил его, чтобы построить дом, напоминавший ему отцовский.
Пройдя вдоль берега пруда, мы наблюдали за скользящими в тине серебристыми карасями. Невдалеке2 проглядывали остатки то ли плотины, то ли водопровода. Вскоре наша тропинка устремилась к дому, обрушенные3 стены которого выглядывали сквозь кусты.
Над полуобвалившимся домом наконец-то загорелось ласковое солнце. Среди редких облаков пролетел коршун. Он вдруг недоброжелательно, заставив меня вздрогнуть от неожиданности, прикрикнул на нас с высоты. Это был удивительный миг. И мне впервые было приятно слышать голоса дикой природы.
Мы осторожно побродили внутри заброшенного холодного дома по темным разломанным, сгнившим доскам, и Петрович поделился планами его обустройства.
2 – разбор по составу
3 – морфологический разбор
4 – синтаксический разбор
Мейотическая регуляция состава и функции комплекса Ndc80
Akiyoshi B, Nelson CR, Ranish JA, Biggins S (2009) Анализ Ipl1-опосредованного фосфорилирования кинетохорного белка Ndc80 в Saccharomyces cerevisiae . Генетика 183: 1591–1595
CAS PubMed PubMed Central Статья Google Scholar
Alushin GM, Ramey VH, Pasqualato S, Ball DA, Grigorieff N, Musacchio A, Nogales E (2010) Кинетохорный комплекс Ndc80 формирует олигомерные массивы вдоль микротрубочек.Nature 467: 805–810
CAS PubMed PubMed Central Статья Google Scholar
Алушин GM, Musinipally V, Matson D, Tooley J, Stukenberg PT, Nogales E (2012) Мультимодальное связывание микротрубочек кинетохорным комплексом Ndc80. Nat Struct Mol Biol 19: 1161–1167
CAS PubMed PubMed Central Статья Google Scholar
Aravamudhan P, Goldfarb AA, Joglekar AP (2015) Кинетохора кодирует механический переключатель, чтобы нарушить сигнализацию контрольной точки сборки шпинделя.Nat Cell Biol 17: 868–879
CAS PubMed PubMed Central Статья Google Scholar
Asakawa H, Hayashi A, Haraguchi T., Hiraoka Y (2005) Диссоциация комплекса Nuf2-Ndc80 высвобождает центромеры из тела полюса веретена во время профазы мейоза у делящихся дрожжей. Mol Biol Cell 16: 2325–2338
CAS PubMed PubMed Central Статья Google Scholar
Au WC, Crisp MJ, DeLuca SZ, Rando OJ, Basrai MA (2008) Измененная дозировка и неправильная локализация гистона h4 и Cse4p приводят к потере хромосом у Saccharomyces cerevisiae .Генетика 179: 263–275
CAS PubMed PubMed Central Статья Google Scholar
Biggins S (2013) Состав, функции и регуляция кинетохоры почкующихся дрожжей. Генетика 194: 817–846
CAS PubMed PubMed Central Статья Google Scholar
Cheeseman IM, Chappie JS, Wilson-Kubalek EM, Desai A (2006) Консервативная сеть KMN составляет основной сайт связывания микротрубочек кинетохоры.Ячейка 127: 983–997
CAS PubMed Статья Google Scholar
Chen Y, Riley DJ, Chen PL, Lee WH (1997) HEC, новый ядерный белок, богатый повторами гептада лейцина, специфически вовлеченными в митоз. Mol Cell Biol 17: 6049–6056
CAS PubMed PubMed Central Статья Google Scholar
Chen J, Tresenrider A, Chia M, McSwiggen DT, Spedale G, Jorgensen V, Liao H, van Werven FJ, Ünal E (2017) Инактивация кинетохор путем экспрессии репрессивной мРНК.Элиф 6: e27417
PubMed PubMed Central Статья Google Scholar
Chen Y, Zhao J, Jiao Z, Wang W, Wang D, Yu X, Shi Z, Ge N, Pan Q, Xia J et al (2018) Сверхэкспрессия SKA1 связана с плохим прогнозом при гепатоцеллюлярной карциноме. BMC Cancer 18: 1240
CAS PubMed PubMed Central Статья Google Scholar
Chen J, Liao A, Powers EN, Liao H, Kohlstaedt LA, Evans R, Holly RM, Kim JK, Jovanovic M, Unal E (2020) Aurora B-зависимая деградация Ndc80 регулирует состав кинетохор в мейозе.Genes Dev 34: 209–225
CAS PubMed PubMed Central Статья Google Scholar
Chia M, Tresenrider A, Chen J, Spedale G, Jorgensen V, Unal E, van Werven FJ (2017) Транскрипция 5′-расширенной изоформы мРНК направляет динамические изменения хроматина и вмешательство нижележащего промотора. Элиф 6: e27420
PubMed PubMed Central Статья Google Scholar
Chu S, Herskowitz I (1998) Гаметогенез у дрожжей регулируется транскрипционным каскадом, зависящим от Ndt80.Mol Cell 1: 685–696
CAS PubMed Статья Google Scholar
Ciferri C, De Luca J, Monzani S, Ferrari KJ, Ristic D, Wyman C, Stark H, Kilmartin J, Salmon ED, Musacchio A (2005) Архитектура человеческого комплекса ndc80-hec1, важнейшего компонента внешняя кинетохора. J Biol Chem 280: 29088–29095
CAS PubMed Статья Google Scholar
Ciferri C, Pasqualato S, Screpanti E, Varetti G, Santaguida S, Dos Reis G, Maiolica A, Polka J, De Luca JG, De Wulf P et al (2008) Последствия для прикрепления кинетохора и микротрубочек из структуры спроектированного комплекса Ndc80.Ячейка 133: 427–439
CAS PubMed PubMed Central Статья Google Scholar
Davis-Roca AC, Muscat CC, Wignall SM (2017) Ооциты Caenorhabditis elegans обнаруживают мейотические ошибки в отсутствие канонических концевых прикреплений кинетохор. J Cell Biol 216: 1243–1253
CAS PubMed PubMed Central Статья Google Scholar
DeLuca JG, Gall WE, Ciferri C, Cimini D, Musacchio A, Salmon ED (2006) Динамика микротрубочек кинетохор и стабильность прикрепления регулируются Hec1.Ячейка 127: 969–982
CAS PubMed Статья Google Scholar
DeLuca KF, Lens SM, DeLuca JG (2011) Временные изменения в стабильности прикрепления кинетохор и микротрубочек, контролирующих фосфорилирование Hec1, во время митоза. J Cell Sci 124: 622–634
CAS PubMed PubMed Central Статья Google Scholar
Dumont J, Oegema K, Desai A (2010) Независимый от кинетохор механизм управляет анафазным разделением хромосом во время ацентросомного мейоза.Nat Cell Biol 12: 894–901
CAS PubMed PubMed Central Статья Google Scholar
Ganem NJ, Pellman D (2012) Связывание аномального митоза с приобретением повреждения ДНК. J Cell Biol 199: 871–881
CAS PubMed PubMed Central Статья Google Scholar
Gascoigne KE, Cheeseman IM (2013) CDK-зависимое фосфорилирование и ядерное исключение координированно контролируют состояние сборки кинетохор.J Cell Biol 201: 23–32
CAS PubMed PubMed Central Статья Google Scholar
Gascoigne KE, Takeuchi K, Suzuki A, Hori T., Fukagawa T., Cheeseman IM (2011) Индуцированная сборка эктопических кинетохор обходит потребность в нуклеосомах CENP-A. Ячейка 145: 410–422
CAS PubMed PubMed Central Статья Google Scholar
Guimaraes GJ, Dong Y, McEwen BF, Deluca JG (2008) Присоединение кинетохор к микротрубочкам основывается на неупорядоченном N-концевом хвостовом домене Hec1.Curr Biol 18: 1778–1784
CAS PubMed PubMed Central Статья Google Scholar
Hattersley N, Cheerambathur D, Moyle M, Stefanutti M, Richardson A, Lee KY, Dumont J, Oegema K, Desai A (2016) Нуклеопорин присоединяет протеинфосфатазу 1 для управления сегрегацией мейотических хромосом и сборкой ядер. Dev Cell 38: 463–477
CAS PubMed PubMed Central Статья Google Scholar
Hayama S, Daigo Y, Kato T, Ishikawa N, Yamabuki T, Miyamoto M, Ito T, Tsuchiya E, Kondo S, Nakamura Y (2006) Активация CDCA1-KNTC2, членов белкового комплекса центромеры, участвующих в легочный канцерогенез.Cancer Res 66: 10339–10348
CAS PubMed Статья Google Scholar
Heun P, Erhardt S, Blower MD, Weiss S, Skora AD, Karpen GH (2006) Неверная локализация CID гистона, специфичного для центромеры Drosophila, способствует образованию функциональных эктопических кинетохор. Dev Cell 10: 303–315
CAS PubMed PubMed Central Статья Google Scholar
Hiruma Y, Sacristan C, Pachis ST, Adamopoulos A, Kuijt T, Ubbink M, von Castelmur E, Perrakis A, Kops GJ (2015) Конкуренция между MPS1 и микротрубочками на кинетохорах регулирует передачу сигналов контрольных точек веретена.Наука 348: 1264–1267
CAS PubMed Статья Google Scholar
Hornung P, Maier M, Alushin GM, Lander GC, Nogales E, Westermann S (2011) Молекулярная архитектура и связность кинетохорного комплекса почкующихся дрожжей Mtw1. J Mol Biol 405: 548–559
CAS PubMed Статья Google Scholar
Howe M, McDonald KL, Albertson DG, Meyer BJ (2001) HIM-10 необходим для кинетохорной структуры и функции на голоцентрических хромосомах Caenorhabditis elegans .J Cell Biol 153: 1227–1238
CAS PubMed PubMed Central Статья Google Scholar
Huis In’t Veld PJ, Jeganathan S, Petrovic A, Singh P, John J, Krenn V, Weissmann F, Bange T, Musacchio A (2016) Молекулярная основа сборки внешних кинетохор на CENP-T. Elife 5: e21007
Статья Google Scholar
Janke C, Ortiz J, Lechner J, Shevchenko A, Shevchenko A, Magiera MM, Schramm C, Schiebel E (2001) Белки почкующихся дрожжей Spc24p и Spc25p взаимодействуют с Ndc80p и Nuf2p на кинетохоре и важны для кинетохора. кластеризация и контроль контрольных точек.EMBO J 20: 777–791
CAS PubMed PubMed Central Статья Google Scholar
Jeganathan KB, van Deursen JM (2006) Дифференциальные потребности в белках митотических контрольных точек в соматических и половых клетках. Biochem Soc Trans 34: 583–586
CAS PubMed Статья Google Scholar
Ji Z, Gao H, Yu H (2015) Прикрепление кинетохор определяется конкурентным Mps1 и связыванием микротрубочек с Ndc80C.Наука 348: 1260–1264
CAS PubMed Статья Google Scholar
Kallio M, Eriksson JE, Gorbsky GJ (2000) Различия в ассоциации веретена митотического контрольного белка Mad2 в сперматогенезе и оогенезе млекопитающих. Dev Biol 225: 112–123
CAS PubMed Статья Google Scholar
Kassir Y, Granot D, Simchen G (1988) IME1, ген позитивного регулятора мейоза у S.cerevisiae. Ячейка 52: 853–862
CAS PubMed Статья Google Scholar
Kemmler S, Stach M, Knapp M, Ortiz J, Pfannstiel J, Ruppert T, Lechner J (2009) Имитация фосфорилирования Ndc80 запускает передачу сигналов контрольной точки сборки шпинделя. EMBO J 28: 1099–1110
CAS PubMed PubMed Central Статья Google Scholar
Kim S, Meyer R, Chuong H, Dawson DS (2013) Двойные механизмы предотвращают преждевременную сегрегацию хромосом во время мейоза.Genes Dev 27: 2139–2146
CAS PubMed PubMed Central Статья Google Scholar
Китамура Э., Танака К., Китамура Ю., Танака Т.У. (2007) Взаимодействие микротрубочек кинетохор во время S-фазы в Saccharomyces cerevisiae . Genes Dev 21: 3319–3330
CAS PubMed PubMed Central Статья Google Scholar
Kudalkar EM, Scarborough EA, Umbreit NT, Zelter A, Gestaut DR, Riffle M, Johnson RS, MacCoss MJ, Asbury CL, Davis TN (2015) Регулирование прикрепления микротрубочек на основе комплекса Ndc80 внешней кинетохоры с помощью центральной кинетохоры Комплекс Mis12 / MIND.Proc Natl Acad Sci USA 112: E5583-5589
CAS PubMed Статья Google Scholar
Laband K, Le Borgne R, Edwards F, Stefanutti M, Canman JC, Verbavatz JM, Dumont J (2017) Сегрегация хромосом происходит путем проталкивания микротрубочек в ооциты. Nat Commun 8: 1499
PubMed PubMed Central Статья CAS Google Scholar
Lampert F, Mieck C, Alushin GM, Nogales E, Westermann S (2013) Молекулярные требования для образования интерфейса кинетохора-микротрубочка комплексами Dam1 и Ndc80.J Cell Biol 200: 21–30
CAS PubMed PubMed Central Статья Google Scholar
Лэмпсон М.А., Грищук Е.Л. (2017) Механизмы предотвращения и исправления ошибочного прикрепления кинетохор к микротрубочкам. Биология (Базель) 6 (1): 1
Google Scholar
Li M, Li S, Yuan J, Wang ZB, Sun SC, Schatten H, Sun QY (2009) Bub3 — это белок контрольной точки сборки веретена, регулирующий сегрегацию хромосом во время мейоза ооцитов мыши.PLoS ONE 4: e7701
PubMed PubMed Central Статья CAS Google Scholar
Li J, Xuan JW, Khatamianfar V, Valiyeva F, Moussa M, Sadek A, Yang BB, Dong BJ, Huang YR, Gao WQ (2014) Сверхэкспрессия SKA1 способствует избыточной дупликации центриолей, амплификации центросом и простате онкогенез. J Pathol 234: 178–189
CAS PubMed Статья Google Scholar
McCleland ML, Gardner RD, Kallio MJ, Daum JR, Gorbsky GJ, Burke DJ, Stukenberg PT (2003) Высококонсервативный комплекс Ndc80 необходим для сборки кинетохор, конгресса хромосом и активности контрольных точек веретена.Genes Dev 17: 101–114
CAS PubMed PubMed Central Статья Google Scholar
Meyer RE, Chuong HH, Hild M, Hansen CL, Kinter M, Dawson DS (2015) Ipl1 / Aurora-B необходим для перестройки кинетохор в мейозе I в Saccharomyces cerevisiae . Mol Biol Cell 26: 2986–3000
CAS PubMed PubMed Central Статья Google Scholar
Meyer RE, Brown J, Beck L, Dawson DS (2018) Mps1 способствует биориентации мейотической хромосомы хромосомы через Dam1.Mol Biol Cell 29: 479–489
CAS PubMed PubMed Central Статья Google Scholar
Miller SA, Johnson ML, Stukenberg PT (2008) Присоединения кинетохор требуют взаимодействия между неструктурированными хвостами на микротрубочках и Ndc80 (Hec1). Curr Biol 18: 1785–1791
CAS PubMed PubMed Central Статья Google Scholar
Miller MP, Unal E, Brar GA, Amon A (2012) Сегрегация хромосомы мейоза I устанавливается посредством регуляции взаимодействий микротрубочки-кинетохоры.Элиф 1: e00117
PubMed PubMed Central Статья CAS Google Scholar
Monen J, Maddox PS, Hyndman F, Oegema K, Desai A (2005) Дифференциальная роль CENP-A в сегрегации голоцентрических хромосом C. elegans во время мейоза и митоза. Nat Cell Biol 7: 1248–1255
PubMed Статья CAS Google Scholar
Musacchio A, Desai A (2017) Молекулярный взгляд на сборку и функцию кинетохор.Биология (Базель) 6 (1): 5
Google Scholar
Muscat CC, Torre-Santiago KM, Tran MV, Powers JA, Wignall SM (2015) Кинетохор-независимая сегрегация хромосом, управляемая латеральными пучками микротрубочек. Элиф 4: e06462
PubMed PubMed Central Статья Google Scholar
Nishino T, Rago F, Hori T, Tomii K, Cheeseman IM, Fukagawa T (2013) CENP-T обеспечивает структурную платформу для сборки внешних кинетохор.EMBO J 32: 424–436
CAS PubMed PubMed Central Статья Google Scholar
Oelschlaegel T, Schwickart M, Matos J, Bogdanova A, Camasses A, Havlis J, Shevchenko A, Zachariae W (2005) Субъединица APC / C дрожжей Mnd2 предотвращает преждевременное разделение сестринских хроматид, вызванное специфическим для мейоза APC / C-Ama1. Ячейка 120: 773–788
CAS PubMed Статья Google Scholar
Shen L, Yang M, Lin Q, Zhang Z, Miao C, Zhu B (2016) SKA1 регулирует метастазирование и устойчивость к цисплатину немелкоклеточного рака легкого.Oncol Rep 35: 2561–2568
CAS PubMed PubMed Central Статья Google Scholar
Shirk K, Jin H, Giddings TH Jr, Winey M, Yu HG (2011) Киназа Aurora Ipl1 необходима для сцепления тела полюса веретена во время мейоза почкующихся дрожжей. J Cell Sci 124: 2891–2896
CAS PubMed PubMed Central Статья Google Scholar
Shrestha RL, Ahn GS, Staples MI, Sathyan KM, Karpova TS, Foltz DR, Basrai MA (2017) Неверная локализация центромерного гистона h4 варианта CENP-A способствует хромосомной нестабильности (CIN) в клетках человека.Oncotarget 8: 46781–46800
PubMed PubMed Central Статья Google Scholar
Sun SC, Lee SE, Xu YN, Kim NH (2010) Нарушение экспрессии Spc25 влияет на организацию мейотического веретена, выравнивание хромосом и контрольную точку сборки веретена в ооцитах мышей. Цикл ячейки 9: 4552–4559
CAS PubMed Статья Google Scholar
Sun SC, Zhang DX, Lee SE, Xu YN, Kim NH (2011) Ndc80 регулирует организацию мейотического веретена, выравнивание хромосом и развитие клеточного цикла в ооцитах мышей.Microsc Microanal 17: 431–439
CAS PubMed Статья Google Scholar
Sundin LJ, Guimaraes GJ, Deluca JG (2011) Белки комплекса NDC80 Nuf2 и Hec1 вносят особый вклад в прикрепление кинетохор к микротрубочкам в митозе. Mol Biol Cell 22: 759–768
CAS PubMed PubMed Central Статья Google Scholar
Tsuchiya D, Gonzalez C, Lacefield S (2011) Белок контрольной точки веретена Mad2 регулирует активность APC / C во время прометафазы и метафазы мейоза I в Saccharomyces cerevisiae .Mol Biol Cell 22: 2848–2861
CAS PubMed PubMed Central Статья Google Scholar
Umbreit NT, Gestaut DR, Tien JF, Vollmar BS, Gonen T, Asbury CL, Davis TN (2012) Кинетохорный комплекс Ndc80 напрямую модулирует динамику микротрубочек. Proc Natl Acad Sci USA 109: 16113–16118
CAS PubMed Статья Google Scholar
van Werven FJ, Amon A (2011) Регулирование вступления в гаметогенез.Philos Trans R Soc Lond B Biol Sci 366: 3521–3531
PubMed PubMed Central Статья CAS Google Scholar
Wei RR, Sorger PK, Harrison SC (2005) Молекулярная организация комплекса Ndc80, важного кинетохорного компонента. Proc Natl Acad Sci USA 102: 5363–5367
CAS PubMed Статья Google Scholar
Wei RR, Al-Bassam J, Harrison SC (2007) Комплекс Ndc80 / HEC1 представляет собой точку контакта для прикрепления кинетохоры и микротрубочек.Nat Struct Mol Biol 14: 54–59
CAS PubMed Статья Google Scholar
Wigge PA, Kilmartin JV (2001) Комплекс Ndc80p из Saccharomyces cerevisiae содержит консервативные компоненты центромеры и выполняет функцию сегрегации хромосом. J Cell Biol 152: 349–360
CAS PubMed PubMed Central Статья Google Scholar
Wignall SM, Villeneuve AM (2009) Боковые пучки микротрубочек способствуют выравниванию хромосом во время мейоза ацентросомных ооцитов.Nat Cell Biol 11: 839–844
CAS PubMed PubMed Central Статья Google Scholar
Wimbish RT, DeLuca JG (2020) Функция хвостового домена Hec1 / Ndc80 на границе кинетохора-микротрубочка. Front Cell Dev Biol 8:43
PubMed PubMed Central Статья Google Scholar
Xu L, Ajimura M, Padmore R, Klein C, Kleckner N (1995) NDT80, мейоз-специфический ген, необходимый для выхода из пахитены в Saccharomyces cerevisiae .Mol Cell Biol 15: 6572–6581
CAS PubMed PubMed Central Статья Google Scholar
Зайцев А.В., Сундин Л.Дж., ДеЛука К.Ф., Грищук Е.Л., ДеЛука Дж.Г. (2014) Точная фосфорегуляция сродства кинетохора-микротрубочка требует неограниченных молекулярных взаимодействий. J Cell Biol 206: 45–59
CAS PubMed PubMed Central Статья Google Scholar
Зайцев А.В., Мик Дж. Э., Масленников Е., Никашин Б., ДеЛука Дж., Грищук Е. Л. (2015) Мультисайтовое фосфорилирование комплекса NDC80 постепенно регулирует его сродство к связыванию микротрубочек.Mol Biol Cell 26: 1829–1844
CAS PubMed PubMed Central Статья Google Scholar
Zhang T, Zhou Y, Qi ST, Wang ZB, Qian WP, Ouyang YC, Shen W, Schatten H, Sun QY (2015) Nuf2 необходим для сегрегации хромосом во время мейотического созревания ооцитов мыши. Ячейочный цикл 14: 2701–2710
CAS PubMed PubMed Central Статья Google Scholar
Zhang T, Zhou Y, Wang HH, Meng TG, Guo L, Ma XS, Shen W, Schatten H, Sun QY (2016) Spc24 необходим для прикрепления мейотических кинетохор к микротрубочкам и производства эуплоидных яиц.Oncotarget 7: 71987–71997
PubMed PubMed Central Статья Google Scholar
Количественный анализ белков Р тельца дрожжей показывает принципы состава и специфичности
[Примечание редактора: далее следует план авторов по внесению исправлений.]
Основные опасения рецензентов можно резюмировать следующим образом:
1. Новизна работы не подчеркнута.Ясно, что он более всеобъемлющий, чем предыдущие работы этих авторов, но требует более перспективного и дополнительного тестирования.
Что касается новизны, мы считаем, что наша работа добавляет важные новые знания о Р-телах и биомолекулярных конденсатах в целом. Во-первых, наша работа — это единственный отчет об абсолютных или относительных концентрациях основных белков в любом конденсате. Такие концентрации являются важными знаниями при рассмотрении природы и биохимических функций тел P (и, в более широком смысле, других конденсатов).Например, модели конденсатов как отсеков для хранения подвергаются сомнению нашими данными на рисунке 3, показывающими, что только небольшая часть большинства белков присутствует в P-тельцах. Кроме того, модели конденсатов как участков высокой биохимической активности должны учитывать тот факт, что большинство неосновных компонентов сконцентрированы только <10 раз относительно окружающей цитоплазмы и что большинство молекул все еще находится в цитоплазме. Таким образом, конденсатные функции с большей вероятностью возникают из основных компонентов или из совокупностей непрофильных компонентов (например,грамм. в каскаде реакций). Это важные концепции для данной области. Во-вторых, наши данные показывают, что лишь небольшая часть из многих белков в P-телец имеет высокую концентрацию в структуре. Эта информация является ключевой для понимания строения конденсатов. Это противоречит большинству преобладающих моделей состава конденсата, которые рассматривают отсеки как трудноразрешимо сложные, с сотнями компонентов, все из которых неявно имеют одинаковый вес с точки зрения функциональной значимости. Наши данные показывают, что компартменты намного проще и предоставляют первые пути к надежному биомиметическому восстановлению.
Наконец, хотя нам предстоит еще поработать, чтобы понять корреляции на рисунке 7, как эмпирический предиктор степени, в которой полноразмерные белки могут быть сконцентрированы в конденсате, они весьма ценны для данной области.
2. Авторам необходимо рассмотреть другие модели для сборки, а не только клиент / скаффолд. Расхождения между данными и их моделью не устранены. Есть несколько подробных экспериментов, которые могли бы сделать больше, чтобы прояснить туманные выводы (см. Ниже).Например, вместо мечения одним флуорофором они могут лучше оценить состав и вариацию с помощью попарного анализа двух флуорофоров.
3. Могут ли они предоставить какие-либо дополнительные данные или идеи, чтобы пролить свет на несоответствие, которое они указывают между их моделью и результатами для DCP2?
Обеспокоенность по поводу модели каркаса / клиента, по-видимому, частично возникает из-за неправильного представления рецензентов о самой модели и о нашем намерении представить корреляции валентностей на рисунке 7.Оглядываясь назад, мы понимаем, как возникли эти неправильные представления, и полагаем, что обширный пересмотр текста в сочетании с дополнительными данными должен привести к гораздо более четкому представлению и более точной модели. Короче говоря, мы не намеревались изобразить модель, в которой валентность взаимодействий является единственным параметром, важным для определения состава конденсата, и где РНК не важна. Скорее, как предполагают составители обзора, мы полагаем, что A) РНК является ключевым каркасом для P-телец, B) важно сродство связывания белков друг с другом и с РНК и C) важна валентность взаимодействий.Мы также ошибочно отождествили «основные» белки с «каркасными» белками, а «неосновные» — с «клиентом» в предложении в начале обсуждения, цитируемом вторым рецензентом, вместо того, чтобы описать их как коррелированные, но не идентичные, что было наше намерение до конца обсуждения. Это вызвало ряд проблем, которые можно решить в пересмотренном введении и обсуждении.
Соответственно, мы не предполагали, что данные на Рисунке 7 представляют тест или валидацию основанной на валентности модели каркаса / клиента или результата, вытекающего из предыдущих данных в рукописи.Скорее, мы задумали это просто как эмпирическую корреляцию, которая потенциально может быть полезна при прогнозировании других конденсатов, где количественные данные изображений получить нелегко. Очевидно, это не было правильно, и в нашей презентации модель была основана исключительно на валентности, что не входило в наши намерения. Это можно исправить в доработке. Тем не менее, мы согласны с авторами обзора в том, что для нас важно понять, почему мутанты Dcp2 не попадают в ту же корреляцию, что и различные полноразмерные белки, и разработали дополнительный набор мутантов, чтобы лучше это понять.
Второй рецензент также обращает внимание на то, что стехиометрия ~ 1: 1 многих ядерных белков предполагает, что они могут формировать стереотипную сборку, которая связывает РНК, а затем рекрутирует другие белки, что приводит к несколько иной модели состава. У нас есть несколько мыслей по этому поводу. Во-первых, мы согласны с тем, что относительная стехиометрия поразительна. Фактически, в более ранней версии рукописи это обсуждалось довольно подробно, как и в комментариях рецензента.Тем не менее, мы в конечном итоге удалили это обсуждение, потому что A) относительная стехиометрия отличается у штаммов дикого типа, лишенных глюкозы, и B) широкий диапазон концентраций P-тел каждого компонента и отсутствие многокомпонентных корреляций в отдельных клетках дрожжей сделали это сложно претендовать на конкретную сборку. Тем не менее, мы согласны с авторами обзора в том, что наше понимание состава тела P было бы значительно укреплено путем сбора данных с двумя цветами, где мы могли бы количественно определить абсолютные концентрации 2 белков одновременно в отдельных клетках.Хотя непрактично собирать такие данные обо всех возможных парах белков P-тел, мы создадим штаммы для изучения ключевых корреляций внутри основной группы и между стержневыми и неосновными белками. Эти данные позволят нам различать разные модели состава тела Р.
[Примечание редакции: авторы отправили на повторное рассмотрение после принятия решения после экспертной оценки. Ниже следует письмо о решении после первого раунда проверки.]
Рецензенты считают, что они не могут поддержать повторное представление этой работы.Причины этого лучше всего резюмирует один из рецензентов, который утверждает:
«Я не сторонник повторного представления. Если я что-то не понял неправильно, авторы не планируют решать проблемы, связанные со значимостью и достоверностью их модели.
Авторы заявляют, что: «Как предполагают обозреватели, мы считаем, что A) РНК является ключевым каркасом для P-телец, B) важно сродство связывания белков друг с другом и с РНК и C) важна валентность взаимодействий» .
Но не предлагаю никаких экспериментов / данных, подтверждающих эти точки.
Мы приносим свои извинения за то, что в нашем первоначальном ответе не было достаточно четко заявлено, что мы намеревались серьезно пересмотреть нашу модель, лучше проиллюстрировать ее значение и проверить ее дальше. Все это мы сделали в ревизии.
Вкратце: мы больше не представляем работу как тестирование модели строительных лесов / клиента для сборки конденсата. Скорее, теперь мы предлагаем гораздо более детальный взгляд на сборку P-телец, подчеркивая роль высокой связности (связанной с валентностью, но отличной от нее) между белками и РНК в производстве конденсата, но также обсуждая важность аффинности связывания и активности. процессы.Мы также обсуждаем несколько других моделей и объясняем, как они несовместимы с данными наших и других лабораторий как в этой статье, так и в литературе. Как было предложено рецензентами и обсуждено с редактором в апреле, теперь мы получили двухцветные данные (изучение корреляции между двумя компонентами Р-тельцов) и данные, исследующие роль высокоаффинных связывающих элементов в управлении рекрутированием Р-тельцов, которые оба оказались полезными при сравнении разных моделей.
Наконец, теперь мы гораздо более подробно описываем новизну наших открытий, которые включают, среди 5 пунктов, подробно описанных в сопроводительном документе: A) открытие, что, несмотря на большое количество молекул, присутствующих в P-телах, только небольшое количество (7) сильно сконцентрированы там с большими коэффициентами разделения и B) открытие, что межмолекулярная связь играет ключевую роль в управлении концентрациями молекул в P-телах.
Они также заявляют, что: «Мы не намеревались, чтобы данные на Рисунке 7 представляли тест или валидацию основанной на валентности модели каркаса / клиента или результата, вытекающего из предыдущих данных в рукописи. Скорее, мы это намеревались просто как эмпирическая корреляция, которая потенциально может быть полезна при прогнозировании других конденсатов, когда количественные данные визуализации получить нелегко ».
Это не похоже на заголовок статьи, обещающей «композиционные принципы».Их предложение изобразить два компонента одновременно, не добавит ничего, кроме подтверждения того, что они уже показали?
Мы удалили количественные корреляции между валентностью и физическими характеристиками P-тел (исходный рисунок 7), что было проблематично по ряду причин. Наши двухцветные эксперименты предоставили важные проверки потенциальных моделей образования конденсата. Кроме того, как указано выше, мы значительно пересмотрели нашу модель.
Мы полагаем, что в рукописи изложены несколько принципов, касающихся состава P-тел.Они описаны в пересмотренном разделе «Обсуждение» статьи, который полностью переписан. К ним относятся: A) концепция (подтвержденная доказательствами), что биологические конденсаты, которые кажутся довольно сложными при качественном анализе их компонентов, на самом деле могут иметь гораздо более простую первичную сложность и организацию при количественном рассмотрении; Б) идея о том, что различия между высококонцентрированными и слабоконцентрированными белками Р-телец, вероятно, тесно связаны с их паттернами межмолекулярной связи внутри Р-телец; C) идея о том, что взаимодействия, которые производят конденсаты, распределяются по их высоко валентным компонентам, они действуют с разной степенью кооперативности, способствуя формированию более крупной сборки; и D) предсказание того, что термодинамика образования конденсата и состав получающейся в результате структуры должны быть связаны, на основе моделей связности в сети взаимодействия; я.е. Удаление сильно связанной молекулы должно влиять как на концентрации других факторов, необходимых для образования конденсата, так и на относительные концентрации компонентов в конденсате.
Наконец, утверждение о том, что «наши данные показывают, что лишь небольшая часть многих белков в Р-тельцах сильно сконцентрирована в структуре. Эта информация является ключевой для концептуализации строения конденсатов. Это говорит против большинства преобладающих моделей состава конденсата, которые Отобразить отсеки как непреодолимо сложные, с сотнями компонентов, все неявно взвешенные и одинаково функционально.Наши данные показывают, что компартменты намного проще и предоставляют первые пути к надежному биомиметическому восстановлению «.
Биомиметическое восстановление гранул РНК уже началось, и уже было показано, что нескольких компонентов может быть достаточно для имитации структуры конденсата (Feric et al., 2016, Putnam et al., 2019). Утверждение также, кажется, подразумевает, что знание концентрации каждого фактора поможет идентифицировать такие ключевые компоненты, концепция, которая остается непроверенной ».
Хотя работа, процитированная Feric и Putnam, элегантна, обе используют только два компонента в ядрышках и гранулах P соответственно.Таким образом, степень, в которой они захватывают свойства клеточных структур, неизвестна. Более того, насколько нам известно, не было установлено, что компоненты, используемые в этих реконструкциях, в количественном отношении являются доминирующими компонентами клеточных структур, или что другие компоненты имеют одинаковую концентрацию. Таким образом, опять же, степень, в которой эти воссозданные структуры воспроизводят биологические структуры, является неопределенной. На наш взгляд, важным достижением в биохимическом восстановлении конденсатов, которые очень похожи на клеточные конденсаты, является знание доминирующего (т.е. наиболее концентрированные) компоненты и их динамические свойства in vivo. Обладая этой информацией, можно комбинировать соответствующие молекулы in vitro при их общих клеточных концентрациях и узнать, образуют ли они конденсаты соответствующих концентраций компонентов (как относительных, так и абсолютных) и динамики. Если они соответствуют этим критериям для нескольких компонентов, то можно быть уверенным в том, что биохимия действительно является биомиметической. Без этой предварительной информации человек делает обоснованное предположение о том, какие белки следует комбинировать биохимически и насколько хорошо воссозданная структура имитирует клеточную структуру.
Резюме рецензента: В этой рукописи сообщается о количественном анализе состава тела P в дрожжах. Авторы характеризуют концентрацию, обогащение относительно цитоплазматического пула и динамику 31 зарегистрированного белка P-тельца, меченного GFP. Они идентифицируют 19 белков, которые были достаточно сконцентрированы в P-тельцах в тестируемых условиях, и делят их на два класса: «основная группа», состоящая из 7 белков с высоким обогащением и низкой динамикой, а остальные 12 белков с низким обогащением и высокой динамикой.Авторы утверждают, что эти наблюдения поддерживают модель каркаса / клиента для сборки конденсата, где количество партнеров по взаимодействию для данного белка (валентность) может быть использовано для прогнозирования его обогащения конденсатами / P тел.
Мы тщательно пересмотрели текст и больше не представляем работу как тестирование модели строительных лесов / клиента для сборки конденсата. Фактически, на основе наших данных мы теперь представляем новый, более детальный взгляд на номенклатуру строительных лесов / клиентов, который лучше отражает поведение природных конденсатов и будет более полезным для полевых работ.Мы также удалили анализы, описывающие количественные отношения между обогащением тел P и валентностью взаимодействий. Однако мы утверждаем, что существует значимая качественная взаимосвязь между связностью в сети взаимодействия P-тела и молекулярным поведением, с множеством оговорок, которые теперь подробно описаны в разделе «Обсуждение». Подробнее о каждом из этих вопросов мы расскажем ниже.
Основные опасения рецензентов можно резюмировать следующим образом:
1) Новизна работы не подчеркнута.Ясно, что он более всеобъемлющий, чем предыдущие работы этих авторов, но требует более перспективного и дополнительного тестирования.
Мы тщательно пересмотрели обсуждение, чтобы выделить новые принципы, которые, по нашему мнению, вытекают из наших данных. Во-первых, наша работа — это первый всесторонний количественный анализ состава и динамики любого природного биомолекулярного конденсата. Во-вторых, это количественное определение показало, что, несмотря на большое количество молекул, присутствующих в P-телах, только небольшое количество (7) сильно сконцентрировано там с большими коэффициентами разделения.Это значительно упрощает процесс формирования, регуляции и функции P-телец. В-третьих, количественный анализ показал, что только небольшая часть большинства белков присутствует в P-тельцах, что имеет важное значение для функций конденсатов. В-четвертых, большинство (6 из 7) высококонцентрированных белков / комплексов сильно связаны в сети взаимодействия P-тельцов, и ни один из слабо концентрированных белков сильно связан. Эти корреляции предполагают, что связность играет важную роль в управлении составом структур.Однако важно отметить, что другие факторы, включая сродство связывания и активные процессы, также вносят вклад в молекулярное поведение, и теперь мы объясним такие сложности в нашем обсуждении. Наконец, основываясь на наших данных и других данных в литературе, мы пересмотрели понятие каркасов и клиентов в биомолекулярных конденсатах. Мы утверждаем, что эти термины следует использовать не для классификации молекул на бинарные группы, как мы делали раньше, а скорее как качественные дескрипторы степени, в которой молекула способствует образованию и составу конденсата.Таким образом, молекула должна быть описана как более подобная каркасу или более подобная клиенту, в зависимости от того, имеет ли она больший или меньший эффект соответственно. Такое использование терминов лучше отражает экспериментальные данные, но при этом отражает идею о том, что одни молекулы вносят больший вклад, чем другие, в образование и состав конденсата.
2) Авторам необходимо рассмотреть другие модели для сборки, а не только клиент / скаффолд. Расхождения между данными и их моделью не устранены.Есть несколько подробных экспериментов, которые могли бы сделать больше, чтобы прояснить туманные выводы (см. Ниже). Например, вместо мечения одним флуорофором они могут лучше оценить состав и вариацию с помощью попарного анализа двух флуорофоров.
Теперь мы предлагаем гораздо более детальный взгляд на сборку P-телец, подчеркивая роль сильно связанных молекул (как белков, так и РНК) в производстве конденсата, но также обсуждая важность сродства связывания и других параметров.По просьбе обозревателей мы также выполнили двухцветную визуализацию, чтобы изучить корреляции между обогащением между различными молекулярными парами (новый рисунок 3). Эти данные выявили значительную корреляцию (коэффициент Пирсона 0,6-0,7) между обогащением Dcp2 и Edc3, Pat1 и Xrn1. Корреляция Dcp2-Xrn1 особенно интересна, поскольку неизвестно, как эти два белка связываются друг с другом напрямую, что указывает на корреляции, опосредованные непрямой связностью в конденсате (вероятно, через РНК или другие компоненты ядра P-тельца).Однако корреляции не столь сильны, чтобы предполагать, что стехиометрически определенный комплекс лежит в основе образования Р-телец (модель, предложенная одним из рецензентов). Более того, как мы приводим ниже, существующие данные говорят против модели, в которой РНК является единственной подобной каркасу молекулой в P-тельцах (вторая модель, предложенная в обзоре), так как ряд белков, как было показано генетически, играют важную роль в образование конденсата. Эти вопросы — кооперативность в рекрутинге, возможность стехиометрического комплекса, роли взаимодействий РНК-РНК и РНК-белок и другие факторы — теперь довольно подробно рассматриваются в разделе «Обсуждение» рукописи.Мы надеемся, что этот более подробный взгляд на образование конденсата понравится рецензентам.
3) Могут ли они предоставить какие-либо дополнительные данные или идеи, чтобы пролить свет на несоответствие, которое они указывают между их моделью и результатами для DCP2?
Мы решили эту проблему двумя способами. Во-первых, мы создали дополнительные мутанты Dcp2, чтобы лучше понять, как его связывание с Edc3 контролирует его обогащение P-тельцами (новый рисунок 6). Это приводит к важному выводу, что когда сродство между двумя конденсатными белками низкое, увеличение сродства может увеличить обогащение, но когда сродство уже высокое, его дальнейшее увеличение не увеличивает обогащение.Таким образом, настройка обогащения, вероятно, происходит за счет изменений в режиме низкого / умеренного сродства. Кроме того, как описано выше, новое обсуждение дает более детальное представление о найме, поскольку происходит из комбинации возможности подключения, аффинности и активных процессов. Вместе они объясняют поведение наших мутантов Dcp2. По существу, не все регионы Dcp2 в равной степени способствуют обогащению; удаление элемента связывания с высоким сродством (либо к РНК, либо к Edc3) имеет гораздо более выраженный эффект на обогащение, чем удаление элемента с низким сродством.
Рецензент № 1:
[…] Для дальнейшего улучшения новинки предлагаем дополнительные вопросы, на которые можно было бы ответить:
1) Основным достижением этого исследования является точное измерение концентрации GFP-слитых белков, которое выполняется путем сравнения интенсивности клеточного GFP со стандартными кривыми. Все выводы зависят от этих стандартов и вычитания фона. Несмотря на то, что лаборатория Розена ранее опубликовала статью, в которой использовался аналогичный подход (Banani et al., 2016), подробности этих калибровок и вычитания фона следует указывать в дополнительных материалах.
Мы добавили подробное описание процедуры получения изображения (показано на рисунке 1 — рисунок в приложении 2) и процедур анализа в раздел «Материалы и методы».
2) Чтобы оценить концентрацию белка в Р-тельцах, авторы сделали фундаментальное предположение: все Р-тельца имеют одинаковый и постоянный состав. Однако на Рисунке 1 авторы показали, что основные компоненты Р-телец, которые также являются наиболее распространенными белками, имеют сильную (4-5-кратную) изменчивость по концентрации и коэффициенту распределения.Неясно, как эта изменчивость влияет на относительные количественные характеристики, представленные в этой рукописи (рис. 3). Контрольный эксперимент, который мог бы ответить на этот вопрос, заключался бы в том, чтобы пометить несколько компонентов Р-телец спектрально различными флуоресцентными белками (2 или 3 одновременно) и убедиться, что ожидаемые относительные соотношения повторяются.
Отметим, что при измерении абсолютных концентраций различных видов мы не делали никаких предположений о том, имеют ли P-тела постоянный или переменный состав.Предполагая, что GFP-тегирование не изменяет концентрации данного белка (что подтверждают наши данные на рисунке 1 — рисунок в приложении 3), наши данные охватывают диапазон значений концентрации, взятых для каждого компонента в популяции клеток. Эти данные показывают, что составы имеют существенную изменчивость, как отмечает рецензент.
При интерпретации данных становится важным вопрос относительной изменчивости. Здесь мы благодарим рецензента за предложение многоцветных экспериментов. На новом рисунке 3 мы использовали двухцветную визуализацию для одновременной количественной оценки концентраций трех пар белков в отдельных клетках: Dcp2 / Edc3, Dcp2 / Pat1 и Dcp2 / Xrn1.Мы обнаружили, что во всех случаях концентрации тел P в парах значимо коррелированы (R Пирсона 0,6–0,7). Таким образом, концентрации этих компонентов колеблются вместе (хотя и с некоторой остающейся вариабельностью, поскольку значения R не равны 1). Учитывая высокую взаимосвязь взаимодействий между белками Р-тельцов, мы полагаем, что многие компоненты, вероятно, демонстрируют сходные корреляции, но более обширный анализ этого момента выходит за рамки этого и без того длительного исследования.
Могут ли быть в популяции клеток несколько типов Р-телец с разными композиционными профилями — это сложный вопрос.Мы не видим убедительных доказательств мультимодального распределения в профилях концентрации, что говорит против такой возможности. Но опять же, для всестороннего рассмотрения этой возможности потребуется гораздо больше данных, чтобы оценить, может ли распределение концентраций лучше соответствовать одной или нескольким популяциям.
3) В том же направлении неясно, экспрессировались ли белки, меченные GFP, которые использовались для количественной оценки компонентов Р-телец в фоне dcp1∆, из эндогенного локуса (Таблица 1: YRP1936, yRP2254, yRP2237, yRP2246, yRP2230, yRP1840, yRP1736, yRP2269, yRP1844, yRP1916, yRP1842).Авторы должны указать это, поскольку это будет иметь значительные последствия для количественной оценки, если будет смешанная популяция меченых и немаркированных белков.
Все меченные GFP и mCherry белки, использованные для создания рисунков 1-4, экспрессировались из своего эндогенного локуса. Об этом говорится в основном тексте и в Материалах и методах.
4) На рисунке 2 авторы обнаружили отрицательную корреляцию между скоростью восстановления фракции и концентрацией P-тел.Однако молекулярный механизм этой корреляции не обсуждается. Авторам следует расширить обсуждение и связать его с валентностью взаимодействия.
Как было предложено рецензентом, в Обсуждении мы теперь связываем связность в сети (количество различных молекулярных типов, с которыми взаимодействует данный белок, что связано с валентностью взаимодействия, количество различных молекул, с которыми взаимодействует данная молекула) с Поведение FRAP. Мы заявляем: «За исключением Xrn1 (см. Ниже), все основные белки обладают высокой валентностью взаимодействия (количество взаимодействующих молекул) и высокой связностью с другими белками Р-тельцов и РНК (≥ 4 непосредственно взаимодействующих молекул).[…] Эти функции обычно должны обеспечивать более низкую концентрацию тел P и более быстрый и полный обмен ».
5) На рисунках 4 и 5 авторы измерили коэффициенты разделения нескольких мутантов Dcp2. Было бы важно продемонстрировать, что эти мутации существенно не влияют на стабильность и экспрессию белка, с помощью вестерн-блоттинга этих мутантов.
На рис. 5 — приложение к рисунку 1B и 1C и на рисунке 7 — приложение к рисунку 1A и 1B, теперь мы показываем вестерн-блоттинг почти всех мутантов Dcp2, исследованных под микроскопом.Эти данные показывают, что белки, сравниваемые на одном рисунке, экспрессируются примерно на одном уровне. Мутанты, не исследованные вестерн-блоттингом, исследовали с помощью флуоресцентной визуализации для сравнения общего уровня экспрессии в проанализированных клетках (фигура 6 — рисунок в приложении 1). Мутанты Dcp2, сравниваемые на рисунке 6, действительно экспрессируются на несколько разных уровнях, так что Dcp2C∆5H, который слабо делится на P-тельца, экспрессируется на ~ 30% выше, чем Dcp2C∆5H-h2, который делит намного сильнее (рисунок 6 и рисунок 6 — приложение к рисунку 1).Однако направление этой разницы фактически усиливает наш вывод о том, что нижнее разделение Dcp2C∆5H происходит не из-за пониженной экспрессии.
6) На рисунке 5 авторы предполагают, что декапирующая активность Dcp2 влияет на коэффициент разделения и скорость восстановления. Однако, как авторы упоминают в тексте, неясно, связано ли это с увеличением цитоплазматической мРНК или прямым результатом каталитической активности Dcp2. Эта проблема может быть решена путем экспрессии вариантов Dcp2 в клетках дикого типа и индукции Р-телец с голоданием.
Благодарим рецензента за это предложение. Мы выполнили этот эксперимент, и результаты суммированы на новом рисунке 7. Вкратце, в условиях голодания динамика и распределение количества Р-телец одинаковы для двух мутантов, что позволяет предположить, что эти параметры в основном отвечают на мРНК. уровни при нарушении катализа. Однако общая доля материала в P-тельцах у каталитического мутанта во время голодания все же выше. Таким образом, этот параметр P-телец, по-видимому, является ответом на потерю каталитической активности.Из этих данных мы заключаем, что как увеличение уровней мРНК, так и потеря каталитической активности объясняют поведение мутанта WD.
7) На рис. 7 авторы обнаружили корреляцию между разделением Р-телец и валентностью взаимодействия белков. Это открытие было бы более убедительным, если бы авторы смогли продемонстрировать, что когда валентность взаимодействия белка увеличивается, этот белок становится более концентрированным в Р-телец. Например, это можно сделать путем слияния клиентского белка с доменом каркасного белка, такого как Dcp2C ∆5H.Слитый белок должен обладать большей валентностью взаимодействия, и можно ожидать, что слитый белок будет больше концентрироваться в Р-тельцах. Этот эксперимент также усилит вывод, сделанный на рисунке 6.
Мы удалили рисунок 7 из статьи и больше не обсуждаем количественные отношения между валентностью и разделением. Проблема с вызовом одной только валентности состоит в том, что она игнорирует сродство (проблема, о которой мы упоминали в предыдущем тексте, но не особо подчеркивали), а сродство играет важную роль в разделении Dcp2.В исправленной рукописи мы рассмотрели это двумя способами. Во-первых, мы прямо заявляем, что данные здесь и в литературе показывают, что связывание РНК N-концевым доменом и связывание Edc3 с помощью HLM1 происходит с высокой аффинностью и сильно способствует разделению Dcp2, в то время как C-концевые элементы HLM имеют меньшее сродство и вносят меньший вклад (рис. 5). Во-вторых, мы провели эксперименты, аналогичные предложенным рецензентом. Мы добавили высокоаффинный Edc3-связывающий мотив, HLM1, как к Dcp2 ∆5H, который слабо разделяет, так и к Dcp2 дикого типа, который сильно разделяет.Мы обнаружили, что добавление HLM1 только увеличивает разделение первого белка (рис. 6D). Из этих данных мы заключаем, что когда сродство к Edc3 низкое (Dcp2 ∆5H), добавление дополнительного сайта связывания с высоким сродством может увеличивать разделение Dcp2. Но когда аффинность уже высока (дикий тип Dcp2), дальнейшее ее увеличение не имеет никакого эффекта. Этот результат, вероятно, является общим при рассмотрении рекрутирования белков в конденсаты.
Рецензент № 2:
[…]
Эта модель была получена группой Розена в предыдущем исследовании, в котором изучались свойства разделения фаз in vitro искусственного набора белков с различным количеством низкоаффинных связывающих мотивов (валентность).Модель предсказывает, что «каркасы» (белки, необходимые для сборки конденсата) демонстрируют высокое обогащение и высокую валентность, тогда как «клиенты» демонстрируют низкое обогащение и низкую валентность. В соответствии с моделью авторы отмечают грубую корреляцию между валентностью и обогащением среди исследованных белков тела 19 P (но см. Ниже). Чтобы проверить модель напрямую, они удалили связывающие мотивы в одном предсказанном «высокомалентном» белке Р-телец (Dcp2). Удивительно, но они не обнаружили сильной корреляции между валентностью и обогащением (многие мутанты Dcp2 не лежат в корреляциях на Рисунке 7.Нам непонятно, как разрешить это несоответствие). Они также обнаружили, что некоторые известные клиенты (белки, не необходимые для сборки P-телец) демонстрируют сильное обогащение, вопреки модели. Несмотря на эти несоответствия, авторы продолжают утверждать, что их результаты подтверждают модель каркаса / клиента.
Мы тщательно пересмотрели текст и наш анализ наших данных, чтобы отреагировать на эту критику. Наиболее важно то, что мы удалили рисунок 7 и устранили все обсуждения, связанные с количественной корреляцией между валентностью и концентрацией P-тел.Как утверждает рецензент, одна только валентность не может объяснить наши данные о мутантах Dcp2. Теперь мы представляем гораздо более детальное представление о том, как, по-видимому, определяются концентрация и динамические свойства компонентов P-тела. Мы считаем, что связность взаимодействий (количество типов молекул, с которыми контактирует конкретная молекула) играет важную роль, поскольку большинство (6 из 7) высококонцентрированных белков также сильно связаны (≥4 партнеров по взаимодействию), и все слабоконцентрированные белки имеют низкую связность (≤2 партнеров по взаимодействию).Кроме того, было показано, что большинство (те же 6 из 7) сильно связанных молекул вносят вклад в сборку тел P, и ни одна из молекул с низкой связностью не делает этого. Тем не менее, связность — не единственный фактор, и сродство связывания и активные процессы также могут быть очень важны. В этом свете мы теперь обсуждаем, как взаимодействия N-концевого домена Dcp2 с РНК и элемента HLM1 с Edc3 имеют более высокое сродство, чем другие взаимодействия Dcp2, и, таким образом, играют более важную роль в определении концентрации белка в P-тельцах. (объясняя данные об удалении).Точно так же Xrn1 связывает РНК с высоким сродством. Таким образом, хотя его связность невысока, он сильно сконцентрирован в P-телах и показывает умеренную динамику. Что касается активных процессов, гидролиз АТФ с помощью Dcp2 также вносит вклад в динамику белка. Таким образом, связь важна, но не вся история в определении поведения молекул конденсата. Эти вопросы обсуждаются в новом Обсуждении.
Благодаря этим соображениям мы пришли к другому взгляду на то, как следует использовать понятия «эшафот» и «клиент».Вместо того, чтобы классифицировать молекулы как каркас или клиент, мы теперь считаем, что эти термины следует использовать как дескрипторы. Молекула более подобна каркасу, если она играет большую роль в сборке Р-телец, и более подобна клиенту, если играет меньшую роль. Таким образом, мы можем объяснить тот факт, что разные молекулы по-разному влияют на делецию. Например. РНК, по-видимому, является наиболее подобным каркасу компонентом P-телец, поскольку ее удаление РНКазой разрушает конденсаты (что согласуется с тем фактом, что все 19 компонентов P-телец, количественно определяемые здесь, связывают РНК), в то время как Edc3 и Pat1 менее подобны каркасу, поскольку их делеционные штаммы сохраняют некоторые Р-тельца, хотя и меньшего размера, чем штаммы дикого типа.Напротив, все 12 изученных нами неосновных белков являются клиентоподобными, поскольку ни один из них не продемонстрировал значительного уменьшения сборки P-телец при удалении. Мы отмечаем, что связность (и, вероятно, центральность сети), по-видимому, играет роль в определении того, является ли молекула более похожей на каркас или более похожей на клиента, поскольку все наиболее связанные молекулы подобны каркасу (и более центральны в теле P. сеть взаимодействия) и молекулы с небольшим количеством подключений все похожи на клиентов (и более периферийны в сети).Эти вопросы обсуждаются в новом Обсуждении в новом разделе под названием «Общие принципы строительных лесов и клиентов в природных конденсатах».
Очень удивительно, что авторы не рассматривают другие модели, которые могли бы лучше соответствовать их данным. Одна возможность состоит в том, что РНК функционирует как истинный каркас для Р-телец и что белки рекрутируются в Р-тельца в силу их сродства к РНК или другим белкам, которые связывают РНК. В этом отношении интересно, что компоненты мультибелковых комплексов обнаруживаются в примерно стехиометрических количествах в P-тельцах, что позволяет предположить, что комплексы сохраняются в конденсатах.В этой альтернативной модели высокого сродства к РНК одного белка в комплексе было бы достаточно для обогащения всего комплекса, даже если ни одна из других субъединиц в комплексе не связывается с другими компонентами P-тельца.
Насколько мы понимаем этот комментарий, рецензент предполагает, что Р-тельца образуются посредством взаимодействий между мРНК, а затем эти мРНК рекрутируют коровые белки Р-тельца за счет связывания РНК с высоким сродством. Однако несколько наблюдений в литературе опровергают эту модель.Например, как мы указываем в рукописи, формирование Р-телец явно требует белок-белковых взаимодействий, поскольку генетически показано, что Dcp2, Edc3, Dhh2, комплекс Lsm1-7 и Pat1 способствуют образованию Р-телец (например, Decker et al. , 2007; Sheth, Parker, 2006; Hondele et al., 2019; Rao, Parker, 2017). Более того, механизмы, с помощью которых белки способствуют образованию P-телец, могут быть напрямую связаны со специфическими белок-белковыми взаимодействиями, такими как димеризация Edc3 (Ling et al., 2008).Кроме того, некоторые белки нуждаются в других компонентах Р-телец для их повторного превращения в Р-тела. Напр., Dcp1 требует, чтобы Dcp2 рекрутировался в P-тела, а комплекс Lsm1-7 требует Pat1 (Teixeira and Parker, 2007). Таким образом, образование Р-телец и привлечение основных компонентов Р-телец к Р-тельцам требует взаимодействия белков.
Мы согласны с рецензентом в том, что РНК способствует образованию Р-телец. Явные данные свидетельствуют о том, что для образования Р-телец необходим пул нетранслирующих мРНК (Teixeira et al., 2005). Одна очевидная роль РНК состоит в обеспечении сайтов связывания для взаимодействующих белков, тем самым обеспечивая сборку Р-телец. В этой роли мы согласны с тем, что РНК функционирует подобно каркасу. Способствует ли РНК также образованию Р-телец посредством межмолекулярных взаимодействий РНК-РНК, еще предстоит установить. Тем не менее, модель, в которой РНК является единственным каркасом, который просто связывает белковые компоненты P-телец, маловероятна. Чтобы прояснить этот вопрос в рукописи, мы добавили этот аргумент в новое Обсуждение.
Более того, как описано выше, мы теперь представляем гораздо более подробный и детализированный вид сборки P-тела, который не зависит от простой бинарной классификации молекул как каркасов, так и клиентов. В пересмотренном Обсуждении также рассматривается вторая модель, предложенная здесь рецензентом, согласно которой высококонцентрированные белки образуют стехиометрический комплекс, который затем собирается на РНК с образованием более крупной структуры. Стехиометрический комплекс будет демонстрировать чрезвычайно высокую кооперативность при рекрутировании в P-тела, поскольку все элементы будут входить или выходить вместе.Хотя новый рисунок 3 действительно показывает корреляции между концентрациями Dcp2 в теле P с Edc3, Pat1 и Xrn1, корреляции недостаточно высоки (значения R Пирсона 0,6-0,7), чтобы предполагать стехиометрически определенную сборку, даже если белки имеют примерно равные значения. средние концентрации в конденсате. Кроме того, концентрации P-телец Pat1 и комплекса Lsm1-7 снижаются примерно в два раза в штаммах дикого типа в условиях голодания по глюкозе по сравнению со штаммами dcp1Δ , что снова говорит против дискретной сборки.Эти аргументы представлены в новом абзаце Обсуждения.
Авторы также утверждают, что их анализ показывает, что относительно небольшое количество основных белков (7) составляет большую часть содержания белка в P-тельцах. Однако, поскольку другие компоненты P-тела, возможно, еще не обнаружены, это утверждение может быть только приближенным в настоящее время. Более того, даже если это правда, значение этой гипотезы неясно — белки, присутствующие в низких концентрациях в P-тельцах, могут играть важную роль.
Мы удалили это утверждение из текста.
В заключение, хотя в этом обзоре документируются концентрации и динамика значительного количества белков P-тела, оно, по-видимому, не дает существенного понимания «правил», которые регулируют состав P-тела. Модель, предложенная авторами, не согласуется с данными, и другие более правдоподобные модели не рассматриваются.
Как описано в нашем ответе на первый сводный комментарий в верхней части этого обзора, мы чувствуем, что наша работа выявила ряд новых и важных принципов, касающихся формирования и состава P-тел.В новом тексте представлено гораздо более подробное описание сборки P-тела, которое теперь согласуется со всеми нашими данными, и рассматривает множество различных механистических проблем и возможностей.
Рецензент № 3:
[…]
— Предел новизны. Уже было известно, что эти 9 белков являются основными белками P-тельца, которые также играют некоторую роль в функции P-тельца. Эти более ранние исследования также уже показали, что некоторые из этих белков содержат несколько доменов взаимодействия, через которые взаимодействуют компоненты P-тельца.
Как описано в ответе на Сводный пункт 1 в верхней части этого письма, мы считаем, что наша работа является новой во многих отношениях, включая то, что она является первым всеобъемлющим количественным анализом любого биомолекулярного конденсата. С помощью этого количественного анализа мы выявили два различных класса молекул на основе концентрации в структурах, чего нельзя было вывести из предыдущей работы, а также важную идею о том, что почти для всех компонентов только небольшая часть молекул присутствует в P тела.Анализ этих данных в свете известных молекулярных взаимодействий также выявил корреляции между физическим поведением компонентов P-тел и их молекулярной связностью, аффинностью связывания и активностью гидролиза АТФ. Опять же, это не могло быть выведено из предыдущих данных, поскольку они по своей сути зависят от нашего количественного анализа. Если рецензент сможет указать нам на соответствующую литературу, в которой документируется, что основные белки Р-телец, которые мы определяем как высокообогащенные, имеют более высокие коэффициенты разделения, чем другие идентифицированные компоненты Р-телец, мы были бы счастливы соответствующим образом отредактировать нашу рукопись.
— Пределы количественного анализа. Конфокальный анализ имеет четкие пределы пространственного разрешения, а количественные измерения основаны на интенсивности флуоресценции, а не на измерениях отдельных молекул. Поскольку все компоненты помечены одним и тем же флуорофором (GFP), нельзя использовать парный анализ или анализ более высокого порядка для определения различий между гранулами, занятости белков, корреляции между белками, чтобы, например, проверить, все ли компоненты находятся в грануле одновременно. , и с аналогичной концентрацией.
Как подробно описано выше, мы выполнили двухцветную визуализацию нескольких пар белков P-телец и обнаружили существенную кооперативность между их обогащением. Это привело нас к более детальному рассмотрению сборки P body, которая описана в практически полностью переписанном разделе «Обсуждение» рукописи.
— Неясная актуальность анализа DCP2. Анализ DCP2, похоже, не сильно улучшает выводы статьи. Вместо того, чтобы показывать, что этот белок поливалентен, как было показано в прошлом путем разделения доменов других белков «каркаса», было бы информативно, если бы авторы предоставили, действительно ли «клиентские» белки имеют меньше доменов взаимодействия.
Наш анализ Dcp2 проанализировал механизмы, с помощью которых он обогащается внутри P тел. Хотя понятие многовалентности было продемонстрировано и для др. Белков, это рассмотрение предоставляет полезную информацию о Dcp2. Кроме того, в исследованиях Dcp2 мы обнаружили два ранее неизвестных свойства, которые, вероятно, имеют отношение к компонентам других конденсатов. Во-первых, мы обнаруживаем, что два фрагмента белка, которые только слабо разделяются на P-тельца по отдельности, при слиянии вместе сильно и совместно разделяются.Это происходит, даже если фрагменты связываются с разными компонентами P-тел, и, таким образом, не то же самое, что простая авидность. Когда мы приступили к работе, этот результат был для нас далеко не очевиден. Во-вторых, в новых данных, представленных на новом рисунке 6, мы обнаруживаем, что добавление элемента, связывающего Edc3 с высоким сродством к белку Dcp2, только увеличивает разделение на P тельца, когда Dcp2 имеет низкое сродство к Edc3. Когда сродство уже высокое, добавление дополнительных элементов привязки не имеет никакого эффекта. Таким образом, разделение компонента конденсата может быть насыщенным, вероятно, из-за ограниченных концентраций партнеров по связыванию.Опять же, это не был очевидный результат, когда мы начали эти эксперименты.
Что касается белков с поведением, подобным клиентскому (см. Ответ на пункт 1 сводки для нашего нового способа использования этого термина), как подробно описано выше, мы показываем в таблице 3 и на рисунке 2 — добавлении к рисунку 3, что все молекулы, которые слабо сконцентрированы в P Тельца имеют низкую связь с другими белками Р-телец и, как известно, не вносят значительный вклад в сборку Р-телец. Итак, действительно, поведение, подобное клиенту, коррелирует с ограниченным взаимодействием с другими компонентами тела Р.Корреляция не всегда верна в противоположном направлении. То есть существует небольшое количество белков, которые имеют лишь несколько связей с другими компонентами P-телец, но при этом сильно сконцентрированы в конденсате (Xrn1, Dcp1 и Pby1). Эти белки, как известно, обладают высоким сродством к другому высококонцентрированному компоненту P-тельца, который их рекрутирует. Эти вопросы теперь подробно рассматриваются в нашем обновленном Обсуждении.
[Примечание редакции: до принятия были предложены дальнейшие исправления, как описано ниже.]
Редакций:
Рецензенты сочли, что рукопись и работа вносят вклад в эту область, но необходимы некоторые исправления, чтобы учесть оговорки при интерпретации данных. Например, рецензент 2 считает, что термин «кооперативность» надлежащим образом не подтверждается данными и что мРНК не рассматривается как компонент P-телец.
Мы изменили описание данных на рисунке 5F, источника этого утверждения, на «синергетический», в котором говорится, что эффект объединения двух компонентов вместе приводит к большему эффекту, чем сумма компонентов по отдельности.В случае Dcp2 конструкция Dcp2 300Δh2 имеет ПК, равное 2,5, а конструкция Dcp2C Δ5H имеет ПК, равное 3,5, в то время как конструкция Dcp2Δh2 Δ5H, которая объединяет Dcp2 300Δh2 и Dcp2C Δ5H, имеет ПК 31, что> 2,5 *. 3.5. Таким образом, система соответствует определению синергии. Теперь отметим, что этот эффект может быть результатом кооперативного связывания с молекулами в теле P.
В рукописи РНК упоминается как важный компонент P-тельца. Мы считаем, что этого достаточно, особенно с учетом того, что статья сосредоточена на описании белков Р-тел, а не РНК.
Reviewer 3 считает, что функциональные свойства недостаточно изучены, особенно с учетом специфичности (почему исключены некоторые мРНК и RBP?).
Наше исследование не пытается рассмотреть функцию P-тел. Это сложный вопрос, который потребует гораздо больше и других данных, чем мы реально можем поместить в рукопись. Наша работа действительно затрагивает специфичность рекрутирования белков в значительной степени посредством идеи синергетического рекрутирования Dcp2 в P тельца.То есть, резидентные белки часто содержат несколько слабых элементов рекрутирования, и, следовательно, белки, которые содержат мало таких элементов, рекрутируются плохо, если вообще рекрутируются. Рекрутирование РНК может следовать схожим принципам, и теперь мы прямо упоминаем эту идею.
Рецензент № 2:
В этой в значительной степени отредактированной рукописи авторы сообщают о всесторонней количественной оценке составляющих белков биологического конденсата, обедненных Dcp1 Р-телец дрожжей. Благодаря этому они идентифицировали семь белков «ядра» P-тельцов, которые существенно разделены, имеют высокую концентрацию и медленную подвижность при обогащении P-тельцами (рис. 1 и 2).Концентрация этих семи белков в тельцах P положительно коррелирует, что согласуется с предыдущими данными, показывающими, что эти белки взаимодействуют биохимически (рис. 3). Сообщенные параметры обогащения кажутся похожими, когда обедненные Dcp1 P-тельца сравниваются с P-тельцами дикого типа в условиях глюкозного голодания, однако Dcp1 и его партнер по связыванию Pby1 отсутствуют, и деградация РНК дефектна в модели P-тельцов, используемой на протяжении всего анализа. Таким образом, хотя на уровне их биофизического анализа P-тела, обедненные Dcp1, кажутся похожими на P-тела в физиологических условиях, функционально эти «P-тела» различны.Это снижает актуальность данного исследования.
Автор обзора прав в том, что мы изучали Р-тельца в 2 различных условиях, только одно из которых является диким типом. Отметим, что это не полностью отличается от большинства исследований в этой области. Например, большинство анализов стрессовых гранул индуцируют в них мышьяк, токсин, который редко встречается в естественной биологии. Многие другие исследования связаны с избыточной экспрессией отдельных компонентов, что также является нефизиологической ситуацией.Тем не менее, такой анализ имеет существенное значение для понимания принципов, по которым собирается конденсат, и мы чувствуем, что наше исследование проводится в том же ключе. В то время как Dcp1 — / — P тельца и P тельца дикого типа, лишенные глюкозы, могут иметь разные функции, что поразительно, так это то, что их составы тесно связаны. Кроме того, сохраняются ключевые паттерны состава — небольшое количество высококонцентрированных белков и большее количество слабоконцентрированных белков — что является важной особенностью этих клеточных структур, которая, насколько нам известно, не была исследована в других местах (даже 3 недавно опубликованных Cell в статьях о стрессовых гранулах указаны только коэффициенты распределения, в которых отсутствует информация относительно абсолютных концентраций, указанных здесь).
На рис. 4 авторы наблюдают, что концентрации корового белка в Р-теле в значительной степени не зависят от стрессовых условий, однако авторы рассматривали только белковые компоненты, в то время как регулируемым субъектом стрессовых Р-телец являются мРНК, а не белки.
Мы заявляем, что наши данные не касаются изменений в содержании мРНК во время голодания: «… они также не говорят о секвестрации / хранении РНК…». Мы также отмечаем, что основной смысл рисунка 4 состоит в том, чтобы показать, что для большинства белков Р тельца существенно не истощают количество молекул из цитоплазмы, не сравнивая Dcp1 — / — и Р тельца дикого типа, лишенные глюкозы.Если обозреватель заинтересован, недавние результаты, полученные на клетках млекопитающих, предполагают, что состав мРНК P-тельца, по-видимому, в значительной степени регулируется скоростью их трансляции, возможно, с дополнительным вкладом от длины поли (A) хвоста (Matheny et al., 2019) .
Затем авторы анализируют локализацию P-тельца DCP2 в двойном нуль-мутанте Dcp1, Dcp2, который все еще образует некоторые P-тела (хотя на рис. S1A показано только присутствие небольших структур, подобных «P-тельцам», но без количественного сравнения с контрольными P-тельцами, в дикого типа при голодании по глюкозе и истощении Dcp1).
Мы не совсем уверены, о чем здесь спрашивает рецензент, поскольку мы количественно оценили PC и динамику для различных повторно экспрессируемых мутантов Dcp2. Теперь мы количественно оценили распределение по размеру точки Edc3 в двойном нулевом мутанте Dcp1, Dcp2, показанном на рисунке S5A (рисунок S1A не имеет отношения к этим экспериментам; мы предполагаем опечатку от автора обзора), и сообщаем, что на рисунке 5 — дополнение 1А.
В исследованиях делеций авт. Обнаруживают, что различные домены Dcp2 вносят вклад в разделение P тел и демонстрируют некоторую избыточность между доменом h2 и др. Спиральными доменами в CTP.Авторы приходят к выводу, что элементы в Dcp2 действуют «кооперативно». Однако их данные показывают аддитивность или, в лучшем случае, синергию, но не кооперативность. Чтобы использовать термин кооперативность, авторам необходимо продемонстрировать, что начальное событие связывания увеличивает сродство связывания последующих событий связывания.
Как указано выше, мы изменили наше описание данных на рисунке 5F, источника этого утверждения, на «синергетический», в котором говорится, что эффект объединения двух компонентов вместе приводит к большему эффекту, чем сумма компонентов по отдельности.В случае Dcp2 конструкция Dcp2 300Δh2 имеет ПК, равное 2,5, а конструкция Dcp2C Δ5H имеет ПК, равное 3,5, в то время как конструкция Dcp2Δh2 Δ5H, которая объединяет Dcp2 300Δh2 и Dcp2C Δ5H, имеет ПК 31, что> 2,5 *. 3.5. Таким образом, система соответствует определению синергии. Теперь отметим, что этот эффект может быть результатом кооперативного связывания с молекулами в теле P.
Авт. Используют исследование структуры-функции DCP2, чтобы доказать, что связность, аффинность и каталитическая активность являются тремя основными факторами для рекрутирования DCP2 P телец и размера и количества P телец.Однако необходимо провести более конкретные эксперименты, чтобы укрепить этот аргумент или обобщить открытие для других компонентов P-телец или других типов RNP-телец: 1) проведение исследования делеции домена / сайта связывания на Edc3 или других основных белках; 2) добавление валентного или высокоаффинного сайта связывания к клиентоподобному белку, чтобы превратить его в каркас (достаточность). 3) Тестирование модели с белками каркаса стрессовых гранул.
Мы согласны с тем, что наши аргументы будут подкреплены дополнительными экспериментами, которые запланированы для дополнительных проектов и публикаций в будущем.
В целом, это исследование технически выполнено хорошо, но довольно ограничено по своему содержанию или новизне. Истинное функциональное считывание отсутствует, поскольку экспериментальная установка не связана с функцией P-тельца (например, уровнем РНК в различных гранулах и активностью по удалению колпачков). Рукопись можно легко сжать до четырех рисунков, каждая из которых представляет собой одну точку для характеристики конкретного типа конденсата: Рисунок 1 и 2: обогащение определенных факторов в P-телах, Рисунки 3 и 4 соотношение концентраций между компонентами и в различных условиях. и рисунки 5 и 6, структурный анализ одного компонента, предполагающий частичную избыточность между CTD-спиралями, и рисунок 7 с исследованиями, касающимися связывания РНК.
Мы согласны с тем, что мы не пытались рассматривать функцию тела P в этой работе. Мы считаем, что такой анализ потребует отдельной публикации. Учитывая отсутствие ограничений по цифрам в eLife , мы не сжимали данные в меньшее количество цифр, так как мы опасаемся, что это затруднит чтение и понимание статьи (например, рисунок 4 не предназначен для сравнения различных условий, но скорее, чтобы подчеркнуть, что большинство молекул не присутствует в P-тельцах для большинства видов.Отсюда его название: «Р-тельца не сильно изолируют свои резидентные белки».
Рецензент № 3:
В этой отредактированной рукописи Xing et al. проанализировать обогащение и динамические свойства белков тельца ~ 20 P в дрожжах. Описательная часть исследования достаточно обширна (31 белок включен в первоначальный обзор, 19, численность которых была определена количественно) и предполагает существование двух групп: белки, сильно обогащенные P-тельцами, некоторые из которых также необходимы для сборки P-телец — и менее обогащенные белки — меньшее количество которых влияет на сборку P-телец.Исходя из этого, авторы предполагают, что P-тельца «биохимически проще, чем предполагает протеомика». В лучшем случае это предположение, а в худшем — грубое упрощение, поскольку изобилие не обязательно является предиктором функции — особенно для ферментов.
Для ясности мы изменили вывод на «композиционно проще, чем предполагает протеомика». Это должно устранить основную озабоченность рецензента. Однако мы отмечаем, что наши данные на рисунке 4 противоречат утверждению рецензента о том, что численность не предсказывает функцию.Этот рисунок показывает, что для почти всех белков, обогащенных P-тельцами, подавляющее большинство молекулярных видов составляют , а не в организме, а скорее присутствуют в цитоплазме. Для всех молекул, кроме 6 верхних, менее 20% находится в теле, даже при консервативной поправке на ненаблюдаемые субдифракционные Р-тела (без этой поправки значение падает до 8%). Таким образом, трудно утверждать, что количество P-тельца имеет большое значение для общей активности этого вида в клетке.Есть способы обойти эту проблему, включая, например, огромное увеличение удельной активности (активности на молекулу) внутри P-тельца по сравнению с цитоплазмой или совместную концентрацию нескольких молекул в каскаде. Но это требует дополнительных предположений, и, по нашему мнению, точка зрения первого порядка состоит в том, что изобилие действительно играет важную роль в определении биохимических функций, возникающих из конденсатов, и, поскольку только небольшое количество молекул является высококонцентрированным, компартменты фактически являются , вероятно, будет биохимически проще, чем можно представить из исследования протеомики, которое не определяет концентрации и, таким образом, по существу взвешивает все компоненты одинаково.
Во второй части исследования авторы исследуют домены в DCP2, необходимые для локализации P тела, и идентифицируют множественные домены, которые, по-видимому, функционируют частично избыточно. Они пришли к выводу, что совокупность синергических взаимодействий управляет сборкой P-телец, что было сделано несколькими другими исследованиями (рассмотренными в Lu Na and Slavoff, 2018), включая анализы in vitro (Shutz et al., 2017).
В целом, у нас осталось исследование, которое будет полезным справочным материалом для будущих исследований тела P, но оно не соответствует обещанию «принципов состава и специфичности».В частности, вопрос специфичности (почему не все РНК-связывающие белки локализуются в P-тельцах?) Напрямую не рассматривается. Авторы проводят исследования структуры-функции только одного белка Р-тельца и никогда не рассматривают, что исключает другие РНК-связывающие белки из Р-тельцов.
Как указано выше, мы считаем, что наша работа действительно затрагивает специфичность рекрутирования белков в значительной степени посредством идеи синергетического рекрутирования Dcp2 в P тельца. То есть, резидентные белки часто содержат несколько слабых элементов рекрутирования, и, следовательно, белки, которые содержат мало таких элементов, рекрутируются плохо, если вообще рекрутируются.Рекрутирование РНК может следовать схожим принципам, и теперь мы прямо упоминаем эту идею.
Наша работа также предполагает, что другие связывающие РНК белки действительно накапливаются в Р-тельцах, но их уровень просто отражает количество доступных сайтов связывания в мРНК Р-тельцов. В частности, хотя РНК-связывающий белок MS2 обычно не накапливается в Р-тельцах, добавление множества сайтов связывания для этого белка в мРНК, резидентную в Р-тельцах, может привести к накоплению MS2 в Р-тельцах.Во-вторых, мы действительно наблюдаем другие РНК-связывающие белки в Р-тельцах, просто они менее эффективно делятся на Р-тельца, чем основные компоненты (рис. 1).
Отметим, что исключение молекул из конденсата (PC <1) будет очень сложно наблюдать и значимо количественно оценить в клетках, учитывая небольшой размер структур. Более того, более вероятно, что большинство молекул просто не будет задействовано (PC ~ 1), чем будет открыто исключено; мы не знаем о молекулах, исключенных из P-тел.В общем, физические механизмы, которые позволяют исключить образование конденсатов in vivo, вообще не поняты и выходят далеко за рамки настоящего исследования.
Мы также отмечаем, что, насколько нам известно, это первый раз, когда синергизм был количественно продемонстрирован для рекрутирования белка в конденсат in vivo. Упомянутая выше работа Sprangers интересна, но проводится исключительно in vitro. В клетках, чтобы заявить о синергии, необходимо удалить белок, а затем количественно оценить коэффициенты разделения для различных фрагментов при повторном введении индивидуально и вместе, как мы это сделали.Нам неизвестно, чтобы такой уровень количественного анализа проводился где-либо еще.
Дополнительные комментарии:
1) Авторы не последовательны в описании CTD. Во-первых, они предполагают, что «N-концевой домен, HLM1 и C-концевой домен все необходимы для эффективного разделения и поддержания характерной медленной динамики Dcp2». Однако позже они говорят, что «удаление CTD не влияет на ПК с полноразмерным Dcp2». Представленные данные предполагают, что C-концевой домен не требуется (300-конец), но может компенсировать отсутствие HLM1.
Благодарим рецензента за обнаружение этого несоответствия. Мы изменили первое утверждение на «Поскольку N-концевой домен и HLM1 необходимы для эффективного разделения и поддержания характерной медленной динамики Dcp2, а C-концевой домен может компенсировать отсутствие HLM1, мы заключаем, что элементы, управляющие разделением и динамика распределяется по белку ».
2) Неповрежденный C-концевой домен никогда не тестируется; вместо этого авторы использовали CTD с 5 мутированными доменами HLM.Хотя авторы подразумевают, что эта версия CTD имеет более слабую связь с телами P, данные не показаны, и из текста неясно, почему была использована эта версия CTD.
У нас были эти данные, и теперь мы показываем их на рисунке 5 — рисунок в приложении 1С.
3) Для данных на фиг. 7 авторы используют конструкции DCP2 с пониженным связыванием с Edc3, чтобы исследовать роль связывания РНК и активности снятия колпачков в ассоциации P-телец. Однако неясно, почему связывание РНК изучали с использованием мутанта Dcp2 300, а декапирование изучали на мутанте Dcp2Δh2.
По сути, это были исторические особенности работы, связанные с тем, когда мы получали различные конструкции. Мы не считаем, что различия здесь влияют на наши выводы.
4) Рисунок, сравнивающий концентрацию / коэффициент распределения тел P и скорости обмена для различных мутантов DCP2 (аналогично рисункам 2A и B), может быть более интуитивным способом сравнения всех различных мутантов DCP2, использованных в этом исследовании.
Мы считаем, что, хотя такой сюжет в некоторых отношениях может помочь, в других он отвлекает внимание, и не включает его.Принципиальный недостаток состоит в том, что на рисунке 2 мы специально подчеркиваем корреляцию между концентрацией тел P и обменными курсами. Но точки на рисунках 5 и 6 отличаются, и они сосредоточены на понимании различных аспектов рекрутирования Dcp2.
5) Исследования структурной функции DCP2 идентифицируют домены в DCP2, которые способствуют локализации P-телец. Достаточно ли этих доменов, чтобы направить белок, не являющийся P-телом, в P-тельца, не решается. Без таких «достаточных» экспериментов остается неясным, можно ли обобщить результаты для DCP2 для других белков.Например, они предполагают, что Xrn1 стабильно рекрутируется из-за его высокой аффинности связывания РНК, однако эта гипотеза не объясняет, почему другие высокоаффинные связывающие РНК белки исключаются из P тельцов.
В этом комментарии рассматриваются два момента. Во-первых, могут ли домены внутри Dcp2, которые способствуют локализации P-телец, действовать доминирующим образом. По сути, мы продемонстрировали этот феномен с GFP как чужеродным белком. Связанный с этим вопрос, но один выходит за рамки этой рукописи: может ли нацеливающий домен P-тельца Dcp2 перекрывать свойства других связывающих РНК белков, которые либо исключают их из P-тельцов, либо нацеливают эти связывающие РНК белки на другие конденсаты.Мы согласны с тем, что это будет интересный вопрос, и рассмотрим его в будущей работе.
Второй момент, который поднимает рецензент, заключается в том, что мы не понимаем, почему другие связывающие РНК белки, которые могут связывать РНК с высокой аффинностью, не сильно разделяются на Р-тельца. Два наблюдения предполагают, что другие связывающие РНК белки действительно накапливаются в Р-тельцах, но их уровень просто отражает количество доступных сайтов связывания в мРНК Р-тельцов. В частности, хотя РНК-связывающий белок MS2 обычно не накапливается в Р-тельцах, добавление множества сайтов связывания для этого белка в мРНК, резидентную в Р-тельцах, может привести к накоплению MS2 в Р-тельцах.Во-вторых, мы действительно наблюдаем другие РНК-связывающие белки в Р-тельцах, просто они менее эффективно делятся на Р-тельца, чем основные компоненты (рис. 1).
6) В конце обсуждения авторы вводят концепцию авидности, когда множественные взаимодействия приводят к сильному связыванию. Возможно, будет полезно познакомить вас с этой концепцией раньше.
Теперь мы представили идею жадности в разделе результатов на рисунке 5.
https://doi.org/10.7554 / eLife.56525.sa2Механизмы разборки реплисом эукариот | Сделки Биохимического Общества
Клетки почкующихся дрожжей, лишенные Dia2 ( dia2 Δ клеток), сохраняют реплисомы на хроматине через митоз и в G1 следующего клеточного цикла [18], указывая тем самым, что разборка CMG у почкующихся дрожжей контролируется только одним путем. Однако это не относится к высшим эукариотам, где недавние работы показали существование Cullin2 LRR1 -независимых путей для разборки CMG.Было показано, что в отсутствие активности Cullin2 LRR1 терминированные реплисомы остаются на хроматине во время S-фазы, но вступление в митоз приводит к быстрой разборке реплисом, что указывает на активацию митотического специфического пути (Рисунок 4A) [19,39 , 40]. На этом пути убиквитинлигаза TRAIP отвечает за убиквитилирование Mcm7 и разборку CMG [39,40]. В отличие от S фазы, убиквитиновые связи, необходимые для митотического пути разборки реплисом, включают lysine 6 (K6) и lysine 63 (K63), и в целом паттерн убиквитилирования отличается, согласуясь с более длинными цепями, собираемыми на Mcm7 в митозе [40].В настоящее время мы не знаем, требует ли этот путь убиквитилирования других компонентов CMG. В отличие от Cullin2 LRR1 , TRAIP конститутивно связан с реплисомой [20,41] и его активация во время митоза, по-видимому, регулируется механизмом, который не включает его рекрутирование de novo в реплисому. Этот митотический путь разборки реплисом также требует активности p97 [39,40] и других факторов, которые были идентифицированы у эмбрионов C. elegans , включая кофакторы p97 UFD-1-NPL-4 и UBXN-3 (гомолог червя супрессор опухолей позвоночных Faf1), а также протеазу SUMO ULP-4 (червь, гомолог протеазы SUMO SENP6 / 7 позвоночных) [19].Точные роли UBXN-3 и ULP-4 в разборке митотических реплисом еще предстоит выяснить. Однако неудивительно, если будет обнаружено, что для этого митотического пути требуется еще больше кофакторов p97, поскольку кажется вероятным, что разные кофакторы будут способствовать распознаванию различных связей убиквитина. Было бы интересно исследовать, играет ли Faf1, как в C. elegans , какую-либо роль в разборке митотических реплисом у др. Многоклеточных животных. Роль пути SUMO во время разборки митотической реплисомы была изучена в экстракте яиц Xenopus , и было показано, что на последний не влияет усиленная конъюгация SUMO или ингибирование деконъюгации SUMO.Более того, ингибирование конъюгации SUMO также не влияет на разборку митотических реплисом, указывая тем самым, что активность пути SUMO не важна для разборки реплисом во время митоза в этой модельной системе [40]. Следовательно, участие ULP-4 во время разборки митотической реплисомы в C. elegans может быть ограничено этим организмом, или не повторяться в яичном экстракте Xenopus , или его ферментативная активность просто не требуется для разборки митотической реплисомы; вместо этого он может опосредовать белок-белковые взаимодействия.
Состав кинетохор и их функции: уроки дрожжей | Обзоры FEMS Microbiology
Аннотация
Правильная сегрегация хромосом во время деления клеток важна для пролиферации, и этому способствуют кинетохоры, большие белковые комплексы, собранные в центромерной области хромосом. Хотя последовательности центромерной ДНК полностью различаются у разных организмов, многие компоненты кинетохор, собранные на центромерах, очень хорошо законсервированы среди эукариот.Чтобы определить идентичность центромер, центромерный белок A (CENP-A), который гомологичен каноническому гистону h4, действует как ориентир для сборки кинетохор. Кинетохоры обеспечивают прикрепление веретена к микротрубочкам и контролируют движение хромосом во время митоза и мейоза. Чтобы провести точную сегрегацию хромосом, сборка кинетохор и прикрепление микротрубочек тщательно регулируются. Здесь мы рассматриваем текущее понимание состава, сборки, функций и регуляции кинетохор, выявленное в основном в результате исследований делящихся и почкующихся дрожжей.Более того, поскольку недавние кумулятивные доказательства подтверждают важность регуляции ориентации прикрепления кинетохор к микротрубочкам, которая отчетливо различается между митозом и мейозом, мы уделяем особое внимание молекулярным механизмам, лежащим в основе этой регуляции.
Введение
Для передачи генетической информации дочерним клеткам реплицированные хромосомы, называемые сестринскими хроматидами, должны быть точно разделены. Динамический процесс сегрегации хромосом обеспечивается взаимодействием хромосома-микротрубочка через кинетохоры, сформированные на центромерной ДНК.Недавние исследования выявили молекулярные детали компонентов и функций кинетохор. Почкующиеся дрожжи Saccharomyces cerevisiae и делящиеся дрожжи Schizosaccharomyces pombe могут быть лучшими модельными организмами в этой области из-за их относительной простоты. Однако у этих двух дрожжей очень разные центромерные структуры. У почкующихся дрожжей есть точечная центромера, определяемая последовательностью 125 пар оснований CEN (Clarke & Carbon, 1980), тогда как у делящихся дрожжей центромерная ДНК охватывает более 40 т.п.н. ДНК (Chikashige et al ., 1989), собирая региональную центромеру, которая больше похожа на таковую у высших эукариот (Cleveland et al ., 2003; Black & Bassett, 2008). Хотя особенности центромерной ДНК совершенно разные, многие компоненты кинетохор, собранные на центромерах, очень хорошо сохраняются во всех организмах. В этом обзоре мы обрисовываем текущее состояние исследований кинетохор дрожжей.
Определение местоположения кинетохоры
Хотя последовательность центромерных ДНК сильно различается у разных видов, центромерные нуклеосомы обычно содержат вариант гистона h4 Cse4 / Cnp1 / CENP-A (рис.1) (обзор, в частности, Kitagawa & Hieter, 2001; Henikoff & Dalal, 2005; Black & Bassett, 2008; Wang et al. ., 2008). Нуклеосомы CENP-A функционируют как каркас, на котором собираются другие кинетохорные белки. Точечная центромера почкующихся дрожжей предоставляет отличную модель для изучения того, как определяется центромерная область (Meluh et al ., 1998). В ДНК CEN почкующихся дрожжей есть три консервативных элемента: CDE (центрерный элемент ДНК) I , CDEII и CDEIII (Kiermaier et al ., 2009). Предыдущие исследования выявили несколько факторов, которые напрямую связаны с этими регионами. CBF1 (фактор связывания центромеры 1), спираль-петля-спираль, связывается с CDEI , тогда как CBF3, который включает четыре белка, Ndc10, Ctf13, Cep3 и Skp1, связывается с областью CDEIII (Connelly, 1996; Cam et al ., 2008; Sarkar et al ., 2013). Важно, что CBF3 необходим для ассоциации CENP-A с центромерной ДНК, возможно, посредством прямого взаимодействия между Ndc10 и шапероном CENP-A Scm3 (Cho & Harrison, 2012).В отличие от точечных центромер, региональные центромеры, наблюдаемые у делящихся дрожжей и высших эукариот, определяются эпигенетическими механизмами, а не самой последовательностью ДНК. В соответствии с этим функциональная неоцентромера (центромера, сформированная в нецентромерном сайте на хромосоме) может формироваться, если эндогенная центромерная ДНК теряется (Ishii et al ., 2008). Центромеры делящихся дрожжей, как и у большинства высших эукариот, состоят из центральной области ядра ( cnt и imr ), где существуют Cnp1-содержащие нуклеосомы, и фланкирующих повторяющихся последовательностей ( или ), которые собирают гетерохроматин (рис.1) (Оллшир, 1995). Центромера человека намного длиннее ( c . 0.5-4.0 Mb) и содержит альтернативные блоки нуклеосом CENP-A и нуклеосомы канонического гистона h4 (Рис. 1) (Wevrick & Willard, 1989; Willard, 1990).
Рисунок 1
Разнообразие центромерной структуры и распределение нуклеосом CENP-A среди эукариот. Схематическое изображение центромер у почкующихся дрожжей ( Saccharomyces cerevisiae ), делящихся дрожжей ( Schizosaccharomyces pombe ) и человека.У почкующихся дрожжей есть точечная центромера, которая определяется последовательностью 125 пар оснований и занята единственной нуклеосомой CENP-A (CSe4). Schizosaccharomyces pombe и человек имеют региональные центромеры, фланкированные перицентромерным гетерохроматином. В Schizosaccharomyces pombe множество нуклеосом, содержащих CENP-A (Cnp1), собраны в уникальные последовательности ( cnt и imr ). Центромеры человека состоят из α-сателлитной ДНК, упорядоченной в тандеме в повторы более высокого порядка (каждая стрелка), а некоторые α-сателлитные ДНК содержат сайты связывания CENP-B (CENP-B box).CENP-A локализуется в части этих массивов. Количество мест прикрепления микротрубочек также варьируется у разных организмов. CENP-B является высококонсервативным центромерным белком у млекопитающих и связывается с мотивом из 17 пар оснований в блоке CENP-B. Было показано, что α-сателлитная ДНК с CENP-B-боксом ответственна за сборку de novo центромер в соматических клетках человека (Masumoto et al. ., 2004), хотя мыши, лишенные CENP-B, жизнеспособны (Hudson ). et al ., 1998). Делящиеся дрожжи также имеют гомологи CENP-B, Abp1, Cbh2 и Cbh3.Регуляторные роли этих гомологов в спецификации центромер остаются неуловимыми; однако они регулируют стабильность генома посредством репликации, целостности гетерохроматина и подавления ретротранспозонов (Murakami et al ., 1996; Halverson et al ., 1997; Irelan et al ., 2001; Cam et al ., 2008. ).
Рисунок 1
Разнообразие центромерной структуры и распределение нуклеосом CENP-A среди эукариот. Схематическое изображение центромер у почкующихся дрожжей ( Saccharomyces cerevisiae ), делящихся дрожжей ( Schizosaccharomyces pombe ) и человека.У почкующихся дрожжей есть точечная центромера, которая определяется последовательностью 125 пар оснований и занята единственной нуклеосомой CENP-A (CSe4). Schizosaccharomyces pombe и человек имеют региональные центромеры, фланкированные перицентромерным гетерохроматином. В Schizosaccharomyces pombe множество нуклеосом, содержащих CENP-A (Cnp1), собраны в уникальные последовательности ( cnt и imr ). Центромеры человека состоят из α-сателлитной ДНК, упорядоченной в тандеме в повторы более высокого порядка (каждая стрелка), а некоторые α-сателлитные ДНК содержат сайты связывания CENP-B (CENP-B box).CENP-A локализуется в части этих массивов. Количество мест прикрепления микротрубочек также варьируется у разных организмов. CENP-B является высококонсервативным центромерным белком у млекопитающих и связывается с мотивом из 17 пар оснований в блоке CENP-B. Было показано, что α-сателлитная ДНК с CENP-B-боксом ответственна за сборку de novo центромер в соматических клетках человека (Masumoto et al. ., 2004), хотя мыши, лишенные CENP-B, жизнеспособны (Hudson ). et al ., 1998). Делящиеся дрожжи также имеют гомологи CENP-B, Abp1, Cbh2 и Cbh3.Регуляторные роли этих гомологов в спецификации центромер остаются неуловимыми; однако они регулируют стабильность генома посредством репликации, целостности гетерохроматина и подавления ретротранспозонов (Murakami et al ., 1996; Halverson et al ., 1997; Irelan et al ., 2001; Cam et al ., 2008. ).
Механизм отложения Cnp1 / CENP-A на центромерах широко изучался на делящихся дрожжах. Напр., Комплекс Mis6 / Sim4 локализуется на центромерах и необходим для центромерной ассоциации Cnp1 (Takahashi et al ., 2000; Pidoux и др. ., 2003). Др. Фактором, необходимым для отложения Cnp1, является комплекс Mis16-Mis18, который может удерживать центромерные гистоны деацетилированными (Hayashi et al ., 2004). Комплексы Mis6 и Mis16 необходимы для центромерной локализации Scm3, что также необходимо для отложения Cnp1 в центромерах делящихся дрожжей (Pidoux et al. ., 2009; Hinshaw & Harrison, 2013). Следовательно, как и у почкующихся дрожжей, центромерная локализация CENP-A шаперона Scm3 может быть центральным регуляторным признаком центромерного отложения Cnp1, который формирует основу для сборки кинетохор.Многие из факторов, необходимых для отложения Cnp1 на центромере у делящихся дрожжей, эволюционно законсервированы и, как известно, важны для центромерной локализации CENP-A в клетках человека (Stellfox et al ., 2013).
Кинетохор в сборе
Благодаря недавнему прогрессу в идентификации белковых компонентов кинетохор мы теперь знаем более 50 белков, которые собираются на кинетохорах (Obuse et al ., 2004; Cheeseman et al ., 2006, 2008; Foltz и др. ., 2006; Изута, и др., , 2006; Окада и др. , 2006; Westermann & Schleiffer, 2013). Кинетохора примерно делится на две части: внутреннюю кинетохору и внешнюю кинетохору. Белки, которые образуют внутреннюю кинетохору, взаимодействуют с центромерным хроматином, в то время как белки внешней кинетохоры вносят вклад в интерфейс связывания микротрубочек. В этом разделе и на рис. 2 мы кратко суммируем известные функции нескольких важных кинетохорных белков.Более подробную информацию о составе кинетохорных факторов и их сохранении можно найти, обратившись к следующим превосходным обзорам (Ogiyama & Ishii, 2012; Funabiki & Wynne, 2013; Roy et al. ., 2013; Westermann & Schleiffer, 2013).
Рисунок 2
Схематическое изображение кинетохорной структуры. Внутренний KT (кинетохора) состоит из белков CCAN (конститутивная сеть, связанная с центромерой), включая CENP-A, CENP-C и CENP-T.CENP-C напрямую взаимодействует с нуклеосомой CENP-A. CENP-C также связывается с Nnf1, субъединицей комплекса Mis12, предполагая, что CENP-C может действовать как медиатор CCAN и внешних белков KT (сеть KMN). CENP-T также связывает комплекс Ndc80. Это взаимодействие необходимо для локализации комплекса Ndc80 в кинетохорах, это указывает на то, что CENP-T, подобно CENP-C, также может опосредовать взаимодействие между центромерным хроматином и внешними белками KT. Обратите внимание, что CENP-T и комплекс Mis12 являются конкурирующими партнерами по связыванию для комплекса Ndc80 (показано красным прямоугольником) (Bock et al ., 2012; Schleiffer et al ., 2012). Комплекс Ndc80 и N-концевые основные остатки Knl1 обладают активностью связывания микротрубочек и, таким образом, действуют как интерфейсы для взаимодействия кинетохора-микротрубочка. Считается, что комплекс Dam1 как у почкующихся дрожжей, так и у делящихся дрожжей поддерживает эти взаимодействия. У человека комплекс Ska может быть функциональным гомологом комплекса Dam1.
Рисунок 2
Схематическое изображение кинетохорной структуры. Внутренний KT (кинетохора) состоит из белков CCAN (конститутивная сеть, связанная с центромерой), включая CENP-A, CENP-C и CENP-T.CENP-C напрямую взаимодействует с нуклеосомой CENP-A. CENP-C также связывается с Nnf1, субъединицей комплекса Mis12, предполагая, что CENP-C может действовать как медиатор CCAN и внешних белков KT (сеть KMN). CENP-T также связывает комплекс Ndc80. Это взаимодействие необходимо для локализации комплекса Ndc80 в кинетохорах, это указывает на то, что CENP-T, подобно CENP-C, также может опосредовать взаимодействие между центромерным хроматином и внешними белками KT. Обратите внимание, что CENP-T и комплекс Mis12 являются конкурирующими партнерами по связыванию для комплекса Ndc80 (показано красным прямоугольником) (Bock et al ., 2012; Schleiffer et al ., 2012). Комплекс Ndc80 и N-концевые основные остатки Knl1 обладают активностью связывания микротрубочек и, таким образом, действуют как интерфейсы для взаимодействия кинетохора-микротрубочка. Считается, что комплекс Dam1 как у почкующихся дрожжей, так и у делящихся дрожжей поддерживает эти взаимодействия. У человека комплекс Ska может быть функциональным гомологом комплекса Dam1.
Белки внутренней кинетохоры
Cse4 / Cnp1 / CENP-A
Центрер-специфический вариант гистона h4 Cse4 / Cnp1 / CENP-A, как полагают, является ориентиром для сборки кинетохор.Фактически, CENP-A необходим для локализации почти всех кинетохорных белков. Недавний отчет показал, что если CENP-A или шаперон CENP-A HJURP, который считается гомологом Scm3, искусственно привязан к нецентромерным областям через систему LacO — LacI , сборка кинетохор индуцируется на этом noncentromere локус в культивируемых клетках млекопитающих и Drosophila (Barnhart et al ., 2011; Mendiburo et al ., 2011).Кроме того, в экстрактах яиц Xenopus кинетохорные белки собираются на CENP-A-содержащих полинуклеосомах, но не на h4-содержащих полинуклеосомах in vitro (Guse et al ., 2011). Эти результаты также предполагают, что CENP-A действует как эпигенетический маркер сборки кинетохор.
Cnn1 / Cnp20 / CENP-T
CENP-T был первоначально идентифицирован с помощью MS-анализа в полинуклеосомах, содержащих CENP-A (Foltz et al. ., 2006).CENP-T обладает гистоновым доменом и образует комплекс с CENP-S, X и W (Amano et al. ., 2009; Nishino et al. ., 2012). Предполагается, что этот комплекс образует нуклеосомоподобную структуру для взаимодействия с ДНК (Nishino et al. ., 2012; Yang et al. ., 2012). Предполагается, что образование тетрамера CENP-T, W, S и X необходимо для установления центромерного хроматина с образованием интактной кинетохоры (Gascoigne et al ., 2011; Nishino et al ., 2012).
CENP-T млекопитающих, как было показано, взаимодействует напрямую с комплексом Ndc80, состоящим из Ndc80, Nuf2, Spc24 и Spc25, через его удлиненный N-конец и необходим для связывания кинетохор комплекса Ndc80 (Nishino et al ., 2013. ). Cnn1, недавно описанный у почкующихся дрожжей CENP-T, также напрямую взаимодействует с комплексом Ndc80 (Bock et al. ., 2012; Schleiffer et al. ., 2012). Искусственное связывание Cnn1 позволяет сегрегацию минихромосом, лишенных центромер (Schleiffer et al ., 2012). Этот результат указывает на то, что Cnn1 / CENP-T рекрутирует комплекс Ndc80, который играет центральную роль в формировании сайтов прикрепления микротрубочек. Cnn1 ингибирует взаимодействие между сетью KMN (комплекс KNL1 / Mis12 / комплекс Ndc80) (см. Ниже) путем конкурентного связывания с комплексом Ndc80, особенно во время анафазы (Bock et al ., 2012; Schleiffer et al ., 2012. ).
Mif2 / Cnp3 / CENP-C
Внутренний белок кинетохоры Mif2 / Cnp3 / CENP-C служит структурным центром для сборки кинетохор (Przewloka et al ., 2011; Screpanti et al ., 2011). Как у почкующихся, так и у делящихся дрожжей локализация CENP-C зависит от CENP-A (Westermann et al. ., 2003; Tanaka et al. ., 2009). У почкующихся дрожжей комплекс CBF3 также необходим для локализации кинетохор CENP-C (Meluh & Koshland, 1997), а затем Mif2 / CENP-C взаимодействует с Cse4 / CENP-A (Pinsky et al ., 2003). . Как у почкующихся, так и у делящихся дрожжей Mif2 / Cnp3 / CENP-C рекрутирует Iml3 / Fta1 / CENP-L на кинетохоры посредством прямого взаимодействия (Tanaka et al ., 2009; Хиншоу и Харрисон, 2013 г.). Сверхэкспрессия Fta1 в значительной степени подавляет дефекты сегрегации хромосом в клетках cnp3∆ , подтверждая, что основная функция Cnp3 состоит в рекрутировании Fta1 на кинетохоры, которые играют центральную роль в прикреплении микротрубочек (Tanaka et al ., 2009). Cnp3 делящихся дрожжей выполняет дополнительную роль в рекрутировании комплекса Pcs1-Mde4 и Moa1 на кинетохоры (Tanaka et al ., 2009) (см. Также рис. 6). Комплекс Pcs1-Mde4 рекрутирует комплексы конденсина в центральной области ядра центромер (Tada et al ., 2011). Этот конденсиновый комплекс играет ключевую роль в предотвращении ошибочного прикрепления кинетохор, такого как прикрепление меротелии, возможно, за счет зажима сайтов прикрепления микротрубочек. Moa1 — это специфичный для мейоза кинетохорный белок, который играет важную роль в регуляции редукционной сегрегации в мейозе I (см. Ниже).
Белки внешней кинетохоры
Ndc80 комплекс
Комплекс Ndc80, который, как было показано, способствует прикреплению несущих нагрузку микротрубочек (Powers et al ., 2009), состоит из димеров Ndc80 / Hec1-Nuf2 и Spc24-Spc25. И Ndc80-Nuf2, и Spc24-Spc25 имеют шаровидную головку и длинный домен спиральной спирали (Wigge & Kilmartin, 2001; Bharadwaj et al ., 2004; McCleland et al ., 2004) и вместе образуют тупой Тетрамер в форме колокольчика через их домены coiled-coil (Wei et al ., 2005). Глобулярные головки Ndc80 и Nuf2 содержат пару тесно взаимодействующих доменов гомологии кальпонина (CH) (Wei et al ., 2007; Alushin et al. ., 2010), которые могут представлять поверхность связывания микротрубочек. Помимо домена CH, положительно заряженная область в N-концевом хвосте Ndc80 также важна для связывания микротрубочек (Guimaraes et al. ., 2008; Miller et al. ., 2008). В соответствии с этим, мутации в домене CH или делеция положительно заряженной области в N-концевом хвосте нарушают активность связывания микротрубочек комплекса Ndc80 in vitro (Cheeseman et al ., 2006; Ciferri и др. ., 2008).
Взаимодействие комплекса Ndc80 с микротрубочками, по-видимому, регулируется посредством фосфорилирования N-концевого хвоста Ndc80 с помощью консервативной киназы Ipl1 / Ark1 / Aurora B (see below). Aurora B фосфорилирует Ndc80 для отделения микротрубочек от кинетохор, что важно для коррекции ошибочного прикрепления (Cheeseman et al ., 2006; DeLuca et al ., 2006; Akiyoshi et al ., 2009). Сайты фосфорилирования Aurora B располагаются в N-конце Ndc80, и их фосфорилирование вызывает отслоение микротрубочек, возможно, за счет изменения электрических свойств положительно заряженной области.Структурный анализ показывает, что N-концевой хвост Ndc80 содержит уникальную короткую петлю, состоящую из c . 100 аминокислот, окруженных спиральными спиралями (Ciferri et al. ., 2008; Wang et al. ., 2008). Эта область внутренней петли Ndc80 в N-концевом хвосте также способствует прикреплению кинетохоры к микротрубочкам, рекрутируя регуляторы прикрепления к кинетохоре, такие как комплекс Dam1 у почкующихся дрожжей, сверхэкспрессируемые опухоли гены у делящихся дрожжей и Ska1 или Cdt1 в человек (Hsu & Toda, 2011; Maure et al ., 2011; Варма и др. ., 2012; Чжан и др. , 2012; Tang et al ., 2013).
Глобулярный домен димера Spc24-Spc25 соединяет комплекс Ndc80 с внутренним кинетохорным комплексом посредством прямого взаимодействия с CENP-T или комплексом Mis12 (Petrovic et al ., 2010; Gascoigne et al ., 2011; Мальвецци и др. ., 2013; Нишино и др. ., 2013).
Комплекс Mis12
Комплекс Mis12 содержит четыре субъединицы, включая Mtw1 / Mis12, Dsn1 / Mis13, Nsl1 / Mis14 и Nnf1.У почкующихся дрожжей Cse4 и Ndc10 играют роль в рекрутировании кинетохор комплекса Mis12 (Pinsky et al. ., 2003). У делящихся дрожжей, но не у почкующихся дрожжей, Spc105 / Spc7 / KNL1 необходим для локализации кинетохор Mis12 (Kerres et al ., 2007). Хотя точная функция комплекса Mis12 полностью не изучена, он действует как платформа для образования сетевого комплекса KMN (Cheeseman et al ., 2006) и связывает другие компоненты внешней кинетохоры с внутренней кинетохорой посредством прямого связывание с CENP-C (Screpanti et al ., 2011). Наряду с KNL1, Nsl1 взаимодействует с комплексом Spc24-Spc25 в клетках млекопитающих (Petrovic et al ., 2010), тогда как Dsn1 почкующихся дрожжей иммунопреципитирует с Mif2 и Cse4 (Pinsky et al ., 2003). Dsn1 выполняет вспомогательную роль в прикреплении кинетохор к микротрубочкам посредством фосфорилирования Dsn1 с помощью Aurora B (Welburn et al ., 2010).
Spc105 / Spc7 / KNL1
Spc105 / Spc7 / KNL1 имеет консервативный домен связывания микротрубочек на своем N-конце, связывающая способность которого регулируется его фосфорилированием с помощью Aurora B (Cheeseman et al ., 2006; Welburn и др. ., 2010). KNL1 также имеет сайт связывания для протеинфосфатазы PP1 на своем N-конце (Liu et al. ., 2010). PP1 требует KNL1 для его локализации в кинетохорах. В клетках человека PP1 противодействует Aurora B-зависимому фосфорилированию некоторых кинетохорных белков, таких как Ndc80, что приводит к стабилизации прикрепления кинетохор к микротрубочкам (Liu et al ., 2010). Т.о., KNL1 вносит вклад в регуляцию прикрепления кинетохор к микротрубочкам путем рекрутирования PP1 на кинетохоры.Более того, у дрожжей и Caenorhabditis elegans PP1, расположенный в кинетохорах, также играет роль в подавлении контрольной точки веретена путем дефосфорилирования компонентов контрольной точки сборки веретена (SAC) (Meadows et al ., 2011; Rosenberg et al ., 2011; Espeut et al ., 2012). SAC является защитной системой, предотвращающей разделение сестринских хроматид до тех пор, пока каждая кинетохора не будет должным образом прикреплена к веретену, исходящему от обоих полюсов, чтобы создать напряжение между сестринскими кинетохорами.Помимо рекрутирования PP1, KNL1 также играет ключевую роль в SAC, рекрутируя Bub1 и Mad3 / BubR1 (см. Раздел «Кинетохора как платформа для активации SAC»).
Комплекс Dam1 / DASH
Комплекс Dam1 состоит из 10 субъединиц, все из которых необходимы для роста клеток почкующихся дрожжей (Cheeseman et al. ., 2001; Janke et al. ., 2002; Li et al. ., 2005). Электронно-микроскопические исследования показали, что комплекс Dam1 образует кольцевую структуру вокруг микротрубочек (Westermann et al ., 2005). Считается, что основная функция комплекса Dam1 связана с перемещением хромосом с деполимеризацией микротрубочек. Бусинки, покрытые комплексом Dam1, следуют за растущими или сокращающимися концами микротрубочек in vitro (Asbury et al ., 2006). Важно, что искусственного связывания комплекса Dam1 с ДНК достаточно для разделения ДНК у почкующихся дрожжей (Kiermaier et al ., 2009; Lacefield et al ., 2009). Локализация кинетохор комплекса Dam1 зависит от его прямого связывания с внутренней петлей Ndc80 (Maure et al ., 2011), что согласуется с мнением, что комплекс Dam1 связывает движение груза с деполимеризующимися микротрубочками.
В отличие от почкующихся дрожжей, гомолог комплекса Dam1 у делящихся дрожжей (комплекс DASH) не важен для жизнеспособности (Sanchez-Perez et al ., 2005). Это различие может быть связано с количеством сайтов прикрепления микротрубочек на кинетохору (Burrack et al. ., 2011). Хотя прямой гомолог комплекса Dam1 не был идентифицирован у высших эукариот, предполагается, что комплекс Ska является функциональным гомологом комплекса Dam1 у людей (Welburn et al ., 2009; Джеяпракаш и др. ., 2012).
Присоединение кинетохор к микротрубочкам и ориентация кинетохор
Присоединение микротрубочек к кинетохорам необходимо для выравнивания и сегрегации хромосом. Решающее различие между почкующимися дрожжами и делящимися дрожжами в прикреплении кинетохор к микротрубочкам заключается в количестве микротрубочек, прикрепляющихся к одной кинетохоре. Электронно-микроскопический анализ показал, что одна кинетохора прикреплена одной микротрубочкой у почкующихся дрожжей (Peterson & Ris, 1976; King et al ., 1982), тогда как одна кинетохора прикреплена несколькими микротрубочками у делящихся дрожжей (Ding et al ., 1993), как и в случае высших эукариот (Rieder, 1982; McEwen et al ., 1997).
Точная сегрегация сестринских хроматид достигается с помощью микротрубочек, захватывающих сестринские кинетохоры с противоположных полюсов веретена, процесс, называемый амфитарным прикреплением (сестринские хроматиды двуориентированы). Однако во время ранних стадий выравнивания хромосом микротрубочки из одного полюса веретена временно прикрепляются к одной или обеим сестринским кинетохорам.Эти способы привязанности называются монотелической или синтетической привязкой соответственно. В обоих случаях к одному полюсу прикрепляются сестринские хроматиды. Кроме того, у делящихся дрожжей другой способ прикрепления, известный как merotelic прикрепление, происходит во время выравнивания, при котором одна сестринская кинетохора одновременно прикрепляется с помощью микротрубочек, исходящих из обоих полюсов (Fig. 3). В следующих разделах мы рассмотрим текущее понимание того, как би-ориентация сестринских кинетохор устанавливается посредством коррекции ошибочных прикреплений.
Рисунок 3
Типы прикрепления кинетохоры к микротрубочкам. В митозе (или мейозе II) сестринские кинетохоры разделены и ориентированы в конфигурации спина к спине. В результате сестринские кинетохоры захватываются микротрубочками, исходящими из противоположных полюсов, и это приводит к амфителическому прикреплению: хромосомы становятся двуориентированными. Однако моноориентация может происходить, если одна или обе сестринские кинетохоры захватываются микротрубочками, исходящими из одного полюса, что приводит к монотелическому или синтелическому прикреплению, соответственно.Если кинетохора связана микротрубочками с обоих полюсов (меротелическое прикрепление), хромосомы будут би-ориентированными, но это может привести к неправильной сегрегации и анеуплоидии. Подобные ошибочные присоединения в основном исправляются киназой Aurora B.
Рисунок 3
Типы прикрепления кинетохор к микротрубочкам. В митозе (или мейозе II) сестринские кинетохоры разделены и ориентированы в конфигурации спина к спине. В результате сестринские кинетохоры захватываются микротрубочками, исходящими из противоположных полюсов, и это приводит к амфителическому прикреплению: хромосомы становятся двуориентированными.Однако моноориентация может происходить, если одна или обе сестринские кинетохоры захватываются микротрубочками, исходящими из одного полюса, что приводит к монотелическому или синтелическому прикреплению, соответственно. Если кинетохора связана микротрубочками с обоих полюсов (меротелическое прикрепление), хромосомы будут би-ориентированными, но это может привести к неправильной сегрегации и анеуплоидии. Подобные ошибочные присоединения в основном исправляются киназой Aurora B.
Коррекция ошибочного прикрепления кинетохоры к микротрубочкам
Во время митоза нежелательные прикрепления, такие как синтетические или меротелические прикрепления, обычно корректируются в амфителиальные прикрепления с наступлением анафазы.Киназа Aurora B играет центральную роль в этом механизме коррекции. Гомолог Aurora B дрожжей, Ipl1, был идентифицирован при скрининге мутантов, демонстрирующих фенотип увеличения плоидности ( ipl1 ) (Chan & Botstein, 1993). Впоследствии было показано, что Ipl1 способствует обороту прикрепления кинетохор к микротрубочкам, пока сестринские кинетохоры не установят амфителическое прикрепление (би-ориентацию) (Tanaka et al ., 2002). Ipl1 выполняет эту функцию путем фосфорилирования субстратов, которые играют роли в прикреплении кинетохор и микротрубочек, включая Ndc80, Knl1 и Dam1, все из которых важны для прикрепления кинетохор к микротрубочкам и точной сегрегации хромосом (Cheeseman et al ., 2002; ДеЛука, и др., , 2006; Welburn и др. ., 2010).
Современная модель, объясняющая, как Aurora B распознает ошибочные прикрепления, предполагает, что этот процесс опосредуется напряжением между сестринскими кинетохорами, которое генерируется за счет сцепления между сестринскими хроматидами, противодействующими силам притяжения микротрубочек с противоположных полюсов (Tanaka, 2010). Aurora B локализуется между сестринскими кинетохорами в сайтах, соответствующих перицентромерной области гетерохроматина у делящихся дрожжей и внутренней центромере в клетках млекопитающих.Aurora B локализуется в этой области как компонент хромосомного комплекса-пассажира (CPC), который включает Ipl1 / Ark1 / Aurora B, Bir1 / Survivin, Sli15 / Pic1 / INCENP и Nbl1 / Borealin (Ruchaud et al ., 2007). , где он генерирует градиент фосфорилирования с центром во внутренних центромерах (Wang et al ., 2011). В неправильных прикреплениях, где напряжение между сестринскими кинетохорами недостаточно, ошибочные места прикрепления становятся ближе к внутренним центромерам. Следовательно, субстраты Aurora B в сайтах прикрепления кинетохор к микротрубочкам фосфорилируются, что приводит к дестабилизации прикрепления кинетохор к микротрубочкам (рис.4; Лю и др. ., 2009). Как только амфителическое прикрепление установлено, расстояние между Aurora B и его субстратами увеличивается из-за тянущих сил микротрубочек. Субстраты кинетохор дефосфорилируются фосфатазой PP1, которая локализуется на кинетохорах за счет связывания с Knl1, что приводит к дальнейшей стабилизации прикрепления (Liu et al ., 2010). Фосфатаза PP2A, которая рекрутируется в кинетохоры через BubR1, также стабилизирует прикрепление путем дефосфорилирования субстратов кинетохор (рис.4; Фоли и др. , 2011; Suijkerbuijk et al ., 2012). Однако недавнее исследование показало, что у зарождающегося мутанта дрожжей sl15 / INCENP, который имеет дефект во взаимодействии с Bir1 / Survivin, Ipl1 / Aurora B не может локализоваться на центромерах, но дефект роста отсутствует (Campbell & Desai, 2013). У этого мутанта slo15 CPC обнаруживает преждевременную локализацию на веретене, ведущую к активации Ipl1 на веретене, а не на центромере, указывая тем самым, что локализация центромеры CPC может не быть существенной для исправления ошибок (Campbell & Desai, 2013).Т.о., молекулярные детали механизма сбора ошибок, зависимого от Aurora B, все еще обсуждаются, особенно у почкующихся дрожжей.
Рисунок 4
Зависимая от напряжения коррекция неправильного прикрепления с помощью Aurora B. Аврора B локализуется на внутренних центромерах в митотических хромосомах, где она производит градиент фосфорилирования (темные и светло-серые области), таким образом фосфорилируя кинетохорные белки, включая сеть KMN. Во время прометафазы кинетохоры захватываются микротрубочками, часто ошибочным образом (монотелическое прикрепление, синтетическое прикрепление или меротелическое прикрепление; рис.3). В этих случаях места прикрепления находятся в непосредственной близости от активности Aurora B, пик которой приходится на внутренние центромеры, поэтому прикрепление становится нестабильным. Однако, как только две кинетохоры захватываются веретенами, исходящими из противоположных полюсов, напряжение, создаваемое через центромеры, перемещает места прикрепления от Aurora B. Одновременно это движение способствует ассоциации протеинфосфатазы 1 (PP1) с компонентом KMN KNL1. . Напряжение также действует для перераспределения PP2A от внутренней центромеры к стороне кинетохор.Таким образом, увеличенное расстояние от Aurora B и повышение активности фосфатазы (пурпурная область) могут действовать кумулятивно, дефосфорилируя сеть KMN, тем самым стабилизируя только правильное прикрепление.
Рисунок 4
Зависимая от напряжения коррекция неправильного прикрепления с помощью Aurora B. Аврора B локализуется на внутренних центромерах в митотических хромосомах, где она производит градиент фосфорилирования (темные и светло-серые области), таким образом фосфорилируя кинетохорные белки, включая сеть KMN.Во время прометафазы кинетохоры захватываются микротрубочками, часто ошибочным образом (монотелическое прикрепление, синтетическое прикрепление или меротелическое прикрепление; Рис. 3). В этих случаях места прикрепления находятся в непосредственной близости от активности Aurora B, пик которой приходится на внутренние центромеры, поэтому прикрепление становится нестабильным. Однако, как только две кинетохоры захватываются веретенами, исходящими из противоположных полюсов, напряжение, создаваемое через центромеры, перемещает места прикрепления от Aurora B.Одновременно это движение способствует ассоциации протеинфосфатазы 1 (PP1) с компонентом KMN KNL1. Напряжение также действует для перераспределения PP2A от внутренней центромеры к стороне кинетохор. Таким образом, увеличенное расстояние от Aurora B и повышение активности фосфатазы (пурпурная область) могут действовать кумулятивно, дефосфорилируя сеть KMN, тем самым стабилизируя только правильное прикрепление.
Молекулярные механизмы, лежащие в основе центромерной локализации CPC
За исключением почкующихся дрожжей, локализация CPC на внутренней центромере, i.е. между сестринскими кинетохорами, важен для правильной коррекции ошибочного прикрепления кинетохор к микротрубочкам. Молекулярные детали, лежащие в основе центромерной локализации CPC, хорошо охарактеризованы у делящихся дрожжей, а основные механизмы законсервированы в клетках позвоночных.
Hrk1 / Haspin представляет собой эволюционно консервативную киназу, которая фосфорилирует гистон h4 по треонину 3 во время митоза (рис. 5). Фосфорилированный h4-T3 взаимодействует напрямую с Bir1 / Survivin, одной из субъединиц CPC, через консервативный домен BIR (Kelly et al ., 2010; Ван и др. , 2010; Ямагиши и др. , 2010; Джеяпракаш и др. , 2011). Hrk1 / Haspin локализуется на хроматине за счет непосредственного взаимодействия с cohesin-ассоциированным белком Pds5 (Fig. 5; Yamagishi et al. ., 2010) и, таким образом, накапливается вдоль хроматина, где существуют комплексы cohesin. Также было показано, что Hrk1 / Haspin фосфорилирует h4 в гетерохроматических регионах, включая центромеры у делящихся дрожжей, и что это фосфорилирование зависит от накопления cohesin в гетерохроматических регионах (Yamagishi et al ., 2010). Причина, по которой Hrk1 / Haspin фосфорилирует h4 в гетерохроматических регионах, но не в др. Областях, обогащенных cohesin, в настоящее время неизвестна, но сам гетерохроматин может вносить вклад в активацию Hrk / Haspin.
Рисунок 5
Регуляция внутренней локализации центромеры Aurora B. Bub1 фосфорилирует гистон h3A вокруг центромер, где белки семейства шугошинов (SGO), как известно, связываются через свои мотивы SGO. Делящиеся дрожжи и человеческий Sgo1 связываются через свои мотивы P-V-I с Swi6 / HP1 (гетерохроматиновый белок 1), и локализация Sgo1 на перицентромерном гетерохроматине частично зависит от этого взаимодействия.В дополнение к Bub1, Hrk1 / Haspin kinase, которая локализуется в хроматине за счет связывания с cohesin, также, как было показано, имеет решающее значение для локализации Aurora B (CPC) за счет фосфорилирования гистона h4 по Thr3 только в M-фазе. Фосфорилированный h4-T3 взаимодействует непосредственно с консервативным BIR доменом Survivin / Bir1, субъединицы CPC, и это взаимодействие важно для нацеливания Aurora B на центромерные нуклеосомы. Кроме того, фосфорилирование с помощью CDK в N-концевой области Bir1 у делящихся дрожжей или бореалина у человека также может способствовать его связыванию с областью спиральной спирали белков семейства шугошин.В клетках человека CDK также фосфорилирует Sgo1, чтобы облегчить его связывание с cohesin (Liu et al. ., 2013a, b). Взаимодействие между человеческим Sgo1 и cohesin, как полагают, необходимо для связывания Sgo1 с хроматином (Liu et al. ., 2013a, b). PP2A, рекрутируемый белками Shugoshin на внутренней центромере, отменяет состояние фосфорилирования cohesins, приводя к защите от расщепления сепаразой в мейозе и от удаления с помощью пути профазы при митозе позвоночных (Sakuno & Watanabe, 2009).
Рисунок 5
Регуляция внутренней локализации центромеры Aurora B. Bub1 фосфорилирует гистон h3A вокруг центромер, где белки семейства шугошинов (SGO), как известно, связываются через свои мотивы SGO. Делящиеся дрожжи и человеческий Sgo1 связываются через свои мотивы P-V-I с Swi6 / HP1 (гетерохроматиновый белок 1), и локализация Sgo1 на перицентромерном гетерохроматине частично зависит от этого взаимодействия. В дополнение к Bub1, Hrk1 / Haspin kinase, которая локализуется в хроматине за счет связывания с cohesin, также, как было показано, имеет решающее значение для локализации Aurora B (CPC) за счет фосфорилирования гистона h4 по Thr3 только в M-фазе.Фосфорилированный h4-T3 взаимодействует непосредственно с консервативным BIR доменом Survivin / Bir1, субъединицы CPC, и это взаимодействие важно для нацеливания Aurora B на центромерные нуклеосомы. Кроме того, фосфорилирование с помощью CDK в N-концевой области Bir1 у делящихся дрожжей или бореалина у человека также может способствовать его связыванию с областью спиральной спирали белков семейства шугошин. В клетках человека CDK также фосфорилирует Sgo1, облегчая его связывание с когезином (Liu et al. ., 2013а, б). Взаимодействие между человеческим Sgo1 и cohesin, как полагают, необходимо для связывания Sgo1 с хроматином (Liu et al. ., 2013a, b). PP2A, рекрутируемый белками Shugoshin на внутренней центромере, отменяет состояние фосфорилирования cohesins, приводя к защите от расщепления сепаразой в мейозе и от удаления с помощью пути профазы при митозе позвоночных (Sakuno & Watanabe, 2009).
Bub1 представляет собой консервативную многофункциональную киназу, которая локализуется на кинетохорах в митозе и играет важную роль в сборке компонентов SAC на кинетохорах.Другая функция Bub1 — это рекрутирование центромер shugoshin, белка, необходимого для сцепления сестринских хроматид и локализации CPC на центромерах. Bub1 фосфорилирует гистон h3A по серину 121 (треонин 120 у человека) у делящихся дрожжей (рис. 5; Kawashima et al ., 2010). Белки Shugoshin связываются с нуклеосомами, содержащими фосфорилированный h3A-S121 через его консервативный C-концевой мотив SGO, и это взаимодействие необходимо для центромерной локализации белков shugoshin.Делящиеся дрожжи shugoshin Sgo2 взаимодействуют непосредственно с CPC субъединицей Bir1 и рекрутируют ее на центромеры (Tsukahara et al ., 2010). Поскольку это взаимодействие зависит от фосфорилирования Bir1 с помощью CDK1, локализация CPC на центромерах ограничена M-фазой клеточного цикла (Fig. 5).
Генетический анализ делящихся дрожжей показал, что эти два пути, обеспечиваемые с помощью Bub1 и Hrk1 / Haspin, являются избыточными в локализации CPC на центромерах (Yamagishi et al ., 2010).Если оба пути нарушены, локализация CPC снижается на центромерах, что приводит к серьезным дефектам сегрегации хромосом, которые включают отставание хромосом, признак меротелического прикрепления, указывающий на то, что исправление ошибочных прикреплений в этих клетках является дефектным. Эти два пути хорошо сохраняются в клетках позвоночных; однако механизм сохранения у почкующихся дрожжей остается неясным.
Ориентация кинетохор в мейозе
В митозе сестринские кинетохоры двуориентированы, вызывая сегрегацию сестринских хроматид на противоположных полюсах, процесс, называемый эквациональной сегрегацией.В этом процессе весь cohesin, связанный с хроматином, расщепляется сепаразой в начале анафазы (Uhlmann, 2009; Nasmyth, 2011).
В мейозе за одним раундом репликации ДНК следуют два раунда последовательных сегрегаций хромосом, называемых мейозом I и мейозом II. В мейозе I гомологи (пара сестринских хроматид), соединенные хиазмами, сегрегированы на противоположных полюсах, в то время как сестринские хроматиды сегрегированы на одном полюсе. Этот тип сегрегации называется редукционной сегрегацией.Для достижения этого сестринские кинетохоры должны всегда захватываться микротрубочками, исходящими из одних и тех же полюсов, что называется моноориентацией сестринских кинетохор. Анафаза в мейозе I запускается расщеплением когезина, как в митозе. Однако в анафазе I когезин вдоль плеча хромосомы, но не в перицентромерных регионах, расщепляется сепаразой (Buonomo et al. ., 2000; Kitajima et al. ., 2003). Мейотический шугошин Sgo1 (Sgo2 у позвоночных) защищает когезин от расщепления, рекрутируя протеинфосфатазу PP2A в перицентромерные области (рис.5; Kitajima et al ., 2006; Ридель и др. , 2006; Ли и др. ., 2008). Cohesin, сохраняющийся в перицентромерной области, важен для установления би-ориентации сестринских кинетохор в мейозе II. Во время следующей анафазы II, поскольку белок Sgo1 разрушается после анафазы I (Kitajima et al ., 2004), сестринские хроматиды могут разделяться на противоположные полюса, как они это делают в митозе, при расщеплении сохраняющегося cohesin одновременно с реактивацией сепаразы.
В следующих разделах мы рассмотрим механизмы, которые регулируют моноориентацию кинетохор в мейозе I, как выяснено в основном у почкующихся и делящихся дрожжей.
Регуляция моноориентации сестринских кинетохор у почкующихся дрожжей
У почкующихся дрожжей рекрутирование комплекса монополина на кинетохоры требуется для моно-ориентации сестринских кинетохор в мейозе I. Монополин был впервые идентифицирован в ходе функционального геномного поиска как фактор, необходимый для правильной сегрегации хромосом в мейозе (Toth et al. ., 2000). Монополиновый комплекс состоит из Mam1, Csm1 и Lrs4 и локализуется в кинетохорах во время мейоза I (Rabitsch et al ., 2003) за счет прямого связывания Csm1 с кинетохорным белком Dsn1 (Sarkar et al ., 2013). . Кроме того, у почкующихся дрожжей CK1 δ / ε Hrr25, как было установлено, связывается с Mam1 (Petronczki et al ., 2006). Hrr25 рекрутируется на кинетохоры с помощью Mam1, и его киназная активность играет важную роль в моноориентации сестринских кинетохор (рис.6; Petronczki et al ., 2006). Субстрат (ы) Hrr25, необходимый для моноориентации сестринских кинетохор, остается неуловимым; однако было обнаружено, что поло-подобные киназы Cdc5 и Cdc7 киназы необходимы для правильной локализации кинетохор монополина и, следовательно, необходимы для моноориентации в мейозе I (рис. 6b; Katis et al ., 2004. ; Ли и др. ., 2004; Матос и др. ., 2008).
Рисунок 6
Четкая регуляция моноориентации кинетохор в мейозе I у дрожжей.(a) У почкующихся дрожжей моноориентация достигается за счет действия монополинового комплекса, который состоит из Csm1, Lrs4, Mam1 и Hrr25 (см. также b). Считается, что этот комплекс действует как молекулярный зажим сестринских кинетохор. Напротив, сцепление в ядре центромеры с помощью комплекса cohesin Rec8 является необходимым для моноориентации у делящихся дрожжей. Кроме того, Moa1, специфичный для мейоза кинетохорный белок, также играет существенную роль в слипчивости центральных центромер посредством Rec8, хотя механизм, с помощью которого Moa1 регулирует Rec8, неизвестен.(b) Moa1 может локализоваться в области кинетохор посредством связывания с CENP-C, тогда как комплекс Monopolin может локализоваться в кинетохорах посредством связывания с Csm1 и Dsn1 (субъединица комплекса Mis12). Гомологи Csm1 и Lrs4 у делящихся дрожжей (Pcs1 и Mde4, соответственно) необязательны для моноориентации сестринских кинетохор в мейозе I; вместо этого они необходимы для накопления конденсина в области кинетохор во время митоза. Обратите внимание, что никаких очевидных гомологов субъединиц монополинового комплекса (кроме Hrr25, консервативного гомолога казеинкиназы I) и Moa1 у высших эукариот пока не обнаружено.
Рисунок 6
Четкая регуляция моноориентации кинетохор в мейозе I у дрожжей. (a) У почкующихся дрожжей моноориентация достигается за счет действия монополинового комплекса, который состоит из Csm1, Lrs4, Mam1 и Hrr25 (см. также b). Считается, что этот комплекс действует как молекулярный зажим сестринских кинетохор. Напротив, сцепление в ядре центромеры с помощью комплекса cohesin Rec8 является необходимым для моноориентации у делящихся дрожжей. Кроме того, Moa1, специфичный для мейоза кинетохорный белок, также играет существенную роль в слипчивости центральных центромер посредством Rec8, хотя механизм, с помощью которого Moa1 регулирует Rec8, неизвестен.(b) Moa1 может локализоваться в области кинетохор посредством связывания с CENP-C, тогда как комплекс Monopolin может локализоваться в кинетохорах посредством связывания с Csm1 и Dsn1 (субъединица комплекса Mis12). Гомологи Csm1 и Lrs4 у делящихся дрожжей (Pcs1 и Mde4, соответственно) необязательны для моноориентации сестринских кинетохор в мейозе I; вместо этого они необходимы для накопления конденсина в области кинетохор во время митоза. Обратите внимание, что никаких очевидных гомологов субъединиц монополинового комплекса (кроме Hrr25, консервативного гомолога казеинкиназы I) и Moa1 у высших эукариот пока не обнаружено.
Недавнее структурное исследование показало, что монополин имеет V-образную форму, включающую Csm1 и Lrs4 (Corbett et al ., 2010), и что каждое плечо V-образной формы образовано спиральной спиралью. димер Csm1. Было высказано предположение, что Mam1 и Hrr25 связываются с каждым концом этой «V-образной формы» (Corbett & Harrison, 2012). Из этих исследований предполагается, что V-образный комплекс монополина зажимает две сестринские кинетохоры, тем самым способствуя их моноориентации. Однако у делящихся дрожжей гомолог монополина (включающий Psc1 и Mde4), по-видимому, не требуется для моноориентации кинетохор в мейозе I (рис.6b; Gregan и др. ., 2007). Скорее, это необходимо для предотвращения меротельного прикрепления путем рекрутирования конденсинового комплекса (Tada et al. ., 2011). Таким образом, модель V-образного сгустка остается дискуссионной.
Регуляция моноориентации сестринских кинетохор у делящихся дрожжей
У делящихся дрожжей одним из наиболее важных регуляторов моноориентации кинетохор является специфичный для мейоза когезин Rec8. Комплекс cohesin состоит из двух субъединиц Smc, Smc1 и Smc3, субъединицы клейзина, Scc1, и дополнительной субъединицы, Scc3 (Nasmyth & Haering, 2009).В митозе субъединица клейзина когезина — это Rad21, которая заменяется другой субъединицей клейзина, Rec8, в мейозе. В нуль-мутанте rec8- cohesin Rad21 используется вместо cohesin Rec8, способствуя эквациональной, а не редукционной сегрегации во время анафазы I (Watanabe & Nurse, 1999; Yokobayashi et al. ., 2003). Это открытие указывает на то, что когезин Rec8 важен для моноориентации кинетохор. Важное различие между когезинами Rad21 и Rec8 заключается в их паттернах локализации вокруг центромер.В митозе когезин Rad21 накапливается специфически в перицентромерном гетерохроматине, как описано выше. Напротив, Rec8 накапливается не только в перицентромерном гетерохроматине, но также и в центральной области ядра, где собираются кинетохоры (Watanabe et al ., 2001). Соответственно, специфическое удаление Rec8 из центральной центромеры ведет к биориентации кинетохор в мейозе I (Yokobayashi & Watanabe, 2005), указывая на существенную роль Rec8 для моноориентации кинетохор.
Др. Мейоз-специфический фактор, необходимый для моноориентации кинетохор, — это Moa1, который был идентифицирован во время генетического скрининга на фактор, необходимый для редукционной сегрегации в мейозе I (Fig. 6a; Yokobayashi & Watanabe, 2005). Moa1 локализуется на кинетохорах путем связывания непосредственно с Cnp3 / CENP-C (Fig. 6b; Tanaka et al ., 2009). Важно, что сцепление в центральной центромере теряется у мутантов moa1 и rec8 , вызывая дефекты моноориентации сестринских кинетохор.Более того, искусственное связывание в центральной центромере восстанавливает моноориентацию сестринских кинетохор и редукционную сегрегацию у мутантов moa1 и rec8 в мейозе I (Sakuno et al ., 2009). Таким образом, можно сделать вывод, что моноориентация кинетохор устанавливается путем соединения дуплексов ДНК вместе в центральных центромерах (Fig. 6). Как Moa1 регулирует когезию центральной центромеры — важный вопрос для будущих исследований.
Кинетохор как платформа для активации SAC
Помимо обеспечения прикрепления хромосомы к микротрубочкам, кинетохора играет решающую роль в качестве платформы для активации SAC.SAC — это система наблюдения за клеточным циклом, которая задерживает наступление анафазы за счет ингибирования комплекса, способствующего анафазе (APC) (Rudner & Murray, 1996; Musacchio & Salmon, 2007). APC активирует сепаразу путем разложения секурина, ингибитора сепаразы (Cohen-Fix et al ., 1996; Funabiki et al ., 1996). SAC обнаруживает неприсоединенные кинетохоры и активируется за счет накопления на кинетохорах основных компонентов SAC Mps1 / Mph2, Bub1, Bub3, Mad1, Mad2 и Mad3 / BubR1, которые были первоначально идентифицированы во время генетического скрининга у почкующихся дрожжей (Hoyt et al. ., 1991; Ли и Мюррей, 1991; Вайс и Вайни, 1996; Тейлор и др. , 1998; Abrieu и др. ., 2001). Эти белки SAC задерживают наступление анафазы за счет инактивации Cdc20, белка-активатора APC (Hwang et al. ., 1998; Kim et al. ., 1998). Недавние исследования выявили механизмы, лежащие в основе локализации белков SAC на кинетохорах (London et al ., 2012; Shepperd et al ., 2012; Yamagishi et al ., 2012).
Нацеливание белков SAC на кинетохоры
Среди белков SAC киназа Mps1 / Mph2, как было установлено, необходима для рекрутирования почти всех др. Компонентов SAC на кинетохоры (Heinrich et al ., 2012). Mps1 представляет собой широко консервативную протеинкиназу, которая локализуется на неприсоединенных кинетохорах в раннем митозе. Определение важнейшего субстрата Mps1 заняло много времени, но совсем недавно три независимые группы показали, что кинетохорный белок KNL1 / Spc105 / Spc7 является консервативным субстратом Mps1 в почкующихся дрожжах, делящихся дрожжах и клетках человека (рис.7; Лондон, и др., , 2012; Шепперд и др. , 2012; Ямагиши и др. , 2012). Mps1 фосфорилирует KNL1 по множеству сайтов, в основном по консервативным повторам MELT, и это фосфорилирование рекрутирует комплекс Bub1-Bub3 на кинетохоры. Bub1 и Bub3 также являются консервативными белками SAC и образуют плотный комплекс на протяжении всего клеточного цикла. Связанный с кинетохорами Bub1-Bub3 необходим для локализации др. Белков SAC, Mad1 и BubR1 / Mad3. Mad3 взаимодействует с комплексом Bub1 – Bub3 и тем самым локализуется в кинетохорах (рис.7). Напротив, лежащий в основе молекулярный механизм локализации кинетохор Mad1 остается неясным. Связанный с кинетохорами Bub1-Bub3 необходим, но недостаточен для локализации Mad1 на кинетохорах, и эта локализация нуждается в Mps1 (Yamagishi et al ., 2012). Выяснение того, как Mad1 нацелен на кинетохоры, является важным следующим шагом к полному пониманию механизмов активации SAC.
Рисунок 7
Путь Mph2 – Spc7 – Bub1, необходимый для активации SAC.В присутствии неприсоединенных кинетохор в раннем митозе Mph2 / Mps1 локализуется на кинетохорах способом, зависящим от Aurora B, и фосфорилирует Spc7 / Knl1 / Spc105. Это облегчает рекрутирование комплекса Bub1-Bub3-Mad3 / BubRI на кинетохоры. Впоследствии комплекс Bub1 может рекрутировать Mad1 и Mad2, и эти комплексы затем активируют SAC. Mph2 также необходим для локализации кинетохор Mad1 независимо от комплекса Bub1. Белки каркаса Mph2 и Mad1 на несвязанных кинетохорах остаются неизвестными.
Рисунок 7
Путь Mph2 – Spc7 – Bub1, необходимый для активации SAC. В присутствии неприсоединенных кинетохор в раннем митозе Mph2 / Mps1 локализуется на кинетохорах способом, зависящим от Aurora B, и фосфорилирует Spc7 / Knl1 / Spc105. Это облегчает рекрутирование комплекса Bub1-Bub3-Mad3 / BubRI на кинетохоры. Впоследствии комплекс Bub1 может рекрутировать Mad1 и Mad2, и эти комплексы затем активируют SAC. Mph2 также необходим для локализации кинетохор Mad1 независимо от комплекса Bub1.Белки каркаса Mph2 и Mad1 на несвязанных кинетохорах остаются неизвестными.
Хотя рекрутирование Mps1 на неприсоединенные кинетохоры может быть самым вышестоящим событием в активации SAC, неизвестно, как Mps1 обнаруживает неприсоединенные кинетохоры. Недавнее исследование на делящихся дрожжах показало, что киназная активность Aurora B гомолога Ark1 необходима для локализации кинетохор Mph2 и для активации SAC (Fig. 7; Heinrich et al ., 2012). Привлекательной моделью является то, что Aurora B фосфорилирует субстраты в сайтах связывания микротрубочек, чтобы дестабилизировать прикрепление кинетохор к микротрубочкам, и что фосфорилированные субстраты одновременно становятся сайтами стыковки для Mps1.В поддержку этой схемы, домен связывания микротрубочек Ndc80, который фосфорилируется Aurora B, необходим для локализации кинетохор Mps1 в клетках человека (Martin-Lluesma et al ., 2002; Saurin et al . , 2011; Nijenhuis et al ., 2013). Хотя недавнее исследование показало, что известные сайты фосфорилирования на N-конце Ndc80 не вносят вклад в нацеливание на кинетохоры Mps1 (Nijenhuis et al ., 2013), фосфорилирование на других сайтах в Ndc80 или других кинетохорных белках может быть важным для нацеливания Mps1 .
Заключительные замечания
Недавний прогресс в исследованиях кинетохор идентифицировал почти полный список компонентов кинетохор и выявил многие аспекты функции и регуляции кинетохор. Однако остается много безответных вопросов. Как регулируется сборка кинетохор во время репликации ДНК? Как сплоченность центральной центромеры устанавливается специфически в мейозе I? Каким образом SAC различает прикрепленные и неприсоединенные кинетохоры? Распространено мнение, что почкующиеся дрожжи и делящиеся дрожжи внесли совместный вклад в изучение кинетохор.В частности, недавнее исследование почкующихся дрожжей преуспело в очистке кинетохорных частиц, которые содержат все основные кинетохорные белки и сохраняют ключевые функции нативных кинетохор (Akiyoshi et al ., 2010). В настоящее время дрожжи могут оставаться основными модельными организмами, используемыми для ответа на фундаментальные вопросы о кинетохоре.
Список литературы
и др. . (
2001
)Mps1 представляет собой кинетохор-ассоциированную киназу, необходимую для контрольной точки митоза позвоночных
.Ячейка
106
:83
—93
.& (
2009
)Анализ Ipl1-опосредованного фосфорилирования кинетохорного белка Ndc80 в Saccharomyces cerevisiae
.Генетика
183
:1591
—1595
.и др. . (
2010
)Натяжение напрямую стабилизирует воссозданные прикрепления кинетохор и микротрубочек
.Природа
468
:576
—579
.(
1995
)Элементы структуры и функции хромосом у делящихся дрожжей
.Semin Cell Biol
6
:55
—64
.& (
2010
)Кинетохорный комплекс Ndc80 формирует олигомерные массивы вдоль микротрубочек
.Природа
467
:805
—810
.& (
2009
)Комплекс CENP-S необходим для стабильной сборки внешней кинетохорной структуры
.J Cell Biol
186
:173
—182
.& (
2006
)Кинетохорный комплекс Dam1 использует динамику микротрубочек для создания силы и движения
.P Natl Acad Sci USA
103
:9873
—9878
.& (
2011
)HJURP представляет собой фактор сборки хроматина CENP-A, достаточный для образования функциональной кинетохоры de novo
.J Cell Biol
194
:229
—243
.& (
2004
)Идентификация двух новых компонентов кинетохорного комплекса NDC80 человека
.J Biol Chem
279
:13076
—13085
.& (
2008
)Вариант гистона CENP-A и спецификация центромеры
.Curr Opin Cell Biol
20
:91
—100
.и др. . (
2012
)Cnn1 ингибирует взаимодействия между комплексами KMN кинетохоры дрожжей
.Nat Cell Biol
14
:614
—624
.& (
2000
)Разъединение гомологичных хромосом в мейозе I зависит от протеолитического расщепления мейотического когезина Rec8 сепарином
.Ячейка
103
:387
—398
.& (
2011
)Потребность в комплексе Dam1 зависит от количества кинетохорных белков и микротрубочек
.Curr Biol
21
:889
—896
.& (
2008
)Наблюдение за геномом хозяина на наличие ретротранспозонов с помощью белков, полученных из транспозонов
.Природа
451
:431
—436
.& (
2013
)Восприятие напряжения с помощью киназы Aurora B не зависит от локализации центромеры на основе сурвивина
.Природа
497
:118
—121
.& (
1993
)Выделение и характеристика мутантов по увеличению хромосом и увеличению плоидности у дрожжей
.Генетика
135
:677
—691
.и др. . (
2001
)Влияние нового мультипротеинового комплекса Dam1p на функцию внешней кинетохоры
.J Cell Biol
155
:1137
—1145
.и др. . (
2002
)Фосфорегуляция прикрепления кинетохор к микротрубочкам с помощью киназы Aurora Ipl1p
.Ячейка
111
:163
—172
.& (
2006
)Консервированная сеть KMN составляет основной сайт связывания микротрубочек кинетохоры
.Ячейка
127
:983
—997
.& (
2008
)KNL1 и комплекс CENP-H / I / K координированно направляют сборку кинетохор у позвоночных
.Mol Biol Cell
19
:587
—594
.& (
1989
)Составные мотивы и повторяющаяся синметрия в S. pombe центромер
.Ячейка
57
:739
—751
.& (
2012
)Ndc10 представляет собой платформу для сборки внутренней кинетохор у почкующихся дрожжей
.Нат Структ Мол Биол
19
:48
—55
.и др. .(
2008
)Влияние на прикрепление кинетохор к микротрубочкам из структуры сконструированного комплекса Ndc80
.Ячейка
133
:427
—439
.& (
1980
)Выделение центромеры дрожжей и построение функциональных малых кольцевых хромосом
.Nuture
287
:504
—509
.& (
2003
)Центромеры и кинетохоры.От эпигенетики к передаче сигналов митотических контрольных точек
.Ячейка
112
:407
—421
.& (
1996
)Инициирование анафазы в Saccharomyces cerevisiae контролируется APC-зависимой деградацией ингибитора анафазы Pds1p
.Genes Dev
10
:3081
—3093
.(
1996
)SKP1 почкующихся дрожжей кодирует эволюционно консервативный кинетохорный белок, необходимый для развития клеточного цикла
.Ячейка
86
:275
—285
.& (
2012
)Молекулярная архитектура дрожжевого монополинового комплекса
.Cell Rep
1
:583
—589
.& (
2010
)Монополиновый комплекс сшивает компоненты кинетохор, чтобы регулировать прикрепление хромосомы к микротрубочкам
.Ячейка
142
:556
—567
.& (
2006
)Динамика микротрубочек кинетохор и стабильность прикрепления регулируются Hec1
.Ячейка
127
:969
—982
.& (
1993
)Трехмерная реконструкция и анализ митотических веретен дрожжей, Schizosaccharomyces pombe
.J Cell Biol
120
:141
—151
.& (
2012
)Связывание микротрубочек с помощью KNL-1 вносит вклад в молчание контрольных точек веретена на кинетохоре
.J Cell Biol
196
:469
—482
.& (
2011
)Формирование стабильных связей между кинетохорами и микротрубочками зависит от фосфатазы B56-PP2A
.Nat Cell Biol
13
:1265
—1271
.& (
2006
)Комплекс, связанный с центромерной нуклеосомой CENP-A человека
.Nat Cell Biol
8
:458
—469
.& (
2013
)Создание эффективного переключения кинетохоры путем фосфорилирования и дефосфорилирования
.Хромосома
122
:135
—158
.& (
1996
)Протеолиз Cut2, необходимый для разделения сестринских хроматид у делящихся дрожжей
.Природа
381
:438
—441
.& (
2011
)Индуцированная эктопическая сборка кинетохор обходит потребность в нуклеосомах CENP-A
.Ячейка
145
:410
—422
.и др. . (
2007
)Кинетохорные белки Pcs1 и Mde4 и гетерохроматин необходимы для предотвращения меротельной ориентации
.Curr Biol
17
:1190
—1200
.& (
2008
)Присоединение кинетохор к микротрубочкам основывается на неупорядоченном N-концевом хвостовом домене Hec1
.Curr Biol
18
:1778
—1784
.& (
2011
)Сборка центромер и кинетохор in vitro на определенных шаблонах хроматина
.Природа
477
:354
—358
.& (
1997
)Центромерный ДНК-связывающий белок из делящихся дрожжей влияет на сегрегацию хромосом и имеет гомологию с CENP-B
человека.J Cell Biol
136
:487
—500
.& (
2004
)Mis16 и Mis18 необходимы для загрузки CENP-A и деацетилирования гистонов на центромерах
.Ячейка
118
:715
—729
.& (
2012
)Локализация кинетохор Mph2 является критической и вышестоящей в иерархии рекрутирования белка контрольной точки сборки веретена на кинетохоры
.J Cell Sci
125
:4720
—4727
.& (
2005
)Центромерный хроматин: что делает его уникальным?
Curr Opin Genet Dev
15
:177
—184
.& (
2013
)Гетеродимер Iml3-Chl4 связывает центральную центромеру с факторами, необходимыми для точной сегрегации хромосом
.Cell Rep
5
:29
—36
.& (
1991
)S. cerevisiae гены, необходимые для остановки клеточного цикла в ответ на потерю функции микротрубочек
.Ячейка
66
:507
—517
.& (
2011
)Внутренняя петля Ndc80 взаимодействует с Dis1 / TOG для обеспечения правильного прикрепления кинетохора к веретену у делящихся дрожжей
.Curr Biol
21
:214
—220
.и др. . (
1998
)Мыши с нулевым центромерным белком B митотически и мейотически нормальны, но имеют вес нижней части тела и семенников
.J Cell Biol
141
:309
—319
.и др. . (
1998
)Бутылочные дрожжи Cdc20: мишень для контрольной точки веретена [см. Комментарии]
[опубликованная ошибка появляется в Science 1998 May 29; 280 (5368): 1331].Наука
279
:1041
—1044
.& (
2001
)Функциональная избыточность, различные локализации и взаимодействия между тремя гомологами центромерного белка B
у делящихся дрожжей.Генетика
157
:1191
—1203
.и др. . (
2008
)Целостность гетерохроматина влияет на реорганизацию хромосом после дисфункции центромеры
.Наука
321
:1088
—1091
.и др. . (
2006
)Комплексный анализ компонентов ICEN (Interphase Centromere Complex), обогащенных CENP-A хроматином клеток человека
.Гены Клетки
11
:673
—684
.& (
2002
)Четыре новых субъединицы комплекса Dam1-Duo1 обнаруживают новые функции в биориентации сестринских кинетохор
.EMBO J
21
:181
—193
.& (
2011
)Структурная основа распознавания фосфорилированного гистона h4 субъединицей сурвивина хромосомного пассажирского комплекса
.Структура
19
:1625
—1634
.& (
2012
)Структурная и функциональная организация комплекса Ska, ключевого компонента интерфейса кинетохора-микротрубочка
.Mol Cell
46
:274
—286
.& (
2004
)Spo13 облегчает рекрутирование монополинов на кинетохоры и регулирует поддержание центромерной когезии во время дрожжевого мейоза
.Curr Biol
14
:2183
—2196
.& (
2010
)Фосфорилирование h3A с помощью Bub1 предотвращает хромосомную нестабильность за счет локализации шугошина
.Наука
327
:172
—177
.& (
2010
)Сурвивин считывает фосфорилированный гистон h4 треонин 3 для активации митотической киназы Aurora B
.Наука
330
:235
—239
.& (
2007
)Консервативный белок Spc7 необходим для целостности веретена и связывает кинетохорные комплексы у делящихся дрожжей
.Mol Biol Cell
18
:2441
—2454
.& (
2009
)Искусственной кинетохоры на основе Dam1 достаточно, чтобы способствовать сегрегации хромосом у почкующихся дрожжей
.Nat Cell Biol
11
:1109
—1115
.& (
1998
)Делящиеся дрожжи Slp1: эффектор Mad2-зависимой контрольной точки веретена
.Наука
279
:1045
—1047
.& (
1982
)Ультраструктура митотических веретен, выделенных из мутанта дрожжевого цикла клеточного деления, Saccharomyces cerevisiae
.евро J Cell Biol
28
:98
—102
.& (
2001
)Эволюционная консервация между почкующимися дрожжами и кинетохорами человека
.Nat Rev Mol Cell Biol
2
:678
—687
.& (
2003
)Расщепление Rec8 сепаразой необходимо для мейотических ядерных делений у делящихся дрожжей
.EMBO J
22
:5643
—5653
.& (
2004
)Консервативный кинетохорный белок шугошин защищает центромерную когезию во время мейоза
.Природа
427
:510
—517
.& (
2006
)Шугошин сотрудничает с протеинфосфатазой 2A для защиты когезина
.Природа
441
:46
—52
.& (
2009
)Рекрутирование комплекса связывания микротрубочек с ДНК направляет сегрегацию хромосом у почкующихся дрожжей
.Nat Cell Biol
11
:1116
—1120
.& (
2004
)Spo13 поддерживает центромерную когезию и коориентацию кинетохор во время мейоза I
.Curr Biol
14
:2168
—2182
.и др. . (
2008
)Единый режим центромерной защиты шугошином в ооцитах и соматических клетках млекопитающих
.Nat Cell Biol
10
:42
—52
.& (
1991
)Контроль митоза с обратной связью у почкующихся дрожжей
.Ячейка
66
:519
—531
.& (
2005
)Генетический анализ кинетохорного комплекса DASH показывает антагонистические отношения с путем ras / протеинкиназы A и новой субъединицей, необходимой для ассоциации Ask1
.Mol Cell Biol
25
:767
—778
.& (
2009
)Определение би-ориентации хромосом путем пространственного отделения киназы Aurora B от кинетохорных субстратов
.Наука
323
:1350
—1353
.& (
2010
)Регулируемое нацеливание протеинфосфатазы 1 на внешнюю кинетохору с помощью KNL1 противостоит киназе Aurora B
.J Cell Biol
188
:809
—820
.& (
2013a
)Phospho-h3A и cohesin определяют отдельные регулируемые натяжением пулы Sgo1 на кинетохорах и внутренних центромерах
.Curr Biol
23
:1927
—1933
.& (
2013b
)Связывание SGO1-PP2A с cohesin с помощью фосфорилирования защищает когезию сорорина и центромеров во время митоза
.Nat Cell Biol
15
:40
—49
.& (
2012
)Фосфорегуляция Spc105 с помощью Mps1 и PP1 регулирует локализацию Bub1 в кинетохорах
.Curr Biol
22
:900
—906
.& (
2013
)Структурная основа рекрутирования кинетохор комплекса Ndc80 посредством двух различных рецепторов центромер
.EMBO J
32
:409
—423
.& (
2002
)Роль Hec1 в передаче сигналов контрольной точки веретена и рекрутировании кинетохор Mad1 / Mad2
.Наука
297
:2267
—2270
.& (
2004
)Роль CENP-B и альфа-сателлитной ДНК: de novo сборка и эпигенетическое поддержание центромер человека
.Chromosome Res
12
:543
—556
.и др. . (
2008
)Dbf4-зависимая киназа CDC7 связывает репликацию ДНК с сегрегацией гомологичных хромосом в мейозе I
.Ячейка
135
:662
—678
.и др. . (
2011
)Область петли Ndc80 способствует образованию прикрепления кинетохор к динамической микротрубочке плюс конец
.Curr Biol
21
:207
—213
.и др. . (
2004
)Комплекс Ndc80 позвоночных содержит гомологи Spc24 и Spc25, которые необходимы для установления и поддержания прикрепления кинетохор к микротрубочкам
.Curr Biol
14
:131
—137
.& (
1997
)Созревание кинетохор в клетках PtK1 и его значение для механизмов хромосомной конгрессии и начала анафазы
.J Cell Biol
137
:1567
—1580
.и др. . (
2011
)Для отключения контрольной точки шпинделя требуется связь PP1 с двигателями Spc7 и kinesin-8
.Dev Cell
20
:739
—750
.& (
1997
)Состав и сборка центромер почкующихся дрожжей, выявленные с помощью in vivo сшивания
.Genes Dev
11
:3401
—3412
.& (
1998
)Cse4p является компонентом центральной центромеры Saccharomyces cerevisiae
.Ячейка
94
:607
—613
.& (
2011
)Drosophila CENh4 достаточно для образования центромеры
.Наука
334
:686
—690
.& (
2008
)Присоединения кинетохор требуют взаимодействия между неструктурированными хвостами на микротрубочках и Ndc80 (Hec1)
.Curr Biol
18
:1785
—1791
.& (
1996
)Идентификация, очистка и молекулярное клонирование автономно реплицирующегося связывающего последовательность белка 1 из делящихся дрожжей Schizosaccharomyces pombe
.P Natl Acad Sci USA
93
:502
—507
.& (
2007
)Контрольная точка сборки шпинделя в пространстве и времени
.Nat Rev Mol Cell Biol
8
:379
—393
.(
2011
)Cohesin: цепочка с отдельными входными и выходными воротами?
Nat Cell Biol
13
:1170
—1177
.& (
2009
)Cohesin: его роли и механизмы
.Annu Rev Genet
43
:525
—558
.и др. . (
2013
)N-концевой модуль MPS1, содержащий TPR домен, необходим для локализации его кинетохор с помощью Aurora B
.J Cell Biol
201
:217
—231
.и др. .(
2012
)CENP-T-W-S-X формирует уникальную центромерную структуру хроматина с гистоноподобной складкой
.Ячейка
148
:487
—501
.& (
2013
)CENP-T обеспечивает структурную платформу для сборки внешней кинетохоры
.EMBO J
32
:424
—436
.& (
2004
)Консервативный комплекс центромеры Mis12 связан с гетерохроматическим HP1 и белком внешней кинетохоры Zwint-1
.Nat Cell Biol
6
:1135
—1141
.& (
2012
)Плавная и стабильная работа центромер
.Гены Genet Syst
87
:63
—73
.и др. . (
2006
)Комплекс CENP-H-I необходим для эффективного включения вновь синтезированного CENP-A в центромеры
.Nat Cell Biol
8
:446
—457
.& (
1976
)Электронно-микроскопическое исследование веретена и движения хромосом у дрожжей Saccharomyces cerevisiae
.J Cell Sci
22
:219
—242
.и др. . (
2006
)Для монополярного прикрепления сестринских кинетохоров в мейозе I требуется казеинкиназа 1
.Ячейка
126
:1049
—1064
.и др. . (
2010
)Комплекс MIS12 является центром взаимодействия белков для сборки внешней кинетохоры
.J Cell Biol
190
:835
—852
.& (
2003
)Sim4: новый кинетохорный белок делящихся дрожжей, необходимый для центромерного сайленсинга и сегрегации хромосом
.J Cell Biol
161
:295
—307
.и др. . (
2009
)Scm3 делящихся дрожжей: рецептор CENP-A, необходимый для целостности субкинетохорного хроматина
.Mol Cell
33
:299
—311
.& (
2003
)Комплекс Mtw1 способствует биориентации кинетохор, которая контролируется протеинкиназой Ipl1 / Aurora
.Dev Cell
5
:735
—745
.и др. . (
2009
)Кинетохорный комплекс Ndc80 формирует несущие нагрузки прикрепления к динамическим концам микротрубочек посредством смещенной диффузии
.Ячейка
136
:865
—875
.& (
2011
)CENP-C — это структурная платформа для сборки кинетохор
.Curr Biol
21
:399
—405
.и др. . (
2003
)Рекрутирование кинетохор двух ядрышковых белков необходимо для сегрегации гомологов в мейозе I
.Dev Cell
4
:535
—548
.и др. . (
2006
)Протеиновая фосфатаза 2A защищает слипание центромерных сестринских хроматид во время мейоза I
.Природа
441
:53
—61
.(
1982
)Формирование, структура и состав кинетохор и кинетохорных волокон млекопитающих
.Int Rev Cytol
79
:1
—58
.& (
2011
)KNL1 / Spc105 нанимает PP1, чтобы заглушить контрольную точку узла шпинделя
.Curr Biol
21
:942
—947
.& (
2013
)Процесс сборки кинетохор в дрожжах
.FEMS Microbiol Lett
338
:107
—117
.& (
2007
)Хромосомные пассажиры: деление клеток
.Nat Rev Mol Cell Biol
8
:798
—812
.& (
1996
)Контрольная точка шпиндельной сборки
.Curr Opin Cell Biol
8
:773
—780
.& (
2009
)Исследования мейоза раскрывают различные роли когезии в центральной центромере и перицентромерном регионе
.Chromosome Res
17
:239
—249
.& (
2009
)Геометрия кинетохор определяется сцеплением внутри центромеры
.Природа
458
:852
—858
.и др. . (
2005
)Комплекс DASH и кинезин Klp5 / Klp6 координируют прикрепление биполярных хромосом у делящихся дрожжей
.EMBO J
24
:2931
—2943
.& (
2013
)Субъединица монополина Csm1 ассоциирует с комплексом MIND, чтобы установить монополярное прикрепление сестринских кинетохоров в мейозе I
.PLoS Genet
9
:e1003610
.& (
2011
)Aurora B потенцирует активацию Mps1 для обеспечения быстрого установления контрольных точек в начале митоза
.Нац Коммуна
2
:316
.& (
2012
)Белки CENP-T являются консервативными центромерными рецепторами комплекса Ndc80
.Nat Cell Biol
14
:604
—613
.& (
2011
)Прямое связывание Cenp-C с комплексом Mis12 соединяет внутреннюю и внешнюю кинетохоры
.Curr Biol
21
:391
—398
.и др. . (
2012
)Фосфозависимое рекрутирование Bub1 и Bub3 на Spc7 / KNL1 с помощью киназы Mph2 поддерживает контрольную точку веретена
.Curr Biol
22
:891
—899
.& (
2013
)Замена CENP-A
.Cell Mol Life Sci
70
:387
—406
.& (
2012
)Интеграция киназной и фосфатазной активностей с помощью BUBR1 обеспечивает образование стабильных прикреплений кинетохор и микротрубочек
.Dev Cell
23
:745
—755
.& (
2011
)Ассоциация конденсина с гистоном h3A формирует митотические хромосомы
.Природа
474
:477
—483
.& (
2000
)Требование соединителя центромеры Mis6 для локализации CENP-A-подобного белка в делящихся дрожжах
.Наука
288
:2215
—2219
.(
2010
)Взаимодействия кинетохора-микротрубочка: шаги к би-ориентации
.EMBO J
29
:4070
—4082
.и др. . (
2002
)Доказательство того, что комплекс Ipl1-Sli15 (Aurora kinase-INCENP) способствует биориентации хромосом путем изменения связей кинетохора-полюс веретена
.Ячейка
108
:317
—329
.& (
2009
)CENP-C функционирует как каркас для эффекторов с важными кинетохорными функциями в митозе и мейозе
.Dev Cell
17
:334
—343
.& (
2013
)Внутренняя петля делящихся дрожжей Ndc80 связывает Alp7 / TACC-Alp14 / TOG и обеспечивает правильное прикрепление хромосомы
.Mol Biol Cell
24
:1122
—1133
.& (
1998
)Человеческий гомолог Bub3 необходим для кинетохорной локализации Bub1 и родственной Mad3 / Bub1 протеинкиназы
.J Cell Biol
142
:1
—11
.& (
2000
)Функциональная геномика идентифицирует монополин: кинетохорный белок, необходимый для сегрегации гомологов во время мейоза I
.Ячейка
103
:1155
—1168
.& (
2010
)Фосфорилирование CPC с помощью Cdk1 способствует би-ориентации хромосом
.Природа
467
:719
—723
.(
2009
)Вопрос выбора: установление сцепления сестринских хроматид
.Представитель EMBO
10
:1095
—1102
.и др. . (
2012
)Рекрутирование человеческого белка лицензирования репликации Cdt1 петлевым доменом Hec1 необходимо для стабильного прикрепления кинетохора к микротрубочке
.Nat Cell Biol
14
:593
—603
.& (
2008
)Архитектура и гибкость дрожжевого кинетохорного комплекса Ndc80
.Дж Мол Биол
383
:894
—903
.и др. . (
2010
)Фосфорилирование гистона h4 Thr-3 с помощью Haspin позиционирует Aurora B на центромерах митоза
.Наука
330
:231
—235
.& (
2011
)Динамика полярного сияния B на центромерах создает градиент фосфорилирования
, основанный на диффузии.J Cell Biol
194
:539
—549
.& (
1999
)Cohesin Rec8 необходим для редукционной сегрегации хромосом при мейозе
.Природа
400
:461
—464
.& (
2001
)Премейотическая S-фаза связана с редукционной сегрегацией и рекомбинацией хромосом
.Природа
409
:359
—363
.& (
2005
)Молекулярная организация комплекса Ndc80, важного кинетохорного компонента
.P Natl Acad Sci USA
102
:5363
—5367
.& (
2007
)Комплекс Ndc80 / HEC1 является точкой контакта для прикрепления кинетохоры и микротрубочек
.Nat Struct Mol Biol
14
:54
—59
.& (
1996
)Saccharomyces cerevisiae ген дупликации тела полюса веретена MPS1 является частью митотической контрольной точки
.J Cell Biol
132
:111
—123
.& (
2009
)Комплекс кинетохор человека Ska1 способствует подвижности микротрубочек, связанной с деполимеризацией
.Dev Cell
16
:374
—385
.& (
2010
)Aurora B фосфорилирует пространственно разные мишени, чтобы по-разному регулировать интерфейс кинетохора-микротрубочка
.Mol Cell
38
:383
—392
.& (
2013
)Семейные вопросы: структурная и функциональная консервация белков, связанных с центромерой, от дрожжей до человека
.Trends Cell Biol
23
:260
—269
.& (
2003
)Архитектура кинетохоры почкующихся дрожжей обнаруживает консервативное молекулярное ядро
.J Cell Biol
163
:215
—222
.и др. . (
2005
)Формирование динамического интерфейса кинетохора-микротрубочка посредством сборки кольцевого комплекса Dam1
.Mol Cell
17
:277
—290
.& (
1989
)Организация дальнего действия тандемных массивов альфа-сателлитной ДНК в центромерах хромосом человека: высокочастотный полиморфизм длины массива и мейотическая стабильность
.P Natl Acad Sci USA
86
:9394
—9398
.& (
2001
)Комплекс Ndc80p из Saccharomyces cerevisiae содержит консервативные компоненты центромеры и выполняет функцию сегрегации хромосом
.J Cell Biol
152
:349
—360
.(
1990
)Центромеры хромосом млекопитающих
.Trends Genet
6
:410
—416
.& (
2010
)Две гистоновые метки устанавливают внутреннюю центромеру и биориентацию хромосомы
.Наука
330
:239
—243
.& (
2012
)MPS1 / Mph2 фосфорилирует кинетохорный белок KNL1 / Spc7 для рекрутирования компонентов SAC
.Nat Cell Biol
14
:746
—752
.и др. . (
2012
)Комплекс Saccharomyces cerevisiae MHF структурно напоминает гетеротетрамер гистонов (h4-h5) (2) и функционирует как гетеротетрамер
.Структура
20
:364
—370
.& (
2005
)Кинетохорный белок Moa1 обеспечивает опосредованное когезией монополярное прикрепление в мейозе I
.Ячейка
123
:803
—817
.& (
2003
)Cohesins определяют способ прикрепления кинетохор к микротрубочкам веретена в мейозе I у делящихся дрожжей
.Mol Cell Biol
23
:3965
—3973
.& (
2012
)Внутренняя петля Ndc80 необходима для рекрутирования комплекса Ska для установления прикрепления микротрубочек на конце к кинетохорам
.J Cell Sci
125
:3243
—3253
.© 2014 Федерация европейских микробиологических обществ.
Инструктивный внеклеточный матрикс легкого: основной состав и изменения при хроническом заболевании легких
Часть A: легочный ECM
Эволюция сложных тканей у высших организмов сопровождается увеличением разнообразия белков и структурной организации в ECM [ 1], а также расширение разнообразия рецепторов ЕСМ на клетках.Как и во всех других системах органов, легочный ECM состоит из двух основных структурных типов: 1) базальные мембраны, которые представляют собой тонкие слои гликопротеинов, которые покрывают базальную сторону эпителия и эндотелия и окружают мышечные, жировые и периферические нервные клетки; и 2) интерстициальные матрицы, которые образуют рыхлую и похожую на фибриллы сетку, которая связывает структурные типы клеток в тканях и, таким образом, поддерживает трехмерную (3D) когезию и биомеханические характеристики легких [2].И базальные мембраны, и интерстициальные матрицы образуют тканеспецифические «ниши», которые влияют на стволовость и дифференцировку популяций клеток-предшественников / стволовых клеток, а также на правильную функцию тканеспецифичных дифференцированных типов клеток.
Распутывание матрисомы
На основании биоинформатического анализа доступного генома млекопитающих, число основных структурных компонентов всего ЕСМ млекопитающего, по прогнозам, включает ~ 300 белков (основная матрисома) [3, 4].Кроме того, ЕСМ связывается и служит резервуаром для большого количества секретируемых белков, таких как факторы роста, модифицирующие ЕСМ ферменты или другие связанные с ЕСМ белки, которые не вносят вклад в структуру ЕСМ, но влияют на его функцию как обучающая «ниша» (белки, ассоциированные с матрисомой). Из-за их сложных биохимических свойств (нерастворимость, высокая молекулярная масса и высокая степень сшивки белков) детальный анализ белков ЕСМ был очень сложным [5]; однако недавний прогресс в области оборудования для масс-спектрометрии (МС) и алгоритмов количественной оценки впервые позволил провести всесторонний анализ протеомов ЕСМ из различных тканей [6–13].Количественная оценка белков без метки с помощью МС не только позволяет относительное сравнение белков в разных образцах и экспериментальных условиях, но также позволяет оценить абсолютные количества [14]. Используя этот подход, мы проанализировали наш недавно опубликованный набор протеомных данных протеома легких мышей [12] и оценили относительное содержание белков коровой матрицы, что позволило получить углубленный профиль экспрессии ECM в легких здоровых мышей (рис. 1).
РИСУНОК 1Протеом внеклеточного матрикса (ЕСМ) взрослого здорового легкого мыши.а) Мы использовали наш недавно опубликованный набор протеомных данных протеомов легких мышей для расчета относительной массовой доли белка указанных категорий генов. Интенсивности МС белков в пределах изображенных категорий генов выражали в миллионных долях от общей интенсивности МС всех белков. б – г) Для определения относительного числа копий белков ЕСМ в протеоме легких интенсивность МС нормализовали к теоретическому количеству триптических пептидов (нормализация размера белка; iBAQ).Мы использовали эту оценку числа копий белка для ранжирования коллагенов (b), протеогликанов (c) и гликопротеинов (d) по их количеству. МС: масс-спектрометрия; iBAQ: абсолютное количественное определение на основе интенсивности.
Состав ЕСМ
Коллагены составляют основную часть протеина в легких [15], и они сильно изменяются при многих заболеваниях легких (рис. 2). Фибриллярные коллагены (типы I, II, III, V и XI), которые имеют большую прочность на разрыв, но низкую эластичность, вносят вклад в общую архитектуру легкого [16, 17], тогда как большие эластичные волокна, которые характеризуются низкой прочность на разрыв и высокая эластичность, обеспечивают легкому необходимую податливость и упругую отдачу.Эластичные волокна состоят из двух различных компонентов: эластин белка ЕСМ находится в его сшитой форме во внутренней сердцевине эластичных волокон, тогда как внешняя периферия эластичных волокон содержит микрофибриллы размером 10-15 нм [18].
РИСУНОК 2Патологические изменения внутри интерстициального внеклеточного матрикса (ЕСМ) в пораженном легком. а) Обзор легкого и участков образования болезни. б) Здоровый интерстициальный ECM поддерживается активностью резидентных фибробластов и представляет собой рыхлую сеть коллагенов, эластина и фибронектина, прикрепленную к базальной мембране слоя эпителиальных клеток.c) При идиопатическом фиброзе легких (IPF) фибробласты трансдифференцируются в миофибробласты с высокой сократимостью, которые откладывают высокие уровни молекул ECM в интерстиции и резко увеличивают жесткость ECM за счет ферментативного ковалентного сшивания коллагена и эластина. г) Признаками патологических изменений внутри ВКМ при хронической обструктивной болезни легких (ХОБЛ) являются обширное разрушение эластических волокон ферментами, разрушающими ВКМ, высвобождаемыми воспалительными клетками, наряду с повышенными уровнями гиалуронана и тенасцина С и сниженным отложением декорина. .Разрушение слоя эпителиальных клеток приводит к увеличению воздушного пространства (эмфиземе). д) При легочной артериальной гипертензии (ЛАГ) ремоделирование внеклеточного матрикса в стенке артерии характеризуется увеличением эластиновых и коллагеновых волокон, фибронектина и тенасцина С и гиперплазией гладкомышечных клеток. е) При астме характерные изменения ВКМ происходят под эпителием бронхов и утолщенной базальной мембраной. Кроме того, гладкомышечные клетки подвергаются гиперплазии, и увеличивается отложение коллагенов, фибронектина, гиалуронана и декорина.ж) При раке опухоли на первичной и метастатической сторонах окружены обширной жесткой стромой, которая содержит сильно сшитые коллагены и высокие уровни фибронектина, тенасцина С и гиалуронана. з) Легенда, изображающая молекулы и типы клеток.
Основными структурными компонентами микрофибрилл являются крупные гликопротеины фибриллин-1, -2 и -3 [19]. Кроме того, другие белки, такие как гликопротеины, ассоциированные с микрофибриллами, фибулины, белки, расположенные на границе раздела микрофибрилл эластина (EMILINs) и члены семейства эластин-сшивающих лизилоксидаз (LOX), связаны с микрофибриллами или с самим эластином [18].Интересно, что связанный с микрофибриллами протеин 4 (MFAP4) был самым распространенным гликопротеином, обнаруженным в нашем наборе данных по матрисомам легких здоровых взрослых мышей (рисунок 1) [12]. У людей высокая экспрессия MFAP4 была показана не только для легких, но и для других высокоэластичных тканей, таких как сердце и кишечник [20]. Биологическая функция MFAP4 в значительной степени неизвестна; Хотя он был идентифицирован как сывороточный биомаркер гаптического фиброза, он не может служить биомаркером фиброза легких [21].
Интерстициальный ECM альвеол состоит из расслабленной сети, в значительной степени основанной на коллагенах I и III типов и эластине как важных коровых белках [22, 23].Трехмерное расположение этой сети переплетенных волокон допускает нелинейное поведение напряжения-деформации (гистерезис и вязкоупругость), которое является характерным свойством мягких соединительных тканей [24]. Во время дыхания рассеяние энергии, вызывающее гистерезис и вязкоупругость в паренхиме легких, обусловлено контактами волокна с волокном в ECM коллаген-эластин, хотя типы сократительных клеток и сурфактант на границе раздела воздух-жидкость также могут способствовать этим эффектам [17] . В дополнение к своим биомеханическим функциям компоненты эластичных волокон, такие как фибулины и EMILINs, регулируют адгезию клетка-ECM, взаимодействуя с гетеромерными трансмембранными интегриновыми рецепторами [25, 26].В отличие от EMILINs, которые связывают интегрины через их домен gC1q-1, фибулин-5 связывает интегрины через эволюционно консервативную последовательность RGD (аргинин-глицин-аспарагиновая кислота). Этот трипептид-связывающий мотив RGD характерен для других гликопротеинов ЕСМ, включая фибронектин, витронектин, остеопонтин, коллагены, тромбоспондины, фибриноген и фактор фон Виллебранда, все из которых опосредуют адгезию клетки-ЕСМ через рецепторы интегрина [27]. Помимо фиброзных коллагенов и гликопротеинов, протеогликаны (PGs), которые состоят из основного белкового компонента, ковалентно связанного с сульфатированными полисахаридами или гликозаминогликанами (GAG), являются основными составляющими ECM [28].Благодаря высокому содержанию полисахаридов PG являются гидрофильными, что способствует образованию гидрогелей и способствует вязкоупругости легких. PG содержат составляющие базальной мембраны перлекан и агрин, а также hyalectans versican, aggrecan, нейрокан, бревикан и подкласс протеогликанов с низким содержанием лейцина, включая его наиболее выдающиеся представители, декорин, бигликан и люмикан [29]. Декорин, бигликан и люмикан были одними из самых распространенных протеогликанов в нашем наборе данных по матрисомам здоровых легких взрослых мышей (рис. 1) [12]. In vitro , как декорин человека, так и бигликан способны связываться с профибротическим цитокин-трансформирующим фактором роста-β1 (TGF-β1), но in vivo , только декорин, но не бигликан, ингибирует фиброгенный эффект TGF- β1 [30]. Кроме того, сообщается, что декорин взаимодействует с различными металлопротеазами и может действовать как опухолевый супрессор, ослабляя рост, миграцию и ангиогенез опухоли [31].
Посттрансляционные модификации компонентов ECM
Посттрансляционные модификации (PTMs), e.грамм. Известно, что ферментативное и химическое сшивание, трансглютаминирование, гликозилирование и гликозилирование, окисление и цитруллинирование влияют на структурное и / или функциональное разнообразие белков ЕСМ [32]. Например, ферментативное перекрестное сшивание коллагена и эластина, существенный шаг во время их биосинтеза, который в основном осуществляется ферментами семейства лизилоксидаз (LOX, LOXL1-4) и членами семейства трансглутаминаз (TG1-7, FXIII- A), обеспечивает компоненты ECM их характерной прочностью на разрыв [33–35].Кроме того, ферментативное (гликозилирование) или неферментативное (гликозилирование) добавление сахаров к белкам также влияет на биомеханику и функцию ЕСМ. В частности, в настоящее время гликирование считается фактором фиброза, связанного со старением. Этот процесс вызывает образование и накопление конечных продуктов гликирования (AGE). Аберрантные процессы гликирования были связаны с повышенной жесткостью тканей, например. при экспериментальном образовании AGE в сухожилиях, которые, как было показано, уменьшают скольжение волокна при увеличении растяжения волокна [36].Карбамилирование, представляющее собой неферментативное присоединение мочевины к остаткам изоциановой кислоты в белках, отрицательно влияет на стабильность и конформацию тройных спиралей коллагена I, а также на их расщепление под действием ММП [37]. Окисление белков ЕСМ реактивными формами кислорода (ROS) дополнительно модулирует качества ЕСМ, изменяя его производство, оборот и модификации, а также оказывая влияние на взаимодействия клетка-ЕСМ [38]. Кроме того, было обнаружено, что сывороточные уровни маркеров окислительного стресса повышены у пациентов с ИЛФ [39] и в конденсатах дыхания пациентов с астмой [40].ECM также может модулироваться цитруллинированием, ферментативной реакцией дезаминирования аргинина, которая влияет на адгезию клеток [41]. Для более полного обзора PTMs в ECM и их роли в заболевании мы отсылаем читателя к этим дополнительным обзорам [32, 42–45]. Взятые вместе, структурные и функциональные свойства легочного ECM могут быть изменены с помощью PTM, которые считаются важным потенциальным источником заболевания легких, как подробно описано в следующих разделах.
Биомеханика и перекрестные помехи между клетками и ЕСМ
Все клетки временно или постоянно прикрепляются к какой-либо форме ЕСМ через рецепторы клеточной адгезии , наиболее заметно семейство интегринов трансмембранных гетеродимерных рецепторов [46, 47].Клетки могут использовать интегрины для исследования биохимических и топографических характеристик своего окружения [47, 48]. Сигнальная трансдукция, исходящая от адгезии клетка-ECM, контролирует клеточное поведение, такое как подвижность и распространение, морфология, выживаемость, пролиферация и дифференцировка [1, 22]. Эти сигнальные события зависят от множества белков, которые рекрутируются в кластеры интегринов плазматической мембраны, которые вместе называются «адгезомами» [49]. Недавние протеомные исследования очертили общий белковый состав адгезомы и его динамику под влиянием механических сил [50–55].Когда клетки сталкиваются со своим внеклеточным субстратом, они реагируют на жесткость этого субстрата множеством способов, включая немедленные изменения формы и активности клеток, а также долговременную экспрессию генов и изменения идентичности клеток. Эта механо-реципрокность генерируется посредством обратных связей между адгезиями клетка-ECM и цитоскелетом, которые настраивают силу сократительных сил на равновесие между приложенной силой и прочностью на разрыв субстрата ECM [47]. В этом процессе структура и организация цитоскелета изменяются, и было показано, что это вызывает долгосрочные изменения экспрессии генов [56].Точная молекулярная природа многих элементов в этих обратных связях в настоящее время неизвестна, и также неясно, в какой степени равновесие механо-чувствительности и механо-реакции различается между типами клеток и как такие различия могут быть запрограммированы. Важно отметить, что хорошо известно, что механочувствительные сигнальные пути важны в патофизиологии фиброзных заболеваний и рака, оба из которых обнаруживают динамические изменения в составе ВКМ и механических свойствах во время прогрессирования заболевания [57–61].В частности, патологически повышенное отложение ВКМ, сопровождающееся ковалентным перекрестным связыванием и ремоделированием ВКМ, вызывает резкое увеличение жесткости ВКМ, вызывая, таким образом, механический градиент между патологической и нормальной тканью. Градиенты жесткости внутри ЕСМ диктуют миграционное поведение клеток в процессе, называемом дуротаксисом. Дуротаксис, по-видимому, является довольно общим явлением, поскольку было показано, что многие типы клеток, включая фибробласты, мезенхимальные стволовые клетки (МСК), миобласты и раковые клетки, перемещаются по градиентам жесткости [62–65].Кроме того, жесткость ВКМ влияет на распространение, сократимость и дифференцировку фибробластов [66, 67]. При выращивании на мягких матрицах фибробласты и многие другие клетки обычно демонстрируют низкие сократительные силы вместе с уменьшенным распространением и пролиферацией [68, 69]. Жесткость ВКМ также влияет на дифференцировку МСК, поскольку остеогенные и адипогенные клоны появляются на жестких и мягких поверхностях, соответственно [66]. Первичные культуры клеток альвеолярного эпителия типа II (ATII), которые, как считается, обладают потенциалом стволовых клеток и способны к долгосрочному самообновлению во взрослом легком, изменяют свою морфологию и функциональные характеристики (синтез и секреция сурфактанта) в зависимости от субстрат ЕСМ, используемый в культуре [28].В исследовании in vitro первичные альвеолярные макрофаги человека, которые опосредуют фиброз легких, показали увеличение фагоцитоза и изменения транскрипции и фенотипа при культивировании на жестком ECM [70]. Кроме того, для монослоя эндотелиальных клеток было продемонстрировано, что их культивирование на более жестком ECM оказывает негативное влияние на целостность монослоя, таким образом подтверждая важность проницаемости барьера в отношении трансмиграции лейкоцитов [71].
Резервная функция ЕСМ
ЕСМ служит резервуаром для ряда факторов роста и цитокинов, которые имеют решающее значение для дифференцировки и пролиферации клеток [4, 22, 72].Связь таких факторов, как фактор роста фибробластов (FGF), фактор роста гепатоцитов, а также латентный и активный TGF-β1 (полный список мы отсылаем читателя к ранее опубликованной таблице [72]) с ECM имеет некоторые последствия: ECM -связанные факторы 1) могут быть латентными, замаскированными или иметь иную активность по сравнению с их растворимой формой, 2) могут образовывать иммобилизованные градиенты, имеющие решающее значение для миграции клеток, 3) могут, как отпечатки прежней клеточной активности, иметь функцию памяти для инструктирования клеток поведение, 4) облегчают клеточную адгезию и рост клеток, и 5) как запасенные факторы могут быстро активироваться протеолитическим высвобождением и генерировать локальные сигналы, которые не зависят от медленных процессов, таких как экспрессия генов [72, 73].Деградация ЕСМ является ключевым событием в ремоделировании ткани, и в этом процессе цинк-зависимые протеиназы (метцинцины) играют решающую роль.
Ферменты, разрушающие ЕСМ
Это суперсемейство металлопротеиназ включает матриксные металлопротеиназы (ММП) и адамализины. ММП представляют собой семейство из 25 цинк-зависимых эндопептидаз. Эти ферменты способны расщеплять все компоненты ВКМ [74] и базальные мембраны [75]. ММП секретируются в высоко согласованном процессе вместе с их ингибиторами, тканевыми ингибиторами металлопротеиназ (ТИМП) [76].Адамализины включают дезинтегрин и металлопротеиназы (ADAM) и ADAM с мотивом тромбоспондина (ADAMTS). Благодаря способности ADAM разрушать цитокины, факторы роста и лиганд FAS, им приписывают потенциальное клиническое применение при фиброзе, раке, воспалении и нейродегенерации [77]. При фиброзных заболеваниях легких производство и секреция ММП и ТИМП связывается с макрофагами [78], фиброцитами, эндотелиальными клетками и фибробластами [79], а также сильная экспрессия ММП, особенно ММП-1 и ММР-7. наблюдается в бронхиолярных и альвеолярных эпителиальных клетках [80].Для более подробного обсуждения молекулярных игроков в деградации и ремоделировании ECM, читатель может обратиться к превосходному обзору Lu et al. [81].
Часть B: Процессы ремоделирования ВКМ при хронических заболеваниях легких
IPF
Патогенез и ремоделирование тканей
Хотя этиология IPF остается в значительной степени неизвестной, IPF затрагивает примерно пять миллионов человек во всем мире. До недавнего времени единственным эффективным методом лечения была трансплантация легких. Недавно было показано, что два препарата, одобренные Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), пирфенидон и нинтеданиб, которые оказывают плейотропное действие на клетки, включая ингибирование продукции ECM, замедляют скорость снижения функции легких [82, 83].При IPF повторяющееся повреждение легких и последующие механизмы восстановления приводят к продолжающемуся разрушению эластичной паренхиматозной ткани легкого, которая постоянно замещается жесткой рубцовой тканью, состоящей из крупных и конденсированных агрегатов клетки-внеклеточного матрикса, известных как фибробластные очаги в легочном интерстиции (рис. 2c). . Прогрессивное ремоделирование ткани приводит к тракционным бронхоэктазам, утолщению межлобулярных перегородок и субплевральным сотам, что можно визуализировать с помощью компьютерной аксиальной томографии (CAT) [84]. Все эти микроскопические и макроскопические изменения способствуют прогрессирующей потере газообмена с последующим ухудшением функции легких, одышкой и, наконец, дыхательной недостаточностью, ведущей к смерти [85].
Миофибробласты
Фибробластные очаги содержат активированные фибробласты и / или высококонтрактильные миофибробласты, которые в основном характеризуются неоэкспрессией α-гладкомышечного актина (α-SMA) и его включением в волокна сократительного стресса. Помимо сократительных свойств, миофибробласты продуцируют большое количество молекул ВКМ в ответ на профибротические стимулы, которые, как полагают, являются результатом несбалансированных механизмов восстановления альвеолярного и бронхиолярного эпителия после повторяющихся микротравм и воспалительных процессов [86] (рисунок 2c).Происхождение миофибробластов в фиброзных очагах все еще остается предметом серьезных дискуссий. В различных исследованиях было показано, что миофибробласты в фиброзном легком происходят из клеток-предшественников костного мозга [87], циркулирующих фиброцитов периферической крови [88, 89], альвеолярных эпителиальных клеток, претерпевающих эпителиально-мезенхимальный переход [90], резидентных фибробластов [ 91] и перициты [92]. Довольно спорно, применяя отслеживание клонов, другое исследование описало пока еще не идентифицированную популяцию резидентных стромальных клеток в фиброзных очагах как источник миофибробластов, но исключило перициты и эпителиальные клетки как источники [93].
Инструктивность
Поскольку миофибробласт считается отличительной чертой IPF, можно предположить, что ECM, продуцируемый миофибробластом, является поучительным компонентом заболевания, который способствует прогрессированию заболевания. Действительно, культивируя фибробласты, происходящие из IPF или здоровых контрольных легких на фиброзной или здоровой децеллюляризованной легочной ткани, Parker et al. продемонстрировал, что аберрантное микроокружение ЕСМ в IPF преимущественно управляет изменениями в экспрессии генов и белков, а не внутренними клеточными изменениями [94].Процесс децеллюляризации и успешной рецеллюляризации целых органов, в идеале с использованием аутологичных стволовых клеток или клеток-предшественников, был протестирован как потенциальный суррогат в медицине трансплантации легких [95–97]. Даже трупные легкие человека, взятые у людей с хроническими заболеваниями легких, были исследованы на предмет их возможного использования в тканевой инженерии ex vivo [98]. Однако в свете текущих открытий, что децеллюляризованные каркасы ВКМ от пациентов с IPF изменяют транскриптом и трансатом пересеянных фибробластов, остается интригующим открытым вопрос, могут ли такие суррогаты, полученные из патологических тканей легких, вообще использоваться для трансплантации легких.
Механофизиология
Современные концепции в этой области предполагают важнейшие функции конкретных белков ЕСМ в тонкой настройке сигнальных путей за счет их способности модулировать передачу сигналов факторов роста [99–101] или важные эффекты жесткости тканей на прогрессирование заболевания. Жесткость ECM при фиброзных нарушениях увеличивается за счет ферментативного ковалентного сшивания коллагена и эластина членами семейства LOX и TG [34, 35]. Было показано, что при IPF экспрессия лизилоксидазоподобного 2 (LOXL2) и TG2 повышается в сыворотке и легких, соответственно, пациентов с IPF [102, 103].Жесткость децеллюляризованной ткани IPF действительно выше, чем обычно, как показывает атомно-силовая микроскопия [13], и, соответственно, активность немышечного миозина-II, который управляет сократимостью клеток, также выше в фиброзных областях пациенты с ИЛФ [57]. Таким образом, активность и выживание активированных фибробластов при фиброзных заболеваниях можно в значительной степени контролировать с помощью механических сигналов. Действительно, ингибирование опосредованной миозином-II сократимости клеток с использованием ингибитора Rho-киназы индуцировало апоптоз миофибробластов и улучшало экспериментальный фиброз легких [57].Чумперлин и его коллеги использовали измерения экспериментального фиброза в легких, поврежденных блеомицином, с помощью атомно-силовой микроскопии, чтобы выявить поразительное увеличение фиброзных зон с модулем упругости (который измеряет жесткость ткани в Паскалях), превышающим 2 кПа [68]. Интересно, что диапазон физиологической жесткости (0,2–2 кПа) удерживает фибробласты легких в состоянии покоя, тогда как субстраты с более высокой жесткостью (2–35 кПа), наблюдаемые в фиброзных легких, вызывают профиброгенный фенотип с высокой пролиферацией и синтезом ВКМ. ставки [68].Мы показали, что (мио) фибробластам требуется комбинация α5β1-интегрина и гетеродимеров семейства αV-интегрина для эффективного ответа на жесткость богатого фибронектином тканевого микроокружения, которое присутствует в тканевом фиброгенезе [50]. Интересно, что устранение интегринов αV-семейства снижает фиброз в нескольких органах, включая легкие, на экспериментальных моделях мышей с травмой [104], что может указывать на то, что эти интегрины участвуют в механо-чувствительной реакции [50] и / или активации TGF-β. [105].
Протеомные сигнатуры ECM
Будущие протеомные исследования острых по сравнению с хроническими моделями повреждения легких и последующего фиброза могут позволить идентифицировать компоненты внеклеточной ниши, которые выборочно вызывают патологию в постоянном и прогрессирующем фенотипе рубцевания, как видно на IPF. Мы провели протеомное исследование с временным разрешением на модели мышей с острым повреждением легких блеомицином и, основываясь на наблюдаемой временной кинетике изобилия белков, мы смогли предсказать функции отдельных белков на ранних стадиях восстановления ткани, таких как мобилизация стволовых клеток. или поздние стадии, такие как разрешение фиброза.Неожиданные белки ЕСМ, которые не были изучены в контексте повреждения по сравнению с восстановлением и фиброзом, такие как Эмилин-2 и коллаген-XXVIII, были обнаружены в высокой степени через 2 недели после повреждения [12]. Используя сочетание метки стабильных изотопов, фракционирования растворимости децеллюляризованной легочной ткани и протеомного анализа, Декарис и его коллеги оценили кинетику синтеза и отложения ВКМ на модели блеомицина [106] и обнаружили, что скорость синтеза белка фибриллярных коллагенов (типы I, III и V) резко увеличивались как в растворимой, так и в нерастворимой фракциях во время позднего фиброзного ответа, тогда как небольшие богатые лейцином протеогликаны бигликан и декорин, а также фибронектин были повышены при раннем фиброзном ответе.Однако в другом анализе ECM на основе MS децеллюляризованных IPF легких авт. Идентифицировали обогащение гликозаминокликанами, матриксным Gla белком и ассоциированными с микрофибриллами белками в ECM легких IPF [13]. Безусловно, ECM пораженных легких человека может содержать специфическую для заболевания и прогрессирования комбинацию секретируемых белков и протеолитических фрагментов компонентов ECM («сигнатуры»), которая может иметь не только большую диагностическую и / или прогностическую ценность для точной медицины будущего. но может также дать новое понимание молекулярных механизмов патогенеза болезни.
ХОБЛ и эмфизема
Патофизиологические аспекты ХОБЛ, которая в основном вызвана воздействием дыма, включают обструкцию воздушного потока и гиперинфляцию. Ограничение воздушного потока при ХОБЛ вызвано тремя взаимосвязанными процессами: ремоделирование малых дыхательных путей, приводящее к утолщению стенок дыхательных путей, потеря мелких дыхательных путей и увеличение дыхательных пространств в альвеолах, состояние, называемое эмфиземой [17]. Следовательно, распространение транспульмонального давления нарушается, вызывая гиперинфляцию легких.Эти структурные изменения вызывают биомеханические изменения, которые проявляются в потере эластической отдачи легких. Поскольку ECM представляет собой основной компонент дыхательной системы, несущий нагрузку, потеря упругой отдачи при эмфиземе легких предполагает, что эластин, основной компонент эластичных волокон, является главной целью разложения (рис. 2d). На модели эмфиземы мышей как интратрахеальная инстилляция эластолитического фермента эластазы, так и дефицит α1-антитрипсина, основного ингибитора эластазы нейтрофилов, приводили к образованию эмфиземы [107].Дисбаланс протеазной и антипротеазной активности — широко распространенная гипотеза о том, как разложение ткани может происходить при эмфиземе [108]. Высвобождение ферментов, разрушающих ECM, в значительной степени связано с воспалительными клетками, в основном макрофагами, нейтрофилами и Т-клетками [109]. Однако не только разрушение эластических волокон может быть ответственным за изменения биомеханики легких, поскольку есть также экспериментальные доказательства того, что ремоделирование коллагена в стенках альвеол вносит вклад в структурные и биомеханические изменения, обнаруживаемые при эмфиземе легких [110].Соответственно, утолщение коллагеновых фибрилл было продемонстрировано на ультраструктурном уровне у людей и на моделях мышей-грызунов [111]. Это довольно неожиданное открытие подтверждается данными in vivo доказательств того, что деградация эластазой компонентов ECM может запускать синтез коллагена [112], но описанный ответ также может быть результатом TGF-β1-продуцирующих макрофагов, которые стимулируют выработку коллагена эффекторными клетками. [111]. Однако аберрантное отложение коллагена при ХОБЛ по-разному влияет на разные отделы легких.В то время как электронные микрофотографии показали высокое содержание коллагена и эластина в стенках альвеолярной перегородки эмфизематозной ткани [113], более низкая экспрессия коллагена I была обнаружена в дыхательных путях пациентов с ХОБЛ [114]. Annoni et al. проанализировал подробный состав внеклеточного матрикса пациентов с ХОБЛ по сравнению со здоровым контролем в различных отделах легких и показал, что в образцах умеренной ХОБЛ были изменения эластичных волокон, фибронектина, коллагенов, тенасцина-С и версикана во всех отделах легких. [114].В соответствии с этими выводами Roman et al. продемонстрировал индуцированное никотином усиление экспрессии фибронектина как in vitro, , так и in vivo [115]. Более того, in vitro , клетки гладких мышц дыхательных путей (ASM), выделенные от пациентов с ХОБЛ, продуцировали более высокие уровни Col8a1, MMP1, MMP3 и MMP10 в ответ на экстракт сигаретного дыма [116]. Недавно было обнаружено, что у мышей с дефицитом гликопротеина ЕСМ фибулина-4 повышена активность ММП и эластазы нейтрофилов в легких, что привело к разрушению альвеол у новорожденных мышей и впоследствии к образованию эмфиземы [117].Было обнаружено, что при ХОБЛ уровни экспрессии остеопонтина, который представляет собой фосфорилированный кислый гликопротеин ВКМ с функциями клеточной адгезии и миграции, повышены в мокроте пациентов с ХОБЛ [118]. Повышенные уровни остеопонтина неспецифичны для ХОБЛ, поскольку аналогичная повышающая регуляция остеопонтина была описана в легких и жидкости бронхоальвеолярного лаважа пациентов с ИЛФ [119]. Было обнаружено, что AGE, которые в основном вызваны воспалительными процессами, накапливаются в коже пациентов с ХОБЛ.Это потенциально подразумевает роль AGEs и событий гликирования в ранних патологических фазах COPD, хотя прямое участие AGEs в ECM in vivo и в легких человека все еще остается неясным [120]. Кроме того, во время острых обострений ХОБЛ происходит ускоренный оборот белка ЕСМ, что приводит к продуцируемой протеазой фрагментации белков ЕСМ, таких как коллагены, версикан и эластины. Эти отпечатки пальцев белка ЕСМ, циркулирующего в крови, могут быть использованы в качестве мощных биомаркеров при прогнозировании прогрессирования ХОБЛ [121].
ЛАГ
ЛАГ — прогрессирующее заболевание с неблагоприятным прогнозом. Патофизиология ЛАГ характеризуется повышенной нагрузкой на правый желудочек сердца в результате нескольких процессов, таких как генетическая предрасположенность, воспаление, пролиферация клеток, сужение сосудов и ремоделирование сосудов. Легочные артерии подвержены стойкому сужению сосудов и ремоделированию сосудов, что приводит к снижению эластичности легочной артерии [122]. При ЛАГ вся трехслойная архитектура артериальной стенки претерпевает ремоделирование, что приводит к утолщению интимы, медиальной части и адвентиции [123] (рис. 2а).Соответственно, исследования динамического включения с использованием радиоактивного индикатора показали быстрый синтез эластина и коллагена в легочных артериях во время гипоксической легочной гипертензии [124]. Кроме того, компонент ECM, тенасцин-C, был связан с прогрессированием заболевания. У пациентов с ЛАГ и на экспериментальных моделях заболевания тенасцин-C коррелировал с пролиферацией гладкомышечных клеток (SMC) (рисунок 2e) и митогенным ответом на FGF2. Аналогичным образом, в легких мышей с фиброзом тенасцин-C отрицательно коррелировал с эластичностью легких, то есть большие количества этого белка были связаны с более жесткой легочной тканью [12].Между тем, положительная корреляция между экспрессией тенасцина-C и пролиферацией SMC была обнаружена у пациентов с врожденным пороком сердца и на модели грызунов с монокроталином-индуцированной ЛАГ [125]. Однако, in vitro экспрессия эластина обратно коррелировала с пролиферацией SMCs [126]. Кроме того, в утолщенной интиме пораженных сосудов из тканей биопсии легких пациентов с ЛАГ повышенные уровни фибронектина и тенасцина-C были идентифицированы с помощью иммуногистохимии и гибридизации in situ [125].Повышенное отложение ГАГ, таких как гиалуроновая кислота (ГК), также наблюдалось в реконструированных легочных артериях [127, 128]. Более того, патологическая модификация тяжелой цепи НА, которая, как предполагается, также способствует адгезии и активации лейкоцитов, была идентифицирована в ткани легких пациентов с ЛАГ [129].
Известно, что ММП играют решающую роль в ремоделировании легочных сосудов. In vitro и in situ Исследования SMC легочной артерии выявили дисбаланс MMP и TIMP при идиопатической ЛАГ [130]; Было обнаружено, что MMP3 подвергается понижающей регуляции, тогда как TIMP1 активируется в пораженных SMCs [131].Nave et al. сообщил, что лизилоксидазы также участвуют в ремоделировании легочных сосудов при ЛГ, вызывая массивное перекрестное сшивание ВКМ [132]. Несмотря на гиперплазию и гипертрофию сосудистой стенки, обнаруженную в легких с легочной гипертензией, они были успешно децеллюляризованы и рецеллюляризованы мезенхимальными стволовыми клетками [133]. При успешной рецеллюляризации стволовыми клетками децеллюляризованные каркасы 3D ECM из больных легких могут представлять собой действительный источник в клиническом использовании для создания здоровых функциональных тканей.Однако предварительным условием является то, что процесс рецеллюляризации приводит к успешному ремоделированию больного гипертрофического ВКМ в децеллюляризованных каркасах, и, по крайней мере, при фиброзных заболеваниях наблюдается противоположный эффект [94].
Астма
Патология астмы характеризуется хроническим воспалением подслизистых областей малых дыхательных путей с ассоциированной гиперплазией бокаловидных клеток, повышенной секрецией слизи, гипертрофией гладких мышц и бронхоспазмом (рисунок 2f).На структуру легких влияет ремоделирование дыхательных путей, вызванное гиперплазией ASM, с сопутствующим измененным профилем ECM вокруг структур дыхательных путей. Эти структурные изменения проявляются в биомеханических дисфункциях. Соответственно, уменьшается упругая отдача легких, что может быть вызвано нарушением передачи упругой нагрузки между паренхимой легкого и дыхательными путями. Аберрантное накопление ВКМ ранее было обнаружено в легких, страдающих астмой, с его основной локализацией в подслизистых и адвентициальных областях как больших, так и малых дыхательных путей [134].Отложения ВКМ, которые возникают даже при легкой форме астмы, включают коллагены I, III и V в субэпителиальной области, а также фибронектин в ретикулярной пластинке бронхиального эпителия [135] (рисунок 2f). Кроме того, при астме со смертельным исходом сообщалось об увеличении эластических волокон, MMP-9 и MMP-12 в крупных дыхательных путях [136]. Интересно, что состав ВКМ центральных и дистальных дыхательных путей у пациентов со стойкими симптомами астмы, несмотря на терапию кортикостероидами (неконтролируемая астма), отличается от такового у пациентов с чувствительной к кортикостероидам (контролируемой) астмой.По сути, при неконтролируемой по сравнению с контролируемой астмой было обнаружено, что отложение коллагена увеличивается в альвеолярной паренхиме, тогда как версикан увеличивается в центральных дыхательных путях, а декорин и бигликан увеличиваются в обоих отделах [137]. Различия между дистальными отделами дыхательных путей и ремоделированием бронхов могут быть основаны на изменении статуса секреции ВКМ фибробластов, происходящих из этих разных областей [138]. Эти данные указывают на высокую клиническую значимость ремоделирования ВКМ при астме.Было показано, что в ASM присутствие растворимых форм фибронектина и коллагена I может уменьшать сократительную способность, но увеличивать пролиферативную способность ASM, тогда как культивирование клеток в присутствии только экзогенного растворимого ламинина не влияло ни на пролиферацию, ни на сократимость [ 139]. Однако механизм, объясняющий, как белки ECM в их растворимых, не депонированных формах по-разному влияют на фенотип и сократительные функции в ASMs, остается неуловимым. Таким образом, изменения в ECM могут управлять механизмами, ведущими к усиленному росту ASM (рисунок 2f), что является ключевым событием в молекулярной патологии астмы [140].Более того, in vitro исследований ASMs предполагают, что изменения в ECM также происходят на посттрансляционных уровнях при астме [140]. Аберрантное отложение компонентов внеклеточного матрикса по-разному влияет на биомеханические свойства легких. Отложение ВКМ вокруг дыхательных путей усиливает сужение дыхательных путей и вызывает изменения в жесткости тканей.
Рак легкого
Признаками рака у человека, которые были подробно описаны Ханаханом и Вайнбергом [141], являются многоступенчатые биологические возможности, которые включают устойчивую пролиферацию, уклонение от подавления роста, устойчивость к смерти, репликативное бессмертие, индуцированный ангиогенез, инициирование инвазия и метастазирование, нарушение регуляции клеточной энергетики и воспалительные процессы (рис. 2g).Поскольку ЕСМ по своим биохимическим и биофизическим свойствам является регулятором клеточных ответов, лежащих в основе признаков рака, изучение влияния ЕСМ на неопластическое прогрессирование становится важным [142]. Например, мелкоклеточный рак легкого (SCLC) окружен обширной стромой ECM, которая содержит высокие уровни фибронектина, ламинина, коллагена IV и тенасцина-C [143]. Более того, строма опухоли развитой склеротической опухолевой ткани богата коллагеном I, тогда как коллаген III очень распространен в менее зрелой строме [144].Трансляционные исследования показали, что у пациентов с опухолями SCLC, окруженными обширной стромой, время выживания было сокращено, поскольку связывание клеток SCLC с ECM защищает раковые клетки от апоптоза, вызванного химиотерапией [143]. Ремоделирование стромы опухоли сильно влияет на жесткость ткани, что, в свою очередь, влияет на механобиологию клеток и запускает клеточные реакции (рисунок 2g). Поскольку коллаген, как сообщается, вносит основной вклад в прочность на разрыв в архитектуре легких, метаболизм коллагена играет решающую роль в укреплении стромы опухоли.Помимо аберрантного отложения и обмена коллагена, при раке легких наблюдались изменения в перекрестном связывании коллагена. Совсем недавно Chen et al. сообщил, что строма опухоли демонстрирует высокие уровни поперечных связей коллагена, производных гидроксилизинового альдегида (HLCC), и более низкие уровни поперечных связей, производных лизинового альдегида (LCC) [145] (рисунок 2g). Механически этот переход от преимущественно LCC в здоровых к HLCC в опухолевой ткани легкого был связан с ферментом лизилгидроксилазой 2 (Lh3).Сопутствующее увеличение жесткости стромы, в свою очередь, способствовало инвазии опухолевых клеток и метастазированию [145]. В соответствии с этими результатами известно, что опухолевые клетки экспрессируют высокие уровни LOX, и фармакологические вмешательства, направленные на это семейство ферментов, подавляли метастазирование у животных с опухолями [146]. Mouw et al. показали, что при раке груди жесткость ECM индуцирует miR-18a для снижения экспрессии фосфатазы и гомолога тензина (PTEN), что, в свою очередь, приводит к прогрессированию опухоли [147]. Кроме того, повышенная жесткость ECM в опухолях возвращается к клеткам Rho-зависимым образом, увеличивая напряжение цитоскелета и стабилизируя фокальные спайки [148].Поскольку микросреда опухоли создается раком и стромальными клетками, активация стромальных клеток происходит аутокринным и паракринным образом. В частности, активированные фибробласты, так называемые фибробласты, ассоциированные с раком, играют важную роль в прогрессировании опухоли, существенно ремоделируя ECM опухоли, подавляя иммунный ответ и высвобождая факторы, способствующие росту опухоли [149]. Таким образом, опухолевый ЕСМ обеспечивает аберрантные сигналы микросреды, благоприятствующие пролиферации и метастазированию, а также ингибируя апоптоз опухолевых клеток.Соответственно, на первичных участках и участках метастазов инкапсулирующая строма опухоли может придавать устойчивость к химиотерапии. При SCLC было продемонстрировано, что адгезия опухолевых клеток через интегрин-β1 к белкам ECM является решающим событием в устойчивости клеток к химиотерапии [143]. Безусловно, патологические изменения в ECM при раке легких, такие как повышенная экспрессия коллагена, изменение перекрестного связывания коллагена и последующее увеличение жесткости тканей, напоминают изменения, также обнаруженные в IPF, который защищает сходство между этими двумя заболеваниями.Интересно, что сообщается о многих патогенных аналогиях между раком и IPF: общие факторы риска ( например, курение, воздействие окружающей среды, вирусные инфекции и хроническое повреждение тканей), отсроченный апоптоз, активация конкретных сигнальных путей, как эпигенетические, так и генетические изменения, измененная экспрессия микроРНК и аберрантная пролиферация и инвазия клеток [150–154]. Есть практические основания рассматривать IPF как рак, подобное заболеванию, что в конечном итоге может привести к новым клиническим испытаниям противораковых препаратов для IPF [154].
Модельные системы ECM
Состав ECM и его биомеханические свойства влияют на морфологию клеток [155], подвижность, распространение, жизнеспособность клеток и апоптоз, а также на пролиферацию и дифференцировку [5]. Следовательно, поскольку клеточное поведение и ECM сильно взаимосвязаны, необходимы системы культур клеток in vitro, , которые точно имитируют физиологические и патологические условия, обнаруженные in vivo . Множественные модели in vivo на животных , отражающие патогенез заболеваний легких человека, были разработаны в прошлом.Поскольку подробное обсуждение животных моделей, представляющих заболевания легких, далеко выходит за рамки этого обзора, мы отсылаем читателя к ряду отличных обзоров для дальнейшего чтения [156–162]. В частности, исследования мезенхимальных клеток, которые физиологически встроены в ЕСМ, могут быть полезны с использованием моделей in vitro, , in vivo, или ex vivo, , которые очень похожи по структуре и биомеханике интерстициального легочного ВКМ [163–165] . В прошлом применялись различные системы трехмерных культур клеток [166].Самая упрощенная модель — это пластик для тканевой культуры, покрытый молекулами ЕСМ. Благодаря упрощенной конструкции его можно использовать для изучения взаимодействия определенных молекул ЕСМ с клетками, хотя здесь клетки прикреплены к двумерной (2D) поверхности, а не встроены в ЕСМ. Более того, жесткость пластика для клеточных культур намного превосходит физиологически обнаруженный in vivo ; Согласно измерениям с помощью атомно-силовой микроскопии, модуль Юнга (измеренный в Паскалях) пластика клеточной культуры колеблется от 2 до 4 ГПа, тогда как нормальная ткань легких колеблется от 0.44 и 7,5 кПа, в зависимости от измеряемой области, а фиброзная ткань легкого человека у пациентов с ИЛФ в среднем составляет 16,52 кПа [13, 167, 168]. Однако механически настраиваемые 2D-модели с использованием синтетических матриц на основе акриламида или полиэтиленгликоля дают возможность индуцировать образование градиента и жесткий контроль жесткости ECM [166, 169]. Помимо этих искусственно синтезированных макромолекулярных структур, в модельных системах in vitro ECM [174] широко используются нативные и сконструированные биополимеры, состоящие из коллагенов [170], эластина [171], фибрина [172] или ламинина [173].Гели экстракта базальной мембраны и децеллюляризованные матриксы на основе фибробластов также используются в настоящее время [175], и они более точно имитируют состав, трехмерную структуру и биомеханику физиологического внеклеточного матрикса. Однако ни одна из этих моделей не может имитировать уникальную пространственную геометрию легочной ткани. Чтобы обойти эти биомиметические ограничения, можно использовать нарезанные вибратомом матрицы ex vivo , взятые из различных моделей болезней животных, а также из пораженных тканей человека в их нативных или децеллюляризованных формах [13, 176–178]. Ex vivo Модели , использующие децеллюляризованную легочную ткань, помогут дополнительно механистически определить влияние ECM на патологии легких. Наконец, в будущем технологии трехмерной биопечати или методы аддитивного производства могут открыть многообещающие и захватывающие новые способы создания биосовместимых каркасов ECM, которые биомеханически напоминают настоящую ткань. Такие изготовленные каркасы могут быть использованы либо в качестве настраиваемых моделей in vitro для изучения инструктивной природы ECM, либо, в конечном счете, при успешном пересеве с клетками, в качестве биоинженерной ткани, готовой заменить больные ткани или целые органы [179].
Заключение и перспективы на будущее
Хронические респираторные заболевания возникают в результате сложного взаимодействия факторов риска окружающей среды, эпигенетических и генетических влияний. Считается, что неблагоприятные воздействия окружающей среды во время жизни плода и младенца приводят к стойким изменениям в структуре и функции легких. Такое «программирование» на ранних этапах жизни могло бы ошибочно переделать ECM и, следовательно, проложить путь для развития хронических респираторных заболеваний во взрослом возрасте. Регулируемое ремоделирование внеклеточного матрикса, особенно в процессе заживления ран, его резидентными клетками является предпосылкой для поддержания гомеостаза тканей.В патологических событиях качества ECM, такие как его состав и топологические особенности, биомеханические свойства, PTM или роль резервуара для секретируемых медиаторов, действуют как поучительные сигналы, которые влияют на поведение фибробластов и других типов клеток. Как только гомеостаз ткани нарушается повторным повреждением и восстановлением, аберрантные механизмы обратной связи между клетками и их реконструированным ECM запускают порочный круг, который приводит к прогрессированию заболевания. Во время прогрессирования заболевания взаимодействие между клетками и ECM может быть очень сложным, может включать различные типы клеток и может происходить в пространственно различных компартментах.Например, успешное метастазирование требует раннего ремоделирования ВКМ в метастатической нише, которая пространственно удалена от локальной ниши первичной опухоли, чтобы помочь циркулирующим опухолевым клеткам прижиться в отдаленных органах [180]. Следовательно, определение молекулярного состава ЕСМ в пораженных легких с помощью современных технологий, таких как протеомика, управляемая МС или секвенирование следующего поколения, является важным шагом на пути к идентификации диагностических биомаркеров прогрессирования заболевания и одинаковая терапия.Будущие попытки разработать методы для понимания сложной функциональной и физической топологии ECM in situ на системном уровне будут ключевыми для понимания его роли в тканевой (патофизиологии). Чтобы увидеть прорывы в разработке новых терапевтических вмешательств, крайне важно понять сложные взаимодействия и лежащие в основе механизмы обратной связи, которые происходят между основной матрисомой, факторами, связанными с матрисомой, и клетками [168, 181]. Потенциальные терапевтические средства для лечения фиброзных заболеваний включают ферменты, которые воздействуют на жесткость ECM путем разрушения аномального ECM, а также антитела, которые ингибируют активность ферментов сшивания ECM, таких как лизилоксидазы, а также активность MMP и TGF-β1 [73].Кроме того, ингибиторы клеточных рецепторов, таких как рецептор эпидермального фактора роста, или лекарства, нацеленные на механизм механотрансдукции через интегрины , в настоящее время тестируются в качестве терапевтических средств при таких заболеваниях, как рак легких и фиброзные расстройства [73). Кроме того, молекулы и пути, участвующие в реакции легких на окислительный стресс, обсуждаются как потенциальные терапевтические мишени [38]. Также растет интерес к использованию клеток-предшественников, таких как мезенхимальные стволовые клетки, которые могут обладать регенеративным потенциалом, в качестве усилителей восстановления тканей [168].Однако на данный момент трансплантация легких остается единственным действенным методом лечения терминальной стадии заболеваний легких, но нехватка донорских легких и необходимость интенсивной иммуносупрессии для предотвращения отторжения аллотрансплантата ограничивают их клиническое применение. Следовательно, биоартификационные каркасы внеклеточного матрикса станут важными элементами терапии на основе стволовых клеток в регенеративной медицине. Дальнейшие усилия позволят определить, могут ли синтетические (напечатанные на 3D-принтере) каркасы или децеллюляризованные каркасы ECM целых органов и их рецеллляризация аутологичными предшественниками или стволовыми клетками привести к полностью функциональным и трансплантируемым органам.Изготовление таких суррогатов легких все еще далеко от реальности, но фундаментальные исследования архитектуры и функции ECM, а также тканевой инженерии, вероятно, дадут новые идеи для практического применения.
Потеря полицистинов подавляет децилизацию посредством активации пути центросомной целостности
Abstract
Первичная ресничка представляет собой основанную на микротрубочках, антенно-подобную органеллу, в которой находятся несколько сигнальных путей. Он следует циклическому паттерну сборки и дециляции (разборки и / или шеддинга), когда клетки выходят и снова входят в клеточный цикл, соответственно.Как правило, потеря первичных ресничек приводит к цистогенезу почек. Однако в моделях на животных аутосомно-доминантной поликистозной болезни почек, основного заболевания, вызванного мутациями в генах полицистина ( Pkd1 или Pkd2 ), удаление первичных ресничек или ускорение децилитации подавляет кистозный рост, тогда как замедление децилирования усиливается. цистогенез. Здесь мы показываем, что децилиция задерживается в кистозном эпителии мышиной модели постнатальной делеции Pkd1 и в Pkd1 — или Pkd2 — нулевых клетках в культуре.Механистические эксперименты показывают, что истощение PKD1 активирует путь центросомной целостности / митотического наблюдения с участием 53BP1, USP28 и p53, что приводит к задержке децилирования. Снижение скорости децилитации вызывает длительную активацию сигнальных путей на основе ресничек, которые могут способствовать росту кисты. Наше исследование связывает поликистины с динамикой ресничек, идентифицирует клеточную децилизацию ниже пути центросомной целостности и помогает объяснить прокистозные эффекты первичных ресничек при аутосомно-доминантной поликистозной болезни почек.
Введение
Первичная ресничка представляет собой одиночную антенно-подобную органеллу, присутствующую практически во всех типах клеток человеческого тела. Он состоит из аксонемы, микротрубочковой структуры, покрытой специальной формой плазматической мембраны и базального тельца, модифицированной центросомы, формирующей основу реснички (Haimo & Rosenbaum, 1981). Сборка и поддержание ресничек достигается за счет внутрижгутикового транспорта (IFT), опосредованного согласованным действием антероградных кинезинов (комплекс IFT-B) и ретроградного динеина (комплекс IFT-A) (Ishikawa & Marshall, 2011; Kobayashi & Dynlacht, 2011; Nigg & Stearns, 2011; Sung & Leroux, 2013).Реснички достигают своей максимальной длины в состоянии покоя (G0) и постепенно разбираются или сбрасываются при повторном входе в клеточный цикл (Pugacheva et al, 2007; Liu et al, 2018; Mirvis et al, 2018, 2019; Wang & Dynlacht, 2018). Постепенная разборка и отторжение ресничек — сложный процесс, и хотя он был связан с развитием клеточного цикла в культивируемых клетках, его биологическая роль в контексте всего животного неясна (Sanchez & Dynlacht, 2016; Breslow & Holland, 2019). Ускоренная или пониженная скорость разборки ресничек может уменьшать или увеличивать время, которое клетки проводят в G1 и, таким образом, усиливать или замедлять повторный вход клеточного цикла, соответственно (Kim et al, 2011; Li et al, 2011; Phua et al, 2017).Также появляются доказательства связи ресничек и реакции на повреждение ДНК (Chaki et al, 2012; Johnson & Collis, 2016; Walz, 2017). Следовательно, также возможно, что пониженная скорость разборки может также запускать активацию ответа на повреждение ДНК, вызывая остановку клеток в G2 и G1 для полной резорбции ресничек. В этом случае несвоевременная разборка ресничек может привести к анеуплоидии и геномной нестабильности, что может привести к неконтролируемой пролиферации. Следовательно, изменения в скорости разборки и / или шедирования ресничек могут иметь положительные и отрицательные эффекты на прогрессию клеточного цикла в зависимости от клеточного контекста и типа и передачи сигналов на основе ресничек.
HEF1 / AURKA / HDAC6 (Pugacheva et al, 2007), Nek2 / Kif24 (Kim et al, 2015) и Plk1 / Kif2A (Miyamoto et al, 2015) являются основными путями разборки ресничек, которые активируются при индуцировании клеток. повторно войти в клеточный цикл. В пути HEF1 / AURKA / HDAC6 HEF1 является каркасным белком, который при связывании с AURKA индуцирует аутофосфорилирование и активацию AURKA (Nikonova et al, 2013). Активированный AURKA фосфорилирует HEF1 и HDAC6 (Никонова и др., 2013). Активированный HDAC6 ведет к разборке ресничек за счет деацетилирования α-тубулина, вызывая деполимеризацию микротрубочек (Pugacheva et al, 2007).Этот путь молчит в G1 / G0 и не участвует в контроле длины ресничек в G1 / G0, но активируется за счет активации HEF1 в ответ на передачу митогенных сигналов (Pugacheva et al, 2007). AURKA и некоторые др. Центросомные белки, включая NDE1, негативный регулятор цилиогенеза, образуют большой комплекс, называемый комплексом разборки ресничек (CDC) (Gabriel et al, 2016). Активность CDC может быть положительно или отрицательно модулирована несколькими факторами / путями. Эти пути включают передачу сигналов Ca 2+ (Plotnikova et al, 2010, 2012), неканоническую передачу сигналов Wnt5a (Lee et al, 2012), изменения в составе фосфолипидов цилиарной мембраны (Bielas et al, 2009; Phua et al, 2017) и др.Супрессоры опухолей, такие как Von Hippel-Lindau (pVHL) (Xu et al, 2010) и гомолог фосфатазы и тензина (PTEN) (Shnitsar et al, 2015), негативно регулируют разборку ресничек. Таким образом, разборка ресничек в значительной степени контролируется тремя путями, на которые в дальнейшем могут влиять внеклеточные / средовые и внутриклеточные факторы.
ADPKD характеризуется образованием массивных кист в почках и повышенной пролиферацией клеток (Bhunia et al, 2002; Kim et al, 2004; Zhou, 2009).В культуре клеток потеря Pkd1 или Pkd2 , по-видимому, ускоряет переход G1 в S, влияя на уровни p21 (Bhunia et al, 2002; Kim et al, 2004; Li et al, 2005; Low et al, 2006 г.). Соответственно, количество активно циркулирующих клеток в кистозном эпителии всегда заметно увеличивается в Pkd1 — или Pkd2 -нулевых почках по сравнению с почками дикого типа (Zhou, 2009). Однако, несмотря на повышенную пролиферацию кистозных клеток, на животных моделях ADPKD или тканях пациентов с ADPKD нет грубых цилиарных аномалий, за заметным исключением более длинных ресничек в медленно прогрессирующей гипоморфной мышиной модели патогенной мутации человека (Hopp и др., 2012).Это наблюдение указывает на то, что сильно пролиферирующие кистозные клетки, по-видимому, утратили способность поддерживать координацию прогрессии клеточного цикла и обновления ресничек. Эти данные также согласуются с идеей, что постоянная митогенная передача сигналов на основе ресничек может поддерживать пролиферацию клеток и экспансию кист в клетках, лишенных Pkd1 или Pkd2 . Фактически, мыши с двойными мутантами, лишенные одного из генов полицистина и гена, необходимого для образования ресничек, ift20 или Kif3a , демонстрируют гораздо менее тяжелый фенотип с точки зрения образования кист и пролиферации клеток по сравнению с одиночные мутанты (Ma et al, 2013).Соответственно, ускорение разборки ресничек (Nikonova et al, 2018) подавляет рост кисты и улучшает функцию почек, тогда как замедление разборки ресничек имеет противоположные эффекты в моделях ADPKD у мышей (Nikonova et al, 2014).
Наши исследования, представленные здесь, показывают, что делеция Pkd1 или Pkd2 в нескольких клеточных линиях и MEF приводит к ингибированию индуцированной сывороткой разборки и / или шедирования ресничек и стойкой активации передачи сигналов на основе ресничек.Отсроченная разборка также наблюдается в модели ADPKD у мышей в послеродовой период. Задержка разборки, вызванная потерей Pkd1 , является вторичной по отношению к активации пути центросомной целостности / митотического наблюдения (CI / MS), включающего ось 53BP1-USP28-p53.
Результаты
Удаление
Pkd1 / 2 вызывает отсроченную разборку ресничекМы создали и охарактеризовали мышиную модель ADPKD, используя индуцируемый тамоксифеном Ubc-Cre ERT2 Pally удалили драйвер для post ген во всем мире (рис. 1A, S1A и B).Как сообщалось ранее (Piontek et al, 2007; Ma et al, 2013), пролиферация клеток была заметно увеличена в кистозных почках, а количество EdU-положительных эпителиальных клеток почек было выше у 21-дневного возраста Ubc-Cre ERT2 ; Pkd1 f / f мышей, индуцированных 4-гидрокситамоксифеном (4-OHT), по сравнению с однопометниками дикого типа. Кроме того, мы заметили, что количество EdU-положительных клеток с первичными ресничками увеличивалось в три раза в мутантных почках по сравнению с почками дикого типа (Рис. 1B и C).Чтобы дополнительно проверить, имеют ли кистозные клетки более длинные реснички в S фазе, чем клетки дикого типа, срезы почек были дважды помечены на реснички и GEMININ, белок, который накапливается в S фазе (McGarry & Kirschner, 1998). ГЕМИНИН-положительные клетки с ресничками или без них очень редко встречаются в почках дикого типа. Однако GEMININ-позитивные клетки с ресничками были легко идентифицированы в почках, не содержащих Pkd1 и (фиг. S1C). Эти данные повышают вероятность того, что разборка может быть нарушена или сильно задержана в мутантных клетках.
Рисунок 1. Делеция Pkd1 увеличивает количество реснитчатых клеток EdU + in vivo.(A) Схема, показывающая введение 4-гидрокситамоксифена (4-OHT) от P2 к P6 и внутрибрюшинную инъекцию EdU на P20. (B) Типичные изображения срезов почек, окрашенных на EdU (зеленый) и ацетилированный α-тубулин (реснички, красный) P21 Pkd1 f / f или Ubc-Cre ERT2 ; Pkd1 f / f мышей, индуцированных 4-OHT от P2 к P6.Стрелками обозначены клетки EdU + с ресничками. Звездочки обозначают кисты. Масштабные линейки: 5 мкм. (C) Процент клеток EdU + с ресничками в Pkd1 f / f (n = 3) и Ubc-Cre ERT2 ; Pkd1 f / ; Pkd1 f / 907 (n = 4) почки. 50–100 EdU + клеток на животное оценивали на наличие ресничек. Данные представлены как средние значения ± стандартная ошибка среднего. t test, **** P <0.0001.
Рисунок S1. Характеристика модели мыши UbcCre ERT2 ; Pkd1 f / f .(A, B) Отношение веса двух почек к массе тела (2 кВт / масса тела) (A) и определение происхождения кисты в P21 Pkd1 f / f или UbcCre ERT2 ; Pkd1 f / f мышей (B), индуцированных тамоксифеном из P2-P6. Lotus Tetragonolobus Lectin маркирует проксимальные канальцы, а Dolichos Biflorus Agglutinin маркирует собирающие протоки.Масштабные линейки: 30 мкм. Данные представлены как средние значения ± стандартная ошибка среднего. t test, **** P <0,0001. (C) Типичные изображения срезов почек, окрашенных на ацетилированный α-тубулин (реснички, зеленый) и GEMININ (красный) из P21 Pkd1 f / f или Ubc-Cre ERT2 ; Pkd1 f / f мышей, индуцированных 4-OHT от P2 к P6. Стрелки указывают на ГЕМИНИН-положительные клетки. Масштабные линейки: 5 мкм.
Разборка или выпадение ресничек — это динамический процесс, который трудно повторить in vivo.Таким образом, мы непосредственно протестировали влияние делеции Pkd1 или Pkd2 на индуцированную сывороткой децилиацию в культуре клеток. Поскольку потеря / укорочение ресничек в ответ на сыворотку может быть опосредовано постепенной резорбцией / разборкой ресничек (Пугачева и др., 2007), мгновенным расслоением и / или отслаиванием (Мирвис и др., 2019), мы оценивали клеточные культуры на основе наличия или отсутствие детектируемых ресничек, чтобы объяснить все способы потери ресничек. С этого момента мы адаптируем термин «децилиация» для включения всех форм потери ресничек.Мы использовали три разных типа клеток: MEF, фибробласты NIh4T3 и почечные эпителиальные клетки мыши (mIMCD3). Делеция Pkd1 или Pkd2 , достигнутая либо путем гомологичной рекомбинации в MEF, либо путем редактирования гена CRISPR / Cas9 в NIh4T3 (рис. S2A и B) и mIMCD3 (Kleene & Kleene, 2016), не повлияла на процент мерцательных клеток или длина ресничек после 48 часов сывороточного голодания (рис. S2C), что указывает на отсутствие эффекта делеции Pkd1 или Pkd2 на сборку ресничек.Однако делеция Pkd1 или Pkd2 значительно снижает уровень индуцированной сывороткой децилитации во всех типах клеток, несмотря на различную кинетику среди этих типов клеток (Figs 2A – D и S2D – G).
Рисунок S2. Задержка разборки первичных ресничек в разных типах клеток Pkd1- или Pkd2-null .(A) Инактивация Pkd1 путем редактирования гена CRISPR / Cas9 в клетках NIh4T3. PKD1 иммунопреципитировали из лизатов клеток NIh4T3 дикого типа (дорожка 1) или стабильного клона NIh4T3 (клон 9.7) трансфицировали Pkd1 -специфической единственной направляющей РНК, нацеленной на экзон 1 (дорожка 2), с использованием двух ранее охарактеризованных PKD1-специфических антител (7e12 и E4). Присутствие PKD1 в иммунокомплексах определяли иммуноблоттингом с использованием третьего PKD1-специфического антитела (E8) (верхняя панель). Секвенирование по Сэнгеру экзона 1 мыши Pkd1 в клетках NIh4T3 Pkd1-KO выявило индели вокруг сайта расщепления Cas9 (показаны красным) в четырех обнаруженных аллелях Pkd1 .Последовательности дикого типа не обнаружено. Последовательность дикого типа показана вверху для справки. (B) Уровни белка PKD2 в клонах NIh4T3 дикого типа или в изолированных клонах NIh4T3, стабильно трансфицированных Pkd2 -специфической единственной направляющей РНК, нацеливающей экзон 8. Клон 5.4 продемонстрировал полное истощение PKD2 и был использован для последующих экспериментов. Секвенирование по Сэнгеру экзона 8 мыши Pkd2 в клетках NIh4T3 Pkd2-KO (клон 5.4) выявило большую делецию вокруг сайта расщепления Cas9 (показано красным).Последовательности дикого типа не обнаружено. Для справки вверху показана последовательность дикого типа. (C) Анализ длины ресничек у клеток дикого типа, Pkd1- или Pkd2- нулевых NIh4T3 клеток после 48 часов сывороточного голодания (~ 100 первичных ресничек проанализировано на группу). Данные представлены как средние значения ± стандартная ошибка среднего. Односторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака. (D, E) Репрезентативные изображения клеток MEF дикого типа ( Pkd1 + / + ) или Pkd1-null ( Pkd1 — / — ) клеток MEF в 0 или 8 часов после рестимуляции сыворотки окрашивали на Arl13b (зеленый) и γ-тубулин (красный) для визуализации аксонемы ресничек и базального тельца соответственно (D). (E) Показатели дециляции, вызванной сывороткой, показаны как наиболее подходящие с 95% доверительным интервалом для указанных типов клеток (n = 6) (E). Масштабные линейки: 5 мкм. Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака. *** P <0,001, **** P <0,0001. (F, G) Репрезентативные изображения Pkd2-нулевых клеток mIMCD3 дикого типа через 0 или 8 часов после рестимуляции сывороткой, окрашенных на Arl13b (зеленый) и γ-тубулин (красный) для визуализации аксонемы ресничек и базального тельца соответственно (F). (G) Уровни децилирования, вызванного сывороткой, показаны как наиболее подходящие с 95% доверительным интервалом для указанных типов клеток (n = 3) (G). Масштабные линейки: 5 мкм. Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака. *** P <0,001, **** P <0,0001.
Исходные данные доступны для этого рисунка.
Рис. 2. Удаление Pkd1 или Pkd2 снижает скорость дециляции ячеек.(A, B, C, D) Репрезентативные изображения клеток NIh4T3 дикого типа или клеток NIh4T3 (A) дикого типа или клеток NIh4T3 (A) и клеток дикого типа или клеток NIh4T3 клеток NIh4T3 (C) через 0 или 24 ч после рестимуляция сыворотки, окрашенная на Arl13b (зеленый) и γ-тубулин (красный) для визуализации аксонемы ресничек и базального тельца соответственно.Уровни децилиляции, вызванной сывороткой, показаны как наиболее подходящие с 95% доверительным интервалом для указанных типов клеток (n = 3) (B, D). Масштабные линейки: 5 мкм. Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака. * P <0,05, *** P <0,001, **** P <0,0001. (E, F, G, H) Репрезентативные изображения клеток дикого типа, Pkd1, — или Pkd2, , нулевых клеток NIh4T3, трансфицированных указанными конструкциями и GFP через 24 часа после повторного добавления сыворотки (E, G ).Клетки GFP + (зеленые, вставки) оценивали на наличие первичных ресничек с помощью окрашивания Arl13b (красный). Уровни децилирования, вызванные сывороткой, показаны как наиболее подходящие с 95% доверительным интервалом для указанных типов клеток (n = 3) (F, H). Масштабные линейки: 5 мкм. Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака. Все сравнения проводились с контрольными временными точками ( NIh4T3 Pkd1-KO , трансфицированные pcDNA3 или NIh4T3 Pkd2-KO , трансфицированные pcDNA3, красные кривые).Цвет звездочек указывает на сравнение соответствующей цветовой группы с контрольной группой. * P <0,05, ** P <0,01, *** P <0,001, **** P <0,0001.
Чтобы проверить, являются ли эти эффекты на децилирование специфичными для PKD1 или PKD2 и не связаны ли они с «нецелевыми» эффектами CRISPR / Cas9, мы трансфицировали обратно дикого типа или мутантные формы PKD1 или PKD2. Добавление обратно человеческих PKD1 или PKD2 скорректировало отсроченную децилиляцию, указывая на специфический эффект PKD1 или PKD2 на децилирование.Напротив, трансфекция PKD1 S99I , патогенного мутанта PKD1, который не может должным образом перемещаться к плазматической мембране (Kim et al, 2016), PKD2 D511V , патогенного мутанта PKD2 (Reynolds et al, 1999; Koulen et al, 2002) или PKD2 Y684del , которые оба обнаруживают сниженную активность каналов (Zheng et al, 2018), не смогли спасти отсроченную индуцированную сывороткой децилизацию (Fig 2E-H). Эти результаты подтверждают, что наблюдаемая задержка разборки ресничек специфична для отсутствия любого из полицистинов и устраняется добавлением обратно белков дикого типа.Более того, они поддержали гипотезу о том, что полностью функциональный комплекс PKD1 / PKD2, с точки зрения правильного нацеливания на плазматическую мембрану и бескомпромиссной активности каналов, необходим для правильного децилирования.
p53 и пути TGFβ / Smad гиперактивированы в
Pkd1 — и Pkd2 -нулеких клеткахЧтобы получить представление о механизме замедленного децилирования, а также идентифицировать гиперактивированные сигнальные пути в клетках Pkd1 kd2 Pkd1 kd2 907 мы проверили платформу из 45 сигнальных путей (Cignal Reporter Assays; QIAGEN) на предмет их модуляции путем инактивации Pkd1 или Pkd2 .Хотя кинетика кистозного роста может быть разной в почках Pkd1 и Pkd2 мутантных почек, мы сосредоточили внимание на путях, которые показали аналогичное направление изменения активности пути в Pkd1 — и Pkd2 -null клетках по сравнению с клетками дикого типа, несмотря на разные уровни. Гиперактивация путей p53 и TGFβ / Smad выделялась тем, что они были гиперактивированы в 10 из 10 независимых экспериментов (рис. 3A) в клетках NIh4T3, лишенных PKD1 или PKD2, и клетках mIMCD3, лишенных PKD2.Другие пути также были активированы в мутантных клетках (например, ATF6, Hedgehog / Gli, E2F1, MYC и TCF / LEF). Однако пути, такие как путь MEF2, по-разному реагировали на делецию Pkd1 по сравнению с Pkd2 . Делеция Pkd2 активируется, тогда как делеция Pkd1 подавляет активность пути MEF2, что указывает на то, что делеция Pkd1 или Pkd2 не полностью перекрывает активность пути. Соответственно, специфический для почек нокаут Mef2c снижает рост кистозных клеток в почках, не содержащих Pkd2 (Xia et al, 2010).Было бы интересно изучить кистозный рост у сложных мышей Pkd1 / Mef2c . Путь TGFβ / Smad2, как известно, гиперактивируется в почках, лишенных Pkd1 (Hassane et al, 2010; Leonhard et al, 2016), и вызывает фиброз почек, распространенный признак кистозных почек. Также известно, что он способствует пролиферации клеток NIh4T3 (Benzakour et al, 1992). Здесь наиболее актуально то, что для максимальной активности необходима интактная ресничка (Clement et al, 2013). Поэтому мы исследовали, проявляет ли он пролонгированную активность в ответ на сыворотку в клетках Pkd1, -null NIh4T3 по сравнению с клетками дикого типа.Уровни активированного фосфо-Smad2 (p-Smad2) определяли в несколько временных точек во время индуцированной сывороткой разборки ресничек в клетках NIh4T3 дикого типа или Pkd1, -null NIh4T3, ранее синхронизированных в G1 / G0 (фиг. 3B и C). После сывороточного голодания Smad2 не активировался в клетках дикого типа или мутантных клетках, что указывает на отсутствие эндогенно секретируемых лигандов суперсемейства TGF. Через 1 час после повторного добавления сыворотки уровень активации Smad2 был одинаковым для обоих типов клеток. Однако во все последующие моменты времени уровни p-Smad2 были выше в мутантных клетках, что указывает на постоянную активацию Smad2 во время разборки.Эти данные согласуются с уменьшенными скоростями децилирования Pkd1 -нульных клеток.
Рисунок 3. Повышенная передача сигналов p53 и TGFβ / Smad в Pkd1 -нулевых клетках NIh4T3.(A) Сводные данные функционального скрининга сигнальных путей, модулированных инактивацией Pkd1 или Pkd2 . Складчатая индукция на клетках дикого типа (показаны зеленой пунктирной линией) указанных сигнальных путей в NIh4T3 Pkd1-KO (n = 4), NIh4T3 Pkd2-KO (n = 3) или mIMCD3 Pkd2-KO (n = 3).Пути TGFβ / Smad и p53 (обведены) последовательно индуцировались во всех 10 независимых экспериментах. (B) Репрезентативный временной ход активации Smad2 (фосфо-SMAD2 на 465 и 467) в ответ на повторное добавление сыворотки в клетках дикого типа и Pkd1- нулевых клетках NIh4T3. (C) Сводные данные (B), показанные как наиболее подходящие с 95% доверительным интервалом для указанных типов клеток (n = 3). Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака. * P <0.05, ** P <0,01, *** P <0,001.
Исходные данные доступны для этого рисунка.
Ингибирование p53 восстанавливает отсроченную децилиляцию в
Pkd1 — или Pkd2 -null NIh4T3 клеткахАнализ сигнального пути идентифицировал p53 как один из путей, гиперактивируемых в Pkd1 или мутантных клетках Pkd2. Мы подтвердили, что уровни экспрессии р53 были выше в Pkd1 — или Pkd2 -нулевых клетках, чем в клетках дикого типа (фиг. 4A).Затем мы определили, повышается ли уровень p53 в кистозных почках у 21-дневного возраста Ksp-Cre ERT2 ; Pkd1 f / f и в 16- или 21-дневном возрасте. — старый Ubc-Cre ERT2 ; Pkd1 f / f мышей. Сначала мы охарактеризовали модель мыши Ksp-Cre ERT2 ; Pkd1 f / f (рис. S3A и B). В то время как Ubc-Cre управляет экспрессией рекомбиназы Cre во всех типах клеток, Ksp-Cre ERT2 использует промотор Cdh26 , который активен в эпителиальных клетках развивающихся нефронов, зачатке мочеточника, и мезонефрические канальцы с низкой эффективностью рекомбинации в проксимальных канальцах (Shao et al, 2002).Во взрослых почках этот промотор активен в собирательных трубках, петлях Генле и дистальных канальцах, а также в проксимальных канальцах (Shao et al, 2002; Shibazaki et al, 2008). Этот драйвер индуцируется тамоксифеном (4-OHT). В поддержку наших данных в культуре клеток, уровни экспрессии белка p53 в лизатах кистозных почек P21 Ksp-Cre ERT2 ; Pkd1 f / f и P16 или P21 Ubc-Cre. ERT2 ; Pkd1 f / f мышей, индуцированных 4-OHT из P2-P6, были увеличены в мутантных почках (рис. 4B – D и S3C – E), что указывает на удаление Pkd1 либо повсеместно, либо специфически в эпителиальных клетках почек, приводит к массивной активации p53 в кистозных почках.
Рисунок 4. Индуцированная сывороткой децилиция зависит от р53 в Pkd1 -нулевых клетках NIh4T3.(A) Уровни экспрессии p53 в общих клеточных лизатах дикого типа, Pkd1 -null или Pkd2 -null NIh4T3 клеток. (B) Уровни экспрессии p53 в ядерных и цитозольных экстрактах, полученных из почек P21 Pkd1 f / f и Ubc-Cre ERT2 ; Pkd1 f f мышей получали 4-OHT. (C, D) Количественная оценка уровней белка p53 в ядре (C) и цитозоле (D), нормализованных для однопометников дикого типа, объединенных из трех пар P16 и трех пар P21 однопометников. Данные представлены как средние значения ± стандартная ошибка среднего. т проба. * P <0,05, ** P <0,01. (E, F) Репрезентативные изображения Pkd1- нулевых клеток NIh4T3 (E), котрансфицированных указанными конструкциями и GFP через 24 часа после повторного добавления сыворотки. pcDNA3 использовали в качестве отрицательного контроля. px330 p53 экспрессирует p53-специфическую одиночную направляющую РНК. Клетки GFP + (зеленые, вставки) оценивали на наличие первичных ресничек с помощью окрашивания Arl13b (красный). Скорость индуцированной сывороткой децилиляции показана как наиболее подходящая с 95% доверительным интервалом для указанных типов клеток (n = 3) (F). Масштабные линейки: 5 мкм. Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака. * P <0,05, **** P <0,0001. (G, H, I) Диаграмма, показывающая лечение 10 мкМ пифитрином во время сывороточного голодания и во время рестимуляции сыворотки (G).Репрезентативные изображения первичных ресничек (Arl13b, красный) из нулевых клеток Pkd1- (H) через 24 часа после рестимуляции сывороткой после указанного лечения. Уровни децилиляции, вызванной сывороткой, показаны как наиболее подходящие с 95% доверительным интервалом для указанных типов клеток (n = 3) (I). Стрелками обозначены первичные реснички. Масштабные линейки: 5 мкм. Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма-Сидака. * P <0,05, ** P <0,01. (J, K, L) Диаграмма, показывающая обработку 10 мкМ пифитрина только во время рестимуляции сыворотки (J).Репрезентативные изображения первичных ресничек (Arl13b, красный) из нулевых клеток Pkd1- (K) через 24 часа после рестимуляции сыворотки после указанного лечения. Скорости индуцированной сывороткой децилиляции показаны как наиболее подходящие с 95% доверительным интервалом для указанных типов клеток (n = 3) (L). Стрелками обозначены первичные реснички. Масштабные линейки: 5 мкм. Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака. ** P <0,01, **** P <0,0001.
Исходные данные доступны для этого рисунка.
Рисунок S3. Характеристика модели мыши KspCre ERT2 ; Pkd1 f / f .(A, B) Соотношение 2 KW / BW (A) и визуализация происхождения кисты в Pkd1 f / f или KspCre ERT2 ; Pkd1 f 907 мышей на P21 (B), индуцированных тамоксифеном от P2 до P6. Lotus Tetragonolobus Lectin маркирует проксимальные канальцы, а Dolichos Biflorus Agglutinin маркирует собирающие протоки.Масштабные линейки: 30 мкм. Данные представлены как средние значения ± стандартная ошибка среднего. t test, **** P <0,0001. (C, D, E) Уровни экспрессии p53 в ядерных и цитозольных экстрактах, полученных из почек P21 Pkd1 f / f и Ksp-Cre ERT2 ; ; Pkd1 f / f мышей, получавших 4-OHT (C). (D, E) Количественная оценка уровней белка p53 в ядре (D) и цитозоле (E), нормализованных для однопометников дикого типа (три пары однопометников).Данные представлены как средние значения ± стандартная ошибка среднего. t тест, ** P <0,01.
Исходные данные доступны для этого рисунка.
Поскольку PKD1 и PKD2 присутствуют в первичных ресничках (Yoder et al, 2002; Pazour et al, 2002b), а образование и рост кист, вызванные делецией Pkd1 или Pkd2 , имеют несколько общих характеристик цистогенеза у мутантов ресничек ( Davenport et al, 2007; Piontek et al, 2007), мы пришли к выводу, что потеря Pkd1 или Pkd2 могла привести к некоторому структурному дефекту ресничек и / или центросомы / базального тельца, который может быть обнаружен центросомная целостность / путь митотического наблюдения, ведущий к активации p53.Этот путь активируется потерей центросом, а не амплификацией центросом или повреждением ДНК (Fong et al, 2016; Lambrus et al, 2016; Meitinger et al, 2016; Lambrus & Holland, 2017). В соответствии с этой гипотезой мы не увидели различий в количестве фосфо-h3AX (γ-h3AX) -положительных клеток дикого типа и Pkd1, -нулевых клеток NIh4T3 или окрашивания почек дикого типа и мутантов (рис. S4A и B) это указывает на то, что двухцепочечные разрывы ДНК и нестабильность генома вряд ли могут быть причиной отсроченной разборки в мутантных клетках.Основные компоненты пути CI / MS включают 53BP1, USP28 и p53. Инактивация гена p53 посредством редактирования гена CRISPR / Cas9 (рис. 4E и F и S5A и B) или ингибирование его транскрипционной активности пифитрином (рис. 4G – I и S5C и D) восстанавливали отсроченную децилизацию в Pkd1 — или Pkd2 — нулевые клетки NIh4T3. Добавление пифитрина сразу после повторного добавления сыворотки имело аналогичные эффекты в Pkd1 — или Pkd2 -нулевых клетках (рис. 4J – L, S5E и F), что указывает на острый эффект p53 на децилирование в фазах G1 и / или S. того же цикла.Делеция или ингибирование p53 не влияли на клетки дикого типа (рис. S5G-I). Таким образом, эти данные показали, что делеция Pkd1 или Pkd2 в культивируемых клетках или почках приводит к увеличению уровней p53 и активности, которая отвечает за ингибирование индуцированной сывороткой децилиации клеток.
Рисунок S4. Активация ответа на повреждение ДНК в клетках дикого типа и Pkd1 и -нулевых клетках и почках.(A, B) Репрезентативные изображения клеток NIh4T3 дикого типа и Pkd1 -null (A) или Pkd1 f / f и UbcCre ERT2 88 f / f срезы почек мыши на P21 (B), окрашенные на γ-h3AX (красный).Стрелка указывает на клетку, положительную по γ-h3AX. Масштабные линейки: 5 мкм.
Рисунок S5. Эффект делеции p53 или ингибирование индуцированной сывороткой децилиляции нулевых клеток Pkd2 или клеток NIh4T3 дикого типа.(A, B) Репрезентативные изображения Pkd2 -нулевых клеток NIh4T3 (A), котрансфицированных указанными конструкциями и GFP через 24 часа после повторного добавления сыворотки. Клетки GFP + (зеленые, вставки) оценивали на наличие первичных ресничек с помощью окрашивания Arl13b (красный).Показатели индуцированной сывороткой децилиляции показаны как наиболее подходящие с 95% доверительным интервалом для указанных типов клеток (n = 3) (B). Масштабные линейки: 5 мкм. Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака. *** P <0,001, **** P <0,0001. (C, D, E, F) Репрезентативные изображения Pkd2 -null NIh4T3 клеток, обработанных ДМСО или пифитрином во время сывороточной депривации и рестимуляции сыворотки (C) или обработанных DMSO или пифитрином только во время рестимуляции сыворотки (E).Клетки оценивали на наличие первичных ресничек с помощью окрашивания Arl13b (красный). Скорости индуцированной сывороткой децилиляции показаны как наиболее подходящие с 95% доверительным интервалом для указанных типов клеток (n = 3) (D, F). Масштабные линейки: 5 мкм. Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака. * P <0,05, ** P <0,01, *** P <0,001, **** P <0,0001. (G, H, I) Скорость индуцированной сывороткой децилиляции клеток NIh4T3 дикого типа, трансфицированных GFP и pcDNA3 или px330 p53 (G), или обработанных DMSO или пифитрином во время лишения сыворотки и рестимуляции сыворотки (H) или обработанные ДМСО или пифитрином только во время рестимуляции сыворотки (I), показаны как наиболее подходящие с 95% доверительным интервалом (n = 3).Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака.
Затем мы проверили, будет ли истощение 53BP1 и USP28 иметь аналогичные эффекты с делецией p53 на децилирование в -нулевых клетках Pkd1 . Хотя это не является статистически значимым, уровни мРНК как 53bp1 , так и Usp28 были повышены в лишенных сыворотки Pkd1 нулевых клетках по сравнению с клетками дикого типа (фиг. 5A и B). Эта тенденция к увеличению уровней мРНК Usp28 и 53bp1 на исходном уровне (0 ч) может указывать на активацию CI / MS перед повторным добавлением сыворотки.Подавление обоих этих белков (рис. S6A – D) восстанавливает децилирование в мутантных клетках (рис. 5C и D). В целом, эти данные предполагают, что делеция Pkd1 или Pkd2 ведет к активации пути CI / MS, что, в свою очередь, ведет к активации активности p53 для подавления децилитации. Повышенные уровни мРНК 53bp1 и Usp28 в G1 / G0 предполагают, что центросомный «дефект» мог быть индуцирован раньше, но он не проявлялся до тех пор, пока клетки не были индуцированы децилироваться.Мы предположили, что избыточная экспрессия основных компонентов пути CI / MS в клетках NIh4T3 дикого типа должна быть способна повторять задержку децилирования, наблюдаемую в Pkd1-нулевых клетках . Действительно, сверхэкспрессия USP28, 53BP1, как USP28, так и 53BP1 или p53 была способна подавлять децилиляцию в клетках дикого типа (рис. 5E и F). В целом, эти результаты подтверждают вывод о том, что активация пути CI / MS ингибирует децилиацию, а не наоборот.
Рис. 5. Скорость децилирования, индуцированного сывороткой, модулируется компонентами центросомной целостности / пути митотического наблюдения.(A, B) Usp28 (A) и 53bp1 (B) Уровни мРНК в клетках дикого типа или Pkd1-null NIh4T3 клетках в различные моменты времени после повторного добавления сыворотки (n = 3) . Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака. (C, D) Репрезентативные изображения нулевых клеток Pkd1-, трансфицированных указанными конструкциями и GFP, через 24 часа после повторного добавления сыворотки (C). Клетки GFP + (зеленые, вставки) оценивали на наличие первичных ресничек с помощью окрашивания Arl13b (красный) (C).Уровни децилирования, вызванного сывороткой, показаны как наиболее подходящие с 95% доверительным интервалом для указанных типов клеток (n = 3) (D). Масштабные линейки: 5 мкм. Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака. Все сравнения выполнялись относительно временных точек контрольной группы ( NIh4T3 Pkd1-KO , трансфицированные скремблированной миРНК, красная кривая). Цвет звездочек указывает на сравнение соответствующей цветовой группы с контрольной группой.** P <0,01, *** P <0,001, **** P <0,0001. (E, F) Репрезентативные изображения клеток NIh4T3 дикого типа, трансфицированных указанными конструкциями и GFP, через 24 часа после повторного добавления сыворотки. Клетки GFP + (зеленые, вставки) оценивали на наличие первичных ресничек с помощью окрашивания Arl13b (красный) (E). Скорость индуцированной сывороткой децилиляции показана как наиболее подходящая с 95% доверительным интервалом для указанных типов клеток (n = 3) (F). Масштабные линейки: 5 мкм.Все сравнения проводились с контрольными временными точками группы (NIh4T3, трансфицированный pcDNA3 , черная кривая). Цвет звездочек указывает на сравнение соответствующей цветовой группы с контрольной группой. Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака. * P <0,05, ** P <0,01, **** P <0,0001.
Рисунок S6. Подтверждение эффективности нокдауна миРНК Usp28 и 53bp1 .(A, B) Эффективность миРНК Usp28 была подтверждена с помощью вестерн-блоттинга после трансфекции скремблированной миРНК или возрастающих количеств Usp28 миРНК (15, 30 и 50 нМ) (A) и с помощью иммунофлуоресценции для USP28 ( красный) в Pkd1 -нулевых клетках NIh4T3 (B). (C, D) Эффективность миРНК 53bp1 была подтверждена с помощью вестерн-блоттинга после трансфекции скремблированной миРНК или 50 нМ 53bp1 миРНК (C) и с помощью иммунофлуоресценции для 53BP1 (красный) в клетках Pkd1 4 -null D).Масштабные линейки: 5 мкм.
Исходные данные доступны для этого рисунка.
Pkd1 -null клетки обнаруживают пониженные уровни NDE1 во время индуцированной сывороткой децилицииЧтобы понять, как повышенная активность p53 может ингибировать децилизацию, мы исследовали уровни экспрессии известных факторов разборки или негативных регуляторов образования ресничек. NDE1 является негативным регулятором цилиогенеза, экспрессия которого индуцируется при повторном входе в клеточный цикл, но подавляется в G1 / G0 с помощью SCF FBW7 E3 лигазы (Maskey et al, 2015). Pkd1 -нулевые клетки показали пониженные уровни NDE1 при повторном добавлении сыворотки по сравнению с клетками дикого типа (фиг. 6A и B). Чтобы дополнительно проверить возможную роль p53 в снижении уровней экспрессии белка NDE1 во время децилиляции, мы обработали клетки NIh4T3 дикого типа нутлином, стабилизатором p53, сразу после рестимуляции сыворотки, и определили уровни белка NDE1 через 24 часа и процентное соотношение ресничек через 8 и 24 ч после повторного добавления сыворотки. Обработка нутлином снижала уровни белка NDE1 и децилизацию клеток в клетках NIh4T3 дикого типа (рис. 6C – E).Эти данные свидетельствуют о том, что повышенная активность p53 может подавлять уровни белка NDE1. Однако, поскольку децилирование подавлялось при концентрациях нутлина, которые были неэффективны в подавлении уровней NDE1 (20 мкМ), мы предполагаем, что другие белки, регулируемые p53, могут быть затронуты параллельно с NDE1, чтобы подавить децилизацию в этих клетках.
Рис. 6. p53 играет отрицательную роль в разборке ресничек посредством подавления NDE1.(A) Типичная динамика уровней белка различных факторов разборки во время децилитации в ответ на повторное добавление сыворотки в клетках дикого типа и Pkd1- нулевых NIh4T3 клетках. (B) Сводные данные об уровнях белка NDE1 в (A) показаны как наиболее подходящие с 95% доверительным интервалом для указанных типов клеток (n = 3). Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака. * P <0,05, ** P <0,01. (C) Внизу: репрезентативные уровни белка NDE1 в клетках NIh4T3 дикого типа через 0 или 24 часа после стимуляции сывороткой после указанных обработок. Вверху: сводные данные об уровнях NDE1, нормализованные для имитации лечения через 24 часа (серая полоса) (n = 3).Данные представлены как средние значения ± стандартная ошибка среднего. Односторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака, ** P <0,01, *** P <0,001, **** P <0,0001. (D, E) Репрезентативные изображения клеток NIh4T3 дикого типа через 24 часа после повторного добавления сыворотки после указанных обработок. Первичные реснички визуализировали с помощью Arl13b (зеленый) (D). Уровни децилитации, вызванной сывороткой, показаны как наиболее подходящие с 95% доверительным интервалом для указанных видов лечения (n = 3) (E). Масштабные линейки: 5 мкм.Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака. * P <0,05, *** P <0,001. (F, G, H, I) Графическое представление конструкций, кодирующих FLAG-GEMININ или FLAG-NDE1-GEMININ (F). Экспрессию конструкций индуцировали индукцией доксициклина в момент времени 0 ч (G). Репрезентативные изображения Pkd1-нулевых клеток NIh4T3 через 24 часа после повторного добавления сыворотки, трансфицированных указанными конструкциями.Клетки dsRED + (красные) оценивали на наличие первичных ресничек с помощью окрашивания Arl13b (зеленый) (H). Уровни децилитации, вызванной сывороткой, показаны как наиболее подходящие с 95% доверительным интервалом для указанных видов лечения (n = 3) (I). Масштабные линейки: 5 мкм. Данные представлены как средние значения ± стандартная ошибка среднего. Двусторонний дисперсионный анализ с тестом множественных сравнений Холма – Сидака. *** P <0,001.
Исходные данные доступны для этого рисунка.
Мы рассудили, что добавление обратно NDE1 в Pkd1 -null клетках должно способствовать децилитации, если низкие уровни NDE1 играли причинную роль в снижении скорости децилитации, наблюдаемой в этих клетках.Однако сверхэкспрессия NDE1 на протяжении клеточного цикла оказывает сильное влияние на подавление ресничек. Чтобы максимизировать экспрессию NDE1 в фазе G1 / S (когда происходит децилиция), мы использовали индуцируемый тетрациклином вектор, чтобы вызвать экспрессию NDE1 во время повторного добавления сыворотки. Мы также слили на его С-конце аминокислотные остатки 1–110 человеческого GEMININ, содержащие хорошо зарекомендовавший себя фосфодегрон APC / C (McGarry & Kirschner, 1998), чтобы гарантировать почти полную деградацию на G0 (Рис. 6F). Как показано на рис. 6G-I, процент реснитчатых клеток через 12 и 24 часа после повторного добавления сыворотки в Pkd1 -нулевых клетках NIh4T3, трансфицированных NDE1-hGEM и индуцированных 2 мкг / мл доксициклина при 0- h момент времени, был снижен до уровней дикого типа.Сверхэкспрессия этой конструкции и индукция экспрессии схожей концентрацией доксициклина не ускоряли разборку в клетках дикого типа. Мы пришли к выводу, что уровни ресничек в мут-трансфицированных и NDE1-hGEM-трансфицированных Pkd1 -нулевых клетках схожи в 0 ч повторного добавления сыворотки, но децилиция усиливается после повторного добавления сыворотки в мутантных клетках, трансфицированных NDE1-hGEM. , NDE1 может функционировать как сывороточный фактор децилирования, и его наблюдаемое подавление в Pkd1 -null клетках может иметь причинный эффект в подавлении скорости децилирования в этих клетках.В целом, эти данные предполагают, что NDE1 может функционировать ниже PKD1 в сывороточной децилиации в клетках NIh4T3.
Обсуждение
Хотя 18 лет назад было осознано, что реснички могут играть важную роль в патогенезе поликистозной болезни почек (Pazour & Rosenbaum, 2002; Pazour et al, 2002a), точный клеточный механизм того, как реснички способствуют формированию кисты. формирование / прогрессирование ADPKD все еще остается неизвестным. Поскольку реснички кажутся нормального размера в нескольких моделях ADPKD у мышей, считается, что потеря полицистинов может играть первичную роль в модуляции функции ресничек, а не структуры (Nauli et al, 2003; Pazour, 2004; Ma et al, 2013).Наши исследования оспаривают эту идею, показывая, что измененная функция ресничек вторична по отношению к дефектной дециляции. Это согласуется с предыдущими данными, показывающими, что абляция первичных ресничек (Ma et al, 2013) или ускорение разборки ресничек подавляет рост кисты (Nikonova et al, 2018), тогда как замедление разборки ресничек усиливает рост кисты в моделях ADPKD у мышей (Nikonova et al. al, 2014). Наши данные указывают на вызванную сывороткой децилизацию как клеточный процесс, на который влияет потеря полицистинов.
Мы предполагаем, что путь CI / MS является важным промежуточным звеном между потерей полицистинов и снижением скорости индуцированной сывороткой децилитации. Этот вывод основан на следующих доказательствах. Во-первых, клетки, лишенные Pkd1 или Pkd2 , не обнаруживают различий в уровнях ресничек или длине ресничек при голодании сыворотки, указывая тем самым, что потеря PKD1 или PKD2 не влияет на программы сборки ресничек. Напротив, клетки, лишенные Pkd1 или Pkd2 , демонстрируют пониженную скорость индуцированной сывороткой децилитации, которая устраняется за счет нокаутации или ингибирования компонентов пути CI / MS, таких как USP28, 53BP1 и p53.Напротив, сверхэкспрессия этих факторов в клетках дикого типа вызывает отсроченную децилиацию, указывая на то, что активация пути CI / MS происходит ниже по течению потери полицистина и выше по течению от отсроченной разборки. Во-вторых, почечные клетки, выстилающие кистозный эпителий в моделях мышей с ADPKD, показывают не только большее количество EdU-положительных клеток, но также большее количество EdU-положительных клеток с первичными ресничками, чем клетки дикого типа, что позволяет предположить, что децилиация клеток нарушена. тем не менее, вход в S активируется в мутантных клетках.Это указывает на возможное разъединение тесной координации децилиляции и развития клеточного цикла. В-третьих, сверхэкспрессия NDE1 во время разборки вызывает децилиацию в мутантных клетках, но не в клетках дикого типа. Эти находки указывают на то, что NDE1 оказывает негативное влияние на биогенез и поддержание ресничек, но не на реснички, подвергающиеся разборке или отслаиванию, несмотря на тот факт, что он был идентифицирован как компонент CDC (Gabriel et al, 2016). Важный вопрос заключается в том, как активация p53 приводит к снижению уровня экспрессии белка NDE1.Поскольку p53 опосредует свои эффекты посредством активации транскрипции, мы полагаем, что влияние p53 на NDE1 является непрямым, возможно, через индукцию транскрипции фактора (ов), которые подавляют NDE1 и дополнительные факторы децилирования. Эти данные привели нас к предложению модели, в которой делеция полицистинов активирует путь CI / MS за счет увеличения уровней / активности USP28, 53BP1 и p53. Активация этого пути приостанавливает индуцированную сывороткой децилизацию, обеспечивая стойкую активацию цилиарных сигнальных путей.Эти пути могут включать TGF-β / Smad, Hedgehog, канонический Wnt / β-catenin и др., Которые могут способствовать росту кисты линейным и / или параллельным путями (Рис. 7).
Рис. 7. Предлагаемый механизм, с помощью которого истощение PKD1 / PKD2 приводит к усилению передачи сигналов, связанных с ресничками.Истощение PKD1 или PKD2 индуцирует центросомную целостность / путь митотического наблюдения, приводя к снижению скорости разборки ресничек и / или шеддинга (децилитации). Снижение скорости децилирования продлевает активацию зависимых от ресничек сигнальных путей (т.е.е., TGFβ / Smad, Hedgehog и Wnt / βcatenin).
Наши данные, однако, подтверждают не прямой эффект потери полицистинов на вызванную сывороткой децилиляцию, а скорее косвенный эффект через активацию пути CI / MS. Мы показываем, что делеция или фармакологическое ингибирование p53, 53BP1 или USP28 восстанавливает скорость децилитации в клетках, лишенных Pkd1 . Эти данные подтверждают, что эти белки функционируют после потери Pkd1 в децилиации. Мы пока не знаем, как именно потеря Pkd1 или Pkd2 активирует путь CI / MS.Поскольку этот путь может быть активирован потерей центросомы, задержкой митоза или обоими способами, и в этом случае потеря центросомы вызывает задержку митоза (Lambrus & Holland, 2017), возможно, что одной из нормальных функций поликистинов может быть поддержание CI. Однако мы не наблюдаем центросомной потери, грубых центросомных аномалий, таких как фрагментация или амплификация, в Pkd1 — или Pkd2 -null клетках, несмотря на предыдущие сообщения о центросомной амплификации в Pkd1 — или Pkd2 -null MEF. и почки (Battini et al, 2008; Burtey et al, 2008).Следует отметить, что даже если центросомная амплификация происходит в Pkd1 -нулевых клетках NIh4T3 выше их известных уровней в 6% (Wong et al, 2015), путь CI / MS должен активироваться не центросомной амплификацией, а скорее центросомной потерей. . Мы поддерживаем идею о том, что полицистины дикого типа могут играть важную роль в поддержании CI, и их потеря вызывает тонкие структурные изменения даже до того, как клетки будут индуцированы для вступления в клеточный цикл, потому что уровни мРНК 53bp1 и Usp28 были повышены в сыворотке. -голодные клетки.Поскольку центросома представляет собой безмембранную органеллу, маловероятно, что комплекс PKD1 / PKD2 физически участвует в CI. Однако PKD1 / PKD2-обеспечиваемая передача сигналов Ca 2+ может влиять на критические аспекты биогенеза, созревания и поддержания центросом. В поддержку этой гипотезы, мутантные формы PKD1 или PKD2, которые нарушают активность канала, не смогли устранить дефекты дециляции в Pkd1 — или Pkd2 -мутантных клетках, что указывает на то, что присутствие функционального комплекса полицистина необходимо для CI / нормального децилирования.В будущем потребуется дополнительная работа, чтобы определить механизм, с помощью которого потеря полицистина запускает путь CI / MS.
Наши данные показывают, что процент мерцательных клеток или длина ресничек не изменяется в клетках с недостатком сыворотки, лишенных Pkd1 или Pkd2 и клеток дикого типа. Следовательно, у нас нет доказательств того, что потеря полицистинов влияет на программы сборки ресничек. Это согласуется с данными наших мышей, у которых длина ресничек, по-видимому, не сильно отличается между клетками дикого типа и мутантными клетками, если только клетки не активно циклируют, как это определено с помощью мечения EdU.Можно утверждать, что 24-часовой импульс EdU может маркировать клетки во всех фазах клеточного цикла, включая G1. Однако на P21 пролиферация клеток в почках чрезвычайно низка, как было показано ранее, что 3-часовой импульс BrdU на P24 метил только 4% кистозных клеток и 0% клеток дикого типа (Shibazaki et al, 2008). Следовательно, вероятность того, что EdU-положительная клетка окажется в фазе G1 после прохождения фаз S, G2 и M, довольно мала. Более того, клетка, которая перешла от S к G1 в течение 24 часов, должна продуцировать две дочерние клетки, меченные EdU, локализованные рядом друг с другом, чего мы не видим.Следовательно, мы поддерживаем идею, что EdU-положительные клетки представляют клетки в основном в S-фазе и в меньшей степени в G2. Это подтверждается нашими данными по идентификации GEMININ-позитивных клеток с ресничками в мутантных почках, но не в почках дикого типа. Основываясь на окрашивании DAPI, мы не видим много делящихся клеток, а согласно окрашиванию γ-h3AX мы заключаем, что клетки, подвергающиеся повреждению ДНК или испытывающие геномную нестабильность, едва обнаруживаются ни в почках дикого типа, ни в мутантных почках. Следовательно, мы предполагаем, что кистозные клетки перешли в фазу S с частично резорбированными ресничками или интактными ресничками.Сначала эта гипотеза может показаться противоречащей общей повышенной пролиферации клеток в кистозных почках. Однако может быть несколько объяснений, требующих дальнейшего рассмотрения. Другие и мы предположили, что ускоренная разборка или укорочение / потеря ресничек может ускорить повторный вход в клеточный цикл, тогда как отсроченная разборка или аномально длинные реснички могут иметь противоположные эффекты (Pan & Snell, 2007; Kim & Tsiokas, 2011; Sung & Li, 2011; Ван и Динлахт, 2018). Эти данные предполагают, что первичные реснички могут функционировать как физическая контрольная точка прогрессии клеточного цикла.Несколько противоречит этой идее, однако, тот факт, что первичные реснички содержат многочисленные сигнальные пути, большинство из которых обладают сильными митогенными эффектами (Schneider et al, 2005; Christensen et al, 2012; Yeh et al, 2013). Кроме того, реснички могут способствовать или подавлять зависимый от передачи сигналов Hedgehog туморогенез в зависимости от мутации драйвера (Han et al, 2009; Wong et al, 2009). Наконец, реснички придают химиорезистентность определенным типам опухолей (Jenks et al, 2018). Следовательно, оказывается, что первичные реснички могут иметь как положительные, так и отрицательные эффекты на развитие клеточного цикла.Хотя они необходимы для инициации митогенной передачи сигналов, они также должны своевременно разбираться или сбрасываться для нормального развития клеточного цикла. Предполагая, что отсроченная разборка не вызывает полной остановки клеток, это может поддерживать постоянную передачу митогенных сигналов на основе ресничек в некотором количестве клеток, которые, возможно, стохастически, обычно не входят в клеточный цикл. Это дополнительное время, в течение которого клетки подвергаются митогенному стимулу, может привести к тому, что в конечном итоге в клеточный цикл войдет больше клеток, увеличивая количество пролиферирующих клеток.Тем не менее, может ли и как отсроченная децилиация способствовать повторному входу в клеточный цикл в условиях ADPKD, требует дальнейшего изучения.
В целом, наши исследования выдвинули новую модель, в которой физиологическая клеточная функция полицистинов заключается в поддержании КИ. Утрата этой функции активирует путь CI / MS, который, в свою очередь, сигнализирует клеткам о замедлении скорости децилирования. В результате передача сигналов на основе ресничек может сохраняться, способствуя росту кист (Рис. 7). Молекулярная идентичность базирующегося на ресничках сигнального пути (ов) с активностью промотирования кисты все еще остается невыясненной, но это могут быть пути, которые опосредуют передачу митогенных сигналов.Постоянная активация митогенной передачи сигналов на основе ресничек может рекрутировать почечные эпителиальные клетки в G1 / G0, чтобы в конечном итоге войти в клеточный цикл, способствуя разрастанию и росту кист.
Материалы и методы
Культура клеток
Pkd1 + / + (дикий тип) и Pkd1 — / — MEF были получены из Балтиморского центра PKD. Pkd2 + / + и Pkd2 — / — клетки внутреннего мозгового протока мыши (mIMCD3) были любезным подарком от лаборатории Клини (Университет Цинциннати).Клетки NIh4T3 получали из Американской коллекции типовых культур. MEF поддерживали в DMEM (4,5 г / л глюкозы, L-глутамина и пирувата натрия) с добавлением 1% пенициллина-стрептомицина, 1% заменимых аминокислот и 10% FBS. Клетки mIMCD3 культивировали в смеси 1: 1 DMEM и Ham’s F-12 с добавлением 10% FBS. Клетки NIh4T3 поддерживали в среде DMEM, содержащей 10% бычью телячью сыворотку.
Реагенты
Параформальдегид (Кат. Номер J19943-K2), EdU (Кат. Номер C10337), пролонгированный алмазный DAPI (Кат.нет. P36966), Trizol (каталожный номер 15596018) и реагент LTX (каталожный номер 15338100) были приобретены у Thermo Fisher Scientific. Нутлин-3 (каталожный номер 3984) и пифитрин-α гидробромид (каталожный номер 1267) были приобретены у Tocris. 4-гидрокситамоксифен был приобретен у Sigma-Aldrich (каталожный номер H6278).
Редактирование гена CRISPR – CAS9
Для генерации NIh4T3 Pkd1-KO и NIh4T3 Pkd2-KO с помощью вектора pkd2-KO , кодирующего клоны 3, клетки были трансфицированы с помощью антивирусного вектора pkd2-IPR, клетки NIh4T2 были трансфицированы (клетки NIh4T2 были трансфицированы) Cas9, устойчивость к пуромицину и последовательности одиночной направляющей РНК (sgRNA), специфичные для Pkd1 (5′-AGGGCCGAGTCTGCGCATCC-3 ‘) или Pkd2 (5′-AAGTGCTGAAGTCATCGACC-3′).После трансфекции клетки подвергали серийным разведениям и высевали с выделением пуромицина (1 мкг / мл) в течение 3 недель. После отбора отдельные колонии были изолированы и размножены. Полученные клоны оценивали на предмет делеции интересующих генов с помощью секвенирования ДНК по Сэнгеру и вестерн-блоттинга.
Иммунопреципитация
Лизаты клеток дикого типа или Pkd1 -нулевых клеток NIh4T3 инкубировали с двумя антителами α-PKD1 (7e12; Santa Cruz and E4; PKD Baltimore Center) в течение ночи для иммунопреципитации PKD1.Комплексы антиген-антитело затем инкубировали с шариками протеин G-сефарозы в течение 3 часов при 4 ° C. Иммунопреципитаты анализировали на присутствие PKD1 с помощью вестерн-блоттинга.
Непрямая иммунофлуоресценция на культивируемых клетках
Клетки первоначально высевали на стеклянные покровные стекла с плотностью ~ 30 000 клеток / лунку в 24-луночные планшеты. Чтобы вызвать синхронизацию образования G1 / G0 и первичных ресничек, клетки частично или полностью лишали сыворотки в течение 48 часов. В частности, MEF культивировали в среде с низким содержанием сыворотки OptiMEM, клетки mIMCD3 культивировали в среде DMEM / F12, содержащей 0.Клетки 5% FBS и NIh4T3 содержали в среде DMEM без сыворотки. Для индукции децилитации клетки рестимулировали их соответствующей средой для полного роста (описанной выше). После рестимуляции сыворотки клетки фиксировали 4% параформальдегидом в PBS, pH 7,5, в различные моменты времени. Визуализацию первичных ресничек выполняли, как описано ранее (Maskey et al, 2015). Вкратце, фиксированные клетки пермеабилизировали 0,15% Triton X-100 в PBS в течение 90 с и блокировали 3% козьей сывороткой / 0.15% Triton X-100 в PBS в течение 1 часа. Затем фиксированные клетки инкубировали в течение ночи при 4 ° C с первичными антителами, детектирующими Arl13b (1: 500; Proteintech), γ-тубулин (1: 500; Invitrogen), γ-h3AX (1: 200; Cell Signaling), USP28 ( 1: 100; Proteintech) и 53BP1 (1: 1000; Novus Biologicals). Затем клетки промывали 3 раза PBS и инкубировали с вторичными антителами, конъюгированными с Alexa Fluor (1: 2,000; Invitrogen), в течение 2 часов при 4 ° C в защищенном от света месте. Затем образцы промывали 3 раза PBS и устанавливали с помощью Diamond DAPI (Thermo Fisher Scientific) для контрастирования ядер.Изображения были получены с помощью конфокального микроскопа Olympus FV1000 и обработаны с помощью программного обеспечения ImageJ для измерения длины ресничек.
Эксперименты по спасению и siRNA
Для экспериментов по спасению от дециляции клетки NIh4T3 дикого типа или мутантные клетки NIh4T3 котрансфицировали с использованием LTX (Invitrogen) плазмидой, экспрессирующей GFP, и одной из следующих плазмид, экспрессирующих а) пустой вектор, ) PKD1 человека, c) PKD1 S99I d) PKD2 человека, e) PKD2 D511V , или f) PKD2 Y684del .Затем клетки подвергались синхронизации за счет сывороточного голодания и индуцировались децилизацией и повторным входом в клеточный цикл с помощью сыворотки. GFP-положительные клетки оценивали на наличие первичных ресничек. На р53 была направлена плазмида, экспрессирующая единственную направляющую РНК, нацеленную на мышиный р53 (Addgene) в клетках дикого типа или мутантных клетках NIh4T3. Эксперименты по нокдауну Usp28 и 53bp1 проводили с использованием SMARTpool: ON-TARGETplus Usp28 siRNA (Dharmacon, каталожный номер L-065548-01-0005) и SMARTpool: ON-TARGETplus 53bp1 907 .нет. L-042290-01-0005) соответственно. Клетки котрансфицировали, используя LTX, GFP и любой из конструкций siRNA и анализировали на наличие первичных ресничек после индуцированной сывороткой децилиации. Плазмиды экспрессии, несущие кДНК USP28, 53BP1 или p53, котрансфицировали с GFP в клетки NIh4T3 дикого типа с использованием LTX, и GFP-положительные клетки оценивали на наличие первичных ресничек после индукции сывороткой.
Обработка мышей и ткани почек
Все процедуры выполнялись в соответствии с требованиями Институционального комитета по уходу за животными и их использованию.В этом исследовании использовались три типа мышей C57Bl / 6-фона: a) Pkd1 f / f , в качестве однопометников дикого типа, b) UbcCre ERT2 ; Pkd1 f / f , и c) KspCre ERT2 ; Pkd1 f / f . Для делеции Pkd1 кормящим самкам внутрибрюшинно вводили 4-гидрокситамоксифен (4-OHT; Sigma-Aldrich), разведенный в кукурузном масле, в дозе 100 мкг на грамм веса тела мыши, со 2-6 дней постнатального развития (P2– P6).За 1 день до эвтаназии детенышам внутрибрюшинно вводили EdU в PBS (20 мкг EdU на грамм веса тела мыши) и умерщвляли через 24 часа. Перед умерщвлением измеряли общую массу тела мышей. У каждой мыши извлекали почки и взвешивали. Одну из почек быстро замораживали в жидком азоте и хранили при -80 ° C. Замороженные почки позже лизировали и фракционировали на ядерную и цитозольную фракции с использованием набора для экстракции цитоплазматических и ядерных белков (каталожный номер.P504L; 101Bio). Другая почка была разделена пополам, хранилась в 4% PFA в PBS в течение ночи, затем в 10% сахарозе в PBS в течение ночи, помещалась на криомонтаж с замороженным соединением срезов (Leica) в течение 30 минут, а затем быстро замораживалась на сухом льду и хранилась при −80 ° С. Замороженные срезы почек толщиной 10 мкм были приготовлены в Центре медицинских наук Университета Оклахомы (OUHSC) Stephenson Cancer Center Histology Core и были использованы для непрямого иммунофлуоресцентного окрашивания.
Непрямая иммунофлуоресценция на образцах ткани почек
Все эксперименты проводили с использованием системы окрашивания Thermo Scientific Sequenza (кат.нет. 73310017) на основе протокола, любезно предоставленного доктором Пазуром (Массачусетс, Массачусетс). Вкратце, замороженные срезы почек сначала инкубировали в бане с трис-буфером и физиологическим раствором с твином (TBST) в течение 5 минут для удаления замороженного соединения срезов, а затем помещали на покрывающие планшеты (каталожный номер 7211017; Thermo Fisher Scientific) и инкубировали с блокированием. буфер (4% неиммунная козья сыворотка / 0,1% желатин из кожи холодноводной рыбы / 0,1% Triton X-100 в TBST) в течение 30 мин. Затем EdU-положительные клетки визуализировали в соответствии с инструкциями производителя.Если желательно окрашивание почечного сегмента, эндогенный биотин блокировали с помощью набора для блокировки стрептавидина / биотина (Vector). После трехкратной промывки TBST эндогенный мышиный IgG блокировали Fab антителом-хозяином, полученным из вторичных антител-хозяина, в течение 2 часов (разведение 1:10 в 0,1% желатине рыбьей кожи в TBST; Jackson Immunoresearch). Затем срезы инкубировали с первичным антителом против ацетилированного α-тубулина (611b, 1: 5 000; Sigma-Aldrich), γ-h3AX (1: 200; Cell Signaling) или GEMININ (1: 100; Proteintech) в течение ночи при 4 час. ° C (разбавленный 0.1% желатина рыбьей кожи в TBST). Для визуализации сегментов почек образцы инкубировали с биотинилированным агглютинином Dolichos Biflorus (вектор) для маркировки собирающих протоков или с биотинилированным лектином Lotus Tetragonolobus (вектор) для маркировки проксимальных канальцев. После 5-кратной отмывки в TBST срезы инкубировали с вторичными антителами, конъюгированными с Alexa Fluor (1: 1000), в течение 1 ч в RT, защищенной от света, промывали 5-кратно TBST, инкубировали в бане TBST в течение 15 минут, а затем в Ванна TBS на 15 мин. Наконец, срезы были закреплены с помощью Diamond DAPI и визуализированы с помощью конфокальной микроскопии.
Иммуноблоттинг
Клеточные лизаты получали в растворе для лизиса, содержащем 1% Тритон X-100, 150 мМ NaCl, 10 мМ Трис-HCl при pH 7,5, 1 мМ EGTA, 1 мМ EDTA, 10% сахарозу, коктейль ингибиторов протеаз. (Roche Applied Science) и ингибиторы фосфатазы 0,2 мМ Na 3 VO 4 и 1 мМ NaF при 4 ° C в течение 30 мин. Лизаты клеток или тканей разделяли с помощью SDS-PAGE. Антитела использовали против p-Smad2 465/467 (1: 1000; Cell Signaling), GAPDH (1: 4000; Genetex), p53 (1: 1,000; Cell Signaling или 1: 500; Millipore), Disheveled-2 (1: 1000; Cell Signaling), INPP5E (1: 1000; Proteintech), NDE1 (1: 1000; Proteintech), USP28 (1: 1000; Proteintech), 53BP1 (1: 1000; Novus Biologicals), β-тубулин (1: 1000. ; Санта-Крус), β-актин (1: 1000; Санта-Крус) PKD1 (E8, 1: 1000; PKD Baltimore Center) и PKD2 (G-20, 1: 1000; Санта-Крус).Денситометрический количественный анализ проводили с помощью программного обеспечения Licor Image Studio.
Скрининг сигнальных путей
Активность 45 различных клеточных сигнальных путей измеряли в соответствии с инструкциями производителя (каталожный номер CCA-901L-12; Qiagen). Вкратце, нулевые клетки MIMCD3 дикого типа и Pkd1, — или Pkd2, , NIh4T3, или клетки mIMCD3 дикого типа и Pkd2, , нулевые клетки высевали для обратной трансфекции в 96-луночный планшет, содержащий иммобилизованные репортерные плазмиды.Каждая пара лунок содержала плазмиды, экспрессирующие люциферазу светлячка в зависимости от активности конкретного клеточного пути. Каждая лунка также содержала плазмиду, которая конститутивно экспрессировала люциферазу Renilla, чтобы учесть различия в эффективности трансфекции. Обратная трансфекция опосредована аттрактеном (№ по каталогу 301005; Qiagen). Полную среду роста заменяли через 24 часа после трансфекции, и клетки лизировали в буфере для лизиса (каталожный номер E194A; Promega) через 48 часов после трансфекции. Лизаты клеток инкубировали с субстратами Stop & Glo (Dual-Luciferase Reporter Assay System, Cat.нет. E1960; Promega), а активность люциферазы измеряли в Synergy Neo2 Reader (Biotek). Все значения люциферазы светлячков были нормализованы к значениям люциферазы Renilla, а затем значения всех мутантных образцов были нормализованы к дикому типу.
Количественная ОТ-ПЦР (qRT-PCR)
РНКэкстрагировали и очищали из клеток NIh4T3 дикого типа или -нулевых Pkd1 -нулевых клеток в различные моменты времени после рестимуляции сыворотки с использованием реагента TRIzol (Thermo Fisher Scientific). РНК подвергали обратной транскрипции в кДНК, и образцы амплифицировали с помощью кПЦР.Уровни мРНК представляющих интерес генов были нормализованы к дикому типу через 0 ч с помощью метода ΔΔCt. Праймеры, использованные для кПЦР, были Usp28, Fw: 5′-AGTTGGGCTGAAAAATGTTGGC-3 ‘, Usp28 Rv: 5′-TCAAGGATGTTCTGTGGCAGG-3′, T-3bp1 FwGCC1 FwGCC1 FwGCC1 FwGCC1 FwGCC1 FwGCC1 ′ -TGATGGTTCTTCCAGAC TTGGT-3 ′, Tbp, Fw: 5′-TCTACCGTGAATCTTGGCTGT-3 ′ и Tbp, Rv: 5′-GTCCGTGGCTCTCTTATTCTCA-3 ′.
Статистика
Программное обеспечение GraphPad Prism 8.3 использовался для всех статистических анализов, описанных в тексте. Количественные результаты, которые требовали сравнения между группами, подвергали статистическому анализу с использованием теста t для двух групп или одно- или двустороннего дисперсионного анализа с последующим соответствующим специальным тестом.
Благодарности
Мы благодарим докторов наук. S Kleene за предоставление клеток IMCD3 без PKD2, G Pazour и M. Hinsdale за предоставление протоколов иммунофлуоресцентного мечения тканей и W Berry за советы по экспериментам с CRISPR / Cas9.Мы благодарим Центр гистологии и иммуногистохимии Центра медицинских наук Университета Оклахомы (OUHSC) Онкологического центра Стивенсона за гистологию и срезы тканей при поддержке P30CA225520 и P20GM103639. Эта работа была поддержана DK59599 и DK117654 (Национальные институты здравоохранения), пресвитерианским фондом здоровья и кафедрой поликистозной болезни почек Джона С. Гэммилла (Центр медицинских наук Университета Оклахомы) Л. Циокасу. В. Геракопулос был поддержан докторской стипендией Американского общества нефрологов.
Вклад авторов
V Gerakopoulos: концептуализация, обработка данных, формальный анализ, привлечение финансирования, исследование и написание — первоначальный черновик, рецензирование и редактирование.
P Ngo: методология.
L Tsiokas: концептуализация, обработка данных, надзор, получение финансирования, расследование, администрирование проекта и написание — первоначальный черновик, рецензирование и редактирование.
Заявление о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
- Получено 21 апреля 2020 г.
- Исправление получено 1 июля 2020 г.
- Принято 3 июля 2020 г.
- © 2020 Gerakopoulos et al.
Дихлоризоцианурат натрия задерживает созревание и старение плодов банана во время хранения | BMC Chemistry
Mohapatra D, Mishra S, Singh CB, Jayas DS (2010) Послеуборочная обработка бананов: возможности и проблемы. Food Bioprocess Technol 4: 327–339
Статья Google Scholar
Huang H, Jiang Y (2012) Влияние регуляторов роста растений на банановые фрукты и брокколи во время хранения. Sci Hortic 145: 62–67
CAS Статья Google Scholar
Ян Х, Чжан З., Джойс Д., Хуанг Х, Сюй Л., Панг Х (2009) Характеристика разложения хлорофилла в банане и подорожнике во время созревания при высокой температуре. Food Chem 114: 383–390
CAS Статья Google Scholar
Лохани С., Триведи П.К., Нат П. (2004) Изменения активности гидролаз клеточной стенки во время индуцированного этиленом созревания банана: эффект 1-MCP, ABA и IAA. Послеуборочная Биол Технол 31: 119–126
CAS Статья Google Scholar
Лин З, Чжун С., Грирсон Д. (2009) Последние достижения в исследованиях этилена. J Exp Bot 60: 3311–3336
CAS Статья PubMed Google Scholar
Александр Л., Грирсон Д. (2002) Биосинтез и действие этилена в томатах: модель созревания плодов в климактерическом периоде. J Exp Bot 53: 2039–2055
CAS Статья PubMed Google Scholar
Cheng G, Yang E, Lu W, Jia Y, Jiang Y, Duan X (2009) Влияние оксида азота на синтез этилена и размягчение ломтика бананового плода во время созревания. J Agric Food Chem 57: 5799–5804
CAS Статья PubMed Google Scholar
Xu F, Feng X, Wang Y (2014) Влияние 1-пентилциклопропена на физиологические реакции и экспрессию генов рецепторов этилена в бананах после сбора урожая. Food Biotechnol 28: 162–182
CAS Статья Google Scholar
Binder BM, Walker JM, Gagne JM, Emborg TJ, Hemmann G, Bleecker AB, Vierstra RD (2007) Связывающие EIN3 арабидопсиса белки F-Box EBF1 и EBF2 играют разные, но частично совпадающие роли в передаче сигналов этилена.Растительная клетка 19: 509–523
CAS Статья PubMed PubMed Central Google Scholar
Wang MM, Zhu QG, Deng CL, Luo ZR, Sun NJ, Grierson D, Yin XR, Chen KS (2017) Чувствительные к гипоксии ERF, участвующие в постдестринговом смягчении плодов хурмы. Plant Biotechnol J 15: 1409–1419
CAS Статья PubMed PubMed Central Google Scholar
Cheng G, Duan X, Shi J, Lu W, Luo Y, Jiang W, Jiang Y (2008) Влияние активных форм кислорода на разрушение клеточной стенки плодов банана во время созревания. Food Chem 109: 319–324
CAS Статья PubMed Google Scholar
Ren Y, He J, Liu H, Liu G, Ren X (2017) Оксид азота смягчает порчу и сохраняет антиоксидантные свойства плодов манго «Тайнун» во время созревания. Hortic Environ Biotechnol 58: 27–37
CAS Статья Google Scholar
Хуанг Х, Цзин Г, Го Л., Чжан Д., Ян Б., Дуань Х, Ашраф М., Цзян Ю. (2013) Влияние щавелевой кислоты на признаки созревания плодов банана во время хранения. Послеуборочная Биол Технол 84: 22–27
CAS Статья Google Scholar
Corpas FJ, Freschi L, Rodríguezruiz M, Mioto PT, Gonzálezgordo S, Palma JM (2018) Нитроокислительный метаболизм во время созревания плодов. J Exp Bot 69: 3449–3463
Статья PubMed Google Scholar
Финкель Т., Холбрук Н.Дж. (2000) Окислители, окислительный стресс и биология старения. Nature 408: 239–247
CAS Статья PubMed Google Scholar
MacRae E, Quick WP, Benker C, Stitt M (1992) Углеводный обмен во время послеуборочного созревания киви. Planta 188: 314–323
CAS Статья PubMed Google Scholar
Nieman DC, Gillitt ND, Wei S, Meaney MP, John C, Pappan KL, Kinchen JM (2015) Основанный на метаболомике анализ приема банана и груши на выполнение упражнений и восстановление.J Proteome Res 14: 5367–5377
CAS Статья PubMed Google Scholar
Mack C, Wefers D, Schuster P, Weinert CH, Egert B, Bliedung S, Trierweiler B, Muhle-Goll C, Bunzel M, Luy B (2017) Ненаправленный мультиплатформенный анализ метаболома и некрахмальные полисахариды киви при послеуборочном созревании. Послеуборочная Биол Технол 125: 65–76
CAS Статья Google Scholar
Proto A, Zarrella I, Cucciniello R, Pironti C, De Caro F, Motta O (2016) Бактерицидная и фунгицидная активность в газовой фазе дихлоризоцианурата натрия (NaDCC). Curr Microbiol 73: 287–291
CAS Статья PubMed Google Scholar
Лешевалье М.В., Эванс TM, Зайдлер Р.Дж. (1981) Влияние мутности на эффективность хлорирования и устойчивость бактерий в питьевой воде. Appl Environ Microbiol 42: 159–167
CAS PubMed PubMed Central Google Scholar
El Zawawy LA, Elsaid D, Ali SM, Fathy FM (2010) Эффективность дезинфекции дихлоризоцианурата натрия (NADCC) против обычных кишечных простейших пищевого происхождения. J Egypt Soc Parasitol 40: 165–185
PubMed Google Scholar
Beerli KMC, Piccoli RH (2004) Влияние дезинфицирующих средств на микробные, физические и физико-химические характеристики свежесрезанного лука ( Allium cepa л). Cienc E Agrotecnol 28: 107–112
Статья Google Scholar
Jeong RD, Chu EH, Shin EJ, Lee ES, Kwak YS, Park HJ (2015) Противогрибковый эффект гамма-облучения и дихлоризоцианурата натрия против Penicillium expansum на грушах. Lett Appl Microbiol 61: 437–445
CAS Статья PubMed Google Scholar
Koo TH, Hong SJ, Yun SC (2016) Комбинированная обработка гамма-облучением и дихлоризоциануратом натрия для борьбы с фитофторозом и для сохранения срезанных лилий.Res Plant Dis 22: 94–99
CAS Статья Google Scholar
Юн М., Чжон К., Ли К.Й., Чон Дж.Й., Ли Дж. В., Парк Х. Дж. (2014) Синергетический эффект комбинированного лечения гамма-облучением и дихлоризоциануратом натрия для борьбы с серой гнилью ( Botrytis cinerea ) на паприке. . Radiat Phys Chem 98: 103–108
CAS Статья Google Scholar
Lima MS, Pires EMF, Maciel MIS, Oliveira VA (2010) Качество минимально обработанной гуавы с различными типами нарезки, санитарной обработки и упаковки. Cienc E Tecnol De Aliment 30: 79–87
Статья Google Scholar
Chen CR, Ramaswamy HS (2002) Кинетика изменения цвета и текстуры созревающих бананов. LWT Food Sci Technol 35: 415–419
CAS Статья Google Scholar
Golding JB, Shearer D, Mcglasson WB, Wyllie SG (1999) Взаимосвязь между дыханием, этиленом и производством аромата в созревающем банане. J Agric Food Chem 47: 1646–1651
CAS Статья PubMed Google Scholar
Hong JH, Gross KC (1998) Поверхностная стерилизация целых плодов томатов гипохлоритом натрия влияет на последующее поведение свежесрезанных ломтиков после уборки урожая. Послеуборочный Biol Technol 13: 51–58
Статья Google Scholar
Ян С.Ф., Хоффман Н.Е. (1984) Биосинтез этилена и его регуляция у высших растений. Annu Rev Plant Physiol 35: 155–189
CAS Статья Google Scholar
Ouyang Z, Liu S, Huang L, Hong Y, Li X, Huang L, Zhang Y, Zhang H, Li D, Song F (2016) Помидор SlERF.A1, SlERF.B4, SlERF.C3 и SlERF.A3, члены группы B3 семейства ERF, необходимы для устойчивости к Botrytis cinerea . Фронтальный завод Sci 7: 1964–1981
PubMed PubMed Central Google Scholar
Jiang CM, Wu MC, Wu CL, Chang HM (2003) Активность пектинэстеразы и полигалактуроназы и текстурные свойства каучукообразной папайи ( Carica papaya Linn.). J Food Sci 68: 1590–1594
CAS Статья Google Scholar
Miedes E, Suslov D, Vandenbussche F, Kenobi K, Ivakov A, Van Der Straeten D, Lorences EP, Mellerowicz EJ, Verbelen JP, Vissenberg K (2013) Ксилоглюкановая эндотрансглюкозилаза / гиперэкспрессия (XTH) влияет на рост и механика клеточной стенки в этиолированных гипокотилях Arabidopsis.J Exp Bot 64: 2481–2497
CAS Статья PubMed Google Scholar
Mbéguiéambéguié D, Hubert O, Baurens FC, Matsumoto T, Chillet M, Filslycaon B, Sidibébocs S (2009) Паттерны экспрессии генов, изменяющих клеточную стенку банана, во время созревания плодов и во взаимосвязи с падением пальца. J Exp Bot 60: 2021–2034
Статья Google Scholar
Zheng Q, Song J, Campbell-Palmer L, Thompson K, Li L, Walker B, Cui Y, Li X (2013) Протеомное исследование плодов яблони во время созревания и в ответ на обработку этиленом. J Proteom 93: 276–294
CAS Статья Google Scholar
Дуань Х, Лю Т., Чжан Д., Су Х, Линь Х, Цзян И (2011) Влияние атмосферы чистого кислорода на антиоксидантные ферменты и антиоксидантную активность собранных плодов личи во время хранения. Food Res Int 44: 1905–1911
CAS Статья Google Scholar
Li T, Zhang J, Zhu H, Qu H, You S, Duan X, Jiang Y (2016) Протеомный анализ дифференциально экспрессируемых белков, участвующих в старении кожуры собранных плодов мандарина. Front Plant Sci 7: 725–742
PubMed PubMed Central Google Scholar
Zhu F, Yun Z, Ma Q, Gong Q, Zeng Y, Xu J, Cheng Y, Deng X (2015) Влияние обработки экзогенным 24-эпибрассинолидом на качество и устойчивость мандарина Сацума ( Citrus уншиу ).Послеуборочная Биол Технол 100: 8–15
CAS Статья Google Scholar
Hatoum D, Annaratone C, Hertog MLATM, Geeraerd AH, Nicolai BM (2014) Целевое исследование метаболомики яблок Braeburn при длительном хранении. Послеуборочная Биол Технол 96: 33–41
CAS Статья Google Scholar
Yuan Y, Zhao Y, Yang J, Jiang Y, Lu F, Jia Y, Yang B (2017) Метаболический анализ банана во время постуборочного старения с помощью ЯМР 1H-высокого разрешения.Food Chem 218: 406–412
CAS Статья PubMed Google Scholar
Keutgen AJ, Pawelzik E (2008) Вклад аминокислот в качество плодов клубники и их значимость в качестве индикаторов стресса при солености NaCl. Food Chem 111: 642–647
CAS Статья Google Scholar
Pratta G, Zorzoli R, Boggio SB, Picardi LA, Valle EM (2004) Уровни глутамина и глутамата и связанные с ними метаболические ферменты в плодах томатов с разным сроком хранения.Sci Hortic 100: 341–347
CAS Статья Google Scholar
Cordenunsi BR, Lajolo FM (1995) Распад крахмала во время созревания бананов: сахарозосинтаза и сахарозофосфатсинтаза. J Agric Food Chem 43: 347–351
CAS Статья Google Scholar
Pesis E (2005) Роль анаэробных метаболитов, ацетальдегида и этанола, в созревании плодов, улучшении качества и порче плодов.Послеуборочная Биол Технол 37: 1–19
CAS Статья Google Scholar
Сайни Р.К., Замани А.Дж., Кеум Ю.С. (2017) Созревание улучшает содержание каротиноидов, альфа-токоферола и полиненасыщенных жирных кислот в плодах томатов ( Solanum lycopersicum L.). 3 Biotech 7:43
Статья PubMed PubMed Central Google Scholar
Deshpande AB, Chidley HG, Oak PS, Pujari KH, Giri AP, Gupta VS (2016) Данные об изменениях в составе жирных кислот во время развития плодов и созревания трех сортов манго (Alphonso, Pairi и Kent) различное содержание лактона.Краткий обзор данных 9: 480–491
Статья PubMed PubMed Central Google Scholar
Pedreschi R, Hollak S, Harkema H, Otma E, Robledo P, Westra E, Somhorst D, Ferreyra R, Defilippi BG (2016) Влияние стратегий послеуборочного созревания на профили жирных кислот авокадо Hass. S Afr J Bot 103: 32–35
CAS Статья Google Scholar
Lim GH, Singhal R, Kachroo A, Kachroo P (2017) Передача сигналов, опосредованная жирными кислотами и липидами, в защите растений.Анну Рев Фитопатол 55: 505–536
CAS Статья PubMed Google Scholar
Griebel T, Zeier J (2010) Роль преобразования бета-ситостерина в стигмастерол во взаимодействиях между растениями и патогенами. Завод J 63: 254–268
CAS Статья PubMed Google Scholar
Loewus FA, Murthy PPN (2000) Метаболизм мио-инозитола в растениях. Plant Sci 105: 1–19
Статья Google Scholar
Huang H, Jian Q, Jiang Y, Duan X, Qu H (2016) Повышенная устойчивость к охлаждению плодов банана, обработанных яблочной кислотой перед хранением при низкой температуре. Послеуборочная Биол Технол 111: 209–213
CAS Статья Google Scholar
Jing G, Li T, Qu H, Yun Z, Jia Y, Zheng X, Jiang Y (2015) Каротиноиды и летучие профили плодов папайи с желтой и красной мякотью в зависимости от экспрессии каротиноидного расщепления гены диоксигеназы.Послеуборочная Биол Технол 109: 114–119
CAS Статья Google Scholar
Li T, Jian Q, Feng C, Yong W, Liang G, Duan X, Bao Y, Jiang Y (2016) Влияние бутилированного гидроксианизола на рост, морфологию гиф и биосинтез фумонизинов в Fusarium proliferatum .

 Ко второму предложению могут быть добавлены союзы вследствие чего или так что.
Ко второму предложению могут быть добавлены союзы вследствие чего или так что.