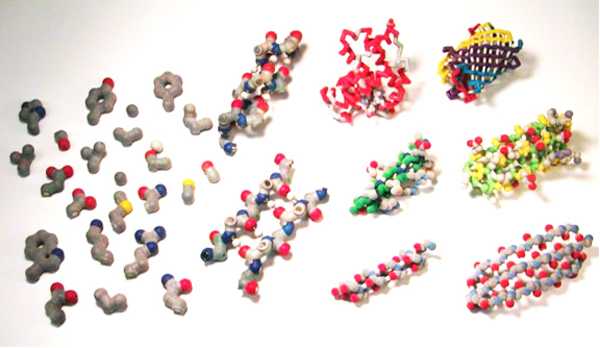Свойства и функции белков
Белки — органические вещества с большой молекулярной массой, основными компонентами которых являются альфа аминокислоты, связанные между собой цепочкой пептидных связей. Выявлено множество свойств и функций белков, в зависимости от среды обитания и самих живых организмов, в которых они обитают. Физико-химические свойства белков также различны, что объясняется разным составом аминокислот.
Особенности белков и их химические свойства
Особенно интересны химические свойства белков, так как некоторые из них совершенно противоположны друг-другу. Одни белки легко растворяются в воде, другие же, напротив, не растворяются вообще. Существуют белки, на которые не действуют разнообразные химические агенты, соответственно есть и такие, которым достаточно самого малого воздействия, вроде, лёгкого прикосновения или небольшого освещения, чтобы измениться. Некоторые разновидности в облике нитей, длинною в сотню нанометров, а встречаются напоминающие шар, имеющий в диаметре около шести нанометров. Однако, вне зависимости от своих размеров и форм свойства белка и его функции остаются неизменными. Белок кератина, например, имеет твёрдость стали и способствует образованию защитных механизмов у животных, таких, как копыта, когти, рога, панцирь, волосяной покров и перья. В мышечный состав включены состоящие из нитевидных молекул белки, обеспечивающие двигательную активность клеток благодаря своей эластичности и способности удлиняться или сужаться. Для перемещения веществ по организму необходимы представители с небольшими, круглыми молекулами. Быстрорастворимые, с легко изменяющейся структурой, белки принимают и передают в клетку сигналы, которые получают из окружающей среды.
Как происходит денатурации белка
Для того чтобы свойства и функции белка изменились, необходима денатурация. Что же это такое? Денатурация – это изменение изначальной структуры белка. Изменить ее можно, воздействуя на белок физическими или химическими факторами, вроде больших температур, механических воздействий или при помощи некоторых химических веществ. Наглядным примером денатурации является сваренное яйцо: из жидкого оно превращается в плотное. Белок перестаёт быть растворимыми и облегчает пищеварительными ферментам своё воздействие на него.
Однако, этот процесс обратим в том случае, если конструкция белка устанавливается особым порядком последовательности аминокарбоновых кислот в полипептидной цепи и его составом. В этом случае уже развёрнутая полипептидная цепь способна в произвольном порядке закрутиться спиралью и уложиться в единую. Эта способность основывается на системе раздражимости, свойственной всему живому.
Белки: функции и свойства
Первостепенная задача белков – строительная. Именно из них составлены мембраны клеток и ее органоидов, стенки системы кровоснабжения организма, сухожилий, хрящей и т.д.
Второй, но не менее важной задачей, является каталитическая. Ферменты являются катализаторами клетки, их активность очень высока. Благодаря им, химические реакции внутри организма ускоряются в разы. Белки являются ферментами по своему химическому составу. Именно они катализируют самые мизерные молекулы, используя для ускорения лишь активный центр белка. Такая реакция возможна лишь при близком нахождении молекул и геометрически верных пропорций конформаций вещества и активного центра белка. При процессе денатурации ускорение активности фермента пропадает по причине того, что конструкция активного центра расстраивается. Для любой химической реакции предусмотрен организмом определённый фермент — катализатор.
Следующие функции белка — сигнальная и защитная. Сигнальная функция отвечает за то, чтобы молекулы белков, входящие во внешнюю мембрану клетки и имеющие способность менять свою структуру под воздействием внешних раздражителей, принимали сигналы из окружающей среды и передавали в клетку команды. Защитная — за обезвреживание инородных клеток и веществ, вводимых в организм.
Помимо этого, белки обладают двигательной и транспортной функциями. За двигательные функции отвечают сократительные ферменты, демонстрирующие жизненную активность организма. Любое движение, от мерцания ресничек или движения жгутиков у простейших, вплоть до сокращения мышц у животных или человека, осуществляется при помощи актина и миозина. Транспортная функция отвечает за присоединение разнообразных веществ и перемещение их из разных клеточных мест в другие. К примеру, гемоглобин – белок, содержащийся в крови, отвечает за присоединение кислорода и доставку его ко всем тканям и органам организма.
И последняя функция – энергетическая. В клетке происходит распад белков на аминокислоты, одна часть которых обеспечивает синтез белков, а другая тщательно расщепляется для высвобождения энергии.
Читайте также:
Лучшее на сайте
Дата публикации:  29.11.2015 © Алина
muscleoriginal.com
БЕЛКИ: СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ
БЕЛКИ: СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ
1. Белки и их основные признаки
2. Биологические функции белков
3. Аминокислотный состав белков
4. Классификация белков
5. Физические свойства белков
6. Структурная организация белковых молекул (первичная, вторичная, третичная структуры)
Белки и их основные признаки
Белки или протеины (что в переводе с греческого означает «первые» или «важнейшие»), количественно преобладают над всеми макромолекулами, присутствующими в живой клетке, и составляют более половины сухого веса большинства организмов. Представления о белках как о классе соединений сформировались в XVII-XIX вв. В этот период из разнообразных объектов живого мира (семена и соки растений, мышцы, кровь, молоко) были выделены вещества, обладающие сходными свойствами: они образовывали вязкие растворы, свертывались при нагревании, при горении ощущался запах паленой шерсти и выделялся аммиак. Поскольку все эти свойства ранее были известны для яичного белка, то новый класс соединений назвали белками. После появления в начале XIX вв. Более совершенных методов анализа веществ определили элементный состав белков. В них обнаружили С, Н, О, N, S. К концу XIX вв. Из белков было выделено свыше 10 аминокислот. Исходя из результатов изучения продуктов гидролиза белков, немецкий химик Э.Фишер (1852-1919) предположил, что белки построены из аминокислот.
В результате работ Фишера стало ясно, что белки представляют собой линейные полимеры a-аминокислот, соединенных друг с другом амидной (пептидной) связью, а все многообразие представителей этого класса соединений могло быть объяснено различиями аминокислотного состава и порядка чередования разных аминокислот в цепи полимера.
Первые исследования белков проводились со сложными белковыми смесями, например: с сывороткой крови, яичным белком, экстрактами растительных и животных тканей. Позже были разработаны методы выделения и очистки белков, такие как осаждение, диализ, хроматография на целлюлозных и других гидрофильных ионообменниках, гель-фильтрация, электрофорез. Более подробно рассмотрим эти методы на лабораторной работе и семинарском занятии.
На современном этапе основными направлениями изучения белков являются следующие:
¨ изучение пространственной структуры индивидуальных белков;
¨ изучение биологических функций разных белков;
¨ изучение механизмов функционирования индивидуальных белков (на уровне отдельных атомов, атомных групп молекулы белка).
Все эти этапы взаимосвязаны, ведь одна из основных задач биохимии как раз и состоит в том, чтобы понять, каким образом аминокислотные последовательности разных белков дают им возможность выполнять различные функции.
Биологические функции белков
Ферменты — это биологические катализаторы, самый многообразный, многочисленный класс белков. Почти все химические реакции, в которых участвуют присутствующие в клетке органические биомолекулы, катализируются ферментами. Настоящему времени открыто более 2000 различных ферментов.
Транспортные белки — Транспортные белки плазмы крови связывают и переносят специфические молекулы или ионы из одного органа в другой. Например, гемоглобин, содержащийся в эритроцитах, при прохождении через легкие связывает кислород и доставляет его к периферическим тканям, где кислород освобождается. Плазма крови содержит липопротеины, осуществляющие перенос липидов из печени в другие органы. В клеточных мембранах присутствует еще один клеточный тип транспортных белков, способных связывать определенные молекулы (напр., глюкозу) и переносить их через мембрану внутрь клетки.
Пищевые и запасные белки. Наиболее известными примерами таких белков служат белки семян пшеницы, кукурузы, риса. К пищевым белкам относится яичныйальбумин — основной компонент яичного белка, казеин — главный белок молока.
Сократительные и двигательные белки. Актин и миозин — белки, функционирующие в сократительной системе скелетной мышцы, а также во многих немышечных тканях.
Структурные белки. Коллаген — главный компонент хрящей и сухожилий. Этот белок имеет очень высокую прочность на разрыв. Связки содержат эластин — структурный белок, способный растягиваться в двух измерениях. Волосы, ногти состоят почти исключительно из прочного нерастворимого белка — кератина. Главным компонентом шелковых нитей и паутины служит белок фиброин.
Защитные белки. Иммуноглобулины или антитела — это специализированные клетки, вырабатываемые в лимфоцитах. Они обладают способностью распознавать проникшие в организм бактерии вирусы или чужеродные молекулы, а затем запускать систему их нейтрализации. Фибриноген и тромбин — белки, участвующие в процессе свертывания крови, они предохраняют организм от потери крови при повреждении сосудистой системы.
Регуляторные белки. Некоторые белки участвуют в регуляции клеточной активности. К ним относятся многие
Классификация белков
По растворимости
Альбумины. Растворимы в воде и солевых растворах.
Глобулины. Слаборастворимы в воде, но хорошо растворимы в солевых растворах.
Проламины. Растворимы в 70-80% этаноле, нерастворимы в воде и абсолютном спирте. Богаты аргинином.
Гистоны. Растворимы в солевых растворах.
Склеропротеины. Нерастворимы в воде и солевых растворах. Повышено содержание глицина, аланина, пролина.
По форме молекул
Если исходить из отношения осей (продольной и поперечной), можно выделить два больших класса белков. У глобулярных белков отношение составляет меньше 10 и в большинстве случаев не превышает 3-4. Они характеризуются компактной упаковкой полипептидных цепей. Примеры глобулярных белков: многие ферменты, инсулин, глобулин, белки плазмы крови, гемоглобин.
Фибриллярные белки, у которых отношение осей превышает 10, состоят из пучков полипептидных цепей, спирально навитых друг на друга и связанных между собой поперечными ковалентными или водородными связями (кератин, миозин, коллаген, фибрин).
Физические свойства белков
На физических свойствах белков, таких как ионизация, гидратация, растворимость основаны различные методы выделения и очистки белков.
Так как белки содержат ионогенные, т.е. способные к ионизации аминокислотные остатки (аргинин, лизин, глутаминовая кислота и т.д.), следовательно, они представляют собой полиэлектролиты. При подкислении степень ионизации анионных групп снижается, а катионных — повышается, при подщелачивании наблюдается обратная закономерность. При определенном рН число отрицательно и положительно заряженных частиц становится одинаковым, такое состояние называется изоэлектрическим (суммарный заряд молекулы равен нулю). Значение рН, при котором белок находится в изоэлектрическом состоянии, называют изоэлектрической точкой и обозначают рI. На различной ионизации белков при определенном значении рН основан один из методов их разделения — метод электрофореза.
Полярные группы белков (ионогенные и неионогенные) способны взаимодействовать с водой, гидратироваться. Количество воды, связанное с белком достигает 30-50 г на 100 г белка. Гидрофильных групп больше на поверхности белка. Растворимость зависит от количества гидрофильных групп в белке, от размеров и формы молекул, от величины суммарного заряда. Совокупность всех этих физических свойств белка позволяет использовать метод молекулярных сит или гель-фильтрацию для разделения белков. Метод диализа используется для очистки белков от низкомолекулярных примесей и основан на больших размерах молекул белка.
Растворимость белков зависит и от наличия других растворенных веществ, например, нейтральных солей. При высоких концентрациях нейтральных солей белки выпадают в осадок, причем для осаждения (высаливания) разных белков требуется разная концентрация соли. Это связано с тем, что заряженные молекулы белка адсорбируют ионы противоположного заряда. В результате частицы теряют свои заряды и электростатическое отталкивание, в результате происходит осаждение белка. Методом высаливания можно фракционировать белки.
Первичная структура белков
 |
Первичной структурой белканазывают состав и последовательность аминокислотных остатков в белковой молекуле. Аминокислоты в белке связаны пептидными связями.
Все молекулы данного индивидуального белка идентичны по аминокислотному составу, последовательности аминокислотных остатков и длине полипептидной цепи. Установление последовательности аминокислотной последовательности белков — трудоемкая задача. Более подробно на эту тему мы поговорим на семинаре. Инсулин был первым белком, для которого установили аминокислотную последовательность. Бычий инсулин имеет молярную массу около 5700. Его молекула состоит из двух полипептидных цепей: А-цепи, содержащей 21 а.к., и В-цепи, содержащей 30 а.к., эти две цепи соединены двумя дисульфидными ( -S-S-) связями. Даже небольшие изменения первичной структуры могут значительно изменять свойства белка. Болезнь серповидноклеточная анемия является результатом изменения всего 1 аминокислоты в b-цепи гемоглобина (Glu ® Val).
Видовая специфичность первичной структуры
При изучении аминокислотных последовательностей гомологичных белков, выделенных из разных видов, было сделано несколько важных выводов. К гомологичным белкам относятся те белки, которые у разных видов выполняют одинаковые функции. Примером может служить гемоглобин: у всех позвоночных он осуществляет одну и ту же функцию, связанную с транспортом кислорода. Гомологичные белки разных видов обычно имеют полипептидные цепи одинаковой или почти одинаковой длины. В аминокислотных последовательностях гомологичных белков во многих положениях всегда находятся одни и те же аминокислоты — их называют инвариантными остатками. Вместе с тем в других положениях белков наблюдаются значительные различия: в этих положениях аминокислоты варьируются от вида к виду; такие аминокислотные остатки называютсявариабельными. Всю совокупность сходных черт в аминокислотных последовательностях гомологичных белков объединяют в понятиегомология последовательностей. Наличие такой гомологии предполагает, что животные, из которых были выделены гомологичные белки, имеют общее эволюционное происхождение. Интересным примером является сложный белок — цитохром с — митохондриальный белок, учавствующий в качестве переносчика электронов в процессах биологического окисления. М » 12500, содержит »100 а.к. Были установлены а.к. последовательности для 60 видов. 27 а.к. — одинаковы, это указывает на то, что все эти остатки играют важную роль в определении биологической активности цитохрома с. Второй важный вывод, сделанный на основе анализа аминокислотных последовательностей, состоит в том, что число остатков, по которым различаются цитохромы с любых двух видов, пропорционально филогенетическому различию между данными видами. Например, молекулы цитохрома с лошади и дрожжей различаются по 48 а.к., у утки и курицы — по 2 а.к., у курицы и индейки не различаются. Сведения с числе различий в аминокислотных последовательностях гомологичных белков из разных видов используют для построения эволюционных карт, отражающих последовательные этапы возникновения и развития различных видов животных и растений в процессе эволюции.
Вторичная структура белков
— это укладка белковой молекулы в пространстве без учета влияния боковых заместителей. Выделяют два типа вторичной структуры: a-спираль и b- структуру (складчатый слой). Остановимся более подробно на рассмотрении каждого типа вторичной структуры.
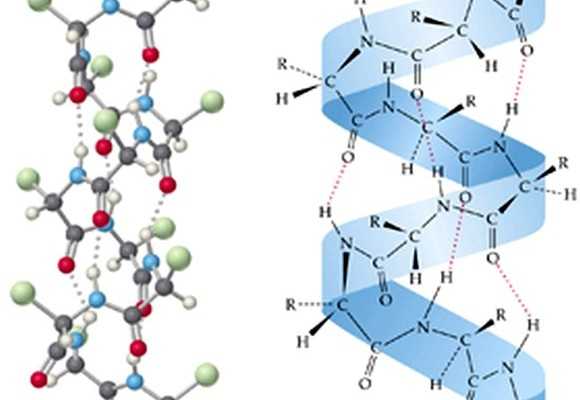
a-Спираль представляет из себя правую спираль с одинаковым шагом, равным 3,6 аминокислотных остатков. a-Спираль стабилизируется внутримолекулярными водородными связями, возникающими между атомами водорода одной пептидной связи и атомами кислорода четвертой по счету пептидной связи.
Боковые заместители расположены перпендикулярно плоскости a-спирали.
Т.о. свойства данного белка определяются свойствами боковых групп аминокислотных остатков: входящих в состав того или иного белка. Если боковые заместители гидрофобны, то и белок, имеющий структуру a-спираль гидрофобен. Примером такого белка является белок кератин, из которого состоят волосы.
В результате получается, что a- спираль пронизана водородными связями и является очень устойчивой структурой. При образовании такой спирали работают две тенденции:
¨ молекула стремится к минимуму энергии, т.е. к образованию наибольшего числа водородных связей;
¨ из-за жесткости пептидной связи сблизиться в пространстве могут лишь первая и четвертая пептидные связи.
В складчатом слое пептидные цепи располагаются параллельно друг другу, образуя фигуру, подобную листу, сложенному гармошкой. Пептидных цепей, взаимодействующих между собой водородными связями, может быть большое количество. Расположены цепи антипараллельно.
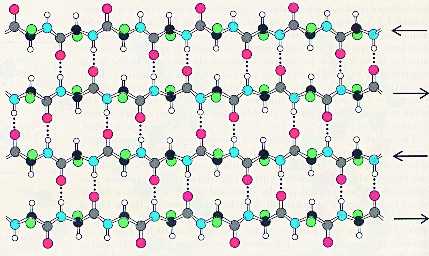 |
Чем больше пептидных цепей входит в состав складчатого слоя, тем прочнее молекула белка.
Сравним свойства белковых материалов шерсти и шелка и объясним различие в свойствах этих материалов с точки зрения строения белков, из которых они состоят.
Кератин — белок шерсти — имеет вторичную структуру a-спираль. Шерстяная нить не такая прочная, как шелковая, легко растягивается в мокром состоянии. Это свойство объясняется тем, что при приложении нагрузки водородные связи рвутся и спираль растягивается.
Фиброин — белок шелка — имеет вторичную b-структуру. Шелковая нить не вытягивается и является очень прочной на разрыв. Это свойство объясняется тем, что в складчатом слое взаимодействуют между собой водородными связями много пептидных цепей, что делает эту структуру очень прочной.
Аминокислоты различаются по способности участвовать в образовании a-спиралей и b-структур. Редко встречаются в a-спиралях глицин, аспаргин, тирозин. Пролин дестабилизирует a-спиральную структуру. Объясните, почему? В состав b-структур входит глицин, почти не встречаются пролин, глютаминовая кислота, аспаргин, гистидин, лизин, серин.
В структуре одного белка могут находиться участки b-структур, a-спиралей и нерегулярные участки. На нерегулярных участках пептидная цепь может сравнительно легко изгибаться, менять конформацию, в то время, как спираль и складчатый слой представляют собой достаточно жесткие структуры. Содержание b-структур и a-спиралей в разных белках неодинаково.
Третичная структура белков
определяется взаимодействием боковых заместителей пептидной цепи. Для фибриллярных белков трудно выделить общие закономерности в образовании третичных структур. Что касается глобулярных белков, то такие закономерности существуют, и мы их рассмотрим. Третичная структура глобулярных белков образуется путем дополнительного складывания пептидной цепи, содержащей b-структуры, a-спирали и нерегулярные участки, так , что гидрофильные боковые группы аминокислотных остатков оказываются на поверхности глобулы, а гидрофобные боковые группы спрятаны вглубь глобулы, иногда образуют гидрофобный карман.
Силы, стабилизирующие третичную структуру белка.
Электростатическое взаимодействие между разно заряженными группами, крайний случай — ионные взаимодействия.
Водородные связи, возникающие между боковыми группами полипептидной цепи.
Гидрофобные взаимодействия.
Ковалентные взаимодействия (образование дисульфидной связи между двумя остатками цистеина с образованием цистина). Образование дисульфидных связей приводит к тому, что удаленные области полипептидной молекулы сближаются и фиксируются. Дисульфидные связи разрушаются под действием восстановителей. Это свойство используется для химической завивки волос, которые почти полностью представляют собой белок кератин, пронизанный дисульфидными связями.
Характер пространственной укладки определяется аминокислотным составом и чередованием аминокислот в полипептидной цепи (первичной структурой). Следовательно, каждый белок имеет только одну пространственную структуру, соответствующую его первичной структуре. Небольшие изменения конформации белковых молекул происходят при взаимодействии с другими молекулами. Эти изменения порой играют огромную роль при функционировании белковых молекул. Так, при присоединении молекулы кислорода к гемоглобину несколько изменяется конформация белка, что приводит к эффекту кооперативного взаимодействия при присоединении остальных трех молекул кислорода. Такое изменение конформации в лежит в основе теории индуцирующего соответствия при объяснении групповой специфичности некоторых ферментов.
Кроме ковалентной дисульфидной все остальные связи, стабилизирующие третичную структуру, являются по своей природе слабыми и легко разрушаются. При разрыве большого числа связей, стабилизирующих пространственную структуру белковой молекулы, упорядоченная уникальная для каждого белка конформация нарушается, при этом часто теряется биологическая активность белка. Такое изменение в пространственном строении называется денатурацией.
Ингибиторы функций белков
Учитывая, что различные лиганды отличаются Ксв, всегда можно подобрать вещество, похожее по структуре на природный лиганд, но имеющий большее значение Ксв с данным белком. Например, СО имеет Ксв в 100 раз больше, чем О2 с гемоглобином, поэтому достаточно 0,1% СО в воздухе, чтобы заблокировать большое количество молекул гемоглобина. По такому же принципу действуют многие лекарства. Например, дитилин.
Ацетилхолин — медиатор передачи нервных импульсов на мышцу. Дитилин блокирует белок-рецептор, с которым связывается ацетилхолин и создает эффект парализации.
9.Связь структуры белков с их функциями на примере гемоглобина и миоглобина
Транспорт двуокиси углерода
Гемоглобин не только переносит кислород от легких к периферическим тканям, но и ускоряет транспорт СО2 от тканей к легким. Гемоглобин связывает СО2 сразу после освобождения кислорода (» 15 % всего СО2). В эритроцитах происходит ферментативный процесс образования угольной кислоты из СО2, поступающего из тканей: СО2 + Н2О = Н2СО3. Угольная кислота быстро диссоциирует на НСО3— и Н+. Для предотвращения опасного повышения кислотности должна существовать буферная система, способная поглощать избыток протонов. Гемоглобин связывает два протона на каждые четыре освободившиеся молекулы кислорода и определяет буферную емкость крови. В легких идет обратный процесс. Высвобождающиеся протоны связываются с бикарбонат- ионом с образованием угольной кислоты, которая под действием фермента превращается в СО2 и воду, СО2 выдыхается. Т.о., связывание О2 тесно сопряжено с выдыханием СО2. Это обратимое явление известно как эффект Бора. У миоглобина эффекта Бора не обнаруживается.
Изофункциональные белки
Белок, выполняющий определенную функцию в клетке, может быть представлен несколькими формами — изофункциональными белками, или изоферментами. такие белки хоть и выполняют одинаковую функцию, но отличаются, константой связывания, что приводит к некоторым различиям в функциональном отношении. Например, в эритроцитах человека обнаружено несколько форм гемоглобина: HbA (96%), HbF (2%), HbA2(2%). Все гемоглобины представляют собой тетрамеры, построенные из протомеров a, b, g, d (HbA -a2b2, HbF — a2g2, HbA2 — a2d2). Все протомеры сходны между собой по первичной структуре, и очень большое сходство наблюдается по вторичной и третичной структурам. Все формы гемоглобинов предназначены для переноса кислорода в клетки тканей, но HbF, например, имеет большее сродство к кислороду, чем HbA. HbF характерен для эмбриональной стадии развития человека. Он способен отнимать кислород у HbA, что обеспечивает нормальное снабжение кислородом плода.
Изобелки — это результат наличия более чем одного структурного гена в генофонде вида.
БЕЛКИ: СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ
1. Белки и их основные признаки
2. Биологические функции белков
3. Аминокислотный состав белков
4. Классификация белков
5. Физические свойства белков
6. Структурная организация белковых молекул (первичная, вторичная, третичная структуры)
infopedia.su
строение и функции. Свойства белков
Как известно, белки — основа зарождения жизни на нашей планете. По теории Опарина-Холдейна именно коацерватная капля, состоящая из молекул пептидов, стала основой зарождения живого. Это и не вызывает сомнений, ведь анализ внутреннего состава любого представителя биомассы показывает, что эти вещества есть во всем: растениях, животных, микроорганизмах, грибах, вирусах. Причем они очень разнообразны и макромолекулярны по природе.
Названий у этих структур четыре, все они являются синонимами:
- белки;
- протеины;
- полипептиды;
- пептиды.
Белковые молекулы
Их количество поистине неисчислимо. При этом все белковые молекулы можно разделить на две большие группы:
- простые — состоят только из аминокислотных последовательностей, соединенных пептидными связями;
- сложные — строение и структура белка характеризуются дополнительными протолитическими (простетическими) группами, называемыми еще кофакторами.
При этом сложные молекулы также имеют свою классификацию.
Градация сложных пептидов
- Гликопротеиды — тесно связанные соединения белка и углевода. В структуру молекулы вплетаются простетические группы мукополисахаридов.
- Липопротеиды — комплексное соединение из белка и липида.
- Металлопротеиды — в качестве простетической группы выступают ионы металлов (железо, марганец, медь и другие).
- Нуклеопротеиды — связь белка и нуклеиновых кислот (ДНК, РНК).
- Фосфопротеиды — конформация протеина и остатка ортофосфорной кислоты.
- Хромопротеиды — очень схожи с металлопротеидами, однако элемент, входящий в состав простетической группы, представляет собой целый окрашенный комплекс (красный — гемоглобин, зеленый — хлорофилл и так далее).
У каждой рассмотренной группы строение и свойства белков различны. Функции, которые они выполняют, также варьируются в зависимости от типа молекулы.

Химическое строение белков
С данной точки зрения протеины — это длинная, массивная цепь аминокислотных остатков, соединяющихся между собой специфическими связями, называемыми пептидными. От боковых структур кислот отходят ответвления — радикалы. Такое строение молекулы было открыто Э. Фишером в начале XXI века.
Позже более подробно были изучены белки, строение и функции белков. Стало ясно, что аминокислот, образующих структуру пептида, всего 20, но они способны комбинироваться самым разным способом. Отсюда и разнообразие полипептидных структур. Кроме того, в процессе жизнедеятельности и выполнения своих функций белки способны претерпевать ряд химических превращений. В результате они меняют структуру, и появляется уже совсем новый тип соединения.
Чтобы разорвать пептидную связь, то есть нарушить белок, строение цепей, нужно подобрать очень жесткие условия (действие высоких температур, кислот или щелочей, катализатора). Это объясняется высокой прочностью ковалентных связей в молекуле, а именно в пептидной группе.
Обнаружение белковой структуры в условиях лаборатории проводится при помощи биуретовой реакции — воздействия на полипептид свежеосажденным гидроксидом меди (II). Комплекс пептидной группы и иона меди дает ярко-фиолетовую окраску.
Существует четыре основные структурные организации, каждая из которых имеет свои особенности строения белков.
Уровни организации: первичная структура
Как уже упоминалось выше, пептид — это последовательность аминокислотных остатков с включениями, коферментами или же без них. Так вот первичной называют такую структуру молекулы, которая является природной, естественной, представляет собой истинно аминокислоты, соединенные пептидными связями, и больше ничего. То есть полипептид линейного строения. При этом особенности строения белков такого плана — в том, что такое сочетание кислот является определяющим для выполнения функций белковой молекулы. Благодаря наличию данных особенностей возможно не только идентифицировать пептид, но и предсказать свойства и роль совершенно нового, еще не открытого. Примеры пептидов, обладающих природным первичным строением, — инсулин, пепсин, химотрипсин и другие.
Вторичная конформация
Строение и свойства белков этой категории несколько меняются. Такая структура может сформироваться изначально от природы либо при воздействии на первичную жестким гидролизом, температурой или иными условиями.
Данная конформация имеет три разновидности:
- Ровные, правильные, стереорегулярные витки, построенные из остатков аминокислот, которые закручиваются вокруг основной оси соединения. Удерживаются вместе только водородными связями, возникающими между кислородом одной пептидной группировки и водородом другой. Причем строение считается правильным из-за того, что витки равномерно повторяются через каждые 4 звена. Такая структура может быть как левозакрученной, так и правозакрученной. Но в большинстве известных белков преобладает правовращающий изомер. Такие конформации принято называть альфа-структурами.
- Состав и строение белков следующего типа отличается от предыдущего тем, что водородные связи образуются не между рядом стоящими по одной стороне молекулы остатками, а между значительно удаленными, причем на достаточно большое расстояние. По этой причине вся структура принимает вид нескольких волнообразных, извитых змейкой полипептидных цепочек. Есть одна особенность, которую должен проявлять белок. Строение аминокислот на ответвлениях должно быть максимально коротким, как у глицина или аланина, например. Этот тип вторичной конформации носит название бета-листов за способность будто слипаться при образовании общей структуры.
- Относящееся к третьему типу строение белка биология обозначает как сложные, разноразбросанные, неупорядоченные фрагменты, не обладающие стереорегулярностью и способные изменять структуру под воздействием внешних условий.
Примеров белков, имеющих вторичную структуру от природы, не выявлено.
Третичное образование
Это достаточно сложная конформация, имеющая название «глобула». Что собой представляет такой белок? Строение его основывается на вторичной структуре, однако добавляются новые типы взаимодействий между атомами группировок, и вся молекула словно сворачивается, ориентируясь, таким образом, на то, чтобы гидрофильные группировки были направлены внутрь глобулы, а гидрофобные — наружу.
Этим объясняется заряд белковой молекулы в коллоидных растворах воды. Какие же типы взаимодействий здесь присутствуют?
- Водородные связи — остаются без изменений между теми же самыми частями, что и во вторичной структуре.
- Гидрофобные (гидрофильные) взаимодействия — возникают при растворении полипептида в воде.
- Ионные притяжения — образуются между разнозаряженными группами аминокислотных остатков (радикалов).
- Ковалентные взаимодействия — способны формироваться между конкретными кислотными участками — молекулами цистеина, вернее, их хвостами.
Таким образом, состав и строение белков, обладающих третичной структурой, можно описать как свернутые в глобулы полипептидные цепи, удерживающие и стабилизирующие свою конформацию за счет разных типов химических взаимодействий. Примеры таких пептидов: фосфоглицераткеназа, тРНК, альфа-кератин, фиброин шелка и другие.
Четвертичная структура
Это одна из самых сложных глобул, которую образуют белки. Строение и функции белков подобного плана очень многогранны и специфичны.
Что собой представляет такая конформация? Это несколько (в некоторых случаях десятки) крупных и мелких полипептидных цепей, которые формируются независимо друг от друга. Но затем за счет тех же взаимодействий, что мы рассматривали для третичной структуры, все эти пептиды скручиваются и переплетаются между собой. Таким образом получаются сложные конформационные глобулы, которые могут содержать и атомы металлов, и липидные группировки, и углеводные. Примеры таких белков: ДНК-полимераза, белковая оболочка табачного вируса, гемоглобин и другие.
Все рассмотренные нами структуры пептидов имеют свои методы идентификации в лабораторных условиях, основанные на современных возможностях использования хроматографии, центрифугирования, электронной и оптической микроскопии и высоких компьютерных технологиях.
Выполняемые функции
Строение и функции белков тесно коррелируют друг с другом. То есть каждый пептид играет определенную роль, уникальную и специфическую. Встречаются и такие, которые способны выполнять в одной живой клетке сразу несколько значительных операций. Однако можно в обобщенном виде выразить основные функции белковых молекул в организмах живых существ:
- Обеспечение движения. Одноклеточные организмы, либо органеллы, или некоторые виды клеток способны к передвижениям, сокращениям, перемещениям. Это обеспечивается белками, входящими в состав структуры их двигательного аппарата: ресничек, жгутиков, цитоплазматической мембраны. Если же говорить о неспособных к перемещениям клетках, то белки могут способствовать их сокращению (миозин мышц).
- Питательная или резервная функция. Представляет собой накопление белковых молекул в яйцеклетках, зародышах и семенах растений для дальнейшего восполнения недостающих питательных веществ. При расщеплении пептиды дают аминокислоты и биологически активные вещества, которые необходимы для нормального развития живых организмов.
- Энергетическая функция. Помимо углеводов, силы организму могут давать и белки. При распаде 1 г пептида высвобождается 17,6 кДж полезной энергии в форме аденозинтрифосфорной кислоты (АТФ), которая расходуется на процессы жизнедеятельности.
- Сигнальная и регуляторная функция. Заключается в осуществлении тщательного контроля за происходящими процессами и передачи сигналов от клеток к тканям, от них к органам, от последних к системам и так далее. Типичным примером может служить инсулин, который строго фиксирует количество глюкозы в крови.
- Рецепторная функция. Осуществляется путем изменения конформации пептида с одной стороны мембраны и вовлечения в реструктуризацию другого конца. При этом и происходит передача сигнала и необходимой информации. Чаще всего такие белки встраиваются в цитоплазматические мембраны клеток и осуществляют строгий контроль над всеми веществами, проходящими через нее. Также оповещают о химических и физических изменениях окружающей среды.
- Транспортная функция пептидов. Ее осуществляют белки-каналы и белки-переносчики. Роль их очевидна — транспортировка необходимых молекул к местам с низкой концентрацией из частей с высокой. Типичным примером служит перенос кислорода и диоксида углерода по органам и тканям белком гемоглобином. Ими же осуществляется доставка соединений с невысокой молекулярной массой через мембрану клетки внутрь.
- Структурная функция. Одна из важнейших из тех, которые выполняет белок. Строение всех клеток, их органелл обеспечивается именно пептидами. Они подобно каркасу задают форму и структуру. Кроме того, они же ее поддерживают и видоизменяют в случае необходимости. Поэтому для роста и развития всем живым организмам необходимы белки в рационе питания. К таким пептидам можно отнести эластин, тубулин, коллаген, актин, кератин и другие.
- Каталитическая функция. Ее выполняют ферменты. Многочисленные и разнообразные, они ускоряют все химические и биохимические реакции в организме. Без их участия обычное яблоко в желудке смогло бы перевариться только за два дня, с большой вероятностью загнив при этом. Под действием каталазы, пероксидазы и других ферментов этот процесс происходит за два часа. В целом именно благодаря такой роли белков осуществляется анаболизм и катаболизм, то есть пластический и энергетический обмен.
Защитная роль
Существует несколько типов угроз, от которых белки призваны оберегать организм.
Во-первых, химическая атака травмирующих реагентов, газов, молекул, веществ различного спектра действия. Пептиды способны вступать с ними в химическое взаимодействие, переводя в безобидную форму или же просто нейтрализуя.
Во-вторых, физическая угроза со стороны ран — если белок фибриноген вовремя не трансформируется в фибрин на месте травмы, то кровь не свернется, а значит, закупорка не произойдет. Затем, наоборот, понадобится пептид плазмин, способный сгусток рассосать и восстановить проходимость сосуда.
В-третьих, угроза иммунитету. Строение и значение белков, формирующих иммунную защиту, крайне важны. Антитела, иммуноглобулины, интерфероны — все это важные и значимые элементы лимфатической и иммунной системы человека. Любая чужеродная частица, вредоносная молекула, отмершая часть клетки или целая структура подвергается немедленному исследованию со стороны пептидного соединения. Именно поэтому человек может самостоятельно, без помощи лекарственных средств, ежедневно защищать себя от инфекций и несложных вирусов.
Физические свойства
Строение белка клетки весьма специфично и зависит от выполняемой функции. А вот физические свойства всех пептидов схожи и сводятся к следующим характеристикам.
- Вес молекулы — до 1000000 Дальтон.
- В водном растворе формируют коллоидные системы. Там структура приобретает заряд, способный варьироваться в зависимости от кислотности среды.
- При воздействии жестких условий (облучение, кислота или щелочь, температура и так далее) способны переходить на другие уровни конформаций, то есть денатурировать. Данный процесс в 90% случаев необратим. Однако существует и обратный сдвиг — ренатурация.
Это основные свойства физической характеристики пептидов.
fb.ru
|
Строительная: Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
|
|
Транспортная: |
Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
|
Регуляторная: Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
|
|
Защитная: В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. |
|
|
Двигательная: Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. |
|
|
Сигнальная: В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
|
|
Запасающая: В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. |
|
|
Энергетическая: При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов - воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
|
|
Каталитическая: Одна из важнейших функций белков. Обеспечивается белками - ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. Copyright © BioFile 2007-2016 |
biofile.ru
Свойства и функции белков | Биология
Свойства белков. Из разных живых объектов – животных, растений, микроорганизмов – были извлечены и изучены тысячи разных белков. Поражает разнообразие физических и химических свойств белков, что обусловлено их различным аминокислотным составом.
Существуют белки совершенно нерастворимые в воде, есть белки легко растворимые в воде. Есть белки малоактивные в химическом отношении, устойчивые к действию различных агентов. Есть белки крайне неустойчивые, изменяющиеся под влиянием ничтожных воздействий, например под влиянием слабого освещения или простого прикосновения. Есть белки, имеющие вид нитей, достигающих в длину сотен нанометров; есть белки, молекулы которых имеют вид шариков диаметром всего 5–7 нм. Но во всех случаях структура и свойства белка строго соответствуют выполняемой им функции. Из устойчивого, твердого, как сталь, белка кератина состоят образования, используемые животными для защиты и агрессии,– рога, копыта, панцири, когти, перья, волосы. Белки с нитевидными молекулами входят в состав мышц. Они способны укорачиваться и растягиваться и обеспечивают двигательные реакции клеток. Белки с мелкими круглыми молекулами, легко растворимые, подвижные используются для транспорта веществ. Белки высокоактивные, с легко изменяемой структурой выполняют функции катализаторов, а также используются для приема и передачи сигналов в клетку из внешней среды.
Под влиянием различных физических и химических факторов – высокой температуры, ряда химических веществ, облучения, механического воздействия слабые связи, поддерживающие вторичную и третичную (но не первичную) структуры белка, рвутся и молекула развертывается [73]. Нарушение природной структуры белка называется денатурацией. В результате денатурации свойства белка изменяются. Он утрачивает растворимость, становится доступным действию пищеварительных ферментов, теряет присущие ему функции. Явление денатурации белка, без сомнения, знакомо всем, ибо каждый наблюдал, как прозрачное жидкое содержимое яйца после нагревания становится плотным и непрозрачным.
Рис. 73. Денатурация белка
Процесс денатурации обратим, т. е. развернутая полипептидная цепь способна самопроизвольно закрутиться в спираль, а спираль в самопроизвольно уложиться в третичную структуру. Но это значит,что все особенности строения белка определяются его первичной структурой, т. е. составом и порядком чередования аминокислот в полипептидной цепи.
Способность белков к обратимому изменению структуры в ответ на действие физических и химических факторов лежит в основе важнейшего свойства всех живых систем раздражимости.
Функции белков. Белки в клетке выполняют важные и многообразные функции. Прежде всего они выполняют строительную функцию. Из белков состоят мембраны клеток и клеточных органоидов. У высших животных в основном из белков состоят стенки кровеносных сосудов, сухожилия, хрящи и т. д.
Громадное значение имеет каталитическая функция белков. Из курса химии вам известно, что скорость химических реакций зависит от свойств реагирующих веществ, от их концентрации и температуры, при которой идет реакция. Химическая активность веществ в живой клетке, как правило, невелика. Концентрации их в клетке большей частью незначительны. Температура клеточной среды невысокая. Таким образом, реакции в клетке должны были бы протекать очень медленно. Между тем реакции в клетке идут с большими скоростями. Это достигается благодаря наличию в клетке катализаторов. Клеточные катализаторы называются ферментами. Каталитическая активность ферментов исключительно велика. Она ускоряют реакции в десятки, сотни миллионов раз. По химической структуре ферменты – белки. В большинстве случаев ферменты катализируют превращения веществ, размеры молекул которых по сравнению с размерами макромолекулы фермента очень малы. Например, фермент каталаза имеет молекулярную массу 250 000, а пероксид водорода (H2O2), распад которого катализирует каталаза, всего 34. Такое соотношение между размерами фермента и веществом, на которое он действует, наводит на мысль, что каталитическая активность фермента определяется не всей его молекулой. а только небольшим ее участком – активным центром фермента. Как известно, реакция между веществами происходит при условии тесного сближения их молекул. Возможность сближения фермента и вещества происходит благодаря геометрическому соответствию структур активного центра фермента и молекулы вещества. Они подходят друг к другу, «как ключ к замку». При денатурации фермента его каталитическая активность исчезает, так как нарушается структура активного центра.
Почти каждая химическая реакция в клетке катализируется особым ферментом. Число различных реакций, протекающих в клетке, достигает нескольких тысяч. Соответственно н клетке обнаружено несколько тысяч разных ферментов.
Кроме строительной и каталитической функций, важна сигнальная функция белков. В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача команд в клетку.
Белкам присуща также двигательная функция. Движение одно из проявлений жизненной активности. Все виды движения, к которым способны клетки у высших животных, в том числе и сокращение мышц, а также мерцание ресничек у простейших, движения жгутиков, выполняют особые сократительные белки.
Белки выполняют также транспортную функцию. Они способны присоединять различные вещества и переносить их из одного места клетки в другое. Белок крови гемоглобин присоединяет кислород и разносит его ко всем тканям и органам тела.
Большое значение имеет защитная функция белков. При введении чужеродных белков или клеток в организм в нем происходит выработка особых белков, которые связывают и обезвреживают чужеродные клетки и вещества.
Следует отметить, наконец, энергетическую функцию белков. Белки распадаются в клетке до аминокислот. Часть аминокислот используется для синтеза белков, часть же подвергается глубокому расщеплению, в ходе которого освобождается энергия. При полном расщеплении 1 г белка освобождается 17,6 кДж.
О громадном значении белков для жизни догадывались давно. Сто лет назад Ф. Энгельс писал, что «жизнь есть форма существования белковых тел». Эта фраза стала крылатой, в ней подчеркивается решающее значение белков для жизни. Данные современной биологии полностью подтверждают этот вывод.
1. Что представляет собой денатурация белка? Какие структуры белка нарушаются при денатурации и какие сохраняются. Почему? 2. Что представляют собой ферменты? Какую роль они играют в клетке? 3. Докажите, что все особенности строения молекулы белка определяются его первичной структурой. 4. Охарактеризуйте функции белков.
blgy.ru
Белки. Химические и физические свойства. Биологические функции.
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
| первичная | последовательность соединения остатков аминокислот | |
| вторичная | локальное упорядочивание фрагмента полипептидной цепи в спирали | |
| третичная | пространственная ориентация полипептидной спирали или способ ее укладки определенном объеме в глобулы (клубки) или фибриллы (нити) |
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Химические свойства белков
Гидролиз
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α-аминокислот:
Белок + nH2O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
раствор белка + HNO3(конц.) => желтое окрашивание
Биологические функции белков
| каталитическая | ускоряют различные химические реакции в живых организмах | ферменты |
| структурная | строительный материал клеток | коллаген, белки клеточных мембран |
| защитная | защищают организм от инфекций | иммуноглобулины, интерферон |
| регуляторная | регулируют обменные процессы | гормоны |
| транспортная | перенос жизненно-необходимых веществ от одних частей организма к другим | гемоглобин переносит кислород |
| энергетическая | снабжают организм энергией | 1 грамм белка может обеспечить организм энергией в количестве 17,6 Дж |
| моторная (двигательная) | любые двигательные функции организма | миозин (мышечный белок) |
scienceforyou.ru
Строение и функции белков
Строение белков
Определение 1
Белки – сложные органические соединения (биополимеры), в состав молекул которых входят углерод, водород, кислород и азот (иногда серы). Их мономеры — аминокислоты.
Белки играют первостепенное значение в жизни всех организмов. Они характеризуются неисчерпаемым разнообразием, которое одновременно очень специфично.
Замечание 1
Белки и нуклеиновые кислоты являются материальной основой всего богатства организмов окружающей среды. Их доля составляет 50 – 80% сухой массы клетки.
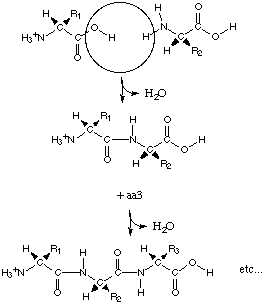
Молекулы белков похожи на длинные цепи, состоящие из 50 – 1500 остатков аминокислот, соединённых крепкой ковалентной азотно-углеродной (пептидной) связью. В результате образуется первичная структура белка — полипептидная цепь.
Замечание 2
Молекула белка — это полипептид, молекулярная масса которого составляет от 5 тыс. до 150 тыс. Бывает и больше.
Простые белки состоят лишь из аминокислот, а сложные белки, кроме аминокислот, могут содержать нуклеиновые кислоты (нуклеопротеиды), липиды (липопротеиды), углеводы (гликопротеиды), окрашенные химические соединения (хромопротеиды) и т.п.
Все свойства клетки (химические, морфологические, функциональные) зависят от специфических белков, содержащихся в ней.
Замечание 3
Именно набор аминокислот, их количество и последовательность расположения в полипептидной цепи и определяет специфичность белка.
Замена лишь одной аминокислоты в составе белковой молекулы или изменение последовательности расположения аминокислот может привести к изменению функций белка. Этим и объясняется большое разнообразие в строении белковой молекулы первичной структуры. Потому не удивительно, что живой организм, чтобы иметь возможность выполнять свои функции, использует особенный виды белков и его возможности в этом отношении неограниченные.
Пространственное расположение полипептидных цепей также определяет свойства белков. В живой клетке полипептидные цепи скрученные или согнутые, имеют вторичную или третичную структуру.
Вторичная структура представлена спирально закрученной белковой цепочкой. Витки спирали удерживаются благодаря водородным связям, образующимся между расположенными на соседних витках СО – и NH – группами.
В результате дальнейшего закручивания спирали возникает специфическая конфигурация каждого белка — третичная структура. Образуется она благодаря связям между белковыми радикалами аминокислотных остатков:
- ковалентным дисульфидным (S – S-связям) между остатками цистеина,
- водородным,
- ионными.
- гидрофобным взаимодействиям.
В количественном соотношении наиболее важными являются гидрофобные взаимодействия, вызванные тем, что неполярные боковые цепи аминокислот стремятся объединиться друг с другом, не смешиваясь с водной средой. Белок при этом свёртывается так, чтобы его гидрофобные боковые цепи были спрятаны внутри молекулы, то есть защищены от контакта с водой, а наружу, наоборот, выставлены боковые гидрофильные цепи.
Для каждого белка специфичны количество молекуламинокислот с гидрофобными радикалами и количество молекул цистеина и характер их взаимного расположения в полипептидной цепи.
Взаимное расположение групп атомов, обходимое для проявления активности белка как катализатора, его гормональных функций и др. обеспечивается сохранением определённой формы молекулы. Потому стойкость макромолекул – не случайное свойство, а один из важнейших способовстабилизации организма.
Биологическая активность белка может проявлятся лишь когда он имеет третичную структуру, потому при замене в полипептидной цепи даже одной аминокислоты могут возникнуть изменения в конфигурации белка, а его биологическая активность снизится или же исчезнет совсем.
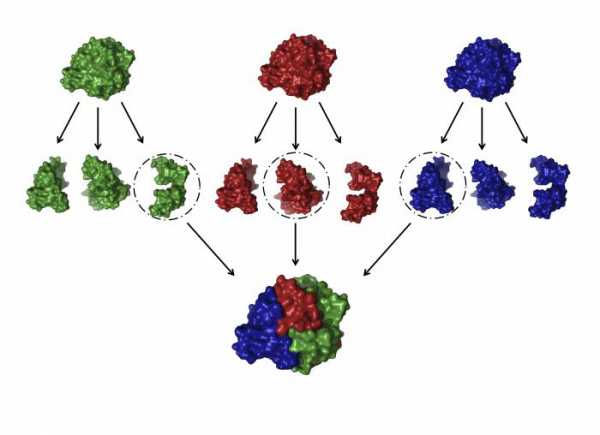
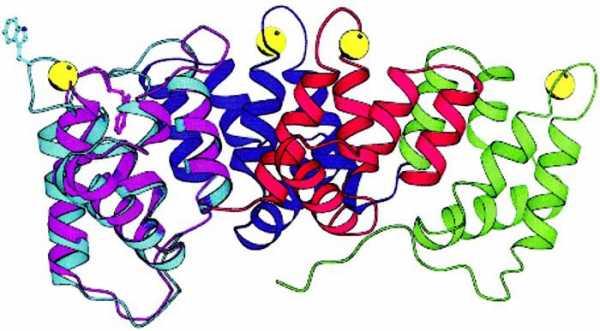
Иногда две, три, и больше белковых молекул с третичной структурой могут объединиться в единый комплекс. Подобные образования являются четвертичной структурой белка.
Пример 1
Примером такого сложного белка является гемоглобин, который состоит из четырёх субединиц и небелковой части – гема. Он способен выполнять свои функции только в такой форме.
В четвертичной структуре белковые субединицы не связаны химически, однако вся структура достаточно крепкая благодаря действию слабых межмолекулярных сил.
Под влиянием разнообразных физических и химических факторов (обработка щелочами, кислотами, спиртом, ацетоном, влияние высоких температур и давления и пр.) третичная и четвертичная структуры белка изменяются, потому что разрываются водородные и ионные связи.
Определение 2
Денатурация – нарушение естественной (нативной) структуры белка.
При денатурации уменьшается растворимость белков, изменяется форма и размеры молекул, теряется ферментативная активность и т.п. Процесс денатурации оборотный, то есть возвращение нормальных условий сопровождается непроизвольным оновлением естественной (природной) структуры белка. Этот процесс называют ренатурацией.
Замечание 4
Все особенности строения и функционирования белковой макромолекулы зависят от его первичной структуры.
Функции белков в клетке
- Строительная (пластическая) функция белковых молекул является одной из важнейших.Они являются составным компонентом клеточных мембран и органел. Стенки кровеносных сосудов, сухожилия, хрящи высших животных также состоят в основном из белка.
- Двигательная функция обеспечивается особенными сократительными белками, благодаря которым осуществляются движения жгутиков и ресничек, перемещение хромосом во время деления клеток, сокращение мускулатуры, движения органов растений и т.п., пространственные изменения положения различных структур организма.
- Транспортная функция белков обеспечивается их способностью связывать и переносить с течением крови химические соединения.
Пример 2
Белок крови гемоглобин переносит кислород из лёгких в клетки других органов и тканей (аналогичную функцию в мышцах выполняет миоглобин).
Белки сыворотки крови переносят липиды и жирные кислоты, различные биологически активные вещества.
Молекулы белков, входящих в состав плазматической мембраны, берут участие в транспорте веществ как в клетку, так и из неё.
Белки выполняют и защитную функцию. Как ответ на проникновение внутрь чужеродных веществ (антигенов – белков или высокомолекулярных полисахаридов бактерий, вирусов) в клетке вырабатываются особенные белки – иммуноглобулины (антитела), которые нейтрализуют чужеродные вещества и осуществляют иммунологичную защиту организма.
Благодаря функционированию иммунной системы организма обеспечивается распознавание антигенов антигенным детерминантам (характерным участкам их молекул). Благодаря этому специфически связываются и обеззараживаются чужеродные вещества за.
Замечание 5
Внешнюю защитную функцию могут выполнять также и белки, токсические для других организмов ( белок яда змей).
Белкам свойственна также сигнальная функция. В поверхность клеточной мембранны встроены молекулы белков, которые в ответ на действия факторов внешней среды способны к изменению свей третичной структуры. Так происходит восприятие сигналов из внешней среды и передача команд в клетку.
Регуляторная функция свойственна белкам-гормонам, которые влияют на обмен веществ. Гормоны поддерживают постоянную концентрацию веществ в крови, учавствуют в росте размножении и других жизненно важных процессах.
Пример 3
Одним из наиболее известных гормонов является инсулин, понижающий содержание сахара в крови. В случае стойкой недостаточности инсулина содержание сахара в крови увеличивается и развивается сахарны диабет. Главными регуляторами биохимических процессов в организме могут быть и многочисленные белки-ферменты (каталитическая функция).
Белки являются и энергетическим материалом. При расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии, необходимой для большинства жизненно важных процессов в клетке.
Ферменти, их роль в клетке
Определение 3
Ферменты (энзимы) – это специфические белки, присутствующие во всех организмах и выполняющие функцию биологических катализаторов.
Химические реакции в живой клетке происходят при умеренной температуре нормальном давлении и в нейтральной среде. При таких условиях течение реакций синтеза или распада веществ в клетке был быочень медленным, если бы не действие ферментов. Ферменты ускоряют реакции за счёт снижения энергии активации не измененяя их общего результата, то есть при их наличии для придания молекулам, вступающим в реакцию, реакционной способности, необходимо значительно меньше энергии
Все процессы в живом организме прямо или косвенно происходят с участием ферментов.
Под действием ферментов составляющие компоненты пищи (белки, липиды, углеводы и др.) расщепляются до простейших соединений, а из них позже синтезируются новые, свойственные данному виду макромолекулы. Потому нарушение образования и активности ферментов часто становятся причиной тяжёлых заболеваний.
Ферментативный катализ подчиняется тем же законам, что и неферментативный катализ в химической промышленности, однако в отличие от последнего характеризируется чрезвычайно высокой степенью специфичности (фермент катализирует только одну реакцию или действует лишь на один тип связи). Этим обеспечивается тонкое регулирование всех жизненно важных процессов (дыхание, пищеварение, фотосинтез и т. п.), происходящих в клетке и организме.
Пример 4
Фермент уреаза катализирует расщепление только одного вещества – мочевины, но не действует каталитически на структурно родственные соединения.
Для понятия механизма действия ферментов, которые имеют высокую специфичность, чрезвычайно важна теория активного центра. Согласно с ней, в молекуле каждого фермента есть один или больше участков, в которых катализ происходит за счёт тесного (во многих местах) контакта между молекулами фермента и субстрата (специфического вещества), а функциональная группа (пример – ОН – группа аминокислоты серина), или же отдельная аминокислота, выступает активным центром.
Обычно для действия катализатора необходимо, чтобы объединились несколько аминокислотных остатков, расположенных в определённой последовательности (в среднем 3 – 12).
Активный центр также может формироваться благодаря связи ферментов с ионами металов, витаминами и другими соединениями небелковой природы – так называемыми коферментами, или кофакторами.
Химическое строение и форма активного центра такова, что с ним способны связывать лишь определённые субстраты благодаря их идеальному соответствию (взаимодополняемости, или комплементарности) друг другу.
Остальные аминокислотные остатки обеспечивают большой молекуле ферментп соответствующую глобулярную форму, необходимую для эффективной работы самого центра.
Кроме того, вокруг большой молекулы фермента возникает сильное электрическое поле. В таком поле становится возможной ориентация молекул субстрата и приобретение ими ассиметрической формы. В результате ослабевают химические связи и начальная затрата энергии на реакцию, которая катализируется, будет меньше, а значит, значительно увеличится её скорость.
Пример 5
Одна молекула фермента каталазы способна за 1 мин расщепить более 5 млн. молекул перекиси водорода, которая возникает во время окисления в организме различных соединений.
Активный центр некоторых ферментов в присутствии субстрата может изменять конфигурацию: для обеспечения наибольшей каталитической активности такой фермент специально ориентирует свои функциональные группы. Молекулы субстрата, присоединяясь к ферменту, также в определённых пределах изменяют свою конфигурацию для увеличения реакционной способностит функциональных групп центра. На заключительном этапе химической реакции комплекс фермента и субстрата распадается, образуются конечные продукты и свободный фермент. Активный центр при этом освобождается и способен снова принимать новые молекулы субстрата.
Скорость реакций с участием ферментов зависит от многих факторов: от концентрации фермента, от природы субстрата, от давления, температуры, кислотности среды, от наличия ингибиторов.
При температурах, близких к 0˚С, до минимума замедляется скорость биохимических реакций. Это свойство широко используют в различных отраслях, особенно в медицине и сельском хозяйстве.
Пример 6
Для консервации органы человека (почки, серце, селезёнка, печень) перед пересадкой больному подвергают охлаждению, чтобы понизить интенсивность биохимических реакций и тем самым продлить время жизни этих органов. При быстром замораживании пищевых продуктов предотвращается размножение микроорганизмов, а так же инактивируются их ферменты, потому они уже не способны вызывать разложение пищевых продуктов.
spravochnick.ru