
Как получить из воды кислород?
#1
Значение кислорода для человека неоценимо велико. Он необходим для дыхания живых организмов, активно участвует в процессах горения. Получением кислорода занимаются растения. Именно в их зеленых листьях осуществляется важный процесс фотосинтеза, который и обогащает атмосферу земли этим ценным газом. А возможно ли получать кислород человеку? Промышленным способом его добывают из воздуха. При этом воздух сжижают и одновременно очищают. Но ведь на земной поверхности огромные запасы простого вещества воды, в химический состав которой входит кислород. Соответственно, еще один способ получения кислорода – это разложение воды. Причем осуществить данный процесс можно даже в домашних условиях.
Для этого понадобится гальваническая ванна, в которую наливается вода на высоту, превышающей середину ванны. В воду надо добавить до 2 мл разбавленной серной кислоты или едкого натра. Это делается для усиления электропроводности воды. Кроме того, необходимо взять два пластмассовых стакана. В дне каждого из них делается отверстие. Через него внутрь стакана помещается угольная пластина — электрод. Можно использовать и другой металл в качестве электрода (медный или железный) . А воздушную прослойку между такой пластиной и стаканом нужно хорошо заизолировать. Электроды помещаются в воду так, чтобы стаканы расположились вверх дном. А воздуха между дном стакана и поверхностью воды должно быть как можно меньше.
#3
К верхней части каждого электрода припаивается металлический провод. Этими проводами электроды подключают к полюсам источника питания. Электрод, подключенный к отрицательному полюсу, называется катодом. А положительный электрод – анодом. В результате, при прохождении через воду электрического тока происходит электролиз воды. Химическая реакция идет по такому типу 2 h3O→2 h3+O2. Как видно из уравнения, образуется два газа. На катоде внутри стакана собирается водород, а на аноде – кислород. Образование газов можно наблюдать по поднимающимся из воды пузырьков. Образующийся кислород можно выводить из стакана в другой сосуд с помощью трубки от капельницы. Чтобы убедиться в наличии кислорода, можно внести в сосуд тлеющую лучину. Она ярко вспыхнет.#4
uznay-kak.ru
Получение кислорода из воды
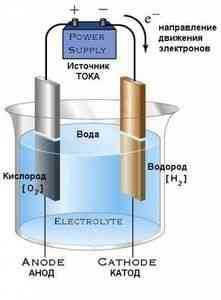
Большое количество кислорода получают электролизом воды.
При электролизе воды одновременно с кислородом выделяется другой ценный промышленный продукт — водород.
При наличии дешевой электроэнергии чрезвычайно выгодно получать кислород и водород из воды путем разложения ее электрическим током на составные части.
Впервые кислород и водород были получены электролизом воды примерно сто шестьдесят лет назад. Однако этот метод не находил практического применения почти в течение ста лет.
В 1888 году русский профессор Д. А. Лачинов сконструировал несколько типов электролитических ванн для получения кислорода и водорода. Через несколько лет появились первые промышленные установки по производству этих газов электролитическим путем. Это были сравнительно небольшие установки, дававшие в сутки 100— 200 кубических метров Кислорода и водорода.
В настоящее время имеются установки, способные вырабатывать в один час 20 тысяч кубических метров водорода и 10 тысяч кубических метров кислорода.
Такие установки требуют много электроэнергии.
В нашей стране, где вырабатывается большое количество дешевой электрической энергии, кислород получают не только из воздуха, а широко используют электролитический способ получения кислорода и водорода из воды.
В настоящее время на крупных реках идет строительство новых гигантских гидроэлектростанций. Через четыре-пять лет они дадут свыше 22 миллиардов киловатт часов электроэнергии в год. Часть этой дешевой электроэнергии пойдет на электрохимические предприятия, в том числе и на заводы по электролизу воды.
Поделитесь ссылкой с друзьями
Получение кислорода
Кислород в лаборатории получают разложением перманганата калия KMnO 4 . Для опыта понадобится пробирка с газоотводной трубкой. В пробирку насыпаем кристаллический перманганат калия. Для сбора кислорода приготовим колбу. При нагревании перманганат калия начинает разлагаться, выделяющийся кислород поступает по газоотводной трубке в колбу. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Тлеющая лучинка вспыхивает в колбе: значит нам удалось собрать кислород.
Чистый кислород впервые получили независимо друг от друга шведский химик Шееле и английский ученый Пристли . До их открытия ученые считали, что воздух однородная субстанция. После открытия Шееле и Пристли Лавуазье создал теорию горения и назвал новый элемент Oxygenium – рождающий кислоту, кислород. Кислород — необходим для поддержания жизни. Человек может выдержать без кислорода всего несколько минут.
Оборудование: пробирка с газоотводной трубкой, колба, штатив, спиртовка, шпатель, лучина.
Техника безопасности. Следует соблюдать правила обращения с нагревательными приборами. Недопустимо попадание органических веществ в перманганат калия. Избегать прямого контакта кожи и слизистых оболочек с кристаллами перманганата калия.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Водород из воды: просто и дешево Российский исследователь сконструировал электролизер, позволяющий получать водород из воды, затрачивая на это очень мало энергии.
Российский исследователь сконструировал электролизер, позволяющий получать водород из воды, затрачивая на это очень мало энергии.
Водород — экологически чистый энергоноситель, к тому же практически неисчерпаемый. Согласно расчетам, из 1 л воды можно получить 1234, 44 л водорода. Однако переход энергетики на водородное топливо тормозят большие затраты энергии, необходимые для получения водорода из воды. Процесс электролиза идет при напряжении 1,6—2,0 В и силе тока в десятки и сотни ампер. Самые современные электролизеры расходуют на получение кубометра водорода больше энергии, чем можно получить при его сжигании . Проблему уменьшения затрат энергии на получение водорода из воды решают многие лаборатории мира, но существенных результатов достичь пока не удалось. Однако в природе существует экономный процесс разложения молекул воды на водород и кислород. Протекает он при фотосинтезе. При этом атомы водорода участвуют в формировании органических молекул, а кислород уходит в атмосферу. Ячейка электролизера, разработанная Ф.Канаревым из Кубанского государственного аграрного университета, моделирует этот процесс.
Сходство с фотосинтезом заключается в том, что ячейка потребляет очень мало энергии. Фактически устройство использует напряжение всего в 0,062 В при силе тока 0,02 А. Ф.Канарев сконструировал две лабораторные модели электролизера: с коническими и цилиндрическими стальными электродами. По замыслу своего создателя, они моделируют годовые кольца ствола дерева. Даже при полном отсутствии электролита на электродах ячейки появляется разность потенциалов около 0,1В. После заливки раствора разность потенциалов возрастает. При этом положительный знак заряда всегда появляется на верхнем электроде, отрицательный — на нижнем. Ячейка низкоамперного электролизера представляет собой конденсатор. Вначале он заряжается при напряжении 1,5-2 В и силе тока, значительно большей 0,02 А, а затем постепенно разряжается под действием происходящих в нем электролитических процессов. И в это время устройство потребляет совсем немного энергии, которую тратит на подзарядку конденсатора. Даже в отключенном от сети приборе электролиз идет еще пять часов, о чем свидетельствует интенсивное бульканье пузырьков газа.
Обе модели электролизера, и с коническими, и с цилиндрическими электродами, работают с одинаковой энергетической эффективностью. Показатель этой эффективности еще предстоит уточнять. Но уже сейчас ясно, что затраты энергии на получение водорода из воды при низкоамперном электролизе уменьшаются в 12 раз, а по самым смелым подсчетам — почти в 2000 раз . По мнению Ф.Канарева, предложенный им метод получения дешевого водорода из воды можно будет использовать для создания промышленных электролизеров, которые найдут применение в будущей водородной энергетике.
СВОЙСТВА КИСЛОРОДА И СПОСОБЫ ЕГО ПОЛУЧЕНИЯ
Кислород О2 является наиболее распространенным элементом на земле. Он находится в большом количестве в виде химических соединений с различными веществами в земной коре , в соединении с водородом в воде и в свободном состоянии в атмосферном воздухе в смеси главным образом с азотом в количестве 20,93% об. .
Кислород имеет большое значение в народном хозяйстве. Он широко применяется в металлургии; химической промышленности; для газопламенной обработки металлов, огневого бурения твердых горных пород, подземной газификации углей; в медицине и различных дыхательных аппаратах, например для высотных полетов, и в других областях.
В нормальных условиях кислород представляет собой газ без цвета, запаха и вкуса, не горючий, но активно поддерживающий горение. При весьма низких температурах кислород превращается в жидкость и даже твердое вещество.
Источники: www.activestudy.info, files.school-collection.edu.ru, gazeta.zn.ua, chemport.ru, forum.homedistiller.ru, metallicheckiy-portal.ru
Это интересно

Абеляр и Элоиза
Трогательная история о любви Абеляра и Элоизы попала в бретонский фольклор, превратившись в легенду о магии. Абеляр …
Шумерские боги
Сословие жрецов занимало одну из высших ступеней среди классовых сословий. Они ненавязчиво правили всем и представляли собой замкнутую …
Священный бык египтян
Апис – священный бык египтян. Бог плодородия Мемфиса. Этот культ имеет очень глубокие корни, связанные с …

Развитие науки в древней Греции
Были учебные дисциплины, значит, были и научные дисциплины. Существовали научные школы: Академия Платона, Школа последователей Аристотеля, сад …

Святой Корнелий — предания Карнака
Поразительную историю донесли до нашего времени предания Карнака о Святом Корнелии. Предание повествует, что святой Корнелий, преследуемый языческим …

Карфаген
Карфаген был настолько сильным городом, что с легкостью переживал все неприятности, вызванные соседством римлян. Так как город …

Кто такие циклопы
В преданиях древних народов, причем, живущих в самых разных частях мира, говорится об устрашающих существах, именуемых …
objective-news.ru
Урок 17. Получение кислорода – HIMI4KA
В уроке 17 «Получение кислорода» из курса «Химия для чайников» выясним, как получают кислород в лабораторных условиях; узнаем, что такое катализатор, и как растения влияют на производство кислорода на нашей планете.

Наиболее важным для человека и других живых организмов веществом, входящим в состав воздуха, является кислород. Большие количества кислорода используются в промышленности, поэтому важно знать, как можно его получать.
Получение кислорода в лабораторных условиях
В химической лаборатории кислород можно получать нагреванием некоторых сложных веществ, в состав которых входят атомы кислорода. К числу таких веществ относится вещество KMnO4, которое имеется в вашей домашней аптечке под названием «марганцовка».
Вы знакомы с простейшими приборами для получения газов. Если в один из таких приборов поместить немного порошка KMnO4 и нагреть, то будет выделяться кислород (рис. 76):

Кислород можно также получить разложением пероксида водорода H2O2. Для этого в пробирку с H2O2 следует добавить очень небольшое количество особого вещества — катализатора — и закрыть пробирку пробкой с газоотводной трубкой (рис. 77).

Для данной реакции катализатором является вещество, формула которого MnO2. При этом протекает следующая химическая реакция:
Обратите внимание на то, что ни в левой, ни в правой частях уравнения формулы катализатора нет. Его формулу принято записывать в уравнении реакции над знаком равенства. Для чего же добавляется катализатор? Процесс разложения H2O2 при комнатных условиях протекает очень медленно. Поэтому для получения заметных количеств кислорода необходимо много времени. Однако эту реакцию можно резко ускорить путем прибавления катализатора.
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ней не расходуется.
Именно потому, что катализатор не расходуется в реакции, мы не записываем его формулу ни в одной из частей уравнения реакции.
Еще один способ получения кислорода — разложение воды под действием постоянного электрического тока. Этот процесс называется электролизом воды. Получить кислород можно в приборе, схематично изображенном на рисунке 78.

При этом протекает следующая химическая реакция:
Кислород в природе
Огромное количество газообразного кислорода содержится в атмосфере, растворено в водах морей и океанов. Кислород необходим всем живым организмам для дыхания. Без кислорода невозможно было бы получать энергию за счет сжигания различных видов топлива. На эти нужды ежегодно расходуется примерно 2% атмосферного кислорода.
Откуда берется кислород на Земле и почему его количество остается примерно постоянным, несмотря на такой расход? Единственным источником кислорода на нашей планете являются зеленые растения, производящие его под действием солнечного света в процессе фотосинтеза. Это очень сложный процесс, включающий много стадий. В результате фотосинтеза в зеленых частях растений углекислый газ и вода превращаются в глюкозу C6H12O6 и кислород. Суммарное
уравнение реакций, протекающих в процессе фотосинтеза, можно представить следующим образом:
Установлено, что примерно одну десятую часть (11%) производимого зелеными растениями кислорода дают наземные растения, а остальные девять десятых (89%) — водные растения.
Получение кислорода и азота из воздуха
Огромные запасы кислорода в атмосфере позволяют получать и использовать его в различных производствах. В промышленных условиях кислород, азот и некоторые другие газы (аргон, неон) получают из воздуха.
Для этого воздух сначала превращают в жидкость (рис. 79) путем охлаждения до такой низкой температуры, при которой все его компоненты переходят в жидкое агрегатное состояние.

Затем эту жидкость медленно нагревают, в результате чего при разных температурах происходит последовательное выкипание (т. е. переход в газообразное состояние) веществ, которые содержатся в воздухе. Собирая выкипающие при разных температурах газы, по отдельности получают азот, кислород и другие вещества.
Краткие выводы урока:
- В лабораторных условиях кислород получают разложением некоторых сложных веществ, в состав которых входят атомы кислорода.
- Катализатор — вещество, которое ускоряет протекание химической реакции, но само при этом не расходуется.
- Источником кислорода на нашей планете являются зеленые растения, в которых протекает процесс фотосинтеза.
- В промышленности кислород получают из воздуха.
Надеюсь урок 17 «Получение кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Как из воды получить кислород
При электролитическом разложении воды образуется смесь газов – водорода и кислорода (как из воды получить кислород):
Активные угли получают при действия на неактивные паров или при . При этом часть угля выгорает и получается активный уголь, пронизанный весьма тонкими порами с радиусом менее 1 мм. Поверхность покрыта главным образом оксидными группами, причем из-за неоднородности состава оксидов на поверхности физическая адсорбция может сопровождаться как катионо-, так и анионообменными процессами. Особое место занимают окисленные активные угли, являющиеся селективными полифункциональными катионообменниками, Они весьма устойчивы к химическим, термическим и радиационным воздействиям, их легко получить и регенерировать. Активные угли используют в качестве эффективных сорбентов для извлечения свинца из атмосферного воздуха; Са, Ва и Sr из концентрированных растворов щелочей, солей и других соединений; Cr, Мо и V из воды и рассолов ртутного электролиза. Как правило, определение элементов заканчивается непосредственно в концентрате: прямым сжиганием концентрата в канале спектрального угольного электрода или концентрат облучают потоком нейтронов или определяют элементы в концентрате рентгено-флуоресцентным методом. Окончание анализа может быть другим: после разложения сорбента, содержащего сорбированные компоненты, действием азотной кислотой в полученном растворе компоненты определяют атомно-абсорбционным, спектрофотометрическим и другими методами.
ru.solverbook.com
Как выделить кислород и водород из воды электролизом » VripMaster
Процесс расщепления воды (h3O) на ее составляющие (водород и кислород) с применением электричества называется электролизом. Хотя такое название, возможно, и звучит заумно, на самом деле это проще чем может показаться, при условии если у вас есть необходимые приспособления и минимум знаний. В этой статье вы узнаете, как расщепить воду на кислород и водород с помощью электролиза.
Шаги
Заполните обычный стеклянный стакан (диаметром около 7,5 см) водопроводной водой примерно на 3/4.
Растворите в воде столовую ложку поваренной соли. Соль повысит электропроводность воды. Учтите, что это может привести к выделению некоторого количества газообразного хлора во время электролиза. Тем не менее, при умеренной силе тока его количество будет невелико.
Накройте стакан куском тонкого картона (подойдет и плотная бумага). Проткните картон двумя тонкими электрическими проводами длиною 30-60 см, так чтобы расстояние между ними было около 5 см, и чтобы они погружались в воду на 5-7 см.
Подсоедините противоположные концы проводов к положительному и отрицательному полюсу 9-вольтовой батарейки. Вскоре вы увидите, как на погруженной в воду проволоке выступают пузырьки газа — это образуются водород на отрицательном полюсе и кислород на положительном.
Для получения значительного количества водорода (и кислорода) [ВНИМАНИЕ: соблюдайте осторожность] продолжайте выполнять следующие пункты; если же вы не ставите перед собой такой задачи, остановитесь на данном этапе. Для дальнейших шагов вам дополнительно понадобятся небольшая емкость (лучше всего использовать спринцовку) и приспособление для того, чтобы подвесить эту емкость горлышком вниз (можно использовать скотч).
Погрузите меньшую емкость в стакан. Не выливая воду из большого стакана и проследив, чтобы она не выплеснулась, погрузите меньший стакан в больший вверх дном. Если вы используете спринцовку, просто погрузите ее горлышко в воду и наберите в нее воду из стакана, перейдя затем сразу к выполнению пункта 9.
Приподнимите меньший стакан так, чтобы его края находились вблизи поверхности воды, но при этом проследите, чтобы они не выступали из воды. Если вы все сделали правильно, этот стакан выступит из воды, будучи заполнен ею (результат атмосферного давления).
Закрепите меньший стакан с помощью скотча, зажима и т.п.
Поместите свободный конец ВОДОРОДНОЙ (минус) или КИСЛОРОДНОЙ (плюс) проволоки под меньший стакан.
Подождите, пока вода в меньшем стакане не опустится.
Советы
- НИ В КОЕМ СЛУЧАЕ не разбирайте батарейку для получения графита или по каким-либо другим соображениям. Содержащаяся в ней кислота коррозионно опасна, а ее пары токсичны. Графитовый стержень проще и безопаснее получить из простого карандаша.
- Заточите два карандаша с обоих концов и подсоедините к ним проволоку. Погрузите карандаши в воду. Образование пузырьков газа на графитовых стержнях будет интенсивней.
- Запишите ваши наблюдения.
- За небольшую цену вы можете приобрести медные контакты, покрытые платиной. Они послужат хорошим анодом, поскольку платина не окисляется.
- Используйте только источник прямого тока.
- Если вы не хотите иметь дело с опасным хлором, образующимся при электролизе, можно вместо поваренной соли использовать пищевую соду (NaHCO3), которая при электролизе даст безопасную двуокись углерода (хотя процесс электролиза при этом несколько замедлится).
- Если у вас есть проволока, покрытая изолирующей пластиковой оболочкой, срежьте покрытие, и проволока сгодится для электродов.
- Количество выделяемого при электролизе газа пропорционально току. Ток можно увеличить поднятием напряжения (как это делается в блоке питания компьютера), понижением электросопротивления (больше соли в растворе, но не перестарайтесь), либо уменьшением расстояния между катодами.
- Проявите фантазию! Добавьте в раствор немного средства для мытья посуды, и газовыделение станет более заметным.
Предупреждения
- При использовании поваренной соли на положительном полюсе проволоки, кроме кислорода, будет выделяться и токсичный хлор. Если вода приобрела зеленый оттенок, НИ В КОЕМ СЛУЧАЕ не продолжайте эксперимент, поскольку такой цвет воды свидетельствует о выделении хлора.
- В случае опасности взрыва водорода примите меры предосторожности — защитите глаза и уши. По возможности используйте предохранитель, однако это не обязательно, учитывая малое количество выделяющегося водорода.
- Водород взрывоопасен в смеси с кислородом. НЕ смешивайте эти два газа в одной емкости. Водород — легковоспламеняющийся газ, а в смеси с кислородом в пропорции 2:1 (как раз такая смесь получается в результате электролиза) он чрезвычайно взрывоопасен.
Что вам понадобится
- Небольшой стакан
- Кусок картона или плотной бумаги
- Вода
- Медная проволока (2 карандаша либо угольные стержни от батареек)
- ОСТОРОЖНО: при разборе батарейки будьте осторожны, в ней содержатся токсичные вещества
- Соль (пищевая сода или лимонный сок)
- 9-вольтовая батарейка (возможно большее напряжение)
- Мелкая емкость высотой не более 7,5 см, либо спринцовка без иглы [Предпочтительно]
vripmaster.com
Получение кислорода простыми способами — Вода и воздух — самое дешевое сырье — Практическая химия
Укрепим пробирку из тугоплавкого стекла на штативе и внесем в нее 5 г порошкообразной селитры (нитрата калия КNО3 или нитрата натрия NaNO3). Поставим под пробирку чашку из огнеупорного материала, наполненную песком, так как при этом опыте стекло часто плавится и вытекает горячая масса. Поэтому и горелку при нагревании будем держать сбоку. Когда мы сильно нагреем селитру, она расплавится и из нее выделится кислород (обнаружим это с помощью тлеющей лучины — она воспламенится в пробирке). При этом нитрат калия перейдет в нитрит KNO2. Бросим затем тигельными щипцами или пинцетом кусок черенковой серы в расплав (никогда не держать лицо над пробиркой).
Сера воспламенится и сгорит с выделением большого количества тепла. Опыт следует проводить при открытых окнах (из-за получающихся окислов серы). Полученный нитрит натрия сохраним для последующих опытов.
Процесс протекает следующим образом (через нагревание):
2KNO3 → 2KNO2 + O2
Можно получить кислород и другими методами.
Перманганат калия КMnO4 (калийная соль марганцевой кислоты) отдает при нагревании кислород и превращается при этом в оксид марганца (IV):
4KMnO4 → 4Mn2 + 2K2O + 3O2
или 4KMnO4 → MnO2 + K2MnO4 + O2
Из 10 г перманганата калия можно получить примерно литр кислорода, значит двух граммов достаточно, чтобы наполнить кислородом пять пробирок нормальной величины. Перманганат калия можно приобрести в любой аптеке, если он отсутствует в домашней аптечке.
Некоторое количество перманганата калия нагреем в тугоплавкой пробирке и уловим в пробирки выделяющийся лислород с помощью пневматической ванны. Кристаллы, растрескиваясь, разрушаются, и, зачастую, некоторое количество пылеобразного перманганата увлекается вместе с газом. Вода в пневматической ванне и отводной трубке в этом случае окрасится в красный цвет. После окончания опыта очистим ванну и трубку раствором тиосульфата (гипосульфита) натрия — фотофиксажа, который немного подкислим разбавленной соляной кислотой.
В больших количествах кислород можно также получить из пероксида (перекиси) водорода Н2О2. Купим в аптеке трехпроцентный раствор — дезинфицирующее средство или препарат для обработки ран. Пероксид водорода мало устойчив. Уже при стоянии на воздухе он разлагается на кислород и воду:
2Н2О2 → 2Н2О + О2
Разложение можно существенно ускорить, если добавить к пероксиду немного диоксида марганца МnО2 (пиролюзита), активного угля, металлического порошка, крови (свернувшейся или свежей), слюны. Эти вещества действуют как катализаторы.
Мы можем в этом убедиться, если в маленькую пробирку поместим примерно 1 мл пероксида водорода с одним из названных веществ, а наличие выделяющегося кислорода установим с помощью пробы лучинкой. Если в химическом стакане к 5 мл трехпроцентного раствора пероксида водорода добавить равное количество крови животного, то смесь сильно вспенится, пена застынет и вздуется в результате выделения пузырьков кислорода.
Затем испытаем каталитическое действие 10 %-ного раствора сульфата меди (II) с добавкой гидроксида калия (едкого кали), раствора сульфата железа (П), раствора хлорида железа (III) (с добавкой железного порошка и без него), карбоната натрия, хлорида натрия и органических веществ (молока, сахара, размельченных листьев зеленых растений и т. д.). Теперь мы на опыте убедились, что различные вещества каталитически ускоряют разложение пероксида водорода.
Катализаторы повышают скорость реакции химического процесса и при этом сами не расходуются. В конечном итоге они снижают энергию активации, необходимую для возбуждения реакции. Но существуют и вещества, действующие противоположным образом. Их называют отрицательными катализаторами, антикатализаторами, стабилизаторами или ингибиторами. Например, фосфорная кислота препятствует разложению пероксида водорода. Поэтому продажный раствор пероксида водорода обычно стабилизирован фосфорной или мочевой кислотой.
Катализаторы необходимы для многих химико-технологических процессов. Но и в живой природе во многих процессах участвуют так называемые биокатализаторы (энзимы, ферменты, гормоны). Так как катализаторы не потребляются в реакциях, то они могут действовать уже в малых количествах. Одного грамма сычужного фермента достаточно, чтобы обеспечить свертывание 400—800 кг молочного белка.
Особое значение для работы катализаторов имеет величина их поверхности. Для увеличения поверхности применяют пористые, испещренные трещинами вещества с развитой внутренней поверхностью, напыляют компактные вещества или металлы на так называемые носители. Например, 100 г платинового катализатора на носителе содержит только около 200 мг платины; 1 г компактного никеля имеет поверхность 0,8 см2, а 1 г порошка никеля — 10 мг. Это соответствует отношению 1 : 100000; 1 г активного глинозема обладает поверхностью от 200 до 300 м2, для 1 г активного угля эта величина составляет даже 1000 м2. В некоторых установках катализатора — на несколько миллионов марок. Так, бензиновая контактная печь в Белене высотой 18 м содержит 9—10 тонн катализатора.
Источник: Э.Гроссе, Х.Вайсмантель, «Химия для любознательных»
www.himhelp.ru
Получение кислорода — Ида Тен
История открытия кислорода
Открытие кислорода ознаменовало новый период в развитии химии. С глубокой древности было известно, что для горения необходим воздух. Процесс горения веществ долгое время оставался непонятным. В эпоху алхимии широкое распространение получила теория флогистона, согласно которой вещества горят благодаря их взаимодействию с огненной материей, то есть с флогистоном, который содержится в пламени.
Кислород был получен английским химиком Джозефом Пристли в 70-х годах XVIII века. Химик нагревал красный порошок оксида ртути (II), в итоге вещество разлагалось, с образованием металлической ртути и бесцветного газа:
2HgO t° → 2Hg + O2↑
Оксиды – бинарные соединения, в состав которых входит кислород
При внесении тлеющей лучины в сосуд с газом она ярко вспыхивала. Ученый считал, что тлеющая лучина вносит в газ флогистон, и он загорается.
Д. Пристли пробовал дышать полученным газом, и был восхищен тем, как легко и свободно им дышится. Тогда ученый и не предполагал, что удовольствие дышать этим газом предоставлено каждому.
Результатами своих опытов Д. Пристли поделился с французским химиком Антуаном Лораном Лавуазье. Имея хорошо оснащенную на то время лабораторию, А. Лавуазье повторил и усовершенствовал опыты Д. Пристли.
А. Лавуазье измерил количество газа, выделяющееся при разложении определенной массы оксида ртути. Затем химик нагрел в герметичном сосуде металлическую ртуть до тех пор, пока она не превратилась в оксид ртути (II). Он обнаружил, что количество выделившегося газа в первом опыте равно газу, поглотившемуся во втором опыте. Следовательно, ртуть реагирует с каким-то веществом, содержащимся в воздухе. И это же вещество выделяется при разложении оксида. Лавуазье первым сделал вывод, что флогистон здесь совершенно ни при чем, и горение тлеющей лучины вызывает именно неизвестный газ, который в последствии был назван кислородом. Открытие кислорода ознаменовало крах теории флогистона!
Способы получения и собирания кислорода в лаборатории
Лабораторные способы получения кислорода весьма разнообразны. Существует много веществ, из которых можно получить кислород. Рассмотрим наиболее распространенные способы.
1) Разложение оксида ртути (II)
Одним из способов получения кислорода в лаборатории, является его получение по описанной выше реакции разложения оксида ртути (II). Ввиду высокой токсичности соединений ртути и паров самой ртути, данный способ используется крайне редко.
2) Разложение перманганата калия
Перманганат калия (в быту мы называем его марганцовкой) – кристаллическое вещество темно-фиолетового цвета. При нагревании перманганата калия выделяется кислород.
В пробирку насыплем немного порошка перманганата калия и закрепим ее горизонтально в лапке штатива. Недалеко от отверстия пробирки поместим кусочек ваты. Закроем пробирку пробкой, в которую вставлена газоотводная трубка, конец которой опустим в сосуд- приемник. Газоотводная трубка должна доходить до дна сосуда-приемника.
Ватка, находящаяся около отверстия пробирки нужна, чтобы предотвратить попадание частиц перманганата калия в сосуд-приемник (при разложении выделяющийся кислород увлекает за собой частички перманганата).
Когда прибор собран, начинаем нагревание пробирки. Начинается выделение кислорода.
Уравнение реакции разложения перманганата калия:
2KMnO4 t° → K2MnO4 + MnO2 + O2↑
Как обнаружить присутствие кислорода? Воспользуемся способом Пристли. Подожжем деревянную лучину, дадим ей немного погореть, затем погасим, так, чтобы она едва тлела. Опустим тлеющую лучину в сосуд с кислородом. Лучина ярко вспыхивает!
Газоотводная трубка была не случайно опущена до дна сосуда-приемника. Кислород тяжелее воздуха, следовательно, он будет собираться в нижней части приемника, вытесняя из него воздух.
Кислород можно собрать и методом вытеснения воды. Для этого газоотводную трубку необходимо опустить в пробирку, заполненную водой, и опущенную в кристаллизатор с водой вниз отверстием. При поступлении кислорода газ вытесняет воду из пробирки.
Разложение пероксида водорода
Пероксид водорода – вещество всем известное. В аптеке оно продается под названием «перекись водорода». Данное название является устаревшим, более правильно использовать термин «пероксид». Химическая формула пероксида водорода Н2О2
Пероксид водорода при хранении медленно разлагается на воду и кислород. Чтобы ускорить процесс разложения можно произвести нагрев или применить катализатор.
Катализатор – вещество, ускоряющее скорость протекания химической реакции
Нальем в колбу пероксид водорода, внесем в жидкость катализатор. Катализатором может служить порошок черного цвета – оксид марганца MnO2. Тотчас смесь начнет вспениваться вследствие выделения большого количества кислорода. Внесем в колбу тлеющую лучину – она ярко вспыхивает. Уравнение реакции разложения пероксида водорода:
2h3O2 MnO2 → 2h3O + O2↑
Обратите внимание: катализатор, ускоряющий протекание реакции, записывается над стрелкой, или знаком «=», потому что он не расходуется в ходе реакции, а только ускоряет ее.
Разложение хлората калия
Хлорат калия – кристаллическое вещество белого цвета. Используется в производстве фейерверков и других различных пиротехнических изделий. Встречается тривиальное название этого вещества – «бертолетова соль». Такое название вещество получило в честь французского химика, впервые синтезировавшего его, – Клода Луи Бертолле. Химическая формула хлората калия KСlO3.
При нагревании хлората калия в присутствии катализатора – оксида марганца MnO2, бертолетова соль разлагается по следующей схеме:
2KClO3 t°, MnO2 → 2KCl + 3O2↑.
Разложение нитратов
Нитраты – вещества, содержащие в своем составе ионы NO3⎺. Соединения данного класса используются в качестве минеральных удобрений, входят в состав пиротехнических изделий. Нитраты – соединения термически нестойкие, и при нагревании разлагаются с выделением кислорода:

Обратите внимание, что все рассмотренные способы получения кислорода схожи. Во всех случаях кислород выделяется при разложении более сложных веществ.
Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые
В общем виде реакцию разложения можно описать буквенной схемой:
АВ → А + В.
Реакции разложения могут протекать при действии различных факторов. Это может быть нагревание, действие электрического тока, применение катализатора. Существуют реакции, в которых вещества разлагаются самопроизвольно.
Получение кислорода в промышленности
В промышленности кислород получают путем выделения его из воздуха. Воздух – смесь газов, основные компоненты которой представлены в таблице.
Сущность этого способа заключается в глубоком охлаждении воздуха с превращением его в жидкость, что при нормальном атмосферном давлении может быть достигнуто при температуре около -192°С. Разделение жидкости на кислород и азот осуществляется путем использования разности температур их кипения, а именно: Ткип. О2 = -183°С; Ткип.N2 = -196°С (при нормальном атмосферном давлении).
При постепенном испарении жидкости в газообразную фазу в первую очередь будет переходить азот, имеющий более низкую температуру кипения, и, по мере его выделения, жидкость будет обогащаться кислородом. Многократное повторение этого процесса позволяет получить кислород и азот требуемой чистоты. Такой способ разделения жидкостей на составные части называется ректификацией жидкого воздуха.
- В лаборатории кислород получают реакциями разложения
- Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые
- Кислород можно собрать методом вытеснения воздуха или методом вытеснения воды
- Для обнаружения кислорода используют тлеющую лучину, она ярко вспыхивает в нем
- Катализатор – вещество, ускоряющее химическую реакцию, но не расходующееся в ней
idaten.ru
