кислота | соли | ||
Название | Формула | Кислотный остаток | Название аниона |
КИСЛОРОДСОДЕРЖАЩИЕ кислоты и их соли | |||
Азотная | HNO3 | NO3— | Нитрат |
Азотистая | HNO2 | Нитрит | |
Алюминиевая (орто) | H3AlO3 | AlO33- | Орто-алюминат |
Алюминиевая (мета) | HAlO2 | AlO2— | Мета-алюминат |
Бериллиевая | H2BeO2 | BeO22- | Бериллат |
Борная (орто) | H3BO3 | BO 33- | Орто-борат |
Борная (мета) | HBO2 | BO2— | Мета-борат |
Борная (тетра) | H2B4O7 | B4O72- | Тетраборат |
Висмутовая | HBiO3 | BiO3— | Висмутат |
Вольфрамовая | H2WO4 | WO | Вольфрамат |
Железная | H2FeO4 | FeO42- | Феррат |
Железистая (мета) | HFeO2 | FeO2— | Феррит |
Кремниевая (орто) | H4SiO4 | SiO44- | Орто-силикат |
Кремниевая (мета) | H2SiO3 | SiO3 2- | Мета-силикат |
Марганцовая | HMnO4 | MnO4— | Перманганат |
Марганцовистая | H2MnO4 | MnO42- | Манганат |
Марганцоватистая | H2MnO3 | MnO32- | Манганит |
Молибденовая | H2MoO4 | MoO42- | Молибдат |
Мышьковая (орто) | H3AsO4 | AsO43- | Орто-арсенат |
Мышьяковая (мета) | HAsO3 | AsO3— | Мета-арсенат |
Димышьяковая | H4As2O7 | As2O74- | Диарсенат |
Оловянная (орто) | H4SnO4 | SnO 44- | Орто-станнат |
Оловянная (мета) | H2SnO3 | SnO32- | Мета-станнат |
Оловянистая | H2SnO2 | SnO22- | Станнит |
Селеновая | H2SeO4 | SeO42- | Селенат |
Селенистая | H2SeO3 | SeO | Селенит |
Свинцовая (орто) | H4PbO4 | PbO44- | Орто-плюмбат |
Свинцовая (мета) | H2PbO3 | PbO32- | Мета-плюмбат |
Свинцовистая | H2PbO2 | PbO22- | Плюмбит |
Серная | H2SO4 | SO 42- | Сульфат |
Дисерная | H2S2O7 | S2O72- | Дисульфат |
Надсерная | H2S2O8 | S2O82- | Пероксодисульфат |
Тиосерная | H2S2O3 | S2O32- | Тио-сульфат |
Дитионовая | H2S2O6 | S2O62- | Дитионат |
Тетратионовая | H2S4O6 | S4O62- | Тетратионат |
Сернистая | H2SO3 | SO32- | Сульфит |
Сурьмяная (орто) | H3SbO4 | SbO 43- | Орто-антимонат |
Сурьмяная (мета) | HSbO3 | SbO3— | Мета-антимонат |
Теллуровая | H2TeO4 | TeO42- | Теллурат |
Угольная | H2CO3 | CO32- | Карбонат |
Муравьиная | HCOOH | HCOO— | Формиат |
Уксусная | CH3COOH | CH3COO— | Ацетат |
Фосфорная (орто) | H3PO4 | PO43- | Орто-фосфат |
Фосфорная (мета) | HPO3 | PO3— | Мета-фосфат |
Дифосфорная | H4P2O7 | P2O74- | Дифосфат |
Фосфористая (орто) | H3PO3 | Н2PO3— и HPO32- | Ди- и ГИДРО-фосфиты |
Фосфористая (мета) | HPO2 | PO2— | Мета-фосфит |
Фосфорноватистая | H3PO2 | H2PO2— | Дигидро-гипо-фосфит |
Хромовая | H2CrO4 | CrO42- | Хромат |
Дихромовая | H2Cr2O7 | Cr2O72- | Дихромат |
Хромистая (орто) | H3CrO3 | CrO33- | Орто-хромит |
Хромистая (мета) | HCrO2 | CrO2— | Мета-хромит |
ОКСО-кислоты и -соли элементов Cl, Br, I – ПОДОБНЫ. | |||
Хлорная | HClO4 | ClO4— | Пер-хлорат |
Хлорноватая | HClO3 | ClO3— | Хлорат |
Хлористая | HClO2 | ClO2— | Хлорит |
Хлорноватистая | HClO | ClO— | Гипо-хлорит |
Бромная | HBrO4 | BrO4— | Пер-бромат |
Бромноватая | HBrO3 | BrO3— | Бромат |
Бромристая | HBrO2 | BrO2— | Бромит |
Бромноватистая | HBrO | BrO— | Гипо-бромит |
Иодная | HIO4 | IO4— | Пер-иодат |
Иодноватая | HIO3 | IO3— | Иодат |
Иодистая | HIO2 | IO2— | Иодит |
Иодноватистая | HIO | IO— | Гипо-иодит |
БЕСКИСЛОРОДНЫЕ кислоты и их соли | |||
Фтороводородная | HF | F— | Фторид |
Хлороводородная | HCl | Cl— | Хлорид |
Бромоводородная | HBr | Br— | Бромид |
Иодоводородная | HI | I— | Иодид |
Циановодородная | HCN | CN— | Цианид |
Тиоциановодородная | HSCN | SCN— | Тио-цианид |
Селеноводородная | H2Se | Se2- | Селенид |
Сероводородная | H2S | S2- | Сульфид |
Теллуроводородная | H2Te | Te2- | Теллурид |
studfiles.net
Формула кислоты | Название кислоты | Название соответствующей соли |
| HAlO2 | Метаалюминиевая | Метаалюминат |
| HBO2 | Метаборная | Метаборат |
| h4BO3 | Ортоборная | Ортоборат |
| HBr | Бромоводородная | Бромид |
| HCOOH | Муравьиная | Формиат |
| HCN | Циановодородная | Цианид |
| h3CO3 | Угольная | Карбонат |
| h3C2O4 | Щавелевая | Оксолат |
| h5C2O2 (Ch4COOH) | Уксусная | Ацетат |
| HCl | Хлороводородная | Хлорид |
| HClO | Хлорноватистая | Гипохлорит |
| HClO2 | Хлористая | Хлорит |
| HClO3 | Хлорноватая | Хлорат |
| HClO4 | Хлорная | Перхлорат |
| HCrO2 | Метахромистая | Метахромит |
| HCrO4 | Хромовая | Хромат |
| HCr2O7 | Двухромовая | Дихромат |
| HI | Иодоводородная | Иодид |
| HMnO4 | Марганцевая | Перманганат |
| h3MnO4 | Марганцовистая | Манганат |
| h3MoO4 | Молибденовая | Молибдат |
| HNO2 | Азотистая | Нитрит |
| HNO3 | Азотная | Нитрат |
| HPO3 | Метафосфорная | Метафосфат |
| HPO4 | Ортофосфорная | Ортофосфат |
| h5P2O7 | Двуфосфорная (Пирофосфорная) | Дифосфат (Пирофосфат) |
| h4PO3 | Фосфористая | Фосфит |
| h4PO2 | Фосфорноватистая | Гипофосфит |
| h3S | Сероводородная | Сульфид |
| h3SO3 | Сернистая | Сульфит |
| h3SO4 | Серная | Сульфат |
| h3S2O3 | Тиосерная | Тиосульфат |
| h3Se | Селеноводородная | Селенид |
| h3SiO3 | Кремниевая | Силикат |
| HVO3 | Ванадиевая | Ванадат |
| h3WO4 | Вольфрамовая | Вольфрамат |
reshal.ru
| Формула кислоты | Название кислоты | Формула кислотного остатка |
Название кислотного остатка |
| HF | Фтороводород (Плавиковая кислота) | F— | Фторид |
| HCl | Хлороводород (Соляная кислота) | Cl— | Хлорид |
| HBr | Бромоводород (Бромистоводородная кислота) | Br— | Бромид |
| HI | Йодоводород (Йодоводородная кислота) | I— | Йодид |
| H2S | Сероводород (Сероводородная кислота) | S2- | Сульфид |
| HCN | Циановодород (Синильная кислота) | CN— | Цианид |
| HNO2 | Азотистая | NO2— | Нитрит |
| HNO3 | Азотная | NO3— | Нитрат |
| H3PO4 | Ортофосфорная (Фосфорная кислота) | PO43- | Фосфат |
| H3AsO4 | Мышьяковая (Ортомышьяковая) | AsO43- | Арсенат |
| H2SO3 | Сернистая | SO32- | Сульфит |
| H2SO4 | Серная | SO42- | Сульфат |
| H2CO3 | Угольная | CO32- | Карбонат |
| H2SiO3 | Кремниевая | SiO32- | Силикат |
| H2CrO4 | Хромовая | CrO42- | Хромат |
| H2Cr2O7 | Дихромовая | Cr2O72- | Дихромат |
| HMnO4 | Марганцовая | MnO4— | Перманганат |
| HClO | Хлорноватистая | ClO- | Гипохлорит |
| HClO2 | Хлористая | ClO2— | Хлорит |
| HClO3 | Хлорноватая | ClO3— | Хлорат |
| HClO4 | Хлорная | ClO4— | Перхлорат |
| HCOOH | Метановая, Муравьиная | HCOO— | Формиат |
| CH3COOH | Этановая, Уксусная | CH3COO— | Ацетат |
| H2C2O4 | Этандиовая, Щавельная | C2O42- | Оксалат |
worldtable.info
Кислоты — классификация, получение и свойства » HimEge.ru
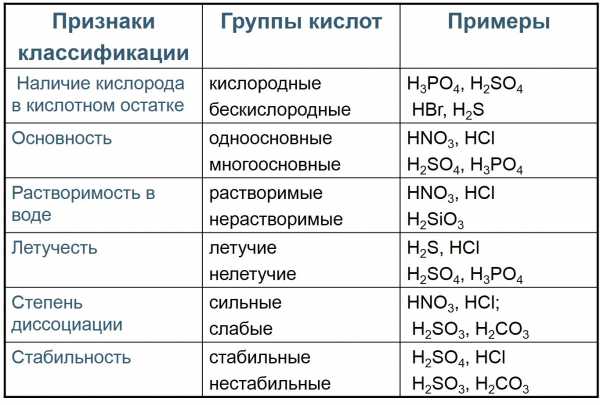
Кислоты — электролиты, диссоциирующие с образованием катионов водорода и анионов кислотного остатка
Общая формула кислот HnAc, где n – число атомов водорода, равное заряду иона кислотного остатка, Ac — кислотный остаток.
Сила кислот убывает в ряду:
HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > H2SO3 > H3PO4 > HF > HNO2 >H2CO3 > H2S > H2SiO3
Кислородосодержащие кислоты и соответствующие кислотные оксиды

Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3.
1) Взаимодействие простых веществ
(получают бескислородные кислоты)
H2 + Cl2 = 2HCl,
H2 + S = H2S.
2) Взаимодействие кислотных оксидов с водой
(получают кислородсодержащие кислоты)
SO3 + H2O = H2SO4,
3) Взаимодействие солей с растворами сильных кислот
(получают слабые кислоты)
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl,
SiO32- + 2H+ = H2SiO3.
4) Электролиз водных растворов солей
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4.
1) Растворы кислот кислые на вкус, изменяют окраску индикаторов:
лакмуса в красный цвет, метилового оранжевого – в розовый, цвет фенолфталеина не изменяется.
В водном растворе растворимые кислоты диссоциируют, образуя ион водорода, и кислотный остаток:
HCl = H+ + Cl—.
Многоосновные кислоты диссоциируют ступенчато:
H2SO4 = H+ + HSO4—,
HSO4— = H+ + SO42-.
Суммарное уравнение:
H2SO4 = 2H+ + SO42-
2) Взаимодействие с металлами
Ca + 2HCl = CaCl2 + H2
Водород из кислот-неокислителей могут вытеснять только металлы, стоящие в электрохимическом ряду напряжений металлов до водорода.
Кислоты-окислители — азотная и серная конц., реагируют с металлами по-другому, потому что в качестве окислителя выступает элемент кислотного остатка, а не водород!
Cu + 4HNO3 = Cu(NO3)2+ 2NO2↑+2H2O
Cu +2H2SO4 конц = CuSO4+SO2↑ + 2H2O
3) Взаимодействие с основными оксидами
CaO + 2HCl = CaCl2 + H2O
(если образуется растворимая соль)
4) Взаимодействие с основаниями (реакция нейтрализации)
H2SO4 + 2KOH = K2SO4 + 2H2O,
2H+ + 2OH— = 2H2O
2HCl + Cu(OH)2 = CuCl2 + 2H2O,
Cu(OH)2 + 2H+ = Cu2+ + 2H2O.
Многоосновные кислоты образуют кислые и средние соли:
H2SO4 + NaOH = NaHSO4 + H2O,
H2SO4 + 2NaOH = Na2SO4 + 2H2O.
5) Взаимодействие с солями
Реакции с солями происходят только в том случае, если в результате химического превращения образуется малодиссоциирующее вещество, выделяется газ или выпадает осадок.
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O,
CO32- + 2H+ = CO2 + H2O.
В этом случае выделяется углекислый газ и образуется малодиссоциирующее вещество – вода.
Na2SiO3 + H2SO4 = H2SiO3↓ + Na2SO4,
SiO32- + 2H+ = H2SiO3.
Реакция происходит, так как образуется осадок.
6) Специфические свойства кислот
Связаны с окислительно-восстановительными реакциями, бескислородные кислоты в растворе могут только окисляться (проявлять восстановительные свойства):
2KMn+7O4 + 16HCl— = Cl20 + 2KCl + 2Mn+2Cl2 + 8H2O,
H2S-2 + Br20 = S0 + 2HBr—.
Кислородсодержащие кислоты могут окисляться (проявлять восстановительные свойства), только когда центральный атом в них находится в промежуточной степени окисления, как, например, в сернистой кислоте:
H2S+4O3 + Cl20 + H2O = H2S+6O4 + 2HCl—.
Если центральный атом находится в максимальной степени окисления, то кислоты проявляют окислительные свойства, например, взаимодействие с металлами и неметаллами:
C0 + 2H2S+6O4 = C+4O2 + 2S+4O2 + 2H2O,
3P0 + 5HN+5O3 + 2H2O = 3H3P+5O4 + 5N+2O.
himege.ru
Таблица «Кислоты». Формулы, названия кислот, солей.
|
Молекулярная формула |
Название кислоты |
Сила |
Кислотный остаток и его заряд |
Название солей |
|
HCl |
соляная или хлороводородная |
сильная |
-Cl— |
хлориды |
|
H2 S |
сероводородная |
слабая |
-HS— =S2 — |
гидросульфиды сульфиды |
|
H2SO3 |
сернистая |
слабая |
-HSO3— =SO32 — |
гидросульфиты сульфиты |
|
HNO3 |
азотная |
сильная |
-NO3— |
нитраты |
|
H2SO4 |
серная |
сильная |
-H2SO4— =SO42 — |
гидросульфаты сульфаты |
|
H2SiO3 |
кремниевая |
слабая |
=SiO32 — |
силикаты |
|
H2CO3 |
угольная |
слабая |
-HCO3 — =CO3 2 — |
гидрокарбониты карбонаты |
|
H3PO4 |
фосфорная (ортофосфорная) |
слабая |
-H2PO4 — =HPO4 2 — =PO4 3 — |
дигидрофосфаты гидрофосфаты фосфаты
|
|
CH3COOH |
уксусная |
слабая |
CH3COOH— |
ацетаты |
|
HNO2 |
азотистая |
слабая |
-NO2 — |
нитриты |
Обратите внимание
Многоосновные кислоты образуют два вида солей: средние и кислые, причем трехосновная фосфорная образует кислые соли двух типов: дигидрофосфаты и гидрофосфаты. В порядке уменьшения силы наиболее распространенные кислоты располагаются так:
HNO3
H2SO4 H2SO3 H3PO4 CH3COOH
H2CO3 H2S
HClO
H2SiO3
HCl
iumka.ru
Кислоты
Кислоты бывают:
бескислородные: хлороводородная (соляная) HCl, сероводородная H2S
кислородосодержащие: азотная HNO3, серная H2SO4 и т.д.
• По числу атомов водорода: одноосновные (HNO3), двухосновные (H2SO4) трехосновные (H3PO4).
• По растворимости: растворимые, нерстворимые (см. таблицу растворимости)
На рисунке слева представлена небольшая часть уже знакомой тебе таблицы растворимости. Под общим названием анионы расположены различные отрицательно заряженные ионы, кроме гидроксид иона ОН— все остальные – это ионы кислотных остатков.
При пересечении, например столбца иона водорода Н+ с ионом хлора Cl— мы видим ячейку в которой находится буква Р (растворяется). Это значит, что соляная кислота HCl растворяется в воде. Так определяют растворимость кислот.
Запомни: Оксид, которому соответствует кислота называется кислотный оксид: S > SO3 > H2SO4 . Кслотный оксид SO3, ему соотвествует серная кислота.
Вопрос: Как составить формулу оксида соответствующего данной кислоте?
Пример: Для серной кислоты составим соответствующий оксид. Для этого:
1. Определим степень окисления элементов в кислоте.
H2SO4 — формула серной кислоты
Степени окисления водорода и кислорода нам известны: водорода +1, кислорода -2. Неизвестна только степень окисления у серы. Обозначим её х. Подставим все степени окисления в формулу серной кислоты.
H2+1SхO4-2 т.к. для химического соединения в сумме все степени окисления равны 0, можно составить уравнение:
+1 • 2 + х + (-2) • 4 = 0
решим его:
2 + х – 8 = 0
Х = +6
все степени окисления известны: H2+1S+6O4-2
2. Степень окисления серы в серной кислоте +6. Составим оксид соответствующий серной кислоте: S+6O3-2или SO3.
Таблица кислот и оксидов

Табл.1
В таблице представленны формулы кислот, их названия и оксиды, соответствующие данной кислоте.
* * *
.
osievskaja.narod.ru
Названия основных неорганических кислот и солей. Неорганические кислоты, соли
| Формулы кислот | Названия кислот | Названия соответствующих солей |
| HClO4 | хлорная | перхлораты |
| HClO3 | хлорноватая | хлораты |
| HClO2 | хлористая | хлориты |
| HClO | хлорноватистая | гипохлориты |
| H5IO6 | иодная | периодаты |
| HIO3 | иодноватая | иодаты |
| H2SO4 | серная | сульфаты |
| H2SO3 | сернистая | сульфиты |
| H2S2O3 | тиосерная | тиосульфаты |
| H2S4O6 | тетратионовая | тетратионаты |
| HNO3 | азотная | нитраты |
| HNO2 | азотистая | нитриты |
| H3PO4 | ортофосфорная | ортофосфаты |
| HPO3 | метафосфорная | метафосфаты |
| H3PO3 | фосфористая | фосфиты |
| H3PO2 | фосфорноватистая | гипофосфиты |
| H2CO3 | угольная | карбонаты |
| H2SiO3 | кремниевая | силикаты |
| HMnO4 | марганцовая | перманганаты |
| H2MnO4 | марганцовистая | манганаты |
| H2CrO4 | хромовая | хроматы |
| H2Cr2O7 | дихромовая | дихроматы |
| HF | фтороводородная (плавиковая) | фториды |
| HCl | хлороводородная (соляная) | хлориды |
| HBr | бромоводородная | бромиды |
| HI | иодоводородная | иодиды |
| H2S | сероводородная | сульфиды |
| HCN | циановодородная | цианиды |
| HOCN | циановая | цианаты |
Напомню кратко на конкретных примерах, как следует правильно называть соли.
Пример 1. Соль K2SO4 образована остатком серной кислоты (SO4) и металлом К. Соли серной кислоты называются сульфатами. K2SO4 — сульфат калия.
Пример 2. FeCl3 — в состав соли входит железо и остаток соляной кислоты (Cl). Название соли: хлорид железа (III). Обратите внимание: в данном случае мы не только должны назвать металл, но и указать его валентность (III). В прошлом примере в этом не было необходимости, т. к. валентность натрия постоянна.
Важно: в названии соли следует указывать валентность металла только в том случае, если данный металл имеет переменную валентность!
Пример 3. Ba(ClO)2 — в состав соли входит барий и остаток хлорноватистой кислоты (ClO). Название соли: гипохлорит бария. Валентность металла Ва во всех его соединениях равна двум, указывать ее не нужно.
Пример 4. (NH4)2Cr2O7. Группа NH4 называется аммоний, валентность этой группы постоянна. Название соли: дихромат (бихромат) аммония.
В приведенных выше примерах нам встретились только т. н. средние или нормальные соли. Кислые, основные, двойные и комплексные соли, соли органических кислот здесь обсуждаться не будут.
Для тренировки рекомендую вам самостоятельно назвать следующие соединения: LiF, NaClO3, Al2(SO4)3, Ni(NO3)2, KMnO4, AgBr, ZnCO3, (NH4)3PO4.
Если вас интересует не только номенклатура солей, но и методы их получения и химические свойства, рекомендую обратиться к соответствующим разделам справочника по химии: «Химические свойства неорганических соединений» и «Методы получения неорганических соединений».
www.repetitor2000.ru
