Латинские названия химических элементов (Таблица)
По древней традиции, корни которой тянутся к средним векам, все химические элементы получали свои названия на латинском языке; эта традиция не нарушается и в наше время. В начале XIX столетия для химических элементов были предложены сокращенные буквенные обозначения, которыми служили или одна начальная буква латинских названий элементов, или, значительно чаще, две буквы, начальная и одна из последующих. Так образовались современные знаки (символы) химических элементов, получившие впоследствии международное признание.
Русские названия химических элементов в большинстве представляют собой их латинские названия с измененными окончаниями в соответствии с особенностями нашего языка. Но вместе с тем можно назвать много элементов, которые имеют на русском языке особые названия, отличные от латинских. Этими названиями служат или коренные русские слова, например железо (Fe), медь (Сu), ртуть (Hg), или перевод латинского названия элемента на русский язык, например водород (Н), кислород (О). Для того, чтобы в этих случаях можно было понять происхождение символов, следует сопоставить их с латинскими названиями соответствующих элементов, указанными в табл. 2-16.
Попутно в примечаниях к таблице указываются те особые названия и обозначения химических элементов, которые применяются в научной литературе ряда зарубежных стран.
Примечания к таблице:
1) Жансен и независимо от него Локьер в 1868 г. обнаружили в спектре солнца неизвестные до того времени линии; этот новый элемент был назван гелием, так как предполагалось, что он находится только на солнце. Через 27 лет Рамзаи и Клив обнаружили те же линии в спектре нового газа, полученного ими при анализе минерала клевеита; название гелий для этого элемента было сохранено.
2) Еще в конце XVIII в. было известно, что при действии серной кислоты на плавиковый шпат выделяется особая кислота, которая разъедает стекло. В 1810 г. Ампер показал, что эта кислота подобна соляной и является соединением с водородом некоторого неизвестного элемента, который он назвал фтором. В чистом виде фтор удалось получить Муассану только в 1886 г.
3) Окись магния была известна давно, ее исследовал Блэк еще в 1775 г. Деви в 1808 г. пытался получить металлический магний, но в чистом виде металл получить ему не удалось.
4) Двуокись титана была получена лабораторным путем еще в конце XVIII в., Берцелиус получал титан, но не вполне чистый. Более чистый металлический титан был получен Грегор, затем Муассаном.
5) Сернистые соединения мышьяка былп известны в древнее время.
6) В начале XIX в. была получена смесь ниобия и тантала, которая рассматривалась как новый элемент; ему было присвоено название колумбий. В Америке и Англии ниобий до сих пор носит название колумбий.
7) В виде окиси церий был получен в 1803 г.
8) Долгое время смесь празеодима и неодима считалась отдельным элементом, который назывался дидием (Di).
9) Как особый металл платина была описана в 1750 г.; до 1810 г. единственным местом добычи платины была Колумбия. Затем платина была найдена в других местах, в том числе на Урале, который до настоящего времени является наиболее богатым источником ее получения.
10) Двуокись урана, полученная впервые еще в 1789 г., была принята вначале за новый элемент. Металлический уран был получен впервые в 1842 г., его радиоактивные свойства были открыты только в 1896 г.
_______________
Источник информации: КРАТКИЙ ФИЗИКО-ТЕХНИЧЕСКИЙ СПРАВОЧНИК/ Том 1, — М.: 1960.
infotables.ru
|
Латинское название |
Символ |
Русское название |
Происхождение названия |
|
Aluminium |
Al |
Алюминий |
От слова alumen — квасцы |
|
Argentum |
Ag |
Серебро |
От слова arguo — делаю ясным |
|
Arsenicum |
As |
Мышьяк (т.е. мышиный яд) |
Возможно, от греч. arsеn — мужественный, сильный (яд) |
|
Aurum |
Au |
Золото |
Древнелатинское |
|
Barium |
Ba |
Барий |
Название произошло от названия минерала барита, из которого он был получен; греч. barys — тяжелый |
|
Bismuthum |
Bi |
Висмут |
Немецкое происхождение (weise Masse — белая масса) |
|
Borum |
B |
Бор |
От слова borax — бура |
|
Bromum |
Br |
Бром |
От греч. bromos — зловонньй (из-за неприятного запаха) |
|
Calcium |
Ca |
Кальций |
От лат. calx — известняк |
|
Carboneum |
С |
Углерод |
От лат. carbo — уголь |
|
Chlorum |
Cl |
Хлор |
От греч. chloros — зеленый |
|
Cuprum |
Cu |
Медь |
От названия острова Кипр |
|
Ferrum |
Fe |
Железо |
Древнелатинское |
|
Fluоrum |
F |
Фтор (от греч phthorios — разрушаю-щий) |
Oт названия минерала флюорита |
|
Jodum |
J |
Йод |
Oт греч. iodes — фиолетовый |
|
Hydrogenium |
H |
Водород |
От греч. hydor — вода+ -genes — родящий, производящий |
|
Nitrogenium |
N |
Азот |
Oт греч. nitron — природная сода, селитра и -genes – родящий, производящий (встречается в виде селитр) |
|
Oxygenium |
O |
Кислород |
От греч. кислый и -genes – родящий, производящий (“рождающий кислоту”) |
|
Hydrargyrum |
Hg |
Ртуть |
От греч. hydor — вода, жидкость и argyros – cеребро; буквально: жидкое серебро |
Kalium |
K |
Калий |
От арабск. Al-qali – зола растений, щелочь |
|
Lithium |
Li |
Литий |
От греч. lithos — камень |
|
Magnesium seu Magnium |
Mg |
Магний |
От названия местности в Малой Азии |
|
Manganum |
Mn |
Марганец |
От итальянского manganese |
|
Natrium |
Na |
Натрий |
От арабск. natron — сода, из греч. nitron |
|
Phosphorus |
P |
Фосфор |
От греч. phos — свет + phoros — несущий |
|
Plumbum |
Pb |
Свинец |
Древнелатинское |
|
Silicium |
Si |
Кремний |
От лат. silex — твердый камень |
|
Stibium |
Sb |
Сурьма |
Древнелатинское |
|
Sulfur |
S |
Сера |
Древнелатинское |
|
Thallium |
Tl |
Таллий |
От греч. thallos — зелёная ветвь (по зелёному цвету линий спектра) |
|
Zincum |
Zn |
Цинк |
Немецкое |
ebooks.grsu.by
Ответы@Mail.Ru: Химические элементы на латыни
Посмотрите здесь <a href=»/» rel=»nofollow» title=»96215:##:2006/03/5.htm»>[ссылка заблокирована по решению администрации проекта]</a> и здесь <a rel=»nofollow» href=»http://latinsk.ru/index.php?option=com_content&task=view&id=103&Itemid=75″ target=»_blank»>http://latinsk.ru/index.php?option=com_content&task=view&id=103&Itemid=75</a>
Русское название Символ Латинское название элемента Азот N Nitrogenium Актиний Ас Actinium Алюминий Аl Aluminium Америций Аm Americium Аргон 1) Аr Argon Астат At Astatinum Барий Bа Barium Бериллий 2) Be Beryllium Беркелий Bk Berkelium Бор В Borum Бром Вr Bromum Ванадий V Vanadium Висмут Bi Bismutum Водород Н Hydrogenium Вольфрам 3) W Wolframium Гадолиний Gd Gadolinium Галлий Ga Gallium Гафний Hf Hafnium Гелий Не Helium Германий Ge Germanium Гольмий Но Holmium Диспрозий Dy Dysprosium Европий Eu Europium Железо Fe Ferrum Золото Au Aurum Индий In Indium Иод 4) J Jodum Иридий Ir Iridium Иттербий Yb Ytterbium Иттрий Y Yttrium Кадмий Cd Cadmium Калий К Kalium Калифорний Cf Californium Кальций Ca Calcium Кислород О Oxygenium Кобальт Co Cobaltum Кремний Si Silicium Криптон Kr Krypton Ксенон 5) Xe Xenon Кюрий Cm Curium Лантан La Lanthanum Литий Li Lithium Лютеций 6) Lu Lutetium Магний Mg Magnesium Марганец Mn Manganum Медь Си Cuprum Менделевий Mv Mendelevium Молибден Мо Molybdanum Мышьяк As Arsenicum Натрий Na Natrium Неодим Nd Neodymium Неон Ne Neon Нептуний Np Neptunium Никель Ni Niccolum Ниобий 7) Mb Niobium Олово Sn Stannum Осмий Os Osmium Палладий Pd Palladium Платина Pt Platinum Плутоний Pu Plutonium Полоний Po Polonium Празеодим Pr Praseodimium Прометий Pm Promethium Протактиний Pa Protactinium Радий Ra Radium Радон 8) Rn Radon Рений Re Renium Родий Rh Rhodium Ртуть Hg Hydrargyrum Рубидий Rb Rubidium Рутений Ru Ruthenium Самарий Sm Samarium Свинец Pb Plumbum Селен Se Selenium Сера S Sulfur Серебро Ag Argentum Скандий Sc Scandium Стронций Sr Strontium Сурьма Sb Stibium Таллий T1 Thallium Тантал Та Tantalum Теллур Те Tellurium Тербий Tb Terbium Технеций Tc Technetium Титан Ti Titanium Торий Th Thorium Туллий 9) Tu Thulium Углерод C Carboneum Уран U Uranium Фермий Fm Fermium Фосфор P Phosphorus Франций 10) Fr Francium Фтор F Fluorum Хлор Cl Chlorum Хром Cr Chromium Цезий Cs Cesium Церий Ce Cerium Цинк Zn Zincum Цирконий Zr Zirconium Эйнштейний En Einsteinium Эрбий Er Erbium <img src=»//otvet.imgsmail.ru/download/223448423_e0b13c1c9cb5bfe54d6bac27c9977a81_800.png» alt=»» data-lsrc=»//otvet.imgsmail.ru/download/223448423_e0b13c1c9cb5bfe54d6bac27c9977a81_120x120.png» data-big=»1″>
touch.otvet.mail.ru
Алюминий. Описание, свойства, происхождение и применение металла

Кусок чистого алюминия
Алюминий — очень редкий минерал семейства меди-купалита подкласса металлов и интерметаллидов класса самородных элементов. Преимущественно в виде микроскопических выделений сплошного мелкозернистого строения. Может образовывать пластинчатые или чешуйчатые кристаллы до 1 мм., отмечены нитевидные кристаллы длиной до 0,5 мм. при толщине нитей несколько мкм. Лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке.
СТРУКТУРА
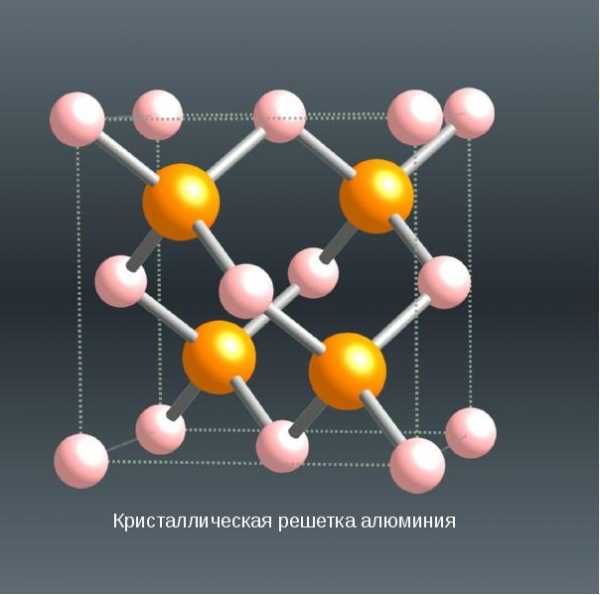
Кубическая гранецентрированная структура. 4 оранжевых атома
Кристаллическая решетка алюминия — гранецентрированный куб, которая устойчива при температуре от 4°К до точки плавления. В алюминии нет аллотропических превращений, т.е. его строение постоянно. Элементарная ячейка состоит из четырех атомов размером 4,049596×10-10 м; при 25 °С атомный диаметр (кратчайшее расстояние между атомами в решетке) составляет 2,86×10-10 м, а атомный объем 9,999×10-6 м3/г-атом.
Примеси в алюминии незначительно влияют на величину параметра решетки. Алюминий обладает большой химической активностью, энергия образования его соединений с кислородом, серой и углеродом весьма велика. В ряду напряжений он находится среди наиболее электроотрицательных элементов, и его нормальный электродный потенциал равен -1,67 В. В обычных условиях, взаимодействуя с кислородом воздуха, алюминий покрыт тонкой (2-10-5 см), но прочной пленкой оксида алюминия А1203, которая защищает от дальнейшего окисления, что обусловливает его высокую коррозионную стойкость. Однако при наличии в алюминии или окружающей среде Hg, Na, Mg, Ca, Si, Си и некоторых других элементов прочность оксидной пленки и ее защитные свойства резко снижаются.
СВОЙСТВА

Самородный алюминий. Поле зрения 5 x 4 мм. Азербайджан, Гобустанский район, Каспийское море, Хере-Зиря или остров Булла
Алюминий — мягкий, легкий, серебристо-белый металл с высокой тепло- и электропроводностью, парамагнетик. Температура плавления 660°C. К достоинствам алюминия и его сплавов следует отнести его малую плотность (2,7 г/см3), сравнительно высокие прочностные характеристики, хорошую тепло- и электропроводность, технологичность, высокую коррозионную стойкость. Совокупность этих свойств позволяет отнести алюминий к числу важнейших технических материалов. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминий химически активен (на воздухе покрывается защитной оксидной пленкой — оксидом алюминия.) надежно предохраняет металл от дальнейшего окисления. Но если порошок алюминия или алюминиевую фольгу сильно нагреть, то металл сгорает ослепительным пламенем, превращаясь в оксид алюминия. Алюминий растворяется даже в разбавленных соляной и серной кислотах, особенно при нагревании. А вот в сильно разбавленной и концентрированной холодной азотной кислоте алюминий не растворяется. При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты — соли, содержащие алюминий в составе аниона.
ЗАПАСЫ И ДОБЫЧА

Кусочки алюминия
По распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14%.
Современный метод получения, процесс Холла—Эру был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов. Такой метод получения требует очень больших затрат электроэнергии, и поэтому получил промышленное применение только в XX веке.
ПРОИСХОЖДЕНИЕ

Аллюминий, агрегированный с коркой байерита на поверхности. Узбекистан, Навойская область, Учкудук
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико. Самые распространенные вещества, содержащие рассматриваемый металл: полевые шпаты; бокситы; граниты; кремнезем; алюмосиликаты; базальты и прочие. В небольшом количестве алюминий обязательно входит в состав клеток живых организмов. Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
ПРИМЕНЕНИЕ

Украшение из алюминия
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость. Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при напылении проводников на поверхности кристаллов микросхем.
Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Так, Наполеон III заказал алюминиевые пуговицы, а Менделееву в 1889 г. были подарены весы с чашами из золота и алюминия. Мода на ювелирные изделия из алюминия сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.
Алюминий (англ. Aluminium) — Al
| Молекулярный вес | 26.98 г/моль |
| Происхождение названия | от латинского alumen |
| IMA статус | утверждён в 1978 |
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.21
| Strunz (8-ое издание) | 1/A.03-05 |
| Nickel-Strunz (10-ое издание) | 1.AA.05 |
| Dana (7-ое издание) | 1.1.22.1 |
| Dana (8-ое издание) | 1.1.1.5 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | серовато-белый, белый |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | нет |
| Твердость (шкала Мооса) | 2-3 |
| Прочность | ковкий |
| Плотность (измеренная) | 2.7 г/см3 |
| Радиоактивность (GRapi) | 0 |
ОПТИЧЕСКИЕ СВОЙСТВА
Плеохроизмне плеохроирует
| Тип | изотропный |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
| Магнетизм | парамагнетик |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | (4/m 3 2/m) — изометричная гексаоктаэдральная |
| Пространственная группа | F m3m, P m3m |
| Сингония | кубическая |
| Параметры ячейки | a = 4.04Å |
Интересные статьи:
mineralpro.ru 26.07.2016mineralpro.ru
Название
Открытие
Открытие
Положение в периодической системе, строение атома
Нахождение в природе
Важнейшие алюминиевые руды:
Получение
Физические свойства
Химические свойства
Химические свойства
Химические свойства
Химические свойства
Применение алюминия:
Применение
Применение
Применение
Важнейшие соединения алюминия:
Оксид алюминия
Гидроксид алюминия
Матикова Алла9 а класс. |
dok.opredelim.com
алюминий — это… Что такое алюминий?
АЛЮМИ́НИЙ -я; м. [от лат. alumen (aluminis) — квасцы]. Химический элемент (Al), серебристо-белый лёгкий ковкий металл с высокой электропроводностью (применяемый в авиации, электротехнике, строительстве, быту и т.п.). Сульфат алюминия. Сплавы алюминия.
АЛЮМИ́НИЙ (лат. Aluminium), Al (читается «алюминий»), химический элемент с атомным номером 13, атомная масса 26,98154. Природный алюминий состоит из одного нуклида 27Al. Расположен в третьем периоде в группе IIIA периодической системы элементов Менделеева. Конфигурация внешнего электронного слоя 3s2p1. Практически во всех соединениях степень окисления алюминия +3 (валентность III).Радиус нейтрального атома алюминия 0,143 нм, радиус иона Al3+ 0,057 нм. Энергии последовательной ионизации нейтрального атома алюминия равны, соответственно, 5,984, 18,828, 28,44 и 120 эВ. По шкале Полинга электроотрицательность алюминия 1,5.
Простое вещество алюминий — мягкий легкий серебристо-белый металл.
История открытия
Латинское aluminium происходит от латинского же alumen, означающего квасцы (см. КВАСЦЫ) (сульфат алюминия и калия KAl(SO4)2·12H2O), которые издавна использовались при выделке кож и как вяжущее средство. Из-за высокой химической активности открытие и выделение чистого алюминия растянулось почти на 100 лет. Вывод о том, что из квасцов может быть получена «земля» (тугоплавкое вещество, по-современному — оксид алюминия (см. АЛЮМИНИЯ ОКСИД)) сделал еще в 1754 немецкий химик А. Маргграф (см. МАРГГРАФ Андреас Сигизмунд). Позднее оказалось, что такая же «земля» может быть выделена из глины, и ее стали называть глиноземом. Получить металлический алюминий смог только в 1825 датский физик Х. К. Эрстед (см. ЭРСТЕД Ханс Кристиан). Он обработал амальгамой калия (сплавом калия со ртутью) хлорид алюминия AlCl3, который можно было получить из глинозема, и после отгонки ртути выделил серый порошок алюминия.
Только через четверть века этот способ удалось немного модернизировать. Французский химик А. Э. Сент-Клер Девиль (см. СЕНТ-КЛЕР ДЕВИЛЬ Анри Этьен) в 1854 предложил использовать для получения алюминия металлический натрий (см. НАТРИЙ), и получил первые слитки нового металла. Стоимость алюминия была тогда очень высока, и из него изготовляли ювелирные украшения.
Промышленный способ производства алюминия путем электролиза расплава сложных смесей, включающих оксид, фторид алюминия и другие вещества, независимо друг от друга разработали в 1886 году П. Эру (см. ЭРУ Поль Луи Туссен) (Франция) и Ч. Холл (США). Производство алюминия связано с высоким расходом электроэнергии, поэтому в больших масштабах оно было реализовано только в 20 веке. В Советском Союзе первый промышленный алюминий был получен 14 мая 1932 года на Волховском алюминиевом комбинате, построенном рядом с Волховской гидроэлектростанцией.
Нахождение в природе
По распространенности в земной коре алюминий занимает первое место среди металлов и третье место среди всех элементов (после кислорода и кремния), на его долю приходится около 8,8% массы земной коры. Алюминий входит в состав огромного числа минералов, главным образом, алюмосиликатов (см. АЛЮМОСИЛИКАТЫ), и горных пород. Соединения алюминия содержат граниты (см. ГРАНИТ), базальты (см. БАЗАЛЬТ), глины (см. ГЛИНА), полевые шпаты (см. ПОЛЕВЫЕ ШПАТЫ) и др. Но вот парадокс: при огромном числе минералов и пород, содержащих алюминий, месторождения бокситов (см. БОКСИТЫ) — главного сырья при промышленном получении алюминия, довольно редки. В России месторождения бокситов имеются в Сибири и на Урале. Промышленное значение имеют также алуниты (см. АЛУНИТ) и нефелины (см. НЕФЕЛИН).
В качестве микроэлемента алюминий присутствует в тканях растений и животных. Существуют организмы-концентраторы, накапливающие алюминий в своих органах, — некоторые плауны, моллюски.
Промышленное получение
При промышленном производстве бокситы сначала подвергают химической переработке, удаляя из них примеси оксидов кремния и железа и других элементов. В результате такой переработки получают чистый оксид алюминия Al2O3 — основное сырье при производстве металла электролизом. Однако из-за того, что температура плавления Al2O3 очень высока (более 2000 °C), использовать его расплав для электролиза не удается.
Выход ученые и инженеры нашли в следующем. В электролизной ванне сначала расплавляют криолит (см. КРИОЛИТ) Na3AlF6 (температура расплава немного ниже 1000 °C). Криолит можно получить, например, при переработке нефелинов Кольского полуострова. Далее в этот расплав добавляют немного Al2О3 (до 10 % по массе) и некоторые другие вещества, улучающие условия проведения последующего процесса. При электролизе этого расплава происходит разложение оксида алюминия, криолит остается в расплаве, а на катоде образуется расплавленный алюминий:
2Al2О3 = 4Al + 3О2.
Так как анодом при электролизе служит графит, то выделяющийся на аноде кислород реагирует с графитом и образуется углекислый газ СО2.
При электролизе получают металл с содержанием алюминия около 99,7%. В технике применяют и значительно более чистый алюминий, в котором содержание этого элемента достигает 99,999% и более.
Физические и химические свойства
Алюминий — типичный металл, кристаллическая решетка кубическая гранецентрированная, параметр а = 0,40403 нм. Температура плавления чистого металла 660 °C, температура кипения около 2450 °C, плотность 2,6989 г/см3. Температурный коэффициент линейного расширения алюминия около 2,5·10-5 К-1. Стандартный электродный потенциал Al3+/Al –1,663В.
Химически алюминий — довольно активный металл. На воздухе его поверхность мгновенно покрывается плотной пленкой оксида Al2О3, которая препятствует дальнейшему доступу кислорода к металлу и приводит к прекращению реакции, что обусловливает высокие антикоррозионные свойства алюминия. Защитная поверхностная пленка на алюминии образуется также, если его поместить в концентрированную азотную кислоту.
С остальными кислотами алюминий активно реагирует:
6НСl + 2Al = 2AlCl3 + 3H2,
3Н2SO4 + 2Al = Al2(SO4)3 + 3H2.
Алюминий реагирует с растворами щелочей. Сначала растворяется защитная оксидная пленка:
Al2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
Затем протекают реакции:
2Al + 6H2O = 2Al(OH)3 + 3H2,
NaOH + Al(OH)3 = Na[Al(OH)4],
или суммарно:
2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2,
и в результате образуются алюминаты (см. АЛЮМИНАТЫ): Na[Al(OH)4] — алюминат натрия (тетрагидроксоалюминат натрия), К[Al(OH)4] — алюминат калия (терагидроксоалюминат калия) или др. Так как для атома алюминия в этих соединениях характерно координационное число (см. КООРДИНАЦИОННОЕ ЧИСЛО) 6, а не 4, то действительные формулы указанных тетрагидроксосоединений следующие: Na[Al(OH)4(Н2О)2] и К[Al(OH)4(Н2О)2].
При нагревании алюминий реагирует с галогенами:
2Al + 3Cl2 = 2AlCl3,
2Al + 3 Br2 = 2AlBr3.
Интересно, что реакция между порошками алюминия и иода (см. ИОД) начинается при комнатной температуре, если в исходную смесь добавить несколько капель воды, которая в данном случае играет роль катализатора:
2Al + 3I2 = 2AlI3.
Взаимодействие алюминия с серой при нагревании приводит к образованию сульфида алюминия:
2Al + 3S = Al2S3,
который легко разлагается водой:
Al2S3 + 6Н2О = 2Al(ОН)3 + 3Н2S.
С водородом алюминий непосредственно не взаимодействует, однако косвенными путями, например, с использованием алюминийорганических соединений (см. АЛЮМИНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ), можно синтезировать твердый полимерный гидрид алюминия (AlН3)х — сильнейший восстановитель.
В виде порошка алюминий можно сжечь на воздухе, причем образуется белый тугоплавкий порошок оксида алюминия Al2О3.
Высокая прочность связи в Al2О3 обусловливает большую теплоту его образования из простых веществ и способность алюминия восстанавливать многие металлы из их оксидов, например:
3Fe3O4 + 8Al = 4Al2O3 + 9Fe и даже
3СаО + 2Al = Al2О3 + 3Са.
Такой способ получения металлов называют алюминотермией (см. АЛЮМИНОТЕРМИЯ).
Амфотерному оксиду Al2О3 соответствует амфотерный гидроксид — аморфное полимерное соединение, не имеющее постоянного состава. Состав гидроксида алюминия может быть передан формулой xAl2O3·yH2O, при изучении химии в школе формулу гидроксида алюминия чаще всего указывают как Аl(OH)3.
В лаборатории гидроксид алюминия можно получить в виде студенистого осадка обменными реакциями:
Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4,
или за счет добавления соды к раствору соли алюминия:
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3Ї + 6NaCl + 3CO2,
а также добавлением раствора аммиака к раствору соли алюминия:
AlCl3 + 3NH3·H2O = Al(OH)3Ї + 3H2O + 3NH4Cl.
Применение
По масштабам применения алюминий и его сплавы занимают второе место после железа и его сплавов. Широкое применение алюминия в различных областях техники и быта связано с совокупностью его физических, механических и химических свойств: малой плотностью, коррозионной стойкостью в атмосферном воздухе, высокой тепло- и электропроводностью, пластичностью и сравнительно высокой прочностью. Алюминий легко обрабатывается различными способами — ковкой, штамповкой, прокаткой и др. Чистый алюминий применяют для изготовления проволоки (электропроводность алюминия составляет 65,5% от электропроводности меди, но алюминий более чем в три раза легче меди, поэтому алюминий часто заменяет медь в электротехнике) и фольги, используемой как упаковочный материал. Основная же часть выплавляемого алюминия расходуется на получение различных сплавов. Сплавы алюминия отличаются малой плотностью, повышенной (по сравнению с чистым алюминием) коррозионной стойкостью и высокими технологическими свойствами: высокой тепло- и электропроводностью, жаропрочностью, прочностью и пластичностью. На поверхности сплавов алюминия легко наносятся защитные и декоративные покрытия.
Разнообразие свойств алюминиевых сплавов обусловлено введением в алюминий различных добавок, образующих с ним твердые растворы или интерметаллические соединения. Основную массу алюминия используют для получения легких сплавов — дуралюмина (см. ДУРАЛЮМИН) (94% Al, 4% Cu, по 0,5% Mg, Mn, Fe и Si), силумина (85—90% Al, 10—14% Si, 0,1% Na) и др. В металлургии алюминий используется не только как основа для сплавов, но и как одна из широко применяемых легирующих добавок в сплавах на основе меди, магния, железа, никеля и др.
Сплавы алюминия находят широкое применение в быту, в строительстве и архитектуре, в автомобилестроении, в судостроении, авиационной и космической технике. В частности, из алюминиевого сплава был изготовлен первый искусственный спутник Земли. Сплав алюминия и циркония — циркалой — широко применяют в ядерном реакторостроении. Алюминий применяют в производстве взрывчатых веществ.
Особо следует отметить окрашенные пленки из оксида алюминия на поверхности металлического алюминия, получаемые электрохимическим путем. Покрытый такими пленками металлический алюминий называют анодированным алюминием. Из анодированного алюминия, по внешнему виду напоминающему золото, изготовляют различную бижутерию.
При обращении с алюминием в быту нужно иметь в виду, что нагревать и хранить в алюминиевой посуде можно только нейтральные (по кислотности) жидкости (например, кипятить воду). Если, например, в алюминиевой посуде варить кислые щи, то алюминий переходит в пищу и она приобретает неприятный «металлический» привкус. Поскольку в быту оксидную пленку очень легко повредить, то использование алюминиевой посуды все-таки нежелательно.
Алюминий в организме
В организм человека алюминий ежедневно поступает с пищей (около 2—3 мг), но его биологическая роль не установлена. В среднем в организме человека (70 кг) в костях, мышцах содержится около 60 мг алюминия.
dic.academic.ru
Алюминий — ТеплоВики — энциклопедия отопления
Материал из ТеплоВики — энциклопедия отоплении
Алюминий (лат. Aluminium) — Al, химический элемент III группы периодической системы Менделеева; атомный номер 13, атомная масса 26,9815; серебристо-белый лёгкий металл. Состоит из одного стабильного изотопа 27Al.
Историческая справка
Название алюминий происходит от латинского alumen — так ещё за 500 лет до н. э. назывались алюминиевые квасцы, которые применялись как протрава при крашении тканей и для дубления кожи. Датский учёный Х. К. Эрстед в 1825, действуя амальгамой калия на безводный AlCl3 и затем отгоняя ртуть, получил относительно чистый алюминий. Первый промышленный способ производства алюминия предложил в 1854 французский химик Анри Сент-Клер Девиль: способ заключался в восстановлении двойного хлорида алюминия и натрия Na3AICI6 металлическим натрием. Похожий по цвету на серебро, алюминий на первых порах ценился очень дорого. С 1855 по 1890 было получено всего 200 тонн алюминия. Современный способ получения алюминия электролизом криолито-глинозёмного расплава разработан в 1886 одновременно и независимо друг от друга Ч. Холлом в США и П. Эру во Франции.
Свойства
Замечательным свойством алюминия является его легкость; плотность алюминия примерно в три раза меньше, чем у стали, меди или цинка.
Чистый алюминий — мягкий металл, но образует сплавы с другими элементами, что обеспечивает большой диапазон полезных свойств. В ряду величин теплопроводности и электрической проводимости алюминий стоит после серебра и меди. Алюминий отличается высокой реакционной способностью, поэтому он не встречается в природе в свободном состоянии. Металлический алюминий быстро растворяется в соляной кислоте с образованием хлорида AlCl3, медленнее — в серной с образованием сульфата Al2(SO4)3, но с азотной кислотой реагирует только в присутствии солей ртути. В реакции со щелочами он образует алюминаты, например, с NaOH образует NaAlO2.
Алюминий проявляет амфотерные свойства, так как он реагирует и с кислотами, и со щелочами. На воздухе алюминий быстро покрывается прочной защитной пленкой оксида Al2O3, предохраняющей его от дальнейшего окисления. Поэтому алюминий стабилен на воздухе и в присутствии влаги даже при умеренном нагревании. Если защитная пленка оксида нарушена, то при нагревании на воздухе или в кислороде он сгорает ярким белым пламенем. При нагревании алюминий активно реагирует с галогенами, серой, углеродом и азотом. Расплавленный алюминий реагирует с водой со взрывом.
| Свойства алюминия | ||
|---|---|---|
| Атомный номер | 13 | |
| Атомная масса | 26,9815 | |
| Изотопы: | стабильные | 27 |
| нестабильные | 24, 25, 26, 28, 29 | |
| Температура плавления | 660°С | |
| Температура кипения | 2467°С | |
| Плотность | 2,7 г/см3 | |
| Твердость (по Моосу) | 2,0-2,9 | |
| Содержание в земной коре | 8,13% | |
| Степени окисления | +3 | |
Сплавы
К ним относятся литейные сплавы (Al — Si), сплавы для литья под давлением (Al — Mg) и самозакаливающиеся сплавы повышенной прочности (Al — Cu). Алюминиевые сплавы экономичны, легкодоступны, прочны при низких температурах и легко обрабатываемы (они легко куются, штампуются, пригодны для глубокой вытяжки, волочения, экструдирования, литья, хорошо свариваются и обрабатываются на металлорежущих станках). К сожалению, механические свойства всех алюминиевых сплавов начинают заметно ухудшаться при температурах выше приблизительно 175°С. Но благодаря образованию защитной оксидной пленки они проявляют хорошую коррозионную стойкость в большинстве обычных агрессивных сред. Эти сплавы хорошо проводят электричество и тепло, обладают высокой отражательной способностью, немагнитны, безвредны в контакте с пищевыми продуктами (поскольку продукты коррозии бесцветны, не имеют вкуса и нетоксичны), взрывобезопасны (поскольку не дают искр) и хорошо поглощают ударные нагрузки. Благодаря такому сочетанию свойств алюминиевые сплавы служат хорошими материалами для легких поршней, применяются в вагоно-, автомобиле- и самолетостроении, в пищевой промышленности, в качестве архитектурно-отделочных материалов, в производстве осветительных отражателей, технологических и бытовых кабелепроводов, при прокладке высоковольтных линий электропередачи. Примесь железа, от которой трудно избавиться, повышает прочность алюминия при высоких температурах, но снижает коррозионную стойкость и пластичность при комнатной температуре. Кобальт, хром и марганец ослабляют охрупчивающее действие железа и повышают коррозионную стойкость. При добавлении лития к алюминию повышаются модуль упругости и прочность, что делает такой сплав весьма привлекательным для авиакосмической промышленности. К сожалению, при своем превосходном отношении предела прочности к массе (удельной прочности) сплавы алюминия с литием обладают низкой пластичностью.
Применение
Сочетание физических, механических и химических свойств алюминия определяет его широкое применение практически во всех областях техники, особенно в виде его сплавов с др. металлами. В электротехнике алюминий успешно заменяет медь, особенно в производстве массивных проводников, например в воздушных линиях, высоковольтных кабелях, шинах распределительных устройств, трансформаторах (электрическая проводимость алюминия достигает 65,5% электрической проводимости меди, и он более чем в три раза легче меди; при поперечном сечении, обеспечивающем одну и ту же проводимость, масса проводов из алюминия вдвое меньше медных).
Сверхчистый алюминий употребляют в производстве электрических конденсаторов и выпрямителей, действие которых основано на способности окисной плёнки алюминия пропускать электрический ток только в одном направлении. Сверхчистый алюминий, очищенный зонной плавкой, применяется для синтеза полупроводниковых соединений типа AIIIBV, применяемых для производства полупроводниковых приборов.
Чистый алюминий используют в производстве разного рода зеркал отражателей. Алюминий высокой чистоты применяют для предохранения металлических поверхностей от действия атмосферной коррозии (плакирование, алюминиевая краска). Обладая относительно низким сечением поглощения нейтронов, алюминий применяется как конструкционный материал в ядерных реакторах.
В алюминиевых резервуарах большой ёмкости хранят и транспортируют жидкие газы (метан, кислород, водород и т. д.), азотную и уксусную кислоты, чистую воду, перекись водорода и пищевые масла. Алюминий широко применяют в оборудовании и аппаратах пищевой промышленности, для упаковки пищевых продуктов (в виде фольги), для производства разного рода бытовых изделий. Резко возросло потребление алюминия для отделки зданий, архитектурных, транспортных и спортивных сооружений.
В металлургии алюминий (помимо сплавов на его основе) — одна из самых распространённых легирующих добавок в сплавах на основе Cu, Mg, Ti, Ni, Zn и Fe. Применяют алюминий также для раскисления стали перед заливкой её в форму, а также в процессах получения некоторых металлов методом алюминотермии. На основе алюминия методом порошковой металлургии создан САП (спечённый алюминиевый порошок), обладающий при температурах выше 300°С большой жаропрочностью.
Источники
ru.teplowiki.org
