Основание (химия) — Циклопедия
Основания. Неорганическая химия, 8 класс, по учебнику О. С. Габриелян Химия 8 класс. Основания // SovaFilmProductionОснование — сложное вещество, которое состоит из атома металла или иона аммония и гидроксогруппы (−OH).
Имеются различные определения основания. С точки зрения теории раствора, основание — это соединение, при растворении которого увеличивается концентрация отрицательных ионов растворителя.
При взаимодействии кислот и оснований друг с другом образуются молекулы растворителя, то есть происходит нейтрализация.
[править] Основания по теории Аррениуса
Согласно теории Аррениуса, основаниями называют электролиты, которые в водном растворе диссоциируют с образованием катионов металла (или неметаллических катионов, как NH4+) и анионов только одного типа — гидроксида ОН−.
Например:
- NaOH = Na+ + OH−
- NH4OH = NH4+ + OH−
- Ba(OH)2 = Ba2+ + 2OH−
Основания Аррениуса можно рассматривать как гидроксиды основных оксидов, то есть как продукты соединения воды с основными оксидами:
- Na2 O + H2O = 2NaOH
- CaO + H2O = Ca(OH)2
- BaO + H2O = Ba(OH)2
Основания Аррениуса, как и основные оксиды, при взаимодействии с кислотами и ангидридами, а также с амфотерными оксидами образуют соли, а между собой не взаимодействуют.
Например: Cu(OH)2 + 2HCl = CuCl2 + 2H2O Ca(OH)2 + CO2 = CaCO3 + H2О
Основные гидроксиды, или основания, изображают по следующей общей формуле: Ме(ОН)x, где Ме — атом металла, или металлоподобная группа (как NH4), а x — число гидроксидных групп, равное валентности металла. Например: NaOH, Ba(OH)2, Fe(OH)3.
Основания называют обычно гидроксидами соответствующих металлов. Если металл имеет постоянную валентность и образует только один гидроксид, то его называют просто гидроксидом этого металла. Так, NaOH — гидроксид натрия, Ba(OH)
Основания Аррениуса являются твердыми веществами. Некоторые из них, в частности NaOH и KOH, в термическом отношении достаточно устойчивы: их можно нагревать до температуры плавления и даже кипения, и они не разлагаются. Однако большинство оснований неустойчивы и при нагревании легко разлагаются с образованием оксидов и выделением воды.
Например:
- Ca(OH)2 = CaO + H2O
- 2Fe(OH)3 = Fe2O3 + 3H2O
Большинство оснований Аррениуса нерастворимы в воде. Хорошо растворимыми являются только основания щелочных и щелочноземельных металлов, то есть щелочи. Среди щелочей практически наиболее применяемыми являются NaOH, KOH, Ca(OH)2 и Ba(OH)2. Водные растворы едких щелочей имеют едкий мыльный вкус. Они легко разрушают растительные и животные ткани. Поэтому их называют еще едкими щелочами. Растворы едких щелочей обладают способностью изменять окраску индикаторов. Так, в щелочной среде фиолетовый цвет лакмуса меняется на синий, оранжевый цвет метилоранжа — на светло-желтый, а бесцветный раствор фенолфталеина становится фиолетовым. Щелочные свойства растворов оснований обусловливаются наличием в растворе гидроксильных ионов.
Химические свойства оснований Аррениуса определяются их отношением к кислотам, ангидридам, амфотерным оксидам и солям. Наиболее характерным свойством оснований является их способность вступать в химические реакции с кислотами. Причем с кислотами взаимодействуют как растворимые, так и нерастворимые основания.
Реакции взаимодействия оснований с кислотами называют реакциями нейтрализации. Суть реакций нейтрализации заключается в том, что кислотный водород и гидроксильная группа в основании образуют воду, а катионы металла основания и кислотные остатки образуют соль:
- Ba(OH)2 + 2HCl = BaCl2 + 2H2O
- Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Основания вступают в химические реакции также с ангидридами и амфотерными оксидами:
- 2NaOH + CO2 = Na2CO3 + H2O
- 2KOH + SO2 = K2SO3 + H2O
- 2KOH + PbO = K2PbO2 + H2O
Растворы едких щелочей взаимодействуют и с растворами солей, образуя нерастворимые основания:
- CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
- Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4
Основания Аррениуса можно получить разными способами.
- Непосредственным сообщением основных оксидов с водой. Этим способом можно пользоваться в тех случаях, когда основной оксид непосредственно взаимодействует с водой. Например:
- Na2O + H2O = 2NaOH
- CaO + H2O = Ca(OH)2
- Взаимодействием едких щелочей, с растворами солей. Этим способом пользуются в лабораториях, когда соответствующий оксид с водой непосредственно не взаимодействует, а гидроксид нерастворим. Например:
- CuSO4 + 2KOH = Cu(OH)2
- FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
- CuSO4 + 2KOH = Cu(OH)2
- Взаимодействием активных металлов (K, Na, Ca, Ba) с водой. Например:
- 2Na + 2H2O = 2NaOH + H2↑
- Ca + 2H2O = Ca(OH)2 + H2↑
Для технического получения NaOH и KOH широко используют способ электролиза водных растворов NaCl и KCl.
[править] Основания как катализаторы
Основания могут использоваться как нерастворимые гетерогенные катализаторы для химических реакций. Например, катализаторами являются оксиды магния, кальция, бария, некоторые цеолиты. Многие переходные металлы входят в состав катализаторов, и многие из них входят в состав оснований. Катализаторы на базе оснований используются для гидрогенизации, при миграции двойных связей, реакции Меервейна-Пондорфа-Верлея, реакции Майкла и многих других реакций.
- Ф. А. Деркач «Химия» Л.: 1968
- Ю. О. Ластухин, С. А. Воронов. Органическая химия. Учебник для высших учебных заведений. Издание четвертое. — Львов: Центр Европы, 2009—868 с. (Страница 164)
- Глоссарий терминов по химии // Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — Донецк: «Вебер», 2008—758 с.
cyclowiki.org
Основание (химия) — это… Что такое Основание (химия)?
У этого термина существуют и другие значения, см. Основание.Основа́ния — класс химических соединений.
В статье смысл термина «основание» раскрывается в первом, наиболее широко используемом значении — осно́вные гидрокси́ды.
Получение
Классификация
Основания классифицируются по ряду признаков.
- По растворимости в воде.
- Растворимые основания (щёлочи): гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)
- Практически нерастворимые основания: Mg(OH)2, Ca(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3, Be(OH)2.
- Другие основания: NH3·H2O
- Растворимые основания (щёлочи): гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды металлов и переходных элементов
- По летучести.
- Летучие: NH3, CH3-NH2
- Нелетучие: щёлочи, нерастворимые основания.
- По стабильности.
- По наличию кислорода.
- По типу соединения:
- Неорганические основания: содержат одну или несколько групп -OH.
- Органические основания: органические соединения, являющиеся акцепторами протонов: амины, амидины и другие соединения.
Номенклатура
По номенклатуре IUPAC неорганические соединения, содержащие группы -OH, называются гидроксидами. Примеры систематических названий гидроксидов:
- NaOH — гидроксид натрия
- TlOH — гидроксид таллия(I)
- Fe(OH)2 — гидроксид железа(II)
Если в соединении есть оксидные и гидроксидные анионы одновременно, то в названиях используются числовые приставки:
- TiO(OH)2 — дигидроксид-оксид титана
- MoO(OH)3 — тригидроксид-оксид молибдена
Для соединений, содержащих группу O(OH), используют традиционные названия с приставкой мета-:
- AlO(OH) — метагидроксид алюминия
- CrO(OH) — метагидроксид хрома
Для оксидов, гидратированных неопределённым числом молекул воды, например Tl2O3•n H2O, недопустимо писать формулы типа Tl(OH)3. Называть такие соединениями гидроксидами также
- Tl2O3•n H2O — полигидрат оксида таллия(III)
- MnO2•n H2O — полигидрат оксида марганца(IV)
Особо следует именовать соединение NH3•H2O, которое раньше записывали как NH4OH и которое в водных растворах проявляет свойства основания. Это и подобные соединения следует именовать как гидрат:
Химические свойства
- В водных растворах основания диссоциируют, что изменяет ионное равновесие:
- это изменение проявляется в цветах некоторых кислотно-основных индикаторов:
- При взаимодействии с кислотой происходит реакция нейтрализации и образуется соль и вода:
- Примечание: реакция не идёт, если и кислота и основание слабые.
- При избытке кислоты или основания реакция нейтрализации идёт не до конца и образуются кислые или осно́вные соли, соответственно:
- Амфотерные основания могут реагировать с щелочами с образованием гидроксокомплексов:
- Основания реагируют с кислотными или амфотерными оксидами с образованием солей:
- Основания вступают в обменные реакции (реагируют с растворами солей):
- Слабые и нерастворимые основания при нагреве разлагаются на оксид и воду:
- Некоторые основания (Cu(I), Ag, Au(I)) разлагаются уже при комнатной температуре.
См. также
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8
- Лидин Р.А. и др. Номенклатура неорганических веществ. — М.: КолосС, 2006. — 95 с. — ISBN 5-9532-0446-9
dic.academic.ru
Основания: классификация и химические свойства
Основания (гидроксиды) – сложные вещества, молекулы которых в своём составе имеют одну или несколько гидрокси-групп OH. Чаще всего основания состоят из атома металла и группы OH. Например, NaOH – гидроксид натрия, Ca(OH)2 – гидроксид кальция и др.
Существует основание – гидроксид аммония, в котором гидрокси-группа присоединена не к металлу, а к иону NH4+ (катиону аммония). Гидроксид аммония образуется при растворении аммиака в воде (реакции присоединения воды к аммиаку):
NH3 + H2O = NH4OH (гидроксид аммония).
Валентность гирокси-группы – 1. Число гидроксильных групп в молекуле основания зависит от валентности металла и равно ей. Например, NaOH, LiOH, Al (OH)3, Ca(OH)2, Fe(OH)3 и т.д.
Все основания – твёрдые вещества, которые имеют различную окраску. Некоторые основания хорошо растворимы в воде (NaOH, KOH и др.). Однако большинство из них в воде не растворяются.
Растворимые в воде основания называются щелочами. Растворы щелочей «мыльные», скользкие на ощупь и довольно едкие. К щелочам относят гидроксиды щелочных и щелочноземельных металлов (KOH, LiOH, RbOH, NaOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 и др.). Остальные являются нерастворимыми.
Нерастворимые основания – это амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью ведут себя, как кислоты.
Разные основания отличаются разной способностью отщеплять гидрокси-группы, поэтому признаку они делятся на сильные и слабые основания.
|
Сильные основания |
Слабые основания |
|
NaOH гидроксид натрия (едкий натр) KOH гидроксид калия (едкое кали) LiOH гидроксид лития Ba(OH)2 гидроксид бария Ca(OH)2 гидроксид кальция (гашеная известь) |
Mg(OH)2 гидроксид магния Fe(OH)2 гидроксид железа (II) Zn(OH)2 гидроксид цинка NH4OH гидроксид аммония Fe(OH)3 гидроксид железа (III) и т.д. (большинство гидроксидов металлов) |
Сильные основания в водных растворах легко отдают свои гидрокси-группы, а слабые – нет.
Химические свойства оснований
Химические свойства оснований характеризуются отношением их к кислотам, ангидридам кислот и солям.
1. Действуют на индикаторы. Индикаторы меняют свою окраску в зависимости от взаимодействия с разными химическими веществами. В нейтральных растворах – они имеют одну окраску, в растворах кислот – другую. При взаимодействии с основаниями они меняют свою окраску: индикатор метиловый оранжевый окрашивается в жёлтый цвет, индикатор лакмус – в синий цвет, а фенолфталеин становится цвета фуксии.
2. Взаимодействуют с кислотными оксидами с образованием соли и воды:
2NaOH + SiO2 → Na2SiO3 + H2O.
3. Вступают в реакцию с кислотами, образуя соль и воду. Реакция взаимодействия основания с кислотой называется реакцией нейтрализации, так как после её окончания среда становится нейтральной:
2KOH + H2SO4 → K2SO4 + 2H2O.
4. Реагируют с солями, образуя новые соль и основание:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4.
5. Способны при нагревании разлагаться на воду и основной оксид:
Cu(OH)2 = CuO + H2O.
Остались вопросы? Хотите знать больше об основаниях?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Шпаргалка — Основания — Химия
Муниципальное общеобразовательное учреждение.
Вечерняя (сменная) общеобразовательная школа.
Пос. Кавалерово Приморского края.
РЕФЕРАТ
По химии.
Тема: «Основания».
За курс средней (полной) школы.
Выполнил:
Лукашкин Павел
Дмитриевич
Учитель:
Тильба Людмила
Васильевна
Пос. Кавалерово.
2003 – 2004 учебный год.
План
1. Определение оснований
2. Классификация оснований
3. Физические свойства некоторых оснований
4. Химические свойства некоторых оснований
5. Получение
6. Применение
Основания
1. Основаниями называют гидроксиды, которые диссоциируют (распадаются) на гидроксильную группу и положительно заряженный катион. Часто основаниями называют металлосодержащие химические соединения, в которых каждый атом металла связан с одной или несколькими гидроксогруппами, например NaOH, Ca(OH)2 и т.п. Однако класс оснований не ограничивается гидроксидами металлов. Понятие «основание» более сложное, оно возникает из рассмотрения кислотно-основных химических равновесий. В реакциях:
OH + h3 SO4 — HSO4 + h3 O
Ch4 COOH + Nh4 — Ch4 COO + Nh5
Серная и уксусная кислоты взаимодействуют с основаниями, отдавая им протон H+. Вещества, стремящиеся принять протон, называются основаниями (определение Й. Бренстенда, 1923). С точки зрения теории электролитической диссоциации (Сванте Август Аррениус) даётся определение и описывается свойства оснований: основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы:
Ca(OH)2 — CaOH + OH
CaOH — Ca + OH
2. По степени диссоциации различают слабые основания, например Nh5 OH и сильные основания, например NaOH, Ca(OH)2. Хорошо растворимые в воде основания называются щёлочами. Основания бывают растворимы и практически не растворимые. Нейтрализация – это реакция кислот с основаниями, приводящая к образованию солей:
HCl + NaOH NaCl + h3 O
h4 PO4 + 3KOHK3 PO4 + 3h3 O
Реакцию нейтрализации обычно проводят титрованием – постепенным добавлением раствора одного из реагентов к раствору другого, например раствора соляной кислоты HCl к раствору гидроксида натрия NaOH. Реакции нейтрализации помогают определить в лаборатории свойства растворимых гидроксидов, если они вступают в реакцию нейтрализации со щелочами, их относят к кислотам; если реагируют с кислотами, то относят к основаниям. Основания с 1, 2, 3 гидроксильными группами называют соответственно одно-, двух-, трёхосновными. Число гидроксогрупп определяется валентностью металла. Например: — гидроксид калия, 2 — гидроксид бария. Если металл имеет переменную валентность, то последнюю указывают в названии основания римскими цифрами в скобочках. Например: Cu(OH)2 – гидроксид меди (II), Fe(OH)3 – гидроксид железа (III). Не полностью диссоциирующие при растворении в воде основания называют, как кислоты, слабыми. К сильным основаниям относятся гидрооксия калия KOH, натрия NaOH, бария Ba(OH)2
.
3. Большинство оснований – твёрдые вещества с различной растворимостью в воде. Согласно определению Бренстенда, основные свойства вещества зависят от партнёра – кислоты:
OH + h3 SO4 — HSO4 + h3 O
Чем сильнее кислота, тем легче основание принимает протон (верно так же и обратное определение). Так, вода или уксусная кислота в присутствии сильных кислот ведут себя как основания:
h3 SO4 + h3 O — HSO4 + h4 O
h3 SO4 + Ch4 COOH — HSO4 + Ch4 COOh3.
Металлы, атомы которых входят в состав нерастворимых в воде оснований, а также их оксиды с водой при обычных условиях не реагируют.
4. Растворимые и не растворимые основания имеют общее свойство: они реагируют с кислотами с образованием соли и воды. Чтобы опытным путём познакомиться с этими реакциями, надо знать, как в растворе обнаружить щелочь и кислоту. Растворы щелочей и кислот по-разному изменяют цвет индикаторов. Индикаторами можно обнаружить не только кислую и щелочную среду, но и нейтральную.
Индикатор | Цвет индикатора в среде | ||
| кислой | щелочной | нейтральной | |
1. Лакмус 2. Фенолфталеин 3. Метиловый оранжевый | Красный Бесцветный Розовый | Синий Малиновый Жёлтый | Фиолетовый Бесцветный Оранжевый |
По изменению окраски индикаторов можно судить о ходе реакции между кислотой и щёлочью. Например, если в химический стакан с раствором гидроксида натрия добавить несколько капель раствора индикатора, например, фенолфталеина, то раствор станет малиновым. Затем из бюретки следует малыми порциями прилить раствор соляной кислоты, пока не произойдёт обесцвечивание. Следовательно, раствор становится нейтральным, т.е. в нём нет ни щёлочи, ни кислоты. После выпаривания полученного раствора остаётся твёрдое вещество – хлорид натрия NaCl:
NaOH + HCl h3 O + NaCl
Элементы, гидроксиды которых проявляют свойства оснований и располагаются они слева внизу в периодической системе химических элементов. Особенно ярко эти свойства заметны у щелочных металлов.
Кроме общих свойств, щелочи и нерастворимые в воде основания обладают также и отличительными свойствами. Нерастворимые в воде основания, как правило, термически нестойкие – разлагаются при нагревании. Например, при нагревании голубого осадка гидроксида меди (II) образуются вещество чёрного цвета – это оксид меди (II) и вода:
Cu(OH)2CuO + h3 O
Щёлочи в отличие от нерастворимых оснований при умеренном нагревании обычно не разлагаются. Их растворы действуют на индикаторы, разъедают многие органические вещества, реагируют с кислотами, растворами некоторых солей и кислотными оксидами. Например, при пропускании оксида углерода (IV) через известковую воду – раствор Ca(OH)2 – происходит её помутнение:
Ca(OH)2 + CO2CaCO3 + h3 O
Если основания будут воздействовать на соли, то происходит образование гидроксидов:
FeCl3 + 3KOH = Fe(OH)3 + 3KCl
Ch4 COOK + HCl = Ch4 COOH + KCl
5. Растворимые в воде основания (щелочи) в лаборатории можно получить при взаимодействии активных металлов и их оксидов с водой:
3Li + 2HOH2LiOH + h3
Взаимодействие оксида кальция CaO с водой используется также в технике для получения гашёной извести, основной составной частью которой является гидроксид кальция Ca(OH)2. Этот процесс можно изобразить так:
CaO + HOH Ca(OH)2
Щёлочи – гидроксид натрия NaOH и гидроксид калия KOH – в технике получают электролизом водных растворов хлорида натрия NaCl и хлорида калия KCl.
Для получения нерастворимого в воде основания, нам уже известно, что кроме оксидов и оснований, атомы металлов входят также в состав солей. Так атомы меди входят в состав CuO, Cu(OH)2, а также в составе солей, например хлорида меди (II) CuCl2 и сульфата меди (II) CuSO4. Но можно в этих солях кислотные остатки – Cl и =SO4 заменить гидроксогруппами – OH. С этой целью к раствору хлорида меди (II) CuCl2 добавляют раствор гидроксида натрия NaOH. Тотчас же выпадает голубой осадок гидроксида меди (II) Cu(OH)2. Уравнения реакции можно записать так:
CuCl2 + 2NaOHCu(OH)2 + 2NaCl
Такие реакции относят к реакциям обмена. Реакциями обмена называют реакции между двумя сложными веществами, в ходе которых они обмениваются составными частями.
6. Основания находят широкое применение в промышленности и быту. Например, большое значение имеет гидроксид кальция Ca(OH)2, или гашёная известь – белый рыхлый порошок. При смешивании его с водой образуется так называемое известковое молоко. Так как гидроксид кальция немного растворяется в воде, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё оксида углерода (IV). Происходит реакция:Ca(OH)2 + CO2CaCO3 + h3 O.
Эта же реакция происходит при затвердении строительного раствора.
Гашёную известь применяют для приготовления бордосской смеси – средства борьбы с болезнями и вредителями растений. Известковое молоко широко используется в химической промышленности, например в производстве сахара, соды и других веществ.
Гидроксид натрия NaOH применяют для очистки нефти, производства мыла, в текстильной промышленности. Гидроксид калия KOH и гидроксид лития LiOH используют в аккумуляторах.
Список использованной литературы:
1. Учебник по химии за 8 класс 2000г. (Г.Е. Рудзитис, Ф.Г. Фельдман).
2. Мир химии 1988г. (Марк Колтун).
3. БЭС 1999г. (А.М. Прохоров)
4. Справочник школьника 2000г. (А.В. Паноренко).
5. Малый энциклопедический словарь 2000г. (В.И. Бородулина, А.П. Горкин).
www.ronl.ru
Основания (гидроксиды). Свойства, получение, применение
Ещё со школы нам известно, что основаниями называют соединения, где атомы металла связаны с одной или несколькими гидроксогруппами — KOH, Ca(OH)2 и т. п. Однако понятие «основания» на самом деле шире, и существует две теории оснований — протонная (теория Брёнстеда — Лоури) и электронная (теория Льюиса). Основания и кислоты Льюиса мы рассмотрим в отдельной статье, поэтому возьмём определение из теории Брёнстеда (далее в данной статье — только основания Брёнстеда): Основания — это вещества или частицы, способные принимать (отщеплять) протон от кислоты. Согласно такому определению, свойства основания зависят от свойств кислоты — например, вода или уксусная кислота ведут себя как основания в присутствии более сильных кислот:
H2SO4 + H2O ⇄ HSO4— + H3O+(катион гидроксония)
H2SO4 + CH3COOH ⇄ HSO4— + CH3COOH2+
Номенклатура оснований
Названия оснований образуются весьма просто — сначала идёт слово «гидроксид», а затем название металла, который входит в данное основание. Если металл имеет переменную валентность, это отражают в названии.
KOH — гидроксид калия
Ca(OH)2 — гидроксид кальция
Fe(OH)2 — гидроксид железа (II)
Fe(OH)3 — гидроксид железа (III)
Существует также основание NH4OH (гидроксид аммония), где гидроксогруппа связана не с металлом, а катионом аммония NH4+.
Классификация оснований
Основания можно классифицировать по следующим признакам:
- По растворимости основания делят на растворимые — щёлочи (NaOH, KOH) и нерастворимые основания (Ca(OH)2, Al(OH)3).
- По кислотности (количеству гидроксогрупп) основания делят на однокислотные (KOH, LiOH) и многокислотные (Mg(OH2), Al(OH)3).
- По химическим свойствам их делят на оснóвные (Ca(OH)2, NaOH) и амфотерные, то есть проявляющие как основные свойства, так и кислотные (Al(OH)3, Zn(OH)2).
- По силе (по степени диссоциации) различают:
а) сильные (α = 100 %) – все растворимые основания NaOH, LiOH, Ba(OH)2, малорастворимый Ca(OH)2.
б) слабые (α < 100 %) – все нерастворимые основания Cu(OH)2, Fe(OH)3 и растворимое NH4OH.
Сила оснований
Для оснований можно количественно выразить их силу, то есть способность отщеплять протон от кислоты. Для этого используют константу основности Kb — константу равновесия для реакции между основанием и кислотой, причём в качестве кислоты выступает вода. Чем выше значение константы основности, тем выше сила основания и тем сильнее его способность отщеплять протон. Также вместо самой константы часто используют показатель константы основности pKb. Например, для аммиака NH3 имеем:
Получение
Взаимодействие активного металла с водой:
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Mg + 2H2O Mg(OH)2 + H2
Взаимодействие основных оксидов с водой (только для щелочных и щелочноземельных металлов):
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
Промышленным способом получения щелочей является электролиз растворов солей:
2NaCI + 4H2O 2NaOH + 2H2 + CI2
Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения:
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4.
Физические свойства
Все основания являются твердыми веществами, имеющими различную окраску. В воде нерастворимы, кроме щелочей.
Внимание! Щёлочи являются очень едкими веществами. При попадании на кожу растворы щелочей вызывают сильные долгозаживающие ожоги, при попадании в глаза могут вызвать слепоту. При работе с ними следует соблюдать технику безопасности и пользоваться индивидуальными средствами защиты.
Внешний вид оснований. Слева направо: гидроксид натрия, гидроксид кальция, метагидроксид железа
Химические свойства
Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид – ионов ОН—.
Изменение цвета индикаторов:
фенолфталеин – малиновый
лакмус – синий
метиловый оранжевый – желтый

Фенолфталеин придаёт раствору щёлочи малиновую окраску
Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
2KOH + H2SO4 → K2SO4 + 2H2O,
растворимое
Mg(OH)2 + 2HCI → MgCI2 + 2H2O.
нерастворимое
Взаимодействие с кислотными оксидами:
2KOH + SO3 → K2SO4 + H2O
Взаимодействие с амфотерными оксидами и гидроксидами:
а) при плавлении:
2NaOH + AI2O3 → 2NaAIO2 + H2O,
NaOH + AI(OH)3 → NaAIO2 + 2H2O.
б) в растворе:
2NaOH + AI2O3 +3H2O → 2Na[AI(OH)4],
NaOH + AI(OH)3 → Na[AI(OH)4].
Взаимодействие с некоторыми простыми веществами (амфотерными металлами, кремнием и другими):
2NaOH + Zn + 2H2O → Na2[Zn(OH)4] + H2
2NaOH + Si + H2O → Na 2SiO3 + 2H2
Взаимодействие с растворимыми солями с образованием осадков:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4,
Ba(OH)2 + K2SO4 → BaSO4 + 2KOH.
Малорастворимые и нерастворимые основания разлагаются при нагревании:
Ca(OH)2 → CaO + H2O,
Cu(OH)2 → CuO + H2O.
in-chemistry.ru
| Химическая формула | Название соединения | Номер по классификатору CAS |
|---|---|---|
| D2O | оксид дейтерия | 7732-20-0 |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| LaCl3 | Хлорид лантана (III) | 10099-58-8 |
| LaPO4 | Фосфат лантана (III) | 14913-14-5 |
| Li(AlSi2O6) | Кеатит | |
| LiBr | Бромид лития | 7550-35-8 |
| LiBrO3 | Бромат лития | |
| LiCN | Цианид лития | |
| LiC2H5O | Этилат лития | |
| LiF | фторид лития | 7789-24-4 |
| LiHSO4 | Гидросульфат лития | |
| LiIO3 | Иодат лития | |
| LiNO3 | Нитрат лития | |
| LiTaO3 | Танталат лития | |
| Li2CrO4 | Хромат лития | |
| Li2Cr2O7 | Дихромат лития | |
| Li2MoO4 | Ортомолибдат лития | 13568-40-6 |
| Li2NbO3 | Метаниобат лития | |
| Li2SO4 | Сульфат лития | 10377-48-7 |
| Li2SeO3 | Селенит лития | |
| Li2SeO4 | Селенат лития | |
| Li2SiO3 | Метасиликат лития | 10102-24-6 |
| Li2SiO4 | Ортосиликат лития | |
| Li2TeO3 | Теллурит лития | |
| Li2TeO4 | Теллурат лития | |
| Li2TiO3 | Метатитанат лития | 12031-82-2 |
| Li2WO4 | Ортовольфрамат лития | 13568-45-1 |
| Li2ZrO3 | Метацирконат лития | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| PH3 | phosphine | 7803-51-2 |
| POCl3 | phosphoryl chloride | 10025-87-3 |
| PO43− | phosphate ion | |
| P2I4 | phosphorus(II) iodide | |
| P2O74− | pyrophosphate ion | |
| P2S3 | phosphorus(III) sulfide | |
| P2Se3 | phosphorus(III) selenide | |
| P2Se5 | phosphorus(V) selenide | |
| P2Te3 | phosphorus(III) telluride | |
| P3N5 | phosphorus(V) nitride | 12136-91-3 |
| P4O10 | tetraphosphorus decaoxide | 16752-60-6 |
| Pb(CH3COO)2·3H2O | ацетат свинца — тригидрат | |
| PbCO3 | lead carbonate cerussite | |
| Pb(C2H5)4 | tetraethyllead | |
| PbC2O4 | lead oxalate | |
| PbCrO4 | lead chromate | |
| PbF2 | lead fluoride | 7783-46-2 |
| Pb(IO3)2 | lead iodate | |
| PbI2 | lead(II) iodide | 10101-63-0 |
| Pb(NO3)2 | lead(II) nitrate lead dinitrate plumbous nitrate | |
| Pb(N3)2 | lead azide | |
| PbO | lead(II) oxide litharge | 1317-36-8 |
| Pb(OH)2 | plumbous hydroxide | |
| Pb(OH)4 | plumbic hydroxide plumbic acid | |
| Pb(OH)62− | plumbate ion | |
| PbO2 | lead(IV) oxide lead dioxide | 1309-60-0 |
| PbS | сульфид свинца галенит | 1314-87-0 |
| PbSO4 | сульфат свинца(II) | 7446-14-2 |
| Pb3(SbO4)2 | lead antimonate | |
| PtBr2 | platinum(II) bromide | |
| PtBr4 | platinum(IV) bromide | |
| PtCl2 | platinum(II) chloride | |
| PtCl4 | platinum(IV) chloride | |
| PtI2 | platinum(II) iodide | |
| PtI4 | platinum(IV) iodide | |
| [Pt(NH2CH2CH2NH2)3]Br4 | tris(ethylenediamine)platinum(IV) bromide | |
| [Pt(NH3)2(H2O)2Cl2]Br2 | diamminediaquadichloroplatinum(VI) bromide | |
| PtO2 | platinum(IV) oxide | 50417-46-4 |
| PtS2 | platinum(IV) sulfide | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| RbAl(SO4)2·12H2O | rubidium aluminum sulfate — dodecahydrate | |
| RbBr | rubidium bromide | 7789-39-1 |
| RbC2H3O2 | rubidium acetate | |
| RbCl | rubidium chloride | 7791-11-9 |
| RbClO4 | rubidium perchlorate | |
| RbF | rubidium fluoride | 13446-74-7 |
| RbNO3 | rubidium nitrate | 13126-12-0 |
| RbO2 | rubidium superoxide | |
| Rb2C2O4 | rubidium oxalate | |
| Rb2CrO4 | rubidium chromate | |
| Rb2PO4 | rubidium orthophosphate | |
| Rb2SeO3 | rubidium selenite | |
| Rb2SeO4 | rubidium selenate | |
| Rb3C6H5O7·H2O | rubidium citrate — monohydrate | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| SCN− | thiocyanate | |
| SF4 | sulfur tetrafluoride | |
| SF6 | sulfur hexafluoride | 2551-62-4 |
| SOF2 | thionyl difluoride | 7783-42-8 |
| SO2 | sulfur dioxide | 7446-09-5 |
| SO2Cl2 | sulfuryl chloride | 7791-25-5 |
| SO2F2 | sulfuryl difluoride | 2699-79-8 |
| SO2OOH− | peroxymonosulfurous acid (aqueous) | |
| SO3 | sulfur trioxide | 7446-11-9 |
| SO32− | sulfite ion | |
| SO42− | sulfate ion | |
| S2Br2 | sulfur(II) bromide | 71677-14-0 |
| S2O32− | thiosulfate ion | |
| S2O72− | disulfate ion | |
| SbBr3 | antimony(III) bromide | 7789-61-9 |
| SbCl3 | antimony(III) chloride | 10025-91-9 |
| SbCl5 | antimony(V) chloride | 7647-18-9 |
| SbI3 | antimony(III) iodide | 7790-44-5 |
| SbPO4 | antimony(III) phosphate | |
| Sb2OS2 | antimony oxysulfide kermesite | |
| Sb2O3 | antimony(III) oxide | 1309-64-4 |
| Sb2O5 | antimony(V) oxide | |
| Sb2S3 | antimony(III) sulfide | 1345-04-6 |
| Sb2Se3 | antimony(III) selenide | 1315-05-5 |
| Sb2Se5 | antimony(V) selenide | |
| Sb2Te3 | antimony(III) telluride | |
| Sc2O3 | scandium oxide scandia | |
| SeBr4 | selenium(IV) bromide | |
| SeCl | selenium(I) chloride | |
| SeCl4 | selenium(IV) chloride | 10026-03-6 |
| SeOCl2 | selenium(IV) oxychloride | 7791-23-3 |
| SeOF2 | selenyl difluoride | |
| SeO2 | selenium(IV) oxide | 7446-08-4 |
| SeO42− | selenate ion | |
| SeTe | selenium(IV) telluride | 12067-42-4 |
| SiBr4 | silicon(IV) bromide | 7789-66-4 |
| SiC | карбид кремния | 409-21-2 |
| SiCl4 | silicon(IV) chloride | 10026-04-7 |
| SiH4 | силан | 7803-62-5 |
| SiI4 | silicon(IV) iodide | 13465-84-4 |
| SiO2 | диоксид кремния silica кварц | 7631-86-9 |
| SiO44− | silicate ion | |
| Si2O76− | disilicate ion | |
| Si3N4 | silicon nitride | 12033-89-5 |
| Si6O1812− | cyclosilicate ion | |
| SnBrCl3 | tin(IV) bromotrichloride | |
| SnBr2 | tin(II) bromide | 10031-24-0 |
| SnBr2Cl2 | tin(IV) dibromodichloride | |
| SnBr3Cl | tin(IV) tribromochloride | 14779-73-8 |
| SnBr4 | tin(IV) bromide | 7789-67-5 |
| SnCl2 | tin(II) chloride | 7772-99-8 |
| SnCl2I2 | tin(IV) dichlorodiiodide | |
| SnCl4 | tin(IV) chloride | 7646-78-8 |
| Sn(CrO4)2 | tin(IV) chromate | |
| SnI4 | tin(IV) iodide | 7790-47-8 |
| SnO2 | tin(IV) oxide | 18282-10-5 |
| SnO32− | stannate ion | |
| SnS | tin(II) sulfide | 1314-95-0 |
| SnS2 | tin(IV) sulfide | |
| Sn(SO4)2·2H2O | tin(IV) sulfate — dihydrate | |
| SnSe | tin(II) selenide | 1315-06-6 |
| SnSe2 | tin(IV) selenide | |
| SnTe | tin(II) telluride | 12040-02-7 |
| SnTe4 | tin(IV) telluride | |
| Sn(VO3)2 | tin(II) metavanadate | |
| Sn3Sb4 | tin(IV) antimonide | |
| SrBr2 | strontium bromide | 10476-81-0 |
| SrBr2·6H2O | strontium bromide — hexahydrate | |
| SrCO3 | strontium carbonate | |
| SrC2O4 | strontium oxalate | |
| SrF2 | strontium fluoride | 7783-48-4 |
| SrI2 | strontium iodide | 10476-86-5 |
| SrI2·6H2O | strontium iodide — hexahydrate | |
| Sr(MnO4)2 | strontium permanganate | |
| SrMoO4 | strontium orthomolybdate | 13470-04-7 |
| Sr(NbO3)2 | strontium metaniobate | |
| SrO | strontium oxide | 1314-11-0 |
| SrSeO3 | strontium selenite | |
| SrSeO4 | strontium selenate | |
| SrTeO3 | strontium tellurite | |
| SrTeO4 | strontium tellurate | |
| SrTiO3 | титанат стронция | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| T2O | оксид трития tritiated water | 14940-65-9 |
| TaBr3 | бромид тантала (III) | |
| TaBr5 | бромид тантала (V) | |
| TaCl5 | Хлорид тантала(V) | 7721-01-9 |
| TaI5 | Иодид тантана(V) | |
| TaO3− | tantalate ion | |
| TcO4− | pertechnetate ion | |
| TeBr2 | tellurium(II) bromide | |
| TeBr4 | tellurium(IV) bromide | |
| TeCl2 | tellurium(II) chloride | |
| TeCl4 | tellurium(IV) chloride | 10026-07-0 |
| TeI2 | tellurium(II) iodide | |
| TeI4 | tellurium(IV) iodide | |
| TeO2 | tellurium(IV) oxide | 7446-07-3 |
| TeO4− | tellurate ion | |
| TeY | yttrium telluride | 12187-04-1 |
| Th(CO3)2 | thorium carbonate | 19024-62-5 |
| Th(NO3)4 | thorium nitrate | 13823-29-5 |
| TiBr4 | titanium(IV) bromide | 7789-68-6 |
| TiCl2I2 | titanium(IV) dichlorodiiodide | |
| TiCl3I | titanium(IV) trichloroiodide | |
| TiCl4 | titanium tetrachloride | 7550-45-0 |
| TiO2 | оксид титана (IV) рутил | 1317-70-0 |
| TiO32− | titanate ion | |
| TlBr | thallium(I) bromide | 7789-40-4 |
| TlBr3 | thallium(III) bromide | |
| Tl(CHO2) | thallium(I) formate | |
| TlC2H3O2 | thallium(I) acetate | 563-68-8 |
| Tl(C3H3O4) | thallium(I) malonate | |
| TlCl | thallium(I) chloride | 7791-12-0 |
| TlCl3 | thallium(III) chloride | |
| TlF | thallium(I) fluoride | 7789-27-7 |
| TlI | thallium(I) iodide | 7790-30-9 |
| TlIO3 | thallium(I) iodate | |
| TlI3 | thallium(III) iodide | |
| TiI4 | titanium(IV) iodide | 7720-83-4 |
| TiO(NO3)2 · xH2O | titanium(IV) oxynitrate — hydrate | |
| TlNO3 | thallium(I) nitrate | 10102-45-1 |
| TlOH | thallium(I) hydroxide | |
| TlPF6 | thallium(I) hexafluorophosphate | 60969-19-9 |
| TlSCN | thallium thiocyanate | |
| Tl2MoO4 | thallium(I) orthomolybdate | |
| Tl2SeO3 | thallium(I) selenite | |
| Tl2TeO3 | thallium(I) tellurite | |
| Tl2WO4 | thallium(I) orthotungstate | |
| Tl3As | thallium(I) arsenide | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| Zn(AlO2)2 | алюминат цинка | |
| Zn(AsO2)2 | арсенит цинка | 10326-24-6 |
| ZnBr2 | бромид цинка | 7699-45-8 |
| Zn(CN)2 | цианид цинка | 557-21-1 |
| ZnCO3 | карбонат цинка | 3486-35-9 |
| Zn(C8H15O2)2 | каприлат цинка | 557-09-5 |
| Zn(ClO3)2 | хлорат цинка | 10361-95-2 |
| ZnCl2 | хлорид цинка | 7646-85-7 |
| ZnCr2O4 | хромит цинка | 12018-19-8 |
| ZnF2 | фторид цинка | 7783-49-5 |
| Zn(IO3)2 | иодат цинка | 7790-37-6 |
| ZnI2 | иодид цинка | 10139-47-6 |
| ZnMoO4 | ортомолибдат цинка | |
| Zn(NO2)2 | нитрит цинка | 10102-02-0 |
| Zn(NO3)2 | нитрат цинка | 7779-88-6 |
| Zn(NbO3)2 | метаниобат цинка | |
| ZnO | оксид цинка | 1314-13-2 |
| ZnO2 | пероксид цинка | 1314-22-3 |
| Zn(OH)2 | гидроксид цинка | 20427-58-1 |
| Zn(OH)42− | zincate ion | |
| ZnS | сульфид цинка сфалерит | 1314-98-3 |
| Zn(SCN)2 | тиоцианат цинка | 557-42-6 |
| ZnSO4 | сульфат цинка | 7733-02-0 |
| ZnSb | антимонид цинка | 12039-35-9 |
| ZnSe | селенид цинка | 1315-09-9 |
| ZnSeO3 | селенит цинка | |
| ZnSnO3 | станнат цинка | |
| Zn(TaO3)2 | метатанталат цинка | |
| ZnTe | теллурид цинка | 1315-11-3 |
| ZnTeO3 | теллурит цинка | |
| ZnTeO4 | теллурат цинка | |
| ZnTiO3 | метатитанат цинка | |
| Zn(VO3)2 | метаванадат цинка | |
| ZnWO4 | zinc orthotungstate | |
| ZnZrO3 | метацирконат цинка | |
| Zn2P2O7 | пирофосфат цинка | 7446-26-6 |
| Zn2SiO4 | ортосиликат цинка | 13597-65-4 |
| Zn3(AsO4)2 | арсенат цинка | 13464-44-3 |
| Zn3As2 | арсенид цинка | |
| Zn3N2 | нитрид цинка | 1313-49-1 |
| Zn3P2 | фосфид цинка | 1314-84-7 |
| Zn3(PO4)2 | фосфат цинка | 7779-90-0 |
| Zn3Sb2 | антимонид цинка | |
| ZrB2 | борид циркония | 12045-64-6 |
| ZrBr4 | бромид циркония | 13777-25-8 |
| ZrC | карбид циркония | 12020-14-3 |
| ZrCl4 | тетрахлорид циркония | 10026-11-6 |
| ZrF4 | фторид циркония | 7783-64-4 |
| ZrI4 | иодид циркония | 13986-26-0 |
| ZrN | нитрид циркония | 25658-42-8 |
| Zr(OH)4 | гидроксид циркония | 14475-63-9 |
| ZrO2 | диоксид циркония бадделеит | 1314-23-4 |
| ZrO32− | цирконат-ион | |
| ZrP2 | фосфид циркония | 12037-80-8 |
| ZrS2 | сульфид циркония | 12039-15-5 |
| ZrSi2 | силицид циркония (ди)силицид циркония[1] | 12039-90-6 |
| ZrSiO4 | ортосиликат циркония циркон | 10101-52-7 |
| Zr3(PO4)4 | фосфат циркония |
dic.academic.ru
Основания — классификация, получение и свойства » HimEge.ru
Основаниями называют гидроксиды, которые диссоциируют (распадаются) на гидроксильную группу и положительно заряженный катион.
Общая формула оснований — Э(OН)m, где m – степень окисления металла.
Классификация оснований
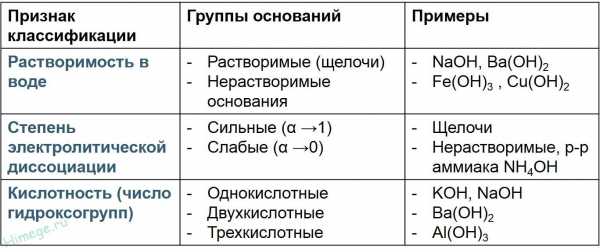
Взаимодействие активных металлов с водой (только щелочи)
2Na + 2H2O = 2NaOH + H2,
Ba + 2H2O = Ba(OH)2 + H2,
Взаимодействие основных оксидов с водой (только щелочи)
Na2O + H2O = 2NaOH,
Взаимодействие солей со щелочами (малорастворимые основания)
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4,
Cu2+ + 2OH— = Cu(OH)2,
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl,
Al3+ + 3OH— = Al(OH)3.
Электролиз водных растворов солей (промышленный способ)
2NaCl + 2H2O = 2NaOH + H2 + Cl2.
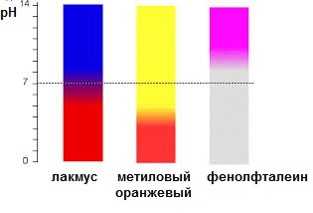 1) Растворы оснований мыльные на ощупь, изменяют окраску индикаторов: лакмуса – в синий цвет, бесцветного фенолфталеина – в малиновый.
1) Растворы оснований мыльные на ощупь, изменяют окраску индикаторов: лакмуса – в синий цвет, бесцветного фенолфталеина – в малиновый.
В водном растворе растворимые основания диссоциируют, образуя катион металла и гидроксогруппу:
NaOH = Na+ + OH—.
Многоосновные основания диссоциируют ступенчато:
Ba(OH)2 = BaOH+ + OH—,
BaOH+ = Ba2+ + OH—,
суммарное уравнение:
Ba(OH)2 = Ba2+ + 2OH—.
2) Взаимодействие с кислотами (реакция нейтрализации)
NaOH + HCl = NaCl + H2O,
OH— + H+ = H2O.
При реакции нейтрализации взаимодействие сводится к взаимодействию ионов водорода и гидроксогруппы с образованием малодиссоциирующего вещества – воды.
Многоосновные основания образуют основные и средние соли:
Ba(OH)2 + HCl = BaOHCl + H2O,
Ba(OH)2 + 2HCl = BaCl2 + 2H2O.
3) Взаимодействие с кислотными оксидами
Ca(OH)2 + CO2 = CaCO3 + H2O,
4) Взаимодействие с солями
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4,
2Fe3+ + 6OH— = 2Fe(OH)3.
5) Термическое разложение
Cu(OH)2 = CuO + H2O,
2Fe(OH)3 = Fe2O3 + 3H2O .
Щелочи термическому разложению не подвергаются, например, гидроксид натрия кипит при 1400°С без разложения, из всех растворимых оснований разлагается только гидроксид лития:
2LiOH = Li2O + H2O.
6)Взаимодействие с неметаллами
6KOH + 3S = K2SO3 + 2K2S + 3H2O,
2NaOH + Cl2 = NaCl + NaOCl + H2O (на холоде).
himege.ru
