основный оксид + амфотерный оксид= ?
Кислотные оксидыКислотный оксид + вода = кислота (исключение — SiO2)
SO3 + h3O = h3SO4
Cl2O7 + h3O = 2HClO4
Кислотный оксид + щелочь = соль + вода
SO2 + 2NaOH = Na2SO3 + h3O
P2O5 + 6KOH = 2K3PO4 + 3h3O
Кислотный оксид + основный оксид = соль
CO2 + BaO = BaCO3
SiO2 + K2O = K2SiO3
Основные оксиды
Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + h3O = Ca(OH)2
Na2O + h3O = 2NaOH
Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl2 + h3O
3K2O + 2h4PO4 = 2K3PO4 + 3h3O
Основный оксид + кислотный оксид = соль
MgO + CO2 = MgCO3
Na2O + N2O5 = 2NaNO3
Амфотерные оксиды
Амфотерные оксиды
Амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3h3O
ZnO + h3SO4 = ZnSO4 + h3O
Кислоты
Кислота + основный оксид = соль + вода
2HNO3 + CuO = Cu(NO3)2 + h3O
3h3SO4 + Fe2O3 = Fe2(SO4)3 + 3h3O
Кислота + амфотерный оксид = соль + вода
3h3SO4 + Cr2O3 = Cr2(SO4)3 + 3h3O
2HBr + ZnO = ZnBr2 + h3O
Кислота + основание = соль + вода
h3SiO3 + 2KOH = K2SiO3 + 2h3O
2HBr + Ni(OH)2 = NiBr2 + 2h3O
Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH)3 = CrCl3 + 3h3O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2h3O
Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO3 = CaBr2 + h3O + CO2
h3S + K2SiO3 = K2S + h3SiO3
Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
2HCl + Zn = ZnCl2 + h3
h3SO4 (разб.) + Fe = FeSO4 + h3
Важно: кислоты-окислители (HNO3, конц. h3SO4) реагируют с металлами по-другому.
Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K2ZnO2 + h3O (Правильнее: ZnO + 2KOH + h3O = K2[Zn(OH)4])
Al2O3 + 2NaOH = 2NaAlO2 + h3O (Правильнее: Al2O3 + 2NaOH + 3h3O = 2Na[Al(OH)4])
Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3
Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO2)2
Амфотерные гидроксиды
Амфотерный гидроксид + кислота = соль + вода
2Al(OH)3 + 3h3SO4 = Al2(SO4)3 + 6h3O
Be(OH)2 + 2HCl = BeCl2 + 2h3O
Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2h3O
Al(OH)3 + NaOH = NaAlO2 + 2h3O
Амфотерный гидроксид + щелочь = соль (в водном растворе)
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4]
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Щелочи
Щелочь + кислотный оксид = соль + вода
Ba(OH)2 + N2O5 = Ba(NO3)2 + h3O
2NaOH + CO2 = Na2СO3 + h3O
Щелочь + кислота = соль + вода
3KOH + h4PO4 = K3PO4 + 3h3O
Bа (OH)2 + 2HNO3 = Ba(NO3)2 + 2h3O
Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na2ZnO2 + h3O (Правильнее: 2NaOH + ZnO + h3O = Na2[Zn(OH)4])
Щелочь + амфотерный гидроксид = соль (в водном растворе)
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4]
Щелочь + растворимая соль = нерастворимое основание + соль
Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3KOH + FeCl3 = Fe(OH)3 + 3KCl
Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2h3O = Na2[Zn(OH)4] + h3
2KOH + 2Al + 6h3O = 2K[Al(OH)4] + 3h3
Соли
Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO3 + h3SiO3
BaCO3 + 2HCl = BaCl2 + h3O + CO2 (h3CO3)
Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO3)2 + K2S = PbS + 2KNO3
СaCl2 + Na2CO3 = CaCO3 + 2NaCl
Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3
Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
otvet.mail.ru
Химические свойства основных классов неорганических соединений. Оксиды, кислоты, основания, соли
Кислотные оксиды
- Кислотный оксид + вода = кислота (исключение — SiO2)
SO3 + H2O = H2SO4
Cl2O7 + H2O = 2HClO4 - Кислотный оксид + щелочь = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O - Кислотный оксид + основный оксид = соль
CO2 + BaO = BaCO3
SiO2 + K2O = K2SiO3
Основные оксиды
- Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + H2O = Ca(OH)2
Na2O + H2O = 2NaOH - Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl2 + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O - Основный оксид + кислотный оксид = соль
MgO + CO2 = MgCO3
Na2O + N2O5 = 2NaNO3
Амфотерные оксиды
- Амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl 3 + 3H2O
ZnO + H2SO4 = ZnSO4 + H2O - Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K2ZnO2 + H2O (Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4])
Al2O3 + 2NaOH = 2NaAlO2 + H2O (Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]) - Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3 - Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO2)2
Кислоты
- Кислота + основный оксид = соль + вода
2HNO3 + CuO = Cu(NO3)2 + H2O
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O - Кислота + амфотерный оксид = соль + вода
3H2SO4 + Cr2O3 = Cr2(SO4)3 + 3H2O
2HBr + ZnO = ZnBr2 + H2O - Кислота + основание = соль + вода
H2SiO3 + 2KOH = K2SiO3 + 2H2O
2HBr + Ni(OH)2 = NiBr2 + 2H2O - Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH)3 = CrCl3 + 3H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O - Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO3 = CaBr2 + H2O + CO2
H2S + K2SiO3 = K2S + H2SiO3 - Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
2HCl + Zn = ZnCl2 + H2
H2SO4 (разб.) + Fe = FeSO4 + H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
Амфотерные гидроксиды
- Амфотерный гидроксид + кислота = соль + вода
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Be(OH)2 + 2HCl = BeCl - Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O - Амфотерный гидроксид + щелочь = соль (в водном растворе)
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4]
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Щелочи
- Щелочь + кислотный оксид = соль + вода
Ba(OH)2 + N2O5 = Ba(NO3)2 + H2O
2NaOH + CO2 = Na 2СO3 + H2O - Щелочь + кислота = соль + вода
3KOH + H3PO4 = K3PO4 + 3H2O
Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O - Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na2ZnO2 + H2O (Правильнее: 2NaOH + ZnO + H2O = Na2[Zn(OH)4]) - Щелочь + амфотерный гидроксид = соль (в водном растворе)
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4] - Щелочь + растворимая соль = нерастворимое основание + соль
Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3KOH + FeCl3 = Fe(OH)3 + 3KCl - Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2
2KOH + 2Al + 6H2O = 2K[Al(OH)4] + 3H2
Соли
- Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (H2CO3) - Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO3)2 + K2S = PbS + 2KNO3
СaCl2 + Na2CO3 = CaCO3 + 2NaCl - Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO3)2 + 2NaOH = 2NaNO 3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3 - Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Возможно, вам также будут интересны другие разделы справочника по химии:
Методы получения основных классов неорганических соединенийНазвания некоторых неорганических кислот и солей
www.repetitor2000.ru
основные, кислотные, амфотерные оксиды. Примеры
Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами. Например, к основным относятся следующие:K2O (окись калия) , CaO (окись кальция) , FeO (окись железа 2-валентного) .
1. Взаимодействие с водой с образованием основания (или щёлочи) :
CaO+h3O = Ca(OH)2
2. Взаимодействие с кислотами с образованием солей:
CaO+h3SO4 = CaSO4+ h3O
3. Взаимодействие с кислотными оксидами с образованием солей
CaO+CO2=CaCO3
Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
Примерами кислотных окислов могут быть:
CO2 (всем известный углекислый газ) , P2O5 — оксид фосфора (образуется при сгорании на воздухе белого фосфора) , SO3 — триокись серы — это вещество используют для получения серной кислоты.
— реакция с водой с образованием кислоты
SO2+h3O=h3SO3
— реакция с щелочами (основаниями) с образованием соли:
CO2+NaOH=Na2CO3
— реакция с основными оксидами с образованием соли:
CO2+MgO=MgCO3
Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами) . Наиболее частое применение слово «амфотерный» в нашем случае относится к оксидам металлов.
Примером амфотерных оксидов могут быть:
ZnO – оксид цинка, Al2O3 — оксид алюминия
Химические свойства амфотерных оксидов уникальны тем, что они могут вступать в химические реакции, соответствующие как основаниями так и с кислотами. Например:
— реакция с кислотным оксидом с образованием соли:
ZnO+h3CO3 = ZnCO3 + h3O
— реакция с основаниями с образованием соли:
ZnO+2NaOH=Na2ZnO2+h3O
— реакция с кислотными и с основными оксидами с образованием содей:
ZnO + SO2 = ZnSO3
ZnO + Na2O = Na2ZnO2
otvet.mail.ru
Химические свойства оксидов — урок. Химия, 8–9 класс.
1. Основные оксиды, образованные щелочными и щелочноземельными металлами, взаимодействуют с водой, образуя растворимое в воде основание — щёлочи.
Основный оксид + вода → основание.
Например, при взаимодействии оксида кальция с водой образуется гидроксид кальция:
CaO+h3O→Ca(OH)2.
2. Основные оксиды взаимодействуют с кислотами, образуя соль и воду.
Основный оксид + кислота → соль + вода.
Например, при взаимодействии оксида меди с серной кислотой образуются сульфат меди и вода:CuO+h3SO4→CuSO4+h3O.
3. Основные оксиды могут взаимодействовать с оксидами, принадлежащими к другим классам, образуя соли.
Основный оксид + кислотный оксид → соль.
Например, при взаимодействии оксида магния с углекислым газом образуется карбонат магния:
MgO+CO2→MgCO3.
Химические свойства кислотных оксидов
1. Кислотные оксиды могут взаимодействовать с водой, образуя кислоты.
Кислотный оксид + вода → кислота.
Например, при взаимодействии оксида серы(\(VI\)) с водой образуется серная кислота:
SO3+h3O→h3SO4.
Обрати внимание!
Оксид кремния SiO2 с водой не реагирует.
2. Кислотные оксиды взаимодействуют со щелочами, образуя соль и воду.
Кислотный оксид + основание → соль + вода.
Например, при взаимодействии оксида серы(\(IV\)) с гидроксидом натрия образуются сульфит натрия и вода:
SO2+2NaOH→Na2SO3+h3O.
3. Кислотные оксиды могут реагировать с основными оксидами, образуя соли.
Кислотный оксид + основный оксид → соль.
Например, при взаимодействии оксида углерода(\(IV\)) с оксидом кальция образуется карбонат кальция:CO2+CaO→CaCO3.
Химические свойства амфотерных оксидов
1. Амфотерные оксиды при взаимодействии с кислотой или кислотным оксидом проявляют свойства, характерные для основных оксидов. Так же, как основные оксиды, они взаимодействуют с кислотами, образуя соль и воду.
Например, при взаимодействии оксида цинка с соляной кислотой образуется хлорид цинка и вода:
ZnO+2HCl→ZnCl2+h3O.
2. Амфотерные оксиды при взаимодействии со щёлочью или с оксидом щелочного или щелочноземельного металла проявляют кислотные свойства. При сплавлении их со щелочами протекает химическая реакция, в результате которой образуются соль и вода.
Например, при сплавлении оксида цинка с гидроксидом калия образуется цинкат калия и вода:
ZnO+2KOH→K2ZnO2+h3O.
Если же с гидроксидом калия сплавить оксид алюминия, кроме воды образуется алюминат калия: Al2O3+2KOH→2KAlO2+h3O.
www.yaklass.ru
Химия
ОКСИДЫ
Оглавление:
1. Определение
2. Классификация
3. Электролитическая
диссоциация
5. Важнейшие химические свойства
6. Задания
7. Ответы
|
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых кислород со степенью окисления -2. |
КЛАССИФИКАЦИЯ
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Оксиды не диссоциируют на ионы.
ВАЖНЕЙШИЕ СПОСОБЫ ПОЛУЧЕНИЯ
1. Взаимодействие металлов с кислородом:
4Li+O2= 2Li2O
2. Взаимодействие неметаллов с кислородом:
S+O2=
SO2
3. Разложение оснований при нагревании:
Cu(OH)2=CuO+H2O
4. Разложение некоторых солей при нагревании:
CaCO3= CaO+ CO2
ВАЖНЕЙШИЕ ХИМИЧЕСКИЕ СВОЙСТВА
Основные оксиды:
1. Основный оксид + вода = основание
Na2O + H2O = 2NaOH
2. Основный оксид + кислота = соль + вода
CaO + 2HCl
= CaCl2 +H2O
3. Основный оксид + кислотный оксид = соль
Li2O+CO2 = Li2CO3
Кислотные оксиды:
1. Кислотный оксид + вода = кислота
P2O5+3H2O = 2H3PO4
2. Кислотный оксид + основание = соль + вода
SO3 + 2NaOH
= Na2SO4
+ H2O
3. Кислотный оксид + основный оксид = соль
CaO + SO3 = CaSO4
Амфотерные оксиды:
1. Амфотерный оксид + кислота = соль(1 типа) + вода
ZnO +H2SO4
= ZnSO4 + H2O
2. Амфотерный оксид + щёлочь = соль(2 типа) +
вода
ZnO + 2NaOH = Na2ZnO2
+ H2O
Оксиды некоторых металлов можно восстановить до
металла при нагревании с углём, оксидом углерода(II),
водородом или алюминием (алюминотермия).
Fe2O3 + 3C = 2Fe + 3CO
CuO + H2 = Cu + H2O
Fe2O3 + 2Al = 2Fe + Al2O3
NiO + CO = Ni + CO2
ЗАДАНИЯ
Задание 1. Из приведённого перечня выберите
оксиды, назовите их, определите тип.
1)Na2O2 2)
Li2O 3) Al 2O3
4) FeO 5) P2O5 6) CO2 7) OF2
8) MgO
Задание 2. С
какими из перечисленных веществ может реагировать а)
Li2O
б)CO2 в)Al2O3
1)Na2O 2)SO3 3)H2O
4)NaOH 5)H2SO4 6)Na2SO4
7)O2 8) AlCl3
ОТВЕТЫ.
Наверх
novschool31.narod.ru
основных, амфотерных, кислотных – HIMI4KA

Определения и формулы основных, амфотерных и кислотных оксидов были приведены ранее в уроке 6.
Характерные химические свойства основных оксидов: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:
Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:
В аналогичных условиях, например, оксид железа (II) с водой реагировать не будет, так как гидроксид железа (II) в воде нерастворим.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:
Кроме того, амфотерные оксиды могут взаимодействовать как с кислотными, так и с основными оксидами, например:
С водой амфотерные оксиды не взаимодействуют.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями, с образованием солей и воды или кислых солей, а также с водой, в том случае если образующаяся в ходе такой реакции кислота растворима в воде:
Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:
Тренировочные задания
1. Оксид натрия взаимодействует с каждым из двух веществ:
1) серная кислота и вода
2) уксусная кислота и азот
3) оксид лития и фосфор
4) оксид бария и серная кислота
2. Оксид калия взаимодействует с
1) азотом и фосфором
2) водой и сульфатом натрия
3) серной кислотой и оксидом фосфора (V)
4) литием и хлоридом натрия
3. Оксид кальция взаимодействует с
1) оксидом кремния
2) оксидом углерода (II)
3) оксидом азота (II)
4) оксидом азота (I)
4. Оксид бария взаимодействует с каждым из двух веществ:
1) азотной кислотой и водой
2) уксусной кислотой и хлором
3) оксидом натрия и азотом
4) оксидом серы (IV) и кремнием
5. Оксид магния не взаимодействует с
1) соляной кислотой
2) серной кислотой
3) оксидом лития
4) оксидом кремния
6. Оксид кальция взаимодействует с каждым из двух веществ:
1) оксидом фосфора (V), водой
2) оксидом углерода (IV) и сульфидом натрия
3) оксидом магния и азот
4) кислородом и сульфатом натрия
7. Оксид кальция реагирует с
1) медью
2) фосфором
3) оксидом углерода (IV)
4) оксидом магния
8. Оксид натрия реагирует с
1) водой
2) сульфатом калия
3) нитратом железа (II)
4) оксидом азота (II)
9. Оксид бария реагирует с каждым из двух веществ:
1) оксидом азота (II) и хлором
2) азотной кислотой и водой
3) оксидом углерода (II) и железом
4) серой и хлоридом кальция
10. Оксид магния реагирует с каждым из двух веществ:
1) оксидом кальция и оксидом железа (II)
2) оксидом алюминия и оксидом хрома (II)
3) соляной кислотой и оксидом кремния (VI)
4) оксидом фосфора (V) и цинком
11. Оксид цинка
1) растворяется в кислотах, но не реагирует с основаниями
2) растворяется в щелочах, но не реагирует с кислотами
3) реагирует с оксидом натрия, но не реагирует с водой
4) реагирует с оксидом калия и водой
12. Оксид хрома (III) реагирует с
1) оксидом калия
2) водой
3) оксидом серы (VI)
4) оксидом азота (I)
13. Оксид алюминия амфотерен, поскольку он способен взаимодействовать
1) как с азотной, так и серной кислотой
2) с водой и кислотами
3) с водой и щелочами
4) как с кислотами, так и со щелочами
14. Оксид алюминия реагирует с
1) сульфатом калия
2) оксидом калия
3) оксидом азота (II)
4) оксидом углерода (IV)
15. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) оксидом лития и углекислым газом
2) водой и углекислым газом
3) водой и гидроксидом калия
4) кислородом и натрием
16. Оксид фосфора (V) взаимодействует с каждым из двух веществ:
1) кислородом и водородом
2) водой и углекислым газом
3) водой и гидроксидом натрия
4) водой и оксидом углерода (II)
17. Оксид серы (VI) не взаимодействует с
1) водой
2) хлоридом калия
3) гидроксидом натрия
4) оксидом бария
18. Оксид серы (IV) взаимодействует с
1) оксидом углерода (IV) и водой
2) оксидом фосфора (V) и водой
3) сульфатом калия и водой
4) оксидом кальция и гидроксидом натрия
19. Оксид серы (IV) не взаимодействует с
1) водой
2) фосфатом кальция
3) раствором гидроксида натрия
4) гидроксидом кальция
20. Оксид хлора (VII) взаимодействует с каждым из двух веществ:
1) кальцием и углекислым газом
2) водой и углеродом
3) водой и оксидом калия
4) кислородом и азотом
21. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na2O + HCl →
Б) Na2O + CO2 →
В) Na2O + O2 →
ПРОДУКТЫ РЕАКЦИИ
1) Na2CO3
2) NaCl + H2
3) NaCl + H2O
4) NaO3
5) Na2O2
22. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na2O + H2SO4 (изб.) →
Б) Na2O + Al2O3 →
В) Na2O + P2O5 →
ПРОДУКТЫ РЕАКЦИИ
1) NaHSO4
2) NaHSO4 + H2O
3) NaAlO2
4) Na3PO4
5) Na2SO4 + H2O
23. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CaO + H3PO4 (изб.) →
Б) CaO + H2O →
В) CaO + CO2 →
ПРОДУКТЫ РЕАКЦИИ
1) Ca(H2PO4)2 + H2O
2) CaCO3
3) Ca(OH)2
4) CaCO2
5) Ca3(PO4)2
24. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CaO + SiO2 →
Б) CaO + H3PO4 (разб.) →
В) CaO + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) Ca(H2PO4)2 + H2O
2) Ca3(PO4)2 + H2O
3) CaCl2 + H2O
4) CaSiO3 5) Ca(OCl)2
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + HCl →
Б) ZnO + NaOH ⎯⎯H2O→
В) ZnO + Na2O ⎯⎯сплавление→
ПРОДУКТЫ РЕАКЦИИ
1) ZnCl2 + H2O
2) ZnCl2
3) Na2[Zn(OH)4]
4) Na2ZnO2 + H2O
5) Na2ZnO2
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + H3PO4 →
Б) ZnO + NaOH + H2O →
В) ZnO + C →
ПРОДУКТЫ РЕАКЦИИ
1) Na2[Zn(OH)4] + H2
2) Na2ZnO2
3) Zn(H2PO4)2 + H2O
4) Zn + CO
5) Zn3(PO4)2 + H2O
27. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) P2O5 + H2O →
Б) P2O5 + Ca(OH)2 ⎯⎯сплавление→
В) P2O5 + NaOH (изб.) →
ПРОДУКТЫ РЕАКЦИИ
1) Ca3(PO4)2 + H2O
2) CaHPO4
3) Na3PO4 + H2O
4) Na3PO4
5) H3PO4
28. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) P2O5 + H2O →
Б) P2O5 + Na2O →
В) P2O5 + HNO3 →
ПРОДУКТЫ РЕАКЦИИ
1) H3PO4 + HNO2
2) H3PO4
3) Na3PO4
4) H3PO3
5) HPO3 + N2O5
29. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) SO2 + Ca(OH)2 (изб.) →
Б) SO2 + Na2O →
В) SO2 + O2 →
ПРОДУКТЫ РЕАКЦИИ
1) CaSO3 + H2O
2) SO3
3) Ca(HSO3)2
4) Na2SO4
5) Na2SO3
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) SO2 + H2S →
Б) SO2 (изб.) + NaOH →
В) SO2 + NaOH (изб.) →
ПРОДУКТЫ РЕАКЦИИ
1) Na2SO4 + H2O
2) Na2SO3 + H2O
3) NaHSO3
4) S + H2O
5) NaHSO4
31. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
32. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
33. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
35. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
37. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
38. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
39. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
40. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
41. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
42. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
43. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
47. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
48. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
49. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
50. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
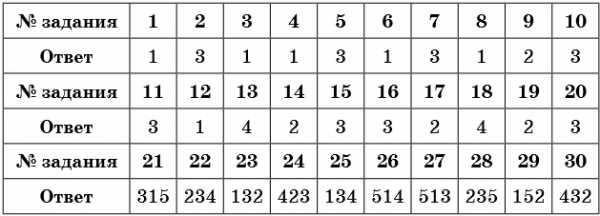
Ответы
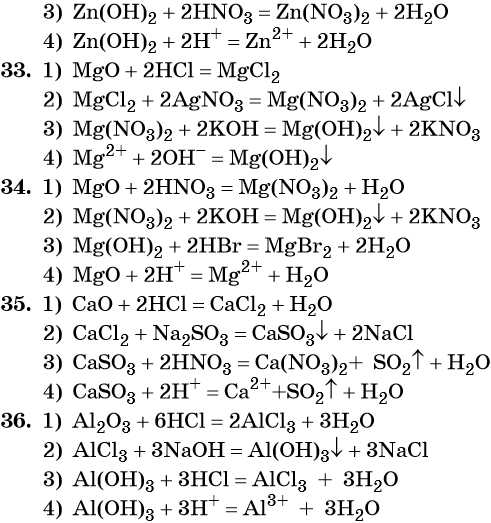
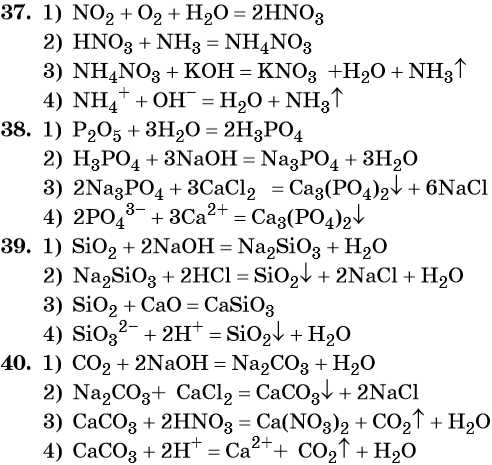
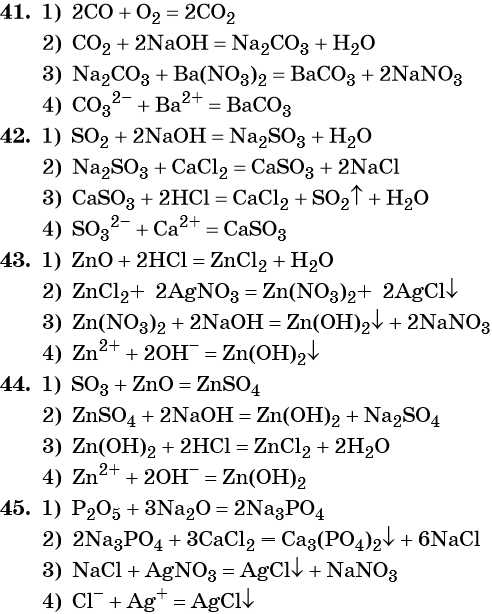
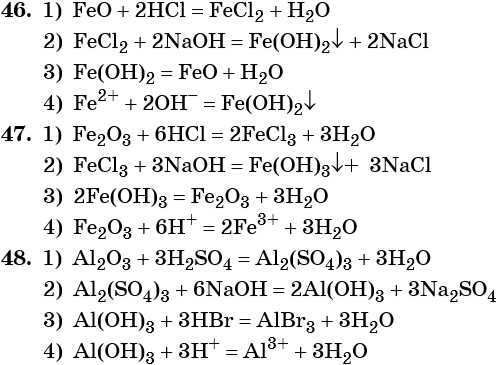
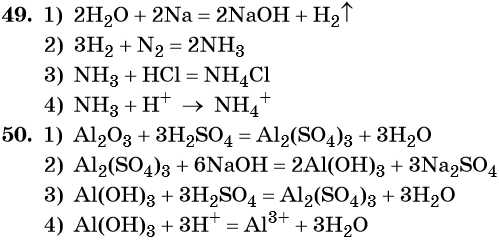
himi4ka.ru
Тема №10 «Характерные химические свойства основных, амфотерных и кислотных оксидов»
Оглавление
- Оксиды
- Типичные реакции основных оксидов
- Типичные реакции кислотных оксидов
- Типичные реакции амфотерных оксидов
- Получение оксидов
- Шпаргалка
- Итог урока
Оксиды
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления (-2). Общая формула оксидов: ЭmОn, где m — число атомов элемента Э, а n — число атомов кислорода. Оксиды могут быть твердыми (песок SiO2, разновидности кварца), жидкими (оксид водорода H2O), газообразными (оксиды углерода: углекислый CO2 и угарный СО газы).
Номенклатура химических соединений развивалась по мере накопления фактического материала. Сначала, пока число известных соединений было невелико, широко использовались тривиальные названия, не отражающие состава, строения и свойства вещества, — сурик РЬ3О4, глет РЬО, жженая магнезия MgO, железная окалина Fe3О4, веселящий газ N2О, белый мышьяк As2О3• На смену тривиальной номенклатуре при шла полусистематическая номенклатура — в название были включены указания числа атомов кислорода в соединении: закись — для более низких, окись — для более высоких степеней окисления; ангидрид — для оксидов кислотного характера.
В настоящее время почти завершен переход к современной номенклатуре. Согласно международной номенклатуре, в названии оксида следует указывать валентность элемента; например, SО2 — оксид cepы(IV), SО3 — оксид cepы(VI), CrO — оксид хрома(II), Cr2О3 — оксид хрома(III), CrO3 — оксид хрома(VI).
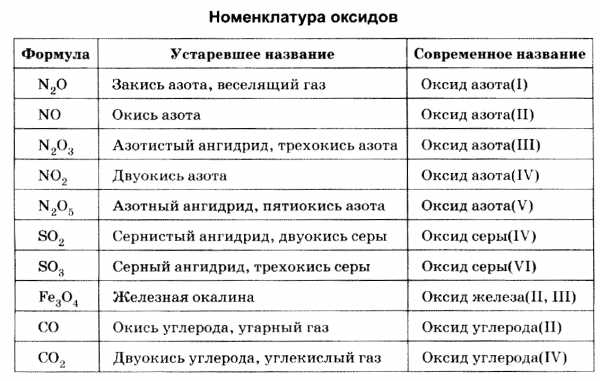 Номенклатура оксидов
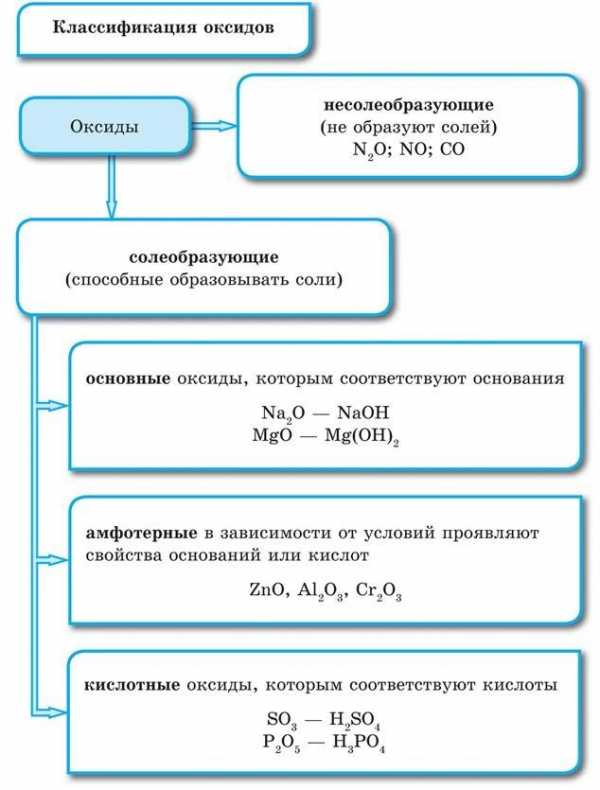
Номенклатура оксидовПо химическим свойствам оксиды подразделяются на солеобразующие и несолеобразующие.
 Типы оксидов
Типы оксидовНесолеобразующими называются такие оксиды, которые не взаимодействуют ни со щелочами, ни с кислотами и не образуют солей. Их немного, в состав входят неметаллы.
Солеобразующими называются такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
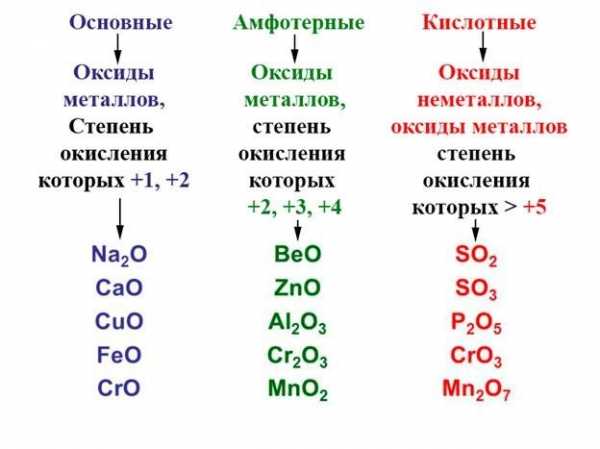
Среди солеобразующих оксидов различают оксиды основные, кислотные, амфотерные.
Основные оксиды — это такие оксиды, которым соответствуют основания. Например: CuO соответствует основание Cu(OH)2, Na2O — основание NaOH, Cu2O — CuOH и т. д.
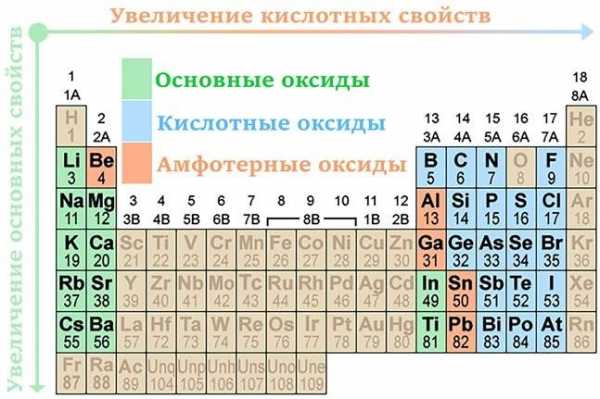 Оксиды в таблице Менделеева
Оксиды в таблице МенделееваТипичные реакции основных оксидов
1. Основный оксид + кислота = соль + вода (реакция обмена):
2. Основный оксид + кислотный оксид = соль (реакция соединения):
3. Основный оксид + вода = щелочь (реакция соединения):
Кислотные оксиды — это такие оксиды, которым соответствуют кислоты. Это оксиды неметаллов: N2O5 соответствует HNO3, SO3 — H2SO4, CO2 — H2CO3, P2O5 — H4PO4 а также оксиды металлов с большим значением степеней окисления: Cr2+6O3 соответствует H2CrO4, Mn2+7O7 — HMnO4.
Типичные реакции кислотных оксидов
1. Кислотный оксид + основание = соль + вода (реакция обмена):
2. Кислотный оксид + основный оксид соль (реакция соединения):
3. Кислотный оксид + вода = кислота (реакция соединения):
Такая реакция возможна, только если кислотный оксид растворим в воде.
Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Это ZnO, Al2O3, Cr2O3, V2O5.
Амфотерные оксиды с водой непосредственно не соединяются.
Типичные реакции амфотерных оксидов
1. Амфотерный оксид + кислота = соль + вода (реакция обмена):
2. Амфотерный оксид + основание = соль + вода или комплексное соединение:
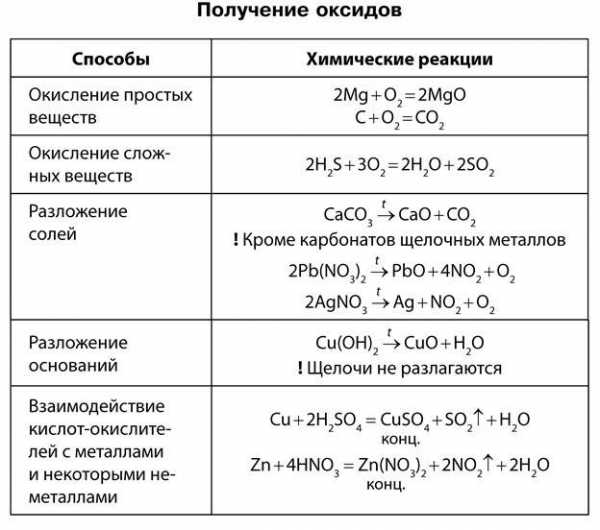
 Получение оксидов
Получение оксидов
Основные оксиды. К основным относят оксиды типичных металлов, им соответствуют гидроксиды, обладающие свойствами оснований.
Получение основных оксидов
Окисление металлов при нагревании в атмосфере кислорода.
2Mg + O2 = 2MgO
2Cu + O2 = 2CuO
Метод неприменим для получения оксидов щелочных металлов. В реакции с кислородом щелочные металлы обычно дают пероксиды, поэтому оксиды Na2O, К2O труднодоступны.
Обжиг сульфидов
2CuS + 3O2 = 2CuO + 2SO2
4FeS2 + 1102 = 2Fe2O3 + 8SO2
Метод неприменим для сульфидов активных металлов, окисляющихся до сульфатов.
Разложение гидроксидов
Cu(OH)2 = СuО + Н2О
Этим методом нельзя получить оксиды щелочных металлов.
Разложение солей кислородсодержащих кислот.
ВаСO3 = ВаО + СO2
2Pb(NO3)2 = 2РЬО + 4N02 + O2
4FeSO4 = 2Fe2O3 + 4SO2 + O2
Разложение легко осуществляется для нитратов и карбонатов, в том числе и для основных солей.
[ZnОH]2CO3 = 2ZnO + СO2 + Н2O
Получение кислотных оксидов
Кислотные оксиды представлены оксидами неметаллов или переходных металлов в высоких степенях окисления. Они могут быть получены методами, аналогичными методам получения основных оксидов, например:
- 4Р + 5O2 = 2Р2O5
- 2ZnS + 3O2 = 2ZnO + 2SO2
- K2Cr2O7 + H2SO4 = 2CrO3↓ + K2SO4 + H2O
- Na2SiO3 + 2HCl = 2NaCl + SiO2↓ + H2O
Шпаргалка

Справочный материал для прохождения тестирования:
Таблица Менделеева Таблица растворимостиwww.chem-mind.com
