Презентация к уроку «Строение электронных оболочек атомов № 1
Инфоурок › Химия › Презентации › Презентация к уроку «Строение электронных оболочек атомов № 1 — 20» (8 класс) ВНИМАНИЮ ВСЕХ УЧИТЕЛЕЙ: согласно Федеральному закону N273-ФЗ «Об образовании в Российской Федерации» педагогическая деятельность требует от педагога наличия системы специальных знаний в области обучения и воспитания детей с ОВЗ. Поэтому для всех педагогов является актуальным повышение квалификации по этому направлению!Дистанционный курс «Организация работы с обучающимися с ограниченными возможностями здоровья (ОВЗ) в соответствии с ФГОС» от проекта «Инфоурок» даёт Вам возможность привести свои знания в соответствие с требованиями закона и получить удостоверение о повышении квалификации установленного образца (72 часа).
Подать заявку на курс
Описание презентации по отдельным слайдам:
 Описание слайда: 2 слайд
Описание слайда: 2 слайд  Описание слайда:
Описание слайда:Вспомните! Чему равно общее количество электронов в атоме? Что такое энергетический уровень? Как определить число энергетических уровней? Как определить число электронов на внешнем уровне?
3 слайд Описание слайда:
Описание слайда:Запомните! Электроны, расположенные на последней электронной оболочке, называются внешними Число внешних электронов для химических элементов главных подгрупп равно номеру группы, в которой находится элемент
4 слайд Описание слайда:
Описание слайда:Проверка домашнего задания Задания Вариант 1 Вариант 1 1. По данным определить, какой это элемент а)2e 8e 3e б)2e 1e в)2e 8e 8e а)2e 4e б)2e 8e 7e в)1e 2. Определить элемент по его положению в ПСХЭ а)2период 3 группа главная подгруппа б)5 период 1 группа побочная подгруппа а)4 период 3 группа побочная подгруппа б)2 период 6 группа главная подгруппа
5 слайд
Проверьте себя и поставьте оценку, равную количеству правильных ответов: Задание 1. Вариант 1. а) Al б) Li в)Ar Вариант 2. а) С б) С l в)Н Задание 2. Вариант 1. а)В б)Аg Вариант 2. а) Ga б) O
6 слайд Описание слайда: 7 слайд
Описание слайда: 7 слайд  Описание слайда:
Описание слайда:«Строение электронных оболочек атомов химических элементов»
8 слайд Описание слайда:
Описание слайда:Цель урока: научиться составлять электронные формулы атомов элементов первых трех периодов ПСХЭ; объяснять зависимость и закономер- ные изменения свойств химических элементов от электронного строения их атомов.
9 слайд Описание слайда:
Описание слайда:Электронная оболочка Совокупность всех электронов в атоме, окружающих ядро Каждый электрон имеет свою траекторию движения и запас энергии Электроны расположены на различном расстоянии от ядра: чем ближе электрон к ядру, тем он прочнее с ним связан, его труднее вырвать из электронной оболочки По мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее
 Описание слайда: 11 слайд
Описание слайда: 11 слайд  Описание слайда:
Описание слайда:Форма электронных облаков (орбиталей) Орбиталь – это область наиболее вероят- ного местонахождения электрона в прост- ранстве
12 слайд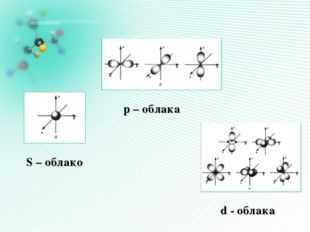 Описание слайда: S – облако р – облака d — облака 13 слайд
Описание слайда: S – облако р – облака d — облака 13 слайд  Описание слайда:
Описание слайда:Алгоритм составления электронных формул Записываем знак химического элемента и заряд ядра его атома – он равен порядковому номеру элемента. Определяем количество энергетических уровней (оно равно номеру периода) и коли- чество электронов на каждом уровне. Составляем электронную схему и формулу.
14 слайд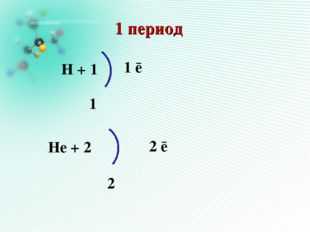 Описание слайда:
Описание слайда:1 период Н + 1 2 ē 1 1 ē Нe + 2 2
15 слайд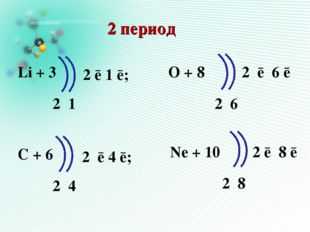 Описание слайда:
Описание слайда:2 период Li + 3 С + 6 O + 8 Ne + 10 2 1 2 6 2 4 2 8 2 ē 1 ē; 2 ē 6 ē 2 ē 4 ē; 2 ē 8 ē
16 слайд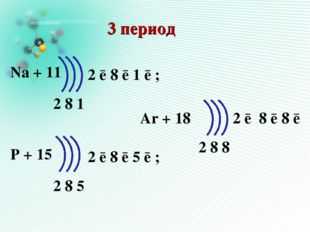 Описание слайда:
Описание слайда:3 период Na + 11 P + 15 Ar + 18 2 8 1 2 8 5 2 8 8 2 ē 8 ē 1 ē ; 2 ē 8 ē 5 ē ; 2 ē 8 ē 8 ē
17 слайд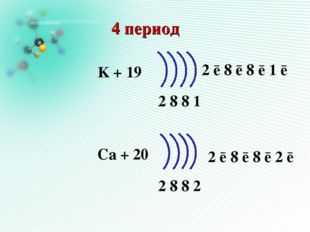 Описание слайда:
Описание слайда:4 период K + 19 Ca + 20 2 8 8 1 2 8 8 2 2 ē 8 ē 8 ē 1 ē 2 ē 8 ē 8 ē 2 ē
18 слайд Описание слайда:
Описание слайда:Физкультминутка Руки подняли и покачали – Это деревья в лесу. Руки согнули, кисти встряхнули – Ветер сбивает росу. В стороны руки, плавно помашем – Это к нам птицы летят. Как они тихо садятся, покажем – Крылья сложили назад.
19 слайд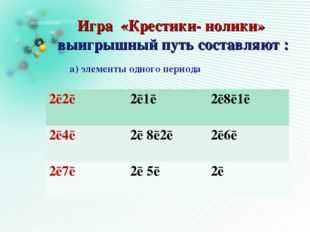 Описание слайда:
Описание слайда:Игра «Крестики- нолики» выигрышный путь составляют : а) элементы одного периода 2ē2ē 2ē1ē 2ē8ē1ē 2ē4ē 2ē 8ē2ē 2ē6ē 2ē7ē 2ē 5ē 2ē
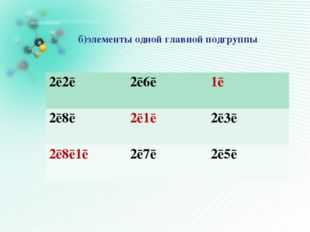 Описание слайда:
Описание слайда:б)элементы одной главной подгруппы 2ē2ē 2ē6ē 1ē 2ē8ē 2ē1ē 2ē3ē 2ē8ē1ē 2ē7ē 2ē5ē
21 слайд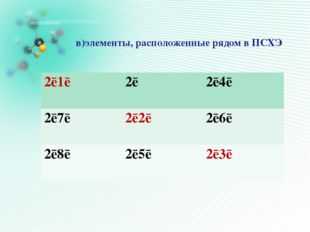 Описание слайда:
Описание слайда:в)элементы, расположенные рядом в ПСХЭ 2ē1ē 2ē 2ē4ē 2ē7ē 2ē2ē 2ē6ē 2ē8ē 2ē5ē 2ē3ē
22 слайд Описание слайда:
Описание слайда:Рефлексия Я все понял, могу объяснить другому По данной теме у меня остались вопросы Недостаточно понял тему, сам ошибаюсь
23 слайд Описание слайда:
Описание слайда:Ответьте на вопросы Какие данные об особеннос- тях строения атома отражает электронная формула? В чем заключается причина сходства элементов, расположен- ных в одной группе?
24 слайд Описание слайда:
Описание слайда:Выводы Причина сходства элементов заключа- ется в одинаковом строении внешних энергетических уровней их атомов Одинаковое строение внешних энерге- тических уровней периодически (т.е. через определенные промежутки – пери- оды) повторяется, поэтому периодически повторяются и свойства химических эле- ментов
 Описание слайда:
Описание слайда:Домашнее задание §40 стр. 169 – 171. Упражнение №1, 2 стр. 171. Составить электронные схемы и формулы строения атомов 2 и 3 периодов.
26 слайд Описание слайда:
Описание слайда:Молодцы! Вы сегодня хорошо потрудились. Спасибо за урок!

Курс повышения квалификации

Курс профессиональной переподготовки
Учитель химии

Курс повышения квалификации
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
Выберите категорию: Все категорииАлгебраАнглийский языкАстрономияБиологияВсеобщая историяГеографияГеометрияДиректору, завучуДоп. образованиеДошкольное образованиеЕстествознаниеИЗО, МХКИностранные языкиИнформатикаИстория РоссииКлассному руководителюКоррекционное обучениеЛитератураЛитературное чтениеЛогопедияМатематикаМузыкаНачальные классыНемецкий языкОБЖОбществознаниеОкружающий мирПриродоведениеРелигиоведениеРусский языкСоциальному педагогуТехнологияУкраинский языкФизикаФизическая культураФилософияФранцузский языкХимияЧерчениеШкольному психологуЭкологияДругое
Выберите класс: Все классыДошкольники1 класс2 класс3 класс4 класс5 класс6 класс7 класс8 класс9 класс10 класс11 класс
Выберите учебник: Все учебники
Выберите тему: Все темы
также Вы можете выбрать тип материала:
Общая информация
Номер материала: ДВ-475886

Похожие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарийinfourok.ru
Презентация по химии на тему » Строение электронных оболочек»(8 класс)
Инфоурок › Химия › Презентации › Презентация по химии на тему » Строение электронных оболочек»(8 класс) ВНИМАНИЮ ВСЕХ УЧИТЕЛЕЙ: согласно Федеральному закону N273-ФЗ «Об образовании в Российской Федерации» педагогическая деятельность требует от педагога наличия системы специальных знаний в области обучения и воспитания детей с ОВЗ. Поэтому для всех педагогов является актуальным повышение квалификации по этому направлению!Дистанционный курс «Организация работы с обучающимися с ограниченными возможностями здоровья (ОВЗ) в соответствии с ФГОС» от проекта «Инфоурок» даёт Вам возможность привести свои знания в соответствие с требованиями закона и получить удостоверение о повышении квалификации установленного образца (72 часа).
Подать заявку на курс
Описание презентации по отдельным слайдам:
1 слайд Описание слайда:
Описание слайда:«Строение электронных оболочек атомов химических элементов»
2 слайд Описание слайда:
Описание слайда:ВСПОМНИМ Чему равно общее количество электронов в атоме? Что такое энергетический уровень? Как определить число энергетических уровней? Как определить число электронов на внешнем уровне?
3 слайд Описание слайда:
Описание слайда:ЗАПОМНИМ Электроны, расположенные на последней электронной оболочке, называются внешними. Число внешних электронов для химических элементов главных подгрупп равно номеру группы, в которой находится элемент
4 слайд Описание слайда:
Описание слайда:ТЕМА УРОКА «Строение электронных оболочек атомов химических элементов №1-20»
5 слайд Описание слайда:
Описание слайда:Цель урока: научиться составлять электронные формулы атомов элементов первых трех периодов ПСХЭ; объяснять зависимость и закономерные изменения свойств химических элементов от электронного строения их атомов.
6 слайд Описание слайда:
Описание слайда:Электронная оболочка Совокупность всех электронов в атоме, окружающих ядро Каждый электрон имеет свою траекторию движения и запас энергии Электроны расположены на различном расстоянии от ядра: чем ближе электрон к ядру, тем он прочнее с ним связан, его труднее вырвать из электронной оболочки По мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее
7 слайд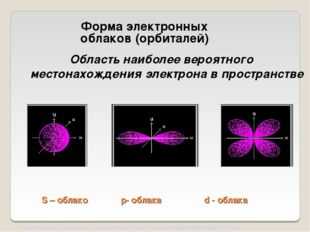 Описание слайда:
Описание слайда:S – облако p- облака d — облака Область наиболее вероятного местонахождения электрона в пространстве Форма электронных облаков (орбиталей) http://files.school-collection.edu.ru/dlrstore/bb14a035-aae7-11db-abbd-0800200c9a66/ch08_08_08.swf
8 слайд Описание слайда:
Описание слайда:Алгоритм составления электронных формул. Записываем знак химического элемента и заряд ядра его атома – он равен порядковому номеру элемента. Определяем количество энергетических уровней (оно равно номеру периода) и количество электронов на каждом уровне. Составляем электронную формулу, учитывая порядок заполнения каждого уровня – сначала s-электроны, затем – р-электроны: номер уровня, вид орбитали и количество электронов на ней. http://files.school-collection.edu.ru/dlrstore/bb14a033-aae7-11db-abbd-0800200c9a66/ch08_08_06.swf
9 слайд Описание слайда:
Описание слайда:1 период Н + 1 1 n=1 S 1 S1 Нe + 2 2 n=1 S 1 S2 Одиночный электрон на незавершенной оболочке 2 спаренных электрона на завершенной оболочке S — элементы
10 слайд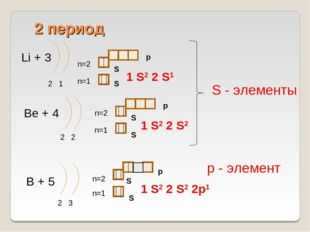 Описание слайда:
Описание слайда:2 период Li + 3 2 1 n=1 n=2 1 S2 2 S1 Be + 4 2 2 n=1 n=2 1 S2 2 S2 B + 5 2 3 n=1 n=2 1 S2 2 S2 2p1 S — элементы р — элемент S S S S S S p p p
11 слайд Описание слайда:
Описание слайда:2 период С + 6 2 4 n=1 n=2 N + 7 2 5 n=1 n=2 O + 8 2 6 n=1 n=2 1 S2 2 S2 2p4 р — элементы 1 S2 2 S2 2p2 1 S2 2 S2 2p3 S S S S S S p p p
12 слайд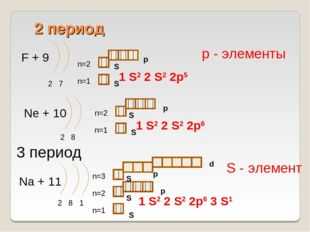 Описание слайда:
Описание слайда:2 период F + 9 2 7 n=1 n=2 Ne + 10 2 8 n=1 n=2 Na + 11 2 8 1 n=1 n=2 1 S2 2 S2 2p6 3 S1 р — элементы 1 S2 2 S2 2p5 1 S2 2 S2 2p6 3 период S — элемент S S S S S S S p p p p d n=3
13 слайд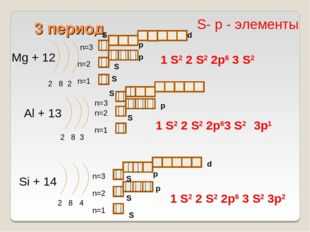 Описание слайда:
Описание слайда:3 период Mg + 12 2 8 2 n=1 n=2 Al + 13 2 8 3 n=1 n=2 Si + 14 2 8 4 n=1 n=2 1 S2 2 S2 2p6 3 S2 3p2 S- р — элементы 1 S2 2 S2 2p6 3 S2 1 S2 2 S2 2p63 S2 S S S S S S S p p p p d n=3 n=3 S p d n=3 3p1
14 слайд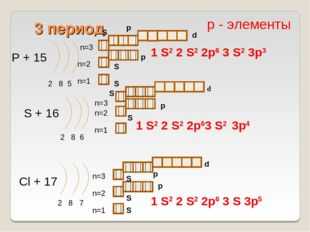 Описание слайда:
Описание слайда:3 период P + 15 2 8 5 n=1 n=2 S + 16 2 8 6 n=1 n=2 Cl + 17 2 8 7 n=1 n=2 1 S2 2 S2 2p6 3 S 3p5 р — элементы 1 S2 2 S2 2p6 3 S2 3p3 1 S2 2 S2 2p63 S2 S S S S S S S p p p p d n=3 n=3 S p d n=3 3p4 d
15 слайд Описание слайда:
Описание слайда:3 период Ar + 18 2 8 8 n=1 n=2 K + 19 2 8 8 1 Ca + 20 2 8 8 2 1 S2 2 S2 2p6 3 S2 3p64S2 р — элемент 1 S2 2 S2 2p6 3 S2 3p6 1 S2 2 S2 2p63 S2 S S p n=3 S p d 3p6 4S1
16 слайд Описание слайда:
Описание слайда:Физкультминутка Следим глазами
17 слайд Описание слайда:
Описание слайда:Закрепление материала Определить число орбиталей http://files.school-collection.edu.ru/dlrstore/bb14a031-aae7-11db-abbd-0800200c9a66/ch08_08_04.swf Определить число электронов на внешнем электронном уровне http://files.school-collection.edu.ru/dlrstore/bb14a032-aae7-11db-abbd-0800200c9a66/ch08_08_05.swf Определить общее число электронов на энергетическом уровне http://files.school-collection.edu.ru/dlrstore/bb14a030-aae7-11db-abbd-0800200c9a66/ch08_08_03.swf тест «электронные формулы атомов элементов» http://files.school-collection.edu.ru/dlrstore/bb14a038-aae7-11db-abbd-0800200c9a66/ch08_08_11.swf
18 слайд Описание слайда:
Описание слайда:Ответьте на вопросы Какие данные об особенностях строения атома отражает электронная формула? В чем заключается причина сходства элементов, расположенных в одной группе?
19 слайд Описание слайда:
Описание слайда:Выводы Причина сходства элементов заключается в одинаковом строении внешних энергетических уровней их атомов Одинаковое строение внешних энергетических уровней периодически (т.е. через определенные промежутки — периоды) повторяется, поэтому периодически повторяются и свойства химических элементов
20 слайд Описание слайда:
Описание слайда:Ресурсы http://fcior.edu.ru – сайт Федерального центра информационно-образовательных ресурсов. ФЦИОР реализует концепцию «единого окна» для доступа к любым электронным образовательным ресурсам системы образования РФ и предоставление единой современной технологической платформы для существующих и вновь создаваемых электронных образовательных ресурсов. http://rusedu.ru – Архив учебных программ и презентаций. На сайте представлены разработки уроков с использованием ИКТ, программы, пособия и методики. http://openclass.ru – «Открытый класс». http://school–collection.edu.ru — «Единая коллекция цифровых образовательных ресурсов» http://lyalyasirazhee.ucoz.ru — адрес личного сайта

Курс повышения квалификации

Курс профессиональной переподготовки
Учитель химии

Курс повышения квалификации
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
Выберите категорию: Все категорииАлгебраАнглийский языкАстрономияБиологияВсеобщая историяГеографияГеометрияДиректору, завучуДоп. образованиеДошкольное образованиеЕстествознаниеИЗО, МХКИностранные языкиИнформатикаИстория РоссииКлассному руководителюКоррекционное обучениеЛитератураЛитературное чтениеЛогопедияМатематикаМузыкаНачальные классыНемецкий языкОБЖОбществознаниеОкружающий мирПриродоведениеРелигиоведениеРусский языкСоциальному педагогуТехнологияУкраинский языкФизикаФизическая культураФилософияФранцузский языкХимияЧерчениеШкольному психологуЭкологияДругое
Выберите класс: Все классыДошкольники1 класс2 класс3 класс4 класс5 класс6 класс7 класс8 класс9 класс10 класс11 класс
Выберите учебник: Все учебники
Выберите тему: Все темы
также Вы можете выбрать тип материала:
Общая информация
Номер материала: ДБ-431906

Похожие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарийinfourok.ru
Презентация по Химии «Строение электронных оболочек атомов»
Презентация по Химии «Строение электронных оболочек атомов» — скачать смотреть бесплатно53335531463039513235404944384142294843374734365045565452
XСкопируйте код и вставьте его на свой сайт.
Строение электронных оболочек атомов
Описание презентации по отдельным слайдам:
 1 слайд
1 слайд2007 [email protected] Тема: Строение электронных оболочек атомов. Разработал: Учитель химии – биологии первой квалификационной категории Баженов Алексей Анатольевич Тюменская область. Ханты – Мансийский автономный округ. Нижневартовский район. МОУ Охтеурская ОСШ [email protected]
 2 слайд
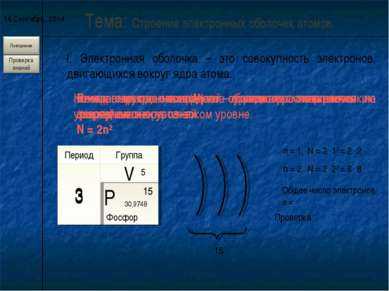
2 слайд* I. Электронная оболочка – это совокупность электронов, двигающихся вокруг ядра атома. Тема: Строение электронных оболочек атомов. Электроны в электронной оболочке располагаются на энергетических уровнях. n – главное квантовое число – определяет число энергетических уровней . Номер периода совпадает с числом энергетических уровней элемента. Период 3 Группа V 3 Число электронов (N) на уровне рассчитывается по формуле. N = 2n2 n = 1, N = 2 . 12 = 2 2 n = 2, N = 2 . 22 = 8 8 Номер группы совпадает с числом электронов на последнем энергетическом уровне. 5 Общее число электронов е = 15 Проверка 15
 3 слайд
3 слайд* Тема: Строение электронных оболочек атомов. II. Нарисуйте схемы строения электронных оболочек атомов: кислорода, натрия, водорода, кремния, углерода, гелия. O Na H Si C 2 1 Hе 2 6 2 8 1 2 8 4 2 4 +8 0 0 0 0 0 0 +11 +1 +14 +6 +2 16 23 1 28 12 4
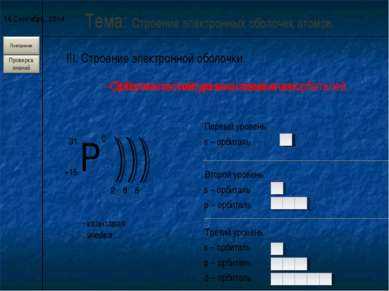 4 слайд
4 слайд* III. Строение электронной оболочки. Тема: Строение электронных оболочек атомов. — Энергетический уровень состоит из орбиталей. 2 8 5 Первый уровень s – орбиталь Второй уровень s – орбиталь p – орбиталь Третий уровень s – орбиталь p – орбиталь d – орбиталь — Орбиталь состоит из квантовых ячеек. квантовая ячейка
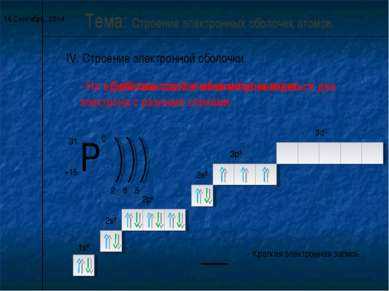 5 слайд
5 слайд* IV. Строение электронной оболочки. Тема: Строение электронных оболочек атомов. 2 8 5 — Орбиталь состоит из квантовых ячеек. — На одной квантовой ячейке могут находиться два электрона с разными спинами. 1s2 1s2 2s2 2s2 2p6 2p6 3s2 3s2 3p3 3p3 3d0 — Краткая электронная запись.
 6 слайд
6 слайд* Тема: Строение электронных оболочек атомов. V. Составить строение электронной оболочки элемента: В, Cl. В +5 11 0 2 3 1s2 1s2 2s2 2s2 2p1 2p1
 7 слайд
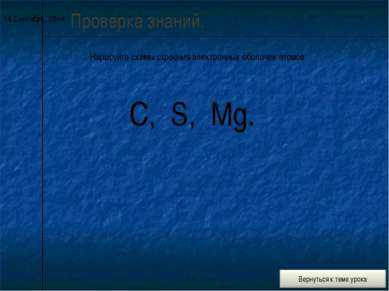
7 слайд* Проверка знаний. Нарисуйте схемы строения электронных оболочек атомов: C, S, Mg.
 8 слайд
8 слайд* Тема: Строение электронных оболочек атомов. Домашнее задание. & 8 Стр. 46 — 50 Нарисуйте схемы строения электронных оболочек атомов: бора, магния, хлора, лития, серы, алюминия.
 9 слайд
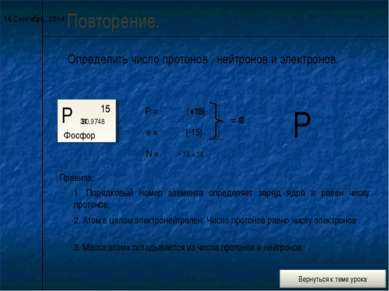
9 слайд* Повторение. Определить число протонов , нейтронов и электронов. Р Фосфор 15 30,9748 Р = е = N = Правила: 1. Порядковый номер элемента определяет заряд ядра и равен числу протонов. (+15) 15 2. Атом в целом электронейтрален. Число протонов равно числу электронов . 15 (-15) = 0 31 — 15 = 16 3. Масса атома складывается из числа протонов и нейтронов. Р +15 0 31
 10 слайд
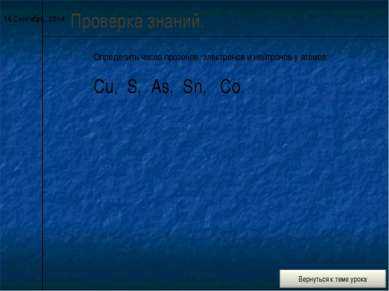
10 слайд* Проверка знаний. Определить число протонов, электронов и нейтронов у атомов: Cu, S, As, Sn, Co.
Чтобы скачать материал, введите свой email, укажите, кто Вы, и нажмите кнопку
Нажимая кнопку, Вы соглашаетесь получать от нас email-рассылку
Если скачивание материала не началось, нажмите еще раз «Скачать материал».
1052711870142541714117304185162166024400
336683380833837339533399334172341863420534206342353423634334
У вас есть презентация, загружайте:
Для того чтобы загрузить презентацию на сайт, необходимо зарегистрироваться.
uslide.ru
| 1 слайд | ЧТО ТАКОЕ ЭЛЕКТРОН? |
2 слайд |
• é – это частица! m0 = 0,9109534*10 – 27 г Z = 1,6021892*10 – 19 Кл |
3 слайд |
é – волна! Электрон обладает большой СКОРОСТЬЮ и ЭНЕРГИЕЙ! За долю секунды электрон способен «обежать» целую область пространства, называемую Электронное облако или атомная орбиталь |
4 слайд |
Местоположение электронов в
пространстве в данный момент времени определить
невозможно. Они ведут себя примерно так, как описал Льюис Кэрролл Чеширского Кота в сказке «Алиса в стране чудес»: Вроде бы он здесь, но в тоже время его нет, осталась лишь улыбка… |
5 слайд |
Виды электронных облаков: s-, p-, d-, f- |
6 слайд |
Все электроны атома образуют его ЭЛЕКТРОННУЮ ОБОЛОЧКУ |
7 слайд |
ЭЛЕКТРОННАЯ ОБОЛОЧКА
ДЕЛИТСЯ НА УРОВНИ. |
8 слайд |
(пример атома кремния) Атом какого химического элемента изображен на рисунке? |
9 слайд |
УРОВНИ состоят из ПОДУРОВНЕЙ, на которых располагаются атомные орбитали s-, p-, d- и f-типа |
10 слайд ПРОБЛЕМНЫЙ |
1 уровень – s- подуровень, 2 уровень – s- и p- подуровни, 3 уровень – s-, p- и d- подуровни, 4 уровень – s-, p-, d- и f- подуровни. Чему равно число подуровней на уровне? |
11 слайд |
s-подуровень 1 АО р-подуровень 3 АО d-подуровень 5 АО f-подуровень 7 АО ИТАК, имеем: 1s2s2p3s3p3d4s4p4d4f5s5p5d5f… 6s6p6d6f…7s7p7d7f… |
12 слайд |
ПРАВИЛА ЗАПОЛНЕНИЯ ЭЛЕКТРОНАМИ АО,
ПОДУРОВНЕЙ, УРОВНЕЙ 1) На одной АО могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (условно: по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами. |
13 слайд |
2) В пределах подуровня атомные орбитали заполняются одиночными электронами с параллельными спинами, и когда все орбитали данного подуровня будут заняты, происходит спаривание последних |
14 слайд |
3) Электроны стремятся занять
энергетически выгодное положение в электронной
оболочке, руководствуясь правилом
наименьшей энергии. Расположим АО в порядке
возрастания значений их энергии, которая
определяется суммой: (№ УРОВНЯ + число, которое
соответствует подуровню): s (0), p (2), d (3), f (4) |
15 слайд |
1 2 3
3 4 5 4 5 6 7 5 6 7 8 1s 2s2p3s3p3d4s4p4d4f5s5p5d5f… 6 7 8 9 7 8 9 10 6s6p6d6f… 7s7p7d7f… РЯД НАИМЕНЬШЕЙ ЭНЕРГИИ: 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p7s5f6d7p… |
16 слайд |
ЭНЕРГЕТИЧЕСКАЯ ДИАГРАММА РАСПОЛОЖЕНИЯ АО В ЭЛЕКТРОННОЙ ОБОЛОЧКЕ |
17 слайд |
СХЕМА СТРОЕНИЯ АТОМА Показывает распределение электронов по уровням |
18 слайд |
ЭЛЕКТРОННАЯ ФОРМУЛА (КОНФИГУРАЦИЯ)
АТОМА 1s1 Показывает распределение электронов по подуровням |
19 слайд |
ЭЛЕКТРОННО-ГРАФИЧЕСКАЯ ФОРМУЛА
АТОМА Показывает распределение электронов по АО |
xn--i1abbnckbmcl9fb.xn--p1ai
» Строение электронных оболочек атомов».
Инфоурок › Химия › Презентации › Презентация по химии на тему: » Строение электронных оболочек атомов». ВНИМАНИЮ ВСЕХ УЧИТЕЛЕЙ: согласно Федеральному закону N273-ФЗ «Об образовании в Российской Федерации» педагогическая деятельность требует от педагога наличия системы специальных знаний в области обучения и воспитания детей с ОВЗ. Поэтому для всех педагогов является актуальным повышение квалификации по этому направлению!Дистанционный курс «Организация работы с обучающимися с ограниченными возможностями здоровья (ОВЗ) в соответствии с ФГОС» от проекта «Инфоурок» даёт Вам возможность привести свои знания в соответствие с требованиями закона и получить удостоверение о повышении квалификации установленного образца (72 часа).
Подать заявку на курс
Описание презентации по отдельным слайдам:
1 слайд Описание слайда:
Описание слайда:СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМОВ 8 класс
2 слайд Описание слайда:
Описание слайда:Цели урока Сформировать представления об электронной обоблочек атома и энергетических уровнях Рассмотреть электронное строение элементов 1-3 периодов
3 слайд Описание слайда:
Описание слайда:Проверка домашнего задания Упражнения – стр. 46 Я́дерная реа́кция — процесс образования новых ядер или частиц при столкновениях ядер или частиц. Впервые ядерную реакцию наблюдал Резерфорд в 1919 году, бомбардируя α-частицами ядра атомов азота .
4 слайд Описание слайда:
Описание слайда:Правило смещения (правило Содди-Фаянса): При α – распаде радиоактивный элемент превращается в другой, отстоящий от исходного на 2 клеточки левее в периодической системе химических элементов, а при β – распаде получается химический элемент с порядковым номером на единицу большим, чем исходный. Фредерик Содди (1877-1956), открыл явление изотопии в 1910г. (Нобелевская премия по химии, 1921г.) Казимир Фаянс (1887-1975) Закон смещения дал возможность предсказывать последовательность распада многих радиоактивных элементов, определяя образующиеся таким образом элементы на основе вида излучения и включая их в таблицу периодической системы.
5 слайд Описание слайда:
Описание слайда:ОБОЗНАЧЕНИЕ ЯДРА АТОМА АЛЬФА α — РАСПАД — характерен для радиоактивных элементов с порядковым номером больше 83 — обязательно выполняется закон сохранения массового и зарядового числа. — часто сопровождается гамма-излучением. Реакция альфа-распада: БЕТА β — РАСПАД — часто сопровождается гамма-излучением. — может сопровождаться образованием антинейтрино ( легких электрически нейтральных частиц, обладающих большой проникающей способностью). — обяэательно должен выполняться закон сохранения массового и зарядового числа. Реакция бета-распада: ГАММА γ -распад – это поток электромагнитного излучения с очень короткой длиной волны и очень высокой (интенсивной) частотой, при этом массовое число и заряд ядра не изменяются, а энергия ядра уменьшается. Закон сохранения массового числа и заряда: Сумма зарядов (массовых чисел) продуктов распада равна заряду (массовому числу) исходного ядра
6 слайд Описание слайда:
Описание слайда:Написание уравнений ядерных реакций
7 слайд Описание слайда: 8 слайд
Описание слайда: 8 слайд  Описание слайда:
Описание слайда:Ответьте на вопросы Чем можно объяснить различие в свойствах элементов? Причина – различие атомов (различное число протонов и электронов) Чем можно объяснить сходство некоторых элементов? — Причина – сходство внутреннего строения атома
9 слайд Описание слайда:
Описание слайда:Электронная оболочка Совокупность всех электронов в атоме, окружающих ядро Каждый электрон имеет свою траекторию движения и запас энергии Электроны расположены на различном расстоянии от ядра: чем ближе электрон к ядру, тем он прочнее с ним связан, его труднее вырвать из электронной оболочки По мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее
10 слайд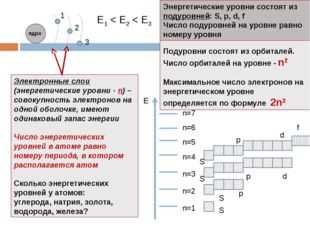 Описание слайда:
Описание слайда:Подуровни состоят из орбиталей. Число орбиталей на уровне — n2 Максимальное число электронов на энергетическом уровне определяется по формуле 2n2 1 2 3 Е1 < E2 < E3 Электронные слои (энергетические уровни — n) – совокупность электронов на одной оболочке, имеют одинаковый запас энергии Число энергетических уровней в атоме равно номеру периода, в котором располагается атом Сколько энергетических уровней у атомов: углерода, натрия, золота, водорода, железа? Энергетические уровни состоят из подуровней: S, p, d, f Число подуровней на уровне равно номеру уровня Е n=1 n=2 n=3 n=4 n=5 n=6 n=7 S p d f S S S p p d ядро
11 слайд Описание слайда:
Описание слайда:Энергетические уровни, содержащие максимальное число электронов, называются завершенными. Они обладают повышенной устойчивостью и стабильностью Энергетические уровни, содержащие меньшее число электронов, называются незавершенными n=1 – 1 подуровень (S), 2 электрона n=2 – 2 подуровня (S, р), 8 электронов n=3 – 3 подуровня (S, р, d), 18 электронов n=4 – 4 подуровня (S, р, d, f), 32 электрона
12 слайд Описание слайда:
Описание слайда:Запомните! Электроны, расположенные на последней электронной оболочке, называются внешними. Число внешних электронов для химических элементов главных подгрупп равно номеру группы, в которой находится элемент
13 слайд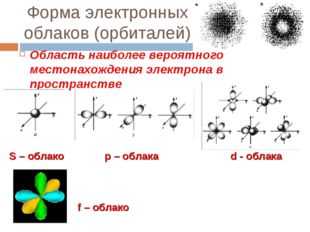 Описание слайда:
Описание слайда:Форма электронных облаков (орбиталей) Область наиболее вероятного местонахождения электрона в пространстве S – облако р – облака d — облака f – облако
14 слайд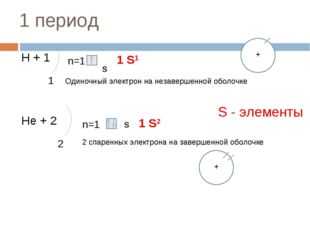 Описание слайда:
Описание слайда:1 период Н + 1 1 n=1 S 1 S1 Нe + 2 2 n=1 S 1 S2 Одиночный электрон на незавершенной оболочке 2 спаренных электрона на завершенной оболочке S — элементы + +
15 слайд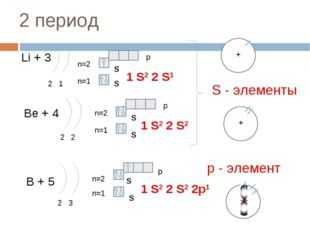 Описание слайда:
Описание слайда:2 период Li + 3 2 1 n=1 n=2 1 S2 2 S1 Be + 4 2 2 n=1 n=2 1 S2 2 S2 B + 5 2 3 n=1 n=2 1 S2 2 S2 2p1 S — элементы р — элемент S S S S S S p p p + + + +
16 слайд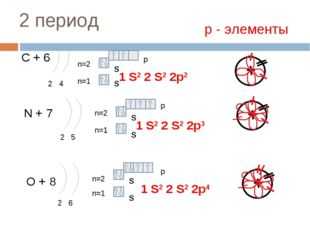 Описание слайда:
Описание слайда:2 период С + 6 2 4 n=1 n=2 N + 7 2 5 n=1 n=2 O + 8 2 6 n=1 n=2 1 S2 2 S2 2p4 р — элементы 1 S2 2 S2 2p2 1 S2 2 S2 2p3 S S S S S S p p p
17 слайд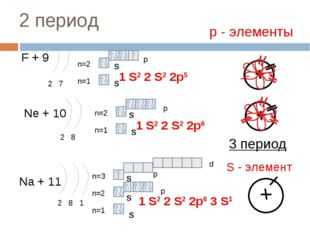 Описание слайда:
Описание слайда:2 период F + 9 2 7 n=1 n=2 Ne + 10 2 8 n=1 n=2 Na + 11 2 8 1 n=1 n=2 1 S2 2 S2 2p6 3 S1 р — элементы 1 S2 2 S2 2p5 1 S2 2 S2 2p6 3 период S — элемент S S S S S S S p p p p d n=3
18 слайд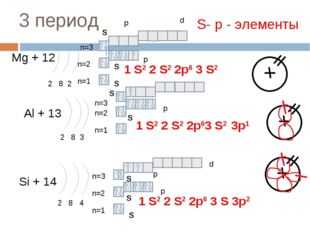 Описание слайда:
Описание слайда:3 период Mg + 12 2 8 2 n=1 n=2 Al + 13 2 8 3 n=1 n=2 Si + 14 2 8 4 n=1 n=2 1 S2 2 S2 2p6 3 S 3p2 S- р — элементы 1 S2 2 S2 2p6 3 S2 1 S2 2 S2 2p63 S2 S S S S S S S p p p p d n=3 n=3 S p d n=3 3p1
19 слайд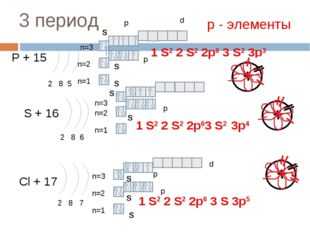 Описание слайда:
Описание слайда:3 период P + 15 2 8 5 n=1 n=2 S + 16 2 8 6 n=1 n=2 Cl + 17 2 8 7 n=1 n=2 1 S2 2 S2 2p6 3 S 3p5 р — элементы 1 S2 2 S2 2p6 3 S2 3p3 1 S2 2 S2 2p63 S2 S S S S S S S p p p p d n=3 n=3 S p d n=3 3p4
20 слайд Описание слайда:
Описание слайда:3 период Ar + 18 2 8 8 n=1 n=2 K + 19 2 8 8 1 Ca + 20 2 8 8 2 1 S2 2 S2 2p6 3 S2 3p64S2 р — элемент 1 S2 2 S2 2p6 3 S2 3p6 1 S2 2 S2 2p63 S2 S S p n=3 S p d 3p6 4S1
21 слайд Описание слайда:
Описание слайда:Выводы Причина сходства элементов заключается в одинаковом строении внешних энергетических уровней их атомов Одинаковое строение внешних энергетических уровней периодически (т.е. через определенные промежутки — периоды) повторяется, поэтому периодически повторяются и свойства химических элементов
22 слайд Описание слайда:
Описание слайда:Домашнее задание Параграф 8, записи в тетради Зарисовать строение химических элементов 3 периода Упражнения 2-5, стр. 52-53

Курс повышения квалификации

Курс профессиональной переподготовки
Учитель химии

Курс повышения квалификации
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
Выберите категорию: Все категорииАлгебраАнглийский языкАстрономияБиологияВсеобщая историяГеографияГеометрияДиректору, завучуДоп. образованиеДошкольное образованиеЕстествознаниеИЗО, МХКИностранные языкиИнформатикаИстория РоссииКлассному руководителюКоррекционное обучениеЛитератураЛитературное чтениеЛогопедияМатематикаМузыкаНачальные классыНемецкий языкОБЖОбществознаниеОкружающий мирПриродоведениеРелигиоведениеРусский языкСоциальному педагогуТехнологияУкраинский языкФизикаФизическая культураФилософияФранцузский языкХимияЧерчениеШкольному психологуЭкологияДругое
Выберите класс: Все классыДошкольники1 класс2 класс3 класс4 класс5 класс6 класс7 класс8 класс9 класс10 класс11 класс
Выберите учебник: Все учебники
Выберите тему: Все темы
также Вы можете выбрать тип материала:
Общая информация
Номер материала: ДБ-046729

Похожие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарийinfourok.ru
Презентация «Строение электронных оболочек»

Строение электронных оболочек атомов элементов №1-20

Строение электронных оболочек атомов
Каждый электрон в атоме обладает запасом энергии ( Е связи).
Электроны с близкой энергией (Е связи), образуют энергетические уровни.
Число энергетических уровней в атоме химического элемента равно номеру периода.
энергетические уровни
Общее число электронов, находящихся на энергетическом уровне, определяется по формуле:
N = 2 n 2 , где n – номер уровня
+
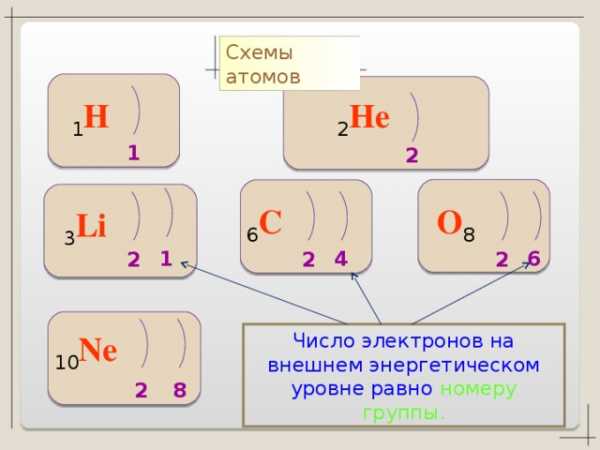
Схемы атомов
1 H
2 He
1
2
6 C
O 8
3 Li
6
4
1
2
2
2
Число электронов на внешнем энергетическом уровне равно номеру группы.
10 Ne
8
2
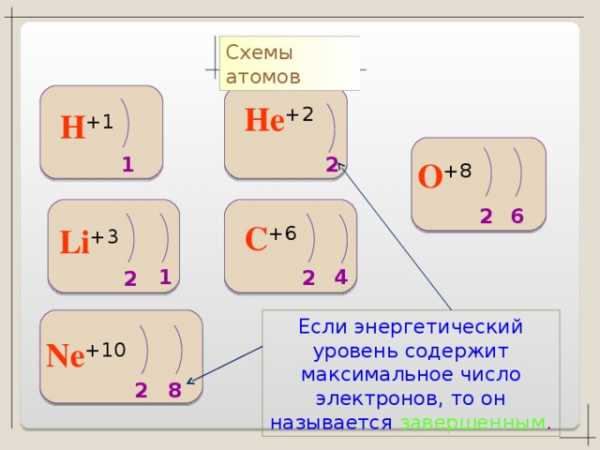
Схемы атомов
He +2
H +1
1
2
O +8
6
2
C +6
Li +3
1
4
2
2
Если энергетический уровень содержит максимальное число электронов, то он называется завершенным .
Ne +10
2
8
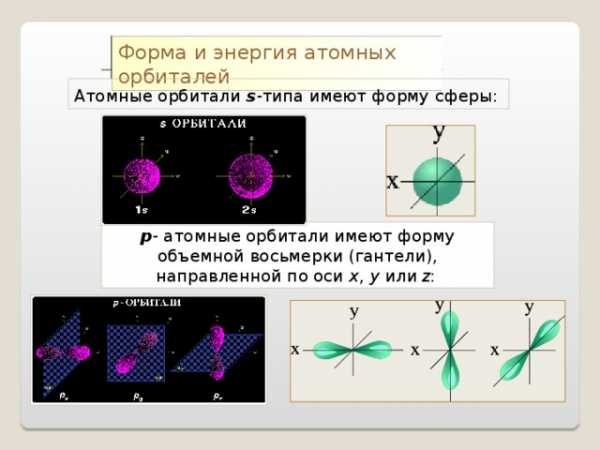
Форма и энергия атомных орбиталей
Атомные орбитали s -типа имеют форму сферы:
р — атомные орбитали имеют форму объемной восьмерки (гантели), направленной по оси x , y или z :
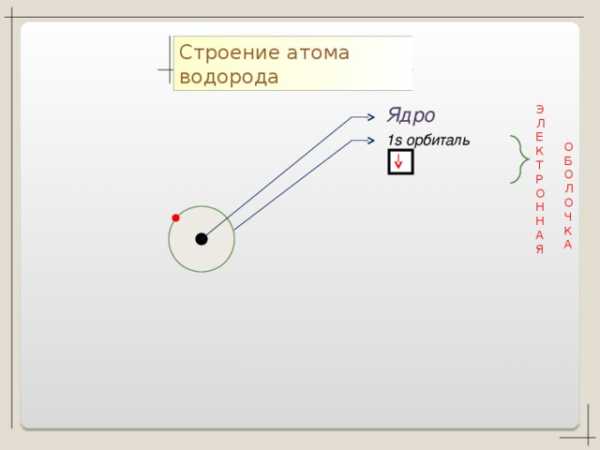
Коллекция учебных динамических слайдов по химии 8 класс.
Строение атома водорода
Э
Л
Е
К
Т
Р
О
Н
Н
А
Я
Ядро
1 s орбиталь
О
Б
О
Л
О
Ч
К
А
Баженов Алексей Анатольевич
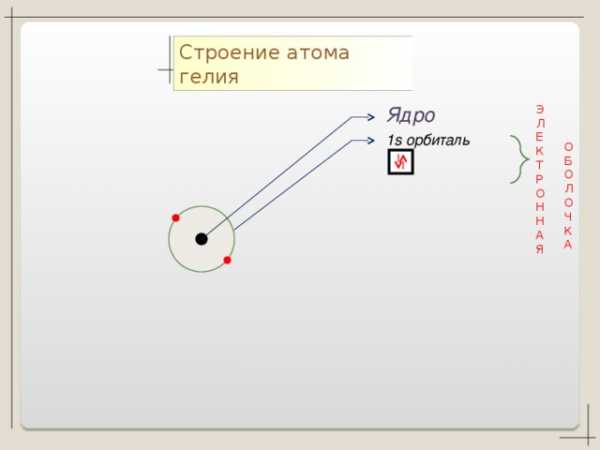
Коллекция учебных динамических слайдов по химии 8 класс.
Строение атома гелия
Ядро
Э
Л
Е
К
Т
Р
О
Н
Н
А
Я
1 s орбиталь
О
Б
О
Л
О
Ч
К
А
Баженов Алексей Анатольевич
Коллекция учебных динамических слайдов по химии 8 класс.
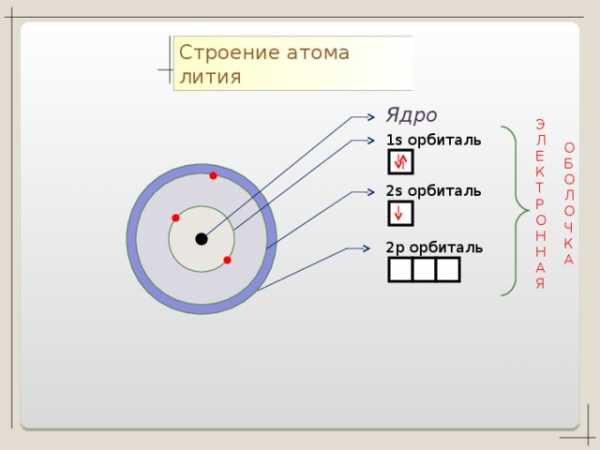
Строение атома лития
Ядро
Э
Л
Е
К
Т
Р
О
Н
Н
А
Я
1 s орбиталь
О
Б
О
Л
О
Ч
К
А
2 s орбиталь
2 p орбиталь
Баженов Алексей Анатольевич
Коллекция учебных динамических слайдов по химии 8 класс.
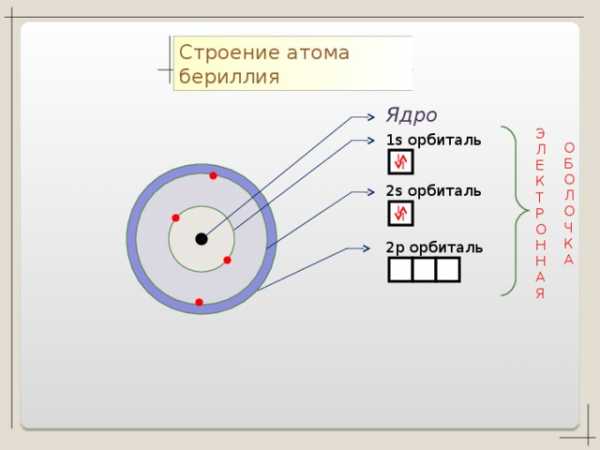
Строение атома бериллия
Ядро
Э
Л
Е
К
Т
Р
О
Н
Н
А
Я
1 s орбиталь
О
Б
О
Л
О
Ч
К
А
2 s орбиталь
2 p орбиталь
Баженов Алексей Анатольевич
Коллекция учебных динамических слайдов по химии 8 класс.
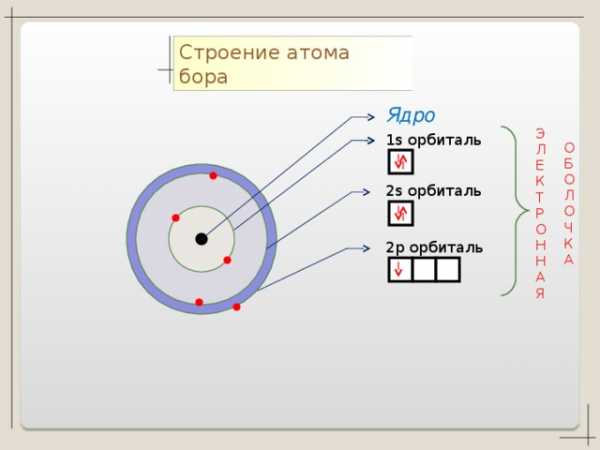
Строение атома бора
Ядро
Э
Л
Е
К
Т
Р
О
Н
Н
А
Я
1 s орбиталь
О
Б
О
Л
О
Ч
К
А
2 s орбиталь
2 p орбиталь
Баженов Алексей Анатольевич
Коллекция учебных динамических слайдов по химии 8 класс.
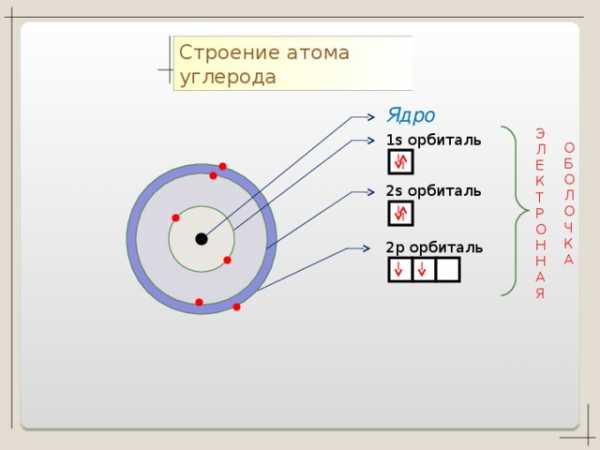
Строение атома углерода
Ядро
Э
Л
Е
К
Т
Р
О
Н
Н
А
Я
1 s орбиталь
О
Б
О
Л
О
Ч
К
А
2 s орбиталь
2 p орбиталь
Баженов Алексей Анатольевич
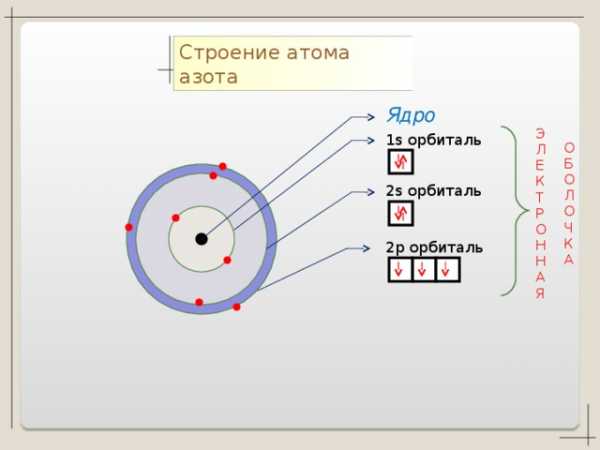
Коллекция учебных динамических слайдов по химии 8 класс.
Строение атома азота
Ядро
Э
Л
Е
К
Т
Р
О
Н
Н
А
Я
1 s орбиталь
О
Б
О
Л
О
Ч
К
А
2 s орбиталь
2 p орбиталь
Баженов Алексей Анатольевич
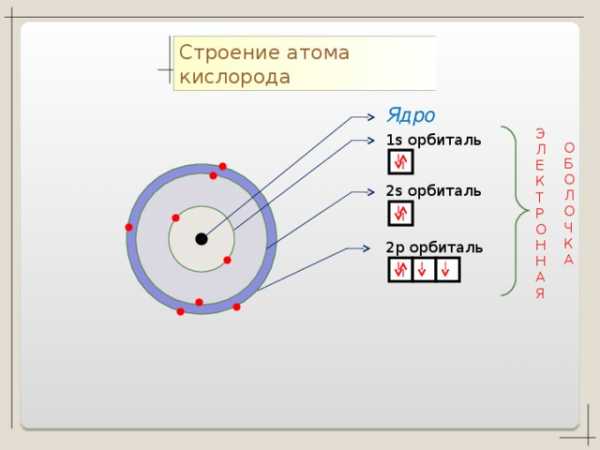
Коллекция учебных динамических слайдов по химии 8 класс.
Строение атома кислорода
Ядро
Э
Л
Е
К
Т
Р
О
Н
Н
А
Я
1 s орбиталь
О
Б
О
Л
О
Ч
К
А
2 s орбиталь
2 p орбиталь
Баженов Алексей Анатольевич
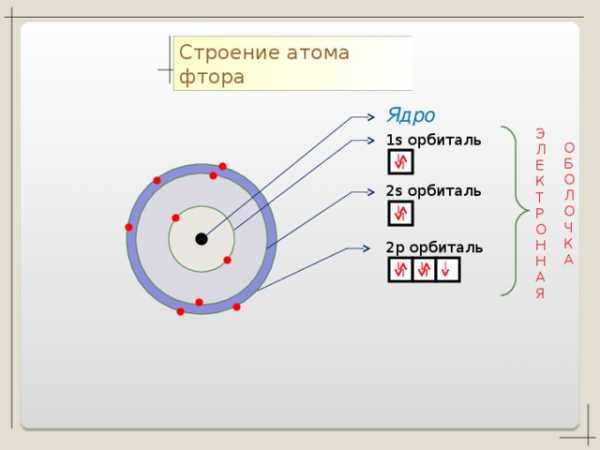
Коллекция учебных динамических слайдов по химии 8 класс.
Строение атома фтора
Ядро
Э
Л
Е
К
Т
Р
О
Н
Н
А
Я
1 s орбиталь
О
Б
О
Л
О
Ч
К
А
2 s орбиталь
2 p орбиталь
Баженов Алексей Анатольевич
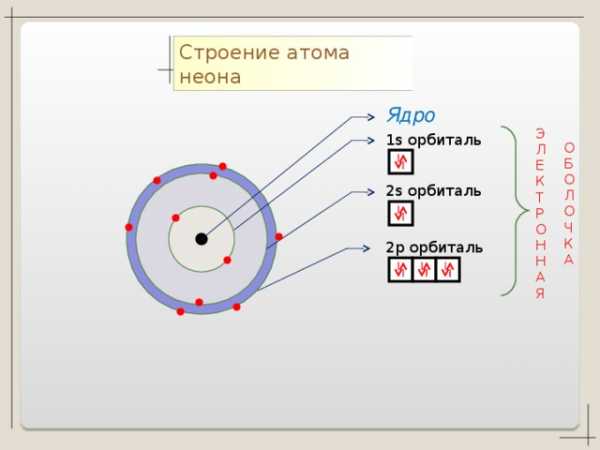
Коллекция учебных динамических слайдов по химии 8 класс.
Строение атома неона
Ядро
Э
Л
Е
К
Т
Р
О
Н
Н
А
Я
1 s орбиталь
О
Б
О
Л
О
Ч
К
А
2 s орбиталь
2 p орбиталь
Баженов Алексей Анатольевич
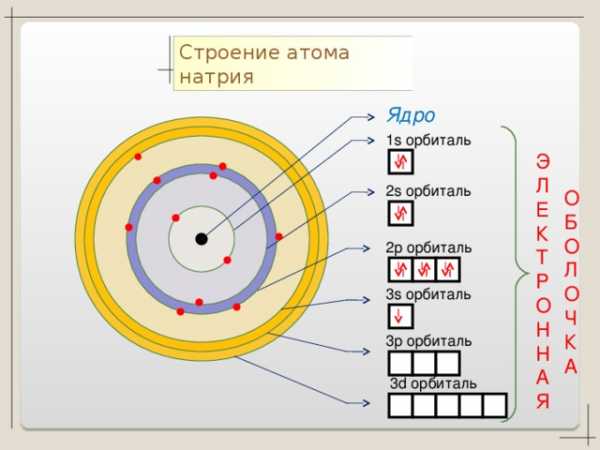
Коллекция учебных динамических слайдов по химии 8 класс.
C троение атома Na .
Строение атома натрия
Ядро
1 s орбиталь
Э
Л
Е
К
Т
Р
О
Н
Н
А
Я
2 s орбиталь
О
Б
О
Л
О
Ч
К
А
2 p орбиталь
3s орбиталь
3p орбиталь
3d орбиталь
Баженов Алексей Анатольевич

multiurok.ru
