Презентация — Строение электронных оболочек атомов
Слайды и текст этой презентации
Слайд 1

Строение электронных оболочек атомов
8 класс
Слайд 2

Сначала заполняется электронами ближайший к ядру слой. На этом слое не больше 2-х электронов
Слайд 3

Электронная оболочка – это совокупность всех электронов в атоме, окружающих ядро
Электроны расположены на различном расстоянии от ядра: чем ближе электрон к ядру, тем он прочнее с ним связан, его труднее вырвать из электронной оболочки
По мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее
Слайд 4

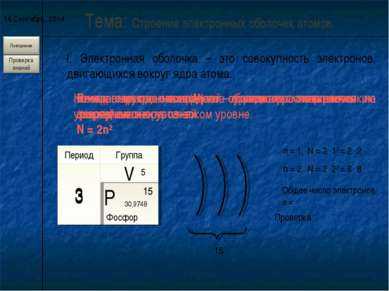
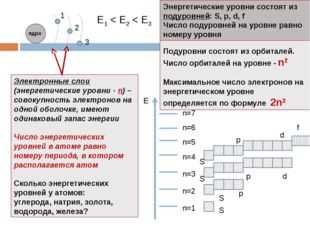
Подуровни состоят из орбиталей. Число орбиталей на уровне — n2
Максимальное число электронов на энергетическом уровне определяется по формуле 2n2
1
2
3
Е1 Электронные слои (энергетические уровни — n) – совокупность электронов на одной оболочке, имеют одинаковый запас энергии
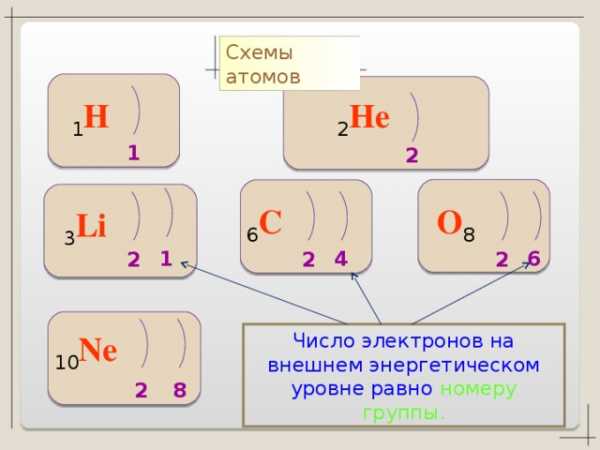
Число энергетических уровней в атоме равно номеру периода, в котором располагается атом
Сколько энергетических уровней у атомов:
углерода, натрия, золота, водорода, железа?
Энергетические уровни состоят из подуровней: S, p, d, f
Число подуровней на уровне равно номеру уровня
Е
n=1
n=2
n=3
n=4
n=5
n=6
n=7
S
p
d
f
S
S
S
p
p
d
ядро
Слайд 5

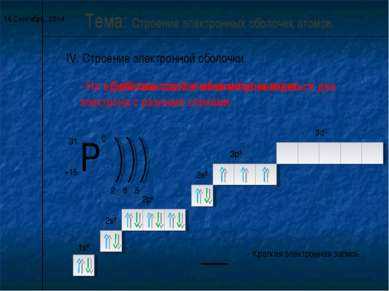
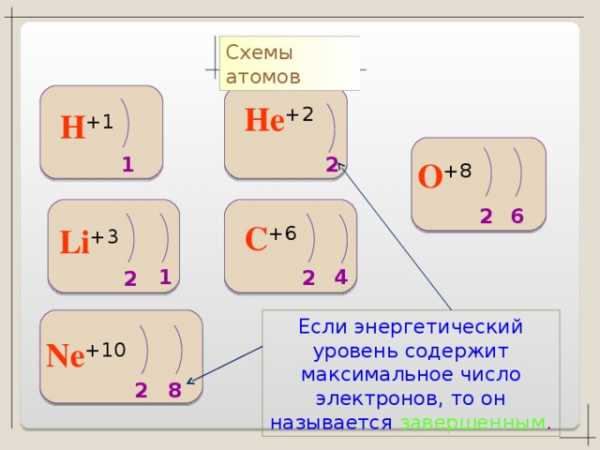
Энергетические уровни, содержащие максимальное число электронов, называются завершенными. Они обладают повышенной устойчивостью и стабильностью
Энергетические уровни, содержащие меньшее число электронов, называются незавершенными
n=1 – 1 подуровень (S), 2 электрона
n=2 – 2 подуровня (S, р), 8 электронов
n=3 – 3 подуровня (S, р, d), 18 электронов
n=4 – 4 подуровня (S, р, d, f), 32 электрона
Слайд 6

ЗАПОМНИТЕ!
Электроны, расположенные на последней электронной оболочке, называются внешними.
Число внешних электронов для химических элементов главных подгрупп равно номеру группы, в которой находится элемент
Слайд 7

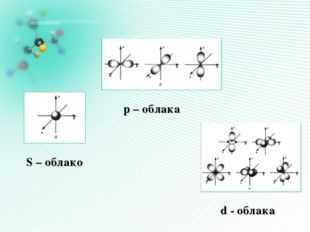
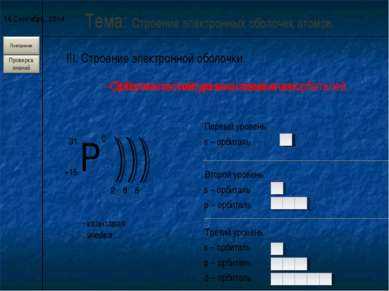
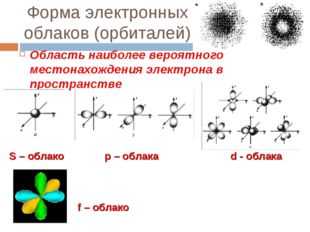
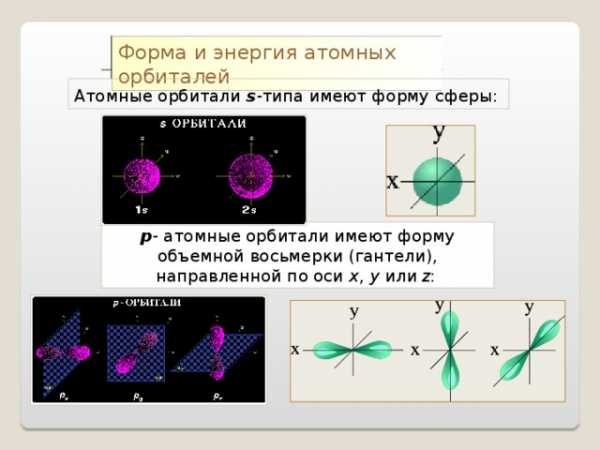
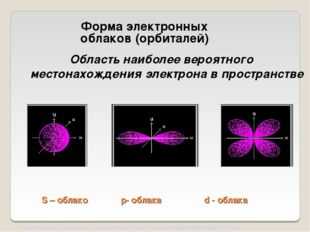
Форма электронных облаков (орбиталей)
Область наиболее вероятного местонахождения электрона в пространстве
S – облако р – облака d — облака
f – облако
Слайд 8

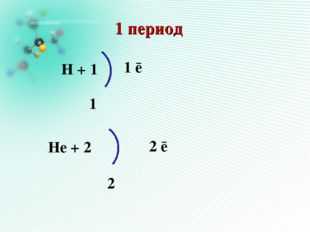
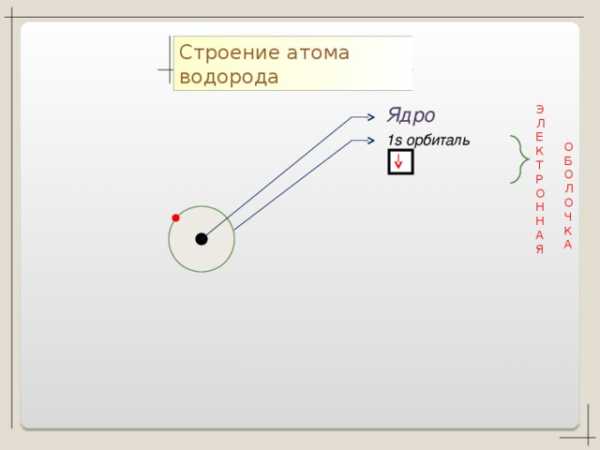
1 период
Н + 1
1
n=1
S
1 S1
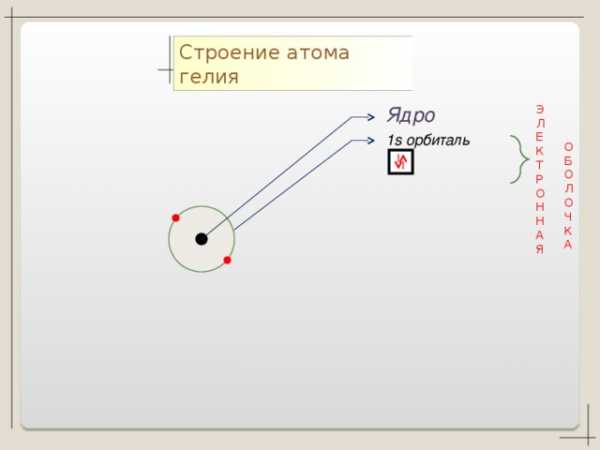
Нe + 2
2
n=1
S
1 S2
Одиночный электрон на незавершенной оболочке
2 спаренных электрона на завершенной оболочке
S — элементы
+
+
Слайд 9

Электронные облака
С
6
Схема построена
Для построения схемы нажимайте на клавишу «ПРОБЕЛ»
Следующий слайд
Слайд 10

Электронные облака
O
8
Схема построена
Для построения схемы нажимайте на клавишу «ПРОБЕЛ»
Следующий слайд
Слайд 11

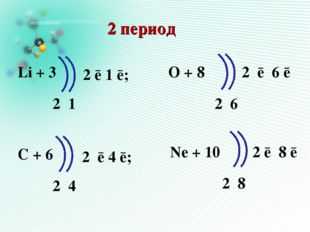
2 период
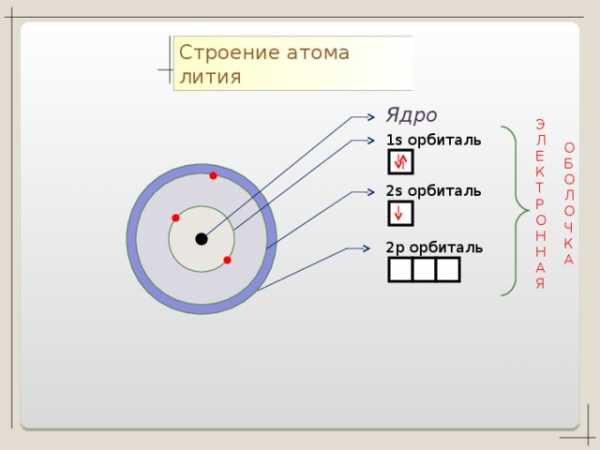
Li + 3
2 1
n=1
n=2
1 S2 2 S1
Be + 4
2 2
n=1
n=2
1 S2 2 S2
B + 5
2 3
n=1
n=2
1 S2 2 S2 2p1
S — элементы
р — элемент
S
S
S
S
S
S
p
p
p
+
+
+
+
Слайд 12
2 период
С + 6
2 4
n=1
n=2
N + 7
2 5
n=1
n=2
O + 8
2 6
n=1
n=2
1 S2 2 S2 2p4
р — элементы
1 S2 2 S2 2p2
1 S2 2 S2 2p3
S
S
S
S
S
S
p
p
p
Слайд 13

2 период
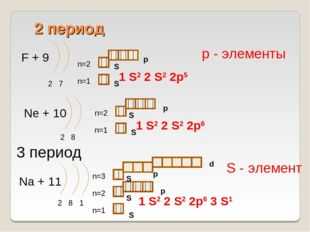
F + 9
2 7
n=1
n=2
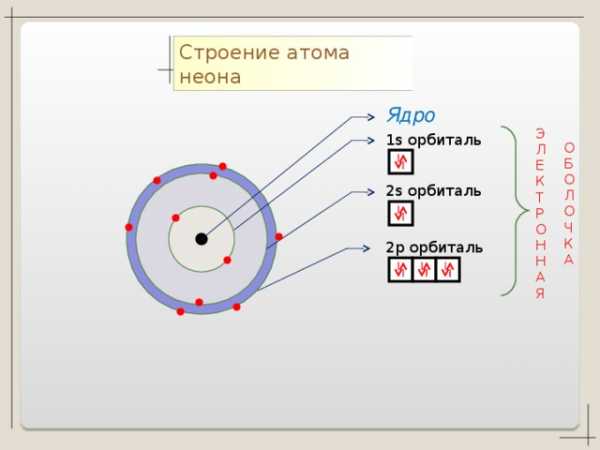
Ne + 10
2 8
n=1
n=2
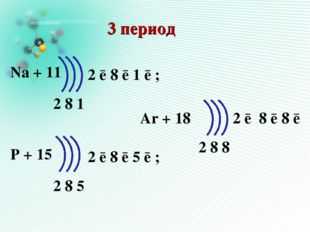
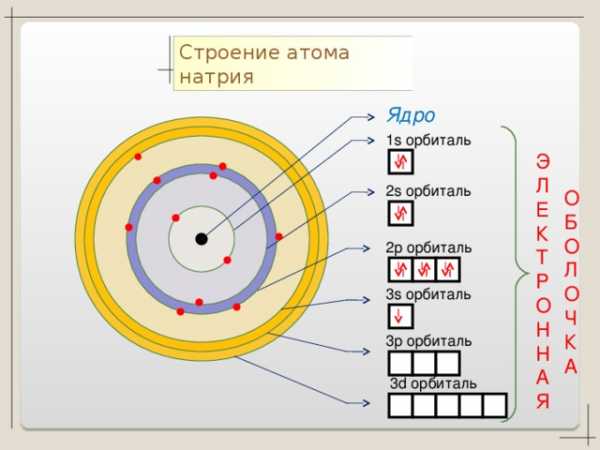
Na + 11
2 8 1
n=1
n=2
1 S2 2 S2 2p6 3 S1
р — элементы
1 S2 2 S2 2p5
1 S2 2 S2 2p6
3 период
S — элемент
S
S
S
S
S
S
S
p
p
p
p
d
n=3
Слайд 14
3 период
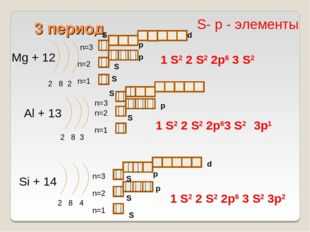
Mg + 12
2 8 2
n=1
n=2
Al + 13
2 8 3
n=1
n=2
Si + 14
2 8 4
n=1
n=2
1 S2 2 S2 2p6 3 S 3p2
S- р — элементы
1 S2 2 S2 2p6 3 S2
1 S2 2 S2 2p63 S2
S
S
S
S
S
S
S
p
p
p
p
d
n=3
n=3
S
p
d
n=3
3p1
Слайд 15
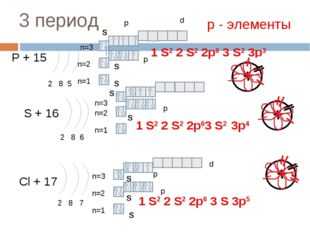
3 период
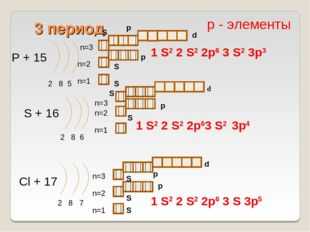
P + 15
2 8 5
n=1
n=2
S + 16
2 8 6
n=1
n=2
Cl + 17
2 8 7
n=1
n=2
1 S2 2 S2 2p6 3 S 3p5
р — элементы
1 S2 2 S2 2p6 3 S2 3p3
1 S2 2 S2 2p63 S2
S
S
S
S
S
S
S
p
p
p
p
d
n=3
n=3
S
p
d
n=3
3p4
Слайд 16
3 период
Ar + 18
2 8 8
n=1
n=2
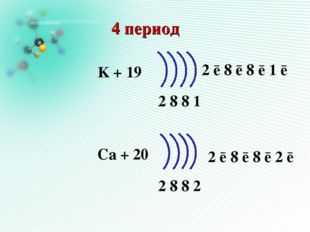
K + 19
2 8 8 1
Ca + 20
2 8 8 2
1 S2 2 S2 2p6 3 S2 3p64S2
р — элемент
1 S2 2 S2 2p6 3 S2 3p6
1 S2 2 S2 2p63 S2
S
S
p
n=3
S
p
d
3p6 4S1
Слайд 17
ВЫВОДЫ
Причина сходства элементов заключается в одинаковом строении внешних энергетических уровней их атомов
Одинаковое строение внешних энергетических уровней периодически (т.е. через определенные промежутки — периоды) повторяется, поэтому периодически повторяются и свойства химических элементов
lusana.ru
| Почему учителям и воспитателям следует проходить курсы повышения квалификации и профессиональной переподготовки в учебном центре «Инфоурок» ?• Огромный каталог: 677 курсов профессиональной переподготовки и повышения квалификации;• Очень низкая цена, при этом доступна оплата обучения в рассрочку – первый взнос всего 10%, оставшуюся часть необходимо оплатить до конца обучения; • Курсы проходят полностью в дистанционном режиме (форма обучения в документах не указывается); • Возможность оплаты курса за счёт Вашей организации. • Дипломы и Удостоверения от проекта «Инфоурок» соответствуют всем установленным законодательству РФ требованиям. (Согласно ФЗ «Об образовании в Российской Федерации» от 2012 года). |
infourok.ru
Строение электронных оболочек атомов химических элементов 8 класс
Обратная связь
Если не удалось найти и скачать доклад-презентацию, Вы можете заказать её на нашем сайте. Мы постараемся найти нужный Вам материал и отправим по электронной почте. Не стесняйтесь обращаться к нам, если у вас возникли вопросы или пожелания:
Не стесняйтесь обращаться к нам, если у вас возникли вопросы или пожелания:
Email: [email protected]
Мы в социальных сетях
Социальные сети давно стали неотъемлемой частью нашей жизни. Мы узнаем из них новости, общаемся с друзьями, участвуем в интерактивных клубах по интересам
ВКонтакте >
Что такое Myslide.ru?
Myslide.ru — это сайт презентаций, докладов, проектов в формате PowerPoint. Мы помогаем учителям, школьникам, студентам, преподавателям хранить и обмениваться своими учебными материалами с другими пользователями.
Для правообладателей >
myslide.ru
Презентация «Строение атома» — Химия
Тема урока : «Строение атома».
Архангельская область, Устьянский район, пос.Октябрьский, МОУ «ОСОШ№1» , учитель химии Ржавитина Ольга Львовна.
8 класс
Атом – сложная частица.
Понятие «атом» пришло к нам из далекой античности
( в переводе с греческого «атом» означает » неделимый «).
Этимология названия «неделимый» отражает сущность
атома с точностью до наоборот.
I. Доказательства сложности строения атома.
- 1891г. — ирландский физик Стони ввёл понятие «электрон» для обозначения частиц, электризующих янтарь и вследствие этого притягивающих кусочки бумаги.
- 1895г. — открытие рентгеновских лучей К.Рентгеном.
- 1896г. — открытие радиоактивности А.Беккерелем.
- 1897г. — открытие катодных лучей Д.Томсоном.

II. Модели строения атома.
«Сливовый пудинг» Дж. Томсона.
+
Атом уподоблен сферической капле пудинга с положительным зарядом.
—
—
+
+
—
—
+
—
+
+
—
Внутрь сферы вкраплены отрицательно заряженные «сливины» – электроны.
—
—
—
+
+
+
—
—
+
Планетарная модель Резерфорда.
Ядро – «Солнце».
Электроны – «планеты».

Современная модель строения атома.
АТОМ
ЭЛЕКТРОННАЯ ОБОЛОЧКА ( — )
ЯДРО ( + )
НЕЙТРОНЫ
ПРОТОНЫ
ЭЛЕКТРОНЫ
e
n 0
р +
m= 0 заряд -1
m=1 заряд +1
m=1 заряд 0
Вся масса атома сосредоточена в ядре.
Атом электронейтрален, делим и состоит из элементарных частиц.

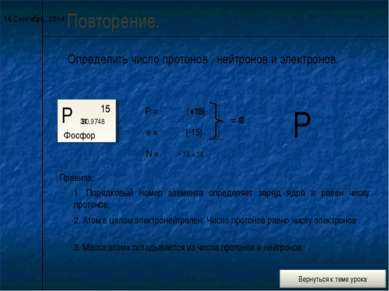
Н 1
1,00797
водород
порядковый номер
относительная атомная масса
Na 11
22 ,9 898
натрий
Заряд ядра, число протонов в ядре, число электронов в атоме равно порядковому номеру элемента в Периодической системе Д.И.Менделеева.
Число нейтронов определяется по формуле : n 0 = Ar – p +

p + 1
ē 1
n 0 0
p + 11
ē 11
n 0 12
H
Na
Определите число протонов, нейтронов и электронов для атомов:
p +
ē
n 0
8
8
8
О
p +
ē
n 0
p +
ē
n 0
13
13
14
35
35
46
Al
Br

?
Что произойдет, если изменить число протонов в ядре, т.е. заряд атомного ядра ?
Ответ : образуется новый химический элемент.
?
Что произойдет, если изменить число нейтронов в ядре ?
Ответ : это будет тот же химический элемент, но атомы его будут отличаться от исходных своей массой.
Образуются изотопы.
Относительная атомная масса
2
1
3
1
1
1
Н
Н
Н
Заряд ядра

Строение электронных оболочек атомов.
Каждый электрон в атоме обладает запасом энергии ( Е связи).
Электроны, имеющие близкие значения Е связи, образуют энергетические уровни.
Число энергетических уровней в атоме определяется по номеру периода.
энергетические уровни
+
Максимальное число электронов, находящихся на энергетическом уровне, определяется по формуле:
2 n 2 , где n – номер уровня .
2 ē
8 ē
18 ē
32 ē

H +1
He +2
2
1
C +6
O +8
Li +3
1
6
4
2
2
2
Ne +10
Число электронов на внешнем энергетическом уровне равно номеру группы.
8
2

H +1
He +2
2
1
Li +3
C +6
O +8
4
1
6
2
2
2
Если энергетический уровень содержит максимальное число электронов, то он называется завершенным .
Ne +10
8
2

∞
∞
∞
Пространство вокруг ядра атома, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона .
Форма орбиталей
P – орбиталь
S – орбиталь
На любой орбитали может быть не более 2 ē .

Электронные формулы.
H +1
1 S 1
число ē на данной орбитали
форма орбитали
№ эн. уровня
1
He +2
1 S 2
2
O +8
1 S 2
2 S 2
2 p 4
6
2

Напишите распределение электронов по энергетическим уровням и электронные формулы для следующих атомов.
P +15
Mg +12
1s 2 2s 2 2p 6 3s 2 3p 3
1s 2 2s 2 2p 6 3s 2
8
2
2
8
2
5
Cl +17
Ar +18
1s 2 2s 2 2p 6 3s 2 3p 5
1s 2 2s 2 2p 6 3s 2 3p 6
8
8
8
2
7
2
Ca +20
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
2
8
8
2
До новых
встреч !
multiurok.ru
Строение электронных оболочек атомов

Тема:
Строение
электронных оболочек
атомов
1. В течении 2 минут своими словами , напишите небольшой рассказ, который расскажет о том , что такое атом. Оценивается объём информации, а не качество составления предложений и текста в целом.
Определите: 1 уровень. Число структурных частиц , порядковый номер и относительную атомную массу , используя данные таблицы 2 уровень . Что такое изотопы? Приведите примеры известных Вам изотопов. 3 уровень . Рассчитайте относительную атомную массу лития, исходя из данных таблицы , отражающих распространенность изотопов в природе.
2
.
Изотоп
14 N
Рас
простро
ненность
Z
99,635%
15 N
e —
0,365%
p +
n 0
Ar

Планетарная модель атома.
Что такое электрон?
е – это частица!
е – волна!
е обладает скоростью
и энергией. Определить
где электрон будет
в следующий
момент времени
практически невозможно.
Он охватывает целую
область, называемую
электронным облаком
или атомной орбиталью.
m0 = 0,9109534*10 – 27 г
Z = 1,6021892*10 – 19 Кл

Формы электронных облаков или атомных орбиталей разноообразны:
s- p-
d-
f-
Атомная орбиталь (электронное облако) – это область пространства, где нахождение электрона наиболее вероятно.
Все электроны, окружающие ядро образуют электронную оболочку.

Электронная оболочка
Энергетические уровни
( электронные слои)
1
у
2
р
3
о
4
в
5
н
6
е
7
й
Электроны с разным запасом энергии
располагаются на разном расстоянии от ядра.

Меньше
запас
энергии
электрона.
Связь
с ядром
прочнее.
Связь
е
с ядром
Больше
запас
энергии
электрона.
Связь
с ядром
слабее.
ЯДРО

Запомни!
Число электронных слоёв или энергетических уровней = номеру периода в котором стоит элемент.

Энергетические уровни состоят из подуровней, на которых располагаются атомные орбитали s -, p -, d — и f -типа

Электронная оболочка
Энергетический уровень
( электронный слой)
Электронные подуровни
Атомные орбитали
s
p
d
f

+Z
1
2
s
3
s
4
p
s
p
s
5
6
p
s
d
s
p
7
d
p
f
d
s
f
d
p
f
d
f

Атомные орбитали
- На s -подуровне может находиться одна атомная орбиталь
- На p — подуровне их может быть уже три –
- На d — подуровне их может быть уже пять –
- На f — подуровне их может быть уже семь –

На одной АО могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами:

+Z
1
2
s
2e —
3
s
2e —
4
P 6e —
s
2e —
s
2e —
5
p
6e —
p
6e —
6
d
10e —
S
2e —
7
s
2e —
d 10e —
p
6e —
f
14e —
p
6e —
s
2e —
d 10e —
P
6e —
d 10e —
f 14e —
f 14e —
d 10e —
f 14e —
+Z
1
2
3
4
5
6
7
2e
8e
18e
32e
32e
32e
32e
2 n 2

Электронные конфигурации с повышенной устойчивостью
p 3 d 5 f 7
s 2 p 6 d 10 f 14

В пределах подуровня атомные орбитали заполняются одиночными электронами с параллельными спинами, и когда все орбитали данного подуровня будут заняты, происходит спаривание последних:
↑↓
↑↓
↑
↑↓
↑
↑
↑
↑
↓
↑↓
↑
+Z
1
2
s
2e —
3
s
2e —
4
P 6e —
s
2e —
s
2e —
5
p
6e —
p
6e —
6
d
10e —
S
2e —
7
s
2e —
d 10e —
p
6e —
f
14e —
p
6e —
s
2e —
d 10e —
P
6e —
d 10e —
f 14e —
f 14e —
d 10e —
f 14e —
Электронная формула, которая показывает распределение электронов по подуровням.
1s ι 2s2p ι 3s3p3d ι 4s4p4d4f ι 5s5p5d 5f ι 6s6p 6d 6 f ι 7 s7p7d7f
ЭНЕРГИТИЧЕСКАЯ ДИАГРАММА РАСПОЛОЖЕНИЯ АО В ЭЛЕКТРОННОЙ ОБОЛОЧКЕ
РЯД НАИМЕНЬШЕЙ ЭНЕРГИИ:
1s ι 2s2p ι 3s3p ι 4s3d4p ι 5s4d5p ι 6s4f5d6p ι 7 s5f6d7p
Периоды показывают количество энергетических уровней
Номер группы показывает :
1. Количество электронов на внешнем энергетическом уровне
+ 8
Порядковый номер показывает:
1.Заряд ядра атома
2.Количество протонов
3.Количество электронов.
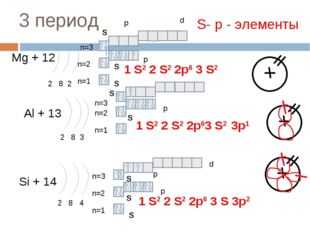
СХЕМА СТРОЕНИЯ АТОМА
Н
Показывает распределение электронов
по уровням
1
+1
1
Число частиц.
e — = 1
p + =1
n 0 =1 — 1
- e — = 1 p + =1 n 0 =1 — 1

ЭЛЕКТРОННАЯ ФОРМУЛА (КОНФИГУРАЦИЯ) АТОМА
Уровень форма орбитали
1 s 1
Число электронов
на данной орбитали
Показывает распределение электронов по подуровням

ЭЛЕКТРОННО — ГРАФИЧЕСКАЯ ФОРМУЛА АТОМА
s
1
Показывает распределение электронов по АО
↑

Валентные электроны
Электроны, которые не имеют пары.
= 1
в

Примеры электронных структур
Полная электронная формула
Cl — 1s 2 2s 2 2p 6 3s 2 3p 5
Краткая формула Cl — 3 s 2 3 p 5
Электроно-графическая формула
s p d
3
2
1 = 1
в

- Свойства химических элементов в таблице периодически повторяются. Каждый период начинается щелочным металлом и заканчивается инертным газом.
- Составив схемы строения атомов предложенных химических элементов, ответьте на вопрос – Почему свойства х.э. периодически повторяются? Как это связано с внутренним миром атома? Для этого сравните составленные схемы между собой и найдите черты сходства.
- 1 вариант – 1 А группа ( малые периоды)
- 2 вариант – 2А группа
- 3 вариант- 3А группа
- 4 вариант – 4а группа

- П.9.
- 1. 1 — 2 уровень. Составьте схемы строения атомов химических элементов 4 группы. Укажите черты сходства.
- 2. 3 уровень. Решите задачу. Элементы А и В имеют одинаковое число энергетических уровней, число электронов внешнего уровня элемента А равно общему числу электронов элемента В. В каком периоде находится элемент В.
Спасибо за урок!
videouroki.net
Презентация «Строение электронных оболочек атомов химических элементов №1-20»
Просмотр содержимого документа
«Презентация «Строение электронных оболочек атомов химических элементов №1-20″»

Строение электронных оболочек атомов химических элементов №1-20
ВЫПОЛНИЛА
МАМИТОВА К. Г
УЧИТЕЛЬ ХИМИИ И БИОЛОГИИ МБОУ СОШ С. КОСТА
2016

Содержание
- 1. Мотивация к учебной деятельности.
- 2. Актуализация знаний
- 3. Формулирование темы урока, постановка цели
- 4. Изучение нового материала
- 5. Закрепление.
6. Домашнее задание.
- 7. Литература
- 8. Приложения.

Актуализация знаний .
- Чему равно общее количество электронов в атоме?
- Чему равно общее количество электронов в атоме?
- Что такое энергетический уровень?
- Что такое энергетический уровень?
- Как определить число энергетических уровней?
- Как определить число энергетических уровней?
- Как определить число электронов на внешнем уровне?
- Как определить число электронов на внешнем уровне?
Расшифруйте ребусы, укажите их положение в ПСХЭ, определите число электронов в атомах этих химических элементов.
Ответы:
- 1. Никель ( 4 период ( большой), VIII группа ( побочная подгруппа) , порядковый № 28; электронов -28.
- 2.Йод ( 5 период ( большой), VII группа( главная подгруппа) , порядковый № 53; электронов -53.
- 3. Азот ( 2 период ( малый), V группа( главная подгруппа) , порядковый № 7; электронов -7.
- 4. Бор ( 3 период ( малый), III группа( главная подгруппа) , порядковый № 5; электронов -5.
- 5. Марганец( 4 период ( большой), VII группа( побочная подгруппа) , порядковый № 25; электронов -25.
- 6. Кремний( 3 период ( малый), IV группа( главная подгруппа) , порядковый № 14; электронов -14.
Ответы
- 7. Мышьяк( 4 период ( большой), V группа( главная подгруппа) , порядковый № 33; электронов -33.
- 8. Углерод( 2 период ( малый), I V группа( главная подгруппа) , порядковый № 6; электронов -6.
- 9. Цирконий( 5 период ( большой), IV группа( побочная подгруппа) , порядковый № 40; электронов -40.
- 10. Аргон( 3 период ( малый), VIII группа( главная подгруппа) , порядковый № 18; электронов -18.
- 11. Медь( 4 период ( большой), I группа( побочная подгруппа) , порядковый № 29; электронов -29.
- 12. Криптон( 4 период ( большой), VIII группа( главная подгруппа) , порядковый № 36; электронов -36.
ТЕМА УРОКА
- «Строение электронных оболочек атомов химических элементов
№ 1-20».
Цель урока:
- научиться составлять электронные формулы атомов элементов первых трех периодов ПСХЭ;
- объяснять зависимость и закономерные изменения свойств химических элементов от электронного строения их атомов
.
Электронная оболочка
- Совокупность всех электронов в атоме, окружающих ядро
- Каждый электрон имеет свою траекторию движения и запас энергии
- Электроны расположены на различном расстоянии от ядра: чем ближе электрон к ядру, тем он прочнее с ним связан, его труднее вырвать из электронной оболочки
- По мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее
.
Энергетические уровни состоят из подуровней : S, p, d, f
Число подуровней на уровне равно номеру уровня
1
Е 1
2
Подуровни состоят из орбиталей. Число орбиталей на уровне — n 2
Максимальное число электронов на энергетическом уровне определяется по формуле 2n 2
ядро
3
Электронные слои (энергетические уровни — n ) – совокупность электронов на одной оболочке, имеют одинаковый запас энергии
Число энергетических уровней в атоме равно номеру периода, в котором располагается атом
Сколько энергетических уровней у атомов:
углерода, натрия, золота, водорода, железа?
Е
n=7
n=6
f
d
p
n=5
n=4
S
n=3
p
d
S
n=2
p
S
n=1
S
- Энергетические уровни , содержащие максимальное число электронов, называются завершенными . Они обладают повышенной устойчивостью и стабильностью
- Энергетические уровни, содержащие меньшее число электронов, называются незавершенными
- n=1 – 1 подуровень ( S ), 2 электрона
- n= 2 – 2 подуровня ( S , р), 8 электронов
- n= 3 – 3 подуровня ( S , р, d ), 1 8 электронов
Форма электронных облаков (орбиталей )
- Область наиболее вероятного местонахождения электрона в пространстве
S – облако р – облака d — облака
Выводы:
- Электроны, двигаясь вокруг ядра атома, образуют электронную оболочку.
- Электронная оболочка состоит из электронных слоев.
- Каждый электронный слой состоит из электронов с близким значением энергии, поэтому электронные слои называются еще и энергетическими уровнями.
- Число энергетических уровней в атоме равно № периода.
- Максимальное число электронов, которое может находиться на определенном энергетическом уровне, можно вычислить по формуле 2 n 2 , где n — номер энергетического уровня.
.
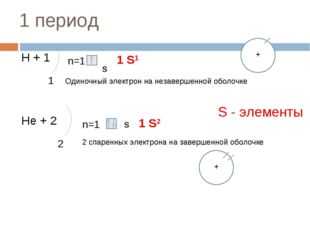
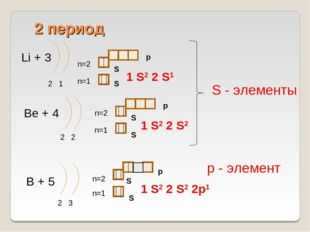
1 период
Н + 1
1 S 1
n=1
S
1
Одиночный электрон на незавершенной оболочке
S — элементы
Н e + 2
1 S 2
n=1
S
2
2 спаренных электрона на завершенной оболочке
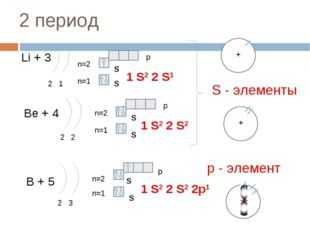
2 период
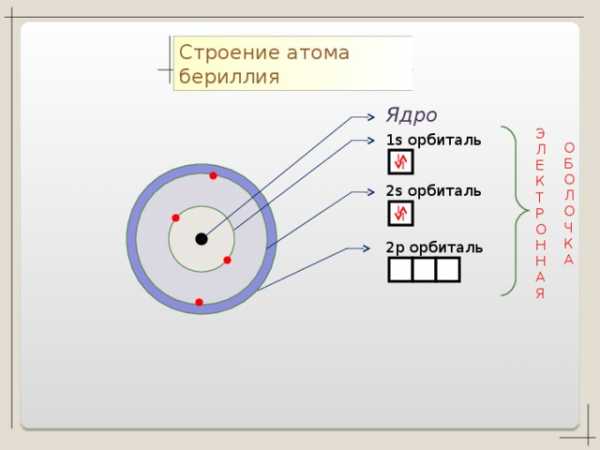
Li + 3
p
n=2
S
1 S 2 2 S 1
n=1
2 1
S
S — элементы
p
Be + 4
n=2
S
1 S 2 2 S 2
n=1
S
2 2
р — элемент
p
n=2
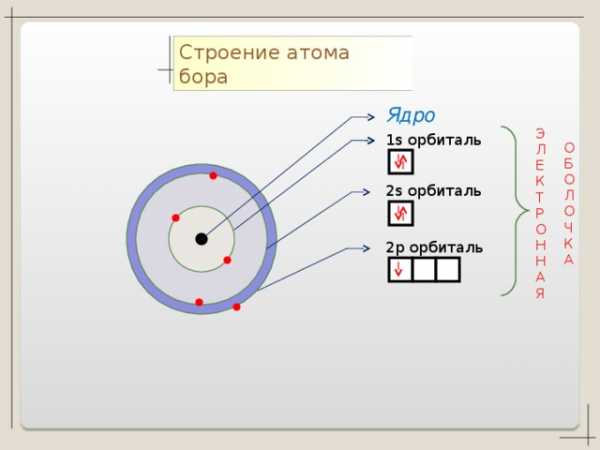
B + 5
S
1 S 2 2 S 2 2p 1
n=1
S
2 3
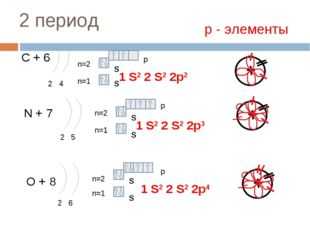
2 период
р — элементы
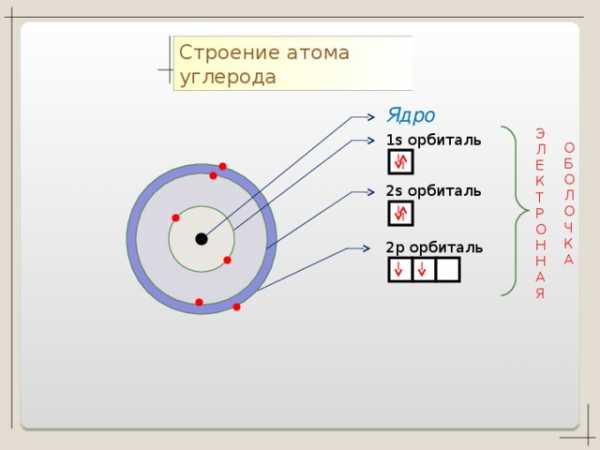
С + 6
p
n=2
S
1 S 2 2 S 2 2p 2
n=1
2 4
S
p
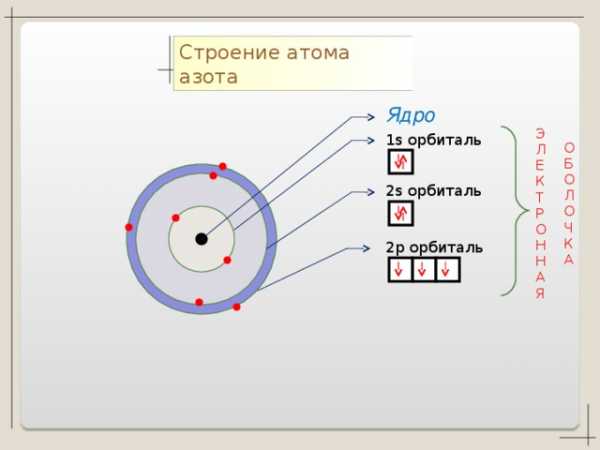
N + 7
n=2
S
1 S 2 2 S 2 2p 3
n=1
S
2 5
p
n=2
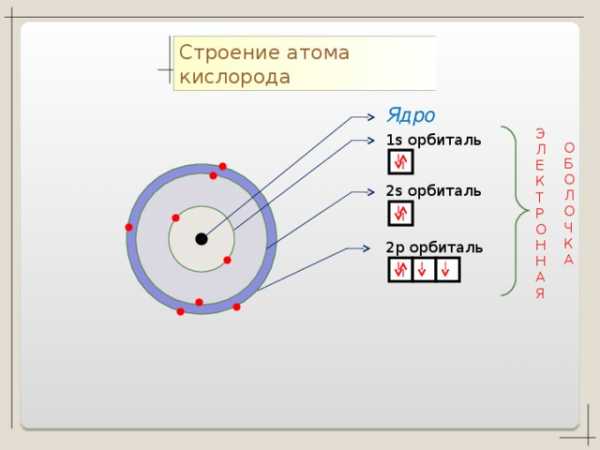
O + 8
S
1 S 2 2 S 2 2p 4
n=1
S
2 6
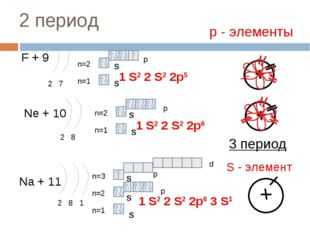
3 период
d
S- р — элементы
p
S
n= 3
Mg + 12
p
n=2
S
1 S 2 2 S 2 2p 6 3 S 2
n=1
2 8 2
S
S
n= 3
p
Al + 13
n=2
S
1 S 2 2 S 2 2p 6 3 S 2
3p 1
n=1
2 8 3
d
p
n= 3
Si + 14
S
p
n=2
1 S 2 2 S 2 2p 6 3 S 3p 2
S
2 8 4
n=1
S

3 период
р — элементы
d
p
S
n= 3
1 S 2 2 S 2 2p 6 3 S 2 3p 3
P + 15
p
n=2
S
n=1
2 8 5
S
S
n= 3
p
S + 16
n=2
S
3p 4
1 S 2 2 S 2 2p 6 3 S 2
n=1
2 8 6
d
p
n= 3
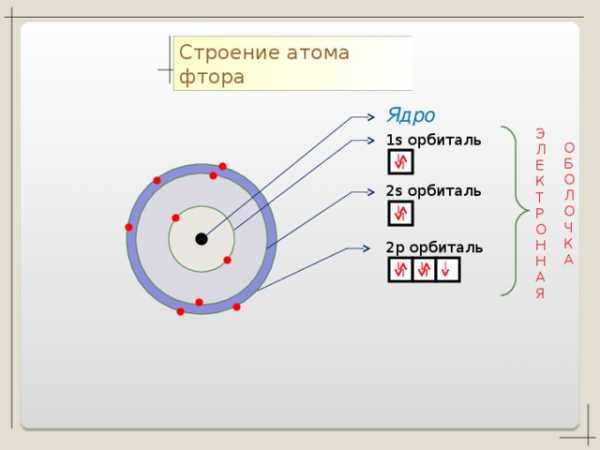
Cl + 17
S
p
n=2
1 S 2 2 S 2 2p 6 3 S 3p 5
S
2 8 7
n=1
S
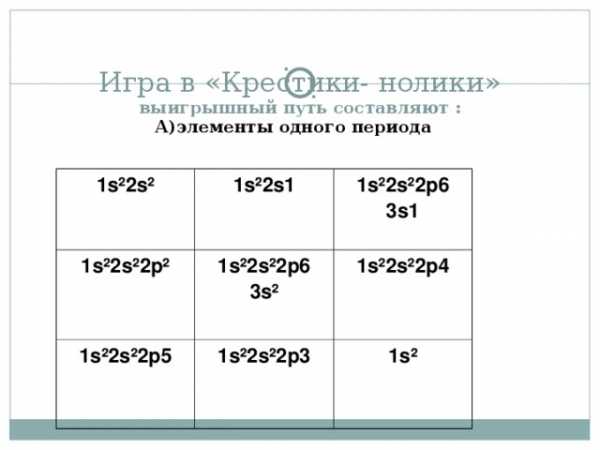
Игра в «Крестики- нолики» выигрышный путь составляют :
А)элементы одного периода
1s²2s²
1s²2s1
1s²2s²2p²
1s²2s²2p6 3s1
1s²2s²2p6 3s²
1s²2s²2p5
1s²2s²2p3
1s²2s²2p4
1s²

Игра в «Крестики- нолики»
выигрышный путь составляют :
Б)элементы одной главной подгруппы
1s ² 2s ²
1s ² 2s 2 2p 4
1s ² 2s ² 2p 6
1s 1
1s ² 2s 1
1s ² 2s ² 2p 6 3s 1
1s ² 2s ² 2p 5
1s ² 2s ² 2p 1
1s ² 2 s ² 2p 3
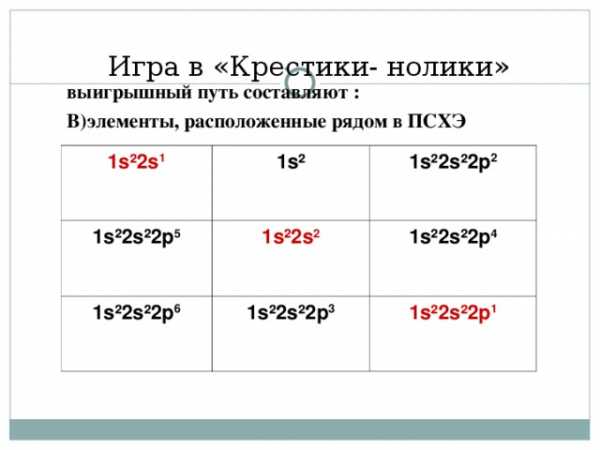
Игра в «Крестики- нолики»
выигрышный путь составляют :
В)элементы, расположенные рядом в ПСХЭ
1s ² 2s 1
1s ²
1s ² 2s ² 2p 5
1s ² 2s ² 2p 2
1s ² 2s 2
1s ² 2s ² 2p 6
1s ² 2s ² 2p 3
1s ² 2s ² 2p 4
1s ² 2 s ² 2p 1
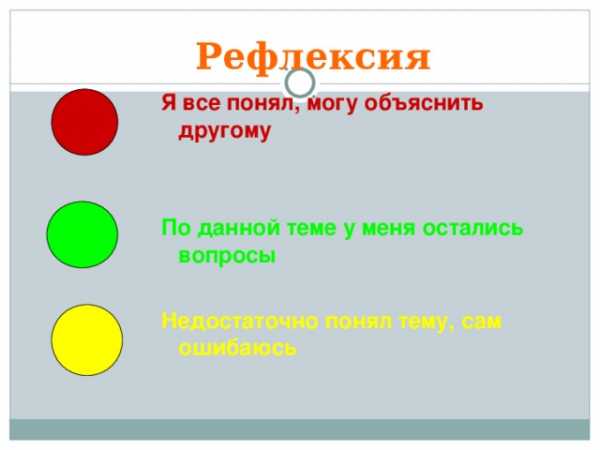
Рефлексия
Я все понял, могу объяснить другому
По данной теме у меня остались вопросы
Недостаточно понял тему, сам ошибаюсь

Выводы
- Причина сходства элементов заключается в одинаковом строении внешних энергетических уровней их атомов
- Одинаковое строение внешних энергетических уровней периодически (т.е. через определенные промежутки — периоды) повторяется , поэтому периодически повторяются и свойства химических элементов

Домашнее задание
- §8, упр. № 1 , № 2 , № 6
multiurok.ru
| Почему учителям и воспитателям следует проходить курсы повышения квалификации и профессиональной переподготовки в учебном центре «Инфоурок» ?• Огромный каталог: 677 курсов профессиональной переподготовки и повышения квалификации;• Очень низкая цена, при этом доступна оплата обучения в рассрочку – первый взнос всего 10%, оставшуюся часть необходимо оплатить до конца обучения; • Курсы проходят полностью в дистанционном режиме (форма обучения в документах не указывается); • Возможность оплаты курса за счёт Вашей организации. • Дипломы и Удостоверения от проекта «Инфоурок» соответствуют всем установленным законодательству РФ требованиям. (Согласно ФЗ «Об образовании в Российской Федерации» от 2012 года). |
infourok.ru

 Описание слайда:
Описание слайда: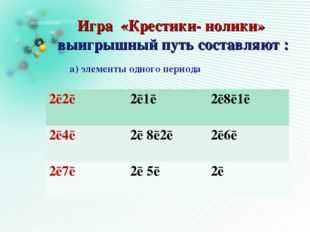 Описание слайда:
Описание слайда: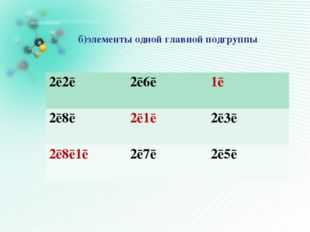 Описание слайда:
Описание слайда: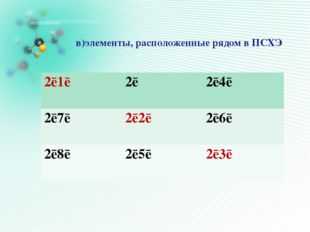 Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:


 Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: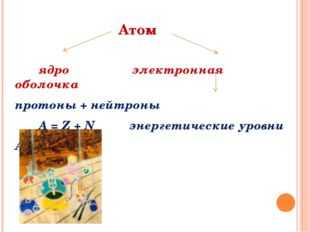 Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: Описание слайда:
Описание слайда: