Онлайн тесты по химии для подготовки к ОГЭ 2017-2018 учебного года с ответами
Стандартный тест ОГЭ (ГИА-9) формата 2018-го года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развёрнутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно текущей структуре экзамена, среди этих заданий варианты ответов предлагаются только в 15. Однако для удобства прохождения тестов администрация сайта gia-online.ru приняла решение предложить варианты ответов во всех заданиях. Но для заданий, в которых варианты ответов составителями реальных контрольно измерительных материалов (КИМов) не предусмотрены, количество вариантов ответов было значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем Вам придется столкнуться в конце учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2018-го года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развёрнутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно текущей структуре экзамена, среди этих заданий варианты ответов предлагаются только в 15. Однако для удобства прохождения тестов администрация сайта gia-online.ru приняла решение предложить варианты ответов во всех заданиях. Но для заданий, в которых варианты ответов составителями реальных контрольно измерительных материалов (КИМов) не предусмотрены, количество вариантов ответов было значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем Вам придется столкнуться в конце учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2018-го года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развёрнутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно текущей структуре экзамена, среди этих заданий варианты ответов предлагаются только в 15. Однако для удобства прохождения тестов администрация сайта gia-online.ru приняла решение предложить варианты ответов во всех заданиях. Но для заданий, в которых варианты ответов составителями реальных контрольно измерительных материалов (КИМов) не предусмотрены, количество вариантов ответов было значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем Вам придется столкнуться в конце учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2018-го года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развёрнутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно текущей структуре экзамена, среди этих заданий варианты ответов предлагаются только в 15. Однако для удобства прохождения тестов администрация сайта gia-online.ru приняла решение предложить варианты ответов во всех заданиях. Но для заданий, в которых варианты ответов составителями реальных контрольно измерительных материалов (КИМов) не предусмотрены, количество вариантов ответов было значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем Вам придется столкнуться в конце учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2018-го года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развёрнутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно текущей структуре экзамена, среди этих заданий варианты ответов предлагаются только в 15. Однако для удобства прохождения тестов администрация сайта gia-online.ru приняла решение предложить варианты ответов во всех заданиях. Но для заданий, в которых варианты ответов составителями реальных контрольно измерительных материалов (КИМов) не предусмотрены, количество вариантов ответов было значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем Вам придется столкнуться в конце учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2017-го года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развёрнутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно текущей структуре экзамена, среди этих заданий варианты ответов предлагаются только в 15. Однако для удобства прохождения тестов администрация сайта gia-online.ru приняла решение предложить варианты ответов во всех заданиях. Но для заданий, в которых варианты ответов составителями реальных контрольно измерительных материалов (КИМов) не предусмотрены, количество вариантов ответов было значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем Вам придется столкнуться в конце учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2016-го года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развёрнутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно текущей структуре экзамена, среди этих заданий варианты ответов предлагаются только в 15. Однако для удобства прохождения тестов администрация сайта gia-online.ru приняла решение предложить варианты ответов во всех заданиях. Но для заданий, в которых варианты ответов составителями реальных контрольно измерительных материалов (КИМов) не предусмотрены, количество вариантов ответов было значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем Вам придется столкнуться в конце учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2016-го года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развёрнутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно текущей структуре экзамена, среди этих заданий варианты ответов предлагаются только в 15. Однако для удобства прохождения тестов администрация сайта gia-online.ru приняла решение предложить варианты ответов во всех заданиях. Но для заданий, в которых варианты ответов составителями реальных контрольно измерительных материалов (КИМов) не предусмотрены, количество вариантов ответов было значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем Вам придется столкнуться в конце учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2016-го года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развёрнутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно текущей структуре экзамена, среди этих заданий варианты ответов предлагаются только в 15. Однако для удобства прохождения тестов администрация сайта gia-online.ru приняла решение предложить варианты ответов во всех заданиях. Но для заданий, в которых варианты ответов составителями реальных контрольно измерительных материалов (КИМов) не предусмотрены, количество вариантов ответов было значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем Вам придется столкнуться в конце учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2016-го года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развёрнутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно текущей структуре экзамена, среди этих заданий варианты ответов предлагаются только в 15. Однако для удобства прохождения тестов администрация сайта gia-online.ru приняла решение предложить варианты ответов во всех заданиях. Но для заданий, в которых варианты ответов составителями реальных контрольно измерительных материалов (КИМов) не предусмотрены, количество вариантов ответов было значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем Вам придется столкнуться в конце учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2016-го года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развёрнутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно текущей структуре экзамена, среди этих заданий варианты ответов предлагаются только в 15. Однако для удобства прохождения тестов администрация сайта gia-online.ru приняла решение предложить варианты ответов во всех заданиях. Но для заданий, в которых варианты ответов составителями реальных контрольно измерительных материалов (КИМов) не предусмотрены, количество вариантов ответов было значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем Вам придется столкнуться в конце учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2015-го года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развёрнутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно текущей структуре экзамена, среди этих заданий варианты ответов предлагаются только в 15. Однако для удобства прохождения тестов администрация сайта gia-online.ru приняла решение предложить варианты ответов во всех заданиях. Но для заданий, в которых варианты ответов составителями реальных контрольно измерительных материалов (КИМов) не предусмотрены, количество вариантов ответов было значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем Вам придется столкнуться в конце учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2015-го года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развёрнутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно текущей структуре экзамена, среди этих заданий варианты ответов предлагаются только в 15. Однако для удобства прохождения тестов администрация сайта gia-online.ru приняла решение предложить варианты ответов во всех заданиях. Но для заданий, в которых варианты ответов составителями реальных контрольно измерительных материалов (КИМов) не предусмотрены, количество вариантов ответов было значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем Вам придется столкнуться в конце учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2015-го года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развёрнутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно текущей структуре экзамена, среди этих заданий варианты ответов предлагаются только в 15. Однако для удобства прохождения тестов администрация сайта gia-online.ru приняла решение предложить варианты ответов во всех заданиях. Но для заданий, в которых варианты ответов составителями реальных контрольно измерительных материалов (КИМов) не предусмотрены, количество вариантов ответов было значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем Вам придется столкнуться в конце учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2015-го года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развёрнутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно текущей структуре экзамена, среди этих заданий варианты ответов предлагаются только в 15. Однако для удобства прохождения тестов администрация сайта gia-online.ru приняла решение предложить варианты ответов во всех заданиях. Но для заданий, в которых варианты ответов составителями реальных контрольно измерительных материалов (КИМов) не предусмотрены, количество вариантов ответов было значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем Вам придется столкнуться в конце учебного года.
При выполнении заданий А1-А19 выберите только один правильный вариант.
При выполнении заданий B1-B3 выберите два правильных варианта.
При выполнении заданий А1-А15 выберите только один правильный вариант.
При выполнении заданий А1-А15 выберите только один правильный вариант.
gia-online.ru
Демонстрационные варианты ОГЭ по химии (9 класс)

nbsp; На официальном сайте Федерального института педагогических измерений (ФИПИ) опубликованы демонстрационные варианты ОГЭ по химии (9 класс) за 2009 — 2019 годы.
Все варианты содержат задания трех типов: задания, где нужно выбрать один из предложенных ответов, задания, где нужно дать краткий ответ, и задания, где нужно дать развернутый ответ. К заданиям первого и второго типов даны правильные ответы, а к заданиям третьего типа приведены содержание правильного ответа и критерии оценивания заданий с развернутым ответом.
Демонстрационные варианты ОГЭ по химии представлены двумя моделями. Эти модели различаются только в практико-ориентированных заданиях последней части, причем модель 1 аналогична работам предыдущих лет, а модель 2 предусматривает выполнение реального химического эксперимента (задания 22,23). Для организации и проведения реального химического эксперимента в модели 2 Федеральным институтом педагогических измерений разработаны методические материалы. Выбор модели экзамена осуществляется органами управления образованием суъектов РФ.
В демострационных вариантах ОГЭ 2019 года по химии по сравнению с демонстрационными вариантами 2018 года изменений нет.
Демонстрационные варианты ОГЭ по химии
Отметим, что демонстрационные варианты ОГЭ по химии представлены в формате pdf, и для их просмотра необходимо, чтобы на Вашем компьютере был установлен, например, свободно распространяемый программный пакет Adobe Reader.
Шкала пересчёта первичного балла за выполнение экзаменационной работы в отметку по пятибалльной шкале
Приводим также рекомендованную Федеральным институтом педагогических измерений (ФИПИ)
Изменения в демонстрационных вариантах по химии
В 2015 году в демострационных вариантах ОГЭ по химии была изменена структура вариантов:
- Вариант стал состоять из двух частей.
- Нумерация заданий стала сквозной по всему варианту без буквенных обозначений А, В, С.
- Была изменена форма записи ответа в заданиях с выбором ответа: ответ стало нужно записывать цифрой с номером правильного ответа (а не обводить кружком).
Начиная с 2014 года, демонстрационные варианты ОГЭ по химии представлены двумя моделями. Эти модели различаются только в практико-ориентированных заданиях последней части, причем модель 1 аналогична работам предыдущих лет, а модель 2 предусматривает выполнение реального химического эксперимента (задания С3,С4 в варианте 2014 года и задания 22,23 в вариантах 2015-2016 годов). Для организации и проведения реального химического эксперимента в модели 2 Федеральным институтом педагогических измерений были разработаны методические материалы. Выбор модели экзамена осуществляется органами управления образованием суъектов РФ.
В демострационных вариантах ОГЭ 2016-2019 годов по химии по сравнению с демонстрационными вариантами 2015 года изменений не было.
Приглашаем школьников (можно вместе с родителями) на бесплатное тестирование по математике, позволяющее выяснить, какие разделы математики и навыки в решении задач являются для ученика «проблемными». Запись по телефону (495) 509-28-10 |
Для школьников 8 и 9 классов, желающих хорошо подготовиться и сдать ОГЭ по математике или русскому языку на высокий балл, учебный центр «Резольвента» проводит
У нас также для школьников организованы
МОСКВА, СВАО, Учебный центр «РЕЗОЛЬВЕНТА»
www.resolventa.ru
Итоговый тест для подготовки к ОГЭ в 9 классе по теме «Галогены»
Итоговый тест для подготовки к ОГЭ по химии в 9 классе по теме «Галогены»
Инструкция по выполнению работы
На выполнение работы отводится 2 часа (120 минут). Работа состоит из 2 частей, включающих 22 задания. Часть 1 содержит 19 заданий с кратким ответом, часть 2 содержит 3 задания с развернутым ответом.
Ответы к заданиям 1-15 записываются в виде одной цифры, которая соответствует номеру правильного ответа.
Ответы к заданиям 16-19 записываются в виде последовательности цифр.
К заданиям 20-22 следует дать полный развёрнутый ответ, включающий в себя необходимые уравнения реакций и решение задачи.
При выполнении работы можно пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.
Часть 1
При выполнении заданий 1-15 из четырех предложенных вам вариантов ответов выберите один верный. |
1.Распределение электронов по энергетическим уровням в атоме фтора
1) 2е, 4е 2) 2е, 5е 3) 2е, 6е 4) 2е, 7е
О
2. Неметаллические свойства простых веществ в ряду I-Br-Cl-F
1) не изменяются
2) ослабевают
3) усиливаются
4) изменяются периодически
О
3. Молекулярную кристаллическую решетку имеют оба вещества
1) F2 и Cl2 2) Cl2 и KCl 3) Br2 и NaBr 4) F2 и KF
О
4. В каком соединении степень окисления хлора равна +7?
1) HCl 2) Cl2O 3) KClO3 4) KClO4
Ответ:
5. Вещества, которые взаимодействуют с бромом
1) раствор хлорида натрия и вода
2) водород и алюминий
3) оксид углерода (II) и медь
4) оксид железа (III) и водород
О
6. Пара веществ, с каждый из которых взаимодействует соляная кислота
1) медь и нитрат бария
2) нитрат серебра и оксид серы (IV)
3) оксид цинка и нитрат серебра
4) карбонат калия и хлорид магния
О
7. Фтор F2 в ходе химических реакций может проявлять свойства
1) только восстановительные
2) только окислительные
3) и окислительные и восстановительные
4) не проявляет указанных свойств
О
8. Необратимое протекание реакции ионного обмена между растворами нитрата серебра и хлорида калия обусловлено взаимодействием ионов
1) K+ и NO3―
2) Ag+ и NO3―
3) Ag+ и Cl―
4) K+ и Cl―
О
9. Раствор, с помощью которого можно обнаружить бромид-ион
1) гидроксид калия
2) соляная кислота
3) нитрат серебра
4) карбонат натрия
О
10. В лаборатории хлор получают взаимодействием
1) соляной кислоты и оксида кремния
2) соляной кислоты и оксида марганца (IV)
3) хлорида натрия и оксида марганца (IV)
4) хлорида цинка и гидроксида натрия
О
11. Определите вещества X и Y, необходимые для осуществления следующих превращений
X Y
NaBr Br2 KBr
1) Cl2 и KI
2) Cl2 и KCl
3) I2 и KI
4) HCl и KNO3
О
12. Схеме превращений I0 I― соответствует уравнение химической реакции
1) Br2 + 2KI=I2 + KBr
2) h3 + I2 =2HI
3) Cl2 + 2KI=I2 + 2KCl
4) 8HI + h3SO4 = 4I + h3S + 4h3O
О
13. Верны ли суждения о свойствах галогенов?
А. Химическая активность галогенов от фтора к йоду уменьшается.
Б. Все галогены являются сильными токсическими веществами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
О
14. Какое сокращённое ионное уравнение соответствует взаимодействию соляной кислоты с оксидом меди(ІІ)
1)Cu2++H+=CuCl2+h3O 2)CuO+2H+=Cu2++h3O 3)Cu(OH)2+2H+=Cu2++2h3O 4) CuO + H+ = Cu2+ + 2 h3O
О
15. Массовая доля хлора в соединении KClO4 равна
1) 24,2%
2) 33,6%
3) 25,6%
4) 26%
О
Часть 2
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и обведите их номера. Цифры выбранных ответов запишите в указанном месте в порядке возрастания без дополнительных символов. |
16. В ряду химических элементов Br- Cl- F
1) уменьшается атомный радиус
2) возрастает высшая степень окисления
3) увеличивается значение электроотрицательности
4) увеличиваются основные свойства образуемых гидроксидов
5) уменьшается число электронов на внешнем уровне
Ответ:
17. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
Для хлора верны следующие утверждения:
1) является жидкостью при н.у.
2) молекула состоит из двух атомов
3) не ядовит
4) плохо растворим в воде
5) вступает в реакцию с серебром
При выполнении заданий 18,19 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Выбранные цифры запишите в таблицу под соответствующими буквами. |
18. Установите соответствие между схемой химической реакции и изменением степени окисления окислителя
Схема реакции |
| Изменение степени окисления |
А) Cl2 + h3O → HCl + HClO Б) Cl2 + KOH → KClO3 + KCl + h3O В) HClO → HCl + HClO3 |
| 1) Cl0 →Cl-1 2) Cl0→ Cl+1 3) Cl+5→ Cl-1 4) Cl+1 → Cl-1 5) Cl +5 → Cl0 |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
19. Установите соответствие между формулами кислот и соответствующих им кислотных оксидов
Формула кислоты | Формула оксида |
A) HClO | 1) Cl2O |
Б) HClO4 | 2) Cl2O5 |
B) HClO3 | 3) Cl2O3 |
4) Cl2O7 |
Ответ:
Часть 2
Для ответов на задания 20-22 используйте отдельный лист. Запишите сначала номер задания (20,21, или 22), а затем развернутый ответ к нему. |
20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
I2 + Cl2 + h3O = HIO3 + HCl
Определите окислитель и восстановитель
21. Рассчитайте массу осадка, полученного при взаимодействии 150 г 10% раствора хлорида калия с раствором, содержащим 5г нитрата серебра.
22. Даны вещества:CuO, NaCl, KOH, MnO2, h3SO4, CaCO3
Используя воду и необходимые вещества только из этого списка, получите в две стадии хлорид меди(II). Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение реакции.
Система оценивания тестовой работы по химии
Верное выполнение каждого из заданий части 1 базового уровня сложности (1–15) оценивается 1 баллом.
Верное выполненное каждого из заданий части 1 повышенного уровня сложности (16–19) максимально оценивается 2 баллами. Задания 16 и 17 считаются верно выполненными, если в каждом из них правильно выбраны два варианта ответа. За неполный ответ – правильно назван один из двух ответов или названы три ответа, из которых два верные, – выставляется 1 балл. Остальные варианты ответов считаются неверными и оцениваются в 0 баллов.
Задания 18 и 19 считаются выполненными верно, если правильно установлены три соответствия. Частично верным считается ответ, в котором установлены два соответствия из трех; он оценивается 1 баллом. Остальные варианты считаются неверным ответом и оцениваются в 0 баллов.
Часть 1
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
4 | 3 | 1 | 4 | 2 | 3 | 2 | 3 | 3 | 2 |
11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |
3 | 2 | 2 | 2 | 3 | 13 | 25 | 114 | 142 |
Баллы за задания 20 -3, 21-3, 22-5
Максимальное количество баллов, которое может получить экзаменуемый за выполнение всей экзаменационной работы (без реального эксперимента), — 34 балла.
Таблица 4
Шкала пересчета первичного балла за выполнение экзаменационной работы в отметку по пятибалльной шкале (работа без реального эксперимента, демоверсия 1)
0—8 баллов — отметка «2»
9—17 баллов — отметка «3»
18—26 баллов — отметка «4»
27—34 баллов — отметка «5»
Отметку «5» рекомендуется выставлять в том случае, если из общей суммы баллов, достаточной для получения этой отметки, выпускник набрал 5 и более баллов за выполнение заданий части 3. Результаты экзамена могут быть использованы при приеме учащихся в профильные классы средней школы. Ориентиром при отборе в профильные классы может быть показатель, нижняя граница которого соответствует 23 баллам.
xn--j1ahfl.xn--p1ai
Тесты по химии (9 класс) с ответами, итоговые и тренировочные
1. Общая характеристика химических элементов и химических реакций
2. Металлы
3. Неметаллы
4. Обобщение знаний по химии за курс основной школы. Подготовка к государственной итоговой аттестации (ГИА)
5. Введение
6. Другие
Тесты по химии (9 класс) с ответами рассчитаны на учеников средней и старшей школы, которые хотят оценить или закрепить свои знания по темам. Задания проверяют знание химических понятий, законов. Некоторые подборки представлены в задачах и уравнениях к разделу. Чтобы добиться хорошего результата, ученик должен не только знать теоретическую базу, алгоритмы решения подобных заданий, но и потренироваться на упражнениях, которые поданы в учебниках или на специализированных сайтах.
Тематические подборки тестов касаются всех необходимых аспектов разделов, поэтому являются прекрасным помощников для экспресс-подготовки к контрольным работам. Задания разного уровня, что позволяет объективно оценить свои знания. Все они, подобно ЕГЭ, предполагают выбор одного варианта из нескольких. Часть вопросов подкреплена иллюстративным материалом. Для экономии времени к тестам уже даны правильные ответы, которые можно использовать как подсказки. Вопросы можно скачать или просматривать онлайн с любых устройств, имеющихся под рукой.
Итоговый тест по химии (9 класс) позволяет быстро и качественно оценить знания данной темы, это отличный помощник для тех, кто хочет подтянуть предмет. Тренировочные задания можно использовать для подготовки к тематической контрольной и итоговой проверке знаний.
obrazovaka.ru
Тренировочный тест для подготовки к ОГЭ – 2017 по химии в 9 классе
Тренировочный тест для подготовки к ОГЭ – 2017 по химии в 9 классе
Инструкция по выполнению работы
На выполнение работы отводится 2 часа (120 минут). Работа состоит из 2 частей, включающих 22 задания. Часть 1 содержит 19 заданий с кратким ответом, часть 2 содержит 3 задания с развернутым ответом.
Ответы к заданиям 1-15 записываются в виде одной цифры, которая соответствует номеру правильного ответа.
Ответы к заданиям 16-19 записываются в виде последовательности цифр.
К заданиям 20-22 следует дать полный развёрнутый ответ, включающий в себя необходимые уравнения реакций и решение задачи.
При выполнении работы можно пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.
Часть 1
1.Химическому элементу 2-го периода VIA-группы соответствует схема распределения электронов
1) Рис. 1
2) Рис. 2
3) Рис. 3
4) Рис. 4
О
твет:2. Неметаллические свойства простых веществ усиливаются в ряду
1) фосфор → кремний → алюминий
2) фтор → хлор → бром
3) селен → сера → кислород
4) азот → фосфор → мышьяк
О
твет:3. Ковалентная полярная связь реализуется в веществе
1) CuO
2) P4
3) SO2
4) MgCl2
О
твет:4. В каком соединении степень окисления хлора равна +7?
1)HCl
2) Cl2O
3) KClO3
4) KClO4
Ответ:
5. Вещества, формулы которых — ZnO и Na2SO4, являются соответственно
1) оснόвным оксидом и кислотой
2) амфотерным гидроксидом и солью
3) амфотерным оксидом и солью
4) оснόвным оксидом и основанием
О
твет:6. Реакция, уравнение которой
2NaOH + CuCl2 = Cu(OH)2 + 2NaCl
относится к реакциям
1) разложения
2) соединения
3) замещения
4) обмена
О
твет:7. Наименьшее количество положительных ионов образуется при диссоциации 1 моль
1) азотной кислоты
2) карбоната натрия
3) сульфата алюминия
4) фосфата калия
О
твет:8. Необратимое протекание реакции ионного обмена между растворами гидроксида бария и карбоната калия обусловлено взаимодействием ионов
1) K+ и OH―
2) K+ и CO32―
3) Ba2+ и CO32―
4) Ba2+ и OH―
О
твет:9. Медь реагирует с раствором
1) AgNO3
2) Al2(SO4)3
3) Fe SO4
4) NaOH
О
твет:10. Оксид меди(II) может реагировать с каждым веществом пары
1) HCl, O2
2) Ag, SO3
3) H2, SO4
4) Al, N2
О
твет:11. Определите формулу неизвестного вещества в схеме реакции:
KOH + …→ K2CO3 +h3O
1) CO
2) CO2
3) CH4
4) C
О
твет:12. Превратить CaNO3 в CaSO3 можно с помощью
1) сероводорода
2) сульфита бария
3) сульфита натрия
4) сернистого газа
О
твет:13. Верны ли суждения о способах разделения смесей?
А. Выпаривание относят к физическим способам разделения смесей.
Б. Разделение смеси воды и этанола возможно способом фильтрования.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
О
твет:14. В реакции 3CuO + 2NH3 =3Cu+ N2+ 3H2O
изменение степени окисления окислителя соответствует схеме
1) +2 → 0
2) −3 → 0
3) −2 → 0
4) 0 → +2
О
твет:15. На какой диаграмме распределение массовых долей элементов
соответствует NHNO3
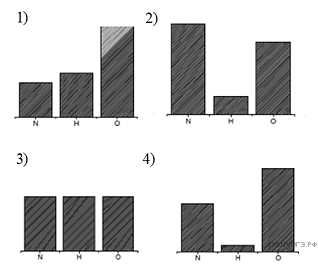
Часть 2
16. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
В ряду химических элементов Be- Mg- Ca
1) увеличивается атомный радиус
2) возрастает высшая степень окисления
3) увеличивается значение электроотрицательности
4) увеличиваются основные свойства образуемых гидроксидов
5) уменьшается число электронов на внешнем уровне
17. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
Для метилового спирта верны следующие утверждения:
1) является газообразным веществом (н. у.)
2) в молекуле имеется гидроксильная группа
3) ядовит
4) плохо растворим в воде
5) вступает в реакцию с серебром
18. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
ВЕЩЕСТВА
РЕАКТИВ
А) NaNO3 и Ca(NO3)2
Б) FeCl2 и FeCl3
В) H2SO4 и HNO3
1) BaCl2
2) Na2CO3
3) HCl
4) NaOH
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
- А
Б
В
19. Установите соответствие между веществом и реагентами, с каждым из которых оно может вступать в реакцию.
1) SO2, FeSO4
Б) гидроксид цинка
2) NaOH, h3SO4
B) соляная кислота
3) Na2SO3, AgNO3
4) KCl, CaO
Ответ:
Часть 2
20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
P + H2SO4 →H3PO4 + SO2 + H20
Определите окислитель и восстановитель
21. При взаимодействии избытка раствора карбоната калия с 10%-ным раствором нитрата бария выпало 3,94 г осадка. Определить массу взятого для опыта раствора нитрата бария.
22. Даны вещества:CuO, NaCl, KOH, MnO2, H2SO4, CaCO3
Используя воду и необходимые вещества только из этого списка, получите в две стадии хлорид меди(II). Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение реакции.
Система оценивания тестовой работы по химии
Верное выполнение каждого из заданий части 1 базового уровня сложности (1–15) оценивается 1 баллом.
Верное выполненное каждого из заданий части 1 повышенного уровня сложности (16–19) максимально оценивается 2 баллами. Задания 16 и 17 считаются верно выполненными, если в каждом из них правильно выбраны два варианта ответа. За неполный ответ – правильно назван один из двух ответов или названы три ответа, из которых два верные, – выставляется 1 балл. Остальные варианты ответов считаются неверными и оцениваются в 0 баллов.
Задания 18 и 19 считаются выполненными верно, если правильно установлены три соответствия. Частично верным считается ответ, в котором установлены два соответствия из трех; он оценивается 1 баллом. Остальные варианты считаются неверным ответом и оцениваются в 0 баллов.
Часть 1
Часть 2
20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой:
HNO3 +Zn = Zn(NO3)2 + NO + H2O
Укажите окислитель и восстановитель.
Элементы ответа(допускаются иные формулировки ответа, не искажающие его смысл)
1) Составим электронный баланс:
S+6 + 2ē = S+4 │2 │5
10
P0 — 5ē = P+5 │5 │2
2) Укажем, что S+6 (H2SO4) — окислитель, а P0(P) —восстановитель
3) Расставим коэффициенты в уравнений реакции:
2P + 5H2SO4 →2H3PO4 + 5SO2 + 2H20
Критерии оценивания
Баллы
Ответ правильный и полный, включает все названные элементы
3
В ответе допущена ошибка только в одном из элементов
2
В ответе допущены ошибки в двух элементах
1
Все элементы ответа записаны неверно
0
Максимальный балл
3
21. При взаимодействии избытка раствора карбоната калия с 10%-ным раствором нитрата бария выпало 3,94 г осадка. Определить массу взятого для опыта раствора нитрата бария.
Элементы ответа(допускаются иные формулировки ответа, не искажающие его смысл)
Пояснение.
Составлено уравнение реакции:
K2CO3 + Ba(NO3)2 = ↓ + 2KNO3
2) Рассчитано количество вещества карбоната бария и масса нитрата бария:
n(BaCO3) = m(BaCO3) / M(BaCO3) = 3,94 : 197 = 0,02 моль
n (Ba(NO3)2) = n(BaCO3) = 0,02 моль
m (Ba(NO3)2) = n (Ba(NO3)2) •M (Ba(NO3)2) = 0,02• 261= 5,22 г.
3) Определена масса раствора нитрата бария:
m (раствора) = m(Ba(NO3)2 / ω (Ba(NO3)2 = 5,22 / 0,1= 52,2 г
Ответ: 52,2 г.
Критерии оценивания
Баллы
Ответ правильный и полный, включает все названные элементы
3
Правильно записаны 2 элемента из названных выше
2
Правильно записан 1 элемент из названных выше (1-ый или 2-ой)
1
Все элементы ответа записаны неверно
0
Максимальный балл
3
22. Даны вещества:CuO, NaCl, KOH, MnO2, H2SO4, CaCO3
Используя воду и необходимые вещества только из этого списка, получите в две стадии хлорид меди(II). Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение реакции.
Элементы ответа(допускаются иные формулировки ответа, не искажающие его смысл)
Напишем 2 уравнения реакций:
2NaCl + H2SO4 =2HCl↑+ Na2SO4
CuO +2HCl =CuCl2 +H2O
Укажем признаки реакций.
Для первой реакции — выделение газа. Для реакции растворения CuO — изменение цвета, образование голубого раствора.
Составим сокращённое ионное уравнение для первой реакции:
CuO +2H+ =Cu2+ +H2O
Критерии оценивания
Баллы
Ответ правильный и полный, включает все названные элементы
5
Правильно записаны четыре элемента ответа
4
Правильно записаны три элемента ответа
3
Правильно записаны два элемента ответа
2
Правильно записан один элемент ответа
1
Все элементы ответа записаны неверно
0
Максимальный балл
5
2017 год.
Максимальное количество баллов, которое может получить экзаменуемый за выполнение всей экзаменационной работы (без реального эксперимента), — 34 балла.
Таблица 4
Шкала пересчета первичного балла за выполнение экзаменационной работы в отметку по пятибалльной шкале (работа без реального эксперимента, демоверсия 1)
0—8 баллов — отметка «2»
9—17 баллов — отметка «3»
18—26 баллов — отметка «4»
27—34 баллов — отметка «5»
Отметку «5» рекомендуется выставлять в том случае, если из общей суммы баллов, достаточной для получения этой отметки, выпускник набрал 5 и более баллов за выполнение заданий части 3. Результаты экзамена могут быть использованы при приеме учащихся в профильные классы средней школы. Ориентиром при отборе в профильные классы может быть показатель, нижняя граница которого соответствует 23 баллам.
infourok.ru
Я решу ЕГЭ : Тесты ОГЭ по химии в 2018
ОГЭ по химии сдается только по выбору ученика, это испытание не входит в перечень обязательных. Выбирают химию ученики, которые после 9-го класса планируют поступать в профильный 10-й класс школы или специализированный колледж, техникум. Для поступления в медицинское училище требуется сдавать не только химию, но и биологию. Экзамен подразумевает ориентацию в теории, успешное применение ее на практике. Испытуемому необходимо решить немало заданий разных уровней сложности из широкого спектра тем. Чтобы определиться в том, на какие темы обратить внимание, ознакомьтесь с Программой подготовки в ОГЭ по химии.
Экзамен состоит из заданий, который делятся на два логических блока:
- В первую часть входят задания на знание теории: здесь нужно дать краткий ответ – цифра, последовательность чисел, слово.
- Во второй части – несколько вопросов, на которые нужно дать развернутые, полные ответы, провести лабораторный эксперимент, написать заключения, выполнить расчеты. Крайне важно умение пользоваться специальным оборудованием, использовать алгоритмы решения задач разного уровня сложности.
На экзамене у испытуемого есть подсказки: таблицы растворимости солей, кислот, оснований в воде, периодическая таблица Менделеева, таблицы напряжений металлов. При условии умения пользоваться этими материалами, можно решить многие задания без трудностей.
- Главный совет, актуальный на каждом экзамене – планируйте свое обучение. Без четкого плана вы не сможете достичь высокого уровня подготовки. Чтобы планирование было максимально эффективным, ознакомьтесь с Программой подготовки – в ней указаны темы и разделы, на которые нужно обратить особое внимание.
- Оцените свои силы: наиболее простой способ – онлайн тестирование. По факту прохождения теста, вы получаете результат, и можете оценить – какие типы заданий и темы вызывают у вас наибольшие трудности.
- Когда вы определили проблемные темы, уделите им большее внимание, чем остальным. Для обучения возьмите учебники, справочники.
- Обязательно решайте задачи! Чем больше задач вы решите для подготовки, тем проще будет на экзамене.
- Задавайте вопросы: найдите специалиста, который сможет вам помочь в проблемных ситуациях. Это может быть репетитор или школьный учитель. Только специалист может помочь вам проанализировать свои ошибки и больше не совершать их.
- Научитесь пользоваться подсказками – теми таблицами, которые можно брать с собой на экзамен.
- Изучать теорию — мало, очень важно тренироваться выполнять тесты. Данная форма проверки знаний у многих вызывает трудности, особенно, если на уроках она не использовалась. Решайте больше тестовых заданий разных типов, чтобы на экзамене они не вызывали страха и непонимания.
- «Решу ОГЭ по химии» поможет вам подготовиться к экзамену и успешно сдать его, рационально используя отведенное время, без стресса.
Тренировочные варианты (2019 год)
Тренировочные варианты (2018 год)
cknow.ru
| № задания | Тема задания | Материал |
| 1 | Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И.Менделеева. | Тест 1-1 |
| 2 | Периодический закон и Периодическая система химических элементов Д.И.Менделеева. | Тест 2-1 |
| 3 | Строение молекул. Химическая связь. | Тест 3-1 |
| 4 | Валентность химических элементов. Степень окисления. | Тест 4-1 |
| 5 | Простые и сложные вещества. Основные классы неорганических веществ. | Тест 5-1 |
| 6 | Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. | Тест 6-1 |
| 7 | Электролиты. Неэлектролиты. Электролитическая диссоциация. | Тест 7-1 |
| 8 | Реакции ионного обмена. Условия их осуществления. | Тест 8-1 |
| 9 | Химические свойства простых веществ: металлов и неметаллов. | Тест 9-1 |
| 10 | Химические свойства оксидов. | Тест 10-1 |
| 11 | Химические свойства оснований. Химические свойства кислот. | Тест 11-1 |
| 12 | Химические свойства солей (средних) | Тест 12-1 |
| 13 | Чистые вещества и смеси. Правила безопасной работы в школьной лаборатории. Лабораторная посуда и оборудование. | Тест 13-1 |
| 14 | Степень окисления химических элементов. Окислитель и восстановитель. ОВР. | Тест 14-1 |
| 15 | Вычисление массовой доли химического элемента в веществе. | Тест 15-1 |
| 16 | Периодический закон Д.И.Менделеева. Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов. | Тест 16-1 |
| 17 | Первоначальные сведения об органических веществах: предельных и непредельных углеводородах и кислородсодержащих веществах: спиртах, карбоновых кислотах. | Тест 17-1 |
| 18 | Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе. | Тест 18-1 |
| 19 | Химические свойства простых и сложных веществ. | Тест 19-1 |
| 20 | Взаимосвязь различных классов неорганических веществ. Реакции ионного обмена и условия их осуществления. | Тест 20-1 |
| 21 | Вычисления массовой доли растворенного вещества в растворе. | Тест 21-1 |
| 22 | Химические свойства простых и сложных веществ. Качественные реакции на ионы в растворе(хлорид-, сульфат-, карбонат-ионы, ион аммония) | Тест 22-1 |
mirhimika.ucoz.ru
