Соли — Википедия
У этого термина существуют и другие значения, см. Соль (значения). Соль со дна Мёртвого моряСо́ли — сложные вещества, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков[1]. ИЮПАК определяет соли как химические соединения, состоящие из катионов и анионов[2]. Есть ещё одно определение: солями называют вещества, которые могут быть получены при взаимодействии кислот и оснований с выделением воды[3].
Кроме катионов металлов в солях могут находиться катионы аммония NH4+, фосфония PH4+ и их органические производные, а также комплексные катионы и т. д. Анионами в солях выступают анионы кислотного остатка различных кислот Брёнстеда — как неорганических, так и
ru.wikipedia.org
Соли. Названия и классификация солей.
Солями называются вещества, в которых атомы металла связаны с кислотными остатками.
Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH4+. Примеры типичных солей приведены ниже.
NaCl – хлорид натрия,
Na2SO4 – сульфат натрия,
СаSO4 – сульфат кальция,
СаCl2 – хлорид кальция,
(NH4)2SO4 – сульфат аммония.
Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли – ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток. Названия солей в зависимости от кислотного остатка показаны в таблице 4.6. В верхней части таблицы приведены кислородсодержащие кислотные остатки, в нижней – бескислородные.
Таблица 4-6. Построение названий солей.
Соль какой кислоты | Кислот-ный остаток | Валент-ность остатка | Название солей | Примеры |
Азотная HNO3 | NO3 | I | нитраты | Ca(NO3)2 нитрат кальция |
Кремниевая H2SiO3 | SiO32 | II | силикаты | Na2SiO3 силикат натрия |
Серная H2SO4 | SO42 | II | сульфаты | PbSO4 сульфат свинца |
Угольная H2CO3 | CO32 | II | карбонаты | Na2CO3карбонат натрия |
Фосфорная H3PO4 | PO43 | III | AlPO4 фосфат алюминия |
Бромоводородная HBr | Br | I | бромиды | NaBr бромид натрия |
Иодоводородная HI | I | I | иодиды | KI иодид калия |
| Сероводородная H2S | S2 | II | сульфиды | FeS сульфид железа (II) |
Соляная HCl | Cl | I | хлориды | NH4Cl хлорид аммония |
Фтороводородная HF | F | I | CaF2 фторид кальция |
Из таблицы 4-6 видно, что названия кислородсодержащих солей имеют окончания «ат», а названия бескислородных солей – окончания «ид».
В некоторых случаях для кислородсодержащих солей может использоваться окончание «ит».Например, Na2SO3 – сульфит натрия. Это делается для того, чтобы различать соли серной кислоты (H2SO4) и сернистой кислоты (H2SO3) и в других таких же случаях.
Все соли разделяются на средние, кислые и основные. Средние соли содержат только атомы металла и кислотного остатка. Например, все соли из таблицы 4-6 являются средними солями.
Любую соль можно получить соответствующей реакцией нейтрализации. Например, сульфит натрия образуется в реакции между сернистой кислотой и основанием (едким натром). При этом на 1 моль кислоты требуется взять 2 моля основания:
H2SO3 | + | 2 NaOH | = | Na2SO3 | + | 2 H2O |
|
|
|
| сульфит натрия (средняя соль) |
|
|
Если взять только 1 моль основания – то есть меньше, чем требуется для полной нейтрализации, то образуется кислая соль – гидросульфит натрия:
H2SO3 | + | NaOH | = | NaHSO3 | + | H2O |
|
|
|
| гидросульфит натрия (кислая соль) |
|
|
Кислые соли образуются многоосновными кислотами. Одноосновные кислоты кислых солей не образуют.
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку «гидро» (от слова hydrogenium – водород). Например:
NaHCO3 – гидрокарбонат натрия,
K2HPO4 – гидрофосфат калия,
KH2PO4 – дигидрофосфат калия.
Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки «гидроксо». Ниже приведен пример, показывающий отличие основных солей от обычных (средних):
Mg(OH)2 | + | 2 HCl | = | MgCl2 | + | 2 H2O |
|
|
|
| хлорид магния(средняя соль) |
|
|
Mg(OH)2 | + | HCl | = | Mg(OH)Cl | + | H2O |
|
|
|
| гидроксохлорид магния(основная соль) |
|
|
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы.
Основные соли образуются только из многокислотных оснований. Однокислотные основания таких солей образовать не могут.
В таблице 4.6 приведены международные названия солей. Однако полезно знать также русские названия и некоторые исторически сложившиеся, традиционные названия солей, имеющих важное значение (таблица 4.7).
Таблица 4.7. Международные, русские и традиционные названия некоторых важных солей.
Соль | Международное название | Русское название | Традиционное название | Применение |
Na2CO3 | Карбонат натрия | Натрий углекислый | Сода | В быту – как моющее и чистящее средство |
NaHCO3 | Гидрокарбонат натрия | Натрий углекислый кислый | Питьевая сода | Пищевой продукт: выпечка кондитерских изделий |
K2CO3 | Карбонат калия | Калий углекислый | Поташ | Применяется в технике |
Na2SO4 | Сульфат натрия | Натрий сернокислый | Глауберова соль | Лекарственное средство |
MgSO4 | Сульфат магния | Магний сернокислый | Английская соль | Лекарственное средство |
KclO3 | Хлорат калия | Калий хлорнова-токислый | Бертолетова соль | Применяется в зажигательных смесях для головок спичек |
Например, ни в коем случае нельзя путать соду Na2CO3 и питьевую соду NaHCO3. Если нечаянно использовать в пищу соду вместо питьевой соды, можно получить тяжелый химический ожог.
В химии и в технике до сих пор сохраняется много старинных названий. Например, каустическая сода– вовсе не соль, а техническое название гидроксида натрия NaOH. Если обыкновенной содой можно почистить раковину или посуду, то каустическую соду ни при каких обстоятельствах брать в руки или использовать в быту нельзя!
Строение солей аналогично строению соответствующих кислот и оснований. Ниже приведены структурные формулы типичных средних, кислых и основных солей.
Приведем строение и название основной соли, формула которой выглядит: [Fe(OH)2]2CO3 – дигидроксокарбонат железа (III). При рассмотрении структурной формулы такой соли становится ясно, что эта соль –продукт частичной нейтрализации гидроксида железа (III) угольной кислотой:
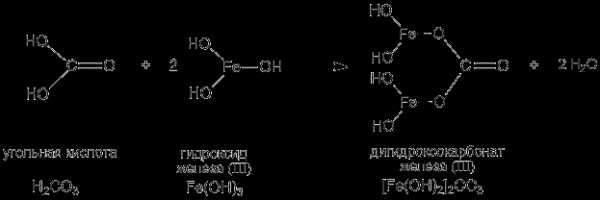
studfiles.net
10. Соли, их классификация, номенклатура, получение, химические свойства.
Солями называются сложные вещества формула молекулы которых, состоит из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д.
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие типы солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na2CO3, KNO3 2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 и т. д.
3. Основные соли можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO4 , Zn(OH)Cl и т.д.
По числу присутствующих в структуре катионов и анионов выделяют следующие типы солей.
Простые соли — соли, состоящие из одного вида катионов и одного вида анионов (NaCl)
Двойные соли — соли, содержащие два различных катиона (KAl(SO4)2·12 H2O).
Смешанные соли — соли, в составе которых присутствует два различных аниона (Ca(OCl)Cl).
Также различают гидратные соли (кристаллогидраты), в состав которых входят молекулы кристаллизационной воды, например,Na2SO4·10 H2O, и комплексные соли, содержащие комплексный катион или комплексный анион (K4[Fe(CN)6], Cu(NH3)4](OH)2
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO4 – сульфат кальция, Mg SO4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI2 – хлорид цинка и т.д.
В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl3)2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH2PO4 – дигидрофосфат натрия.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
Способы получения солей
Взаимодействие металла с кислотой.
Zn + 2HCl = ZnCl2 + H2
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Взаимодействие основного оксида с кислотой
CaO + 2HCl = CaCl2 + 2H2O
FeO + H2SO4 = FeSO4 + H2O
Взаимодействие основания с кислотой (реакция нейтрализации).
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
2NaOH + H2SO4 = Na2SO4 + H2O
При неполной нейтрализации кислоты основанием образуется кислая соль:
H2SO4 + NaOH = NaHSO4 + H2O
Взаимодействие соли с кислотой. В этом случаи образуется новая кислота и новая соль. Для осуществления этой реакции необходимо, что бы взятая кислота была сильнее образующейся или менее летучей.
2NaCl + H2So4 = Na2SO4 + 2HCl↑
Действием избытка кислоты на средние соли многоосновных кислот получают кислые соли:
Na2SO4 + H2SO4 = 2NaHSO4
CaCO3 + CO2 + H2O = Ca(HCO3)2
Взаимодействие основного оксида с кислотным оксидом.
CaО + SiО2 = CaSiO3
Взаимодействие основания с кислотным оксидом
6NaOH + P2O5 = 2Na3PO4 + 3H2O
Взаимодействие соли с кислотным оксидом. Вступающий в реакцию кислотный оксид должен быть менее летуч, чем образующийся после реакции.
CaCO3 + SiO2 =t CaSiO3 + CO2 ↑
Взаимодействие соли с основанием. Этим способом можно получить как средние соли, так и, при недостатке основания, основные соли. Кислые соли, взаимодействуют с основанием, переходят в средние:
Fe(NO3)3 + 3NaOH = 3NaNo3 + Fe(OH)3 ↓
ZnCl2 + KOH = ZnOHCl + KCl
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
Взаимодействие между двумя солями. Образуются две новые соли. Реакция протекает до конца лишь в том случае, если одна из образующихся солей выпадает в осадок:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
AgNO3 + KJ = AgI↓ + KNO3
Взаимодействие между металлом и солью. Вступивший в реакцию металл должен находится в ряду напряжения металлов левее металла, входящего в состав исходной соли.
Fe + CuSO4 = FeSO4 + Cu
Взаимодействие металла с неметаллом
2Fe + 3Cl2= 2FeCl3
Взаимодействие металла со щелочью.
Zn + 2NaOHкрNa2ZnO2 + H2 ↑
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 ↑
Взаимодействие металла со щелочью
Cl2 + 2KOH = KCl + KClO + H2O
Взаимодействие неметалла с солью.
Cl2 + KJ = 2KCl + J2
Термическое разложение солей.
2KNO32KNO2 + O2↑
2KClO32KCl + 3O2↑
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
3. Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
studfiles.net
Что такое соль? Формула, свойства соли (химия) :: SYL.ru
Для того чтобы ответить на вопрос, что такое соль, обычно долго задумываться не приходится. Это химическое соединение в повседневной жизни встречается достаточно часто. Об обычной поваренной соли и говорить не приходится. Подробное внутреннее строение солей и их соединений изучает неорганическая химия.
Определение соли
Четкий ответ на вопрос, что такое соль, можно найти в трудах М. В. Ломоносова. Такое имя он присвоил хрупким телам, которые могут растворяться в воде и не воспламеняются под воздействием высоких температур или открытого огня. Позднее определение выводили не из их физических, а из химических свойств данных веществ.
Школьные учебники неорганической химии дают достаточно ясное понятие того, что такое соль. Так называются продукты замещения химической реакции, при которой атомы водорода кислоты в соединении замещаются на металл. Примеры типичных соединений солей: NaCL, MgSO4. Легко увидеть, что любую эту запись можно разделить на две половины: в левой составляющей формулы всегда будет записан металл, а в правой – кислотный остаток. Стандартная формула соли выглядит следующим образом:
MenmКислотный остатокmn.
Физические свойства соли
Химия, как точная наука, вкладывает в название того или иного вещества всю возможную информацию о его составе и возможностях. Так, все наименования солей в современной интерпретации состоят из двух слов: одна часть имеет название металлического составляющего в именительном падеже, вторая — содержит описание кислотного остатка.
Эти соединения не имеют молекулярного строения, поэтому при обычных условиях они представляют собой твердые кристаллические вещества. Многие соли обладают кристаллической решеткой. Кристаллы этих веществ тугоплавки, поэтому для их плавления нужны очень высокие температуры. Например, сульфид бария плавится при температуре около 2200о С.
По растворимости соли делятся на растворимые, малорастворимые и нерастворимые. Примером первых могут служить хлорид натрия, нитрат калия. К малорастворимым относят сульфит магния, хлорид свинца. Нерастворимые – это карбонат кальция. Информация о растворимости того или иного вещества содержится в справочной литературе.
Рассматриваемый продукт химической реакции обычно не имеет запаха и обладает разным вкусом. Предположение о том, что все соли соленые — ошибочно. Чистый соленый вкус имеет только один элемент этого класса – наша старая знакома поваренная соль. Существуют сладкие соли бериллия, горькие – магния и безвкусные – например, карбонат кальция (мел обыкновенный).
Большинство данных веществ бесцветно, но среди них имеются и такие, которые имеют характерные окрасы. Например, железа (II) сульфат отличается характерным зеленым цветом, калия перманганат – фиолетовый, а кристаллы хромата калия – ярко-желтые.
Классификация соли
Химия разделяет все виды неорганических солей на несколько основных признаков. Соли, получающиеся при полном замещении водорода в кислоте, называют нормальными или средними. Например, сульфат кальция.
Соль, которая является производной от реакции неполного замещения, называется кислой или основной. Примером такого образования может быть реакция гидросульфата калия:
Основная соль получается при такой реакции, в которой гидроксогруппа не полностью замещается на кислотный остаток. Вещества данного вида могут быть образованны теми металлами, чья валентность равна двум или больше. Типичная формула соли этой группы может быть выведена из такой реакции:
Нормальные, средние и кислые химические соединения образуют классы солей и являются стандартной классификацией этих соединений.
Двойная и смешанная соль
Химия неорганических веществ показывает, что данный продукт может быть образован двумя металлами и одной кислотой. В этом случае кислота должна иметь основность больше или равной 2. Такое соединение называют двойная соль. Химические соли этой группы – алюмокалиевые квасцы, их еще называют сульфат калия-алюминия.
Примером смешанной является кальциевая соль соляной и хлорноватистой кислоты: CaOCl2.
Номенклатура
Соли, образованные металлами с переменной валентностью, имеют дополнительное обозначение: после формулы в скобках пишут римскими цифрами валентность. Так, существует сульфат железа FeSO4 (II) и Fe2 (SO4)3 (III). В названии солей имеется приставка гидро-, если в ее составе существуют незамещенные атомы водорода. Например, гидрофосфат калия обладает формулой K2HPO4 .
Свойства солей в электролитах
Теория электролитической диссоциации дает собственное толкование химическим свойствам. В свете этой теории соль может быть определена как слабый электролит, который в растворенном виде диссоциирует (распадается) в воде. Таким образом, раствор соли можно представить как комплекс положительных отрицательных ионов, причем первые – это не атомы водорода Н+, а вторые – не атомы гидроксогруппы ОН—. Ионов, которые присутствовали бы во всех видах растворов солей, не существует, поэтому какими-либо общими свойствами они не обладают. Чем меньше заряды ионов, образующих раствор соли, тем лучше они диссоциируют, тем лучше электропроводимость такой жидкой смеси.
Растворы кислых солей
Кислые соли в растворе распадаются на сложные отрицательные ионы, представляющие собой кислотный остаток, и простые анионы, являющиеся положительно заряженными частицами металла.  Например, реакция растворения гидрокарбоната натрия ведет к распаду соли на ионы натрия и остаток НСО3—.
Например, реакция растворения гидрокарбоната натрия ведет к распаду соли на ионы натрия и остаток НСО3—.
Полная формула выглядит таким образом: NaHCO3 = Na+ + HCO3—,HCO3 — = H+ + CO32-.
Растворы основных солей
Диссоциация основных солей ведет к образованию анионов кислоты и сложных катионов, состоящих из металлов и гидроксокрупп. Эти сложные катионы, в свою очередь, также способны распадаться в процессе диссоциации. Поэтому в любом растворе соли основной группы присутствуют ионы ОН— . Например, диссоциация хлорида гидроксомагния протекает следующим образом: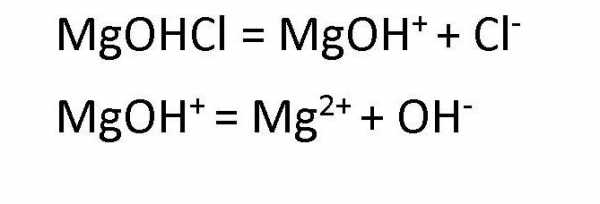
Распространение солей
Что такое соль? Этот элемент является одним из самых распространенных химических соединений. Всем известны поваренная соль, мел (карбонат кальция) и прочее. Среди солей карбонатной кислоты самым распространенным является карбонат кальция. Он является составной частью мрамора, известняка, доломита. А еще карбонат кальция — основа для формирования жемчуга и кораллов. Это химическое соединение является неотъемлемой составляющей для формирования твердых покровов у насекомых и скелетов у хордовых животных.
Поваренная соль известна нам с детства. Врачи предостерегают от ее чрезмерного употребления, но в умеренных количествах она крайне необходима для осуществления жизненных процессов в организме. А нужна она для поддержания правильного состава крови и вырабатывания желудочного сока. Физрастворы, неотъемлемая часть инъекций и капельниц, есть не что иное, как раствор поваренной соли.
www.syl.ru
Основные классы неорганических соединений. Соли
Тема урока – основные классы неорганических соединений. Соли, урок химии 5. Ранее прошли урок химии 4.
Соли – продукты замещения (полного или частичного) атомов водорода в молекулах кислот катионами металла (а также ионами аммония), либо гидроксо — групп в молекулах оснований кислотными остатками.
Классификация солей
Соли делятся на средние, кислые, основные, двойные, смешанные, комплексные, кристаллогидраты.
Средние соли – это продукты полного замещения атомов водорода кислоты атомами металла или гидроксо – групп основания кислотными остатками. Средние соли образуют все кислоты и основания, независимо от их основности или кислотности. Состав средних солей можно представить общей формулой MexAny, x – число катионов металла, равное заряду аниона, у – число анионов (кислотных остатков), равные заряду катиона металла.
Кислые соли – это продукты неполного замещения атомов водорода в молекулах только многоосновных кислот катионами металла.
H2SO4 +NaOH → NaHSO4 NaHSO4+NaOH → Na2SO4
двухосновная кислота кислая соль средняя соль
Основные соли – продукты неполного замещения гидроксо – групп в молекулах только многокислотных оснований кислотными остатками.
Fe(OH)2 + HCl → Fe(OH)Cl Fe(OH)Cl + HCl → FeCl2
двухкислотное основание основная соль средняя соль
Двойные соли — соли, содержащие два химически разных катиона и один тип аниона. Например: KAl(SO4)2 – сульфат алюминия-калия.
Смешанные соли – соли, содержащие один тип катиона, но два типа аниона.
Например: Ca(Cl)OCl – хлорид-гипохлорит кальция (хлорная известь).
Комплексные соли – это такие соли, которые диссоциируют с образованием комплесных ионов.
K4[Fe(CN)6] – желтая кровяная соль.
K3[Fe(CN)6] – красная кровяная соль.
K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4 –
Кристаллогидраты – это соли, связанные с молекулами воды.
Nа2SO4 *10 H2O – глауберова соль.
CuSO4*5h3O – медный купорос.
FeSO4*7H2O – железный купорос.
Название соли строится по следующей схеме:
Название средней соли = название кислотного остатка + название металла
(род. падеж) + степень окисления металла
Например: Fe2S3 – сульфид железа (III).
Для кислых солей добавляются приставки «гидро» или «дигидро», например: Mg(H2PO4)2 – дигидрофосфат магния.
Для основных солей добавляются приставки «гидроксо» или «дигидроксо», например: [Cu(OH)]2CO3 – гидроксокарбонат меди (II).
Название комплексных солей строят так: название аниона, затем название катиона в родительном падеже. В названии сложного иона отражают количество и названия группировок (лигандов), окружающих центральный ион (комплексообразователь), и заряд центрального иона.
Например, Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия.
Химические свойства солей
1) Почти все соли являются ионными соединениями, поэтому в расплаве и в водном растворе диссоциируют на ионы. При пропускании тока через раствор или расплавы солей идет процесс эллектролиза.
2) Взаимодействие солей с металлами идет только в том случае, если более активный металл вытесняет менее активный металл из его солей:
CuSO4 + Fe → FeSO4+Cu
3) Соли малорастворимых оснований взаимодействуют с растворимыми основаниями с образованием или свободного основания или основной соли (при недостатке основания):
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
2CuSO4 + 2NaOH → (CuOH)2SO4 + Na2SO4
4) Взаимодействие солей с кислотами возможно только в случае образования:
а) более слабой кислоты;
б) труднорастворимой соли;
в) газа;
При этом, в зависимости от соотношения компонентов возможно образование как кислот, так и кислых солей:
а) Na3PO4 + 3HCl → H3PO4 + 3NaCl;
Na3PO4 + 2HCl → NaH2PO4 + 2NaCl
б) BaCl2 + H2SO4 → BaSO4↓ + 2HCl
в) Na2S(крист.) + 2HCl→ H2S↑ + 2NaCl
5) Две растворимые соли вступают в реакцию обмена, если одна из образующих солей выпадает в осадок:
3CaCl2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaCl
6) Средние, кислые и основные соли взаимосвязаны и могут быть превращены друг в друга:
CaCO3 + H2CO3 → Ca(HCO3)2
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
7) Соли, в состав которых входят остаток любого электролита, в водном растворе гидролизуются.
8) При нагревании некоторые соли разлагаются:
t t
CaCO3 → CaO + CO2; 2KClO3 → 2KCl + 3O2
Способы получения солей
Большая часть методов получения солей основана на взаимодействии веществ противоположной природы – металлов с неметаллами, кислотных оксидов с основными, оснований с кислотами. Однако, при синтезе конкретной соли следует иметь в виду: а) не все предложенные методы могут быть использованы в данном случае; б) существуют специфические способы получений солей.
- Реакция металла с неметаллом: Mg + Br2 → MgBr2.
- Взаимодействие кислот с металлами: 2Na + H2S → Na2S + H2↑.
- Вытеснением менее активного металла более активным из раствора: Fe + CuSO4 → Cu + FeSO4.
- Реакция между основным и кислотным оксидом: К2О + СО2 → К2СО3.
- Реакция основного оксида с кислотой: BaO + 2HCl → BaCl2 + H2O.
- Кислотный оксид с основанием: SO3 + 2NaOH → Na2SO4 + H2O.
- Реакция кислоты и основания: H3PO4 + 3NaOH → Na3PO4 + 3H2O.
- Взаимодействие раствора основания с раствором соли:
- Ва(ОН)2 + К2SO4 → 2KOH + BaSO4↓.
- Взаимодействие соли с кислотой: CuCO3 +H2SO4 → CuSO4 + H2CO3.
- Реакция растворов двух солей: АgNO3 + NaCl → AgCl↓ + NaNO3.
Это был урок химии 5 — основные классы неорганических соединений. Соли.
Friend me:
к нашему сайту.
sovety-tut.ru
Физические и химические свойства солей
Соли принято делить на три группы – средние (NaCl), кислые (NaHCO3) и основные (Fe(OH)Cl). Кроме этого различают двойные (смешанные) и комплексные соли. Двойные соли образованы двумя катионами и одним анионом. Они существуют только в твердом виде.
Химические свойства солей
а) кислые соли
Кислые соли при диссоциации дают катионы металла (иона аммония), ионы водорода и анионы кислотного остатка:
NaHCO3 ↔ Na+ + H+ + CO32-.
Кислые соли – продукты неполного замещения атомов водорода соответствующей кислоты на атомы металла.
Кислые соли термически неустойчивы и при нагревании разлагаются с образованием средних солей:
Ca(HCO3)2 = CaCO3↓ + CO2↑ + H2O.
Для кислых солей характерны реакции нейтрализации со щелочами:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2H2O.
б) основные соли
Основные соли при диссоциации дают катионы металла, анионы кислотного остатка и ионы ОН—:
Fe(OH)Cl ↔ Fe(OH)+ + Cl— ↔ Fe2+ + OH— + Cl—.
Основные соли – продукты неполного замещения гидроксильных групп соответствующего основания на кислотные остатки.
Основные соли, также, как и кислые, термически неустойчивы и при нагревании разлагаются:
[Cu(OH)]2CO3 = 2CuO + CO2↑ + H2O.
Для основных солей характерны реакции нейтрализации с кислотами:
Fe(OH)Cl + HCl ↔ FeCl2 + H2O.
в) средние соли
Средние соли при диссоциации дают только катионы металла (ион аммония) и анионы кислотного остатка (см. выше). Средние соли – продукты полного замещения атомов водорода соответствующей кислоты на атомы металла.
Большинство средних солей термически неустойчивы и при нагревании разлагаются:
CaCO3 = CaO + CO2;
NH4Cl = NH3 + HCl;
2Cu(NO3)2 = 2CuO +4NO2 + O2.
В водном растворе средние соли подвергаются гидролизу:
Al2S3 +6H2O ↔ 2Al(OH)3 + 3H2S;
K2S + H2O ↔ KHS + KOH;
Fe(NO3)3 + H2O ↔ Fe(OH)(NO3)2 + HNO3.
Средние соли вступают в реакции обмена с кислотами, основаниями и другими солями:
Pb(NO3)2 + H2S = PbS↓ + 2HNO3;
Fe2(SO4)3 + 3Ba(OH)2 = 2Fe(OH)3↓ + 3BaSO4↓;
CaBr2 + K2CO3 = CaCO3↓ + 2KBr.
Физические свойства солей
Чаще всего соли – кристаллические вещества с ионной кристаллической решеткой. Соли имеют высокие температуры плавления. При н.у. соли – диэлектрики. Растворимость солей в воде различна.
Получение солей
а) кислые соли
Основные способы получения кислых солей – неполная нейтрализация кислот, действие избытка кислотных оксидов на основания, а также действие кислот на соли:
NaOH + H2SO4 = NaHSO4 + H2O;
Ca(OH)2 + 2CO2 = Ca(HCO3)2;
CaCO3 + CO2 + H2O = Ca(HCO3)2.
б) основные соли
Основные соли получают путем осторожного добавления небольшого количества щелочи к раствору средней соли, либо действием солей слабых кислот на средние соли:
AlCl3 + 2NaOH = Al(OH)2Cl + 2NaCl;
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3↓ + CO2↑ + 2NaCl.
в) средние соли
Основные способы получения средних солей – реакции взаимодействия кислот с металлами, основными или амфотерными оксидами и основаниями, а также реакции взаимодействия оснований с кислотными или амфотерными оксидами и кислотами, реакции взаимодействия кислотных и основных оксидов и реакции обмена:
Mg + H2SO4 = MgSO4 + H2↑;
Ag2O + 2HNO3 = 2AgNO3 + H2O;
Cu(OH)2 + 2HCl = CuCl2 + 2H2O;
2KOH + SO2 = K2SO3 + H2O;
CaO + SO3 = CaSO4;
BaCl2 + MgSO4 = MgCl2 + BaSO4↓.
Примеры решения задач
ru.solverbook.com
Урок 25. Соли – HIMI4KA
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.

Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).

Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.

Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
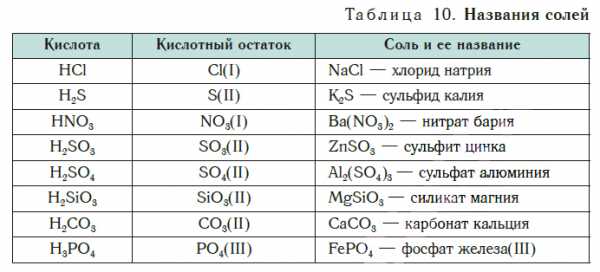
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
