классификация, формулы и их свойства
Каждый школьник встречался с понятием «оксид» на уроках химии. От одного этого слова предмет начинал казаться чем-то неописуемо страшным. Но ничего страшного здесь нет. Высшие оксиды – это вещества, в которых содержатся соединения простых веществ с кислородом (в степени окисления -2). Стоит отметить, что они реагируют с:
- O2 (кислородом), в том случае, если элемент стоит не в высшей СО. К примеру, SO2 реагирует с кислородом (т. к. СО равна +4), а SO3 — нет (т. к. стоит в наивысшей степени окисления +6).
- H2 (водород) и C (углерод). Вступают в реакцию только некоторые оксиды.
- Водой в том случае, если получается растворимая щелочь или кислота.
Все оксиды вступают в реакцию с солями и неметаллами (за исключением вышеперечисленных веществ).
Стоит отметить, что некоторые вещества (например, оксид азота, оксид железа и оксид хлора) имеют свои особенности, т. е. их химические особенности могут отличаться от других субстанций.
Классификация оксидов
Они делятся на две ветки: те, кто могут образовывать соль, и те, кто образовывать ее не могут.
Примеры формул высших оксидов, которые не образуют солей: NO (окись азота двух валентная; газ без цвета, образующийся во время гроз), CO (угарный газ), N2O (оксид азота одновалентный), SiO (оксид кремния), S2O (оксид серы), вода.

Эти соединения могут реагировать с основаниями, кислотами и солеобразующими оксидами. Но при реагировании этих веществ никогда не образуется солей. Например:
CO (угарный газ) + NaOH (гидроксид натрия) = HCOONa (формиат натрия)
Солеобразующие оксиды делятся на три вида: кислотные, основания и амфотерные окислы.
Кислотные окиси
Кислотный высший оксид – это солеобразующий оксид, который соответствует кислоте. Например, у оксида серы шестивалентного (SO3) есть соответствующее ему химическое соединения – H2SO4. Эти элементы вступают в реакцию с оксидами основных и амфотерных свойств, основаниями и водой. Образуется соль или кислота.
- Со щелочными оксидами: CO2 (углекислый газ) + MgO (окись магния) = MgCO3 (горькая соль).
- С амфотерными окисями: P2О5 (окисел фосфора)+ Al2О3 (окисел алюминия) = 2AlPO4 (фосфат или ортофосфат алюминия).
- С основаниями (щелочами): CO2 (углекислый газ) + 2NaOH (едкий натр) = Na2CO3 (карбонат натрия или кальцинированная сода) + H2O (вода).
- С водой: CO2 (углекислый газ) + H2O = H2CO3 (угольная кислота, после реакции мгновенно распадается на углекислый газ и воду).
Оксиды кислот не вступают в реакцию друг с другом.
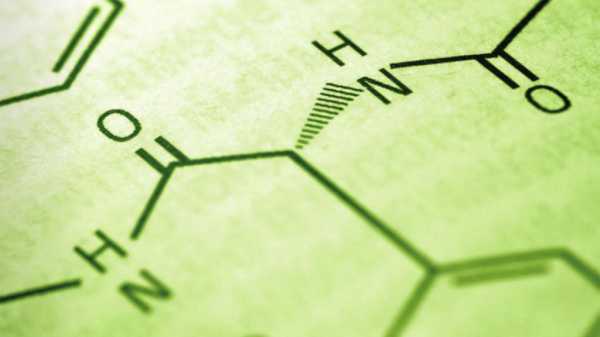
Основные оксиды
Основный высший оксид – это солеобразующий окисел металла, которому соответствует основание. Окислу кальция (CaO) соответствует гидроксид кальция (Ca(OH)2). Эти вещества взаимодействуют с окислами кислотного и амфотерного характера, кислотами (за исключением H2SiO3, так как кремниевая кислота нерастворимая) и водой.
- С кислотными оксидами: CaO (оксид кальция) + CO2 (углекислый газ) = CaCO3 (карбонат кальция или обычный мел).
- С амфотерной окисью: CaO (оксид кальция) + Al2O3 (окись алюминия) = Ca(AlO2)2 (алюминат кальция).
- С кислотами: CaO (окисел кальция) + H2SO4 (серная кислота) = CaSO4 (сульфат кальция или гипс) + H2O .
- С водой: CaO (оксид кальция) + H2O = Ca(OH)2 (гидроксид кальция или реакция гашения извести).
Не взаимодействуют между собой.

Амфотерные окиси
Амфотерный высший оксид – это окисел амфотерного металла. В зависимости от условий, он может проявить основные или кислотные свойства. Например, формулы высших оксидов, которые проявляют амфотерные свойства: ZnO (окисел цинка), Al2O3 (глинозем). Реагируют амфотерные окиси со щелочами, кислотами (так же за исключением кремниевой кислоты), основными и кислотными оксидами.
- С основаниями: ZnO (окисел цинка) + 2NaOH (основание натрия) = Na2ZnO2 (двойная соль цинка и натрия)+ H2O.
- С кислотами: Al2O3 (алюминия оксид) + 6HCl (соляная кислота) = 2AlCl3 (хлорид алюминия или хлористый алюминий) + 3H2O.
- С кислотными оксидами: Al2O3 (окисел алюминия) + 3SO3 (окисел серы шестивалентный) = Al2(SO4)3 (алюминиевые квасцы).
- С окислами основного характера: Al2O3 (окисел алюминия) + Na2O (окись натрия) = 2NaAlO2 (алюминат натрия).
Элементы высших оксидов амфотерного характера не взаимодействуют между собой и с водой.
fb.ru
классификация, формулы и их свойства
Образование 6 августа 2018Каждый школьник встречался с понятием «оксид» на уроках химии. От одного этого слова предмет начинал казаться чем-то неописуемо страшным. Но ничего страшного здесь нет. Высшие оксиды – это вещества, в которых содержатся соединения простых веществ с кислородом (в степени окисления -2). Стоит отметить, что они реагируют с:
- O2 (кислородом), в том случае, если элемент стоит не в высшей СО. К примеру, SO2 реагирует с кислородом (т. к. СО равна +4), а SO3 — нет (т. к. стоит в наивысшей степени окисления +6).
- H2 (водород) и C (углерод). Вступают в реакцию только некоторые оксиды.
- Водой в том случае, если получается растворимая щелочь или кислота.
Все оксиды вступают в реакцию с солями и неметаллами (за исключением вышеперечисленных веществ).
Стоит отметить, что некоторые вещества (например, оксид азота, оксид железа и оксид хлора) имеют свои особенности, т. е. их химические особенности могут отличаться от других субстанций.
Классификация оксидов
Они делятся на две ветки: те, кто могут образовывать соль, и те, кто образовывать ее не могут.
Примеры формул высших оксидов, которые не образуют солей: NO (окись азота двух валентная; газ без цвета, образующийся во время гроз), CO (угарный газ), N2O (оксид азота одновалентный), SiO (оксид кремния), S2O (оксид серы), вода.

Эти соединения могут реагировать с основаниями, кислотами и солеобразующими оксидами. Но при реагировании этих веществ никогда не образуется солей. Например:
CO (угарный газ) + NaOH (гидроксид натрия) = HCOONa (формиат натрия)
Солеобразующие оксиды делятся на три вида: кислотные, основания и амфотерные окислы.
Кислотные окиси
Кислотный высший оксид – это солеобразующий оксид, который соответствует кислоте. Например, у оксида серы шестивалентного (SO3) есть соответствующее ему химическое соединения – H2SO4. Эти элементы вступают в реакцию с оксидами основных и амфотерных свойств, основаниями и водой. Образуется соль или кислота.
- Со щелочными оксидами: CO2 (углекислый газ) + MgO (окись магния) = MgCO3 (горькая соль).
- С амфотерными окисями: P2О5 (окисел фосфора)+ Al2О3 (окисел алюминия) = 2AlPO4 (фосфат или ортофосфат алюминия).
- С основаниями (щелочами): CO2 (углекислый газ) + 2NaOH (едкий натр) = Na2CO3 (карбонат натрия или кальцинированная сода) + H 2O (вода).
- С водой: CO2 (углекислый газ) + H2O = H2CO3 (угольная кислота, после реакции мгновенно распадается на углекислый газ и воду).
Оксиды кислот не вступают в реакцию друг с другом.
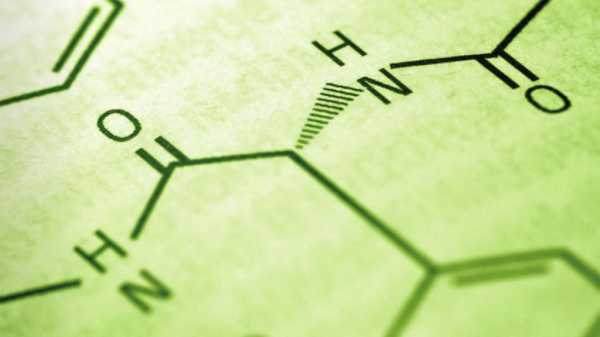
Видео по теме
Основные оксиды
Основный высший оксид – это солеобразующий окисел металла, которому соответствует основание. Окислу кальция (CaO) соответствует гидроксид кальция (Ca(OH)2). Эти вещества взаимодействуют с окислами кислотного и амфотерного характера, кислотами (за исключением H2SiO3, так как кремниевая кислота нерастворимая) и водой.
- С кислотными оксидами: CaO (оксид кальция) + CO2 (углекислый газ) = CaCO3 (карбонат кальция или обычный мел).
- С амфотерной окисью: CaO (оксид кальция) + Al2O3 (окись алюминия) = Ca(AlO2)2 (алюминат кальция).
- С кислотами: CaO (окисел кальция) + H
- С водой: CaO (оксид кальция) + H2O = Ca(OH)2 (гидроксид кальция или реакция гашения извести).
Не взаимодействуют между собой.

Амфотерные окиси
Амфотерный высший оксид – это окисел амфотерного металла. В зависимости от условий, он может проявить основные или кислотные свойства. Например, формулы высших оксидов, которые проявляют амфотерные свойства: ZnO (окисел цинка), Al2O3 (глинозем). Реагируют амфотерные окиси со щелочами, кислотами (так же за исключением кремниевой кислоты), основными и кислотными оксидами.
- С основаниями: ZnO (окисел цинка) + 2NaOH (основание натрия) = Na2ZnO2 (двойная соль цинка и натрия)+ H2O.
- С кислотами: Al2O3 (алюминия оксид) + 6HCl (соляная кислота) = 2AlCl 3 (хлорид алюминия или хлористый алюминий) + 3H2O.
- С кислотными оксидами: Al2O3 (окисел алюминия) + 3SO3 (окисел серы шестивалентный) = Al2(SO4)3 (алюминиевые квасцы).
- С окислами основного характера: Al2O3 (окисел алюминия) + Na2O (окись натрия) = 2NaAlO2 (алюминат натрия).
Элементы высших оксидов амфотерного характера не взаимодействуют между собой и с водой.
Источник: fb.rumonateka.com
Оксид
Оксид — бинарное соединение, в состав которой входит Кислород.
Кроме нормальных оксидов кислород может образовывать и другие бинарные соединения: сложные оксиды, двойные оксиды, высший оксид пероксиды и т.д..
Нормальными оксидами называются бинарные соединения элементов с кислородом, в молекулах которых все атомы кислорода обеими валентными связями напрямую соединены с атомами другого элемента, а атомы элемента, в свою очередь, всеми своими валентными связями напрямую соединены с атомами кислорода.
Высший оксид-это оксид, в котором элемент проявляет высшую степень окисления. Высшая степень окисления часто равна номеру группы или числу электронов на внешнем энергетическом уровне
Нормальные оксиды достаточно распространены. они образуют почти все химические элементы, кроме инертных элементов. Формулы нормальных оксидов всех элементов можно свести к следующим восьми общих формул: R 2 О, RO, R 2 О 3, RO 2, R 2 О 5, RO 3, R 2 О 7 и RO 4, где R — соответствующий элемент ( металл или неметалл).
1. Состав и названия
Если химический элемент проявляет постоянную валентность и с кислородом образует только один оксид, то его называют просто оксидом этого элемента. Например, K 2 O — оксид калия, CaO — оксид кальция, Аl 2 О 3 — оксид алюминия и т. д.
Если же элемент проявляет переменную валентность и образует по несколько оксидов, то в их названиях к слову оксид добавляются префиксы из греческих числительных, которые показывают количество атомов кислорода, приходящихся на один атом данного элемента. Например, Cu 2 O — гемиоксид (пивоксид) меди, а CuO — монооксид (однооксид) меди. Железо чаще всего бывает положительно двух-и трехвалентным и с кислородом образует: FeO — монооксид железа и Fe 2 O 3 — сесквиоксид (пивтораоксид) железа. Сера с кислородом образует SO 2 — диоксид (двуокись) серы и SO 3 — триоксид серы.
Азот образует несколько оксидов, в том числе N 2 O — оксид азота (I) известен как веселя газ, NO — монооксид азота, N 2 O 3 — сесквиоксид азота, NO 2 — диоксид азота и N 2 O 5 — гемипентаоксид (пивпьятиоксид) азота.
Хлор среди других оксидов образует Cl 2 O 7 — гемигептаоксид хлора, а осмий — OsO 4 тетраоксид осмия. Более четырех атомов кислорода, приходящихся на один атом элемента, в нормальных оксидов не бывает.
Также, оксиды с переменной валентностью элементов могут записываться с добавлением валентности элемента. Например, CO 2 — оксид углерода (IV) или Карбон (IV) оксид.
Кроме того, некоторые оксиды имеют еще и особые названия. Например, диоксид углерода CO 2 — называют углекислым газом, диоксид серы, SO 2 — сернистый газом, монооксид углерода СО — угарным газом и т.п.. Большинство оксидов неметаллов называют ангидридами соответствующих кислот. Например, триоксид серы SO 3 называют сульфатным ангидридом (ангидридом серной кислоты Н 2 SO 4), гемипентоксид фосфора P 2 O 5 — фосфатным ангидридом (ангидридом фосфорной кислоты Н 3 РО 4) и т. д.
2. Свойства
Оксиды металлов представляют собой кристаллические вещества. Оксиды неметаллов — это, наоборот, преимущественно летучие вещества и газы.
3. Основные оксиды
Основные оксиды — это оксиды, которым соответствуют основы. Основными оксидами являются, например, Na 2 O, CaO, MgO, K 2 O. Некоторые оксиды легко взаимодействуют с водой с образованием соответствующих оснований:
- CaO + H 2 O → Ca (OH) 2
- K 2 O + H 2 O → 2KOH.
Оксиды Fe 2 O 3, CuO, Ag 2 O с водой не взаимодействуют, однако они нейтрализуют кислоты и поэтому считаются основными.
- Fe 2 O 3 + 6HCl → 2FeCl 3 + 3H 2 O
- CuO + H 2 SO 4 → CuSO 4 + H 2 O
Характерной химической свойством основных оксидов является их взаимодействие с кислотами, при этом, как правило, образуются соль и вода
- FeO + 2HCl → FeCl 2 + H 2 O
При взаимодействии с кислотными и амфотерными оксидами образуют соли, а между собой не взаимодействуют. Например:
- СаО + СО 2 = СаСО 3
- Na 2 O + ZnO = Na 2 ZnO 2
Основные оксиды образуются только металлами с низкой валентностью (не выше 3 +). Большинство основных оксидов с водой непосредственно не взаимодействуют, за исключением оксидов щелочных и щелочно-земельных металлов, которые реагируют с водой. Всем основным оксидам соответствуют основания, то есть гидроксиды, которые проявляют свойства оснований.
4. Кислотные оксиды
Кислотных оксидов относят такие оксиды, которые взаимодействуют с основными и амфотерными оксидами, а также с их гидроксидами с образованием солей. Например:
- P 2 O 5 + 3СаО → Са 3 (РО 4) 2
- SO 3 + ZnO → ZnSO 4
- CO 2 + 2NaOH → Na 2 СО 3 + Н 2 О
Кислотные оксиды называют обычно ангидридами (обезвоженной кислотами), указывая тем самым, что их можно получить из кислот, отнимая от них элементы воды. Кислотные оксиды образуются неметаллами и некоторыми металлами, которые проявляют переменную валентность. Валентность металлов в кислотных оксидах бывает, от 4 + до 7 +. Например CrO 3 — хроматное ангидрид (валентность хрома 6 +), Mn 2 O 7 — ангидрид марганца (валентность марганца 7 +) и т. д.
Некоторые кислотные оксиды взаимодействуют с водой, образуя соответствующие гидроксиды, т.е. кислоты. Есть кислотные оксиды, которые не взаимодействуют с водой. Например, SiO 2 практически не растворим в воде, однако он нейтрализует основы, поэтому есть кислотным оксидом
- 2NaOH + SiO 2 → сплавления Na 2 SiO 3 + H 2 O
Гидроксиды, т.е. кислоты, тех кислотных оксидов, непосредственно с водой не взаимодействуют, получают посредственным путем.
5. Амфотерные оксиды
Амфотерными называют такие оксиды, которые взаимодействуют как с кислотами, так и с основами, образуя соль и воду. При взаимодействии с кислотами они ведут себя как основные оксиды, а при взаимодействии с основаниями — как кислотные.
- ZnO + H 2 SO 4 → ZnSO 4 + H 2 О
- ZnO + 2NaOH → Na 2 ZnO 2 + H 2 О
С водой амфотерные оксиды не взаимодействуют. Амфотерные оксиды образуются только металлами с валентностью от 2 + до 4 +. К амфотерных оксидов относятся ZnO, SnO, PbO, Al 2 O 3, SnO 2, PbO 2 и др..
Итак, неметаллы образуют только кислотные оксиды, а металлы могут образовывать основные, амфотерные и кислотные. Причем для металлов с переменной валентностью существует такая зависимость: при низком валентном состоянии металла (не выше 3 +) он образует основной оксид, при высоком валентном состоянии (от 4 + до 7 +) он образует кислотный оксид, а при промежуточном (обычно от 2 + до 4 +) он образует амфотерный оксид. Основные, кислотные и амфотерные оксиды называют еще солетвирнимы, потому что они при взаимодействии с кислотами или основаниями образуют соли.
6. Индифферентные (несолетвирни) оксиды
Индифферентными называют такие оксиды, которые не взаимодействуют ни с кислотами, ни с основами и солей не образуют. Поэтому их называют еще несолетвирнимы оксидами. Индифферентных оксидов немного. К ним относятся монооксид углерода — CO, гемиоксид азота — N 2 O, монооксид азота — NO и некоторые другие.
7. Получение
Оксиды можно получать различными способами.
- Непосредственным сообщением элементов с кислородом:
- 4Р + 5О 2 = 2Р 2 О 5
- Окислением различных соединений кислородом:
- СН 4 + 2О 2 = СО 2 + 2Н 2 О
- 2Н 2 S + 3О 2 = 2SO 2 + 2Н 2 О
- Расписанию гидроксидов при нагревании:
- Ca (OH) 2 = СаО + Н 2 О
- 2Fe (OH) 3 = Fe 2 О 3 + 3Н 2 О
- Расписанию солей кислородных кислот при нагревании:
- CaCO 3 = CaO + CO 2
- Cu 2 (OH) 2 СО 3 = CuO + СО 2 + Н 2 О
См.. также
Источники
- Ф. А. Деркач «Химия» Л. 1968
Примечания
- Химия: Пособие для поступающих в высшие анвчальних заведений / В. В. Сухан, Т. В. Табенская, А. И. Капустян, В. Ф. Горлач. — 3-э вид. — М.: Просвещение, 1996. — 448 с. ISBN 5-325-00832-3
nado.znate.ru
Общая характеристика оксидов — урок. Химия, 8–9 класс.
Оксидами называют сложные вещества, состоящие из двух химических элементов, одним из которых является кислород.
В оксидах химический элемент кислород находится в степени окисления \(–2\).
Оксиды — весьма распространённый в природе класс соединений. Они находятся в воздухе, распространены в гидросфере и литосфере.
Примеры оксидов:
h3O — оксид водорода, или вода.
На Земле вода встречается во всех трёх агрегатных состояниях — газообразном (водяной пар), жидком и твёрдом (лёд, снег). На долю воды также приходится большая часть массы живых организмов.
CO2 — оксид углерода(\(IV\)), двуокись углерода или углекислый газ.
Как вы уже знаете, углекислый газ нужен зелёным растениям для фотосинтеза. Оксид углерода(\(IV\)), находящийся в твёрдом агрегатном состоянии, называют сухим льдом.
CO — оксид углерода(\(II\)), угарный газ.
Примесь этого очень ядовитого вещества может содержаться в воздухе. Основным источником загрязнения является транспорт. Угарный газ образуется в результате неполного сгорания топлива. Этот же оксид образуется и во время пожаров.
Fe2O3 — оксид железа(\(III\)).
В природе этот оксид встречается в виде минерала гематита. Он составляет основу руды, называемой красным железняком.
SiO2 — оксид кремния.
В природе встречается в виде кварцевого песка, кварца, горного хрусталя.
Классификация оксидов
Оксиды принято группировать в зависимости от их способности реагировать с кислотами и основаниями. Различают три важнейшие группы оксидов: основные, кислотные и амфотерные. Их относят к солеобразующим оксидам. Существуют также оксиды, которые называют несолеобразующими.
- Основные оксиды.
Основными называют оксиды, которые реагируют с кислотами, образуя соль и воду.
Основные оксиды образуются химическими элементами — металлами. Как правило, степень окисления элемента, образующего основной оксид, является невысокой: \(+1\) или \(+2\).Примеры основных оксидов:
оксид натрия Na2O, оксид меди(\(II\)) CuO.
- Кислотные оксиды.
Кислотными называют оксиды, которые реагируют с основаниями, образуя соль и воду.
Кислотные оксиды образуют элементы — неметаллы. Например, оксид серы(\(VI\)) SO3, оксид азота(\(IV\)) NO2.
Также кислотные оксиды могут быть образованы металлическими химическими элементами, в которых те проявляют степень окисления от \(+5\) до \(+8\). Например, оксид хрома(\(VI\)) CrO3 и оксид марганца(\(VII\)) Mn2O7.
- Амфотерные оксиды.
Амфотерными называют оксиды, которые реагируют как с кислотами, так и с основаниями, образуя соли.
Амфотерные свойства проявляет оксид цинка ZnO, оксид алюминия Al2O3, оксид бериллия BeO.
Если металлический элемент имеет переменную валентность (проявляет несколько степеней окисления), то из всех образуемых им оксидов амфотерными свойствами обладают те, в которых этот элемент имеет промежуточную валентность (промежуточную степень окисления).
Например, хром может быть двухвалентен, трёхвалентен и шестивалентен.
Амфотерными свойствами обладает именно оксид хрома (\(III\)) Cr2O3.
- Несолеобразующие оксиды.
Несолеобразующими называют оксиды, которые при обычных условиях не взаимодействуют ни с кислотами, ни с основаниями.
Примеры несолеобразующих оксидов: оксид углерода(\(II\)), или угарный газ CO, оксид азота(\(I\)), или веселящий газ N2O, и оксид азота(\(II\)) NO.
Номенклатура оксидов
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже.
Например: Na2O — оксид натрия, Al2O3 — оксид алюминия.Если элемент, образующий оксид, имеет переменную степень окисления (или валентность), то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, или моноокисью, если два — диоксидом, или двуокисью, если три — то триоксидом, или трёхокисью и т. д.
Например: монооксид углерода CO, диоксид углерода CO2, триоксид серы SO3.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например, угарный газ CO, серный ангидрид SO3 и т. д.
www.yaklass.ru
Высший оксид — Большая Энциклопедия Нефти и Газа, статья, страница 1
Высший оксид
Cтраница 1Высшие оксиды имеют кислый характер, низшие — основной. Существование ReCu и RejOj окончательно не установлено. [1]
Высший оксид V2Os — обладает ясно выраженным кислотным характером, диоксид VO2 амфотерен; оба низших оксида проявляют только основные свойства. Наибольшее значение имеют VzOs и его производные. [2]
Высший оксид V2Os — обладает ясно выраженным кислотным характером, диоксид VO2 амфотерен; оба низших оксида проявляют только основные свойства. Наибольшее значение имеют V2Os и его производные. [3]
Высший оксид V2O5 обладает ясно выраженным кислотным характером, диоксид VU2 амфотерен; оба низших оксида проявляют только основные свойства. Наибольшее значение имеют V2Os и его производные. [4]
Высший оксид
Высший оксид V2O5 — обладает ясно выраженным кислотным характером, диоксид VO2 амфотерен; оба низших оксида проявляют только основные свойства. Наибольшее значение имеют X Os и его производные. [6]
Высшие оксиды получаются обычно при непосредственном взаимодействии металлов с кислородом, низшие же ( преимущественно ванадия) при взаимодействии высших с соответствующими металлами. [7]
Высшие оксиды всех трех элементов имеют формулы ЭОз, отвечающие им кислоты — Н ЭСи. Растворимость, окислительное действие п сила кислот уменьшаются с ростом порядкового номера элемента. Молибден образует с фтором гексафторид MoF6, вольфрам — WF6, а также WCle и УВге. Связи в этих галогепидах ковалептные; они летучи и гидролизуются в воде. Молибден и вольфрам образуют пентагалогениды МоСЬ, VC15 и др. Хром реагирует со всеми галогенами, но не образует гексага-логенидов. [8]
Высший оксид — Bi2O5 — еще менее устойчив, чем РЬО2, и в чистом виде не существует. [9]
Высший оксид Мп207 — это маслянистая темно-зеленая жидкость, которая легко разлагается со взрывом с выделением кислорода и образованием низших оксидов. [10]
Высший оксид обладает кислотными свойствами. [11]
Высший оксид ниобия Nb2O5 — белый порошок, нерастворимый в кислотах. [12]
Высшие оксиды рутения и осмия различаются между собой по своей устойчивости. Тетраоксид же рутения при нагревании быстро разлагается по уравнению: RuO, RuO2 O2, а при его соприкосновении со спиртом происходит взрыв. [13]
Высшие оксиды рения ( ReO3 и Re2O7) — кислотные, диоксид рения ReO2 — амфотерное соединение, a Re2O и ReO — основные оксиды. [14]
Высшие оксиды рения ( ReO3 и Re2O7) — кислотные, диоксид рения ReO2 — амфотерное соединение, a Re2O н ReO — основные оксиды. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Химия металлов :: Основы химии металлов :: Обзор свойств соединений металлов
Для оксидов, помимо кислотно-основных взаимодействий, т. е. реакций между основными оксидами и кислотами и кислотными оксидами, а также реакций кислотных и амфотерных оксидов со щелочами, характерны также окислительно-восстановительные реакции.Поскольку в любых оксидах металл находится в окисленном состоянии, все оксиды без исключения способны проявлять окислительные свойства. Если металл образует несколько оксидов, то оксиды металла в более низкой степени окисления могут окисляться, т. е. проявлять восстановительные свойства.
Особенно сильные восстановительные свойства проявляют оксиды металлов в низких и неустойчивых степенях окисления, как например. TiO, VO, CrO. При растворении их в воде они окисляются, восстанавливая воду. Их реакции с водой, подобна реакциям металла с водой.
2TiO + 2H2O = 2TiOOH + H2.
Окислительно-восстановительные взаимодействия между оксидами металлов и разными восстановителями, приводящие к получению металла, — это самые распространенные реакции в пирометаллургии.
2Fe2O3 + 3C = 4Fe + 3CO2
Fe3O4 + 2C = 3Fe + 2CO2
MnO2 +2C = Mn + 2CO
SnO2 + C = Sn + 2CO2
ZnO + C = Zn + CO
Cr2O3 + 2Al = 2Cr + Al2O3
WO3 + 3H2 = W + 3H2O
Сильные окислительные свойства некоторых оксидов используются на практике. Например,
окислительные свойства оксида PbO2 используют в свинцовых аккумуляторах, в которых за счет химической реакции между PbO2 и металлическим свинцом получают электрический ток.
PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O
Окислительные свойства MnO2 также используют для получения электрического тока в гальванических элементах (электрических батарейках).
2MnO2 + Zn + 4NH4Cl = [Zn(NH3)4] Cl2 + 2MnOOH + 2HCl
Сильные окислительные свойства некоторых оксидов приводят к их своеобразному взаимодействию с кислотами. Так оксиды PbO2 и MnO2 при растворении в концентрированной соляной кислоте восстанавливаются.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
Если металл имеет несколько степеней окисления, то при достаточном повышении температуры становится возможным разложение оксида с выделением кислорода.
3PbO2 = Pb3O4 + O2, 2Pb3O4 = O2 + 6PbO
Некоторые оксиды, особенно оксиды благородных металлов, могут при нагревании разлагаться с образованием металла.
2Ag2O = 4Ag + O2 2Au2O3 = 4Au + 3O2.
media.ls.urfu.ru
Оксиды. Классификация оксидов. Названия оксидов
Оксиды — это сложные неорганические соединения, состоящие из двух элементов, один из которых кислород (в степени окисления -2).
Например, Na2O, B2O3, Cl2O7 относятся к оксидам. Все перечисленные вещества содержат кислород и еще один элемент. Вещества Na2O2, H2SO4, HCl не относятся к оксидам: в первом степень окисления кислорода равна -1, в составе второго не два, а три элемента, а третье вообще не содержит кислорода.
Если вы не понимаете смысл термина «степень окисления», ничего страшного. Во-первых, можно обратиться к соответствующей статье на этом сайте. Во-вторых, даже без понимания этого термина можно продолжать чтение. Временно можете забыть про упоминание о степени окисления.
Получены оксиды практически всех известных на сегодняшний день элементов, кроме некоторых благородных газов и «экзотических» трансурановых элементов. Более того, многие элементы образуют несколько оксидов (для азота, например, их известно шесть).
Номенклатура оксидов
Мы должны научиться называть оксиды. Это очень просто.Пример 1. Назовите следующие соединения: Li2O, Al2O3, N2O5, N2O3.
Li2O — оксид лития,
Al2O3 — оксид алюминия,
N2O5 — оксид азота (V),
N2O3 — оксид азота (III).
Обратите внимание на важный момент: если валентность элемента постоянна, мы НЕ упоминаем ее в названии оксида. Если валентность меняется, следует обязательно указать ее в скобках! Литий и алюминий имеют постоянную валентность, у азота валентность переменная; именно по этой причине названия окислов азота дополнены римскими цифрами, символизирующими валентность.
Задание 1. Назовите оксиды: Na2O, P2O3, BaO, V2O5, Fe2O3, GeO2, Rb2O. Не забывайте, что существуют элементы как с постоянной, так и с переменной валентностью.
Еще один важный момент: вещество F2O правильнее называть не «оксид фтора», а «фторид кислорода»!
Физические свойства оксидов
Физические свойства весьма разнообразны. Обусловлено это, в частности, тем, что в оксидах могут проявляться разные типы химической связи. Температуры плавления и кипения варьируются в широких пределах. При нормальных условиях оксиды могут находиться в твердом состоянии (CaO, Fe2O3, SiO2, B2O3), жидком состоянии (N2O3, H2O), в виде газов (N2O, SO2, NO, CO).
Разнообразна окраска: MgO и Na2O белого цвета, CuO — черного, N2O3 — синего, CrO3 — красного и т. д.
Расплавы оксидов с ионным типом связи хорошо проводят электрический ток, ковалентные оксиды, как правило, имеют низкую электропроводность.
Классификация оксидов
Все существующие в природе оксиды можно разделить на 4 класса: основные, кислотные, амфотерные и несолеобразующие. Иногда первые три класса объединяют в группу солеобразующих оксидов, но для нас это сейчас несущественно. Химические свойства оксидов из разных классов отличаются весьма сильно, поэтому вопрос классификации очень важен для дальнейшего изучения этой темы!
Начнем с несолеобразующих оксидов. Их нужно запомнить: NO, SiO, CO, N2O. Просто выучите эти четыре формулы!
Для дальнейшего продвижения мы должны вспомнить, что в природе существуют два типа простых веществ — металлы и неметаллы (иногда выделяют еще группу полуметаллов или металлоидов). Если вы четко понимаете, какие элементы относятся к металлам, продолжайте читать эту статью. Если есть малейшие сомнения, обратитесь к материалу «Металлы и неметаллы» на этом сайте.
Итак, сообщаю вам, что все амфотерные оксиды являются оксидами металлов, но не все оксиды металлов относятся к амфотерным. Я перечислю наиболее важные из них: BeO, ZnO, Al2O3, Cr2O3, SnO. Список не является полным, но перечисленные формулы следует обязательно запомнить! В большинстве амфотерных оксидов металл проявляет степень окисления +2 или +3 (но есть исключения).
В следующей части статьи мы продолжим говорить о классификации; обсудим кислотные и основные оксиды.
Продолжение статьи →
www.repetitor2000.ru
