Урок биологии по теме «Функции белков». 10-й класс
Цель урока: используя знания о строении и свойствах белков расширить представления о функциях белков через творческую и исследовательскую деятельность (Приложение 1. Слайд №2).
Задачи (Слайд №3)
Образовательные:
Расширить знания о белках как природных полимерах, о многообразии их функций во взаимосвязи со строением и свойствами.
Развивающие:
1. Развивать мышление учащихся и умение
устанавливать причинно-следственные связи на
примере изучения свойств и функций белка.
2. Развивать практические умения постановки
цитологических опытов при установлении роли
белков ферментов.
3. Развивать умение делать выводы на основе
практических работ, развивать умение
самостоятельно получать информацию из
дополнительных информационных источников
(информационная компетентность).
4. Развивать умение структурировать материал.
5. Формировать способность анализировать свою деятельность.
Воспитательные:
1. Воспитывать умение работать в группе
2. Воспитывать аккуратность учащихся при
выполнении и оформлении практических работ и
записей в тетради.
Тип урока: комбинированный с использованием исследовательской деятельности.
Технологии: тестовая, ИКТ, проблемного обучения.
Методы: частично-поисковый, словесный, наглядный, исследовательский.
Оборудование: презентация «Функции белков», компьютер с мультимедийным проектором, лабораторное оборудование к исследованию по теме «Ферментативная функция белка»: чашки петри, пероксид водорода, пипетка, кусочки вареного и сырого мяса, вареного и сырого картофеля, речной песок.
Методическое обеспечение:
- Раздаточный материал – текст «Белки» (Приложение 2),
инструктивная карточка к лабораторной работе
«Ферментативная функция белков» (Приложение
3), задание на установление
соответствия между белками и их функциями (Приложение 4).
 Презентация Microsoft PowerPoint «Функции белков» (Приложение 1) – (POWER
POINT).
Презентация Microsoft PowerPoint «Функции белков» (Приложение 1) – (POWER
POINT). - Актуальность использования средств ИКТ
- Возможность представления в мультимедийной форме уникальных информационных материалов (Приложение 5).
ХОД УРОКА
1. Организационное начало урока (приветствие, проверка готовности к работе, психологический настрой на урок) (Слайд № 4).
Притча
“Жил мудрец, который знал все. Один человек
захотел доказать, что мудрец знает не все. Зажав в
ладонях бабочку, он спросил: “Скажи, мудрец,
какая бабочка у меня в руках: мертвая или живая?”
А сам думает: “Скажет живая – я ее умерщвлю,
скажет мертвая – выпущу”. Мудрец, подумав,
ответил: “Все в твоих руках”.
В наших руках сегодня создать такую атмосферу на
уроке, при которой все будут чувствовать себя
комфортно.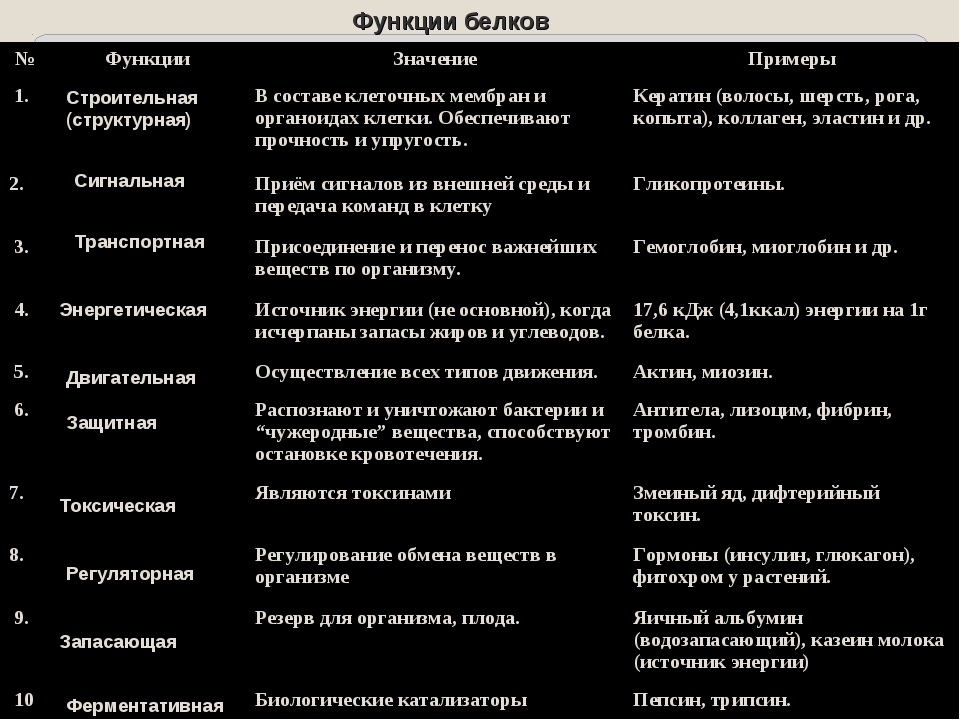
Эпиграфом нашего урока будут слова А. Эйнштейна
«Радость видеть и понимать есть величайший дар
природы» (Слайд №5).
2. Мотивация
Задание: сделайте анализ круговой диаграммы (Слайд №6) и ответьте на вопросы:
1) Каков химический состав клетки?
2) Каких веществ органической природы в клетке
больше?
3) О чем свидетельствует сходство химического
состава клеток?
«Жизнь – это способ существования белковых
тел» (Ф. Энгельс) (Слайд №7).
Ни одно вещество химики не изучали так долго, как
белок прежде, чем удалось разгадать их
строение. От первых шагов на пути познания
состава белка до расшифровки структуры прошло
более двухсот лет.
Любой биологический объект, начиная от вирусов и
заканчивая человеком, состоит в основном из
белков (в пересчете на сухое вещество),
поэтому очень важно знать строение, свойства и
функции этих соединений.
3. Личностная значимость изучаемого материала
В сутки человек должен обязательно употреблять
100 г белка, иначе разовьется белковое голодание.
В 70-х годах отмечались смертельные случаи у людей, длительное время соблюдающих низкокалорийные диеты с выраженным недостатком белка. Происходило это из-за серьезных нарушений в деятельности сердечной мышцы. Дефицит белка уменьшает устойчивость организма к инфекциям. Кроме того, белковая недостаточность часто сопровождается авитаминозом В12, А, Д, К и так далее, что также влияет на состояние здоровья.
Вопрос к учащимся: «Какой личностный смысл для каждого из Вас имеют эти факты?»
4. Целеполагание
Задание: Установите соответствие между белками и их функциями (Приложение 4, Слайд №9).
Белки: Функции
А. Кератин 1. Строительная
Б. Гемоглобин 2. Запасающая
В. Актин 3. Защитная
Г. Антитела 4. Двигательная
Д. Миозин 5. Транспортная
Е. Фибриноген 6. Ферментативная
Ж. Коллаген 7.Регуляторная
З. Альбумин
И. Каталаза
К. Пепсин
Л. Инсулин
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
Почему Вы не можете выполнить данное задание? (ответ: не хватает знаний)
Постановка проблемного вопроса.
В состав клетки входят белки, жиры, углеводы, нуклеиновые кислоты, вода, минеральные вещества, но ни одно из веществ не выполняет столь специфичных функций, как белки.Учащиеся ставят цели и задачи работы на данном уроке.
5. Актуализация знаний
Задания:
1. Работа со слайдами № 10-15 и беседа по вопросам:
1) Что такое полимеры?
2) Используя схему, ответьте доказательно, к каким
полимерам относятся белки?
3) Строение мономера белка.
4) Характеристика структурной организации белка.
2. Работа с текстом «Белки» (Слайд №16).
Вставьте в текст пропущенные термины и слова.
1) В состав белка входят следующие
элементы___,___,____,___,____. 2) Белки –
_______________,___________________ полимеры,
 ________________. 5) В состав
всех мономеров белка входят___________,________________, а
отличаются_______________. 6) Денатурация – процесс
изменения нативной структуры белка.
________________. 5) В состав
всех мономеров белка входят___________,________________, а
отличаются_______________. 6) Денатурация – процесс
изменения нативной структуры белка.6. Изучение нового материала
Свойства и функции белка определяются его
структурой, строением и многообразием, поэтому
даже малые его дефекты структуры имеют серьезные
последствия.
Наследственное заболевание
серповидно-клеточная анемия связано с тем, что
при синтезе гемоглобина, состоящего
приблизительно из 600 аминокислотных остатков,
два из них меняются на другие. Это приводит к
нарушению функции гемоглобина: эритроциты
больных приобретают серповидную форму и
утрачивают способность к нормальному переносу
кислорода (Слайд №17).
Работа со слайдом № 18
Результатом данной работы будет таблица,
которую по ходу работы будем заполнять.
Функции белков
Функция |
Сущность |
Пример |
| Структурная | Образование мембраны клеток и органоидов и др. структур | Коллаген, кератин |
| Регуляторная | Регулирование обмена веществ в организме | Некоторые гормоны – инсулин, глюкагон |
| Защитная | 1. При попадании в организм чужеродных
белков и микроорганизмов в лейкоцитах
образуются защитные белки. 2. Защита от потери крови при ранении в результате свертывания |
Антитела Фибриноген |
| Транспортная | Присоединение и перенос химических элементов по организму | Гемоглобин |
| Сократительная | Осуществление всех типов движения | Актин, миозин |
| Запасающая | Резерв для организма, плода | Яичный альбумин, казеин молока. |
| Токсическая | Змеиный яд, дифтерийный токсин | |
| Энергетическая | Не основной, но источник энергии в клетке | Расщепление 1 г белка – 17 кДж |
| Сигнальная | Узнавание молекул мембраной клетки | Гликопротеины |
| Ферментативная или каталитическая | Каталитическое ускорение биохимических реакций в клетке | Белки-ферменты (каталаза, пепсин, трипсин) |
Давайте вспомним: «О чем в ядре клетки хранится
наследственная информация» (представить
логическую цепь: признак – вещество – реакция –
белок – фермент). Павлов назвал ферменты
«возбудителями жизни и первым актом жизненной
деятельности».
Среди многочисленных функций белков особое
место занимает ферментативная.
Наука о ферментах называется энзимологией, а
ферменты – энзимами.
Выражение И.П. Павлова «Не все белки –
ферменты, но все ферменты белки» подчеркивают их
химическую организацию.
Далее учитель объясняет строение и механизм
действия фермента.
Чем же объясняется ускоряющее действие ферментов?
(Слайд 19) Каждый фермент имеет активный центр – определенная группа аминокислотных остатков. В активном центре происходит соединение фермента с субстратом (вещество, которое подлежит превращению) Форма активного центра и субстрата подходят друг другу как ключ к замку.
Процесс действия ферментов можно разделить на три стадии:
- Фермент распознает субстрат и связывается с ним.
- Образуется активный комплекс, состоящий из
фермента и субстрата.

- Отделение продукта в результате ферментативной реакции.
Свойства ферментов (анализ графиков) (Слайды 20-23)
Далее учащимся предлагается выполнить исследование.
Исследовательское задание (Работа по группам):
Лабораторная работа «Ферментативное расщепление пероксида водорода в тканях организма» (Приложение 3)
Цель: сформировать знания о роли ферментов в клетках, закрепить умения проводить опыты и объяснять результаты работы.
Оборудование: свежий 3%-ный раствор пероксида водорода, штатив с пробирками, ткани растений (кусочки сырого и варёного картофеля) и животных (кусочки сырого и варёного мяса), пипетки, песок.
Ход работы:
1. Приготовьте четыре пробирки и поместите в
первую пробирку — кусочек сырого картофеля, во
вторую — кусочек варёного картофеля, в третью —
кусочек сырого мяса, в четвёртую — кусочек
варёного мяса. Капните в каждую из пробирок
немного пероксида водорода. Пронаблюдайте, что
будет происходить в каждой из пробирок.
Капните в каждую из пробирок
немного пероксида водорода. Пронаблюдайте, что
будет происходить в каждой из пробирок.
2. Составьте таблицу, показывающую активность каждой ткани.
«Результаты исследования»
| № пробирки | Содержимое | Что делаю? | Что наблюдаю? |
| № 1 | |||
| № 2 | |||
| № 3 | |||
| № 4 |
Ответьте на вопросы (устно):
— В каких пробирках проявилась активность
фермента? Объясните почему?
— Как проявляется активность фермента в живых и
мёртвых тканях? Объясните наблюдаемое явление.
— Различается ли активность фермента в живых
тканях растений и животных?
— Как вы считаете, все ли живые организмы
содержат фермент каталазу, обеспечивающую
разложение пероксида водорода?
— Ответ обоснуйте.
— Сделайте вывод.
Группы учащихся отчитываются о выполнении
задания.
7. Рефлексия. Учащиеся выполняют задание, делают вывод (Слайд № 24).
8. Домашнее задание (Слайд № 25):
1. Задание для всех: глава 3.2.1., таблица «Функции
белков»,
2. Задание для проявляющих интерес к предмету:
найти классификацию ферментов в Интернете.
Интернет-ресурсы:
www.biology.asvu.ru — все о
биологии.
www.biodev.ru — все о биологии.
10 класс Функции белков
КОНСПЕКТ УРОКА НА ТЕМУ
«ФУНКЦИИ БЕЛКОВ. СВОЙСТВА ФЕРМЕНТОВ».
Лабораторная работа «Изучение свойств ферментов»
ЦЕЛЬ: дать представление об основных функциях белков – ферментативной;
рассказать о ферментах, их основных свойствах (денатурация, ренатурация, деструкция) и принципе действия ферментов.
ТЕРМИНЫ: каталаза, уреаза, кофермент (активный центр), фермент – субстратный комплекс.
ОБОРУДОВАНИЕ: таблицы, схемы, рисунки, перекись водорода, пробирки, штативы, термо-метр, часы, стеклянная палочка, варенное мясо картофель, сырое мясо и картофель, горсть проросшего гороха, теплая вода (t 40 ) на бане.
КОНЦЕПЦИЯ УРОКА: Изучение свойств белков и функций ферментов, опираясь на знания о третичной структуре белков, показать принцип действия ферментов; наличие у них активного центра, способности образовывать фермент – субстратный комплекс и снижать энергию начала реакции,.
Исходя из этого, вывести другие свойства ферментов. Подвести итог, что ферменты – биологические катализаторы, ускоряющие реакции в десятки раз. На лабораторной работе показать учащимся свойства ферментов.
СТРУКТУРА УРОКА.
1. Организационный момент …………………………………………… 2 мин.
2. Актуализация опорных знаний………………………………………. 7 мин
7 мин
3. Изучение нового материала………………………………………….. 15 мин
4. Выполнение лабораторной работы …………………………………. 10мин
5. Закрепление…………………………………………………………… 7 мин
6.Домашнее задание …………………………………………………….. 2мин
7.Итог урока Формулировка выводов …………………………. 2мин
СОДЕРЖАНИЕ И ХОД УРОКА.
Актуализация опорных знаний.
Устно.
Дайте определение белкам как непериодическим полимерам. Белки – важнейшая часть ЖО.
У доски.
Записать строение структурной единицы белков – аминокислоты, отношение их к воде, доказать их амфотерные свойства.
Записать пептидную связь, объяснить механизм ее образования.
Записать классификацию радикалов аминокислот белков.
Работа с тетрадью.
Тестирование по теме «Белки». Обменятся тетрадями, проставить оценки. Вводное
Обменятся тетрадями и подвести итог тестированию: 14 – 12; 13 – 11; 12 -10; 10, 11 -9; 9,8 -8, 7-7.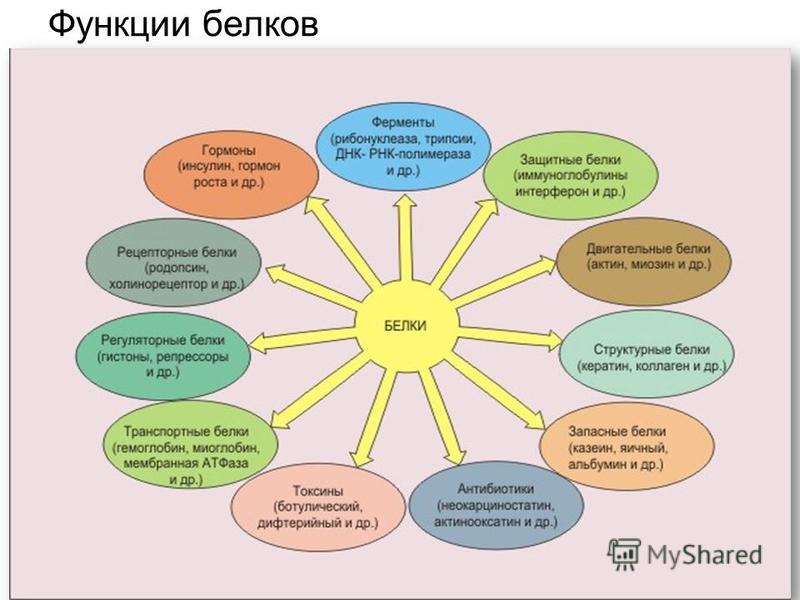 6-6 и т.д. Выставить оценки в журнал по домашнему заданию.(на перерыве)
6-6 и т.д. Выставить оценки в журнал по домашнему заданию.(на перерыве)
Ответы:В1:1б; 2г; 3б;4б,в; 5б,в,г; 6а,б,в,г; 7а; 8б; 9в; 10г,з,и,к,л,м,о,с;
Ответы.В2;1в; 2б; 3а; 4б,в; 5б,в,г; 6б; 7б; 8б; 9в; 10г,з,и,к,л,м,о,с;
ТЕСТ 1. Тема: «БЕЛКИ». В I
Белки полимеры: а) периодичные; б) не периодичные.
Молекула белков образует структур: а) 1; б) 2; в) 3; г) 4; д) 5; е) 6; ж) 7; з) 8.
Первичная структура белка образована типами химических связей: а) ионными;
б) ковалентными; в) водородными; г) гидрофобными.
Вторичная структура белка образована типами химических связей: а) ионными;
б) ковалентными; в) водородными; г) гидрофобными.
Третичная структура белка образована типами химических связей: а) ионными;
б) ковалентными; в) водородными; г) гидрофобными.
Четвертичная структура белка образована типами химических связей: а) ионными;
б) ковалентными; в) водородными; г) гидрофобными.
7. Первичная структура белка имеет вид: а) нити; б) спирали; в) глобулы.
8. Вторичная структура белка имеет вид: а) нити; б) спирали; в) глобулы.
9. Третичная структура белка имеет вид: а) нити; б) спирали; в) глобулы.
10. К незаменимым аминокислотам относятся: а) лизин; б) аланин; в) тирозин; г) триптофан; д) фенилаланин; е) серин; ж) пролин; з) лейцин; и) изолейцин; к) валин; л) метионин; м) треонин; н) гистидин; о) глицин; п) цистеин; р) аргинин.
ТЕСТ 1. Тема: «БЕЛКИ». В II
Белки состоят из мономеров: а) глюкозы; б) нуклеотидов; в) аминокислот.
Сколько аминокислот участвуют в синтезе белка: а) 23; б)20; в) 100?
Какая частью аминокислоты отличается друг от друга: а) радикалом; б) аминогруппой;
в) карбоксильной группой.
Вторичная структура белка образована типами химических связей: а) ионными;
б) ковалентными; в) водородными; г) гидрофобными.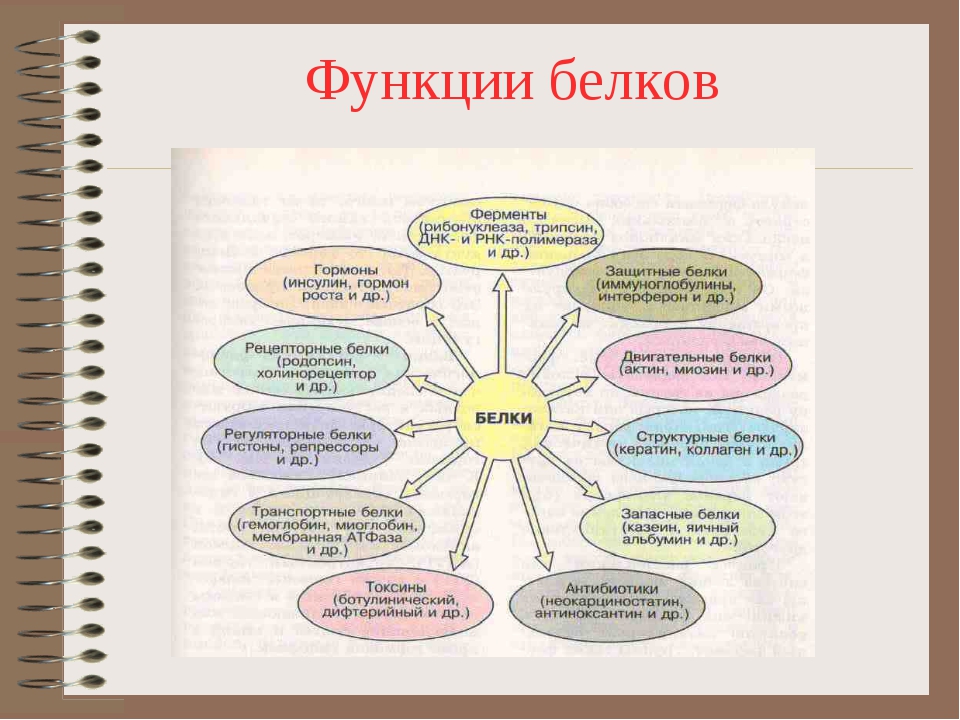
Третичная структура белка образована типами химических связей: а) ионными;
б) ковалентными; в) водородными; г) гидрофобными.
Первичная структура белка образована типами химических связей: а) ионными;
б) пептидными; в) водородными; г) гидрофобными; д) ковалентными полярными.
7. Посредством какой химической связи соединены между собой аминокислоты первичной структуры: а) дисульфидной; б)пептидныой; в) водородной.
8. Вторичная структура белка имеет вид: а) нити; б) спирали; в) глобулы.
9. Третичная структура белка имеет вид: а) нити; б) спирали; в) глобулы.
10. К незаменимым аминокислотам относятся: а) лизин; б) аланин; в) тирозин; г) триптофан; д) фенилаланин; е) серин; ж) пролин; з) лейцин; и) изолейцин; к) валин; л) метионин; м) треонин; н) гистидин; о) глицин; п) цистеин; р) аргинин; с) лизин.
.
Актуализация опорных знаний и мотивация учебной деятельности
Что вы знаете о химических реакциях, которые протекают в живых организмах? Чем они отличаются от реакций, протекающих в неживой природе?
Что вы знаете о катализаторах, каковы их свойства? Какие условия необходимы для действия тех или иных катализаторов?
Известно, что молекула перекиси водорода расщепляется под действием каталазы на воду и молекулярный кислород.
 Как вы думаете, сколько молекул перекиси водорода может расщепить одна молекула каталазы за одну секунду?
Как вы думаете, сколько молекул перекиси водорода может расщепить одна молекула каталазы за одну секунду?
Ответ 1: Реакции в живых организмах протекают быстрее в 1000 –чи раз.
Они отличаются не только скоростью, но и условиями их протекания, т.к. протекают при низких температурах, как в кислой так и в щелочной среде и др.
Ответ 2: Катализаторы – это вещества, определяющие скорость химических реакций. В разных условиях они ускоряют или замедляют скорость химических реакций.
Ответ 3: Каталаза – один из наиболее быстро работающих ферментов: при 0 градусов по Цельсию одна молекула каталазы разлагает за 1 сек до 40 000 молекул перекиси водорода!
Что вы знаете о ферментах (биологических катализаторах)? Как бы без них протекали реакции и к чему бы это привело?
НОВЫЙ МАТЕРИАЛ.
ФЕРМЕНТЫ – это биологические катализаторы, способные ускорять химические реакции
в клетке в десятки тысяч раз. Изучает ферменты наука энзимология.
Изучает ферменты наука энзимология.
ОСНОВНЫЕ СВОЙСТВА ФЕРМЕНТОВ,
ВСЕ ФЕРМЕНТЫ – глобулярные белки.
ФЕРМЕНТЫ увеличивают скорость реакций, но сами в этой реакции не расходуются.
ФЕРМЕНТЫ высоко специфичны: один фермент может катализировать только одну реакцию.
ФЕРМЕНТ всегда больше субстрата, с которыми он взаимодействует.
ФЕРМЕНТ в малом количестве вызывает превращения большого количества субстрата.
ФЕРМЕНТ своим присутствием не влияет ни на свойства, ни на природу конечного продукта.
ФЕРМЕНТ взаимодействует из субстратом с помощью АЦ (К — 10 — 20 аминокислот) специфического участка, который по форме соответствует субстрату.
Катализируемая им реакция обратима.
Активность ферментов зависит от t, рН среды, температуры, давления и от концентрации как субстрата так и самого фермента.
Фермент – субстратный комплекс способен снижать энергию начала реакции, это и позволяет ферменту ускорить протекание реакции.
СТРОЕННИЕ ФЕРМЕНТА.
АПОФЕМЕНТ – БЕКОВАЯ ЧАСТЬ ФЕРМЕНТА;
Орг — е в — ва: белки или близкие к витаминам в – ва (гормоны)
КОФЕРМЕНТ — небелковая часть фермента,
Активная часть фермента.
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТА.
«КЛЮЧА И ЗАМКА» «РУКИ И ПЕРЧАТКИ»
1890 г. Фишер
СУБСТРАТ ФЕРМЕНТ СУБСТРАТ ФЕРМЕНТ
Главная часть замка – активный центр. Форма субстрата соответствует активному центру.
Фермент – субстратный комплекс существует короткое время. Образовавшиеся продукты реакции поступают в окружающую среду. Комплекс распался и готов принимать новый субстрат. Активный центр не жестко подходит к субстрату как «рука в перчатку».
Каталаза — м = 250 000; Перекись водорода – м = 34.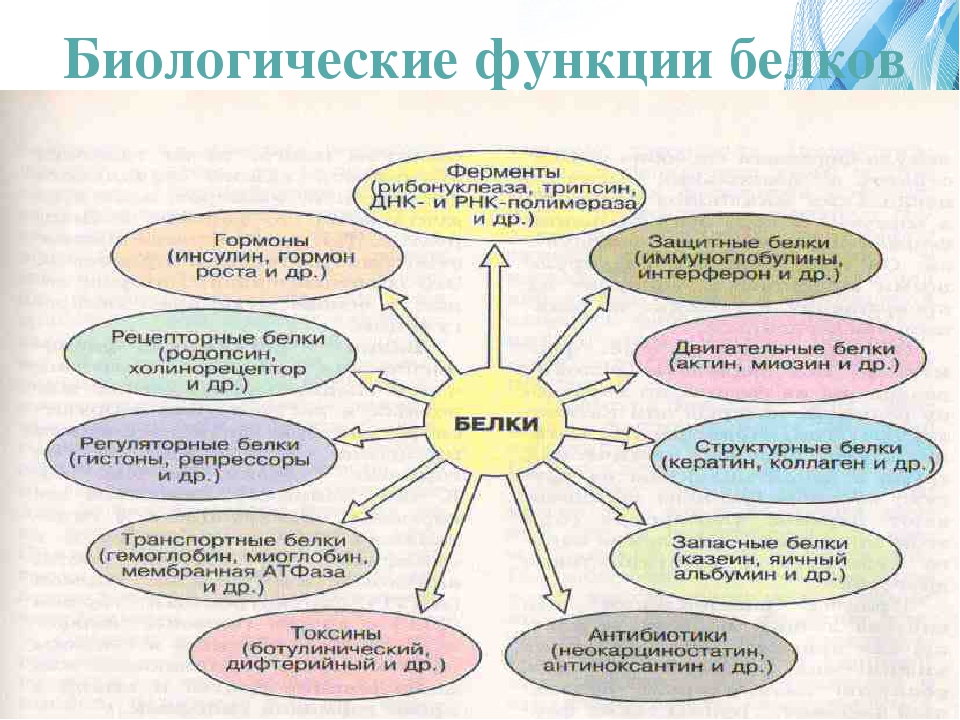
ЭТАПЫ ДЕЙСТВИЯ ФЕРМЕНТА.
Приближение субстрата к активному центру;
Вхождение С (субстрата) в активный центр;
Перестройка субстрата в продукт реакции;
Выход продукта реакции из активного центра.
СВОЙСТВА БЕЛКОВ.
ДЕНАТУРАЦИЯ РЕНАТУРАЦИЯ ДЕСТРУКЦИЯ
Нарушение высших уровней организации белковой молекулы (вторичной, третичной, четвертичной структур белка из сохранением первичной структуры).
ПРИЧИНЫ.
1)температура; 2) давление; 3) рН среды – кислая или щелочная; 4) ультразвук; 5) вещества.
ЖИВОЙ __________________ РАЗВЕРНУТЫЙ ________________ РЕНАТУРАЦИЯ
БЕЛОК денатурация (t, р, рН) БЕЛОК если не нарушена I стр – ра белка
КАТАЛАЗА УТРАТИЛА СВОЙСТВА ВОССТАНОВИЛА СВОЙСВА
Лабораторная работа
ТЕМА. Свойства белков. Определение свойств ферментов.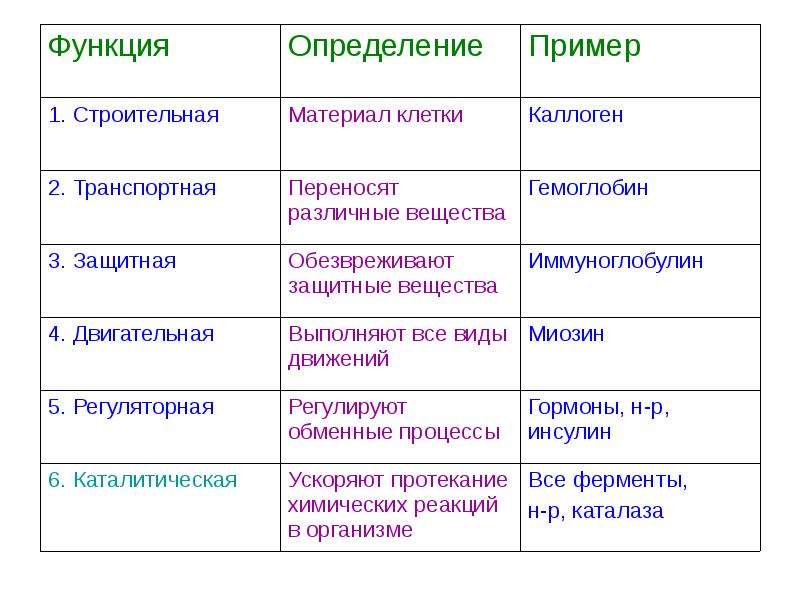
ЦЕЛЬ: выявить каталитическую активность ферментов в живых тканях.
Оборудование: перекись водорода, сырой и вареный картофель, сырое и вареное мясо, про бирки, штативы, стеклянные палочки, проросшие семена гороха, термометр.
ХОД РАБОТЫ.
В приготовленные пробирки добавьте несколько капель перекиси водорода. Наблюдаемое запишите в таблицу:
Исследуемыйобъект
Действие перекиси водорода
Наблюдения
1.
Сырой
картофель
Каталаза + перекись водорода
Вскипание в пробирке;Ф ката-лаза расщепляет яд до про-стых в-в: воды и кислорода
2.
Вареный
картофель
Деструкция Ф каталазы + перек. водород
Кипячение
Реакции не протекают, т.к. нарушена нативная структура белка – фермента при кипячен.
3.
Сырое
Мясо
Каталаза + перекись водорода
Вскипание в пробирке;Ф ката-лаза расщепляет яд до про-стых в-в: воды и кислорода
4.
Вареное
мясо
Деструкция Ф каталазы + перек. водород
Кипячение
Реакции не протекают, т.к. нарушена нативная структура белка – фермента при кипячен.
5.
Сырое семя
гороха
Каталаза + перекись водорода
Вскипание в пробирке;Ф ката-лаза расщепляет яд до про-стых в-в: воды и кислорода
6.
Вареное семя
гороха
Деструкция Ф каталазы + перек. водород
кипячение
Реакции не протекают, т.к. нарушена нативная структура белка – фермента при кипячен.
ВЫВОД. Денатурированный белок не взаимодействуют с перекисью водорода с выделением конечных продуктов воды и кислорода, а белок – фермент каталаза в живых клетках за доли секунды разрушает яд, перекись водорода, до простых веществ.
II часть. НОВЫЙ МАТЕРИАЛ.
БИОЛОГИЧЕСКАЯ РОЛЬ БЕЛКОВ. ФУНКЦИИ ФЕРМЕНТОВ.
№
П/п
Группы
белков
ВИДЫ
ФУНКЦИИ
ПРИМЕРЫ
1.
Структурные
кератин
коллаген
строительная
опорная
Входит в состав волос, ногтей, копыт, рогов
Компонент сухожилий, связок, и хрящей
2.
Гормоны
инсулин
вазопрессин
регуляторная
——— « ———
Регулируют обмен веществ
3.
Сократительные
актин
миозин
двигательная
——— « ——-
Осуществляют мышечные сокращения
4.
Запасные
козеин
ферритин
запасающая
——- « ——-
Белок в молоке
железо в селезенке
5.
Транспортные
Гемоглобин
альбумин
перенос веществ
—— «———
Перенос О и СО
Перенос жирных кислот
6.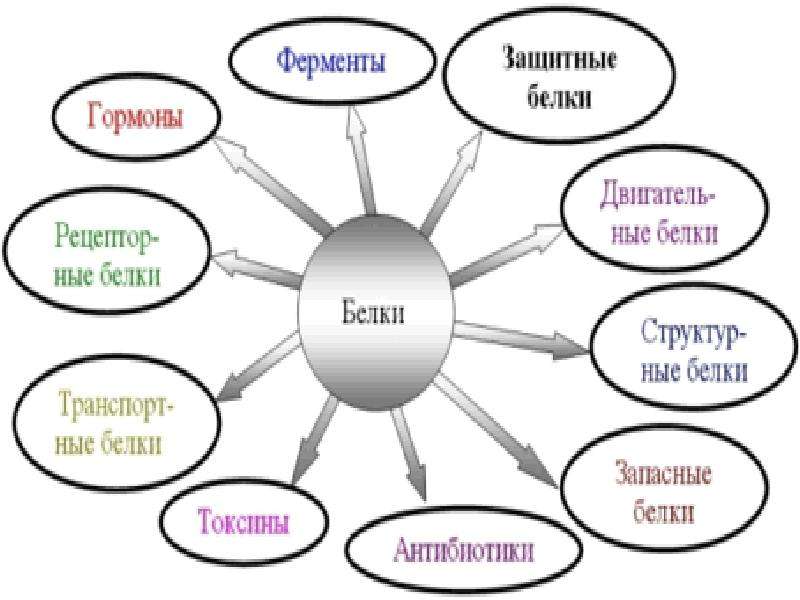
Защитные
антитела
иммунная
Защищают организм от бактерий, вирусов, антигенов, чужеродных белков
7.
Сигнальная
рецепторы
иодопсин
родопсин
Рефлекторная, передает сигналы из внешней среды
Осуществляет взаимосвязь организма и окружающей среды
8.
токсины
нейротоксин
блокирующее
Блокирует передачу нервного импульса
9.
Энергетическая
все
все
При расщеплении 1г-7,8 кДж
10.
Ферментативная
каталаза
амилаза
инсулин
глюкогон
ДНКполимераза
уреаза
каталитическая
Расщепляет Н О
Расщепляет крахмал
превращ-т крахмал в глюкозу
превращ-т глюкозу в крахмал
осущ-т репарацию мол-л ДНК
разложение мочевины
Свойства белков обусловлены аминокислотным составом белков.
Протамины – содержащиеся в икре рыб, где их до 30 % аминокислот с двумя аминогруппами, что обуславливает щелочные свойства этих белков.
Химическая активность веществ в живой клетке невелика.
Концентрация их в клетке ничтожно мала.
В клетке низкая t.
Реакции идут очень быстро и качественно потому, что химические реакции регулируются белками – катализаторами.
Для каждого фермента существует определенное значение реакции среды, при котором он проявляет наивысшую активность
Изменение рН вызывает снижение или полное торможение деятельности фермента.
Изменение t вызывает изменение скорости и ход ферментативной реакции.
Пример: разложение мочевины (кошачьей мочи) уреазой (выработанной бактериями)
при комнатной t (1 мол уреазы за 1 сек расщепляет 30 000 мол мочевины) –
Н N- СО- NН + Н О ———- СО + 2 NН (запах аммиака).
III. ЗАКРЕПЛЕНИЕ.
Почему все ферменты глобулярные белки?.Чем ферменты отличаются от катализаторов в неживой природе?
Почему активность ферментов зависит от t среды?
Одни ферменты активны в кислой среде, а другие — в щелочной. Как вы это можете объяснить?
Известно, что один фермент катализирует только одну реакцию. Объясните, почему невозможно с помощью этого же фермента ускорить любую реакцию?
ТЕСТ 2. Тема. «Свойства и функции белков. Выходное.
1.Процесс восстановления структуры белка после ее нарушения называется: а) деструкция; б) денатурация; в) ренатурация; г) биосинтезом.
2. К растворимым в воде органическим веществам относятся: а) липиды; б) моносахариды; в) полисахариды; г) некоторые белки.
3При расщеплении 1 г белка выделяется энергия: а) 17,8 кДж; б) 39,8 кДж; в) 178 кДж.
4Ускорение биохимических реакций обеспечивают: а) алкалоиды; б) гормоны; в) белки (ферменты)
5Антитела имеют природу: а) белковую; б) углеводную; в) липидную.
6В полипептидную цепь аминокислоты соединяются благодаря: а) водородным связям; б) ковалентным связям; в) гидрофобным; г) ионным.
7Вторичная структура белка имеет вид: а) глобулы; б) спирали; в) цепи аминокислотных остатков.
8Процесс разрушения первичных пептидных связей называют: а) денатурация; б) деструкция; в) ренатурация.
l l вариант.
В состав молекулы белков входят химические элементы: а) С; б) К; в) Н ; г) О ; д) Са; е) N ; ж) S; з) Fe.
Активная часть белка – фермента, обеспечивающая каталитические свойства:
а) апофермент; б) кофермент.
Сократительную функцию выполняют белки: а) протеины; б) миозин; в) кератин;
в) актин.
Каталитическую функцию выполняют белки: а) каталаза; б) миозин; в) кератин;
в) уреаза;
Транспортную функцию выполняют белки: а) гемоглобин; б) миозин; в) кератин;
в) актин.
Защитную функцию выполняют белки: а) коллаген; б) иммуноглобулины; в) тромбо-пластин; г) тромбин; д) фибриноген.
Строительную (структурную) функцию выполняют белки: а) коллаген; б) кератин;
в) инсулин.
8. Какие структуры молекул белка способны разрушаться при денатурации, а затем, вновь восстанавливаться: а) первичная; б) вторичная; в) третичная; г) четвертичная?
IV. ДОМАШНЕЕ ЗАДАНИЕ: учить &5 и конспект урока, подготовить
нформацию о роли белков в организме,повторить биологические термины.
V. ИТОГ УРОКА.
Подвести обучающихся к следующим выводам:
Свойства белков обусловлены аминокислотным составом белков.
Без участия ферментов протекание большинства биохимических процессов в клетке было бы невозможным.
В результате ферментативных реакций не образуются побочные продукты, то есть наблюдается почти 100% выход конечного продукта.
Для нормального функционирования организма это имеет большое значение, т.к. все вещества, распавшиеся до конечных продуктов – воды и углекислого газа, выводятся полностью наружу из организмов, при этом не накапливаются ненужные вещества в ЖО.
.
§ 8. Функции белков. Биология 9 класс Пасечник
1. Какова функция углеводов?
Углеводы представляют собой важнейшие источники энергии, необходимой для жизнедеятельности организмов.
2. Какие функции белков вы знаете?
• являются материалом для построения всех клеток, тканей и органов;
• обеспечивают иммунитет организма и выступают в качества антител;
• участвуют в пищеварительном процессе и энергетическом обмене.
Вопросы
1. Чем объясняется многообразие функций белков?
Это возможно в значительной мере благодаря разнообразию форм и состава самих белков.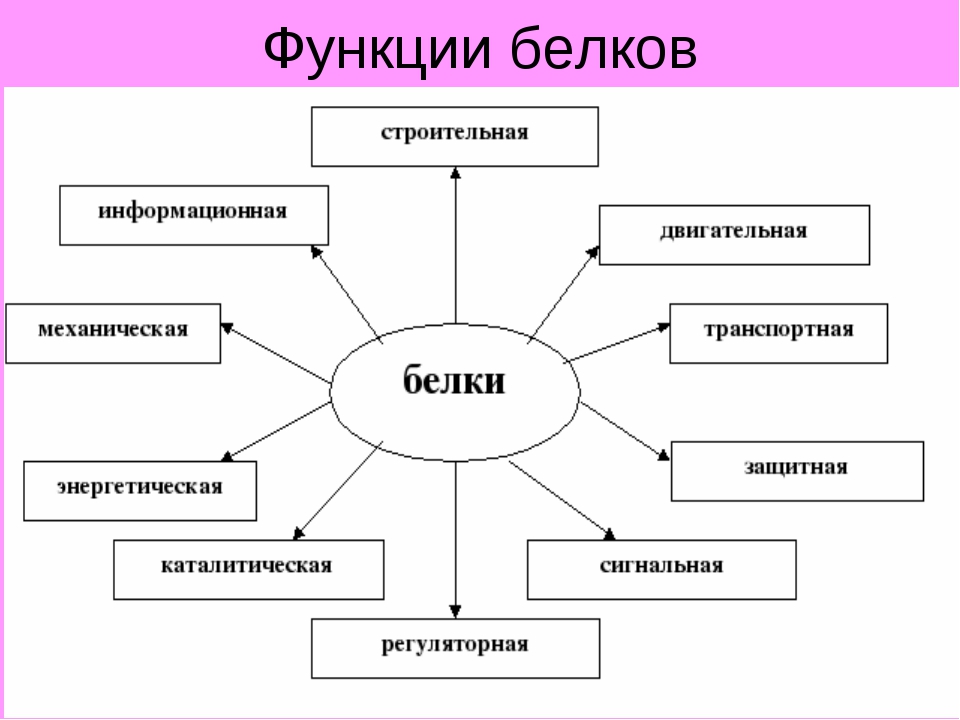
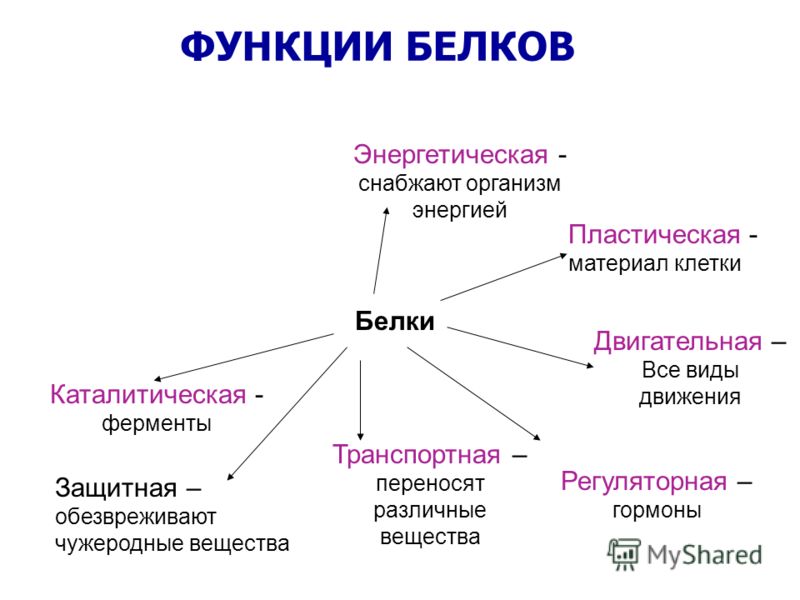
2. Какие функции белков вам известны?
Функции белков: строительная, двигательная, транспортная, защитная, регуляторная, сигнальная, энергетическая, каталитическая.
3. Какую роль играют белки-гормоны?
Белкам-гормонам присуща регуляторная функция. Они поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах. Например, инсулин регулирует содержание сахара в крови.
4. Какую функцию выполняют белки-ферменты?
Специальные белки — ферменты способны ускорять биохимические реакции в клетке в десятки и сотни миллионов раз.
5. Почему белки редко используются в качестве источника энергии?
Мономеры белков аминокислоты — ценное сырье для построения новых белковых молекул. Поэтому полное расщепление полипептидов до неорганических веществ происходит редко. Следователь¬но, энергетическая функция, заключающаяся в выделении энергии при полном расщеплении, выполняется белками до¬вольно редко.
Это невыгодно, выгоднее использовать липиды. Белки также выполняют много важных функций в организме.
Самостоятельная работа «Белки: строение и функции»
Самостоятельная работа по биологии в 10 классе. 4 варианта.belki.docx
1. Аминокислоты отличаются друг от друга:
а) радикалом;
б) аминогруппой;
в) карбоксильной группой;
г) химическим составом.
2. Определите, что изображено на рисунке:
а) гликопротеид;
б) нуклеопротеид;
в) металлопротеид;
г) липопротеид.
3. Для большинства белков характерна структура пространственной организации молекулы:
а) четвертичная;
б) третичная;
в) вторичная;
г) первичная.
4. Одна из важнейших функций белков:
а) двигательная;
б) транспортная;
в) энергетическая;
г) строительная.
5. Все белки состоят из:
а) аминокислот;
б) нуклеиновых кислот;
в) гормонов;
г) нуклеотидов.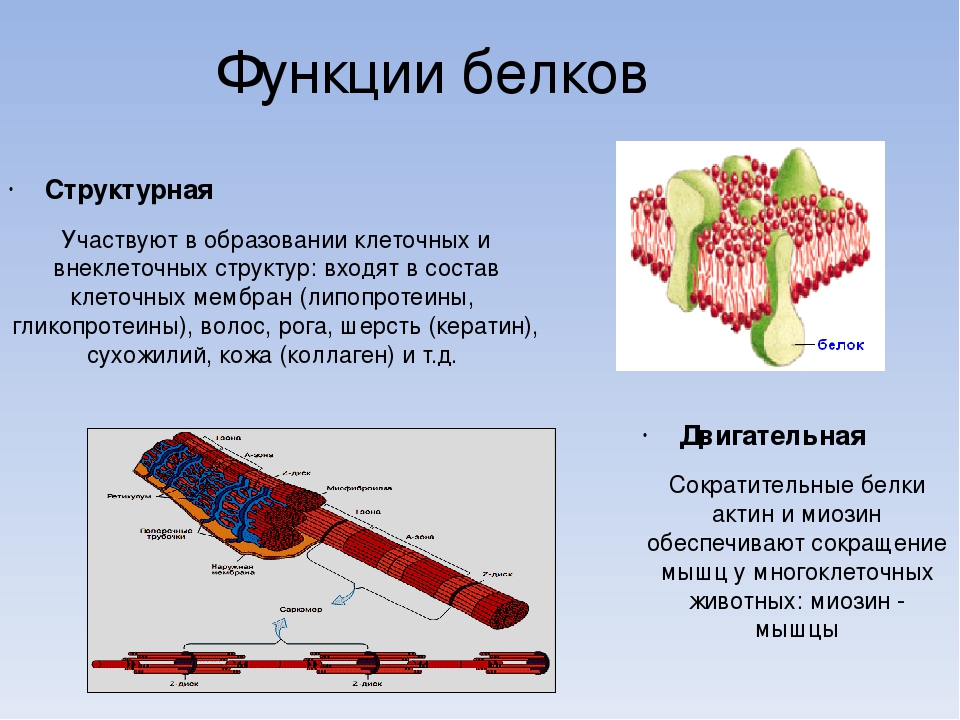
6. Молекулы белков отличаются друг от друга:
а) последовательностью чередования аминокислот;
б) количеством аминокислот в молекуле;
в) формой третичной структуры;
г) всеми указанными особенностями.
7. К какой структуре белка относится глобула?
а) первичной;
б) вторичной;
в) третичной;
г) четвертичной.
8. Денатурация – это:
а) регулирование физиологическими процессами организма;
б) утрата белковой молекулой своей структуры;
в) предохранение организма от чужеродных белков.
9. При понижении температуры активность ферментов:
а) повышается;
б) периодически изменяется;
в) понижается.
10. В каком из указанных процессов белки НЕ участвуют?
а) обмен веществ;
б) транспорт веществ;
в) кодирование наследственной информации.
11. Установите соответствие между протеидом и его особенностью:
1) нуклеопротеид
2) гликопротеид
3) металлопротеид
4) липопротеид
а) содержит небелковый компонент – липид;
б) содержит небелковый компонент – углевод;
в) содержит небелковый компонент – атом металла;
г) содержит небелковый компонент – НК.
Ответы
1 а)
2 в)
3 б)
4 г)
5 а)
6 г)
7 в)
8 б)
9 в)
10 в)
11 1г 2б 3в 4а
Автор: Бирюкова Татьяна Алексеевна.
Белок в организме: функции, норма, продукты, признаки дефицита
Материал проверила и прокомментировала Горбачёва Наталья Леонидовна, диабетолог, диетолог, эндокринолог, ведущий специалист сети клиник «Семейная»
Что такое белок
Белки — главный строительный материал организма. Он участвует в создании мышц, сухожилий, органов и кожи, а также нужен для производства ферментов, гормонов, нейромедиаторов и различных молекул, которые выполняют множество важных функций. Белки состоят из более мелких молекул, аминокислот, которые соединяются вместе, как бусы на нитке. Эти связанные аминокислоты образуют длинные белковые цепи, которые затем складываются в сложные формы. Некоторые аминокислоты организм производит самостоятельно, другие можно восполнить только с помощью еды.
Некоторые аминокислоты организм производит самостоятельно, другие можно восполнить только с помощью еды.
Функции белка в организме
Рост мышц и повышение выносливости
Организму необходим протеин, ведь мышцы в основном состоят из белка. Как и большинство тканей тела, мышцы динамично разрушаются и восстанавливаются, поэтому им необходим строительный материал для роста. Чтобы мышечная масса увеличивалась, в организме должен быть положительный белковый баланс. Его также называют азотным, из-за высокого содержания этого элемента в протеине. Употребление белка помогает не только нарастить мышцы при занятиях спортом, но и предотвратить их потерю, если вы придерживаетесь строгих диет [1] [2].
Биохимические процессы
Белки — ферменты, они помогают тысячам биохимических реакций, происходящих внутри клеток организма [3]. В том числе активируют метаболизм посредством объединения с другими молекулами — субстратами. Ферменты также могут функционировать и вне клетки, например, пищеварительные — лактоза и сахароза, которые помогают переваривать сахар. От их количества зависит пищеварение, свертывание крови и энергетический баланс. Дисбаланс некоторых ферментов может привести к сбоям в работе большинства систем организма [4].
От их количества зависит пищеварение, свертывание крови и энергетический баланс. Дисбаланс некоторых ферментов может привести к сбоям в работе большинства систем организма [4].
Гормональный баланс
Некоторые белки представляют собой гормоны, которые как химические посредники помогают взаимодействовать различным клеткам организма. Их производят эндокринные ткани и железы, а затем белки транспортируются по внутренним органам. Эти гормоны делят на три группы: белок и пептиды, стероиды и амины [5].
Структура тканей
Некоторые белки являются волокнами, придающими жесткость клеткам: кератин, коллаген и эластин. Они помогают формировать каркас тканей тела [6]. Кератин — строительный материал для кожи, волос и ногтей, коллаген — структурный белок костей, кожи, связок и сухожилий, а эластин позволяет тканям возвращаться в первоначальную форму после растяжений и сокращений.
Правильный pH
Белок играет жизненно важную роль в регулировании концентрации кислот и оснований в крови и других жидкостях организма [7]. Этот баланс измеряется с помощью шкалы pH от 0 до 14, где 0 — максимально кислый, 7 — нейтральный, 14 — наиболее щелочной. Протеины — один из способов регулирования этих показателей. Например, гемоглобин — тоже белок, из которого состоят эритроциты. Он связывает небольшое количество кислоты, помогая поддерживать нормальный уровень pH в крови.
Хороший иммунитет
Белки помогают формировать иммуноглобулины или антитела для борьбы с инфекцией [8] [9]. Антитела — белки в крови, которые помогают защитить организм от бактерий и вирусов. Вырабатывая их в качестве реакции на вторжение чужеродных элементов, клетки в дальнейшем лучше противостоят похожим заболеваниям.
Баланс жидкости
Альбумин и глобулин — белки крови, которые помогают сохранить баланс жидкости в организме, удерживая воду в клетках [10] [11]. При недостатке протеина могут возникать отеки, так как жидкость вытесняется в промежутки между клетками [12].
При недостатке протеина могут возникать отеки, так как жидкость вытесняется в промежутки между клетками [12].
Нормализация веса
Белок важен для тех, кому необходимо нормализовать вес. Некоторые эксперименты ученых подтверждают, что увеличение количества белка в рационе ведет к повышению скорости метаболизма и снижению аппетита [13]. Протеин хорошо насыщает, в результате чего реже хочется перекусывать, снижается объем порций в основных приемах пищи [14] [15]. В одном из исследований женщины 12 недель употребляли белковую пищу в количестве 30% от дневной калорийности рациона. В среднем каждая из участниц эксперимента потеряла порядка пяти килограмм веса, сохранив здоровые пищевые привычки [16].
Норма белка в день
Если вы каждый день едите продукты животного происхождения, такие как мясо, рыбу, яйца или молочные продукты, вы, вероятно, получаете достаточно белка. Если придерживаетесь растительной диеты, получить незаменимые аминокислоты, необходимые организму, будет сложнее. Среднестатистические нормы протеина в рационе на один килограмм веса:
Среднестатистические нормы протеина в рационе на один килограмм веса:
- для женщин – 60–90 г;
- для мужчин – 80–150 г;
- для дошкольников – 3 г;
- для школьников – 2,5 г.
В некоторых случаях требуется больше белка, например, в периоды болезни, интенсивных занятий спортом, а также при беременности и кормлении грудью [17] [18]. Данные о точном количестве вещества разнятся, поэтому правильно будет проконсультироваться с лечащим врачом, который подберет индивидуальный рацион, исходя из особенностей организма. Так, авторы одного исследования утверждают, что беременным женщинам в день необходимы 1,2–1,52 г протеина на один кг веса [19]. Другие врачи рекомендуют потреблять дополнительно 1,1г белка на кг веса [20]. Суточная норма белка во время грудного вскармливания составляет 1,3 г на килограмм в день плюс 25 дополнительных граммов [21].
Активным людям требуется больше белка, чем тем, кто ведет малоподвижный образ жизни.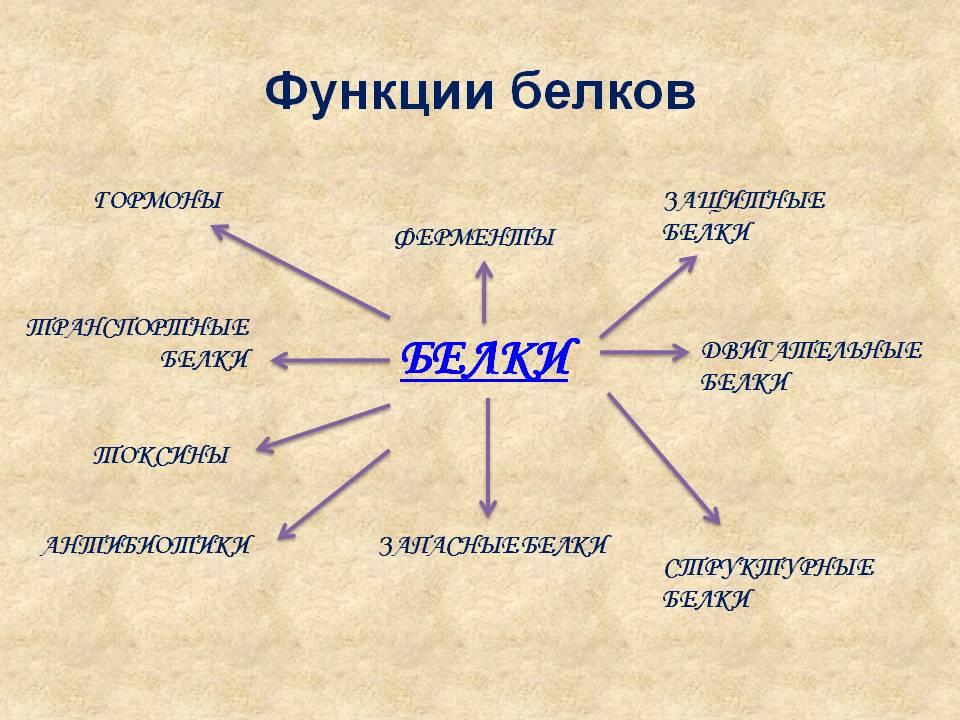 Спортсменам, предпочитающим тренировки на выносливость, необходимо около 1,2–1,4 г на каждый кг веса [22] [23]. Достаточное количество протеина необходимо для предотвращения развития заболеваний, таких как остеопороз. Пожилым людям, а также тем, кто восстанавливается после травмы или операции, требуется до 1–1,3 г на один кг массы тела [24] [25].
Спортсменам, предпочитающим тренировки на выносливость, необходимо около 1,2–1,4 г на каждый кг веса [22] [23]. Достаточное количество протеина необходимо для предотвращения развития заболеваний, таких как остеопороз. Пожилым людям, а также тем, кто восстанавливается после травмы или операции, требуется до 1–1,3 г на один кг массы тела [24] [25].
Сколько белка в яйцах, курице и твороге
Эти продукты врачи и диетологи чаще всего упоминают как отличные источники протеина:
-
Яйца. Содержат 6-7 г белка на штуку среднего размера. Содержатся они именно в белковой части яйца. Поэтому в фитнес-меню часто присутствуют блюда без желтка, но на самом деле, при сбалансированном рационе нет смысла от них отказываться.
-
Курица. Если необходимо добавить белка в рацион, выбирайте куриную грудку — в ней больше волокон и меньше жира.
 На 100 г продукта — 27% белка. Оптимальный ингредиент для повышения уровня белка в организме, если вы не придерживаетесь растительной диеты.
На 100 г продукта — 27% белка. Оптимальный ингредиент для повышения уровня белка в организме, если вы не придерживаетесь растительной диеты. -
Творог. В 200-граммовой пачке творога содержится 35 г белка, что соответствует почти трети среднестатистической дневной нормы. Отдавайте предпочтение творогу средней жирности, так как обезжиренного усваивается меньше необходимым микроэлементов.
Продукты, богатые белком
В первую очередь, протеин попадает в организм из животных продуктов. Средние показатели белка на 100 г продукта:
- птица — 27 г;
- свинина — 27 г;
- говядина — 26 г;
- рыба — 22 г;
- морепродукты — 22 г.
Вегетарианцам и веганам стоит позаботиться о наличии растительного белка в рационе. Это могут быть бобовые, крупы, соевые и цельнозерновые продукты:
- красная чечевица — 18 г белка;
- красная фасоль — 16 г;
- маш, нут, черная фасоль — 14 г;
- гречка и цельнозерновой хлеб — 13 г;
- киноа и тофу — 8 г;
- тыквенные семечки — 5 г в одной порции (горсть 25-30 г).

Норма белка в моче и крови
Лучший способ проверить, хватает ли организму белка, — сдать анализы, например биохимический анализ крови. В норме концентрация белка в крови взрослого человека должна составлять 62–86 г/л, а у детей — от 45 до 80 г/л. Снижение этих показателей возникает в результате ряда заболеваний, в том числе первичных иммунодефицитов, нарушениях обмена веществ, дисфункциях желудочно-кишечного тракта, а также дефицита протеина в рационе.
Превышение нормы встречается редко, но оно может указывать на хронические тяжелые инфекции (такие как туберкулез), ускоренный распад эритроцитов, системные опухоли или обезвоживание организма.
С-реактивный белок — фракция протеинов плазмы, которая повышается при наличии в организме воспалительного процесса. Синтезируется в ответ на попадание в кровь токсинов патологических микроорганизмов и обезвреживает их путем их связывания, а также запускает иммунные реакции. С-реактивный белок в норме отсутствует в крови (либо его показатели не превышают 0,4 мг/л). Большие значения указывают на развитие патологий: инфекционных и вирусных заболеваний, панкреатита, пиелонефрита, гепатита, язвенного колита и онкологии.
С-реактивный белок в норме отсутствует в крови (либо его показатели не превышают 0,4 мг/л). Большие значения указывают на развитие патологий: инфекционных и вирусных заболеваний, панкреатита, пиелонефрита, гепатита, язвенного колита и онкологии.
Помимо крови, белок учитывают в анализе мочи. Небольшое его количество встречается и у здоровых людей, в норме — до 140 мг/л (до 0,140 г/л). При активной физической нагрузке показатели не должны превышать 250 мг/сутки (0,250 г/л). Для того, что точнее узнать потери белка с мочой, необходимо проводить исследование его концентрации в суточных анализах. Их назначают при заболеваниях мочевыделительной системы и почек, инфекциях, а также для контроля осложнений, в том числе при приеме препаратов, оказывающих нефротоксическое действие — поражение почек.
Переизбыток белка
Высокое потребление белка может нанести вред людям с заболеваниями почек [26]. Двумя основными факторами риска почечной недостаточности являются высокое кровяное давление (гипертония) и диабет. И то, и другое провоцируется переизбытком белка [27] [28]. Точное количество необходимого протеина варьируется в зависимости от возраста, состояния здоровья и образа жизни. Исследование с участием здоровых мужчин, занимающихся силовыми тренировками, показало, что ежедневное употребление 3 г белка на кг массы тела в течение года не имело никаких неблагоприятных последствий для здоровья [29]. Даже 4,4 г на кг веса в течение двух месяцев не вызывало никаких побочных эффектов [30].
И то, и другое провоцируется переизбытком белка [27] [28]. Точное количество необходимого протеина варьируется в зависимости от возраста, состояния здоровья и образа жизни. Исследование с участием здоровых мужчин, занимающихся силовыми тренировками, показало, что ежедневное употребление 3 г белка на кг массы тела в течение года не имело никаких неблагоприятных последствий для здоровья [29]. Даже 4,4 г на кг веса в течение двух месяцев не вызывало никаких побочных эффектов [30].
Нет никаких доказательств того, что потребление белка в разумных количествах причиняет вред здоровым людям. Напротив, существует множество доказанных преимуществ. Однако, если у вас заболевание почек, следует следовать советам врача и ограничить потребление протеинов.
Богатое белками, но бедное жирами и углеводами питание — нагрузка на почки и печень. Переизбыток белка на фоне нехватки других необходимых организму веществ выражается в проблемах с пищеварением, неприятном запахе изо рта и постоянной жажде.
Недостаток белка
Помимо показателей медицинских анализов есть и другие признаки недостатка протеина, которые вы можете заметить перед походом к врачу.
Постоянный голод
Белки насыщают и заряжают энергией надолго, но в качестве перекуса многие из нас используют не белковые продукты, а содержащие углеводы: бананы, печенье, конфеты, выпечку и бутерброды. Еда, богатая углеводами, приводит к быстрому подъему уровня сахара (и мы чувствуем себя сытыми) и такому же быстрому падению (через полчаса мы снова голодны). Этот же эффект вызывает тягу к сладкому: организму не хватает сил, а конфета — самый быстрый способ их получить. Правда, ненадолго.
Слабые волосы и ногти
Ногти и волосы — это тоже белок, а точнее, кератин. Для их здоровья регулярное потребление белковой пищи абсолютно необходимо, иначе организму неоткуда будет брать строительный материал. При дефиците белка волосы становятся тонкими, слабыми и тусклыми, плохо растут и секутся, а ногти начинают ломаться и расслаиваться.
Медленное заживление ран
Если даже маленькая царапина заживает дольше недели, это тоже может быть признаком недостатка белка. Он входит в состав клеток мышечной ткани, кожи и крови, поэтому, если макроэлемента не хватает, на ремонт повреждений у организма уходит гораздо больше времени.
Частые инфекционные болезни
По мнению доктора Алиссы Рамси из американской Академии питания и диетологии, белок также необходим для построения клеток иммунной системы — если вы едите мало белковых продуктов, со временем защита организма может ослабеть.
Без белка замедляется выработка интерферона и лизоцима, «защитников», отбивающих атаки патогенов. Иммунитет перестает справляться с бактериями и вирусами, и мы болеем чаще. Причем любыми инфекционными заболеваниями: у людей на низкобелковой диете часто диагностируют инфекции.
Отеки
Дефицит белка приводит к нарушению водно-солевого баланса, из-за чего жидкость скапливается в тканях.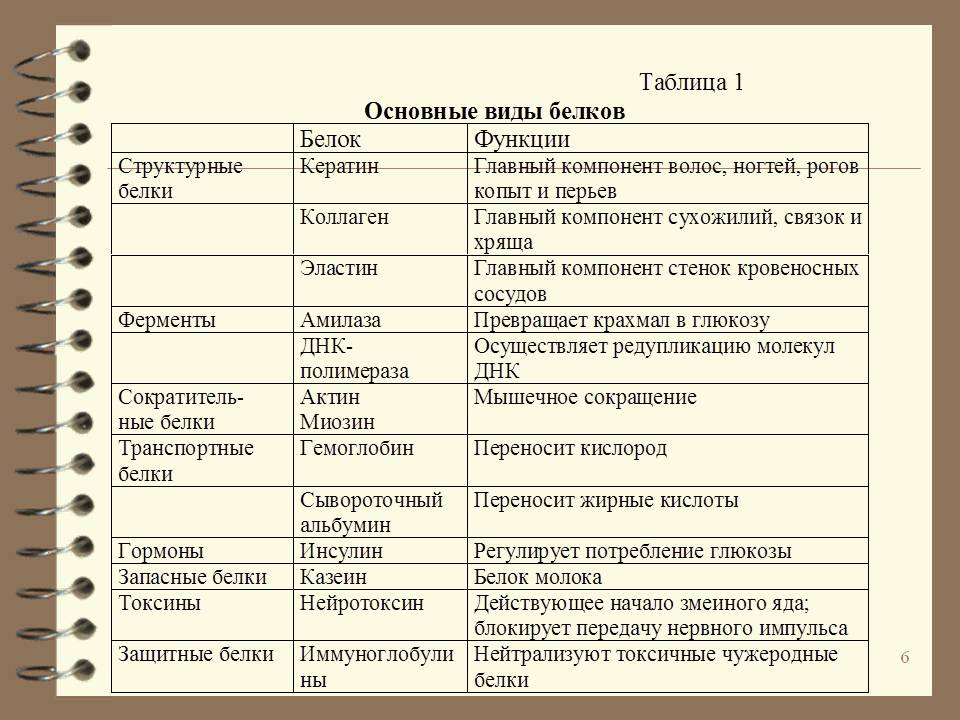 Результат — мешки под глазами и опухшее по утрам лицо, отеки лодыжек и стоп, чувство тяжести в ногах, которое появляется уже в середине дня, даже если вы носите удобную обувь.
Результат — мешки под глазами и опухшее по утрам лицо, отеки лодыжек и стоп, чувство тяжести в ногах, которое появляется уже в середине дня, даже если вы носите удобную обувь.
Снижение веса
У нашего организма свои приоритеты. Если белка не хватает, то все поступающие протеины направляются туда, где они жизненно необходимы, то есть к внутренним органам. Мышцам при этом почти ничего не достается, и они начинают уменьшаться в объеме. Правда, снижение мышечной массы при белковой недостаточности заметить трудно — за счет отеков вес может оставаться относительно стабильным или снижаться очень медленно. Зато вы точно заметите другие признаки постепенной атрофии мышечной ткани — слабость и быструю утомляемость. Люди, желающие скорректировать вес, часто отказываются от жиров или белка, но это ошибка. Важно соблюдать баланс: основу правильной диеты составляют мясо, рыба (или продукты с высоким содержанием белка растительного происхождения), крупы и овощи.
Плохое настроение
Белок, помимо всего прочего, важен для синтеза нейромедиатора серотонина. Именно он отвечает за хорошее настроение и стрессоустойчивость. Недостаток серотонина приводит не только к хандре, плаксивости и мрачным мыслям, но и к бессоннице, повышенной тревожности, нервозности и склонности взрываться по пустякам.
Именно он отвечает за хорошее настроение и стрессоустойчивость. Недостаток серотонина приводит не только к хандре, плаксивости и мрачным мыслям, но и к бессоннице, повышенной тревожности, нервозности и склонности взрываться по пустякам.
Комментарии эксперта
Горбачёва Наталья Леонидовна, диабетолог, диетолог, эндокринолог, ведущий специалист сети клиник «Семейная»
«Правильный белковый обмен веществ — баланс между распадом и синтезом белков. Организму должно хватать аминокислот для построения новых соединений. Степень усвоения белка зависит от его происхождения и способа термической обработки. Элемент не способен накапливаться в организме, его излишки выводятся с помощью почек. Поэтому чрезмерное потребление белка негативно сказывается на их состоянии
Причинами нарушений белкового обмена могут стать наследственные заболевания: подагра, а также тяжелые состояния, такие как онкопатологии, следствие радиационного облучения и прочее.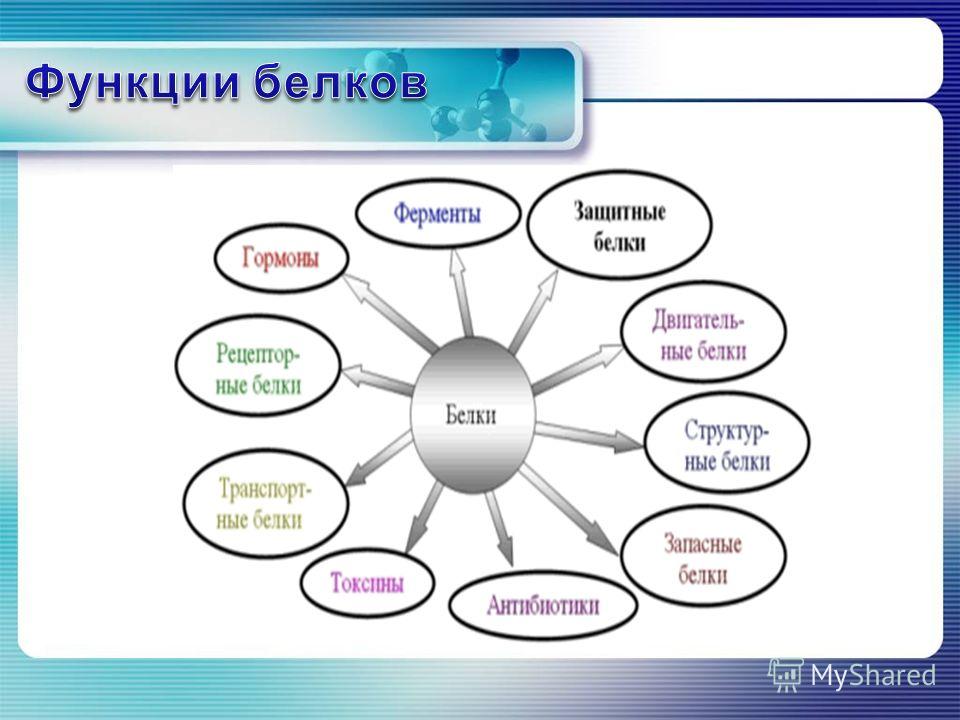 Но в большинстве случаев у взрослого человека симптомы нарушения биосинтеза белков говорят о несбалансированном рационе питания.
Но в большинстве случаев у взрослого человека симптомы нарушения биосинтеза белков говорят о несбалансированном рационе питания.
Недостаток белков — актуальная проблема. Одних она настигает при избавлении от лишнего веса, других — при вегетарианстве, а третьих — из-за заболеваний пищеварительной и эндокринной систем. Дефицит белков может не проявляться клинически, но последствия недостатка протеина довольно печальны:
- задержка роста и развития у детей;
- малая мышечная масса;
- сердечно-сосудистые заболевания;
- плохой аппетит;
- вялость, апатия, усталость;
- плохое состояние кожи, волос, ногтей.
Если биосинтез белков нарушен на этапе построения, человек может страдать от белкового отравления. Характерными признаками интоксикации являются поражение печени и почек, нарушения работы ЖКТ. Переизбыток белка влияет на центральную нервную систему вплоть до серьезных поражений при врожденных нарушениях обмена веществ.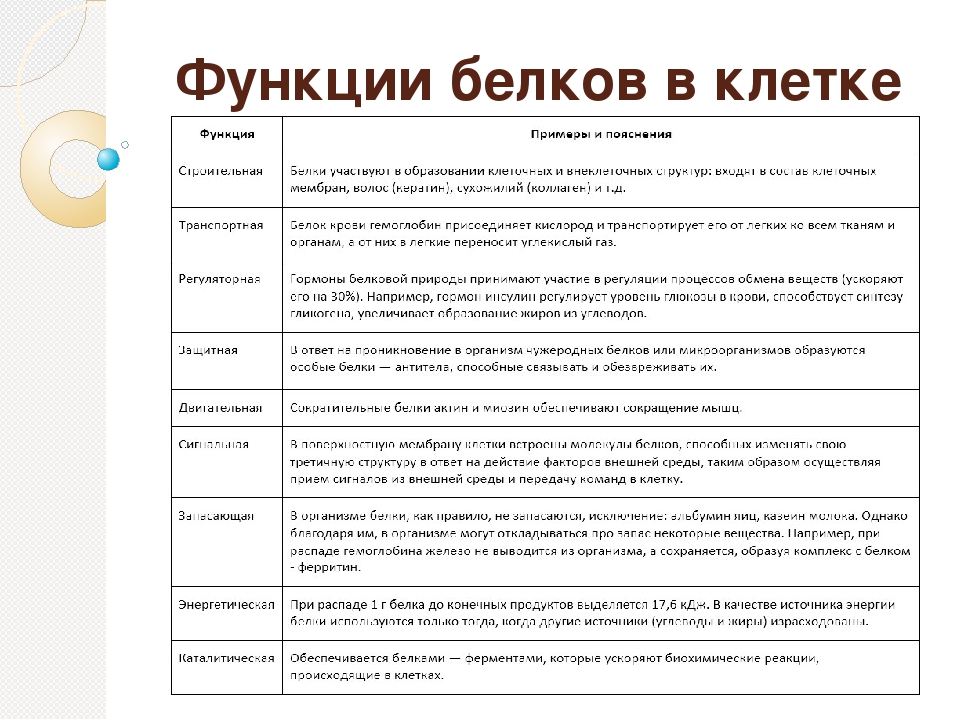 При ухудшении самочувствия необходимо сдать анализы и получить рекомендации специалиста.»
При ухудшении самочувствия необходимо сдать анализы и получить рекомендации специалиста.»
Функции БЕЛКОВ в Организме Человека
Белки очень важны молекул в наших клетках. Они участвуют практически во всех клеточных функций. Каждый белок в организме выполняет определенную функцию. Некоторые протеины участвуют в структурной поддержки, в то время как другие участвуют в движениях, или защищают организм от микробов. Белки различаются между собой по структуре , а также по функциям. Они построены из 20 аминокислот, которые соединены в виде полипептидных цепей. Полипептидных цепи, которые образуют отдельные трехмерные фигуры представляют собой белок.
Функции белков в организме человека
Белки являются важным строительным материалом для клеток организма. Белки и аминокислоты необходимы телу для формирования специальных белковых строительных блоков. Также белки нужны для поддержания многих жизненно важных функций и процессов.
Белки и аминокислоты необходимы телу для формирования специальных белковых строительных блоков. Также белки нужны для поддержания многих жизненно важных функций и процессов.
Какие функции выполняют белки в организме человека
Белки участвуют в выработке важных гормонов и необходимы для контроля различных функций организма и органов.
Инсулин, например, представляет собой небольшой белковый гормон, который регулирует уровень сахара в крови, взаимодействуя с такими органами, как поджелудочная железа и печень.
Секретин, еще один пример белкового гормона. Этот гормон помогает процессу пищеварения, стимулируя поджелудочную железу и кишечник к выработке необходимых пищеварительных соков.
Источник энергии
Когда для поддержания жизнедеятельности и других функций организма, поглощается больше белка чем необходимо, его избыток используется в качестве источника энергии.
При наличии достаточного количества дополнительных источников энергии, таких как углеводы, излишки белка временно сохраняются в виде жировых клеток в качестве запасного источника энергии.
Энзимы
Для производства ДНК необходимы белковые ферменты. Ферменты — это белки, которые могут катализировать химическую реакцию, необходимую для различных метаболических процессов.
Как правило, ферменты используются в процессе переваривания больших молекул белка, углеводов и жиров.
Транспортировка и хранение молекул
Для транспортировки и хранения молекул необходимы определенные белки.
Гемоглобин, например, является белком, который транспортирует кислород через организм. Ферритин, это белок, который соединяется с железом, и хранит его в печени.
Антитела
Антитела образуются белками, и помогают предотвратить заболевания и инфекции. Они поддерживают процесс уничтожения антигенов, таких как бактерии и вирусы.
Антитела работают вместе с другими клетками иммунной системы, для поддержания важных защитных функций. Например, они идентифицируют и окружают антигены до тех пор, пока они не будут уничтожены лейкоцитами.
ФУНКЦИИ БЕЛКОВ
Антитела — это специализированные белки, участвующие в защите организма от антигенов (инородных захватчиков). Они могут путешествовать через кровь и используются иммунной системой для идентификации и защиты от бактерий, вирусов, и других инородных вторжений. Один из способов антитела нейтрализуют антигены путем иммобилизации их так, что они могут быть уничтожены белых кровяных клеток.
- Сократительные белки актин и миозин — отвечают за движение. Эти белки вовлечены в мышечные сокращения и движения.
- Ферменты — это белки, которые способствуют биохимическим реакциям.
- Они часто называются катализаторами, потому что они ускоряют химические реакции. Примеры включают лактазы ферменты и пепсина.
 Лактаза расщепляет сахар лактозу, содержащийся в молоке.
Лактаза расщепляет сахар лактозу, содержащийся в молоке. - Пепсин пищеварительный фермент, который работает в желудке для расщепления белков в пище.
- Гормональные протеины — это посланники белков, которые помогают координировать определенные деяния. Примеры включают инсулин, окситоцин, соматотропин.
- Инсулин регулирует метаболизм глюкозы, контролируя уровень сахара в крови и концентрацию.
- Окситоцин стимулирует схватки у женщин во время родов. Соматотропный гормон, который стимулирует производство белка в мышечных клетках.
- Структурные белки — это волокнистые и жилистые белки.
- Примеры: кератин, коллаген и эластин.
- Кератины укрепляет защитные покрытия, такие как кожа, волосы, ногти. Коллагены и эластин обеспечивают поддержку соединительной ткани , такие как сухожилия и связки.
- Хранительные протеины — магазин аминокислот. Примеры включают овальбумин, казеин, ферритин.
 Овальбумин находится в яичном белке и казеин это молочный белок. Ферритин сохраняет железо в гемоглобине.
Овальбумин находится в яичном белке и казеин это молочный белок. Ферритин сохраняет железо в гемоглобине. - Транспортные белки — являются носительными белками, которые движут молекулы с одного места на другое вокруг тела. Примеры включают гемоглобина и цитохромов.
- Гемоглобин переносит кислород через кровь через красные кровяные тельца. Цитохромы действуют электронно-транспортной цепи как электронный носитель белков.
СТРУКТУРА БЕЛКА
Существует четыре уровня структуры белка. Эти уровни отличаются друг от друга по степени сложности в полипептидной цепи (связанных аминокислот). Четыре уровня структуры белка первичная, вторичная, третичная, и четвертичная структура. Одна молекула белка может содержать один или более из этих типов структуры белка. Структура белка определяет его функцию. Например, коллаген обладает супер-спиральную винтовую форму. Он длинный, тягучий, сильный, и напоминает веревку. Эта структура отлично подходит для обеспечения поддержки твердых тканей. Гемоглобин, с другой стороны, представляет собой глобулярный белок, который сложенный и компактный. Своей шаровидной формы удобен как для маневрирования по кровеносные сосуды.
Гемоглобин, с другой стороны, представляет собой глобулярный белок, который сложенный и компактный. Своей шаровидной формы удобен как для маневрирования по кровеносные сосуды.
СИНТЕЗ БЕЛКА
Белки синтезируются в организме посредством процесса, называемого трансляция. Трансляция происходит в цитоплазме и предполагает перевод генетического кода в белки. Эти генные коды были собраны в ходе транскрипции ДНК, где ДНК транскрибируется в РНК-.
Поделитесь увиденным с друзьями!Защитная функция белков. Строение и функции белков
Белки являются основой всех живых организмов. Именно эти вещества выступают компонентом клеточных мембран, органелл, хрящей, сухожилий и роговых производных кожи. Однако защитная функция белков — одна из самых важных.
Белки: особенности строения
Наряду с липидами, углеводами и нуклеиновыми кислотами белки являются органическими веществами, составляющими основу живых существ.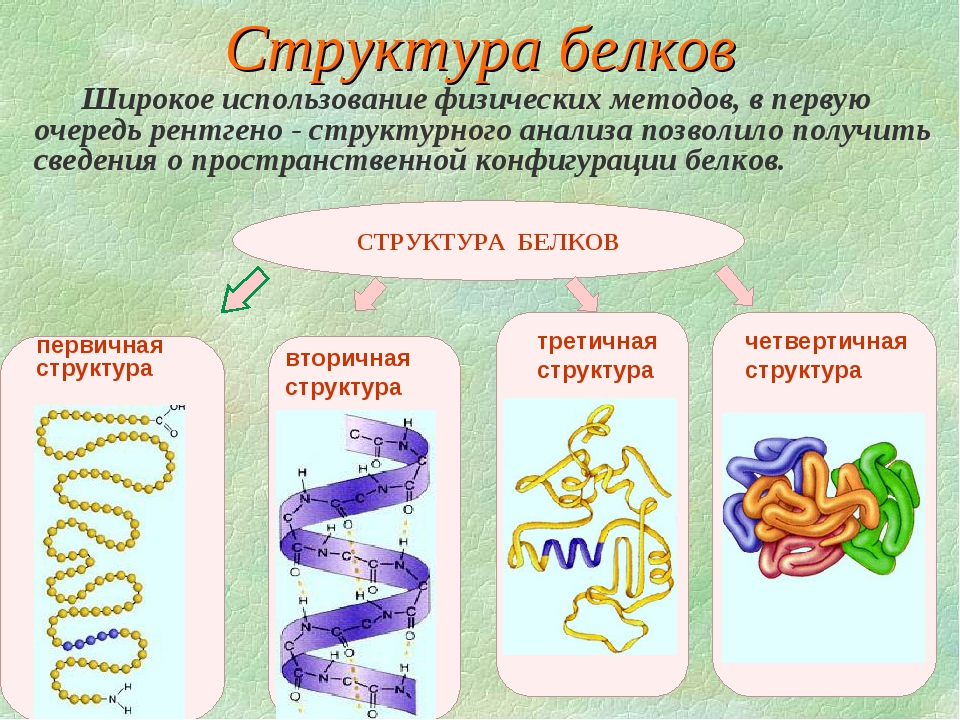 Все они — природные биополимеры. Эти вещества состоят из многократно повторяющихся структурных единиц. Они называются мономеры. Для белков такими структурными единицами являются аминокислоты. Соединяясь в цепочки, они образуют крупную макромолекулу.
Все они — природные биополимеры. Эти вещества состоят из многократно повторяющихся структурных единиц. Они называются мономеры. Для белков такими структурными единицами являются аминокислоты. Соединяясь в цепочки, они образуют крупную макромолекулу.
Уровни пространственной организации белка
Цепочка, состоящая из двадцати аминокислот, может образовывать различные структуры. Это уровни пространственной организации или конформации белка. Первичная структура представлена цепью из аминокислот. Когда она закручивается в спираль, возникает вторичная. Третичная структура возникает при закручивании предыдущей конформации в клубок или глобулу. А вот следующая структура самая сложная — четвертичная. Она состоит из нескольких глобул.
Свойства белков
Если четвертичная структура разрушается до первичной, а именно до цепи аминокислот, то происходит процесс, который называется денатурацией. Он обратим. Цепочка аминокислот способна снова образовать более сложные структуры. А вот когда происходит деструкция, т.е. разрушение первичной структуры, белок восстановить уже невозможно. Такой процесс является необратимым. Деструкцию осуществлял каждый из нас, когда термически обрабатывал продукты, состоящие из белка — куриные яйца, рыбу, мясо.
А вот когда происходит деструкция, т.е. разрушение первичной структуры, белок восстановить уже невозможно. Такой процесс является необратимым. Деструкцию осуществлял каждый из нас, когда термически обрабатывал продукты, состоящие из белка — куриные яйца, рыбу, мясо.
Функции белков: таблица
Белковые молекулы очень многобразны. Это обусловливает широкий спектр их возможностей, которые обусловлены строением аминокислот. Функции белков (таблица содержит необходимую информацию) являются необходимым условием существования живых организмов.
| Функция белка | Значение и суть процесса | Название белков, осуществляющих функцию |
Строительная (структурная) | Белок является строительным материалом для всех структур организма: от мембран клетки до мышц и связок. | Коллаген, фиброин |
| Энергетическая | При расщеплении белков выделяется энергия, необходимая для осуществления процессов жизнедеятельности организма (1 г белка — 17, 2 кДж энергии).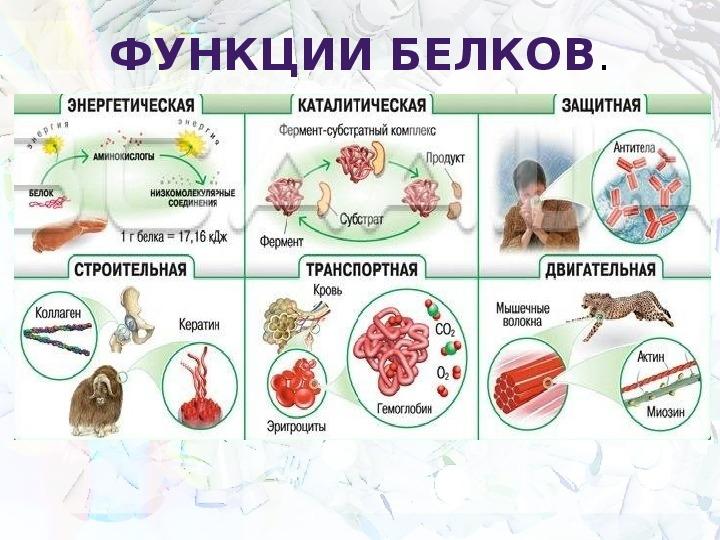 | Проламин |
| Сигнальная | Белковые соединения клеточных мембран способны распознавать специфические вещества из окружающей среды. | Гликопротеиды |
| Сократительная | Обеспечение двигательной активности. | Актин, миозин |
| Резервная | Запас питательных веществ. | Эндосперм семян |
| Транспортная | Обеспечение газообмена. | Гемоглобин |
| Регуляторная | Регуляция химических и физиологических процессов в организме. | Белки гормонов |
| Каталитическая | Ускорение протекания химических реакций. | Ферменты (энзимы) |
Защитная функция белков в организме
Как видите, функции белков очень разнообразны и важны по своему значению. Но мы не упомянули еще об одной из них. Защитная функция белков в организме заключается в предотвращении проникновения чужеродных веществ, которые могут нанести существенный вред организму. Если же это произошло, специализированные белки способны их обезвредить. Эти защитники называются антителами или иммуноглобулинами.
Если же это произошло, специализированные белки способны их обезвредить. Эти защитники называются антителами или иммуноглобулинами.
Процесс формирования иммунитета
С каждым вздохом в наш организм проникают болезнетворные бактерии и вирусы. Они попадают в кровь, где начинают активно размножаться. Однако на их пути встает значительная преграда. Это белки плазмы крови — иммуноглобулины или антитела. Они являются специализированными и характеризуются способностью распознавать и обезвреживать чужеродные для организма вещества и структуры. Они называются антигенами. Так проявляется защитная функция белков. Примеры ее можно продолжить информацией об интерфероне. Этот белок также является специализированным и распознает вирусы. Это вещество даже является основой многих иммуностимулирующих лекарственных препаратов.
Благодаря наличию защитных белков организм способен противостоять болезнетворным частицам, т.е. у него формируется иммунитет. Он может быть врожденным и приобретенным. Первым все организмы наделены еще с момента появления на свет, благодаря чему и возможна жизнь. А приобретенный появляется после перенесения различных инфекционных заболеваний.
Первым все организмы наделены еще с момента появления на свет, благодаря чему и возможна жизнь. А приобретенный появляется после перенесения различных инфекционных заболеваний.
Механическая защита
Белки выполняют защитную функцию, непосредственно предохраняя клетки и весь организм от механических воздействий. К примеру, наружный скелет ракообразных играет роль панциря, надежно защищая все содержимое. Кости, мышцы и хрящи образуют основу организма, и не только предотвращают повреждение мягких тканей и органов, но и обеспечивают его передвижение в пространстве.
Образование тромбов
Процесс свертывания крови — это также защитная функция белков. Он возможен благодаря наличию специализированных клеток — тромбоцитов. При повреждении кровеносных сосудов они разрушаются. В результате растворимый белок плазмы фибриноген превращается в его нерастворимую форму — фибрин. Это сложный ферментативный процесс, в результате которого нити фибрина очень часто переплетаются и образуют густую сеть, которая препятствует вытеканию крови. Другими словами, образуется сгусток крови или тромб. Это является защитной реакцией организма. При нормальной жизнедеятельности этот процесс длится максимум до десяти минут. Но при болезни несвертываемости крови — гемофилии, которой страдают в основном мужчины, человек может погибнуть даже при незначительном ранении.
Другими словами, образуется сгусток крови или тромб. Это является защитной реакцией организма. При нормальной жизнедеятельности этот процесс длится максимум до десяти минут. Но при болезни несвертываемости крови — гемофилии, которой страдают в основном мужчины, человек может погибнуть даже при незначительном ранении.
Однако если тромбы образуются внутри кровеносного сосуда, это может быть очень опасно. В некоторых случаях это даже приводит к нарушению его целостности и внутреннему кровоизлиянию. В этом случае рекомендованы препараты, наоборот, разжижающие кровь.
Химическая защита
Защитная функция белков проявляется и в химической борьбе с болезнетворными веществами. И начинается она уже в ротовой полости. Попадая в нее, пища вызывает рефлекторное выделение слюны. Основу этого вещества составляет вода, ферменты, которые расщепляют полисахариды и лизоцим. Именно последнее вещество обезвреживает вредоносные молекулы, защищая организм от их дальнейшего воздействия.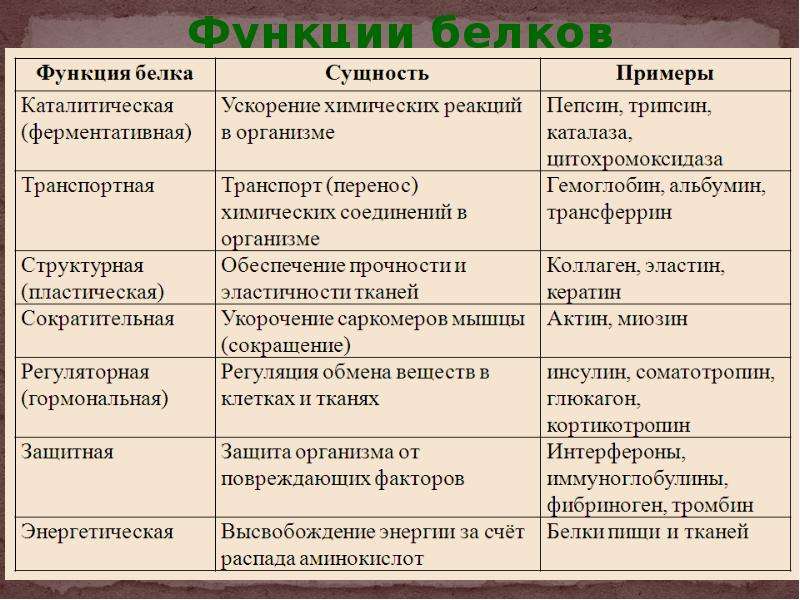 Содержится он и в слизистых оболочках желудочно-кишечного тракта, и в слезной жидкости, которая омывает роговицу глаза. В большом количестве лизоцим находится в грудном молоке, слизи носоглотки и белке куриных яиц.
Содержится он и в слизистых оболочках желудочно-кишечного тракта, и в слезной жидкости, которая омывает роговицу глаза. В большом количестве лизоцим находится в грудном молоке, слизи носоглотки и белке куриных яиц.
Итак, защитная функция белков проявляется в первую очередь в обезвреживании бактериальных и вирусных частиц в крови организма. В результате у него формируется способность противостоять болезнетворным агентам. Ее и называют иммунитетом. Белки, которые входят в состав наружного и внутреннего скелета, защищают внутреннее содержимое от механических повреждений. А белковые вещества, находящиеся в слюне и других средах, предотвращают действие на организм химических агентов. Другими словами, защитная функция белков заключается в обеспечении необходимых условий для всех процессов жизнедеятельности.
основных функций белка | 6 основных функций белка — стенограмма видео и урока
Состав белков
Белки состоят из аминокислот. Аминокислоты — это соединения, которые содержат аминогруппу и карбоксил, как показано на схеме. Белки образуются из длинных цепочек аминокислот, объединенных особой связью, известной как пептидная связь. Связь образуется между аминогруппой одной аминокислоты и карбоксильной группой другой аминокислоты.Это соединение продолжается для многих аминокислот с образованием полипептидной цепи, которая является белком.
Белки образуются из длинных цепочек аминокислот, объединенных особой связью, известной как пептидная связь. Связь образуется между аминогруппой одной аминокислоты и карбоксильной группой другой аминокислоты.Это соединение продолжается для многих аминокислот с образованием полипептидной цепи, которая является белком.
Аминокислоты различаются группами R , показанными на диаграмме. Затем последовательность аминокислот определяет структуру белка. Трехмерная структура белка определяется водородными связями, которые образуются между полипептидными цепями.Основываясь на таком расположении, белки складываются в разные структуры, которые позволяют им выполнять свои функции. Трехмерная структура белка проиллюстрирована на диаграмме.
Основные функции белков
Каковы некоторые функции белков? Основные функции белков — обеспечение структуры, регулирование процессов в организме, транспортировка материалов, баланс жидкости, помощь в укреплении иммунитета и обеспечение энергией.Каждая из различных функций связана с различным или несколькими разными типами белка.
Обеспечить структуру
Структурные белки — это тип белков, отвечающих за форму клеток и обеспечивающих поддержку основных структур, таких как волосы, кожа и кости. В организме человека существует множество структурных белков. Двумя наиболее распространенными являются коллаген и кератин.
- Коллаген — это структурный белок, который присутствует в костях, соединительных тканях и коже.Он твердый и волокнистый и составляет примерно одну треть белка в организме человека.
- Кератин также является структурным белком, который содержится в волосах, ногтях и коже, а также в слизистой оболочке органов и желез.
 Аминокислотный состав кератина отличается от коллагена, наделяя его разными функциями.
Аминокислотный состав кератина отличается от коллагена, наделяя его разными функциями.
Регулируют процессы в организме
Белки регулируют многие процессы в организме. Ферменты — это тип белка, который ускоряет скорость химических реакций, включая пищеварение и репликацию ДНК.Без ферментов эти поддерживающие жизнь химические реакции происходили бы слишком медленно. Белковые гормоны также регулируют процессы в организме. Гормоны отвечают за отправку в организм сигналов, регулирующих активность клеток. Инсулин — это белковый гормон, который регулирует метаболизм, способствуя абсорбции глюкозы клетками.
Транспортные материалы
Другая функция белков в организме человека — транспортировка других материалов. Транспортные белки перемещают ионы или молекулы через биологические мембраны.Гемоглобин — это белок, который присутствует в красных кровяных тельцах.
Это транспортный белок, который переносит кислород из легких в ткани. Когда человек дышит, молекулы кислорода из воздуха выходят из легких в кровоток. В кровотоке молекулы кислорода связываются с гемоглобином, который затем транспортирует его в другие ткани тела.Гемоглобин также участвует в транспортировке углекислого газа из организма. Это называется процессом дыхания.
Баланс жидкости
Один из процессов, регулируемых белком, — это баланс жидкости в организме. Баланс жидкости описывает баланс между поступлением и выводом жидкости, позволяющий метаболическим процессам функционировать. Это необходимо в организме человека. Если баланс жидкости не поддерживается, это может привести к обезвоживанию, которое может вызвать проблемы с сердечной и почечной функциями.Белки, называемые альбумином и глобулином, вырабатываются в печени и помогают поддерживать водный баланс, притягивая и удерживая воду в крови. Альбумин также действует как транспортный белок для ферментов и гормонов в крови. Глобулин играет важную роль в функции печени и иммунной системы.
Альбумин также действует как транспортный белок для ферментов и гормонов в крови. Глобулин играет важную роль в функции печени и иммунной системы.
Помощь с иммунитетом
Белок также играет важную роль в иммунной системе. Иммунная система в организме человека представляет собой обширную сеть, содержащую множество типов клеток, органов, тканей и белков, и защищает от чужеродных захватчиков, таких как бактерии и вирусы.Первым шагом иммунного ответа является обнаружение чужеродного захватчика или антигена. Это делается с помощью специальных белков, называемых рецепторами распознавания образов (PRR). После того, как иммунная система распознает антиген, она высвобождает антитела. Антитела — это еще один тип белка, который атакует антигены. К разным антигенам вырабатываются разные антитела, поэтому, как показано на диаграмме, они имеют немного разные формы.
Иммунная система также производит другие белки, помогающие бороться с болезнями или инфекциями. К ним относятся белки комплемента и интерферон. Белки комплемента вызывают воспалительные реакции и помогают бороться с инфекциями. Интерфероны — это сигнальные белки, которые выделяются возле клеток, инфицированных вирусами. Этот сигнал заставляет близлежащие клетки повышать противовирусную защиту.
Обеспечивает энергию
Белок также может использоваться для получения энергии.Углеводы используются в качестве основного источника энергии в организме человека. Они очень легко разрушаются и, следовательно, эффективно преобразуются в энергию. Жиры также являются источником энергии, но усваиваются они гораздо медленнее, чем углеводы. Однако при недостатке углеводов или жиров человеческий организм расщепляет белки для получения энергии, что может произойти, если человек соблюдает диету с экстремальной потерей веса.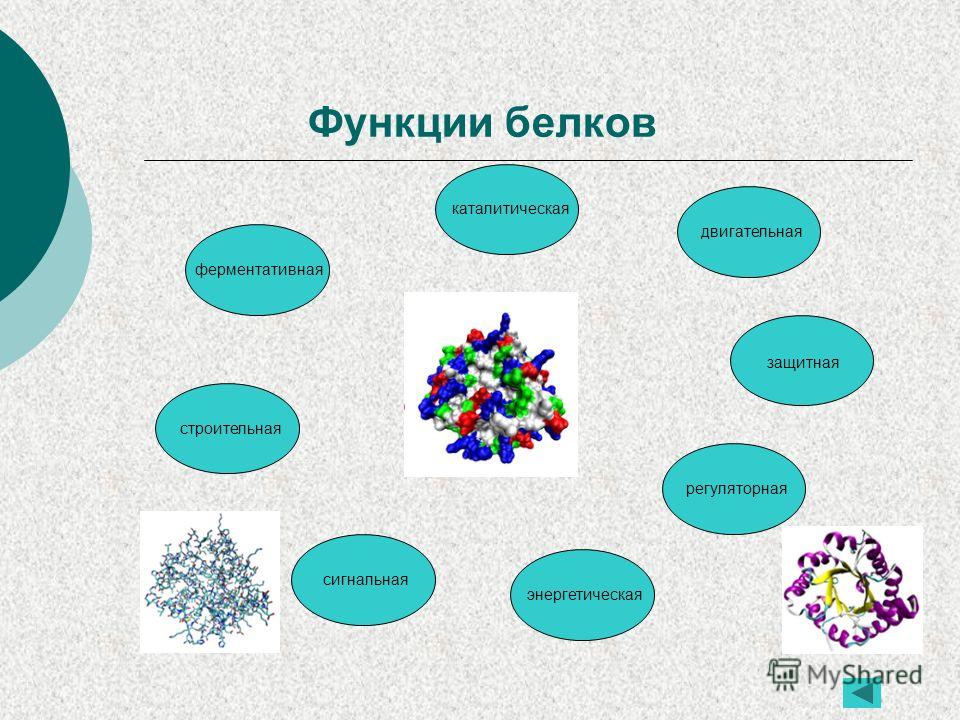
Белок расщепляется на аминокислоты и азот.Аминогруппа используется для получения энергии, а азот превращается в мочевину и выводится почками. Мочевина токсична, и ее чрезмерное производство заставляет почки работать тяжелее. Следовательно, использование белков в качестве топлива может иметь долгосрочные неблагоприятные последствия для организма.
Краткое содержание урока
Белок является жизненно важной частью всех живых клеток и выполняет множество функций в организме человека. Они состоят из аминокислоты, , а структура и состав аминокислот определяют функцию белка.Шесть основных функций белков:
- Обеспечение структуры
- Регулирующие процессы в организме
- Транспортные материалы
- Балансировочные жидкости
- Помощь с иммунитетом
- Обеспечение энергией
Кератин и коллаген — два примера структурных белков. Кератин присутствует в волосах и коже, а коллаген присутствует в соединительных тканях. Гормоны , такие как инсулин, регулируют процессы в организме и активность клеток, передавая сигналы по всему телу. Ферменты также помогают регулировать процессы в организме, ускоряя химические процессы, такие как пищеварение. Гемоглобин является примером транспортного белка, который переносит кислород из легких по всему телу. Некоторые белки также действуют как антитела и атакуют чужеродных захватчиков, таких как бактерии или вирусы.
Гормоны , такие как инсулин, регулируют процессы в организме и активность клеток, передавая сигналы по всему телу. Ферменты также помогают регулировать процессы в организме, ускоряя химические процессы, такие как пищеварение. Гемоглобин является примером транспортного белка, который переносит кислород из легких по всему телу. Некоторые белки также действуют как антитела и атакуют чужеродных захватчиков, таких как бактерии или вирусы.
В отсутствие других источников энергии, таких как углеводы и жиры, белок может расщепляться с образованием энергии. Это может произойти, когда человек соблюдает диету для сильного похудания.
Почему белок важен в вашем рационе?
Достаточно ли белка в вашем рационе? Хотя вы можете следить за потреблением калорий, сахара и соли, вам также следует убедиться, что вы потребляете достаточно белка. Он играет ключевую роль в создании и поддержании каждой клетки нашего тела. Он питает наши клетки и питает наши тела.
Нэнси Вальдек, шеф-повар и диетолог семейного онкологического центра Томаса Ф. Чепмена в Пьемонте, отмечает, что наши тела не накапливают белок.
«Людям важно потреблять белок каждый день. Ежедневное потребление белка играет важную роль в поддержании ваших клеток в хорошей форме и должно быть частью вашего ежедневного плана поддержания здоровья ».
Белок состоит из аминокислот, широко известных как строительные блоки, поскольку они связаны длинными цепями. Он также считается «макроэлементом», что означает, что вам нужно относительно большое его количество, чтобы оставаться здоровым.
Зачем вашему организму белок
Вот пять веских причин, по которым вы должны получать достаточно белка каждый день:
1.Строить. Белок является важным строительным материалом для костей, мышц, хрящей и кожи. Фактически, ваши волосы и ногти в основном состоят из белка.
2. Ремонт. Ваше тело использует его для создания и восстановления тканей.
3. Кислород. Красные кровяные тельца содержат белковое соединение, переносящее кислород по всему телу. Это помогает снабжать все ваше тело необходимыми питательными веществами.
4. Дайджест. Около половины диетического белка, который вы потребляете каждый день, идет на выработку ферментов, которые помогают переваривать пищу, а также производить новые клетки и химические вещества в организме.
5. Регулируйте. Белок играет важную роль в регуляции гормонов, особенно во время трансформации и развития клеток в период полового созревания.
Как белок помогает оставаться в форме
Употребление в пищу продуктов с высоким содержанием белка имеет много преимуществ для фитнеса, в том числе:
- Ускорение восстановления после тренировки и / или травмы
- Снижение потери мышечной массы
- Наращивание мышечной массы
- Помогаем поддерживать нормальный вес
- Сдерживание голода
Вальдек отмечает еще одно преимущество протеина — он быстрее насытит.
«Протеин плюс клетчатка дольше сохраняет нас сытыми, а это значит, что вы не чувствуете желания есть так часто. Это помогает снизить вес, одновременно обеспечивая наши клетки необходимыми питательными веществами ».
Щелкните здесь, чтобы получить дополнительные советы по питанию.
Вам нужно записаться на прием к врачу из Пьемонта? Экономьте время, бронируйте онлайн.
белка | Источник питания
Белок является важным макроэлементом, но не все пищевые источники белка одинаковы, и вам может не понадобиться столько, сколько вы думаете.Изучите основы белковой пищи и составьте свой рацион с помощью здоровой белковой пищи.
Перейти к:
–Что такое белок?
–Сколько мне нужно белка?
–Это все о белковом «пакете»
–Исследования белков и здоровья человека
–Белковые продукты и планета
– Итог: выбор здоровой белковой пищи
— [Викторина] Проверьте свои знания о белках!
Что такое белок?
Белок содержится во всем теле — в мышцах, костях, коже, волосах и практически во всех других частях или тканях тела.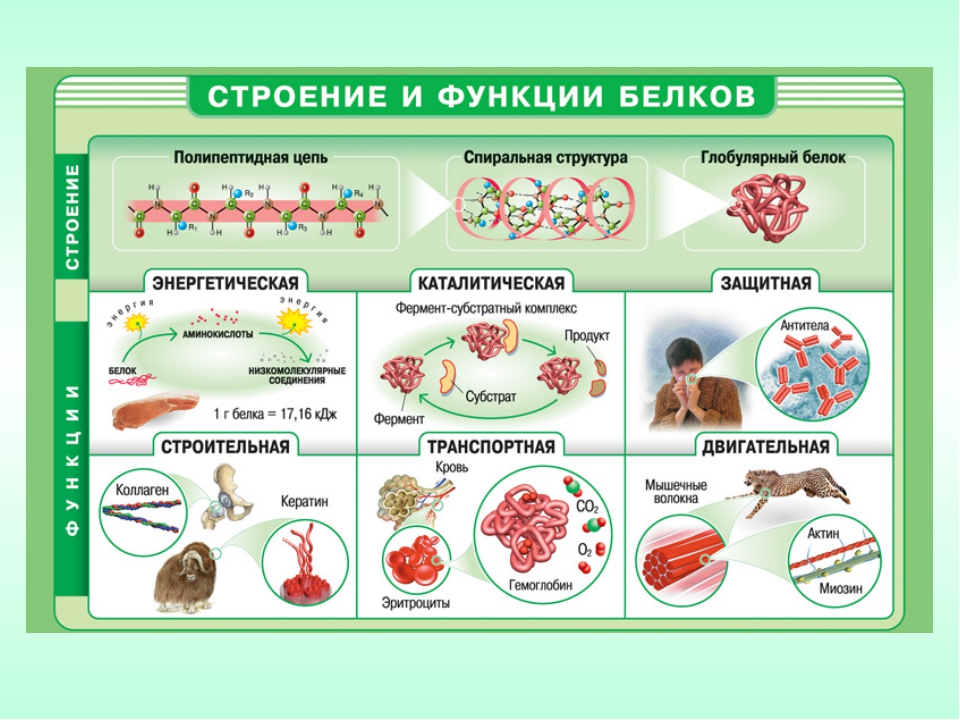 Он составляет ферменты, которые запускают многие химические реакции, и гемоглобин, переносящий кислород в вашу кровь. По крайней мере, 10 000 различных белков делают вас тем, что вы есть, и удерживают вас в таком состоянии.
Он составляет ферменты, которые запускают многие химические реакции, и гемоглобин, переносящий кислород в вашу кровь. По крайней мере, 10 000 различных белков делают вас тем, что вы есть, и удерживают вас в таком состоянии.
Белок состоит из более чем двадцати основных строительных блоков, называемых аминокислотами. Поскольку мы не храним аминокислоты, наш организм производит их двумя разными способами: либо с нуля, либо путем модификации других. Девять аминокислот — гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин — известных как незаменимые аминокислоты, должны поступать с пищей.
Сколько протеина мне нужно?
Национальная академия медицины рекомендует взрослым получать минимум 0,8 грамма белка на каждый килограмм веса тела в день или , чуть более 7 граммов на каждые 20 фунтов веса тела . [1]
- Для человека весом 140 фунтов это означает около 50 граммов белка в день.
- Для человека весом 200 фунтов это означает около 70 граммов белка в день.

Национальная медицинская академия также устанавливает широкий диапазон допустимого потребления белка — от 10% до 35% калорий каждый день.Помимо этого, существует относительно мало достоверной информации об идеальном количестве белка в рационе или о самом здоровом целевом показателе калорий, вносимых белком. В анализе, проведенном в Гарварде среди более чем 130 000 мужчин и женщин, за которыми наблюдали до 32 лет, процент калорий от общего потребления белка не был связан с общей смертностью или конкретными причинами смерти. [2] Однако источник белка был важен.
Что такое «полные» белки и сколько мне нужно? «Чистый» белок, полученный из растительной или животной пищи, вероятно, оказывает аналогичное воздействие на здоровье, хотя сочетание аминокислот может иметь последствия для здоровья.Некоторые белки, содержащиеся в пище, являются «полноценными», что означает, что они содержат все двадцать с лишним типов аминокислот, необходимых для производства нового белка в организме.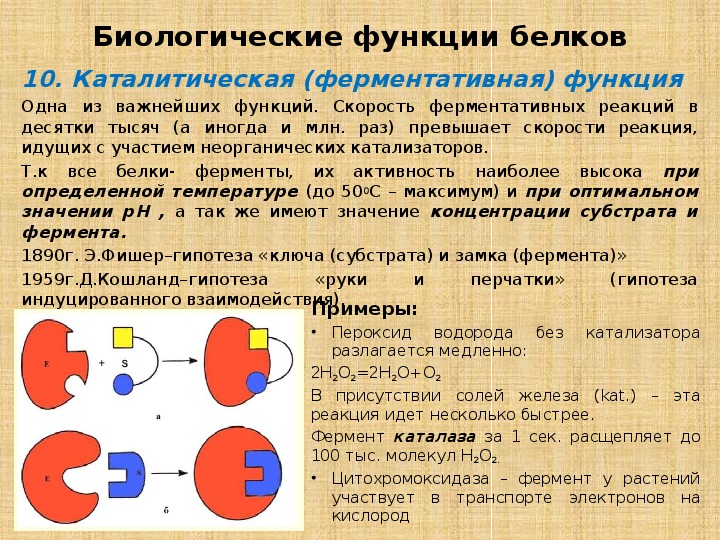 Другие неполноценны, в них отсутствует одна или несколько из девяти незаменимых аминокислот, которые наш организм не может произвести с нуля или из других аминокислот. Продукты животного происхождения (мясо, птица, рыба, яйца и молочные продукты), как правило, являются хорошими источниками полноценного белка, в то время как продукты растительного происхождения (фрукты, овощи, зерна, орехи и семена) часто не имеют одного или нескольких незаменимых аминокислот. кислота.Те, кто воздерживается от пищи животного происхождения, могут каждый день употреблять в пищу различные белковые растительные продукты, чтобы получить все аминокислоты, необходимые для производства нового белка, а также выбрать полноценные растительные белки, такие как семена киноа и чиа.
Другие неполноценны, в них отсутствует одна или несколько из девяти незаменимых аминокислот, которые наш организм не может произвести с нуля или из других аминокислот. Продукты животного происхождения (мясо, птица, рыба, яйца и молочные продукты), как правило, являются хорошими источниками полноценного белка, в то время как продукты растительного происхождения (фрукты, овощи, зерна, орехи и семена) часто не имеют одного или нескольких незаменимых аминокислот. кислота.Те, кто воздерживается от пищи животного происхождения, могут каждый день употреблять в пищу различные белковые растительные продукты, чтобы получить все аминокислоты, необходимые для производства нового белка, а также выбрать полноценные растительные белки, такие как семена киноа и чиа.
Важно отметить, что миллионы людей во всем мире, особенно дети младшего возраста, не получают достаточного количества белка из-за отсутствия продовольственной безопасности. Последствия белковой недостаточности и недоедания варьируются по степени тяжести от задержки роста и потери мышечной массы до снижения иммунитета, ослабления сердца и дыхательной системы и смерти.
Однако здоровые взрослые люди в США и большинстве других развитых стран редко испытывают дефицит, потому что там изобилие продуктов растительного и животного происхождения, богатых белком. Фактически, многие в США потребляют более чем достаточно белка, особенно из продуктов животного происхождения. [3]
Все дело в протеиновой «упаковке»
Когда мы едим пищу для получения белка, мы также едим все, что с ней связано: различные жиры, клетчатку, натрий и многое другое. Именно этот протеиновый «пакет» может иметь значение для здоровья.
В приведенной ниже таблице показан образец пищевых «упаковок», отсортированных по содержанию белка, а также ряд компонентов, которые поставляются с ними.
Таблица: Сравнение протеиновых пакетов
Чтобы назвать несколько примеров:
- Стейк из жареной вырезки весом 4 унции — отличный источник белка — его стоит около 33 граммов. Но он также содержит около 5 граммов насыщенных жиров.
- В стейке ветчины на 4 унции с 22 граммами белка всего 1,6 грамма насыщенных жиров, но при этом он содержит 1500 миллиграммов натрия.

- 4 унции жареной нерки на гриле содержат около 30 граммов белка с низким содержанием натрия и чуть более 1 грамма насыщенных жиров. Лосось и другая жирная рыба также являются отличными источниками жиров омега-3, которые особенно полезны для сердца.
- Чашка вареной чечевицы содержит около 18 граммов белка и 15 граммов клетчатки и практически не содержит насыщенных жиров или натрия.
Сухой протеин может поступать из различных источников, включая яйца, молоко (например,g., казеин, сыворотка) и растения (например, соя, горох, конопля). Некоторые протеиновые порошки содержат протеин из нескольких источников; например, веганский вариант может включать белок, полученный из гороха, семян тыквы, семян подсолнечника и люцерны. Как и другие пищевые добавки, протеиновые порошки не регулируются Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в целях безопасности. Они часто могут содержать небелковые ингредиенты, включая витамины и минералы, загустители, добавленные сахара, некалорийные подсластители и искусственные ароматизаторы.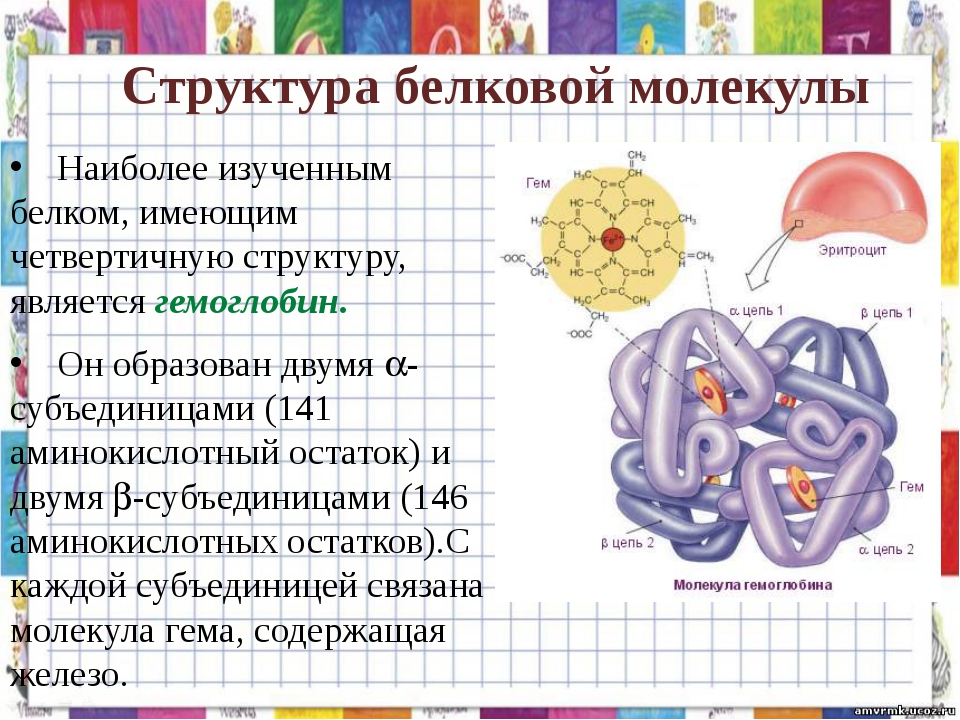 Если вы решите употреблять протеиновый порошок, важно заранее прочитать этикетки с питанием и ингредиентами, поскольку продукты могут содержать неожиданные ингредиенты и большое количество добавленных сахаров и калорий.
Если вы решите употреблять протеиновый порошок, важно заранее прочитать этикетки с питанием и ингредиентами, поскольку продукты могут содержать неожиданные ингредиенты и большое количество добавленных сахаров и калорий.
Исследования белков и здоровья
Имеющиеся данные показывают, что для нашего здоровья, вероятно, важен источник белка (или белковая «упаковка»), а не количество белка.Вы можете изучить исследования, связанные с каждым заболеванием, на вкладках ниже, но вот вывод, основанный на фактах: употребление в пищу здоровых источников белка, таких как бобы, орехи, рыба или птица, вместо красного мяса и обработанного мяса может снизить риск нескольких заболеваний. и преждевременная смерть.
Болезнь сердца Исследования, проведенные Гарвардской школой общественного здравоохранения Чана, показали, что регулярное употребление даже небольшого количества красного мяса, особенно обработанного красного мяса, связано с повышенным риском сердечных заболеваний и инсульта, а также с риском смерти от сердечно-сосудистых заболеваний или по любой другой причине. [4-6] И наоборот, замена красного и обработанного красного мяса полезными источниками белка, такими как бобы, соевые продукты, орехи, рыба или птица, по-видимому, снижает эти риски. Одна из причин, по которой растительные источники белка связаны с более низким риском сердечно-сосудистых заболеваний по сравнению с белком из красного мяса и молочных продуктов, заключается в том, что эти белковые пакеты содержат разные типы жиров. Источники белка растительного происхождения являются более ненасыщенными, что снижает уровень холестерина ЛПНП — установленного фактора риска сердечных заболеваний. Также растительные источники не содержат холестерина.Другие факторы могут способствовать снижению риска, но это ключевой фактор.
[4-6] И наоборот, замена красного и обработанного красного мяса полезными источниками белка, такими как бобы, соевые продукты, орехи, рыба или птица, по-видимому, снижает эти риски. Одна из причин, по которой растительные источники белка связаны с более низким риском сердечно-сосудистых заболеваний по сравнению с белком из красного мяса и молочных продуктов, заключается в том, что эти белковые пакеты содержат разные типы жиров. Источники белка растительного происхождения являются более ненасыщенными, что снижает уровень холестерина ЛПНП — установленного фактора риска сердечных заболеваний. Также растительные источники не содержат холестерина.Другие факторы могут способствовать снижению риска, но это ключевой фактор.
- Одно исследование отслеживало 120 000 мужчин и женщин, включенных в исследование медсестер и последующее наблюдение медицинских работников на протяжении более двух десятилетий. На каждые дополнительные 3 унции необработанного красного мяса, которые участники исследования потребляли каждый день, их риск смерти от сердечно-сосудистых заболеваний увеличивался на 13%.
 [5]
[5]- Обработанное красное мясо было еще более тесно связано со смертью от сердечно-сосудистых заболеваний — и в меньших количествах: каждые дополнительные 1.Ежедневное употребление 5 унций обработанного красного мяса (эквивалент одного хот-дога или двух полосок бекона) было связано с 20% увеличением риска смерти от сердечно-сосудистых заболеваний.
- Сокращение употребления красного мяса может спасти жизни: исследователи подсчитали, что если бы все мужчины и женщины, участвовавшие в исследовании, сократили общее потребление красного и переработанного красного мяса до менее половины порции в день, каждый десятый умерший от сердечно-сосудистых заболеваний имел бы было предотвращено.
- В другом исследовании с участием 43 000 мужчин, изучавшего как количество, так и источники белка, было обнаружено, что потребление общего белка было минимально связано с риском сердечных заболеваний, но потребление белка из красного мяса было связано с более высоким риском.
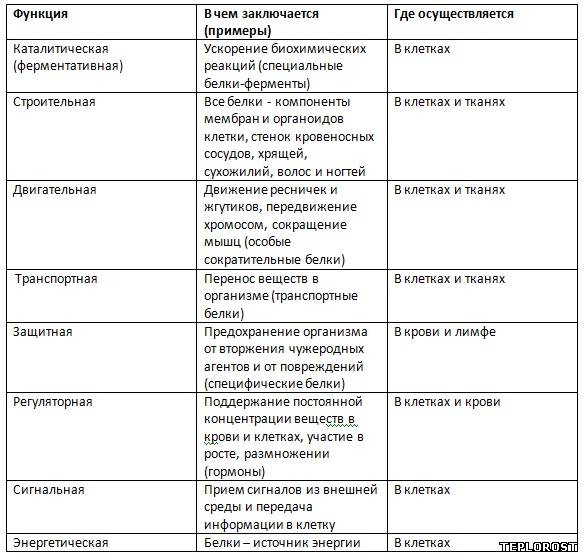 [7]
[7]
- Другое исследование — первый метаанализ рандомизированных контролируемых испытаний, изучающих влияние красного мяса на здоровье путем замены его другими конкретными типами продуктов питания, — обнаружило, что диеты, в которых красное мясо заменяется здоровыми растительными белками, приводят к снижению факторов риска. при сердечно-сосудистых заболеваниях. [28]
- В исследование были включены данные 36 рандомизированных контролируемых испытаний с участием 1803 человека. Исследователи сравнили людей, которые придерживались диеты с красным мясом, с людьми, которые ели больше других видов пищи (т.е. курица, рыба, углеводы или растительные белки, такие как бобовые, соя или орехи), глядя на концентрацию холестерина, триглицеридов, липопротеинов и артериальное давление в крови — все это факторы риска сердечно-сосудистых заболеваний.
- Исследователи обнаружили, что при сравнении диеты с красным мясом со всеми другими типами диет, вместе взятых, не было значительных различий в общем холестерине, липопротеинах или артериальном давлении, хотя диеты с более высоким содержанием красного мяса действительно приводили к более высоким концентрациям триглицеридов, чем диеты сравнения.
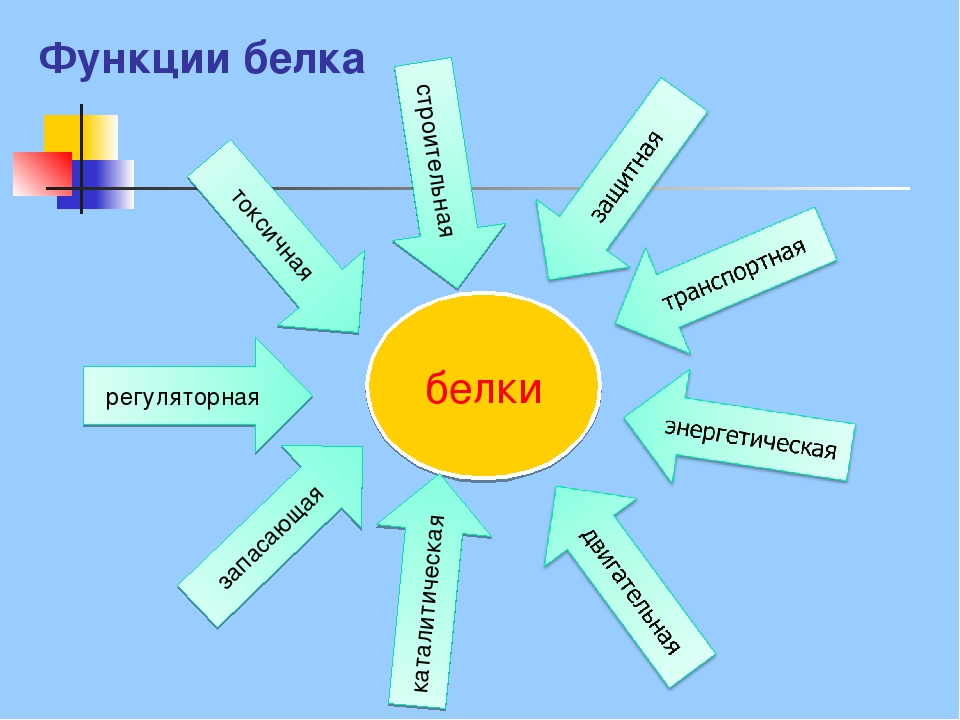 .
. - Однако исследователи обнаружили, что диета с более высоким содержанием высококачественных источников растительного белка, таких как бобовые, соя и орехи, приводит к более низким уровням как общего, так и ЛПНП («плохого») холестерина по сравнению с диетами с красным мясом.
Что касается количества потребленного белка , то есть доказательства того, что относительно высокобелковая диета может быть полезной для сердца, если белок поступает из здорового источника.
- 20-летнее проспективное исследование с участием более 80000 женщин показало, что у тех, кто придерживался низкоуглеводной диеты с высоким содержанием растительных жиров и белков, риск сердечных заболеваний на 30% ниже, чем у женщин, которые ели высокоуглеводные. , нежирные диеты.[8] Однако низкоуглеводная диета с высоким содержанием животных жиров или белков не обеспечивала такой защиты.
- Еще одно доказательство пользы здорового белка вместо углеводов для сердца было получено в рандомизированном исследовании, известном как «Исследование оптимального потребления макроэлементов для здоровья сердца» (OmniHeart).
 Здоровая диета, в которой часть углеводов заменяется здоровым белком (или здоровым жиром), лучше справляется с понижением артериального давления и вредным холестерином липопротеинов низкой плотности (ЛПНП), чем диета с более высоким содержанием углеводов.[9]
Здоровая диета, в которой часть углеводов заменяется здоровым белком (или здоровым жиром), лучше справляется с понижением артериального давления и вредным холестерином липопротеинов низкой плотности (ЛПНП), чем диета с более высоким содержанием углеводов.[9] - Точно так же в исследовании по снижению веса «EcoAtkins» сравнивали вегетарианскую диету с низким содержанием жиров и высоким содержанием углеводов с веганской диетой с низким содержанием углеводов, которая была богата растительными белками и жирами. Хотя потеря веса на двух диетах была одинаковой, участники исследования, соблюдающие диету с высоким содержанием белка, отметили улучшение липидов в крови и артериального давления. [10]
- Конечно, иногда исследование генерирует заголовки, потому что оно дает противоположный результат. Например, одно исследование шведских женщин, которые придерживались диеты с низким содержанием углеводов и высоким содержанием белка, имели более высокие показатели сердечно-сосудистых заболеваний и смертности, чем те, кто придерживался диеты с низким содержанием белка и высоким содержанием углеводов.
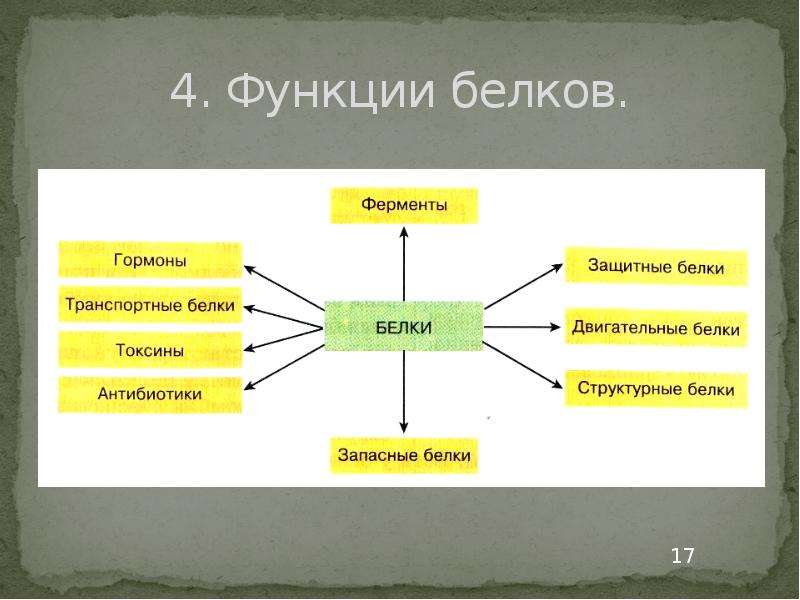 [11] Но в исследовании, в котором диета женщин оценивалась только один раз, а затем следовали за ними в течение 15 лет, не рассматривалось, какие типы углеводов или какие источники протеина ели эти женщины. Это было важно, потому что большая часть женского белка поступала из животных источников.
[11] Но в исследовании, в котором диета женщин оценивалась только один раз, а затем следовали за ними в течение 15 лет, не рассматривалось, какие типы углеводов или какие источники протеина ели эти женщины. Это было важно, потому что большая часть женского белка поступала из животных источников.
Опять же, источник белка имеет большее значение, чем количество белка, когда речь идет о риске диабета. Употребление большего количества красного мяса прогнозирует более высокий риск развития диабета 2 типа, в то время как употребление орехов, бобовых и птицы связано с меньшим риском.
- Исследование 2011 года показало, что люди, которые ели диету с высоким содержанием красного мяса, особенно переработанного красного мяса, имели более высокий риск развития диабета 2 типа, чем те, кто редко ел красное или переработанное мясо. [12] За каждую дополнительную дневную порцию красного мяса или обработанного красного мяса, которое ели участники исследования, их риск диабета увеличивался на 12% и 32% соответственно.
 Исследователи также обнаружили, что замена порции красного мяса одной порцией орехов, нежирных молочных продуктов или цельнозерновых продуктов каждый день, по оценкам, снижает риск диабета 2 типа на 16-35%.
Исследователи также обнаружили, что замена порции красного мяса одной порцией орехов, нежирных молочных продуктов или цельнозерновых продуктов каждый день, по оценкам, снижает риск диабета 2 типа на 16-35%. - Сопутствующее исследование также показало, что люди, которые начали есть больше красного мяса, чем обычно, имели на 50% более высокий риск развития диабета 2 типа в течение следующих четырех лет, и исследователи также обнаружили, что у тех, кто сократил потребление красного мяса, был на 14% ниже риск развития диабета 2 типа. риск диабета 2 типа в течение 10-летнего периода наблюдения. [13]
- Способ приготовления мяса также может повлиять на риск диабета 2 типа. В исследовании, в котором отслеживалось состояние здоровья более 289000 мужчин и женщин, исследователи обнаружили, что люди, которые чаще всего ели красное мясо и курицу, приготовленную при высоких температурах, были 1.Вероятность развития диабета 2 типа в 5 раз выше, чем у тех, кто меньше всего ел. Также был повышенный риск набора веса и развития ожирения у тех, кто часто пользовался высокотемпературными методами приготовления пищи, что могло способствовать развитию диабета.
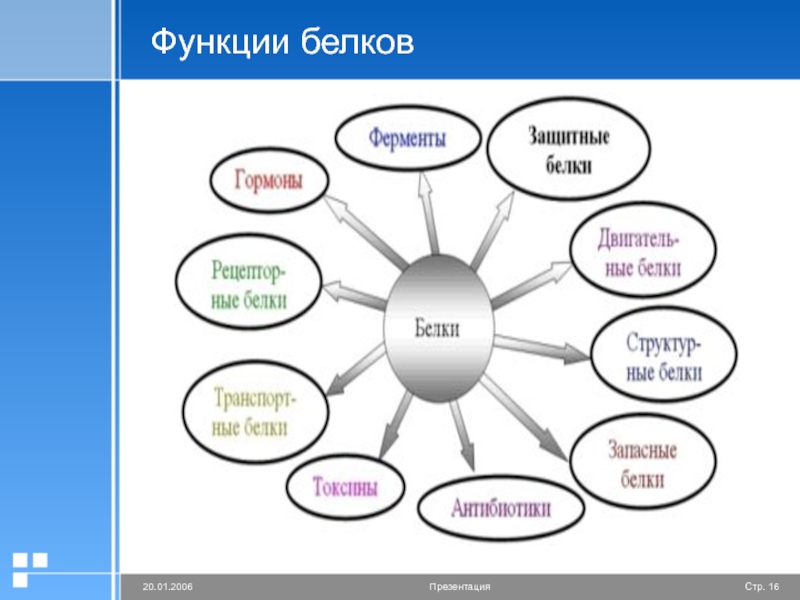 Следует отметить, что это исследование показало, что методы приготовления пищи могут способствовать риску диабета, помимо последствий употребления только мяса. [14] Подробнее об этом исследовании .
Следует отметить, что это исследование показало, что методы приготовления пищи могут способствовать риску диабета, помимо последствий употребления только мяса. [14] Подробнее об этом исследовании . - Дополнительные доказательства того, что источник белка имеет значение, получены из 20-летнего исследования, в котором изучалась взаимосвязь между низкоуглеводными диетами и диабетом 2 типа у женщин.Низкоуглеводные диеты с высоким содержанием растительных жиров и белков были связаны с более низким риском диабета 2 типа. [15] Но низкоуглеводные диеты с высоким содержанием белков или жиров животного происхождения не показали этого преимущества.
- Для диабета 1 типа (ранее называвшегося ювенильным или инсулинозависимым диабетом) белки, обнаруженные в коровьем молоке, участвовали в развитии заболевания у детей с предрасположенностью к этому заболеванию, но исследования остаются безрезультатными.[16,17]
Когда дело доходит до рака, опять же, источник белка , кажется, имеет большее значение, чем количество.
- В исследовании медсестер и последующем исследовании медицинских работников каждая дополнительная порция в день красного мяса или обработанного красного мяса была связана с повышением риска смерти от рака на 10% и 16% соответственно. [5]
- В октябре 2015 года Международное агентство по изучению рака (IARC) Всемирной организации здравоохранения (ВОЗ) пришло к выводу, что потребление переработанного мяса «канцерогенно для человека», а потребление красного мяса «вероятно, канцерогенно для человека».[18] Рабочая группа МАИР (в которую вошли 22 ученых из десяти стран) пришла к таким выводам на основе оценки более 800 исследований.
- Выводы были в основном основаны на доказательствах колоректального рака . Данные также показали положительную связь между потреблением обработанного мяса и раком желудка , а также между потреблением красного мяса и раком поджелудочной железы и раком простаты .
- Исследование 2014 года также обнаружило связь между высоким потреблением красного мяса в подростковом возрасте и пременопаузальным раком груди, в то время как более высокое потребление птицы, орехов и бобовых было связано с более низким риском.Используя данные о здоровье 89000 женщин (в возрасте от 24 до 43 лет), за которыми наблюдали в течение 20-летнего периода, исследователи обнаружили на 22% более высокий риск рака груди у тех, кто ел 1,5 порции красного мяса в день во время учебы в старшей школе. по сравнению с теми, у кого была только одна порция в неделю. Кажется, что каждая дополнительная ежедневная порция красного мяса увеличивает риск рака груди еще на 13%. [19]
- Способ приготовления мяса также может иметь значение для риска рака. При жарке при высокой температуре в мясе образуются потенциально вызывающие рак соединения, в том числе полициклические ароматические углеводороды и гетероциклические амины. Узнайте о советах по приготовлению здорового блюда на гриле.
- В 2016 году исследователи проанализировали потребление белка более чем 131 000 женщин и мужчин в рамках исследования медсестер и последующего наблюдения медицинских работников. Проследив свой рацион в течение 32 лет, авторы обнаружили, что более высокое потребление красного мяса, особенно обработанных его разновидностей (колбаса, бекон, хот-доги, салями), было связано с умеренно более высоким риском смерти при более высоком потреблении белка. от растительной пищи несут меньший риск.[2] Подробнее об этом исследовании.
- Перевариваемый белок выделяет кислоты в кровоток, которые организм обычно нейтрализует с помощью кальция и других буферных агентов. В результате ранние исследования предположили, что потребление большого количества белка требует гораздо большего количества кальция, который может быть извлечен из костей. Систематический обзор 2009 года показал, что этого не происходит. [20]
Те же здоровые белковые продукты, которые являются хорошим выбором для профилактики болезней, также могут помочь в контроле веса.Опять же, имеет значение источник белка .
- Исследователи из Гарвардской школы общественного здравоохранения Чана наблюдали за диетой и образом жизни более 120 000 мужчин и женщин в течение 20 лет, изучая, как небольшие изменения способствовали увеличению веса с течением времени. [21]
- Те, кто ел больше красного и обработанного мяса в ходе исследования, набирали больше веса, примерно на один лишний фунт каждые четыре года, в то время как те, кто ел больше орехов в ходе исследования, набирали меньше веса, примерно на полфунта меньше каждые четыре года. четыре года.
- Последующий подробный анализ этой когорты также показал, что употребление красного мяса, курицы с кожей и обычного сыра было связано с большим набором веса. Йогурт, арахисовое масло, грецкие орехи и другие орехи, курица без кожи, нежирный сыр и морепродукты были связаны с меньшим набором веса. [22]
- Другое исследование показало, что употребление около одной ежедневной порции фасоли, нута, чечевицы или гороха может увеличить чувство насыщения, что может привести к лучшему контролю веса и потере веса.[23]
Нет нужды переусердствовать с белком. Хотя некоторые исследования показывают преимущества диеты с высоким содержанием белка и низким содержанием углеводов в краткосрочной перспективе (например, палеодиета), отказ от фруктов и цельнозерновых продуктов означает отсутствие здоровой клетчатки, витаминов, минералов и других фитонутриентов.
Другие соображения, связанные с белком- Определенные белки в пище и окружающей среде участвуют в пищевой аллергии, которая является чрезмерной реакцией иммунной системы (например, глютен и глютеновая болезнь).
- Медицинские журналы также пестрят сообщениями, связывающими аллергические реакции на определенные источники белка с различными состояниями (проблемы с дыханием, хронические проблемы с пищеварением и т. Д.). Яйца, рыба, молоко, арахис, древесные орехи и соевые бобы вызывают у некоторых людей аллергические реакции.
- Лица, у которых диагностированы определенные заболевания (например, заболевания почек и печени), должны контролировать потребление белка в соответствии с рекомендациями своего врача.
- Возможно, вы также слышали, что использование антибиотиков в производстве продуктов животного происхождения способствовало появлению «супербактерий» или штаммов бактерий, устойчивых к доступным в настоящее время антибиотикам.В 2016 году FDA объявило о добровольной программе по ограничению рутинного использования антибиотиков в производстве продуктов питания (например, введение антибиотиков здоровым животным, чтобы помочь им быстрее расти). [24] Как потребитель, вы, возможно, захотите найти продукты, «выращенные без антибиотиков», если планируете есть мясо. У одних компаний этот язык есть на упаковке, у других — нет.
Белковые продукты и планета
Точно так же, как разные продукты могут по-разному влиять на здоровье человека, они также по-разному влияют на окружающую среду.Сельское хозяйство является основным источником выбросов парниковых газов (ПГ) во всем мире, накопление которых приводит к изменению климата с беспрецедентной скоростью в истории человечества. Однако не все продукты имеют одинаковое воздействие. Производство продуктов животного происхождения, как правило, приводит к более высоким выбросам парниковых газов, чем производство продуктов растительного происхождения, а молочные продукты и особенно красное мясо (особенно говядина, баранина и коза) выделяются своим непропорциональным воздействием.- Источник: Институт мировых ресурсов, www.wri.org/proteinscorecard
Чтобы дать вам представление, эта «оценочная карта» от Института мировых ресурсов иллюстрирует различные выбросы парниковых газов на грамм белка как из продуктов животного происхождения, так и из растительных белковых продуктов. [25] При приготовлении всего одного фунта (454 грамма) ягненка образуется в пять раз больше парниковых газов, чем при приготовлении фунта курицы, и примерно в 30 раз больше, чем при приготовлении фунта чечевицы. [26] Только в США на говядину приходится 36% всех выбросов парниковых газов, связанных с пищевыми продуктами. [27] Помимо выбросов, важно также отметить, что производство продуктов питания предъявляет огромные требования к нашим природным ресурсам, поскольку сельское хозяйство является основным фактором вырубки лесов, исчезновения видов, истощения и загрязнения пресной воды.
Узнайте больше о влиянии различных продуктов на вашу тарелку.Итог
Белок — ключевая часть любой диеты. В среднем человеку требуется около 7 граммов белка каждый день на каждые 20 фунтов веса тела. Поскольку белок содержится в большом количестве продуктов, многие люди могут легко достичь этой цели. Однако не все белковые «пакеты» созданы равными. Поскольку продукты содержат намного больше, чем белок, важно обращать внимание на то, что еще с ними связано. Вот почему тарелка здорового питания поощряет выбор здоровой белковой пищи.
Основываясь на этом общем руководстве, вот несколько дополнительных деталей и советов по формированию своего рациона с оптимальным выбором белков:
- По возможности получайте белок из растений . Употребление в пищу бобовых (фасоль и горох), орехов, семян, цельного зерна и других растительных источников белка — это победа для вашего здоровья и здоровья всей планеты. Если большая часть вашего белка поступает из растений, убедитесь, что вы смешиваете свои источники, чтобы не пропустить «важные» компоненты белка.Хорошая новость заключается в том, что царство растений предлагает множество вариантов, которые можно смешивать и сочетать. Вот несколько примеров для каждой категории:
- Бобовые: чечевица, фасоль (адзуки, черная, фава, нут / гарбанзо, почка, лима, маш, пинто и т. Д.), Горох (зеленый, снежный, щелчковый, расколотый и т. Д.), Эдамаме / соевые бобы (и продукты из сои: тофу, темпе и др.), арахис.
- Орехи и семена: миндаль, фисташки, кешью, грецкие орехи, фундук, орехи пекан, семена конопли, тыквенные и тыквенные семечки, семена подсолнечника, семена льна, семена кунжута, семена чиа.
- Цельнозерновые: камут, теф, пшеница, киноа, рис, дикий рис, просо, овес, гречка,
- Прочее: Хотя многие овощи и фрукты содержат определенный уровень белка, его обычно меньше, чем в других растительных продуктах. Некоторые примеры с более высоким содержанием белка включают кукурузу, брокколи, спаржу, брюссельскую капусту и артишоки.
Простые стратегии для создания сытных, вкусных и даже недорогих блюд на растительной основе.
- Обновите источники животного белка . Когда речь идет о продуктах животного происхождения, особенно важно учитывать белковый состав:
- Как правило, лучше всего подходят птицы, (курица, индейка, утка) и различные морепродукты , (рыба, ракообразные, моллюски). Яйца тоже могут быть хорошим выбором.
- Если вам нравится молочных продуктов , лучше всего делать это в умеренных количествах (подумайте, что ближе к 1-2 порциям в день; возможно, употребление йогурта будет лучшим выбором, чем получение всех порций из молока или сыра).
- Красное мясо , которое включает необработанную говядину, свинину, баранину, телятину, баранину и козлятину, следует потреблять в более ограниченных масштабах. Если вам нравится красное мясо, подумайте о том, чтобы есть его в небольших количествах или только в особых случаях.
- Обработанное мясо , такое как бекон, хот-доги, колбасы и мясное ассорти, следует избегать. Хотя эти продукты часто делаются из красного мяса, обработанное мясо также включает такие продукты, как бекон из индейки, куриные колбасы и нарезанные кусочками курицу и ветчину.(Обработанное мясо относится к любому мясу, которое было «преобразовано путем соления, консервирования, ферментации, копчения или других процессов для улучшения вкуса или улучшения консервации» [18]).
Хотите уменьшить количество красного и обработанного мяса, но не знаете, с чего начать? Вот несколько подходов к сокращению потребления при сохранении насыщенности и вкуса блюд. Просто найдите свою «отправную точку» и двигайтесь вперед, используя подходящие для вас стратегии:
Оцените, как часто вы едите красное мясо, и посмотрите, может ли одна из этих стратегий помочь вам найти способ немного сократить.
Если вы думаете о еде, в состав которой входит красное мясо, подумайте, можете ли вы заменить его лучшим вариантом, например, птицей или морепродуктами.
Этот подход способствует развитию здоровой растительной пищи, такой как бобы, орехи, цельнозерновые и другие овощи, но при этом дает возможность включить в рацион некоторые из ваших любимых продуктов животного происхождения.
Проверьте свои знания о белках!
Готовы узнать, что вы знаете о белке и здоровой белковой пище? Попробуйте эту викторину из 10 вопросов, чтобы узнать:
Ссылки- Национальные академии медицины. Нормы потребления энергии, углеводов, клетчатки, жиров, жирных кислот, холестерина, белков и аминокислот (макроэлементов).
- Song M, Fung TT, Hu FB, Willett WC, Longo VD, Chan AT, Giovannucci EL. Связь потребления животного и растительного белка со смертностью от всех причин и от конкретных причин. Внутренняя медицина JAMA . 2016 1 октября; 176 (10): 1453-63.
- Fehrenbach KS, Righter AC, Santo RE. Критический анализ доступных источников данных для оценки потребления мяса и белка в США. Общественное питание . 2016 июн; 19 (8): 1358-67.
- Бернштейн А.М., Сан К., Ху Ф. Б., Штампфер М. Дж., Мэнсон Дж. Э., Виллетт В. Основные источники белка в пище и риск ишемической болезни сердца у женщин. Тираж . 31 августа 2010 г .; 122 (9): 876-83.
- Pan A, Sun Q, Bernstein AM, Schulze MB, Manson JE, Stampfer MJ, Willett WC, Hu FB. Потребление красного мяса и смертность: результаты 2 проспективных когортных исследований. Архив внутренней медицины . 2012 9 апреля; 172 (7): 555-63.
- Bernstein AM, Pan A, Rexrode KM, Stampfer M, Hu FB, Mozaffarian D, Willett WC. Источники диетического белка и риск инсульта у мужчин и женщин. Ход . 2011 1 января: СТРОКЕГА-111.
- Preis SR, Stampfer MJ, Spiegelman D, Willett WC, Rimm EB. Диетический белок и риск ишемической болезни сердца у мужчин среднего возраста–. Американский журнал клинического питания . 2010, 29 сентября; 92 (5): 1265-72.
- Halton TL, Willett WC, Liu S, Manson JE, Albert CM, Rexrode K, Hu FB.Оценка низкоуглеводной диеты и риск ишемической болезни сердца у женщин. Медицинский журнал Новой Англии . 2006 9 ноября; 355 (19): 1991-2002.
- Appel LJ, Sacks FM, Carey VJ, Obarzanek E, Swain JF, Miller ER, Conlin PR, Erlinger TP, Rosner BA, Laranjo NM, Charleston J. Влияние потребления белков, мононенасыщенных жиров и углеводов на артериальное давление и липиды сыворотки крови : результаты рандомизированного исследования OmniHeart. ЯМА . 2005 16 ноября; 294 (19): 2455-64.
- Jenkins DJ, Wong JM, Kendall CW, Esfahani A, Ng VW, Leong TC, Faulkner DA, Vidgen E, Greaves KA, Paul G, Singer W.Влияние низкоуглеводной («Эко-Аткинса») диеты на растительной основе на массу тела и концентрацию липидов в крови у субъектов с гиперлипидемией. Архив внутренней медицины . 2009 г. 8 июня; 169 (11): 1046-54.
- Lagiou P, Sandin S, Lof M, Trichopoulos D, Adami HO, Weiderpass E. Низкоуглеводная диета с высоким содержанием белка и частота сердечно-сосудистых заболеваний у шведских женщин: проспективное когортное исследование. BMJ . 26 июня 2012 г .; 344: e4026.
- Pan A, Sun Q, Bernstein AM, Schulze MB, Manson JE, Willett WC, Hu FB.Потребление красного мяса и риск диабета 2 типа: 3 группы взрослых в США и обновленный метаанализ -. Американский журнал клинического питания . 2011 10 августа; 94 (4): 1088-96.
- Pan A, Sun Q, Bernstein AM, Manson JE, Willett WC, Hu FB. Изменения в потреблении красного мяса и последующий риск сахарного диабета 2 типа: три группы мужчин и женщин в США. Внутренняя медицина JAMA . 2013 22 июля; 173 (14): 1328-35.
- Pan A, Sun Q, Bernstein AM, Manson JE, Willett WC, Hu FB.Изменения в потреблении красного мяса и последующий риск сахарного диабета 2 типа: три группы мужчин и женщин в США. Внутренняя медицина JAMA . 2013 22 июля; 173 (14): 1328-35.
- Халтон Т.Л., Лю С., Мэнсон Дж. Э., Ху Ф. Б. Оценка низкоуглеводной диеты и риск диабета 2 типа у женщин–. Американский журнал клинического питания . 2008 1 февраля; 87 (2): 339-46.
- Åkerblom HK, Vaarala O, Hyöty H, Ilonen J, Knip M. Факторы окружающей среды в этиологии диабета 1 типа. Американский журнал медицинской генетики . 2002 30 мая; 115 (1): 18-29.
- Vaarala O, Ilonen J, Ruohtula T, Pesola J, Virtanen SM, Härkönen T, Koski M, Kallioinen H, Tossavainen O, Poussa T, Järvenpää AL. Удаление бычьего инсулина из смеси коровьего молока и раннее инициирование бета-клеточного аутоиммунитета в пилотном исследовании FINDIA. Архив педиатрии и подростковой медицины . 2012 1 июля; 166 (7): 608-14.
- Bouvard V, Loomis D, Guyton KZ, Grosse Y, El Ghissassi F, Benbrahim-Tallaa L, Guha N, Mattock H, Straif K.Канцерогенность употребления в пищу красного и обработанного мяса. Онкология Ланцет . 2015 1 декабря; 16 (16): 1599-600.
- Фарвид М.С., Чо Э, Чен В.Й., Элиассен А.Х., Виллетт В. Потребление мяса подростками и риск рака груди. Международный онкологический журнал . 2015 15 апреля; 136 (8): 1909-20.
- Дарлинг А.Л., Миллуорд ди-джей, Торгерсон ди-джей, Хьюитт CE, Lanham-New SA. Диетический белок и здоровье костей: систематический обзор и метаанализ–. Американский журнал клинического питания .2009 4 ноября; 90 (6): 1674-92.
- Mozaffarian D, Hao T., Rimm EB, Willett WC, Hu FB. Изменения в диете и образе жизни и длительное увеличение веса у женщин и мужчин. Медицинский журнал Новой Англии . 2011, 23 июня; 364 (25): 2392-404.
- Smith JD, Hou T, Ludwig DS, Rimm EB, Willett W, Hu FB, Mozaffarian D. Изменения в потреблении белковой пищи, количества и качества углеводов, а также долгосрочные изменения веса: результаты трех предполагаемых когорт -. Американский журнал клинического питания .2015 8 апреля; 101 (6): 1216-24.
- Ли СС, Кендалл К.В., де Соуза Р.Дж., Джаялат В.Х., Козма А.И., Ха В., Миррахими А., Кьявароли Л., Огюстин Л.С., Бланко Мехиа С., Лейтер Л.А. Зернобобовые, сытость и прием пищи: систематический обзор и метаанализ испытаний острого вскармливания. Ожирение . 2014 августа; 22 (8): 1773-80.
- Управление по санитарному надзору за качеством пищевых продуктов и медикаментов. Стратегия FDA по устойчивости к противомикробным препаратам — вопросы и ответы. https://www.fda.gov/animalveterinary/guidancecomplianceenforcement/guidanceforindustry/ucm216939.htm. Дата обращения 06.11.2018.
- Институт мировых ресурсов. Карта показателей белка. https://www.wri.org/resources/data-visualizations/protein-scorecard. Дата обращения 06.11.2018.
- Кулинарный институт Америки и Гарвард T.H. Школа общественного здравоохранения Чан. Меню изменений: Годовой отчет 2016. http://www.menusofchange.org/
- Heller MC, Keoleian GA. Оценки выбросов парниковых газов при выборе диеты и потери продуктов питания в США. Журнал промышленной экологии .2015 июн; 19 (3): 391-401.
- Guasch-Ferré M, Satija A, Blondin S, Janiszewski M, Emlen E, O’Connor L, Campbell W., Hu F, Willett W., Stampfer M. Метаанализ рандомизированных контролируемых испытаний потребления красного мяса в сравнении с различными Диеты сравнения по факторам риска сердечно-сосудистых заболеваний. Тираж . 2019 1 апреля; 139 (15): 1828-45.
* Раскрытие информации: доктор Ху получил исследовательскую поддержку от Комиссии по орехам Калифорнии. Доктор Кэмпбелл сообщил о получении исследовательской поддержки от Национальных институтов здравоохранения (стипендия T32 для Лорен О’Коннор), Американского совета по яйцам — Центра питания яиц, Программы проверки говядины, Национального совета по молочным продуктам, Программы проверки свинины и Барилла Групп.Доктор Кэмпбелл также сообщил о работе в Консультативном комитете по диетическим рекомендациям 2015 года. Доктор Сатия является сотрудником Analysis Group, Inc. Остальные авторы заявляют об отсутствии конфликтов.
Условия использования
Содержание этого веб-сайта предназначено для образовательных целей и не предназначено для предоставления личных медицинских консультаций. Вам следует обратиться за советом к своему врачу или другому квалифицированному поставщику медицинских услуг с любыми вопросами, которые могут у вас возникнуть относительно состояния здоровья. Никогда не пренебрегайте профессиональным медицинским советом и не откладывайте его обращение из-за того, что вы прочитали на этом веб-сайте.Nutrition Source не рекомендует и не одобряет какие-либо продукты.
Углеводы, белки и жиры — нарушения питания
Белки состоят из единиц, называемых аминокислотами, связанных в сложные образования. Поскольку белки представляют собой сложные молекулы, организму требуется больше времени, чтобы их расщепить. В результате они являются гораздо более медленным и долговечным источником энергии, чем углеводы.
Всего 20 аминокислот. Организм синтезирует некоторые из них из компонентов внутри тела, но не может синтезировать 9 аминокислот, называемых незаменимыми аминокислотами.Их необходимо употреблять в пищу. Каждому нужны 8 из этих аминокислот: изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Младенцам также нужен девятый — гистидин.
Процент белка, который организм может использовать для синтеза незаменимых аминокислот, варьируется от белка к белку. Организм может использовать 100% белка, содержащегося в яйцах, и высокий процент белков, содержащихся в молоке и мясе. Организм может использовать чуть меньше половины белка, содержащегося в большинстве овощей и злаков.
Белок необходим организму для поддержания и замены тканей, а также для функционирования и роста. Белок обычно не используется для получения энергии. Однако, если организм не получает достаточно калорий из других питательных веществ или жира, хранящегося в организме, белок расщепляется на кетоновые тела, которые используются для получения энергии. Если белка потребляется больше, чем необходимо, организм расщепляет белок и откладывает его компоненты в виде жира.
В организме содержится большое количество белка. Белок, главный строительный блок организма, является основным компонентом большинства клеток.Например, мышцы, соединительные ткани и кожа состоят из белка.
Взрослым необходимо съедать около 60 граммов белка в день (0,8 грамма на килограмм веса или от 10 до 15% от общего количества калорий). Взрослым, которые пытаются нарастить мышцы, нужно немного больше. Детям тоже нужно больше, потому что они растут. Людям, которые ограничивают количество калорий для похудения, обычно требуется большее количество белка, чтобы предотвратить потерю мышечной массы во время похудения. Пожилым людям может потребоваться более высокий уровень белка — до 1.2 г / кг массы тела. Однако это количество является чрезмерным и потенциально опасным при определенных состояниях, таких как почечная недостаточность и почечная недостаточность. Исследования также показывают, что белок более насыщает (помогает людям дольше чувствовать сытость), чем углеводы и жиры.
Масштабная оценка предсказания вычислительной функции белка
Liolios, K. et al. База данных Genomes On Line (GOLD) в 2009 г .: состояние геномных и метагеномных проектов и связанных с ними метаданных. Nucleic Acids Res. 38 , D346 – D354 (2010).
CAS Статья Google Scholar
Bork, P. et al. Функция прогнозирования: от генов к геномам и обратно. J. Mol. Биол. 283 , 707–725 (1998).
CAS Статья Google Scholar
Рост, Б., Лю, Дж., Наир, Р., Вжещински, К.О. & Офран, Ю. Автоматическое предсказание функции белка. Cell Mol. Life Sci. 60 , 2637–2650 (2003).
CAS Статья Google Scholar
Watson, J.D., Laskowski, R.A. & Thornton, J.M. Прогнозирование функции белка на основе данных последовательности и структуры. Curr. Opin. Struct. Биол. 15 , 275–284 (2005).
CAS Статья Google Scholar
Фридберг, И.Автоматизированное предсказание функции белков — геномная проблема. Краткое. Биоинформ. 7 , 225–242 (2006).
CAS Статья Google Scholar
Шаран Р., Улицкий И. и Шамир Р. Сетевое предсказание функции белков. Мол. Syst. Биол. 3 , 88 (2007).
Артикул Google Scholar
Ли, Д., Редферн, О. и Оренго, С. Прогнозирование функции белка на основе последовательности и структуры. Nat. Rev. Mol. Cell Biol. 8 , 995–1005 (2007).
CAS Статья Google Scholar
Punta, M. & Ofran, Y. Примерное руководство по предсказанию in silico функции, или как использовать информацию о последовательности и структуре для предсказания функции белка. PLoS Comput. Биол. 4 , e1000160 (2008).
Артикул Google Scholar
Рентч, Р.И Оренго, C.A. Прогнозирование функции белков — сила множественности. Trends Biotechnol. 27 , 210–219 (2009).
CAS Статья Google Scholar
Xin, F. & Radivojac, P. Вычислительные методы идентификации функциональных остатков в белковых структурах. Curr. Protein Pept. Sci. 12 , 456–469 (2011).
CAS Статья Google Scholar
Альтшул, С.F. et al. Gapped BLAST и PSI-BLAST: новое поколение программ поиска по базам данных белков. Nucleic Acids Res. 25 , 3389–3402 (1997).
CAS Статья Google Scholar
Jensen, L.J. et al. Прогнозирование функции белков человека по посттрансляционным модификациям и особенностям локализации. J. Mol. Биол. 319 , 1257–1265 (2002).
CAS Статья Google Scholar
Васс, М.Н. и Штернберг, М.Дж. ConFunc — функциональная аннотация в сумеречной зоне. Биоинформатика 24 , 798–806 (2008).
CAS Статья Google Scholar
Мартин Д.М., Берриман М. и Бартон Г.Дж. GOtcha: новый метод прогнозирования функции белков, оцениваемый по аннотации семи геномов. BMC Bioinformatics 5 , 178 (2004).
Артикул Google Scholar
Хокинс, Т., Luban, S. & Kihara, D. Расширенное автоматическое прогнозирование функций с использованием отдаленно связанных последовательностей и контекстной ассоциации с помощью PFP. Protein Sci. 15 , 1550–1556 (2006).
CAS Статья Google Scholar
Clark, W.T. & Radivojac, P. Анализ функции белка и ее предсказание на основе аминокислотной последовательности. Белки 79 , 2086–2096 (2011).
CAS Статья Google Scholar
Пеллегрини, М., Маркотт, Э.М., Томпсон, М.Дж., Айзенберг, Д., и Йейтс, Т.О. Назначение функций белков с помощью сравнительного анализа генома: филогенетические профили белков. Proc. Natl. Акад. Sci. USA 96 , 4285–4288 (1999).
CAS Статья Google Scholar
Marcotte, E.M. et al. Обнаружение функции белков и белок-белковых взаимодействий по последовательностям генома. Наука 285 , 751–753 (1999).
CAS Статья Google Scholar
Enault, F., Suhre, K. & Claverie, J.M. Phydbac «Предиктор функции гена»: инструмент для аннотации генов, основанный на анализе геномного контекста. BMC Bioinformatics 6 , 247 (2005).
Артикул Google Scholar
Engelhardt, B.E., Jordan, M.I., Muratore, K.E. И Бреннер, С. Прогнозирование молекулярной функции белков с помощью байесовской филогеномики. PLoS Comput. Биол. 1 , e45 (2005).
Артикул Google Scholar
Gaudet, P., Livstone, M.S., Lewis, S.E. И Томас, П. Филогенетическое распространение функциональных аннотаций в рамках консорциума Gene Ontology. Краткое. Биоинформ. 12 , 449–462 (2011).
Артикул Google Scholar
Дэн, М., Zhang, K., Mehta, S., Chen, T. & Sun, F. Прогнозирование функции белка с использованием данных взаимодействия белок-белок. J. Comput. Биол. 10 , 947–960 (2003).
CAS Статья Google Scholar
Летовский С. и Касиф С. Прогнозирование функции белка на основе данных взаимодействия белок / белок: вероятностный подход. Биоинформатика 19 (приложение 1), i197 – i204 (2003).
Артикул Google Scholar
Васкес, А., Фламмини, А., Маритан, А. и Веспиньяни, А. Прогнозирование глобальной функции белка на основе сетей взаимодействия белок-белок. Nat. Biotechnol. 21 , 697–700 (2003).
CAS Статья Google Scholar
Набиева, Э., Джим, К., Агарвал, А., Чазел, Б. и Синг, М. Целнопротеомное предсказание функции белка с помощью теоретико-графического анализа карт взаимодействия. Биоинформатика 21 (доп.1), i302 – i310 (2005).
CAS Статья Google Scholar
Пазос, Ф. и Стернберг, М.Дж. Автоматизированное предсказание функции белка и определение функциональных сайтов по структуре. Proc. Natl. Акад. Sci. USA 101 , 14754–14759 (2004).
CAS Статья Google Scholar
Pal, D. & Eisenberg, D. Вывод функции белка из структуры белка. Структура 13 , 121–130 (2005).
CAS Статья Google Scholar
Ласковски, Р.А., Уотсон, Дж. Д. и Торнтон, Дж. М. Прогнозирование функции белка с использованием локальных трехмерных шаблонов. J. Mol. Биол. 351 , 614–626 (2005).
CAS Статья Google Scholar
Хаттенхауэр, К., Хиббс, М., Майерс, К. и Троянская, О.G. Масштабируемый метод интеграции и функционального анализа нескольких наборов данных микрочипов. Биоинформатика 22 , 2890–2897 (2006).
CAS Статья Google Scholar
Троянская О.Г., Долински К., Оуэн, А.Б., Альтман, Р. Proc.Natl. Акад. Sci. США 100 , 8348–8353 (2003).
CAS Статья Google Scholar
Ли, И., Дате, С.В., Адай, А.Т. & Маркотт, Э.М. Вероятностная функциональная сеть генов дрожжей. Наука 306 , 1555–1558 (2004).
CAS Статья Google Scholar
Costello, J.C. et al. Генные сети в Drosophila melanogaster : объединение экспериментальных данных для прогнозирования функции генов. Genome Biol. 10 , R97 (2009 г.).
Артикул Google Scholar
Курмпетис Ю.А., ван Дейк А.Д., Бинк М.С., ван Хам Р.С. & тер Браак, К.Дж. Байесовский марковский анализ случайных полей для предсказания функции белков на основе сетевых данных. PLoS ONE 5 , e9293 (2010 г.).
Артикул Google Scholar
Соколов, А.И Бен-Гур, А. Иерархическая классификация терминов генной онтологии с использованием метода GOstruct. J. Bioinform. Comput. Биол. 8 , 357–376 (2010).
CAS Статья Google Scholar
Ashburner, M. et al. Генная онтология: инструмент для объединения биологии. Консорциум генных онтологий. Nat. Genet. 25 , 25–29 (2000).
CAS PubMed PubMed Central Google Scholar
Байроч, А.и другие. Универсальный белковый ресурс (UniProt). Nucleic Acids Res. 33 , D154 – D159 (2005).
CAS Статья Google Scholar
Schnoes, A.M., Brown, S.D., Dodevski, I. & Babbitt, P.C. Ошибка аннотации в общедоступных базах данных: неправильная аннотация молекулярной функции в суперсемействе ферментов. PLoS Comput. Биол. 5 , e1000605 (2009).
Артикул Google Scholar
Пунта, М.и другие. База данных семейств белков Pfam. Nucleic Acids Res. 40 , D290 – D301 (2012).
CAS Статья Google Scholar
Wang, G. et al. PNPASE регулирует импорт РНК в митохондрии. Cell 142 , 456–467 (2010).
CAS Статья Google Scholar
Sarkar, D. et al. Подавление Myc как потенциальной мишени для остановки роста, индуцированной полинуклеотидфосфорилазой человека (hPNPaseold-35) в клетках меланомы человека. J. Biol. Chem. 278 , 24542–24551 (2003).
CAS Статья Google Scholar
Wu, J. & Li, Z. Полинуклеотидфосфорилаза человека снижает окислительное повреждение РНК и защищает клетку HeLa от окислительного стресса. Biochem. Биофиз. Res. Commun. 372 , 288–292 (2008).
CAS Статья Google Scholar
Ван Д.Д., Шу, З., Лизер, С.А., Чен, П.Л. И Ли, W.H. Митохондриальная SUV3 человека и полинуклеотидфосфорилаза образуют гетеропентамер массой 330 кДа для кооперативного разрушения двухцепочечной РНК с направленностью от 3′-к-5′. J. Biol. Chem. 284 , 20812–20821 (2009).
CAS Статья Google Scholar
Портной В., Пальницкий Г., Иегудаи-Решефф С., Глейзер Ф. и Шустер Г. Анализ полинуклеотидфосфорилазы человека (PNPase) выявляет различия в связывании РНК и реакции на фосфат по сравнению с своим бактериальным и хлоропластным аналогам. РНК 14 , 297–309 (2008).
CAS Статья Google Scholar
Джеффри, К.Дж. Белки под луной. Trends Biochem. Sci. 24 , 8–11 (1999).
CAS Статья Google Scholar
Херсонский О. и Тауфик Д.С. Ферментная неразборчивость: механистическая и эволюционная перспектива. Annu.Rev. Biochem. 79 , 471–505 (2010).
CAS Статья Google Scholar
Brenner, S.E. Ошибки в аннотации генома. Trends Genet. 15 , 132–133 (1999).
CAS Статья Google Scholar
Дулиттл, Р.Ф. Of URFS и ORFS: Праймер по анализу производных аминокислотных последовательностей (University Science Books, 1986).
Addou, S., Rentzsch, R., Lee, D. & Orengo, C.A. Пороги идентичности последовательностей на основе доменов и семейств повышают уровни надежной передачи функции белков. J. Mol. Биол. 387 , 416–430 (2009).
CAS Статья Google Scholar
Nehrt, N.L., Clark, W.T., Radivojac, P. & Hahn, M.W. Проверка гипотезы ортолога со сравнительными функциональными геномными данными млекопитающих. PLoS Comput. Биол. 7 , e1002073 (2011).
CAS Статья Google Scholar
Браун, С.Д., Герлт, Дж. А., Сефферник, Дж. Л. и Бэббит, П.С. Золотой стандартный набор механически разнообразных суперсемейств ферментов. Genome Biol. 7 , R8 (2006).
Артикул Google Scholar
Герлт, Дж. А. и другие. Инициатива по ферментной функции. Биохимия 50 , 9950–9962 (2011).
CAS Статья Google Scholar
Barrell, D. et al. База данных GOA в 2009 году — интегрированный ресурс аннотаций генных онтологий. Nucleic Acids Res. 37 , D396 – D403 (2009).
CAS Статья Google Scholar
Hanley, J.A. И Макнил, Б.Дж. Значение и использование площади под кривой рабочей характеристики приемника (ROC). Радиология 143 , 29–36 (1982).
CAS Статья Google Scholar
DeepGOPlus: улучшенное предсказание функции белка по последовательности | Биоинформатика
007″> 1 Введение
Прогнозирование функций белков — основная задача биоинформатики, которая важна для понимания роли белков в патобиологии болезней, функций метагеномов или поиска мишеней для лекарств.Был разработан широкий спектр методов для прогнозирования функций белков с помощью вычислений (Fa et al. , 2018; Jiang et al. , 2016; Kahanda and Ben-Hur, 2017; Kulmanov et al. , 2018; Radivojac и др. , 2013; You и др. , 2018a, b; Чжоу и др. , 2019). Функции белков можно предсказать по последовательностям белков (Fa et al. , 2018; Jiang et al. , 2016; Kulmanov et al. , 2018; Radivojac et al., 2013; You et al. , 2018а, б; Zhou et al. , 2019), белок-белковые взаимодействия (PPI) (Кулманов и др. , 2018), белковые структуры (Ян и др. , 2015), биомедицинская литература и другие особенности (Kahanda and Ben-Hur, 2017; You et al. , 2018a). Способы, основанные на последовательностях, используют сходство последовательностей, поиск доменов последовательностей или выравнивание нескольких последовательностей для определения функций. Поскольку белки редко функционируют сами по себе, белок-белковые взаимодействия могут быть хорошим предиктором сложных биологических процессов, в которые белки вносят свой вклад.Хотя идентифицировать белковые структуры экспериментально сложно, они имеют решающее значение для понимания того, на что способны белки. Литература может способствовать прогнозированию функций, поскольку она может содержать явное описание функций белков или описывать свойства белков, которые косвенно позволяют прогнозировать функции белков. В целом, многие из этих функций доступны только для небольшого числа белков, в то время как аминокислотная последовательность белка может быть идентифицирована для большинства белков.Следовательно, методы, которые точно предсказывают функции белков только на основе последовательности, могут быть наиболее общими и применимыми к белкам, которые не были широко изучены.
Белки со сходной последовательностью имеют тенденцию к сходным функциям (Radivojac et al. , 2013). Следовательно, основной способ прогнозирования функций для новых последовательностей — найти наиболее похожие последовательности с известными функциональными аннотациями и передать их аннотации. Другой подход заключается в поиске конкретных мотивов последовательности, которые связаны с некоторой функцией; например, InterProScan (Mitchell et al., 2014) — это инструмент, который может помочь найти белковые домены и семейства. Домены и семейства можно использовать для определения функций белков.
Недавние разработки в методах глубокого изучения функций привели к появлению множества методов, которые могут изучать особенности последовательностей белков. В 2017 году мы разработали DeepGO (Кулманов и др. , 2018) как одну из первых моделей глубокого обучения, которая может предсказывать функции белка с использованием аминокислотной последовательности белка и сетей взаимодействия. С 2017 года стали доступны многие методы-преемники, которые обеспечивают лучшую прогностическую эффективность (You et al., 2018а, б).
DeepGO имеет несколько ограничений. Во-первых, он может предсказывать функции только для белков с длиной последовательности менее 1002 и не содержащих «неоднозначных» аминокислот, таких как союзы или неизвестные. Хотя около 90% белковых последовательностей в UniProt удовлетворяют этим критериям, это также означает, что DeepGO не может предсказать функции примерно для 10% белков. Во-вторых, из-за вычислительных ограничений DeepGO может прогнозировать только около 2000 функций из более чем 45000, которые в настоящее время находятся в генной онтологии (GO) (Ashburner et al., 2000). В-третьих, DeepGO использует сетевые функции взаимодействия, которые доступны не для всех белков. В частности, для новых или не охарактеризованных белков может быть известна только последовательность, а не какая-либо дополнительная информация, такая как взаимодействия белков или упоминания в литературе. Наконец, DeepGO был обучен и оценен на случайно выбранных наборах для обучения, проверки и тестирования. Однако такие модели могут чрезмерно соответствовать конкретным функциям обучающих данных и могут не давать адекватных результатов в реальных сценариях прогнозирования.Следовательно, такие задачи, как Критическая оценка функциональной аннотации (CAFA) (Jiang et al. , 2016; Radivojac et al. , 2013; Zhou et al. , 2019), используют временную оценку, когда обучение и прогнозы фиксируются и оцениваются по прошествии некоторого времени для прогнозов, которые стали доступными за это время. DeepGO не смог добиться такой же производительности в тесте CAFA3 (Zhou et al. , 2019), как это было в наших собственных экспериментах.
Здесь мы расширяем и улучшаем DeepGO, преодолевая его основные ограничения, связанные с длиной последовательности, отсутствующими функциями и количеством прогнозируемых классов.Мы увеличили входную длину модели до 2000 аминокислот и теперь покрывают более 99% последовательностей в UniProt. Кроме того, архитектура нашей новой модели позволяет нам разбивать более длинные последовательности и сканировать более мелкие фрагменты для прогнозирования функций. Мы также удаляем функции, полученные из сетей взаимодействия, потому что только небольшое количество белков имеет такую сетевую информацию. Вместо этого мы комбинируем наши прогнозы нейронной сети с методами, основанными на сходстве последовательностей, чтобы фиксировать ортологию и, косвенно, некоторую информацию о взаимодействии.Благодаря этому шагу мы также преодолеем ограничение на количество классов для прогнозирования и теоретически можем предсказать любой класс GO, который когда-либо использовался в экспериментальной аннотации. Чтобы избежать переобучения нашей модели, мы существенно уменьшили возможности нашей модели, заменив уровень встраивания триграммы аминокислот быстрым кодированием и удалив уровень иерархической классификации.
В нашей оценке мы точно воспроизводим оценку CAFA3, обучая нашу модель, используя только данные, предоставленные CAFA3 в качестве данных обучения, и оценивая данные тестирования CAFA3.Используя общедоступный инструмент оценки CAFA, DeepGOPlus достигает F max из 0,390, 0,557 и 0,614 для оценок BPO, MFO и CCO соответственно. Эти результаты сделали бы DeepGOPlus одним из трех лучших предикторов в CCO и вторым наиболее эффективным методом в оценках BPO и MFO.
Мы также сравниваем DeepGOPlus с нашими базовыми методами, включая DeepGO и два наиболее эффективных метода прогнозирования функции белков, GOLabeler (You et al., 2018b) и DeepText2GO (You и др. , 2018a) в другом наборе данных. GOLabeler в основном использует функции на основе последовательностей, DeepGO использует сетевые функции взаимодействия, а DeepText2GO использует функции, извлеченные из литературы, в дополнение к функциям на основе последовательностей. Что касается показателя F max , мы превосходим все методы в прогнозировании биологических процессов и клеточных компонентов. Примечательно, что наша модель значительно улучшает предсказания аннотаций биологических процессов с F max , равным 0.474.
Чтобы понять, какие функции наша модель использует для прогнозирования функций, мы анализируем сверточные фильтры нашей модели, чтобы понять, какие типы функций они распознают. Мы обнаружили, что участки последовательностей, которые активируют наши фильтры, очень похожи на исходные последовательности семейств белков и доменов в базе данных Pfam (El-Gebali et al. , 2019). Мы смогли связать белковые последовательности в нашей тестовой выборке почти с половиной их InterPro (Finn et al., 2017) аннотации с использованием областей последовательности, которые активируют наши сверточные фильтры.
Используя одну модель с несколькими параметрами, мы также значительно улучшили время выполнения модели. В среднем DeepGOPlus может аннотировать 40 белков в секунду на обычном оборудовании. В целом, с этими улучшениями, наша модель теперь может быстро выполнять предсказание функции для любого белка с доступной последовательностью. Наш онлайн-предсказатель доступен на http://deepgoplus.bio2vec.net и DeepGOPlus.
018″> 2.1 Наборы данных и генная онтология Мы используем два набора данных для оценки нашего подхода. Во-первых, мы загрузили обучающие последовательности CAFA3 и экспериментальные аннотации, опубликованные в сентябре 2016 года, и тестовые тесты, опубликованные 15 ноября 2017 года, которые использовались для оценки методов прогнозирования функции белков, представленных в тесте. Согласно CAFA3, аннотации с кодами доказательств: EXP, IDA, IPI, IMP, IGI, IEP, TAS или IC считаются экспериментальными.Обучающий набор включает все белки с экспериментальными аннотациями, известными до сентября 2016 года, а тестовый тест содержит белки без знания, которые получили экспериментальные аннотации в период с сентября 2016 года по ноябрь 2017 года. Подобные расщепления на основе времени использовались во всех предыдущих задачах CAFA.
Мы распространяем аннотации, используя иерархическую структуру Онтологии генов (GO) (Ashburner et al. , 2000). Мы используем версию GO, выпущенную 1 июня 2016 года. Версия имеет 10 693 класса молекулярных функций (MFO), классов, 29 264 классов биологических процессов (BPO) и 4034 класса клеточных компонентов (CCO).Эта версия также используется для оценки прогнозов CAFA3. При распространении аннотаций мы учитываем все типы отношений между классами. Например, если белок P аннотируется классом C , который имеет частичное отношение к классу D , то мы аннотируем P классом D . Эта процедура повторяется до тех пор, пока дальнейшее распространение аннотации не прекращается. После этого шага мы подсчитываем количество аннотированных белков для каждого класса GO и выбираем все классы с 50 или более аннотациями для нашей модели прогнозирования.Статистика с количеством классов в таблице 1 представляет, сколько классов мы можем предсказать, используя нашу модель глубокой нейронной сети.
Таблица 1. Количество белковых последовательностей с экспериментальными аннотациями в наборах данных CAFA3 и 2016, сгруппированных по суб-онтологиям
Набор данных
. Статистика
. МФО
. BPO
. CCO
. Все
. CAFA3 Размер обучения 36110 53 500 50 596 66 841 CAFA3 Размер тестирования 1137 2392 1265 3328 CAFA3 Количество классов 677 3992 551 5220 2016 Объем обучения 34 488 51716 49 346 65028 2016 Размер для испытаний 679 1434 1148 1788 2016 Количество классов 652 3904 545 5101
Набор данных
. Статистика
. МФО
. BPO
. CCO
. Все
. CAFA3 Размер обучения 36110 53 500 50 596 66 841 CAFA3 Размер тестирования 1137 2392 1265 3328 CAFA3 Количество классов 677 3992 551 5220 2016 Объем обучения 34 488 51716 49 346 65028 2016 Размер для испытаний 679 1434 1148 1788 2016 Количество классов 652 3904 545 5101
Таблица 1. Количество белковых последовательностей с экспериментальными аннотациями в наборах данных CAFA3 и 2016, сгруппированных по суб-онтологиям
Набор данных
. Статистика
. МФО
. BPO
. CCO
. Все
. CAFA3 Размер обучения 36110 53 500 50 596 66 841 CAFA3 Размер тестирования 1137 2392 1265 3328 CAFA3 Количество классов 677 3992 551 5220 2016 Объем обучения 34 488 51716 49 346 65028 2016 Размер для испытаний 679 1434 1148 1788 2016 Количество классов 652 3904 545 5101
Набор данных
. Статистика
. МФО
. BPO
. CCO
. Все
. CAFA3 Размер обучения 36110 53 500 50 596 66 841 CAFA3 Размер тестирования 1137 2392 1265 3328 CAFA3 Количество классов 677 3992 551 5220 2016 Объем обучения 34 488 51716 49 346 65028 2016 Размер испытания 679 1434 1148 1788 2016 Количество классов 652 3904 545 5101
Во-вторых, для сравнения с другими методами для прогнозирования функций, таких как DeepText2GO (You et al., 2018a) и GoLabeler (You et al. , 2018b) мы загрузили белки, проверенные SwissProt, опубликованные в январе 2016 г. и октябре 2016 г. Мы используем все экспериментальные аннотации до января 2016 г. в качестве обучающей выборки и экспериментальные аннотации, собранные в период с января по октябрь 2016 г. Октябрь 2016 как набор для тестирования. Мы фильтруем тестовый набор с 23 целевыми видами, которые находятся в оценочном наборе CAFA3. В таблице 1 представлены оба набора данных.
024″> 2.2.1 Наивный подход Можно получить сопоставимые результаты прогнозов, просто назначив одинаковые классы GO для всех белков на основе частот аннотации. Это происходит из-за иерархической структуры GO, которая после процесса распространения приводит к множеству аннотаций в классах высокого уровня. В CAFA этот подход называется «наивным» и используется в качестве одного из базовых методов для сравнения предсказаний функций. Здесь каждый белок запроса p аннотирован классами GO с оценками прогнозирования, вычисленными как: где f — класс GO, N f — количество обучающих белков, аннотированных классом GO f и N всего — общее количество обучающих белков.028″> 2.2.3 DiamondScore
DiamondScore очень похож на подход DiamondBLAST. Единственное отличие состоит в том, что мы нормализуем сумму битовых баллов похожих последовательностей. Мы вычисляем оценки прогнозов по формуле: S (q, f) = ∑s∈Ebitscore (q, s) * I (f∈Ts) ∑s∈Ebitscore (q, s)
(3)032″> 2.2.5 GOLabeler и DeepText2GO
В настоящее время наиболее эффективными методами для задачи прогнозирования функций являются GOLabeler (You и др. , 2018b) и DeepText2GO (You и др. , 2018a), разработанные одной и той же группой. GOLabeler добился одних из лучших результатов в предварительной оценке всех трех субонтологий GO в испытании CAFA3. Это метод ансамбля, который сочетает в себе несколько подходов и предсказывает функции, главным образом, по признакам последовательности.DeepText2GO улучшает результаты, достигнутые GOLabeler, расширяя их ансамбль моделями, которые предсказывают функции из литературы.
Наш второй набор данных специально разработан для сравнения наших результатов с этими двумя методами. Поскольку мы используем одни и те же данные для обучения и тестирования, мы напрямую сравниваем наши результаты с результатами, указанными в их документах.
039″> 2.4 DeepGOPlus в сравнении с DeepGO
Есть три основных отличия нашей модели от исходной модели DeepGO (Кулманов и др. , 2018). Во-первых, DeepGO использует слой встраивания триграммы для представления последовательности. Слой внедрения имеет векторы размером 128 для каждой триграммы (всего 20 × 20 × 20).Этот слой добавляет к модели 128 × 8000 параметров. Мы заменили это представление на одно-горячее кодирование без параметров, что позволило нам значительно сократить количество параметров новой модели. В ходе наших экспериментов мы заметили, что модели со слоем встраивания легко запоминают обучающие данные и подгоняют под них. Использование однократного кодирования помогло избежать этой проблемы. Во-вторых, DeepGO имеет один слой CNN с фиксированной длиной фильтра, который был расширен до нескольких слоев CNN с различной длиной фильтра.Наконец, в DeepGOPlus мы используем слой плоской классификации вместо иерархического классификатора в DeepGO. Причина этого выбора заключается в том, что мы построили единую модель для всех трех онтологий с более чем 5000 классами, и мы не смогли построить иерархический классификатор из-за ограничений памяти и временных сложностей.
045″> 3 Результаты
028″> 2.2.3 DiamondScore
DiamondScore очень похож на подход DiamondBLAST. Единственное отличие состоит в том, что мы нормализуем сумму битовых баллов похожих последовательностей. Мы вычисляем оценки прогнозов по формуле:S (q, f) = ∑s∈Ebitscore (q, s) * I (f∈Ts) ∑s∈Ebitscore (q, s)
(3)032″> 2.2.5 GOLabeler и DeepText2GO
В настоящее время наиболее эффективными методами для задачи прогнозирования функций являются GOLabeler (You и др. , 2018b) и DeepText2GO (You и др. , 2018a), разработанные одной и той же группой. GOLabeler добился одних из лучших результатов в предварительной оценке всех трех субонтологий GO в испытании CAFA3. Это метод ансамбля, который сочетает в себе несколько подходов и предсказывает функции, главным образом, по признакам последовательности.DeepText2GO улучшает результаты, достигнутые GOLabeler, расширяя их ансамбль моделями, которые предсказывают функции из литературы.
Наш второй набор данных специально разработан для сравнения наших результатов с этими двумя методами. Поскольку мы используем одни и те же данные для обучения и тестирования, мы напрямую сравниваем наши результаты с результатами, указанными в их документах.
039″> 2.4 DeepGOPlus в сравнении с DeepGO
Есть три основных отличия нашей модели от исходной модели DeepGO (Кулманов и др. , 2018). Во-первых, DeepGO использует слой встраивания триграммы для представления последовательности. Слой внедрения имеет векторы размером 128 для каждой триграммы (всего 20 × 20 × 20).Этот слой добавляет к модели 128 × 8000 параметров. Мы заменили это представление на одно-горячее кодирование без параметров, что позволило нам значительно сократить количество параметров новой модели. В ходе наших экспериментов мы заметили, что модели со слоем встраивания легко запоминают обучающие данные и подгоняют под них. Использование однократного кодирования помогло избежать этой проблемы. Во-вторых, DeepGO имеет один слой CNN с фиксированной длиной фильтра, который был расширен до нескольких слоев CNN с различной длиной фильтра.Наконец, в DeepGOPlus мы используем слой плоской классификации вместо иерархического классификатора в DeepGO. Причина этого выбора заключается в том, что мы построили единую модель для всех трех онтологий с более чем 5000 классами, и мы не смогли построить иерархический классификатор из-за ограничений памяти и временных сложностей.
045″> 3 Результаты
050″> 3,2 Оценка и сравнение
Мы оцениваем DeepGOPlus с использованием двух наборов данных. Во-первых, мы используем последний набор данных CAFA3 (Radivojac et al. , 2013) и сравниваем наш метод с базовыми методами, такими как Naive predictions, BLAST и нашей предыдущей моделью глубокого обучения DeepGO.Мы используем две стратегии для прогнозирования функций на основе сходства последовательностей, вычисленных с помощью инструмента Diamond (Buchfink et al. , 2015) (который является более быстрой реализацией алгоритма BLAST). Мы называем их DiamondBLAST и DiamondScore. DiamondBLAST рассматривает только наиболее похожую последовательность, тогда как DiamondScore прогнозирует функции, используя все аналогичные последовательности, возвращаемые Diamond. Мы также сообщаем о производительности при использовании только нашей модели нейронной сети (обозначенной как DeepGOCNN). Мы обнаружили, что с подходом DiamondScore мы можем превзойти прогнозы DeepGO в MFO и достичь сопоставимых результатов в оценках BPO и CCO, в то время как DeepGOCNN дает лучшие прогнозы в CCO.Мы достигаем наилучшей производительности во всех трех субонтологиях с нашей моделью DeepGOPlus, которая сочетает в себе DiamondScore и DeepGOCNN. В таблице 2 приведены характеристики моделей.
Таблица 2.Сравнение производительности по первому набору данных задачи CAFA3
| Метод . | F макс. . | S мин . | AUPR . | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| . | МФО . | BPO . | CCO . | МФО . | BPO . | CCO . | МФО . | BPO . | CCO . | ||||||||||
| Наивный | 0,290 | 0,357 | 0,562 | 10.733 | 25,028 | 8,465 | 0,130 | 0,254 | 0,456 | ||||||||||
| DiamondBLAST | 0,431 | 0,399 | 0,506 | 10,233 | 25,320 | 8,800 | 0,178 | 0,1 | |||||||||||
| DiamondScore | 0,509 | 0,427 | 0,557 | 9,031 | 22,860 | 8,198 | 0.340 | 0,267 | 0,335 | ||||||||||
| DeepGO | 0,393 | 0,435 | 0,565 | 9,635 | 24,181 | 9,199 | 0,303 | 0,385 | 0,579 | ||||||||||
| 0,607 | 9,711 | 24,234 | 8,153 | 0,355 | 0,323 | 0,616 | |||||||||||||
| DeepGOPlus | 0.544 | 0,469 | 0,623 | 8,724 | 22,573 | 7,823 | 0,487 | 9901 0,4012 0147 Метод . F макс. . | S мин . | AUPR . | |||||||||
| . | МФО . | BPO . | CCO . | МФО . | BPO . | CCO . | МФО . | BPO . | CCO . | ||||||||||
| Наивный | 0,290 | 0.357 | 0,562 | 10,733 | 25,028 | 8,465 | 0,130 | 0,254 | 0,456 | ||||||||||
| DiamondBLAST | 0,431 | 0,399 | 0,506 | 10,233 | 25,320 | 10,233 | 25,320 | 0,116 | 0,142 | ||||||||||
| DiamondScore | 0,509 | 0,427 | 0,557 | 9,031 | 22.860 | 8,198 | 0,340 | 0,267 | 0,335 | ||||||||||
| DeepGO | 0,393 | 0,435 | 0,565 | 9,635 | 24,181 | 9,199 | 0,303 | 0,385 | 0,512 | 0,420 | 0,378 | 0,607 | 9,711 | 24,234 | 8,153 | 0,355 | 0,323 | 0.616 | |
| DeepGOPlus | 0,544 | 0,469 | 0,623 | 8,724 | 22,573 | 7,823 | 7,823 | 7,823 | |||||||||||
Сравнение производительности на первом наборе данных CAFA3
| Метод . | F макс. . | S мин . | AUPR . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| . | МФО . | BPO . | CCO . | МФО . | BPO . | CCO . | МФО . | BPO . | CCO . | |
| Наивный | 0,290 | 0,357 | 0,562 | 10,733 | 25,028 | 8,465 | 0,130 | 0,254 | 0,456 | |
| DiamondBLAST | 0,431 | 0,399 10,233 | 25,320 | 8,800 | 0,178 | 0,116 | 0,142 | |||
| DiamondScore | 0.509 | 0,427 | 0,557 | 9,031 | 22,860 | 8,198 | 0,340 | 0,267 | 0,335 | |
| DeepGO | 0,393 | 0,435 | 0,565 | 9,635 | 24,181 | 9,635 | 24,181 | 0,303 | 0,385 | 0,579 |
| DeepGOCNN | 0,420 | 0,378 | 0,607 | 9,711 | 24.234 | 8,153 | 0,355 | 0,323 | 0,616 | |
| DeepGOPlus | 0,544 | 0,469 | 0,623 | 8,724 | 8,724 | 0 0,487 | 0,404 | 0,627 | ||
| Метод . | F макс. . | S мин . | AUPR . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| . | МФО . | BPO . | CCO . | МФО . | BPO . | CCO . | МФО . | BPO . | CCO . | |
| Наивный | 0,290 | 0,357 | 0,562 | 10,733 | 25,028 | 8,465 | 0,130 | 0,254 | 0,456 | |
| DiamondBLAST | 0,431 | 0,399 10,233 | 25,320 | 8,800 | 0,178 | 0,116 | 0,142 | |||
| DiamondScore | 0.509 | 0,427 | 0,557 | 9,031 | 22,860 | 8,198 | 0,340 | 0,267 | 0,335 | |
| DeepGO | 0,393 | 0,435 | 0,565 | 9,635 | 24,181 | 9,635 | 24,181 | 0,303 | 0,385 | 0,579 |
| DeepGOCNN | 0,420 | 0,378 | 0,607 | 9,711 | 24.234 | 8,153 | 0,355 | 0,323 | 0,616 | |
| DeepGOPlus | 0,544 | 0,469 | 0,623 | 8,724 | 8,724 | 0 | 0 0,487 | 0,404 | 0,627 | |
Чтобы сравнить наш подход с современными методами, GOLabeler (You et al., 2018b) и DeepText2GO (You et al. , 2018a), мы генерируем второй набор данных, который использует данные, полученные в те же даты, что и другие методы, чтобы мы могли сгенерировать временное разделение данных обучения и тестирования. Оба метода обучаются на аннотациях экспериментальных функций, которые появились до января 2016 года, и тестируются на аннотациях, которые были утверждены в период с января 2016 года по октябрь 2016 года. Кроме того, мы используем ту же версию GO и следуем процедурам проверки CAFA3 для обработки данных.В результате мы можем напрямую сравнивать наши результаты оценки с другими методами. В этой оценке DeepGOPlus дает лучшие результаты для BPO и CCO с точки зрения измерения F max и занимает второе место в оценке MFO (после DeepText2GO). Однако важно отметить, что DeepText2GO использует функции, извлеченные из литературы, в дополнение к функциям на основе последовательностей, в то время как прогнозы DeepGOPlus основаны только на последовательности белков. Примечательно, что наш метод значительно повысил производительность прогнозов классов BPO в обоих наборах оценочных данных (Таблица 3).
Таблица 3.Сравнение производительности второго набора данных, созданного с помощью временного разделения
| Метод . | F макс. . | S мин . | AUPR . | ||||||
|---|---|---|---|---|---|---|---|---|---|
| . | МФО . | BPO . | CCO . | МФО . | BPO . | CCO . | МФО . | BPO . | CCO . |
| Наивный | 0,306 | 0,318 | 0,605 | 12,105 | 38,890 | 9,646 | 0,150 | 0,219 | 0,512 |
| DiamondBLAST | 0.525 | 0,436 | 0,591 | 9,291 | 39,544 | 8,721 | 0,101 | 0,070 | 0,089 |
| DiamondScore | 0,548 | 0,439 | 0,621 | 8,736 | 34,060,9 0,362 | 0,240 | 0,363 | ||
| DeepGO | 0,449 | 0,398 | 0,667 | 10,722 | 35.085 | 7,861 | 0,409 | 0,328 | 0,696 |
| Глубокий | 0,627 | 0,441 | 0,694 | 5,240 | 17,713 | 4,531 | 0.605 | 0,336 | 0,729 |
| GOLabeler | 0,580 | 0,370 | 0,687 | 5,077 | 15,177 | 5,518 | 0,546 | 0,585 | 0,474 | 0,699 | 8,824 | 33,576 | 7,693 | 0.536 | 0,407 | 0,726 |
| Метод . | F макс. . | S мин . | AUPR . | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| . | МФО . | BPO . | CCO . | МФО . | BPO . | CCO . | МФО . | BPO . | CCO . | ||||||||||||
| Наивный | 0,306 | 0,318 | 0,605 | 12,105 | 38,890 | 9,646 | 0,150 | 0,219 | 0,512 | ||||||||||||
| Алмазный 0,40BLAST | 0,525 | 5919,291 | 39,544 | 8,721 | 0,101 | 0,070 | 0,089 | ||||||||||||||
| DiamondScore | 0,548 | 0,439 | 0,621 | 8,736 | 34,060 | 7,997 | 0,25 0,363 | ||||||||||||||
| DeepGO | 0,449 | 0,398 | 0,667 | 10,722 | 35,085 | 7,861 | 0.409 | 0,328 | 0,696 | ||||||||||||
| DeepGOCNN | 0,409 | 0,383 | 0,663 | 11,296 | 36,451 | 8,642 | 0,350 | 0,316 | 0,688 | 0,316 | 0,688 | ||||||||||
| 0,441 | 0,694 | 5,240 | 17,713 | 4,531 | 0,605 | 0.336 | 0,729 | ||||||||||||||
| GOLabeler | 0,580 | 0,370 | 0,687 | 5,077 | 15,177 | 5,518 | 0,546 | 0,225 | 0,700 | 0,546 | 0,225 | 0,700 | 0,546 | 0,474 | 0,699 | 8,824 | 33,576 | 7,693 | 0,536 | 0.407 | 0,726 |
Сравнение производительности второго набора данных, созданного с помощью разбиения по времени
| Метод . | F макс. . | S мин . | AUPR . | ||||||
|---|---|---|---|---|---|---|---|---|---|
| . | МФО . | BPO . | CCO . | МФО . | BPO . | CCO . | МФО . | BPO . | CCO . |
| Наивный | 0,306 | 0,318 | 0,605 | 12,105 | 38,890 | 9,646 | 0,150 | 0,219 | 0,512 |
| DiamondBLAST | 0.525 | 0,436 | 0,591 | 9,291 | 39,544 | 8,721 | 0,101 | 0,070 | 0,089 |
| DiamondScore | 0,548 | 0,439 | 0,621 | 8,736 | 34,060,9 0,362 | 0,240 | 0,363 | ||
| DeepGO | 0,449 | 0,398 | 0,667 | 10,722 | 35.085 | 7,861 | 0,409 | 0,328 | 0,696 |
| Глубокий | 0,627 | 0,441 | 0,694 | 5,240 | 17,713 | 4,531 | 0.605 | 0,336 | 0,729 |
| GOLabeler | 0,580 | 0,370 | 0,687 | 5,077 | 15,177 | 5,518 | 0,546 | 0,585 | 0,474 | 0,699 | 8,824 | 33,576 | 7,693 | 0.536 | 0,407 | 0,726 |
| Метод . | F макс. . | S мин . | AUPR . | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| . | МФО . | BPO . | CCO . | МФО . | BPO . | CCO . | МФО . | BPO . | CCO . | ||||||||||||
| Наивный | 0,306 | 0,318 | 0,605 | 12,105 | 38,890 | 9,646 | 0,150 | 0,219 | 0,512 | ||||||||||||
| Алмазный 0,40BLAST | 0,525 | 5919,291 | 39,544 | 8,721 | 0,101 | 0,070 | 0,089 | ||||||||||||||
| DiamondScore | 0,548 | 0,439 | 0,621 | 8,736 | 34,060 | 7,997 | 0,25 0,363 | ||||||||||||||
| DeepGO | 0,449 | 0,398 | 0,667 | 10,722 | 35,085 | 7,861 | 0.409 | 0,328 | 0,696 | ||||||||||||
| DeepGOCNN | 0,409 | 0,383 | 0,663 | 11,296 | 36,451 | 8,642 | 0,350 | 0,316 | 0,688 | 0,316 | 0,688 | ||||||||||
| 0,441 | 0,694 | 5,240 | 17,713 | 4,531 | 0,605 | 0.336 | 0,729 | ||||||||||||||
| GOLabeler | 0,580 | 0,370 | 0,687 | 5,077 | 15,177 | 5,518 | 0,546 | 0,225 | 0,700 | 0,546 | 0,225 | 0,700 | 0,546 | 0,474 | 0,699 | 8,824 | 33,576 | 7,693 | 0,536 | 0.407 | 0,726 |
Из-за большого количества доступных последовательностей анализ последовательностей требует как точных, так и быстрых методов прогнозирования. В частности, прогнозирование функции является решающим шагом в интерпретации вновь секвенированных геномов или мета-геномов. Хотя мы сравнивали DeepGOPlus с точки зрения производительности прогнозирования, мы не могли сравнить время работы моделей, поскольку время выполнения моделей прогнозирования редко сообщается. С DeepGOPlus можно аннотировать 40 белковых последовательностей в секунду с использованием одного процессора Intel (R) Xeon (R) E5-2680 и графического процессора Nvidia P6000.
3.3 Сравнение с методами CAFA3
Результаты проверки CAFA3 (Zhou et al. , 2019) стали доступны недавно, что позволило нам оценить наш метод на том же наборе данных, который использовался в CAFA3. Мы используем метод, используемый CAFA3, для оценки DeepGOPlus (см. Методы) и сравнения с другими методами, которые были оценены в CAFA3. Согласно критериям оценки CAFA3, DeepGOPlus достигает F max 0,390, 0,557 и 0,614 для оценок BPO, MFO и CCO соответственно.Эти результаты сделали бы DeepGOPlus одним из трех лучших предикторов в CCO и вторым наиболее эффективным методом в оценках BPO и MFO. На рисунке 2 показано сравнение DeepGOPlus со всеми наиболее эффективными методами CAFA3.
Рис. 2.
Сравнение DeepGOPlus с 10 самыми популярными методами CAFA3
Рис. 2.
Сравнение DeepGOPlus с 10 самыми популярными методами CAFA3
Используя нашу собственную оценку (основанную на выводе родительских и дочерних классов по всей онтологии GO вместо того, чтобы раздельно в суб-онтологиях), мы получаем аналогичные результаты для MFO и CCO, как и для метода оценки CAFA3, хотя разница в оценке BPO довольно велика.
3,4
S мин анализ производительностиНесмотря на то, что наш метод оказался среди методов высшего ранга в нескольких оценках F max , и GOLabeler, и DeepText2GO работают значительно лучше при рассмотрении оценки на основе измерения S min . DeepGOPlus потенциально может предсказать любой класс GO, включая очень специфические классы. Оценка S min зависит от количества ложных отрицательных результатов, ложных срабатываний и информационного содержания (IC) классов GO.На рисунке 3 показано распределение значений IC для классов, прогнозируемых моделью DeepGOPlus. IC для общих классов близок к нулю, а более конкретные классы имеют значения IC, близкие к 10. Следовательно, методы, которые пытаются предсказать многие конкретные классы, в целом будут иметь более высокое значение S мин. Чтобы проверить, верно ли это для нашего метода, мы оценили ложноположительные прогнозы для набора тестов CAFA3. В среднем наш метод предсказывает 6,1 ложноположительных классов на белок с общим IC 8.3 для MFO, демонстрируя, что наши ложноположительные прогнозы весьма специфичны.
Рис. 3.
Значения распределения информационного содержимого (IC) для 5220 классов GO, которые прогнозируются для набора данных CAFA3
Рис. 3.
Распределение значений информационного содержимого (IC) для 5220 классов GO, которые прогнозируются для CAFA3 набор данных
3.5 Сверточные фильтры
Чтобы понять, что изучают сверточные фильтры модели CNN, мы провели эксперимент, в котором мы анализировали участки последовательности, которые активируют наши фильтры.Мы выбрали конкретный класс молекулярных функций «активность активатора фермента» (GO: 0008047) и отфильтровали все белки, аннотированные к этому классу. Всего к этому классу экспериментально отнесено 623 белка. Причина, по которой мы выбрали этот класс, заключается в том, что этот класс очень специфичен и на него ссылаются несколько функциональных доменов и семейств InterPRO. Наша гипотеза состоит в том, что наши фильтры CNN распознают области последовательности, которые подобны функциональным доменам последовательности.
Сначала мы извлекли оценки всех 8192 фильтров и упорядочили их в порядке убывания для всех последовательностей.Мы обнаружили, что фильтр номер 8048 (на основе 0) дает наивысший балл для всех последовательностей, а многие другие 10 лучших фильтров активны более чем в 600 последовательностях. Это показывает, что фильтры изучили похожие мотивы, связанные с выбранной нами функцией. Затем мы извлекли области последовательностей, которые дают наивысший балл для 10 лучших фильтров CNN, и сравнили их с семенами базы данных семейств белков Pfam (El-Gebali et al. , 2019). Мы используем Diamond BLAST (Buchfink и др. , 2015) с e-значением 0.001 и связывают области сходной последовательности с семействами Pfam. Кроме того, мы сопоставляем идентификаторы семейств Pfam с идентификаторами InterPRO. Посредством этого процесса мы связали белковые последовательности с доменами InterPRO, используя участки последовательностей, распознаваемые нашими фильтрами CNN. Всего 563 последовательности были связаны по крайней мере с одним InterPRO ID. Наконец, мы сравниваем ассоциации InterPRO с аннотациями InterPRO в базе данных UniProt (The Uniprot Consortium, 2007), используя F-критерий, ориентированный на белок, и получаем оценку F , равную 0.62 с точностью 0,9 и отзывом 0,47. Этот эксперимент демонстрирует, что наши фильтры CNN изучают значимые мотивы последовательностей и могут, для активаторов ферментов, точно распознавать почти половину известных в настоящее время аннотаций функциональных доменов.
3,6 Внедрение и доступность
DeepGOPlus доступен как бесплатное программное обеспечение по адресу https://github.com/bio-ontology-research-group/deepgoplus. Мы также публикуем данные обучения и тестирования, используемые для получения оценок и результатов, на http: // deepgoplus.bio2vec.net/data/. Кроме того, DeepGOPlus доступен через веб-интерфейс и REST API по адресу http://deepgoplus.bio2vec.net.
4 Обсуждение
DeepGOPlus — это быстрый и точный инструмент для прогнозирования функций белка только на основе последовательности белка. Наша модель преодолевает некоторые ограничения других методов и нашей собственной модели DeepGO (Кулманов и др. , 2018). В частности, DeepGOPlus не имеет ограничений по длине аминокислотной последовательности и, следовательно, может использоваться для аннотации функций белка в масштабе генома, в частности, у вновь секвенированных организмов.DeepGOPlus также не делает никаких предположений относительно таксонов или царств, к которым принадлежит белок, что позволяет, например, прогнозировать функции для мета-геномики, в которой могут смешиваться белки из разных царств. Кроме того, DeepGOPlus работает быстро и может аннотировать несколько тысяч белков за считанные минуты даже на одном процессоре, что позволяет использовать его в метагеномике или в проектах, в которых идентифицируется очень большое количество белков с неизвестными функциями. Хотя мы изначально ожидали, что отсутствие функций, полученных из сетей взаимодействия, повлияет на производительность прогнозирования, мы обнаружили, что можем достичь еще более высокой точности прогнозирования с помощью нашей текущей модели; кроме того, наша модель не ограничивается несбалансированной или отсутствующей информацией о межбелковых взаимодействиях.
В DeepGOPlus мы объединяем поиск на основе сходства с белками с известными функциями и предсказание функции на основе мотивов, и эта комбинация дает нам в целом наилучшую прогностическую эффективность. Однако DeepGOPlus также может применяться с использованием только мотивов последовательностей; в частности, при аннотировании новых белков, для которых не существует подобных белков с известными функциями, наша модель на основе мотивов будет наиболее подходящей.
В будущем мы планируем включить дополнительные функции и протестировать другие типы моделей глубоких нейронных сетей.В то время как родственные методы используют функции, которые могут быть получены только для известных белков, такие как информация, полученная из литературы или сетей взаимодействия, DeepGOPlus будет полагаться в первую очередь на функции, которые могут быть получены из аминокислотных последовательностей, чтобы гарантировать, что модель может применяться как можно шире. . Возможная дополнительная информация, которая может улучшить DeepGOPlus в будущем, — это информация о структуре белка, в частности, поскольку методы прогнозирования структуры значительно улучшаются (Wang et al., 2017). Мы уже экспериментировали с несколькими типами нейронных сетей, такими как рекуррентные нейронные сети, сети с долговременной памятью и автоэнкодеры, чтобы изучить особенности последовательности. Однако наши попытки не увенчались успехом, и CNN дали лучший результат. В последнее время сети внимания были успешно применены к последовательностям белков (Rives et al. , 2019), и мы планируем протестировать их для прогнозирования функций.
Благодарности
Мы подтверждаем использование вычислительных ресурсов из базовой лаборатории суперкомпьютеров KAUST.
Финансирование
Эта работа была поддержана при финансовой поддержке Управления спонсируемых исследований (OSR) Университета науки и технологий имени короля Абдаллы (KAUST) в рамках награды № URF / 1 / 3454-01-01, URF / 1 / 3790-01-01, FCC. / 1 / 1976-08-01 и FCS / 1 / 3657-02-01.
Конфликт интересов : не заявлен.
Список литературы
Абади
М.
et al. (2016
) Tensorflow: система для крупномасштабного машинного обучения.В: Труды 12-й конференции USENIX по разработке и внедрению операционных систем, , OSDI’16, стр. 265–283. Ассоциация USENIX, Беркли, Калифорния, США.Altschul
S.F.
et al. (1997
)Gapped BLAST и PSI-BLAST: новое поколение программ поиска в базе данных белков
.Nucleic Acids Res
.,25
,3389
—3402
.Пепельница
M.
et al. (2000
)Генная онтология: инструмент для объединения биологии
.Nat. Genet
.,25
,25
—29
.Buchfink
B.
et al. (2015
)Быстрое и чувствительное выравнивание белков с помощью ромба
.Nat. Методы
,12
,59.
Дэвис
J.
,Goadrich
M.
(2006
) Взаимосвязь между кривыми точности – возврата и ROC. In: Proceedings of the 23rd International Conference on Machine Learning , ICML ’06, pp.233
—240
. ACM, Нью-Йорк, Нью-Йорк, США.Эль-Гебали
S.
et al. (2019
)База данных семейств белков Pfam на 2019 год
.Nucleic Acids Res
.,47
,D427
—D432
.Fa
R.
et al. (2018
)Прогнозирование функции белков человека с помощью многозадачных глубоких нейронных сетей
.PLoS One
,13
,e0198216
—16
.Finn
RD
et al. (2017
)Interpro в 2017 году — помимо аннотаций семейства белков и доменов
.Nucleic Acids Res
.,45
,D190.
Fishburn
P.C.
(1967
)Дополнительные утилиты с неполными наборами продуктов: приложение к приоритетам и назначениям
.Operations Res
.,15
,537
—542
.Цзян
Ю.
et al. (2016
)Расширенная оценка методов прогнозирования функции белков показывает повышение точности
.Genome Biol
.,17
,184.
Kahanda
I.
,Ben-Hur
A.
(2017
) Gostruct 2.0: Автоматическое предсказание функции белков для аннотированных белков. В: Труды 8-й Международной конференции ACM по биоинформатике, вычислительной биологии и информатике здравоохранения , ACM-BCB ’17, стр.60
—66
. ACM, Нью-Йорк, Нью-Йорк, США.Kingma
D.P.
,Ba
J.
(2014
) Адам: Метод стохастической оптимизации. В: Опубликован как доклад на 3-ей Международной конференции по обучению представительств , Сан-Диего, 2015.Кулманов
M.
et al. (2018
)DeepGO: прогнозирование функций белка на основе последовательности и взаимодействий с использованием классификатора с глубокими онтологиями
.Биоинформатика
,34
,660
—668
.Mitchell
A.
et al. (2014
)InterProScan 5: классификация функций белков в масштабе генома
.Биоинформатика
,30
,1236
—1240
.Наир
V.
,Hinton
G.E.
(2010
). Выпрямленные линейные блоки улучшают ограниченные машины Больцмана.In: Proceedings of the 27th International Conference on International Conference on Machine Learning , ICML’10, pp. 807–814. Омнипресс, США.Radivojac
P.
,Clark
W.T.
(2013
)Теоретико-информационная оценка прогнозируемых онтологических аннотаций
.Биоинформатика
,29
,i53
—i61
.Radivojac
P.
et al. (2013
)Масштабная оценка предсказания вычислительной функции белка
.Nat. Методы
,10
,221
—227
.Ривс
A.
et al. (2019
) Биологическая структура и функция возникают в результате масштабирования неконтролируемого обучения до 250 миллионов белковых последовательностей. Лаборатория Колд-Спринг-Харбор , В печати.Консорциум Uniprot (
2007
)Универсальный белковый ресурс (унипрот)
.Nucleic Acids Res
.,35
,Wang
S.
et al. (2017
)Точное предсказание de novo карты контакта белков с помощью модели сверхглубокого обучения
.PLOS Comput. Биол
.,13
,e1005324
—34
.Ян
J.
et al. (2015
)The I-TASSER Suite: предсказание структуры и функции белков
.Nat. Методы
,12
,7.
You
R.
et al. (2018a
)DeepText2GO: улучшение крупномасштабного предсказания функции белков с помощью глубокого семантического текстового представления
.Методы
,145
,82
—90
.You
R.
et al. (2018b
)GOLabeler: улучшение предсказания крупномасштабной функции белка на основе последовательностей путем обучения ранжированию
.Биоинформатика
,34
,2465
—2473
.Zhou
N.
et al. (2019
) Задача CAFA сообщает об улучшенном прогнозировании функции белков и новых функциональных аннотациях для сотен генов с помощью экспериментальных скринингов. bioRxiv.© Автор (ы) 2019. Опубликовано Oxford University Press.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное повторное использование, распространение и воспроизведение на любом носителе при условии, что оригинал работа правильно цитируется.GrAPFI: прогнозирование ферментативной функции белков на основе графиков сходства доменов | BMC Bioinformatics
GrAPFI объединяет понятие сходства белковых доменов с техникой вывода графа соседства для автоматической аннотации номера EC.Более конкретно, функциональные аннотации рассмотренных белков в SwissProt используются для прогнозирования аннотаций неотсмотренных белков в TrEMBL с использованием распространения меток в сложном сетевом представлении данных последовательности белков. Алгоритм GrAPFI сначала строит неориентированный взвешенный граф белков, используя состав доменов рассматриваемых белков. Затем, для не рассмотренного белка, алгоритм распространения метки применяется к графу белков, чтобы вывести соответствующие аннотации.
Обозначения
В этом разделе мы сначала представим некоторые определения и обозначения, используемые в статье.
График: Граф — это набор объектов, обозначенных как G = ( V , E ), где V — это набор вершин / узлов, а E ⊆ V × V — это набор кромок.
Взвешенный график: Взвешенный график — это график, который представлен в виде трех кортежей G = ( V , E , W ), где:
V — это набор узлов,
E ⊆ V × V — это набор ребер,
W — матрица весов, где каждая ячейка W uv представляет собой числовой вес кромки ( u , v ) ⊆ E .
Маркированный график: Помеченный график — это график, который представлен в виде четырех кортежей G = ( V , E , L , I ) где:
V — это набор узлов,
E ⊆ V × V — это набор кромок,
L — набор этикеток,
I : V ∪ E → L — это функция маркировки.
Направленный граф: Направленный граф G = ( V , E ) — это набор объектов, где V — это набор вершин / узлов, а E ⊆ V × V — это набор ребер с упорядоченной парой вершин ( u , v ) такой, что ( u → v ) ∈ E .
Ненаправленный граф: Ненаправленный граф — это совокупность объектов, обозначенных как G = ( V , E ), где V — это набор вершин / узлов, а E ⊆ V × V — это набор ребер с неупорядоченными вершинами ( u , v ) такой, что если ( u → v ) ∈ E существует, то ( v → u ) ∈ E должен существовать.
Соседи: Соседи узла u определены как N ( u ) = { v | ( u , v ) ∈ E }.
Степень: Степень узла в графе — это количество ребер, которые касаются его. Степень узла u на графике G обозначена d e g ( u ) = N ( u ).
Средняя степень: Средняя степень графа G = ( V , E ) — это мера того, сколько ребер находится в наборе E по сравнению с количеством вершин в наборе V .Средняя степень графика G = ( V , E ) определяется как A v g d e g = 2 | E | / | В |.
Построение графа
Мы представляем здесь новый способ соединения последовательностей белков с использованием связанных с ними доменов InterPro. Домены можно рассматривать как естественные строительные блоки белков. В результате эволюции белковые домены, возможно, претерпели изменения, такие как дупликация, слияние, рекомбинация, с образованием белков с различными структурами и функциями [42].Здесь каждый узел графа представляет белок, а связь между двумя узлами означает, что белки демонстрируют заданный уровень сходства доменов. Таким образом, каждый узел u идентифицируется набором меток L ( u ), имеет набор соседей N ( u ), и для каждого соседа v он имеет связанный вес W u , v . Общая цель состоит в том, чтобы распространить метки (т. Е. Аннотации) с узлов, имеющих метки, на аналогичные узлы, у которых нет меток.
Чтобы проиллюстрировать построение графа белков, рассмотрим пять белков с символическими названиями P 1, P 2, P 3, P 4 и P 5. Предположим, что эти белки состоят из доменов D 1 = ( d 1, d 2, d 3, d 4), D 2 = ( d 1, d 3, d 5), D 3 = ( d 1, d 2, d 10), D 4 = ( d 5, d 6, d 1) и D 5 = ( d 4, d 1, d 10, d 40, d 7, d 9, d 12, d 52, d 100) , соответственно.
Доменный состав белка — это набор доменов, обнаруженных в последовательности белка и рассматриваемых независимо от порядка появления в последовательности. Например, информация о домене в D 1 = ( d 1, d 2, d 3, d 4) может использоваться в любом другом порядке D 1 = ( d 1, d 4, d 3, d 2). Следовательно, композиция не является строго линейной. Перекрытие доменов не учитывается, если перекрывающиеся домены имеют новый идентификатор домена.
Тогда очевидно, что белки P 1 и P 2 содержат два общих домена: d 1 и d 3. Следовательно, белки P 1 и P 2 могут быть связаны, и количество общих доменов может служить в качестве веса связи, определяемого выражением
$$ {} W_ {P1, P2} = | (d1, d2, d3, d4) \ cap (d1, d3, d5) | = | (d1, d3) | = 2. $$
В аналогичным образом белки P 1 и P 5 могут быть связаны с весом связи | ( d 1, d 2, d 3, d 4) ∩ ( d 4, d 1, d 10, d 40, d 7, d 9, d 12, d 52, d 100) | = | ( d 1, d 4) | = 2.В обоих случаях вес звена равен 2. Однако вес звена, вычисленный таким образом, не отражает относительную силу взаимосвязи между белками. Более конкретно, в первом случае два белка имеют | ( d 1, d 2, d 3, d 4) ∪ ( d 1, d 3, d 5) | = | ( d 1, d 2, d 3, d 4, d 5) | = 5 разных доменов, два из которых являются общими. Во втором случае есть | ( d 1, d 2, d 3, d 4) ∪ ( d 4, d 1, d 10, d 40 , d 7, d 9, d 12, d 52, d 100) | = 11 различных доменов, два из которых снова являются общими.Хотя в каждом случае используются два домена, P1 интуитивно более согласован с P2, чем P5. Таким образом, вместо использования вышеуказанной исходной оценки сходства мы использовали индекс сходства Жаккара или коэффициент сходства Жаккара, чтобы лучше отразить сходство в композиции. Это вычисляется как \ (\ frac {| A \ cap B |} {| A \ cup B |} \), где A и B — два набора составляющих областей. Используя индекс подобия Жаккара, веса ссылок для P1 и P2 рассчитываются как
$$ \ begin {array} {* {20} l} W_ {P1, P2} & = \ frac {| (d1, d2, d3, d4) \ cap (d1, d3, d5) |} {| (d1, d2, d3, d4) \ cup (d1, d3, d5) |} \\ & = \ frac {| (d1, d3) |} {| (d1, d2, d3, d4, d5) |} = \ frac {2} {5} = 0.4. \ end {array} $$
Аналогично, для P1 и P5 вес ссылки рассчитывается как
$$ {\ begin {align} W_ {P1, P5} & = \ frac {| (d1, d2, d3, d4) \ cap (d4, d1, d10, d40, d7, d9, d12, d52, d100) |} {| (d1, d2, d3, d4) \ cup (d4, d1, d10, d40, d7, d9, d12, d52, d100) |} \\ & = \ frac {2} {11} = 0,18. \ end {align}} $$
Используя индекс подобия Жаккара, окончательный граф строится в два простых шага. На первом этапе файлы данных, содержащие информацию о проверенных белках, анализируются для сбора составляющих доменов каждого белка.Если обучающие данные содержат только последовательности, InterProScan [40, 43] используется для поиска доменов, связанных с каждой из белковых последовательностей. Затем строится граф с использованием доменного состава белков.
Стоит отметить, что порядок доменов не сохраняется при вычислении индекса сходства jaccard. Состав домена для каждого белка содержит набор уникальных сигнатур InterPro, обнаруженных в последовательности.
Комиссионные номера ферментов
Ферменты обычно маркируются в соответствии с системой Enzyme Commission (EC) [44], широко используемой схемой числовой классификации ферментов.Система EC присваивает каждому ферменту четырехзначный номер. Эта система классификации имеет иерархическую структуру. Первый уровень состоит из шести основных классов ферментов: (i) оксидоредуктазы, (ii) трансферазы, (iii) гидролазы, (iv) лиазы, (v) изомеразы и (vi) лигазы, представленные первой цифрой. Каждый узел основного класса расширяет несколько узлов подкласса, определяя подклассы ферментов, представленные второй цифрой. Точно так же третья цифра указывает подкласс, а четвертая цифра обозначает подклассы.Рассмотрим в качестве примера рестрикционный фермент II типа, который обозначен как EC 3.1.21.4. Первая цифра 3 означает, что это гидролаза. Вторая цифра, 1, указывает, что он действует на сложноэфирные связи. Третья цифра, 21, показывает, что это эндодезоксирибонуклеаза, продуцирующая 5-фосфомоноэфиры. Последняя цифра, 4, указывает, что это сайт-специфическая дезоксирибонуклеаза II типа.
Распространение метки для аннотации функции белка
После построения графика из рассмотренных белков график готов к использованию для аннотации функций новых последовательностей белка.{i} _ {u} \) — взвешенная оценка функции-кандидата i для белка запроса и . И δ ( v i , i ) равно 1, если функция белка v v i совпадает с функцией i, в противном случае — 0. Подробная информация на этикетке алгоритм распространения описан в алгоритме 1. В целом для данной входной последовательности алгоритм аннотации работает в соответствии с блок-схемой, показанной на рис.11.
Рис. 11Рабочий процесс аннотации, используемый в GrAPFI. Правая часть рабочего процесса изображает построение графа с использованием рассмотренных белков из UniprotKB / Swissprot. В левой части показан поток аннотаций
Рассмотрим белок запроса P с набором доменов D = ( d 5, d 6, d 101). Наша цель — аннотировать этот белок с помощью номера EC в соответствии с алгоритмом распространения метки, как показано на рис.12. На основании сходства доменов белок P будет иметь связь с белками P 2 и P 4 на графике текущего примера. Пунктирными линиями показаны связи от P до P 2 и P 4 на графике вместе с соответствующими весами. Следовательно, белок P будет иметь в качестве соседей P 2 и P 4. После нахождения соседей функциональные аннотации всех соседей распространяются вместе с соответствующими весами.Все функциональные аннотации ранжируются на основе их совокупного веса.




