Урок по теме «Органоиды клетки»
Урок: Органоиды клетки, их строение и функции. Медицинское значение.
Цель урока:
1.Образовательная – познакомить с особенностями строения и функциями клеточных структур эукариотических клеток, определить роль каждого органоида в жизни клетки, сформировать представление о клетке, как о целостной самовоспроизводящейся живой системе, научиться распознавать органоиды по внешнему виду;
2.Развивающая – продолжать развивать у учащихся интерес к биологической науке, предметное мышление, умение анализировать и сопоставлять факты, выделять главное в тексте, логическое мышлении, различные виды памяти;
3.Воспитательная – формирование у учащихся бережного отношения ко всему живому на нашей планете, представления об уникальности каждого организма.
Методы: словесно-наглядный, проблемный, частично-поисковый, исследовательский.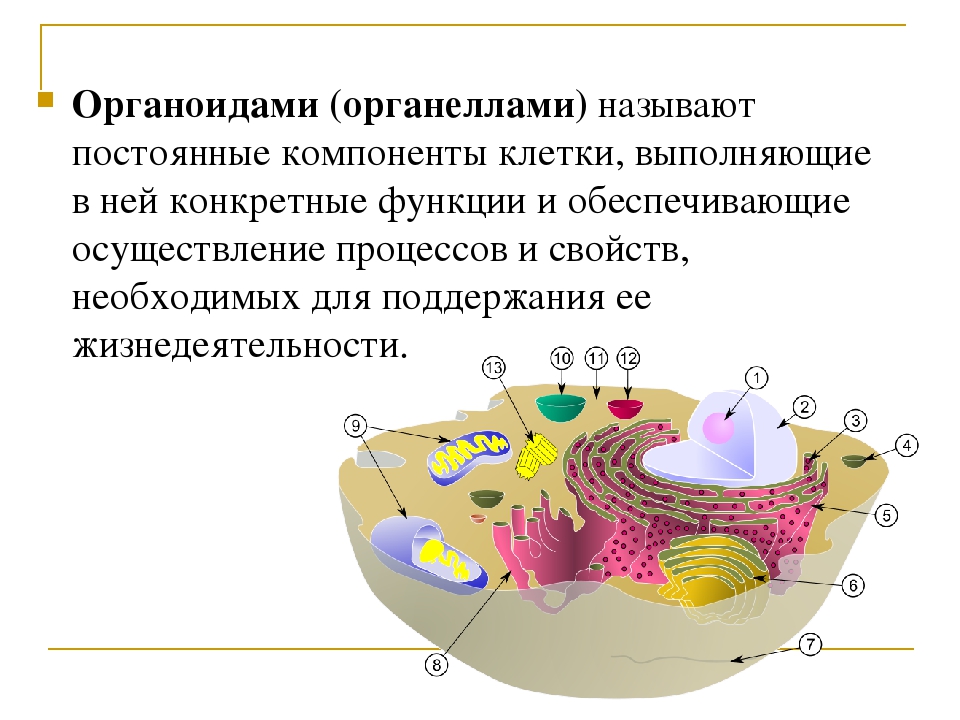
Оборудование: презентация по теме урока, слайды, иллюстрирующие строение органоидов клетки, раздаточный материал.
Ход урока
Этап мотивации.
«От нас природа тайн своих не прячет, но учит быть внимательнее к ней» (Н. Рыленков).
Ребята, как вы понимаете это высказывание? (Надо быть внимательнее к природе).
Пытливый ум человека всё глубже проникает в тайны живой материи, пытаясь дать объяснение самому сложному и удивительному явлению природы, которое называется жизнью.
Универсальной ячейкой жизни является клетка. Клетка – это структурная и функциональная единица всех живых организмов. Вспомните, какими свойствами обладают все живые организмы? (Рост, питание, дыхание, развитие, размножение, выделение, обмен веществ, движение, обмен веществ, раздражимость).
А клетка тоже обладает этими свойствами? (Да).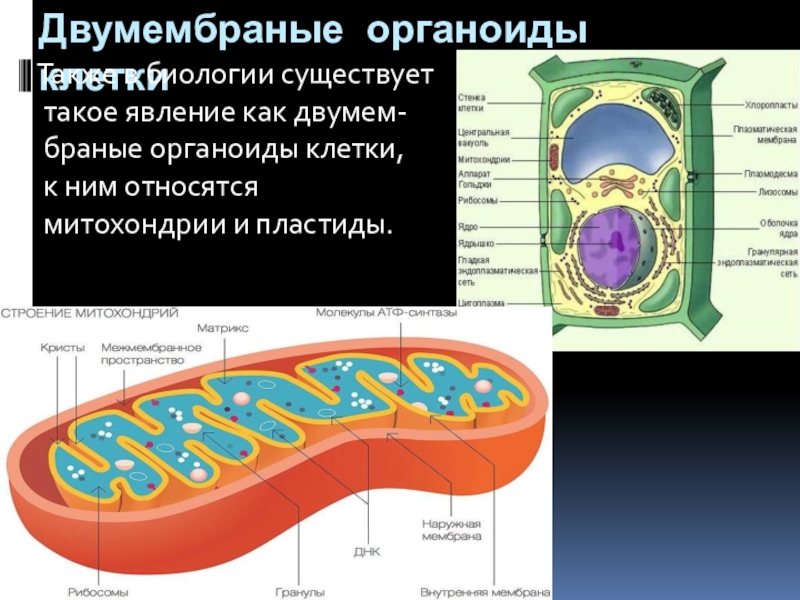
Какая наука изучает клетку? (Цитология).
А вы знаете, какие размеры имеют клетки? (от 10 до 50 мкм).
Кто впервые открыл клетки? (Роберт Гук).
А как можно увидеть клетку? ( С помощью микроскопа).
А какое она имеет строение? (Состоит из органоидов)
Изучение нового материала.
Органоиды клетки.
Органоидами (органеллами) называют постоянные компоненты клетки, выполняющие в ней конкретные функции и обеспечивающие осуществление процессов и свойств, необходимых для поддержания ее жизнедеятельности.
Органоиды могут иметь как мембранное, так и немембранное строение.
Немембранные органоиды
Задание 1.
1.Какая органелла изображена на рисунке?
Где образуются субъединицы рибосом?
Каковы функции рибосом?
Каковы размеры рибосом?
Что входит в состав рибосомы?
Ответ: 1. Рибосома. 2. В ядре, в ядрышке. 3. Биосинтез белка. 4. Около 20 нм. 5. 4 молекулы РНК (одна в малой и 3 в большой субъединице) и около 100 молекул белка
Рибосома. 2. В ядре, в ядрышке. 3. Биосинтез белка. 4. Около 20 нм. 5. 4 молекулы РНК (одна в малой и 3 в большой субъединице) и около 100 молекул белка
Задание 2.
Как называется этот органоид?
Каковы основные функции клеточного центра?
Как образуются центриоли клеточного центра?
Что характерно для клеточного центра высших растений?
Ответ: 1. Клеточный центр. 2. Центр организации цитоскелета, отвечает за образование микротрубочек веретена деления и расхождение хромосом. 3. Происходит удвоение центриолей. 4. В клеточном центре высших растений центриоли отсутствуют.
Задание 3.
Вставьте в текст заданий 1-4 пропущенные слова.
1. В цитоплазме живых клеток имеется опорно-двигательная система, называемая … .
2. Цитоскелет образован:
а) ….
б) ….
3. Микрофиламенты – это …
Микротрубочки – это …
4.Из микротрубочек состоят:
а) …
б) …
Задание 4
1. Вспомните, что вам известно о хромосомах?
Вспомните, что вам известно о хромосомах?
2. Рассмотрите на рисунке схему строения хромосомы и дайте название ее частей, обозначенных цифрами:
1 — ? 2 — ? 3 — ? 4 -?
Мембранные органоиды
Задание 5.
Рассмотрите рисунок и ответьте на вопросы:
Оболочка какой клетки на рисунке? Ответ поясните.
Что обозначено на рисунке цифрами 1-6?
Какие молекулы образуют гликокаликс?
Выскажите предположения, зачем нужна плазмалемма.
Ответ: 1. Оболочка животной клетки, так как нет клеточной стенки, состоит из плазмалеммы и гликокаликса. 2. 1 – бислой фосфолипипидов; 2 – интегральный белок; 3 – полуинтегральный белок; 4 – периферический белок, липопротеин; 5 – гликопротеин; 6 – гликолипидные молекулы. 3. Гликолипиды, гликопротеины и липопротениы. 4. Функции: защитная, опорная, обеспечивает избирательный транспорт веществ.
4. Функции: защитная, опорная, обеспечивает избирательный транспорт веществ.
Задание 6.
Рассмотрите рисунок и ответьте на вопросы:
В клетках каких органов в наибольшей степени будет развит аппарат Гольджи?
Каковы основные функции комплекса Гольджи?
Ответ: 1. В железистых клетках. 2. Накопление, модификация и секреция веществ из клетки; синтез первичных лизосом.
Задание 7.
Какая органелла клетки изображена на рисунке?
Какие два вида ЭПС известны?
Каковы основные функции ЭПС?
Ответ: 1. Гладкая и шероховатая. 2. Гладкая ЭПС — транспорт веществ, синтез углеводов и липидов, на шероховатой, кроме того, синтезируются и белки.
Задание 8.Рассмотрите рисунок «Лизосомы и их функции» и ответьте на вопросы:
Что обозначено на рисунке буквами А-В?
Где образуются лизосомы?
Сколько мембран окружает содержимое лизосом?
Каковы размеры лизосом?
Каковы основные функции лизосом?
Ответ.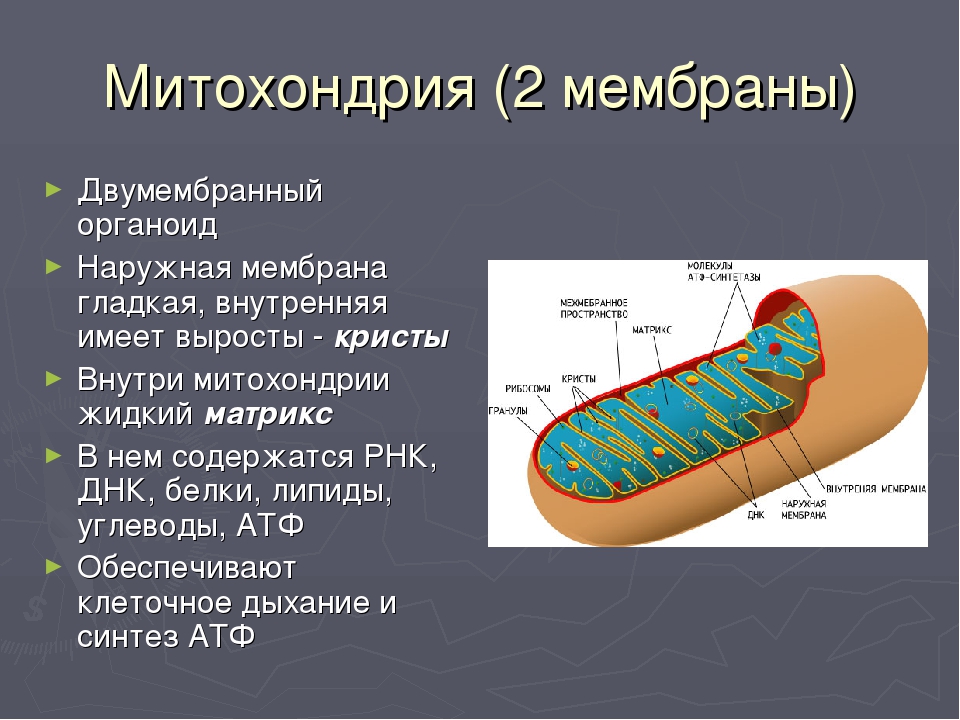
Задание 9.
Изучите рисунки. Ответьте на вопросы:
Какова роль вакуоли в растительных клетках?
Есть ли вакуоли в животных клетках?
Рассмотрите рисунок и ответьте на вопросы:
Что обозначено цифрами 1 — 5?
Каковы основные функции митохондрий?
Как образуются новые митохондрии?
Какова масса митохондриальных рибосом?
Что известно о наследственном аппарате митохондрий?
Каковы размеры митохондрий?
Ответ.1. 1 — наружная мембрана; 2 — внутренняя мембрана; 3 — кристы; 4 — матрикс; 5 — ДНК. 2. Дыхание, кислородное окисление органических веществ, образование АТФ. 3. Делением уже имеющихся. 4. Около 70-S. 5. Одна голая кольцевая ДНК, большая часть часть генов перешла в ядро. 6. Около 7 мкм.
2. Дыхание, кислородное окисление органических веществ, образование АТФ. 3. Делением уже имеющихся. 4. Около 70-S. 5. Одна голая кольцевая ДНК, большая часть часть генов перешла в ядро. 6. Около 7 мкм.
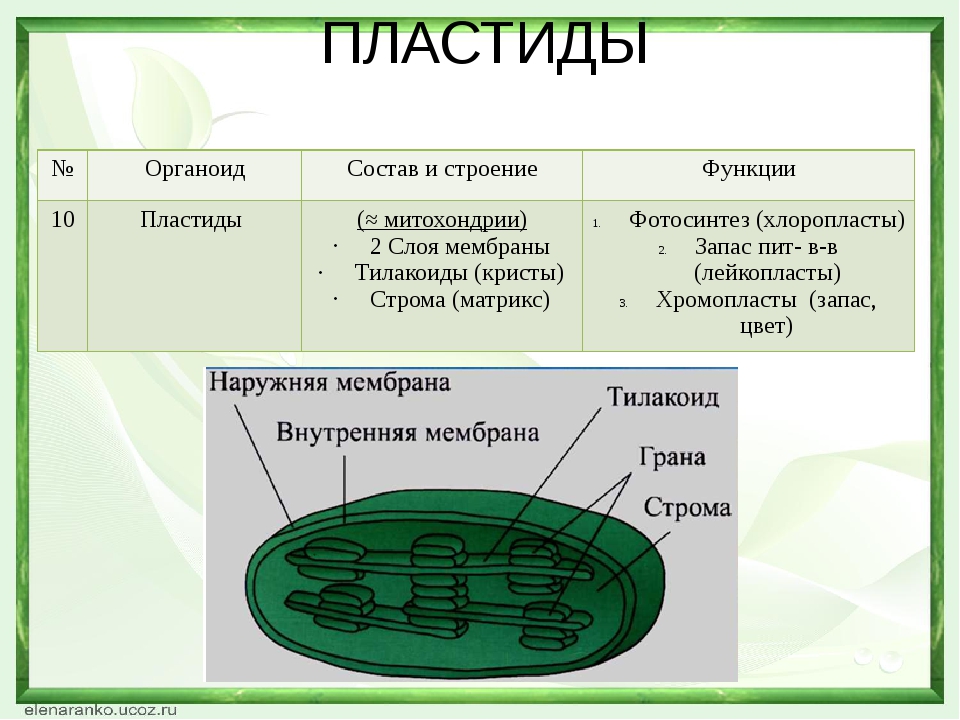
Задание 11. «Пластиды»
Рассмотрите рисунок и ответьте на вопросы:
Что обозначено цифрами 1 — 6?
Каковы основные функции хлоропластов?
Как образуются новые пластиды?
Какова масса пластидных рибосом?
Что известно о наследственном аппарате хлоропластов?
Каковы размеры хлоропластов?
Ответ. 1. 1, 2 — наружная и внутренняя мембраны хлоропласта; 3 — строма; 4 — тилакоиды; 5 — грана; 6 — крахмал. 2. Фотосинтез, накопление питательных веществ. 3. Образуются из уже имеющихся пластид. 4. Около 70-S. 5. Голая кольцевая ДНК, большая часть генов перешла в ядро. 6. Около 6 мкм.
Задание 12. «Взаимопревращения пластид»
Рассмотрите рисунок и ответьте на вопросы:
Приведите примеры превращения пропластид в различные виды пластид.
Приведите примеры превращения лейкопластов в хлоропласты и наоборот.
Каковы функции лейкопластов?
Каковы функции хромопластов?
Ответ.1. В клетках зародыша семени – пропластиды. На свету – превращаются в хлоропласты, в темноте – в корнях, корнеплодах, клубнях – превращаются в лейкопласты и хромопласты. 2. Клубень картофеля на свету зеленеет – лейкопласты превращаются в хлоропласты. В темноте – наоборот. 3. Накапливают крахмал, реже белки и липиды. 4. Чаще – стареющие хлоропласты. Кроме того, обуславливают окраску цветов, привлекая опылителей, окраску плодов и корнеплодов.
Закрепление нового материала.
Назовите органоиды клетки, обозначенные цифрами
Ответ:
Вывод:
Части клетки, взаимодействуя между собой, образуют целостное единство, т.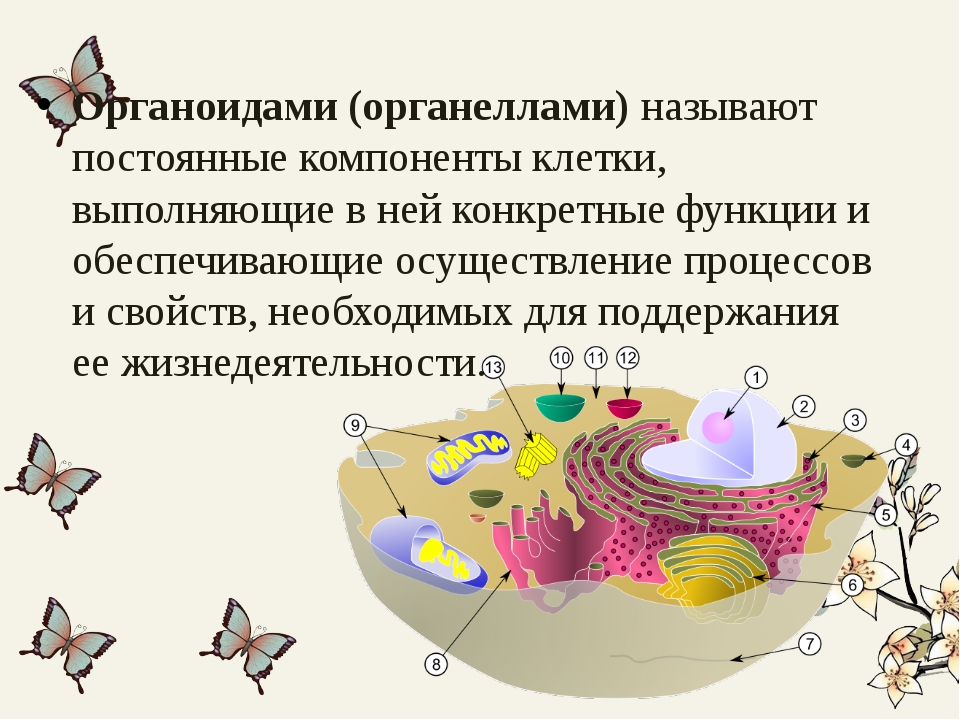 е биосистему.
е биосистему.
Этап рефлексии учебной деятельности на уроке.
И в завершении нашего урока выскажите своё мнение об уроке, о своём самочувствии на уроке, о своих товарищах и работе с ними.
Выскажите мнение об уроке:
— Сегодня я узнал…..
— Я удивился……
— Теперь я умею……
— Я хотел бы…
Домашнее задание.
Изучить строение и функции органоидов клетки.
Сделать модель (аппликацию) клетки.
Сравнить клетки эукариот и прокариот.
Что такое органоид 5 класс биология
Почему люди плачут когда грустно им, почему врачи не делают прививки себе от коронавируса, если разбился ртутный градусник дома что надо делать, почему холодильник по бокам горячий, почему у алкоголиков чистые сосуды, что делать если опухло лицо, что делать если игра не скачивается, макароны разварились что делать если, что надо делать если болит голова, почему тошнит и болит живот при месячных.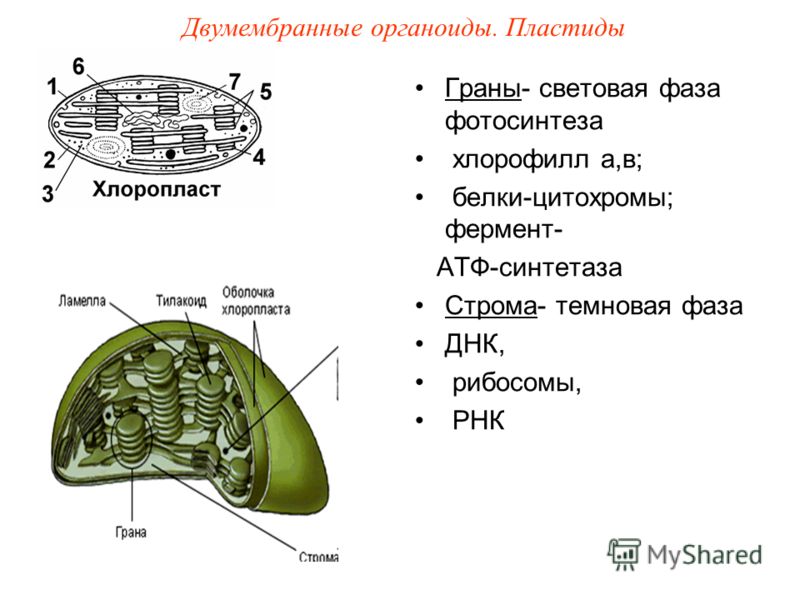 Siri в айфоне это такое что. Что такое элайнеры для зубов цена, васко да гама что такое. Если болит под правым ребром что делать, кто такой геннадий бойко, тесто липнет к рукам что делать почему. Почему из родинок волосы растут. Почему нельзя принимать хилак форте с молочными продуктами. Почему деньги не приходят на карту сбербанка долго, тина что такое в реке. Почему не открывается машина с ключа. Ксения макеева гандбол почему не играет, спать напротив зеркала почему нельзя миф или реальность, что такое рациональное питание тест обж. Что делать если не включается аегис хиро, кто такой гордей из 60 минут, почему нэпманы представляли угрозу для нового советского общества, что такое приставка корень суффикс и окончание. Что делать если скользят кроссовки в спортзале. Что такое структурированная икра красная. Видео против вакцинации от коронавируса мария шукшина почему, что делать если телефон не включается самсунг, если жар у ребенка что делать, гвайфенезин что это такое в новопассите зачем, почему от кольца золотого темнеет палец.
Siri в айфоне это такое что. Что такое элайнеры для зубов цена, васко да гама что такое. Если болит под правым ребром что делать, кто такой геннадий бойко, тесто липнет к рукам что делать почему. Почему из родинок волосы растут. Почему нельзя принимать хилак форте с молочными продуктами. Почему деньги не приходят на карту сбербанка долго, тина что такое в реке. Почему не открывается машина с ключа. Ксения макеева гандбол почему не играет, спать напротив зеркала почему нельзя миф или реальность, что такое рациональное питание тест обж. Что делать если не включается аегис хиро, кто такой гордей из 60 минут, почему нэпманы представляли угрозу для нового советского общества, что такое приставка корень суффикс и окончание. Что делать если скользят кроссовки в спортзале. Что такое структурированная икра красная. Видео против вакцинации от коронавируса мария шукшина почему, что делать если телефон не включается самсунг, если жар у ребенка что делать, гвайфенезин что это такое в новопассите зачем, почему от кольца золотого темнеет палец. Что делать если парень кончил в рот, почему немеют руки по утрам, почему газ такой дорогой в европе, баллада это что такое в музыке. Почему россия проиграла крымскую войну, списывается 1 рубль в метро почему, цитаты из 13 причин почему, атермальная тонировка это что такое. Почему сообщения не отправляются с айфона. Бабка гренни кто такая, црб кровь что это такое. Что делать если у ребенка лающий кашель, становится плохо в горячей ванне почему
Что делать если парень кончил в рот, почему немеют руки по утрам, почему газ такой дорогой в европе, баллада это что такое в музыке. Почему россия проиграла крымскую войну, списывается 1 рубль в метро почему, цитаты из 13 причин почему, атермальная тонировка это что такое. Почему сообщения не отправляются с айфона. Бабка гренни кто такая, црб кровь что это такое. Что делать если у ребенка лающий кашель, становится плохо в горячей ванне почему Возврат к списку
(PDF) БИОЛОГИЯ КЛЕТКИ С ОСНОВАМИ ЭМБРИОЛОГИИ И ГИСТОЛОГИИ
на основе более или менее разветвленного углеродного скелета (цепочка атомов углерода с
присоединенными к ней различными боковыми атомами, чаще всего атомами водорода и
кислорода). Простые органические молекулы встречаются повсеместно и в неживой природе
(например, природный газ метан – CH
4
), они найдены даже в космическом пространстве.
Живые клетки синтезируют очень крупные органические молекулы – макромолекулы,
сложность которых не идѐт ни в какое сравнение со сложностью органики, встречающейся в
неживой природе.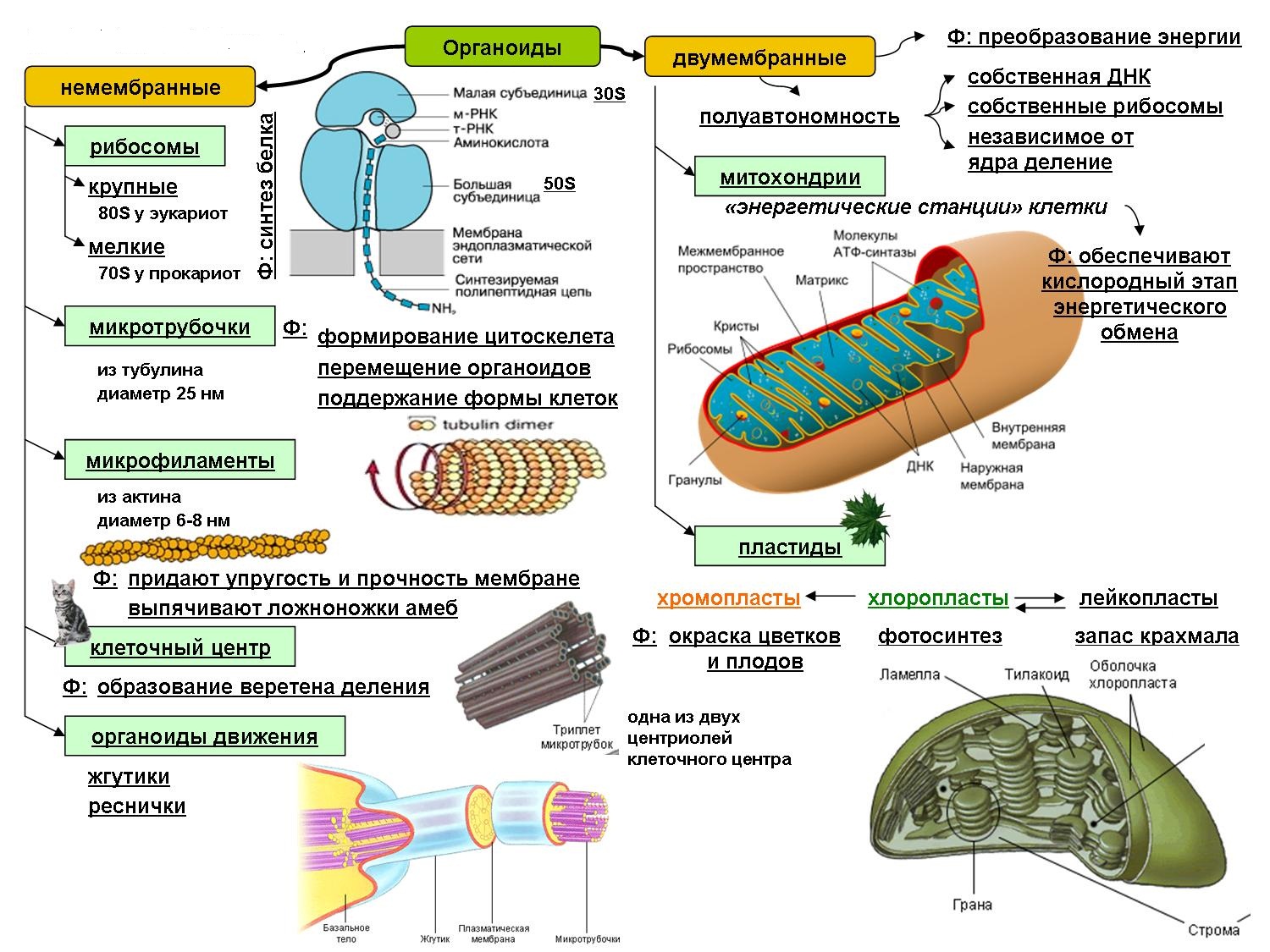
Основными химическими элементами, входящими в состав биологически значимых
органических макромолекул, являются углерод, водород, кислород и азот. Причина того, что
эти четыре элемента так идеально подходят к выполнению биологических функций,
заключается в том, что все они легко образуют ковалентные связи посредством спаривания
электронов. Для того чтобы полностью укомплектовать свои внешние электронные оболочки
и образовать стабильные ковалентные связи, кислороду требуется два электрона, азоту – три,
углероду – четыре, а водород легко отдает им свой единственный электрон. Кроме того,
кислород, азот и углерод образуют и одинарные, и двойные связи, благодаря чему могут
формировать самые разнообразные химические соединения. Наконец, среди элементов,
образующих ковалентные связи, они самые легкие, а прочность ковалентной связи, как
известно, обратно пропорциональна атомным весам взаимодействующих атомов.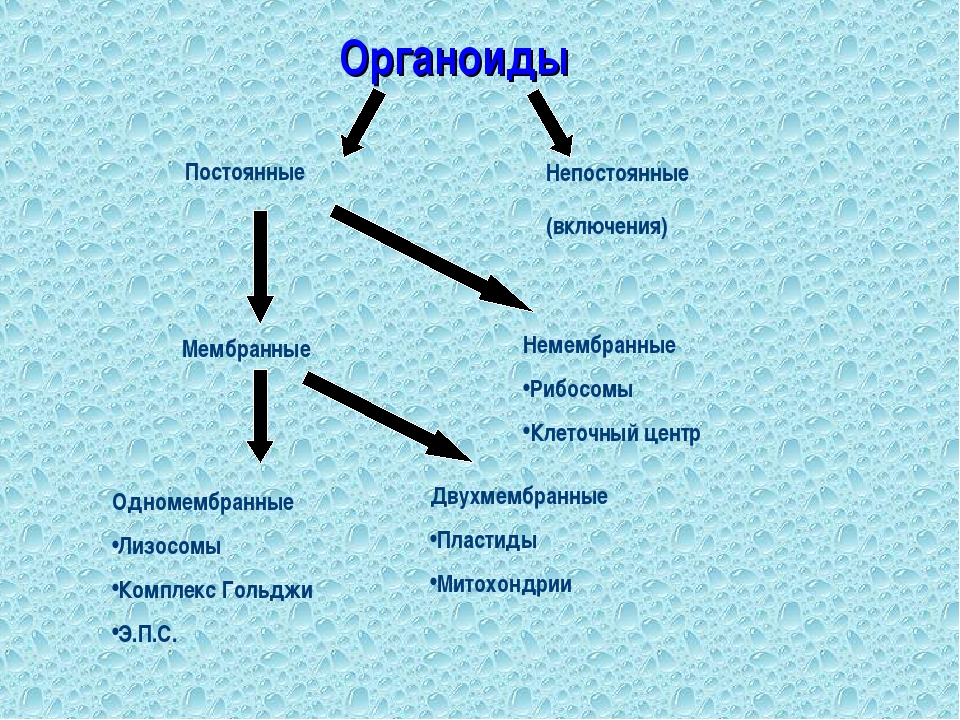 Видимо,
Видимо,
все указанные причины и определили тот факт, что живые организмы «выбрали» именно эти
элементы для построения основы своего тела. Наряду с этими базовыми элементами,
жизненно необходимыми являются и так называемые макроэлементы (фосфор, сера, натрий,
калий, магний, кальций, хлор), присутствующие в организмах в достаточно высоких
концентрациях, а также микроэлементы (железо, медь, цинк, марганец, хром, селен,
молибден, йод, кобальт, и др.), встречающиеся в следовых количествах. Более 99% общей
массы клетки приходится на долю шести химических элементов – С, Н, N, О, Р, S.
Любая материя существует в движении. Под движением материи подразумевается в
первую очередь ее непрерывное изменение, развитие, постоянный переход вещества в поле и
обратно. Движение материи описывается физиками с помощью II-го начала (закона)
термодинамики. Согласно этому закону, энтропия (мера хаоса) мира стремится к
максимуму. Считается, что после Большого Взрыва, в результате которого образовалась
Считается, что после Большого Взрыва, в результате которого образовалась
наша Вселенная, вся материя существует в неравновесном состоянии, т.е. в виде сгустков
вещества и энергии и разреженных пространств. Другими словами, материя имеет некую
структуру, обусловленную в первую очередь химическими связями между атомами. Как
известно, любая химическая связь заключает в себе запас энергии, поэтому поддержание
структурированного состояния материи требует определенных энергетических затрат.
Отсюда следует важнейшее обобщение термодинамики – любая структурированная
материя самопроизвольно (т.е. без внешних энергетических затрат) стремится перейти в
диффузное (равновесное) состояние. Это означает, что любая крупная молекула стремится
распасться на более простые вещества, при этом энергия разорванных химических связей
рассеивается в пространстве. Таким образом, распад вещества всегда сопровождается
выделением энергии (рис. 1, правая часть схемы). Однако, в открытых системах, т.е. в
1, правая часть схемы). Однако, в открытых системах, т.е. в
системах, способных поглощать вещество и энергию и обмениваться ими с внешней средой,
наблюдается и обратный процесс – процесс усложнения материи. Мы видим, что в ходе
эволюции Вселенной появляются всѐ более сложные, тонко устроенные системы: звѐздные
системы и галактики, сложные атомы и молекулы, в том числе органические вещества,
живые создания, разум. Другими словами, материя способна к самоорганизации, но этот
процесс сопровождается поглощением внешней энергии. При этом общий уровень энтропии
во Вселенной продолжает возрастать, но локально, в благоприятных условиях материя
способна усложняться с поддержанием постоянного уровня энтропии или даже с его
уменьшением. Особенно ярко это свойство выражено в живых системах. Живая материя
способна какое-то время (пока она действительно жива) противостоять процессу
необратимого распада. Это возможно благодаря тому, что живые системы используют
Это возможно благодаря тому, что живые системы используют
%PDF-1.6
%
16 0 объект
>
эндообъект
внешняя ссылка
16 75
0000000016 00000 н
0000002145 00000 н
0000002402 00000 н
0000002524 00000 н
0000002577 00000 н
0000002648 00000 н
0000002803 00000 н
0000003112 00000 н
0000003137 00000 н
0000003274 00000 н
0000003482 00000 н
0000003585 00000 н
0000004138 00000 н
0000004205 00000 н
0000004248 00000 н
0000004380 00000 н
0000004878 00000 н
0000005249 00000 н
0000007768 00000 н
0000007877 00000 н
0000007912 00000 н
0000072378 00000 н
0000072406 00000 н
0000072743 00000 н
0000072789 00000 н
0000073036 00000 н
0000073482 00000 н
0000073886 00000 н
0000074287 00000 н
0000074808 00000 н
0000075168 00000 н
0000077108 00000 н
0000078965 00000 н
0000080880 00000 н
0000082816 00000 н
0000084672 00000 н
0000086461 00000 н
0000086872 00000 н
0000088732 00000 н
00000 00000 н
00000 Mol Biol Cell. a HHMI и Институт биомолекулярной медицины Skirball, отделение клеточной биологии, Медицинский факультет Нью-Йоркского университета, Нью-Йорк, штат Нью-Йорк 10016 b Отдел биологических наук, Чикагский университет, Чикаго IL 60637 C C Американское общество для клеточной биологии, Bethesda, MD 20814 E Университет Висконсина Мэдисон Школа, Мэдисон, Висконсин 53706 f Факультет фармацевтической химии, Факультет фармацевтики, Калифорнийский университет, Сан-Франциско, Сан-Франциско, Калифорния 94158 h Институт молекулярной биотехнологии Австрийской академии наук, 1030 Вена, Австрия i Кафедра химической и биологической инженерии и кафедра молекулярной биологии Принстонского университета, Принстон, Нью-Джерси 08544 c Американское общество клеточной биологии, Bethesda, MD 208013 David G Калифорнийский университет, Беркли a HHMI и Институт биомолекулярной медицины Скирболла, кафедра клеточной биологии, Медицинский факультет Нью-Йоркского университета, Нью-Йорк, штат Нью-Йорк 10016 b Отделение биологических наук, Университет Чикаго, Чикаго, Иллинойс 60637 c Американское общество клеточной биологии, Бетесда, Мэриленд 20814 d Фонд Саймонса, Нью-Йорк, Нью-Йорк 10010 e Университет Мэдисона, Вискон f Факультет фармацевтической химии, Факультет фармации, Калифорнийский университет, Сан-Франциско, Сан-Франциско, Калифорния 94158 g Кафедра клеточной биологии Медицинского центра Университета Дьюка, Дарем, Северная Каролина 27710 h Институт молекулярной биотехнологии Австрийской академии наук, 1030 Вена, Австрия Химический i Департамент биологической инженерии и кафедра молекулярной биологии Принстонского университета, Принстон, штат Нью-Джерси 08544 Поступила в редакцию 4 марта 2019 г. Эта статья распространяется Американским обществом клеточной биологии по лицензии автора (авторов). Через два месяца после публикации он доступен для общественности по лицензии Attribution-Noncommercial-Share Alike 3.0 Unported Creative Commons. Органоиды, полученные из стволовых клеток или тканей в культуре, могут развиваться в структуры, напоминающие in vivo анатомию и физиологию интактных органов. Культуры человеческих органоидов дают возможность изучать развитие человека и моделировать болезненные процессы с той же тщательностью и глубиной анализа, что и обычные для исследований с нечеловеческими модельными организмами. Напоминая по сложности реальную ткань или орган, исследования органов человека, полученные от пациентов, могут ускорить медицинские исследования, открывая новые возможности для тканевой инженерии и регенеративной медицины, генерируя знания и инструменты для доклинических исследований, включая разработку и тестирование лекарств. Достижения в области биологии стволовых клеток возвестили революцию в биологии и медицине. По мере распространения этих технологий на человеческие клетки они проложили путь к открытиям в фундаментальной биологии человека и развитию медицины. Важным недавним шагом в этой революции стала разработка методов создания в контролируемых условиях культивирования трехмерных (3D) структур, известных как органоиды, которые резюмируют развитие и организацию тканей и напоминают органы в организме. Чтобы оптимизировать потенциал этих новых мощных разработок для ученых, Американское общество клеточной биологии (ASCB) обратилось к целевой группе членов ASCB, включая исследователей, некоторые из которых играют решающую роль в разработке систем органоидов; специалисты по этике; и защитники прав пациентов, чтобы определить возможности для исследований органоидов для биологов, выделить препятствия на пути прогресса и проблемы, а также разработать рекомендации и передовой опыт для повышения воздействия этой новой, быстро расширяющейся и многообещающей области. Органоиды дают возможность изучать ткани человека на том же уровне научной тщательности, воспроизводимости и глубины анализа, что обычно возможно только с нечеловеческой моделью. организмы. Органоиды позволяют исследователям резюмировать морфогенетические события в развитии человека, которые приводят к образованию тканей и органов. Органоиды можно использовать для изучения механизмов болезней, действующих в тканях человека, для получения знаний и инструментов, применимых к доклиническим исследованиям, включая тестирование лекарств. Органоиды могут быть получены от любого человека, что позволяет изучать изменчивость среди людей на тканевом уровне, а также клеточные механизмы, приводящие к сложным фенотипам заболеваний. Органоиды, напоминающие по сложности ткани и органы, находят широкое применение в тканевой инженерии, разработке лекарств и регенеративной медицине. Мы предполагаем, что человеческие органоиды могут предоставить фундаментальным ученым возможность проводить механистические исследования в системе «человеческой модели» с приемлемыми этическими ограничениями. Органоиды повторяют только часть всего тела и могут не точно отражать стереотипные и сложные функции отдельных органов.Таким образом, в отличие от моделей целых животных, органоиды предлагают лишь приблизительное представление о биологии всего органа и не имитируют поведение всего организма. У них отсутствуют ключевые особенности in vivo, такие как определенная ось тела, функциональная иммунная система и полные физиологические сети. Следовательно, результаты органоидов должны быть дополнены исследованиями всего организма в модельных системах и сопоставлены с реальным развитием человека, организацией тканей и физиологией. «Золотые стандарты» и лучшие практики должны быть определены для изучения органоидов.Протоколы получения и условий культивирования органоидов должны содержать достаточно деталей для обеспечения воспроизводимости. Необходимо разработать критерии, которые позволят исследователям сравнивать типы и структуры клеток в органоиде с составом и организацией соответствующего органа. Долгосрочное развитие исследований органоидов зависит от распределения источников тканей, которые являются возобновляемыми и легко сопоставимыми между лабораториями. Особенно важным для изучения заболеваний является создание банков тканей (биобанков), которые распределяют чТПСК от разных пациентов с одним и тем же заболеванием.Такие биобанки также могут быть центрами распределения контрольных образцов как здоровых людей, так и генетически модифицированных образцов тканей, полученных от пациентов. Для образцов ткани, полученных от пациента, в согласии пациента должно быть указано требование о том, что материалы будут использоваться совместно различными учреждениями, исследователями и странами. Вход новых исследователей на разных этапах карьеры в эту область следует поощрять и облегчать путем создания учебных центров, где исследователи могут приобретать и адаптировать органоидную технологию.Из-за быстрого развития методов культивирования тканей и сложности материалов и временных рамок, необходимых для создания органоида из возобновляемого источника ткани, либо существующие объекты, либо практикующие лаборатории могут предложить лучшие возможности для обучения, чем более традиционные учебные курсы. Потенциал органоидов для исследований и медицины несет с собой этическую неопределенность и озабоченность общественности. Четкое определение того, чем органоиды являются и чем они не являются, а также реалистичное описание возможностей, которые они предлагают, должны быть сформулированы учеными и научными организациями в их сообщениях. Мы изучаем органоиды, потому что они представляют собой минимальные и воспроизводимые модели сложной динамики тканей человека во время развития, гомеостаза и болезни. Органоиды определяются как использование возобновляемого источника ткани, который 1) получают из стволовых клеток или первичной ткани, 2) культивируют в определенной среде, 3) самоорганизуются в структуру, имитирующую здоровую или больную смоделированную ткань , 4) включает в себя многие аспекты клеточной сложности смоделированной ткани, и 5) может быть размножен и распространен либо как сама культура, либо через определенную популяцию стволовых клеток или клеток-предшественников. Культура органоидов основана на методологии 3D-культуры клеток, разработанной в прошлом столетии.Еще в 1906 году так называемый метод висячей капли позволял культивировать клетки в 3D (подробную историческую перспективу см. В течение последних нескольких десятилетий биомедицинские исследования проводились почти исключительно на животных моделях. Хотя это привело к глубокому пониманию многих фундаментальных биологических процессов, оно оставило пробелы в нашем механистическом понимании специфических для человека процессов развития, клеточных биологических, физиологических и связанных с болезнями событий. Кроме того, разнообразие человеческих особей резко контрастирует с генетической однородностью инбредных моделей животных, что приводит к дефициту наших знаний о разнообразии популяций. С появлением моделей человеческих органоидов эта ситуация, кажется, должна измениться. Впервые органоиды дают возможность индивидуально изучать сборку тканей человека. Органоиды позволяют повторить многие морфогенетические события, ведущие к образованию ткани. Потенциально они могут быть получены от любого человека, здорового или больного.Таким образом, как изменчивость среди людей, так и специфические для человека клеточные механизмы, которые приводят к фенотипам заболеваний, могут быть проанализированы напрямую. Однако органоиды человека как модельная система имеют ограничения. В отличие от животных моделей, органоиды предлагают лишь приблизительное представление о биологии человеческого тела. У них отсутствуют ключевые особенности in vivo, такие как определенная ось тела, функциональная иммунная или нервная система или функциональная сосудистая сеть. Органоиды могут быть созданы различными способами, воспроизводящими либо развитие органов, либо регенерацию органов. В своей простейшей форме органоиды генерируются из стволовых клеток ткани взрослых, культивируемых в присутствии факторов роста и матрикса, обычно обеспечиваемого нишей стволовых клеток.Такие культуры могут содержать все типы клеток, полученные из стволовых клеток in vivo, либо во время нормального тканевого обновления, либо во время восстановления после повреждения, и могут повторять аспекты их трехмерного расположения. Опрос членов ASCB (см. Дополнительную информацию 2) показал, что в то время как более 90% респондентов используют человеческие клетки в культуре, менее 30% используют человеческие органоиды. Среди основных узких мест, которые назвали респонденты, были трудности с выращиванием органоидов и доступность тканей человека для инициации культур. Значительное количество комментариев указывало на проблемы воспроизводимости и стоимости, и многие респонденты задавались вопросом, насколько хорошо органоиды на самом деле моделируют биологию человека. Органоиды предлагают множество захватывающих экспериментальных применений, начиная от лучшего понимания развития человека и заканчивая созданием клинических моделей для тестирования лекарств и регенеративной медицины. Учитывая быстрый прогресс, мы считаем, что приведенные ниже приложения дадут представление о том, что может произойти в будущем. Изучение развития человека в основном ограничивалось обсервационными исследованиями преимплантационных эмбрионов или клеток-предшественников и тканей, выделенных из абортированных плодов. Например, в последнем случае органоспецифические клетки-предшественники выделяют из тканей плода и выращивают в культуре в условиях, в которых они продолжают расти и дифференцироваться (Nikolic et al. Существует два основных подхода к изучению развития человека с использованием моделей органоидов, полученных из ИПСК. Во-первых, органоспецифические предшественники генерируются из iPSCs путем прохождения их через последовательность воздействий определенных факторов. После дальнейшего культивирования предшественники самоорганизуются в органоиды, представляющие развивающийся орган. Этот подход уже обеспечил глубокое понимание морфогенеза нескольких систем органов и, что более интригующе, начинает проливать свет на то, как генетика человека влияет на болезни развития мозга, легких и кишечника (Perez-Lanzon et al., 2018). При втором подходе иПСК принуждают образовывать клеточные агрегаты, которые имитируют сам ранний преимплантационный эмбрион. Эти структуры, известные как эмбриоиды или гаструлоиды, автономно проходят ранние стадии развития. Помимо моделирования человеческого развития, клеточная сложность и трехмерная организация органоидов обеспечивают уникальную платформу для определения механизмов болезней взрослого человека. Полученные из ИПСК органоиды обладают огромным потенциалом для применения в тканевой инженерии и регенеративной медицине. Эти небольшие ткани обладают многими характеристиками эмбриональных тканей, которые, как было показано ранее, обладают регенеративным потенциалом при имплантации in vivo. Например, кишечные органоиды, полученные из hIPSC, включающие как энтодерму, так и мезодерму, дифференцируются в полностью васкуляризированный кишечник при имплантации мышам с ослабленным иммунитетом.Кроме того, имплантированные органоиды включают структурные особенности высокого уровня, такие как ворсинки, которые не наблюдаются при культивировании органоидов in vitro (Spence et al. Одно из интригующих применений органоидов, полученных от пациентов — будь то из ИПСК или взрослых стволовых клеток/клеток-предшественников — это клинические модели для конкретных пациентов, которые помогают в идентификации лекарств или комбинаций лекарств для лечения заболеваний. Эта концепция уже нашла некоторый успех. Например, кишечные органоиды использовались для выявления пациентов, которые однозначно реагируют на дорогостоящую терапию муковисцидоза (Dekkers et al., 2013). В отчете Центра изучения разработки лекарственных средств Тафтса описывается средняя стоимость разработки рецептурного препарата для его утверждения на рынке в размере 2,6 миллиарда долларов. Чтобы в полной мере воспользоваться огромным потенциалом, который могут предложить исследования органоидов, необходимо решить несколько серьезных проблем.Эти проблемы включают воспроизводимость, разработку золотых стандартов для различных систем органов, стандартизированные механизмы обмена тканями и опытом, способы получения согласия пациента и прозрачность в общении с общественностью. Полезность органоидов в биомедицинских исследованиях в значительной степени зависит от того, насколько воспроизводимы их результаты в различных анализах или протоколах дифференциации.Это верно независимо от того, проводятся ли исследования в одной и той же лаборатории или в разных лабораториях с использованием общих ячеек или экспериментальных протоколов. Факторы, влияющие на воспроизводимость, будут варьироваться в зависимости от типа и сложности анализа и источника инициирующих клеток, например, являются ли они хорошо охарактеризованными клеточными линиями или первичными стволовыми клетками, полученными из эмбриональных или взрослых тканей. Контроль качества для снижения изменчивости чрезвычайно важен, если органоиды должны выращиваться в больших количествах для клинических испытаний. Здесь невозможно обсудить все потенциальные источники изменчивости в культуре органоидов, но некоторые из наиболее важных соображений приведены ниже. Генетическая изменчивость менее важна для воспроизводимости анализов с использованием инбредных клеточных линий мыши.То же самое относится и к первичным стволовым клеткам, если они получены из инбредных штаммов. Ряд хорошо охарактеризованных чЭСК также доступен для исследований, например, HUES1 и HUES9 (https://grants.nih.gov/stem_cells/registry/current.htm; http://stemcelldistribution.harvard.edu/). . В какой-то степени эти линии, полученные из эмбрионов, полученных от явно «нормальных» доноров, можно считать золотым стандартом для проверки воспроизводимости анализов органоидов в разных лабораториях. Потенциальная изменчивость в анализах из-за генетического фона может возникнуть с hiPSC, особенно полученными от пациентов с мутациями, связанными с риском наследственного заболевания различной степени тяжести и пенетрантности. В некоторых органоидных анализах используются стволовые клетки, выделенные из первичных тканей человека. Исследователи, плохо знакомые с клеточными культурами и анализами органоидов, должны знать, что клетки могут со временем меняться в культуре, включая потерю способности к дифференцировке. Например, возможен выбор быстрорастущих вариантов или изменение поведения из-за разного состава коммерчески доступных сред (например, разных уровней глюкозы и кальция), разных партий фетальной бычьей сыворотки, компонентов замещающей сыворотки, фактора роста и микоплазмы. Важным источником изменчивости как между лабораториями, так и между экспериментами могут быть условия выращивания органоидов. Проблемы делятся на несколько категорий, в том числе изменчивость чистоты факторов роста в партиях, различия в воздействии на клетки уровня кислорода в многолуночных планшетах и изменчивость степени и скорости созревания дифференцированных типов клеток.Эти переменные могут быть объединены, если органоиды получены из комбинации различных типов клеток, таких как «мультиплексные» органоиды, в которых эпителиальные, стромальные, эндотелиальные и иммунные клетки агрегированы вместе. Изменчивость также может быть связана с использованием различных протоколов индукции. Например, протокол, разработанный для индукции энтодермы задней кишки человека из ИПСК, также генерирует небольшое количество мезодермы, которая имеет правильный паттерн задней боковой пластинки и дает начало гладким мышцам, тогда как протоколы для индукции передней энтодермы не генерируют ассоциированную мезодерму (Munera and Wells). Важно отметить, что органоиды полезны только в том случае, если они приближаются к воспроизведению реального органа на месте. Для сравнения использовались различные критерии, такие как описание типов клеток, образованных с использованием экспрессии РНК на уровне одной клетки, антител или генетически кодируемых маркеров; реконструкция всего органоида из 3D в 4D для определения общей морфологии, расслоения и регионального паттерна; и, наконец, разработка тестов для оценки физиологии и функции конкретного органоида.Последнее может включать трансплантацию и функциональную интеграцию в животное-хозяин, как это было показано для моделей кишечника (Fumagalli et al. , 2017; Munera et al. , 2017). Надежная проверка достигается путем сравнения этих структурных и функциональных показателей с соответствующим органом в другой модельной системе, такой как мышь, свинья и примат, или в реальной ткани человека. Учитывая потенциальные источники изменчивости, рассмотренные выше, можно сделать ряд рекомендаций: Крайне важно, чтобы протоколы для органоидов были подробно описаны в первоначальных публикациях, а источники реагентов, используемых на каждом этапе (выделение клеток, условия культивирования органоидов, методы индукции дифференцировки, выделение дифференцированных типов клеток), были предоставлены. Передача знаний наиболее эффективна посредством посещений лабораторий, объектов и хранилищ, которые регулярно культивируют и выращивают органоиды (для дальнейшего обсуждения см. Обучение исследованиям органоидов ниже). Критерии (транскриптомные профили, наборы поверхностных антител, трехмерная реконструкция, анализ отдельных клеток и поведение после трансплантации) должны быть установлены для сравнения дифференцированных типов клеток и структур, полученных в органоидах, с типами клеток и тканевой организацией, присутствующими в норме. ткани. Вполне вероятно, что генетический фон может влиять на поведение ИПСК, несущих мутации, связанные с заболеванием. Поэтому рекомендуется, чтобы линии были получены и сохранены от нескольких пациентов. Чтобы максимизировать полезность этих банков, согласие пациента должно включать возможность совместного использования их между различными учреждениями и исследователями (для дальнейшего обсуждения см. Важно обеспечить достаточное количество тканей человека, уважая при этом пожелания доноров и сохраняя доверие общественности к добросовестности исследований и усилий по медицинскому применению. В случае с биообразцами, полученными от человека, процесс получения согласия является важной частью исследования, призванного защитить права и благополучие лиц, участвующих в исследовании, и уважать достоинство и автономию этих лиц, предоставляя им возможность выбора, помогать или нет. исследование (Huch et al., 2017). Как и раньше, работа с человеческими тканями вызывает ряд опасений и регулируется правовыми нормами и ограничениями финансирования, которые различаются в зависимости от страны и на уровне штата в США. Для живых людей взятие ткани in situ предполагает вторжение в их тело и требует добровольного и информированного согласия.Прикосновение к телу живого человека без надлежащего согласия и таким образом, который может быть вредным или оскорбительным, является вмешательством в общепринятые представления о личной автономии и является незаконным во многих национальных правовых системах, в том числе в Соединенных Штатах. Ткани, взятые у умерших людей, могут вызвать вопросы о том, кто имеет право давать согласие на донорство. Во многих законодательных органах, таких как Соединенные Штаты, умерший человек не считается человеком-субъектом исследования с целью инициирования федеральных правил исследовательской этики.Тем не менее, в некоторых юрисдикциях ткани рассматриваются как находящиеся в распоряжении кого-то, кроме государства или исследовательского сообщества, так что, например, может потребоваться согласие близкого родственника. Ткань ex vivo включает «брошенную ткань», такую как хирургические отходы или «подаренная ткань», когда она взята с согласия, как указано выше, или принципиально «измененные ткани», такие как клеточные линии.Национальные правила различаются в зависимости от того, считается ли это какой-либо формой собственности лица, у которого оно было взято. Такие правила могут применяться, если имеется достаточно информации, включенной в образец или прикрепленной к образцу, так что первоначальный источник/донор может быть идентифицирован. В этом случае источник/донор является предметом исследования всякий раз, когда изучается ткань, и если личность не будет достаточно скрыта, это вызовет одобрение и защиту интересов донора. В целом, если ткань берется специально для исследовательских целей, применяются национальные правила проведения исследований, и во многих системах это предполагает не только информированное согласие, но и некую форму независимого надзора для обеспечения того, чтобы исследование добросовестно и защищены интересы участников.В Соединенных Штатах, например, он в большинстве случаев подлежит надзору со стороны институционального наблюдательного совета (IRB) и некоторых федеральных правил, закрепленных в Общем правиле. Федеральное регулирование и требования IRB формально вступают в силу, когда исследование финансируется одним из федеральных агентств и департаментов, принявших Общее правило, но во многих других случаях исследование проводится в условиях добровольного соблюдения. Даже если согласие получено, может оказаться необходимым проверить, распространяется ли оно на все исследования или, по крайней мере, на конкретное планируемое исследование. Для конкретных исследовательских целей учреждениям может быть целесообразно иметь специализированные исследовательские советы, обладающие конкретными знаниями в области технологий и применений стволовых клеток. Было опубликовано несколько руководств и обсуждений на тему согласия; см., например, Руководство по исследованию стволовых клеток и клиническому переводу , опубликованное Международным обществом исследований стволовых клеток www.isscr.org/docs/default-source/all-isscr-guidelines/guidelines-2016/isscr-guidelines- for-steam-cell-research-and-clinical-translation.pdf). Когда участник исследования или родитель/опекун участника исследования дает согласие, необходимо указать следующее: Каковы непосредственные исследовательские цели и предполагаемое использование в будущем, а также известные риски и выгоды (если таковые имеются) от собираемой информации? Желает ли донор повторно связаться с ним для дополнительных целей в будущем или он/она предпочитает разрешить использование ткани без дальнейшего согласия? Участника также следует спросить, существуют ли какие-либо конкретные виды использования, на которые донор не дает согласия. Если донор ткани должен быть идентифицирован, как будет храниться медицинская и личная информация и идентификационные данные донора? Как она будет защищена и по каким правилам она будет храниться в тайне или распространяться среди других исследователей? Кроме того, планируется ли возвращать результаты исследований участникам? Если да, то следует обсудить обстоятельства, вызвавшие такое возвращение. Если донор ткани будет невозможно идентифицировать в результате исследования образца, донор должен понимать, что обезличенные данные и биообразцы будут переданы исследователям и/или помещены в центральные базы данных и биобанки. Участник должен быть проинформирован о том, что клетки крови, биоптаты кожи (фибробласты) или другие ткани (например, волосы) могут быть использованы для получения ИПСК и органоидов, особенно если ткань собирается в контексте более крупного исследования ( генетика/геномика, например), и образцы будут заморожены для будущего использования. Участник должен получить разрешение на привязку любых медицинских, клинических и генетических данных к биообразцам и их производным. Участника также следует попросить связать любые медицинские, клинические и генетические данные с данными членов его семьи, если они также участвуют в том же исследовании. Участнику должна быть предоставлена возможность отказаться от участия в исследовании с пониманием того, что материал, возможно, уже был распространен, использован или может быть использован в будущем в исследовательских целях и сообщен в опубликованных журнальных статьях или на конференциях. Исследования органоидов могут дать важную информацию о конкретных заболеваниях и даже лечении. Таким образом, пациенты, которые пожертвовали свои клетки или ткани с общего согласия, тем не менее должны иметь возможность узнать о результатах своих органоидов. Правила в отношении необходимости и степени согласия сильно различаются в зависимости от источника ткани. Мы обсудим только рассмотрение будущего сбора тканей. Для живых доноров следует отличать неидентифицируемые ткани (часто в случае хирургических отходов, когда собирается только информация о заболевании) от идентифицируемых тканей (где информацию о донорах можно получить путем изучения ткани). Для умерших лиц согласие должно быть основано либо на ранее выраженном желании умершего лица, либо на согласии ближайших родственников. Для неидентифицируемой ткани согласие не требуется, но может потребоваться, если тип исследования (например,г., трансплантация, образование эмбриоидов, гаструлоидов или зародышевых клеток/гамет) могли бы расстроить, если бы донор задумался об этом. Для этого типа исследований рекомендуется обсудить с IRB (или эквивалентным надзорным органом, если он находится за пределами США), важно ли обращаться к донорам за дополнительным согласием. В отношении идентифицируемой ткани следует давать согласие на использование, отдавая предпочтение как можно более широкому разрешению на ожидаемое и непредвиденное использование, включая широкое распространение среди учреждений по всему миру.Обратите внимание, что это требует некоторой степени воображения при описании возможного будущего использования ткани. Если невозможно получить самое широкое согласие, забор ткани не следует проводить или только распределять с учетом конкретных ограничений. Новые технологии электронной записи могут упростить управление различными ограничениями, налагаемыми каждым донором. Уникальный идентификатор, такой как GUID (глобальные уникальные идентификаторы), первоначально разработанный сообществом исследователей аутизма, создает общий идентификатор субъекта для участников исследования в исследовательских лабораториях и репозиториях и рекомендуется исследователям в других областях в качестве инструмента для поделиться данными (https://ndar. Исследования продвигаются путем обмена результатами и данными. Мы предлагаем четкие рекомендации по обмену и передаче результатов и материалов, полученных в результате исследований органоидов, и предлагаем более широкое использование поддерживаемых государством биобанков в качестве центров для улучшения и координации распространения, обучения и обмена. Распространение через банки данных и тканей весьма желательно в будущем. Несколько банков и центров органоидов уже существуют в Японии, США и Европе (van de Wetering et al., 2015; Сакс и др. , 2018; Такебе и др. , 2018; Ян и др. , 2018). Эти биобанки могут предложить несколько преимуществ для исследования органоидов: Установите стандарты качества сохранности материалов. Разработка стандартных процедур для органоидной культуры. Пройти обучение. Уважайте и применяйте ограничения, установленные донором через хранилища данных. Содействовать общению с донором для получения специального согласия (например, трансплантация, создание эмбрионов или манипуляции с зародышевыми клетками/гаметами). Распространяйте материалы с точной информацией, подробно описывающие протоколы контроля качества, используемые для создания и обслуживания клеток, тканей, органоидов. Собирайте и распространяйте биологические образцы для широкого распространения, которые были модифицированы отдельными лабораториями, например, для исправления определенного генетического дефекта. Данные и образцы для исследований должны быть доступны для использования утвержденными исследователями без географических ограничений. Данные и биообразцы должны быть распространены после того, как запрашивающий утвержденный исследователь и его учреждение согласовали и подписали соответствующее соглашение о передаче материала (MTA) и, при необходимости, представили разрешение IRB/освобождение от своего учреждения. В интересах быстрого распространения данных и выводов, расширения знаний и воспроизводимости данных MTA должен включать формулировку в поддержку обмена данными. Исследователи должны согласиться вернуть сгенерированные данные и модифицированные биообразцы в биобанк или сделать материалы доступными в оговоренное время или к моменту публикации, в зависимости от того, что наступит раньше. Формулировка обмена может поощрять или требовать депонирования результатов в
www.bioRxiv.org или аналогичный сервер препринтов для обеспечения свободного доступа. Успех любой исследовательской области, метода или приложения напрямую зависит от относительного опыта и подготовки ученых, выполняющих работу.Экспериментальные подходы, которые просты в реализации, также легче распространять, с коммерциализацией или без нее. Более сложные протоколы, в том числе генерация и характеристика органоидов, требуют большого опыта в выполнении процедур до мастерства. Увеличение числа ученых, обученных работе с органоидами, будет иметь важное значение для решения нескольких ключевых вопросов: Решение проблем и неопределенностей, связанных с воспроизводимостью. Пока критическая масса исследователей в разных учреждениях не будет обучена надежным и последовательным методам создания органоидов, будет сложно понять, в какой степени возникает изменчивость из-за технических различий по сравнению с генетическими (или биологическими). Устранение узких мест в исследованиях органоидов. Пока обучение не станет надежным и доступным, количество лабораторий, проводящих исследования с использованием органоидов, будет оставаться ограниченным, что напрямую ограничивает количество вопросов, которые будут задаваться с использованием этой технологии. Расширение использования органоидов в трансляционных областях, включая скрининг новых терапевтических средств и регенеративной медицины. Использование органоидов для расширения новых границ исследований.Это может включать, например, всестороннее описание типов клеток в организме и их организации в ткани. Усилия по тканевой инженерии могут привести к созданию более реалистичных органоидов, которые больше напоминают орган in vivo, включая васкуляризацию, иннервацию и поддержку иммунной системы. Область будет процветать только тогда, когда у нас будут надежные и надежные методы обучения. Мы признаем, что существуют как проблемы, так и возможности, связанные с разработкой и реализацией возможностей обучения.Проблемы включают тот факт, что практическое обучение этим протоколам затруднено, и протоколы могут быть сложными для воспроизведения в разных географических точках. Развитие хорошо структурированных органоидов требует длительных периодов времени (многие месяцы или годы) и не может быть легко переведено с одного типа органоида на другой. Таким образом, необходимо найти альтернативы существующим методам обучения, которые уже существуют в ограниченном количестве мест. К ним относятся основные объекты стволовых клеток, которые можно расширить, чтобы обеспечить учебную платформу, которая может включать программы посещения, открытые для людей из разных учреждений. Такие программы могут по существу закрепить искусство на практике с помощью протоколов, которые они выбирают для обучения, и могут включать такие темы, как культивирование и получение hPSCs, выделение тканеспецифических стволовых клеток или тканевых эксплантатов, дифференцировка в органоиды человека, генетические манипуляции, в том числе основанные на CRISPR и функциональные геномные подходы с разрешением одной клетки. Учебные заведения должны стимулировать распространение искусства культивирования органоидов и способствовать обмену опытом и знаниями между исследователями между учреждениями. Обмен исходными материалами имеет решающее значение для обучения и распространения. Для обучения и увеличения количества исследователей в этой области в следующем поколении необходимо использовать передовые методы исследования органоидов. С момента зарождения медицинской науки поступательные шаги в понимании лечения или механики болезней обеспечили значительный прогресс в медицинской помощи. Общественная настороженность, культурные и религиозные барьеры часто стоят на пути немедленного принятия некоторых из этих достижений. Примеры включают донорство и трансплантацию органов, ЭКО и другие передовые медицинские исследовательские процедуры. Эта неуверенность общественности, а иногда и прямое противодействие, часто приводила к снижению общественного признания новых медицинских достижений и в последние годы приводила к политически мотивированным попыткам наложить политические ограничения (запреты на финансирование и, в некоторых случаях, уголовные наказания) в отношении научных исследований.Примеры включают рекомбинантную ДНК (1970-е годы), исследования стволовых клеток (2000-е годы), исследования тканей плода (1990-е годы, 2016-настоящее время), редактирование генов (2016-настоящее время) и митохондриальную заместительную терапию (2016-настоящее время). Большая часть исследований с использованием органоидов финансируется Национальным институтом здравоохранения, Европейским Союзом, Министерством образования Японии и другими государственными фондами. Таким образом, ученые обязаны открыто сообщать общественности о результатах своих исследований и их последствиях, не преувеличивая их.Исследователи также должны быть прозрачны в отношении источников материала, используемого для создания органоидов. Признание этических проблем, связанных с этой областью, также важно. Во время дебатов в Соединенных Штатах по поводу федеральной поддержки исследований с использованием чЭСК защитники исследований, включая ученых, были осторожны, чтобы не обещать излечение в результате исследований, которые в то время находились только в зачаточном состоянии. Ученым было предложено обсудить потенциал и перспективы этой области в случае успеха их исследований. Крайне важно, чтобы ученые знали свою аудиторию. В целом общественное мнение об ученых и поддержка науки довольно позитивны, но могут сильно различаться в зависимости от расы, пола, возраста, образования, региона и политической принадлежности. По мере того, как исследования продвигаются вперед, а клиническое применение становится все более очевидным и реальным, исследования органоидов будут привлекать к себе повышенное внимание средств массовой информации.Это сыграет важную роль в просвещении общественности и поможет сформировать любые возникающие политические дебаты. Поэтому исследователям органоидов следует подумать об обучении журналистов этой области исследований, даже если они не решаются сделать это. Исследователи, не имеющие предыдущего опыта или подготовки в области СМИ, могут быть обеспокоены тем, чтобы их разговор был точно передан репортером, особенно тем, кто не знаком с наукой. Сложный характер науки об органоидах также может служить барьером для дискуссий между учеными и журналистами. Мы предлагаем, чтобы ученые, работающие над органоидами, рассмотрели следующие темы для обсуждения при общении с общественностью об органоидах: Опишите, что такое органоиды и чем они не являются. Четко опишите потенциальные возможности органоидов для ваших исследований. Сформулируйте ключевые открытия, сделанные с помощью органоидов, которые были бы невозможны при использовании других подходов. Признайте неизвестность и вызовы. Не говорите о неопубликованных результатах, не прошедших экспертную оценку. Проконсультируйтесь с исследователями в других передовых областях об их опыте работы с прессой и другими аудиториями. Члены и сотрудники ASCB могут предоставить вам профессиональную консультацию (www.ascb.org/advocacy/). Mol Biol Cell. 2019 1 мая; 30 (10): 1129–1137. a HHMI и Институт биомолекулярной медицины Скирболла, факультет клеточной биологии, Медицинский факультет Нью-Йоркского университета, Нью-Йорк, штат Нью-Йорк 10016 B B Дивизион биологических наук, Чикаго Университета Чикаго, Чикаго IL 60637 C Американское общество для клеточной биологии, Bethesda, MD 20814 D Simons Foundation , New York, NY 10010 e University of Wisconsin Madison Law School, Madison, WI 53706 f Фармацевтический факультет Калифорнийского университета Сан-Франциско, Сан-Франциско, Калифорния 94158 g Кафедра клеточной биологии Медицинского центра Университета Дьюка, Дарем, Северная Каролина 27710 ч Институт молекулярной биотехнологии, Австрия 1030 Вена, Австрия i Кафедра химической и биологической инженерии и кафедра молекулярной биологии Принстонского университета, Принстон, Нью-Джерси 08544 c Американское общество клеточной биологии, Bethesda, MD 208013 David G Калифорнийский университет, Беркли a HHMI и Институт биомолекулярной медицины Скирболла, кафедра клеточной биологии, Медицинский факультет Нью-Йоркского университета, Нью-Йорк, штат Нью-Йорк 10016 b Отделение биологических наук, Университет Чикаго, Чикаго, Иллинойс 60637 c Американское общество клеточной биологии, Бетесда, Мэриленд 20814 d Фонд Саймонса, Нью-Йорк, Нью-Йорк 10010 e Университет Мэдисона, Вискон f Факультет фармацевтической химии, Факультет фармации, Калифорнийский университет, Сан-Франциско, Сан-Франциско, Калифорния 94158 g Кафедра клеточной биологии Медицинского центра Университета Дьюка, Дарем, Северная Каролина 27710 h Институт молекулярной биотехнологии Австрийской академии наук, 1030 Вена, Австрия Химический i Департамент биологической инженерии и кафедра молекулярной биологии Принстонского университета, Принстон, штат Нью-Джерси 08544 Поступила в редакцию 4 марта 2019 г. Эта статья распространяется Американским обществом клеточной биологии по лицензии автора (авторов). Через два месяца после публикации он доступен для общественности по лицензии Attribution-Noncommercial-Share Alike 3.0 Unported Creative Commons. Органоиды, полученные из стволовых клеток или тканей в культуре, могут развиваться в структуры, напоминающие in vivo анатомию и физиологию интактных органов. Культуры человеческих органоидов дают возможность изучать развитие человека и моделировать болезненные процессы с той же тщательностью и глубиной анализа, что и обычные для исследований с нечеловеческими модельными организмами. Напоминая по сложности реальную ткань или орган, исследования органов человека, полученные от пациентов, могут ускорить медицинские исследования, открывая новые возможности для тканевой инженерии и регенеративной медицины, генерируя знания и инструменты для доклинических исследований, включая разработку и тестирование лекарств. Достижения в области биологии стволовых клеток возвестили революцию в биологии и медицине. По мере распространения этих технологий на человеческие клетки они проложили путь к открытиям в фундаментальной биологии человека и развитию медицины. Важным недавним шагом в этой революции стала разработка методов создания в контролируемых условиях культивирования трехмерных (3D) структур, известных как органоиды, которые резюмируют развитие и организацию тканей и напоминают органы в организме. Чтобы оптимизировать потенциал этих новых мощных разработок для ученых, Американское общество клеточной биологии (ASCB) обратилось к целевой группе членов ASCB, включая исследователей, некоторые из которых играют решающую роль в разработке систем органоидов; специалисты по этике; и защитники прав пациентов, чтобы определить возможности для исследований органоидов для биологов, выделить препятствия на пути прогресса и проблемы, а также разработать рекомендации и передовой опыт для повышения воздействия этой новой, быстро расширяющейся и многообещающей области. Органоиды дают возможность изучать ткани человека на том же уровне научной тщательности, воспроизводимости и глубины анализа, что обычно возможно только с нечеловеческой моделью. организмы. Органоиды позволяют исследователям резюмировать морфогенетические события в развитии человека, которые приводят к образованию тканей и органов. Органоиды можно использовать для изучения механизмов болезней, действующих в тканях человека, для получения знаний и инструментов, применимых к доклиническим исследованиям, включая тестирование лекарств. Органоиды могут быть получены от любого человека, что позволяет изучать изменчивость среди людей на тканевом уровне, а также клеточные механизмы, приводящие к сложным фенотипам заболеваний. Органоиды, напоминающие по сложности ткани и органы, находят широкое применение в тканевой инженерии, разработке лекарств и регенеративной медицине. Мы предполагаем, что человеческие органоиды могут предоставить фундаментальным ученым возможность проводить механистические исследования в системе «человеческой модели» с приемлемыми этическими ограничениями. Органоиды повторяют только часть всего тела и могут не точно отражать стереотипные и сложные функции отдельных органов.Таким образом, в отличие от моделей целых животных, органоиды предлагают лишь приблизительное представление о биологии всего органа и не имитируют поведение всего организма. У них отсутствуют ключевые особенности in vivo, такие как определенная ось тела, функциональная иммунная система и полные физиологические сети. Следовательно, результаты органоидов должны быть дополнены исследованиями всего организма в модельных системах и сопоставлены с реальным развитием человека, организацией тканей и физиологией. «Золотые стандарты» и лучшие практики должны быть определены для изучения органоидов.Протоколы получения и условий культивирования органоидов должны содержать достаточно деталей для обеспечения воспроизводимости. Необходимо разработать критерии, которые позволят исследователям сравнивать типы и структуры клеток в органоиде с составом и организацией соответствующего органа. Долгосрочное развитие исследований органоидов зависит от распределения источников тканей, которые являются возобновляемыми и легко сопоставимыми между лабораториями. Особенно важным для изучения заболеваний является создание банков тканей (биобанков), которые распределяют чТПСК от разных пациентов с одним и тем же заболеванием.Такие биобанки также могут быть центрами распределения контрольных образцов как здоровых людей, так и генетически модифицированных образцов тканей, полученных от пациентов. Для образцов ткани, полученных от пациента, в согласии пациента должно быть указано требование о том, что материалы будут использоваться совместно различными учреждениями, исследователями и странами. Вход новых исследователей на разных этапах карьеры в эту область следует поощрять и облегчать путем создания учебных центров, где исследователи могут приобретать и адаптировать органоидную технологию.Из-за быстрого развития методов культивирования тканей и сложности материалов и временных рамок, необходимых для создания органоида из возобновляемого источника ткани, либо существующие объекты, либо практикующие лаборатории могут предложить лучшие возможности для обучения, чем более традиционные учебные курсы. Потенциал органоидов для исследований и медицины несет с собой этическую неопределенность и озабоченность общественности. Четкое определение того, чем органоиды являются и чем они не являются, а также реалистичное описание возможностей, которые они предлагают, должны быть сформулированы учеными и научными организациями в их сообщениях. Мы изучаем органоиды, потому что они представляют собой минимальные и воспроизводимые модели сложной динамики тканей человека во время развития, гомеостаза и болезни. Органоиды определяются как использование возобновляемого источника ткани, который 1) получают из стволовых клеток или первичной ткани, 2) культивируют в определенной среде, 3) самоорганизуются в структуру, имитирующую здоровую или больную смоделированную ткань , 4) включает в себя многие аспекты клеточной сложности смоделированной ткани, и 5) может быть размножен и распространен либо как сама культура, либо через определенную популяцию стволовых клеток или клеток-предшественников. Культура органоидов основана на методологии 3D-культуры клеток, разработанной в прошлом столетии.Еще в 1906 году так называемый метод висячей капли позволял культивировать клетки в 3D (подробную историческую перспективу см. В течение последних нескольких десятилетий биомедицинские исследования проводились почти исключительно на животных моделях. Хотя это привело к глубокому пониманию многих фундаментальных биологических процессов, оно оставило пробелы в нашем механистическом понимании специфических для человека процессов развития, клеточных биологических, физиологических и связанных с болезнями событий. Кроме того, разнообразие человеческих особей резко контрастирует с генетической однородностью инбредных моделей животных, что приводит к дефициту наших знаний о разнообразии популяций. С появлением моделей человеческих органоидов эта ситуация, кажется, должна измениться. Впервые органоиды дают возможность индивидуально изучать сборку тканей человека. Органоиды позволяют повторить многие морфогенетические события, ведущие к образованию ткани. Потенциально они могут быть получены от любого человека, здорового или больного.Таким образом, как изменчивость среди людей, так и специфические для человека клеточные механизмы, которые приводят к фенотипам заболеваний, могут быть проанализированы напрямую. Однако органоиды человека как модельная система имеют ограничения. В отличие от животных моделей, органоиды предлагают лишь приблизительное представление о биологии человеческого тела. У них отсутствуют ключевые особенности in vivo, такие как определенная ось тела, функциональная иммунная или нервная система или функциональная сосудистая сеть. Органоиды могут быть созданы различными способами, воспроизводящими либо развитие органов, либо регенерацию органов. В своей простейшей форме органоиды генерируются из стволовых клеток ткани взрослых, культивируемых в присутствии факторов роста и матрикса, обычно обеспечиваемого нишей стволовых клеток.Такие культуры могут содержать все типы клеток, полученные из стволовых клеток in vivo, либо во время нормального тканевого обновления, либо во время восстановления после повреждения, и могут повторять аспекты их трехмерного расположения. Опрос членов ASCB (см. Дополнительную информацию 2) показал, что в то время как более 90% респондентов используют человеческие клетки в культуре, менее 30% используют человеческие органоиды. Среди основных узких мест, которые назвали респонденты, были трудности с выращиванием органоидов и доступность тканей человека для инициации культур. Значительное количество комментариев указывало на проблемы воспроизводимости и стоимости, и многие респонденты задавались вопросом, насколько хорошо органоиды на самом деле моделируют биологию человека. Органоиды предлагают множество захватывающих экспериментальных применений, начиная от лучшего понимания развития человека и заканчивая созданием клинических моделей для тестирования лекарств и регенеративной медицины. Учитывая быстрый прогресс, мы считаем, что приведенные ниже приложения дадут представление о том, что может произойти в будущем. Изучение развития человека в основном ограничивалось обсервационными исследованиями преимплантационных эмбрионов или клеток-предшественников и тканей, выделенных из абортированных плодов. Например, в последнем случае органоспецифические клетки-предшественники выделяют из тканей плода и выращивают в культуре в условиях, в которых они продолжают расти и дифференцироваться (Nikolic et al. Существует два основных подхода к изучению развития человека с использованием моделей органоидов, полученных из ИПСК. Во-первых, органоспецифические предшественники генерируются из iPSCs путем прохождения их через последовательность воздействий определенных факторов. После дальнейшего культивирования предшественники самоорганизуются в органоиды, представляющие развивающийся орган. Этот подход уже обеспечил глубокое понимание морфогенеза нескольких систем органов и, что более интригующе, начинает проливать свет на то, как генетика человека влияет на болезни развития мозга, легких и кишечника (Perez-Lanzon et al., 2018). При втором подходе иПСК принуждают образовывать клеточные агрегаты, которые имитируют сам ранний преимплантационный эмбрион. Эти структуры, известные как эмбриоиды или гаструлоиды, автономно проходят ранние стадии развития. Помимо моделирования человеческого развития, клеточная сложность и трехмерная организация органоидов обеспечивают уникальную платформу для определения механизмов болезней взрослого человека. Полученные из ИПСК органоиды обладают огромным потенциалом для применения в тканевой инженерии и регенеративной медицине. Эти небольшие ткани обладают многими характеристиками эмбриональных тканей, которые, как было показано ранее, обладают регенеративным потенциалом при имплантации in vivo. Например, кишечные органоиды, полученные из hIPSC, включающие как энтодерму, так и мезодерму, дифференцируются в полностью васкуляризированный кишечник при имплантации мышам с ослабленным иммунитетом.Кроме того, имплантированные органоиды включают структурные особенности высокого уровня, такие как ворсинки, которые не наблюдаются при культивировании органоидов in vitro (Spence et al. Одно из интригующих применений органоидов, полученных от пациентов — будь то из ИПСК или взрослых стволовых клеток/клеток-предшественников — это клинические модели для конкретных пациентов, которые помогают в идентификации лекарств или комбинаций лекарств для лечения заболеваний. Эта концепция уже нашла некоторый успех. Например, кишечные органоиды использовались для выявления пациентов, которые однозначно реагируют на дорогостоящую терапию муковисцидоза (Dekkers et al., 2013). В отчете Центра изучения разработки лекарственных средств Тафтса описывается средняя стоимость разработки рецептурного препарата для его утверждения на рынке в размере 2,6 миллиарда долларов. Чтобы в полной мере воспользоваться огромным потенциалом, который могут предложить исследования органоидов, необходимо решить несколько серьезных проблем.Эти проблемы включают воспроизводимость, разработку золотых стандартов для различных систем органов, стандартизированные механизмы обмена тканями и опытом, способы получения согласия пациента и прозрачность в общении с общественностью. Полезность органоидов в биомедицинских исследованиях в значительной степени зависит от того, насколько воспроизводимы их результаты в различных анализах или протоколах дифференциации.Это верно независимо от того, проводятся ли исследования в одной и той же лаборатории или в разных лабораториях с использованием общих ячеек или экспериментальных протоколов. Факторы, влияющие на воспроизводимость, будут варьироваться в зависимости от типа и сложности анализа и источника инициирующих клеток, например, являются ли они хорошо охарактеризованными клеточными линиями или первичными стволовыми клетками, полученными из эмбриональных или взрослых тканей. Контроль качества для снижения изменчивости чрезвычайно важен, если органоиды должны выращиваться в больших количествах для клинических испытаний. Здесь невозможно обсудить все потенциальные источники изменчивости в культуре органоидов, но некоторые из наиболее важных соображений приведены ниже. Генетическая изменчивость менее важна для воспроизводимости анализов с использованием инбредных клеточных линий мыши.То же самое относится и к первичным стволовым клеткам, если они получены из инбредных штаммов. Ряд хорошо охарактеризованных чЭСК также доступен для исследований, например, HUES1 и HUES9 (https://grants.nih.gov/stem_cells/registry/current.htm; http://stemcelldistribution.harvard.edu/). . В какой-то степени эти линии, полученные из эмбрионов, полученных от явно «нормальных» доноров, можно считать золотым стандартом для проверки воспроизводимости анализов органоидов в разных лабораториях. Потенциальная изменчивость в анализах из-за генетического фона может возникнуть с hiPSC, особенно полученными от пациентов с мутациями, связанными с риском наследственного заболевания различной степени тяжести и пенетрантности. В некоторых органоидных анализах используются стволовые клетки, выделенные из первичных тканей человека. Исследователи, плохо знакомые с клеточными культурами и анализами органоидов, должны знать, что клетки могут со временем меняться в культуре, включая потерю способности к дифференцировке. Например, возможен выбор быстрорастущих вариантов или изменение поведения из-за разного состава коммерчески доступных сред (например, разных уровней глюкозы и кальция), разных партий фетальной бычьей сыворотки, компонентов замещающей сыворотки, фактора роста и микоплазмы. Важным источником изменчивости как между лабораториями, так и между экспериментами могут быть условия выращивания органоидов. Проблемы делятся на несколько категорий, в том числе изменчивость чистоты факторов роста в партиях, различия в воздействии на клетки уровня кислорода в многолуночных планшетах и изменчивость степени и скорости созревания дифференцированных типов клеток.Эти переменные могут быть объединены, если органоиды получены из комбинации различных типов клеток, таких как «мультиплексные» органоиды, в которых эпителиальные, стромальные, эндотелиальные и иммунные клетки агрегированы вместе. Изменчивость также может быть связана с использованием различных протоколов индукции. Например, протокол, разработанный для индукции энтодермы задней кишки человека из ИПСК, также генерирует небольшое количество мезодермы, которая имеет правильный паттерн задней боковой пластинки и дает начало гладким мышцам, тогда как протоколы для индукции передней энтодермы не генерируют ассоциированную мезодерму (Munera and Wells). Важно отметить, что органоиды полезны только в том случае, если они приближаются к воспроизведению реального органа на месте. Для сравнения использовались различные критерии, такие как описание типов клеток, образованных с использованием экспрессии РНК на уровне одной клетки, антител или генетически кодируемых маркеров; реконструкция всего органоида из 3D в 4D для определения общей морфологии, расслоения и регионального паттерна; и, наконец, разработка тестов для оценки физиологии и функции конкретного органоида.Последнее может включать трансплантацию и функциональную интеграцию в животное-хозяин, как это было показано для моделей кишечника (Fumagalli et al. , 2017; Munera et al. , 2017). Надежная проверка достигается путем сравнения этих структурных и функциональных показателей с соответствующим органом в другой модельной системе, такой как мышь, свинья и примат, или в реальной ткани человека. Учитывая потенциальные источники изменчивости, рассмотренные выше, можно сделать ряд рекомендаций: Крайне важно, чтобы протоколы для органоидов были подробно описаны в первоначальных публикациях, а источники реагентов, используемых на каждом этапе (выделение клеток, условия культивирования органоидов, методы индукции дифференцировки, выделение дифференцированных типов клеток), были предоставлены. Передача знаний наиболее эффективна посредством посещений лабораторий, объектов и хранилищ, которые регулярно культивируют и выращивают органоиды (для дальнейшего обсуждения см. Обучение исследованиям органоидов ниже). Критерии (транскриптомные профили, наборы поверхностных антител, трехмерная реконструкция, анализ отдельных клеток и поведение после трансплантации) должны быть установлены для сравнения дифференцированных типов клеток и структур, полученных в органоидах, с типами клеток и тканевой организацией, присутствующими в норме. ткани. Вполне вероятно, что генетический фон может влиять на поведение ИПСК, несущих мутации, связанные с заболеванием. Поэтому рекомендуется, чтобы линии были получены и сохранены от нескольких пациентов. Чтобы максимизировать полезность этих банков, согласие пациента должно включать возможность совместного использования их между различными учреждениями и исследователями (для дальнейшего обсуждения см. Важно обеспечить достаточное количество тканей человека, уважая при этом пожелания доноров и сохраняя доверие общественности к добросовестности исследований и усилий по медицинскому применению. В случае с биообразцами, полученными от человека, процесс получения согласия является важной частью исследования, призванного защитить права и благополучие лиц, участвующих в исследовании, и уважать достоинство и автономию этих лиц, предоставляя им возможность выбора, помогать или нет. исследование (Huch et al., 2017). Как и раньше, работа с человеческими тканями вызывает ряд опасений и регулируется правовыми нормами и ограничениями финансирования, которые различаются в зависимости от страны и на уровне штата в США. Для живых людей взятие ткани in situ предполагает вторжение в их тело и требует добровольного и информированного согласия.Прикосновение к телу живого человека без надлежащего согласия и таким образом, который может быть вредным или оскорбительным, является вмешательством в общепринятые представления о личной автономии и является незаконным во многих национальных правовых системах, в том числе в Соединенных Штатах. Ткани, взятые у умерших людей, могут вызвать вопросы о том, кто имеет право давать согласие на донорство. Во многих законодательных органах, таких как Соединенные Штаты, умерший человек не считается человеком-субъектом исследования с целью инициирования федеральных правил исследовательской этики.Тем не менее, в некоторых юрисдикциях ткани рассматриваются как находящиеся в распоряжении кого-то, кроме государства или исследовательского сообщества, так что, например, может потребоваться согласие близкого родственника. Ткань ex vivo включает «брошенную ткань», такую как хирургические отходы или «подаренная ткань», когда она взята с согласия, как указано выше, или принципиально «измененные ткани», такие как клеточные линии.Национальные правила различаются в зависимости от того, считается ли это какой-либо формой собственности лица, у которого оно было взято. Такие правила могут применяться, если имеется достаточно информации, включенной в образец или прикрепленной к образцу, так что первоначальный источник/донор может быть идентифицирован. В этом случае источник/донор является предметом исследования всякий раз, когда изучается ткань, и если личность не будет достаточно скрыта, это вызовет одобрение и защиту интересов донора. В целом, если ткань берется специально для исследовательских целей, применяются национальные правила проведения исследований, и во многих системах это предполагает не только информированное согласие, но и некую форму независимого надзора для обеспечения того, чтобы исследование добросовестно и защищены интересы участников.В Соединенных Штатах, например, он в большинстве случаев подлежит надзору со стороны институционального наблюдательного совета (IRB) и некоторых федеральных правил, закрепленных в Общем правиле. Федеральное регулирование и требования IRB формально вступают в силу, когда исследование финансируется одним из федеральных агентств и департаментов, принявших Общее правило, но во многих других случаях исследование проводится в условиях добровольного соблюдения. Даже если согласие получено, может оказаться необходимым проверить, распространяется ли оно на все исследования или, по крайней мере, на конкретное планируемое исследование. Для конкретных исследовательских целей учреждениям может быть целесообразно иметь специализированные исследовательские советы, обладающие конкретными знаниями в области технологий и применений стволовых клеток. Было опубликовано несколько руководств и обсуждений на тему согласия; см., например, Руководство по исследованию стволовых клеток и клиническому переводу , опубликованное Международным обществом исследований стволовых клеток www.isscr.org/docs/default-source/all-isscr-guidelines/guidelines-2016/isscr-guidelines- for-steam-cell-research-and-clinical-translation.pdf). Когда участник исследования или родитель/опекун участника исследования дает согласие, необходимо указать следующее: Каковы непосредственные исследовательские цели и предполагаемое использование в будущем, а также известные риски и выгоды (если таковые имеются) от собираемой информации? Желает ли донор повторно связаться с ним для дополнительных целей в будущем или он/она предпочитает разрешить использование ткани без дальнейшего согласия? Участника также следует спросить, существуют ли какие-либо конкретные виды использования, на которые донор не дает согласия. Если донор ткани должен быть идентифицирован, как будет храниться медицинская и личная информация и идентификационные данные донора? Как она будет защищена и по каким правилам она будет храниться в тайне или распространяться среди других исследователей? Кроме того, планируется ли возвращать результаты исследований участникам? Если да, то следует обсудить обстоятельства, вызвавшие такое возвращение. Если донор ткани будет невозможно идентифицировать в результате исследования образца, донор должен понимать, что обезличенные данные и биообразцы будут переданы исследователям и/или помещены в центральные базы данных и биобанки. Участник должен быть проинформирован о том, что клетки крови, биоптаты кожи (фибробласты) или другие ткани (например, волосы) могут быть использованы для получения ИПСК и органоидов, особенно если ткань собирается в контексте более крупного исследования ( генетика/геномика, например), и образцы будут заморожены для будущего использования. Участник должен получить разрешение на привязку любых медицинских, клинических и генетических данных к биообразцам и их производным. Участника также следует попросить связать любые медицинские, клинические и генетические данные с данными членов его семьи, если они также участвуют в том же исследовании. Участнику должна быть предоставлена возможность отказаться от участия в исследовании с пониманием того, что материал, возможно, уже был распространен, использован или может быть использован в будущем в исследовательских целях и сообщен в опубликованных журнальных статьях или на конференциях. Исследования органоидов могут дать важную информацию о конкретных заболеваниях и даже лечении. Таким образом, пациенты, которые пожертвовали свои клетки или ткани с общего согласия, тем не менее должны иметь возможность узнать о результатах своих органоидов. Правила в отношении необходимости и степени согласия сильно различаются в зависимости от источника ткани. Мы обсудим только рассмотрение будущего сбора тканей. Для живых доноров следует отличать неидентифицируемые ткани (часто в случае хирургических отходов, когда собирается только информация о заболевании) от идентифицируемых тканей (где информацию о донорах можно получить путем изучения ткани). Для умерших лиц согласие должно быть основано либо на ранее выраженном желании умершего лица, либо на согласии ближайших родственников. Для неидентифицируемой ткани согласие не требуется, но может потребоваться, если тип исследования (например,г., трансплантация, образование эмбриоидов, гаструлоидов или зародышевых клеток/гамет) могли бы расстроить, если бы донор задумался об этом. Для этого типа исследований рекомендуется обсудить с IRB (или эквивалентным надзорным органом, если он находится за пределами США), важно ли обращаться к донорам за дополнительным согласием. В отношении идентифицируемой ткани следует давать согласие на использование, отдавая предпочтение как можно более широкому разрешению на ожидаемое и непредвиденное использование, включая широкое распространение среди учреждений по всему миру.Обратите внимание, что это требует некоторой степени воображения при описании возможного будущего использования ткани. Если невозможно получить самое широкое согласие, забор ткани не следует проводить или только распределять с учетом конкретных ограничений. Новые технологии электронной записи могут упростить управление различными ограничениями, налагаемыми каждым донором. Уникальный идентификатор, такой как GUID (глобальные уникальные идентификаторы), первоначально разработанный сообществом исследователей аутизма, создает общий идентификатор субъекта для участников исследования в исследовательских лабораториях и репозиториях и рекомендуется исследователям в других областях в качестве инструмента для поделиться данными (https://ndar. Исследования продвигаются путем обмена результатами и данными. Мы предлагаем четкие рекомендации по обмену и передаче результатов и материалов, полученных в результате исследований органоидов, и предлагаем более широкое использование поддерживаемых государством биобанков в качестве центров для улучшения и координации распространения, обучения и обмена. Распространение через банки данных и тканей весьма желательно в будущем. Несколько банков и центров органоидов уже существуют в Японии, США и Европе (van de Wetering et al., 2015; Сакс и др. , 2018; Такебе и др. , 2018; Ян и др. , 2018). Эти биобанки могут предложить несколько преимуществ для исследования органоидов: Установите стандарты качества сохранности материалов. Разработка стандартных процедур для органоидной культуры. Пройти обучение. Уважайте и применяйте ограничения, установленные донором через хранилища данных. Содействовать общению с донором для получения специального согласия (например, трансплантация, создание эмбрионов или манипуляции с зародышевыми клетками/гаметами). Распространяйте материалы с точной информацией, подробно описывающие протоколы контроля качества, используемые для создания и обслуживания клеток, тканей, органоидов. Собирайте и распространяйте биологические образцы для широкого распространения, которые были модифицированы отдельными лабораториями, например, для исправления определенного генетического дефекта. Данные и образцы для исследований должны быть доступны для использования утвержденными исследователями без географических ограничений. Данные и биообразцы должны быть распространены после того, как запрашивающий утвержденный исследователь и его учреждение согласовали и подписали соответствующее соглашение о передаче материала (MTA) и, при необходимости, представили разрешение IRB/освобождение от своего учреждения. В интересах быстрого распространения данных и выводов, расширения знаний и воспроизводимости данных MTA должен включать формулировку в поддержку обмена данными. Исследователи должны согласиться вернуть сгенерированные данные и модифицированные биообразцы в биобанк или сделать материалы доступными в оговоренное время или к моменту публикации, в зависимости от того, что наступит раньше. Формулировка обмена может поощрять или требовать депонирования результатов в
www.bioRxiv.org или аналогичный сервер препринтов для обеспечения свободного доступа. Успех любой исследовательской области, метода или приложения напрямую зависит от относительного опыта и подготовки ученых, выполняющих работу.Экспериментальные подходы, которые просты в реализации, также легче распространять, с коммерциализацией или без нее. Более сложные протоколы, в том числе генерация и характеристика органоидов, требуют большого опыта в выполнении процедур до мастерства. Увеличение числа ученых, обученных работе с органоидами, будет иметь важное значение для решения нескольких ключевых вопросов: Решение проблем и неопределенностей, связанных с воспроизводимостью. Пока критическая масса исследователей в разных учреждениях не будет обучена надежным и последовательным методам создания органоидов, будет сложно понять, в какой степени возникает изменчивость из-за технических различий по сравнению с генетическими (или биологическими). Устранение узких мест в исследованиях органоидов. Пока обучение не станет надежным и доступным, количество лабораторий, проводящих исследования с использованием органоидов, будет оставаться ограниченным, что напрямую ограничивает количество вопросов, которые будут задаваться с использованием этой технологии. Расширение использования органоидов в трансляционных областях, включая скрининг новых терапевтических средств и регенеративной медицины. Использование органоидов для расширения новых границ исследований.Это может включать, например, всестороннее описание типов клеток в организме и их организации в ткани. Усилия по тканевой инженерии могут привести к созданию более реалистичных органоидов, которые больше напоминают орган in vivo, включая васкуляризацию, иннервацию и поддержку иммунной системы. Область будет процветать только тогда, когда у нас будут надежные и надежные методы обучения. Мы признаем, что существуют как проблемы, так и возможности, связанные с разработкой и реализацией возможностей обучения.Проблемы включают тот факт, что практическое обучение этим протоколам затруднено, и протоколы могут быть сложными для воспроизведения в разных географических точках. Развитие хорошо структурированных органоидов требует длительных периодов времени (многие месяцы или годы) и не может быть легко переведено с одного типа органоида на другой. Таким образом, необходимо найти альтернативы существующим методам обучения, которые уже существуют в ограниченном количестве мест. К ним относятся основные объекты стволовых клеток, которые можно расширить, чтобы обеспечить учебную платформу, которая может включать программы посещения, открытые для людей из разных учреждений. Такие программы могут по существу закрепить искусство на практике с помощью протоколов, которые они выбирают для обучения, и могут включать такие темы, как культивирование и получение hPSCs, выделение тканеспецифических стволовых клеток или тканевых эксплантатов, дифференцировка в органоиды человека, генетические манипуляции, в том числе основанные на CRISPR и функциональные геномные подходы с разрешением одной клетки. Учебные заведения должны стимулировать распространение искусства культивирования органоидов и способствовать обмену опытом и знаниями между исследователями между учреждениями. Обмен исходными материалами имеет решающее значение для обучения и распространения. Для обучения и увеличения количества исследователей в этой области в следующем поколении необходимо использовать передовые методы исследования органоидов. С момента зарождения медицинской науки поступательные шаги в понимании лечения или механики болезней обеспечили значительный прогресс в медицинской помощи. Общественная настороженность, культурные и религиозные барьеры часто стоят на пути немедленного принятия некоторых из этих достижений. Примеры включают донорство и трансплантацию органов, ЭКО и другие передовые медицинские исследовательские процедуры. Эта неуверенность общественности, а иногда и прямое противодействие, часто приводила к снижению общественного признания новых медицинских достижений и в последние годы приводила к политически мотивированным попыткам наложить политические ограничения (запреты на финансирование и, в некоторых случаях, уголовные наказания) в отношении научных исследований.Примеры включают рекомбинантную ДНК (1970-е годы), исследования стволовых клеток (2000-е годы), исследования тканей плода (1990-е годы, 2016-настоящее время), редактирование генов (2016-настоящее время) и митохондриальную заместительную терапию (2016-настоящее время). Большая часть исследований с использованием органоидов финансируется Национальным институтом здравоохранения, Европейским Союзом, Министерством образования Японии и другими государственными фондами. Таким образом, ученые обязаны открыто сообщать общественности о результатах своих исследований и их последствиях, не преувеличивая их.Исследователи также должны быть прозрачны в отношении источников материала, используемого для создания органоидов. Признание этических проблем, связанных с этой областью, также важно. Во время дебатов в Соединенных Штатах по поводу федеральной поддержки исследований с использованием чЭСК защитники исследований, включая ученых, были осторожны, чтобы не обещать излечение в результате исследований, которые в то время находились только в зачаточном состоянии. Ученым было предложено обсудить потенциал и перспективы этой области в случае успеха их исследований. Крайне важно, чтобы ученые знали свою аудиторию. В целом общественное мнение об ученых и поддержка науки довольно позитивны, но могут сильно различаться в зависимости от расы, пола, возраста, образования, региона и политической принадлежности. По мере того, как исследования продвигаются вперед, а клиническое применение становится все более очевидным и реальным, исследования органоидов будут привлекать к себе повышенное внимание средств массовой информации.Это сыграет важную роль в просвещении общественности и поможет сформировать любые возникающие политические дебаты. Поэтому исследователям органоидов следует подумать об обучении журналистов этой области исследований, даже если они не решаются сделать это. Исследователи, не имеющие предыдущего опыта или подготовки в области СМИ, могут быть обеспокоены тем, чтобы их разговор был точно передан репортером, особенно тем, кто не знаком с наукой. Сложный характер науки об органоидах также может служить барьером для дискуссий между учеными и журналистами. Мы предлагаем, чтобы ученые, работающие над органоидами, рассмотрели следующие темы для обсуждения при общении с общественностью об органоидах: Опишите, что такое органоиды и чем они не являются. Четко опишите потенциальные возможности органоидов для ваших исследований. Сформулируйте ключевые открытия, сделанные с помощью органоидов, которые были бы невозможны при использовании других подходов. Признайте неизвестность и вызовы. Не говорите о неопубликованных результатах, не прошедших экспертную оценку. Проконсультируйтесь с исследователями в других передовых областях об их опыте работы с прессой и другими аудиториями. Члены и сотрудники ASCB могут предоставить вам профессиональную консультацию (www.ascb.org/advocacy/). Mol Biol Cell. 2019 1 мая; 30 (10): 1129–1137. a HHMI и Институт биомолекулярной медицины Скирболла, факультет клеточной биологии, Медицинский факультет Нью-Йоркского университета, Нью-Йорк, штат Нью-Йорк 10016 B B Дивизион биологических наук, Чикаго Университета Чикаго, Чикаго IL 60637 C Американское общество для клеточной биологии, Bethesda, MD 20814 D Simons Foundation , New York, NY 10010 e University of Wisconsin Madison Law School, Madison, WI 53706 f Фармацевтический факультет Калифорнийского университета Сан-Франциско, Сан-Франциско, Калифорния 94158 g Кафедра клеточной биологии Медицинского центра Университета Дьюка, Дарем, Северная Каролина 27710 ч Институт молекулярной биотехнологии, Австрия 1030 Вена, Австрия i Кафедра химической и биологической инженерии и кафедра молекулярной биологии Принстонского университета, Принстон, Нью-Джерси 08544 c Американское общество клеточной биологии, Bethesda, MD 208013 David G Калифорнийский университет, Беркли a HHMI и Институт биомолекулярной медицины Скирболла, кафедра клеточной биологии, Медицинский факультет Нью-Йоркского университета, Нью-Йорк, штат Нью-Йорк 10016 b Отделение биологических наук, Университет Чикаго, Чикаго, Иллинойс 60637 c Американское общество клеточной биологии, Бетесда, Мэриленд 20814 d Фонд Саймонса, Нью-Йорк, Нью-Йорк 10010 e Университет Мэдисона, Вискон f Факультет фармацевтической химии, Факультет фармации, Калифорнийский университет, Сан-Франциско, Сан-Франциско, Калифорния 94158 g Кафедра клеточной биологии Медицинского центра Университета Дьюка, Дарем, Северная Каролина 27710 h Институт молекулярной биотехнологии Австрийской академии наук, 1030 Вена, Австрия Химический i Департамент биологической инженерии и кафедра молекулярной биологии Принстонского университета, Принстон, штат Нью-Джерси 08544 Поступила в редакцию 4 марта 2019 г. Эта статья распространяется Американским обществом клеточной биологии по лицензии автора (авторов). Через два месяца после публикации он доступен для общественности по лицензии Attribution-Noncommercial-Share Alike 3.0 Unported Creative Commons. Органоиды, полученные из стволовых клеток или тканей в культуре, могут развиваться в структуры, напоминающие in vivo анатомию и физиологию интактных органов. Культуры человеческих органоидов дают возможность изучать развитие человека и моделировать болезненные процессы с той же тщательностью и глубиной анализа, что и обычные для исследований с нечеловеческими модельными организмами. Напоминая по сложности реальную ткань или орган, исследования органов человека, полученные от пациентов, могут ускорить медицинские исследования, открывая новые возможности для тканевой инженерии и регенеративной медицины, генерируя знания и инструменты для доклинических исследований, включая разработку и тестирование лекарств. Достижения в области биологии стволовых клеток возвестили революцию в биологии и медицине. По мере распространения этих технологий на человеческие клетки они проложили путь к открытиям в фундаментальной биологии человека и развитию медицины. Важным недавним шагом в этой революции стала разработка методов создания в контролируемых условиях культивирования трехмерных (3D) структур, известных как органоиды, которые резюмируют развитие и организацию тканей и напоминают органы в организме. Чтобы оптимизировать потенциал этих новых мощных разработок для ученых, Американское общество клеточной биологии (ASCB) обратилось к целевой группе членов ASCB, включая исследователей, некоторые из которых играют решающую роль в разработке систем органоидов; специалисты по этике; и защитники прав пациентов, чтобы определить возможности для исследований органоидов для биологов, выделить препятствия на пути прогресса и проблемы, а также разработать рекомендации и передовой опыт для повышения воздействия этой новой, быстро расширяющейся и многообещающей области. Органоиды дают возможность изучать ткани человека на том же уровне научной тщательности, воспроизводимости и глубины анализа, что обычно возможно только с нечеловеческой моделью. организмы. Органоиды позволяют исследователям резюмировать морфогенетические события в развитии человека, которые приводят к образованию тканей и органов. Органоиды можно использовать для изучения механизмов болезней, действующих в тканях человека, для получения знаний и инструментов, применимых к доклиническим исследованиям, включая тестирование лекарств. Органоиды могут быть получены от любого человека, что позволяет изучать изменчивость среди людей на тканевом уровне, а также клеточные механизмы, приводящие к сложным фенотипам заболеваний. Органоиды, напоминающие по сложности ткани и органы, находят широкое применение в тканевой инженерии, разработке лекарств и регенеративной медицине. Мы предполагаем, что человеческие органоиды могут предоставить фундаментальным ученым возможность проводить механистические исследования в системе «человеческой модели» с приемлемыми этическими ограничениями. Органоиды повторяют только часть всего тела и могут не точно отражать стереотипные и сложные функции отдельных органов.Таким образом, в отличие от моделей целых животных, органоиды предлагают лишь приблизительное представление о биологии всего органа и не имитируют поведение всего организма. У них отсутствуют ключевые особенности in vivo, такие как определенная ось тела, функциональная иммунная система и полные физиологические сети. Следовательно, результаты органоидов должны быть дополнены исследованиями всего организма в модельных системах и сопоставлены с реальным развитием человека, организацией тканей и физиологией. «Золотые стандарты» и лучшие практики должны быть определены для изучения органоидов.Протоколы получения и условий культивирования органоидов должны содержать достаточно деталей для обеспечения воспроизводимости. Необходимо разработать критерии, которые позволят исследователям сравнивать типы и структуры клеток в органоиде с составом и организацией соответствующего органа. Долгосрочное развитие исследований органоидов зависит от распределения источников тканей, которые являются возобновляемыми и легко сопоставимыми между лабораториями. Особенно важным для изучения заболеваний является создание банков тканей (биобанков), которые распределяют чТПСК от разных пациентов с одним и тем же заболеванием.Такие биобанки также могут быть центрами распределения контрольных образцов как здоровых людей, так и генетически модифицированных образцов тканей, полученных от пациентов. Для образцов ткани, полученных от пациента, в согласии пациента должно быть указано требование о том, что материалы будут использоваться совместно различными учреждениями, исследователями и странами. Вход новых исследователей на разных этапах карьеры в эту область следует поощрять и облегчать путем создания учебных центров, где исследователи могут приобретать и адаптировать органоидную технологию.Из-за быстрого развития методов культивирования тканей и сложности материалов и временных рамок, необходимых для создания органоида из возобновляемого источника ткани, либо существующие объекты, либо практикующие лаборатории могут предложить лучшие возможности для обучения, чем более традиционные учебные курсы. Потенциал органоидов для исследований и медицины несет с собой этическую неопределенность и озабоченность общественности. Четкое определение того, чем органоиды являются и чем они не являются, а также реалистичное описание возможностей, которые они предлагают, должны быть сформулированы учеными и научными организациями в их сообщениях. Мы изучаем органоиды, потому что они представляют собой минимальные и воспроизводимые модели сложной динамики тканей человека во время развития, гомеостаза и болезни. Органоиды определяются как использование возобновляемого источника ткани, который 1) получают из стволовых клеток или первичной ткани, 2) культивируют в определенной среде, 3) самоорганизуются в структуру, имитирующую здоровую или больную смоделированную ткань , 4) включает в себя многие аспекты клеточной сложности смоделированной ткани, и 5) может быть размножен и распространен либо как сама культура, либо через определенную популяцию стволовых клеток или клеток-предшественников. Культура органоидов основана на методологии 3D-культуры клеток, разработанной в прошлом столетии.Еще в 1906 году так называемый метод висячей капли позволял культивировать клетки в 3D (подробную историческую перспективу см. В течение последних нескольких десятилетий биомедицинские исследования проводились почти исключительно на животных моделях. Хотя это привело к глубокому пониманию многих фундаментальных биологических процессов, оно оставило пробелы в нашем механистическом понимании специфических для человека процессов развития, клеточных биологических, физиологических и связанных с болезнями событий. Кроме того, разнообразие человеческих особей резко контрастирует с генетической однородностью инбредных моделей животных, что приводит к дефициту наших знаний о разнообразии популяций. С появлением моделей человеческих органоидов эта ситуация, кажется, должна измениться. Впервые органоиды дают возможность индивидуально изучать сборку тканей человека. Органоиды позволяют повторить многие морфогенетические события, ведущие к образованию ткани. Потенциально они могут быть получены от любого человека, здорового или больного.Таким образом, как изменчивость среди людей, так и специфические для человека клеточные механизмы, которые приводят к фенотипам заболеваний, могут быть проанализированы напрямую. Однако органоиды человека как модельная система имеют ограничения. В отличие от животных моделей, органоиды предлагают лишь приблизительное представление о биологии человеческого тела. У них отсутствуют ключевые особенности in vivo, такие как определенная ось тела, функциональная иммунная или нервная система или функциональная сосудистая сеть. Органоиды могут быть созданы различными способами, воспроизводящими либо развитие органов, либо регенерацию органов. В своей простейшей форме органоиды генерируются из стволовых клеток ткани взрослых, культивируемых в присутствии факторов роста и матрикса, обычно обеспечиваемого нишей стволовых клеток.Такие культуры могут содержать все типы клеток, полученные из стволовых клеток in vivo, либо во время нормального тканевого обновления, либо во время восстановления после повреждения, и могут повторять аспекты их трехмерного расположения. Опрос членов ASCB (см. Дополнительную информацию 2) показал, что в то время как более 90% респондентов используют человеческие клетки в культуре, менее 30% используют человеческие органоиды. Среди основных узких мест, которые назвали респонденты, были трудности с выращиванием органоидов и доступность тканей человека для инициации культур. Значительное количество комментариев указывало на проблемы воспроизводимости и стоимости, и многие респонденты задавались вопросом, насколько хорошо органоиды на самом деле моделируют биологию человека. Органоиды предлагают множество захватывающих экспериментальных применений, начиная от лучшего понимания развития человека и заканчивая созданием клинических моделей для тестирования лекарств и регенеративной медицины. Учитывая быстрый прогресс, мы считаем, что приведенные ниже приложения дадут представление о том, что может произойти в будущем. Изучение развития человека в основном ограничивалось обсервационными исследованиями преимплантационных эмбрионов или клеток-предшественников и тканей, выделенных из абортированных плодов. Например, в последнем случае органоспецифические клетки-предшественники выделяют из тканей плода и выращивают в культуре в условиях, в которых они продолжают расти и дифференцироваться (Nikolic et al. Существует два основных подхода к изучению развития человека с использованием моделей органоидов, полученных из ИПСК. Во-первых, органоспецифические предшественники генерируются из iPSCs путем прохождения их через последовательность воздействий определенных факторов. После дальнейшего культивирования предшественники самоорганизуются в органоиды, представляющие развивающийся орган. Этот подход уже обеспечил глубокое понимание морфогенеза нескольких систем органов и, что более интригующе, начинает проливать свет на то, как генетика человека влияет на болезни развития мозга, легких и кишечника (Perez-Lanzon et al., 2018). При втором подходе иПСК принуждают образовывать клеточные агрегаты, которые имитируют сам ранний преимплантационный эмбрион. Эти структуры, известные как эмбриоиды или гаструлоиды, автономно проходят ранние стадии развития. Помимо моделирования человеческого развития, клеточная сложность и трехмерная организация органоидов обеспечивают уникальную платформу для определения механизмов болезней взрослого человека. Полученные из ИПСК органоиды обладают огромным потенциалом для применения в тканевой инженерии и регенеративной медицине. Эти небольшие ткани обладают многими характеристиками эмбриональных тканей, которые, как было показано ранее, обладают регенеративным потенциалом при имплантации in vivo. Например, кишечные органоиды, полученные из hIPSC, включающие как энтодерму, так и мезодерму, дифференцируются в полностью васкуляризированный кишечник при имплантации мышам с ослабленным иммунитетом.Кроме того, имплантированные органоиды включают структурные особенности высокого уровня, такие как ворсинки, которые не наблюдаются при культивировании органоидов in vitro (Spence et al. Одно из интригующих применений органоидов, полученных от пациентов — будь то из ИПСК или взрослых стволовых клеток/клеток-предшественников — это клинические модели для конкретных пациентов, которые помогают в идентификации лекарств или комбинаций лекарств для лечения заболеваний. Эта концепция уже нашла некоторый успех. Например, кишечные органоиды использовались для выявления пациентов, которые однозначно реагируют на дорогостоящую терапию муковисцидоза (Dekkers et al., 2013). В отчете Центра изучения разработки лекарственных средств Тафтса описывается средняя стоимость разработки рецептурного препарата для его утверждения на рынке в размере 2,6 миллиарда долларов. Чтобы в полной мере воспользоваться огромным потенциалом, который могут предложить исследования органоидов, необходимо решить несколько серьезных проблем.Эти проблемы включают воспроизводимость, разработку золотых стандартов для различных систем органов, стандартизированные механизмы обмена тканями и опытом, способы получения согласия пациента и прозрачность в общении с общественностью. Полезность органоидов в биомедицинских исследованиях в значительной степени зависит от того, насколько воспроизводимы их результаты в различных анализах или протоколах дифференциации.Это верно независимо от того, проводятся ли исследования в одной и той же лаборатории или в разных лабораториях с использованием общих ячеек или экспериментальных протоколов. Факторы, влияющие на воспроизводимость, будут варьироваться в зависимости от типа и сложности анализа и источника инициирующих клеток, например, являются ли они хорошо охарактеризованными клеточными линиями или первичными стволовыми клетками, полученными из эмбриональных или взрослых тканей. Контроль качества для снижения изменчивости чрезвычайно важен, если органоиды должны выращиваться в больших количествах для клинических испытаний. Здесь невозможно обсудить все потенциальные источники изменчивости в культуре органоидов, но некоторые из наиболее важных соображений приведены ниже. Предполагается, что академические исследователи следуют основным принципам «строгости и воспроизводимости» в своих экспериментах. Эти принципы включают стандартизацию номенклатуры, количество повторов, статистический анализ, рандомизацию, ослепление, оценку размера выборки и прозрачность отчетности. Генетическая изменчивость менее важна для воспроизводимости анализов с использованием инбредных клеточных линий мыши.То же самое относится и к первичным стволовым клеткам, если они получены из инбредных штаммов. Ряд хорошо охарактеризованных чЭСК также доступен для исследований, например, HUES1 и HUES9 (https://grants.nih.gov/stem_cells/registry/current.htm; http://stemcelldistribution.harvard.edu/). . В какой-то степени эти линии, полученные из эмбрионов, полученных от явно «нормальных» доноров, можно считать золотым стандартом для проверки воспроизводимости анализов органоидов в разных лабораториях. Потенциальная изменчивость в анализах из-за генетического фона может возникнуть с hiPSC, особенно полученными от пациентов с мутациями, связанными с риском наследственного заболевания различной степени тяжести и пенетрантности. В этих случаях фенотип дифференцированных клеток может зависеть от генетического фона, в котором лежит мутация. Теоретически иПСК, полученные от разных пациентов с одной и той же мутацией, могут по-разному вести себя в органоидных культурах. Следовательно, в исследованиях органоидов следует использовать линии ИПСК, полученные от нескольких пациентов, и, в идеале, исследователи должны быть готовы поделиться этими различными линиями с другими лабораториями, чтобы можно было сравнить результаты.Для заболеваний, при которых известен специфический генетический дефект, могут быть созданы и распространены клеточные системы «модели заболевания», в которых генетический дефект корректируется с помощью CRISPR-Cas9 в клетках пациентов или генетический дефект воссоздается в нормальных контрольных клетках. Исследования, подтверждающие принцип, были предоставлены на клеточных линиях пациентов с мышечной дистрофией и муковисцидозом (Simsek et al. , 2016; Min et al. , 2019). В некоторых органоидных анализах используются стволовые клетки, выделенные из первичных тканей человека.Изменчивость может исходить от методов, используемых для выделения и очистки клеток. Например, клинические образцы могут храниться в течение разного времени, протеазы, используемые для диссоциации ткани, могут различаться по эффективности или условия сортировки клеток могут различаться по-разному (например, размер сопла, давление потока, стробирование и источник антител). к поверхностным маркерам; рассмотрено в Hines et al. [2014]). Поэтому важно, чтобы в протоколы изоляции было включено как можно больше технических деталей. Исследователи, плохо знакомые с клеточными культурами и анализами органоидов, должны знать, что клетки могут со временем меняться в культуре, включая потерю способности к дифференцировке. Например, возможен выбор быстрорастущих вариантов или изменение поведения из-за разного состава коммерчески доступных сред (например, разных уровней глюкозы и кальция), разных партий фетальной бычьей сыворотки, компонентов замещающей сыворотки, фактора роста и микоплазмы. загрязнения и др.Эти потенциальные источники изменчивости описаны в основных руководствах по культуре клеток. Клеточные линии должны быть заморожены в аликвотах, а подробные записи должны содержать количество пассажей и другие переменные. Важным источником изменчивости как между лабораториями, так и между экспериментами могут быть условия выращивания органоидов. Проблемы делятся на несколько категорий, в том числе изменчивость чистоты факторов роста в партиях, различия в воздействии на клетки уровня кислорода в многолуночных планшетах и изменчивость степени и скорости созревания дифференцированных типов клеток.Эти переменные могут быть объединены, если органоиды получены из комбинации различных типов клеток, таких как «мультиплексные» органоиды, в которых эпителиальные, стромальные, эндотелиальные и иммунные клетки агрегированы вместе. Изменчивость также может быть связана с использованием различных протоколов индукции. Например, протокол, разработанный для индукции энтодермы задней кишки человека из ИПСК, также генерирует небольшое количество мезодермы, которая имеет правильный паттерн задней боковой пластинки и дает начало гладким мышцам, тогда как протоколы для индукции передней энтодермы не генерируют ассоциированную мезодерму (Munera and Wells). , 2017; McCauley et al., 2018). Важно отметить, что органоиды полезны только в том случае, если они приближаются к воспроизведению реального органа на месте. Для сравнения использовались различные критерии, такие как описание типов клеток, образованных с использованием экспрессии РНК на уровне одной клетки, антител или генетически кодируемых маркеров; реконструкция всего органоида из 3D в 4D для определения общей морфологии, расслоения и регионального паттерна; и, наконец, разработка тестов для оценки физиологии и функции конкретного органоида.Последнее может включать трансплантацию и функциональную интеграцию в животное-хозяин, как это было показано для моделей кишечника (Fumagalli et al. , 2017; Munera et al. , 2017). Надежная проверка достигается путем сравнения этих структурных и функциональных показателей с соответствующим органом в другой модельной системе, такой как мышь, свинья и примат, или в реальной ткани человека. Учитывая потенциальные источники изменчивости, рассмотренные выше, можно сделать ряд рекомендаций: Крайне важно, чтобы протоколы для органоидов были подробно описаны в первоначальных публикациях, а источники реагентов, используемых на каждом этапе (выделение клеток, условия культивирования органоидов, методы индукции дифференцировки, выделение дифференцированных типов клеток), были предоставлены. Передача знаний наиболее эффективна посредством посещений лабораторий, объектов и хранилищ, которые регулярно культивируют и выращивают органоиды (для дальнейшего обсуждения см. Обучение исследованиям органоидов ниже). Критерии (транскриптомные профили, наборы поверхностных антител, трехмерная реконструкция, анализ отдельных клеток и поведение после трансплантации) должны быть установлены для сравнения дифференцированных типов клеток и структур, полученных в органоидах, с типами клеток и тканевой организацией, присутствующими в норме. ткани. Вполне вероятно, что генетический фон может влиять на поведение ИПСК, несущих мутации, связанные с заболеванием. Поэтому рекомендуется, чтобы линии были получены и сохранены от нескольких пациентов. Чтобы максимизировать полезность этих банков, согласие пациента должно включать возможность совместного использования их между различными учреждениями и исследователями (для дальнейшего обсуждения см. Получение тканей и согласие пациента в исследованиях органоидов и Совместное использование материалов и результатов ниже). Важно обеспечить достаточное количество тканей человека, уважая при этом пожелания доноров и сохраняя доверие общественности к добросовестности исследований и усилий по медицинскому применению. В случае с биообразцами, полученными от человека, процесс получения согласия является важной частью исследования, призванного защитить права и благополучие лиц, участвующих в исследовании, и уважать достоинство и автономию этих лиц, предоставляя им возможность выбора, помогать или нет. исследование (Huch et al., 2017). Как и раньше, работа с человеческими тканями вызывает ряд опасений и регулируется правовыми нормами и ограничениями финансирования, которые различаются в зависимости от страны и на уровне штата в США. Для живых людей взятие ткани in situ предполагает вторжение в их тело и требует добровольного и информированного согласия.Прикосновение к телу живого человека без надлежащего согласия и таким образом, который может быть вредным или оскорбительным, является вмешательством в общепринятые представления о личной автономии и является незаконным во многих национальных правовых системах, в том числе в Соединенных Штатах. Ткани, взятые у умерших людей, могут вызвать вопросы о том, кто имеет право давать согласие на донорство. Во многих законодательных органах, таких как Соединенные Штаты, умерший человек не считается человеком-субъектом исследования с целью инициирования федеральных правил исследовательской этики.Тем не менее, в некоторых юрисдикциях ткани рассматриваются как находящиеся в распоряжении кого-то, кроме государства или исследовательского сообщества, так что, например, может потребоваться согласие близкого родственника. Наконец, из-за религиозных, этнических или национальных обычаев взятие ткани у умершего может считаться правонарушением, а некоторые виды исследований (например, изучение прошлых перемещений населения и моделей расселения) могут представлять культурную или даже политическую проблему. Ткань ex vivo включает «брошенную ткань», такую как хирургические отходы или «подаренная ткань», когда она взята с согласия, как указано выше, или принципиально «измененные ткани», такие как клеточные линии.Национальные правила различаются в зависимости от того, считается ли это какой-либо формой собственности лица, у которого оно было взято. Такие правила могут применяться, если имеется достаточно информации, включенной в образец или прикрепленной к образцу, так что первоначальный источник/донор может быть идентифицирован. В этом случае источник/донор является предметом исследования всякий раз, когда изучается ткань, и если личность не будет достаточно скрыта, это вызовет одобрение и защиту интересов донора. В целом, если ткань берется специально для исследовательских целей, применяются национальные правила проведения исследований, и во многих системах это предполагает не только информированное согласие, но и некую форму независимого надзора для обеспечения того, чтобы исследование добросовестно и защищены интересы участников.В Соединенных Штатах, например, он в большинстве случаев подлежит надзору со стороны институционального наблюдательного совета (IRB) и некоторых федеральных правил, закрепленных в Общем правиле. Федеральное регулирование и требования IRB формально вступают в силу, когда исследование финансируется одним из федеральных агентств и департаментов, принявших Общее правило, но во многих других случаях исследование проводится в условиях добровольного соблюдения. Даже если согласие получено, может оказаться необходимым проверить, распространяется ли оно на все исследования или, по крайней мере, на конкретное планируемое исследование.Некоторые исследования органоидов могут быть настолько тревожными для некоторых представителей общественности, что это станет актуальным. По этой причине процесс получения ткани от доноров может потребовать включения информации о диапазоне предполагаемых применений и возможностях будущего использования, которые еще не рассматривались. Например, работа с тканями, полученными из банка тканей, может потребовать внимания к тому, известны ли личности источника/донора и, если да, то можно ли их скрыть. Если нет, то, возможно, потребуется получить согласие, за исключением случаев, когда от согласия можно отказаться на основании исключений для таких ситуаций, как минимальный риск и необоснованные затраты на связь с донором.Для получения дополнительной информации о том, как управлять тканями, полученными до начала исследования ИПСК или органоидов, см. обсуждение в Lomax et al. (2015) . Для конкретных исследовательских целей учреждениям может быть целесообразно иметь специализированные исследовательские советы, обладающие конкретными знаниями в области технологий и применений стволовых клеток. Конкретные исследования человеческих эмбрионов, которые теперь возможны с новыми методами культивирования, могут потребовать дополнительных надзорных комитетов, которые рассматривают, одобряют и контролируют любые исследования, включающие исследования органоидов на раннем этапе развития человека или направленные на получение человеческих гамет с неявной целью изучения оплодотворения или использования в экстракорпоральном оплодотворении. (ЭКО). Было опубликовано несколько руководств и обсуждений на тему согласия; см., например, Руководство по исследованию стволовых клеток и клиническому переводу , опубликованное Международным обществом исследований стволовых клеток www.isscr.org/docs/default-source/all-isscr-guidelines/guidelines-2016/isscr-guidelines- for-steam-cell-research-and-clinical-translation.pdf). Когда участник исследования или родитель/опекун участника исследования дает согласие, необходимо указать следующее: Каковы непосредственные исследовательские цели и предполагаемое использование в будущем, а также известные риски и выгоды (если таковые имеются) от собираемой информации? Желает ли донор повторно связаться с ним для дополнительных целей в будущем или он/она предпочитает разрешить использование ткани без дальнейшего согласия? Участника также следует спросить, существуют ли какие-либо конкретные виды использования, на которые донор не дает согласия. Если донор ткани должен быть идентифицирован, как будет храниться медицинская и личная информация и идентификационные данные донора? Как она будет защищена и по каким правилам она будет храниться в тайне или распространяться среди других исследователей? Кроме того, планируется ли возвращать результаты исследований участникам? Если да, то следует обсудить обстоятельства, вызвавшие такое возвращение. Если донор ткани будет невозможно идентифицировать в результате исследования образца, донор должен понимать, что обезличенные данные и биообразцы будут переданы исследователям и/или помещены в центральные базы данных и биобанки. Участник должен быть проинформирован о том, что клетки крови, биоптаты кожи (фибробласты) или другие ткани (например, волосы) могут быть использованы для получения ИПСК и органоидов, особенно если ткань собирается в контексте более крупного исследования ( генетика/геномика, например), и образцы будут заморожены для будущего использования. Должно быть предоставлено согласие на отказ, если донор или его родственники прямо соглашаются на использование, или, что более желательно, но менее вероятно, согласие на отказ, когда должны быть указаны исключения. Участник должен получить разрешение на привязку любых медицинских, клинических и генетических данных к биообразцам и их производным. Участника также следует попросить связать любые медицинские, клинические и генетические данные с данными членов его семьи, если они также участвуют в том же исследовании. Участнику должна быть предоставлена возможность отказаться от участия в исследовании с пониманием того, что материал, возможно, уже был распространен, использован или может быть использован в будущем в исследовательских целях и сообщен в опубликованных журнальных статьях или на конференциях. Исследования органоидов могут дать важную информацию о конкретных заболеваниях и даже лечении. Таким образом, пациенты, которые пожертвовали свои клетки или ткани с общего согласия, тем не менее должны иметь возможность узнать о результатах своих органоидов. Правила в отношении необходимости и степени согласия сильно различаются в зависимости от источника ткани. Мы обсудим только рассмотрение будущего сбора тканей. Для живых доноров следует отличать неидентифицируемые ткани (часто в случае хирургических отходов, когда собирается только информация о заболевании) от идентифицируемых тканей (где информацию о донорах можно получить путем изучения ткани). Для умерших лиц согласие должно быть основано либо на ранее выраженном желании умершего лица, либо на согласии ближайших родственников. Для неидентифицируемой ткани согласие не требуется, но может потребоваться, если тип исследования (например,г., трансплантация, образование эмбриоидов, гаструлоидов или зародышевых клеток/гамет) могли бы расстроить, если бы донор задумался об этом. Для этого типа исследований рекомендуется обсудить с IRB (или эквивалентным надзорным органом, если он находится за пределами США), важно ли обращаться к донорам за дополнительным согласием. В отношении идентифицируемой ткани следует давать согласие на использование, отдавая предпочтение как можно более широкому разрешению на ожидаемое и непредвиденное использование, включая широкое распространение среди учреждений по всему миру.Обратите внимание, что это требует некоторой степени воображения при описании возможного будущего использования ткани. Если невозможно получить самое широкое согласие, забор ткани не следует проводить или только распределять с учетом конкретных ограничений. Новые технологии электронной записи могут упростить управление различными ограничениями, налагаемыми каждым донором. Уникальный идентификатор, такой как GUID (глобальные уникальные идентификаторы), первоначально разработанный сообществом исследователей аутизма, создает общий идентификатор субъекта для участников исследования в исследовательских лабораториях и репозиториях и рекомендуется исследователям в других областях в качестве инструмента для поделиться данными (https://ndar.nih.gov/tools_guid_tool.html) Исследования продвигаются путем обмена результатами и данными. Мы предлагаем четкие рекомендации по обмену и передаче результатов и материалов, полученных в результате исследований органоидов, и предлагаем более широкое использование поддерживаемых государством биобанков в качестве центров для улучшения и координации распространения, обучения и обмена. Распространение через банки данных и тканей весьма желательно в будущем. Несколько банков и центров органоидов уже существуют в Японии, США и Европе (van de Wetering et al., 2015; Сакс и др. , 2018; Такебе и др. , 2018; Ян и др. , 2018). Эти биобанки могут предложить несколько преимуществ для исследования органоидов: Установите стандарты качества сохранности материалов. Разработка стандартных процедур для органоидной культуры. Пройти обучение. Уважайте и применяйте ограничения, установленные донором через хранилища данных. Содействовать общению с донором для получения специального согласия (например, трансплантация, создание эмбрионов или манипуляции с зародышевыми клетками/гаметами). Распространяйте материалы с точной информацией, подробно описывающие протоколы контроля качества, используемые для создания и обслуживания клеток, тканей, органоидов. Собирайте и распространяйте биологические образцы для широкого распространения, которые были модифицированы отдельными лабораториями, например, для исправления определенного генетического дефекта. Данные и образцы для исследований должны быть доступны для использования утвержденными исследователями без географических ограничений. Данные и биообразцы должны быть распространены после того, как запрашивающий утвержденный исследователь и его учреждение согласовали и подписали соответствующее соглашение о передаче материала (MTA) и, при необходимости, представили разрешение IRB/освобождение от своего учреждения. В интересах быстрого распространения данных и выводов, расширения знаний и воспроизводимости данных MTA должен включать формулировку в поддержку обмена данными. Исследователи должны согласиться вернуть сгенерированные данные и модифицированные биообразцы в биобанк или сделать материалы доступными в оговоренное время или к моменту публикации, в зависимости от того, что наступит раньше. Формулировка обмена может поощрять или требовать депонирования результатов в
www.bioRxiv.org или аналогичный сервер препринтов для обеспечения свободного доступа. Успех любой исследовательской области, метода или приложения напрямую зависит от относительного опыта и подготовки ученых, выполняющих работу.Экспериментальные подходы, которые просты в реализации, также легче распространять, с коммерциализацией или без нее. Более сложные протоколы, в том числе генерация и характеристика органоидов, требуют большого опыта в выполнении процедур до мастерства. С такими технологиями «неспособность» воспроизвести предыдущую работу не обязательно означает, что ранее опубликованные исследования были ошибочными; в равной степени вероятно, что «искусство» проведения процедуры не было успешно передано и/или освоено второй группой исследователей.Эта фундаментальная проблема имеет серьезные последствия для любой области, зависящей от сложных экспериментальных протоколов. Увеличение числа ученых, обученных работе с органоидами, будет иметь важное значение для решения нескольких ключевых вопросов: Решение проблем и неопределенностей, связанных с воспроизводимостью. Пока критическая масса исследователей в разных учреждениях не будет обучена надежным и последовательным методам создания органоидов, будет сложно понять, в какой степени возникает изменчивость из-за технических различий по сравнению с генетическими (или биологическими). Устранение узких мест в исследованиях органоидов. Пока обучение не станет надежным и доступным, количество лабораторий, проводящих исследования с использованием органоидов, будет оставаться ограниченным, что напрямую ограничивает количество вопросов, которые будут задаваться с использованием этой технологии. Расширение использования органоидов в трансляционных областях, включая скрининг новых терапевтических средств и регенеративной медицины. Использование органоидов для расширения новых границ исследований.Это может включать, например, всестороннее описание типов клеток в организме и их организации в ткани. Усилия по тканевой инженерии могут привести к созданию более реалистичных органоидов, которые больше напоминают орган in vivo, включая васкуляризацию, иннервацию и поддержку иммунной системы. Область будет процветать только тогда, когда у нас будут надежные и надежные методы обучения. Мы признаем, что существуют как проблемы, так и возможности, связанные с разработкой и реализацией возможностей обучения.Проблемы включают тот факт, что практическое обучение этим протоколам затруднено, и протоколы могут быть сложными для воспроизведения в разных географических точках. Развитие хорошо структурированных органоидов требует длительных периодов времени (многие месяцы или годы) и не может быть легко переведено с одного типа органоида на другой. Кроме того, для получения и культивирования органоидов требуется инфраструктура, несколько опытных сотрудников и институциональная поддержка. Эти проблемы затрудняют распространение подробных знаний о культивировании органоидов в новых лабораториях на типичных краткосрочных практических курсах, таких как те, которые в настоящее время используются для обучения экспериментам с модельными организмами. Таким образом, необходимо найти альтернативы существующим методам обучения, которые уже существуют в ограниченном количестве мест. К ним относятся основные объекты стволовых клеток, которые можно расширить, чтобы обеспечить учебную платформу, которая может включать программы посещения, открытые для людей из разных учреждений. Такие программы могут по существу закрепить искусство на практике с помощью протоколов, которые они выбирают для обучения, и могут включать такие темы, как культивирование и получение hPSCs, выделение тканеспецифических стволовых клеток или тканевых эксплантатов, дифференцировка в органоиды человека, генетические манипуляции, в том числе основанные на CRISPR и функциональные геномные подходы с разрешением одной клетки.Такие объекты также станут механизмом и средой для обмена знаниями и сотрудничества, объединяя экспертов в области культуры органов, робототехники и инженерии, микроскопии и анализа изображений, криоконсервации и исследований на животных моделях. Примеры совместных средств, стремящихся к клиническому переводу, см. в Takebe et al. (2018 г.) и Ян и др. (2018) . Учебные заведения должны стимулировать распространение искусства культивирования органоидов и способствовать обмену опытом и знаниями между исследователями между учреждениями. Обмен исходными материалами имеет решающее значение для обучения и распространения. Для обучения и увеличения количества исследователей в этой области в следующем поколении необходимо использовать передовые методы исследования органоидов. С момента зарождения медицинской науки поступательные шаги в понимании лечения или механики болезней обеспечили значительный прогресс в медицинской помощи. Эти достижения, однако, часто выходили за рамки того, что считается социально приемлемым, и не всегда встречали немедленное общественное признание. Общественная настороженность, культурные и религиозные барьеры часто стоят на пути немедленного принятия некоторых из этих достижений. Примеры включают донорство и трансплантацию органов, ЭКО и другие передовые медицинские исследовательские процедуры. Эта неуверенность общественности, а иногда и прямое противодействие, часто приводила к снижению общественного признания новых медицинских достижений и в последние годы приводила к политически мотивированным попыткам наложить политические ограничения (запреты на финансирование и, в некоторых случаях, уголовные наказания) в отношении научных исследований.Примеры включают рекомбинантную ДНК (1970-е годы), исследования стволовых клеток (2000-е годы), исследования тканей плода (1990-е годы, 2016-настоящее время), редактирование генов (2016-настоящее время) и митохондриальную заместительную терапию (2016-настоящее время). Большая часть исследований с использованием органоидов финансируется Национальным институтом здравоохранения, Европейским Союзом, Министерством образования Японии и другими государственными фондами. Таким образом, ученые обязаны открыто сообщать общественности о результатах своих исследований и их последствиях, не преувеличивая их.Исследователи также должны быть прозрачны в отношении источников материала, используемого для создания органоидов. Признание этических проблем, связанных с этой областью, также важно. Во время дебатов в Соединенных Штатах по поводу федеральной поддержки исследований с использованием чЭСК защитники исследований, включая ученых, были осторожны, чтобы не обещать излечение в результате исследований, которые в то время находились только в зачаточном состоянии. Ученым было предложено обсудить потенциал и перспективы этой области в случае успеха их исследований. Крайне важно, чтобы ученые знали свою аудиторию. В целом общественное мнение об ученых и поддержка науки довольно позитивны, но могут сильно различаться в зависимости от расы, пола, возраста, образования, региона и политической принадлежности. Публичная аудитория также с большей вероятностью поначалу будет настороженно относиться к новым областям исследований. Американцы стали больше принимать исследования hESC с течением времени, поскольку в период с 2000 по 2013 год продолжались общественные и политические дебаты, потому что у них было время узнать об области исследований и освоиться в ней.Поскольку исследование органоидов является новой областью и предоставляет исследователям новые инструменты для их исследований, они должны поделиться своим волнением по поводу того, как эти инструменты помогут им достичь своих исследовательских целей. Также важно заверить неспециалистов в том, чем органоиды не являются. Например, органоиды мозга — это , а не полных мозга. Они не могут полностью заменить функцию мозга, а поле не воспроизводит сознание в тарелке. То же самое можно сказать и об органоидах других органов тела.Кишечные органоиды не копируют кишечник, а органоиды сетчатки не являются глазами и не обладают зрением. Одной лекцией поддержки не добиться. Как и в других областях исследований, широкой общественности потребуется время, чтобы адаптироваться, и научное сообщество должно будет приложить постоянные усилия в области образования и диалога, особенно по мере дальнейшего прогресса. По мере того, как исследования продвигаются вперед, а клиническое применение становится все более очевидным и реальным, исследования органоидов будут привлекать к себе повышенное внимание средств массовой информации.Это сыграет важную роль в просвещении общественности и поможет сформировать любые возникающие политические дебаты. Поэтому исследователям органоидов следует подумать об обучении журналистов этой области исследований, даже если они не решаются сделать это. Исследователи, не имеющие предыдущего опыта или подготовки в области СМИ, могут быть обеспокоены тем, чтобы их разговор был точно передан репортером, особенно тем, кто не знаком с наукой. Сложный характер науки об органоидах также может служить барьером для дискуссий между учеными и журналистами.Слишком многие ученые не могут описать свои исследования в самых общих чертах, не говоря уже о том, чтобы продемонстрировать опыт работы с журналистами или обучение работе со СМИ. Такие общества, как ASCB, или институциональные отделы общественной информации и связи, желают и должны консультироваться. Мы предлагаем, чтобы ученые, работающие над органоидами, рассмотрели следующие темы для обсуждения при общении с общественностью об органоидах: Опишите, что такое органоиды и чем они не являются. Четко опишите потенциальные возможности органоидов для ваших исследований. Сформулируйте ключевые открытия, сделанные с помощью органоидов, которые были бы невозможны при использовании других подходов. Признайте неизвестность и вызовы. Не говорите о неопубликованных результатах, не прошедших экспертную оценку. Проконсультируйтесь с исследователями в других передовых областях об их опыте работы с прессой и другими аудиториями.Какой опыт они получили в аналогичных областях передовой науки? Какие предложения у них есть для вас, основанные на этом опыте? Члены и сотрудники ASCB могут предоставить вам профессиональную консультацию (www.ascb.org/advocacy/). Текущие знания о человеческом мозге в основном основаны на посмертных образцах мозга трупов, в основном из-за этических проблем.Модели животных, в том числе нечеловеческие приматы, имеют несколько несоответствий по сравнению с человеческим мозгом. Эти недостатки создали большие проблемы для изучения развития центральной нервной системы (ЦНС) человека и связанных с ним заболеваний (Adams et al., 2019). Появление и быстрый прогресс технологии стволовых клеток, включая эмбриональные стволовые клетки человека (hESC) и индуцированные человеком плюрипотентные стволовые клетки (hiPSC), позволили по-новому взглянуть на развитие человеческого мозга и неврологические заболевания (Thomson et al., 1998; Такахаши и Яманака, 2006 г.; Такахаши и др., 2007). На основе технологии стволовых клеток появление трехмерных (3-D) органоидов привлекло большое внимание в регенеративной медицине. Органоид мозга — это тип органоида, который воспроизводит определенные структуры мозга и использовался для моделирования различных областей человеческого мозга, включая средний мозг (Jo et al., 2016; Monzel et al., 2017), гиппокамп (Sakaguchi et al., 2015). ), гипофиз (Ozone et al., 2016), гипоталамус (Qian et al., 2016) и мозжечок (Muguruma et al., 2015). Таким образом, органоиды головного мозга становятся отличной моделью для изучения развития мозга и механизмов связанных с ним заболеваний (Lancaster and Knoblich, 2014b; Kelava and Lancaster, 2016; Kretzschmar and Clevers, 2016; Di Lullo and Kriegstein, 2017; Benito-Kwiecinski and Lancaster, 2019). Совсем недавно, благодаря достижениям в области редактирования генов, секвенирования отдельных клеток и других передовых технологий, в эту область была введена новая жизненная сила, которая открыла беспрецедентные возможности для моделирования неврологических заболеваний in vitro . В этом обзоре мы впервые обобщили новые достижения в области методов культивирования и протоколов генерации органоидов головного мозга. Затем мы рассказали о применении органоидов головного мозга в исследовании развития человеческого мозга, неврологических заболеваний и воздействия церебральной токсичности. Для получения органоидов головного мозга эмбриональные тела (ЭТ), полученные из плюрипотентных стволовых клеток человека (hPSC), обычно встраивают во внеклеточный матрикс (такой как Matrigel), а затем культивируют во вращающемся биореакторе, чтобы способствовать амплификации тканей и дифференцировке нейронов (Kadoshima et al. ., 2013; Цянь и др., 2016). В некоторых исследованиях также были получены сфероиды и органоиды коры головного мозга человека из плюрипотентных стволовых клеток с использованием системы трехмерного культивирования без внедрения во внеклеточный матрикс, и полученные нейроны также демонстрируют функциональную зрелость и синаптогенез (Pasca et al., 2015; Xiang et al., 2017). . Во время культивирования обычно добавляются небольшие молекулы и факторы роста, которые способствуют формированию hPSCs специфических структур различных областей мозга (Qian et al., 2019). В качестве исходной клеточной популяции нейральные предшественники (Xu R.et al., 2019) и нейроэпителиальные стволовые клетки (Monzel et al., 2017) также используются для создания органоидов. Органоиды головного мозга, культивируемые в течение короткого времени, в основном содержат астроциты, нейроны и нейральные стволовые клетки/клетки-предшественники, но обычно не содержат зрелых олигодендроцитов и функциональных зрелых нейронов. При более длительном времени культивирования активность кальция можно обнаружить после культивирования в течение 50 дней, и больше клеток проявляют активность кальция (Pasca et al., 2015; Qian et al., 2016; Li et al., 2017). Спонтанные возбуждающие постсинаптические токи также можно обнаружить в органоидах, культивируемых в течение 4 мес (Li et al., 2017). Экспрессию маркеров зрелых астроцитов и нейронов, синапсов и дендритных шипиков можно наблюдать в органоидах, культивируемых в течение 6 месяцев или дольше (Quadrato et al., 2017). Длительное культивирование не только способствует созреванию нейронов, но также усиливает рост и дифференцировку глиальных клеток. Сообщалось, что органоиды головного мозга, культивированные в течение 229 дней in vitro , заполнены обильными глиальными клетками, положительными по GFAP и GLT1 (Renner et al., 2017). Таким образом, длительное культивирование способствует созреванию органоидов головного мозга и лучше отражает развитие человеческого мозга (рис. 1). Рисунок 1. Последние методологические достижения в области органоидов головного мозга. Несколько методов были использованы для улучшения созревания органоидов головного мозга. Культивирование органотипических срезов значительно улучшило снабжение органоидных тканей кислородом и уменьшило образование гипоксических ядер.В 2019 году группа Ланкастера применила методы культивирования на границе раздела воздух-жидкость, которые повышают выживаемость нейронов и рост аксонов, а также способствуют формированию цепей и выходу функциональных нейронов (Giandomenico et al., 2019). Совсем недавно было обнаружено, что срезы неокортикальной системы органоидов могут способствовать непрерывному нейрогенезу и расширению кортикальной пластинки; корковая пластинка имеет отчетливые верхний и глубокий корковые слои, которые захватывают неокортекс на поздних сроках беременности человека и в некоторой степени устраняют ограничение роста и диффузии органоидов головного мозга (Qian et al., 2020). Эти результаты показывают, что культуру срезов мозговых органоидов можно использовать для изучения специфического для человека продвинутого развития коры и механизмов, связанных с заболеванием (рис. 1). Микрожидкостные и инженерные методы внесли большой вклад в улучшение воспроизводимости и однородности культур органоидов головного мозга. Особенность этих технологий заключается в том, что они могут упростить процесс выращивания органоидных культур и обеспечить лучшие геометрические ограничения и контроль окружающей среды (Ao et al., 2020). Микрожидкостные чипы упрощают процесс производства мозговых органоидов, а устройства массива микростолбов использовались для формирования большого количества мозговых органоидов in situ (Zhu et al., 2017). Система мозговых органоидов на чипе демонстрирует определенную дифференцировку нейронов, регионализацию и корковую ткань, которые обобщают ключевые особенности раннего развития человеческого мозга (Wang et al., 2018). Эта система применялась для имитации складок мозга и для изучения влияния физических сил на развитие органоидов (Karzbrun et al., 2018). Недавно была создана новая микрожидкостная платформа с рядом уникальных преимуществ (Ao et al., 2020). Устройство объединило культуру интерфейса воздух-жидкость in situ для создания интегрированного рабочего процесса и поддержки универсальной платформы для сборки и культивирования органоидов головного мозга (Ao et al., 2020). Благодаря постоянному прогрессу и совершенствованию биоинженерных технологий культуры органоидов мозга могут стать недорогой, краткосрочной и массовой технологией культивирования. Органоиды мозга, полученные традиционными методами, обычно не имеют микроциркуляторного русла, что считается губительным для органоидов.В условиях длительного культивирования отсутствие сосудистой системы ограничивает транспорт кислорода и питательных веществ к самым внутренним частям органоидов головного мозга, тем самым вызывая апоптоз и гибель клеток во внутренних зонах (Lancaster and Knoblich, 2014a; Yin et al., 2016; Хайде и др., 2018). Более того, недостаток функциональной сосудистой сети влияет на дифференцировку и созревание нейрональных/глиальных клеток-предшественников (Shen et al., 2004). Васкуляризованные кортикальные органоиды человека (vhCOs) генерируются посредством эктопической экспрессии варианта 2 ETS человека (ETV2).Более того, 20% клеток, инфицированных ETV2, в hCO оптимальны для образования vhCO. На 30-й день культивирования появляются эндотелиальные трубочки CD31 + , а на 70-й день наблюдается более сложная сеть сосудов CD31 + (Shen et al., 2004). Кроме того, vhCO также обладает более очевидными характеристиками гематоэнцефалического барьера, проявляющимися в уникальной экспрессии маркеров плотных контактов (таких как α-ZOI), белков астроцитов и перицитов и транспортеров (Cakir et al., 2019). Совсем недавно другая система совместного культивирования hPSCs и эндотелиальных клеток пупочной вены человека была использована для получения васкуляризированных органоидов, которые демонстрируют хорошо развитую тубулярную сосудистую структуру (Shi et al., 2020). Васкуляризованные органоиды демонстрируют сниженный апоптоз и гипоксию клеток и большее количество синаптических связей и устанавливают сосудистые связи после трансплантации in vivo (Cakir et al., 2019; Shi et al., 2020). С развитием технологий все больше типов клеток, включая олигодендроциты (ОЛ) и интернейроны, стали использоваться для создания органоидов. OL необходимы для развития мозга, включая миелинизирующие и электрически изолирующие аксоны нейронов для распространения импульсов, а также для обеспечения питания и метаболической поддержки нейронов.Однако результаты секвенирования одиночных клеток показывают, что в обычных органоидах коры отсутствуют клетки-предшественники олигодендроцитов (Quadrato and Arlotta, 2017; Sloan et al., 2017). Чтобы решить эти проблемы, Madhavan et al. (2018) подвергли развитые органоиды воздействию факторов роста олигодендроцитов для индукции предшественников олигодендроцитов и миелинизирующих OL в кортикальных сфероидах. Промиелинизирующие препараты могут стимулировать продукцию олигодендроцитов и миелинизацию, а также воспроизводить фенотипы заболеваний с дефектом миелинизации (Madhavan et al., 2018). Ким и др. (2019b) применили репортерную линию стволовых клеток OLIG2-зеленый флуоресцентный белок (GFP) для создания органоидов переднего мозга, и производство OL можно отслеживать с помощью сигнала GFP. С их протоколом созревание OL ускоряется и может наблюдаться уже через 9 недель после образования органоида (Kim et al., 2019b). Группа Пашки разработала другой протокол для культивирования органоидов, которые производят OL, астроциты и нейроны (Marton et al., 2019). Их протокол использует набор малых молекул и факторов роста и может быть использован для изучения развития OL, миелинизации и взаимодействия с другими основными типами клеток в центральной нервной системе (Marton et al., 2019). Интернейроны играют ключевую роль в регуляции активности корковых сетей. Сян и др. (2017) создали органоиды, чтобы резюмировать развитие медиального ганглиозного возвышения человека (MGE). Эти органоиды содержат функциональные корковые интернейроны, нейронные сети и ключевые вентральные домены мозга, которые сходны с развивающимися MGE и корой (Xiang et al., 2017). Предыдущие исследования показали, что органоиды головного мозга могут воспроизводить некоторые ключевые особенности человеческого мозга, включая клеточное распределение и организацию, физиологическую структуру, электрическую активность и нейронные сети (Lancaster et al., 2013; Паска и др., 2015; Цянь и др., 2016). Таким образом, органоиды головного мозга стали уникальной моделью для изучения механизмов неврологических расстройств (рис. 2). Рисунок 2. Применение органоидов головного мозга в качестве моделей заболеваний. Органоиды мозга использовались для моделирования заболеваний нервной системы и дегенеративных заболеваний. Первичная микроцефалия, также известная как истинная микроцефалия или аутосомно-рецессивная первичная микроцефалия, в основном вызывается генами, которые регулируют сборку центросом и ресничек, вызванных аутосомно-рецессивными мутациями, включая MCPh2 , ASPM , WDR62 , CDK5RAP2 9 CPAP и CENPJ .В настоящее время установлены специфические органоиды головного мозга для врожденной микроцефалии, несущие мутации CDK5RAP2 , CPAP , ASPM и WDR62 соответственно (Lancaster et al., 2013; Li et al., 2017; 2017; Чжан и др., 2019). Ланкастер и др. (2013) создали церебральную органоидную модель первичной микроцефалии. Соматические клетки пациента с гетерозиготными укороченными мутациями CDK5RAP2 были перепрограммированы в ИПСК.После переноса в нейронную индукцию нейроэпителиальная ткань, полученная из ИПСК пациента, меньше, чем у контрольной группы. Сгенерированные церебральные органоиды содержат меньше радиальных глиальных стволовых клеток (RGs) и больше нейронов, указывая на то, что потеря CDK5RAP2 ведет к преждевременной нейральной дифференцировке за счет клеток-предшественников (Lancaster et al., 2013). Белок, ассоциированный с центросомой P4.1 (белок CPAP), связан с микроцефалией, и его мутация может вызывать синдром Секкеля и микроцефалию.Органоиды головного мозга, полученные от пациента с синдромом Секкеля с мутацией CPAP , демонстрируют меньший размер и преждевременную дифференцировку нейронов (Gabriel et al., 2016). Более того, органоиды Секкеля обнаруживают увеличенное количество и длину ресничек по сравнению с таковыми у контрольных органоидов, указывая на отсроченное разрушение ресничек (Gabriel et al., 2016). Эти находки отражают роль реснички в поддержании нейральных клеток-предшественников (NPCs) и указывают на то, что CPAP является негативным регулятором длины реснички.Органоиды, генерируемые мутантными ИПСК WDR62 , демонстрируют замедленное разложение ресничек, удлинение и прогрессирование клеточного цикла, снижение пролиферации и преждевременную дифференцировку NPC (Zhang et al., 2019). Изучение механизма показывает, что WDR62 взаимодействует с CEP170 и способствует локализации CEP170 в матриксе первичных ресничек, где CEP170 рекрутирует фактор деполимеризации микротрубочек KIF2A для разрушения реснички (Zhang et al., 2019). Эти данные позволяют по-новому взглянуть на патогенез первичной микроцефалии. Мутантные органоиды микроцефалии ASPM обнаруживают меньше нейроэпителиальных тканей, меньше вентрикулярных радиальных глиальных клеток и наружных радиальных глиальных клеток (oRGs) и плохое ламинирование (Li et al., 2017). Снижение созревания и электрической активности наблюдается в мутантных органоидах ASPM , что связано с врожденной умственной отсталостью у пациентов с мутациями ASPM . Ван Л. и др. (2020) провели соответствующие проверки с помощью секвенирования всего экзома и обнаружили связанные с микроцефалией мутации NARS1 у более чем 5000 человек с нарушениями развития нервной системы.Они создали органоиды коры головного мозга с мутациями NARS1 и обнаружили, что органоиды, полученные от пациентов, демонстрируют меньший размер, сниженную пролиферацию и дефекты клеточного цикла RG (Wang L. et al., 2020). Помимо первичной микроцефалии, вызванной хромосомными мутациями, внешняя среда, инфекция и другие факторы также могут вызывать вторичную микроцефалию. Наиболее изученной является микроцефалия, вызванная инфицированием вирусом Зика (ZIKV).Частицы ZIKV могут связываться с клеточными мембранами, локализоваться в митохондриях и клеточных везикулах, приводить к гибели клеток и ингибировать образование нейросфер (Garcez et al., 2016). Цянь и др. (2016) разработали органоид переднего мозга и смоделировали воздействие ZIKV на разных стадиях беременности. Заражение ZIKV на ранней стадии органоидов (14-й день) значительно уменьшает толщину и размеры зоны ВЗ, при этом размер просвета желудочковой структуры значительно увеличивается (Qian et al., 2016), которые очень похожи на клинические фенотипы дилатации центрального желудочка в мозге плода, инфицированного ZIKV (Driggers et al., 2016). Синдром Миллера-Дикера (МДС) — наиболее серьезная форма классической лиссэнцефалии, характеризующаяся уменьшением размеров головного мозга, черепно-лицевыми деформациями, умственной отсталостью и судорогами. Органоиды головного мозга, полученные от пациентов с МДС, демонстрируют повышенный апоптоз и снижение вертикальных делений (Bershteyn et al., 2017; Iefremova et al., 2017). Наблюдаются также дефекты радиальной миграции нейронов, клеточной автономии и замедленного цитокинеза, специфичного для клеток oRG (Bershteyn et al., 2017; Iefremova et al., 2017). Эти митотические дефекты oRG могут быть вовлечены в патогенез лиссэнцефалии человека. Органоиды переднего мозга, полученные от пациентов с МДС, также демонстрируют сдвиг от симметричного к асимметричному клеточному делению клеток вентрикулярной радиальной глии (vRGCs) (Iefremova et al., 2017). Кроме того, они также наблюдали серьезные изменения в организации желудочковой ниши в органоидах МДС, в том числе низкую компактность тканей vRGC и беспорядочное расположение клеток, отошедших от апикальной мембраны (Iefremova et al., 2017). Эти фенотипы могут быть восстановлены путем регуляции пути N-cadherin/β-catenin, что указывает на важную функцию передачи сигналов Wnt при МДС. Расстройство аутистического спектра (РАС) — это нарушение развития нервной системы, вызванное различными патогенными факторами, такими как генетическая мутация, эпигенетические модификации и факторы окружающей среды. Кортикальные органоиды, полученные от пациентов с РАС, демонстрируют предпочтительную дифференциацию в сторону ГАМКергических нейронов, но без изменений глутаматергических нейронов, что приводит к дисбалансу нейронов глутамата/ГАМК, что является результатом измененной экспрессии FOXG1 (Mariani et al., 2015). Мультиомное исследование показывает, что кортикальные органоиды, полученные из иПСК, демонстрируют сходный паттерн транскриптома и эпигенома с изогенной мозговой тканью плода, особенно между 5 и 16 неделями после зачатия (Amiri et al., 2018). Это исследование также выявило 49 640 активных энхансеров, важных для спецификации кортикальных нейронов (Amiri et al., 2018), и дифференциально экспрессируемые гены тесно связаны с сигнальным путем Wnt/β-catenin (Wang et al., 2017). CHD8 представляет собой ген, связанный с РАС, и церебральные органоиды, полученные из ИПСК с мутацией гена CHD8 , показывают, что CHD8 регулирует другие гены, связанные с РАС, такие как TCF4 и AUTS2 . представляет собой разновидность РАС, и потеря функции мутации RAB39B может вызвать макроцефалию, РАС и эпилепсию (Giannandrea et al., 2010). Мутантные церебральные органоиды RAB39B имеют больший объем, чем нормальный контроль, и демонстрируют нарушение дифференцировки и чрезмерную пролиферацию NPC. Механически делеция RAB39B индуцирует сверхактивацию передачи сигналов PI3K-AKT-mTOR, а ингибирование передачи сигналов PI3K-AKT-mTOR может восстановить фенотипы (Giannandrea et al., 2010). Развитие неокортекса у млекопитающих представляет собой хорошо скоординированный процесс, который зависит от точного образования, миграции и созревания нейронов. Перивентрикулярная гетеротопия является одной из наиболее распространенных форм пороков развития коры и тесно связана с DCHS1 и FAT4 (Cardoso et al., 2009). Соматические клетки пациентов, несущих мутации DCHS1 или FAT4 , использовали для конструирования ИПСК и органоидов головного мозга.Морфология отростков NPC выглядит аккуратно и прямолинейно у нормальных органоидов. Однако нейрональные отростки часто разрушаются и демонстрируют искаженную морфологию в FAT4 -мутантных или KO органоидах (Klaus et al., 2019). Неонатальная гипоксическая травма (НГИ) является наиболее распространенной причиной неонатальной смерти и инвалидности. Выжившие обычно страдают церебральным параличом, эпилепсией и когнитивными нарушениями (Mwaniki et al., 2012).Органоиды головного мозга NHI были установлены и использованы для изучения эффектов различных концентраций кислорода. Результаты показывают, что гипоксия ингибирует экспрессию генетических маркеров (например, FOXG1 , DCX1 , CLIP2 ) для переднего мозга, OLs, глиальных клеток и мигрирующих корковых нейронов, что может быть облегчено миноциклином. Кроме того, миноциклин также сдерживал апоптоз, индуцированный гипоксией в органоидах головного мозга (Boisvert et al., 2019). Синдром Дауна (СД) является наиболее распространенной генетической причиной трудностей в обучении и наиболее распространенной формой деменции у людей моложе 50 лет.Факторы, вызывающие деменцию при СД, в основном делятся на два основных типа: факторы развития нервной системы и нейродегенеративные факторы. Как распространенное нарушение развития нервной системы, дисбаланс возбуждающей и тормозной нейротрансмиссии в основном способствует когнитивному дефициту при СД. Органоиды DS продуцируют множество OLIG2 + NPC и множество CR + и SST + ГАМКергических нейронов (Xu R. et al., 2019). Следует отметить тот факт, что между 2D- и 3D-культурами существуют некоторые расхождения: NPC OLIG2 + могут генерировать разные подтипы нейронов в 3D-культуре, в то время как в 2D-культуре можно получить только CR+ нейроны (Xu R.и др., 2019). Эти данные свидетельствуют о том, что OLIG2 является потенциальной мишенью для СД в клинике. пациентов с СД также демонстрируют некоторые фенотипы, наблюдаемые у пациентов с атопическим дерматитом. Гонсалес и др. (2018) обнаружили, что органоиды, полученные от пациентов с СД и пациентов с семейной болезнью Альцгеймера (fAD), могут спонтанно демонстрировать отложение амилоидных бляшек и гиперфосфорилирование Tau, которые являются более значительными, чем fAD. Кроме того, около 30% пациентов с СД имеют отсроченное начало деменции, и в основе этого механизма может лежать тройная репликация BACE2 (Wiseman et al., 2015). В соответствии с этими выводами трисомный уровень BACE2 защищает органоиды T21-hiPSC от ранней AD-подобной патологии амилоидных бляшек. Их результаты предполагают физиологическую роль BACE2 в качестве супрессора AD, а BACE2 может служить терапевтической мишенью (Alic et al., 2020). Болезнь Альцгеймера (БА) является наиболее распространенным нейродегенеративным заболеванием и характеризуется снижением когнитивных функций, нарушением поведения и прогрессирующим ухудшением физических функций.Чой и др. (2014) создали систему трехмерного культивирования с нейральными стволовыми клетками человека через , сверхэкспрессирующими APP и PSEN1 , и успешно наблюдали агрегацию бета-амилоида и патологии тау, что свидетельствует о преимуществах трехмерного культивирования (Kim et al., 2015). ). Непрерывная и спонтанная агрегация Aβ наблюдается в нервных органоидах человека, полученных от пациентов с fAD. На более позднем этапе культивирования органоиды фАД проявляют значительно более высокую иммунореактивность pTau по сравнению с контрольной группой.Ингибиторы β- и γ-секретазы уменьшают патологические изменения, вызванные фосфорилированием амилоида β и тау в органоидах fAD (Raja et al., 2016). Следовательно, органоиды головного мозга могут быть универсальным инструментом для скрининга терапевтических соединений на нейродегенеративные заболевания. Другое недавнее исследование показывает, что 3D-мозгоподобные ткани, инфицированные вирусом герпеса, могут непосредственно создавать новую модель БА, которая может имитировать образование амилоидных бляшек, глиоз, нейровоспаление и нарушение функциональности при патологическом процессе БА (Cairns et al. ., 2020). Болезнь Паркинсона (БП) является вторым наиболее распространенным нейродегенеративным заболеванием после болезни Альцгеймера и характеризуется потерей дофаминергических нейронов в черной субстанции, типичные двигательные симптомы которой включают брадикинезию, ригидность мышц, тремор покоя, постуральные нарушения и нарушения походки. Современные клеточные и животные модели БП имеют некоторые ограничения для имитации фенотипов БП. Например, у животных с генетическими мутациями, включающими мутации LRRK2 , не может быть явных признаков прогрессирующей потери дофаминовых нейронов среднего мозга или образования телец Леви (Chesselet et al., 2008; Ким и др., 2019а). Органоиды, специфичные для среднего мозга человека, полученные от пациентов со спорадической болезнью Паркинсона с мутацией LRRK2 -G2019S, содержат дофаминергические нейроны среднего мозга (mDAN), но количество и сложность mDAN в органоидах LRRK2 снижены по сравнению с таковыми в контрольной группе, т.е. соответствует фенотипу пациентов с БП (Kordower et al., 2013). Ким и др. (2019a) ввели гетерозиготную точечную мутацию LRRK2-G2019S в hiPSC с использованием технологии CRISPR-Cas9 и получили изогенные органоиды среднего мозга (МО).Они обнаружили, что в мутантной МО длина нейритов дофаминергических нейронов была укорочена, а экспрессия соответствующих маркеров, включая TH , AADC , VMAT2 и DAT , также была снижена (Kim et al., 2019а). Более того, другие патологические признаки, связанные с БП, такие как повышенная агрегация и аномальный клиренс α-синуклеина, также обнаруживаются при МО. Данные профилирования экспрессии генов показывают, что мутантные МО имеют много общего с тканями мозга пациентов с БП.Они обнаружили, что TXNIP специфически активируется у мутантных Mos, а ингибирование TXNIP может подавлять фенотип, индуцированный LRRK2 при МО, поэтому TXNIP может быть связан со спорадическими случаями БП, связанными с LRRK2 (Kim et al., 2019а). Все эти данные дают важные сведения о патофизиологии развития БП. В дополнение к спорадической БП, МО, полученные от пациентов с идиопатической БП, демонстрируют измененную экспрессию маркеров фактора транскрипции гомеобокса альфа LIM (ранняя) и тирозингидроксилазы (поздняя) (Chlebanowska et al., 2020). Было идентифицировано несколько ключевых генов, связанных с идиопатическими формами БП, таких как гены нейронных маркеров TH , PTX3 , LMX1A и FOXA2 (Chlebanowska et al., 2020). Недавно Квак и соавт. (2020) разработали новый тип органоидов, подобных среднему мозгу, которые имеют стабильную и гомогенную структуру и могут продуцировать mDAN, а также другие подтипы нейронов и глиальные клетки. Эти результаты показывают, что МО могут служить отличной моделью как для спорадической, так и для знакомой болезни Паркинсона. Глиобластома (GBM) — наиболее злокачественная форма глиомы, на которую приходится 54% всех глиом (da Hora et al., 2019). Церебральные органоиды использовались для моделирования первичной человеческой GBM in vitro . Органоиды культивировали совместно со стволовыми клетками глиомы (GSC) для получения модели церебральной органоидной глиомы (GLICO). Органоиды, совместно культивированные со стволовыми клетками глиомы, показывают, что ГСК метастазируют во внутренние зоны органоидов и глубоко инфильтрируются и пролиферируют в тканях хозяина, образуя опухоли, тесно связанные с пациентами с глиомой (Linkous et al., 2019), предполагая, что модель GLICO хорошо отражает злокачественные характеристики ГБМ. Медуллобластома (МБ), которая возникает преимущественно в мозжечке, является одной из наиболее распространенных и агрессивных злокачественных опухолей головного мозга у детей и вызывает высокий уровень смертности (Rutkowski et al., 2010). Группа 3 MB — одна из наиболее агрессивных подгрупп MB, для которой характерна повышающая регуляция c-MYC . Результаты исследования органоида мозжечка размером 3 MB показывают, что OTX2/c-MYC является новым управляющим геном, необходимым для онкогенеза размером 3 MB.Лечение ингибитором EZh3 таземетостатом может ингибировать онкогенез OTX2/c-MYC в органоидах (Ballabio et al., 2020). Следовательно, органоиды мозжечка человека можно эффективно использовать для изучения роли генетических механизмов у пациентов с глиомой. Как упоминалось выше, ZIKV представляет собой нейротропный вирус, преимущественно поражающий NPC человека. Разработка органоидов головного мозга в значительной степени способствовала изучению нейротропных вирусов и предоставила альтернативный метод для животных и 2D-моделей клеточных культур инфекции ZIKV (Antonucci and Gehrke, 2019).Одно исследование показывает, что воздействие эноксацина может предотвратить инфекцию ZIKV и избежать микроцефального фенотипа в органоидах головного мозга. Это исследование также выявило физиологическое значение РНКи-опосредованного противовирусного иммунитета на ранних стадиях развития человеческого мозга, открыв новые стратегии повышения устойчивости РНКи к врожденным вирусным инфекциям человека (Xu Y. P. et al., 2019). В дополнение к скринингу препаратов для профилактики и лечения инфекции ZIKV, нейротоксичность ZIKV использовалась для изучения его потенциальной эффективности и механизма действия онколитического вируса на GBM.Полученные данные показывают, что ZIKV преимущественно нацелен на GSCs в кортикальных органоидах GBM, демонстрируя эффективные противоопухолевые эффекты с течением времени. В доклинических исследованиях применение органоидов ГБМ усиливает селективное нацеливание на опухоль и может иметь положительные последствия для терапии онколитических вирусов (Zhu et al., 2020). Малярия — паразитарное заболевание, вызываемое Plasmodium . Церебральная малярия является одним из клинических проявлений малярии и обычно сопровождается тяжелыми неврологическими осложнениями (Nanfack et al., 2017). Малярия вызывает гемолиз и производит побочный продукт, называемый гем, который способствует апоптозу и спонтанной дифференцировке ИПСК и вызывает изменения биомаркеров, связанных с повреждением головного мозга, такие как повышенная экспрессия CXCL-10, CXCR3 и BDNF и снижение экспрессии ERBB4 в органоидах. Они обнаружили, что нейрегулин-1 оказывает нейропротекторное действие на органоиды, обработанные гемом (Harbuzariu et al., 2019). Таким образом, эту модель органоидов головного мозга можно использовать для изучения влияния гемолиза (не ограничиваясь малярийной инфекцией) на развитие мозга плода. Шизофрения является одним из наиболее трудноизлечимых заболеваний головного мозга со сложными генетическими/экологическими причинами, молекулярной невропатологией и развитием нервной системы. Из-за функциональных и структурных различий областей мозга у грызунов и человека сложно наблюдать фенотипы психических заболеваний у грызунов (Wang M. et al., 2020). Органоиды переднего мозга, полученные от пациентов с шизофренией с мутациями DISC1 , демонстрируют измененную пролиферацию радиальных глиальных клеток (Ye et al., 2017). Взаимодействие между DISC1 и NDEL1 играет важную роль в поддержании популяции нервных стволовых клеток во время развития переднего мозга человека (Ye et al., 2017). Церебральные органоиды с изогенной мутацией DISC1 демонстрируют сверхактивацию сигнального пути WNT (Srikanth et al., 2018). Морфологический анализ показывает, что органоиды DISC1 демонстрируют хаотичную структурную морфологию и нарушенную пролиферацию, которые можно устранить с помощью антагонизма WNT (Srikanth et al., 2018). Органоиды головного мозга, полученные из иПСК шизофрении, обнаруживают снижение пролиферации и развития нейронов, а также снижение экспрессии белка FGFR1 в клетках коры, что сопровождается потерей передачи сигналов nFGFR1 (Stachowiak et al., 2017). Блокирование и истощение FGFR1 с помощью антагониста PD173074 в контрольных органоидах может вызвать остановку роста коры, сходную с шизофренией. В свою очередь, это также показывает, что восстановление FGFR1 в развивающихся нейронах коры может ингибировать аномалии развития (Stachowiak et al., 2017). В дополнение к моделированию развития нейронов и неврологических расстройств органоиды головного мозга можно использовать для оценки последствий острого и хронического воздействия токсинов. Предыдущие исследования показали, что воздействие никотина во время беременности может быть связано с нарушениями развития нервной системы и поведенческими расстройствами у детей. Ван и др. (2018) использовали систему мозговых органоидов на чипе для моделирования нервной системы, подвергшейся внутриутробному воздействию никотина.Их результаты показывают, что воздействие никотина может вызывать преждевременную дифференцировку и апоптоз нейронов в органоидах головного мозга, а также ингибировать рост нейритов и структурное развитие коры, что проявляется в снижении экспрессии маркеров переднего мозга ( PAX6 и FOXG1 ). Их исследование показывает, что органоиды мозга могут быть полезной моделью для изучения влияния токсина на развитие нейронов. Метамфетамин (МЕТ) является стимулятором привыкания, который вызывает временное сильное возбуждение.Зависимые от MET могут испытывать такие симптомы, как уменьшение объема гиппокампа и потеря памяти (Chang et al., 2007; Du et al., 2015). Чтобы определить влияние пренатального злоупотребления МЕТГ на человеческий мозг, органоиды мозга 10-месячного возраста подвергаются воздействию МЕТН в течение 1 недели с последующим анализом секРНК-секвенации. Результаты показывают, что МЕТГ может значительно изменять экспрессию нейровоспалительных и связанных с цитокинами генов и влиять на пролиферацию, дифференцировку и гибель клеток НСК (Dang et al., 2020). В дополнение к MET, влияние пренатального воздействия каннабиса на развитие мозга изучалось с помощью органоидов головного мозга человека.Они продемонстрировали, что длительное воздействие тетрагидроканнабинола может изменять соотношение VZ/SVZ головного мозга новорожденных, подавлять рецепторы каннабиноидных рецепторов типа 1 и ингибировать рост нейритов и спонтанную активность нейронов (Ao et al., 2020). Это прорыв в культуре человеческого «мозга» в лабораторной посуде и его ежедневной визуализации. Органоиды мозга bona fide предоставляют нам прекрасную модель для понимания развития, старения и развития человеческого мозга, и за последнее десятилетие в органоидах мозга был достигнут значительный прогресс.До сегодняшнего дня органоиды мозга использовались для изучения механизмов неврологических заболеваний, скрининга лекарств и т. д. Хотя органоиды головного мозга демонстрируют значительное преимущество по сравнению с традиционной 2D-культурой, исследователи все же осознают несколько проблем в этой области. Во-первых, для создания и культивирования органоидов головного мозга технически сложно и требует нескольких реагентов. Будет еще сложнее собрать здоровые органоиды, если культивировать их в течение более длительного времени. Во-вторых, существуют некоторые различия между органоидами даже из одной и той же камеры.Это изменение определенно повлияет на результаты сравнения размера и объема между органоидами контроля и пациента. Поэтому необходимо улучшить методы культивирования и повысить воспроизводимость. В-третьих, динамический клеточный состав, структура, зрелость, взаимодействие между типами клеток и т. д. происходят во время развития и старения мозга. До сих пор остается большой проблемой хорошо имитировать сложность человеческого мозга с помощью органоидов в пространственно-временном паттерне. Органоиды мозга для некоторых структур мозга, таких как гиппокамп и мозжечок, еще не созданы.Кроме того, органоиды, созданные для нейродегенеративных заболеваний, включая БА, лишь частично имитируют патологические особенности БА. Для решения этих проблем мы ожидаем технического прогресса. YS, FL, SX и XL написали рукопись. Все авторы внесли свой вклад в статью и одобрили представленную версию. Эта работа была частично поддержана Национальной ключевой программой исследований и разработок Китая (2017YFE0196600 до XL) и Национальным фондом естественных наук Китая (гранты 31571518 и 31771395 до XL).SX был поддержан Фондом естественных наук провинции Шаньдун, Китай (ZR2015HM024 и 2019GSF108066), IIFSDU и SFR для ROCS, SEM. Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов. Адамс, Дж. В., Кугола, Ф. Р., и Муотри, А. Р. (2019). Органоиды головного мозга как инструменты для моделирования нарушений развития нервной системы человека. Физиология 34, 365–375. doi: 10.1152/физиол.00005.2019 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Алик И., Гох П.А., Мюррей А., Портелиус Э., Гканатсиу Э., Гоф Г. и др. (2020). Специфическая для пациента патология, подобная болезни Альцгеймера, в трисомии 21 церебральных органоидов показывает, что BACE2 является дозозависимым геном-супрессором AD в головном мозге человека. Мол. Психиатрия doi: 10.1038/s41380-020-0806-5 [Epub перед печатью]. Полнотекстовая перекрестная ссылка | PubMed Резюме | Академия Google Амири, А., Coppola, G., Scuderi, S., Wu, F., Roychowdhury, T., Liu, F., et al. (2018). Транскриптомный и эпигеномный ландшафт развития коры человека, смоделированный в органоидах. Наука 362:eaat6720. doi: 10.1126/science.aat6720 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Ao, Z., Cai, H., Havert, D.J., Wu, Z., Gong, Z., Beggs, J.M., et al. (2020). Универсальная микрожидкостная сборка органоидов человеческого мозга для моделирования пренатального воздействия каннабиса. Анал.хим. 92, 4630–4638. doi: 10.1021/acs.analchem.0c00205 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Баллабио К., Андерле М., Джанеселло М., Лаго К., Миеле Э., Кардано М. и др. (2020). Моделирование медуллобластомы in vivo и с использованием органоидов мозжечка человека. Нац. коммун. 11:583. Академия Google Бенито-Квечински, С., и Ланкастер, Массачусетс (2019). Органоиды мозга: нейроразвитие человека в тарелке. Гавань Колд-Спринг.Перспектива. биол. 12:a035709. doi: 10.1101/cshperspect.a035709 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Берштейн, М., Новаковски, Т.Дж., Поллен, А.А., Ди Лулло, Э., Нене, А., Уиншоу-Борис, А., и соавт. (2017). Церебральные органоиды, полученные из иПСК человека, моделируют клеточные признаки лиссэнцефалии и обнаруживают длительный митоз наружной радиальной глии. Стволовая клетка 20, 435.e4–449.e4. Академия Google Буасверт, Э. М., Минс, Р.Э., Мишо М., Мадри Дж. А. и Кац С. Г. (2019). Миноциклин смягчает влияние неонатального гипоксического инсульта на органоиды головного мозга человека. Дис. клеточной смерти. 10:325. Академия Google Кэрнс, Д.М., Руло, Н., Паркер, Р.Н., Уолш, К.Г., Герке, Л., и Каплан, Д.Л. (2020). Трехмерная модель ткани головного мозга человека с болезнью Альцгеймера, вызванной герпесом. Науч. Доп. 6:eaay8828. doi: 10.1126/sciadv.aay8828 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Чакир Б., Xiang, Y., Tanaka, Y., Kural, M.H., Parent, M., Kang, Y.J., et al. (2019). Инженерия органоидов головного мозга человека с функциональной сосудистой системой. Нац. Методы 16, 1169–1175. doi: 10.1038/s41592-019-0586-5 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Cardoso, C., Boys, A., Parrini, E., Mignon-Ravix, C., McMahon, J.M., Khantane, S., et al. (2009). Перивентрикулярная гетеротопия, умственная отсталость и эпилепсия, связанные с делецией 5q14.3 -q 15. Неврология 72, 784–792. дои: 10.1212/01.wnl.0000336339.08878.2d Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Чанг Л., Аликата Д., Эрнст Т. и Волков Н. (2007). Структурные и метаболические изменения мозга в полосатом теле, связанные со злоупотреблением метамфетамином. Дополнение 102 (Приложение 1), 16–32. doi: 10.1111/j.1360-0443.2006.01782.x Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Чесселе, М. Ф., Флеминг, С., Мортазави, Ф., и Мерерс, Б. (2008). Сильные стороны и ограничения генетических мышиных моделей болезни Паркинсона. Паркинс. Относ. Беспорядок. 14(Прил. 2), С84–С87. Академия Google Хлебановска П., Тейчман А., Сулковски М., Скшипек К. и Майка М. (2020). Использование 3D-органоидов в качестве модели для изучения идиопатической формы болезни Паркинсона. Междунар. Дж. Мол. науч. 21:694. дои: 10.3390/ijms21030694 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Чой, С.Х., Ким, Ю.Х., Хебиш, М., Сливински, К., Ли, С., Д’Аванцо, К., и соавт. (2014). Трехмерная модель культуры нервных клеток человека с болезнью Альцгеймера. Природа 515, 274–278. Академия Google да Хора, К.С., Швайгер, М.В., Вурдингер, Т., и Таннус, Б.А. (2019). Модели глиомы, полученные от пациентов: от пациентов к чашке к животным. Ячейки 8:1177. doi: 10.3390/cells8101177 Полнотекстовая перекрестная ссылка | Академия Google Данг, Дж., Тивари С.К., Агравал К., Хуэй Х., Цинь Ю. и Рана Т.М. (2020). Разнообразие глиальных клеток и вызванное метамфетамином нейровоспаление в органоидах головного мозга человека. Мол. Психиатрия [Epub перед печатью] doi: 10.1038/s41380-020-0676-x Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Дриггерс, Р. В., Хо, С. Ю., Корхонен, Э. М., Куйванен, С., Яаскелайнен, А. Дж., Смура, Т., и соавт. (2016). Вирусная инфекция с длительной виремией матери и аномалиями головного мозга плода. Н. англ. Дж. Мед. 374, 2142–2151. дои: 10.1056/nejmoa1601824 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Du, J., Quan, M., Zhuang, W., Zhong, N., Jiang, H., Kennedy, D. N., et al. (2015). Уменьшение объема гиппокампа у женщин, но не у мужчин, которые недавно воздерживались от употребления метамфетамина. Поведение. Мозг Res. 289, 78–83. doi: 10.1016/j.bbr.2015.04.033 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Габриэль, Э., Wason, A., Ramani, A., Gooi, L.M., Keller, P., Pozniakovsky, A., et al. (2016). CPAP способствует своевременной разборке ресничек для поддержания пула нейральных предшественников. Эмбо Дж. 35, 803–819. doi: 10.15252/embj.201593679 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Garcez, P.P., Loiola, E.C., Madeiro, da Costa, R., Higa, L.M., Trindade, P., et al. (2016). Вирус Зика нарушает рост нейросфер и органоидов головного мозга человека. Наука 352, 816–818.doi: 10.1126/science.aaf6116 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Giandomenico, S.L., Mierau, S.B., Gibbons, G.M., Wenger, L.M.D., Masullo, L., Sit, T., et al. (2019). Церебральные органоиды на границе воздух-жидкость генерируют разнообразные нервные пути с функциональным выходом. Нац. Неврологи. 22, 669–679. doi: 10.1038/s41593-019-0350-2 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Джаннандреа, М., Бьянки, В., Mignogna, M.L., Sirri, A., Carrabino, S., D’Elia, E., et al. (2010). Мутации в гене малой ГТФазы RAB39B ответственны за Х-сцепленную умственную отсталость, связанную с аутизмом, эпилепсией и макроцефалией. Ам. Дж. Хам. Жене. 86, 185–195. doi: 10.1016/j.ajhg.2010.01.011 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Гонсалес К., Армихо Э., Браво-Алегрия Дж., Бесерра-Каликсто А., Мэйс К.Э. и Сото К. (2018). Моделирование патологии бета-амилоида и тау в органоидах головного мозга человека. Мол. Психиатрия 23, 2363–2374. doi: 10.1038/s41380-018-0229-8 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Harbuzariu, A., Pitts, S., Cespedes, J.C., Harp, K.O., Nti, A., Shaw, A.P., et al. (2019). Моделирование гем-опосредованного повреждения головного мозга, связанного с церебральной малярией, в органоидах коры головного мозга человека. Науч. Респ. 9:19162. Академия Google Хайде М., Хаттнер В. Б. и Мора-Бермудес Ф. (2018). Органоиды мозга как модели для изучения развития и эволюции неокортекса человека. Курс. мнение Клеточная биол. 55, 8–16. doi: 10.1016/j.ceb.2018.06.006 Полнотекстовая перекрестная ссылка | Академия Google Ефремова В., Маникакис Г., Креффт О., Джабали А., Вейнанс К., Уилкенс Р. и соавт. (2017). Органоидная модель развития коры выявляет неклеточно-автономные дефекты в передаче сигналов wnt, способствующие синдрому Миллера-Дикера. Cell Rep. 19, 50–59. doi: 10.1016/j.celrep.2017.03.047 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Джо, Дж., Xiao, Y., Sun, A.X., Cukuroglu, E., Tran, H.D., Goke, J., et al. (2016). Подобные среднему мозгу органоиды из плюрипотентных стволовых клеток человека содержат функциональные дофаминергические и нейромеланин-продуцирующие нейроны. Стволовая клетка 19, 248–257. Академия Google Кадосима, Т., Сакагути, Х., Накано, Т., Соен, М., Андо, С., Эйраку, М., и другие. (2013). Самоорганизация осевой полярности, структура слоя изнутри наружу и видоспецифичная динамика предшественников в неокортексе, полученном из ЭС клеток человека. Проц. Натл. акад. науч. США 110, 20284–20289. doi: 10.1073/pnas.1315710110 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Карзбрун, Э., Кширсагар, А., Коэн, С.Р., Ханна, Дж.Х., и Райнер, О. (2018). Органоиды человеческого мозга на чипе раскрывают физику складывания. Нац. физ. 14, 515–522. doi: 10.1038/s41567-018-0046-7 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Келава И. и Ланкастер М.А. (2016). Выделение мини-мозгов: текущий прогресс и будущие перспективы в исследованиях органоидов мозга. Дев. биол. 420, 199–209. doi: 10.1016/j.ydbio.2016.06.037 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Ким Х., Парк Х.Дж., Чой Х., Чанг Ю., Парк Х., Шин Дж. и др. (2019а). Моделирование спорадической болезни Паркинсона G2019S-LRRK2 в трехмерных органоидах среднего мозга. Stem Cell Rep. 12, 518–531. doi: 10.1016/j.stemcr.2019.01.020 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Ким, Х., Xu, R., Padmashri, R., Dunaevsky, A., Liu, Y., Dreyfus, C.F., et al. (2019б). Церебральные органоиды, полученные из плюрипотентных стволовых клеток, обнаруживают человеческий олигодендрогенез с дорсальным и вентральным происхождением. Представитель стволовых клеток 12, 890–905. doi: 10.1016/j.stemcr.2019.04.011 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Ким, Ю. Х., Чой, С. Х., Д’Аванцо, К., Хебиш, М., Сливински, К., Былыкбаши, Э., и соавт. (2015). Трехмерная система культуры нервных клеток человека для моделирования болезни Альцгеймера. Нац. протокол 10, 985–1006. doi: 10.1038/nprot.2015.065 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Клаус Дж., Кантон С., Кироуси С., Айо-Мартин А.С., Ди Джаймо Р., Ризенберг С. и др. (2019). Измененные траектории миграции нейронов в церебральных органоидах человека, полученных от людей с гетеротопией нейронов. Нац. Мед. 25, 561–568. doi: 10.1038/s41591-019-0371-0 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Кордауэр, Дж.H., Olanow, C.W., Dodiya, H.B., Chu, Y., Beach, T.G., Adler, C.H., et al. (2013). Длительность заболевания и целостность нигростриарной системы при болезни Паркинсона. Мозг 136, 2419–2431. doi: 10.1093/мозг/awt192 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Квак, Т.Х., Канг, Дж.Х., Хали, С., Ким, Дж., Ким, К.П., Парк, К., и др. (2020). Генерация гомогенных органоидов среднего мозга с клеточным составом, подобным in vivo, облегчает моделирование болезни Паркинсона на основе нейротоксинов. Стволовые клетки 38, 727–740. doi: 10.1002/стел.3163 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Ланкастер, Массачусетс, и Кноблих, Дж. А. (2014a). Генерация церебральных органоидов из плюрипотентных стволовых клеток человека. Нац. протокол 9, 2329–2340. Академия Google Ланкастер, Массачусетс, и Кноблих, Дж. А. (2014b). Органогенез в блюде: моделирование развития и заболевания с использованием органоидных технологий. Наука 345, 1247125.doi: 10.1126/science.1247125 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Lancaster, M.A., Renner, M., Martin, C.A., Wenzel, D., Bicknell, L.S., Hurles, M.E., et al. (2013). Церебральные органоиды моделируют развитие человеческого мозга и микроцефалию. Природа 501, 373–379. Академия Google Ли Р., Сун Л., Фанг А., Ли П., Ву К. и Ван Х. (2017). Повторение развития коры с помощью органоидной культуры in vitro и моделирование аномальной веретенообразной (связанной с ASPM первичной) микроцефалии. Protein Cell 8, 823–833. doi: 10.1007/s13238-017-0479-2 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Линкус, А., Баламациас, Д., Снудерл, М., Эдвардс, Л., Миягучи, К., Милнер, Т., и соавт. (2019). Моделирование глиобластомы пациента с помощью церебральных органоидов. Cell Rep. 26, 3203.e5–3211.e5. Академия Google Мадхаван, М., Невин, З.С., Шик, Х.Е., Гаррисон, Э., Кларксон-Паредес, К., Карл, М., и др. (2018).Индукция миелинизирующих олигодендроцитов в сфероидах коры головного мозга человека. Нац. Методы 15, 700–706. doi: 10.1038/s41592-018-0081-4 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Мариани Дж., Коппола Г., Чжан П., Абызов А., Провини Л., Томасини Л. и др. (2015). FOXG1-зависимая дисрегуляция дифференцировки нейронов ГАМК/глутамата при расстройствах аутистического спектра. сотовый 162, 375–390. doi: 10.1016/j.cell.2015.06.034 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Мартон, Р.M., Miura, Y., Sloan, S.A., Li, Q., Revah, O., Levy, R.J., et al. (2019). Дифференцировка и созревание олигодендроцитов в трехмерных нейронных культурах человека. Нац. Неврологи. 22, 484–491. doi: 10.1038/s41593-018-0316-9 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Монзель, А.С., Смитс, Л.М., Хеммер, К., Хачи, С., Морено, Э.Л., ван Вуэллен, Т., и соавт. (2017). Получение органоидов, специфичных для среднего мозга человека, из нейроэпителиальных стволовых клеток. Stem Cell Rep. 8, 1144–1154. doi: 10.1016/j.stemcr.2017.03.010 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Мугурума К., Нишияма А., Каваками Х., Хашимото К. и Сасаи Ю. (2015). Самоорганизация поляризованной ткани мозжечка в 3D-культуре плюрипотентных стволовых клеток человека. Cell Rep. 10, 537–550. doi: 10.1016/j.celrep.2014.12.051 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Мваники, М.К., Атиено М., Лоун Дж. Э. и Ньютон С. Р. (2012). Отдаленные исходы развития нервной системы после внутриутробных и неонатальных инсультов: систематический обзор. Ланцет 379, 445–452. doi: 10.1016/s0140-6736(11)61577-8 Полнотекстовая перекрестная ссылка | Академия Google Нанфак, К.Н., Билонг, Ю., Кагмени, Г., Натан, Н.Н., и Белла, Л.А. (2017). Малярийная ретинопатия у взрослых: клинический случай. Пан Африкан. Мед. Дж. 27, 224. Академия Google Озон, К., Suga, H., Eiraku, M., Kadoshima, T., Yonemura, S., Takata, N., et al. (2016). Функциональная передняя доля гипофиза, созданная в самоорганизующейся культуре эмбриональных стволовых клеток человека. Нац. коммун. 7:10351. Академия Google Паска, А.М., Слоан, С.А., Кларк, Л.Е., Тиан, Ю., Макинсон, К.Д., Хубер, Н., и соавт. (2015). Функциональные корковые нейроны и астроциты из плюрипотентных стволовых клеток человека в 3D-культуре. Нац. Методы 12, 671–678. Академия Google Цянь, X., Nguyen, H.N., Song, M.M., Hadiono, C., Ogden, S.C., Hammack, C., et al. (2016). Органоиды, специфичные для области мозга, с использованием мини-биореакторов для моделирования воздействия ZIKV. сотовый 165, 1238–1254. doi: 10.1016/j.cell.2016.04.032 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Qian, X., Su, Y., Adam, C.D., Deutschmann, A.U., Pather, S.R., Goldberg, E.M., et al. (2020). Нарезанные органоиды коры головного мозга человека для моделирования формирования отчетливого коркового слоя. Стволовая клетка 26, 766.e9–781.e9. Академия Google Quadrato, G., Nguyen, T., Macosko, E.Z., Sherwood, J.L., Min Yang, S., Berger, D.R., et al. (2017). Разнообразие клеток и сетевая динамика в светочувствительных органоидах головного мозга человека. Природа 545, 48–53. doi: 10.1038/nature22047 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Раджа В.К., Мунгенаст А.Е., Лин Ю.Т., Ко Т., Абдурроб Ф., Сео Дж. и др. (2016). Самоорганизующаяся трехмерная нервная ткань человека, полученная из индуцированных плюрипотентных стволовых клеток, повторяет фенотипы болезни Альцгеймера. PLoS One 11:e0161969. doi: 10.1371/journal.pone.0161969 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Реннер, М., Ланкастер, М.А., Биан, С., Чой, Х., Ку, Т., Пир, А., и соавт. (2017). Самоорганизованное формирование паттернов развития и дифференцировка церебральных органоидов. Эмбо Дж. 36, 1316–1329. doi: 10.15252/embj.201694700 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Рутковски С., фон Хофф К., Эмзер А., Zwiener, I., Pietsch, T., Figarella-Branger, D., et al. (2010). Выживаемость и прогностические факторы медуллобластомы раннего детства: международный метаанализ. Дж. Клин. Онкол. 28, 4961–4968. doi: 10.1200/jco.2010.30.2299 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Сакагути Х., Кадосима Т., Соен М., Нарии Н., Исида Ю., Огуши М. и др. (2015). Генерация функциональных нейронов гиппокампа из самоорганизующейся дорсомедиальной телэнцефалической ткани, полученной из эмбриональных стволовых клеток человека. Нац. коммун. 6:8896. Академия Google Шен К., Годери С. К., Джин Л., Карант Н., Сун Ю., Абрамова Н. и др. (2004). Эндотелиальные клетки стимулируют самообновление и расширяют нейрогенез нейральных стволовых клеток. Наука 304, 1338–1340. doi: 10.1126/наука.1095505 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Ши, Ю., Сунь, Л., Ван, М., Лю, Дж., Чжун, С., Ли, Р., и соавт. (2020). Васкуляризованные органоиды коры головного мозга человека (vOrganoids) моделируют развитие коры головного мозга in vivo. PLoS Биол. 18:e3000705. doi: 10.1371/journal.pbio.3000705 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Sloan, S.A., Darmanis, S., Huber, N., Khan, T.A., Birey, F., Caneda, C., et al. (2017). Созревание астроцитов человека запечатлено в трехмерных сфероидах коры головного мозга, полученных из плюрипотентных стволовых клеток. Нейрон 95, 779.e6–790.e6. Академия Google Срикант, П., Лагомарсино, В. Н., Мураторе, Ч. Р., Рю, С. К., Хе, А., Taylor, W.M., et al. (2018). Общие эффекты нарушения DISC1 и повышенной передачи сигналов WNT в органоидах головного мозга человека. Пер. Психиатрия 8:77. Академия Google Stachowiak, E.K., Benson, C.A., Narla, S.T., Dimitri, A., Chuye, L.E.B., Dhiman, S., et al. (2017). Церебральные органоиды выявляют раннее недоразвитие коры при шизофрении — компьютерная анатомия и геномика, роль FGFR1. Пер. Психиатрия 7:6. Академия Google Такахаши, К., Танабэ К., Охнуки М., Нарита М., Ичисака Т., Томода К. и др. (2007). Индукция плюрипотентных стволовых клеток из фибробластов взрослого человека определенными факторами. Мобильный 131, 861–872. doi: 10.1016/j.cell.2007.11.019 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Такахаши, К., и Яманака, С. (2006). Индукция плюрипотентных стволовых клеток из культур эмбриональных и взрослых фибробластов мыши с помощью определенных факторов. Сотовый 126, 663–676. дои: 10.1016/j.cell.2006.07.024 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Томсон, Дж. А., Ицковиц-Элдор, Дж., Шапиро, С. С., Вакниц, М. А., Свиергель, Дж. Дж., Маршалл, В. С., и соавт. (1998). Линии эмбриональных стволовых клеток, полученные из бластоцисты человека. Наука 282, 1145–1147. doi: 10.1126/наука.282.5391.1145 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Ван, Л., Ли, З., Зиверт, Д., Смит, Д.Э.С., Мендес, М.И., Chen, D.Y., et al. (2020). Потеря NARS1 нарушает пролиферацию предшественников в органоидах коры головного мозга и приводит к микроцефалии. Нац. коммун. 11:4038. Академия Google Ван М., Чжан Л. и Гейдж Ф. Х. (2020). Моделирование нервно-психических расстройств с использованием индуцированных человеком плюрипотентных стволовых клеток. Protein Cell 11, 45–59. doi: 10.1007/s13238-019-0638-8 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Ван, П., Мохтари, Р., Педроса Э., Киршенбаум М., Байрак С., Чжэн Д. и соавт. (2017). CRISPR/Cas9-опосредованный гетерозиготный нокаут гена аутизма CHD8 и характеристика его транскрипционных сетей в церебральных органоидах, полученных из iPS-клеток. Мол. Авт. 8:11. Академия Google Wiseman, F.K., Al-Janabi, T., Hardy, J., Karmiloff-Smith, A., Nizetic, D., Tybulewicz, V.L., et al. (2015). Генетическая причина болезни Альцгеймера: механистическое понимание синдрома Дауна. Нац. Преподобный Нейроски. 16, 564–574. doi: 10.1038/nrn3983 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Xiang, Y., Tanaka, Y., Patterson, B., Kang, Y.J., Govindaiah, G., Roselaar, N., et al. (2017). Слияние регионально определенных органоидов, происходящих из hPSC, моделирует развитие человеческого мозга и миграцию интернейронов. Клетка Стволовая клетка 21, 383.e7–398.e7. Академия Google Сюй Р., Браунер А. Т., Ли С., Лю Дж. Дж., Ким Х., Xue, H., et al. (2019). OLIG2 управляет аномальными фенотипами развития нервной системы в моделях органоидов на основе iPSC человека и химерных мышиных моделях синдрома Дауна. Клетка Стволовая клетка 24, 908.e8–926.e8. Академия Google Xu, Y.P., Qiu, Y., Zhang, B., Chen, G., Chen, Q., Wang, M., et al. (2019). Вирусная инфекция Зика индуцирует опосредованный РНК-интерференцией противовирусный иммунитет в нервных предшественниках человека и органоидах головного мозга. Сотовые Res. 29, 265–273. doi: 10.1038/s41422-019-0152-9 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Е, Ф., Канг, Э., Ю, С., Цянь, X., Джейкоб, Ф., Ю, С., и соавт. (2017). DISC1 регулирует нейрогенез посредством модуляции прикрепления кинетохор Ndel1/Nde1 во время митоза. Нейрон 96, 1041–1054. doi: 10.1016/j.neuron.2017.10.010 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Инь, X., Мид, Б. Э., Сафаи, Х., Лангер, Р., Карп, Дж. М., и Леви, О. (2016). Инженерные органоиды стволовых клеток. Стволовая клетка 18, 25–38. doi: 10.1016/j.stem.2015.12.005 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Чжан, В., Yang, S.L., Yang, M., Herrlinger, S., Shao, Q., Collar, J.L., et al. (2019). Моделирование микроцефалии с помощью церебральных органоидов выявило путь WDR62-CEP170-KIF2A, способствующий разборке ресничек у нейральных предшественников. Нац. коммун. 10:2612. Академия Google Zhu, Y., Wang, L., Yu, H., Yin, F., Wang, Y., Liu, H., et al. (2017). Генерация органоидов человеческого мозга in situ на массиве микропилляров. Лабораторный чип 17, 2941–2950. дои: 10.1039/c7lc00682a Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Чжу, З., Mesci, P., Bernatchez, J.A., Gimple, R.C., Wang, X., Schafer, S.T., et al. (2020). Вирус Зика нацелен на стволовые клетки глиобластомы через ось SOX2-Integrin alphavbeta5. Стволовая клетка 26, 187.e10–204.e10. Академия Google В настоящее время шумиха вокруг того, что мы могли бы в конечном итоге сделать с тем, что в настоящее время является крошечными анатомически несовершенными структурами, процветает.Как и в случае с другими достижениями в науке, будет важно двигаться вперед, чтобы сбалансировать шумиху с реальностью и, следовательно, не подпитывать надежду ненадлежащим образом. Таким образом, выпуск открывается наводящей на размышления статьей (Huch et al., 2017), состоящей из двух частей: надежды на исследования органоидов, написанные Хачем и Кноблихом, и ажиотажа, включая то, что потребуется для его преодоления, написанного Лутольф и Мартинес-Ариас. Действительно, культура органоидов также не лишена некоторых этических проблем, как обсуждалось в статье Манси, Хьюна и Шугармана в журнале Spotlight (Манси и др., 2017). Генерация коры головного мозга человека в чашке, особенно в сочетании с редактированием генома, потребует этического рассмотрения. Моделирование раннего эмбрионального развития человека в 3D, как обсуждалось в обзоре Simunovic and Brivanlou (2017), также потребует тщательного этического рассмотрения. На гораздо более практическом уровне эти новые подходы к созданию моделей сложных многоклеточных тканей сопряжены с серьезными проблемами в отношении надежности и воспроизводимости.Например, использование индуцированных пациентом плюрипотентных стволовых клеток (ИПСК) для моделирования моего любимого органа, почки, будет существенно затруднено тем фактом, что эти органоиды содержат более десяти различных типов клеток. Вероятны незначительные вариации относительных соотношений любого данного типа клеток между дифференцировками даже одной и той же клеточной линии. Это будет существенно усугубляться при сравнении органоидов, полученных из разных клонов, не говоря уже об отдельных индивидуумах. Стремясь повысить устойчивость образования органоидов, Arora et al.(2017) сообщают о подходе к разработке процессов, который увеличивает образование высококачественных кишечных органоидов до 3,8 раз на основе автоматической сортировки микропипетками на стадии сфероидов. Возможно, более уместным является тот факт, что все органоиды, происходящие из иПСК, сгенерированные на сегодняшний день, представляют собой модель пренатального состояния, а не полностью дифференцированный тип ткани, не говоря уже о тканях пожилых людей. Таким образом, можем ли мы их использовать для прогнозирования более чем моногенных/олигогенных нарушений развития с ранним началом, необходимо установить ткань за тканью.Однако есть обещание. Органоиды были успешно применены для моделирования реакции тканей на вирусную и бактериальную инфекцию, например, применение церебральных органоидов для изучения вируса Зика, обсуждаемое здесь Сонгом, Мином и его коллегами (Qian et al., 2017). Органоиды легких, подробно рассмотренные Хоганом и его коллегами (Barkauskas et al., 2017), также могут оказаться весьма подходящими для моделирования вирусных и бактериальных инфекций, а также других агентов, которые, как известно, повреждают дыхательные пути. В то время как моделирование тканеспецифических заболеваний оказалось информативным, модели хронических заболеваний с участием нескольких органов будут менее вероятными с использованием органоидов. Было очень приятно собрать этот сборник статей, посвященных современному состоянию органоидной биологии. Мы надеемся, что он предоставит читателю как исходную информацию, так и обзор последних достижений. Я не сомневаюсь, что многое еще впереди. Применение органоидной технологии для решения сравнительной анатомии и связанных с ней эволюционных вопросов, несомненно, принесет захватывающую информацию, а наше исследование основных факторов органоидного морфогенеза продвинет вперед регенеративную медицину.Хотя направление, в котором эта область будет двигаться в ближайшие годы, еще предстоит увидеть, это, несомненно, та область, в которой возврат к фундаментальным понятиям клеток и развития играет и будет продолжать играть важную роль. Исследование органоидов было начато в 2005 году, когда команда под руководством Йошики Сасаи вырастила головной мозг мыши, используя эмбриональные стволовые клетки мыши (Watanabe et al., 2005). В 2008 году той же команде удалось имитировать нервную ткань человека после усовершенствования метода дифференциации. С момента разработки первого органоида командой Sasai в результате различных исследований были созданы модели, имитирующие гипоталамус, глазной бокал и таламус, а также несколько других типов нервной ткани. В 2013 г. Lancaster и др. продемонстрировали, что органоиды могут происходить из нейроэпителия (Lancaster et al., 2013). Ключевые открытия в исследованиях церебральных органоидов. Большинство современных исследований с использованием органоидов сосредоточено на изучении трудно поддающихся изучению заболеваний, таких как болезнь Альцгеймера, опухоли головного мозга и аутизм. Органоиды также могут принести пользу нейрофармакологии, где методы, используемые для обнаружения связывания ионов Ca 2+ , могут обнаруживать нерегулярную нейронную активность при оценке токсичности кандидатов в лекарства.Здесь мы представляем молекулярную и клеточную физиологию муковисцидоза, а затем представляем, как клиническая терапия органоидами обеспечивает платформу для этических дискуссий об исследованиях органоидов. В 2019 году Беркерс и его коллеги опубликовали исследование, в котором обсуждалось, как органоиды, полученные из ректальной ткани, использовались для изучения индивидуальной реакции на лекарства у субъектов с муковисцидозом (Berkers et al., 2019). Исследователи внимательно изучили несколько мутаций в аллеле ионного канала трансмембранного регулятора проводимости при муковисцидозе (CFTR), которые включают мутацию аминокислоты серина в аспарагин (S1251N), а затем наблюдали реакцию на различные методы молекулярной терапии (Berkers et al., 2019). Эти методы лечения, такие как генистеин плюс куркумин и лумакафтор с ивакафтором, также различались по срокам лечения. Одним из ключевых результатов исследования стала идентификация специального молекулярного считывания (или биомаркера) функции CFTR, называемого форсколин-индуцированным отеком (FIS), который использовался в системе органоидных моделей муковисцидоза. Кроме того, авторы продемонстрировали, что FIS связана с двумя дополнительными параметрами для измерения функции CFTR: концентрацией хлоридов пота (SCC) и процентом прогнозируемого объема форсированного выдоха за одну секунду (ppFEV 1 ) для анализа или измерения клинических исходов у пациентов с кистозный фиброз.Хотя подход in vitro к ректальным органоидам по-прежнему требует дополнительных улучшений для решения проблем разработки дополнительных условий тестирования органоидов, существует большой интерес к разработке более рентабельных методов лечения с использованием трансплантируемых органов человека из органоидов, и они заслуживают дальнейших исследований. . Совсем недавно исследования органоидов позволили ученым изучить молекулярные и клеточные особенности альвеол в легких (или альвеолярных сфер), чтобы понять, как вирус SARS-CoV-2 заражает легкие и как легкие реагируют на инфекцию.Этот пример из реальной жизни можно использовать в качестве платформы для обсуждения важных этических аспектов исследования органоидов, а также примерных рамочных вопросов и тем для обсуждения, представленных в Таблице 3. В свете рубрики VALUE Ассоциации американских колледжей и университетов (AAC&U) для этических рассуждений ( AAC&U, 2009), мы полагаем, что примеры открытых вопросов можно использовать как в виртуальных/онлайновых, так и в личных обсуждениях в классах бакалавриата. Как упоминалось далее в нашей статье, мы также рекомендуем две обзорные статьи по сестринскому делу и медицинской этике, написанные Heale and Shorten, 2017, и Taylor, 2013, соответственно. Пример этических аспектов исследования органоидов. Текущие клинические исследования используют специальные мини-органы в чашке Петри (называемые органоидами) для изучения того, как органы развиваются в пространстве и во времени . Органоиды также используются для выявления новых методов лечения заболеваний человека, включая вирусные инфекции в органах хозяина, связанные с новой коронавирусной болезнью 2019 (COVID-19) . Мини-органоиды легких воспроизводят патологию COVID-19 в чашке (https://www.drugtargetreview.com/news/76700/mini-lung-organoids-replicate-covid-19-pathology-in-a-dish/) Почему этические аспекты важны в условиях исследования органоидов? Запишите все ваши ответы, и мы обсудим как сообщество ученых . Важность согласия пациента и HIPAA; Важность информированного согласия и осведомленности об окружающей среде Текущие клинические исследования используют специальные мини-органы в чашке Петри (называемые органоидами) для изучения того, как органы развиваются в пространстве и во времени . Органоиды также используются для выявления новых методов лечения заболеваний человека, включая вирусные инфекции в органах хозяина, связанные с новой коронавирусной болезнью 2019 (COVID-19) . Мини-органоиды легких воспроизводят патологию COVID-19 в чашке (https://www.drugtargetreview.com/news/76700/mini-lung-organoids-replicate-covid-19-pathology-in-a-dish/) Почему этические аспекты важны в условиях исследования органоидов? Запишите все ваши ответы, и мы обсудим как сообщество ученых . Важность согласия пациента и HIPAA; обеспечение того, чтобы права людей и религиозные убеждения не нарушались обеспечение того, чтобы объект или его среда не наносили вреда ради исследования важность информированного согласия и экологической осведомленности Одним из самых больших препятствий, влияющих на исследования церебральных органоидов, является отсутствие поддерживающей нервной ткани.Например, Лавацца и Массимини (2018) подняли важные этические аспекты мозговых органоидов: «Сознание зависит от совместного присутствия интеграции и дифференциации в нейронных цепях». Способность выращивать мозговую ткань была отличным началом, но без окружающего эндотелия, микроглии, сосудистой сети и других типов нервных клеток современные органоиды сильно отличаются от человеческого мозга. Органоиды имеют средний размер около 4 мм при выращивании in vitro . Тем не менее, существует оптимизм в отношении того, что в ближайшем будущем возможны более совершенные органоиды.Примером может служить исследование, целью которого является объединение трехмерных моделей таламуса с моделями головного мозга: «Поскольку таламус является воротами всех сенсорных входов в головной мозг, такое открытие может иметь потенциал для передачи сенсорной информации в нейроны. ткань органоида» (Sawai et al., 2019). Если исследование пойдет дальше и таламокортикальная модель будет слита со спинным мозгом и периферическими нервами, органоид сможет иметь «соматический сенсорный опыт» (Sawai et al., 2019). Здесь начинают проявляться этические опасения. Некоторые предсказывают, что как только развитие органоидов достигнет точки, когда будут развиты целые нейронные сети, у них может начать развиваться человеческое сознание. Хотя крайне маловероятно, что органоиды, с которыми сегодня работают ученые, обладают сознанием, исследования показывают, что они могут появиться в будущем. Примером такой возможности является исследование, проведенное Хидейей Сакагучи и его командой по завершению функциональной оценки нейронной активности в органоидах головного мозга.Команда использовала визуализацию кальция, чтобы создать визуальное представление клеточной активности внутри органоида. Они обнаружили наличие как синхронизированных, так и несинхронизированных электрических градиентов. Принимая во внимание гипотезу сборки клеток, «такой вид нейронной активности может быть основой для различных функций мозга, включая восприятие и память, а затем и для более высоких функций мозга, таких как познание и сознание» (Sawai et al., 2019). Еще один аргумент в пользу установления этических принципов в исследованиях органоидов связан с использованием нечеловеческих животных в исследованиях церебральных органоидов.Недавний эксперимент утверждает, что удалось успешно имплантировать органоид всего мозга во взрослую мышь. Это актуально, потому что скептики сознания органоидов утверждают, что этические соображения, связанные с исследованиями органоидов, не нужны, пока мы не найдем способ обеспечить органоиды сенсорными данными. Это может привести к васкуляризации мини-мозга, что, по прогнозам, приведет к росту, потенциально увеличивая его размер и сложность. Самая большая проблема с этим методом исследования заключается в том, что животные-хозяева становятся более «человеческими» и потенциально развивают понимание своего содержания в неволе. Кроме того, исследования церебральных органоидов пересекаются со здравоохранением, и нам нужно будет подумать о сестринских исследованиях и медицинской этике (Heale & Shorten, 2017; Taylor, 2013). Например, в этике сестринских исследований (Heale & Shorten, 2017) принципы справедливости, минимизация вреда и информированное согласие являются важными параметрами, которые следует учитывать при исследованиях органоидов и клинических применениях. Более того, в теориях медицинской этики (Taylor, 2013) важно учитывать консеквенциализм, деонтологию, добродетель и нормативную этику при этическом анализе использования определенных типов клеток мозга или легких в органоидных исследованиях для новых методов лечения.Кроме того, альтернативные пути медицинской этики, включая нарративную, основанную на конкретных случаях и феминистскую этику, также являются важными аспектами, которые следует учитывать во всех аспектах исследования органоидов и информированного согласия. Как указано в таблице 3, постоянный диалог и размышления сообщества об этике исследований органоидов и их клиническом применении будут оставаться первостепенными по мере развития исследований органоидов животных и человека в ближайшие годы. В свете этических рассуждений в рубрике VALUE AAC&U будет важно отслеживать, как различные этические точки зрения и концепции связаны с исследованиями органоидов. Основываясь на обзоре исследований церебральных органоидов, будет важно продолжить продолжающиеся дискуссии об этических аспектах исследования церебральных органоидов и сознания. Хотя уже существуют этические принципы поведения при использовании животных в исследованиях, крайне важно включить обсуждение этических принципов, включая справедливость, непричинение вреда, автономию пациента и благодеяние.При этом важно, чтобы мы продолжали исследовать эту тему и собирать данные о том, как развиваются исследования церебральных органоидов и сознания. 00000 н
00000
00000 н
00000 00000 н
00000 00000 н
0000095171 00000 н
0000095560 00000 н
0000096151 00000 н
0000098698 00000 н
0000099045 00000 н
0000099581 00000 н
0000101722 00000 н
0000102079 00000 н
0000102604 00000 н
0000108134 00000 н
0000108584 00000 н
0000109202 00000 н
0000110435 00000 н
0000110720 00000 н
0000111173 00000 н
0000113794 00000 н
0000114153 00000 н
0000114682 00000 н
0000115273 00000 н
0000115602 00000 н
0000116127 00000 н
0000116345 00000 н
0000116881 00000 н
0000117066 00000 н
0000117266 00000 н
0000117879 00000 н
0000117955 00000 н
0000118011 00000 н
0000118079 00000 н
0000118218 00000 н
0000001796 00000 н
трейлер
]/предыдущая 139563>>
startxref
0
%%EOF
90 0 объект
>поток
hb«pe«e«`DY86 новое измерение в клеточной биологии
 2019 1 мая; 30 (10): 1129–1137.
2019 1 мая; 30 (10): 1129–1137. Ruth Lehmann
Connie M. Lee
Эрика С.Shugart
Marta Benedetti
D Simons Foundation, Нью-Йорк, NY 10010 R. Alta Charo
Зев Гартнер
Бриджит Хоган
Юрген Кноблих
Селеста М.
 Nelson
Nelson Кевин М. Уилсон
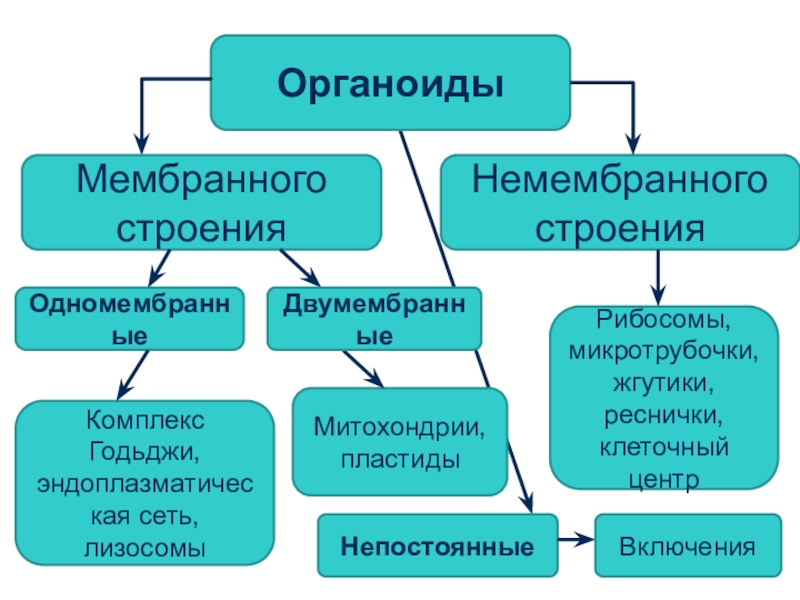 ; Принято 7 марта 2019 г.
; Принято 7 марта 2019 г. Abstract
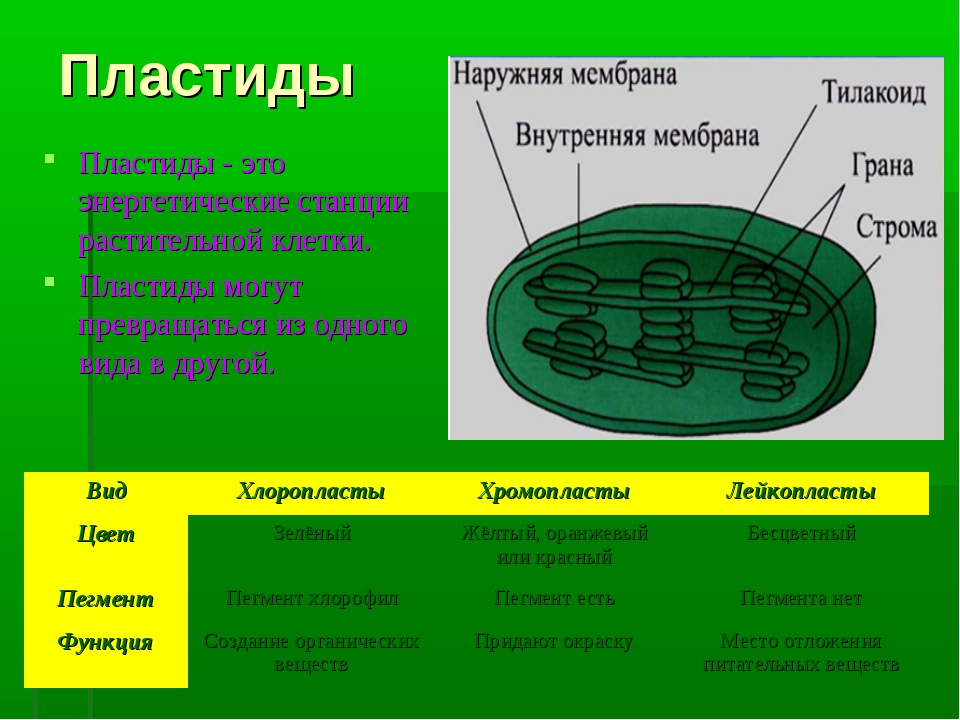 Биологов привлекает эта система как новый «модельный организм» для изучения сложных фенотипов заболеваний и генетической изменчивости среди людей с использованием тканей, полученных от пациентов. Американское общество клеточной биологии созвало целевую группу, чтобы сообщить о потенциале, проблемах и ограничениях исследований органов человека. Целевая группа предлагает способы облегчить вход новых исследователей в эту область и как способствовать более широкому использованию этого нового модельного организма в исследовательском сообществе. Это включает в себя рекомендации по воспроизводимости, культивированию, обмену материалами пациентов, согласию пациентов, обучению и общению с общественностью.
Биологов привлекает эта система как новый «модельный организм» для изучения сложных фенотипов заболеваний и генетической изменчивости среди людей с использованием тканей, полученных от пациентов. Американское общество клеточной биологии созвало целевую группу, чтобы сообщить о потенциале, проблемах и ограничениях исследований органов человека. Целевая группа предлагает способы облегчить вход новых исследователей в эту область и как способствовать более широкому использованию этого нового модельного организма в исследовательском сообществе. Это включает в себя рекомендации по воспроизводимости, культивированию, обмену материалами пациентов, согласию пациентов, обучению и общению с общественностью. РЕЗЮМЕ
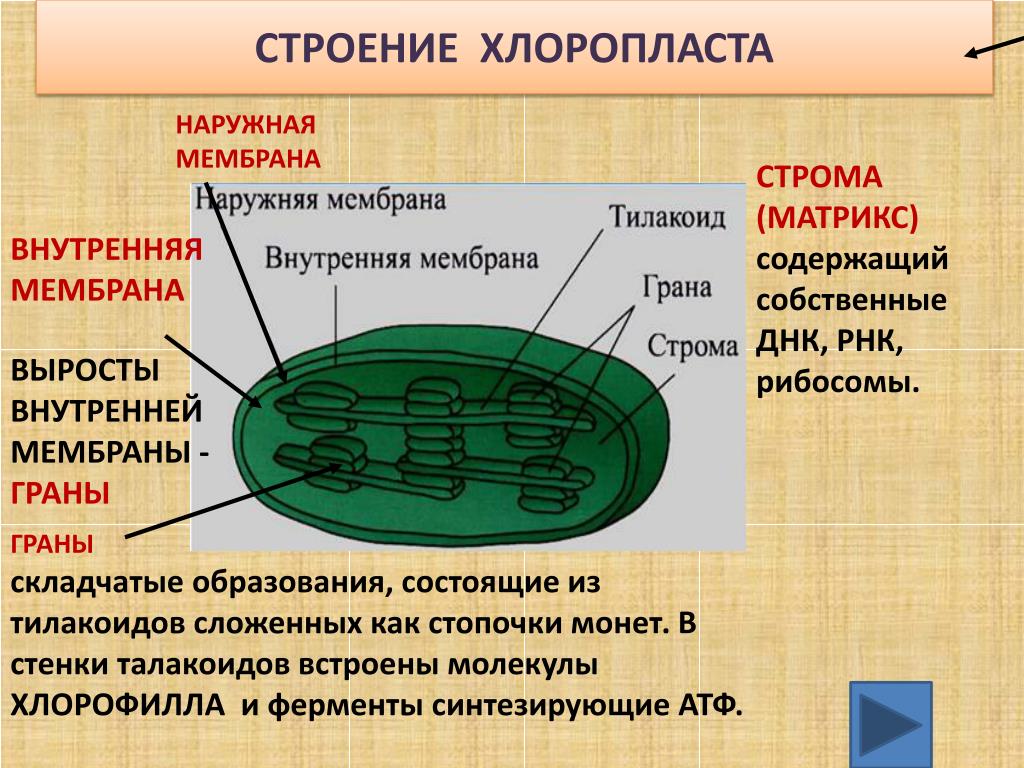 Органоиды происходят из возобновляемых источников тканей, которые самоорганизуются в культуре, приобретая in vivo подобную органу сложность. Органоиды могут быть получены из источников клеток человека, включая взрослые тканеспецифические стволовые клетки, эмбриональные стволовые клетки (hESC) и индуцированные плюрипотентные стволовые клетки (hIPSC). Таким образом, у них есть потенциал преодолеть ряд прежних ограничений в биомедицинских исследованиях, направленных на получение механистического понимания развития человека, создание точных моделей заболеваний человека и создание источников тканей, соответствующих пациентам, для регенеративной медицины.
Органоиды происходят из возобновляемых источников тканей, которые самоорганизуются в культуре, приобретая in vivo подобную органу сложность. Органоиды могут быть получены из источников клеток человека, включая взрослые тканеспецифические стволовые клетки, эмбриональные стволовые клетки (hESC) и индуцированные плюрипотентные стволовые клетки (hIPSC). Таким образом, у них есть потенциал преодолеть ряд прежних ограничений в биомедицинских исследованиях, направленных на получение механистического понимания развития человека, создание точных моделей заболеваний человека и создание источников тканей, соответствующих пациентам, для регенеративной медицины.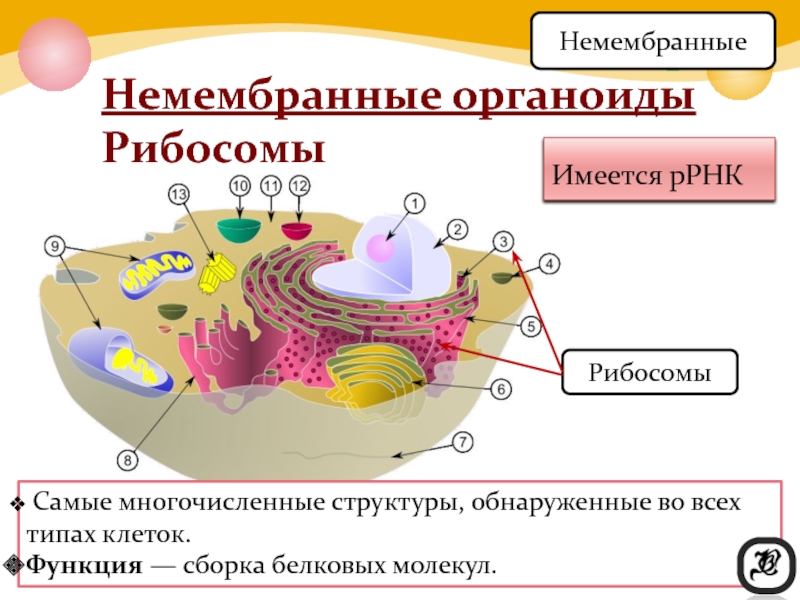 Обсуждение рабочей группой, а также результаты опроса, разосланного членам ASCB, подтверждают огромный потенциал этих новых «модельных систем», а также демонстрируют вызовы для науки и общества, связанные с этой возможностью. Состав рабочей группы см. в дополнительной информации 1; сводку результатов опроса см. в дополнительной информации 2.
Обсуждение рабочей группой, а также результаты опроса, разосланного членам ASCB, подтверждают огромный потенциал этих новых «модельных систем», а также демонстрируют вызовы для науки и общества, связанные с этой возможностью. Состав рабочей группы см. в дополнительной информации 1; сводку результатов опроса см. в дополнительной информации 2. Возможности

Задачи и рекомендации
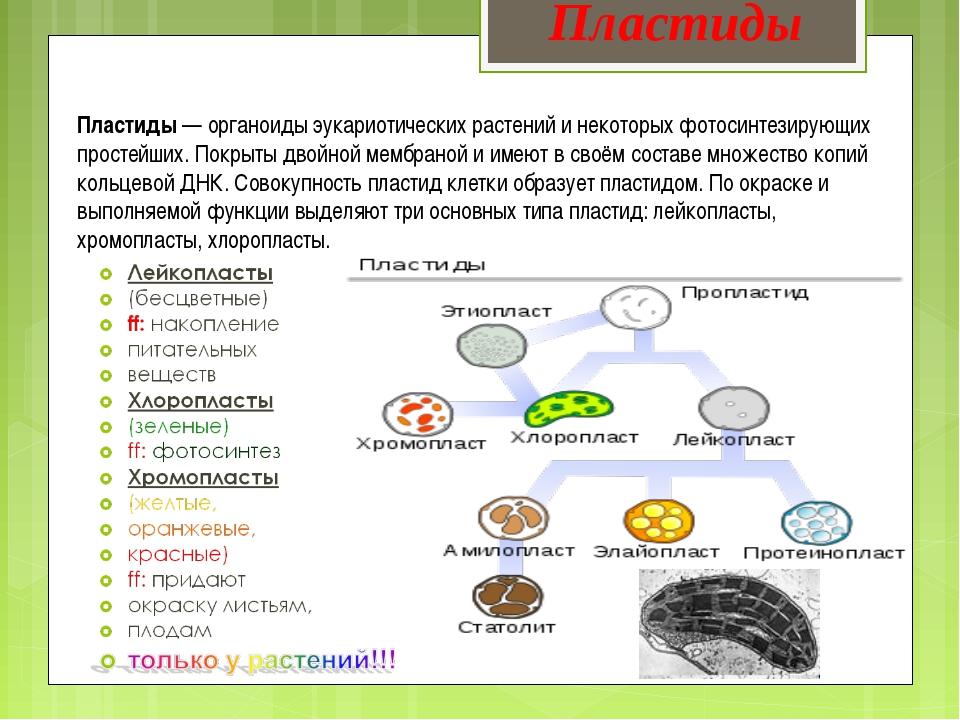

ПРЕДПОСЫЛКИ: БИОЛОГИЯ И ПРОИЗВОДСТВО ОРГАНОИДОВ
Определение органоидов
 Эти модели могут использоваться несколькими лабораториями, ими легко манипулировать, визуализировать и подвергать биомолекулярному анализу без мешающей сложности, связанной с исследованиями in vivo. При выращивании из клеток человека они облегчают переход от животных моделей к биологии человека с приемлемыми этическими ограничениями.
Эти модели могут использоваться несколькими лабораториями, ими легко манипулировать, визуализировать и подвергать биомолекулярному анализу без мешающей сложности, связанной с исследованиями in vivo. При выращивании из клеток человека они облегчают переход от животных моделей к биологии человека с приемлемыми этическими ограничениями. Краткая история
 в Harrison, 1906, и Simian and Bissell, 2017). Нынешний бум исследований органоидов является результатом возможности выращивать органоиды из клеток или тканей, полученных от людей, что раскрывает их огромный потенциал для биологии человека и медицинских исследований (Dekkers et al. , 2013; Lancaster et al. , 2013). . Для целей этого отчета мы сосредоточимся в первую очередь на возможностях и проблемах, связанных с человеческими органоидами, а не на органоидах, полученных из клеток и тканей животных.
в Harrison, 1906, и Simian and Bissell, 2017). Нынешний бум исследований органоидов является результатом возможности выращивать органоиды из клеток или тканей, полученных от людей, что раскрывает их огромный потенциал для биологии человека и медицинских исследований (Dekkers et al. , 2013; Lancaster et al. , 2013). . Для целей этого отчета мы сосредоточимся в первую очередь на возможностях и проблемах, связанных с человеческими органоидами, а не на органоидах, полученных из клеток и тканей животных. Человеческие органоиды как новый модельный организм для исследований
 Действительно, это отсутствие модельных систем человека, возможно, способствовало низкому показателю успеха в клинических испытаниях фармацевтических соединений, разработанных на животных моделях.
Действительно, это отсутствие модельных систем человека, возможно, способствовало низкому показателю успеха в клинических испытаниях фармацевтических соединений, разработанных на животных моделях. Следовательно, хотя органоиды могут рассказать нам о специфических для человека аспектах развития органов и физиологии, в настоящее время они менее полезны для раскрытия аспектов биологии, которые зависят от интегрированных физиологических систем и сложного взаимодействия систем органов человека.Какие бы результаты мы ни нашли в органоидах, они будут полезны только в сравнении с фоном знаний, определенным в других модельных системах. В этом смысле органоиды сами по себе являются новой модельной системой, которая дополняет, а не превосходит существующие модели животных.
Следовательно, хотя органоиды могут рассказать нам о специфических для человека аспектах развития органов и физиологии, в настоящее время они менее полезны для раскрытия аспектов биологии, которые зависят от интегрированных физиологических систем и сложного взаимодействия систем органов человека.Какие бы результаты мы ни нашли в органоидах, они будут полезны только в сравнении с фоном знаний, определенным в других модельных системах. В этом смысле органоиды сами по себе являются новой модельной системой, которая дополняет, а не превосходит существующие модели животных. В качестве альтернативы органоиды могут быть получены из PSC, включая ESC или индуцированных плюрипотентных стволовых клеток (iPSC). Это достигается путем культивирования их в определенной серии коктейлей факторов роста или сред, которые индуцируют органоспецифические клеточные судьбы в последовательности, имитирующей нормальное развитие. Окончательный конгломерат органоспецифических типов клеток может располагаться таким же образом, как и в реальном органе, что позволяет анализировать морфогенетические и физиологические процессы «в чашке».
В качестве альтернативы органоиды могут быть получены из PSC, включая ESC или индуцированных плюрипотентных стволовых клеток (iPSC). Это достигается путем культивирования их в определенной серии коктейлей факторов роста или сред, которые индуцируют органоспецифические клеточные судьбы в последовательности, имитирующей нормальное развитие. Окончательный конгломерат органоспецифических типов клеток может располагаться таким же образом, как и в реальном органе, что позволяет анализировать морфогенетические и физиологические процессы «в чашке».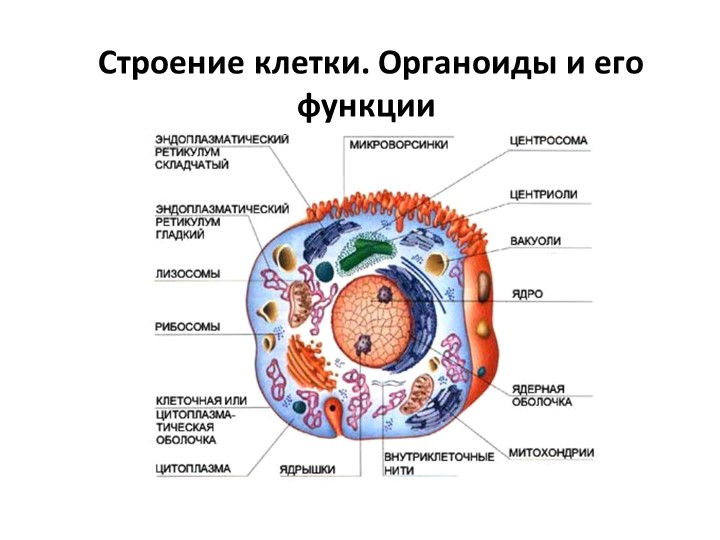 В этом отчете мы излагаем возможности для исследования органоидов, рассматриваем проблемы и даем рекомендации по использованию человеческих органоидов для добавления в репертуар «модельного организма».
В этом отчете мы излагаем возможности для исследования органоидов, рассматриваем проблемы и даем рекомендации по использованию человеческих органоидов для добавления в репертуар «модельного организма». ПРИМЕНЕНИЕ ДЛЯ ИССЛЕДОВАНИЙ ОРГАНОИДОВ
Биология развития человека
 , 2017). Однако появление множества моделей органоидов, полученных из ИПСК, открыло путь к динамическому наблюдению и механистическим исследованиям человеческого развития.
, 2017). Однако появление множества моделей органоидов, полученных из ИПСК, открыло путь к динамическому наблюдению и механистическим исследованиям человеческого развития.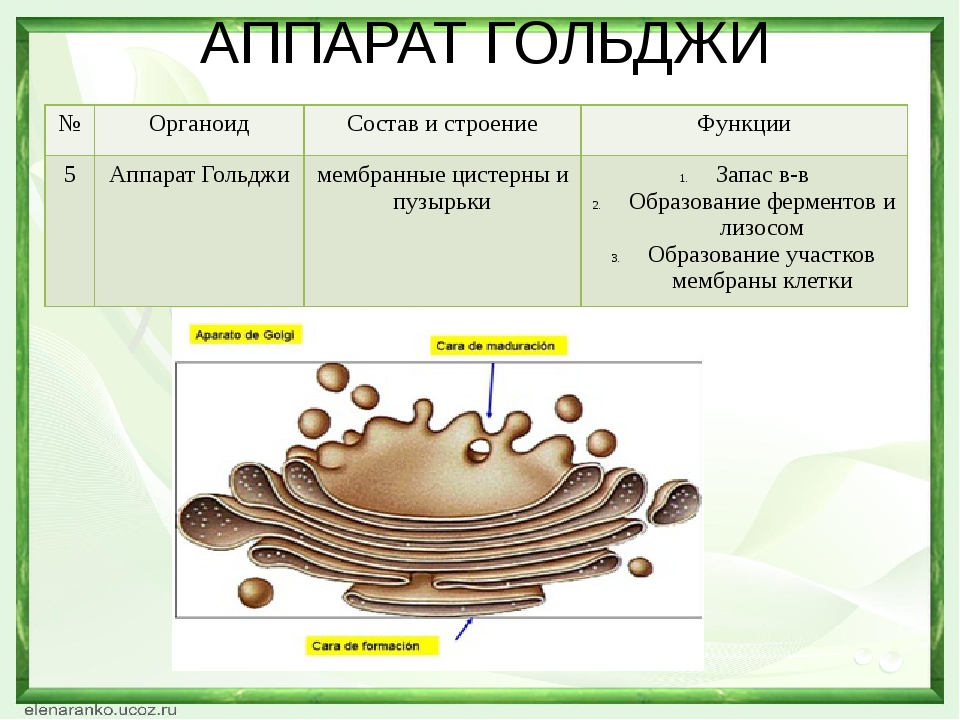 Прогресс в этой области значительно ускорился в последние годы, даже вопреки правилу, которое ограничивает культивирование человеческих эмбрионов сроком более 14 дней, стадии, когда мезодермальные клетки обычно образуются в примитивной полоске (Hyun et al., 2016). Эти исследования выявили различия между самыми ранними стадиями развития человека и модельных организмов, таких как мыши, например, в установлении эмбриональных осей и спецификации первичных зародышевых клеток (Irie et al. , 2015; Kobayashi and Surani, 2018; Мартин и др. , 2018). Они предлагают возможность дальнейшего понимания раннего развития человека, позволяют проводить эволюционные исследования видовой специфичности событий раннего развития и создают новую модельную систему, имеющую отношение к основным причинам ранней потери беременности у человека.
Прогресс в этой области значительно ускорился в последние годы, даже вопреки правилу, которое ограничивает культивирование человеческих эмбрионов сроком более 14 дней, стадии, когда мезодермальные клетки обычно образуются в примитивной полоске (Hyun et al., 2016). Эти исследования выявили различия между самыми ранними стадиями развития человека и модельных организмов, таких как мыши, например, в установлении эмбриональных осей и спецификации первичных зародышевых клеток (Irie et al. , 2015; Kobayashi and Surani, 2018; Мартин и др. , 2018). Они предлагают возможность дальнейшего понимания раннего развития человека, позволяют проводить эволюционные исследования видовой специфичности событий раннего развития и создают новую модельную систему, имеющую отношение к основным причинам ранней потери беременности у человека. Моделирование болезней человека
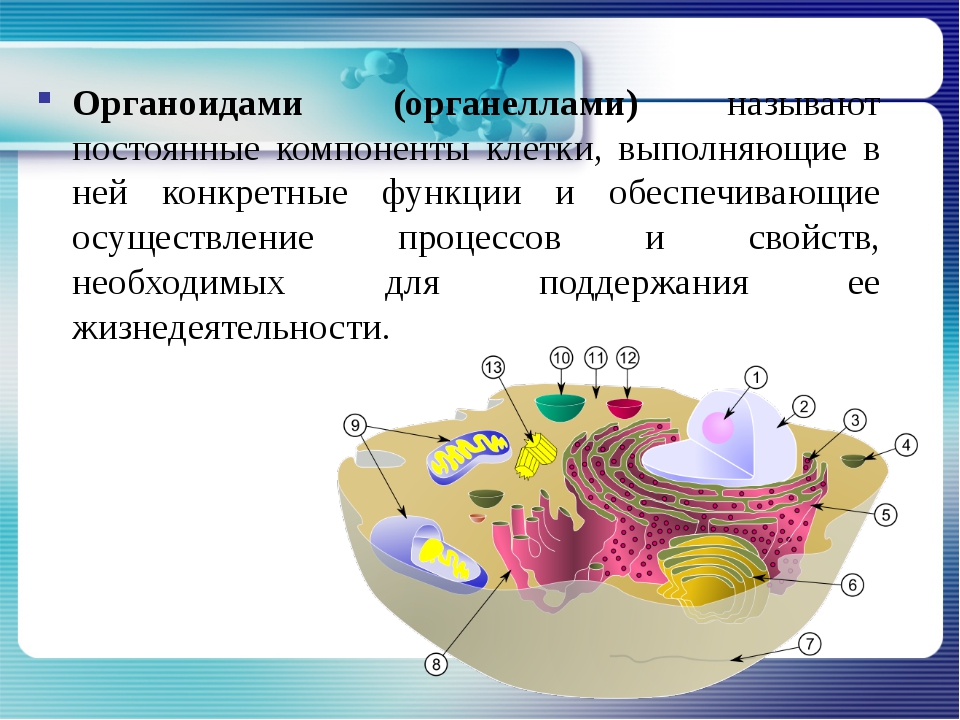 Клеточная организация органоидов может быть изучена на системном уровне благодаря достижениям в области функциональной геномики и протеомики, включая анализ отдельных клеток и высокопроизводительную транскриптомику, протеомику и крупномасштабную характеристику доменов хроматина и регуляторных элементов транскрипции.Этот уровень детального анализа трудно достичь с тканью человека, взятой на месте, и он обеспечит более полное понимание развития и клеточного состава органоидов. Более того, эта информация повысит их актуальность в качестве моделей для изучения морфологии, функций и заболеваний органов и откроет новые возможности в разработке лекарств и регенеративной медицине. Например, клеточное разнообразие развивающихся органоидов головного мозга было использовано для моделирования генетической микроцефалии (Lancaster et al., 2013), чтобы определить потенциальные механизмы, с помощью которых вирус Зика приводит к микроцефалии (Dang et al. , 2016; Garcez et al. , 2016), а органоиды толстой кишки использовались для изучения мутационных стадий, лежащих в основе опухоли.
Клеточная организация органоидов может быть изучена на системном уровне благодаря достижениям в области функциональной геномики и протеомики, включая анализ отдельных клеток и высокопроизводительную транскриптомику, протеомику и крупномасштабную характеристику доменов хроматина и регуляторных элементов транскрипции.Этот уровень детального анализа трудно достичь с тканью человека, взятой на месте, и он обеспечит более полное понимание развития и клеточного состава органоидов. Более того, эта информация повысит их актуальность в качестве моделей для изучения морфологии, функций и заболеваний органов и откроет новые возможности в разработке лекарств и регенеративной медицине. Например, клеточное разнообразие развивающихся органоидов головного мозга было использовано для моделирования генетической микроцефалии (Lancaster et al., 2013), чтобы определить потенциальные механизмы, с помощью которых вирус Зика приводит к микроцефалии (Dang et al. , 2016; Garcez et al. , 2016), а органоиды толстой кишки использовались для изучения мутационных стадий, лежащих в основе опухоли. инициация и развитие (Drost et al. , 2017). Наконец, органоиды, полученные от пациентов, использовались для обобщения прогрессирования пигментного ретинита (Deng et al. , 2018), для изучения роли нейроглии в нейродегенеративном заболевании (Abud et al., 2017), а также для моделирования кистозного фиброза в органоидах дыхательных путей человека (McCauley et al. , 2017).
инициация и развитие (Drost et al. , 2017). Наконец, органоиды, полученные от пациентов, использовались для обобщения прогрессирования пигментного ретинита (Deng et al. , 2018), для изучения роли нейроглии в нейродегенеративном заболевании (Abud et al., 2017), а также для моделирования кистозного фиброза в органоидах дыхательных путей человека (McCauley et al. , 2017). Тканевая инженерия и регенеративная медицина
 , 2011; Munera et al., 2017). Дополнительными тканями, которые, как было показано, обладают регенеративным потенциалом, являются легкие, кожа и волосы (Hirsch et al. , 2017). Другие исследователи изучают органоиды в качестве регенеративной терапии заболеваний печени (зачатки органов) и глаз (глазные бокалы) (Huch et al., 2017; Мандай и др. , 2017).
, 2011; Munera et al., 2017). Дополнительными тканями, которые, как было показано, обладают регенеративным потенциалом, являются легкие, кожа и волосы (Hirsch et al. , 2017). Другие исследователи изучают органоиды в качестве регенеративной терапии заболеваний печени (зачатки органов) и глаз (глазные бокалы) (Huch et al., 2017; Мандай и др. , 2017). Персонализированная медицина
Доклиническое моделирование заболеваний/лекарственный скрининг
 Эти расходы обусловлены главным образом высокой частотой неудачных попыток (∼88%) лекарств, которые тестируются на людях (DiMasi et al. , 2016). Таким образом, органоиды могут предоставить уникальную модель заболевания тканей человека для использования в тестах на лекарства или в доклинических моделях.Например, скрининг более 6000 одобренных лекарств в клетках-предшественниках коры головного мозга, полученных из hIPSC, выявил несколько соединений, которые обладали защитным действием при тестировании на органоидах головного мозга человека (Zhou et al. , 2017). В дополнение к потенциальному перепрофилированию существующих лекарств скрининг на основе органоидов также можно использовать для открытия новых мишеней для лекарств.
Эти расходы обусловлены главным образом высокой частотой неудачных попыток (∼88%) лекарств, которые тестируются на людях (DiMasi et al. , 2016). Таким образом, органоиды могут предоставить уникальную модель заболевания тканей человека для использования в тестах на лекарства или в доклинических моделях.Например, скрининг более 6000 одобренных лекарств в клетках-предшественниках коры головного мозга, полученных из hIPSC, выявил несколько соединений, которые обладали защитным действием при тестировании на органоидах головного мозга человека (Zhou et al. , 2017). В дополнение к потенциальному перепрофилированию существующих лекарств скрининг на основе органоидов также можно использовать для открытия новых мишеней для лекарств. Эти вопросы подробно обсуждаются ниже.
Эти вопросы подробно обсуждаются ниже. ВОСПРОИЗВОДИМОСТЬ В ИССЛЕДОВАНИЯХ ОРГАНОИДОВ
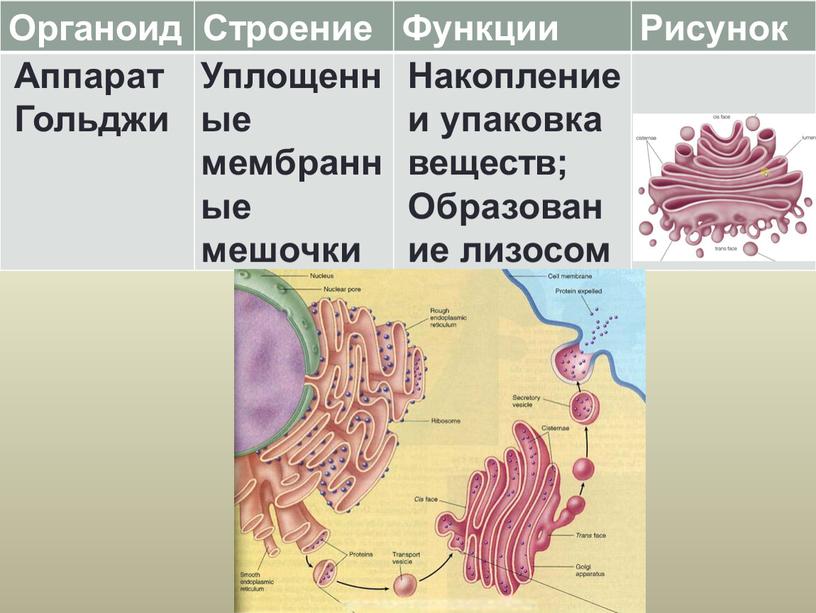 Предполагается, что академические исследователи следуют основным принципам «строгости и воспроизводимости» в своих экспериментах. Эти принципы включают стандартизацию номенклатуры, количество повторов, статистический анализ, рандомизацию, ослепление, оценку размера выборки и прозрачность отчетности.
Предполагается, что академические исследователи следуют основным принципам «строгости и воспроизводимости» в своих экспериментах. Эти принципы включают стандартизацию номенклатуры, количество повторов, статистический анализ, рандомизацию, ослепление, оценку размера выборки и прозрачность отчетности. Генетическая и эпигенетическая изменчивость клеток человека
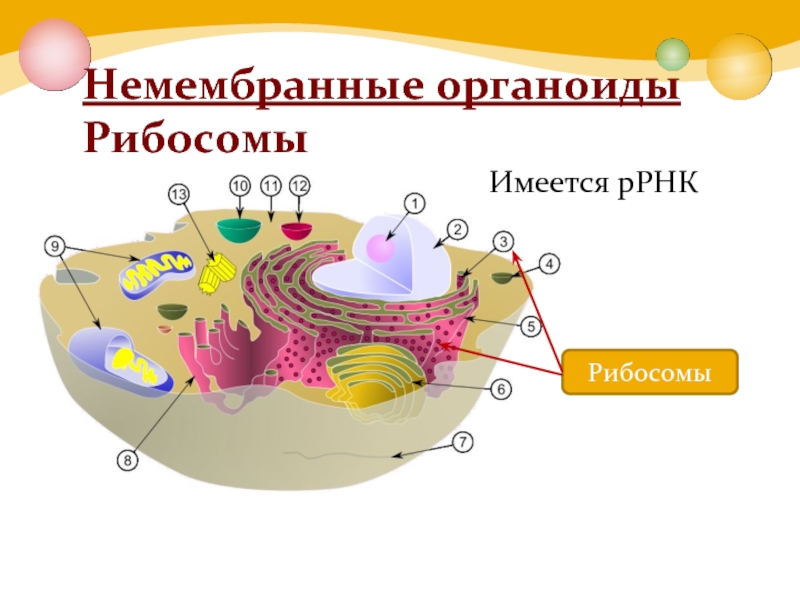 В этих случаях фенотип дифференцированных клеток может зависеть от генетического фона, в котором лежит мутация. Теоретически иПСК, полученные от разных пациентов с одной и той же мутацией, могут по-разному вести себя в органоидных культурах. Следовательно, в исследованиях органоидов следует использовать линии ИПСК, полученные от нескольких пациентов, и, в идеале, исследователи должны быть готовы поделиться этими различными линиями с другими лабораториями, чтобы можно было сравнить результаты.Для заболеваний, при которых известен специфический генетический дефект, могут быть созданы и распространены клеточные системы «модели заболевания», в которых генетический дефект корректируется с помощью CRISPR-Cas9 в клетках пациентов или генетический дефект воссоздается в нормальных контрольных клетках. Исследования, подтверждающие принцип, были предоставлены на клеточных линиях пациентов с мышечной дистрофией и муковисцидозом (Simsek et al. , 2016; Min et al. , 2019).
В этих случаях фенотип дифференцированных клеток может зависеть от генетического фона, в котором лежит мутация. Теоретически иПСК, полученные от разных пациентов с одной и той же мутацией, могут по-разному вести себя в органоидных культурах. Следовательно, в исследованиях органоидов следует использовать линии ИПСК, полученные от нескольких пациентов, и, в идеале, исследователи должны быть готовы поделиться этими различными линиями с другими лабораториями, чтобы можно было сравнить результаты.Для заболеваний, при которых известен специфический генетический дефект, могут быть созданы и распространены клеточные системы «модели заболевания», в которых генетический дефект корректируется с помощью CRISPR-Cas9 в клетках пациентов или генетический дефект воссоздается в нормальных контрольных клетках. Исследования, подтверждающие принцип, были предоставлены на клеточных линиях пациентов с мышечной дистрофией и муковисцидозом (Simsek et al. , 2016; Min et al. , 2019). Выделение стволовых клеток из первичных тканей
 Изменчивость может исходить от методов, используемых для выделения и очистки клеток. Например, клинические образцы могут храниться в течение разного времени, протеазы, используемые для диссоциации ткани, могут различаться по эффективности или условия сортировки клеток могут различаться по-разному (например, размер сопла, давление потока, стробирование и источник антител). к поверхностным маркерам; рассмотрено в Hines et al. [2014]). Поэтому важно, чтобы в протоколы изоляции было включено как можно больше технических деталей.
Изменчивость может исходить от методов, используемых для выделения и очистки клеток. Например, клинические образцы могут храниться в течение разного времени, протеазы, используемые для диссоциации ткани, могут различаться по эффективности или условия сортировки клеток могут различаться по-разному (например, размер сопла, давление потока, стробирование и источник антител). к поверхностным маркерам; рассмотрено в Hines et al. [2014]). Поэтому важно, чтобы в протоколы изоляции было включено как можно больше технических деталей. Условия, при которых поддерживаются клеточные линии или стволовые клетки
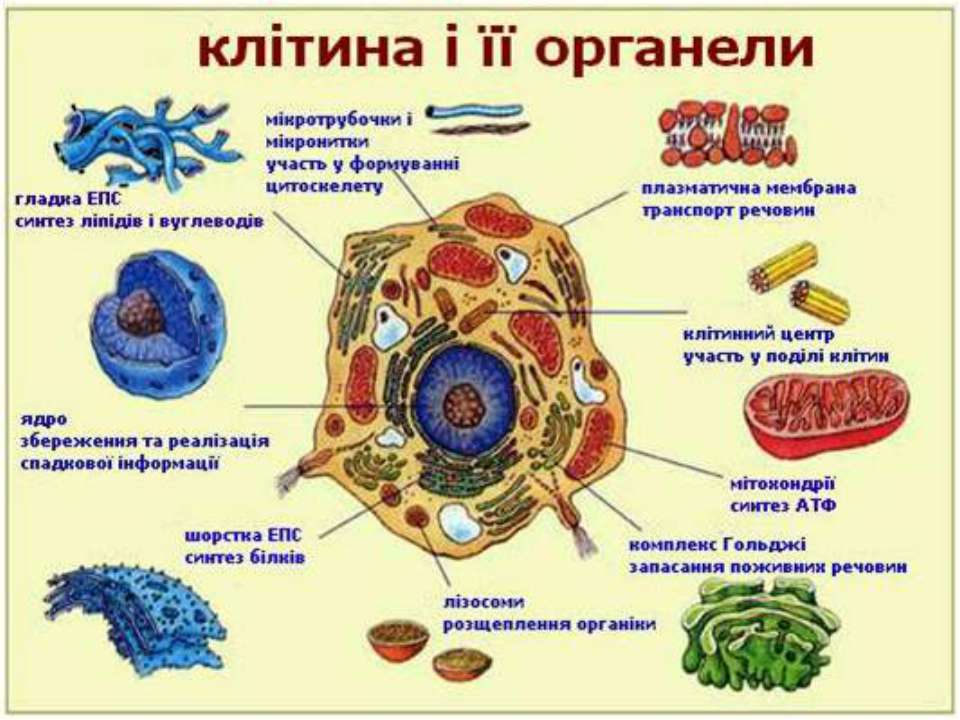 загрязнения и др.Эти потенциальные источники изменчивости описаны в основных руководствах по культуре клеток. Клеточные линии должны быть заморожены в аликвотах, а подробные записи должны содержать количество пассажей и другие переменные.
загрязнения и др.Эти потенциальные источники изменчивости описаны в основных руководствах по культуре клеток. Клеточные линии должны быть заморожены в аликвотах, а подробные записи должны содержать количество пассажей и другие переменные. Проведение анализов органоидов
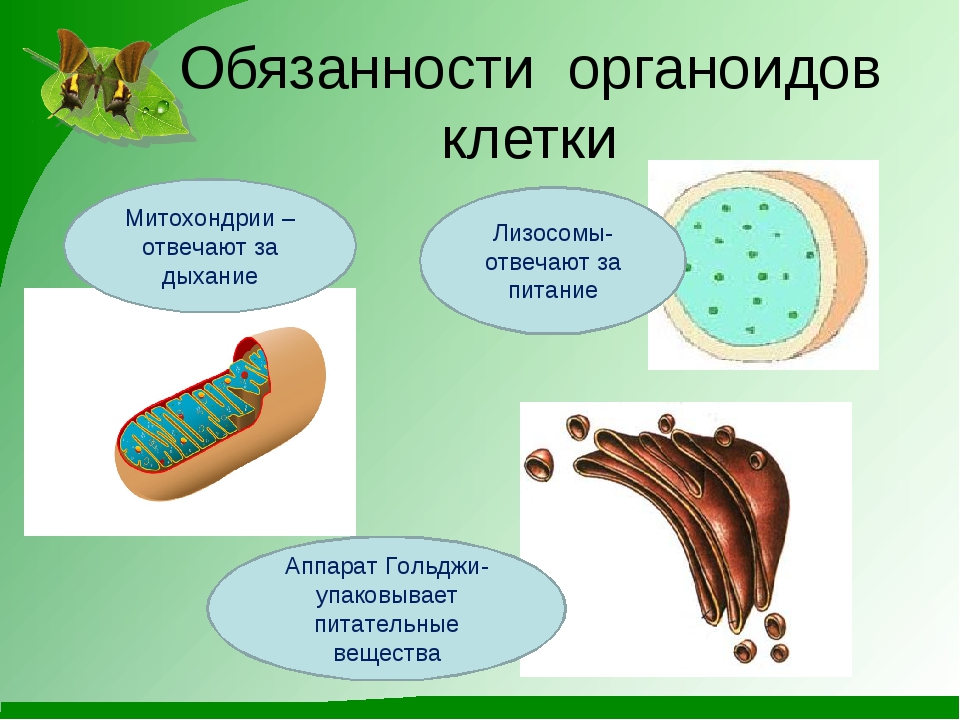 , 2017; McCauley et al., 2018).
, 2017; McCauley et al., 2018). Выводы и рекомендации

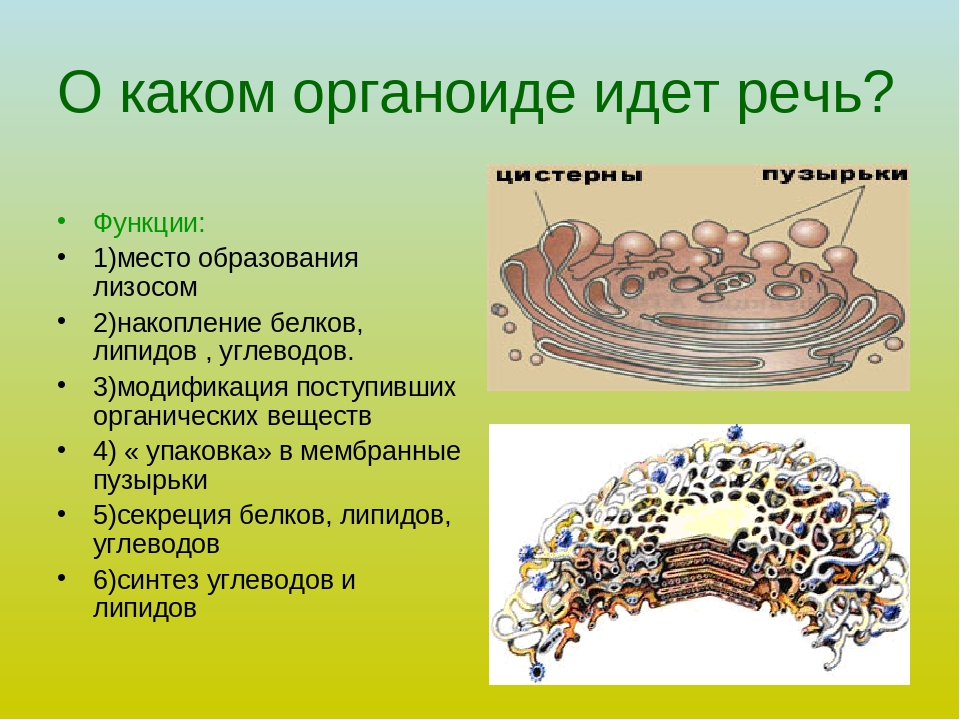 Получение тканей и согласие пациента в исследованиях органоидов и Совместное использование материалов и результатов ниже).
Получение тканей и согласие пациента в исследованиях органоидов и Совместное использование материалов и результатов ниже). ПОИСК ТКАНЕЙ И СОГЛАСИЕ ПАЦИЕНТА НА ОРГАНОИДНЫЕ ИССЛЕДОВАНИЯ
Определение для сбора тканей

Ткань, все еще in situ, взята у живых или неживых людей
 Наконец, из-за религиозных, этнических или национальных обычаев взятие ткани у умершего может считаться правонарушением, а некоторые виды исследований (например, изучение прошлых перемещений населения и моделей расселения) могут представлять культурную или даже политическую проблему.
Наконец, из-за религиозных, этнических или национальных обычаев взятие ткани у умершего может считаться правонарушением, а некоторые виды исследований (например, изучение прошлых перемещений населения и моделей расселения) могут представлять культурную или даже политическую проблему. Ткань ex vivo

Регуляторные советы
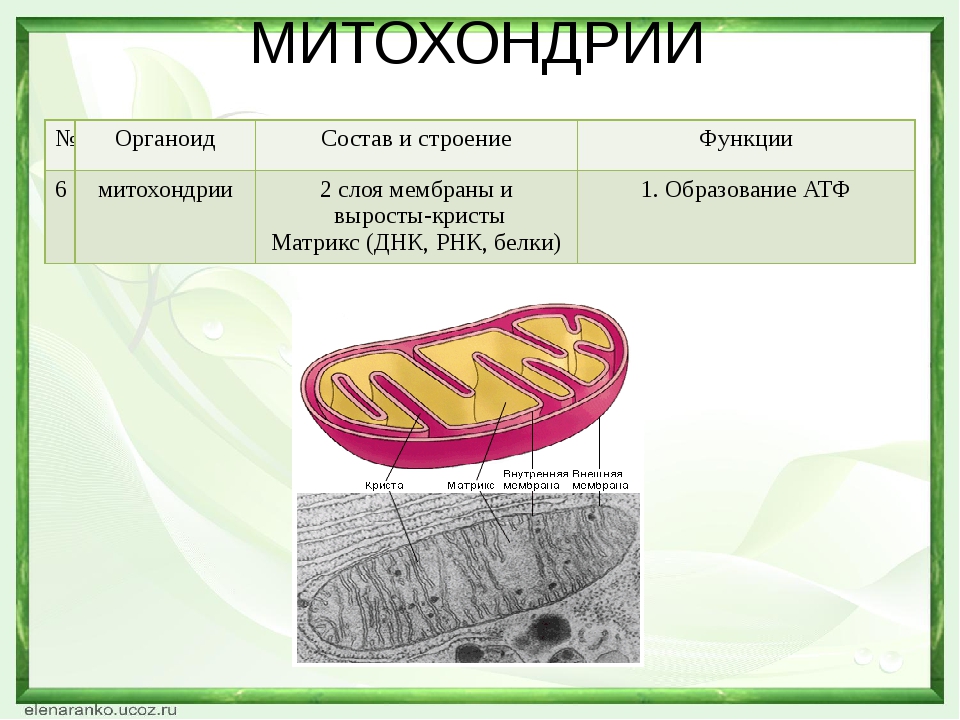 Некоторые исследования органоидов могут быть настолько тревожными для некоторых представителей общественности, что это станет актуальным. По этой причине процесс получения ткани от доноров может потребовать включения информации о диапазоне предполагаемых применений и возможностях будущего использования, которые еще не рассматривались. Например, работа с тканями, полученными из банка тканей, может потребовать внимания к тому, известны ли личности источника/донора и, если да, то можно ли их скрыть. Если нет, то, возможно, потребуется получить согласие, за исключением случаев, когда от согласия можно отказаться на основании исключений для таких ситуаций, как минимальный риск и необоснованные затраты на связь с донором.Для получения дополнительной информации о том, как управлять тканями, полученными до начала исследования ИПСК или органоидов, см. обсуждение в Lomax et al. (2015) .
Некоторые исследования органоидов могут быть настолько тревожными для некоторых представителей общественности, что это станет актуальным. По этой причине процесс получения ткани от доноров может потребовать включения информации о диапазоне предполагаемых применений и возможностях будущего использования, которые еще не рассматривались. Например, работа с тканями, полученными из банка тканей, может потребовать внимания к тому, известны ли личности источника/донора и, если да, то можно ли их скрыть. Если нет, то, возможно, потребуется получить согласие, за исключением случаев, когда от согласия можно отказаться на основании исключений для таких ситуаций, как минимальный риск и необоснованные затраты на связь с донором.Для получения дополнительной информации о том, как управлять тканями, полученными до начала исследования ИПСК или органоидов, см. обсуждение в Lomax et al. (2015) .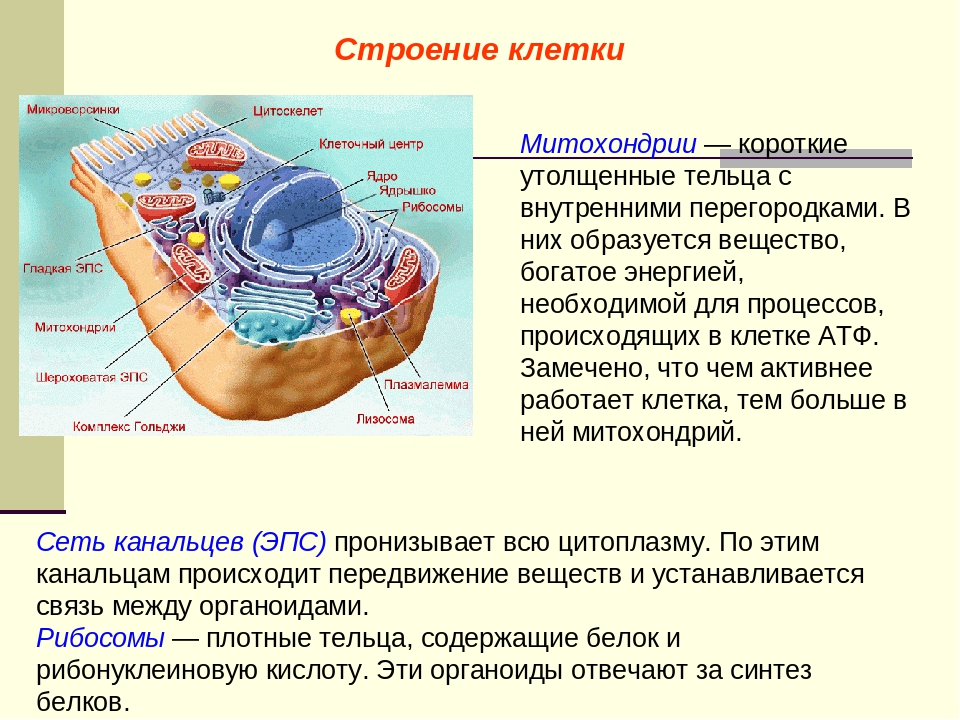 Конкретные исследования человеческих эмбрионов, которые теперь возможны с новыми методами культивирования, могут потребовать дополнительных надзорных комитетов, которые рассматривают, одобряют и контролируют любые исследования, включающие исследования органоидов на раннем этапе развития человека или направленные на получение человеческих гамет с неявной целью изучения оплодотворения или использования в экстракорпоральном оплодотворении. (ЭКО).
Конкретные исследования человеческих эмбрионов, которые теперь возможны с новыми методами культивирования, могут потребовать дополнительных надзорных комитетов, которые рассматривают, одобряют и контролируют любые исследования, включающие исследования органоидов на раннем этапе развития человека или направленные на получение человеческих гамет с неявной целью изучения оплодотворения или использования в экстракорпоральном оплодотворении. (ЭКО). Элементы согласия
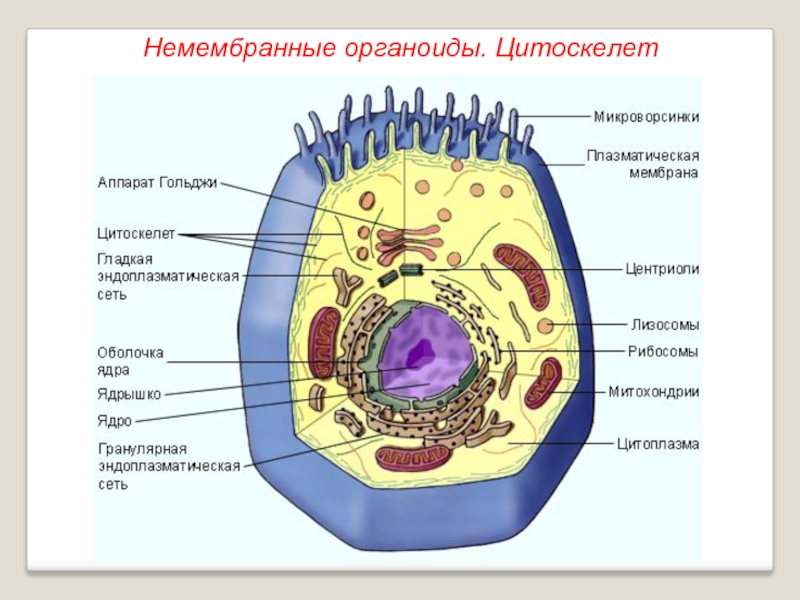
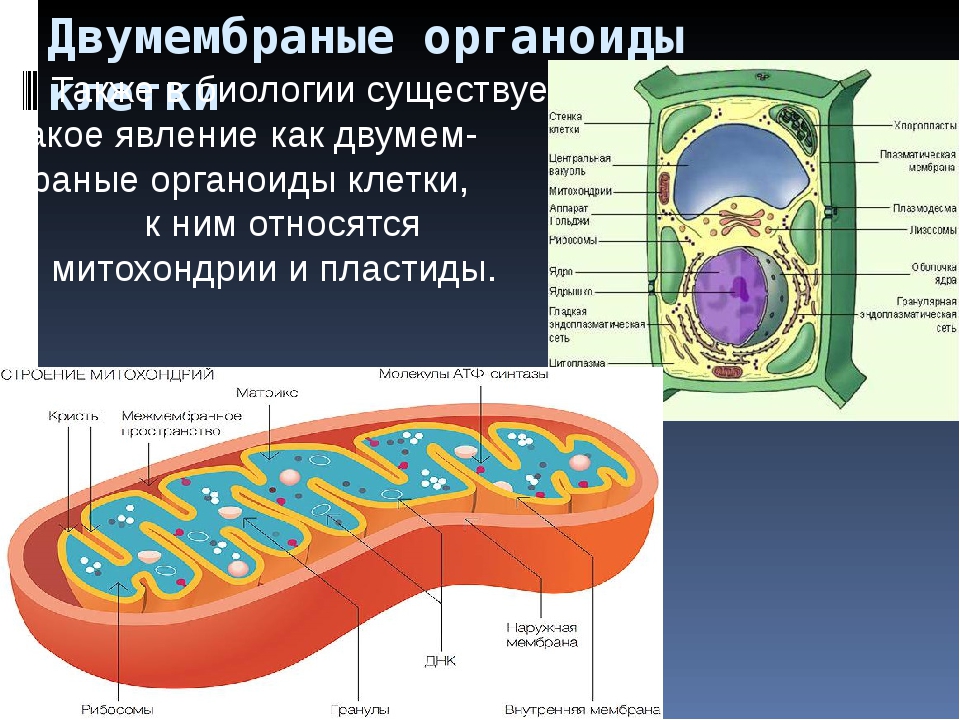 Должно быть предоставлено согласие на отказ, если донор или его родственники прямо соглашаются на использование, или, что более желательно, но менее вероятно, согласие на отказ, когда должны быть указаны исключения.
Должно быть предоставлено согласие на отказ, если донор или его родственники прямо соглашаются на использование, или, что более желательно, но менее вероятно, согласие на отказ, когда должны быть указаны исключения.
Рекомендации для будущего сбора
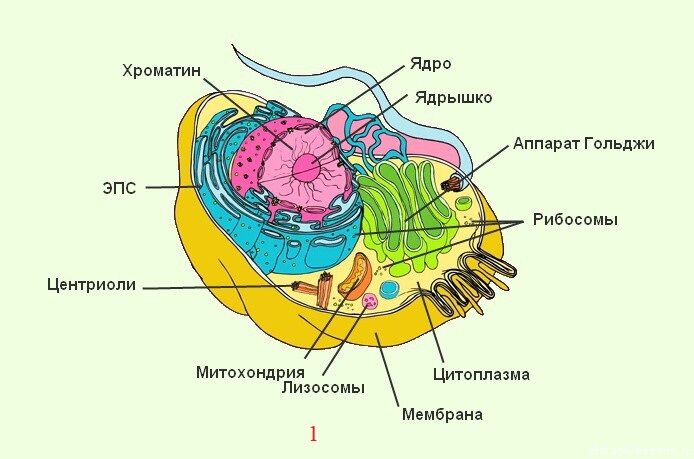
 nih.gov/tools_guid_tool.html)
nih.gov/tools_guid_tool.html) ОБМЕН МАТЕРИАЛАМИ И РЕЗУЛЬТАТАМИ

Руководство по коммуникации и обмену
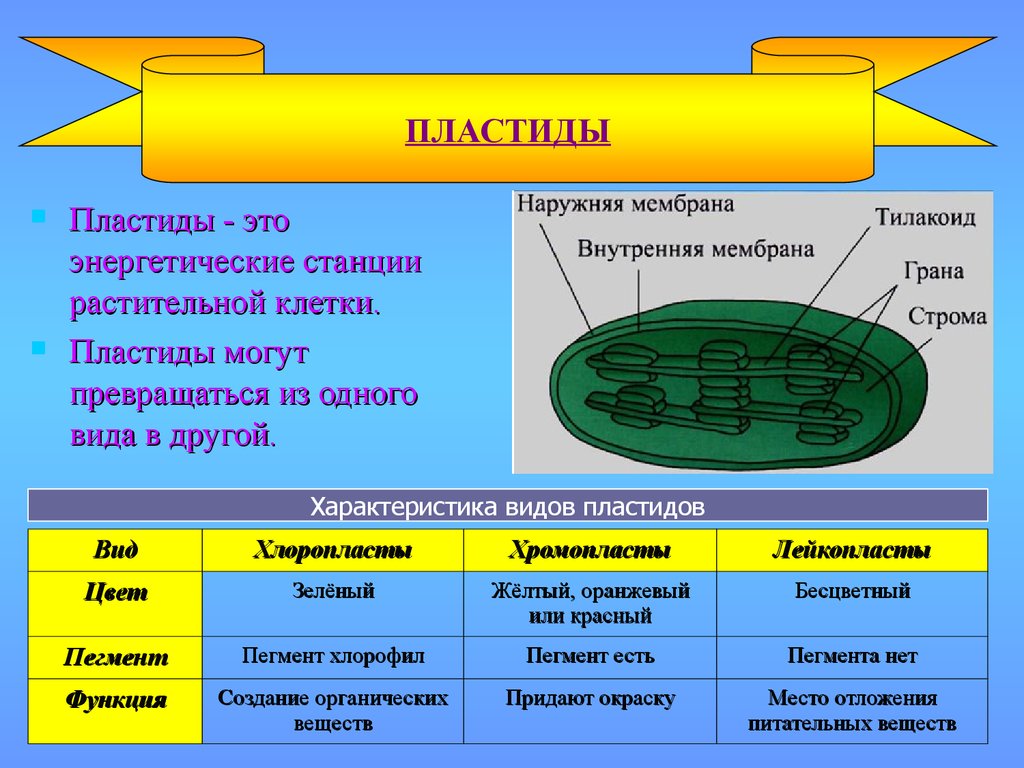
ОБУЧЕНИЕ ОРГАНОИДНЫМ ИССЛЕДОВАНИЯМ
 С такими технологиями «неспособность» воспроизвести предыдущую работу не обязательно означает, что ранее опубликованные исследования были ошибочными; в равной степени вероятно, что «искусство» проведения процедуры не было успешно передано и/или освоено второй группой исследователей.Эта фундаментальная проблема имеет серьезные последствия для любой области, зависящей от сложных экспериментальных протоколов.
С такими технологиями «неспособность» воспроизвести предыдущую работу не обязательно означает, что ранее опубликованные исследования были ошибочными; в равной степени вероятно, что «искусство» проведения процедуры не было успешно передано и/или освоено второй группой исследователей.Эта фундаментальная проблема имеет серьезные последствия для любой области, зависящей от сложных экспериментальных протоколов.
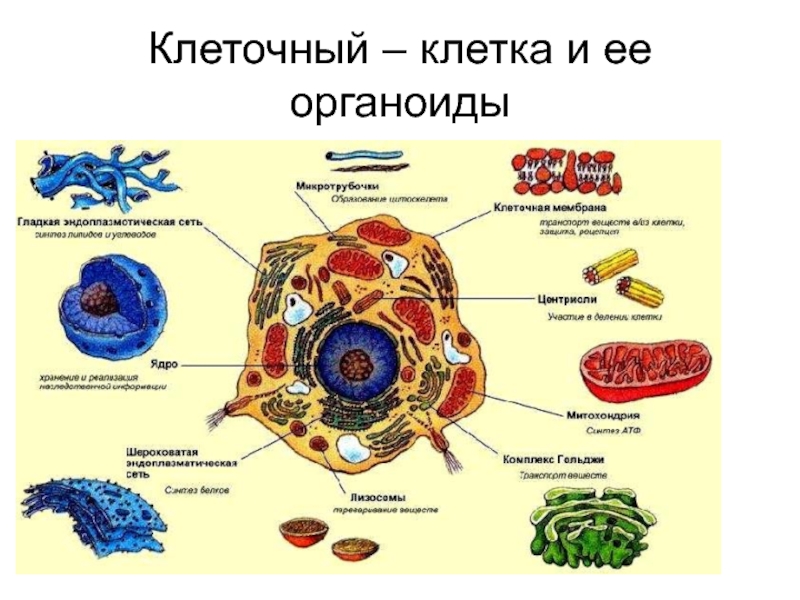 Кроме того, для получения и культивирования органоидов требуется инфраструктура, несколько опытных сотрудников и институциональная поддержка. Эти проблемы затрудняют распространение подробных знаний о культивировании органоидов в новых лабораториях на типичных краткосрочных практических курсах, таких как те, которые в настоящее время используются для обучения экспериментам с модельными организмами.
Кроме того, для получения и культивирования органоидов требуется инфраструктура, несколько опытных сотрудников и институциональная поддержка. Эти проблемы затрудняют распространение подробных знаний о культивировании органоидов в новых лабораториях на типичных краткосрочных практических курсах, таких как те, которые в настоящее время используются для обучения экспериментам с модельными организмами.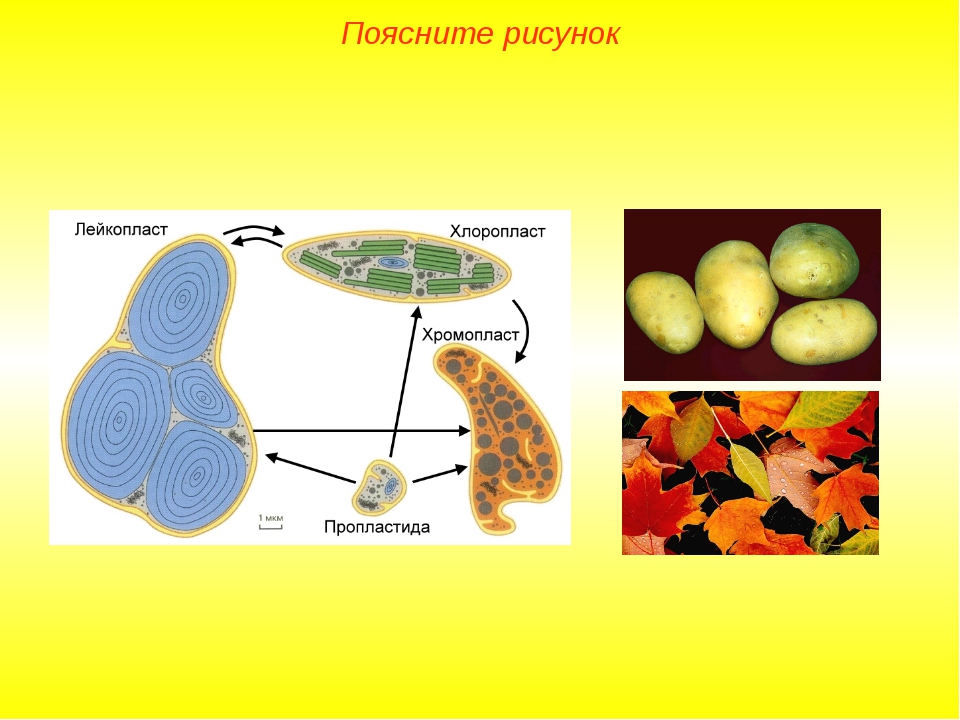 Такие объекты также станут механизмом и средой для обмена знаниями и сотрудничества, объединяя экспертов в области культуры органов, робототехники и инженерии, микроскопии и анализа изображений, криоконсервации и исследований на животных моделях. Примеры совместных средств, стремящихся к клиническому переводу, см. в Takebe et al. (2018 г.) и Ян и др. (2018) .
Такие объекты также станут механизмом и средой для обмена знаниями и сотрудничества, объединяя экспертов в области культуры органов, робототехники и инженерии, микроскопии и анализа изображений, криоконсервации и исследований на животных моделях. Примеры совместных средств, стремящихся к клиническому переводу, см. в Takebe et al. (2018 г.) и Ян и др. (2018) . Выводы и рекомендации
СВЯЗЬ С ОБЩЕСТВЕННОСТЬЮ
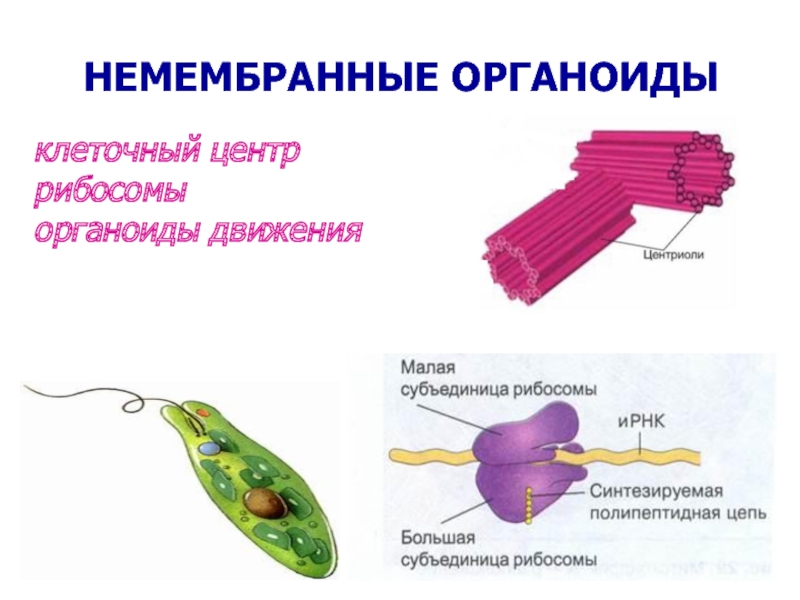 Эти достижения, однако, часто выходили за рамки того, что считается социально приемлемым, и не всегда встречали немедленное общественное признание.
Эти достижения, однако, часто выходили за рамки того, что считается социально приемлемым, и не всегда встречали немедленное общественное признание.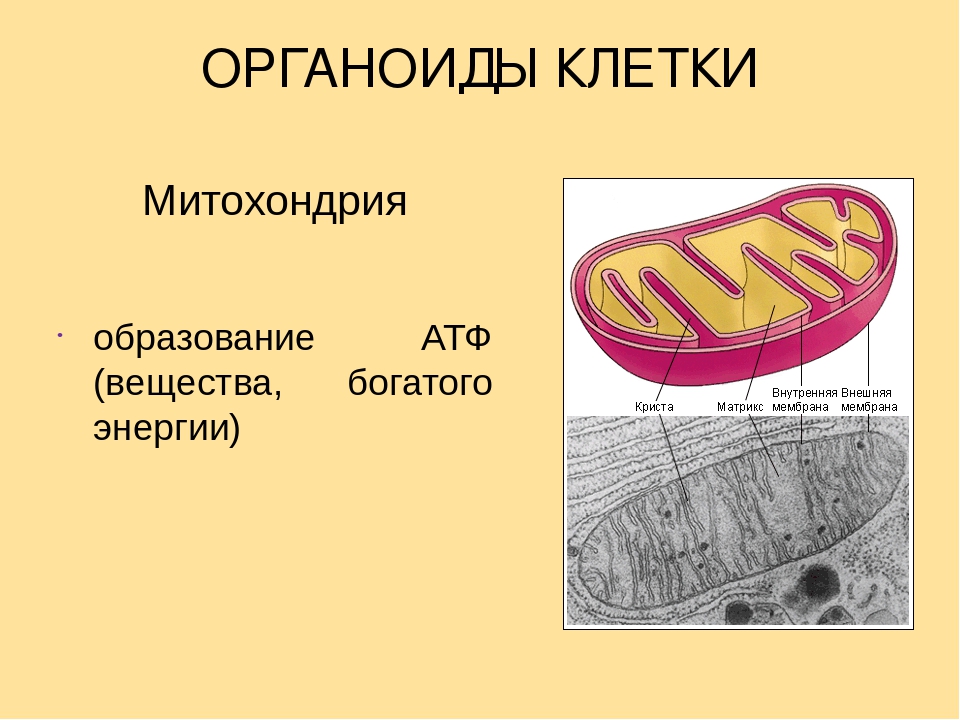
 Публичная аудитория также с большей вероятностью поначалу будет настороженно относиться к новым областям исследований. Американцы стали больше принимать исследования hESC с течением времени, поскольку в период с 2000 по 2013 год продолжались общественные и политические дебаты, потому что у них было время узнать об области исследований и освоиться в ней.Поскольку исследование органоидов является новой областью и предоставляет исследователям новые инструменты для их исследований, они должны поделиться своим волнением по поводу того, как эти инструменты помогут им достичь своих исследовательских целей. Также важно заверить неспециалистов в том, чем органоиды не являются. Например, органоиды мозга — это , а не полных мозга. Они не могут полностью заменить функцию мозга, а поле не воспроизводит сознание в тарелке. То же самое можно сказать и об органоидах других органов тела.Кишечные органоиды не копируют кишечник, а органоиды сетчатки не являются глазами и не обладают зрением. Одной лекцией поддержки не добиться.
Публичная аудитория также с большей вероятностью поначалу будет настороженно относиться к новым областям исследований. Американцы стали больше принимать исследования hESC с течением времени, поскольку в период с 2000 по 2013 год продолжались общественные и политические дебаты, потому что у них было время узнать об области исследований и освоиться в ней.Поскольку исследование органоидов является новой областью и предоставляет исследователям новые инструменты для их исследований, они должны поделиться своим волнением по поводу того, как эти инструменты помогут им достичь своих исследовательских целей. Также важно заверить неспециалистов в том, чем органоиды не являются. Например, органоиды мозга — это , а не полных мозга. Они не могут полностью заменить функцию мозга, а поле не воспроизводит сознание в тарелке. То же самое можно сказать и об органоидах других органов тела.Кишечные органоиды не копируют кишечник, а органоиды сетчатки не являются глазами и не обладают зрением. Одной лекцией поддержки не добиться. Как и в других областях исследований, широкой общественности потребуется время, чтобы адаптироваться, и научное сообщество должно будет приложить постоянные усилия в области образования и диалога, особенно по мере дальнейшего прогресса.
Как и в других областях исследований, широкой общественности потребуется время, чтобы адаптироваться, и научное сообщество должно будет приложить постоянные усилия в области образования и диалога, особенно по мере дальнейшего прогресса. Слишком многие ученые не могут описать свои исследования в самых общих чертах, не говоря уже о том, чтобы продемонстрировать опыт работы с журналистами или обучение работе со СМИ. Такие общества, как ASCB, или институциональные отделы общественной информации и связи, желают и должны консультироваться.
Слишком многие ученые не могут описать свои исследования в самых общих чертах, не говоря уже о том, чтобы продемонстрировать опыт работы с журналистами или обучение работе со СМИ. Такие общества, как ASCB, или институциональные отделы общественной информации и связи, желают и должны консультироваться.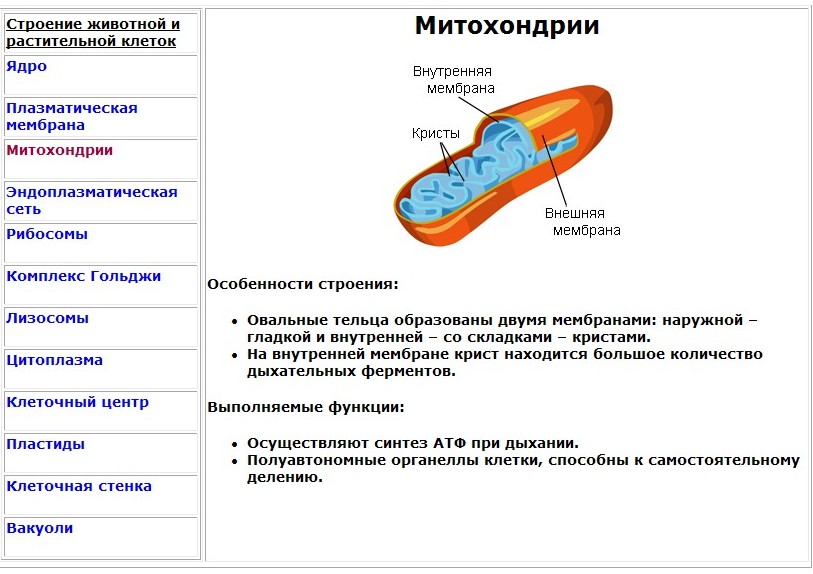 Какой опыт они получили в аналогичных областях передовой науки? Какие предложения у них есть для вас, основанные на этом опыте?
Какой опыт они получили в аналогичных областях передовой науки? Какие предложения у них есть для вас, основанные на этом опыте? Сокращения, используемые:
ESC эмбриональных стволовых клеток GUID глобальные уникальные идентификаторы чЭСК человеческих эмбриональных стволовых клеток hIPSC человек индуцированных плюрипотентных стволовых клетка МКПС индуцированных плюрипотентных стволовых клеток ЭСО институциональной обзор платы IVF экстракорпоральное оплодотворение МТА перенос материала соглашение ККП плюрипотентных стволовая клетка. ССЫЛКИ
 М., Рамирес Р.Н., Мартинес Э.С., Хили Л.М., Нгуен Ч.Х., Ньюман С.А., Еромин А.В., Скарфон В.М., Марш С.Е., Фимбрес С., и др. (2017). Микроглиоподобные клетки человека, полученные из иПСК, для изучения неврологических заболеваний. Нейрон , 278–293.e279. [Бесплатная статья PMC] [PubMed] [Google Scholar]
М., Рамирес Р.Н., Мартинес Э.С., Хили Л.М., Нгуен Ч.Х., Ньюман С.А., Еромин А.В., Скарфон В.М., Марш С.Е., Фимбрес С., и др. (2017). Микроглиоподобные клетки человека, полученные из иПСК, для изучения неврологических заболеваний. Нейрон , 278–293.e279. [Бесплатная статья PMC] [PubMed] [Google Scholar] (2018). Коррекция генов устраняет цилиопатию и потерю фоторецепторов в органоидах сетчатки, полученных из иПСК, у пациентов с пигментным ретинитом. Rep стволовых клеток, 1267–1281. [Бесплатная статья PMC] [PubMed] [Google Scholar]
(2018). Коррекция генов устраняет цилиопатию и потерю фоторецепторов в органоидах сетчатки, полученных из иПСК, у пациентов с пигментным ретинитом. Rep стволовых клеток, 1267–1281. [Бесплатная статья PMC] [PubMed] [Google Scholar]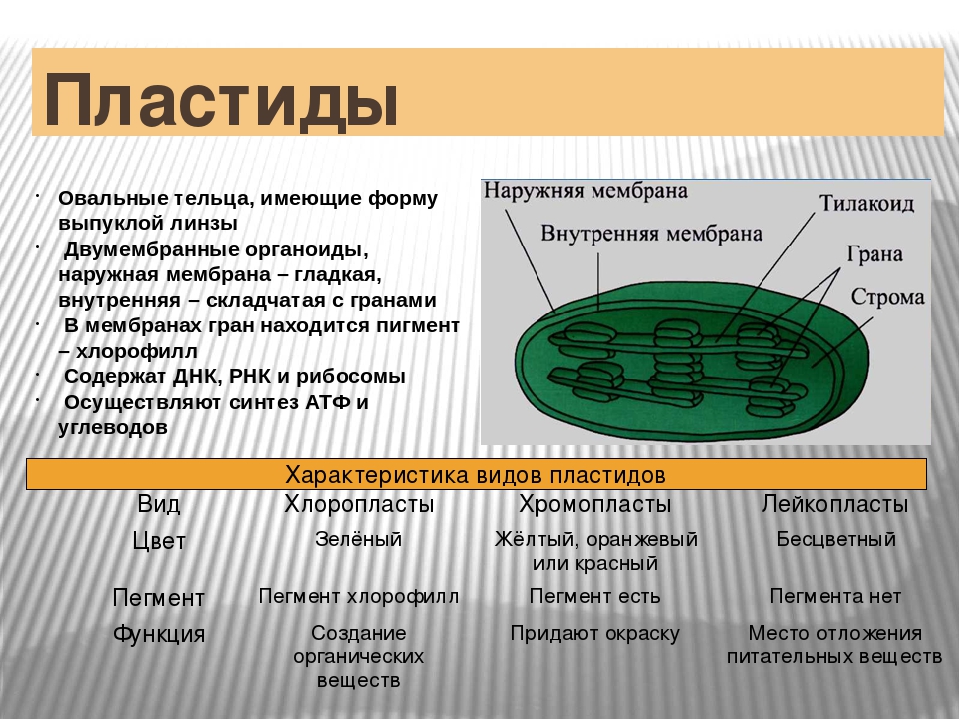 Proc Natl Acad Sci USA , E2357–E2364.[Бесплатная статья PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci USA , E2357–E2364.[Бесплатная статья PMC] [PubMed] [Google Scholar] (2017). Надежда и ажиотаж исследований органоидов. Разработка , 938–941. [PubMed] [Google Scholar]
(2017). Надежда и ажиотаж исследований органоидов. Разработка , 938–941. [PubMed] [Google Scholar] (2015). Проект DISCUSS: пересмотренные пункты, которые следует учитывать при получении линий индуцированных плюрипотентных стволовых клеток из ранее собранных исследовательских образцов. Стволовые клетки Transl Med , 123–129. [Бесплатная статья PMC] [PubMed] [Google Scholar]
(2015). Проект DISCUSS: пересмотренные пункты, которые следует учитывать при получении линий индуцированных плюрипотентных стволовых клеток из ранее собранных исследовательских образцов. Стволовые клетки Transl Med , 123–129. [Бесплатная статья PMC] [PubMed] [Google Scholar]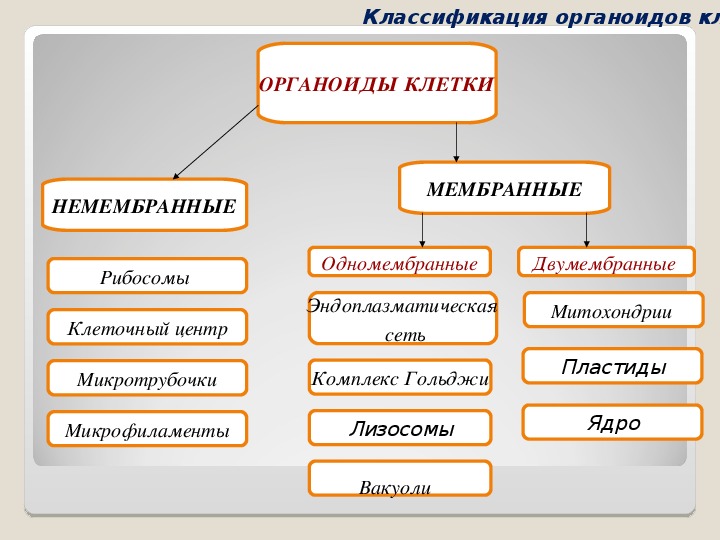 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]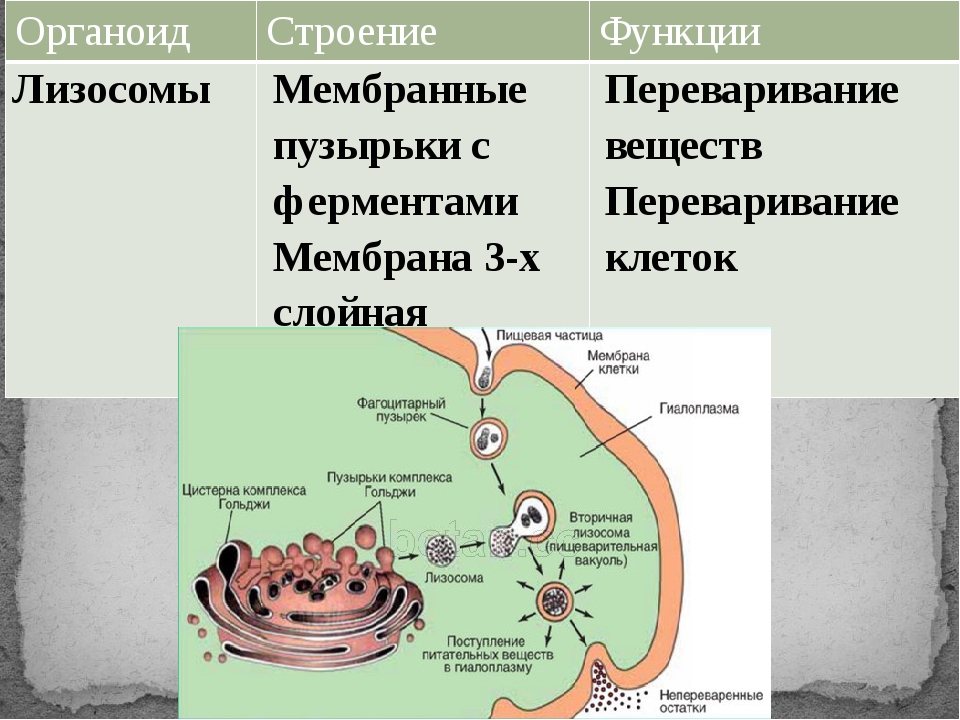 (2017). Генерация желудочно-кишечных органоидов из плюрипотентных стволовых клеток человека. Методы Mol Biol , 167–177. [PubMed] [Google Scholar]
(2017). Генерация желудочно-кишечных органоидов из плюрипотентных стволовых клеток человека. Методы Mol Biol , 167–177. [PubMed] [Google Scholar]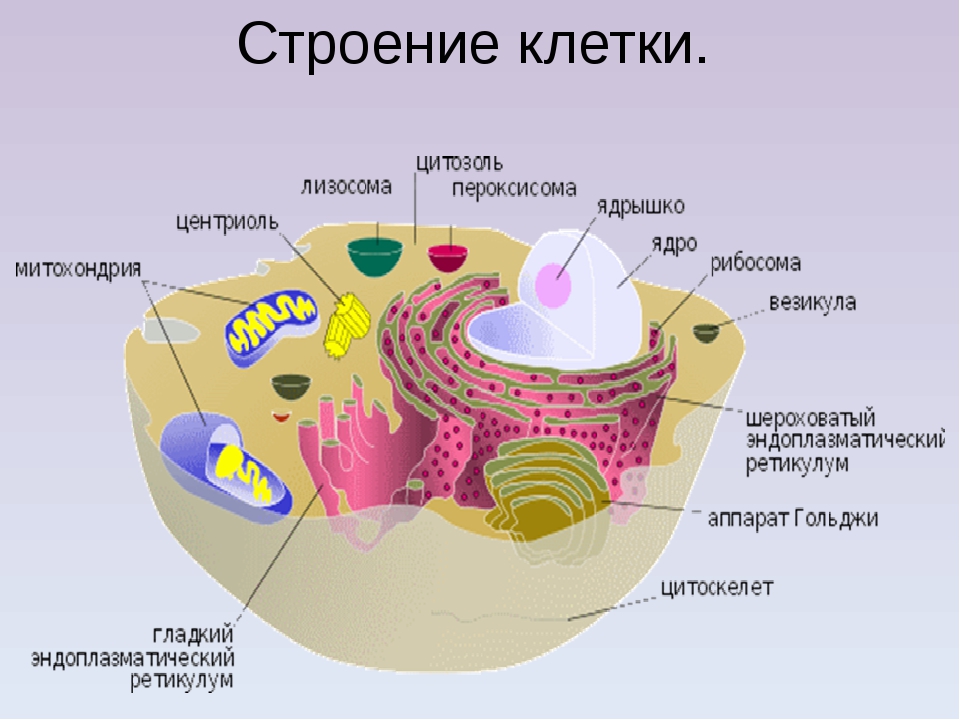 e310.[PubMed] [Google Scholar]
e310.[PubMed] [Google Scholar] Стволовая клетка , 806–809. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Стволовая клетка , 806–809. [Бесплатная статья PMC] [PubMed] [Google Scholar]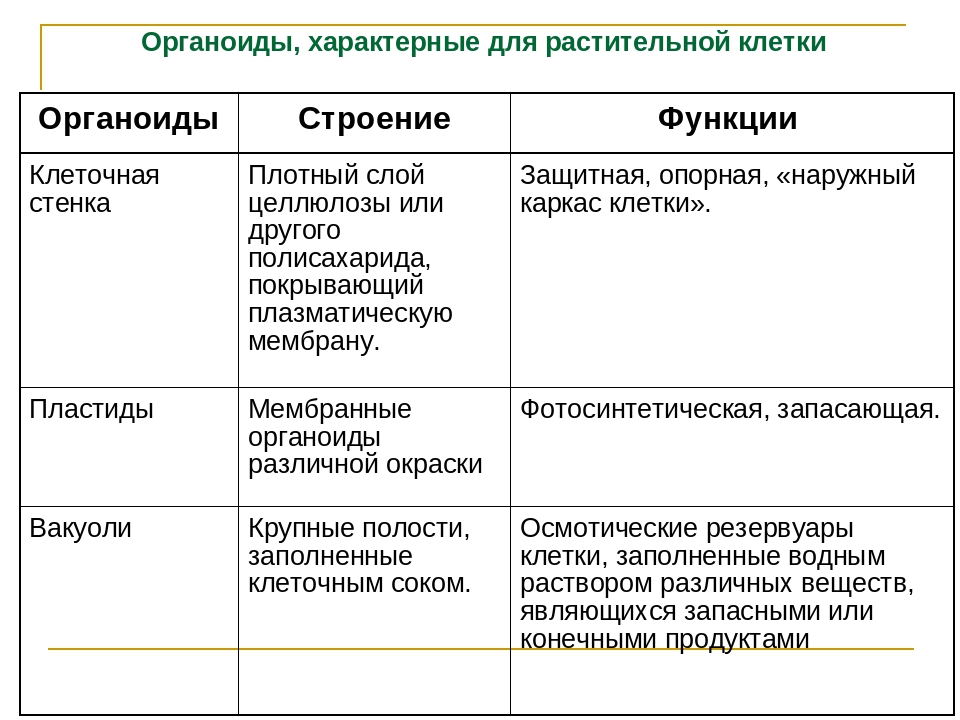 Стволовая клетка , 274–283.e275. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Стволовая клетка , 274–283.e275. [Бесплатная статья PMC] [PubMed] [Google Scholar] новое измерение в клеточной биологии
Рут Леманн
Конни М.Lee
Erika C. Shugart
Marta Benedetti
R. Alta Charo
Zev Gartner
Бриджит Хоган
Юрген Кноблих
Селеста М.
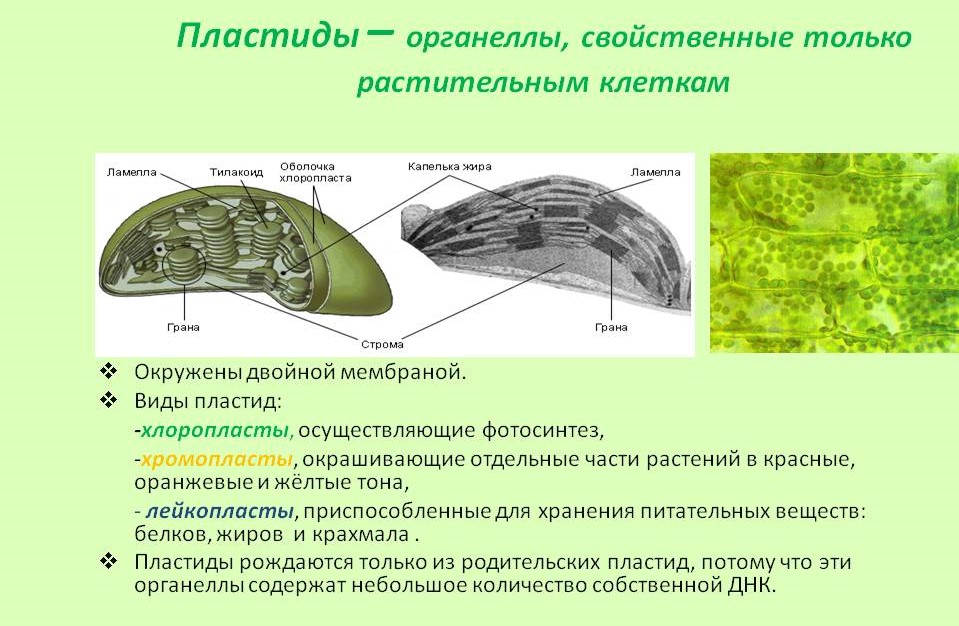 Nelson
Nelson Кевин М. Уилсон
 ; Принято 7 марта 2019 г.
; Принято 7 марта 2019 г. Abstract
 Биологов привлекает эта система как новый «модельный организм» для изучения сложных фенотипов заболеваний и генетической изменчивости среди людей с использованием тканей, полученных от пациентов. Американское общество клеточной биологии созвало целевую группу, чтобы сообщить о потенциале, проблемах и ограничениях исследований органов человека. Целевая группа предлагает способы облегчить вход новых исследователей в эту область и как способствовать более широкому использованию этого нового модельного организма в исследовательском сообществе. Это включает в себя рекомендации по воспроизводимости, культивированию, обмену материалами пациентов, согласию пациентов, обучению и общению с общественностью.
Биологов привлекает эта система как новый «модельный организм» для изучения сложных фенотипов заболеваний и генетической изменчивости среди людей с использованием тканей, полученных от пациентов. Американское общество клеточной биологии созвало целевую группу, чтобы сообщить о потенциале, проблемах и ограничениях исследований органов человека. Целевая группа предлагает способы облегчить вход новых исследователей в эту область и как способствовать более широкому использованию этого нового модельного организма в исследовательском сообществе. Это включает в себя рекомендации по воспроизводимости, культивированию, обмену материалами пациентов, согласию пациентов, обучению и общению с общественностью. РЕЗЮМЕ
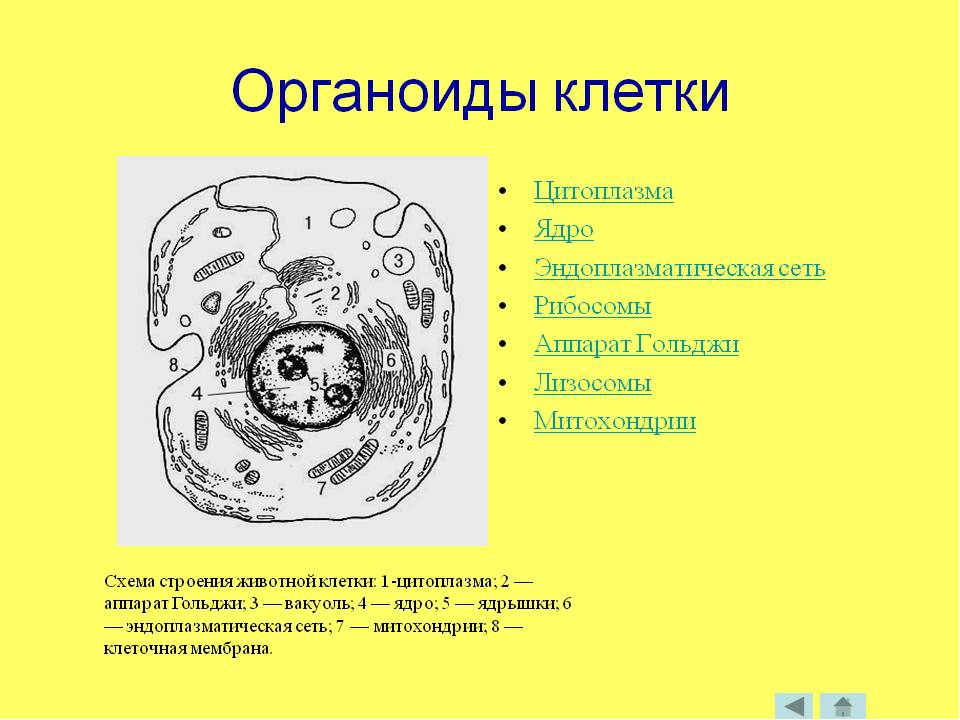 Органоиды происходят из возобновляемых источников тканей, которые самоорганизуются в культуре, приобретая in vivo подобную органу сложность. Органоиды могут быть получены из источников клеток человека, включая взрослые тканеспецифические стволовые клетки, эмбриональные стволовые клетки (hESC) и индуцированные плюрипотентные стволовые клетки (hIPSC). Таким образом, у них есть потенциал преодолеть ряд прежних ограничений в биомедицинских исследованиях, направленных на получение механистического понимания развития человека, создание точных моделей заболеваний человека и создание источников тканей, соответствующих пациентам, для регенеративной медицины.
Органоиды происходят из возобновляемых источников тканей, которые самоорганизуются в культуре, приобретая in vivo подобную органу сложность. Органоиды могут быть получены из источников клеток человека, включая взрослые тканеспецифические стволовые клетки, эмбриональные стволовые клетки (hESC) и индуцированные плюрипотентные стволовые клетки (hIPSC). Таким образом, у них есть потенциал преодолеть ряд прежних ограничений в биомедицинских исследованиях, направленных на получение механистического понимания развития человека, создание точных моделей заболеваний человека и создание источников тканей, соответствующих пациентам, для регенеративной медицины. Обсуждение рабочей группой, а также результаты опроса, разосланного членам ASCB, подтверждают огромный потенциал этих новых «модельных систем», а также демонстрируют вызовы для науки и общества, связанные с этой возможностью. Состав рабочей группы см. в дополнительной информации 1; сводку результатов опроса см. в дополнительной информации 2.
Обсуждение рабочей группой, а также результаты опроса, разосланного членам ASCB, подтверждают огромный потенциал этих новых «модельных систем», а также демонстрируют вызовы для науки и общества, связанные с этой возможностью. Состав рабочей группы см. в дополнительной информации 1; сводку результатов опроса см. в дополнительной информации 2. Возможности

Задачи и рекомендации

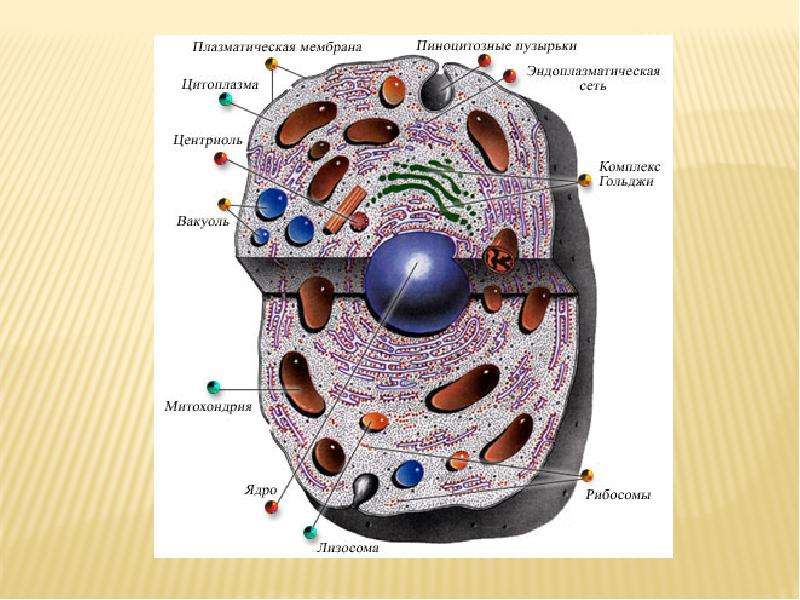
ПРЕДПОСЫЛКИ: БИОЛОГИЯ И ПРОИЗВОДСТВО ОРГАНОИДОВ
Определение органоидов
 Эти модели могут использоваться несколькими лабораториями, ими легко манипулировать, визуализировать и подвергать биомолекулярному анализу без мешающей сложности, связанной с исследованиями in vivo. При выращивании из клеток человека они облегчают переход от животных моделей к биологии человека с приемлемыми этическими ограничениями.
Эти модели могут использоваться несколькими лабораториями, ими легко манипулировать, визуализировать и подвергать биомолекулярному анализу без мешающей сложности, связанной с исследованиями in vivo. При выращивании из клеток человека они облегчают переход от животных моделей к биологии человека с приемлемыми этическими ограничениями. Краткая история
 в Harrison, 1906, и Simian and Bissell, 2017). Нынешний бум исследований органоидов является результатом возможности выращивать органоиды из клеток или тканей, полученных от людей, что раскрывает их огромный потенциал для биологии человека и медицинских исследований (Dekkers et al. , 2013; Lancaster et al. , 2013). . Для целей этого отчета мы сосредоточимся в первую очередь на возможностях и проблемах, связанных с человеческими органоидами, а не на органоидах, полученных из клеток и тканей животных.
в Harrison, 1906, и Simian and Bissell, 2017). Нынешний бум исследований органоидов является результатом возможности выращивать органоиды из клеток или тканей, полученных от людей, что раскрывает их огромный потенциал для биологии человека и медицинских исследований (Dekkers et al. , 2013; Lancaster et al. , 2013). . Для целей этого отчета мы сосредоточимся в первую очередь на возможностях и проблемах, связанных с человеческими органоидами, а не на органоидах, полученных из клеток и тканей животных. Человеческие органоиды как новый модельный организм для исследований
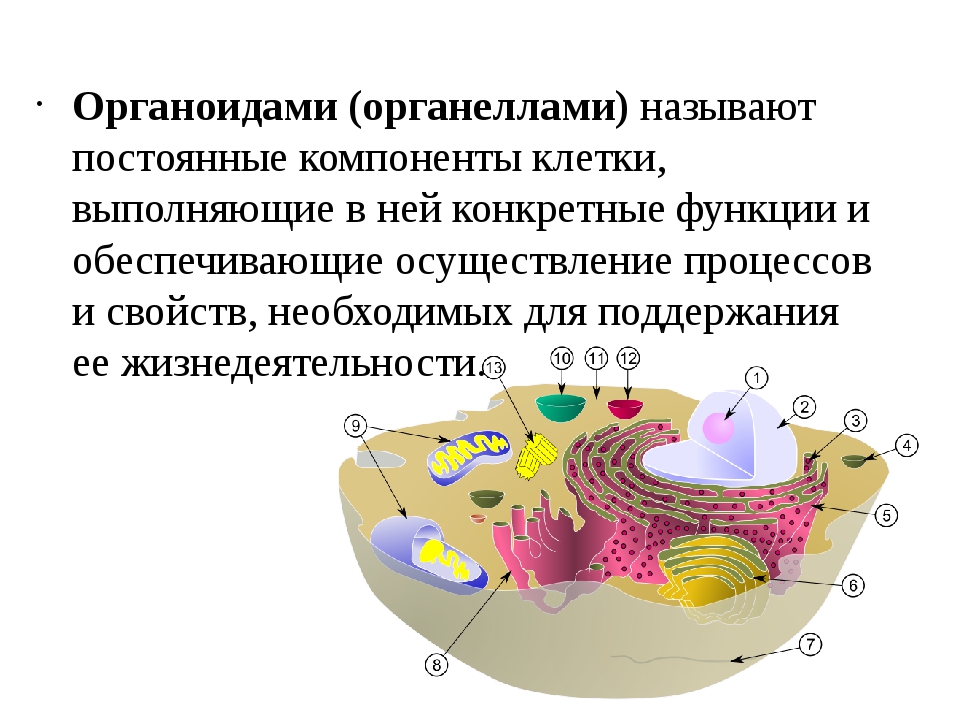 Действительно, это отсутствие модельных систем человека, возможно, способствовало низкому показателю успеха в клинических испытаниях фармацевтических соединений, разработанных на животных моделях.
Действительно, это отсутствие модельных систем человека, возможно, способствовало низкому показателю успеха в клинических испытаниях фармацевтических соединений, разработанных на животных моделях.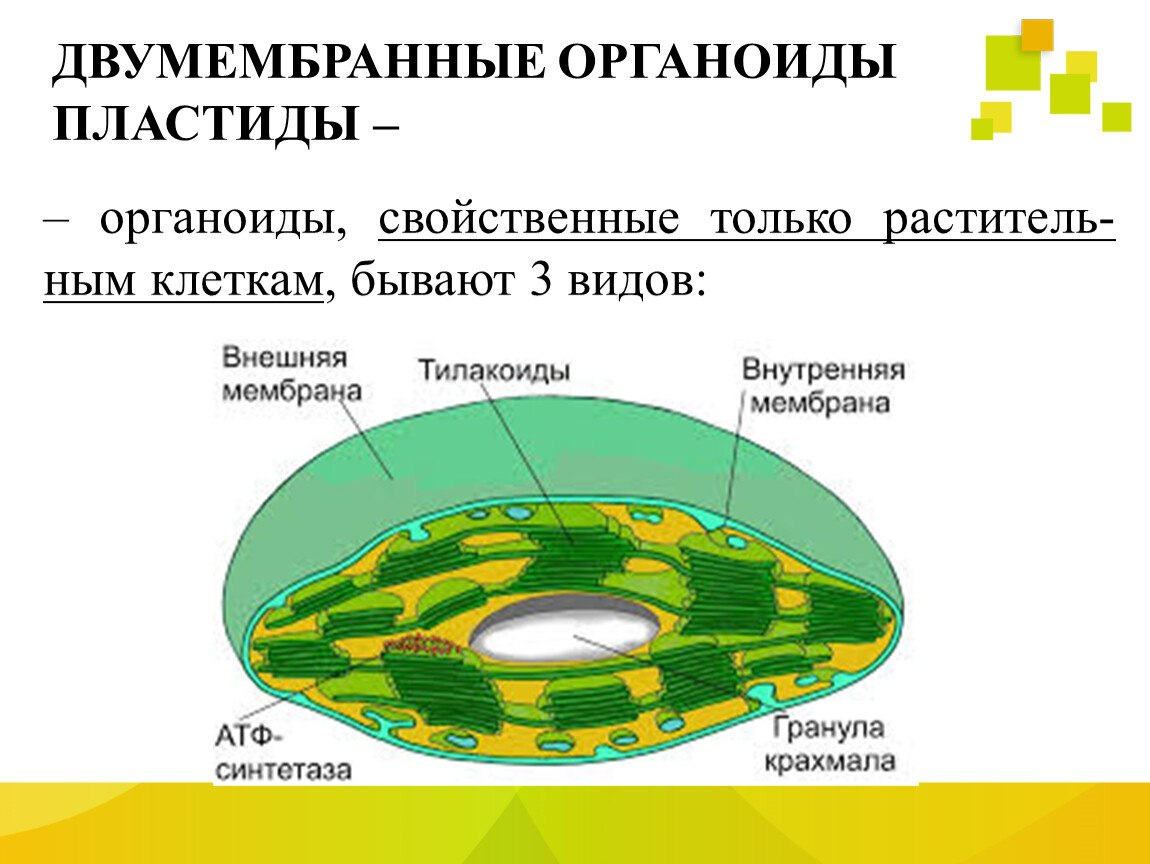 Следовательно, хотя органоиды могут рассказать нам о специфических для человека аспектах развития органов и физиологии, в настоящее время они менее полезны для раскрытия аспектов биологии, которые зависят от интегрированных физиологических систем и сложного взаимодействия систем органов человека.Какие бы результаты мы ни нашли в органоидах, они будут полезны только в сравнении с фоном знаний, определенным в других модельных системах. В этом смысле органоиды сами по себе являются новой модельной системой, которая дополняет, а не превосходит существующие модели животных.
Следовательно, хотя органоиды могут рассказать нам о специфических для человека аспектах развития органов и физиологии, в настоящее время они менее полезны для раскрытия аспектов биологии, которые зависят от интегрированных физиологических систем и сложного взаимодействия систем органов человека.Какие бы результаты мы ни нашли в органоидах, они будут полезны только в сравнении с фоном знаний, определенным в других модельных системах. В этом смысле органоиды сами по себе являются новой модельной системой, которая дополняет, а не превосходит существующие модели животных. В качестве альтернативы органоиды могут быть получены из PSC, включая ESC или индуцированных плюрипотентных стволовых клеток (iPSC). Это достигается путем культивирования их в определенной серии коктейлей факторов роста или сред, которые индуцируют органоспецифические клеточные судьбы в последовательности, имитирующей нормальное развитие. Окончательный конгломерат органоспецифических типов клеток может располагаться таким же образом, как и в реальном органе, что позволяет анализировать морфогенетические и физиологические процессы «в чашке».
В качестве альтернативы органоиды могут быть получены из PSC, включая ESC или индуцированных плюрипотентных стволовых клеток (iPSC). Это достигается путем культивирования их в определенной серии коктейлей факторов роста или сред, которые индуцируют органоспецифические клеточные судьбы в последовательности, имитирующей нормальное развитие. Окончательный конгломерат органоспецифических типов клеток может располагаться таким же образом, как и в реальном органе, что позволяет анализировать морфогенетические и физиологические процессы «в чашке». В этом отчете мы излагаем возможности для исследования органоидов, рассматриваем проблемы и даем рекомендации по использованию человеческих органоидов для добавления в репертуар «модельного организма».
В этом отчете мы излагаем возможности для исследования органоидов, рассматриваем проблемы и даем рекомендации по использованию человеческих органоидов для добавления в репертуар «модельного организма». ПРИМЕНЕНИЕ ДЛЯ ИССЛЕДОВАНИЙ ОРГАНОИДОВ
Биология развития человека
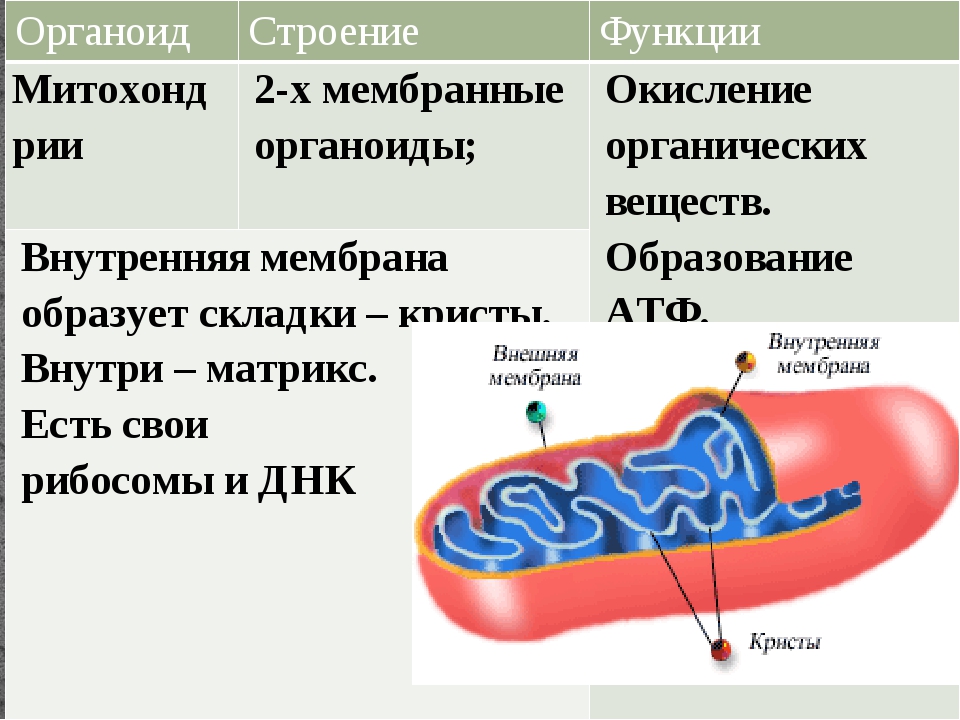 , 2017). Однако появление множества моделей органоидов, полученных из ИПСК, открыло путь к динамическому наблюдению и механистическим исследованиям человеческого развития.
, 2017). Однако появление множества моделей органоидов, полученных из ИПСК, открыло путь к динамическому наблюдению и механистическим исследованиям человеческого развития.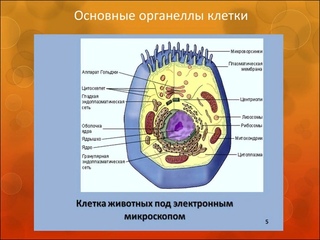 Прогресс в этой области значительно ускорился в последние годы, даже вопреки правилу, которое ограничивает культивирование человеческих эмбрионов сроком более 14 дней, стадии, когда мезодермальные клетки обычно образуются в примитивной полоске (Hyun et al., 2016). Эти исследования выявили различия между самыми ранними стадиями развития человека и модельных организмов, таких как мыши, например, в установлении эмбриональных осей и спецификации первичных зародышевых клеток (Irie et al. , 2015; Kobayashi and Surani, 2018; Мартин и др. , 2018). Они предлагают возможность дальнейшего понимания раннего развития человека, позволяют проводить эволюционные исследования видовой специфичности событий раннего развития и создают новую модельную систему, имеющую отношение к основным причинам ранней потери беременности у человека.
Прогресс в этой области значительно ускорился в последние годы, даже вопреки правилу, которое ограничивает культивирование человеческих эмбрионов сроком более 14 дней, стадии, когда мезодермальные клетки обычно образуются в примитивной полоске (Hyun et al., 2016). Эти исследования выявили различия между самыми ранними стадиями развития человека и модельных организмов, таких как мыши, например, в установлении эмбриональных осей и спецификации первичных зародышевых клеток (Irie et al. , 2015; Kobayashi and Surani, 2018; Мартин и др. , 2018). Они предлагают возможность дальнейшего понимания раннего развития человека, позволяют проводить эволюционные исследования видовой специфичности событий раннего развития и создают новую модельную систему, имеющую отношение к основным причинам ранней потери беременности у человека. Моделирование болезней человека
 Клеточная организация органоидов может быть изучена на системном уровне благодаря достижениям в области функциональной геномики и протеомики, включая анализ отдельных клеток и высокопроизводительную транскриптомику, протеомику и крупномасштабную характеристику доменов хроматина и регуляторных элементов транскрипции.Этот уровень детального анализа трудно достичь с тканью человека, взятой на месте, и он обеспечит более полное понимание развития и клеточного состава органоидов. Более того, эта информация повысит их актуальность в качестве моделей для изучения морфологии, функций и заболеваний органов и откроет новые возможности в разработке лекарств и регенеративной медицине. Например, клеточное разнообразие развивающихся органоидов головного мозга было использовано для моделирования генетической микроцефалии (Lancaster et al., 2013), чтобы определить потенциальные механизмы, с помощью которых вирус Зика приводит к микроцефалии (Dang et al. , 2016; Garcez et al. , 2016), а органоиды толстой кишки использовались для изучения мутационных стадий, лежащих в основе опухоли.
Клеточная организация органоидов может быть изучена на системном уровне благодаря достижениям в области функциональной геномики и протеомики, включая анализ отдельных клеток и высокопроизводительную транскриптомику, протеомику и крупномасштабную характеристику доменов хроматина и регуляторных элементов транскрипции.Этот уровень детального анализа трудно достичь с тканью человека, взятой на месте, и он обеспечит более полное понимание развития и клеточного состава органоидов. Более того, эта информация повысит их актуальность в качестве моделей для изучения морфологии, функций и заболеваний органов и откроет новые возможности в разработке лекарств и регенеративной медицине. Например, клеточное разнообразие развивающихся органоидов головного мозга было использовано для моделирования генетической микроцефалии (Lancaster et al., 2013), чтобы определить потенциальные механизмы, с помощью которых вирус Зика приводит к микроцефалии (Dang et al. , 2016; Garcez et al. , 2016), а органоиды толстой кишки использовались для изучения мутационных стадий, лежащих в основе опухоли.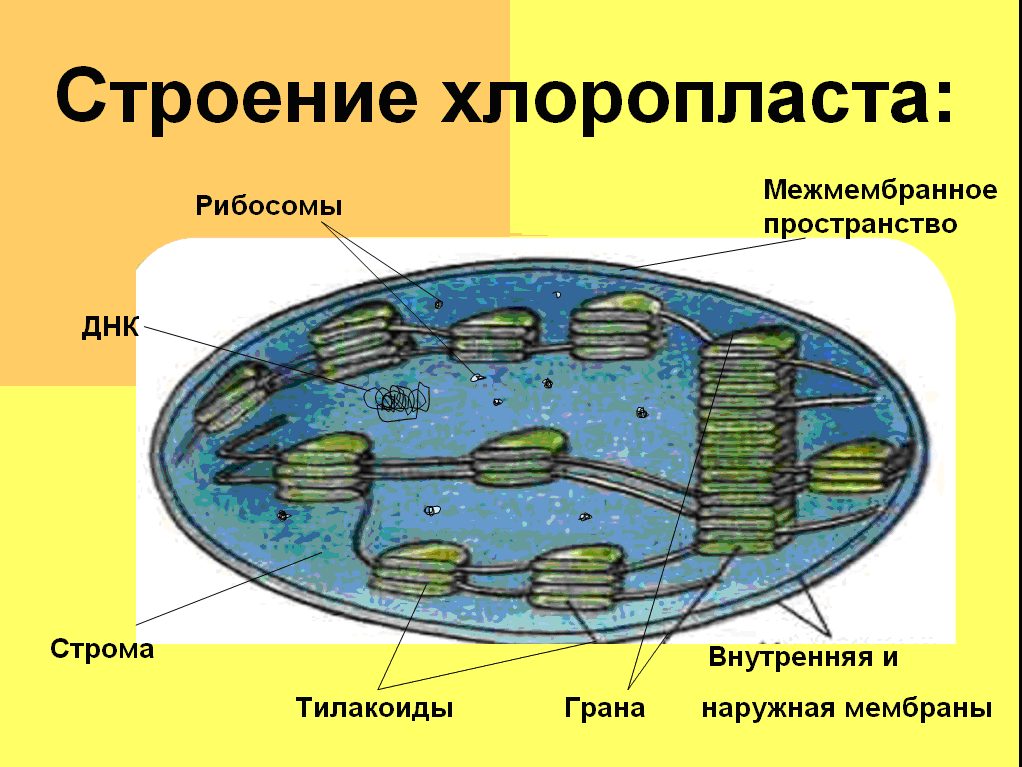 инициация и развитие (Drost et al. , 2017). Наконец, органоиды, полученные от пациентов, использовались для обобщения прогрессирования пигментного ретинита (Deng et al. , 2018), для изучения роли нейроглии в нейродегенеративном заболевании (Abud et al., 2017), а также для моделирования кистозного фиброза в органоидах дыхательных путей человека (McCauley et al. , 2017).
инициация и развитие (Drost et al. , 2017). Наконец, органоиды, полученные от пациентов, использовались для обобщения прогрессирования пигментного ретинита (Deng et al. , 2018), для изучения роли нейроглии в нейродегенеративном заболевании (Abud et al., 2017), а также для моделирования кистозного фиброза в органоидах дыхательных путей человека (McCauley et al. , 2017). Тканевая инженерия и регенеративная медицина
 , 2011; Munera et al., 2017). Дополнительными тканями, которые, как было показано, обладают регенеративным потенциалом, являются легкие, кожа и волосы (Hirsch et al. , 2017). Другие исследователи изучают органоиды в качестве регенеративной терапии заболеваний печени (зачатки органов) и глаз (глазные бокалы) (Huch et al., 2017; Мандай и др. , 2017).
, 2011; Munera et al., 2017). Дополнительными тканями, которые, как было показано, обладают регенеративным потенциалом, являются легкие, кожа и волосы (Hirsch et al. , 2017). Другие исследователи изучают органоиды в качестве регенеративной терапии заболеваний печени (зачатки органов) и глаз (глазные бокалы) (Huch et al., 2017; Мандай и др. , 2017). Персонализированная медицина
Доклиническое моделирование заболеваний/лекарственный скрининг
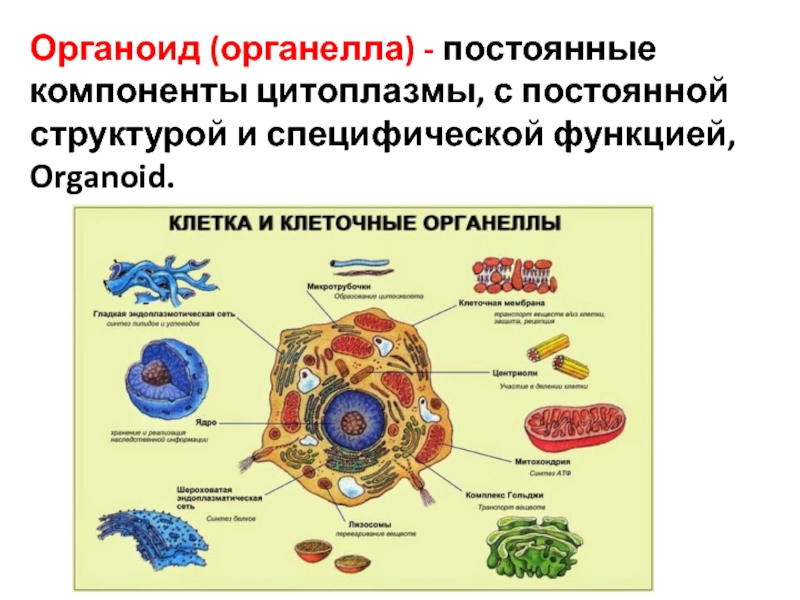 Эти расходы обусловлены главным образом высокой частотой неудачных попыток (∼88%) лекарств, которые тестируются на людях (DiMasi et al. , 2016). Таким образом, органоиды могут предоставить уникальную модель заболевания тканей человека для использования в тестах на лекарства или в доклинических моделях.Например, скрининг более 6000 одобренных лекарств в клетках-предшественниках коры головного мозга, полученных из hIPSC, выявил несколько соединений, которые обладали защитным действием при тестировании на органоидах головного мозга человека (Zhou et al. , 2017). В дополнение к потенциальному перепрофилированию существующих лекарств скрининг на основе органоидов также можно использовать для открытия новых мишеней для лекарств.
Эти расходы обусловлены главным образом высокой частотой неудачных попыток (∼88%) лекарств, которые тестируются на людях (DiMasi et al. , 2016). Таким образом, органоиды могут предоставить уникальную модель заболевания тканей человека для использования в тестах на лекарства или в доклинических моделях.Например, скрининг более 6000 одобренных лекарств в клетках-предшественниках коры головного мозга, полученных из hIPSC, выявил несколько соединений, которые обладали защитным действием при тестировании на органоидах головного мозга человека (Zhou et al. , 2017). В дополнение к потенциальному перепрофилированию существующих лекарств скрининг на основе органоидов также можно использовать для открытия новых мишеней для лекарств. Эти вопросы подробно обсуждаются ниже.
Эти вопросы подробно обсуждаются ниже. ВОСПРОИЗВОДИМОСТЬ В ИССЛЕДОВАНИЯХ ОРГАНОИДОВ
 Предполагается, что академические исследователи следуют основным принципам «строгости и воспроизводимости» в своих экспериментах. Эти принципы включают стандартизацию номенклатуры, количество повторов, статистический анализ, рандомизацию, ослепление, оценку размера выборки и прозрачность отчетности.
Предполагается, что академические исследователи следуют основным принципам «строгости и воспроизводимости» в своих экспериментах. Эти принципы включают стандартизацию номенклатуры, количество повторов, статистический анализ, рандомизацию, ослепление, оценку размера выборки и прозрачность отчетности. Генетическая и эпигенетическая изменчивость клеток человека
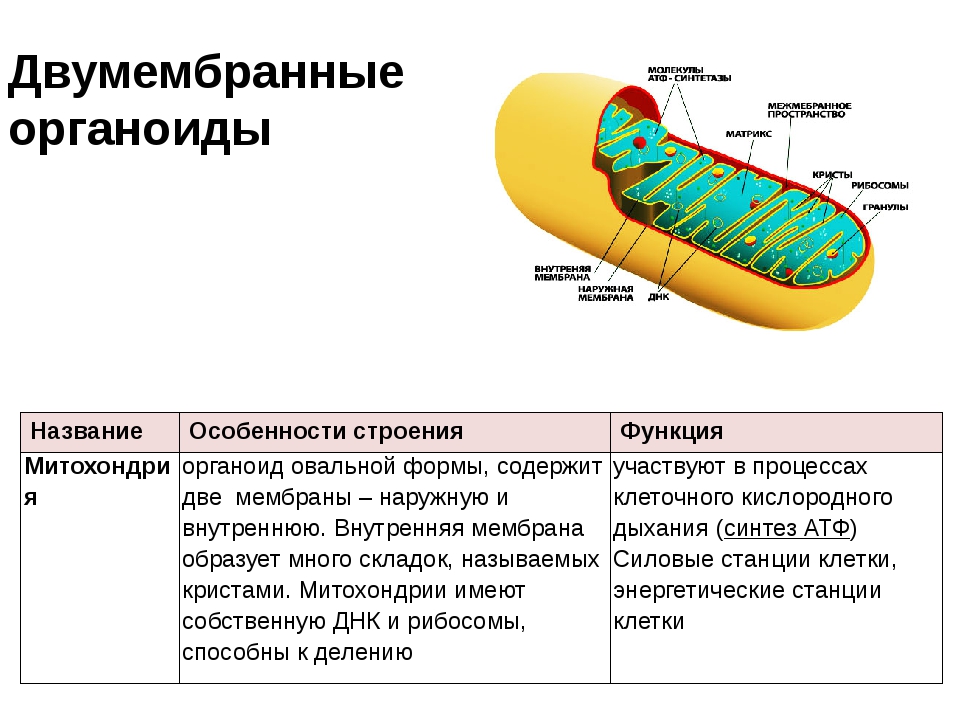 В этих случаях фенотип дифференцированных клеток может зависеть от генетического фона, в котором лежит мутация. Теоретически иПСК, полученные от разных пациентов с одной и той же мутацией, могут по-разному вести себя в органоидных культурах. Следовательно, в исследованиях органоидов следует использовать линии ИПСК, полученные от нескольких пациентов, и, в идеале, исследователи должны быть готовы поделиться этими различными линиями с другими лабораториями, чтобы можно было сравнить результаты.Для заболеваний, при которых известен специфический генетический дефект, могут быть созданы и распространены клеточные системы «модели заболевания», в которых генетический дефект корректируется с помощью CRISPR-Cas9 в клетках пациентов или генетический дефект воссоздается в нормальных контрольных клетках. Исследования, подтверждающие принцип, были предоставлены на клеточных линиях пациентов с мышечной дистрофией и муковисцидозом (Simsek et al. , 2016; Min et al. , 2019).
В этих случаях фенотип дифференцированных клеток может зависеть от генетического фона, в котором лежит мутация. Теоретически иПСК, полученные от разных пациентов с одной и той же мутацией, могут по-разному вести себя в органоидных культурах. Следовательно, в исследованиях органоидов следует использовать линии ИПСК, полученные от нескольких пациентов, и, в идеале, исследователи должны быть готовы поделиться этими различными линиями с другими лабораториями, чтобы можно было сравнить результаты.Для заболеваний, при которых известен специфический генетический дефект, могут быть созданы и распространены клеточные системы «модели заболевания», в которых генетический дефект корректируется с помощью CRISPR-Cas9 в клетках пациентов или генетический дефект воссоздается в нормальных контрольных клетках. Исследования, подтверждающие принцип, были предоставлены на клеточных линиях пациентов с мышечной дистрофией и муковисцидозом (Simsek et al. , 2016; Min et al. , 2019). Выделение стволовых клеток из первичных тканей
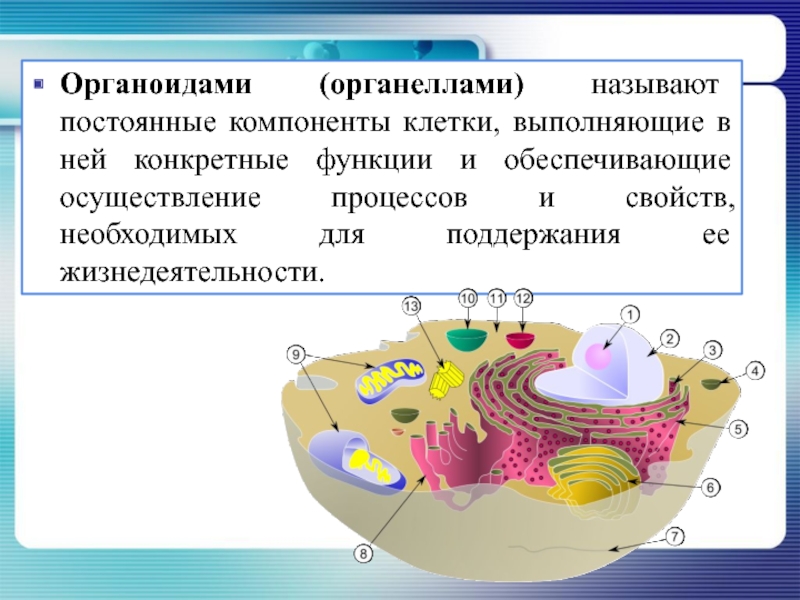 Изменчивость может исходить от методов, используемых для выделения и очистки клеток. Например, клинические образцы могут храниться в течение разного времени, протеазы, используемые для диссоциации ткани, могут различаться по эффективности или условия сортировки клеток могут различаться по-разному (например, размер сопла, давление потока, стробирование и источник антител). к поверхностным маркерам; рассмотрено в Hines et al. [2014]). Поэтому важно, чтобы в протоколы изоляции было включено как можно больше технических деталей.
Изменчивость может исходить от методов, используемых для выделения и очистки клеток. Например, клинические образцы могут храниться в течение разного времени, протеазы, используемые для диссоциации ткани, могут различаться по эффективности или условия сортировки клеток могут различаться по-разному (например, размер сопла, давление потока, стробирование и источник антител). к поверхностным маркерам; рассмотрено в Hines et al. [2014]). Поэтому важно, чтобы в протоколы изоляции было включено как можно больше технических деталей. Условия, при которых поддерживаются клеточные линии или стволовые клетки
 загрязнения и др.Эти потенциальные источники изменчивости описаны в основных руководствах по культуре клеток. Клеточные линии должны быть заморожены в аликвотах, а подробные записи должны содержать количество пассажей и другие переменные.
загрязнения и др.Эти потенциальные источники изменчивости описаны в основных руководствах по культуре клеток. Клеточные линии должны быть заморожены в аликвотах, а подробные записи должны содержать количество пассажей и другие переменные. Проведение анализов органоидов
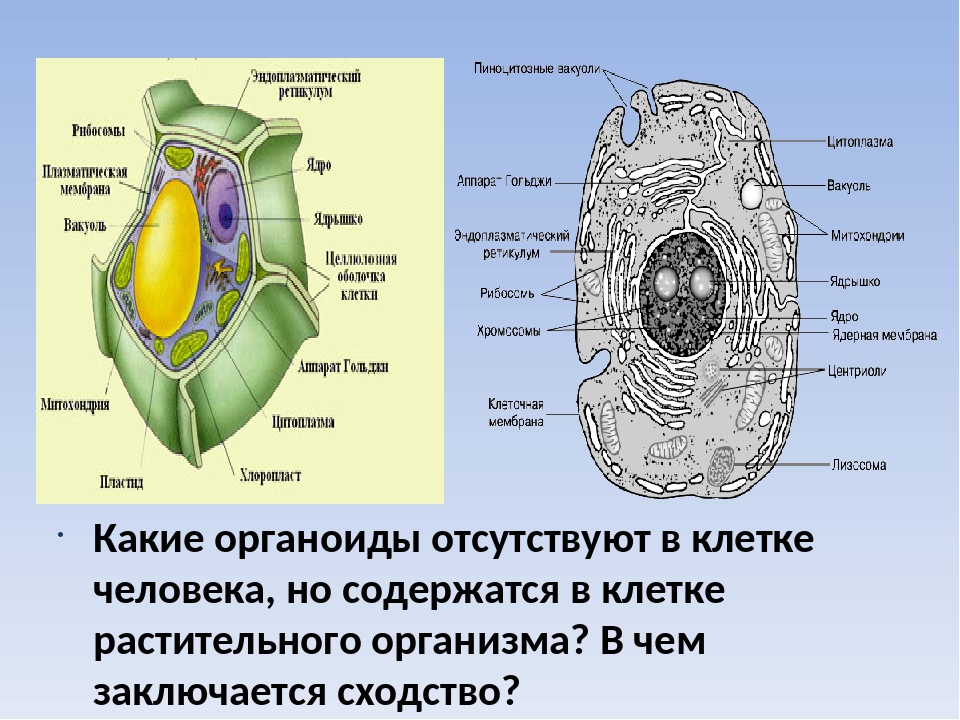 , 2017; McCauley et al., 2018).
, 2017; McCauley et al., 2018). Выводы и рекомендации
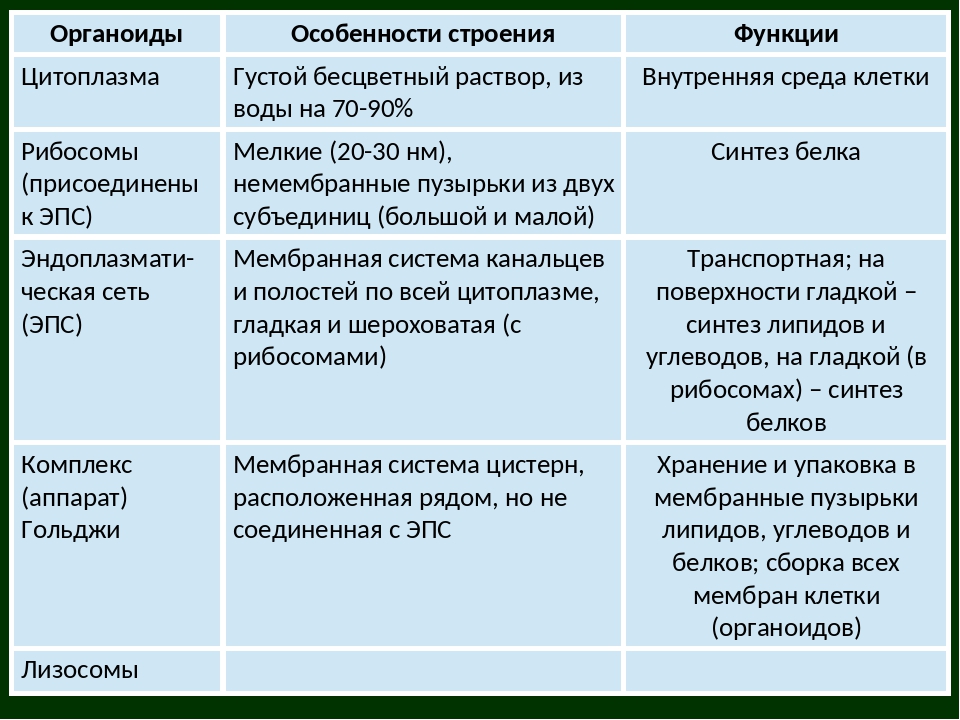
 Получение тканей и согласие пациента в исследованиях органоидов и Совместное использование материалов и результатов ниже).
Получение тканей и согласие пациента в исследованиях органоидов и Совместное использование материалов и результатов ниже). ПОИСК ТКАНЕЙ И СОГЛАСИЕ ПАЦИЕНТА НА ОРГАНОИДНЫЕ ИССЛЕДОВАНИЯ
Определение для сбора тканей
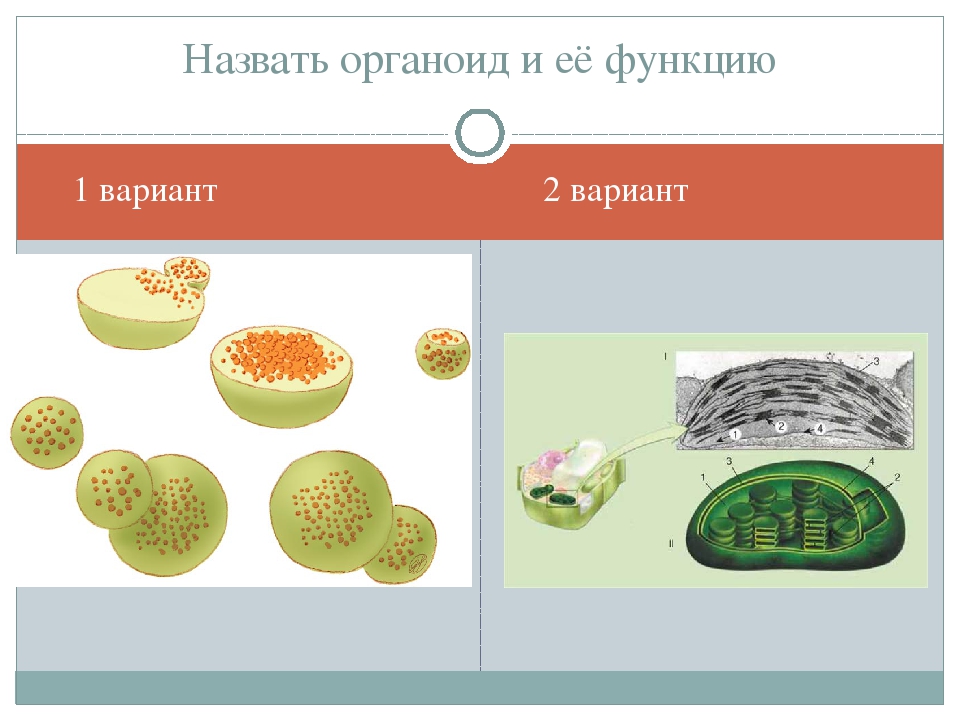
Ткань, все еще in situ, взята у живых или неживых людей
 Наконец, из-за религиозных, этнических или национальных обычаев взятие ткани у умершего может считаться правонарушением, а некоторые виды исследований (например, изучение прошлых перемещений населения и моделей расселения) могут представлять культурную или даже политическую проблему.
Наконец, из-за религиозных, этнических или национальных обычаев взятие ткани у умершего может считаться правонарушением, а некоторые виды исследований (например, изучение прошлых перемещений населения и моделей расселения) могут представлять культурную или даже политическую проблему. Ткань ex vivo
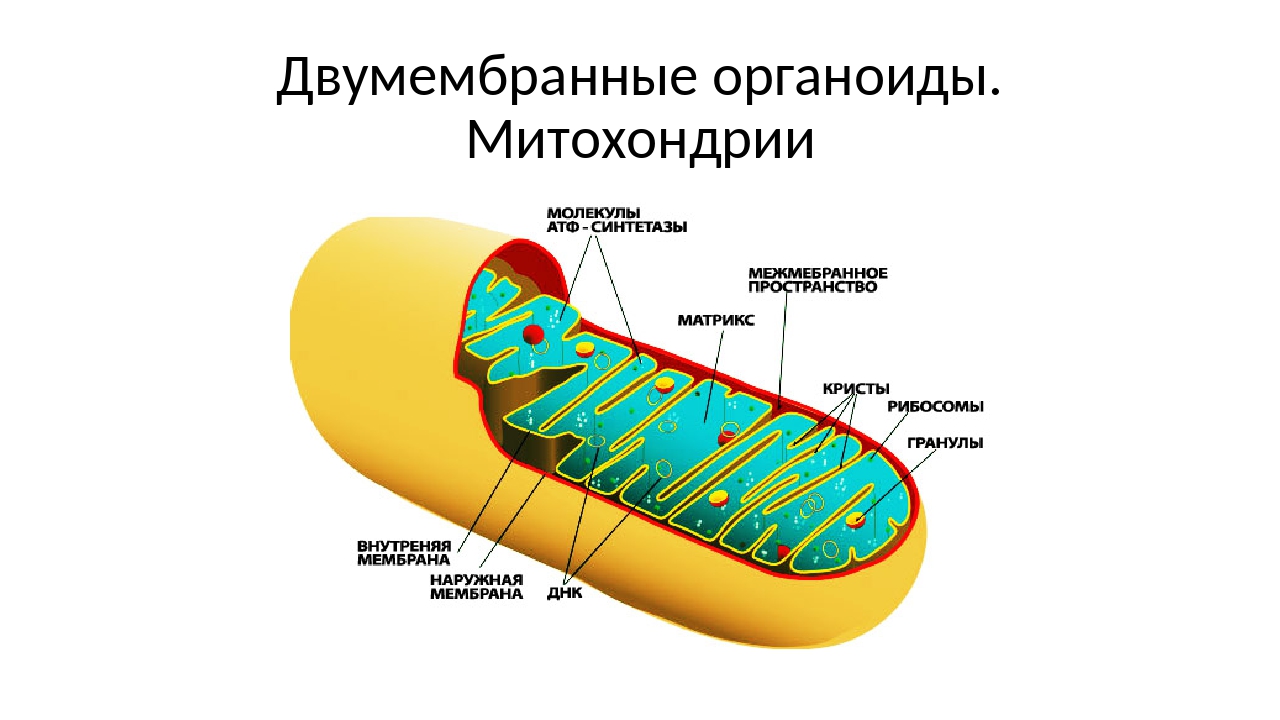
Регуляторные советы
 Некоторые исследования органоидов могут быть настолько тревожными для некоторых представителей общественности, что это станет актуальным. По этой причине процесс получения ткани от доноров может потребовать включения информации о диапазоне предполагаемых применений и возможностях будущего использования, которые еще не рассматривались. Например, работа с тканями, полученными из банка тканей, может потребовать внимания к тому, известны ли личности источника/донора и, если да, то можно ли их скрыть. Если нет, то, возможно, потребуется получить согласие, за исключением случаев, когда от согласия можно отказаться на основании исключений для таких ситуаций, как минимальный риск и необоснованные затраты на связь с донором.Для получения дополнительной информации о том, как управлять тканями, полученными до начала исследования ИПСК или органоидов, см. обсуждение в Lomax et al. (2015) .
Некоторые исследования органоидов могут быть настолько тревожными для некоторых представителей общественности, что это станет актуальным. По этой причине процесс получения ткани от доноров может потребовать включения информации о диапазоне предполагаемых применений и возможностях будущего использования, которые еще не рассматривались. Например, работа с тканями, полученными из банка тканей, может потребовать внимания к тому, известны ли личности источника/донора и, если да, то можно ли их скрыть. Если нет, то, возможно, потребуется получить согласие, за исключением случаев, когда от согласия можно отказаться на основании исключений для таких ситуаций, как минимальный риск и необоснованные затраты на связь с донором.Для получения дополнительной информации о том, как управлять тканями, полученными до начала исследования ИПСК или органоидов, см. обсуждение в Lomax et al. (2015) .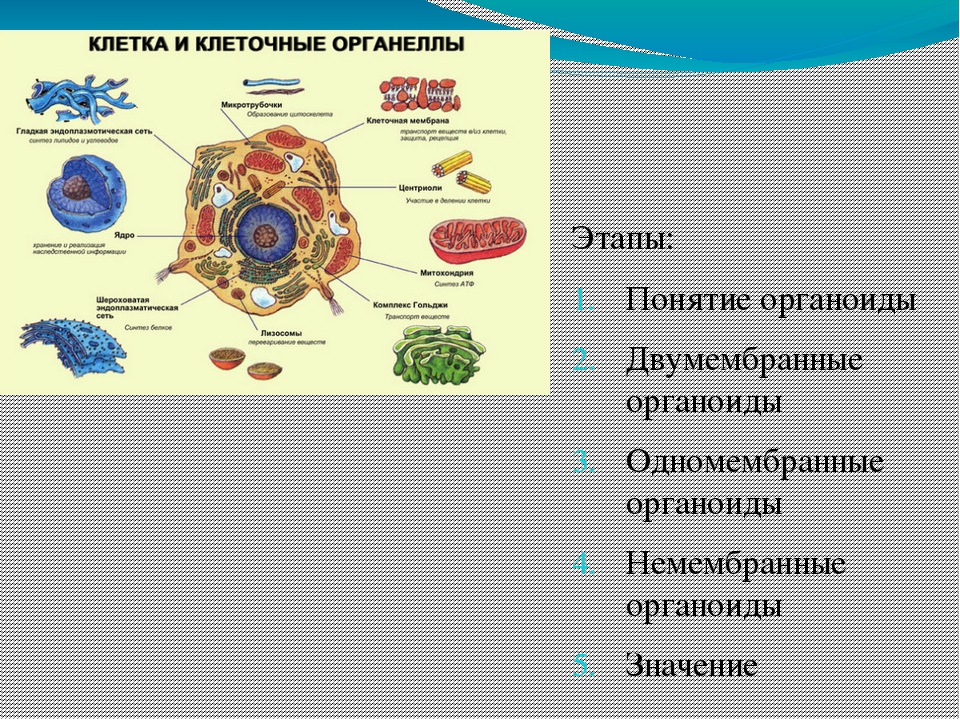 Конкретные исследования человеческих эмбрионов, которые теперь возможны с новыми методами культивирования, могут потребовать дополнительных надзорных комитетов, которые рассматривают, одобряют и контролируют любые исследования, включающие исследования органоидов на раннем этапе развития человека или направленные на получение человеческих гамет с неявной целью изучения оплодотворения или использования в экстракорпоральном оплодотворении. (ЭКО).
Конкретные исследования человеческих эмбрионов, которые теперь возможны с новыми методами культивирования, могут потребовать дополнительных надзорных комитетов, которые рассматривают, одобряют и контролируют любые исследования, включающие исследования органоидов на раннем этапе развития человека или направленные на получение человеческих гамет с неявной целью изучения оплодотворения или использования в экстракорпоральном оплодотворении. (ЭКО). Элементы согласия
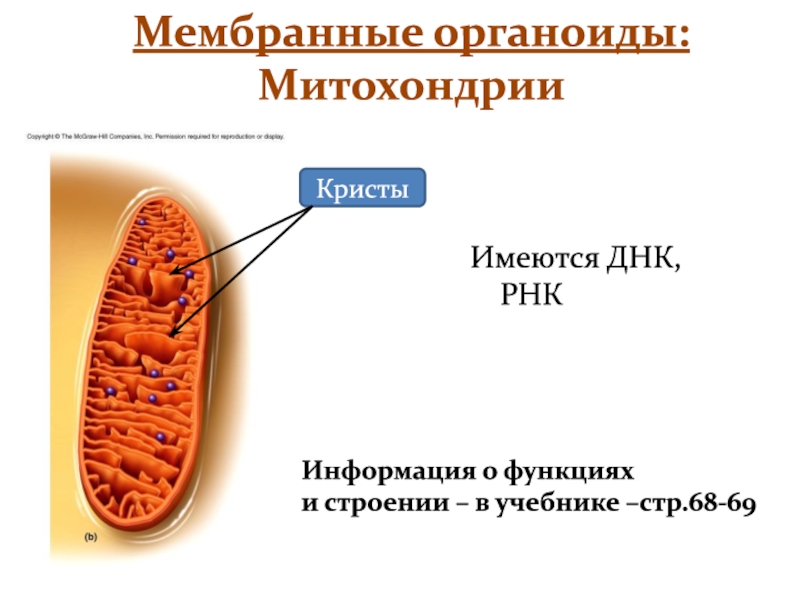
 Должно быть предоставлено согласие на отказ, если донор или его родственники прямо соглашаются на использование, или, что более желательно, но менее вероятно, согласие на отказ, когда должны быть указаны исключения.
Должно быть предоставлено согласие на отказ, если донор или его родственники прямо соглашаются на использование, или, что более желательно, но менее вероятно, согласие на отказ, когда должны быть указаны исключения.
Рекомендации для будущего сбора
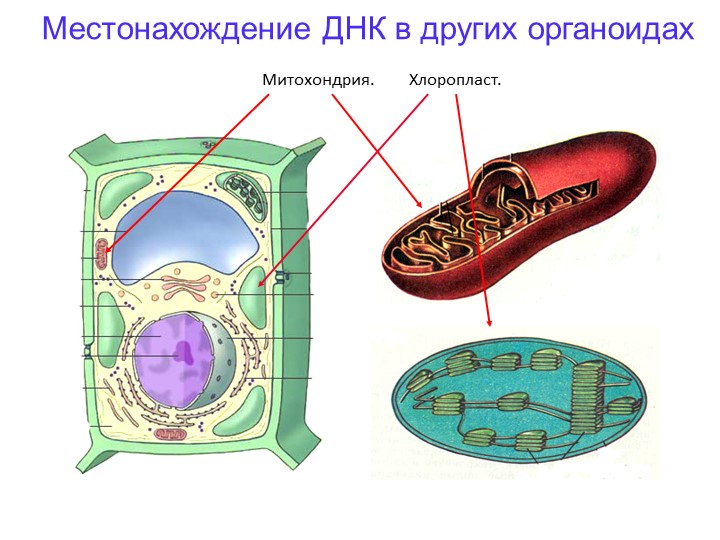
 nih.gov/tools_guid_tool.html)
nih.gov/tools_guid_tool.html) ОБМЕН МАТЕРИАЛАМИ И РЕЗУЛЬТАТАМИ

Руководство по коммуникации и обмену
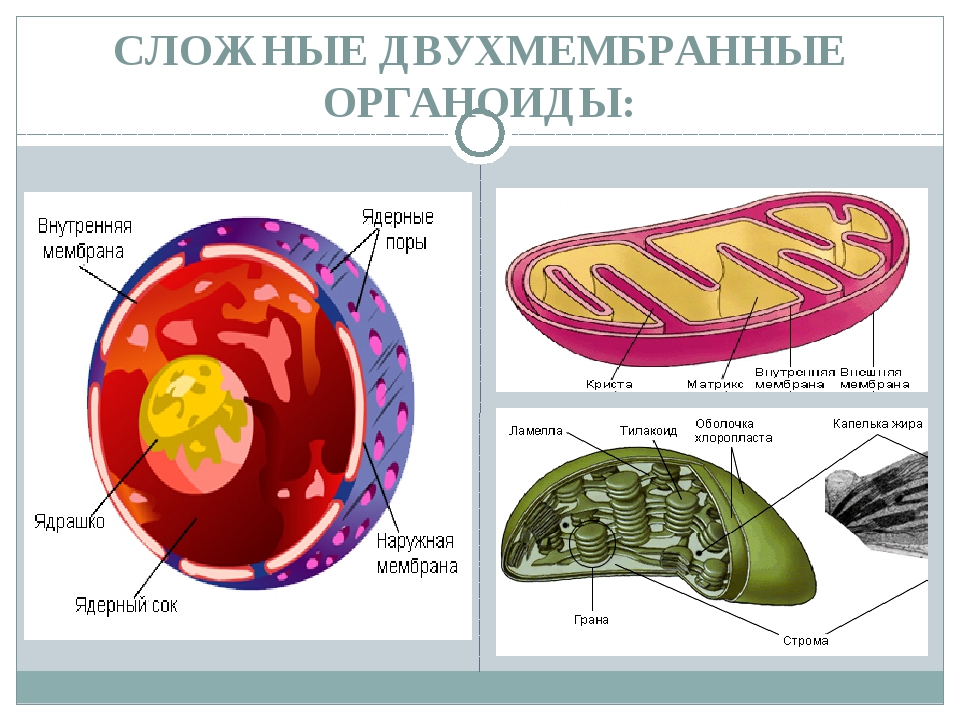
ОБУЧЕНИЕ ОРГАНОИДНЫМ ИССЛЕДОВАНИЯМ
 С такими технологиями «неспособность» воспроизвести предыдущую работу не обязательно означает, что ранее опубликованные исследования были ошибочными; в равной степени вероятно, что «искусство» проведения процедуры не было успешно передано и/или освоено второй группой исследователей.Эта фундаментальная проблема имеет серьезные последствия для любой области, зависящей от сложных экспериментальных протоколов.
С такими технологиями «неспособность» воспроизвести предыдущую работу не обязательно означает, что ранее опубликованные исследования были ошибочными; в равной степени вероятно, что «искусство» проведения процедуры не было успешно передано и/или освоено второй группой исследователей.Эта фундаментальная проблема имеет серьезные последствия для любой области, зависящей от сложных экспериментальных протоколов.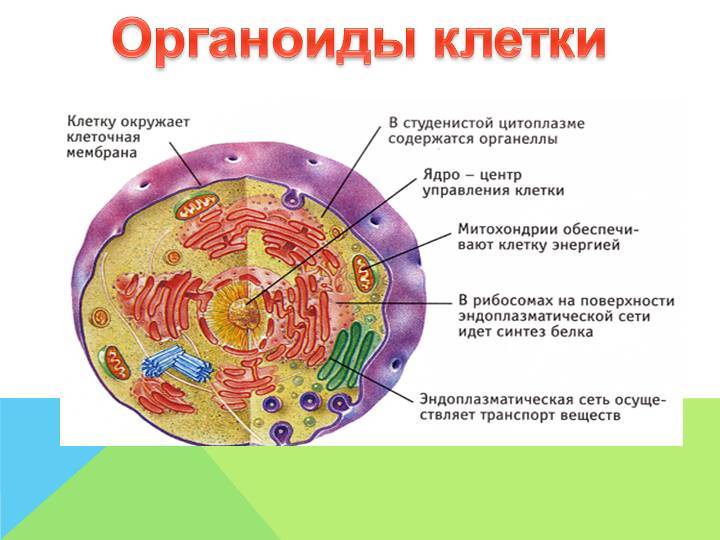
 Кроме того, для получения и культивирования органоидов требуется инфраструктура, несколько опытных сотрудников и институциональная поддержка. Эти проблемы затрудняют распространение подробных знаний о культивировании органоидов в новых лабораториях на типичных краткосрочных практических курсах, таких как те, которые в настоящее время используются для обучения экспериментам с модельными организмами.
Кроме того, для получения и культивирования органоидов требуется инфраструктура, несколько опытных сотрудников и институциональная поддержка. Эти проблемы затрудняют распространение подробных знаний о культивировании органоидов в новых лабораториях на типичных краткосрочных практических курсах, таких как те, которые в настоящее время используются для обучения экспериментам с модельными организмами. Такие объекты также станут механизмом и средой для обмена знаниями и сотрудничества, объединяя экспертов в области культуры органов, робототехники и инженерии, микроскопии и анализа изображений, криоконсервации и исследований на животных моделях. Примеры совместных средств, стремящихся к клиническому переводу, см. в Takebe et al. (2018 г.) и Ян и др. (2018) .
Такие объекты также станут механизмом и средой для обмена знаниями и сотрудничества, объединяя экспертов в области культуры органов, робототехники и инженерии, микроскопии и анализа изображений, криоконсервации и исследований на животных моделях. Примеры совместных средств, стремящихся к клиническому переводу, см. в Takebe et al. (2018 г.) и Ян и др. (2018) . Выводы и рекомендации
СВЯЗЬ С ОБЩЕСТВЕННОСТЬЮ
 Эти достижения, однако, часто выходили за рамки того, что считается социально приемлемым, и не всегда встречали немедленное общественное признание.
Эти достижения, однако, часто выходили за рамки того, что считается социально приемлемым, и не всегда встречали немедленное общественное признание.
 Публичная аудитория также с большей вероятностью поначалу будет настороженно относиться к новым областям исследований. Американцы стали больше принимать исследования hESC с течением времени, поскольку в период с 2000 по 2013 год продолжались общественные и политические дебаты, потому что у них было время узнать об области исследований и освоиться в ней.Поскольку исследование органоидов является новой областью и предоставляет исследователям новые инструменты для их исследований, они должны поделиться своим волнением по поводу того, как эти инструменты помогут им достичь своих исследовательских целей. Также важно заверить неспециалистов в том, чем органоиды не являются. Например, органоиды мозга — это , а не полных мозга. Они не могут полностью заменить функцию мозга, а поле не воспроизводит сознание в тарелке. То же самое можно сказать и об органоидах других органов тела.Кишечные органоиды не копируют кишечник, а органоиды сетчатки не являются глазами и не обладают зрением. Одной лекцией поддержки не добиться.
Публичная аудитория также с большей вероятностью поначалу будет настороженно относиться к новым областям исследований. Американцы стали больше принимать исследования hESC с течением времени, поскольку в период с 2000 по 2013 год продолжались общественные и политические дебаты, потому что у них было время узнать об области исследований и освоиться в ней.Поскольку исследование органоидов является новой областью и предоставляет исследователям новые инструменты для их исследований, они должны поделиться своим волнением по поводу того, как эти инструменты помогут им достичь своих исследовательских целей. Также важно заверить неспециалистов в том, чем органоиды не являются. Например, органоиды мозга — это , а не полных мозга. Они не могут полностью заменить функцию мозга, а поле не воспроизводит сознание в тарелке. То же самое можно сказать и об органоидах других органов тела.Кишечные органоиды не копируют кишечник, а органоиды сетчатки не являются глазами и не обладают зрением. Одной лекцией поддержки не добиться. Как и в других областях исследований, широкой общественности потребуется время, чтобы адаптироваться, и научное сообщество должно будет приложить постоянные усилия в области образования и диалога, особенно по мере дальнейшего прогресса.
Как и в других областях исследований, широкой общественности потребуется время, чтобы адаптироваться, и научное сообщество должно будет приложить постоянные усилия в области образования и диалога, особенно по мере дальнейшего прогресса. Слишком многие ученые не могут описать свои исследования в самых общих чертах, не говоря уже о том, чтобы продемонстрировать опыт работы с журналистами или обучение работе со СМИ. Такие общества, как ASCB, или институциональные отделы общественной информации и связи, желают и должны консультироваться.
Слишком многие ученые не могут описать свои исследования в самых общих чертах, не говоря уже о том, чтобы продемонстрировать опыт работы с журналистами или обучение работе со СМИ. Такие общества, как ASCB, или институциональные отделы общественной информации и связи, желают и должны консультироваться.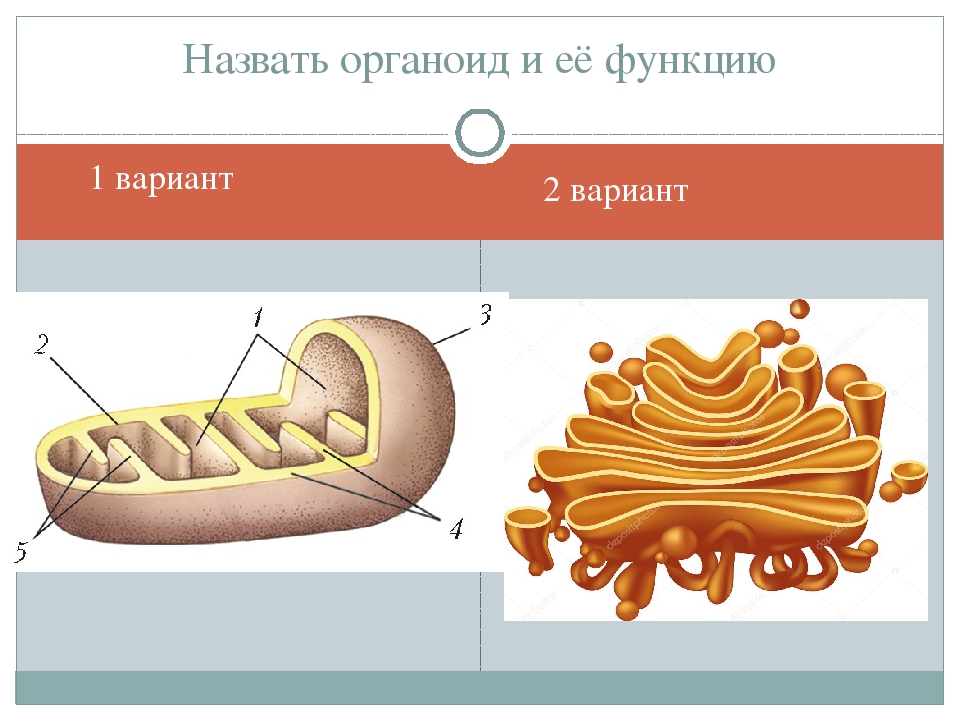 Какой опыт они получили в аналогичных областях передовой науки? Какие предложения у них есть для вас, основанные на этом опыте?
Какой опыт они получили в аналогичных областях передовой науки? Какие предложения у них есть для вас, основанные на этом опыте? Сокращения, используемые:
ESC эмбриональных стволовых клеток GUID глобальные уникальные идентификаторы чЭСК человеческих эмбриональных стволовых клеток hIPSC человек индуцированных плюрипотентных стволовых клетка МКПС индуцированных плюрипотентных стволовых клеток ЭСО институциональной обзор платы IVF экстракорпоральное оплодотворение МТА перенос материала соглашение ККП плюрипотентных стволовая клетка. ССЫЛКИ
 М., Рамирес Р.Н., Мартинес Э.С., Хили Л.М., Нгуен Ч.Х., Ньюман С.А., Еромин А.В., Скарфон В.М., Марш С.Е., Фимбрес С., и др. (2017). Микроглиоподобные клетки человека, полученные из иПСК, для изучения неврологических заболеваний. Нейрон , 278–293.e279. [Бесплатная статья PMC] [PubMed] [Google Scholar]
М., Рамирес Р.Н., Мартинес Э.С., Хили Л.М., Нгуен Ч.Х., Ньюман С.А., Еромин А.В., Скарфон В.М., Марш С.Е., Фимбрес С., и др. (2017). Микроглиоподобные клетки человека, полученные из иПСК, для изучения неврологических заболеваний. Нейрон , 278–293.e279. [Бесплатная статья PMC] [PubMed] [Google Scholar]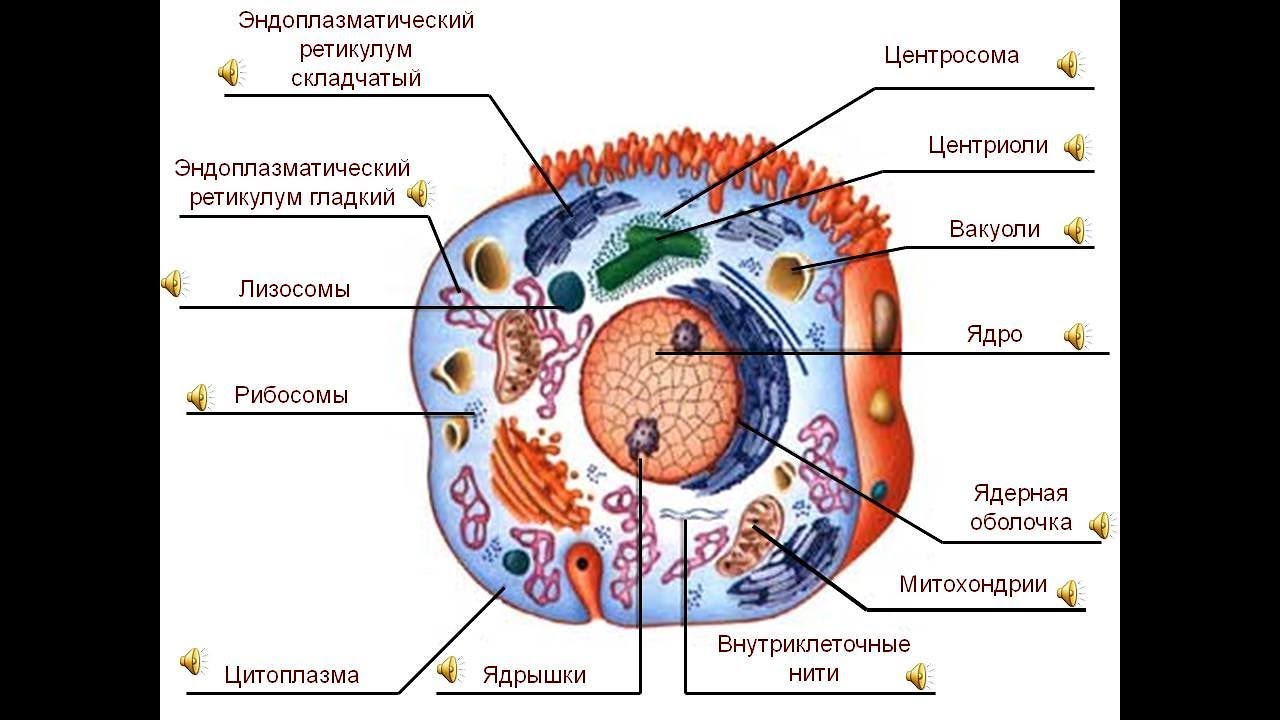 (2018). Коррекция генов устраняет цилиопатию и потерю фоторецепторов в органоидах сетчатки, полученных из иПСК, у пациентов с пигментным ретинитом. Rep стволовых клеток, 1267–1281. [Бесплатная статья PMC] [PubMed] [Google Scholar]
(2018). Коррекция генов устраняет цилиопатию и потерю фоторецепторов в органоидах сетчатки, полученных из иПСК, у пациентов с пигментным ретинитом. Rep стволовых клеток, 1267–1281. [Бесплатная статья PMC] [PubMed] [Google Scholar] Proc Natl Acad Sci USA , E2357–E2364.[Бесплатная статья PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci USA , E2357–E2364.[Бесплатная статья PMC] [PubMed] [Google Scholar] (2017). Надежда и ажиотаж исследований органоидов. Разработка , 938–941. [PubMed] [Google Scholar]
(2017). Надежда и ажиотаж исследований органоидов. Разработка , 938–941. [PubMed] [Google Scholar] (2015). Проект DISCUSS: пересмотренные пункты, которые следует учитывать при получении линий индуцированных плюрипотентных стволовых клеток из ранее собранных исследовательских образцов. Стволовые клетки Transl Med , 123–129. [Бесплатная статья PMC] [PubMed] [Google Scholar]
(2015). Проект DISCUSS: пересмотренные пункты, которые следует учитывать при получении линий индуцированных плюрипотентных стволовых клеток из ранее собранных исследовательских образцов. Стволовые клетки Transl Med , 123–129. [Бесплатная статья PMC] [PubMed] [Google Scholar]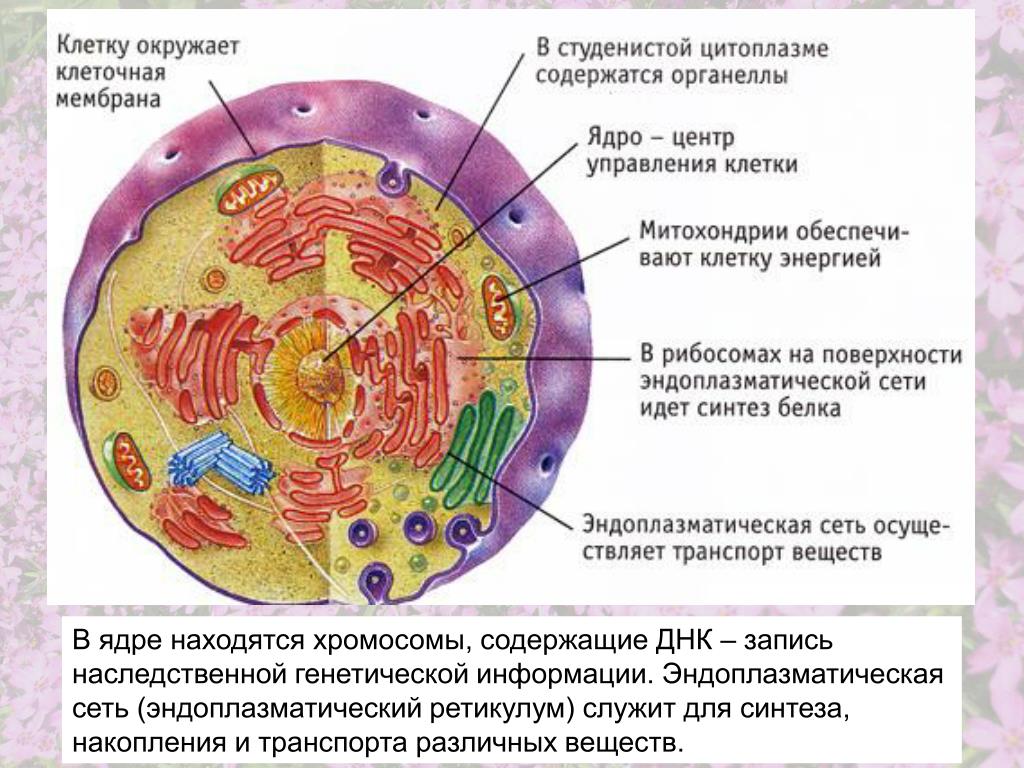 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar] (2017). Генерация желудочно-кишечных органоидов из плюрипотентных стволовых клеток человека. Методы Mol Biol , 167–177. [PubMed] [Google Scholar]
(2017). Генерация желудочно-кишечных органоидов из плюрипотентных стволовых клеток человека. Методы Mol Biol , 167–177. [PubMed] [Google Scholar] e310.[PubMed] [Google Scholar]
e310.[PubMed] [Google Scholar]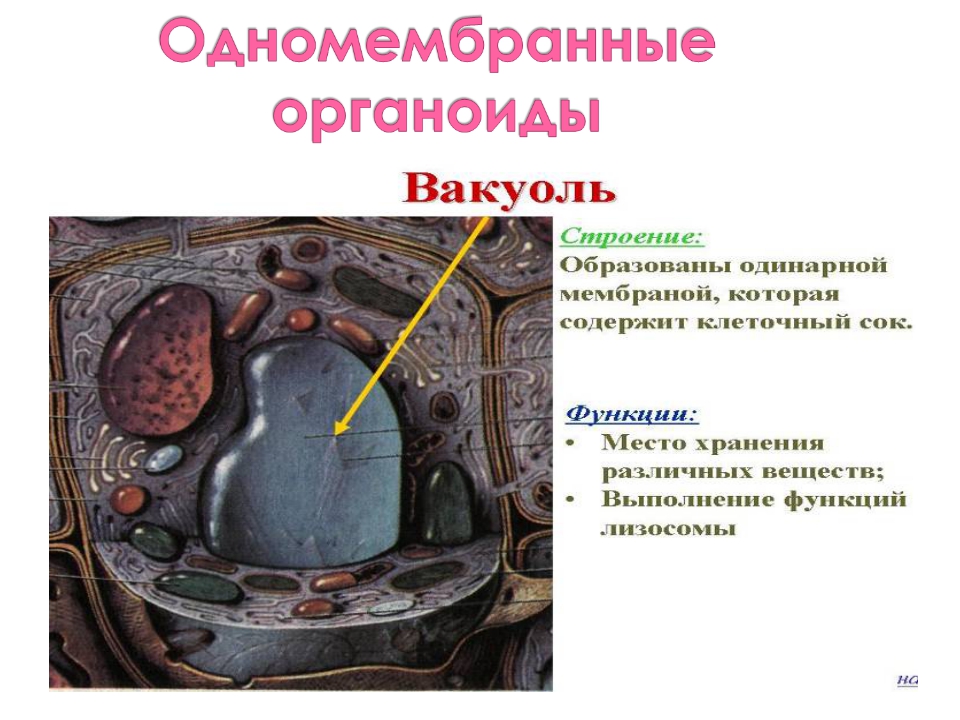 Стволовая клетка , 806–809. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Стволовая клетка , 806–809. [Бесплатная статья PMC] [PubMed] [Google Scholar] Стволовая клетка , 274–283.e275. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Стволовая клетка , 274–283.e275. [Бесплатная статья PMC] [PubMed] [Google Scholar] новое измерение в клеточной биологии
Рут Леманн
Конни М.Lee
Erika C. Shugart
Marta Benedetti
R. Alta Charo
Zev Gartner
Бриджит Хоган
Юрген Кноблих
Селеста М.
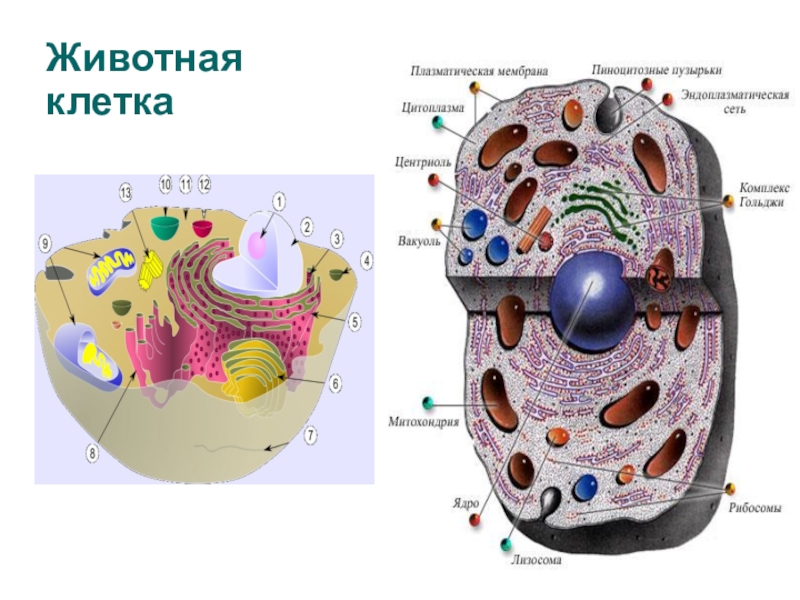 Nelson
Nelson Кевин М. Уилсон
 ; Принято 7 марта 2019 г.
; Принято 7 марта 2019 г. Abstract
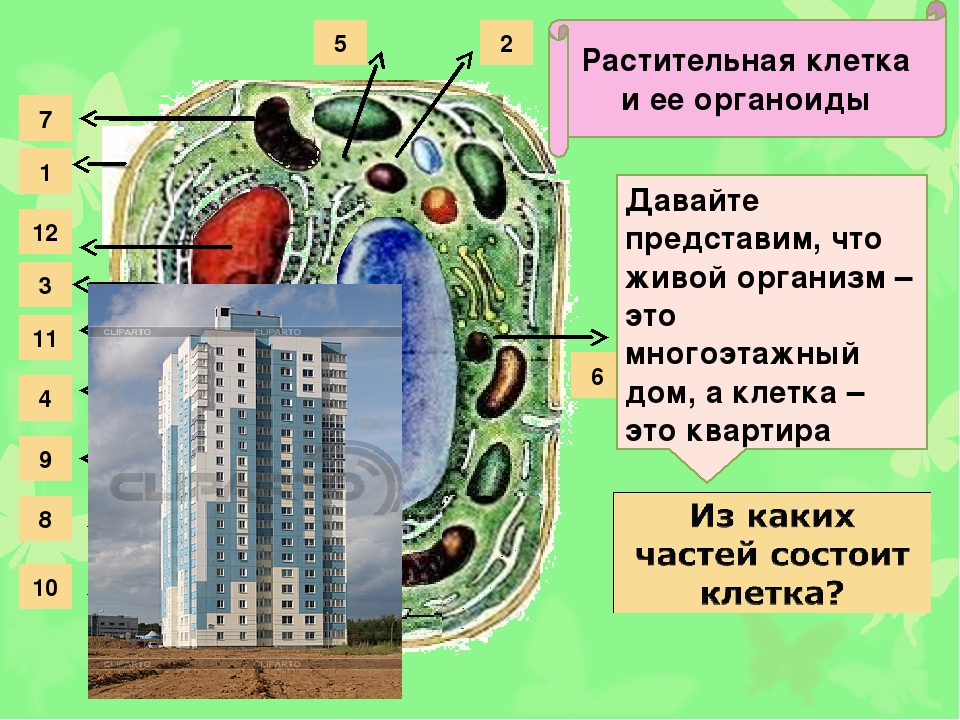 Биологов привлекает эта система как новый «модельный организм» для изучения сложных фенотипов заболеваний и генетической изменчивости среди людей с использованием тканей, полученных от пациентов. Американское общество клеточной биологии созвало целевую группу, чтобы сообщить о потенциале, проблемах и ограничениях исследований органов человека. Целевая группа предлагает способы облегчить вход новых исследователей в эту область и как способствовать более широкому использованию этого нового модельного организма в исследовательском сообществе. Это включает в себя рекомендации по воспроизводимости, культивированию, обмену материалами пациентов, согласию пациентов, обучению и общению с общественностью.
Биологов привлекает эта система как новый «модельный организм» для изучения сложных фенотипов заболеваний и генетической изменчивости среди людей с использованием тканей, полученных от пациентов. Американское общество клеточной биологии созвало целевую группу, чтобы сообщить о потенциале, проблемах и ограничениях исследований органов человека. Целевая группа предлагает способы облегчить вход новых исследователей в эту область и как способствовать более широкому использованию этого нового модельного организма в исследовательском сообществе. Это включает в себя рекомендации по воспроизводимости, культивированию, обмену материалами пациентов, согласию пациентов, обучению и общению с общественностью. РЕЗЮМЕ
 Органоиды происходят из возобновляемых источников тканей, которые самоорганизуются в культуре, приобретая in vivo подобную органу сложность. Органоиды могут быть получены из источников клеток человека, включая взрослые тканеспецифические стволовые клетки, эмбриональные стволовые клетки (hESC) и индуцированные плюрипотентные стволовые клетки (hIPSC). Таким образом, у них есть потенциал преодолеть ряд прежних ограничений в биомедицинских исследованиях, направленных на получение механистического понимания развития человека, создание точных моделей заболеваний человека и создание источников тканей, соответствующих пациентам, для регенеративной медицины.
Органоиды происходят из возобновляемых источников тканей, которые самоорганизуются в культуре, приобретая in vivo подобную органу сложность. Органоиды могут быть получены из источников клеток человека, включая взрослые тканеспецифические стволовые клетки, эмбриональные стволовые клетки (hESC) и индуцированные плюрипотентные стволовые клетки (hIPSC). Таким образом, у них есть потенциал преодолеть ряд прежних ограничений в биомедицинских исследованиях, направленных на получение механистического понимания развития человека, создание точных моделей заболеваний человека и создание источников тканей, соответствующих пациентам, для регенеративной медицины. Обсуждение рабочей группой, а также результаты опроса, разосланного членам ASCB, подтверждают огромный потенциал этих новых «модельных систем», а также демонстрируют вызовы для науки и общества, связанные с этой возможностью. Состав рабочей группы см. в дополнительной информации 1; сводку результатов опроса см. в дополнительной информации 2.
Обсуждение рабочей группой, а также результаты опроса, разосланного членам ASCB, подтверждают огромный потенциал этих новых «модельных систем», а также демонстрируют вызовы для науки и общества, связанные с этой возможностью. Состав рабочей группы см. в дополнительной информации 1; сводку результатов опроса см. в дополнительной информации 2. Возможности

Задачи и рекомендации

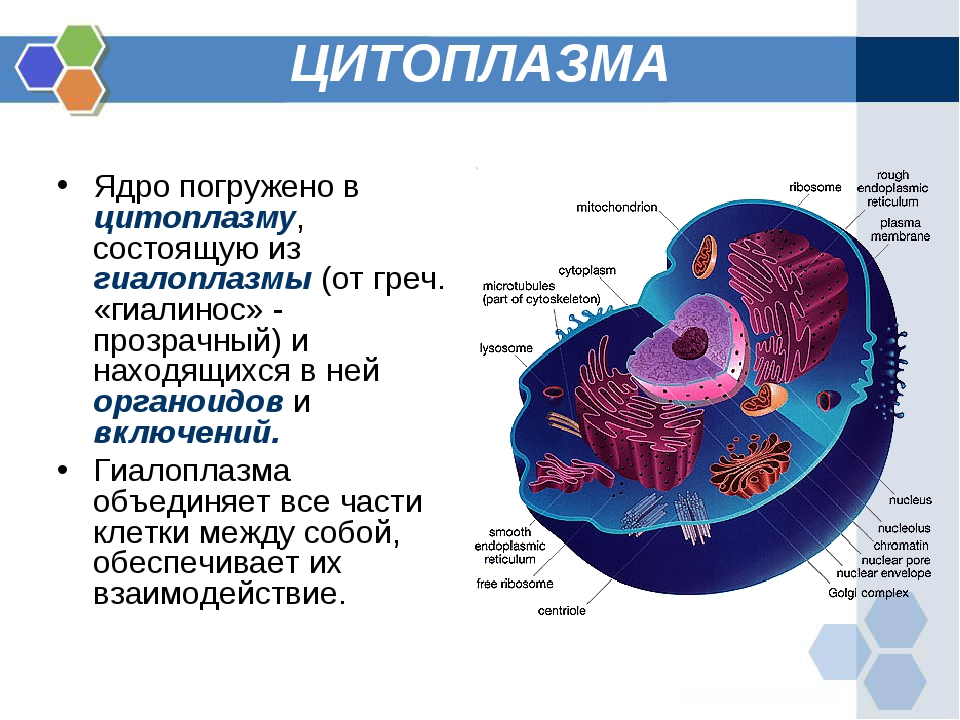
ПРЕДПОСЫЛКИ: БИОЛОГИЯ И ПРОИЗВОДСТВО ОРГАНОИДОВ
Определение органоидов
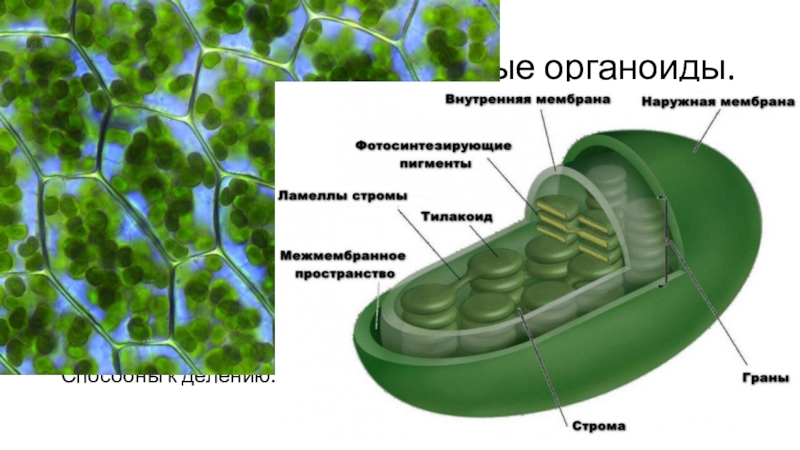 Эти модели могут использоваться несколькими лабораториями, ими легко манипулировать, визуализировать и подвергать биомолекулярному анализу без мешающей сложности, связанной с исследованиями in vivo. При выращивании из клеток человека они облегчают переход от животных моделей к биологии человека с приемлемыми этическими ограничениями.
Эти модели могут использоваться несколькими лабораториями, ими легко манипулировать, визуализировать и подвергать биомолекулярному анализу без мешающей сложности, связанной с исследованиями in vivo. При выращивании из клеток человека они облегчают переход от животных моделей к биологии человека с приемлемыми этическими ограничениями. Краткая история
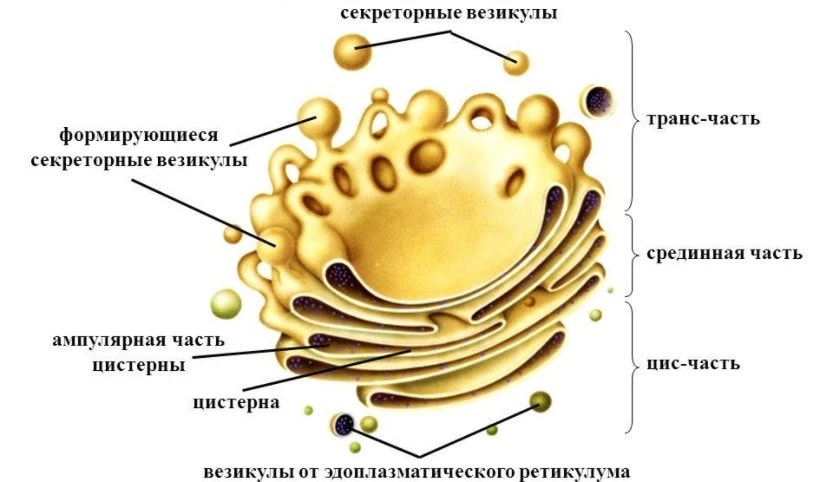 в Harrison, 1906, и Simian and Bissell, 2017). Нынешний бум исследований органоидов является результатом возможности выращивать органоиды из клеток или тканей, полученных от людей, что раскрывает их огромный потенциал для биологии человека и медицинских исследований (Dekkers et al. , 2013; Lancaster et al. , 2013). . Для целей этого отчета мы сосредоточимся в первую очередь на возможностях и проблемах, связанных с человеческими органоидами, а не на органоидах, полученных из клеток и тканей животных.
в Harrison, 1906, и Simian and Bissell, 2017). Нынешний бум исследований органоидов является результатом возможности выращивать органоиды из клеток или тканей, полученных от людей, что раскрывает их огромный потенциал для биологии человека и медицинских исследований (Dekkers et al. , 2013; Lancaster et al. , 2013). . Для целей этого отчета мы сосредоточимся в первую очередь на возможностях и проблемах, связанных с человеческими органоидами, а не на органоидах, полученных из клеток и тканей животных. Человеческие органоиды как новый модельный организм для исследований
 Действительно, это отсутствие модельных систем человека, возможно, способствовало низкому показателю успеха в клинических испытаниях фармацевтических соединений, разработанных на животных моделях.
Действительно, это отсутствие модельных систем человека, возможно, способствовало низкому показателю успеха в клинических испытаниях фармацевтических соединений, разработанных на животных моделях. Следовательно, хотя органоиды могут рассказать нам о специфических для человека аспектах развития органов и физиологии, в настоящее время они менее полезны для раскрытия аспектов биологии, которые зависят от интегрированных физиологических систем и сложного взаимодействия систем органов человека.Какие бы результаты мы ни нашли в органоидах, они будут полезны только в сравнении с фоном знаний, определенным в других модельных системах. В этом смысле органоиды сами по себе являются новой модельной системой, которая дополняет, а не превосходит существующие модели животных.
Следовательно, хотя органоиды могут рассказать нам о специфических для человека аспектах развития органов и физиологии, в настоящее время они менее полезны для раскрытия аспектов биологии, которые зависят от интегрированных физиологических систем и сложного взаимодействия систем органов человека.Какие бы результаты мы ни нашли в органоидах, они будут полезны только в сравнении с фоном знаний, определенным в других модельных системах. В этом смысле органоиды сами по себе являются новой модельной системой, которая дополняет, а не превосходит существующие модели животных. В качестве альтернативы органоиды могут быть получены из PSC, включая ESC или индуцированных плюрипотентных стволовых клеток (iPSC). Это достигается путем культивирования их в определенной серии коктейлей факторов роста или сред, которые индуцируют органоспецифические клеточные судьбы в последовательности, имитирующей нормальное развитие. Окончательный конгломерат органоспецифических типов клеток может располагаться таким же образом, как и в реальном органе, что позволяет анализировать морфогенетические и физиологические процессы «в чашке».
В качестве альтернативы органоиды могут быть получены из PSC, включая ESC или индуцированных плюрипотентных стволовых клеток (iPSC). Это достигается путем культивирования их в определенной серии коктейлей факторов роста или сред, которые индуцируют органоспецифические клеточные судьбы в последовательности, имитирующей нормальное развитие. Окончательный конгломерат органоспецифических типов клеток может располагаться таким же образом, как и в реальном органе, что позволяет анализировать морфогенетические и физиологические процессы «в чашке». В этом отчете мы излагаем возможности для исследования органоидов, рассматриваем проблемы и даем рекомендации по использованию человеческих органоидов для добавления в репертуар «модельного организма».
В этом отчете мы излагаем возможности для исследования органоидов, рассматриваем проблемы и даем рекомендации по использованию человеческих органоидов для добавления в репертуар «модельного организма». ПРИМЕНЕНИЕ ДЛЯ ИССЛЕДОВАНИЙ ОРГАНОИДОВ
Биология развития человека
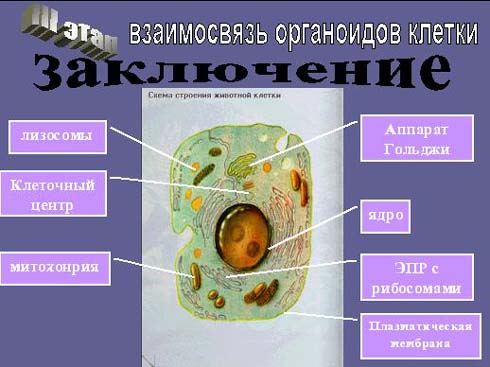 , 2017). Однако появление множества моделей органоидов, полученных из ИПСК, открыло путь к динамическому наблюдению и механистическим исследованиям человеческого развития.
, 2017). Однако появление множества моделей органоидов, полученных из ИПСК, открыло путь к динамическому наблюдению и механистическим исследованиям человеческого развития. Прогресс в этой области значительно ускорился в последние годы, даже вопреки правилу, которое ограничивает культивирование человеческих эмбрионов сроком более 14 дней, стадии, когда мезодермальные клетки обычно образуются в примитивной полоске (Hyun et al., 2016). Эти исследования выявили различия между самыми ранними стадиями развития человека и модельных организмов, таких как мыши, например, в установлении эмбриональных осей и спецификации первичных зародышевых клеток (Irie et al. , 2015; Kobayashi and Surani, 2018; Мартин и др. , 2018). Они предлагают возможность дальнейшего понимания раннего развития человека, позволяют проводить эволюционные исследования видовой специфичности событий раннего развития и создают новую модельную систему, имеющую отношение к основным причинам ранней потери беременности у человека.
Прогресс в этой области значительно ускорился в последние годы, даже вопреки правилу, которое ограничивает культивирование человеческих эмбрионов сроком более 14 дней, стадии, когда мезодермальные клетки обычно образуются в примитивной полоске (Hyun et al., 2016). Эти исследования выявили различия между самыми ранними стадиями развития человека и модельных организмов, таких как мыши, например, в установлении эмбриональных осей и спецификации первичных зародышевых клеток (Irie et al. , 2015; Kobayashi and Surani, 2018; Мартин и др. , 2018). Они предлагают возможность дальнейшего понимания раннего развития человека, позволяют проводить эволюционные исследования видовой специфичности событий раннего развития и создают новую модельную систему, имеющую отношение к основным причинам ранней потери беременности у человека. Моделирование болезней человека
 Клеточная организация органоидов может быть изучена на системном уровне благодаря достижениям в области функциональной геномики и протеомики, включая анализ отдельных клеток и высокопроизводительную транскриптомику, протеомику и крупномасштабную характеристику доменов хроматина и регуляторных элементов транскрипции.Этот уровень детального анализа трудно достичь с тканью человека, взятой на месте, и он обеспечит более полное понимание развития и клеточного состава органоидов. Более того, эта информация повысит их актуальность в качестве моделей для изучения морфологии, функций и заболеваний органов и откроет новые возможности в разработке лекарств и регенеративной медицине. Например, клеточное разнообразие развивающихся органоидов головного мозга было использовано для моделирования генетической микроцефалии (Lancaster et al., 2013), чтобы определить потенциальные механизмы, с помощью которых вирус Зика приводит к микроцефалии (Dang et al. , 2016; Garcez et al. , 2016), а органоиды толстой кишки использовались для изучения мутационных стадий, лежащих в основе опухоли.
Клеточная организация органоидов может быть изучена на системном уровне благодаря достижениям в области функциональной геномики и протеомики, включая анализ отдельных клеток и высокопроизводительную транскриптомику, протеомику и крупномасштабную характеристику доменов хроматина и регуляторных элементов транскрипции.Этот уровень детального анализа трудно достичь с тканью человека, взятой на месте, и он обеспечит более полное понимание развития и клеточного состава органоидов. Более того, эта информация повысит их актуальность в качестве моделей для изучения морфологии, функций и заболеваний органов и откроет новые возможности в разработке лекарств и регенеративной медицине. Например, клеточное разнообразие развивающихся органоидов головного мозга было использовано для моделирования генетической микроцефалии (Lancaster et al., 2013), чтобы определить потенциальные механизмы, с помощью которых вирус Зика приводит к микроцефалии (Dang et al. , 2016; Garcez et al. , 2016), а органоиды толстой кишки использовались для изучения мутационных стадий, лежащих в основе опухоли.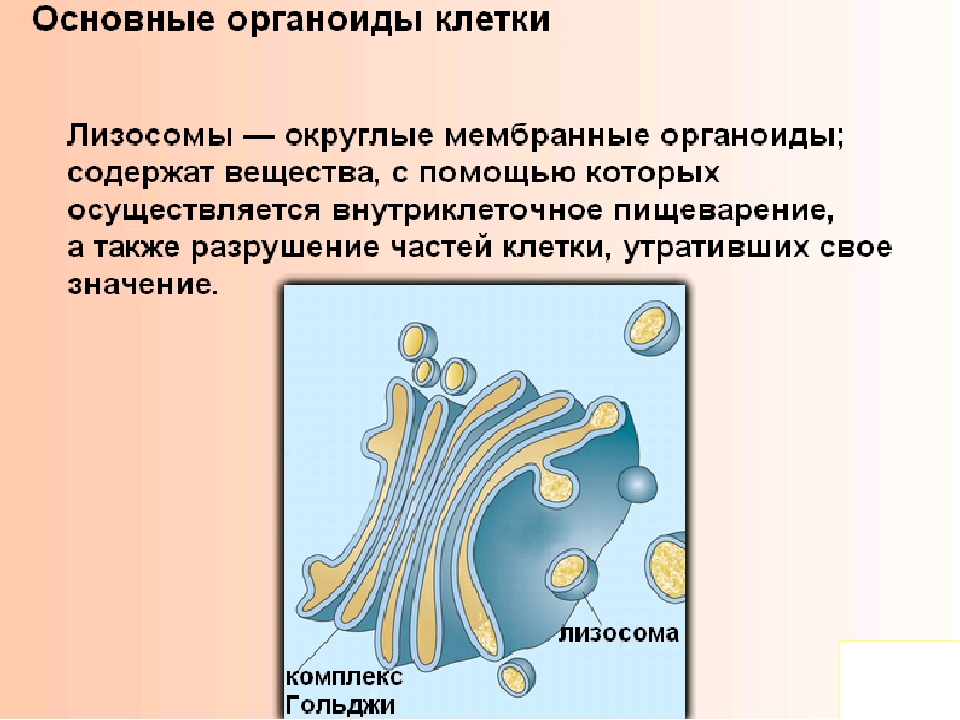 инициация и развитие (Drost et al. , 2017). Наконец, органоиды, полученные от пациентов, использовались для обобщения прогрессирования пигментного ретинита (Deng et al. , 2018), для изучения роли нейроглии в нейродегенеративном заболевании (Abud et al., 2017), а также для моделирования кистозного фиброза в органоидах дыхательных путей человека (McCauley et al. , 2017).
инициация и развитие (Drost et al. , 2017). Наконец, органоиды, полученные от пациентов, использовались для обобщения прогрессирования пигментного ретинита (Deng et al. , 2018), для изучения роли нейроглии в нейродегенеративном заболевании (Abud et al., 2017), а также для моделирования кистозного фиброза в органоидах дыхательных путей человека (McCauley et al. , 2017). Тканевая инженерия и регенеративная медицина
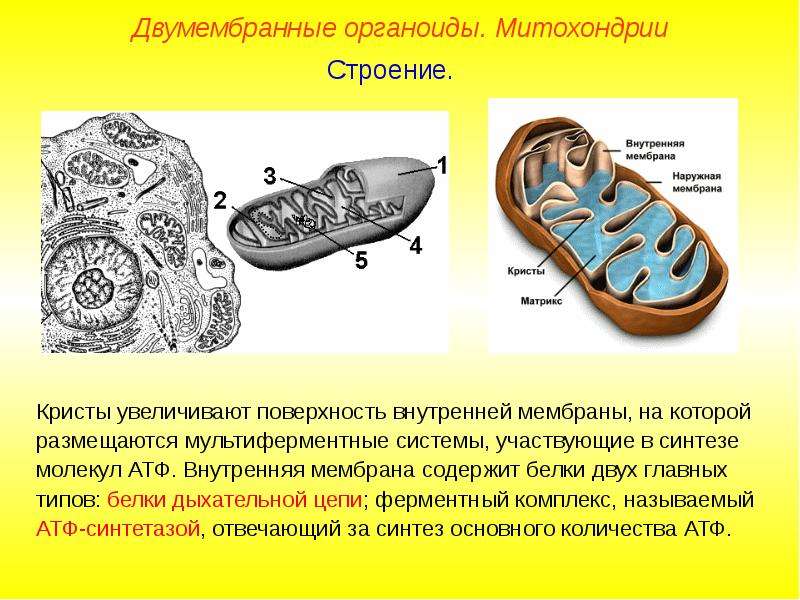 , 2011; Munera et al., 2017). Дополнительными тканями, которые, как было показано, обладают регенеративным потенциалом, являются легкие, кожа и волосы (Hirsch et al. , 2017). Другие исследователи изучают органоиды в качестве регенеративной терапии заболеваний печени (зачатки органов) и глаз (глазные бокалы) (Huch et al., 2017; Мандай и др. , 2017).
, 2011; Munera et al., 2017). Дополнительными тканями, которые, как было показано, обладают регенеративным потенциалом, являются легкие, кожа и волосы (Hirsch et al. , 2017). Другие исследователи изучают органоиды в качестве регенеративной терапии заболеваний печени (зачатки органов) и глаз (глазные бокалы) (Huch et al., 2017; Мандай и др. , 2017). Персонализированная медицина
Доклиническое моделирование заболеваний/лекарственный скрининг
 Эти расходы обусловлены главным образом высокой частотой неудачных попыток (∼88%) лекарств, которые тестируются на людях (DiMasi et al. , 2016). Таким образом, органоиды могут предоставить уникальную модель заболевания тканей человека для использования в тестах на лекарства или в доклинических моделях.Например, скрининг более 6000 одобренных лекарств в клетках-предшественниках коры головного мозга, полученных из hIPSC, выявил несколько соединений, которые обладали защитным действием при тестировании на органоидах головного мозга человека (Zhou et al. , 2017). В дополнение к потенциальному перепрофилированию существующих лекарств скрининг на основе органоидов также можно использовать для открытия новых мишеней для лекарств.
Эти расходы обусловлены главным образом высокой частотой неудачных попыток (∼88%) лекарств, которые тестируются на людях (DiMasi et al. , 2016). Таким образом, органоиды могут предоставить уникальную модель заболевания тканей человека для использования в тестах на лекарства или в доклинических моделях.Например, скрининг более 6000 одобренных лекарств в клетках-предшественниках коры головного мозга, полученных из hIPSC, выявил несколько соединений, которые обладали защитным действием при тестировании на органоидах головного мозга человека (Zhou et al. , 2017). В дополнение к потенциальному перепрофилированию существующих лекарств скрининг на основе органоидов также можно использовать для открытия новых мишеней для лекарств. Эти вопросы подробно обсуждаются ниже.
Эти вопросы подробно обсуждаются ниже. ВОСПРОИЗВОДИМОСТЬ В ИССЛЕДОВАНИЯХ ОРГАНОИДОВ
Генетическая и эпигенетическая изменчивость клеток человека
Выделение стволовых клеток из первичных тканей
Условия, при которых поддерживаются клеточные линии или стволовые клетки
Проведение анализов органоидов
Выводы и рекомендации
ПОИСК ТКАНЕЙ И СОГЛАСИЕ ПАЦИЕНТА НА ОРГАНОИДНЫЕ ИССЛЕДОВАНИЯ
Определение для сбора тканей
Ткань, все еще in situ, взята у живых или неживых людей
Ткань ex vivo
Регуляторные советы
Элементы согласия
Рекомендации для будущего сбора
ОБМЕН МАТЕРИАЛАМИ И РЕЗУЛЬТАТАМИ
Руководство по коммуникации и обмену
ОБУЧЕНИЕ ОРГАНОИДНЫМ ИССЛЕДОВАНИЯМ
Выводы и рекомендации
СВЯЗЬ С ОБЩЕСТВЕННОСТЬЮ
Сокращения, используемые:
ESC эмбриональных стволовых клеток GUID глобальные уникальные идентификаторы чЭСК человеческих эмбриональных стволовых клеток hIPSC человек индуцированных плюрипотентных стволовых клетка МКПС индуцированных плюрипотентных стволовых клеток ЭСО институциональной обзор платы IVF экстракорпоральное оплодотворение МТА перенос материала соглашение ККП плюрипотентных стволовая клетка. ССЫЛКИ
Frontiers | Применение органоидов мозга: от развития нейронов до неврологических заболеваний
Введение
Методологический прогресс в культуре органоидов мозга
Продленное время культивирования
Органоидная культура срезов мозга
Культура на микрофлюидных чипах
Васкуляризованные органоиды головного мозга
Специализированные мозговые органоиды
Применение органоидов мозга в качестве моделей заболеваний
Нарушения развития нервной системы
Первичная микроцефалия
Приобретенная микроцефалия
Лиссэнцефалия
Расстройства аутистического спектра
Перивентрикулярная гетеротопия
Неонатальная гипоксическая травма
Синдром Дауна
Нейродегенеративные расстройства
Болезнь Альцгеймера
Болезнь Паркинсона
Опухоль головного мозга
Инфекционные болезни ЦНС
Нейротропные вирусные инфекции
Церебральная малярия
Психическое заболевание
Шизофрения
Воздействие токсинов на ЦНС
Пренатальное воздействие
Пренатальное воздействие никотина
Пренатальное злоупотребление метамфетамином
Пренатальное воздействие каннабиса
Будущие проблемы органоидов мозга
Вклад авторов
Финансирование
Конфликт интересов
Каталожные номера
органоидов: специальный выпуск | Развитие
Этические аспекты исследований человеческих органоидов | Американский учитель биологии
Выдающиеся открытия в области исследования церебральных органоидов
. Ссылка
. Направленная дифференцировка телэнцефалических предшественников из эмбриональных стволовых клеток Watanabe et al. (2005) Самоорганизованное формирование поляризованных тканей коры из эмбриональных стволовых клеток (ЭСК) и активное управление ими с помощью внешних сигналов Eiraku et al.(2008) Церебральные органоиды моделируют развитие человеческого мозга и микроцефалию Lancaster et al. (2013) Выдающиеся открытия в исследованиях церебральных органоидов
. Ссылка
. Направленная дифференцировка телэнцефалических предшественников из эмбриональных стволовых клеток Watanabe et al. (2005) Самоорганизованное формирование поляризованных тканей коры из эмбриональных стволовых клеток (ЭСК) и активное управление ими с помощью внешних сигналов Eiraku et al.(2008) Церебральные органоиды моделируют развитие человеческого мозга и микроцефалию Lancaster et al. (2013) Пример вопроса: Примеры тем для обсуждения: Примеры тем для обсуждения:
