Формула серы в химии
Электронная формула серы
Атомная масса: 32,065 а.е.м.
Электронная формула: 1s2 2s2 2p6 3s23p4
Электронно-графическая формула атома серы
Электронно-графическая формула атома серы в основном и возбужденных состояниях с примерами соединений:
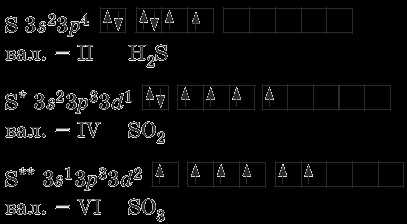
Атомы серы способны образовывать устойчивые цепочки. Такие гомоцепи имеют зигзагообразную форму, поскольку их образуют р-электроны соседних атомов, расположенные на взаимно перпендикулярных орбиталях. Цепи могут открытыми или замыкаться в циклы состава S20, S8, S6 и S 4.
Сера образует несколько десятков кристаллических и аморфных модификаций, которые отличаются составом молекул и полимерных цепей, а также спо собом их упаковки в твердом состоянии.
Основные аллотропные модификации серы:

В природе сера встречается в свободном состоянии (самородная сера) и в виде минералов (FeS2, ZnS, PbS и др.). Сера также присутст вует в нефти, природном угле, сланцах и природном газе. Присутствие сульфат-ионов в воде обуславливает ее постоянную жёсткость. Сера является жизненно важным элементом живых организмов, входит в состав белков.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Валентность серы (S), формулы и примеры
Общие сведения о валентности серы
При обычном давлении сера образует хрупкие кристаллы желтого цвета, плавящиеся при температуре 112,8oС. Плотность 2,07 г/см3. Нерастворима в воде, но довольно хорошо растворима в сероуглероде, бензоле и некоторых других жидкостях. При испарении этих жидкостей сера выделяется из раствора в виде прозрачных желтых кристалликов ромбической системы, имеющих форму октаэдров (ромбическая модификация).Если расплавленную серу медленно охлаждать и в тот момент, когда она частично затвердевает слить еще не успевшую застыть жидкость можно получить длинные темно-желтые игольчатые кристаллы моноклинной системы (моноклинная модификация). Плотность 1,96 г/см3. Температура плавления 119,3oС.
Валентность серы в соединениях
Сера — шестнадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Она находится в третьем периоде в VIA группе. В ядре атома серы содержится 16 протонов и 16 нейтронов (массовое число равно 32). В атоме серы есть три энергетических уровня, на которых находятся 16 электронов (рис. 1).
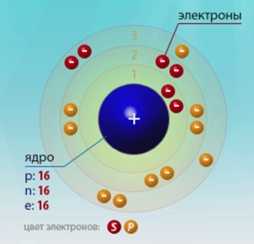
Рис. 1. Строения атома серы.
Электронная формула атома серы в основном состоянии имеет следующий вид:
1s22s22p63s23p4.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие двух неспаренных электронов свидетельствует о том, что сера способна проявлять валентность II в своих соединениях (H2SII).
Для атома серы характерно наличие нескольких возбужденных состояний из-за того, что орбитали 3d-подуровня являются вакантными (на третьем энергетическом слое помимо 3s- и 3p-подуровней есть еще и 3d-подуровень). Сначала распариваются электроны 3 p -подуровня и занимают свободные d-орбитали, а после – электроны 3s-подуровня:
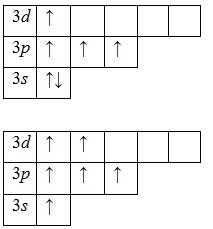
Наличие четырех и шести неспаренных электронов в возбужденном состоянии свидетельствует о том, что сера проявляет в своих соединениях валентности IV (SIVO2, H2SIVO3, Na2SIVO3) и VI (SVIO3, H2SVIO4, CaSVIO4).
Примеры решения задач
ru.solverbook.com
Строение атома серы (S), схема и примеры
Общие сведения о строении атома серы
Относится к элементам p-семейства. Неметалл. Элементы-неметаллы, входящие в эту группу, носят общее название халькогены. Обозначение – S. Порядковый номер – 16. Относительная атомная масса — 32,064 а.е.м.
Электронное строение атома серы
Атом серы состоит из положительно заряженного ядра (+16), состоящего из 16 протонов и 16 нейтронов, вокруг которого по 3-м орбитам движутся 16 электронов.
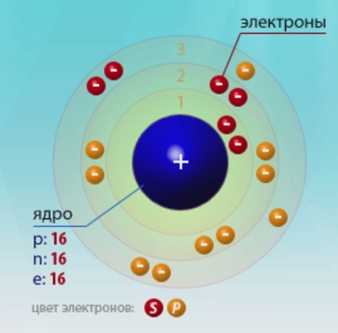
Рис.1. Схематическое строение атома серы.
Распределение электронов по орбиталям выглядит следующим образом:
+16S)2)8)6;
1s22s22p63s23p4.
На внешнем энергетическом уровне атома серы находится шесть электронов, все они считаются валентными. Энергетическая диаграмма принимает следующий вид:
Наличие двух неспаренных электронов свидетельствует о том, что сера способна проявлять степень окисления +2. Также возможно несколько возбужденных состояний из-за наличия вакантной 3d-орбитали. Сначала распариваются электроны 3 p -подуровня и занимают свободные d-орбитали, а после – электроны 3s-подуровня:
Этим объясняется наличие у серы ещё двух степеней окисления: +4 и +6.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
УГППУ Решение задач по химии Подробнее на сайте http://ugppuchemistry.my1.ru/
? LiveJournal- Find more
- Communities
- RSS Reader
- Shop
- Help
- Login
- CREATE BLOG Join
- English
(en)
- English (en)
- Русский (ru)
- Українська (uk)
- Français (fr)
- Português (pt)
- español (es)
- Deutsch (de)
- Italiano (it)
- Беларуская (be)
pilnikov-vp.livejournal.com
Охарактеризуйте валентные возможности атомов серы
Сера — химический элемент, расположенный в третьем периоде в VIA группе. Обозначение – S. Неметалл (входит в группу халькогенов), относится к элементам р-семейства. Порядковый номер – 16, значит заряд ядра атома равен (+16). В ядре атома серы содержится 16 протонов и 16 нейтронов (массовое число равно 32). В атоме серы есть три энергетических уровня, на которых находятся 16 электронов. Электронная конфигурация основного состояния серы имеет вид:
.
На внешнем энергетическом уровне серы находится 6 электронов, из которых всего два неспаренных. Однако, из-за наличия незаполненных орбиталей 3d-валентного уровня, при сильном возбуждении сначала электроны 3s-подуровня, а потом и 3p-подуровня могут распариваться и один из электронов пары способен занимать вакантную орбиталь 3d-подуровня. Т.е. для атома серы характерно два возбужденных состояния, в каждом из которых число неспаренных электронов равно четырем и шести соответственно. Общее количество валентных электронов в атоме серы равно шести.
При обычном давлении сера образует хрупкие кристаллы желтого цвета, плавящиеся при температуре . Плотность . Нерастворима в воде, но довольно хорошо растворима в сероуглероде, бензоле и некоторых других жидкостях. При испарении этих жидкостей сера выделяется из раствора в виде прозрачных желтых кристалликов ромбической системы, имеющих форму октаэдров (ромбическая модификация).
Если расплавленную серу медленно охлаждать и в тот момент, когда она частично затвердевает слить еще не успевшую застыть жидкость можно получить длинные темно-желтые игольчатые кристаллы моноклинной системы (моноклинная модификация). Плотность . Температура плавления .
ru.solverbook.com
Какое состояние атома называется основным, и какое – возбужденным? Чем ион отличается от нейтрального атома? Изобразите электронные формулы и схемы атома серы в основном и возбужденном состояниях, а также ионов S+4 и S-2.
Какое состояние атома называется основным, и какое – возбужденным? Чем ион отличается от нейтрального атома? Изобразите электронные формулы и схемы атома серы в основном и возбужденном состояниях, а также ионов S+4 и S-2.
Решение:
Атом не излучает и не поглощает энергию при движении электронов только по определенным (стационарным орбитам). Такое состояние атома называется устойчивым.
При поглощении атомом энергии он переходит из нормального (основного) в возбужденное состояние. При этом электроны удаляются от ядра, «перескакивая» на более дальние стационарные орбиты.
Размещение электронов по АО в пределах одного энергетического подуровня определяется правилом Хунда (суммарный спин данного подуровня должен быть максимальным). При любом другом размещении электронов атом будет находиться в возбужденном состоянии.
16S – 1s22s22p63s23p4 p-элемент
s p d
| n=3 | ↑↓ | ↑↓ | ↑ | ↑ | |||||
| n=2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||||
| n=1 | ↑↓ |
Основное состояние; В=2 (число неспаренных электронов)
При возбуждении:
S + hν → S*
16 S*
s p d
| n=3 | ↑↓ | ↑ | ↑ | ↑ | ↑ |
В=4
16 S*
s p d
| n=3 | ↑↓ | ↑ | ↑ | ↑ | ↑ | ↑ |
В=6
Ион от нейтрального атома отличается числом электронов.
S0 – 4 e → S+4
S+4 – 1s22s22p63s23p0
s p d
S0 + 2 e → S-2
S-2 – 1s22s22p63s23p6
s p d
| n=3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
einsteins.ru
Задачи по химии — контрольная работа
КОНТРОЛЬНАЯ
РАБОТА
по дисциплине «Химия»
Вариант
Сызрань, 2010.
Задача №16. Определите молярную
массу эквивалента и фактор эквивалентности
кислоты и основания, участвующих в реакции
нейтрализации. Уравнение реакции H3PO4 + NaOH = NaH2PO4 + 2H2O
Решение:
Фактор
эквивалентности кислоты
fэкв = —————————— ;
основность кислоты
молярная масса эквивалента Мэкв = fэкв . М
В
данном случае в фосфорной кислоте
замещается только 1 атом водорода, т.е.
она реагирует как
Задача
№35. Напишите
электронные формулы атомов серы и ванадия
в основном и в возбужденном состоянии.
Почему сера может проявлять только четную
валентность в своих соединениях?
Решение:
Сера – элемент 3-го периода, поэтому орбитали 1s, 2s и 2p заполнены целиком, и на них размещается 10 электронов. Порядковый номер серы 16, поэтому в её атоме 16 электронов. Оставшиеся 6 электронов занимают 3s и 3р – орбитали в соответствии с принципом наименьшей энергии. Таким образом, электронная формула серы в основном состоянии 1s22s22p63s23p4, или [Ne]3s23p4.
Графическая схема выглядит следующим образом:
| ↑↓ | ↑ | ↑ | |||||
| ↑↓ | |||||||
16S 3s 3p 3d
| ↑↓ | ↑↓ | ↑↓ |
| ↑↓ |
2s 2p
1s
В возбужденных состояниях электроны из спаренного состояния переходят на свободную орбиталь с более высокой энергией, в данном случае – 3d-орбиталь:
| ↑ | |||||||
| ↑ | ↑ | ↑ | |||||
| ↑↓ | |||||||
16S* 3s 3p 3d
| ↑↓ | ↑↓ | ↑↓ |
| ↑↓ |
2s 2p
1s
1s22s22p63s23p33d1 (однократно возбужденное состояние).
Дважды возбужденное состояние:
1s22s22p63s13p33d2
| ↑ | ↑ | ||||||
| ↑ | ↑ | ↑ | |||||
| ↑ | |||||||
16S** 3s 3p 3d
| ↑↓ | ↑↓ | ↑↓ |
| ↑↓ |
2s 2p
1s
Валентность
элемента (число образуемых его атомом
ковалентных связей) определяется числом
неспаренных электронов. В основном
состоянии атома серы их 2, в возбуждённых
– 4 и 6. Во всех состояниях число неспаренных
электронов чётное, поэтому сера проявляет
только чётную валентность (2, 4 и 6).
Ванадий – элемент 4-го периода, поэтому у него полностью заняты орбитали 1s, 2s, 2p, 3s, 3p. На них размещаются 18 электронов. Порядковый номер ванадия 23, поэтому на следующих по порядку заполнения орбиталях 4s и 3d остаётся разместить еще 5 электронов. Таким образом, электронная формула атома ванадия в основном состоянии 1s22s22p63s23p64s23d3, или [Ar]3d34s2. 3d-электроны, в соответствии с правилом Хунда, неспаренные. Графическая схема:
4s
| ↑ | ↑ | ↑ | |||||
| ↑↓ | ↑↓ | ↑↓ | |||||
| ↑↓ | |||||||
23V 3s 3p 3d
| ↑↓ | ↑↓ | ↑↓ |
| ↑↓ |
2s 2p
1s
(Рекомендация. Энергия 4s-орбитали чуть ниже, чем 3d, поэтому её лучше нарисовать ниже).
В возбуждённом состоянии 1 электрон с 4s-орбитали перейдёт на свободную 3d-орбиталь: 23V* 1s22s22p63s23p64s13d4 .
Графическая схема:
4s
| ↑ | ↑ | ↑ | ↑ | ||||
| ↑↓ | ↑↓ | ↑↓ | |||||
| ↑↓ | |||||||
23V* 3s 3p 3d
| ↑↓ | ↑↓ | ↑↓ |
| ↑↓ |
2s 2p
1s
Задача
№56. Назовите
самый активный металл и неметалл и дайте
объяснение, исходя из электронного строения
атома и его расположения в Периодической
системе Д.И.Менделеева.
Решение:
Самые активные металлы – щелочные. Они находятся в 1 группе, главной подгруппе Периодической системы (IA). В атомах этих элементов всего 1 электрон на внешнем уровне, радиус этих атомов максимальный среди всех элементов периода, а заряд ядра – минимальный в периоде. Поэтому валентный электрон связан слабо и атом легко его отдаёт, превращаясь в положительно заряженный ион, что и является проявлением металлических свойств.
В подгруппе с увеличением номера периода (т.е. сверху вниз) металлические свойства усиливаются, так как растёт радиус атома и число электронных слоёв, экранирующих валентный электрон от притяжения ядра. Поэтому самым активным металлом будет франций, а из стабильных элементов – цезий.
Самые
активные неметаллы – галогены,
которые расположены в 7 группе, главной
подгруппе (VIIA). У атомов этих элементов
7 электронов на внешнем уровне, т.е. до
завершения его заполнения не хватает
только одного электрона, радиус атома
наименьший в периоде, а заряд ядра – наибольший
(не считая инертных газов). Поэтому атомы
галогенов легко присоединяет электрон,
превращаясь в отрицательно заряженный
ион, в чём и заключаются неметаллические
свойства. Эти свойства ослабевают с увеличением
номера периода из-за увеличения радиуса
атома и экранирования валентных электронов
внутренними электронными оболочками,
поэтому самый активный неметалл – фтор.
Задача
№75. Каковы
особенности металлической связи?
Решение:
Особенности металлической связи.
Электроны, осуществляющие такую связь, делокализованы, т.е. могут свободно перемещаться в пределах кристаллической решётки, в том числе направленно – в электрическом поле, вследствие чего металлы проводят электрический ток. По той же причине при механической деформации металла не происходит разрыва химических связей, поэтому металлы способны к пластической деформации (обладают ковкостью).
Металлическая связь, в отличие от ковалентной, не обладает направленностью, поэтому взаимное расположение атомов в кристалле с металлической связью определяется в основном геометрическими факторами (принцип плотнейшей упаковки), а не их электронным строением.
Задача
№96. Вычислите
энтальпию образования оксида фосфора
(V), если при сгорании 4 г фосфора выделяется
97,2 кДж.
Решение:
Энтальпия образования вещества (∆Нобр) – это тепловой эффект образования 1 моля этого вещества из простых веществ. ∆Н > 0, если теплота поглощается, и меньше 0, если теплота выделяется.
Уравнение реакции образования 1 моля оксида фосфора (V) :
2Р + 2,5О2 = Р2О5
Это же уравнение является уравнением сгорания 2 молей фосфора (так как коэффициент перед формулой фосфора равен 2). Найдём массу 2 моль фосфора: m = n . M =
= 2 моль . 31 г/моль = 62 г.
Составим пропорцию:
При сгорании 4 г фосфора выделяется 97,2 кДж;
При сгорании 62 г – х кДж
62 г . 97,2 кДж
Отсюда х = ——————— = 1506,6 кДж.
Таким образом, ∆Нобр(Р2О5) = -1506,6 кДж/моль.
Задача №115. Химическая реакция
протекает по уравнению: 2SO2+ O2 = 2SO3. Иcходные
концентрации SO2 и О2 соответственно
равны 0,4 и 0,2 моль/л . Через некоторое время
концентрация SO2 уменьшилась на 0,2 моль/л.
Определите равновесные концентрации
всех веществ.
Решение:
Согласно уравнению реакции, 2 моль SO2 вступают в реакцию с 1 моль кислорода и при этом образуется 2 моль SO3. Соответственно, если израсходовалось 0,2 моль/л SO2, то израсходовалось 0,1 моль/л кислорода и образовалось 0,2 моль/л SO3. Равновесные концентрации исходных веществ найдём как разность начальной и израсходованной концентрации. SO3 в начальный момент не было, поэтому его равновесная концентрация равна образовавшейся в ходе реакции:
freepapers.ru
