Азот — урок. Химия, 8–9 класс.
Химический элемент
Азот — химический элемент № \(7\). Он расположен в VА группе Периодической системы химических элементов.
N7+7)2e)5e
На внешнем слое атома азота содержатся пять валентных электронов, до его завершения не хватает трёх электронов. Поэтому в соединениях с металлами и водородом азоту характерна степень окисления \(–3\), а при взаимодействии с более электроотрицательными кислородом и фтором он проявляет положительные степени окисления от \(+1\) до \(+5\).
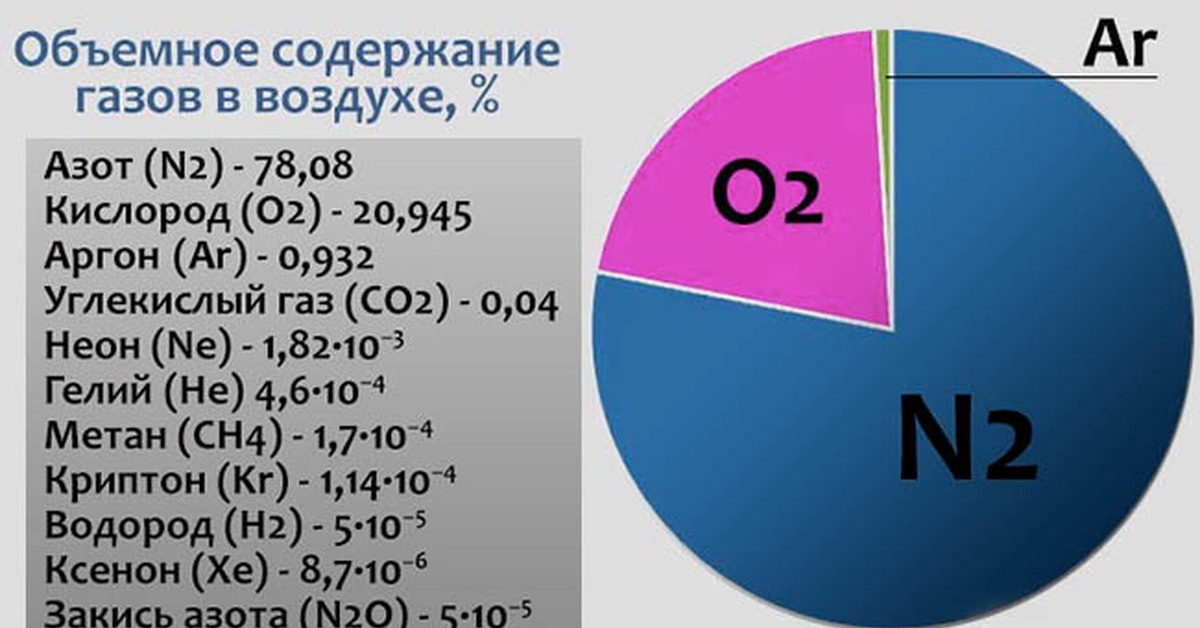
Азот в виде простого вещества содержится в воздухе. Его объёмная доля составляет \(78\) %. В земной коре соединения азота встречаются редко. Известно месторождение нитрата натрия NaNO3 (чилийская селитра).
Азот относится к жизненно важным элементам, так как входит в состав молекул белков и нуклеиновых кислот.
Простое вещество
Молекулы простого вещества состоят из двух атомов, связанных прочной тройной связью:
N:::N. …, N≡N.
…, N≡N.
При обычных условиях азот — бесцветный газ без запаха и вкуса, малорастворимый в воде.
Не ядовит.
Азот химически малоактивен из-за прочной тройной связи и в химические реакции вступает только при высоких температурах.
При комнатной температуре он реагирует только с литием с образованием нитрида лития:
6Li0+N20=2Li+13N−3.
При нагревании образует нитриды и с некоторыми другими металлами:
3Ca+N2=tCa3N2.
С водородом азот реагирует только при высоком давлении, повышенной температуре и в присутствии катализатора. В реакции образуется аммиак:
N20+3h30⇄t,p,k2N−3h4+1.
В реакциях с металлами и водородом азот проявляет окислительные свойства.
Восстановительные свойства азота проявляются в реакции с кислородом:
N20+O20⇄t2N+2O−2.
Реакция возможна только при очень высокой температуре (\(3000\) °С) и частично протекает в атмосфере во время грозы. Образуется оксид азота(\(II\)).
Применение и получение
Большое количество азота используется для получения аммиака и азотных удобрений.
Применяется он для создания инертной среды при проведении химических реакций. Жидкий азот находит применение в медицине, используется для охлаждения в химических и физических исследованиях.
Чистый азот получают из воздуха.
РИА Новости — события в Москве, России и мире: темы дня, фото, видео, инфографика, радио
«Веселящий газ» — закись азота (гемиоксид азота). Представляет собой смесь кислорода и оксида азота (N2О). Его формула была получена в 1772 1774 годах английским физиком, философом и протестантским священником Джозефом Пристли (1733-1804).
Представляет собой смесь кислорода и оксида азота (N2О). Его формула была получена в 1772 1774 годах английским физиком, философом и протестантским священником Джозефом Пристли (1733-1804).
Закись азота — это бесцветный газ со слабым запахом и сладковатым вкусом, тяжелее воздуха (относительная плотность 1,527). Растворим в воде (1:2). При 0°C и давлении 30 атмосфер, а также при обычной температуре и давлении 40 атмосфер сгущается в бесцветную жидкость. Из одного килограмма жидкой закиси азота образуется 500 литров газа. Закись азота не воспламеняется, но поддерживает горение. Смеси с эфиром, циклопропаном, хлорэтилом в определенных концентрациях взрывоопасны.
Гемиоксид азота назван «веселящим газом» английским химиком Хэмфри Дэви, который, изучая на себе действие закиси азота (1799), обнаружил в начальной фазе возбуждение, сопровождающееся смехом и беспорядочными телодвижениями, в последующем потерю сознания.
Малые концентрации закиси азота вызывают чувство опьянения и легкую сонливость. При вдыхании чистого газа быстро развиваются наркотическое состояние и асфиксия. В смеси с кислородом при правильном дозировании вызывает наркоз без предварительного возбуждения и побочных явлений. Закись азота не вызывает раздражения дыхательных путей. В организме она почти не изменяется, с гемоглобином не связывается; находится в растворенном состоянии в плазме. После прекращения вдыхания выделяется (полностью через 10 15 мин) через дыхательные пути в неизмененном виде. В медицине применяют в смеси с кислородом как средство для ингаляционного наркоза при хирургических операциях, родах, иногда при инфаркте миокарда.
При вдыхании чистого газа быстро развиваются наркотическое состояние и асфиксия. В смеси с кислородом при правильном дозировании вызывает наркоз без предварительного возбуждения и побочных явлений. Закись азота не вызывает раздражения дыхательных путей. В организме она почти не изменяется, с гемоглобином не связывается; находится в растворенном состоянии в плазме. После прекращения вдыхания выделяется (полностью через 10 15 мин) через дыхательные пути в неизмененном виде. В медицине применяют в смеси с кислородом как средство для ингаляционного наркоза при хирургических операциях, родах, иногда при инфаркте миокарда.
После введения в России с 1 июня 2012 года запрета на безрецептурную продажу комбинированных лекарственных препаратов, содержащих кодеин или его соли, психоактивное вещество закись азота стало популярным у токсикоманов.Они употребляют его ингаляционно, в основном с использованием воздушных шариков, заполненных закисью азота.
Вещество распространяется в основном в ночных клубах с лета 2012 года. По словам главного нарколога Минздрава РФ Евгения Брюна, медики пока не знают, какие последствия могут быть от употребления этого вещества, и как возникает зависимость от него.
По словам главного нарколога Минздрава РФ Евгения Брюна, медики пока не знают, какие последствия могут быть от употребления этого вещества, и как возникает зависимость от него.
Признаки употребления закиси азота:
При краткосрочном применении — глупое поведение, беспричинный безудержный смех, головокружение, частые головные боли, частые падения в обморок и частые потери сознания.
При долгосрочном применении кратковременная амнезия, эмоциональая неустойчивость, нарушение мыслительных процессов, ухудшение слуха и осязания, шаткая походка, невнятность речи, постепенная атрофия мозга.
характеристика, химические свойства, физические свойства, соединения, место в природе.
АЗОТ, N (лат. Nitrogenium * а. nitrogen; н. Stickstoff; ф. azote, nitrogene; и. nitrogeno), — химический элемент V группы периодической системы Менделеева, атомный номер 7, атомная масса 14,0067. Открыт в 1772 английским исследователем Д. Резерфордом.
Свойства азота
При обычных условиях азот — газ без цвета и запаха. Природный азот состоит из двух стабильных изотопов: 14N (99,635%) и 15N (0,365%). Молекула азота двухатомная; атомы связаны ковалентной тройной связью NN. Диаметр молекулы азота, определённый разными способами, 3,15-3,53 А. Молекула азота очень устойчива — энергия диссоциации 942,9 кДж/моль.
Природный азот состоит из двух стабильных изотопов: 14N (99,635%) и 15N (0,365%). Молекула азота двухатомная; атомы связаны ковалентной тройной связью NN. Диаметр молекулы азота, определённый разными способами, 3,15-3,53 А. Молекула азота очень устойчива — энергия диссоциации 942,9 кДж/моль.
Молекулярный азот
Константы молекулярного азота: f плавления — 209,86°С, f кипения — 195,8°С; плотность газообразного азота 1,25 кг/ м3, жидкого — 808 кг/м3.
Характеристика азота
В твёрдом состоянии азот существует в двух модификациях: кубической а-форме с плотностью 1026,5 кг/м3 и гексагональной b-форме с плотностью 879,2 кг/м3. Теплота плавления 25,5 кДж/кг, теплота испарения 200 кДж/кг. Поверхностное натяжение жидкого азота в контакте с воздухом 8,5•10-3 Н/м; диэлектрическая проницаемость 1,000538. Растворимость азота в воде (см3 на 100 мл Н2О): 2,33 (0°С), 1,42 (25°С) и 1,32 (60°С).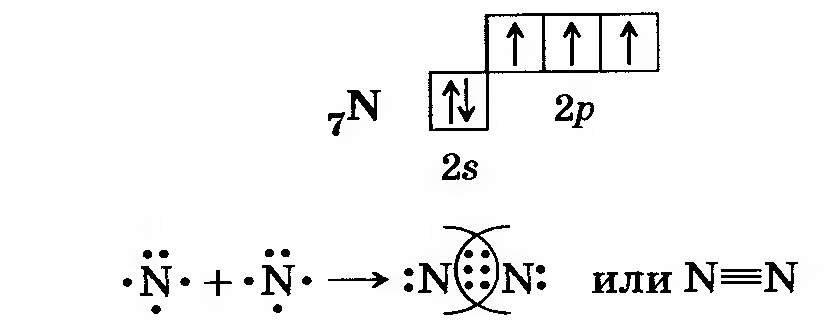 Внешняя электронная оболочка атома азота состоит из 5 электронов. Степени окисления азота меняются от 5 (в N2О5) до -3 (в NH3).
Внешняя электронная оболочка атома азота состоит из 5 электронов. Степени окисления азота меняются от 5 (в N2О5) до -3 (в NH3).
Соединение азота
Азот при нормальных условиях может реагировать с соединениями переходных металлов (Ti, V, Mo и др.), образуя комплексы либо восстанавливаясь с образованием аммиака и гидразина. С такими активными металлами, как литий, кальций, магний, азот взаимодействует при нагревании до сравнительно невысоких температур. С большинством других элементов азот реагирует при высокой температуре и в присутствии катализаторов. Хорошо изучены соединения азота с кислородом: N С серой также не происходит непосредственного соединения азота. При взаимодействии раскалённого кокса с азотом образуется циан (CN)2. При действии на обычный азот электрических разрядов, а также при электрических разрядах в воздухе может образоваться активный азот, представляющий собой смесь молекул и атомов азота, обладающих повышенным запасом энергии. Активный азот весьма энергично взаимодействует с кислородом, водородом, парами серы, фосфором и некоторыми металлами.
С серой также не происходит непосредственного соединения азота. При взаимодействии раскалённого кокса с азотом образуется циан (CN)2. При действии на обычный азот электрических разрядов, а также при электрических разрядах в воздухе может образоваться активный азот, представляющий собой смесь молекул и атомов азота, обладающих повышенным запасом энергии. Активный азот весьма энергично взаимодействует с кислородом, водородом, парами серы, фосфором и некоторыми металлами.
Азот — один из самых распространённых элементов на Земле, причём основная его масса (около 4•1015 т) сосредоточена в свободном состоянии в атмосфере. Ежегодно при вулканической деятельности в атмосферу выделяется 2•106 т азота. Незначительная часть азота концентрируется в литосфере (среднее содержание в литосфере 1,9•10-3%). Природные соединения азота — хлористый аммоний и различные нитраты (селитры). Нитриды азота могут образовываться только при высоких температурах и давлениях, что, по-видимому, имело место на самых ранних стадиях развития Земли.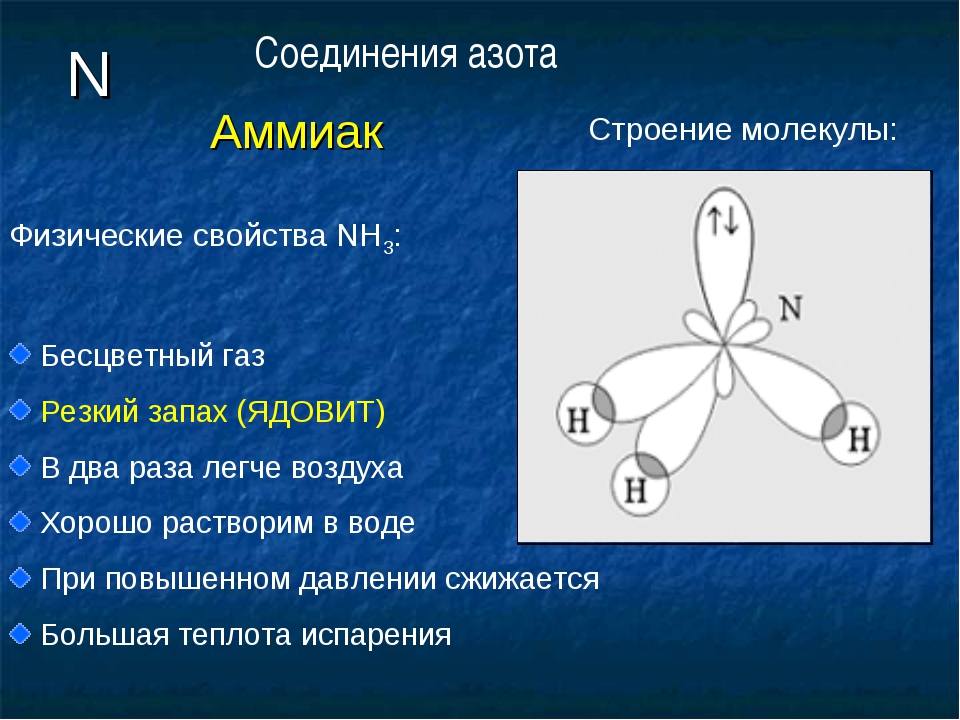 Крупные скопления селитры встречаются только в условиях сухого пустынного климата (Чили, Индия, Египет, Испания и др.). Небольшие количества связанного азота находятся в каменном угле (1-2,5%) и нефти (0,02-1,5%), а также в водах рек, морей и океанов. Азот накапливается в почвах (0,1 %) и живых организмах (0,3%). Азот входит в состав белковых молекул и многих естественных органических соединений.
Крупные скопления селитры встречаются только в условиях сухого пустынного климата (Чили, Индия, Египет, Испания и др.). Небольшие количества связанного азота находятся в каменном угле (1-2,5%) и нефти (0,02-1,5%), а также в водах рек, морей и океанов. Азот накапливается в почвах (0,1 %) и живых организмах (0,3%). Азот входит в состав белковых молекул и многих естественных органических соединений.
Круговорот азота в природе
В природе осуществляется круговорот азота, который включает цикл молекулярного атмосферного азота в биосфере, цикл в атмосфере химически связанного азота, круговорот захоронённого с органическим веществом поверхностного азота в литосфере с возвратом его обратно в атмосферу. Азот для промышленности ранее добывался целиком из месторождений природных селитр, число которых в мире весьма ограничено. Особенно крупные залежи азота в виде азотнокислого натрия находятся в Чили; добыча селитры в отдельные годы составляла более 3 млн. т.
Применение азота
Азот получают главным образом разделением предварительно сжиженного воздуха, который затем подвергается разгонке.
Азот. Химия азота и его соединений
1. Положение азота в периодической системе химических элементов
 Строение атома азота
Строение атома азота 3. Физические свойства и нахождение в природе
4. Строение молекулы
5. Соединения азота
6. Способы получения
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и кремнием
7.1.3. Взаимодействие с водородом и фосфором
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с активными металлами
Аммиак
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с серной кислотой
3.2. Взаимодействие с азотной кислотой
3.3. Взаимодействие с солями
Соли аммония
Способы получения солей аммония
Химические свойства солей аммония
Оксиды азота
1. Оксид азота (I)
2. Оксид азота (II)
3. Оксид азота (III)
5. Оксид азота (V)
Азотная кислота
1. Строение молекулы и физические свойства
Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация азотной кислоты
2.3. Взаимодействие с основными и амфотерными оксидами и гидроксидами
2.4. Вытеснение более слабых кислот из солей
2.5. Взаимодействие с металлами
2.6. Взаимодействие с неметаллами
2.7. Окисление сложных веществ
2.8. Взаимодействие с белками
Азотистая кислота
Соли азотной кислоты — нитраты
Соли азотистой кислоты — нитриты
Азот
Положение в периодической системе химических элементов
Азот расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение азота
Электронная конфигурация азота в основном состоянии:
Атом азота содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом азота может образовать 3 связи по обменному механизму и 1 связь по донорно-акцепторному механизму. Таким образом, максимальная валентность азота в соединениях равна IV. Также характерная валентность азота в соединениях — III.
Следовательно, атом азота может образовать 3 связи по обменному механизму и 1 связь по донорно-акцепторному механизму. Таким образом, максимальная валентность азота в соединениях равна IV. Также характерная валентность азота в соединениях — III.
Степени окисления атома азота – от -3 до +5. Характерные степени окисления азота -3, 0, +1, +2, +3, +4, +5.
Физические свойства и нахождение в природе
Азот в природе существует в виде простого вещества газа N2. Нет цвета, запаха и вкуса. Молекула N2 неполярная, следовательно, в воде азот практически нерастворим.
Азот – это основной компонент воздуха (79% по массе). В земной коре азот встречается в основном в виде нитратов. Входит в состав белков, аминокислот и нуклеиновых кислот в живых организмах.
Строение молекулы
Связь между атомами в молекуле азота – тройная, т. к. у каждого атома в молекуле по 3 неспаренных электрона. Одна σ-связь (сигма-связь) и две — π-связи.
к. у каждого атома в молекуле по 3 неспаренных электрона. Одна σ-связь (сигма-связь) и две — π-связи.
Структурная формула молекулы азота:
Структурно-графическая формула молекулы азота: N≡N.
Схема перекрывания электронных облаков при образовании молекулы азота:
Соединения азота
Типичные соединения азота:
| Степень окисления | Типичные соединения |
| +5 | оксид азота (V) N2O5 азотная кислота HNO3 нитраты MeNO3 |
| +4 | оксид азота (IV) NO2 |
| +3 | оксид азота (III) азотистая кислота нитриты MeNO2 |
| +2 | оксид азота (II) NO |
| +1 | оксид азота (I) |
| -3 | аммиак NH3 нитриды металлов MeN бинарные соединения азота с неметаллами |
Способы получения азота
1. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды. В колбу наливают раствор хлорида аммония, а капельную воронку раствор нитрита натрия. При приливании нитрита натрия в колбу начинается выделение азота. Собирают выделяющийся азот в цилиндр. Горящая лучинка в атмосфере азота гаснет.
Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды. В колбу наливают раствор хлорида аммония, а капельную воронку раствор нитрита натрия. При приливании нитрита натрия в колбу начинается выделение азота. Собирают выделяющийся азот в цилиндр. Горящая лучинка в атмосфере азота гаснет.
NaNO2 + NH4Cl → NH4NO2 + NaCl
NH4NO2 → N2 + 2H2O
Суммарное уравнение процесса:
NaNO2 + NH4Cl → N2 + NaCl + 2H2O
Видеоопыт взаимодействия нитрита натрия с хлоридом аммония можно посмотреть здесь.
Азот также образуется при горении аммиака:
4NH3 + 3O2 → 2N2 + 6H2O
2. Наиболее чистый азот получают разложением азидов щелочных металлов.
Наиболее чистый азот получают разложением азидов щелочных металлов.
Например, разложением азида натрия:
2NaN3 → 2Na + 3N2
3. Еще один лабораторный способ получения азота — восстановление оксида меди (II) аммиаком при температуре ~700 °C:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
В промышленности азот получают, буквально, из воздуха. При промышленном производстве очень важно, чтобы сырье было дешевым и доступным. Воздуха много и он пока бесплатный.
Используются различные способы выделения азота из воздуха — адсорбционная технология, мембранная и криогенная технологии.
Адсорбционные методы разделения воздуха на компоненты основаны на разделения газовых сред в азотных установках лежит явление связывания твёрдым веществом, называемым адсорбентом, отдельных компонентов газовой смеси.
Основным принципом работы мембранных систем является разница в скорости проникновения компонентов газа через вещество мембраны. Движущей силой разделения газов является разница парциальных давлений на различных сторонах мембраны.
В основе работы криогенных установок разделения воздуха лежит метод разделения газовых смеси, основанный на разности температур кипения компонентов воздуха и различии составов находящихся в равновесии жидких и паровых смесей.
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами.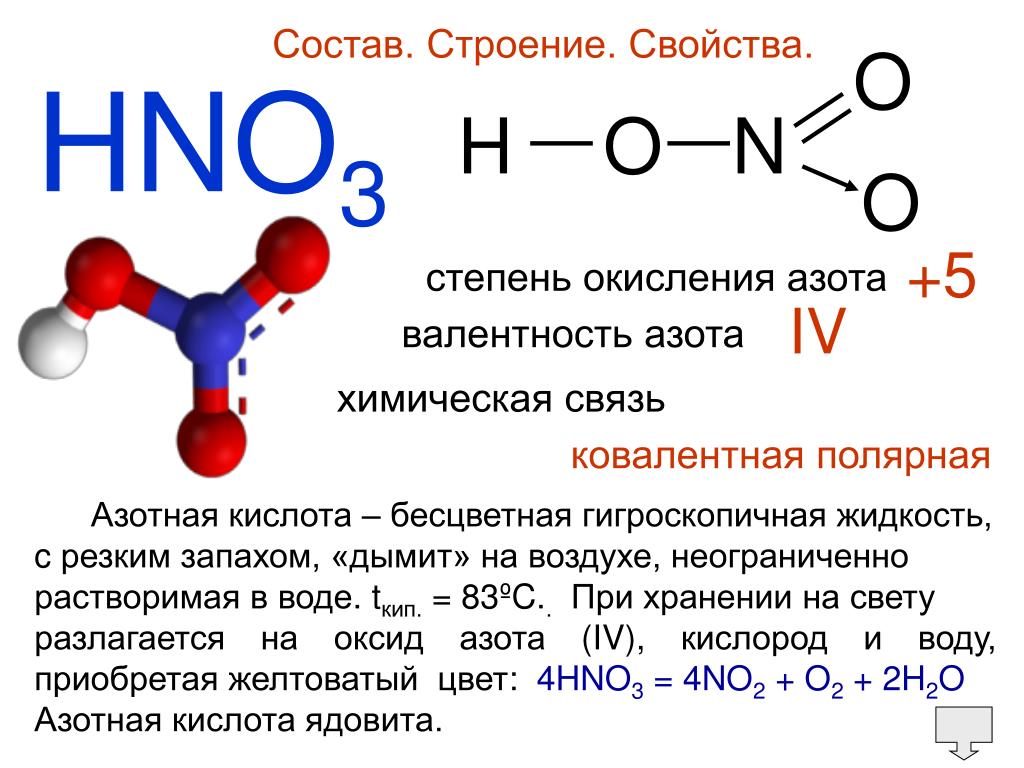
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000оС), на электрической дуге (в природе – во время грозы):
N2 + O2 ⇄ 2NO – Q
Процесс эндотермический, т.е. протекает с поглощением теплоты.
1.2. При сильном нагревании (2000оС или действие электрического разряда) азот реагирует с серой, фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С + N2 → N≡C–C≡N
1.3. Азот взаимодействует с водородом при высоком давлении и высокой температуре ,в присутствии катализатора. При этом образуется аммиак:
N2 + ЗН2 ⇄ 2NH3
Этот процесс экзотермический, т. е. протекает с выделением теплоты.
е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
Например, литий реагирует с азотом с образованием нитрида лития:
N2 + 6Li → 2Li3N
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например, азот окисляет гидрид лития:
N2 + 3LiH → Li3N + NH3
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида.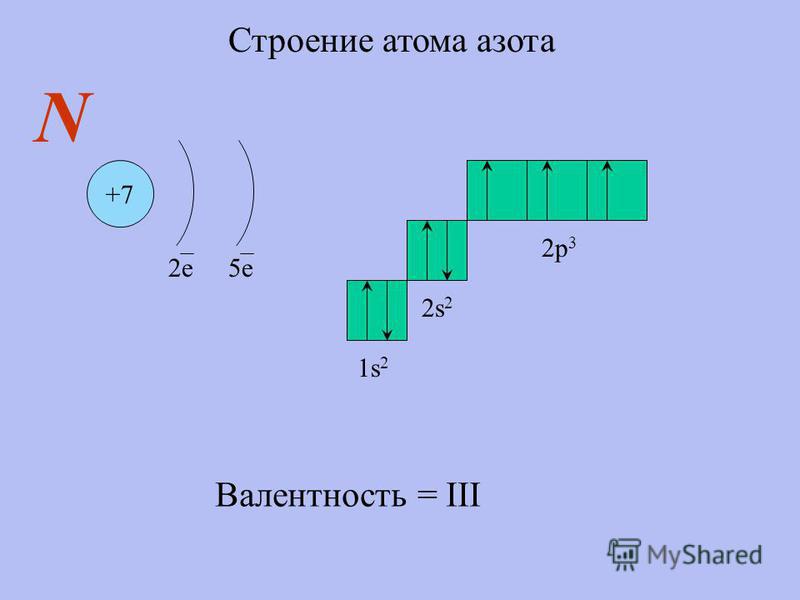 Валентный угол H-N-H составляет 107,3о:
Валентный угол H-N-H составляет 107,3о:
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск
ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
:NH3 + H2O ⇄ NH4+ + OH–
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – амминокомплексы.
Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – амминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
При этом азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка.
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами. Реакции подробно описаны выше.
Соли аммония можно получить взаимодействием аммиака с кислотами. Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например, хлорид аммония реагирует с нитратом серебра:
NH4Cl + AgNO3 → AgCl + NH4NO3
3. Средние соли аммония можно получить из кислых солей аммония. При добавлении аммиака кислая соль переходит в среднюю.
Например, гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
NH4НCO3 + NH3 → (NH4)2CO3
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты, почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4+ + Cl–
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями, если в продуктах образуется газ, осадок или образуется слабый электролит.
Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями, если в продуктах образуется газ, осадок или образуется слабый электролит.
Например, карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
Соли аммония реагируют с щелочами с образованием аммиака.
Например, хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону, т.к. гидроксид аммония — слабое основание:
NH4Cl + Н2O ↔ NH3 ∙ H2O + HCl
NH4+ + HOH ↔ NH3 ∙ H2O + H+
4. При нагревании соли аммония разлагаются. При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
NH4Cl → NH3 + HCl
NH4HCO3 → NH3 + CO2 + H2O
(NH4)2SO4 → NH4HSO4 + NH3
NH4HS → NH3 + H2S
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
Так протекает разложение нитрата, нитрита и дихромата аммония:
NH4NO2 → N2 + 2H2O
190 – 245° C:
NH4NO3 → N2O + 2H2O
При температуре 250 – 300°C:
2NH4NO3 → 2NO + 4H2O
При температуре выше 300°C:
2NH4NO3 → 2N2 + O2 + 4H2O
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (I)
Оксид азота (I) – это несолеобразующий оксид. Малые концентрации закиси азота вызывают лёгкое опьянение (отсюда название — «веселящий газ»). При вдыхании чистого газа быстро развиваются состояние опьянения и сонливость. Закись азота обладает слабой наркотической активностью, в связи с чем в медицине её применяют в больших концентрациях. В смеси с кислородом при правильном дозировании (до 80 % закиси азота) вызывает хирургический наркоз.
Малые концентрации закиси азота вызывают лёгкое опьянение (отсюда название — «веселящий газ»). При вдыхании чистого газа быстро развиваются состояние опьянения и сонливость. Закись азота обладает слабой наркотической активностью, в связи с чем в медицине её применяют в больших концентрациях. В смеси с кислородом при правильном дозировании (до 80 % закиси азота) вызывает хирургический наркоз.
Строение молекулы оксида азота (I) нельзя описать методом валентных связей. Так как оксид азота (I) состоит из двух, так называемых резонансных структур, которые переходят одна в другую:
Общую формулу в таком случае можно задать, обозначая изменяющиеся связи в резонансных структурах пунктиром:
Получить оксид азота (I) в лаборатории можно разложением нитрата аммония:
NH4NO3 → N2O + 2H2O
Химические свойства оксида азота (I):
1. При нормальных условиях оксид азота (I) инертен. При нагревании проявляет свойства окислителя. Оксид азота (I) при нагревании окисляет водород, аммиак, металлы, сернистый газ и др. При этом азот восстанавливается в простое вещество.
При нормальных условиях оксид азота (I) инертен. При нагревании проявляет свойства окислителя. Оксид азота (I) при нагревании окисляет водород, аммиак, металлы, сернистый газ и др. При этом азот восстанавливается в простое вещество.
N2O + H2 → N2 + H2O
N2O + Mg → N2 + MgO
N2O + 2Cu → N2 + Cu2O
3N2O + 2NH3 → 4N2 + 3H2O
N2O + H2O + SO2 → N2 + H2SO4
Еще пример: оксид азота (I) окисляет углерод и фосфор при нагревании:
N2O + C → N2 + CO
5N2O + 2Р → 5N2 + Р2O5
2. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя.
При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя.
Например, N2O окисляется раствором перманганата в серной кислоте:
5N2O + 3H2SO4 + 2KMnO4 → 10NO + 2MnSO4 + K2SO4 + 3H2O
Оксид азота (II)
Оксид азота (II) – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения.
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Например, при действии 30 %-ной азотной кислоты на медь образуется NO:
3Cu + HNO3(разб. ) → 3Cu(NO3)2 + 2NO + 4H2O
) → 3Cu(NO3)2 + 2NO + 4H2O
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
3FeCl2 + NaNO3 + 4HCl → 3FeCl3 + NaCl + NO + 2H2O
2HNO3 + 6HI → 2NO + I2 + 4H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
N2 + O2 → 2NO
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака:
4NH3 + 5O2 → 4NO + 6H2O
Химические свойства.
1. Оксид азота (II) легко окисляется под действием окислителей.
Например, горит в атмосфере кислорода:
2NO + O2 → 2NO2
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
NO + O3 → NO2 + O2
2. В присутствии более сильных восстановителей проявляет свойства окислителя. В атмосфере оксида азота (II) могут гореть водород, углерод и т.п.
Например, оксид азота (II) окисляет водород и сернистый газ:
2NO + 2H2 → N2 + 2H2O
2NO + 2SO2 → 2SO3 + N2
Оксид азота (III)
Оксид азота (III), азотистый ангидрид – кислотный оксид. За счет азота со степенью окисления +3 проявляет восстановительные и окислительные свойства. Устойчив только при низких температурах, при более высоких температурах разлагается.
За счет азота со степенью окисления +3 проявляет восстановительные и окислительные свойства. Устойчив только при низких температурах, при более высоких температурах разлагается.
Способы получения: можно получить при низкой температуре из оксидов азота:
NO2 + NO ↔ N2O3
Химические свойства:
1. Оксид азота (III) взаимодействует с водой с образованием азотистой кислоты:
N2O3 + H2O ↔ 2HNO2
2. Оксид азота (III) взаимодействует с основаниями и основными оксидами:
Например, оксид азота (III) реагирует с гидроксидом и оксидом натрия с образованием нитрита натрия и воды:
N2O3 + 2NaOH → 2NaNO2 + H2O
N2O3 + Na2O → 2NaNO2
Оксид азота (IV)
Оксид азота (IV) — бурый газ. Очень ядовит! Для NO2 характерна высокая химическая активность.
Очень ядовит! Для NO2 характерна высокая химическая активность.
Способы получения.
1. Оксид азота (IV) образуется при окислении оксида азота (I) и оксида азота (II) кислородом или озоном:
2NO + O2 → 2NO2
2. Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
Например, при действии концентрированной азотной кислоты на медь:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
3. Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Например, при разложении нитрата серебра:
2AgNO3 → 2Ag + 2NO2 + O2
Химические свойства.
1. Оксид азота (IV) реагирует с водой с образованием двух кислот — азотной и азотистой:
2NO2 + H2O → HNO3 + HNO2
Если растворение NO2 в воде проводить в избытке кислорода, то образуется только азотная кислота:
4NO2 + 2H2O + O2 → 4HNO3
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
3NO2 + H2O → 2HNO3 + NO
2. При растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
При растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
4NO2 + 2Ca(OH)2 → Ca(NO2)2 + Ca(NO3)2 + 2H2O
В присутствии кислорода образуются только нитраты:
4NO2 + 4NaOH + O2 → 4NaNO3 + 2H2O
3. Оксид азота (IV) – сильный окислитель. В атмосфере оксида азота (IV) горят фосфор, уголь, сера, оксид серы (IV) окисляется до оксида серы (VI):
2NO2 + 2S → N2 + 2SO2
2NO2 + 2C → N2 + 2CO2
10NO2 + 8P → 5N2 + 4P2O5
NO2 + SO2 → SO3 + NO
4. Оксид азота (IV) димеризуется:
Оксид азота (IV) димеризуется:
2NO2 ⇄ N2O4
Оксид азота (V)
N2O5– оксид азота (V), ангидрид азотной кислоты – кислотный оксид.
Получение оксида азота (V).
1. Получить оксид азота (V) можно окислением диоксида азота:
2NO2 + O3 → N2O5 + O2
2. Еще один способ получения оксида азота (V) – обезвоживание азотной кислоты сильным водоотнимающим веществом, оксидом фосфора (V):
2HNO3 + P2O5 → 2HPO3 + N2O5
Химические свойства оксида азота (V).
1. При растворении в воде оксид азота (V) образует азотную кислоту:
При растворении в воде оксид азота (V) образует азотную кислоту:
N2O5 + H2O → 2HNO3
2. Оксид азота (V), как типичный кислотный оксид, взаимодействует с основаниями и основными оксидами с образованием солей-нитратов.
Например, оксид азота (V) реагирует с гидроксидом натрия:
N2O5 + 2NaOH → 2NaNO3 + H2O
Еще пример: оксид азота (V) реагирует с оксидом кальция:
N2O5 + CaO → Ca(NO3)2
3. За счет азота со степенью окисления +5 оксид азота (V) – сильный окислитель.
Например, он окисляет серу:
2N2O5 + S → SO2 + 4NO2
4. Оксид азота (V) легко разлагается при нагревании (со взрывом):
Оксид азота (V) легко разлагается при нагревании (со взрывом):
2N2O5 → 4NO2 + O2
Азотная кислота
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например, концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
KNO3 + H2SO4(конц) → KHSO4 + HNO3
2. В промышленности азотную кислоту получают из аммиака. Процесс осуществляется стадийно.
1 стадия. Каталитическое окисление аммиака.
4NH3 + 5O2 → 4NO + 6H2O
2 стадия.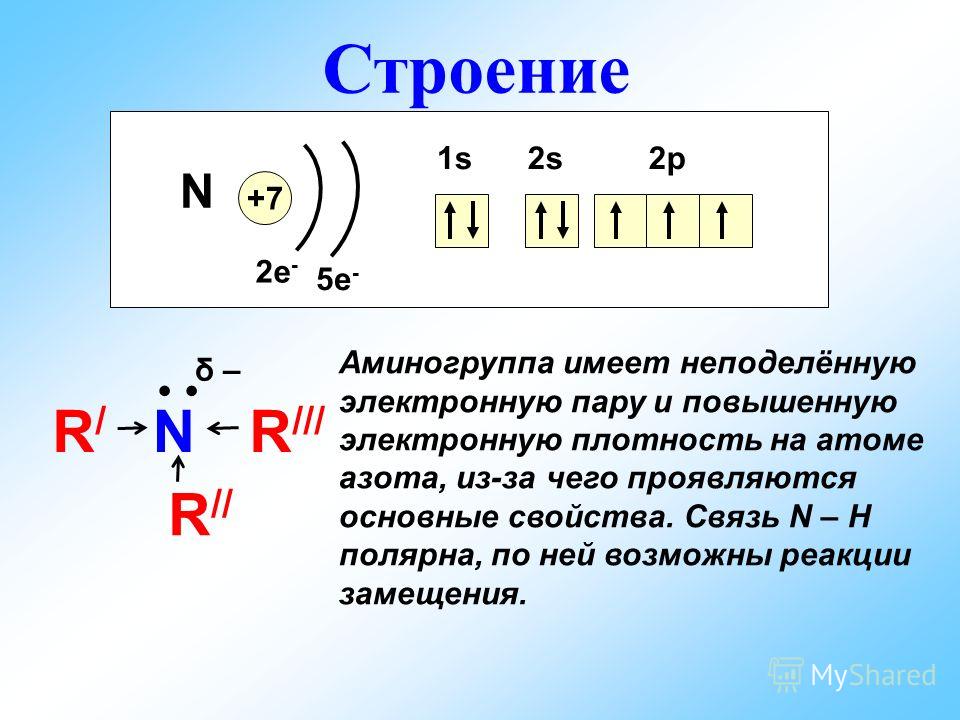 Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
2NO + O2 → 2NO2
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
4NO2 + 2H2O + O2 → 4HNO3
Химические свойства
Азотная кислота – это сильная кислота. За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства.
1. Азотная кислота практически полностью диссоциирует в водном растворе.
HNO3 → H+ + NO3–
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, азотная кислота взаимодействует с оксидом меди (II):
CuO + 2HNO3 → Cu(NO3)2 + H2O
Еще пример: азотная кислота реагирует с гидроксидом натрия:
HNO3 + NaOH → NaNO3 + H2O
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например, азотная кислота взаимодействует с карбонатом натрия:
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
4. Азотная кислота частично разлагается при кипении или под действием света:
4HNO3 → 4NO2 + O2 + 2H2O
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2 + 3H2O
Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
8HNO3 (разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
12HNO3(разб) + 10Na → 10NaNO3 + N2 + 6H2O
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
10HNO3 + 4Zn → 4Zn(NO3)2 + NH4NO3 + 3H2O
Таблица. Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например, азотная кислота окисляет серу, фосфор, углерод, йод:
6HNO3 + S → H2SO4 + 6NO2 + 2H2O
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором. Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
5HNO3 + P → H3PO4 + 5NO2 + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
4HNO3 + C → CO2 + 4NO2 + 2H2O
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
10HNO3 + I2 → 2HIO3 + 10NO2 + 4H2O
7. Концентрированная азотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например, азотная кислота окисляет оксид серы (IV):
2HNO3 + SO2 → H2SO4 + 2NO2
Еще пример: азотная кислота окисляет йодоводород:
6HNO3 + HI → HIO3 + 6NO2 + 3H2O
Азотная кислота окисляет углерод до углекислого газа, т.к. угольная кислота неустойчива.
3С + 4HNO3 → 3СО2 + 4NO + 2H2O
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например, сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
2HNO3 + H2S → S + 2NO2 + 2H2O
При нагревании до серной кислоты:
2HNO3 + H2S → H2SO4 + 2NO2 + 2H2O
8HNO3 + CuS → CuSO4 + 8NO2 + 4H2O
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
4HNO3 + FeS → Fe(NO3)3 + NO + S + 2H2O
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция»).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Азотистая кислота
Азотистая кислота HNO2— слабая, одноосновная, химически неустойчивая кислота.
Получение азотистой кислоты.
Азотистую кислоту легко получить вытеснением из нитритов более сильной кислотой.
Например, соляная кислота вытесняет азотистую кислоту из нитрита серебра:
AgNO2 + HCl → HNO2 + AgCl
Химические свойства.
1. Азотистая кислота HNO2 существует только в разбавленных растворах, при нагревании она разлагается:
3HNO2 → HNO3 + 2NO + H2O
без нагревания азотистая кислота также разлагается:
2HNO2 → NO2 + NO + H2O
2. Азотистая кислота взаимодействует с сильными основаниями.
Например, с гидроксидом натрия:
HNO2 + NaOH → NaNO2 + H2O
3. За счет азота в степени окисления +3 азотистая кислота проявляет слабые окислительные свойства. Окислительные свойства HNO2 проявляет только при взаимодействии с сильными восстановителями.
Например, HNO2 окисляет иодоводород:
2HNO2 + 2HI → 2NO + I2 + 2H2O
Азотистая кислота также окисляет иодиды в кислой среде:
2НNO2 + 2KI + 2H2SO4 → K2SO4 + I2 + 2NO + 2H2O
Азотистая кислота окисляет соединения железа (II):
2HNO2 + 3H2SO4 + 6FeSO4 → 3Fe2(SO4)3 + N2 + 4H2O
4. За счет азота в степени окисления +3 азотистая кислота проявляет сильные восстановительные свойства. Под действием окислителей азотистая кислота переходит в азотную.
Например, хлор окисляет азотистую кислоту до азотной кислоты:
HNO2 + Cl2 + H2O → HNO3 + 2HCl
Кислород и пероксид водорода также окисляют азотистую кислоту:
2HNO2 + O2 → 2HNO3
HNO2 + H2O2 → HNO3 + H2O
Соединения марганца (VII) окисляют HNO2:
5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3H2O
Соли азотной кислоты — нитраты
Нитраты металлов — это твердые кристаллические вещества. Большинство очень хорошо растворимы в воде.
1. Нитраты термически неустойчивы, причем все они разлагаются на кислород и соединение, характер которого зависит от положения металла (входящего в состав соли) в ряду напряжений металлов:
- Нитраты щелочных и щелочноземельных металлов (до Mg в электрохимическом ряду) разлагаются до нитрита и кислорода.
Например, разложение нитрата натрия:
2KNO3 → 2KNO2 + O2
Исключение – литий.
Видеоопыт разложения нитрата калия можно посмотреть здесь.
- Нитраты тяжелых металлов (от Mg до Cu, включая магний и медь) и литий разлагаются до оксида металла, оксида азота (IV) и кислорода:
Например, разложение нитрата меди (II):
2Cu(NO3)2 → 2CuO + 4NO2 + O2
- Нитраты малоактивных металлов (правее Cu) – разлагаются до металла, оксида азота (IV) и кислорода.
Например, нитрат серебра:
2AgNO3 → 2Ag + 2NO2 + O2
Исключения:
Нитрит железа (II) разлагается до оксида железа (III):
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Нитрат марганца (II) разлагается до оксида марганца (IV):
Mn(NO3)2 → MnO2 + 2NO2
2. Водные растворы не обладают окислительно-восстановительными свойствами, расплавы – сильные окислители.
Например, смесь 75% KNO3, 15% C и 10% S называют «черным порохом»:
2KNO3 + 3C + S → N2 + 3CO2 + K2S
Соли азотистой кислоты — нитриты
Соли азотистой кислоты устойчивее самой кислоты, и все они ядовиты. Поскольку степень окисления азота в нитритах равна +3, то они проявляют как окислительные свойства, так и восстановительные.
Кислород, галогены и пероксид водорода окисляют нитриты до нитратов:
2KNO2 + O2 → 2KNO3
KNO2 + H2O2 → KNO3 + H2O
KNO2 + H2O + Br2 → KNO3 + 2HBr
Лабораторные окислители — перманганаты, дихроматы — также окисляют нитриты до нитратов:
5KNO2 + 3H2SO4 + 2KMnO4 → 5KNO3 + 2MnSO4 + K2SO4 + 3H2O
3KNO2 + 4H2SO4 + K2Cr2O7 → 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
В кислой среде нитриты выступают в качестве окислителей.
При окислении йодидов или соединений железа (II) нитриты восстанавливаются до оксида азота (II):
2KNO2 + 2H2SO4 + 2KI → 2NO + I2 + 2K2SO4 + 2H2O
2KNO2 + 2FeSO4 + 2H2SO4 → Fe2(SO4)3 + 2NO + K2SO4 + 2H2O
При взаимодействии с очень сильными восстановителями (алюминий или цинк в щелочной среде) нитриты восстанавливаются максимально – до аммиака:
NaNO2 + 2Al + NaOH + 6H2O → 2Na[Al(OH)4] + NH3
Смесь нитратов и нитритов также проявляет окислительные свойства. Например, смесь нитрата и нитрита калия окисляет оксид хрома (III) до хромата калия:
3KNO2 + Cr2O3 + KNO3 → 2K2CrO4 + 4NO
Аммиак — Что такое Аммиак?
Аммиак представляет собой бинарное неорганическое химическое соединение азота и водорода
Аммиак (Ammonia, нитрид водорода) — химическое соединение азота и водорода с формулой Nh4, при нормальных условиях — бесцветный газ с резким характерным запахом.Плотность аммиака почти в 2 раза меньше, чем у воздуха, ПДКр.з. 20 мг/м3 — IV класс опасности (малоопасные вещества) по ГОСТ 12.1.007.
Растворимость Nh4 в воде чрезвычайно велика — около 1200 объемов (при 0°C) или 700 объемов (при 20°C) в объеме воды.
В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство превышает 180 млн т.
Молекула аммиака имеет форму треугольной пирамиды с атомом азота в вершине. 3 неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами 3х атомов водорода (связи N − H), 4я пара внешних электронов является неподеленной, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония Nh5+.
Несвязывающее 2х-электронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также меньшие плотность, вязкость (в 7 раз меньше вязкости воды), проводимость (почти не проводит электрический ток) и диэлектрическую проницаемость.
Это в некоторой степени объясняется тем, что прочность водородных связей в жидком аммиаке существенно ниже, чем у воды; а также тем, что в молекуле аммиака имеется лишь одна пара неподеленных электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвленную сеть водородных связей между несколькими молекулами.
Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м3, сильно преломляющую свет.
Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счет образования водородных связей.
Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений.
Твердый аммиак — кубические кристаллы.
Исследование уровня оксида азота
О чем расскажет оксид азота?
Простое и информативное исследование, которое помогает врачам-пульмонологам.
Оксид азота (химическая формула – NO) давно известен как загрязнитель воздуха, который содержится в сигаретном дыме и выхлопных газах. И лишь относительно недавно ученые обнаружили, что это вещество присутствует в организме человека и животных. Оксид азота выполняет важные биологические функции: помогает передавать нервные сигналы, участвует в подавлении воспаления, расширяет просвет сосудов, бронхов, а является свободным радикалом и может повреждать клетки.
NO – неотъемлемый участник большинства процессов, происходящих в легких. Он присутствует в выдыхаемом воздухе, и по его концентрации можно судить о состоянии дыхательной системы. Например, определение оксида азота в выдыхаемом воздухе очень помогает в диагностике бронхиальной астмы.
В каких случаях проводят это исследование?
Основные показания для измерения уровня оксида азота в выдыхаемом воздухе:
- Диагностика атопической и эозинофильной бронхиальной астмы в случаях, когда после проведения других исследований диагноз все еще остается сомнительным.
- Иногда этот тест применяют для диагностики других заболеваний, таких как хронические обструктивные болезни легких (ХОБЛ), хронический и эозинофильный бронхит, пневмония, идиопатический фиброзирующий альвеолит и др.
- Подбор оптимального лечения. Определение уровня оксида азота в выдыхаемом воздухе помогает проверить, насколько хорошо помогают ингаляции стероидов.
- Проверка эффективности лечения. На фоне терапии пациент может чувствовать себя хорошо. Но если во время исследования в воздухе, который он выдыхает, повышено содержание оксида азота, это говорит о том, что коррекция достигнута не полностью. Врач повысит дозы препаратов, и это поможет улучшить состояние больного в долгосрочной перспективе.
Тест на уровень NO в выдыхаемом воздухе зачастую помогает разобраться в причинах хронического кашля, если исследования показывают, что функция внешнего дыхания в норме. Вы можете пройти такую процедуру в клинике «Сова». У нас ее выполняют опытные врачи-пульмонологи.
Как подготовиться к процедуре?
Итак, врач сказал, что вам нужно провести исследование содержания оксида азота в выдыхаемом воздухе и назначил дату визита в клинику. Для того чтобы тест показал точные результаты, к нему нужно немного подготовиться и соблюдать некоторые рекомендации:
- Лучше проходить исследование на пустой желудок, или, по крайней мере, ничего не есть в течение 1–3 часов.
- За сутки до визита в клинику нужно избегать физических нагрузок, курения, употребления алкоголя.
- Нужно прекратить принимать бронхорасширяющие препараты короткого действия за 6 часов до процедуры, а длительного действия – за 12 часов. Еще лучше, если получится отказаться от всех препаратов за 12 часов.
Как происходит измерение уровня оксида азота в выдыхаемом воздухе?
Ничего страшного в процедуре нет, это совсем не больно и не причинит вам никаких неприятных ощущений. Исследование продолжается около пяти минут.
Измерение уровня оксида азота проводят с помощью специального небольшого прибора – портативного газоанализатора. К нему подсоединяют трубку, а на нее надевают одноразовый чистый мундштук, который пациент должен взять в рот. Нужно сделать вдох и выдохнуть воздух в мундштук. При этом нос должен быть зажат (врач даст вам специальный зажим). Через несколько секунд газоанализатор покажет результат. Всё, исследование закончено. Но, возможно, его придется повторить, чтобы врач мог убедиться в достоверности результата.
Преимущества этого метода диагностики налицо:
- Он весьма информативен, зачастую помогает быстро подтвердить или исключить диагноз, проверить состояние дыхательной системы.
- Для этого не нужно большое, сложное, дорогое оборудование.
- Процедура проходит очень быстро, и врач тут же получает результат. Если нужно, исследование можно быстро повторить.
- Для пациента это совершенно безопасно и безболезненно. Никакого дискомфорта. Не нужно госпитализироваться в стационар – достаточно приехать на несколько минут в клинику. У некоторых людей во время глубокого вдоха и выдоха может закружиться голова, но это не опасно. Врач попросит немного отдохнуть, успокоиться, и повторит тест.
Как врач интерпретирует результаты, и что они означают?
Концентрация оксида азота в выдыхаемом воздухе измеряется в миллиардных долях, что обозначается сокращенно как ppb:
|
Значение в ppb |
Результат исследования |
|
менее 25 (у детей – менее 20) |
В дыхательных путях с высокой степенью вероятности нет воспалительного процесса. |
|
26–50 (у детей – 21–35) |
«Серая зона». Результаты исследования оценивают в совокупности с симптомами, которые беспокоят пациента. |
|
более 50 (у детей – более 35) |
В дыхательных путях есть воспаление. Нужно назначить терапию, которая улучшит состояние пациента. |
Интерпретируя результаты, врач должен учитывать симптомы и жалобы пациента, данные других исследований, в том числе предыдущих определений уровня NO, поинтересоваться, является ли пациент курильщиком (если да – какой стаж), не болен ли они сейчас простудой. Важно оценивать уровень оксида азота в выдыхаемом воздухе в динамике: как он изменяется с течением времени, после использования ингалятора.
По результатам исследования врач может:
- Диагностировать бронхиальную астму
- Назначить стероиды.
- Увеличить дозировку стероидов.
- Порекомендовать пациенту повторить тест 3–4 раза в год, чтобы проверить, как протекает заболевание, не стоит ли изменить план лечения.
Пройдите исследование уровня оксида азота в выдыхаемом воздухе в клинике «Сова». У нас его проводят опытные врачи-пульмонологи прямо во время приема в кабинете. Доктор сразу же даст рекомендации, составит оптимальную программу лечения, если показатель окажется повышенным.
Азот газообразный и жидкий — Щекиноазот
При нормальных условиях азот — это бесцветный газ, не имеет запаха, мало растворим в воде
Трудность преобразования N2 в другие соединения и легкость превращения соединений азота в элементарный N2 обуславливают важную роль азота и в природе, и хозяйственной деятельности человека.
Температура кипения — минус 195,8 0С
Температура плавления — минус 210,0 0С
В жидком состоянии – бесцветная, подвижная, как вода, жидкость.
Плотность жидкого азота 808 кг/м³. При контакте с воздухом поглощает из него кислород.
По физико-химическим показателям азот газообразный и жидкий соответствует нормам ГОСТ 9293-74
|
Наименование показателя |
Норма для марки газообразного и жидкого азота |
|||||
|
|
особой чистоты |
повышенной чистоты |
технического |
|||
|
|
1-й сорт |
2-й сорт |
1-й сорт |
2-й сорт |
1-й сорт |
2-й сорт |
|
1 Объемная доля азота, %, не менее |
99,999 |
99,996 |
99,99 |
99,95 |
99,6 |
99,0 |
|
2 Объемная доля кислорода, %, не более |
0,0005 |
0,001 |
0,001 |
0,05 |
0,4 |
1,0 |
|
3 Объемная доля водяного пара в газообразном азоте, %, не более |
0,0007 |
0,0007 |
0,0015 |
0,004 |
0,009 |
выдерживает испытание по п. 3.6 ГОСТ 9293-74 |
|
4 Содержание масла в газообразном азоте |
не определяется |
выдерживает испытание по п. 3.7 ГОСТ 9293-74 |
||||
|
5 Содержание масла, механических примесей и влаги в жидком азоте |
выдерживает испытание по п. 3.8 ГОСТ 9293-74 |
|||||
|
6 Объемная доля водорода, %, не более |
0,0002 |
0,001 |
не нормируется |
|||
|
7 Объемная доля суммы углеродсодержащих соединений в пересчете на СН4, %, не более |
0,0003 |
0,001 |
не нормируется |
|||
Производство
В промышленных масштабах азот получают низкотемпературной ректификацией жидкого воздуха
В химической лаборатории его получают путем обработки водного раствора хлорида аммония с нитритом натрия.
Nh5Cl (водный) + NaNO2 → N2 (г) + NaCl (водный) + 2h3O
Очень чистый азот может быть получен путем термического разложения азида бария или азида натрия.
2NaN3 → 2Na + 3N2
Сферы применения
Промышленные применения газообразного азота обусловлены его инертными свойствами. Газообразный азот пожаро- и взрывобезопасен, препятствует окислению, гниению.
Газообразный азот используется для создания инертной атмосферы при производстве, хранении и транспортировании легко окисляемых продуктов, при высокотемпературных процессах обработки металлов, не взаимодействующих с азотом, для консервации замкнутых металлических сосудов и трубопроводов и других целей.
Кроме того, азот:
- Чистый азот используется в качестве пищевой добавки E941:добавка к консервированным сокам, защитный газ для упаковки мяса и мясных изделий, рыбы, хлебобулочной продукции, различных жиров, склонных к окислению продуктов.
- Используется в недорогих лампах накаливания в смеси с аргоном.
- Используется в некоторых топливных системах самолетов для снижения пожарной опасности.
- Азотом заполняют автомобильные и авиационные шины из-за его инертности, отсутствия влаги или окислительных свойств (такими характеристиками не может похвастать воздух).
- Жидкий азот популярен в качестве хладагента. Помимо всего прочего, он используется в криоконсервации крови, половых клеток, а также других биологических образцов и материалов. Он используется в клинической практике в криотерапии для удаления кисты и бородавок на коже.
Хранить азот следует при температуре 20°C в специальных герметичных баллонах во избежание утечки.
Безопасность
Быстрое выделение газообразного азота в замкнутом пространстве может вытеснить кислород, и, следовательно, существует угроза удушья. Симптомы «отравления» – сонливость, возникающая из-за гипоксии.
Если газ вдыхают при больших парциальных давлениях, то азот начинает действовать в качестве анестезирующего средства. Это может привести к азотному наркозу и временному легкому опьянению (аналогичным действием обладает закись азота – «веселящий газ»).
Азот растворяется в крови и жирах организма. Быстрая декомпрессия может привести к кессонной болезни, когда пузырьки азота образуются в крови, нервах, суставах и других чувствительных или важных областях. Пузырьки других «инертных» газов (за исключением углекислого газа) оказывают аналогичное воздействие, поэтому замена азота в дыхательных газах может предотвратить азотный наркоз, но не мешает развитию декомпрессионной болезни.
Прямой контакт кожи с жидким азотом вызывает серьезные обморожения (криогенные «ожоги»). Нахождение в природе
Азот является важным строительным блоком аминокислот и нуклеиновых кислот, необходимых для жизнедеятельности на Земле. Он составляет 78% атмосферного воздуха (кислород занимает лишь 21%, все остальное – другие газы).
Распад организмов и их отходов может производить небольшое количество нитрата, но большая часть азота в конечном итоге возвращается в атмосферу. Циркуляция азота из атмосферы к органическим соединениям, а затем обратно в атмосферу, называется азотным циклом.
Транспортирование
Жидкий азот – криогенная жидкость, которая условиях атмосферного давления кипит при -195,8 °C. Если его изолировать в специальные контейнеры (сосуд Дьюара), то транспортировка пройдет без потерь за счет испарения.
Обратите внимание на другие сферы деятельности ОХК»Щекиноазот»:
Просмотреть прайс-лист
Динитроген — Viquipèdia, l’enciclopèdia lliure
| | |
| Substància química | газ и аллотроп азота (en) | 12 Трообетон (en) 12
|---|---|
| Estructura química | |
| Fórmula química | N |
| SMILES canònic | Модель 2D N # N |
| Identificador InChI | Модель 3D |
| Propietat | |
| Скорость движения | 939 м / с (−195,8 ° C, жидкость) 353 м / с (27 ° C, газ) |
| Энтропия молярный стандарт | 191,6 Дж / (моль К) |
| Альтрес | |
| Инертный | |
El молекулярный азот o диазот [1] (общий аноменат Només (азот ) представляет собой гомоядерную молекулярную форму для атомов азота.Это газ (нормальное состояние давления и температуры), который составляет 78% от атмосферного воздуха. Это инертный газ, не содержащий металлов, бесцветный, бесцветный и безвкусный, без вмешательства в горение и дыхание. Конденсация на 77 K и твердость на 63 K. Es fa servir en aplicacions criogèniques. L’aplicació имеет важное коммерческое значение — l’obtenció d’amoníac pel procés de Haber. L’amoníac es fa servir для производства удобрений i àcid nítric. Жидкий азот, произведенный для очистки жидкого хладагента от жидкого хладагента.
- ↑ Коннелли, Нил Г. «Номенклатура неорганической химии — рекомендации ИЮПАК». Номенклатура неорганической химии , 2005. с. 49, ISBN 0-85404-438-8.
Enllaços externs [изменение]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Dinitrogen |
- Enciclopedia Libre
- Азот, WebElements.com
- Азот, химия окружающей среды.com
- Азот, это элементаль
- Nitrogen Arxivat 22.08.2007 a Wayback Machine., Общественный колледж округа Скенектади
- Fitxa internacional de seguretat química del азотная жидкость Arxivat 07.01.2010 a Wayback Machine .. Instituto Nacional de Seguridad e Higiene en el Trabajo de España
| Identificadors | CAS · InChIKey · PubChem KEGG · UNII · ZVG · DrugBank · Infocard ECHA · HMDB · DSSTOX · Gmelin: 150 · HSDB · CosIng · |
|---|
азота | Определение, символ, использование, свойства, атомный номер и факты
Азот (N) , неметаллический элемент 15 группы [Va] периодической таблицы Менделеева.Это бесцветный газ без запаха и вкуса, который является наиболее распространенным элементом в атмосфере Земли и является составной частью всего живого.
Британская викторина
118 Названия и символы Периодической таблицы викторины
Периодическая таблица Менделеева состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
| атомный номер | 7 |
|---|---|
| атомный вес | 14,0067 |
| точка плавления | −209,86 ° C (−345,8 ° F) |
| точка кипения | ° C (−320,4 ° F)|
| плотность (1 атм, 0 ° C) | 1,2506 г / литр |
| обычные степени окисления | −3, +3, +5 |
| электронная конфигурация | 1 с 2 2 с 2 2 p 3 |
История
Около четырех пятых атмосферы Земли составляет азот, который был выделен и признан специфическим веществом во время ранних исследований воздуха.Карл Вильгельм Шееле, шведский химик, показал в 1772 году, что воздух представляет собой смесь двух газов, один из которых он назвал «огненным воздухом», потому что он поддерживает горение, а другой «грязным воздухом», потому что он остался после « огненный воздух ». «Огненный воздух» — это, конечно, кислород, а «грязный воздух» — азот. Примерно в то же время азот был признан шотландским ботаником Дэниелом Резерфордом (который первым опубликовал свои открытия), британским химиком Генри Кавендишем и британским священником и ученым Джозефом Пристли, который вместе с Шееле дается заслуга в открытии кислорода.Более поздние исследования показали, что новый газ является составной частью селитры, общего названия нитрата калия (KNO 3 ), и, соответственно, французский химик Жан-Антуан-Клод Шапталь в 1790 году назвал его азотом. считался химическим элементом Антуаном-Лораном Лавуазье, чье объяснение роли кислорода в горении в конечном итоге опровергло теорию флогистона, ошибочный взгляд на горение, который стал популярным в начале 18 века. Неспособность азота поддерживать жизнь (по-гречески: zoe ) побудила Лавуазье назвать его азотом , по-прежнему французским эквивалентом азота .
Возникновение и распространение
Среди элементов азот занимает шестое место по количеству в космосе. Атмосфера Земли состоит из 75,51 процента по весу (или 78,09 процента по объему) азота; это основной источник азота для торговли и промышленности. Атмосфера также содержит различные небольшие количества аммиака и солей аммония, а также оксидов азота и азотной кислоты (последние вещества образуются во время грозы и в двигателе внутреннего сгорания).Свободный азот содержится во многих метеоритах; в газах вулканов, шахт и некоторых минеральных источников; на солнце; и в некоторых звездах и туманностях.
Азот также присутствует в минеральных отложениях селитры или селитры (нитрат калия, KNO 3 ) и чилийской селитры (нитрат натрия, NaNO 3 ), но эти отложения существуют в количествах, которые совершенно не соответствуют потребностям человека. Еще один богатый азотом материал — гуано, которое можно найти в пещерах летучих мышей и в сухих местах, часто посещаемых птицами.В сочетании азот содержится в дожде и почве в виде аммиака и солей аммония, а в морской воде — в виде аммония (NH 4 + ), нитрита (NO 2 — ) и нитрата (NO 3 ). — ) ионы. Азот составляет в среднем около 16 процентов по массе сложных органических соединений, известных как белки, присутствующих во всех живых организмах. Естественное содержание азота в земной коре составляет 0,3 части на 1000 человек. Космическое содержание — предполагаемое общее содержание во Вселенной — составляет от трех до семи атомов на атом кремния, что считается стандартом.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасИндия, Россия, США, Тринидад и Тобаго и Украина входили в пятерку крупнейших производителей азота (в форме аммиака) в начале 21 века.
Промышленное производство и использование
Промышленное производство азота в основном осуществляется путем фракционной перегонки сжиженного воздуха. Температура кипения азота составляет -195,8 ° C (-320,4 ° F), что примерно на 13 ° C (-23 ° F) ниже, чем у кислорода, который поэтому остается позади.Азот также можно производить в больших масштабах путем сжигания углерода или углеводородов в воздухе и отделения образующихся диоксида углерода и воды от остаточного азота. В небольших масштабах чистый азот получают путем нагревания азида бария, Ba (N 3 ) 2 . Различные лабораторные реакции, в результате которых образуется азот, включают нагревание растворов нитрита аммония (NH 4 NO 2 ), окисление аммиака бромной водой и окисление аммиака горячим оксидом меди.
Элементарный азот можно использовать в качестве инертной атмосферы для реакций, требующих исключения кислорода и влаги.В жидком состоянии азот имеет ценные криогенные применения; За исключением газов водорода, метана, окиси углерода, фтора и кислорода, практически все химические вещества имеют пренебрежимо малое давление пара при температуре кипения азота и, следовательно, существуют в виде кристаллических твердых веществ при этой температуре.
В химической промышленности азот используется для предотвращения окисления или другого порчи продукта, в качестве инертного разбавителя реактивного газа, в качестве носителя для отвода тепла или химикатов, а также в качестве ингибитора пожара или взрывов.В пищевой промышленности газообразный азот используется для предотвращения порчи из-за окисления, плесени или насекомых, а жидкий азот используется для сублимационной сушки и для холодильных систем. В электротехнической промышленности азот используется для предотвращения окисления и других химических реакций, для создания избыточного давления в оболочках кабелей и для защиты двигателей. Азот находит применение в металлургической промышленности при сварке, пайке и пайке, где он помогает предотвратить окисление, науглероживание и обезуглероживание. Как инертный газ, азот используется для изготовления вспененного или вспененного каучука, пластмасс и эластомеров, в качестве газа-вытеснителя для аэрозольных баллончиков и для повышения давления жидких пропеллентов для реакционных струй.В медицине быстрое замораживание жидким азотом может использоваться для сохранения крови, костного мозга, тканей, бактерий и спермы. Жидкий азот также оказался полезным в криогенных исследованиях.
азот | Определение, символ, использование, свойства, атомный номер и факты
Азот (N) , неметаллический элемент 15 группы [Va] периодической таблицы Менделеева. Это бесцветный газ без запаха и вкуса, который является наиболее распространенным элементом в атмосфере Земли и является составной частью всего живого.
Британская викторина
118 Названия и символы Периодической таблицы викторины
Периодическая таблица Менделеева состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
| атомный номер | 7 |
|---|---|
| атомный вес | 14,0067 |
| точка плавления | −209,86 ° C (−345,8 ° F) |
| точка кипения | ° C (−320,4 ° F)|
| плотность (1 атм, 0 ° C) | 1,2506 г / литр |
| обычные степени окисления | −3, +3, +5 |
| электронная конфигурация | 1 с 2 2 с 2 2 p 3 |
История
Около четырех пятых атмосферы Земли составляет азот, который был выделен и признан специфическим веществом во время ранних исследований воздуха.Карл Вильгельм Шееле, шведский химик, показал в 1772 году, что воздух представляет собой смесь двух газов, один из которых он назвал «огненным воздухом», потому что он поддерживает горение, а другой «грязным воздухом», потому что он остался после « огненный воздух ». «Огненный воздух» — это, конечно, кислород, а «грязный воздух» — азот. Примерно в то же время азот был признан шотландским ботаником Дэниелом Резерфордом (который первым опубликовал свои открытия), британским химиком Генри Кавендишем и британским священником и ученым Джозефом Пристли, который вместе с Шееле дается заслуга в открытии кислорода.Более поздние исследования показали, что новый газ является составной частью селитры, общего названия нитрата калия (KNO 3 ), и, соответственно, французский химик Жан-Антуан-Клод Шапталь в 1790 году назвал его азотом. считался химическим элементом Антуаном-Лораном Лавуазье, чье объяснение роли кислорода в горении в конечном итоге опровергло теорию флогистона, ошибочный взгляд на горение, который стал популярным в начале 18 века. Неспособность азота поддерживать жизнь (по-гречески: zoe ) побудила Лавуазье назвать его азотом , по-прежнему французским эквивалентом азота .
Возникновение и распространение
Среди элементов азот занимает шестое место по количеству в космосе. Атмосфера Земли состоит из 75,51 процента по весу (или 78,09 процента по объему) азота; это основной источник азота для торговли и промышленности. Атмосфера также содержит различные небольшие количества аммиака и солей аммония, а также оксидов азота и азотной кислоты (последние вещества образуются во время грозы и в двигателе внутреннего сгорания).Свободный азот содержится во многих метеоритах; в газах вулканов, шахт и некоторых минеральных источников; на солнце; и в некоторых звездах и туманностях.
Азот также присутствует в минеральных отложениях селитры или селитры (нитрат калия, KNO 3 ) и чилийской селитры (нитрат натрия, NaNO 3 ), но эти отложения существуют в количествах, которые совершенно не соответствуют потребностям человека. Еще один богатый азотом материал — гуано, которое можно найти в пещерах летучих мышей и в сухих местах, часто посещаемых птицами.В сочетании азот содержится в дожде и почве в виде аммиака и солей аммония, а в морской воде — в виде аммония (NH 4 + ), нитрита (NO 2 — ) и нитрата (NO 3 ). — ) ионы. Азот составляет в среднем около 16 процентов по массе сложных органических соединений, известных как белки, присутствующих во всех живых организмах. Естественное содержание азота в земной коре составляет 0,3 части на 1000 человек. Космическое содержание — предполагаемое общее содержание во Вселенной — составляет от трех до семи атомов на атом кремния, что считается стандартом.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасИндия, Россия, США, Тринидад и Тобаго и Украина входили в пятерку крупнейших производителей азота (в форме аммиака) в начале 21 века.
Промышленное производство и использование
Промышленное производство азота в основном осуществляется путем фракционной перегонки сжиженного воздуха. Температура кипения азота составляет -195,8 ° C (-320,4 ° F), что примерно на 13 ° C (-23 ° F) ниже, чем у кислорода, который поэтому остается позади.Азот также можно производить в больших масштабах путем сжигания углерода или углеводородов в воздухе и отделения образующихся диоксида углерода и воды от остаточного азота. В небольших масштабах чистый азот получают путем нагревания азида бария, Ba (N 3 ) 2 . Различные лабораторные реакции, в результате которых образуется азот, включают нагревание растворов нитрита аммония (NH 4 NO 2 ), окисление аммиака бромной водой и окисление аммиака горячим оксидом меди.
Элементарный азот можно использовать в качестве инертной атмосферы для реакций, требующих исключения кислорода и влаги.В жидком состоянии азот имеет ценные криогенные применения; За исключением газов водорода, метана, окиси углерода, фтора и кислорода, практически все химические вещества имеют пренебрежимо малое давление пара при температуре кипения азота и, следовательно, существуют в виде кристаллических твердых веществ при этой температуре.
В химической промышленности азот используется для предотвращения окисления или другого порчи продукта, в качестве инертного разбавителя реактивного газа, в качестве носителя для отвода тепла или химикатов, а также в качестве ингибитора пожара или взрывов.В пищевой промышленности газообразный азот используется для предотвращения порчи из-за окисления, плесени или насекомых, а жидкий азот используется для сублимационной сушки и для холодильных систем. В электротехнической промышленности азот используется для предотвращения окисления и других химических реакций, для создания избыточного давления в оболочках кабелей и для защиты двигателей. Азот находит применение в металлургической промышленности при сварке, пайке и пайке, где он помогает предотвратить окисление, науглероживание и обезуглероживание. Как инертный газ, азот используется для изготовления вспененного или вспененного каучука, пластмасс и эластомеров, в качестве газа-вытеснителя для аэрозольных баллончиков и для повышения давления жидких пропеллентов для реакционных струй.В медицине быстрое замораживание жидким азотом может использоваться для сохранения крови, костного мозга, тканей, бактерий и спермы. Жидкий азот также оказался полезным в криогенных исследованиях.
Расшифровка: Химия в ее элементе: азот(Promo) Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества. (Конец промо) Крис Смит Здравствуйте! На этой неделе мы взрываем подушки безопасности, удушаем животных и разбираемся с порохом, потому что химик из Кембриджа Питер Уотерс исследует историю азота. Питер Уотерс Азот составляет около 80% воздуха, которым мы дышим. Это, безусловно, самый распространенный элемент в своей группе в периодической таблице, и все же это последний член этого семейства, который был обнаружен.Другие элементы в этой группе, фосфор, мышьяк, сурьма и висмут, были открыты, использовались и злоупотребляли по крайней мере за 100 лет до того, как стало известно об азоте. На самом деле только в 18 — годах люди сосредоточили свое внимание на химии воздуха и свойствах подготовки различных газов. Мы можем по-настоящему понять открытие азота, только обратив внимание на открытие некоторых из этих других газов. Роберт Бойль заметил в 1670 году, что при добавлении кислоты в железные опилки смесь становилась очень горячей и выделяла обильные и вонючие пары.Он был настолько легковоспламеняем, что при приближении к нему зажженной свечи легко загорался и вспыхивал голубоватым и несколько зеленоватым пламенем. Примерно 100 лет спустя гениальный, но замкнутый ученый-миллионер Генри Кавендиш более тщательно подготовил и собрал водород. Кавендиш назвал легковоспламеняющийся воздух из металлов в знак признания этого поразительного свойства. Он также изучал известный нам газ, называемый диоксидом углерода, который впервые был получен шотландским химиком Джозефом Блэком в 1750-х годах.Черный назывался фиксированным воздухом двуокиси углерода, поскольку считалось, что он заблокирован или зафиксирован в определенных минералах, таких как известняк. Его можно было освободить из каменной тюрьмы под действием тепла или кислот. Углекислый газ был также известен под названием «mephitic air», слово «mephitic» означает ядовитый или ядовитый. Это название, очевидно, произошло от его свойства разрушать жизнь, поскольку оно быстро задыхает всех животных, погруженных в него. Здесь начинается путаница с газообразным азотом, поскольку чистый газообразный азот также удушает животных.Если кислород в замкнутом количестве воздуха израсходован, либо за счет сжигания в нем свечи, либо из-за содержания животного, большая часть кислорода превращается в газообразный углекислый газ, который смешивается с газообразным азотом, присутствующим в воздухе. Эта ядовитая смесь больше не поддерживает жизнь и поэтому была названа мефитической. Решающим экспериментом в открытии азота стало осознание того, что в этом ядовитом воздухе есть по крайней мере два различных вида удушающих газов. Это было сделано путем пропускания смеси газов через раствор щелочи, который поглотил диоксид углерода, но оставил после себя газообразный азот.Таким образом Кавендиш приготовил газообразный азот. Он пропускал воздух взад и вперед над нагретым углем, который превращал кислород воздуха в углекислый газ. Затем диоксид углерода растворяли в щелочи, оставляя после себя инертный газообразный азот, который, как он правильно заметил, был немного менее плотным, чем обычный воздух. К сожалению, Кавендиш не опубликовал свои выводы. Он просто передал их в письме своему коллеге-ученому Джозефу Пристли, одному из первооткрывателей газообразного кислорода. Следовательно, открытие азота обычно приписывается одному из учеников Джозефа Блэка, шотландскому ученому Дэниелу Резерфорду, который также является дядей писателя и поэта сэра Вальтера Скотта.Резерфорд опубликовал свои открытия, которые были аналогичны результатам Кавендиша в его докторской диссертации, озаглавленной «Инаугурационная диссертация по воздуху, названному фиксированным или зловонным» в 1772 году. Так как насчет названия, азот? В конце 1780-х годов химическая номенклатура претерпела крупную революцию под руководством французского химика Антуана Лавуазье. Именно он и его коллеги предложили многие из названий, которые мы все еще используем сегодня, в том числе слово водород, которое происходит от греческого, означающего образование воды, и кислород от греческого — производитель кислоты, поскольку Лавуазье ошибочно полагал, что кислород является ключевым компонентом образования кислоты. все кислоты.Однако в свой список известных тогда элементов Лавуазье включил термин азот или азотический газ для того, что мы теперь называем азотом. Это опять-таки происходит от греческих слов, на этот раз означающих отсутствие жизни, опять-таки акцентируя внимание на ее зловонных свойствах. Вскоре было отмечено, что существует множество анаэробных газов, фактически никакой другой газ, кроме кислорода, не может поддерживать жизнь. Поэтому название азот было предложено из наблюдения, опять же впервые сделанного Кавендишем, что если газы воспламеняются кислородом, а затем образующиеся газы диоксида азота проходят через щелочь, образуется селитра, иначе известная как селитра или нитрат калия.Слово азот, следовательно, означает образование селитры. Производные от слова азот сохранились до сих пор. Компаунд, используемый для взрывного наполнения газом автомобильных подушек безопасности, представляет собой азид натрия, соединение только натрия и азота. При срабатывании это соединение взрывоопасно разлагается, высвобождая газообразный азот, который надувает мешки. Это азотное соединение не только не уничтожило жизнь, но и спасло тысячи людей. Крис Смит Питер Уотерс из Кембриджского университета рассказывает историю открытия азота.В следующий раз, когда мы расскажем о химии в ее стихии, о том, как химики вроде Менделеева разобрались как с известным, так и с неизвестным. Марк Пеплоу В то время как другие ученые пытались создать способы упорядочения известных элементов, Менделеев создал систему, которая могла предсказать существование элементов, которые еще не были обнаружены. Когда он представил эту таблицу миру в 1869 году, в ней было четыре заметных пробела. Один из них был чуть ниже марганца, и Менделеев предсказал, что будет найден элемент с атомным весом 43, который восполнит этот пробел, но только в 1937 году группа итальянских ученых наконец нашла недостающий элемент, который они назвали технецием. Крис Смит И вы можете услышать, как Марк Пеплоу рассказывает историю технеция в выпуске «Химии в ее стихии» на следующей неделе. Я Крис Смит, спасибо за внимание. Увидимся в следующий раз. (Промо) (Конец промо) |
Газообразный азот Формула
Формула и структура: Химическая формула газообразного азота — N 2 .Молярная масса г / моль. Молекула образована двумя атомами азота, связанными тройной связью. Все тройные связи образованы одной сигма-связью и двумя пи-связями, образуя линейную молекулу. Его химическая структура может быть записана, как показано ниже, в общих представлениях, используемых для органических молекул.
Происшествие: Газообразный азот присутствует в природе, он содержится в атмосфере и во всех живых организмах. Поскольку атомарного азота не существует в природе, каждое упоминание азота, присутствующего в природе, относится к газообразному двухатомному азоту.
Приготовление: Азот может быть приготовлен для коммерческого использования для криогенной перегонки воздуха. Эта перегонка приводит к образованию газообразного азота, а также кислорода и газообразного аргона в качестве побочных продуктов. Азот, образующийся в результате этой перегонки, является жидким, хотя может находиться под давлением для образования газообразного азота. Его также можно получить при сжигании природного газа или пропана.
Физические свойства: Газообразный азот — это газ или жидкость без цвета и запаха, в зависимости от температуры.При комнатной температуре это газ. Его температура плавления составляет -210 ° C, а температура кипения составляет -196 ° C. Газообразный азот плохо растворяется в воде и спирте.
Химические свойства: Газообразный азот — сверхстабильная молекула. Многие соединения азота имеют тенденцию к разложению с образованием этого газа из-за его высокой стабильности. Причиной такой стабильности является тройная связь, образованная между двумя атомами азота, благодаря этому электронному расположению каждый атом азота достигает правила восьмиэлектронной валентности (правила октета).Расстояние связи в молекуле азота чрезвычайно короткое, что свидетельствует о сильной тройной связи, требующей высокой энергии (225 ккал / моль) для ее разрыва.
Область применения: Газообразный азот в основном используется для проведения реакций в химической промышленности и лабораториях в инертной атмосфере. Низкая реакционная способность этого газа позволяет проводить химические реакции без вмешательства кислорода воздуха. Азот также используется в составе освежителей, аэрозолей и пестицидов. Газообразный азот также является реагентом при производстве аммиака, нитратов и других соединений азота.
Воздействие на здоровье / опасность для здоровья: Газообразный азот нетоксичен и безопасен для вдыхания. Он негорючий и нереактивный. Хотя, если баллоны с газообразным азотом нагреть, они могут взорваться.
Химия азота (Z = 7) — Chemistry LibreTexts
Азот присутствует почти во всех белках и играет важную роль как в биохимических, так и в промышленных приложениях. Азот образует прочные связи из-за его способности образовывать тройную связь с самим собой и другими элементами.Таким образом, в соединениях азота много энергии. Раньше 100 лет назад об азоте было мало что известно. Теперь азот обычно используется для сохранения продуктов питания и в качестве удобрения.
Введение
Азот имеет 3 или 5 валентных электронов и находится в верхней части 15-й группы периодической таблицы. Он может иметь 3 или 5 валентных электронов, потому что он может связываться с внешними 2p- и 2s-орбиталями. Молекулярный азот (\ (N_2 \)) не вступает в реакцию при стандартной температуре и давлении и представляет собой газ без цвета и запаха.
Рисунок \ (\ PageIndex {1} \) : Диаграмма Бора атома азота.Азот — неметаллический элемент, который наиболее часто встречается в атмосфере. Газообразный азот (N 2 ) составляет 78,1% от объема воздуха Земли. Он появляется только в 0,002% земной коры по массе. Соединения азота содержатся в продуктах питания, взрывчатых веществах, ядах и удобрениях. Азот составляет ДНК в форме азотистых оснований, а также в нейромедиаторах. Это один из крупнейших промышленных газов, который коммерчески производится в виде газа и жидкости.
| Название и символ | Азот, N |
| Категория | неметаллический |
| Атомный вес | 14.0067 |
| Группа | 15 |
| Электронная конфигурация | 1с 2 2с 2 2п 3 |
| Валентные электроны | 2, 5 |
| Фаза | Газ |
История
Азот, который составляет около 78% нашей атмосферы, представляет собой бесцветный, без запаха, вкуса и химически неактивный газ при комнатной температуре.Он назван от греческого «нитрон +» гены образования соды. В течение многих лет, в течение 1500-х и 1600-х годов, ученые намекали, что в атмосфере есть еще один газ, помимо углекислого газа и кислорода. Только в 1700-х годах ученые смогли доказать, что на самом деле существует другой газ, который набрал массу в атмосфере Земли.
Обнаружен в 1772 году Дэниелом Резерфордом (и независимо другими, такими как Пристли и Кавендиш), который смог удалить кислород и углекислый газ из заполненной трубки, полной воздуха.Он показал, что есть остаточный газ, который не поддерживает горение, как кислород или углекислый газ. В то время как его эксперимент был тем, который доказал существование азота, другие эксперименты также проводились в Лондоне, где они назвали это вещество «сгоревшим» или «дефлогистированным воздухом».
Азот является четвертым по распространенности элементом в организме человека, и в известной нам вселенной его больше, чем углерода или кремния. Газообразный азот, производимый в промышленных масштабах, извлекается из сжиженного воздуха. Из этого количества большая часть используется для производства аммиака (\ (NH_3 \)) по процессу Габера.Многое также преобразуется в азотную кислоту (\ (HNO_3 \)).
Изотопы
Азот содержит два изотопа природного происхождения: азот-14, и азот-15, , которые можно разделить с помощью химического обмена или термодиффузии. У азота также есть изотопы массой 12, 13, 16, 17, но они радиоактивны.
- Азот 14 — самая распространенная форма азота, составляющая более 99% всего азота на Земле. Это стабильное соединение и нерадиоактивно.Азот-14 имеет наиболее практическое применение: он используется в сельском хозяйстве, консервировании пищевых продуктов, биохимических и биомедицинских исследованиях. Азот-14 содержится в изобилии в атмосфере и среди многих живых организмов. Он имеет 5 валентных электронов и не является хорошим проводником.
- Азот-15 — другая стабильная форма азота. Его часто используют в медицинских исследованиях и консервации. Этот элемент нерадиоактивен, поэтому его иногда можно использовать в сельском хозяйстве.Азот-15 также используется в исследованиях мозга, в частности, в спектроскопии ядерного магнитного резонанса (ЯМР), потому что в отличие от азота-14 (ядерный спин равен 1), он имеет ядерный спин 1/2, что дает преимущества при наблюдении за исследованиями МРТ. и наблюдения ЯМР. Наконец, азот-15 можно использовать в качестве метки или в некоторых белках в биологии. Ученые в основном используют это соединение в исследовательских целях и еще не осознали его полный потенциал для использования в исследованиях мозга.
Соединения
Двумя наиболее распространенными соединениями азота являются нитрат калия (KNO 3 ) и нитрат натрия (NaNO 3 ).Эти два соединения образуются при разложении органических веществ, в которых присутствует калий или натрий, и часто встречаются в удобрениях и побочных продуктах промышленных отходов. Большинство соединений азота имеют положительную свободную энергию Гиббса (т.е. реакции не являются спонтанными).
Рисунок \ (\ PageIndex {2} \) : Точечная структура молекулярного азота ЛьюисаМолекула диазота (\ (N_2 \)) является «необычно стабильным» соединением, особенно потому, что азот образует тройную связь с самим собой. Эту тройную связь трудно разорвать.Для того чтобы диазот следовало правилу октетов, он должен иметь тройную связь. У азота всего 5 валентных электронов, поэтому, удвоив это количество, мы получим в общей сложности 10 валентных электронов с двумя атомами азота. Октет требует, чтобы у атома было всего 8 электронов, чтобы иметь полную валентную оболочку, поэтому у него должна быть тройная связь. Соединение также очень инертно, так как имеет тройную связь. Тройные связи очень трудно разорвать, поэтому они сохраняют свою полную валентную оболочку вместо того, чтобы вступать в реакцию с другими соединениями или атомами.Подумайте об этом так: каждая тройная связь похожа на резиновую ленту с тремя резиновыми лентами, атомы азота очень притягиваются друг к другу.
Нитриды
Нитриды — соединения азота с менее электроотрицательным атомом; другими словами, это соединение с атомами, имеющими менее полную валентную оболочку. Эти соединения образуются с литием и металлами 2-й группы. Нитриды обычно имеют степень окисления -3.
\ [3Mg + N_2 \ rightarrow Mg_3N_2 \ label {1} \]
При смешивании с водой азот образует аммиак, и этот нитрид-ион действует как очень сильное основание.-_ {(водный)} \ label {2} \]
Когда азот образует с другими соединениями, он в первую очередь образует ковалентные связи. Обычно это делают с другими металлами и выглядят так: MN, M 3 N и M 4 N. Эти соединения обычно твердые, инертные и имеют высокие температуры плавления из-за способности азота образовывать тройные ковалентные связи.
Ионы аммония
Азот фиксируется путем реакции с газообразным водородом над катализатором. Этот процесс используется для производства аммиака.Как упоминалось ранее, этот процесс позволяет нам использовать азот в качестве удобрения, поскольку он разрушает прочную тройную связь, удерживаемую N 2 . Знаменитый процесс синтеза аммиака Габера-Боша выглядит так:
\ [N_2 + 3H_2 \ rightarrow 2NH_3 \ label {3} \]
Аммиак является основанием и также используется в типичных кислотно-основных реакциях.
\ [2NH_ {3 (водн.)} + H_2SO_4 \ rightarrow (NH_4) _2SO_ {4 (водн.)} \ Label {4} \]
Нитрид-ионы — очень сильные основания, особенно в водных растворах.
Оксиды азота
Нитриды используют различные степени окисления от +1 до +5 для оксидных соединений. Почти все образующиеся оксиды представляют собой газы и существуют при температуре 25 градусов Цельсия. Оксиды азота кислые и легко присоединяют протоны.
\ [N_2O_5 + H_2O \ rightarrow 2HNO_ {3 (водн.)} \ Label {5} \]
Оксиды играют большую роль в живых организмах. Они могут быть полезны, но опасны.
- Окись азота (N 2 O) — анестетик, используемый стоматологами в качестве веселящего газа.
- Двуокись азота (NO 2 ) вредна. Он связывается с молекулами гемоглобина, не позволяя молекуле выделять кислород по всему телу. Он выделяется из автомобилей и очень вреден.
- Нитрат (NO 3 — ) — многоатомный ион.
- Более нестабильные оксиды азота позволяют путешествовать в космосе.
Гидриды
Гидриды азота включают аммиак (NH 3 ) и гидразин (N 2 H 4 ).
- В водном растворе аммиак образует описанный выше ион аммония, обладающий особыми амфипротическими свойствами.
- Гидразин обычно используется в качестве ракетного топлива
Применение азота
- Азот служит защитным слоем для нашей атмосферы для производства химикатов и электронных отсеков.
- Азот используется в качестве удобрения в сельском хозяйстве для стимулирования роста.
- Газ под давлением для масла.
- Хладагент (например, быстрое замораживание продуктов)
- Взрывчатые вещества.
- Обработка металлов / защитное средство путем воздействия азота вместо кислорода
Список литературы
- Петруччи, Ральф Х., Уильям Харвуд и Ф. Херринг. Общая химия: принципы и современные приложения. 8 -е Изд. Нью-Джерси: Pearson Education Inc, 2001.
- Sadava, David et al. ЖИЗНЬ: Биология. Восьмое издание.Sinauer Associate.
- Томас, Иаков. Азот и его применение в современном будущем . Издательство Государственного университета Сан-Диего: 2007.
Проблемы
- Заполните и сбалансируйте следующие уравнения
N 2 + ___H 2 → ___NH _
H 2 N 2 O 2 →?
2NH 3 + CO 2 →?
__Mg + N 2 → Mg _ N _
N 2 H 5 + H 2 O →?
- Какие бывают изотопы азота?
- Перечислите состояния окисления различных оксидов азота: N 2 O, NO, N 2 O 3 , N 2 O 4 , N 2 O 5
- Перечислите различные элементы, с которыми азот будет реагировать, делая его щелочным или кислым….
- Использование азота
Ответы
- Заполните и сбалансируйте следующие уравнения
N 2 + 3H 2 → 2NH 3 (процесс Габера)
H 2 N 2 O 2 → HNO
2NH 3 + CO 2 → (NH 2 ) 2 CO + H 2 O
2Mg + 3N 2 → Mg 3 N 2
N 2 H 5 + H 2 O → N 2 + H + + H 2 O
- Какие бывают изотопы азота?
Стабильные формы включают азот-14 и азот-15
- Перечислите степени окисления различных оксидов азота: +1, +2, +3, +4, +5 соответственно
- Перечислите различные элементы, с которыми азот будет реагировать, чтобы сделать его щелочным или кислым: нитрид-ион является сильным основанием при взаимодействии с водой, аммиак обычно является слабой кислотой
- Использование азота включает анестетик, хладагент, металлический протектор
соединений азота | Введение в химию
Цель обучения
- Приведите примеры применения соединений азота.
Ключевые моменты
- Оксиды азота, называемые соединениями NO x , важны из-за их взрывоопасных свойств. Эти свойства определяются чрезвычайно прочной и стабильной связью, обнаруженной в молекулярном двухатомном азоте, N 2 , который имеет энергию диссоциации связи 945 кДж / моль (226 ккал / моль).
- Основным нейтральным гидридом азота является аммиак (NH 3 ) с pK b , равным 9,2, и поэтому он является слабым основанием.Соответствующий депротонированный вид NH 2 — называется амидом и является сильным основанием (потому что это сопряженное основание с аммиаком, pK a которого составляет около 38).
- Азот входит в состав молекул всех основных классов лекарств в фармакологии и медицине, от антибиотиков до нейротрансмиттеров и не только. Одним из важных аспектов азота является то, что это единственный неметалл, который может поддерживать положительный заряд при физиологическом pH.
Условия
- пропеллент Топливо, окислитель, реакционная масса или смесь для одного или нескольких двигателей (особенно двигателей внутреннего сгорания или реактивных двигателей), которые перевозятся в транспортном средстве перед использованием.
- Оксид — бинарное химическое соединение кислорода с другим химическим элементом.
- анион: отрицательно заряженный ион, в отличие от катиона.
- Энергия диссоциации связи: Энергия, необходимая для разделения двух атомов, соединенных определенной связью. Выражается в молях таких связанных атомов. Указывает на прочность связи.
Обзор соединений азота и их использования
Соединения азота играют важную роль во многих аспектах жизни и коммерческих процессов, от промышленного производства удобрений до строительных блоков жизни.
Тройная связь азот-азот в N 2 содержит 226 ккал / моль энергии, что делает ее одной из самых прочных из известных связей. Когда газообразный азот образуется как продукт различных реакций, энергия связи, связанная с тройной связью N-N, высвобождается, вызывая взрывные свойства, наблюдаемые во многих соединениях азота.
Амины
Основным нейтральным гидридом азота является аммиак (NH 3 ), хотя также обычно используется гидразин (N 2 H 4 ).Аммиак на 6 порядков щелочнее воды. В растворе аммиак образует ион аммония (NH 4 + ). PK a хлорида аммония составляет 9,2. Жидкий аммиак (точка кипения 240 K) является амфипротонным (проявляет либо кислотный, либо основной характер по Бренстеду-Лоури) и образует аммоний и менее распространенные амид-ионы (NH 2 — ). Аммиак имеет pK a из 38, что делает соответствующие амидные ионы очень сильными основаниями. По отдельности, дважды, трех- и четырехзамещенные алкильные соединения аммиака называются аминами (четыре замещения с образованием коммерчески и биологически важных четвертичных аминов, приводят к положительно заряженному азоту и, таким образом, к водорастворимому соединению).
Азиды
Другие классы анионов азота (отрицательно заряженные ионы) представляют собой ядовитые азиды (N 3 —), которые являются линейными и изоэлектронными по отношению к диоксиду углерода, но которые связываются с важными железосодержащими ферментами в организме таким же образом, как и цианид.
Оксиды азота
Другой молекулой такой же структуры является бесцветный и относительно инертный анестезирующий газ закись азота (окись азота, N 2 O), также известный как веселящий газ.Это один из множества оксидов азота, которые образуют семейство, часто обозначаемое сокращенно NO x . Оксид азота (оксид азота, NO) — это естественный свободный радикал, используемый для передачи сигналов как у растений, так и у животных. Красноватый и ядовитый диоксид азота (NO 2 ) содержит неспаренный электрон и является важным компонентом смога. Молекулы азота, содержащие неспаренные электроны, проявляют тенденцию к димеризации (тем самым спаривая электроны) и, как правило, обладают высокой реакционной способностью. Соответствующими кислотами являются азотистая (HNO 2 ) и азотная кислота (HNO 3 ) с соответствующими солями, называемыми нитритами и нитратами.
Соединения азота, используемые в качестве взрывчатых веществ и топлива
Одним из первых соединений азота в качестве взрывчатого вещества был нитрат калия, также называемый селитрой, который использовался в порохе. Это смесь нитрата калия, углерода и серы. Когда смесь воспламеняется в замкнутом пространстве, таком как дуло ружья или фейерверк, ионы нитрата окисляют углерод и серу в сильно экзотермической реакции, очень быстро образуя высокотемпературные газы. Это может выбить пулю из пистолета или вызвать взрыв фейерверка.
Нитрат калия Нитрат калия, или селитра, входил в состав ранних порохов. Он служит окислителем вместе с окисляемым материалом, таким как сахар.Высшие оксиды, триоксид диазота (N 2 O 3 ), четырехокись азота (N 2 O 4 ) и пятиокись азота (N 2 O 5 ), нестабильны и взрывоопасны, a Следствие химической устойчивости N 2 . Почти каждый гиперголик (т.е.не требует зажигания) в ракетном двигателе в качестве окислителя используется N 2 O 4 ; их топливо, различные формы гидразина, также являются соединениями азота.
Эти двигатели широко использовались на космических кораблях, таких как космические шаттлы и двигатели программы Apollo, поскольку их топливо является жидким при комнатной температуре, а воспламенение происходит при контакте без системы зажигания, что позволяет получить многие точно контролируемые ожоги. N 2 O 4 является промежуточным продуктом при производстве азотной кислоты HNO 3 , одной из немногих кислот, более сильных, чем ион гидроксония, и довольно сильным окислителем.
Азот примечателен рядом взрывоопасных соединений, которые он может производить. Трииодид азота (NI 3 ) — чрезвычайно чувствительное контактное взрывчатое вещество. Нитроцеллюлоза, полученная путем нитрования целлюлозы азотной кислотой, также известна как пушечный хлопок. Нитроглицерин, полученный нитрованием глицерина, является опасно нестабильным взрывчатым ингредиентом динамита. Сравнительно стабильный, но менее мощный взрывчатый тринитротолуол (ТНТ) является стандартным взрывчатым веществом, с которым измеряется мощность ядерных взрывов.Во всех случаях взрывчатые свойства соединений азота проистекают из чрезвычайной стабильности продукта этих реакций: газообразного молекулярного азота, N 2 .
Соединения азота в лекарствах и медицине
Азот входит в состав молекул всех основных классов лекарств в фармакологии и медицине. Оксид азота (NO) недавно был обнаружен как важная сигнальная молекула в физиологии. Закись азота (N 2 O) была открыта в начале XIX века как частичный анестетик, хотя позже она не использовалась в качестве хирургического анестетика.Было обнаружено, что под названием «веселящий газ» он вызывает состояние социальной расторможенности, напоминающее опьянение.
Другими известными азотсодержащими препаратами являются препараты, полученные из растительных алкалоидов, таких как морфин.
