Страница не найдена — Портал Продуктов Группы РСС
Сообщите нам свой адрес электронной почты, чтобы подписаться на рассылку новостного бюллетеня. Предоставление адреса электронной почты является добровольным, но, если Вы этого не сделаете, мы не сможем отправить Вам информационный бюллетень. Администратором Ваших персональных данных является Акционерное Общество PCC Rokita, находящееся в Бжег-Дольном (ул. Сенкевича 4, 56-120 Бжег-Дольный, Польша ). Вы можете связаться с нашим инспектором по защите личных данных по электронной почте: .
Мы обрабатываем Ваши данные для того, чтобы отправить Вам информационный бюллетень — основанием для обработки является реализация нашей законодательно обоснованной заинтересованности или законодательно обоснованная заинтересованность третьей стороны – непосредственный маркетинг наших продуктов / продуктов группы PCC .
Как правило, Ваши данные мы будем обрабатывать до окончания нашего с Вами общения или же до момента, пока Вы не выразите свои возражения, либо если правовые нормы будут обязывать нас продолжать обработку этих данных, либо мы будем сохранять их дольше в случае потенциальных претензий, до истечения срока их хранения, регулируемого законом, в частности Гражданским кодексом.
В любое время Вы имеете право:
- выразить возражение против обработки Ваших данных;
- иметь доступ к Вашим данным и востребовать их копии;
- запросить исправление, ограничение обработки или удаление Ваших данных;
- передать Ваши персональные данные, например другому администратору, за исключением тех случаев, если их обработка регулируется законом и находится в интересах администратора;
- подать жалобу Президенту Управления по защите личных данных.
Получателями Ваших данных могут быть компании, которые поддерживают нас в общении с Вами и помогают нам в ведении веб-сайта, внешние консалтинговые компании (такие как юридические, маркетинговые и бухгалтерские) или внешние специалисты в области IT, включая компанию Группы PCC .
Больше о том, как мы обрабатываем Ваши данные Вы можете узнать из нашего Полиса конфиденциальности.
Какая формула уксусной кислоты, полученной методом брожения — ООО ДХЗ
Опубликовано: 15. 02.2022
Время чтения: 2 минуты
214
02.2022
Время чтения: 2 минуты
214
В последние годы производство уксусной кислоты развивается очень высокими темпами, поскольку данный продукт очень важен для промышленности, и без него невозможно изготовить некоторые химические составы или завершить производственный процесс.
Уксусная кислота относится к гомологическому ряду алифатических (жирных) кислот и является одним из простейших, но самых важных представителей данного ряда. Если вы не знаете, какая формула уксусной кислоты, то оно представлена ниже:
СН3СООН
В природе уксусную кислоту в свободном состоянии можно найти в растениях, в организмах животных (желчь, пот, моча), а также в некоторых минеральных водах. Следует отметить, что уксусную кислоту можно найти в средах, благоприятных для брожения и гниения (в торфяной воде, нуано и т. д.). Там она появляется из-за окисления воздухом компонентов этилового спирта, который образуется в ходе брожения:
д.). Там она появляется из-за окисления воздухом компонентов этилового спирта, который образуется в ходе брожения:
С2Н5ОН + О2 = СН2СООН + 2 ОН
Также уксусную кислоту можно найти в отходящих водах при промывке шерсти и в водной части дистиллята, который образуется при разгонке с паром множества растительных эфирных масел. Если рассматривать уксусную кислоту в чистом виде, то она представляет собой жидкость без цвета с плотностью 1,04923 г/см 3 при температуре 20°С. Она способна активно поглощать влагу из воздуха. Она застывает в бесцветные кристаллы при температуре 16,63°С, их плотность 1,105 г/см3. В случае остывания происходит небольшое уменьшение объема – на 4,7%, соответственно при плавлении объем уксусной кислоты увеличивается почти на 5%.
Переохлажденная уксусная кислота при внесении затравки или в случае взбалтывания моментально застывает. Достигая температуры 40°С, данная кислота очень легко воспламеняется.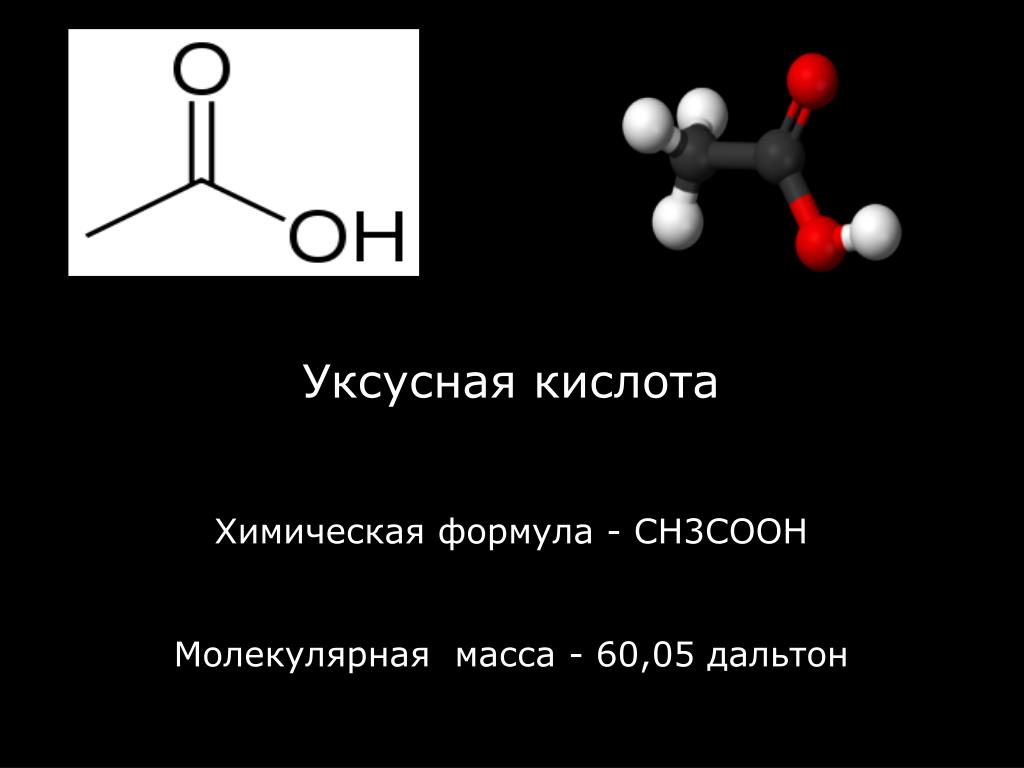
Уксусная кислота обладает очень резки запахом, но приятным кисловатым вкусом. Однако она разрушительно действует на человеческую кожу и вызывает ожоги. Он смешивается во всех соотношениях с такими веществами как эфир, спирт, вода, ацетон, дихлорэтан, хлороформ и многими другими растворителями. Следует отметить, что уксусная кислота и сама является отличным растворителем для многих органических соединений.
.
Урок по химии — Информио
Дисциплина: ХимияТема урока: Карбоновые кислоты. Общие свойства карбоновых кислот
Тип урока: творческий урок.
Вид урока: практическое занятие с элементами деловой игры.
Время: 80 минут
Цель урока: Формирование системы знаний и общих компетенций, связанных с исследованием строения и свойств карбоновых кислот.
По окончанию урока студент умеет:
— объяснять взаимное влияние атомов в функциональной группе, образование водородной связи между молекулами карбоновых кислот;
— уметь объяснять кислотные свойства карбоновых кислот.
По окончанию урока студент знает
— строение функциональной группы карбоновых кислот;
— общие физические свойства карбоновых кислот;
Задачи урока:
1. развивающие: развивать интеллектуальные умения выделять главное, анализировать, сравнивать, делать выводы, использовать ранее накопленные знания по химии в контексте нового материала, расширить научную лексику путем введения в активный словарь новых терминов, продолжить формирование умений оформлять результаты своей работы и делать обобщения на основании полученных результатов;
2. образовательные: рассмотреть общие свойства карбоновых кислот в сравнении со свойствами минеральных кислот. Сравнить физические свойства спиртов и карбоновых кислот;
3. воспитательные: воспитывать коммуникативные навыки,
формировать научное мировоззрение, интерес к предмету, поддерживать устойчивую
мотивацию к изучению химии на основании положительного эмоционального
восприятия предмета.
Материалы и оборудование:
— лабораторное оборудование и реактивы: растворы соляной и уксусной кислот, раствор сульфата меди (II), порошок оксида магния, лакмус, гидроксид натрия, раствор карбоната натрия, пробирки;
— таблицы и дидактические материалы к уроку: «Физические свойства некоторых предельных одноатомных спиртов и предельных одноосновных карбоновых кислот», «Водородная связь между молекулами спиртов и карбоновых кислот;
— литература: О. С. Габриелян и др. Химия — 10 класс. М.: Дрофа, 2009 г
— Электронные уроки и тесты СD-диск Химия. Сложные химические соединения в повседневной жизни. ЗАО «Просвещение — МЕДИА», 2009. Новый диск.
Ход урока.
Ум заключается не только в знаниях,
но и в умении применять знания в деле…
Аристотель .
Урок начинается с игры «черный
ящик», в ходе которой формулируется тема, цели и задачи урока.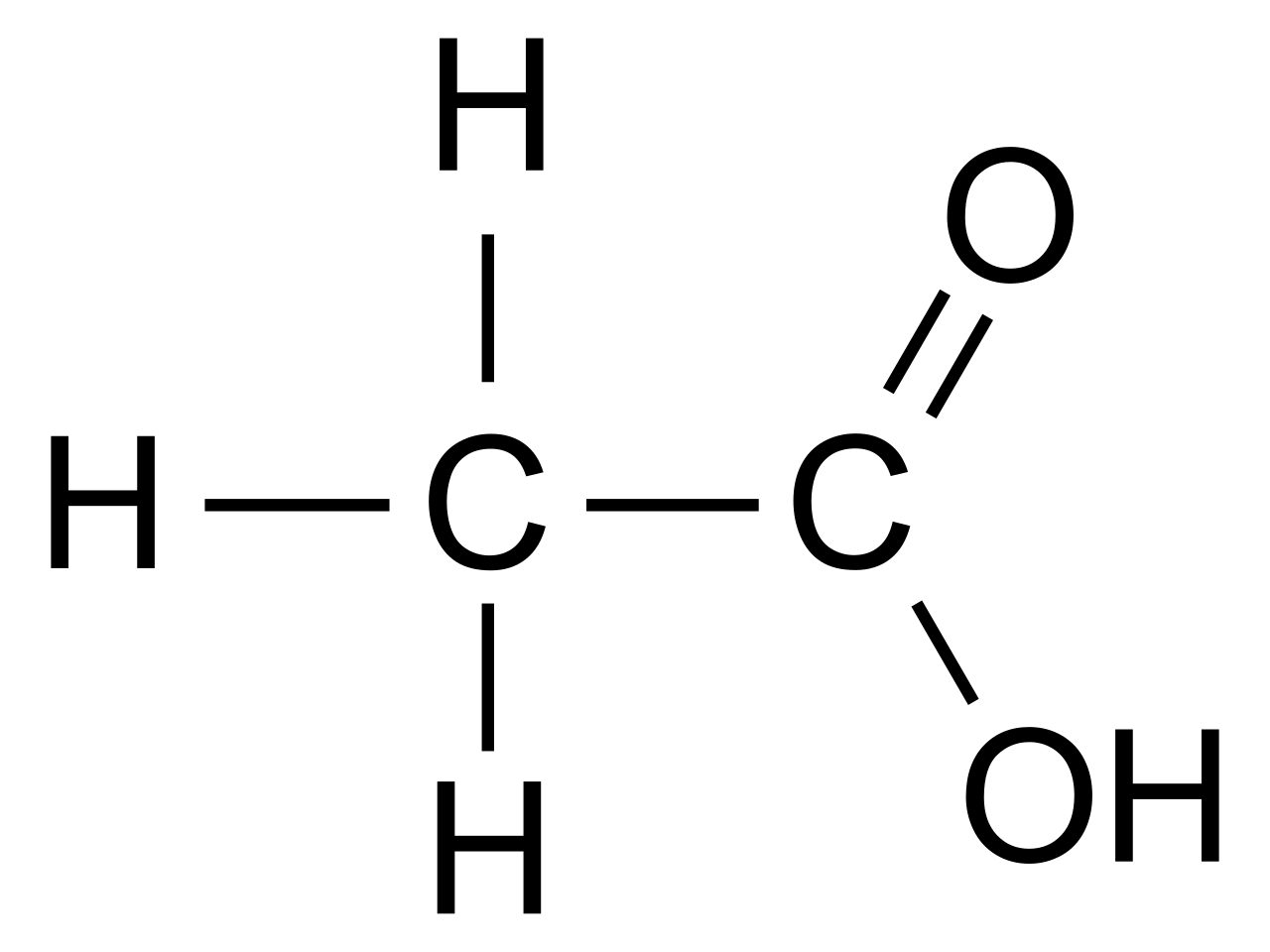
Преподаватель. Вам уже известны общие физические свойства карбоновых кислот, знаете вы и строение функциональной группы, номенклатуру этих кислородосодержащих органических соединений. А хорошо ли вам знакомы отдельные представители этого класса соединений?
Задание «черный ящик».
1-ое вещество. У меня в черном ящике находится удивительное, но хорошо вам знакомое вещество. Название этого вещества древними греками отождествлялось с самим представлением о кислом. Нам оно хорошо известно в жидком агрегатном состоянии, но при охлаждении ниже 17 0С превращается в бесцветные кристаллы, похожие на лед.
Ответ: уксусная кислота – в ящике находится бутылка с уксусом.
|
2-ое вещество.
В черном ящике находится
вещество, которым богаты плоды цитрусовых. | |
Ответ: лимонная кислота (в черный ящик можно поместить апельсины, лимоны, пакетики с лимонной кислотой).
| |
3-е вещество. Впервые было получено алхимиком Агриколой, который наблюдал при прокаливании в янтаре похожие на соль белый налет этого вещества, используется в медицине.
Ответ: янтарная кислота– таблетки янтарной кислоты и табличка с формулой НООС-СН2-СН2-СООН.
После ответов учащихся учитель рассказывает о значении янтарной кислоты. Янтарная
кислота — настоящий подарок для нас. Это естественное вещество, которое
присутствует в организме, вырабатывается им. При приёме внутрь не вызывает
привыкания и не вызывает особых побочных эффектов, укрепляет иммунитет,
усиливает клеточное дыхание, способствует усвоению кислорода клетками.
При приёме внутрь не вызывает
привыкания и не вызывает особых побочных эффектов, укрепляет иммунитет,
усиливает клеточное дыхание, способствует усвоению кислорода клетками.
Беседа по итогам мини-разминки;
— к какому классу кислородосодержащих органических соединений относятся эти вещества;
— как называется функциональная группа, содержащаяся в этих соединениях;
— какие свойства веществ помогли нам их быстро определить?
— как вы думаете, какие свойства
данных органических соединений мы еще не рассматривали?
В ходе обсуждения ответов формулируются изучаемые вопросы:
а) какая связь существует между свойствами карбоновых кислот и их строением?
б) сходны ли по свойствам органические кислоты и минеральные и если сходны, в чем причина этого?
Затем
определяются направления работы и
способы их решения, заранее оговариваются формы представления результатов
работы, критерии оценивания работ. Работа класса организуется в малых группах, каждая из которых выполняет
собственное исследование.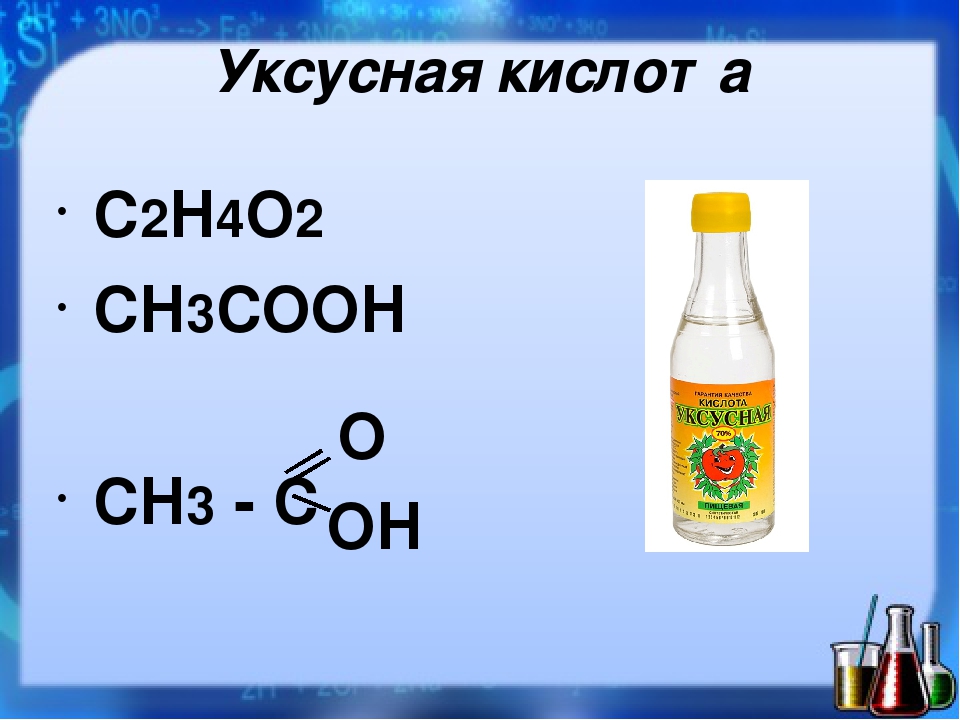
Группа 1. «Исследование строения предельных карбоновых кислот, сравнение физических свойств предельных карбоновых кислот и предельных одноатомных спиртов».
На основе молекулярной формулы уксусной кислоты и общей формулы карбоновых кислот, учитывая положения теории строения органических соединений, группе необходимо рассмотреть химическое и электронное строение уксусной кислоты. Указать взаимное влияние атомов в составе функциональной группы карбоновых кислот.
Шагами решения исследовательской
задачи стали определение валентности всех химических элементов в молекулярной
формуле уксусной кислоты, выделение функциональной группы. На основе положения химических элементов в таблице Д. И. Менделеева группой проводится анализ смещения электронной
плотности химических связей в молекуле. На
основании предложенных таблиц проводится сравнение температур кипения и
плавления предельных одноатомных спиртов и предельных одноосновных карбоновых
кислот. Результатом работы являются записи полной и краткой структурных формул
уксусной кислоты, электронной формулы этого вещества; определение по
структурной формуле уксусной кислоты направления взаимного влияния атомов в
молекуле через выявление смещения электронной плотности химических связей;
представлена схема образования водородных связей между двумя молекулами
уксусной кислоты.
Справочный материал для группы 1.
Прочитайте соответствующий раздел учебника. Рассмотрите представленную таблицу и справочную информацию. Составьте полную и сокращенную структурную формулу уксусной кислоты, объясните смещение электронной плотности в молекуле органической кислоты, сравните физические свойства предельных одноатомных спиртов и предельных одноосновных карбоновых кислот. Составьте схему образования водородной связи между двумя молекулами уксусной кислоты.
Таблица.
Физические свойства некоторых предельных одноатомных спиртов и предельных одноосновных карбоновых кислот.
Спирты | Карбоновые кислоты. | ||||
Формула спирта
| Температура, 0С | Формула кислоты | Температура, 0С | ||
плавления | кипения | плавления | кипения | ||
СН3ОН
| -98 | 65 | Н-СООН | 8,3 | 100,8 |
С2Н5ОН
| — 117 | 78 | СН3-СООН | 16,8 | 118,1 |
С3Н7ОН
| — 127 | 97 | С2Н5СООН | -20,8 | 141,1 |
С4Н9ОН
| — 80 | 118 | С3Н7-СООН | -5 | 163,5 |
Низшие члены гомологического ряда
одноосновных карбоновых кислот являются жидкостями. Муравьиная, уксусная и
пропионовая кислоты обладают резким запахом, смешиваются с водой в любых
соотношениях. Последующие кислоты, начиная с масляной, имеют неприятный запах и
ограниченно растворяются в воде. Высшие кислоты – твердые вещества,
нерастворимые в воде.
Муравьиная, уксусная и
пропионовая кислоты обладают резким запахом, смешиваются с водой в любых
соотношениях. Последующие кислоты, начиная с масляной, имеют неприятный запах и
ограниченно растворяются в воде. Высшие кислоты – твердые вещества,
нерастворимые в воде.
Группа 2. Исследование химических свойств уксусной кислоты общих со свойствами минеральных кислот. (Взаимодействие с металлами и действие на индикатор).
Группе необходимо на основе знаний химических свойств минеральных кислот (на примере соляной кислоты) выдвинуть гипотезу о возможности переноса этих свойств на уксусную кислоту. Учащиеся самостоятельно проводят химический эксперимент и сравнивают взаимодействие соляной и уксусной кислоты с лакмусом и порошком магния, соблюдая правила техники безопасности, в ходе выполнения лабораторного опыта учащиеся должны подтвердить или опровергнуть предположение о сходстве общих химических свойств минеральных и органических кислот.
Результатом работы должны стать
наблюдения, оформленные в виде таблицы. Записи уравнений реакции взаимодействия
магния с кислотами и вывод о причинах изменения окраски индикатора в растворах
кислот, а так же указаны названия полученных веществ.
Записи уравнений реакции взаимодействия
магния с кислотами и вывод о причинах изменения окраски индикатора в растворах
кислот, а так же указаны названия полученных веществ.
Задание для группы 2.
Лабораторная работа:
«Свойства уксусной кислоты в сравнении со свойствами соляной кислоты».
Цель. Изучить свойства кислотные свойств уксусной кислоты. Сравнить химические свойства минеральных и органических кислот.
Опыт 1. В две пробирки налейте 1 – 2 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с органическими веществами и минеральными кислотами). В первую внесите 1-2 капли лакмуса (отметьте цвет индикатора). Во вторую добавьте немного порошка магния. Отметьте, какие изменения произошли.Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенной реакции.
Опыт 2.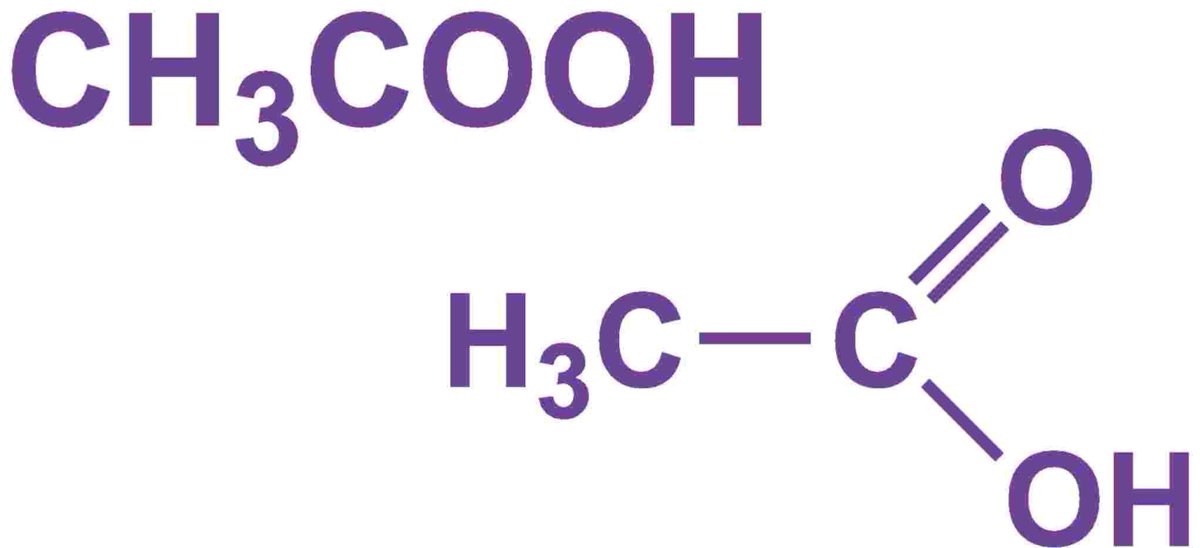 В две пробирки налейте 1 – 2 мл раствора соляной
кислоты (помните о правилах техники
безопасности при работе с кислотами). В одну пробирку 1 -2 капли лакмуса (отметьте цвет индикатора). В другую
добавьте немного порошка магния. Отметьте,
какие изменения произошли.Сделайте
соответствующий вывод. Составьте полные и сокращенные ионные уравнения
проведенной реакции. Наблюдения оформите
в виде таблицы.
В две пробирки налейте 1 – 2 мл раствора соляной
кислоты (помните о правилах техники
безопасности при работе с кислотами). В одну пробирку 1 -2 капли лакмуса (отметьте цвет индикатора). В другую
добавьте немного порошка магния. Отметьте,
какие изменения произошли.Сделайте
соответствующий вывод. Составьте полные и сокращенные ионные уравнения
проведенной реакции. Наблюдения оформите
в виде таблицы.
| № опыта | действие | наблюдение | уравнение реакции |
Уксусная кислота | 1 | Взаимодействие уксусной кислоты с лакмусом | Лакмус окрасился в красный цвет |
|
2 | Взаимодействие уксусной кислоты с магнием | Выделение газа | 2СH3COOH+Mg=Mg(CH3COО)2+H2 2Н+ + Mg = Mg 2+ + Н2 | |
Соляная кислота | 3 | Взаимодействие соляной кислоты с лакмусом | Лакмус окрасился в красный цвет |
|
4 | Взаимодействие соляной кислоты с магнием | Выделение газа | 2HCl+Mg=MgCl2+H2 2Н+ + Mg = Mg 2+ + Н2 |
Вывод: уксусная и соляная кислоты
одинаково взаимодействуют с активным металлом магнием. Магний вытесняет водород
из растворов кислот.
Магний вытесняет водород
из растворов кислот.
Группа 3. Исследование химических свойств уксусной кислоты общих со свойствами минеральных кислот. (Взаимодействие с оксидами металлов и основаниями).
Группе необходимо на основе знаний химических свойств минеральных кислот (на примере соляной кислоты) выдвинуть гипотезу о возможности переноса этих свойств на уксусную кислоту. Учащиеся самостоятельно проводят химический эксперимент и сравнивают взаимодействие соляной и уксусной кислоты с растворами щелочей и взаимодействие с оксидом магния. Результатом работы должно стать составление уравнения химических реакций взаимодействия уксусной и соляной кислот с предложенными веществами и оформление результатов эксперимента в виде таблицы.
Задание для группы 3.
Лабораторная работа:
«Свойства уксусной кислоты в сравнении со свойствами соляной кислоты».
Цель. Изучить свойства кислотные свойств уксусной
кислоты. Сравнить химические свойства минеральных и органических кислот.
Сравнить химические свойства минеральных и органических кислот.
Опыт 1. В две пробирки налейте 1 – 2 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с органическими веществами). В первую добавьте немного порошка оксида магния. Во вторую пробирку внесите 1-2 капли лакмуса (отметьте цвет индикатора), затем нейтрализуйте кислоту раствором щелочи (гидроксида калия или натрия). Отметьте, какие изменения произошли.Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенной реакции.
Опыт 2. В две пробирки налейте 1 – 2 мл раствора соляной
кислоты (помните о правилах техники
безопасности при работе с кислотами). В первую добавьте немного порошка оксида магния. Во вторую пробирку внесите 1-2
капли лакмуса (отметьте цвет индикатора), затем нейтрализуйте кислоту раствором
щелочи. Отметьте, какие изменения
произошли.Сделайте соответствующий
вывод. Составьте полные и сокращенные ионные уравнения проведенной реакции. Наблюдения оформите в виде таблицы.
Наблюдения оформите в виде таблицы.
| № опыта | действие | наблюдение | уравнение реакции |
Уксусная кислота | 1 | Взаимодействие уксусной кислоты с порошком оксида магния | Наблюдаем постепенное растворение порошка магния в кислоте | 2СH3COOH+MgО=Mg(CH3COО)2+H2О 2Н+ + MgО = Mg 2+ + Н2О |
2 | Взаимодействие уксусной кислоты с лакмусом и раствором гидроксида калия | При добавлении лакмуса к
раствору кислоты его окраска изменилась на красную, затем при внесении
нескольких капель щелочи раствор
обесцветился. | СH3COOH+КОН=CH3COОК+H2О Н+ + ОН—= Н2О | |
Соляная кислота | 3 | Взаимодействие соляной кислоты с порошком оксида магния | Наблюдаем постепенное растворение порошка магния в кислоте | 2HCl+MgО=MgСl2+H2О 2Н+ + MgО = Mg 2+ + Н2О |
4 | Взаимодействие соляной кислоты с лакмусом и раствором гидроксида калия | При добавлении лакмуса к
раствору кислоты его окраска изменилась на красную, затем при внесении нескольких
капель щелочи раствор обесцветился. | HCl+КОН = КCl +H2О Н+ + ОН—= Н2О |
Вывод: уксусная и соляная кислоты одинаково реагируют с оксидами металлов и щелочами, образуя соответствующие соли и воду.
Группа 4. Изучение взаимодействия уксусной и соляной кислот с солями и нерастворимыми основаниями.
Учащиеся выдвигают предположение о сходстве химических свойств минеральных и органических кислот и самостоятельно проводят химический эксперимент, в котором сравнивают взаимодействие этих кислот с карбонатом натрия и гидроксидом меди (II). Результат исследования – запись уравнений химических реакций, оформление наблюдений.
Задание для группы 4.
Лабораторная работа:
«Свойства уксусной кислоты в сравнении со
свойствами соляной кислоты».
Цель. Изучить свойства кислотные свойств уксусной кислоты. Сравнить химические свойства минеральных и органических кислот.
Опыт 1. налейте в пробирку 2- 3 мл раствора сульфата меди (II) и прибавьте 1 – 2 мл раствора гидроксида калия (отметьте, что наблюдаете), затем налейте немного уксусной кислоты. Во вторую пробирку добавьте 1-2 мл раствора уксусной кислоты, затем добавьте раствор карбоната натрия или карбоната калия. Отметьте, какие изменения произошли.Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенной реакции.
Опыт 2. Налейте в пробирку 2- 3 мл раствора сульфата меди
(II) и прибавьте 1 – 2 мл раствора гидроксида калия (отметьте, что наблюдаете),
затем налейте раствор соляной кислоты. Во вторую пробирку добавьте 1-2 мл раствора соляной кислоты, затем
добавьте раствор карбоната натрия или карбоната калия. Отметьте, какие изменения произошли.Сделайте соответствующий вывод.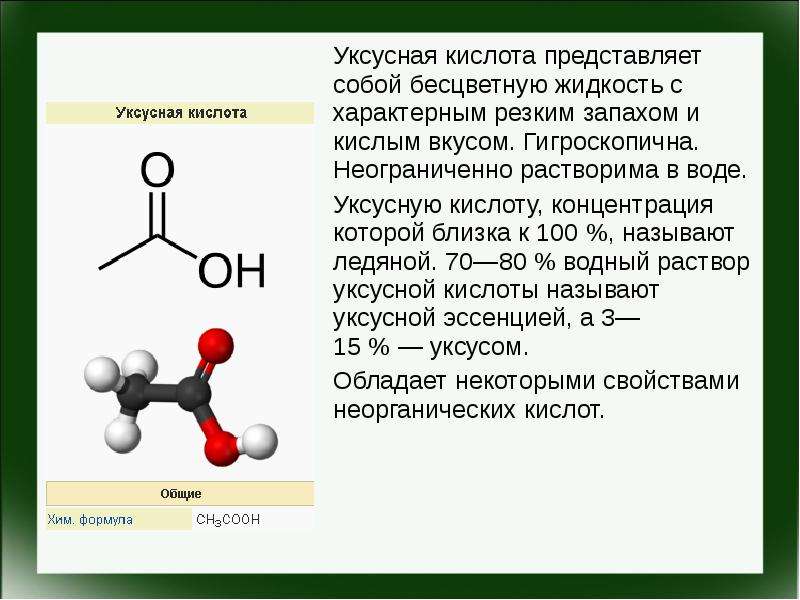 Составьте полные и сокращенные ионные
уравнения проведенной реакции. Наблюдения оформите в виде таблицы.
Составьте полные и сокращенные ионные
уравнения проведенной реакции. Наблюдения оформите в виде таблицы.
| № опыта | действие | наблюдение | уравнение реакции |
Уксусная кислота | 1 | Взаимодействие уксусной кислоты и нерастворимого основания (гидроксида меди (II)). | При смешивании растворов сульфата меди (II) и гидроксида натрия выпал осадок синего цвета, который растворяется при добавлении раствора уксусной кислоты | CuSO4+2KOH=Cu(OH)2+K2SO4 Cu2++2OH—=Cu(OH)2 Cu(OH)2+2СH3COOH= Cu(CH3COО)2+2H2О
Cu(OH)2+2CH3COO—= Cu2+ + 2H2O
|
2 | Взаимодействие уксусной кислоты с раствором карбоната натрия | Выделение газа | 2CH3COOH + Na2CO3= 2CH3COONa + CO2+ H2O 2H+ + CO32- = CO2 + H2O | |
Соляная кислота | 3 | Взаимодействие соляной кислоты
с нерастворимым основанием (гидроксидом меди (II)). | При смешивании растворов сульфата меди (II) и гидроксида натрия выпал осадок синего цвета, который растворяется при добавлении раствора соляной кислоты | CuSO4+2KOH=Cu(OH)2+K2SO4 Cu2++2OH—=Cu(OH)2
Cu(OH)2+2HCl= CuCl2+2H2О Cu(OH)2+2Cl—= Cu2+ + 2H2O
|
4 | Взаимодействие раствора соляной кислоты с раствором карбоната натрия | Выделение газа | 2HCl + Na2CO3= 2NaCl + CO2+ H2O 2H+ + CO32- = CO2 + H2O |
Вывод: уксусная и соляная
кислоты проявляют общие химические свойства, реагируют с нерастворимыми
основаниями и солями.
После завершения исследования группы представляют результаты своей работы, которые оцениваются по следующим критериям:
- Умение учащихся кратко обобщить и записать итог выполненной работы в виде химических формул, уравнений, словесных выводов.
- Умение учащихся конкретно, полно, развернуто и научно объяснить полученные результаты исследования.
- Использование наглядности (моделей, таблиц, схем, эксперимента) для обоснования своих теоретических выводов.
- Участие (активность) каждого учащегося в работе группы.
- Умение анализировать, сравнивать логически мыслить и делать выводы.
В качестве закрепления знаний и обобщения полученных результатов учащимся предлагается ответить на вопросы мини-теста «Пятерочка» (если учащиеся отвечают правильно, то в таблице ответов появляется цифра пять).
Тест.
№ 1. Уксусная кислота в растворе реагирует с веществами:
а) NН3 | г) ZnO |
б) FeO | д) CO |
в) Na2CO3 |
|
№ 2. Предельные одноосновные
карбоновые кислоты имеют общую формулу:
Предельные одноосновные
карбоновые кислоты имеют общую формулу:
а) СnН2nO | г) СnН2nO3 |
б) СnН2nO2 | д) СnН2n-2O2 |
в) СnН2n+2O |
|
№ 3. Какие признаки верно отражают физические свойства уксусной кислоты.
а) газообразное вещество | г) при комнатной температуре бесцветная жидкость |
б) имеет характерный запах | д) плохо растворяется в воде |
в) хорошо растворяется в воде |
|
№ 4. Соли уксусной кислоты называются:
Соли уксусной кислоты называются:
а) формиаты | г) ацетаты |
б) цитраты | д) оксалаты |
в) пропионаты |
|
№ 5. При взаимодействии уксусной кислоты с карбонатом натрия образуются вещества:
а) Н2СО3 | г) СН3СООNa | ||||||
б) СО2 | д) NaОН | ||||||
в) Н2О |
| ||||||
Список литературы:
1. Артеменко А. И. Удивительный мир органической
химии. – М.: Дрофа, 2009.
Артеменко А. И. Удивительный мир органической
химии. – М.: Дрофа, 2009.
2. Новошинский И. И. Органическая химия: 11 класс. – Краснодар: «Сов. Кубань», 2009.
3. Бердоносов С. С., Менделеева Е. А. Химия. Новейший справочник. – М.: Махаон, 2008.
4. Габриелян О. С. Химия. 10 класс. Базовый уровень: учеб. для общеобразоват. учреждении. – М.: Дрофа, 2009.
Физические свойства уксусной кислоты, формула расчета
Обычная бутылка пищевого уксуса, которую можно найти на кухне у любой домохозяйки, имеет в составе множество других кислот и витаминов. Добавление пары капель продукта в приготовленную пищу, салаты вызывает естественное усиление вкуса. Но мало кто из нас всерьез задумывался о свойствах и реальных масштабах применения основного компонента – уксусной кислоты.
Что это за вещество?
Формула уксусной кислоты СН3СООН, что относит ее к ряду жирных карбоновых кислот. Присутствие одной карбоксильной группы (СООН) относит ее к одноосновным кислотам. Вещество встречается на земном шаре в органическом виде и получается синтетическим путем в лабораториях. Кислота является самым простым, но не менее важным представителем своего ряда. Легко растворяется в воде, гигроскопична.
Вещество встречается на земном шаре в органическом виде и получается синтетическим путем в лабораториях. Кислота является самым простым, но не менее важным представителем своего ряда. Легко растворяется в воде, гигроскопична.
Физические свойства уксусной кислоты и плотность меняются в зависимости от температурного режима. При комнатной температуре в 20оС кислота находится в жидком состоянии, обладает плотностью 1,05 г/см3. Имеет специфический запах и кисловата на вкус. Раствор вещества без примесей твердеет и переходит в кристаллы на температуре ниже 17оС. Процесс кипения уксусной кислоты начинается при температуре свыше 117оС. Метиловая группа (СН3) формулы уксусной кислоты получается при взаимодействии спиртов с кислородом: брожение спиртовых веществ и углеводов, скисание вин.
Немного истории
Открытие уксуса было одним из первых в ряду кислот и совершалось поэтапно. Вначале уксусную кислоту стали добывать путем перегонки арабские ученые 8-го века. Однако еще в древнем Риме это вещество, полученное из скисшего вина, использовалось в качестве универсального соуса. Само название с древнегреческого переводится как «кислый». В 17 веке ученым Европы удалось добыть чистую субстанцию вещества. На тот момент они вывели формулу и обнаружили необычную способность – уксусная кислота в парообразном состоянии воспламенялась голубым огнем.
Однако еще в древнем Риме это вещество, полученное из скисшего вина, использовалось в качестве универсального соуса. Само название с древнегреческого переводится как «кислый». В 17 веке ученым Европы удалось добыть чистую субстанцию вещества. На тот момент они вывели формулу и обнаружили необычную способность – уксусная кислота в парообразном состоянии воспламенялась голубым огнем.
Вплоть до 19-го века ученые находили присутствие уксусной кислоты только в органическом виде — как часть соединений солей и эфиров. В составе растений и их плодов: яблок, винограда. В организме людей и животных: потовые выделения, желчь. В начале 20-го века русские ученые случайным образом добыли уксусный альдегид из реакции ацетилена с окисью ртути. На сегодня потребление уксусной кислоты на столько велико, что ее основная добыча происходит только синтетическим способом в огромных масштабах.
Способы добычи
Будет ли уксусная кислота чистого вида или с наличием примесей в растворе зависит от метода добычи. Пищевая уксусная кислота получается биохимическим методом в процессе брожения этанола. В промышленности выделяют несколько способов добычи кислоты. Как правило, реакции сопровождаются высокой температурой и наличием катализаторов:
Пищевая уксусная кислота получается биохимическим методом в процессе брожения этанола. В промышленности выделяют несколько способов добычи кислоты. Как правило, реакции сопровождаются высокой температурой и наличием катализаторов:
- Метанол в реакции с углеродом (карбонилирование).
- Окислением фракции нефти кислородом.
- Пиролизом древесины.
- Окислением ацетальдегида кислородом.
Промышленный способ эффективнее и экономичнее биохимического. Благодаря промышленному способу, объем производства уксусной кислоты в 20-м и 21-м столетии вырос в сотни раз, по сравнению с 19-м веком. На сегодня синтез уксусной кислоты карбонилированием метанола дает боле 50% от всего производимого объема.
Физические свойства уксусной кислоты и влияние ее на индикатор
В жидком состоянии уксусная кислота бесцветна. Уровень кислотности pH 2,4 легко проверяется лакмусовой бумажкой. Уксусная кислота при попадании на индикатор окрашивает его в красный цвет. Физические свойства уксусной кислоты меняются визуально. Когда температура опускается ниже 16оС, вещество принимает твердую форму и напоминает мелкие кристаллы льда. Она легко растворяется в воде и взаимодействует с широким спектром растворителей, кроме сероводорода. Уксусная кислота снижает общий объем жидкости при разбавлении ее водой. Самостоятельно опишите физические свойства уксусной кислоты, ее цвет и консистенцию, которые вы наблюдаете на следующем изображении.
Физические свойства уксусной кислоты меняются визуально. Когда температура опускается ниже 16оС, вещество принимает твердую форму и напоминает мелкие кристаллы льда. Она легко растворяется в воде и взаимодействует с широким спектром растворителей, кроме сероводорода. Уксусная кислота снижает общий объем жидкости при разбавлении ее водой. Самостоятельно опишите физические свойства уксусной кислоты, ее цвет и консистенцию, которые вы наблюдаете на следующем изображении.
Вещество воспламеняется при температуре от 455оС с выделением теплоты в 876 кДж/моль. Молярная масса составляет 60,05 г/моль. Физические свойства уксусной кислоты как электролита в реакциях проявляются слабо. Диэлектрическая проницаемость равна 6,15 при комнатной температуре. Давление, как и плотность, – переменная величина физического свойства уксусной кислоты. При давлении 40 мм. рт. ст. и температуре 42оС начнется процесс кипения. Но уже при давлении в 100 мм. рт. ст. кипение произойдет только при 62оС.
кипение произойдет только при 62оС.
Химические свойства
Вступая в реакцию с металлами и оксидами, вещество проявляет свои кислотные свойства. Прекрасно растворяя в себе более сложные соединения, кислота образует соли, которые называются ацетаты: магния, свинца, калия и др. Значение pK кислоты составляет 4,75.
При взаимодействии с газами уксус вступает в реакцию замещения с последующим вытеснением и образованием более сложных кислот: хлоруксусной, йодоуксусной. Растворяясь в воде, кислота диссоциирует с выделением ацетат-ионов и протонов водорода. Степень диссоциации равна 0,4 процента.
Физические и химические свойства молекул уксусной кислоты в кристаллическом виде создают диамеры на водородных связях. Также ее свойства необходимы при создании более сложных жирных кислот, стероидов и биосинтезе стеринов.
Лабораторные испытания
Обнаружить уксусную кислоту в растворе можно за счет выявления ее физических свойств, например запаха. Достаточно добавить в раствор более сильную кислоту, которая начнет вытеснять соли уксуса с выделением ее паров. Путем лабораторной перегонки CH3COONa и H2SO4 возможно получить уксусную кислоту в сухом виде.
Путем лабораторной перегонки CH3COONa и H2SO4 возможно получить уксусную кислоту в сухом виде.
Проведем опыт из школьной программы по химии 8 класса. Физические свойства уксусной кислоты ярко демонстрирует химическая реакция расстворения. Достаточно добавить в раствор к веществу оксид меди и слегка нагреть его. Оксид полностью растворяется, делая раствор голубоватого цвета.
Производные вещества
Качественные реакции вещества со многими растворами образуют: эфиры, амиды и соли. Однако во время производства других веществ, требования к физическим свойствам уксусной кислоты остаются высокими. Она всегда должна иметь высокую степень растворения, а значит, не иметь сторонних примесей.
В зависимости от концентрации уксусной кислоты водного раствора выделяют ряд ее производных. Концентрация вещества более 96% имеет название — ледяная уксусная кислота. Уксусную кислоту в 70-80% можно приобрести в продуктовых магазинах, там она будет называться – уксусная эссенция. Столовый уксус имеет концентрацию 3-9 %.
Столовый уксус имеет концентрацию 3-9 %.
Уксусная кислота и повседневная жизнь
Помимо пищевых особенностей, уксусная кислота обладает рядом физических свойств, которым человечество нашло свое применение в быту. Раствор вещества невысокой концентрации легко удаляет налет с металлических изделий, поверхности зеркал и окон. Способность впитывать влагу также играет на пользу. Уксус хорошо устраняет запахи в затхлых помещениях, удаляет пятна от овощей и фруктов на одежде.
Как выяснилось, физическое свойство уксусной кислоты – устранять жир с поверхности — может найти применение в народной медицине и косметологии. Слабым раствором пищевого уксуса обрабатывают волосы для придания им блеска. Вещество широко применяется для лечения простудных заболеваний, удаления бородавок и кожных грибков. Набирает темп использование уксуса в составе косметических обертываний для борьбы с целлюлитом.
Использование в производстве
В соединениях солей и других сложных веществ уксусная кислота выступает незаменимым элементом:
- Фармацевтическая отрасль.
 Для создания: аспирина, антисептических и антибактериальных мазей, фенацетина.
Для создания: аспирина, антисептических и антибактериальных мазей, фенацетина. - Производство синтетических волокон. Негорючие пленки, ацетилцеллюлоза.
- Пищевая отрасль. Для успешной консервации, приготовления маринадов и соусов, в качестве пищевой добавки E260.
- Текстильная отрасль. Входит в состав красителей.
- Производство косметики и средств гигиены. Ароматические масла, крема для улучшения тонуса кожи.
- Изготовление протрав. Используется как инсектицид и протрава от сорняков.
- Производство лаков. Технические растворители, производство ацетона.
Ежегодно производство уксусной кислоты увеличивается. На сегодня его объем в мире составляет более 400 тысяч тонн в месяц. Транспортировка кислоты осуществляется в прочных цистернах из стали. Хранение в пластиковой таре на многих производствах в связи с высокой физической и химической активностью уксусной кислоты запрещено либо ограничено сроком до нескольких месяцев.
Безопасность
Уксусная кислота высокой концентрации имеет третью степень воспламенения и выделяет токсичные пары. Рекомендуется надевать специальные противогазы и другие средства индивидуальной защиты в процессе работы с кислотой. Смертельная доза для человеческого организма от 20 мл. В момент попадания вещества внутрь кислота в первую очередь обжигает слизистую оболочку, а затем поражает остальные органы. В таких случаях нужна немедленная госпитализация.
Рекомендуется надевать специальные противогазы и другие средства индивидуальной защиты в процессе работы с кислотой. Смертельная доза для человеческого организма от 20 мл. В момент попадания вещества внутрь кислота в первую очередь обжигает слизистую оболочку, а затем поражает остальные органы. В таких случаях нужна немедленная госпитализация.
После попадания кислоты на открытые участки кожи рекомендуется сразу промыть их проточной водой. Поверхностный ожог кислотой может вызвать некроз тканей, что также требует госпитализации.
Интересные факты
Ученые физиологии выяснили, что человеку вовсе не обязателен прием уксусной кислоты — без пищевых добавок можно обойтись. Зато людям с непереносимостью кислоты, а также с проблемами желудка, вещество противопоказано.
Уксусная кислота используется в книгопечатании.
Вещество в небольшом количестве было найдено в меде, бананах и пшенице.
Охладив уксусную кислоту и резко взболтав с ней емкость, можно наблюдать ее резкое застывание.
Небольшая концентрация уксусной кислоты может снизить болевой симптом от укуса насекомых, а также мелких ожогов.
Прием в пищу продуктов с малым содержанием уксусной кислоты снижает уровень холестерина в организме. Вещество хорошо стабилизирует уровень сахара у диабетиков.
Употребление белковой и углеводной пищи вместе с небольшим количеством уксусной кислоты повышает их усвояемость организмом.
Если еда пересолена, достаточно добавить пару капель уксуса, чтобы сгладить солоноватость.
Напоследок
Тысячелетия использования уксусной кислоты привели к тому, что ее физические и химические свойства находят свое применение на каждом шагу. Сотни возможных реакций, тысячи полезных веществ, благодаря которым человечество идет дальше. Главное знать все особенности уксусной кислоты, ее положительные и отрицательные качества.
Не стоит забывать о пользе, но всегда надо помнить какой вред может причинить неосторожное обращение с уксусной кислотой высокой концентрации. По своей опасности она стоит рядом с соляной и серной кислотой. Всегда помните о технике безопасности при использовании кислоты. Правильно и осторожно разбавляйте эссенцию водой.
По своей опасности она стоит рядом с соляной и серной кислотой. Всегда помните о технике безопасности при использовании кислоты. Правильно и осторожно разбавляйте эссенцию водой.
Очистка и абсолютизированиеСпособ 1. Уксусную кислоту кипятят над избытком трехокиси хрома для удаления легко окисляемых примесей. Кислоту отгоняют и фракционируют. Источник: Hutchinson A.W., Chandlee G.C., J. Am. Chem. Soc., 1931, v.53, 2881. Способ 2. Дробная кристаллизация. Кислоту несколько раз замораживают и сливают незамерзающий остаток. При этом повышается концентрация кислоты в водных растворах. Источник: McDougall F.H., J. Am. Chem. Soc., 1936, v.58, 2585. Способ 3. Если кислота содержит примеси реагирующие с хлором и бромом, то их можно удалить перегонкой над пятиокисью фосфора. В этом случае дистиллят будет содержать небольшое количество уксусного ангидрида. Источник: Orton K.J.P., Edwards M.G., King H., J. Chem. Soc., 1911, 1178. Для обезвоживания также можно использовать: P2O5, триацетат бора, перхлорат магния, безводный сульфат меди, триацетат хрома, уксусный ангидрид. |
|
Бутилацетат (бутиловый эфир уксусной кислоты)
Химическая формула: C6h22O2
Синоним: бутиловый эфир уксусной кислоты
Международное название: BUTYL ACETATE
CAS No: 123-86-4
Квалификация: Имп. «ч», ГОСТ 22300-76
Внешний вид: прозрачная жидкость с резким запахом
Гарантийный срок хранения: 2 года
Фасовка: канистры, 27 кг
Условия хранения: Избегать механического повреждения емкости
Молярная масса | 116. |
Плотность (20° С) | 0,878-0,883 |
Температура кипения | 126 °C |
Цветность | не более 10 |
Массовая доля основного вещества, %, не менее | 99,0 |
Массовая доля воды, %, не более | 0,1 |
Массовая доля кислот в пересчете на уксусную, %, не более | 0,05 |
Массовая доля спиртов, %, не более | 0,5 |
 Для согласования условий оплаты, звоните нашим менеджерам по телефонам:
Для согласования условий оплаты, звоните нашим менеджерам по телефонам: (383) 289- 98- 09, (383) 289- 98- 08
(383) 279-97-52
(383) 279-98-76
Бутилацетат (бутиловый эфир уксусной кислоты) — получаемый из уксусной кислоты бутиловый эфир. Бесцветные жидкости с характерным эфирным запахом, Бутилацетат мало растворим в воде; смешивается с органическими растворителями и растительными маслами; обладает всеми свойствами сложных эфиров.
Получение
В промышленности Бутилацетат получают этерификацией уксусной кислоты соответствующим бутанолом в присутствии h3SO4 при 100-110°С по непрерывной схеме.
Применение
Бутилацетат (бутиловый эфир уксусной кислоты) — наиболее распространенный растворитель при получении и применении лакокрасочных материалов.
• Растворяет эфиры целлюлозы, масла, жиры, хлоркаучуки, виниловые полимеры, карбиольные смолы и т.д.
• Добавка бутилацетата вместе с небольшим количеством бутилового спирта предотвращает побеление лаковых пленок.
• Является душистым веществом, входящим в состав фруктовых эссенций и парфюмерных композиций.
• Применяется в кожевенной промышленности в качестве дубильного вещества.
• Широко используется в фармацевтической промышленности для отделения первичных субстанций при производстве антибиотиков и др.
Изопроприлацетат | Telko
Бесцветный, летучий растворитель с хорошей растворимостью для многочисленных природных и синтетических смол. Растворитель в ЛКМ, печатных красках и химических перерабатывающих отраслях.
Химическая природа
изопропиловый эфир уксусной кислоты
2-ацетоксипропан
Молекулярная формула: C5H10O2
Молярная масса: 102,13 г/моль
№ CAS: 108-21-4
Спецификация
| Характеристики | Значение | Метод испытания |
|---|---|---|
| Содержание основного вещества | мин. 99% 99% | GC |
| Содержание изопропанола | макс. 0,10% | GC |
| Содержание воды | макс. 0,04% | ASTM E1064 |
| Нелетучие вещества | макс. 0,002% | ASTM D1218 |
| Цвет, Pt-Co | макс. 10 | ASTM D5386 |
Физические и химические свойства
| Внешний вид | Бесцветная жидкость |
|---|---|
| Плотность при 20 °C | 0.870 — 0,872 г/мл |
| Кислотность по уксусной кислоте | макс. 0,005% |
| Начальная точка кипения | мин. 87 °C |
| Точка перегонки | макс. 90 °C |
| Показатель преломления при 20°C | 1,376 — 1,378 |
Применение
Изопропилацетат используется в производстве флексографских красок, применяется в печатных процессах для корректировки скорости высыхания краски в качестве ускорителя.
Так же применяется в парфюмерных композициях, лаках для ногтей и волос, в виду хорошей растворяющей способности смол, целлюлозы и душистых веществ.
Что такое уксусная кислота? — Использование, структура и формула — Видео и стенограмма урока
КИСЛОТА УКСУСНАЯ
Органические соединения:
Уксусная кислота может быть отнесена к категории органических соединений.
1. Что такое органические соединения?
2. Какие из следующих соединений можно отнести к органическим соединениям?
3. Какое из следующих соединений НЕ МОЖЕТ быть отнесено к категории органических соединений?
Карбоновые кислоты:
Карбоновые кислоты представляют собой органические соединения, имеющие в своей структуре карбоксильную группу.Уксусная кислота является карбоновой кислотой, поскольку в ее структуре содержится карбоксильная группа.
4. Рассмотрим структуру уксусной кислоты, показанную ниже. Какой из атомов, обозначенных буквами А и В, является карбоксильной группой?
5. Какие из следующих соединений можно отнести к карбоновым кислотам?
Использование уксусной кислоты:
6. Уксусная кислота используется в производстве мономера винилацетата (ВАМ).Что такое мономер?
7. Уксусная кислота используется в производстве уксусного ангидрида. Уксусный ангидрид используется в лаборатории для синтеза аспирина, как показано в приведенной ниже реакции.
а. Какое из соединений, обозначенных A, B, C и D, является уксусным ангидридом?
б. Какое из соединений, обозначенных A, B, C и D, НЕ является карбоновой кислотой?
8. Уксусная кислота используется в производстве уксуса.
а. Какое растворенное вещество содержится в уксусе?
б. Что является растворителем в уксусе?
Ключ ответа:
1. Органические соединения – соединения на основе углерода (соединения содержат ковалентные связи между атомом углерода и водородом, кислородом, азотом)
2. Соединение C и соединение E можно отнести к категории органических соединений. Почему? Потому что они содержат атомы углерода, водорода и кислорода.
3. Соединение B и соединение D НЕ МОГУТ быть классифицированы как органические соединения. Почему? Потому что они не содержат атомов углерода, водорода и кислорода.
4. Группа атомов, обозначенная буквой B, представляет собой карбоксильную группу. Почему? Карбоксильная группа представлена как -COOH.
5. Соединение B можно отнести к карбоновой кислоте. Почему? Соединение B содержит карбоксильную группу -COOH
6. Мономер представляет собой соединение, которое подвергается полимеризации с образованием полимера.
Мономер представляет собой соединение, которое подвергается полимеризации с образованием полимера.
7а. Соединение, обозначенное буквой B, представляет собой ангидрид уксусной кислоты.
7б. Соединение, обозначенное буквой В, не является карбоновой кислотой (не содержит карбоксильную группу)
8а. Уксусная кислота является растворенным веществом в уксусе.
8б. Вода является растворителем уксуса.
(Уксус представляет собой раствор уксусной кислоты в воде)
Уксусная кислота — эпидемиология
Что такое уксусная кислота? Уксусная кислота также известна как этановая кислота, этиловая кислота, уксусная кислота и метанкарбоновая кислота; он имеет химическую формулу CH 3 COOH.Уксусная кислота является побочным продуктом брожения и придает уксусу его характерный запах. Уксус составляет около 4-6% уксусной кислоты в воде. Более концентрированные растворы можно найти в лаборатории, а чистая уксусная кислота, содержащая только следы воды, известна как ледяная уксусная кислота.
Уксусная кислота является 33-м химическим веществом, производимым в Соединенных Штатах. Уксусная кислота используется в производстве уксусного ангидрида, ацетата целлюлозы, мономера винилацетата, сложных эфиров уксусной кислоты, хлоруксусной кислоты, пластмасс, красителей, инсектицидов, фотографических химикатов и каучука.Другое коммерческое использование включает производство витаминов, антибиотиков, гормонов и органических химикатов, а также в качестве пищевой добавки. Типичные концентрации уксусной кислоты в пищевых продуктах составляют от 700 до 1200 мг/кг в винах, до 860 мг/кг в выдержанных сырах и 2,8 мг/кг в свежевыжатом апельсиновом соке.
Каковы последствия воздействия уксусной кислоты на здоровье?
Уксусная кислота сильно раздражает глаза, кожу и слизистые оболочки. Длительный контакт кожи с ледяной уксусной кислотой может привести к разрушению тканей.Ингаляционное воздействие (8 часов) паров уксусной кислоты с концентрацией 10 частей на миллион (млн) может вызвать некоторое раздражение глаз, носа и горла; при 100 ppm может возникнуть заметное раздражение легких и возможное повреждение легких, глаз и кожи. Непосредственно опасные для жизни или здоровья (IDLH) концентрации паров 1000 частей на миллион вызывают заметное раздражение глаз, носа и верхних дыхательных путей и недопустимы. Эти прогнозы были основаны на экспериментах на животных и промышленном воздействии. Кожная сенсибилизация к уксусной кислоте встречается редко, но имела место.
Непосредственно опасные для жизни или здоровья (IDLH) концентрации паров 1000 частей на миллион вызывают заметное раздражение глаз, носа и верхних дыхательных путей и недопустимы. Эти прогнозы были основаны на экспериментах на животных и промышленном воздействии. Кожная сенсибилизация к уксусной кислоте встречается редко, но имела место.
Сообщалось, что у 12 рабочих, подвергавшихся в течение двух или более лет воздействию переносимой по воздуху уксусной кислоты со средней концентрацией 51 ppm, наблюдались симптомы раздражения конъюнктивы, раздражения верхних дыхательных путей и гиперкератотического дерматита. Воздействие 50 частей на миллион или более непереносимо для большинства людей и приводит к интенсивному слезотечению и раздражению глаз, носа и горла, отеку глотки и хроническому бронхиту. Неакклиматизированные люди испытывают сильное раздражение глаз и носа при концентрациях, превышающих 25 частей на миллион, и сообщалось о конъюнктивите при концентрациях ниже 10 частей на миллион. В исследовании 5 рабочих, которые в течение 7-12 лет подвергались воздействию концентраций от 80 до 200 частей на миллион при пиках, основными результатами были почернение и гиперкератоз кожи рук, конъюнктивит (но без повреждения роговицы), бронхит и фарингит и эрозия. обнаженных зубов (резцов и клыков).
В исследовании 5 рабочих, которые в течение 7-12 лет подвергались воздействию концентраций от 80 до 200 частей на миллион при пиках, основными результатами были почернение и гиперкератоз кожи рук, конъюнктивит (но без повреждения роговицы), бронхит и фарингит и эрозия. обнаженных зубов (резцов и клыков).
Может ли уксусная кислота вызывать рак?
Неизвестно, может ли уксусная кислота вызывать рак у людей, но исследования на животных и клеточных линиях не выявили связи с раком или врожденными дефектами.
Существуют ли стандарты воздействия?
Стандарт Управления по безопасности и гигиене труда (OSHA) для переносимой по воздуху уксусной кислоты в виде восьмичасового средневзвешенного по времени значения (TWA) составляет 10 частей на миллион. Американская конференция государственных специалистов по промышленной гигиене (ACGIH) приняла пороговое предельное значение (TLV) в 10 частей на миллион. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) подтвердило, что уксусная кислота в целом признана безопасной как многоцелевая пищевая добавка, как вещество, мигрирующее в пищу из хлопка и хлопчатобумажных тканей, используемых в упаковке сухих пищевых продуктов, как вещество, мигрирующее в пищу. из изделий из бумаги и картона, а также в качестве пищевой добавки общего назначения к кормам для животных.
из изделий из бумаги и картона, а также в качестве пищевой добавки общего назначения к кормам для животных.
Как узнать больше об уксусной кислоте?
октябрь 2018 г.
Формула уксусной кислоты, структура, свойства и использование — видео и расшифровка урока
КИСЛОТА УКСУСНАЯ
Органические соединения:
Уксусная кислота может быть отнесена к категории органических соединений.
1. Что такое органические соединения?
2. Какие из следующих соединений можно отнести к органическим соединениям?
3. Какое из следующих соединений НЕ МОЖЕТ быть отнесено к категории органических соединений?
Карбоновые кислоты:
Карбоновые кислоты представляют собой органические соединения, имеющие в своей структуре карбоксильную группу. Уксусная кислота является карбоновой кислотой, поскольку в ее структуре содержится карбоксильная группа.
4. Рассмотрим структуру уксусной кислоты, показанную ниже. Какой из атомов, обозначенных буквами А и В, является карбоксильной группой?
5. Какое из следующих соединений можно отнести к карбоновой кислоте?
Использование уксусной кислоты:
6. Уксусная кислота используется в производстве мономера винилацетата (ВАМ). Что такое мономер?
7. Уксусная кислота используется в производстве уксусного ангидрида. Уксусный ангидрид используется в лаборатории для синтеза аспирина, как показано в приведенной ниже реакции.
а. Какое из соединений, обозначенных A, B, C и D, является уксусным ангидридом?
б. Какое из соединений, обозначенных A, B, C и D, НЕ является карбоновой кислотой?
8. Уксусная кислота используется в производстве уксуса.
а. Какое растворенное вещество содержится в уксусе?
б. Что является растворителем в уксусе?
Ключ ответа:
1. Органические соединения – соединения на основе углерода (соединения содержат ковалентные связи между атомом углерода и водородом, кислородом, азотом)
2. Соединение C и соединение E можно отнести к категории органических соединений. Почему? Потому что они содержат атомы углерода, водорода и кислорода.
3. Соединение B и соединение D НЕ МОГУТ быть классифицированы как органические соединения. Почему? Потому что они не содержат атомов углерода, водорода и кислорода.
4. Группа атомов, обозначенная буквой B, представляет собой карбоксильную группу. Почему? Карбоксильная группа представлена как -COOH.
5. Соединение B можно отнести к категории карбоновых кислот. Почему? Соединение B содержит карбоксильную группу -COOH
6. Мономер представляет собой соединение, которое подвергается полимеризации с образованием полимера.
Мономер представляет собой соединение, которое подвергается полимеризации с образованием полимера.
7а. Соединение, обозначенное буквой B, представляет собой ангидрид уксусной кислоты.
7б. Соединение, обозначенное буквой В, не является карбоновой кислотой (не содержит карбоксильную группу)
8а. Уксусная кислота является растворенным веществом в уксусе.
8б. Вода является растворителем уксуса.
(Уксус представляет собой раствор уксусной кислоты в воде)
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.
 Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie. - Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
14.6 Буферы – Химия 2e
Изменения pH в забуференных и не забуференных растворах
Ацетатные буферы используются в биохимических исследованиях ферментов и других химических компонентов клеток для предотвращения изменений рН, которые могут повлиять на биохимическую активность этих соединений.
(a) Рассчитайте рН ацетатного буфера, представляющего собой смесь 0,10 М уксусной кислоты и 0,10 М ацетата натрия.
(b) Рассчитайте pH после добавления 1,0 мл 0,10 NaOH к 100 мл этого буфера.
(c) Для сравнения рассчитайте рН после добавления 1,0 мл 0,10 М NaOH к 100 мл раствора незабуференного раствора с рН 4,74.
Решение
(a) Следование подходу ICE к этому расчету равновесия дает следующее:
Подстановка условий равновесной концентрации в выражение K a , предполагая, что x << 0,10, и решение упрощенного уравнения для x дает
х=1.8×10−5Mx=1,8×10−5M [h4O+]=0+x=1,8×10-5M[h4O+]=0+x=1,8×10-5M pH=-log[h4O+]=-log(1,8×10-5) pH=-log[h4O+]=-log(1,8×10-5) (b) Рассчитайте рН после добавления 1,0 мл 0,10 М NaOH к 100 мл этого буфера.
Добавление сильного основания нейтрализует часть уксусной кислоты, давая сопряженный ион ацетата основания. Рассчитайте новые концентрации этих двух компонентов буфера, затем повторите расчет равновесия в части (а), используя эти новые концентрации.
0,0010 л×(0,0.10моль NaOH2L)=1,0×10-4моль NaOH0,0010L×(0,10моль NaOH2L)=1,0×10-4моль NaOHНачальное молярное количество уксусной кислоты равно
. 0,100л×(0,100мольCh4CO2ч2л)=1,00×10-2мольCh4CO2H0,100л×(0,100мольCh4CO2ч2л)=1,00×10-2мольCh4CO2HКоличество уксусной кислоты, оставшееся после нейтрализации некоторого количества добавленным основанием, равно
. (1,0×10-2)-(0,01×10-2)=0,99×10-2мольCh4CO2H(1,0×10-2)-(0,01×10-2)=0,99×10-2мольCh4CO2HВновь образованный ацетат-ион вместе с изначально присутствующим ацетатом дает конечную концентрацию ацетата
. (1.0×10-2)+(0,01×10-2)=1,01×10-2мольNaCh4CO2(1,0×10-2)+(0,01×10-2)=1,01×10-2мольNaCh4CO2Расчет молярных концентраций двух компонентов буфера:
[Ch4CO2H]=9,9×10-3моль0,101л=0,098М[Ch4CO2H]=9,9×10-3моль0,101л=0,098М [NaCh4CO2]=1,01×10-2моль0,101л=0,100М[NaCh4CO2]=1,01×10-2моль0,101л=0,100М Используя эти концентрации, можно рассчитать рН раствора, как в части (а) выше, что дает рН = 4,75 (лишь немного отличается от значения до добавления сильного основания).
(c) Для сравнения рассчитайте pH после 1.0 мл 0,10 М NaOH добавляют к 100 мл раствора незабуференного раствора с рН 4,74.
Количество иона гидроксония, изначально присутствующего в растворе, равно
. [h4O+]=10-4,74=1,8×10-5M[h4O+]=10-4,74=1,8×10-5M моль-час4O+=(0,100 л)(1,8×10-5М)=1,8×10-6 моль-час4O+моль-час4O+=(0,100 л)(1,8×10-5М)=1,8×10-6 моль-час4O+Количество гидроксид-иона, добавленного к раствору, составляет
мольОН-=(0,0010л)(0,10М)=1,0×10-4мольОН-мольОН-=(0,0010л)(0,10М)=1,0×10-4мольОН-Добавленный гидроксид нейтрализует ион гидроксония посредством реакции
h4O+(водн.)+OH-(водн.)⇋2h3O(ж)h4O+(водн.)+OH-(водн.)⇋2h3O(ж.)Стехиометрия 1:1 этой реакции показывает, что был добавлен избыток гидроксида (большее молярное количество, чем первоначально присутствующий ион гидроксония).
Количество оставшегося гидроксид-иона составляет
1,0×10-4моль-1,8×10-6моль=9,8×10-5мольOH-1,0×10-4моль-1,8×10-6моль=9,8×10-5мольOH-соответствует молярности гидроксида
9,8×10-5 моль OH-/0,101 л=9,7×10-4M9,8×10-5 мольOH-/0,101 л=9,7×10-4MЗатем вычисляется рН раствора, равный
. pH=14,00-pOH=14,00-log(9,7×10-4)=10,99pH=14,00-pOH=14,00—log(9,7×10-4)=10,99
pH=14,00-pOH=14,00-log(9,7×10-4)=10,99pH=14,00-pOH=14,00—log(9,7×10-4)=10,99В этом незабуференном растворе добавление основания приводит к значительному повышению рН (с 4,74 до 10,00).99) по сравнению с очень небольшим увеличением, наблюдаемым для буферного раствора в части (б) (с 4,74 до 4,75).
Проверьте свои знания
Покажите, что добавление 1,0 мл 0,10 M HCl изменяет pH 100 мл раствора 1,8 × × 10 -5 M HCl с 4,74 до 3,00.Отвечать:
Начальный pH 1,8 ×× 10 −5 M HCl; pH = -log[H 3 O + ] = -log[1,8 × × 10 -5 ] = 4,74
Моль H 3 O + в 100 мл 1.8 ×× 10 −5 M HCl; 1,8 × × 10 −5 моль/л × × 0,100 л = 1,8 × × 10 −6
Моли H 3 O + , добавленные добавлением 1,0 мл 0,10 M HCl: 0,10 моль/л × × 0,0010 л = 1,0 × × 10 -4 моль; конечный pH после добавления 1,0 мл 0,10 M HCl:
 0×10-4моль+1,8×10-6моль101мл(1л1000мл))=3,00
0×10-4моль+1,8×10-6моль101мл(1л1000мл))=3,00Что такое этановая кислота? | Блог о химии
Этановая кислота — это другое название уксусной кислоты, но она более известна как активный ингредиент уксуса. Этановая кислота, наиболее типичный пример карбоновой кислоты, имеет кислый запах и вкус и используется в качестве консерванта, поскольку ее кислая среда неблагоприятна для бактерий. Но какая реальная химия стоит за этим химическим веществом?
Каково общее название этановой кислоты?Наиболее распространенным названием на самом деле является этановая кислота (CH 3 COOH), и это также систематическое название, присвоенное Международным союзом теоретической и прикладной химии (IUPAC).Это химическое вещество также известно под формальными и неофициальными названиями, в том числе:
.- Уксусная кислота
- Метанкарбоновая кислота
- Ацетат водорода
- Этиловая кислота
Систематическое название этановая кислота является более точным, поскольку оно содержит информацию о функциональной группе и структуре этого химического вещества.
Как мы уже говорили, этановая кислота является активным ингредиентом уксуса, но не путайте их с одним и тем же. Уксус представляет собой разбавленный водный раствор CH 3 COOH, и в нем присутствует много примесей, что делает его пригодным для употребления в пищу человеком.Итак, уксус технически не является этановой кислотой — это просто 4-8% раствор.
Уксус представляет собой разбавленный водный раствор этановой кислоты Какова формула этановой кислоты?Химическая формула этановой кислоты или уксусной кислоты может быть записана как C 2 H 4 O 2 . Эта химическая формула указывает на соответствующее пропорциональное количество элементов на молекулу. В данном случае это просто означает, что на каждую молекулу этановой кислоты приходится два атома углерода, четыре атома водорода и два атома кислорода.
Однако есть и другие способы записать формулу этановой кислоты, чтобы лучше понять ее химические свойства и другие атрибуты.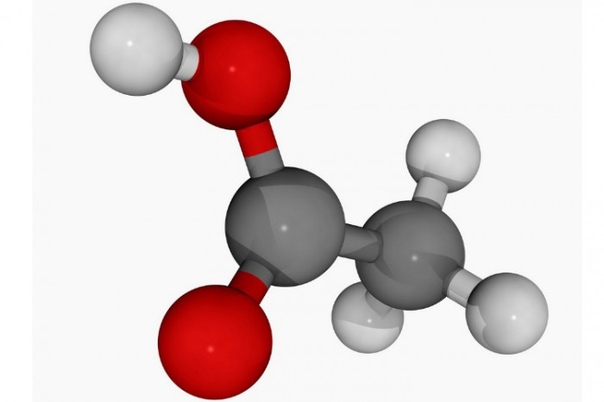 Например, его обычно записывают как CH 3 COOH, формула функциональной группы, указывающая на наличие двух групп в одной молекуле: CH 3 — это метильная группа, а COOH — это единственная карбоксильная группа.
Например, его обычно записывают как CH 3 COOH, формула функциональной группы, указывающая на наличие двух групп в одной молекуле: CH 3 — это метильная группа, а COOH — это единственная карбоксильная группа.
Для химиков различные формулы этановой кислоты имеют соответствующее значение с точки зрения интерпретации химического поведения этого вещества.Метильная группа, например, распространена среди углеводородных цепей. Это означает, что этановая кислота может быть получена с использованием углеводородов или спиртов, таких как этанол. Фактически этановая кислота образуется при окислении этанола. С другой стороны, карбоксильная группа указывает на то, что это вещество может быть депротонировано (удалены его протоны), что делает его кислым и коррозионно-активным.
Формула функциональной группы этановой кислоты также может помочь предсказать ее возможные реакции с другими веществами.Например, при растворении этановой кислоты в воде образуются положительные и отрицательные ионы, но метильная группа и карбоксильная группа не диссоциируют полностью. Вместо этого происходит следующее:
Вместо этого происходит следующее:
CH 3 COOH + H 2 O ⇆ H 3 O + + CH 3 COO –
Как видите, карбоксильная группа отдает дополнительный протон (водородное ядро) молекуле воды. Это делает этановый ион отрицательно заряженным. Как кислота, хотя и слабая, она отдает протон или положительно заряженный ион водорода, когда реагирует с основанием.
Слабые кислотные свойства этого химического вещества означают, что он имеет ряд самых разнообразных применений, в том числе:
- В качестве прекурсора ацетата целлюлозы, используемого в фотографии и полиграфии
- В качестве прекурсора поливинилацетата для производства синтетических волокон
- В качестве компонента герметиков, таких как столярный клей
- В качестве обезжиривающего растворителя – возможно, вы слышали о чудесах очистки уксусом
- В качестве антибиотика при бактериальных или грибковых инфекциях
- В качестве пищевого консерванта из-за его способности останавливать рост бактерий
pH этановой кислоты варьируется в зависимости от ее концентрации. Например, при концентрации 1,0 М раствора, что является приблизительной концентрацией бытового уксуса, рН составляет 2,4. Это свидетельствует о том, что диссоциировано только 0,4% молекул кислоты. В качестве альтернативы, при очень низкой концентрации всего 10 -6 М раствора диссоциирует около 90% молекул.
Например, при концентрации 1,0 М раствора, что является приблизительной концентрацией бытового уксуса, рН составляет 2,4. Это свидетельствует о том, что диссоциировано только 0,4% молекул кислоты. В качестве альтернативы, при очень низкой концентрации всего 10 -6 М раствора диссоциирует около 90% молекул.
Уровень pH любого растворенного вещества демонстрирует его склонность либо отдавать протоны, делая его кислым, либо принимать протоны, делая его щелочным.Протоны здесь относятся к ядру атома водорода в растворе при определенной концентрации. Вот почему pH означает «потенциал водорода».
pH рассчитывается как концентрация ионов водорода, но в отрицательной логарифмической форме, в диапазоне от 0 до 14, что делает значение pH 7 нейтральным. В то время как кислоты имеют уровень pH менее семи, основания или щелочные растворы имеют уровень pH выше семи. Но рН — не единственный способ измерить слабость или силу кислоты или основания.Истинным показателем силы кислотности или щелочности является константа диссоциации. Это рассчитывается на основе следующих формул:
Это рассчитывается на основе следующих формул:
Альтернативно выражается как:
В основном, константа диссоциации представляет собой соотношение между числом неповрежденных молекул вещества в растворе и диссоциированными ионами.
Этановая кислота имеет константу диссоциации K a =1,7×10 -5 или pK a =4.76. Логарифмическая версия используется для упрощения числа путем удаления научного обозначения. Основным эталоном является ион гидроксония, или h4O + , который имеет K a 1,00 и pK a 0,00.
pH рассчитывается как концентрация ионов водорода в растворе Какой цвет придает этановая кислота синей лакмусовой бумаге? Этановая кислота окрашивает синюю лакмусовую бумагу в красный цвет. Это имеет смысл, если учесть, что в тесте с лакмусовой бумагой синяя бумага используется для проверки кислотности, а красная бумага используется для проверки щелочности. Однако лакмусовая бумага используется только как индикаторный тест; он не может обеспечить точные показания уровня pH раствора.
Однако лакмусовая бумага используется только как индикаторный тест; он не может обеспечить точные показания уровня pH раствора.
имеет диапазон pH 4,5–8,3 при температуре 25°C. Это означает, что синяя лакмусовая бумажка станет красной, если рН 4,5 или ниже. И наоборот, красная лакмусовая бумажка станет синей, если уровень pH 8,3 или выше. Если лакмусовая бумажка становится пурпурной в любом случае, это означает, что уровень pH близок к нейтральному.
Лакмусовая бумажка является общепринятым лабораторным методом для определения того, является ли вещество кислотным или щелочным.Поскольку этановая кислота имеет уровень pH ниже 4,5, ее легко обнаружить с помощью лакмусовой бумаги. Однако из-за ограниченного диапазона лакмусовой бумаги он может быть не в состоянии определить кислотность этановой кислоты на определенных уровнях. Более точным инструментом для получения точных показаний является цифровой рН-метр.
Лакмусовые тесты редко проводятся в аналитической химии, особенно в промышленных лабораториях. Это потому, что он не обеспечивает достаточно точного чтения. Тем не менее, его по-прежнему часто проводят в лабораторных исследованиях средней школы в качестве подтверждения концепции.
Это потому, что он не обеспечивает достаточно точного чтения. Тем не менее, его по-прежнему часто проводят в лабораторных исследованиях средней школы в качестве подтверждения концепции.
1.19: Как предсказать результат кислотно-щелочной реакции
A: Определение константы кислотности
Вы, несомненно, знаете, что некоторые кислоты сильнее других. Относительная кислотность различных соединений или функциональных групп — другими словами, их относительная способность отдавать протон общему основанию в идентичных условиях — количественно определяется числом, называемым константой кислотности , сокращенно K a .Общей основой, выбранной для сравнения, является вода.
В качестве первого примера рассмотрим уксусную кислоту. Если сделать разбавленный раствор уксусной кислоты в воде, то между кислотой (донором протонов) и водой (акцептором протонов) произойдет кислотно-щелочная реакция.
Уксусная кислота является слабой кислотой, поэтому равновесие благоприятствует реагентам, а не продуктам — оно термодинамически «в гору», как показано на рисунке выше относительной длиной стрелок прямой и обратной реакции, и на диаграмме координат реакции ниже, в которой продукты обладают большей энергией, чем реагенты. -]}{[CH_3COOH]} \]
-]}{[CH_3COOH]} \]
Фактически, для разбавленного водного раствора активность воды приблизительно равна 1, поэтому общая константа диссоциации для данной кислоты HA или HB + выражается как:
Значение K a для уксусной кислоты равно 1.75 x 10 -5 — намного меньше 1, что указывает на то, что в равновесном растворе уксусной кислоты намного больше, чем ионов ацетата и гидроксония.
Наоборот, серная кислота с K a примерно 10 9 или соляная кислота с K a примерно 10 7 обе подвергаются практически полной диссоциации в воде: они являются очень сильными кислотами.
Число вроде 1,75 x 10 — 5 не очень легко ни произнести, ни запомнить, ни представить себе, поэтому химики обычно используют более удобный термин для выражения относительной кислотности.Значение pK a кислоты — это просто логарифм (основание 10) ее значения K a .
pK a = -log K a Ka = 10 -pKa
Подсчитав, мы находим, что pK a уксусной кислоты составляет 4,8. pK a серной кислоты составляет -10, а соляной кислоты -7. Использование значений pK a позволяет нам выразить относительную кислотность обычных соединений и функциональных групп по числовой шкале примерно от –10 (для очень сильной кислоты) до 50 (для соединения, которое вообще не является кислотным). Чем ниже значение pK a , тем сильнее кислота.
Ионизируемые (отдающие или принимающие протоны) функциональные группы, относящиеся к биологической органической химии, обычно имеют значения pK a в диапазоне от примерно 5 до примерно 20. Наиболее важные из них приведены ниже, с очень грубыми значениями pK a для сопряженных кислотных форм. Для справки также включены более кислотные группы со значениями рК и , близкими к нулю.
Приблизительный pK a значений, которые необходимо знать
ион гидроксония (H 3 O + ): 0
протонированный спирт: 0
протонированный карбонил: 0
карбоновые кислоты: 5
протонированные имины: 7
протонированные амины: 10
фенолы: 10
тиолы: 10
вода: 14
спирты: 15-18
альфа-карбоновые кислоты*: 20
*альфа-карбоновые кислоты будут рассмотрены далее в этой главе
Настоятельно рекомендуется зафиксировать эти грубые значения в памяти сейчас — тогда, если вам понадобится более точное значение, вы всегда сможете найти его в таблице pK a .
Внимание! pKa — это не то же самое, что pH!
Важно понимать, что pK a — это , а не , то же самое, что и pH: первое — это неотъемлемое свойство соединения или функциональной группы, а второе — мера концентрации ионов гидроксония в данном водном растворе:
pH = -log [H 3 O + ]
Знание значений pK и позволяет не только сравнивать кислотную силу, но и сравнивать щелочную силу.Следует помнить ключевую идею: чем сильнее сопряженная кислота, тем слабее сопряженное основание . Мы можем определить, что ион гидроксида является более сильным основанием, чем аммиак (NH 3 ), поскольку ион аммония (NH 4 + , pK a = 9,2) является более сильной кислотой, чем вода (pK a = 14,0).
Упражнение 7.2.1
Какое основание прочнее: CH 3 O — или CH 3 S — ? Ацетат-ион или аммиак? Гидроксид-ион или ацетат-ион?
Решение
Давайте применим наше понимание концепции pK a в контексте более сложной молекулы. Например, что такое pK a соединения, указанного ниже?
Например, что такое pK a соединения, указанного ниже?
Нам нужно оценить потенциальную кислотность четырех различных типов протонов в молекуле и найти наиболее кислотный из них. Не все ароматические протоны кислые — их pK a около 45. Аминная группа тоже некислая, ее pK a около 35. (Помните, незаряженные амины являются основными: это положительно заряженные протонированные амины со значениями pKa около 10, которые являются слабокислотными.) Протон спирта имеет pK a около 15, а протон фенола имеет pK a около 10: таким образом, наиболее кислой группой в молекуле выше является фенол. (Убедитесь, что вы можете распознать разницу между фенолом и спиртом — помните, что в феноле ОН-группа связана непосредственно с ароматическим кольцом). Если бы эта молекула вступала в реакцию с одним молярным эквивалентом сильного основания, такого как гидроксид натрия, то протон фенола отдавался бы с образованием фенолят-аниона.
Упражнение 7.2.2
Определите наиболее кислую функциональную группу каждой из приведенных ниже молекул и укажите ее приблизительный pK a .
Решение
B: Использование значений pK
и для прогнозирования равновесия реакцийПо определению, значение pK a говорит нам, в какой степени кислота будет реагировать с водой в качестве основания, но в более широком смысле мы также можем рассчитать константу равновесия для реакции между любой парой кислота-основа.Математически можно показать, что:
К экв. = 10 Δ pKa
. . . где Δ pK a = (pK a полученной кислоты минус pK a реагентной кислоты).
Рассмотрим реакцию между метиламином и уксусной кислотой:
Первым шагом является определение кислотных соединений по обе стороны уравнения и поиск или оценка их значений pK a . С левой стороны кислота, конечно же, является уксусной кислотой, а с правой стороны кислота представляет собой ион метиламмония (другими словами, ион метиламмония представляет собой кислоту в реакции, идущей справа налево). Мы можем найти точные значения pK a в таблице 7 (в конце книги), но мы уже знаем (потому что мы запомнили эту информацию, верно?!), что pK a уксусной кислоты примерно равно 5, а метиламмоний около 10. Более точные значения 4,8 и 10,6 соответственно.
С левой стороны кислота, конечно же, является уксусной кислотой, а с правой стороны кислота представляет собой ион метиламмония (другими словами, ион метиламмония представляет собой кислоту в реакции, идущей справа налево). Мы можем найти точные значения pK a в таблице 7 (в конце книги), но мы уже знаем (потому что мы запомнили эту информацию, верно?!), что pK a уксусной кислоты примерно равно 5, а метиламмоний около 10. Более точные значения 4,8 и 10,6 соответственно.
Не выполняя вообще никаких расчетов, вы должны увидеть, что это равновесие находится далеко в правой части: уксусная кислота имеет более низкий pK a , что означает, что она является более сильной кислотой, чем метиламмоний, и, следовательно, она хочет отдавать свой протон больше, чем это делает метиламмоний. Делая математику, мы видим, что
K EQ = 10 pka = 10 (10.6 — 4. 8) = 10 5.8 = 6,3 x 10 5
8) = 10 5.8 = 6,3 x 10 5
Итак, K eq — очень большое число (намного больше 1), и равновесие реакции между уксусной кислотой и метиламином находится далеко в правой части уравнения, как мы и предсказывали.Это также говорит нам о том, что реакция имеет отрицательное изменение свободной энергии Гиббса и является термодинамически благоприятной.
Если бы вы просто хотели быстро приблизить значение K eq без использования точной информации pK a или калькулятора, вы могли бы приблизительно вычислить pK a ~ 5 (для карбоновой кислоты) и pK a ~10 (для иона аммония) и подсчитали в уме, что константа равновесия должна быть порядка 10 5 .
Упражнение 7.2.3
Покажите продукты следующих кислотно-щелочных реакций и приблизительно оцените значение K eq .
Решение
C: Органические молекулы в буферном растворе: уравнение Хендерсона-Хассельбаха
Среда внутри живой клетки, в которой протекает большинство биохимических реакций, представляет собой водный буфер с рН ~ 7. Вспомните из курса общей химии, что буфер представляет собой раствор слабой кислоты и сопряженного с ней основания.Ключевым уравнением для работы с буферами является уравнение Хендерсона-Хассельбаха:
Вспомните из курса общей химии, что буфер представляет собой раствор слабой кислоты и сопряженного с ней основания.Ключевым уравнением для работы с буферами является уравнение Хендерсона-Хассельбаха:
Уравнение Хендерсона-Хассельбаха:
Уравнение говорит нам, что если наш буфер представляет собой эквимолярный раствор слабой кислоты и сопряженного с ней основания, pH буфера будет равен pK a кислоты (поскольку логарифм 1 равен нулю). Если кислой формы больше, чем основания, то, конечно, pH буфера ниже, чем pK a кислоты.
Упражнение 7.2.4
Каков рН водного буферного раствора, который составляет 30 мМ в уксусной кислоте и 40 мМ в ацетате натрия? pK a уксусной кислоты составляет 4,8.
Решение
Уравнение Хендерсона-Хассельбаха особенно полезно, когда мы хотим подумать о состоянии протонирования различных функциональных групп биомолекул в буфере с рН 7. Когда мы делаем это, мы всегда предполагаем, что концентрация биомолекулы мала по сравнению с концентрацией компонентов буфера.(Фактический состав физиологического буфера сложен, но в основном он основан на фосфорной и угольной кислотах).
Когда мы делаем это, мы всегда предполагаем, что концентрация биомолекулы мала по сравнению с концентрацией компонентов буфера.(Фактический состав физиологического буфера сложен, но в основном он основан на фосфорной и угольной кислотах).
Представьте себе остаток аспарагиновой кислоты, расположенный на поверхности белка в клетке человека. Находясь на поверхности, боковая цепь полностью контактирует с буфером pH 7, окружающим белок. В каком состоянии находится функциональная группа боковой цепи: в протонированном состоянии (карбоновая кислота) или в депротонированном состоянии (карбоксилат-ион)? Используя уравнение Хендерсона-Хассельбальха, мы вводим наши значения pH буфера и грубое приближение pKa pK a = 5 для функциональной группы карбоновой кислоты.Подсчитав, мы находим, что отношение карбоксилата к карбоновой кислоте составляет примерно 100 к 1: карбоновая кислота практически полностью ионизирована (в депротонированном состоянии) внутри клетки. Этот результат распространяется на все другие группы карбоновых кислот, которые вы можете найти в природных биомолекулах или молекулах лекарств: в физиологической среде карбоновые кислоты почти полностью депротонированы.
Теперь давайте снова воспользуемся уравнением, на этот раз для функциональной группы амина, такой как боковая цепь остатка лизина: внутри клетки мы, вероятно, увидим нейтральный амин (R-NH 2 ) или аммоний катион (R-NH 3 + ?) Используя уравнение с pH = 7 (для биологического буфера) и pKa = 10 (для аммониевой группы), находим, что отношение нейтрального амина к катиону аммония составляет примерно 1 к 100: группа близка к полностью протонированной внутри клетки, поэтому мы увидим R-NH 3 + , а не R-NH 2 .
Мы можем сделать такой же грубый расчет для других общих функциональных групп, встречающихся в биомолекулах. Будет очень полезно запомнить следующее:
При физиологическом pH:
Карбоновые кислоты депротонированы (в форме аниона карбоксилата)
Амины протонированные (в форме катиона аммония)
Тиолы, фенолы, спирты и амиды незаряженные
Имины представляют собой смесь протонированного (катионного) и депротонированного (нейтрального) состояний
О физиологическом состоянии протонирования фосфатных групп мы поговорим в главе 9.
Упражнение 7.2.5
Молекула ниже — , а не , нарисованная в приемлемом состоянии протонирования для pH 7. Перерисуйте ее с функциональными группами в правильном состоянии протонирования.
Решение
Хотя нас больше всего интересует состояние молекул при pH 7, уравнение Хендерсона-Хассельбаха, конечно, можно использовать для определения состояния протонирования функциональных групп в растворах, забуференных до других уровней pH.Упражнения ниже дают некоторую практику в этом типе расчета.
Упражнение 7.2.6
Каково отношение ацетат-иона к нейтральной уксусной кислоте, когда небольшое количество уксусной кислоты (pK a = 4,8) растворено в буфере с pH 2,8? рН 3,8? рН 4,8? рН 5,8? рН 6,8?
Решение
Упражнение 7.2.7
Можно ли ожидать, что фенол будет растворим в водном растворе, забуференном до pH 2? рН 7? рН 12? Поясните свой ответ.

 В мякоти апельсина его около 2%, в
лимоне – 6% из которых и было впервые выделено в 1784 г. К. Шееле.
В мякоти апельсина его около 2%, в
лимоне – 6% из которых и было впервые выделено в 1784 г. К. Шееле.



 0520 г/моль
0520 г/моль 16 г/моль
16 г/моль