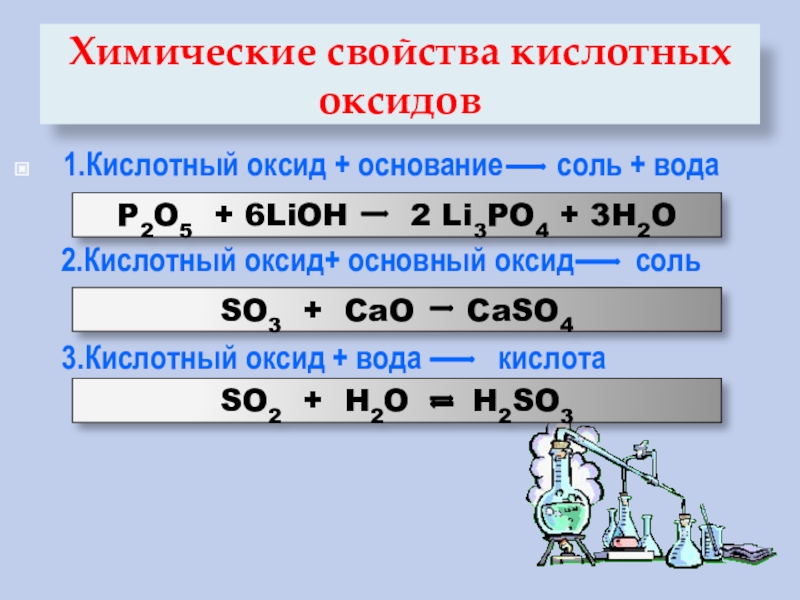
ЕГЭ. Химические свойства солей
Химические свойства солей
1. Взаимодействие растворов солей с металлами
Более активные металлы вытесняют из солей менее активные металлы:
Fe + CuSO4 → Cu + FeSO4
Железо является более активным металлом, чем медь, так как стоит левее в ряду активностей металлов, следовательно вытесняет медь из ее соли. Такие реакции протекают в растворах, следовательно, соли должны быть растворимыми.
Ag + CuSO4 → реакция не идет, так как серебро стоит правее меди в ряду активностей металлов и, следовательно, является более слабым металлом.
2. Соли вступают в реакции ионного обмена с щелочами:
Условия: 1) оба реагента должны быть растворимыми; 2) должен выпадать осадок или выделяться газ.
2NaOH + ZnCl2 → Zn(OH)2 + 2NaCl
NaOH + NH4NO3 → NH3 + NaNO3 + H2O
3. Соли вступают в реакции ионного обмена с кислотами:
Условие: должен выделяться газ, выпадать осадок или образовываться более слабая кислота:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
AgNO3 + HCl → AgCl + HNO3
K3PO4 + HCl → NaCl + H3PO4 (слабая кислота)
4. Некоторые соли могут вступать в окислительно-восстановительные реакции.
1) Соли, проявляющие окислительные свойства: соли кислородсодержащих кислот галогенов (KClO3, KClO4 и др.), KMnO4, K2CrO7, нитраты (KNO3
и др) и некоторые другие.2KClO3 + 3FeSO4 + 12KOH → 2KCl + 3K2FeO4 + 3K2SO4 + 6H2O
3KBrO4 + 8NH3 → 3KBr + 4N2 + 12H2O
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
K2Cr2O7 + 3KNO2 + 8HNO3 → 2Cr(NO3)3 + 5KNO3 + 4H2O
KNO3 + MnO2 + 2KOH → KNO2 + K2MnO4 + H2O
2FeCl3 + Fe → 3FeCl2
2) Соли, прявляющие восстановительные свойства: соли Fe+2, Cr+2, Cr+3, Sn
2CrCl2 + 4H2SO4(к) → Cr2(SO4)3 + SO2 + 4HCl + 2H2O
Cr2O3 + NaClO3 + 2K2CO3 → 2K2CrO4 + NaCl + 2CO2
Cu2S + 14HNO3(к) → H2SO4 + 2Cu(NO3)2 + 10NO2 + 6H2O
3Na2S + K2Cr2O7 + 7H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 3Na2SO4 + 7H2O
Na2SO3 + H 2O2 → Na2SO4 + H2O
5. Химические свойства кислых солей
1) Реагируют с металлами:
2KНSO4 + Ca → CaSO4 + K2SO4 + H2
2NaHSO4 + Zn → ZnSO4 + Na2SO4 + H2
2) Реагируют с оксидами и гидроксидами металлов:
2KHSO4 + MgO → MgSO4 + K2SO4 + H2O
2KHSO4 + 2NaOH → K2SO4 + Na2SO4 + 2H2O
2KHSO4 + Cu(OH)2 → K2SO4 + CuSO4 + 2H2O
3) Реагирую с солями, если выделяется газ или образуется осадок:
2KHSO4 + CaCO3 → K2SO4 + CaSO4 + CO2 + H2O
2KHSO
KHS + Cu(NO3)2 → CuS + KNO3 + HNO3
AgH2PO4 + NH4Br → AgBr + NH4H2PO4
3NaHCO3 + AlCl3  → Al(OH)3 + 3NaCl + 3CO2
4) Реагируют с основаниями с образованием средних солей:
KНСO3 + KОН → K2СO3 + H2O
NaHCO3 + KOH → KNaCO3 + H2O
2KHCO3 + Ba(OH)2 → BaCO3 + K2CO3 + 2H2O
KHCO3 + Ba(OH)2(изб. )  → BaCO3 + KOH + H2O
Ca(H2PO4)2 + 2Ca(OH)2 → Ca3(PO4)2 + 4H2O
3Mg(H2PO4)2 + 12KOH → Mg3(PO4)2 + 4K3PO4 + 12H2O
2NH4H2PO4 + 3Ba(OH)2 → Ba3(PO4)2 + 2NH3 + 6H2O
5) Реагируют с кислотами с образованием средних солей, если выделяется газ или образуется осадок:
NaHCO3 + HCl → NaCl + H2O + CO2
2KHS + H2SO4 → K2SO4 + 2H2S
6) Разлагаются при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O (t)
Mg(HCO3)2 → MgCO3 + CO2 + H2O (t)
NH4HCO3 → NH3 + CO2+ H2O (t)
6. Химические свойства комплексных солей
Химические свойства комплексных солей
1) Реагируют с CO2 и SO2 с образованием амфотерных гидроксидов (могут образовываться как средние, так и ксилые соли):
Na[Al(OH)4] + CO2 → NaHCO3 + Al(OH)3 или
2Na[Al(OH)4] + CO2 → Na2CO3 + 2Al(OH)3 + H2O
K3[Cr(OH)6]+ 3SO2 → 3KHSO3 + Cr(OH)3
2) Реагируют с кислотами (могут образовываться как средние, так и ксилые соли)
Na[Al(OH)4] + HCl → NaCl + Al(OH)3 + H2O
K3[Cr(OH)6] + 3HNO3 → 3KNO3 + Cr(OH)3 + 3H2O
K[Al(OH)4] + H2S(изб.) → KHS + Al(OH)3 + H2O
Но:
K2[Zn(OH)4] + 3H2S → 2KHS + ZnS + 4H2O
3) Разлагаются при нагревании:
Na[Al(OH)4] → NaAlO2 + 2H2O (t)
K2[Zn(OH)4] → K2ZnO2 + 2H2O (t)
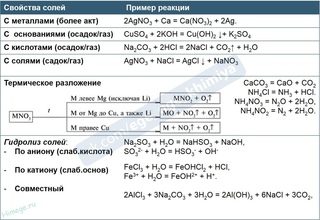
7. Разложение средних солей при нагревании
Разложение средних солей при нагревании
1) Нерастворимые карбонаты разлагаются при нагревании:
CaCO3 → CaO + CO2 (t)
FeCO3 → FeO + CO2 (t)
MgCO
2) Нитраты разлагаются при нагревании. Продукты зависят от положения металла в ряду активности металлов:
| MNO3 → MNO2 + O2 | M – металл, находящийся в ряду активности металлов левее Mg, исключая Li. |
| MNO3 → MO + NO2 + O2 | M – металл, находящийся в ряду активности металлов от Mg до Cu (Mg и Cu включительно), а также Li. |
| MNO3 → M + NO2 + O2 | M – металл, находящийся в ряду активности металлов правее Cu. |
3) Соли аммония разлагаются при нагревании:
NH4Cl → NH3 + HCl (t)
(NH4)3PO4 → 3NH3 + H3PO4(t)
(NH4
Соли аммония азотной и азотистой кислот разлагаются с изменением степени окисления:
NH4NO3 → N2O + H2O (t)
NH4NO2 → N2 + H2O (t)
4) Термическое разложение кислородсодержащих солей хлора:
2KClO3 → 2KCl + 3O2 (t, kt = MnO2)
Физические и химические свойства солей
Соли принято делить на три группы – средние (NaCl), кислые (NaHCO3) и основные (Fe(OH)Cl). Кроме этого различают двойные (смешанные) и комплексные соли. Двойные соли образованы двумя катионами и одним анионом. Они существуют только в твердом виде.
Кроме этого различают двойные (смешанные) и комплексные соли. Двойные соли образованы двумя катионами и одним анионом. Они существуют только в твердом виде.
Химические свойства солей
а) кислые соли
Кислые соли при диссоциации дают катионы металла (иона аммония), ионы водорода и анионы кислотного остатка:
NaHCO3 ↔ Na+ + H+ + CO32-.
Кислые соли – продукты неполного замещения атомов водорода соответствующей кислоты на атомы металла.
Кислые соли термически неустойчивы и при нагревании разлагаются с образованием средних солей:
Ca(HCO3)2 = CaCO3↓ + CO2↑ + H2O.
Для кислых солей характерны реакции нейтрализации со щелочами:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2H2O.
б) основные соли
Основные соли при диссоциации дают катионы металла, анионы кислотного остатка и ионы ОН—:
Fe(OH)Cl ↔ Fe(OH)+ + Cl— ↔ Fe2+ + OH— + Cl—.
Основные соли – продукты неполного замещения гидроксильных групп соответствующего основания на кислотные остатки.
Основные соли, также, как и кислые, термически неустойчивы и при нагревании разлагаются:
[Cu(OH)]2CO3 = 2CuO + CO2↑ + H2O.
Для основных солей характерны реакции нейтрализации с кислотами:
Fe(OH)Cl + HCl ↔ FeCl2 + H2O.
в) средние соли
Средние соли при диссоциации дают только катионы металла (ион аммония) и анионы кислотного остатка (см. выше). Средние соли – продукты полного замещения атомов водорода соответствующей кислоты на атомы металла.
Большинство средних солей термически неустойчивы и при нагревании разлагаются:
CaCO3 = CaO + CO2;
NH4Cl = NH3 + HCl;
2Cu(NO3)2 = 2CuO +4NO2 + O2.
В водном растворе средние соли подвергаются гидролизу:
Al2S3 +6H2O ↔ 2Al(OH)3 + 3H2S;
K2S + H2O ↔ KHS + KOH;
Fe(NO3)3 + H2O ↔ Fe(OH)(NO3)2 + HNO3.
Средние соли вступают в реакции обмена с кислотами, основаниями и другими солями:
Pb(NO3)2 + H2S = PbS↓ + 2HNO3;
Fe2(SO4)3 + 3Ba(OH)2 = 2Fe(OH)3↓ + 3BaSO4↓;
CaBr2 + K2CO3 = CaCO3↓ + 2KBr.
Физические свойства солей
Чаще всего соли – кристаллические вещества с ионной кристаллической решеткой. Соли имеют высокие температуры плавления. При н.у. соли – диэлектрики. Растворимость солей в воде различна.
Получение солей
а) кислые соли
Основные способы получения кислых солей – неполная нейтрализация кислот, действие избытка кислотных оксидов на основания, а также действие кислот на соли:
NaOH + H2SO4 = NaHSO4 + H2O;
Ca(OH)2 + 2CO2 = Ca(HCO3)2;
CaCO3 + CO2 + H2O = Ca(HCO3)2.
б) основные соли
Основные соли получают путем осторожного добавления небольшого количества щелочи к раствору средней соли, либо действием солей слабых кислот на средние соли:
AlCl3 + 2NaOH = Al(OH)2Cl + 2NaCl;
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3↓ + CO2↑ + 2NaCl.
в) средние соли
Основные способы получения средних солей – реакции взаимодействия кислот с металлами, основными или амфотерными оксидами и основаниями, а также реакции взаимодействия оснований с кислотными или амфотерными оксидами и кислотами, реакции взаимодействия кислотных и основных оксидов и реакции обмена:
Mg + H2SO4 = MgSO4 + H2↑;
Ag2O + 2HNO3 = 2AgNO3 + H2O;
Cu(OH)2 + 2HCl = CuCl2 + 2H2O;
2KOH + SO2 = K2SO3 + H2O;
CaO + SO3 = CaSO4;
BaCl2 + MgSO4 = MgCl2 + BaSO4↓.
Примеры решения задач
средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
Видеоурок 1: Классификация неорганических солей и их номенклатура
Видеоурок 2: Способы получения неорганических солей. Химические свойства солей
Химические свойства солей
Лекция: Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
Характеристика солей
Соли – это такие химические соединения, состоящие из катионов металлов (или аммония) и кислотных остатков.
Соли так же следует рассматривать в виде продукта взаимодействия кислоты и основания. В итоге данного взаимодействия, могут образовываться:
нормальные (средние),
кислые,
основные соли.
Нормальные соли образуются при достаточном для полного взаимодействия количестве кислоты и основания. К примеру:
Названия нормальных солей состоят из двух частей. В начале называется анион (кислотный остаток), затем катион. Например: хлорид натрия — NaCl, сульфат железа(III) — Fe2(SО4)3, карбонат калия — K2CO3, фосфат калия — K3PO4 и др.
Кислые соли образуются при избытке кислоты и недостаточном количестве щелочи, потому как при этом катионов металла становится недостаточно для замещения всех катионов водорода, имеющихся в молекуле кислоты. К примеру:
В составе кислотных остатков данного вида солей вы всегда увидите водород. Кислые соли всегда возможны для многоосновных кислот, а для одноосновных нет.
В названиях кислых солей ставится приставка гидро- к аниону. Например: гидросульфат железа(III)- Fe(HSO4)3, гидрокарбонат калия — KHCO3, гидрофосфат калия — K2HPO4 и др.
Основные соли образуются при избытке основания и недостаточном количестве кислоты, потому как в данном случае анионов кислотных остатков недостаточно для полного замещения гидроксогрупп, имеющихся в основании. К примеру:
Таким образом основные соли в составе катионов содержат гидроксогруппы. Основные соли возможны для многокислотных оснований, а для однокислотных нет. Некоторые основные соли способны самостоятельно разлагаться, при этом выделяя воду, образуя оксосоли, обладающие свойствами основных солей. К примеру:
Некоторые основные соли способны самостоятельно разлагаться, при этом выделяя воду, образуя оксосоли, обладающие свойствами основных солей. К примеру:
Название основных солей строится следующим образом: к аниону добавляется приставка гидроксо-. Например: гидроксосульфат железа(III) — FeOHSO4, гидроксосульфат алюминия — AlOHSO4, дигидроксохлорид железа (III) — Fe(OH)2Cl и др.
Многие соли, находясь в твердом агрегатном состоянии, являются кристаллогидратами: CuSO4.5h3O; Na2CO3.10h3O и т.д.
Химические свойства солей
Соли – это достаточно твердые кристаллические вещества, имеющие ионную связь между катионами и анионами. Свойства солей обусловлены их взаимодействием с металлами, кислотами, основаниями и солями.
Типичные реакции нормальных солей
С металлами реагируют хорошо. При этом, более активные металлы вытесняют менее активные из растворов их солей. К примеру:
С кислотами, щелочами и другими солями реакции проходят до конца, при условии образования осадка, газа или малодиссоциируемых соединений. Например, в реакциях солей с кислотами образуются такие вещества, как сероводород H2S – газ; сульфат бария BaSO4 – осадок; уксусная кислота CH3COOH – слабый электролит, малодиссоциируемое соединение. Вот уравнения данных реакций:
Например, в реакциях солей с кислотами образуются такие вещества, как сероводород H2S – газ; сульфат бария BaSO4 – осадок; уксусная кислота CH3COOH – слабый электролит, малодиссоциируемое соединение. Вот уравнения данных реакций:
K2S + H2SO4 → K2SO4 + H2S;
BaCl2 + H2SO4 → BaSO4 + 2HCl;
CH3COONa + HCl → NaCl + CH3COOH.
В реакциях солей со щелочами образуются такие вещества, как гидроксид никеля (II) Ni(OH)2 – осадок; аммиак NH3 – газ; вода H2О – слабый электролит, малодиссоциируемое соединение:
Соли реагируют между собой, если образуется осадок:
Или в случае образования более устойчивого соединения:
В этой реакции из кирпично-красного хромата серебра образуется черный сульфид серебра, ввиду того, что он является более нерастворимым осадком, чем хромат.
Многие нормальные соли разлагаются при нагревании с образованием двух оксидов – кислотного и основного:
Нитраты разлагаются другим, отличным от остальных нормальных солей образом. При нагревании нитраты щелочных и щелочноземельных металлов выделяют кислород и превращаются в нитриты:
Нитраты почти всех других металлов разлагаются до оксидов:
Нитраты некоторых тяжелых металлов (серебра, ртути и др) разлагаются при нагревании до металлов:
Особое положение занимает нитрат аммония, который до температуры плавления (170оС) частично разлагается по уравнению:
При температурах 170 — 230 оС, по уравнению:
При температурах выше 230 оС — со взрывом, по уравнению:
Хлорид аммония NH4Cl разлагается с образованием аммиака и хлороводорода:
Типичные реакции кислых солей
Они вступают во все те реакции, в которые вступают кислоты. Со щелочами реагируют следующим образом, если в составе кислой соли и щелочи имеется один и тот же металл, то в результате образуется нормальная соль.
 К примеру:
К примеру:Если же щелочь содержит другой металл, то образуются двойные соли. Пример образования карбоната лития — натрия:
Типичные реакции основных солей
Данные соли вступают в те же реакции, что и основания. С кислотами реагируют следующим образом, если в составе основной соли и кислоты имеется один и тот же кислотный остаток, то в результате образуется нормальная соль. К примеру:
Если же кислота содержит другой кислотный остаток, то образуются двойные соли. Пример образования хлорида меди — брома:
Комплексные соли
Комплексное соединение — соединение, в узлах кристаллической решетки которого содержатся комплексные ионы.
Рассмотрим комплексные соединения алюминия — тетрагидроксоалюминаты и цинка — тетрагидроксоцинкаты. В квадратных скобках формул данных веществ указываются комплексные ионы.
Химические свойства тетрагидроксоалюмината натрия Na[Al(OH)4] и тетрагидроксоцинката натрия Na2[Zn(OH)4]:
1. Как и все комплексные соединения выше названные вещества диссоциируются:
Как и все комплексные соединения выше названные вещества диссоциируются:
- Na[Al(OH)4] → Na+ + [Al(OH)4]—;
- Na2[Zn(OH)4] → 2Na+ + [Zn(OH)4]—.
Имейте ввиду, что дальнейшая диссоциация комплексных ионов невозможна.
2. В реакциях с избытком сильных кислот образуют две соли. Рассмотрим реакцию тетрагидроксоалюмината натрия с разбавленным раствором хлороводорода:
- Na[Al(OH)4] + 4HCl → AlCl3 + NaCl + H2O.
Мы видим образование двух солей: хлорида алюминия, хлорида натрия и воды. Подобная реакция произойдет и в случае с тетрагидроксоцинкатом натрия.
3. Если же сильной кислоты будет недостаточно, допустим вместо 4HCl мы взяли 2HCl, то соль образует наиболее активный металл, в данном случае натрий активнее, значит образуется хлорид натрия, а образовавшиеся гидроксиды алюминия и цинка выпадут в осадок. Этот случай рассмотрим на уравнении реакции с тетрагидроксоцинкатом натрия:
Этот случай рассмотрим на уравнении реакции с тетрагидроксоцинкатом натрия:
Химические свойства солей — урок. Химия, 8–9 класс.
1. Соли являются электролитами.
В водных растворах соли диссоциируют на положительно заряженные ионы (катионы) металлов и отрицательно заряженные ионы (анионы) кислотных остатков.
Например, при растворении кристаллов хлорида натрия в воде положительно заряженные ионы натрия и отрицательно заряженные ионы хлора, из которых образована кристаллическая решётка этого вещества, переходят в раствор:
NaCl→Na++Cl−.При электролитической диссоциации сульфата алюминия образуются положительно заряженные ионы алюминия и отрицательно заряженные сульфат-ионы:
Al2SO43→2Al3++3SO42−.2. Соли могут взаимодействовать с металлами.
В ходе реакции замещения, протекающей в водном растворе, химически более активный металл вытесняет менее активный.

Например, если кусочек железа поместить в раствор сульфата меди, он покрывается красно-бурым осадком меди. Раствор постепенно меняет цвет с синего на бледно-зелёный, поскольку образуется соль железа(\(II\)):
Fe+CuSO4→FeSO4+Cu↓.
Видеофрагмент:
взаимодействие сульфата меди(\(II\)) с железом |
При взаимодействии хлорида меди(\(II\)) с алюминием образуются хлорид алюминия и медь:
2Al+3CuCl2→2AlCl3+3Cu↓.
3. Соли могут взаимодействовать с кислотами.
Протекает реакция обмена, в ходе которой химически более активная кислота вытесняет менее активную.
Например, при взаимодействии раствора хлорида бария с серной кислотой образуется осадок сульфата бария, а в растворе остаётся соляная кислота:
BaCl2+h3SO4→BaSO4↓+2HCl.
При взаимодействии карбоната кальция с соляной кислотой образуются хлорид кальция и угольная кислота, которая тут же разлагается на углекислый газ и воду:
CaCO3+2HCl→CaCl2+h3O+CO2↑⏟h3CO3.
Видеофрагмент:
Взаимодействие кислот с солями |
4. Растворимые в воде соли могут взаимодействовать со щелочами.
Реакция обмена возможна в том случае, если в результате хотя бы один из продуктов является практически нерастворимым (выпадает в осадок).
Например, при взаимодействии нитрата никеля(\(II\)) с гидроксидом натрия образуются нитрат натрия и практически нерастворимый гидроксид никеля(\(II\)):
NiNO32+2NaOH→NiOh3↓+2NaNO3.
Видеофрагмент:
Взаимодействие нитрата никеля(\(II\)) с гидроксидом натрия |
При взаимодействии карбоната натрия (соды) с гидроксидом кальция (гашёной известью) образуются гидроксид натрия и практически нерастворимый карбонат кальция:
Na2CO3+CaOh3→2NaOH+CaCO3↓.
5. Растворимые в воде соли могут вступать в реакцию обмена с другими растворимыми в воде солями, если в результате образуется хотя бы одно практически нерастворимое вещество.
Например, при взаимодействии сульфида натрия с нитратом серебра образуются нитрат натрия и практически нерастворимый сульфид серебра:
Na2S+2AgNO3→2NaNO3+Ag2S↓.
Видеофрагмент:
Взаимодействие сульфида натрия с нитратом серебра |
При взаимодействии нитрата бария с сульфатом калия образуются нитрат калия и практически нерастворимый сульфат бария:
BaNO32+K2SO4→2KNO3+BaSO4↓.

6. Некоторые соли при нагревании разлагаются.
Разложение солей может происходить:
- без изменения степени окисления элементов;
- с изменением степени окисления элементов (то есть, протекают окислительно-восстановительные реакции).
A. Реакции разложения солей, в которых степени окисления элементов не изменяются.
При сильном нагревании карбонат кальция (мел, известняк, мрамор) разлагается, образуя оксид кальция (жжёную известь) и углекислый газ:
CaCO3⇄t°CaO+CO2↑.
Видеофрагмент:
| Разложение мела при нагревании |
Гидрокарбонат натрия (пищевая сода) при небольшом нагревании разлагается на карбонат натрия (соду), воду и углекислый газ:
2NaHCO3⇄t°Na2CO3+h3O+CO2↑.
Видеофрагмент:
| Разложение гидрокарбоната натрия |
Кристаллогидраты солей при нагревании теряют воду. Например, пентагидрат сульфата меди(\(II\)) (медный купорос), постепенно теряя воду, превращается в безводный сульфат меди(\(II\)):
CuSO4⋅5h3O→t°CuSO4+5h3O.
При обычных условиях образовавшийся безводный сульфат меди можно превратить в кристаллогидрат:
CuSO4+5h3O→CuSO4⋅5h3O
Видеофрагмент:
| Разрушение и образование медного купороса |
Аналогичная химическая реакция протекает, когда к гемигидрату сульфата кальция (жжёному гипсу) при помешивании добавляют воду. Получившаяся кашица быстро застывает в результате образования дигидрата сульфата кальция (гипса):
CaSO4⋅0,5h3O+1,5h3O→CaSO4⋅2h3O
Видеофрагмент:
| Застывание гипса |
Б. Окислительно-восстановительные реакции разложения солей.
Окислительно-восстановительные процессы протекают при разложении нитратов.
Например, при термическом разложении нитрата калия образуются нитрит этого металла и кислород:
2KN+5O−23⟶t°2KN+3O2+O2↑0
Видеофрагмент:
Разложение нитрата калия |
Разложение перманганата калия в лабораторных условиях можно использовать для получения кислорода. При разложении этой соли, кроме кислорода, образуются манганат калия и оксид марганца(\(IV\)):
2KMn+7O−24⟶t°K2Mn+6O4+Mn+4O2+O2↑0
Кислые соли, реакция — Справочник химика 21
Соли, в которых не все, а только часть атомов водорода, замещены атомами металла, называют кислыми. Кислые соли получаются при реакции основания с избытком многоосновной кислоты. [c.13]
Кислые соли получаются при реакции основания с избытком многоосновной кислоты. [c.13]Химические свойства кислых и основных солей отличаются от свойств средних солей тем, что кислые соли вступают также во все реакции, характерные для кислот, а основные соли вступают во все реакции, характерные для оснований. [c.158]
Большинство нормальных солей сернистой кислоты, называемых сульфитами, практически нерастворимы. Хорошо растворимые сульфиты натрия и калия в водных растворах гидролизуются по обычной схеме, характерной для солей, образованных многовалентными анионами слабых кислот. Растворы этих солей имеют щелочную реакцию. Кислые соли (гидросульфиты) этих металлов также гидролизуются, однако водные растворы этих солей имеют кислую реакцию. [c.165]
Кислые соли образуются в том случае, если для реакции нейтрализации взято недостаточное количество гидроксида. Кислые соли диссоциируют ступенчато, например гидросульфат натрия диссоциирует согласно уравнениям [c.33]
Кислые соли диссоциируют ступенчато, например гидросульфат натрия диссоциирует согласно уравнениям [c.33]
Гидролиз солей. Гидролизом солей называются реакции взаимодействия ионов соли с ионами воды с образованием основания (или основных солей) и кислоты (или кислых солей). Реакции гидролиза обычно сопровождаются изменением pH раствора. Это явление следует рассмотреть здесь несколько глубже, чем это было сделано в [c.41]
Написать молекулярное и ионное уравнения реакции гидролиза сульфита натрия. При гидролизе каких солей получаются кислые соли [c.88]
В водных растворах фосфаты гидролизуются. При этом растворы средних солей щелочных металлов имеют сильно щелочную реакцию. Например, pH 1% раствора NasP04 равен 12,1. В случае кислых солей гидролиз сопровождается протолизом кислотного остатка. Поэтому растворы гидрофосфатов щелочных металлов имеют слабо щелочную реакцию, а растворы дигидрофосфатов этих металлов — слабокислую. Например, pH % раствора Na2HP04 равен 8,9, а NaHoP04 — 6,4. [c.445]
Например, pH % раствора Na2HP04 равен 8,9, а NaHoP04 — 6,4. [c.445]
Реакции гидроксильных радикалов, образованных действием солей железа на перекись водорода в кислом растворе (реакция Фентона [28]), слишком многочисленны, чтобы можно было рассмотреть их в этой главе [44, 75]. Однако следует заметить, что такие гидроксильные радикалы обладают в суш,ности всеми свойствами гидроксильных радикалов, полученных фотохимическим способом с той разницей, что они не дают с олефинами 1,2-гликоли. [c.371]
С помощью каких реакций с кислотами или основаниями перечисленные основные и кислые соли могут быть переведены в средние [c.73]
После нейтрализации кислых продуктов реакции едким натром в состав добавки вводятся натриевые соли карбоновых кислот, а также нейтральные продукты окисления. [c.180]
В результате слабого нагревания смеси, состоящей пз хлористого натрия и серной кислоты, образовалось 10,95 г хлористого водорода.
 Вычислить количества вступивших в реакцию а) хлористого натрия б) серной кислоты, учтя, что при этом образовалась кислая соль. [c.29]
Вычислить количества вступивших в реакцию а) хлористого натрия б) серной кислоты, учтя, что при этом образовалась кислая соль. [c.29]Если слабая двухосновная кислота образует кислую соль с катионом сильного основания, при титровании этой соли сильным основанием в реакцию вступают НАп -ионы. При этом проводимость до точки эквивалентности растет, так как в растворе образуются двухзарядные Ап -ионы и накапливаются катионы титранта. Подобного типа кривую (рис. 8,л) можно получить при титровании основанием битартрата натрия (рД а = 2,98 4,34). В случае, когда кислая соль слабой двухосновной кислоты образована катионами слабого основания (р/Сь = 4—9), в реакцию с основанием вступают сначала НАп -ионы, а затем катионы слабого основания. При этом кондуктометрические кривые имеют два излома (рис. 8, л), если (р/С + рКь) [c.87]
Под гидролизом солей понимают всякую реакцию между ионами соли и ионами воды, в результате которой образуется кислота (или кислая соль) и основание (или основная соль). Гидролиз солей обусловлен взаимной электролитической диссоциацией солей и воды, а также образующихся в результате гидролиза кислот, оснований и солей. Гидролиз протекает с образованием малодиссоциированных, летучих или малорастворимых веществ. В процессе гидролиза один или оба иона весьма незначительно диссоциирующей воды связываются ионами подвергающейся гидролизу соли, вследствие чего все новые и новые молекулы воды вовлекаются в реакцию. [c.55]
Гидролиз солей обусловлен взаимной электролитической диссоциацией солей и воды, а также образующихся в результате гидролиза кислот, оснований и солей. Гидролиз протекает с образованием малодиссоциированных, летучих или малорастворимых веществ. В процессе гидролиза один или оба иона весьма незначительно диссоциирующей воды связываются ионами подвергающейся гидролизу соли, вследствие чего все новые и новые молекулы воды вовлекаются в реакцию. [c.55]
Написать уравнения реакций неполной нейтрализации оснований кислотами (образуются кислые соли) [c.73]
На51р5 — соединение комплексное Н2[51р51 — сильная кислота (см. комплексные соединения, стр. 100). Будучи двухосновной, она образует нормальные и кислые соли. Реакция ее с едкими щело- [c.14]
Олеиновокислый натрий, помимо его эмульгирующего действия, выполняет при омылении хлористого амила еще одну функцию. Он участвует в реакции двойного обмена хлористого алкила, приводящей к образованию сложного эфира соответствующей жирной кислоты, которая затем быстро омыляется в щелочной среде с регенерацией олеиново -кислой соли и образованием спирта [c. 219]
219]
Сендерс и Додж [46] рассмотрели термодинамические данные по гидратации этилена и пришли к следующему заключению Ясно, что в настоящее время (1934 г.) невозможно получить константу равновесия, отклоняющуюся от теоретической менее чем в сто раз . Они изучали гидратацию этилена в паровой фазе при 360—380° и давлениях от 35 до 135 ат над окисью алюминия и окисью вольфрама в качестве катализаторов. На основании своих результатов и результатов других исследователей они пришли к выводу, что еще не найден активный катализатор для реакции гидратации. Выдано большое количество патентов по гидратации этилена в присутствии кислых солей и фосфорной кислоты на носителях [39] в паровой фазе при высоких температурах и давлениях. Один из таких процессов, в котором в качестве катализатора используется фосфорная кислота, применяется в промышленности. Этилен может реагировать с разбавленной 10 %-ной серной кислотой при температурах 240—260° и давлениях около 141 кг/см , при этих условиях образуется равновесная смесь этилена, этанола и этилового эфира. Спирт или эфир монполучения другого продукта, но технические трудности процесса помешали его промышленному использованию [29]. [c.355]
Спирт или эфир монполучения другого продукта, но технические трудности процесса помешали его промышленному использованию [29]. [c.355]
Таким образом, реакция раствора кислой соли момгидролиз аниона преобладает над его диссоциацией), так и кислой (в обратном случае). Это определяется соотношением константы гидролиза соли и соответствующей константы диссоциации кислоты. В рассмотренном примере константа гидролиза аниона превышает соответствующую константу диссоциации кислоты, поэтому раствор нмеет слабо щелочную реакцию. При обратном соотношении (например, при гидролизе NaHSOs) реакция раствора кислая. [c.263]
Если кислоты взято меньше расчетного количества, образуется основная соль, в молекуле которой содержится гидроксильная группа ОН. В этом случае в реакторе остается осадок непрореагировавшей гидроокиси алюминия (реакция на метилоранж будет щелочной, т. е. окраска желтая). Чтобы довести реакцию до ко1г-ца, следует добавить немного серной кислоты. Большой избыток серной кислоты приводит к образованию кислой соли, в молекуле которой содержится, кроме атома алюминия, незамещенный атом водорода. В этом случае для полного замещения водорода необходимо добавить некоторое количество гидроокиси алюминия. [c.40]
Большой избыток серной кислоты приводит к образованию кислой соли, в молекуле которой содержится, кроме атома алюминия, незамещенный атом водорода. В этом случае для полного замещения водорода необходимо добавить некоторое количество гидроокиси алюминия. [c.40]
Это равновесие с уменьшением pH смещается вправо (в присутствии H I образуются ионы СгОзС1 ). Таким образом, хроматы устойчивы в нейтральной и щелочной средах, а бихроматы — в кислой среде. Кислые соли М+НСЮ4 неизвестны (при соответствующих реакциях получаются бихроматы). В растворе хроматы имеют щелочную реакцию [c.538]
Полуацетали R H(OH)OR и ацетали R H(0R )2 часто образуются при синтезе альдегидов и их различных превращениях. Они получаются, например, при взаимодействии спиртов с альдегидами, катализируемом НС1, h3SO4 или кислыми солями этих кислот по обратимой реакции, равновесие которой смещается при нагревании в сторону разложения ацеталя [c. 554]
554]
При использовании такой кислой соли, как хлорное железо, существенным становится порядок смешения реагентов при приготовлении сырья для гидрогецолиза необходимо избежать контакта никелевого катализатора с хлорным железом в кислой среде. Поэтому к раствору моносахаридов добавляют сначала раствор хлорного железа в необходимом количестве, перемешивают в течение 15—30 мин для образования хелатных соединений железа с углеводами, затем вводят необходимое количество гидроокиси кальция и уже к щелочному раствору добавляют суспензию катализатора. Часть введенной Са(0Н)2 связывается при обменной реакции с хлорным железом, что необходимо учитывать при расчете ее дозировки при изменяющихся количествах хлорного железа [35]. [c.123]
Различные кобальтовые и медные соли [365] сульфоуксусной и сульфопропионовой кислот, включая ряд комплексных соединений, содержащих пиридин, послужили объектом детального исследования. Вследствие различия в кислотности сульфо- и карбоксильной групп, можно предполагать, что кислые соли являются сульфокислыми, а не уксуснокислыми. Обычные соли сульфоуксусной кислоты получены различными исследователями при изучении ее синтеза и реакций. При взаимодействии пятихлористого фосфора С натриевой солью кислоты происходит одновременно хлорирование [366] и образование хлорангидрида. Из сухой серебряной соли и иодистого эти.ла получается [325а, 367] диэтиловый эфир кислоты, который разлагается при перегонке. Непосредственным действием спирта кислота превращается в моно-этиловый эфир НОзЗСНгСООСаН [322]. [c.166]
Обычные соли сульфоуксусной кислоты получены различными исследователями при изучении ее синтеза и реакций. При взаимодействии пятихлористого фосфора С натриевой солью кислоты происходит одновременно хлорирование [366] и образование хлорангидрида. Из сухой серебряной соли и иодистого эти.ла получается [325а, 367] диэтиловый эфир кислоты, который разлагается при перегонке. Непосредственным действием спирта кислота превращается в моно-этиловый эфир НОзЗСНгСООСаН [322]. [c.166]
Фуран и хтиррол в присутствии кислот при нагревании и даже при комнатной температуре разрушаю гея с образованием солей (реакции приводить не будем, поскольку нас интересует именно устойчивость ига нестойкость гетероциклов в кислой и щелочной среде). Тиофен устойчив к воздействию кислот. Тиофен, а также фуран устойчгшьг в щелочной среде, а пиррол образует соли с едкими щелочами. [c.250]
Эти свойства можно характеризовать первой константой диссоциации слабой кислоты, так как реакции (12) и (12а) связаны с равновесием между НгА и ионами НА и Н» . Таким образом, кислая соль имеет два противоречивых свойства она может выделять водородные ионы и может их поглощать. В зависимости от того, какая из двух реакций (11) или (12) идет в большей степени, кислая соль может н.меть кислую реакцию (например, МаНЗО,) или щелочную реакцию (например, ЫаНСО,). [c.299]
Таким образом, кислая соль имеет два противоречивых свойства она может выделять водородные ионы и может их поглощать. В зависимости от того, какая из двух реакций (11) или (12) идет в большей степени, кислая соль может н.меть кислую реакцию (например, МаНЗО,) или щелочную реакцию (например, ЫаНСО,). [c.299]
Вывод формулы для вычисления pH кислой соли довольно сложен. В наиболее простом случае можно принять, что часть водородных ионов, выделяющихся по реакции (11), связываются с ионами НА , образуя молекулу Н А [см. уравнение (151)]. Таким образом, нельзя считать, что концентрация водородных ионов равна концентрации анионов А как можно было бы принять па основании одного только уравнения (11). В действительности концентрация водородных иопов меньше, чем [А ], а именно [c.299]
Титрование многоосновной кислоты (или ее средней соли) до кислой соли. Кроме рассмотренных определений, имеется ряд других определений, как титрование солей слабых неорганических оснований (например Al l,) с образованием нерастворимого основания, титрование некоторых комплексных ионов (например SiF,. —) и т, д. Наиболее часто применяется титрование многоосновных кислот (или их средних солей) с образованием в точке эквивалентности кислой соли. Ранее было показано, что кислые соли могут иметь как кислую, так и щелочную реакцию, в зависимости от соотношения ступенчатых констант диссоциации. Поэтому для выбора индикатора необходимо в каждом отдельном случае рассчитывать pH соотЕСТствую-щей кислой соли. [c.313]
—) и т, д. Наиболее часто применяется титрование многоосновных кислот (или их средних солей) с образованием в точке эквивалентности кислой соли. Ранее было показано, что кислые соли могут иметь как кислую, так и щелочную реакцию, в зависимости от соотношения ступенчатых констант диссоциации. Поэтому для выбора индикатора необходимо в каждом отдельном случае рассчитывать pH соотЕСТствую-щей кислой соли. [c.313]
Пользуясь табл. 2, алгоритмом и Справочкой частью, попроб> йте закончить схемы превращений (коэффициенты расставлять не надо). При составлении схем реакций в растворе не забудьте, что в присутствии кислоты (как слева, так н справа) могут образовываться кислые соли. [c.100]
Миогоосновные кислоты при реакции с основаниями могут образовывать кислые соли. [c.127]
Подобно молярной массе эквивалентов элемента, молярная масса эквивалентов сложного вещества может иметь несколько значений, если вещество способно вступать в реакции различного типа. Так, кислая соль NaHS04 может взаимодействовать с гидроксидом натрия или с гидроксидом бария [c.35]
Так, кислая соль NaHS04 может взаимодействовать с гидроксидом натрия или с гидроксидом бария [c.35]
В первом случае вследствие гидролиза образуется основная соль и сильная кислота, во втором — кислая соль и сильное основание. Накопление в растворе сильной кислоты в первом случае и щелочи во втором препятствует протеканию гидролиза до конца, т. е. образованию Mg (ОН) 2 и Н2СО3. Образующееся слабое основание тут же будет взаимодействовать с образующейся в растворе сильной кислотой, а слабая кислота — со щелочью. Таким образом, гидролиз является процессом обратимым и реакцией, обратной реакции гидролиза, всегда будет реакция нейтрализации. В растворе гидролизующейся соли устанавливается равновесие скорость реакции гидролиза равна скорости реакции нейт]зализации. [c.142]
Соли аммония по своим свойствам — растворимости и некоторым аналитическим реакциям — очень напоминают соли щелочных металлов и отличаются от них своей сравнительно малой термической прочностью. В то время как многие соли щелочных металлов плавятся без разложения при высоких температурах, их одноименные аммонийные соли уже при сравнительно небольшом нагревании претерпевают разложение, характер которого определяется природой анионов, входящих в их состав, а также устойчивостью продукта (кислоты или кислой соли), получаемого после первичного отщепления аммиака. Если анионы соли не являются окислителями, например в случае Nh5 I и NH Br, или если их окислительные свойства проявляются в незначительной степени, как в случае (Nh5)2S04, (ЫН4)зР04, нагревание солей сопровождается отщеплением аммиака, которое может иногда иметь обратимый характер. [c.180]
В то время как многие соли щелочных металлов плавятся без разложения при высоких температурах, их одноименные аммонийные соли уже при сравнительно небольшом нагревании претерпевают разложение, характер которого определяется природой анионов, входящих в их состав, а также устойчивостью продукта (кислоты или кислой соли), получаемого после первичного отщепления аммиака. Если анионы соли не являются окислителями, например в случае Nh5 I и NH Br, или если их окислительные свойства проявляются в незначительной степени, как в случае (Nh5)2S04, (ЫН4)зР04, нагревание солей сопровождается отщеплением аммиака, которое может иногда иметь обратимый характер. [c.180]
Приведите формулы 2—3 кислых солей—неорганических и карбоновых кислот — и зaпиuJнтe уравнения реакций их получения. [c.167]
Почему раствор кислой соли ЫаН2Р04 показывает кислую реакцию, а раствор кислой соли КН5 — щелочную [c.217]
Катализаторами поликонденсации служат те же соединения, которые катализируют аналогичные реакции конденсации низКо-молекулярных веществ. Например, в качестве катализаторов полиэтерификации используют минеральные кислоты, сульфокислоты, кислые соли и т. д. Концентрация катализатора остается в течение всего процесса постоянной, что позволяет заменить к Склт на А — [c.33]
Например, в качестве катализаторов полиэтерификации используют минеральные кислоты, сульфокислоты, кислые соли и т. д. Концентрация катализатора остается в течение всего процесса постоянной, что позволяет заменить к Склт на А — [c.33]
С уменьшением pH равновесие снещаетс вправо (а присутствии H I образуются ионы Сг0)О ). Таким образом, хроматы устойчивы а нейтральной и щелочной средах (желтая окраска), а дихроматы-а кислой среде (оранжевая окраска). Кислые соли М НСгОд неизвестны (при соответствующих реакциях получаются дихроматы). В растворе хроматы имеют щелочную реакцию, а дихроматы — кислую [c.516]
Под гидролизом солей понимается всякая реакция между ионами солп и ионами воды. Это процесс химического взаимодействия ионов солп с ноиами воды с образованием кислот (или кислой соли) и основания (или осиовноп соли). Гидролиз солей обусловлен взаимной элек 1ролитической диссоциацией солей н воды и [c.32]
Свойства солей в свете ТЭД
Это вещество так необходимо человеческому роду, что даже
духовные удовольствия не могут быть лучше выражены,
как словом «…» — таково
имя, данное всем проявлениям острого ума.
Плиний-Старший
В древней раздробленной Германии наличие соляных источников на той или иной территории считалось вполне достаточным и убедительным поводом для военного вторжения соседей.
Легионерам Древнего Рима часто платили жалование не деньгами, а солью. Слово «солдат» и английское слово “salary” (жалованье) родились благодаря такому «жалованью».
В XIII в., по свидетельству Марко Поло, в Тибете монетой служила лепёшка из соли с оттиснутым на ней изображением «великого хана», а по словам М. В. Ломоносова, ещё и в его время за 4-5 плиток «Горной соли» в Абиссинии можно было купить раба.
Соли – это сложные вещества, состоящие из ионов металла и ионов кислотного остатка. Соли – это твёрдые вещества, они отличаются между собой окраской и растворимость в воде.
Ещё
в начале XIX в.
шведский химик Й. Берцелиус сформулировал определение солей как продуктов
реакций кислот с основаниями, или соединений, полученных заменой атомов
водорода в кислоте на металл. По этим признакам соли делят на средние,
кислые и основные.
Берцелиус сформулировал определение солей как продуктов
реакций кислот с основаниями, или соединений, полученных заменой атомов
водорода в кислоте на металл. По этим признакам соли делят на средние,
кислые и основные.
Средние соли – это продукты полного замещения атомов водорода в кислоте на металл. Именно эти соли вам уже известны. Например,
Na2CO3 – карбонат натрия
Al2(SO4)3 – сульфат алюминия
Ba(NO3)2 – нитрат бария
CaCl2 – хлорид кальция
K3PO4 – фосфат калия
Эти
соли диссоциируют на катионы металла и анионы кислотного остатка. Так, карбонат
натрия диссоциирует на катион натрия и карбонат-ион, сульфат алюминия
диссоциирует на катион алюминия и сульфат-ион, нитрат бария диссоциирует
на катион бария и нитрат-ион, хлорид кальция – на катион кальция и
хлорид-ион, а фосфат калия диссоциирует на катион калия и фосфат-ион.
Na2CO3 = 2Na+ + CO32-
Al2(SO4)3 = 2Al3+ + 3SO42-
Ba(NO3)2= Ba2+ +2 NO3—
CaCl2 = Ca2+ + 2Cl—
K3PO4 = 3K+ + PO43-
Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл.
К кислым солям относят такие соли как NaHSO4, KHCO3, CaHPO4. Название этих солей складывается из названий средних солей с прибавлением слова «гидро». Назовём наши соли:
NaHSO4 – гидросульфат натрия
KHCO3 – гидрокарбонат калия
CaHPO4 – гидрофосфат кальция
Эти соли диссоциируют
ступенчато. На первой ступени образуется катион металла и анион
кислотного остатка, содержащий ион водорода, а на второй ступени отщепляется
ион водорода и кислотный остаток.
На первой ступени образуется катион металла и анион
кислотного остатка, содержащий ион водорода, а на второй ступени отщепляется
ион водорода и кислотный остаток.
NaHSO4 = Na+ + HSO4—
HSO4— ↔ H + SO42-
Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
К
таким солям относится малахит, формула которого (CuOH)2CO3.
Как видите, это соль состоит из двух гидроксокатионов CuOH+ и
двухзарядного аниона кислотного остатка СО32-. Если
подсчитать сумму зарядов ионов, то получается, что эта соль электронейтральна.
Названия основных солей складывается из названия средней соли с добавлением
слова «гидроксо». Например, назовём соли: (CuOH)2CO3,
Mg(OH)Cl.
(CuOH)2CO3 – гидроксокарбонат меди (II)
Mg(OH)Cl – гидроксохлорид магния
Эти соли также диссоциируют ступенчато: сначала отщепляется катион металла, содержащий гидроксогруппу и анион кислотного остатка, а затем отщепляется катион металла и гидроксогруппа.
Mg(OH)Cl = MgOH+ + Cl—
MgOH+ ↔ Mg2+ + OH—
Соли
реагируют с кислотами, но только в том случае, если образуется осадок, или
выделяется газ. Этот тип реакций относится к реакциям
обмена. Проведём эксперимент. В одну пробирку нальем силиката натрия
и серной кислоты, во вторую – карбонат натрия и азотную кислоту, а в
третью нитрат натрия и серную кислоту. В результате у нас получается,
что в первой пробирке выпал студенистый осадок, во второй пробирке мы
можем наблюдать выделение газа, а в третьей изменений нет.
Следовательно, химические реакции прошли только в двух пробирках.
В результате у нас получается,
что в первой пробирке выпал студенистый осадок, во второй пробирке мы
можем наблюдать выделение газа, а в третьей изменений нет.
Следовательно, химические реакции прошли только в двух пробирках.
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
SiO32- + 2H+ = H2SiO3↓
Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ + H2O
CO32- + 2H+ = CO2↑ + H2O
NaNO3 + H2SO4 ≠
Соли
вступают в реакции обмена со щелочами, при этом образуется
новая соль и новое основание. Для этого нальём в первую пробирку раствор
сульфата железа (III)
и добавим гидроксида натрия, во вторую сульфата аммония и
гидроксида калия, слегка нагреем содержимое пробирки, а в третью нальём раствор
нитрата бария и добавим гидроксида калия. В первой пробирке мы наблюдаем
осадок бурого цвета, во второй пробирке образуется газ с резким запахом, в
третьей пробирке изменений не наблюдаем. Поэтому, можно говорить о том, что соли
реагируют с основаниями в том случае, если образуется слабое основание или
нерастворимое в воде основание.
Для этого нальём в первую пробирку раствор
сульфата железа (III)
и добавим гидроксида натрия, во вторую сульфата аммония и
гидроксида калия, слегка нагреем содержимое пробирки, а в третью нальём раствор
нитрата бария и добавим гидроксида калия. В первой пробирке мы наблюдаем
осадок бурого цвета, во второй пробирке образуется газ с резким запахом, в
третьей пробирке изменений не наблюдаем. Поэтому, можно говорить о том, что соли
реагируют с основаниями в том случае, если образуется слабое основание или
нерастворимое в воде основание.
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4
Fe3+ + 3OH— = Fe(OH)3↓
(NH4)2SO4 + 2KOH = K2SO4 + 2NH3↑ + 2H2O
NH4+ + OH— = NH3↑ + H2O
Ba(NO3)2 + KOH ≠
Соли
могут реагировать между собой. Эти реакции относятся к
реакциям обмена. При этом образуется две новые соли, одна из них должна быть
нерастворимой. Например, если мы к раствору хлорида бария добавим
раствор сульфата натрия, то у нас образуется осадок белого цвета. Т.о. в
результате данной реакции образовалось две соли, причём одна выпадает в виде
осадка.
Эти реакции относятся к
реакциям обмена. При этом образуется две новые соли, одна из них должна быть
нерастворимой. Например, если мы к раствору хлорида бария добавим
раствор сульфата натрия, то у нас образуется осадок белого цвета. Т.о. в
результате данной реакции образовалось две соли, причём одна выпадает в виде
осадка.
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Ba2+ + SO42- = BaSO4↓
Соли
могут вступать в реакции замещения с металлами.
При этом образуется другая соль и другой металл. Однако для прогнозирования
протекания этих реакций необходимо использовать ряд активности металлов.
Впервые этот ряд составил Н.Н. Бекетов, который расположил металлы и водород по
способности вытеснять друг друга из растворов солей. Этот ряд он назвал
вытеснительным рядом металлов. Вытеснительный ряд металлов называют ещё
электрохимическим рядом напряжений металлов. Более активные металлы находятся
вначале ряда, а неактивные – в конце. Поэтому, этот вытеснительный ряд
металлов используют для определения протекания реакций между солями и
металлами. Каждый металл вытесняет из раствора соли металлы, расположенные
правее его в ряду напряжений. При этом должны соблюдаться условия: обе
соли (и реагирующая, и образующаяся) должны быть растворимыми, металлы не
должны реагировать с водой (т.е. щелочные и щелочноземельные металлы,
которые реагируют с водой с образованием щелочей).
Этот ряд он назвал
вытеснительным рядом металлов. Вытеснительный ряд металлов называют ещё
электрохимическим рядом напряжений металлов. Более активные металлы находятся
вначале ряда, а неактивные – в конце. Поэтому, этот вытеснительный ряд
металлов используют для определения протекания реакций между солями и
металлами. Каждый металл вытесняет из раствора соли металлы, расположенные
правее его в ряду напряжений. При этом должны соблюдаться условия: обе
соли (и реагирующая, и образующаяся) должны быть растворимыми, металлы не
должны реагировать с водой (т.е. щелочные и щелочноземельные металлы,
которые реагируют с водой с образованием щелочей).
Для
подтверждения этих правил проведём опыт. Для этого в первую пробирку
поместим железный гвоздь, во вторую – свинцовую пластину, а в
третью – медную пластину. В первые две пробирки нальём раствора
сульфата меди (II),
а в третью – раствор сульфата железа (II). Через некоторое время мы можем наблюдать, что на железном гвозде осела медь, а
во второй и третьей пробирке нет никаких изменений. Следовательно, в первой
пробирке находился более активный металл, который вытеснил медь из
раствора, во второй пробирке реакция не пошла, т.к. образующая соль (сульфат
свинца (II)) является
нерастворимой, в третьей пробирке реакция не прошла, т.к. медь стоит правее
железа в ряду напряжений и не может вытеснить его из раствора соли.
Через некоторое время мы можем наблюдать, что на железном гвозде осела медь, а
во второй и третьей пробирке нет никаких изменений. Следовательно, в первой
пробирке находился более активный металл, который вытеснил медь из
раствора, во второй пробирке реакция не пошла, т.к. образующая соль (сульфат
свинца (II)) является
нерастворимой, в третьей пробирке реакция не прошла, т.к. медь стоит правее
железа в ряду напряжений и не может вытеснить его из раствора соли.
Fe + CuSO4 = FeSO4 + Cu↓
Fe0 + Cu2+ = Fe2+ + Cu0↓
Pb + CuSO4 ≠
Cu + FeSO4 ≠
21.1: Свойства кислот — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Кислоты
- Резюме
- Участники и авторство
Чашка кофе первым делом с утра может помочь начать день. Однако содержать кофеварку в чистоте может быть проблемой. Известковые отложения накапливаются через некоторое время и замедляют процесс пивоварения. Лучшее лекарство от этого — налить в кастрюлю уксус (разбавленную уксусную кислоту) и запустить цикл заваривания. Уксус растворяет отложения и очищает кофеварку, что ускорит процесс заваривания до его первоначальной скорости. Просто не забудьте пропустить воду через процесс заваривания после уксуса, иначе вы получите действительно ужасный кофе!
Однако содержать кофеварку в чистоте может быть проблемой. Известковые отложения накапливаются через некоторое время и замедляют процесс пивоварения. Лучшее лекарство от этого — налить в кастрюлю уксус (разбавленную уксусную кислоту) и запустить цикл заваривания. Уксус растворяет отложения и очищает кофеварку, что ускорит процесс заваривания до его первоначальной скорости. Просто не забудьте пропустить воду через процесс заваривания после уксуса, иначе вы получите действительно ужасный кофе!
Кислоты
Кислоты очень распространены в некоторых продуктах, которые мы едим.Цитрусовые, такие как апельсины и лимоны, содержат лимонную кислоту и аскорбиновую кислоту, более известную как витамин С. Газированные газированные напитки содержат фосфорную кислоту. Уксус содержит уксусную кислоту. Ваш собственный желудок использует соляную кислоту для переваривания пищи.
Кислоты представляют собой отдельный класс соединений из-за свойств их водных растворов. Эти свойства:
- Водные растворы кислот являются электролитами, то есть проводят электрический ток.
 Некоторые кислоты являются сильными электролитами, так как полностью ионизируются в воде, образуя большое количество ионов.Другие кислоты являются слабыми электролитами, существующими в основном в неионизированной форме при растворении в воде.
Некоторые кислоты являются сильными электролитами, так как полностью ионизируются в воде, образуя большое количество ионов.Другие кислоты являются слабыми электролитами, существующими в основном в неионизированной форме при растворении в воде. - Кислоты имеют кислый вкус. Лимоны, уксус и кислые леденцы содержат кислоты.
- Кислоты изменяют цвет некоторых кислотно-щелочных индикаторов. Двумя распространенными индикаторами являются лакмус и фенолфталеин. Синий лакмус в присутствии кислоты становится красным, а фенолфталеин обесцвечивается.
- Кислоты реагируют с активными металлами с образованием газообразного водорода. Напомним, что ряд активности — это список металлов в порядке убывания реакционной способности.Металлы, находящиеся выше водорода в ряду активности, заменят водород из кислоты в реакции с одним замещением, как показано ниже:
\[\ce{Zn} \left( s \right) + \ce{H_2SO_4} \left ( aq \right) \rightarrow \ce{ZnSO_4} \left( aq \right) + \ce{H_2} \left( g \right)\] - Кислоты реагируют с основаниями с образованием соединения соли и воды.
 -_{(водн.)}\)
-_{(водн.)}\)В то время как Na + не будет гидролизоваться, OCl — будет (помните, что это сопряженное основание HOCl).-]\]
\[рН = 12,77\]
Каковы химические свойства кислоты?
Каковы химические свойства кислоты?Химические свойства кислот:
- Кислоты реагируют с активными металлами .
- Кислота + металл → соль + водород
- Медь и серебро не реагируют с разбавленной кислотой.
- Кислоты реагируют с основаниями .
- Кислота + основание → соль + вода
- Кислота + основание → соль + вода
- Кислоты реагируют с карбонатами.
9 6 - Кислотный + карбонат → соль + вода + углекислый газ
- Кислоты реагируют с активными металлами .
10
5 Люди также задают6
для изучения химических реакций кислот эксперимента AIM: Для изучения химических реакций кислоты.
Материалы: 2 моль дм -3 кислота соляная, 2 моль дм -3 этановая кислота, магний, карбонат меди(II), оксид железа(III), известковая вода, деревянная шина и фильтровальная бумага.
Аппаратура: Пробирки, трубка подачи, шпатель, держатель пробирок, горелка Бунзена, пробка, чашка для выпаривания и фильтрующая воронка.
Меры безопасности: Кислоты вызывают коррозию. Носите защитные очки.
Процедура:
- Около 5 см 3 разбавленной соляной кислоты наливают в пробирку.
- Кислота нагревается с помощью мягкого пламени.
- Порошок оксида железа(III) добавляют понемногу при перемешивании в горячую кислоту.
- Любое происходящее изменение отслеживается и регистрируется.
- Непрореагировавший оксид железа(III) удаляют фильтрованием.
- Фильтрат выпаривают в чашке для выпаривания до тех пор, пока не останется треть исходного объема.

- Горячему раствору дают остыть для образования кристаллов.
- Образовавшиеся кристаллы удаляют фильтрованием и сушат, вдавливая кристаллы между листами фильтровальной бумаги.
- Особенности кристаллов отмечают и записывают.
- Шаги с 1 по 9 повторяются с использованием разбавленной этановой кислоты вместо разбавленной соляной кислоты.
Наблюдения:
| Кислота | Наблюдение |
| Гидрохлористая кислота | Красновато-коричневое твердое вещество растворяется с образованием коричневого раствора. Получают красновато-коричневые кристаллы. |
| Этановая кислота | Красновато-коричневое твердое вещество растворяется с образованием коричневого раствора.Получают красновато-коричневые кристаллы. |
Обсуждение:
- Оксид железа (III) является примером основания.
- Реагирует с кислотами с образованием солей и воды.
- Кристаллы представляют собой хлорид железа (III) и этаноат железа (III).
- Соли железа(III) растворяются в воде с образованием растворов коричневого цвета.
Процедура:
- Около 5 см 3 разбавленной соляной кислоты наливают в пробирку.
- В кислоту добавляют один шпатель порошка магния.
- К отверстию пробирки подносят зажженную деревянную щепку, чтобы поджечь выделившийся газ.
- Все наблюдения записываются.
- Непрореагировавший магний отфильтровывают.
- Фильтрат упаривают до тех пор, пока не останется треть исходного объема.
- Горячему раствору дают остыть для образования кристаллов.
- Образовавшиеся кристаллы удаляют фильтрованием и сушат, вдавливая кристаллы между листами фильтровальной бумаги.

- Особенности кристаллов отмечают и записывают.
- Шаги с 1 по 9 повторяются с использованием разбавленной этановой кислоты вместо разбавленной соляной кислоты.
5 Наблюдения:
| Кислотный | Наблюдение |
| Гидрохлорическая кислота | Серое твердое вещество растворяется с образованием бесцветного раствора. Образуется бесцветный газ, который горит с характерным хлопком. Получаются белые кристаллы. |
| Этановая кислота | Серое твердое вещество растворяется с образованием бесцветного раствора. Образуется бесцветный газ, который горит с характерным хлопком. Получаются белые кристаллы. |
Обсуждение:
- Магний является химически активным металлом.
- Химически активные металлы реагируют с кислотами с образованием солей и водорода.
 Нереакционноспособные металлы, такие как медь и серебро, не реагируют с разбавленными кислотами.
Нереакционноспособные металлы, такие как медь и серебро, не реагируют с разбавленными кислотами. - Выделившийся газообразный водород можно определить с помощью зажженной деревянной лучины.Газообразный водород горит с характерным «хлопком».
- Белые кристаллы представляют собой хлорид магния и этаноат магния. Они растворяются в воде, образуя бесцветные растворы.
Процедура:
- Около 5 см 3 разбавленной соляной кислоты наливают в пробирку.
- В кислоту добавляют один шпатель порошка карбоната меди(II).
- Пробирку быстро закрывают пробкой, снабженной нагнетательной трубкой, погруженной в известковую воду.
- Любое происходящее изменение записывается.
- Непрореагировавший карбонат меди(II) отфильтровывают.
- Фильтрат упаривают до тех пор, пока не останется треть исходного объема.
- Горячему раствору дают остыть для образования кристаллов.

- Образовавшиеся кристаллы удаляют фильтрованием и сушат, вдавливая кристаллы между листами фильтровальной бумаги.
- Особенности кристаллов отмечают и записывают.
- Шаги с 1 по 9 повторяются с использованием разбавленной этановой кислоты вместо разбавленной соляной кислоты.
14
5 Наблюдение:
| Кислота | Наблюдение Наблюдение |
| Гидрохлорическая кислота | Зеленое твердое вещество растворяется с шипением для формирования синего раствора. Образуется бесцветный газ, окрашивающий известковую воду в молочный цвет. Получаются синие кристаллы. |
| Этановая кислота | Зеленое твердое вещество растворяется с шипением с образованием голубого раствора. Образуется бесцветный газ, окрашивающий известковую воду в молочный цвет. Получаются синие кристаллы. Получаются синие кристаллы. |
Обсуждение:
- Карбонат меди(II) представляет собой карбонат металла.
- Реагирует с кислотами с образованием солей, воды и двуокиси углерода.
- Соли меди(II) кристаллизуются в виде синих кристаллов и растворяются в воде с образованием синих растворов.
- При пропускании углекислого газа через известковую воду образуется белый осадок карбоната кальция. Белый осадок заставляет известковую воду мутнеть.
Вывод:
- Кислота реагирует с основанием с образованием соли и воды.
- Кислота реагирует с химически активным металлом с образованием соли и газообразного водорода.
- Кислота реагирует с карбонатом металла с образованием соли, воды и углекислого газа.
- Щелочи реагируют с кислотами .
- Щелочь + кислота → соль + вода
- Щелочь нейтрализует кислоты.

- Щелочи реагируют с ионами металлов .
- Щелочь + ион металла → гидроксид металла
- Большинство гидроксидов металлов нерастворимы в воде и выпадают в осадок.
- Ионы переходных металлов образуют окрашенные осадки.
Свойства кислот и оснований
Молекула, способная образовывать ковалентную связь с электронной парой, является кислотой. Кислоты очень часто встречаются в некоторых продуктах, которые мы потребляем, например, в цитрусовых, таких как апельсины и лимоны, которые содержат лимонную кислоту; уксус содержит уксусную кислоту; на самом деле наш желудок использует для пищеварения соляную кислоту.Кислоты имеют кислый вкус. Он реагирует с металлами с образованием h3 и реагирует с карбонатами с образованием соли, углекислого газа и воды. Кислоты окрашивают синюю лакмусовую бумажку в красный цвет. Силу кислоты можно измерить по pH. Кислоты липкие. Кислоты часто вызывают жжение в носу.
Свойства кислот и оснований
Здесь мы узнаем об основных свойствах кислот и оснований позже, мы узнаем о химических свойствах кислот и оснований, а также о физических свойствах кислот и оснований.Кислоты представляют собой другую группу соединений из-за свойств их водных растворов. Свойства кислот следующие:
Кислоты могут проводить электрический ток из-за природы электролита, а некоторые кислоты являются сильными электролитами, потому что они могут полностью ионизироваться в воде с образованием большого количества ионов H+.
Кислоты кислые. Апельсины, лимоны и уксус — вот несколько примеров.
Кислота изменяет цвет некоторых кислотно-щелочных индикаторов.Двумя распространенными индикаторами кислот являются лакмус и фенолфталеин. Кислота превращает синий лакмус в красный, а фенолфталеин в бесцветный.

Кислоты реагируют с металлами с образованием газообразного водорода.
1 Zn (S) + H 2 SO 2 (AQ) → ZNSO 4 (AQ) + H 2 (G)
1 Свойства баз:
Базы могут быть сильный или слабый. Водные растворы оснований также являются электролитами.
Основы часто бывают горькими.Мыло менее распространено в качестве продуктов питания, но присутствует во многих предметах домашнего обихода. Мыло является примером скользкой основы.
Базы также меняют цвет индикаторов. Лакмусовая бумажка становится синей, а фенолфталеин — розовой.
Основания не реагируют с металлами, как кислоты.
Как кислоты и основания реагируют с металлами?
Кислоты реагируют с большинством металлов с образованием соли и газообразного водорода. Как известно, металлы, более активные, чем кислоты, могут вступать в одну реакцию замещения.
Как известно, металлы, более активные, чем кислоты, могут вступать в одну реакцию замещения.
Металлический цинк реагирует с соляной кислотой с образованием хлорида цинка и газообразного водорода.
Zn(s) + 2HCl(aq) → ZnCl 2 (aq) + H 2 (g)
Основания также реагируют с несколькими металлами, такими как цинк или алюминий, с образованием газообразного водорода.
Гидроксид натрия реагирует с цинком и водой с образованием цинката натрия и газообразного водорода.
Zn(s) + 2NaOH(aq) + 2H 2 O(l) → Na 2 Zn(OH) 4 (aq) + H 2 (g)
Химические свойства кислот и Основания
Так же, как мы узнали об основных свойствах кислот и оснований, теперь мы узнаем о химических свойствах кислот и оснований.Мы узнаем, что происходит, когда основания встречаются с металлами, а кислоты — с металлами.
Химические свойства кислот:
Кислоты реагируют с активными металлами следующим образом:
(изображение будет загружено в ближайшее время)
Кислота + металл → соль + водород
Медь и серебро не реагируют с активными металлами кислота.
Нравится:
2HCl(водн.) + Mg(s) → MgCl 2 (водн.) + H 2 (г)
Реакция кислот с основаниями
- 0 90
Кислота + Основание -> соль + вода
6HNO 3 (водн.) + Fe 2 O 3 (тв.) → 2Fe(NO 3 ) 3 9090 + 904H (водн. O(l)
Это реакция кислот и оснований с металлами.
Кислоты реагируют с карбонатами
(изображение будет загружено в ближайшее время)
Кислота + карбонат => любая соль + вода + диоксид углерода
H 2 SO 4 4 4 0 (тв) → CuSO 4 (водн.) + H 2 O(л) + CO 2 (г)
Итак, это химические свойства кислот и оснований.
Физические свойства кислот
Итак, вот физические свойства кислот:
1.
 Кислоты кислые.
Кислоты кислые.2. Кислоты растворимы в воде.
3. Растворы кислот могут окрашивать синюю лакмусовую бумажку в красную.
4. Кислотные растворы имеют значения pH менее 7.
5. Реагируют с карбонатами металлов с образованием соли, двуокиси углерода и воды.
Решаемые примеры
Вопрос 1: Что происходит, когда вы смешиваете кислоту и основание?
Решение: Когда кислота и основание помещаются вместе, происходит процесс нейтрализации — реакция кислоты и основания приводит к нейтрализации свойств кислоты и основания.Нейтрализация — это процесс, при котором кислота и основание соединяются вместе; образуются соль и вода. Например, когда NaOH реагирует с HCl, образующийся продукт представляет собой NaCl и H 2 O. Здесь NaCl представляет собой соль.
Вопрос 2: Все ли основания являются щелочными по своей природе? Обосновать ответ.
Решение: термин «щелочной» обычно используется для основных растворов, но они не должны быть одинаковыми.
 Все основания не являются щелочными, потому что все основания не растворяются в воде, а щелочи наиболее известны как основания, которые растворяются в воде с образованием гидроксильного иона (ОН-), и все они являются основаниями Аррениуса.Обычно водорастворимые щелочи, например карбонат бария, становятся растворимыми в воде только при взаимодействии с кислым раствором, содержащим воду. Основания обычно представляют собой химические вещества, которые могут принимать ионы H+.
Все основания не являются щелочными, потому что все основания не растворяются в воде, а щелочи наиболее известны как основания, которые растворяются в воде с образованием гидроксильного иона (ОН-), и все они являются основаниями Аррениуса.Обычно водорастворимые щелочи, например карбонат бария, становятся растворимыми в воде только при взаимодействии с кислым раствором, содержащим воду. Основания обычно представляют собой химические вещества, которые могут принимать ионы H+.Забавные факты
Мы можем определить неизвестное химическое вещество как кислоту или основание, взяв в него влажную лакмусовую бумажку. Лакмусовая бумага окрашивает кислоты в красный цвет, а основания в синий. Лакмусовая бумажка обрабатывается экстрактом определенного лишайника, который меняет цвет в зависимости от рН. И кислоты, и основания могут нейтрализовать друг друга.сильные основания могут иметь скользкое ощущение. Витамин С также является разновидностью кислоты, известной как аскорбиновая кислота.

Кислотная соль – обзор
14.2.3 Безводные твердые кислотно-наполненные нанокомпозиты
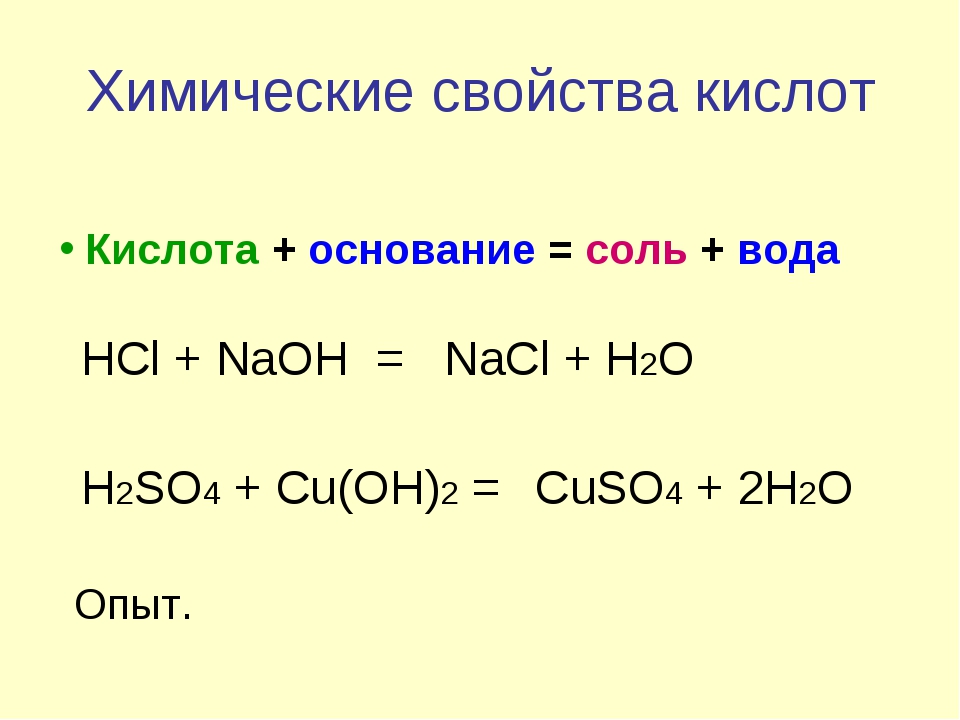
Соли суперпротонных кислот являются хорошо известными проводниками протонов с общим составом M m H n (XO 4 900 + n)/2 (M = K, Rb, NH 4 или Cs; X = S или Se) и CsH 2 (RO 4 ) (R = P или As). Структурно они относятся к категории нормальных кислот и нормальных солей и содержат оксианионы, которые связаны водородными связями.Они претерпевают структурно-фазовое изменение при определенной температуре, а голые протоны подвижны в безводных состояниях благодаря наличию динамически неупорядоченной сети Н-связей (Баранов и др. , 1989) (рис. 14.11). Поэтому суперпротонные фазы характеризуются быстрой протонной диффузией и интенсивными колебаниями тетраэдров XO 4 или RO 4 . Таким образом, протонная проводимость является неотъемлемым свойством из-за совершенной кристаллической решетки, и любые структурные дефекты уменьшают протонную проводимость.
 Эти соединения не содержат в своей структуре молекул воды, благодаря чему обладают высокой термической и электрохимической стабильностью. Их проводимость не зависит от влажности воздуха и может быть повышена за счет получения неорганических композитов с оксидами металлов с большой площадью поверхности (Пономарева и др. , 1996; Пономарева, Лаврова, 1998).
Эти соединения не содержат в своей структуре молекул воды, благодаря чему обладают высокой термической и электрохимической стабильностью. Их проводимость не зависит от влажности воздуха и может быть повышена за счет получения неорганических композитов с оксидами металлов с большой площадью поверхности (Пономарева и др. , 1996; Пономарева, Лаврова, 1998).14.11. Структурно-фазовые превращения твердых кислот.
Наиболее известным соединением является CsHSO 4 , структура которого показана на рис.14,12 2 Он демонстрирует высокую протонную проводимость 10 -2 См/см при температурах > 141 °C, когда происходит фазовый переход, и он является суперпротонным. Как показано в Таблице 14.5 и Рис. 14.13, температура суперпротонного перехода обычно составляет 70–250 °C, и эти материалы обладают очень высокой проводимостью (от 10 -3 до 10 -1 См/см). Это делает эти материалы очень перспективными для применения в топливных элементах, работающих при средних температурах (100–250 °С).
 Для получения более низкой температуры суперпротонного перехода и высокой проводимости были получены новые твердые соединения, например, CsHSO 4 • CsH 2 PO 4 и CsHSO 4 • CsH 2 PO 4 (HaileCholm , 2000; Хайле и др., 1995).
Для получения более низкой температуры суперпротонного перехода и высокой проводимости были получены новые твердые соединения, например, CsHSO 4 • CsH 2 PO 4 и CsHSO 4 • CsH 2 PO 4 (HaileCholm , 2000; Хайле и др., 1995).14.12. Кристаллическая структура твердой кислоты CsHSO 4 : (а) моноклинная фаза II и (б) тетрагональная фаза III, где каждое положение кислорода заполнено наполовину, а атомы водорода расположены в середине неупорядоченных водородных костей (штриховые линии). .
Таблица 14.5. Различные твердые кислоты и их свойства
90 790
Соединения Температура стеклования (° С) Протонная проводимость (См / см) Структура суперпротонной фазы Справочник KHSO 4 177 10 −1 выше 177 °С – Баранов и др.  , 2005
, 2005РбХСО 4 – ~ 10 −2 – Баранов и др. , 2005RbHSeO 4 172 ~ 10 −2 – 8 Барэтал. , 2005 CSHSO 4 4 140 4 × 10 -2 при 200 ° C — Haile et al. , 2001 CsHSeO 4 124 ~ 10 −2 – 4 и др. 8 Haile 4, 2001 KH3PO 4 178 7 × 10 -5 при 185 ° C Monoclinic Ortiz et al. , 1999 RBH 2 PO 4 PO 4 4 71 6,8 × 10 -2 при 340 ° C Monoclinic Ortiz et al.  , 1999
, 1999CSH 2 PO 4 4 230 22 × 10 -2 при 240 ° C Cubic Baranov et al., 1989 NH 4 H 2 PO 4 PO 4 4 160 4 × 10 -2 при 180 ° C Cubic Baranov et al. , 1989 K 3 H (SO 4 ) 2 2 2054 4 × 10 -3 при 208 ° C — Boysen et al. , 2004 9, 2004 K 3 H (SEO 4 H (SEO 4 ) 2 2 117 ~ 10 -3 при 127 ° C Rhombohedral Sinitsyn et al., 2000 RB 3 H (SEO 4 ) 2 ) 2 174 2 × 10 -4 при 186 ° C Rhombohedral Sinitsyn et al. 0 , 2000
, 2000CS 3 H (SEO 4 ) 2 2 182 ~ 2 × 10 -4 при 187 ° C — Boysen et al. , 2004 (NH 4 ) 3 H (SEO 4 ) 2 227 4 × 10 -3 на 110 ° C — Boysen Et др. , 2004 14.13. Протонная проводимость твердых кислот при различных температурах.
Твердые кислоты являются хорошими кандидатами для протонпроводящих мембран благодаря их высокой протонной проводимости в безводном состоянии, что устраняет деликатную проблему управления водными ресурсами. Тем не менее, они также имеют серьезные недостатки, такие как хрупкость, узкий диапазон температур для суперпротонной фазы (между температурой перехода и температурой плавления) (Piao et al., 2009), химическая нестабильность (Баранов и др.
 , 2005), растворимость в воде и плохое механическое поведение (Boysen и др. , 2004). Поэтому их композиционные материалы направлены на объединение преимуществ твердых кислот для устранения этих недостатков. Однако этот тип нанокомпозитного материала до сих пор мало изучен по сравнению с другими типами неорганических наполнителей. Только предварительные исследования полимерных композитов на основе CsHSO -4- и поливинилиденфторида (ПВДФ) (Boysen et al., 2000) и CsHSO 4 с поли(акрилонитрилом) можно найти в литературе (Andronie et al. , 2008).
, 2005), растворимость в воде и плохое механическое поведение (Boysen и др. , 2004). Поэтому их композиционные материалы направлены на объединение преимуществ твердых кислот для устранения этих недостатков. Однако этот тип нанокомпозитного материала до сих пор мало изучен по сравнению с другими типами неорганических наполнителей. Только предварительные исследования полимерных композитов на основе CsHSO -4- и поливинилиденфторида (ПВДФ) (Boysen et al., 2000) и CsHSO 4 с поли(акрилонитрилом) можно найти в литературе (Andronie et al. , 2008).Первый отчет о применении CsHSO 4 в топливном элементе был в 2001 году (Haile et al. , 2001). Эта система могла работать при 150–160 °C в конфигурации H 2 / O 2 с напряжением холостого хода 1,1 В и плотностью тока короткого замыкания 44 мА/см 2 . Он также был стабилен во влажной среде, но его характеристики значительно уступали характеристикам эквивалентных композитных полимерных мембран, работающих при 130–140 °C (Costamagna et al.
 , 2002). Позднее те же группы использовали мембрану из электролита CsH 2 PO 4 в топливном элементе, работающем при 250 °C. Ячейка смогла работать стабильно, и были достигнуты пиковая и максимальная плотности мощности 48,9 мВт/см 2 и 301 мА/см 2 (короткое замыкание) соответственно. Это был очень положительный результат, но проводимость CsH 2 PO 4 при низких температурах (< 140 °C) была очень низкой (10 -6 См/см). Следовательно, вполне вероятно, что эти топливные элементы могут иметь ряд проблем с запуском при использовании в циклических приложениях (например, в автомобилях).
, 2002). Позднее те же группы использовали мембрану из электролита CsH 2 PO 4 в топливном элементе, работающем при 250 °C. Ячейка смогла работать стабильно, и были достигнуты пиковая и максимальная плотности мощности 48,9 мВт/см 2 и 301 мА/см 2 (короткое замыкание) соответственно. Это был очень положительный результат, но проводимость CsH 2 PO 4 при низких температурах (< 140 °C) была очень низкой (10 -6 См/см). Следовательно, вполне вероятно, что эти топливные элементы могут иметь ряд проблем с запуском при использовании в циклических приложениях (например, в автомобилях).Были проведены дополнительные исследования смеси твердых кислот с частицами оксида. Гетерогенное легирование высокодисперсными инертными оксидами показало заметное увеличение протонной проводимости для некоторых твердых кислот, в частности, при температурах ниже суперпротонной температуры (Otomo et al. , 2008; Saito et al.
 , 2009). В этих композитах имело место сильное поверхностное взаимодействие между компонентами, что приводило не только к стабилизации новой фазы на поверхности оксида, но и к изменению объемных свойств солей (Лаврова, Пономарева, 2008). ).Часто используемые оксидные частицы являются пористыми, и было изучено влияние их пористости на проводимость. Однако низкотемпературная протонная проводимость этих композитов остается неясной, но часто утверждается, что твердая кислота принимает аморфную фазу с высокой протонной проводимостью в мезопорах при более низких температурах (Лаврова и Пономарева, 2008). Другим объяснением могло бы быть существование метастабильной фазы во время охлаждения композитов под действием сил упругости сдвига (Otomo et al., 2008). Окончательным объяснением может быть то, что изменение кристаллической структуры и усиленное межфазное взаимодействие между двумя фазами в композите приводит к более низкой температуре плавления твердой кислоты в композите, чем чистой твердой кислоты (Piao et al.
, 2009). В этих композитах имело место сильное поверхностное взаимодействие между компонентами, что приводило не только к стабилизации новой фазы на поверхности оксида, но и к изменению объемных свойств солей (Лаврова, Пономарева, 2008). ).Часто используемые оксидные частицы являются пористыми, и было изучено влияние их пористости на проводимость. Однако низкотемпературная протонная проводимость этих композитов остается неясной, но часто утверждается, что твердая кислота принимает аморфную фазу с высокой протонной проводимостью в мезопорах при более низких температурах (Лаврова и Пономарева, 2008). Другим объяснением могло бы быть существование метастабильной фазы во время охлаждения композитов под действием сил упругости сдвига (Otomo et al., 2008). Окончательным объяснением может быть то, что изменение кристаллической структуры и усиленное межфазное взаимодействие между двумя фазами в композите приводит к более низкой температуре плавления твердой кислоты в композите, чем чистой твердой кислоты (Piao et al. , 2009). ).
, 2009). ).Было обнаружено, что диспергирование частиц SiO 2 в твердокислотной матрице улучшает механические свойства мембраны (Бондаренко и др. , 2009). Введение CsH 2 PO 4 в пористые мембраны из анодного оксида алюминия обеспечило высокую выходную мощность при комнатной температуре, и, кроме того, поддержка мембраны из анодного оксида алюминия гарантирует работу топливных элементов с хорошей воспроизводимостью без какой-либо внешней поддержки (Bocchetta et al. ., 2009).
Безводные кислоты обычно имеют плохие механические свойства и растворимость в воде, а также чрезмерную пластичность и объемное расширение при повышении температуры. Однако, когда они включены в каналы полимерной мембраны, они могут быть очень полезны при высоких температурах, поскольку их проводимость не зависит от влажности. Однако перед тем, как твердые кислоты можно будет использовать в топливных элементах, все еще остаются технологические проблемы: (а) изготовление тонких непроницаемых твердокислотных мембран, (б) повышение производительности электродов и (в) конструкция системы для защиты электролита.
 из жидкой воды во время отключения топливных элементов (Haile et al., 2004).
из жидкой воды во время отключения топливных элементов (Haile et al., 2004).Химические свойства кислот и оснований: значение, примеры
Химические свойства кислот и оснований: Кислоты и основания имеют решающее значение в нашей повседневной жизни. Многие продукты, которые мы едим, кислые. Лимонная кислота содержится в лимонах и апельсинах, а уксус представляет собой раствор уксусной кислоты. Пищевая сода является основной по своей природе. Основы горькие, а их растворы скользкие, мыльные. В этой статье мы рассмотрим химические характеристики кислот и оснований и поймем их важность в реальном мире.
Прежде чем изучать химические характеристики кислот и оснований, мы изучим значение кислот и оснований .
РАЗЪЯСНИТЕ СВОИ КОНЦЕПТУАЛЬНЫЕ СОМНЕНИЯ ПО AICDS & BASES
КислотыСлово «кислота» происходит от латинского слова acidus, , что означает кислый.
Физические свойства кислот + }} \right]\) как единственные положительно заряженные ионы.
+ }} \right]\) как единственные положительно заряженные ионы.- Вкус: Кислоты имеют кислый вкус.
- Физическое состояние: Некоторые кислоты являются твердыми, а другие — жидкими при комнатной температуре.
Например, щавелевая кислота, борная кислота и т. д. представляют собой твердые вещества, а уксусная кислота, муравьиная кислота и т. д. — жидкости. - Коррозионная природа: Большинство кислот являются коррозионными по своей природе. Они производят жжение на коже и дырках в одежде, на которую попадают.
- Действие индикаторов: Окрашивают синий лакмус в красный цвет, изменяют цвет метилового оранжевого с оранжевого на красный, Фенолфталеин в кислых растворах остается бесцветным.
Практические экзаменационные вопросы
Скачать решения NCERT для кислот и оснований
Химические свойства кислот 1. Реакция с активными металлами
Реакция с активными металлами Разбавленные кислоты, такие как \({\rm{HCl}}\) и \({{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4}\), реагируют с активными металлы, такие как цинк, магний, железо и др., чтобы выделить газообразный водород.
\({\rm{Металл}} + {\rm{Разбавить}}\,{\rm{кислота}} \to {\rm{Металл}}\,{\rm{соль}} + {\rm{ Водород}}\)
Например,
(i) Металлический цинк реагирует с разбавленной серной кислотой с выделением газообразного водорода вместе с образованием сульфата цинка.
\({\rm{Zn}} + {{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4} \to {\rm{ZnS}}{{\ rm{O}}_4} + {{\rm{H}}_2} \стрелка вверх\)
(ii) Металлический магний реагирует с разбавленной соляной кислотой с выделением газообразного водорода вместе с образованием хлорида магния.
\({\rm{Mg}} + {\rm{HCl}} \to {\rm{MgC}}{{\rm{l}}_2} + {{\rm{H}}_2} \uparrow \)
(iii) Металлическое железо реагирует с разбавленной серной кислотой с выделением газообразного водорода вместе с образованием сульфата железа.

\({\rm{Fe}} + {{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4} \to {\rm{FeS}}{{\ rm{O}}_4} + {{\rm{H}}_2} \стрелка вверх\)
Некоторые металлы, такие как медь и серебро, менее реакционноспособны и не реагируют с разбавленными кислотами.
Таким образом, не все металлы реагируют с одной и той же кислотой с одинаковой энергией.Высокоактивные металлы, расположенные над водородом в ряду активности, энергично реагируют с разбавленными кислотами с выделением газообразного водорода, тогда как менее активные металлы менее энергично реагируют с разбавленными кислотами.
2. Реакция карбонатов/бикарбонатов металлов с кислотойРазбавленные кислоты реагируют с карбонатами и бикарбонатами металлов с выделением углекислого газа с сильным шипением и образованием соответствующей соли и воды.
\({\rm{Металл}}\,{\rm{карбонаты}}/{\rm{бикарбонаты}} + {\rm{Кислота}} \to {\rm{Соль}} + {\rm{вода }} + {\rm{углерод}}\,{\rm{диоксид}}\)
Попытка пробных тестов
Например,
(т.
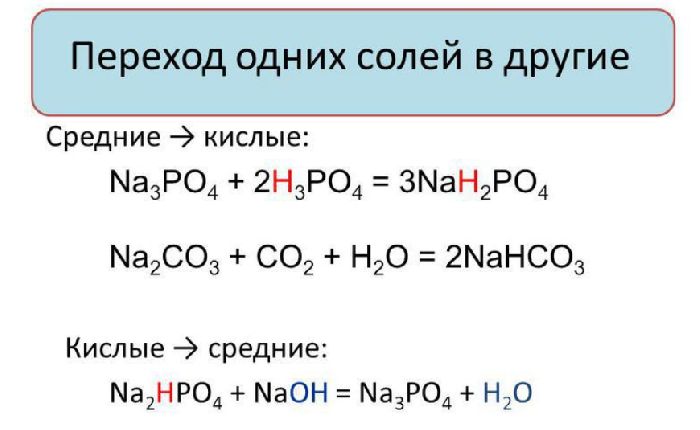 ) Карбонат натрия реагирует с разбавленной серной кислотой с выделением диоксида углерода, а также с образованием сульфата натрия и воды.
) Карбонат натрия реагирует с разбавленной серной кислотой с выделением диоксида углерода, а также с образованием сульфата натрия и воды.\({\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3} + {{\rm{H}}_2}{\ rm{S}}{{\rm{O}}_4} \to {\rm{N}}{{\rm{a}}_2}{\rm{S}}{{\rm{O}}_4 } + {{\rm{H}}_2}{\rm{O}} + {\rm{C}}{{\rm{O}}_2} \uparrow \)
(ii) Гидрокарбонат натрия реагирует с разбавленной соляной кислотой с выделением двуокиси углерода с образованием хлорида натрия и воды.
\({\rm{NaHC}}{{\rm{O}}_3} + {\rm{HCl}} \to {\rm{NaCl}} + {{\rm{H}}_2}{\ rm {O}} + {\ rm {C}} {{\ rm {O}}_2} \ uparrow \)
(iii) Известняк, мел и мрамор, которые представляют собой различные формы карбоната кальция, реагируют с разбавленной соляной кислотой с выделением диоксида углерода и образованием хлорида кальция и воды.
\({\rm{CaC}}{{\rm{O}}_3} + 2{\rm{HCl}} \to {\rm{CaC}}{{\rm{l}}_2} + { {\rm{H}}_2}{\rm{O}} + {\rm{C}}{{\rm{O}}_2} \uparrow \)
Если кто-то страдает от повышенной кислотности из-за переедания, рекомендуется принять щепотку пищевой соды.
3.Реакция кислот с основаниями Это связано с тем, что пищевая сода представляет собой бикарбонат натрия, который является основанием, нейтрализующим избыток соляной кислоты в желудке, и, таким образом, человек получает облегчение от жжения, вызванного кислотностью.
Это связано с тем, что пищевая сода представляет собой бикарбонат натрия, который является основанием, нейтрализующим избыток соляной кислоты в желудке, и, таким образом, человек получает облегчение от жжения, вызванного кислотностью.При взаимодействии кислоты с основанием образуется соль и вода. Эта реакция называется нейтрализацией.
\({\rm{Кислота}} + {\rm{Основание}} \to {\rm{Соль}} + {\rm{Вода}}\)
Например, когда соляная кислота реагирует с растворами гидроксида натрия, происходит реакция нейтрализации с образованием хлорида натрия и воды.
\({\rm{NaOH}} + {\rm{HCl}} \to {\rm{NaCl}} + {{\rm{H}}_2}{\rm{O}}\)
4.Реакция оксидов металлов с кислотамиКислоты реагируют с оксидами металлов с образованием соли и воды. Таким образом, реакция между оксидами металлов и кислотами является своего рода реакцией нейтрализации.
\({\rm{Металл}}\,{\rm{Оксид}} + {\rm{Кислота}} \to {\rm{Соль}} + {\rm{Вода}}\)
Например, когда черный оксид металла, представляющий собой оксид меди, реагирует с соляной кислотой, образуется сине-зеленый хлорид меди и вода.

\({\rm{CuO}} + 2{\rm{HCl}} \to {\rm{CuC}}{{\rm{l}}_2} + {{\rm{H}}_2}{ \rm{O}}\)
ОснованияОсновы горькие на вкус и скользкие или мыльные на ощупь.– }} \право)\) как единственные отрицательно заряженные ионы. Основания, нерастворимые в воде, не являются щелочами. Таким образом, все щелочи являются основаниями, но не все основания являются щелочами.
Примеры некоторых распространенных щелочей:
Физические свойства основания- Вкус и ощущение: Основы имеют горький вкус, а их раствор кажется скользким или мыльным.
- Коррозионная природа: Сильные основания сильно обжигают кожу и могут вызывать волдыри.
- Действие индикаторов: Они окрашивают красный лакмусовый раствор в синий цвет, изменяют метиловый оранжевый из оранжевого в желтый, а бесцветный фенолфталеин в розовый.
- Проводимость электричества: Подобно кислотам, растворы оснований в воде также проводят электричество.

Основания реагируют с кислотами с образованием только соли и воды. Эта реакция называется нейтрализацией.
Например, гидроксид натрия реагирует с соляной кислотой с образованием только хлорида натрия и воды.
\({\rm{NaOH}} + {\rm{HCl}} \to {\rm{NaCl}} + {{\rm{H}}_2}{\rm{O}}\)
Щелочи осаждают нерастворимые гидроксиды металловРаствор щелочей осаждает нерастворимые гидроксиды металлов из раствора их солей.
Например,
а. Хлорид меди реагирует с гидроксидом натрия и дает голубовато-белый осадок гидроксида меди с образованием хлорида натрия.
\({\rm{CuC}}{{\rm{l}}_2}({\rm{aq}}) + 2{\rm{NaOH}}({\rm{aq}}) \to { \rm{Cu}}{({\rm{OH}})_2}(\;{\rm{s}}) \downarrow + 2{\rm{NaCl}}({\rm{aq}})\ )
б. Хлорид железа реагирует с гидроксидом аммония с образованием красновато-коричневого осадка гидроксида железа и образованием хлорида аммония.

\({\rm{FeC}}{{\rm{l}}_3}({\rm{aq}}) + 3{\rm{N}}{{\rm{H}}_4}{\ rm{OH}}({\rm{aq}}) \to {\rm{Fe}}{({\rm{OH}})_3}(\;{\rm{s}}) \downarrow + 3 {\rm{N}}{{\rm{H}}_4}{\rm{Cl}}({\rm{aq}})\)
Щелочи выделяют аммиак из солей аммонияЩелочи при нагревании с солями аммония выделяют газообразный аммиак.\ Дельта {\ rm {NaCl}} ({\ rm {водный}}) + {{\ rm {H}}_2} {\ rm {O}} ({\ rm {l}}) + {\ rm { N}}{{\rm{H}}_3}(\;{\rm{g}}) \uparrow \)
Реакция щелочей с металламиНекоторые основания, такие как гидроксид натрия и гидроксид калия, реагируют с активными металлами, такими как цинк и алюминий, с выделением газообразного водорода.
Например,
а. Реакция цинка с гидроксидом натрия дает цинкат натрия и выделяет газообразный водород.
\({\rm{Zn}} + 2{\rm{NaOH}} \to {\rm{N}}{{\rm{a}}_2}{\rm{Zn}}{{\rm{ O}}_2} + {{\rm{H}}_2}\)
б.Всякий раз, когда алюминий реагирует с гидроксидом натрия, он дает алюминат натрия вместе с выделением газообразного водорода.

\(2{\rm{Al}} + 2{\rm{NaOH}} + 2{{\rm{H}}_2}{\rm{O}} \to 2{\rm{NaAl}}{ {\rm{O}}_2} + 3{{\rm{H}}_2}\)
Реакция оснований с оксидами неметалловОснования реагируют с оксидами неметаллов с образованием соли и воды.
Например,
а. Гидроксид натрия реагирует с углекислым газом с образованием карбоната натрия и воды.
\(2{\rm{NaOH}}({\rm{aq}}) + {\rm{C}}{{\rm{O}}_2}(\;{\rm{g}}) \ к {\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3}({\rm{aq}}) + {{\rm{ H}}_2}{\rm{O}}({\rm{l}})\)
б. Гидроксид кальция реагирует с диоксидом серы с образованием сульфита кальция и воды.
\({\rm{Ca}}{({\rm{OH}})_2}(\;{\rm{s}}) + {\rm{S}}{{\rm{O}}_2 }(\;{\rm{g}}) \to {\rm{CaS}}{{\rm{O}}_3}({\rm{aq}}) + {{\rm{H}}_2 {\ rm {O}} ({\ rm {l}}) \)
РезюмеВ этой статье мы изучили физические и химические характеристики кислот и оснований.Мы также изучали, как различные индикаторы меняют свой цвет при контакте с кислотами и основаниями.
Часто задаваемые вопросы о химических свойствах кислот и оснований Кроме того, теперь мы знаем различные реакции, такие как – реакция кислот с основанием, реакция кислот с металлами, реакция щелочей с гидроксидами металлов и т. д.
Кроме того, теперь мы знаем различные реакции, такие как – реакция кислот с основанием, реакция кислот с металлами, реакция щелочей с гидроксидами металлов и т. д.Q.1. Каковы химические свойства кислот?
Ответ: Химические свойства кислот следующие:
1.Они реагируют с активными металлами с выделением газообразного водорода.
2. Они реагируют с основаниями с образованием соли и воды.
3. Они реагируют с карбонатами/бикарбонатами металлов с выделением углекислого газа.
4. Реагируют с оксидами металлов только с образованием соли и воды.Q.2. Каковы химические свойства оснований?
Ответ: Химические свойства оснований следующие:
1. Они реагируют с кислотами с образованием соли и воды.
2. Они реагируют с оксидами неметаллов с образованием только соли и воды.
3. Некоторые основания реагируют с мета-металлами с выделением газообразного водорода.
Некоторые основания реагируют с мета-металлами с выделением газообразного водорода.
4. Щелочи выделяют аммиак из солей аммония.
5. Щелочи осаждают нерастворимые гидроксиды металлов.Q.3. Что такое реакция нейтрализации?
Ответ: При взаимодействии кислоты с основанием образуется соль и вода. Эта реакция называется нейтрализацией.
\({\rm{Кислота}} + {\rm{Основание}} \to {\rm{Соль}} + {\rm{Вода}}\)
Например, когда соляная кислота реагирует с растворами гидроксида натрия, затем происходит реакция нейтрализации с образованием хлорида натрия и воды.
\({\rm{NaOH}} + {\rm{HCl}} \to {\rm{NaCl}} + {{\rm{H}}_2}{\rm{O}}\)Q.4. Почему рекомендуется принимать щепотку пищевой соды при повышенной кислотности?
Ответ : Если кто-то страдает от повышенной кислотности из-за переедания, рекомендуется принять щепотку пищевой соды. Это связано с тем, что пищевая сода представляет собой бикарбонат натрия, который является основанием, нейтрализующим избыток соляной кислоты в желудке, и, таким образом, человек получает облегчение от жжения, вызванного кислотностью.
Q5. Сравните физические свойства кислот и оснований?
Ответ: Различие между физическими свойствами кислот и оснований заключается в следующем:Кислоты Базы I.) Яркий вкус I.) горький вкус II.) Не мыльный / скользкий коснитесь ii.) SAPANY / SLAPPERY для прикосновения к III.) III.) он становится синим литм для красного III.) он становится красным литмом на синий IV.) Они освобождают ионы гидрония вода. iv.) Высвобождают гидроксильные ионы в воде. Мы надеемся, что эта подробная статья о химических свойствах кислот и оснований поможет вам в подготовке.
 Если у вас есть какие-либо вопросы, связанные со статьей или общими вопросами о химических свойствах кислот и оснований, свяжитесь с нами через раздел комментариев, и мы свяжемся с вами как можно скорее.
Если у вас есть какие-либо вопросы, связанные со статьей или общими вопросами о химических свойствах кислот и оснований, свяжитесь с нами через раздел комментариев, и мы свяжемся с вами как можно скорее.311 просмотров
Кислотно-основные свойства солей — AP Chemistry
Соли, состоящие из катионов сильных оснований и анионов сильных кислот, не действуют на Н + при растворении в воде. Другими словами, водные растворы, такие как NaCl, KCl и NaNO
3, являются нейтральными или имеют pH = 7.
Когда катионы слабых оснований или анионы слабых кислот растворяются в воде, pH изменяется..
Примером является NaC 2 H 3 O 2 . Поскольку C 2 H 3 O 2 — является сопряженным основанием слабой кислоты, оно имеет сродство к протонам. В воде действует как основание с образованием ионов ОН — . Для таких реакций выражение равновесия такое же, как и для любой кислоты или основания, но иногда значение K b или K a неизвестно. Чтобы найти эти значения, мы используем уравнение (K b )(K a ) = K w и K w равно 1.0X10 -14 . Итак, чтобы найти K b сопряженного основания, вы делите K w на K a слабой кислоты, или для сопряженной кислоты вы делите K w на K b . слабого основания
В воде действует как основание с образованием ионов ОН — . Для таких реакций выражение равновесия такое же, как и для любой кислоты или основания, но иногда значение K b или K a неизвестно. Чтобы найти эти значения, мы используем уравнение (K b )(K a ) = K w и K w равно 1.0X10 -14 . Итак, чтобы найти K b сопряженного основания, вы делите K w на K a слабой кислоты, или для сопряженной кислоты вы делите K w на K b . слабого основанияПр. Найти КБ C 2 H 3 O 2 2 — , K A C 2 H 3 O 2 — — 1.8×10 -5
(1.0X10 -14 )/(1.8X10 -5 ) = 5,6X10 -10
Помните, что кислоты и основания конкурируют за ионы H + и OH — с водой, поэтому в то время как HCN кислоты, такой как HCN, очень мала (6,2X10 -10 ), и можно ожидать, что она будет сильным основанием (1X10 -14 ) / (6,2X10 -10 ) = 1,6X10 -5 , что все еще слабое основание по сравнению с другими сильными основаниями.
Сила основания соответствует OH — > Слабые основания > H 2 O
Другие соли образуют кислоты в растворе, такие как NH 4 Cl.Он диссоциирует на Cl — и NH 4 + , а NH 4 + диссоциирует на H + и NH 3 . Cl — практически не имеет сродства к протонам в воде, поэтому он не влияет на pH, в отличие от аммония.
Обычно соли, в которых анион не является основанием, а катион представляет собой сопряженную кислоту слабого основания, образуют кислые растворы.
Еще одна соль, образующая кислый раствор, — это соль с высокозаряженным ионом металла.Примером является AlCl 3 , который образует очень кислый раствор в воде. Al(H 2 O) 6 3+ также действует как слабая кислота, хотя это и не кислота Бренстеда-Лоури.
Al(H 2 O) 6 3+ (aq) <=> Al(OH)(H 2 O) 5 2+ (aq0) (aq)
Это связано с тем, что сильно заряженные ионы металлов поляризуют связи ОН в молекулах воды, делая водород в молекулах воды более кислым, чем обычный водород в свободных ионах воды.
