Возрастная анатомия опорно-двигательного аппарата
Рис. 7. Развитие костей туловища.
Рис. 8. Развитие и аномалии развития позвонков.
Рис. 9. Расщелина дуг позвонков на протяжении всех грудных позвонков.
Кости туловища по развитию относятся к вторичным костям. Они окостеневают энхондрально (рис. 7).
Развитие позвонков:
У зародыша закладывается 38 позвонков: 7 шейных, 13 грудных, 5 поясничных, 12-13 крестцовых и копчиковых (рис. 8).
13-й грудной превращается в 1-й поясничный, последний поясничный – в 1-й крестцовый, Идет редукция большинства копчиковых позвонков.
Каждый позвонок имеет первоначально три ядра окостенения: в теле и по одному в каждой половинке дуги.
Вторичные центры появляются по верхнему и нижнему краям тела позвонка у девочек в 6-8 лет, у мальчиков – в 7-9 лет. Они прирастают к телу позвонка в 20-25 лет.
Самостоятельные ядра окостенения образуются в отростках позвонков.
Аномалии развития позвонков (рис. 8, 9):
— Врожденные расщелины позвонков:
— Spina bifida — расщелина только дуг.
— Рахишизис – полная расщелина (тело и дуга).
— Клиновидные позвонки и полупозвонки.
— Платиспондилия – расширение тела позвонка в поперечнике.
— Брахиспондилия – уменьшение тела позвонка по высоте, уплощение и укорочение.
— Аномалии суставных отростков: аномалии положения, аномалии величины, аномалии сочленения, отсутствие суставных отростков.
— Спондилолиз – дефект в межсуставной части дуги позвонка.
— Врожденные синостозы: полный и частичный.
— Os odontoideum – неслияние зуба с телом осевого позвонка.
— Ассимиляция (окципитализация) атланта – слияние атланта с затылочной костью.
— Шейные ребра.
— Сакрализация – полное или частичное слияние последнего поясничного позвонка с крестцом.
— Люмбализация – наличие шестого поясничного позвонка (за счет мобилизации первого крестцового).
В Северном Ледовитом океане обнаружен тропический планктон // Смотрим
Международная группа учёных обнаружила в пробах воды, взятых в 2010 году близ архипелага Шпицберген, 98 разновидностей планктонных организмов, которые обычно водятся в тропиках. За 100 лет наблюдений исследователи ещё ни разу не встречали крошечных теплолюбивых радиолярий в арктических широтах.

В пробах воды, взятых на северо-западе от архипелага Шпицберген, учёные выделили 145 таксонов планктона, 98 из которых вызвали у специалистов крайнее удивление.
Речь идёт о крошечных одноклеточных радиоляриях, которые никогда не встречались в северных водах за почти столетнюю историю наблюдений.
Радиолярии имеют под клеточной мембраной хитиновый скелет, который придаёт им причудливые ветвистые формы. Разные виды этих существ живут в разных температурных диапазонах.
По большому количеству их отслуживших своё оболочек в слоях древнего океанического ила учёные узнают о колебаниях температуры мирового океана в прошлом.
Настоящие исследования проводились в 2010 году на борту судна, принадлежащего Норвежскому полярному институту (Norsk polarinstitutt). В них также принимали участие учёные из Колумбийского университета (Columbia University) и российского Института Океанологии РАН.
“То, что мы обнаружили тропический планктон в Арктике, может лишний раз поднять вопрос о глобальном потеплении мирового океана. Поэтому очень важно рассмотреть все обстоятельства, прежде чем делать такие выводы», — говорит участник экспедиции Роджер Андерсон (O. Roger Anderson).
Поэтому очень важно рассмотреть все обстоятельства, прежде чем делать такие выводы», — говорит участник экспедиции Роджер Андерсон (O. Roger Anderson).
Исследователи считают, что микроорганизмы попали в Арктику с течением Гольфстрим, которое несёт свои воды от Карибского моря до Норвегии и Кольского полуострова. Обычно это тёплое течение значительно остывает на участке между Великобританией и Гренландией. Но в отдельные годы океанологи фиксировали, как массы тёплой воды проникали с течением глубоко в северные широты. Такие всплески отмечены в двадцатые, тридцатые и пятидесятые годы прошлого века.
Кроме того, по отложению хитиновых скелетов радиолярий на дне Северного Ледовитого океана учёные определили, что эти организмы появлялись в этих местах и в прошлом. Похожие процессы происходили 4100 лет до нашей эры, а также в 220-х, 370-х и 1100-х годах нашей эры.
«Факты, которыми мы располагаем, говорят, что нашествие тропического планктона на север не является немедленным доказательством глобального потепления, — считает Андерсон. – Это не происходит на регулярной основе, но иногда случается».
– Это не происходит на регулярной основе, но иногда случается».
При этом специалистов настораживает то обстоятельство, что вбросы тёплой воды, проникающей в арктический регион, заметно участились в последние десятилетия. А ведь даже без этого температура арктических морей в летний период поднялась с 1950 года в среднем на 5 °C.
Исследования найденных радиолярий показали, что они сильно варьируются по размерам. Это свидетельствует о том, что они не просто вторглись на север, но и прекрасно там размножались.
Продолжительность жизни этих существ не превышает один месяц. Учёные полагают, что их путешествие из тропиков могло занять несколько лет. За это время должны были смениться несколько десятков поколений существ, и организмы плавно адаптировались к более холодным водам.
В 2009 году летняя температура воды на северо-западе от архипелага Шпицберген составила рекордные 7,5 градусов Цельсия. Через год, когда были обнаружены радиолярии, температура снизилась до обычных 3,5 °C, но тепловодные организмы продолжили обитание в этих местах.
Правда, соавтор исследований Светлана Кругликова из Института Океанологии РАН сообщает, что в 2010 году тропических радиолярий в пробах уже не было. Погибли они или переместились в другие области, можно узнать, только проведя новые исследования.
Добавим, что нынешнее открытие — не первое свидетельство миграции теплолюбивых видов на север. Например, бабочки в течение каждого десятилетия продвигаются на шесть километров в направлении полюсов Земли. На Аляску с юга обрушились ядовитые водоросли, вредные для местных моллюсков. Также специалисты отмечают массовое движение рыб в районе Великобритании и Норвегии, где появились теплолюбивые виды, и сократилась популяция более холодноводной трески. Подобные явления наблюдаются на Восточном побережье США, в Беринговом море и в Австралии.
Такие миграции могут серьёзно нарушить баланс в существующих экосистемах. Но сегодня никто не может точно сказать, имеем мы дело с временным явлением или с глобальным долгосрочным изменением климата.
Результаты своего исследования морские биологи опубликовали в журнале Journal of Micropalaeontology.
Тип членистоногие, подготовка к ЕГЭ по биологии
Тип членистоногие наиболее богатый видами среди всех животных. Он насчитывает около 1,5 млн. видов, которые широко расселились по всему земному шару и на данный эволюционный период — господствуют, достигнув невиданного расцвета и отлично приспособившись к жизни вблизи людей.
Членистоногие — первичноротые трехслойные многоклеточные животные, произошедшие от многощетинковых кольчецов и включающие в себя многочисленные классы — ракообразные, паукообразные и насекомые. Давайте обозначим ароморфозы, которые помогли занять членистоногим их доминирующее положение, и общие черты строения.
По-другому членистоногих называют артроподы (от др.-греч. ἄρθρον — сустав и πούς, род. п. ποδός — нога), что еще раз подчеркивает их важнейшие ароморфозы,
о которых вы скоро узнаете.
п. ποδός — нога), что еще раз подчеркивает их важнейшие ароморфозы,
о которых вы скоро узнаете.
Ароморфозы членистоногих
- Членистые конечности
- Поперечно-полосатая мускулатура
- Слияние сегментов тела
- Наружный скелет — хитиновый покров
- Способность к полету у насекомых
Органы движения членистоногих имеют более сложное строение, через суставы соединяясь с телом животного. Конечности подобны многоколенным рычагам, к которым крепятся мышцы, приводящие их в движение. Выполняют самые разные функции: копание, передвижение, собирание, плавание, служат органом защиты и нападения на жертву.
Поперечно-полосатая мышечная ткань впервые возникла у членистоногих. Мышечная ткань дифференцирована на отдельные пучки. Они состоят из длинных волокон, которые начинаются от одних члеников и крепятся к другим членикам тела, превращая их в подвижные рычаги.
Для членистоногих характерна гетерономная сегментация тела (от греч.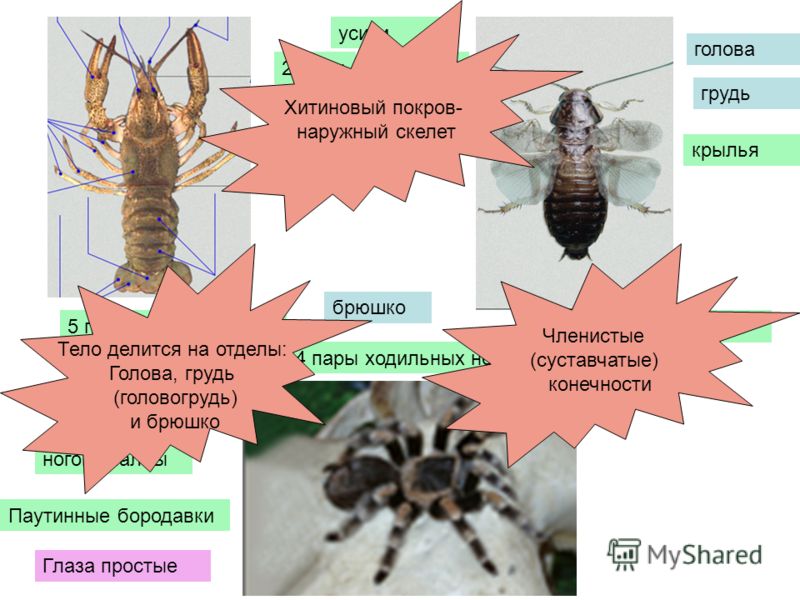
Тело членистоногих покрыто твердым наружным покровом — хитинизированной кутикулой. Хитин — природный полимер из группы азотсодержащих полисахаридов. Такая оболочка надежно защищает все внутренние органы от механических повреждений, предотвращает высыхание и служит опорой для внутренних органов, мышц.
Перед вами одно из величайших событий эволюции на Земле — приобретение насекомыми крыльев. Это важное новшество дало возможность осваивать обширные
ранее недоступные территории, заселить множество разных экологических ниш.
Перечисленные ароморфозы членистоногих и их маленькие размеры дали этим животным невероятные преимущества, и, повторюсь, мы с вами на данный момент живем в эру господства членистоногих. Они прекрасно уживаются с человеком — вы не раз встречали насекомых в своем жилище, и порой это были не самые лучшие и ожидаемые встречи, но ведь они были — это еще одно очевидное доказательство их адаптации к жизни рядом с нами.
Приступим к перечислению общих особенностей, характерных для членистоногих в целом.
Общие особенности членистоногих
- Покровы тела
- Гетерономная сегментация
- Членистые конечности
- Полость тела
- Кровеносная система
- Дыхательная система
- Выделительная система
- Нервная система
- Половая система
Снаружи тело членистоногих покрыто хитиновой кутикулой — твердым наружным скелетом (его также называют экзоскелет). Он выполняет защитную функцию, изнутри к нему крепятся многочисленные мышечные пучки.
Важно отметить, что хитиновый покров нерастяжим и сдерживает рост животного, поэтому запомните, что членистоногие растут только
в период линьки, когда спадает хитиновая кутикула.
Тело членистоногих подразделяется на неоднородные сегменты, которые отличаются по строению и функции — такая сегментация называется гетерономная. Группы сегментов сливаются в отделы тела: голову — несущую органы чувств и конечности для захвата пищи, грудь — с расположенными на ней ходильными конечностями, и брюшко — задний отдел.
У паукообразных и ракообразных голова и грудь сливаются в единый отдел — головогрудь. У клещей тело вообще не дифференцировано на отделы, представлено единой монолитной структурой.
Членистые конечности — важная прогрессивная черта членистоногих, они представляют собой систему множество подвижно соединенных друг с другом рычагов.
Между отдельными члениками в конечности образуются суставы, что обеспечивает большой объем двигательных возможностей.
Конечности могут видоизменяться, и в зависимости от выполняемой функции конечность получает разные названия: бегательная, прыгательная, копательная, плавательная, хватательная, собирательная и другие.
Как уже было сказано, хитиновая кутикула выполняет функцию экзоскелета, поэтому у членистоногих полость тела утрачивает опорную функцию. Вследствие гетерономной сегментации тела и смешения первичной полости тела со вторичной, у членистоногих полость тела называется — миксоцель (от греч. μῖξις — «смешение» и κοῖλος — «полый»).
Остатки вторичной полости тела (целома) можно обнаружить в протоках половых железах (гонад) и выделительных органах. За счет крови, заполняющей большую часть тела, полость тела членистоногих (и моллюсков) также называют гемоцель.
У членистоногих кровеносная система незамкнутого (лакунарного) типа. Из сосудов кровь попадает в щелевые промежутки и омывает внутренние органы,
доставляя клеткам питательные вещества. Сердце располагается на спинной стороне тела.
Из сосудов кровь попадает в щелевые промежутки и омывает внутренние органы,
доставляя клеткам питательные вещества. Сердце располагается на спинной стороне тела.
По сосудам и полостям движется единственная тканевая жидкость насекомых — гемолимфа. Она не переносит кислород, в ней редко можно обнаружить гемоцианин. Чаще всего она бесцветна, либо желтовато-зеленоватого цвета. Тем не менее, гемоцианин (за счет содержания меди придает характерный голубой цвет), обнаруживается среди мечехвостов, некоторых паукообразных, ракообразных и насекомых.
У водных форм представлена жабрами, у наземных — листовидными легкими и трахеями.
Органы выделения членистоногих представлены видоизмененными метанефридиями. У насекомых имеются мальпигиевы сосуды, позволяющие максимально экономить воду,
всасывая ее прямо из мочи. У ракообразных выделительная система представлена зелеными железами, располагающимися на головном конце тела.
У ракообразных выделительная система представлена зелеными железами, располагающимися на головном конце тела.
Обитание на суше в целом требует от членистоногих сильной экономии жидкости, что вызывает изменения продуктов выделения. Так у паукообразных легко растворимые мочевина и аммиак заменяются малорастворимым гуанином, у насекомых мочевина и аммиак заменяется мочевой кислотой.
Нервная система узлового типа. Состоит из головного мозга (надглоточного ганглия), подглоточного ганглия и брюшной нервной цепочки. От ганглиев (нервных узлов) отходят нервные волокна, иннервирующие близлежащие внутренние органы и ткани.
Все членистоногие размножаются только половым путем. Большинство из них раздельнополые животные, развитие чаще непрямое (происходит с метаморофозом). Метаморфоз (греч. metamorphosis — превращение) — глубокое преобразование в строении организма, в результате которого личинка через стадию куколки
превращается во взрослую особь.
Метаморфоз (греч. metamorphosis — превращение) — глубокое преобразование в строении организма, в результате которого личинка через стадию куколки
превращается во взрослую особь.
Подтип Трилобитовые
Этих животных мы с вами могли увидеть, если бы переместились на 540 млн. лет назад, в самое начало палеозоя (кембрийский период). В кембрии они впервые появились, и тогда же начался их расцвет. Вымерли эти удивительные животные к концу пермского периода.
Для этих животных характерна гомономная сегментация, отсутствие дифференциации конечностей.
Значение членистоногих
Значение членистоногих для человека сложно переоценить. Некоторых членистоногих употребляют в пищу — раки, крабы, омары (лобстеры). Медоносные пчелы создают мед —
ценнейшее природное «лекарство», из меда изготавливается множество других фармацевтических лекарств.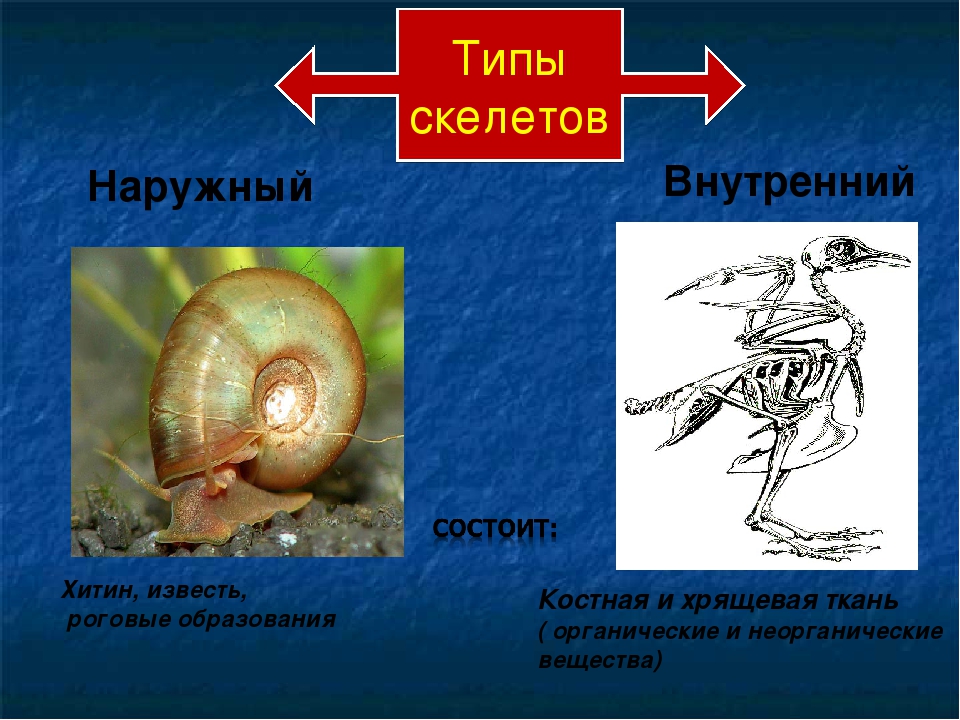 Хитиновая кутикула
наружного скелета используется в фармацевтике. Из яда паукообразных изготавливают снотворные средства.
Хитиновая кутикула
наружного скелета используется в фармацевтике. Из яда паукообразных изготавливают снотворные средства.
Членистоногие доставляют и множество хлопот человеку. Часть из них являются переносчиками тяжелых заболеваний (комар рода Anopheles переносит возбудителя малярии — малярийного плазмодия, возбудителей различных инфекционных заболеваний могут переносить мухи, москиты, блохи, тараканы).
Ряд членистоногих напрямую вызывает заболевания у человека, к примеру — чесоточный зудень приводит к развитию чесотки. Многие насекомые наносят вред культурным растениям, выращиваемым человеком, это — саранча, клопы, жук-короед.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Что такое хитиновый покров?
Поэзия все чаще обращается к специфическим вопросам какой-либо отрасли знаний, зачастую звучащим для не вовлеченных в нее людей как нечто совершенно непонятное. Так, в песне Оксимирона «Хитиновый покров» звучит призыв снять с лирического героя этот самый покров. Вопрос в том, а что, собственно говоря, эта метафора означает.
Путешествие в седьмой класс
На одном из уроков биологии, зоологии, естественных наук (все зависит от профиля школы) дети изучают такой тип животных, как членистоногие. Среди них выделяют в настоящий момент такие надклассы, как ракообразные, трахейные, хелицеровые. Иначе говоря, это крабы, раки, креветки, многоножки, бабочки, морские пауки и многие другие замечательные создания, являющиеся в совокупности причинами фобии у семидесяти процентов землян.
Иначе говоря, это крабы, раки, креветки, многоножки, бабочки, морские пауки и многие другие замечательные создания, являющиеся в совокупности причинами фобии у семидесяти процентов землян.
Сами членистоногие по своему количеству составляют восемьдесят процентов от всех представителей животного мира планеты. Но что такое хитиновый покров?
Животные этого типа не обладают скелетом в привычном понимании слова, то есть эндоскелетом. Вместо него у них есть экзоскелет, то есть скелет внешний. Он и называется хитиновый покров.
Биологическое значение
Если сама суть понятия ясна, то возникает следующий вопрос: а зачем вообще нужен хитиновый покров членистоногим? Экзоскелет нужен им ровно для того же, для чего иным позвоночным нужен эндоскелет. Склерит – еще одна вариация названия – необходим для выполнения ряда функций:
- опорная функция – он служит животному для опоры, устойчивости;
- функция крепежа – к хитиновому покрову изнутри прикрепляются мышцы;
- увлажняющая функция – в состав хитинового покрова входит кутикула, которая содержит железу, вырабатывающую секрет, защищающий животное от высыхания на суше;
- защитная функция – защита мягкого тела животного от физических повреждений, ударов;
- двигательная – та же кутикула является крайне удобным материалом.
 Это позволяет членистоногим животным двигаться в непредсказуемых порой направлениях благодаря тому, что она выполняет роль гнущегося материала, соединяющего сегменты друг с другом.
Это позволяет членистоногим животным двигаться в непредсказуемых порой направлениях благодаря тому, что она выполняет роль гнущегося материала, соединяющего сегменты друг с другом.
Кроме того, в ходе эволюции в некоторых случаях экзоскелет преобразовался, трансформировался в челюсти и клешни, позволяющие хватать, жевать и дробить добычу.
Очевидно, что такой хитиновый покров является жизненно необходимым условием для выживания вида.
В случае с летающими или прыгающими членистоногими (кузнечики, например) особую важность приобретает легкость склерита, позволяющая осуществлять полеты или прыжки.
Экзоскелет как метафора
Если с понятием хитинового покрова как биологического термина более или менее ясно, то что такое хитиновый покров как метафора? Что имеет в виду поэт, обращаясь к нему?
Человека принято рассматривать с двух сторон: то, что он предпочитает показывать обществу, и то, что он скрывает внутри себя. Как правило, говоря о первом в контексте «защитной брони», речь ведут о цинизме, практичности, разумном эгоизме, самоиронии – всех тех вещах, которые позволяют защититься от чьей-то агрессии, ядовитой среды, но делают его носителям жестким в чьих-нибудь глазах. Второе в данном контексте – доброта, мягкость, все то, за что человека можно зацепить и ранить.
Второе в данном контексте – доброта, мягкость, все то, за что человека можно зацепить и ранить.
Иначе говоря, второе – мягкое «тельце», которое легко ранить, а хитиновый покров – защита.
И мы никогда не знаем, что потеряли. Впереди водоворот, Я ранимый, не снимай с меня хитиновый покров. Но кто же твоего лица теперь коснется руками? Впереди водоворот, не щади меня! Сними с меня хитиновый покров!
Под этими строками Oxxxymiron имеет в виду, что по-настоящему жить и чувствовать можно, только избавившись от защитного слоя и позволив кому-то прикоснуться к тому мягкому и беззащитному перед внешней угрозой, что есть в каждом из людей. Вот что такое хитиновый покров в одноименной песне – пассивно-агрессивная защита от мира, бьющая по людям, которые могут стать близкими.
Arthropoda 1 Наружный хитиновый скелет к которому
Arthropoda
1. Наружный хитиновый скелет, к которому изнутри крепятся многочисленные поперечнополосатые мышцы
2. Метамерия. Сходные сегменты образуют отделы тела.
Метамерия. Сходные сегменты образуют отделы тела.
3. Членистые конечности, выполняющие самые разные функции
4. Нервная система состоит из головного мозга и брюшной нервной цепочки. Органы чувств хорошо развиты.
5. Кровеносная система незамкнутая
6. Пищеварительная система имеет 3 отдела, детали строения определяются типом питания.
7. Дыхательная система различна: у водных – жабры, у наземных – листовидные лёгкие или трахеи
8. Выделительная система. У раков – зелёные железы У пауков – мальпигиевы сосуды У насекомых – мальпигиевы сосуды.
9. Половое размножение У некоторых наблюдается партеногенез (дафнии, пчёлы и др. )
Развитие с полным или неполным метаморфозолм
Класс Crustacea крабы, раки, креветки, дафнии, циклопы, около 26, 000 видов
Медицинское значение Crustacea Cyclops spp. Nematoda—(D. medinensis) (веслоногие рачки Cestoda— (D. latum) Sparganosis — водные блохи) Spirometra spp. Diaptomus spp. Cestoda— (D. latum) Order Decapoda (крабы, раки) Trematoda— (P. westermani)
Nematoda—(D. medinensis) (веслоногие рачки Cestoda— (D. latum) Sparganosis — водные блохи) Spirometra spp. Diaptomus spp. Cestoda— (D. latum) Order Decapoda (крабы, раки) Trematoda— (P. westermani)
Пресноводные крабы (P. westermani)
Класс ARACHNIDA (около 57, 000 известных видов). Усиков нет 6 пар конечностей : 1 – хелицеры, 2 – педипальпы, 3 – 6 – ходильные ноги. Тело подразделяется на головогрудь и брюшко, у клещей тело слитное. Большинство – сухопутные Многие хищники и паразиты Отряды: Scorpionidae, Araneida и Acari имеют медицинское значение
Медицинское значение. • Ядовитые животные (пауки и скорпионы) • Внутрикожные паразиты (Sarcoptes scabiei и Demodex folliculorum) • Временные кровососущие эктопаразиты, переносчики болезней • Аллергены (например, клещи домашней пыли) Отряд скорпионы Scorpionidae Тело подразделяется на головогрудь и брюшко с иглой на конце. Скорпионы живородящи и носят молодь на спине. Скорпионы редко атакуют людей, если их не задевать. Они производят 2 вида яда Гемолитический яд дает жжение, отек и некроз Нейротропный – боль, озноб, слюнотечение и даже паралич дыхания Следует применять антисыворотку
Скорпионы редко атакуют людей, если их не задевать. Они производят 2 вида яда Гемолитический яд дает жжение, отек и некроз Нейротропный – боль, озноб, слюнотечение и даже паралич дыхания Следует применять антисыворотку
Рука ребенка, ужаленного скорпионом
Order Araneida (пауки) Ядовитые пауки(Яд нейротропный, в течение получаса развивается общая интоксикация. Следует использовать антисыворотку. ) В роде Latrodectus описано около 30 видов. В СНГ это каракурт – Latrodectus trеdеcimguttatus, в Америке – черная вдова
Черная вдова (Latradectus lugubris)
Укус черной вдовы. Очень болезненный
Тарантулы (Lycosa) — род крупных ядовитых пауков. Длина тела крупных представителей достигает 3, 5 см. Укус встречающегося на юге России мизгиря или южно-русского тарантула (Lycosa singoriensis) болезненен и вызывает отек.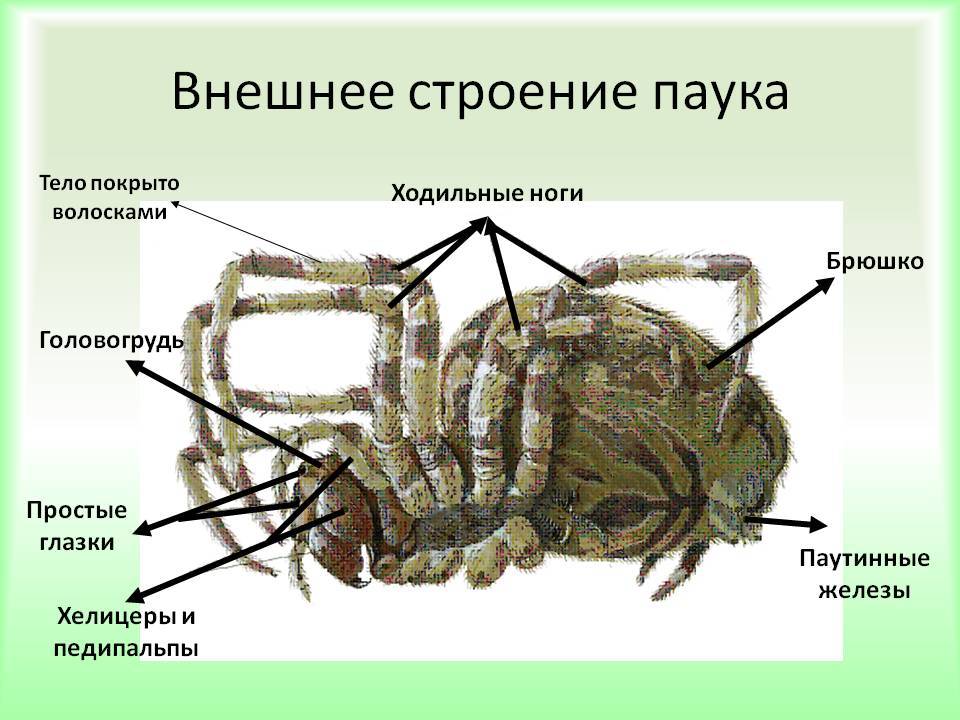
Acari (клещи) Описано свыше 48 тысяч видов. Некоторые виды относится к паразитам и переносчикам возбудителей заболеваний человека, но и непаразитические формы часто вызывают раздражение кожи. Существует трансовариальная передача возбудителя
Развитие включает стадии яйца, личинки (3 пары ног), куколки (4 пары ног) и имаго.
2 группы: Паразитиформные и Акариформные Паразитиформные клещи имеют колюще-сосущий ротовой аппарат и являются временными эктопаразитами и переносчиками нескольких десятков видов вирусов, бактерий и простейших. Существует трансовариальная передача возбудителя. Семейство иксодовые Ixodidae Таежный клещ — Ixodes persulcatus (переносчики вирусов энцефалита)
Сбачий клещ Ixodes ricinus
Пастбищный клещ Dermacentor sp. (семейство Ixodidae) Туляремия, лихорадка Ку, бруцеллез, энцефалит
Клещи рода Hyalomma (семейство Ixodidae) передачa возбудителей Ку лихорадки, крымской геморрагической лихорадки
Семейство Argasidae Переносчики спирохет рода Borrelia возбудителей клещевого возвратного тифа
Семейство Краснотелковые (Trombiculidae) являются переносчиками возбудителей цуцугамуши и некоторых других болезней
Семейство Гамазовые (Gamasoidea) являются переносчиками возбудителей крысиного сыпного тифа и чумы, реккетсиоза, лихорадки Q. Гамазовые клещи
Гамазовые клещи
Акариформные клещи – мелкие и ротовой аппарат имеют грызущего типа. 2 вида являются постоянными внутрикожными паразитами человека Sarcoptes scabiei
Чесоточный ход Вход Вентиляцио нные отверстия Место, где сидит самка
Железница угревая Demodex folliculorum
Демодекоз
Шмель-кукушка – и такое бывает!
Шмель-кукушка – и такое бывает!
21 июня 2016
Лето – ароматы и разноцветье, с цветка на цветок перелетают маленькие труженики из семейства настоящих пчёл. Спешат собрать пыльцу и нектар пчёлы и шмели. Быстро перелетают с цветка на цветок крупные шмели-самки (их еще называют «царицами») и более мелкие «рабочие» шмели.
В конце мая – начале июня к ним присоединились крупные медлительные, лениво питающиеся и долго отдыхающие шмели, они не спешат улететь при попытке их потревожить, а, наоборот, пытаются пугать, угрожая жалом и поднимая среднюю ногу. Это – самки шмелей-кукушек, являющиеся паразитами настоящих шмелей; они специально поздно начинают летать после зимовки, чтобы дать время настоящим шмелям основать гнезда-семьи и вырастить первое поколение «рабочих» (бесплодных самок). Шмели-кукушки – это особый подрод (Psithyrus) в роде Шмелей (Bombus).
Это – самки шмелей-кукушек, являющиеся паразитами настоящих шмелей; они специально поздно начинают летать после зимовки, чтобы дать время настоящим шмелям основать гнезда-семьи и вырастить первое поколение «рабочих» (бесплодных самок). Шмели-кукушки – это особый подрод (Psithyrus) в роде Шмелей (Bombus).
Многие представители шмелей-кукушек внешне довольно похожи на своих шмелей-хозяев. Их важный признак – более темные, чем у настоящих шмелей, крылья. Шмели-кукушки не имеют специальной корзиночки для сбора пыльцы на задних ногах; она им просто не нужна, так как сбором пыльцы эти шмели не занимаются.
2016 год оказался очень удачным в плане наблюдений за редкими на территории заповедника шмелями–кукушками. В конце весны – начале лета в разных частях заповедника удалось несколько раз наблюдать два вида шмелей–кукушек. Первый вид – холмовой шмель–кукушка (Bombusrupestris), внешне похожий на очень обычного каменного шмеля (Bombuslapidarius). Шмели этих видов черные с красной вершиной брюшка, но самка холмового шмеля-кукушки легко отличается от вида хозяина: у неё более темные крылья и на передней части груди имеется широкая желтая перевязь.
Шмели этих видов черные с красной вершиной брюшка, но самка холмового шмеля-кукушки легко отличается от вида хозяина: у неё более темные крылья и на передней части груди имеется широкая желтая перевязь.
Другой вид – лесной шмель-кукушка (Bombussylvestris) внешне похож на лугового шмеля (Bombuspratorum), легко отличаясь более темными крыльями и белым концом брюшка. Лесной шмель-кукушка похож также на сорейского шмеля (Bombussoroeensis), отличаясь более темными крыльями и наличием широкой желтой перевязи на передней части груди. Лесной шмель-кукушка – новый вид для фауны Воронежской и Липецкой областей; этот вид отсутствует в Кадастре беспозвоночных животных Воронежской области (2005) и Кадастре пчелиных Липецкой области (В.Т. Кузнецова, 2009). Лесной шмель-кукушка характерен для лесной зоны и нахождение его на территории Воронежского заповедника – самое южное в европейской части территории России.
Шмели-кукушки характеризуются очень сложным, довольно пластичным и пока еще плохо изученным поведением. По одним данным, шмели-кукушки ведут себя очень агрессивно: самка находит гнездо подходящего вида шмеля, проникает в него и сразу убивает хозяйку гнезда. Оставшиеся шмели — «рабочие» гнезда служат новой хозяйке как «рабы», воспитывая из яиц, отложенных самкой шмеля-кукушки, репродуктивное потомство шмеля-паразита (будущих самок и самцов).
По другим данным, самка шмеля-кукушки незаметно проникает в гнездо подходящего вида шмеля и ведет себя тихо несколько дней, чтобы пропитаться запахом гнезда, и даже живет несколько недель вместе с настоящей хозяйкой. Паразит убивает настоящую хозяйку только перед откладкой собственных яиц репродуктивного потомства.
В любом случае обнаружение и «завоевание» подходящего гнезда для самки шмеля-кукушки – сложная проблема. Гнездо шмеля-хозяина должно быть не слишком слабым (малочисленным), не слишком сильным (многочисленным). Рабочие особи в гнездах настоящих шмелей умеют распознавать «чужаков» и, нападая группой, могут убивать самок шмелей–кукушек.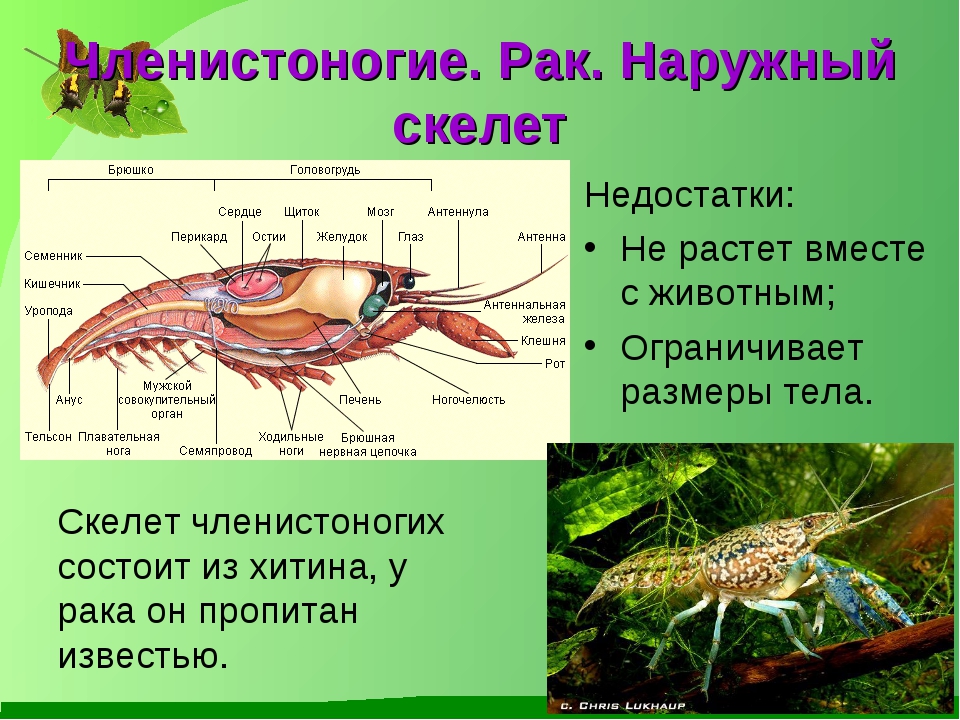 Именно поэтому у самок шмелей-кукушек особо прочный хитиновый скелет, однако, уязвимые для жала «рабочих» шмелей участки в «броне» все равно есть: это – конец брюшка и шея.
Именно поэтому у самок шмелей-кукушек особо прочный хитиновый скелет, однако, уязвимые для жала «рабочих» шмелей участки в «броне» все равно есть: это – конец брюшка и шея.
Главный научный сотрудник Воронежского заповедника,
доктор биологических наук В.М. Емец
Хитин | Encyclopedia.com
Хитин — основная составляющая экзоскелета или внешнего скелета многих членистоногих, таких как насекомые, пауки и ракообразные. Экзоскелеты, сделанные из этого прочного и прочного компаунда, поддерживают и защищают нежные мягкие ткани этих животных, у которых отсутствует внутренний скелет. Хитин — это полисахарид , тип углеводов, основная структура которого представляет собой повторяющуюся цепочку молекул сахара. Хитин по строению аналогичен целлюлозе,
соединение, которое обеспечивает структурную поддержку тканей растений.Помимо того, что хитин находится в экзоскелете членистоногих, он также находится в клеточных стенках некоторых видов грибов.
Хитин не работает сам по себе в формировании экзоскелетов. Он связан с рядом белков, в том числе с эластичным резиноподобным веществом резилином. От идентичности и природы этих белков зависит, будет ли экзоскелет жестким, как панцирь жука, или мягким и гибким, как суставы лапки краба. Хитин также связывается с небелковыми соединениями, такими как карбонат кальция, который является частью панцирей ракообразных, таких как крабы, омары и креветки.
Животные, которые носят свои скелеты снаружи, относительно негибки из-за жесткости их брони. Членистоногие могут сгибать конечности или части тела только в суставах, где экзоскелет тоньше. Поэтому важно, чтобы состав и характер экзоскелета дополняли анатомию, которую он покрывает, и общую экологию организма.
Хитин дает животным с экзоскелетами ряд защитных свойств. Помимо определения основной формы животного, прочная оболочка, покрывающая членистоногих, защищает владельца от обезвоживания или обезвоживания.Эта особая функция важна для наземных членистоногих, которые могут погибнуть, если из их крови и тканей тела будет потеряно слишком много воды. Панцири также обеспечивают эффективную защиту от некоторых хищников.
Панцири также обеспечивают эффективную защиту от некоторых хищников.
Хитиновый экзоскелет необходимо линять или сбрасывать по мере роста животного, потому что жесткий панцирь не расширяется вместе с остальной частью тела. После того, как старый панцирь сброшен, новый, более крупный экзоскелет секретируется железами эпидермиса. Недавно линьки особенно уязвимы для нападения, потому что у них мало защиты, пока они ждут, пока затвердеет их новый панцирь.
Экзоскелеты непрактичны для крупных животных, потому что хитин недостаточно силен, чтобы защищать и поддерживать их. Сухопутные беспозвоночные, которым не помогает плавучесть вода, ограничены в размерах, потому что по мере того, как экзоскелет становится больше, он становится толще и тяжелее. Эти животные не смогли бы хорошо передвигаться под тяжестью этой защитной брони.
см. Также Кость; Кератин.
Джуди П. Шин
Библиография
Андерсон Д.Т. Атлас анатомии беспозвоночных. Портленд: международный. Specialized Bood Service, 1997.
Портленд: международный. Specialized Bood Service, 1997.
«Хитин». Энциклопедия Новой Колумбии. Ред. Уильям Х. Харрис и Джудит С. Леви. Нью-Йорк: издательство Колумбийского университета, 1975.
Пирс, Сидни К., Тимоти К. Могл и Лоис Рид. Иллюстрированная анатомия беспозвоночных: лабораторное руководство. New York: Oxford University Press, 1989.
Animal Sciences Sheen, Judy P.
Первые свидетельства присутствия хитина в скелетах морских губок.Часть II. Стеклянные губки (Hexactinellida: Porifera)
Губки (Porifera) в настоящее время привлекают повышенное внимание ученых из-за их вторичных метаболитов и специфических структур скелета. В отличие от демоспонжей, скелеты которых сформированы из биополимерного спонгина, стеклянные губки (гексактинеллиды) обладают кремнеземно-органическими композитами в качестве основного природного материала для их скелетных волокон. Хитин имеет кристаллическую структуру и представляет собой сеть организованных волокон. Эта структура придает жесткость и устойчивость организмам, которые ее содержат, включая одноклеточные (дрожжи, амебы, диатомовые водоросли) и многоклеточные (высшие грибы, членистоногие, нематоды, моллюски) организмы. В отличие от различных морских беспозвоночных, экзоскелеты которых построены из хитина, этот полисахарид ранее не обнаруживался в качестве эндогенного биополимера в стеклянных губках (Hexactinellida). Мы предположили, что стеклянные губки, которые считаются самой основной ветвью многоклеточных животных, должны содержать хитин.Здесь мы представляем подробное исследование структурных и физико-химических свойств фрагментов скелета стеклянной губки Farrea occa. Мы показываем, что эти волокна имеют многослойную структуру с определенными вариациями состава хитин / кремнеземного композита. Мы применили эффективный подход к деминерализации скелетных образований стеклянной губки, основанный на процедуре травления растворами щелочей. Результаты однозначно показывают, что альфа-хитин является важным компонентом скелетных структур Hexactinellida.
Эта структура придает жесткость и устойчивость организмам, которые ее содержат, включая одноклеточные (дрожжи, амебы, диатомовые водоросли) и многоклеточные (высшие грибы, членистоногие, нематоды, моллюски) организмы. В отличие от различных морских беспозвоночных, экзоскелеты которых построены из хитина, этот полисахарид ранее не обнаруживался в качестве эндогенного биополимера в стеклянных губках (Hexactinellida). Мы предположили, что стеклянные губки, которые считаются самой основной ветвью многоклеточных животных, должны содержать хитин.Здесь мы представляем подробное исследование структурных и физико-химических свойств фрагментов скелета стеклянной губки Farrea occa. Мы показываем, что эти волокна имеют многослойную структуру с определенными вариациями состава хитин / кремнеземного композита. Мы применили эффективный подход к деминерализации скелетных образований стеклянной губки, основанный на процедуре травления растворами щелочей. Результаты однозначно показывают, что альфа-хитин является важным компонентом скелетных структур Hexactinellida. Это первое сообщение о сложном биоматериале кремнезем-хитин, обнаруженном в природе. С этой точки зрения, точка зрения, что силика-хитиновые каркасы могут быть ключевыми матрицами для формирования скелета также у предковых одноклеточных организмов, а не кремнеземно-белковых композитов, становится жизнеспособной альтернативной гипотезой.
Это первое сообщение о сложном биоматериале кремнезем-хитин, обнаруженном в природе. С этой точки зрения, точка зрения, что силика-хитиновые каркасы могут быть ключевыми матрицами для формирования скелета также у предковых одноклеточных организмов, а не кремнеземно-белковых композитов, становится жизнеспособной альтернативной гипотезой.
Обнаружение хитина в скелетах неверонгиидных демоспонгов Красного моря
Abstract
Морские демоспонги (Porifera: Demospongiae) признаны первыми многоклеточными животными, которые за миллионы лет эволюции разработали эффективные стратегии выживания, основанные на уникальных метаболических путях для производства как биологически активных вторичных метаболитов, так и жестких скелетов на основе биополимеров с трехмерной архитектурой.На сегодняшний день среди морских демоспонгов известны только представители отряда Verongiida, способные синтезировать биологически активные вещества, а также скелеты из структурного полисахарида хитина. Эта работа, насколько нам известно, впервые демонстрирует, что хитин является важным структурным компонентом скелетов неверонгиидных демоспонгов Acarnus wolffgangi и Echinoclathria gibbosa , собранных в Красном море. Белое окрашивание Calcofluor, FTIR и анализ комбинационного рассеяния, ESI-MS, SEM и флуоресцентная микроскопия, а также анализ расщепления хитиназы были применены, чтобы подтвердить, с убедительными доказательствами, обнаружение α-хитина в скелете обоих видов.Мы полагаем, что обнаружение хитина у этих представителей отряда Poecilosclerida является многообещающим шагом в оценке этих губок как новых возобновляемых источников как биологически активных метаболитов, так и хитина, которые имеют перспективное применение в фармакологии и биомедицине.
Образец цитирования: Ehrlich H, Shaala LA, Youssef DTA, ółtowska-Aksamitowska S, Tsurkan M, Galli R, et al. (2018) Обнаружение хитина в скелетах неверонгиидных демоспонгов Красного моря.PLoS ONE 13 (5):
e0195803. https://doi.org/10.1371/journal.pone.0195803
https://doi.org/10.1371/journal.pone.0195803
Редактор: Bernd Schierwater, Tierarztliche Hochschule Hannover, GERMANY
Поступила: 18 января 2018 г .; Принята к печати: 29 марта 2018 г .; Опубликован: 15 мая 2018 г.
Авторские права: © 2018 Ehrlich et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и его файлах с вспомогательной информацией.
Финансирование: Эта работа была частично поддержана Немецким исследовательским фондом (DFG), проектом HE 394 / 3-2 и исследовательским грантом PUT No. 03/32 / DSPB / 0806. M.W. благодарит за финансовую поддержку Фонд польской науки — START 097. 2017 и S.Z.A. за поддержку со стороны Deutscher Akademischer Austauschdienst (DAAD), а также программ Erasmus Plus. Исследования В.Н.И. поддержан Российским фондом фундаментальных исследований (грант № 15-29-02601). Анализ литературы и таксономических данных поддержан Российским научным фондом (грант № 14-50-00029).
2017 и S.Z.A. за поддержку со стороны Deutscher Akademischer Austauschdienst (DAAD), а также программ Erasmus Plus. Исследования В.Н.И. поддержан Российским фондом фундаментальных исследований (грант № 15-29-02601). Анализ литературы и таксономических данных поддержан Российским научным фондом (грант № 14-50-00029).
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Структурный аминополисахарид хитин считается основным компонентом как неминерализованных, так и минерализованных скелетных образований клеточных стенок различных грибов [1–3], диатомовых водорослей [4], губок [5–9], кораллов. [10], кольчатые червяки [11], моллюски [12,13] и членистоногие (см. Обзор [14]).Этот древний биополимер обычно сшит из-за сложной связи с пигментами, липидами, другими полисахаридами, пептидами и белками. Как универсальный шаблон в биоминерализации, хитин играет важную роль в образовании биоминералов на основе кальция (у моллюсков) и кремнезема (у диатомовых водорослей и стеклянных губок) [15]. Взаимодействие между различными органическими и неорганическими молекулами, перечисленными выше, и хитином часто является ключевым способом придания жесткости широкому разнообразию скелетных конструкций у беспозвоночных.Механическая жесткость скелетов остается решающим фактором для выживания губок как сидячих и фильтрующих организмов. Хитин играет важную роль в ригидизации некоторых губок как в неминерализованном, так и в минерализованном состояниях, о которых недавно сообщалось у представителей морских (см. Обзор [16–19]) и пресноводных [20,21] губок. У некоторых демоспонгов хитин был подтвержден как матрица для образования биоминерализованных структур в виде композитов арагонит-кремнезем-хитин [22]. Скелетные структуры на основе кремнезема и хитина были идентифицированы в стеклянных губках [5,23].Интересно, что изоляция основанных на хитине структур никогда не описывалась у известковых губок (класс Calcarea), хотя гены хитинсинтазы уже были обнаружены у двух видов [24] (Рис. 1). Кроме того, в литературе нет сообщений о наличии хитина в скелетах губок, принадлежащих к классу Homoscleromorpha.
Взаимодействие между различными органическими и неорганическими молекулами, перечисленными выше, и хитином часто является ключевым способом придания жесткости широкому разнообразию скелетных конструкций у беспозвоночных.Механическая жесткость скелетов остается решающим фактором для выживания губок как сидячих и фильтрующих организмов. Хитин играет важную роль в ригидизации некоторых губок как в неминерализованном, так и в минерализованном состояниях, о которых недавно сообщалось у представителей морских (см. Обзор [16–19]) и пресноводных [20,21] губок. У некоторых демоспонгов хитин был подтвержден как матрица для образования биоминерализованных структур в виде композитов арагонит-кремнезем-хитин [22]. Скелетные структуры на основе кремнезема и хитина были идентифицированы в стеклянных губках [5,23].Интересно, что изоляция основанных на хитине структур никогда не описывалась у известковых губок (класс Calcarea), хотя гены хитинсинтазы уже были обнаружены у двух видов [24] (Рис. 1). Кроме того, в литературе нет сообщений о наличии хитина в скелетах губок, принадлежащих к классу Homoscleromorpha.
Чистый хитин, который традиционно в больших количествах добывался из грибов и ракообразных, получил особое внимание в современной промышленности [25].Возможность применения хитина в качестве адсорбента [26] и биоматериала для биомедицинских целей [27] хорошо известна. Новую информацию о прикладном потенциале хитина можно найти в многочисленных обзорах, в том числе в нескольких сообщениях [28–30]. Здесь следует отметить, что промышленно производимый хитин можно выделить в основном в виде порошков и хлопьев. Интересно, что изначально губки производят трехмерные хитиновые каркасы, которые являются волокнистыми и макропористыми из-за их функциональной роли в скелетах этих фильтрующих беспозвоночных.Эта особенность наблюдалась также у ископаемых демоспонгов кембрия, включая Vauxia gracilenta [31]. Более того, хитиновый скелет происхождения демоспонгов напоминает по стилю и форме исходные губки [7]. Нанофибриллярная организация вместе с уникальными механическими и термическими свойствами хитиновых скелетных каркасов является ключом к их успешному применению в тканевой инженерии [9,32,33] и современной биомиметике [34–39].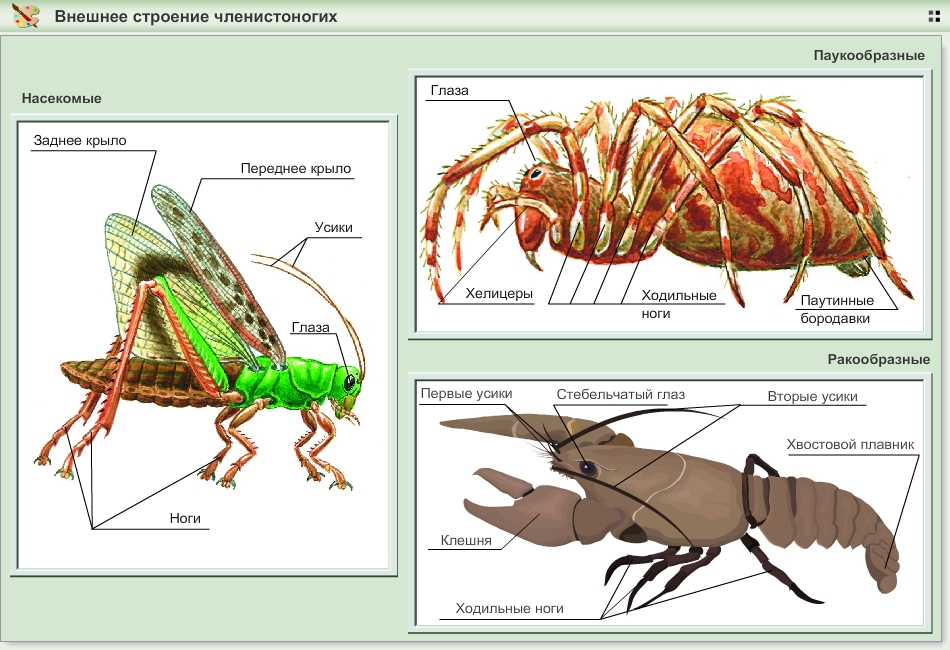 Однако в настоящее время в основе этого прогресса лежит исключительно хитин, выделенный из различных представителей только одного отряда морских демоспонгов — отряда Verongiida.Логично возникла идея предложить использование этого признака для систематизации всех губок, относящихся к отряду веронгиид. Однако наши недавние открытия хитина у пресноводных демоспонгов [20,21] неверонгиидного происхождения стимулировали мониторинг хитина также и у других родов демоспонгов, особенно у морских видов, которые возникли до пресноводных губок.
Однако в настоящее время в основе этого прогресса лежит исключительно хитин, выделенный из различных представителей только одного отряда морских демоспонгов — отряда Verongiida.Логично возникла идея предложить использование этого признака для систематизации всех губок, относящихся к отряду веронгиид. Однако наши недавние открытия хитина у пресноводных демоспонгов [20,21] неверонгиидного происхождения стимулировали мониторинг хитина также и у других родов демоспонгов, особенно у морских видов, которые возникли до пресноводных губок.
Следовательно, два года назад мы начали интенсивный мониторинг различных морских демоспонгов, не относящихся к веронгиидам, с целью найти, очистить, охарактеризовать и идентифицировать хитин из разных отрядов морских демоспонгов.В частности, мы воспользовались всемирным распространением губок отряда Poecilosclerida, который включает четыре подотряда и 25 семейств. Этот отряд признан самым крупным и самым разнообразным среди отрядов Demospongiae [40], виды которого встречаются во всех океанах, от мелководных местообитаний до глубоких морей.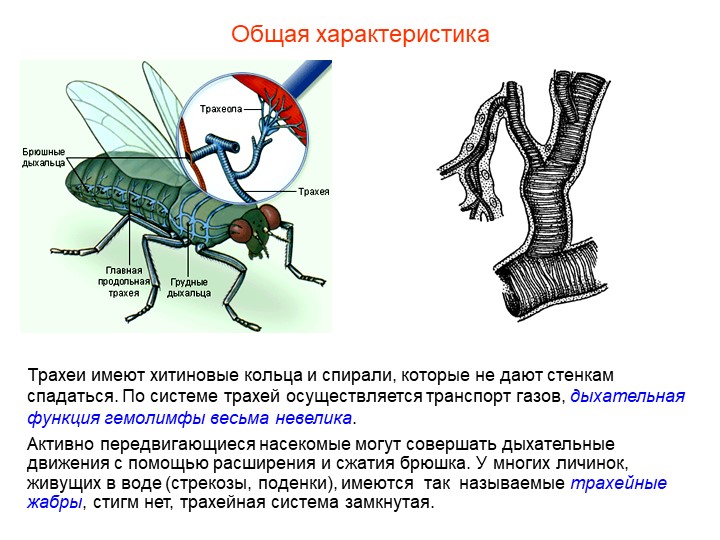
Предварительные исследования по идентификации хитина у 60 различных демоспонгов, недавно собранных в Красном море, показали, что такие представители Poecilosclerida, как Acarnus woffgangi и Echinoclathria gibbosa (рис. 2), должны содержать хитин в своих скелетах из-за их характерной нерастворимости в 2.5 М раствор NaOH.
Рис. 2.
Образцы из A . wolffgangi (а) и E . gibbosa (c) в естественной среде обитания. Промытые деионизированной водой лиофилизированные скелеты A . wolffgangi (б) и E . gibbosa (d), которые использовались для выделения хитина в этом исследовании.
https://doi.org/10.1371/journal.pone.0195803.g002
Представители рода Acarnus (Gray, 1867) (Porifera: Poecilosclerida) принадлежат к семейству Acarnidae (Dandy, 1922) с 26 репрезентативными видами. [41–45]. Acarnus wolfgangii был впервые описан Конрадом Келлером в 1889 году [46] как губка с жестким скелетом на основе волокон, которая демонстрирует сетевую архитектуру и богата губкой. Диаметр скелетных волокон составлял около 0,05 мм, а высушенная на воздухе губка была твердой, как камень [46].
Диаметр скелетных волокон составлял около 0,05 мм, а высушенная на воздухе губка была твердой, как камень [46].
Echinoclathria (Carter, 1885) — род демоспонгов, принадлежащих к семейству Microcionidae (Carter, 1885). Это семейство включает два подсемейства, Clathriinae и Ophlitaspongiinae, с девятью действительными родами и 524 действительными видами, живущими во всем мире на мелководье, с некоторыми записями из более глубоких морей [47].К сожалению, за исключением одного отчета об идентификации вторичных метаболитов из E . gibbosa [48] дополнительных отчетов по этому виду нет.
Здесь мы представляем первое исследование по выделению хитина из скелета A . wolffgangi и E . gibbosa демоспонги в соответствии с пошаговым подходом (рис. 3) и идентификация этого структурного аминополисахарида с использованием соответствующих биоаналитических методов в сравнительном модусе.
Материалы и методы
Биологические материалы, сбор и подготовка проб
Acarnus wolffgangi Келлер (Demospongiae, Poecilosclerida, Acarnidae). Губки были собраны аквалангом в июле 2017 года с восточной стороны острова Малый Гифтун (N 27 ° 11′12.9 ′ ′ E 33 ° 59′03.1 ′ ′) в Красном море Египта на глубине 28 м. Губка желтоватого цвета, образует массивную корку с клатратной поверхностью. Скелет образован сеткой скелетных волокон, сердцевиной которых являются толстые гладкие стержни и эхинация гладких кладотилотов.Диаметр волокна от 50 до 100 мкм. На поверхности расположены тангенциально разбросанные тилоты. Спикулы включают в себя: эктосомные тилоты с микрошипчатыми тайлами размером 215–255 x 2–3 мкм, гладкие и изогнутые хоаносомные стили размером 300–330 x 15–20 мкм и кладотилоты, существующие в двух различных формах и размерах, оба с гладкими округлыми тайлами на концах. на одном конце больший с тремя прочными крючками на противоположных концах с габаритными размерами 220–290 x 10 мкм, а меньший — с четырьмя крючками, гладкими или иногда со стержневым стержнем с габаритными размерами 90–125 x 3–6 мкм.Токсасы существуют в трех различных категориях, в том числе токсас I с формой бычьего рога размером 90–115 х 3–5 мкм, токсас II, который является тонким с пологой кривой размером 55–65 х 1 мкм, и оксеа-подобный токсас III, который едва достигает формы.
Губки были собраны аквалангом в июле 2017 года с восточной стороны острова Малый Гифтун (N 27 ° 11′12.9 ′ ′ E 33 ° 59′03.1 ′ ′) в Красном море Египта на глубине 28 м. Губка желтоватого цвета, образует массивную корку с клатратной поверхностью. Скелет образован сеткой скелетных волокон, сердцевиной которых являются толстые гладкие стержни и эхинация гладких кладотилотов.Диаметр волокна от 50 до 100 мкм. На поверхности расположены тангенциально разбросанные тилоты. Спикулы включают в себя: эктосомные тилоты с микрошипчатыми тайлами размером 215–255 x 2–3 мкм, гладкие и изогнутые хоаносомные стили размером 300–330 x 15–20 мкм и кладотилоты, существующие в двух различных формах и размерах, оба с гладкими округлыми тайлами на концах. на одном конце больший с тремя прочными крючками на противоположных концах с габаритными размерами 220–290 x 10 мкм, а меньший — с четырьмя крючками, гладкими или иногда со стержневым стержнем с габаритными размерами 90–125 x 3–6 мкм.Токсасы существуют в трех различных категориях, в том числе токсас I с формой бычьего рога размером 90–115 х 3–5 мкм, токсас II, который является тонким с пологой кривой размером 55–65 х 1 мкм, и оксеа-подобный токсас III, который едва достигает формы. изогнутые размером 500–620 х 3 мкм; пальчатые изохелы, 15–20 мкм. Нам удалось изучить типовой материал Acarnus wolffgangi , хранящийся в коллекциях Museum für Naturkunde Berlin, ZMB 1498 и 2922. Образец из Красного моря полностью соответствует этому типу по форме, скелету и спикулам.Ваучер Red Sea хранился в коллекции губок Naturalis под регистрационным номером ZMA Por. 16636 размером 10 х 5 на 1 см. Другой ваучер хранился в Коллекции беспозвоночных Красного моря на факультете фармакогнозии Университета Суэцкого канала под кодовым номером RS-23.
изогнутые размером 500–620 х 3 мкм; пальчатые изохелы, 15–20 мкм. Нам удалось изучить типовой материал Acarnus wolffgangi , хранящийся в коллекциях Museum für Naturkunde Berlin, ZMB 1498 и 2922. Образец из Красного моря полностью соответствует этому типу по форме, скелету и спикулам.Ваучер Red Sea хранился в коллекции губок Naturalis под регистрационным номером ZMA Por. 16636 размером 10 х 5 на 1 см. Другой ваучер хранился в Коллекции беспозвоночных Красного моря на факультете фармакогнозии Университета Суэцкого канала под кодовым номером RS-23.
Echinoclathria gibbosa (Келлер, 1889). Губка была собрана в июле 2017 г. в Хургаде (N 27 ° 17′0,53 ′ ′ E 46 ° 22′0,8 ′ ′) в Красном море Египта на глубине 30 м. Живая губка кроваво-красного цвета и образует массу длинных ветвей, которые нечасто анастомозируют.Длина ветвей в путевом образце до 20 см с различной толщиной за счет неправильного очертания ветвей от 1 до 2 см. Поверхность ямчатая и клатратная. В скелете прослеживалась сетка скелетных волокон с квадратными или круглыми ячейками, сердцевина которых составляла 1–5 спикул в поперечном сечении. Сетки имеют размер 150–300 мм, а соединительные волокна — 10–25 мм в диаметре соответственно. Каркас поверхности имел тангенциальное расположение рыхлых стилей. Спикулы относятся к хоаносомным типам и эктосомным субтилистилям, существуют в двух или трех различных размерах, но они не четко дифференцированы и имеют размер примерно 125–360 х 1–4 мм.Микроселеры представляют собой очень тонкие, неглубоко изогнутые токсасы и имеют длину до 20 мм. Образец сравнили со слайдом типа Берлинского музея и установили, что он полностью соответствует ему. Ваучер зарегистрирован в коллекциях Нидерландского центра натурального биоразнообразия под номером ZMA Por. 19793. Другой ваучер хранился в Коллекции беспозвоночных Красного моря на кафедре фармакогнозии Университета Суэцкого канала под кодовым номером. РС-46.
Сетки имеют размер 150–300 мм, а соединительные волокна — 10–25 мм в диаметре соответственно. Каркас поверхности имел тангенциальное расположение рыхлых стилей. Спикулы относятся к хоаносомным типам и эктосомным субтилистилям, существуют в двух или трех различных размерах, но они не четко дифференцированы и имеют размер примерно 125–360 х 1–4 мм.Микроселеры представляют собой очень тонкие, неглубоко изогнутые токсасы и имеют длину до 20 мм. Образец сравнили со слайдом типа Берлинского музея и установили, что он полностью соответствует ему. Ваучер зарегистрирован в коллекциях Нидерландского центра натурального биоразнообразия под номером ZMA Por. 19793. Другой ваучер хранился в Коллекции беспозвоночных Красного моря на кафедре фармакогнозии Университета Суэцкого канала под кодовым номером. РС-46.
Выделение хитинового скелета из
A . wolffgangi и E . гиббоса Выделение хитиновых скелетов из A . wolffgangi и E .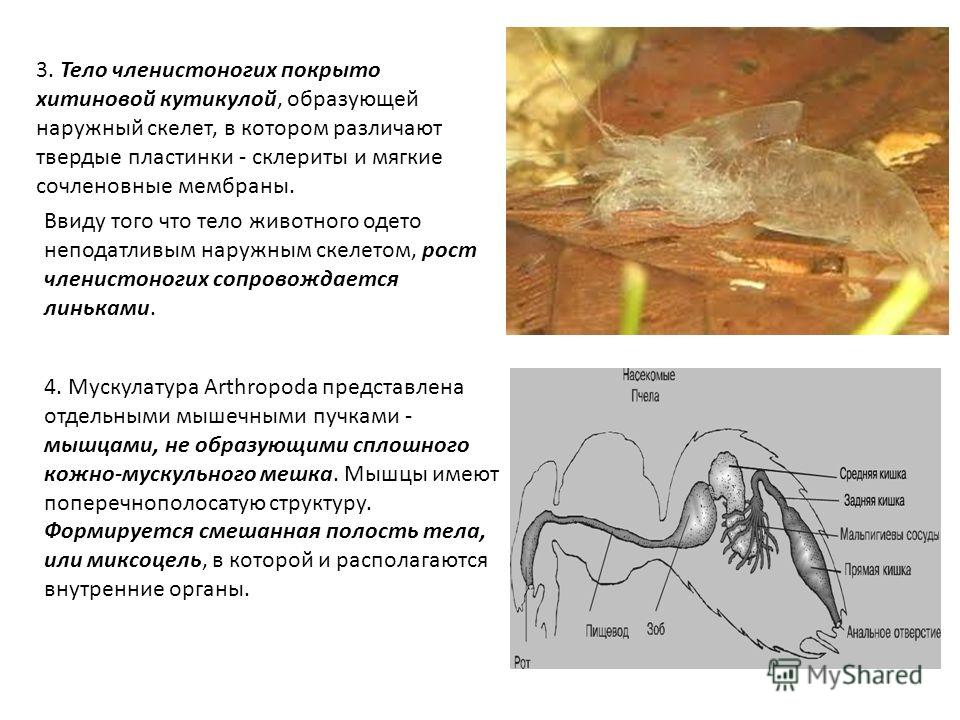 gibbosa были выполнены, как сообщалось ранее [17–20,49]. Протокол состоит из четырех этапов (рис. 3): во-первых, скелеты губки были помещены отдельно в деионизированную воду при комнатной температуре на 1 час, чтобы удалить возможные водорастворимые частицы осадка и соли. Затем образцы обрабатывали 20% -ной уксусной кислотой при комнатной температуре в течение 12 ч для удаления остатков карбонатных остатков (микрофрагменты раковин моллюсков и панцирей ракообразных) со скелета A . wolffgangi и E . gibbosa . После этого образцы несколько раз промывали деионизированной водой до достижения pH 6,5 с последующей обработкой 2,5 M NaOH при 37 ° C в течение 72 часов для удаления пигментов и белков. Спикулы кремнезема наблюдались в образцах после 72 ч обработки щелочью, поэтому требовалось тщательное обескремнивание. Следовательно, после обработки щелочью образцы были тщательно промыты деионизированной водой и помещены в пластиковый сосуд, содержащий соответствующее количество 2% раствора фтористоводородной кислоты (HF).
gibbosa были выполнены, как сообщалось ранее [17–20,49]. Протокол состоит из четырех этапов (рис. 3): во-первых, скелеты губки были помещены отдельно в деионизированную воду при комнатной температуре на 1 час, чтобы удалить возможные водорастворимые частицы осадка и соли. Затем образцы обрабатывали 20% -ной уксусной кислотой при комнатной температуре в течение 12 ч для удаления остатков карбонатных остатков (микрофрагменты раковин моллюсков и панцирей ракообразных) со скелета A . wolffgangi и E . gibbosa . После этого образцы несколько раз промывали деионизированной водой до достижения pH 6,5 с последующей обработкой 2,5 M NaOH при 37 ° C в течение 72 часов для удаления пигментов и белков. Спикулы кремнезема наблюдались в образцах после 72 ч обработки щелочью, поэтому требовалось тщательное обескремнивание. Следовательно, после обработки щелочью образцы были тщательно промыты деионизированной водой и помещены в пластиковый сосуд, содержащий соответствующее количество 2% раствора фтористоводородной кислоты (HF). Сосуд был накрыт, чтобы предотвратить испарение HF. Обескремнивание проводили при комнатной температуре в течение 12 ч. Влияние щелочной и сильной кислотной обработки на структуру скелетов обоих демоспонгов исследовали с помощью оптической и флуоресцентной микроскопии (Keyence BZ-8000). Наконец, изолированные материалы несколько раз промывали деионизированной водой до pH 6,5. Волокнистые каркасы помещали в большие стеклянные флаконы GLS 80 Duran объемом 250 мл, содержащие деионизированную воду, и хранили при 4 ° C для дальнейших анализов.
Сосуд был накрыт, чтобы предотвратить испарение HF. Обескремнивание проводили при комнатной температуре в течение 12 ч. Влияние щелочной и сильной кислотной обработки на структуру скелетов обоих демоспонгов исследовали с помощью оптической и флуоресцентной микроскопии (Keyence BZ-8000). Наконец, изолированные материалы несколько раз промывали деионизированной водой до pH 6,5. Волокнистые каркасы помещали в большие стеклянные флаконы GLS 80 Duran объемом 250 мл, содержащие деионизированную воду, и хранили при 4 ° C для дальнейших анализов.
Световая и флуоресцентная микроскопия, визуализация
Отобранные образцы губки и изолированные хитиновые каркасы из A . wolffgangi и E . gibbosa наблюдались с помощью микроскопа BZ-9000 (Keyence) в белом свете, а также в режимах флуоресценции.
Тест Calcofluor White (CFW)
Для оценки локализации хитина в деминерализованном скелете A . wolffgangi и E . gibbosa , Calcofluor White (Fluorescent Brightener M2R, Sigma) использовали в качестве флуоресцентного красителя для окрашивания полисахаридов, связанных β- (1 → 3) и β- (1 → 4) [31,49–52]. После связывания с полисахаридами, содержащими β-гликозидную связь, такими как хитин, этот флорохром излучает ярко-синий свет при УФ-возбуждении даже при очень коротком времени воздействия света (до 1/1000 с). Избранные фрагменты деминерализованных скелетов A . Вольфганги и E . gibbosa были помещены в 0.Добавляли 1 М раствор КОН-глицерин-вода и несколько капель 0,1% растворов CFW, и смесь помещали в темноту на 60 мин. После этого окрашенные скелеты промывали 5 раз деионизированной водой и сушили при комнатной температуре с последующим исследованием каркасов под флуоресцентной микроскопией.
gibbosa , Calcofluor White (Fluorescent Brightener M2R, Sigma) использовали в качестве флуоресцентного красителя для окрашивания полисахаридов, связанных β- (1 → 3) и β- (1 → 4) [31,49–52]. После связывания с полисахаридами, содержащими β-гликозидную связь, такими как хитин, этот флорохром излучает ярко-синий свет при УФ-возбуждении даже при очень коротком времени воздействия света (до 1/1000 с). Избранные фрагменты деминерализованных скелетов A . Вольфганги и E . gibbosa были помещены в 0.Добавляли 1 М раствор КОН-глицерин-вода и несколько капель 0,1% растворов CFW, и смесь помещали в темноту на 60 мин. После этого окрашенные скелеты промывали 5 раз деионизированной водой и сушили при комнатной температуре с последующим исследованием каркасов под флуоресцентной микроскопией.
Сканирующая электронная микроскопия
Морфология поверхности и микроструктура изолированных хитиновых матриксов, а также необработанных образцов обеих губок были исследованы на основе изображений SEM с использованием сканирующего электронного микроскопа ESEM XL 30 Philips. Перед анализом образцы покрывали слоем углерода в течение 1 мин с использованием устройства для нанесения покрытий распылением Edwards S150B.
Перед анализом образцы покрывали слоем углерода в течение 1 мин с использованием устройства для нанесения покрытий распылением Edwards S150B.
Рамановская спектроскопия
Рамановскую спектроскопиювыполняли с использованием рамановского спектрометра (RamanRxn1 ™, Kaiser Optical Systems Inc., Анн-Арбор, США), соединенного со световым микроскопом (DM2500 P, Leica Microsystems GmbH, Вецлар, Германия). Подробнее см. [17].
Образцы демонстрировали интенсивную флуоресценцию, что делало невозможным получение высококачественного рамановского спектра.Поэтому образцы отбеливали в 10% -ном растворе перекиси водорода в течение 3 ч. После трех стадий промывки в дистиллированной воде образцы сушили при комнатной температуре. Затем были получены спектры комбинационного рассеяния с использованием времени накопления 3 с и суммирования 50 накоплений. Наконец, в Matlab была применена коррекция базовой линии, чтобы удалить остаточный сигнал флуоресценции из спектров и отобразить комбинационное рассеяние.
Инфракрасная спектроскопия с преобразованием Фурье
ИК-Фурье спектроскопия— мощный инструмент для структурного анализа полисахаридов.Этот метод чувствителен к положению и аномерной конфигурации гликозидных связей в глюканах. Стоит отметить, что хитин, в зависимости от его происхождения и функции ткани, встречается в основном в трех основных изоформах: α-хитин (грибы, губки, членистоногие), β-хитин (диатомеи, моллюски) и редко как γ-хитин ( коконы некоторых насекомых) [14,16]. Эта колебательная спектроскопия также чувствительна к геометрии молекул, системе внутримолекулярных и межмолекулярных взаимодействий. Спектры пропускания хитиновых каркасов были получены с использованием спектрометра Nicolet 210c FTIR с использованием принадлежности ATR.Исследование проводилось в диапазоне волновых чисел 4000–400 см –1 (при разрешении 0,5 см –1 ). Стандартный α-хитин был приобретен в INTIB GmbH, Фрайберг, Германия.
Тест на переваривание хитиназы
Для проведения теста на переваривание хитиназы фермент Yatalase ® из культуральных супернатантов Corynebacterium sp.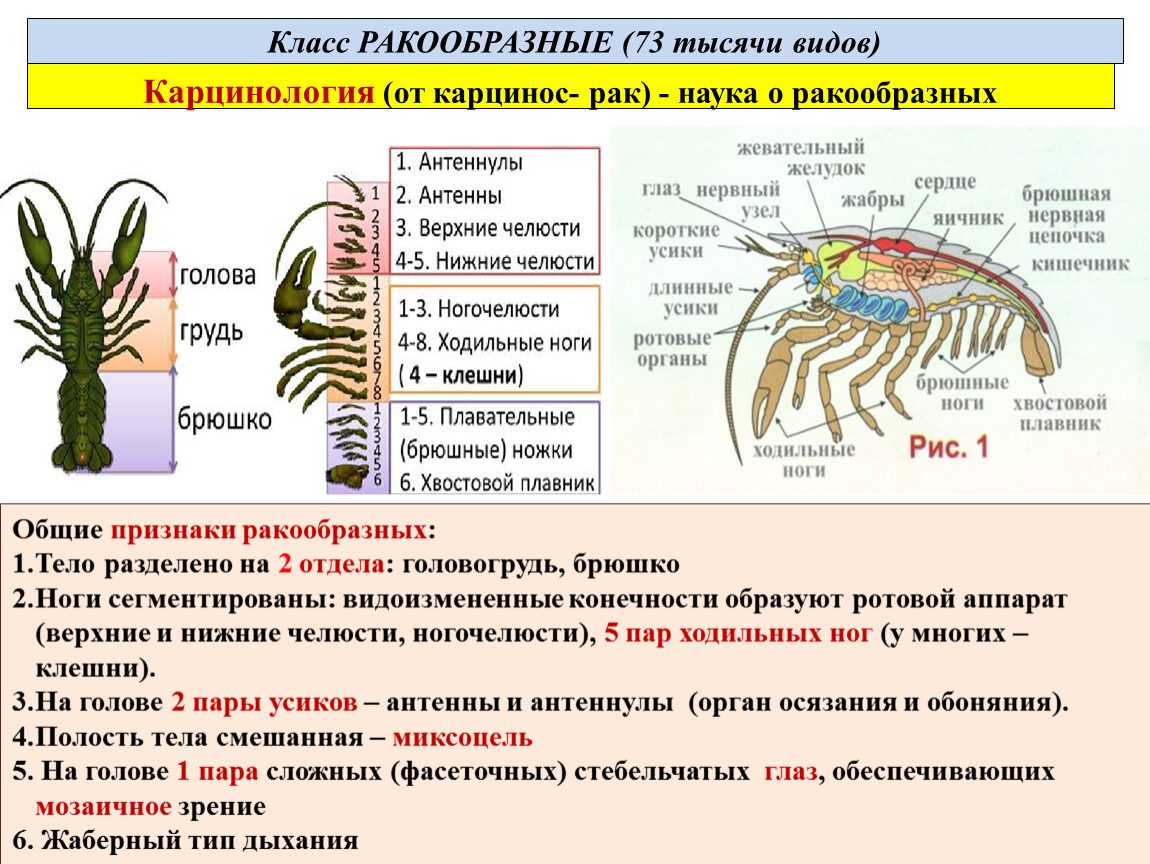 Использовали OZ-21 (Cosmo Bio, Япония). Одна единица этого фермента высвобождает 1 мкмоль N -ацетил-D-глюкозамина из 0.5% раствор хитина и 1 мкмоль п-нитрофенола из раствора п-нитрофенил- N -ацетил-β-D-глюкозаминида за 1 мин при 37 ° C и pH 6,0. Полностью деминерализованные волокна марки А . wolffgangi и E . gibbosa инкубировали в растворе фермента, содержащем 10 мг яталазы, растворенной в 1 мл цитрат-фосфатного буфера при pH 5,0, в течение 2 часов. Эффективность ферментативного переваривания контролировали с помощью оптической микроскопии (Keyence).
Использовали OZ-21 (Cosmo Bio, Япония). Одна единица этого фермента высвобождает 1 мкмоль N -ацетил-D-глюкозамина из 0.5% раствор хитина и 1 мкмоль п-нитрофенола из раствора п-нитрофенил- N -ацетил-β-D-глюкозаминида за 1 мин при 37 ° C и pH 6,0. Полностью деминерализованные волокна марки А . wolffgangi и E . gibbosa инкубировали в растворе фермента, содержащем 10 мг яталазы, растворенной в 1 мл цитрат-фосфатного буфера при pH 5,0, в течение 2 часов. Эффективность ферментативного переваривания контролировали с помощью оптической микроскопии (Keyence).
Оценка содержания
N -ацетил-D-глюкозамина (NAG) (масс-спектрометрия с ионизацией электрораспылением, ESI-MS)Анализ Моргана-Элсона использовался для оценки содержания N -ацетил-D-глюкозамина, высвобождаемого после обработки хитиназой, как сообщалось ранее [17,20].
Подготовка образцов для ESI-MS: деминерализованные органические каркасы из A . wolffgangi и E . gibbosa гидролизовали в 6 M HCl в течение 24 часов при 50 o C. После гидролиза образцы фильтровали через фильтр 0,4 мкм и сушили вымораживанием для удаления избытка HCl. Высушенные образцы растворяли в деионизированной воде для анализа. Все измерения ESI-MS проводили на масс-спектрометре Waters TQ Detector ACQUITYuplc (Waters, США), оборудованном насосом ACQUITYuplc (Waters, США) и BEHC18 1.Колонка UPLC 7 мкм, 2,1 × 50 мм. Азот использовали в качестве газа для распыления и десольватации. Графики были созданы с помощью Origin 8.5 для ПК.
wolffgangi и E . gibbosa гидролизовали в 6 M HCl в течение 24 часов при 50 o C. После гидролиза образцы фильтровали через фильтр 0,4 мкм и сушили вымораживанием для удаления избытка HCl. Высушенные образцы растворяли в деионизированной воде для анализа. Все измерения ESI-MS проводили на масс-спектрометре Waters TQ Detector ACQUITYuplc (Waters, США), оборудованном насосом ACQUITYuplc (Waters, США) и BEHC18 1.Колонка UPLC 7 мкм, 2,1 × 50 мм. Азот использовали в качестве газа для распыления и десольватации. Графики были созданы с помощью Origin 8.5 для ПК.
Результаты
Рис. 4 ясно показывает, что применяемые процедуры химической обработки (подробно представленные на Рис. 3) приводят к очистке фиброзных каркасов с хорошо организованной анастомозирующей морфологией от каркасов A . wolffgangi и E . gibbosa соответственно. Изображения, представленные на рис. 3A и 3D, показывают, что общая форма и морфология извлеченных трехмерных каркасов очень похожи на стили и формы исследованных губок (рис. 2B и 2D).Это означает, что процедура изоляции не приводит к разрушению иногда очень хрупких структур демоспубка, даже после удаления на основе HF скелета, поддерживающего спикулы.
2B и 2D).Это означает, что процедура изоляции не приводит к разрушению иногда очень хрупких структур демоспубка, даже после удаления на основе HF скелета, поддерживающего спикулы.
Рис. 4.
Бесцветный трехмерный каркас без спикул, полученный из A . wolffgangii (а) и E . gibbosa (d) в соответствии с процедурой выделения, представленной на рис. 3. Микроструктурные особенности выбранных скелетных волокон A . wolffgangii (отмечены стрелками) (b) и E . gibbosa (e) до и после обработки HF (c и f, соответственно) хорошо видны на соответствующих изображениях световой микроскопии.
https://doi.org/10.1371/journal.pone.0195803.g004
СЭМ микрофотографии скелетных волокон A . wolffgangi и E . gibbosa до любого лечения подтвердили сложный характер их скелетов, где хорошо видны различные формы неорганических (спикулы), а также органических (волокна) структур. Фиг. 5B и 5E) показывают, что стекловидные спикулы все еще присутствовали в скелетных каркасах, выделенных из обеих губок после обработки NaOH и уксусной кислотой. Только обработка на основе HF приводит к растворению спикул и очистке микроволокон без кремнезема (рис. 5C и 5F).
Фиг. 5B и 5E) показывают, что стекловидные спикулы все еще присутствовали в скелетных каркасах, выделенных из обеих губок после обработки NaOH и уксусной кислотой. Только обработка на основе HF приводит к растворению спикул и очистке микроволокон без кремнезема (рис. 5C и 5F).
Рис. 5.
SEM-изображение очищенного A . wolffgani (а) и E . gibbosa (d) фрагменты скелета до (b и e, соответственно) и после процедуры деминерализации (c и f, соответственно).Хорошо заметные спикулы отмечены стрелками.
https://doi.org/10.1371/journal.pone.0195803.g005
Белое окрашивание Calcofluor (CFW) [50] было первым шагом для предварительной идентификации хитина в изолированных и деминерализованных образцах скелета. Флуоресцентный микроскопический анализ каркасов, выделенных из A . wolffgangi и E . gibbosa после окрашивания CFW проявляла очень сильную флуоресценцию даже при времени воздействия света всего 1/4800 с (рис. 6B и 6D).Соответствующие результаты ранее были получены для хитина, выделенного из морских [7,17,18] и пресноводных губок [20], а также из хитинсодержащих окаменелых остатков [31,51].
6B и 6D).Соответствующие результаты ранее были получены для хитина, выделенного из морских [7,17,18] и пресноводных губок [20], а также из хитинсодержащих окаменелых остатков [31,51].
Чтобы подтвердить присутствие хитина в изолированных каркасах (рис. 4A и 4D), были применены более чувствительные аналитические методы. Спектры FTIR, полученные для волокнистых каркасов, полученных из A . wolffgangi и E . gibbosa , а также стандарт α-хитина представлены на рис.Область амидного фрагмента между 1700 и 1500 см -1 дает разные сигнатуры для полиморфов хитина. В этой области в спектрах исследованных нами образцов наблюдалась сильная полоса адсорбции, связанная с валентными колебаниями группы C = O, характерная для амидной полосы I. Амидная полоса I имела двойной пик при 1659 см -1 и 1626 см. -1 для A . wolffgangi ; 1659 см -1 и 1626 см -1 для E . gibbosa , в результате межмолекулярных C = O ⋯ H-N и внутримолекулярных водородных связей C = O ⋯ HO-CH 2 , что характерно для полиморфа α-хитина [53,54]. Дополнительная особенность, характерная интенсивная полоса при 950 см -1 , относящаяся к γCHx, наблюдалась в стандарте α-хитина, а также в образцах очищенного хитина губок. Более того, индикативная полоса α-хитина, приписываемая β-гликозидной связи, наблюдается при ν max 897 см -1 в FTIR-спектрах каркасов, выделенных из A . wolffgangii и E . gibbosa (рис 7). Детальный анализ полос показывает, что полученные спектры обоих изолированных хитиновых каркасов очень похожи на спектры стандарта α-хитина.
Дополнительная особенность, характерная интенсивная полоса при 950 см -1 , относящаяся к γCHx, наблюдалась в стандарте α-хитина, а также в образцах очищенного хитина губок. Более того, индикативная полоса α-хитина, приписываемая β-гликозидной связи, наблюдается при ν max 897 см -1 в FTIR-спектрах каркасов, выделенных из A . wolffgangii и E . gibbosa (рис 7). Детальный анализ полос показывает, что полученные спектры обоих изолированных хитиновых каркасов очень похожи на спектры стандарта α-хитина.
Результаты исследований рамановской спектроскопией показали, что спектры A . wolffgangi и E . gibbosa очень сопоставимы со спектром, полученным для эталонного α-хитина (см. Фиг. 8). Для аналитических исследований изолированных каркасов до и после обработки HF использовалась рамановская спектроскопия.Следовательно, например, спектры комбинационного рассеяния хитинового каркаса, выделенного из A . Вольфганги и E . gibbosa до деминерализации демонстрируют интенсивные полосы биокремнезема на 443, 480, 599, 640, 805 см -1 . Полосы органических матриц видны в диапазонах ≈ 900–1800 см –1 и 2700–3000 см –1 . Эти полосы сопоставимы с полосами, указанными для стандарта α-хитина. О подобных наблюдениях сообщалось ранее для хитина демоспубкового происхождения [5–9,18,49].
Вольфганги и E . gibbosa до деминерализации демонстрируют интенсивные полосы биокремнезема на 443, 480, 599, 640, 805 см -1 . Полосы органических матриц видны в диапазонах ≈ 900–1800 см –1 и 2700–3000 см –1 . Эти полосы сопоставимы с полосами, указанными для стандарта α-хитина. О подобных наблюдениях сообщалось ранее для хитина демоспубкового происхождения [5–9,18,49].
Хитиназы обладают способностью расщеплять хитин непосредственно до низкомолекулярных олигомеров хитина, включая N -ацетилглюкозамин (GlcNAc). Следовательно, такая ферментативная обработка привела к потере целостности хитина и высвобождению остаточных микроволокон хитина, размер которых постоянно уменьшался. Активность хитиназы хорошо видна с помощью оптического микроскопа (рис. 9). Тест на переваривание хитиназой, который ранее использовался в исследованиях для обнаружения хитина в других губках [5–9,17,49,55], определенно подтвердил хитиновую природу деминерализованных каркасов, выделенных как из A .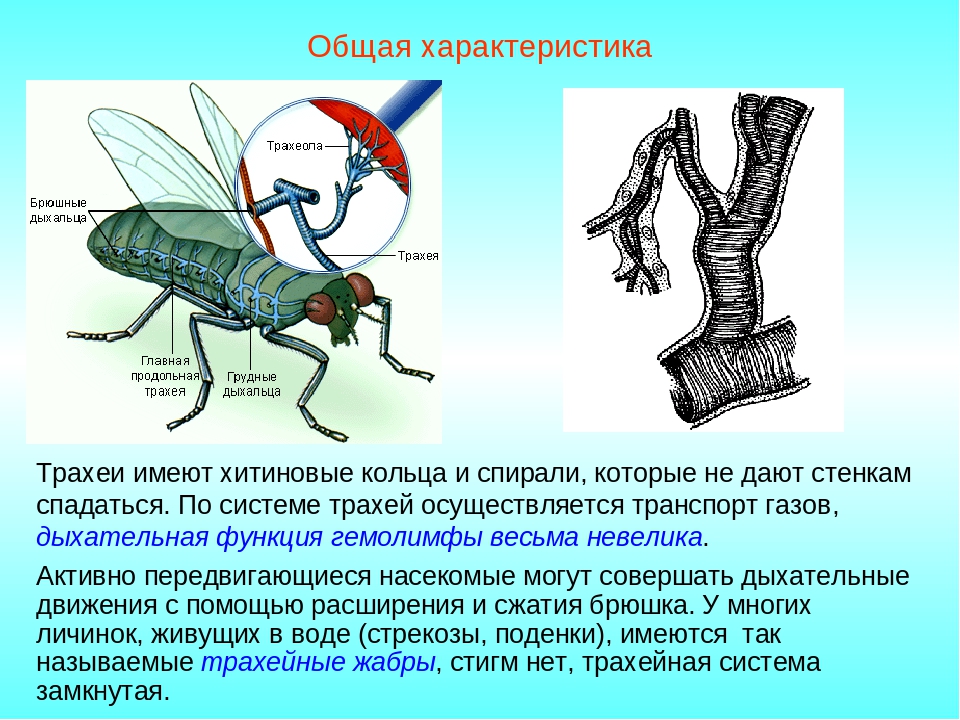 wolffgangi и E . gibbosa .
wolffgangi и E . gibbosa .
Рис. 9. Визуализация теста на переваривание хитиназы с использованием микроскопии в белом свете.
Расщепление хитиназой очищенного и полностью деминерализованного отобранного скелетного волокна, выделенного из A . wolffgangi и E . gibbosa до (а и в соответственно) и через 3 ч обработки хитиназой (б и г, соответственно).
https://doi.org/10.1371 / journal.pone.0195803.g009
Анализ Моргана-Элсона был подробно описан ранее [6,20] и использовался как наиболее точный метод для оценки GlcNAc, высвобождаемого после обработки хитиназой. Определение GlcNAc в каркасах на основе хитина A . Вольфганги и E . gibbosa показал 750 ± 1,5 мкг и 730 ± 1,5 мкг N -ацетилглюкозамин на мг хитиновых каркасов этих губок, соответственно. Эти результаты аналогичны результатам, полученным для хитина, выделенного из демоспубка Spongilla lacustris [20].
ESI-MS стандарта D-глюкозамина (GlcN) показал четыре основных пика при m / z = 162,08, 180,09, 202,07 и 381,15 (фиг.10). Ионный пик с m / z = 180,09 соответствует молекулярным ионам [M + H] + разновидностей с молекулярной массой 179,09, соответствующих GlcN (вычислено: 179,1). Пик иона при m / z = 162,08 соответствует ионному фрагменту [M-H 2 O + H] + после потери одной молекулы H 2 O из DGlcN (вычислено: 162,1). Наконец, ионный пик при m / z = 381.15 соответствует разновидности [2M + Na] + , которая представляет собой связанный с натрием нековалентный диммер GlcN. Аналогичный ионный пик для связанного с протонами ковалентного диммера GlcN наблюдался в спектрах при m / z 359,17 [M + H] + .
Основные пики в спектрах ESI-MS гидролизованных образцов A . wolffgangi и E . gibbosa , наблюдаемые при m / z = 162,08, 180,09, 202,07 и 381,15, сопоставимы с пиками GlcN (рис.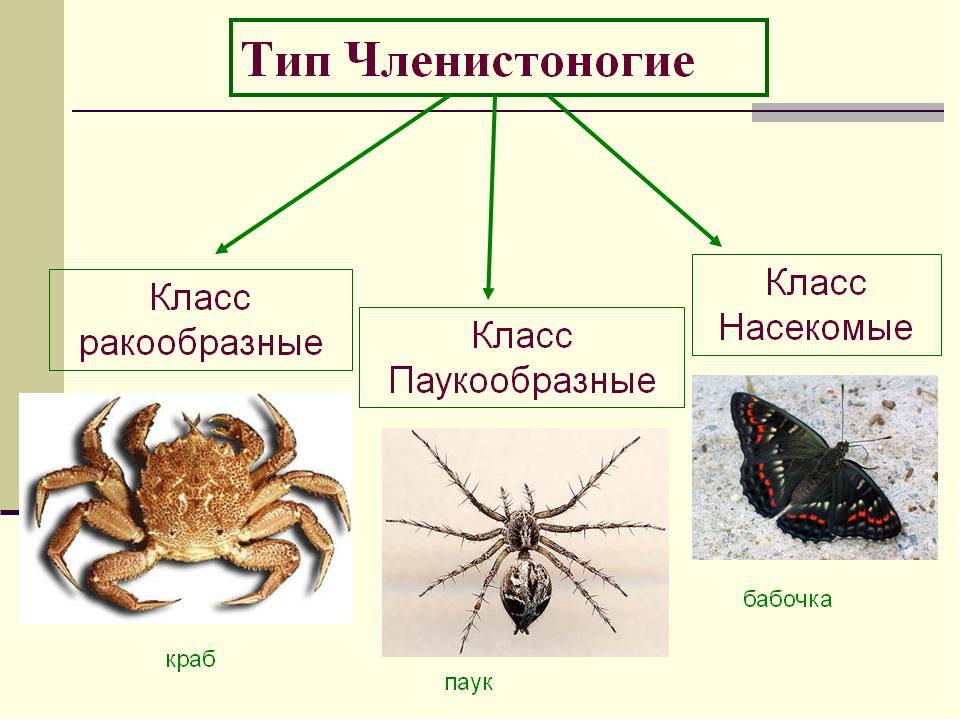 A в файле S1). Ионный пик связанного с натрием GlcN доминировал в спектрах этих губок, как и ожидалось для образцов морского происхождения из-за сильного присутствия соли [31].
A в файле S1). Ионный пик связанного с натрием GlcN доминировал в спектрах этих губок, как и ожидалось для образцов морского происхождения из-за сильного присутствия соли [31].
Обсуждение
Ранее представители рода Acarnus в основном исследовали как источник фармакологически активных соединений. Например, группа соединений под названием акарнидины была выделена экстракцией гомогенизированных тканей губки A . erithacus смесью толуол-метанол (1: 3) и распределением с помощью 1 М раствора нитрата натрия. Они обладают уникальным замещенным гомоспермидиновым скелетом с различными заместителями жирных кислот.Акарнидины проявляли антибактериальные и противогрибковые свойства и проявляли значительную противовирусную активность в отношении простого герпеса 1 типа [56]. Два циклических пероксидсодержащих метиловых эфира поликетида C22, метиловые эфиры пероксиакарновой кислоты A и B, были выделены из морской губки Красного моря Acarnus cf . bergquistae [57]. Метанольный экстракт этой губки проявлял цитотоксичность в отношении опухолевых клеток P-388, A-549 и HT-29 с IC 50 0,1 мкг / мл [58].Сообщалось о двух новых циклических пероксидах в органическом экстракте губки A . bicladotylota из Индии [59].
bergquistae [57]. Метанольный экстракт этой губки проявлял цитотоксичность в отношении опухолевых клеток P-388, A-549 и HT-29 с IC 50 0,1 мкг / мл [58].Сообщалось о двух новых циклических пероксидах в органическом экстракте губки A . bicladotylota из Индии [59].
Кроме того, губки из рода Echinoclathria признаны продуцентами биологически активных соединений. Азаспирацид-2 выделен из морской губки Echinoclathria sp. собраны в районе Амами-Осима в Японии. Он проявлял сильную цитотоксичность в отношении клеток P388 со значением IC 50 0,72 нг / мл и вызывал остановку S-фазы клеточного цикла [60].Демоверсия E . Субгиспида дала новый стероидный сульфат, эхинокластерин сульфат с экспериментально подтвержденной противогрибковой активностью против Mortierella ramannianus и цитотоксичностью в отношении клеток рака легких человека PC-9 [61]. Эхиноклатрины A-C, новый класс пиридиновых алкалоидов, имеющих 4-арил-2-метилпиридиновый фрагмент в качестве общего структурного элемента, были выделены из окинавской губки Echinoclathria sp [62]. Недавно была запатентована процедура выделения эхиноклатринов [63].Некоторые из эхиноклатринов проявляли слабую иммуносупрессивную активность в анализе реакции смешанных лимфоцитов. Исследования морского фармакологического потенциала демоспонгов Echinoclathria , обитающих в Красном море, начались совсем недавно. Исследование губки Красного моря E . gibbosa привело к выделению трех новых соединений, включая β-ситостерин-3-O- (3 Z ) -пентакосеноат, 5α-прегна-3β-ацетокси-12β, 16β-диол-20-он и эхиноклатриамид вместе тимин и урацил [48].β-Ситостерин-3-O- (3 Z ) -пентакосеноат проявил слабую активность в отношении линий клеток немелкоклеточного рака легкого (NSCLC) A549, глиобластомы U373 (GBM) и рака предстательной железы PC-3 [48]. Новый церамид (икозанамид) был выделен из губки Красного моря. Echinoclathria sp. [64]. Была оценена активность in vitro по ингибированию роста этого церамида против различных линий раковых клеток человека.
Недавно была запатентована процедура выделения эхиноклатринов [63].Некоторые из эхиноклатринов проявляли слабую иммуносупрессивную активность в анализе реакции смешанных лимфоцитов. Исследования морского фармакологического потенциала демоспонгов Echinoclathria , обитающих в Красном море, начались совсем недавно. Исследование губки Красного моря E . gibbosa привело к выделению трех новых соединений, включая β-ситостерин-3-O- (3 Z ) -пентакосеноат, 5α-прегна-3β-ацетокси-12β, 16β-диол-20-он и эхиноклатриамид вместе тимин и урацил [48].β-Ситостерин-3-O- (3 Z ) -пентакосеноат проявил слабую активность в отношении линий клеток немелкоклеточного рака легкого (NSCLC) A549, глиобластомы U373 (GBM) и рака предстательной железы PC-3 [48]. Новый церамид (икозанамид) был выделен из губки Красного моря. Echinoclathria sp. [64]. Была оценена активность in vitro по ингибированию роста этого церамида против различных линий раковых клеток человека.
Насколько нам известно, нет сообщений даже о попытках поиска хитина у этих видов демоспонгов.До сих пор протоколы выделения различных вторичных метаболитов из репрезентативных представителей родов Acarnus и Echinoclathria следовали традиционным подходам к экстракции на основе органических растворителей. Нет данных о методах выделения таких метаболитов, основанных на обработке щелочными растворами, а также о структурной стабильности этих биомакромолекул при щелочных уровнях pH. Хорошо известно, что, начиная с экспериментальной работы, выполненной фон Кёлликером в 1864 г. [65], основной скелетный белок демоспонгов-спонгин быстро растворяется в растворах щелочей [66,67].Эта особенность имеет решающее значение для экстракции и выделения хитина пориферана в очищенной форме из-за его исключительной устойчивости к обработке щелочью до концентрации 5% и температурам не выше 40 ° C, например, в случае NaOH [5,6 , 8,9,20,21,31,34]. Такая обработка также не показала видимых под электронным микроскопом изменений на поверхности кремнистых спикул исследуемых демогубок (см. Рис. 5). Более того, наши наблюдения убедительно подтверждают локализацию спикул в хитиновом (рис. 3 и 5) и не основанном на спонгине матриксе.Подобные результаты сообщались ранее в случае хитинового скелета пресноводного демоспуба S . lacustris (отряд Spongillida) [20]. Возможная роль пориферного хитина в качестве структурной опоры для продуцирующих спикулы клеток, а также в полном процессе спикулогенеза у демоспонгов до сих пор неизвестна.
Рис. 5). Более того, наши наблюдения убедительно подтверждают локализацию спикул в хитиновом (рис. 3 и 5) и не основанном на спонгине матриксе.Подобные результаты сообщались ранее в случае хитинового скелета пресноводного демоспуба S . lacustris (отряд Spongillida) [20]. Возможная роль пориферного хитина в качестве структурной опоры для продуцирующих спикулы клеток, а также в полном процессе спикулогенеза у демоспонгов до сих пор неизвестна.
Полное обескровливание спикул может быть достигнуто с помощью обработки на основе HF. Это исследование вместе с ранее опубликованными данными [7,18,19,20,21] показало, что хитин остается хорошо сохраненным даже после такой обработки.Однако логичный вопрос о возможном присутствии различных вторичных метаболитов с щелочными экстрактами или экстрактами на основе HF остается открытым. Напротив, эксперименты с производящими бромтирозин и хитин демоспонгами, представляющими отряд Verongiida, показали, что бромтирозины и каркасы на основе хитина могут быть выделены из скелетов губок с использованием процедуры ступенчатой экстракции, в основном основанной на использовании NaOH [6].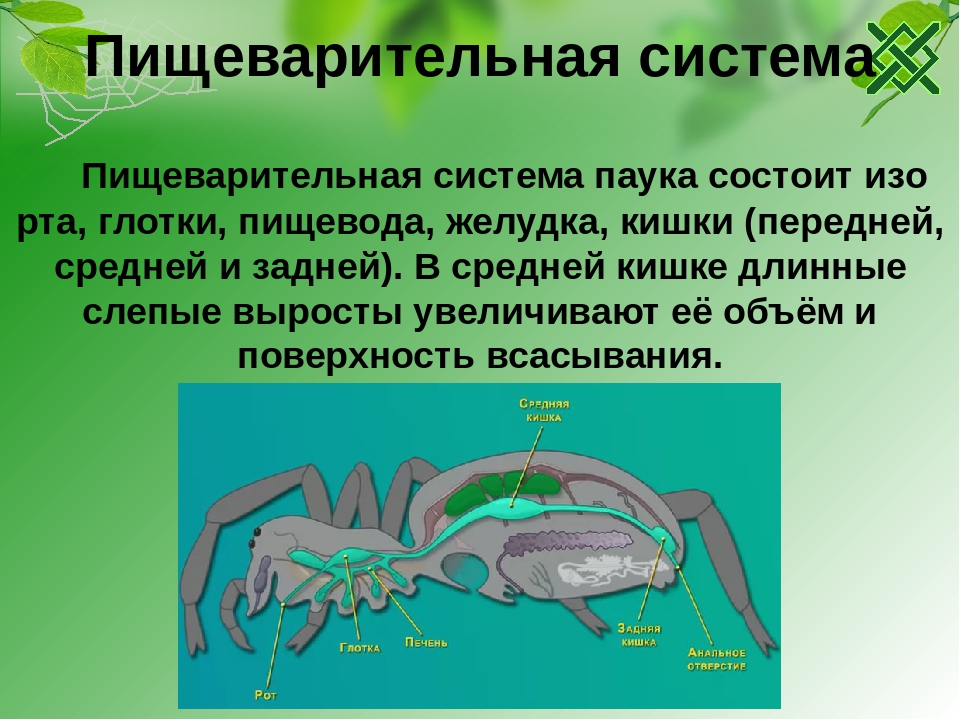 Недавно было сообщено о запатентованном методе выделения как бромтирозинов, так и хитиновых каркасов скелета из выбранных губок без разрушения скелетов в ступке [68].Здесь мы предлагаем схематический вид основных шагов, которые теперь могут быть применены для выделения вторичных метаболитов и хитина из губок отряда Poecilosclerida (рис. 11).
Недавно было сообщено о запатентованном методе выделения как бромтирозинов, так и хитиновых каркасов скелета из выбранных губок без разрушения скелетов в ступке [68].Здесь мы предлагаем схематический вид основных шагов, которые теперь могут быть применены для выделения вторичных метаболитов и хитина из губок отряда Poecilosclerida (рис. 11).
Нет сомнений в необходимости разработки новых, более эффективных технологий экстракции биологически активных соединений вместе с хитиновыми каркасами из губок родов Acarnus и Echinoclathria . Особенно те виды, которые могут быть адаптированы для выращивания в условиях морского земледелия, в этом случае будут обладать высоким потенциалом.
Мы предполагаем, что открытие хитина у других представителей отряда Poecilosclerida станет следующим шагом в оценке возможности принятия этих всемирно распространенных демоспонгов в качестве нового возобновляемого источника как хитина, так и биологически активных метаболитов, которые являются перспективными для биомедицины и морской фармакологии.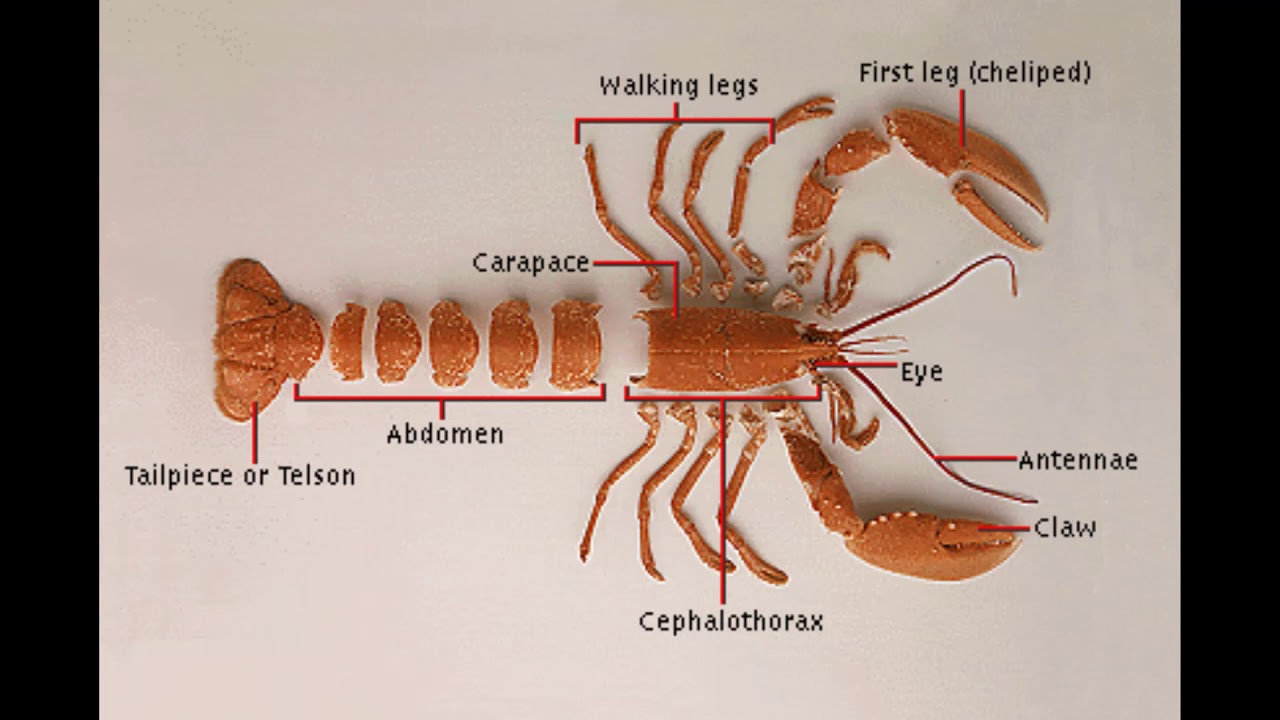 , соответственно.
, соответственно.
Выводы
Хитинпродуцирующие морские демоспонги являются очень перспективными беспозвоночными из-за их способности синтезировать широкий спектр вторичных метаболитов с противовирусной, антибиотической, антидиабетической, цитотоксической и противоопухолевой активностями, а также хитин.Здесь мы впервые показали, что хитин присутствует как структурный компонент в скелетах демоспонгов Красного моря Accarnus wolffgangi и Echinoclathria gibbosa . Вопрос о синтезе хитина у представителей родов Acarnus и Echinoclathria должен стать актуальным в результате наших открытий. Следовательно, эволюция, локализация и функции хитина у этих демоспонгов, а также у других представителей отряда Poeciloscrerida должны быть изучены в будущем.Кроме того, необходимо провести отдельные исследования по идентификации генов хитинсинтазы в геномах различных представителей родов Acarnus и Echinoclathria . Кроме того, необходимы дополнительные исследования для лучшего понимания природы и происхождения содержащих спикулы скелетов этих демоспонгов в отношении взаимоотношений губок-хитин. До сих пор неясно, сколько спонгина присутствует в хитиновых скелетах исследованных губок.Необходимо предложить новые подходы, которые объединят молекулярную биологию и современные биоаналитические методы для лучшего понимания синтеза хитинов порифер в различных таксонах на молекулярном уровне. Лучший способ решить эту сложную задачу — объединить слаженных и синергетических сотрудников и экспертов в области морской биологии, морской химии, морской фармакологии, морской биотехнологии и биоматериалов вместе со спонгологами, используя их многопрофильные знания и опыт, чтобы ответить на поставленные вопросы и разработать новые подходы в это интересное направление исследований.
До сих пор неясно, сколько спонгина присутствует в хитиновых скелетах исследованных губок.Необходимо предложить новые подходы, которые объединят молекулярную биологию и современные биоаналитические методы для лучшего понимания синтеза хитинов порифер в различных таксонах на молекулярном уровне. Лучший способ решить эту сложную задачу — объединить слаженных и синергетических сотрудников и экспертов в области морской биологии, морской химии, морской фармакологии, морской биотехнологии и биоматериалов вместе со спонгологами, используя их многопрофильные знания и опыт, чтобы ответить на поставленные вопросы и разработать новые подходы в это интересное направление исследований.
Благодарности
Мы благодарим EEAA и Протекторат Красного моря Египта за разрешение на сбор губок Красного моря Acarnus wolffgangi и Echinoclathria gibbosa . Мы благодарим профессора Роба ван Соста за таксономическую идентификацию образцов губок.
Ссылки
- 1.
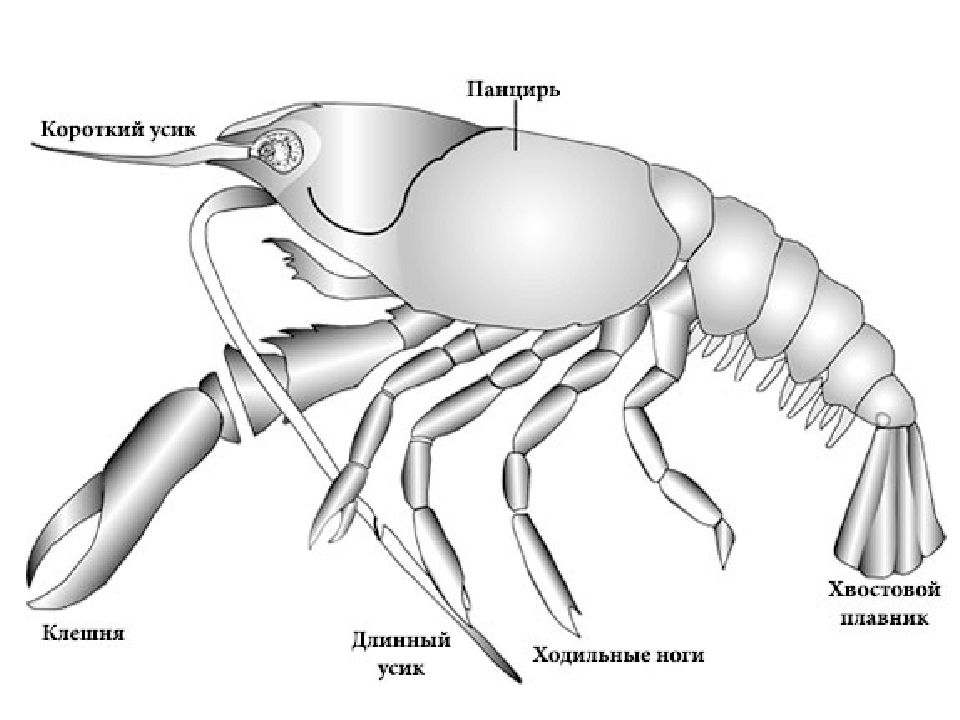 Мерцендорфер Х. Клеточные основы синтеза хитина у грибов и насекомых: общие принципы и различия.Eur J Cell Biol. 2011; 90: 759–769. pmid: 21700357
Мерцендорфер Х. Клеточные основы синтеза хитина у грибов и насекомых: общие принципы и различия.Eur J Cell Biol. 2011; 90: 759–769. pmid: 21700357 - 2. Дегучи С., Цуджи К., Хорикоши К. Микроскопическое наблюдение хитина и грибковых клеток с хитиновыми клеточными стенками в гидротермальных условиях. Sci Rep.2015; 5: 11907. pmid: 26148792
- 3. Gow NAR, Latge J, Munro CA. Клеточная стенка грибов: структура, биосинтез и функции. Microbiol Spectr. 2017; 5: 1–25.
- 4. Бруннер Э., Рихтхаммер П., Эрлих Х., Пааш С., Саймон П., Уберлейн С. и др.Органические сети на основе хитина: неотъемлемая часть биокремнезема клеточной стенки у диатомовых водорослей Thalassiosira pseudonana . Angew Chemie — Int Ed. 2011; 48: 9724–9727.
- 5.
Эрлих Х., Крауттер М., Ханке Т., Саймон П., Книб С., Хайнеманн С. и др. Первые свидетельства наличия хитина в скелетах морских губок. Часть II. Стеклянные губки (Hexactinellida: Porifera).
 J Exp Zool B Mol Dev Evol. 2007; 308: 473–483. pmid: 17520693
J Exp Zool B Mol Dev Evol. 2007; 308: 473–483. pmid: 17520693 - 6. Эрлих Х., Мальдонадо М., Спиндлер К., Эккерт С., Ханке Т., Борн Р. и др.Первое свидетельство хитина как компонента скелетных волокон морских губок. Часть I. Verongidae (Demospongia: Porifera). J Exp Zool B Mol Dev Evol. 2007. 308: 347–356. pmid: 17285638
- 7. Бруннер Э., Рихтхаммер П., Эрлих Х., Пааш С., Саймон П., Уберлейн С. и др. Каркасы на основе хитина являются неотъемлемой частью скелета морского демозуба Ianthella basta . J. Struct Biol. 2009. 168: 539–547. pmid: 19567270
- 8. Эрлих Х., Илан М., Мальдонадо М., Муриси Дж., Бавестрелло Дж., Кляджич З. и др.Трехмерные каркасы на основе хитина из губок Verongida (Demospongiae: Porifera). Часть I. Выделение и идентификация хитина. Int J Biol Macromol. 2010; 47: 132–140. pmid: 20471418
- 9.
Эрлих Х., Стек Э., Илан М., Мальдонадо М., Муриси Дж., Бавестрелло Дж. И др. Трехмерные каркасы на основе хитина из губок Verongida (Demospongiae: Porifera).
 Часть II: Биомиметический потенциал и приложения. Int J Biol Macromol. 2010; 47: 141–145. pmid: 20478334
Часть II: Биомиметический потенциал и приложения. Int J Biol Macromol. 2010; 47: 141–145. pmid: 20478334 - 10.Бо М., Бавестрелло Г., Курек Д., Пааш С., Бруннер Э., Борн Р. и др. Выделение и идентификация хитина в черном коралле Parantipathes larix (Anthozoa: Cnidaria). Int J Biol Macromol. 2012. 51: 129–137. pmid: 22546360
- 11. Guggolz T, Henne S, Politi Y, Schütz R, Mašić A, Müller CHG и др. Гистохимическое свидетельство β-хитина в параподиальных железистых органах и трубках Spiophanes (Annelida, Sedentaria: Spionidae) и первые исследования отдельных Annelida.J Morphol. 2015; 276: 1433–1447. pmid: 26291785
- 12. Коннорс М.Дж., Эрлих Х., Хог М., Годеффрой С., Арая С., Каллай И. и др. Трехмерная структура сборки пластин оболочки хитона Tonicella marmorea и ее биомеханические последствия. J. Struct Biol. 2012; 177: 314–328. pmid: 22248452
- 13.
Куонг Х.Н., Минь НК, Ван Хоа Н., Чунг Т.
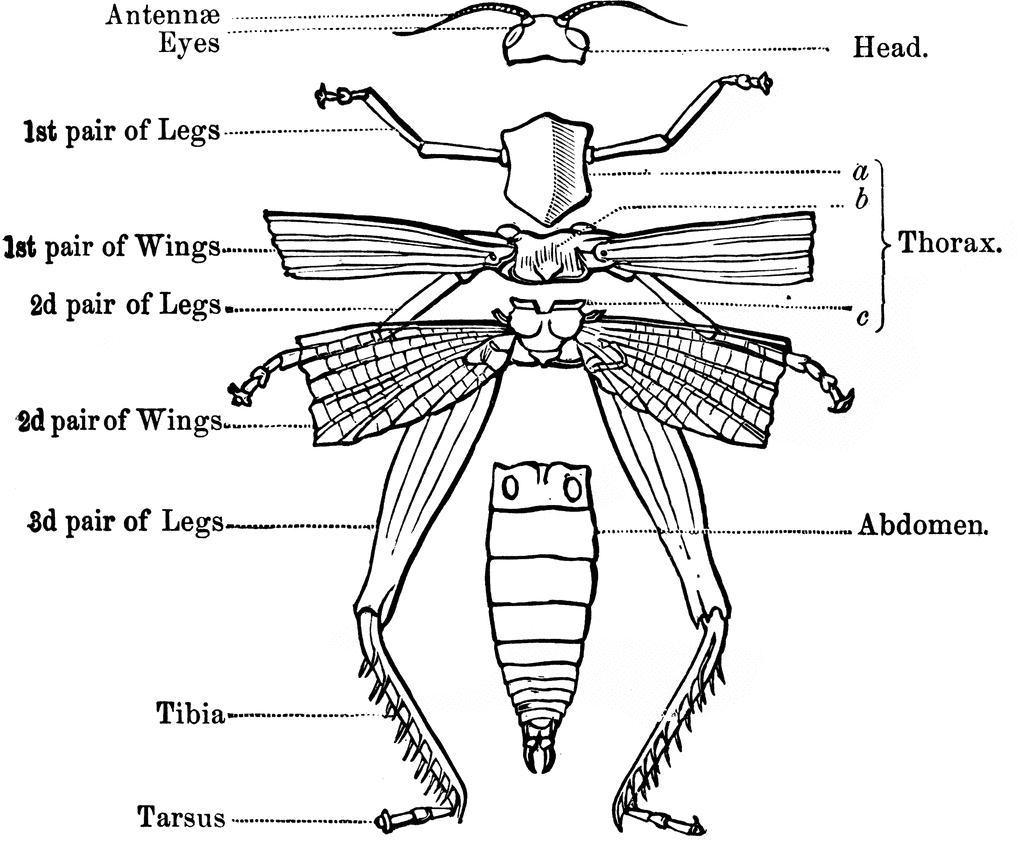 С. Получение и определение характеристик β-хитина высокой чистоты из загонов кальмаров ( Loligo chenisis ).Int J Biol Macromol. 2016; 93: 442–447. pmid: 27593242
С. Получение и определение характеристик β-хитина высокой чистоты из загонов кальмаров ( Loligo chenisis ).Int J Biol Macromol. 2016; 93: 442–447. pmid: 27593242 - 14. Кая М., Муджтаба М., Эрлих Х., Салаберрия А.М., Баран Т., Амемия СТ и др. По химии γ-хитина. Carbohydr Polym. 2017; 176: 177–186. pmid: 28927596
- 15. Эрлих Х. Хитин и коллаген как универсальные и альтернативные шаблоны в биоминерализации. Int Geo Rev.2010; 52: 661–699.
- 16. Высоковски М., Петренко И., Стеллинг А.Л., Ставски Д., Есионовски Т., Эрлих Х. Пориферский хитин как универсальный шаблон для экстремальных биомиметиков.Полимеры 2015; 7: 235–265.
- 17. Высоковский М., Баженов В.В., Цуркан М., Галли Р., Стеллинг А.Л., Штеккер Х. и др. Выделение и идентификация хитина в трехмерном скелете морской губки Aplysina fistularis . Int J Biol Macromol. 2013; 62: 94–100. pmid: 23994783
- 18.
Ółtowska-Aksamitowska S, Tsurkan M, Swee-Cheng L, Meissner H, Tabachnik K, Shaala LA, et al.
 Демоспубка Pseudoceratina purpurea как новый источник волокнистого хитина.Int J Biol Macromol. 2018; 112: 1021–1028. pmid: 29452181
Демоспубка Pseudoceratina purpurea как новый источник волокнистого хитина.Int J Biol Macromol. 2018; 112: 1021–1028. pmid: 29452181 - 19. Ółtowska-Aksamitowska S, Shaala LA, Youssef D, Hady El, Tsurkan M, Petrenko I, et al. Первое сообщение о хитине у неверонгиидных морских демоспубков: случай Mycale euplectellioides . Mar Drugs. 2018; 16:68.
- 20. Эрлих Х., Калужная О.В., Бруннер Э., Цуркан М., Ересковский А., Илан М. и др. Идентификация и первые сведения о структуре и биосинтезе хитина из пресноводной губки Spongilla lacustris .J. Struct Biol. 2013; 183: 474–483. pmid: 23831449
- 21. Эрлих Х., Калужная О.В., Цуркан М., Ересковский А., Табачник К., Илан М. и др. Первое сообщение о хитиновой задержке губок (Porifera). Труды Biol Sci. 2013; 280: 20130339.
- 22.
Эрлих Х., Саймон П., Карилло-Кабрера В., Баженов В.В., Боттинг Дж. П., Илан М. и др. Понимание химии биологических материалов: недавно обнаруженные биокомпозиты кремнезем-арагонит-хитин в демоспонге.
 Chem Mater. 2010; 22: 1462–1471.
Chem Mater. 2010; 22: 1462–1471. - 23. Эрлих Х., Мальдонадо М., Паркер А.Р., Кульчин Ю.Н., Шиллинг Дж., Келер Б. и др. Генерация суперконтинуума в природных спикулах стеклянных губок. Adv Opt Mater. 2016; 4: 1608–1613.
- 24. Закжевский А.С., Вейгерт А., Хельм С., Адамски М., Адамска М., Блейдорн С. и др. Раннее расхождение, широкое распространение и большое разнообразие хитинсинтаз животных. Genome Biol Evol. 2014; 6: 316–325. pmid: 24443419
- 25. Филибер Т., Ли Б.Х., Фабьен Н.Текущее состояние и новые перспективы хитина и хитозана как функциональных биополимеров. Appl Biochem Biotechnol. 2017; 181: 1314–1337. pmid: 27787767
- 26. Шлейтер Д., Гюнтер А., Пааш С., Эрлих Х., Кляйич З., Ханке Т. и др. Возобновляемые материалы на основе хитина из морских губок для адсорбции урана. Carbohydr Polym. 2013; 92: 712–718. pmid: 23218358
- 27.
Anitha A, Sowmya S, Kumar PTS, Deepthi S, Chennazhi KP, Ehrlich H, et al.
 Хитин и хитозан в избранных биомедицинских приложениях.Prog Polym Sci. 2014; 39: 1644–1667.
Хитин и хитозан в избранных биомедицинских приложениях.Prog Polym Sci. 2014; 39: 1644–1667. - 28. Анастопулос И., Бхатнагар А., Бикиарис Д., Кизас Г. Адсорбенты хитина для токсичных металлов: обзор. Int J Mol Sci. 2017; 18: 114.
- 29. Bk M, Gutlowska O, Wagner E, Gosk J. Роль хитина и хитозана в реконструкции периферических нервов. Polym Med. 2017; 47: 43–47.
- 30. Сингх Р., Шитиз К., Сингх А. Хитин и хитозан: биополимеры для лечения ран. Int Wound J. 2017; 14: 1276–1289. pmid: 28799228
- 31.Эрлих Х., Ригби Дж. К., Боттинг Дж. П., Цуркан М., Вернер С., Швилле П. и др. Открытие хитина возрастом 505 миллионов лет в базальной демоспубе Vauxia gracilenta . Sci Rep.2013; 3: 3497. pmid: 24336573
- 32.
Муценко В.В., Баженов В.В., Рогульская О., Тарусин Д.Н., Шютц К.В., Гришков О. и др. Трехмерные хитиновые каркасы, полученные из культивируемого морского демоспуба Aplysina aerophoba , для подходов к тканевой инженерии на основе мезенхимальных стромальных клеток человека.
 Int J Biol Macromol. 2017; 104: 1966–1974. pmid: 28347785
Int J Biol Macromol. 2017; 104: 1966–1974. pmid: 28347785 - 33. Муценко В.В., Гришков О., Лаутербек, Рогульская О., Тарусин Д.Н., Баженов В.В. и др. Новые хитиновые каркасы, полученные из морской губки Ianthella basta , для подходов к тканевой инженерии на основе мезенхимальных стромальных клеток человека: биосовместимость и криоконсервация. Int J Biol Macromol. 2017; 104: 1955–1965. pmid: 28365291
- 34. Высоковский М., Мотыленко М., Баженов В.В., Ставский Д., Петренко И., Эрлих А. и др.Хитин пориферана как матрица для гидротермального отложения диоксида циркония. Front Mater Sci. 2013; 7: 248–260.
- 35. Высоковски М., Мотиленко М., Рафая Д., Кольцов И., Штеккер Х., Салаты Т.Дж. и др. Экстремальный биомиметический подход к синтезу нанокристаллических многофазных композитов хитин- (Ti, Zr) O 2 . Mater Chem Phys. 2017; 188: 115–124.
- 36.
Высоковски М., Мотиленко М., Бейер Дж., Макарова А.
 , Штеккер Х., Вальтер Дж. И др. Экстремальный биомиметический подход к разработке новых нанокомпозитов хитин-GeO 2 с фотолюминесцентными свойствами.Nano Res. 2015; 8: 2288–2301.
, Штеккер Х., Вальтер Дж. И др. Экстремальный биомиметический подход к разработке новых нанокомпозитов хитин-GeO 2 с фотолюминесцентными свойствами.Nano Res. 2015; 8: 2288–2301. - 37. Степняк И., Галински М., Новацкий К., Высоковски М., Якубовская П., Баженов В.В. и др. Новый материал происхождения хитозана / губчатого хитина в качестве мембраны для суперконденсаторов — подготовка и характеристика. RSC Adv. 2016; 6: 4007–4013.
- 38. Петренко И., Баженов В.В., Галли Р., Высоковски М., Фромонт Дж., Шупп П.Дж. и др. Хитин пористого происхождения и биоэлектрометаллургия меди / оксида меди. Int J Biol Macromol. 2017; 104: 1626–1632.pmid: 28119189
- 39. Эрлих Х. Биомиметический потенциал композиционных биоматериалов на основе хитина пористого происхождения. В: Руйс А.Дж., редактор. Биомиметические биоматериалы: структура и применение. Кембридж: издательство Woodhead Publishing; 2013. С. 46–66.
- 40.
Хупер ЮНА, Ван Сост RWM.
 Заказать Poecilosclerida Topsent, 1928. В: Hooper JNA, Van Soest RWM, ред. Systema Porifera. Руководство по классификации губок. Нью-Йорк, Бостон, Дордрехт, Лондон, Москва: Academic / Plenum Publishers; 2002 г.С. 403–408.
Заказать Poecilosclerida Topsent, 1928. В: Hooper JNA, Van Soest RWM, ред. Systema Porifera. Руководство по классификации губок. Нью-Йорк, Бостон, Дордрехт, Лондон, Москва: Academic / Plenum Publishers; 2002 г.С. 403–408. - 41. Ван Сост RWM, [Интернет] Acarnus wolffgangi Keller, 1889. Всемирная база данных Porifera. [цитировано 10 января 2018 г.]. Доступно по адресу: http://www.marinespecies.org/porifera/porifera.php?p=taxdetails&id=167358
- 42. Van Soest RWM, Hooper JNA, Hiemstra F. Таксономия, филогения и биогеография рода морских губок Acarnus (Porifera: poecilosclerida). Бофорция. 1991; 42: 49–89.
- 43. Hooper JNA. Семейство Acarnidae Dendy, 1922.В: Hooper JNA, Van Soest RWM, редакторы. Systema Porifera: Руководство по классификации губки s . Нью-Йорк, Бостон, Дордрехт, Лондон, Москва: Academic / Plenum Publishers; 2002. С. 412–431.
- 44.
Hooper JNA. Новые записи о Acarnus Gray (Porifera: Demospongiae, Poecilosclerida) из Австралии, с синопсисом этого рода.
 Mem Qd Mus. 1987. 25: 71–105.
Mem Qd Mus. 1987. 25: 71–105. - 45. Агилар-Камачо Дж. М., Карбальо Дж. Л., Крус-Барраза Дж. А. Acarnidae (Porifera: Demospongiae: Poecilosclerida) из Мексиканского Тихого океана с описанием шести новых видов.Sci, март 2013; 77: 677–696.
- 46. Келлер К. Die Spongienfauna des rothen Meeres (I. Hiilfte.). Zeits fur wiss Zool. 1889; 51: 399–400. Немецкий.
- 47. Ленерт Х., Стоун Р., Хеймлер В. Новый вид глубоководных демоспонгов (Porifera) с Алеутских островов (Аляска, США). Zootaxa 2006; 1250: 1–35.
- 48. Мохамед Г.А., Абд-Эльразек А.Е., Хассанеан Н.А., Юсеф Д.ТА., Ван Сост RWM. Новые соединения из морской губки Красного моря Echinoclathria gibbosa .Phytochem Lett. 2014; 9: 51–58.
- 49.
Эрлих Х., Баженов В.В., Дебитус К., де Воогд Н., Галли Р., Цуркан М. и др. Выделение и идентификация хитина из сильно минерализованного скелета морской демоспубии Suberea clavata (Verongida: Demospongiae: Porifera).
 Int J Biol Macromol. 2017; 104B: 1706–1712.
Int J Biol Macromol. 2017; 104B: 1706–1712. - 50. Hickey PC, Swift SR, Roca MG, Read ND. Визуализация живых клеток мицелиальных грибов с использованием витальных флуоресцентных красителей и конфокальной микроскопии. Методы Microbiol.2004. 34: 63–87.
- 51. Высоковский М., Затонь М., Баженов В.В., Бем Т., Эрлих А., Стеллинг А.Л. и др. Идентификация хитина в капсулах яиц брюхоногих моллюсков возрастом 200 миллионов лет. Палеобиология. 2014; 40: 529–540.
- 52. Elorza MV, Rico H, Sentandreu R. Calcofluor white изменяет сборку хитиновых фибрилл в клетках Saccharomyces cerevisiae и Candida albicans . J Gen Microbiol. 1983; 129: 1577–1582. pmid: 6352860
- 53. Kumirska J, Czerwicka M, Kaczyński Z, Bychowska A, Brzozowski K, Thoming J, et al.Применение спектроскопических методов для структурного анализа хитина и хитозана. Mar Drugs. 2010. 8: 1567–1636. pmid: 20559489
- 54.
Лавалл Р.
 Л., Ассис ОБГ, Кампана-Филхо СП. Бета-хитин из загонов Loligo sp .: Извлечение и характеристика. Биоресур Технол. 2007. 98: 2465–2472. pmid: 17070041
Л., Ассис ОБГ, Кампана-Филхо СП. Бета-хитин из загонов Loligo sp .: Извлечение и характеристика. Биоресур Технол. 2007. 98: 2465–2472. pmid: 17070041 - 55. Эрлих Х., Хайнеманн С., Хайнеманн С., Саймон П., Баженов В.В., Шапкин Н.П. и др. Наноструктурная организация природных композитов — Часть I: Биокомпозиты на основе кремнезема и коллагена.J Nanomater. 2008; 2008: 623838.
- 56. Картер GT, Райнхарт KL. Акарнидины, новые противовирусные и противомикробные соединения из губки Acarnus erithacus (de Laubenfels). J Am Chem Soc. 1978; 100: 4302–4304.
- 57. Yosief T, Rudi A, Wolde-ab Y, Kashman Y. Два новых 1,2-диоксановых поликетида C22 из морской губки Acarnus cf . bergquistae . J Nat Prod. 1998; 3864: 491–493.
- 58.
Руди А., Голдберг И., Стейн З., Кашман Ю., Бенаяху Ю., Шлейер М. и др.Sodwanones G, H и I, новые цитотоксические тритерпены из морской губки. J Nat Prod.
 1995; 58: 1702–1712. pmid: 8594147
1995; 58: 1702–1712. pmid: 8594147 - 59. Fontana A, D’Ippolito G, D’Souza L, Mollo E, Parameswaram PS, Cimino G. Новые пероксиды ацетогенина из индийской губки Acarnus bicladotylota. J Nat Prod. 2001. 64: 131–133. pmid: 11170688
- 60. Уэока Р., Ито А., Изумикава М., Маэда С., Такаги М., Син-я К. и др. Выделение азаспирацида-2 из морской губки Echinoclathria sp .как мощный цитотоксин. Токсикон. 2009. 53: 680–684. pmid: 19233223
- 61. Ли Х.Й., Мацунага С., Фусетани Н., Фуджики Х., Мерфи П. Т., Уиллис Р. Х. и др. Эхинокластерин сульфат фенэтиламмониевая соль, уникальный стероидный сульфат из морской губки, Echinoclathria subhispida . Tetrahedron Lett. 1993; 34: 5733–5736.
- 62. Китамура А., Танака Дж., Отани II, Хига Т. Эхиноклатрины A-C: новый класс пиридиновых алкалоидов из окинавской губки, Echinoclathria sp.Тетраэдр 1999; 55: 2487–2492.
- 63.
Патент: Морской натуральный продукт, эхиноклатрин А.
 Способ приготовления. Патент 2013 г. CN 201310296865.
Способ приготовления. Патент 2013 г. CN 201310296865. - 64. Абдельхамид Р.Ф., Ибрагим А.К., Темраз Т.А., Ямада К., Ахмед С.А. Химико-биологические исследования красной морской губки Echinoclathria вида. J Pharm Sci Res. 2017; 9: 1324–1328.
- 65. Kölliker von A. Der feinere Bau der Protozoen. Лейпциг: Вильгельм Энгельман; 1864.
- 66.Есионовский Т., Норман М., Жултовска-Аксамитовска С., Петренко И., Йозеф Ю., Эрлих Х. Морской губчатый материал: естественным образом предварительно изготовленный трехмерный биоматериал на основе каркаса. Mar Drugs. 2018; 16: 88.
- 67. Ehrlich H, Wysokowski M, ółtowska-Aksamitowska S, Petrenko I, Jesionowski T. Коллагены пористого происхождения. Mar Drugs. 16; 2018: 79.
- 68. Эрлих Х., Бруннер Э., Рихтер В., Илан М., Шупп П. 2011. Двух- или трехмерный очищенный хитиновый скелет диктиоцератидных губок.Способ их производства и использования. Патент No. WO2011023531 A2
Обнаружение хитина возрастом 505 миллионов лет в базальном демоспорте Vauxia gracilenta
Станкевич, Б. А., Бриггс, Д.Э.Г., Эвершед, Р.П., Фланнери, М.Б. и Вуттке, М. Сохранение хитина в окаменелостях возрастом 25 миллионов лет. Science 276, 1541–1543, 10.1126 / science.276.5318.1541 (1997).
А., Бриггс, Д.Э.Г., Эвершед, Р.П., Фланнери, М.Б. и Вуттке, М. Сохранение хитина в окаменелостях возрастом 25 миллионов лет. Science 276, 1541–1543, 10.1126 / science.276.5318.1541 (1997).
CAS Статья Google Scholar
Уивер, П.G. et al. Характеристика органических веществ, согласующихся с β-хитином, сохраненным в позднеэоценовых каракатицах Mississaepia mississippiensis . PLoS ONE 6, e28195, 10.1371 / journal.pone.0028195 (2011).
CAS ОБЪЯВЛЕНИЯ Статья PubMed PubMed Central Google Scholar
Харви, Т. Х. П., Ортега-Эрнандес, Дж., Лин, Ж.-П., Чжао, Ю. и Баттерфилд, Н. Дж. Берджесс Микрофоссилий сланцевого типа из формации Кайли среднего кембрия, провинция Гуйчжоу, Китай.Acta Palaeontologica Polonica 57, 423–436 (2012).
Артикул Google Scholar
Редекер, Д., Робин Коднер, Р. и Грэм, Л. Е. Гломалийские грибы ордовика. Science 289, 1920–1921 (2009).
и Грэм, Л. Е. Гломалийские грибы ордовика. Science 289, 1920–1921 (2009).
ADS Статья Google Scholar
Коди, Г. Д. и др. Молекулярная сигнатура хитин-белкового комплекса у палеозойских членистоногих. Геология 39, 255–258, 10.1130 / G31648.1 (2011).
CAS ОБЪЯВЛЕНИЯ Статья Google Scholar
Эрлих, Х. и др. Первые свидетельства наличия хитина в скелетах морских губок. Часть II. Стеклянные губки (Hexactinellida: Porifera). J. Exp. Zool. (Mol. Dev. Evol.) 308B, 473–483, 10.1002 / jez.b.21174 (2007).
CAS Статья Google Scholar
Эрлих, Х. и др. Первое свидетельство хитина как компонента скелетных волокон морских губок.Часть I. Verongidae (Demospongia: Porifera). J. Exp. Zool. (Mol. Dev. Evol.) 308B, 347–356, 10.1002 / jez.b.21156 (2007).
CAS Статья Google Scholar
Эрлих, Х. и др. Трехмерные каркасы на основе хитина из губок Verongida (Demospongiae: Porifera). Часть I. Выделение и идентификация хитина. Int. J. Biol. Макромол. 47, 132–140, 10.1016 / j.ijbiomac.2010.05.007 (2010).
и др. Трехмерные каркасы на основе хитина из губок Verongida (Demospongiae: Porifera). Часть I. Выделение и идентификация хитина. Int. J. Biol. Макромол. 47, 132–140, 10.1016 / j.ijbiomac.2010.05.007 (2010).
CAS Статья PubMed Google Scholar
Бруннер, Э.и другие. Каркасы на основе хитина являются неотъемлемой частью скелета морского демозуба Ianthella basta . J. Struct. Биол. 168, 539–547, 10.1016 / j.jsb.2009.06.018 (2009).
CAS Статья PubMed PubMed Central Google Scholar
Эрлих, Х. и др. Идентификация и первые сведения о структуре и биосинтезе хитина из пресноводной губки Spongilla lacustris . J. Struct.Биол. 183, 474–483, 10.1016 / j.jsb.2013.06.015 (2013).
CAS Статья PubMed Google Scholar
Philippe, H. et al. Филогеномика возрождает традиционные взгляды на глубокие взаимоотношения животных. Curr. Биол. 19, 706–712, 10.2475 / ajs.301.8.683 (2009).
Curr. Биол. 19, 706–712, 10.2475 / ajs.301.8.683 (2009).
CAS Статья PubMed Google Scholar
Reitner, J. & Wörheide, G. История сохранения.В Systema Porifera: Руководство по классификации губок (ред. Хупер, Дж. Н. А. и Ван Суст, Р. В. М.), стр. 52–68. Kluwer Academic / Plenum Publishers (2002).
Сперлинг, Э. А., Петерсон, К. Дж. И Лафламм, М. Рангоморфы, Thectardis (Porifera?) И растворенный органический углерод в Эдиакарских океанах. Геобиология 9, 24–33, 10.1111 / j.1472-4669.2010.00259.x (2011).
CAS Статья PubMed Google Scholar
Любовь, Г.D. et al. Ископаемые стероиды фиксируют появление Demospongiae в криогенный период. Nature 457, 718–721, 10.1038 / nature07673 (2009).
CAS ОБЪЯВЛЕНИЯ Статья PubMed Google Scholar
Walcott, C. D. Среднекембрийские губки. Кембрийская геология и палеонтология IV. Смитсоновский институт Разное. Coll. 67, 261–289 (1920).
Кембрийская геология и палеонтология IV. Смитсоновский институт Разное. Coll. 67, 261–289 (1920).
Google Scholar
Ригби, Дж.К. Губки сланцев Берджесс (средний кембрий), Британская Колумбия. Palaeontographica Canadiana 2, 1–105 (1986).
Google Scholar
Бриггс, Д. Э. Г., Эрвин, Д. Х. и Коллиер, Ф. Дж. Ископаемые останки сланцевого месторождения Берджесс. Пресса Смитсоновского института (1994).
Орр, П. Дж., Бриггс, Д. Э. Г. и Кернс, С. Л. Кембрийский Берджесс Сланцевые животные, воспроизведенные в глинистых минералах. Science 281, 1173–1175, 10.1126 / science.281.5380.1173 (1998).
CAS ОБЪЯВЛЕНИЯ Статья PubMed Google Scholar
Гейнс, Р. Р., Бриггс, Д. Э. Г. и Чжао, Ю. Л. Кембрийские месторождения сланцевого типа Берджесс имеют общий способ окаменения. Геология 36, 755–758, 10.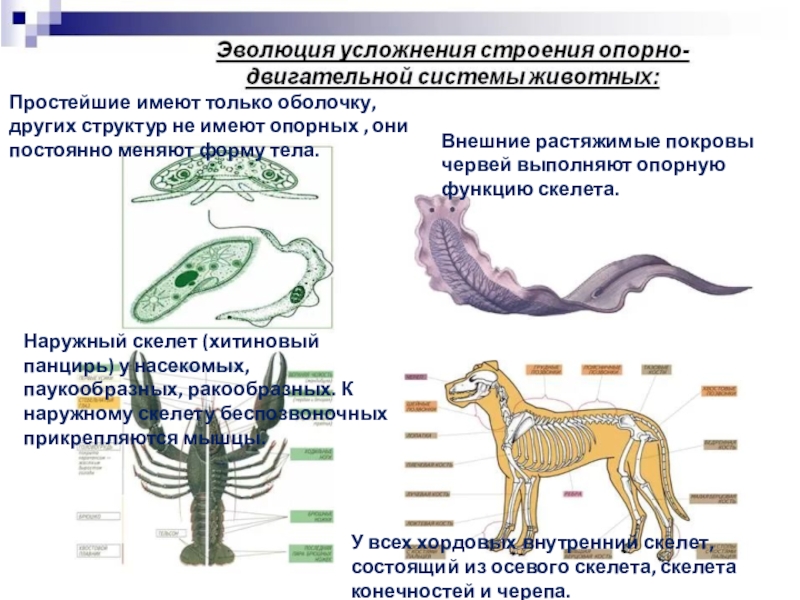 1130 / G24961A.1 (2008).
1130 / G24961A.1 (2008).
CAS ОБЪЯВЛЕНИЯ Статья Google Scholar
Лин, Дж. П. и Бриггс, Д. Э. Г. Сохранение сланцевого типа Берджесс: сравнение Naraoiids (Arthropoda) из трех кембрийских местонахождений.PALAIOS 25, 463–467, 10.2110 / palo.2009.p09-145r (2010).
ADS Статья Google Scholar
Albani, J. D. Förster исследования переноса энергии между остатками Trp гликопротеина α1-кислоты (оросомукоид) и сайтом гликозилирования белка. Carboh. Res. 338, 2233–2236, 10.1016 / S0008-6215 (03) 00360-4 (2003).
CAS Статья Google Scholar
Патент США 6875421 Метод обнаружения хитинсодержащих организмов.
Фланнери, М. Б., Стотт, А. В., Бриггс, Д. Э. Г. и Эвершед, Р. П. Хитин в летописи окаменелостей: идентификация D-глюкозамина. Орг. Геохим. 32, 745–754, 10.1130 / G20640. 1 (2001).
1 (2001).
CAS Статья Google Scholar
Mancosky, D. G. et al. Новые визуализационные исследования химии окисления лигноцеллюлозы с применением спектроскопии тонкой структуры поглощения рентгеновских лучей у C-ближнего края. Целлюлоза 12, 35–41, 10.1023 / B: CELL.0000049352.60007.76, (2005).
CAS Статья Google Scholar
Миллер Р.Ф. Хитин Палеоэкология. Биохим. Syst. Ecol. 19, 401–411 (1991).
CAS Статья Google Scholar
Ставски, Д., Рабей, С., Герчинска, Л., Драчински, Дж. Термогравиметрический анализ хитинов различного происхождения. J. Therm. Анальный. Калорим. 93, 489–494, 10.1007 / s10973-007-8691-6 (2008).
CAS Статья Google Scholar
Карлайл, Д. Б. Хитин в кембрийской окаменелости. Биохим. J. 90, lc – 2c (1964).
Google Scholar
Миллер, Р. Ф., Фосс-Фукар, М. Ф., Туссен, К. и Жено, К. Сохранение хитина четвертичных жесткокрылых: предварительные результаты. Палеогеография, Палеоклиматология, Палеоэкология 103, 133–140 (1993).
ADS Статья Google Scholar
Баас, М., Бриггс, Д. Э. Г., ван Хемст, Дж. Д. Х., Кир, А. Дж. И де Леу, Дж. У. Селективное сохранение хитина во время разложения креветок. Геохим. Космохим. Acta 59, 945–951 (1995).
CAS ОБЪЯВЛЕНИЯ Статья Google Scholar
Брумиул, Д. и Фосс-Фукар, М. Ф. Органические вещества в ископаемых панцирях ракообразных.Комп. Биохим. Physiol. 57B, 171–175 (1977).
Google Scholar
Эрпенбек Д. и Верхайде Г. Молекулярная филогения губок (Porifera). В: Linnaeus Tercentenary: прогресс в таксономии беспозвоночных, Zootaxa 1668 (ред.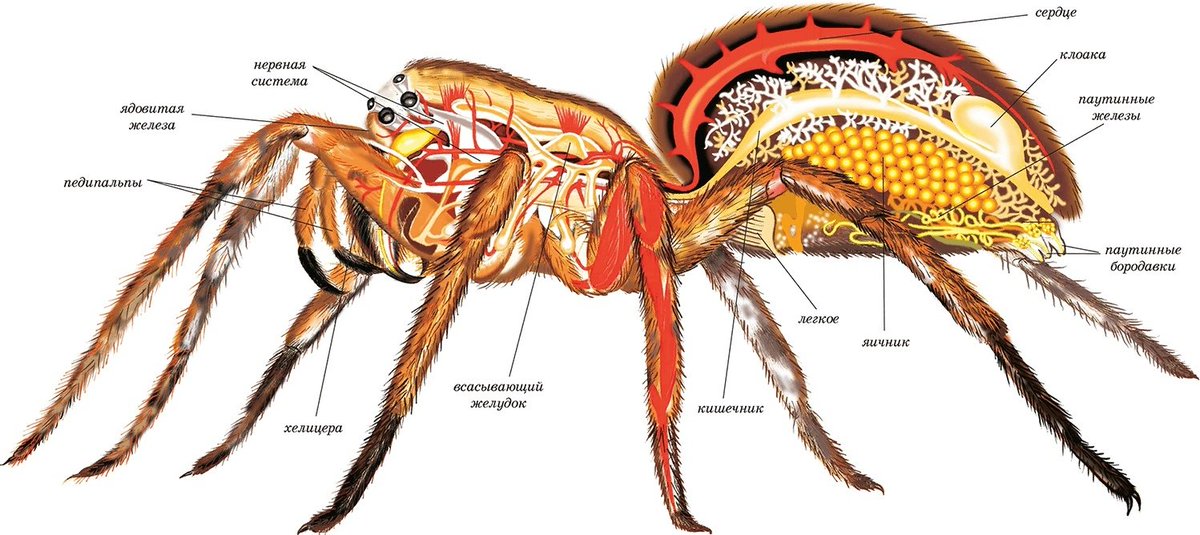 Zhang, Z.-Q. & Shear, W. A.), стр. 107–126, Окленд (Новая Зеландия): Magnolia Press (2007).
Zhang, Z.-Q. & Shear, W. A.), стр. 107–126, Окленд (Новая Зеландия): Magnolia Press (2007).
Мальдонадо, М. Эмбриональное развитие веронгид демоспонгов поддерживает независимое приобретение губчатых скелетов в качестве альтернативы кремнистому скелету губок.Биол. Дж. Линн. Soc. 97, 427–447, 10.1111 / j.1095-8312.2009.01202.x (2009).
Артикул Google Scholar
Пауэлл, В. Метаморфизм зеленых сланцевых фаций сланцев Берджесс и его значение для моделей образования и сохранения окаменелостей. Может. J. Earth Sci. 40, 13–25, 10.1139 / E02-103 (2003).
CAS ОБЪЯВЛЕНИЯ Статья Google Scholar
Цай, Ю., Шиффбауэр, Дж. Д., Хуа, Х. и Сяо, С. Режимы консервации в эдиакарском лагере Гаоцзяшан: пиритизация, алюмосиликатизация и углеродистое сжатие. Палеогеография, палеоклиматология, палеоэкология 326–328, 109–117, 10.1016 / j.palaeo.2012.02.009 (2012).
ADS Статья Google Scholar
Табудраву, Дж. Н. и др. Псаммаплин А, ингибитор хитиназы, выделенный из фиджийской морской губки Aplysinella rhax .Биоорг. Med. Chem. 10, 1123–1128, 10.1016 / S0968-0896 (01) 00372-8 (2002).
CAS Статья PubMed Google Scholar
Морские биомиметики: хитиновый скелет, нагруженный бромтирозинами, в качестве источника антибактериальных агентов
Applied Physics A (2021) 127: 15
https://doi.org/10.1007/s00339-020-04167-0
T.C. БИОЛОГИЧЕСКИЕ И БИОМИМЕТИЧЕСКИЕ МАТЕРИАЛЫ
Морские биомиметики: хитиновый скелет, нагруженный бромтирозинами
как источник антибактериальных агентов
ЛюбовьМузычка1 · АлонаВоронкина2 · ВалентинКовальчук3.Smolii1 · MarcinWysokowski4,5 ·
IaroslavPetrenko5 · DiaaT.A.Youssef6,7 · IrinaEhrlich8 · HermannEhrlich5,9
Поступила: 27 октября 2020 г. / Принята в печать : 23 ноября 2020 г.
/ Принята в печать : 23 ноября 2020 г.
© Springer-Verlag GmbH Германия, часть Springer Nature 2021
Реферат
Морские губки отряда Verongiida (Demospongiae: Porifera) выжили на нашей планете более 500 миллионов —
миллионов лет. благодаря наличию уникальной стратегии химической защиты путем биосинтеза более 300 производных
биологически активных бромтирозинов в качестве вторичных метаболитов.Эти соединения синтезируются в сферулоцитах, высокоспециализированных клетках
, расположенных в хитиновых скелетных волокнах этих губок, откуда они могут быть экструдированы в морской воде
и образуют защитное пространство против патогенных вирусов, бактерий и других хищников. Этот хитин является примером уникального материала био-
как источника веществ с антибиотическими свойствами. Традиционно внимание исследователей
привлекали исключительно липофильные бромтирозины, методы экстракции которых основывались на использовании только органических растворителей. В качестве альтернативы,
В качестве альтернативы,
мы использовали в этой работе биомиметический подход на водной основе, потому что в естественных условиях губки активно экструдируют
бромтирозинов, которые смешиваются с водной средой. Это позволило выделить 3,5-дибромхинолуксусную кислоту
из водного экстракта высушенного демоспуба Aplysina aerophoba и сравнить ее антимикробную активность с тем же соединением
, полученным химическим синтезом. Как синтетические, так и натуральные соединения продемонстрировали противомикробные свойства
против клинических штаммов Staphylococcus aureus, Enterococcus faecalis и Propionibacterium acnes.
Ключевые слова Хитин · Биомиметики · Бромтирозины · Антибактериальные · Губки · Вторичные метаболиты · Сферулоциты
1 Введение
В последнее десятилетие морские демоспонжи, принадлежащие отряду
Verongiida (Demospongiae 1: Porifera) [ ] привлекли внимание исследователей
во всем мире по ряду
причин. Было достоверно установлено [2], что первая
Было достоверно установлено [2], что первая
Дополнительная информация Онлайн-версия содержит
дополнительных материалов, доступных по адресу https: // doi.org / 10.1007 / s0033
9-020-04167-0.
* Марцин Высоковски
* Герман Эрлих
1 V.P. Институт биоорганической химии
и Петрохимии НАН Украины
, Украина, ул. 1, Киев02094, Украина
2 Кафедра «Аптеки Национального мемориала Пирогова
Медицинский университет, Винница, Винница» 21018, Украина
3 Кафедра «Микробиологии Национального мемориала Пирогова
Медицинский университет, Винница, Винница» 21018, Украина
4 Институт химической технологии и инженерии, факультет
Химической технологии, Познанский технологический университет,
Бердыхово 4, 60965 Познань, Польша
5 Институт электронных и сенсорных материалов , TU
Bergakademie Freiberg, Gustav-Zeuner Str. 3,
3,
09599 Фрайберг, Германия
6 Кафедра натуральных продуктов, Фармацевтический факультет, King
Университет Абдулазиза, Джидда 21589, Саудовская Аравия
7 Кафедра Фармакогнозии, Факультет Фармации
Canal University, Исмаилия41522, Египет
8 BromMarin GmbH, 09599Freiberg, Германия
9 Центр передовых технологий, Адам Мицкевич
Университет, 61614 Познан, Польша
Содержание предоставлено Springer Nature, условия содержания применения применяются.Права защищены.
ЛОР 425 — Общая энтомология
У многих насекомых определенные клетки эпидермиса специализируются как экзокринные железы. Эти большие секреторные клетки производят соединения (например, феромоны, репелленты и т. Д.), Которые высвобождаются на поверхность экзоскелета через микроскопические протоки.
Крошечные волоскоподобные выступы или моделирование поверхности кутикулы известны как микротрихи или ворс (PILL-EE). Эти бесклеточные структуры состоят из твердого ядра экзокутикулы, покрытого тонким слоем эпикутикулы. Более крупные волосы, щетинки и чешуйки (называемые щетинками или макротрихами) являются продуктом двух специализированных эпидермальных клеток: клетки трихогена (стержень волоса) и клетки тормогена (гнездо). Многоклеточные выступы экзоскелета называют шипами (или шпорами, если они подвижны). Они выстланы эпидермисом и содержат прокутикулу и эпикутикулу.
Скелетные мышцы прикрепляются к внутренней поверхности покровов. Несмотря на небольшой размер тела, у насекомых намного больше мышц, чем у позвоночных, потому что экзоскелет имеет большую площадь поверхности, чем эндоскелет (относительно объема тела) для прикрепления мышц.Невероятной силой насекомое обязано геометрии мускулатуры, которая обеспечивает оптимальный рычаг для движения конечностей.
Инвагинации (складки внутрь) экзоскелета добавляют ему прочности и жесткости. Они также обеспечивают увеличенную площадь поверхности для прикрепления мышц. Гребневидные впячивания называются аподемами . Обычно они видны снаружи в виде бороздки (шва). Пальцевидные инвагинации называются апофизами . Крошечная ямка обычно отмечает их местонахождение снаружи.
Пальцевидные инвагинации называются апофизами . Крошечная ямка обычно отмечает их местонахождение снаружи.
Цвета покровов насекомых создаются либо молекулами пигмента, обычно расположенными в кутикуле, либо физическими характеристиками покровов, которые вызывают рассеяние, интерференцию или дифракцию света. Часто присутствующие пигменты включают птерины, меланины, каротиноиды и мезобиливердин.
Цветовые узоры со временем могут изменяться. Быстрые, временные изменения могут происходить в ответ на повседневные условия окружающей среды или угрозу опасности.Более медленные, более постоянные изменения обычно связаны с сезонными изменениями в окружающей среде или гормональными влияниями.
Определение и примеры хитина — Биологический онлайн-словарь
ˈkaɪ tɪn
Определение
существительное
множественное число: хитин
chitin, kaɪtɪn
(1) Полимер азотсодержащего полисахарида (C 8 13 O 5 N) n обеспечение прочного защитного покрытия или структурной опоры у некоторых организмов
(2) Полисахарид, из которого состоят клеточные стенки грибов и экзоскелет насекомых
Детали
Обзор
Хитин относится к группе полисахаридов углеводов .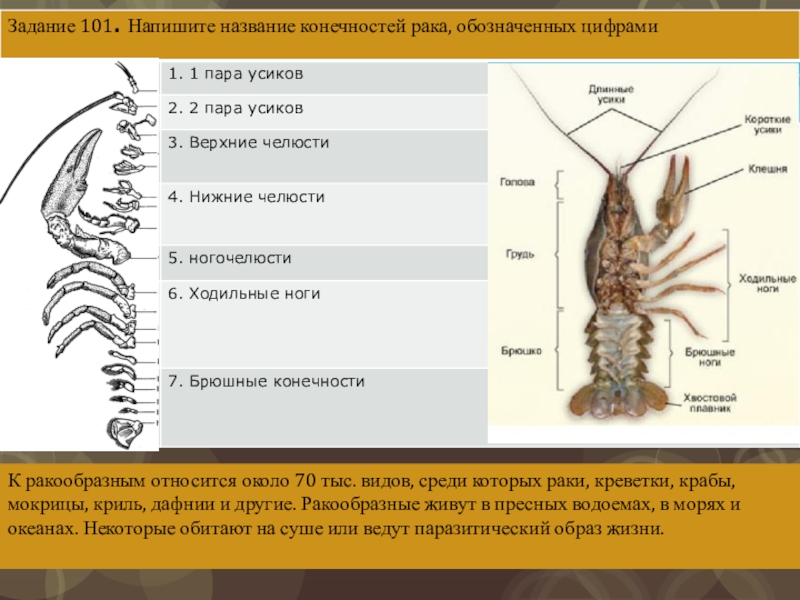 Углеводы — это органические соединения, состоящие из углерода, водорода и кислорода, обычно в соотношении 1: 2: 1. Они являются одним из основных классов биомолекул. Полисахариды — это углеводы, состоящие из нескольких сахаридных единиц. Некоторые из них служат в качестве энергетического топлива, а другие выполняют структурные функции.
Углеводы — это органические соединения, состоящие из углерода, водорода и кислорода, обычно в соотношении 1: 2: 1. Они являются одним из основных классов биомолекул. Полисахариды — это углеводы, состоящие из нескольких сахаридных единиц. Некоторые из них служат в качестве энергетического топлива, а другие выполняют структурные функции.
История и терминология
Открытие хитина было приписано французскому ученому Анри Браконно в 1811 году. Он был первым, кто описал соединение, которое он извлек из грибов и не растворим в серной кислоте.Он назвал его гриб . Другой французский ученый, Огюст Одье , также смог выделить соединение из кутикулы жуков и назвал его хитин , французское слово, образованное от греческого слова χιτών ( «хитон» ), что означает покрытие. Позже название соединения было изменено на хитин . 1 С тех пор хитин используется в медицине и промышленности. Он имеет несколько применений, поскольку он нетоксичен, поддается биологическому разложению (таким образом, более безопасен для окружающей среды) и обладает антимикробными свойствами. Например, его использовали в хирургических швах, которые со временем растворяются. Он также использовался в качестве добавки в некоторых кремах и косметических средствах. 1 Структура хитина была известна в 1929 году швейцарским ученым Альбертом Хофманном 1906–2008 (который был более известен как первооткрыватель диэтиламида лизергиновой кислоты, ЛСД).
Например, его использовали в хирургических швах, которые со временем растворяются. Он также использовался в качестве добавки в некоторых кремах и косметических средствах. 1 Структура хитина была известна в 1929 году швейцарским ученым Альбертом Хофманном 1906–2008 (который был более известен как первооткрыватель диэтиламида лизергиновой кислоты, ЛСД).
Структура
Хитин похож на кератин (белковый компонент волос и ногтей человека) по структурным функциям.Тем не менее, он отличается от кератина своим углеводным (полисахаридным) структурным компонентом. По структуре он напоминает целлюлозу . Хитин — это модифицированный углевод, содержащий азота . Он состоит из линейного полимера из мономеров N -ацетил-D-глюкозамина (C 8 H 13 O 5 N) n »1 . Подобно целлюлозе, мономеры связаны друг с другом гликозидной связью β (1 → 4). Однако в целлюлозе мономеры представляют собой единицы глюкозы. Кроме того, хитин имеет ацетиламиновую группу вместо гидроксильной группы на каждом мономере. Это открывает больше возможностей для образования водородных связей между полимерами в хитине и, таким образом, обеспечивает повышенную прочность конструкции. Удаление ацетильных групп COCh4 из хитина приводит к образованию хитозана , который, в отличие от хитина, растворим в воде.
Кроме того, хитин имеет ацетиламиновую группу вместо гидроксильной группы на каждом мономере. Это открывает больше возможностей для образования водородных связей между полимерами в хитине и, таким образом, обеспечивает повышенную прочность конструкции. Удаление ацетильных групп COCh4 из хитина приводит к образованию хитозана , который, в отличие от хитина, растворим в воде.
Типы
Описаны три основные кристаллические формы хитина: 2
- α-хитин .Это наиболее распространенная форма хитина. Это происходит в виде микрофибрилл, расположенных антипараллельно образом. Он менее растворим в воде, обладает сильными механическими свойствами. Низкая растворимость в воде обусловлена наличием внутрицепочечных водородных связей. Встречается у членистоногих, в том числе у насекомых. У ракообразных он сильно минерализован солями кальция и магния.
- β-хитин .
 Эта форма хитина представляет собой микрофибриллы, расположенные в ориентации параллельно .Он гораздо легче гидратируется, чем α-хитин. Он также очень гибкий. Он содержится в загонах кальмаров и иглах диатомовых водорослей.
Эта форма хитина представляет собой микрофибриллы, расположенные в ориентации параллельно .Он гораздо легче гидратируется, чем α-хитин. Он также очень гибкий. Он содержится в загонах кальмаров и иглах диатомовых водорослей. - γ-хитин . Эта форма хитина состоит из β-хитина и α-хитина. Он содержится в коконах некоторых жуков.
Общие биологические реакции
Хитин считается вторым по распространенности природным полисахаридом. Он встречается в экзоскелете некоторых насекомых и ракообразных. Он также является компонентом клеточной стенки некоторых грибов.Другими организмами, которые синтезируют хитин, являются определенные протистов , губки , кишечнополостных , нематоды , моллюски и Rhizobia . У насекомых хитин синтезируется в основном в эпидермисе и средней кишке. Предшественниками хитина могут быть трегалоза и гликоген . 3 Ниже представлен путь биосинтеза хитина, где трегалоза является исходным субстратом, как было предложено Kramer and Koga, 1986 4 и Cohen, 2001 5 :
(1) трегалоза → β-D-глюкоза (по треалазе )
(2) β-D-глюкоза → глюкозо-6-фосфат (по гексокиназе )
(3) глюкозо-6-фосфат → фруктозо-6-фосфат (по ”Глюкозо-6-фосфат-изомераза)
(4) фруктозо-6-фосфат → глюкозамин-6-фосфат (посредством” глутамин: фруктозо-6-фосфатаминотрансфераза)
(5) глюкозамин-6-фосфат → N -ацетил -глюкозамин-6-фосфат (по глюкозамин-6-фосфат N -ацетилтрансфераза)
(6) N -ацетил-глюкозамин-6-фосфат → N -ацетилглюкозамин-1-фосфат (по фосфоацетилглюкозамин мутацией )
(7) N -ацетилглюкозамин-1-фосфат → UDP- N -ацетилглюкозамин (по UDP-9005 3 N -ацетилглюкозаминпирофосфорилаза)
(8) UDP- N -ацетилглюкозамин → хитиновый полимер (по хитинсинтазе )
Хитин обычно сочетается с другими соединениями (например,г.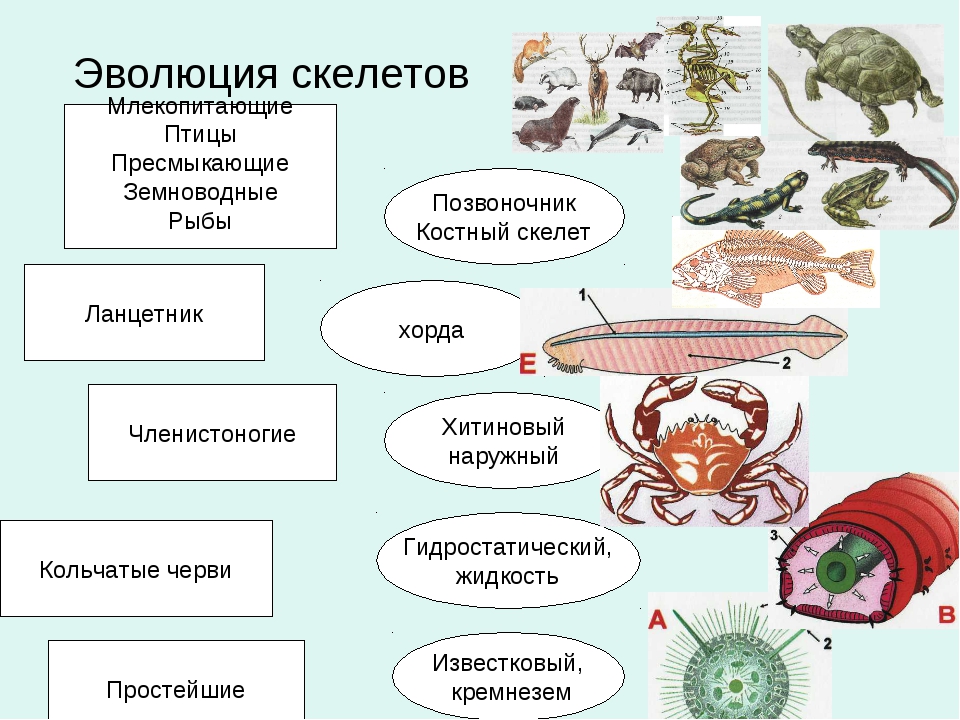 карбонат кальция), образующий более прочный композитный материал; чистый хитин или карбонат кальция по отдельности будут хрупкими и не такими прочными, как композит.
карбонат кальция), образующий более прочный композитный материал; чистый хитин или карбонат кальция по отдельности будут хрупкими и не такими прочными, как композит.
Общие биологические реакции
У насекомых и ракообразных, подвергающихся линьке и метаморфозу, разложение и синтез хитина происходят одновременно и согласованно. Бинарная ферментная система (состоящая из хитиназы и ~ -N-ацетилглюкозаминидазы ) из жидкости линьки разлагает хитин экзоскелета и внутренней оболочки кишечника на мономерные компоненты, особенно во время линьки.В частности, хитиназы расщепляют хитин на олигосахариды, тогда как ~ -N-ацетилглюкозаминидаза дополнительно расщепляет олигосахариды на мономеры N -ацетил-D-глюкозамина с невосстанавливающего конца. 3 Эти ферменты катализируют гидролиз β- (1-4) -гликозидной связи.
Биологическое значение
Хитин служит защитным покровом и механической опорой для мягкотелых организмов, его производящих. У насекомых и членистоногих хитин является важным компонентом их экзоскелета.Хитин также присутствует в стенках тела насекомых, слизистой оболочке кишечника, слюнных железах, частях рта и точках прикрепления мышц. У хитиновых грибов в их клеточной стенке присутствует хитин, а не целлюлоза. Помимо насекомых, у некоторых паукообразных также есть хитин в твердом внешнем покрытии. Хитин также присутствует в радуле моллюсков и клювах головоногих моллюсков. Люди и другие позвоночные не производят хитин. Таким образом, ферменты, разлагающие хитин, можно использовать в качестве потенциальных фунгицидов, а также в качестве инсектицидов, нацеленных на хитиновые грибы и болезнетворных насекомых.Хитин и хитозан используются в качестве пищевой добавки, загустителя, текстуризатора, эмульгатора, увлажнителя и стабилизатора в кондитерских изделиях, напитках и других продуктах питания. Хитозан считается в целом безопасным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США.
У насекомых и членистоногих хитин является важным компонентом их экзоскелета.Хитин также присутствует в стенках тела насекомых, слизистой оболочке кишечника, слюнных железах, частях рта и точках прикрепления мышц. У хитиновых грибов в их клеточной стенке присутствует хитин, а не целлюлоза. Помимо насекомых, у некоторых паукообразных также есть хитин в твердом внешнем покрытии. Хитин также присутствует в радуле моллюсков и клювах головоногих моллюсков. Люди и другие позвоночные не производят хитин. Таким образом, ферменты, разлагающие хитин, можно использовать в качестве потенциальных фунгицидов, а также в качестве инсектицидов, нацеленных на хитиновые грибы и болезнетворных насекомых.Хитин и хитозан используются в качестве пищевой добавки, загустителя, текстуризатора, эмульгатора, увлажнителя и стабилизатора в кондитерских изделиях, напитках и других продуктах питания. Хитозан считается в целом безопасным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США. Однако людям, страдающим аллергией на ракообразных, может потребоваться избегать пищи, содержащей хитин или хитозан. 6
Однако людям, страдающим аллергией на ракообразных, может потребоваться избегать пищи, содержащей хитин или хитозан. 6
Дополнительный
Этимология
- Латинский chitōn (что означает «моллюск» )
- Французский хитин , от греческого слова χιτών («хитон8
Производные термины
- Хитинсинтаза
- хитиновый ( прилагательное )
Дополнительная литература
См. Также
Упоминания
Ссылка
- Stoye, E.(2019). Хитин. Получено с www.chemistryworld.com/podcasts/chitin/6478.article Ссылка
- Мутукришнан, С., Мерзендорфер, Х., Аракан, Ю. и Янг, К. (2016). Глава 2: Метаболические пути хитина у насекомых и их регуляция. В E. Cohen & B. Moussian (Eds.), Extracellular Composite Matrices in Arthropods (pp. 31-65). Швейцария: Springer International Publishing.

